Изобретение относится к вторичным источникам тока, работающим при высоких температурах, и может быть использовано для аккумулирования электрической энергии в различных отраслях народного хозяйства, где необходимы высокая удельная энергия и, одновременно, высокая удельная мощность, в частности, в электротранспорте.
Одной из наиболее эффективных электрохимических пар является пара литий-кислород, расчетная удельная энергоемкость которой может достигать величины 4500 Вт•ч/кг, а без учета веса окислителя, т.е. при работе на воздухе - до 10000 Вт•ч/кг. Учитывая соотношение реальной и теоретической удельной энергии в традиционных и разрабатываемых аккумуляторах, можно ожидать, что предлагаемый вариант аккумулятора обеспечит реальную удельную энергоемкость не менее 200 Вт•ч/кг, что пока недостижимо для любых других видов аккумуляторов.
Используемые в настоящее время традиционные аккумуляторы для электротранспорта с водным электролитом: свинцовые, никель-кадмиевые и никель-гидридные имеют энергоемкость менее 100 Вт•ч/кг. Разрабатываемые высокотемпературные аккумуляторы для электромобиля имеют следующую практическую энергоемкость: натрий-никель- хлоридные 100-120 Вт•ч/кг Bohm (H) Techn. Mitt. RTT. 68, 425, 1990), натрий-серные 120-150 Вт•ч/кг (Садуорс Дж., Тилли А. Серно-натриевые аккумуляторы. - М.: Мир. 1988), литий (сплав лития с алюминием) - дисульфиджелезные - 150-180 Вт•ч/кг (Разработка герметичной аккумуляторной батареи на основе системы Li(сплав)/FeS с биполярными электродами для электромобиля. ЭИ, ППЭ, N 2,2-11, 1994).
Наиболее близким является литий-кислородный аккумулятор [l] (Kristina W. Semkow and Antony F. Sammells. J. Electrochem. Soc. 134, 2084-5, 1987) с электрохимической системой (см. табл.1), работающий в интервале 600-850oC.
Токообразующий процесс описывается следующей реакцией: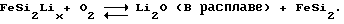
Описанный аккумулятор имеет целый ряд существенных недостатков:
1. Высок рабочий температурный интервал (заявленный в статье он составляет 600 - 850oC.
Известно, что используемый в аккумуляторе твердый электролит на основе оксида циркония удовлетворительно работает при температурах порядка 800oC. Снижение рабочей температуры приводит к существенному ухудшению рабочих характеристик, что видно из приводимого в статье графика - см. фиг. 2[1] (снижение температуры с 800 до 650oC ухудшает характеристики примерно в два раза).
2. Наличие в анодном расплаве растворенного оксида лития неизбежно должно вести к взаимодействию его с твердым электролитом с образованием цирконата лития, что приведет к невозможности сколько-нибудь длительной работы аккумулятора. Видимо, по этой причине в работе не приводятся данные о количестве циклов заряд-разряд, которые являются одной из главных характеристик работы любого аккумулятора.
К коррозии твердого электролита с образованием того же продукта будет приводить и литий, растворенный в электролите, из анодного сплава.
3. Использование в качестве анодного материала литиевого сплава FeSi2Lix, а не чистого лития приводит к существенному снижению активности анода. Использовать же чистый литий данная конструкция не позволяет опять же по причине коррозии (взаимодействие растворенного в анодном расплаве лития с материалом твердого электролита). Использование сплава приводит также к многоступенчатости разрядной кривой (см. фиг. 4 [1]) и к снижению величины НРЦ.
4. Использование в качестве анодного материала литиевого сплава неизбежно обуславливает низкий ток (а значит длительное время) заряда, так как процесс интеркаляции лития - медленный. Кроме того, в случае перезаряда возможно разрушение сплава.
Задачей настоящего изобретения является повышение электрических характеристик аккумулятора с одновременным понижением рабочей температуры.
Решение поставленной задачи достигается тем, что предлагаемый высокотемпературный литий-кислородный (воздушный) аккумулятор имеет электрохимическую схему, приведенную в табл.2.
Токоооразующая реакция имеет вид
2Li + 1/2 O2 = Li2O.
В предлагаемом аккумуляторе в качестве анодного материала используется чистый литий, что предпочтительнее использования сплава.
Система с анодом из чистого лития имеет следующие преимущества:
а. более высокая ЭДС,
б. более высокая энергоемкость,
в. возможность вести заряд аккумулятора большими токами,
г. нет опасности перезаряда.
В предлагаемом аккумуляторе используется твердый электролит с высокой литийкатионной проводимостью и низкой электронной проводимостью, который коррозионно устойчив к расплавленному электролиту и к растворенным в нем компонентам (Li и Li2O). В качестве твердого электролита использовали один из двойных оксидов лития и следующих элементов: Al, Be, Y, Sc, Zr, Hf и лантонидов.
Расплавленный электролит не содержит фторидов, которые также являются коррозионно активными агентами.
Катод (кислородный электрод) предлагаемого аккумулятора представляет собой газодиффузионный электрод. В качестве материала катода могут быть использованы либо литированный оксид никеля, либо кобальтиты и манганиты лантана-стронция, либо ферриты и кобальтиты лития или композиты на их основе, либо другие ионно-электронные проводники. Ионно-электронные проводники предпочтительнее, поскольку имеет место доставка кислорода к зоне электрохимической реакции через объем электрода и отпадает необходимость в применении пористых электродов.
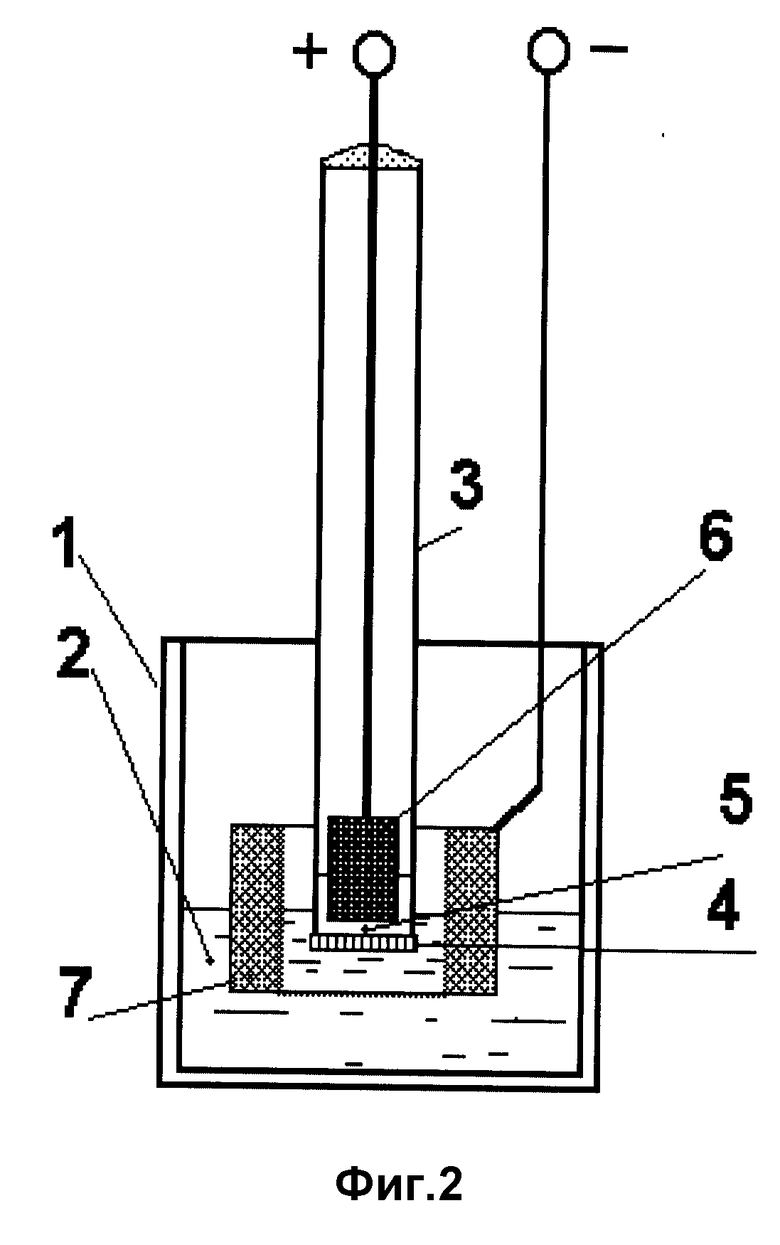
На фиг. 1 представлена лабораторная модель аккумулятора с катодом из кобальтита лантана-стронция.
Пример 1. В стакан из оксида бериллия 1 помещен предварительно приготовленный карбонатно-хлоридный электролит, содержащий растворенный оксид лития 2. В расплав помещена анодная камера, выполненная в виде трубки из оксида бериллия 3. К дну трубки приварена таблетка твердого литийпроводящего электролита 4. Внутри трубки помещен анодный материал из расплавленного лития 5. Рядом с анодной камерой в расплав 2 помещен катод из кобальтита лантана-стронция 6, выполненный в виде пробирки, через которую с помощью газоподводящих трубок 7 осуществляли проток рабочего газа (кислород, воздух).
Собранную конструкцию помещали в электрическую печь, температуру которой поднимали до 620oC.
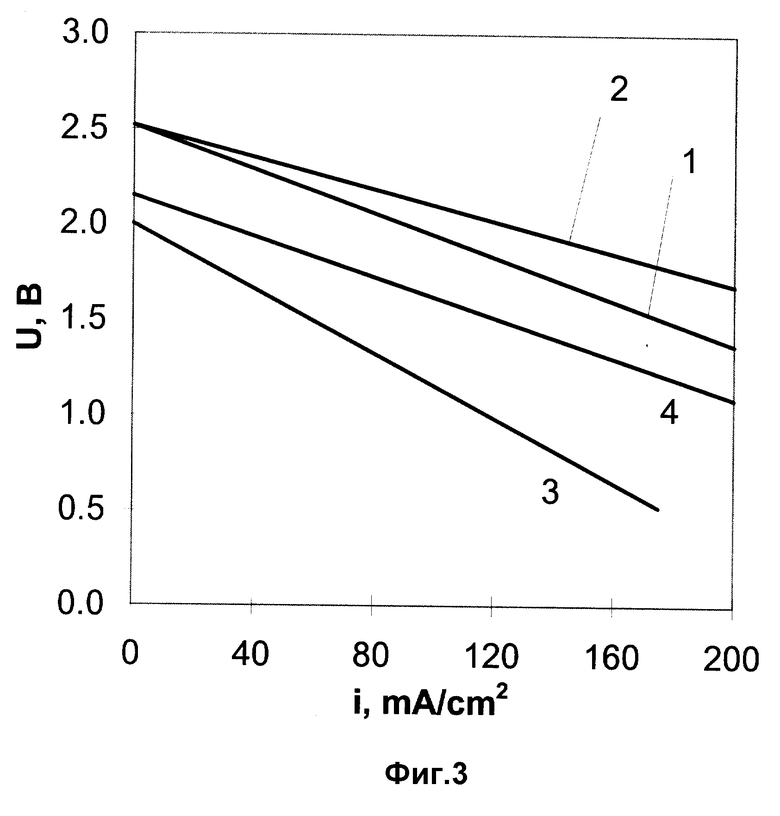
Данную модель аккумулятора испытывали на разряд в гальваностатическом режиме при плотности тока 100 мА/см2. Расчет плотности тока проводили на площадь твердого электролита. В процессе разряда была снята I - V - кривая (фиг. 3, кривая 1).
Пример 2. Лабораторная модель аккумулятора с катодом из литированного оксида никеля (фиг. 2).
В стакан из оксида бериллия 1 помещали карбонатно-хлоридный расплав 2, содержащий растворенный оксид лития. В расплав помещали трубку из оксида бериллия 3, которая выполняла роль анодной камеры. К дну трубки была приварена таблетка твердого литийпроводящего электролита 4. Внутрь трубки помещали небольшое количество расплавленного электролита из смеси галогенидов лития 5. Анодный токоотвод 6 был выполнен из крупноячеистого железа. Катод аккумулятора был выполнен из крупноячеистого никеля в виде кольца 7, опоясывающего анодную камеру. При погружении катода в расплав поверхность никеля окислялась и, взаимодействуя с расплавом, литировалась. Катодным газом, в данном случае, служил окружающий воздух. Литий в анодное пространство не загружали, а получали его в процессе заряда аккумулятора.
Заряд проводили в потенциостатическом режиме при напряжении 3 В, разряд - 1 в гальваностатическом режиме при плотности тока 100 мА/см2.
Данный вариант аккумулятора подвергали циклированию.
На фиг. 3 приведена разрядная кривая аккумулятора, полученная при 620oC после пятого цикла (кривая 2).
Для сравнения на этом же рисунке приведены разрядные кривые прототипа, полученные при 650(3) и 850oC (4).
Из приведенного графика видно, что наши разрядные кривые, полученные при пониженной температуре, существенно превосходят разрядные кривые прототипа. Если взять, например, значение плотности тока 100 мА/с2, то напряжение на клеммах аккумулятора будет для наших примеров для температуры 620oC 2,0 В (пример 1) и 2,2 В (пример 2). Для прототипа - 1, 2 В (650oC и 1,7 В (800oC).
Таким образом, поставленную задачу можно считать выполненной: при меньшем значении рабочей температуры получены более высокие электрические характеристики.
| название | год | авторы | номер документа |
|---|---|---|---|
| АКТИВНЫЙ ЭЛЕКТРОД ДЛЯ ВЫСОКОТЕМПЕРАТУРНЫХ ЭЛЕКТРОХИМИЧЕСКИХ УСТРОЙСТВ С ТВЕРДЫМ ЭЛЕКТРОЛИТОМ | 1994 |
|
RU2079935C1 |
| СПОСОБ ПОЛУЧЕНИЯ КАДМИЯ | 1994 |
|
RU2123544C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКО- И НАНОДИСПЕРСНОГО ПОРОШКА МЕТАЛЛОВ ИЛИ СПЛАВОВ | 2009 |
|
RU2423557C2 |
| ЭЛЕКТРОЛИЗЕР ДЛЯ ПОЛУЧЕНИЯ МЕТАЛЛОВ В ЖИДКОМ ВИДЕ | 1994 |
|
RU2089674C1 |
| ТВЕРДЫЙ ЭЛЕКТРОЛИТ ДЛЯ ЭЛЕКТРОХИМИЧЕСКИХ УСТРОЙСТВ | 1995 |
|
RU2097756C1 |
| СПОСОБ ЭЛЕКТРОХИМИЧЕСКОГО ПОЛУЧЕНИЯ АЛЮМИНИЙ-ТИТАНОВОЙ ЛИГАТУРЫ ДЛЯ КОРРОЗИОННОСТОЙКИХ АЛЮМИНИЕВЫХ СПЛАВОВ | 2013 |
|
RU2537676C1 |
| МАТЕРИАЛ ДЛЯ КИСЛОРОДНОГО ЭЛЕКТРОДА ЭЛЕКТРОХИМИЧЕСКИХ УСТРОЙСТВ | 1997 |
|
RU2146360C1 |
| ТОПЛИВНЫЙ ЭЛЕМЕНТ С ТВЕРДЫМ ЭЛЕКТРОЛИТОМ | 1994 |
|
RU2068603C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОРОШКОВ МЕТАЛЛОВ И СПЛАВОВ ВОССТАНОВЛЕНИЕМ ИЗ КАТОДНОГО МАТЕРИАЛА | 2008 |
|
RU2423556C2 |
| МАТЕРИАЛ ДЛЯ КИСЛОРОДНОГО ЭЛЕКТРОДА ТОПЛИВНОГО ЭЛЕМЕНТА | 2003 |
|
RU2248649C1 |


Изобретение относится к электрохимическим устройствам, в частности к вторичным источникам тока, работающим при высоких температурах, и может быть использовано для аккумулирования электрической энергии в различных отраслях народного хозяйства. Изобретение позволяет повысить электрические характеристики с одновременным понижением рабочей температуры. Аккумулятор состоит из анода (металлический литий), катода (газодиффузионный кислородный электрод) и двух электролитов (твердого и расплавленного). Твердый электролит - литийпроводящий. 2 з.п.ф-лы, 3 ил., 2 табл. Референт В.Р.Чернова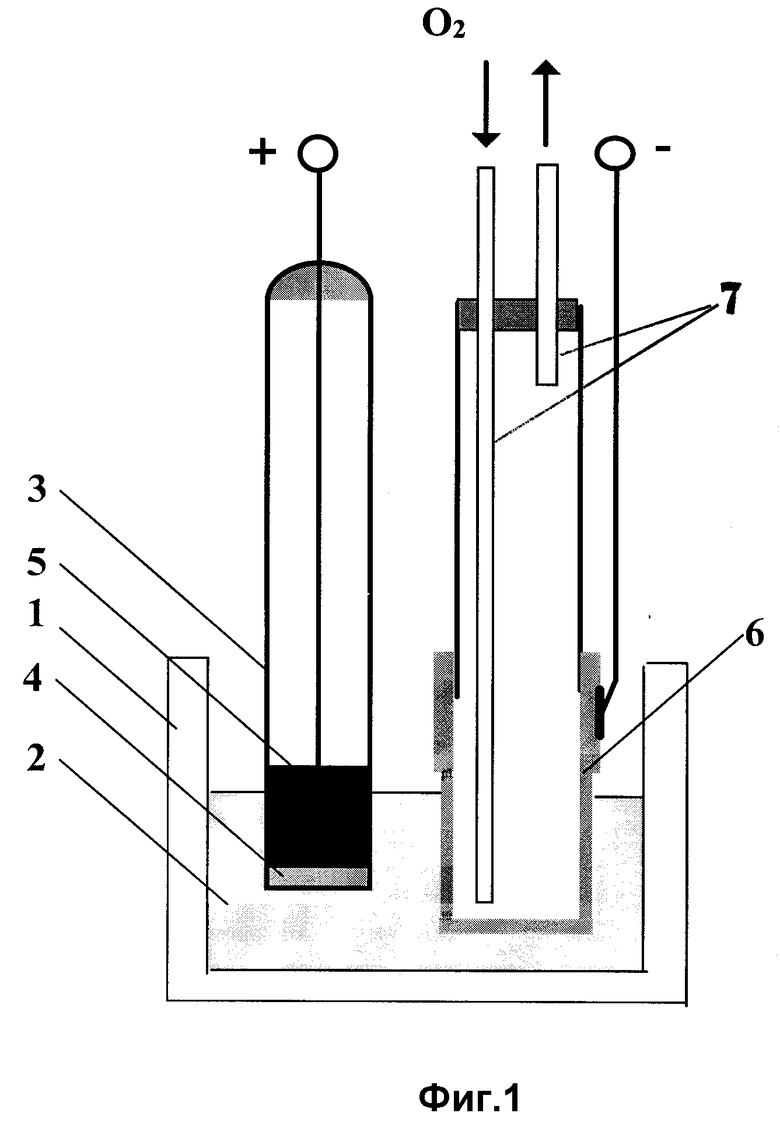
| Kristina W | |||
| Semkow and Antony | |||
| F | |||
| Sammells | |||
| J | |||
| Electrochem | |||
| Soc | |||
| Халат для профессиональных целей | 1918 |
|
SU134A1 |
| Садурс Дж., Тилли А | |||
| Серно - натриевые аккумуляторы | |||
| - М.: Мир, 1988 | |||
| Разработка герметичной аккумуляторной батареи на основе системы Li (сплав)/FeS с биполярными электродами для электромобиля | |||
| - ЭИ, ППЭ, N 2, 2-11, 1994 | |||
| ПЕРВИЧНЫЙ ЭЛЕМЕНТ | 0 |
|
SU389581A1 |
| SU 532916 A, 28.02.77 | |||
| Твердый электролит для химического источника тока | 1982 |
|
SU1053191A1 |
| ТВЕРДЫЙ ЭЛЕКТРОЛИТ ДЛЯ ХИМИЧЕСКОГО ИСТОЧНИКА ТОКА | 1989 |
|
SU1642917A1 |
| US 4147842 A, 27.09.95 | |||
| Способ приготовления сернистого красителя защитного цвета | 1921 |
|
SU84A1 |
Авторы
Даты
1999-02-10—Публикация
1997-01-23—Подача