Изобретение относится к кристаллам, содержащим кристаллизационную воду (далее упоминаемым как гидратная форма или просто гидрат), и к кристаллам без кристаллизационной воды (далее упоминаемым как безводная форма или просто безводные), к способу селективного получения этих кристаллов и, кроме того, к фармацевтическим препаратам, содержащим такую кристаллическую форму.
Производное хинолина, представленное формулой (1):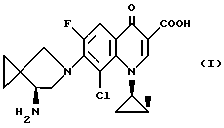
то есть 7-[(7-(S)-амино-5-азаспиро[2,4]гептан-5-ил]-8-[хлор-6-фтор-1-[(1R, 2S)-2-фторциклопропил]-4-оксо-1,4-дигидрохинолин-3-карбоновая кислота (далее упоминаемая как соединение (1)) имеет высокую антимикробную активность с превосходной безопасностью (ЕР-А-О 341493 или JP-А-2-231475; где термин JP-А, в том виде, как он используется, означает ("не прошедшая экспертизу опубликованная заявка на патент Японии") и, как ожидается, должно быть превосходным синтетическим антимикробным агентом.
Обнаружено, что соединение (1) может существовать в форме нескольких видов гидратных форм, иных чем 1/4 (0,25) гидрат, таких как 1/2 (0,5) гидрат (т.е. полугидрат), 1 гидрат (т.е., моногидрат) и 3/2 (1,5) гидрат (т.е. сесквигидрат). Обнаружено также, что в дополнение к этим гидратам существует также безводная форма.
Гидратная форма соединения (1) включает различные типы кристаллов, имеющих различное число молекул кристаллизационной воды. В зависимости от условий кристаллизации или перекристаллизации в целевых кристаллах образуются различные типы гидратов, и такие кристаллы являются непригодными в качестве основного материала для твердых фармацевтических препаратов.
В результате широких исследований авторы данного изобретения обнаружили, что возможно селективное получение кристаллов, как гидратов, так и базводных соединения (1) путем контроля условий кристаллизации или перекристаллизации. Данное изобретение полностью основывается на этом обнаруженном факте.
Соответственно данное изобретение относится к способу селективного получения 3/2 гидрата соединения (1), который включает обработку 7-[(7-(S)-амино-5-азаспиро[2,4] гептан-5-ил] -8-[хлор-6-фтор-1-[(1R, 2S)-2-фторциклопропил] -4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты в водном растворителе или в воде или перекристаллизацию соединения (1) из водного растворителя или воды.
Данное изобретение относится к способу селективного получения 3/2 гидрата соединения (1), который включает обработку 7-[(7-(S)-амино-5-азаспиро[2,4] гептан-5-ил] -8-[хлор-6-фтор-1-[(1R, 2S)-2-фторциклопропил]-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты в водном растворе или в воде.
Данное изобретение относится к способу селективного получения 3/2 гидрата соединения (1), который включает перекристаллизацию 7-[(7-(S)-амино-5-азаспиро[2,4] гептан-5-ил]-8-[хлор-6-фтор-1-[(1R, 2S)-2-фторциклопропил]-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты из водного растворителя или воды.
Данное изобретение относится также к указанным выше способам, где водным растворителем является водный раствор этанола, содержащий аммиак.
Данное изобретение относится также к 3/2 гидрату 7-[(7-(S)-амино-5-азаспиро[2,4] гептан-5-ил] -8-[хлор-6-фтор-1-[(1R, 2S)-2-фторциклопропил]-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты.
Данное изобретение относится также к безводной 7-[(7-(S)-амино-5-азаспиро[2,4] гептан-5-ил] -8-[хлор-6-фтор-1-[(1R, 2S)-2-фторциклопропил]-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты.
Данное изобретение относится также к кристаллическому 3/2 гидрату 7-[(7-(S)-амино-5-азаспиро[2,4] гептан-5-ил] -8-[хлор-6-фтор-1-[(1R, 2S)-2-фторциклопропил] -4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты, который, в основном, имеет следующие характеристики дифракции рентгеновских лучей.
Значение d (постоянные решетки) - Относительная интенсивность
(А)
11,47 - Слабая
10,49 - Сильная
9,69 - Слабая
7,12 - Исключительно слабая
6,87 - Сильная
6,23 - Сильная
5,68 - Слабая
5,25 - Сильная
4,90 - Исключительно сильная
4,71 - Исключительно слабая
4,61 - Слабая
4,25 - Слабая
4,15 - Исключительно слабая
4,01 - Сильная
3,85 - Исключительно слабая
3,74 - Исключительно слабая
3,69 - Слабая
3,58 - Слабая
3,50 - Слабая
3,46 - Слабая
3,39 - Слабая
3,34 - Слабая
3,29 - Слабая
3,17 - Слабая
Данное изобретение относится далее к фармацевтическим композициям, содержащим моногидрат или безводное соединение, указанное выше.
Данное изобретение относится к антибактериальному агенту, содержащему в качестве активного ингредиента терапевтически эффективное количество 3/2 гидрата 7-[(7-(S)-амино-5-азаспиро[2,4] гептан-5-ил] -8-[хлор-6-фтор-1-[(1R, 2S)-2-фторциклопропил]-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты.
Данное изобретение такие относится к антибактериальному агенту, содержащему в качестве активного ингредиента терапевтически эффективное количество 3/2 гидрата 7-[(7-(S)-амино-5-азаспиро[2,4]гептан-5-ил]-8-[хлор-6-фтор-1-[(1R, 2S)-2-фторциклопропил]-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты, который имеет следующие характеристики дифракции рентгеновских лучей.
Значение d (постоянные решетки) - Относительная интенсивность
(А)
11,47 - Слабая
10,49 - Сильная
9,69 - Слабая
7,12 - Исключительно слабая
6,87 - Сильная
6,23 - Сильная
5,68 - Слабая
5,25 - Сильная
4,90 - Исключительно сильная
4,71 - Исключительно слабая
4,61 - Слабая
4,25 - Слабая
4,15 - Исключительно слабая
4,01 - Сильная
3,85 - Исключительно слабая
3,80 - Исключительно слабая
3,74 - Исключительно слабая
3,69 - Слабая
3,58 - Слабая
3,50 - Слабая
3,46 - Слабая
3,39 - Слабая
3,34 - Слабая
3,29 - Слабая
3,17 - Слабая
Данное изобретение относится также к способу лечения бактериальных инфекций, который состоит во введении терапевтически эффективного количества 3/2 гидрата 7-[(7-(S)-амино-5-азаспиро[2,4]гептан-5-ил]-8-[хлор-6-фтор-1-[(1R, 2S)-2-фторциклопропил]-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты, который имеет следующие характеристики рентгеновских лучей:
Значение d (постоянные решетки) - Относительная интенсивность
(А)
11,47 - Слабая
10,49 - Сильная
9,69 - Слабая
7,12 - Исключительно слабая
6,87 - Сильная
6,23 - Сильная
5,68 - Слабая
5,25 - Сильная
4,90 - Исключительно сильная
4,71 - Исключительно слабая
4,61 - Слабая
4,25 - Слабая
4,15 - Исключительно слабая
4,01 - Сильная
3,85 - Исключительно слабая
3,80 - Исключительно слабая
3,74 - Исключительно слабая
3,69 - Слабая
3,58 - Слабая
3,50 - Слабая
3,46 - Слабая
3,39 - Слабая
3,34 - Слабая
3,29 - Слабая
3,17 - Слабая
Фиг. 1 представляет пример спектра дифракции рентгеноавских лучей 3/2 гидрата соединения (1);
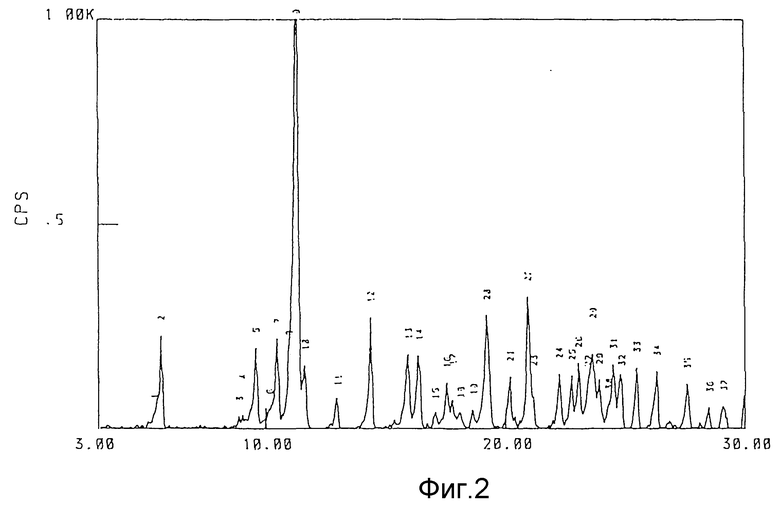
фиг. 2 - пример спектра дифракции рентгеновских лучей 1/2 гидрата соединения (1).
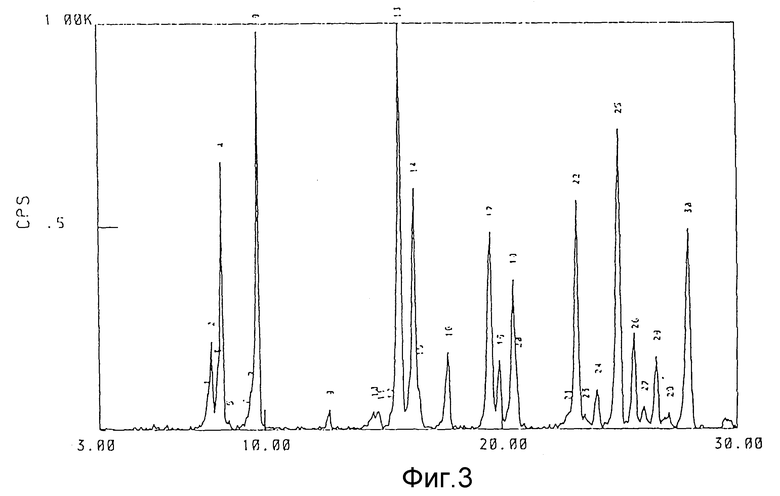
фиг. 3 - пример спектра дифракции рентгеновских лучей безводного соединения (1).
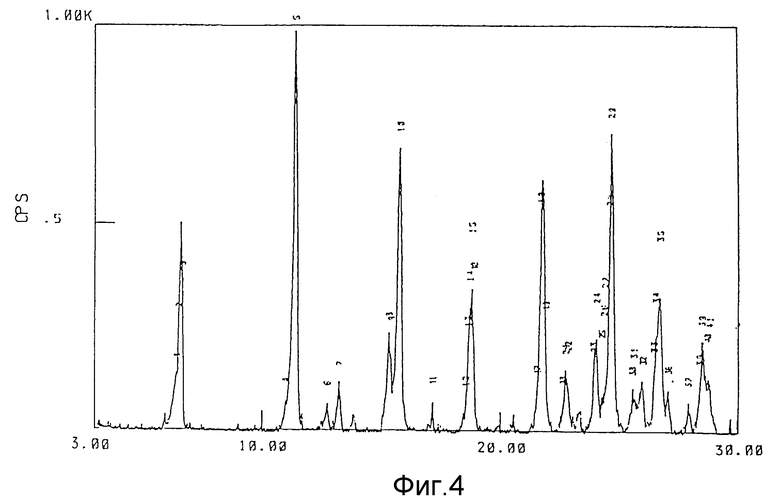
фиг. 4 представляет пример спектра дифракции рентгеновских лучей моногидрата соединения (1).
Прежде всего авторы изучили кристаллы соединения (1) и, как результат, обнаружили, что они существуют как в безводной, так и гидратных формах, включая 1/2 гидраты, 1 гидраты и 3/2 гидраты в дополнение к 1/4 гидрату. С точки зрения промышленного производства кристаллов, 3/2 гидрат является предпочтительным как из-за физико-химической стабильности, так и из-за выхода продукта и легкости подбора условий производства при производстве основного материала для фармацевтических применений. С другой стороны, безводная форма подходит из-за скорости растворения сама по себе и в таблетках.
Каждый из гидратов и безводная форма соединения (1) данного изобретения дает структуру спектра, показанную на фиг. 1-4, и имеет достаточно характерную структуру спектра дифракции рентгеновских лучей порошков, представленную в последующих примерах. Термин "достаточно характерная" означает, что структура спектра каждого из кристаллов не ограничивается той, которая представлена на прилагаемых фиг.1-4 и таблицах, но включает ошибки в определении постоянной решетки (значения d) и интенсивности, обычно приемлемые в этой области.
Обнаружено, что может образоваться более чем один кристаллический гидрат при различных условиях получения гидрата, в частности 1/2 гидрат получается, как загрязнение при получении 3/2 гидрата. Такая смесь гидратов является непригодной в качестве основного материала для фармацевтических препаратов. Таким образом, авторы изучили способ селективного получения кристаллов соединения (1), содержащих исключительно единственный гидрат или единственную безводную форму.
Авторы исследовали стабильность кристаллов соединения (1) в водном растворителе или в воде следующим образом.
Эквивалентные количества 1/2 гидрата и 3/2 гидрата смешивают и добавляют к смеси водный растворитель. Смесь перемешивают при различных температурах и после заданного периода времени анализируют пропорцию гидратов в общем количестве кристаллов. Во время перемешивания смесь находится в суспендированном состоянии, а именно в состоянии мутной взвеси.
В качестве водного растворителя используют водный раствор этанола, имеющий содержание воды (определяемое ниже) между 0 и 100%. Обнаружено также, что водный раствор этанола, содержащий, кроме того, от 1 до 28% водного раствора аммиака, повышает растворимость кристаллов и ускоряет превращения одной формы гидрата в другую. Растворитель используют в количестве от 15 до 30 мл на 1 г кристаллов. Содержание воды в используемом растворителе выражают в терминах объемного отношения до смешивания. Например, водный раствор этанола, имеющий содержание воды 60%, означает смесь этанола и воды с объемным соотношением 4 : 6, и водный раствор этанола, имеющий содержание воды 60%, содержащий 1% водного раствора аммиака, является смесью, содержащий этанол, воду и 28% водный раствор аммиака в объемном отношении 40 : 59 : 1.
Перемешивание продолжают в течение 3 дней при температуре 25oC и 45oC. Период времени в 3 дня не является обязательным для превращения кристаллов, и доказано, что превращение завершается в течение примерно одного дня.
Результаты этих экспериментов показывают, что виды кристаллов, существующих в смеси, могут изменяться в зависимости от температуры, содержания воды в растворителе и от времени.
Более подробно, (i) 14-часовая обработка при температуре кипения растворителя дает только безводную форму при содержании воды 5% или менее, только 1/2 гидрат при содержании воды 50%, и смесь 1/2 гидрата 3/2 гидрата при содержании воды 75% или более; (ii) 3-х дневная обработка при 45oC дает только 3/2 гидрат при содержании воды 50% или более, и смесь 1/2 гидрата и 3/2 гидрата при содержании воды 45oC или менее; и (iii) 3-х дневная обработка при 25oC дает только 3/2 гидрат при содержании воды 40% или более и смесь 1/2 гидрата и 3/2 гидрата при содержании воды в 25% или менее.
Эти результаты показывают, что 3/2 гидрат может быть получен в виде единственного вещества путем обработки в растворителе, имеющем содержание воды 50% или более, когда температура составляет 45oC; или в растворителе, имеющем содержание воды 40% или более, когда температура составляет 25oC.
Термин "обработка", как он здесь используется, означает непрерывное перемешивание смеси кристаллов и растворителя в виде мутной взвеси при указанной выше температуре в течение указанного выше периода.
Взвесь кристаллов может быть получена либо путем только одного растворения кристаллов с последующей кристаллизацией, либо простым смешиванием кристаллов и растворителя.
Растворитель, который может быть использован в данном изобретении, не является специально ограниченным до тех пор, пока кристаллы могут растворяться в растворителе и растворитель является смешиваемым с водой. Иллюстративные примеры растворителя включают низкоатомные спирты, такие как метанол, этанол и пропанол, и ацетон, среди которых этанол является предпочтительным. В дополнение, вода сама по себе может быть использована в качестве растворителя.
Авторы обнаружили также, что кристаллы, состоящие только из 3/2 гидрата, могут быть селективно получены путем перекристаллизации, которая служит в качестве условий при начале кристаллизации в описанных выше условиях, которые дают возможность только 3/2 гидрату существовать в виде взвеси. Термин "при начале кристаллизации" используют здесь для обозначения точки, до которой вся предварительная обработка перед образованием кристаллов, например, растворение исходных кристаллов в растворителе и, если желательно, воздействие на раствор путем обработки активированным углем, концентрирование и тому подобное, является законченной.
Авторы также достигли цели в установлении способа получения 1/2 гидрата, безводной формы или 1 гидрата в виде монокристаллов путем перекристаллизации или обработки растворителя подобным способом.
Например, 1 гидрат соединения (1) может быть получен путем обработки при примерно 25oC в водном растворе метанола, имеющего содержание воды 1% или менее, и безводная форма может быть получена путем обработки в этаноле, содержащем 15% (вес/вес) аммиака.
Следующие методики являются примерами селективного получения гидратов и безводной формы соединения (1).
А) Способ получения безводной формы.
Смесь неочищенных кристаллов соединения (1), которые могут быть получены по способу патента ЕР-А-0341493, и водный раствор этанола или водный раствор метанола нагревают с обратным холодильником при перемешивании в состоянии мутной взвеси в течение от 0,5 до 8 часов. Содержание воды в водном растворе метанола или этанола составляет менее чем 5% (объем-объем). Количество растворителя находится в отношении от 10 до 30 мл на 1 г исходного соединения (1). Увеличение содержания воды в растворителе вызывает тенденцию к уменьшению времени завершения обработки. Когда используют безводный этанол в качестве растворителя, превращение завершается при 70oC и за 8 часов.
Безводная форма может быть получена с помощью способа перекристаллизации. Одной из наилучших методик является представленная в примере 3, изложенном ниже. В этой методике водный растворитель, содержащий менее чем 5% (объем/объем) воды, может быть использован в качестве растворителя.
Б) Способ получения 1,2 гидрата.
Смесь исходных кристаллов соединения (1) и водный раствор этанола, имеющий содержание воды 50%, нагревают с обратным холодильником при перемешивании в состоянии мутной взвеси в течение от 1 до 20 часов. Количество растворителя берется в соотношении от 10 до 30 мл на 1 г исходного соединения (1). Известно, что когда используют растворитель, содержащий аммиак, скорость образования 1/2 гидрата увеличивается.
1/2 Гидрат может быть получен с помощью способа перекристаллизации. Одной из наилучших методик является представленная в примере 2, изложенном ниже.
С) Способ получения 1 гидрата.
Одной из наилучших методик для селективного получения 1 гидрата является представленная в примере 4, изложенном ниже.
Д) Способ получения 3/2 гидрата.
3/2 Гидрат получают из смеси в виде мутной взвеси, перемешиваемой при условиях, изложенных ранее, при которых образуется преимущественно 3/2 гидрат. Условия, в которых преимущественно образуется 3/2 гидрат определяются в основном содержанием воды в растворителе и температурой, и казанная зависимость представлена таким образом.
Преимущественная область взвеси 3/2 гидрата
Температура, oC - Содержание воды
45 - Более чем 50%
50 - Более чем 60%
55 - Более чем 70%
60 - Более чем 90%
Количество растворителя находится в отношении от 10 до 30 мл на 1 г исходного соединения (1).
3/2 Гидрат может быть получен с помощью способа перекристаллизации. Преимущественная методика представлена в примерах 1 и 5, изложенных ниже. Обычно для способа перекристаллизации является предпочтительным использование растворителя, содержащего аммиак, поскольку требуемое количество растворителя может быть уменьшено. Количество растворителя находится в отношении от 5 до 50 мл на 1 г исходного соединения (1) и предпочтительно от 10 до 20 мл. Содержание воды находится в пределах от 50 до 100% и предпочтительно от 50 до 75%. Если содержание аммиака возрастает, количество используемого растворителя может быть уменьшено. Количество аммиака находится в отношении от 0,5 до 2,0 г, предпочтительно от 0,7 до 1,0 г на 1 г исходного соединения (1). Растворитель, содержащий аммиак, может быть получен путем добавления аммиачной воды или введения газообразного аммиака в растворитель. Когда используют аммиачную воду, необходимо рассчитывать ее ингредиенты для получения растворителя с заданным содержанием воды. Температура для кристаллизации может быть определена, как указано выше. Кристаллы данного изобретения могут быть включены в антимикробные препараты в соответствующей твердой лекарственной форме с помощью обычных способов приготовления. Твердые лекарственные формы для перорального приема включают таблетки, порошки, гранулы и капсулы.
При приготовлении твердых форм активный ингредиент может быть смешан с соответственно подобранными фармацевтически приемлемыми наполнителями, такими как вкусовые и цветовые наполнители, связующие, увлажняющие агенты и смазывающие вещества.
Кристаллы изобретения могут быть включены в препараты для животных, такие как порошки, мелкие гранулы и растворимые порошки, с помощью широко используемых способов приготовления.
Данное изобретение ниже будет иллюстрировано более подробно с помощью примеров, но не ограничено ими.
Данные спектров дифракции рентгеновских лучей, представленные в примерах, определяются при следующих условиях с использованием установки Geiger Flex производства Rigaku-Denki.
Мишень - Си-Ка
Фильтр - Ni
Напряжение - 40 кВ
Ток - 20 мА
Пример 1.
3/2 Гидрат 7-[(7-(S)-амино-6-азаспиро[2,4}гептан-5-ил]-8-хлор-6-фтор-1-[(1R, 2S)-2-фторциклопропил] -4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты.
Исходные кристаллы 7-{(7-(S)-амино-5-азаспиро[2,4]гептан-5-ил]-8-хлор-6-фтор-1-[(1R, 2S)-2-фторциклопропил]-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты добавляют к смеси 5500 мл водного раствора этанола, имеющего содержание воды 75%, и 45 мл 28% аммиачной воды, и смесь перемешивают на водяной бане при 45oC в течение 30 минут. После растворения кристаллов добавляют 7,5 г активированного угля с последующей фильтрацией. Фильтрат концентрируют при пониженном давлении, при температуре снаружи 45oC для удаления примерно 3000 мл растворителя путем выпаривания. Концентрат охлаждают до комнатной температуры и собирают путем фильтрации выпавшие в осадок кристаллы и сушат при 40oC при пониженном давлении, получая 143 г целевого соединения.
Температура плавления: 225oC (разложение).
Порошковая рентгеновская дифрактометрия (характерные пики):
Значение d (постоянные решетки) - Относительная интенсивность
(А)
11.47 - Слабая
10.49 - Сильная
9.69 - Слабая
7.12 - Исключительно слабая
6,87 - Сильная
6,23 - Сильная
5,68 - Слабая
5,25 - Сильная
4,90 - Исключительно сильная
4,71 - Исключительно слабая
4,61 - Слабая
4,25 - Слабая
4,15 - Исключительно слабая
4,01 - Сильная
3,85 - Исключительно слабая
3,80 - Исключительно слабая
3,74 - Исключительно слабая
3,69 - Слабая
3,58 - Слабая
3,50 - Слабая
3,46 - Слабая
3,39 - Слабая
3,34 - Слабая
3,29 - Слабая
3,17 - Слабая
ИК; νax (КВr) см-1: 3450, 3000, 2880, 1620
Элементный анализ для С19Н18F2ClN3O3 3/2 Н2О:
Вычислено, (%): С 52.24; Н 4.85; N 9.62
Обнаружено, (%): C 52.07; Н 4.68; N 9.47
Содержание воды (способ Karl Fisher)
Вычислено, (%): 6,18
Обнаружено, (%): 6,5
Пример 2.
3/2 Гидрат 7-[(7-(S)-амино-5-азаспиро[2,4}гептан-5-ил]-8-хлор-6-фтор-1-[(1R, 2S)-2-фторциклопропил] -4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты.
Исходные кристаллы 7-[(7-(S)-амино-5-азаспиро[2,4]гептан-5-ил]-8-хлор-6-фтор-1-[(1R, 2S)-2-фторциклопропил]-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты добавляют к смеси 160 мл водного раствора этанола, имеющего содержание воды 50%, и 6 мл 28% аммиачной воды, и смесь перемешивают при 60oC в течение 30 минут. После растворения кристаллов добавляют к раствору 0,2 г активированного угля с последующей фильтрацией. Фильтрат концентрируют при атмосферном давлении, для удаления примерно 80 мл растворителя. Концентрат охлаждают до комнатной температуры, собирают путем фильтрации выпавшие в осадок кристаллы и сушат при 40oC при пониженном давлении, получая 3,6 г целевого соединения.
Температура плавления: 195oC (разложение).
Порошковая рентгеновская дифрактометрия (характерные пики):
Значение d (постоянные решетки) - Относительная интенсивность
(А)
15,66 - Слабая
9,19 - Слабая
8,42 - Слабая
8,80 - Исключительно сильная
7,60 - Слабая
6,82 - Исключительно слабая
6,15 - Слабая
5,55 - Слабая
5,40 - Слабая
4,60 - Слабая
4,23 - Слабая
ИК νax (KBr)см-1: 3420, 3000, 2860, 1620
Элементный анализ для С19Н18F2ClN3O3 1/2 Н2О:
Вычислено, (%): С 54,49; Н 4,57; N 10,03
Обнаружено, (%): C 54,59; Н 4,29; N 9,88
Содержание воды (способ Karl Fisher)
Вычислено, (%): 2,15
Обнаружено, (%): 2,1
Пример 3.
Безводная 7-[(7-(S)-амино-5-азаспиро[2,4}гептан-5-ил]-8-хлор-6-фтор-1-[(1R,2S)-2-фторциклопропил]-4-оксо-1,4-дигидрохинолин-3-карбоновая кислота.
Исходные кристаллы 7-[(7-(S)-амино-5-азаспиро[2,4]гептан-5-ил]-8-хлор-6-фтор-1-[(1R, 2S)-2-фторциклопропил]-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты добавляют к 360 ил 15% раствора аммиака в этаноле (по весу этанола; получают путем продувки газообразного аммиака через абсолютный этиловый спирт), и смесь перемешивают в течение 30 минут. После растворения кристаллов к раствору добавляют 0,2 г активированного угля с последующим фильтрованием. Фильтрат концентрируют при атмосферном давлении, удаляя примерно 260 мл растворителя. Концентрат охлаждают до комнатной температуры и собирают выпавшие в осадок кристаллы путем фильтрования и сушат при 40oC при пониженном давлении, получая 3,5 г целевого соединения.
Температура плавления 231oC (разложение).
Порошковая рентгеновская дифрактометрия (характерные пики):
Значение d (постоянные решетки) - Относительная интенсивность
(А)
11,35 - Слабая
10,72 - Сильная
9,07 - Исключительно сильная
6,94 - Исключительно слабая
5,63 - Исключительно сильная
5,42 - Сильная
4,99 - Слабая
4,54 - Сильная
4,45 - Слабая
4,32 - Сильная
3,83 - Сильная
3,70 - Исключительно слабая
3,56 - Сильная
3,47 - Слабая
3,42 - Исключительно слабая
3,35 - Слабая
3,19 - Сильная
ИК; νax (КВr) см-1: 3430, 2950, 2800, 1630, 1610
Элементный анализ для С19Н18F2ClN3O3:
Вычислено,(%): С 55,69; Н 4,43; N 10,25
Обнаружено,(%): С 55,78; Н 4,23; N 10,26
Содержание воды (способ Karl Fisher)
Вычислено, %: 0
Обнаружено, %: 0,2
Пример 4.
Моногидрат 7-[(7-(S)-амино-5-азаспиро[2,4} гептан-5-ил]-8-хлор-6-фтор-1-[(1R, 2S)-2-фторциклопропил] -4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты.
Исходные кристаллы 7-[(7-(S)-амино-5-азаспиро[2,4]гептан-5-ил]-8-хлор-6-фтор-1-[(1R, 2S)-2-фторциклопропил]-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты добавляют к 150 мл водного раствора метанола, имеющего содержание воды 1% или менее, для образования мутной взвеси. Взвесь перемешивают при 25oC в течение 3 дней. Кристаллы собирают путем фильтрования и сушат при комнатной температуре при пониженном давлении до тех пор, пока не подтвердится, что вес стал постоянным, получая 4,5 г целевого соединения. Порошковая рентгеновская дифрактометрия (характерные пики):
Значение d (постоянные решетки) - Относительная интенсивность
(А)
13,22 - Сильная
7,74 - Исключительно сильная
6,94 - Исключительно слабая
6,68 - Слабая
5,77 - Слабая
5,60 - Сильная
5,16 - Исключительная слабая
4,71 - Средняя
4,09 - Сильная
3,91 - Слабая
3,72 - Слабая
3,60 - Сильная
ИК; νax (КВr) см-1: 3620, 3410, 3080, 2870, 1630, 1610, 1540
Элементный анализ для С19Н18F2ClN3O3 Н2О:
Вычислено, (%): С 53,34; Н 4,71; N 9,82
Обнаружено, (%): C 53,31; H 4,55; N 9,93
Содержание воды (способ Karl Fisher)
Вычислено, %: 4,2
Обнаружено,%: 4,1
Пример 5.
3/2 Гидрат 7-[(7-(S)-амино-5-азаспиро[2,4}гептан-5-ил]-8-хлор-6-фтор-1-[(1R, 2S)-2-фторциклопропил] -4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты.
Исходные кристаллы 7-[(7-(S)-амино-5-азаспиро[2,4]гептан-5-ил]-8-хлор-6-фтор-1-[(1R, 2S)-2-фторциклопропил]-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты добавляют к смеси 45 мл мл этанола, 37 мл воды и 25 мл 28% аммиачной воды, и всю смесь перемешивают на бане при 45oC в течение 10 минут. После растворения кристаллов удаляют около 50 мл растворителя при пониженном давлении и целевые кристаллы собирают путем фильтрования, затем сушат при 40oC в вакууме, получая 7,32 г (94,8%) целевого соединения.
Пример приготовления 1.
Капсула:
Соединение формулы 1 (3/2 гидрат) - 100,0 мг
Пшеничный крахмал - 23,0 мг
Кальцикарбоксиметилцеллюлоза - 22,5 мг
Гидроксипропилцеллюлоза - 3,0 мг
Стеарат магния - 1,5 мг
Итого: - 150,0 мг
Пример приготовления 2.
Порошок для примешивания в корм:
Соединение по примеру 1 (3/2 гидрат) - 1 - 10 г
Пшеничный крахмал - 89,5 - 98,5 г
Легкая безводная кремниевая кислота - 0,5 г
Итого: 100 г
Хотя изобретение описано подробно с упоминанием конкретных примеров, для специалистов понятно, что различные изменения и модификации могут быть осуществлены без выхода за его рамки.
Описан способ получения любой из форм: безводной, 1/2 гидрата, 1 гидрата и 3/2 гидрата 7-/(7-(S)-амино-5-азаспиро /2,4/гептан-5-ил/-8-хлор-6-фтор-1-/(IR, 2S)-2-фторциклопропил/ -4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты, включающий обработку соединения в водном растворителе или в воде или перекристаллизацию соединения из водного растворителя или воды. Предложена также фармацевтическая композиция на основе вышеуказанной безводной кислоты, обладающая антибактериальной активностью. Безводная кислота проявляет также антимикробную активность. 2 с. и 4 з.п. ф-лы, 4 ил.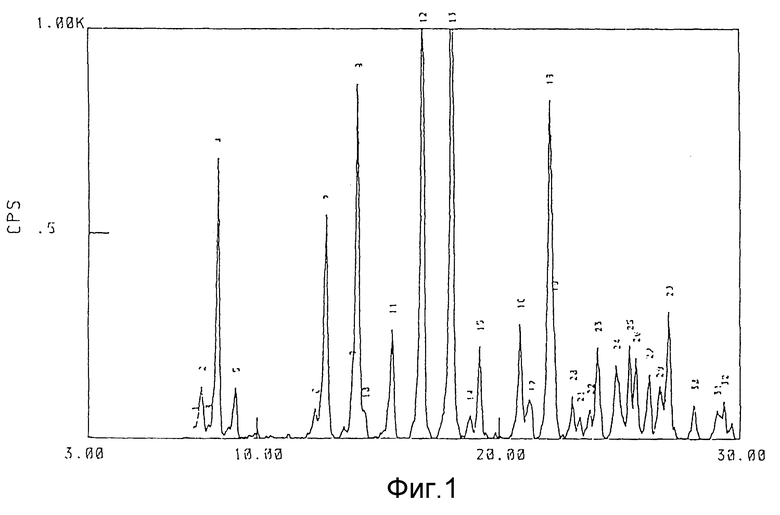
| АЭРОЗОЛЬНЫЙ ИНГАЛЯТОРФШДЖОЕГТ! | 0 |
|
SU341493A1 |
Авторы
Даты
1999-02-20—Публикация
1994-09-09—Подача