Изобретение относится к новым веществам с фармакологической активностью, более конкретно к производному вещества межклеточной адгезии ICAM-1 и кодирующей его ДНК.
ICAM-1 ("Intercellulat adhesion molecule" - молекула межклеточный адгезии), являющийся лигандом, связывающимся с LFA-1 (связанный с лимфоцитарной функцией антиген-1), представляет собой гликопротеин клеточной поверхности размером 76-114 кД, экспрессируемый на некроветочных клетках, таких как, например, эндотелиальные клетки сосудов и фибропласты, и на кроветворных клетках, таких как, например, эндотелиальные клетки сосудов, тимусные эпителиальные клетки, некоторые другие эпителиальные клетки, фибропласты, и на таких кроветворных клетках, как например, тканевые макрофаги, митогенстимулированные бластные клетки Т-лимфоцитов, терминативные центрированные B-клетки и дендрированные клетки в миндалинах, лимфотических узлах и пейеровых бляшках. ICAM-1 сильно экспрессируется на эндотелиальных клетках сосудов в областях Т-клеток в лимфатических узлах и миндалинах, у которых наблюдается гиперплазия. В малых количествах ICAM-1 экспрессируется на периферических кровяных лимфоцитах.
ICAM-1 содержит внеклеточную область из 5 иммуноглобулиноподобных доменов (домен 5 является ближайшим к поверхности клетки, домен 1 является наиболее удаленным от поверхности клетки), трансмембранный домен и цитоплазматический домен.
Задачей изобретения является представление нового высокоэффективного противовоспалительного агента.
Данная задача решается предлагаемым производным вещества межклеточной адгезии ICAM-1, обладающим противовоспалительными свойствами, содержащим пять последовательно расположенных иммуноглобулинподобных доменов ICAM-1, или пять последовательно расположенных иммуноглобулинподобных доменов и цитоплазматический домен ICAM-1, или пять последовательно расположенных иммуноглобулинподобных доменов и цитоплазматический домен ICAM-1, или пять последовательно расположенных иммуноглобулинподобных доменов и трансмембранный домен ICAM-1. Дальнейшим объектом изобретения является ДНК, кодирующая предлагаемое производное вещества межклеточной адгезии ICAM-1. Предлагаемую ДНК получают за счет конструирования рекомбинантными способами, и полученную таким образом ДНК экспрессируют в организме-хозяине с последующими ее выделением и очисткой.
На фиг. 1 показаны нуклеидная и аминокислотная последовательность кДНК ICAM-1. Первый фрагмент АТС находится в положении 58. Подчеркнуты транслируемые последовательности, соответствующие триптическим пептидам ICAM-1. Гидрофобный предполагаемый сигнальный пептид и трансмембранные последовательности подчеркнуты жирной чертой, N-связанные сайты гликозилирования обведены рамками. Сигнальная последовательность ААТААА в положении 2976 отмечена чертой над строкой. Приведенная последовательность соответствует кДНК клона HL-60. Последовательность для кДНК эндотелиальных клеток определена для общей части длины молекулы кДНК и показано, что имеются лишь незначительные различия.
На фиг. 2 показаны гомологические домены ICAM-1 и их связь с семейством супергена иммуноглобулинов. (А) Порядок расположения пяти гомологических доменов (D 1-5). В рамки заключены два или несколько идентичных остатков в выстроенных последовательностях. Остатки, встречающиеся два раза или несколько раз в доменах NCAM, а также остатки, сохраняющиеся в доменах рядов C2 и C1, упорядоченно расположены вместе с повторами внутри ICAM-1. Расположение предсказанных β-структур в домене ICAM-1 отмечено чертами и маленькими буквами над последовательностями, а известное положение β-структур в доменах иммуноглобулина C отмечено чертами и заглавными буквами над последовательностями. Расположение предполагаемого дисульфидного мостика в доменах ICAM-1 обозначено через 5-5. (B-D). Порядок расположения остатков в белковых доменах, гомологичных доменам ICAM-1. Белковыми последовательностями являются MAG, NCAM, V-домен α -субъединицы рецептора T-клетки, цепь Ig Mμ и a-1-β- гликопротеин.
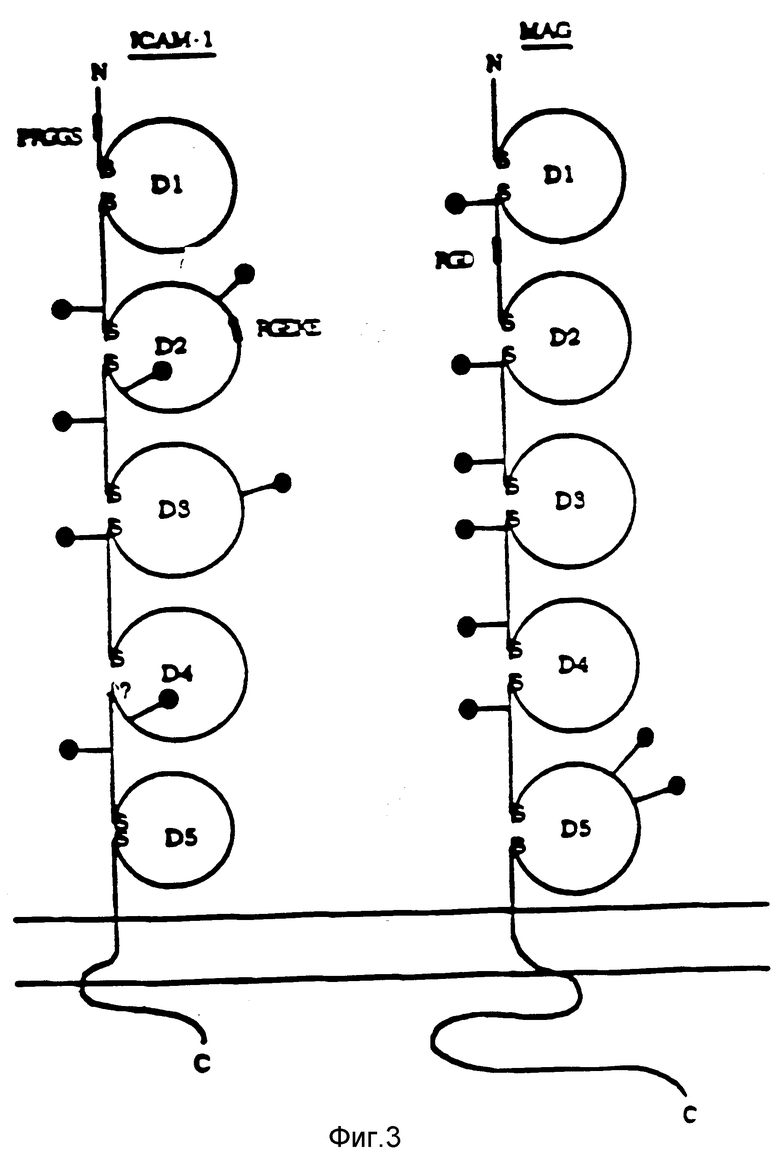
Фиг. 3 представляет собой диаграмму сравнения вторичных структур ICAM-1 и MAG.
5 вышеупомянутых иммуноглобулинподобных доменов или полный внеклеточный домен ICAM-1 показаны (с упорядоченным расположением остатков) на фиг. 2A.
Домены 1-4 содержат 88, 97, 99 и 99 остатков соответственно, что является типичным для размера домена 1; домен 5 усечен до 68 остатков. Анализ показывает, что имеется значительная гомологичность с представителями семейства иммуноглобулинового супергена, в том числе с C-доменами Ig Mμ и IgG, переменным доменом α-субъединицы рецептора T-клетки, и с альфа-1-бетагликопротеином (фиг. 2B-D).
Различают три типа доменов суперсемейства Ig: V, C1 и C2. Домены V и C состоят из 2 β- слоев, связанных друг с другом внутридоменной дисульфидной связью; домены V содержат 9 антипараллельных β- структур, в то время как домены C содержат 7 таких структур. Постоянные домены разделены на ряды C1 и C2 на основе характерных остатков, показанных на фиг. 2A. Ряд C1 включает в себя белки, принимающие участие в распознавании антигена. Ряд C2 включает в себя несколько Ec-рецепторов и белков, принимающих участие в адгезии клеток, в том числе CD2, LFA-3, MAG и NCAM. Найдено, что домены ICAM-1 обладают наиболее ярко выраженной гомологичностью с доменами ряда C2, что позволяет отнести ICAM-1 к этому ряду: это выражается в большом сходстве его остатков с остатками, сохраняющимися в доменах C2, чем в доменах C1, как это показано для β- структур B-F на фиг. 2. Кроме того, домены ICAM-1 значительно лучше совпадают с β- структурами A и G доменов C2, чем с этими структурами в доменах V и C1, что дает хорошее соответствие порядка расположения по всей длине домена C2. Сравнение порядка расположения остатков с порядком расположения в доменах C2 из NCAN. MAG и альфа-1-бета-гликопротеина показано на фиг. 2B и 2C; степень идентичности составляет от 28 до 33%. Показаны также сравнения (фиг. 2B, 2D) с Vα рецептора T-клеток (степень идентичности 27%) и C-доменом 3 IgM (степень идентичности 34%).
Одной из наиболее важных характеристик доменов иммуноглобулинов является наличие связанных дисульфидным мостиком цистеинов, соединяющих β- структуры B и F, что стабилизирует сандвич β- слоя; в ICAM-1 цистеины сохраняются во всех случаях, за исключением структуры f домена 4, в котором обнаружены лейцин, способный обращаться внутрь сандвича и стабилизировать контакт, как это предложено для некоторых других доменов ряда V и C2. Расстояние между цистеинами (остатки 43, 50, 52, 37) такое, как описано для ряда C2.
Найдено, что ICAM-1 обладает наиболее ярко выраженной гомологичностью с гликопротеинами NCAN и MAC ряда C2. Это представляет особенный интерес, поскольку NCAM и MAC являются медиаторами адгезии клеток друг к другу, NCAM играет важную роль во взаимодействиях нейтрона с нейтроном и в нейтроно-мышечных взаимодействиях, в то время как MAG играет важную роль во взаимодействиях нейтрона с олигодентроцитом и олигодентроцита с олигодентроцитом при миенилизации.
Пример 1. Конструирование и экспрессия производных ICAM-1 кДНК ICAM-1 расщепляют рестрикционными эндонуклеазами Sal 1 и Kpn 1, и полученный фрагмент ДНК размером 1,8 тыс. пар оснований субклонируют в плазмидный вектор CDM8. Полученным конструктом pCD178C трансформируют штамм dut-, ung- E.coli (BW313/P3). Однонитевую урацилсодержащую матрицу выделяют из трансформантов с помощью инфекции фагом-помощником R408. Мутантные кДНК ICAM-1 получают синтезом второй нити с применением олигонуклеотида, содержащего несоответствующие основания, и последующей трансформацией хозяина ung+ (MC1061/P3) полученной гетерогенной парой. Мутанты выделяют отбором по вновь сконструированным сайтам рестрикции под действием эндонуклеаз, введенным мутантным олигонуклеотидом. Мутантный белок ICAM-1 экспрессируют путем трансфекции клеток COS-7 мутантной ДНК в эукариотном экспрессионном векторе CDMDB.
Синтезируют функциональное производное ICAM-1, содержащее внеклеточную область, имеющую все 5 иммуноглобулинподобных доменов. Мутантный олигонуклеотид, состоящий из 30 пар оснований (CNC TCC CCC CGG TTC TAG ATT GTC ATC ATC), используют для того, чтобы трансформировать кодоны аминокислот тирозин (Y) и глутаминовой кислоты (E) в положениях 452 и 453 соответственно, в кодон фенилаланин (F) и стоп-кодон трансляции (TAG). Мутант выделяют по его рестрикционному сайту Xba1. Его обозначают Y452E/F, TAG.
Для экспрессии мутантного белка клетки COS трансфекцируют тремя мутантными субклонами (N 2, N 7, N 8). Через три для после трансфекции указанными тремя мутантными клонами супернатанты культуры и клеточный лизат анализируют методом иммуноосаждения с помощью моноклонального антитела против ICAM-1 (RRI/I) и методом ДСН-ПАГЭ (электрофорез на полиакриламидном геле с использованием додецилсульфата натрия). ICAM-1 осаждается из супернатантов культур клеток, трансформированных мутантными субклонами N 2 и N 8, но не из детергентных лизатов этих клеток. Молекулярная масса ICAM-1, обнаруженного в супернатантных культур, примерно на 6 кДальтон меньше молекулярной массы мембранной формы ICAM-1, что согласуется с размером, предположенным с учетом мутантной ДНК. Таким образом, это функциональное производное ICAM-1 выделяется в виде растворимого белка. Напротив, ICAM-1 не поддается иммуноосаждению из супернатантов контрольных культур, трансфекцированных нативным ICAM-1, что показывает, что мембранная форма ICAN-1 не выделяется из клеток COS. Более того не наблюдается иммуноосаждение ICAM-1 ни из супернатантов культур, ни из клеточных лизатов псевдотрансфекцированных клеток (отрицательный контроль), "Усеченный" ICAM-1, выделенный из трансфекцированных клеток, очищают иммуноаффиной хроматографией с использованием специфичного антитела против ICAM-1 (R6-5-6), и его проверяют на функциональную активность с помощью анализа на связывание с клетками. После очистки в присутствии детергента октилглюкозида препараты, содержащие нативный ICAN-1 или "усеченный" ICAM-1, разбавляют до конечной концентрации октилглюкозида, равной 0,25% (концентрация меньше критической концентрации мицеллообразования детергента). Этим препаратам ICAM-1 дают возможность связываться с поверхностями пластмассовых чашек, имеющих 96 ячеек, чтобы получить ICAM-1, связанный с твердой фазой. После отмывки от несвязанного вещества, примерно 75-80% и 83-88% клеток SKW-3, несущих на своей поверхности LFA-1, связываются специфически с нативной и усеченной формами ICAM-1 соответственно. Полученные данные показывают, что полученный "усеченный" растворимый ICAM-1 сохраняет как иммунологическую реакционную способность, так и способность опосредовать зависящую от ICAM-1 адгезию, что является свойствами, характерными для нативного ICAM-1.
Функциональное производное ICAM-1, содержащее 5 иммуноглобулиновых доменов и трансмембранный домен, получают аналогичным способом.
Состоящий из 25 пар оснований олигонуклетид (TC AGC ACG TAC CTC TAG AAC CGC CA) используют для того, чтобы заменить кодон аминокислоты в положении 476 (Y) на стоп-кодон трансляции TAG. Этот мутант обозначают Y476/TAG. Иммуноосаждением и анализом ДСН-ПАГЭ клеток COS, трансфекцированных мутантом, выделяют связанную с мембранной форму ICAM-1 с молекулярной массой примерно на 3 кД меньше, чем у нативного ICAM-1. Косвенная иммунофлуоресценция трансфекцированных мутантом клеток COS показывает наличие пятен, аналогичных в случае нативного ICAM-1, экспрессируемого на эндотелиальных клетках человека, стимулированных LPS. Наконец, клетки, трансфекцированные мутантной ДНК, специфически связываются с очищенным LFA-1 на пластмассовых поверхностях способом, аналогичным имеющему место в случае клеток COS, трансфекцированных ДНК нативного ICAM-1.
Пример 2. Повторяют пример 1 с той лишь разницей, что трансмембранный домен, аминокислоты 454-476, удаляют из ICAM-1 путем обработки состоящего из 48 пар оснований олигонуклеотида. При этом кодоны Y452 и E453 соответственно связываются с кодонами N477 и R478, что подтверждено анализом аминокислотной последовательности. В результате иммуноосаждения и электрофореза на полиакриламидном геле с использованием додецилсульфата натрия обнаруживается уменьшенный молярный вес по сравнению с ICAM-1. Кроме того, экспрессию данного мутанта ICAM-1 проверяют с помощью моноклональных антител RRI/I, R6.5, LB-2 и CL203.
Как уже указывалось выше, предлагаемые производные ICAM-1 являются высокоэффективным противовоспалительным агентом.





Изобретение может быть использовано в биотехнологии и относится к производному вещества межклеточной адгезии ICAM-I. Производное имеет пять последовательно расположенных иммуноглобулиновых доменов ICAM-I и цитоплазматический домен ICAM-I или трансмембранный домен ICAM-I. ДНК, кодирующую производное ICAM-I, получают рекомбинантным путем. Производное ICAM-I может быть полезно как новый высокоэффективный противовоспалительный агент. 2 с.п. ф-лы, 1 табл., 3 ил.
| Аналогов в патентной и научно-технической литературе не обнаружено. |
Авторы
Даты
1999-02-20—Публикация
1989-09-28—Подача