Изобретение относится к терапевтически активным производным гидроксамовой кислоты, способам их получения, фармацевтическим композициям их содержащим и к использованию таких соединений в медицине. В частности, эти соединения являются ингибиторами металлопротеиназ, участвующих в процессе разрушения тканей и, кроме того, являются ингибиторами выделения фактора некроза опухолей из клеток.
Считается, что соединения, обладающие свойством ингибировать действие металлопротеиназ, участвующих в разрушении соединительных тканей, например коллагеназы, стромелизина и желатинозы (известных как "матричные металлопротеиназы" и обозначаемые в данном контексте ММР), являются потенциально полезными для лечения или профилактики в случае таких разрушений соединительной ткани, как например, ревматоидный артрит, остеоартрит, остеопения, например, остеопороз, пермодонтит, гингивит, эпидермальное изъязвление или язва желудка, инвазия и рост метастаз.
Фактор некроза опухолей (обозначаемый TNF), является цитокином, который продуцируется первоначально как связанный с клеткой 28 kD-предшественник. Он выделяется в виде активной 17 kD-формы, которая может оказывать разрушительное действие in vivo. При введении его в организм животных или людей он вызывает воспаление, лихорадку, кардиоваскулярные эффекты, кровотечение, коагуляцию и обострения, похожие на те, которые возникают при острых заболеваниях или в шоковом состоянии. Постоянное введение может также вызвать худосочие и анорексию. Накопление избыточного TNF может быть летальным.
В результате проверки на животных накоплено большое количество данных, свидетельствующих, что блокирование действия TNF специфическими антителами может быть полезным в случае острых инфекций, шокового состояния, реакции организма-хозяина при трансплантации и аутоиммунных болезней. TNF также является аутокринным фактором роста некоторых миелом и лимфом и может ингибировать нормальное кровообразование у пациентов с этими новообразованиями.
Поэтому соединения, ингибирующие образование или действие TNF, считаются потенциально полезными при лечении и профилактике многих воспалительных, инфекционных, иммунологических или злокачественных заболеваний. Эти заболевания включают (но не ограничиваются) септический шок, гемодинамический шок и синдром сепсиса, постишемические заболевания, малярию, болезнь Крона, микобактериальную инфекцию, менингит, псориаз, инфаркты, худосочие, отторжение имплантатов, рак, аутоиммунные болезни, ревматоидный артрит, рассеянный склероз, последствия облучения, токсичность, вызванную применением иммуноподавляющих моноклональных антител, например, ОКТЗ или САМРАТН-1 и альвеолярные повреждения.
Поскольку образование избытка TNF отмечено в случае различных заболеваний или условий, также характеризующихся разрушением ткани, вызванным ММР, соединения, ингибирующие образование как ММР, так и TNF могут иметь преимущества при лечении или профилактике болезней и условий, при которых работают оба механизма.
Известно несколько классов ингибиторов ММР, включая производные гидроксамовой кислоты. Ингибиторы ММР на основе гидроксамовой кислоты описаны в следующих патентах:
US 4599361 (Searle)
ЕР-А-0236872 (Roche)
EP-A-0274453 (Bellon)
WO 90/05716 (British Bio-technology)
WO 90/05719 (British Bio-technology)
WO 91/02716 (British Bio-technology)
EP-A-0489577 (Celitech)
EP-A-0489579 (Celitech)
EP-A-0497192 (Roche)
WO 92/13831 (British Bio-technology)
WO 92/22523 (Research Corporation Technologies)
WO 93/09090 (Yamanouchi)
Активность соединений большой группы производных гидроксамовой кислоты, описанных в вышеприведенных патентах, по отношению к конкретным ММР может быть высокой. Например, многие соединения имеют IС50 коллагеназы in vitro (по методу Cawston and Barrett, Anal. Biochem. 99, 340-345, 1979) менее 50 нМ. Однако физико-химические и/или фармакокинетические свойства конкретных соединений, описанных в этих патентах, обычно неудовлетворительны.
Создание ингибиторов ММР на основе гидроксамовой кислоты, сочетающих высокую активность по отношению к ММР и хорошие физико-химические и/или фармокинетические свойства, что обеспечивает простое получение препаратов для применения, хорошую биодоступность в течение приемлемого времени после их введения в организм и высокую активность in vivo по отношению к болезням, по-прежнему является целью работ в данной области. Вышеуказанные патентные документы не содержат сведений, касающихся ингибирования выделения TNF. Оказалось, что из уровня техники неизвестны производные гидроксамовой кислоты, сочетающие ингибирующие свойства по отношению к ММР и анти-TNF свойства.
Производные гидроксамовой кислоты, описанные в вышеуказанных публикациях, имеют следующую структуру (IА):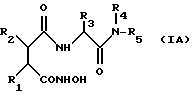
где пять заместителей R1-R5 имеют различные значения, указанные в каждой публикации. Сочетание уровня активности, степени специфического ингибирования различных видов ММР, физико-химических и фармакокинетических свойств может непредсказуемым образом меняться в зависимости от значений заместителей R1-R5.
Из всех указанных публикаций только в ЕР-А-0236872 раскрыт случай, когда у ингибиторов коллагеназы общей формулы (IА) заместитель R1 может быть гидроксилом. Это значение упоминается среди многих других возможных значений R1 в контексте соединений, у которых R3 - боковая цепь природной аминокислоты, у которой любой функциональный заместитель может быть блокирован, любая аминогруппа может быть ацилирована и любая карбоксильная группа может быть этерифицирована.
В ЕР-А-0236872 не раскрыты соединения, имеющие предпочтительные, улучшенные ингибирующие свойства по отношению к коллагеназе и нет описания конкретного соединения, в молекуле которого R1 - гидрокси. В этой публикации не рассматривается проблема получения производных гидроксамовой кислоты, ингибирующих ММР, сочетающих высокую активность с хорошими физико-химическими и фармакокинетическими свойствами.
Данное изобретение относится к новой группе соединений общей формулы (IА), принципиально отличающихся тем, что R1 является гидроксильной группой, а заместитель R3 не является боковой цепью природной аминокислоты. Было установлено, что такие соединения в общем имеют желаемую, но непредсказуемую комбинацию свойств, включая хорошую растворимость в воде, активность, ингибирующую ММР, включая как коллагеназу, так и стромелизин. Этот класс включает соединения, которые приводят к высокому уровню сыворотки после орального применения и которые активны in vivo при оральном введении подопытным животным, больным заболеваниями, вызванными ММР. Кроме того, как уже сказано выше, соединения по изобретению обладают неожиданным и желаемым свойством ингибировать образование TNF.
Согласно одному аспекту данного изобретения получают соединение формулы (I):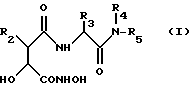
где R2 - R6 А-, где A представляет двухвалентный линейный или разветвленный, насыщенный или ненасыщенный углеводородный радикал, содержащий до 6 атомов С, который может содержать в основной цепи атомы О или S, и R6 водород или необязательно замещенный фенил, циклоалкил или циклоалкинил;
R3 - R4 - (В)n-, где n = 0 или 1, В представляет собой двухвалентный линейный или разветвленный, насыщенный или ненасыщенный углеводородный радикал, содержащий до 6 атомов С, который может содержать в основной цепи атомы О или S, R7 - CONHOH, карбоксил, этерифицированный или амидированный карбоксил, циклоалкил, циклоалкенил, гетероциклил, фенил, нафтил или замещенные фенил и нафтил, причем заместители выбраны из группы, включающей фенил, гидрокси, C1-C6 - алкокси, бензилокси или R8-(С=0)-(С1-С6-алкил)-О-, где R8 - гидрокси, амино или остаток аминокислоты, присоединенный через амидную группу, или (за исключением случая, когда n = 0), R7 - водород;
R4 - водород или метил; R5 - водород, C1-С6 - алкил или D-(C1-C6) - алкил, где D - гидрокси, (С1-C6) - алкокси, (С1-С6) - алкилтио, ациламино, необязательно замещенный фенил или гетероциклическая группа, NH2, или моно- или ди-(С1-C6-алкил)амин или гетероциклическая группа;
или R3 и R5 вместе образуют двухвалентный, насыщенный или ненасыщенный углеводородный радикал, содержащий 8 - 16 атомов С, который может содержать в основной цепи гетероатомы О, S или N;
или его соль, сольват или гидрат;
при условии, что R3 не является боковой цепью природной аминокислоты или боковой цепью природной аминокислоты, у которой любой функциональный заместитель блокирован, любая аминогруппа ацилирована и любая карбоксильная группа этерифицирована.
В контексте данного описания термин "C1-С6-алкил" или "замещенный углеводородный радикал, содержащий до 6 атомов С" относится к линейной или разветвленной алкильной группе, содержащей 1 - 6 атомов С, включая, например, метил, этил, пропил, изопропил, бутил, третбутил, пентил и гексил.
Термин "С2-С6-алкенил" или "ненасыщенный углеводородный радикал, содержащий до 6 атомов С, относится к линейному или разветвленному алкенилу, содержащему от 2 до 6 атомов С и имеющему в дополнение одну двойную связь или E- или Z-стереохимии. Этот термин относится, например, к винилу, 1-пропенилу, 1- и 2-бутенилу и 2-метил-2-пропенилу.
Термин "циклоалкенил" относится к ненасыщенному алициклическому радикалу, содержащему 3 - 8 атомов С, и включает, например, циклогексенил, циклооктенил, циклогептенил, циклопентенил, циклобутенил и циклопропенил. В случае циклоалкенилов, содержащих 5 - 8 атомов С, кольцо может содержать более одной двойной связи.
Термин "гетероциклил" или "гетероциклический" относится к 5-7-членному гетероциклическому кольцу, содержащему один или несколько гетероатомов: S, N или О, и может означать гетероцикл, сконденсированный с бензольным ядром, включая, например, пиролил, фуранил, тиенил, имидазолил, оксазолил, тиазолил, пиразолил, пиридинил, пирролидинил, пиримидинил, морфолинил, пиперизинил, индолил и бензимидазол.
Если иначе не оговаривается, термин "замещенный" означает замещенный 1 - 4-мя заместителями, каждый из которых может независимо означать C1-C6 алкокси, гидрокси, тио, C1- C6-алкилтио, амино, галоген (включая фтор, хлор, бром и иод), трифторметил, нитро, -СООН, -CONH2 или CONHRA, где RA - C1-C6-алкил или остаток природной альфа-аминокислоты.
Термин "боковая цепь природной альфа-аминокислоты" означает боковую цепь, присоединенную к -CH(NH2)(СООН)-группам следующих аминокислот: глицин, аланин, валин, лейцин, изолейцин, фенилаланин, тирозин, триптофан, серин, треонин, цистеин, метионин, аспарагин, глутамин, лизин, гистидин, аргинин, глутамовая кислота и аспартовая кислота.
Когда карбоксильная группа в соединениях формулы (I) этерифицирована, эфирная группа может быть, например, производной C1-C6-алканола или бензилового спирта.
Когда в соединениях формулы (I) карбоксильная группа амидирована, примеры включают аминокарбонил, (C1-C6-алкил)аминокарбонил, ди-(C1-C6- алкил)аминокарбонил и бензиламинокарбонил, а также карбоксильная группа может быть амидирована аминокарбоновой кислотой, например, природной альфа-аминокислотой (например, глицином, аланином и т.д.).
Соли соединений по изобретению включают физиологически приемлемые соли присоединения, например, гидрохлориды, гидробромиды, сульфаты, метансульфонаты, n-толуолсульфонаты, фосфаты, ацетаты, цитраты, сукцинаты, лактаты, тартраты, фумараты и малеаты. Соли могут получаться при реакции с основаниями, например, соли натрия, калия, магния и кальция.
Благодаря наличию асимметричного атома углерода в соединениях по изобретению имеется несколько хиральных центров.
Наличие нескольких асимметричных атомов углерода порождает ряд диастереомеров с R- или S-стереохимией у каждого хирального центра. Следует иметь в виду, что общая формула (I) и (если это иначе не оговаривается) все другие формулы в этом описании охватывают все такие стереоизомеры и их смеси (например, рацемические смеси).
В соединениях по данному изобретению предпочтительна следующая стереохимия:
С-атом, имеющий в качестве заместителя гидроксильную группу и остатки гидроксамовой кислоты - S,
С-атом с заместителем R2-R,
С-атом с заместителем R3-S,
но предполагаются также смеси, в которых превалируют вышеуказанные конфигурации.
В соединениях по изобретению:
R2 может быть, например, С3-С6-алкил, циклоалкил (С3-С6-алкил), фенил (С2-С6-алкил), С2-С4-алкокси (С1-С3-алкил)m или С2-С4-алкилсульфанил (C1- С3-алкил)m, где m = 0 или 1. Примеры конкретных R2 групп включают изобутил, н-пентил, циклогексилпропил, циклогексилбутил, циклогексилпентил, фенилэтил, фенилпропил, фенилбутил, фенилпентил, пропилоксиметил и пропилсульфанил. Предпочтительны соединения, у которых R2 - изобутил, (всегда при условии, что R3 не является характерной боковой цепью природной альфа-аминокислоты или характерной боковой цепью природной альфа-аминокислоты, у которой любой функциональный заместитель блокирован, любая аминогруппа ацилирована и любая карбоксильная группа этерифицирована), R3 может представлять собой, например, фенил, C1-C6- алкил, С2-С6-алкинил, фенил (С2-С6-алкил), замещенный фенил (С2-С6-алкил), циклоалкил, циклоалкил (С2-С6-алкил), тиенил, тиенил (С1-С6-алкил), пиридил (С1-С6-алкил), тиазолил (С1-С6-алкил), тиофуранил (С1-С6-алкил), бензотиофуранил (С1-С6-алкил) или имидазолил (С1-С6-алкил); или R3 и R5, взятые вместе, могут образовать С7-С12-алкиленовую цепь, которая может содержать в основной цепи гетероатомы - О, S или N. Примерами конкретных R3-групп являются фенил, третбутил, циклогексилпропил, циклогексилбутил, циклогексилпентил, необязательно замещенные фенилэтил, фенилпропил, фенилбутил и фенилпентил, в которых возможные заместители находятся в фенильном ядре и выбраны из группы, включающей фенил, гидрокси, C1-С6-алкокси, бензилокси, тетрафторметил, галоид (например, хлор) и R8 - (С = O)-(С1-С6-алкил)-O-, где R8 - гидрокси, аминогруппа или остаток аминокислоты, присоединенный через амидную связь. Другие примеры R3-групп включают фенилэтил, циклогексил, тиенил (C1-C6-алкил), пиридилметил, тиазолилметил, тиофуранилметил, бензотиофуранилметил или имидазолилметил, 1-этенил, 1-пропенил, 1-пропинил, 2,2- диметилпропил, нафтил, нафтилметил, пропилоксиметил, бутилоксиметил и пропилсульфанилметил и бутилсульфанилметил. Предпочтительны соединения, в которых R3 - циклогексилметил, третбутил, 2-тиенилметил, (4-гидроксикарбонилметокси)фенилметил,(4-фенил) фенилметил, метоксикарбонилэтил и N-гидроксиаминокарбонилэтил;
R4 может быть, например, водородом, метилом или этилом. Предпочтительны соединения, в которых R4 - водород; R5 может быть, например, водородом или С1-С4-алкилом или группой D-(C1- С6-алкил), где D представляет собой гидрокси, (C1-С6-алкокси), (С1-С6)алкилтио, ациламино, необязательно замещенный фенил или гетероциклическую группу. Примерами конкретных R5-групп являются метил, этил, пропил, бутил, гидроксиэтил, 2-этилтиоэтил, 2-ацетоксиэтил, N-ацетил-2-аминоэтил, 3-(2-пирролидон)пропил, необязательно замещенный фенилэтил, фенилпропил, фенилбутил и фенилпентил. Предпочтительны соединения, в которых R5 является метилом или этилом.
Интересными соединениями являются:
N2-[3S-гидрокси-4-(N-гидроксиамино)-2R-изобутилсукцинил] -L-(4-оксиметил-карбокси)-фенилаланин-N1-метиламид;
N2-[3S-гидрокси-4-(N-гидроксиамино)-2R-изобутилсукцинил] - L -фенилглицин-N1-метиламид;
N2-[3S-гидрокси-4-(N-гидроксиамино)-2R-изобутилсукцинил] - L-(4-фенил)-фенилаланин-N1-метиламид; '
N3-[3S-гидрокси-4-(N-гидроксиамино)-2R-изобутилсукцинил] - амино-1-азациклотридекан-2-ОН;
N2-[3S-гидрокси-4-(N-гидроксиамино)-2R-изобутилсукцинил] - L-3-(1-пиразолил)аланин-N1-метиламид;
N2-[3S-гидрокси-4-(N-гидроксиамино)-2R-изобутилсукцинил] - L-4-(N-гидроксиамино)глютамовой кислоты-N1-метиламид;
N2-[3S-гидрокси-4-(N-гидроксиамино)-2R-изобутилсукцинил] - L-3-(2-тиенил)аланин-N1-метиламид;
N2-[3S-гидрокси-4-(N-гидроксиамино)-2R-изобутилсукцинил] - L-циклoгeкcил-аланин-N1-(3-(2-пирролидон)пропил)амид;
их соли, сольваты или гидраты.
Соединения по изобретению, которые особенно предпочтительны из-за сочетания хороших препаративных свойств, например, растворимости в воде, высокой активности в ингибировании коллагеназы и стромелизина, активности в ингибировании выделения TNF и хороших фармакокинетических свойств, выражающихся, например, в высокой активности in vivo после орального введения в стандартную модель адъюванта крысы с артритом, представляют собой:
N2-[3S-гидрокси-4-(N-гидроксиамино)-2R-изобутилсукцинил] - -L-циклогексил-аланин-N1-метиламид;
N2-[3S-гидрокси-4-(N-гидроксиамино)-2R-изобутилсукцинил] - L-третлейцин-N1-метиламид и их соли, сольваты или гидраты.
Соединения по изобретению могут быть получены способами, известными per se из уровня техники, и по следующему способу, который представляет собой другой аспект изобретения, а именно по способу получения соединения формулы (I), включающему:
(а) сочетание кислоты общей формулы (II)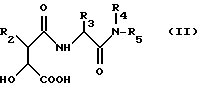
или ее активированного производного с гидроксиламином, О-замещенным гидроксиламином или их солями, причем R2, R3, R4 и R5 имеют значения, указанные для общей формулы (I), за исключением того, что любые заместители в R2, R3, R4 и R5, которые потенциально могут взаимодействовать с гидроксиламином, О-замещенным гидроксиламином или их солями, могут сами быть защищены от такой реакции с последующим удалением блокирующих групп из образующихся остатков гидроксамовой кислоты и из любых защищенных заместителей в R2, R3, R4 и R5, и
(b) возможное превращение соединения общей формулы (I) в другое соединение общей формулы (I).
Превращение (II) в активированный промежуточный продукт, например, пентафторфениловый, гидроксисукциниловый или гидроксибензотриазолиловый эфиры, можно осуществлять реакцией с соответствующим спиртом в присутствии дегидратирующего агента, например, дициклогексилдикарбодиимида (DCC), N,N-диметиламинопропил-N1-этилкарбодиимида (W S CDI) или 2-этокси-1-этоксикарбонил-1,2-дигидрохинолина (ЕЕ DQ).
Блокирующие группы хорошо известны per se, например, в химии пептидов. Аминогруппы часто защищаются бензильными, карбонильными, третбутоксикарбонильными или ацетильными группами или в виде фталимидной группы. Гидроксильные группы часто защищаются в виде легко расщепляющихся простых эфиров, например, третбутилового или бензилового эфира, или в виде легко расщепляющихся сложных эфиров, например ацетата. Карбоксильные группы часто защищаются в виде легко расщепляющихся простых эфиров, например третбутилового или бензилового.
Соединение общей формулы (II) может быть получено сочетанием кислоты формулы (III) или ее активированного производного с амином формулы (IV),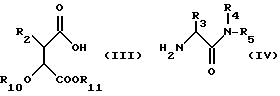
где R2, R3, R4 и R5 имеют значения, указанные для общей формулы (I), и R10 и R11 по отдельности представляют собой группы, блокирующие гидроксилы или взятые вместе образуют двухвалентную группу, которая одновременно защищает обе гидроксильные группы, с последующим удалением блокирующих групп. Активные производные кислоты (III) включают активированные эфиры, например, пентафторфениловый эфир, ангидриды и галоидангидриды, например, хлорангидриды. R10 и R11 могут быть любой стандартной блокирующей гидроксилгруппой, но особенно предпочтительна одновременная защита двух гидроксильных групп в форме диоксалона формулы (V):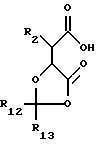
где R12 и R13 получены из реагента, образующего диоксалон и могут быть, например, водородом, алкилом, фенилом или замещенным фенилом.
Как указано выше, соединения формулы (I) полезны в медицине и ветеринарии, т. к. они активны как ингибиторы MMP, а также способны ингибировать выделение TNF из клеток.
Согласно другому аспекту изобретение касается:
(i) способа воздействия (под которым подразумевается лечение или профилактика) на болезни или состояния, вызываемые ММР и/или TNF у млекопитающих, в частности у людей, заключающегося во введении в организм млекопитающего эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли и
(ii) соединения формулы (I) для использования в медицине или ветеринарии, в частности для воздействия (под которым подразумевается лечение или профилактика) на болезни или состояния, вызываемые ММР и/или TNF, и
(iii) использования соединения формулы (I) при приготовлении агента для воздействия (под которым подразумевается лечение или профилактика) на болезни или состояния, вызываемые ММР и/или TNF.
Болезни или состояния, вызываемые ММР, включают такие, которые связаны с разрушением ткани, например резорбция костей, воспалительные заболевания, дерматологические состояния и вторичные метастазы, в особенности ревматоидный артрит, остеоартирит, периодонтит, гингивит, изъязвление роговицы, вторичные метастазы. Болезни или состояния, вызываемые TNF, включают воспаления, грипп, кардиоваскулярные эффекты, кровотечение, коагуляцию и острую реакцию, худосочие и анорексию, острые инфекции, шоковые состояния, реакцию на имплантаты и автоиммунные заболевания.
Согласно дальнейшему аспекту изобретения предлагается фармацевтическая или ветеринарная композиция, включающая соединение формулы (I) вместе с фармацевтически приемлемым или приемлемым в ветеринарии носителем. Вследствие растворимости в воде и оральной биодоступности соединений по изобретению фармацевтическая или ветеринарная композиция, включающая соединение формулы (I) вместе с приемлемым носителем, предназначена для орального применения.
Одно или более соединений формулы (I) может использоваться в композиции вместе с одним или несколькими носителями.
Соединения по изобретению могут быть подготовлены к применению способом, соответствующим их фармакокинетическим свойствам. Применяемые орально композиции могут быть в форме таблеток, капсул, порошков, гранул, пастилок, жидких или гелевых препаратов, например оральных, локальных или стерильных парентеральных растворов или суспензий. Таблетки и капсулы для орального применения могут содержать только единицу дозы активного вещества и могут содержать обычные добавки, например связующие, такие как сироп, акацию, желатин, сорбитол, трагакант или поливинилпирролидон; наполнители, например, лактозу, сахар, маисовый крахмал, кальций фосфат, тальк, полиэтиленгликоль или окись кремния; размельчители, например, картофельный крахмал, или приемлемые смачиватели, такие как лаурилсульфат натрия. Таблетки могут содержать покрытие, нанесенное методами, хорошо известными в фармацевтической практике. Оральные жидкие препараты могут быть в форме, например, водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров, или могут быть в виде сухих порошков для восстановления водой или другим подходящим разбавителем перед применением. Такие жидкие препараты могут содержать обычные добавки, например, суспендирующие агенты, такие как сорбитол, сироп, желатин, гидрированные съедобные жиры, эмульгаторы, например лецитин, сорбитанмоноолеат или акация, неводные разбавители (которые могут включать съедобные масла), например миндальное масло, фракционированное кокосовое масло, эфиры глицерина, пропиленгликоля или этилового спирта, стабилизаторы, например, метил- или пропил-n-оксибензат или сорбиновая кислота, и, если желательно, вкусовые добавки и красители.
Доза, используемая при оральном применении, может содержать от ~1 до 250 мг, предпочтительно от ~25 до 250 мг соединения по изобретению. Дневная доза для млекопитающего может колебаться в широких пределах, зависящих от состояния пациента. Однако подходящей является доза соединения формулы (I), равная 0,1 - 300 мг/кг веса, предпочтительно 1 - 100 мг/кг веса тела.
Для локального применения на коже, лекарство может быть в виде крема, лосьона или мази. Составы крема или мази составляются по обычной методике, хорошо известной в данной области, например описанной в стандартных учебниках по фармацевтике, например в British Pharmacopoeia.
Для локального применения для глаз лекарство может быть в виде раствора или суспензии в подходящем стерильном водном или неводном разбавителе.
Могут также добавляться добавки, например буферы, такие как метабисульфит натрия или disodium edeate; стабилизаторы, включая бактерициды и фунгициды, такие как фенилртутоацетат или нитрат, бензалконийхлорид или хлориксидин, и защищающие агенты, например гипромеллоза.
Доза при локальном применении будет, конечно, зависеть от площади обрабатываемой поверхности. Для глаз каждая доза обычно находится в интервале 10-100 мг лекарства.
Активный ингредиент можно также применять парентерально в стерильной среде. При этом в зависимости от вида разбавителя и используемой концентрации лекарство может быть в виде суспензии или раствора. Преимущественно в растворе содержатся добавки, например, локальные анестетики, стабилизаторы и буферные добавки.
Для лечения ревматоидного артрита лекарство можно применять орально или путем инъекции в пораженный сустав. Дневная доза для пациента весом 70 кг находится в интервале 10 мг - 1 г.
Изобретение иллюстрируется следующими примерами. Аминокислоты, используемые в примерах, являются коммерчески доступными или приготовлены известными из литературы методами. Во всех случаях они были превращены в требуемые N-метил-амиды обычными методами.
Пример 1.
N2-[3S-гидрокси-4-(N-гидроксиамино)-2R-изобутилсукцинил] - L-циклогексилаланин-N1-метиламид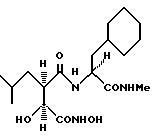
Пример 1а.
Изопропил-3R-карбоксиизопропил-2S-гидрокси-5-метилгекс-5-еноат
Диизопропил-2S-гидроксибутандиоат (50 мг, 230 ммол) добавляют к раствору литий-N, N-диизопропиламида [из N,N-диизопропиламина (80 мл, 570 ммол) и 10М н-бутиллития (48,1 мл, 481 ммол)] в сухом тетрагидрофуране (500 мл) при температуре -70oC. Когда добавление заканчивают, температуру повышают до -15oC и смесь перемешивают в течение 8 часов. Реакционную смесь охлаждают до -70oC и медленно добавляют металлилиодид (46 г, 252 ммол), следя за тем, чтобы температура не превышала -65oC. Смесь подогревают до -40oC и перемешивают в течение 18 часов до прекращения реакции при -15oC лимонной кислотой. Органический слой отделяют и промывают 10% раствором бикарбоната натрия (500 мл) и соляным раствором (300 мл), затем сушат над сульфатом магния. Раствор фильтруют и концентрируют в вакууме, получая коричневое масло (64 г), которое очищают колоночной хроматографией (силикагель, 1 кг, градиентное элюирование 20 - 35% диэтилового эфира в гексане), целевой продукт выделяют в виде бесцветного масла (30,9 г, 49%), он, как было найдено, является 17:1 смесью диастереомеров. 1Н-ЯМР; δ (хлороформ-d, основной диастереомер), 5,06(1H, септет, Y= 6,3 Гц), 4,97 (1H, септет, Y=6,3 Гц), 4,78 (2H, d, Y = 7,1 Гц), 4,16 (1H, m), 3,20 (1H, d, Y = 6,2 Гц), 3,00 (1H, m), 2,50; 2,35 (2H, ABX, Y = 7, 0, 8, 7, 14,4 Гц), 1,72 (3H, s) и 1,24 - 1,16 (12H, 2m).
Пример Ib.
Изопропил-3R-карбоксиизопропил-2S-гидрокси-5-метилгексаноат.
Изопропил-3R-карбоксиизопропил-2S-гидрокси-5-метилгекс-5-еноат (7,14 г, 26,2 ммол) растворяют в этаноле (80 мл) и перемешивают в течение ночи с 10% палладия, нанесенного на уголь, в качестве катализатора (1 г) в атмосфере водорода. Катализатор удаляют фильтрованием, фильтрат испаряют досуха с получением прозрачного масла (7,03 г, 98%).
1H-ЯМР: δ (хлороформ-d), 5,06 (1H, септет, Y = 6,3 Гц), 4,97 (1H, септет, Y= 6,3 Гц), 4,17 (1H, br s), 2,83 (1H, m), 1,68 (2H,m), 1,44 (1H,m), 1,24 (6H, d, Y = 6,2 Гц), 1,18 (6H, d, Y = 6,2 Гц) и 0,89 (6H, m).
Пример 1 с.
3R-карбокси-2S-гидрокси-5-метилгексановая кислота.
Изопропил-3R-карбоксиизопропил-2S-гидрокси-5-метилгексаноат (7,0 г, 25,6 ммол) растворяют в диоксане (15 мл) и воде (15 мл), добавляют раствор гидроокиси калия (4,29 г) в воде (22 мл) и нагревают смесь в течение ночи при 90oC. Раствор оставляют охлаждаться и затем пропускают через ионообменник (Dowex 50 х 4 - 400, 200 мл) с получением целевого продукта (4,82 г, 99 %). 1H-ЯМР: δ (хлороформ-d), 8,70 (2H, br s), 4,32 (1H, br s), 3,10 (1H, m), 1,85 - 1,55 (3H, m) и 0,96 (6H, m).
Пример 1d.
2R-(2,2-диметил-4-оксо-1,3-диоксалан-5S-ил)-4-метилпентановая кислота.
3R-карбокси-2S-гидрокси-5-метилгексановую кислоту (5,19 г, 27,3 ммол) растворяют в 2,2-диметоксипропане (150 мл) и N,N-диметилформамиде (40 мл) и перемешивают в течение ночи при 30oC в присутствии каталитического количества п-толуолсульфокислоты. Растворитель удаляют и получают целевой продукт, загрязненный растворителем (6,87 г, > 100%).
1H-ЯМР: δ (хлороформ-d), 4,41 (1H, d, Y = 4,8 Гц), 2,91 (1H, m), 1,69 (3H, m), 1,54 (3H, s), 1,48 (3H, s) и 0,88 (6H, m).
Пример 1e.
Пентафторфенил-R-(2,2-диметил-4-оксо-1,3-диоксалан-5S-ил)-4- метилпентаноат.
2R-(2,2-диметил-4-оксо-1,3-диоксалан-5S-ил)-4-метилпентановую кислоту (558 мг, 2,4 ммол) растворяют в дихлорметане (10 мл) и охлаждают до 0oC перед добавлением пентафторфенола (670 мг, 3,6 ммол) и N-этил-N1-(3-диметиламинопропил) карбодиимида (560 мг, 2,9 ммол). Реакционную смесь перемешивают при 0oC в течение 2 час, затем раствор промывают 1M карбоната натрия (50 мл) и соляным раствором (20 мл). Органический слой высушивают (сульфат магния), фильтруют, испаряют досуха и очищают методом колоночной хроматографии (силикагель, дихлорметан) с получением активированного эфира (552 мг, 58%). 1H-ЯМР: δ (хлороформ-d), 4,57 (IH, d, Y = 6,5 Гц), 3,32 (1H, m), 1,86 (3H, m), l,67 (3H, s), 1,58 (3H, s) и 1,03 (6H, m).
Пример 1f.
N2-[2R-(2,2-диметил-4-оксо-1,3-диоксалан)-5S-ил)-4- метилпентаноил] -L- циклогексилаланин-N1-метиламид.
Пентафторфенил-2R-(2,2-диметил-4-оксо-1,3-диоксалан-5S-ил)-4- метилпентаноат (1,06 г, 2,7 ммол) и L-циклогексилаланин-М-метиламид (0,33 г, 1,8 ммол) растворяют в N,N-диметилформамиде (150 мл), смесь перемешивают в течение ночи при комнатной температуре. Растворитель удаляют и получают масло, которое очищают методом колоночной хроматографии (силикагель, элюирование 0-5% метанола в дихлорметане) с получением вначале непрореагировавшего эфира, а затем целевого продукта (0,43 г, 60%). 1H-ЯМР: δ (хлороформ-d), 6,47 (2H, br m and d,Y = 8,3 Гц), 4,53 (1H, d, Y = 6,3 Гц), 4,49 (1H, m), 2,76 (4H, m), 1,80 - 1,50 (12H, br m), 1,62 (3H, s), 1,54 (3H, s), 1,35-1,10 (4H, br m) и 0,91 (6H, m).
Пример 1g.
N2-[ЗS-гидpoкcи-4-гидpoкcи-2R-изoбутилcуцинил] -L- циклoгeкcилaлaнин-N1- метиламид.
N2-[2R-(2,2-диметил-4-оксо-1,3-диоксалан-5S-ил)-4- метилпентаноил] -L-циклогексилаланин-N1-метиламид (0,43 г, 1,1 ммол) растворяют в 2M соляной кислоты (15 мл) и тетрагидрофуране (20 мл) и перемешивают при комнатной температуре в течение ночи. Растворитель удаляют с получением целевого продукта в виде белой пены (0,35 г, 91%). 1H-ЯМР: δ (метанол-d4), 4,37 (1H, m), 4,16 (1H, d, Y = 5,6 Гц), 2,75 (1H, m), 2,65 (3H, s), 1,80 - 1,50 (12H, m), 1,38 - 1,10 (4H, br m) и 0,90 (6H, m).
Пример 1h.
N2-[(4-бензилоксиамино)-3S-гидрокси-2R-изобутилсукцинил] - L-циклогексилаланин-Н1-метиламид.
Берут N2-[3S-гидрокси-4-гидрокси-2R-изобутилсукцинил)] -L- циклогексилаланин-H1-метиламид (0,35 г, 1,0 ммол) в тетрагидрофуране (5 мл), добавляют затем воду (5 мл) и О-бензилгидроксиламин гидрохлорид (0,24 г, 1,5 ммол). Раствор охлаждают до 0oC перед добавлением N-этил-N1-(3-диметиламинопропил)карбодиимида гидрохлорида (0,38 г, 2,0 ммол), реакционную смесь затем перемешивают в течение ночи при комнатной температуре. Тетрагидрофуран удаляют при пониженном давлении, при этом продукт кристаллизуется. Смесь разбавляют равным объемом воды и продукт отделяют фильтрованием, промывают водой и сушат под глубоким вакуумом (0,30 г, 65%).
1H-ЯМР: δ (метанол-d4), 7,50 - 7,30 (5H, m), 4,81 (2H, s; под H2О-пиком), 4,36 (1H, t, Y = 7,6 Гц), 3,98 (1H, d, Y = 6,1 Гц), 2,72 (1H, m), 2,67 (3H, s), 1,85 - 1,43 (12H, br m), 1,38 - 1,10 (4H, br m) и 0,88 (6H, m).
Пример 1i.
N2-[3S-гидрокси-4-(N-гидроксиамино)-2R-изобутилсукцинил] -L- циклогексилаланин-N1-метиламид.
N2-[4-N-бензилоксиамино)-2S-гидрокси-2R-изобутилсукцинил)] - L-циклогексилаланин-N1-метиламид (1,0 г, 2,16 ммол) растворяют в этаноле (100 мл), добавляют 10% палладия, нанесенного на уголь (100 мг) и смесь выдерживают в атмосфере водорода. Через 4 часа катализатор отфильтровывают, затем удаляют растворитель с получением целевого продукта (650 мг, 1,75 ммол, 81%). 1H-ЯМР: δ (метанол-d4), 4,35 (1H, t, Y = 7,6 Гц), 3,99 (1H, d, Y = 6,4 Гц), 2,69 (4H, m и s), 1,80 - 1,50 (12H, br m), 1,40 - 1,10 (4H, br m) и 0,89 (6H, m). 13C-ЯМР: δ (метанол-4d), 175,6, 175,3, 171,5, 72,9, 52,4, 40,2, 39,2, 35,2, 34,9, 33,2, 30,9, 27,6, 27,4, 27,1, 26,9, 26,3, 23,7 и 22,1.
Найдено,%: С 58,27; H 8,93; N 11,20
С18H33N3О5
Рассчитано,%: С 58,20; H 8,95; N 11,31.
Пример 2.
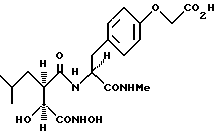
N2-[3S-гидрокси-4-(N-гидроксиамино)-2R-изобутилсукцинил] - L-(4-оксиметил- карбокси)-фенилаланин-N1-метиламид.
Пример 2а.
Метил-3R-карбокси-2S-гидрокси-5-метилгексаноат.
3R-карбокси-2S-гидрокси-5-метилгексановую кислоту (5,76 г, 30,3 ммол), полученную методом, описанным в примере 1c, охлаждают до 0oC и обрабатывают трифторуксусным ангидридом (14 мл). Смесь перемешивают в течение 2 час, затем избыток ангидрида удаляют при пониженном давлении. Полученное коричневое масло растворяют в свежеперегнанном безводном метаноле (30 мл) и перемешивают смесь в течение ночи. Раствор выпаривают и получают технический продукт (7,0 г, > 100 %), который используют без дальнейшей очистки. 1H-ЯМР: б (хлороформ-d), 4,28 (1H, d, Y = 6 Гц), 3,80 (3H, s), 3,00 (1H, dt, Y = 6,8 Гц), 1,73 (2H, m), 1,54 (1H, m) и 0,96 (6H, m). 13C-ЯМР: δ (хлороформ-d), 176,2; 69,6; 51,3; 45,0; 35,3; 24,2 и 20,9.
Пример 2b. N2-[3S-гидрокси-2R-изобутил-4-метилсукцинил] -L-(4- оксиметилкарбоксибензил)-фенилаланин-N1-метиламид.
Метил-3R-карбокси-2S-гидрокси-5-метилгексаноат (700 мг, 3,4 ммол), 4-(oкcимeтилкapбoкcибeнзил)-L-фeнилaлaнин-N-мeтилaмид(1,56 г, 4,56 ммoл), пентафторфенол (1,26 г, 6,8 ммол) и N-метилморфолин (690 мг, 6,8 ммол) растворяют в диметилформамиде (30 мл) и охлаждают до 0oC перед добавлением N-этил-N1-(3-диметиламинопропил) карбодиимида гидрохлорида (980 мг, 5,1 ммол). После перемешивания при комнатной температуре в течение ночи растворитель удаляют при пониженном давлении и остаток очищают методом колоночной хроматографии (С30 силикагель, градиентное элюирование 50 - 100% этилацетата в гексане). Целевой продукт выделяют в виде бледно-желтого твердого вещества (1,42 г, 78%). 1H-ЯМР: δ (хлороформ-d), 7,34 (5H, s), 7,09 (2H, d, Y = 8 Гц), 6,92 (1H, d, Y = 8 Гц), 6,79 (2H, d, Y = 8 Гц), 6,55 (1H, q, Y = 6 Гц), 5,20 (2H, s), 4,60 (3H, m), 4,22 (1H, d, Y = 4 Гц), 3,71 (3H, s), 3,00 (2H, m), 2,76 (1H, m), 2,48 (3H, d, Y = 6 Гц), 1,55 (1H, m), 1,42 (2H, m), 0,88 (3H, d, Y = 7 Гц) и 0,88 (3H, d, Y = 7 Гц). 13C-ЯМР: дельта (хлороформ-d), 172,6; 172,3; 171,7; 170,3; 134,3; 127,1; 126,9; 127,8; 70,4; 65,1; 51,0; 50,8; 46,1; 36,6; 28,9; 26,2; 24,8; 24,2; 21,1 и 21,0.
Пример 2c.
N2[4-(N-бензилоксиамино)-3S-гидрокси-2R-изобутилсукцинил] -L-(4-оксиметилкарбоксибензил)фенилаланин-N1-метиламид.
N2-[3S-гидрокси-2R-изобутил-4-метоксисукцинил] - L-(4-оксиметилкарбоксибензил)фенилаланин-N1-метиламид (820 мг, 1,55 ммол) растворяют в тетрагидрофуране (7 мл) и воде (7 мл), добавляют гидроокись лития (66 мг, 1,55 ммол) и раствор перемешивают в течение ночи при комнатной температуре. Выпаривание растворителей при пониженном давлении приводит к получению литиевой соли карбоновой кислоты, которую характеризуют методом 1H-ЯМР. Соль вновь растворяют в тетрагидрофуране (15 мл) и воде (15 мл) и обрабатывают О-бензилгидроксиламин гидрохлоридом (0,30 г, 1,86 ммол) и затем N-этил-N1-[3-диметиламинопропил)карбодиимидом гидрохлоридом (0,36 г, 1,86 ммол). После перемешивания при комнатной температуре в течение ночи тетрагидрофуран удаляют, получая масло, которое экстрагируют несколько раз этилацетатом. Соединенные вместе растворы высушивают (сульфат магния), фильтруют и концентрируют. Затем очищают продукт методом колоночной хроматографии (C30 силикагель, этилацетат), получают целевой продукт в виде белого твердого вещества (213 мг, 22%). 1H-ЯМР: δ (метанол-d4), 7,80 (1H, d, Y = 8 Гц), 7,41 (2H, m), 7,32 (8H, m), 7,19 (2H, d, Y = 8 Гц), 6,78 (2H, d, J = 8 Гц), 5,17 (2H, s), 4,80 (4H, m), 4,50 (1H, dd, J = 7,8 Гц), 3,99 (1H, d, J = 4 Гц), 3,07 (1H, dd, J = 14,6 Гц), 2,88 (IH, dd, J = 14,8 Гц), 2,64 (4H, m и s), 1,46 (1H, m), 1,29 (1H, m), 1,12 (1H, m) и 0,80 (6H, t, Y = 7 Гц).
Пример 2d.
N2-[3S-гидрокси-4-(H-гидроксиамино)-2R-изобутилсукцинил] - L-(4-оксиметил- карбокси)фенилаланин-N1-метиламид.
N2-[4-(N-бензилоксиамино)-3S-гидрокси-2R- изобутилсукцинил] -L-(4-оксиметилкарбоксибензил)фенилаланин-N1 -метиламид (210 мг, 0,34 ммол) растворяют в этаноле (35 мл) и гидрируют над катализатором - 10% палладия на угле (200 мг) в течение часа. Катализатор удаляют фильтрованием, затем удаляют растворитель и получают целевой продукт (140 мг, 93%).
1Н-ЯМР: δ (метанол-d4), 7,1 (2H,d , J = 8,5 Гц), 6,8 (2H, d, J = 8,5 Гц), 4,5 (2H, s), 4,4 (1H, dd, J = 8,2;6,7 Гц), 4,01 (1H, d, J = 5,6 Гц), 3,05 (2H, dd, J = 12,9; 6,2 Гц), 2,90 (2H, dd, J = 13,9; 8,3 Гц), 2,61 (1H, m), 2,60 (3H, s), 1,3 (3H, m) и 0,8 (6H, t, Y = 6,3 Гц). 13C-ЯМР: δ (метанол-d4), 175,5; 173,9; 171,5; 158,5; 131,3; 131,1; 115,7; 72,7; 66,7; 58,3; 56,3; 39,3; 37,9; 26,6; 26,4; 23,8; 22,1 и 18,4.
Пример 3.
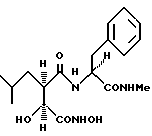
N2-[3S-гидрокси-4-(М-гидроксиамино)-2R-изобутилсукцинил] -L-фенилглицин-N1-метиламид.
Получают методом аналогичным описанному в примере 1 из L-фенилглицин-Н-метиламида. 1H-ЯМР: δ (метанол-d4), 7,37 (5H, m), 5,4 (1H, s), 4,05 (1H, d, J = 5 Гц), 3,1 (1H, m), 2,7 (3H, s), 1,6 (2H, m), 1,27 (1H, m), 0,9 (6H, 2d, J = 6 Гц. 13C-ЯМР: δ (метанол-d4), 175,3; 172,9; 171,5; 139,0; 129,7; 129,1; 128,5; 73,0; 58,7; 43,4; 39,1; 26,8; 26,5; 23,6; 22,3.
Пример 4.
N2-[3S-гидрокси-4-(H-гидроксиамино)-2R-изобутилсукцинил] -L-(4-фенил)- фенилаланин-N1-метиламид.
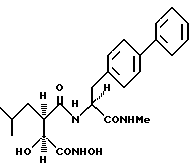
Получают методом, аналогичным описанному в примере 1, из L-(4-фенил)фенилаланин-N-метиламида. 1H-ЯМР: δ (диметилсульфоксид-d6), 7,90 (2H, m), 7,62 (2H, d, J = 7,9 Гц), 7,46 (6H, m), 7,30 (2H, d, J = 7,9 Гц), 5,66 (1H, br s), 4,44 (1H, m), 3,86 (1H, d, J = 6,9 Гц), 3,12 (1H, dd, J = 5,2; 13,8 Гц), 2,93 (1H, dd, J = 9,1; 13,8 Гц), 2,58 (3H, d, J = 4,3 Гц), 2,51 (1H, m), 1,40 (1H, m), 1,24 (1H, m), 1,19 (1H, br m), 0,94 (1H, m) и О,72 (6H, m). 13C-ЯМР: δ (диметилсульфоксид-d6), 172,5; 171,1; 168,7; 140,1; 138,0; 137,5; 129,6; 128,9; 127,2; 126,4; 126,3; 71,2; 54,1; 48,3; 37,4; 36,6; 25,6; 25,0; 23,6 и 21,5.
Найдено,%: C 63,43; H 7,00; N 8,92
С24H31N3О5. 0,7 H2О
Рассчитано,%: С 63,48; H 7,19; N 9,25
Пример 5.
N3-[3S-гидpoкcи-4-(N-гидpoкcиaминo)-2R-изoбутилcукцинил] aминo-l-азациклотридекан-2-он.
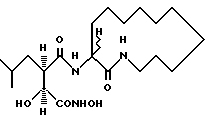
Получают методом, аналогичным описанному в примере 1 из 3(RS)-aмино-1-азациклотридекан-2-он. 1H-ЯМР: δ (диметилсульфоксид-d6), 10,60 (1H, d, J = 10,7 Гц), 8,86 (1H, d, J = 7,9 Гц), 7,83 (1H, d, J = 7,3 Гц), 7,61 (1H, d, J = 7,6 Гц), 5,46 (0,5H, d, J = 6,4 Гц; диастереомер А), 5,31 (0,5H, d, J = 7,5 Гц; диастереоизомер В), 4,22 (1H, m), 3,72 (1H, d, J = 7,4 Гц), 2,98 (1H, br m), 2,78 (2H, br m), 1,6 - 1,25 (21H, br m) и 0,82 (6H, m). 13C-ЯМР: δ (диметилсульфоксид-d6), 175,5; 173,9; 171,5; 73,4; 55,4; 54,9; 40,0; 39,5: 39,0; 32.7; 29.3; 27,7; 27.1; 26,8; 26,1; 25.4; 24,6; 23,6; 23,0 и 22,3.
Пример 6.
N2-[3S-гидрокси-4-(N-гидроксиамино)-2R-изобутилсукцинил] -L-3-(1-пиразолил)аланин-N1-метиламид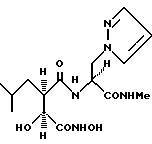
получают методом, аналогичным описанному в примере 1, из L-3-(1- пиразолил)аланин-N-метиламида. 1H-ЯМР: δ (диметилсульфоксид-d6), 10,70 (1H, s), 8,93 (1H, s), 8,00 (2H, m), 7,59 (1H, d, J = 2 Гц), 7,41 (1H, d, J = 1,5 Гц), 6,22 (1H, m), 5,75 (1H, d, Y = 5,8 Гц), 4,57 (1H, m), 4,46 (2H, m), 3,86 (1H, dd, J = 6,2 Гц), 2,55 (4H, m), 1,44 (1H, m), 1,25 (1H, m), 0,97 (1H, m) и 0,76 (6H, m). 13C-ЯМР: δ (диметилсульфоксид-d6), 172,7; 169,2; 168,6; 138,9; 130,6; 104,9; 71,1; 53,6; 51,6; 48,4; 37,1; 25,7; 25,0; 23,6 и 21,5.
Найдено,%: C 50,11; H 7,01; N 8,92
С15H25N5О5. 0,2 H2О
Рассчитано,%: С 50,19; H 7,13; N 19,51.
Пример 7. N2-[3S-гидрокси-4-(N-гидроксиамино)-2R -изобутилсукцинил]-L-4-(N-гидроксиамино)глутамовой кислоты-N1-метиламид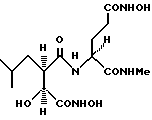
получают методом, аналогичным описанному в примере 1, из N-метиламида- 5-метил-L-глутамовой кислоты. 1H-ЯМР: δ (диметилсульфоксид-d6), 10,64 (1H, br s), 10,30 (1H, br,s), 8,9 (1H,br s), 8,7 (1H, br s), 7,8 (1H, d, J = 8 Гц), 7,72 (1H, d, J = 4,5 Гц), 5,35 (1H, d, Y = 6,9 Гц), 4,16 (1H, m), 3,75 (1H, m), 2,57 (4H, d и m), 2,14 - 1,73 (4H, br m), 1,44 (3H, br m) и 0,80 (6H, m). 13C-ЯМР: δ (диметилсульфоксид-d6), 172,8; 171,4; 168,7; 168.6; 71,3; 52,3; 47,7; 37,2; 28,9; 28,0; 25,5; 25,2; 23,6 и 21,7.
Пример 8.
N2-[3S-гидрокси-4-(N-гидроксиамино)-2R-изобутилсукцинил] -L-3-(2-тиенил)аланин-N1-метиламид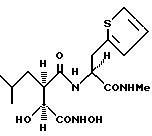
получают методом, аналогичным описанному в примере 1, из L-3-(2- тиенил)аланин-N-метиламида. 1H-ЯМР: δ (метанол-d4), 7,18 (1H, d, J = 4,8 Гц), 6,88 (2H, dd, J = 3,5; 4,8 Гц), 4,49 (1H, dd, J = 7,0 Гц), 4,01 (1H, d, J = 5,4 Гц), 3,27 (2H, m), 2,67 (4H, m), 1,53 (1H, m), 1,33 (1H, m), 1,24 (1H, m) и 0,82 (6H, m). 13C-ЯМР: δ (метанол-d4), 175,6; 173,3; 171,4; 140,2; 127,8; 127,5; 125,3; 72,7; 56,2; 39,2; 32,6; 26,6; 26,4, 23,7; 22,1 и 21,9.
Пример 9. N2-[3S-гидрокси-4-(N-гидроксиамино)-2R-изобутилсукцинил]-L-циклогексилаланин-N1-(3-(2-пирролидон)пропил)амид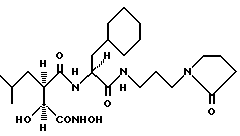
получают методом, аналогичным описанному в примере 1, из L-циклогексилаланин-N(3-(2-пирролидон)пропил)амида. 1H-ЯМР: δ (метанол-d4), 4,35 (1H, m), 4,01 (1H, d, J = 6,3 Гц), 3,43 (2H, m), 3,27 (2H, m). 3,15 (2H, m), 2,73 (1H, m), 2,34 (2H, t, J = 7,8 Гц), 2,01 (2H, m), 1,70 (15H, br m), 1,21 (3H, br m) и O, 90 (6H, dd, J = 5,3; 6,3 Гц). 1C-ЯМР: δ (метанол-d4), 177,9; 175,7; 174.8; 171,5; 73,0; 52,7; 41,2; 40,3; 39,3; 37,8; 35,4; 34,9; 33,2; 32,0; 27,8; 27,6; 27,4; 27,1; 26,9; 23,8; 22,3 и 18,9.
Найдено,%: C 60,06; H 8,88; N 11,60
C24H42N4O6
Рассчитано,%: C 59,73; H 8,77; N 11,61
Пример 10.
N2-[3S-гидрокси-4-(N-гидроксиамино)-2R-изобутилсукцинил] -L-третлейцин-N1-метиламид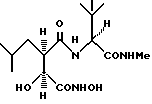
получают методом, аналогичным описанному в примере 1, из L-третлейцин-N-метиламида. 1H-ЯМР: δ (метанол-d4), 4,17 (1H, s), 4,00 (1H, d, J = 5,6 Гц), 2,81 (1H, m), 2,69 (3H, s), 1,65 - 1,44 (2H, br m), 1,29 - 1,21 (1H, br m), 0,95 (9H, s), 0,88 (3H, d, J = 6,5 Гц) и 0,86 (3H, d, J = 6,5 Гц). 13C-ЯМР: δ (метанол-d4), 175,4; 173,2; 171,5; 73,0; 62,1; 39,8; 35,4; 27,2; 26,9; 26,0; 23,5 и 22,4.
Найдено,%: C 54,36; H 8,74; N 12,73
С15H29N2О5
Рассчитано,%: C 54,36; H 8,82; N 12,68.
Биологический пример А.
Способность соединений по изобретению ингибировать коллагеназу определялась по методике Cawston и Barrett (Anal. Biochem, 99, 340 - 345, 1979), ссылка включена в отчет о поиске), по которой 1 мМ раствора испытуемого соединения или разбавленный раствор выдерживают при 37oC в течение 16 час с коллагеном и коллагеназой (буферный раствор, 25 мМ Hepes, pH 7,5, содержащий 5 мМ CaCl2, 0,05% Brij 35 и 0,02% NaN3). Коллаген был ацетилирован 14C-коллагеном, полученным методом Cawston и Murphy (Methods in Enzymology, 80, 711, 1981), эта ссылка также содержится в отчете о поиске. Образцы подвергают центрифугированию для осаждения неусвоенного коллагена и аликвотное количество радиоактивной надосадочной жидкости удаляют для анализа на сцинтилляционном счетчике для измерения степени гидролиза. Активность коллагеназы в присутствии 1mМ испытуемого соединения или его разбавленного раствора сравнивается с активностью контрольного образца без ингибитора и ниже указан результат-концентрация ингибитора, вызывающая 50%-ное ингибирование активности коллагеназы (IC50).
Оценка соединений по изобретению как ингибиторов стромелизина производилась по методике Cawston et al. (Biochem.J., 195, 159 - 165, 1981), эта ссылка включена в отчет о поиске. Согласно этой методике 1mМ раствор испытуемого соединения или его разбавленный раствор инкубируют при 37oC в течение 16 час со стромелизином и 14C-ацетилатом казеина (буфер, 25mМ Hepes, pH 7,5, содержащий 5mM CaCI2 0,05% Brij 35 и 0,02% NaN3). Казеин ацетилируют 14C-казеином, полученным по методике Cawston et al. (ibid). Активность стромелизина в присутствии 1mМ испытуемого соединения или его разбавленного раствора сравнивалась с активностью образца без ингибитора, ниже приведена концентрация ингибитора, вызывающая 50%-ное ингибирование активности стромелизина (IC50).
Ниже результаты оценки соединений по примерам 1-10 в сравнении с теми же характеристиками продуктов по примерам 13 и 27 ЕР-А-236872 (Roche), а именно:
этиловый эфир [4-(N-гидроксиамино)-2(R)-изобутилсукцинил)]-L -лейцил-L-аланина и глицидил этиловый эфир [4-(N-гидроксиамино)-3(S)-фталоиламино- бутил-2(R)-изобутилсукцинил]-L-лейцила.
Первое соединение (обозначенное C1) выбрано для сравнения в связи с тем, что из всех ингибиторов коллагеназы, чья активность приведена в ЕР-А-236872, оно наиболее активно. Второе соединение (обозначенное С2) было выбрано для сравнения вследствие того, что из всех ингибиторов коллагеназы, чья активность приведена в ЕР-А-236872, оно является единственным с заместителем в положении, эквивалентном гидроксильному заместителю у соединений по изобретению (см. табл.1).
Биологический опыт В.
Испытывали концентрацию соединений по изобретению в зависимости от времени в крови лабораторных животных после введения испытываемых соединений.
Испытываемые соединения вводили 6 крысам-самцам (300 г) из подопытной группы. Образцы крови брали из вены в хвостах крыс через 0,5, 1,0, 2,0, 6,0 и 24 часа после введения соединений. 0,4 мл крови помещали в 4,5 мл пробирки, содержащие 0,1 мл кислого цитрата декстрозы (АСД) в качестве антикоагулянта. Для экстракции добавляли 3 мл метанола и осажденную кровь гранулировали центрифугированием (30 мин при 3000 об/мин). Удаляли 2 мл аликвота надосадочной жидкости и концентрировали лиофилизацией. Экстракт вновь растворяли в 200 мл диметилсульфоксида и 10 мл аликвота отбирали для анализа на определение активности ингибирования коллагеназы. Ингибирующую активность экстрактов определяли с использованием метода анализа, описанного в вышеприведенном биологическом примере А, и получали концентрацию ингибитора (т.е. лекарства + любой активный метаболит) при сравнении со стандартными кривыми. Результаты выражены в виде пиковых концентраций в нг/мл, площади под кривой (АИС) в нг/мл • часы, через 0-6 час и в виде АИС в числе IC50 • час.
Соединения примеров 1 и 10 сравниваются с соединениями C1 и С2 (см. табл.2).
Биологический пример С.
Активности соединения по примеру 1 и сравнительного соединения C1 (см. биологический пример А) проверялись в случае артрита.
Адъювантный артрит был вызван у самцов крыс Lewis (Charles River) путем единичной внутридермальной инъекции 0,75 мг М butyricum в легком парафиновом масле (полный адъювант Freunds-FCA) в основание хвоста. "Вторичное" повреждение возникает через 10 дней и характеризуется воспалением задних лап.
Объемы поврежденных участков задних лап измеряют плетизмографически вытеснением воды. Испытуемое соединение вводят b.i.d. через 13-17 дней. Измеряют объем лапы на 20-й день и сравнивают с объемом лапы на 13-й день. Эксперимент окончили на 23-й день. На 20-й день соединение по примеру 1 (доза 10 мг/кг) приводит к значительному (p<0,01) уменьшению опухоли по сравнению с контрольным животным, в то время как соединение C1 не оказывало действия.
Биологический пример D.
Соединение по примеру 1 испытывают на активность in vivo в случае карциномы молочной железы у крыс. Осуществляют исследование колонизации легкого для определения, является ли соединение по примеру 1 эффективным в процессе ингибирования колонизации легких путем циркуляции клеток карциномы HOSP1.P молочной железы после орального введения HOSP1. P клетки (1•105 клеток/животное) вводили двум группам из 12 крыс путем инъекции в яремную вену. Соединение по примеру 1 вводили орально одной группе дозой 30 мг/кг через -4, +1, +6, +24 и +72 часа после инокуляции клеток опухоли в 0 часов. Вторая (контрольная) группа получила только разбавитель (орально) по той же схеме. Животные были убиты через 34 дня. Легкие удаляли и после 24-часовой фиксации в Methacarn подсчитывали отдельные опухоли. Внелегочные опухоли не были обнаружены. Обработка соединением из примера 1 привела к значительному ингибированию колонизации легких по сравнению с контрольной группой (p<0,01, Mann-Whitney). Результаты смотри в табл.3.
Биологический пример E.
Изучалась способность соединений по изобретению ингибировать выделение TNF. Анализ основан на способности форболмиристатацетата (РМА) стимулировать выделение TNF- α из человеческой моноцитарной клеточной линии, U937. Клетки U937, выращенные в среде RPMI1640 + 5% фетальной телячьей сыворотки, центрифугируются при 1000 • g в течение 5 мин и затем вновь суспендируются в указанной среде при 2 • 106 мл. 1 мл клеточной суспензии распределяется аликвотными порциями в лунки 24х- луночного плантета. Испытуемые соединения растворяют в диметилсульфоксиде (DMSO), получая концентрацию 100 mM, затем разбавляют до концентрации, равной 50 х конечную требуемую концентрацию средой RPMI1640. 20 мл разбавленных растворов испытуемых соединений добавляют к U937 - клеткам в дублетные лунки. Выделение α- TNF стимулируется добавлением РМА к клеткам при концентрации 50 нМ. Соответствующие контрольные культуры помещают в дублеты. Плангиеты инкубируют в течение 18 час при 37oC, 5% CO2, затем центрифугируют при 1000 • g в течение 5 мин.
Специфический твердофазный иммуноферментный анализ (ELISA) TNF- α , полученного из British Bio-technology Products Limited, Abingdon, England, используется для измерения уровней α TNF в надосадочных культуральных жидкостях.
Была установлена средняя концентрация испытуемого соединения, ингибирующая выделение TNF -α на 50% по отношению к контрольной культуре. Соединения из вышеприведенных примеров 1,2,5 и 10 имеют значения IC50 менее 50 мкм.
Пример по определению водорастворимости.
Определяют растворимости соединений по изобретению в воде при комнатной температуре и сравнивают с аналогичными характеристиками соединений С1 и С2 (см. биологический пример А, приведенный выше).
Результаты
Соединение - Растворимость, мг/мл
Пример 1 - 0,1
Пример 2 - 13,13
Пример 3 - 2,34
Пример 4 - 0,11
Пример 5 - 0,14
Пример 6 - 0,33
Пример 7 - 0,18
Пример 9 - 1,8
Пример 10 - 1,4
С1 - 0,3
С2 - < 0,1
Композиция для инъекций
Ампулы, содержащие 1,5 мг/мл продукта по примеру 10, приготавливают следующим образом:
Ингредиенты (фармацевтически приемлемого качества) - Количество на ампулу
Продукт по примеру 10 - 15 мг
Этанол - 1000 мг
Ледяная уксусная кислота - 6 мг
Хлористый натрий - 50 мг
Гидроокись натрия - до pH 5,2
Вода для инъекций - до 10 мл
Продукт, полученный в примере 10, растворяют в этаноле при перемешивании. Медленно добавляют воду для инъекций при перемешивании в течение 5 мин до получения загрузки, составляющей 95% от общего количества. pH раствора доводят до 5,2 (± 0,1) добавлением раствора гидроокиси натрия (1,0 М) при перемешивании. Раствор доводят при этом до требуемого объема и фильтруют, если это требуется, через стерильный фильтр 0,22 мкм.
Полученным раствором заполняют ампулы 10 мл (стекло чистого типа 1, 10 мл, DIN, закрытые ампулы из стекла белого цвета).
Капсулы для перорального введения
Мягкие желатиновые капсулы, содержащие продукт по примеру 10, готовят следующим образом:
Ингредиенты (фармацевтически приемлемого качества) - Количество на капсулу
Продукт по примеру 10 - 10 мг
Триглецириды с цепочками средней длины (Miglyol 810) - до 100 мг )
Продукт по примеру 10 суспендируют в триглециридах с цепочками средней длины при перемешивании при небольшой скорости, чтобы предотвратить повышение температуры, до получения гомогенной суспензии. Полученную суспензию помещают в воронку устройства для капсулирования R.P. Sherer Rotary Die Encapsulation Machine для получения и заполнения мягких желатиновых капсул с вращающимся мундштуком для минимум 3,0 капсул для орального введения. Загружают в Rotary Die Machine желатиновый расплав и получают капсулы, содержащие 100 мг суспензии. Полученные наполненные капсулы сушат перед помещением на хранение.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ГИДРОКСАМОВОЙ ИЛИ КАРБОНОВОЙ КИСЛОТЫ И ФАРМАЦЕВТИЧЕСКАЯ ИЛИ ВЕТЕРИНАРНАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1995 |
|
RU2136657C1 |
| АНТИБАКТЕРИАЛЬНЫЕ АГЕНТЫ | 2000 |
|
RU2269525C2 |
| ЦИТОСТАТИЧЕСКИЕ АГЕНТЫ | 1998 |
|
RU2187499C2 |
| N-[2,2-ДИМЕТИЛ-1S-(ПИРИДИН-2-ИЛКАРБАМОИЛ)ПРОПИЛ]-N-ГИДРОК СИ-2R-ИЗОБУТИЛ-3S-МЕТОКСИСУКЦИНАМИД ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, ГИДРАТ ИЛИ СОЛЬВАТ | 1997 |
|
RU2198164C2 |
| ПРОИЗВОДНОЕ ИЗОИНДОЛИНА, ПРОМЕЖУТОЧНЫЙ ПРОДУКТ, СПОСОБ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ЕЕ ПРИМЕНЕНИЕ | 2015 |
|
RU2695521C2 |
| АНТИБАКТЕРИАЛЬНЫЕ АГЕНТЫ | 1999 |
|
RU2246941C2 |
| МОДУЛЯТОРЫ АНДРОГЕНОВОГО РЕЦЕПТОРА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2797622C2 |
| ПРОИЗВОДНЫЕ ТАКСОЛА С ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2007 |
|
RU2419622C2 |
| ФЕНИЛПИРАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ | 2008 |
|
RU2480456C2 |
| УСИЛИТЕЛЬ ПРОТИВООПУХОЛЕВОГО ЭФФЕКТА С ПРИМЕНЕНИЕМ НОВОГО СОЕДИНЕНИЯ БИФЕНИЛА | 2018 |
|
RU2765153C2 |
Предложены производные гидроксамовой кислоты формулы (I) HONHCO-CH(OH)-CHR2-C(O)-NH-CHR3C(O)NP4R5 , где R2 - C1 - C6 алкил; R3-C1-C6 алкил или R7-(B)n; n = 0,1; В-двухвалентный C1-C6 алкил; R7-CONHOH, циклоалкил, 5-6-членный гетероцикл, содержащий в качестве гетероатома N или S, фенил, фенилзамещенный фенил, R4, - H, CH3, R5-C1-C6 алкил; возможно замещенный гетероциклом, или R3 и R5 - вместе образуют двухвалентный C8-C14 радикал. Указанные соединения получают взаимодействием соединения HCOO-CH(OH)-CHR2-C(O)-NH-CR3H-C(O)-NR4R5 с гидроксиламином. Соединения I обладают ингибирующей в отношении металлопротеиназ и образования фактора некроза опухолей активностью и могут использоваться в соответствующей фармацевтической композиции. 3 с. и 18 з.п.ф-лы.
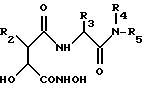
где R2 означает линейный или разветвленный C1-C6-алкил;
R3 означает линейный или разветвленный C1-C6-алкил или группу R7-(B)n-, где n = 0 или 1;
В - двухвалентный линейный или разветвленный C1-C6-алкил;
R7 означает - CONHOH, циклоалкил, 5-6-членный гетероцикл, содержащий в качестве гетероатома азот или серу; фенил или фенилзамещенный фенил;
R1 - водород или метил;
R5 - C1-C6-алкил, возможно замещенный гетероциклом, содержащим азот в качестве гетероатома, или R3 и R5 вместе образуют двухвалентный замещенный углеводородный радикал, содержащий 8-14 атомов углерода,
или их соли, сольваты или гидраты, при условии, что R3 не является боковой цепью природной альфа-аминокислоты или боковой цепью природной альфа-аминокислоты, в которой защищены любые функциональные заместители, ацилированы любые аминогруппы и этерифицированы любые карбоксильные группы.
N2-[3S-гидрокси-4-(N-гидроксиамино)-2R-изобутилсукцинил] -L-(4-оксиметилкарбокси)фенилаланин-N1-метиламид;
N2-[3S-гидрокси-4-(N-гидроксиамино)-2R-изобутилсукцинил] -L-фенилглицин-N1-метиламид;
N2-[3S-гидрокси-4-(N-гидроксиамино)-2R-изобутилсукцинил] -L-(4-фенил)фенилаланин-N1-метиламид;
N2-[3S-гидрокси-4-(N-гидроксиамино)-2R-изобутилсукцинил] -амино-1-азациклотридекан-2-он;
N2-[3S-гидрокси-4-(N-гидроксиамино)-2R-изобутилсукцинил] -L-3-(1-пиразолил)аланин-N1-метиламид;
N2-[3S-гидрокси-4-(N-гидроксиамино)-2R-изобутилсукцинил] -L-4-(N-гидроксиамино)глутамовой кислоты-N1-метиламид;
N2-[3S-гидрокси-4-(N-гидроксиамино)-2R-изобутилсукцинил] -L-3-(2-тиенил)аланин-N1-метиламид;
N2-[3S-гидрокси-4-(N-гидроксиамино)-2R-изобутилсукцинил] -L-циклогексил-аланин-N1-(3-(2-пирролидон)пропил)амид,
и их соли, сольваты и гидраты.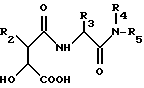
или ее активированного производного с гидроксиламином, О-защищенным гидроксиламином или их солями, причем R2, R3, R4 и R5 имеют значения, указанные для соединений общей формулы (I), за исключением того, что любые заместители в R2, R3, R4 и R5, которые способны реагировать с гидроксиламином, О-защищенным гидроксиламином или их солями, могут быть сами защищены от такой реакции, с последующим удалением любых блокирующих групп из образующихся звеньев гидроксамовой кислоты и из любых защищенных заместителей в R2, R3, R4 и R5, и необязательное превращение соединения общей формулы (I) в другое соединение общей формулы (I).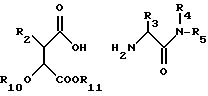
где R2, R3, R4 и R5 имеют значения, указанные для общей формулы (I), и R10 и R11, каждый в отдельности представляют собой группы, блокирующие гидроксильные группы, или, взятые вместе, образуют двухвалентный радикал, который одновременно блокирует обе гидроксильные группы,
с последующим удалением блокирующих групп или блокирующего радикала.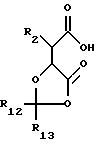
где R2 имеет значения, указанные для общей формулы (I);
R12 и R13 получены из реагента, образующего диоксалон.
| ПОЛЯРИЗАЦИОННО-ОПТИЧЕСКИЙ СПОСОБ ОПРЕДЕЛЕНИЯ ВНУТРЕННИХ НАПРЯЖЕНИИ В ТВЕРДЫХ ТЕЛАХ | 0 |
|
SU274453A1 |
| US 4599361 A, 1986 | |||
| Пожарный двухцилиндровый насос | 0 |
|
SU90A1 |
| Пожарный двухцилиндровый насос | 0 |
|
SU90A1 |
| Огнетушитель | 0 |
|
SU91A1 |
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ МАТЕРИАЛОВ, АРМИРОВАННЫХ МЕТАЛЛИЧЕСКИМ ВОЛОКНОМ | 0 |
|
SU206090A1 |
| РЕВЕРСИВНЫЙ ДВОИЧНЫЙ СЧЕТЧИК | 0 |
|
SU236872A1 |
| Штамп для горячей штамповки заготовок | 1974 |
|
SU489577A1 |
Авторы
Даты
1999-02-27—Публикация
1993-07-23—Подача