Изобретение относится к терапевтически активным сложным эфирам и тиоэфирам, к способам их получения и содержащим их фармацевтическим композициям, а также к применению указанных соединений в медицине. В частности, указанные соединения являются ингибиторами пролиферации ряда быстро делящихся опухолевых клеток, например, клеток меланомы и/или лимфомы.
Уровень техники
В описании и в формуле изобретения международной заявки PCT/GB97/02398 заявителя раскрыт способ ингибирования пролиферации опухолевых клеток млекопитающих, включающий введение млекопитающим, страдающим от указанной пролиферации соединения общей формулы (I) или его фармацевтически приемлемой соли, гидрата или сольвата, взятого в количестве, достаточном для ингибирования такой пролиферации:
где R представляет собой водород
или (C1-C6) алкил;
R1 представляет собой водород;
(C1-C6) алкил;
(С2-С6)алкенил;
фенил или замещенный фенил,
фенил (C1-C6) алкил или замещенный фенил(С1-С6)алкил;
фенил (C2-C6) алкенил или замещенный фенил (С2-С6)алкенил, гетероциклил или замещенный гетероциклил;
гетероциклил(С1-С6)алкил или замещенный гетероциклил (C1-С6) алкил;
группу BSOnА, где n имеет значение 0, 1 или 2, и В представляет собой водород или (C1-C6) алкил, фенил, замещенный фенил, гетероциклил, замещенный гетероциклил, (C1-C6)ацил, фенацил или замещенную фенацильную группу, и А представляет собой (С2-С6)алкилен;
гидрокси или (С1-С6)алкокси;
амино, защищенную амино, ациламино, (С1-С6)алкиламино или ди-(С1-С6)алкиламино;
меркапто или (С1-С6) алкилтио;
амино(С1-С6) алкил, (С1-С6)алкиламино(С1-С6)алкил, ди(С1-С6)алкиламино(С1-С6)алкил, гидрокси(С1-С6)алкил, меркапто(С1-С6)алкил или карбокси(С1-С6) алкил, при этом амино-, гидрокси-, меркапто или карбоксильная группа необязательно защищены или карбоксильная группа - амидирована;
низший алкил, замещенный карбамоилом, моно(низший алкил) карбамоилом, ди(низший алкил) карбамоилом, ди(низший алкил)амино, или карбоксинизший алканоиламино; или
циклоалкильное, циклоалкенильное или не-ароматическое гетероциклическое кольцо, содержащее до 3 гетероатомов, каждое из которых может быть (i) замещено одним или более заместителями, выбранными из C1-C6 алкила, С2-С6 алкенила, галогена, циано (-CN), -СО2Н, -CO2R, -CONH2, -CONHR, -CON(R)2. -OH, -OR, оксо-, -SH, -SR, -NHCOR, и -NHCO2R, где R представляет собой C1-C6 алкил или бензил и/или (ii) сконденсировано с циклоалкильным или гетероциклическим кольцом;
R2 представляет собой C1-C12 алкильную, С1-C12 алкенильную, C1-C12 алкинильную, фенил(С1-С6 алкильную)-, гетероарил (С1-С6 алкильную)-, фенил(С2-С6 алкенильную)-, гетероарил-(С2-С6 алкенильную)-, фенил (С2-С6 алкинильную)-, гетероарил(С2-С6 алкинильную)-, циклоалкил (С1-С6 алкильную)-, циклоалкил (C2-C6 алкенильную)-, циклоалкил (С2-С6 алкинильную)-, циклоалкенил (С1-С6 алкильную)-, циклоалкенил(С2-С6 алкенильную)-, циклоалкенил(С2-С6 алкинильную)-, фенил(С1-С6 алкил)O(С1-С6 алкильную)-, или гетероарил(С1-С6 алкил)O(С1-С6 алкильную)-группу, каждая из которых может быть необязательно замещена с помощью
С1 -С6 алкила,
C1-C6 алкокси,
галогена,
циано (-CN),
фенила, или
фенила, замещенного C1-C6 алкилом, C1-C6 алкокси, галогеном, или циано (-CN);
R3 представляет собой характеристическую группу природной или неприродной α-аминокислоты, в которой любые функциональные группы могут быть защищены, и
R4 представляет собой группу сложного эфира или тиоэфира, или его фармацевтически приемлемая соль, гидрат или сольват.
Краткое описание изобретения
Настоящее изобретение относится к определенным характерным соединениям, которые ингибируют пролиферацию опухолевых клеток у млекопитающих. Эти соединения специально не описаны в PCT/GB97/02398, и имеют ценные фармакологические и фармакокинетические свойства как ингибиторы опухолевых клеток.
Детальное описание изобретения
Объектом настоящего изобретения является соединение, выбранное из группы, включающей:
2(R или S)-[2R-(S-Гидрокси-гидроксикарбамоил-метил)-4-метил-пентаноиламин]-2-фенилэтановой кислоты циклопентиловый эфир,
2(R или S)-(3S-Гидроксикарбамоил-2R-изобутил-гекс-5-еноиламино)-2-фенилэтановой кислоты изопропиловый эфир,
2(R или S)-[2R-(S-Гидроксикарбамоил-метокси-метил)-4-метил-пентаноиламино]-3-фенилэтановой кислоты циклопентиловый эфир,
2(R или S)-(3S-Гидроксикарбамоил-2R-изобутил-гекс-5-еноиламино)-2-(4-метоксифенил)этановой кислоты циклопентиловый эфир,
2(R или S)-(3S-Гидроксикарбамоил-2R-изобутил-гекс-5-еноиламино)-2-(тиен-2-ил)этановой кислоты циклопентиловый эфир,
2(R или S)-(3S-Гидроксикарбамоил-2R-изобутил-гекс-5-еноиламино)-2-(тиен-3-ил)этановой кислоты циклопентиловый эфир,
и их фармацевтически или ветеринарно приемлемые соли, гидраты или сольваты.
2-S Диастереоизомеры приведенных выше соединений предпочтительны.
Соли соединений по изобретению включают физиологически приемлемые кислотно-аддитивные соли, например, хлоргидраты, бромгидраты, сульфаты, метансульфонаты, п-толуолсульфонаты, фосфаты, ацетаты, цитраты, сукцинаты, лактаты, тартраты, фумараты и малеаты. Соли могут быть также образованы с основаниями, например натриевые, калиевые, магниевые и кальциевые соли.
В другом аспекте изобретение включает в себя способ ингибирования пролиферации опухолевых клеток у млекопитающих, включающий введение млекопитающему, страдающему от такой пролиферации, соединения, определенного выше или его фармацевтически или ветеринарно приемлемой соли, гидрата или сольвата, взятого в количестве, достаточном для ингибирования указанной пролиферации.
Еще в одном аспекте изобретение включает применение соединения, определенного выше, или его фармацевтически или ветеринарно приемлемой соли, гидрата или сольвата, для получения композиции для ингибирования пролиферации опухолевых клеток у млекопитающих.
Соединения по изобретению пригодны для лечения человека и животного, поскольку они проявляют активность, связанную с ингибированием пролиферации раковых клеток. Таким образом областью применения настоящего изобретения является лечение таких злокачественных опухолей, которые вызываются сверхпролиферацией клеток лимфомы, лейкемии, миеломы, аденокарциномы, карциномы, мезотелиомы, тератокарциномы, хориокарциномы, мелкоклеточной карциномы, крупноклеточной карциномы, меланомы, ретинобластомы, фибросаркомы, леомиосаркомы, глиобластомы или эндотелиомы. Должно быть понятно, что различные соединения по изобретению будут проявлять различную активность в качестве ингибиторов пролиферации в зависимости от типа опухоли, которую подвергают лечению. Активность каждого конкретного соединения по изобретению в отношении ингибирования пролиферации каждого конкретного типа опухоли может быть определена с помощью разработанных стандартных методик, например, аналогичных тем, что описаны в примерах, приведенных далее в описании.
В другом аспекте изобретением является фармацевтическая или ветеринарная композиция, содержащая вышеприведенное соединение вместе с фармацевтически или ветеринарно приемлемым эксципиентом или носителем. В композицию могут входить одно или более соединений по изобретению вместе с одним или более эксципиентами или носителями.
Перорально вводимые композиции могут быть в виде таблеток, капсул, порошков, гранул, облаток, жидких или гелевых препаратов, таких как оральные, для местного нанесения или стерильные парентеральные растворы или суспензии. Таблетки или капсулы для перорального введения могут быть в форме разовой дозы и могут содержать обычные эксципиенты, такие как связывающие вещества, например, сиропы, акацию, желатин, сорбитол, трагакант или поливинил-пирролидон; наполнители, например, лактозу, сахар, маисовый крахмал, фосфат кальция, сорбитол или глицин; таблетируемые смазывающие вещества, например, стеарат магния, тальк полиэтиленгликоль или кремнезем; разрыхлители, например, картофельный крахмал или приемлемые смачивающие вещества, такие как лаурилсульфат натрия. Таблетки могут иметь оболочку, которую изготавливают по известной методике, применяемой в фармацевтике. Перорально вводимые жидкие препараты могут быть в форме, например, водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров, или они могут быть в виде сухого продукта, предназначенного для разведения водой или другим пригодным растворителем перед употреблением. Указанные жидкие препараты могут содержать обычные добавки, такие как суспендирующие агенты, например, сорбитол, сироп, метилцеллюлозу, сироп глюкозы, желатиновые гидрированные пищевые жиры; эмульгаторы, например, летицин, сорбитан моноолеат; или акацию; не водные растворители (которые могут включать пищевые жиры), например, миндальное масло, фракционированное кокосовое масло, масляные эфиры, например, глицерин, пропиленгликоль, или этиловый спирт; консерванты, например, метил или пропил п-гидроксибензоат или сорбиновую кислоту и, по желанию, обычные вкусовые и окрашивающие добавки.
Для местного нанесения на кожу лекарственное средство может быть изготовлено в виде крема, лосьона или мази. Составы кремов или мазей, которые могут быть использованы в качестве лекарственного средства, являются обычными составами, хорошо известными в этой области, например, такими как описанные в справочниках по фармакопее.
Активный ингредиент может быть также введен парентерально в стерильной среде. В зависимости от растворителя и используемой концентрации, лекарственное средство может быть либо суспендировано, либо растворено в растворителе. Преимущественно в растворителе могут быть растворены адъюванты, такие как местные анастетики, консерванты и буферные агенты.
Должно быть понятно, что уровень индивидуальной дозы для каждого конкретного пациента будет зависеть от множества факторов, включая активность применяемого конкретного соединения, возраста, веса тела, общего состояния здоровья, пола, диеты, времени введения, пути введения, степени экскреции, комбинации лекарственных средств и серьезности конкретного заболевания, которое лечат.
Соединения по изобретению (Примеры 1-6) получают с использованием процессов, аналогичных описанным в Примерах 8, 16, 3 и 41, приведенным в описании к международной заявке PCT/GB97/02398. Эти примеры воспроизведены ниже, как Препаративные примеры A-D соответственно. Продукты, полученные в виде смесей диастереоизомеров, разделяют с помощью высокоэффективной жидкостной хроматографии (hplc) с обращенной фазой. В примерах использованы следующие сокращения:
ДХМ - Дихлорметан
ДМФА - N,N-Диметилформамид
NMM - N-Метилморфолин
TFA - Трифторуксусная кислота
НОВТ - 1-Гидроксибензотриазол
Проводят колоночную флэш градиентную хроматографию на силикагеле. 1H-ЯМР и 13С-ЯМР снимают на Bruker AC 250E спектрометре при 250,1 и 62,9 МГц соответственно. CDCl3 метанол-d4 и димeтилcyльфoкcид-d6 (DMSO-d6) используют в качестве растворителей и внутренних стандартов; спектры выражены как δ ppm от TMS.
Препаративный пример А
2S-[2R-(S-Гидрокси-гидроксикарбамоил-метил)-4-метил-пентаноиламин] -3-фенил-пропионовой кислоты изопропиловый эфир.

(a) 2S-[2R-(2,2-Диметил-5-оксо-[1,3] диоксолан-4S-ил)-4-метил-пентаноиламино]-3-фенилпропионовой кислоты изопропиловый эфир.
Раствор пентафторфенилового эфира 2R-(2,2-диметил-5-оксо-[1,3-диоксолан-4S-ил)-4-метилпентановой кислоты (WO 95/19956) (2,87 г, 7,3 ммоль) и изопропилового эфира L-фенилаланина (1,5 г, 7,3 ммоль) в ДХМ оставляют стоять при комнатной температуре в течение 96 часов. Реакционную смесь разбавляют с помощью ДХМ и промывают 1М водным раствором карбоната натрия, 1М соляной кислотой и рассолом, а затем сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении. Продукт перекристаллизовывают из этилацетата/гексана с получением 2S-[2R-(2,2-диметил-5-оксо-[1,3]-диоксолан-45-ил)-4-метил-пентаноиламино] -3-фенилпропионовой кислоты изопропилового эфира в виде тонких белых игл (810 мг, 29%).
(b) 2S-[2R-(S-Гидрокси-гидроксикарбамоил-метил)-4-метил-пентаноиламин] -3-фенилпропионовой кислоты изопропиловый эфир.
Раствор метилата натрия (325 мг, 6,1 ммоль) и хлоргидрата гидроксиламина (396 мг, 6,1 ммоль) в метаноле (15 мл) перемешивают при комнатной температуре в течение 2 часов. Затем раствор фильтруют в раствор 2S-[2R-(2,2-диметил-5-оксо-[1,3]-диоксолан-4S-ил)-4-метил-пентаноиламино]-3-фенилпропионовой кислоты изопропилового эфира (800 мг, 2,1 ммоль) в метаноле (10 мл). Реакцию оставляют стоять при комнатной температуре на 18 часов. Затем реакционную смесь концентрируют при пониженном давлении и остаток распределяют между этилацетатом и водой. Органический слой промывают водой, сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении. Перекристаллизация из этилацетата дает 2S-[2R-(S-гидрокси-гидроксикарбамоил-метил)-4-метил-пентаноиламин] -3-фенил-пропионовой кислоты изопропиловый эфир в виде белого кристаллического продукта, который сушат под вакуумом (465 мг, 58%).
Препаративный пример В
2S-[2R-(S-Гидроксикарбамоил-метокси-метил)-4-метил-пентаноиламино] -3-фенилпропионовой кислоты изопропиловый эфир
(a) 2R-(S-Бензилоксикарбамоил-метокси-метил)-4-метил-пентановая кислота. Раствор 3R-изобутил-4S-метокси-дигидрофуран-2,5-диона (WO 97/02239) (609 мг, 3,27 ммоль), и 0-бензилгидроксиламина (403 мг, 3,27 ммоль) в этилацетате (5 мл) перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь концентрируют при пониженном давлении, что обеспечивает получение 2R-(S-бензилоксикарбамоил-метокси-метил)-4-метил-пентановой кислоты в виде белой пены (1,01 г, 100%).
(b) 2S-[2R-(S-Бензилоксикарбамоил-метокси-метил)-4-метил-пентаноиламино] -3-фенилпропионовой кислоты изопропиловый эфир
Раствор 2R-(S-бензилоксикарбамоил-метокси-метил)-4-метил-пентановой кислоты (1,01 г, 3,3 ммоль) в тетрагидрофуране (15 мл) при 0oС обрабатывают с помощью изопропилового эфира L-фенилаланина (810 мг, 3,9 ммоль) и хлоргидрата N-(3-диметиламинопропил)-N'-этилкарбодиимида (750 мг, 3,9 ммоль). Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение 18 часов. Раствор концентрируют при пониженном давлении и остаток переносят в ДХМ. Этот раствор промывают 1 М соляной кислотой, насыщенным раствором бикарбоната натрия и рассолом. Органическую фазу сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Продукт очищают с помощью колоночной хроматографии, элюируя 2% метанолом/ДХМ. Содержащие продукт фракции объединяют и концентрируют при пониженном давлении, что обеспечивает получение 2S-[2R-(S-бензилоксикарбамоил-метокси-метил)-4-метил-пентаноиламино] -3-фенил-пропионовой кислоты изопропилового эфира в виде белого твердого вещества (1,39 г, 85%).
(с) 2S-[2R-(S-Гидроксикарбамоил-метокси-метил)-4-метил-пентаноиламино] -3-фенилпропионовой кислоты изопропиловый эфир
Раствор 2S-[2R-(S-бензилоксикарбамоил-метокси-метил)-4-метил-пентаноиламиио] -3-фенилпропионовой кислоты изопропилового эфира (1,37 г, 2,8 ммоль) в этаноле (30 мл) обрабатывают с помощью палладиевого катализатора (274 мг, 10% Pd/уголь) в виде взвеси в этилацетате (5 мл). В течение 2 часов через суспензию пропускают водород. Реакционную смесь фильтруют и концентрируют при пониженном давлении. Продукт перекристаллизовывают из этилацетата/гексана, что обеспечивает получение 2S-[2R-(S-гидроксикарбамоил-метокси-метил)-4-метил-пентаноиламино] -3-фенилпропионовой кислоты изопропилового эфира в виде белого твердого вещества (778 мг, 70%).
Препаративный пример С
2S-(3S-Гидроксикарбамоил-2R-изобутил-гекс-5-еноиламино)-3-фенилпропионовой кислоты изопропиловый эфир
(a) 2S-(3S-трет-Бутоксикарбонил-2R-изобутил-гекс-5-еноиламино)-3-фенилпропионовой кислоты изопропиловый эфир
Раствор изопропилового эфира L-фенилаланина (3,9 г, 18,8 ммоль) в ДМФА (15 мл) охлаждают на водяной бане со льдом и обрабатывают с помощью пентафторфенилового эфира 3S-трет. -бутоксикарбонил-2R-изобутил-гекс-5-еновой кислоты (9,03 г, 20,7 ммоль). Реакцию оставляют нагреваться до комнатной температуры и перемешивают в течение ночи. Реакционную смесь концентрируют при пониженном давлении. Остаток переносят в этилацетат и промывают 1М соляной кислотой, 1М карбонатом натрия и рассолом. Раствор сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Продукт очищают с помощью колоночной хроматографии, используя градиент элюирования от 100% ДХМ до 10% метанол/ДХМ. Фракции, содержащие продукт, объединяют, растворитель удаляют с получением 2S-(3S-трет.-бутоксикарбонил-2R-изобутил-гекс-5-еноиламино)-3-фенилпропионовой кислоты изопропиловый эфир в виде твердого вещества желтого цвета (3,5 г, 41%).
(b) 2S-(3S-Гидроксикарбонил-2R-изобутил-гекс-5-еноиламино)-3-фенилпропионовой кислоты изопропиловый эфир
Раствор изопропилового эфира 2S-(3S-трет-бутоксикарбонил-2R-изобутил-гекс-5-еноиламино)-3-фенилпропионовой кислоты (3,5 г, 7,6 ммоль) в смеси трифторуксусной кислоты и ДХМ (1:1, 10 мл) оставляют стоять при 5oС в течение ночи. Реакционную смесь концентрируют при пониженном давлении. Добавление эфира к остатку приводит к 2S-(3S-гидроксикарбонил-2R-изобутил-гекс-5-еноиламино)-3-фенилпропионовой кислоты изопропиловому эфиру в виде белого твердого вещества (261 мг, 8%).
(с) 2S-(3S-Гидроксикарбамоил-2R-изобутил-гекс-5-еноиламино)-3-фенилпропионовой кислоты изопропиловый эфир
Раствор 2S-(3S-гидроксикарбонил-2R-изобутил-гекс-5-еноиламино)-3-фенилпропионовой кислоты изопропиловый эфир (260 мг, 0,64 ммоль) в ДМФА (10 мл) охлаждают на водяной бане со льдом. При перемешивании добавляют N-(3-диметиламинопропил)-N'-этилкарбодиимид хлоргидрат (148 мг, 0,77 ммоль) и НОВТ (104 мг, 0,77 ммоль). Реакции дают нагреться до комнатной температуры и через 2 часа добавляют раствор гидроксиламина хлоргидрата (67 мг, 0,96 ммоль) и NMM (0,1 мл, 0,96 ммоль) в ДМФА (5 мл). После перемешивания в течение ночи реакционную смесь концентрируют при пониженном давлении и продукт очищают с помощью хроматографии на промытом кислотой диоксиде кремния, используя 5-10% метанол в ДХМ. Перекристаллизация из этилацетата/гексана обеспечивает получение 2S-(3S-гидроксикарбамоил-2R-изобутил-гекс-5-еноиламино)-3-фенилпропионовой кислоты изопропилового эфира в виде белого твердого вещества (12 мг, 4%).
Препаративный пример D
2S-(3S-Гидроксикарбамоил-2R-изобутил-гекс-5-еноиламино)-2-фенилэтановой кислоты циклопентиловый эфир
Названное соединение получают по методике, аналогичной описанной в Препаративном примере С, с использованием циклопентилового эфира L-фенилглицина вместо изопропилового эфира L-фенилаланина.
Пример 1
2-[2R-(S-Гидрокси-гидроксикарбамоил-метил)-4-метил-пентаноиламин] -2-фенилэтановой кислоты диклопентиловый эфир
Получают с использованием методики, аналогичной описанной в Препаративном примере А из циклопентилового эфира фенилглицина.
Диастереоизомер А
1H-ЯМР: δ (MeOD), 7.4-7.29 (5Н, м), 5.43 (1H, с), 5.2-5.14 (1Н, м), 4.02 (1H, д J= 6,9Гц), 2.94-2.85 (1H, м), 1.91-1.34 (10Н, широкий мультиплет), 1.25-1.14 (1H, м) и 0.86 (6Н, дд, J= 6.5, 11.5Гц).
13С-ЯМР; δ (MeOD), 175.6, 171.8, 171.4, 137.8, 129.8, 129.4, 128.6, 80.0, 73.2, 58.5, 49.2, 39.1, 33.3, 33.3, 26.8, 24.5, 24.4, 23.7 и 22.1.
Диастереоизомер В
1H-ЯМР; δ (MeOD), 7.33-7.19 (5Н, м), 5.3 (1H, с), 5.11-5.06 (1H, м). 3.81 (lH, d. J=7.3Гц), 2.83-2.74 (1H, м), 1.83-1.45 (10Н, широкий мультиплет), 1.12-1.03 (1H, м) и 0.88-0.81 (6Н, дд, J=6.4, 12,3Гц). 13С-ЯМР; δ (MeOD), 175.8, 171.8, 171.5, 137.3, 129.8, 129.5, 128.8, 79.9, 73.3, 58.7, 48.9, 39.2, 33.3, 33.3, 26.7, 24.5, 24.5, 24.0 и 22.2.
Пример 2
2-(3S-Гидроксикарбамоил-(2R-изобутил-гекс-5-еноиламино)-2-фенилэтановой кислоты изопропиловый эфир
Получают, используя методику, аналогичную описанной в Препаративном примере D, исходя из изопропилового эфира фенилглицина.
Диастереоизомер А
1Н-ЯМР; δ (MeOD), 7.34-7.24 (5Н, м), 5.59-5.42 (1H, м), 5.36 (1H, с), 5.02-4.77 (3Н, м), 2.63-2.53 (1H. м), 2.17-2.02 (2Н, м), 1.89-1.78 (1H, м), 1.63-1.45 (2Н, м). 1.18 (3Н, д, J=6.3 Гц), 1.05 (3Н, д, J=6.2 Гц), 1.00-0.93 (1H, м), 0.88 (3Н, d, J=6.5Гц) и 0.81 (3Н, d. J=6.5 Гц). 13С-ЯМР; δ (MeOD), 176.2, 172.4, 171.3, 137.6, 136.0, 129.9, 129.6, 129.0, 117.4, 70.5, 58.7, 47.4, 41,5, 36.0, 26.7, 24.5, 21.9, 21.7 и 21.7.
Диастереоизомер В
1Н-ЯМР; δ (MeOD), 7.4-7.34 (5Н, м), 5.77-5.61 (1H, м), 5.42 (1Н, с), 5.1-4.98 (3Н, м), 2.7-2.6 (1Н, м), 2.44-2.17 (3Н, м), 1.61-1.5 (1Н,м), 1.42-1.29 (1H, м), 1.25 (3Н, д, J=6.3Гц), 1.13 (3Н, д, J=6.2 Гц), 1.09-1.00 (1H, м) и 0.81 (6Н, д, J=6.4Гц). 13С-ЯМР; δ (MeOD), 176.4. 172.5, 171.5, 137.2, 136.4, 129.9, 129.6, 129.0, 117.5, 70.5, 58.8, 48.4, 47.4, 41.3, 36.0, 27.1, 24.3, 21.9, 21.8 и 21.6.
Пример 3
2-[2R-(S-Гидроксикарбамоил-метокси-метил)-4-метил-пентаноиламино] -3-фенилэтановой кислоты циклопентиловый эфир
Получают, используя методику, аналогичную описанной в Препаративном примере В, исходя из циклопентилового эфира фенилглицина.
Диастереоизомер А
1H-ЯМР; δ (MeOD), 8.83 (1H, д, J=6.6 Гц), 7.48-7.29 (5Н, м), 5.44-5.42 (1H, м), 5.20-5.16 (1H, м), 3.53 (1H, д, J=9.7 Гц), 3.17 (3Н, с), 2.89-2.79 (1H, м), 1.90-1.54 (10Н, широкий мультиплет), 1.06-0,99 (1H, м), 0.95 (3Н, д, J= 6.5 Гц) и 0.90 (3Н, д, J=6,4Гц). 13С-ЯМР; δ (MeOD), 175.3, 171.6, 169.4, 137.5, 129.7, 129.4, 128,7, 83.1, 79.9, 58.7, 58.1, 48.5, 38.4, 33.4, 33.3, 26.7, 24.6, 24.5, 24.3 и 21.8.
Диастереоизомер В
1Н-ЯМР; δ (MeOD), 7.39-7.30 (5Н, м), 5.45 (1 Н, с), 5.21-5.15 (1 Н, м), 3.59 (1Н, д, J= 9.4 Гц). 3.29 (3Н, с), 2-89-2.79 (1Н, м), 1.93-1,49 (9Н, широкий мультиплет), 1.42-1.21 (1H, м), 1.01 (1H, дд, J=3.7, 9.9, 13.3 Гц), 0.83 (3Н, д, J=6.5 Гц) и 0.79 (3Н, д, J=6.6 Гц). 13С-ЯМР; δ (MeOD), 175.1, 171.5, 169.5, 137.9, 129.7, 129.4, 128.7, 83.0, 79.8, 58.5, 58.3, 48.6, 38.5, 33.3, 27.8, 24.5, 24.4, 24.1 и 21.7.
Пример 4
2-(3S-Гидроксикарбамоил-2R-изобутил-гекс-5-еноиламино)-2-(4-метоксифенил)этановой кислоты циклопентиловый эфир
Получают, используя методику, аналогичную описанной в Препаративном примере D, исходя из циклопентилового эфира 4-метоксифенилглицина.
Диастереоизомер А
1Н-ЯМР; δ (MeOD), 8.94 (1H, д. J=6.4 Гц), 7.32 (2Н, д, J=8.7 Гц), 6.93 (2Н, д, J=8.7 Гц), 5.67-5.50 (1H, м), 5.36-5.33 (1H, м), 5.20-5.14 (1H, м), 4.93-4,87 (2Н, м), 3.79 (3Н, с), 2.68-2.59 (1H, м), 2.24-2.09 (2Н, м), 1.97-1.55 (11Н, широкий мультиплет), 1.11-1.00 (1Н, м), 0.95 (3Н, д, J= 6.5Гц) и 0.88 (3Н, д, J=6.5Гц). 13С-ЯМР; δ (MeOD). 176.2, 172.4, 171.9, 161.4, 136.0, 130.2, 129.4, 117.4, 115.2, 79.7, 58,2, 55.8, 48.3, 47.3, 41.5, 36.0, 33.4, 33,3, 26.7, 24.6, 24.5 и 21.7.
Диастереоизомер В
1H-ЯМР; δ (MeOD), 8.96 (1Н, д, J=6.7 Гц), 7.29 (2Н, д, J=8.7 Гц), 6.93 (2Н, д, J= 8.7 Гц), 5.77-5.61 (1Н, м), 5.32 (1H, с), 5.20-5.15 (1Н, м), 5.09-4.97 (2Н, м), 3.80 (3Н, с), 2.64 (1 Н, дт, J=3.3. 11.4. 13.5 Гц), 2.43-2.16 (3Н, м), 1.91-1.49 (9Н, широкий мультиплет), 1.42-1.29 (1Н, м), 1.05 (1H, ддд, J=3.3, 10.1, 13.2 Гц) и 0.81 (6Н, д, J=6.5 Гц). 13С-ЯМР; δ (MeOD), 176.3, 172.5, 172.0, 161.4, 136.4, 130.2, 129.0, 117.5, 115.2, 79.8, 58.2, 55.8, 48.4, 47.4, 41.3, 36.1, 33.4, 27.1, 24.5, 24.3 и 21.6.
Пример 5
2-(3S-Гидроксикарбамоил-2R-изобутил-гекс-5-еноиламино)-2-(тиен-2-ил)этановой кислоты циклопептиловый эфир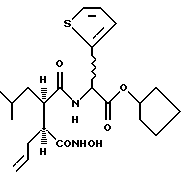
Получают, используя методику, аналогичную описанной в Препаративном примере D, исходя из циклопентилового эфира тиен-2-илглицина.
Диастереоизомер А
1Н-ЯМР; δ (MeOD),7.41 (1H, дд, J=5.1, 1.2 Гц), 7.12 (1Н, д, J=3.5 Гц), 7.01 (1Н, дд, J= 5.1, 3.5 Гц), 5.72 (1H, с), 5.69-5.52 (1H, м), 5.26-5.18 (1H, м), 5.00-4.89 (2Н, м), 2.70-2.59 (1H, м), 2.28-2.13 (2Н, м), 2.09-1.50 (11Н, м), 1.05 (1H, ддд, J=13.8, 11,0, 2.9 Гц), 0.93 (3Н, д. J=6,4 Гц) и 0.87 (3Н. д, J= 6.5 Гц). 13С-ЯМР; δ (MeOD), 176.5, 172.7, 171.1, 139.5, 136.4, 128.4, 128.3, 127.7, 117.9, 80.7, 54.1, 48.7, 47.7, 41.9, 36.5, 33.8, 33.7, 27.2, 25.1, 25.0, 24.9 и 22,1.
Диастереоизомер В
1Н-ЯМР; δ (MeOD), 7.42 (1H, дд, J=5.0, 0.7 Гц), 7.10 (1H, д, J=3.6 Гц), 7.01 (1H, дд, J=5.0, 3.6 Гц), 5.79-5.59 (2Н, м), 5.28-5.19 (1H, м), 5.10-4.94 (2Н, м), 2.71-2.59 (1H, м), 2.36-2.16 (3Н, м), 1.97-1.34 (10Н, м), 1.13-1.00 (1H, м), 0.86 (3Н, д, J=6,2 Гц) и 0.84 (3Н, д, J=6.3 Гц). 13С-ЯМР; δ (MeOD), 176.7, 172.8, 171.2, 139.3, 136.7, 128.3, 128.2, 127.6, 117.9, 80.7, 54.2, 48.8, 47.8, 41.7, 36.4, 33.8, 27.5, 25.1, 25.0, 24.8 и 22.1.
Пример 6
2-(3S-Гидроксикарбамоил-2R-изобутил-гекс-5-еноиламино)-2-(тиен-3-ил)этановой кислоты циклопентиловый эфир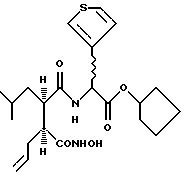
Получают, используя методику, аналогичную описанной в Препаративном примере D, исходя из циклопентилового эфира тиен-3-илглицина.
Диастереоизомер А
1H-ЯМР; δ (MeOD), 7.48-7.42 (2Н, м), 7.13 (1H, дд, J=4.2, 2.0 Гц), 5.69-5.52 (2Н, м), 5.21-5.16 (1H, м), 4.98-4.90 (2Н, м), 2.71-2.59 (1H, м), 2.28-2.11 (2Н. м), 2.00-1.50 (11Н, м), 1.12-0.98 (1H, м), 0.94 (3Н, д, J=6.4 Гц) и 0-88 (3Н, д, J=6.5Гц). 13С-ЯМР; δ (MeOD), 176.6, 172.8, 171.8, 137.8, 136.4, 128.3, 128.0, 125.2, 117.9, 80.3, 54.6, 41.9, 36.5, 33.8, 33.8, 27.1, 25.0, 24.9 и 22.1.
Диастереоизомер В
1Н-ЯМР; δ (MeOD), 7.45 (1H, дд, J=4.9, 3.0 Гц), 7.43-7.40 (1H, м), 7.12 (1H, дд, J=5.0, 1.3 Гц), 5.68 (1H, ддт, J=17.0, 10.1, 6.8 Гц), 5.53 (1H, с), 5,23-5,17 (1H, м), 5.10-4.96 (2Н, м), 2.70-2.60 (1H, м), 2.41-2.16 (3Н, м), 1.94-1.49 (9Н, м), 1.44-1.29 (1Н, м), 1.05 (1Н, ддд, J=12.9, 10.3, 3,3 Гц), 0.84 (3Н, д, J=6.5 Гц) и 0.83 (3Н, д, J=6,5 Гц).
Биологический Пример
В следующих исследованиях клеточной пролиферации, соединения по Примерам 1-6 проходят тесты, по которым соответственно определяют их способность к ингибированию пролиферации обсуждаемого типа клеток.
Клеточную линию человека, а именно гистиоцитную лимфому (U937), засевают в 30 мм2 ячейки для культивирования клеток в соответствующей культуральной среде с добавлением 10% околоплодной сыворотки теленка, при плотности 250 клеток/мм2. Шесть часов спустя к клеткам добавляют тестируемые соединения в той же культуральной среде, при этом конечная концентрация составляет 6 мкМ. Контрольные ячейки содержат клетки, к которым добавляют ту же культуральную среду, содержащую эквивалентное количество растворителя лекарственного средства, в качестве которого в данном случае используют диметилсульфоксид с конечной концентрацией 0,08%. Через 72 часа культивирования клетки подвергают кратковременному мечению [метил-3[Н] Тимидином] (2 мк Сi/мл) в течение 3 часов и затем переносят на матрасики с фильтрами и подсчитывают радиактивность, связанную с ДНК. Результаты выражают как процент внедрения контрольного 3[Н] Тимидина (n=6±1 Stdv). Ингибирование пролиферации наблюдают в случае всех тестируемых соединений.
Примеры - Процент внедрения контрольного 3[H] Тимидина
1A - 55
1B - 1
2A - 6
2B - 23
3A - 0
3B - 26
4A - 0
4B - 19
5A - 0
5B - 0
6A - 0
6B - 3
Меченый тимидин содержат только размножающиеся клетки. Поэтому 20-процентный результат означает, что испытываемое соединений полностью ингибировало пролиферацию. Любая цифра менее 100% означает, что испытываемое соединение проявляет активность.
| название | год | авторы | номер документа |
|---|---|---|---|
| N-[2,2-ДИМЕТИЛ-1S-(ПИРИДИН-2-ИЛКАРБАМОИЛ)ПРОПИЛ]-N-ГИДРОК СИ-2R-ИЗОБУТИЛ-3S-МЕТОКСИСУКЦИНАМИД ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, ГИДРАТ ИЛИ СОЛЬВАТ | 1997 |
|
RU2198164C2 |
| АНТИБАКТЕРИАЛЬНЫЕ АГЕНТЫ | 2000 |
|
RU2269525C2 |
| ПРОИЗВОДНЫЕ ГИДРОКСАМОВОЙ ИЛИ КАРБОНОВОЙ КИСЛОТЫ И ФАРМАЦЕВТИЧЕСКАЯ ИЛИ ВЕТЕРИНАРНАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1995 |
|
RU2136657C1 |
| ПРОИЗВОДНЫЕ ГИДРОКСАМОВОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ ИЛИ ВЕТЕРИНАРНАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1993 |
|
RU2126791C1 |
| АНТИБАКТЕРИАЛЬНЫЕ АГЕНТЫ | 1999 |
|
RU2246941C2 |
| ПРОИЗВОДНЫЕ АЗОТСОДЕРЖАЩИХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБЫ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ И ЗАБОЛЕВАНИЙ ДЫХАТЕЛЬНЫХ ПУТЕЙ | 2001 |
|
RU2265011C2 |
| ПРОИЗВОДНЫЕ ПИПЕРИДИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2001 |
|
RU2298550C2 |
| СПОСОБ ИДЕНТИФИКАЦИИ ПРОТИВООПУХОЛЕВЫХ ЦЕЛЕВЫХ ФЕРМЕНТОВ | 2002 |
|
RU2319482C2 |
| СОЕДИНЕНИЯ, ПРИГОДНЫЕ ДЛЯ ТЕРАПИИ ПРОТИВ ВИЧ | 2019 |
|
RU2806030C2 |
| ПРОИЗВОДНОЕ АМИНОКИСЛОТЫ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1992 |
|
RU2104265C1 |
Настоящее изобретение относится к следующим соединениям: 2(R или S)-[2R-(S-гидрокси-гидроксикарбамоил-метил)-4-метил-пентаноиламин] -2-фенилэтановой кислоты циклопентиловый эфир; 2(R или S)-(3S-гидроксикарбамоил-2R-изобутил-гекс-5-еноиламино)-2-фенилэтановой кислоты изопропиловый эфир; 2(R или S)-[2R-(S-гидроксикарбамоил-метокси-метил)-4-метил-пентаноиламино] -3-фенилэтановой кислоты циклопентиловый эфир; 2(R или S)-(3S-гидроксикарбамоил-2R-изобутил-гекс-5-еноиламино)-2-(4-метоксифенил) этановой кислоты циклопентиловый эфир; 2(R или S)-(3S-гидроксикарбамоил-2R-изобутил-гекс-5-еноиламино)-2-(тиен-2-ил) этановой кислоты циклопентиловый эфир; 2(R или S)-(3S-гидроксикарбамоил-2R-изобутил-гекс-5-еноиламино)-2-(тиен-3-ил) этановой кислоты циклопентиловый эфир. Эти соединения обладают свойствами ингибировать пролиферацию опухолевых клеток у млекопитающих и поэтому могут использоваться в качестве активного ингредиента в фармацевтической композиции. 3 с. и 2 з.п. ф-лы.
| Пожарный двухцилиндровый насос | 0 |
|
SU90A1 |
| RU 95109920 А1, 27.10.1996 | |||
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| US 4743587 А, 18.03.1997. | |||
Авторы
Даты
2002-08-20—Публикация
1998-03-12—Подача