Изобретение относится к области микробиологии, более конкретно оно связано с микробиологическими анализами. В частности предметом данного изобретения является способ обнаружения микроорганизмов в биологическом образце компьютеризированным анализом отображения. Кроме того, предметом данного изобретения является способ определения чувствительности микроорганизмов к антибиотическим препаратам компьютеризированным анализом отображения.
Данным изобретением предлагается также система для реализации указанных способов.
Предшествующие данному изобретению работы, которые можно рассматривать в качестве уровня техники, 'представлены в конце описания перед формулой изобретения. Ссылки на эти предшествующие работы будут осуществляться путем обозначения в скобках их номера в этом списке.
Микробиологические тесты широко применяют в таких прикладных областях, как медицина, мониторинг качества воды, проверка безопасности продуктов и т. д. В клинической практике микробиологические анализы имеют особое значение и играют главную роль в диагностике инфекций и (или) в выборе надлежащих препаратов для лечения в случае инфекции. При выполнении таких анализов определяют присутствие патогенных микроорганизмов в клинических образцах, их количество, идентифицируют их, а также определяют их чувствительность к антибиотическим препаратам.
Наиболее широко используемые микробиологические анализы включают в себя инкубирование биологического образца на различных ростовых средах и определение роста микроорганизмов на них [1]. Для определения чувствительности микроорганизмов к препаратам рост микроорганизмов определяют в присутствии препарата [2]. Среди наиболее существенных недостатков таких анализов следует отметить тот факт, что они требуют значительного времени, обычно от 24 до 48 часов, что делает невозможным осуществление быстрой диагностики, которая необходима в случаях, когда требуется немедленное лечение. Поэтому очень часто медики вынуждены начинать лечение, не дожидаясь клинических результатов, которые имеют поэтому лишь подтверждающее значение. В результате лечение не всегда соответствует заболеванию и иногда его применяют к неинфицированным пациентам.
Кроме того, такие анализы очень трудоемки и требуют для их проведения обширных лабораторных помещений, что существенно ограничивает их широкое использование в скриннинге чувствительных популяций в случае инфекций. Например, инфекции мочевыводящих путей не всегда сопровождаются клиническими симптомами [5] , и пожилые люди, которые подвержены риску асимптоматических инфекций [5,6.7], могут не получить соответствующего лечения.
Поэтому совершенно очевидна необходимость разработки способов, не требующих длительных инкубационных периодов, у которых обнаружение, идентификация и определение чувствительности микроорганизмов к антибиотическим препаратам осуществляются достаточно быстро.
Имеется ряд быстрых способов и систем для обнаружения микроорганизмов и определения их чувствительности к антибиотическим препаратам, используемых в настоящее время [8,9,10,11,12,13,14,15]. Одна группа таких способов и систем обнаружения микроорганизмов и определения их чувствительности к антибиотическим препаратам включает в себя определенный исходный инкубационный период длительностью примерно 24 часа. Кроме временных затрат, эти способы и системы имеют еще один существенный недостаток, заключающийся в том, что они дают большой процент ложных как позитивных, так и негативных результатов. Кроме того, такие способы и системы часто не чувствительны к концентрациям микроорганизмов ниже, чем 104, либо иногда даже 105 микроорганизмов/мл. Примерами тестов, относящихся к этой группе, являются Autobac System [16,17], Auto Microbic System [18,19,20], Impedance System [21] и Bactec System [22].
Способы, относящиеся к другой группе, не требуют исходного инкубационного периода и поэтому являются более оперативными. Однако все эти способы имеют серьезный недостаток, заключающийся в том, что с их помощью нельзя определять чувствительность микроорганизмов к антибиотическим препаратам, и так же как в случае предыдущей группы возникают определенные сложности, связанные с высокой долей ложных как позитивных, так и негативных результатов, а также с невозможностью обнаруживать с их помощью микроорганизмы в концентрациях ниже 104-105 микроорганизмов/мл. Примерами таких способов являются Bac-t-Screen [19,20,23,24] , Leucocyte Esterase Activity Assay [19,23,25], the Nitrite Test [19,23,26] и АТФ Тест [26,23,27].
Следует отметить, что все описанные выше способы включают в себя определение отдельного характерного свойства бактериальной популяции, что существенно усиливает недостатки этих способов. Способ, который даст возможность тестировать несколько свойств на уровне отдельной микробной клетки, будет намного более чувствительным при идентификации и характеристике микроорганизмов в биологическом образце.
Задачей данного изобретения является разработка способа и систем компьютеризированного анализа изображения, с помощью которых микроорганизмы в биологическом образце могут быть быстро и надежно выявлены и охарактеризованы.
Другой задачей данного изобретения является разработка способа и систем компьютеризированного анализа изображения, с помощью которых микроорганизмы могут быть выявлены и охарактеризованы на основании различных морфологических свойств, которые различаются у микроорганизмов и других частиц, также как и у разных типов микроорганизмов.
Следующей задачей данного изобретения является разработка такого способа и систем, с помощью которых можно оценивать чувствительность микроорганизмов к различным антибиотическим препаратам.
Остальные задачи данного изобретения станут очевидными из последующего описания.
Задача данного изобретения решается тем, что предложен способ компьютеризированного анализа изображения, при котором пробу помещают в микроскоп, регистрируют изображение образца, например, с помощью видеокамеры, решетки из фотогальванических ячеек либо на фотографической пленке, преобразуют в цифровую форму, по возможности сохраняют и анализируют автономно или интерактивно. На основании проведенных анализов микроорганизмы идентифицируют, подсчитывают и характеризуют.
При анализе микроскопического изображения с целью обнаружения микроорганизмов прежде всего необходимо различить клетки микроорганизмов и другие частицы, близкие к ним по размеру, которые могут присутствовать в пробе, например тканевые остатки, частицы пыли, агрегаты белков и сахаров и тому подобное. Очень часто общие оптические свойства таких немикробных частиц, также как и их форма, сходны с аналогичными параметрами некоторых микроорганизмов, и поэтому при использовании обычных способов анализа отображений большая доля таких объектов может быть классифицирована как микроорганизмы либо наоборот, большое количество микроорганизмов может быть охарактеризовано как немикробные объекты, что приводит соответственно либо к завышению, либо, к занижению результатов подсчета микроорганизмов. Этот факт является основной причиной невозможности до настоящего времени использования способов анализа изображений в микробиологических исследованиях.
Как известно, объект, рассматриваемый под микроскопом, не однороден по своей яркости и различные части объекта могут отличаться друг от друга по яркости. Такая неоднородность возникает из-за различий в составе разных частей объекта, а также его формы. В соответствии с данным изобретением было неожиданно установлено, что микроорганизмы отличаются от объектов немикробной природы характером поверхностного распределения яркости. Частным примером является скорость или градиент изменения яркости на краю объекта (между внутренностью объекта и внешним окружением), причем было установлено, что они существенно различны для микроорганизмов и объектов немикробной природы одинаковых размеров. Степень изменения яркости на краю объекта будет именоваться в дальнейшем как "Оптический Наклон". Другим примером является параметр, называемый в дальнейшем "момент", который является произведением интенсивности света в каждой точке и расстояния от края объекта до этой точки.
Данное изобретение, таким образом, предлагает способ обнаружения микроорганизмов в образце компьютеризированным анализом изображения, включающий в себя помещение пробы из образца в микроскоп, регистрацию изображение, наблюдаемого в микроскоп, посредством соответствующих средств для регистрации изображения, анализ изображения с целью идентификации в нем объектов-частиц и классификацию этих объектов как микроорганизмов (микробные) или немикроорганизменных объектов (немикробные). Эта классификация включает в себя определение пространственного распределения яркости по поверхности каждого объекта.
Согласно одной предпочтительной реализации способа по изобретению, указанная классификация включает в себя определение оптического наклона объекта. Согласно другой предпочтительной реализации, указанная классификация включает в себя определение момента объекта.
Пространственное распределение яркости у микробных объектов в целом и оптического наклона и момента, в частности, лежит в определенном диапазоне, величина которого зависит от различных факторов, таких как тип освещения и его интенсивность. Например, при освещении рассеянным светом, когда используют очень яркий либо очень тусклый источник освещения, общий контраст в изображении, видимом в микроскоп, меньше, чем в случае, когда освещающий свет лежит в среднем диапазоне, и следовательно, момент и оптический наклон объектов при ярком или тусклом освещении меньше, чем в условиях средней освещенности. При использовании флуоресцентного красителя оптический наклон и момент по существу не зависят от интенсивности освещения в большом интервале.
Их величины будут зависеть от типа освещения: при использовании освещения, создающего сильные контрасты в изображении, такого как, например, освещение по методу темного поля. Фазово-контрастное освещение или эпифлуоресценция, момент и оптические наклоны, например ,будут больше, чем в случае использования освещения, не дающего сильных контрастов, такого как обычное рассеянное освещение.
С целью увеличения контраста, облегчения идентификации объектов в пробе и выявления различий между микробными и немикробными объектами, рекомендуется использовать различные контрастирующие агенты: краски, окрашивающие специфически живой материал, например метиленовый синий, акридиновый оранжевый, этидиум бромид и т.д.: краски, окрашивающие различным образом различные группы микроорганизмов, например окраска по Грамму, а также красители и реагенты, способные идентифицировать специфически одну группу микроорганизмов, например моноклональные антитела [29], специфичные для Enterobacteriaceae.
Следует отметить, что абсолютное значение как оптического наклона, так и момента зависит от типа используемого освещения: если освещение такого типа, при котором объекты-частицы видны ярче, чем их окружение, например, эпифлуоресцентное освещение, освещение по методу темного поля и т.д., то оптический наклон будет иметь положительное значение (градиент измеряли изнутри), а в случае использования такого типа освещения, при котором объекты-частицы выглядят темнее своего окружения, например освещение по методу стандартного поля, оптический наклон будет иметь отрицательное значение; а если используют освещение, создающее более выраженные контрасты, например фазовый контраст либо освещение по методу темного поля, то момент будет иметь большее значение, чем в случае освещения, имеющего тенденцию понижать контраст, например обычного рассеянного освещения. Кроме того, абсолютные величины как оптического наклона, так и момента могут быть легко оценены специалистами, и зависят от типа используемых линз, от типа микроскопа, от того, используют ли фильтры, и какого типа и т.д.
У специалиста не возникнет затруднений с непосредственным экспериментом для калибровки настроенной определенным образом системы, чтобы определить диапазон значений как оптического наклона, так и момента, характеризующих микроорганизм. Эту операцию можно осуществить, например, посредством определения оптического наклона и момента объектов при одинаковых условиях в стандартных суспензиях, содержащих либо различные немикробные объекты, либо другие суспензии, содержащие микроорганизмы.
Точность анализа в соответствии с изобретением может быть увеличена путем определения ряда других морфологических параметров объекта. К числу таких морфологических параметров относятся длина объекта, его ширина и площадь, а также его общая форма.
Термин "морфологические параметры", который будет встречаться в тексте, обозначает параметры объекта, измеряемые в соответствии с данным изобретением, включая оптический наклон, момент, длину, ширину, общую форму, а также любой другой измеряемый параметр.
Посредством определения различных морфологических параметров каждый объект может быть охарактеризован либо как микроорганизм, либо как немикробный объект на основании его положения в многомерном параметральном поле, параметров может быть два или более, их выбирают из группы, включающей оптический наклон, момент, длину, ширину, площадь, общую форму, а также любой другой морфологический параметр. В дополнение к увеличению точности при определении природы объекта (микробный или немикробный) положение объекта в таком многомерном параметральном поле может облегчить дальнейшую характеристику объекта и его идентификацию, например, бактерия, дрожжи, тип бактерии либо дрожжей и т.д.
Путем идентификации всех микроорганизмов в одном или нескольких видимых отображениях одной или более проб из образца может быть определена концентрация клеток микроорганизмов в образце.
Данное изобретение предлагает также способ определения чувствительности микроорганизмов в биологическом образце к антибиотическим препаратам. Для определения чувствительности микроорганизмов в образце к антибиотикам пробу из образца инкубируют в течение 0,5 - 2 часов в присутствии антибиотика и сравнивают концентрацию микроорганизмов в образце после инкубации с их концентрацией в контрольной пробе из того же образца, инкубировавшейся при тех же условиях, но без антибиотического препарата.
Данное изобретение предлагает также способ определения чувствительности микроорганизмов к антибиотическому препарату, включающий в себя приготовление тестируемой смеси, состоящей из микроорганизмов и антибиотического препарата, и контрольной смеси, состоящей из микроорганизмов без антибиотика, инкубацию обеих смесей при одних и тех же условиях в течение одинакового промежутка времени и определение концентрации микробных клеток в обеих смесях по способу компьютеризированного анализа изображения согласно изобретению.
Кроме того, в соответствии с данным изобретением, было неожиданно установлено, что микроорганизмы, чувствительные к антибиотическому препарату, претерпевают существенные морфологические изменения при воздействии на них этого препарата. О морфологических изменениях микроорганизмов как результате воздействия антибиотических препаратов уже сообщалось [27]. Однако на основании полученных данных не было выявлено существования корреляции между морфологическим изменением и чувствительностью к антибиотикам [28]. И только в данном изобретении, когда впервые удалось точно идентифицировать микроорганизмы и определять их различные морфологические параметры на уровне отдельной клетки, было установлено, что определенные морфологические изменения микроорганизмов, происходящие в результате воздействия антибиотических препаратов, являются показателем чувствительности микроорганизмов к этим препаратам.
Таким образом, данное изобретение предлагает способ определения чувствительности микроорганизмов к антибиотическому препарату, который включает в себя приготовление тестируемой смеси, состоящей из микроорганизмов и антибиотика, и контрольной смеси, состоящей из микроорганизмов без антибиотика, инкубирование обеих смесей при одинаковых условиях в течение одного и того же промежутка времени, измерение морфологических параметров микроорганизмов и определение чувствительности на основании различия этих параметров у двух смесей.
Для определения чувствительности микроорганизмов к антибиотическим препаратам оценивают как морфологические изменения, так и изменения концентрации клеток под воздействием препаратов, а затем на основании обоих результатов определяют степень чувствительности микроорганизма к указанному препарату.
Данное изобретение предлагает также систему для реализации способа согласно изобретению, эта система включает в себя микроскоп, средство для регистрации видимого в микроскоп отображения, средство для преобразования в цифровую форму зарегистрированного изображения и средства для обработки изображения, характеризующиеся тем, что указанные средства для обработки изображения адаптированы для определения оптического наклона и (или) различий в яркости объектов, зарегистрированных указанными средствами регистрации изображения.
Желательно, чтобы указанные средства обработки изображения были адаптированы также для анализа других морфологических параметров объектов, определяемых по изображению, видимому в микроскоп.
Способ и система по данному изобретению облегчают определение концентрации клеток микроорганизмов, а также характеристику микроорганизмов в образце. Способ и система по данному изобретению дают возможность также оценивать чувствительность микроорганизмов к антибиотическим препаратам посредством измерения как концентрации клеток, так и различных морфологических параметров при воздействии антибиотического препарата и без него.
На фиг.1 представлена общая схема выполнения операций для начальной характеристики объектов в образце в соответствии с данным изобретением.
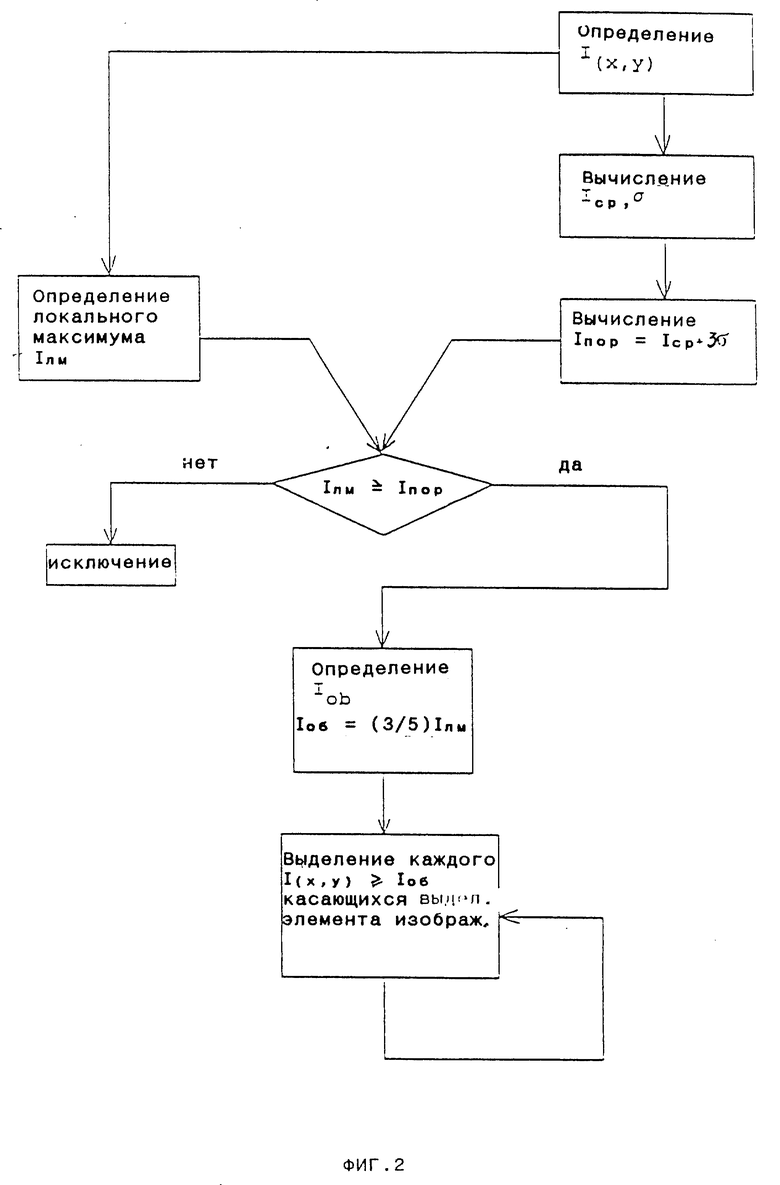
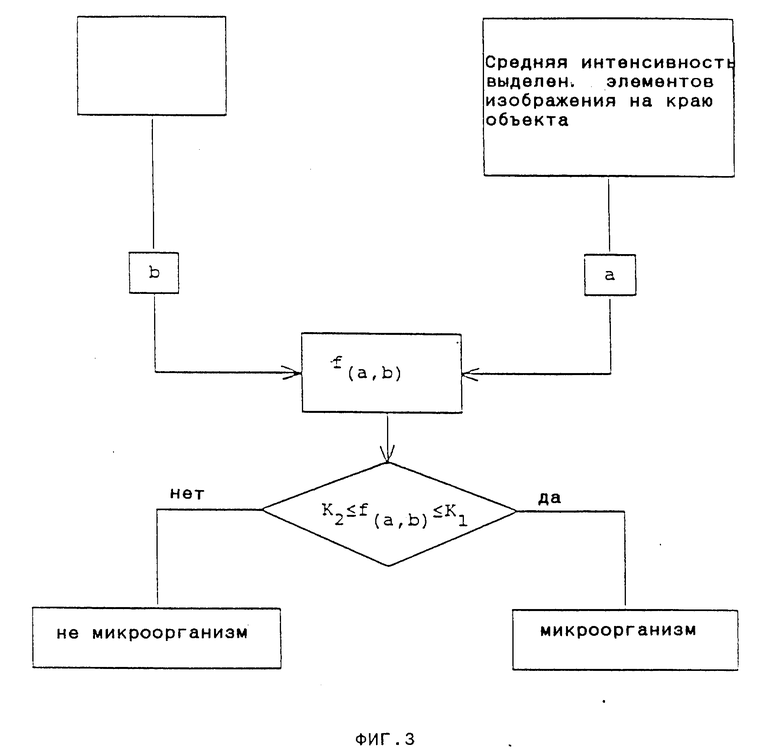
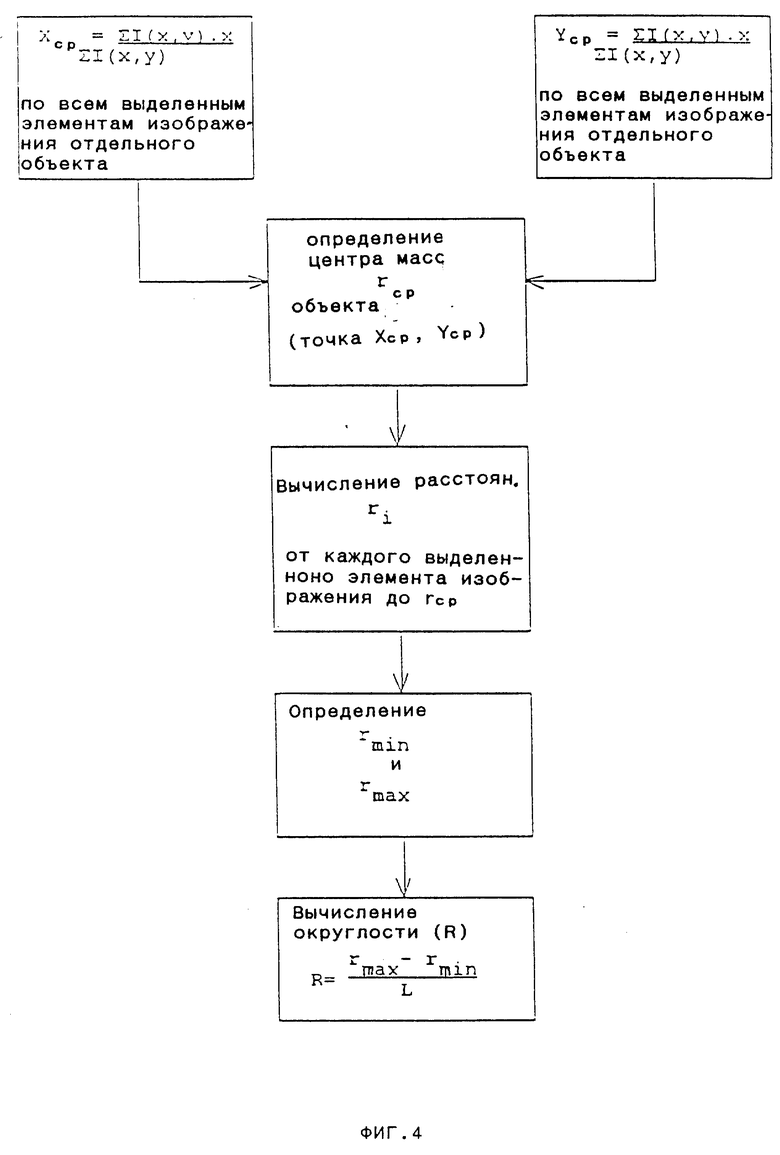
На фиг. 2-4 представлены подробные схемы выполнения операций, изображенных соответственно в виде блоков I-III на фиг.1.
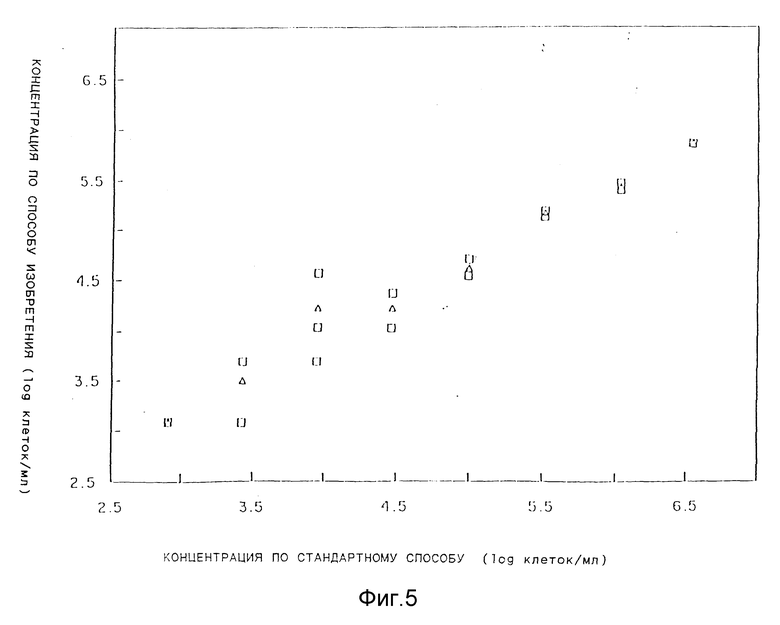
На фиг. 5 графически представлены результаты оценки концентраций клеток E.coli, суспендированных в буфере, полученные по способу данного изобретения (ордината) и действительные количествами клеток (абсцисса). Незаштрихованные квадраты обозначают индивидуальные результаты, а незаштрихованные треугольники - средние значения двух или трех результатов.
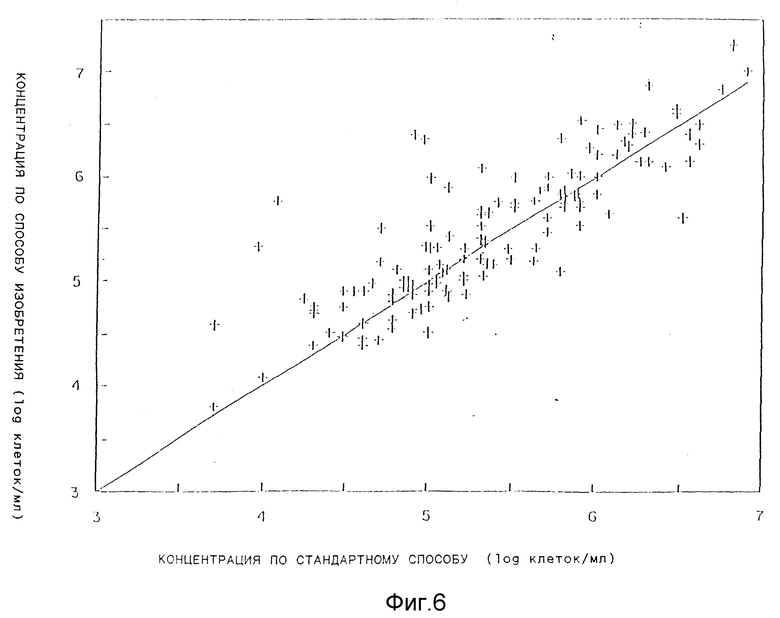
На фиг.6 графически представлены концентрации клеток в 144 образцах молока, определенных стандартным способом (абсцисса) и концентрации клеток, определенных по способу в соответствии с изобретением (ордината).
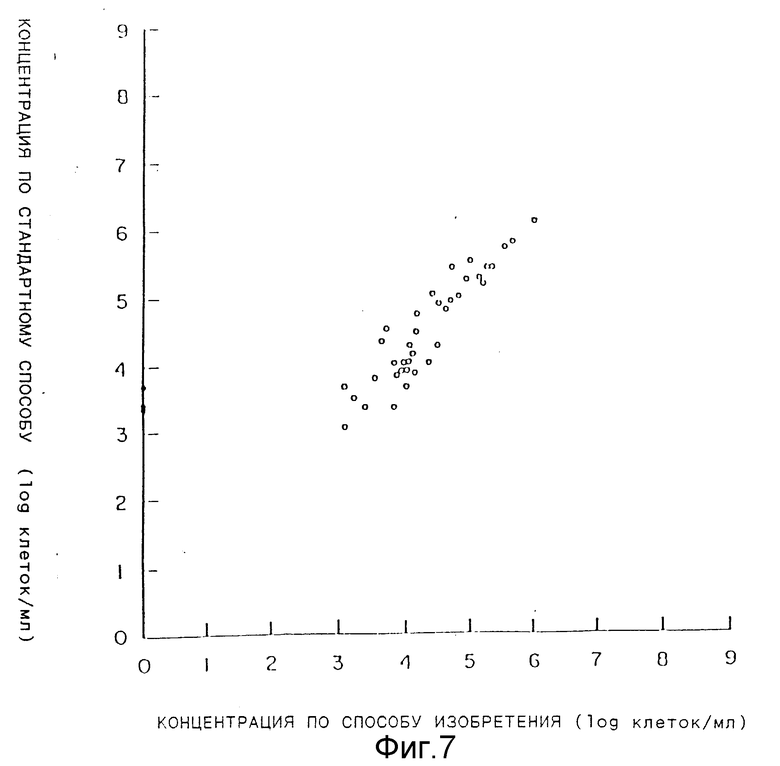
На фиг. 7 графически представлены концентрации клеток в моче, определенные стандартным способом (ордината) и концентрации, полученные по способу в соответствии с данным изобретением (Абсцисса).
Далее изобретение будет проиллюстрировано со ссылкой на определенную реализацию, показанную посредством блочных диаграмм в прилагаемых иллюстрациях, и не имеющую ограничительного характера. Не вызывает сомнения, что могут быть рассмотрены различные модификации этой реализации, также как и другие реализации, лежащие в рамках данного изобретения, как определено ранее.
Для осуществления способа согласно данному изобретению биологический образец помещают сначала под объектив микроскопа и освещают. В принципе может быть использован любой тип освещения, однако, согласно данному изобретению желательно использовать такое освещение, при котором мелкие прозрачные объекты-частицы, такие как бактерии, выглядят ярче, чем их окружение, это, например, освещение по методу темного поля, фазово-контрастное освещение, эпифлуоресценция, причем последнее особенно удобно. (В качестве красителей для эпифлуоресценции могут быть использованы, например, флуоресцеин, изотиоцианат, акридиновый оранжевый, этидиум бромид, пропидиум иодид и т.д.). Затем согласно изобретению желательно добавлять красители, увеличивающие контрастность изображения и облегчающие, таким образом, обнаружение мелких объектов в образце. Наиболее пригодными являются красители, способные окрашивать живой материал, способствуя выявлению различий между клетками и другими объектами - частицами, и особенно красители, специфически окрашивающие микроорганизмы. Наиболее удобными для использования в способе в соответствии с данным изобретением являются красители, специфически окрашивающие определенную группу микроорганизмов, например антитела к Enterobacteriaceae, о которых сообщалось [29].
Желательно также производить выравнивание и сглаживание тестируемого образца, что позволит осуществлять одновременное фокусирование на всех объектах, находящихся в поле зрения.
Освещенный и возможно окрашенный образец фиксируют с помощью соответствующего средства регистрации изображения, которым может быть, например, видеокамера, решетка из фотогальванических ячеек, наиболее предпочтительна видеокамера в силу простоты использования (включая относительную простоту электронного контура, необходимого для регистрации изображения) и относительно низкой стоимости. Изображение фиксируют с помощью указанных средств регистрации отображения в виде множества элементов изображения и яркость каждого из указанных элементов изображения измеряют и преобразуют в цифровую форму.
Измеренные и таким образом преобразованные в цифровую форму изображения обрабатывают затем как показано на очень упрощенных диаграммах на фиг.1. На первой стадии I идентифицируют элементы изображения, образующие часть объекта, и выделяют объекты. Затем на следующей стадии II определяют в соответствии с данным изобретением природу объектов, а именно является ли объект микроорганизмом или немикробным объектом, а затем на заключительной стадии III определяют различные морфологические параметры объектов, идентифицированных как микроорганизмы. Каждая из стадий I-III на фиг.1 способа изобретения описана несколько подробнее ниже со ссылками на фиг.2-4, соответственно.
Рассмотрим фиг.2, иллюстрирующий путь, которым осуществляют идентификацию и выделение объектов. На первом этапе измеряют уровень яркости в каждом элементе изображения, I(x,y) [I(x,y) - уровень яркости элемента изображения, имеющего определенные координаты x,y], а затем определяют среднее значение яркости во всем поле зрения Icp и стандартное отклонение яркости б. Icp и б используют на следующем этапе для вычисления порога уровня яркости, Iпор, который представляет собой уровень яркости, используемый в качестве эталонного уровня на следующих стадиях. Iпор можно вычислять как уровень яркости, превышающий Icp на определенное число стандартных отклонений (б), например на три, для реализации, представленной на фиг.2.
Кроме того, в предварительно откалиброванной системе пороговый уровень яркости также может быть предварительно определенной константой.
Затем идентифицируют локальные максимумы, являющиеся элементами изображения, яркость которых сильнее, чем у восьми соседних элементов. Локальные максимумы, Iлм сравнивают с Iпор, максимумы, меньшие, чем Iпор, отбрасывают, а большие - выделяют. Определяют уровень яркости Iоб, такой, что соседние элементы изображения, имеющие яркость выше этого уровня, считаются принадлежащими тому же объекту, что и выделенный элемент изображения. Iоб является определенной компонентой Iлм; для случая, представленного на фиг.3, он составляет 3/5. Затем выделяют каждый элемент изображения, касающийся выделенного элемента изображения и имеющий уровень яркости, больший или равный Iоб, и таким образом осуществляется выделение всех относящихся к этой категории пиков, касающихся либо локального максимального пика, либо других отмеченных пиков. Все отмеченные пики, касающиея друг друга, рассматривают далее как один объект.
Посредством повторения этой операции по отношению ко всем локальным максимумам в видимом отображении производят выделение всех объектов.
Локальные максимумы, расположенные близко друг к другу, например отделенные друг от друга одним или двумя элементами изображения, и выделенные элементы изображения, ассоциированные с ними, рассматривают как принадлежащие соответствующему числу объектов.
Идентифицированные, как указано выше, объекты могут быть как микроорганизмами, так и объектами немикробной природы, например частицами, агрегатами макромолекул, обломками клеток и тому подобное. Данное изобретение предлагает способ, позволяющий отличать немикробные объекты и микроорганизмы. Пример такого способа представлен на фиг.3.
Как отмечалось выше, в соответствии с данным изобретением было установлено, что объект может быть охарактеризован как микроорганизм на основании величины его оптического наклона, как было определено ранее. Если оптический наклон попадает в рамки определенного выбранного заранее интервала, в сильной степени зависящего от типа освещения и интенсивности света, то объект классифицируют как микроорганизм, а если оптический наклон не попадает в данный интервал (больше либо меньше всех значений этого интервала), то объект классифицируют как немикробный.
Определение оптического наклона может производиться различными способами, и пример, представленный на фиг.3, является только одним из возможных вариантов.
Для определения оптического наклона в соответствии с данной реализацией, на первой стадии определяют среднее значение яркости элементов изображения на краю объекта (а именно, выделенных элементов изображения объекта, которые касаются неотмеченных элементов изображения), а также среднее значение яркости всех неотмеченных элементов изображения (которые т. о. не являются частью объекта), касающихся вышеуказанных выделенных элементов изображения, и получают соответствующие значения (a) и (b). Затем определяют оптический наклон как функцию (a) и (b), например, путем вычисления разности между (a) и (b), либо отношения (a) к (b) и т.п. Значение этой функции, f(a,b), сравнивают с определенными предварительно значениями K1 и K2, и, если функция f(a, b) объекта попадает в пределы этих значений, то его классифицируют как микроорганизм, а если значение f(a,b) лежит выше или ниже этого интервала, то объект считают немикробным.
Значения K1 и K2 могут быть определены экспериментально путем тестирования известных образцов, содержащих либо различные виды микроорганизмов, либо различные виды объектов немикробной природы.
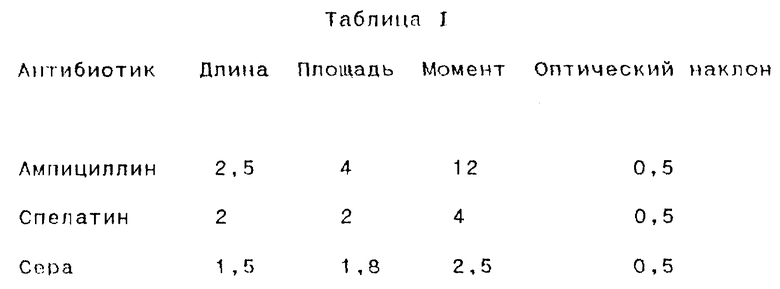
Например, путем использования параметров эксперимента, которые описаны ниже, было установлено, что в случае, когда f(a,b) вычисляли как разность между (a) и (b), [f(a,b) = a-b], значения K1 и K2 составляли 10 и 1,6 (а именно, если f(a.b) лежала между 1,6 и 10, то объект являлся микроорганизмом), а в случае, когда f(a,b) вычисляли как отношение (a) к (b), [f(a,b) = a/b], значения K1 и K2 составляли 100 и 25 соответственно.
Помимо оптического наклона могут быть определены и другие параметры объекта. Такими параметрами являются, например, момент, длина, площадь, ширина и общая форма. Эти параметры могут служить для более точной характеристики объекта как микроорганизма или объекта немикробной природы на основании его положения в многомерном параметральном поле. Это положение объекта облегчает также дальнейшую характеристику микроорганизма и его идентификацию.
Определение длины объекта, ширины и площади может проводиться известными способами, которые не будут рассматриваться.
Рассмотрим фиг. 4, показывающую на конкретном примере один из вариантов определения общей формы объекта, обозначаемой ниже как "округлость". Округлость определяет, насколько близка форма объекта к кругу.
На первом этапе определяют среднее значение Xср координаты X и среднее значение Yср координаты Y, а затем вычисляют координаты центра объекта (Xср, Yср). Затем вычисляют расстояние ri от каждого отмеченного элемента изображения объекта до (Xср,Yср), определяют наименьшее ri, rmin, наибольшее ri, rmax и вычисляют округлость R как результат отношения разности между rmax и rmin к длине объекта, L [R=( rmax-rmin)/L], R=0 обозначает сферический объект, а R, близкое к 0,5 обозначает палочковидный объект.
Особенно существенным параметром для характеристики объекта как микроорганизма и для дальнейшей характеристики свойств микроорганизма является момент. Было установлено, в соответствии с данным изобретением, что момент микроорганизмов отличается от момента немикробных объектов. Момент может быть использован для характеристики объекта как микроорганизма или немикробного объекта, либо один, либо предпочтительно в сочетании с другими параметрами, упоминавшимися ранее. Для того чтобы объект охарактеризовать как микроорганизм, необходимо чтобы его момент находился в пределах определенного интервала, определяемого экспериментально.
Момент (М) можно определять различными способами. Согласно одному из вариантов, приведенному только в качестве примера, момент определяют по следующей формуле:
М(объект) = Σ [ r2(x, y)•I(x,y)],
где r(x,y) - расстояние от элемента изображения (x,y) до центра объекта (Xср,Yср);
I(x,y) - яркость каждого элемента изображения (x,y).
Совершенно очевидно, что момент можно определить с помощью ряда других функций положения и интенсивности освещения, отличающихся от приведенных в примере.
Уникальность способа согласно данному изобретению заключается в том, что в отличие от уже существующих способов, он реализуется путем определения свойств отдельных объектов, с помощью которых могут быть определены характерные значения для всей популяции в целом (среднее значение и стандартное отклонение для каждого значения). Эти специфические значения являются характерными признаками микробной популяции и в случае необходимости могут быть использованы для идентификации типов микроорганизмов в образце. Кроме того, путем подсчета числа микроорганизмов, идентифицированных в одном или нескольких изображениях образца, может быть определена концентрация в нем микроорганизмов.
Данное изобретение предлагает способ определения чувствительности микроорганизмов к антибиотическим препаратам. Как известно, пролиферация микроорганизмов ингибируется под воздействием антибиотических препаратов, к которым они чувствительны. Так, например, чувствительность микроорганизмов в образце к препарату может быть определена посредством обработки пробы из образца антибиотическим препаратом и сравнения концентрации клеток после такой обработки с концентрацией клеток в контрольной пробе, инкубировавшейся при тех же условиях, но без препарата. Однако в отличие от существующих способов, требующих, как правило, длительных инкубационных периодов, в пределах 24 - 36 часов, согласно способу по данному изобретению требуемый инкубационный период намного меньше и составляет примерно 0,5-2 часа. Короткий инкубационный период возможен в силу следующего обстоятельства: т.к. отдельные микроорганизмы уже подсчитаны, то даже небольшое изменение их концентрации, необнаружимое посредством обычных способов, может быть выявлено.
Согласно данному изобретению, было установлено, что обработка микроорганизмов антибиотическим препаратом, к которому они чувствительны, приводит к морфологическим изменениям, которые могут быть обнаружены способом по изобретению. Кроме того, появление таких изменений отражает степень чувствительности микроорганизма к препарату, вызывающему это изменение. Другими словами, существует жесткая корреляция между морфологическими изменениями, выявляемыми по способу согласно данному изобретению, и чувствительностью микроорганизмов к препарату, вызывающему эти изменения. Эти морфологические изменения особенно заметны при измерении округлости и момента микроорганизмов.
Таким образом, данное изобретение предлагает способ определения чувствительности микроорганизмов к антибиотическим препаратам, включающий в себя инкубацию микроорганизмов в течение короткого промежутка времени, примерно 0,5-2 часа, с антибиотическим препаратом и определение степени изменения морфологических параметров микроорганизмов, особенно округлости и момента, а также ряда других дополнительных морфологических параметров, таких как длина, ширина и оптический наклон.
Для определения чувствительности микроорганизма к антибиотическим препаратам по способу данного изобретения пробу, содержащую тестируемый микроорганизм, инкубируют в течение короткого промежутка времени, примерно 0,5-2 часа, контрольную пробу инкубируют в течение такого же промежутка времени при тех же условиях, но без антибиотического препарата. Как в тестируемой, так и в контрольной пробах определяют различные свойства культуры, а именно концентрацию клеток и различные морфологические параметры, а затем вычисляют изменение каждого параметра, например, путем определения отношения значения параметра после обработки антибиотиком (В) к значению этого параметра при отсутствии такой обработки (А).
Примеры таких отношений, вычисленных согласно изобретению, представлены в Таблице 1 (А:В):
Каждому такому отношению затем присваивают определенную оценку в соответствии с его величиной, например, между 1-100. Каждой оценке присваивают определенный вес и таким образом может быть вычислено среднее взвешенное значение. Соответственно оценке для изменения концентрации микроорганизма присваивают вес около 0,4 - 0,6, а оценке для изменения различных морфологических параметров присваивается остаток, например, равный вес для каждого морфологического параметра. Это среднее взвешенное значение представляет меру чувствительности микроорганизмов к тестируемому антибиотическому препарату, а именно, является ли микроорганизм чувствительным, устойчивым или занимает промежуточное положение.
В отличие от существующих способов определения чувствительности микроорганизмов к антибиотическим препаратам, способ согласно данному изобретению может быть использован для анализа исходного выбранного биологического образца без какого-либо предварительного инкубационного периода даже в случае, если образец содержит несколько типов микроорганизмов. Посредством определения положения каждого типа микроорганизмов в многомерном параметральном поле, микроорганизмы могут быть классифицированы на различные популяции в зависимости от их положения в таком многомерном параметральном поле, а затем могут быть определены изменения как в положении, так и в концентрации каждой популяции после обработки антибиотическим препаратом. Таким образом, чувствительность каждой популяции к антибиотическому препарату может быть определена за один шаг.
Ниже данное изобретение будет проиллюстрировано отдельными примерами, не ограничивающими изобретение.
Экспериментальные методы
1) Бактериальные препараты
Были подвергнуты тестированию следующие бактериальные штаммы:
а) Четыре стандартных АТСС штамма, E.coli 25922; P.aeruginosa 27853: S. fecalis 29212; S.aureus 29213, согласно рекомендациям NCCLS, [31].
б) Штаммы, выделенные из образцов мочи, полученных из бактериологической лаборатории The Sheba Medical Centre и The Zamenhoff Central Laboratory of the General Sick Fund of 1srael (Kupat Ho1im).
Эти штаммы были выделены и идентифицированы в лаборатории с помощью стандартных методов согласно описанию [1]. Была предпринята попытка включить в исследование наиболее распространенные классы мочевых патогенов. Тестируемые штаммы включали E.coli, Klebsiella sp., Proteus sp., Pseudomonas aeroqinosa и Acinetobacter.
Все штаммы хранились в маленьких стеклянных пузырьках [30] при - 20oC. Культуры инициировали путем инокуляции одного пузырька, извлекавшегося стерильным пинцетом в стерильную емкость с бульоном Мюллера-Хинтона (MX).
Кроме того, также тестировали клинические образцы мочи и образцы молока.
2) Проведение подсчета клеток стандартным способом.
Делали серийные разведения препаратов и высевали их на агарозные чашки, и после 24 часов инкубирования подсчитывали число колоний, развившихся на агарозе.
3) Исследование бактериальных образцов согласно данному изобретению
1 мл бактериального препарата вносили в пробирку Эппендорф и добавляли 20 мкл связывающей нуклеиновую кислоту краски - пропидиум иодида (ПИ) до конечной концентрации 50 мкг/мл, затем останавливали рост микроорганизмов посредством прогревания при 95oC в течение 5 минут.
3 мкл каждого окрашенного бактериального образца наносили на предметное стекло микроскопа, покрывали покровным стеклом 18 х 18 мм и скрепляли лаком для ногтей (Pavyon clear No. 401).
Затем стекла измеряли с помощью видеомикроскопической системы согласно данному изобретению. А именно, видеокамера (RCA модель 100 SU), установленная на микроскопе с эпифлуоресцентным освещением (Olympus Model BH-2), регистрирует образец через объектив 60х, отображение переносится на микрокомпьютер с помощью панели фиксации отображения на печатной схеме. Рисунок разделяли на элементы изображения, каждый из которых соответствовал площади изображения размером 0,2 х 0,3 мкм. Измеряли уровень интенсивности света на каждом элементе изображения и переводили в цифровую форму в виде значения в интервале 0 - 255. Каждое стекло сканировали путем случайного выбора определенного количества полей (рефокусировка вручную для каждого поля) и серию отображений сохраняли в компьютерной памяти до тех пор, пока не были собраны по меньшей мере 50 объектов со значениями флуоресценции свыше ранее определенного порога. Файлы, сохраненные для каждого образца, были скопированы на дискеты и проанализированы следующим образом.
Пороговую интенсивность определяли как 50 (по общей шкале 0-255), а затем проводили выделение объектов и определение их различных морфологических параметров, как описано выше со ссылкой на фиг. 1-4. Измеряли следующие параметры для каждого объекта, число против каждого параметра показывает интервал значений, в пределах которого объект считали микроорганизмом (все другие считали немикробными объектами).
Интенсивность света - 50 - 250.
Длина объекта - 2-15 элементов изображения
Ширина объекта - 2 - 4 элемента изображения
Оптический наклон - 1:10 - 1:2
Округлость - 0 - 0,5
Момент - 10 - 100
4) Определение чувствительности к антибиотикам на основе изменения морфологического параметра и изменения количества клеток микроорганизмов.
Бактерии выращивали в течение ночи в среде MX, затем препараты разводили в 1000 раз свежей средой MX и инкубировали при 37oC в течение 2 часов. Затем культуру разводили до конечной концентрации 1•107/мл и по 1 мл этой клеточной суспензии добавляли в серию пробирок, содержавших 1 мл среды MX с тестируемым антибиотическим препаратом. Испытывали при различных концентрациях каждого препарата. Три пробирки без препаратов служили контролем: одна, в которой рост останавливали в момент t=0, и две пробирки, инкубировавшиеся одновременно с пробирками, содержавшими препарат, в течение 120 минут. Спустя 120 минут (и при t=0 для одного контроля), по 1 мл из каждой из этих пробирок переносили в пробирки Эппендорф и окрашивали затем ПИ и останавливали рост как описано выше.
Для того чтобы оценить антибиотическую чувствительность, каждый из вышеописанных четырех морфологических параметров определяли как в тестируемом образце, так и в контрольном образце, и проводили определение степени чувствительности следующим образом.
А) Каждый морфологический параметр определяли для каждой бактерии, идентифицированной в образце.
Б) Вычисляли среднее значение для каждого морфологического параметра для всех бактерий в образце.
В) Вычисляли отношение между средним значением после обработки антибиотиком и средним значением, полученным без обработки антибиотиками.
Если это отношение было больше или меньше (в зависимости от измеренных параметров), чем определенный исходный пограничный уровень, который определяли специфически для каждого параметра, оно получало оценку 100. Если это отношение было ниже или выше (снова в зависимости от измерявшихся параметров) определенной второй границы (которая также была определена для каждого параметра), оно получало оценку 0. Если отношение лежало между этими двумя границами, ему присваивали оценку между 0-100, линейно в зависимости от его положения между двумя границами.
Границы, определенные для каждого отношения (перечислены согласно соответствующим параметрам) представлены в таблице II:
Помимо сравнения морфологических параметров между контрольным и обработанным образцом, сравнивали также число бактерий, обнаруженных в 50 произвольно выбранных полях, как описано выше. Определяли отношение между числами в двух случаях (обработка: контроль), минимальную границу определяли при 0,5, а верхнюю как 0,25. Значению, лежащему между этими двумя границами, присваивали оценку между 1-100, по аналогии с предыдущим описанием.
Каждой из перечисленных выше пяти оценок, а именно четырем морфологическим оценкам и оценке, соответствующей изменению числа, присваивали определенный вес следующим образом: оценке изменения в бактериальной концентрации присваивали весовой фактор, равный 0,4, а каждой из морфологических оценок - весовой фактор 0,1. Таким образом получали среднее взвешенное значение. Бактерии считали чувствительными, если конечное среднее взвешенное значение оценки лежало в интервале 50-100, и устойчивой, если оценка попадала в интервал 0-35. Другие оценки считали промежуточными.
Для определения воспроизводимости способа стандартные штаммы E.coli 25922 и Р. aeruginosa 27853 тестировали по меньшей мере трижды с каждым из пяти препаратов, изучавшихся в данной работе. Для того чтобы избежать искажений, три испытания проводили в разные дни, каждый раз с новым бактериальным препаратом, эксперименты выполнялись двумя лаборантами, между которыми они были распределены случайным образом.
5) Испытание стандартной антимикробной чувствительности
Использовали тест на антимикробную чувствительность с разведением бульоном [31]. Для каждого тестируемого микроорганизма испытывали параллельно как микро-, так и макроразведения. Для анализов использовали среду Мюллера-Хинтона (MX) (Difco). В качестве внутреннего контроля в каждом анализе служил стандартный штамм E.coli 25922. Классификацию каждого штамма как устойчивого (У), чувствительного (Ч) или промежуточного (П) проводили путем сравнения полученных значений МИК (минимальная ингибирующая концентрация) с набором рекомендованных [31] МИК интерпретационных стандартов.
Пример 1. Определение числа клеток способом по данному изобретению.
Бактериальные клетки суспендировали в солевом фосфатном буфере (СФБ) в различных концентрациях клеток/мл. Затем готовили для микроскопирования образец каждой суспензии в соответствии со способом данного изобретения, как описано ранее. Для некоторых концентраций делали два или три повторения. Результаты представлены на фиг.5, где по оси абсцисс отложены действительные количества клеток, а по оси ординат - количества клеток, определенные по способу данного изобретения (незаштрихованные квадраты соответствуют отдельным результатам, а незаштрихованные треугольники обозначают усредненные значения отдельных результатов при той же концентрации клеток).
Результаты показывают, что, хотя измеренные количества клеток несколько отличаются от действительного числа клеток при всех концентрациях, общее совпадение между действительными и измеренными количествами клеток значительно.
Следует отметить, что для большего количества клеток отклонение может быть скомпенсировано с помощью фактора коррекции.
Пример 2. Определение содержания клеток в молоке.
Для определения содержания клеток как по способу данного изобретения, так и с помощью стандартного чашечного метода, описанного ранее, испытывали 144 образца свежего молока. Полученные результаты представлены на фиг. 6 (абсцисса - количество клеток, определенное стандартным способом, ордината - количество клеток, определенное по способу согласно данному изобретению). Результаты, полученные в обоих случаях, прекрасно согласуются друг с другом.
Пример 3. Сравнение содержания клеток в клиническом образце, определенного стандартным способом, с определенным по способу согласно данному изобретению.
Определяли содержание клеток в 24 образцах мочи, взятых у различных пациентов, как стандартным способом, так и по способу согласно данному изобретению.
Графическое представление количества клеток, определенного по способу согласно данному изобретению, и количества клеток, определенного стандартным чашечным методом представлено на фиг.7 (абсцисса - количество клеток согласно изобретению, ордината - количество клеток по стандартному методу).
Как видно из чертежа полученные в обоих случаях результаты прекрасно согласуются друг с другом.
Пример 4. Определение чувствительности бактерий к антибиотическим препаратам.
А) сравнение способа согласно данному изобретению и стандартного способа определения чувствительности к антибиотическим препаратам.
Различные бактериальные штаммы, как стандартные АТСС штаммы, так и штаммы, выделенные исследователем из клинических образцов, испытывали на чувствительность к 5 широко распространенным антибиотическим препаратам как по способу данного изобретения, так и стандартным методом разведения бульоном.
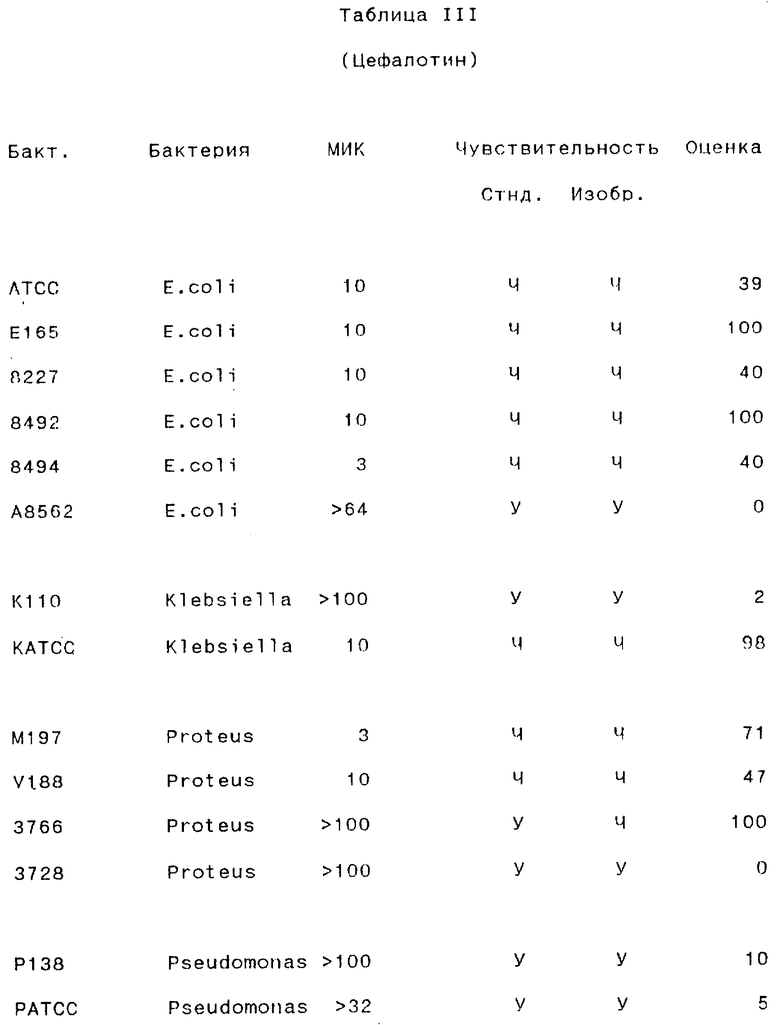
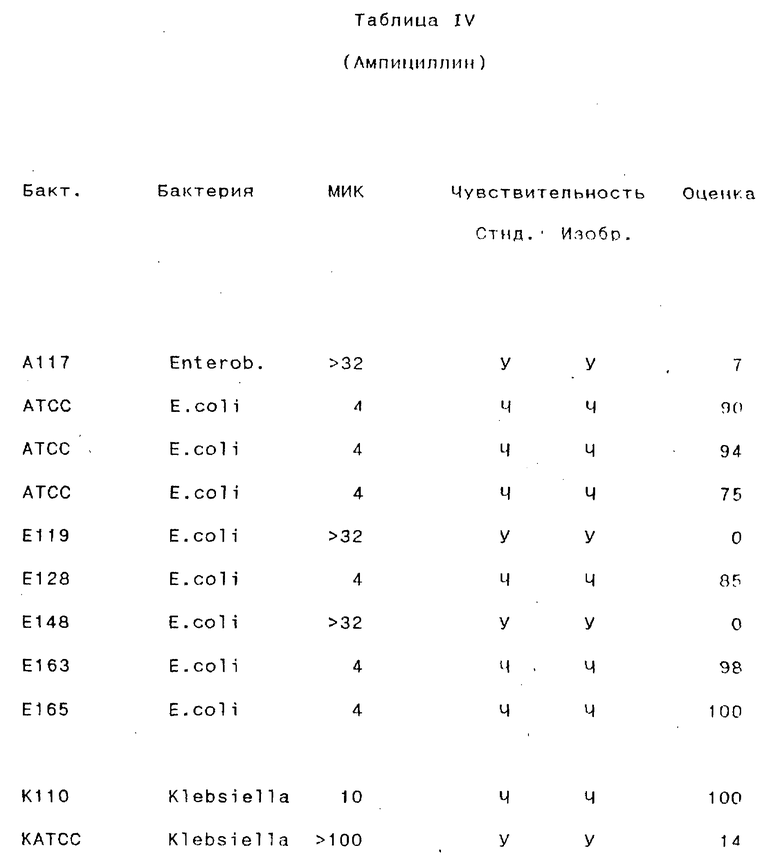
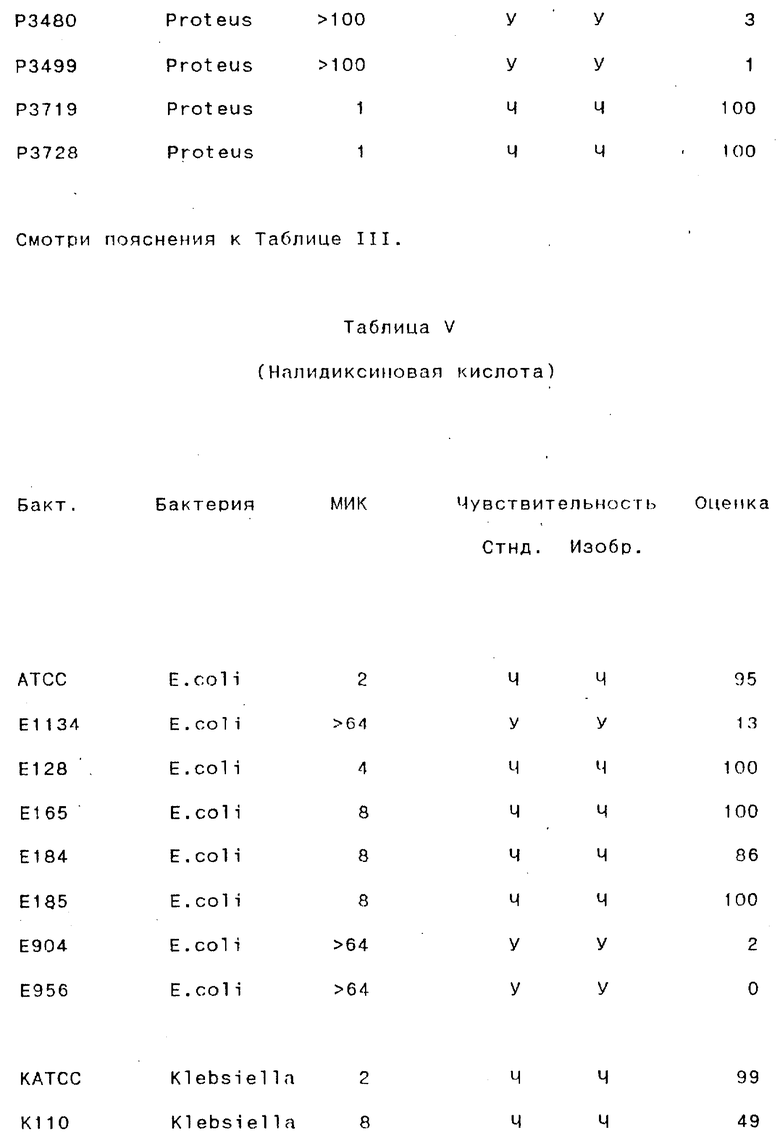
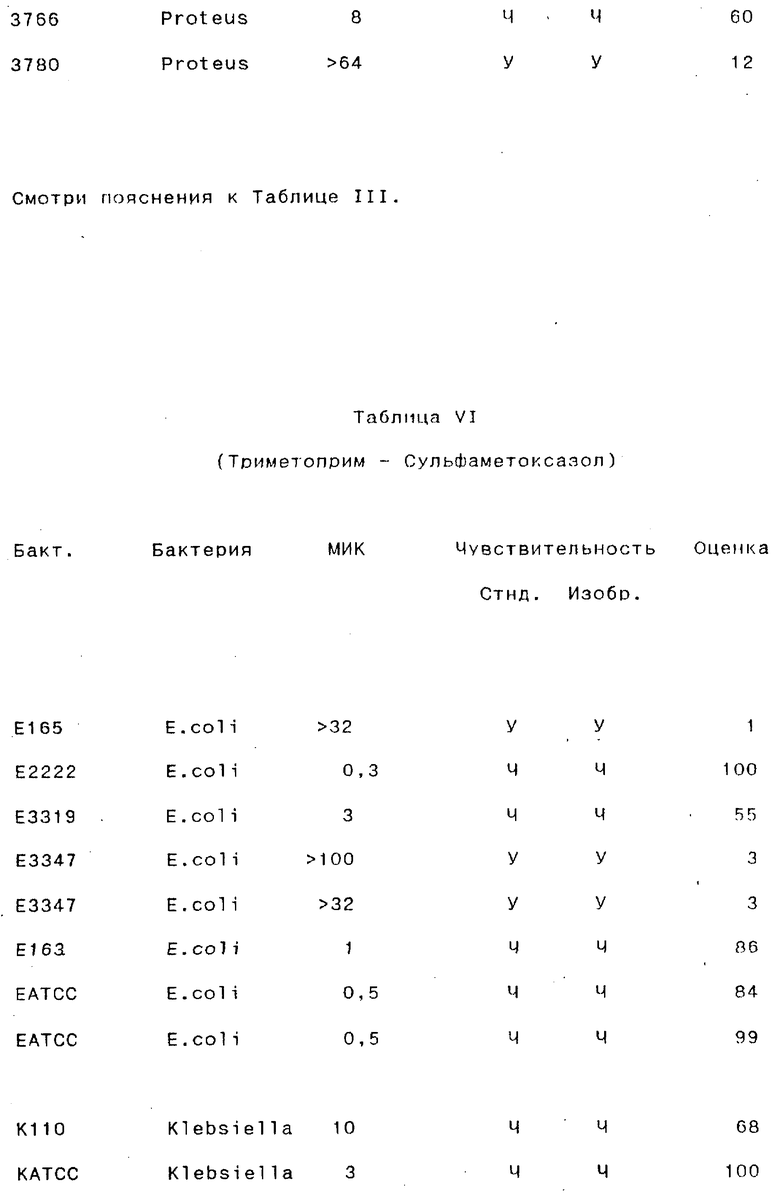
Результаты, полученные для различных антибиотических препаратов, суммированы в следующих таблицах III-VII (в каждой таблице представлены результаты, полученные для одного антибиотического препарата).
Бакт. - Обозначение бактерии исследователем.
МИК - Минимальная ингибирующая концентрация (в мг/мл), определенная стандартным методом с разведением бульоном.
Стнд. - Стандартный метод.
Изобр.- Способ согласно изобретению:
У - устойчивый; Ч - чувствительный.
Оценка- Оценка, определенная способом согласно изобретению.
В) Эксперименты по воспроизводимости.
Для того чтобы оценить степень воспроизводимости способа согласно данному изобретению, тестировали два стандартных рекомендованных NCCLS штамма: E. coli ATCC 25922 и Pseudomonas aeruginosa 27853 с каждым из пяти препаратов, исследовавшихся в пункте А. Каждый тест для каждого штамма повторяли трижды, независимые повторения проводили в разные дни различные лаборанты. Результаты представлены в следующих таблицах VIII-XI.
Как видно из этого примера, способ согласно данному изобретению правильно классифицировал стандартные штаммы как чувствительные и устойчивые почти во всех случаях. В 96% (49/51) случаев при испытании изолятов из мочи, способ согласно данному изобретению давал результаты, идентичные результатам, полученным стандартным методом (параллельное осуществление микро- и макроразведений каждого образца) в отношении как чувствительности, так и устойчивости. 4% (2/51 случаев) случаев были определены неправильно по способу согласно данному изобретению по сравнению со стандартным методом: один случай был неверно классифицирован как чувствительный, и один - неверно определен как устойчивый.
Как уже указывалось выше, результаты получали через 2 часа инкубации с антибиотическим препаратом. Однако инкубационный период может быть существенно сокращен.
ЛИТЕРАТУРА
1. Isenberg et a1., 1985. 1n: Manual of Clinical Microbiology, Edwin H. Lennette, Albert Balows. William J. Hausler, J. R., M. Jean Shadomy, (eds.) 4th Ed. American Society for Microbiology, Washington. D.C., p. 73-98.
2. Washington et a1., Ibid, p. 967-987.
3. Memorandum from a WHO Meeting. 1983. Bulletin of the World Health Organization. 61 (3): 423-433.
4. Pezzlo et a1., 1982. J. Clin. Microbiol; 15: 468-474.
5. Bates. 1982. Lab. Manag. 20: 7-13.
6. Donta et a1., 1981. N. England, J. Med. 304: 939-943.
7. Kass, 1978. J. Infect. Dis. 138: 546-557.
8. D'Amato et a1., 1985. In: Manual of Clinical Microbiology. Leunette C. H. , Balows A., Hauslower W.J. Jr., Shadomy H.J. (eds.). American Society for Microbiology, Washington, D.C., p. 52-65.
9. Thornsberg et a1., 1985. Ibid., p. 1015-1018.
10. Baird-Parker, 1989. In: Rapid Methods and Automation in Microbiology and Immunology. Brixia Academic Press, Brescia, Italy, 276-281. Balows A., Tilton R.C., Turano A. (eds.).
11. Isenberg, 1989. Ibid., p. 320-326.
12. Vincent et a1.. 1989. Ibid., p. 326-332.
13. Sanbolle et a1., 1989. Ibid., p. 333-341.
14. Thabaut. 1989. Ibid., p. 342-352.
15. Jonston, 1989. Ibid., p. 353-359.
16. Kelly et a1., 1981. J. Clin. Microbiol. 13: 677-680.
17. Hale et a1.. 1981. J. Clin. Microbiol. 13: 147-150.
18. Aldrige et a1., 1977. J. Clin. Microbiol. 6: 406-413.
19. Pfaller, 1985. J. Clin. Microbiol. 21: 783-787.
20. Bixler-Forell et a1., 1985. J. Clin. Microbiol. 22: 62-67.
21. Cady et a1., 1978. J. Clin. Microbiol. 7: 273-278.
22. Morgan et a1.. 1983. J. Clin. Microbiol. 18: 384-388.
23. Wu et a1., 1985. J. Clin. Microbiol. 21: 796-799.
24. Wallis et a1., 1981. J. Clin. Microbiol. 14: 342-346.
25. Perry et a1., 1982. J. Clin. Microbiol. 15: 852-854.
26. Marr et a1., 1975. Am. J. Dis. Child. 129: 940-943.
27. Atkinson et a1., 1984. In: Antimicrobial Therapy, A.M. Ristuccia and B.A. Cunha (eds.). Rowen Press, New York, p. 23-36.
28. Greenwood, 1985. In: Rapid Methods and Automat ion'in Microbiology and Immunology, K.O. Habermehe (ed.). Springer Verlag, Berlin, p. 479-509.
29. Заявка на патент в Израеле (1srael) No.95140.
30. Applied Microbiology, 1972, vol. 23, р. 837.
31. NCCLS document M7-T2, 1988, vol. 8, No. 8.






Изобретение относится к области микробиологии. Задачей изобретения является разработка способа и систем компьютеризованного анализа изображения, основанного на определении распределения яркости на каждом из объектов. Частным случаем применения изобретения является определение чувствительности микроорганизмов к антибиотику. 4 с. и 12 з.п.ф-лы, 11 табл., 7 ил.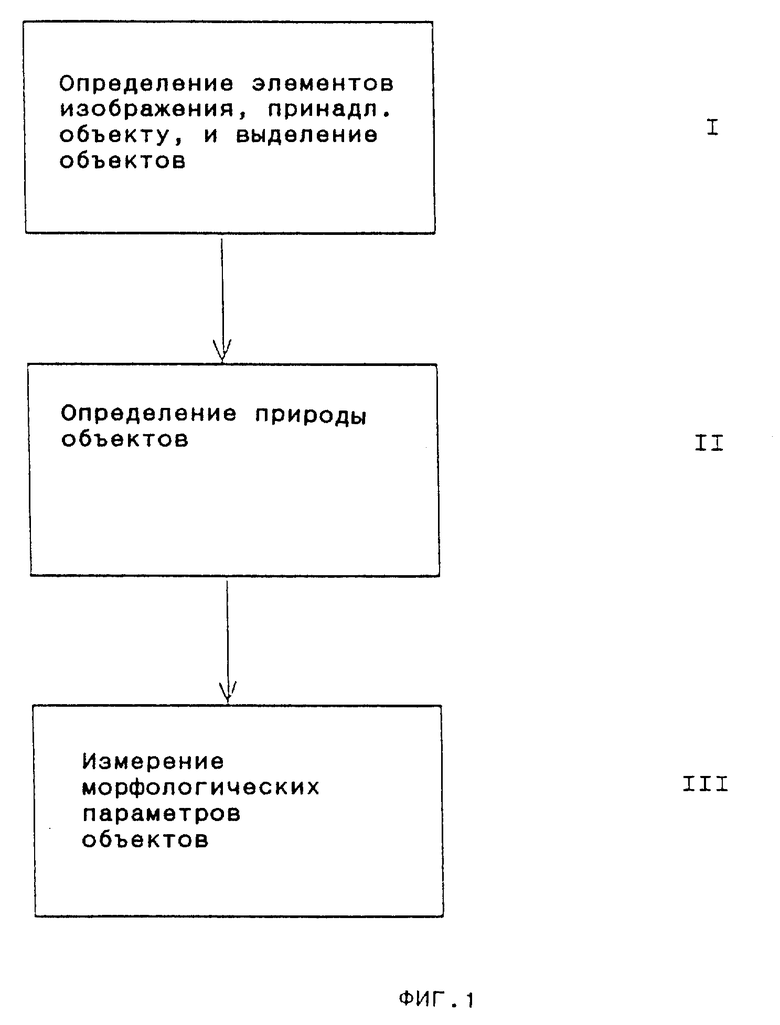
| J.W.Bacus et al | |||
| Optical microscope system for standardired cell measurements and analyses | |||
| Applied Optics, v.26, N16, 1987, p.3280 - 3293 | |||
| Устройство многофракционной сортировки клеток, хромосом и микрочастиц | 1988 |
|
SU1778631A1 |
| Способ определения показателя сферичности эритроцитов | 1984 |
|
SU1144031A1 |
| US 4232970 A, 1980 | |||
| УСТРОЙСТВО ДЛЯ АВТОМАТИЧЕСКОГО РЕГУЛИРОВАНИЯ СХОЖДЕНИЯ УПРАВЛЯЕМЫХ КОЛЕС АВТОМОБИЛЯ В ПРОЦЕССЕ ДВИЖЕНИЯ | 2009 |
|
RU2410270C1 |
| СПОСОБ ИЗВЛЕЧЕНИЯ МЯСА ИЗ ПЛЕЧЕВОГО СУСТАВА КРАБОВОЙ НОЖКИ | 0 |
|
SU210343A1 |
| УСТРОЙСТВО для ЗАЩИТЫ от ЗАМЫКАНИЙ НА ЗЕМЛЮ В РАДИАЛЬНЫХ СЕТЯХ | 0 |
|
SU317139A1 |
| СТАБИЛИЗИРОВАННАЯ ПОЛИМЕРНАЯ КОМПОЗИЦИЯ | 0 |
|
SU365928A1 |
Авторы
Даты
1999-02-27—Публикация
1993-04-05—Подача