Настоящее изобретение относится к группе гетероциклических производных, которые ингибируют адгезией клеток (например, агрегацию тромбоцитов), к способам их получения и содержащим их фармацевтическим композициям.
Процесс развития многих заболеваний сопровождается адгезию клеток. Например, агрегация клеток наблюдается при образовании тромбов крови, которое может привести к таким заболеваниям, как тромбоз (в частности, к приступам и тромботическим случаям, сопровождающим неустойчивую стенокардию и приступы транзиторной ишемии), инфаркт миокарда, атеросклероз, тромбоэмболия и повторная закупорка во время и после тромболитической терапии.
Общепризнано, что гликопротеин IIb/IIIa (GPIIb/IIIa) мембран тромбоцитов участвует в агрегации тромбоцитов. Как полагают, молекулы адгезии, такие как фибриноген и фактор фон Виллебранда, связываются с местами GPIIb/IIIa соседних тромбоцитов и вызывают тем самым их агрегацию. Другими известными молекулами адгезии, которые связываются с GPIIb/IIIa, являются фибронектин, витронектин и тромбоспондин.
Неожиданно в результате выборочной проверки было обнаружено, что некоторые гетероциклические производные, содержащие 4-[(4- пиридил)пиперазин-1-ильную] или родственную группу, обладают способностью ингибировать агрегацию тромбоцитов и ингибировать связывание фибриногена с GPIIb/IIIa.
В патентной заявке Японии 57183738 (Chem. Abs., 98, 125889b) указывается, что некоторые производные пиридина, такие как 3-диметиламинопропиловый эфир 4-(- пиридиниламино)бензойной кислоты, обладают тромболитической активностью.
В Европейской патентной заявке 0244115 указывается, что некоторые производные пиперазина, такие как 4- [4-(4-пиридил)пиперазин-1-ил]бензамид обладают антиаритмической активностью.
Далее в J. Chem. Soc., Perkin I, 1983, 973 сообщается, что могут быть получены некоторые производные анилинзамещенного пиридина, такие как 4- (карбоксианилино)пиридин, 4-(4-метоксикарбониланилино)пиридин, 4-(4-метоксианилино)пиридин и 4-(4-гидроксианилино) пиридин.
В Европейской патентной заявке 0100158 указывается, что некоторые 3-пиридиламиноалкильные производные, такие как метиловый эфир 2-[4-(3-пиридиламинометил)фенокси] уксусной кислоты (пример 2), обладают ингибиторной активностью по отношению к тромбоксан A2 синтетазе и что соединения могут быть полезными в качестве антивоспалительных средств, в качестве антигипертонических средств и ингибиторов метастаз опухолевых клеток.
В соответствии с одним из аспектов в настоящем изобретении заявляются соединения общей формулы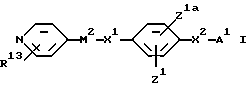
где M2 обозначает - NR3-, где R3 является атомом водорода или (1-4C)алкилом; или обозначает группу - NR4-D-TR5-,
где (i) T обозначает N; D обозначает группу CH2CO; CH2SO2; (2-3C)алкиленовую группу, необязательно замещенную карбоксиль ной, (1-4C)алкоксикарбонильной или (1-4C)алкоксиметильной группой; и R4 и R5 вместе обозначают (2-3C)алкиленовую груп пу или группу CH2CO или каждый независимо обозначает атом водорода или (1-4C)алкил; или
(ii) T обозначает CH; D обозначает группу CH2CO, CH2CH2NH, (1-3C)алкиленовую группу, необязательно замещенную карбоксильной или (1-4C)алкоксикарбонильной группой, или (2-3C)алкиленокси-группу; и R4 и R5 вместе обозначают (1-3C) алкиленовую группу; или
(iii) R4 и -D-TR5 вместе образуют (5-6C)алкениленовую группу.
X1 обозначает простую связь или (1-4C)алкиленовую группу, (2-4C)алкениленовую группу, (2-4C)алкиниленовую группу, (1-2C)алкиниленфениленовую группу, фениленокси-группу, фениленоксиметиленовую группу, фениленкарбонильную группу, группу фениленCONH, (1-3C)алкиленкарбонильную группу, (1-2C)алкиленкарбонильную группу, замещенную бензильной группой или п-гидроксибензильной группой, метилиденпирролидин-1-илацетильную группу, (1- 2С)алкиленкарбонилокси-группу, (1-2C)алкиленCONH-группу, (1- 2C)алкиленCONH(1-2C)алкиленCO-группу, (1-2C)алкиленCONH(1- 2C)алкиленCONH-группу, группу бензил(1-2C)алкиленCONH, (1- 4C)алкиленокси-группу, (1-2C)алкиленокси(1-2C) алкиленовую группу, (1-2C)алкиленокси(1-2C)алкиленкарбонильную группу, группу (1-3C)алкиленCH(OH), а когда М2 обозначает группу NR4-D-TR5-, карбонильную группу, карбонил(1-3C) алкиленовую группу, группу CONH, группу (1-2C)алкиленNHCO и CONH (1-3C) алкиленовую группу, а когда T обозначает CH, гидрокси-группу, окси(1-3C)алкиленовую группу, окси (1-2C)алкиленкарбонильную группу или окси(1-2C)алкиленфениленовую группу;
или X1 вместе с M2 могут образовывать группу формулы: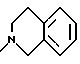
группы Z1 и Z1a каждая независимо обозначает атом водорода, гидроксильную группу, атом галогена, (1-4C)алкильную группу, (2-4C)алкенильную группу, (2-4C)алкинильную группу, (1- 4C)алкокси-группу, (1-4C)алкилтиогруппу, (2-4C) алкенилокси-группу, нитро-группу, амино-группу, (1-4C)алкиламино-группу, (2- 4C)алканоиламино-группу, циано-группу (1-4C)алкил> сульфониламино-группу; фенил(1-C)сульфониламино-группу, п- толуолсульфониламино-группу или (1-4C)алкоксикарбонильную группу или имеют одно из значений, приведенных для X2 - A1;
X2 обозначает связь или (1-4C)алкиленовую группу, (2- 4C) алкениленовую группу, окси(1-4C)алкиленовую группу, окси(5- 6C) алкиленовую группу, окси(2-4C)алкениленовую группу, тио(1-3C) алкиленовую группу, SO2(1-3C)алкиленовую группу, амино(1- 4C) алкиленовую группу, SO2NH(1-3C)алкиленовую группу, NR21CO(1-2C)алкиленовую группу (где R21 обозначает атом водорода, (1-4C)алкильную группу или бензильную группу), CONR21(1-2C) алкиленовую группу, в каждой из которых алкиленовая группа может быть необязательно замещена (2-4C)алкенильной группой; (2-4C)алкинильной группой; (1-4C)алкокси-группой; карбоксильной группой; (1-4C)алкоксикарбонильной группой; фенил(1-4C)алкоксикарбонильной группой; фенил(1-2C)алкилNHCO-группой; карбокси(1-2C)алкильной группой; фенил(1-2C)алкильной группой; фенилсульфонил(1-2C)алкильной группой; пиридильной группой; фенильной группой; амино-группой или группой формулы NR12XR6, где X обозначает SO2, CO или CO2; R12 обозначает атом водорода или (1-4C)алкил, a R6 обозначает (1-6C)алкил, (6- 10C)арил, (6-10C)арил(1-4C)алкил, ди(1-4C)алкиламино(1-4C)алкил, морфолино(1-4C)алкил, пиперидино(1-4C)алкил или N-(1-4C)алкилпиперидино(1-4C)алкил;
A1 обозначает карбокси-группу или ее метаболически лабильный сложный эфир или амид; и
R13 обозначает атом водорода, (1-4C)алкил, (1-4C)алкокси- группу или атом галогена;
и их фармацевтически приемлемые соли;
при условии, что X2 не обозначает простую связь, если X1 обозначает простую связь.
Не желая углубляться в теорию, мы просто полагаем, что роль атома азота пиридильной группы заключается в замещении сильно основной группы в аргинине. Мы полагаем, что роль атома азота, присоединенного к пиридилу в группе, обозначенной через М2, заключается в том, что он повышает способность атома азота пиридильной группы выполнять функции основания. Например, в 4-(4-пиперидил)пиперазинил-1-ильной группе атом азота, как мы полагаем, повышает способность атома азота пиридильной группы играть роль основания, как это показано ниже: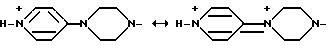
Примерами значений для -NR3-, когда R3 обозначает атом водорода или (1-4C)алкил, являются группа NH или метилимино- группа.
Примерами значений для -NR4-D-TR5-, когда T обозначает атом азота, являются 5-оксоимидазолидин-1, 3-диил, 2- оксопиперазин-1,4-диил, 2,6-диоксопиперазин-1,4-диил, 1,1- диоксо-1, 2,5-тиадиазидин-2,5-диил, пиперазин-1,4-диил, 2-карбоксипиперазин-1,4-диил, 3-карбоксипиперазин-1,4-диил, 2-метоксикарбонилпиперазин-1,4-диил, 3-метоксикарбонилпиперазин-1,4-диил, 2- метоксиметилпиперазин-1,4-диил, 3-метоксиметилпиперазин-1,4- диил и N-2-(N'-метиламино)этил(N-метил)амино-группа.
Примерами значений для -NR4-D-TR5-, когда T обозначает группу CH, являются пирролидин-3,1- диил, 3-оксо-пирролидин -4,1-диил, 2-карбоксипирролидин-4,1-диил, 2-метоксикарбонилпирролидин- 4,1-диил, 2-этоксикарбонилпирролидин-4,1-диил, пиперидин-3,1-диил, пиперидин-4,1-диил, пиперазин-2,4-диил и морфолино-2,4-диил.
Примером группы формулы -NR4 -D- TR5-, в которой R4 и -D-TR5- вместе образуют (5-6C)алкиленовую группу, является 1,2,3,6-тетрагидропиперидин-4,1-диил.
Наиболее предпочтительными значениями для М2 являются пиперазин-1,4-диил, пиперидин-4,1-диил и 2-оксо-пиперазин- 1,4-диил.
Примерами для X1 являются простая связь, метиленовая группа, этиленовая группа, пропиленовая группа, 1- метилэтиленовая группа, этениленовая группа, этиниленовая группа, метиленфениленовая группа, фениленокси-группа, фениленоксиметиленовая группа, фенилкарбонильная группа, группа фениленCONH, метиленкарбонильная группа, этиленкарбонильная группа, 1-метилэтиленкарбонильная группа, этилидинкарбонильная группа, 2-пропилиденкарбонильная группа, бензилметиленкарбонильная группа, п-гидроксибензилметиленкарбонильная группа, метилиденпирролидин-1-илацетильная группа, метиленкарбонилокси-группа, группа метиленCONH, группа метиленCОNHметиленCОNH, группа бензилметиленCОNH, метиленокси-группа, этиленокси-группа, пропиленокси-группа, бутиленокси-группа, метиленоксиметиленовая группа, метиленоксиметиленкарбонильная группа, группа метиленCH (OH), а когда М2 обозначает -NR4-D-TR5-, карбонильная группа, карбонилметиленовая группа, карбонилэтиленовая группа, группа CONH, группа метиленNHCО, CОNHметиленовая группа, а когда T обозначает CH, окси-группа, оксиметиленовая группа, группа метиленNHCO, оксиметиленкарбонильная группа и оксиметиленфениленовая группа.
Наиболее предпочтительные значения для X1 включают простую связь, метиленкарбонильную группу, этиленкарбонильную группу, этилидинкарбонильную группу, карбонильную группу, карбонилэтиленовую группу, метиленокси- группу, этиленокси-группу, а когда М2 обозначает -NR4-D-TR5- и T обозначает CH, - окси-группу.
Z1 преимущественно располагается в орто-положении относительно X2, т.е. в 2- или 6-положении. Примерами фениленовых групп, необязательно замещенных группами Z1 или Z1a являются 1,4-фениленовая группа, 2-метокси-1,4-фениленовая группа, 3-метокси-1,4-фениленовая группа, 2,6-дихлор-1,4-фениленовая группа, 2,6-ди-трет-бутил-1,4-фениленовая группа, 2-карбонилметокси-1,4-фениленовая группа, 2-метоксикарбонилметокси-1,4-фениленовая группа, 2-этоксикарбонилметокси-1,4-фениленовая группа, 3-метил-1,4-фениленовая группа, 2-метил-1,4-фениленовая группа, 3-метоксикарбонилметокси-1,4-фениленовая группа, 2- аллил-1,4-фениленовая группа, 2-пропил-1,4-фениленовая группа, 2-нитро-1,4-фениленовая группа, 3-этоксикарбонилметокси-1,4- фениленовая группа, 3-карбонилметокси-1,4-фениленовая группа и 2-трет-бутилоксикарбонилметилокси-1,4- фениленовая группа.
Примерами Z1 и Z1a являются атом водорода, гидроксильная группа, атом хлора, атом фтора и атом брома, метил, этил, пропил, трет-бутил, аллил, метокси-группа, метилтио-группа, аллилокси-группа, нитро-группа, циано-группа, метокси-карбонильная группа, карбоксиметокси-группа, метоксикарбонилметокси-группа, этоксикарбонилметокси-группа и трет-бутилоксикарбонилметокси-группа.
Примерами значений для X2 являются простая связь, метиленовая группа, этиленовая группа, этениленовая группа, оксиметиленовая группа, 2-оксиэтиленовая группа, 3-оксипропиленовая группа, 2-оксипроп-2-иленовая группа, 4-оксибутиленовая группа, 5-оксипентиленовая группа, тиометиленовая группа, аминометиленовая группа, карбоксамидометиленовая группа, 2-карбоксамидоэтиленовая группа, 2-фенилэтилиденовая группа, окси(метоксикарбонил)метиленовая группа, 1-(2-карбоксиэтил)этиленовая группа, 1-(бензилоксикарбонил)этиленовая группа и группы формулы CH2CH(NR12XR6), такие как 1-(бутилсульфониламино)этиленовая группа [CH2CH(NHSO2CH2CH2CH2CH)] , 1-(метилсульфониламино) этиленовая группа, 1-(бензилсульфониламино) этиленовая группа, 1-(п-толуолсульфониламино) этиленовая группа, 2-(бутилсульфониламино)этиленовая группа, 2-(п-толуолсульфониламино) этиленовая группа, 3-окси(1-бутилсульфониламино)этиленовая группа, 2-карбоксамидо(2-фенил) этиленовая группа и 2-карбоксамидопропиленовая группа.
Примерами значений для R13 являются атом водорода, метил, метокси-группа и атом хлора. R13 преимущественно является атомом водорода.
Могут быть идентифицированы две подгруппы соединений формулы I. Одна состоит из соединений формулы I, в которых X1 представляет собой простую связь. В этой подгруппе X2 преимущественно является окси(2-4C)алкиленовой группой или окси(5-6C)алкиленовой группой, в частности оксипропиленовой группой, необязательно замещенной алкиленовой группой, как указано ранее. Другая состоит из тех соединений формулы I, в которых X2 представляет оксиметиленовую группу. В этой подгруппе X1 преимущественно является метиленкарбонильной группой.
Примеры наиболее предпочтительных соединений представлены в примерах 1, 2, 3, 4, 25, 26, 35, 36, 152, 153, 154 и 155 настоящего описания.
Примерами метаболически лабильных сложноэфирных производных карбоксильной группы являются сложные эфиры, образованные такими спиртами, как (1-6C)алканолы, например метанол, этанол, пропанол и изо-пропанол; инданол; адамантанол; (1-6C) алканоилокси(1-4C)алканолы, такие как пивалоилоксиметил; гликоламиды; (S-метил-2-оксо-1,3-диоксол-4- ил)метиловый спирт; и (1-4C)алкилоксикарбонил(1-4C)алканолы. Очевидно, что соединения формулы I, в которых X обозначает гидроксильную группу, могут образовывать внутренние сложные эфиры.
Примеры метаболически лабильных амидных производных карбоксильной группы включают амиды, образованные аммиаком и аминами, такими как (1-4C)алкиламин, например метиламин, ди(1-4C)алкиламины, (1-4C)алкокси(1-4C)алкиламины, такие как метоксиэтиламин, фенил(1-2C)алкиламины, такие как бензиламин; и аминокислотами, такими как глицин или его эфиры. Очевидно, что некоторые соединения общей формулы I находятся в форме энантиомеров. Следует понимать, что изобретение включает любые энантиомеры, которые обладают способностью ингибировать агрегацию тромбоцитов и присоединение молекул адгезии к GPIIb/IIIa, присутствуют ли они в смеси с другими энантиомерами (например в рацемической смеси) или практически свободны от других энантиомеров.
В контексте настоящего описания термины алкил, алкиленовая группа, алкениленовая группа или алкиниленовая группа включают разветвленные или неразветвленные группы. Однако в тех случаях, когда применяются специфические термины, например пропил, изо-пропил или пропиленовая группа, то они указывают, является ли группа разветвленной или нет. При нумерации дирадикалов, например 2-оксо-пиперазин-1,4-диила, принимается, что формула I читается справа налево, при этом группа A располагается на правой стороне, как изображено выше в формуле I.
Так, например, 2-оксо-пиперазин-1,4-диил обозначает группу: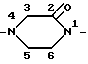
Следует понимать в контексте настоящего описания, что порядок двух номеров, непосредственно предшествующих суффикса "диил" в названии дирадикала, обозначает ориентацию дирадикала в соединении формулы I. Таким образом, первый номер обозначает положение дирадикала, наиболее близко расположенного к группе A1.
Наиболее фармацевтически приемлемые соли включают, например, соли с кислотами, дающими физиологически приемлемые анионы, такими как соли с минеральными кислотами, например соли галогеноводородов (таких как хлористый водород или бромистый водород), серной кислоты или фосфорной кислоты, и соли с органическими кислотами, например трифторуксусной кислотой. Другие фармацевтически приемлемые соли включают, например, соли с неорганическими основаниями, такими как соли щелочных и щелочноземельных металлов (например, соли натрия), соли аммония и соли с органическими аминами и четвертичные основания, образующие физиологически приемлемые катионы, такие как соли с метиламином, диметиламином, триметиламином, этилендиамином, пиперидином, морфолином, пирролидином, пиперазином, этаноламином, триэтаноламином, N-метилглюкамином, гидроксидом тетраметиламмония и гидроксидом бензилтриметиламмония.
В соответствии с другим аспектом в данном изобретении заявляется способ получения соединения общей формулы I или его метаболически лабильного сложного эфира или амида или его фармацевтически приемлемой соли, который включает:
(A) Для соединения формулы I, в котором М2 обозначает NR3 или -NR4-D-NR5-, - взаимодействие соединения формулы: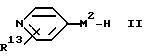
или его кислотно-аддитивной соли с соединением формулы: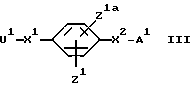
где U1 обозначает уходящий атом или уходящую группу.
Примеры значений для U1 включают атом галогена, такого как хлор или бром, и гидроксикарбилсульфонилокси-группу, такую как метансульфонилокси-группу и п/толуолсульфонилокси-группу. Когда группой в заместителе X1, к которой присоединен U1, является карбонильная группа, U1 может также представлять собой гидроксильную группу или ее реакционноспособное производное. Примерами реакционноспособных производных гидроксильной группы являются ацилокси-группы, такие как ацетилокси-группа, и группы, образуемые in situ взаимодействием соединения формулы III, в котором U1 является гидроксильной группой, с пептидным конденсирующим агентом. Примерами пептидных конденсирующих агентов являются карбодиимиды, такие как 1,3- дициклогексилкарбодиимид, преимущественно в сочетании с гидратом 1-гидроксибензотриазола (HOBT).
Примеры кислотно-аддитивных солей включают, например, гидрохлориды.
Реакцию удобно проводить при в интервале температур от минус 10 до 120oC, преимущественно от 10 до 100oC. Подходящие растворители включают, например, простые эфиры, такие как тетрагидрофуран, амиды, такие как диметилформамид, нитрилы, такие как ацетонитрил, галоидпроизводные углеводородов, такие как дихлорметан, и спирты, такие как этанол или изо-пропанол.
В некоторых случаях, например, когда в качестве исходного соединения используется кислотно-аддитивная соль соединения формулы II или когда соединение формулы II является относительно мало реакционноспособным, реакцию удобнее проводить в присутствии основания. Примерами подходящих оснований являются третичные амины, такие как триэтиламин, и гидроксиды, карбонаты и бикарбонаты щелочных металлов, такие как гидроксид, карбонат или бикарбонат натрия или калия. Когда соединение формулы II является относительно мало реакционноспособным, то удобнее использовать сильное основание, такое как гидрид щелочного металла, например, гидрид калия.
(B) Для соединения формулы I, в котором A является карбоксильной группой, - расщепление сложного эфира формулы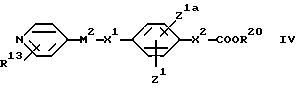
где R20 обозначает группу, защищающую карбоксильную группу.
R20 может быть обычной защитной группой для карбоксила, которая может быть удалена без ущерба для других частей молекулы. Примерами защитных групп для карбоксильной группы являются (1-6C)алкильные группы (такие, как метил, этил, пропил или трет-бутил), фенил и бензил, в каждой из которых фенильный фрагмент может включать 1 или 2 атома галогена, (1- 4C) алкильные группы, (1-4C)алкокси-группы или нитро-группу.
Расщепление можно осуществить с использованием любого или любых обычных реагентов и условий проведения реакции, известных из области техники для превращения карбоновых эфиров в карбоновые кислоты. Так, например, расщепление удобно проводить с помощью катализируемого основанием гидролиза, например, применяя гидроксид щелочного металла, такого как гидроксид лития, калия или натрия, третичный амин, такой как триэтиламин, в присутствии воды. Катализируемый основанием гидролиз удобно проводить в присутствии растворителя, такого как спирт, например метанол или этанол, или простого эфира, такого как тетрагидрофуран или диоксан. В качестве альтернативы расщепление можно проводить гидролизом, катализируемым кислотой, например, с использованием водного раствора уксусной кислоты или трифторуксусной кислоты. Температура преимущественно лежит в интервале от минус 10 до 100oC, например от 10 до 50oC. В том случае, когда остатком спирта является трет-бутил, его удобно также удалять нагреванием соединения, например, при температуре в интервале от 80 до 150oC, в чистом виде или в присутствии подходящего разбавителя, такого как дифениловый эфир или дифенилсульфон. Бензильную группу удобно удалять с помощью каталитического гидрирования, например гидрированием в присутствии палладия на угле при температуре в интервале от минус 10 до 100oC в присутствии растворителя, такого как спирт, например метанол или этанол.
(C) Взаимодействие соединения формулы:
где U3 - уходящий атом или уходящая группа, с соединением формулы:
или его кислотно-аддитивной солью.
Примеры значений для U включают атом галогена, такого как хлор или бром, или циано-группу.
Примеры кислотно-аддитивных солей включают, например, гидрохлориды.
Реакцию удобно проводить в интервале температур от минус 10 до 120oC, преимущественно от 10 до 100oC. Подходящими растворителями являются, например, простые эфиры, такие как тетрагидрофуран и диоксан, амиды, такие как диметилформамид, нитрилы, такие как ацетонитрил, галогензамещенные углеводороды, такие как дихлорметан, спирты, такие как этанол, или вода.
В некоторых случаях, например, когда в качестве исходного соединение используется кислотно-аддитивная соль соединения формулы VII, реакцию удобнее проводить в присутствии основания. Примерами подходящих оснований являются третичные амины, такие как триэтиламин, и гидроксиды, карбонаты и бикарбонаты щелочных металлов, такие как гидроксид, карбонат или бикарбонат натрия или калия.
(D) Для соединения формулы I, в котором X1 - представляет собой группу CONH, - взаимодействие соответствующей карбоновой кислоты формулы: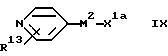
где X1a является остатком карбоксильной группы карбоновой кислоты, или ее реакционноспособного производного с подходящим амином формулы: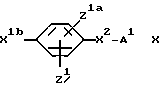
где X1b представляет собой остаток амино-группы.
Примеры значений для X1a включают группы (1-2C) алкилен COOH, бензил(1-2C)алкиленCOOH и COOH. Примерами значений для X1b являются группа H2N и H2N(1-3C)алкиленовая группа.
Примеры реакционноспособных производных соединений формулы IX включают ацилгалогениды, такие как хлориды и бромиды и группы, образуемые in situ взаимодействием остатка карбоновой кислоты с пептидным сшивающим агентом, таким как карбодиимид, например 1,3-дициклогексилкарбодиимид, преимущественно в сочетании с гидратом 1-гидроксибензотриазола (HOBT).
Реакцию обычно проводят в интервале температур от 0 до 100oC. Подходящими растворителями являются галогензамещенные углеводороды, такие как дихлорметан, амиды, такие как диметилформамид, и третичные амины, такие как триэтиламин.
(E) Для соединения формулы I, где X1 представляет собой (2-4C)метиленовую группу, - взаимодействие соединения формулы: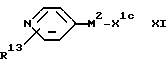
где X1c является подходящей альдегидсодержащей группой с соответствующим реактивом Виттига формулы: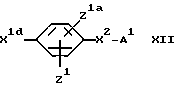
где X1d является триарилфосфонилалкиленовой группой, такой как трифенилфосфонилметиленовая группа.
Реакцию обычно проводят в интервале температур от минус 20 до 50oC, преимущественно от 0 до 25oC. Подходящими растворителями являются простые эфиры, такие как тетрагидрофуран, сульфоксиды, такие как диметилсульфоксид, и ароматические углеводороды, такие как толуол.
(F) Для соединения формулы I, в котором X1 представляет собой окси(эфирную) мостиковую связь, - взаимодействие соответствующего соединения формулы: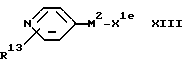
с соответствующим соединением формулы: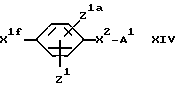
где один из заместителей X1e и X1f представляет собой остаток спиртовой группы, а другой является остатком спиртовой группы или группы, содержащей уходящий атом или уходящую группу.
Если X1e и X1f оба являются остатками спиртовой группы, реакцию удобно проводить в присутствии дегидратирующего агента, такого как комплекс диэтиловый эфир азодикарбоновой кислоты - трифенилфосфин. Подходящими растворителями для реакции являются простые эфиры, такие как тетрегидрофуран, и амиды, такие как диметилформамид. Реакцию обычно проводят в интервале температур от 0 до 50oC.
(G) Для соединения формулы I, в котором X2 обозначает группу CH2CH(NHXR6), - взаимодействие соединения формулы: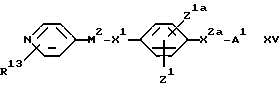
где X2a обозначает группу CH2CH(NH2), или его кислотно-аддитивной соли с соединением формулы:
R6•X•U4 XVI
где U4 является уходящим атомом или уходящей группой.
Примеры значений для U4 включают атом галогена, такого как хлор или бром. Примерами кислотно-аддитивных солей являются, например, гидрохлориды. Реакцию удобно проводить в интервале температур от минус до 120oC, преимущественно от 10 до 100oC. Подходящими растворителями являются, например, простые эфиры, такие как тетрагидрофуран, амиды, такие как диметилформамид, нитрилы, такие как ацетонитрил, галогензамещенные углеводороды, такие как дихлорметан, спирты, такие как этанол. Реакцию обычно проводят в присутствии основания, например третичного амина, такого как триэтиламин.
(H) Для соединения формулы I, в котором X2 обозначает оксиалкиленовую группу или оксиалкениленовую группу, - взаимодействие соединения формулы: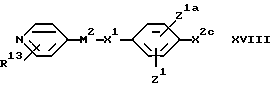
с соответствующим соединением формулы
X2d-A1 XIX
где X2c обозначает гидроксильную группу, или ее реакционноспособное производное (такое как галогенид), а X2d обозначает гидроксиалкиленовую или гидроксиалкениленовую группу или ее реакционноспособное производное (такое как галогенид, например, бромид). Реакцию обычно проводят в присутствии сильного основания, такого как гидрид щелочного металла, например гидрид натрия. Подходящими растворителями являются амиды, такие как диметилформамид. Реакцию удобно проводить в интервале температур от 0 до 100oC.
(I) Для соединения формулы I, в котором X2 представляет собой CONHалкиленовую группу, - взаимодействие соединения формулы: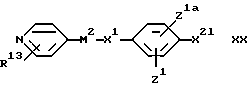
с подходящим соединением формулы:
X2f-A1 XXI
где X2e обозначает карбоксильную группу или ее реакционноспособное производное (такое как ацилгалогенид, например ацилхлорид, или ангидрид), а X2f представляет собой аминоалкиленовую группу или ее кислотно-аддитивную соль (такую как гидрохлорид)
Подходящими растворителями являются галогензамещенные углеводороды, такие как дихлорметан, амиды, такие как диметилформамид, и третичные амины, такие как триэтиламин. Реакцию обычно проводят в интервале температур от 0 до 100oC.
(J) Для соединения формулы I, в котором X1 обозначает группу CONH или CONHалкиленовую группу, - взаимодействие соединения формулы II с соединением формулы: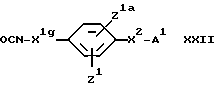
где X1g обозначает простую связь или алкиленовую группу.
Реакцию обычно проводят в интервале температур от 0 до 100oC. Подходящими растворителями являются галогензамещенные углеводороды, такие как дихлорметан.
(K) Для соединения формулы I, в котором X1 обозначает (1-2С)алкиленкарбонилокси-группу, - взаимодействие соединения формулы: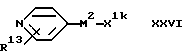
в котором X1k обозначает (1-2C)алкиленкарбоксильную группу или ее реакционноспособное производное, с соединением формулы: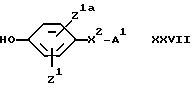
Реакцию обычно проводят в интервале температур от 0 до 100oC. Подходящими растворителями являются галогензамещенные углеводороды, такие как дихлорметан.
(L) Для соединения формулы I, в котором X1 обозначает (1-3C)алкиленкарбонильную группу, - взаимодействие соединения формулы:
в котором X1L обозначает (1-3C)алкиленкарбоксильную группу или ее реакционноспособное производное, с соединением формулы VI в присутствии кислоты Льюиса.
Примером подходящей кислоты Льюиса является трихлорид алюминия. Примеры реакционноспособных производных соединения формулы XXVIII включают галогениды, такие как хлориды.
Реакцию обычно проводят в интервале температур от минус 10 до 50oC. Подходящими растворителями являются галогензамещенные углеводороды, такие как дихлорметан.
(М)ДлясоединенияформулыI,вкоторомX2обозначаетNR21CO(1-2C)алкиленовую группу, - взаимодействие соединения формулы: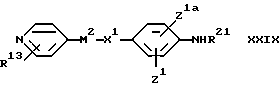
с соединением формулы
X2h-A XXX
где X2h представляет карбокси(1-2C)алкильную группу или ее реакционноспособное производное.
Примерами реакционноспособных производных соединений формулы XXX включают галогениды, такие как хлориды, или ангидриды.
Реакцию обычно проводят в интервале температур от 0 до 100oC. Подходящими растворителями являются амиды, такие как диметилформамид. \\2 Некоторые соединения формулы I, применяя известные способы, можно превратить в другие соединения формулы I. Например, соединение формулы I, в котором X1 обозначает (2-4C)алкиленовую группу, можно получить гидрированием соответствующего соединения формулы I, в котором X1 обозначает (2-4C)алкениленовую группу. Гидрирование можно провести, например, в присутствии палладия на угле и в подходящем растворителе, таком как спирт, например этанол. Соединение формулы I, в котором X1 обозначает группу (1-3C)алкиленCH(OH) можно получить восстановлением соответствующего соединения формулы I, в котором X1 обозначает (1-3C)алкиленкарбонильную группу. Восстановление можно осуществить, например, с помощью боргидрида щелочного металла, такого как боргидрид натрия.
Промежуточные соединения, которые используются в рассмотренных выше процессах, могут быть получены по способам, аналогичным известным способам, применяемым для получения известных соединений.
Так, соединение формулы IV можно получить по методам, аналогичным указанным в описании процессов (A) и от (C) до (G), взяв в качестве исходных соответствующие соединения, содержащие защитные группы. Понятно, что некоторые соединения формулы IV являются соединениями по настоящему изобретению.
Соединение формулы II, в которых М2 обозначает 2-оксопиперазин-1,4-диил, может быть получено взаимодействием пиперазинона с соединением формулы VII.
Соединения формулы XV можно получить, защищая соответствующее соединение формулы: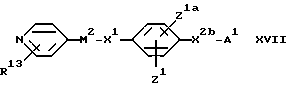
где X2b обозначает группу CH2CH(NHR11), а R11 является защитной группой для амино-группы.
Примеры групп для защиты амино-группы включают оксикарбонильные группы, такие как бензилкарбонильная группа. Бензилкарбонильную группу удобно удалять, например, гидрированием в присутствии карбонила палладия, такого как палладий на угле.
Соединения формулы XVII можно получить по способам, аналогичным способам приготовления соединений формулы I, используя соответствующие исходные соединения. Например, если требуется соединение формулы XVII, в котором X1 обозначает метиленокси-группу, то его можно получить по способам, аналогичным приведенному ранее в данном описании процессу (F), взяв в качестве исходного соединение формулы XIII и соответствующее N- защищенное производное тирозина.
Соединение формулы XVIII можно получить взаимодействием соединения формулы VII с соединением формулы:
где X2g обозначает гидроксильную группу или ее защищенное производное (например, метокси-группу) с последующим, в случае необходимости, удалением любых защитных групп (например, обработкой бромистоводородной кислотой) и, если необходимо, превращением гидроксильной группы в ее реакционноспособное производное с использованием известных способов.
Многие из промежуточных соединений, например соединения формулы XV, XVII и XVIII и соединения формулы II и VIII, в которых М2 обозначает 2-оксопиперазин-1,4-диил, являются новыми соединениями и представляют еще одну цель настоящего изобретения.
Соединения формулы I можно превратить в фармацевтически приемлемые соли и/или их метаболически лабильные сложные эфиры или амиды по способам, хорошо известным из области техники. Например, фармацевтически приемлемые соли можно получить взаимодействием соединения формулы I с кислотой, способной образовывать физиологически приемлемый анион, или с основанием, способным образовывать физиологически приемлемый катион. Фармацевтически приемлемый метаболически лабильный сложный эфир или амид можно получить соответственно этерифицированием соединения формулы I с использованием известных способов или взаимодействием кислоты или ее реакционноспособного производного с подходящим амином.
Способность соединений формулы I ингибировать агрегацию тромбоцитов может быть показана при использовании стандартного теста (а), основанного на тесте, описанном Barn (Nature, 1962, 194, 927-929) и включающем:
(i) агрегацию обогащенной тромбоцитами и содержащей цитратный буфер плазмы человека путем добавления аденозиндифосфата (АДФ) в таком количестве, чтобы можно было.построить кривую зависимости отклика от дозы;
(ii) построение кривой зависимости отклика для стимулированной АДФ агрегации тромбоцитов в присутствии возрастающего количества испытуемого соединения (обычно в диапазоне от 10-5 М до 10-10 М); и
(iii) вычисление значения pA2, указывающего на способность испытуемых соединений ингибировать агрегацию тромбоцитов, усредненного для нескольких концентраций, на основе рассчитанного значения 50%-ного отклика для агрегации под действием АДФ в присутствии или в отсутствие испытуемого соединения.
Тест (a) можно модифицировать таким образом, чтобы исследовать воздействие испытуемого соединения в условиях ex vitro на агрегацию тромбоцитов человека после назначения испытуемого соединения лабораторному животному, такому как крыса, кролик, морская свинка, мышь или собака. Например, группам из четырех голодных самцов крыс Alderly Park Wistar орально вводят испытуемые соединения в подходящем носителе и через определенные промежутки времени (1, 3, 5 и 8 час после дозировки) животных анастезируют и берут пункцию крови из сердца.
Кровь отбирают в 3,2%-ный цитратный буфер (1 часть на 9 частей крови) и центрифугированием (4500 x g в течение 10 минут) получают обедненную тромбоцитами плазму. Кровь человека отбирают в 3,2%-ный раствор тринатрий-цитрата (1 часть на 9 частей цельной крови) и центрифугируют (200 x g в течение 15 минут), получая обогащенную тромбоцитами плазму.
Смешивают равные объемы (125 мкл) обедненной тромбоцитами плазмы крысы и обогащенной тромбоцитами плазмы человека, добавляют АДФ и полученную смесь выдерживают в термостате (37oC) и перемешивают (900 об/мин) в агрегометре тромбоцитов фирмы "Bio Data". Агрегацию вызывают добавлением АДФ и вычисляют агонистические значения EC50 для смесей обогащенная тромбоцитами плазма человека/обедненная тромбоцитами плазма крыс, взятых у животных, которым вводили дозы испытуемого соединения или носитель. Каждый раз вычисляют среднее отношение концентраций (концентрация АДФ, необходимая для того, чтобы вызвать 50%-ный агрегационный отклик в смесях обогащенная тромбоцитами плазма человека/обедненная тромбоцитами плазма крыс, взятых у животных, которым вводили дозы антагониста, деленная на концентрацию АДФ, необходимую для того, чтобы вызвать 50%-ную агрегацию в смесях обогащенная тромбоцитами плазма человека/обедненная тромбоцитами плазма крыс, взятых у животных, которым вводили дозы носителя).
Способность соединений формулы I ингибировать связывание фибриногена с GPIIb/IIIa можно продемонстрировать, используя следующий стандартный тест (b), включающий:
(i) Приготовление лизатов тромбоцитов человека
Получают обогащенную тромбоцитами плазму центрифугированием (1000 об/мин, 15 минут) из цельной крови, в которую в качестве антикоагулянта в количестве 1 часть на 6 частей крови добавлен кислый цитратный раствор декстрозы (тринатрий-цитрат 86 мМ, лимонная кислота 70 мМ, d-глюкоза 110 мМ). К обогащенной тромбоцитами плазме перед центрифугированием (2400 об/мин, 115 минут) добавляют простациклин (PG1, 1 мкМ) и полученную таблетку вновь суспендируют в модифицированном растворе Тиродеса (NaCl 130 мМ, KCl 26 мМ, NaHCO3 12 мМ, NaH2PO4 0,5 мМ, MgCl2 1 мМ, CaCl2 20 мМ, глюкоза 12 мМ, HEPES 5 мМ), содержащем бычий сывороточный альбумин 3,5 г/л, PG12 1 мкМ и гирудин 0,5 ед/мл. Суспензию тромбоцитов центрифугируют (2400 об/мин, 15 минут) и полученную таблетку вновь суспендируют в буфере для лизиса (октилглюкозид 50 мМ, HEPES 10 мМ, NaCl 150 мМ, CaCl2 1 мМ, MgCl2 1 мМ, PMSF 1 мМ, NEM 10 мМ, лейпептин 0,1 мМ), перемешивают при температуре 4oC в течение 15 минут и центрифугируют со скоростью 24000 об/мин в течение 15 минут. Жидкость над осадком хранят при температуре 4oC, а таблетку вновь суспендируют в буфере для лизиса. Операцию центрифугирования повторяют еще три раза, жидкости над осадком объединяют и хранят при температуре минус 70oC.
(ii) Очистка рецептора
Гликопротеин IIb/IIIa выделяют из лизатов тромбоцитов человека на колонке для аффинной хроматографии с сефарозой, содержащей 2 мл пептида (KYGRGDS). 1,5 мл лизата тромбоцитов помещают в колонку и оставляют на ночь при температуре 4oC. Колонку промывают буферным раствором (30 мл, октилглюкозид 25 мМ, HEPES 10 мM, NaCl 150 мМ, CaCl2 1 мМ, MgCl2 1 мМ, PMSF 1 мМ, NEM 10 мМ, лейпептин 0,1 мМ) и собирают фракции объемом 2 мл. GPIIb/IIIa элюируют с помощью 12 мл буферного раствора, содержащего HHLGGAKQAGAN (2 мг/мл, pH 7,5), колонку промывают 4 мл буфера и оставшийся GPIIb/IIIa элюируют с помощью 12 мл буферного раствора, содержащего GКRGDSPG (1 мг/мл, pH 7,5). Колонку последний раз промывают 20 мл буферного раствора, после чего ее можно использовать для трех аналогичных приготовлений. Фракции, содержащие GPIIb/IIIa, идентифицируют с помощью гель-электрофореза и иммуноблотинга, объединяют и хранят при температуре минус 70oC.
(iii) Иммуноферментный твердофазный анализ GPIIb/IIIa
Планшеты с 96 ячейками покрывают 100 мкл очищенного рецептора фибриногена тромбоцитов человека GPIIb/IIIa, разбавленного буферным раствором для нанесения покрытия (Tris- HCl 20 мМ, NaCl 150 мМ, CaCl2 1 мМ, pH 7,4) и оставляют на ночь при температуре 4oC. Планшеты промывают с помощью буферного раствора для промывки (Tris-HCl 50 мМ, NaCl 100 мМ, CaCl2 2 мМ, pH 7,4) и неспецифическое связывание блокируют добавлением 200 мкл 2%-ного бычьего сывороточного альбумина (2 час, 30oC). Планшеты промывают перед помещением в термостат (2 час, 30oC) 100 мкл фибриногена, обработанного биотином, содержащего либо носитель либо испытуемое соединение. Планшеты промывают, помещают в термостат вместе с стрептавидином (5 мкг/мл, 1 час, комнатная температура), вновь промывают перед добавлением 100 мкл биотинилированной пероксидазы хрена (0,1 мкг/мл, 1 час, комнатная температура). Затем планшеты промывают и непосредственно перед добавлением 150 мкл в каждую ячейку смешивают равные объемы субстрата пероксидазы (3, 5, тетраметилбензидин 0,4 г/л) и перекиси водорода (0,02%). В течение 10-15 минут дают цвету насытиться и определяют оптическую плотность на длине волны 650 нм.
Принятые сокращения
PMSF - Фенилметилсульфонилфторид
HEPES - N-[2-гидроксиэтил]пиперазин-N-[2-этансульфоновая кислота]
NEM - этилмалеимид
Концентрацию соединения, необходимую, чтобы вызвать 50%-ное ингибирование связывания фибриногена, обработанного биотином, вычисляют и выражают в виде pIC50 (-log(IC50)).
В общем случае испытуемые соединения, проявляющие активность в указанном тесте, имеют значения pIC50 более чем 4,0.
Воздействие каждого приведенного в настоящем описании соединения формулы I, наблюдаемое в приведенных выше тестах, указано в таблице. В тех случаях, когда приведен интервал значений, соединение испытывали более чем один раз. Тире (-) обозначает, что соединение не проходило испытаний.
Было показано, что в общем случае соединения формулы I, в которых A1 обозначает карбоксильную группу, обладают большим уровнем активности в тесте (a) и тесте (b), чем аналогичные соединения, в которых A1 обозначает сложноэфирную группу. Однако часто обнаруживается, что соединения, в которых A1 обозначает сложноэфирную группу, обладают более высоким уровнем активности, чем соединения, в которых A1 обозначает карбоксильную группу в тесте (a), когда указанный тест модифицирован с целью исследовать активность испытуемых соединений при оральном назначении.
Например, было показано, что соединение, приведенное в примере 1 настоящего описания, имеет величину pA2, равную 6,5-6,8, в тесте (a) и величину pIC50, равную 5,8-6,4, в тесте (b), в то время как соединение по примеру 2 имеет величину pA2, равную 7,1-7,3, в тесте (a) и величину pIC50, равную 7,6, в тесте (b). Однако было обнаружено, что соединение по примеру 1 активно в течение до 12 час при оральном назначении с дозой 5 мг/кг. Не желая углубляться в теорию, мы поэтому просто полагаем, что соединения формулы I, в которых A1 обозначает сложноэфирную группу, ведут себя как предшественники лекарственных средств формулы I, в которых A1 обозначает карбоксильную группу.
Как указывалось ранее, соединения формулы I могут использоваться при терапевтическом лечении или предотвращении заболеваний, связанных с адгезией клеток (особенно агрегацией тромбоцитов), например, венозного или артериального тромбоза (в частности, легочной эмболии, приступов и тромботических случаев, сопровождающих неустойчивую стенокардию и приступы транзиторной ишемии), инфаркта миокарда, атеросклероза, тромбоэмболии и повторной закупорки во время и после тромболитической терапии. Соединения могут быть также полезны для предотвращения повторной закупорки и рестеноза, при чрескожных транслюминальных пластических операциях на коронарных сосудах, и закупорки шунтирующего трансплантанта коронарной артерии. Понятно, что соединения могут быть полезны при лечении других заболеваний, которые сопровождаются связыванием молекул адгезии к GPIIb/IIIa, например рака.
Поэтому в соответствии с еще одним аспектом настоящего изобретения, заявляется способ ингибирования агрегации тромбоцитов у теплокровных млекопитающих, нуждающихся в подобном лечении, который заключается в назначении эффективного количества соединения формулы I, или его метаболически лабильного сложного эфира или амида, или его фармацевтически приемлемой соли.
В соответствии с еще одним аспектом настоящего изобретения заявляется способ ингибирования связывания фибриногена с GPIIb/IIIa у теплокровных млекопитающих, нуждающихся в подобном лечении, который заключается в назначении эффективного количества соединения формулы I, или его метаболически лабильного сложного эфира или амида, или его фармацевтически приемлемой соли.
В соответствии с еще одним аспектом настоящего изобретения, заявляется использование соединения формулы I, или его метаболически лабильного сложного эфира или амида, или его фармацевтически приемлемой соли для приготовления медицинского средства для предотвращения или лечения заболеваний, связанных с агрегацией тромбоцитов.
Наконец, в соответствии с еще одним аспектом настоящего изобретения, заявляется использование соединения формулы I, или его метаболически лабильного сложного эфира или амида, или его фармацевтически приемлемой соли для приготовления медицинского средства для предотвращения или лечения заболеваний, включающих связывание фибриногена с GPIIb/IIIa.
В общем случае соединения формулы I назначаются с этой целью орально, ректально, местно, внутривенно, подкожно, внутримышечно или с помощью ингаляции, так что получаемая доза составляет от 0,01 до 50 мг/кг веса тела, в зависимости от способа назначения, возраста и пола пациента и тяжести состояния, лечение которого проводится.
Соединение формулы 1 обычно используют в форме фармацевтической композиции, включающей соединение формулы I или его фармацевтически приемлемую соль, как указано ранее в настоящем описании, вместе с фармацевтически приемлемым разбавителем или носителем. Указанная композиция является еще одной особенностью настоящего изобретения и может изменяться в зависимости от дозировочной формы. Например, она может быть в виде таблеток, капсул, растворов или суспензий для орального назначения; в форме крема или мази или трансдермальной (накожной) бляшки для местного назначения; в форме суппозиторий для ректального назначения; в форме стерильного раствора или суспензии для назначения путем внутривенной или внутримышечной инъекции; в форме аэрозоля или раствора или суспензии для распылителя для назначения с помощью ингаляции; и в форме порошка вместе с фармацевтически приемлемыми инертными твердыми разбавителями, такими как лактоза, для назначения методом вдувания. В зависимости от способа назначения композиции могут содержать, например, от 0,1 до 99,9% вес. соединения формулы I.
Фармацевтические композиции можно получить обычными способами с использованием фармацевтически приемлемых разбавителей и носителей, хорошо известных из области техники. Таблетки или капсулы для орального назначения могут быть покрыты защитными оболочками, например, состоящими из ацетата-фталата целлюлозы, с целью уменьшить контакт активного ингредиента формулы с кислотами, находящимися в желудке.
Соединения по настоящему изобретению могут назначаться и смешиваться в композиции совместно с одним или большим количеством средств, известных как полезные для лечения заболеваний или состояний; например, обычно в фармацевтической композиции по настоящему изобретению при использовании для лечения сердечно-сосудистых заболеваний или состояний могут также содержаться известный ингибитор агрегации тромбоцитов (в частности, аспирин, антагонист тромбоксана или ингибитор тромбоксансинтетазы), гиполипидемическое средство, средство, понижающее давление, тромболитическое средство (такое как стрептокиназа, урокиназа, проурокиназа, клеточный плазминогеновый активатор или его производные), бета-адренергический блокатор или сосудорасширяющее средство.
Помимо их использования в терапии, соединения формулы I полезны также в качестве фармакологических средств при разработке и стандартизации тестовых методов для оценки воздействия молекул адгезии при наблюдении за лабораторными животными, такими как кошки, собаки, кролики, обезьяны, крысы и мыши, в процессе разработки новых терапевтических средств. Соединения формулы I можно также использовать благодаря их свойствам ингибировать агрегацию тромбоцитов при сохранении крови и поддержании жизнеспособности крови и кровеносных сосудов теплокровных животных (или их органов) при осуществлении искусственного кровообращения вне тела, например во время трансплантации конечностей или органов. При использовании в указанных целях соединение формулы I или его физиологически приемлемая соль обычно назначается таким образом, чтобы в крови поддерживалась постоянная устойчивая концентрация в интервале, например, от 0,1 до 10 мг на литр.
Изобретение далее иллюстрируется следующими не ограничивающими его примерами, в которых, если специально не оговаривается:
(i) концентрирование и упаривание проводят в вакууме с помощью ротационного испарителя;
(ii) операции проводят при комнатной температуре, т.е. в интервале температур 18-26oC;
(iii) колоночную хроматографию осуществляют на силикагеле (Merk Art. 9385), получаемом от фирмы "E. Merck and Co.," Дармштадт, Германия; и на нейтральном оксиде алюминия (ICN Alumina, активность III или IV), получаемом от фирмы "ICN Biomedicals GmBH", D 3440, Эшвеге, Германия;
(iv) выходы даны лишь для справок и необязательно являются максимально достижимыми при тщательном проведении операции выделения получаемых продуктов;
(v) спектры протонного магнитного резонанса обычно регистрируют на частоте 200 МГц или 250 МГц в диметилсульфоксиде-d6, используя тетраметилсилан (ТМС) в качестве внутреннего стандарта, и выражают в виде значения химических сдвигов (по шкале дельта) в миллионных долях по отношению к ТМС, при этом используются принятые сокращения для обозначения основных пиков: с - синглет; м - мультиплет; т - триплет; ш - уширенный сигнал; д - дублет; и
(vi) "эфир" обозначает диэтиловый эфир, ТГФ обозначает тетрагидрофуран, ДМФА обозначает N,N-диметилформамид, ДМСО обозначает диметилсульфоксид, ТФК обозначает трифторуксусную кислоту, HOBT обозначает 1-гидроксибензотриазол; и NBA обозначает м-нитробензиловый спирт.
(vii) Указание на сушку с помощью бумаги для разделения фаз обозначает использование бумаги Whatman PS для разделения фаз.
Пример 1: Метиловый эфир 4-[2-[4-(4-пиридил)пиперазин-1- ил]ацетил]феноксиуксусной кислоты
Раствор метилового эфира 4-бромацетилфеноксиуксусной кислоты (4,3 г) в ацетонитриле (50 мл) добавляют по каплям в течение 40 минут к перемешиваемому раствору 1-(4-пиридил)пиперазина (4,9 г) в ацетонитриле (100 мл). Перемешивают еще в течение 1,5 час, затем раствор отфильтровывают и фильтрат упаривают в вакууме. Твердый остаток растирают с водой (50 мл), сушат и суспендируют в хлористом метилене (50 мл). Суспензию отфильтровывают и фильтрат упаривают до небольшого объема. Очищают тонкослойной хроматографией на нейтральном оксиде алюминия, элюируя вначале дихлорметаном, затем 0,5% об/об смесью метанол/дихлорметан и, наконец, 1% об/об смесью метанол/дихлорметан, получая целевое соединение, 1,93 г, в виде твердого вещества белого цвета с т. пл. 150-152oC; спектр ПМР (ДМСО-d6): δ 8,14 (2H, д), 7,98 (2H, д), 7,03 (2H, д), 6,78 (2H, д), 4,90 (2H, с), 3,83 (2H, с), 3,72 (3H, с), 3,34 (4H, широкий т), 2,65 (4H, широкий т); масс-спектр: m/e 370 (М + H)+; вычислено для C20H23N3O4: C, 65,0; H, 6,3; N, 11,4; найдено: C, 65,2; H, 6,4; N, 11,3%.
Пример 2: 4-[2-[4-(4-пиридил)пиперазин-1-ил]ацетил]феноксиуксусная кислота
К перемешиваемому раствору продукта по примеру 1 (550 мг) в метаноле (10 мл) добавляют 1М раствор гидроксида натрия (1,65 мл) и перемешивают еще в течение 2 час. Смесь разбавляют водой (10 мл) и полученный раствор упаривают в вакууме. Добавляют воду (20 мл), а затем 1М раствор соляной кислоты (1,65 мл). При охлаждении до 4oC выпадает твердое вещество. Полученную смесь упаривают в вакууме, твердое вещество отделяют и промывают ледяной водой, сушат и получают целевое соединение, 320 мг, в виде твердого вещества с т.пл. 294-296oC; спектр ПМР (ДМСО-d6 + ТФК): δ 8,34 (2H, д), 7,95 (2H, д), 7,26 (2H, д), 7,10 (2H, д), 5,06 (2H, с), 4,82 (2H, с), 4,06 (4H, широкий с), 3,52 (4H, широкий с): масс-спектр: m/e 356 (М+H)+; вычислено для C19H21N3O4: C, 64,2; H, 6,0; N, 11,8; найдено: C, 64,1; H, 6,1; N, 11,6%.
Пример 3: Диметиловый эфир 2,2'-[4-[2-(4-(4-пиридил) пиперазин-1-ил]ацетил] фенилен-1,2-диокси]диуксусной кислоты
Раствор диметилового эфира 2,2'-[4-бромацетил]фенилен- 1,2-диоксидиуксусной кислоты (3,0 г) в ацетонитриле (15 мл) добавляют по каплям в течение 30 минут к перемешиваемому раствору 1-(4-пиридил)пиперазина (2,6 г) в ацетонитриле (75 мл) и оставляют смесь перемешиваться на ночь. Смесь затем отфильтровывают и фильтрат упаривают, получая масло. После очистки методом тонкослойной хроматографии на силикагеле, элюируя вначале смесью метанол/дихлорметан (2,5% об/об), а затем смесью метанол/дихлорметан (5% об/об), получают твердое вещество. Растирают с эфиром и получают целевое соединение, 0,95 г, в виде твердого вещества с т.пл. 81-83oC; спектр ПМР (ДМСО-d6) δ 8,14 (2H, д), 7,67 (1H, два д), 7,52 (1H, д), 7,03 (1H, д), 6,80 (2H, д), 4,94 (2H, с), 4,88 (2H, с), 3,81 (2H, с), 3,69 (6H, с), 3,29 (4H, т), 2,60 (4H, т); масс-спектр: m/e 458 (М+H)+; вычислено для C23H27N3O7•0,25 H2O: C, 59,8; H, 6,0; N, 9,1; найдено: C, 59,7; H, 6,2; N, 8,8%.
Исходное соединение получают следующим образом:
(i) Метиловый эфир бромуксусной кислоты (19,1 мл) добавляют по каплям к перемешиваемой смеси 3,4-дигидроксиацетофенола (12,6 г) и безводного карбоната калия (27,5 г) в ацетоне (250 мл). Перемешивание продолжают в течение 16 час, затем смесь отфильтровывают и растворитель удаляют в вакууме. Остаток после растирания с эфиром дает диметиловый эфир 2,2'-[4- ацетил]фенилен-1,2-диоксидиуксусной кислоты, 13,1 г, в виде беловатого твердого вещества с т.пл. 101-102oC; спектр ПМР (ДМСО-d6): δ 7,60 (1H, два д), 7,41 (1H, д), 7,02 (1H, д), 4,94 (2H, с); 4,89 (2H, с), 3,71 (6H, с), 2,50 (3H, с); масс- спектр: m/e 297 (М+H)+; вычислено для C14H16O7: C, 56,8; H, 5,4; найдено: C, 56,4; H, 5,5%.
(ii) Раствор брома (2,27 мл) в хлороформе (10 мл) добавляют по каплям в течение 15 минут к перемешиваемому раствору продукта, полученного на стадии (i) (12,9 г), в хлороформе (40 мл) при температуре 30oC. Затем смесь перемешивают в течение 2 час при комнатной температуре и растворитель удаляют в вакууме. Полученное воскообразное твердое вещество при растирании с этанолом дает диметиловый эфир 2,2'- [4-бромацетил]фенилен-1,2-диоксидиуксусной кислоты, 11,5 г, в виде твердого вещества кремового цвета с т.пл. 76-78oC; спектр ПМР (ДМСО-d6): δ 7,66 (1H, два д), 7,47 (1H, д), 7,06 (1H, д), 4,96 (2H, с), 4,90 (2H, с), 4,62 (2H, с), 3,71 (6H, с); масс-спектр: m/e 375/377 (М+H)+, соответствует 1 Br.
Пример 4: 2'2-[4-[2-[4-(4-пиридил)пиперазин-1-ил]ацетил] фенилен-1,2-диокси]диуксусная кислота
К перемешиваемому раствору продукта по примеру 3 (300 мг) в метаноле (4 мл) добавляют 1М раствор гидроксида натрия (1,31 мл) и перемешивают смесь в течение 1 час. Разбавляют водой (10 мл), полученный раствор упаривают до объема приблизительно 7 мл и добавляют 1М раствор соляной кислоты (1,31 мл). При охлаждении до 4oC выпадает твердое вещество, которое отделяют, промывают ледяной водой, сушат и получают целевое соединение, 120 мг, в виде твердого вещества белого цвета с т.пл. 180-184oC (с разложением); спектр ПМР (ДМСО - d6): δ 8,16 (2H, д), 7,61 (1H, т), 6,93 (1H, д), 6,87 (2H, д), 4,73 (2H, с), 4,68 (2H, с), 3,77 (2H, с), 3,44 (4H, широкий т), 2,58 (4H, широкий т); масс-спектр: m/e 430 (М+H)+; вычислено для C21H23N3O7•0,75H2O: C, 56,9; H, 5,5; N,9,5; найдено: C, 57,0; H, 5,6; N, 9,3%.
Пример 5: Метиловый эфир 4-[2-[4-(4-пиридил)пиперазин- 1-ил]ацетил]-2-метоксифеноксиуксусной кислоты
Раствор метилового эфира 4-бромацетил-2-метоксифеноксиуксусной кислоты (1,27 г) в ацетонитриле (10 мл) добавляют по каплям в течение 15 минут к перемешиваемому раствору 1-(4-пиридил) пиперазина (1,30 г) в ацетонитриле (30 мл). После того как смесь оставляют перемешивать на ночь, жидкость декантируют с осадка и упаривают в вакууме. После очистки методом тонкослойной хроматографии на силикагеле, элюируя вначале дихлорметеном, а затем смесью метанол/дихлорметан (5% об/об), получают твердое вещество. Растирают с эфиром и получают целевое соединение, 42 мг, т.пл. 110-112oC; спектр ПМР (ДМСО - d6): δ 8,14 (2H, д), 7,65 (1H, два д), 7,55 (1H, д), 6,97 (1H, д), 6,80 (2H, д), 4,90 (2H, с), 3,87 (5H, с), 3,72 (ЗH, с), 3,33 (4H, т), 2,62 (4H, т); масс-спектр: m/e 400 (М+H)+; вычислено для C21H25N3O5: C, 63,1; H, 6,3; N, 10,5; найдено: C, 62,9; H, 6,3; N, 10,4%.
Пример 6: 4-[2-[4-(4-пиридил)пиперазин-1-ил]ацетил]-2- метоксифеноксиуксусная кислота
Целевое соединение с выходом 47% получают аналогично примеру 2, взяв в качестве исходного продукт по примеру 5; т.пл. 218-224oC; спектр ПМР (ДМСО - d6): δ 8,16 (2H, д), 7,65 (1H, два д), 7,53 (1H, д), 6,92 (1H, д), 6,85 (2H, д), 4,73 (2H, с), 3,86 (2H, с), 3,82 (3H, с), 3,36 (4H, т), 2,63 (4H, т); масс-спектр: m/e 386 (М+H)+; вычислено для C20H23N3O5•H2O: C, 59,5; H, 6,2; N, 10,4; найдено: C, 59,5; H, 5,9; N 10,1%
Пример 7: Метиловый эфир 4-[3-[4-(4-пиридил)пиперазин-1-ил] пропаноил] феноксиуксусной кислоты
Целевое соединение с выходом 65% получают аналогично примеру 3, взяв в качестве исходного метиловый эфир 4-[3-хлорпропаноил] феноксиуксусной кислоты; т. пл. 93-95oC; спектр ПМР (ДМСО - d6): δ 8,14 (2H, д), 7,96 (2H, д), 7,04 (2H, д), 6,81 (2H, д); 4,92 (2H, с), 3,71 (3H, с), 3,29 (4H, т), 3,17 (2H, т), 2,72 (2H, т), 2,51 (4H, т); масс-спектр: m/e 384 (М+H)+; вычислено для C21H25N3O4: C, 65,8; H, 6,6; N, 11,0; найдено: C, 65,6; H, 6,8; N, 10,8%
Необходимые исходные соединения получают следующим образом:
Хлорид алюминия (33,35 г) добавляют порциями к перемешиваемому охлажденному (<0oC) раствору метилового эфира феноксиуксусной кислоты (14,46 мл) и 3-хлорпропионилхлорида (9,55 мл) в дихлорметане (500 мл). По окончании добавления баню со льдом убирают и смесь перемешивают в течение 1 час, а затем выливают в ледяную воду (500 мл). Органическую фазу отделяют и водную фазу дважды экстрагируют дихлорметаном. Дихлорметановые вытяжки объединяют, промывают водой, затем насыщенным раствором соли и сушат (над сульфатом магния). После удаления растворителя в вакууме остаток растирают с эфиром и получают метиловый эфир 4-[3-хлорпропаноил]феноксиуксусной кислоты, 22,3 г, в виде твердого вещества с т.пл. 89-90oC; спектр ПМР (ДМСО - d6): δ 7,95 (2H, д), 7,05 (2H, д), 4,92 (2H, с), 3,91 (2H, т), 3,71 (3H, с), 3,49 (2H, т); масс-спектр: m/e 257 (М+H)+; вычислено для C12H13ClO4: C, 56,1; H, 5,0; найдено: C, 55,8; H, 5,1%.
Пример 8: 4-[3-[4-(4-пиридил)пиперазин-1-ил]пропаноил] феноксиуксусная кислота
Целевое соединение с выходом 60% получают аналогично примеру 2, взяв в качестве исходного продукт по примеру 7; т.пл. 238-239oC; спектр ПМР (ДМСО - d6 + уксусная кислота - d4): δ 8,21 (2H, д), 7,97 (2H, д), 7,15 (2H, д), 7,02 (2H, д), 4,77 (2H, с), 3,64 (4H, т), 3,21 (2H, т), 2,82 (2H, т), 2,62 (4H, т); масс-спектр: m/e 370 (М+H)+; вычислено для C20H23N3O4: C, 65,0; H, 6,3; N,11,4; найдено: C, 64,6; H, 6,4; N, 11,1%.
Пример 9: Метиловый эфир 4-[2-[4-(4-пиридил)пиперазин-1- ил]ацетил]фенилтиоуксусной кислоты
Целевое соединение с выходом 27% получают аналогично примеру 3, взяв в качестве исходного метиловый эфир 4-бром- ацетилфенилтиоуксусной кислоты; т. пл. 109-110oC; спектр ПМР (ДМСО - d6): δ 8,15 (2H, д), 7,93 (2H, д), 7,40 (2H, д), 6,80 (2H, д), 4,07 (2H, с), 3,86 (2H, с), 3,66 (3H, с),. 3,30 (4H, т), 2,61 (4H, т); масс-спектр: m/e 386 (М+H)+; вычислено для C20H23N3O3S•0,25H2O: C, 61,4; H, 6,0; N, 10,7; найдено: C, 61,8; H, 6,0; N, 10,6%.
Необходимые исходные соединения получают следующим образом:
Хлорид алюминия (18,03 г) добавляют порциями к перемешиваемому охлажденному (<5oC) раствору метилового эфира фенилтиоуксусной кислоты (9,84 г) и бромацетилхлорида (4,46 мл) в дихлорметане (250 мл), поддерживая температуру ниже 5oC. Затем смесь перемешивают при комнатной температуре в течение 1 час и выливают на лед. После фильтрования органическую фазу отделяют и водную фазу дважды экстрагируют дихлорметаном. Дихлорметановые вытяжки объединяют, промывают насыщенным раствором соли, сушат (над сульфатом магния), фильтруют и упаривают, получая 4-бромацетилфенилтиоацетат, 11,52 г, в виде твердого вещества с т. пл. 48-50oC; спектр ПМР (хлороформ-d): δ 7,91 (2H, д), 7,40 (2H, д), 4,39 (2H, с), 3,76 (5H, с); масс-спектр: m/e 302/304 (М+H)+; соответствует 1 Br.
Пример 10: 4-[2-[4-(4-пиридил)пиперазин-1-ил] ацетил] фенилтиоуксусная кислота
Целевое соединение с выходом 83% получают аналогично примеру 2, взяв в качестве исходного продукт по примеру 9; т. пл. 240-244oC; спектр ПМР (ДМСО-d6): δ 8,16 (2H, д), 7,93 (2H, д), 7,39 (2H, д), 6,86 (2H, д), 3,92 (2H, с), 3,86 (2H, с), 3,38 (4H, т), 2,64 (4H, т); масс-спектр; m/e 372 (М+H)+; вычислено для C19H21N3O3S•0,25H2О: C, 60,6; H, 5,7; N, 11,2; найдено: C, 60,5; H, 5,6; N, 10,8%.
Пример 11: Метиловый эфир 3-[2-[4-[4-(4-пиридил)пиперазин- 1-ил]ацетил] фенил]пропионовой кислоты
Раствор метилового эфира 3-(4-бромацетилфенил)пропионовой кислоты (380 мг) в ацетонитриле (4 мл) добавляют по каплям в течение 15 минут к перемешиваемому раствору 1-(4-пиридил) пиперазина (450 мг) в ацетонитриле (10 мл) и смесь оставляют перемешиваться на ночь. Смесь отфильтровывают и фильтрат упаривают в вакууме, получая масло. После очистки методом тонкослойной хроматографии на силикагеле, элюируя вначале дихлорметаном, а затем смесью метанол/дихлорметан (5% об/об), получают твердое вещество. Растирают с эфиром и получают целевое соединение, 172 мг, в виде твердого вещества с т.пл. 141-143oC; спектр ПМР (ДМСО-d6): δ 8,15 (2H, д), 7,92 (2H, д), 7,37 (2H, д), 6,83 (2H, д), 3,89 (2H, с), 3,59 (3H, с), 3,37 (4H, т), 2,93 (2H, т), 2,69 (2H, т); масс-спектр: m/e 368 (М+H)+; вычислено для C21H25N3O3•0,25H2O: C, 67,8; H, 6,9; N, 11,3; найдено: C, 67,8; H, 6,9; N, 11,1%
Пример 12: 3-(2-[4-[4-(4-пиридил)пиперазин-1-ил] ацетил] фенил]пропионовая кислота
К перемешиваемому раствору продукта по примеру 11 (70 мг) в метаноле (0,5 мл) добавляют 1М раствор гидроксида натрия (0,19 мл) и перемешивают смесь в течение 3 час. Метанол удаляют в вакууме и остаток разбавляют водой (1 мл), затем добавляют 1М раствор соляной кислоты (0,19 мл). При охлаждении до 4oC выпадает твердое вещество, которое отделяют, промывают ледяной водой, сушат и получают целевое соединение, 36,5 мг, т.пл. 245-247oC; спектр ПМР (ДМСО-d6): δ 8,05 (2H, д), 7,91 (2H, д), 7,36 (2H, д), 6,86 (2H, д), 3,89 (2H, с), 3,34 (4H, т), 2,87 (2H, т), 2,62 (4H, т), 3,58 (2H, т); масс- спектр: m/e 354 (М+H)+; вычислено для C20H23N3O3•0,2H2O: C, 67,2; H, 6,6; N, 11,8; найдено: C, 67,6; H, 6,6; N, 11,4%.
Пример 13: Метиловый эфир 4-[2-[4-(4-пиридил)пиперазин-1- ил)ацетил] фенилуксусной кислоты
Раствор метилового эфира 4-хлорацетилфенилуксусной кислоты (260 мг) в ацетонитриле (4 мл) добавляют по каплям в течение 15 минут к перемешиваемому раствору 1-(4-пиридил)пиперазина (375 мг) в ацетонитриле (10 мл) и смесь оставляют перемешиваться на ночь. Жидкость декантирует с осадка, упаривают в вакууме и очищают тонкослойной хроматографией на нейтральном оксиде алюминия, элюируя вначале дихлорметаном, затем смесью метанол/дихлорметан (0,25% об/об) и наконец смесью метанол/ дихлорметан (0,5% об/об). Фракции упаривают в вакууме и получают целевое соединение, 96 мг, в виде кристаллического вещества белого цвета с т.пл. 127-129oC; спектр ПМР (ДМСО-d6): δ 8,15 (2H, д), 7,98 (2H, д), 7,41 (2H, д), 6,81 (2H, д), 3,91 (2H, с), 3,78 (2H, с), 3,53 (3H, с), 3,33 (4H, т), 2,64 (4H, т); масс-спектр: m/e 354 (М+H)+; вычислено для C20H23N3O3: C, 68,0; H, 6,6; N, 11,9; найдено: C, 68,2; H, 6,6; N, 11,9%.
Пример 14: Этиловый эфир 4-[2-[4-(4-пиридил)пиперазин-1- ил]ацетил]фенилуксусной кислоты
Используют способ, аналогичный указанному в примере 13, однако взяв в качестве исходного соединения этиловый эфир 4- хлорацетилфенилуксусной кислоты, и применяют для очистки тонкослойную хроматографию на силикагеле, элюируя дихлорметаном, затем смесью метанол/дихлорметан (5% об/об), получают целевое соединение с выходом 13% в виде твердого вещества с т.пл. 122-124oC; спектр ПМР (ДМСО-d6): δ 8,01 (2H, д), 7,29 (2H, д), 7,25 (2H, д), 6,67 (2H, д), 3,93 (2H, квартет), 3,75 (2H, с), 3,60 (2H, с), 3,18 (4H, т), 2,47 (4H, т), 1,03 (3H, т); масс- спектр: m/e 368 (М+H)+; вычислено для C21H25N3О3: C, 68,6; H, 6,9; N, 11,4; найдено: C, 68,2; H, 6,8; N, 11,3%.
Пример 15: Соль 4-[2-[4-(4-пиридил)пиперазин-1-ил]ацетил] фенилуксусной кислоты с трифторуксусной кислотой
К перемешиваемому раствору продукта по примеру 13 (142 мг) в метаноле (1 мл) добавляют 1М раствор гидроксида натрия (0,46 мл) и перемешивают смесь в течение 2 час. Метанол удаляют в вакууме и остаток разбавляют водой (1 мл), затем добавляют 1М раствор соляной кислоты (0,46 мл). Полученный раствор переносят в колонку препаративной жидкостной хроматографии высокого давления с обращенной фазой длиной 1 дюйм (VVDACR 218TP1022) и элюируют смесью вода/ацетонитрил/трифторуксусная кислота в градиенте от 98:2:0,1 об/об/об до 75:25:0,1 об/об/об. Из очищенных фракций после сублимационной сушки получают целевое соединение, 95 мг, в виде пенообразного вещества; спектр ПМР (ДМСО-d6): δ 8,34 (2H, д), 7,95 (2H, д), 7,48 (2H, д), 7,25 (2H, д), 4,67 (2H, ш), 3,93 (4H, ш), 3,72 (2H, с), 3,20 (4H, ш); масс-спектр: m/e 340 (М + H)+; вычислено для C19H21N3O3•2,25 CF3COOH: C, 47,4; H, 3,9; N, 7,1; найдено: C, 47,8; H, 3,8; N, 7,0%.
Пример 16: Метиловый эфир (RS)-4-[2-[4-(4-пиридил)пиперазин- 1-ил]-2-метилацетил]феноксиуксусной кислоты
Раствор метилового эфира (RS)-4-(2-метилацетил)феноксиуксусной кислоты (1,2 г) в ацетонитриле (10 мл) добавляют по каплям в течение 30 минут к перемешиваемому раствору 1-(4-пиридил) пиперазина (1,3 г) в ацетонитриле (30 мл) и оставляют перемешиваться на ночь. Затем смесь отфильтровывают и фильтрат упаривают, получая масло. После очистки методом тонкослойной хроматографии, элюируя вначале дихлорметаном, а затем последовательно смесями метанол/дихлорметан (2,5%, 3%, 4%, 5% и 10% об/об), получают целевое соединение, 220 мг, в виде твердого вещества с т.пл. 81-83oC; Спектр ПМР (ДМСО - d6) : δ 8,13 (2H, д), 8,06 (2H, д), 7,02 (2H, д), 6,77 (2H, д), 4,92 (2H, с), 4,33 (1H, квартет), 3,72 (3H, с), 3,26 (4H, т), 2,63 (4H, т), 1,16 (3H, д); масс-спектр: m/e 384 (M+H)+; вычислено для C21H25N3O4: C, 65,8; H, 6,6; N, 11,0; найдено: C, 65,7; H, 6,8; N, 10,9%.
Пример 17: Дигидрат аддукта (RS)-4-[2-[4-(4-пиридил)пиперазин- 1-ил]-2-метилацетил]феноксиуксусная кислота - хлорид натрия
К перемешиваемому раствору продукта по примеру 16 (110 мг) в метаноле (1 мл) добавляют 1М раствор гидроксида натрия (0,32 мл) и оставляют смесь перемешиваться на ночь. Метанол удаляют в вакууме, остаток разбавляют водой и добавляют 1М раствор соляной кислоты (0,32 мл). Растворитель удаляют в вакууме и получают желтое пенообразное вещество, из которого при растирании с эфиром получают целевое соединение, 116 мг; спектр ПМР (ДМСО- d6): δ 8,17 (2H, д), 8,06 (2H, д), 7,01 (2H, д), 6,98 (2H, д), 4,76 (2H, с), 4,37 (1H, квартет), 3,47 (4H, т), 2,15 (4H, т), 1,16 (3H, д); масс-спектр: m/e 370 (М + H)+; вычислено для C20H23N3O4•NaCl•2H2O: C, 51,8; H, 6,8; N, 9,1; найдено: C, 52,0; H, 5,6; N, 8,9%.
Пример 18: 2,2'-[4-[3-[4-(4-пиридил)пиперазин-1-ил] пропаноил]фенилен-1,2-диокси]диацетат, соль с трифторуксусной кислотой
Три-трет-бутиловый эфир 2,2'-[4-[3-[4-(4-пиридил)пиперазин- 1-ил]пропаноил]фенилен-1,2-диокси]диуксусной кислоты (555 мг) растворяют в смеси 90% об/об трифторуксусная кислота/вода (15 мл) и перемешивают полученную смесь в течение 1 час. Растворитель удаляют испарением в вакууме и полученное масло растирают с эфиром, получая целевое соединение, 608 мг, в виде твердого вещества с т.пл. 42-44oC; спектр ПМР (ДМСО-d6): δ 8,26 (2H, д), 7,15 (2H, д), 6,80 (3H, м), 4,67 (2H, с), 4,63 (2H, с), 3,65 (8H, ш), 3,39 (1H, квартет), 2,75 (2H, м), 2,66 (2H, д), 1,09 (1,5H, т); масс-спектр: m/e 444 (М+H)+; вычислено для C22H25N3O7•1,3•CF3COOH• 1H2О•0,25C4H10O: C, 48,9; H, 4,9; N, 6,7; найдено: C, 49,1; H, 5,0; N, 6,3%; вычислено для CF3COOH: 23,6; найдено 23,2%.
Необходимые исходные соединения получают следующим образом:
(i) Твердый гидрид натрия (1,6 г 60%-ной дисперсии в минеральном масле) добавляют к перемешиваемому и охлажденному до 4oC раствору 3,4-дигидроксибензальдегида (2,76 г) в ТГФ (50 мл). Затем полученную смесь перемешивают при комнатной температуре в течение еще 15 минут, охлаждают до 4oC и добавляют трет-бутиловый эфир бромуксусной кислоты (6,5 мл) и ДМФА (5 мл). По прошествии 1 час смесь разбавляют эфиром (100 мл), промывают водой и насыщенным раствором соли, сушат (над сульфатом магния) и упаривают, получая твердое вещество. Перекристаллизовывают из циклогексана и получают ди-трет-бутиловый эфир 2,2'-([4- формил])фенилен-1,2-диокси)диуксусной кислоты, 4,1 г, в виде кристаллов бледно-желтого цвета с т.пл. 96oC; спектр ПМР (ДМСО-d6): δ 9,82 (1H, с), 7,54 (1H, два д), 7,33 (1H, д), 7,08 (IH, д), 4,82 (2H, с), 4,75 (2H, с), 1,43 (18H, с); масс-спектр: m/e 366 (М+); вычислено для C19H26О7: C, 62,4; H, 7,3; найдено: C, 62,3; H, 7,2%.
(ii) К раствору продукта, полученного на стадии (i) (10,0 г), и малоновой кислоты (42 г) в пиридине (150 мл) добавляют несколько капель пиперидина и нагревают смесь на паровой бане в течение 4 час. Пиридин удаляют в вакууме, добавляют 300 мл воды и экстрагируют смесь эфиром (3 х 100 мл). Органические вытяжки объединяют, промывают водой, насыщенным раствором соли, сушат (над сульфатом магния) и упаривают, получая смолу. Перекристаллизация из циклогексана дает ди-трет-бутиловый эфир 2,2'-([4-(3- пропеновая кислота)] фенилен-1,2-диокси)диуксусной кислоты в виде аддукта с 0,5 мол циклогексана, 6,6 г, с т.пл. 104- 106oC; спектр ПМР (ДМСО-d6): δ 12,20 (1H, ш), 7,48 (1H, д), 7,26 (1H, с), 7,20 (1H, д), 6,89 (1H, д), 6,40 (1H, д), 4,74 (2H, с), 4,72 (2H, с), 1,43 (18H, с), 1,40 (6H, с); масс-спектр: m/e 408 (М+).
(iii) 10%-ный палладий на активированном угле (250 мг) добавляют к раствору продукта, полученного на стадии (ii) (2,05 г), в этилацетате (100 мл) и гидрируют смесь при комнатной температуре и нормальном давлении до тех пор, пока не поглотится теоретическое количество водорода. Добавляют активированный уголь, смесь перемешивают в течение 5 минут и фильтруют через диатомитовую землю, фильтрат упаривают досуха и получают ди-трет-бутиловый эфир 2,2'-(4-[1-(2-карбоксиэтил)] фенилен-1,2-диокси)диуксусной кислоты, 1,9 г, в виде бесцветной смолы; спектр ПМР (хлороформ-d): δ 6,76 (3H, м), 4,58 (2H, с), 4,56 (2H, с), 2,86 (2H, т), 2,60 (2H, т), 1,47 (18H, с); масс-спектр: m/e 410 (М). Полученная смола медленно кристаллизуется и дает твердое вещество белого цвета с т.пл. 68-70oC; вычислено для C21H30O8: C, 61,5; H, 7,4; найдено: C, 61,7; H, 7,7%.
(iv) К перемешиваемому раствору продукта, полученного на стадии (iii) (615 мг), в сухом ДМФА добавляют N,N'-диизопропилэтиламин (0,78 мл), HOBT (230 мг), гексафторфосфат 2-(1H-бензотриазол-1-ил)-1,1,3,3- тетраметилурония (596 мг). Через 15 минут добавляют 1-(4- пиридил)пиперазина (245 мг) и оставляют перемешиваться на ночь. ДМФА удаляют в вакууме, полученное масло выливают в смесь этилацетата (60 мл) и воды (20 мл). Органическую фазу отделяют, последовательно промывают водой (20 мл), 1М раствором едкого натра (20 мл), насыщенным раствором соли (3 х 20 мл), сушат и растворитель упаривают, получая масло. Очищают методом тонкослойный хроматографии на силикагеле, элюируя смесью метанол/дихлорметан (6,5% об/об), и получают ди-трет-бутиловый эфир 2,2'-[4-[3-[4-(4-пиридил) пиперазин-1-ил] пропаноил] фенилен- 1,2-диокси] диуксусной кислоты, 728 мг, в виде пенообразного вещества с т.пл. 57-61oC; спектр ПМР (ДМСО-d6): δ 8,16 (2H, д), 6,80 (3H, м), 4,63 (2H, с), 4,59 (2H, с), 3,58 (4H, ш), 3,32 (4H, ш), 2,73 (2H, м), 2,61 (2H, м), 1,45 (18H, с); масс-спектр: m/e 556 (М+H)+; вычислено для C30H41N3O7•0,5H2O: C, 63,8; H, 7,5; N, 7,4; найдено: C, 63,5; H, 7,4; N, 7,1%.
Пример 19: Метиловый эфир 2-S-(н-бутилсульфониламино)-3- [4-[1-(4-пиридил)пиперидин-4-ил]-2-метоксифенил]пропионовой кислоты
н-Бутилсульфохлорид (0,32 мл) добавляют по каплям к раствору метилового эфира 2-S-амино-3-[4-[1-(4-пиридил)пиперидин- 4-ил]-2-метоксифенил)пропионовой кислоты (750 мг) и триэтиламина (0,5 мл) в дихлорметане (15 мл), охлаждаемому в бане со льдом. Дают смеси нагреться до комнатной температуры и перемешивают в течение 5 час, а затем кипятят с обратным холодильником в течение 2 час. Реакционную смесь промывают водой (20 мл) и насыщенным раствором хлорида натрия (15 мл) и сушат (над сульфатом магния). Растворитель упаривают и остаток очищают тонкослойной хроматографией, элюируя смесью метанол/дихлорметан (1:9 об/об), получая целевое соединение (650 мг) в виде смолы; спектр ПМР (хлороформ-d): δ 0,87 (3H, т), 1,26-1,7 (6H, м), 1,95 (2H, д), 2,1 (1H, м), 2,72- 3,18 (6H, м), 3,77 (3H, с), 3,79 (2H, д), 3,96 (2H, д), 4,32 (1H, м), 4,82 (1H, уширенный д), 6,69 (2H, д), 6,83 (2H, д), 7,1 (2H, д), 8,25 (2H, ш); масс-спектр (+ve FAB, MeOH/NBA): 490 (М + H)+; [α]
Исходные соединения получают следующим образом:
(i) Диэтилазодикарбоксилат (0,58 мл) добавляют по каплям к перемешиваемой смеси 4-(4- гидроксиметилпиперидин-1-ил)пиридина (700 мг), метилового эфира N-бензилоксикарбонил-S-тирозина (1,2 г), трифенилфосфина (955 мг) и ТГФ (40 мл) в атмосфере аргона и охлаждают до 10oC. Дают смеси нагреться до комнатной температуры и перемешивают в течение 48 час. Растворитель упаривают и остаток очищают методом тонкослойной хроматографии, элюируя смесью метанол/дихлорметан (1:9 об/об), и получают метиловый эфир 2-S-(бензилоксикарбониламино)-3-[4- (1-(4-пиридил)пиперидин-4-ил)метоксифенил] пропионовой кислоты (1,2 г) в виде твердого вещества с т.пл. 68-75oC; спектр ПМР (ДМСО-d6): δ 1,2-1,4 (2H, м), 1,84 (2H, два д), 1,92-2,1 (1H, м), 2,7-3,02 (4H, м), 3,6 (3H, с), 3,8 (2H, д), 3,98 (2H, д), 4,14-4,28 (1H, м), 4,98 (2H, с), 6,78-6,88 (4H, м), 7,13 (2H, д), 7,20-7,4 (5H, м), 7,75 (1H, д), 8,13 (2H, д); масс-спектр (+ ve FAB MeOH/NBA): 504 (М + H)+.
(ii) Раствор продукта, полученного на стадии (i) (1 г), в этаноле (40 мл) и 10%-ный палладий на угле (200 мг) перемешивают в токе водорода в течение 4 час при комнатной температуре. Смесь отфильтровывают через слой диатомитовой земли и растворитель упаривают, получая метиловый эфир 2-S-амино-3-[4-[1-(4-пиридил)пиперидин-4-ил] -2- метоксифенил]пропионовой кислоты в виде масла; спектр ПМР (ДМСО-d6): δ 1,13-1,44 (2H, м), 1,75-2,13 (3H, м), 2,64-2,94 (4H, м), 3,6 (3H, с), 3,51 (1H, м), 3,57 (3H, с), 3,81 (2H, д), 3,96 (2H, д), 6,8 (2H, два д), 6,83 (2H, д), 7,08 (2H, д), 8,12 (2H, два д); масс-спектр (+ve FAB, MeOH/NBA): 370 (М + H)+.
Пример 20: 2-S-(н-Бутилсульфониламино)-3-[4-[1-(4-пиридил) пиперидин-4-ил]-2-метоксифенил]пропионовая кислота
Гидроксид лития (285 мг) добавляют к раствору продукта по примеру 33 (520 мг) в смеси метанол (9 мл), ТГФ (9 мл) и вода (9 мл) и перемешивают при комнатной температуре в течение 3,75 час. Растворитель упаривают и к остатку приливают воду (5 мл). Добавляют 10%-ный раствор бисульфата калия (8 мл) и масло отделяют, растворяют его в метаноле и фильтруют через диатомитовую землю. Растворитель упаривают и остаток растирают с этилацетатом, получая целевое соединение (500 мг) в виде аморфного твердого вещества; спектр ПМР (ДМСО-d6): δ 0,81 (3H, т), 1,1-1,6 (6H, м), 1,85 (2H, д), 2,0 (1H, уширенный с), 2,58-3,0 (6H, м), 3,68 (3H, т), 3,8 (2H, д), 3,98 (2H, д), 6,8 (4H, уширенный с), 7,13 (2H, д), 8,12 (2H, уширенный с); масс-спектр (+ve FAB, MeOH/NBA): 476 (М + H)+.
Пример 21: Метиловый эфир 2-S-(н-бутилсульфониламино)- 3-[4-[2-[1-(4-пиридил)пиперидин-4-ил]этокси]фенил]пропионовой кислоты
н-Бутилсульфохлорид (0,28 мл) добавляют по каплям к раствору метилового эфира 2-S-амино-3-[4-[2-[1-(4-пиридил)пиперидин- 4-ил]этокси]фенил]пропионовой кислоты (630 мг) и триэтиламина (0,5 мл) в дихлорметане (15 мл), охлаждаемому в бане со льдом. Дают смеси нагреться до комнатной температуры и перемешивают в течение 5 час. Реакционную смесь разбавляют дихлорметаном (10 мл) и промывают водой (20 мл), насыщенным раствором хлорида натрия (10 мл) и сушат (над сульфатом магния). Растворитель упаривают и остаток очищают тонкослойной хроматографией, элюируя смесью метанол-дихлорметан (1:9 об/об), и получают целевое соединение (680 мг) в виде смолы; спектр ПМР (хлороформ-d): δ 0,9 (3H, т), 1,25-1,45 (4H, м), 1,55- 1,95 (7H, м), 2, 72-3,15 (6H, м), 3,78 (3H, с), 3,9 (2H, уширенный д), 4,0 (2H, 7), 4,32 (1H, уширенный с), 4,84 (1H, уширенный с), 6,68 (2H, д), 6,83 (2H, д), 7,09 (2H, д), 8,23 (2H, уширенный с); масс-спектр (+ve FAB, MeOH/NBA): 504 (М + H)+.
Исходные соединения получают следующим образом.
(i) Метиловый эфир 2-S-(бензилоксикарбониламино)-3-[4-[2-[1-(4- пиридил)пиперидин-4-ил]этокси]фенил]пропионовой кислоты (900 мг) получают в виде масла аналогично стадии (i) примера 19, взяв в качестве исходного 4-(4-гидроксиэтилпиперидин-1-ил)пиридин; спектр ПМР (ДМСО-d6): δ 1,05-1,35 (2H, м), 1,6-1,9 (5H, м), 2,7-3,05 (4H, м), 3,63 (3H, с), 3,92 (2H, д), 4,0 (2H, т), 4,21 (1H, м), 4,98 (2H, с), 6,8 (2H, д), 6,84 (2H, д), 7,14 (2H, д), 7,3 (4H, м), 7,75 (1H, д), 8,12 (2H, д); масс-спектр (+ve FAB, NBA/дихлорметан): 518 (М + H)+.
(ii) Метиловый эфир 2-S-амино-3-[4-[2-[1-(4-пиридил)пиперидин- 4-ил] этокси] фенил] пропионовой кислоты получают в виде масла аналогично стадии (ii) примера 19, взяв в качестве исходного продукт, полученный выше на стадии (i); спектр ПМР (ДМСО-d6): δ 1,08-1,32 (2H, м), 1,58-1,86 (5H, м), 2,61-2,9 (4H, м), 3,52 (1H, м), 3,58 (3H, с), 3,82-4,02 (4H, м), 6,79 (2H, два д), 6,81 (2H, д), 7,07 (2H, д), 8,1 (2H, два д); масс-спектр (+ve FAB, MeOH/NBA): 384 (М + H)+.
Пример 22: 2-S-(н-Бутилсульфониламино)-3-[4-[2-[1-(4-пиридил) пиперидин-4-ил]этокси]фенил]пропионовая кислота
Целевое соединение (380 мг) получают аналогично примеру 21, взяв в качестве исходного продукт по примеру 21; спектр ПМР (ДМСО-d6): δ 0,78 (3H, т), 1,05-1,5 (6H, м), 1,6-1,9 (5H, м), 2,5-3,05 (6H, м), 3,8-4,05 (6H, м), 4,6 (1H, уширенный с), 6,85 (4H, м), 7,19 (2H, д), 8,13 (2H, уширенный с); масс- спектр (+ve FAB, MeOH/NBA): 490 (М + H)+; вычислено для C25H35N3O5•2H2О: C, 57,1; H, 7,4; N, 8,0; найдено: C, 57,7; H, 7,5; N, 8,0; H 0, 6,9%.
Пример 23: Метиловый эфир 2-S-(н-бутилсульфониламино)-3- [4-[1-(4-пиридил)пиперидин-4-ил]оксифенил]пропионовой кислоты
Целевое соединение получают аналогично примеру 20, взяв в качестве исходного соответствующий эфир аминокислоты; спектр ПМР (хлороформ-d): δ 0,9 (3H, т), 1,25-1,45 (2H, м), 1,55-1,8 (2H, м), 1,8-2,15 (4H, м), 2,6-2,83 (2H, м), 2,9-3,2 (2H, м), 3,3-3,45 (2H, м), 3,55-3,74 (2H, м), 3,78 (3H, с), 4,27-4,4 (1H, м), 4,45-4,6 (1H, м), 4,8 (1H, уширенный д), 6,7 (2H, д), 6,86 (2H, д), 7,1 (2H, д), 8,26 (2H, уширенный д); масс-спектр (+ve FAB, MeOH/NBA): 476 (М + H)+.
Исходные соединения получают аналогично методике, приведенной в примере 21. Используя 4-(4- гидроксипиперидин-1-ил)пиридин, получают следующие промежуточные соединения:
Метиловый эфир 2-5 - (бензилоксикарбониламино)- 3-[4-[1-(4'-пиридил) пиперидин-4- ил] оксифенил] пропионовой кислоты; спектр ПМР (ДМСО-d6): δ 1,5-1,72 (2H, м), 1,9-2,1 (2H, м), 2,7-3,02 (2H, м), 3,18 (2H, д), 3,2-3,35 (1H, м), 3,48-3,77 (1H, м), 3,62 (3H, с), 4,13-4,28 (1H, м), 4,5-4,65 (1H, м), 4,97 (2H, с), 6,8-6,94 (4H, м), 7,14 (2H, д), 7,77 (1H, д), 8,15 (2H, д); масс-спектр (+ ve FAB, дихлорметан/NBA): 518 (М + H)+.
Метиловый эфир 2-S-амино-3-[4-[1-(4'-пиридил)пиперидин- 4-ил]оксифенил] пропионовой кислоты; спектр ПМР (ДМCО- d6): δ 1,54- 1,72 (2H, м), 1,9-2,06 (2H, м), 2,65-2,88 (2H, м), 3,15- 3,4 (2H, м), 3,52 (1H, т), 3,59 (3H, с), 3,6-3,75 (2H, м), 4,52- -4,65 (1H, м), 6,8-6,92 (4H, м), 7,09 (2H, д), 8,15 (2H, два д); масс-спектр (+ve FAB, MeOH/NBA): 356 (М + H)+.
Пример 24: 2-S-(н-Бутилсульфониламино)-3-[4-[1-(4-пиридил) пиперидин-4-ил]оксифенил]пропионовая кислота
Целевое соединение получают в виде твердого соединения с т.пл. 255-258oC (с разложением) по методике, аналогичной приведенной в примере 20, взяв в качестве исходного продукт по примеру 23; спектр ПМР (ДМСО-d6): δ/ 0,66 (3H, т), 0,98-1,04 (2H, м), 1,05-1,4 (2H, м), 1,44-1,62 (2H, м), 1,8-1,96 (2H, м), 2,49 (2H, т), 2,61 (1H, два д), 2,87 (1H, два д), 3,12-3,28 (2H, м), 3,4-4,0 (5H, м), 4,43-4,55 (1H, м), 6,79 (4H, м), 7,09 (2H, д), 8,04 (2H, уширенный д); масс-спектр (+ve FAB, MeOH/NBA): 462 (М + H)+; вычислено для C23H31N3O5S: C, 59,8; H, 6,8; N, 9,1; найдено: C, 59,6; H, 6,9; N, 9,0%.
Пример 25: Этиловый эфир 4-[4-[4-(4-пиридил)пиперазин- ил]фенокси]масляной кислоты
К перемешиваемой суспензии 4-(4-(4-пиридил)пиперазин-1- ил)фенола (1,34 г) в сухом ДМФА (20 мл) добавляют гидрид натрия (60%-ная суспензия в минеральном масле, 0,21 г) и перемешивают в течение 1 час. К полученному раствору добавляют этиловый эфир 4-броммасляной кислоты и перемешивают полученную смесь в течение 16 час. Растворитель удаляют при пониженном давлении и остаток выливают в смесь этилацетата и воды. Органический слой отделяют, промывают водой, фильтруют через бумагу для разделения фаз (Whatman 1PS) и упаривают. Остаток очищают тонкослойной хроматографией на силикагеле, элюируя смесью (1,5/92,5/6 об/об/об) метанол/этилацетат/водный раствор аммиака (SG 0,89) и перекристаллизовывают из этилацетата, получая целевое соединение (0,7 г) в виде твердого вещества с т.пл. 84-85oC; спектр ПМР (хлороформ-d): δ 8,3 (2H, д), 6,86 (4H, с), 6,72 (2H, д), 4,12 (2H, квартет), 4,0 (2H, т), 3,47 (4H, м), 3,20 (4H, м), 2,5 (214, т), 2,1 (2H, м), 1,26 (3H, т); масс-спектр: m/e 370 (М + H)+; вычислено для C21H27N3O3: C, 68,3; H, 7,4; N, 11,4; найдено: C, 68,1; H, 7,4; N, 11,1%.
Необходимые исходные соединения получают следующим образом.
(i) 4-(Пиперазин-1-ил)анизол (4,24 г) и гидрохлорид 4-хлорпиридина (3,35 г) тщательно смешивают и нагревают при температуре 160-170oC (температура в бане) в течение 7 минут. Полученное после охлаждения твердое вещество растворяют в воде (75 мл) и раствор подщелачивают водным раствором аммиака. Выпавший осадок экстрагируют этилацетатом и органический экстракт промывают водой, отфильтровывают через бумагу для разделения фаз (Whatman 1PS) и упаривают. Остаток перекристаллизовывают из этанола и получают 4-[4-[(4- пиридил)пиперазин-1-ил] анизол] (1,84 г) в виде твердого вещества с т.пл. 165-167oC; δ спектр ПМР (хлороформ-d): δ 8,3 (2H, д), 6,86 (4H, м), 6,71 (2H, д), 3,78 (3H, с), 3,46 (4H, м), 3,2 (4H, м).
(ii) Продукт, полученный на стадии (i) (1,5 г), в концентрированной бромистоводородной кислоте (30 мл) нагревают в атмосфере аргона при температуре 130-135oC в течение 2,5 час. Раствор охлаждают, выливают в воду (150 мл) и подщелачивают водным раствором аммиака. Осадок отфильтровывают, промывают водой и сушат, получая 4-[4-(4-пиридил)пиперазин-1-ил]фенола (1,36 г) в виде твердого вещества с т.пл. 310-312oC; спектр ПМР (ДМСО-d6): δ 8,2 (2H, д), 6,8 (4H, м), 6,66 (2H, д), 3,45 (4H, м), 3,08 (4H, м).
Пример 26: 4-[4-[4-(4-пиридил)пиперазин-1-ил]фенокси] масляная кислота
Раствор продукта по примеру 25 (0,1 г) в водном растворе едкого натра (1N, 0,8 мл) и этаноле (2 мл) оставляют на 2 час. Раствор упаривают и остаток растворяют в воде (5 мл). Добавляют соляную кислоту (1N, 0,8 мл) и полученный осадок отфильтровывают, промывают водой и эфиром, получая целевое соединение в виде твердого вещества с т.пл. 305-306oC; масс- спектр: m/e 342 (М + H)+; спектр ПМР (ДМСО-d6): δ 8,0 (2H, д), 6,72 (6H, с), 3,74 (2H, т), 3,3 (4H, м), 2,94 (4H, м), 2,19 (2H, т), 1,72 (2H, м); вычислено для C19H23N3O3: C, 66,8; H, 6,8; N 12,3; найдено: C, 67,0; H, 6,8; N, 12,2%.
Пример 27: Этиловый эфир 5-[4-[4-(4-пиридил)пиперазин-1- ил]фенокси] пентановой кислоты
Целевое соединение с выходом 41% (из смеси этилацетат/гексан) получают аналогично примеру 25, взяв в качестве исходного соединения этиловый эфир 5-бромпентановой кислоты: т. пл. 79-82oC; спектр ПМР (хлороформ-d): δ 8,2 (2H, д), 6,88 (4H, м), 6,7 (2H, д), 4,13 (2H, квартет), 3,47 (4H, м), 3,17 (4H, м), 2,36 (2H, м), 1,8 (4H, м), 1,33 (3H, т); масс-спектр: m/e 384 (М + H)+; вычислено для C22H29N3O3•0,25H2О: C, 68,1; H, 7,6; N, 10,8; найдено: C, 68,2; H, 7,8; N, 10,5%.
Пример 28: 5-[4-[4-(4-пиридил)пиперазин-1-ил]фенокси] пентановая кислота
Целевое соединение с выходом 50% получают аналогично примеру 26, взяв в качестве исходного соединения продукт по примеру 27: т.пл. 237-241oC; спектр ПМР (ДМСО-d6): δ 8,2 (2H, д), 6,97 (4H, м), 6,83 (2H, д), 3,69 (2H, т), 3,57 (4H, м), 3,13 (4H, м), 2,27 (2H, т), 1,67 (4H, м); масс-спектр: m/e 356 (М + H)+; вычислено для C20H25N3O3•0,75H2O: C, 65,0; H, 7,2; N, 11,3; найдено: C, 65,0; H, 6,9; N, 11,1%.
Пример 29: Этиловый эфир 4-[4-(4-пиридил)пиперазин-1-ил]феноксикротоновой кислоты
Целевое соединение с выходом 3% (из смеси этилацетат/гексан) получают аналогично примеру 25, взяв в качестве исходного соединения этиловый эфир 4-бромкротоновой кислоты: т.пл. 127- 128oC; спектр ПМР (хлороформ-d): δ 8,3 (2H, д), 7,1 (1H, м), 6,9 (4H, м), 6,7 (2H, м), 6,18 (2H, м), 4,66 (2H, м), 4,25 (2H, квартет), 3,49 (4H, м), 3,2 (4H, м), 2,36 (2H, м), 1,3 (3H, т); масс-спектр: m/e 368 (М + H)+; вычислено для C21H25N3О3: C, 68,6; H, 6,9; N, 11,4; найдено: C, 68,4; H, 6,9; N, 10,7%.
Пример 30: Метиловый: эфир 3-[4-[4-(4-пиридил)пиперазин- 1-ил]бензамидопропионовой кислоты
Гидрохлорид метиловый эфир 3-аминопропионовой кислоты (0,195 г) и триэтиламина (0,59 мл) добавляют к суспензии гидрохлорида 4-[(4-пиридил)пиперазин-4-ил]бензоилхлорида (0,473 г) при комнатной температуре. Смесь перемешивают в течение двух дней и растворитель удаляют при пониженном давлении. Остаток очищают колоночной хроматографией. Полученный продукт элюируют смесью метанол/дихлорметан/0,88 SG водный аммиак (1/9/0,1 об/об/об) в виде твердого вещества, которое перекристаллизовывают из этилацетата и получают целевое соединение (0,2 г) с т.пл. 197-199oC; спектр ПМР (ДМСО-d6): δ 8,19 (2H, д), 7,72 (2H, д), 7,13 (2H, д), 6,90 (2H, д), 3,82 (4H,м), 3,56 (3H, с), 3,48 (6H, м), 2,50 (2H, т); масс-спектр: m/e 369 (М + H)+; вычислено для C20H24N4O3•0,25H2O; C, 64,4; H, 6,6; N, 15,0; найдено: C, 64,3; H, 6,6; N, 14,9%.
Необходимые исходные соединения получают следующим образом.
(i) Тщательно смешивают 1-(4-пиридил)пиперазин (1,36 г) и 4-бромбензойную кислоту (1,05 г), нагревают в течение 6 час при температуре 220oC. Образовавшееся стекло охлаждают и растирают с метанолом (50 мл), получая 4-[(4-пиридил)пиперазин-4-ил] бензойную кислоту в виде твердого вещества беловатого цвета с т.пл. > 350oC; ИК спектр (см-1): 1682, 1600, 1514, 1236, 1013.
(ii) К перемешиваемой суспензии 4-[(4- пиридил)пиперазин-4-ил]бензойной кислоты в дихлорметане (15 мл) добавляют хлористый оксалил (0,5 мл) и одну каплю ДМФА. Смесь перемешивают 2 час и упаривают досуха, получая 4-(4- пиридил)пиперазин-4--ил]бензоилхлорид, который тут же используют.
Пример 31: 3-[4-[4-(4-пиридин)пиперазин-1-ил] ] бензамидопропионовая кислота
К раствору продукта по примеру 30 (0,062 г) в метаноле (1 мл) добавляют раствор гидроксида натрия (1N, 0,17 мл) и раствор оставляют на 4 дня при комнатной температуре. Добавляют соляную кислоту (1N, 0,17 мл) и получают целевое соединение (0,052 г) в виде твердого вещества с т.пл. > 330oC; спектр ПМР (ДМСО- d6): δ 6,96 (2H, д), 3,76 (4H, м), 3,46 6H, сложный спектр), 2,5 (2H, м); масс-спектр: m/e 355 (М+H)+; вычислено для C19H22N4O3•0,7H2O: C, 62,2; H, 6,4; N, 15,3; найдено: C, 62,3; H, 6,4; N, 15,3%.
Пример 32: Метиловый эфир 3-[4-[4-(4-пиридил)пиперазин- 1-ил]бензамидо] -3-фенилпропионовой кислоты
Целевое соединение с выходом 26% получают в виде твердого вещества (после растирания с горячим этилацетатом) аналогично примеру 30, взяв в качестве исходного соединения метиловый эфир 3-амино-3-фенилпропионовой кислоты: спектр ПМР (ДМСО-d6): δ 8,6 (1H, д), 8,2 (1H, уширенный с), 7,75 (2H, д),
7,3 (5H, M), 7,0 (2H, д), 6,85 (2H, уширенный с), 5,45 (1H, м), 3,55 (3H, с), 3,45 (8H, м), 2,92 (2H, м); масс-спектр: m/e 445 (М+H)+; вычислено для C26H28N4O3•0,5H2O: C, 68,9; H, 6,4; N, 12,4; найдено: C, 68,7; H, 6,3; N, 12,3%.
Пример 33: 3-[4-[4-(4-пиридил)пиперазин-1-ил]бензамидо]- 3-фенилпропионовая кислота
Целевое соединение с выходом 73% получают в виде твердого вещества аналогично методике, приведенной в примере 26, взяв в качестве исходного соединения продукт по примеру 32; спектр ПМР (ДМСО-d6): δ 8,61 (1H, д), 8,2 (1H, уширенный с), 7,78 (2H, д), 7,3 (5H, м), 7,0 (2H, д), 6,9 (2H, д), 5,43 (1H, м), 3,45 (8H, м), 2,82 (1H, м); масс-спектр: m/e 431 (М + H)+; вычислено для C25H26N4O3•0,5H2O: C, 68,3; H, 5,9; N, 12,8; найдено: C, 68,3; H, 6,0; N, 12,9%.
Пример 34: Метиловый эфир 3-[4-[4-(4-пиридил)пиперазин-1- ил]бензамидо] масляной кислоты
Целевое соединение с выходом 11% получают в виде твердого вещества (после перекристаллизации из смеси этилацетат/гексан) с т.пл. 130-132oC аналогично примеру 30, взяв в качестве исходного соединения метиловый эфир 3-аминомасляной кислоты; спектр ПМР (ДМСО-d6): δ 8,28 (2H, д), 8,07 (1H, д), 7,77 (2H, д), 7,13 (2H, д), 7,0 (2H, д), 4,36 (1H, м), 3,74 (4H, м), 3,6 (3H, с), 3,48 (4H, м), 2,55 (2H, т); масс-спектр: m/e 383 (М + H)+; вычислено для C21H26N4O3•0,25H2О: C, 65,2; H, 6,9; N, 14,5; найдено: C, 65,3; H, 6,8; N, 14,4%.
Пример 35: Метиловый эфир 4-[2-[4-(4-пиридил)пиперазин-2- он-1-ил]ацетил]феноксиуксусной кислоты
Дисперсию гидрида калия в минеральном масле (35% вес., 0,63 г) добавляют к перемешиваемой суспензии 4-(4-пиридил)пиперазин- 2-она (0,885 г) в ДМФА (10 мл) и перемешивают полученную смесь при комнатной температуре в течение 2 час.
К полученному аниону добавляют метиловый эфир 4-бромацетилфеноксиуксусной кислоты (1,44 г) и смесь перемешивают при комнатной температуре в течение 20 час. Растворитель упаривают и остаток выливают в смесь дихлорметана (20 мл) и воды (20 мл). Органический слой отделяют, сушат (над сульфатом магния) и упаривают. Остаток очищают методом испарительной колоночной хроматографии, элюируя продукт смесью метанол/дихлорметан/0,88 SG водный раствор аммиака (1/9/0,1). Перекристаллизовывают из этилацетата и получают целевое соединение с т.пл. 164-165oC; спектр ПМР (ДМСО-d6): δ 8,2 (2H, д), 7,97 (2H, д), 7,08 (2H, д), 6,83 (2H, д), 4,93 (4H, д), 4,02 (2H, с), 3,71 (3H, с), 3,7 (2H, м), 3,52 (2H, м); масс-спектр: m/e 384 (М + H)+; вычислено для C20H21N3O5: C, 62,7; H, 5,52; N, 11,0; найдено: C, 62,6; H, 5,6; N, 10,9%.
Необходимые исходные соединения получают следующим образом.
Тщательно приготовленную смесь пиперазинона (4,2 г) и гидрохлорида 4-хлорпиридина (7,33 г) перемешивают и нагревают до температуры 200oC в течение 10 минут, а затем дают остыть. Продукт очищают методом испарительной колоночной хроматографии, элюируя смесью метанол/дихлорметан/0,88 SG водный раствор аммиака (1/9/0,1). Полученное твердое вещество перекристаллизовывают из этанола и получают 4-(4-пиридил)пиперазин- 2-он (1,75 г) с т.пл. 268-270oC; спектр ПМР (ДМСО-d6): δ 8,2 (3H, м), 6,8 (12H, м), 3,885 (2H, с), 3,52 (2H, м), 3,31 (2H, м); масс-спектр; m/e 178 (М + H)+.
Пример 36: 4-[2-[4-(4-пиридил)пиперазин-2-он-1-ил] ацетил] феноксиуксусная кислота
Целевое соединение с выходом 20% получают в виде твердого вещества аналогично методике, приведенной в примере 26, взяв в качестве исходного соединения продукт по примеру 35; спектр ПМР (ДМСО-d6): δ 8,22 (2H, д), 7,97 (2H, д), 7,04 (2H, д), 6,89 (2H, д), 4,93 (2H, с), 4,77 (2H, с), 4,07 (2H, с), 3,72 (2H, м), 3,49 (2H, м); масс-спектр: m/e 370 (М + H)+; вычислено для C19H19N3O5•2,5H2O: C, 55,1; H, 5,8; N, 10,1; найдено: C, 55,1; Н 5,3; N, 10,6%.
Пример 37: Метиловый эфир 4-[[4-(4-пиридил)пиперазин-1- ил]карбоксамидо] феноксиуксусной кислоты
К раствору 1-(4-пиридил)пиперазина (0,4 г) в дихлорметане (10 мл) добавляют раствор метилового эфира 4-изоцианатофеноксиуксусной кислоты (0,5 г) в дихлорметане (5 мл). Полученный раствор перемешивают в течение 3 час при комнатной температуре. Растворитель упаривают и остаток растирают с этанолом, получая целевое соединение в виде твердого вещества (0,155 г); спектр ПМР (ДМСО-d6): δ 8,55 (1H, с), 8,22 (2H, д), 7,28 (2H, д), 7,02 (2H, д), 6,82(2H, д), 4,72 (2H, с), 3,7 (3H, с), 3,58 (8H, м); масс-спектр: m/e 371 (М + Н)+; вычислено для C19H22N4О4•H2О: C, 58,8; H, 6,2; N, 14,4; найдено: C, 58,7; H, 5,8, N, 14,8%.
Необходимое исходное соединение получают следующим образом.
Метиловый эфир 4-аминофеноксиуксусной кислоты (2,2 г) в этилацетате (высушенном над хлоридом кальция) (50 мл) добавляют по каплям к перемешиваемому раствору фосгена в толуоле (115 мл, примерно 2М) при температуре 75oC. По окончании добавления смесь перемешивают при температуре 75oC в течение 1,5 час и 16 час при температуре 95-105oC. Растворитель упаривают, получая масло (2,5 г); в ИК спектре наблюдается сильная полоса 2273 см-1.
Пример 38: 4-[[4-(4-пиридил)пиперазин-1-ил]карбоксамидо] феноксиуксусная кислота
Целевое соединение с выходом 86% получают в виде твердого вещества аналогично методике, приведенной в примере 26, взяв в качестве исходного соединения продукт по примеру 37; спектр ПМР (ДМСО-d6): δ 8,45 (1H, с), 8,2 (2H, д), 7,35 (2H, д), 6,35 (4H, м), 4,55 (2H, с), 3,49 (8H, м); масс-спектр: m/e 357 (М+H)+; вычислено для C18H20N4O4•0,75H2O: C, 58,5; H, 5,8; N, 15,2; найдено: C, 58,5; H, 5,9; N, 15,1%.
Пример 39: Метиловый эфир 2-RS-(н-бутилсульфониламино)-3- [4-[2-[4-(4-пиридил)пиперазин-1-ил]ацетил]фенил]пропионовой кислоты
К раствору 1-(4-пиридил)пиперазина (296 мг) и триэтиламина (0,25 мл) в ацетонитриле (10 мл) добавляют по каплям в течение 30 минут раствор метилового эфира 2-RS-(н-бутилсульфониламино)- 3-(4-бромацетилфенил)пропионовой кислоты (382 мг) в ацетонитриле (8 мл). Смесь перемешивают в течение еще 4 час, растворитель упаривают и получают масло, которое очищают методом испарительной колоночной хроматографии на силикагеле, элюируя смесью метанол/дихлорметан (от 5: 95 до 10:90 об/об), и получают целевое соединение в виде твердого вещества (202 мг); спектр ПМР (ДМСО-d6): δ 0,7 (3H, т), 1,05-1,4 (4H, м), 2,55-2,7 (4H, м), 2,8-3,2 (4H, м), 3,25-3,4 (4H, м), 3,65 (3H, с), 3,9 (2H, с), 4,1-4,25 (1H, м), 6,85 (2H, д), 7,45 (2H, д), 7,95 (1H, д), 7,95 (2H, д) 8,15 (2H, д); масс-спектр: m/e 503 (М+H)+; вычислено для C25H34N4O5•0,5H2O: C, 58,7; H, 6,85; N, 10,9; найдено: C, 58,8; H, 6,9; N, 10,6%.
Необходимые исходные соединения получают следующим образом.
(i) Метиловый эфир 2-амино-3-(4-ацетилфенил)пропионовой кислоты получают по методике, приведенной в М. Р. Doyle, JOC (1977), Vol. 42, 2431 и G.H. Cleland, JOC (1969), Vol. 34, 744.
(ii) н-Бутилсульфохлорид (0,6 мл) добавляют по каплям в течение 15 минут к раствору продукта, полученного на стадии (i) (926 мг), и триэтиламина (0,7 мл) в дихлорметане (20 мл). Полученную смесь перемешивают еще в течение 3 час, выливают в воду (10 мл) и экстрагируют дихлорметаном (3 х 20 мл). Органические вытяжки объединяют и сушат (над сульфатом магния), а затем упаривают, получая смолу. Очищают испарительной колоночной хроматографией на силикагеле, элюируя смесью этилацетат/гексан (40:60 об/об), и получают метиловый эфир 2-RS-(н-бутилсульфониламино)- 3-(4-ацетилфенил)пропионовой кислоты (794 мг) в виде смолы; спектр ПМР (ДМСО-d6): δ 0,75 (3H, т), 1,0-1,4 (4H, м), 2,55 (3H, с), 2,65 (3H, с), 2,8-2,95 (2H, м), 3,05-3,2 (2H, м), 3,65 (3H, с), 4,1-4,25 (1H, м), 7,45 (2H, д), 7,85 (1H, д), 7,9 (2H, д); масс-спектр: m/e 342 (М+H)+.
(iii) К суспензии бромида меди (II) (822 мг) в этилацетате (8 мл) при кипячении с обратным холодильником в течение 10 минут по каплям добавляют раствор продукта, полученного на стадии (ii), в хлороформе (8 мл). Полученную смесь кипятят с обратным холодильником в течение 3 час, охлаждают, отфильтровывают и растворитель упаривают, получая масло. Очищают испарительной колоночной хроматографией на силикагеле, элюируя смесью этилацетат/гексан (градиентно от 10:90 до 50:50 об/об, изменяя смесь порциями на 10%), и получают метиловый эфир 2-RS- (н-бутилсульфониламино)-3-(4-бромацетилфенил)пропионовой кислоты (387 мг) в виде масла; спектр ПМР (хлороформ- d): δ 0,9 (3H, т), 1,25-1,4 (2H, м), 1,6-1,75 (2H, м), 2,75-2,85 (2H, м), 3,05-3,3 (2H, м), 3,8 (3H, с), 4,35-4,45 (1H, м), 4,4 (2H, с), 4,8 (1H, д), 7,35 (2H, д), 7,95 (2H, д); масс-спектр: m/e 420/422 (М+H)+, соответствует 1 Br.
Пример 40: 2-RS -(н-Бутилсульфониламино)-3-[4-[2-[4-(4- пиридил)пиперазин-1-ил]ацетил]фенил]пропионовая кислота
К раствору продукта по примеру 39 (105 мг) в метаноле (4 мл) добавляют 2N раствор гидроксида натрия (0,25 мл) и полученный раствор перемешивают в течение 3 час. Смесь упаривают, растворяют в воде (2 мл) и подкисляют уксусной кислотой. Полученный раствор переносят в колонку жидкостной хроматографии высокого давления с обращенной фазой (Dynamax C18 83- 201-C 60A) и элюируют 0,1%-ным раствором ТФК в смеси вода/ацетонитрил. Из очищенных фракций после сублимационной сушки получают целевое соединение (89 мг) в виде твердого вещества: спектр ПМР (ДМСО-d6): δ 0,8 (3H, т), 1,15-1,6 (4H, м), 2,75 (2H, т), 2,9-3,05 (1H, м), 3,2-3,3 (1H,м), 3,4-3,5 (4H, м), 3,95- 4,2 (5H, м), 4,95 (2H, с), 7,25 (2H, д), 7,55 (2H, д), 8,0 (2H, д), 8,35 (2H, д); масс-спектр: m/e 489 (М + H)+; вычислено для C24H32N4O5•3CF3COOOH: C, 43,4; H, 4,2; N, 6,7; ТФК, 41,2; найдено: C, 43,7; H, 4,3; N, 6,8%, ТФК, 42,7.
Пример 41: 2-RS -(н-бутилсульфониламино)-3-[4-(4-пиридил) пиперазин-1-ил]метилен]фенилпропионовая кислота
К раствору этилового эфира 2-RS-(н-бутилсульфониламино)- 3-[4-(4-пиридил)пиперазин-1-ил] метилен] фенилпропионовой кислоты в метаноле (3 мл) добавляют 2N раствор гидроксида натрия (0,3 мл). Полученную смесь перемешивают в течение 3 час и упаривают. Остаток растворяют в воде (2 мл) и подкисляют уксусной кислотой. Полученный раствор переносят в колонку жидкостной хроматографии высокого давления с обращенной фазой (Dynamaxt C18 83-201-C 60A) и элюируют 0,1%-ным раствором ТФК в смеси вода/ацетонитрил. Из очищенных фракций после сублимационной сушки получают целевое соединение (165 мг) в виде твердого вещества: спектр ПМР (ДМСО-d6): δ 0,8 (3H, т), 1,1-1,6 (4H, м), 2,65-2,95 (4H, м), 3,2-3,3 (4H, м), 3,85-4,0 (4H, м), 4,05-4,15 (1H, м), 4,3 (2H, с), 7,2 (2H, д), 7,4 (5H, с), 8,3 (2H, д); масс-спектр: m/e 461 (М+H)+; вычислено для C23H32N4О4S•H2О•2CF3COOH: C, 45,9; H, 5,1; N, 7,9; найдено: C, 45,5; H, 4,8; N, 7,5%.
Исходные соединения получают следующим образом.
(i) К раствору α,α′-дибром-п-ксилола (6,59 г), этилового эфира N-(дифенилметилен) глицина (4,76 г) и йодида кадия в диоксане (120 мл), охлажденному до 10oC, добавляют в течение 1 час 40%-ный водный раствор гидроксида бензилтриметиламмония (7,45 мл). Дают смеси нагреться до комнатной температуры и перемешивают еще в течение 2,5 час. Выливают в смесь воды (50 мл) и этилацетата (100 мл). Органическую фазу отделяют, сушат (над сульфатом магния) и упаривают, получая масло. После очистки методом испарительно колоночной хроматографии на силикагеле, элюируя смесью эфир/гексан (10:90 об/об), получают этиловый эфир RS-N- (дифенилметилен)-4-(бромметил)фенилаланина (3,58 г) в виде масла; спектр ПМР (ДМСО-d6): δ 1,5 (3H, т), 3,0-3,2 (2H, м), 4,05-4,15 (3H, м), 4,65 (2H, с), 6,55-6,65 (2H, м), 7,0 (2H, д), 7,25 (2H, д), 7,3-7,5 (8H, м); масс-спектр; m/e 450/452 (М+H)+; соответствует 1 Br.
(ii) К теплому раствору 1-(4-пиридил)пиперазина (296 мг) и триэтиламина (0,14 мл) в ацетонитриле (15 мл) медленно добавляют в течение 40 минут раствор продукта, полученного на стадии (L) (409 мг), в ацетонитриле (5 мл). Полученную смесь перемешивают при комнатной температуре в течение 18 час, упаривают и очищают методом испарительной колоночной хроматографии на силикагеле, элюируя смесью метанол/дихлорметан (от 3:97 до 10:90 об/об), и получают этиловый эфир RS-N-(дифенилметилен)- 4-[4-(4-пиридил)пиперазин-1-ил]метилен] фенилаланина (305 мг) в виде твердого вещества; спектр ПМР (ДМСО-d6): δ 1,15 (3H, т), 2,4-2,5 (4H, м), 3,0-3,2 (2H, м), 3,25-3,35 (4H, м), 3,45 (2H, с), 4,05-4,15 (3H, м), 6,65 (2H, д), 7,0 (2H, д), 7,1 (2H, д), 7,35-7,5 (8H, м), 8,1 (2H, д); масс-спектр: m/e 533 (М + H)+.
(iii) К суспензии продукта, полученного на стадии (ii), в эфире (5 мл) добавляют 1N раствор соляной кислоты (2,2 мл) и полученную смесь перемешивают в течение 1 час. Выливают в смесь эфира (20 мл) и 1N соляной кислоты (10 мл). Кислый слой отделяют, подшелачивают водным раствором бикарбоната натрия и экстрагируют дихлорметаном (3 х 20 мл). Органические вытяжки объединяют, сушат (над сульфатом магния) и упаривают, получая этиловый эфир RS-4-[4-(4-пиридил)пиперазин-1- илметилен]фенилаланина в виде масла; спектр ПМР (ДМСО-d6) δ 1,1 (3H, т), 2,4-2,5 (4H, м), 2,7-2,9 (2H, м), 3,2-3,35 (4H, м), 3,5 (2H, с), 3,5-3,6 (1H, м), 4,0 (2H, квартет), 6,8 (2H, м), 7,2 (4H, два д), 8,1 (2H, широкий м); масс-спектр: m/e 369 (М + H)+.
(iv) К раствору продукта, полученного на стадии (iii) (137 мг), и триэтиламина (0,11 мл) в тетрагидрофуране (5 мл) добавляют 0,75 мл заранее подготовленного раствора н-бутилсульфохлорида (0,2 мл в 3 мл тетрагидрофурана) и полученную смесь перемешивают в течение 3 час. Растворитель упаривают и получают масло. Очищают методом испарительной колоночной хроматографии на силикагеле, элюируя смесью метанол/дихлорметан (от 5:95 до 10:90 об/об), получая этиловый эфир 2-(RS)-(н-бутилсульфониламино)- 3-[4-(4-пиридил)пиперазин-1-ил] метилен] фенилпропионовой кислоты в виде твердого вещества, которое используют без дальнейшей очистки.
Пример 42: 4-[[4-(4-пиридил)пиперазин-1-ил]метилен] коричная кислота
Трет-бутиловый эфир 4-[[4-(4-пиридил)пиперазин-1-ил] метилен] коричной кислоты (200 мг) перемешивают в трифторуксусной кислоте (5 мл) в течение 2 час. Растворитель упаривают и полученное масло растирают с безводным эфиром, получая целевое соединение (210 мг) в виде твердого вещества белого цвета; спектр ПМР (ДМСО-d6): δ 3,05-3,25 (4H, м), 3,7-4,1 (4H, широкий м), 4,25 (2H, с), 6,6 (1H, д), 7,25 (2H, д), 7,5 (2H, д), 7,6 (1H, д), 7,75 (2H, д), 8,35 (2H, д); масс-спектр: m/e 324 (М + H)+; вычислено для C19H21N3О2•2CF3COOH•H2О: C, 49,5; H, 4,25; N, 7,4; найдено: C, 49,1; H, 4,2; N, 7,1%.
Необходимые исходные соединения получают следующим образом.
(i) Трет-бутиловый эфир 4-[[4-(4-пиридил)пиперазин-1-ил) метилен]коричной кислоты получают по методике, приведенной в примере 39, взяв в качестве исходного трет-бутиловый эфир 4- бромметилкоричной кислоты: спектр ПМР (ДМСО-d6): δ 1,45 (9H, с), 3,55 (2H, с), 6,5 (1H, д), 6,8 (2H, д), 7,35 (2H, д), 7,55 (1H, д), 7,65 (1H, д), 8,15 (2H, д).
Пример 43: Диметиловый эфир 4-[2-[4-(4-пиридил)пиперазин- 1-ил)-2-метил] ацетил]-1,2-дифеноксидиуксусной кислоты
Целевое соединение получают аналогично методике, приведенной в примере 39, взяв в качестве исходного соединения диметиловый эфир 4-[(2'-бромпропионил)фенилен-1,2-диокси] диуксусной кислоты; спектр ПМР (ДМСО-d6): δ 1,15 (3H, д), 2,55-2,7 (4H, м), 3,2-3,35 (4H, м), 3,68 (3H, с), 3,70 (3H, с), 4,25 (1H, квартет), 4,9 (2H, с), 4,95 (2H, с), 6,75 (2H, д), 7,0 (1H, д), 7,65 (1H, д), 7,75 (1H, два д), 8,15 (2H, д); масс-спектр: m/e 472 (М + H)+.
Исходные соединения получают следующим образом.
(i) К раствору 3,4-дигидроксипропиофенона (1,24 г) в ДМФА (15 мл) добавляют безводный карбонат калия (3,09 г), а затем метиловый эфир бромуксусной кислоты (1,4 мл). Полученную смесь перемешивают в течение 24 час. Добавляют воду (50 мл) и смесь экстрагируют этилацетатом (3 х 100 мл). Органические вытяжки объединяют, сушат (над сульфатом магния) и упаривают, получая смолу. Очисткой методом испарительной колоночной хроматографии на силикагеле, элюируя смесью этилацетат/гексан (1:1 об/об), получают диметиловый эфир 4-пропионилфенилен-1,2- диоксидиуксусной кислоты (1,79 г) в виде масла; спектр ПМР (ДМСО-d6): δ 1,05 (3H, т), 3,0 (2H, квартет), 3,7 (6H, с), 4,9 (2H, с), 4,95 (2H, с), 7,05 (1H, два д), 7,45 (1H, д), 7,6 (1H, два д); масс-спектр: m/e 311 (М + H)+.
(ii) К раствору продукта, полученного на стадии (i) (1,79 г), в хлороформе (15 мл) добавляют по каплям раствор брома (0,3 мл) в хлороформе (5 мл) и полученную смесь перемешивают в течение 3 час. Растворитель упаривают, получая смолу, которую очищают методом испарительной колоночной хроматографии на силикагеле, элюируя смесью этилацетат/гексан (2:3 об/об), и получают диметиловый эфир 4-[(2'- бромпропионил)фенилен-1,2-диокси]диуксусной кислоты (1,95 г); спектр ПМР (ДМСО-d6): δ 1,75 (3H, д), 3,7 (6H, с), 4,9 (2H, с), 4,95 (2H, с), 5,8 (1H, квартет), 7,05 (1H, д), 7,5 (1H, д), 7,7 (1H, два д); масс- спектр: m/e 389/391 (М + H)+; соответствует 1 Br.
Пример 44: 4-[2-[4-(4-пиридил)пиперазин-1-ил)-2-метил] ацетил]-1,2-дифеноксидиуксусная кислота
Целевое соединение получают аналогично методике, приведенной в примере 40, взяв в качестве исходного соединения продукт по примеру 43; спектр ПМР (ДМСО-d6): δ 1,4 (3H, д), 3,0-3,2 (4H, м), 3,75-3,9 (4H, м), 3,75 (1H, м), 4,8 (2H, с), 4,85 (2H, с), 7,05 (1H, д), 7,25 (2H, д), 7,55 (1H, д), 7,75 (1H, два д), 8,3 (2H, д); масс-спектр: m/e 444 (М + H)+ вычислено для C22H25N3O7•2,25CF3COOH•H2О: C, 44,3; H, 4,1; N, 5,85; ТФК, 35,7; найдено: C, 44,2; H, 3,9; N, 5,7%; ТФК, 36,2.
Пример 45: Метиловый эфир 2-S-(н-бутилсульфониламино)- 3-[4-[3-[1-(4-пиридил)пиперидин-4-ил]пропокси]фенил]пропионовой кислоты
Целевое соединение получают аналогично методике, приведенной в примере 21, взяв в качестве исходного соединения эфир соответствующей аминокислоты; спектр ПМР (хлороформ- d): δ 0,75 (3H, т), 1,0-1,44 (8H, м), 1,44-1,64 (1H, м), 1,75 (4H, широкий д), 2,5-3,02 (6H, м), 3,64 (3H, с), 3,85-4,1 (5H, м), 6,81 (2H, д), 6,84 (2H, д), 7,19 (2H, д), 7,78 (1H, д), 8,12 (2H, д); масс-спектр (+ve FAB, MeОH/NBA): 518 (М + H)+.
Исходные соединения получают по методикам, приведенным в примере 19. Указанным способом получают следующие промежуточные соединения (i) и (ii), которые, в свою очередь, получают из 4-(4- гидроксипропилпиперидин-1-ил)пиридина (iii).
(i) Метиловый эфир 2-S-(бензилоксикарбониламино)-3-[4- [3-[1-(4-пиридил)пиперидин-4-ил] пропокси]фенил]пропионовой кислоты; спектр ПМР (ДМСО-d6): δ 1,18-1,24 (2H, м), 1,3- 1,43 (2H, м), 1,44-1,65 (1H, м), 1,65-1,83 (4H, м), 2,7-2,88 (3H, м), 2,96 (1H, два д), 3,61 (3H, с), 3,92 (4H, т), 4,14- 4,25 (1H, м), 4,98 (2H, с), 6,8 (2H, д), 6,82 (2H, д), 7,14 (2H, д), 7,2-7,4 (5H, м), 7,74 (1H, д), 8,12 (2H, д); масс- спектр (+ve FAB, NBA /дихлорметан): 532 (М+H)+.
(ii) Метиловый эфир 2-S-амино-3-[4-[2-[1-(4-пиридил)пиперидин- 4-ил] пропокси] фенил] пропионовой кислоты; спектр ПМР (ДМСО-d6): δ 1,28-1,40 (2H, м), 1,42-1,62 (1H,м), 1,64- -1,80 (4H, м), 2,65-2,9 (4H, м), 3,58 (3H, с), 3,45-4,6 (1H, м), 3,85-3,98 (4H, м), 6,78 (2H, д), 6,8 (2H, д), 7,06 (2H, д), 8,11 (2H, д); масс-спектр (+ ve FAB, MeOH/NBA): 398 (М + H)+.
(iii) 4-(4-Гидроксипропилпиперидин-1-ил)пиридин
Раствор N-(2-карбомоилэтил)-4-цианопиридинийхлорида (2,1 г) в воде (5 мл) добавляют по каплям к перемешиваемой смеси 4- гидроксипропилпиперидина (2,4 г), воды (10 мл) и 2,5М раствора гидроксида натрия (4,6 мл), охлаждаемой в бане со льдом. Смесь перемешивают при температуре 0-5oC в течение 1 час. Добавляют 2,5М раствор гидроксида натрия (7 мл) и нагревают смесь до кипения с обратным холодильником в течение 3 час. Охлаждают смесь в бане со льдом, при этом выделяется смолообразное твердое вещество. Водный слой декантируют, смолообразное твердое вещество растворяют в дихлорметане (75 мл), промывают полученный раствор насыщенным раствором хлорида натрия и сушат (над сульфатом магния). Растворитель упаривают и получают смолообразное вещество (880 мг), которое при растирании с эфиром дает твердое вещество; спектр ПМР (ДМСО-d6): δ 1,0- 1,35 (4H, м), 1,35-1,6 (3H, м), 1,7 (2H, два д), 2,70-2,88 (2H, два т), 3,38 (2H, т), 3,89 (2H, уширенный д), 4,35 (1H, уширенный с), 6,78 (2H, д), 8,1 (2H, д); масс-спектр (Cl+): 221 (М+H)+.
Пример 46: 2-S-(н-бутилсульфониламино)-3-[4-[3-[1-(4- пиридил)пиперидин-4-ил]пропокси]фенил]пропионовая кислота
Целевое соединение получают в виде аморфного твердого вещества аналогично методике, приведенной в примере 20, взяв в качестве исходного соединения продукт по примеру 45; спектр ПМР (ДМСО-d6/CD3COOD): δ 0,73 (3H, т), 1,0-1,5 (8H, м), 1,55-1,85 (1H, м), 2,54-2,78 (3H, м), 2,9-3,2 (3H, м), 3,8-3,98 (3H, м), 4,15 (2H, уширенный д), 6,8 (2H, д), 7,09. (2H, д), 7,15 (2H, д), 8,1 (2H, д); масс-спектр (+ve FAB, MeOH/NBA): 504 (М + H)+; вычислено для C26H37N3O5•H2O: C, 59,9; H, 7,5; N, 8,1; найдено: C, 60,3; H, 7,2; N, 7,9.
Пример 47: Метиловый эфир 2-S-(н-бутилсульфониламино)-3- [4-[4-[1-(4-пиридил)пиперидин-4-ил]бутокси] фенил]пропионовой кислоты
Целевое соединение получают аналогично методике, приведенной в примере 21, взяв в качестве исходного соединения эфир соответствующей аминокислоты; спектр ПМР (хлороформ-d): δ 0,87 (3H, т), 1,14-1,4 (6H, м), 1,42-1,7 (5H, м), 1,7-1,9 (4H, м), 2,7-3,18 (6H, м), 3,78 (3H, с), 3,9 (2H, уширенный д), 3,93 (2H, т), 4,32 (1H, уширенный с), 4,82 (1H, уширенный с), 6,66 (2H, д), 6,83 (2H, д), 7,09 (2H, д), 8,22 (2H, д); масс-спектр (+ve FAB, MeOH/NBA): 532 (М + H)+.
Исходные соединения получают по методикам, приведенным в примере 19 и 45 (iii). Указанным способом получают следующие промежуточные соединения:
(i) 4-(4-гидроксибутилпиперидин-1-ил)пиридин; спектр ПМР (ДМСО- d6): δ 0,97-1,58 (9H, м), 1,7 (2H, два т), 2,78 (2H, два т), 3,38 (2H, м), 4,29 (1H, т), 6,78 (2H, д), 8,10 (2H, д); масс- спектр (Cl+): 235 (М + H)+.
Метиловый эфир 2-S-(бензилоксикарбониламино)-3-[4-[4-[1- (4-пиридил)пиперидин-4-ил] бутокси]фенил]пропионовой кислоты; спектр ПМР (ДМСО-d6): δ 1,0-1,35 (4H, м), 1,35-1,60 (3H, м), 1,62-1,80 (4H, м), 2,8 (3H, два т), 2,96 (1H, два д), 3,62 (3H, с), 3,85-3,97 (4H, м), 4,15-4,28 (1H, м), 4,99 (2H, с), 6,78 (2H, д), 6,81 (2H, д), 7,13 (2H, д), 7,2-7,4 (5H, м), 7,74 (1H, д), 8,11 (2H, д); масс-спектр (Cl+): 546 (М+H)+.
(iii) Метиловый эфир 2-S-амино-3-[4-[4-[1-(4-пиридил)пиперидил-4-ил]пропокси]фенил] пропионовой кислоты; спектр ПМР (ДМСО-d6): δ 1,05-1,35 (4H, м), 1,35-1,58 (3H, м), 1,6-1,8 (4H, м), 2,65-2,9 (4H, м), 3,51 (1H, т), 3,58 (3H, с), 3,8-3,98 (4H, м), 6,78 (2H, д), 6,81 (2H, д), 7,05 (2H, д), 8,1 (2H, д); масс-спектр (Cl+): 412 (М+H)+.
(iv) Метиловый эфир 2-S-амино-3-[4-[2-[1-(4-пиридил)пиперидин-4- ил]пропокси] фенил]пропионовой кислоты; спектр ПМР (ДМСО-d6): δ 1,28-1,40 (2H, м), 1,42-1,62 (1H, м), 1,64- 1,80 (4H, м), 2,65-2,9 (4H, м), 3,58 (3H, с), 3,45-4,6 (1H, м), 3,85-3,98 (4H, м), 6,78 (2H, д), 6,8 (2H, д), 7,06 (2H, д), 8,11 (2H, д); масс-спектр (+ve FAB, MeOH/NBA): 398 (М + H)+.
Пример 48: 2-S-(н-Бутилсульфониламино)-3-[4-[4-[1-(4- пиридил)пиперидин-4-ил]бутокси]фенил]пропионовая кислота
Целевое соединение получают в виде аморфного твердого вещества аналогично методике, приведенной в примере 20, взяв в качестве исходного соединения продукт по примеру 47; спектр ПМР. (ДМСО-d6): δ 0,78 (3H, т), 1,0-1,6 (11H, м), 1,61-1,82 (4H, уширенный т), 2,5-3,04 (6H, м), 3,8-4,0 (5H, м), 6,8 (4H, м), 7,19 (2H, д), 8,1 (2H, уширенный д); масс-спектр (+ve FAB, MeOH/NBA): 518 (М+ H)+; вычислено для C27H39N3O5S: C, 62,6; H, 7,6; N, 8,1; найдено: C, 62,4; H, 7,8; N, 7,9%.
Примеры 49-51
По методике, аналогичной приведенной в примере 21, взяв в качестве исходных соединений соответствующий замещенный сульфохлорид и метиловый эфир 2-S-амино-3-[4-[2-[1-(4-пиридил)пиперидин- 4-ил]этокси]фенил]пропионовой кислоты, получают следующие соединения:
Пример 49: Метиловый эфир 2-S-(метилсульфониламино)-3- [4-[2-[1-(4-пиридил)пиперидин-4-ил]этокси]фенил]пропионовой кислоты: спектр ПМР (ДМСО-d6): δ 1,08-1,34 (2H, м), 1,6-1,85 (5H, м), 2,6 (3H, с), 2,7-3,0 (4H, м), 3,63 (3H, с), 3,84- 4,2 (5H, м), 6,80 (2H, д), 6,85 (2H, д), 7,18 (2H, д), 8,12 (2H, д); масс-спектр (+ve FAB, MeOH/NBA): 462 (М+ H)+.
Пример 50: Метиловый эфир 2-S-(бензилсульфониламино)-3- [4-[2-[1-(4-пиридил)пиперидин-4-ил] этокси] фенил] пропионовой кислоты: спектр ПМР (ДМCО-d6): δ 1,05-1,28 (2H, м), 1,57-1,82 (5H, м), 2,68-2,95 (4H, м), 3,58 (3H, с), 3,8-4,15 (7H, м), 6,79 (2H, д), 6,88 (2H, д), 7,12 (2H, д), 7,17 (2H, м), 7,3 (3H, м), 7,79 (1H, уширенный д), 8,1 (2H, д); масс-спектр (+ve FAB, MeOH/NBA): 538 (М + H)+.
Пример 51: Метиловый эфир 2-S-(4-метилфенилсульфониламино)- 3-[4-[2-[1-(4-пиридил)пиперидин-4-ил] этокси] фенил]пропионовой кислоты: спектр ПМР (ДМСО-d6): δ 1,1-1,33 (2H, м), 1,6-1,88 (5H, М), 2,35 (3H, с), 2,6-2,75 (1H, два д), 2,75- 2,92 (3H, м), 3,38 (3H, с), 3,8-4,1 (5H, м), 6,76 (2H, д), 6,81 (2H, д), 7,0 (2H, д), 7,28 (2H, д), 7,47 (2H, д), 8,12 (2H, д), 8,32 (1H, д); масс-спектр (+ve FAB, MeOH/NBA): 538 (М + H)+.
Примеры 52-54:
По методике, аналогично приведенной в примере 20, взяв в качестве исходных соединений продукты по примерам 49-51, получают следующие соединения:
Пример 52: 2-S-(Метилсульфониламино)-3-[4-[2-[1-(4-пиридил) пиперидин-4-ил] этокси] фенил] пропионовая кислота: спектр ПМР (ДМСО-d6): δ 1,05-1,35 (2H, м), 1,6-1,95 (5H, м), 2,61 (3H, с), 2,65-3,1 (4H, м), 3,88-4,1 (5H, м), 6,84 (2H, д), 6,9 (2H, д), 7,18 (2H, д), 8,14 (2H, д); масс-спектр (+ve FAB, MeOH/NBA): 448 (М + H)+.
Пример 53: 2-S-(Бензилсульфониламино)-3-[4-[2-[1-(4-пиридил) пиперидин-4-ил] этокси] фенил]пропионовой кислоты: спектр ПМР (ДМСО-d6/CD3COOD): δ 1,07-1,35 (2H, м), 1,60-1,88 (5H, м), 2,7-3,2 (4H, м), 3,85-4,25 (7H, м), 6,87 (2H, д), 7,1 (2H, д), 7,13-7,45 (7H,м), 8,15 (2H, д); масс-спектр (+ve FAB, MeOH/NBA): 524 (М+H); вычислено для C28H33N3O5S•H2O: C, 62,1; H, 6,5; N, 7,8; найдено: C, 61,8; H, 6,8; N, 7.6%.
Пример 54: Литиевая соль 2-S-(4-метилфенилсульфониламино)- 3-[4-[2-[1-(4-пиридил)пиперидин-4-ил] этокси] фенил] пропионовой кислоты: спектр ПМР (ДМСО-d6/CD3COOD): δ 1,15- 1,38 (2H, м), 1,67-1,78 (2H, м), 1,82-2,0 (3H, м), 2,36 (3H, с), 3,78 (1H, м), 4,0 (2H, т), 4,18 (2H, д), 6,77 (2H, д), 7,04 (2H, д), 7,11 (2H, д), 7,24 (2H, д), 7,51 (2H, д), 8,15 (2H, д); масс-спектр (+ve FAB, MeOH/NBA): 536 (М + Li)+; вычислено для C28H32N3O5SLi: C, 63,5; H, 6,1; N, 7,9; найдено: C, 63,2; H, 6,5; N, 7,9%.
Пример 55: Метиловый эфир 2-S-(пентаноиламино)-3-[4-[2- [1-(4-пиридил)пиперидин-4-ил]этокси]фенил]пропионовой кислоты
Хлористый валерил (0,25 мл) добавляют по каплям к раствору метилового эфира 2-S-амино-3-[4-[2-[1-(4-пиридил)пиперидин- 4-ил]этокси]фенил]пропионовой кислоты (640 мг) и триэтиламина (0,7 мл) в дихлорметане (17 мл) при комнатной температуре. Реакционную смесь перемешивают в течение 5 час, затем разбавляют дихлорметаном (20 мл) и промывают водой (20 мл), насыщенным раствором хлорида натрия (10 мл) и сушат (над сульфатом магния). Очищают методом испарительной колоночной хроматографии на силикагеле, элюируя смесью метанол/дихлорметан (1:9 об/об), и получают целевое соединение (660 мг) в виде смолы; спектр ПМР (ДМСО-d6): δ 0,81 (3H, т), 1,05-1,3 (4H, м), 1,3-1,45 (2H, м), 1,60-1,85 (5H, м), 2,04 (2H, т), 2,7-3,0 (4H, м), 3,6 (3H, с), 3,92 (2H, д), 3,99 (2H, т), 4,35-4,48 (1H, м), 6,8 (2H, д), 6,83 (2H, д), 7,11 (2H, д), 8,12 (2H, д), 8,18 (1H, д); масс-спектр (+ve FAB, MeOH/NBA): 468 (М + H)+.
Пример 56: Метиловый эфир 2-S-(пентаноиламино)-3-[4-[1-(4- пиридил)пиперидин-4-ил]метоксифенил]пропионовой кислоты
Целевое соединение получают аналогично методике, приведенной в примере 55, взяв в качестве исходного соединения эфир соответствующей аминокиcлоты; спектр ПМР (ДМСО- d6): δ 0,8 (3H, т), 1,05-1,45 (6H, м), 1,83 (2H, два д), 1,9-2,1 (1H, м), 2,04 (2H, т), 2,7-3,0 (4H, м), 3,59 (3H, с), 3,82 (2H, д), 3,96 (2H, д), 4,35-4,48 (1H, м), 6,80 (2H, д), 6,83 (2H, д), 7,10 (2H, д), 8,12 (2H, д), 8,17 (1H, д); масс-спектр (+ve FAB, MeOH/NBA): 454 (М + H)+.
Пример 57: 2-S-(Пентаноиламино)-3-[4-[2-[1-(4- пиридил)пиперидин-4-ил] этокси]фенил]пропионовая кислота
Целевое соединение получают аналогично методике, приведенной в примере 20, взяв в качестве исходного соединения продукт по примеру 55; спектр ПМР (ДМСО-d6): δ 0,8 (3H, т), 1,08-1,3 (4H, м), 1,3-1,45 (2H, м), 1,6-1,87 (5H, м), 2,05 (2H, т), 2,7-3,05 (4H, м), 3,9-4,05 (4H, м), 4,3-4,43 (1H, м), 6,82 (2H, д), 6,85 (2H, д), 7,11 (2H, д), 7,97 (1H, д), 8,12 (2H, уширенный д); масс-спектр (+ve FAB, MeOH/NBA): 454 (М + H)+ вычислено для C26H35N3O4•2H2O: C, 63,8; H, 8,0; N, 8,6; найдено: C, 63,1; H, 7,8; N, 8,3%.
Пример 58: 2-S-(Бензилоксикарбониламино)-3-[4-[2-[1-(4- пиридил)пиперидин-4-ил]этокси]фенил]пропионовая кислота
Целевое соединение получают аналогично методике, приведенной в примере 20, взяв в качестве исходного соединения продукт, полученный на стадии (i) примера 35; спектр ПМР (ДМСО- d6): δ 1,1-1,35 (2H, м), 1,6-1,9 (5H, м), 2,65-3,1 (4H, м), 3,85-4,2 (5H, м), 4,96 (2H, с), 6,75-6,9 (4H, д), 7,14 (2H, д), 7,2-7,35 (5H, м), 7,5 (1H, д), 8,1 (2H, д); масс-спектр (+ve FAB, MeOH/NBA): 504 (М+H)+.
Пример 59: Метиловый эфир 2-S-(н-бутилсульфониламино)- 3-[3-(N-метил-N-4-пиридил)аминопропокси]фенилпропионовой кислоты
Целевое соединение получают аналогично методике, приведенной в примере 19, взяв в качестве исходного соединения метилового эфира 2-S-амино-3-[3-(N-метил-N-4-пиридил)аминопропокси] фенилпропионовой кислоты; спектр ПМР (хлороформ-d): δ 0,89 (3H, т), 1,25-1,4 (2H, м), 1,55-1,75 (2H, м), 2,0-2,15 (2H, м), 2,80 (2H, два д), 2,9-3,15 (2H, м), 3,05 (3H, с), 3,63 (2H, т), 3,77 (3H, с), 3,95 (2H, т), 4,28-4,38 (1H, м), 6,57 (2H, д), 6,80 (2H, д), 7,10 (2H, д), 8,14 (2H, д); масс-спектр (Cl+): 464 (М + H)+.
Необходимые исходные соединения получают следующим образом.
(i) Метиловый эфир 2-S-(трет-бутоксикарбониламино)-3- [3-(N-метил-N-(4-пиридил)аминопропокси] фенилпропионовой кислоты получают в виде смолы по методике, аналогичной приведенной для стадии (i) примера 19, взяв в качестве исходного соединения N-метил-N-(4-пиридил)аминопропанол и метиловый эфир N-трет-бутоксикарбонил- S-тирозина; спектр ПМР (хлороформ- d): δ 1,43 (9H, с), 2,02-2,15 (2H, м), 3,04 (3H, с), 2,95-3,10 (2H, м), 3,62 (2H, т), 3,73 (3H, с), 3,98 (2H, т), 4,54 (1H, уширенный д), 4,98 (1H, уширенный д), 6,56 (2H, д), 6,80 (2H, д), 7,04 (2H, д), 8,17 (2H, д).
(ii) Продукт, полученный на стадии (i) (50 мг), и 5М раствор соляной кислоты (4 мл) перемешивают при комнатной температуре в течение 16 час. Растворитель упаривают и получают соответствующее амино-производное в виде дигидрохлорида, которое используют без дальнейшей очистки.
Пример 60: 2-S-(н-Бутилсульфониламино)-3-[3-(N-метил- N-4-пиридил)аминопропокси]фенилпропионовая кислота
Целевое соединение получают аналогично методике, приведенной в примере 20, взяв в качестве исходного соединения продукт по примеру 59; спектр ПМР (ДМСО-d6/CD3COOD): δ 0,8 (3H, т), 1,1-1,28 (2H, м), 1,28-1,55 (2H, м), 2,0-2,15 (2H, м), 2,6- 2,8 (3H, м), 2,93-3,08 (1H, два д), 3,18 (3H, с), 3,75 (2H, т), 3,9-4,05 (3H, м), 6,86 (2H, д), 7,0 (2H, д), 7,2 (2H, д), 8,15 (2H, д); масс-спектр (+ve FAB, MeOH/NBA): 450 (М + H)+; вычислено для C22H31N3O5S•2H2O: C, 54,4; H, 7,2; N, 8,6; найдено: C, 53,9; H, 6,9; N, 8,4%.
Пример 61: Метиловый эфир 3-(н-бутилсульфониламино)-3-[4- [1-(4-пиридил)пиперидин-4-ил]метоксифенил]пропионовой кислоты
Целевое соединение получают аналогично методике, приведенной
в примере 19, взяв в качестве исходного соединения дигидрохлорид метилового эфира 3-амино-3-[4-[1-(4- пиридил)пиперидин-4-ил]метоксифенил]пропионовой кислоты; спектр ПМР (хлороформ-d): δ 0,84 (3H, т), 1,2-1,4 (2H, м), 1,4-1,55 (2H, м), 1,55-1,75 (2H, м), 1,97 (2H, уширенный д), 2,02-2,2 (1H, м), 2,65-2,85 (2H, м), 2,88 (2H, д), 3,0 (2H, два т), 3,67 (3H, с), 3,84 (2H, д), 4,0 (2H, уширенный д), 4,85 (1H, квартет), 5,40 (1H, д), 6,71 (2H, д), 6,86 (2H, д), 7,27 (2H, д), 8,25 (2H, д); масс-спектр (+ve FAB, MeOH/NBA): 490 (M+H)+.
Исходные соединения получают следующим образом.
(i) Хлористый тионил (4,3 мл) добавляют к метанолу (50 мл), помещенному в баню, охлаждаемую смесью льда и соли. Добавляют 3- амино-3-(4-гидроксифенил)пропионовую кислоту (3,7 г), дают смеси нагреться до комнатной температуры и кипятят с обратным холодильником в течение 2 час. Растворитель упаривают в вакууме и получают твердое смолообразное вещество (12,8 г), которое используют без дальнейшей очистки. К перемешиваемому раствору полученного твердого смолообразного вещества (5,75 г) и бикарбоната калия (6,2 г) в воде (20 мл) добавляют раствор ди- трет-бутилдикарбоната (0,8 г) в дихлорметане. Полученную смесь перемешивают при комнатной температуре в течение 4 час. Органический слой отделяют и промывают водой (10 мл), 1М раствором соляной кислоты (10 мл), насыщенным раствором бикарбоната натрия (10 мл), водой (10 мл) и сушат (над сульфатом магния). Растворитель упаривают, получая метиловый эфир 3-(трет- бутилоксикарбониламино)-3-(4- гидроксифенил)пропионовой кислоты в виде твердого вещества с т.пл. 119-120oC; спектр ПМР (ДМСO- d6): δ 1,34 (9H, с), 2,54-2,78 (2H, м), 3,53 (3H, с), 4,7- 4,9 (1H, квартет), 6,67 (2H, д), 7,08 (2H, д), 7,28 (1H, уширенный д), 9,24 (1H, уширенный с).
(ii) Метиловый эфир 3- (трет-бутилоксикарбониламино)-3-[4-[1-(4-пиридил)пиперидин-4- ил] метоксифенил]пропионовой кислоты получают в виде смолы по методике, аналогичной приведенной на стадии (i) примера 19, взяв в качестве исходного соединения продукт, полученный на стадии (i); спектр ПМР (хлороформ-d): δ 1,33-1,55 (2H, м), 1,44 (9H, с), 1,95 (2H, уширенный д), 1,95-2,15 (1H, м), 2,7-3,0 (4.4, м), 3,61 (3H, с), 3,80 (2H, д), 3,95 (2H, уширенный д), 4,95-5,1 (1H, м), 5,25- 5,40 (1H, м), 6,68 (2H, д), 6,85 (2H, д), 7,2 (2H, д), 8,25 (2H, д).
(iii) Продукт, полученный на стадии (ii) (550 мг), и 5М раствор хлористого водорода в метаноле (4 мл) перемешивают при комнатной температуре в течение 18 час. Растворитель упаривают и получают дигидрохлорид метилового эфира 3-амино-3-[4-[1-(4- пиридил) пиперидин-4-ил]метоксифенил] пропионовой кислоты в виде пенообразного вещества; спектр ПМР (ДМСО-d6/CD3COOD: δ 1,23-1,45 (2H, м), 1,92 (2H, уширенный д), 2,05-2,25 (1H, м), 3,0- 3,25 (4H, м), 3,52 (3H, с), 3,85 (2H, д), 4,2 (2H, уширенный д), 4,54 (1H, т), 6,92 (2H, д), 7,1 (2H, д), 7,39 (2H, д), 8,10 (2H, д).
Пример 62: 3-(н-Бутилсульфониламино)-3-[4-[1-(4-пиридил) пиперидин-4-ил] метоксифенил]пропионовая кислота
Целевое соединение получают аналогично методике, приведенной в примере 20, взяв в качестве исходного соединения продукт по примеру 61; спектр ПМР (ДМСО-d6/CD3COOD): δ 0,78 (3H, т), 1,05-1,3 (2H, м), 1,3-1,57 (4H, м), 1,98 (2H, уширенный д), 2,1-2,33 (1H, м), 2,445-2,85 (4H, м), 3,25 (2H, т), 3,89 (2H, д), 4,25 (2H, уширенный д), 4,68 (1H, т), 6,90 (2H, д), 7,14 (2H, д), 7,33 (2H, д), 8,14 (2H, д); масс-спектр (+ve FAB, MeOH/NBA): 490 (М + H)+.
Пример 63: Метиловый эфир 3-(4-метилфенилсульфониламино)- 3-[4-[1-(4-пиридил)пиперидин-4-ил]метоксифенил]пропионовой кислоты
Целевое соединение получают аналогично методике, приведенной в примере 19, взяв в качестве исходного соединения продукт, полученный на стадии (iii) примера 61, и п- толуолсульфохлорид; спектр ПМР (хлороформ-d): δ 11,34-1,55 (2H, м), 1,97 (2H, д), 2,02-2,2 (1H, м), 2,38 (3H, с), 2,62-3,05 (4H, м), 3,55 (3H, с), 3,78 (21-1, д), 3,96 (2H, д), 4,65 (1H, м), 5,65 (1H, уширенный с), 6,7 (2H, д), 6,72 (2H, д), 7,05 (2H, д), 7,2 (2H, д), 7,65 (2H, д), 8,25 (2H, д); масс-спектр (+ve FAB, MeOH/NBA): 524 (М + H)+.
Пример 64: Метиловый эфир 2-R-(н-бутилсульфониламино)-3- [4-[1-(4-пиридил)пиперидин-4-ил]метоксифенил]пропионовой кислоты
Целевое соединение получают аналогично методике, приведенной в примере 19, взяв в качестве исходного соединения дигидрохлорид метилового эфира 2-R-амино- 3-[4-[1-(4- пиридил) пиперидин-4-ил] метоксифенил] пропионовой кислоты; спектр ПМР (хлороформ-d): δ 0,88 (3H, т), 1,2-1,7 (6H, м), 1,96 (2H, д), 2,0-2,2 (1H, м), 2,7-2,83 (2H, м), 2,85-3,15 (4H, м), 3,77 (3H, с), 3,79 (2H, д), 3,96 (2H, д), 4,32 (1H, м), 4,85 (1H, уширенный д), 6,7 (2H, д), 6,83 (2H, д), 7,08 (2H, д), 8,25 (2H, уширенный д); масс-спектр (+ve FAB, MeOH/NBA): 490 (М + H)+.
Необходимые исходные соединения получают следующим образом.
(i) Метиловый эфир 2-8-(трет-бутилоксикарбониламино)-3- [4-(1-(4-пиридил)пиперидин-4-ил)метоксифенил] пропионовой кислоты (1,2 г) получают в виде смолы по методике, аналогичной приведенной на стадии (i) примера 19, взяв в качестве исходного соединения метиловый эфир N-трет-бутилоксикарбонил-S-тирозина; спектр ПМР (xлopoфopм-d): δ 1,43 (9H, с), 1,36-1,55 (2H, м), 1,96 (2H, уширенный д), 2,0-2,15 (1H, м), 2,95 (2H, два т), 3,03 (2H, д), 3,71 (3H, с), 3,81 (2H, д), 3,95 (2H, уширенный д), 4,52 (1H, уширенный д), 4,95 (2H, уширен ный д), 6,70 (2H, д), 6,80 (2H, д), 7,01 (2H, д), 8,24 (2H, д).
(ii) Метиловый эфир 2-R-амино-3-[4-[1-(4-пиридил)пиперидин-4- ил]метоксифенил]пропионовой кислоты получают в виде пенообразного вещества по методике, приведенной для стадии (ii) примера 59, взяв в качестве исходного соединения продукт, полученный на стадии (i); спектр ПМР (ДМСО-d6/CD3COOD): δ 1,26-1,48 (2H, м), 1,96 (2H, уширенный д), 2,1-2,3 (1H, м), 3,09 (2H, два д), 3,21 (2H, т), 3,70 (3H, с), 3,84 (2H, д), 4,15-4,3 (3H, м), 6,88 (2H, д), 7,14 (4H, м), 8,14 (2H, д).
Пример 65: 2-R-(н-Бутилсульфониламино)-3-[4-[1-(4-пиридил) пиперидин-4-ил]метоксифенил пропионовая кислота
Целевое соединение получают аналогично методике, приведенной в примере 20, взяв в качестве исходного соединения продукт по примеру 64; спектр ПМР (ДМСО- d6/CD3COOD): δ 0,75 1,03-1,45 (6H, м), 1,87 (2H, д), 1,95-2,2 (1H, м), 2,45- 2,78 (3H, м), 2,88-3,08 (3H, м), 3,82 (2H, д), 3,8-3,95 (1H, м), 4,05 (2H, уширенный д), 6,84 (2H, д), 6,92 (2H, д), 7,18 (2H, д), 8,13 (2H, уширенный с); масс-спектр (- ve FAB, MeOH/NBA): 474 (М - H)-; вычислено для C24H33N3O5S•2,5Н2O: C, 55,4; H, 7,3; N, 8,1; найдено: C, 55,1; H, 6,8; N, 7,8%.
Пример 66: Метиловый эфир 4-[2-[4-(4-пиридил)пиперазин-1 -ил]ацетил]-2,6-дихлорфеноксиуксусной кислоты
Получают по методике, аналогичной приведенной в примере 5, взяв в качестве исходного соединения метиловый эфир 4-бромацетил- 2,6-дихлорфеноксиуксусной кислоты, перемешивают всего в течение 6 час, очищают тонкослойной хроматографией на силикагеле, элюируя вначале дихлорметаном, а затем последовательно 2, 3, 4 и 5% об/об смесями метанол/дихлорметан. Фракции концентрируют в вакууме и перекристаллизовывают из метанола, получая целевое соединение с выходом 24% в виде твердого вещества бледно-оранжевого цвета с т. пл. 149-150oC; спектр ПМР (ДМСO-d6): δ 8,14 (2H, д), 8,06 (2H, с), 6,81 (2H, д), 4,82 (2H, с), 4,05 (0,5H, ш), 3,94 (2H, с), 3,73 (3H, с), 3,32 (4H, т), 3,18 (1,5H, с), 2,64 (4H, т); масс-спектр: m/e 438 (М+H); соответствует 2 х C1; вычислено для C20H21Cl2N3O4•0,5CH3OH: C, 54,1; H, 5,1; N, 9,2; найдено: C, 53,7; H, 5,4; N, 8,9%.
Исходные соединения получают следующим образом.
(i) Гидрид натрия (50%-ная дисперсия в минеральном масле, 1,32 г) промывают несколько раз свежими порциями гексана. Остаток, освобожденный от масла, суспендируют в сухом ДМФА (10 мл) и при перемешивании и при охлаждении (на бане со льдом) по каплям добавляют раствор 3,5-дихлор-4-гидроксиацетофенона (5,13 г) в сухом ДМФА (15 мл). Перемешивание продолжают в течение 30 минут, а затем по каплям добавляют метиловый эфир бромуксусной кислоты (3,06 мл) и перемешивают при комнатной температуре еще в течение 18 час. Полученную смесь выливают в воду, дважды экстрагируют этилацетатом, органическую фазу сушат (над сульфатом магния), отфильтровывают и упаривают. Из остатка после перекристаллизации из гексана (250 мл) получают метиловый эфир 4-ацетил-2,6- дихлорфеноксиуксусной кислоты, 4,25 г, в виде белых кристаллов; спектр ПМР (ДМСО-d6): δ 8,00 (2H, с), 4,80 (2H, с), 3,73 (3H, с), 2,59 (3H, с).
(ii) Раствор брома (0,77 мл) в хлороформе (10 мл) добавляют по каплям в течение 15 минут к перемешиваемому раствору продукта, полученного на стадии (i) (4,16 г), в хлороформе (40 мл) при температуре 25oC. В течение 1 час нагревают при температуре 40oC, а затем продолжают перемешивание еще в течение 18 час при комнатной температуре. Растворитель удаляют в вакууме и полученное масло очищают тонкослойной хроматографией на силикагеле, элюируя дихлорметаном, и получают кристаллическое вещество. Перекристаллизовывают из метанола и получают метиловый эфир 4-бромацетил-2,6-дихлорфеноксиуксусной кислоты, 1,88 г, в виде белых кристаллов с т.пл. 89-90oC; спектр ПМР (ДМСO-d6) δ 8,06 (2H, с), 4,93 (2H, с), 4,82 (2H, с), 3,72 (3H, с); масс-спектр: m/e 455/357 (М+H); соответствует 1 Br; вычислено для C11H9BrCl2O4: C, 37,1; H, 2,3; найдено: C, 36,8; H, 2,4%.
Пример 67: Метиловый эфир 4-[2-[4-(4-пиридил)пиперазин-1- ил]ацетил]-3-метилфеноксиуксусной кислоты
Целевое соединение в виде масла желтого цвета получают с выходом 97% по методике, аналогичной приведенной в примере 5, взяв в качестве исходного соединения метиловый эфир 4-бромацетил- 3-метилфеноксиуксусной кислоты, после очистки вначале тонкослойной хроматографией на силикагеле, элюируя смесями метанол/дихлорметан (от 0 до 5% об/об), а затем тонкослойной хроматографией на нейтральном оксиде алюминия, элюируя вначале дихлорметаном, а затем 1% смесью метанол/дихлорметан; спектр ПМР (ДМСО-d6): δ 8,15 (2H, д), 7,38 (1H, д), 6,82 (4H, д), 4,88 (2H, с), 3,75 (2H, с), 3,71 (3H, с), 3,32 (4H, т), 2,61 (4H, т), 2,43 (3H, с); масс-спектр: m/e 384 (М+H)+; вычислено для C21H25N3O4•0,5H2O• 0,1CH2Cl2: C, 63,1; H, 6,5; N, 10,5; найдено: C, 62,6; H, 6,6; N, 10,2%.
Исходные соединения получают следующим образом.
(i) Смесь 4-гидрокси-2-метилацетофенона (4,8 г), безводного карбоната калия (5,3 г) и метилового эфира бромуксусной кислоты (3,55 мл) в безводном ацетоне (100 мл) перемешивают в течение 2 дней. Из смеси после фильтрования и упаривания растворителя выделяют метиловый эфир 4-ацетил-3- метилфеноксиуксусной кислоты, 6,6 г, в виде кристаллического вещества с т.пл. 49-50oC; спектр ПМР (ДМСO-d6): δ 7,84 (1H, с), 6,83 (2H, м), 4,87 (2H, с), 3,71 (3H, с), 2,50 (3H, с), 2,45 (3H, с).
(ii) Получают аналогично методике, приведенной для стадии (ii) примера 76, взяв в качестве исходного продукт, полученный на стадии (i) и очищая методом тонкослойной хроматографии на силикагеле (элюируют смесями этилацетат/гексан от 10 до 17,5% об/об). Перекристаллизовывают из этанола и получают метиловый эфир 4-бромацетил-3-метилфеноксиуксусной кислоты с выходом 35% в виде белых игл; спектр ПМР (ДМСО-d6): δ 7,90 (1H, д), 6,90 (1H, с), 6,88 (1H, д), 4,90 (2H, с), 4,78 (2H, с), 3,71 (3H, с), 2,43 (3H, с).
Пример 68: Смесь метилового эфира 4-[2-[4-(4-пиридил) пиперазин-1-ил] ацетил] -2-метилфеноксиуксусной кислоты и этилового эфира 4-[2-[4-(4-пиридин)пиперазин-1-ил]ацетил]-2- метилфеноксиуксусной кислоты (3:2)
Смесь метилового эфира 4-ацетил-2-метилфеноксиуксусной кислоты (3,33 г) и бромида меди (II) (7,0 г) в этилацетате (50 мл) нагревают на водяной бане в течение 18 час. После фильтрования растворитель упаривают и остаток очищают тонкослойной хроматографией на силикагеле, элюируя смесью этилацетат/гексан (10% об/об), и получают твердое вещество беловатого цвета. Перекристаллизацией из этанола получают белые иглы, 2,37 г, которые, как показывают данные ПМР (ДМСO-d6), представляют собой смесь метилового эфира 4-бромацетил-2-метилфеноксиуксусной кислоты и этилового эфира 4-бромацетил-2-метилфеноксиуксусной кислоты, которую используют без дальнейшей очистки. Эту смесь (2,25 г) добавляют порциями к перемешиваемому раствору 1-(4- пиридил)пиперазина (2,45 г) в ацетонитриле и перемешивают в течение 18 час. Отфильтровывают и фильтрат упаривают, получая оранжевое масло. После очистки методом тонкослойной хроматографии на силикагеле, элюируя дихлорметаном, а затем смесями метанол/дихлорметан (от 1 до 3% об/об), получают целевое соединение, 0,87 г, в виде твердого вещества с т.пл. 136-138oC; спектр ПМР (ДМСО-d6): δ 8,04 (2H, д), 7,85 (1H, д), 7,82 (1H, с), 6,95 (1H, д), 6,81 (44, д), 4,96 и 4,93 (2H, два с), 4,18 (0,7H, квартет), 3,84 (2H, с), 3,72 (1,7H, с), 3,30 (4H, т), 2,60 (4H, т), 2,25 (3H, с), 1,21 (1,3H, т), [отношение метилового к этиловому эфиру составляет 3:2]; масс- спектр: m/e 384 (М+H)+ для метилового эфира, 398 (М+H)+ для этилового эфира; вычислено для C21H25N3O4:C22H27N3O4 (3:2): C, 66,1; H, 6,6; N, 10,8; найдено: C, 65,8; H, 6,7; N, 10,2%.
Исходное соединение получают следующим образом.
(i) Смесь 4-гидрокси-3-метилацетофенона (5 г), метилового эфира бромуксусной кислоты (3,70 мл) и безводного карбоната калия (5,52 г) в ацетоне (100 мл) перемешивают в течение 66 час. Смесь отфильтровывают и фильтрат упаривают, получая масло, которое кристаллизуется при стоянии и дает метиловый эфир 4-ацетил-2- метилфеноксиуксусной кислоты, 7,2 г, с т.пл. 51-53oC; спектр ПМР (ДМСO-d6): δ 7,79 (1H, с), 7,77 (1H, д), 6,94 (1H, д), 4,93 (2H, с), 3,71 (3H, с), 2,50 (3H, с + ДМСО), 2,24 (3H, с).
Пример 69: Смесь метилового эфира 4-[2-[4-(4-пиридил) пиперазин-1-ил]ацетил] -3-метоксифеноксиуксусной кислоты и этилового эфира 4-[2-[4-(4-пиридил)пиперазин-1-ил]ацетил]-2- метоксифеноксиуксусной кислоты (3:1)
Смесь метилового эфира 4-бромацетил-2-метоксифеноксиуксусной кислоты и этилового эфира 4-бромацетил-2-метоксифеноксиуксусной кислоты с выходом 60% получают после тонкослойной хроматографии на силикагеле, элюируя дихлорметаном, по методике, аналогичной приведенной в примере 68, взяв в качестве исходного метиловый эфир 4-ацетил-2-метоксифеноксиуксусной кислоты; т.пл. 84-86oC. Обрабатывают эту смесь так же, как в примере 68, очищают хроматографически на силикагеле, элюируя смесями метанол/дихлорметан (от 1 до 5% об/об), и получают целевую смесь соединений с выходом 24% в виде твердого вещества: спектр ПМР (ДМСO-d6): δ 8,13 (2H, д), 7,63 (1H, д), 6,80. (2H, д), 6,67 (1H, д), 6,59 (1H, два д), 4,90 и 4,88 (2H, два с), 4,18 (0,5H, квартет), 3,88 (3H, с), 3,75 (2H, с), 3,71 (2,3H, с), 3,32 (4H, т), 2,62 (4H, т), 1,22 (0,7H, т), [отношение метилового к этиловому эфиру составляет 3:1]; масс- спектр: m/e 400 (М+H)+ для метилового эфира, 414 (М+H)+ для этилового эфира; вычислено для C21H25N3O5:C22H27N3O5 (3:1): C, 63,3; H, 6,3; N, 10,4; найдено: C, 63,2; H, 6,5; N, 10,3%.
Исходное соединение получают следующим образом.
(i) По методике, аналогичной приведенной для стадии (i) примера 68, взяв в качестве исходного соединения 4-гидрокси-2- метоксиацетофенон, получают метиловый эфир 4-ацетил-3-метоксифеноксиуксусной кислоты с выходом 91% после упаривания растворителя и растирания с диэтиловым эфиром в виде твердого вещества с т.пл. 95-96oC; спектр ПМР (ДМСО-d6) δ: 7,64 (1H, д), 6,70 (1H, д), 6,60 (1H, два д), 4,91 (2H,"с), 3,89 (3H, с), 3,72 (3H, с), 2,49 (3H, с).
Пример 70: Смесь диметилового эфира 2,2'-[4-[2- [4-(4-пиридил) пиперазин-1-ил] ацетил] фенилен-1,3-диокси] диуксусной кислоты и диэтилового эфира 2,2'-[4-[2-[4-(4-пиридил) пиперазин-1-ил]ацетил]фенилен-1,3-диокси]диуксусной кислоты (1:1)
Смесь диметилового эфира 2,2'-[(4-бромацетил]фенилен-1,3- диокси]диуксусной кислоты и диэтилового эфира 2,2'-[(4-бромацетил]фенилен-1,3-диокси] диуксусной кислоты с выходом 28% получают после тонкослойной хроматографии на силикагеле, элюируя дихлорметаном, по методике, аналогичной приведенной в примере 68, взяв в качестве исходного диметиловый эфир 2,2'-[(4- ацетил] фенилен-1,3-диокси] диуксусной кислоты. Обрабатывают эту смесь так же, как в примере 68, очищают хроматографически на силикагеле, элюируя смесями метанол/дихлорметан (от 1 до 5% об/об), получают целевую смесь соединений с выходом 44% в виде твердого вещества; спектр ПMP (ДМСO-d6): δ 8,14 (2H, д), 7,63. (1H, д), 6,82 (2H, д), 6,65 (2H, д), 4,96 и 4,93 (2H, два с), 4,49 и 4,47 (2H, два с), 4,20 (2H, м), 3,91 (2H, с), 3,75 и 3,71 (3H, два с), 3,32 (4H + H2О), 2,61 (4H, т), 1,23 (3H, м) [отношение метилового к этиловому эфиру составляет 1: 1]; масс-спектр: m/e 458 (М+H)+ для диметилового эфира и 486 (М+H)+ для диэтилового эфира; вычислено для C23H27N3O7: C25H31N3O7(1: 1)•H2O: C, 60,0; H, 6,3; N, 8,7; найдено: C, 60,3; H, 6,2; N, 8,5%.
Исходное соединение получают следующим образом.
(i) По методике, аналогичной приведенной для стадии (i) примера 68, взяв в качестве исходного 2,4-дигидроксиацетофенон и используя 2,4 эквивалента безводного карбоната калия, получают диметиловый эфир 2,2'-[(4-ацетил)фенилен-1,3-диокси] диуксусной кислоты с выходом 82% после упаривания растворителя и растирания с диэтиловым эфиром в виде твердого вещества с т. пл. 119-120oC; спектр ПМР (ДМСО-d6): δ 7,64 (1H, д), 6,56 (2H, м), 4,93 (2H, с), 3,90 (2H, с), 3,71 (3H, с), 2,57 (3H, с).
Пример 71: Дигидрохлорид 4-[2-[4-(4-пиридил)пиперазин-1- ил]ацетил]-2-6-дихлорфеноксиуксусной кислоты
Раствор продукта по примеру 66 (190 мг) в диоксане (1,7 мл) обрабатывают 1N раствором соляной кислоты (1,7 мл) и нагревают смесь при температуре 100oC в течение 1,5 час. Смесь охлаждают, разбавляют водой и подвергают сублимационной сушке. Из полученного твердого остатка после обработки небольшим количеством этанола получают целевое соединение, 120 мг, в виде твердого вещества белого цвета с т.пл. 174-176oC; спектр ПМР (D2O): δ 8,42 (2H, д), 8,26 (2H, с), 7,41 (2H, д), 5,24 (2H, с), 4,98 (2H, с), 4,34 (4H, т), 3,90 (4H, т); масс-спектр: m/e 424 (M I H)+, соответствует 2 x Cl; вычислено C19H19Cl2N3O4•2H2O: C, 44,4; H, 4,5; N, 8,2; найдено: C, 44,8; H, 4,2; N, 8,1%.
Примеры 72-75
По методике, аналогичной приведенной в примере 71, взяв в качестве исходного соединения продукт по примерам 63-66, получают следующие соединения.
Пример 72: Дигидрохлорид 4-[2-[4-(4-пиридил)пиперазин-1- ил]ацетил]-3-метилфеноксиуксусной кислоты
Целевое соединение получают с выходом 78% из продукта по примеру 67; т. пл. 242-244oC; спектр ПМР (D2O): δ 8,38 (2H, д), 8,00 (1H, д), 7,36 (2H, д), 7,14 (1H, с), 7,10 (1H, д), 5,12 (2H, с), 4,97 (2H, с), 4,30 (4H, уширенный с), 3,84 (4H, уширенный с), 2,75 (3H, с), 2,43 (3H, с); масс-спектр: m/e 370 (М + H)+; вычислено для C20H23N3O4•2HCl•0,5H2O: C, 53,4; H, 5,3; N, 9,3; найдено: C, 53,2; H, 5,8; N, 8,8%.
Пример 73: Дигидрохлорид 4-[2-[4-(4-пиридил)пиперазин-1- ил]ацетил]-2-метилфеноксиуксусной кислоты
Целевое соединение получают с выходом 98% из продукта по примеру 68; т. пл. 259-263oC; спектр ПМР (ДМСО-d6 + D2O): δ 8,46 (2H, д), 7,95 (2H, м), 7,38 (2H, д), 7,15 (1H, д), 5,17 (2H, с), 5,00 (2H, с), 4,19 (4H, с), 3,62 (4H, с), 2,39 (3H, с); масс-спектр: m/e 370 (М + H)+; вычислено для C20H23N3O4•2HCl•0,5H2O: C, 53,5; H, 5,8; N, 9,4; найдено: C, 53,6; H, 5,7; N, 9,5%.
Пример 74: Дигидрохлорид 4-[2-[4-(4-пиридил)пиперазин-1- ил]ацетил]-3-метоксифеноксиуксусной кислоты
Целевое соединение получают с выходом 69% из продукта по примеру 69; т. пл. 168-170oC; спектр ПМР (ДМСО-d6 + уксусная кислота - d4): δ 8,36 (2H, д), 7,93 (1H, м), 7,28 (2H, д), 6,76 (1H, д), 6,72 (1H, два д), 4,86 (2H, с), 4,78 (2H, с), 4,08 (411, уширенный с), 3,98 (3H, с), 3,54 (3H, с); масс-спектр: m/e 386 (М + H)+; вычислено для C20H23N3O5•2HCl•2H2O: C, 48,7; H, 5,9; N, 8,5; найдено: C, 48,5; H, 5,7; N, 8,3%.
Пример 75: Дигидрохлорид 2,2'-[4-[2-[4-(4-пиридил)пиперазин-1-ил]ацетил] фенилен-1,3-диокси)диуксусной кислоты
Целевое соединение получают с выходом 69% из продукта по примеру 70; т. пл. 257-258oC; спектр ПМР (D2O): δ 8,39 (2H, д), 8,18 (1H, д), 7,48 (2H, д), 6,94 (1H, два д), 6,76 (1H, д), 5,18 (2H, с), 5,09 (2H, с), 5,01 (2H, с), 4,29 (4H, ш), 3,34 (4H, ш); масс-спектр: m/e 430 (М + H)+; вычислено для C21H24N3O7•2HCl•0,5H2O: C, 49,5;H, 5,3: N, 8,2; найдено: C, 49,4; H, 5,3; N, 7,8%.
Пример 76: 4-[2-[4-(4-пиридил)пиперазин-1-ил] ацетил]-2,6- ди-трет-бутилфеноксиуксусная кислота
Раствор метилового эфира 4-[2-[4-(4-пиридил)пиперазин-1- ил]ацетил]-2,6-ди-трет-бутилфеноксиуксусной кислоты (241 мг) в диоксане (2,0 мд) обрабатывают 1N раствором соляной кислоты и нагревают смесь до температуры 100oC в течение 20 час. Смесь охлаждают, разбавляют водой, отфильтровывают и подвергают сублимационной сушке. Полученный твердый остаток очищают тонкослойной хроматографией на силикагеле, элюируя смесью толуол/этилацетат/0,880 водный раствор аммиака/этанол (60:20:20:35 об/об/об/об). Фракции, содержащие целевой продукт упаривают, остаток обрабатывают диоксаном, отфильтровывают, фильтрат разбавляют водой и подвергают сублимационной сушке, получая пенообразное вещество белого цвета, которое после сушки при 55oC дает целевое соединение, 90 мг; спектр ПMP (ДМСО-d6): δ 8,16 (2H, д), 7,97 (2H, с), 6,84 (4H, д), 4,22 (2H, с), 3,86 (2H, с), 3,37 (4H, т), 2,64 (4H, т), 1,39 (18H, с); масс-спектр: m/e 468 (М + H)+; вычислено для C27H37N3O40•2H2O: C, 64,4; H, 8,2; N, 8,3; найдено: 0, 64,6; H, 7,9; N, 7,9%.
Исходные соединения получают следующим образом.
(i) По методике, аналогичной приведенной для стадии (i) примера 66, взяв в качестве исходного соединения 2,5-ди-трет- бутил-4-гидроксиацетофенон, получают коричневое масло (выделяют из экстрактов в этилацетате). После очистки методом тонкослойной хроматографии на силикагеле, элюируя последовательно гексаном, затем смесью 2% об/об этилацетат/гексан и наконец смесью 5% об/об этилацетат/гексан, выделяют с выходом 50% метиловый эфир 4-ацетил-2,6-ди-трет-бутилфеноксиуксусной кислоты в виде масла; спектр ПМР (ДМСО-d6): δ 7,84 (2H, с), 4,38 (2H, с), 3,76 (3H, с), 2,55 (3H, с), 1,40 (18H, с); масс-спектр: m/e 321 (М + H)+; вычислено для C19H28: C, 71,2; H, 8,8; найдено: C, 71,5; H, 9,0%.
(ii) Смесь продукта, полученного выше на стадии (i) (4,91 г), и бромида меди (II) (6,82 г) в этилацетате (45 мл) кипятят с обратным холодильником в течение 24 час. После охлаждения смесь отфильтровывают и фильтрат упаривают в вакууме. Остаток очищают тонкослойной хроматографией на силикагеле, элюируя смесью этилацетат/гексан (5% об/об), и получают метиловый эфир 4-бромацетил-2,6-ди-трет-бутилфеноксиуксусной кислоты, 4,98 г, в виде масла; спектр ПМР (ДМСО-d6): δ 7,90 (2H, с), 4,92 (2H, с), 4,40 (2H, с), 3,76 (3H, с), 1,41 (18H, с).
(iii) По методике, аналогичной приведенной в примере 5, взяв в качестве исходного соединения продукт, полученный выше на стадии (ii), после очистки методом тонкослойной хроматографии на силикагеле, последовательно элюируя вначале дихлорметаном, а затем смесями метанол/дихлорметан (от 2 до 5% об/об), получают твердое вещество. Его растирают с эфиром и получают с выходом 33% метиловый эфир 4-[2-[4-(4-пиридил)пиперазин-1-ил]ацетил] -2,6-ди-трет-бутилфеноксиуксусной кислоты с т.пл. 140-142oC; спектр ПМР (ДМСО-d6): δ 7,97 (2H, с), 6,82 (2H, д), 4,39 (2H, с), 3,85 (2H, с), 3,75 (3H, с), 3,33 (4H, т), 2,64 (4H, т), 1,39 (18H, с); масс-спектр: m/e 482 (М+H)+; вычислено для C28H39N3O4: C, 69,8; H, 8,2; N, 8,7; найдено: C, 69,7; H, 8,6; N, 8,1%.
Пример 77: Этиловый эфир 4-[2-[4-(4-пиридил)пиперазин-1-ил]ацетил]бензойной кислоты
Проводят синтез аналогично методике, приведенной в примере 5, взяв в качестве исходного соединения этиловый эфир 4- бромацетилбензойной кислоты; перекристаллизовывают из метанола и получают целевое соединение с выходом 32% в виде кристаллов бледно-желтого цвета с т.пл. 147-149oC; спектр ПМР (ДМСО-d6): δ 8,14 (2H, д), 8,08 (4H, квартет), 6,78 (2H, д), 4,35 (4H, квартет, AB спектр), 3,98 (2H, с), 3,31 (4H, т), 2,63 (4H, т), 1,35 (3H, т); масс-спектр: m/e 354 (М + H)+; вычислено для C20H23N3O3: C, 68,0; H, 6,6; N, 11,9; найдено: C, 68,0; H, 6,5; N, 11,7%.
Пример 78: Натриевая соль 4-[2-[4-(4-пиридил)пиперазин-1- ил]ацетил]бензойной кислоты
К перемешиваемой суспензии продукта по примеру 77 (353 мг) в метаноле (5 мл) добавляют 1М раствор гидроксида натрия (3 мл). Через 2 час выделяют твердое вещество кремового цвета, промывают его небольшим количество метанола и сушат, получая целевое соединение, 240 мг, с т.пл. > 300oC; спектр ПМР (ДМСО- d6): δ 8,15 (2H, д), 8,05 (4H, т, AB спектр), 6,85 (2H, д), 3,97 (2H, с), 3,38 (4H, т), 2,65 (4H, т); масс-спектр: m/e 348 (М + H)+; вычислено для C18H18N3NaO3•0,25H2O: C, 61,4; H, 5,3; N, 11,9; найдено: C, 61,3; H, 5,2; N, 11,7%.
Пример 79: Дигидробромид 2-[4-[2-[4-(4-пиридил)пиперазин- 1-ил]ацетил] фенокси]изомасляной кислоты
Смесь метилового эфира 2-[4-[2-[4-(4-пиридил)пиперазин-1- ил]ацетил]фенокси] изомасляной кислоты (50 мг), 48%-ной бромистоводородной кислоты (0,74 мл), диоксана (1 мл) и воды (3 мл) нагревают в течение 4 час до температуры 95oC. Раствор охлаждают, разбавляют водой и подвергают сублимационной сушке, получая целевое соединение, 40 мг, в виде твердого вещества бледно- желтого цвета с т. пл. 163-167oC; спектр ПМР (D2O): δ 8,40 (2H, д), 8,16 (2H, д), 7,40 (2H, д), 7,21 (2H, д), 5,21 (2H, с), 4,32 (4H, ш), 3,89 (4H, уширенный т), 1,86 (6H, с); масс-спектр: m/e 384 (М + H)+; вычислено для C21H25N3O4•2HBr•2H2O: C, 43,3; H, 5,3; N, 7,2; найдено: C, 43,6; H, 5,3; N, 7,3%.
Исходные соединения получают следующим образом.
(i) Метиловый эфир 2-(4-бромацетилфенокси)изомасляной кислоты с выходом 45% после очистки тонкослойной хроматографией на силикагеле, элюируя смесью этилацетат/гексан (1: 2 об/об) получают в виде масла оранжевого цвета по методике, аналогичной приведенной для стадии (ii) примера 66, взяв в качестве исходного соединения метиловый эфир 2-(4-ацетилфенокси)изомасляной кислоты; спектр ПМР (хлороформ-d): δ 7,91 (2H, с), 6,85 (2H, д), 4,48 (2H, с), 3,76 (3H, с), 1,67 (6H, с); масс-спектр: m/e 315/317 (М + H)+, соответствует 2 Br.
(ii) Продукт, полученный выше на стадии (i) (2,00 г), в ацетонитриле (10 мл) добавляют по каплям в течение 15 минут к перемешиваемому раствору 1-(4-пиридил)пиперазина (1,04 г) и триэтиламина (0,89 мл) в ацетонитриле (15 мл) и оставляют смесь перемешиваться на ночь. Выпавший осадок отфильтровывают и фильтрат упаривают. Полученный остаток очищают тонкослойной хроматографией на силикагеле, элюируя смесями от 0 до 5% метанол/дихлорметан и получают смолу желтого цвета. Ее растирают с диэтиловым эфиром и получают метиловый эфир 2-[4-[2-[4-(4-пиридил)пиперазин-1-ил]ацетил]фенокси]изомасляной кислоты, 170 мг, в виде твердого вещества белого цвета с т.пл. 88-90oC; спектр ПМР (ДМСО-d6): δ 8,15 (2H, д), 7,96 (2H, д), 6,82 (4H,м), 3,92 (2H, с), 3,33 (4H, т), 2,63 (4H, т), 1,60 (6H, с); масс-спектр: m/e 398 (M+H)+; вычислено для C22H27N3O4•0,25H20: C, 65,8; H, 6,8; N, 10,5; найдено: C, 65,8; H, 7,1; N, 10,4%.
Пример 80: Этиловый эфир 4-[2-[4-(4-пиридил)пиперазин- 1-ил]ацетил]феноксиуксусной кислоты
Этиловый эфир 4-бромацетилфеноксиуксусной кислоты (6,0 г) добавляют к перемешиваемому охлажденному (4oC) раствору 1-(4- пиридил)пиперазина (6,5 г) в ацетонитриле (225 мл). Перемешивают при температуре 4oC в течение 1 час, а затем оставляют перемешиваться на ночь при комнатной температуре и выпавший осадок отделяют фильтрованием. Фильтрат упаривают в вакууме и полученный остаток растирают с водой, отфильтровывают, промывают водой и сушат. Перекристаллизовывают из небольшого количества этанола и получают целевое соединение, 1,71 г, в виде твердого вещества кремового цвета с т.пл. 113-114oC; спектр ПМР (ДМСО- d6): δ 8,15 (2H, д), 7,98 (2H, д), 7,02 (2H, д), 6,80 (2H, д), 4,89 (2H, д), 4,17 (2H, квартет), 3,84 (2H, с), 3,32 (4H, т), 2,62 (4H, т), 1,22 (3H, т); масс-спектр: m/e 384 (M + H)+; вычислено для C21H25N3O4: C, 65,8; H, 6,6; N, 10,0; найдено: C, 65,5; H, 6,6; N, 10,8%.
Исходные соединения получают следующим образом.
(i) Этиловый эфир 4-ацетилфеноксиуксусной кислоты получают количественно в виде кристаллического вещества по методике, аналогичной приведенной для стадии (i) примера 67, взяв в качестве исходного соединения этиловый эфир бромуксусной кислоты.
Продукт используют без дальнейшей очистки.
(ii) Этиловый эфир 4-бромацетилфеноксиуксусной кислоты с выходом 47% получают в виде твердого вещества с т.пл. 41-42oC по методике, аналогичной приведенной для стадии (ii) примера 76, взяв в качестве исходного соединения продукт, полученный выше на стадии (i); спектр ПМР (ДМСО-d6): δ 7,90 (2H, д), 7,05 (2H, д), 4,90 (2H, с), 4,72 (2H, с), 4,18 (2H, квартет), 1,33 (3H, т).
Пример 81: изо-Пропиловый эфир 4-2-4-(4-пиридил)пиперазин-1-ил]aцeтил] фeнoкcиукcуcнoй кислоты
изо-Пропиловый эфир 4-бромацетилфеноксиуксусной кислоты (6,3 г) добавляют к перемешиваемому охлажденному (4oC) раствору 1-(4-пиридил)пиперазина (6,5 г) в ацетонитриле (225 мл). Перемешивают при температуре 4oC в течение 1 час, а затем оставляют перемешиваться на ночь при комнатной температуре и выпавший осадок отделяют фильтрованием. Фильтрат упаривают в вакууме и остаток выливают в смесь этилацетата и воды. Органическую фазу отделяют, сушат (над сульфатом магния) и упаривают. Очищают тонкослойной хроматографией на силикагеле, элюируя вначале смесями метанол/дихлорметан (от 0 до 10% об/об), а затем смесью толуол/этилацетат/0.88 гидроксид аммония/этанол (60:20:10:35 об/об/об/об), получая твердое вещество кремового цвета. Перекристаллизовывают из изопропанола и получают целевое соединение, 2,1 г, с т.пл. 121- 122oC; спектр ПМР (ДМСО-d6): δ 8,14 (2H, д), 7,98 (2H, д), 7,02 (2H, д), 6,80 (2H, д), 4,99 (1H, м), 4,85 (2H, с), 3,84 (2H, с), 3,33 (4H, т), 2,62 (4H, т), 1,22 (6H, д); масс-спектр: m/e 398 (М+H); вычислено для C22H27N3O4: C, 66,5; H, 6,9; N, 10,6; найдено: C, 65,8; H, 6,8; N, 10,4%.
Исходные соединения получают следующим образом.
(i) изо-Пропиловый эфир 4-ацетилфеноксиуксусной кислоты получают количественно в виде кристаллического вещества по методике, аналогичной приведенной для стадии (i) примера 67, взяв в качестве исходного соединения изо-пропиловый эфир бромуксусной кислоты. Продукт используют без дальнейшей очистки.
(ii) изо-Пропиловый эфир 4-бромацетилфеноксиуксусной кислоты с выходом 69% получают в виде твердого кристаллического вещества с т.пл. 64-66oC по методике, аналогичной приведенной для стадии (ii) примера 76, взяв в качестве исходного соединения продукт, полученный выше на стадии (i); спектр ПМР (ДМСО- d6): δ 7,98 (2H, д), 7,06 (2H, д), 4,99 (1H, м), 4,88 (2H, с), 4,83 (2H, с), 1,22 (3H, д).
Пример 82: трет-Бутиловый эфир 4-[2-[4-(4- пиридил)пиперазин-1-ил]ацетил]феноксиуксусной кислоты
Получают по методике, аналогичной приведенной в примере 80, взяв в качестве исходного соединения трет-бутиловый эфир 4- бромацетилфеноксиуксусной кислоты. После упаривания раствора в ацетонитриле остаток очищают колоночной хроматографией на силикагеле, элюируя смесью метанол/дихлорметан (от 0 до 5% об/об) и получают масло желтого цвета. Растирают с диэтиловым эфиром и с выходом 35% получают целевое соединение в виде твердого вещества с т.пл. 103-104oC; спектр ПМР (ДМСО-d6): δ 8,15 (2H, д), 7,98 (2H, д), 7,00 (2H, д), 6,82 (2H, д), 4,76 (2H, с), 3,84 (2H, с), 3,37 (4H, т), 2,62 (4H, т), 1,43 (9H, д); масс-спектр: m/e 412 (М + H)+; вычислено для C23H29N3O4: C, 67,1; H, 7,1; N, 10,2; найдено: C, 66,9; H, 7,3; N, 10,0%.
Исходные соединения получают следующим образом.
(i) трет-Бутиловый эфир 4-ацетилфеноксиуксусной кислоты получают с выходом 90% в виде кристаллического вещества с т.пл. 59-61oC 120 методике, аналогичной приведенной для стадии (i) примера 67, взяв в качестве исходного соединения трет-бутиловый эфир бромуксусной кислоты, спектр ПМР (ДМСО-d6 + уксусная кислота - d4): δ 7,94 (1H, д), 6,98 (2H, д), 4,21 (2H, с), 2,52 (3H, с), 1,44 (9H, с).
(ii) Раствор продукта, полученного выше на стадии (i) (3,3 г), и N-бромсукцинимида (2,35 г) в четыреххлористом углероде кипятят с обратным холодильником в течение 80 час. После охлаждения осадок отфильтровывают и фильтрат упаривают в вакууме. Полученное масло очищают тонкослойной хроматографией на силикагеле, элюируя смесью этилацетат/толуол (5% об/об), и получают трет-бутиловый эфир 4- бромацетилфеноксиуксусной кислоты, 1,9 г, в виде твердого кристаллического вещества (размягчается при температуре 110-116oC); спектр ПМР (ДМСО- d6): δ 7,97 (1H, д), 7,04 (2H, д), 4,84 (2H, с), 4,80 (2H/с), 1,43 (9H, с).
Пример 83: Неопентиловый эфир 4-[2-[4-(4-пиридил)пиперазин-1-ил]ацетил] феноксиуксусной кислоты
Получают по методике, аналогичной приведенной в примере 80, взяв в качестве исходного соединения неопентиловый эфир 4- бромацетилфеноксиуксусной кислоты. После упаривания фильтрата в ацетонитриле остаток очищают тонкослойной хроматографией на силикагеле, элюируя смесью метанол/дихлорметан (от 0 до 5% об/об) и получают масло. Его растирают со смесью диэтиловый эфир/гексан и с выходом 23% получают целевое соединение в виде твердого вещества с т. пл. 88-90oC; спектр ПМР (ДМСO-d6): δ 8,14 (2H, д), 7,98 (2H, д), 7,04 (2H, д), 6,81 (2H, д), 4,97 (2H, с), 3,83 (4H, с), 3,32 (4H, т), 2,61 (4H, т), 0,86 (9H, д); масс-спектр: m/e 426 (М + H)+; вычислено для C24H31N3O4: C, 67,7; H, 7,3; N, 9,9; найдено: C, 68,1; H, 7,4; N, 9,9%.
Исходные соединения получают следующим образом.
(i) К перемешиваемой суспензии 4-ацетилфеноксиуксусной кислоты (4,36 г) в дихлорметане (50 мл) добавляют хлористый оксалил (2,36 мл) и ДМФА (одну каплю). Смесь перемешивают в течение 1 час и растворитель упаривают в вакууме, получая масло желтого цвета (4,8 г). Раствор полученного масла в диэтиловом эфире добавляют по каплям к перемешиваемому раствору неопентилового спирта (2,18 г) и триэтиламина (3,4 мл) в диэтиловом эфире (50 мл). По окончании добавления смесь перемешивают еще в течение 18 час и осадок отфильтровывают. Фильтрат упаривают и остаток очищают тонкослойной хроматографией на силикагеле, элюируя дихлорметаном, и получают неопентиловый эфир 4- ацетилфеноксиуксусной кислоты, 5,1 г, в виде масла бледно-желтого цвета: спектр ПМР (хлороформ-d): δ 7,94 (2H, д), 6,95 (2H, д), 4,72 (2H, с), 3,91 (2H, с), 2,56 (3H, с), 0,93 (9H, с).
(ii) К перемешиваемому раствору продукта, полученного выше на стадии (i) (2,64 г), в хлороформе (25 мл) медленно в течение 10 минут добавляют раствор брома (0,52 мл) в хлороформе (10 мл). Перемешивание продолжают еще в течение 1 час и растворитель упаривают в вакууме. Остаток растирают со смесью диэтиловый эфир/гексан и получают неопентиловый эфир 4- бромацетилфеноксиуксусной кислоты, 2,3 г, в виде твердого кристаллического вещества с т.пл. 85-87oC.
Пример 84: Диметиловый эфир 4-[2-[4-(4-пиридил)пиперазин- -1-ил]ацетил] феноксималоновой кислоты
Получают по методике, аналогичной приведенной в примере 80, взяв в качестве исходного соединения диметиловый эфир 4- бромацетилфеноксималоновой кислоты. После упаривания фильтрата в ацетонитриле остаток выливают в смесь воды и дихлорметана. Органический слой сушат (над сульфатом магния), упаривают и очищают тонкослойной хроматографией на силикагеле, элюируя смесью метанол/дихлорметан (от 0 до 5% об/об), растирают с диэтиловым эфиром и с выходом 31% получают целевое соединение в виде твердого вещества бледно-желтого цвета с т.пл. 115-116oC; спектр ПМР (ДМСО-d6): δ 8,16 (2H, д), 8,02 (2H, д), 7,09 (2H, д), 6,82 (2H, д),-5,95 (1H, с), 3,86 (2H, с), 3,80 (6H, с), 3,34 (4H, т), 2,63 (41-1, т); масс-спектр: m/e 428 (М + H)+; вычислено для C22H25N3O6: C, 61,8; H, 5,9; N, 9,8; найдено: C, 61,3; H, 5,9; N, 9,2%.
Исходные соединения получают следующим образом.
(i) Диметиловый эфир 4-ацетилфеноксималоновой кислоты получают с выходом 53% в виде кристаллического вещества белого цвета с т.пл. 71-72oC по методике, аналогичной приведенной для стадии (i) примера 67, взяв в качестве исходного соединения диметиловый эфир броммалоновой кислоты; спектр ПМР (ДМСО-d6): δ 7,95 (1H, д), 7,09 (2H, д), 5,95 (1H, с), 3,78 (6H, с), 2,53 (3H, с); масс-спектр: m/e 267 (М + H)+; вычислено для C13H14O6: C, 58,6; H, 5,3; найдено: C, 58,9, H, 5,3%.
(ii) Диметиловый эфир 4-бромацетилфеноксималоновой кислоты получают с выходом 59% в виде твердого кристаллического вещества белого цвета с т.пл. 114-115oC по методике, аналогичной приведенной для стадии (ii) примера 76, взяв в качестве исходного соединения продукт, полученный ранее на стадии (i), и заменив этилацетат на метилацетат; спектр ПМР (ДМСО-d6): δ 7,99 (1H, д), 7,12 (2H, д), 5,99 (1H, с), 4,86 (2H, с), 3,80 (6H, с).
Пример 85: 4-[2-[4-(4-пиридил)пиперазин-1-ил]ацетил] феноксиацетамид
Раствор продукта, полученного по примеру 1 (200 мг), в метаноле (10 мл) под аргоном охлаждают до 4oC и насыщают сухим газообразным аммонием, затем закрывают в сосуде для проведения операции под давлением и оставляют на 2 дня. После фильтрования и промывки небольшим количеством метанола получают кристаллы оранжевого цвета, 140 мг, с т.пл. 247-248oC; спектр ПМР (ДМСО- d6): δ 8,16 (2H, д), 7,99 (2H, д), 7,55 (1H, с), 7,37 (1H, уширенный с), 7,02 (2H, д), 6,81 (2H, д), 4,54 (2H, с), 3,85 (2H, с), 3,33 (4H, т), 2,60 (4H, т); масс-спектр: m/e 355 (М + H)+; вычислено для C19H22N4O3: C, 64,4; H, 6,3; N, 15,8; найдено: C, 64,4; H, 6,4; N, 15,6%.
Пример 86: 2-[4-[2-[4-(4-пиридил)пиперазин-1-ил]ацетил]фенокси]-N-метилацетамид
Суспензию продукта, полученного по примеру 1 (100 мг), в 33%-ном растворе метиламина в этаноле (3 мл) перемешивают в течение 18 час. Из полученного твердого вещества после фильтрования и промывки небольшим количеством этилацетата получают целевое соединение, 65 мг, с т.пл. 169-171oC; спектр ПМР (ДМСО-d6): δ 8,14 (2H, д), 8,06 (1H, уширенный квартет), 8,00 (2H, д), 7,05 (2H, д), 6,80 (2H, д), 4,56 (2H, с), 3,82 (2H, с), 3,30 (4H, т), 2,66 (4H, т); масс-спектр: m/e 369 (М + H)+; вычислено для C20H24N4O3: C, 65,2; H, 6,6; N, 15,2; найдено: C, 65,0; H, 6,8; N, 15,1%.
Пример 87: 2-[4-[2-[4-(4-пиридил)пиперазин-1-ил]ацетил]фенокси]-N -(2-метоксиэтил)ацетамид
Суспензию продукта, полученного по примеру 1 (100 мг), в 2-метоксиэтиламина (1 мл) перемешивают в течение 18 час. После фильтрования и промывки полученного твердого вещества этилацетатом получают целевое соединение, 70 мг, в виде кристаллического вещества белого цвета с т.пл. 142-145oC; спектр ПМР (ДМСО-d + уксусная кислота - d6): δ 8,20 (2H, д), 8,00 (2H, д), 7,14 (2H, д), 7,06 (2H, д), 4,62 (2H, с), 3,72 (4H, т), 3,38 (4H, м), 3,26 (3H, с), 2,78 (4H, т); масс- спектр: m/e 413 (М + H)+; вычислено для C22H28N4O4: C, 64,1; H, 6,8; N, 13,6;. найдено: C, 63,9; H, 6,8; N, 13,3%.
Пример 88: 2-[4-[2-[4-(4-пиридил)пиперазин-1- ил] ацетил]фенокси]-N-(фенилметил)ацетамид
Раствор 2-[4-(бромацетил)фенокси] -N-(фенилметил)ацетамида (1,40 г) (получают по методике, приведенной в Европейской патентной заявке 052442) в ацетонитриле (5 мл) добавляют к перемешиваемому раствору 1-(4-пиридин)пиперазина (1,14 г) в ацетонитриле (20 мл). Оставляют перемешиваться на ночь, жидкость над смолообразным осадком декантируют и упаривают в вакууме. Очищают тонкослойной хроматографией на силикагеле, элюируя смесями метанол/дихлорметан (от 2 до 5% об/об), и получают твердое вещество. Его растирают с диэтиловым эфиром и получают целевое соединение, 95 мг с т.пл. 150-151oC; спектр ПМР (ДМСО-d6): δ 8,67 (1H, уширенный т), 8,15 (2H, д), 8,00 (2H, д), 7,26 (5H, м), 7,06 (2H, д), 6,81 (2H, д), 4,66 (2H, с), 4,34 (2H, д), 3,84 (2H, с), 3,33 (4H, т), 2,54 (4H, т); масс-спектр: m/e 445 (М+H)+; вычислено для C26H28N4O3•0,25H2O: C, 69,5; H, 6,4; N, 12,5; найдено: C, 69,6; H, 6,4; N, 12,3%.
Пример 89: Метиловый эфир N-[4-[2-[4-(4-пиридил)пиперазин-1-ил] ацетил] феноксиацетил]глициновой кислоты
Раствор метилового эфира N-[4-(бромацетил)феноксиацетил] глициновой кислоты (0,85 г) в ацетонитриле (10 мл) добавляют к перемешиваемому раствору 1-(4-пиридил)пиперазина (0,81 г) в ацетонитриле (30 мл). Оставляют перемешиваться на ночь, растворитель упаривают в вакууме и остаток выливают в смесь воды и этилацетата. Органический слой отделяют, промывают водой, сушат (над сульфатом магния) и упаривают. Остаток очищают тонкослойной хроматографией на силикагеле, элюируя смесями метанол/дихлорметан (от 0 до 7,5% об/об). Фракции упаривают и получают целевое соединение, 130 мг, в виде пенообразного вещества; спектр ПМР (ДМСО-d6): δ 8,58 (1H, т), 8,16 (2H, д), 8,01 (2H, д), 7,08 (2H, д), 6,83 (2H, д), 5,75 (1H, с), 4,68 (2H, с), 3,92 (2H, д), 3,84 (2H, с), 3,65 (3H, с), 3,34 (4H, т + H2O), 2,65 (4H, т); масс-спектр: m/e 427 (М + H); вычислено для C22H26N4O5•0,5CH2Cl2: C, 57,6; H, 5,8; N, 11,9; найдено, 57,8; H, 5,7; N, 12,0%.
Исходные соединения получают следующим образом.
(i) К перемешиваемой суспензии 4-(ацетил)феноксиуксусной кислоты (3,00 г) в дихлорметане (40 мл) добавляют хлористый оксалил (1,62 мл) и одну каплю ДМФА. Перемешивают в течение 1,5 час и полученный прозрачный раствор упаривают, получая масло (I). К охлажденной (4oC) суспензии гидрохлорида метилового эфира глицина (1,95 г) в дихлорметане (25 мл) в атмосфере аргона медленно добавляют при перемешивании триэтиламин (4,30 мл). Перемешивают 10 минут и добавляют раствор вещества (I) в дихлорметане (10 мл) и перемешивают полученную смесь в течение 2 час. Осадок отфильтровывают и фильтрат упаривают в вакууме. Очищают остаток тонкослойной хроматографией на силикагеле, элюируя смесью метанол/дихлорметан (2% об/об), и получают твердое вещество. Его растирают со смесью эфир/гексан и выделяют метиловый эфир N-[4-ацетилфеноксиацетил] глицина, 3,1 г, в виде кристаллов белого цвета с т.пл. 120-121oC; спектр ПМР (ДМСО-d6): δ 8,57 (1H, т), 7,94 (2H, д), 7,07 (2H, д), 4,66 (2H, с), 3,92 (2H, с), 3,64 (3H, с), 2,52 (3H, с); масс-спектр: m/e 266 (М + H)+; вычислено для C13H15NO5: C, 58,9; H, 5,7; N, 5,3; найдено: C, 58,4; H, 5,5; N, 5,0%.
(ii) Продукт, полученный на стадии (i) (3,00 г), и N-бромсукцинимид (2,02 г) в четыреххлористом углероде (50 мл) кипятят с обратным холодильником в течение 64 час. Растворитель упаривают и остаток черного цвета растворяют в смеси метанол/этилацетат, обрабатывают активированным углем, отфильтровывают и упаривают. Полученное масло черного цвета очищают тонкослойной хроматографией на силикагеле, элюируя дихлорметаном. Растирают с гексаном и получают метиловый эфир N-[4- (бромацетил)феноксиацетил]глицина, 0,885 г, в виде твердого вещества, которое размягчается при температуре 109-111oC; спектр ПМР (ДМСО-d6): δ 8,60 (1H, т), 7,99 (2H, д), 7,09 (2H, д), 4,84 (2H, с), 4,69 (2H, с), 3,91 (2H, д), 3,64 (3H, с).
Пример 90: Метиловый эфир 4-[2-[4-(4-пиридил)пиперазин-1- ил]этил]феноксиуксусной кислоты
Смесь метилового эфира 4-[1-(2-метансульфонилоксиэтил] феноксиуксусной кислоты (2,0 г) и 1-(4-пиридил)пиперазина (2,26 г) в ацетонитриле кипятят с обратным холодильником в течение 25 час. Растворитель удаляют в вакууме и остаток очищают колоночной хроматографией на силикагеле, элюируя последовательно смесями 2,5, 3, 3,5 и 4% об/об метанол/дихлорметан. Нужные фракции отбирают и растирают с диэтиловым эфиром, получая целевое соединение, 600 мг; перекристаллизовывают из метанола и получают кристаллы белого цвета с т. пл. 104-105oC; спектр ПМР (ДМСО-d6): δ 8,15 (2H, д), 7,15 (2H, д), 6,86 (2H, д), 6,82 (2H, д), 4,74 (2H, с), 3,69 (3H, с), 3,30 (4H, т.2H + H2O), 2,71 (2H, м), 2,54 (4H, т); масс-спектр: m/e 356 (М+H)+; вычислено для C20H25N3O3: C, 66,7; H, 7,1; N, 11,7; найдено: C, 67,0; H, 7,2; N, 11,4%.
Исходные соединения получают следующим образом.
(i) Смесь 4-гидроксифенэтилового эфира (5,37 г), безводного карбоната калия (5,37 г) и метилового эфира бромуксусной кислоты (3,80 мл) в безводном ацетоне (50 мл) перемешивают в течение 18 час. Смесь отфильтровывают, упаривают и из остатка после очистки тонкослойной хроматографией на силикагеле, элюируя смесью метанол/дихлорметан (2% об/об), получают метиловый эфир 4-[1- (2-гидроксиэтил)] феноксиуксусной кислоты, 5,05,г, в виде масла; спектр ПМР (хлороформ-d); δ 7,15 (2H, д), 6,86 (2H, д), 4,62 (2H, с), 3,84 (2H, м), 3,80 (3H, с), 2,81 (2H, т), 1,40 (1H, уширенный т); масс-спектр: m/e 210 (М)+; вычислено для C11H14O4: C, 62,8; H, 6,7; найдено: C, 62,8; H, 6,8%.
(ii) Метансульфохлорид (0,98 мл) добавляют в атмосфере аргона по каплям в течение 30 минут к перемешиваемому и охлажденному (4oC) раствору продукта, полученного на стадии (i) (2,22 г), и триэтиламина (1,91 мл) в дихлорметане (35 мл). Через 2 час растворитель упаривают и остаток выливают в смесь этилацетата (75 мл) и воды (20 мл). Органический слой отделяют, промывают насыщенным раствором хлорида натрия (3 х 15 мл), сушат (над сульфатом магния) и упаривают. Остаток очищают тонкослойной хроматографией на силикагеле, элюируя смесями этилацетат/гексан (45% об/об), и получают метиловый эфир 4-[1- (2-метансульфонилоксиэтил)] феноксиуксусной кислоты, 2,85 г, в виде масла; спектр ПМР (хлороформ-d): δ 7,16 (2H, д), 6,87 (2H, д), 4,62 (211, с), 4,38 (2H, т), 3,81 (3H, с), 3,00 (2H, т), 2,85 (3H, с); масс-спектр: m/e 288 (М)+; вычислено для C12H16O6S: C, 50,0; H, 5,6; S, 11,1; найдено: C, 50,1; H, 5,5; S, 11,0%.
Пример 31: Дигидрохлорид 4-[2-[4-(4-пиридил]пиперазин-1-ил]этил]феноксиуксусной кислоты
Целевое соединение с выходом 95% получают по методике, аналогичной приведенной в примере 71, взяв в качестве исходного соединения продукт, полученный по примеру 90; т.пл. 270-273oC; спектр ПМР (ДМСО-d6 + уксусная кислота - d4): δ 8,34 (2H, д), 7,30 (2H, д), 7,22 (2H, д), 6,91 (2H, д), 4,67 (2H, с), 4,06 (4H, ш), 3,46 (4H, ш), 3,35 (2H, м), 3,05 (2H, м); масс-спектр: m/e 342 (М + H)+; вычислено для C19H22N3O3•2HCl: C, 55,0; H, 6,5; N, 10,1; найдено: C, 54,8; H, 6,2; N, 9,8%.
Пример 92: трет-Бутиловый эфир 4-[2-[4-(4-пиридил)пиперазин-1-ил]карбонилметил]феноксиуксусной кислоты
Аналогично методике, приведенной для стадии (iv) примера 18, взяв в качестве исходного соединения трет-бутиловый эфир 4-(карбоксиметил)феноксиуксусной кислоты и очищая методом тонкослойной хроматографии на силикагеле (элюируют смесями метанол/дихлорметан от 0 до 5% об/об) получают смолу. После дальнейшей очистки методом тонкослойной хроматографии на нейтральном оксиде алюминия, элюируя смесью метанол/дихлорметан (1% об/об), с последующим растиранием с диэтиловым эфиром с выходом 17% получают целевое соединение в виде твердого вещества белого цвета с т.пл. 110-112oC; спектр ПМР (ДМСО- d6): δ 8,22 (2H, д), 7,15 (2H, д), 7,06 (2H, д), 6,83 (2H, д), 4,60 (2H, с), 3,70 (2H, с), 3,62 (4H, уширенный т), 3,38 (4H, уширенный т + H2O), 1,42 (9H, с); масс-спектр: m/e 412 (М+ H); вычислено для C23H29N3O4•0,25H2O: C, 66,4; H, 7,1; N, 10,1; найдено: C, 86,4; H, 7,2; N, 10,1%.
Исходные соединения получают следующим образом.
(i) Гидрид натром (50%-ная дисперсия в минеральном масле, 3,7 г) промывают несколько раз в атмосфере аргона свежими порциями гексана. Остаток, освобожденный от масла, суспендируют в сухом ДМФА (100 мл) и при перемешивании и при охлаждении (4oC) порциями добавляют 4-гидроксифенилуксусную кислоту (13,0 г). Перемешивание продолжают в течение 30 минут, а затем по каплям добавляют бромистый бензил (9,2 мл) и перемешивание продолжают при температуре 4oC еще в течение 1 час, а затем оставляют перемешиваться на ночь при комнатной температуре. Растворитель упаривают и остаток выливают в смесь этилацетата и воды. Органический слой отделяют, водную фазу дважды экстрагируют этилацетатом, органические вытяжки объединяют, промывают водой и насыщенным раствором соли, сушат (над сульфатом магния) и упаривают. Из кристаллического продукта выделяют бензиловый эфир 4-гидроксифенилуксусной кислоты, 17,8 г, в виде кристаллов беловатого цвета с т.пл. 70-72oC; спектр ПМР (хлороформ-d): δ 7,32 (5H, м), 7,14 (2H, д), 6,76 (2H, д), 5,12 (2H, с), 3,59 (2H, с); масс-спектр: m/e 242 (М.)+.
(ii) Гидрид натрия (50%-ная дисперсия в минеральном масле, 2,1 г) промывают несколько раз в атмосфере аргона свежими порциями гексана. Остаток, освобожденный от масла, суспендируют в сухом ДМФА (130 мл) и при перемешивании и при охлаждении (4oC) в три приема добавляют продукт, полученный на стадии (i) (10 г). Перемешивание продолжают еще в течение 15 минут, а затем по каплям в течение 15 минут добавляют трет-бутиловый эфир бромуксусной кислоты (7,0 мл). Перемешивание продолжают при температуре 4oC еще в течение 1 час, а затем 6 час при комнатной температуре. Растворитель упаривают и остаток выливают в смесь этилацетата и воды. Органический слой отделяют, водную фазу дважды экстрагируют этилацетатом, органические вытяжки объединяют, промывают водой и насыщенным раствором соли, сушат (над сульфатом магния) и упаривают. Из остатка после очистки тонкослойной хроматографией на силикагеле, элюируя дихлорметаном, получают трет-бутиловый эфир 4-(бензилоксикарбонилметил)феноксиуксусной кислоты, 7,5 г, в виде бесцветного масла; спектр ПМР (хлороформ-d): δ 7,31 (5H, м), 7,20 (2H, д), 6,85 (2H, м), 5,12 (2H, с), 4,49 (2H, с), 3,60 (2H, с), 1,48 (9H, с); масс-спектр: m/e 356 (М.)+.
(iii) трет-Бутиловый эфир 4- (карбоксиметил)феноксиуксусной кислоты с выходом 96% получают в виде твердого кристаллического вещества белого цвета с т. пл. 78-80oC по методике, аналогичной приведенной для стадии (iii) примера 18, взяв в качестве исходного соединения продукт, полученный выше на стадии (ii); спектр ПМР (ДМСО-d6): δ 7,15 (2H, д), 6,82 (2H, д), 4,60 (2H, с), 3,48 (2H, с), 1,43 (9H, с); масс- спектр: m/e 266 (М.)+; вычислено для C14H18O5•0,75H2O: C, 60,1; H, 7,0; найдено: C, 59,9; H, 7,2%.
Пример 93: Дигидрохлорид 4-[2-[4-(4-пиридил)пиперазин-1- ил]карбонилметил]феноксиуксусной кислоты
Раствор продукта, полученного в примере 92 (50 мг), в смеси диоксан (1 мл), вода (2 мл) и 1М раствор соляной кислоты (0,61 мл) оставляют нагреваться на ночь при температуре 90oC. Полученный раствор разбавляют водой, подвергают сублимационной сушке и получают целевое соединение, 320 мг, в виде пенообразного вещества желтого цвета; спектр ПМР (ДМСО-d6 + уксусная кислота - d4): δ 8,31 (2H, д), 7,24 (2H, д), 7,18 (2H, д), 6,87 (2H, м), 4,64 (2H, с), 3,96 (4H, т), 3,72 (2H, с), 3,32 (4H, т); масс-спектр: m/e 356 (М + H)+; вычислено для C19H21N3O4•2HCl•2,5H2O: C, 48,2; H, 5,9; N, 8,9; найдено: C, 48,5; H, 6,0; N, 8,8%.
Пример 94: Метиловый эфир 4-[2-[4-(2-метилпирид-4-ил) пиперазин-1-ил] ацетил]феноксиуксусной кислоты
Метиловый эфир 4-бромацетилфеноксиуксусной кислоты (1,72, г) добавляют к перемешиваемой смеси дигидрохлорида 1-[4-(2-метилпирид- 4-ил)]пиперазина (1,5 г) и триэтиламина (2,5 мл) в ацетонитриле (25 мл). Оставляют перемешиваться на ночь и растворитель упаривают в вакууме. Очищают тонкослойной хроматографией, вначале на силикагеле, элюируя смесью метанол/дихлорметан (10% об/об), а затем на нейтральном оксиде алюминия, элюируя смесью метанол/дихлорметан (1% об/об), и получают целевое соединение, 418 мг, в виде твердого вещества белого цвета с т.пл. 155-157oC; спектр ПМР (ДМСО-d6): δ 8,00 (3H, м), 7,04 (2H, д), 6,70 (1H, д), 6,64 (1H, два д), 4,92 (2H, с), 3,83 (2H, с), 3,71 (3H, с), 3,30 (4H, ш + H2O), 2,61 (4H, т), 2,32 (3H, с); масс-спектр: m/e 384 (М + H)+: вычислено для C21H25N3O4: C, 65,8; H, 6,6; N, 11,0; найдено: C, 65,4; H, 6,8; N, 10,9%.
Исходные соединения получают следующим образом.
(i) Смесь 4-хлор-2-пиколина (5 г) и 1-бензилпиперазина (13,6 мл) в ксилоле (50 мл) кипятят с обратным холодильником в течение 18 час. Раствор охлаждают, твердое вещество отфильтровывают и фильтрат упаривают в вакууме. Очищают тонкослойной хроматографией на силикагеле, элюируя смесью метанол/дихлорметан (20% об/об), и получают 4-[4-(2-пиколил)]-1- бензилпиперазин, 9,54 г, в виде кристаллического вещества светло-коричневого цвета с т. пл. 94-95oC; спектр ПМР (хлороформ-d): δ 8,15 (1H, д), 7,30 (5H, м), 6,51 (2H, м), 3,57 (2H, с), 3,44 (4H, т), 2,57 (4H, т), 2,46 (3H, с); масс- спектр: m/e 268 (М+H)+; вычислено для C17H21N3: C, 76,4; H, 7,9; N, 15,7; найдено: C, 75,7; H, 8,1; N, 15,7%.
(ii) 10%-ный палладий на активированном угле (1,5 г) добавляют к перемешиваемому раствору продукта, полученного на стадии (i) (9,00 г), и 2М раствора соляной кислоты (34 мл) в метаноле (180 мл) и гидрируют при комнатной температуре и нормальном давлении до тех пор, пока не поглотится теоретическое количество водорода. Добавляют активированный уголь, перемешивают смесь в течение 5 минут и фильтруют через диатомитовую землю, фильтрат упаривают досуха и получают дигидрохлорид 1-[4-(2-метилпирид-4-ил)]пиперазина, 10,6 г, в виде твердого вещества светло-коричневого цвета с т.пл. 64-68oC; спектр ПМР (ДМСО-d6): δ 8,20 (1H, д), 7,18 (1H, д), 7,12 (1H, два д), 3,92 (4H, т), 2,19 (4H, т), 2,51 (3H, с + ДМСО); масс-спектр: m/e 178 (М + H)+; вычислено для C10H15N3•2HCl•0,75H2O: C, 45,5; H, 7,0; N, 15,9; найдено: C, 45,3; H, 7,0; N, 15,8%.
Пример 95: Дигидробромид 4-[2-[4-(2-метилпирид-4-ил)пиперазин-1-ил]ацетил]феноксиуксусной кислоты
Смесь продукта, полученного по примеру 94 (160 мг), 48%-ной бромистоводородной кислоты (0,25 мл) и диоксана (1 мл) в воде (3 мл) нагревают до температуры 90oC в течение 30 минут. Раствор охлаждают, добавляют дополнительное количество воды и подвергают смесь сублимационной сушке. Остаток растирают с абсолютным этанолом и получают целевое соединение, 50 мг, в виде твердого вещества светло-коричневого цвета с т.пл. 146-148oC; спектр ПМР (ДМСО-d6 + уксусная кислота - d4): δ 8,17 (1H, д), 7,95 (2H, д), 7,09 (4.4, м), 4,94 (2H, с), t,78 (2H, с), 3,99 (4H, ш), 3,07 (1H, квартет), 2,46 (3H, с), 1,17 (1,5H, т); масс-спектр: m/e 370 (М + H)+; вычислено для C20H23N3O4•2HBr•H2O: C, 44,1; H, 5,3; N, 7,3; найдено: C, 44,0; H, 5,4; N, 7,2.
Пример 96: Метиловый эфир 4-[1-(4-пиридил)пиперидин-4-ил]оксифеноксиуксусной кислоты
Диэтиловый эфир азодикарбоновой кислоты (0,47 мл) добавляют до каплям в течение 30 минут к перемешиваемой смеси 1-(4- пиридил)-4-пиперидинола (534 мг), метилового эфира 4- гидроксифеноксиуксусной кислоты (546 мг), трифенилфосфина (787 мг) и сухого ТГФ (30 мл) в атмосфере аргона и охлаждают до 4oC. Перемешивают 1 час при температуре 4oC, дают смеси нагреться до комнатной температуры и перемешивают еще в течение 48 час. Растворитель удаляют упариванием и остаток очищают тонкослойной хроматографией на силикагеле, элюируя смесью метанол/дихлорметан (5% об/об). Перекристаллизовывают из смеси этилацетат/гексан и получают целевое соединение 532 мг, в виде твердого вещества белого цвета с т.пл. 74-76oC; спектр ПМР (ДМСО-d6): δ 8,15 (3H, уширенный д), 6,89 (6H, м), 4,71 (2H, с), 4,50 (1H, м), 3,70 (2H, м), 3,69 (3H, с), 3,23 (2H, м), 1,96 (2H, м), 1,62 (2H, м); масс-спектр: m/e 343 (М + H)+; вычислено для C19H22N2O4: C, 66,7; H, 6,5; N, 8,2; найдено: C, 66,2; H, 6,7; N, 8,2%.
Пример 97: 4-[1-(4-пиpидил)пипepидин-4-ил]оксифеноксиуксусная кислота
Целевое соединение с выходом 85% получают по методике, аналогичной приведенной в примере 2, взяв в качестве исходного соединения продукт, полученный по примеру 96; т.пл. 288- 291oC; спектр ПМР (NaOD + ДМСО-d6): δ 7,97 (2H, д), 6,77 (4H, м), 6,69 (2H, д), 4,35 (1H, м), 4,19 (2H, с), 3,53 (2H, м), 3,08 (2H, м), 1,82 (2H, м), 1,49 (2H, м); масс-спектр: m/e 329 (М + H)+; вычислено для C18H20N2O4: C, 65,8; H, 6,1; N, 8,5; найдено: C, 65,7; H, 6,3; N, 8,4%.
Пример 98: Метиловый эфир 4-[1-(4-пиридил)пиперидин-4- ил]метоксифеноксиуксусной кислоты
Целевое соединение с выходом 18% получают по методике, аналогичной приведенной в примере 96, взяв в качестве исходного соединения 4-(4-гидроксиметилпиперидин-1-ил)пиридин; т. пл. 127-129oC; спектр ПМР (ДМСО-d6) δ 8,12 (3H, д), 6,84 (4H, с), 6,81 (2H, д), 4,70 (2H, с), 3,36 (2H, уширенный д), 3,79 (2H, д), 3,70 (3H, с), 2,88 (2H, два т), 2,01 (1H, м), 1,82 (2H, уширенный д), 1,30 (2H, м); масс-спектр: m/e 357 (М + H)+; вычислено для C20H24N2O4•0,5H2O: C, 65,7; H, 6,9; N, 7,7; найдено: 0, 66,1; 6,9; N, 7,8%.
Пример 99: 4-[1-(4-пиридил)пиперидин-4-ил]метоксифеноксиуксусная кислота
Целевое соединение с выходом 86% получают по методике, аналогичной приведенной в примере 2, взяв в качестве исходного соединения продукт, полученный по примеру 98; т.пл. 278-281oC; спектр ПМР (ДМСО-d6 + ТФК): δ 8,09 (2H, т), 7,08 (2H, д), 6,78 (4H, с), 4,50 (2H, с), 4,20 (2H, уширенный д), 3,74 (2H, д), 3,17 (2H, уширенный т), 2,12 (1H, м), 1,91 (2H, два м), 1,32 (2H, м); масс-спектр: m/e 343 (М + H)+; вычислено для C19H22N2O4•0,25H2O: C, 65,8; H, 6,5; N, 8,1; найдено: C, 66,0; H, 6,6; N, 8,0%.
Пример 100: Метиловый эфир 4-[2-[1-(4-пиридил)пиперидин-4-ил]этоксифеноксиуксусной кислоты
Целевое соединение с выходом 65% получают по методике, аналогичной приведенной в примере 96, взяв в качестве исходного соединения 4-(4-гидроксиэтилпиперидин-1-ил)пиридин; т.пл. 86-88oC; спектр ПМР (ДМСО-d6): δ 8,11 (2H, д), 6,85 (4H, с), 6,79 (2H, д), 4,70 (2H, с), 3,96 (2H, т), 3,92 (2H, уширенный д), 3,69 (3H, с), 2,81 (2H, два т), 1,78 (2H, уширенный д),. 1,65 (2H, квартет), 1,20 (2H, м); масс-спектр: m/e 371 (М+H)+; вычислено для C21H26N2O4: C, 68,1; H, 7,1; N, 7,6; найдено: C, 67,5; H, 7,3; N, 7,5%.
Пример 101: 4-[1-(4-пиридил)пиперидин-4-ил]этоксифеноксиуксусная кислота
Целевое соединение с выходом 74% получают по методике, аналогичной приведенной в примере 2, взяв в качестве исходного соединения продукт, полученный по примеру 100; т.пл. 247- 249oC; спектр ПМР (ДМСО-d6 + ТФК) δ 8,19 (2H, т), 7,19 (2H, д), 6,38 (4H, с), 4,60 (2H, с), 4,25 (2H, уширенный д), 4,01 (2H, т), 3,20 (2H, два т), 1,93 (3H, м), 1,70 (2H, квартет), 1,28 (2H, м); масс-спектр: m/e 357 (М + H)+; вычислено для C20H24N2O4: C, 67,4; H, 6,8; N, 7,9; найдено: C, 67,0; H, 6,8; N, 7,7%.
Пример 102: Метиловый эфир 3-[4-[1-(4-пиридил)пиперидин- 4-ил]метоксифенил]пропионовой кислоты
Целевое соединение с выходом 14% получают по методике, аналогичной приведенной в примере 96, взяв в качестве исходных соединений 4-(4-гидроксиметилпиперидин-1-ил)пиридина и метиловый эфир 3-(4-гидроксифенил)пропионовой кислоты; т. пл. 96,5-98,5oC; спектр ПМР (ДМСО-d6): δ 8,13 (2H, д), 7,11 (2H, д), 6,83 (411, м), 3,97 (2H, два м), 3,81 (2H, д), 3,56 (3H, с), 2,87 (2H, два т), 2,77 (2H, т), 2,57 (2H, т), 2,01 (1H, м), 1,84 (2H, м), 1,30 (2H, м); масс-спектр: m/e 355 (М + H)+; вычислено для C21H26N2O3•0,75H2O: C, 68,5; H, 7,2; N, 7,8; найдено: C, 68,5; H, 7,5; N, 7,6%.
Пример 103: 3-[4-[1-(4-пиридил)пиперидин-4-ил]метоксифенил]пропионовой кислоты
Целевое соединение с выходом 80% получают по методике, аналогичной приведенной в примере 2, взяв в качестве исходного соединения продукт, полученный по примеру 102; т.пл. 303-307oC; спектр ПМР (ДМСО-d6 + ТФК): δ 8,20 (2H, д), 7,25 (6H, м), 4,31 (2H, два м), 3,88 (2H, д), 3,27 (2H, уширенный т), 2,82 (2H, т), 2,52 (2H, т), 2,25 (1H, м), 2,00 (2H, уширенный д), 1,40 (2H, м); масс-спектр: m/e 341 (М + H)+; вычислено для C20H24N2O3•0,25H2O: C, 69,6; H, 7,2; N, 8,1; найдено: C, 69,6; H, 7,2; N, 8,0%.
Пример 104: Гидрохлорид метилового эфира 4-[[1-(4-пиридил) пиперидин-4-ил]карбоксамидо]феноксиуксусной кислоты
Хлористый тионил (5 мл) добавляют по каплям в течение десяти минут к перемешиваемой суспензии 1-(4-пиридил)-4- пиперидинкарбоновой кислоты (2,06 г) в сухом дихлорметане (20 мл) при температуре 4oC. Перемешивают при указанной температуре в течение 1 час, а затем смеси дают нагреться до комнатной температуры и перемешивают в течение 16 час. Растворитель упаривают и остаток сушат в глубоком вакууме, получая твердое пенообразное вещество (2,84 г).
К перемешиваемой суспензии гидрохлорида метилового эфира 4- аминофеноксиуксусной кислоты (544 мг) в сухом дихлорметане (10 мл) добавляют триэтиламин (0,70 мл). Перемешивают в течение 1 час, охлаждают смесь до 4oC и добавляют пенообразное вещество (0,71 г). Перемешивают при температуре 4oC в течение 1 час, дают смеси нагреться до комнатной температуры и перемешивают в течение 16 час. Выпавшее твердое вещество выделяют, промывают дихлорметаном и перекристаллизовывают из воды, получая целевое соединение, 744 мг, с т. пл. 233-234,5oC; спектр ПМР (ДМСО - d6): δ 3,56 (1H, ш), 9,98 (1H, с), 8,21 (2H, д), 7,51 (2H, д), 7,20 (2H, д), 6,85 (2H, д), 4,72 (2H, с), 4,25 (2H, уширенный д), 3,69 (3H, д), 3,27 (2H + H2O), 2,78 (1H, м), 1,97 (2H, м), 1,67 (2H, м); масс-спектр: m/e 370 (М + H)+; вычислено для C20H23N3O4•HCl: C, 59,2; H, 6,0; N, 10,4; найдено: C, 58,8; 6,1; N, 10,3%.
Пример 105: 4-4-[[1-[1-(4-пиридил)пиперидин-4-ил]карбоксамидо]феноксиуксусная кислота
Целевое соединение с выходом 69% получают по методике, аналогичной приведенной в примере 2, взяв в качестве исходного
соединения продукт, полученный по примеру 104; т.пл. 285-287oC; спектр ПМР (NaOD): δ 8,30 (2H, д), 7,44 (2H, д), 7,07 (2H, д), 7,04 (2H, д), 4,60 (2H, с), 4,14 (2H, уширенный д), 3,11 (3H, два т), 2,81 (1H, м), 2,11 (2H, уширенный д), 1,88 (2H, квартет); масс-спектр: m/e 356 (М + H)+; вычислено для C19H21N3O4•H2O: C, 61,1; H, 6,2; N, 11,3; найдено: C, 60,9; H, 6,2; N, 11,0%.
Пример 106: Метиловый эфир 4-[2-[1-(4-пиридил)пиперидин- 4-ил]ацетамидо] феноксиуксусной кислоты
К перемешиваемому раствору гидрохлорида 1-(4-пиридилпиперидин-4-ил) уксусной кислоты (400 мг) в сухой ДМФА (5 мл) добавляют N,N'-ди-изо-пропилэтиламин (1,1 мл), HOBT (240 мг), гексафторфосфат 2-(1H-бензотриазол-1-ил)-1,1,3,3- тетраметил-урония (600 мг). Через 15 минут добавляют метиловый эфир 4-аминофеноксиуксусной кислоты (280 мг) и оставляют перемешиваться на ночь. Реакционную смесь приливают к этилацетату (100 мл) и полученную смесь промывают водой, 10%-ным раствором бисульфата натрия, насыщенным раствором соли, сушат (над сульфатом магния) и упаривают. Полученную смолу очищают методом тонкослойной хроматографии, вначале на силикагеле, элюируя смесями метанол/дихлорметан (от 0 до 5% об/об), а затем на нейтральном оксиде алюминия, элюируя смесью метанол/дихлорметан (2% об/об), растирают с диэтиловым эфиром и получают целевое соединение, 55 мг, в виде твердого вещества беловатого цвета с т.пл. 155-157oC; спектр ПМР (ДМСО-d6): δ 9,74 (1H, с), 8,11 (2H, д), 7,48 (2H, д), 6,86 (2H, д), 6,79 (2H, д), 4,73 (2H, с), 3,91 (2H, уширенный д), 3,70 (3H, с), 2,84 (2H, два т), 2,21 (2H, м), 2,03 (1H, м), 1,72 (2H, уширенный д), 1,22 (2H, два квартета); масс-спектр: m/e 384 (М + H)+; вычислено для C21H25N3O4•0,5H2O: C, 64,5; H, 6,6; N, 10,7; наведено: C, 64,7; H, 6,8; N, 10,8%.
Исходные соединения получают следующим образом.
(i) Суспензию гидрида натрия (50%-ная дисперсия в минеральном масле, 4,8 г, 0,1 моль) в диметоксиэтане (300 мл) охлаждают при перемешивании в бане со льдом и в атмосфере аргона добавляют порциями триэтиловый эфир фосфоноуксусной кислоты (19,82 мл, 0,1 моль). Перемешивают в течение 1 час, поддерживая температуру < 5oC. Охлаждающую баню удаляют и по каплям добавляют N-бензилпиперидон (17,85 мл, 0,1 моль). Оставляют смесь перемешиваться на ночь при комнатной температуре, разбавляют водой (500 мл) и экстрагируют эфиром (3 х 200 мл). Органические вытяжки объединяют, промывают водой (200 мл) и насыщенным раствором соли (100 мл), сушат (над сульфатом магния) и упаривают при пониженном давлении. Остаток очищают хроматографически (испарительная колоночная хроматография, элюируют смесью гексан/этилацетат; 3:2) и получают этиловый эфир 4-карбоксиметилен-N-бензилпиперидина (5,52 г) в виде желтого масла; спектр ПМР (хлороформ-d): δ 1,1 (3H, т), 2,2 (2H, т), 2,4 (4H, м), 3,4 (2H, с), 4,0 (2H, квартет), 5,6 (1H, с), 7,2 (5H, м); масс-спектр: m/e 260 (М+H)+.
(ii) Раствор этилового эфира 4-карбоксиметилен-N-бензилпиперидина (5,5 г, 21 ммол) в этаноле (250 мл) перемешивают с 10%-ным палладием на угле в атмосфере водорода до тех пор, пока не поглотится 950 мл водорода. Добавляют дополнительное количество 10%-ного палладия на угле (500 мг) и перемешивание продолжают еще в течение 4 час с тем, чтобы прореагировал весь исходный материал. Смесь фильтруют и упаривают при пониженном давлении, получая этиловый эфир 4-карбоксиметил-N-бензилпиперидина (3,31 г) в виде масла зеленоватого цвета, которое используют без дальнейшей очистки; спектр ПМР (хлороформ-d): δ 1,0-1,2 (2H, м), 1,25 (3H, т), 1,7 (2H, с), 1,9 (1H, м), 2,6 (2H, три д), 3,05 (2H, два т), 4,0 (2H, квартет); масс-спектр: m/e 172 (М + H)+.
(iii) Смесь этилового эфира 4-карбоксиметил-N-бензилпиперидина (3,25 г), триэтиламина (5,28 мл), гидрохлорида 4-хлорпиридина (2,85 г) и ксилола (100 мл) оставляют на ночь кипятиться с обратным холодильником. Смесь охлаждают, осадок отфильтровывают и фильтрат упаривают. Остаток растворяют в дихлорметане, промывают водой, сушат (над сульфатом магния) и упаривают. Очищают тонкослойной хроматографией на силикагеле, элюируя смесью метанол/дихлорметан (10% об/об) и получают этиловый эфир 1-(4-пиридилпиперидин-4-ил)уксусной кислоты, 2,15 г, в виде масла; спектр ПМР (хлороформ-d): δ 8,23 (2H, д), 6,64 (2H, д), 4,26 (2H, квартет), 3,88 (2H, два м), 2,89 (2H, два т), 2,27 (2H, д), 2,05 (1H, м), 1,83 (2H, два м), 1,36 (2H, два квартета), 1,27 (3H, т); масс-спектр: m/e 249 (М+H)+.
(iv) Смесь продукта, полученного на стадии (iii) (2,20 г), 1 М раствора соляной кислоты (25,5 мл) и диоксана (100 мл) нагревают до температуры 95oC в течение 3 час. Полученный раствор подвергают сублимационной сушке и получают гидрохлорид 1- (4-пиридилпиперидин-4-ил)уксусной кислоты, 2,3 г, в виде порошка светло-коричневого цвета с т.пл. 105-108oC; спектр ПМР (ДМСО-d6): δ 13,57 (1H, ш), 8,18 (2H, д), 7,17 (2H, д), 4,21 (2H, уширенный д), 3,17 (2H, два т), 2,21 (2H, д), 2,09 (1H, м), 1,83 (2H, два м), 1,22 (2H, два квартета); масс-спектр: m/e 221 (М + H)+; вычислено для C12H16N2O2•HCl•1,25Н2O: C, 51,6; H, 7,0; N, 10,0; Cl, 12,7; найдено: C, 51,7; H, 7,0; N, 9,8; Cl, 12,2%.
Пример 107: Дигидрохлорид 4-[2-[1-(4-пиридил)пиперидин-4- ил]ацетамидо] феноксиуксусной кислоты
Смесь продукта, полученного по примеру 106 (30 мг), 1М раствора соляной кислоты (0,40 мл), воды (2 мл) и диоксана (1 мл) нагревают до температуры 95oC в течение 1 час. Полученный раствор подвергают сублимационной сушке и остаток растирают с эфиром и получают целевое соединение, 25 мг, в виде твердого вещества светло-коричневого цвета с т.пл. 158-162oC; спектр ПМР (ДМСО-d6) + уксусная кислота - d4): δ 8,17 (2H, д), 7,49 (2H, д), 7,20 (2H, д), 6,85 (2H, д), 4,61 (2H, с), 4,23 (2H, уширенный д), 2,21 (2H, два т), 2,21 (3H, м), 1,86. (2H, уширенный д + уксусная кислота), 1,28 (2H, два квартета); масс-спектр: m/e 370 (М + H)+; вычислено для C20H23N3O4•2HCl•1,25Н2O: C, 51,7; H, 5,9; N, 6,0; найдено: C, 51,6; H,6,0; N, 9,2%.
Пример 108: Дигидрохлорид 4-[[1-(4-пиридил-)пиперидин-4- ил]аминокарбонил]феноксиуксусной кислоты
Целевое соединение с выходом 50% получают по методике, аналогичной приведенной в примере 107, взяв в качестве исходного соединения трет-бутиловый эфир 4-[[1-(4-пиридил)пиперидин-4-ил] аминокарбонил]феноксиуксусной кислоты (50 мг), а нерастворимый осадок перед проведением сублимационной сушки предварительно отфильтровывают; т.пл. 278-280oC; спектр ПМР (ДМСО- d6 + уксусная кислота - d4): δ 8,19 (2H, д), 7,82 (2H, д), 7,20 (2H, д), 6,98 (2H, д), 4,74 (2H, с), 4,23 (2H, м), 3,38 (2H, уширенный т), 2,04 (1H, м), 1,64 (2H, м); масс-спектр: m/e 356 (М+H)+; вычислено для C19H21N3O4•HCl•1,25H2O: C, 50,6; H, 5,7; N, 9,3; найдено: C, 50,6; H, 5,7; N, 9,2%.
Исходные соединения получают следующим образом.
(i) Хлористый ацетил (3,9 мл) добавляют при температуре 4oC по каплям к перемешиваемому раствору 4-аминобензилпиперидина (10,0 г) и триэтиламина (7,7 мл) в сухом дихлорметане (100 мл). Дают смеси нагреться до комнатной температуры и перемешивают в течение 16 час. Добавляют воду, органический слой отделяют, сушат (над сульфатом магния) и после упаривания растворителя получают 4-ацетиламино-1-бензилпиперидин, 10,23 г, в виде твердого вещества светло-желтого цвета, которое используют без дальнейшей очистки; спектр ПМР (хлороформ-d): δ 7,29 (5H,м), 5,29 (1H, ш), 3,79 (1H, м), 3,49 (2H, с), 2,80 (2H, два м), 2,12 (2H, два т), 1,95 (3H, с), 1,91 (2H, два м), 1,46 (2H, два квартета); масс-спектр: m/e 233 (М + H)+.
(ii) 10%-ный палладий на активированном угле (1,5 г) добавляют к перемешиваемому раствору продукта, полученного на стадии (i) (10,0 г), 1М раствора соляной кислоты (21,5 мл) и метанола (150 мл) и полученную смесь гидрируют при комнатной температуре и нормальном давлении до тех пор, пока не поглотится теоретическое количество водорода. Добавляют активированный уголь, перемешивают смесь в течение 1 час и фильтруют через диатомитовую землю, фильтрат упаривают досуха и получают гидрохлорид 4-ацетиламинопиперидина, 8,64 г, в виде липкого пенообразного вещества; спектр ПМР (хлороформ-d + ДМСО - d6) δ 9,72 (1H, ш), 9,02 (1H, ш), 7,40 (1H, уширенный д), 3,87 (1H, м), 3,30 (2H, м), 2,81 (2H, м), 1,86 (4H, м), 1,80 (3H, с); масс- спектр: m/e 143 (М + H)+.
(iii) Смесь продукта, полученного на стадии (ii) (1,79 г), гидрохлорида 4-хлорпиридина (1,50 г), бикарбоната натрия (2,86 г) в 3-метил-1-бутаноле (25 мл) кипятят с обратным холодильником в течение 16 час. Охлажденную смесь отфильтровывают и фильтрат упаривают в вакууме. Остаток очищают тонкослойной хроматографией на силикагеле, элюируя смесью метанол/дихлорметан (1:2 об/об) и получают 4-ацетиламино-1-(4-пиридил)пиперидина, 0,69 г, в виде пенообразного вещества; спектр ПМР (ДМСО-d6): δ 8,10 (2H, д), 7,80 (1H, уширенный д), 6,80 (2H, два д), 3,82 (3H, м), 2,93 (2H, два т), 1,78 (3H, с), 1,77 (2H, м), 1,22 (2H, квартет); масс-спектр: m/e 220 (М + H)+.
(iv) Продукт, полученный на стадии (iii) (0,52 г), в 1М растворе соляной кислоты нагревают до температуры 95oC в течение 5 час. Растворитель упаривают и из остатка после упаривания в вакууме над гидроксидом калия получают гидрат тригидрохлорида 4-амино-1-(4-пиридил)пиперидина, 0,70 г, в виде твердого вещества светло-коричневого цвета с т. пл. >300oC; спектр, ПМР (ДМСО-d6): δ 8,28 (4H, м), 7,22 (2H, д), 4,27 (2H, два д), 3,5-3,15 (3H + H2O), 2,09 (2H, м), 1,59 (2H, квартет); масс-спектр: m/e 178 (М + H)+; вычислено для C10H15N3•3HCl•0,75H2O: C, 40,0; H, 6,5; N, 14,0; найдено: C, 40,4; H, 6,3; N, 13,5%.
(v) Смесь бензилового эфира 4-гидроксибензойной кислоты (4 г), трет-бутилового эфира бромуксусной кислоты (3,7 г), порошка безводного карбоната калия (2,4 г) и ацетона (100 мл) кипятят с обратным холодильником в течение 3 дней. Реакционную смесь охлаждают, отфильтровывают и фильтрат упаривают досуха, получая вязкое масло (6,37 г). Порцию полученного масла (3,4 г) растворяют в метаноле (30 мл) и добавляют формиат аммония (4 г). Продувают аргоном и в атмосфере аргона помещают взвесь 10%-ного палладия на угле (100 мг) в метаноле (5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 18 час, катализатор отфильтровывают через слой кизельгура и промывают этанолом и водой, полученные фильтрат и промывные воды объединяют, упаривают досуха и остаток выливают в смесь дихлорметана и водного раствора бикарбоната натрия. Водный слой отделяют, промывают дихлорметаном и осторожно подкисляют разбавленным водным раствором лимонной кислоты. Выпавший осадок собирают, промывают водой и сушат на воздухе, получая 4-трет- бутоксикарбонилметоксибензойную кислоту (1,45 г) в виде белого кристаллического вещества с т.пл. 119-121oC.
(vi) Гексафторфосфат трет-бутилового эфира 4-[[1-(4-пиридил)пиперидин-4-ил] аминокарбонил] феноксиуксусной кислоты с выходом 49% получают после очистки тонкослойной хроматографией на силикагеле, элюируя смесями метанол/дихлорметан (0-5% об/об), в виде твердого вещества белого цвета с т.пл. 196-198oC по методике, аналогичной приведенной в примере 106, взяв в качестве исходных соединений продукты, полученные на стадии (v) и (iv); спектр ПМР (ДМСО-d6): δ 8,21 (2H, д), 8,18 (1H, д), 7,80 (2H, д), 7,19 (2H, д), 6,95 (2H, д), 4,72 (2H, с), 4,20 (3H, м), 3,5-3,1 (4H + H2O), 1,98 (2H, м), 1,59 (2H, м), 1,42 (9H, с); масс-спектр: m/e 412 (М + H)+; вычислено для C23H29N3O4•HPF6: C, 49,6; H, 5,4; N, 7,5; найдено: C, 49,1; H, 5,5; N, 7,3%. Свободное основание выделяют методом тонкослойной хроматографии на нейтральном оксиде алюминия, элюируя смесью метанол/дихлорметан (1% об/об) и используют для получения кислоты.
Пример 109: 4-[[1-(4-пиридил)пиперидин-4-ил]метиламинокарбонил]феноксиуксусная кислота
Целевое соединение с выходом 95% получают по методике, аналогичной приведенной в примере 107, взяв в качестве исходного соединения трет-бутиловый эфир 4-[1-(4-пиридил)пиперидин- -4-ил]метиламинокарбонил]феноксиуксусной кислоты, т.пл. 84- 86oC; спектр ПМР (ДМСО-d6): δ 8,38 (1H, т), 8,18 (2H, д), 7,81 (2H, д), 7,19 (2H, д), 6,95 (2H, д), 4,73 (2H, с), 4,20 (2H, уширенный д), 3,8-3,0 (Hg0), 1,99 (1H, м), 1,84 (2H, уширенный д), 1,21 (2H, м); масс-спектр: m/e 370 (М + H)+.
Исходные соединения получают следующим образом.
(i) N-[(1-трет-Бутилоксикарбонилпиперидин-4-ил)метил]ацетамид с выходом 95% получают в виде масла, которое медленно кристаллизуется, по методике, аналогичной приведенной для стадии (i) примера 108, взяв в качестве исходного соединения тозилат 1-трет-бутилоксикарбонилпиперидин-4-ил-метиламина; спектр ПМР (хлороформ-d): δ 5,52 (1H, ш), 4,12 (2H, уширенный д), 3,14 (2H, м), 2,68 (2H, два т), 1,98 (3H, с), 1,67 (3H, м), 1,44 (9H, с), 1,12 (2H, два квартета); масс-спектр: m/e 257 (М + H)+.
Полученный продукт используют на стадии (ii) без дальнейшей очистки.
(ii) Раствор продукта, полученного на стадии (i) (6,50 г), в трифторуксусной кислоте (50 мл) оставляют перемешиваться на ночь. Растворитель упаривают и остаток очищают тонкослойной хроматографией на силикагеле, элюируя смесью метанол/дихлорметан (10% об/об), и получают N-[4- пиперидинилметил]ацетамид, 3,78 г, в виде масла желтого цвета; спектр ПМР (уксусная кислота-d4): δ 3,22 (2H, уширенный д), 2,96 (2H, д), 2,81 (2H, два т), 1,83 (3H, с), 1,76 (2H, уширенный д), 1,67 (1H, м); масс-спектр: m/e 157 (М+H)+.
(iii) 4-(4-Ацетиламинометилпиперидин-1-ил)пиридин с выходом 28% получают после очистки тонкослойной хроматографией на силикагеле, элюируя смесями метанол/дихлорметан (20-33% об/об), в виде смолообразного твердого вещества по методике, аналогичной приведенной для стадии (i) примера 106, взяв в качестве исходного соединения продукт, полученный ранее на стадии (ii); спектр ПМР (ДМСО-d6): δ 8,18 (2H, д), 7,90 (1H, т), 7,07 (2H, д), 4,12 (2H, уширенный д), 3,05 (2H, два т), 2,95 (2H, т), 1,80 (3H, с), 1,77 (3H, м), 1,13 (2H, м); масс-спектр: m/e 234 (М+H)+.
(iv) 4-(4-Аминометилпиперидин-1- ил)пиридин с выходом 95% получают в виде смолы по методике, аналогичной приведенной для стадии (iv) примера 108, взяв в качестве исходного соединения продукт, полученный ранее на стадии (iii); спектр ПМР (ДМСО-d6): δ 8,26 (4H, м), 7,21 (2H, д), 4,26 (2H, уширенный д), 3,19 (2H, два т), 2,74 (2H, т), 2,05 (1H, м), 1,92 (2H, уширенный д), 1,26 (2H, два квартета); масс- спектр: m/e 192 (М + H)+.
(v) Гексафторфосфат трет-бутилового эфира 4-[[1-(4-пиридил)пиперидин-4-ил] метиламинокарбонил] феноксиуксусной кислоты с выходом 35% получают после очистки тонкослойной хроматографией на силикагеле, элюируя смесями метанол/дихлорметан (0-5% об/об) и растирая с диэтиловым эфиром, в виде твердого вещества белого цвета с т.пл. 182- 184oC по методике, аналогичной приведенной в примере 106, взяв в качестве исходных соединений продукт, полученный на стадии (v) примера 108, продукт, полученный ранее на стадии (iv); спектр ПМР (ДМСО-d6): δ 13,11 (1H, ш), 8,37 (1H, т), 8,17 (1H, д), 7,80 (2H, д), 7,19 (2H, д), 6,95 (2H, д), 4,72 (2H, с), 4,21 (2H, уширенный д), 3,19 (4H, м), 2,00 (1H, м), 1,86 (2H, м), 1,42 (9H, с), 1,21 (2H, м); масс-спектр: m/e 426 (М + H)+; вычислено для C24H31N3O4•HPF6•0,5H2O: C, 49,6; H, 5,7; N, 7,2; P, 5,4; найдено: C, 49,6; H, 5,7; N, 7,1; P, 5,8%.
Пример 110: 4-[[1-(4-пиридил)пиперидин-4-ил]карбоксамидо]феноксиуксусная кислота
Целевое соединение с выходом 93% получают по методике, аналогичной приведенной в примере 2, взяв в качестве исходного соединения гидрохлорид метилового эфира 4-[[1-(4-пиридил) пиперидин-4-ил]карбоамидо]феноксиуксусной кислоты; т. пл. 281- 282oC; спектр ПМР (ДМСО-d6): δ 9,87 (1H, с), 7,51 (2H, д), 7,16 (2H, д), 6,33 (2H, два д), 4,00 (2H, два м), 3,49 (2H, с), 2,90 (2H, два т), 2,61 (1H, м), 1,87 (2H, два д), 1,66 (2H, два квартета); масс-спектр: m/e 340 (М + H)+; вычислено для C19H21N3O3: C, 67,2; H, 6,2; N, 12,4; найдено: C, 67,4; H, 6,2; N, 12,4%.
Исходное соединение получают следующим образом:
Гидрохлорид метилового эфира 4-[[1-(4-пиридил)пиперидин-4-ил]карбоксамидо]феноксиуксусной кислоты с выходом 78% получают по методике, аналогичной приведенной в примере 104, взяв в качестве исходного соединения гидрохлорид метилового эфира 4-аминофенилуксусной кислоты; т.пл. 235-236,5oC; спектр ПМР (ДМСО-d6): δ 13,61 (1H, ш), 10,10 (1H, с), 8,21 (2H, д), 7,55 (2H, д), 7,21 (2H, д), 7,16 (2H, д), 4,28 (2H, два д), 3,60 (5H, с), 3,30 (2H, м + H2O), 2,81 (1H, м), 1,98 (2H, м), 1,67 (2H, м); масс-спектр: m/e 354 (М+H)+; вычислено для C20H23N3O3•HCl: C, 61,6; H, 6,2; N, 10,8; найдено: C, 61,7; H, 6,3; N, 10,6%.
Пример 111: 4-Метилоксикарбонилметиламинофениловый эфир [1-(4-пиридил)пиперидин-4-ил]уксусной кислоты
Хлористый тионил (1 мл) добавляют по каплям к перемешиваемой суспензии [1-(4-пиридил)пиперидин-4-ил] уксусной кислоты (300 мг) в сухом дихлорметане (5 мл) и смесь перемешивают в течение 4 час. Растворитель упаривают и остаток растирают с гексаном и сушат в глубоком вакууме над гидроксидом калия, получая твердое пенообразное вещество.
Его растворяют в дихлорметане (5 мл) и полученный раствор по каплям добавляют при перемешивании к раствору метилового эфира N-(4- гидроксифенил)глициновой кислоты (10 мг) и триэтиламина (0,33 мл) в сухом дихлорметане (10 мл) и полученную смесь перемешивают в течение 16 час. Разбавляют дихлорметаном, промывают водой, сушат и упаривают. Очищают тонкослойной хроматографией на силикагеле, элюируя смесями метанол/дихлорметан (0-10% об/об), растирают полученную смолу с диэтиловым эфиром и получают целевое соединение, 80 мг, в виде твердого вещества белого цвета с т.пл. 120-122oC; спектр ПМР (ДМСО- d6): δ 8,13 (2H, д), 6,84 (2H, д), 6,81 (2H, д), 6,54 (2H, д), 6,01 (1H, т), 3,96 (2H, уширенный д), 3,90 (2H, д), 3,66 (3H, с), 2,90 (2H, два т), 2,50 (2H, д + ДМСО), 2,07 (1H, м), 1,81 (2H, уширенный д), 1,30 (2H, два квартета); масс-спектр: m/e 384 (М + H)+; вычислено для C21H25N3O4•0,5H2O: C, 64,3; H, 6,6; N, 10,7; найдено: C, 64,2; H, 6,3; N, 10,7%.
Пример 112: Метиловый эфир 4-[2-[1-(4-пиридил)пиперидин-4- ил]ацетил] феноксиуксусной кислоты
Хлористый оксалил (2,40 мл) добавляют под аргоном к перемешиваемой суспензии гидрата дигидрохлорида [1-(4- пиридил)пиперидин-4-ил]уксусной кислоты (1,25 г) в сухом дихлорметане. Добавляют несколько капель ДМФА и смесь перемешивают в течение 30 минут, получая прозрачный раствор. Растворитель удаляют в вакууме и остаток высушивают. Полученное твердое пенообразное вещество суспендируют в дихлорметане (40 мл), охлаждают суспензию до 4oC и при перемешивании добавляют хлорид алюминия (3,21 г). Через 30 минут дают смеси нагреться до комнатной температуры и добавляют метиловый эфир феноксиуксусной кислоты (1,16 мл) и перемешивание продолжают еще в течение 2,5 час. Выливают в смесь ледяной воды и хлористого метилена. Доводят рH водной фазы до величины 7 и осадок отфильтровывают. Фильтрат трижды экстрагируют дихлорметаном и органическое вытяжки сушат (над сульфатом магния). После упаривания растворителя получают масло, которое кристаллизуется при добавлении эфира. Выделенное твердое вещество перекристаллизовывают из этилацетата, получая целевое соединение, 1,06 г, с т.пл. 137-138oC; спектр ПМР (ДМСО-d6): δ 8,11 (2H, ш), 7,94 (2H, д), 7,03 (2H, д), 6,78 (2H, уширенный д), 4,91 (2H, с), 3,90 (2H, д), 3,71 (3H, с), 2,91 (2H, д), 2,85 (2H, два т), 2,12 (1H, м), 1,75 (2H, уширенный д), 1,26 (2H, два квартета); масс-спектр: m/e 369 (М + H)+; вычислено для C21H24N2O4: C, 68,5; H, 6,6; N, 7,6; найдено: C, 68,2; H, 6,5; N, 7,5%.
Получение исходного гидрата гидрохлорида 1-(4-пиридил) пиперидин-4-ил] уксусной кислоты описано на стадиях (i) и (ii) примера 106.
Пример 113: Гидрохлорид 4-[2-[1-(4-пиридил)пипepидин-4- ил]ацетил]феноксиуксусной кислоты
Смесь продукта, полученного по примеру 112 (300 мг), диоксана (10 мл) и 1М раствора соляной кислоты (2,7 мл) перемешивают при комнатной температуре в течение 80 час. Растворитель удаляют в вакууме и добавляют небольшое количество воды. Образовавшееся твердое соединение выделяют, промывают водой и после сушки получают целевое соединение, 170 мг, с т.пл. 239-241oC; спектр ПМР (D2O): δ 8,17 (2H, ш), 8,15 (2H, д), 7,36 (2H, д), 7,20 (2H, д), 5,01 (2H, с), 4,33 (2H, д), 3,38 (2H, два т), 3,16 (2H, д), 2,48 (1H, м), 2,08 (2H, д), 1,54 (2H, два квартета); масс-спектр: m/e 355 (М + H)+; вычислено для C20H22N2O4•HCl•1,5H2O: C, 57,4; H, 6,1; N, 6,7; найдено: C, 57,3; H, 6,1; N, 6,4%.
Пример 114: Метиловый эфир 4-[2-[4-(4-пиридил)пиперазин-1- ил]-2,2-диметилацетил]феноксиуксусной кислоты
Метиловый эфир 4-(2,2-диметилбромацетил)феноксиуксусной кислоты (1,58 г) добавляют к перемешиваемому раствору 1-(4-пиридил) пиперазина (1,63 г) в ацетонитриле (40 мл). Через 34 дня образовавшееся твердое вещество отфильтровывают и фильтрат упаривают, получая масло. Очищают тонкослойной хроматографией на силикагеле, элюируя смесями метанол/дихлорметан (от 0,5 до 4% об/об), и получают целевое соединение, 240 мг, в виде пенообразного вещества белого цвета; спектр ПМР (ДМСО- d6): δ 8,49 (2H, д), 8,12 (2H, д), 6,96 (2H, д), 6,77 (2H, д), 4,87 (2H, с), 3,63 (3H, с), 3,28 (4H, т), 2,58 (4H, т), 1,25 (6H, с); масс-спектр: m/e 398 (М + H)+; вычислено для C22H27N3O4•0,25H2O: C, 65,7; H, 6,8; N, 10,4; найдено: C, 65,3; H, 6,9; N, 10,4%.
Исходные соединения получают следующим образом.
(i) Метиловый эфир 4-(2,2-диметилацетил)феноксиуксусной кислоты с выходом 90% получают аналогично методике, приведенной для стадии (i) примера 67, взяв в качестве исходного соединения 4-(2,2-диметилацетил)фенол и перемешивая не 2 дня, а 18 час, в виде кристаллического твердого вещества беловатого цвета с т.пл. 45-46oC; спектр ПМР (ДМСО-d6): δ 7,92 (2H, д), 7,02 (2H, д), 4,90 (2H, с), 3,71 (3H, с), 2,60 (1H, м), 1,09 (6H, д).
(ii) К перемешиваемому раствору продукта, полученного выше на стадии (i) (9,44 г), в четыреххлористом углероде (200 мл) добавляют по каплям бром (2,09 мл) в течение десяти минут. Полученный раствор перемешивают в течение 16 час, растворитель упаривают в вакууме и получают масло оранжевого цвета. Его растворяют в небольшом количестве дихлорметана и фильтруют через силикагель, фильтрат упаривают и получают метиловый эфир 4-(2,2- диметилбромацетил)феноксиуксусной кислоты, 11,3 г, в виде кристаллического твердого вещества белого цвета с т.пл. 46-50oC; спектр ПМР (ДМСО-d6): δ 8,09 (2H, д), 7,05 (2H, д), 4,92 (2H, с), 3,72 (3H, с), 2,00 (6H, д).
Пример 115: 4-[2-[4-(4-Пиридил)пиперазин-1-ил]-2,2- диметилацетил]феноксиуксусная кислота
Целевое соединение с выходом 76% получают по методике, аналогичной приведенной в примере 2, взяв в качестве исходного соединения продукт, полученный по примеру 114, и перемешивая не 2 час, а 16 час, в виде кристаллического твердого вещества белого цвета с т.пл. 278-279oC; спектр ПМР (D2O): δ 8,72 (2H, д), 8,20 (2H, д), 7,16 (4H, д), 4,76 (2H, с), 3,80 (4H, уширенный т), 2,91 (4H, уширенные т), 1,55 (6H, с); масс-спектр: m/e, 406 (М + Na)+, 384 (М + H)+; вычислено для C21H25N3O4•0,5NaCl: C, 61,1; H, 6,1; N, 10,2; найдено: C, 60,8; H, 5,9; N, 10,0%.
Пример 116: RS метиловый эфир 4-[3-[4-(4- пиридил)пиперазин-1-ил]-2-метилпропаноил]феноксиуксусной кислоты
К перемешиваемой смеси метилового эфира 4-(2,2-диметилбромацетил) феноксиуксусной кислоты (3,15 г) и 1-(4-пиридил)пиперазина (3,26 г) в ацетонитриле (200 мл) кипятят с обратным холодильником в течение 4 дней. Растворитель упаривают в вакууме и остаток выливают в смесь дихлорметана и воды. Органической слой отделяют, сушат (над сульфатом магния), упаривают и очищают тонкослойной хроматографией на силикагеле, элюируя смесями метанол/дихлорметан (от 2 до 5% об/об). После дальнейшей очистки тонкослойной хроматографией на нейтральном оксиде алюминия, элюируя дихлорметаном, получают целевое соединение, 350 мг, в виде прозрачного масла; спектр ПМР (ДМСО-d6): δ 8,12 (2H, д), 7,98 (2H, д), 7,04 (2H, д), 6,75 (2H, д), 4,92 (2H, с), 3,86 (1H, м), 3,71 (3H, с), 3,19 (4H, т), 2,70 (4H, т), 2,49 (ДМСО + 4H), 2,36 (1H, квартет), 1,09 (3H, с), следы дихлорметана; масс-спектр: m/e 398 (М+H)+; вычислено для C22H27N3O4•0,1CH2Cl2: C, 65,3; H, 6,7; N, 10,3; найдено: C, 65,1; H, 6,9; N, 10,1%.
Пример 117: Метиловый эфир 4-[4-[4-(4-пиридил)пиперазин-1-ил]метилфенил] масляной кислоты
1-(4-Пиридил)пиперазин (1,63 г) растворяют в теплом ацетонитриле (25 мл), раствор охлаждают до 30oC и при перемешивании добавляют раствор метилового эфира 4-(4-бромметилфенил) масляной кислоты в ацетонитриле (5 мл). Через 30 минут выпавшее твердое вещество удаляют фильтрованием, а фильтрат упаривают в вакууме, получая масло желтого цвета. Очищают тонкослойной хроматографией на силикагеле, элюируя смесями метанол/дихлорметан (от 0 до 4% об/об). Растирают с эфиром и после удаления нерастворимого твердого вещества получают прозрачный раствор. Его упаривают и получают целевое соединение, 0,90 г, в виде пушистого твердого вещества с т.пл. 126-127oC; спектр ПМР (ДМСО-d6): δ 8,14 (2H, д), 7,24 (2H, д), 7,14 (2H, д), 6,77 (2H, д), 3,59 (3H, с), 3,48 (2H, с), 3,30 (4H, т), 2,59 (2H, т), 2,47 (4H, т), 2,32 (2H, т), 1,63 (2H, м); масс-спектр: m/e 354 (М + H)+; вычислено для C21H27N3O2•0,25H2O: C, 70,4; H, 7,7; N,.11,7; найдено: C, 70,6; H, 7,6; N, 11,7%.
Пример 118: Метиловый эфир 5-[4-[4-(4-пиридил)пиперазин-1- ил]метилфенил]пентановой кислоты
Из исходного вещества по примеру 117 (2,14 г), используя методику, приведенную в примере 117, получают смесь метиловых эфиров 5-(4-бромметилфенил)пентановой кислоты и 5-(2-бромметилфенил) пентановой кислоты (70:30 вес/вес по данным ПМР). Сырую смесь эфиров очищают тонкослойной хроматографией на силикагеле, элюируя смесями метанол/дихлорметан (0-5% об/об). Hужные фракции упаривают и получают целевое соединение, 605 мг, в виде твердого воскообразного вещества с т.пл. 53-54oC; спектр ПМР (ДМСО-d6): δ 8,13 (2H, д), . 7,23 (2H, д), 7,14 (2H, д), 6,79 (2H, д), 3,58 (3H, с), 3,47 (2H, с), 3,30 (4H, т + H2O), 2,57 (2H, т), 2,46 (4H, т), 2,32 (2H, т), 1,56 (4H, м); масс-спектр: m/e 368 (М + H)+; вычислено для C22H29N3O2•0,5H2O: C, 70,1; H, 8,0; N, 11,2; найдено: C, 70,3; H, 8,2; N, 11,0%.
Пример 119: Дигидрохлорид 4-[4-[4-(4-пиридил)пиперазин- 1-ил]метилфенил] масляной кислоты
Целевое соединение с выходом 88% получают по методике, аналогичной приведенной в примере 71, взяв в качестве исходного соединения продукт, полученный по примеру 117, и нагревая до температуры 100oC не 1,5 час, а 4 час; т. пл. 236-238oC; спектр ПМР (D2O): δ 8,40 (2H, д), 7,66 (2H, д), 7,61(2H, д), 7,36 (2H, д), 4,61 (2H, с), 4,19 (4H, ш), 3,69 (4H, ш), 2,94 (2H, т), 2,61 (4H, т), 2,15 (2H, м); масс-спектр: m/e 340 (М + H)+; вычислено для C20H25N3O2•2HCl•0,5H2O: C, 57,0; H, 6,6; N, 10,0; найдено: C, 57,2; H, 6,9; N, 9,8%.
Пример 120: Смесь дигидрохлоридов 5-[4-[4-(4-пиридил) пиперазин-1-ил]метилфенил] пентановой кислоты и 5-[2-[4-(4-пиридил)пиперазин-1-ил]метилфенил] пентановой кислоты (4:1)
Целевую смесь соединений в виде твердого вещества белого цвета с выходом 59% получают по методике, аналогичной приведенной в примере 119, взяв в качестве исходного соединения продукт, полученный по примеру 118; спектр ПМР (D2O): δ 8,38 (2H, д), 7,62 (4H, д), 7,35 (2H, д), 4,70 (0,4H, с), 4,61 (1,6H, с), 4,18 (4H, ш), 3,68 (4H, m), 2,98 (0,4H, т), 2,91 (1,6H, т), 2,59 (2H, т), 1,82 (4H, м); масс-спектр: m/e 354 (М+H); вычислено для C21H27N3O2•2HCl•0,5H2O: C, 57,9; H, 6,9; N, 9,7; найдено: C, 59,6; H, 7,2; N, 9,4%.
Пример 121: Этиловый эфир 6-[4-(4-пиридиламино)фенокси] гексановой кислоты
К перемешиваемому раствору этилового эфира 6-[4-N-(4-пиридил)-N-трет-бутилоксикарбониламино)фенокси]гексановой кислоты (260 мг) в дихлорметане (3 мл) добавляют трифторуксусную кислоту (3 мл). Перемешивают в течение 18 час, растворители упаривают в вакууме и полученную смолу растворяют в дихлорметане. Полученный раствор обрабатывают насыщенным раствором бикарбоната аммония, промывают органическую фазу водой, сушат и упаривают. После растирания остатка с гексаном получают целевое соединение, 120 мг, в виде твердого вещества белого цвета с т.пл. 104-106oC; спектр ПМР (хлороформ-d): δ 8,22 (2H, д), 7,12 (2H, д), 6,90 (2H, д), 6,64 (2H, два д), 5,82 (1H, с), 4,13 (2H, квартет), 3,97 (2H, т), 2,34 (4H, т), 1,80 (2H, м); масс-спектр: m/e 329 (М + H)+; вычислено для C19H24N2O3•0,25H2O: C, 68,6; H, 7,4; N, 8,4; найдено: C, 68,8; H, 7,3; N, 8,2%.
Исходные соединения получают следующим образом.
(i) Смесь гидрохлорида 4-хлорпиридина (2 г) и 4-метокси-анилина (4,9 г) нагревают до температуры 140oC в течение 5 час. После охлаждения остаток растворяют в дихлорметане (250 мл), а раствор экстрагируют водой (2 х 100 мл). Водные вытяжки обрабатывают раствором гидроксида натрия и экстрагируют этилацетатом (4 х 100 мл). Органические вытяжки объединяют, промывают водой, насыщенным раствором хлорида натрия, сушат и растворитель упаривают. Очищают тонкослойной хроматографией на силикагеле, элюируя смесью метанол/дихлорметан (10% об/об), и получают 4- (4-пиридиламино)метоксибензол, 2 г, в виде пушистого твердого вещества с т.пл. 159-160oC; спектр ПМР (ДМСО-d6): δ 8,47 (1H, с), 8,09 (2H, д), 7,10 (2H, д), 6,92 (2H, д), 6,70 (2H, два д), 3,73 (3H, с); масс-спектр: m/e 201 (М + H)+; вычислено для C12H12N2O3: C, 72,0; H, 6,0; N, 14,0; найдено: C, 71,4; H, 6,1; N, 13,8%.
(ii) Смесь продукта, полученного выше на стадии (i) (2,0 г), и 48%-ной бромистоводородной кислоты (30 мл) нагревают до температуры 140oC в течение 4 час. Раствор охлаждают и нейтрализуют 0,880 S.G. раствором аммиака и экстрагируют четыре раза этилацетатом. Органические вытяжки объединяют, промывают водой и насыщенным раствором хлорида натрия, сушат (над сульфатом магния) и упаривают. Очищают тонкослойной хроматографией на силикагеле, элюируя смесями метанол/дихлорметан (от 10% до 20% об/об), и получают 4-(4-пиридиламино)фенол, 0,78 г, в виде беловатого твердого вещества с т.пл. 246-248oC спектр ПМР (хлороформ-d + ДМСO-d6): δ 8,92 (1H, ш), 8,09 (2H, д), 7,31 (2H, с), 7,00 (2H, д), 6,79 (2H, д), 6,67 (2H, два д); масс-спектр: m/e 187 (М+H)+.
(iii) Смесь продукта, полученного выше на стадии (ii) (0,78 г), ди-трет-бутилдикарбоната (0,91 г), триэтиламина (0,59 мл), 1,2-диметоксиметана (20 мл) и воды (10 мл) перемешивают в течение 18 час. Растворители удаляют в вакууме и остаток выливают в смесь этилацетата и воды. Водную фазу дополнительно экстрагируют два раза этилацетатом, органические вытяжки объединяют, промывают водой и насыщенным раствором соли, сушат (над сульфатом магния) и упаривают до тех пор, пока не начнется кристаллизация. Продукт выделяют фильтрованием и получают 4-[N-(4-пиpидил)-N-трет-бутилоксикарбониламино] фенол, 1,07 г, в виде твердого кристаллического вещества белого цвета, с т. пл. 192-194oC (с разложением); спектр ПМР (хлороформ- d): δ 8,28 (2H, два д), 7,18 (4H, с), 6,76 (2H, два д), 6,03 (1H, уширенный с), 1,57 (9H, с); масс-спектр: m/e 287 (М + H)+.
(iv) Гидрид натрия (50%- ная дисперсия в минеральном масле, 55 мг) в атмосфере аргона добавляют к перемешиваемому раствору продукта, полученного выше на стадии (iii) (300 мг), в сухом ДМФА (5 мл). Через пять минут добавляют этиловый эфир 6- бромгексановой кислоты (0,20 мл) и перемешивают в течение 16 час. ДМФА упаривают в вакууме и остаток выливают в смесь дихлорметана и воды. Органический слой отделяют, водную фазу дополнительно экстрагируют дихлорметаном. Органические вытяжки объединяют, промывают водой, сушат и упаривают. Остаток очищают тонкослойной хроматографией на оксиде алюминия, элюируя дихлорметаном, а затем смесью метанол/дихлорметан (1% об/об). Упаривая нужные фракции, получают этиловый эфир 6-[4-N-(4- пиридил)-N-трет-бутилоксикарбониламино)фенокси]гексановой кислоты, 260 мг, в виде смолы желтого цвета; спектр ПМР (хлороформ-d): δ 8,40 (2H, два д), 7,16 (2H, два д), 7,07 (2H, м), 6,30 (2H, м), 4,13 (2H, квартет), 3,98 (2H, т), 2,34 (2H, т), 1,78 (4H, м), 1,57 (2H, м), 1,44 (9H, с), 1,26 (3H, т); масс-спектр: m/e 329 (М + H)+.
Пример 122: Гидрохлорид 6-[4-(4-пиридиламино)фенокси] гексановой кислоты
Целевое соединение с выходом 80% получают после сублимационной сушки по методике, аналогичной приведенной в примере 71, взяв в качестве исходного соединения продукт, полученный по примеру 121, и нагревая до температуры 100oC не 1,5 час, а 16 час; спектр ПМР (ДМСО-d6): δ 13,63 (1H, ш), 11,95 (1H, ш), 10,49 (1H, с), 8,21 (2H, д), 7,26 (2H, д), 6,98 (4H, м), 4,00 (2H, т), 2,23 (2H, т), 1,70 (2H, м), 1,55 (2H, м), 1,45 (2H, м); масс-спектр: m/e 301 (М + H)+; вычислено для C17H20N2O2•HCl•1,25H2O: C, 56,8; H, 6,6; N, 7,8; найдено: C, 56,8; H, 6,6; N, 7,4%.
Пример 123: Трифторацетат N-4-[(4-пиридил)пиперазин-1- ил]бензоил]-N-метилглицина
К раствору этилового эфира N-4-[(4-пиридил)пиперазин-1- ил]бензоил]-N-метилглицина (78 мг) в метаноле (2 мл) добавляют раствор гидроксида натрия (1N, 0,4 мл) и оставляют полученную смесь на 1 час при комнатной температуре. Доводят pH реакционной смеси до величины 2 добавлением 2N водного раствора соляной кислоты (0,45-0,5 мл) и полученный раствор очищают препаративной жидкостной хроматографией высокого разрешения с обращенной фазой на колонке DYNAMAX C-18, 60A [83-201-C], используя в качестве подвижной фазы смесь ацетонитрил/вода, содержащую 0,1% трифторуксусной кислоты, и получают целевое соединение после сублимационной сушки (46 мг) в виде стекла: спектр ПМР (ДМСО-d6): δ 2,98 (3H, с), 3,45 (4H, м), 3,86 (4H, м), 4,07 (2H, с), 6,97 (2H, д), 7,23 (2H, д), 7,31 (2H, м), 8,27 (2H, д); масс-спектр: m/e 355 (М+H)+; вычислено для C19H22N4O3•CF3COOH•1,25H2O: C, 51,4; H, 5,24; N, 11,4; найдено: C, 51,2; H, 4,9; N, 11,2%.
Исходные соединения получают следующим образом.
(i) К перемешиваемой смеси 4-[(4-пиридил)пиперазин-1-ил]бензойной кислоты (получают по методике, приведенной в примере 30 (i)) (311 мг, HOBt•H2O (170 мг) и HBTU (416 мг) в ДМФА (5 мл) при температуре 0-5oC в атмосфере аргона добавляют ди-изопропилэтиламин (0,75 мл). Баню со льдом убирают и реакционную смесь, прежде чем добавить гидрохлорид этилового эфира метиламиноуксусной кислоты (154 мг), перемешивают при комнатной температуре в течение 15 минут. Реакционную смесь в атмосфере аргона оставляют перемешиваться на ночь, затем разбавляют дихлорметаном (30 мл) и водой (30 мл). Органический слой отделяют и водную фазу дополнительно экстрагируют дихлорметаном (30 мл). Органические вытяжки объединяют, промывают водой, насыщенным раствором бикарбоната натрия, водой, сушат (над сульфатом магния) и упаривают. Остаток очищают фильтрованием через тонкий слой активированного (активность II) оксида алюминия, элюируя смесью этилацетат/метанол, 5:1, и получают этиловый эфир N-4-[(4-пиридил)пиперазин-1-ил]бензоил] -N-метилглицина (92 мг) в виде аморфного вещества; спектр ПМР (ДМСО-d6 + уксусная кислота-d4): δ 1,18 (3H, т), 2,98 (3H, с), 3,44 (4H, м), 3,79 (4H, м), 4,11 (4H, м), 6,94 (2H, д), 7,12 (2H, д), 7,31 (2H, уширенный д), 8,19 (2H, д); масс-спектр: m/e 383 (М+H)+.
Пример 124: Метиловый эфир N-4-[(4-пиридил)пиперазин-1- ил]бензоил]-L-фенилаланина
По методике, аналогичной приведенной в примере 123 (i), из 4-[(4-пиридил)пиперазин-1-ил] бензойной кислоты (311 мг), моногидрата п-толуолсульфокислоты (418 мг), HOBt•H2O (170 мг), HBTU (416 мг), ДМФА (5 мл), ди-изо-пропилэтиламина (1,13 мл) и гидрохлорида метилового эфира L-фенилаланина (216 мг) после фильтрования через слой нейтрального оксида алюминия, элюируя смесью этилацетат/метанол, 6:1, получают целевое соединение в виде кристаллического твердого вещества белого цвета (336 мг) с т.пл. 139-143,5oC; спектр ПМР (хлороформ-d): δ 3,26 (2H, м), 3,50 (8H, м), 3,76 (3H, с), 5,09 (1H, м), 6,46 (1H, д), 6,70 (2H, м), 6,90 (2H, д), 7,13 (2H, м), 7,28 (3H, м), 7,68 (2H, д), 8,31 (2H, м); масс-спектр: m/e 445 (М+H)+; вычислено для C26H28N4O3•1,0H2O: C, 67,5; H, 6,54; N, 12,1; найдено: C, 67,6; H, 6,4; N, 12,1%.
Пример 125: N-4-[(4-пиридил)пиперазин-1-ил]бензоил]-L-фенилаланин
К раствору продукта, полученного по примеру 124 (100 мг), в метаноле (2,2 мл) добавляют раствор гидроксида натрия (1N, 0,44 мл), полученную смесь оставляют стоять при комнатной температуре на 2,5 час, изредка помешивая, затем доводят pH до величины 5 добавлением 2N водного раствора соляной кислоты (0,22 мл) и 50%-ного водного раствора уксусной кислоты (3 капли). Смесь отфильтровывают и упаривают досуха. Остаток перекристаллизовывают из горячей воды, содержащей следы метанола, и получают целевое соединение в виде кристаллического вещества желтого цвета (47 мг): спектр ПМР (ДМСО- d6 + уксусная кислота-d4): δ 3,05 (1H, м), 3,15 (1H, м), 3,45 (4H, м), 3,77 (3H, м), У, 58 (1H, м), 6,90 (2H, д), 7,12 (2H, д), 7,22 (5H, м), 7,70 (2H, д), 8,19 (2H, д); масс-спектр: m/e 431 (М + H)+; вычислено для C25H26N4O3•0,75H2O: C, 67,6; H, 6,24; N, 12,6; найдено: C, 67,6; H, 6,0; N, 12,5%.
Пример 126: (S)-3-[N-[2-фeнэтил] кapбoксaмидo] -3-[4-[4- (4-пиридил)пиперазин-1-ил]бензоил]бензамидопропионовая кислота
К перемешиваемой суспензии бензилового эфира (S)-3-[N- [2-фенэтил]карбоксамидо] -3-[4-[4- (4-пиридил) пиперазин-1-ил]бензоил]бензамидопропионовой кислоты (120 мг) в метаноле (3 мл) добавляют раствор гидроксида натрия (1N, 0,5 мл). Через 15 минут все твердые вещества и реакционную смесь перемешивают при комнатной температуре еще в течение 2 час. Доводят pH до величины 5 добавлением 2N водного раствора соляной кислоты (0,22 мл) и 50%-ного водного раствора уксусной кислоты (3 капли). Смесь отфильтровывают и упаривают досуха. Остаток перекристаллизовывают из горячей воды, содержащей следы метанола, и получают целевое соединение в виде кристаллического вещества желтого цвета (66 мг): спектр ПМР (ДМСО-d6 + уксусная кислота-d4): δ 2,70 (4H, м), 3,30 (2H, т), 3,56 (4H, м), 3,85 (4H, м), 4,73 (1H, м), 6,99 (2H, д), 7,20 (7H, м), 7,80 (2H, д), 8,25 (2H, д); масс-спектр: m/e 502 (М + H)+; вычислено для C28H31N5O4•1,25H2O: C, 64,2; H, 6,44; N, 13,4; найдено: C, 64,2; H, 6,4; N, 13,6%.
Необходимые исходные соединения получают следующим образом.
(i) β-Бензиловый эфир 2-фенэтиламида Boc-L-аспарагиновой кислоты (методику получения см. J. Samanen et al., 1991, J. Med. Chem., Vol. 34, 3114-25) (2 г) растворяют в смеси, содержащей дихлорметан (10 мл) и трифторуксусную кислоту (10 мл). Полученный раствор бледно-желтого цвета оставляют на 2 час при комнатной температуре, а затем смесь упаривают досуха. Маслянистый продукт растворяют в сухом эфире и вновь упаривают. Указанную процедуру повторяют дважды и получают остаток в виде вязкого масла, содержащий соль β-бензилового эфира 2-фенэтиламида L-аспарагиновой кислоты с трифторуксусной кислотой (2,07 г), которую используют без дальнейшей очистки.
(ii) Аналогично методике, приведенной в примере 123 (i), из 4-[(4-пиридил)пиперазин-1-ил] бензойной кислоты (311 мг), моногидрата п-толуолсульфокислоты (627 мг), HOBt•H2O (170 мг), HBTU (416 мг), ДМФА (15 мл), ди-изо-пропилэтиламина (1,5 мл) и β-бензилового эфира 2-фенэтиламида L-аспарагиновой кислоты (440 мг) после очистки тонкослойной хроматографией на силикагеле, элюируя смесями этилацетат/метанол (от 4:1 до 2:1), получают бензиловый эфир (S)-3-[N-[2-фенэтил] карбоксамидо]- 3-[4-[4-(4-пиридил)пиперазин-1-ил] бензоил]] бензамидопропионовой кислоты (268 мг) в виде кристаллического вещества белого цвета: спектр ПМР (ДМСО-d6): δ 2,70 (4H, т), 2,76 (1H, м), 2,83 (1H, м), 3,25 (2H, м), 3,44 (4H, м), 3,50 (4H, м), 4,84 (1H, м), 5,08 (2H, с), 6,89 (2H, д), 7,02 (2H, д), 7,20 (5H, м), 7,31 (5H, м), 7,78 (2H, д), 7,90 (1H, т), 8,20 (2H, д), 8,36 (1H, д); масс-спектр: m/e 592 (М+H)+: вычислено для C35H37N5O4•0,25H2O: C, 70,5; H, 6,34; N, 11,7; найдено: C, 70,5; H, 6,3; N, 11,7%.
Пример 127: (R)-3-[N-[2-фeнэтил] карбоксамидо] -3-[4-[4- (4-пиридил)пиперазин-1-ил]бензоил]бензамидопропионовая кислота
Целевое соединение в виде кристаллического твердого вещества бледно-желтого цвета с выходом 33% получают по методике, аналогичной приведенной в примере 126, взяв в качестве исходного соединения не (S)-изомер, а бензиловый эфир (R)-3-[N-[2- фенэтил] карбоксамидо]- 3-[4-[4-(4-пиридил) пиперазин-1-ил] бензоил]] бензамидопропионовой кислоты; спектр ПМР (ДМСО-d6 + уксусная кислота-d4): β 2,71 (4H, м), 3,29 (2H, т), 3,53 (4H, м), 3,83 (4H, м), 4,72 (1H, м), 6,99 (2H, д), 7,17 (7H, м), 7,77 (2H, д), 8,24 (2H, д); масс-спектр: m/e 502 (М+H)+ вычислено для C28H31N5O3•1,25H2O: C, 64,2; H, 6,44; N, 13,4; найдено: C, 64,2; H, 6,4; N, 13,3%.
Необходимые исходные соединения получают следующим образом.
(i) β-Бензиловый эфир 2-фенэтиламида Boc-D- аспарагиновой кислоты (методику поучения см. M. Radriguer et al., 1989, J. Med. Chem., Vol. 32, 522-8) (1 г) растеряют при слабом нагревании в ацетонитриле (5 мл), охлаждают до комнатной температуры и добавляют избыток эфирного раствора хлористого водорода (5 мл). Реакционную смесь оставляют на ночь при комнатной температуре и упаривают досуха. Остаток в виде масла бледно-желтого цвета растирают с эфиром и вновь упаривают. Указанную процедуру повторяют дважды и получают остаток в виде гигроскопичного маслянистого вещества, содержащий гидрохлорид β-бензилового эфира 2-фенэтиламида D-аспарагиновой кислоты (0,55 г), который используют без дальнейшей очистки.
(ii) Аналогично методике, приведенной в примере 30 из гидрохлорида δ-бензилового эфира 2-фенэтиламида D-аспарагиновой кислоты (363 мг), 4-[(4-пиридил)пиперазин-1- ил]бензоилхлорида (377 мг), ди-изо-пропилэтиламина (0,87 мл) и ДМФА (5 мл) получают бензиловый эфир (S)-3-[N-[2-фeнэтил]кapбoксaмидo] - 3-[4-[4-(4-пиридил)пиперазин-ил] бензоил]]бензамидопропионовой кислоты (510 мг) в виде аморфного вещества беловатого цвета; масс-спектр: m/e 592 (М+H)+
Пример 128: 4-Оксо-4-[4-(4-пиридил)пиперазин-1-ил]фенил] аминомасляной кислоты
К раствору 1-(4-аминофенил)-4-(4-пиридил)пиперазина (100 мг) в ДМФА (8 мл) добавляют ангидрид янтарной кислоты (79 мг). Реакционную смесь перемешивают при комнатной температуре в течение 2,5 час и выпавший осадок отделяют, промывают диметилформамидом и этанолом, сушат и получают целевое соединение (106 мг) в виде твердого вещества бежевого цвета с т.пл. 263-264oC; спектр ПМР (ДМСО-d6 + CF3COOH): δ 2,68 (4H, м), 3,80 (4H, м), 4,19 (4H, м), 7,20 (2H, д), 7,56 (2H, д), 7,82 (2H, д), 8,21 (2H, д), 9,62 (1H, с); масс-спектр: m/e 355 (М+H)+; вычислено для C19H22N4O3•0,4H2O: C, 63,1; H, 6,36; N,15,5; найдено: C, 63,1; H, 6,4; N, 15,7%.
Необходимые исходные соединения получают следующим образом.
(i) К тщательно приготовленной смеси 4-[(4- пиридил)пиперазин-1-ил] бензойной кислоты (пример 30 (i)) (500 мг) и гидрохлорида гидроксиламина (13,5 мг) добавляют полифосфорную кислоту (16 г). Полученную смесь нагревают до температуры 160oC и перемешивают при указанной температуре в течение 30 минут. Дают смеси остыть приблизительно до температуры 100oC, добавляют колотый лед, а затем 15%-ный раствор гидроксида калия, доводя pH до 11. Дают суспензии остыть до комнатной температуры и образовавшийся осадок отделяют, промывают водой и сушат на воздухе, получая 1-(4-аминофенил)-4-(4-пиридил)пиперазин (159 мг) в виде твердого вещества светло-коричневого цвета с т. пл. 204- 208oC; спектр ПМР (ДМСО-d6): δ 3,00 (4H, м), 3,41 (4H, м), 4,65 (2H, уширенный с), 6,51 (2H, д), 6,73 (2H, м), 6,85 (2H, д), 8,18 (2H, д); масс-спектр: m/e 255 (М + H)+.
Пример 129: Гидрохлорид 4-[4-[4-(4-пиридил)пиперазин-1-ил]фенокси]масляной кислоты
Смесь продукта, полученного по примеру 26 (1,5 г), и метанола (80 мл) кипятят при перемешивании с обратным холодильником и добавляют гидрохлорид пиридина (0,5 г). Нагрев прекращают и добавляют этилацетат (10 мл). Реакционную смесь упаривают до тех пор, пока не появится легкое помутнение. При дальнейшем охлаждении образуется осадок, который отделяют, промывают этилацетатом и сушат, получая целевое соединение (1,33 г) в виде твердого вещества бежевого цвета с т.пл. > 240oC (с разложением); спектр ПМР (ДМСО-d6): δ 1,90 (2H, м), 2,36 (2H, т), 3,17 (4H, м), 3,83 (4H, м), 3,91 (2H, т), 6,89 (4H, квартет), 7,26 (2H, д), 8,25 (2H, д), 12,1 (1H, ш), 13,75 (1H, ш); масс-спектр: m/e 342 (М + H)+; вычислено для C19H23N3O3•1,0HCl: C, 60,4; H, 6,4; N, 11,1; найдено: C, 60,0; H, 6,4; N, 10,8%.
Пример 130: Трифторацетат N-2-мeтoксиэтил-4-[4-[4-(4-пиридил)пиперазин- 1-ил]фенокси]бутирамида
Раствор метоксиэтиламина (0,9 мл) в сухом дихлорметане (5 мл) добавляют в атмосфере аргона по каплям к перемешиваемому 2М раствору триметилалюминия в толуоле (5 мл) при температуре 5-10oC. По окончании добавления баню со льдом убирают и реакционную смесь перемешивают при комнатной температуре в течение 1 час и добавляют по каплям раствор продукта, полученного по примеру 25 (0,62 мг), в дихлорметане (5 мл). Реакционную смесь в атмосфере аргона кипятят с обратным холодильником при перемешивании в течение 2 час. Затем реакционную смесь охлаждают до комнатной температуры и разбавляют дихлорметаном (20 мл). Затем по каплям при перемешивании добавляют раствор метанол/дихлорметан, 1:1 (10 мл). Реакционную смесь далее разбавляют дихлорметаном (10 мл), метанолом (3 мл) и водой (5 мл). Органический слой отделяют, сушат (над сульфатом магния) и упаривают досуха. Остаток очищают препаративной жидкостной хроматографией высокого давления с обращенной фазой на колонке DYNAMAX C-18, 60A [83-201-C] , используя в качестве подвижной фазы смесь ацетонитрил/вода, содержащую 0,1%-ную трифторуксусную кислоту, и получают после сублимационной сушки целевое соединение (56 мг) в виде твердого вещества беловатого цвета; спектр ПМР (ДМСО-d6): δ/ 1,89 (2H, м), 2,22 (2H, т), 3,18 (6H, м), 3,23 (3H, с), 3:32 (2H, т), 3,85 (6H, м), 6,90 (4H, квартет), 7,28 (2H, д), 7,88 (1H, уширенный т), 8,25 (2H, д); масс- спектр: m/e 399 (М + H)+; вычислено для C22H30N4O3•1,7CF3COOH: C, 51,5; H, 5,4; N, 9,5; найдено: C, 51,4; H, 5,6; N, 9,3%.
Пример 131: Моногидрохлорид 4-[2-[4-(4-пиридил)пиперазин-2- oн-1-ил]ацетил]феноксиуксусной кислоты
Раствор метилового эфира 4-[2-(пиперазин-2-он-1-ил] ацетил] феноксиуксусной кислоты (0,347 г), гидрохлорида 4-хлор пиридина (0,19 г) и триэтиламина (0,178 г) в воде (8 мл) и диоксане (1 мл) нагревают на паровой бане в течение 2 час, а затем упаривают досуха. Остаток растирают с водой (2 мл) и отфильтровывают. Полученное твердое вещество перекристаллизовывают из воды и получают целевое соединение (0,187 г) с т.пл. 275-277oC; спектр ПМР (ДМСО-d6): δ 8,33 (2H, д), 8,0 (2H, д), 7,21 (2H, д), 7,1 (2H, д), 4,97 (2H, с), 4,81 (2H, с), 3,94 (2H, м), 3,59 (2H, м); масс-спектр: m/e 370 (М + H)+; вычислено для C19H20N3O5Cl•0,75H2O: C, 54,4; H, 5,0; N, 10,0; найдено: C, 54,5; H, 5,3; N, 9,5%.
Необходимые исходные соединения получают следующим образом.
(i) К энергично перемешиваемой смеси пиперазинона (3,23 г), карбоната калия (4,46 г) в воде (15 мл) и трет-бутаноле (15 мл) при комнатной температуре порциями в течение 54 минут добавляют трет-бутилдикарбонат (7,75 г). Смесь перемешивают в течение 2 час. Для экстрагирования образовавшегося твердого вещества добавляют этилацетат (20 мл) и органический слой отделяют, фильтруют через бумагу для разделения фаз и упаривают. Полученный твердый остаток перекристаллизовывают из этилацетата и получают 4-трет-бутоксикарбонилпиперазин-2-он (5,31 г) с т. пл. 157-159oC; спектр ПМР (ДМСО-d6): δ 8,0 (1H, ш), 3,81 (2H, с), 3,45 (2H, т), 3,17 (2H, м), 1,4 (9H, с); масс-спектр: m/e 207 (М + H)+.
(ii) К перемешиваемой суспензии продукта, полученного на стадии (i) (0,5 г), в сухом ДМФА (3 мл) в атмосфере аргона добавляют гидрид натрия (60%-ная дисперсия в минеральном масле, 0,1 г). Через 1 час при комнатной температуре добавляют метиловый эфир 4-бромуксусной кислоты (0,72 г) и раствор перемешивают в течение 1,5 час. Выливают в смесь воды и этилацетата. Органическую фазу отделяют, промывают водой и фильтруют через бумагу для разделения фаз. Очищают методом испарительной колоночной хроматографии на силикагеле, элюируя смесью этилацетат/гексан (1:1 об/об), и получают 4-(2-(4-трет- бутоксикарбонил)пиперазин-2-он-1-ил ацетил феноксиуксусной кислоты (0,32 г) в виде твердого вещества с т.пл. 81-82oC; спектр ПМР (хлороформ-d): δ 7,97 (2H, м), 6,98 (2H, м), 4,83 (2H, с), 4,71 (2H, с), 4,18 (2H, с), 3,81 (3H, с), 3,72 (2H, т), 3,42 (2H, т), 1,47 (9H, с).
(iii) Раствор продукта, полученного на стадии (ii) (2,2 г), в ТФК (10 мл) оставляют при комнатной температуре на 1 час и упаривают досуха. Остаток добавляют в смесь этилацетата и водного раствора бикарбоната натрия. Органический слой отделяют, фильтруют через бумагу для разделения фаз и растворитель упаривают. Остаток растирают с этилацетатом и получают твердое вещество с т.пл. 128-132oC; спектр ПМР (ДМСО-d6): δ 7,95 (2H, д), 7,06 (2H, д), 4,9 (2H, с), 3,7 (3H, с), 3,3 (2H, м), 2,9 (2H, м).
Пример 132: Трифторацетат RS 3-метил-4-[4-[4-(4-пиридил) пиперазин-1-ил] фенокси]масляной кислоты
К перемешиваемой суспензии 4-(4-(4-пиpидил)пипepaзин-1- ил)фенола (1,02 г) в сухом (10 мл) добавляют гидрид натрия (60%-ная суспензия в минеральном масле, 0,16 г) и перемешивают при комнатной температуре в течение 1 час. К полученному раствору добавляют этиловый эфир 4-бром-3- метилмасляной кислоты и перемешивают полученную смесь в течение 16 час. Растворитель упаривают и остаток выливают в смесь воды и дихлорметана. Нерастворимые вещества отделяют центрифугированием. Органический слой фильтруют через бумагу для разделения фаз (Whatman 1PS) и остаток очищают тонкослойной хроматографией на силикагеле, элюируя смесью метанол/этилацетат/концентрированный водный раствор аммиака (50/950/5), и получают этиловый эфир 3-метил-4- [4-[4-(4-пиридил)пиперазин-1-ил)фенокси] масляной кислоты (0,27 г), который гидролизуют в смеси метанола (3 мл) и водного раствора гидроксида натрия (1N, 2 мл) в течение 2 час при комнатной температуре. Раствор упаривают и остаток очищают жидкостной хроматографией высокого давления с обращенной фазой (в градиенте смеси ацетонитрил/вода/0,1%-ная трифторуксусная кислота) и получают целевое соединение (0,08 г) с т.пл. 169- 171oC; спектр ПМР (ДМСО-d6): δ 13,45 (1H, ш), 12,07 (1H, ш), 8,27 (2H, д), 7,28 (2H, д), 6,9 (4H, м), 3,80 (6H, м), 3,16 (4H, т), 2,45 (1H, м), 2,37 (1H, м), 2,12 (1H, м), 1,0 (3H, д); масс-спектр: m/e 356 (М + H)+; вычислено для C22H25N3O4F3•0,5H2O: C, 55,2; H, 5,6; N, 8,9; найдено: C, 55,3; H, 5,6; N, 8,7%.
Пример 133: Натриевая соль RS-4-[4-[4-(4-пиридил)пиперазин-1-ил]фенокси] -3-винилмасляной кислоты
Раствор метилового эфира (RS)-4-[4-[4-(4-пиридил)пиперазин- 1-ил]фенокси]-3-винилмасляной кислоты (0,29 г) в 1N растворе гидроксида натрия (2,3 мл) и метаноле (5 мл) оставляют на 4 час при комнатной температуре. Раствор упаривают и к остатку добавляют воду (2 мл). Полученное твердое вещество отфильтровывают, промывают ацетоном и эфиром и получают целевое соединение (0,042 г) с т.пл. 293-295oC; спектр ПМР (ДМСО-d6): δ 8,18 (2H, д), 6,9 (6H, м), 5,88 (1H, м), 4,96 (2H, м), 4,0 (1H, м), 3,77 (1H, т), 3,41 (2H, м), 3,10 (2H, м), 2,84 (1H, м), 1,98 (2H, д); масс-спектр: m/e 470 (М + H)+; вычислено для C21H24N3O3Na•H2O: C, 61,9; H, 6,4; N, 10,3; найдено: C, 62,1; H, 6,4; N, 10,5%.
Необходимые исходные соединения получают следующим образом.
(i) Раствор RS 3-винилбутиролактона (3,5 г) и ацетата натрия (2,56 г) в метаноле (30 мл) оставляют при комнатной температуре на 20 час. Растворитель упаривают и остаток выливают в смесь воды и эфира. Органический слой отделят, водную фазу дополнительно дважды экстрагируют эфиром, органические вытяжки объединяют, фильтруют через бумагу для разделения фаз и упаривают. Остаток очищают тонкослойной хроматографией на силикагеле (Merck 7736), элюируя смесями этилацетат/гексан (от 1/9 до 4/6), получая метиловый эфир 4-гидрокси-3- винилмасляной кислоты в виде масла; спектр ПМР (хлороформ- d): δ 5,73 (1H, м), 5,15 (2H, м), 3,68 (3H, с), 3,60 (2H, т), 2,76 (1H, м), 2,48 (2H, м), 1,39 (1H, т); масс-спектр: m/e 145 (М + H)+.
(ii) К перемешиваемой суспензии 4-[4-(4- пиридил)пиперазин-1-ил]фенола (1,98 г) в дихлорметане (30 мл) при 15oC добавляют трифенилфосфин (2,04 г), а затем по каплям добавляют диэтиловый эфир азодикарбоновой кислоты (1,35 г). Смесь перемешивают до полного растворения. По каплям добавляют метиловый эфир 4-гидрокси-3-винилмасляной кислоты (1,12 г) и полученную смесь перемешивают в течение 4 час. Осадок, выделяющийся в процессе реакции представляет собой исходный фенол и его отфильтровывают. Фильтрат упаривают и остаток обрабатывают этилацетатом (20 мл) и отфильтровывают. Фильтрат экстрагируют 2N соляной кислотой (2 х 10 мл) и водную фазу отделяют, подщелачивают 0,89 S.G. раствором аммиака в воде. Выпавший осадок дважды экстрагируют этилацетатом, органические вытяжки объединяют, фильтруют через бумагу для разделения фаз и упаривают. Остаток очищают тонкослойной хроматографией на силикагеле, элюируя смесью метанол/этилацетат/0,89 S.G. водный раствор аммиака (7,5/92, 5/0,75 об/об/об), и получают метиловый эфир (RS)-4-[4-[4-(4-пиридил)пиперазин-1-ил)фенокси]-3- винилмасляной кислоты (0,29 г); спектр ПМР (ДМСО-d6): δ 8,3 (2H, д), 6,88 (4H, м), 6,70 (2H, д), 5,85 (1H, м), 5,20 (2H, м), 3,90 (2H, м), 3,67 (3H, с), 3,48 (2H, м), 3,18 (2H, м), 3,06 (1H, м), 2,68 (1H, м), 2,47 (1H, м), 1,80 (1H, ш); масс-спектр: m/e 382 (М + H)+.
Пример 134: Этиловый эфир 4-[2-аллил-4-[4-(4-пиридил) пиперазин-1-ил] фенокси]масляной кислоты
Целевое соединение в виде твердого вещества с т.пл. 53- 55oC с выходом 50% получают по методике, аналогичной приведенной в примере 25, взяв в качестве исходного соединения 2-аллил- 4-[4-(4-пиpидил)пипepaзин-1-ил]фенол; спектр ПМР (хлороформ-d): δ 8,3 (1H, м), 6,79 (2H, д), 6,71 (2H, два д), 5,1 (2H, м), 4,15 (2H, квартет), 3,98 (2H, т), 3,49 (4H, м), 3,39 (2H, д), 3,19 (4H, м), 2,53 (2H, т), 2,11 (2H, квартет), 1,76 (3H, т); масс-спектр: m/e 410 (М + H)+; вычислено для C24H31N3O3•0,5H2O: C, 68,9; H, 7,7; N, 10,0; найдено: C, 68,8; H, 7,7; N, 9,9%.
Необходимые исходные соединения получают следующим образом.
(i) Гидрид натрия (60%-ная дисперсия в масле, 0,4 г) добавляют к перемешиваемой суспензий 4-(4-(4-пиридил)пиперазин-1- ил)фенола (2,55 г) в ДМФА (25 мл) и смесь перемешивают при комнатной температуре в течение 20 минут. По каплям добавляют хлористый аллил (0,756 г) и перемешивают еще в течение 20 час. Добавляют ледяную воду (75 мл) и смесь трижды экстрагируют этилацетатом. Органические вытяжки объединяют, промывают водой и насыщенным раствором соли, сушат (над сульфатом магния) и упаривают. Остаток растирают с гексаном и отфильтровывают, получая аллиловый эфир 4-(4-(4-пиридил)пиперазин-1-ил)фенола (2,5 г) в виде твердого вещества; спектр ПМР (ДМСО-d6): δ 8,18 (2H, два д), 6,8-7,0 (6H, м), 5,92-6,13 (1H, м), 5,2-5,45 (2H, м), 4,5 (2H, м), 3,45 (4H, м), 3,11 (4H, м).
(iii) Продукт, полученный на стадии (i) (5 г), нагревают в атмосфере аргона, в слабо кипящем дифениловом эфире (15 г) в течение 2,5 час. Смесь охлаждают до комнатной температуры и добавляют эфир (70 мл). Твердое вещество отфильтровывают и очищают тонкослойной хроматографией на силикагеле, элюируя смесью метанол/дихлорметан (1/4 об/об), и получают 2- аллил-4-[4-(4-пиридил)пиперазин-1-ил] фенол (0,03 г) в виде твердого вещества с т.пл. 180-182oC; спектр ПМР (ДМСО-d6): δ 8,88 (1H, о), 8,19 (2H, два д), 6,87 (2H, два д), 6,7 (3H, м), 5,88-6,03 (1H, м), 5,0 (2H, м), 3,44 (4H, т), 3,28 (2H, д), 3,05 (4H, т); масс-спектр: m/e 296 (М + H)+.
Пример 135: 4-[2-Аллил-4-[4-(4-пиридил)пиперазин-1-ил] фенокси]масляная кислота
Целевое соединение с выходом 61% получают по методике, аналогичной приведенной в примере 26, взяв в качестве исходного соединения продукт, полученный по примеру 132, в виде твердого вещества с т.пл. 209-210oC (с разложением); спектр ПМР (ДМСО- d6): δ 8,19 (2H, д), 6,84 (5H, м), 5,82-6,08 (1H, м), 4,92-5,12 (2H, м), 3,91 (2H, т), 3,44 (4H, т), 3,3 (2H, д), 3,1 (4H, т), 2,4 (2H, т), 1,93 (3H, т); масс-спектр: m/e 382 (М + H)+; вычислено для C22H27N3O3: C, 69,3; H, 7,13; N, 11,0; найдено: C, 69,2; H, 7,3; N, 11,2%.
Пример 136: Этиловый эфир 4-[2-н-пропил-4-[4-(4-пиридил)пиперазин-1-ил] фенокси]масляной кислоты
Целевое соединение в виде твердого вещества с т.пл. 65- 67oC с выходом 24% получают по методике, аналогичной приведенной в примере 25, взяв в качестве исходного соединения 2-н-пропил-4-[4- (4-пиридил)пиперазин-1-ил]фенол; спектр ПМР (хлороформ-d): дельта 8,29 (1H, д), 6,8 (1H, д), 6,73 (2H, д), 6,7 (2H, м), 4,13 (2H, квартет), 3,94 (2H, т), 3,46 (4H, т), 3,18 (3H, т), 2,52 (4H, м), 2,09 (2H, м), 1,54 (2H, м), 1,24 (3H, т); масс-спектр: m/e 412 (М + H)+.
Необходимое исходное соединение получают следующим образом.
Продукт, полученный на стадии (ii) примера 134 (0,74 г), в этаноле (25 мл) и 1N раствор соляной кислоты (2,5 мл) гидрируют при комнатной температуре при атмосферном давлении над 10%-ным палладием на угле (0,15 г) до полного прекращения поглощения водорода. Катализатор отделяют фильтрованием через диатомитовую землю и фильтрат упаривают. Остаток растирают со смесью этилацетата (25 мл) и насыщенного раствора бикарбоната натрия (25 мл), нерастворимые твердые вещества отфильтровывают и промывают водой и этилацетатом. Водный слой фильтрата дважды экстрагируют дихлорметаном, органические вытяжки объединяют и упаривают. Остаток объединяют с нерастворимым веществом, обработанным этилацетатом и кипятят в этаноле (40 мл), не растворившиеся вещества отфильтровывают. Фильтрат упаривают и получают 2-н-пропил-4-[4-(4-пиридил)пиперазин-1-ил] фенол (0,7 г) в виде твердого вещества; спектр ПМР (ДМСО-d6): δ 8,84-8,68 (1H, м), 8,18 (2H, д), 6,32 (2H, м), 6,7 (3H, м), 4,1 (1H, квартет), 3,42 (4H, т), 3,17 (3H, с), 3,05 (4H, т), 2,48 (ДМСО), 1,55 (2H, м), 0,85 (3H, т).
Пример 137: 4-[2-н-пропил-4-[4-(4-пиридил)пиперазин-1- ил]фенокси]масляная кислота
Целевое соединение с выходом 64% получают по методике, аналогичной приведенной в примере 26, взяв в качестве исходного соединения продукт, полученный по примеру 132, в виде твердого вещества с т.пл. 207-209oC (из изо-пропанола); спектр (ДМСО-d6): δ 8,18 (2H, д), 6,7-6,92 (5H, м), 3,91 (2H, т), 3,45 (4H, т), 3,10 (4H, т), 2,5 (ДМСО), 2,4 (2H, т), 1,91 (2H, ?), 1,54 (2H, м), 0,9 (3H, т) + изо-пропанол (0,9% мол) при 3,79 и 1,04; масс-спектр: m/e 384 (М + H)+; вычислено для C22H29N3O3•0,7C3H7O: C, 68,0; H, 8,2; N, 9,9; найдено: C, 68,1; H, 8,2; N,9,9%.
Пример 138: Этиловый эфир 4-[2-метил-4-[4-(4-пиридил) пиперазин-1-ил] фенокси]масляной кислоты
Целевое соединение в виде смолы с выходом 29% получают по методике, аналогичной приведенной в примере 25, взяв в качестве исходного соединения 2-метил-4-(4-(4-пиридил)пиперазин- 1-ил] фенол; спектр ПМР (хлороформ-d): δ 8,3 (1H, м), 6,45-6,35 (5H, м), 4,14 (2H, квартет), 3,87 (2H, т), 3,14 (4H, м), 2,53 (2H, т), 2,21 (3H, с), 2,11 (2H, м), 1,24 (3H, т); масс-спектр: m/e 384 (М + H)+.
Необходимые исходные соединения получают следующим образом.
(i) Карбонилдиимидазол (5 г) добавляют порциями к перемешиваемой суспензии N-бензилиминодиуксусной кислоты (3,14 г) в сухом ТГФ (50 мл) в атмосфере аргона при комнатной температуре. Через 5 минут смесь осторожно доводят до кипения и через 15 минут добавляют (4- амино-2-метил)фенилбензиловый эфир (3,0 г) и перемешивают смесь при кипячении с обратным холодильником в течение 17 час. Растворитель упаривают и остаток перемешивают со смесью этилацетата (100 мл) и воды (150 мл) в течение 1,5 час. Твердое вещество отфильтровывают, промывают водой и сушат, получая (4-[бензил-2,6-дикетопиперазин-1-ил] -2- метил)фенилбензиловый эфир (4,7 г) с т.пл. 128-126oC; спектр ПМР (хлороформ-d): δ 7,1-7,32 (10H, м), 6,76 (3H, с), 4,93 (2H, с), 3,56 (2H, с), 3,4 (4H, с), 2,12 (3H, с); масс-спектр: m/e 373 (М+H)+.
(ii) К раствору продукта, полученного на стадии (i) (2,9 г) в сухом ТГФ (50 мл) добавляют литийалюмогидрид (0,6 г) и смесь кипятят в течение 1,5 час. Дают смеси остыть и добавляют еще 0,3 г литийалюмогидрида и продолжают кипячение в течение 1,5 час. Смесь охлаждают, добавляют воду (0,3 мл), а затем раствор гидроксида натрия (1N, 3,6 мл) и смесь кипятят в течение 10 минут. Твердое вещество отфильтровывают и промывают тетрагидрофураном. Фильтрат и промывные воды упаривают и остаток очищают тонкослойной хроматографией на силикагеле, элюируя раствором этилацетата в дихлорметане, начиная от 5% и кончая 25% этилацетата. Указанным способом получают [2-метил- 4-{4-бензилпиперазин-1-ил} ]фенилбензиловый эфир в виде твердого вещества (1 г) с т. пл. 118-120oC; спектр ПМР (хлороформ-d): δ 7,2-7,5 (10H, м), 6,82 (1H, д), 6,80 (1H, д), 6,7 (1H, м), 5,01 (2H, с), 3,1 (4H, м), 2,53 (3H, с); масс- спектр: m/e 373 (М + H)+.
(iii) Суспензию продукта, полученного на стадии (ii) (1 г), в 1,2-дихлорэтане (25 мл) охлаждают на бане с ледяной водой и добавляют 1-хлорэтилхлорформиат (0,77 г). Дают смеси нагреться до комнатной температуры, перемешивают еще в течение 30 минут и кипятят с обратным холодильником в течение 30 минут. Добавляют метанол (20 мл) и смесь снова кипятят с обратным холодильником в течение 30 минут и упаривают. Остаток растирают с эфиром и отфильтровывают. Полученное твердое вещество промывают эфиром и сушат, получая гидрохлорид [2-метил-4-[4-пиперазин-1-ил]фенилбензилового эфира (0,95 г) с т.пл. 195-198oC; спектр ПМР (ДМСО-d6): δ 9,44 (2H, уширенный с), 7,3-7,5 (6H, м), 6,98 (2H, M), 5,08 (?, c), 4,98 (4H, уширенный с), 3,38 (4H, м), 2,2 (3H, с); масс-спектр: m/e 281 (М+H)+.
(iv) Смесь продукта, полученного на стадии (iii) (0,95 г), гидрохлорида 4-хлорпиридина (0,46 г) и триэтиламина (0,615 г) в воде (10 мл) нагревают до температуры 100oC в течение 3 час. Добавляют дополнительное количество 4-хлорпиридина (0,34 г) и триэтиламина (0,3 мл) и кипячение продолжают еще в течение 3 час. Раствор охлаждают и экстрагируют дихлорметаном (2 х 15 мл). Органический слой упаривают и остаток очищают тонкослойной хроматографией на силикагеле, элюируя 5%-ным раствором метанола в дихлорметане, содержащем 0,4% концентрированного водного раствора аммиака, и получают [2-метил-4-[4-(4-пиридил)пиперазин-1-ил]]фенилбензилового эфира (0,26 г) в виде твердого вещества; спектр ПМР (ДМСО-d6): δ 8,19 (2H, д), 7,25-7,5 (5H, м), 6,88 (4H, м), 6,74 (1H, м), 5,03 (2H, с), 3,44 (4H, уширенный т), 3,1 (4H, уширенный т), 2,18 (3H, с); масс-спектр: m/e 360 (М+H)+.
(v) Раствор продукта, полученного на стадии (iv) (0,52 г), в этаноле (20 мл), содержащем 2N раствор соляной кислоты (2 мл), перемешивают в атмосфере аргона с 10%-ным палладием на угле (0,16 г) до полного прекращения поглощения водорода. Смесь отфильтровывают и фильтрат упаривают. Остаток растирают с горячим этилацетатом и отфильтровывают, получая 2-метил-4- [4-(4-пиридил)пиперазин-1-ил] фенол (0,55 г); спектр ПМР (ДМСО-d6): δ 8,25 (2H, д), 7,24 (2H, д), 7,12 (2H, уширенный д), 6,8 (1H, д), 4,02 (4H, м), 3,46 (4H, м), 2,1 (3H, с); масс-спектр: m/e 270 (М + H)+.
Пример 139: 4-[2-метил-4-[4-(4-пиридил)пиперазин-1-ил] фенокси]масляная кислота
Целевое соединение с выходом 80% получают в виде твердого вещества с т. пл. 261-262oC по методике, аналогичной приведенной в примере 26, взяв в качестве исходного соединения продукт, полученный по примеру 138; спектр (ДМСО-d6): δ 8,18 (2H, д), 6,7-6,9 (2H, м), 3,9 (2H, т), 3,43 (4H, умиренный т), 3,1 (4H, уширенный т), 2,39 (2H, т), 2,13 (3H, с), 1,72 (2H, м); масс-спектр: m/e 356 (М + H)+; вычислено для C20H25N3O3: C, 67,6; H, 7,1; N, 11,8; найдено: C, 67,4; H, 6,9; N, 12,2%.
Пример 140: Метиловый эфир (RS)-2-трет-бутилоксикарбониламино- 4-[4-[4-(4-пиридил)пиперазин-1-ил]фенокси]масляной кислоты
Целевое соединение с выходом 65% получают в виде масла по методике, аналогичной приведенной в примере 25, взяв в качестве исходного соединения метиловый эфир (RS)-4-бром-2- трет-бутилоксикарбониламиномасляной кислоты; спектр ПМР (хлороформ-d): δ 8,31 (2H, д), 6,9 (4H, м), 6,71 (2H, м), 5,3 (1H, ш), 4,5 (1H, уширенный д), 4,01 (2H, т), 3,77 (3H, с), 3,5 (4H, м), 3,21 (4H, м), 2,3 (2H, м), 1,46 (9H, с); а также сигналы при 6,03, 2,97 и 2,9 (ДМФА) и 1,8 (H2O); масс-спектр: m/e 471 (М + Н)+ вычислено для C25H34N4O5•0,5ДМФА•0,5H2O: C, 61,7; H, 7,5; N, 12,2; найдено: C, 61,8; H, 7,2; N, 11,9%.
Необходимое исходное соединение получают следующим образом.
Раствор RS-метил-N-бутоксикарбонилового эфира гомосерина (1,7 г) в четырехбромистом углероде (3,6 г) в дихлорметане (20 мл) перемешивают при температуре 5oC. Порциями в течение 5 минут добавляют трифенилфосфин (3,77 г). Через 2 час после перемешивания при комнатной температуре полученный раствор темного цвета упаривают и остаток растирают со смесью эфир/гексан (1/1, 30 мл) до тех пор, пока не образуется твердое вещество. Твердое вещество отфильтровывают и фильтрат упаривают. Остаток очищают тонкослойной хроматографией, элюируя 25%-ным раствором этилацетата в гексане, и получают (RS)-4-бром-2-трет- бутилоксикарбониламиномасляной кислоты (0,41 г) в виде масла; спектр ПМР (хлороформ-d): δ 5,16 (1H, ш), 4,45 (1H, м), 3,8 (3H, с), 3,45 (2H, т), 2,52-2,11 (2H, м), 1,48 (9H, с); масс-спектр: m/e 296 (М + H)+.
Пример 141: (RS)-2-трет-бутилоксикарбониламино-4-[4-[4-(4- пиридил)пиперазин-1-ил]фенокси масляная кислота
Целевое соединение с выходом 58% получают в виде твердого
вещества с т.пл. 198-207oC по методике, аналогичной приведенной в примере 26, взяв в качестве исходного соединения продукт, полученный по примеру 140; спектр ПMP (ДМСО-d6): δ 8,2 (2H, д), 6,91 (6H, м), 4,06 (1H, м), 3,92 (2H, т), 3,48 (4H, т), 3,12 (4H, т), 2,2-1,84 (2H, м), 1,37 (9H, с); а также сигналы при 6,03, 2,97 и 2,9 (ДМФА) и 1,8 (H2O); масс-спектр: m/e 457 (М+H)+; вычислено для C24H32N4O5•H2O: C, 60,7; H, 7,2; N, 11,8; найдено: C, 60,7; H, 7,2; N, 11,7%.
Пример 142: Метиловый эфир (RS)-2-амино-4-[4-[4-(4-пиридил)пиперазин-1-ил]фенокси]масляной кислоты
Соединение по примеру 140 (0,96 г) в ТФК (10 мл) оставляют при комнатной температуре на 2 час. Раствор упаривают и остаток растворяют в воде (15 мл) и раствор подщелачивают карбонатом натрия. Экстрагируют смесь три раза дихлорметаном. Органические вытяжки объединяют и получают целевое соединение (0,56 г) с т.пл. 125-127oC; спектр ПМР (ДМСО-d6): δ 8,2 (2H, д), 6,92 (6H, м), 4,0 (2H, м), 3,64 (3H, с), 3,46 (4H, т), 3,15 (4H, т), 2,04 (2H, м), 1,84 (1H, м); масс-спектр: m/e 371 (М + H)+; вычислено для C20H26N4O3•0,75H2O: C, 62,5; H, 7,17; N, 14,6; найдено: C, 62,8; H, 6,8; N, 14,3%.
Пример 143: Натриевая соль 4-[2-[4-(4-пиридил)пиперазин- 2-он-1-ил] ацетил]феноксиуксусной кислоты
Целевое соединение по примеру 35 (0,25 г) в метаноле (5 мл) обрабатывают водным раствором гидроксида натрия (1N, 0,65 мл) и смесь оставляют при комнатной температуре на 6 час. Полученное таким образом твердое вещество отфильтровывают и промывают метанолом, получая целевое соединение (0,18 г) с т. пл. 317-318oC; спектр ПМР (ДМСО-d6): δ 8,2 (2H, д), 7,89 (2H, д), 6,91 (2H, д), 6,83 (2H, д), 4,89 (2H, с), 4,21 (2H, с), 4,01 (2H, с), 3,68 (2H, м), 3,68 (2H, м), 3,51 (2H, м); масс-спектр: m/e 392 (М + H)+; вычислено для C19H18N3O5Na•0,25H2O: C, 57,6; H, 4,6; N, 10; найдено: C, 57,2; H, 4,6; N, 10,4%.
Пример 144: Этиловый эфир 4-[2-[4-(4- пиридил)пиперазин-2-он-1-ил]ацетил]феноксиуксусной кислоты
К неочищенному продукту, подлученному по примеру 36 (3,4 г), добавляют при 0oC раствор, полученный при добавлении по каплям при перемешивании хлористого тонила (2,25 г) к этанолу (45 мл) при температуре ниже 0oC. Полученную смесь перемешивают при комнатной температуре в течение 2 час, а затем осторожно кипятят в течение 2,5 час и упаривают. К остатку добавляют воду и доводят pH до 6 с помощью водного раствора бикарбоната натрия. Выпавшую смолу отделяют, доводят pH водного раствора до величины 8 и экстрагируют дихлорметаном (2 х 50 мл). Органические вытяжки объединяют, промывают насыщенным водным раствором соли, сушат и упаривают. Остаток очищают хроматографически, используя колонку Mega Bond Elut весом 10 г с силикагелем, элюируя смесью 570 метанол/дихлорметан/0,5% триэтиламин, и получают целевое соединение в виде твердого вещества (0,2 г) с т.пл. 163-165oC; спектр ПМР (хлороформ-d): δ 8,34 (2Н, м), 7,97 (2H, д), 6,98 (2H, м), 6,63 (2H, м), 4,89 (2H, д), 4,7 (2H, с), 4,29 (2H, квартет), 4,1 (2H, с), 3,7 (2H, м), 3,6 (2H, м), 1,31 (3H, т); масс-спектр: m/e 398 (М+H)+; вычислено для C21H23N3O5: C, 63,5; H, 5,83; N, 10,6; найдено: C, 61,5; H, 5,9; N,10,5%.
Пример 145: Этиловый эфир N-4-[2-[4-(4-пиридил)пиперазин-2-он-1-ил]ацетил]феноксиацетилглицина
Соединение, полученное по примеру 36 (0,37 г), перемешивают в ДМФА (10 мл) с гидроксибензотриазолом (0,17 г) и охлаждают смесь в бане с ледяной водой. Добавляют гидрохлорид 1-(3- диметиламинопропил)-3-этилкарбодиимида (0,14 г), затем триэтиламин (0,14 мл) и смесь перемешивают в течение 30 минут. Далее добавляют гидрохлорид этилового эфира глицина (0,15 г) и триэтиламин (0,28 мл), перемешивают десять минут при охлаждении, дают смеси нагреться до комнатной температуры, перемешивают в течение двух дней и упаривают. К остатку приливают воду (10 мл) и доводят pH до величины 6-7 добавлением бикарбоната натрия. Смесь упаривают и остаток очищают хроматографически, используя колонку Mega Bond Elut c силикагелем (10 г), элюируя смесями 2%-20% метанол/дихлорметан. Продукт перекристаллизовывают из этанола и получают целевое соединение в виде твердого вещества (36 мг) с т.пл. 209-211oC; спектр ПМР (хлороформ-d): δ 8,55 (1H, т), 8,2 (2H, м), 7,99 (2H, м), 7,12 (2H, м), 6,86 (2H, д), 4,92 (2H, с), 4,11 (2H, квартет), 4,02 (2H, с), 3,9 (2H, д), 3,2 (2H, м), 3,52 (2H, м), 1,2 (3H, т); масс-спектр: m/e 455 (М + H)+; вычислено для C23H26N4O6: C, 60,8; H, 5,77; N, 12,3; найдено: C, 60,6; H, 5,7; N, 12,5%.
Пример 146: Этиловый эфир 4-[2-нитро-4-[4-(4-пиридил) пиперазин-1-ил] фенокси]масляной кислоты
К соединению, полученному по примеру 26 (1 г), при перемешивании при комнатной температуре медленно добавляют серную кислоту (98%, 2,5 мл). Охлаждают раствор до температуры ниже 5oC и по каплям добавляют смесь азотной кислоты (0,18 мл) и серной кислоты (0,18 мл). Раствор перемешивают при температуре ниже 10oC в течение 1,5 час, выливают на лед и подщелачивают водным раствором аммиака до pH 10. Экстрагируют смесь этилацетатом (2 х 50 мл), органические вытяжки промывают водой, сушат (над сульфатом магния) и упаривают. Остаток очищают тонкослойной хроматографией на силикагеле, элюируя смесями 5%- 10% метанол/дихлорметан, и получают целевое соединение в виде масла (0,18 г); спектр ПМР (хлороформ-d): δ 8,32 (2H, д), 7,41 (1H, д), 7,14 (1H, м), 7,04 (1H, д), 6,77 (2H, м), 4,17-4,14 (4H, м), 3,51-3,28 (8H, м), 2,57 (2H, т), 2,14 (2H, м), 1,28 (3H, т), плюс H2O (1,87); масс-спектр: m/e 415 (М + H)+; вычислено для C21H26N4O5•0,25H2O: C, 60,1; H, 6,3; N, 13,1; найдено: C, 60,2; H, 6,3; N, 13,2%.
Пример 147: Метиловый эфир (RS)-2-н-бутансульфониламино-4- [4-[4-(4-пиридил)пиперазин-1-ил]фенокси]масляной кислоты
К перемешиваемому раствору соединения, полученного по примеру 142 (0,5 г), и триэтиламина (0,15 г) в дихлорметане (15 мл) при комнатной температуре добавляют н-бутансульфохлорид. Оставляют раствор на два дня и хроматографируют на силикагеле, элюируя смесью метанол/дихлорметан/0,88 SG водный раствор аммиака (7/93/0,7 об/об/об), и после растирания с эфиром получают целевое соединение с выходом 58% в виде твердого вещества с т.пл. 124-125 oC; спектр ПМР (хлороформ-d): δ 8,3 (2H, д), 6,88 (4H, квартет), 6,72 (2H, м), 5,18 (1H, уширенный д), 6 (1H, уширенный квартет), 4,08 (2H, т), 3,8 (3H, с), 3,47 (4H, м), 3,18 (4H, м), 2,98 (2H, м), 2,28 (2H, м), 1,73 (2H, м), 1,45-1,27 (2H, м), 0,9 (3H, т); масс-спектр: m/e 491 (М + H)+; вычислено для C24H34N4O5S: C, 58,8; H, 7,0; N, 11,4; найдено: C, 58,4; H, 7,0; N, 11,1%.
Пример 148: RS 2-н-бутансульфониламино-4-[4-[4-(4-пиридил)пиперазин- 1-ил]фенокси]масляная кислота
Целевое соединение с выходом 58% получают в виде твердого вещества с т. пл. 251-252oC по методике, аналогичной приведенной в примере 26, взяв в качестве исходного соединения продукт, полученный по примеру 147; спектр ПМР (ДМСО-d6): δ 8,18 (2H, д), 7,3 (1H, ш), 6,9 (6H, м), 3,97 (2H, т), 3,9 (1H, м), 3,45 (4H, м), 3,11 (4H, т), 2,9 (2H, т), 2,12 (2H, м), 1,92 (1H, м), 1,58 (2H, м), 0,81 (3H, т); масс-спектр: m/e 477 (М + H)+; вычислено для C23H32N4O5S•H2O: C, 56,9; H, 6,8; N, 11,5; найдено: C, 57,0; H, 6,8; N, 11,3%.
Пример 149: RS 3-бензил-4-[4-[4-(4-пиридил)пиперазин-1- ил]фенокси]масляная кислота
Целевое соединение с выходом 65% получают в виде твердого вещества с т. пл. 205-206oC по методике, аналогичной приведенной в примере 26, взяв в качестве исходного соединения этиловый эфир (RS)-3-бензил-4- [4-[4-(4-пиридил) пиперазин-1-ил] фенокси] масляной кислоты; спектр ПМР (ДМСО-d6): δ 8,2 (2H, д), 7,22 (5H, м), 6,9 (6H, м), 3,8 (2H, д), 3,45 (4H, м), 3,15 (4H, м), 2,72 (2H, м), 2,5-2,18. (Me SO + 3H, м); масс-спектр: m/e 432 (M + H)+; вычислено для C26H29N3O3•0,25H2O: C, 71,6; H, 6,8; N, 9,7; найдено: C, 71,9; H, 6,8; N, 9,5%.
Необходимые исходные соединения получают следующим образом.
(i) Раствор RS 3-бензилбутиролактона (1,14 г) в этаноле (20 мл) перемешивают при 5oC и пропускают через него в течение 4 час слабый поток бромистого водорода. Раствор оставляют при температуре 5oC на 20 час и добавляют воду (70 мл) и карбонат натрия, чтобы нейтрализовать кислоту. Смесь экстрагируют этилацетатом и органический слой фильтруют через бумагу для разделения фаз и упаривают, получая этиловый эфир 4-бензил-3-броммасляной кислоты в виде масла; спектр ПМР (хлороформ-d): δ 7,24 (5H, м), 4,13 (2H, квартет), 3,45 (2H, м), 2,62 (2H, д), 2,44 (3H, м), 1,25 (3H, т); масс-спектр: m/e 285 (М+H)+.
(ii) Этиловый эфир (RS)-3-бензил-4-[4-[4-(4-пиридил)пиперазин-1-ил] фенокси] масляной кислоты с выходом 40% получают в виде масла по методике, аналогичной приведенной в примере 25, взяв в качестве исходного соединения продукт, полученный на стадии (i); спектр ПМР (хлороформ-d): δ 8,34 (2H, д), 7,29 (5H, м), 6,9 (4H, м), 6,72 (2H, м), 5,13 (2H, квартет), 3,85 (2H, м), 3,5 (4H, м), 3,3 (4H, м), 2,9-2,38 (5H, м), 1,26 (3H, т); масс-спектр: m/e 460 (М + H)+.
Пример 150: RS 3-фенил-4-[4-[4-(4-пиридил)пиперазин-1- ил]фенокси]масляная кислота
Целевое соединение с выходом 39% получают в виде твердого вещества с т. п. 120-125oC по методике, аналогичной приведенной в примере 26, взяв в качестве исходного соединения этиловый эфир (RS)-3-фенил-4-[4-[4-(4-пиридил)пиперазин-1- ил]фенокси]масляной кислоты; спектр ПМР (ДМСО- d6): δ 8,18 (2H, д), 7,32 (5H, м), 7,25 (2H, д), 6,87 (6H, м), 4,04 (2H, квартет), 3,45 (5H, м), 3,11 (4H, т), 2,71 (2H, м); масс-спектр: m/e 418 (М+H)+; вычислено для C25H27N3O3•0,25H2O: C, 7,1; H, 6,5; N, 9,9; найдено: C, 7,2; H, 6,5; N, 9,8%.
Необходимое исходное соединение получают следующим образом.
Этиловый эфир (RS)-3-фенил-4-[4-[4-(4- пиридил)пиперазин-1-ил]фенокси] масляной кислоты с выходом 10% получают в виде масла по методике, аналогичной приведенной для стадии (ii) примера 133, взяв в качестве исходного соединения этиловый эфир (RS)-4-гидрокси-3-фенилмасляной кислоты; спектр ПМР (ДМСО-d6 + уксусная кислота-d4): δ 8,23 (2H, д), 7,3 (5H, м), 7,17 (2H, д), 6,95 (2H, д), 6,83 (2H, д), 4,06 (2H, м), 3,77 (2H, т), 3,55 (3H, с), 3,51 (1H, м), 3,17 (4H, т), 2,83 (2H, м); масс-спектр: m/e 432 (М + H)+.
Пример 151: 3-[4-[4-(4-пиридил)пиперазин-1-ил]]-N- бензилбензамидопропионовая кислота
Целевое соединение с выходом 72% получают в виде твердого вещества по методике, аналогичной приведенной в примере 31, взяв в качестве исходного соединения метиловый эфир 3-[4-[4-(4- пиридил)пиперазин-1-ил]]-N-бензилбензамидопропионовой кислоты; спектр ПМР (ДМСО-d6): δ 2,5-2,6 (2H, м), 3,4-3,55 (6H, м), 3,75-3,85 (4H, м), 4,65 (2H, с), 6,95 (2H, д), 7,15 (2H, д), 7,2-7,45 (7H, м), 8,25 (2H, д); масс-спектр: m/e 445 (М + H)+; вычислено для C26H28N4O3•0,5H2O: C, 68,8; H, 6,3; N, 12,3; найдено: C, 69,2; H, 5,8; N, 12,4%.
Необходимые исходные соединения получают следующим образом.
(i) Метиловый эфир 3-[4-[4-(4-пиридил)пиперазин-1-ил]]- N-бензилбензамидопропионовой кислоты с выходом 34% получают в виде твердого вещества по методике, аналогичной приведенной в примере 30, взяв в качестве исходного соединения метиловый эфир N-бензил -β- аланина; спектр ПМР (хлороформ-d): δ 2,0-2,1 (2H, м), 2,6-2,7 (2H, т), 3,35-3,4 (4H, м), 3,45-3,55 (4H, м), 4,65 (3H, с), 4,65 (2H, с), 6,7 (2H, д), 6,85 (2H, д), 7,2- 7,45 (7H, м), 8,2-8,35 (2H, м); масс-спектр: m/e 459 (М + H)+.
Пример 152: [2-пропил-4-[2-[4-(4- пиридил)пиперазин-2-он-1-ил]ацетил]] феноксиуксусная кислота
Целевое соединение получают по методике, аналогичной приведенной в примере 131, взяв в качестве исходного соединения метиловый эфир 2-н-пропилфеноксиуксусной кислоты: спектр ПМР (ДМСО-d6): δ 0,9 (3H, т), 1,55-1,7 (2H, м), 2,65 (2H, т), 3,45-3,55 (2H, м), 3,65-3,75 (2H, м), 4,05 (2H, с), 4,8 (2H, с), 4,9 (2H, с), 6,85 (2H, д), 6,9 (1H, д), 7,75-7,85 (2H, м), 8,2 (2H, д); масс-спектр: m/e 370 (М + H)+; вычислено для C22H25N3O5•0,25H2O: C, 63,5; H, 6,1; N, 10,1; найдено: C, 63,5;H, 6,2; N, 9,9%.
Исходные соединения получают следующим образом.
(i) Метиловый эфир 2-аллил-феноксиуксусной кислоты с выходом 97% получают в виде масла по методике, аналогичной приведенной для стадии (i) примера 3, взяв в качестве исходного соединения 2-аллил-фенол; спектр ПМР (ДМСО-d6): δ 3,45 (2H, д), 3,7 (3H, с), 4,8 (2H, с), 5,0-5,1 (2H, м), 5,9-6,1 (1H, м), 6,85-6,95 (2H, м), 7,1-7,2 (2H, м); масс-спектр: m/e 207 (М + H)+.
(ii) Продукт, полученный на стадии (i) (5,86 г), растворяют в метаноле (100 мл) и добавляют каталитическое количество 10%-ного палладия на угле. Смесь гидрируют при атмосферном давлении в течение 18 час. Смесь отфильтровывают и упаривают, получая масло, которое очищают тонкослойной хроматографией на силикагеле, элюируя смесью этилацетат/гексан (10:90 об/об), и получают метиловый эфир 2-н- пропилфеноксиуксусной кислоты (4,82 г) в виде масла; спектр ПМР (ДМСО-d6): δ 1,4 (3H, т), 1,5-1,7 (2H, м), 2,6 (2H, т), 3,7 (3H, с), 4,8 (2H, с), 6,8-6,95 (2H, м), 7,1-7,2 (2H, м); масс-спектр: m/e 208 (М + H)+.
Пример 153: [2-метил-4-[2-[4-(4-пиридил)пиперазин-2-он-1- ил]ацетил]] феноксиуксусная кислота
Целевое соединение в виде твердого вещества получают по методике, аналогичной приведенной в примере 131, взяв в качестве исходного соединения метиловый эфир 2-метилфеноксиуксусной кислоты; спектр ПМР (ДМСО-d6 уксусная кислота - d4): δ 2,3 (3H, с), 3,6-3,7 (2H, м), 3,9-4,0 (2H, м), 4,35 (2H, с), 6,95 (1H, д), 7,15 (2H, д), 7,8-7,9 (2H, м), 8,25 (2H, д); масс-спектр: m/e 384 (М + H)+; вычислено для C20H21N3O5•1H2O: C, 59,8; H, 5,8; N, 10,0; найдено: C, 59,3; H, 5,8; N, 10,1%.
Пример 154: Этиловый эфир 4-[4-[4-(4-пиридил)пиперазин- 2-он-1-ил]ацетил]феноксимасляной кислоты
Целевое соединение в виде твердого бесцветного вещества (100 мг) получают по методике, аналогичной приведенной в примере 25, взяв в ткачестве исходного соединения 4-[4-(4-пиридил) пиперазин-2-он-1-ил] фенол; спектр ПМР (ДМСО- d6): δ 1,2 (3H, т), 1,9-2,05 (2H, квартет), 2,45 (2H, т), 3,85 (2H, м), 3,95 (2H, м + 2H, т), 4,05 (2H, квартет), 4,4 (2H, с), 6,9 (2H, д), 7,15 (2H, д), 7,25 (2H, д), 8,25 (2H, д); масс-спектр: m/e 384 (М+H)+.
Необходимые исходные соединения получают следующим образом.
(i) К перемешиваемой суспензии 4-(4-пиридил)пиперазин- 2-она (880 мг) в диметилформамиде (20 мл) добавляют гидрид калия (1,0 мл 20%-ной дисперсии) и смесь перемешивают в течение 0,5 час, после чего добавляют иодид меди (I) (1,0 г). Через 0,25 час добавляют 4-бензилоксибромбензол (1,2 г) и смесь перемешивают в атмосфере аргона при температуре 140oC в течение 2 час. Реакционную смесь разбавляют водой и насыщенным раствором соли и экстрагируют дихлорметаном (3 х 40 мл); органические вытяжки объединяют, промывают водой и насыщенным раствором соли, сушат (с помощью бумаги для разделения фаз) и упаривают, получая сырой продукт в виде пастообразного твердого вещества (2,0 г). Его очищают тонкослойной хроматографией на силикагеле, элюируя смесью дихлорметан/метанол/концентрированный водный раствор аммиака (97: 2,5: 0,5 об/об/об), и получают 4-бензилокси-[4-(4- пиридил)пиперазин-2-он-1-ил] бензол в виде бесцветного твердого вещества (1,1 г); спектр ПМР (ДМСО-d6): δ 3,7-3,9 (4H, м), 4,1 (2H, с), 5,1 (2H, с), 6,85 (2H, д), 7,05 (2H, д), 7,3-7,6 (5H, м), 8,2 (2H, д); масс-спектр: m/e 360 (М + H)+.
(ii) К раствору продукта, полученного на стадии (i) (1,1 г) в смеси метанола (500 мл) и тетрагидрофурана (100 мл) добавляют в качестве катализатора 30%-ный палладий на угле (300 мг) и перемешивают смесь в атмосфере водорода при комнатной температуре и нормальном давлении до тех пор, пока полностью не прореагирует исходное соединение. Катализатор отделяют фильтрованием, растворитель упаривают в вакууме, получая 4-[4- (4-пиридил) пиперазин-2-он-1-ил]фенол в виде твердого бесцветного вещества, дающего практически одно пятно по данным тонкослойной хроматографии, которое используют без дальнейшего изучения.
Пример 155: 4-[4-[4-(4-пиридил)пиперазин-2-он-1-ил] ацетил]феноксимасляная кислота
Целевое соединение получают в виде бесцветного твердого вещества (95 мг) по методике, аналогичной приведенной в примере 26, взяв в качестве исходного соединения продукт, полученный по примеру 154; спектр ПМР (ДМСО-d6): δ 1,8-2,0 (2H, квартет), 2,35 (2H, т), 3,7-4,0 (4H, м + 2H, т), 4,3 (2H, с), 6,85 (2H, д), 7,05 (2H, д), 7,2 (2H, д), 8,15 (2H, д); масс-спектр: m/e 356 (М + H)+.
Пример 156: 4-[2-Hитро-4-[4-(4-пиридил)пиперазин-1-ил] фенокси]масляная кислота
Целевое соединение получают с выходом 68% в виде твердого вещества с т. пл. 219-220oC по методике, аналогичной приведенной в примере 26, взяв в качестве исходного соединения продукт, полученный по примеру 146; спектр ПМР (ДМСО-d6): δ 8,2 (2H, д), 7,4 (1H, д), 7,27 (2H, м), 6,98 (2H, д), 4,08 (2H, т), 3,23 (4H, уширенный т), 2,36 (2H, т), 1,69 (2H, м); масс-спектр: m/e 387 (М + H)+; вычислено для C19H22N4O5•H2O: C, 56,4; H, 5,98; N, 13,9; найдено: C, 56,7; H, 5,7; N, 13,9%.
Пример 157
Иллюстративные фармацевтические дозировочные формы, которые могут служить для того, чтобы продемонстрировать использование соединений по настоящему изобретению для терапевтических и профилактических целей, могут быть получены обычными способами, хорошо известными из области техники.
а) Таблетка I - мг/таблетку
Активный ингредиент - 1,0
Лактоза фармакопейной чистоты - 93,25
Натриевая соль кроскармелозы - 4,0
Паста из кукурузного крахмала (5%-ная паста в воде) - 0,75
Стеарат магния - 1,0
b) Таблетка II - мг/таблетку
Активный ингредиент - 50
Лактоза - 223,75
Натриевая соль кроскармелозы - 6,0
Кукурузный крахмал - 15,0
Поливинилпирролидон (5%-ная паста в воде) - 2,25
Стеарат магния - 3,0
с) Таблетка III - мг/таблетку
Активный ингредиент - 100
Лактоза - 182,75
Натриевая соль кроскармелозы - 12,0
Кукурузный крахмал (5%-ная паста в воде) - 2,25
Стеарат магния - 3.0
d) Капсула - мг/капсулу
Активный ингредиент - 10
Лактоза фармакопейной чистоты - 488,5
Стеарат магния - 1,5
e) Инъекция - мг/мл
Активный ингредиент (кислотно-аддитивная соль) - 1,0
Хлорид натрия - 9,0
Очищенная вода - до 1,0 мл2
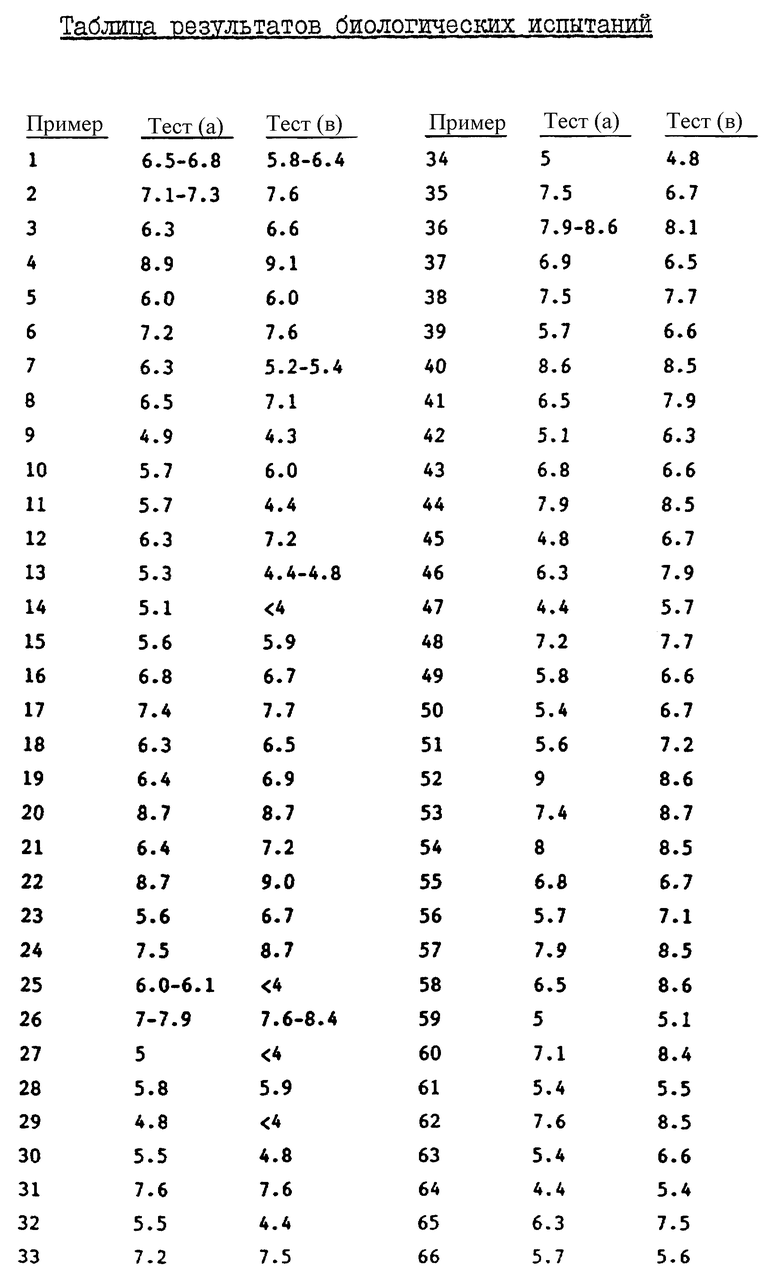
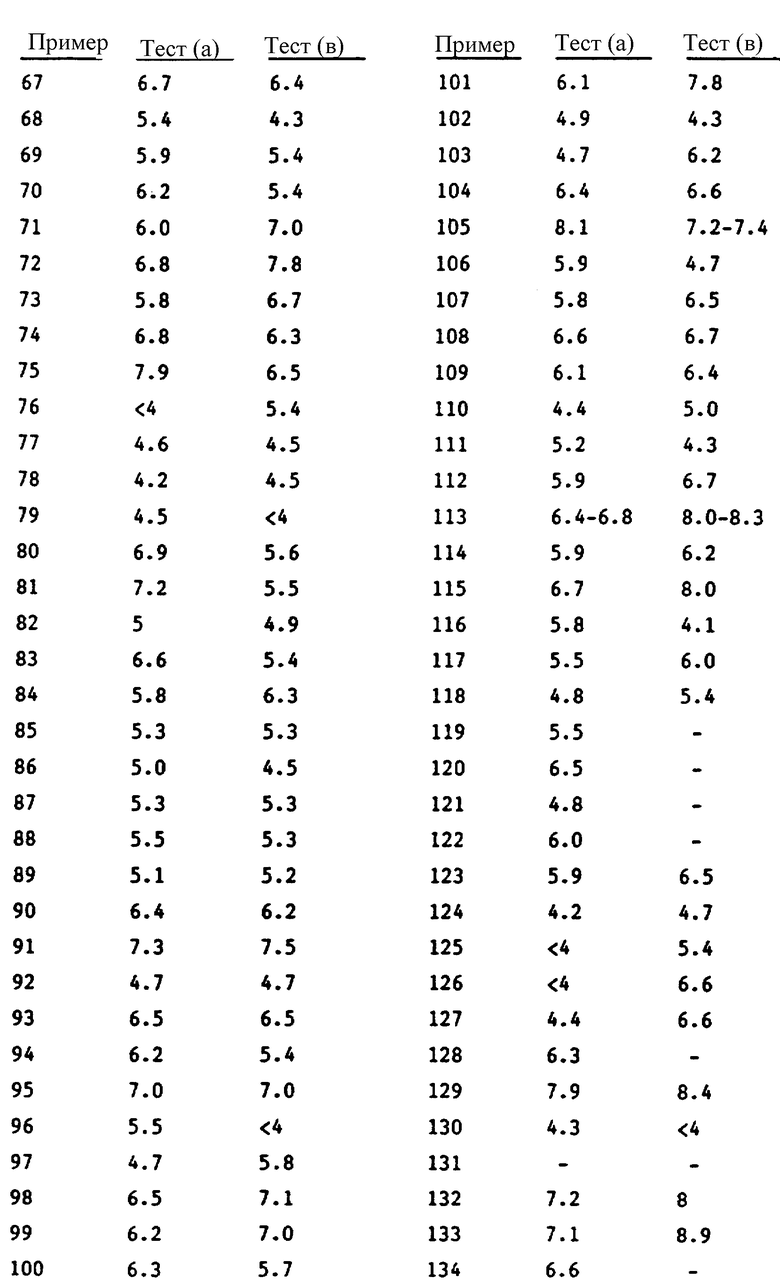
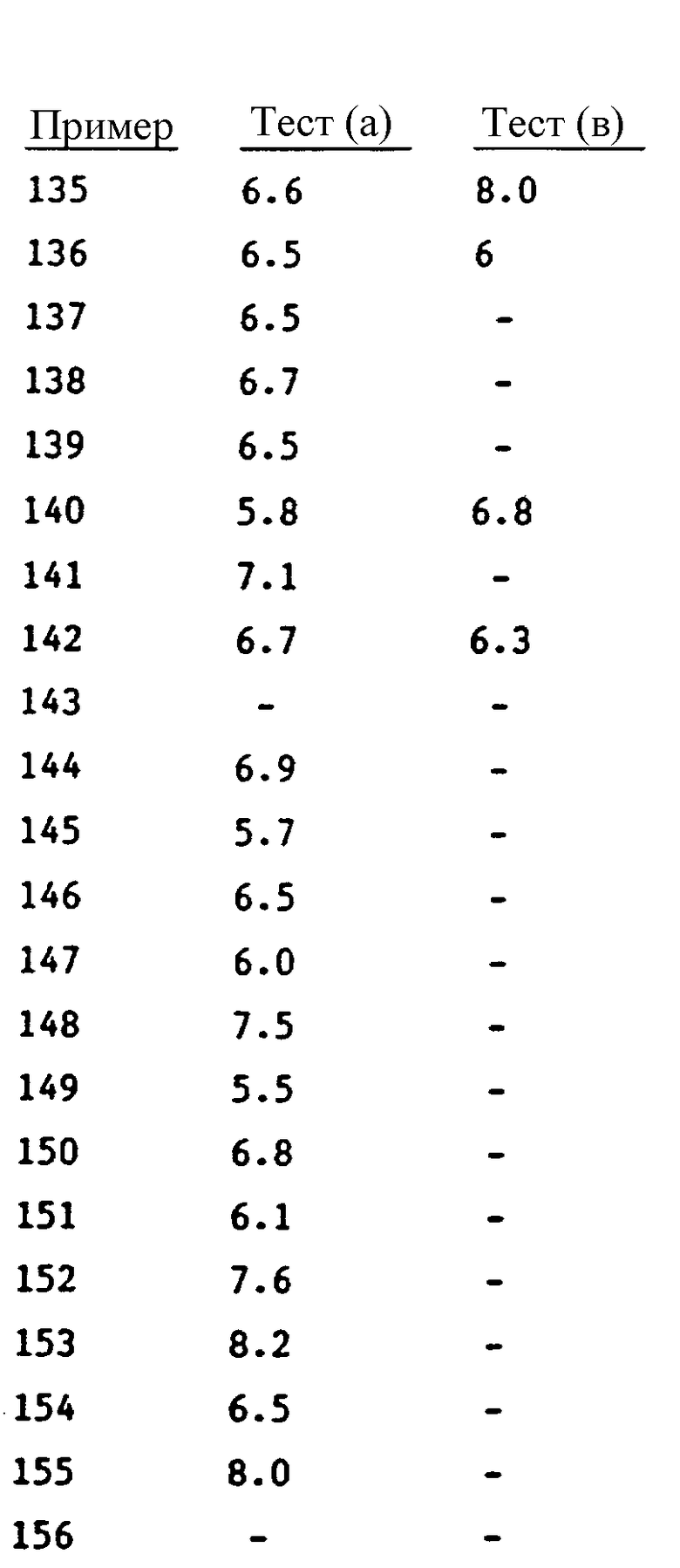
Производные пиридина формулы I, где М2 означает -NR3, R3 - водород, алкил или группа -NR4-D-TR5, Т обозначает N; D - С2-3-алкиленовая группа, R4, R5 вместе обозначают С2-3-алкиленовую группу, Х - простая связь, С1-4-алкиленовая группа, фениленкарбонил, С1-2-алкиленкарбонил, C1-2-aлкиленкарбонилокси, С1-2-алкиленСОNН-, С1-4-алкиленокси (другие значения см. в п. 1 формулы изобретения), обладают способностью ингибировать агрегацию тромбоцитов и ингибировать связывание фибриногена с GPIIb/IIIa. 4 с. и 12 з. п. ф-лы, 1 табл.
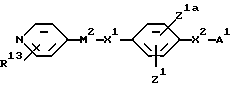
где М2 означает -NR3, где R3 является атомом водорода или (1 - 4С)алкилом; или обозначает группу -NR4-D-TR5-, где (i) Т обозначает N; D обозначает (2-3С)алкиленовую группу, и R4 и R5 вместе обозначают (2-3С) алкиленовую группу;
Х1 обозначают простую связь или (1-4С)алкиленовую группу, фениленкарбонильную группу, (1-2С)алкиленкарбонильную группу, (1-2С)алкиленкарбонилокси группу, (1-2С)алкиленCONH-группу, (1-4С)алкиленокси группу, или когда М2 обозначает группу -NR4-D-TR5-, карбонильную группу, карбонил(1-3С)алкиленовую группу, группу CONH или CONH(1-3C)алкиленовую группу;
группы Z1 и Z1a каждая независимо обозначают атом водорода, атом галогена, (1-4С)алкильную группу, (2-4С)алкенильную группу, (1-4С)алкокси-группу или (2-4С)алкенилоксигруппу;
Х2 обозначает связь или (1-4С)алкиленовую группу, (2-4С)алкениленовую группу, окси(1-4С)алкиленовую группу, тио(1-3С)алкиленовую группу, амино(1-4С)алкиленовую группу, SO2NH(1-3C)алкиленовую группу, NR21CO(1-2C)алкиленовую группу (где R21 обозначает атом водорода, (1-4С)алкильную группу или бензильную группу, CONR21 (1-2С)алкиленовую группу, в каждой из которых алкиленовая группа может быть необязательно замещена (2-4С)алкенильной группой; (2-4С)алкинильной группой; (1-4С)алкокси-группой; карбоксильной группой; (1-4С)алкоксикарбонильной группой; фенил(1-2С)алкил и NHCO-группой; карбокси(1-2С)алкильной группой; фенил(1-2С)алкильной группой; фенилсульфонил(1-2С)алкильной группой; фенильной группой; амино-группой или группой формулы NR12XR6, где Х обозначает SO2 или СО; R12 обозначает атом водорода или (1-4С)алкил, а R6 обозначает (1-6С)алкил или фенил;
А1 обозначает карбокси-группу или ее метаболически лабильный сложный эфир или амид; и
R13 обозначает атом водорода или (1-4С)алкил;
и их фармацевтически приемлемые соли, при условии, что Х2 не обозначает связь, если Х1 обозначает связь.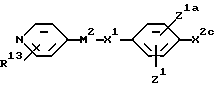 где Х2С обозначает гидроксильную группу или ее реакционно-способное производное, а R13, М2, Х1, Z1 и Z1a имеют любое значение, приведенное по п.1, при условии, что исключаются 4-(4-метоксианилино)пиперидин и 4-(4-гидроксианилино)пиридин.
где Х2С обозначает гидроксильную группу или ее реакционно-способное производное, а R13, М2, Х1, Z1 и Z1a имеют любое значение, приведенное по п.1, при условии, что исключаются 4-(4-метоксианилино)пиперидин и 4-(4-гидроксианилино)пиридин.
где М2 обозначает 2-оксопиперазин-1,4-диил, а R13 имеет любое из значений, приведенных по п.1.
| EP 0244115 A2, 1987 | |||
| Способ автоматического регулирования работы электролизера для получения алюминия | 1952 |
|
SU100158A1 |
| АККУМУЛЯТОР ХОЛОДА ДЛЯ КОНДИЦИОНИРОВАНИЯ ВОЗДУХА | 1938 |
|
SU56114A1 |
| Машковский М.Д | |||
| Лекарственные средства | |||
| - М.:Медицина, ч | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Аппарат, предназначенный для летания | 0 |
|
SU76A1 |
Авторы
Даты
1999-12-20—Публикация
1994-03-28—Подача