Это изобретение относится к фармакологически активным энантиомерам, их солям с физиологически приемлемыми кислотами, способу их получения и фармацевтическим составам, содержащим их.
В заявке PCT/EP 93/00080 описывается класс новых соединений общей формулы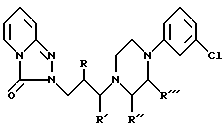
где только один из R', R'' и R''' является алкилом, имеющим от 1 до 3 атомов углерода, в то время как другие являются водородом.
Как показывают фармакологические данные, сообщенные в вышеупомянутой заявке, соединения с химической формулой I обладают фармакологическими показателями, сходными с показателями тразодона (1, R = R' = R"= R' = H), но также имеют и некоторые преимущества, как например пониженное сродство к адренергическим рецепторам.
Как неожиданно установлено в настоящее время, оба (S)- и (R)-энантиомера соединений с химической формулой I, где R, R', R''' - водород и R'' - алкил, имеющий от 1 до 3 атомов углерода, обладают улучшенной анальгезирующей активностью по сравнению с их рацематами.
Это открытие является даже более удивительным, поскольку оба энантиомера обладают более низкой альфалитической активностью и, следовательно, меньшими нежелательными эффектами по сравнению с соответствующими рацематами.
Поэтому первой целью этого изобретения является получение (S)- и (R)-энантиомеров соединений с химической формулой IA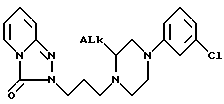
где ALk - алкил, имеющий от 1 до 3 атомов углерода;
и их солей присоединения с физиологически приемлемыми кислотами.
Примерами подходящих кислот являются хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота, молочная кислота, янтарная кислота, уксусная кислота, винная кислота, яблочная кислота, лимонная кислота, бензойная кислота, 2-нафталинсульфоновая кислота, адипиновая кислота и пимелиновая кислота.
Хотя оба (R)- и (S)-энантиомера являются более активными, чем соответствующие рацематы, (S)-энантиомеры активнее (R)-энантиомеров. Следовательно, предпочитаются (S)- энантиомеры. Что касается обозначения ALk, то предпочитается метил.
Таким образом, предпочтительным соединением по этому изобретению является (S)- энантиомер с химической формулой IA, где ALk - метил.
Аналгезирующую активность соединений по этому изобретению проверяли на мышах посредством фенилхинонового теста с подкожным способом применения (Pharmacol. Exp. Ther. 125, pp.237- 240, 1959). Каждое соединение вводили тридцати животным. Результаты экспериментов приводятся в табл. 1.
Как показывает табл. 1, для достижения одинакового аналгезирующего действия требуется более высокая доза рацемического соединения. Это означает, что рацемическое соединение обладает меньшей аналгезирующей активностью по сравнению с отдельными энантиомерами. Табл. 1 также показывает, что (S)- энантиомер более активен, чем (R)-энантиомер.
Так как расстройство адренергической системы является показателем нежелательных эффектов, то оценивались как способность связывания с альфа-1 адренергическими рецепторами, как например IC50 (табл. 2), так и альфалитическая активность (табл. 3) одинаковых соединений.
Что касается испытания на связывание рецепторов, то делается ссылка на "Molecylar Pharmacology", 20, 295-301 (1981).
В свою очередь оценивалась альфалитическая активность на изолированном органе (взятом от крысы) в соответствии с методикой, описанной в "Clinical and Experimental Pharmacology & Physiology", 6, 275-279 (1979).
Результаты экспериментов представлены в табл. 2 и 3.
В табл. 2 сродство к альфа-1 адренергическим рецепторам тем выше, чем ниже величина IC50 в то время как в табл. 3 альфалитическая активность тем выше, чем больше величина pA2. Кроме того, данные табл. 2 и 3, следовательно, оказываются совершенно неожиданными, так как они показывают, что как нарушение адренергического рецептора, так и альфалитическая активность, а, следовательно, и нежелательные действия обоих (S)-и (R)- энантиомеров меньше, чем у рацемата, при этом альфалитическая активность (S)-энантиомера меньше, чем у (R)-энантиомера.
Таким образом, чем больше аналгезирующая активность энантиомеров и рацемата с химической формулой IA, тем меньше нежелательная альфалитическая активность.
Соединения по этому изобретению могут быть получены путем фракционированной кристаллизации их солей с оптически активной кислотой или путем стереоспецифического синтеза.
При первом способе особенно полезными оказались соли винной кислоты.
Следовательно, второй целью этого изобретения является создание способа получения энантиомеров с химической формулой IA, отличающегося тем, что образуют соли рацемической смеси соединения с химической формулой IA с (R, R или S, S ) винной кислотой, путем фракционированной кристаллизации отделяют две полученные таким образом диастереоизомерные соли от подходящего растворителя и, при желании, образуют соль полученного таким образом энантиомера с физиологически приемлемой кислотой.
Примерами подходящих растворителей являются низшие спирты и вода.
Соли энантиомеров по этому изобретению с (R, R или S, S)-винной кислотой также являются новыми и, следовательно, представляют собой третью цель этого изобретения.
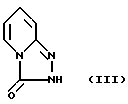
Другой целью этого изобретения является создание способа стереоспецифического синтеза энантиомеров с химической формулой IA и их солей присоединения с физиологически приемлемыми кислотами, отличающиеся тем, что соединение химической формулы III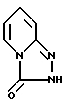
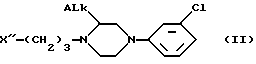
или его соль щелочного металла реагирует с пиперазиновым соединением химической формулы II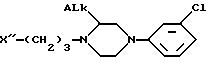
в которой ALk имеет вышеупомянутое значение;
X'' является отщепляемой группой от группы, содержащей хлор, бром и -O-SO2-Z, где Z - алкил или арил,
при этом соединение II, имеет абсолютную (R)-или (S)-конфигурацию, в присутствии подходящего органического разбавителя или смеси органических разбавителей при температуре от 40oC до температуры кипения реакционной смеси, а, при желании, образуют соль полученного таким образом энантиомера с физиологически приемлемой кислотой.
Вышеупомянутая реакция по существу представляет собой подщелачивание вторичной аминогруппы и может проводиться по обычной методике (J.March, Advanced Organie Chemistry, 3 rd ed, J.Wiley & Sons, NY, pages 364-365).
Предпочитается, чтобы соединение химической формулы III реагировало в виде соли щелочного металла, как например соли натрия, описанной в US-A-3.381.009.
Обычными значениями Z являются метил, фенил, толил и парабромфенил.
Реакцию предпочитается проводить путем реагирования натриевой соли соединения химической формулы III с соединением формулы II в присутствии подходящего органического разбавителя или смеси органических разбавителей при температуре от 40oC до температуры кипения реакционной смеси. Примерами подходящих органических разбавителей являются ароматические углеводороды, алифатические спирты, амиды и их смеси.
Примерами предпочтительных ароматических углеводородов являются бензол, толуол и ксилол, а примерами алифатических спиртов - бутанол, трет-бутанол, втор-бутанол, изобутанол, пентанол и трет-пентанол. Типичным примером предпочтительного амида является диметиламид.
В свою очередь, стереоскопический синтез соединений с химической формулой II можно проводить реакцией соединения формулы VIII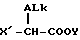
где ALk имеет вышеупомянутое значение
X' является CH3-O-SO2-O- или галогеном;
Y - алкил, имеющий от 1 до 3 атомов углерода,
которое имеет абсолютную (S)- или (R)-конфигурацию,
с соединением формулы VII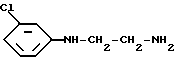
для получения соединения формулы VI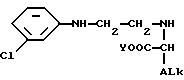
где Y и ALk имеют вышеописанное значение,
которое имеет абсолютную (R)-конфигурацию, когда соединение VIII имеет (S)-конфигурацию, и наоборот.
Реакцию между соединением VIII и соединением VII для получения соединения VI предпочитается проводить в присутствии акцептора кислоты и подходящего растворителя.
Примерами подходящих акцепторов кислоты являются триэтиламин и пиридин, а примерами подходящих растворителей - ароматические углеводороды, как например толуол и ксилол.
Затем проводят циклизацию соединения VI для получения соединения с химической формулой V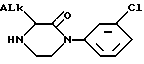
имеющего такую же абсолютную конфигурацию, как и у соединения (VI).
Циклизацию соединения (VI) в соединение (V) нельзя было проводить по методике, описанной в PCT/ЕР 93/00080 в связи с соответствующими рацемическими соединениями, так как при указанной методике происходила полная рацемизация. После ряда неудачных попыток, которые приводили либо к рацемизации, либо к извлечению неизменившегося соединения (VI), неожиданно было обнаружено, что желаемая циклизация могла быть очень легко осуществлена растворением соединения (VI) в водном растворе сильной кислоты и отделением (после кратковременного нагревания) желаемого соединения (V) путем подщелачивания получающегося в результате раствора.
Типичным примером предпочтительной сильной кислоты является хлористоводородная кислота.
Соединение (V), полученное таким образом, затем восстанавливают способом, сходным с тем, который описан для схемы реакции 3 в вышеупомянутой патентной заявке PCT/ЕР 93/00080.
Процесс получения затем продолжают по способу, сходному с тем, который описан в вышеупомянутой патентной заявке в связи со схемой реакции 2.
Как во время стадии циклизации (VI---> V), так и во время всех последующих стадий не происходит никакой инверсии конфигурации, а полученное таким образом конечное соединение с химической формулой IA имеет такую же абсолютную конфигурацию, как и у соединения (V). Возможная рацемизация - очень небольшая, если вообще имеется.
Для практических целей соединения по этому изобретению могут вводиться в том виде, в каком они имеются, но предпочитается вводить их в виде фармацевтических составов.
Эти составы являются дополнительной частью этого изобретения и содержат терапевтическое количество по меньшей мере одного энантиомера с химической формулой lA или соли его присоединения к физиологически приемлемой кислоте вместе с жидкими или твердыми фармацевтическими носителями.
Фармацевтические составы по этому изобретению могут быть твердыми, например в виде таблеток, драже с сахарным покрытием, капсул, порошков или форм с контролируемым выделением, или полужидкими, например в виде паст или мазей, или жидкими, например в виде растворов, суспензий или эмульсий.
Кроме обычных носителей, составы по этому изобретению могут содержать другие подходящие фармацевтические добавки, как например консерванты, стабилизаторы, эмульгаторы, соли для регулирования осмотического давления, буфер, красители и корригенты.
В случае их необходимости для особой терапии, составы по этому изобретению могут также содержать другие совместимые активные ингредиенты, одновременное введение которых является терапевтически полезным.
Для терапевтических целей можно очень широко изменять вводимую действующую дозу энантиомера с химической формулой lA в зависимости от различных факторов, как например требующейся определенной терапии, фармацевтического состава, способа введения и эффективности определенного используемого энантиомера по этому изобретению. Однако оптимальная действующая доза может быть выбрана простыми обычными способами.
В общем, ежедневный прием энантиомеров с химической формулой IA предпочтительно колеблется в пределах от 0,1 до 10,0 мг/кг.
Фармацевтические составы по этому изобретению могут быть приготовлены обычными способами, известными химику-фармацевту и включающими в себя примешивание, гранулирование и прессование или, при необходимости, перемешивание и растворение компонентов, когда это соответствует получению желаемого результата.
Последующие примеры предназначены для иллюстрации этого изобретения.
Пример 1.
Смесь из 12,5 г (0,032 молей) рацемата (1, R = R'= R''' = H, R'' = CH3) в качестве основания и 4,8 г (0,032 моль) природно встречающейся (R, R )-винной кислоты в 125 г абсолютного этилового спирта недолго нагревали при почти температуре кипения вплоть до завершения растворения.
Твердое вещество, отделенное охлаждением, собирали путем фильтрования и рекристаллизовывали из абсолютного этилового спирта, пока не достигали постоянной точки плавления.
Получали соль (S) энантиомера формулы IA с (R, R )-винной кислотой.
Точка плавления 151-152oC, [α]
Соответствующее основание получали путем суспендирования соли в воде и подшелачивания (при перемешивании) порошкообразным карбонатом калия.
Остаток от экстрагировация дихлорметаном расплавляется при 63-65oC (гексан), [α]
Гидрохлорид, точка плавления 122-124oC (из этилового спирта, гигроскопичный).
Сульфат, точка плавления 204-250oC.
Малеат, точка плавления 142-143oC.
Из отфильтрованного раствора, из которого была предварительно отделена (S) (R, R )-соль, извлекали (R)-основание и растворяли его в абсолютном этиловом спирте.
Затем к этому раствору добавляли эквимолярное количество (S, S ) винной кислоты. Путем охлаждения отделяли (R) (S, S)-соль. Эта соль имеет такую же точку плавления (151-152oC), как и у (S) (R, R)-соли [α]
Соответствующее основание расплавляется при 63-65oC, [α]
Гидрохлорид, точка плавления 122-124oC (гигроскопичный).
Пример 2.
a) (R)-1-(3-хлорфенил)-3-метил-пиперазин-2-он (формула V, Alk = CH3)
Кипятили и нагревали с обратным холодильником в течение ночи раствор 18,4 г (0,108 моль) N-(3-хлорфенил)этандиамина (соединение формулы VII; J. Med. Chem., 9., 858-860 (1966)), 19,3 мл (0,119 моль) этилового эфира (S)-метансульфонилмолочной кислоты (соединение формулы VIII, Alk = CH3, Y = C2H5, X' = CH3-SO2-O-) и 22,8 мл (0,163 моль) триэтиламина в 200 мл толуола.
Реакционную смесь промыли водой и экстрагировали 1н. раствором соляной кислоты. Водную фазу подщелочили измельченным в порошок карбонатом калия и экстрагировали хлористым метиленом.
Полученное таким образом основание очищали флэш-хроматографией (силикагель, гексан-этилацетат 1:1).
Маслянистый остаток (соединение формулы (R) VI, Alk= CH3, Y = C2H5), полученный после выпаривания растворителя, растворили в 10 частях (по весу) 2 н.HCI, а затем охладили и подщелочили твердым K2CO3. Масло, которое отделилось, экстрагировали дихлорметаном и остаток после выпаривания растворителя очищали флэш-хроматографией (SiO2, элюент хлороформ) с получением соединения формулы (R) Y (Alk = CH3), проявляющего удельное вращение [α]
b) (R) -2-[3- [4-[3-Хлорфенил)-1- (2-метил)- пиперазинил] пропил]-1,2,4-триазол[4,3-а]-пиридин-3(2H)-он (формула IA, Alk = CH3)
К суспензии литийалюминийгидрида (31,5 г) в этиловом эфире (650 мл) добавили раствор 66 г (R) Y (Alk = CH3) в этиловом эфире (350 мл) при энергичном перемешивании и по каплям, чтобы допустить мягкое кипение растворителя под обратным холодильником. По завершении добавления полученную смесь кипятили с обратным холодильником еще 2 ч, затем охлаждали и избыток гидрида разлагали H2O и 2 н. NaOH. После перемешивания в течение 30 мин при комнатной температуре отфильтрованный раствор выпаривали при пониженном давлении с получением 45 г основания (R)-1-(3-хлорфенил)-3-метилпиперазина, проявляющего удельное вращение [α]D= +15 (1% в этаноле).
К смеси 1-бром-З-хлорпропана (150 мл), K2CO3 (55г) и H2O (4 мл), нагреваемой при 60oC, в течение 48 ч при энергичном перемешивании по каплям добавляли раствор (R)-1-(3-хлорфенил)-3-метилпиперазина (40 г) в толуоле (50 мл). Затем смесь фильтровали, летучую часть удаляли и остаток очищали хроматографией (SiO2, гексан-этилацетат 1:1). Таким образом было получено 25 г соединения формулы II (X'' = Cl, Alk = CH3), [α]D= = + 47,5 (1% в этаноле). Смесь соединения формулы (R) II, X'' - Cl, Alk = CH3, (43 г), натриевой соли соединения формулы (III) (23,6 г), ксилола (300 мл) и изобутилового спирта (30 мл) кипятили с обратным холодильником в течение 8 ч. После этого реакционную смесь разбавили равным объемом воды и остаток, полученный путем удаления растворителей, перевели в соответствующий гидрохлорид, т.пл. 122-124oC.
Основание (соединение формулы IA ALk = CH3) проявляло удельное вращение 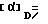 +31,8 (1% в этиловом спирте).
+31,8 (1% в этиловом спирте).
Пример 3.
(S)-2-[3-[4-(3-хлорфенил)-1-(2-метил)пиперазинил] -пропил] -1,2,4- триазол[4,3-а]пиридин-3(2Н)-он (химическая формула IA, ALk = CH3).
Целевой продукт получали по способу, сходному с описанным в примере 2, за исключением замещения (S)-этилового эфира метансульфонил-молочной кислоты эквимолярным количеством (R) -этилового эфира 2-бромпропионовой кислоты.
Основание, точка плавления 63-65oC, [α]


(S)- или (R)-Энантиомер соединения с химической формулой IА, где АLk - алкил, имеющий 1 - 3 атома углерода, и его соль присоединения с физиологически приемлемой кислотой обладают фармакологическими показателями, сходными с показателями тразодона, но имеющими пониженное сродство к адренергическим рецепторам. Способ получения соединений формулы IА или его кислотно-аддитивных солей заключается в том, что соединение формулы III или его соль с щелочным металлом подвергают реакции с пиперазиновым соединением формулы II, в которой АLk имеет упомянутое значение, а Х" является отщепляемой группой от группы, содержащей хлор, бром и -O-SO2-Z, где Z - алкил или арил, при этом соединение II имеет абсолютную (R)- или (S) - конфигурацию в присутствии подходящего органического разбавителя или смеси органических разбавителей при температуре от 40oC до температуры кипения реакционной смеси, и, при желании, образуют соль полученного таким образом энантиомера с физиологически приемлемой кислотой. Описывается целый ряд новых промежуточных соединений. 5 с. и 11 з.п. ф-лы. 3 табл.
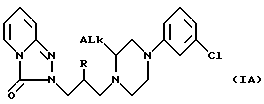
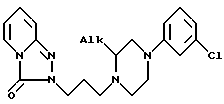
где Alk - алкил с 1 - 3 атомами углерода,
и его кислотно-аддитивные соли.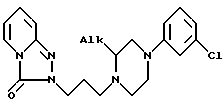
или его кислотно-аддитивных солей,
где Alk - алкил с 1 - 3 атомами углерода,
отличающийся тем, что рацемическую смесь соединения общей формулы IA подвергают взаимодействию с (R,R)- или (S,S)-винной кислотой в среде подходящего растворителя, затем путем фракционированной кристаллизации отделяют две полученные таким образом диастереоизомерные соли от растворителя и при желании полученный таким образом энантиомер переводят в соль с физиологически приемлемой кислотой.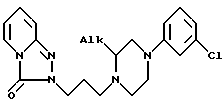
или его кислотно-аддитивных солей,
где Alk - алкил с 1 - 3 атомами углерода,
отличающийся тем, что соединение формулы III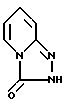
или его соль с щелочным металлом подвергают реакции с пиперазиновым соединением формулы II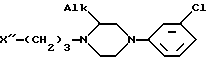
в которой Alk имеет упомянутое значение;
X'' является отщепляемой группой, выбранной из группы, содержащей хлор, бром и -O - SO2 - Z, где Z - алкил или арил,
при этом соединение II имеет абсолютную (R)- или (S)-конфигурацию, в присутствии подходящего органического разбавителя или смеси органических разбавителей при температуре от 40oC до температуры кипения реакционной смеси и при желании образуют соль полученного таким образом энантиомера с физиологически приемлемой кислотой.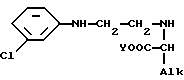
где Y и Alk, одинаковые или разные, являются алкилом с 1 - 3 атомами углерода и с (R)- или (S)-конфигурацией,
для получения соединения формулы V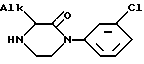
имеющего такую же абсолютную конфигурацию, как и у соединения VI, отличающийся тем, что реакцию циклизации проводят в присутствии водного раствора сильной кислоты и что желаемое соединение V после кратковременного нагревания получают путем подщелачивания полученного раствора.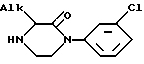
где Alk-алкил с 1 - 3 атомами углерода.
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| Полу генеративная топка для сжигания влажного торфа | 1921 |
|
SU368A1 |
Авторы
Даты
1999-03-27—Публикация
1994-06-21—Подача