Область изобретения
Изобретение относится к продуцированию фитазы в трансгенных растениях и к использованию полученной таким образом фитазы в промышленных технологиях.
Предпосылки настоящего изобретения
Фосфор является важным элементом для роста всех организмов. При выращивании домашних животных корм должен быть дополнен неорганическим фосфором с тем, чтобы получить хорошие показатели роста для одножелудочных животных (например, свиней, птицы и рыбы).
Напротив, никакие неорганические фосфаты нет необходимости добавлять в корм жвачных животных. Микроорганизмы, которые содержатся в рубце, продуцируют ферменты, которые катализируют превращение фитата (мио-инозитгексакис-фосфата) в инозит в неорганических фосфатах.
Фитат возникает как источник хранения фосфора, видимо, у почти всех кормовых материалов, имеющих растительное происхождение (обзорное изложение смотри: фитиновая кислота, химия и применения, Э.Граф (ред.), Пилатус Пресс; Миннеаполис, МН, США (1986)). Фитат составляет 1 - 3% всех орехов, злаков, бобов, масляничных семян, спор и пыльцы. Сложные соли фитиновой кислоты называются фитином. Фитиновая кислота рассматривается как противопищевой фактор, так как она образует хелатные минералы такие, как кальций, цинк, магний, железо, и может также взаимодействовать с протеинами, при этом снижается биодоступность протеинов и важных с пищевой точки зрения минералов.
Фитатный фосфор проходит через желудочно-кишечный тракт одножелудочных животных и выделяется с навозом. Хотя имеет место некоторый гидролиз фитата в толстой кишке, высвобожденный таким образом неорганический фосфор не имеет пищевой ценности, так как неорганический фосфор абсорбируется только в тонкой кишке. Как следствие существенное количество важного с питательной точки зрения фосфора не используется одножелудочными животными, несмотря на его присутствие в корме.
Выделение фитатного фосфора с навозом имеет другие следствия. Поголовье домашнего скота в последние десятилетия увеличивается сверхбыстрыми темпами. Поэтому соответствующим образом увеличивается количество производимого навоза, что порождает проблемы, связанные с окружающей средой в различных частях мира. Это связано частично с накоплением фосфатов, выводимых с навозом, на водных поверхностях, что приводит к эйтрофикации.
Ферменты, производимые микроорганизмами, которые катализируют превращение фитата в инозит и неорганический фосфор, широко известны под названием фитаз. Микроорганизмы, производящие фитазу, включают бактерии такие, как Bacillus Subtilis (В.К.Павер и В.Дж. Джаганнатан (1982), J. Bacteriol., т.151, стр. 1102) и Pseudomonas (Д.Дж.Костроув (1970) Austral. J. Biol. Sci., т.23, стр. 1207); Дрожжи такие как Saccharomyces cerevisiae (Н.Р.Найини и П.Маркакис (1984) Lebensmittel Wissenshaft and Technologie., т. 17, стр. 24); и грибы такие, как Aspergillus terreus (К.Ямада, И.Минода и С.Ямамото (1986) Agric. Biol. Chem. 32, стр. 1275). Известно, что некоторые другие виды Aspergillus продуцируют фитазу, из которых фитаза, продуцируемая Aspergillus ficuum, как было установлено, обладает одним из самых высоких уровней специфической активности, а также обладает лучшей термостабильностью по сравнению с фитазами, продуцируемыми другими микроорганизмами (ван Горком и др. (1991), Европейская Патентная заявка 89202436.5, публикация N 0 420 358, поданная 27 сентября 1989 г.).
Фитазы, кроме того, эндогенно содержатся во многих растительных видах (см. Левус, Ф. А. (1990) в: Биология растений, т. 9: "Метаболизм инозита в растениях" /ред. Д. Дж. Морре, У.Ф.Босс, Ф.А.Левус (13). Геллатли, К.С. и Лефебвр, Д. Д. / (1990) Физиология растений (Дополнение), 93, Реферат 562 упоминают изоляцию и характеризацию клона кДНК фитазы, полученного из клубней картофеля. Гибсон, Д.М. и др. и Христен А.А. и др. /(1988), J. Cell Biochem., т. 12C, рефераты L407 и L402, соответственно) упоминают синтез эндогенной фазы во время прорастания семян соевых бобов. Однако растительные фитазы в общем случае продуцируются в количестве, которое недостаточно для их применения в промышленной технологии.
Концепция добавления микробной фитазы в корм одножелудочных животных была ранее описана (Уар, Дж.Г., Блафф, Л. и Шиех, Т.Р. (1967), патент США N 3297548; Нелсон, Т.С., Шиех, Т.Р., Уодзински, Р.Дж. и Уар, Дж.Г. (1971), J. Nutrition, т. 101, стр. 1289). Однако до настоящего времени применение этой концепции не было осуществлено в промышленных масштабах из-за высокой стоимости продуцирования микробных ферментов (И.У.Хан (1989) Animal Feed Sci and Technol, т. 24, стр. 345). По экономическим причинам неорганический фосфор по-прежнему добавляют в корм одножелудочных животных.
Для фитаз были найдены другие области промышленного использования. Примером такого использования является промышленный способ получения крахмала из злаков таких, как кукуруза и пшеница. Отработанные продукты, содержащие, например, кукурузную клейковину со стадии влажного измельчения, продают на рынке в качестве животного корма. В процессе вымачивания количество фитазы может быть увеличено. Условия (T 50oC и pH 5,5) идеальны для фитазы грибов (см. например, Европейскую патентную заявку 0 321 005, принадлежащую Алко Лтд. ). Ввиду этого животные корма, полученные из отработанных продуктов вышеупомянутого процесса, будут содержать фосфат вместо фитата.
Было также установлено, что фитазы можно использовать для переработки сои (см. ферменты финазы TM фирмы Алко, брошюра, содержащая информацию о продуктах фирмы Алко Лтд., Райамэки, Финляндия). Мука соевых бобов содержит высокие концентрации противопищевого фактора фитата, который наделяет этот источник протеина свойствами, препятствующими ее использованию для детского питания и корма рыб, телят и других нежвачных животных. Ферментативная обработка этого ценного источника протеина улучшает питательную и коммерческую ценность этого материала.
Возможность использования трансгенных растений в качестве системы для продуцирования ценных протеинов была высказана ранее. Примерами, известными в настоящее время, являются получение интерферона в табаке (Гудмэн, Р.М., Кнауф, В. С., Хук, К.М. и Комай, Л. (1987) ПСТ / 0 87/ 00865, энкефалинов в табаке, Brassica napus и Arabidopsis thaliana (Вандекеркхов, Я., Ван Дамм, Я., Ван Лийзебеттенз, М., Боттермэн, Я., Деблок, М., Деклерк, А., Лимэнз, Я. , Ван Монтагу, М. и Кребберз, Е. (1989) Bio/Technol. т. 7, стр. 929), антител в табаке (Хиатт, А., Кафферкей, Р. и Боедиш, К. (1990) Nature, т.342, стр. 76) и альбумина человеческой сыворотки в табаке и картофеле (Сиймонз, П.К., Деккер, Б.М.М., Шраммейер, Б., Вервоерд, Т.К., ван ден Элзен, П.Я.М. и Хоекема, А. (1990) Bio/Technol. т. 8, стр. 217).
На практике трансформация все более значительного количества растительных видов, в частности двудольных видов (например, табака, картофеля, томатов, Petunia, Brassica) стала стандартной процедурой для тех, кто работает в этой области техники (Кли, Х., Хорш, Р. и Роджерс, С. (1987) Annu. Rev. Plant Physiol. , т. 38, стр. 467; Гассер, К.С. и Фралеи, Р.Т. (1989) Science, т. 244, стр. 1293). Стратегии для экспрессии чужеродных генов в растениях также хорошо разработаны (Гассер и Фралей, см. выше). Были идентифицированы регуляторные последовательности из растительных генов, которые используют для конструкции химерных генов, которые могут быть функционально экспрессированы в растениях и в растительных клетках.
Для введения генных конструкций в растения доступны несколько приемов такие, как трансформация при помощи Agrobacterium tumefaciens или Agrobacterium rhizogenes, используя эту стратегию, были обработаны самые разнообразные растительные ткани, причем выбор в значительной степени зависит от вида растения и их восприимчивости к культуре ткани. К успешным в этом отношении примерам относятся трансформация протопластов, микроспор, или пыльцы, и эксплантатов таких, как листья, стебли, корни, гипокотили и котили. Кроме того, используют приемы для прямого введения ДНК в протопласты и растительные клетки или ткани такие, как микроинъекция, электропорация, бомбардировка частицами и прямое поглощение ДНК (Гассер и Фралей, см. выше).
Протеины могут быть получены в растениях с использованием различных систем экспрессии. Например, использование конструктивного промотора такого, как промотор 35S мозаичного вируса цветной капусты (Caму) (Гиллей, Х., Дадлей, Р. К. , Джонард, Г., Балаш, Е. и Ричардс, К.Э. (1982), Cell, т. 30, стр. 753) будет приводить к накоплению экспрессированного протеина во всех органах трансгенного растения. В качестве альтернативы можно использовать промоторы из генов, кодирующих протеины, которые экспрессируются высокоспецифическим относительно ткани или относительно стадии образом (Хиггинс, Т. Дж. В. , (1984) Annu. Rev. Plant Physiol., т. 35, стр. 191; Шотуелл, М.А. и Ларкинз, Б.А. (1989) в: Биология растений, том 15 (изд. Академик Пресс, Сан Диего: Стумпф П.К. и Конн, Е.Е., ред.), 297), т.е. эти гены экспрессируются только в целевой ткани и только в течение определенной стадии развития.
Далее, будет очевидно, что экономически эффективная процедура для продуцирования фитазы будет давать существенную выгоду среди прочего в промышленности по производству кормов для животных. Один из методов получения более дешевой фитазы может заключаться в использовании рекомбинантных методов ДНК, чтобы получать трансгенные растения или органы растений, способные экспрессировать фитазу, которую можно было бы далее добавлять как таковую, например, в корм животных или кормовые продукты для непосредственного потребления животным. В качестве альтернативы фитазу, экспрессированную в этих трансгенных растениях или растительных органах, можно было экстрагировать и, если это необходимо, подвергнуть очистке для соответствующего применения.
Краткое описание изобретения
В соответствии с настоящим изобретением предлагается экспрессия фитазы в трансгенных растениях или органах растений и способы получения таких растений. Этого достигают за счет введения в растение конструкции для экспрессии, содержащей ДНК-последовательность, кодирующую протеин, обладающий активностью фитазы.
Конструкции для ДНК-экспрессии, предлагаемые в соответствии с настоящим изобретением для трансформации растений, находятся под контролем регуляторных последовательностей, которые способны направлять экспрессию фитазы. Эти регуляторные последовательности могут также включать последовательности, способные направлять транскрипцию в растениях либо конструктивно, либо специфически относительно стадии и/или относительно ткани, в зависимости от использования растения или его частей.
Трансгенные растения и органы растения могут быть применены в различных промышленных технологиях либо непосредственно, например, в корме для животных, либо, в качестве альтернативы, экспрессированную фитазу можно экстрагировать и, если это необходимо, подвергнуть очистке перед применением.
Краткое описание фигур:
фиг.1 - стратегия клонирования к ДНК фитазы;
фиг. 2 - нуклеотидная последовательность транслированной области фрагмента кДНК-фитазы и полученная аминокислотная последовательность протеина фитазы; начало зрелого протеина фитазы указана в виде позиции +1;
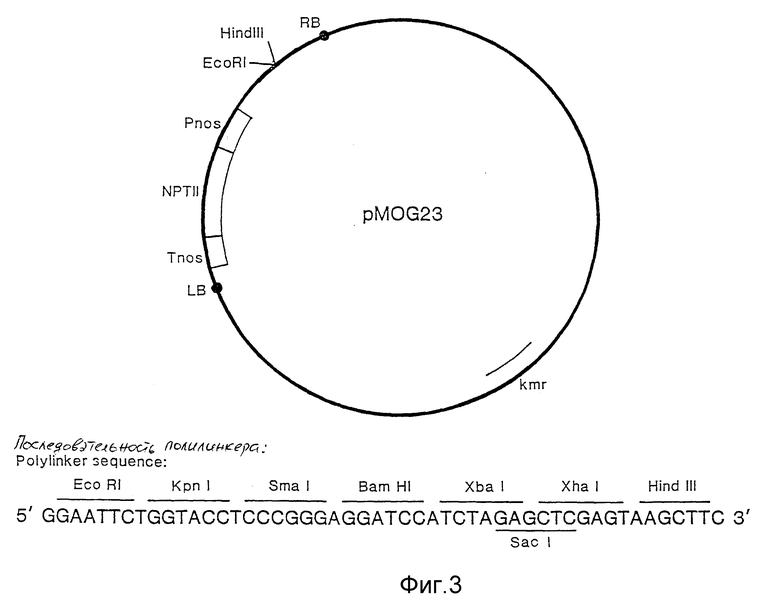
фиг. 3 - бинарный вектор pMOG23;
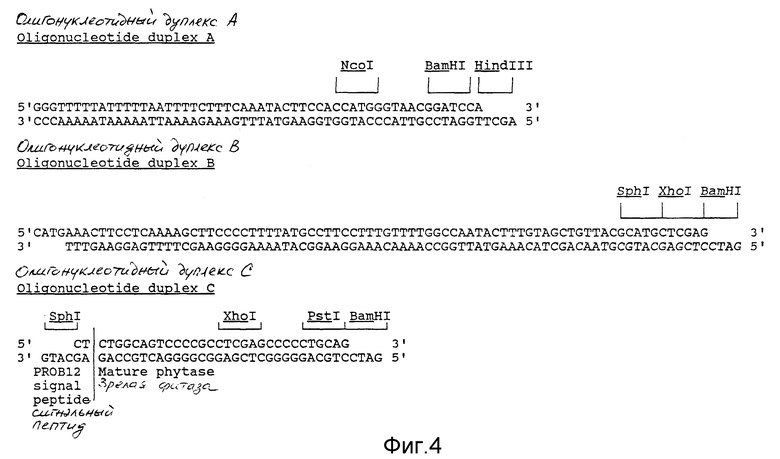
фиг. 4 - олигонуклеотидные дуплексы, используемые при клонировании;
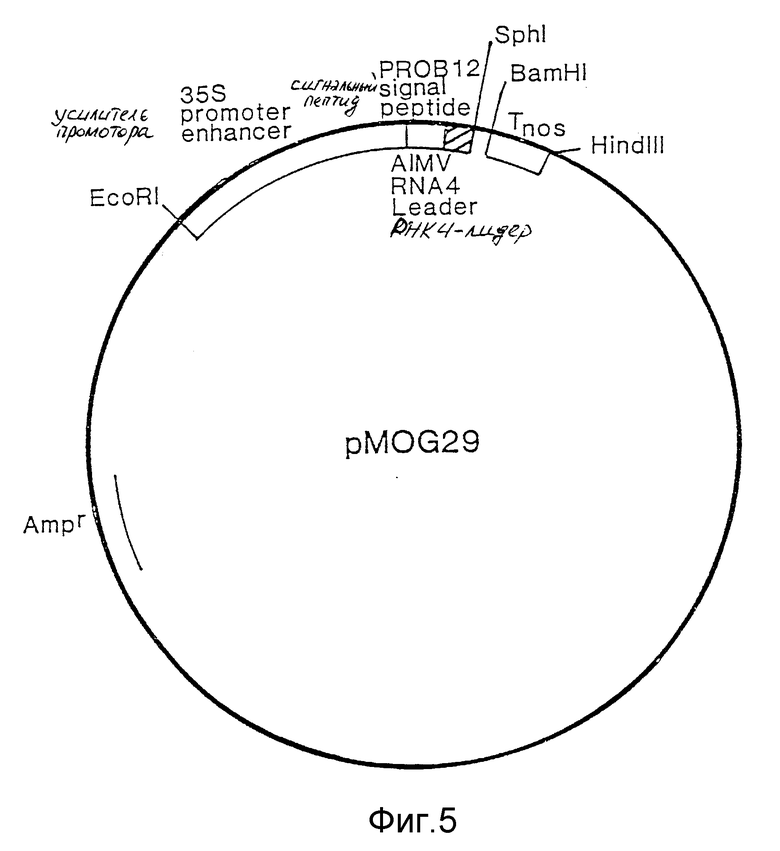
фиг. 5 - плазмида pMOG29. Плазмида pVC18, содержащая кассету экспрессии для конструктивной экспрессии в растениях, и последовательность, кодирующую сигнальный пептид табака;
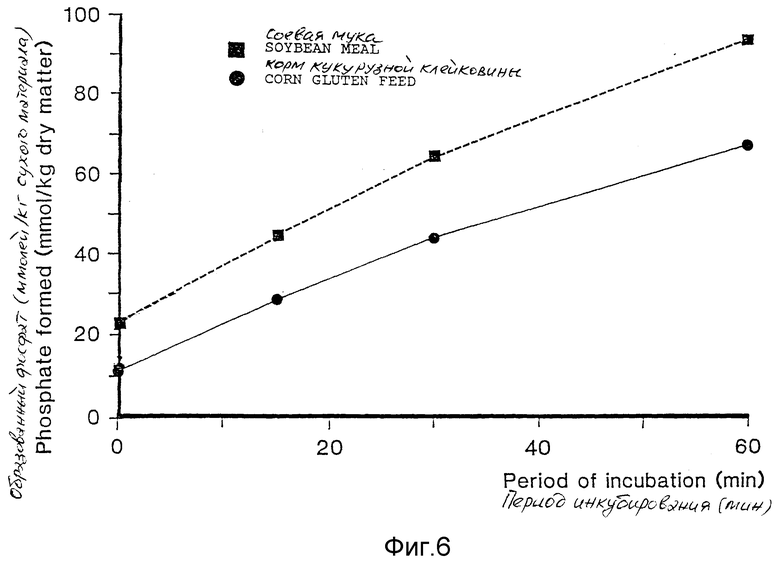
фиг. 6 - эффекты добавления измельченных семян, содержащих фитазу, на высвобождение неорганического фосфора из фитата;
фиг. 7 - соотношение доза - реакция фитазы Aspergillus в модели переваривания ин витро;
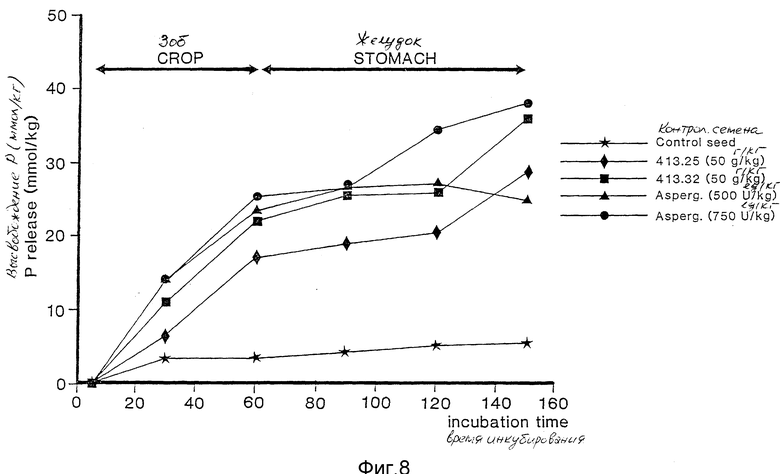
фиг.8 - соотношение реакция - доза фитазы Aspergillus и фитазы, содержащейся в семенах табака, в модели переваривания ин витро.
Подробное описание изобретения
В соответствии с настоящим изобретением трансгенные растения или органы растений получают для продуцирования фитазы. Этого достигают через введение в растение конструкции для экспрессии, содержащей ДНК-последовательность, кодирующую протеин, обладающий активностью фитазы.
Конструкции для ДНК-экспрессии, предлагаемые в соответствии с настоящим изобретением, предназначены для стабильной трансформации растений геномом, кодирующим фитазу. Эти конструкции содержат ДНК-последовательность, кодирующую фитазу, которая оперативно связана с регуляторными последовательностями, которые способны направлять экспрессию фитазы. Эти регуляторные последовательности могут также включать последовательности, способные направлять транскрипцию в растениях либо конструктивно, либо специфически относительно стадии и/или ткани, в зависимости от использования растения или его частей.
Конструкции для экспрессии, предлагаемые в соответствии с настоящим изобретением, могут быть вставлены в вектор, в предпочтительном варианте - плазмиду, используемый в трансформации через посредство бактерии выбранного растения-хозяина. Далее конструкцию экспрессии в предпочтительном варианте интегрируют в геном растения-хозяина.
В контексте настоящего изобретения термин "фитаза" включает семейство ферментов, которые катализируют реакции, включающие высвобождение неорганического фосфора из различных миоинозит фосфатов. То есть этот термин включает все протеины, обладающие активностью фитазы.
ДНК-последовательность, кодирующая фитазу, может быть получена из разнообразных источников таких, как микробный, растительный или животный источник. В предпочтительном варианте ДНК-последовательность получается из микробного источника такого, как нитеобразные грибы Aspergillus. В наиболее предпочтительном варианте ДНК-последовательности получают из Aspergillus ficuum, Aspergillus niger, Aspergillus awamori и Aspergillus nidulans.
Клонирование гена или кДНК, кодирующей протеин фитазы, может быть осуществлено с использованием различных приемов. Один из приемов заключается в очистке протеина фитазы, последовательном определении N-концевых и нескольких внутренних аминокислотных последовательностей, и просеивании геномной или кДНК-библиотеки организма, продуцирующего фитазу, используя олигонуклеотидные зонды на основе этих аминокислотных последовательностей.
Если известна по крайней мере частичная последовательность гена, то эту информацию можно использовать, чтобы клонировать соответствующую кДНК, используя, например, цепную реакцию полимеразы (PCR) (PCR - технология: Принципы и приложения для ДНК-амплификации, (1989), Х.Э.Эрлих, ред., изд. Стоктон Пресс, Нью-Йорк.
Каждому специалисту в этой области техники очевидно, что клонированный ген фитазы, описанный выше, можно использовать в экспериментах с гетерологической гибридизацией, направленных на изоляцию генов, кодирующих фитазу, из других микроорганизмов.
Еще в одном аспекте клонированный ген фитазы, описанный выше, может быть использован в качестве исходных материалов для конструкции фитаз "второго поколения". Фитазами "второго поколения" являются фитазы, измененные при помощи приемов мутагенеза (например, мутагенеза, направленного на сайт), которые обладают свойствами, которые отличаются от свойств фитаз дикого типа или рекомбинантных фитаз таких, как те, что получают в соответствии с настоящим изобретением. Например, температуру или оптимальное pH, специфическую активность или средство субстрата можно изменить с тем, чтобы их лучше приспособить для применения в выбранном эксперименте.
Изоляция кДНК, кодирующей фитазу, позволяет построить конструкции экспрессии, способные управлять продуцированием фитазы в выбранном растении-хозяине через применение приемов рекомбинантной ДНК, таких, как замена регуляторных элементов таких, как, например, промоторы, секретированные сигналы или их комбинации.
Фитаза может быть продуцирована конструктивно в трансгенных растениях в течение всех стадий развития. В зависимости от использования растения или растительных органов ферменты могут быть экспрессированы при помощи приема, специфичного относительно стадии, например, в течение образования клубней или развития плодов. Кроме того, в зависимости от использования ферменты можно экспрессировать специфически относительно ткани, например, в растительных органах таких, как плоды, клубни, листья или семена.
Трансгенные растения, как они определены в контексте настоящего изобретения, включают растения (а также части и клетки вышеупомянутых растений) и их потомство, которое было генетически модифицировано с использованием приемов рекомбинантной ДНК, чтобы инициировать или ускорить продуцирование фитазы в целевом растении или растительном органе.
В контексте настоящего изобретения фраза "увеличенное количество фитазы" относится специфически к статически существенному количеству растительной ткани, которая в среднем содержит с статистическом смысле существенно большее количество фитазы по сравнению со средним количеством фермента фитазы, обнаруженным в равном количестве немодифицированной растительной ткани.
В контексте настоящего изобретения выбранные растения включают (но ими не исчерпывается весь список) культуры, продуцирующие съедобные цветы такие, как капуста цветная (Brassica oleracea), артишок (Cynara scolymus), фрукты такие, как яблоня (Malus, например, domesticus), бананы (Musa, например, acuminata), ягоды (такие, как смородина, Ribes, например rubrum), вишня (такие, как сладкая вишня, Prunus, например avium), огурцы (cucumis, например, sativus), виноград (vitis, например, vinifera), лимон (Citrus limon), дыня (Cucumis melo), орехи (такие, как орех обыкновенный, Juglans, например, regia; земляной орех, Arachis hypogeae), апельсины (Citrus, например, maxima), персик (Prunus, например, persica), груша (Pyra, например, communis), слива (Prunus, например, domestica), земляника (Fragaria, например, moschata), томаты (Lycopersicon, например, esculentum), листовые культуры такие как, люцерна (Medicago, например, sativa), капуста (например, Brassica oleracea), салат эндивий (cichoreum, например, endivia), лук-порей (Allium, например, porrum), латук (Lactuca, например, sativa), шпинат (Spinacia, например, oleraceae), табак (Nicotiana, например, tabacum), корни такие, как маранта (Maranta, например, arudinacea), свекла (Beta, например, vulgaris), морковь (Daucus, например, carota), маниок (Manihot, например, esculenta), репа (Brassica, например, rapa), редис (Raphanus, например, sativus), ямс (Dioscorea, например, esculenta), сладкий картофель (Ipomoca batatas) и семена такие, как бобы (Phaseolus, например, vulgaris), горох (Pisum, например, sativum), соя (Glucin, например, max), пшеница (Titicum, например, aestivum), ячмень (Hordeum, например, vulgare), кукуруза (zea, например, mays), рис (Oryza, например, sativa), семена капусты (Brassica napus), просо (Panicum L. ), подсолнечник (Helianthus annus), овес (Avena sativa), клубни такие, как кольраби (Brassica, например, oleraceae, картофель (Solanum, например, tuberosum) и т.п.
Выбор растительного вида диктуется в первую очередь предстоящим использованием растения или его частей и восприимчивостью растительных видов к трансформации.
Для введения конструкции экспрессии, содержащей ДНК-последовательность, кодирующую фитазу, в выбранные растения можно использовать несколько приемов. Такие приемы включают, но ими не ограничивается полный список, трансформацию протопластов, используя процедуру кальция (полиэтилен гликоля, электропорацию и микроинъекцию или бомбардировку (покрытыми) частицами (Потрикус, И. (1990) Bio/Technol, т.8, стр. 535).
Наряду с так называемыми методами ДНК-трансформации можно широко использовать системы трансформации, включающие векторы, такие, как вирусные векторы (например, из мозаичного вируса цветной капусты (CaMV) и бактериальные векторы (например, из рода Agrobacterium) (Потрикус, см. выше). После селекции и/или просеивания протопласты, клетки или части растений, которые были трансформированы, можно восстановить в полные растения, используя приемы, известные в этой области техники (Хорш, Р.Б., Фрай, Дж.Э., Хоффман, Н. Л. , Эйчгольтц, Д., Роджерс, С.Г. и Фрэйли, Р.Т. (1985) Science, т. 227. стр. 1229). Выбор приема трансформации и/или регенерации не является решающим для настоящего изобретения.
Для двудольных в предпочтительном варианте осуществления настоящего изобретения используют бинарную векторную систему (Хоекема, А., Хирш, П.Р., Хуикаас, П.Дж.Дж. и Шилперурт, Р.А. (1983) Nature, т. 303, стр. 179; Шилперурт, Р. А. , Хоекема, А. и Хуикаас, П.Дж.Дж. (1984) Европейская патентная заявка N 0 120 516), в которой используют штаммы Agrobacterium, которые содержат плазмиду vir с генами вирулентности и совместимой плазмидой, содержащей генную конструкцию, подлежащую переносу. Этот вектор может реплицировать как в E.coli, так и в Agrobacterium, и его получают из бинарного вектора Bin 19 (Беван, М. (1984) Nucl. Asids. Res., т. 12, стр. 8711), который изменяется в деталях, которые не относятся к настоящему изобретению. Эти одинарные векторы, как они используются в этом примере, содержат между левой и правой граничными последовательностями Т-ДНК идентичный N PTII-ген, кодирующий стойкость к канамицину (Беван, см. выше) и кратный сайт клонирования, чтобы клонировать в необходимые генные конструкции.
Трансформация и регенерация однодольных культур не является стандартной процедурой. Однако последние научные достижения показывают, что, в принципе, однодольные восприимчивы к трансформации и что продуктивные трансгенные растения могут быть регенерированы из трансформированных клеток. Развитие репродуцируемых систем культур тканей из этих культур вместе с мощными методами введения генетического материала в растительные клетки упрощает процесс трансформации. В настоящее время методами для выбора с целью трансформации однодольных культур являются бомбардировка! микроснарядами эксплантатов или клеток суспензии, и прямое поглощение ДНК или электропорация протопластов. Например, были успешно получены трансгенные растения риса, используя бактериальный ген hph, кодирующий стойкость к гигромицину в качестве маркера селекции. Этот ген вводили при помощи электропорации (Шимамото, К., Терада, Р., Идзава, Т. и Фуджимото, Х. (1989) Nature, т. 338, стр. 274). Трансгенные растения маиса были получены при помощи введения гена Streptomyces hydroseopicus bar, который кодирует ацетилтрансферазу фосфинотрицина (фермент, который дезактирует гербицид фосфинотрицин), в эмбриогенные клетки культуры маисовой суспензии при помощи бомбардировки микрочастицами (Гордон-Камм, У. Дж. , Спенсер, Т.М., Мангало, М.Л., Адамс, Т.Р., Дайнес, Р.Дж., Старт, У.Г., О'Бриент, Дж.И., Чамберс, С.А., Адамс мл., У.Р., Уиллетс, Н.Г., Райс, Т.Б., Макки, К. Дж., Кругер, Р.У., Кауш, А.П. и Лемо, П.Г. (1990) The Plant Cell, т. 2, стр. 603). Введение генетического материала в протопласты алейрона других однодольных культур таких, как пшеница и ячмень, известно (Ли, Б., Мердоч, К., Топпинг, Дж., Крейз, М. и Джонс, М.Г.К. (1989) Plant Mol. Biol, т. 13. стр. 21). Растения пшеницы были регенерированы из эмбриогенной суспензионной культуры при помощи селекции только зрелого компактного и узелкового эмбриогенного наплыва для создания эмбриогенных суспензионных культур (Васил, В. , Редуэй, Ф. и Васил, И.К. (1990) Bio/Technol., т. 8. стр. 429). Комбинация с системами трансформации для этих культур дает возможность применить настоящее изобретение к однодольным культурам. Эти приемы могут быть также применены с целью трансформации и регенерации двудольных.
Экспрессия конструкции фитазы включает такие детали, как транскрипция гена при помощи растительных полимераз, трансляция иРНК и т.д., которые известны каждому специалисту в этой области техники. Ниже обсуждаются только такие детали, которые непосредственно относятся к пониманию настоящего изобретения.
Регуляторные последовательности, о которых известно или для которых устанавливается, что они вызывают экспрессию фитазы, можно использовать в соответствии с настоящим изобретением, выбор используемых регуляторных последовательностей зависит от применяемой культуры и/или органа культуры. Такие регуляторные последовательности могут быть получены из растений или растительных вирусов, или они могут быть химически синтезированы. Такими регуляторными последовательностями являются промоторы, активные при управлении транскрипцией в растениях, либо конститутивно, либо специфически относительно стадии и/или ткани, в зависимости от использования растений или его частей. Такие промоторы включают, но ими не исчерпывается весь список, промоторы, обеспечивающие конститутивную экспрессию такие, как промотор 35S вируса мозаики цветной капусты (CaMV) (Гиллей и др. (1982) Cell, т. 30, стр. 763), промоторы для специфической относительно экспрессии в листьях такие, как промотор гена малой субъединицы рибулозобисфосфат-карбоксилазы (Коруцци и др., (1984) EMBO J. т. 3, стр. 1671), промоторы специфической относительно экспрессии в корнях такие, как промотор из гена глютаминовой синтазы (Тингей и др. (1987) EMBO J., т. 6, стр. 3565), промоторы экспрессии, специфической относительно семян, такие как промотор A круциферина из Brassica napus (Риан и др. (1989) Nucl. Acids. Res. т. 17, стр. 3584), промоторы экспрессии, специфической относительно клубней, такие как промотор пататина класса 1 из картофеля (Роча-Соза и др. (1989) EMBO. т. 8, стр. 23; Венцлер и др. (1989) Plant. Mol. Biol. т. 12, стр. 41) или промоторы экспрессии, специфической относительно плодов, такие, как промотор полигалактуроназы (PG) из томатов (Берд и др. (1988) Plant. Mol. Biol. т.11, стр. 651).
Другие регуляторные последовательности такие, как терминаторные последовательности и сигналы полиаденилирования, включают любую такую последовательность, функционирующую как таковую в растениях, выбор которой находится внутри компетенции специалистов в этой области техники. Примером такой последовательности является 3'-боковая последовательность гена нопалинсинтазы (nos) Agrobacterium tumefaciens (Беван, М., см. выше).
Регуляторные последовательности могут также включать энхансерные последовательности такие, которые были обнаружены в промоторе 35 CaMV, и иРНК-стабилизирующие последовательности такие, как лидерная последовательность РНК4 вируса мозаики люцерны (AIMV) (Бредерод, Ф.Т., Копер-Цвартофф, Е. К. и Бол, Дж.Ф. (1980) Nucl. Acids. Res., т. 8, стр. 2213) или любые другие последовательности, функционирующие аналогичным образом.
Фитаза должна экспрессироваться в окружающей среде, которая не нарушает стабильности экспрессированного протеина. Выбор клеточных областей таких, как цитозол, эндоплазматический ретикулюм, вакуоль, протеиновое тело или плазматическое пространство можно использовать в соответствии с настоящим изобретением для того, чтобы создать такое стабильное окружение в зависимости от биофизических параметров фитазы. Такие параметры включают, но ими не ограничивается весь список, pH-оптимум, чувствительность к протеазам или чувствительность к молярности предпочтительной области.
Чтобы получить экспрессию в цитоплазме клетки, экспрессированный фермент не должен содержать секреторного сигнального пептида или любых других целевых последовательностей. Для экспрессии в хлоропластах и митохондрии экспрессированный фермент должен содержать специфический, так называемый транзитный пептид для обеспечения перехода в эти органеллы. Целевые последовательности, которые могут быть присоединены к представляющему интерес ферменту для того, чтобы осуществить это, известны (Смикенз и др. (1990) T.I.B.S. Т. 15, стр. 73; ван дер Брок и др. (1985) Nature, т. 313, стр. 358; Шрайер и др. , (1985) EMBO J. т. 4, стр. 25). Если желательна активность фермента в вакуолях, должен присутствовать секреторный сигнальный пептид, а также специфическая целевая последовательность, которая направляет этот фермент в такие вакуоли (Тагью и др. (1988) Plant Phys., т. 86, стр. 506). То же самое верно для протеиновых тел в семенах. ДНК-последовательность, кодирующая фермент, представляющий интерес, должна быть модифицирована таким образом, чтобы фермент мог направлять свое действие в необходимую область клетки.
Чтобы осуществить внеклеточную экспрессию фитазы, конструкция для экспрессии, являющаяся предметом настоящего изобретения, использует секреторную сигнальную последовательность. Хотя сигнальные последовательности, которые гомологичны (нативны) видам растения-хозяина, предпочтительны, можно также использовать гетерологические сигнальные последовательности, т.е. такие, которые происходят из других растительных видов или имеют микробную природу. Такие сигнальные последовательности известны каждому специалисту в этой области техники. Соответствующие сигнальные последовательности, которые могут быть использованы в соответствии с контекстом настоящего изобретения, описаны Уолтером, П. и Блобелом, I. (1986) Biochem. Soc. Symp., т. 47, стр. 183; Фон Хейине, Г. (1986) J. Mol. Biol., т. 189, стр. 239; и Сиймонз, П.К., Деккер, Б.М.М., Шраммейер, Б., Веруоерд, Т.К., ван ден Элзен, П.Дж. и Хоекема, А. (1980) Bio/Technol. т. 8, стр. 217.
Все части соответствующих ДНК-конструкций (промоторы, регуляторные, секреторные, стабилизирующие, целевые или завершающие последовательности) настоящего изобретения могут быть модифицированы, если это необходимо, чтобы нарушить их управляющие характеристики, используя при этом приемы, известные каждому специалисту в этой области.
Необходимо указать, что растения, содержащие фитазу, полученную в соответствии с настоящим изобретением, можно использовать для того, чтобы получить растения или органы растений при помощи приемов сомоклональных вариаций или приемов кросс-бридинга. Такие приемы хорошо известны каждому специалисту в этой области техники.
В соответствии с одним из вариантов осуществления настоящего изобретения двунитевую кДНК, кодирующую фитазу, получают из иРНК, изолированной из Aspergillus ficuum. Эту ДНК-конструкцию помещают под контроль регуляторных последовательностей из гена, кодирующего круциферин, протеин хранения 12S из Brassica napus. Далее эту конструкцию субклонируют в бинарный вектор такой, как pMOG23 (в штамме DH 5 L K-12 E. Coli, депонированном в Central Bureau voor Schimmelcultures, Баарн, Нидерланды, 29 января 1990 г. Под шифром хранения CBS 102.90). Этот вектор вводят в Agrobacterium tumefaciens, который содержит "разоруженную" плазмиду Ti. Бактериальные клетки, содержащие эту конструкцию, совместно культивируют с тканями из табака или Brassica, а трансформированные растительные клетки подвергают селекции при помощи питательной среды, содержащей антибиотики и индукции, чтобы регенерировать в дифференцированные растения на такой среде. Полученные в результате растения будут давать семена, которые содержат и экспрессируют ДНК-конструкцию.
В еще одном варианте осуществления настоящего изобретения ДНК-конструкцию, кодирующую фитазу, помещают под контроль регуляторных последовательностей из промоторов 35S мозаичного вируса цветной капусты (CaMV). Эту конструкцию затем субклонируют в бинарный вектор. Этот вектор затем вводят в Agrobacterium tumefaciens, которая содержит "разоруженную" плазмиду Ti. Бактериальные клетки, содержащие эту конструкцию, совместно культивируют с тканями из табака или Brassica, а трансформированные растительные клетки подвергают селекции на питательной среде, содержащей антибиотики, и индукции, чтобы регенерировать в дифференцированные растения на такой среде. Полученные в результате растения содержат и экспрессируют эту ДНК-конститутивно.
Активность фитазы можно измерить при помощи нескольких анализов, выбор которого не является решающим для настоящего изобретения. Например, активность фермента фитазы трансгенной растительной ткани может быть испытана при помощи ЭЛИЗА-анализа, западных пятен или прямых ферментативных анализов, используя колориметрические приемы, или анализов на нативных гелях.
Растения или растительные органы, содержащие фитазу, полученные в соответствии с настоящим изобретением, можно использовать в промышленных процессах, требующих действия фитазы. Примерами таких приложений являются: кормовые добавки для нежвачных животных, обработка сои или получения инозита или инозитфосфатов из фитата. К другим промышленным процессам, использующим субстраты, которые содержат фитат, относятся крахмальная промышленность и промышленность, содержащая ферментативные процессы, такая, как пивная промышленность. Хелатообразование с ионами металлов под действием фитата может привести к тому, что эти минералы становятся недоступными для продуцирования микроорганизмов. Ферментативный гидролиз фитата предотвращает такие проблемы.
Фитазу, полученную в растениях, можно использовать в процессе вымачивания кукурузы или зерен сорго. Растительную ткань можно измельчить перед добавлением в вымачиваемую кукурузу. Фитаза, высвобожденная из растительной ткани, может воздействовать на фитин, который содержится во многих кукурузных полуфабрикатах. Разложение фитина в вымачиваемой кукурузе предпочтительно, ибо увеличивает питательную ценность ликера из вымоченной кукурузы, который используют в качестве животного корма или в качестве питательного раствора в процессах микробной ферментации. Кроме того, разложение фитина может предотвратить возникновение проблем, связанных с накоплением отложений в фильтрах, трубках, реакционных сосудах и т.д. во время концентрирования, транспортировки и хранения ликера из вымоченной кукурузы (Ваара, Т. и др. (1989) Европейская патентная заявка N 0 321 004). Действие фитазы может, кроме того, ускорить процесс вымачивания и процессы разделения, которые содержатся в качестве стадий при влажном измельчении кукурузы.
Растения или органы растений можно использовать непосредственно, т.е. без последующей обработки, или их можно сначала обработать через известные средства такие, как измельчение до необходимой консистенции перед применением.
В качестве альтернативы фитазу можно экстрагировать из растения или органа растения и, если необходимо, очистить перед использованием, применяя известные приемы экстрагирования и очистки.
Продуцирование фитазы в растениях, которые совместимы с будущим применением, дает преимущество и будет снижать затраты на продуцирование по сравнению с производством микробной фитазы с тем, чтобы гарантировать экономически эффективное применение, например, в корме животных, что, видимо, будет приводить к коэффициенту эффективности затрат/ин виво, сравнимому с неорганическим фосфатом. Еще одно преимущество заключается в том, что содержание фосфора в навозе значительно снижается.
Очевидно, что применение фитаз, доступных по стоимости, сравнимой с неорганическим фосфатом, будет увеличивать степени свободы в промышленности по производству кормов, чтобы получать корма высокого качества. Например, когда в корм добавляют фитазу, неорганический фосфат можно не добавлять, а содержание различных материалов, содержащих фитат, можно увеличить.
Следующие примеры приведены для того, чтобы дать каждому специалисту в этой области техники дополнительные описания и подробности того, как осуществлять и использовать настоящее изобретение, и их не следует рассматривать в качестве ограничения притязаний заявителя. Должны быть предприняты усилия для того, чтобы гарантировать точность чисел (например, количеств, температуры, pH и т.д.), но некоторые экспериментальные ошибки и отклонения должны учитываться. Если не указано противное, то температуры приведены в градусах Цельсия, а давление атмосферное или почти атмосферное.
Пример 1
Изоляция поли A + РНК из Agropergillus ficuum
Штамм NRRL 3135 A. ficuum выращивали в среде, содержащей 22,72 г/л маисовой муки (обработанной амилазой при pH 7 и температуре 85oC в течение 15 минут), 9,36 г/л глюкозы, 2,9 г/л KNO3, 0,142 г/л MgSO4•7H2O и 56,8 мг/л FeSO4•7H2O. Через 6 дней мицелий собирали.
Сухой мицелий (0,5 г) замораживали жидким азотом и измельчали. Далее, этот материал гомогенизировали в ультрасмесителе (на полной скорости, 1 минуту) при 0oC в 3 М растворе LiCl, 6М мочевины и выдерживали в течение ночи при 4 oC, как это описано Ауффреем и Ругеоном (1980) Eur. J. Biochem., т. 107, стр. 303. Общую клеточную РНК получали после центрифугирования со скоростью 16 000 • g, за которым следовало две последовательные экстракции при помощи фенола: хлороформа: изоамилового спирта /50:48:2/. РНК осаждали этанолом и снова растворяли в 1 мл 10 мм трис-HCl /pH 7,4/, 0,5% ДСН /додецил сульфата натрия - пер./. Для поли A+ селекции образец общей РНК нагревали на 5 минут до 65oC, регулировали до уровня 0,5 М NaCl, а затем наносили на олиго(ДТ)-целлюлозную колонну. После нескольких промывок раствором, содержащим 10 мм трис pH 7,0, 1 мМ ЭДТК и 0,1 мМ NaCl, поли A+РНК собирали при помощи элюирования 10 мМ трис pH 7,0 и 1 мМ ЭДТК.
Пример 2
Получение и клонирование кДНК,кодирующей фитазу.
Для синтеза первой нити кДНК 5 мкг поли A+РНК, изолированной в соответствии с примером 1, растворяли в 16,5 мкл воды и добавляли следующие компоненты: 2,5 мкл РНКsin /30 ед/мкл/, 10 мкл буфера, содержащего 50 мм трис-HCl pH 7,6, 6 мМ MgCl2 и 40 мМ HCl, 2 мкл 1 М KCl, 5 мкл 0,1 М ДТТ, 0,5 мкл олиго /ДТ/ 12 - 18 (2,5 мг/мл), 5 мкл 8 мМ ДНТФ-микс, 5 мкл BSA (1 мг/мл) и 2,5 мкл обратной транскриптазы МЛВ молони (200 ед/мкл). Эту смесь инкубировали 30 минут при температуре 37oC и реакцию прекращали добавлением 10 мкл 0,2 М ЭДТК и 50 мкл воды. Экстрагирование осуществляли с использованием 110 л хлороформа и после центрифугирования в течение 5 минут в верхний слой добавляли 5 М NH4Ac и 440 мкл абсолютного этанола (-20oC). Осаждение делали в растворе сухой лед/этанол 30 минут. После центрифугирования (10 минут при 0oC) таблетку кДНК/иРНК промывали 70% льдом - холодным этанолом. Таблетку сушили и растворяли в 20 мл воды.
Изоляцию кДНК, кодирующей фитазу, осуществляли при помощи цепной реакции полимеразы (PCR) в двух фрагментах. Эти два фрагмента соединяли, используя сайт BamHI внутри гена, чтобы получить кДНК полной длины. Стратегия клонирования кДНК фитазы приведена на фиг. 1.
В результате частичного анализа последовательности гена фитазы (Ван Горком и др., см. выше) обнаруживали наличие сайта BamHI в приблизительно 800 пар оснований от кодона инициирования. Эту нуклеотидную последовательность вокруг сайта BamHI, а также нуклеотидную последовательность, предшествующую кодону начала, и нуклеотидную последовательность после кодона стоп гена фитазы, использовали для конструкции олигонуклеотидов для PCR.
Цепную реакцию полимеразы осуществляли в соответствии с рекомендациями производителя Tag-полимеразы (Цетус), используя 1,5 мкл раствора, содержащего реакционный продукт синтеза первой нити и 0,5 мкг каждого из олигонуклеотидов. Амплификацию осуществляли в амплификаторе ДНК Перкин Элмер/Цетус. Через 25 циклов типа: 2 минуты при 94oC, 2 минуты при 55oC и 3 минуты при 72oC реакционную смесь подвергали депротеинизации при помощи последующего экстрагирования фенолом и хлороформом. ДНК осаждали, снова растворяли в буфере, содержащем 10 мм трис, pH 7 и 0,1 мМ ЭДТК, а затем переваривали соответствующими ферментами рестрикции.
Для амплификации фрагмента, кодирующего N-концевую часть протеина, использовали следующие два олигонуклеотида:
Oligo 1: 5' GGGTAGAATTCAAAAATGGGGGTCTCTGCTGTTCTA 3'
Oligo 2: 5' AGTGACGAATTCGTGCTGTGGAGATGGTGTCG 3'
Амплифицированный фрагмент переваривали при помощи EcoRI в pTZ18R (полученной от фирмы Фармация). Карта сайтов рестрикции и нуклеотидные последовательности подтверждают аутентичность фрагмента. Полученную в результате плазмид именовали pGB925.
Для амплификации второго фрагмента использовали следующие два олигонуклеотида.
Oligo 3: GAGCACCAAGCTGAAGGATCC 3'
Oligo 4: AAACTGCAGGCGTTGAGTGTGATTGTTTAAAGGG 3'
Амплифицированный фрагмент переваривали при помощи BamHI и PstI, а затем клонировали в pTZ18R: который предварительно переваривали BamHI и PstI. Карта сайтов рестрикции и нуклеотидные последовательности показывали, что выведен правильный фрагмент. Полученную в результате плазмиду именовали pGB926.
Для того, чтобы выделить кДНК полной длины, pGB925 переваривали при помощи EcoRI и Bam HI, а фрагмент, содержащий ДНК, кодирующую фитазу, выделяли. Этот фрагмент клонировали в плазмиду pCB926, которую предварительно переваривали при помощи EcoRI и Bam HI, что давало плазмиду pGB927. Плазмида pGB927 содержала кДНК, кодирующую фитазу, полной длины размером приблизительно 1,8 кпо. Последовательность области кДНК, кодирующей протеин фитазы, и полученная аминокислотная последовательность протеина фитазы изображены на фиг. 2.
Пример 3
Конструкция бинарного вектора pMOG23
В этом примере описана конструкция бинарного вектора pMOG23 (в штамме DH5L K-12 E. Coli, сданном на хранение в Central Bureau voor Schimmel-cultures 29 января 1990 г. под шифром хранения CBS 102.90).
Бинарный вектор pMOG23 (фиг. 2) является производным вектора Bin 19 (Беван, М. , см. выше). Чтобы получить pMOG23, вектор Bin 19 изменяли так, что это несущественно для настоящего изобретения, используя приемы, известные каждому специалисту в области молекулярной биологии.
Во-первых, позиции левой границы (ЛГ) и правой границы (ПГ) изменяют относительно гена II неомицин фосфотрансферазы (гена NPTII). Во-вторых, ориентация гена NPTII обращается, что обеспечивает транскрипцию в направлении ЛГ. Наконец, полилинкер из Bin 19 заменяется на полилинкер со следующими сайтами узнавания ферментов рестрикции: EcoRI, KpпI, Smal, BAm HI, XbaI, Xbat и Hind III.
Пример 4
Клонирование кДНК фитазы Aspergillus ficuum в конструкции для экспрессии с целью конститутивной экспрессии в растениях
Ген фитазы из Aspergillus ficuum сшивали и клонировали в конструкцию для экспресии с целью конститутивной экспрессии в направлении вниз от промотора 35S мозаичного Вируса Цветной капусты. Конструкция для экспрессии содержала, кроме того, кодирующую информацию для последовательности сигнального пептида растительного органа.
кДНК фитазы клонировали в конструкцию для экспрессии, как содержащуюся на плазмиде pMOG29 (описана в a)). Затем полную конструкцию вводили в бинарный вектор pMOG23 и переносили в штамм LBA4404 Agrobacterium tumefaciens.
a) Конструкция вектора экспрессии pMOG29
Конструкцию для экспрессии из ROKI (Баулкомо и др., (1986) Nature, т. 321, стр. 446) клонировали в виде EcoRI/Hind III-фрагмента в pVC18. Эта конструкция содержала промотор 35S Мозаичного Вируса Цветной капусты (CaMV) на EcoRI/Bam HI-фрагменте и терминатор транскрипции нопалин синтетазы (nos) на Bam HI/Hind III-фрагменте. Промоторный фрагмент состоит из последовательности от -800 до +1 промотора 35S CaMV. Позиция +1, которая включена, является сайтом начала транскрипции (Гиллей и др., см. выше). Последовательность вверх от Сайта N coI в позиции - 512 удаляли и этот сайт заменяли на EcoRI-сайт. Это делали при помощи расщепления конструкции экспрессии, содержащейся в pVC18, при помощи N coI, заполняя однонитевые концы полимеразой Кленоу, и лигации линкера EcoRI. Полученную в результате плазмиду расщепляли EcoRI, что приводило к удалению EcoRI-фрагмента, несущего последовательности промотора 35S, расположенные в направлении вверх от исходного сайта N coI. BamHI/Hind III-фрагмент, содержащий терминатор nos, заменяли синтетическим ДНК-фрагментом (дуплекс A олигонуклеотидов, фиг. 4), содержащим лидер-последовательность из РНК4 Мозаичного Вируса Люцерны (AIMV) (Бредерод и др., см. выше). Это делали при помощи сечения фрагментом Bam HI, затем сечения ферментом Hind III, и лигации этого синтетического фрагмента. Сайт Bam HI и три нуклеотида в направлении вверх удаляли при помощи направленного на сайт мутагенеза. В полученную в результате плазмиду снова вводили Bam HI/Hind III-фрагмент, содержащий последовательность терминатора nos. Ген, кодирующий β -глюкуронидазу (происходящий из плазмиды pRAJ 275; Джефферсон, Р.А. (1987) Plant Mol. Biol. Reporter. т. 5, стр. 387), подвергали лигации в N coI/ BamHI-фрагменте, что дает плазмиду pMOG14. Из литературы известно, что дупликация последовательности между - 343 и -90 увеличивает активность промотора 35S (Кэй, Р. , Чан, Э., Дейли, М. и Макферсон, Дж. (1987) Science, т. 236, стр. 1299). Чтобы получить промоторный фрагмент двойной, так называемой усиливающей последовательностью, осуществляли следующие стадии, известные каждому специалисту в этой области техники. Из плазмиды pMOG14 усиливающий фрагмент изолировали на AccI/EcoRI-фрагменте и затем концы делали липкими при помощи полимеразы Кленоу. Полученный фрагмент вводили в pMOG14, расщепленный при помощи EcoRI, и концы делали липкими так, что граница между сайтами EcoRI и AccI с липкими кольцами порождала новый EcoRI-сайт. Полученная в результате плазмида (pMOG18) содержала промотор 35S с двойной усиливающей последовательностью, лидером-последовательностью из PHR4 AIMV, а терминатор nos в конструкции экспрессии по-прежнему содержится на EcoRI /Hind III-фрагменте. Наконец, N coI/BamHI-фрагмент, кодирующий глюкуронидазу, заменяли синтетическим ДНК-фрагментом B (фиг.4), полученным из кДНК PROB12 (Корнелиссен, Б. , Дж. К., Хоофт Ван Хуисдуйнен, Р.Э.М. и Бол, Дж.Ф. (1986) Nature, т. 321, стр. 531). Этот фрагмент B кодирует PR-протеин последовательности сигнального пептида PR-S из табака Самсун HH. Сайт sphl создавали в ДНК-последовательности, кодирующей сигнальный пептид, при помощи изменения одного нуклеотида. Эта замена не изменяет аминокислотной последовательности, кодирующей сигнальный пептид PR-S. Полученную в результате плазмиду именовали pMOG29 (Чертеж 5).
b) Клонирование гена фитазы из Aspergillus ficuum в бинарный вектор
Олигонуклеотидный дуплекс C (чертеж 4) клонировали в плазмиду pMOG29, переваренную при помощи Sphl и BamHI, что приводит к образованию плазмиды pMOG407. Этот олигонуклеотидный дуплекс содержит кодирующую информацию для последних 2 аминокислот сигнального пептида из PR-S, затем первых 6 аминокислот зрелой фитазы.
Плазмиду pGB927, которая содержит кДНК фитазы полной длины, переваривали при помощи Xhol (частично) и Pst I. XhoI/PstI-фрагмент, содержащий ДНК-последовательности, кодирующие зрелую фитазу, от аминокислоты 6 вперед, клонировали в плазмиде pMOG407, линеаризованной при помощи XhoI и Pst I, что приводит к образованию плазмиды pMOG417. Полную конструкцию, содержащую химерный ген фитазы, вставляли в форме EcoRI/Hind III-фрагмента в бинарный вектор pMOG23, линеаризованный при помощи EcoRI и Hind III. Полученную в результате бинарную плазмиду pMOG413 обрабатывали с целью придания подвижности при помощи трехродительского спаривания со штаммом RK2013 E.coli K-12 (содержащим плазмиду pRK2013) (Дитта, I., Стэнфилд, С., Корбин, Д. и Хелински, Д. Р. (1980) Proc. Natl. Acad. Sci. USA, т.77, стр. 7347) в штамме LBA4404 Agrobacterium tumefaciens, который содержит плазмиду с генами вирулентности для Т-ДНК-переносчика в растение.
Пример 5
Переходная экспрессия химерного гена фитазы в протопластах табака
Протопласты табака трансформировали ДНК плазмиды, несущей химерный ген фитазы, при регулировании конструктивным промотором 35S CaMV. Через 72 часа обработанные протопласты анализировали на переходную экспрессию введенного гена фитазы, используя анализ на активность фитазы.
Протопласты получали из аксенически выращиваемых растений табака до возраста 1 - 2 месяцев (Nicotiana tabacum SR1). Полная процедура описана Роденбургом, К.У., Дегроотом, М.Дж.А., Шилпероортом, Р.А. и Хуикаасом, П.Я.Я. (1989) Plant Mol. Biol. , т. 13, стр. 711). С целью трансформации 5•105 протопластов подвергали электропорации с 40 мкг ДНК плазмиды pMOG417. После электропорации протопласты снова суспендировали в 3 мл среды K3G. Для анализа активности фитазы из протопластов получали таблетку и 3 мл верхнего слоя подвергали диализу в течение ночи относительно избытка воды. Диализат сушили вымораживанием и снова суспендировали в 300 мкл 25 мМ ацетата натрия, pH 5,5. Затем осуществляли анализ, как это описано подробно в Примере 10, за единственным исключением, что вместо 250 мМ буфера HCl-Гликол, pH 2,5, использовали 25 мМ буфер ацетата натрия, pH 5,5.
В этих экспериментах одну единицу фитазы (PTV) определяли, как 1 ммоль фосфата, высвобожденного из 1,5 мМ раствора фитата натрия в минуту при температуре 37oC при pH 5,5.
В необработанных протопластах никакой активности не было обнаружено. Протопласты, подвергнутые электропорации с плазмидой pMOG417, обладали активностью в 0,26 PTV на мг протеина в верхнем слое.
Пример 6
Стабильная экспрессия химерного гена фитазы в растениях табака под контролем промотора 35S CaMV
Табак трансформировали при помощи выращивания растительной ткани со штаммом LBA4404 Agrobacterium tumefaciens, содержащим бинарный вектор pMOG413 с химерным геном фитазы при управлении промотором 35S CaMV. Трансформацию осуществляли с использованием совместного выращивания дисков листа табака (Nicotiana tabacum SR1) в соответствии с Хоршом и др., см. выше. Трансгенные растения регенерировали из ростков, которые выращивали на селективной середе (10 мл/л канамицина), до появления корней, а затем переносили в почву. Молодые растения анализировали на NPTII-активность (стойкость к канамицину), выращивали до зрелости и допускали самоопыление, вплоть до семян.
Для выполнения анализа на активность фитазы листьев трансгенных растений сегмент в приблизительно 5 мм в диметре из молодого листа вырезали у каждого растения и гомогенизировали в 300 мкл 25 мМ буфера ацетата натрия, pH 5,5. Далее осуществляли анализы на фитазу, как это описано для переходного анализа. В 32 независимо испытываемых трансформированных растениях табака максимальную активность наблюдали в 2 PTV/мг общего растворимого протеина в экстрактах. Это соответствует 1,7 общего растворимого протеина. У семян таких трансформированных растений табака отмечали максимальный уровень экспрессии фитазы в 0,4% от общего растворимого протеина семян. Никакой активности фитазы нельзя было обнаружить в нетрансформированных растениях.
Две линии трансгенных растений, 413.25 и 413.32, отбирали на основе их высоких уровней экспрессии фитазы.
Пример 7
Клонирование кДНК фитазы Aspergillus ficuum в конструкции экспрессии, специфической относительно семян
Конструкцию для экспрессии создавали таким образом, чтобы получить экспрессию, специфическую относительно семян, используя последовательности гена протеина хранения 12S Brassica napus, круциферина (cru A; Риан и др., см. выше). Эти последовательности могут быть заменены последовательностями из аналогичных генов, специфических относительно семян, чтобы добиться той же цели, что и цель настоящего изобретения.
кДНК фитазы клонировали в конструкцию экспрессии. Наконец, полную конструкцию вводили в Agrobacterium tumefaciens, которую использовали для трансформации.
Для всех трансформаций E. coli в этом примере использовали штамм DH5L K-12 E. coli.
a) формирование конструкции для экспрессии
Для построения конструкции для экспрессии с целью осуществления специфической относительно семян экспрессии синтезировали промоторную и терминаторную последовательности из гена круциферина A (cru A) из Brassica napus, сем. Джет Неф, используя PCR-технологию с изолированной геномной ДНК (Меттлер, И. Дж. (1987) Plant Mol. Biol. Rep. т. 5, стр. 346) в качестве шаблона. Этот ген демонстрировал специфическую относительно семян экспрессию, а его кодирующие и боковые последовательности затем анализировали (Риан и др., см. выше). Синтезировали два множества олигонуклеотидов. Один - допускающий амплификацию 5'-боковой области cruA и части последовательности, кодирующей сигнальный пептид в виде EcoRI/N coI-фрагмента:
5' GTTCGGAATTCGGGTTCCGG 3' и
5' AACTGTTGAGCTGTAGAGCC 3'.
Другой - для амплификации 3'-боковой последовательности в виде B gl II/Hind III-фрагмента
5' CTTAAGATCTTACCCAGTGA 3' и
5' GGGAGAAGCTTGCATCTCGT 3'
Эти олиго конструировали таким образом, чтобы они содержали соответствующие сайты рестрикции на своих концах, чтобы обеспечить цельную конструкцию для экспрессии после переваривания фрагментов ферментами экспрессии.
5'-фрагмент гена cru A, который включает 54 нуклеотида последовательности, кодирующей отдельный пептид, клонировали в вектор pMOG445 (дуплекс олигонуклеотидов E (фиг. 4), клонированный в вектор pVC18, линеаризованный ферментами Sstl и EcoRI), расщепляли при помощи EcoRI и N coI, в результате чего получали вектор pMOG424. Синтетический олигонуклеотидный дуплекс D (фиг.4), содержащий финальные 5 кодирующих триплетов для сигнальной последовательности круциферина Brassica napus, последовательность, кодирующую аминокислоты 1 - 6 зрелой фитазы и кратный клонирующий сайт, клонировали в вектор pMOG424, расщепленный при помощи N coI и Hind III. Полученный в результате вектор именовали pMOG425. 3' - cru A PCR-фрагмент клонировали в виде BglII/Hind III-фрагмента в pMOG425, переваренный ферментами BglII и Hind III, образуя pMOG426.
b) Клонирование гена фитазы из Aspergillus ficuum в бинарном векторе
Плазмиду pGB927, которая содержит кодирующую последовательность полной длины для фитазы Aspergillus ficuum, переваривали ферментами XhoI (частично) и PstI. XhoI/PstI-фрагмент, содержащий ДНК-последовательности, кодирующие зрелую фитазу из аминокислоты 6 вверх, клонировали в векторе pMOG426, расщепленном при помощи XhoI и PstI. Из полученного в результате вектора pMOG428 полную конструкцию, содержащую химерный ген фитазы, вставляли в виде EcoRI/Hind III-фрагмента в бинарный вектор pMOG23, линеаризованный при помощи EcoRI и Hind III. Полученному в результате бинарному вектору pMOG429 придавали подвижность при трехродительском спаривании со штаммом RK2013 K-12 E. coli (содержащем плазмиду pRK2013) (Дитта и др., см. выше) в штамме LBA4404 Agrobacterium (Хоекема и др., 1983, см. выше), который содержит плазмиду с генами вирулентности, необходимую для Т-ДНК-переносчика в растение.
Пример 8
Стабильная экспрессия, специфическая относительно семян, фитазы в семенах табака при управлении промотором круциферина
Штамм LBA4404 Agrobacterium, содержащий бинарный вектор pMOG429 с кДНК, фитазы при управлении промотором круциферина, использовали в экспериментах с трансформацией. Трансформацию табака (Nicotiana tabacum SRI) осуществляли с использованием совместного выращивания дисков из листьев в соответствии с процедурой Хорша и др. , см. выше. Трансгенные растения регенерировали из ростков, которые выращивали на среде для селекции (100 мг/л канамицина). Молодые растения анализировали на NPTII-активность (стойкость к канамицину), выращивали до зрелости и допускали самоопыление, при этом получали семена. Семена от отдельных трансформантов собирали и часть образцов семян анализировали на присутствие фитазы. Из клонов с самым высоким уровнем экспрессии по сравнению с нетрансформированными контрольными семенами оставшиеся семена проращивали на канамицине (200 мг/л). На основании данных для получения в результате 2-семян подвергали селекции семена гомозиготные для NPTII (следовательно, также для фитазы) и использовали для размножения массы растений, способной продуцировать небольшие количества фитазы. Они могут быть затем использованы, например, для экспериментов с перевариванием.
Чтобы определить активность фитазы, обнаруженную в трансгенных семенах, брали примерно 50 мг семян и гомонизировали при помощи пестика в ступке, охлаждаемой льдом в 1 мл 25 мМ буфера ацетата натрия, pH 5,5. После центрифугирования верхний слой анализировали, как это описано в переходном анализе. В 55 независимо трансформированных растениях табака наблюдали максимальный уровень экспрессии фитазы в 0,15% от общего растворимого протеина семян. Активности фитазы не обнаружили в стеблях, корнях и листьях трансгенных растений. Никакой активности фитазы нельзя было обнаружить в нетрансформированных растениях.
Пример 9
Трансформация семян рапса
В этом примере описана трансформация семян рапса при помощи Agrobacterium tumefaciens, содержащей бинарный вектор с химерным геном фитазы. Трансгенные растения можно селекционировать на антибиотическую стойкость. Трансгенные растения можно проанализировать на активность фитазы. Высокие экспрессоры можно проанализировать более тщательно и использовать в других экспериментах.
Аналогичной химерной конструкции фитазы в бинарном векторе (pMOG429) придавали подвижность в штамме LBA4404 Agrobacterium tumefaciens по схеме, аналогичной описанной в примере 7. Этот штамм можно использовать, чтобы трансформировать семена рапса (Brassica napus, семейство Уэстар). С этой целью стерилизованные на поверхности сегменты стеблей, взятые у растений в возрасте 5 - 6 недель, непосредственно перед цветением, предварительно обрабатывали 24 часа на MS-среде (Фрай и др., (1987) Plant Cell Reports, т. 6, стр. 321) при помощи 1 мг/л ВАР, а затем совместно культивировали 48 часов с Agrobacterium на свежих пластинках с той же средой. Трансгенные ростки регенерировали из побегов, которые выращивали на среде для селекции (500 мг/л карбенициллина, 40 мг/л паромомицина), а затем анализировали, как это описано в Примере 8 для табака.
Пример 10
Анализ активности фитазы
Некоторое количество трансгенного растительного материала измельчали, которое содержало всего приблизительно 0,25 PTV. (PTV = единиц фитазы. Одна единица активности фитазы определяется как количество ферментов, которое высвобождает неорганический фосфор из 1,5 мМ фитата натрия со скоростью 1 мкмоль/мин при 37oC и pH 2,5). В качестве альтернативы это количество фитазы может быть экстрагировано из растительного материала.
Измельченный растительный материал инкубировали в общем объеме 50 мл 250 мМ гликокола/HCl (буфера, pH 2,5), содержащего 0,86 г фитата натрия. 11H2O. Хотя фитаза Aspergillus оптимально экспрессирует при pH 2,5,а также 5,5, выбирали более низкое pH, чтобы исключить активность растительной фитазы.
Полученную в результате смесь инкубировали в течение 15 и 60 минут при температуре 37oC. Реакцию прекращали добавлением 5 мл из инкубируемой среды в 5 мл 10% ТХК (трихлоруксусной кислоты). Далее, в обработанный таким образом раствор фермента добавляли 10 мл индикаторного реагента (3,66 г FeSO4•7H2O в 50 мл раствора молибдата аммония) 2,5 г (NH4)6Mo7O24•4H2O и 8 мл концентрированной H2SO4, разбавленной до 250 мл полуводой (demiwater)). Интенсивность голубой окраски измеряли спектрофотометрически в диапазоне 700 нм.
Содержание неорганического фосфата, имеющегося при T = 0, служит в качестве контроля.
Измерения указывают на количество фосфата, высвобожденного в связи с калибровочной кривой для фосфата в области 0 - 1 мМ.
Пример 11
Инкубирование измельченного растительного материала Nicotiana tabacum с кормом
В общем эксперименте 0,25 г экстрагированной растворителем соевой муки инкубировали с некоторым количеством измельченного растительного материала Nicotiana tabacum, содержащего приблизительно 0,25 PTV, как это описано выше, за исключением добавления фитата натрия. В этом случае добавляемый агент инкубирования состоит из смеси 410 мл буфера и 90 мл полуводы.
Высвобождение фосфата из фитата в экстрагированную растворителем соевую муку представлено на фиг. 6. Без добавляемого измельченного растительного материала никакой активности не наблюдали.
В фактически идентичном эксперименте получали аналогичные результаты, используя корм с маисовой клейковиной в качестве субстрата. Результаты использования трансгенных семян приведены на фиг. 6.
Никакой активности не было отмечено без измельченного растительного материала или когда добавляли измельченный растительный материал, который не содержит фитазы.
Пример 12
Испытание ин витро трансгенного растительного материала, содержащего фитазу, при условиях, стимулирующих пищеварительный тракт птицы
Чтобы проанализировать эффективность фитазы, продуцируемой в трансгенном растительном материале табака, определяли активность фитазы из Aspergillus в модели, моделирующей условия, содержащейся в пищеварительном тракте птицы.
Стандартный образец птичьего корма сначала инкулировали в 1 г/15 мл полуводы в течение 60 минут при температуре 39oC, чтобы смоделировать условия в зобе животных. Затем добавляли 5 мл пепсинового раствора (Мерк: 5,28 г/л, pH 3,0 - отрегулированное HCl), pH обеспечивали на уровне 3,0 при помощи HCl, и инкубирование продолжали еще в течение 90 минут при той же температуре, чтобы смоделировать условия в желудке.
В течение периода инкубирования брали пробы, чтобы определить количество фосфата, высвобожденного из фитата, содержащегося в корме.
Действие грибковой фитазы очевидно на фиг. 7. Увеличение дозы фитазы от 250 до 1000 PTV/кг корма приводит к увеличению высвобождения фосфата из пробы корма.
Когда добавляли образец трансгенного растительного материала табака либо семени, либо листа (линии 413.25 и 413.32; после измельчали в ступке) вместо грибковой фитазы, наблюдали аналогичное увеличенное высвобождение фосфата (фиг. 8). Испытывали также контрольный растительный материал табака, который не содержит фитазу. Никакого высвобождения фосфата не было отмечено, по сравнению с контрольным экспериментом.
Сравнение результатов с 50 г трансгенных семян табака/кг корма с результатами, полученными с 500 и 750 PTV/кг корма указывает на то, что 1 г семян табака равен приблизительно 12 PTV в этой модели ин витро переваривания птицы. Сравнение образца, использующего листовой материал, указывает на то, что 1 г (свежего мяса) листового материала табака содержит приблизительно 25 PTV.
Пример 13
Испытания на животных
Испытания осуществляли с использованием бройлеров, чтобы показать эффективность фитазы, экспрессированной в семенах растений, а также отсутствие какого-либо негативного эффекта семян табака на зоотехнические результаты.
Собирали как семена с экспрессированной фитазой, так и семена с контрольными семенами табака. Эти семена измельчали порциями по 100 г с использованием сита (Ретч-милл ЗМ1), имеющего поры в 500 мкм, обеспечивая охлаждение семян.
Самцов цыплят в возрасте одного дня (Хибро) содержали в двухъярусных рядах клеток (0,45 м2). Окружающая температура составляла 32oC в течение первых двух дней, а затем снижали на 4oC в первую неделю. Каждую следующую неделю температуру снижали на 2oC. Цыплят содержали один час при свете и три часа в темноте.
Птицам прививали вакцину против заболевания Нью Кастл в возрасте одного дня, используя вакцину Клон 30. В течение эксперимента бройлеров кормили экспериментальными диетами как жидкими, так и твердыми. Рост и отношение корм/привес измеряли в течение экспериментальных периодов. Очевидную доступность всего количества фосфора измеряли в течение трех дней, в течение которого измеряли потребление корма в пересчете на сухую массу, а одновременно определяли количество выделений.
Очевидную доступность фосфора определяли как разность между потреблением фосфора и выделением фосфора с пометом.
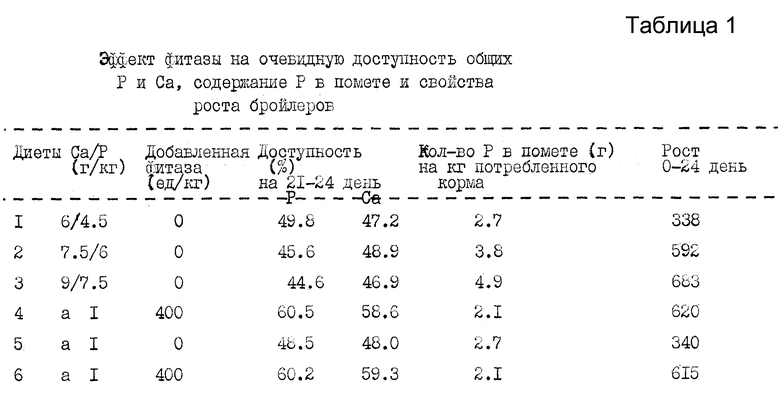
Использовали следующие контрольные диеты без добавления фитазы (см. табл.А).
Никакого кормового фосфата не добавляли в диету 1 (базовая диета). Кальций и фосфор из смеси безводного дифосфата кальция и монофосфата аммония (отношение 5:1) добавляли в диеты 2 и 3. Все экспериментальные диеты получали при помощи добавления в базовую диету (см. таблицу 1).
Экспериментальная диета 4 содержит микробную фитазу в концентрации 400 PTV/кг корма, полученного, как описано Ван Горкомом и др., см. выше.
Экспериментальная диета 5 аналогична диете 4, но измельченные семена нетрансгенного табака добавляли в кормовую смесь, чтобы обеспечить финальное отношение 3 кг/90 кг корма.
Экспериментальная диета 6 также аналогична диете 4, но 3 кг измельченных семян трансгенного табака (линия 413.25) добавляли в смесь 90 кг корма, чтобы получить финальную концентрацию 400 PTV/кг корма.
Этот эксперимент осуществляли с 176 бройлерами в 16 инкубаторных клетках (11 на инкубаторную клетку) до возраста 24 дня. Обработку (диеты) повторяли дважды и связывали случайным образом с клетками в каждом ярусе.
Доступность фосфора измеряли начиная с возраста 21 - 24 дня.
Результаты относительно доступности фосфора и роста животных, полученные для диет 4, 5 и 6, давали каждая отдельно положительный эффект добавления фитазы. Сравнение диет 4, 5 и 6 подтверждает также, что включение семян табака в корм совместно с действием микробной фитазы в желудочно-кишечном тракте домашних животных, таких, как бройлеры, и не дает негативного эффекта на зоотехнические результаты.
Несмотря на то, что настоящее изобретение было описано со ссылкой на его конкретные осуществления, необходимо иметь в виду каждому специалисту в этой области техники, что могут быть реализованы изменения и сделаны эквивалентные замены не выходя из области, охватываемой настоящим изобретением. Кроме того, могут быть сделаны многочисленные модификации для того, чтобы приспособить изобретение к различным конкретным ситуациям, материалам, растениям, семенам, процедурам, различным стадиям, не выходя из области, охватываемой настоящим изобретением. Все такие модификации содержатся внутри области, охватываемой приложенной формулой изобретения.
Состав базовой диеты в экспериментах с бройлерами.
Ингредиенты - Содержание (г/кг)
Желтый маис - 280,0
Сорго (с низким танином) - 200,0
Мука семян подсолнечника (экстрагирована растворителем - 80,0
Мука соевых бобов (экстрагирована растворителем, 48,8% протеина - 350,0
Соевое масло - 58,5
Витамины* - 5,0
Минеральные вещества* - 15,0
Известняк - 1,0
Синтетический метионин - 1,0
C2O3 - 0,5 - 1001,0
ME /МДж/кг - 13,1
Лизин - 12,9
Метионин + цистин - 9,1
Кальций - 6,0 (6,0 - 6,6)**
Общее содержание фосфора - 4,5 (4,7 - 4,7)**-
Органический фитиновый фосфор - 3,0 (3,1 - 3,1)**
* Количество, добавляемое на кг диеты: 12 000 ME витамина A; 2 000 ME витамина D3; 5 ME витамина E; 1,5 мг витамина K3; 1 мг тиамина; 5 мг рибофлавина; 1 мг пиридоксина; 30 мг никотиновой кислоты, 7,5 мг Д-пантотениновой кислоты; 0,015 мг витамина B12; 0,5 мг фолиевой кислоты; 350 мг хлорида холина; 75 мг этоксихина; 9,5 г CaCO3; 2,5 г NaCl; 0,26 г FeSO4; 0,24 г MnSO4; 45 мг CuSO4; 60 мг ZnSO4; 105 мг KI - смеси.
**- ( ) Анализировали для экспериментов 1 и 2 соответственно.




Изобретение может быть использовано в сельском хозяйстве для получения растений, обогащенных фитазой. Для получения таких растений служат векторные конструкции, экспрессирующие ДНК, содержащие ген, кодирующий фитазу. Фитаза, в частности, в значительной мере улучшает усвоение фосфора в организме животных, что делает обогащенные ею растения не только пригодными в различных технологических процессах, но и позволяет использовать их в качестве корма. 6 с. и 2 з.п.ф-лы, 8 ил., 2 табл.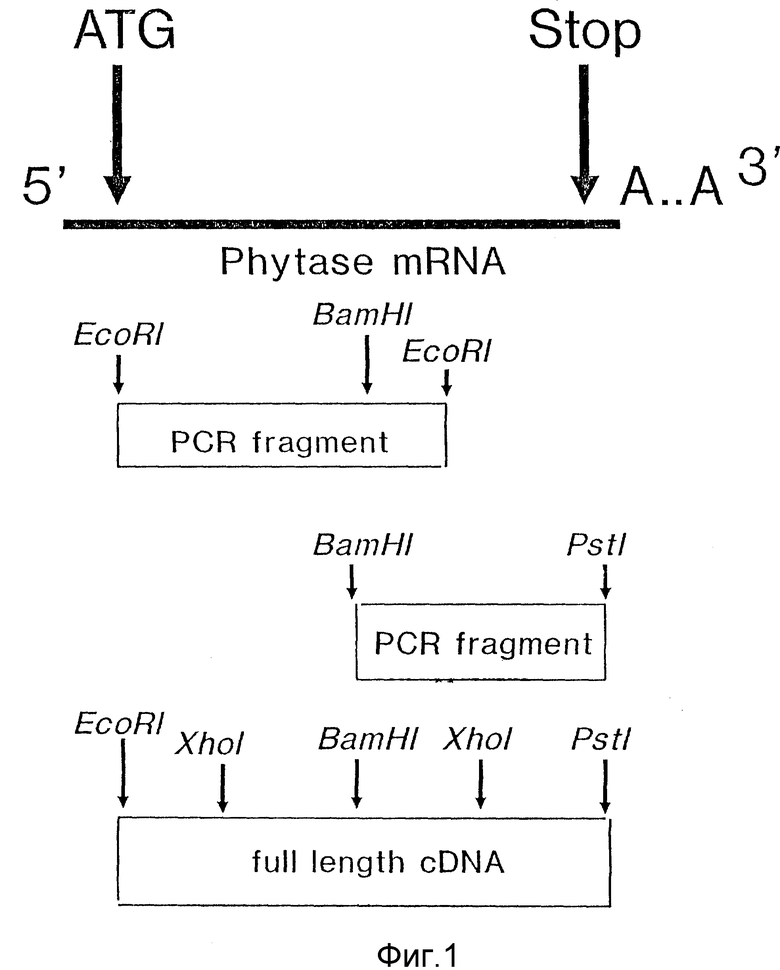
Приоритет по пунктам: 21.09.90 - по 1, 3, 4 и 7;
23.03.90 - по пп.2, 5, 6, 8.
| Торфодобывающая машина с вращающимся измельчающим орудием | 1922 |
|
SU87A1 |
| US 3297548 A, 10.01.67 | |||
| Брухман Э.Э | |||
| Прикладная биохимия | |||
| - М.: Легкая и пищевая промышленность, 1981, с | |||
| Способ образования азокрасителей на волокнах | 1918 |
|
SU152A1 |
Авторы
Даты
1999-03-27—Публикация
1991-03-25—Подача