Изобретение относится к регуляторным последовательностям ДНК, которые могут быть использованы для экспрессии последовательностей ДНК в растительных клетках. Данное изобретение также относится к химерной ДНК, включающей указанные регуляторные последовательности ДНК, оперативно связанные с ДНК, экспрессируемой в растительных клетках, а также растениям, содержащим такую химерную ДНК в своих клетках. Далее, изобретение относится к способам получения растений, резистентных или по меньшей мере восприимчивых к растительным паразитарным нематодам или их действию, а также к клеткам, растениям и их частям.
В Международной патентной заявке WO 92/17054 описан способ идентификации и последующего выделения реагирующих на нематоды регуляторных последовательностей ДНК из Arabidopsis thaliana.
В соответствии с WO 92/21757 было выделено несколько регуляторных последовательностей ДНК из Lycopersicon esculentum, реагирующих на узелково-корневую нематоду Meloidogyne incognita.
Некоторые из этих регуляторных последовательностей (LEMMI's для Lycopersicon esculentum - Meloidogyne incognita) стимулируются, в то время как другие подавляются нематодой. Неизвестно, стимулируются ли какие-либо из индуцируемых регуляторных последовательностей более широким кругом нематод.
Другая регуляторная последовательность, индуцируемая узелково-корневой нематодой Meloidogyne incognita, описана в WO 93/06710. Недостатком этой регуляторной последовательности TobRb7 является то, что она не активируется целым рядом кистозных нематод, включающих виды Heterodera и Globodera. Это делает последовательность TobRB7 непригодной для использования в химерных конструкциях, предназначенных, например, для придания кистозно-нематодной устойчивости картофелю.
Целью данного изобретения является получение регуляторных последовательностей ДНК, которые могут быть индуцированы как кистозными, так и узелково-корневыми нематодами и которые могут быть использованы для экспрессии под их контролем чужеродных последовательностей ДНК внутри питающей структуры нематоды, предпочтительно, но не обязательно, по существу, питающим сайт-специфическим способом.
Данное изобретение предусматривает фрагмент ДНК, получаемый из Arabidopsis thaliana, способный стимулировать узелково-корневую и кистозную индуцируемую нематодами транскрипцию ассоциированной последовательности ДНК при повторном введении в растение. В соответствии с настоящим изобретением предпочтительными являются последовательности, представленные нуклеотидами 1-2163 в SEQ ID No:4. Также предусматриваются части или варианты фрагмента ДНК по данному изобретению, способные стимулировать узелково-корневую и кистозную индуцируемую нематодами транскрипцию ассоциированной последовательности ДНК при повторном введении в растение. Другой предпочтительный аспект данного изобретения включает регуляторный фрагмент ДНК, который, по существу, является сайт-специфическим для питания нематоды.
Другие варианты осуществления данного изобретения относятся к химерным последовательностям ДНК, включающим, в направлении транскрипции, регуляторный фрагмент ДНК по данному изобретению и последовательность ДНК, экспрессируемую под его транскрипционным контролем, естественно не находящуюся под транскрипционным контролем указанного фрагмента ДНК. Препочтительными среди химерных последовательностей ДНК по данному изобретению являются такие последовательности, в которых экспрессируемая последовательность ДНК вызывает продуцирование вещества, разрушающего растительные клетки, такого как барназа. В следующем варианте осуществления изобретения вещество, разрушающее растительные клетки, включает РНК, комплементарную РНК, необходимую для жизнеспособности клеток. В очередном варианте осуществления изобретения экспрессируемая последовательность ДНК вызывает продуцирование вещества, токсичного по отношению к индуцирующей нематоде.
Далее настоящее изобретение относится к использованию в репликоне, включающем микроорганизм ДНК, содержащий такой репликон, а также растительные клетки, инкорпорировавшие в свой геном последовательность химерной ДНК по данному изобретению. Дальнейшие полезные варианты осуществления изобретения относятся к корневой системе растения, по существу, состоящей из клеток в соответствии с данным изобретением, а также к взрослым растениям, по существу, состоящим из клеток в соответствии с данным изобретением, предпочтительно к двудольному растению, более предпочтительно к картофельному растению. Также предусматриваются растения, корневая система которых привита в соответствии с данным изобретением, а также части растений, включающие семена, цветы, клубни, корни, листья, плоды, пыльцу и древесину, равно как и культуры, включающие такие растения.
Настоящее изобретение также включает использование фрагмента ДНК по данному изобретению для идентификации субфрагментов, способных стимулировать танскрипцию ассоциированной последовательности ДНК в растении. Также предусматривается применение последовательности химерной ДНК в соответствии с данным изобретением для трансформирования растений. Далее настоящее изобретение предусматривает применение фрагмента, части или варианта регуляторной ДНК в соответствии с данным изобретением для получения гибридных последовательностей регуляторной ДНК.
Следующие чертежи иллюстрируют данное изобретение.
Фиг.1. Схематическая плазмидная карта бинарного вектора pMOG 23.
Фиг.2. Схематическая плазмидная карта бинарного вектора pMOG 800.
Фиг.3. Схематическая плазмидная карта бинарного вектора pMOG 553.
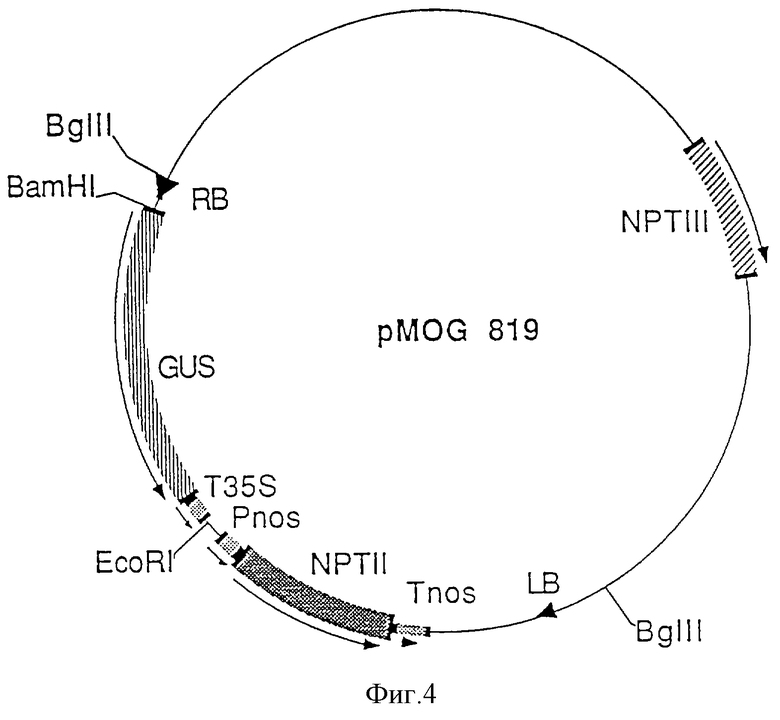
Фиг.4. Схематическая плазмидная карта бинарного вектора pMPG 819.
Фиг.5. Схематическая плазмидная карта бинарного вектора pMOG 849.
Фиг.6. Профили экспрессии вне нематодных питающих сайтов нескольких трансформированных линий Arabidopsis thaliana pMOG 849.
Фиг. 7. Схематическое изображение гена, разрушающего и нейтрализующего нематодный питающий сайт в двухкомпонентной системе для конструирования растений, резистентных к нематодам.
Фиг.8. Схематическая плазмидная карта бинарного вектора pMDG 893.
Некоторые способы осуществления данного изобретения, а также значения различных выражений более подробно описываются ниже.
Настоящее изобретение касается регуляторных последовательностей ДНК, которые могут быть получены из Arabidopsis thaliana, индуцируемых с помощью узелково-корневых и кистозных нематод, весьма предпочтительно экспрессирующих любую ассоциированную ДНК внутри специальных нематодных питающих структур корня растения. Такая нематодная питающая структура используется вторгающейся нематодой в качестве источника питания, при этом нематода индуцирует изменение в растительной ткани, образуя либо гигантскую клетку (узелково-корневые нематоды), либо синцитий (кистозные нематоды). Способ выделения регуляторных последовательностей ДНК был описан и заявлен в предыдущей заявке, WO 92/17054, приводимой в данном описании в качестве ссылки.
В принципе, регуляторные последовательности ДНК в соответствии с данным изобретением могут быть использованы для экспрессии любой чужеродной ДНК в любом выбранном растении путем помещения указанной ДНК под контроль указанных регуляторных последовательностей ДНК и трансформирования растений полученной последовательностью химерной ДНК, используя известные способы. Чужеродную ДНК экспрессируют путем инфицирования корней различными узелково-корневыми нематодами, такими как Meloidogyne incognita, и кистозными нематодами, такими как Heterodera schachtii и Globodera pallida (более подробный, но ни в коей мере не ограничивающий перечень представлен в Таблице 2). Чужеродная ДНК может преимущественно состоять из гена, кодирующего вещество, токсичное или ингибирующее по отношению к растительной паразитарной нематоде для получения растений с пониженной восприимчивостью к растительным паразитарным нематодам. Существуют многочисленные примеры таких токсичных веществ, такие как эндотоксины Bacillus thuringiensis (например, ЕР 0352052), лектины и т.п.
Более предпочтительный подход для получения растений с пониженной восприимчивостью к растительным паразитарным нематодам заключается в разрушении специализированной питающей структуры корней растений путем экспрессии фитотоксичного вещества под контролем регуляторных последовательностей ДНК в соответствии с данным изобретением. Общие принципы этого подхода были описаны и заявлены в Международных патентных заявках WO 92/21757, WO 93/10251 и WO 94/10320, приводимых в данном описании в качестве ссылки. Для последовательности фитотоксичное вещество будет в дальнейшем обозначаться как вещество, разрушающее нематодный питающий сайт (NFS).
Хотя регуляторные последовательности ДНК в соответствии с данным изобретением, по существу, специфичны по отношению к нематодной питающей структуре, возможно, благодаря экспрессии в нецелевой (т.е. не-NFS) ткани, вещества, разрушающие нематодный питающий сайт под их контролем, оказывают обратное действие на жизнеспособность и/или урожай растений. Более того, было найдено, что регуляторные последовательности ДНК в соответствии с данным изобретением являются активными во время фазы культивирования ткани в процедуре трансформации, вызывая необходимость использования во время этой фазы нейтрализующего вещества. Поэтому с целью снижения или устранения (потенциального) побочного действия в высшей степени предпочтительно использование химерной конструкции, разрушающей нематодный питающий сайт в соответствии с данным изобретением в сочетании с нейтрализующей генной конструкцией. Подробности так называемого двухкомпонентного подхода конструирования растений, резистентных к нематодам, описаны в WO 93/10251. В соответствии с этим подходом соединение, разрушающее нематодный питающий сайт (кодирующая последовательность А), ставят под контроль промотора, по меньшей мере активного в нематодном питающем сайте и предпочтительно неактивного или слегка активного вне указанного сайта, в то время как нежелательное фитотоксичное действие вне нематодного питающего сайта нейтрализуется с помощью нейтрализующего соединения (кодирующая последовательность В), экспрессируемого по меньшей мере в тех тканях, где продуцируется разрушающее вещество, за исключением нематодного питающего сайта.
В соответствии с двухкомпонентным подходом подходящий промотор А определяют как промотор, направляющий экспрессию прямой кодирующей последовательности внутри нематодного питающего сайта, на уровне, достаточном для ухудшения метаболизма, и/или функционирования, и/или жизнеспособности нематодного питающего сайта, в то время как этот промотор должен быть предпочтительно, но не обязательно неактивным в тканях вне указанного сайта; по меньшей мере, он не должен быть активным вне нематодного питающего сайта на таком уровне, чтобы активность разрушающего вещества, кодированного кодирущей последовательностью А, не могла быть достаточным образом нейтрализована продуктами кодирующей последовательности В.
Свойства регуляторных последовательностей ДНК в соответствии с данным изобретением, в частности фрагментов 4, 2,1 и 1,5 т.п.о. #1164, делают их в высшей степени полезными в двухкомпонентном подходе, как показывают нижеследующие Примеры. Очевидно, в регуляторных последовательностях ДНК в соответствии с данным изобретением возможны многочисленные мутации, такие как делеции, добавления и изменения в нуклеотидной последовательности и/или их сочетания, не изменяющие свойства этих последовательностей таким образом, чтобы иметь значение для их предполагаемого использования. Поэтому такие мутации входят в объем настоящего изобретения.
Более того, как хорошо известно специалистам в данной области, регуляторные участки растительных генов состоят из различных субучастков с интересными свойствами с точки зрения экспрессии генов. Примерами субучастков в данном описании являются энхансеры, а также "глушители" транскрипции. Эти элементы могут действовать общим (конститутивным) способом или тканево-специфичным образом. Как показано в примерах, некоторые делеции могут быть осуществлены в регуляторных последовательностях ДНК в соответствии с данным изобретением, а субфрагменты могут быть исследованы на профили экспрессии ассоциированной ДНК. Различные субфрагменты, полученные таким образом, или даже их комбинации могут оказаться полезными при конструировании резистентности нематод или в других видах использования, включающих экспрессию чужеродной ДНК в растениях. Использование последовательностей ДНК в соответствии с данным изобретением для идентификации функциональных субучастков и их последующего использования для стимулирования или подавления экспрессии генов в растениях также входит в объем настоящего изобретения.
В контексте данного изобретения термины "вещество, разрушающее нематодный питающий сайт" и "нейтрализующее вещество" охватывают серию выбранных соединений, кодируемых ДНК, генные продукты которой (белок или РНК, или антисмысловая РНК) вредны для метаболизма, и/или функционирования, и/или жизнеспособности нематодного питающего сайта или находящихся в нем органелл. Известны вещества, нейтрализующие такие соединения, которые способны при одновременном экспрессировании в одной и той же клетке в виде разрушающего вещества подавлять активность последнего. Предпочтительными сочетаниями разрушающих и нейтрализующих веществ являются, например, барназа/барстар из Bacillus amyloliquefaciens (Hartley, 1988, J. Mol. Biol. 202, 913-915), рестрикционных эндонуклеаз/соответствующих метилаз, таких как EcoRI из Е. coli (Green et al., 1981, J. Biol. Chem. 256, 2143-2153) и EcoRI метилазы или подобных сочетаний, как описано в обзоре по рестрикцинным модифицирующим системам, тип II (Wilson, 1991, Nucl. Acid Res. 19, 2539-2566), бактериоцины и соответствующие белки иммунности, например колицин Е3/белок иммунности из Е. coli (Lau et al. 1985, Nucl. Acid Res. 12, 8733-8745), или любому гену, кодирующему разрушающее вещество, который может быть нейтрализован одновременным продуцированием десенсибилизирующей РНК под контролем промотора В, такого как последовательности ДНК, кодирующие цепь А токсина дифтерии (Czako & An, 1991, Plant Physiol. 95, 687-692), РНКазам, таким как РНКаза T1, рибонуклеазам или протеазам и рибозимам против мРНК, кодирующие фитотоксичные белки.
В соответствии с другим аспектом данного изобретения сочетания разрушающих и нейтрализующих веществ включают соответственно гены, ингибирующие по отношению к эндогенному гену, кодирующему белок или полипептидный продукт, необходимый для жизнеспособности клеток, и, в качестве нейтрализующего гена, ген, кодирующий белок или полипептидный продукт, способный замещать функцию эндогенного белка или полипетидного продукта. Такие разрушающие гены могут быть выбраны из группы, включающей (а) гены, кодирующие рибозимы против эндогенного транскрипта РНК, (b) гены, которые при транскрибировании продуцируют транскрипты РНК, комплементарные или по меньшей мере частично комплементарные по отношению к транскриптам РНК эндогенных генов, необходимых для жизнеспособности клеток, способ, известный как десенсибилизирующее ингибирование экспрессии генов (описан в ЕР-А 240208), или (с) гены, которые при транскрибировании продуцируют транскрипты РНК, идентичные или по меньшей мере очень похожие на транскрипты эндогенных генов, необходимых для жизнеспособности клеток, еще неизвестный способ ингибирования генной экспрессии, называемый косупрессией (описан Napoli С. et al., 1990, The Plant Cell 2, 279-289).
В соответствии с предпочтительным вариантом осуществления данного изобретения используют десенсибилизирующие гены для ингибирования экспрессии эндогенных генов, необходимых для жизнеспособности клеток, при этом указанные гены экспрессируют в нематодных питающих структурах с помощью регуляторных последовательностей ДНК по данному изобретению, слитых в обратном направлении с указанным десенсибилизирующим геном.
Разрушающее действие, вызываемое десенсибилизирующим геном, который является ингибитором для витального эндогенного гена, нейтрализуют экспрессией нейтрализующего соединения В, при этом экспрессия находится под контролем промотора В, как описано, а указанное соединение В представляет собой белковый или полипептидный продукт, идентичный или похожий на белок или полипептид, кодированный эндогенным витальным геном и способный замещать функцию эндогенного генного продукта в растении-хозяине. Предпочтительно, чтобы нуклеотидная последовательность транскрипта РНК, кодированного нейтрализующим геном, была дивергентна с эндогенным витальным транскриптом гена РНК во избежание возможного косупрессивного действия. Следовательно, предпочтительно, чтобы нейтрализующий ген кодировал белок или полипептид с, по существу, такой же функцией, как и эндогенный витальный ген, но через промежуточный дивергентный транскрипт РНК; нейтрализующие гены, отвечающие этому описанию, могут быть получены в результате скрининга базы данных для генов, получаемых из различных видов растений или даже из различных нерастительных видов, таких как дрожжи, животные эукариоты или прокариоты. Предпочтительно, идентичность нуклеотидной последовательности транскриптов, кодированных разрушающим десенсибилизирующим трансгеном и нейтрализующим сенсибилизирующим трансгеном, составляет менее 90%, предпочтительно менее 80%, еще более предпочтительно указанный нейтрализующий сенсибилизирующий трансген кодирует белковый или полипептидный генный продукт, аминокислотная последовательность которого не идентична последовательности разрушенного генного продукта, при этом идентичность нуклеотидной последовательности транскриптов, кодированных нейтрализующим трансгеном, составляет менее 75%.
Гены-мишени для десенсибилизирующих разрушающих генов выбирают из генов, кодирующих ферменты, необходимые для жизнеспособности клеток, также называемые ферменты "для ведения домашнего хозяйства", ядро которых должно быть закодировано предпочтительно в виде однокопийных генов, хотя для цели изобретения также подходит семейство генов небольших размеров. Более того, действие десенсибилизирующей экспрессии указанных генов не должно быть сведено к нулю в результате диффузии или транслокации из других клеток или органелл ферментных продуктов, обычно синтезируемых такими ферментами. Предпочтительно гены, кодирующие мембранно-транслоцирующие ферменты, выбирают, поскольку они участвуют в установлении химических градиентов через мембраны органелл. Ингибирование таких белков в результате десенсибилизирующей экспрессии по определению не может быть предотвращено диффузией субстратов через мембрану, в которой находятся эти белки. Транслоцированное соединение не ограничивается органическими молекулами, оно также может иметь неорганическую природу, например Р, Н, ОН или электроны.
Предпочтительно, мембранно-транслоцированные ферменты должны присутствовать в органеллах, число которых увеличивается во время паразитизма, показывая тем самым важную роль таких органелл в клетках, включающих нематодный питающий сайт. Конкретные примеры таких органелл включают митохондрии, эндоплазматический ретикулум и плазмодесмы (Hussey et al., 1992 Protoplasma 167; 55-65, Magmusson & Golinowski 1991 Can. J. Botany 69; 44-52). Перечень ферментов-мишеней приведен в Таблице 1 в качестве примера, однако данное изобретение не ограничивается ферментами, включенными в эту таблицу. Более подробные перечни приведены в таких сериях, как Biochemistry of Plants (Eds. Stumpf & Conn, 1988-1991, Vols. 1-16 Academic Press) или Encyclopedia of Plant Physiology (New Series, 1976, Springer-Verlag, Berlin).
Гены, кодирующие эти ферменты, были выделены всего лишь в нескольких случаях, поэтому количество генных копий неизвестно, необходимые критерии описаны в данном изобретении.
Подходящий промотор В означает промотор, направляющий экспрессию в, по существу, всех клетках, в которых экспрессируется кодирующая последовательность А, при условии, что он не направляет экспрессию внутри нематодной питающей структуры или делает это неэффективно. (Выражение "по существу, все клетки" означает по меньшей мере те клетки, которые должны быть жизнеспособными для обеспечения нормального роста растений и/или развития, необходимого для коммерческого использования таких растений.) Примером растений, в которых разрушительное действие не нейтрализуется буквально во всех клетках растения-хозяина и которые тем не менее жизнеспособны и пригодны для коммерческого использования, служат растения, экспрессирующие разрушающий ген в соответствии с данным изобретением в клетках тычинки; это может привести к образованию мужских стерильных растений, что даже считается коммерчески привлекательным свойством некоторых зерновых культур. Подходящие образцы промотора типа В могут быть получены из растений или растительных вирусов либо могут быть синтезированы химическим способом. Регуляторные последовательности могут также включать энхансерные последовательности, например, присутствующие в промоторе 35S вируса мозаики цветной капусты (Кау et al., 1987, Science, 236, 1299-1302), и стабилизирующие последовательности мРНК, такие как лидерные последовательности вируса мозаики Alfalfa PHK4 (Brederobe et al. , 1980, Nucl. Acids Res. 8, 2213-2223) или любые другие последовательности, функционирующие подобным образом.
Альтернативно для обеспечения экспрессии во всех или практически всех растительных тканях промотор В/кодирующая последовательность В могут быть дополнены вторым промотором В' кодирующей последовательностью В, имеющими конфигурацию экспрессии, частично перекрывающую или полностью комплементарную по отношению к промотору В/кодирующей последовательности В, при условии, что ни промотор В, ни промотор В' не направляют экспрессию в нематодном питающем сайте. Гибридные промоторы, включающие различные промоторы (их части), соединенные для обеспечения необходимой конфигурации экспрессии в соответствии с данным описанием, также входят в объем настоящего изобретения.
Предпочтительно промотор В представляет собой промотор 35S вируса мозаики цветной капусты или его производных, который обычно считается сильным конститутивным промотором в растительных тканях (Odell et al. 1985 Nature 313, 810-812). Другим предпочтительным примером промотора В является сильный корневой промотор rolD (Leach & Aoyagi 1991 Plant Sci. 19, 69-76) из плазмиды pRia4 Agrobacterium rhizogenes; фланкирующий участок 5' ORF15 (Slighton et al. , 1986, J. Biol. Chem. 261, 108-121). Пригодность других конститутивных промоторов, таких как промотор синтазы нопалина (Bevan, 1984, Nucl. Acids Ees. 12, 8711-8721) или промотор вируса мозаики норичника (ЕР-А 426641) для использования в качестве промотора В может быть определена путем слияния с генами-маркерами, такими как GUS (Jefferson, 1987, Plant Mol. Biol. Reporter 5, 387-405), переноса этих конструкций на растения и гистохимического анализа таких трансгенных растений после инфицирования PPN.
Другие регуляторные последовательности, такие как терминаторные последовательности и сигналы полиаденилирования, включают любые последовательности, оказывающие такое же действие на растения, их выбор зависит от уровня специалиста в данной области. Примером таких последовательностей является фланкирующий участок 3' гена синтазы нопалина (nos) Agrobacterium tumefaciens (Bevan, 1984, Nucl. Acids Res. 12, 8711-8721).
Дальнейшие подробности двухкомпонентного подхода могут быть найдены в WO 93/10251 (приводится в данном описании в качестве ссылки).
Выбор видов растений прежде всего определяется объемом повреждения после инфицирования PPN, наносимым сельскому хозяйству, и податливостью видов растений к трансформированию. Роды сельскохозяйственных растений, которые страдают от PPN и которые могут стать значительно менее восприимчивыми к PPN при использовании данного изобретения, включают, но не ограничиваются родами, перечисленными в Таблице 2.
Виды нематод в контексте данного изобретения включают все растительно-паразитарные нематоды, модифицирующие клетки-хозяева в специальные питающие структуры от мигрирующих эктопаразитов (например, Xiphiniema spp.) до встречающихся чаще оседлых эндопаразитов (например, Heteroderidae, Meloidogynae или Rotylenchulinae). Перечень паразитарных нематод приведен в Таблице 2, однако данное изобретение не ограничивается видами, включенными в эту таблицу. Более подробные перечни приводят Zuckerman et al. (eds., in: Plant Parasitic Nematodes, Vol. I 1971, Hew York, pp. 139-162).
В контексте данного изобретения растением с пониженной восприимчивостью к растительным паразитарным нематодам (PPN) считается растение со статистически значимым снижением количества взрослых женских особей на поверхности корней растения при сравнении с контрольными растениями. Классификация по восприимчивости/резистентности в соответствии с количеством созревающих женских особей является стандартной практикой как для кистозных, так и для узелково-корневых нематод (например, LaMondia, 1991, Plant Disease 75, 453-454; Omwega et al., 1990, Phytopathol. 80, 745-748).
Нематодная питающая структура в соответствии с данным изобретением включает исходную питающую клетку, т.е. клетку или очень ограниченное количество клеток, которым суждено стать нематодной питающей структурой после индуцирования вторгающейся нематодой.
Разрушающее действие нематодного питающего сайта в соответствии с данным изобретением не ограничивается побочным действием только на нематодный питающий сайт; подразумевается также разрушительное действие на развитие нематод путем прямого взаимодействия.
Существует несколько способов внедрения рекомбинантной ДНК, содержащей последовательности ДНК, в хозяева-растения, как описано в данном изобретении. Такие способы включают, но не ограничиваются ими, трансформирование протопластов с использованием кальциево/полиэтиленгликолевого метода, электропорацию и микроинъекции или бомбардировку частицами (с покрытием) (Potrykus, 1990, Bio/Technol. 8, 535-542).
Помимо этих так называемых прямых способов трансформирования ДНК, широко применяют системы трансформирования с использованием векторов, таких как вирусные векторы (например, из вируса мозаики цветной капусты) и бактериальные векторы (например, из рода Agrobacterium) (Potrykus, 1990, Bio/Technol. 8, 535-542). После селекции и/или скрининга трансформированные протопласты, клетки или части растений могут быть регенерированы в целые растения, используя известные способы (Horsch et al., 1985, Science 225, 1229-1231). Выбор методов трансформации и/или регенерации не имеет значения для данного изобретения.
В соответствии с предпочтительным вариантом осуществления настоящего изобретения используют так называемую бинарную векторную систему (описана в ЕР-А 120516) с использованием штаммов Agrobacterium, содержащих плазмиду-помощник с генами вирулентности и совместимую плазмиду, бинарный вектор, содержащий конструкцию переносимого гена. Этот вектор может реплицировать как в Е. coli, так и в Agrobacterium; вектор, используемый в данном случае, получают из бинарного вектора Bin19 (Bevan., 1984, Nucl. Acids Res. 12, 8711-8721). Бинарные векторы, используемые в данном примере, содержат между правой и левой граничными последовательностями Т-ДНК идентичный ген NPTII, кодирующий резистентность к канамицину (Bevan, 1984, Nucl. Acids Res. 12, 8711-8721) и множественный клонирующий сайт для клонирования в нужные генные конструкции.
Последние научные исследования показывают, что в принципе однодольные растения поддаются трансформированию и что фертильные трансгенные растения могут быть регенерированы из трансформированных клеток. Развитие воспроизводимых культурных систем для этих культур вместе с эффективными способами введения генетического материала в клетки растений облегчает трансформирование. В настоящее время предпочтительными способами трансформирования однодольных растений являются микроналетающая бомбардировка эксплантатов или суспендированных клеток и прямое поглощение ДНК или электропорация (Shimamoto, et al., 1989, Nature 338, 274-276). Трансгенные кукурузные растения получают путем введения барьерного гена Streptomyces hygroscopicus, кодирующего фосфинотрицин ацетилтрансферазу (фермент, инактивирующий гербицид фосфинотрицин), в эмбриогенные клетки кукурузной суспендированной культуры с помощью бомбардировки микрочастицами (Gordon-Kamm, 1990, Plant Cell, 2, 603-618). Описано введение генетического материала в алейронные протопласты других однодольных культур, таких как пшеница и овес (Lee, 1989, Plant Mol. Biol. 13, 21-30). Пшеничные растения регенерируют из эмбриогенной суспендированной культуры путем отбора только старых, компактных и узловых эмбриогенных мозольных тканей для установки эмбриогенных суспендированных культур (Vasil, 1990, Bio/Technol. 8, 429-434). Недавно также был описан способ трансформирования риса с использованием Agrobacterium (WO 95/16031). Соединение систем трансформирования для этих культур делает возможным применение данного изобретения по отношению к однодольным растениям. Эти методы могут также применяться для трансформирования и регенерации двудольных растений.
Нижеследующие примеры предназначены только для иллюстрации, а не для ограничения объема данного изобретения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Процедуры с ДНК
Все процедуры с ДНК осуществляют в соответствии со стандартными способами, описанными в Maniatis (Molecular Cloning, A Laboratory Manual 2nd Edition, Cold Spring Harbor Laboratory, 1990).
Трансформирование Arabidopsis
Трансформирование осуществляют, используя совместное культивирование сегментов корней Arabidopsis thaliana (экотип С24) и штамма Agrobacterium MOG101, содержащего подходящий бинарный вектор, как описано Valvekens et al. (1988, Proc. Nat. Acad. Sci. USA 85, 5536-5540), следующим образом:
Семена Arabidopsis яровизируют в течение 7 дней при 4oС до прорастания. Семена подвергают поверхностной стерилизации в течение 2 минут в 70% EtOH, переносят в 5% NaOCl/0,5% NaDodSO4 на 15 минут, 5 раз промывают стерильной дистиллированной водой и помещают в чашки Петри размером 150х25 мм, содержащие среду для проращивания (GM) (Таблица 3). Чашки Петри запечатывают газонепроницаемой медицинской лентой (Urgopore, Chenove France). Растения выращивают при 22oС, используя следующий цикл: 16 часов на свету и 8 часов в темноте. Такие же комнатные условия для выращивания используют для процедур культивирования тканей. Все растительные среды делают буферными с помощью 2-(N-морфолино)-этансульфоновой кислоты при 0,5 г/л (РН 5,7: используют 1 М КОН), закрепляют 0,8% агаром Difco Bacto и обрабатывают в автоклаве при 121oС в течение 15 минут. Гормоны и антибиотики растворяют в диметилсульфоксиде и воде соответственно и добавляют к среде после стерилизации в автоклаве и охлаждения до 65oС.
Интактные корни инкубируют в течение 3 дней на закрепленной 0,5/0,05 среде (Таблица 3). Затем корни измельчают на мелкие кусочки размером приблизительно 0,5 см (в дальнейшем называемые "корневые эксплантаты") и переносят в 10 мл жидкой среды 0,5/0,05; добавляют 0,5-1,0 мл суточной культуры Agrobacterium. Корневые эксплантаты и бактерии перемешивают путем осторожного встряхивания в течение приблизительно 2 мин.
Затем корневые эксплантаты блотируют на стерильную фильтровальную бумагу для удаления большей части жидкой среды и сокультивируют в течение 48 часов на 0,5/0,05 агаре. Потом эксплантаты промывают в жидкой среде 0,5/0,05, содержащей 1000 мг ванкомицина (Sigma) на литр. Кусочки блотируют, а затем инкубируют на 0,15/5 агаре (Таблица 3), дополненном 750 мг ванкомицина и 50 мг канамицина на литр. Через три недели после инфицирования агробактериями, содержащими химерный неоген, на фоне желтоватых корневых эксплантатов образуются зеленые, резистентные к канамицину каллусы (KmR). На этой стадии корневые трансплантаты переносят в свежий агар 0,15/5, содержащий только 500 мг ванкомицина и 50 мг канамицина на литр. Спустя три недели большая часть зеленых каллусов образует побеги. Трансформированные побеги переносят в чашки Петри размером 150х25 мм, содержащие среду для проращивания, для получения корней или семян либо того и другого. В этих чашках Петри многие регенеранты образуют семена без образования корней. Пустившие корни растения также могут быть перенесены в почву для получения семян. Исходный корневой материал получают следующим образом: 6 стерилизованных семян С24 Arabidopsis thaliana проращивают в 50 мл среды для проращивания (250-миллилитровая колба Эленмейера) в роторной качалке (100 об/мин) в комнате для выращивания в течение 9 дней с неярким освещением. Трансгенные растения регенирируют из побегов, выращенных на селекционной среде (50 мг/л канамицина), вызывают образование корней и переносят в среду для проращивания или почву.
Трансформирование картофеля
Для трансформирования Solanum tuberosum var. Kardal используют протокол, описанный Hoekema et al. 1989 Bio/Technology 7, 273-278, с некоторыми модификациями.
Очищенные, поверхностно-стерилизованные картофельные клубни разрезают на ломтики толщиной 2 мм. Вдоль окружности ломтика вырезают кружочки диаметром 1 см. Кружочки собирают в WM (среда Murashige & Skoog), содержащая 1 мг/л тиамина НСl, 0,5 мг/л пиридоксина НCl, 0,5 мг/л никотиновой кислоты, 100 мг/л мио-инозитола, 30 г/л сахарозы, 0,5 г/л MES рН 5,8). Осуществляют инокуляцию штаммом Agrobacterium tumefaciens EHA105 (Hood et al. 1993 Transgenic Research 2, 208-218), замещая WM 100 мл свежей WM, содержащей ресуспендированную пеллету 10 мл культуры Agrobacterium, свежевыращенной в LB + соответствующий антибиотик к OD600 0,5-0,7. После инкубирования клубневых кружков в течение 20 минут в бактериальной суспензии их переносят в закрепленную CM (WM, дополненная 8 г/л агара, 3,5 мг/л зеатин рибозида, 0,03 мг/л индолуксусной кислоты) при плотности 20 эксплантатов на чашку Петри. Через 2 дня кружки переносят в РМ (СМ, дополненная 200 мг/л цефотаксима, 100 мг/л ванкомицина) для отбора против Agrobacteria. Спустя 3 дня кружки переносят в чашки со средой, индуцирующей побеги (СМ, дополненная 250 мг/л карбенициллина, 100 мг/л канамицина) при плотности, составляющей 10 эксплантатов на чашку Петри с целью отбора для регенерации трансформированных побегов. Через 2 недели кружки с тканью переносят в свежую среду, индуцирующую побеги, а еще через 3 недели их переносят в SEM (SIM с 10 х более низкая концентрация гормонов). Спустя 8-9 недель после сокультивирования побеги становятся достаточно большими, чтобы отрезать их от ткани каллуса и перенести в стеклянные пробирки (Sigma, Cat. nr. C5916), содержащие 10 мл RM (WM, содержащая 0,5 х соли MS, 0,5 х витамины, 10 г/л сахарозы, 100 мг/л цефотаксима, 50 мг/л ванкомицина и 50 мг/л канамицина) для образования корней in vitro и вегетативного размножения.
Обращение с нематодами, выращивание и инфицирование корней растений
Поверхность семян Arabidopsis стерилизуют, а затем засевают их в чашки Петри (диаметр 9 см) на среду В5, содержащую 20 г/л глюкозы и 20 мг/л канамицина. Через 3 дня при 4oС чашки инкубируют в течение 2 недель в камере для выращивания при 22oС и следующем цикле: 16 часов на свету и 8 часов в темноте. Растения, резистентные к канамицину, затем переносят в наполненные землей полупрозрачные пластиковые пробирки (30х15х120 мм, Kelder plastibox b.v. , the Netherlands). Пробирки помещают под углом 60o к вертикальной оси так, чтобы корни росли на нижней стороне клубней. Это позволяет визуально наблюдать за процессом инфицирования и облегчает удаление корневой системы из почвы для GUS-анализа. Еще через 2 недели осуществляют инфицирование, инъецируя суспензию, содержащую 500 личинок Heterodera schachtii второй стадии (в 3 мл H2O) на корневую систему или 300 личинок Meloidogyne incognita второй стадии на корневую систему, в почву.
Подобным образом побеги картофеля, пустившие корни в канамицин-содержащей среде RM, переносят в наполненные землей полупрозрачные пластиковые пробирки (30х15х120 мм, Kelder plastibox b.v., The Netherlands) и выращивают под наклоном на протяжении еще двух недель при 22oС и следующем цикле: 16 часов на свету и 8 часов в темноте. Осуществляют инфицирование, инъецируя суспензию, содержащую 500 личинок Globodera pallida второй стадии (в 3 мл Н2O) на корневую систему, в почву.
GUS-анализ
Активность GUS определяют в различное время во время процесса инфицирования, тщательно промывая корневые системы для удаления большей части прилипшей земли и инкубируя их в растворе X-Glyc (1 мг/мл X-Gluc, 50 мМ NaPO4 (pH 7), 1 мМ K4Fe(CN)6, 1 мМ К K3Fe(CN)6, 10 мМ ЭДТА, 0,1% Тритон х 100) при 37oС в течение ночи. После удаления хлорофилла из ткани путем инкубирования 70% этанола в течение нескольких часов пятна GUS наблюдают под микроскопом.
Пример 1
Конструирование бинарного вектора pMOG800
Бинарный вектор pMOG800 является производным pMOG23 (фиг.1, размещенным в Centraal Bureau voor schiimmelcultures, Oosterstraat 1, Baarn, The Netherlands, 29 января, 1990 г., под номером CBS 102.90), в котором в полилинкер между EcoRI и SmaI вводят дополнительный сайт рестрикции KpnI. Между левой и правой границами Т-ДНК эта плазмида содержит ген резистентности к канамицину для селекции трансгенных растительных клеток (фиг.2). Образец Е. coli DH5 альфа, принимающей pMOG 800, размещен в Centraal Bureau voor Schimmelcultures, Oosterstraat 1, Baarn, The Netherlands, 12 августа 1993 г., под номером GBS 414.93.
Пример 2
Конструирование конструкции GUS pMOG553 без промотора
Конструирование этого вектора описано Goddijn et al. 1993 Plant J. 4, 863-873. В этой ссылке имеется ошибка: конструкция содержит терминатор 35S вируса мозаики цветной капусты позади гена β-глюкуронидазы вместо указанного терминатора синтазы нопалина. Последовательность между границами Т-ДНК этого бинарного вектора размещена в банке данных EMBL под регистрационным номером Х84105. pMOG553 несет маркер HygR для трансформирования растений (фиг.3).
Пример 3
Идентификация и выделение захваченного предпочтительного фрагмента промотора нематодного питающего сайта в Arabidopsis thaliana
Бинарный вектор pMOG553 мобилизуют путем тройственного скрещивания со штаммом Agrobacterium tumefaciens MOG101. Полученный штамм используют для трансформирования корня Arabidopsis. Таким способом получают более 1100 трансгенных линий растения Arabidopsis. Трансгенные растения выращивают до зрелости, дают им возможность самоопылиться, а полученные семена (S1) собирают и яровизируют. Затем семена S1 проращивают на питательном растворе (Goddijn et al. 1993 Plant J. 4, 863-873), закрепленном 0,6% агара, 10 мг/л гигромицина, и хранят при 4oС в течение четырехдневного периода набухания. На пятый день чашки переносят в помещение с комнатной температурой и умеренным освещением (1000 люкс, 16 часов на свету и 8 часов в темноте) для проращивания. 14-дневные проростки переносят в почву для горшков, помещенную в наклонные полупрозрачные пластиковые пробирки (30х15х120 мм) для дальнейшего выращивания при 5000 люкс (20oС). Выращивание растений таким образом приводит к образованию корневой системы на нижней части клубней в пространстве между почвой и пробиркой. Через две недели корни инфицируют нематодами, как описано в Экспериментальной части. Несколько раз после инокулирования (продолжающегося 2-14 дней) корневые системы подвергают анализу на активность GUS, как описано в Экспериментальной части. Линию pMOG 553#1164 идентифицируют как линию, проявляющую достаточно сильную экспрессию GUS внутри синцитий и гигантских клеток, индуцированных Heterodera schachtii и Meloidogyne incognita сответственно. В неинфицированных контрольных растениях (равно как и в инфицированных растениях) этой линии обнаруживается очень слабая экспрессия GUS в некоторых клетках у основания молодых боковых корней и в некоторых зеленых частях растения.
Было определено, что в линии 1164 этот фенотип расщепляется в пропорции 1: 3; это значит, что конструкция GUS присутствует в одном локусе на геном. Присутствие только одной копии Т-ДНК подтверждается саузерн-анализом. Фрагмент, содержащий 1,5 т. п. о. захваченной промоторной последовательности, прилежащей к открытой рамке считывания, выделяют инвертированной цепной полимеразной реакцией. Геномная ДНК этой линии расщепляется рестрикционным ферментом MscI, который производит всего лишь одно расщепление на этом кодирующем участке GUS и объединяется. В результате гидролизации кольцевой ДНК ферментом SnaBI получают линейный фрагмент с известными последовательностями GUB на концах и фланкирующей растительной последовательностью между ними. Этот фрагмент амплифицируют, используя набор праймера GUSinv5 (5' СТТ ТСС САС САА CGC TGA ТС 3' SEQ ID NO: 1) и GUS7 (5' GTA ATG CTC ТАС АСС ACG CCG 3' SEQ ID NO: 2), клонированный в мультикопийный вектор и секвенированный (см. ниже). Для клонирования этого амплифицированного фрагмента вновь впереди GUS растительную последовательность опять амплифицируют из геномной ДНК Arabidopsis, используя праймеры GUSinv5 и 1164ХВМ (5' ТСТ AGA GGA ТСС TGG ССА ТАС ААА ТСА ACG TTT АС 3' SEQ ID NO: 3). Для снижения уровня ошибок используют pfu ДНК-полимеразу, обладающую корректирующей активностью. Праймер 1164ХВМ вводит сайт BamHI в 5' конец промотора, что позволяет клонировать 1480 п.о. BamHI фрагмент, содержащий промотор, назад перед GUS в конструкции pMOG 819, не изменяя последовательность между открытой рамкой считывания GUS и растительным промотором.
Пример 4
Конструирования конструкции GUS pMOG 819 без промотора
Этот вектор конструируют, клонируя кодирующий участок GUSинтрон (Vancanneyt et al. 1990, Mol. Gen. Genet. 220; 245-250) pMOG 553 в виде фрагмента BamHI-EcoRI в полилинкер pMOG 800. Бинарный вектор pMOG 819 (фиг. 4) служит для введения клонированных фрагментов промотора для дальнейшего анализа экспрессии после трансформирования растений.
Пример 5
Анализ фрагментов промотора после повторного введения в Arabidopsis
Продукт полимеразной цепной реакции из метки 553#1164 клонируют назад перед геном GUS бинарного вектора pMOG 819 для получения pMOG 849 (фиг.5). Образец Е. coli DH5α, содержащий pMOG 849, был размещен в Centraal Bureau voor schimmel-cultures, Oosterstraat 1, Baarn, The Netherlands, 4 мая 1995 г., под номером CBS 308.95. Для определения тканево-специфической активности клонированного фрагмента промотора полученный клон pMOG 849 активируют по отношению к Agrobacterium tumefaciens и для трансформирования растений Arabidopsis tchaliana дикого типа используют соответствующий штамм. На конструкцию продуцируется 24-30 трансформантов. Семена исходных трансформантов собирают и выращивают для инфекционных анализов с Heterodera schachtii, как описано в Экспериментальной части. GUS-анализ после инфицирования нематод показывает, что 79% линий, трансформированных pMOG 849, экспрессируют ген-репортер в синцитиях. Некоторая слабая экспрессия также обнаруживается на участке корневого бокового разветвления, в васкулярной ткани корней и листьев, в центре розетки и в некоторых тканях цветков. Экспрессия GUS вне синцития сильно различается от линии к линии (см. фиг.6). Предположительно, это различие является результатом действия положения генома на введенные регуляторные последовательности. Тем не менее, в большинстве линий обнаруживается конфигурация экспрессии, очень похожая на первоначально помеченную линию 553#1164. Даже несмотря на то что активность фрагмента промотора в различных линиях pMOG 849 обычно намного слабее, чем активность GUS внутри синцитий, ни одна из синцитий-положительных линий не является полностью специфичной для питающих сайтов.
Экспрессия GUS также обнаруживается в гигантских клетках, индуцированных путем инфицирования Meloidogyne incognita в тех же линиях, которые экспрессируют GUS в синцитиях, индуцированных Heterodera schachtii. Это показывает, что фрагмент 1164 может быть использован почти как специфичный промотор питающего сайта для получения растений, обладающих пониженной восприимчивостью по отношению к Meloidogyne incognita и Heterodera schachtii.
Во время фазы культивирования тканей было замечено, что регуляторная последовательность 1164 также активна как промотор, подсказывая таким образом необходимость использования нейтрализующего гена при переносе фрагмента промотора 1164 на Arabidopsis геном, разрушающим растительную клетку, под его контролем, таким как барназа (см. Примеры 8 и 9).
Фрагмент полимеразной цепной реакции, основанный на 553#1164, используют в качестве зонда для выделения соответствующего геномного клона. Геномный фрагмент, содержащий 2,1 т.п. (см. SEQ ID NO: 4), затем используют в подобном подходе, как описано выше (pMOG 889 содержит геномный 553#1164, слитый с GUSинтроном). Опять же, индуцированную нематодами экспрессию GUS можно наблюдать в синцитиях и гигантских клетках после нематодного инфицирования корней Arabidopsis с помощью Н. Schachtii и М. incognita соответственно.
Пример 6
Определение последовательности промоторной метки pMOG 553#1164
Последовательность геномного клона 1164 путем метода "прогулки" праймера на CsCl очищенной ДНК, используя автоматический секвенатор ALF Pharmacia. Процедура описана Voss et al. (1992) Mol. Cell. Biol. 3, 153-155. Последовательность изображена в SEQ ID NO: 4.
Пример 7
Клонирование субфрагмента (субфрагментов) промотора
Пять субфрагментов промотора 1164 получают полимеразной цепной реакцией, используя праймеры, как показано в Таблице 4. Нумерация праймеров такая же, как и в перечне последовательностей. Для всех амплификаций используют бляшкообразующую единицу полимеразы корректирующей ДНК, a pMOG 849 служит в качестве ДНК-мишени. Все 5' концевые праймеры содержат сайт XhoI. Таким образом, все делегированные фрагменты промотора 1164, полученные полимеразной цепной реакцией, могут быть вновь клонированы в pMOG 819, по сайту XhoI и BamHI, расположенные в множественном клонирующем сайте pMOG 553 и расположены в помеченной линии 1164 между кодирующим участком GUS и помеченной растительной последовательностью. Номера относятся к конструкциям, получаемым из субфрагментов, клонированных в pMOG 819; праймеры от 6044-1 до 6044-6 соответствуют SEQ ID NO 6-11 соответственно.
После повторного введения этих генных кассет в структуры экспрессии растений, можно определить время и т.п., как описано для фрагмента 1164 с 1,5 т. п. в Примере 3. Фрагменты, имеющие нужные структуры и/или периоды времени, могут быть в дальнейшем использованы для направления экспрессии чужеродных последовательностей ДНК (как смысловые/кодирующие, так и антисмысловые) и/или использованы для получения гибридных промоторных конструкций. Дальнейший анализ позволяет понять некоторые регуляторные элементы, такие как "глушители", энхансеры и т.п., и дает возможность воздействовать по желанию на структуры экспрессии и/или периоды времени. Пример использования фрагментов промотора в соответствии в настоящим изобретением для снижения восприимчивости к нематодам проиллюстрирован для геномного фрагмента 1164 2,1 т.п., клонированного перед барназой. Он также является примером гена, разрушающего нематодный питающий сайт.
Пример 8
Клонирование фрагмента 1164 перед барназой
Геномный фрагмент ДНК 2,1 т. п., содержащий помеченную 5' последовательность из линии 1164, клонируют перед барназой, геном РНКазы, полученным из Bacillus amyloliquefaciens для создания растений, резистентных к "оседлым" растительным нематодам. Геномный продукт получают в результате скрининга 400000 клонов из геномной библиотеки экотипа С24 Arabidopsis с продуктом iPCR, 1164 (см. Пример 3). Из одного из гибридизирующихся клонов выделяют EcoRI фрагмент 4 т.п. и субклонируют его в мультикопийную плазмиду pKS (Stratagene). Анализ последовательности показывает, что этот клон содержит 2,1 т.п. 5' последовательности до инсерции Т-ДНК в линии 1164 и 1,9 т.п. 3' последовательности.
Для восстановления точного контекста последовательности перед кодирующим участком GUS SnaBI фрагмент 546 п. о. из pMOG 849, охватывающий слияние промотора GUS, клонируют в SnaBI сайт геномного клона. Фрагмент HindIII 2325 п. о. выделяют из полученного клона, содержащего полную помеченную 5' последовательность из геномного субклона EcoRI. Этот фрагмент клонируют перед геном барназы в конструкции pFL8 (описанной ниже), образуя клон pFL15.
Фрагмент, содержащий участок, кодирующий барназу, амплифицируют полимеразной цепной реакцией на ДНК рМТ416 (Hartley, sub), используя праймеры 5' CGGACTCTGGATCCGGAAAGTG 3' (SEQ ID NO: 12) и 5' CTGCTCGAGCCTAGGCACAGGTTATCAACACGTTTG 3' (SEQ ID NO: 13). Эти праймеры вводят фланкирующие сайты рестрикции BamHI и XhoI для облегчения клонирования фрагмента. Фрагмент клонируют во множественный клонирующий сайт в векторе, содержащем ген barstar под контролем промотора Tag (необходимого для преодоления токсичности барназы в бактериях). Для устранения токсичности экспрессии барназы на последующих стадиях клонирования в сайт StyI инсерцируют интрон ST-LS1. В трансляционном инициирующем кодоне барназы создают сайт NcoI рекомбинантной полимеразной цепной реакцией, используя праймеры 5' CGGACTCTGGATCCGGAAAGTG 5' (SEQ ID NO: 14) и 5' CTTACTCGAGCCATGGTAAGTTTCTGC 3' (SEQ ID NO: 15), приводящие к образованию pOG16.1. Нетранслированную 5' последовательность барназы далее модифицируют для придания ей сходства с соответствующей последовательностью в первоначальной линии pMOG 553#1164 путем отжига следующих нуклеотидов 5' GATCTAGACTCGAGAAGCTTGGATCCCCGGGTAGGTCAGTCCCC 3' (SEQ ID NO: 16) и 5' CATGGGGGACTGACCTACCCGGGGATCCAAGCTTCTCGAGTCTA 3' (SEQ ID NO: 17) и лигирования полученного адаптера между сайтом ВglII и сайтом HcoI pOG16.1, приводящим к образованию клона pFL8. Адаптер вводит 5' сайт HindIII по отношению к кодирующему участку барназы, используемый для инсерцирования промотора 1164, приводящего к образованию pFL15. Кроме того, эта процедура приводит к обмену с помощью адаптера фрагмента, содержащего промотор Tag и гена barstar.
Пример 9
Конструирование rolD-B
Конструкция pFL11 содержит в бинарном векторе химерный ген barstar. Эту конструкцию клонируют следующим образом. Кодирующий участок barstar находится в HindIII/BamHI фрагменте, в конструкции рМТ316 (Hartley (1988) J. Mol. Biol. 202, 913-915). Сайт HindIII превращают в сайт BamHI, лигируя в этот сайт саморенатурирующийся адаптер 5' AGCTCGGATCCG 3' (SEQ ID NO: 18). Затем полученный фрагмент BamHI клонируют между двойным усиленным промотором СаМ V 35S и терминатором синтазы нопалина в кассетте экспрессии pMOG 180, описанной в WO 93/10251, приводящей к образованию pOG30. Используя адаптер 5' GGCTGCTCGAGC 3' (SEQ ID NO: 19), сайт HindIII на конце 3' терминатора синтазы нопалина превращают в сайт XhoI, a сайт EcoRI на 5' конце промотора превращают в сайт HindIII, используя адаптер 5' AATTGACGAAGCTTCGTC 3' (SEQ ID NO: 20). Затем промотор 35S замещают промотором из гена RolD Agrobacterium rhizogenes. Этот промотор вырезают в виде фрагмента HindIII/BamHI из конструкции pDO2, получаемой от F. Leach (Leach and Aoyagi (1991) Plant Sci. 79, 69-76). Из полученного клона pOG38 вырезают ген barstar, включая промотор и терминатор путем гидролизации HindIII и XhoI и клонируют в соответствующие сайты полилинкера в pMOG 800, что приводит к получению pFL11.
Наконец химерный ген 1164 промотор барназы отщепляют от pFL15 в виде EcoRI фрагмента и клонируют в уникальный EcoRI сайт pFL11 между геном barstar и геном-маркером NptII в тандемной ориентации, что приводит к получению pMOG 893.
Пример 10
Трансформирование картофельных растений с помощью pMOG 893 и проверка на повышенную резистентность против Globodera pallida
Бинарный вектор pMOG 893 активируют по отношению к Agrobacterium tumefaciens и полученный штамм используют для трансформирования клубневых кружочков из культурного сорта картофеля Kardal, как описано в экспериментальной части. В целом получают 98 трансгенных линий. Эти линии размножают вегетативным способом, разрезая побеги на сегменты, содержащие по крайней мере один узел, и образуя корни in vitro. На линии проверяют 15 растений на повышенную резистентность к Globodera pallida, как описано в Экспериментальной части. Ожидается, что картофельные растения, трансформированные с помощью pMOG 893, содержащей конструкцию барназа/барстар, окажутся менее восприимчивыми к Globodera pallida благодаря экспрессии барназы, индуцированной нематодами, внутри (развивающейся) нематодной питающей структуры.
Вышеприведенные примеры служат лишь для иллюстрации данного изобретения, а не для его ограничения. Многочисленные модификации, которые могут быть легко осуществлены специалистами в данной области, входят в объем данного изобретения.



























Фрагменты ДНК могут быть использованы в селекции растений. Введение промоторных фрагментов ДНК, способных стимулировать индуцируемую нематодами узелково-корневую и кистозную транскрипцию связанных с ними последовательностей ДНК, в растение повторно позволяет придать широкому кругу растений устойчивость к нематодам. 5 с. и 11 з.п. ф-лы, 8 ил., 4 табл.
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
Авторы
Даты
2003-02-10—Публикация
1996-06-04—Подача