Изобретение относится к производным глюкагоноподобного пептида 1 /GLP-1/, укороченному /truncated/ GLP-1, инсулинотропину и укороченному инсулинотропину. Точнее, настоящее изобретение относится к производным GLP-1, укороченного GLP-1, инсулинотропина и укороченного инсулинотропина, и к их фармацевтически приемлемым солям, которые имеют pI /изоэлектрическую точку/ около 4 или меньше, или pI около 7,0 или больше. Производные GLP-1, укороченного GLP-1, инсулинотропина и укороченного инсулинотропина в пределах объема охраны настоящего изобретения пригодны, в частности, для введения млекопитающим посредством лекарственного электрофореза. Производные настоящего изобретения обладают инсулинотропной активностью и пригодны для усиления действия инсулина у млекопитающих. Способы лечения настоящего изобретения включают введение млекопитающему эффективного количества производного GLP-1, укороченного GLP-1, инсулинотропина или укороченного инсулинотропина. Кроме того, настоящее изобретение относится к фармацевтическим композициям, содержащим упомянутые производные GLP-1, укороченного GLP-1, инсулинотропина и укороченного инсулинотропина. И еще, кроме того, настоящее изобретение относится к новому применению некоторых известных производных инсулинотропина и укороченного инсулинотропина для усиления действия инсулина у млекопитающих при введении таких производных посредством лекарственного электрофореза.
Предпосылки создания изобретения
Известно, что аминокислотная последовательность GLP-1 имеет вид
His-Asp-Glu-Phe-Glu-Arg-His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val- Ser-Ser-Tyr-Leu-Glu-Gly-Cln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly- Arg-Gly (последовательность N 1).
GLP-1 раскрывается в работах Lopez, L. C., et al., P.N.A.S., USA  5485-5489 (1983); Bell, G.I., et al., Nature
5485-5489 (1983); Bell, G.I., et al., Nature 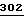 716-718 (1983); Heinrick, G., et al., Endocrinol.
716-718 (1983); Heinrick, G., et al., Endocrinol. 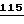 2176-2181 (1984), и Ghiglione, M., et al., Diabetolodia
2176-2181 (1984), и Ghiglione, M., et al., Diabetolodia 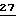 599-600 (1984).
599-600 (1984).
Известно, что в естественных условиях P-1 превращается в пептид, содержащий 31 аминокислоту, с аминокислотами 7-37 P-1 (7-37). Этот процессинг, как сообщается, происходит в поджелудочной железе и в кишечнике. Пептид 7-37, называемый здесь иначе инсулинотропин, представляет собой гормон, который обладает инсулинотропной активностью.
Инсулинотропин имеет следующую аминокислотную последовательность:
His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Tyr-Leu-Glu-Gly-Cln- Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Arg-Gly (Последовательность N 2).
Инсулинотропин, некоторые его производные и их применение для лечения сахарного диабета у млекопитающих раскрываются в заявке по договору о патентной кооперации PCT/US 87/01005 /ИОИС 87/ 06941/, опубликованной 19 ноября 1987 г. Материалы этой заявки включены в настоящее описание в качестве ссылки. Производные инсулинотропина, раскрытые в PCT/US 87/01005, включают полипептиды, которые содержат, или в которых отсутствуют, одна или несколько аминокислот, которые не могут присутствовать во встречающейся в природе последовательности. Кроме того, производные инсулинотропина, раскрываемые в PCT/US 87/01005, включают некоторые C-концевые соли, сложные эфиры и амиды, из которых соли и сложные эфиры определяются как OM, где M является фармацевтически приемлемым катионом или низшей (C1-C6) разветвленной или неразветвленной алкильной группой, а амиды определяются как - NH2R3, где R2 и R3 являются одинаковыми или различными, и выбираются из группы, состоящей из водорода и низшей (C1-C6) разветвленной или неразветвленной алкильной группы.
Некоторые другие полипептиды, отнесенные здесь иначе к укороченному инсулинотропину, обладающему инсулинотропной активностью и его производные раскрываются в PCT/US 89/01121 /ВОИС 90/11296/. Эти полипептиды, названные GLP-1/7-36/, GLP-1/7-35/ и GLP-1/7-34/ имеют указанные далее аминокислотные последовательности соответственно
His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly- Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Arg (SEQUENCE ID NO: последовательность 3);
His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly- Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly (SEQUENCE ID NO: последовательность 4);
His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly- Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys (SEQUENCE ID NO: последовательность 5).
Производные полипептидов, раскрываемые в PCT/US 89/01121, включают полипептиды, имеющие несущественные замены аминокислот или дополнительные аминокислоты для усиления присоединения к белку-носителю или для усиления их инсулинотропного действия. Другие производные инсулинотропина, раскрываемые в PCT/US 89/01121, включают некоторые C-концевые соли, сложные эфиры и амиды, из которых соли и сложные эфиры определяются как OM, где M представляет собой фармацевтически приемлемый катион или низшую разветвленную или неразветвленную алкильную группу, а амиды определяются как -NR2R3, где R2 и R3 являются одинаковыми или различными, и выбираются из группы, состоящей из водорода и низшей алкильной разветвленной или неразветвленной группы.
Введение терапевтически эффективных полипептидов млекопитающим представляет некоторые трудности, хорошо известные специалистам в этой области техники. Оральное введение полипептида без некоторых приспособлений для введения будет, как правило, безуспешным вследствие низкой, присущей от природы, проницаемости кишечника и других процессов, таких как химическое расщепление в желудке и кишечнике. Трансдермальное введение полипептидов создает возможность обеспечения млекопитающего терапевтически эффективными полипептидами, не подвергая полипептиды расщеплению в желудочно-кишечном тракте. Специалистам известны различные подходы к трансдермальному введению фармацевтически активных соединений. Одним из таких способов трансдермального введения является способ, известный специалистам в этой области техники как лекарственный электрофорез.
Лекарственный электрофорез включает приложение к коже градиента электрического потенциала в сочетании с одновременным нанесением на поверхность лекарственных средств. Для выполнения лекарственного электрофореза, кроме емкости с лекарственным препаратом и источника тока, требуются два электрода. Различные типы приборов для лекарственного электрофореза описаны Tyle, P., в Pharmaceutical Research 3: 318-326 (1986). Пример электрода для применения при лекарственном электрофорезе раскрывается в патенте США N 4950229, который включен в настоящее описание в качестве ссылки. Результатом лекарственного электрофореза является перенос лекарственных средств через кожу - системный или в определенное место. Кроме того, известно, что лекарственный электрофорез включает различные схемы приложения напряжения, включая такие способы, как электрофорез или технические приемы с пульсирующим током.
Электрический ток небольшой величины применяют для трансдермального введения лейпролида, синтетического аналога гормона, высвобождающего лютеинизирующий /leutinizing/ гормон с 9 аминокислотами. - Meyer, B.R., et al., Clin. Rharmacol. Ther 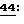 607-612 (1988). Сообщается об исследованиях введения инсулина крысам лекарственным элекетрофорезом. - Siddiqui, O., et al., J. Pharmaceutical Sciences
607-612 (1988). Сообщается об исследованиях введения инсулина крысам лекарственным элекетрофорезом. - Siddiqui, O., et al., J. Pharmaceutical Sciences  341-345 (1987). Сообщается об исследованиях по введению лекарственным электрофорезом гормона, высвобождающегося гонадотропин, и гормона, высвобождающего тиротропин. - Мiller, L.L., et al., I. Pharmaceutical Sciences
341-345 (1987). Сообщается об исследованиях по введению лекарственным электрофорезом гормона, высвобождающегося гонадотропин, и гормона, высвобождающего тиротропин. - Мiller, L.L., et al., I. Pharmaceutical Sciences  490-493 (1990) Burnette, R.R., et al., I. Pharmaceutical Sciences
490-493 (1990) Burnette, R.R., et al., I. Pharmaceutical Sciences  738-743 (1986). Сообщается, что этанол усиливает трансдермальную доставку при лекарственном электрофорезе лейпролида и аналога CCK-8 /холецистокинин-8/. -Srinivasan, V. et al., I. Pharmaceutical Sciences
738-743 (1986). Сообщается, что этанол усиливает трансдермальную доставку при лекарственном электрофорезе лейпролида и аналога CCK-8 /холецистокинин-8/. -Srinivasan, V. et al., I. Pharmaceutical Sciences  588-591 (1990).
588-591 (1990).
Настоящее изобретение относится к полипептидным производным глюкагоноподобного пептида 1 /GLP-1 и укороченного GLP-1, включающих первичную структуру
H2N - W - COOH,
где W представляет собой аминокислотную последовательность, выбираемую из группы, состоящей из последовательности ID N 1 и последовательности ID N 6.
His-Asp-Glu-Phe-Glu-Arg-His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser- Ser-Tyr-Leu-Glu-Gly-Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly- Arg-Gly (SEQUENCE ID NO: последовательность 1)
His-Asp-Glu-Phe-Glu-Arg-His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser- Ser-Tyr-Leu-Glu-Gly-Gin-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly- Arg (SEQUENCE ID NO: последовательность 6);
к их фармацевтически приемлемым солям, и такие производные имеют pI около 4,0 или меньше или pI около 7,0 или больше и при переработке млекопитающим дают в результате полипептидные производные, обладающие инсулинотропной активностью.
Настоящее изобретение также относится к полипептидным производным GLP-1 и укороченного GLP-1, описанным выше, включающим первичную структуру
H2N - W - (X)m - (Y)n - Z,
и их фармацевтически приемлемым солям, и в них W имеет установленные выше значения; m равен нулю или единице; n равен нулю или единице; X представляет собой основной или нейтральный остаток L-аминокислоты; Y представляет собой основной или нейтральный остаток L-аминокислоты; и Z представляет собой CO2R1 или CONR2R3, где R1 представляет собой H или (C1-C6)-алкил с линейной или разветвленной цепью, когда m равен единице, n равен нулю и X представляет собой основной остаток L-аминокислоты, или m равен нулю, n равен единице, и Y представляет собой основной остаток L-аминокислоты, или m и n, оба равны единице, и X и Y, один или оба, являются основными остатками L-аминокислоты; R1 представляет собой (C1-C6)-алкил с линейной или разветвленной цепью, когда m и n оба равны нулю, или m равен единице, n равен нулю, и X представляет собой нейтральный остаток L-аминокислоты, или m равен нулю, n равен единице, и Y представляет собой нейтральный остаток L-аминокислоты, или n и n оба равны единице, и X и Y оба представляют собой нейтральные остатки L-аминокислоты; и R2 и R3 каждый представляет собой, независимо, H или (C1-C6)-алкил с линейной или разветвленной цепью.
Кроме того, изобретение также относится к производным полипептидов, включающих первичную структуру.
H2N - R - COOH,
в которой R представляет собой аминокислотную последовательность, выбираемую из группы, состоящей из последовательностей ID N 2, ID N: 3, ID N: 4 и ID N:5.
His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Gln-Ala- Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Arg-Gly (SEQUENCE ID NO: последовательность 2),
His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Gln-Ala- Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Arg (SEQUENCE ID NO: последовательность 3),
His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Ala- Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly (SEQUENCE ID NO: последовательность 4)
His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Ala- Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys (SEQUENCE ID NO: последовательность 5),
и их фармацевтически приемлемым солям, и эти производные имеют pI около 4,0 или меньше или pI около 7,0 или больше и обладают инсулинотропной активностью, при условии, что упомянутые производные не являются C-концевыми сложными эфирами с (C1-C6)-алкилом с линейной или разветвленной цепью, и также при условии, что упомянутые производные не являются C-концевыми карбоксамидами формулы CONR2R3, где каждый из R2 и R3, независимо, представляет собой H или (C1-C6)-алкил с линейной или разветвленной цепью.
Настоящее изобретение относится также к производным полипептидов, только что описанным выше, содержащим первичную структуру
H2N - R - X - (Y)n - Z
и их фармацевтически приемлемым солям, где R имеет описанные выше значения; n равен нулю или единице; X представляет собой основной или нейтральный остаток L-аминоксилоты; Y представляет собой основной или нейтральный остаток L-аминокислоты; и Z представляет собой CO2 R1 или CONR2R3, где R1 представляет собой H или (C1-C6)-алкил с линейной или разветвленной цепью, когда n равен нулю, и X представляет собой основной остаток L-аминокислоты, или n равен единице, и один или оба X и Y представляют собой основные остатки L-аминокислоты; R1 представляет собой (C1-C6)-алкил с линейной или разветвленной цепью, когда n равен нулю, и X представляет собой нейтральный остаток L-аминокислоты, или равен единице, и X и Y оба представляют собой нейтральные остатки L-аминокислоты; и R2 и R3 каждый независимо, представляет собой H или (C1-C6)-алкил с линейной или разветвленной цепью.
Предпочтительными производными настоящего изобретения являются производные, имеющие pI 8,5 или больше. Другими предпочтительными производными таких полипептидов являются производные, в которых R представляет собой
His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly- Cln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Arg-Gly /последовательность ID N: 2/.
Даже более предпочтительными являются такие производные, в которых R представляет собой
His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Clu-Gly-Gln-Ala- Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Arg-Gly /последовательность ID N: 2/; n равен нулю и X представляет собой Arg, или n равен единице, а X и Y каждый представляет собой Arg. Еще более предпочтительными производными являются такие предпочтительные производные, в которых Z представляет собой CO2R1, R1 представляет собой H, или Z представляет собой CONR2R3 и каждый из R2 и R3 представляет собой H.
Настоящее изобретение также относится к способам усиления действия инсулина у млекопитающего, которые включают введение упомянутому млекопитающему эффективного количества производного, соответствующего настоящему изобретению. Предлагаемый способ усиления инсулина по настоящему изобретению включает лечение диабета типа II. Предпочтительным способом введения таких производных является трансдермальное введение лекарственным электрофорезом.
Кроме того, настоящее изобретение относится к способу усиления действия инсулина у млекопитающего, который включает введение лекарственным электрофорезом упомянутому млекопитающему эффективного количества производного полипептида, содержащего первичную структуру
H2N - R - (X)m - (V)n - Z,
в которой R представляет собой аминокислотную последовательность, выбираемую из группы, состоящей из последовательности ID N: 2, последовательности ID N: 3, последовательности ID N 4 и последовательности ID N 5
His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Gln- Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Arg-Gly (SEQUENCE ID NO: последовательность 2),
His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Glh-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Arg (SEQUENCE ID NO: последовательность 3),
His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly- Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly (SEQUENCE ID NO: последовательность 4)
His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu- Gly-Gln-Ala-Ala-Lys-Glu-Phe-Ile-Trp-Leu-Val-Lys (SEQUENCE ID NO: последовательность 5)
и его фармацевтически приемлемых солей, при этом m равен нулю или единице; n равен нулю или единице; X представляет собой основной или нейтральный остаток L-аминоксилоты; Y представляет собой основной или нейтральный остаток L-аминокислоты и Z представляет собой CO2R1 или CONR2R3, где R1 представляет собой H или (C1-C6)-алкил с линейной или разветвленной цепью, когда m равен единице, n равен нулю, и X представляет собой основной остаток L-аминоксилоты, или m равен нулю, n равен единице и Y представляет собой основной остаток L-аминоксилоты, или m и n оба равны единице, а X и Y - один из них или оба - представляют собой основные остатки L-аминоксилоты; R1 представляет собой (C1-C6)-алкил с линейной или разветвеленной цепью, когда m и n оба равны нулю, или m равен единице, n равен нулю и X представляет собой нейтральный остаток L-аминокислоты, или m равен нулю, n равен единице и Y представляет собой нейтральный остаток L-аминоксилоты, или m и n оба равны единице, X и Y оба представляют собой нейтральные остатки L-аминоксилоты; R2 и R3 каждый представляет собой, независимо, H или (C1-C6)-алкил с линейной или разветвленной цепью.
Производные настоящего изобретения также могут применяться в сочетании с другими лечебными средствами, такими как другие противодиабетические средства (например, с сульфонилмочевинами).
Предлагаемый способ введения лекарственным электрофорезом производного полипептида, как только что упоминалось, включает введение методом лекарственного электрофореза упомянутого производного, в котором R представляет собой
His-Ala-Glu-Gly-Thr-PheThr--Ser-Asp-Val-Ser-Ser-Tyr-Leu-Clu-Cly- Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Arg-Gly /последовательность ID N: 2/;
m равен нулю и n равен нулю,
и еще более предпочтительный способ включает упомянутый способ, когда Z представляет собой CONR2R3, а R2 и R3 каждый являются H.
Настоящее изобретение также относится к фармацевтическим композициям, содержащим производные полипептидов, соответствующие настоящему изобретению. Такие фармацевтические композиции пригодны для усиления действия инсулина на млекопитающих. Таким образом, фармацевтические композиции настоящего изобретения являются особенно подходящими для лечения некоторых диабетических состояний, таких как диабет типа II.
Термин "производное", который используется в настоящем описании и в прилагаемой формуле изобретения, включает (но не ограничивается) полипептиды, содержащие показанную первичную структуру, при этом в ее C-конец включаются одна или несколько L-аминокислот, в которых C-концевые карбоксильные группы образуют сложные эфиры с (C1-C6)-алкильной линейной разветвленной группой; в которых C-концевая карбоксильная группа образует карбоксамид или замещенный карбоксамид; в которых аминокислотные остатки /Asp и/или Glu/ образуют сложный эфир или карбоксамид; и их сочетания.
Термин "основной остаток L-аминоксилоты", который используется в настоящем описании и в прилагаемой формуле изобретения, включает (но не ограничивается) остатки обычных аминокслот - Lys, Arg и His.
Термин "нейтральный остаток L-аминоксилоты", который используется в настоящем описании и в прилагаемой формуле изобретения, включает (но не ограничивается ими) Ala, Val, Leu, Ile, Pro, Met, Phe, Trp, Gly, Ser, Thr, Cys, Tyr, Asn и Glu.
Хотя Gly формально не является остатком L-аминоксилоты, благодаря присутствию у α-углерода, кроме карбоксильной и аминогрупп, только водорода, здесь он относится к L-аминокислотным остаткам для простоты.
Упомянутая выше классификация остатков L-аминокислот как основных или нейтральных основывается на полном заряде соответствующей аминокислоты при pH 7,0.
Используемый в настоящем описании и прилагаемой формуле изобретения термин "pI" относится к теоретической pI, которую вычисляют, используя коммерческий мягкий продукт /Soft-ware/, известный как PCGENE /Intelli Genetics, Inc., 700 East E1 Camino Real, Mountain View, CA 94040/.
В объем охраны настоящего изобретения включаются полипептиды, гомологичные полипептидам, описанным выше, когда гомология является достаточной для придания таким полипептидам инсулинотропной активности. В объем настоящего изобретения также включают незначительные замены аминокислот и имеют инсулинотропную активность.
Фраза "усиление действия инсулина", которая используется в настоящем описании и прилагаемой формуле изобретения, включает (но не ограничивается) одно или несколько явлений из числа увеличения синтеза инсулина, увеличения секреции инсулина, увеличения поглощения глюкозы мышцами и жировой клетчаткой и снижение выработки глюкозы печенью.
Полипептиды настоящего изобретения получают различными способами, хорошо известными специалистам в этой области техники. Например, полипептиды могут быть синтезированы с применением автоматических синтезаторов пептидов, таких как твердофазный синтезатор пептидов Applied Biosystems /ABI/ 430A. С другой стороны, полипептиды настоящего изобретения, в которых Z представляет собой CO2H, могут быть получены с применением технологии рекомбинантных ДНК, когда ДНК-последовательность, кодирующую полипептид, соединяют с вектором экспрессии и используют для трансформации соответствующей клетки-хозяина. Трнасформированную клетку-хозяина затем культивируют в условиях, при которых будет экспрессироваться полипептид. Затем полипептид извлекают из культуры. Кроме того, можно использовать сочетание синтеза и технологии рекомбинантных ДНК, чтобы получить амидные и эфирные производные настоящего изобретения, и/или получить фрагменты нужного полипептида, некоторые затем соединяют способами, хорошо известными специалистам в этой области техники.
Производные полипептидов, соответствующих настоящему изобретению, получают способами, хорошо известными специалистам в этой области техники. Например, C-концевые алкилэфирные производные полипептидов настоящего изобретения получают путем взаимодействия нужного (C1-C6)-алканола с нужным полипептидом в присутствии кислотного катализатора, такого как HCl. Подходящие условия реакции для образования такого алкилэфира включают температуру реакции около 50oC и время реакции от 1 до 3 часов. Подобным образом могут быть получены производные полипептидов настоящего изобретения, содержащие в полипептиде сложные (C1-C6)-алкилэфиры остатков Asp и/или Glu.
Получение карбоксамидных производных полипептидов настоящего изобретения также осуществляют методами твердофазного синтеза пептидов, хорошо известными специалистам в этой области техники. См., например Solid Phase Peptide Synthesis, Stewart, J.M.,et al., Pierce Chem. Co. Press. 1984. Когда требуются производные полипептидов по настоящему изобретению, имеющие pI 4,0 или меньше, такие производные могут быть получены различными способами, хорошо известными специалистам в этой области техники. Например, деамидирование глутаминового остатка с образованием остатка глутаминовой кислоты, алкилирование или амидирование свободных аминогрупп на N-концах и/или в эпсилон-аминогруппах лизиновых остатков, или сочетание этих способов, будут давать в результате производные, имеющие низкие значения pI. Чтобы снизить pI производного инсулинотропина до величины менее 3,89, необходимо осуществить модификацию любых двух подходящих аминогрупп, или модификацию по крайней мере одной аминогруппы, и деамидирование глутамина. Деамидирование глутаминовых остатков легко осуществляется путем суспендирования нужного полипептида настоящего изобретения в воде при pH свыше 8 в течение нескольких часов.
Например, в зависимости от pH реакции, ацетилирование инсулинотропина при основных условиях может дать производное, в котором имеет место амидирование как N-концевой аминогруппы, так и эпсилон-аминогруппа. Результатом является производное с теоретической pI, 3,61. С другой стороны, N-концевое ацетилирование в сочетании с деамидированием только глутаминового остатка инсулинотропина до остатка глутаминовой кислоты дает производное с теоретической pI 4,11.
В качестве альтернативного способа уменьшения pI может быть использовано взаимодействие циклического ангидрида с полипептидом для блокирования основного остатка и введения кислотного остатка. В качестве примера, но не ограничения, можно упомянуть, что раствор инсулинотропина /последовательность 1D N:2/в ДМФА в присутствии 8 эквивалентов триэтиламина и 8 эквивалентов янтарного ангидрида дает производное инсулинотропина с N-сукцинатными группами у N-концов и остатков Lys20 и Lys28.
С другой стороны или в сочетании с упомянутым выше, производные полипептидов настоящего изобретения могут быть получены путем модификации ДНК-кодирующей последовательности такого полипептида таким образом, что основной аминокислотный остаток заменяется кислотным или нейтральным аминокислотным остатком, или нейтральный аминокислотный остаток замещается кислотным аминокислотным остатком. Такие изменения первичной полипептидной последовательности могут быть также осуществлены путем прямого синтеза производного. Такие способы хорошо известны специалистам в этой области техники. Конечно, такие производные, чтобы быть полезными для практического применения настоящего изобретения, должны обладать инсулинотропным действием.
Инсулинотропную активность полипептидного производного настоящего изобретения, когда упомянутый полипептид не содержит аминокислот с 1 до 6 GLP-1, или укороченного GLP-1, определяют следующим образом.
Панкреатические островки выделяют из панкреатической ткани обыкновенных крыс модифицированным способом Lacy P.E. и др., Diabetes, 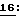 35-39 (1967), при котором коллагеназный перевар панкреатической ткани разделяют на градиенте Ficoll /27%, 23%, 20,5% и 11% в сбалансированном солевом растворе Хэнкса pH 7,4/. Островки собирают в промежутке 20,5% - 11%, промывают и вручную освобождают от экзокринной и других тканей под стереоскопическим микроскопом. Островки инкубируют в течение носи в среде RPM1 1640 с добавлением 10% фетальной коровьей сыворотки и содержащей 11 мМ глюкозы, при 37oC в воздушной среде с добавлением CO2 /95% воздуха, 5% CO2/. Островки затем переносят в среду RPM1 1640 с добавлением 10% фетальной коровьей сыворотки и содержащую 5,6 мМ глюкозы. Островки инкубируют в течение 60 минут при 37oC и в атмосфере 95% воздуха с 5% CO2. Полипептидное производное, которое исследуют, готовят в виде препараторов с концентрацией 1 нМ и 10 нМ в среде PM1, содержащей 10% фетальной коровьей сыворотки и 16,7 мМ глюкозы. От 8 до 10 отдельных островков затем переносят пипеткой в общий объем в 250 мкл среды, содержащей полипептидное производное, в 96-луночные микротитровальные планшеты. Островки инкубируют в присутствии полипептидного производного при 37oC в атмосфере 95% воздуха и 5% CO2 в течение 90 минут. Затем собирают аликвоты среды, свободной от островков, и 10 мкл ее проверяют на количество присутствуюбщего инсулина с помощью радиоиммунного анализа, используя Equate Insulin RIA Kit/Binax, Inc., Portland, ME/.
35-39 (1967), при котором коллагеназный перевар панкреатической ткани разделяют на градиенте Ficoll /27%, 23%, 20,5% и 11% в сбалансированном солевом растворе Хэнкса pH 7,4/. Островки собирают в промежутке 20,5% - 11%, промывают и вручную освобождают от экзокринной и других тканей под стереоскопическим микроскопом. Островки инкубируют в течение носи в среде RPM1 1640 с добавлением 10% фетальной коровьей сыворотки и содержащей 11 мМ глюкозы, при 37oC в воздушной среде с добавлением CO2 /95% воздуха, 5% CO2/. Островки затем переносят в среду RPM1 1640 с добавлением 10% фетальной коровьей сыворотки и содержащую 5,6 мМ глюкозы. Островки инкубируют в течение 60 минут при 37oC и в атмосфере 95% воздуха с 5% CO2. Полипептидное производное, которое исследуют, готовят в виде препараторов с концентрацией 1 нМ и 10 нМ в среде PM1, содержащей 10% фетальной коровьей сыворотки и 16,7 мМ глюкозы. От 8 до 10 отдельных островков затем переносят пипеткой в общий объем в 250 мкл среды, содержащей полипептидное производное, в 96-луночные микротитровальные планшеты. Островки инкубируют в присутствии полипептидного производного при 37oC в атмосфере 95% воздуха и 5% CO2 в течение 90 минут. Затем собирают аликвоты среды, свободной от островков, и 10 мкл ее проверяют на количество присутствуюбщего инсулина с помощью радиоиммунного анализа, используя Equate Insulin RIA Kit/Binax, Inc., Portland, ME/.
Фармацевтические композиции, содержащие полипептидные производные, соответствующие настоящему изобретению, могут быть приготовлены в соответствии со способами, хорошо известными специалистам в этой области техники. Например, полипептидные производные могут быть соединены с фармацевтически приемлемым разбавителем или носителем. Когда полипептидные производные настоящего изобретения должны вводиться внутривенно, внутримышечно или подкожно, используют подходящий стерильный разбавитель, как это хорошо известно в технике. Такие фармацевтические композиции будут содержать достаточное количество полипептидного производного с тем, чтобы можно было вводить подходящие дозы, как описано ниже, в течение подходящего периода времени.
Для доставки полипептидного производного по изобретению методом лекарственного электрофореза могут быть приготовлены различные композиции. Полипептидное производное может быть включено в раствор или являться частью геля или пены. Предпочтительно, чтобы полипептидное производное в таких композициях имело тот же самый, или приблизительно тот же самый заряд, какой имеет электрод в емкости для лекарственного препарата прибора для лекарственного электрофореза, который используется. Заряд производного может быть отрегулирован, например, путем применения подходящего буфера. При применении буфера предпочтительно использовать буфер, который имеет заряд, противоположный заряду конкретного полипептидного производного, которое вводят. С другой стороны, полипептидное производное само может действовать как собственный "буфер", если используется его подходящая солевая форма. К переменным в таких композициях относятся концентрация полипептидного производного, концентрация буфера, когда он присутствует, ионная сила композиции и неводные сорастворители. Вообще, чтобы достичь наивысшей эффективности переноса методом лекарственного электрофореза в случае таких композиций, предпочтительно в таких композициях свести к минимуму концентрацию всех видов ионов, за исключением полипептидного производного. Корректировка таких концентраций является делом специалистов в этой области техники, и облегчается данным описанием.
Известны различные приборы для лекарственного электрофореза. Известны и доступны различные материалы для электродов для применения в таких приборах. Такие электроды включают электроды, изготовленные из пластины или серебра и хлорида серебра. Известно, что различия между электродами ассоциируются с некоторыми оттенками рабочих характеристик. Например, применение платиновых электродов вызывает гидролиз, ведущий к освобождению ионов водорода и последующим изменениям pH. Изменения pH, в свою очередь, могут влиять на ионизованное состояние полипептидного производного и, таким образом, на результат его переноса при лекарственном электрофорезе. Электроды из серебра и хлорида серебра, с другой стороны, не гидролизуют воду, когда применяются в приборах для лекарственного электрофореза. Такие электроды из серебра и хлорида серебра, однако, требуют присутствия хлорид-ионов, которые могут конкурировать при индуцированном током переносе через кожу. Выбор подходящего электрода для применения при лекарственном электрофорезе полипептидных производных, соответствующих настоящему изобретению, является делом специалистов, работающих в этой области техники и облегчается настоящим описанием.
Кроме того, для количественной оценки переноса лекарственным электрофорезом полипептидных производных и композиций настоящего изобретения могут быть использованы способы с применением полос из свиной кожи /porcine skin flap/ как это описано у Riviere, J.E., и др., в J.Toxicol.-Cut. & Okular Toxicol.  493-504 (1989-1990).
493-504 (1989-1990).
Дозы эффективные для лечения взрослых при начале диабета, будут находиться в интервале от 1 пг/кгт до 1000 мкг/кг в день, когда полипептидное производное настоящего изобретения вводят внутривенно, внутримышечно или подкожно. Предпочтительный дозировочный интервал для внутривенного вливания во время и между приемами пищи составляет от 4 до 10 нг/кг/мин, или от 0,6 до 1,4 мкг/день на 100 кг веса пациента. Следует принять во вниманием, однако, что возможны дозировки вене указанного интервала, и они также входят в объем настоящего изобретения. Соответствующая кодировка может и будет определяться предписаниями лечащего врача, и будет являться результатом тяжести состояния, которое лечится, а также откликом, получаемым на введение производного, и возрастом, весом, полом и историей болезни пациента. Для введения полипептидного производного по настоящему изобретению лекарственным электрофорезом дозировочный интервал составляет от 500 до 1000 мкг в день. В этом случае также возможны дозировки выходящие за указанный интервал, и они входят в объем настоящего изобретения.
Пример 1
H2N-R-X-(Y)n-Z, в котором n равен нулю; X представляет собой Arg:Z представляет собой CONR2R3, где R2 и R3 представляют собой H; и R представляет собой His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Ttr-Leu-Glu-Gly-Gln- Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lts-Gly-Arg-Gly /последовательность ID N:2/.
Названный в заготовке пептид синтезируют, исходя из n метилбензгидриламиновой /HCl-соль/ смолы, используя твердофазный синтезатор пептидов Applied Biosystems /ABI/ 430A [произв., адрес], с применением циклов ABI версии, 1,40 для N-метилпирролидона и трет-БОК-гидроксибензотриазола. Конечный цикл выбирают для удаления первичной защитной трет-БОК-группы при завершении синтеза. Боковые аминокислотные цепи защищают следующим образом: Arg (Tos), Lys (Cl-Z), Trp(CHO), Glu(OCyHex), Tyr (Br-Z), Ser(Bzl), Thr(Bzl), Asp(OCyHex), His(BOM). Используемые циклы синтеза являются циклами, предлагаемыми AB, со следующими изменениями: время доставки гидроксибензотриазола к измеряющей петле /measuring loop/ увеличивают с 6 секунд до 10 секунд, чтобы обеспечить его воспроизводимую и надлежащую доставку; и время доставки гидроксибензотриазола в активатор увеличивают от 12 секунд до 18 секунд. Чтобы предотвратить засорение оборудования, вызванное парами, выделяющимися из сосуда с уксусным ангидридом, изменяют периодическую работу с реакционным сосудом, подавая избыточное давление на клапан, связанный с этим узлом, после каждой подачи уксусного ангидрида. Циклический активатор ABOC11 применяют для активации Glu взамен обычно применяемого ABOC12. После удаления последней N-концевой трет-БОК-группы получают в целом 2,65 г пептидосодержащей смолы. Затем из Trp-остатка удаляют формильную защитную группу путем обработки пептидосодержащей смолы в течение 1 часа осторожным встряхиванием ее в растворе, содержащем 2 мл H2O. 2 мл 70% раствора этаноламина в метаноле и 16 мл диметилформамида. Затем смолу отфильтровывают, тщательно промывают диметилформамидом /3х10 мл/, метанолом /3х10 мл/ и дихлорметаном /3х10 мл/. Промытую смолу сушат под вакуумом, и получают 2,48 г смолы.
Чтобы извлечь пептид из смолы, 997 мг высушенной смолы обрабатывают жидким фтористым водородом (10% раствор в м-крезоле) при 0oC в течение 1 часа. Затем фтористый водород удаляют испарением, и пептид растворяют в трифторуксусной кислоте. Пептид затем осаждают, применяя этиловый эфир, и получают 430 мг пептида в виде белого твердого вещества. Данные аналитической HPLC /высокоэффективной жидкостной хроматографии/ свидетельствуют о неполном удалении защищающей Trp формильной группы из пептида. Чтобы удалить оставшиеся защитные формильные группы, 40 мг пептида растворяют в смеси 3,6 мл H2O и 0,4 мл 70% этаноламина в метаноле. Получающийся в результате раствор оставляют стоять при комнатной температуре в течение 30 минут. Затем добавляют 0,35 мл трифторуксусной кислоты, и осадок собирают центрифугированием /14000 об/мин, 5 мин/. Собранный осадок растворяют в 4,0 мл 6 М гидрохлорида гуанидина и подвергают препаративной HPLC с обращенной фазой на 1-дюймовой /2,54 см/ колонке VYDAC C18, используя градиент 100% → 40%A; 0% → 60%B, в течение 60 мин скорости потока 10 мл/мин /A представляет собой 0,1% трифторуксусной кислоты, 95% H2O и 5% CH3CN, и B представляет собой CH3CN/, и получают 10,5 мг названного в заготовке пептида.
FAB MS: 3511,4 дальтон /макс.недисс. + H расч.: 3511 да/.
Пример 2
H2N-R-X(Y)n-Z, в котором n равен нулю; X представляет собой Arg; Z представляет собой CO2R1, где R1 представляет собой H; R представляет собой His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Cln-Ala- Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Arg-Gly /последовательность 1 N: 2/.
Используя процедуру примера 1, измененную для получения названного в заголовке пептида, получают 2,0 г пептидосодержащей смолы. Обработка 900 мг пептидосодержащей смолы фтористым водородом в соответствии с процедурой примера 1 дает 340 мг пептида после осаждения этиловым эфиром из раствора в трифторукусной кислоте. Затем, как и в примере 1, 1,40 мг пептида обрабатывают водным этаноламином, подкисляют, осаждают и хроматографируют, получают 10 мг названного в заготовке пептида.
FAB MS: 3511,9 да /макс.недисс. + H расч.: 3512 да/.
Пример 3
H2N-R-X(Y)n-, в котором n равен единице; X представляет собой Arg; Y представляет собой arg; Z представляет собой CONR2R3, где R2 и R3 представляет собой H; и R представляет собой His-Ala-Glu-Gly-The-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Cln- Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Arg-Gly /последовательность ID N: 2/
Используя процедуру, описанную в примере 1, измененную, чтобы синтезировать названный в заголовке пептид, получают в целом 1,3 г пептидосодержащей смолы. Обработка 1,3 г пептидсодержащей смолы фтористым водородом в соответствии с процедурой примера 1 дает 671 мг пептида после осаждения из раствора в трифторуксусной кислоте этиловым эфиром. Затем, как и в примере 1, 1,7 мг пептида обрабатывают водным этаноламином, подкисляют, осаждают и подвергают хроматографии, получают 4,2 мг названного в заголовке пептида.
FAB MS: 3667,8 да /макс. недисс. + H расч.: 3667,81 да/.
Пример 4
H2N-R-X(Y)n-Z, в котором равен единице, X представляет собой arg, Y представляет собой arg; Z представляет собой CO2R1, где R1 представляет собой H; и R представляет собой His-Ala-Glu-Gly-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Gln-Ala- Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Arl-Gly /последовательность N: 2/.
Используя процедуру, описанную в примере 1, измененную для синтеза названного в заготовке пептида, получают в целом 2,66 г пептидсодержащей смолы. Обработка 1,1 г пептидсодержащей смолы фтористым водородом в соответствии с процедурой примера 1, получают 490 мг пептида после осаждения из раствора в трифторуксусной кислоте этиловым эфиром. Затем, как и в примере 1, 10 мг пептида обрабатывают водным этаноламином, подкисляют, осаждают и хроматографируют, и получают 3,8 мг названного в заголовке пептида.
FAB M: 3669,1 да /макс. недисс. + H расч.: 3668,83 да/
Пример 5
H2-N-R-COOH, в которой R представляет собой производное His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Gln- Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Arg-Gly /последовательность N: 2/, в котором сукциноилировано N-окончание /N/альфа/ и сукциноилированы эпсилон-аминогруппы обоих остатков Lys.
К раствору 800 мгк /0,24 мкмоль/ инсулинотропина /последовательность ID N: 2/ в 800 мкл диметилформамида /ДМФА/ добавляют последовательность 200 мкг /2,0 мкмоль/ ангидрида янтарной кислоты в 20 мкл ДМФА и 200 мкг /2,0 мкмоль/ триэтиламина в 10 мкл ДМФА. Прозрачный раствор перемешивают в течение трех часов при температуре окружающей среды, и получают единственный основной продукт с помощью анализа HPLC с обращенной фазой, в соответствии со способом примера 1, приблизительно в 9)% выходом /судя по площади пиков HPLC/. К продукту добавляют 10 мл воды, подкисляют трифторуксусной кислотой до pH 2, и лиофилизуют досуха. Лиофилизат растворяют в подвижной фазе HPLC и очищают препаративной HPLC с обращенной фазой, в соответствии со способом примера 1, и получают однородный продукт, который, как показывает масс-спектральный плазменнодесорбционный анализ, представляет собой три-сукциноилзамещенный инсулинотропин.
Ожидаемая масса (M+H): 3656,68 да; найдено: 3658,2 да.
Пример 6
H2N-R-COOH, в которой R представляет собой производное His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Gln-Ala- Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Arg-Gly /последовательность ID N: 2/, которое является шести- или семи-сукциноилированным.
В соответствии со способом примера 5 100 мкг /0,03 мкмоль/, вместо 800 мкг /0,24 мкмоль/, инсулинотропина /последовательность ID N: 2/ вводят во взаимодействие со всеми другими реактивами в количествах, указанных в примере 5, и после перемешивания в течение 16 часов при температуре окружающей среды получают новый продукт /что следует из анализа HPLC/. Продукт, выделенный в соответствии со способом примера 5, как показывает масс-спектральный ES-MS-анализ, представляет собой смесь шести- и семисукциноилированного инсулинотропина. Ожидаемая масса шетисукциноилированного инсулинотропина: 3955,68 да, найдено 3955,9 да. Ожидаемая масса семисукциноилированного инсулинотропина 4055,68 да, найдено 4055,9 да.
Пример 7
H2N-R-COOH, в которой R представляет собой производное His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Gln- Ala-Ala-Lys-Glu-Phe-Ile-Trp-Leu-Val-Lys-Gly-Arg-Gly /последовательность ID N: 2/, в котором деамидируется Gln, давая в результате Glu.
Инсулинотропии /последовательность ID N 2/ /100 мкг/ растворяют в растворе 50 мкл ДМФА, содержащая 20 мкл трицин /tricine/-буфера /pH 8,75/, и перемешивают при 37oC в течение ночи. HPLC, в соответствии со способом примера 1, показывает присутствие нового пика, который, как показано, элюируется вместе с продуктом, полученным в результате синтеза в соответствии с примером 2.
Таким образом, производные полипептида данного изобретения обладают активностью, стимулирующей выделение инсулина.
Список последовательностей
(1) Общие сведения
(i) Заявитель: Andrews, Glenn C.
Daumy, Caston O.
Francoeur, Michael L.
Larson, Eric R.
Pfizer Inc, (Non-US)
(ii) Название изобретения: Глюкагоноподобный пептид и производные инсулинотропина
(iii) Число последовательностей: 6
(iv) Адрес для переписки
(A) Gregg C. Benson, Pfazer Inc
(B) STREET: Eastern Point Road
(C) CITY: Groton
(D) STATE: CT
(E) COUNTRY: USA
(F) ZIP: 06340
(v) Форма компьютерного считывания
(А) Тип среды: дискета
(B) Компьютер: совместимый с IBM PC
(C) Операционная система: PC-DOS/MS-DOS
(D) SOFTWARE: Patent In Release ≠ 1.0, Version ≠ 1.25
(vi) CURRENT APPLICATION DATA:
(A) APPLICATION NUMBER:
(B) FILING DATE:
(C) CLASSIFICATION:
(vii) Сведения о предшествующей заявке:
(A) N заявки: US 07/899,073
(B) Дата регистрации: 15 июня, 1992 г.
(viii) Сведения о доверенном лице:
(A) NAME: Benson, Gregg C.
(B) REGISTRATION NUMBER: 30,997
(C) REFERENCE/DOCKET NIMBER: PC8156AGCB
(ix) Связь:
(A) Телефон: (203) 441-4901
(B) Телефакс: (203) 441-5221
(2) Информация о последовательности SEQ ID NO:1:
(i) Характеристики последовательности
(А) Длина: 37 аминокислот
(В) Тип: аминокислотная
(D) Топология: линейная
(ii) Тип молекулы: пептид
(хi) Описание последовательности: SEQ ID N 1:
(2) Сведения о последовательности SEQ IN N 2:
(i) Характеристики последовательности:
(А) Длина: 31 аминокислота
(В) Тип: аминокислотная
(D) Топология: линейная
(ii) Тип молекулы: пептид
(xi) Описание последовательности SEQ ID N 2: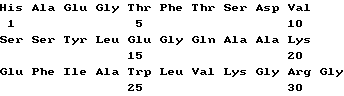
(2) Сведения о последовательности SEQ IN N 3:
(i) Характеристики последовательности
(А) Длина: 30 аминокислот
(В) Тип: аминокислотная
(D) Топология: линейная
(ii) Тип молекулы: пептид
(xi) Описание последовательности SEQ ID N 3: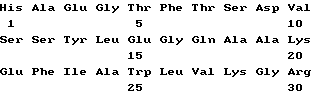
(2) Сведения о последовательности SEQ IN N 4:
(i) Характеристика последовательности:
(А) Длина: 29 аминокислот
(В) Тип: аминокислотная
(D) Топология : линейная
(ii) Тип молекулы: пептид
(xi) Описание последовательности SEQ ID N 4: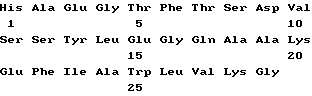
(2) Сведения о последовательности SEQ ID NO:5:
(i) Характеристика последовательности
(А) Длина : 28 аминокислот
(В) Тип : аминокислотная
(D) Топология : линейная
(ii) Тип молекулы: пептид
(xi) Описание последовательности SEQ ID NO:5.
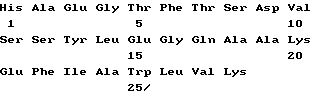
(2) Сведения о последовательности SEQ ID NO:6:
(i) Характеристика последовательности
(А) Длина : 36 аминокислот
(В) Тип : аминокислотная
(D) Топология: линейная
(ii) Тип молекулы: пептид
(xi) Описание последовательности SEQ ID NO:6.
 е
е
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2126264C1 |
| СПОСОБЫ ОБНАРУЖЕНИЯ ФОЛАТНОГО РЕЦЕПТОРА 1 В ОБРАЗЦЕ ПАЦИЕНТА | 2018 |
|
RU2759410C2 |
| РЕКОМБИНАНТНЫЕ МОДИФИЦИРОВАННЫЕ ФАКТОРЫ РОСТА ФИБРОБЛАСТОВ И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2811435C2 |
| ВАРИАНТЫ IgG-FC ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2018 |
|
RU2814952C2 |
| СПЕЦИФИЧНЫЕ К MUC16 ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ И ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2795198C2 |
| ПОЛИПЕПТИДЫ, ЯВЛЯЮЩИЕСЯ РАСТВОРИМЫМИ РЕЦЕПТОРАМИ 3 ФАКТОРА РОСТА ФИБРОБЛАСТОВ (SFGFR3), И ПУТИ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2751483C2 |
| КОНСТРУКЦИИ СЛИТОГО БЕЛКА ДЛЯ ЗАБОЛЕВАНИЯ, СВЯЗАННОГО С КОМПЛЕМЕНТОМ | 2019 |
|
RU2824402C2 |
| ДИСПЛЕЙ ИНТЕГРАЛЬНОГО МЕМБРАННОГО БЕЛКА НА ВНЕКЛЕТОЧНЫХ ОБОЛОЧЕЧНЫХ ВИРИОНАХ ПОКСВИРУСА | 2017 |
|
RU2759846C2 |
| ДОСТАВКА ТЕРАПЕВТИЧЕСКИХ ПОЛИПЕПТИДОВ ПОСРЕДСТВОМ ПСЕВДОТИПИРОВАННЫХ ОНКОЛИТИЧЕСКИХ ВИРУСОВ | 2017 |
|
RU2758007C2 |
| КОНСТРУКЦИИ, ИМЕЮЩИЕ SIRP-АЛЬФА ДОМЕН ИЛИ ЕГО ВАРИАНТ | 2016 |
|
RU2740672C2 |

Производное полипептида, содержащее первичную структуру H2N-R COOH, в которой R представляет собой аминокислотную последовательность ID N 2: His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Arg-Gly или его фармацевтически приемлемые соли, при этом производное имеет рI 4,0 или меньше или рI 7,0 или больше, обладает инсулинотропной активностью и также производное представляет собой эстерифицированное, амидированное, деамидированное, алкилированное, ацетилированное, полученное при взаимодействии с циклическим ангидридом, с дополнительной С-концевой основной и/или нейтральной аминокислотой или присоединенными кислотами или с сочетанием двух или большего числа этих вариантов; производное упомянутой первичной структуры, при условии, что упомянутое производное не представляет собой сложный С-концевой алкилэфир с (С1-С6)-алкилом с линейной или разветвленной цепью упомянутых первичных структур самих по себе, и при условии, что упомянутое производное не представляет собой С-концевой карбоксамид формулы CONR2R3 упомянутой первичной структуры самой по себе, где R2 и R3 представляют собой, каждый независимо, Н или (С1-С6)-алкил с линейной или разветвленной цепью. Описывается фармацевтическая композиция на основе указанного производного полипептида для лечения диабета. Предложен также способ усиления действия инсулина у млекопитающих и способ лечения диабета с использованием указанного полипептида. 12 с. и 11 з.п.ф-лы, 1 табл.
His-ALa-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Arg-Gly,
или его фармацевтически приемлемые соли, при этом производное имеет pI 4,0 или меньше или pI 7,0 или больше, обладает инсулинотропной активностью и также производное представляет собой эстерифицированное, амидированное, демидированное, алкилированное, ацетилированное, полученное при взаимодействии с циклическим ангидридом, с дополнительной С-концевой основной и/или нейтральной аминокислотой или присоединенными кислотами или с сочетанием двух или больше числа этих вариантов, производное упомянутой первичной структуры, при условии, что упомянутое производное не представляет собой сложный С-концевой алкилэфир с (С1-С6)-алкилом с линейной или разветвленной цепью упомянутых первичных структур самих по себе, и при условии, что упомянутое производное не представляет собой С-концевой карбоксамид формулы CONR2R3 упомянутой первичной структуры самой по себе, где R2 и R3 представляет собой, каждый независимо, Н или (С1-С6)-алкил с линейной или разветвленной цепью.
а) n = 0 и Х представляет собой основной остаток L-аминокислоты, или
b) n = 1 и Х и Y, один или оба, представляют собой основные остатки L-аминокислоты;
R1 представляет собой (С1-С6)-алкил с линейной или разветвленной цепью, когда
а) n = 0 и Х представляет собой нейтральный остаток L-аминокислоты, или
b) n = 1 и Х и Y оба, представляют собой нейтральные остатки L-аминокислоты.
и R2 и R3 каждый представляет собой, независимо, Н или (С1-С6)-алкил с линейной или разветвленной цепью.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Огнетушитель | 0 |
|
SU91A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Устройство для зажима инструмента | 1974 |
|
SU499990A1 |
Авторы
Даты
1999-04-10—Публикация
1993-04-14—Подача