Область техники, к которой относится изобретение
Настоящее изобретение предусматривает полипептиды, являющиеся растворимыми рецепторами 3 фактора роста фибробластов (sFGFR3), и композиции на их основе. Настоящее изобретение также предусматривает способы лечения нарушений в виде задержки роста скелета, таких как ахондроплазия.
Предпосылки создания изобретения
Рецептор 3 фактора роста фибробластов (FGFR3) является представителем семейства факторов роста фибробластов (FGFR), в котором между представителями семейства наблюдается высокая степень консервативности аминокислотных последовательностей. Представители семейства FGFR отличаются как по значениям аффинности связывания лигандов, так и по распределению в тканях. Полноразмерный полипептид FGFR содержит внеклеточный домен (ECD), гидрофобный трансмембранный домен и цитоплазматический тирозинкиназный домен. ECD полипептидов FGFR взаимодействует с факторами роста фибробластов (FGF), опосредуя нисходящую передачу сигнала, которая в конечном итоге влияет на дифференцировку клеток. В частности, активация белка FGFR3 играет роль в развитии костей путем ингибирования пролиферации хондроцитов в пластинке роста и ограничения удлинения костей.
Как известно, точечные мутации приобретения функции в FGFR3 вызывают у человека некоторые типы нарушений в виде задержки роста скелета, такие как ахондроплазия, танатофорная дисплазия I типа (TDI), танатофорная дисплазия II типа (TDII), тяжелая ахондроплазия с задержкой развития и черным акантозом (SADDAN), гипохондроплазия и синдромальные краниосиностозы (например, синдром Мюнке, синдром Крузона и синдром Крузона с черным акантозом). Известно, что точечные мутации потери функции в FGFR3 также вызывают нарушения в виде задержки роста скелета, такие как синдром камптодактилии, высокого роста и потери слуха (CATSHL). Ахондроплазия является наиболее распространенной формой карликовости с короткими конечностями и характеризуется непропорционально короткими конечностями и относительной макроцефалией. Примерно 97% случаев ахондроплазии вызываются одиночной точечной мутацией в гене, кодирующем FGFR3, при которой глициновый остаток заменяется аргининовым остатком в положении 380 аминокислотной последовательности FGFR3. При связывании лигандов мутация обуславливает снижение элиминации комплексов рецептор/лиганд, что в результате приводит к длительной внутриклеточной передаче сигнала. При такой длительной передаче сигнала от FGFR3 ингибируется пролиферация и дифференцировка клеток хрящевой пластинки роста, что приводит впоследствии к ухудшению роста эндохондральной кости.
В силу этого существует потребность в улучшенных терапевтических средствах, нацеливающихся на дисфункциональный FGFR3, для лечения нарушений в виде задержки роста скелета, таких как ахондроплазия.
Краткое описание изобретения
Настоящее изобретение предусматривает полипептиды, являющиеся растворимыми рецепторами 3 фактора роста фибробластов (sFGFR3), и пути их применения, в том числе применение полипептидов sFGFR3 для лечения нарушений в виде задержки роста скелета (например, ахондроплазии) у пациента (например, человека, в частности младенца, ребенка или подростка). В частности, полипептиды sFGFR3 по настоящему изобретению предусматривают делецию, например, аминокислот 289-400 аминокислотной последовательности полипептида FGFR3 дикого типа (например, полипептида с аминокислотной последовательностью под SEQ ID NO: 5 или 32), с получением следующих полипептидов sFGFR3: sFGFR3_Del4, содержащего аминокислотную замену цистеинового остатка сериновым остатком в положении 253 (sFGFR3_Del4-C253S; SEQ ID NO: 2), и sFGFR3_Del4, содержащего удлиненный Ig-подобный домен 3 C2-типа (sFGFR3_Del4-D3; SEQ ID NO: 33), а также их вариантов, таких как полипептид sFGFR3 с аминокислотной последовательностью под SEQ ID NO: 4. Кроме того, полипептиды sFGFR3 по настоящему изобретению могут содержать сигнальный пептид, как, например, полипептид sFGFR3 с аминокислотной последовательностью под SEQ ID NO: 18 или 34.
Первый аспект настоящего изобретения предусматривает полипептид, являющийся растворимым рецептором 3 фактора роста фибробластов (sFGFR3), содержащий полипептидную последовательность, характеризующуюся по меньшей мере 90% идентичностью аминокислотной последовательности (например, по меньшей мере 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или большей (например, 100%) идентичностью последовательности) с аминокислотными остатками 23-357 SEQ ID NO: 32. В частности, у полипептида отсутствует сигнальный пептид (например, аминокислоты 1-22 SEQ ID NO: 32) и трансмембранный домен FGFR3 (например, аминокислоты 367-399 SEQ ID NO: 32), и он (i) имеет длину менее 500 аминокислот (например, имеет длину менее 475, 450, 425, 400, 375 или 350 аминокислот); (ii) содержит 200 или меньше последовательных аминокислот (например, 175, 150, 125, 100, 75, 50, 40, 30, 20, 15 или меньше последовательных аминокислот) внутриклеточного домена FGFR3; и/или (iii) у него отсутствует тирозинкиназный домен FGFR3. Полипептид sFGFR3 также может содержать внутриклеточный домен FGFR3, как, например, аминокислотные остатки 423-435 SEQ ID NO: 32 или аминокислотную последовательность, характеризующуюся по меньшей мере 90%, 92%, 95%, 97% или 99% идентичностью последовательности с аминокислотными остатками 423-435 SEQ ID NO: 32. В частности, полипептид содержит аминокислотную последовательность, характеризующуюся по меньшей мере 92%, 95%, 97%, 99% или 100% идентичностью последовательности с SEQ ID NO: 33 (например, полипептид содержит SEQ ID NO: 33 или состоит из нее). Полипептиды sFGFR3 также могут содержать сигнальный пептид (например, сигнальный пептид может иметь аминокислотную последовательность под SEQ ID NO: 6 или 35 или аминокислотную последовательность, характеризующуюся по меньшей мере 92%, 95%, 97% или 99% идентичностью последовательности с SEQ ID NO: 6 или 35). Например, полипептид sFGFR3 может иметь аминокислотную последовательность, характеризующуюся по меньшей мере 92%, 95%, 97%, 99% или 100% идентичностью последовательности с SEQ ID NO: 34 (например, полипептид sFGFR3 содержит SEQ ID NO: 34 или состоит из нее). Полипептид sFGFR3 также может иметь гетерологичный сигнальный пептид (например, полипептид содержит гетерологичный сигнальный пептид с аминокислотной последовательностью под SEQ ID NO: 35).
Второй аспект настоящего изобретения предусматривает полипептид sFGFR3, содержащий аминокислотную последовательность, характеризующуюся по меньшей мере 85% идентичностью последовательности (например, по меньшей мере 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности) с аминокислотной последовательностью под SEQ ID NO: 1, при этом полипептид sFGFR3 дополнительно содержит аминокислотную замену, при которой удаляется цистеиновый остаток в положении 253 SEQ ID NO: 1. Например, в положении 253 цистеиновый остаток заменен сериновым остатком или, например, подвергнут другой консервативной аминокислотной замене, как, например, аланином, глицином, пролином или треонином. В частности, полипептид sFGFR3 содержит аминокислотную последовательность под SEQ ID NO: 2 или состоит из нее. Например, полипептид sFGFR3 может представлять собой выделенный полипептид sFGFR3. Полипептиды sFGFR3 также могут содержать сигнальный пептид (например, сигнальный пептид может иметь аминокислотную последовательность под SEQ ID NO: 6 или 35 или аминокислотную последовательность, характеризующуюся по меньшей мере 92%, 95%, 97% или 99% идентичностью последовательности с SEQ ID NO: 6 или 35). Например, sFGFR3 может иметь аминокислотную последовательность, характеризующуюся по меньшей мере 92%, 95%, 97%, 99% или 100% идентичностью последовательности с SEQ ID NO: 18 (например, полипептид sFGFR3 содержит SEQ ID NO: 18 или состоит из нее). Полипептид sFGFR3 также может иметь гетерологичный сигнальный пептид (например, полипептид содержит гетерологичный сигнальный пептид с аминокислотной последовательностью под SEQ ID NO: 35).
Третий аспект настоящего изобретения предусматривает полипептид sFGFR3, содержащий аминокислотную последовательность, характеризующуюся по меньшей мере 85% идентичностью последовательности (например, по меньшей мере 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности) с аминокислотной последовательностью под SEQ ID NO: 1, при этом полипептид sFGFR3 дополнительно содержит домен, содержащий аминокислотную последовательность, характеризующуюся по меньшей мере 85% идентичностью последовательности (например, по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности) со всей аминокислотной последовательностью под SEQ ID NO: 3 или ее фрагментом (например, по меньшей мере 10, 20, 30, 40, 45 или большим количеством последовательных аминокислот SEQ ID NO: 3), при этом домен вставлен между аминокислотными остатками 288 и 289 SEQ ID NO: 1. Например, домен может содержать аминокислотную последовательность, характеризующуюся по меньшей мере 85%, 90%, 92%, 95%, 97% или 99% идентичностью последовательности с аминокислотной последовательностью под SEQ ID NO: 3 (например, домен может содержать аминокислотную последовательность под SEQ ID NO: 3 или состоять из нее). Полипептид sFGFR3 необязательно содержит аминокислотную замену цистеинового остатка сериновым остатком или, например, другую консервативную аминокислотную замену, как, например, аланином, глицином, пролином или треонином, в положении 253 SEQ ID NO: 1 и/или положении 28 SEQ ID NO: 3. В частности, полипептид sFGFR3 содержит аминокислотную последовательность под SEQ ID NO: 4 или состоит из нее. Например, полипептид sFGFR3 может представлять собой выделенный полипептид sFGFR3.
Также предусмотрен полинуклеотид (например, выделенный полинуклеотид), который кодирует полипептид sFGFR3 согласно первому, второму или третьему аспекту настоящего изобретения, содержащий последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере 85%, 90%, 92%, 95%, 97% или 99% идентичностью последовательности с последовательностью нуклеиновой кислоты под SEQ ID NO: 20, 21, 36 или 37 (например, полинуклеотид содержит нуклеиновую кислоту под SEQ ID NO: 20, 21, 36 или 37 или состоит из нее). Настоящее изобретение также предусматривает вектор (например, выделенный вектор), такой как плазмида, искусственная хромосома, вирусный вектор или фаговый вектор, который содержит полинуклеотид. Кроме того, настоящее изобретение предусматривает клетку-хозяина (например, выделенную клетку-хозяина), содержащую полинуклеотид, такую как клетка HEK 293 или клетка CHO.
Настоящее изобретение предусматривает композицию, содержащую полипептид sFGFR3 согласно первому, второму или третьему аспектам настоящего изобретения или полинуклеотид, который кодирует полипептид sFGFR3 согласно первому, второму или третьему аспектам настоящего изобретения. Кроме того, вектор или клетка-хозяин, которые содержат полинуклеотид, кодирующий полипептид sFGFR3, могут быть составлены в виде композиции. Композиция может дополнительно содержать фармацевтически приемлемый наполнитель, носитель или разбавитель. Композиция, содержащая полипептид sFGFR3, полинуклеотид или вектор, может быть составлена для введения в дозе от приблизительно 0,002 мг/кг до приблизительно 30 мг/кг, как, например, от приблизительно 0,001 мг/кг до приблизительно 10 мг/кг. Композиция, содержащая клетку-хозяина, может быть составлена для введения в дозе от приблизительно 1 X 103 клеток/мл до приблизительно 1 X 1012 клеток/мл. Композиция может быть составлена для ежедневного, еженедельного или ежемесячного введения, такого как семь раз в неделю, шесть раз в неделю, пять раз в неделю, четыре раза в неделю, три раза в неделю, два раза в неделю, один раз в неделю, один раз в две недели или один раз в месяц. Например, композиция, содержащая полипептид sFGFR3, полинуклеотид или вектор, составлена для введения в дозе от приблизительно 0,25 мг/кг до приблизительно 10 мг/кг один раз или два раза в неделю. Композиция может быть составлена для парентерального введения (например, подкожного введения, внутривенного введения, внутримышечного введения, внутриартериального введения, интратекального введения или внутрибрюшинного введения), энтерального введения или местного введения. Композиция предпочтительно составлена для подкожного введения. Настоящее изобретение также предусматривает лекарственный препарат, который содержит одну или несколько композиций, описанных выше.
Настоящее изобретение также предусматривает способ доставки полипептида sFGFR3 в ткань (например, ткань скелета) пациента (например, человека) с нарушением в виде задержки роста скелета (например, ахондроплазией), включающий введение пациенту эффективного количества полипептида sFGFR3 согласно первому, второму или третьему аспекту настоящего изобретения, полинуклеотида, кодирующего полипептид sFGFR3, вектора, содержащего полинуклеотид, клетки-хозяина, содержащей полинуклеотид или вектор, или композиции, содержащей полипептид, полинуклеотид, вектор или клетку-хозяина.
Четвертый аспект настоящего изобретения предусматривает способ лечения нарушения в виде задержки роста скелета (например, заболевания скелета, связанного с FGFR3), у пациента (например, человека), который включает введение полипептида согласно первому, второму или третьему аспекту настоящего изобретения или полинуклеотида, кодирующего полипептид, вектора, содержащего полинуклеотид, клетки-хозяина, содержащей полинуклеотид или вектор, или композиции, содержащей полипептид, полинуклеотид, вектор или клетку-хозяина. Заболевание скелета, связанное с FGFR3, выбрано из группы, состоящей из ахондроплазии, танатофорной дисплазии I типа (TDI), танатофорной дисплазии II типа (TDII), тяжелой ахондроплазии с задержкой развития и черным акантозом (SADDEN), гипохондроплазии, синдромального краниосиностоза (например, синдрома Мюнке, синдрома Крузона и синдрома Крузона с черным акантозом) и синдрома камптодактилии, высокого роста и потери слуха (CATSHL). В частности, нарушение в виде задержки роста скелета представляет собой ахондроплазию.
Заболевание скелета, связанное с FGFR3, может быть вызвано экспрессией конститутивно активного FGFR3 у пациента, как, например, имеющего аминокислотную замену глицинового остатка аргининовым остатком в положении 380 SEQ ID NO: 5 или 32. В частности, у пациента может быть диагностировано нарушение в виде задержки роста скелета (например, до начала лечения). Например, у пациента проявляются один или несколько симптомов нарушения в виде задержки роста скелета, выбранных из группы, состоящей из коротких конечностей, короткого туловища, O-образного искривления ног, утиной походки, мальформаций черепа, черепа в форме трилистника, краниосиностоза, наличия вормиевых костей, аномалий развития кистей, аномалий развития стоп, удлиненного большого пальца кисти и аномалий развития грудной клетки, при которых у пациента проявляется ослабление одного или нескольких симптомов нарушения в виде задержки роста скелета после введения полипептида sFGFR3 (или полинуклеотида, кодирующего полипептид, вектора, содержащего полинуклеотид, клетки-хозяина, содержащей полинуклеотид или вектор, или композиции, содержащей полипептид, полинуклеотид, вектор или клетку-хозяина). Кроме того, пациенту могли ранее не вводить полипептид sFGFR3. Например, пациент может являться младенцем, ребенком, подростком или взрослым.
Например, полипептид вводят пациенту в дозе от приблизительно 0,002 мг/кг до приблизительно 30 мг/кг (например, в дозе от приблизительно 0,001 мг/кг до приблизительно 10 мг/кг). Полипептид можно вводить пациенту один или несколько раз ежедневно, еженедельно (например, два раза в неделю, три раза в неделю, четыре раза в неделю, пять раз в неделю, шесть раз в неделю или семь раз в неделю), один раз в две недели, один раз в месяц или один раз в год. Например, полипептид вводят пациенту в дозе от приблизительно 0,25 мг/кг до приблизительно 30 мг/кг по меньшей мере приблизительно один раз или два раза в неделю или чаще (например, полипептид вводят пациенту в дозе приблизительно 2,5 мг/кг или приблизительно 10 мг/кг один раз или два раза в неделю). Полипептид можно вводить пациенту в композиции, содержащей фармацевтически приемлемый наполнитель, носитель или разбавитель. Полипептид можно вводить пациенту парентерально (например, подкожно, внутривенно, внутримышечно, внутриартериально, интратекально или внутрибрюшинно), энтерально или местно. Композицию предпочтительно вводят пациенту путем подкожной инъекции. Кроме того, полипептид может связываться с фактором роста фибробластов 1 (FGF1), фактором роста фибробластов 2 (FGF2), фактором роста фибробластов 9 (FGF9), фактором роста фибробластов 18 (FGF18), фактором роста фибробластов 19 (FGF19) или фактором роста фибробластов 21 (FGF21). В частности, связывание может характеризоваться равновесной константой диссоциации (Kd) от приблизительно 0,2 нm до приблизительно 20 нm, как, например, связывание характеризуется Kd от приблизительно 1 нМ до приблизительно 10 нМ (например, приблизительно 1 нm, приблизительно 2 нm, приблизительно 3 нm, приблизительно 4 нm, приблизительно 5 нm, приблизительно 6 нm, приблизительно 7 нm, приблизительно 8 нm, приблизительно 9 нm или приблизительно 10 нm). Полипептид может проявлять большую аффинность связывания с FGF1, FGF2, FGF9 и FGF18 по сравнению с аффинностью связывания полипептида с FGF19 и FGF21.
Полипептид может характеризоваться периодом полужизни in vivo от приблизительно 2 часов до приблизительно 25 часов (например, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов, 12 часов, 13 часов, 14 часов, 15 часов, 16 часов, 17 часов, 18 часов, 19 часов, 20 часов, 21 час, 22 часа, 23 часа, 24 часа или 25 часов). Введение полипептида предпочтительно обеспечивает одно или несколько или все из следующего: увеличения выживаемости пациента, улучшения двигательной активности пациента, улучшения брюшного дыхания у пациента, увеличения длины тела и/или костей пациента, улучшения головного указателя пациента и/или восстановления формы большого затылочного отверстия у пациента, например, по сравнению с пациентом, не получавшим лечение (например, пациентом с ахондроплазией, не получавшим лечение).
Настоящее изобретение также предусматривает способ получения полипептида sFGFR3 согласно первому, второму или третьему аспекту настоящего изобретения, который включает культивирование клетки-хозяина, описанной выше (например, клетки CHO или клетки HEK 293), в культуральной среде в условиях, подходящих для осуществления экспрессии полипептида sFGFR3, и извлечение полипептида sFGFR3 из культуральной среды. В частности, извлечение включает в себя хроматографию, такую как аффинная хроматография (например, ионообменная хроматография или хроматография с использованием антител к FLAG, как, например, иммунопреципитация) или эксклюзионная хроматография.
Пятый аспект настоящего изобретения предусматривает полипептид согласно первому, второму или третьему аспекту настоящего изобретения (или полинуклеотид, кодирующий полипептид, вектор, содержащий полинуклеотид, клетку-хозяина, содержащую полинуклеотид или вектор, или композицию, содержащую полипептид, полинуклеотид, вектор или клетку-хозяина) для лечения нарушения в виде задержки роста скелета у пациента. В частности, полипептид sFGFR3 может связываться с фактором роста фибробластов 1 (FGF1), фактором роста фибробластов 2 (FGF2), фактором роста фибробластов 9 (FGF9), фактором роста фибробластов 18 (FGF18), фактором роста фибробластов 19 (FGF19) или фактором роста фибробластов 21 (FGF21).
Шестой аспект настоящего изобретения предусматривает полипептид sFGFR3 (или полинуклеотид, кодирующий полипептид, вектор, содержащий полинуклеотид, клетку-хозяина, содержащую полинуклеотид или вектор, или композицию, содержащую полипептид, полинуклеотид, вектор или клетку-хозяина), содержащий аминокислотную последовательность, характеризующуюся по меньшей мере 85% идентичностью последовательности (например, по меньшей мере 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности) с аминокислотной последовательностью под SEQ ID NO: 1, для лечения нарушения в виде задержки роста скелета у пациента (например, человека), при этом полипептид sFGFR3 дополнительно содержит аминокислотную замену, при которой удаляется цистеиновый остаток в положении 253 SEQ ID NO: 1. Например, в положении 253 цистеиновый остаток заменен сериновым остатком или, например, подвергнут другой консервативной аминокислотной замене, как, например, аланином, глицином, пролином или треонином. В частности, полипептид sFGFR3 содержит аминокислотную последовательность под SEQ ID NO: 2 или состоит из нее. Например, полипептид sFGFR3 может представлять собой выделенный полипептид sFGFR3. Кроме того, полипептид sFGFR3 может связываться с фактором роста фибробластов 1 (FGF1), фактором роста фибробластов 2 (FGF2), фактором роста фибробластов 9 (FGF9), фактором роста фибробластов 18 (FGF18), фактором роста фибробластов 19 (FGF19) или фактором роста фибробластов 21 (FGF21).
Седьмой аспект настоящего изобретения предусматривает полипептид sFGFR3 (или полинуклеотид, кодирующий полипептид, вектор, содержащий полинуклеотид, клетку-хозяина, содержащую полинуклеотид или вектор, или композицию, содержащую полипептид, полинуклеотид, вектор или клетку-хозяина), содержащий аминокислотную последовательность, характеризующуюся по меньшей мере 85% идентичностью последовательности (например, по меньшей мере 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности) с аминокислотной последовательностью под SEQ ID NO: 1, для лечения нарушения в виде задержки роста скелета у пациента (например, человека), при этом полипептид sFGFR3 дополнительно содержит домен, содержащий аминокислотную последовательность, характеризующуюся по меньшей мере 85% идентичностью последовательности (например, по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности) со всей аминокислотной последовательностью под SEQ ID NO: 3 или ее фрагментом (например, по меньшей мере 10, 20, 30, 40, 45 или большим количеством последовательных аминокислот SEQ ID NO: 3), при этом домен вставлен между аминокислотными остатками 288 и 289 SEQ ID NO: 1. Например, домен может содержать аминокислотную последовательность, характеризующуюся по меньшей мере 85%, 90%, 92%, 95%, 97% или 99% идентичностью последовательности с аминокислотной последовательностью под SEQ ID NO: 3 (например, домен может содержать аминокислотную последовательность под SEQ ID NO: 3 или состоять из нее). Полипептид sFGFR3 необязательно содержит аминокислотную замену цистеинового остатка сериновым остатком или, например, другую консервативную аминокислотную замену, как, например, аланином, глицином, пролином или треонином, в положении 253 SEQ ID NO: 1 и/или положении 28 SEQ ID NO: 3. В частности, полипептид sFGFR3 содержит аминокислотную последовательность под SEQ ID NO: 4 или состоит из нее. Например, полипептид sFGFR3 может представлять собой выделенный полипептид sFGFR3. Кроме того, полипептид sFGFR3 может связываться с фактором роста фибробластов 1 (FGF1), фактором роста фибробластов 2 (FGF2), фактором роста фибробластов 9 (FGF9), фактором роста фибробластов 18 (FGF18), фактором роста фибробластов 19 (FGF19) или фактором роста фибробластов 21 (FGF21).
При применении пятого, шестого или седьмого аспекта также предусмотрено введение полинуклеотида, вектора, клетки-хозяина или композиции согласно первому, второму или третьему аспекту настоящего изобретения. Полипептид sFGFR3 согласно шестому аспекту настоящего изобретения может кодироваться полинуклеотидом, содержащим последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере 85%, 90%, 92%, 95%, 97% или 99% идентичностью последовательности с последовательностью нуклеиновой кислоты под SEQ ID NO: 20 или 36 (например, полинуклеотид содержит нуклеиновую кислоту под SEQ ID NO: 20 или 36 или состоит из нее). Полипептид sFGFR3 согласно пятому или седьмому аспекту настоящего изобретения может кодироваться полинуклеотидом, содержащим последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере 85%, 90%, 92%, 95%, 97% или 99% идентичностью последовательности с последовательностью нуклеиновой кислоты под SEQ ID NO: 21 или 37 (например, полинуклеотид содержит нуклеиновую кислоту под SEQ ID NO: 21 или 37 или состоит из нее).
Нарушение в виде задержки роста скелета согласно пятому, шестому или седьмому аспекту настоящего изобретения может представлять собой любое заболевание скелета, связанное с FGFR3, такое как ахондроплазия, TDI, TDII, тяжелая ахондроплазия с задержкой развития и черным акантозом (SADDEN), гипохондроплазия, синдромальный краниосиностоз (например, синдром Мюнке, синдром Крузона и синдром Крузона с черным акантозом) или CATSHL. В частности, нарушение в виде задержки роста скелета представляет собой ахондроплазию. Заболевание скелета, связанное с FGFR3, может быть вызвано экспрессией конститутивно активного FGFR3 у пациента, например, при этом конститутивно активный FGFR3 содержит аминокислотную замену глицинового остатка аргининовым остатком в положении 380 SEQ ID NO: 5.
Пациент (например, человек) согласно пятому, шестому или седьмому аспекту настоящего изобретения может быть пациентом, у которого было диагностировано нарушение в виде задержки роста скелета (например, до начала лечения). У пациента могут проявляться один или несколько симптомов нарушения в виде задержки роста скелета (например, ахондроплазии), выбранных из группы, состоящей из коротких конечностей, короткого туловища, O-образного искривления ног, утиной походки, мальформаций черепа, черепа в форме трилистника, краниосиностоза, наличия вормиевых костей, аномалий развития кистей, аномалий развития стоп, удлиненного большого пальца кисти и аномалий развития грудной клетки. В результате применения способов у пациента может проявляться ослабление одного или нескольких симптомов нарушения в виде задержки роста скелета после введения полипептида sFGFR3. Помимо этого, при введении полипептида sFGFR3 может увеличиваться выживаемость пациента и/или восстанавливаться форма большого затылочного отверстия пациента. Пациент может являться младенцем, ребенком, подростком или взрослым. Кроме того, пациент может являться пациентом, которому ранее не вводили полипептид sFGFR3 (или полинуклеотид, кодирующий полипептид, вектор, содержащий полинуклеотид, клетку-хозяина, содержащую полинуклеотид или вектор, или композицию, содержащую полипептид, полинуклеотид, вектор или клетку-хозяина).
Полипептид sFGFR3, полинуклеотид или вектор согласно пятому, шестому или седьмому аспекту настоящего изобретения можно вводить пациенту (например, человеку) в дозе от приблизительно 0,002 мг/кг до приблизительно 30 мг/кг, как, например, от приблизительно 0,001 мг/кг до приблизительно 10 мг/кг. Композицию, содержащую клетку-хозяина согласно четвертому или пятому аспекту настоящего изобретения, можно вводить пациенту (например, человеку) в дозе от приблизительно 1 X 103 клеток/мл до приблизительно 1 X 1012 клеток/мл. Например, полипептид sFGFR3, полинуклеотид, вектор или клетку-хозяина вводят пациенту один или несколько раз в день, в неделю, в месяц или в год (например, полипептид sFGFR3 вводят пациенту семь раз в неделю, шесть раз в неделю, пять раз в неделю, четыре раза в неделю, три раза в неделю, два раза в неделю, один раз в неделю, один раз в две недели или один раз в месяц). В частности, полипептид sFGFR3 вводят пациенту в дозе от приблизительно 0,25 мг/кг до приблизительно 10 мг/кг один раз или два раза в неделю. Полипептид sFGFR3 можно вводить пациенту в композиции, содержащей фармацевтически приемлемый наполнитель, носитель или разбавитель. Например, композицию вводят пациенту парентерально (например, подкожно, внутривенно, внутримышечно, внутриартериально, интратекально или внутрибрюшинно), энтерально или местно. В частности, композицию вводят пациенту путем подкожной инъекции.
Настоящее изобретение предусматривает способ получения полипептида sFGFR3 согласно первому аспекту настоящего изобретения посредством удаления сигнального пептида, трансмембранного домена и части внутриклеточного домена из полипептида FGFR3 (например, с получением полипептида с аминокислотной последовательностью под SEQ ID NO: 33). В частности, внутриклеточный домен состоит из аминокислотных остатков 436-806 SEQ ID NO: 32. Настоящее изобретение также предусматривает способ получения полипептида sFGFR3 согласно второму аспекту настоящего изобретения путем введения аминокислотной замены, при которой удаляется цистеиновый остаток в положении 253 SEQ ID NO: 1 (например, с получением полипептида с аминокислотной последовательностью под SEQ ID NO: 2). Например, в положении 253 цистеиновый остаток заменен сериновым остатком или, например, подвергнут другой консервативной аминокислотной замене, как, например, аланином, глицином, пролином или треонином.
Настоящее изобретение также предусматривает набор, содержащий полипептид sFGFR3 согласно первому, второму или третьему аспекту настоящего изобретения (например, полипептид с аминокислотной последовательностью под SEQ ID NO: 2, 4 или 33), полинуклеотид согласно первому, второму или третьему аспекту настоящего изобретения (например, полинуклеотид с последовательностью нуклеиновой кислоты под SEQ ID NO: 20, 21, 36 или 37), вектор согласно первому, второму или третьему аспекту настоящего изобретения (например, плазмиду, искусственную хромосому, вирусный вектор или фаговый вектор) или клетку-хозяина согласно первому, второму или третьему аспекту настоящего изобретения (например, клетку HEK 293 или клетку CHO), при этом набор необязательно содержит инструкции по применению набора.
Определения
Используемая в данном документе форма единственного числа означает "по меньшей мере один" или "один или несколько", если не указано иное. Кроме того, форма единственного числа включает определяемые объекты во множественном числе, если из контекста явно не следует иное.
Как используется в данном документе, "приблизительно" относится к количеству, которое находится в пределах ± 10% от указанного значения и предпочтительно находится в пределах ± 5% от указанного значения или более предпочтительно ± 2% от указанного значения. Например, термин "приблизительно" можно использовать для модификации всех доз или диапазонов, перечисленных в данном документе, на ± 10% от указанных значений или конечных точек диапазона.
Термин "домен" относится к консервативному участку аминокислотной последовательности полипептида (например, полипептида FGFR3), характеризующемуся идентифицируемой структурой и/или функцией в пределах полипептида. Длина домена может варьироваться, например, от приблизительно 20 аминокислот до приблизительно 600 аминокислот. Иллюстративные домены включают в себя иммуноглобулиновые домены FGFR3 (например, Ig-подобный домен 1 C2-типа, Ig-подобный домен 2 C2-типа и Ig-подобный домен 3 C2-типа).
Термин "доза" относится к определенному количеству активного средства (например, полипептида sFGFR3 или его варианта, как, например, полипептида с аминокислотной последовательностью под SEQ ID NO: 2, 4 или 33), рассчитанному для получения необходимого терапевтического эффекта (например, лечения нарушения в виде задержки роста скелета, такого как ахондроплазия) при введении активного средства пациенту (например, пациенту с нарушением в виде задержки роста скелета, таким как ахондроплазия). Доза может определяться как определенное количество активного средства или определенное количество в сочетании с конкретной частотой введения. Лекарственная форма может содержать полипептид sFGFR3 или его фрагмент совместно с любым подходящим фармацевтическим наполнителем, носителем или разбавителем.
Термины "эффективное количество", "количество, эффективное для" и "терапевтически эффективное количество" относятся к количеству полипептида sFGFR3, вектора, кодирующего sFGR3, и/или композиции на основе sFGFR3, достаточному для получения необходимого результата, например, лечения нарушения в виде задержки роста скелета (например, ахондроплазии).
Термины "внеклеточный домен" и "ECD" относятся к части полипептида FGFR3, которая выступает за пределы трансмембранного домена во внеклеточное пространство. ECD опосредует связывание FGFR3 с одним или несколькими факторами роста фибробластов (FGF). Например, ECD содержит Ig-подобные домены 1-3 C2-типа полипептида FGFR3. В частности, ECD содержит Ig-подобный домен 1 C2-типа полипептида FGFR3 дикого типа (wt) (например, аминокислоты 36-88 полипептида FGFR3 wt с аминокислотной последовательностью под SEQ ID NO: 5 (зрелый белок FGFR3 без сигнальной последовательности) или аминокислоты 57-110 полипептида FGFR3 wt с аминокислотной последовательностью под SEQ ID NO: 32 (предшественник белка FGFR3 с сигнальной последовательностью)), Ig-подобный домен 2 C2-типа полипептида FGFR3 дикого типа (wt) (например, аминокислоты 139-234 полипептида FGFR3 wt с аминокислотной последовательностью под SEQ ID NO: 5 или аминокислоты 161-245 полипептида FGFR3 wt с аминокислотной последовательностью под SEQ ID NO: 32) и Ig-подобный домен 3 C2-типа полипептида FGFR3 wt (например, аминокислоты 247-335 полипептида FGFR3 wt с аминокислотной последовательностью под SEQ ID NO: 5 или аминокислоты 268-310 полипептида FGFR3 wt с аминокислотной последовательностью под SEQ ID NO: 32). ECD FGFR3 также может содержать фрагмент Ig-подобного домена 3 C2-типа FGFR3 дикого типа, например, аминокислоты 247-288 SEQ ID NO: 1, который может дополнительно содержать, например, аминокислотную замену цистеинового остатка сериновым остатком или другую консервативную аминокислотную замену (например, аланином, глицином, пролином или треонином) в положении 253 SEQ ID NO: 1 (например, аминокислоты 247-288 SEQ ID NO: 2). Кроме того, ECD может содержать Ig-подобный домен 3 C2-типа, например, из аминокислот 247-335 SEQ ID NO: 4. Таким образом, иллюстративные ECD полипептидов FGFR3 включают в себя, например, полипептиды с аминокислотной последовательностью из аминокислот 1-288 SEQ ID NO: 1 и 2 или аминокислот 1-335 SEQ ID NO: 4 и 33. В частности, ECD полипептида FGFR3 содержит аминокислоты 1-335 SEQ ID NO: 33.
Термин "заболевание скелета, связанное с FGFR3", используемый в данном документе, относится к заболеванию скелета, которое вызвано аномальным повышением активации FGFR3, как, например, экспрессией FGFR3 с мутацией приобретения функции. Фраза "FGFR3 с мутацией приобретения функции" относится к мутантной форме FGFR3, демонстрирующей биологическую активность, такую как инициирование нисходящей передачи сигнала, на более высоком уровне, чем биологическая активность соответствующего FGFR3 дикого типа (например, полипептида с аминокислотной последовательностью под SEQ ID NO: 5), в присутствии лиганда FGF. Заболевания скелета, связанные с FGFR3, могут включать в себя наследственное или спорадическое заболевание.
Иллюстративные заболевания скелета, связанные с FGFR3, включают без ограничения ахондроплазию, танатофорную дисплазию I типа (TDI), танатофорную дисплазию II типа (TDII), тяжелую ахондроплазию с задержкой развития и черным акантозом (SADDAN), гипохондроплазию, синдромальный краниосиностоз (например, синдром Мюнке, синдром Крузона и синдром Крузона с черным акантозом) и синдром камптодактилии, высокого роста и потери слуха (CATSHL).
Термины "фактор роста фибробластов" и "FGF" относятся к представителю семейства FGF, которое включает структурно родственные сигнальные молекулы, участвующие в различных метаболических процессах, в том числе эндокринных сигнальных путях, развитии, заживлении ран и ангиогенезе. FGF играют ключевые роли в пролиферации и дифференцировке широкого спектра типов клеток и тканей. Данный термин предпочтительно относится к FGF1, FGF2, FGF9, FGF18, FGF19 и FGF21, которые, как было показано, связывают FGFR3. Например, FGF могут включать в себя FGF1 человека (например, полипептид с аминокислотной последовательностью под SEQ ID NO: 13), FGF2 человека (например, полипептид с аминокислотной последовательностью под SEQ ID NO: 14), FGF9 человека (например, полипептид с аминокислотной последовательностью под SEQ ID NO: 15), FGF18 человека (например, полипептид с аминокислотной последовательностью под SEQ ID NO: 16), FGF19 человека (например, полипептид с аминокислотной последовательностью под SEQ ID NO: 38) и FGF21 человека (например, полипептид с аминокислотной последовательностью под SEQ ID NO: 39).
Термины "рецептор 3 фактора роста фибробластов", "FGFR3" или "рецептор FGFR3", используемые в данном документе, относятся к полипептиду, который специфично связывает один или несколько FGF (например, FGF1, FGF2, FGF9, FGF18, FGF19 и/или FGF21). Ген FGFR3 человека, который локализован в дистальной части короткого плеча хромосомы 4, кодирует предшественник белка из 806 аминокислот (предшественник изоформы 1 рецептора 3 фактора роста фибробластов), который содержит 19 экзонов и содержит сигнальный пептид (например, полипептид с аминокислотной последовательностью под SEQ ID NO: 6 или 35). Мутации в аминокислотной последовательности FGFR3, которые приводят к нарушениям роста скелета (например, ахондроплазии), включают в себя, например, замену глицинового остатка в положении 380 аргининовым остатком (т. е. G380R). Встречающийся в природе ген FGFR3 человека характеризуется нуклеотидной последовательностью, которая показана в Genbank под номером доступа NM_000142.4, и встречающийся в природе белок FGFR3 человека характеризуется аминокислотной последовательностью, которая показана в Genbank под номером доступа NP_000133, в данном документе представленной под SEQ ID NO: 5. FGFR3 дикого типа (например, полипептид с аминокислотной последовательностью под SEQ ID NO: 5) состоит из внеклеточного иммуноглобулиноподобного мембранного домена, содержащего Ig-подобные домены 1-3 C2-типа (аминокислотные остатки 1-335), трансмембранного домена (аминокислотные остатки 345-377) и внутриклеточного домена (аминокислотные остатки 378-784). FGFR3 могут содержать фрагменты и/или варианты (например, сплайс-варианты, такие как сплайс-варианты, в которых используется альтернативный экзон 8 вместо экзона 9) полноразмерного FGFR3 дикого типа (например, полипептида с аминокислотной последовательностью под SEQ ID NO: 5).
Термины "фрагмент" и "часть" относятся к доле целого, как, например, полипептида или молекулы нуклеиновой кислоты, которая предпочтительно охватывает по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или больше полной длины эталонных молекулы нуклеиновой кислоты или полипептида. Фрагмент или часть могут содержать, например, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 500, 600, 700 или больше аминокислотных остатков вплоть до полной длины эталонного полипептида (например, полипептида с аминокислотной последовательностью под SEQ ID NO: 5 или 32). Например, фрагмент FGFR3 может содержать любой полипептид, имеющий по меньшей мере 200, 205, 210, 215, 220, 225, 235, 230, 240, 245, 250, 255, 260, 265, 275, 280, 285, 290 или 300 последовательных аминокислот SEQ ID NO: 1 или 2. Кроме того, фрагмент FGFR3 может содержать любой полипептид, имеющий по меньшей мере 200, 205, 210, 215, 220, 225, 235, 230, 240, 245, 250, 255, 260, 265, 275, 280, 285, 290, 300, 305, 310, 315, 320, 325, 330, 335, 345 или 345 последовательных аминокислот SEQ ID NO: 4 или 33.
Используемый в данном документе термин "клетка-хозяин" относится к среде, которая содержит необходимые клеточные компоненты, например, органеллы, необходимые для экспрессии полипептида sFGFR3 с соответствующего полинуклеотида. Последовательность нуклеиновой кислоты полинуклеотида, как правило, содержится в векторе на основе нуклеиновой кислоты (например, плазмиде, искусственной хромосоме, вирусном векторе или фаговом векторе), который можно вводить в клетку-хозяина с помощью общепринятых методик, известных из уровня техники (например, трансформации, трансфекции, электропорации, осаждения фосфатом кальция и прямой микроинъекции). Клетка-хозяин может быть прокариотической клеткой, например, бактериальной клеткой или клеткой археи, или эукариотической клеткой, например, клеткой млекопитающего (например, клеткой яичника китайского хомячка (CHO) или эмбриональной почки человека 293 (HEK 293)). Клетка-хозяин предпочтительно является клеткой млекопитающего, такой как клетка CHO.
Под "выделенным" подразумевают отделенный, извлеченный или очищенный из его естественной среды. Например, выделенный полипептид sFGFR3 (например, полипептид sFGFR3 или его вариант, такой как полипептид с аминокислотной последовательностью под SEQ ID NO: 2 или 4) может характеризоваться определенной степенью чистоты после выделения полипептида sFGFR3, например, из среды для культивирования клеток. Выделенный полипептид sFGFR3 может быть чистым по меньшей мере на 75%, так что полинуклеотид sFGFR3 составляет по меньшей мере 75% по весу общего материала (например, полипептидов, полинуклеотидов, клеточного дебриса и загрязнителей среды), присутствующего в препарате (например, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 99% или по меньшей мере 99,5% по весу общего материала, присутствующего в препарате). Подобным образом, выделенный полинуклеотид, кодирующий полипептид sFGFR3 (например, полинуклеотид с последовательностью нуклеиновой кислоты под SEQ ID NO: 20, 21, 36 или 37), или выделенная клетка-хозяин (например, клетка CHO, клетка HEK 293, клетка L, клетка C127, клетка 3T3, клетка BHK или клетка COS-7) могут быть чистыми по меньшей мере на 75%, так что полинуклеотид или клетка-хозяин составляют по меньшей мере 75% по весу общего материала (например, полипептидов, полинуклеотидов, клеточного дебриса и загрязнителей среды), присутствующего в препарате (например, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 99% или по меньшей мере 99,5% по весу общего материала, присутствующего в препарате).
"Полинуклеотид" и "молекула нуклеиновой кислоты", используемые в данном документе взаимозаменяемо, относятся к полимерам нуклеотидов любой длины и включают в себя ДНК и РНК. Нуклеотиды могут быть дезоксирибонуклеотидами, рибонуклеотидами, модифицированными нуклеотидами или основаниями и/или их аналогами или любым субстратом, который может быть включен в полимер с помощью ДНК- или РНК-полимеразы или с помощью реакции синтеза. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. Модификация структуры нуклеотида в случае ее наличия может быть выполнена до или после сборки полимера. Последовательность нуклеотидов может прерываться отличными от нуклеотидов компонентами. Полинуклеотид может быть дополнительно модифицирован после синтеза, как, например, путем конъюгации с меткой.
Термины "пациент" и "субъект" относятся к млекопитающему, в том числе без ограничения человеку (например, человеку с нарушением в виде задержки роста скелета, таким как ахондроплазия) или отличному от человека млекопитающему (например, отличному от человека млекопитающему с нарушением в виде задержки роста скелета, таким как ахондроплазия), такому как бык, лошадь, собака, овца или кошка. Пациент предпочтительно является человеком с нарушением в виде задержки роста скелета (например, ахондроплазией), в частности младенцем, ребенком или подростком с нарушением в виде задержки роста скелета (например, ахондроплазией). Термины "парентеральное введение", "введенный парентерально" и другие грамматически эквивалентные фразы, используемые в данном документе, относятся к способу введения композиций, содержащих полипептид sFGFR3 (например, полипептид sFGFR3 или его вариант, такой как полипептид с аминокислотной последовательностью под SEQ ID NO: 2, 4 или 33, или полипептид sFGFR3, содержащий сигнальный пептид, такой как полипептид с аминокислотной последовательностью под SEQ ID NO: 18 или 34), отличному от энтерального и местного введения, обычно путем инъекции, и включает без ограничения подкожную, внутрикожную, внутривенную, интраназальную, внутриглазную, легочную, внутримышечную, внутриартериальную, интратекальную, внутрикапсульную, внутриглазничную, внутрисердечную, внутрикожную, внутрилегочную, внутрибрюшинную, транстрахеальную, субкутикулярную, внутрисуставную, подкапсульную, субарахноидальную, интраспинальную, эпидуральную, интрацеребральную, внутричерепную, интракаротидную и внутригрудинную инъекцию и инфузию.
Под "фармацевтически приемлемым разбавителем, наполнителем, носителем или вспомогательным средством" подразумевают соответственно разбавитель, наполнитель, носитель или вспомогательное средство, которые являются физиологически приемлемыми для субъекта (например, человека) и сохраняют при этом терапевтические свойства фармацевтической композиции (например, полипептида sFGFR3 или его варианта, такого как полипептид с аминокислотной последовательностью под SEQ ID NO: 2, 4 или 33, или полипептида sFGFR3, содержащего сигнальный пептид, такого как полипептид с аминокислотной последовательностью под SEQ ID NO: 18 или 34), с которой их вводят. Одним иллюстративным фармацевтически приемлемым носителем является физиологический раствор. Другие физиологически приемлемые разбавители, наполнители, носители или вспомогательные средства и составы с ними известны специалисту в данной области.
Под "фармацевтической композицией" подразумевают композицию, содержащую активное средство, такое как sFGFR3 (например, полипептид sFGFR3 или его вариант, такой как полипептид с аминокислотной последовательностью под SEQ ID NO: 2, 4 или 33, или полипептид sFGFR3, содержащий сигнальный пептид, такой как полипептид с аминокислотной последовательностью под SEQ ID NO: 18 или 34), составленное по меньшей мере с одним фармацевтически приемлемым наполнителем, носителем или разбавителем. Фармацевтическую композицию можно производить или реализовывать с разрешения государственного регуляторного органа в качестве части терапевтической схемы лечения заболевания или явления (например, нарушения в виде задержки роста скелета, такого как ахондроплазия) у пациента (например, пациента с нарушением в виде задержки роста скелета, такого как пациент с ахондроплазией). Фармацевтические композиции могут быть составлены, например, для парентерального введения, как, например, для подкожного введения (например, путем подкожной инъекции), или внутривенного введения (например, в виде стерильного раствора, не содержащего эмболов в форме частиц, и в системе растворителей, подходящей для внутривенного применения), или для перорального введения (например, в виде таблетки, капсулы, капсуловидной таблетки, желатиновой капсулы или сиропа).
Используемый в данном документе термин "идентичность последовательностей" относится к процентной доле аминокислотных остатков (или остатков нуклеиновой кислоты) в последовательности-кандидате, например, полипептиде FGFR3, идентичных аминокислотным остаткам (или остаткам нуклеиновой кислоты) эталонной последовательности, например, полипептида sFGFR3 дикого типа (например, полипептида с аминокислотной последовательностью под SEQ ID NO: 5 или 32) или полипептида sFGFR3 (например, полипептида sFGFR3 или его варианта, такого как полипептид с аминокислотной последовательностью под SEQ ID NO: 2, 4 или 33, или полипептида sFGFR3, содержащего сигнальный пептид, такого как полипептид с аминокислотной последовательностью под SEQ ID NO: 18 или 34), после выравнивания последовательностей и, при необходимости, введения гэпов для достижения максимальной процентной идентичности (например, гэпы можно вводить в одну или обе из последовательности-кандидата и эталонной последовательности для оптимального выравнивания, и негомологичные последовательности можно не принимать во внимание для целей сравнения). Выравнивание в целях определения процентной идентичности можно осуществлять разными способами, которые находятся в рамках компетенции специалиста в данной области, например, с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, BLAST-P, BLAST-N, BLAST-X, WU-BLAST-2, ALIGN, ALIGN-2, CLUSTAL или Megalign (DNASTAR). Специалист в данной области сможет определить соответствующие параметры для оценки выравнивания, в том числе любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Например, процентная идентичность аминокислотной последовательности (или последовательности нуклеиновой кислоты) для указанной последовательности-кандидата в отношении указанной эталонной последовательности, с ней или в сравнении с ней (что в качестве альтернативы может быть сформулировано как определенная процентная идентичность аминокислотной последовательности (или последовательности нуклеиновой кислоты), которой характеризуется указанная последовательность-кандидат или которая предусматривается для нее в отношении указанной эталонной последовательности, с ней или в сравнении с ней) рассчитывается следующим образом:
100 x (частное A/B),
где A представляет собой количество аминокислотных остатков (или остатков нуклеиновой кислоты), отмеченных как идентичные при выравнивании последовательности-кандидата и эталонной последовательности, и где B представляет собой общее количество аминокислотных остатков (или остатков нуклеиновой кислоты) в эталонной последовательности. В частности, выравнивание эталонной последовательности с последовательностью-кандидатом в целях сравнения может показывать, что последовательность-кандидат демонстрирует, например, идентичность величиной от 50% до 100% по всей длине последовательности-кандидата или выбранной части из смежных аминокислотных остатков (или остатков нуклеиновой кислоты) последовательности-кандидата. Длина последовательности-кандидата, выровненной в целях сравнения, составляет по меньшей мере 30%, например, по меньшей мере 40%, например, по меньшей мере 50%, 60%, 70%, 80%, 90% или 100% длины эталонной последовательности. В тех случаях, когда положение в последовательности-кандидате занято таким же аминокислотным остатком (или остатком нуклеиновой кислоты), что и соответствующее положение в эталонной последовательности, молекулы являются идентичными по данному положению.
Под "сигнальным пептидом" подразумевают короткий пептид (например, длиной 5-30 аминокислот, как, например, длиной 22 аминокислоты) на N-конце полипептида, который направляет полипептид по секреторному пути (например, во внеклеточное пространство). Сигнальный пептид, как правило, отщепляется во время секреции полипептида. Сигнальная последовательность может направлять полипептид во внутриклеточные компартмент или органеллу, например, в аппарат Гольджи. Сигнальная последовательность может быть идентифицирована по гомологии или сходной биологической активности с пептидом с известной функцией нацеливания полипептида на конкретный участок клетки. Специалист в данной области может идентифицировать сигнальный пептид путем применения легкодоступного программного обеспечения (например, пакета программ для анализа последовательностей от Genetics Computer Group, Биотехнологический центр Висконсинского университета, 1710 University Avenue, Мэдисон, Висконсин 53705, программ BLAST или PILEUP/PRETTYBOX). Сигнальный пептид может быть, например, фактически идентичным аминокислотной последовательности под SEQ ID NO: 6 или 35.
Термин "нарушение в виде задержки роста скелета", используемый в данном документе, относится к заболеванию скелета, характеризующемуся деформациями и/или мальформациями костей. Данные нарушения включают без ограничения нарушения в виде задержки роста скелета, вызванные переломами в области пластинки роста (эпифизеолизом), идиопатические нарушения в виде задержки роста скелета или заболевания скелета, связанные с FGFR3. В частности, пациент с нарушением в виде задержки роста скелета (например, ахондроплазией), может иметь кости, более короткие, чем кости здорового пациента. Например, нарушение в виде задержки роста скелета может включать в себя дисплазию скелета, например, ахондроплазию, гомозиготную ахондроплазию, гетерозиготную ахондроплазию, ахондрогенез, акродизостоз, акромезомелическую дисплазию, ателостеогенез, камптомелическую дисплазию, точечную эпифизарную дисплазию, точечную эпифизарную дисплазию тазобедренного сустава, ключично-черепной дизостоз, врожденное укорочение бедренной кости, краниосиностоз (например, синдром Мюнке, синдром Крузона, синдром Аперта, синдром Джексона-Вейсса, синдром Пфайффера или синдром Крузона с черным акантозом), дактилию, брахидактилию, камптодактилию, полидактилию, синдактилию, диастрофическую дисплазию, карликовость, диссегментарную дисплазию, энхондроматоз, фиброхондрогенез, фиброзную дисплазию, множественные костно-хрящевые экзостозы, гипохондроплазию, гипофосфатазию, гипофосфатемический рахит, синдром Яффе-Лихтенстайна, дисплазию Книста, синдром Книста, мезомелическую дисплазию типа Лангера, синдром Марфана, синдром МакКьюна-Олбрайта, микромелию, метафизарную остеодисплазию, метафизарную остеодисплазию типа Янсена, метатрофную дисплазию, синдром Моркио, мезомелическую дисплазию типа Нивергельта, нейрофиброматоз, остеоартрит, остеохондродисплазию, несовершенный остеогенез, перинатальный смертельный тип несовершенного остеогенеза, остеопетроз, остеопойкилоз, периферийный дизостоз, синдром Рейнхардта, синдром Робертса, синдром Робинова, формы синдрома коротких ребер-полидактилии, низкорослость, врожденную спондилоэпифизарную дисплазию и спондилоэпиметафизарную остеодисплазию.
Термины "растворимый рецептор 3 фактора роста фибробластов", "растворимый FGFR3" и "sFGFR3" относятся к FGFR3, который характеризуется отсутствием или нарушением функции всего трансмембранного домена или его значительной части и любой части полипептида, которая заякоривает полипептид FGFR3 на клеточной мембране (например, тирозинкиназного домена). Полипептид sFGFR3 представляет собой немембраносвязанную форму полипептида FGFR3. В частности, трансмембранный домен FGFR3 включает в себя аминокислотные остатки 345-377 последовательности FGFR3 дикого типа (например, полипептида с аминокислотной последовательностью под SEQ ID NO: 5) или аминокислотные остатки 367-399 последовательности FGFR3 дикого типа, содержащего сигнальный пептид (например, полипептида с аминокислотной последовательностью под SEQ ID NO: 32). Таким образом, полипептид sFGFR3 может содержать делецию части или всех аминокислотных остатков 345-377 полипептидной последовательности FGFR3 дикого типа (например, полипептида с аминокислотной последовательностью под SEQ ID NO: 5) или аминокислотных остатков 367-399 последовательности FGFR3 дикого типа, содержащего сигнальный пептид (например, полипептида с аминокислотной последовательностью под SEQ ID NO: 32). Полипептид sFGFR3 может дополнительно содержать делеции цитоплазматического домена полипептидной последовательности FGFR3 дикого типа (аминокислотных остатков 378-784 SEQ ID NO: 5) или полипептидной последовательности FGFR3 дикого типа, содержащей последовательность сигнального пептида (аминокислотных остатков 378-806 SEQ ID NO: 32).
Иллюстративные полипептиды sFGFR3 могут содержать без ограничения по меньшей мере аминокислоты 1-100, 1-125, 1-150, 1-175, 1-200, 1-205, 1-210, 1-215, 1-220, 1-225, 1-230, 1-235, 1-240, 1-245, 1-250, 1-252, 1-255, 1-260, 1-265, 1-270, 1-275, 1-280, 1-285, 1-290, 1-295, или 1-300, или 1-301 SEQ ID NO: 1 или 2. Полипептиды sFGFR3 могут включать в себя любой полипептид, характеризующийся по меньшей мере 50% (например, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или большей) идентичностью последовательности с любым из этих полипептидов sFGFR3 под SEQ ID NO: 1 или 2. Кроме того, иллюстративные полипептиды sFGFR3 могут содержать без ограничения по меньшей мере аминокислоты 1-100, 1-125, 1-150, 1-175, 1-200, 1-205, 1-210, 1-215, 1-220, 1-225, 1-230, 1-235, 1-240, 1-245, 1-250, 1-255, 1-260, 1-265, 1-270, 1-275, 1-280, 1-285, 1-290, 1-295, 1-300, 1-305, 1-310, 1-315, 1-320, 1-325, 1-330, 1-335, 1-340, 1-345 или 1-348 SEQ ID NO: 4 или 33. Полипептиды sFGFR3 могут включать в себя любой полипептид, характеризующийся по меньшей мере 50% (например, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или большей) идентичностью последовательности с любым из этих полипептидов sFGFR3 с аминокислотной последовательностью под SEQ ID NO: 4 или 33. Любой из указанных выше полипептидов sFGFR3 или их вариантов необязательно может содержать сигнальный пептид в N-концевом положении, как, например, аминокислоты 1-22 SEQ ID NO: 6 (MGAPACALALCVAVAIVAGASS) или аминокислоты 1-19 SEQ ID NO: 35 (например, MMSFVSLLLVGILFHATQA).
Под "осуществлением лечения" и "лечением" подразумевают снижение (например, по меньшей мере на приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90%, приблизительно 95%, приблизительно 99% или даже 100%) темпов прогрессирования или степени тяжести нарушения в виде задержки роста скелета (например, ахондроплазии) или темпов прогрессирования, степени тяжести или частоты возникновения одного или нескольких симптомов нарушения в виде задержки роста скелета (например, ахондроплазии) у пациента (например, человека, такого как младенец, ребенок или подросток). Лечение может происходить в течение периода лечения, при котором полипептид sFGFR3 вводят в течение определенного периода времени (например, нескольких дней, месяцев, лет или дольше) для лечения пациента (например, человека, такого как младенец, ребенок или подросток) с нарушением в виде задержки роста скелета, таким как ахондроплазия. Иллюстративные симптомы ахондроплазии, которые можно лечить с помощью sFGFR3 (например, полипептида sFGFR3 или его варианта, такого как полипептид с аминокислотной последовательностью под SEQ ID NO: 2, 4 или 33, или полипептида sFGFR3, содержащего сигнальный пептид, такого как полипептид с аминокислотной последовательностью под SEQ ID NO: 18 или 34), включают без ограничения низкий рост, длинное туловище, укороченные конечности, рост во взрослом возрасте от приблизительно 42 до приблизительно 56 дюймов, относительно большую голову, выпуклый лоб, недоразвитые части лица, вальгусную деформацию коленных суставов (например, X-образные ноги), утиную походку, короткие и толстые пальцы рук, короткие и толстые пальцы ног, ограниченную способность разгибать руку в локтевом суставе, чрезмерный изгиб поясницы, проблемы с зубами (например, в результате скученности зубов), проблемы с контролем веса тела, неврологические проблемы, респираторные проблемы и/или боль и онемение в пояснице и/или позвоночнике.
Термин "вариант" в отношении полипептида относится к полипептиду (например, полипептиду sFGFR3 или его варианту, такому как полипептид с аминокислотной последовательностью под SEQ ID NO: 2, 4 или 33, или полипептиду sFGFR3, содержащему сигнальный пептид, такому как полипептид с аминокислотной последовательностью под SEQ ID NO: 18 или 34), который отличается одним или несколькими изменениями в аминокислотной последовательности от полипептида, из которого получен вариант (например, исходного полипептида, такого как полипептид с аминокислотной последовательностью под SEQ ID NO: 1 или 7). Термин "вариант" в отношении полинуклеотида относится к полинуклеотиду (например, полинуклеотиду, кодирующему полипептид sFGFR3, такому как полинуклеотид с последовательностью нуклеиновой кислоты под SEQ ID NO: 20, 21, 36 или 37), который отличается одним или несколькими изменениями в последовательности нуклеиновой кислоты от полинуклеотида, из которого получен вариант (например, исходного полинуклеотида). Изменения в аминокислотной последовательности или последовательности нуклеиновой кислоты варианта могут представлять собой, например, замены, вставки, делеции, N-концевые усечения или C-концевые усечения аминокислот или нуклеиновых кислот или любую их комбинацию. В частности, аминокислотные замены могут быть консервативными и/или неконсервативными заменами. Вариант может характеризоваться идентичностью аминокислотной последовательности или идентичностью последовательности нуклеиновой кислоты с исходным полипептидом (например, полипептидом sFGFR3 или его вариантом, таким как полипептид с аминокислотной последовательностью под SEQ ID NO: 2, 4 или 33, или полипептидом sFGFR3, содержащим сигнальный пептид, таким как полипептид с аминокислотной последовательностью под SEQ ID NO: 18 или 34) или исходным полинуклеотидом (например, полинуклеотидом, кодирующим полипептид sFGFR3, такой как полинуклеотид с последовательностью нуклеиновой кислоты под SEQ ID NO: 20, 21, 36 или 37) соответственно. Например, вариант может включать в себя любой полипептид, характеризующийся по меньшей мере 50% (например, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или большей) идентичностью последовательности с полипептидом с аминокислотной последовательностью под SEQ ID NO: 1, 2, 4 или 33. Вариант также может включать в себя любой полинуклеотид, характеризующийся по меньшей мере 50% (например, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или большей) идентичностью последовательности с полинуклеотидом с последовательностью нуклеиновой кислоты под SEQ ID NO: 20, 21, 36 или 37.
Под "вектором" подразумевают ДНК-конструкцию, которая содержит один или несколько полинуклеотидов или их фрагментов, кодирующих полипептид sFGFR3 (например, полипептид sFGFR3 или его вариант, такой как полипептид с аминокислотной последовательностью под SEQ ID NO: 2, 4 или 33, или полипептид sFGFR3, содержащий сигнальный пептид, такой как полипептид с аминокислотной последовательностью под SEQ ID NO: 18 или 34). Вектор можно использовать для инфицирования клетки (например, клетки-хозяина или клетки пациента-человека с нарушением в виде задержки роста скелета, таким как ахондроплазия), в результате чего происходит трансляция полинуклеотидов вектора в полипептид sFGFR3. Одним типом вектора является "плазмида", которая относится к кольцевой двухнитевой ДНК-петле, с которой могут быть лигированы дополнительные сегменты ДНК. Определенные векторы способны к автономной репликации в клетке-хозяине, в которую их вводят (например, бактериальные векторы с бактериальной точкой начала репликации и эписомальные векторы экспрессии в клетках млекопитающих). Другие векторы (например, неэписомальные векторы экспрессии в клетках млекопитающих) могут интегрироваться в геном клетки-хозяина при введении в клетку-хозяина, и благодаря этому они реплицируются вместе с геномом хозяина. Более того, определенные векторы способны управлять экспрессией генов, с которыми они функционально связаны. В целом, векторы экспрессии, полезные в методиках с использованием рекомбинантных ДНК, часто находятся в форме плазмид.
Термин "единичная(единичные) лекарственная(лекарственные) форма(формы)" относится к физически дискретной(дискретным) единице(единицам), подходящим в качестве однократных доз для субъектов-людей и других млекопитающих, при этом каждая единица содержит заранее определенное количество активного материала, рассчитанное для получения необходимого терапевтического эффекта, совместно с любым подходящим фармацевтическим наполнителем, носителем или разбавителем.
Предполагается, что перечисление в данном документе числовых диапазонов с помощью конечных точек охватывает все числовые значения, входящие в этот диапазон (например, перечисление 1-5 охватывает 1, 1,5, 2, 2,75, 3, 3,80, 4 и 5).
Другие признаки и преимущества настоящего изобретения будут очевидны из изложенного ниже подробного описания и из формулы изобретения.
КРАТКОЕ ОПИСАНИЕ НЕКОТОРЫХ ИЗОБРАЖЕНИЙ ГРАФИЧЕСКИХ МТЕРИАЛОВ
Фиг. 1A-1D представляют собой графики, на которых показаны сенсограммы полипептидов sFGFR3.
Сенсограммы показаны для sFGFR3_Del1 (SEQ ID NO: 7), sFGFR3_Del4 (SEQ ID NO: 1) и sFGFR3_Del4-LK1-LK2 (SEQ ID NO: 10; фиг. 1A); sFGFR3_Del1 (SEQ ID NO: 7) и sFGFR3_Del1-D3 (SEQ ID NO: 9; фиг. 1B); sFGFR3_Del4-LK1-LK2 (SEQ ID NO: 10), sFGFR3_Del4-LK1-LK2-C253S (SEQ ID NO: 11) и sFGFR3_Del4-LK1-LK2-D3 (SEQ ID NO: 12; фиг. 1C); а также sFGFR3_Del4 (SEQ ID NO: 1), sFGFR3_Del4-C253S (SEQ ID NO: 2) и sFGFR3_Del4-D3 (SEQ ID NO: 33; фиг. 1D).
Фиг. 2A-2C представляют собой изображения картин вестерн-блоттинга полипептидов sFGFR3. Картины вестерн-блоттинга в восстанавливающих (R) и невосстанавливающих (NR) условиях показаны для sFGFR3_Del1, sFGFR3_Del1-C253S (SEQ ID NO: 8) и sFGFR3_Del1-D3 (фиг. 2A); sFGFR3_Del4-LK1-LK2, sFGFR3_Del4-LK1-LK2-C253S и sFGFR3_Del4-LK1-LK2-D3 (фиг. 2B) и sFGFR3_Del4, sFGFR3_Del4-C253S и sFGFR3_Del4-D3 (фиг. 2C).
Фиг. 3A-3B представляют собой графики, на которых показана сенсограмма (фиг. 3A) и анализы пролиферации для sFGFR3_Del4, sFGFR3_Del4-C253S и sFGFR3_Del4-D3 (фиг. 3B) с использованием клеток-хондроцитов Fgfr3ach/+ в присутствии FGF2.
Фиг. 4 представляет собой график, на котором показана отслеживаемая с помощью люциферазы передача сигнала в клетках HEK с конструкцией элемент ответа на сыворотку-люцифераза (SRE-Luc), экспрессирующих FGFR3G380R, которые инкубировали с sFGFR3_Del4-D3 при 0 нМ, 70 нМ и 280 нМ с 1 нг/мл hFGF2 или без него (* указывает на p-значение < 0,05; *** указывает на p-значение < 0,001 по сравнению с sFGFR3_Del4-D3 при 0 нМ).
Фиг. 5 представляет собой график, на котором показана процентная доля живых животных (мышей дикого типа (wt) и Fgfr3ach/+) через 3 дня лечения с помощью низкой дозы (0,25 мг/кг) sFGFR3_Del4-D3 относительно возраста (дней). Также показана процентная доля живых мышей wt, получавших инертную среду (PBS).
Фиг. 6 представляет собой изображение, на котором показаны аминокислотные остатки, соответствующие Ig-подобным доменам 1 (IgI), 2 (IgII) и 3 (IgIII) C2-типа полипептида FGFR3 дикого типа (SEQ ID NO: 5 или 32), sFGFR3_Del4-C253S (SEQ ID NO: 2) и варианта sFGFR3_Del4-D3 (SEQ ID NO: 33). sFGFR3_Del4-C253S содержит аминокислотную замену цистеинового остатка сериновым остатком в положении 253 SEQ ID NO: 1.
Фиг. 7A-7B представляют собой изображения картин вестерн-блоттинга полипептидов sFGFR3. Картины вестерн-блоттинга в восстанавливающих (R) и невосстанавливающих (NR) условиях показаны для 2,3 мг/мл и 23 мг/мл sFGFR3_Del1-D3 (фиг. 7A) и 1,5 мг/мл и 15 мг/мл sFGFR3_Del1-C253S (фиг. 7B).
Фиг. 8A-8B представляют собой графики, на которых показана температура плавления (Tm) sFGFR3_Del4-C253S в буфере с 20 мМ фосфата, 40 мМ NaCl, pH 7,5 и буфере с 40 мМ цитрата, 40 мМ NaCl, pH 6,5 (фиг. 8A) и Tm sFGFR3_Del4-D3 в буфере с 20 мМ фосфата, 40 мМ NaCl, pH 7,5 и буфере с 20 мМ цитрата, 40 мМ NaCl, pH 6,5 (фиг. 8B).
Фиг. 9A-9C представляют собой графики, на которых показаны профили элюирования в ходе жидкостной экспресс-хроматографии белков (FPLC) sFGFR3_Del4-D3. Профили элюирования в ходе FPLC показаны на фиг. 9A: sFGFR3_Del4-D3 через 0 минут, 2 часа и 24 часа в имп./мин./фракция (фиг. 9A); фиг. 9B: sFGFR3_Del4-D3, введенный путем внутривенного болюсного введения, через 1 минуту, 15 минут, 30 минут, 2 часа и 24 часа в имп./мин./фракция и нормализованный по наивысшему пику (показан на фиг. 9B (продолжение)); фиг. 9C: sFGFR3_Del4-D3, введенный путем подкожной инъекции, через 30 минут, 2 часа, 4 часа и 24 часа в имп./мин./фракция и нормализованный по наивысшему пику (показан на фиг. 9C (продолжение)).
Фиг. 10A-10B представляют собой графики, на которых показано процентное значение (%) пролиферации клеток-хондроцитов Fgfr3ach/+ в присутствии полипептидов sFGFR3. Пролиферация хондроцитов Fgfr3ach/+ показана для 1 мкг/мл, 10 мкг/мл и 50 мкг/мл sFGFR3_Del4-D3 (фиг. 10A) и для 1 мкг/мл, 10 мкг/мл и 50 мкг/мл sFGFR3_Del4-C253S (фиг. 10B).
Фиг. 11 представляет собой график, на котором показаны PK-профили 2,5 мг/кг sFGFR3_Del4-D3, введенного подкожно, и 2,5 мг/кг sFGFR3_Del4-D3, введенного внутривенно.
Фиг. 12 представляет собой график, на котором показана концентрация 125I-sFGFR3_Del4-D3 в ткани почек, печени, селезенки, легких и сердца через 30 минут, 120 минут и 1440 минут после внутривенного введения. Концентрация выражена в виде процента инъецированной дозы на грамм (% ID/г).
Фиг. 13 представляет собой график, на котором показана концентрация 125I-sFGFR3_Del4-D3 в ткани почек, печени, селезенки, легких и сердца через 30 минут, 120 минут, 240 минут, 480 минут и 1440 минут после подкожного введения. Концентрация выражена в виде % ID/г.
Фиг. 14A-14B представляют собой графики, на которых показаны концентрация (c) и объем распределения (Vd) 125I-sFGFR3_Del4-D3 в ткани головного мозга. Показаны c 125I-sFGFR3_Del4-D3 до и после поправки на содержание в сосудах и распад через 30 минут, 2 часа и 24 часа после внутривенного болюсного введения (фиг. 14A) и Vd 125I-sFGFR3_Del4-D3 и RSA через 30 минут, 2 часа и 24 часа после внутривенного болюсного введения (фиг. 14B).
Фиг. 15 представляет собой график, на котором показана процентная доля выживших мышей Fgfr3ach/+, которым вводили sFGFR3_Del4-D3. Показаны выжившие мыши дикого типа, мыши Fgfr3ach/+, которым вводили PBS в качестве инертной среды, мыши Fgfr3ach/+, которым вводили 2,5 мг/кг sFGFR3_Del4-D3 один раз в неделю, мыши Fgfr3ach/+, которым вводили 2,5 мг/кг sFGFR3_Del4-D3 два раза в неделю, и мыши Fgfr3ach/+, которым вводили 10 мг/кг sFGFR3_Del4-D3 два раза в неделю в течение 22 дней.
Фиг. 16 представляет собой график, на котором показана процентная доля (%) мышей Fgfr3ach/+, которым вводили PBS в качестве инертной среды, 2,5 мг/кг sFGFR3_Del4-D3 один раз в неделю, 2,5 мг/кг sFGFR3_Del4-D3 два раза в неделю и 10 мг/кг sFGFR3_Del4-D3 два раза в неделю, имеющих осложнения со стороны двигательной активности и брюшного дыхания.
Фиг. 17A-17D представляют собой графики и рентгенограмму, на которых показаны промеры длины мышей Fgfr3ach/+, которым вводили sFGFR3_Del4-D3. Показаны осевая длина тела (фиг. 17A), длина хвоста (фиг. 17B) и длина большеберцовой кости (фиг. 17C) мышей дикого типа, которым вводили PBS в качестве инертной среды, и мышей Fgfr3ach/+, которым вводили PBS в качестве инертной среды, 2,5 мг/кг sFGFR3_Del4-D3 один раз в неделю, 2,5 мг/кг sFGFR3_Del4-D3 два раза в неделю и 10 мг/кг sFGFR3_Del4-D3 два раза в неделю. Также показана рентгенограмма (фиг. 17D) мышей дикого типа, которым вводили PBS в качестве инертной среды, и мышей Fgfr3ach/+, которым вводили PBS в качестве инертной среды, 2,5 мг/кг sFGFR3_Del4-D3 два раза в неделю и 10 мг/кг sFGFR3_Del4-D3 два раза в неделю. Все измеренные значения указаны в миллиметрах (мм).
Фиг. 18A-18B представляют собой соответственно график, на котором показан головной указатель, и рентгенограмму, на которой показаны черепа мышей Fgfr3ach/+, которым вводили sFGFR3_Del4-D3. На графике показан (фиг. 18A) головной указатель (L/W) мышей дикого типа, которым вводили PBS в качестве инертной среды, и мышей Fgfr3ach/+, которым вводили PBS в качестве инертной среды, 2,5 мг/кг sFGFR3_Del4-D3 один раз в неделю, 2,5 мг/кг sFGFR3_Del4-D3 два раза в неделю и 10 мг/кг sFGFR3_Del4-D3 два раза в неделю. На рентгенограмме показаны (фиг. 18B) черепа мышей дикого типа, которым вводили PBS в качестве инертной среды, мышей Fgfr3ach/+, которым вводили PBS в качестве инертной среды, мышей дикого типа, которым вводили 10 мг/кг sFGFR3_Del4-D3 два раза в неделю, и мышей Fgfr3ach/+, которым вводили 10 мг/кг sFGFR3_Del4-D3 два раза в неделю.
Фиг. 19A-19E представляют собой графики, на которых показан кинетический профиль связывания hFGF1, FGF2, hFGF9, hFGF18, hFGF19 и hFGF21 в разных концентрациях с иммобилизованным SFGFR3_DEL4-D3 в режиме реального времени. Показаны кинетические профили для связывания hFGF1 в концентрациях от 0,5 нМ до 12 нМ с иммобилизованным SFGFR3_DEL4-D3 (фиг. 19A); hFGF2 в концентрациях от 2 нМ до 10 нМ с иммобилизованным SFGFR3_DEL4-D3 (фиг. 19B); hFGF9 в концентрациях от 1 нМ до 5 нМ с иммобилизованным SFGFR3_DEL4-D3 (фиг. 19C); hFGF18 в концентрациях от 1 нМ до 10 нМ с иммобилизованным SFGFR3_DEL4-D3 (фиг. 19D); hFGF19 в концентрациях от 2 нМ до 20 нМ с иммобилизованным SFGFR3_DEL4-D3 (фиг. 19E) и hFGF21 в концентрациях от 100 нМ до 10000 нМ с иммобилизованным SFGFR3_DEL4-D3 (фиг. 19F). Более темные накладывающиеся линии представляют модель связывания 2:1, используемую для получения значений Kd.
Фиг. 20 представляет собой изображение картины вестерн-блоттинга с использованием неиндуцированных клеток ATDC5 дикого типа и инфицированных ретровирусом клеток ATDC5, экспрессирующих FGFR3G380R.
Фиг. 21 представляет собой график, на котором показана индукция пролиферации клеток ATDC5 FGFR3G380R в присутствии SFGFR3_DEL4-D3 в рамках трех экспериментов. Необработанные клетки ATDC5 FGFR3G380R использовали в качестве контроля.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения обнаружили, что полипептиды, являющиеся растворимыми рецепторами 3 фактора роста фибробластов (sFGFR3), и их варианты можно применять для лечения нарушений в виде задержки роста скелета, таких как ахондроплазия, у пациента (например, человека, в частности младенца, ребенка или подростка). В частности, полипептиды sFGFR3 по настоящему изобретению предусматривают делецию, например, аминокислот 289-400 SEQ ID NO: 5 или аминокислот 311-422 SEQ ID NO: 32 с получением следующих иллюстративных полипептидов sFGFR3: sFGFR3_Del4, содержащего аминокислотную замену цистеинового остатка сериновым остатком в положении 253 (sFGFR3_Del4-C253S; SEQ ID NO: 2), и sFGFR3_Del4, содержащего удлиненный Ig-подобный домен 3 C2-типа (sFGFR3_Del4-D3; SEQ ID NO: 33), а также их вариантов, таких как полипептид sFGFR3 с аминокислотной последовательностью под SEQ ID NO: 4. Кроме того, полипептиды sFGFR3 могут содержать сигнальный пептид, как, например, полипептид sFGFR3 с аминокислотной последовательностью под SEQ ID NO: 18 или 34. См. предварительную заявку на патент США № 62/276222 и международную заявку № PCT/US16/12553 в отношении описания sFGFR3_Del4 (SEQ ID NO: 1), каждая из которых настоящим включена в данный документ посредством ссылки во всей своей полноте.
Например, полипептиды sFGFR3 и их варианты, характеризующиеся по меньшей мере 85% идентичностью последовательности (например, по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности) с аминокислотной последовательностью под SEQ ID NO: 1, могут содержать аминокислотную замену, при которой удаляется цистеиновый остаток в положении 253 SEQ ID NO: 1 (например, sFGFR3_Del4-C253S; полипептид с аминокислотной последовательностью под SEQ ID NO: 2). В частности, полипептид sFGFR3 по настоящему изобретению может содержать замену цистеинового остатка в положении 253 SEQ ID NO: 1, например, сериновым остатком. Например, в положении 253 цистеиновый остаток заменен сериновым остатком или, например, подвергнут другой консервативной аминокислотной замене, как, например, аланином, глицином, пролином или треонином.
Полипептиды sFGFR3 также могут содержать полипептидную последовательность, характеризующуюся по меньшей мере 90% (например, по меньшей мере 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности) идентичностью аминокислотной последовательности с аминокислотными остатками 23-357 SEQ ID NO: 32, при этом у полипептида отсутствует сигнальный пептид и трансмембранный домен FGFR3, и он (i) имеет длину менее 500 аминокислот; (ii) содержит 200 или меньше последовательных аминокислот внутриклеточного домена FGFR3; и/или (iii) у него отсутствует тирозинкиназный домен FGFR3 (например, sFGFR3_Del4-D3; полипептид с аминокислотной последовательностью под SEQ ID NO: 33). Также описаны способы введения полипептидов sFGFR3 по настоящему изобретению для лечения нарушений в виде задержки роста скелета (например, ахондроплазии), у пациента (например, человека, в частности младенца, ребенка или подростка).
В данном документе описаны полипептиды sFGFR3, способы получения, способы лечения, композиции и наборы по настоящему изобретению.
Полипептиды, являющиеся растворимыми рецепторами 3 фактора роста фибробластов (sFGFR3)
Настоящее изобретение предусматривает полипептиды sFGFR3 и их варианты, составленные для лечения нарушений в виде задержки роста скелета (например, ахондроплазии). В частности, полипептиды sFGFR3 могут характеризоваться по меньшей мере 85% идентичностью последовательности (например, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности) с аминокислотной последовательностью под SEQ ID NO: 1, при этом полипептид sFGFR3 содержит аминокислотную замену, при которой удаляется цистеиновый остаток в положении 253 SEQ ID NO: 1 (например, sFGFR3_Del4-C253S; полипептид с аминокислотной последовательностью под SEQ ID NO: 2). Например, в положении 253 SEQ ID NO: 1 цистеиновый остаток заменен сериновым остатком или подвергнут консервативной аминокислотной замене, как, например, аланином, глицином, пролином или треонином.
Полипептиды sFGFR3 и их варианты также могут содержать фрагменты аминокислотной последовательности под SEQ ID NO: 2 (например, по меньшей мере аминокислоты 1-200, 1-205, 1-210, 1-215, 1-220, 1-225, 1-235, 1-230, 1-240, 1-245, 1-250, 1-253, 1-255, 1-260, 1-265, 1-275, 1-280, 1-285, 1-290 или 1-300 SEQ ID NO: 2), характеризующейся по меньшей мере 50% идентичностью последовательности (например, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности) с SEQ ID NO: 2. Кроме того, полипептиды sFGFR3 могут содержать аминокислоты 1-301 SEQ ID NO: 1, при этом полипептид sFGFR3 содержит аминокислотную замену цистеинового остатка сериновым остатком в положении 253 SEQ ID NO: 1 (например, полипептид с аминокислотной последовательностью под SEQ ID NO: 2).
Полипептиды sFGFR3 и их варианты также могут содержать фрагменты аминокислотной последовательности под SEQ ID NO: 33 (например, по меньшей мере аминокислоты 1-200, 1-210, 1-220, 1-230, 1-240, 1-250, 1-260, 1-270, 1-280, 1-290, 1-300, 1-310, 1-320, 1-330, 1-340, 1-340 или 1-345 SEQ ID NO: 33), характеризующейся по меньшей мере 50% идентичностью последовательности (например, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности) с SEQ ID NO: 33. Кроме того, в положении 253 SEQ ID NO: 4 или 33 и/или положении 316 SEQ ID NO: 4 цистеиновый остаток в случае его наличия может быть заменен сериновым остатком или подвергнут консервативной аминокислотной замене, как, например, аланином, глицином, пролином или треонином.
С учетом результатов, описанных в данном документе, настоящее изобретение не ограничено конкретным полипептидом sFGFR3 или его вариантами. В дополнение к иллюстративным полипептидам sFGFR3 и их вариантам, обсуждаемым выше, любой полипептид, который связывает один или несколько FGF (например, FGF1 (например, полипептид с аминокислотной последовательностью под SEQ ID NO: 13), FGF2 (например, полипептид с аминокислотной последовательностью под SEQ ID NO: 14), FGF9 (например, полипептид с аминокислотной последовательностью под SEQ ID NO: 15), FGF18 (например, полипептид с аминокислотной последовательностью под SEQ ID NO: 16), FGF19 (например, полипептид с аминокислотной последовательностью под SEQ ID NO: 38) и/или FGF21 (например, полипептид с аминокислотной последовательностью под SEQ ID NO: 39)) с аффинностью связывания, сходной с аффинностью связывания полипептидов sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их вариантов (SEQ ID NO: 4) или полипептида sFGFR3, содержащего сигнальный пептид (SEQ ID NO: 18 или 34)), можно применять в способах, как, например, для лечения нарушения в виде задержки роста скелета, например, ахондроплазии. Полипептиды sFGFR3 могут представлять собой, например, фрагменты изоформы 2 FGFR3 без экзонов 8 и 9, кодирующих C-концевую половину Ig-подобного домена 3 C2-типа, и экзона 10, кодирующего трансмембранный домен (например, фрагменты аминокислотной последовательности под SEQ ID NO: 5 или 32), соответствующие фрагментам варианта 2 транскрипта FGFR3 (номер доступа NM_022965).
Полипептид sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4)) могут содержать сигнальный пептид в N-концевом положении. Иллюстративный сигнальный пептид может содержать без ограничения аминокислоты 1-22 SEQ ID NO: 6 (например, MGAPACALALCVAVAIVAGASS) или аминокислоты 1-19 SEQ ID NO: 35 (например, MMSFVSLLLVGILFHATQA). Соответственно, полипептиды sFGFR3 включают в себя как секретируемые формы, у которых отсутствует N-концевой сигнальный пептид, так и несекретируемые формы, которые содержат N-концевой сигнальный пептид. Например, секретируемый полипептид sFGFR3 может содержать аминокислотную последовательность под SEQ ID NO: 2, 4 или 33. В качестве альтернативы, полипептид sFGFR3 все же содержит сигнальный пептид, как, например, аминокислотная последовательность под SEQ ID NO: 18, 19 или 34. Специалисту в данной области будет понятно, что положение N-концевого сигнального пептида будет варьироваться в различных полипептидах sFGFR3, и он может содержать, например, первые 5, 8, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 27, 30 или больше аминокислотных остатков на N-конце полипептида. Специалист в данной области может предсказать положение сайта отщепления сигнальной последовательности, например, с помощью соответствующих компьютерных алгоритмов, таких как описанные в Bendtsen et al. (J. Mol. Biol. 340(4):783-795, 2004) и доступны во Всемирной сети по адресу cbs.dtu.dk/services/SignalP/.
Кроме того, полипептиды sFGFR3 (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4) или полипептид sFGFR3, содержащий сигнальный пептид (SEQ ID NO: 18 или 34)) по настоящему изобретению могут быть гликозилированными. В частности, полипептид sFGFR3 можно изменять в целях увеличения или уменьшения степени гликозилирования полипептида sFGFR3. Добавление или делецию сайтов гликозилирования в полипептиде sFGFR3 можно выполнять путем изменения аминокислотной последовательности таким образом, чтобы создавались или удалялись один или несколько сайтов гликозилирования. Например, N-связанное гликозилирование, при котором олигосахарид присоединен к атому азота амидной группы аспарагинового остатка, может происходить в положении Asn76, Asn148, Asn169, Asn 203, Asn240, Asn272 и/или Asn 294 аминокислотной последовательности sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 4 или 33) и их вариантов. Один или несколько из этих остатков Asn также могут быть заменены с удалением сайта гликозилирования. Например, O-связанное гликозилирование, при котором олигосахарид прикреплен к атому кислорода аминокислотного остатка, может происходить в положении Ser109, Thr126, Ser199, Ser274, Thr281, Ser298, Ser299 и/или Thr301 аминокислотной последовательности sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33), их вариантов (SEQ ID NO: 4), а также полипептидов sFGFR3, содержащих сигнальный пептид (SEQ ID NO: 18 или 34). Кроме того, O-связанное гликозилирование может происходить в положении Ser310 и/или Ser321 sFGFR3_Del4-D3 (SEQ ID NO: 33) и его вариантов (SEQ ID NO: 4). Один или несколько из этих остатков Ser или Thr также могут быть заменены с удалением сайта гликозилирования.
Слитые полипептиды на основе sFGFR3
Полипептиды sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4) или полипептид sFGFR3, содержащий сигнальный пептид (SEQ ID NO: 18 или 34)) могут быть слиты с функциональным доменом гетерологичного полипептида (например, участком, представляющим собой кристаллизующийся фрагмент иммуноглобулина (Fc-участком; таким как полипептид с аминокислотной последовательностью под SEQ ID NO: 25 и 26) или человеческим сывороточным альбумином (HSA; таким как полипептид с аминокислотной последовательностью под SEQ ID NO: 27)) с получением слитого полипептида на основе sFGFR3. Между полипептидом sFGFR3 и гетерологичным полипептидом (например, Fc-участком или HSA) необязательно может содержаться гибкий линкер, такой как последовательность, богатая серином или глицином (например, полиглициновый или полиглициновый/полисериновый линкер, такой как SEQ ID NO: 28 и 29).
Например, полипептиды sFGFR3 (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4) или полипептид sFGFR3, содержащий сигнальный пептид (SEQ ID NO: 18 или 34)) могут представлять собой слитые полипептиды, содержащие, например, Fc-участок иммуноглобулина в области N-концевого или C-концевого домена. В частности, применимые Fc-участки могут включать в себя Fc-фрагмент любой молекулы иммуноглобулина, в том числе IgG, IgM, IgA, IgD или IgE и их различных подклассов (например, IgG-1, IgG-2, IgG-3, IgG-4, IgA-1, IgA-2), от любого млекопитающего (например, человека). Например, это относится к Fc-фрагменту IgG-1 человека (SEQ ID NO: 25) или варианта IgG-1 человека, как, например, варианта, содержащего замену аспарагина в положении 297 SEQ ID NO: 25 аланином (например, полипептиду с аминокислотной последовательностью под SEQ ID NO: 26). Fc-фрагменты по настоящему изобретению могут содержать, например, CH2- и CH3-домены тяжелой цепи и любую часть шарнирного участка. Слитые полипептиды на основе sFGFR3 по настоящему изобретению также могут содержать, например, мономерный Fc, такой как CH2- или CH3-домен. Fc-участок необязательно может быть гликозилированным по любым одному или нескольким подходящим аминокислотным остаткам, известным специалисту в данной области. Fc-фрагмент, описанный в данном документе, может характеризоваться 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 50 или большим количеством добавлений, делеций или замен по сравнению с любым из Fc-фрагментов, описанных в данном документе.
Кроме того, полипептиды sFGFR3 (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4) или полипептид sFGFR3, содержащий сигнальный пептид (SEQ ID NO: 18 или 34)) могут быть конъюгированы с другими молекулами в области N-концевого или C-концевого домена в целях улучшения растворимости и стабильности белка в водном растворе. Примеры таких молекул включают человеческий сывороточный альбумин (HSA), PEG, PSA и бычий сывороточный альбумин (BSA). Например, полипептиды sFGFR3 могут быть конъюгированы с человеческим HSA (например, полипептидом с аминокислотной последовательностью под SEQ ID NO: 27) или его фрагментом.
Слитые полипептиды на основе sFGFR3 могут содержать пептидный линкерный участок между полипептидом sFGFR3 (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их вариантами (SEQ ID NO: 4) или полипептидом sFGFR3, содержащим сигнальный пептид (SEQ ID NO: 18 или 34)) и гетерологичным полипептидом (например, Fc-участком или HSA). Линкерный участок может иметь любую последовательность и длину, которая позволяет sFGFR3 оставаться биологически активным, например, без стерического затруднения. Иллюстративные значения длины линкера находятся в диапазоне от 1 до 200 аминокислотных остатков, например, 1-5, 6-10, 11-15, 16-20, 21-25, 26-30, 31-35, 36-40, 41-45, 46-50, 51-55, 56-60, 61-65, 66-70, 71-75, 76-80, 81-85, 86-90, 91-95, 96-100, 101-110, 111-120, 121-130, 131-140, 141-150, 151-160, 161-170, 171-180, 181-190 или 191-200 аминокислотных остатков. Например, линкеры содержат гибкие части, например, участки без в значительной степени фиксированной вторичной или третичной структуры, или состоят из них. Предпочтительными диапазонами длины являются 5-25 и 10-20 аминокислот. Указанная гибкость, как правило, повышается, если аминокислоты являются малыми и не имеют объемных боковых цепей, которые затрудняют вращение или сгибание аминокислотной цепи. Таким образом, пептидный линкер по настоящему изобретению предпочтительно характеризуется повышенным содержанием малых аминокислот, в частности глициновых, аланиновых, сериновых, треониновых, лейциновых и изолейциновых остатков.
Иллюстративные гибкие линкеры представляют собой линкеры, богатые глицином, например, содержащие по меньшей мере 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или даже 100% глициновых остатков. Линкеры также могут включать в себя, например линкеры, богатые серином, например, содержащие по меньшей мере 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или даже 100% сериновых остатков. В некоторых случаях аминокислотная последовательность линкера состоит только из глициновых и сериновых остатков. Например, линкер может иметь аминокислотную последовательность GGGGAGGGG (SEQ ID NO: 28) или GGGGSGGGGSGGGGS (SEQ ID NO: 29). Линкер необязательно может быть гликозилированным по любым одному или нескольким подходящим аминокислотным остаткам. Линкер также может отсутствовать, при этом полипептид FGFR3 и гетерологичный полипептид (например, Fc-участок или HSA) слиты друг с другом непосредственно, без промежуточных остатков.
Полинуклеотиды, кодирующие полипептиды sFGFR3
Настоящее изобретение дополнительно предусматривает полинуклеотиды, кодирующие полипептиды sFGFR3 (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4) или полипептид sFGFR3, содержащий сигнальный пептид (SEQ ID NO: 18 или 34)), которые можно применять для лечения нарушений в виде задержки роста скелета (например, ахондроплазии) у пациента (например, человека, такого как младенец, ребенок или подросток), как, например, SEQ ID NO: 20, 21, 36 или 37. Например, полинуклеотид может представлять собой последовательность нуклеиновой кислоты под SEQ ID NO: 20 или 36, которая кодирует sFGFR3_Del4-C253S (SEQ ID NO: 2), или ее вариант, характеризующийся по меньшей мере 85% идентичностью последовательности (например, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности) с последовательностью нуклеиновой кислоты под SEQ ID NO: 20 или 36. Кроме того, полинуклеотид может представлять собой последовательность нуклеиновой кислоты под SEQ ID NO: 21 или 37, которая кодирует sFGFR3_Del4-D3 (SEQ ID NO: 33), характеризующуюся по меньшей мере 85% идентичностью последовательности (например, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или большей идентичностью последовательности) с последовательностью нуклеиновой кислоты под SEQ ID NO: 21 или 37. Настоящее изобретение также предусматривает полинуклеотиды, кодирующие слитые полипептиды на основе sFGFR3 (например, полипептид sFGFR3, слитый с гетерологичным полипептидом, таким как Fc-участок или HSA), и полинуклеотиды, кодирующие полипептиды sFGFR3 без сигнального пептида (например, полипептиды с аминокислотной последовательностью под SEQ ID NO: 2, 4 и 33) или с сигнальным пептидом (например, полипептиды с аминокислотной последовательностью под SEQ ID NO: 18, 19 и 34). Кроме того, настоящее изобретение предусматривает полинуклеотиды, которые содержат одну или несколько мутаций для изменения любого из сайтов гликозилирования, описанных в данном документе.
Полинуклеотиды sFGFR3 по настоящему изобретению (например, кодирующие sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4) или полипептид sFGFR3, содержащий сигнальный пептид (SEQ ID NO: 18 или 34)) необязательно могут быть кодон-оптимизированными с целью изменения кодонов в нуклеиновой кислоте, в частности, для отражения обычной частоты использования кодонов у организма-хозяина (например, у человека), без изменения полипептида sFGFR3, кодируемого последовательностью нуклеиновой кислоты полинуклеотида. Оптимизация кодонов полинуклеотидов (например, полинуклеотида с последовательностью нуклеиновой кислоты под SEQ ID NO: 20, 21, 36 или 37) путем снижения содержания GC, например, может облегчать генетические манипуляции и/или экспрессию в клетке-хозяине (например, клетке HEK 293 или клетке CHO). Оптимизацию кодонов может выполнять специалист в данной области, например, путем применения онлайн-инструментов, таких как инструмент JAVA Codon Adaptation (www.jcat.de) или инструмент Integrated DNA Technologies (www.eu.idtdna.com/CodonOpt), путем простого введения последовательности нуклеиновой кислоты полинуклеотида и организма-хозяина, для которого следует оптимизировать кодоны. Частоты использования кодонов у различных организмов доступны в онлайн-базах данных, например, www.kazusa.or.jp/codon.
Клетки-хозяева для экспрессии полипептидов sFGFR3
Клетки млекопитающих можно использовать в качестве клеток-хозяев для экспрессии полипептидов sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их вариантов (SEQ ID NO: 4) или полипептида sFGFR3, содержащего сигнальный пептид (SEQ ID NO: 18 или 34)). Иллюстративные типы клеток млекопитающих, применимые в способах, включают без ограничения клетки эмбриональной почки человека (HEK; например, HEK 293), клетки яичника китайского хомячка (CHO), клетки L, клетки C127, клетки 3T3, клетки BHK, клетки COS-7, клетки HeLa, клетки PC3, клетки Vero, клетки MC3T3, клетки NS0, клетки Sp2/0, клетки VERY, BHK, клетки MDCK, клетки W138, клетки BT483, клетки Hs578T, клетки HTB2, клетки BT20, клетки T47D, клетки NS0, клетки CRL7O3O и клетки HsS78Bst или любую другую подходящую клетку-хозяина, являющуюся клеткой млекопитающего, известную из уровня техники. В качестве альтернативы, клетки E. coli можно использовать в качестве клеток-хозяев для экспрессии полипептидов sFGFR3. Примеры штаммов E. coli включают без ограничения E. coli 294 (ATCC® 31446), E. coli λ 1776 (ATCC® 31537), E. coli BL21 (DE3) (ATCC® BAA-1025), E. coli RV308 (ATCC® 31608) или любой другой подходящий штамм E. coli,, известный из уровня техники.
Векторы, содержащие полинуклеотиды, кодирующие полипептиды sFGFR3
Настоящее изобретение также предусматривает рекомбинантные векторы, содержащие любые один или несколько полинуклеотидов, описанных выше. Векторы по настоящему изобретению можно применять для доставки полинуклеотида, кодирующего полипептид sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4) или полипептид sFGFR3, содержащий сигнальный пептид (SEQ ID NO: 18 или 34)), и они могут включать в себя векторы экспрессии в клетках млекопитающих, вирусные векторы экспрессии и бактериальные векторы экспрессии. Например, векторы могут представлять собой плазмиды, искусственные хромосомы (например, BAG, PAC и YAC) и вирусные или фаговые векторы и необязательно могут содержать промотор, энхансер или регулятор экспрессии полинуклеотида. Векторы также могут содержать один или несколько селектируемых маркерных генов, таких как ген устойчивости к ампициллину, неомицину и/или канамицину в случае бактериальной плазмиды или ген устойчивости для грибного вектора. Векторы можно применять in vitro для получения ДНК или РНК или применять для трансфекции или трансформации клетки-хозяина, такой как клетка-хозяин, являющаяся клеткой млекопитающего, для получения полипептида sFGFR3, кодируемого вектором. Векторы также могут быть адаптированы для применения in vivo в способе генной терапии.
Иллюстративные вирусные векторы, которые можно применять для доставки полинуклеотида, кодирующего полипептид sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4) или полипептид sFGFR3, содержащий сигнальный пептид (SEQ ID NO: 18 или 34)), включают в себя ретровирус, аденовирус (например, Ad2, Ad5, Ad11, Ad12, Ad24, Ad26, Ad34, Ad35, Ad40, Ad48, Ad49, Ad50 и Pan9 (также известный как AdC68)), парвовирус (например, аденоассоциированные вирусы), коронавирус, вирусы с отрицательной нитью РНК, такие как ортомиксовирус (например, вирус гриппа), рабдовирус (например, вирус бешенства и вирус везикулярного стоматита), парамиксовирус (например, вирус кори и вирус Сендай), вирусы с положительной нитью РНК, такие как пикорнавирус и альфавирус, и вирусы с двухнитевой ДНК, в том числе аденовирус, герпесвирус (например, вирус простого герпеса 1 и 2 типов, вирус Эпштейна-Барр, цитомегаловирус) и поксвирус (например, вирус осповакцины, модифицированный вирус осповакцины Анкара (MVA), вирус оспы кур и вирус оспы канареек). Другие вирусы, применимые для доставки полинуклеотидов, кодирующих полипептиды sFGFR3, включают в себя вирус Норуолк, тогавирус, флавивирус, реовирусы, паповавирус, гепаднавирус и вирус гепатита. Примеры ретровирусов включают вирус лейкоза и саркомы птиц, вирусы млекопитающих типа C, типа B, типа D, вирусы группы HTLV-BLV, лентивирус и спумавирус (Coffin, J. M., Retroviridae: The viruses and their replication, в Fundamental Virology, Third Edition, B. N. Fields, et al., Eds., Lippincott-Raven Publishers, Philadelphia, 1996).
Способы получения
Полинуклеотиды, кодирующие полипептиды sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4) или полипептид sFGFR3, содержащий сигнальный пептид (SEQ ID NO: 18 или 34)), можно получать с помощью любого способа, известного из уровня техники. Например, полинуклеотид получают с помощью способов молекулярного клонирования и помещают в вектор, такой как плазмида, искусственная хромосома, вирусный вектор или фаговый вектор. Вектор используют для введения полинуклеотида путем трансформации в клетку-хозяина, подходящую для экспрессии полипептида sFGFR3.
Конструирование векторов на основе нуклеиновой кислоты и клетки-хозяева
Полипептид sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4) или полипептид sFGFR3, содержащий сигнальный пептид (SEQ ID NO: 18 или 34)) можно получать из клетки-хозяина. Полинуклеотиды (например, полинуклеотиды с последовательностью нуклеиновой кислоты под SEQ ID NO: 20, 21, 36 или 37 и их варианты), кодирующие полипептиды sFGFR3, могут содержаться в векторах, которые можно вводить в клетку-хозяина с помощью общепринятых методик, известных из уровня техники (например, трансформации, трансфекции, электропорации, осаждения фосфатом кальция, прямой микроинъекции или инфицирования). Выбор вектора отчасти зависит от применяемых клеток-хозяев. Как правило, клетки-хозяева имеют прокариотическое (например, бактериальные клетки) либо эукариотическое (например, клетки млекопитающих) происхождение.
Полинуклеотид, кодирующий полипептид sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4) или полипептид sFGFR3, содержащий сигнальный пептид (SEQ ID NO: 18 или 34)), можно получать с помощью ряда способов, известных из уровня техники. Эти способы включают без ограничения опосредованный олигонуклеотидами (или сайт-направленный) мутагенез и мутагенез с помощью ПЦР. Полинуклеотид, кодирующий полипептид sFGFR3, можно получать с помощью стандартных методик, например, синтеза генов. В качестве альтернативы, полинуклеотид, кодирующий полипептид sFGFR3 дикого типа (например, полипептид с аминокислотной последовательностью под SEQ ID NO: 5 или 32), можно подвергнуть мутации таким образом, чтобы он содержал конкретные аминокислотные замены (например, аминокислотную замену цистеинового остатка сериновым остатком или консервативную аминокислотную замену, как, например, аланином, глицином, пролином или треонином, в положении 253 SEQ ID NO: 33 и/или положении 316 SEQ ID NO: 4), с использованием стандартных методик из данной области техники, например, мутагенеза согласно протоколу QuikChange™. Полинуклеотиды, кодирующие полипептид sFGFR3, можно синтезировать с использованием, например, синтезатора нуклеотидов или методик ПЦР.
Полинуклеотиды, кодирующие полипептид sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4) или полипептид sFGFR3, содержащий сигнальный пептид (SEQ ID NO: 18 или 34)), могут быть встроены в вектор, способный к репликации и экспрессии полинуклеотида в прокариотических или эукариотических клетках-хозяевах. Иллюстративные векторы, применимые в способах, могут включать без ограничения плазмиду, искусственную хромосому, вирусный вектор и фаговый вектор. Например, вирусный вектор может включать в себя вирусные векторы, описанные выше, такие как ретровирусный вектор, аденовирусный вектор или поксвирусный вектор (например, вектор на основе вируса осповакцины, такого как модифицированный вирус осповакцины Анкара (MVA)), вектор на основе аденоассоциированного вируса и альфавирусный вектор)), содержащие последовательность нуклеиновой кислоты полинуклеотида, кодирующего полипептид sFGFR3. Каждый вектор может содержать разнообразные компоненты, которые могут быть приспособлены и оптимизированы для обеспечения совместимости с конкретной клеткой-хозяином. Например, компоненты вектора могут включать без ограничения точку начала репликации, селектируемый маркерный ген, промотор, сайт связывания рибосомы, сигнальную последовательность, последовательность нуклеиновой кислоты полинуклеотида, кодирующего полипептид sFGFR3, и/или последовательность терминации транскрипции.
Описанные выше векторы можно вводить в подходящие клетки-хозяева (например, клетки HEK 293 или клетки CHO) с использованием общепринятых методик из данной области техники, например, трансформации, трансфекции, электропорации, осаждения фосфатом кальция и прямой микроинъекции. После введения векторов в клетки-хозяева для получения полипептида sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их вариантов (SEQ ID NO: 4) или полипептида sFGFR3, содержащего сигнальный пептид (SEQ ID NO: 18 или 34)) клетки-хозяева культивируют в традиционных питательных средах, модифицированных соответствующим образом для индукции промоторов, отбора трансформантов или амплификации полинуклеотидов (например, SEQ ID NO: 20 и 21 и их вариантов), кодирующих полипептид sFGFR3. Способы экспрессии терапевтических белков, таких как полипептиды sFGFR3, известны из уровня техники, см., например, Paulina Balbas, Argelia Lorence (eds.) Recombinant Gene Expression: Reviews and Protocols (Methods in Molecular Biology), Humana Press; 2nd ed. 2004 (20 июля 2004 г.) и Vladimir Voynov and Justin A. Caravella (eds.) Therapeutic Proteins: Methods and Protocols (Methods in Molecular Biology) Humana Press; 2nd ed. 2012 (28 июня 2012 г.), каждая из которых настоящим включена посредством ссылки во всей своей полноте.
Получение, извлечение и очистка полипептида sFGFR3
Клетки-хозяева (например, клетки HEK 293 или клетки CHO), применяемые для получения полипептида sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их вариантов (SEQ ID NO: 4) или полипептида sFGFR3, содержащего сигнальный пептид (SEQ ID NO: 18 или 34)), можно выращивать в среде, известной из уровня техники и подходящей для культивирования выбранных клеток-хозяев. Примеры подходящих сред для клеток-хозяев, являющихся клетками млекопитающих, включают минимальную поддерживающую среду (MEM), среду Игла в модификации Дульбекко (DMEM), экспрессионную среду Expi293™, DMEM, дополненную фетальной бычьей сывороткой (FBS), и RPMI-1640. Примеры подходящих сред для бактериальных клеток-хозяев включают бульон Лурия (LB) с необходимыми добавками, такими как средство для отбора, например, ампициллин. Клетки-хозяева культивируют при подходящих значениях температуры, таких как от приблизительно 20°C до приблизительно 39°C, например, от 25°C до приблизительно 37°C, предпочтительно 37°C, и уровнях CO2, таких как 5-10% (предпочтительно 8%). Значение pH среды, как правило, составляет от приблизительно 6,8 до 7,4, например, 7,0, главным образом в зависимости от организма-хозяина. В случае применения индуцируемого промотора в векторе экспрессии экспрессия полипептида sFGFR3 индуцируется в условиях, подходящих для активации промотора.
Полипептид sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4) или полипептид sFGFR3, содержащий сигнальный пептид (SEQ ID NO: 18 или 34)) можно извлекать из надосадочной жидкости культуры клеток-хозяев. В качестве альтернативы, полипептид sFGFR3 можно извлекать путем разрушения клетки-хозяина (например, с использованием осмотического шока, обработки ультразвуком или лизиса) с последующими центрифугированием или фильтрацией для удаления полипептида sFGFR3. После извлечения полипептида sFGFR3, полипептид sFGFR3 можно затем дополнительно очищать. Полипептид sFGFR3 можно очищать с помощью любого способа, известного в области очистки белков, как, например, аффинной хроматографии с белком A, других видов хроматографии (например, ионообменной, аффинной и эксклюзионной колоночной хроматографии), центрифугирования, дифференциальной растворимости или с помощью любой другой стандартной методики очистки белков (см. Process Scale Purification of Antibodies, Uwe Gottschalk (ed.) John Wiley & Sons, Inc., 2009, настоящим включенную посредством ссылки во всей своей полноте).
Полипептид sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4) или полипептид sFGFR3, содержащий сигнальный пептид (SEQ ID NO: 18 или 34)) необязательно может быть конъюгирован с детектируемой меткой для очистки. Примеры подходящих меток для применения в очистке полипептидов sFGFR3 включают без ограничения белковую метку, флуорофор, хромофор, радиоактивную метку, коллоидный металл, фермент или хемилюминесцентную или биолюминесцентную молекулу. В частности, белковые метки, применимые для очистки полипептидов sFGFR3, могут включать без ограничения хроматографические метки (например, пептидные метки, состоящие из полианионных аминокислот, такие как FLAG-метка или гемагглютининовая "HA"-метка), аффинные метки (например, поли-(His)-метку, хитин-связывающий белок (CBP), мальтоза-связывающий белок (MBP) или глутатион-S-трансферазу (GST)), солюбилизационные метки (например, тиоредоксин (TRX) и поли-(NANP)), эпитопные метки (например, V5-метку, Myc-метку и HA-метку) или флуоресцентные метки (например, GFP, варианты GFP, RFP и варианты RFP).
Способы лечения
В данном документе предусмотрены способы лечения нарушения в виде задержки роста скелета у пациента, такого как пациент с ахондроплазией (например, человек с ахондроплазией). В частности, у пациента проявляется или имеется вероятность развития одного или нескольких симптомов нарушения в виде задержки роста скелета (например, ахондроплазии). Способ предусматривает введение полипептида sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их вариантов (SEQ ID NO: 4) или полипептида sFGFR3, содержащего сигнальный пептид (SEQ ID NO: 18 или 34)) пациенту с нарушением в виде задержки роста скелета, такому как пациент с ахондроплазией (например, человек с ахондроплазией). В частности, способ предусматривает введение sFGFR3_Del4-C253S (SEQ ID NO: 2) или sFGFR3_Del4-D3 (SEQ ID NO: 33) пациенту с нарушением в виде задержки роста скелета, такому как пациент с ахондроплазией (например, человек с ахондроплазией). Например, пациент является младенцем или ребенком с нарушением в виде задержки роста скелета, таким как младенец, ребенок или подросток с ахондроплазией (например, человек с ахондроплазией).
Пациента (например, человека) можно лечить до появления симптомов нарушения в виде задержки роста скелета (например, ахондроплазии) или после развития симптомов нарушения в виде задержки роста скелета (например, ахондроплазии). В частности, у пациентов, которых можно лечить с помощью полипептида sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их вариантов (SEQ ID NO: 4) или полипептида sFGFR3, содержащего сигнальный пептид (SEQ ID NO: 18 или 34)), проявляются симптомы, включающие без ограничения короткие конечности, короткое туловище, O-образное искривление ног, утиную походку, мальформации черепа, череп в форме трилистника, краниосиностоз, наличие вормиевых костей, аномалии развития кистей, аномалии развития стоп, удлиненный большой палец кисти и/или аномалии развития грудной клетки. Более того, лечение с помощью полипептида sFGFR3 может привести к ослаблению одного или нескольких из указанных выше симптомов нарушения в виде задержки роста скелета (например, по сравнению с пациентом, не получавшим лечение), такого как ахондроплазия.
У пациента (например, человека) может быть диагностировано нарушение в виде задержки роста скелета, такое как ахондроплазия, до введения полипептида sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их вариантов (SEQ ID NO: 4) или полипептида sFGFR3, содержащего сигнальный пептид (SEQ ID NO: 18 или 34)). Кроме того, пациент с нарушением в виде задержки роста скелета, таким как ахондроплазия, может являться пациентом, которого ранее не лечили с помощью полипептида sFGFR3.
Нарушения в виде задержки роста скелета
Нарушения в виде задержки роста скелета можно лечить путем введения полипептида sFGFR3, описанного в данном документе, пациенту (например, человеку), нуждающемуся в этом. Способ предусматривает введение пациенту (например, человеку) с нарушением в виде задержки роста скелета полипептида sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их вариантов (SEQ ID NO: 4) или полипептида sFGFR3, содержащего сигнальный пептид (SEQ ID NO: 18 или 34)). Нарушения в виде задержки роста скелета, которые можно лечить с помощью полипептидов sFGFR3, характеризуются деформациями и/или мальформациями костей и могут включать без ограничения заболевания скелета, связанные с FGFR3. В частности, пациента лечат с помощью sFGFR3_Del4-C253S (SEQ ID NO: 2) или sFGFR3_Del4-D3 (SEQ ID NO: 33).
Путем введения полипептида sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их вариантов (SEQ ID NO: 4) или полипептида sFGFR3, содержащего сигнальный пептид (SEQ ID NO: 18 или 34)) можно лечить нарушение в виде задержки роста скелета, в том числе без ограничения ахондроплазию, ахондрогенез, акродизостоз, акромезомелическую дисплазию, ателостеогенез, камптомелическую дисплазию, точечную эпифизарную дисплазию, точечную эпифизарную дисплазию тазобедренного сустава, ключично-черепной дизостоз, врожденное укорочение бедренной кости, синдром Крузона, синдром Аперта, синдром Джексона-Вейсса, синдром Пфайффера, синдром Крузона с черным акантозом, дактилию, брахидактилию, камптодактилию, полидактилию, синдактилию, диастрофическую дисплазию, карликовость, диссегментарную дисплазию, энхондроматоз, фиброхондрогенез, фиброзную дисплазию, множественные костно-хрящевые экзостозы, гипофосфатазию, гипофосфатемический рахит, синдром Яффе-Лихтенстайна, дисплазию Книста, синдром Книста, мезомелическую дисплазию типа Лангера, синдром Марфана, синдром МакКьюна-Олбрайта, микромелию, метафизарную остеодисплазию, метафизарную остеодисплазию типа Янсена, метатрофную дисплазию, синдром Моркио, мезомелическую дисплазию типа Нивергельта, нейрофиброматоз (такой как 1 типа (например, с костными проявлениями или без костных проявлений), 2 типа или шванноматоз), остеоартрит, остеохондродисплазию, несовершенный остеогенез, перинатальный смертельный тип несовершенного остеогенеза, остеопетроз, остеопойкилоз, периферийный дизостоз, синдром Рейнхардта, синдром Робертса, синдром Робинова, формы синдрома коротких ребер-полидактилии, низкорослость, врожденную спондилоэпифизарную дисплазию и спондилоэпиметафизарную остеодисплазию.
Например, полипептиды sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4) или полипептид sFGFR3, содержащий сигнальный пептид (SEQ ID NO: 18 или 34)) можно применять для лечения симптомов, ассоциированных с нарушением в виде задержки роста скелета, в том числе нарушениями, описанными выше, такими как ахондроплазия. Неограничивающие примеры симптомов нарушений в виде задержки роста скелета, которые можно лечить с помощью полипептидов sFGFR3, включают короткие конечности и туловище, O-образное искривление ног, утиную походку, мальформации черепа (например, большую голову), череп в форме трилистника, краниосиностоз (например, преждевременное сращение костей черепа), наличие вормиевых костей (например, аномальные нитеобразные соединения между костями в черепе), аномалии развития кистей и стоп (например, полидактилию или дополнительные пальцы), удлиненные большие пальцы кистей и аномалии развития ногтей пальцев рук и ног, а также аномалии развития грудной клетки (например, грушевидную грудную клетку или узкую грудь). Дополнительные симптомы, которые можно лечить путем введения полипептидов sFGFR3, также могут включать нескелетные аномалии у пациентов с нарушениями в виде задержки роста скелета, такие как аномалии развития глаз, рта и ушей, как, например, формы врожденной катаракты, близорукость, расщелина неба или глухота; мальформации головного мозга, такие как гидроцефалия, порэнцефалия, гидроанэнцефалия или агенезия мозолистого тела; пороки сердца, такие как дефект межпредсердной перегородки, открытый артериальный проток или транспозиция магистральных сосудов; формы задержки развития или умственной неполноценности.
При лечении с помощью полипептидов sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их вариантов (SEQ ID NO: 4) или полипептида sFGFR3, содержащего сигнальный пептид (SEQ ID NO: 18 или 34)) также может увеличиваться выживаемость пациентов (например, людей) с нарушениями в виде задержки роста скелета (например, ахондроплазией). Например, коэффициент выживаемости пациентов, которых лечили с помощью полипептидов sFGFR3, может увеличиваться по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или больше по сравнению, например, с пациентом с нарушением в виде задержки роста скелета (например, ахондроплазией), не получавшим лечение, в течение периода лечения нескольких дней, месяцев, лет или дольше. В частности, при введении sFGFR3_Del4-D3 может увеличиваться выживаемость пациентов (например, людей) с нарушениями в виде задержки роста скелета (например, по сравнению с пациентом, не получавшим лечение), такими как ахондроплазия.
Любое нарушение в виде задержки роста скелета, которое представляет собой заболевание скелета, связанное с FGFR3 (например, вызываемое избыточной активацией FGFR3 в результате мутации приобретения функции в FGFR3 или ассоциированное с ней), можно лечить путем введения полипептида sFGFR3 по настоящему изобретению ((например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их вариантов (SEQ ID NO: 4) или полипептида sFGFR3, содержащего сигнальный пептид (SEQ ID NO: 18 или 34)) пациенту (например, человеку). Например, заболевания скелета, связанные с FGFR3, могут включать без ограничения ахондроплазию, танатофорную дисплазию I типа (TDI), танатофорную дисплазию II типа (TDII), тяжелую ахондроплазию с задержкой развития и черным акантозом (SADDAN), гипохондроплазию и краниосиностоз (например, синдром Мюнке, синдром Крузона и синдром Крузона с черным акантозом).
Пациенты (например, люди) с мутациями в гене FGFR3, ассоциированными с различными нарушениями со стороны скелета, связанными с FGFR3, такими как ахондроплазия, гипохондроплазия, SADDAN, TDI и TDII, можно лечить с помощью полипептидов sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их вариантов (SEQ ID NO: 4) или полипептида sFGFR3, содержащего сигнальный пептид (SEQ ID NO: 18 или 34)). Например, полипептиды sFGFR3 можно вводить для лечения ахондроплазии, обусловленной мутациями G380R, G375C, G346E или S279C в гене FGFR3. Введение полипептидов sFGFR3 можно применять для лечения следующих иллюстративных нарушений со стороны скелета, связанных с FGFR3: гипохондроплазии, обусловленной мутациями G375C, G346E или S279C в гене FGFR3; TDI, обусловленной мутациями R248C, S248C, G370C, S371C, Y373C, X807R, X807C, X807G, X807S, X807W и K650M в гене FGFR3; TDII, обусловленной мутацией K650E в гене FGFR3; и SADDAN, обусловленной мутацией K650M в гене FGFR3.
Любую из указанных выше мутаций в гене FGFR3 (например, мутацию G380R в гене FGFR3) можно выявить в образце от пациента (например, человека с ахондроплазией, гипохондроплазией, SADDAN, TDI и TDII) до или после лечения с помощью полипептида sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их вариантов (SEQ ID NO: 4) или полипептида sFGFR3, содержащего сигнальный пептид (SEQ ID NO: 18 или 34)). Кроме того, родителей пациента и/или фетальные образцы (например, фетальную нуклеиновую кислоту, полученную из материнской крови, образцы плаценты или фетальные образцы) можно тестировать с помощью способов, известных из уровня техники, в отношении мутации в гене FGFR3 для определения их необходимости в лечении.
Ахондроплазия
Ахондроплазия является наиболее распространенной причиной карликовости у людей, и ее можно лечить путем введения полипептидов sFGFR3, описанных в данном документе. В частности, ахондроплазию можно лечить путем введения полипептида sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их вариантов (SEQ ID NO: 4) или полипептида sFGFR3, содержащего сигнальный пептид (SEQ ID NO: 18 или 34)). Соответственно, введение полипептидов sFGFR3 может приводить к ослаблению симптомов, в том числе без ограничения задержки роста, деформаций черепа, ортодонтических дефектов, компрессии шейного отдела спинного мозга (с риском летального исхода, например, в результате центрального апноэ или эпилептических припадков), стеноза позвоночного канала (например, боли в ногах и пояснице), гидроцефалии (например, требующей операции шунтирования головного мозга), потери слуха вследствие хронического отита, сердечно-сосудистого заболевания, неврологического заболевания, респираторных проблем, утомления, боли, онемения в пояснице и/или позвоночнике и/или ожирения.
Пациенты, подвергаемые лечению с помощью полипептидов sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их вариантов (SEQ ID NO: 4) или полипептида sFGFR3, содержащего сигнальный пептид (SEQ ID NO: 18 или 34)), могут включать в себя младенцев, детей и взрослых с ахондроплазией. В частности, у младенцев часто диагностируют ахондроплазию при рождении, и, таким образом, лечение с помощью полипептидов sFGFR3 может начинаться как можно раньше в жизни пациента, например, вскоре после рождения или до рождения (в утробе).
Симптомы ахондроплазии у пациентов (например, людей) также можно отслеживать до или после осуществления лечения пациента с помощью полипептида sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их вариантов (SEQ ID NO: 4) или полипептида sFGFR3, содержащего сигнальный пептид (SEQ ID NO: 18 или 34)). Например, симптомы ахондроплазии можно отслеживать до осуществления лечения с целью оценивания тяжести ахондроплазии и состояния пациента перед осуществлением способов.
Способы могут включать диагностирование ахондроплазии у пациента и отслеживание у пациента изменений симптомов ахондроплазии, таких как изменения веса тела и размера черепа (например, длины черепа и/или ширины черепа) пациента. Изменения веса тела и размера черепа можно отслеживать в течение определенного периода времени, например, 1, 2, 3, 4 или больше раз в месяц или в год или примерно каждые 1, 2, 3, 4, 5, 6, 7, 8, 12 или 16 недель в ходе курса лечения с помощью полипептида sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их вариантов (SEQ ID NO: 4) или полипептида sFGFR3, содержащего сигнальный пептид (SEQ ID NO: 18 или 34)). Вес тела и/или размер черепа пациента с ахондроплазией также можно определять при определенных событиях в рамках лечения, как, например, до и/или после введения полипептида sFGFR3.
Например, можно измерять вес тела и/или размер черепа в ответ на введение полипептида sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их вариантов (SEQ ID NO: 4) или полипептида sFGFR3, содержащего сигнальный пептид (SEQ ID NO: 18 или 34)). Вес тела можно измерять путем взвешивания пациента с ахондроплазией на весах, предпочтительно стандартизированным способом, как, например, в одной и той же одежде или без нее или в определенное время суток, предпочтительно натощак (например, утром перед завтраком или по меньшей мере через 1, 2, 3, 4, 5 или больше часов голодания). Размер черепа может быть представлен длиной, высотой, шириной и/или длиной окружности черепа. Измерения можно выполнять с помощью любого известного или разработанного самостоятельно стандартизированного способа. Для субъекта-человека предпочтительным является измерение длины окружности черепа, которую можно измерить с использованием эластичного и нерастяжимого материала, такого как лента, обернутого вокруг наиболее широкой возможной окружности головы (например, по окружности от наиболее выступающей части лба до наиболее широкой части затылка). Высоту черепа субъекта (например, человека) также можно определять от нижней поверхности подбородка до крайней верхней точки головы. Любое измерение предпочтительно выполняют более одного раза, например, по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10 или больше раз.
Введение полипептидов sFGFR3
Полипептид sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4) или полипептид sFGFR3, содержащий сигнальный пептид (SEQ ID NO: 18 или 34)) можно вводить любым путем, известным из уровня техники, как, например, путем парентерального введения, энтерального введения или местного введения. В частности, полипептид sFGFR3 можно вводить пациенту с нарушением в виде задержки роста скелета (например, ахондроплазией) подкожно (например, путем подкожной инъекции), внутривенно, внутримышечно, внутриартериально, интратекально или внутрибрюшинно.
Полипептид sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4) или полипептид sFGFR3, содержащий сигнальный пептид (SEQ ID NO: 18 или 34)) можно вводить пациенту (например, человеку) в заранее определенной дозе, как, например, в количестве, эффективном для лечения нарушения в виде задержки роста скелета (например, ахондроплазии) без индуцирования значительной токсичности. Например, полипептиды sFGFR3 можно вводить пациенту с нарушениями в виде задержки роста скелета (например, ахондроплазией) в индивидуальных дозах в диапазоне от приблизительно 0,002 мг/кг до приблизительно 50 мг/кг (например, от 2,5 мг/кг до 30 мг/кг, от 0,002 мг/кг до 20 мг/кг, от 0,01 мг/кг до 2 мг/кг, от, 2 мг/кг до 20 мг/кг, от 0,01 мг/кг до 10 мг/кг, от 10 мг/кг до 100 мг/кг, от 0,1 мг/кг до 50 мг/кг, от 0,5 мг/кг до 20 мг/кг, от 1,0 мг/кг до 10 мг/кг, от 1,5 мг/кг до 5 мг/кг или от 0,2 мг/кг до 3 мг/кг). В частности, полипептид sFGFR3 можно вводить в индивидуальных дозах, например, от 0,001 мг/кг до 50 мг/кг, как, например, от 2,5 мг/кг до приблизительно 10 мг/кг.
Иллюстративные дозы полипептида sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их вариантов (SEQ ID NO: 4) или полипептида sFGFR3, содержащего сигнальный пептид (SEQ ID NO: 18 или 34)) для введения пациенту (например, человеку) с нарушением в виде задержки роста скелета (например, ахондроплазией) включают, например, 0,005, 0,01, 0,02, 0,05, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 2,5, 3, 3,5, 4, 4,5, 5, 5,5, 6, 6,5, 7, 7,5, 8, 8,5, 9, 9,5, 10, 11, 12, 13, 14, 15, 20, 25, 30, 35, 40, 45 или 50 мг/кг. Эти дозы можно вводить один или несколько раз (например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 или больше раз) в день, неделю, месяц или год. Например, полипептид sFGFR3 можно вводить пациентам в еженедельной дозе в диапазоне, например, от приблизительно 0,0014 мг/кг/неделя до приблизительно 140 мг/кг/неделя, например, от приблизительно 0,14 мг/кг/неделя до приблизительно 105 мг/кг/неделя или, например, от приблизительно 1,4 мг/кг/неделя до приблизительно 70 мг/кг/неделя (например, 2,5 мг/кг/неделя, 5 мг/кг/неделя, 10 мг/кг/неделя, 20 мг/кг/неделя, 30 мг/кг/неделя, 40 мг/кг/неделя или 50 мг/кг/неделя).
Генная терапия
Полипептид sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4) или полипептид sFGFR3, содержащий сигнальный пептид (SEQ ID NO: 18 или 34)) также можно доставлять с помощью генной терапии, при этом полинуклеотид, кодирующий полипептид sFGFR3, доставляется в ткани, представляющие интерес, и экспрессируется in vivo. Способы генной терапии обсуждаются, например, в Verme et al. (Nature 389: 239-242, 1997), Yamamoto et al. (Molecular Therapy 17: S67-S68, 2009), и Yamamoto et al., (J. Bone Miner. Res. 26: 135-142, 2011), каждая из которых настоящим включена посредством ссылки.
Полипептид sFGFR3 по настоящему изобретению (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4) или полипептид sFGFR3, содержащий сигнальный пептид (SEQ ID NO: 18 или 34)) можно получать с использованием клеток пациента (например, человека) с нарушением в виде задержки роста скелета (например, ахондроплазией) путем введения вектора (например, плазмиды, искусственной хромосомы (например, BAG, PAC и YAC) или вирусного вектора), содержащего последовательность нуклеиновой кислоты полинуклеотида, кодирующего полипептид sFGFR3. Например, вирусный вектор может представлять собой ретровирусный вектор, аденовирусный вектор или поксвирусный вектор (например, вектор на основе вируса осповакцины, такого как модифицированный вирус осповакцины Анкара (MVA)), вектор на основе аденоассоциированного вируса или альфавирусный вектор. Вектор после проникновения внутрь клетки пациента (например, человека) с нарушением в виде задержки роста скелета (например, ахондроплазией) путем, например, трансформации, трансфекции, электропорации, осаждения фосфатом кальция или прямой микроинъекции будет способствовать экспрессии полипептида sFGFR3, который затем секретируется из клетки. Настоящее изобретение дополнительно предусматривает виды клеточной терапии, при которой пациенту (например, человеку) вводят клетку, экспрессирующую полипептид sFGFR3.
Фармацевтические композиции
Фармацевтические композиции по настоящему изобретению могут содержать полипептид sFGFR3 (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4) или полипептид sFGFR3, содержащий сигнальный пептид (SEQ ID NO: 18 или 34)), полинуклеотид, вектор и/или клетку-хозяина по настоящему изобретению. Композиции, содержащие полипептид sFGFR3, полинуклеотид, вектор и/или клетку-хозяина, могут быть составлены в диапазоне дозировок, в виде ряда составов и в комбинации с фармацевтически приемлемыми наполнителями, носителями или разбавителями.
Фармацевтическая композиция, содержащая полипептид sFGFR3 (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4) или полипептид sFGFR3, содержащий сигнальный пептид (SEQ ID NO: 18 или 34)), полинуклеотид, вектор и/или клетку-хозяина по настоящему изобретению, может быть составлена в конкретной дозировке, такой как дозировка, эффективная для лечения нарушения в виде задержки роста скелета (например, ахондроплазии) у пациента (например, человека) без индуцирования значительной токсичности. Например, композиции можно составлять так, чтобы они содержали от приблизительно 1 мг/мл до приблизительно 500 мг/мл полипептида sFGFR3 (например, от 10 мг/мл до 300 мг/мл, от 20 мг/мл до 120 мг/мл, от 40 мг/мл до 200 мг/мл, от 30 мг/мл до 150 мг/мл, от 40 мг/мл до 100 мг/мл, от 50 мг/мл до 80 мг/мл или от 60 мг/мл до 70 мг/мл полипептида sFGFR3).
Фармацевтические композиции, содержащие полипептид sFGFR3 (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4) или полипептид sFGFR3, содержащий сигнальный пептид (SEQ ID NO: 18 или 34)), полинуклеотид, вектор и/или клетку-хозяина по настоящему изобретению, можно получать в ряде форм, таких как жидкий раствор, дисперсия или суспензия, порошок или другие упорядоченные структуры, подходящие для стабильного хранения. Например, композиции, содержащие полипептид sFGFR3, предназначенные для системной или локальной доставки, могут находиться в форме растворов для инъекций или инфузий, как, например, для парентерального введения (например, подкожного, внутривенного, внутримышечного, внутриартериального, интратекального или внутрибрюшинного введения). Композиции на основе sFGFR3 для инъекции (например, подкожной или внутривенной инъекции) можно составлять с использованием стерильного раствора или любой фармацевтически приемлемой жидкости в качестве инертной среды. Фармацевтически приемлемые инертные среды включают без ограничения стерильную воду, физиологический раствор и среду для культивирования клеток (например, среду Игла в модификации Дульбекко (DMEM), α-модифицированную среду Игла (α-MEM), среду F-12). Способы составления известны из уровня техники, см., например, Banga (ed.) Therapeutic Peptides and Proteins: Formulation, Processing and Delivery Systems (2nd ed.) Taylor & Francis Group, CRC Press (2006), которая настоящим включена посредством ссылки во всей своей полноте.
Композиции, содержащие полипептид sFGFR3 (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4) или полипептид sFGFR3, содержащий сигнальный пептид (SEQ ID NO: 18 или 34)), полинуклеотид, вектор и/или клетку-хозяина по настоящему изобретению, можно предоставлять пациентам (например, людям) с нарушениями в виде задержки роста скелета (например, ахондроплазией) в комбинации с фармацевтически приемлемыми наполнителями, носителями или разбавителями. Приемлемые наполнители, носители или разбавители могут включать в себя буферы, антиоксиданты, консерванты, полимеры, аминокислоты и углеводы. Водные наполнители, носители или разбавители могут включать в себя воду, водно-спиртовые растворы, эмульсии или суспензии, в том числе солевой раствор, забуференные медицинские инертные среды для парентерального введения, в том числе раствор хлорида натрия, раствор Рингера с декстрозой, раствор декстрозы с хлоридом натрия, раствор Рингера, содержащий лактозу, и нелетучие масла. Примерами неводных наполнителей, носителей или разбавителей являются пропиленгликоль, полиэтиленгликоль, растительное масло, рыбий жир и инъекционные органические сложные эфиры.
Фармацевтически приемлемые соли также могут содержаться в композициях, содержащих полипептид sFGFR3 (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4) или полипептид sFGFR3, содержащий сигнальный пептид (SEQ ID NO: 18 или 34)), полинуклеотид, вектор и/или клетку-хозяина по настоящему изобретению.
Иллюстративные фармацевтически приемлемые соли могут включать в себя соли минеральных кислот (например, гидрохлориды, гидробромиды, фосфаты и сульфаты) и соли органических кислот (например, ацетаты, пропионаты, малонаты и бензоаты). Кроме того, могут присутствовать вспомогательные вещества, такие как смачивающие или эмульгирующие средства и pH-буферные вещества. Всестороннее обсуждение фармацевтически приемлемых наполнителей, носителей и разбавителей доступно в Remington: The Science and Practice of Pharmacy, 22nd Ed., Allen (2012), которая настоящим включена посредством ссылки во всей своей полноте.
Фармацевтические композиции, содержащие полипептид sFGFR3 (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их варианты (SEQ ID NO: 4) или полипептид sFGFR3, содержащий сигнальный пептид (SEQ ID NO: 18 или 34)), полинуклеотид, вектор, и/или клетку-хозяина по настоящему изобретению, также могут быть составлены с носителем, который защищает полипептид sFGFR3 от быстрого высвобождения, как, например, в виде состава с контролируемым высвобождением, в том числе имплантатов и микроинкапсулированных систем доставки. Например, композиция на основе sFGFR3 может быть заключена в микрокапсулы, полученные с помощью методик коацервации или с помощью полимеризации на границе раздела фаз, такие как микрокапсулы из гидроксиметилцеллюлозы, желатина или поли-(метилметакрилата); коллоидные системы доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы или нанокапсулы) или макроэмульсии. Кроме того, композиция на основе sFGFR3 может быть составлена в виде композиции с замедленным высвобождением. Например, композиции с замедленным высвобождением могут содержать полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие полипептиды sFGFR3, полинуклеотиды, векторы или клетки-хозяева по настоящему изобретению, при этом матрицы находятся в виде изделий, имеющих определенную форму, как, например, пленок или микрокапсул.
Наборы
Наборы по настоящему изобретению могут содержать одно или несколько из полипептидов sFGFR3 (например, sFGFR3_Del4-C253S (SEQ ID NO: 2), sFGFR3_Del4-D3 (SEQ ID NO: 33) и их вариантов (SEQ ID NO: 4) или полипептида sFGFR3, содержащего сигнальный пептид (SEQ ID NO: 18 или 34)), полинуклеотидов, векторов и/или клеток по настоящему изобретению, описанных в данном документе. Например, полипептид sFGFR3, полинуклеотид, вектор и/или клетка могут присутствовать в контейнере (например, стеклянной ампуле) в жидкой форме (например, в воде или забуференном солевом растворе, как, например, от 2 мМ до 20 мМ фосфата натрия, pH 6,5 или 7,0, и от 25 мМ до 250 мМ хлористого натрия). В качестве альтернативы, полипептид sFGFR3, полинуклеотид и/или вектор присутствуют в контейнере (например, стеклянной ампуле) в лиофилизированной форме, которая необязательно может содержать разбавитель (например, воду или забуференный солевой раствор) для восстановления лиофилизированного полипептида sFGFR3, полинуклеотида, вектора и/или клетки в жидкой форме перед введением. Полипептид sFGFR3, полинуклеотид, вектор и/или клетка также могут присутствовать в наборе в другом составе, описанном в данном документе. Компоненты набора могут быть представлены в лекарственной форме для облегчения введения и необязательно могут включать в себя материалы, необходимые для введения, и/или инструкции по лечению пациента, согласующиеся со способами. Например, набор может содержать инструкции по применению, которые предоставляют пользователю (например, врачу) руководство по введению полипептида sFGFR3, полинуклеотида, вектора и/или клетки.
ПРИМЕРЫ
Следующие примеры предназначены для иллюстрации, а не для ограничения настоящего изобретения. Эти исследования предусматривают введение полипептидов sFGFR3 sFGFR3_Del4-C253S (SEQ ID NO: 2) и sFGFR3_Del4-D3 (SEQ ID NO: 33) пациентам (например, людям) с ахондроплазией для лечения ахондроплазии и ассоциированных с ней симптомов.
Пример 1. Получение полипептидов sFGFR3
sFGFR3_Del4-C253S (SEQ ID NO: 2) и sFGFR3_Del4-D3 (SEQ ID NO: 33) получали посредством транзиентной трансфекции трех различных типов клеток в суспензионных культурах: HEK 293 FreeStyle, клеток CHO-S FreeStyle и клеток ExpiCHO-S. Для получения в клетках HEK 293 FreeStyle и клетках CHO-S FreeStyle трансфекцию осуществляли с использованием полиэтиленимина (PEIpro® - Polyplus-transfection) согласно указаниям производителя. Белки собирали через три дня. Для получения полипептида sFGFR3 в клетках ExpiCHO-S трансфекцию осуществляли с использованием ExpiFectamine согласно описанию производителя с использованием протокола получения с высоким титром. Проводили анализ временной динамики, и полипептиды sFGFR3 в оптимальном случае собирали через 12 дней. Затем выполняли вестерн-блот-анализы с использованием 50 нг полипептида sFGFR3. Использовали традиционные протоколы вестерн-блоттинга с B9 в качестве первичного антитела (антитела к FGFR3, sc-13121, Santa Cruz) в разведении 1:2000 в блокирующем буфере и вторичным антителом к IgG мыши (антителом к IgG мыши, № 7076, Cell Signaling) в разведении 1:5000 в блокирующем буфере.
Пример 2. Очистка полипептидов sFGFR3
Каждый из sFGFR3_Del4-C253S и sFGFR3_Del4-D3 очищали с применением двухстадийного способа очистки, включающего ионообменную хроматографию и эксклюзионную хроматографию.
В рамках ионообменной хроматографии 300 мл надосадочной жидкости культуры очищали путем фильтрации в перекрестном потоке ( KTA™ flux, GE Healthcare) с использованием капсул на 5 мкм и 0,2 мкм (соответственно KGF-A0504 TT и KMP-HEC 9204 TT, GE Healthcare). Очищенный образец, содержащий sFGFR3_Del4-C253S или sFGFR3_Del4-D3, затем загружали в уравновешенную колонку при 20 мл/мин. после доведения удельной электропроводности образца до 14 мСм/см (
KTA™ flux, GE Healthcare) с использованием капсул на 5 мкм и 0,2 мкм (соответственно KGF-A0504 TT и KMP-HEC 9204 TT, GE Healthcare). Очищенный образец, содержащий sFGFR3_Del4-C253S или sFGFR3_Del4-D3, затем загружали в уравновешенную колонку при 20 мл/мин. после доведения удельной электропроводности образца до 14 мСм/см ( KTA™ pure 25 (GE Healthcare)). Используемыми колонками были HiPrep Q FF 26/10 (GE Healthcare) с объемом слоя 53 мл. Буфер для связывания представлял собой 1X PBS, а элюирующий буфер представлял собой PBS 1X+1 M NaCl. Колонку промывали четырьмя объемами колонки 1X PBS. Элюирование sFGFR3_Del4-C253S и sFGFR3_Del4-D3 выполняли в две стадии с 5% NaCl и 10% NaCl, используя четыре объема колонки каждого. Как 5% NaCl, так и 10% NaCl объединяли и концентрировали путем фильтрации в перекрестном потоке (
KTA™ pure 25 (GE Healthcare)). Используемыми колонками были HiPrep Q FF 26/10 (GE Healthcare) с объемом слоя 53 мл. Буфер для связывания представлял собой 1X PBS, а элюирующий буфер представлял собой PBS 1X+1 M NaCl. Колонку промывали четырьмя объемами колонки 1X PBS. Элюирование sFGFR3_Del4-C253S и sFGFR3_Del4-D3 выполняли в две стадии с 5% NaCl и 10% NaCl, используя четыре объема колонки каждого. Как 5% NaCl, так и 10% NaCl объединяли и концентрировали путем фильтрации в перекрестном потоке ( KTA™ flux, GE Healthcare). Оставшийся объем затем концентрировали на фильтре с отсечением по молекулярной массе 30 кДа путем центрифугирования при 4°C, 3900 g в течение 10 мин. (MILLLIPORE® UFC903024, центрифужный фильтрующий концентратор AMICON® Ultra-15). В рамках эксклюзионной хроматографии оставшийся объем загружали в колонку HiLoad 26/600 с чистой для препаративной хроматографии SUPERDEX™ 200 (28-9893-36, GE Healthcare) с объемом слоя 320 мл. Объем загрузки не превышал 12,8 мл. Элюирование выполняли в 1X PBS.
KTA™ flux, GE Healthcare). Оставшийся объем затем концентрировали на фильтре с отсечением по молекулярной массе 30 кДа путем центрифугирования при 4°C, 3900 g в течение 10 мин. (MILLLIPORE® UFC903024, центрифужный фильтрующий концентратор AMICON® Ultra-15). В рамках эксклюзионной хроматографии оставшийся объем загружали в колонку HiLoad 26/600 с чистой для препаративной хроматографии SUPERDEX™ 200 (28-9893-36, GE Healthcare) с объемом слоя 320 мл. Объем загрузки не превышал 12,8 мл. Элюирование выполняли в 1X PBS.
Пример 3. Кинетические анализы и измерения констант диссоциации (Kd) полипептидов sFGFR3
Анализ концентрации без калибровки и кинетические анализы sFGFR3_Del4-C253S и sFGFR3_Del4-D3 выполняли с использованием сенсорного чипа CM5 (GE Healthcare). FGF2 человека (hFGF2) ковалентно иммобилизовали на сенсорном чипе CM5 при уровне приблизительно 5000 RU путем связывания с аминогруппами. Для достижения 5000 RU hFGF2 иммобилизовали в течение 420 секунд при скорости потока 10 мкл/мин. и концентрации 25 мкг/мл. Подвижный буфер представлял собой буфер HBS-EP+ (GE Healthcare). Регенерирующий буфер представлял собой 100 мМ ацетата натрия с 2 M хлорида натрия, pH 4,5. Связывание FGF, измеряемые значения константы диссоциации (Kd) и кинетические параметры определяли с помощью поверхностного плазмонного резонанса с использованием BIACORE™ T200 (GE Healthcare). Модель, используемая для кинетических анализов и определения Kd, представляла собой алгоритм связывания 1: 1.
Пример 4. Анализы пролиферации с использованием полипептидов sFGFR3
Как линию клеток ATDC5, так и линию клеток ATDC5 FGFR3G380R высевали при плотности 25000 клеток/см2 в 96-луночные планшеты NUNC™ MICROWELL™ с оптически прозрачным дном на полимерном основании (ThermoFisher Scientific, № по каталогу 165305). Спустя 24 часа периода инкубирования пул клеток истощали в течение 48 часов в 0,5% BSA и затем стимулировали в течение 72 часов с помощью sFGFR3_Del4-C253S или sFGFR3_Del4-D3 в присутствии и в отсутствие hFGF2 (Peprotech). Пролиферацию клеток затем измеряли с использованием набора CyQUANT® для прямого анализа пролиферации клеток (Molecular Probes, № по каталогу C35012). После стимуляции в каждую лунку добавляли 10 мкл компонентов набора CyQUANT® для прямого анализа пролиферации клеток (Invitrogen; 1 мл 1X PBS, 250 мкл реагента для подавления фоновой флуоресценции и 50 мкл ядерного красителя). Клетки ATDC5 и ATDC5 FGFR3G380R затем инкубировали при комнатной температуре в темноте в течение 2 часов. Флуоресценцию считывали с использованием многорежимного считывающего устройства для микропланшетов VARIOSKAN™ LUX (ThermoFisher Scientific).
Пример 5. Анализ полипептидов sFGFR3 с использованием люциферазы
Клетки HEK с конструкцией элемент ответа на сыворотку-люцифераза (SRE-Luc), экспрессирующие FGFR3G380R, высевали при плотности 100000 клеток/см2 в стандартный культуральный 96-луночный планшет. Пул клеток затем истощали в течение 24 часов с помощью 0,5% термоинактивированной фетальной бычьей сыворотки (hiFBS) перед обработкой с помощью sFGFR3_Del4-D3 в концентрациях 0 нm, 70 нm и 280 нm в присутствии или в отсутствие 1 нг/мл hFGF2 в течение 24 ч. Культуральные планшеты приводили к комнатной температуре в течение 15 минут перед добавлением в каждую лунку 100 мкл рабочего раствора для одностадийного анализа свечения люциферазы светлячка (ThermoFisher Scientific, № по каталогу 16197), затем встряхивали при 600 об./мин. в течение 3 минут. Планшет инкубировали при комнатной температуре в течение 10 минут, и каждый клеточный лизат переносили в белый непрозрачный 96-луночный планшет для усиления сигнала люминесценции и уменьшения перекрестного загрязнения. Сигнал люминесценции считывали с использованием многорежимного считывающего устройства для микропланшетов VARIOSKAN™ LUX (ThermoFisher Scientific).
Пример 6. Исследование эффективности полипептидов sFGFR3 in vivo
Эксперименты проводили на трансгенных животных Fgfr3ach/+, у которых экспрессия мутантной формы FGFR3 управлялась промотором/энхансером Col2a1. Мыши находились в условиях цикла чередования 12 часов света/темноты и имели свободный доступ к стандартной лабораторной пище и воде. Генотипы подтверждали с помощью ПЦР геномной ДНК с использованием праймеров 5'-AGGTGGCCTTTGACACCTACCAGG-3' (SEQ ID NO: 30) и 5'-TCTGTTGTGTTTCCTCCCTGTTGG-3' (SEQ ID NO: 31), которые амплифицировали 360 п. о. трансгена FGFR3.
sFGFR3_Del4-D3, полученный с использованием клеток CHO, оценивали в дозе для подкожного введения 0,25 мг/кг два раза в неделю. В день 3 все новорожденные мыши из одного помета получали одну и ту же дозу. Контрольные пометы получали 10 мкл PBS (инертной среды). После этого проводили подкожные инъекции sFGFR3_Del4-D3 (0,25 мг/кг) два раза в неделю в течение трех недель попеременно в левую и правую части поясницы. Мышей наблюдали ежедневно, уделяя особое внимание изменениям в двигательной активности и мочеиспускании. Выполняли скрещивание с получением пометов, половина мышей в которых имела дикий тип, а половина была гетерозиготной по Fgfr3ach/+. Во избежание систематической ошибки вследствие варьирования фенотипической пенетрантности эксперименты проводили по меньшей мере на двух пометах (одном получавшем лечение и одном контрольном) от одних и тех же производителей. Предыдущие данные указывают на то, что между самцами и самками не существует статистически значимых различий, и, таким образом, самцов и самок рассматривали как одну группу во всех анализах.
В день 22 всех животных умерщвляли путем смертельной инъекции пентобарбитала, и определяли пол. Все последующие измерения и анализы выполняли без осведомленности о генотипе мышей во избежание систематической ошибки исследователя. Генотипирование выполняли в конце исследования для выявления соответствия данных конкретному генотипу. Поскольку ахондроплазия является заболеванием с фенотипической изменчивостью, всех животных включали в исследование. Животных, умерших до дня 22, использовали для изучения влияния лечения на преждевременную смерть. Животных, выживших к 22 дню, использовали во всех анализах. Все эксперименты и измерения данных выполнялись экспериментаторами в слепом режиме во все моменты времени.
После умерщвления в день 22 измеряли значения веса тела. С трупиков осторожно снимали кожу, извлекали внутренности, и выполняли измерения скелета на основе рентгенограмм. Органы собирали, взвешивали и хранили в 10% формалине для дальнейшего гистологического анализа с использованием стандартных методик заливки в парафин. Органы затем обследовали в отношении макроскопических аномалий, таких как модификация цвета или плотности тканей и наличие узелков. Во время проведения всех экспериментов с участием животных придерживались принципов по уходу за лабораторными животными (публикация NIH № 85-23, пересмотренная в 1985 г.; http://grants1.nih.gov/grants/olaw/references/phspol.htm) и указаний Европейской Комиссии по защите животных, используемых для научных целей (http://ec.europa.eu/environment/chemicals/lab_animals/legislation_en.htm). Все процедуры были одобрены институциональным комитетом по этике использования лабораторных животных (CIEPAL-Azur) (решение об одобрении № NCE-2012-52).
Пример 7. Тип линии клеток, используемой для получения полипептидов sFGFR3, не влияет на активность
Сравнивали активность связывания FGF2, Kd и эффект в отношении передачи сигнала в клетках для sFGFR3_Del1 (SEQ ID NO: 7), sFGFR3_Del4 (SEQ ID NO: 1) и sFGFR3_Del4-LK1-LK2 (SEQ ID NO: 10), полученных в клетках HEK 293 или клетках CHO в суспензионных культурах. Клетки HEK 293 или клетки CHO отличаются по посттрансляционной модификации белков. Экспрессия полипептидов sFGFR3 в различных линиях клеток не влияет на Kd, активность связывания или эффект полипептидов sFGFR3 в отношении ингибирования внутриклеточной передачи сигнала (фиг. 1A-1D).
Пример 8. Улучшенное получение sFGFR3_Del4-C253S и sFGFR3_Del4-D3
Каждый из полипептидов sFGFR3 sFGFR3_Del1 (SEQ ID NO: 7), sFGFR3_Del4 (SEQ ID NO: 1) и sFGFR3_Del4-LK1-LK2 (SEQ ID NO: 10) модифицировали таким образом, чтобы он содержал аминокислотную замену цистеинового остатка сериновым остатком в положении 253 либо удлиненный Ig-подобный домен 3 C2-типа (SEQ ID NO: 33). Такие модификации sFGFR3_Del1 и sFGFR3_Del4-LK1-LK2 не оказывали эффект или оказывали минимальный эффект в отношении получения полипептидов sFGFR3, поскольку агрегация была по-прежнему видимой (фиг. 2A и 2B соответственно). На удивление, модификация sFGFR3_Del4, при которой он содержал аминокислотную замену цистеинового остатка сериновым остатком в положении 253 (sFGFR3_Del4-C253S) либо удлиненный Ig-подобный домен 3 C2-типа (SEQ ID NO: 33)), улучшала получение полипептидов sFGFR3. В частности, наблюдалась минимальная агрегация sFGFR3_Del4-C253S и sFGFR3_Del4-D3 как в восстанавливающих, так и в невосстанавливающих условиях (фиг. 2C). Включение C253S или D3 также приводило в результате к относительному увеличению объема получения по сравнению с sFGFR3_Del4, двукратному увеличению объема получения sFGFR3_Del4-C253S и 3-кратному увеличению объема получения sFGFR3_Del4-D3.
Кроме того, sFGFR3_Del4, sFGFR3_Del4-C253S и sFGFR3_Del4-D3 демонстрировали сходную Kd, и на них не влияли изменения посттрансляционных модификаций, характерные для определенного типа клеток. В клетках ExpiCHO Kd sFGFR3_Del4 составляла 0,8 нМ, Kd sFGFR3_Del4-C253S, составляла 0,6 нМ, и Kd sFGFR3_Del4-D3 составляла 0,7 нМ (фиг. 3A и таблица 1).
Таблица 1. Константа диссоциации (Kd) полипептидов sFGFR3
Пример 9. sFGFR3_Del4-C253S и sFGFR3_Del4-D3 обладают одинаковой активностью in vitro
sFGFR3_Del4, sFGFR3_Del4-C253S и sFGFR3_Del4-D3 восстанавливали пролиферацию клеток ATDC5, генетически модифицированных таким образом, чтобы они сверхэкспрессировали мутантную форму FGFR3ach (линии клеток ATDC5 FGFR3G380R). В дозе 36 нМ sFGFR3_Del4, полученный с использованием клеток HEK 293, увеличивал пролиферацию до 115,5%, sFGFR3_Del4, полученный с использованием клеток CHO-S, увеличивал пролиферацию до 116%, sFGFR3_Del4-C253S, полученный с использованием клеток CHO-S, увеличивал пролиферацию до 114,4%, и sFGFR3_Del4-D3, полученный с использованием клеток CHO-S, увеличивал пролиферацию до 120,1% (фиг. 3B).
sFGFR3_Del4-D3 также тестировали в линии клеток HEK с SRE(-Luc), экспрессирующей FGFR3G380R, в дозах 0 нМ, 70 нМ и 280 нМ в присутствии или в отсутствие 1 нг/мл hFGF2 (фиг. 4; n=8). Данные, показанные на фиг. 4, представляют среднее значение +/- стандартную ошибку среднего (SEM). Эти данные соответствовали нормальному закону распределения и характеризовались равными дисперсиями на основании обобщенного критерия нормальности Д'Агостино-Пирсона. Статистические сравнения в присутствии и в отсутствие sFGFR3_Del4-D3 проводили с использованием t-критерия Стьюдента. Как показано на фиг. 4, sFGFR3_Del4-D3 уменьшает отслеживаемую с помощью люциферазы передачу сигнала в линии клеток с SRE.
Пример 10. sFGFR3_Del4-D3 восстанавливает рост костей, предупреждает смертность и восстанавливает форму большого затылочного отверстия у мышей с ахондроплазией
Исследование эффективности in vivo проводили согласно примеру 6 с использованием низкой дозы (0,25 мг/кг) sFGFR3_Del4-D3. В группу, получавшую инертную среду, включали в общей сложности 60 мышей с 32 мышами дикого типа (wt) и 28 мышами Fgfr3ach/+. Группы лечения включали 40 мышей c 19 мышами wt и 21 мышью Fgfr3ach/+. На удивление, низкая доза sFGFR3_Del4-D3 почти полностью предупреждала преждевременную смерть мышей с ахондроплазией (фиг. 5). В контрольной группе 53,6% мышей Fgfr3ach/+ умерли до отъема, тогда как только 4,8% мышей в группе лечения умерли до дня 22, и 20% мышей умерли после лечения с помощью sFGFR3_Del1 при 0,25 мг/кг (таблица 2; см. также Garcia et al. Sci. Transl. Med. 5:203ra124, 2013, настоящим включенную посредством ссылки во всей своей полноте).
sFGFR3_Del4-D3 также частично восстанавливал рост костей, корректируя изначальное несоответствие между мышами wt и Fgfr3ach/+ в отношении осевого и аппендикулярного скелета (таблица 2). В отличие от предыдущих результатов лечения с помощью низкой дозы sFGFR3_Del1, при лечении с помощью низкой дозы sFGFR3_Del4-D3 восстанавливалась нормальная форма большого затылочного отверстия.
Таблица 2. Результаты введения высокой дозы sFGFR3_Del1, низкой дозы sFGFR3_Del1 и низкой дозы sFGFR3_Del4-D3 мышам с ахондроплазией in vivo
Пример 11. Лечение ахондроплазии путем введения sFGFR3_Del4-C253S
Пациента-человека (например, младенца, ребенка, подростка или взрослого), страдающего ахондроплазией, можно лечить путем введения sFGFR3_Del4-C253S (фиг. 6; SEQ ID NO: 2) посредством соответствующего пути (например, путем подкожной инъекции) в определенной дозе (например, от 0,0002 мг/кг/день до приблизительно 20 мг/кг/день, как, например, от 0,001 мг/кг/день до 7 мг/кг/день) в течение нескольких дней, недель, месяцев или лет. Прогрессирование ахондроплазии, которую лечат с помощью sFGFR3_Del4-C253S, можно отслеживать с помощью одного или нескольких из некоторого числа установленных способов. Врач может отслеживать состояние пациента путем непосредственного осмотра в целях оценивания того, как симптомы ахондроплазии, проявляющиеся у пациента, изменяются в ответ на лечение. Например, врач может отслеживать изменения веса тела, длины черепа и/или ширины черепа пациента в течение определенного периода времени, например, 1, 2, 3, 4 или больше раз в месяц или в год или примерно каждые 1, 2, 3, 4, 5, 6, 7, 8, 12 или 16 недель в ходе курса лечения с помощью sFGFR3_Del4-C253S. Вес тела и/или размер черепа пациента или их изменения также можно определять при определенных событиях в рамках лечения, как, например, до и/или после введения sFGFR3_Del4-C253S. Например, измеряют вес тела и/или размер черепа в ответ на введение sFGFR3_Del4-C253S.
Пример 12. Лечение ахондроплазии путем введения sFGFR3_Del4-D3
Кроме того, пациента-человека (например, младенца, ребенка, подростка или взрослого), страдающего ахондроплазией, можно лечить путем введения полипептида sFGFR3 sFGFR3_Del4-D3 (SEQ ID NO: 33) посредством соответствующего пути (например, путем подкожной инъекции) в определенной дозе (например, от 0,0002 мг/кг/день до приблизительно 20 мг/кг/день, как, например, от 0,001 мг/кг/день до 7 мг/кг/день) в течение нескольких дней, недель, месяцев или лет. Прогрессирование ахондроплазии, которую лечат с помощью sFGFR3_Del4-D3, можно отслеживать с помощью одного или нескольких из некоторого числа установленных способов. Врач может отслеживать состояние пациента путем непосредственного осмотра в целях оценивания того, как симптомы ахондроплазии, проявляющиеся у пациента, изменяются в ответ на лечение. Например, врач может отслеживать изменения веса тела, длины черепа и/или ширины черепа пациента в течение определенного периода времени, например, 1, 2, 3, 4 или больше раз в месяц или в год или примерно каждые 1, 2, 3, 4, 5, 6, 7, 8, 12 или 16 недель в ходе курса лечения с помощью sFGFR3_Del4-D3. Вес тела и/или размер черепа пациента или их изменения также можно определять при определенных событиях в рамках лечения, как, например, до и/или после введения sFGFR3_Del4-D3. Например, измеряют вес тела и/или размер черепа в ответ на введение sFGFR3_Del4-D3.
Пример 13. Получение sFGFR3_Del4-D3 и sFGFR3_Del4-C253S
Полипептиды sFGFR3_Del4-D3 и sFGFR3_Del4-C253S очищали согласно описанному в примере 2. Модификация sFGFR3_Del4, при которой он содержал удлиненный Ig-подобный домен 3 C2-типа (FGFR3_Del4-D3) либо аминокислотную замену цистеинового остатка сериновым остатком в положении 253 (sFGFR3_Del4-C253S), улучшала получение полипептидов sFGFR3. В частности, наблюдалась менее чем приблизительно 2% агрегация sFGFR3_Del4-D3 и sFGFR3_Del4-C253S (что наблюдали при загрузке с использованием концентрации 2,3 мг/мл или 23 мг/мл для FGFR3_Del4-D3 и 1,5 мг/мл и 15 мг/мл sFGFR3_Del4-C253S) как в восстанавливающих, так и в невосстанавливающих условиях при использовании электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE; фиг. 7A и 7B соответственно). После получения sFGFR3_Del4-D3 и sFGFR3_Del4-C253S в подпитываемых культурах верхние пять клонов отделяли с использованием капиллярного электрофореза с получением соответственно 0,93-1,0 г/л и 0,98-1,1 г/л sFGFR3_Del4-D3 и sFGFR3_Del4-C253S. Вирусная фильтрация с использованием ионообменной хроматографии давала в результате выход, превышающий 60% как для sFGFR3_Del4-D3, так и для sFGFR3_Del4-C253S.
Пример 14. Фармакокинетические показатели и распределение в тканях sFGFR3_Del4-D3 in vivo
Исследования in vivo выполняли с целью изучения фармакокинетических параметров sFGFR3_Del4-D3, поглощения sFGFR3_Del4-D3 через гематоэнцефалический барьер и распределения sFGFR3_Del4-D3 в тканях почек, печени, селезенки, легких и сердца. Исследования, описанные в данном документе, предусматривали четыре когорты с пятью группами мышей C57BL/6J на когорту и в общей сложности четырьмя мышами (n=4) на группу (таблица 3). Мыши были самцами и весили от 25 до 30 граммов.
Таблица 3. Общие сведения о мышах, используемых в исследованиях sFGFR3_Del4-D3
У группы 1 брали образцы через 1 минуту, 15 минут и 30 минут; у группы 2 брали образцы через 4 часа; у группы 3 брали образцы через 24 часа; у группы 4 брали образцы через 36 часов; и у группы 5 брали образцы через 48 часов. В группе 1 постоянный внутриартериальный катетер (PE-10) вводили в одну общую сонную артерию под анестезией изофлураном и использовали для повторного забора крови в конечный момент времени забора образца 30 минут. При внутривенной инъекции 125I-sFGFR3_Del4-D3 вводили внутривенно в яремную вену, которую обнажали путем кожного разреза под анестезией изофлураном. Мыши из группы 1 оставались под анестезией на всем протяжении экспериментов. Повторный забор образцов крови (2 x ~ 50 мкл) производили из артериального катетера через 1 минуту и 15 минут после внутривенной инъекции. В группах 2-5 после инъекции 125I-sFGFR3_Del4-D3 кожу стягивали хирургическим зажимом, мышам позволяли проснуться, и их возвращали в клетку. За 5 минут до времени завершения для группы 3 мышей повторно подвергали анестезии, и они получали внутривенную болюсную дозу 3H-альбумина в яремную вену. Доза радиоизотопного индикатора 3H предназначалась для получения соотношения 125I и 3H в крови, подходящего для двойного мечения изотопами в более низкой дозе в последующие моменты времени забора образцов. В конечный момент времени забора образца (2 часа, 3 часа, 24 часа, 36 часов и 48 часов) собирали образец крови, и животное подвергали эвтаназии. Из головного мозга брали образцы для гомогенизации и определения концентрации радиоизотопных индикаторов в ткани. Конечные точки исследования включали в себя фармакокинетические параметры для sFGFR3_Del4-D3 (конечный период полувыведения), поглощение sFGFR3_Del4-D3 через гематоэнцефалический барьер и распределение sFGFR3_Del4-D3 в тканях почек, печени, селезенки, легких и сердца.
Пример 15. Температурная стабильность и стабильность в плазме крови sFGFR3_Del4-D3 и sFGFR3_Del4-C253S
Температурную стабильность sFGFR3_Del4-D3 и sFGFR3_Del4-C253S в плазме крови мышей изучали с использованием дифференциальной сканирующей калориметрии. В случае с sFGFR3_Del4-D3 к образцам полипептидов добавляли два буфера (20 мМ фосфата, 40 мМ NaCl, pH 7,5 и 20 мМ цитрата, 40 мМ NaCl, pH 6,5). В случае с sFGFR3_Del4-C253S к образцам полипептидов добавляли два буфера (20 мМ фосфата, 40 мМ NaCl, pH 7,5 и 40 мМ цитрата, 40 мМ NaCl, pH 6,5). Температура плавления (Tm) для sFGFR3_Del4-C253S в буфере с 20 мМ фосфата, 40 мМ NaCl, pH 7,5 составляла 52°C и 56°C, а Tm для sFGFR3_Del4-C253S в буфере с 40 мМ цитрата, 40 мМ NaCl, pH 6,5 составляла 55°C и 60°C (фиг. 8A). В случае с sFGFR3_Del4-D3 к образцам полипептидов добавляли два буфера (20 мМ фосфата, 40 мМ NaCl, pH 7,5 и 20 мМ цитрата, 40 мМ NaCl, pH 6,5). Tm для sFGFR3_Del4-D3 в буфере с 20 мМ фосфата, 40 мМ NaCl, pH 7,5 составляла 50°C и 54°C, а Tm для sFGFR3_Del4-D3 в буфере с 20 мМ цитрата, 40 мМ NaCl, pH 6,5 составляла 53°C и 58°C (фиг. 8B). Эти результаты указывают на то, что как sFGFR3_Del4-D3, так и sFGFR3_Del4-C253S демонстрируют два домена стабильности и разворачивания полипептида.
Стабильность sFGFR3_Del4-D3 с гистидиновой меткой в плазме крови ex vivo определяли путем мечения очищенного sFGFR3_Del4-D3 радиоизотопным индикатором 125I с использованием способа Болтона-Хантера с последующей очисткой на колонках PD-10 (Sephadex® G-25). Также определяли осаждаемость пиковых фракций трихлоруксусной кислотой (TCA) для подтверждения стабильности радиоизотопного индикатора 125I. В плазму крови мышей (n=4), предварительно нагретую до 37°C, добавляли точно измеренное количество 125I-sFGFR3_Del4-D3 до концентрации ~ 10 имп./мин./мл, и затем ее перемешивали вихревым способом. Образцы плазмы крови инкубировали с 125I-sFGFR3_Del4-D3 в Eppendorf ThermoMixer® при плавном вращении (300 об./мин). Аликвоты затем собирали для осаждения с помощью TCA (10 мкл образца и 100 мкл 2% BSA) и для введения в колонку для жидкостной хроматографии быстрого разрешения (FPLC) (20 мкл образца и 150 мкл 10 мМ PBS, pH 7,4) с интервалами 0, 30, 60, 120, 180 и 360 минут. Аликвоты хранили на льду до осуществления осаждения с помощью TCA или введения в колонку для FPLC.
В рамках осаждения с помощью TCA 1 мл ледяной 10% TCA добавляли к образцам плазмы крови, инкубировали в течение 10 минут на льду, центрифугировали при 4000 g в течение 5 минут, а затем надосадочную жидкость и осадок разделяли, и в обоих производили подсчет в счетчике гамма-излучения. В рамках оценивания стабильности в плазме крови ex vivo 100 мкл образца вводили в колонку для FPLC (Superdex® 200 10/300 GL) и элюировали со скоростью 0,75 мл/мин. 1,5 объемами колонки. Фракции по 1 мл собирали из колонки и затем измеряли в счетчике гамма-излучения. Стабильность sFGFR3_Del4-D3 в плазме крови при 37°C определяли составляющей 95% через 0 минут, 95% через 2 часа и ~ 92% через 24 часа при лишь незначительной агрегации (фиг. 9A).
Также определяли стабильность sFGFR3_Del4-D3 в плазме крови in vivo после введения путем внутривенной и подкожной инъекции. sFGFR3_Del4-D3 метили радиоизотопным индикатором 125I с использованием способа Болтона-Хантера с последующей очисткой на колонках PD-10 (Sephadex® G-25). Меченный 125I sFGFR3_Del4-D3 (10 мкКи в ~ 50 мкл PBS) вводили путем внутривенной или подкожной инъекции мышам C57BI/6 под анестезией. Дозу белка, меченного радиоизотопным индикатором 125I (примерно 0,1 мг/кг), дополняли немеченым белком до общей дозы 2,5 мг/кг. Крысиный сывороточный альбумин, используемый в качестве маркера повреждения сосудов, метили [3H]-NSP (N-сукцинимидил[2,3-3H]пропионатом; Perkin Elmer) и очищали на колонках PD-10 (Sephadex® G25).
В рамках исследования стабильности sFGFR3_Del4-D3 в плазме крови после внутривенной болюсной инъекции профили элюирования в ходе FPLC не демонстрировали продуктов распада в плазме крови в течение периода до 15 минут (фиг. 9B). Через 30 минут после введения sFGFR3_Del4-D3 появлялось небольшое количество низкомолекулярных продуктов распада, которое увеличивалось к 2 часам, но в значительной степени исчезало к 24 часам. В рамках исследования стабильности sFGFR3_Del4-D3 в плазме крови после подкожной инъекции профили элюирования в ходе FPLC демонстрировали некоторое количество продуктов распада в плазме крови через 30 минут с увеличением распада к 2 часам и 4 часам (фиг. 9C). Низкое количество радиоизотопного индикатора, остающегося в плазме крови через 24 часа, представлено главным образом интактным полипептидом sFGFR3_Del4-D3. Хроматограммы на нижней панели фиг. 9B и 9C представлены как нормализованные по наивысшему пику в каждом отдельном прогоне для более удобного сравнения паттернов элюирования.
Пример 16. Активность связывания лиганда sFGFR3_Del4-D3 и sFGFR3_Del4-C253S
Эксперименты проводили для получения характеристик аффинности связывания sFGFR3_Del4-D3 и sFGFR3_Del4-C253S в отношении FGF2 человека. Константу диссоциации (Kd) sFGFR3_Del4-D3 и Kd sFGFR3_Del4-C253S в отношении FGF2 определяли согласно описанному в примере 3 с использованием регенерирующего буфера с 20 мМ фосфата, 40 мМ NaCl, pH 7,5. Концентрации 13 нМ, 6,5 нМ, 3,25 нМ и 1,75 нМ тестировали как для sFGFR3_Del4-D3, так и для sFGFR3_Del4-C253S. Kd sFGFR3_Del4-D3 определяли составляющей ~ 3,6 нm, а Kd sFGFR3_Del4-C253S определяли составляющей ~ 6,9 нm. Эти результаты указывают на то, что sFGFR3_Del4-D3 и sFGFR3_Del4-C253S характеризуются активностью связывания в отношении FGF2 в диапазоне низких значений нМ.
Пример 17. sFGFR3_Del4-D3 и sFGFR3_Del4-C253S демонстрируют функциональную активность in vitro
Функциональную активность sFGFR3_Del4-D3 и sFGFR3_Del4-C253S тестировали с использованием анализа пролиферации. Анализы пролиферации с использованием клеток ATDC5, генетически модифицированных таким образом, чтобы они сверхэкспрессировали мутантную форму FGFR3ach (линий клеток ATDC5 FGFR3G380R), выполняли согласно описанному в примере 4 при концентрациях sFGFR3_Del4-D3 и sFGFR3_Del4-C253S 1 мкг/мл, 10 мкг/мл и 50 мкг/мл. В каждой из этих концентраций sFGFR3_Del4-C253S и sFGFR3_Del4-D3 восстанавливали пролиферацию клеток FGFR3G380R (фиг. 10A и 10B). EC50 определяли составляющей приблизительно 10 нМ как для sFGFR3_Del4-D3, так и для sFGFR3_Del4-C253S при использовании концентрации 1 мкг/мл. Эти результаты указывают на то, что sFGFR3_Del4-D3 и sFGFR3_Del4-C253S являются биологически активными в диапазоне низких значений нМ.
Пример 18. Фармакокинетический профиль sFGFR3_Del4-D3 и sFGFR3_Del4-C253S
Фармакокинетический (PK) профиль sFGFR3_Del4-D3, введенного подкожно или внутривенно в дозе 2,5 мг/кг, использовали для определения конечного периода полувыведения sFGFR3_Del4-D3 (фиг. 11). От мышей, которым вводили sFGFR3_Del4-D3 подкожно, образцы собирали через 30 минут, 2 часа, 4 часа, 8 часов, 24 часа, 36 часов и 48 часов.
От мышей, которым вводили sFGFR3_Del4-D3 внутривенно, образцы собирали через 1 минуту, 15 минут, 30 минут, 2 часа, 24 часа и 36 часов. Конечный период полувыведения при подкожном введении 2,5 мг/кг sFGFR3_Del4-D3 составлял ~ 20 часов, тогда как конечный период полувыведения при внутривенном введении 2,5 мг/кг sFGFR3_Del4-D3 составлял ~ 7 часов. Согласно PK-профилю Tmax составляло ~8 часов, Cmax составляла ~4,5 нМ, и расчетная биодоступность составляла ~ 30% для 2,5 мг/кг sFGFR3_Del4-D3, введенного подкожно. Наблюдались быстрое выведение sFGFR3_Del4-D3, введенного внутривенно, в течение α-фазы, за которой следовала β-фаза более медленного выведения, и сходный PK-профиль для внутривенно введенного sFGFR3_Del4-C253S.
Пример 19. Основными путями выведения sFGFR3_Del4-D3 являются почечный и печеночный
Выведение sFGFR3_Del4-D3 оценивали в ткани почек, печени, селезенки, легких и сердца через 30 минут, 120 минут и 1440 минут после внутривенного введения 2,5 мг/кг sFGFR3_Del4-D3 и через 30 минут, 120 минут, 240 минут, 480 минут и 1440 минут после подкожного введения 2,5 мг/кг sFGFR3_Del4-D3. Главными путями выведения sFGFR3_Del4-D3 при внутривенном введении являлись печеночный и почечный (фиг. 12). Главным путем выведения sFGFR3_Del4-D3 при подкожном введении являлся почечный (фиг. 13).
Пример 20. sFGFR3_Del4-D3 не пересекает гематоэнцефалический барьер
Фармакокинетические исследования также выполняли для определения поглощения sFGFR3_Del4-D3 через гематоэнцефалический барьер у мышей дикого типа. После внутривенной болюсной инъекции поглощение sFGFR3_Del4-D3 тканью головного мозга измеряли в три момента времени (30 минут, 2 часа и 24 часа). sFGFR3_Del4-D3 инъецировали в качестве вещества, меченного радиоизотопным индикатором (125I-sFGFR3_Del4-D3), с 2,5 мг/кг немеченого sFGFR3_Del4-D3. Инъецированная доза 125I-sFGFR3_Del4-D3 составляла приблизительно 10 мкКи на животное, что соответствовало величине менее 0,1 мг/кг. После эвтаназии мышей через 30 минут, 2 часа и 24 часа концентрацию 125I-sFGFR3_Del4-D3 в органах и плазме крови измеряли путем жидкостного сцинтилляционного счета.
При определении концентрации 125I-sFGFR3_Del4-D3 вводили поправку на метаболизм в плазме крови и в образцах головного мозга путем измерения фракции материала, осаждаемого трихлоруксусной кислотой (TCA) (например, интактного материала, меченного радиоизотопным индикатором). Правильность поправки с помощью TCA также подтверждали путем введения образцов в колонку для эксклюзионной жидкостной экспресс-хроматографии белков (FPLC). При определении концентрации 125I-sFGFR3_Del4-D3 в органе вводили поправку на содержание внутри сосудов (V0) путем инъекции альбумина, меченного радиоактивным изотопом (3H-RSA), незадолго до умерщвления животного. Кажущийся объем распределения RSA в органе представляет V0. Доза альбумина была пренебрежимо малой (порядка 1% от физиологической концентрации). Для всех органов, отличных от головного мозга, концентрации рассчитывали путем вычитания содержания в сосудах и с учетом осаждаемой с помощью TCA фракции в плазме крови. Однако, поправку на поглощение распадающегося материала в этих органах, отличных от головного мозга, не вводили, поскольку не выполняли осаждение с помощью TCA.
Концентрации в головном мозге рассчитывали по следующей формуле: Cголовной мозг (с поправкой) =[Vd(sFGFR3_Del4-D3) - V0] X Cплазма крови (конечная), в которой Vd(sFGFR3_Del4-D3) представляет собой объем распределения sFGFR3_Del4-D3 в головном мозге (рассчитанный как Cголовной мозг/Cплазма крови), V0 представляет собой объем распределения альбумина в головном мозге, и Cплазма крови (конечная) представляет собой концентрацию sFGFR3_Del4-D3 в плазме крови в конечный момент времени забора образца. Все концентрации выражали в виде процента инъецированной дозы на грамм или мл (% ID/г или % ID/мл) соответственно, и доза внутривенного болюсного введения равнялась 100%. Такие значения можно переводить в [мг/г] или [мг/мл] путем умножения на инъецированную дозу: (вес тела в г/1000 г) x 2,5 мг. Все значения веса тела находились в диапазоне от 25 г до 30 г.
Как указывали концентрации в головном мозге с поправкой (после введения поправки на содержание в сосудах и распад (осаждаемость с помощью TCA)), выявляемое поглощение головным мозгом 125I-sFGFR3_Del4-D3 не наблюдалось ни в один из моментов времени, в которые проводили измерения (фиг. 14A). Кроме того, Vd для RSA (= V0) и 125I-sFGFR3_Del4-D3 значимо не различались ни в один из моментов времени, в которые проводили измерения (30 минут, 2 часа и 24 часа), как определено с помощью парного t-критерия (фиг. 14B). В заключение необходимо отметить, что измеряемое поглощение sFGFR3_Del4-D3, инъецированного путем внутривенного болюсного введения в дозе 2,5 мг/кг, тканью головного мозга мышей через 30 минут, 2 часа и 24 часа не наблюдалось.
Пример 21. Эффективность sFGFR3_Del4-D3 для лечения ахондроплазии in vivo
Каждый из sFGFR3_Del4-D3 и sFGFR3_Del4-C253S оценивали в дозе для подкожного введения 2,5 мг/кг один раз или два раза в неделю или 10 мг/кг два раза в неделю. Выполняли скрещивание с получением 30 пометов, половина мышей в которых имела дикий тип, а половина была гетерозиготной по Fgfr3ach/+ (таблица 4).
Таблица 4. Подкожное введение sFGFR3_Del4-D3 и sFGFR3_Del4-C253S мышам дикого типа (WT) и Fgfr3ach/+
В день 3 все новорожденные мыши из одного помета получали одну и ту же дозу. Контрольные пометы получали 10 мкл PBS (инертной среды). После этого проводили подкожные инъекции sFGFR3_Del4-D3 и sFGFR3_Del4-C253S в дозах 2,5 мг/кг один или два раза в неделю или 10 мг/кг два раза в неделю в течение трех недель попеременно в левую и правую части поясницы. Мышей наблюдали ежедневно, уделяя особое внимание изменениям в двигательной активности и мочеиспускании, и взвешивали в дни инъекции. Мышей с осложнениями наблюдали два раза в день в целях надзора. Предыдущие данные указывают на то, что между самцами и самками не существует статистически значимых различий, и, таким образом, самцов и самок рассматривали как одну группу во всех анализах.
В день 22 всех животных умерщвляли путем смертельной инъекции пентобарбитала, и определяли пол. Все последующие измерения и анализы выполняли без осведомленности о генотипе мышей во избежание систематической ошибки исследователя. Генотипирование выполняли в конце исследования для выявления соответствия данных конкретному генотипу. Поскольку ахондроплазия является заболеванием с фенотипической изменчивостью, всех животных включали в исследование. Животных, умерших до дня 22, использовали для изучения влияния лечения на преждевременную смерть. Животных, выживших к 22 дню, использовали во всех анализах. Все эксперименты и измерения данных выполнялись экспериментаторами в слепом режиме во все моменты времени.
При подкожном введении sFGFR3_Del4-D3 при 2,5 мг/кг один раз или два раза в неделю или 10 мг/кг два раза в неделю увеличивалась выживаемость мышей Fgfr3ach/+ по сравнению с мышами Fgfr3ach/+, получавшими PBS (фиг. 15 и таблица 4). В частности, введение 10 мг/кг sFGFR3_Del4-D3 два раза в неделю приводило к 93% выживаемости мышей Fgfr3ach/+, введение 2,5 мг/кг sFGFR3_Del4-D3 один раз в неделю приводило к 84% выживаемости мышей Fgfr3ach/+, и введение 2,5 мг/кг sFGFR3_Del4-D3 два раза в неделю приводило к 72% выживаемости мышей Fgfr3ach/+, тогда как выживаемость мышей Fgfr3ach/+, получавших PBS, составляла 62,8%. Смертность мышей Fgfr3ach/+, которым вводили 10 мг/кг sFGFR3_Del4-D3 два раза в неделю, составляла 6,7%, смертность мышей Fgfr3ach/+, которым вводили 2,5 мг/кг sFGFR3_Del4-D3 один раз в неделю, составляла 15,4%, смертность мышей Fgfr3ach/+, которым вводили 2,5 мг/кг sFGFR3_Del4-D3 два раза в неделю, составляла 28,0%, и смертность мышей Fgfr3ach/+, которым вводили PBS, составляла 37,2%. Статистические анализы выживаемости мышей Fgfr3ach/+ после лечения с помощью sFGFR3_Del4-D3 выполняли с использованием обобщенного критерия нормальности Д'Агостино-Пирсона, а затем t-критерия. Все изучаемые группы соответствовали критериям нормальности. P-значения для этих анализов показаны ниже, при этом * представляет p-значение < 0,05, а *** представляет p-значение < 0,001 (таблица 5).
Таблица 5. P-значения для подкожного введения sFGFR3_Del4-D3 мышам дикого типа (WT) и Fgfr3ach/+
При подкожном введении sFGFR3_Del4-D3 при 2,5 мг/кг один раз или два раза в неделю или 10 мг/кг два раза в неделю также уменьшалась тяжесть и частота возникновения проблем с двигательной активностью и осложнений со стороны брюшного дыхания у мышей Fgfr3ach/+ по сравнению с мышами Fgfr3ach/+, получавшими PBS (фиг. 16). В частности, интенсивность проявления проблем с двигательной активностью уменьшалась в наибольшей степени у мышей Fgfr3ach/+, которым вводили подкожно 10 мг/кг sFGFR3_Del4-D3 два раза в неделю, за которыми располагались мыши, которым вводили 2,5 мг/кг sFGFR3_Del4-D3 два раза в неделю, и мыши, которым вводили 2,5 мг/кг sFGFR3_Del4-D3 один раз в неделю. Интенсивность проявления осложнений со стороны брюшного дыхания уменьшалась в наибольшей степени у мышей Fgfr3ach/+, которым вводили подкожно 10 мг/кг sFGFR3_Del4-D3 два раза в неделю, за которыми располагались мыши, которым вводили 2,5 мг/кг sFGFR3_Del4-D3 один раз в неделю, а затем мыши, которым вводили 2,5 мг/кг sFGFR3_Del4-D3 два раза в неделю. Эти результаты показывают, что sFGFR3_Del4-D3 уменьшает интенсивность проявления симптомов ахондроплазии у мышей Fgfr3ach/+.
При подкожном введении sFGFR3_Del4-D3 также значимо увеличивалась общая длина тела, в том числе осевая длина тела и длина хвоста, и удлинялись кости (p=0,07) у мышей Fgfr3ach/+, получавших 2,5 мг/кг sFGFR3_Del4-D3 один раз или два раза в неделю или 10 мг/кг sFGFR3_Del4-D3 два раза в неделю, по сравнению с мышами Fgfr3ach/+, получавшими PBS (фиг. 17A-17C). Длину хвоста и тела (осевую длину тела) измеряли с помощью того же цифрового штангенциркуля, который использовали для целых скелетов. Длину большеберцовой кости измеряли с помощью цифровой рентгенографии. Введение 10 мг/кг sFGFR3_Del4-D3 два раза в неделю приводило у мышей Fgfr3ach/+ к 51% коррекции осевого скелета (длины тела и хвоста), за которой располагалась 43% коррекция осевого скелета у мышей Fgfr3ach/+, получавших 2,5 мг/кг sFGFR3_Del4-D3 два раза в неделю, и 39% коррекция осевого скелета у мышей Fgfr3ach/+, получавших 2,5 мг/кг sFGFR3_Del4-D3 один раз в неделю. Увеличения длины костей и тела также были очевидными из рентгенограмм мышей Fgfr3ach/+, которым вводили 2,5 мг/кг или 10 мг/кг sFGFR3_Del4-D3 два раза в неделю, по сравнению с мышами Fgfr3ach/+, получавшими PBS (фиг. 17D). Введение 10 мг/кг sFGFR3_Del4-D3 два раза в неделю приводило у мышей Fgfr3ach/+ к 86% коррекции аппендикулярного скелета (длины большеберцовой кости и бедренной кости), за которой располагалась 68% коррекция аппендикулярного скелета у мышей Fgfr3ach/+, получавших 2,5 мг/кг sFGFR3_Del4-D3 два раза в неделю, и 54% коррекция аппендикулярного скелета у мышей Fgfr3ach/+, получавших 2,5 мг/кг sFGFR3_Del4-D3 один раз в неделю.
Подкожное введение sFGFR3_Del4-D3 также приводило к дозозависимому улучшению головного указателя (отношения длина/ширина (L/W)) у мышей Fgfr3ach/+ по сравнению с мышами Fgfr3ach/+, получавшими PBS (фиг. 18A). У мышей Fgfr3ach/+, которым подкожно вводили 10 мг/кг sFGFR3_Del4-D3 два раза в неделю, проявлялось наибольшее улучшение головного указателя (L/W), за ними располагались мыши Fgfr3ach/+, которым вводили 2 мг/кг sFGFR3_Del4-D3 два раза в неделю, и мыши Fgfr3ach/+, которым вводили 2 мг/кг sFGFR3_Del4-D3 один раз в неделю. В частности, введение 10 мг/кг sFGFR3_Del4-D3 два раза в неделю приводило у мышей Fgfr3ach/+ к 37% коррекции формы черепа (соотношения L/W), за которой располагалась 29% коррекция формы черепа у мышей Fgfr3ach/+, получавших 2,5 мг/кг sFGFR3_Del4-D3 два раза в неделю, и 19% коррекция формы черепа у мышей Fgfr3ach/+, получавших 2,5 мг/кг sFGFR3_Del4-D3 один раз в неделю. Улучшения головного указателя также были очевидными из рентгенограмм мышей Fgfr3ach/+, которым вводили 10 мг/кг sFGFR3_Del4-D3, по сравнению с мышами Fgfr3ach/+, получавшими PBS (фиг. 18B). Измеренные значения параметров костей (представленные в мм и в виде среднего значения ± SEM) для длины тела, хвоста, бедренной кости, большеберцовой кости и головного указателя показаны ниже (таблица 6). Эти результаты указывают на дозозависимую эффективность sFGFR3_Del4-D3 in vivo, демонстрируемую по увеличению выживаемости, снижению количества осложнений, увеличению темпов роста костей и улучшениям пропорций скелета у мышей Fgfr3ach/+.
Таблица 6. Измеренные значения параметров костей (представленные в мм и в виде среднего значения ± SEM) для длины тела, хвоста, бедренной кости, большеберцовой кости и головного указателя мышей WT и Fgfr3ach/+, которым вводили подкожно SFGFR3_Del4-D3
Кроме того, сравнение измеренных значений параметров костей для мышей Fgfr3ach/+, которым вводили sFGFR3_Del1 в дозе 2,5 мг/кг два раза в неделю, показывает, что введение sFGFR3_Del4-D3 в дозе 2,5 мг/кг два раза в неделю было сравнимым или более эффективным для увеличения длины тела, хвоста, бедренной кости и большеберцовой кости и улучшения головного указателя у мышей Fgfr3ach/+ (таблица 7). В частности, длина тела мышей Fgfr3ach/+, которым вводили sFGFR3_Del4-D3, улучшалась до 135,5 ± 1,75 мм по сравнению с 134,4 ± 1,17 мм для мышей Fgfr3ach/+, которым вводили sFGFR3_Del1; длина хвоста мышей Fgfr3ach/+, которым вводили sFGFR3_Del4-D3, улучшалась до 73,69 ± 1,5 мм по сравнению с 71,58 ± 0,86 мм для мышей Fgfr3ach/+, которым вводили sFGFR3_Del1; длина бедренной кости мышей Fgfr3ach/+, которым вводили sFGFR3_Del4-D3, улучшалась до 10,58 ± 0,09 мм по сравнению с 10,01 ± 0,06 мм для мышей Fgfr3ach/+, которым вводили sFGFR3_Del1; длина большеберцовой кости мышей Fgfr3ach/+, которым вводили sFGFR3_Del4-D3, улучшалась до 14,09 ± 0,12 мм по сравнению с 13,27 ± 0,31 мм для мышей Fgfr3ach/+, которым вводили sFGFR3_Del1; и головной указатель мышей Fgfr3ach/+, которым вводили sFGFR3_Del4-D3, улучшался до 1,85 ± 0,01 мм по сравнению с 1,81 ± 0,02 мм для мышей Fgfr3ach/+, которым вводили sFGFR3_Del1.
Таблица 7. Измеренные значения параметров костей (представленные в мм и в виде среднего значения ± SEM) для длины тела, хвоста, бедренной кости, большеберцовой кости и головного указателя мышей WT и Fgfr3ach/+, которым вводили подкожно sFGFR3_Del1 (данные описаны в Garcia et al. Sci. Transl. Med. 5:203ra124, 2013).
Пример 22. Отсутствие органной токсичности, ассоциированной с введением sFGFR3_Del4-D3
Гистопатологические исследования проводили для получения характеристик органной токсичности, ассоциированной с введением sFGFR3_Del4-D3. Мышам дикого типа (6 самцам и 6 самкам на дозу) вводили PBS, 2,5 мг/кг sFGFR3_Del4-D3 один раз в неделю, 2,5 мг/кг sFGFR3_Del4-D3 два раза в неделю или 10 мг/кг sFGFR3_Del4-D3 два раза в неделю. Изучаемые органы включали в себя почки, кожу, слюнные железы, подчелюстные лимфатические узлы, желчный пузырь, селезенку, поджелудочную железу, легкие, сердце, аорту, тощую кишку, ободочную кишку и печень. Результаты гистопатологических исследований, которые указывали бы на органную токсичность у мышей дикого типа, которым вводили какую-либо из доз sFGFR3_Del4-D3, отсутствовали. Эти результаты указывают на отсутствие токсичности, ассоциированной с введением sFGFR3_Del4-D3 в дозах до 10 мг/кг два раза в неделю.
Пример 23. Определение аффинности связывания sFGFR3_Del4-D3 с факторами роста фибробластов
Авторы настоящего изобретения определили, что sFGFR3_Del4-D3 связывается с лигандами, являющимися факторами роста фибробластов (FGF), и действует как "ловушка" для предотвращения связывания FGF с мембраносвязанным FGFR3. Исследование поверхностного плазмонного резонанса выполняли с использованием BIACORE™ T200 (GE Healthcare) для определения значений Kd для различных FGF человека (hFGF), связывающихся с иммобилизованным sFGFR3_Del4-D3. В частности, определяли значения Kd для паракринных hFGF hFGF1 (фиг. 19A), hFGF2 (фиг. 19B), hFGF9 (фиг. 19C) и hFGF18 (фиг. 19D), а также эндокринных hFGF hFGF19 (фиг. 19E) и hFGF21 (фиг. 19F). Все четыре паракринных лиганда FGF связывали sFGFR3_Del4-D3 с наномолярной (нМ) аффинностью (таблица 8).
Таблица 8. Сводная информация об определении и значениях Kd для паракринных FGF человека (hFGF1, hFGF2, hFGF9 и hFGF18) и эндокринных FGF человека (hFGF19 и hFGF21)
с)
с)
Для FGF2 и FGF18 хорошей аппроксимации достигали с моделью связывания 1:1, которая представляет собой наиболее точную модель аффинности связывания. Эта модель описывает связывающее взаимодействие 1:1 на поверхности чипа с иммобилизованным SFGFR3_Del4-D3, связывающим различные FGF: A+B=AB, с одной скоростью ассоциации и диссоциации. Модель 2:1 также описывает взаимодействие 1:1 FGF, связывающегося с SFGFR3_DEL4-D3, но также предполагает конформационное изменение, которое стабилизирует комплекс: A+B=AB=AB*, и предусматривает две скорости ассоциации и диссоциации. Эта модель предполагает, что конформационно измененный комплекс (SFGFR3_Del4-D3, связанный с FGF) может диссоциироваться только путем устранения конформационного изменения. Экспериментальные данные для hFGF1, hFGF9, hFGF19 и hFGF21 определяли для аппроксимации модели 2:1 очень точно, и, таким образом, Kd для hFGF1, hFGF9, hFGF19 и hFGF21 получали из модели 2:1.
Несмотря на то, что все из hFGF1, hFGF9, hFGF19 и hFGF21 характеризовались Kd в диапазоне низких значений нМ, кинетические профили этих hFGF значительно различались. Например, FGF1 связывает sFGFR3_Del4-D3 при очень высокой скорости ассоциации и скорости диссоциации, тогда как FGF2 не связывает sFGFR3_Del4-D3 при такой же высокой скорости ассоциации и скорости диссоциации, как FGF1, что обуславливает в целом меньшую Kd для FGF2 по сравнению с FGF1 (таблица 8). Измеренная аффинность взаимодействия между sFGFR3_Del4-D3 и hFGF19 или hFGF21, которые являются представителями эндокринного подсемейства FGF15/FGF19, была значительно более низкой по сравнению с паракринными hFGF (таблица 8 и фиг. 19D и 19E). Подсемейство FGF15/FGF19 использует клото вместо протеогликанов в качестве кофактора и эволюционировало в факторы роста эндокринного действия, важные для системной регуляции метаболических параметров, таких как метаболизм фосфатов, желчных кислот, углеводов и липидов.
Эти результаты демонстрируют, что взаимодействие sFGFR3_Del4-D3 с hFGF1, hFGF2, hFGF9 и hFGF18 являлось высокоаффинным, тогда как взаимодействие sFGFR3_Del4-D3 с FGF19 и FGF21 являлось низкоаффинным. Низкая аффинность sFGFR3_Del4-D3 в отношении FGF19 и FGF21 является преимущественной, поскольку sFGFR3_Del4-D3 будет характеризоваться низкой вероятностью препятствования функционированию этих FGF in vivo.
Пример 24. Анализ пролиферации in vitro с использованием sFGFR3_Del4-D3
После связывания FGF FGFR3 димеризуется, запуская сигнальные каскады. Некоторые нисходящие сигнальные пути ассоциированы с передачей сигнала от FGF. В хондроцитах димеризованный FGFR3 обуславливает передачу антипролиферативного сигнала/сигнала ранней дифференцировки в хондроцит, что в конечном итоге приводит к ингибированию роста костей. Например, по пути RAS/MAPK передаются сигналы, отрицательного влияющие на пролиферацию, конечную дифференцировку и постмитотический синтез матрикса, и путь STAT1 опосредует ингибирование пролиферации хондроцитов совместно с регуляторами клеточного цикла p107 и 130 и ингибитором клеточного цикла p21Waf/Cip1. Исследования экспрессии генов предполагают наличие ряда других путей, которые также участвуют в снижении количества молекул, стимулирующих рост, или индукции антипролиферативных функций.
Для исследования ингибирования FGFR3G380R, индуцируемого FGFR3-"ловушкой", в клеточной модели на хондроцитах выполняли исследования для определения эффекта sFGFR3_Del4-D3 в отношении пролиферации клеток ATDC5, генетически модифицированных таким образом, чтобы они сверхэкспрессировали мутантную форму FGFR3ach (клеток ATDC5 FGFR3G380R). Клетки линии клеток-хондроцитов ATDC5, которые были впервые выделены из линии дифференцирующихся стволовых клеток тератокарциномы AT805, широко применяются в качестве модели для изучения хондроцитов in vitro. Клетки ATDC5 вначале инфицировали ретровирусным вектором экспрессии, и была получена стабильная линия клеток, экспрессирующая FGFR3G380R. Экспрессию FGFR3G380R в линии клеток ATDC5 определяли с помощью вестерн-блоттинга (фиг. 20). Экстракты клеток ATDC5, экспрессирующих FGFR3G380R при первом (G380R № 1) и втором пассаже (G380R № 2) после отбора устойчивых клеток, и экстракты контрольных клеток ATDC5 подвергали блоттингу, и с помощью антител в них выявляли общее фосфорилирование FGFR3 (pFGFR3), специфический фосфотирозин 724 в FGFR3 (pFGFR3 Y724) и общую экспрессию FGFR3 (FGFR3). В качестве контроля нагрузки использовали общую экспрессию киназы, регулируемой внеклеточными сигналами (ERK). При добавлении SFGFR3_Del4-D3 к клеткам ATDC5 FGFR3G380R происходило дозозависимое увеличение индекса пролиферации клеток ATDC5 FGFR3G380R в два раза при EC50 1,25 +/- 0,27 нМ (фиг. 21). Эти результаты демонстрируют, что добавление SFGFR3_Del4-D3 к клеткам ATDC5 FGFR3G380R компенсирует отрицательный сигнал роста, опосредуемый FGFR3G380R в клеточной модели ахондроплазии, что справедливо и для антипролиферативного сигнала, опосредуемого FGFR3 в хондроцитах, который является более выраженным, если хондроциты экспрессируют FGFR3, содержащий мутацию G380R.
ДРУГИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
Все публикации, патенты и патентные заявки, упомянутые в приведенном выше описании, настоящим включены посредством ссылки в той же степени, как если бы каждая отдельная публикация, патент или патентная заявка была конкретно и отдельно указана как включенная посредством ссылки во всей своей полноте. Различные модификации и видоизменения раскрытых способов, фармацевтических композиций и наборов по настоящему изобретению будут очевидны специалисту в данной области без отступления от объема и сути настоящего изобретения. Хотя настоящее изобретение было описано с использованием конкретных вариантов осуществления, будет понятно, что оно предусматривает дополнительные модификации, и что заявленное настоящее изобретение не должно неоправданно ограничиваться такими конкретными вариантами осуществления. В действительности предполагается, что различные модификации описанных способов осуществления настоящего изобретения, которые очевидны для специалиста в данной области, находятся в пределах объема настоящего изобретения. Предполагается, что настоящая заявка охватывает любые видоизменения, пути применения или адаптации настоящего изобретения, в целом соответствующие принципам настоящего изобретения и включающие такие отступления от настоящего изобретения, которые согласуются с известной обычной практикой в данной области техники, к которой относится настоящее изобретение, и они могут быть применены к существенным признакам, изложенным в данном документе выше.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> THERACHON
INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE
UNIVERSITE NICE SOPHIA ANTIPOLIS
<120> ПОЛИПЕПТИДЫ, ЯВЛЯЮЩИЕСЯ РАСТВОРИМЫМИ РЕЦЕПТОРАМИ 3 ФАКТОРА РОСТА
ФИБРОБЛАСТОВ (SFGFR3), И ПУТИ ИХ ПРИМЕНЕНИЯ
<130> 901-10 PCT
<150> 62/467,478
<151> 2017-03-06
<150> 62/359,607
<151> 2016-07-07
<160> 39
<170> PatentIn версия 3.5
<210> 1
<211> 301
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 1
Glu Ser Leu Gly Thr Glu Gln Arg Val Val Gly Arg Ala Ala Glu Val
1 5 10 15
Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln Leu Val Phe Gly Ser Gly
20 25 30
Asp Ala Val Glu Leu Ser Cys Pro Pro Pro Gly Gly Gly Pro Met Gly
35 40 45
Pro Thr Val Trp Val Lys Asp Gly Thr Gly Leu Val Pro Ser Glu Arg
50 55 60
Val Leu Val Gly Pro Gln Arg Leu Gln Val Leu Asn Ala Ser His Glu
65 70 75 80
Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg Leu Thr Gln Arg Val Leu
85 90 95
Cys His Phe Ser Val Arg Val Thr Asp Ala Pro Ser Ser Gly Asp Asp
100 105 110
Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr Gly Val Asp Thr Gly Ala
115 120 125
Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp Lys Lys Leu Leu Ala Val
130 135 140
Pro Ala Ala Asn Thr Val Arg Phe Arg Cys Pro Ala Ala Gly Asn Pro
145 150 155 160
Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly Arg Glu Phe Arg Gly Glu
165 170 175
His Arg Ile Gly Gly Ile Lys Leu Arg His Gln Gln Trp Ser Leu Val
180 185 190
Met Glu Ser Val Val Pro Ser Asp Arg Gly Asn Tyr Thr Cys Val Val
195 200 205
Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr Tyr Thr Leu Asp Val Leu
210 215 220
Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly Leu Pro Ala Asn
225 230 235 240
Gln Thr Ala Val Leu Gly Ser Asp Val Glu Phe His Cys Lys Val Tyr
245 250 255
Ser Asp Ala Gln Pro His Ile Gln Trp Leu Lys His Val Glu Val Asn
260 265 270
Gly Ser Lys Val Gly Pro Asp Gly Thr Pro Tyr Val Thr Val Leu Lys
275 280 285
Val Ser Leu Glu Ser Asn Ala Ser Met Ser Ser Asn Thr
290 295 300
<210> 2
<211> 301
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 2
Glu Ser Leu Gly Thr Glu Gln Arg Val Val Gly Arg Ala Ala Glu Val
1 5 10 15
Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln Leu Val Phe Gly Ser Gly
20 25 30
Asp Ala Val Glu Leu Ser Cys Pro Pro Pro Gly Gly Gly Pro Met Gly
35 40 45
Pro Thr Val Trp Val Lys Asp Gly Thr Gly Leu Val Pro Ser Glu Arg
50 55 60
Val Leu Val Gly Pro Gln Arg Leu Gln Val Leu Asn Ala Ser His Glu
65 70 75 80
Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg Leu Thr Gln Arg Val Leu
85 90 95
Cys His Phe Ser Val Arg Val Thr Asp Ala Pro Ser Ser Gly Asp Asp
100 105 110
Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr Gly Val Asp Thr Gly Ala
115 120 125
Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp Lys Lys Leu Leu Ala Val
130 135 140
Pro Ala Ala Asn Thr Val Arg Phe Arg Cys Pro Ala Ala Gly Asn Pro
145 150 155 160
Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly Arg Glu Phe Arg Gly Glu
165 170 175
His Arg Ile Gly Gly Ile Lys Leu Arg His Gln Gln Trp Ser Leu Val
180 185 190
Met Glu Ser Val Val Pro Ser Asp Arg Gly Asn Tyr Thr Cys Val Val
195 200 205
Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr Tyr Thr Leu Asp Val Leu
210 215 220
Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly Leu Pro Ala Asn
225 230 235 240
Gln Thr Ala Val Leu Gly Ser Asp Val Glu Phe His Ser Lys Val Tyr
245 250 255
Ser Asp Ala Gln Pro His Ile Gln Trp Leu Lys His Val Glu Val Asn
260 265 270
Gly Ser Lys Val Gly Pro Asp Gly Thr Pro Tyr Val Thr Val Leu Lys
275 280 285
Val Ser Leu Glu Ser Asn Ala Ser Met Ser Ser Asn Thr
290 295 300
<210> 3
<211> 47
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 3
Thr Ala Gly Ala Asn Thr Thr Asp Lys Glu Leu Glu Val Leu Ser Leu
1 5 10 15
Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr Cys Leu Ala Gly Asn
20 25 30
Ser Ile Gly Phe Ser His His Ser Ala Trp Leu Val Val Leu Pro
35 40 45
<210> 4
<211> 348
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 4
Glu Ser Leu Gly Thr Glu Gln Arg Val Val Gly Arg Ala Ala Glu Val
1 5 10 15
Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln Leu Val Phe Gly Ser Gly
20 25 30
Asp Ala Val Glu Leu Ser Cys Pro Pro Pro Gly Gly Gly Pro Met Gly
35 40 45
Pro Thr Val Trp Val Lys Asp Gly Thr Gly Leu Val Pro Ser Glu Arg
50 55 60
Val Leu Val Gly Pro Gln Arg Leu Gln Val Leu Asn Ala Ser His Glu
65 70 75 80
Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg Leu Thr Gln Arg Val Leu
85 90 95
Cys His Phe Ser Val Arg Val Thr Asp Ala Pro Ser Ser Gly Asp Asp
100 105 110
Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr Gly Val Asp Thr Gly Ala
115 120 125
Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp Lys Lys Leu Leu Ala Val
130 135 140
Pro Ala Ala Asn Thr Val Arg Phe Arg Cys Pro Ala Ala Gly Asn Pro
145 150 155 160
Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly Arg Glu Phe Arg Gly Glu
165 170 175
His Arg Ile Gly Gly Ile Lys Leu Arg His Gln Gln Trp Ser Leu Val
180 185 190
Met Glu Ser Val Val Pro Ser Asp Arg Gly Asn Tyr Thr Cys Val Val
195 200 205
Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr Tyr Thr Leu Asp Val Leu
210 215 220
Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly Leu Pro Ala Asn
225 230 235 240
Gln Thr Ala Val Leu Gly Ser Asp Val Glu Phe His Cys Lys Val Tyr
245 250 255
Ser Asp Ala Gln Pro His Ile Gln Trp Leu Lys His Val Glu Val Asn
260 265 270
Gly Ser Lys Val Gly Pro Asp Gly Thr Pro Tyr Val Thr Val Leu Lys
275 280 285
Thr Ala Gly Ala Asn Thr Thr Asp Lys Glu Leu Glu Val Leu Ser Leu
290 295 300
Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr Cys Leu Ala Gly Asn
305 310 315 320
Ser Ile Gly Phe Ser His His Ser Ala Trp Leu Val Val Leu Pro Val
325 330 335
Ser Leu Glu Ser Asn Ala Ser Met Ser Ser Asn Thr
340 345
<210> 5
<211> 784
<212> БЕЛОК
<213> Homo sapiens
<400> 5
Glu Ser Leu Gly Thr Glu Gln Arg Val Val Gly Arg Ala Ala Glu Val
1 5 10 15
Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln Leu Val Phe Gly Ser Gly
20 25 30
Asp Ala Val Glu Leu Ser Cys Pro Pro Pro Gly Gly Gly Pro Met Gly
35 40 45
Pro Thr Val Trp Val Lys Asp Gly Thr Gly Leu Val Pro Ser Glu Arg
50 55 60
Val Leu Val Gly Pro Gln Arg Leu Gln Val Leu Asn Ala Ser His Glu
65 70 75 80
Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg Leu Thr Gln Arg Val Leu
85 90 95
Cys His Phe Ser Val Arg Val Thr Asp Ala Pro Ser Ser Gly Asp Asp
100 105 110
Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr Gly Val Asp Thr Gly Ala
115 120 125
Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp Lys Lys Leu Leu Ala Val
130 135 140
Pro Ala Ala Asn Thr Val Arg Phe Arg Cys Pro Ala Ala Gly Asn Pro
145 150 155 160
Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly Arg Glu Phe Arg Gly Glu
165 170 175
His Arg Ile Gly Gly Ile Lys Leu Arg His Gln Gln Trp Ser Leu Val
180 185 190
Met Glu Ser Val Val Pro Ser Asp Arg Gly Asn Tyr Thr Cys Val Val
195 200 205
Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr Tyr Thr Leu Asp Val Leu
210 215 220
Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly Leu Pro Ala Asn
225 230 235 240
Gln Thr Ala Val Leu Gly Ser Asp Val Glu Phe His Cys Lys Val Tyr
245 250 255
Ser Asp Ala Gln Pro His Ile Gln Trp Leu Lys His Val Glu Val Asn
260 265 270
Gly Ser Lys Val Gly Pro Asp Gly Thr Pro Tyr Val Thr Val Leu Lys
275 280 285
Thr Ala Gly Ala Asn Thr Thr Asp Lys Glu Leu Glu Val Leu Ser Leu
290 295 300
His Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr Cys Leu Ala Gly
305 310 315 320
Asn Ser Ile Gly Phe Ser His His Ser Ala Trp Leu Val Val Leu Pro
325 330 335
Ala Glu Glu Glu Leu Val Glu Ala Asp Glu Ala Gly Ser Val Tyr Ala
340 345 350
Gly Ile Leu Ser Tyr Gly Val Gly Phe Phe Leu Phe Ile Leu Val Val
355 360 365
Ala Ala Val Thr Leu Cys Arg Leu Arg Ser Pro Pro Lys Lys Gly Leu
370 375 380
Gly Ser Pro Thr Val His Lys Ile Ser Arg Phe Pro Leu Lys Arg Gln
385 390 395 400
Val Ser Leu Glu Ser Asn Ala Ser Met Ser Ser Asn Thr Pro Leu Val
405 410 415
Arg Ile Ala Arg Leu Ser Ser Gly Glu Gly Pro Thr Leu Ala Asn Val
420 425 430
Ser Glu Leu Glu Leu Pro Ala Asp Pro Lys Trp Glu Leu Ser Arg Ala
435 440 445
Arg Leu Thr Leu Gly Lys Pro Leu Gly Glu Gly Cys Phe Gly Gln Val
450 455 460
Val Met Ala Glu Ala Ile Gly Ile Asp Lys Asp Arg Ala Ala Lys Pro
465 470 475 480
Val Thr Val Ala Val Lys Met Leu Lys Asp Asp Ala Thr Asp Lys Asp
485 490 495
Leu Ser Asp Leu Val Ser Glu Met Glu Met Met Lys Met Ile Gly Lys
500 505 510
His Lys Asn Ile Ile Asn Leu Leu Gly Ala Cys Thr Gln Gly Gly Pro
515 520 525
Leu Tyr Val Leu Val Glu Tyr Ala Ala Lys Gly Asn Leu Arg Glu Phe
530 535 540
Leu Arg Ala Arg Arg Pro Pro Gly Leu Asp Tyr Ser Phe Asp Thr Cys
545 550 555 560
Lys Pro Pro Glu Glu Gln Leu Thr Phe Lys Asp Leu Val Ser Cys Ala
565 570 575
Tyr Gln Val Ala Arg Gly Met Glu Tyr Leu Ala Ser Gln Lys Cys Ile
580 585 590
His Arg Asp Leu Ala Ala Arg Asn Val Leu Val Thr Glu Asp Asn Val
595 600 605
Met Lys Ile Ala Asp Phe Gly Leu Ala Arg Asp Val His Asn Leu Asp
610 615 620
Tyr Tyr Lys Lys Thr Thr Asn Gly Arg Leu Pro Val Lys Trp Met Ala
625 630 635 640
Pro Glu Ala Leu Phe Asp Arg Val Tyr Thr His Gln Ser Asp Val Trp
645 650 655
Ser Phe Gly Val Leu Leu Trp Glu Ile Phe Thr Leu Gly Gly Ser Pro
660 665 670
Tyr Pro Gly Ile Pro Val Glu Glu Leu Phe Lys Leu Leu Lys Glu Gly
675 680 685
His Arg Met Asp Lys Pro Ala Asn Cys Thr His Asp Leu Tyr Met Ile
690 695 700
Met Arg Glu Cys Trp His Ala Ala Pro Ser Gln Arg Pro Thr Phe Lys
705 710 715 720
Gln Leu Val Glu Asp Leu Asp Arg Val Leu Thr Val Thr Ser Thr Asp
725 730 735
Glu Tyr Leu Asp Leu Ser Ala Pro Phe Glu Gln Tyr Ser Pro Gly Gly
740 745 750
Gln Asp Thr Pro Ser Ser Ser Ser Ser Gly Asp Asp Ser Val Phe Ala
755 760 765
His Asp Leu Leu Pro Pro Ala Pro Pro Ser Ser Gly Gly Ser Arg Thr
770 775 780
<210> 6
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 6
Met Gly Ala Pro Ala Cys Ala Leu Ala Leu Cys Val Ala Val Ala Ile
1 5 10 15
Val Ala Gly Ala Ser Ser
20
<210> 7
<211> 672
<212> БЕЛОК
<213> Homo sapiens
<400> 7
Glu Ser Leu Gly Thr Glu Gln Arg Val Val Gly Arg Ala Ala Glu Val
1 5 10 15
Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln Leu Val Phe Gly Ser Gly
20 25 30
Asp Ala Val Glu Leu Ser Cys Pro Pro Pro Gly Gly Gly Pro Met Gly
35 40 45
Pro Thr Val Trp Val Lys Asp Gly Thr Gly Leu Val Pro Ser Glu Arg
50 55 60
Val Leu Val Gly Pro Gln Arg Leu Gln Val Leu Asn Ala Ser His Glu
65 70 75 80
Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg Leu Thr Gln Arg Val Leu
85 90 95
Cys His Phe Ser Val Arg Val Thr Asp Ala Pro Ser Ser Gly Asp Asp
100 105 110
Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr Gly Val Asp Thr Gly Ala
115 120 125
Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp Lys Lys Leu Leu Ala Val
130 135 140
Pro Ala Ala Asn Thr Val Arg Phe Arg Cys Pro Ala Ala Gly Asn Pro
145 150 155 160
Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly Arg Glu Phe Arg Gly Glu
165 170 175
His Arg Ile Gly Gly Ile Lys Leu Arg His Gln Gln Trp Ser Leu Val
180 185 190
Met Glu Ser Val Val Pro Ser Asp Arg Gly Asn Tyr Thr Cys Val Val
195 200 205
Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr Tyr Thr Leu Asp Val Leu
210 215 220
Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly Leu Pro Ala Asn
225 230 235 240
Gln Thr Ala Val Leu Gly Ser Asp Val Glu Phe His Cys Lys Val Tyr
245 250 255
Ser Asp Ala Gln Pro His Ile Gln Trp Leu Lys His Val Glu Val Asn
260 265 270
Gly Ser Lys Val Gly Pro Asp Gly Thr Pro Tyr Val Thr Val Leu Lys
275 280 285
Val Ser Leu Glu Ser Asn Ala Ser Met Ser Ser Asn Thr Pro Leu Val
290 295 300
Arg Ile Ala Arg Leu Ser Ser Gly Glu Gly Pro Thr Leu Ala Asn Val
305 310 315 320
Ser Glu Leu Glu Leu Pro Ala Asp Pro Lys Trp Glu Leu Ser Arg Ala
325 330 335
Arg Leu Thr Leu Gly Lys Pro Leu Gly Glu Gly Cys Phe Gly Gln Val
340 345 350
Val Met Ala Glu Ala Ile Gly Ile Asp Lys Asp Arg Ala Ala Lys Pro
355 360 365
Val Thr Val Ala Val Lys Met Leu Lys Asp Asp Ala Thr Asp Lys Asp
370 375 380
Leu Ser Asp Leu Val Ser Glu Met Glu Met Met Lys Met Ile Gly Lys
385 390 395 400
His Lys Asn Ile Ile Asn Leu Leu Gly Ala Cys Thr Gln Gly Gly Pro
405 410 415
Leu Tyr Val Leu Val Glu Tyr Ala Ala Lys Gly Asn Leu Arg Glu Phe
420 425 430
Leu Arg Ala Arg Arg Pro Pro Gly Leu Asp Tyr Ser Phe Asp Thr Cys
435 440 445
Lys Pro Pro Glu Glu Gln Leu Thr Phe Lys Asp Leu Val Ser Cys Ala
450 455 460
Tyr Gln Val Ala Arg Gly Met Glu Tyr Leu Ala Ser Gln Lys Cys Ile
465 470 475 480
His Arg Asp Leu Ala Ala Arg Asn Val Leu Val Thr Glu Asp Asn Val
485 490 495
Met Lys Ile Ala Asp Phe Gly Leu Ala Arg Asp Val His Asn Leu Asp
500 505 510
Tyr Tyr Lys Lys Thr Thr Asn Gly Arg Leu Pro Val Lys Trp Met Ala
515 520 525
Pro Glu Ala Leu Phe Asp Arg Val Tyr Thr His Gln Ser Asp Val Trp
530 535 540
Ser Phe Gly Val Leu Leu Trp Glu Ile Phe Thr Leu Gly Gly Ser Pro
545 550 555 560
Tyr Pro Gly Ile Pro Val Glu Glu Leu Phe Lys Leu Leu Lys Glu Gly
565 570 575
His Arg Met Asp Lys Pro Ala Asn Cys Thr His Asp Leu Tyr Met Ile
580 585 590
Met Arg Glu Cys Trp His Ala Ala Pro Ser Gln Arg Pro Thr Phe Lys
595 600 605
Gln Leu Val Glu Asp Leu Asp Arg Val Leu Thr Val Thr Ser Thr Asp
610 615 620
Glu Tyr Leu Asp Leu Ser Ala Pro Phe Glu Gln Tyr Ser Pro Gly Gly
625 630 635 640
Gln Asp Thr Pro Ser Ser Ser Ser Ser Gly Asp Asp Ser Val Phe Ala
645 650 655
His Asp Leu Leu Pro Pro Ala Pro Pro Ser Ser Gly Gly Ser Arg Thr
660 665 670
<210> 8
<211> 672
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 8
Glu Ser Leu Gly Thr Glu Gln Arg Val Val Gly Arg Ala Ala Glu Val
1 5 10 15
Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln Leu Val Phe Gly Ser Gly
20 25 30
Asp Ala Val Glu Leu Ser Cys Pro Pro Pro Gly Gly Gly Pro Met Gly
35 40 45
Pro Thr Val Trp Val Lys Asp Gly Thr Gly Leu Val Pro Ser Glu Arg
50 55 60
Val Leu Val Gly Pro Gln Arg Leu Gln Val Leu Asn Ala Ser His Glu
65 70 75 80
Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg Leu Thr Gln Arg Val Leu
85 90 95
Cys His Phe Ser Val Arg Val Thr Asp Ala Pro Ser Ser Gly Asp Asp
100 105 110
Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr Gly Val Asp Thr Gly Ala
115 120 125
Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp Lys Lys Leu Leu Ala Val
130 135 140
Pro Ala Ala Asn Thr Val Arg Phe Arg Cys Pro Ala Ala Gly Asn Pro
145 150 155 160
Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly Arg Glu Phe Arg Gly Glu
165 170 175
His Arg Ile Gly Gly Ile Lys Leu Arg His Gln Gln Trp Ser Leu Val
180 185 190
Met Glu Ser Val Val Pro Ser Asp Arg Gly Asn Tyr Thr Cys Val Val
195 200 205
Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr Tyr Thr Leu Asp Val Leu
210 215 220
Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly Leu Pro Ala Asn
225 230 235 240
Gln Thr Ala Val Leu Gly Ser Asp Val Glu Phe His Ser Lys Val Tyr
245 250 255
Ser Asp Ala Gln Pro His Ile Gln Trp Leu Lys His Val Glu Val Asn
260 265 270
Gly Ser Lys Val Gly Pro Asp Gly Thr Pro Tyr Val Thr Val Leu Lys
275 280 285
Val Ser Leu Glu Ser Asn Ala Ser Met Ser Ser Asn Thr Pro Leu Val
290 295 300
Arg Ile Ala Arg Leu Ser Ser Gly Glu Gly Pro Thr Leu Ala Asn Val
305 310 315 320
Ser Glu Leu Glu Leu Pro Ala Asp Pro Lys Trp Glu Leu Ser Arg Ala
325 330 335
Arg Leu Thr Leu Gly Lys Pro Leu Gly Glu Gly Cys Phe Gly Gln Val
340 345 350
Val Met Ala Glu Ala Ile Gly Ile Asp Lys Asp Arg Ala Ala Lys Pro
355 360 365
Val Thr Val Ala Val Lys Met Leu Lys Asp Asp Ala Thr Asp Lys Asp
370 375 380
Leu Ser Asp Leu Val Ser Glu Met Glu Met Met Lys Met Ile Gly Lys
385 390 395 400
His Lys Asn Ile Ile Asn Leu Leu Gly Ala Cys Thr Gln Gly Gly Pro
405 410 415
Leu Tyr Val Leu Val Glu Tyr Ala Ala Lys Gly Asn Leu Arg Glu Phe
420 425 430
Leu Arg Ala Arg Arg Pro Pro Gly Leu Asp Tyr Ser Phe Asp Thr Cys
435 440 445
Lys Pro Pro Glu Glu Gln Leu Thr Phe Lys Asp Leu Val Ser Cys Ala
450 455 460
Tyr Gln Val Ala Arg Gly Met Glu Tyr Leu Ala Ser Gln Lys Cys Ile
465 470 475 480
His Arg Asp Leu Ala Ala Arg Asn Val Leu Val Thr Glu Asp Asn Val
485 490 495
Met Lys Ile Ala Asp Phe Gly Leu Ala Arg Asp Val His Asn Leu Asp
500 505 510
Tyr Tyr Lys Lys Thr Thr Asn Gly Arg Leu Pro Val Lys Trp Met Ala
515 520 525
Pro Glu Ala Leu Phe Asp Arg Val Tyr Thr His Gln Ser Asp Val Trp
530 535 540
Ser Phe Gly Val Leu Leu Trp Glu Ile Phe Thr Leu Gly Gly Ser Pro
545 550 555 560
Tyr Pro Gly Ile Pro Val Glu Glu Leu Phe Lys Leu Leu Lys Glu Gly
565 570 575
His Arg Met Asp Lys Pro Ala Asn Cys Thr His Asp Leu Tyr Met Ile
580 585 590
Met Arg Glu Cys Trp His Ala Ala Pro Ser Gln Arg Pro Thr Phe Lys
595 600 605
Gln Leu Val Glu Asp Leu Asp Arg Val Leu Thr Val Thr Ser Thr Asp
610 615 620
Glu Tyr Leu Asp Leu Ser Ala Pro Phe Glu Gln Tyr Ser Pro Gly Gly
625 630 635 640
Gln Asp Thr Pro Ser Ser Ser Ser Ser Gly Asp Asp Ser Val Phe Ala
645 650 655
His Asp Leu Leu Pro Pro Ala Pro Pro Ser Ser Gly Gly Ser Arg Thr
660 665 670
<210> 9
<211> 720
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 9
Glu Ser Leu Gly Thr Glu Gln Arg Val Val Gly Arg Ala Ala Glu Val
1 5 10 15
Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln Leu Val Phe Gly Ser Gly
20 25 30
Asp Ala Val Glu Leu Ser Cys Pro Pro Pro Gly Gly Gly Pro Met Gly
35 40 45
Pro Thr Val Trp Val Lys Asp Gly Thr Gly Leu Val Pro Ser Glu Arg
50 55 60
Val Leu Val Gly Pro Gln Arg Leu Gln Val Leu Asn Ala Ser His Glu
65 70 75 80
Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg Leu Thr Gln Arg Val Leu
85 90 95
Cys His Phe Ser Val Arg Val Thr Asp Ala Pro Ser Ser Gly Asp Asp
100 105 110
Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr Gly Val Asp Thr Gly Ala
115 120 125
Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp Lys Lys Leu Leu Ala Val
130 135 140
Pro Ala Ala Asn Thr Val Arg Phe Arg Cys Pro Ala Ala Gly Asn Pro
145 150 155 160
Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly Arg Glu Phe Arg Gly Glu
165 170 175
His Arg Ile Gly Gly Ile Lys Leu Arg His Gln Gln Trp Ser Leu Val
180 185 190
Met Glu Ser Val Val Pro Ser Asp Arg Gly Asn Tyr Thr Cys Val Val
195 200 205
Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr Tyr Thr Leu Asp Val Leu
210 215 220
Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly Leu Pro Ala Asn
225 230 235 240
Gln Thr Ala Val Leu Gly Ser Asp Val Glu Phe His Cys Lys Val Tyr
245 250 255
Ser Asp Ala Gln Pro His Ile Gln Trp Leu Lys His Val Glu Val Asn
260 265 270
Gly Ser Lys Val Gly Pro Asp Gly Thr Pro Tyr Val Thr Val Leu Lys
275 280 285
Thr Ala Gly Ala Asn Thr Thr Asp Lys Glu Leu Glu Val Leu Ser Leu
290 295 300
His Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr Cys Leu Ala Gly
305 310 315 320
Asn Ser Ile Gly Phe Ser His His Ser Ala Trp Leu Val Val Leu Pro
325 330 335
Val Ser Leu Glu Ser Asn Ala Ser Met Ser Ser Asn Thr Pro Leu Val
340 345 350
Arg Ile Ala Arg Leu Ser Ser Gly Glu Gly Pro Thr Leu Ala Asn Val
355 360 365
Ser Glu Leu Glu Leu Pro Ala Asp Pro Lys Trp Glu Leu Ser Arg Ala
370 375 380
Arg Leu Thr Leu Gly Lys Pro Leu Gly Glu Gly Cys Phe Gly Gln Val
385 390 395 400
Val Met Ala Glu Ala Ile Gly Ile Asp Lys Asp Arg Ala Ala Lys Pro
405 410 415
Val Thr Val Ala Val Lys Met Leu Lys Asp Asp Ala Thr Asp Lys Asp
420 425 430
Leu Ser Asp Leu Val Ser Glu Met Glu Met Met Lys Met Ile Gly Lys
435 440 445
His Lys Asn Ile Ile Asn Leu Leu Gly Ala Cys Thr Gln Gly Gly Pro
450 455 460
Leu Tyr Val Leu Val Glu Tyr Ala Ala Lys Gly Asn Leu Arg Glu Phe
465 470 475 480
Leu Arg Ala Arg Arg Pro Pro Gly Leu Asp Tyr Ser Phe Asp Thr Cys
485 490 495
Lys Pro Pro Glu Glu Gln Leu Thr Phe Lys Asp Leu Val Ser Cys Ala
500 505 510
Tyr Gln Val Ala Arg Gly Met Glu Tyr Leu Ala Ser Gln Lys Cys Ile
515 520 525
His Arg Asp Leu Ala Ala Arg Asn Val Leu Val Thr Glu Asp Asn Val
530 535 540
Met Lys Ile Ala Asp Phe Gly Leu Ala Arg Asp Val His Asn Leu Asp
545 550 555 560
Tyr Tyr Lys Lys Thr Thr Asn Gly Arg Leu Pro Val Lys Trp Met Ala
565 570 575
Pro Glu Ala Leu Phe Asp Arg Val Tyr Thr His Gln Ser Asp Val Trp
580 585 590
Ser Phe Gly Val Leu Leu Trp Glu Ile Phe Thr Leu Gly Gly Ser Pro
595 600 605
Tyr Pro Gly Ile Pro Val Glu Glu Leu Phe Lys Leu Leu Lys Glu Gly
610 615 620
His Arg Met Asp Lys Pro Ala Asn Cys Thr His Asp Leu Tyr Met Ile
625 630 635 640
Met Arg Glu Cys Trp His Ala Ala Pro Ser Gln Arg Pro Thr Phe Lys
645 650 655
Gln Leu Val Glu Asp Leu Asp Arg Val Leu Thr Val Thr Ser Thr Asp
660 665 670
Glu Tyr Leu Asp Leu Ser Ala Pro Phe Glu Gln Tyr Ser Pro Gly Gly
675 680 685
Gln Asp Thr Pro Ser Ser Ser Ser Ser Gly Asp Asp Ser Val Phe Ala
690 695 700
His Asp Leu Leu Pro Pro Ala Pro Pro Ser Ser Gly Gly Ser Arg Thr
705 710 715 720
<210> 10
<211> 512
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 10
Glu Ser Leu Gly Thr Glu Gln Arg Val Val Gly Arg Ala Ala Glu Val
1 5 10 15
Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln Leu Val Phe Gly Ser Gly
20 25 30
Asp Ala Val Glu Leu Ser Cys Pro Pro Pro Gly Gly Gly Pro Met Gly
35 40 45
Pro Thr Val Trp Val Lys Asp Gly Thr Gly Leu Val Pro Ser Glu Arg
50 55 60
Val Leu Val Gly Pro Gln Arg Leu Gln Val Leu Asn Ala Ser His Glu
65 70 75 80
Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg Leu Thr Gln Arg Val Leu
85 90 95
Cys His Phe Ser Val Arg Val Thr Asp Ala Pro Ser Ser Gly Asp Asp
100 105 110
Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr Gly Val Asp Thr Gly Ala
115 120 125
Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp Lys Lys Leu Leu Ala Val
130 135 140
Pro Ala Ala Asn Thr Val Arg Phe Arg Cys Pro Ala Ala Gly Asn Pro
145 150 155 160
Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly Arg Glu Phe Arg Gly Glu
165 170 175
His Arg Ile Gly Gly Ile Lys Leu Arg His Gln Gln Trp Ser Leu Val
180 185 190
Met Glu Ser Val Val Pro Ser Asp Arg Gly Asn Tyr Thr Cys Val Val
195 200 205
Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr Tyr Thr Leu Asp Val Leu
210 215 220
Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly Leu Pro Ala Asn
225 230 235 240
Gln Thr Ala Val Leu Gly Ser Asp Val Glu Phe His Cys Lys Val Tyr
245 250 255
Ser Asp Ala Gln Pro His Ile Gln Trp Leu Lys His Val Glu Val Asn
260 265 270
Gly Ser Lys Val Gly Pro Asp Gly Thr Pro Tyr Val Thr Val Leu Lys
275 280 285
Val Ser Leu Glu Ser Asn Ala Ser Met Ser Ser Asn Thr Ser Gly Ser
290 295 300
Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser Val Val Phe Pro
305 310 315 320
Tyr Phe Pro Arg Leu Gly Arg Tyr Asn Leu Asn Phe His Glu Ala Gln
325 330 335
Gln Ala Cys Leu Asp Gln Asp Ala Val Ile Ala Ser Phe Asp Gln Leu
340 345 350
Tyr Asp Ala Trp Arg Gly Gly Leu Asp Trp Cys Asn Ala Gly Trp Leu
355 360 365
Ser Asp Gly Ser Val Gln Tyr Pro Ile Thr Lys Pro Arg Glu Pro Cys
370 375 380
Gly Gly Gln Asn Thr Val Pro Gly Val Arg Asn Tyr Gly Phe Trp Asp
385 390 395 400
Lys Asp Lys Ser Arg Tyr Asp Val Phe Cys Phe Thr Ser Asn Phe Asn
405 410 415
Gly Arg Phe Tyr Tyr Leu Ile His Pro Thr Lys Leu Thr Tyr Asp Glu
420 425 430
Ala Val Gln Ala Cys Leu Asn Asp Gly Ala Gln Ile Ala Lys Val Gly
435 440 445
Gln Ile Phe Ala Ala Trp Lys Ile Leu Gly Tyr Asp Arg Cys Asp Ala
450 455 460
Gly Trp Leu Ala Asp Gly Ser Val Arg Tyr Pro Ile Ser Arg Pro Arg
465 470 475 480
Arg Arg Cys Ser Pro Thr Glu Ala Ala Val Arg Phe Val Gly Phe Pro
485 490 495
Asp Lys Lys His Lys Leu Tyr Gly Val Tyr Cys Phe Arg Ala Tyr Asn
500 505 510
<210> 11
<211> 512
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 11
Glu Ser Leu Gly Thr Glu Gln Arg Val Val Gly Arg Ala Ala Glu Val
1 5 10 15
Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln Leu Val Phe Gly Ser Gly
20 25 30
Asp Ala Val Glu Leu Ser Cys Pro Pro Pro Gly Gly Gly Pro Met Gly
35 40 45
Pro Thr Val Trp Val Lys Asp Gly Thr Gly Leu Val Pro Ser Glu Arg
50 55 60
Val Leu Val Gly Pro Gln Arg Leu Gln Val Leu Asn Ala Ser His Glu
65 70 75 80
Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg Leu Thr Gln Arg Val Leu
85 90 95
Cys His Phe Ser Val Arg Val Thr Asp Ala Pro Ser Ser Gly Asp Asp
100 105 110
Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr Gly Val Asp Thr Gly Ala
115 120 125
Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp Lys Lys Leu Leu Ala Val
130 135 140
Pro Ala Ala Asn Thr Val Arg Phe Arg Cys Pro Ala Ala Gly Asn Pro
145 150 155 160
Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly Arg Glu Phe Arg Gly Glu
165 170 175
His Arg Ile Gly Gly Ile Lys Leu Arg His Gln Gln Trp Ser Leu Val
180 185 190
Met Glu Ser Val Val Pro Ser Asp Arg Gly Asn Tyr Thr Cys Val Val
195 200 205
Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr Tyr Thr Leu Asp Val Leu
210 215 220
Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly Leu Pro Ala Asn
225 230 235 240
Gln Thr Ala Val Leu Gly Ser Asp Val Glu Phe His Ser Lys Val Tyr
245 250 255
Ser Asp Ala Gln Pro His Ile Gln Trp Leu Lys His Val Glu Val Asn
260 265 270
Gly Ser Lys Val Gly Pro Asp Gly Thr Pro Tyr Val Thr Val Leu Lys
275 280 285
Val Ser Leu Glu Ser Asn Ala Ser Met Ser Ser Asn Thr Ser Gly Ser
290 295 300
Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser Val Val Phe Pro
305 310 315 320
Tyr Phe Pro Arg Leu Gly Arg Tyr Asn Leu Asn Phe His Glu Ala Gln
325 330 335
Gln Ala Cys Leu Asp Gln Asp Ala Val Ile Ala Ser Phe Asp Gln Leu
340 345 350
Tyr Asp Ala Trp Arg Gly Gly Leu Asp Trp Cys Asn Ala Gly Trp Leu
355 360 365
Ser Asp Gly Ser Val Gln Tyr Pro Ile Thr Lys Pro Arg Glu Pro Cys
370 375 380
Gly Gly Gln Asn Thr Val Pro Gly Val Arg Asn Tyr Gly Phe Trp Asp
385 390 395 400
Lys Asp Lys Ser Arg Tyr Asp Val Phe Cys Phe Thr Ser Asn Phe Asn
405 410 415
Gly Arg Phe Tyr Tyr Leu Ile His Pro Thr Lys Leu Thr Tyr Asp Glu
420 425 430
Ala Val Gln Ala Cys Leu Asn Asp Gly Ala Gln Ile Ala Lys Val Gly
435 440 445
Gln Ile Phe Ala Ala Trp Lys Ile Leu Gly Tyr Asp Arg Cys Asp Ala
450 455 460
Gly Trp Leu Ala Asp Gly Ser Val Arg Tyr Pro Ile Ser Arg Pro Arg
465 470 475 480
Arg Arg Cys Ser Pro Thr Glu Ala Ala Val Arg Phe Val Gly Phe Pro
485 490 495
Asp Lys Lys His Lys Leu Tyr Gly Val Tyr Cys Phe Arg Ala Tyr Asn
500 505 510
<210> 12
<211> 560
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 12
Glu Ser Leu Gly Thr Glu Gln Arg Val Val Gly Arg Ala Ala Glu Val
1 5 10 15
Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln Leu Val Phe Gly Ser Gly
20 25 30
Asp Ala Val Glu Leu Ser Cys Pro Pro Pro Gly Gly Gly Pro Met Gly
35 40 45
Pro Thr Val Trp Val Lys Asp Gly Thr Gly Leu Val Pro Ser Glu Arg
50 55 60
Val Leu Val Gly Pro Gln Arg Leu Gln Val Leu Asn Ala Ser His Glu
65 70 75 80
Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg Leu Thr Gln Arg Val Leu
85 90 95
Cys His Phe Ser Val Arg Val Thr Asp Ala Pro Ser Ser Gly Asp Asp
100 105 110
Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr Gly Val Asp Thr Gly Ala
115 120 125
Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp Lys Lys Leu Leu Ala Val
130 135 140
Pro Ala Ala Asn Thr Val Arg Phe Arg Cys Pro Ala Ala Gly Asn Pro
145 150 155 160
Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly Arg Glu Phe Arg Gly Glu
165 170 175
His Arg Ile Gly Gly Ile Lys Leu Arg His Gln Gln Trp Ser Leu Val
180 185 190
Met Glu Ser Val Val Pro Ser Asp Arg Gly Asn Tyr Thr Cys Val Val
195 200 205
Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr Tyr Thr Leu Asp Val Leu
210 215 220
Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly Leu Pro Ala Asn
225 230 235 240
Gln Thr Ala Val Leu Gly Ser Asp Val Glu Phe His Cys Lys Val Tyr
245 250 255
Ser Asp Ala Gln Pro His Ile Gln Trp Leu Lys His Val Glu Val Asn
260 265 270
Gly Ser Lys Val Gly Pro Asp Gly Thr Pro Tyr Val Thr Val Leu Lys
275 280 285
Thr Ala Gly Ala Asn Thr Thr Asp Lys Glu Leu Glu Val Leu Ser Leu
290 295 300
His Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr Cys Leu Ala Gly
305 310 315 320
Asn Ser Ile Gly Phe Ser His His Ser Ala Trp Leu Val Val Leu Pro
325 330 335
Val Ser Leu Glu Ser Asn Ala Ser Met Ser Ser Asn Thr Ser Gly Ser
340 345 350
Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser Val Val Phe Pro
355 360 365
Tyr Phe Pro Arg Leu Gly Arg Tyr Asn Leu Asn Phe His Glu Ala Gln
370 375 380
Gln Ala Cys Leu Asp Gln Asp Ala Val Ile Ala Ser Phe Asp Gln Leu
385 390 395 400
Tyr Asp Ala Trp Arg Gly Gly Leu Asp Trp Cys Asn Ala Gly Trp Leu
405 410 415
Ser Asp Gly Ser Val Gln Tyr Pro Ile Thr Lys Pro Arg Glu Pro Cys
420 425 430
Gly Gly Gln Asn Thr Val Pro Gly Val Arg Asn Tyr Gly Phe Trp Asp
435 440 445
Lys Asp Lys Ser Arg Tyr Asp Val Phe Cys Phe Thr Ser Asn Phe Asn
450 455 460
Gly Arg Phe Tyr Tyr Leu Ile His Pro Thr Lys Leu Thr Tyr Asp Glu
465 470 475 480
Ala Val Gln Ala Cys Leu Asn Asp Gly Ala Gln Ile Ala Lys Val Gly
485 490 495
Gln Ile Phe Ala Ala Trp Lys Ile Leu Gly Tyr Asp Arg Cys Asp Ala
500 505 510
Gly Trp Leu Ala Asp Gly Ser Val Arg Tyr Pro Ile Ser Arg Pro Arg
515 520 525
Arg Arg Cys Ser Pro Thr Glu Ala Ala Val Arg Phe Val Gly Phe Pro
530 535 540
Asp Lys Lys His Lys Leu Tyr Gly Val Tyr Cys Phe Arg Ala Tyr Asn
545 550 555 560
<210> 13
<211> 155
<212> БЕЛОК
<213> Homo sapiens
<400> 13
Met Ala Glu Gly Glu Ile Thr Thr Phe Thr Ala Leu Thr Glu Lys Phe
1 5 10 15
Asn Leu Pro Pro Gly Asn Tyr Lys Lys Pro Lys Leu Leu Tyr Cys Ser
20 25 30
Asn Gly Gly His Phe Leu Arg Ile Leu Pro Asp Gly Thr Val Asp Gly
35 40 45
Thr Arg Asp Arg Ser Asp Gln His Ile Gln Leu Gln Leu Ser Ala Glu
50 55 60
Ser Val Gly Glu Val Tyr Ile Lys Ser Thr Glu Thr Gly Gln Tyr Leu
65 70 75 80
Ala Met Asp Thr Asp Gly Leu Leu Tyr Gly Ser Gln Thr Pro Asn Glu
85 90 95
Glu Cys Leu Phe Leu Glu Arg Leu Glu Glu Asn His Tyr Asn Thr Tyr
100 105 110
Ile Ser Lys Lys His Ala Glu Lys Asn Trp Phe Val Gly Leu Lys Lys
115 120 125
Asn Gly Ser Cys Lys Arg Gly Pro Arg Thr His Tyr Gly Gln Lys Ala
130 135 140
Ile Leu Phe Leu Pro Leu Pro Val Ser Ser Asp
145 150 155
<210> 14
<211> 288
<212> БЕЛОК
<213> Homo sapiens
<400> 14
Met Val Gly Val Gly Gly Gly Asp Val Glu Asp Val Thr Pro Arg Pro
1 5 10 15
Gly Gly Cys Gln Ile Ser Gly Arg Gly Ala Arg Gly Cys Asn Gly Ile
20 25 30
Pro Gly Ala Ala Ala Trp Glu Ala Ala Leu Pro Arg Arg Arg Pro Arg
35 40 45
Arg His Pro Ser Val Asn Pro Arg Ser Arg Ala Ala Gly Ser Pro Arg
50 55 60
Thr Arg Gly Arg Arg Thr Glu Glu Arg Pro Ser Gly Ser Arg Leu Gly
65 70 75 80
Asp Arg Gly Arg Gly Arg Ala Leu Pro Gly Gly Arg Leu Gly Gly Arg
85 90 95
Gly Arg Gly Arg Ala Pro Glu Arg Val Gly Gly Arg Gly Arg Gly Arg
100 105 110
Gly Thr Ala Ala Pro Arg Ala Ala Pro Ala Ala Arg Gly Ser Arg Pro
115 120 125
Gly Pro Ala Gly Thr Met Ala Ala Gly Ser Ile Thr Thr Leu Pro Ala
130 135 140
Leu Pro Glu Asp Gly Gly Ser Gly Ala Phe Pro Pro Gly His Phe Lys
145 150 155 160
Asp Pro Lys Arg Leu Tyr Cys Lys Asn Gly Gly Phe Phe Leu Arg Ile
165 170 175
His Pro Asp Gly Arg Val Asp Gly Val Arg Glu Lys Ser Asp Pro His
180 185 190
Ile Lys Leu Gln Leu Gln Ala Glu Glu Arg Gly Val Val Ser Ile Lys
195 200 205
Gly Val Cys Ala Asn Arg Tyr Leu Ala Met Lys Glu Asp Gly Arg Leu
210 215 220
Leu Ala Ser Lys Cys Val Thr Asp Glu Cys Phe Phe Phe Glu Arg Leu
225 230 235 240
Glu Ser Asn Asn Tyr Asn Thr Tyr Arg Ser Arg Lys Tyr Thr Ser Trp
245 250 255
Tyr Val Ala Leu Lys Arg Thr Gly Gln Tyr Lys Leu Gly Ser Lys Thr
260 265 270
Gly Pro Gly Gln Lys Ala Ile Leu Phe Leu Pro Met Ser Ala Lys Ser
275 280 285
<210> 15
<211> 208
<212> БЕЛОК
<213> Homo sapiens
<400> 15
Met Ala Pro Leu Gly Glu Val Gly Asn Tyr Phe Gly Val Gln Asp Ala
1 5 10 15
Val Pro Phe Gly Asn Val Pro Val Leu Pro Val Asp Ser Pro Val Leu
20 25 30
Leu Ser Asp His Leu Gly Gln Ser Glu Ala Gly Gly Leu Pro Arg Gly
35 40 45
Pro Ala Val Thr Asp Leu Asp His Leu Lys Gly Ile Leu Arg Arg Arg
50 55 60
Gln Leu Tyr Cys Arg Thr Gly Phe His Leu Glu Ile Phe Pro Asn Gly
65 70 75 80
Thr Ile Gln Gly Thr Arg Lys Asp His Ser Arg Phe Gly Ile Leu Glu
85 90 95
Phe Ile Ser Ile Ala Val Gly Leu Val Ser Ile Arg Gly Val Asp Ser
100 105 110
Gly Leu Tyr Leu Gly Met Asn Glu Lys Gly Glu Leu Tyr Gly Ser Glu
115 120 125
Lys Leu Thr Gln Glu Cys Val Phe Arg Glu Gln Phe Glu Glu Asn Trp
130 135 140
Tyr Asn Thr Tyr Ser Ser Asn Leu Tyr Lys His Val Asp Thr Gly Arg
145 150 155 160
Arg Tyr Tyr Val Ala Leu Asn Lys Asp Gly Thr Pro Arg Glu Gly Thr
165 170 175
Arg Thr Lys Arg His Gln Lys Phe Thr His Phe Leu Pro Arg Pro Val
180 185 190
Asp Pro Asp Lys Val Pro Glu Leu Tyr Lys Asp Ile Leu Ser Gln Ser
195 200 205
<210> 16
<211> 207
<212> БЕЛОК
<213> Homo sapiens
<400> 16
Met Tyr Ser Ala Pro Ser Ala Cys Thr Cys Leu Cys Leu His Phe Leu
1 5 10 15
Leu Leu Cys Phe Gln Val Gln Val Leu Val Ala Glu Glu Asn Val Asp
20 25 30
Phe Arg Ile His Val Glu Asn Gln Thr Arg Ala Arg Asp Asp Val Ser
35 40 45
Arg Lys Gln Leu Arg Leu Tyr Gln Leu Tyr Ser Arg Thr Ser Gly Lys
50 55 60
His Ile Gln Val Leu Gly Arg Arg Ile Ser Ala Arg Gly Glu Asp Gly
65 70 75 80
Asp Lys Tyr Ala Gln Leu Leu Val Glu Thr Asp Thr Phe Gly Ser Gln
85 90 95
Val Arg Ile Lys Gly Lys Glu Thr Glu Phe Tyr Leu Cys Met Asn Arg
100 105 110
Lys Gly Lys Leu Val Gly Lys Pro Asp Gly Thr Ser Lys Glu Cys Val
115 120 125
Phe Ile Glu Lys Val Leu Glu Asn Asn Tyr Thr Ala Leu Met Ser Ala
130 135 140
Lys Tyr Ser Gly Trp Tyr Val Gly Phe Thr Lys Lys Gly Arg Pro Arg
145 150 155 160
Lys Gly Pro Lys Thr Arg Glu Asn Gln Gln Asp Val His Phe Met Lys
165 170 175
Arg Tyr Pro Lys Gly Gln Pro Glu Leu Gln Lys Pro Phe Lys Tyr Thr
180 185 190
Thr Val Thr Lys Arg Ser Arg Arg Ile Arg Pro Thr His Pro Ala
195 200 205
<210> 17
<211> 323
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 17
Met Gly Ala Pro Ala Cys Ala Leu Ala Leu Cys Val Ala Val Ala Ile
1 5 10 15
Val Ala Gly Ala Ser Ser Glu Ser Leu Gly Thr Glu Gln Arg Val Val
20 25 30
Gly Arg Ala Ala Glu Val Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln
35 40 45
Leu Val Phe Gly Ser Gly Asp Ala Val Glu Leu Ser Cys Pro Pro Pro
50 55 60
Gly Gly Gly Pro Met Gly Pro Thr Val Trp Val Lys Asp Gly Thr Gly
65 70 75 80
Leu Val Pro Ser Glu Arg Val Leu Val Gly Pro Gln Arg Leu Gln Val
85 90 95
Leu Asn Ala Ser His Glu Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg
100 105 110
Leu Thr Gln Arg Val Leu Cys His Phe Ser Val Arg Val Thr Asp Ala
115 120 125
Pro Ser Ser Gly Asp Asp Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr
130 135 140
Gly Val Asp Thr Gly Ala Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp
145 150 155 160
Lys Lys Leu Leu Ala Val Pro Ala Ala Asn Thr Val Arg Phe Arg Cys
165 170 175
Pro Ala Ala Gly Asn Pro Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly
180 185 190
Arg Glu Phe Arg Gly Glu His Arg Ile Gly Gly Ile Lys Leu Arg His
195 200 205
Gln Gln Trp Ser Leu Val Met Glu Ser Val Val Pro Ser Asp Arg Gly
210 215 220
Asn Tyr Thr Cys Val Val Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr
225 230 235 240
Tyr Thr Leu Asp Val Leu Glu Arg Ser Pro His Arg Pro Ile Leu Gln
245 250 255
Ala Gly Leu Pro Ala Asn Gln Thr Ala Val Leu Gly Ser Asp Val Glu
260 265 270
Phe His Cys Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Leu
275 280 285
Lys His Val Glu Val Asn Gly Ser Lys Val Gly Pro Asp Gly Thr Pro
290 295 300
Tyr Val Thr Val Leu Lys Val Ser Leu Glu Ser Asn Ala Ser Met Ser
305 310 315 320
Ser Asn Thr
<210> 18
<211> 323
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 18
Met Gly Ala Pro Ala Cys Ala Leu Ala Leu Cys Val Ala Val Ala Ile
1 5 10 15
Val Ala Gly Ala Ser Ser Glu Ser Leu Gly Thr Glu Gln Arg Val Val
20 25 30
Gly Arg Ala Ala Glu Val Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln
35 40 45
Leu Val Phe Gly Ser Gly Asp Ala Val Glu Leu Ser Cys Pro Pro Pro
50 55 60
Gly Gly Gly Pro Met Gly Pro Thr Val Trp Val Lys Asp Gly Thr Gly
65 70 75 80
Leu Val Pro Ser Glu Arg Val Leu Val Gly Pro Gln Arg Leu Gln Val
85 90 95
Leu Asn Ala Ser His Glu Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg
100 105 110
Leu Thr Gln Arg Val Leu Cys His Phe Ser Val Arg Val Thr Asp Ala
115 120 125
Pro Ser Ser Gly Asp Asp Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr
130 135 140
Gly Val Asp Thr Gly Ala Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp
145 150 155 160
Lys Lys Leu Leu Ala Val Pro Ala Ala Asn Thr Val Arg Phe Arg Cys
165 170 175
Pro Ala Ala Gly Asn Pro Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly
180 185 190
Arg Glu Phe Arg Gly Glu His Arg Ile Gly Gly Ile Lys Leu Arg His
195 200 205
Gln Gln Trp Ser Leu Val Met Glu Ser Val Val Pro Ser Asp Arg Gly
210 215 220
Asn Tyr Thr Cys Val Val Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr
225 230 235 240
Tyr Thr Leu Asp Val Leu Glu Arg Ser Pro His Arg Pro Ile Leu Gln
245 250 255
Ala Gly Leu Pro Ala Asn Gln Thr Ala Val Leu Gly Ser Asp Val Glu
260 265 270
Phe His Cys Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Leu
275 280 285
Lys His Val Glu Val Asn Gly Ser Lys Val Gly Pro Asp Gly Thr Pro
290 295 300
Tyr Val Thr Val Leu Lys Val Ser Leu Glu Ser Asn Ala Ser Met Ser
305 310 315 320
Ser Asn Thr
<210> 19
<211> 323
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 19
Met Gly Ala Pro Ala Cys Ala Leu Ala Leu Cys Val Ala Val Ala Ile
1 5 10 15
Val Ala Gly Ala Ser Ser Glu Ser Leu Gly Thr Glu Gln Arg Val Val
20 25 30
Gly Arg Ala Ala Glu Val Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln
35 40 45
Leu Val Phe Gly Ser Gly Asp Ala Val Glu Leu Ser Cys Pro Pro Pro
50 55 60
Gly Gly Gly Pro Met Gly Pro Thr Val Trp Val Lys Asp Gly Thr Gly
65 70 75 80
Leu Val Pro Ser Glu Arg Val Leu Val Gly Pro Gln Arg Leu Gln Val
85 90 95
Leu Asn Ala Ser His Glu Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg
100 105 110
Leu Thr Gln Arg Val Leu Cys His Phe Ser Val Arg Val Thr Asp Ala
115 120 125
Pro Ser Ser Gly Asp Asp Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr
130 135 140
Gly Val Asp Thr Gly Ala Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp
145 150 155 160
Lys Lys Leu Leu Ala Val Pro Ala Ala Asn Thr Val Arg Phe Arg Cys
165 170 175
Pro Ala Ala Gly Asn Pro Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly
180 185 190
Arg Glu Phe Arg Gly Glu His Arg Ile Gly Gly Ile Lys Leu Arg His
195 200 205
Gln Gln Trp Ser Leu Val Met Glu Ser Val Val Pro Ser Asp Arg Gly
210 215 220
Asn Tyr Thr Cys Val Val Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr
225 230 235 240
Tyr Thr Leu Asp Val Leu Glu Arg Ser Pro His Arg Pro Ile Leu Gln
245 250 255
Ala Gly Leu Pro Ala Asn Gln Thr Ala Val Leu Gly Ser Asp Val Glu
260 265 270
Phe His Ser Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Leu
275 280 285
Lys His Val Glu Val Asn Gly Ser Lys Val Gly Pro Asp Gly Thr Pro
290 295 300
Tyr Val Thr Val Leu Lys Val Ser Leu Glu Ser Asn Ala Ser Met Ser
305 310 315 320
Ser Asn Thr
<210> 20
<211> 987
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 20
atgggagtga aggtgctgtt cgccctgatc tgtatcgccg tggccgaggc cgagtctctg 60
ggcacagaac agagagtcgt gggcagagcc gccgaagtgc ctggacctga acctggccag 120
caggaacagc tggtgtttgg cagcggcgac gccgtggaac tgagctgtcc tccacctggc 180
ggaggcccta tgggacctac cgtgtgggtc aaggatggca ccggactggt gcctagcgag 240
agggtgctcg tgggacctca gagactgcag gtgctgaacg ccagccacga ggatagcggc 300
gcctacagct gcagacagag actgacacag cgggtgctgt gccacttctc cgtcagagtg 360
accgacgccc ctagctccgg cgacgatgag gatggcgaag atgaggccga ggacaccggc 420
gtggacacag gcgctccata ctggaccaga cccgagcgga tggacaagaa actgctggcc 480
gtgcctgccg ccaacaccgt gcggtttaga tgtcctgccg ccggaaaccc cacccccagc 540
atcagctggc tgaagaacgg cagagagttc cggggcgagc acagaatcgg cggcatcaag 600
ctgagacacc agcagtggtc cctcgtgatg gaaagcgtgg tgcccagcga ccggggcaac 660
tacacctgtg tggtggaaaa caagttcggc agcatccggc agacctacac cctggacgtg 720
ctggaaagaa gcccccacag acccatcctg caggccggac tgcctgccaa tcagacagcc 780
gtgctgggca gcgacgtgga atttcacagc aaggtgtaca gcgacgccca gccccacatc 840
cagtggctga aacacgtgga agtgaacggc agcaaagtgg gccccgacgg caccccttat 900
gtgaccgtgc tgaaggtgtc cctggaaagc aacgccagca tgagcagcaa caccgactac 960
aaggacgacg acgacaagtg aaagctt 987
<210> 21
<211> 1131
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 21
atgggagtga aggtgctgtt cgccctgatc tgtatcgccg tggccgaggc cgagtctctg 60
ggcacagaac agagagtcgt gggcagagcc gccgaagtgc ctggacctga acctggccag 120
caggaacagc tggtgtttgg cagcggcgac gccgtggaac tgagctgtcc tccacctggc 180
ggaggcccta tgggacctac cgtgtgggtc aaggatggca ccggactggt gcctagcgag 240
agggtgctcg tgggacctca gagactgcag gtgctgaacg ccagccacga ggatagcggc 300
gcctacagct gcagacagag actgacacag cgggtgctgt gccacttctc cgtcagagtg 360
accgacgccc ctagctccgg cgacgatgag gatggcgaag atgaggccga ggacaccggc 420
gtggacacag gcgctccata ctggaccaga cccgagcgga tggacaagaa actgctggcc 480
gtgcctgccg ccaacaccgt gcggtttaga tgtcctgccg ccggaaaccc cacccccagc 540
atcagctggc tgaagaacgg cagagagttc cggggcgagc acagaatcgg cggcatcaag 600
ctgagacacc agcagtggtc cctcgtgatg gaaagcgtgg tgcccagcga ccggggcaac 660
tacacctgtg tggtggaaaa caagttcggc agcatccggc agacctacac cctggacgtg 720
ctggaaagaa gcccccacag acccatcctg caggccggac tgcctgccaa tcagacagcc 780
gtgctgggca gcgacgtgga atttcactgc aaggtgtaca gcgacgccca gccccacatc 840
cagtggctga aacacgtgga agtgaacggc agcaaagtgg gccccgacgg caccccttat 900
gtgaccgtgc tgaaaaccgc tggcgccaat accaccgaca aagaactgga agtgctgagc 960
ctgcacaacg tgaccttcga ggatgccggc gagtacacct gtctggccgg caacagcatc 1020
ggcttcagcc accattctgc ctggctggtg gtgctgcccg tgtccctgga aagcaacgcc 1080
agcatgagca gcaacaccga ctacaaggac gacgacgaca agtgaaagct t 1131
<210> 22
<211> 2019
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 22
atggagtctc tgggcacaga gcagagagtc gtgggcagag ccgctgaagt gcctggacct 60
gagcctggcc agcaggaaca gctggtcttt ggctctggcg acgccgtgga actgagctgt 120
cctccacctg gcggaggccc tatgggacct accgtgtggg tcaaggatgg caccggactg 180
gtgcctagcg agagggtgct cgtgggacct cagagactgc aggtcctgaa cgccagccac 240
gaggatagcg gcgcctacag ctgcagacag agactgaccc agcgggtgct gtgccacttc 300
agcgtcagag tgaccgatgc ccccagcagc ggagatgacg aggatggcga ggatgaggcc 360
gaggatacag gcgtggacac aggcgcccct tactggacca gacccgagcg gatggacaag 420
aaactgctgg ccgtgcctgc cgccaacacc gtgcggttta gatgccctgc cgccggaaac 480
cccaccccca gcatctcttg gctgaagaac ggcagagagt tccggggcga gcaccggatc 540
ggcggcatta agctgagaca ccagcagtgg tccctggtca tggaaagcgt ggtgcccagc 600
gaccggggca actacacctg tgtggtggaa aacaagttcg gcagcatccg gcagacctac 660
accctggacg tgctggaaag aagcccccac agacctatcc tgcaggccgg actgcctgcc 720
aatcagacag ccgtgctggg cagcgacgtg gaatttcaca gcaaggtgta cagcgacgcc 780
cagccccaca tccagtggct gaagcacgtg gaagtgaacg gcagcaaagt gggccccgac 840
ggcacccctt acgtgaccgt gctgaaagtg tccctggaaa gcaacgccag catgagcagc 900
aacacccccc tcgtgcggat cgccagactg tctagcggag agggccctac cctggccaac 960
gtgtccgaac tggaactgcc cgccgacccc aagtgggagc tgagcagagc tagactgacc 1020
ctgggcaagc ctctgggcga gggctgtttt ggacaggtgg tcatggccga ggccatcggc 1080
atcgacaagg acagagccgc caagcctgtg accgtggccg tgaagatgct gaaggacgac 1140
gccaccgaca aggacctgag cgacctggtg tccgagatgg aaatgatgaa gatgatcggc 1200
aagcacaaga acatcatcaa cctgctgggc gcctgcaccc agggcggacc tctgtacgtg 1260
ctggtggaat acgccgccaa gggcaacctg agagagttcc tgagagccag aaggccccct 1320
ggcctggact acagcttcga tacctgcaag ccccccgaag aacagctgac cttcaaggat 1380
ctggtgtcct gcgcctatca ggtggccaga ggcatggaat acctggccag ccagaagtgc 1440
atccaccggg atctggccgc cagaaacgtg ctggtcaccg aggacaacgt gatgaagatc 1500
gccgacttcg gcctggcccg ggacgtgcac aacctggact actacaagaa aaccaccaac 1560
ggccggctgc ccgtgaagtg gatggcccct gaggccctgt tcgacagagt gtacacccac 1620
cagagcgacg tgtggtcctt cggcgtgctg ctgtgggaga tctttaccct gggcggcagc 1680
ccttaccccg gcatccctgt ggaagaactg ttcaagctgc tgaaagaggg ccacagaatg 1740
gacaagcccg ccaactgcac ccacgacctg tacatgatca tgagagagtg ctggcacgcc 1800
gctcccagcc agaggcctac ctttaagcag ctggtggaag atctggaccg ggtgctgacc 1860
gtgaccagca ccgacgagta cctggatctg agcgccccct tcgagcagta ctctcctggc 1920
ggccaggata cccctagcag cagctctagc ggcgacgaca gcgtgttcgc ccacgatctg 1980
ctgcctccag cccctcctag ctctggcggc tctagaacc 2019
<210> 23
<211> 1491
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 23
atggagagcc tgggcacaga acagagagtc gtgggcagag ccgccgaagt gcctggacct 60
gaacctggcc agcaggaaca gctggtcttt ggctctggcg acgccgtgga actgagctgt 120
cctccacctg gcggaggccc tatgggacct accgtgtggg tcaaggatgg caccggactg 180
gtgcctagcg agagggtgct cgtgggacct cagagactgc aggtcctgaa cgccagccac 240
gaggatagcg gcgcctacag ctgcagacag agactgaccc agcgggtgct gtgccacttc 300
agcgtcagag tgaccgatgc ccccagcagc ggagatgacg aggatggcga ggatgaggcc 360
gaggatacag gcgtggacac aggcgcccct tactggacca gacccgagcg gatggacaag 420
aaactgctgg ccgtgcctgc cgccaacacc gtgcggttta gatgccctgc cgccggaaac 480
cccaccccca gcatctcttg gctgaagaac ggcagagagt tccggggcga gcaccggatc 540
ggcggcatta agctgagaca ccagcagtgg tccctggtca tggaaagcgt ggtgcccagc 600
gaccggggca actacacctg tgtggtggaa aacaagttcg gcagcatccg gcagacctac 660
accctggacg tgctggaaag aagcccccac agacctatcc tgcaggccgg actgcctgcc 720
aatcagacag ccgtgctggg cagcgacgtg gaatttcact gcaaggtgta cagcgacgcc 780
cagccccaca tccagtggct gaagcacgtg gaagtgaacg gcagcaaagt gggccccgac 840
ggcacccctt acgtgaccgt gctgaaagtg tccctggaaa gcaacgccag catgagcagc 900
aacaccagcg gcagcggctc tggcagcgga tctggttctg gctccggcag cgtggtgttc 960
ccctacttcc cccggctggg ccggtacaac ctgaactttc atgaggccca gcaggcctgc 1020
ctggaccagg atgccgtgat cgccagcttc gaccagctgt acgatgcttg gagaggcggc 1080
ctggactggt gcaatgccgg ctggctgtct gacggcagcg tgcagtaccc catcaccaag 1140
cccagagagc cctgcggcgg acagaatacc gtgcccggcg tgcggaacta cggcttctgg 1200
gacaaggaca agagcagata cgacgtgttc tgcttcacca gcaacttcaa cggccggttc 1260
tactacctga tccaccccac caagctgacc tacgacgagg ccgtgcaggc ctgtctgaac 1320
gatggcgccc agatcgccaa agtgggacag atcttcgccg cctggaagat cctgggctac 1380
gacagatgtg acgccggatg gctggccgac ggctccgtgc ggtatcccat cagccggcct 1440
agaagaagat gcagccctac cgaggccgcc gtcagattcg tgggcttccc c 1491
<210> 24
<211> 1710
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 24
atgggagcac cagcttgtgc cctggctctg tgtgtggccg tggctattgt ggctggcgcc 60
tctagcgaga gcctgggcac agaacagaga gtcgtgggca gagccgccga agtgcctgga 120
cctgaacctg gccagcagga acagctggtc tttggctctg gcgacgccgt ggaactgagc 180
tgtcctccac ctggcggagg ccctatggga cctaccgtgt gggtcaagga tggcaccgga 240
ctggtgccta gcgagagggt gctcgtggga cctcagagac tgcaggtcct gaacgccagc 300
cacgaggata gcggcgccta cagctgcaga cagagactga cccagcgggt gctgtgccac 360
ttcagcgtca gagtgaccga tgcccccagc agcggagatg acgaggatgg cgaggatgag 420
gccgaggata caggcgtgga cacaggcgcc ccttactgga ccagacccga gcggatggac 480
aagaaactgc tggccgtgcc tgccgccaac accgtgcggt ttagatgccc tgccgccgga 540
aaccccaccc ccagcatctc ttggctgaag aacggcagag agttccgggg cgagcaccgg 600
atcggcggca ttaagctgag acaccagcag tggtccctgg tcatggaaag cgtggtgccc 660
agcgaccggg gcaactacac ctgtgtggtg gaaaacaagt tcggcagcat ccggcagacc 720
tacaccctgg acgtgctgga aagaagcccc cacagaccta tcctgcaggc cggactgcct 780
gccaatcaga cagccgtgct gggcagcgac gtggaatttc actgcaaggt gtacagcgac 840
gcccagcccc acatccagtg gctgaagcac gtggaagtga acggcagcaa agtgggcccc 900
gacggcaccc cttacgtgac cgtgctgaaa accgctggcg ccaacaccac cgacaaagaa 960
ctggaagtgc tgagcctgca caacgtgacc ttcgaggacg ccggcgagta cacctgtctg 1020
gccggcaata gcatcggctt cagccaccac tctgcctggc tggtggtgct gccaggcgga 1080
ggctctgtgt ccctggaaag caacgccagc atgagcagca acaccagcgg cagcggctct 1140
ggcagcggat ctggttctgg ctccggcagc gtggtgttcc cctacttccc ccggctgggc 1200
cggtacaacc tgaactttca tgaggcccag caggcctgcc tggaccagga tgccgtgatc 1260
gccagcttcg accagctgta cgatgcttgg agaggcggcc tggactggtg caatgccggc 1320
tggctgtctg acggcagcgt gcagtacccc atcaccaagc ccagagagcc ctgcggcgga 1380
cagaataccg tgcccggcgt gcggaactac ggcttctggg acaaggacaa gagcagatac 1440
gacgtgttct gcttcaccag caacttcaac ggccggttct actacctgat ccaccccacc 1500
aagctgacct acgacgaggc cgtgcaggcc tgtctgaacg atggcgccca gatcgccaaa 1560
gtgggacaga tcttcgccgc ctggaagatc ctgggctacg acagatgtga cgccggatgg 1620
ctggccgacg gctccgtgcg gtatcccatc agccggccta gaagaagatg cagccctacc 1680
gaggccgccg tcagattcgt gggcttcccc 1710
<210> 25
<211> 236
<212> БЕЛОК
<213> Homo sapiens
<400> 25
Gly Gly Gly Gly Ala Gly Gly Gly Gly Asp Lys Thr His Thr Cys Pro
1 5 10 15
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
20 25 30
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
35 40 45
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
50 55 60
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
65 70 75 80
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
85 90 95
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
100 105 110
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
115 120 125
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
130 135 140
Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
145 150 155 160
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
165 170 175
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
180 185 190
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
195 200 205
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
210 215 220
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
225 230 235
<210> 26
<211> 236
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 26
Gly Gly Gly Gly Ala Gly Gly Gly Gly Asp Lys Thr His Thr Cys Pro
1 5 10 15
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
20 25 30
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
35 40 45
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
50 55 60
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
65 70 75 80
Arg Glu Glu Gln Tyr Ala Ser Thr Tyr Arg Val Val Ser Val Leu Thr
85 90 95
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
100 105 110
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
115 120 125
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
130 135 140
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
145 150 155 160
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
165 170 175
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
180 185 190
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
195 200 205
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
210 215 220
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
225 230 235
<210> 27
<211> 585
<212> БЕЛОК
<213> Homo sapiens
<400> 27
Asp Ala His Lys Ser Glu Val Ala His Arg Phe Lys Asp Leu Gly Glu
1 5 10 15
Glu Asn Phe Lys Ala Leu Val Leu Ile Ala Phe Ala Gln Tyr Leu Gln
20 25 30
Gln Cys Pro Phe Glu Asp His Val Lys Leu Val Asn Glu Val Thr Glu
35 40 45
Phe Ala Lys Thr Cys Val Ala Asp Glu Ser Ala Glu Asn Cys Asp Lys
50 55 60
Ser Leu His Thr Leu Phe Gly Asp Lys Leu Cys Thr Val Ala Thr Leu
65 70 75 80
Arg Glu Thr Tyr Gly Glu Met Ala Asp Cys Cys Ala Lys Gln Glu Pro
85 90 95
Glu Arg Asn Glu Cys Phe Leu Gln His Lys Asp Asp Asn Pro Asn Leu
100 105 110
Pro Arg Leu Val Arg Pro Glu Val Asp Val Met Cys Thr Ala Phe His
115 120 125
Asp Asn Glu Glu Thr Phe Leu Lys Lys Tyr Leu Tyr Glu Ile Ala Arg
130 135 140
Arg His Pro Tyr Phe Tyr Ala Pro Glu Leu Leu Phe Phe Ala Lys Arg
145 150 155 160
Tyr Lys Ala Ala Phe Thr Glu Cys Cys Gln Ala Ala Asp Lys Ala Ala
165 170 175
Cys Leu Leu Pro Lys Leu Asp Glu Leu Arg Asp Glu Gly Lys Ala Ser
180 185 190
Ser Ala Lys Gln Arg Leu Lys Cys Ala Ser Leu Gln Lys Phe Gly Glu
195 200 205
Arg Ala Phe Lys Ala Trp Ala Val Ala Arg Leu Ser Gln Arg Phe Pro
210 215 220
Lys Ala Glu Phe Ala Glu Val Ser Lys Leu Val Thr Asp Leu Thr Lys
225 230 235 240
Val His Thr Glu Cys Cys His Gly Asp Leu Leu Glu Cys Ala Asp Asp
245 250 255
Arg Ala Asp Leu Ala Lys Tyr Ile Cys Glu Asn Gln Asp Ser Ile Ser
260 265 270
Ser Lys Leu Lys Glu Cys Cys Glu Lys Pro Leu Leu Glu Lys Ser His
275 280 285
Cys Ile Ala Glu Val Glu Asn Asp Glu Met Pro Ala Asp Leu Pro Ser
290 295 300
Leu Ala Ala Asp Phe Val Glu Ser Lys Asp Val Cys Lys Asn Tyr Ala
305 310 315 320
Glu Ala Lys Asp Val Phe Leu Gly Met Phe Leu Tyr Glu Tyr Ala Arg
325 330 335
Arg His Pro Asp Tyr Ser Val Val Leu Leu Leu Arg Leu Ala Lys Thr
340 345 350
Tyr Glu Thr Thr Leu Glu Lys Cys Cys Ala Ala Ala Asp Pro His Glu
355 360 365
Cys Tyr Ala Lys Val Phe Asp Glu Phe Lys Pro Leu Val Glu Glu Pro
370 375 380
Gln Asn Leu Ile Lys Gln Asn Cys Glu Leu Phe Glu Gln Leu Gly Glu
385 390 395 400
Tyr Lys Phe Gln Asn Ala Leu Leu Val Arg Tyr Thr Lys Lys Val Pro
405 410 415
Gln Val Ser Thr Pro Thr Leu Val Glu Val Ser Arg Asn Leu Gly Lys
420 425 430
Val Gly Ser Lys Cys Cys Lys His Pro Glu Ala Lys Arg Met Pro Cys
435 440 445
Ala Glu Asp Tyr Leu Ser Val Val Leu Asn Gln Leu Cys Val Leu His
450 455 460
Glu Lys Thr Pro Val Ser Asp Arg Val Thr Lys Cys Cys Thr Glu Ser
465 470 475 480
Leu Val Asn Arg Arg Pro Cys Phe Ser Ala Leu Glu Val Asp Glu Thr
485 490 495
Tyr Val Pro Lys Glu Phe Asn Ala Glu Thr Phe Thr Phe His Ala Asp
500 505 510
Ile Cys Thr Leu Ser Glu Lys Glu Arg Gln Ile Lys Lys Gln Thr Ala
515 520 525
Leu Val Glu Leu Val Lys His Lys Pro Lys Ala Thr Lys Glu Gln Leu
530 535 540
Lys Ala Val Met Asp Asp Phe Ala Ala Phe Val Glu Lys Cys Cys Lys
545 550 555 560
Ala Asp Asp Lys Glu Thr Cys Phe Ala Glu Glu Gly Lys Lys Leu Val
565 570 575
Ala Ala Ser Gln Ala Ala Leu Gly Leu
580 585
<210> 28
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 28
Gly Gly Gly Gly Ala Gly Gly Gly Gly
1 5
<210> 29
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 29
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 30
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 30
Ala Gly Gly Thr Gly Gly Cys Cys Thr Thr Thr Gly Ala Cys Ala Cys
1 5 10 15
Cys Thr Ala Cys Cys Ala Gly Gly
20
<210> 31
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 31
Thr Cys Thr Gly Thr Thr Gly Thr Gly Thr Thr Thr Cys Cys Thr Cys
1 5 10 15
Cys Cys Thr Gly Thr Thr Gly Gly
20
<210> 32
<211> 806
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 32
Met Gly Ala Pro Ala Cys Ala Leu Ala Leu Cys Val Ala Val Ala Ile
1 5 10 15
Val Ala Gly Ala Ser Ser Glu Ser Leu Gly Thr Glu Gln Arg Val Val
20 25 30
Gly Arg Ala Ala Glu Val Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln
35 40 45
Leu Val Phe Gly Ser Gly Asp Ala Val Glu Leu Ser Cys Pro Pro Pro
50 55 60
Gly Gly Gly Pro Met Gly Pro Thr Val Trp Val Lys Asp Gly Thr Gly
65 70 75 80
Leu Val Pro Ser Glu Arg Val Leu Val Gly Pro Gln Arg Leu Gln Val
85 90 95
Leu Asn Ala Ser His Glu Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg
100 105 110
Leu Thr Gln Arg Val Leu Cys His Phe Ser Val Arg Val Thr Asp Ala
115 120 125
Pro Ser Ser Gly Asp Asp Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr
130 135 140
Gly Val Asp Thr Gly Ala Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp
145 150 155 160
Lys Lys Leu Leu Ala Val Pro Ala Ala Asn Thr Val Arg Phe Arg Cys
165 170 175
Pro Ala Ala Gly Asn Pro Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly
180 185 190
Arg Glu Phe Arg Gly Glu His Arg Ile Gly Gly Ile Lys Leu Arg His
195 200 205
Gln Gln Trp Ser Leu Val Met Glu Ser Val Val Pro Ser Asp Arg Gly
210 215 220
Asn Tyr Thr Cys Val Val Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr
225 230 235 240
Tyr Thr Leu Asp Val Leu Glu Arg Ser Pro His Arg Pro Ile Leu Gln
245 250 255
Ala Gly Leu Pro Ala Asn Gln Thr Ala Val Leu Gly Ser Asp Val Glu
260 265 270
Phe His Cys Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Leu
275 280 285
Lys His Val Glu Val Asn Gly Ser Lys Val Gly Pro Asp Gly Thr Pro
290 295 300
Tyr Val Thr Val Leu Lys Thr Ala Gly Ala Asn Thr Thr Asp Lys Glu
305 310 315 320
Leu Glu Val Leu Ser Leu His Asn Val Thr Phe Glu Asp Ala Gly Glu
325 330 335
Tyr Thr Cys Leu Ala Gly Asn Ser Ile Gly Phe Ser His His Ser Ala
340 345 350
Trp Leu Val Val Leu Pro Ala Glu Glu Glu Leu Val Glu Ala Asp Glu
355 360 365
Ala Gly Ser Val Tyr Ala Gly Ile Leu Ser Tyr Gly Val Gly Phe Phe
370 375 380
Leu Phe Ile Leu Val Val Ala Ala Val Thr Leu Cys Arg Leu Arg Ser
385 390 395 400
Pro Pro Lys Lys Gly Leu Gly Ser Pro Thr Val His Lys Ile Ser Arg
405 410 415
Phe Pro Leu Lys Arg Gln Val Ser Leu Glu Ser Asn Ala Ser Met Ser
420 425 430
Ser Asn Thr Pro Leu Val Arg Ile Ala Arg Leu Ser Ser Gly Glu Gly
435 440 445
Pro Thr Leu Ala Asn Val Ser Glu Leu Glu Leu Pro Ala Asp Pro Lys
450 455 460
Trp Glu Leu Ser Arg Ala Arg Leu Thr Leu Gly Lys Pro Leu Gly Glu
465 470 475 480
Gly Cys Phe Gly Gln Val Val Met Ala Glu Ala Ile Gly Ile Asp Lys
485 490 495
Asp Arg Ala Ala Lys Pro Val Thr Val Ala Val Lys Met Leu Lys Asp
500 505 510
Asp Ala Thr Asp Lys Asp Leu Ser Asp Leu Val Ser Glu Met Glu Met
515 520 525
Met Lys Met Ile Gly Lys His Lys Asn Ile Ile Asn Leu Leu Gly Ala
530 535 540
Cys Thr Gln Gly Gly Pro Leu Tyr Val Leu Val Glu Tyr Ala Ala Lys
545 550 555 560
Gly Asn Leu Arg Glu Phe Leu Arg Ala Arg Arg Pro Pro Gly Leu Asp
565 570 575
Tyr Ser Phe Asp Thr Cys Lys Pro Pro Glu Glu Gln Leu Thr Phe Lys
580 585 590
Asp Leu Val Ser Cys Ala Tyr Gln Val Ala Arg Gly Met Glu Tyr Leu
595 600 605
Ala Ser Gln Lys Cys Ile His Arg Asp Leu Ala Ala Arg Asn Val Leu
610 615 620
Val Thr Glu Asp Asn Val Met Lys Ile Ala Asp Phe Gly Leu Ala Arg
625 630 635 640
Asp Val His Asn Leu Asp Tyr Tyr Lys Lys Thr Thr Asn Gly Arg Leu
645 650 655
Pro Val Lys Trp Met Ala Pro Glu Ala Leu Phe Asp Arg Val Tyr Thr
660 665 670
His Gln Ser Asp Val Trp Ser Phe Gly Val Leu Leu Trp Glu Ile Phe
675 680 685
Thr Leu Gly Gly Ser Pro Tyr Pro Gly Ile Pro Val Glu Glu Leu Phe
690 695 700
Lys Leu Leu Lys Glu Gly His Arg Met Asp Lys Pro Ala Asn Cys Thr
705 710 715 720
His Asp Leu Tyr Met Ile Met Arg Glu Cys Trp His Ala Ala Pro Ser
725 730 735
Gln Arg Pro Thr Phe Lys Gln Leu Val Glu Asp Leu Asp Arg Val Leu
740 745 750
Thr Val Thr Ser Thr Asp Glu Tyr Leu Asp Leu Ser Ala Pro Phe Glu
755 760 765
Gln Tyr Ser Pro Gly Gly Gln Asp Thr Pro Ser Ser Ser Ser Ser Gly
770 775 780
Asp Asp Ser Val Phe Ala His Asp Leu Leu Pro Pro Ala Pro Pro Ser
785 790 795 800
Ser Gly Gly Ser Arg Thr
805
<210> 33
<211> 349
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 33
Glu Ser Leu Gly Thr Glu Gln Arg Val Val Gly Arg Ala Ala Glu Val
1 5 10 15
Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln Leu Val Phe Gly Ser Gly
20 25 30
Asp Ala Val Glu Leu Ser Cys Pro Pro Pro Gly Gly Gly Pro Met Gly
35 40 45
Pro Thr Val Trp Val Lys Asp Gly Thr Gly Leu Val Pro Ser Glu Arg
50 55 60
Val Leu Val Gly Pro Gln Arg Leu Gln Val Leu Asn Ala Ser His Glu
65 70 75 80
Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg Leu Thr Gln Arg Val Leu
85 90 95
Cys His Phe Ser Val Arg Val Thr Asp Ala Pro Ser Ser Gly Asp Asp
100 105 110
Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr Gly Val Asp Thr Gly Ala
115 120 125
Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp Lys Lys Leu Leu Ala Val
130 135 140
Pro Ala Ala Asn Thr Val Arg Phe Arg Cys Pro Ala Ala Gly Asn Pro
145 150 155 160
Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly Arg Glu Phe Arg Gly Glu
165 170 175
His Arg Ile Gly Gly Ile Lys Leu Arg His Gln Gln Trp Ser Leu Val
180 185 190
Met Glu Ser Val Val Pro Ser Asp Arg Gly Asn Tyr Thr Cys Val Val
195 200 205
Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr Tyr Thr Leu Asp Val Leu
210 215 220
Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly Leu Pro Ala Asn
225 230 235 240
Gln Thr Ala Val Leu Gly Ser Asp Val Glu Phe His Cys Lys Val Tyr
245 250 255
Ser Asp Ala Gln Pro His Ile Gln Trp Leu Lys His Val Glu Val Asn
260 265 270
Gly Ser Lys Val Gly Pro Asp Gly Thr Pro Tyr Val Thr Val Leu Lys
275 280 285
Thr Ala Gly Ala Asn Thr Thr Asp Lys Glu Leu Glu Val Leu Ser Leu
290 295 300
His Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr Cys Leu Ala Gly
305 310 315 320
Asn Ser Ile Gly Phe Ser His His Ser Ala Trp Leu Val Val Leu Pro
325 330 335
Val Ser Leu Glu Ser Asn Ala Ser Met Ser Ser Asn Thr
340 345
<210> 34
<211> 368
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 34
Met Met Ser Phe Val Ser Leu Leu Leu Val Gly Ile Leu Phe His Ala
1 5 10 15
Thr Gln Ala Glu Ser Leu Gly Thr Glu Gln Arg Val Val Gly Arg Ala
20 25 30
Ala Glu Val Pro Gly Pro Glu Pro Gly Gln Gln Glu Gln Leu Val Phe
35 40 45
Gly Ser Gly Asp Ala Val Glu Leu Ser Cys Pro Pro Pro Gly Gly Gly
50 55 60
Pro Met Gly Pro Thr Val Trp Val Lys Asp Gly Thr Gly Leu Val Pro
65 70 75 80
Ser Glu Arg Val Leu Val Gly Pro Gln Arg Leu Gln Val Leu Asn Ala
85 90 95
Ser His Glu Asp Ser Gly Ala Tyr Ser Cys Arg Gln Arg Leu Thr Gln
100 105 110
Arg Val Leu Cys His Phe Ser Val Arg Val Thr Asp Ala Pro Ser Ser
115 120 125
Gly Asp Asp Glu Asp Gly Glu Asp Glu Ala Glu Asp Thr Gly Val Asp
130 135 140
Thr Gly Ala Pro Tyr Trp Thr Arg Pro Glu Arg Met Asp Lys Lys Leu
145 150 155 160
Leu Ala Val Pro Ala Ala Asn Thr Val Arg Phe Arg Cys Pro Ala Ala
165 170 175
Gly Asn Pro Thr Pro Ser Ile Ser Trp Leu Lys Asn Gly Arg Glu Phe
180 185 190
Arg Gly Glu His Arg Ile Gly Gly Ile Lys Leu Arg His Gln Gln Trp
195 200 205
Ser Leu Val Met Glu Ser Val Val Pro Ser Asp Arg Gly Asn Tyr Thr
210 215 220
Cys Val Val Glu Asn Lys Phe Gly Ser Ile Arg Gln Thr Tyr Thr Leu
225 230 235 240
Asp Val Leu Glu Arg Ser Pro His Arg Pro Ile Leu Gln Ala Gly Leu
245 250 255
Pro Ala Asn Gln Thr Ala Val Leu Gly Ser Asp Val Glu Phe His Cys
260 265 270
Lys Val Tyr Ser Asp Ala Gln Pro His Ile Gln Trp Leu Lys His Val
275 280 285
Glu Val Asn Gly Ser Lys Val Gly Pro Asp Gly Thr Pro Tyr Val Thr
290 295 300
Val Leu Lys Thr Ala Gly Ala Asn Thr Thr Asp Lys Glu Leu Glu Val
305 310 315 320
Leu Ser Leu His Asn Val Thr Phe Glu Asp Ala Gly Glu Tyr Thr Cys
325 330 335
Leu Ala Gly Asn Ser Ile Gly Phe Ser His His Ser Ala Trp Leu Val
340 345 350
Val Leu Pro Val Ser Leu Glu Ser Asn Ala Ser Met Ser Ser Asn Thr
355 360 365
<210> 35
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 35
Met Met Ser Phe Val Ser Leu Leu Leu Val Gly Ile Leu Phe His Ala
1 5 10 15
Thr Gln Ala
<210> 36
<211> 963
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 36
atgatgtcct ttgtctctct gctcctggtt ggcatcctat tccatgccac ccaggccgag 60
tccttgggga cggagcagcg cgtcgtgggg cgagcggcag aagtcccggg cccagagccc 120
ggccagcagg agcagttggt cttcggcagc ggggatgctg tggagctgag ctgtcccccg 180
cccgggggtg gtcccatggg gcccactgtc tgggtcaagg atggcacagg gctggtgccc 240
tcggagcgtg tcctggtggg gccccagcgg ctgcaggtgc tgaatgcctc ccacgaggac 300
tccggggcct acagctgccg gcagcggctc acgcagcgcg tactgtgcca cttcagtgtg 360
cgggtgacag acgctccatc ctcgggagat gacgaagacg gggaggacga ggctgaggac 420
acaggtgtgg acacaggggc cccttactgg acacggcccg agcggatgga caagaagctg 480
ctggccgtgc cggccgccaa caccgtccgc ttccgctgcc cagccgctgg caaccccact 540
ccctccatct cctggctgaa gaacggcagg gagttccgcg gcgagcaccg cattggaggc 600
atcaagctgc ggcatcagca gtggagcctg gtcatggaaa gcgtggtgcc ctcggaccgc 660
ggcaactaca cctgcgtcgt ggagaacaag tttggcagca tccggcagac gtacacgctg 720
gacgtgctgg agcgctcccc gcaccggccc atcctgcagg cggggctgcc ggccaaccag 780
acggcggtgc tgggcagcga cgtggagttc cactccaagg tgtacagtga cgcacagccc 840
cacatccagt ggctcaagca cgtggaggtg aatggcagca aggtgggccc ggacggcaca 900
ccctacgtta ccgtgctcaa ggtgtccctg gagtccaacg cgtccatgag ctccaacaca 960
tga 963
<210> 37
<211> 1107
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 37
atgatgtcct ttgtctctct gctcctggtt ggcatcctat tccatgccac ccaggccgag 60
tccttgggga cggagcagcg cgtcgtgggg cgagcggcag aagtcccggg cccagagccc 120
ggccagcagg agcagttggt cttcggcagc ggggatgctg tggagctgag ctgtcccccg 180
cccgggggtg gtcccatggg gcccactgtc tgggtcaagg atggcacagg gctggtgccc 240
tcggagcgtg tcctggtggg gccccagcgg ctgcaggtgc tgaatgcctc ccacgaggac 300
tccggggcct acagctgccg gcagcggctc acgcagcgcg tactgtgcca cttcagtgtg 360
cgggtgacag acgctccatc ctcgggagat gacgaagacg gggaggacga ggctgaggac 420
acaggtgtgg acacaggggc cccttactgg acacggcccg agcggatgga caagaagctg 480
ctggccgtgc cggccgccaa caccgtccgc ttccgctgcc cagccgctgg caaccccact 540
ccctccatct cctggctgaa gaacggcagg gagttccgcg gcgagcaccg cattggaggc 600
atcaagctgc ggcatcagca gtggagcctg gtcatggaaa gcgtggtgcc ctcggaccgc 660
ggcaactaca cctgcgtcgt ggagaacaag tttggcagca tccggcagac gtacacgctg 720
gacgtgctgg agcgctcccc gcaccggccc atcctgcagg ctgggctgcc tgctaaccag 780
acagcggtgc tgggcagcga cgtggagttc cactgcaagg tgtacagtga cgcacagccc 840
cacatccagt ggctcaagca cgtggaggtg aatggcagca aggtgggccc ggacggcaca 900
ccctacgtta ccgtgctcaa gacggcgggc gctaacacca ccgacaagga gctagaggtt 960
ctctccttgc acaacgtcac ctttgaggac gccggggagt acacctgcct ggcgggcaat 1020
tctattgggt tttctcatca ctctgcgtgg ctggtggtgc tgccagtgtc cctggagtcc 1080
aacgcgtcca tgagctccaa cacatga 1107
<210> 38
<211> 216
<212> БЕЛОК
<213> Homo sapiens
<400> 38
Met Arg Ser Gly Cys Val Val Val His Val Trp Ile Leu Ala Gly Leu
1 5 10 15
Trp Leu Ala Val Ala Gly Arg Pro Leu Ala Phe Ser Asp Ala Gly Pro
20 25 30
His Val His Tyr Gly Trp Gly Asp Pro Ile Arg Leu Arg His Leu Tyr
35 40 45
Thr Ser Gly Pro His Gly Leu Ser Ser Cys Phe Leu Arg Ile Arg Ala
50 55 60
Asp Gly Val Val Asp Cys Ala Arg Gly Gln Ser Ala His Ser Leu Leu
65 70 75 80
Glu Ile Lys Ala Val Ala Leu Arg Thr Val Ala Ile Lys Gly Val His
85 90 95
Ser Val Arg Tyr Leu Cys Met Gly Ala Asp Gly Lys Met Gln Gly Leu
100 105 110
Leu Gln Tyr Ser Glu Glu Asp Cys Ala Phe Glu Glu Glu Ile Arg Pro
115 120 125
Asp Gly Tyr Asn Val Tyr Arg Ser Glu Lys His Arg Leu Pro Val Ser
130 135 140
Leu Ser Ser Ala Lys Gln Arg Gln Leu Tyr Lys Asn Arg Gly Phe Leu
145 150 155 160
Pro Leu Ser His Phe Leu Pro Met Leu Pro Met Val Pro Glu Glu Pro
165 170 175
Glu Asp Leu Arg Gly His Leu Glu Ser Asp Met Phe Ser Ser Pro Leu
180 185 190
Glu Thr Asp Ser Met Asp Pro Phe Gly Leu Val Thr Gly Leu Glu Ala
195 200 205
Val Arg Ser Pro Ser Phe Glu Lys
210 215
<210> 39
<211> 209
<212> БЕЛОК
<213> Homo sapiens
<400> 39
Met Asp Ser Asp Glu Thr Gly Phe Glu His Ser Gly Leu Trp Val Ser
1 5 10 15
Val Leu Ala Gly Leu Leu Leu Gly Ala Cys Gln Ala His Pro Ile Pro
20 25 30
Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val Arg Gln Arg Tyr
35 40 45
Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His Leu Glu Ile Arg
50 55 60
Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser Pro Glu Ser Leu
65 70 75 80
Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln Ile Leu Gly Val
85 90 95
Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly Ala Leu Tyr Gly
100 105 110
Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg Glu Leu Leu Leu
115 120 125
Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His Gly Leu Pro Leu
130 135 140
His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro Ala Pro Arg Gly
145 150 155 160
Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro Ala Leu Pro Glu
165 170 175
Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val Gly Ser Ser Asp
180 185 190
Pro Leu Ser Met Val Gly Pro Ser Gln Gly Arg Ser Pro Ser Tyr Ala
195 200 205
Ser
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕЧЕНИЕ АНОМАЛЬНОГО ОТЛОЖЕНИЯ ВИСЦЕРАЛЬНОГО ЖИРА С ИСПОЛЬЗОВАНИЕМ РАСТВОРИМЫХ ПОЛИПЕПТИДОВ РЕЦЕПТОРА ФАКТОРА РОСТА ФИБРОБЛАСТОВ 3 (sFGFR3) | 2018 |
|
RU2794170C2 |
| ГЕННАЯ ТЕРАПИЯ ГИПОФОСФАТЕМИЧЕСКИХ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ФАКТОРОМ РОСТА ФИБРОБЛАСТОВ 23 | 2020 |
|
RU2815545C2 |
| ВАРИАНТЫ КИСЛОЙ АЛЬФА-ГЛЮКОЗИДАЗЫ И ИХ ИСПОЛЬЗОВАНИЕ | 2017 |
|
RU2780410C2 |
| ПРИМЕНЕНИЕ АНТИТЕЛА ПРОТИВ О-АЦЕТИЛИРОВАННОГО ГАНГЛИОЗИДА GD2 ДЛЯ УЛУЧШЕНИЯ ТЕРАПЕВТИЧЕСКОГО ПОТЕНЦИАЛА ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2017 |
|
RU2771173C2 |
| ИММУНОЦИТОКИНЫ НА ОСНОВЕ IL-15 И IL-15Rα ДОМЕНА SUSHI | 2012 |
|
RU2763298C2 |
| ВИРУСОПОДОБНЫЕ ЧАСТИЦЫ С ВЫСОКОПЛОТНЫМ ПОКРЫТИЕМ ДЛЯ ИНДУКЦИИ ЭКСПРЕССИИ АНТИТЕЛ | 2017 |
|
RU2813282C2 |
| ХИМЕРНЫЕ БЕЛКИ НА ОСНОВЕ TIGIT И LIGHT | 2018 |
|
RU2775490C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С CD3 | 2019 |
|
RU2832669C2 |
| ИММУНОКОНЪЮГАТЫ IL2 И МУТАНТНОГО TNF | 2017 |
|
RU2758139C2 |
| ВИДЫ КОМБИНИРОВАННОЙ ТЕРАПИИ РАКА, НАЦЕЛИВАЮЩИЕСЯ НА CD38 И TGF-БЕТА | 2019 |
|
RU2808632C2 |
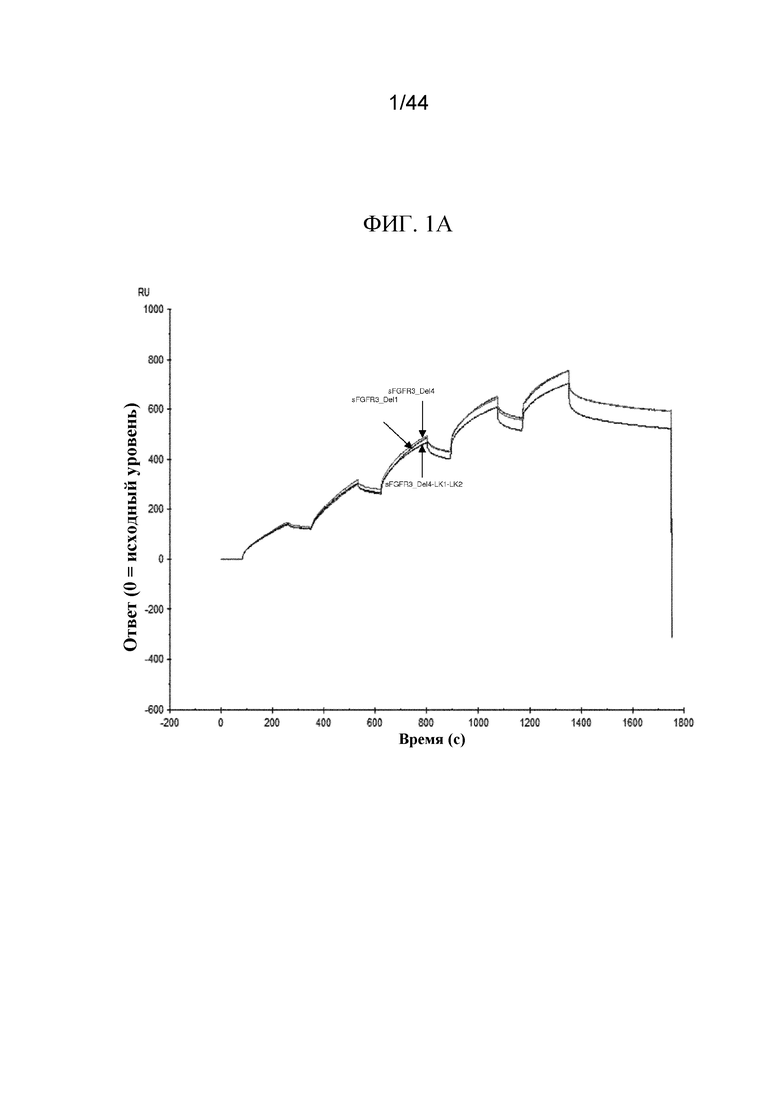
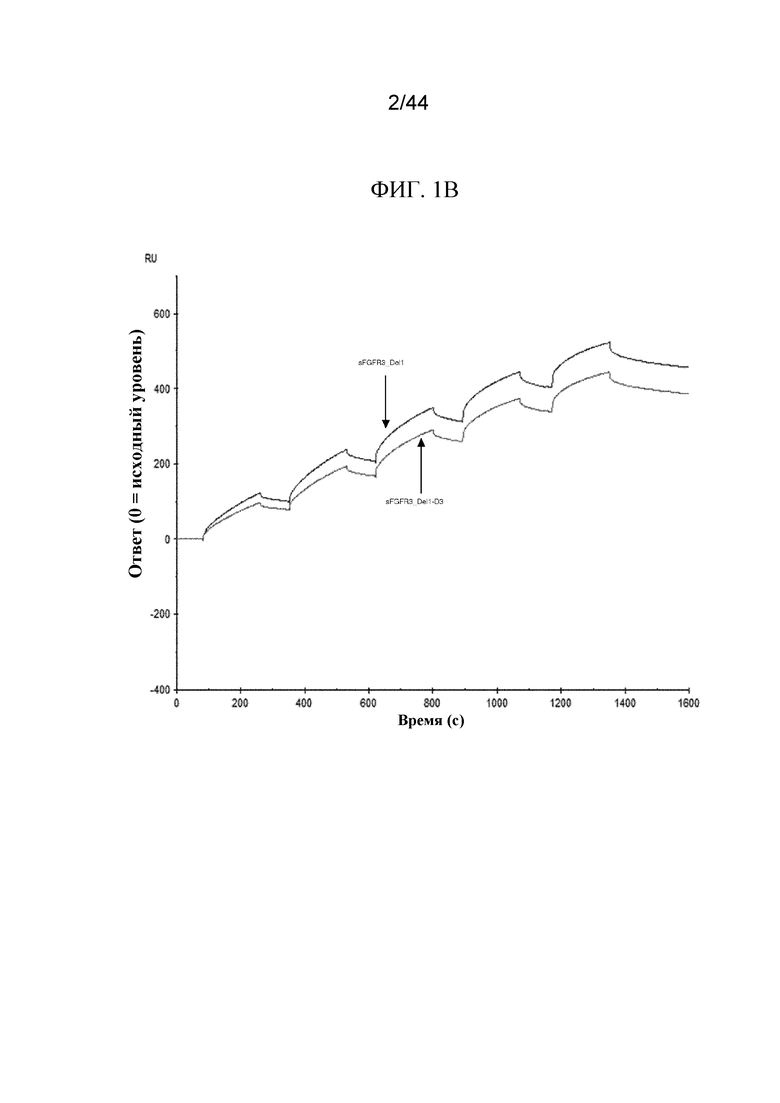
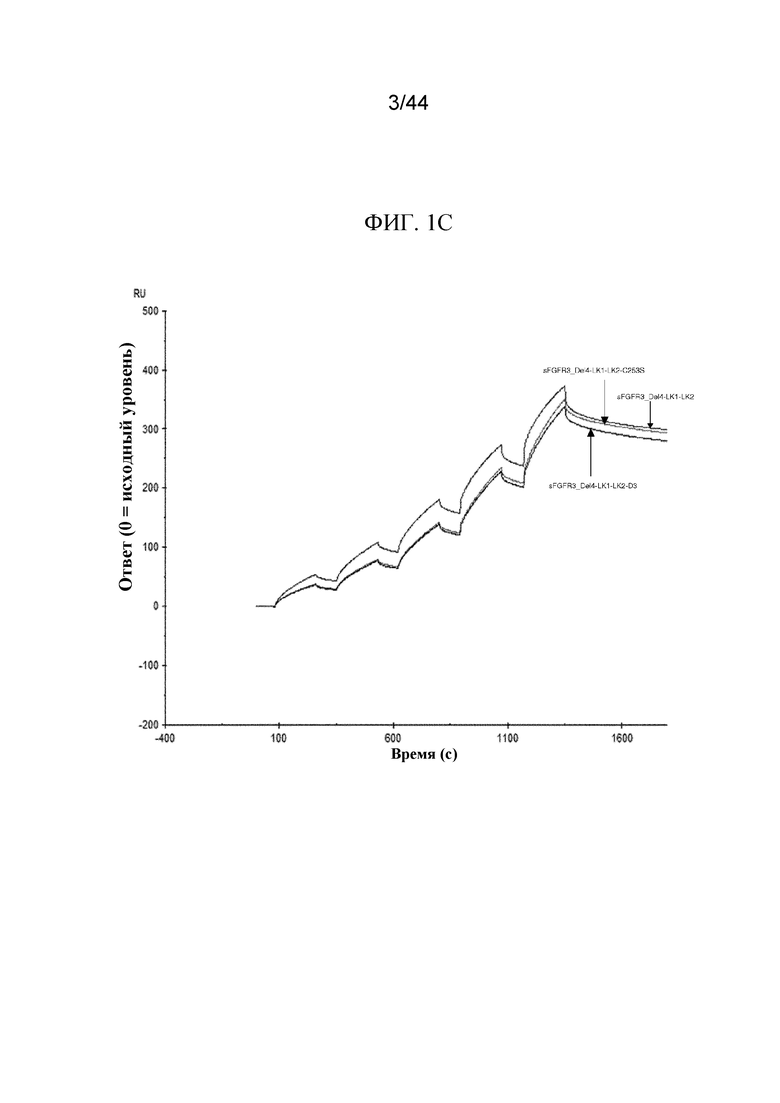

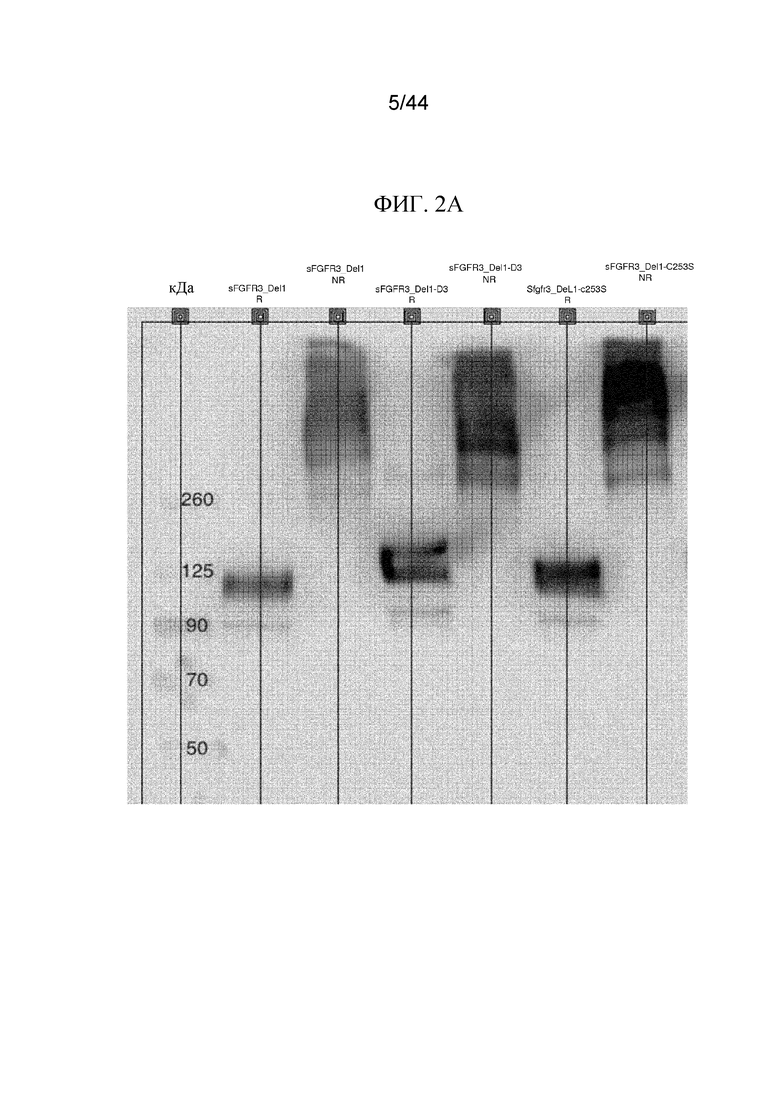
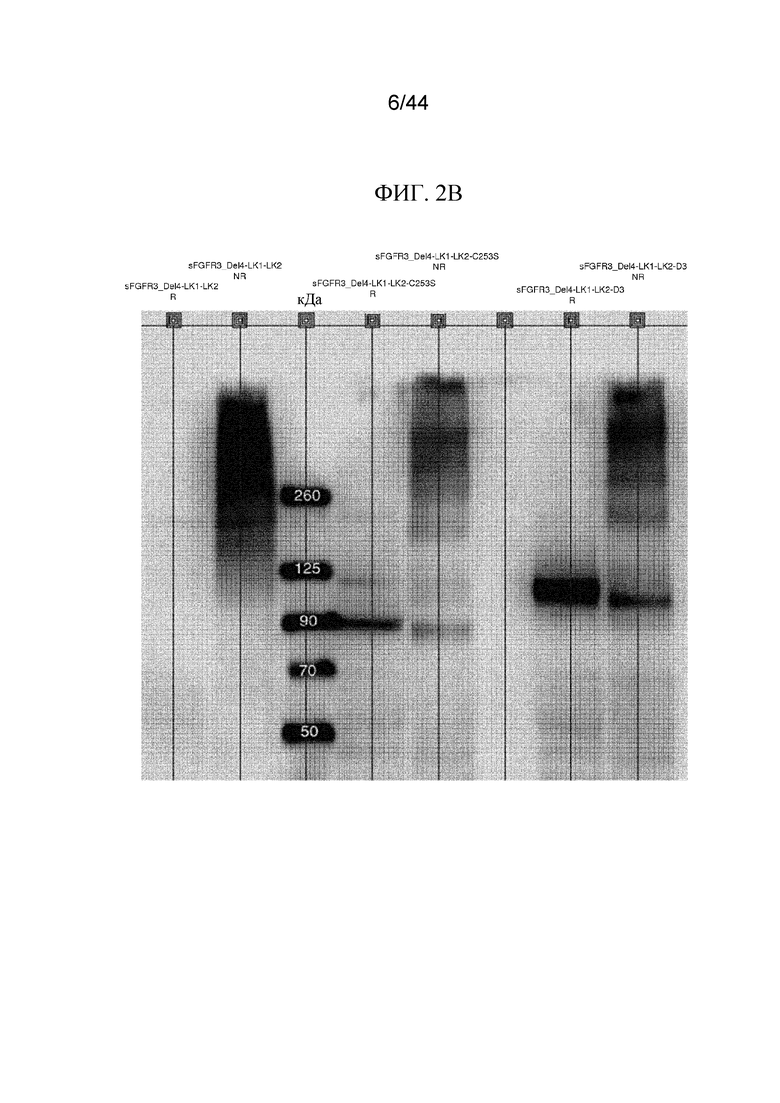
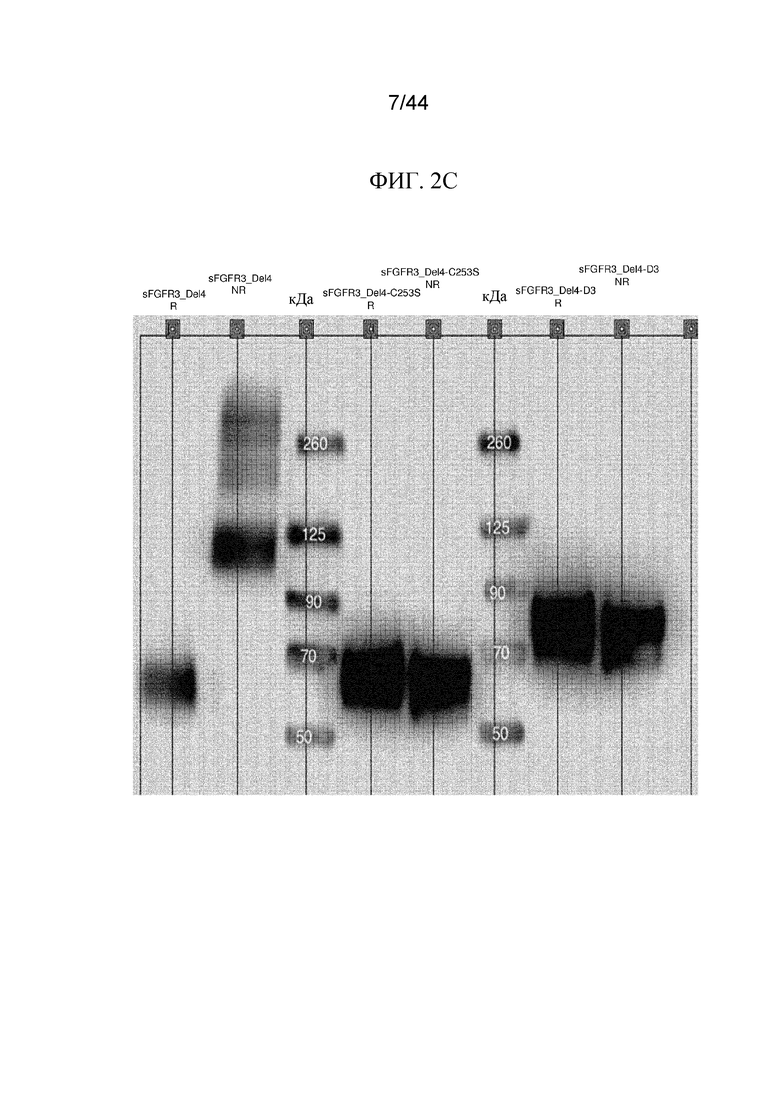
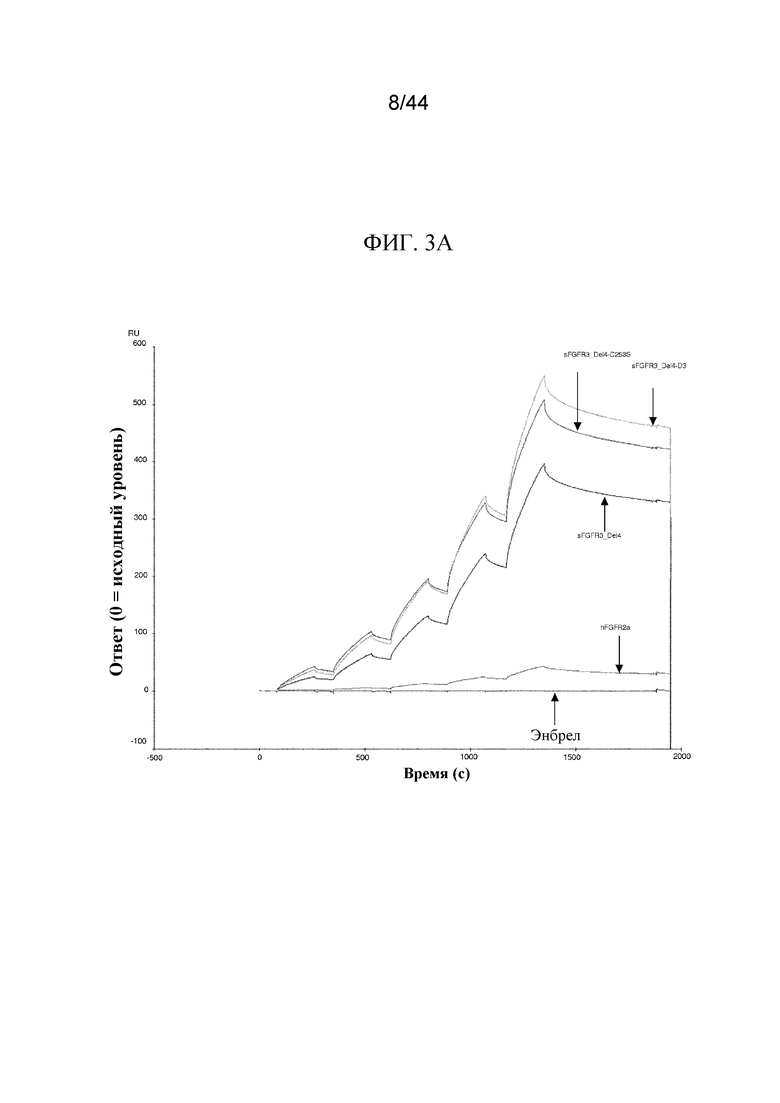
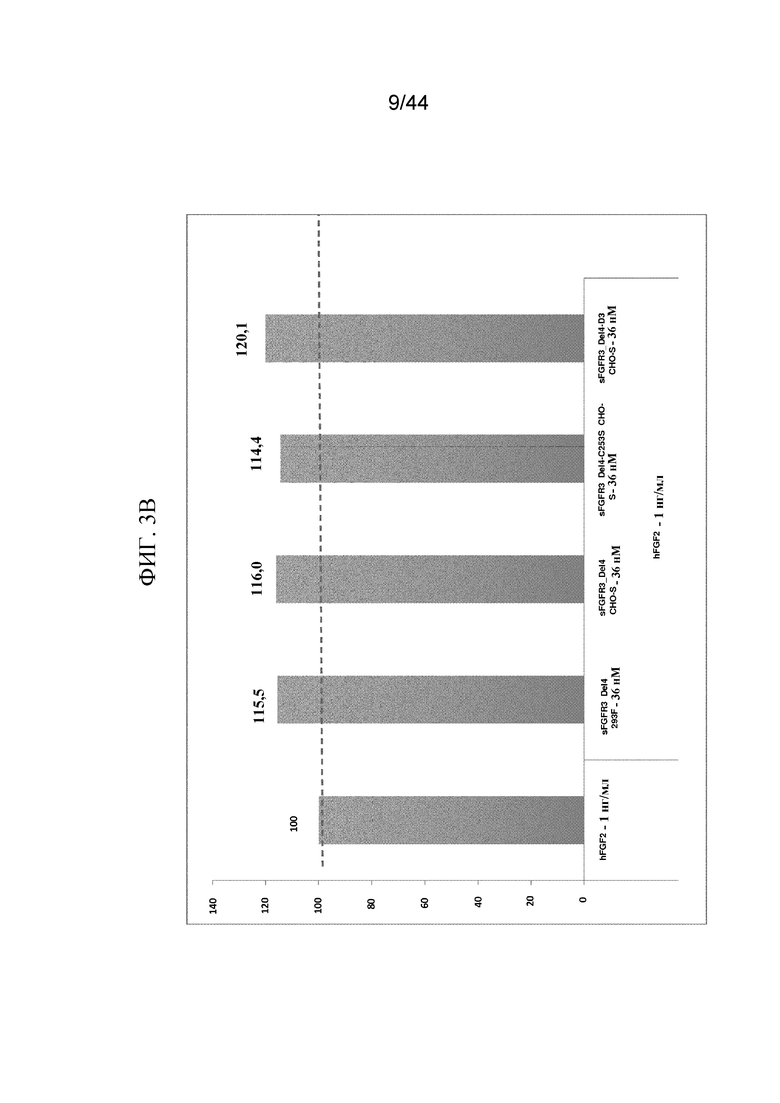
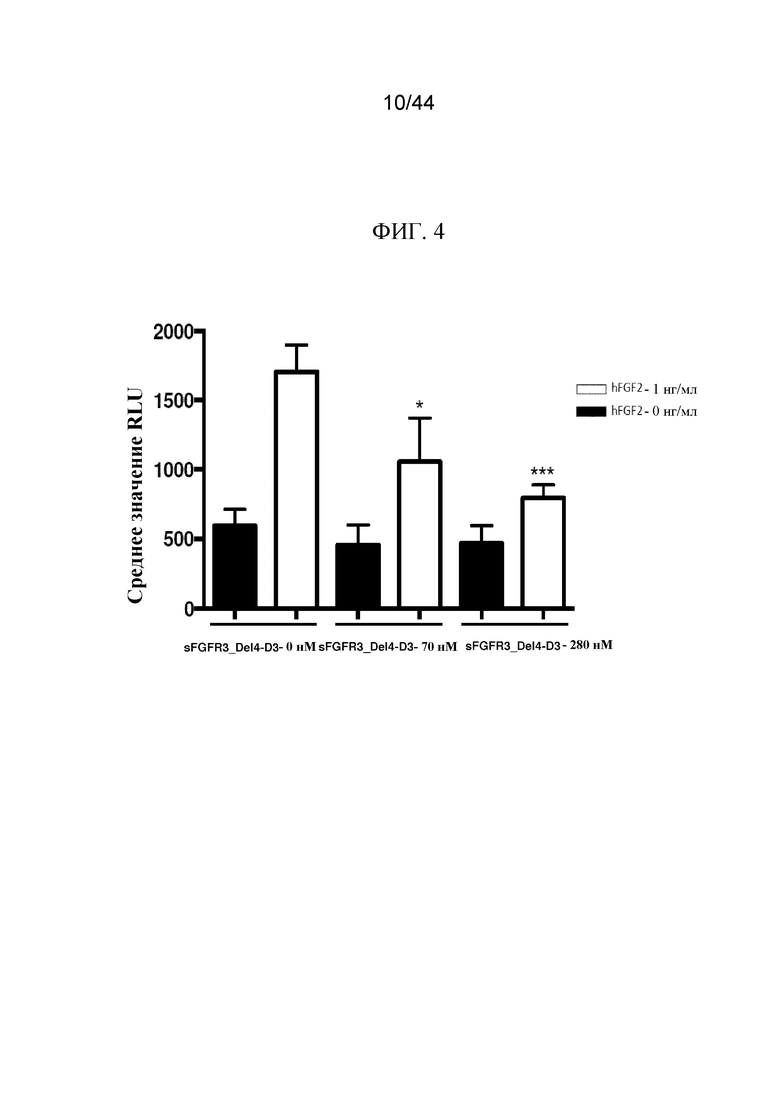
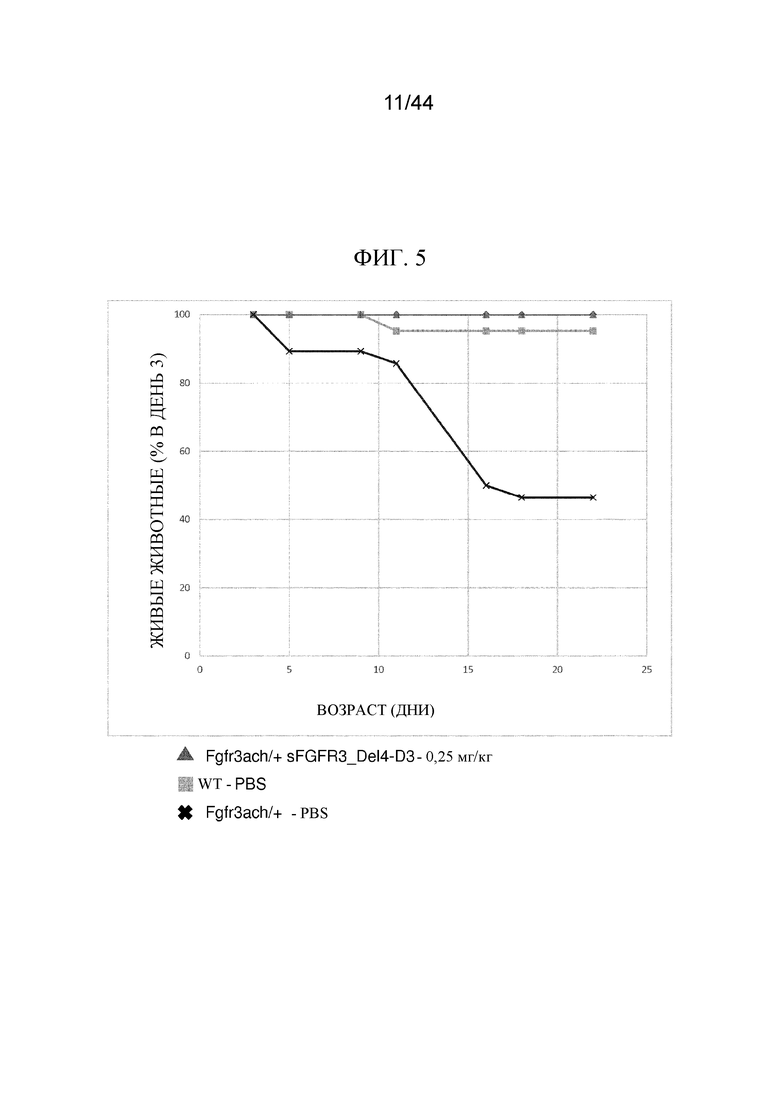
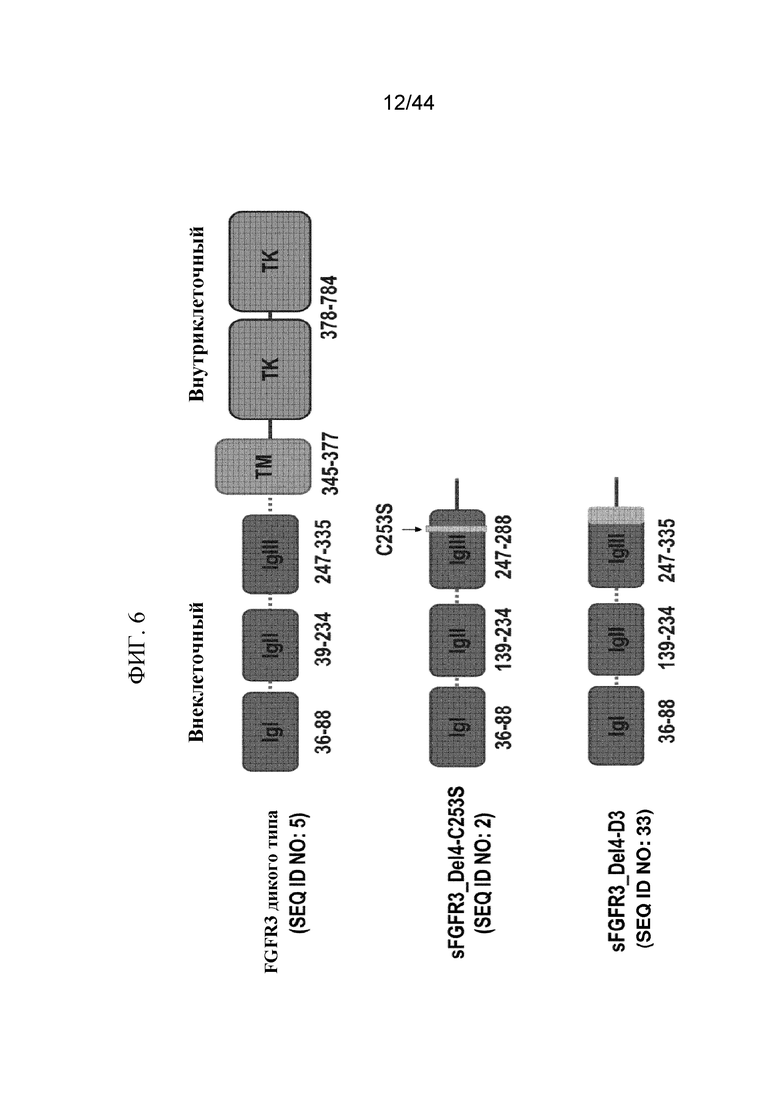
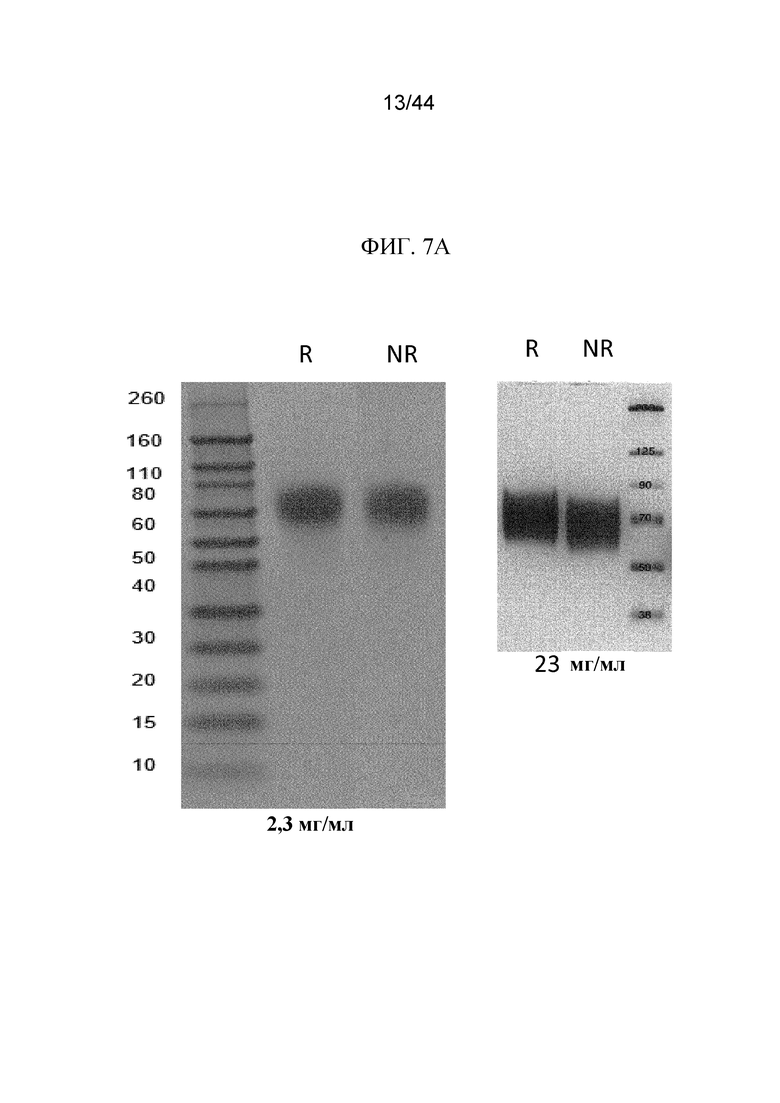
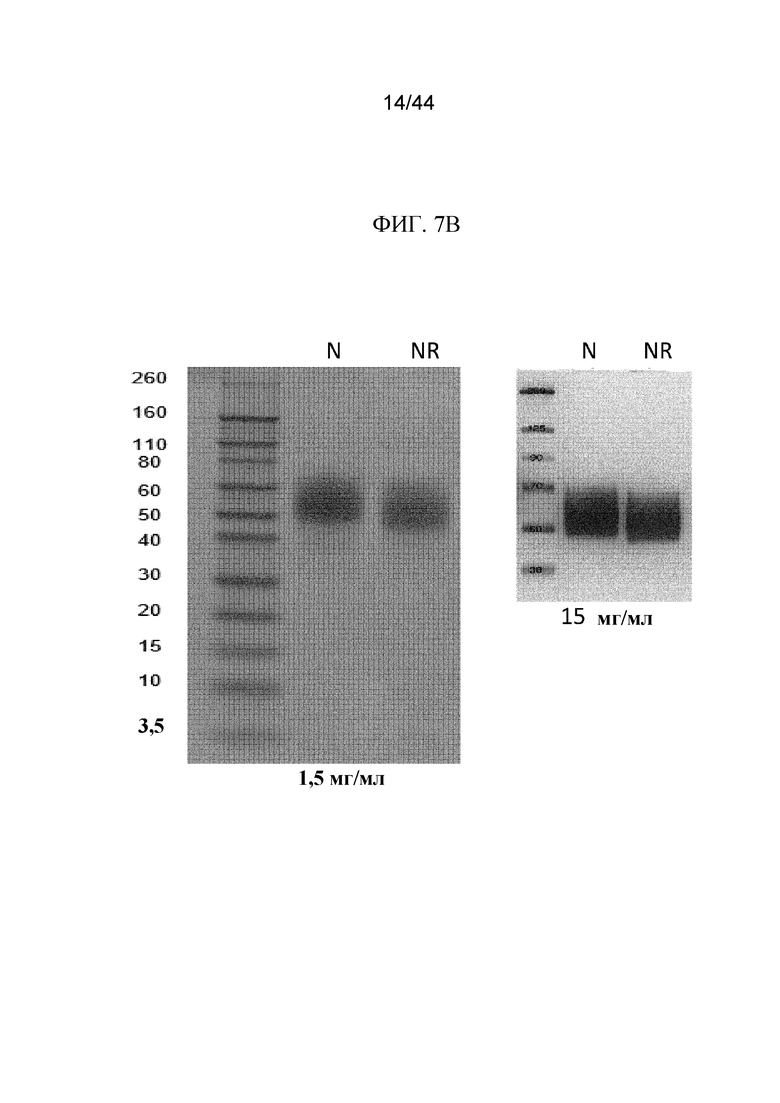
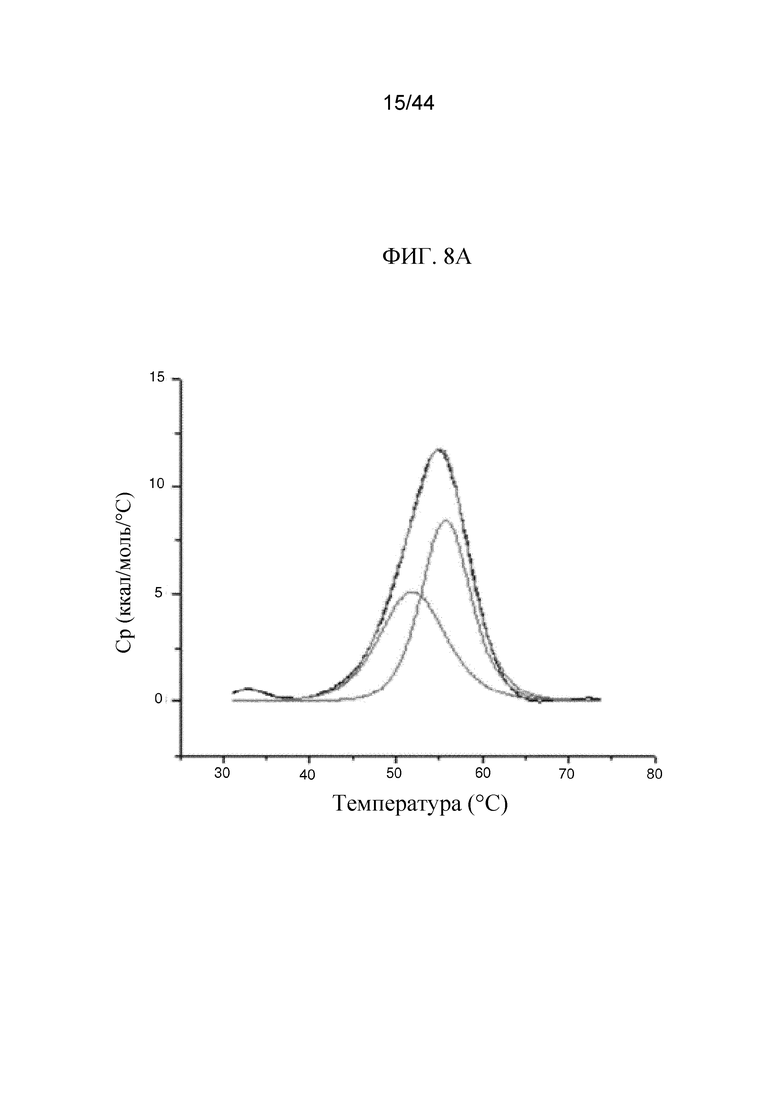

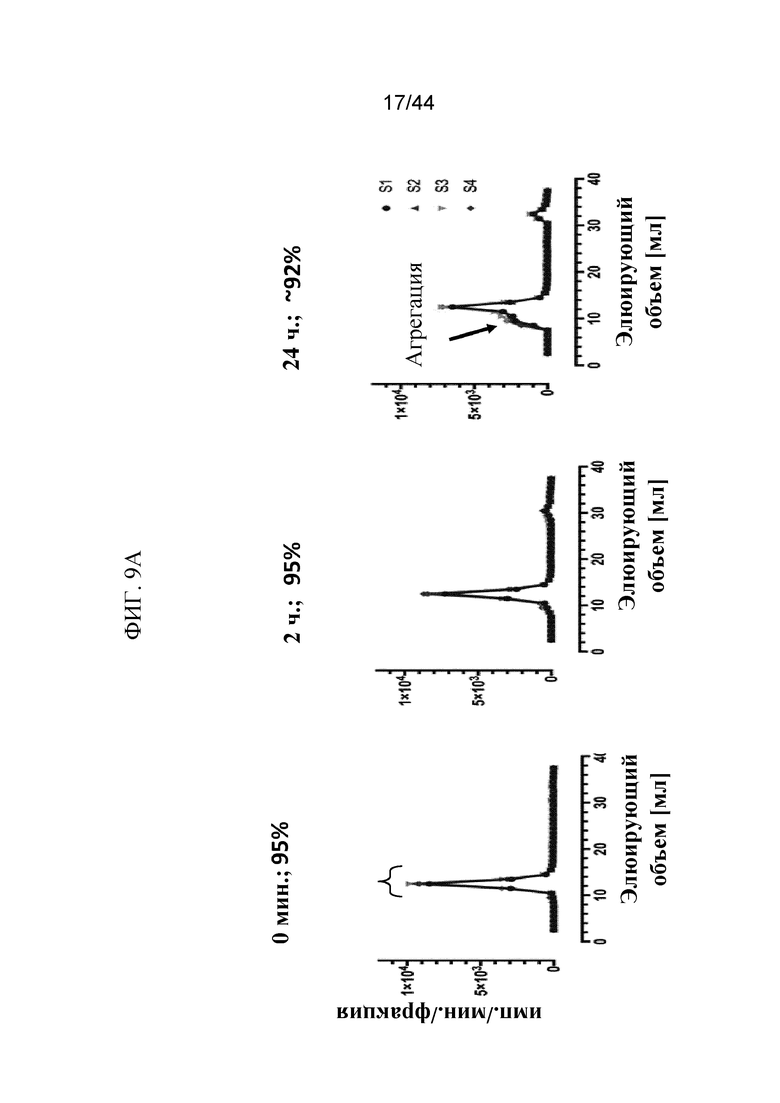
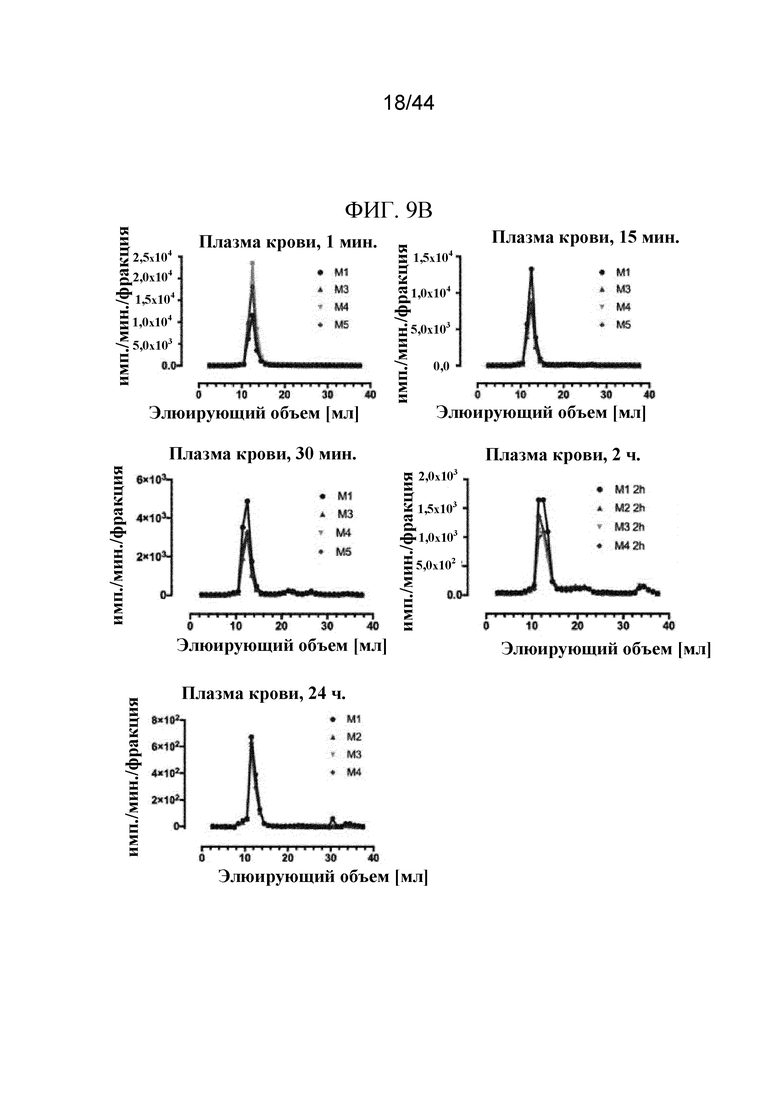
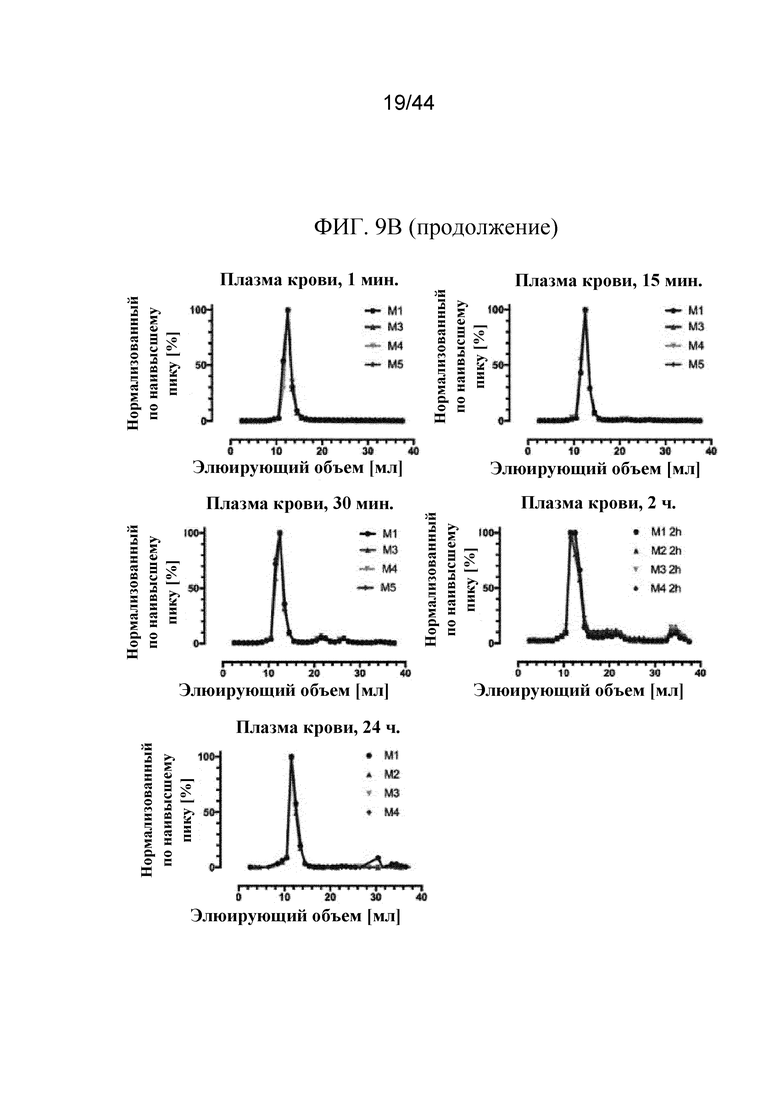
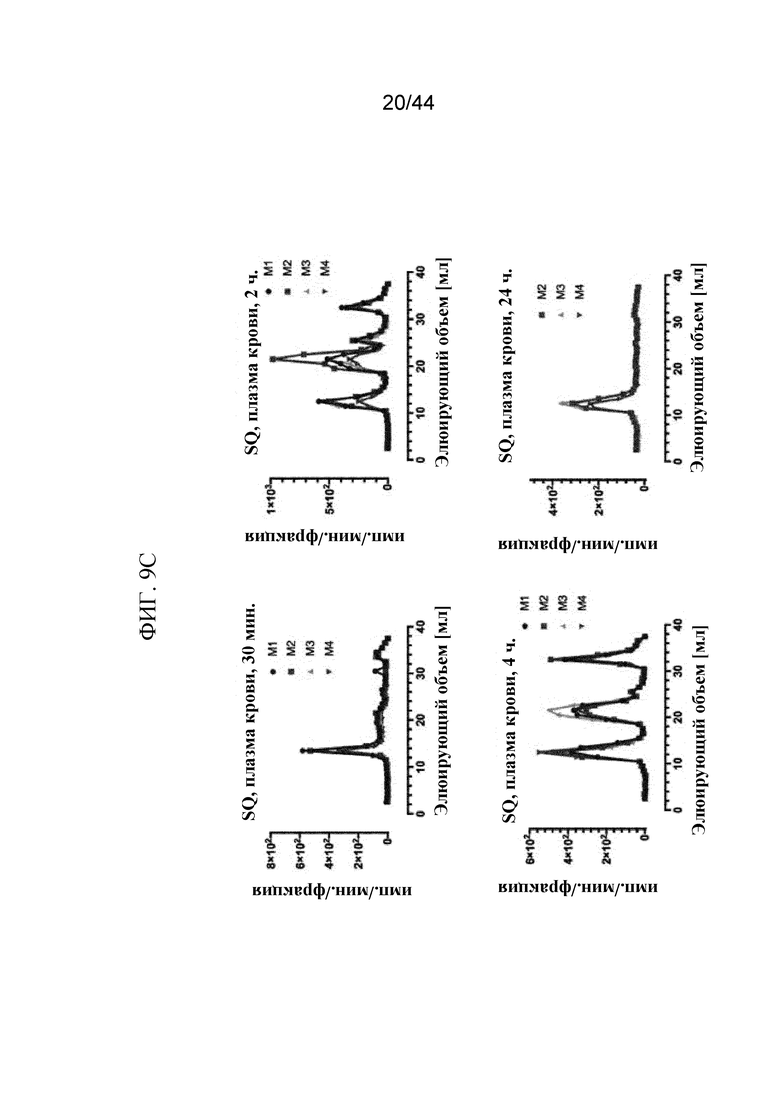
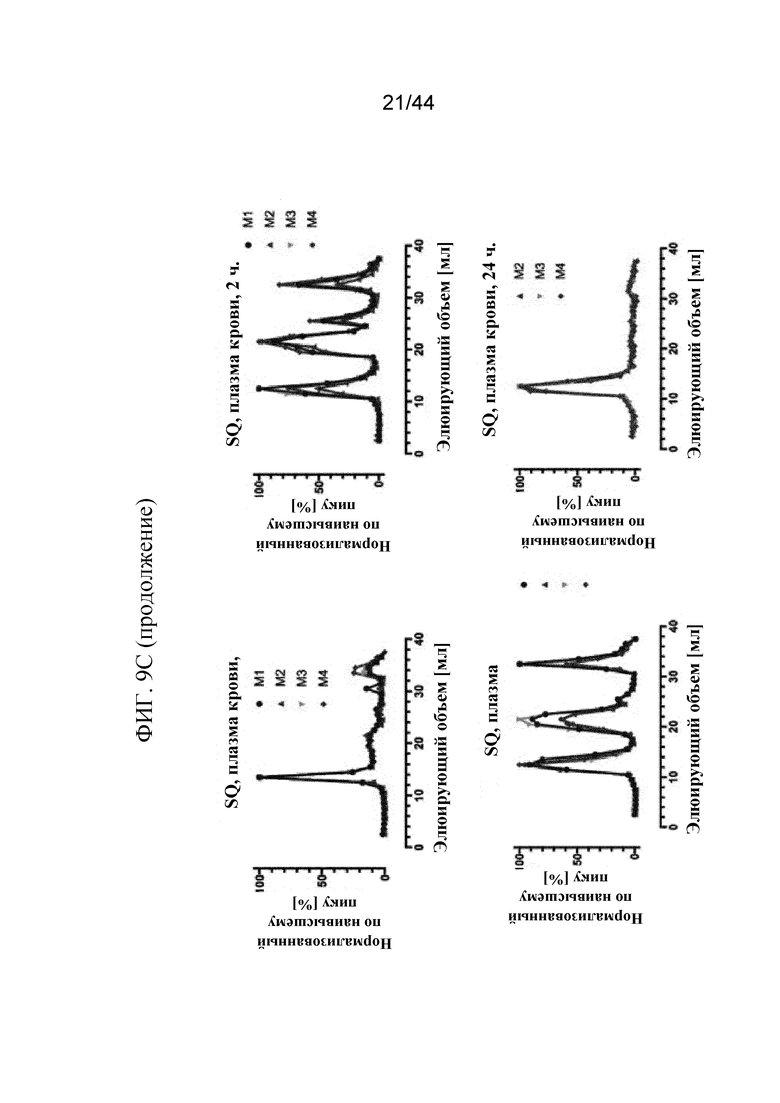
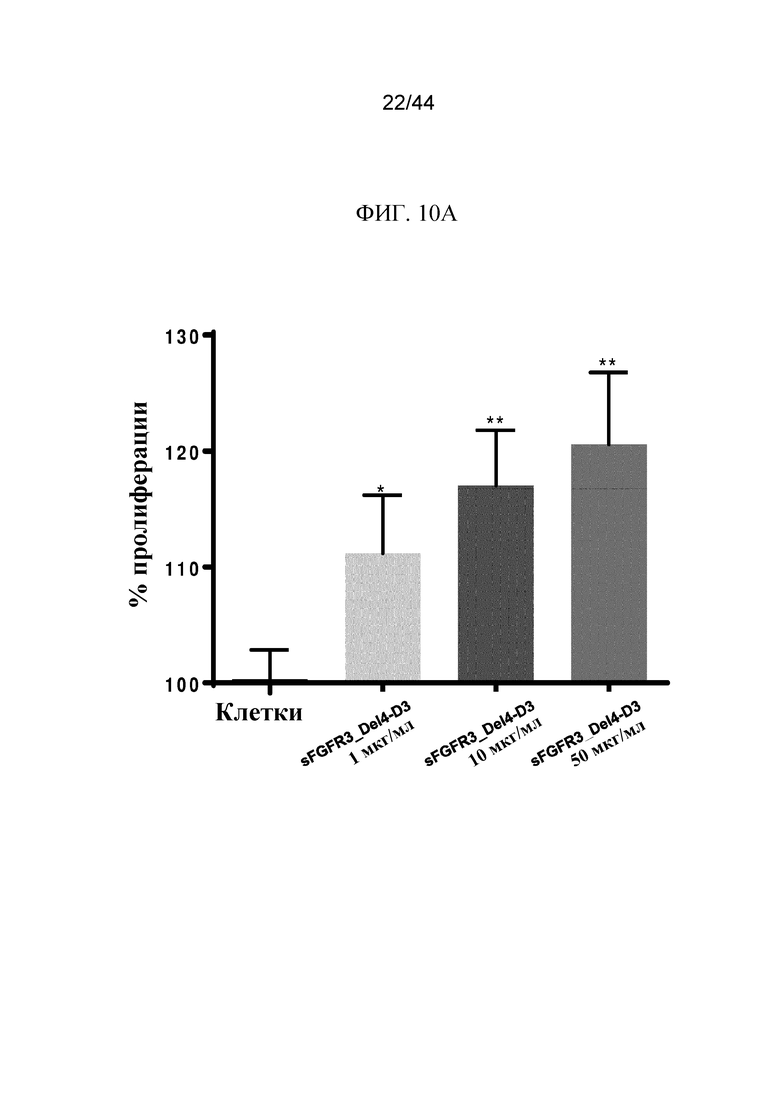
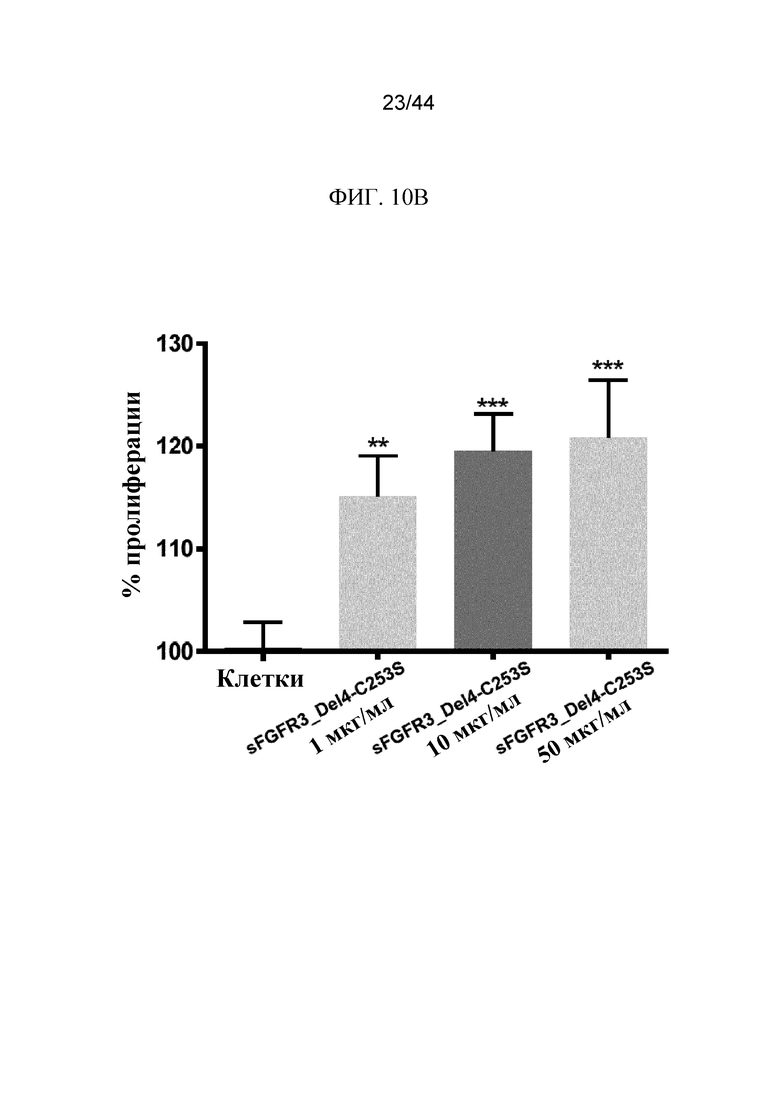
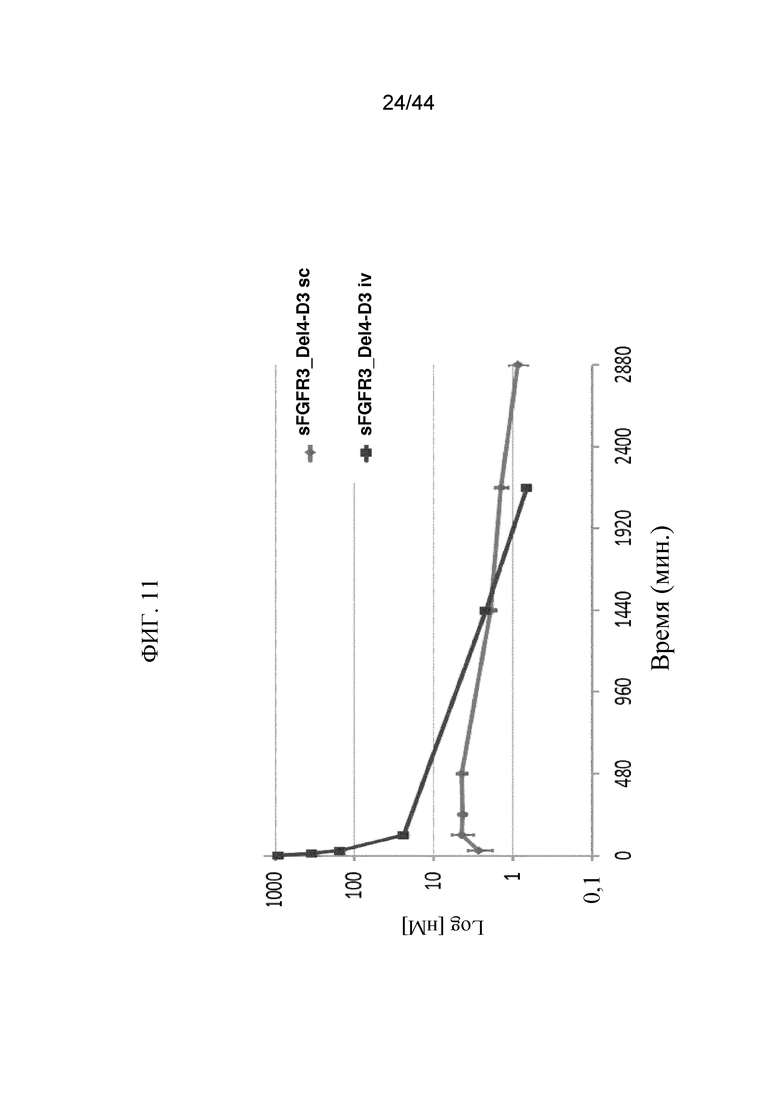
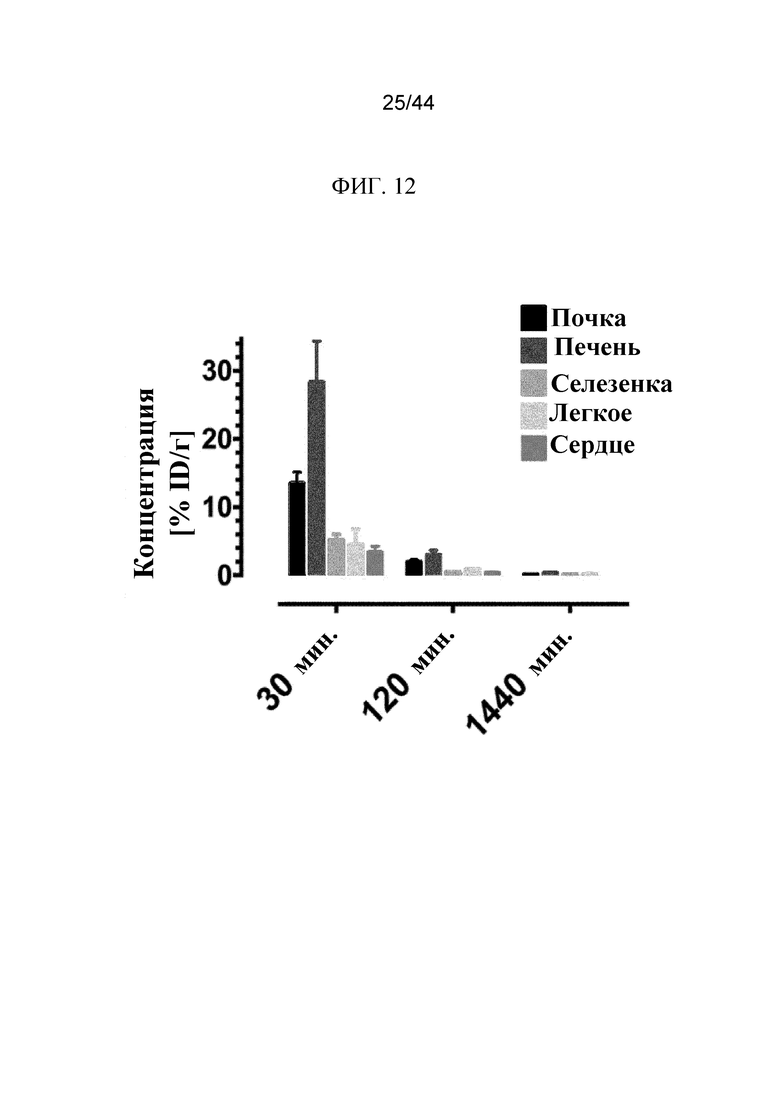
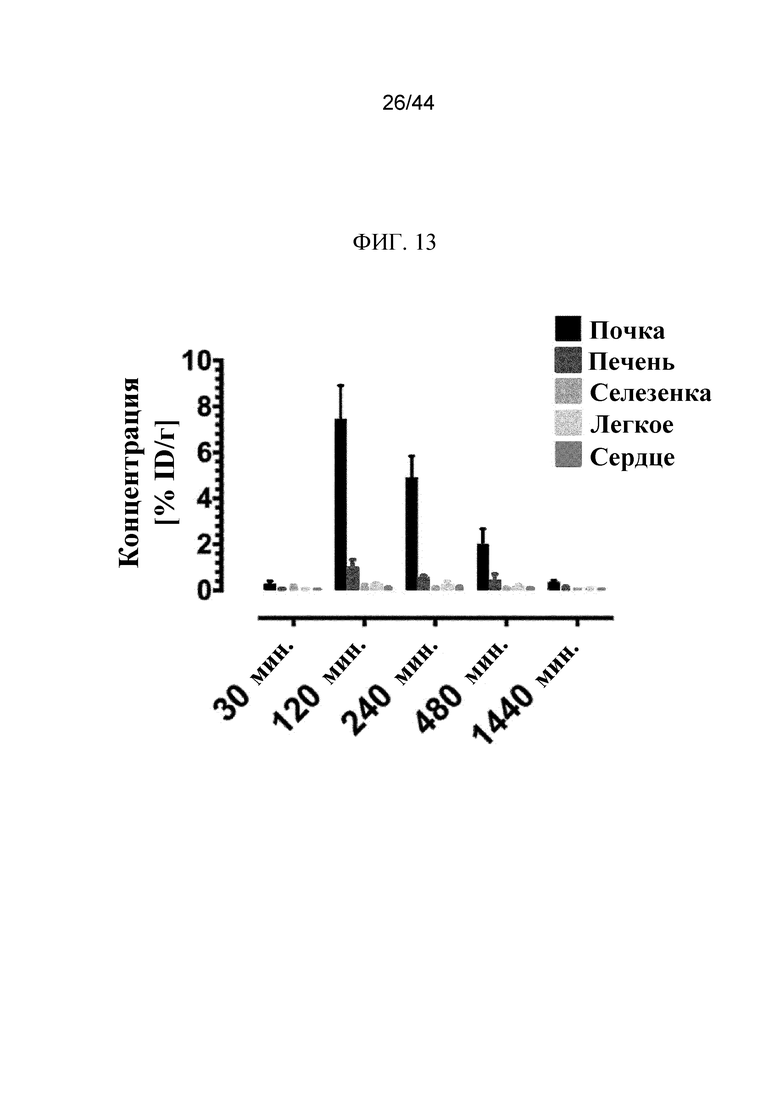
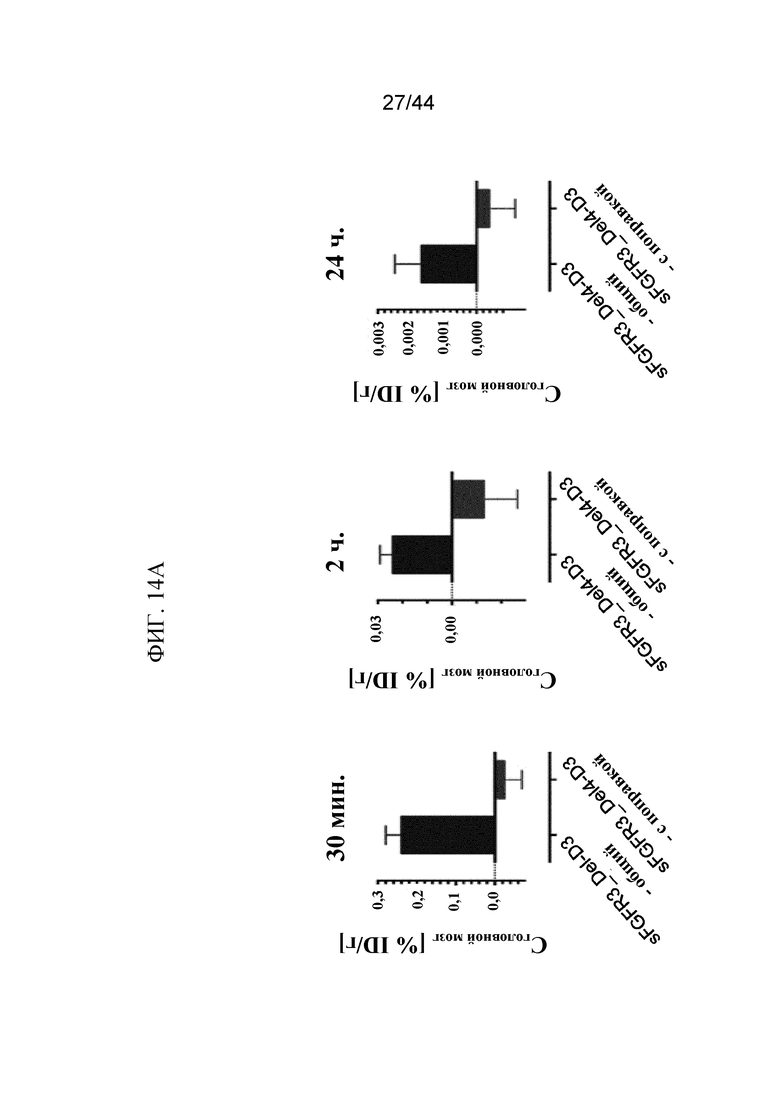
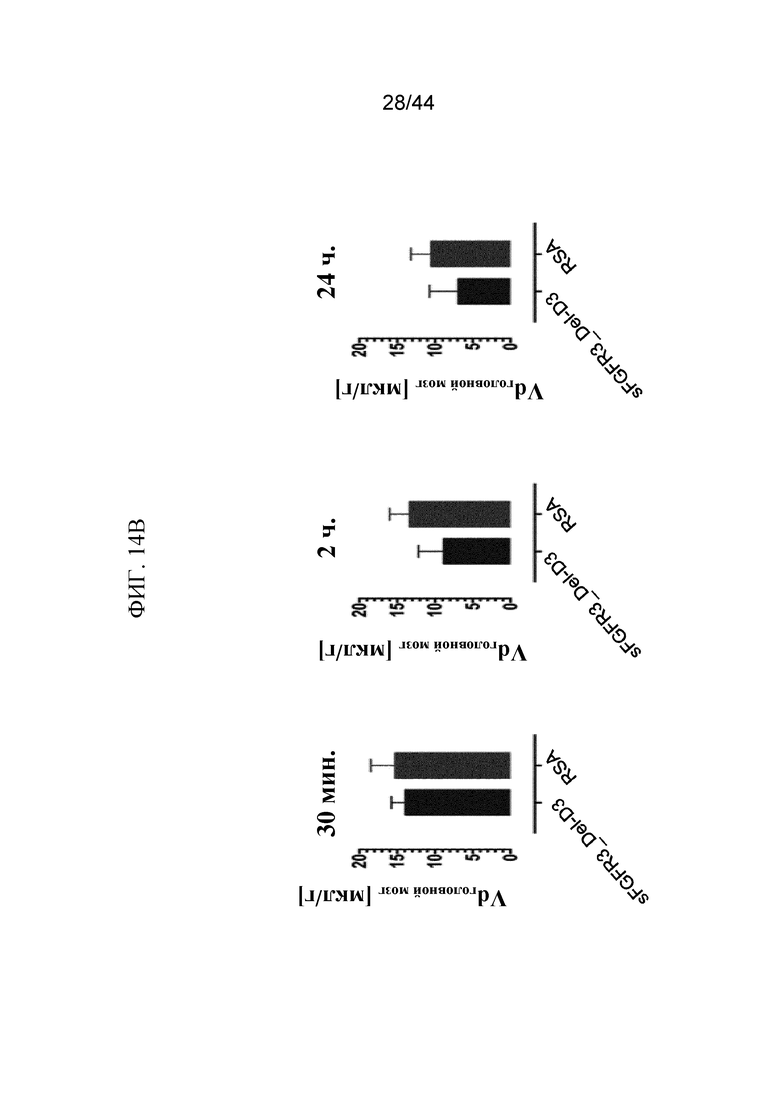
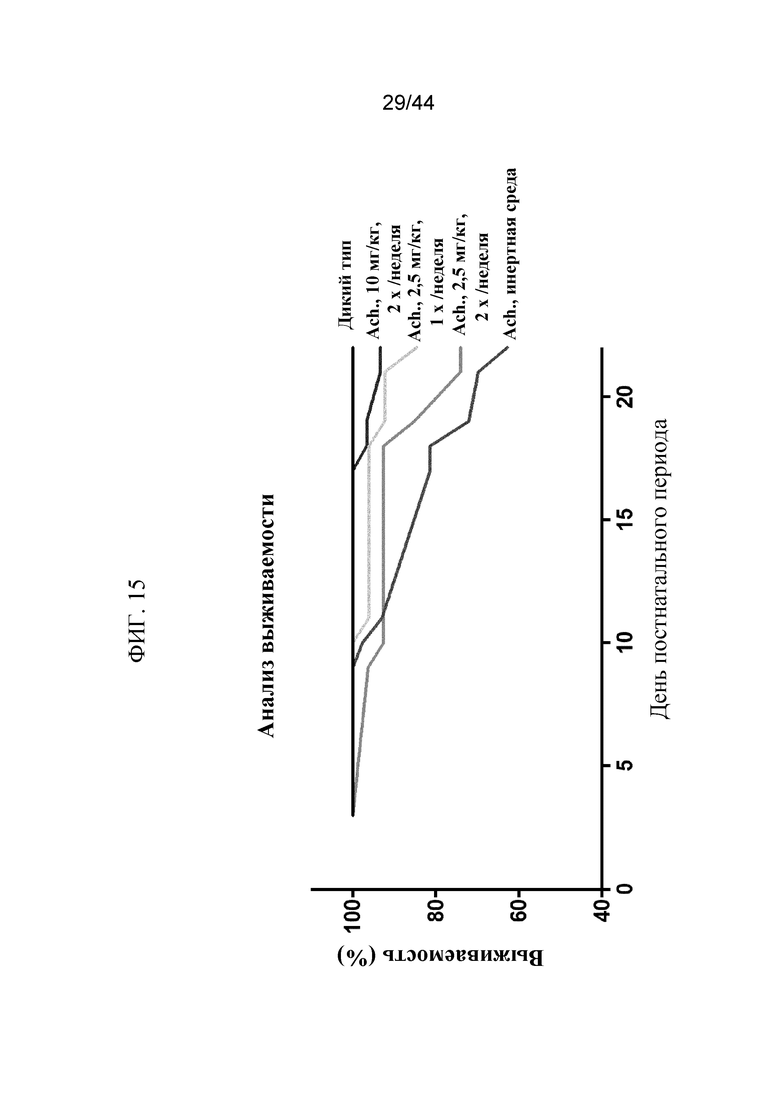
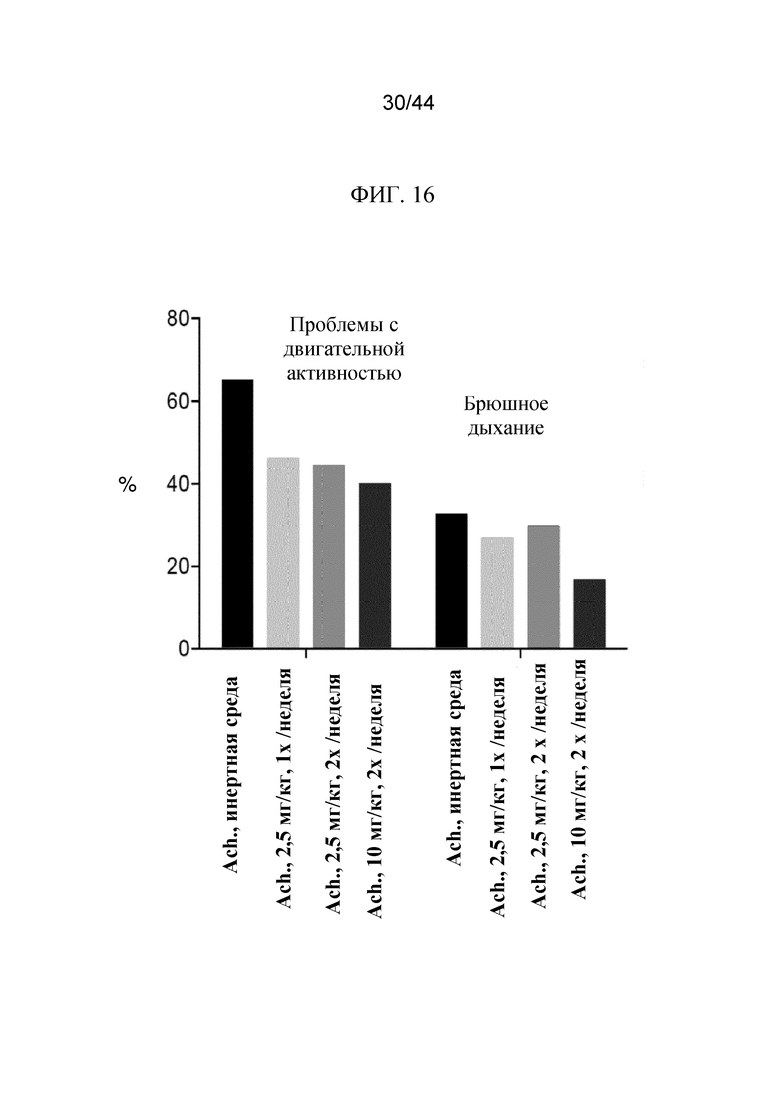
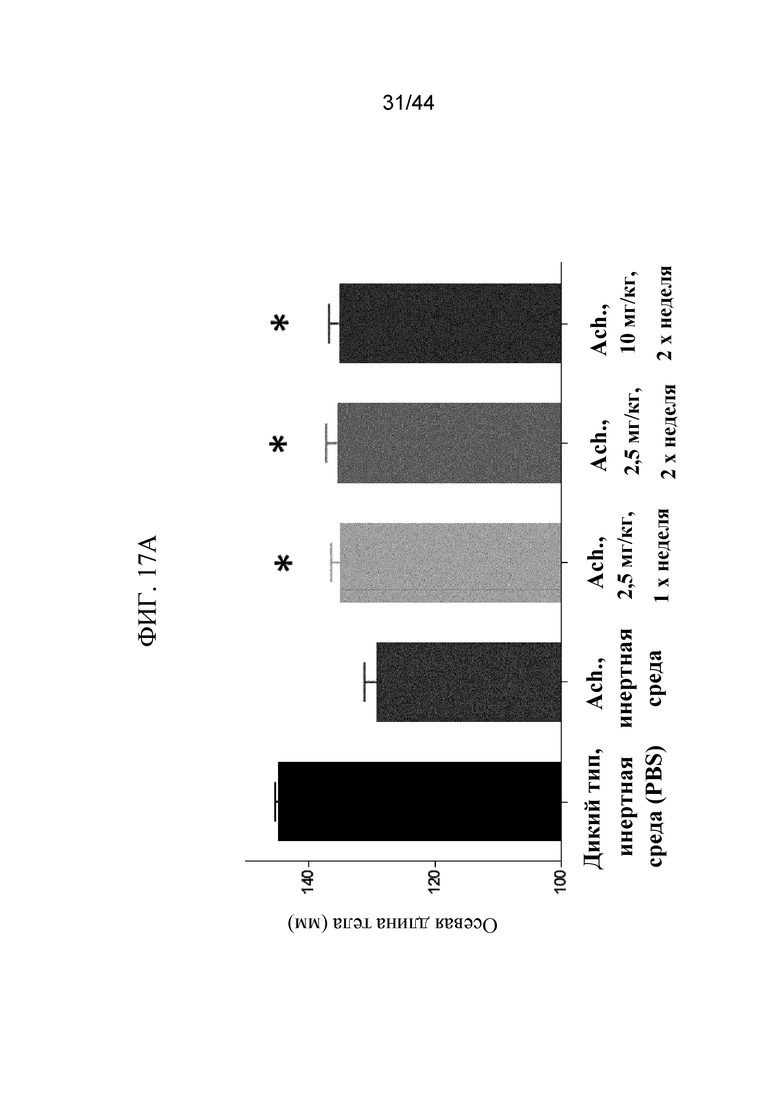
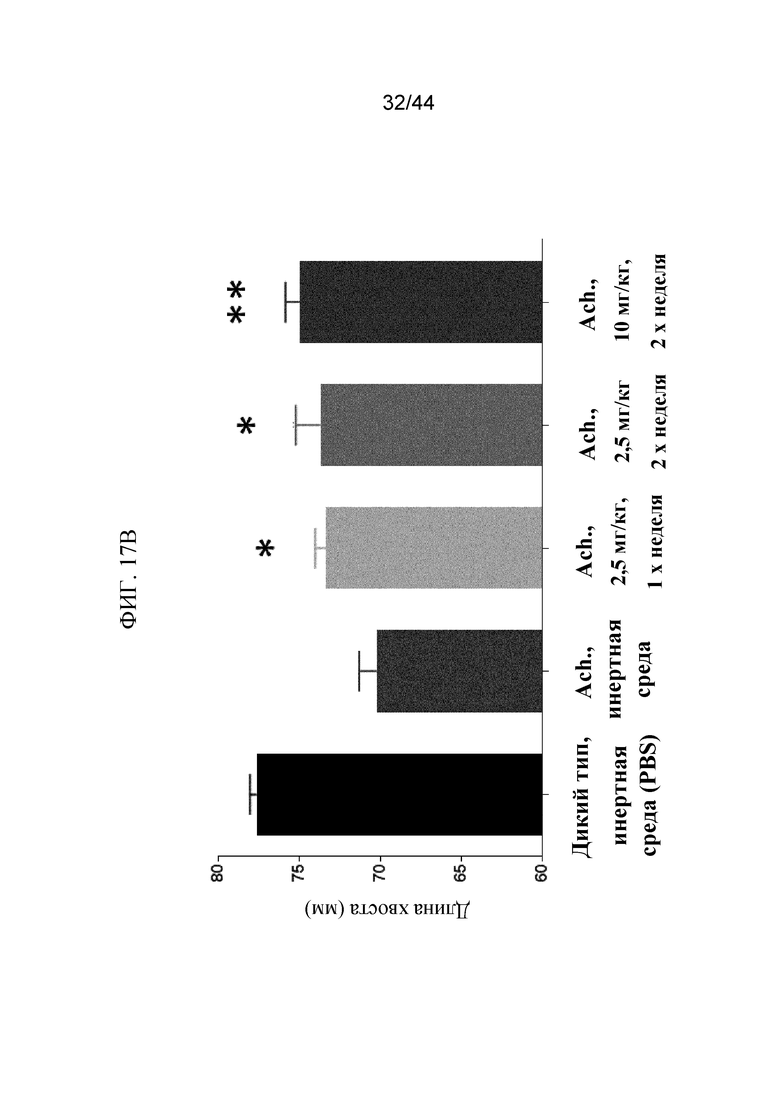
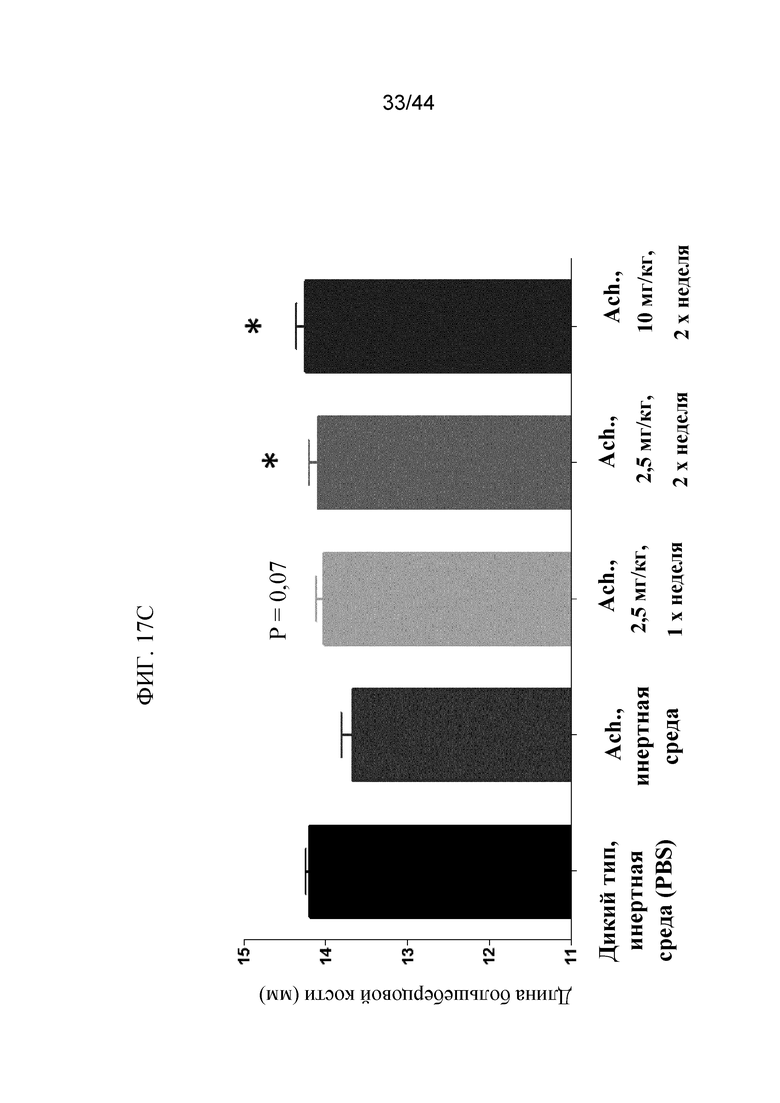
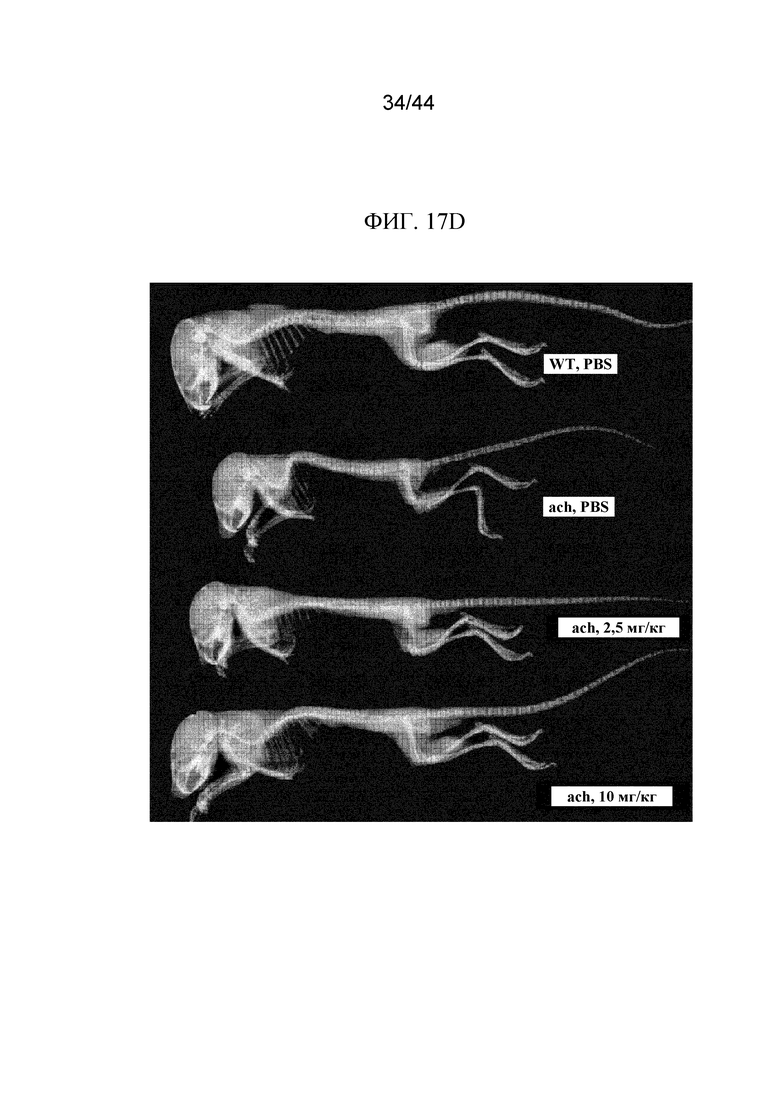
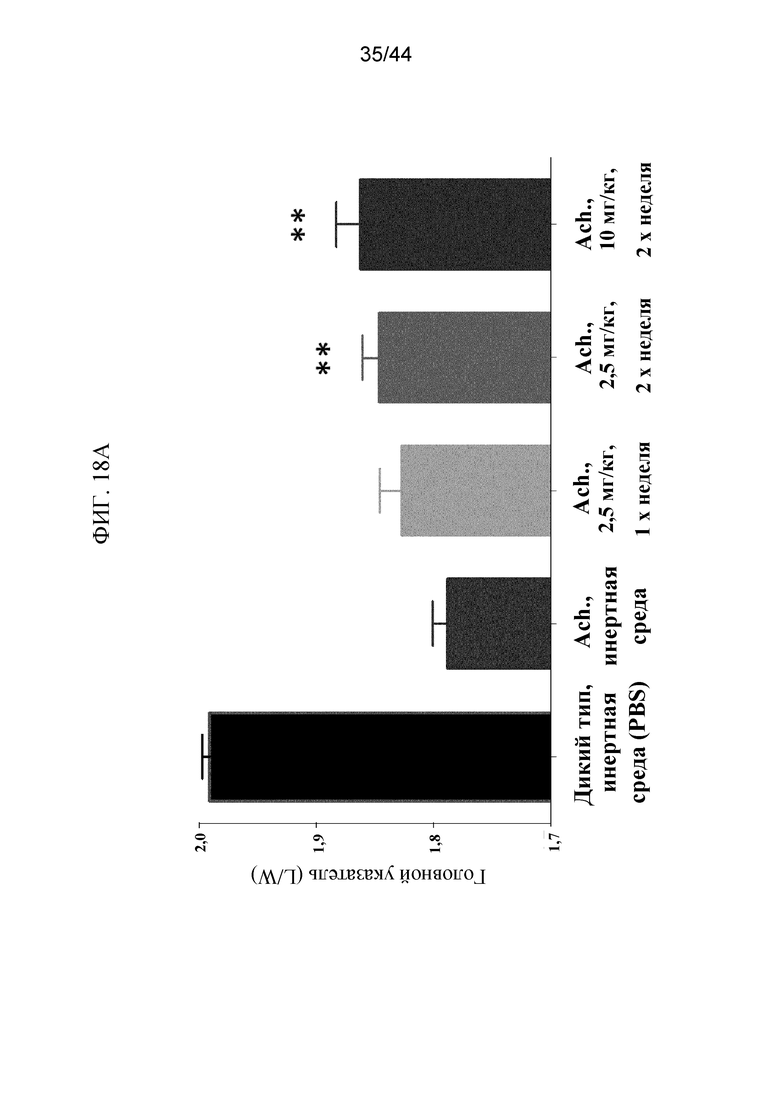
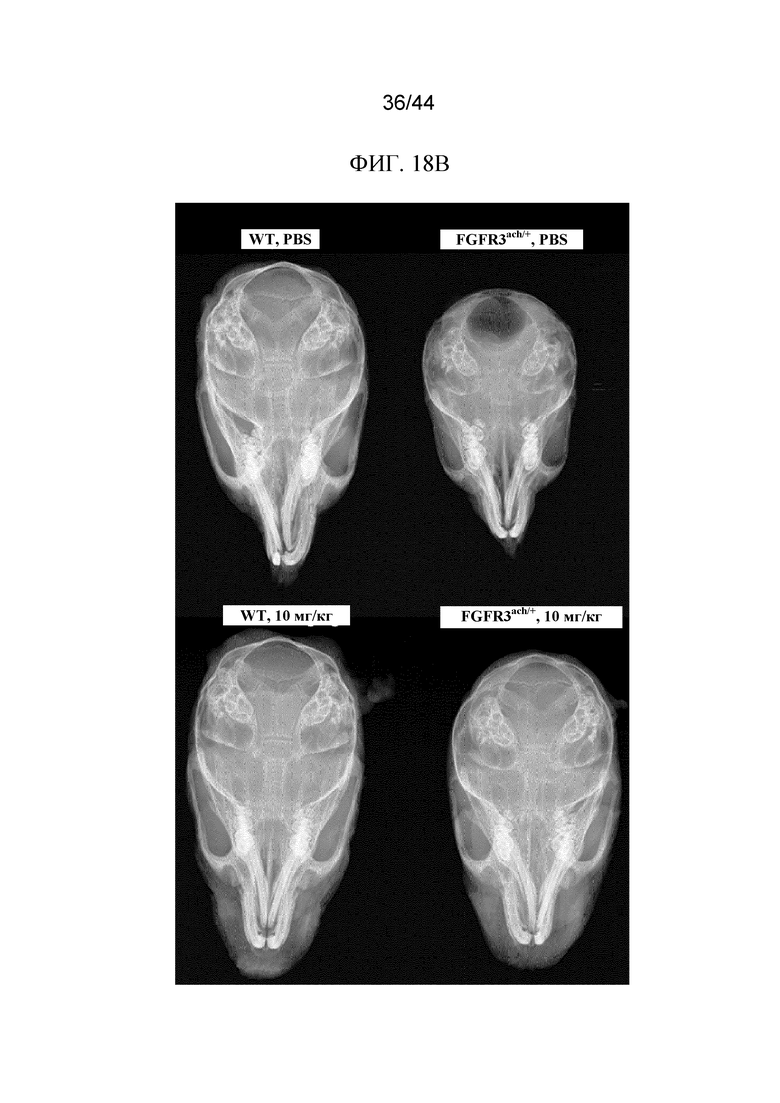
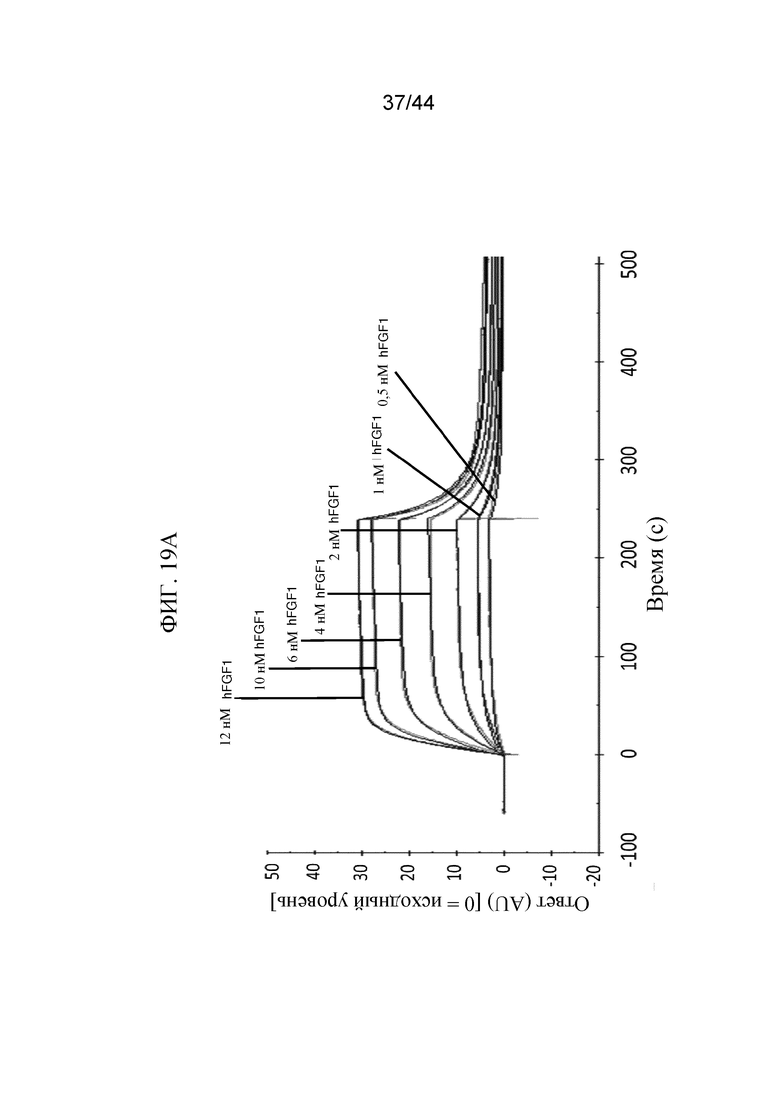
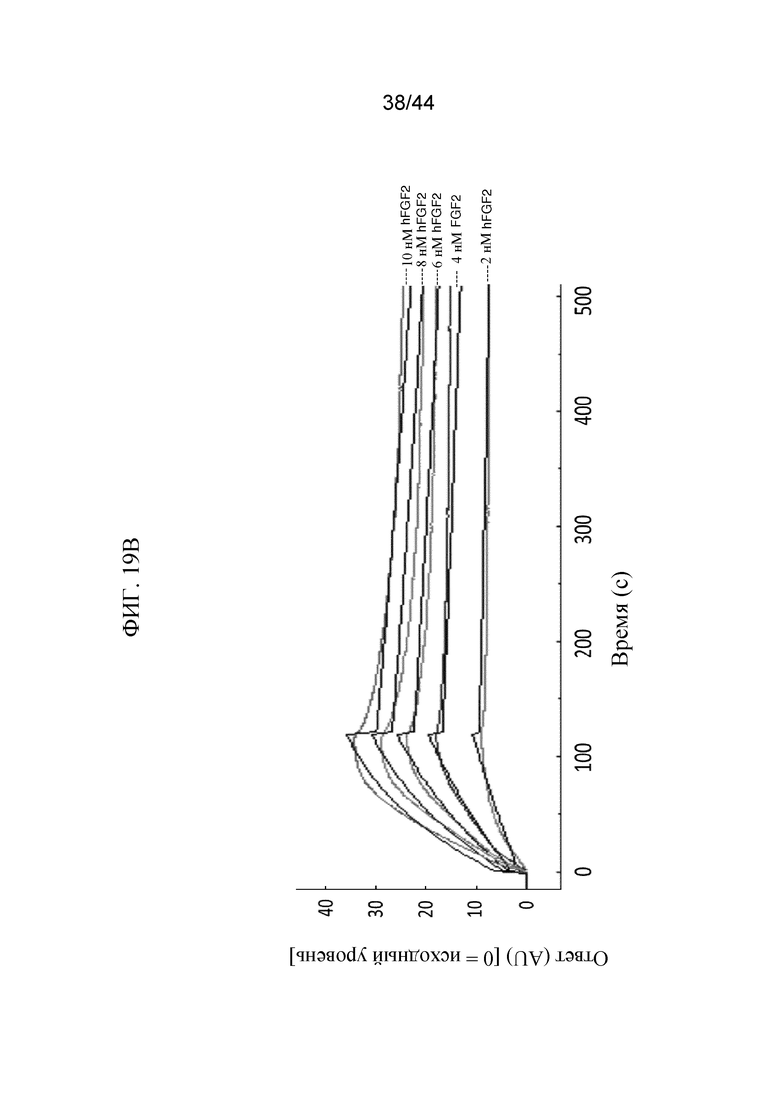
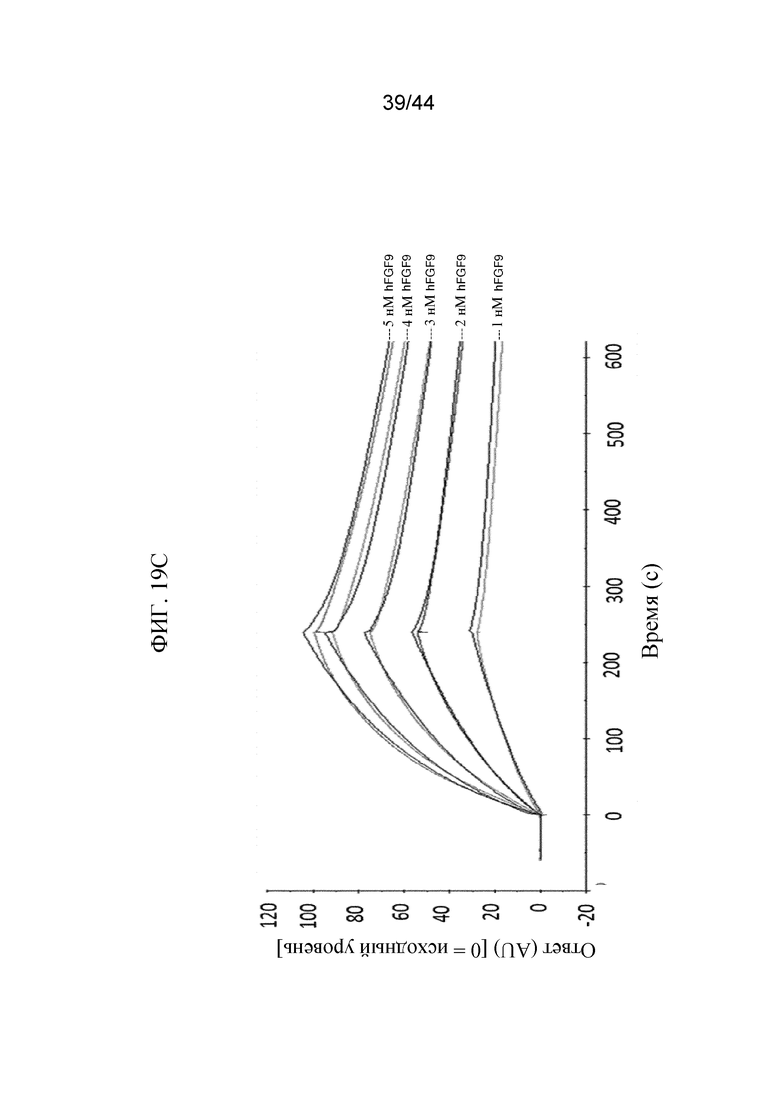
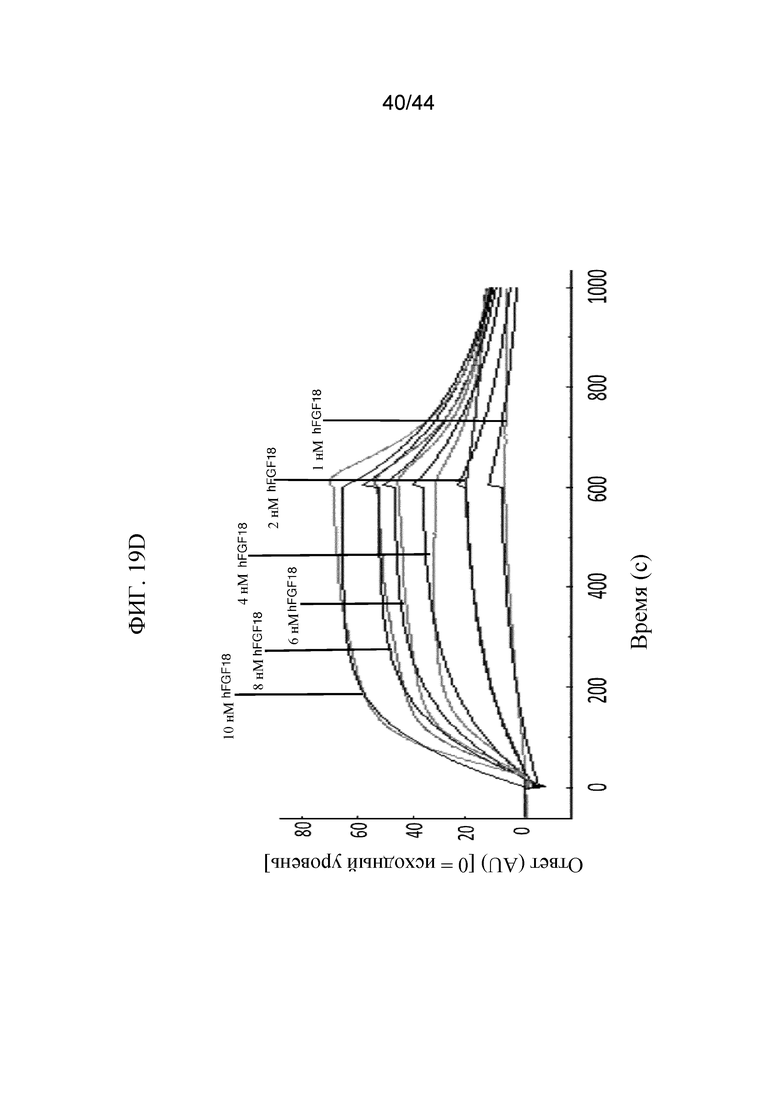
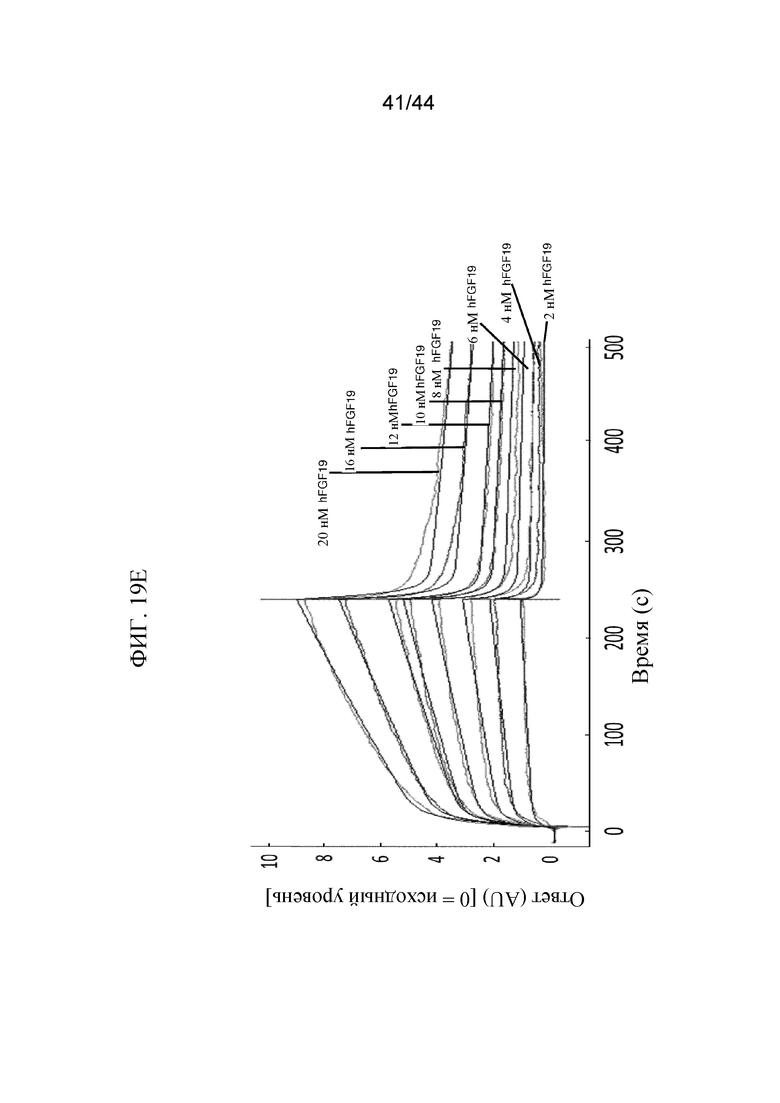
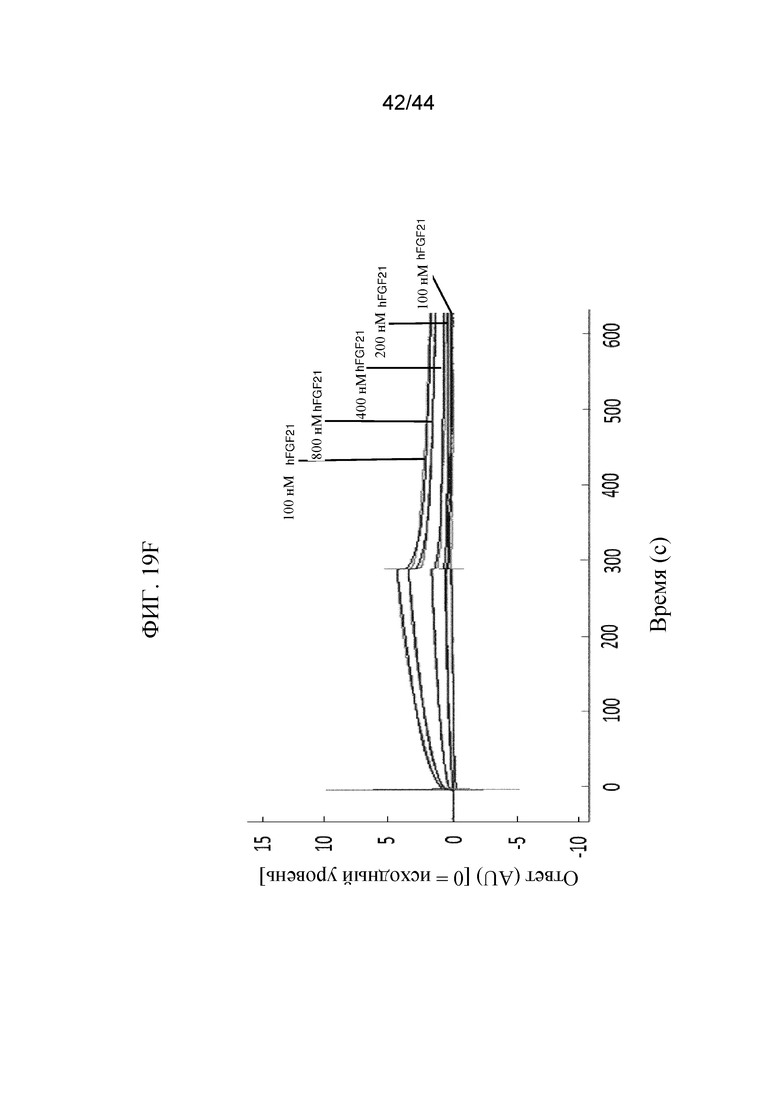
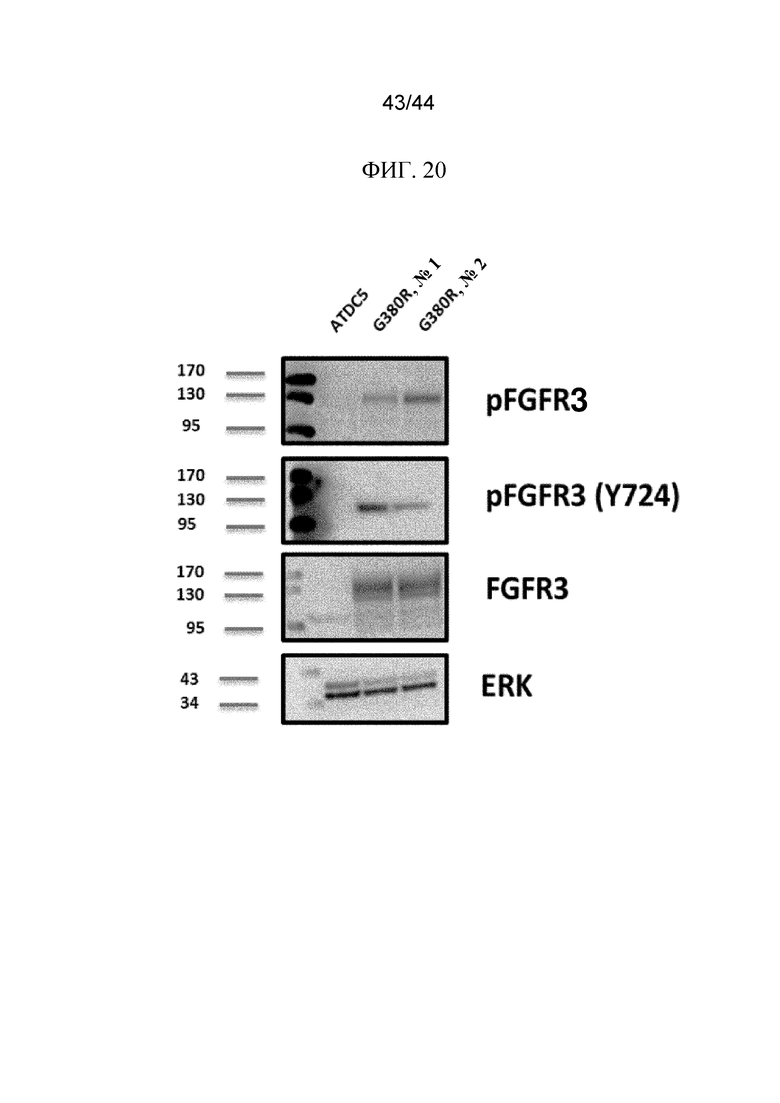
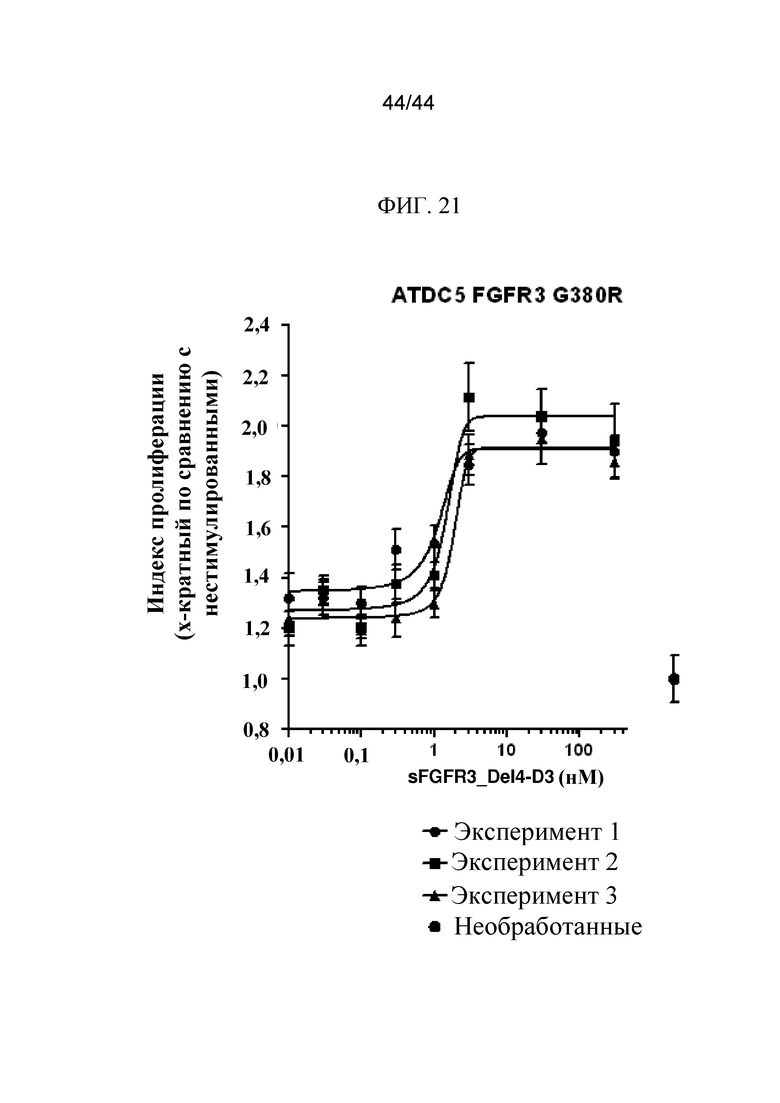
Настоящее изобретение относится к области биотехнологии, в частности к способному связываться с фактором роста фибробластов (FGF) полипептиду. Изобретение может быть применимо в медицинской практике для лечения ассоциированных с функцией sFGFR3 нарушений, в том числе и для терапии задержки роста скелета у субъекта. 11 н. и 31 з.п. ф-лы, 21 ил., 8 табл., 24 пр.
1. Полипептид, который связывается с фактором роста фибробластов (FGF), где полипептид имеет аминокислотную последовательность, содержащую SEQ ID NO: 33.
2. Полипептид по п. 1, где полипептид имеет аминокислотную последовательность, по существу состоящую из SEQ ID NO: 33.
3. Полипептид по любому из пп. 1, 2, где полипептид связывается с по меньшей мере одним из фактора роста фибробластов 1 (FGF1), фактора роста фибробластов 2 (FGF2), фактора роста фибробластов 9 (FGF9), фактора роста фибробластов 18 (FGF18), фактора роста фибробластов 19 (FGF19) или фактора роста фибробластов 21 (FGF21).
4. Полипептид по любому из пп. 1, 2, где полипептид связывается с фактором роста фибробластов 1 (FGF1), фактором роста фибробластов 2 (FGF2), фактором роста фибробластов 9 (FGF9) и фактором роста фибробластов 18 (FGF18).
5. Полипептид по любому из пп. 1-4, где полипептид является гликозилированным.
6. Полипептид по любому из пп. 1-5, где связывание характеризуется равновесной константой диссоциации (Kd) от приблизительно 0,2 нМ до приблизительно 20 нМ.
7. Полипептид любому из пп. 1-6, где связывание характеризуется Kd от приблизительно 1 нМ до приблизительно 10 нМ.
8. Композиция для лечения связанного с sFGFR3 нарушения в виде задержки роста скелета у субъекта, содержащая (i) терапевтически эффективное количество полипептида по любому из пп. 1-7 и (ii) фармацевтически приемлемый наполнитель.
9. Способ лечения связанного с sFGFR3 нарушения в виде задержки роста скелета у пациента, включающий введение субъекту полипептида по любому из пп. 1-7 или композиции по п. 8.
10. Способ по п. 9, где нарушение скелета, связанное с FGFR3, выбрано из группы, состоящей из ахондроплазии, танатофорной дисплазии I типа (TDI), танатофорной дисплазии II типа (TDII), тяжелой ахондроплазии с задержкой развития и черным акантозом (SADDEN), гипохондроплазии, синдромального краниосиностоза или синдрома камптодактилии, высокого роста и потери слуха (CATSHL).
11. Способ по п. 10, где нарушение в виде задержки роста скелета представляет собой ахондроплазию.
12. Способ по п. 10, где нарушение в виде задержки роста скелета представляет собой гипохондроплазию.
13. Способ по любому из пп. 9-12, где полипептид вводят пациенту в дозе от приблизительно 0,0002 мг/кг до приблизительно 30 мг/кг.
14. Способ по любому из пп. 9-12, где полипептид вводят пациенту в дозе от приблизительно 0,2 мг/кг до приблизительно 3 мг/кг.
15. Способ по любому из пп. 9-14, где введение полипептида или композиции:
a) повышает выживаемость субъекта;
b) улучшает двигательную активность субъекта;
c) улучшает брюшное дыхание у субъекта;
d) увеличивает длину тела и/или костей субъекта; или
e) улучшает головной указатель субъекта и/или восстанавливает форму большого затылочного отверстия у субъекта.
16. Способ по любому из пп. 9-14, где полипептид или композицию вводят пациенту подкожно.
17. Способ по любому из пп. 9-15, где полипептид или композицию вводят пациенту внутривенно.
18. Применение полипептида по любому из пп. 1-7 или композиции по п. 8 при лечении связанного с sFGFR3 нарушения в виде задержки роста скелета у пациента.
19. Применение по п. 18, где нарушение скелета, связанное с FGFR3, выбрано из группы, состоящей из ахондроплазии, танатофорной дисплазии I типа (TDI), танатофорной дисплазии II типа (TDII), тяжелой ахондроплазии с задержкой развития и черным акантозом (SADDEN), гипохондроплазии, синдромального краниосиностоза или синдрома камптодактилии, высокого роста и потери слуха (CATSHL).
20. Применение по п. 19, где нарушение в виде задержки роста скелета представляет собой ахондроплазию.
21. Применение по п. 19, где нарушение в виде задержки роста скелета представляет собой гипохондроплазию.
22. Применение по любому из пп. 18-21, где полипептид или композиция улучшает один или более симптомов у субъекта.
23. Применение по любому из пп. 18-22, где полипептид вводят пациенту в дозе от приблизительно 0,0002 мг/кг до приблизительно 30 мг/кг.
24. Применение по любому из пп. 18-22, где полипептид вводят пациенту в дозе от приблизительно 0,2 мг/кг до приблизительно 3 мг/кг.
25. Применение по любому из пп. 18-24, где введение полипептида или композиции:
a) повышает выживаемость субъекта;
b) улучшает двигательную активность субъекта;
c) улучшает брюшное дыхание у субъекта;
d) увеличивает длину тела и/или костей субъекта; или
e) улучшает головной указатель субъекта и/или восстанавливает форму большого затылочного отверстия у субъекта.
26. Применение по любому из пп. 18-25, где полипептид или композицию вводят пациенту подкожно.
27. Применение по любому из пп. 18-25, где полипептид или композицию вводят пациенту внутривенно.
28. Полипептид для применения при получении лекарственного средства для применения при лечении ахондроплазии у субъекта, являющегося человеком, где полипептид содержит аминокислотную последовательность SEQ ID NO: 33.
29. Полипептид для применения при получении лекарственного средства для применения при лечении гипохондроплазии у субъекта, являющегося человеком, где полипептид содержит аминокислотную последовательность SEQ ID NO: 33.
30. Способ получения полипептида, имеющего аминокислотную последовательность SEQ ID NO: 33, при этом указанный способ включает:
(i) культивирование клетки-хозяина, содержащей полинуклеотид, кодирующий полипептид, имеющий аминокислотную последовательность SEQ ID NO: 33, в культуральной среде при условиях, подходящих для экспрессии полипептида; и
(ii) выделение указанного полипептида из культуральной среды.
31. Способ по п. 30, дополнительно содержащий стадию (iii) очистки полипептида с помощью ионообменной хроматографии и эксклюзионной хроматографии.
32. Способ по п. 30 или 31, где клетка-хозяин представляет собой клетку HEK 293.
33. Способ по п. 30 или 31, где клетка-хозяин представляет собой клетку CHO.
34. Способ по любому из пп. 30-33, где полипептид имеет менее чем приблизительно 2% агрегацию.
35. Способ по любому из пп. 30-34, где при стадии выделения достигается концентрация полипептида sFGFR3 от приблизительно 0,9 г/л до приблизительно 1,1 г/л.
36. Молекула нуклеиновой кислоты для получения полипептида по любому из пп. 1-7, где указанная молекула кодирует полипептид по любому из пп. 1-7.
37. Молекула нуклеиновой кислоты по п. 36, где молекула нуклеиновой кислоты содержит нуклеотиды 52-1098 последовательности SEQ ID NO: 21.
38. Молекула нуклеиновой кислоты по п. 36, где молекула нуклеиновой кислоты содержит нуклеотиды 58-1107 последовательности SEQ ID NO: 37.
39. Вектор экспрессии, содержащий молекулу нуклеиновой кислоты по любому из пп. 36-38.
40. Вектор экспрессии по п. 39, где вектор представляет собой плазмиду, искусственную хромосому, вирусный вектор или фаговый вектор.
41. Клетка-хозяин для экспрессии полипептида sFGFR3 по любому из пп. 1-7, содержащая вектор экспрессии по п. 39 или 40.
42. Полипептид, который связывается с фактором роста фибробластов (FGF), где полипептид имеет аминокислотную последовательность, содержащую SEQ ID NO: 2.
| WO 2010017198 A2, 11.02.2010 | |||
| WO 2011084711 A2, 14.06.2011 | |||
| WO 2014111467 A1, 24.07.2014 | |||
| GARCIA S | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Sci | |||
| Transl | |||
| Med., 2013, v.5, p.203ra124 | |||
| DAVIDSON D | |||
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
Авторы
Даты
2021-07-14—Публикация
2017-07-07—Подача