ПЕРЕКРЕСТНАЯ ССЫЛКА
[0001] В данной заявке испрашивается приоритет по предварительной заявке США № 62/778014, поданной 11 декабря 2018 г., которая полностью включена в данный документ посредством ссылки.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0002] Данная заявка содержит перечень последовательностей, который был подан в электронной форме в формате ASCII и в полном объеме включен в данный документ посредством ссылки. Указанная копия ASCII, созданная 11 декабря 2019 г., называется 53542_707_601_SL.txt и имеет размер 950242 байта.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0003] В одном варианте осуществления в данном документе предложена конструкция мономерного слитого белка, которая связывает антиген, ассоциированный с комплементом; при этом конструкция мономерного слитого белка, содержащая: первый полипептид, содержащий: домен A и домен B, расположенные от N-конца к C-концу в ориентации A-B, второй полипептид, содержащий: домен E и домен F, расположенные от N-конца к С-концу в ориентации E-F, где по меньшей мере один из домена A, домена B, домена E или домена F может быть конъюгирован с доменом R, и где: домен A может включать аминокислотную последовательность вариабельной области тяжелой цепи (VH), или его антигенсвязывающий фрагмент, домен В включает аминокислотную последовательность константной области тяжелой цепи CH1, домен R включает полипептид модулятора комплемента, домен E может включать аминокислотную последовательность вариабельной области легкой цепи (VL), или его антигенсвязывающий фрагмент, и домен F может включать аминокислотную последовательность константной области легкой цепи (CL1), где домен B первого полипептида и домен F второго полипептида связаны посредством одной или более дисульфидных связей.
[0004] В некоторых вариантах осуществления первый полипептид содержит домен A, домен B и домен R, где домены первого полипептида могут быть расположены от N-конца к C-концу в ориентации R-A-B, и где домен R и домен A конъюгированы. В некоторых вариантах осуществления первый полипептид содержит домен A, домен B и домен R, где домены первого полипептида расположены от N-конца к C-концу в ориентации A-B-R, и где домен B и домен R могут быть конъюгированы. В некоторых вариантах осуществления второй полипептид содержит домен E, домен F и домен R, где домены второго полипептида расположены от N-конца к C-концу в ориентации R-E-F, и где домен E и домен R могут быть конъюгированы. В некоторых вариантах осуществления второй полипептид содержит домен E, домен F и домен R, где домены второго полипептида расположены от N-конца к C-концу в ориентации E-F-R, и где домен F и домен R могут быть конъюгированы. В некоторых вариантах осуществления конструкция мономерного слитого белка дополнительно содержит второй полипептид модулятора комплемента, причем второй полипептид модулятора комплемента и домен R являются одинаковыми или разными.
[0005] Один вариант осуществления обеспечивает конструкцию слитого белка, которая связывает ассоциированный с комплементом антиген, при этом конструкция слитого белка может включать: первый полипептид и второй полипептид, где первый полипептид содержит домен A, домен B, домен R, шарнирную область, домен C и домен D, где домены A, B, шарнирная область, C и D первого полипептида расположены от N-конца к C-концу в ориентации A-B-шарнирная область-C-D, где домен A может включать аминокислотную последовательность вариабельной области тяжелой цепи (VH), или его антигенсвязывающий фрагмент, домен B может включать аминокислотную последовательность константной области тяжелой цепи CH1, домен C может включать аминокислотную последовательность константной области тяжелой цепи CH2, домен D может включать аминокислотную последовательность константной области тяжелой цепи CH3, а домен R может включать полипептид модулятора комплемента, и где (1) домен A и домен R могут быть конъюгированы, или (2) домен D и домен R могут быть конъюгированы; второй полипептид может включать домен E и домен F, где домены E и F второго полипептида расположены от N-конца к C-концу в ориентации E-F, где (i) домен E может включать аминокислотную последовательность вариабельной области легкой цепи (VL), или его антигенсвязывающий фрагмент, и (ii) домен F может включать аминокислотную последовательность константной области легкой цепи (CL1), и где домен B первого полипептида и домен F второго полипептида связаны посредством одной или более дисульфидных связей .
[0006] В некоторых вариантах осуществления конструкция слитого белка может представлять собой конструкцию четырехвалентного гомодимерного слитого белка, содержащую два первых полипептида и два вторых полипептида, где домен D и домен R могут быть конъюгированы по меньшей мере с одним из первых полипептидов, и где два первых полипептида связаны друг с другом посредством одной или более дисульфидных связей в шарнирной области. В некоторых вариантах осуществления конструкция слитого белка может представлять собой конструкцию четырехвалентного гомодимерного слитого белка, содержащую два первых полипептида и два вторых полипептида, где домен A и домен R могут быть конъюгированы по меньшей мере с одним из первых полипептидов, и где два первых полипептида связаны друг с другом посредством одной или более дисульфидных связей в шарнирной области. В некоторых вариантах осуществления конструкция слитого белка может дополнительно содержать домен R1, где домен R1 может включать второй полипептид модулятора комплемента, и где домен R1 и домен R могут быть одинаковыми или разными.
[0007] В некоторых вариантах осуществления домен A и домен R могут быть конъюгированы, и домен D и домен R1 могут быть конъюгированы. В некоторых вариантах осуществления домен D и домен R могут быть конъюгированы, а домен A и домен R1 могут быть конъюгированы. В некоторых вариантах осуществления конструкция слитого белка может представлять собой конструкцию четырехвалентного гетеродимерного слитого белка, содержащую c) третий полипептид, который содержит: (i) домен A, домен B, шарнирную область, домен C и домен D, (ii) домен A, домен B, шарнирную область и домен C, или (iii) домен A, домен B и шарнирную область, где домены A, B, шарнирная область, C и D третьего полипептида расположены от N-конца к C-концу в ориентации A-B-шарнирная область-C-D; и d) четвертый полипептид, который содержит: домен E и домен F, где домены E и F четвертого полипептида расположены от N-конца к C-концу в ориентации E-F, причем домен B третьего полипептида полипептид и домен F четвертого полипептида связаны посредством одной или более дисульфидных связей, и при этом первый и третий полипептиды связаны вместе посредством одной или более дисульфидных связей в шарнирной области. В некоторых вариантах осуществления домен D и домен R могут быть конъюгированы в первом полипептиде. В некоторых вариантах осуществления домен A и домен R могут быть конъюгированы в первом полипептиде.
[0008] В некоторых вариантах осуществления конструкция слитого белка может дополнительно содержать домен R1, где домен R1 включает второй полипептид модулятора комплемента, и где домен R1 и домен R могут быть одинаковыми или разными. В некоторых вариантах осуществления домен R1 может быть конъюгирован с первым полипептидом. В некоторых вариантах осуществления домен R1 может быть конъюгирован со вторым полипептидом. В некоторых вариантах осуществления домен R1 конъюгирован с третьим полипептидом. В некоторых вариантах осуществления домен R1 конъюгирован с четвертым полипептидом.
[0009] Другой вариант осуществления обеспечивает конструкцию слитого белка, которая связывает антиген, ассоциированный с комплементом, конструкция слитого белка содержит: первый полипептид и второй полипептид, где первый полипептид содержит: домен A, домен B, домен R, шарнирную область и домен C, где домены A, B, шарнирная область и C первого полипептида могут быть расположены от N-конца к C-концу в ориентации A-B-шарнирная область-C, где домен А включает аминокислотную последовательность вариабельной области тяжелой цепи (VH), или его антигенсвязывающий фрагмент, домен В включает аминокислотную последовательность константной области тяжелой цепи CH1, домен С включает аминокислотную последовательность константной области тяжелой цепи CH2, а домен R включает полипептид модулятора комплемента, и где (1) домен A и домен R могут быть конъюгированы, или (2) домен C и домен R могут быть конъюгированы; второй полипептид содержит домен E и домен F, где домены E и F могут быть расположены от N-конца к C-концу в ориентации E-F, где (i) домен E включает аминокислотную последовательность вариабельной области легкой цепи (VL), или его антигенсвязывающий фрагмент, и (ii) домен F включает аминокислотную последовательность константной области легкой цепи (CL1), и где домен B первого полипептида и домен F второго полипептида могут быть связаны посредством одной или более дисульфидных связей.
[0010] В некоторых вариантах осуществления конструкция слитого белка представляет собой конструкцию четырехвалентного гомодимерного слитого белка, содержащую два первых полипептида и два вторых полипептида, где домен C и домен R могут быть конъюгированы по меньшей мере с одним из первых полипептидов, и где два первых полипептида могут быть связаны друг с другом посредством одной или более дисульфидных связей в шарнирной области. В некоторых вариантах осуществления конструкция слитого белка представляет собой конструкцию четырехвалентного гомодимерного слитого белка, содержащую два первых полипептида и два вторых полипептида, где домен A и домен R могут быть конъюгированы по меньшей мере с одним из первых полипептидов, и где два первых полипептида могут быть связаны друг с другом посредством одной или более дисульфидных связей в шарнирной области. В некоторых вариантах осуществления конструкция слитого белка дополнительно содержит домен R1, где домен R1 может включать второй полипептид модулятора комплемента, и где домен R1 и домен R могут быть одинаковыми или разными. В некоторых вариантах осуществления домен A и домен R могут быть конъюгированы, и домен C и домен R1 могут быть конъюгированы. В некоторых вариантах осуществления домен C и домен R могут быть конъюгированы, и домен A и домен R1 могут быть конъюгированы.
[0011] В некоторых вариантах осуществления конструкция слитого белка представляет собой конструкцию четырехвалентного гетеродимерного слитого белка, содержащую c) третий полипептид, который содержит: (i) домен A, домен B, шарнирную область, домен C и домен D, (ii) домен A, домен B, шарнирную область и домен C, или (iii) домен A, домен B и шарнирную область, где домены A, B, шарнирная область, домены C и D третьего полипептида могут быть расположены от N-конца к C-концу в ориентации A-B-шарнирная область -C-D; и d) четвертый полипептид, который содержит: домен E и домен F, где домены E и F четвертого полипептида могут быть расположены от N-конца к C-концу в ориентации E-F, где домен B третьего полипептида и домен F четвертого полипептида могут быть связаны посредством одной или более дисульфидных связей, и при этом первый и третий полипептиды могут быть связаны вместе посредством одной или более дисульфидных связей в шарнирной области.
[0012] В некоторых вариантах осуществления домен C и домен R могут быть конъюгированы в первом полипептиде. В некоторых вариантах осуществления домен A и домен R могут быть конъюгированы в первом полипептиде. В некоторых вариантах осуществления конструкция слитого белка дополнительно содержит домен R1, где домен R1 включает второй полипептид модулятора комплемента, и где домен R1 и домен R могут быть одинаковыми или разными. В некоторых вариантах осуществления домен R1 конъюгирован с первым полипептидом. В некоторых вариантах осуществления домен R1 конъюгирован со вторым полипептидом. В некоторых вариантах осуществления домен R1 конъюгирован с третьим полипептидом. В некоторых вариантах осуществления домен R1 конъюгирован с четвертым полипептидом.
[0013] Еще один вариант осуществления обеспечивает конструкцию слитого белка, которая связывает антиген, ассоциированный с комплементом, причем слитый белок содержит: первый полипептид и второй полипептид, где первый полипептид содержит: домен A, домен B, домен R и шарнирную область, где домены A, B и шарнирная область первого полипептида могут быть расположены от N-конца к C-концу в ориентации A-B-шарнирная область, где домен А включает аминокислотную последовательность вариабельной области тяжелой цепи (VH), или его антигенсвязывающий фрагмент, домен В включает аминокислотную последовательность константной области тяжелой цепи CH1, домен R включает полипептид модулятора комплемента, и где (1) домен A и домен R могут быть конъюгированы, или (2) шарнирная область и домен R могут быть конъюгированы; второй полипептид содержит домен E и домен F, где домены E и F могут быть расположены от N-конца к C-концу в ориентации E-F, где домен E включает аминокислотную последовательность вариабельной области легкой цепи (VL), или его антигенсвязывающий фрагмент, и домен F включает аминокислотную последовательность константной области легкой цепи (CL1), и где домен B первого полипептида и домен F второго полипептида могут быть связаны посредством одной или более дисульфидных связей.
[0014] В некоторых вариантах осуществления конструкция слитого белка представляет собой конструкцию четырехвалентного гомодимерного слитого белка, содержащую два первых полипептида и два вторых полипептида, где домен A и домен R могут быть конъюгированы по меньшей мере с одним из первых полипептидов, и где два первых полипептида могут быть связаны друг с другом посредством одной или более дисульфидных связей в шарнирной области. В некоторых вариантах осуществления конструкция слитого белка представляет собой конструкцию четырехвалентного гомодимерного слитого белка, содержащую два первых полипептида и два вторых полипептида, где шарнирная область и домен R могут быть конъюгированы по меньшей мере с одним из первых полипептидов, и где два первых полипептида могут быть связаны друг с другом посредством одной или более дисульфидных связей в шарнирной области. В некоторых вариантах осуществления конструкция слитого белка дополнительно содержит домен R1, где домен R1 включает второй полипептид модулятора комплемента, и где домен R1 и домен R могут быть одинаковыми или разными. В некоторых вариантах осуществления домен A и домен R могут быть конъюгированы, и шарнирный домен и домен R1 могут быть конъюгированы. В некоторых вариантах осуществления шарнирный домен и домен R могут быть конъюгированы, и домен A и домен R1 могут быть конъюгированы. В некоторых вариантах осуществления конструкция слитого белка представляет собой конструкцию четырехвалентного гетеродимерного слитого белка, содержащую c) третий полипептид, который содержит: (i) домен A, домен B, шарнирную область, домен C и домен D, (ii) домен A, домен B, шарнирную область и домен C, или (iii) домен A, домен B и шарнирную область, где домены A, B, шарнирная область, C и D третьего полипептида могут быть расположены от N-конца к C-концу в ориентации A-B-шарнирная область-C-D; и d) четвертый полипептид, который содержит: домен E и домен F, где домены E и F четвертого полипептида могут быть расположены от N-конца к C-концу в ориентации E-F, где домен B третьего полипептида и домен F четвертого полипептида могут быть связаны посредством одной или более дисульфидных связей, и при этом первый и третий полипептиды могут быть связаны вместе посредством одной или более дисульфидных связей в шарнирной области.
[0015] В некоторых вариантах осуществления шарнирный домен и домен R могут быть конъюгированы в первом полипептиде. В некоторых вариантах осуществления домен A и домен R могут быть конъюгированы в первом полипептиде. В некоторых вариантах осуществления конструкция слитого белка дополнительно содержит домен R1, где домен R1 включает второй полипептид модулятора комплемента, и где домен R1 и домен R могут быть одинаковыми или разными. В некоторых вариантах осуществления домен R1 конъюгирован с первым полипептидом. В некоторых вариантах осуществления домен R1 конъюгирован со вторым полипептидом. В некоторых вариантах осуществления домен R1 конъюгирован с третьим полипептидом. В некоторых вариантах осуществления домен R1 конъюгирован с четвертым полипептидом.
[0016] Другой вариант осуществления обеспечивает конструкцию трехвалентного гетеродимерного слитого белка, которая связывает антиген, ассоциированный с комплементом, при этом конструкция трехвалентного гетеродимерного слитого белка содержит: первый полипептид, второй полипептид, третий полипептид и четвертый полипептид, причем первый полипептид содержит: домен A, домен B, шарнирную область, домен C, домен D и домен R, где домены A, B, шарнирная область, C и D первого полипептида могут быть расположены от N-конца к C-концу в ориентации A-B-шарнирная область-C-D, и где (1) домен A и домен R могут быть конъюгированы, или (2) домен D и домен R могут быть конъюгированы; второй полипептид содержит: домен E и домен F, где домены E и F второго полипептида могут быть расположены от N-конца к C-концу в ориентации E-F; третий полипептид содержит: (i) домен A, домен B, шарнирную область, домен C и домен D, (ii) домен A, домен B, шарнирную область и домен C, или (iii) домен A, домен B и шарнирную область, где домены A, B, шарнирная область, C и D третьего полипептида могут быть расположены от N-конца к C-концу в ориентации A-B-шарнирная область-C-D; четвертый полипептид содержит: домен E и домен F, где домены E и F четвертого полипептида могут быть расположены от N-конца к C-концу в ориентации E-F; где домен B первого полипептида и домен F второго полипептида могут быть связаны посредством одной или более дисульфидных связей, и где домен B третьего полипептида и домен F четвертого полипептида могут быть связаны посредством одной или более дисульфидных связей, где первый и третий полипептиды могут быть связаны друг с другом посредством одной или более дисульфидных связей в шарнирной области, и где домен А включает аминокислотную последовательность вариабельной области тяжелой цепи (VH), или его антигенсвязывающий фрагмент, домен В включает аминокислотную последовательность константной области тяжелой цепи CH1, домен R включает полипептид модулятора комплемента, домен С включает аминокислотную последовательность константной области тяжелой цепи CH2, домен D включает аминокислотную последовательность константной области тяжелой цепи CH3, домен E включает аминокислотную последовательность вариабельной области легкой цепи (VL), или его антигенсвязывающий фрагмент, и домен F включает аминокислотную последовательность константной области легкой цепи (CL1).
[0017] В некоторых вариантах осуществления домен A и домен R первого полипептида могут быть конъюгированы. В некоторых вариантах осуществления домен D и домен R первого полипептида могут быть конъюгированы.
[0018] Еще один вариант осуществления обеспечивает конструкцию трехвалентного гетеродимерного слитого белка, которая связывает антиген, ассоциированный с комплементом, при этом конструкция трехвалентного гетеродимерного слитого белка содержит: первый полипептид, второй полипептид, третий полипептид и четвертый полипептид, где первый полипептид содержит: домен A, домен B, шарнирную область, домен C и домен R, где домены A, B, шарнирная область и C первого полипептида могут быть расположены от N-конца к C-концу в ориентации A-B-шарнирная область-C, и при этом (1) домен A и домен R могут быть конъюгированы, или (2) домен C и домен R могут быть конъюгированы; второй полипептид содержит: домен E и домен F, где домены E и F второго полипептида могут быть расположены от N-конца к C-концу в ориентации E-F; третий полипептид содержит: (i) домен A, домен B, шарнирную область, домен C и домен D, (ii) домен A, домен B, шарнирную область и домен C, или (iii) домен A, домен B и шарнирную область, где домены A, B, шарнирная область, домены C и D третьего полипептида могут быть расположены от N-конца к C-концу в ориентации A-B-шарнирная область-C-D; четвертый полипептид содержит: домен E и домен F, где домены E и F четвертого полипептида могут быть расположены от N-конца к C-концу в ориентации E-F; где домен B первого полипептида и домен F второго полипептида могут быть связаны посредством одной или более дисульфидных связей, и где домен B третьего полипептида и домен F четвертого полипептида могут быть связаны посредством одной или более дисульфидных связей, где первый и третий полипептиды могут быть связаны друг с другом посредством одной или более дисульфидных связей в шарнирной области, и где домен А включает аминокислотную последовательность вариабельной области тяжелой цепи (VH), или его антигенсвязывающий фрагмент, домен В включает аминокислотную последовательность константной области тяжелой цепи CH1, домен R включает полипептид модулятора комплемента, домен С включает аминокислотную последовательность константной области тяжелой цепи CH2, домен E включает аминокислотную последовательность вариабельной области легкой цепи (VL), или его антигенсвязывающий фрагмент, и домен F включает аминокислотную последовательность константной области легкой цепи (CL1).
[0019] В некоторых вариантах осуществления домен A и домен R первого полипептида могут быть конъюгированы. В некоторых вариантах осуществления домен C и домен R первого полипептида могут быть конъюгированы.
[0020] Еще один вариант осуществления обеспечивает конструкцию трехвалентного гетеродимерного слитого белка, которая связывает антиген, ассоциированный с комплементом, при этом конструкция трехвалентного гетеродимерного слитого белка содержит первый полипептид, второй полипептид, третий полипептид и четвертый полипептид, где первый полипептид содержит: домен A, домен B, шарнирную область и домен R, где домены A, B и шарнирная область первого полипептида могут быть расположены от N-конца к C-концу в ориентации A-B-шарнирная область, и где (1) домен A и домен R могут быть конъюгированы или (2) шарнирная область и домен R могут быть конъюгированы; второй полипептид содержит: домен E и домен F, где домены E и F второго полипептида могут быть расположены от N-конца к C-концу в ориентации E-F; третий полипептид содержит: (i) домен A, домен B, шарнирную область, домен C и домен D, (ii) домен A, домен B, шарнирную область и домен C, или (iii) домен A, домен B и шарнирную область, где домены A, B, шарнирная область, домены C и D третьего полипептида могут быть расположены от N-конца к C-концу в ориентации A-B-шарнирная область-C-D; четвертый полипептид содержит: домен E и домен F, где домены E и F четвертого полипептида могут быть расположены от N-конца к C-концу в ориентации E-F; где домен B первого полипептида и домен F второго полипептида могут быть связаны посредством одной или более дисульфидных связей, и где домен B третьего полипептида и домен F четвертого полипептида могут быть связаны посредством одной или более дисульфидных связей, где первый и третий полипептиды могут быть связаны друг с другом посредством одной или более дисульфидных связей в шарнирной области, и где домен А включает аминокислотную последовательность вариабельной области тяжелой цепи (VH), или его антигенсвязывающий фрагмент, домен В включает аминокислотную последовательность константной области тяжелой цепи CH1, домен R включает полипептид модулятора комплемента, домен E включает аминокислотную последовательность вариабельной области легкой цепи (VL), или его антигенсвязывающий фрагмент, а домен F включает аминокислотную последовательность константной области легкой цепи (CL1).
[0021] В некоторых вариантах осуществления домен A и домен R первого полипептида могут быть конъюгированы. В некоторых вариантах осуществления шарнирная область и домен R первого полипептида могут быть конъюгированы.
[0022] Еще один вариант осуществления обеспечивает конструкцию слитого белка, которая связывает антиген, ассоциированный с комплементом, при этом конструкция слитого белка содержит: первый полипептид и второй полипептид, где первый полипептид содержит: домен A, домен B, шарнирную область, домен C и домен D, где домены A, B, шарнирная область, C и D могут быть расположены от N-конца к C-концу в ориентации A-B-шарнирная область-C-D, где домен А включает аминокислотную последовательность вариабельной области тяжелой цепи (VH), или его антигенсвязывающий фрагмент, домен В включает аминокислотную последовательность константной области тяжелой цепи CH1, домен С включает аминокислотную последовательность константной области тяжелой цепи CH2, домен D включает аминокислотную последовательность константной области тяжелой цепи CH3; второй полипептид содержит: домен E, домен F и домен R, где домены E и F могут быть расположены от N-конца к C-концу в ориентации E-F, где (1) домен E и домен R могут быть конъюгированы, или (2) домен F и домен R могут быть конъюгированы, и где домен E включает аминокислотную последовательность вариабельной области легкой цепи (VL) или ее антигенсвязывающий фрагмент, а домен F включает аминокислотную последовательность константной области легкой цепи (CL1), и где домен B первого полипептида и домен F второго полипептида могут быть связаны посредством одной или более дисульфидных связей.
[0023] В некоторых вариантах осуществления конструкция слитого белка представляет собой конструкцию четырехвалентного гомодимерного слитого белка, содержащую два первых полипептида и два вторых полипептида, где домен E и домен R могут быть конъюгированы по меньшей мере с одним из вторых полипептидов, и где два первых полипептида могут быть связаны друг с другом посредством одной или более дисульфидных связей в шарнирной области. В некоторых вариантах осуществления конструкция слитого белка представляет собой конструкцию четырехвалентного гомодимерного слитого белка, содержащую два первых полипептида и два вторых полипептида, где домен F и домен R могут быть конъюгированы по меньшей мере с одним из вторых полипептидов, и где два первых полипептида могут быть связаны друг с другом посредством одной или более дисульфидных связей в шарнирной области. В некоторых вариантах осуществления конструкция слитого белка дополнительно содержит домен R1, где домен R1 включает второй полипептид модулятора комплемента, и где домен R1 и домен R могут быть одинаковыми или разными. В некоторых вариантах осуществления домен E и домен R могут быть конъюгированы, и домен F и домен R1 могут быть конъюгированы. В некоторых вариантах осуществления домен F и домен R могут быть конъюгированы, и домен E и домен R1 могут быть конъюгированы. В некоторых вариантах осуществления конструкция слитого белка представляет собой конструкцию четырехвалентного гетеродимерного слитого белка, содержащую c) третий полипептид, который содержит: (i) домен A, домен B, шарнирную область, домен C и домен D, (ii) домен A, домен B, шарнирную область и домен C, или (iii) домен A, домен B и шарнирную область, где домены A, B, шарнирная область, C и D третьего полипептида могут быть расположены от N-конца к C-концу в ориентации A-B-шарнирная область-C-D; и d) четвертый полипептид, который содержит: домен E и домен F, где домены E и F четвертого полипептида могут быть расположены от N-конца к C-концу в ориентации E-F, где домен B третьего полипептида и домен F четвертого полипептида могут быть связаны посредством одной или более дисульфидных связей, и при этом первый и третий полипептиды могут быть связаны вместе посредством одной или более дисульфидных связей в шарнирной области.
[0024] В некоторых вариантах осуществления домен E и домен R могут быть конъюгированы в первом полипептиде. В некоторых вариантах осуществления домен F и домен R могут быть конъюгированы в первом полипептиде. В некоторых вариантах осуществления конструкция слитого белка дополнительно содержит домен R1, где домен R1 включает второй полипептид модулятора комплемента, и где домен R1 и домен R могут быть одинаковыми или разными. В некоторых вариантах осуществления домен R1 конъюгирован с первым полипептидом. В некоторых вариантах осуществления домен R1 конъюгирован со вторым полипептидом. В некоторых вариантах осуществления домен R1 конъюгирован с третьим полипептидом. В некоторых вариантах осуществления домен R1 конъюгирован с четвертым полипептидом.
[0025] Еще один вариант осуществления обеспечивает конструкцию слитого белка, которая связывает антиген, ассоциированный с комплементом, при этом конструкция слитого белка содержит: первый полипептид и второй полипептид, где первый полипептид содержит: домен A, домен B, шарнирную область и домен C, где домены A, B, шарнирная область и C могут быть расположены от N-конца к C-концу в ориентации A-B-шарнирная область-C, где домен А включает аминокислотную последовательность вариабельной области тяжелой цепи (VH), или его антигенсвязывающий фрагмент, домен В включает аминокислотную последовательность константной области тяжелой цепи CH1, домен С включает аминокислотную последовательность константной области тяжелой цепи CH2; второй полипептид содержит: домен E, домен F и домен R, где домены E и F могут быть расположены от N-конца к C-концу в ориентации E-F, где (1) домен E и домен R могут быть конъюгированы, или (2) домен F и домен R могут быть конъюгированы, и где домен E включает аминокислотную последовательность вариабельной области легкой цепи (VL), или его антигенсвязывающий фрагмент, и домен F включает аминокислотную последовательность константной области легкой цепи (CL1), и где домен B первого полипептида и домен F второго полипептида могут быть связаны посредством одной или более дисульфидных связей.
[0026] В некоторых вариантах осуществления конструкция слитого белка представляет собой конструкцию четырехвалентного гомодимерного слитого белка, содержащую два первых полипептида и два вторых полипептида, где домен E и домен R могут быть конъюгированы по меньшей мере с одним из вторых полипептидов, и где два первых полипептида могут быть связаны друг с другом посредством одной или более дисульфидных связей в шарнирной области. В некоторых вариантах осуществления конструкция слитого белка представляет собой конструкцию четырехвалентного гомодимерного слитого белка, содержащую два первых полипептида и два вторых полипептида, где домен F и домен R могут быть конъюгированы по меньшей мере с одним из вторых полипептидов, и где два первых полипептида могут быть связаны друг с другом посредством одной или более дисульфидных связей в шарнирной области. В некоторых вариантах осуществления конструкция слитого белка дополнительно содержит домен R1, где домен R1 включает второй полипептид модулятора комплемента, и где домен R1 и домен R могут быть одинаковыми или разными. В некоторых вариантах осуществления домен E и домен R могут быть конъюгированы, и домен F и домен R1 могут быть конъюгированы. В некоторых вариантах осуществления домен F конструкции слитого белка и домен R могут быть конъюгированы, и домен E и домен R1 могут быть конъюгированы. В некоторых вариантах осуществления конструкция слитого белка представляет собой конструкцию четырехвалентного гетеродимерного слитого белка, содержащую c) третий полипептид, который содержит: (i) домен A, домен B, шарнирную область, домен C и домен D, (ii) домен A, домен B, шарнирную область и домен C, или (iii) домен A, домен B и шарнирную область, где домены A, B, шарнирная область, C и D третьего полипептида могут быть расположены от N-конца к C-концу в ориентации A-B-шарнирная область-C-D; и d) четвертый полипептид, который содержит: домен E и домен F, где домены E и F четвертого полипептида могут быть расположены от N-конца к C-концу в ориентации E-F, где домен B третьего полипептида и домен F четвертого полипептида могут быть связаны посредством одной или более дисульфидных связей, и при этом первый и третий полипептиды могут быть связаны вместе посредством одной или более дисульфидных связей в шарнирной области.
[0027] В некоторых вариантах осуществления домен E и домен R могут быть конъюгированы в первом полипептиде. В некоторых вариантах осуществления домен F и домен R могут быть конъюгированы в первом полипептиде. В некоторых вариантах осуществления конструкция слитого белка дополнительно содержит домен R1, где домен R1 включает второй полипептид модулятора комплемента, и где домен R1 и домен R могут быть одинаковыми или разными. В некоторых вариантах осуществления домен R1 конъюгирован с первым полипептидом. В некоторых вариантах осуществления домен R1 конъюгирован со вторым полипептидом. В некоторых вариантах осуществления домен R1 конъюгирован с третьим полипептидом. В некоторых вариантах осуществления домен R1 конъюгирован с четвертым полипептидом.
[0028] Еще один вариант осуществления обеспечивает конструкцию слитого белка, которая связывает антиген, ассоциированный с комплементом, при этом конструкция слитого белка содержит: первый полипептид и второй полипептид, где первый полипептид содержит: домен A, домен B и шарнирную область, где домены A, B и шарнирная область могут быть расположены от N-конца к C-концу в ориентации A-B-шарнирная область, где домен А включает аминокислотную последовательность вариабельной области тяжелой цепи (VH), или его антигенсвязывающий фрагмент, домен В включает аминокислотную последовательность константной области тяжелой цепи CH1, домен С включает аминокислотную последовательность константной области тяжелой цепи CH2; второй полипептид содержит: домен E, домен F и домен R, где домены E и F могут быть расположены от N-конца к C-концу в ориентации E-F, где (1) домен E и домен R могут быть конъюгированы, или (2) домен F и домен R могут быть конъюгированы, и где домен E включает аминокислотную последовательность вариабельной области легкой цепи (VL), или его антигенсвязывающий фрагмент, и домен F включает аминокислотную последовательность константной области легкой цепи (CL1), и где домен B первого полипептида и домен F второго полипептида могут быть связаны посредством одной или более дисульфидных связей.
[0029] В некоторых вариантах осуществления конструкция слитого белка представляет собой конструкцию четырехвалентного гомодимерного слитого белка, содержащую два первых полипептида и два вторых полипептида, где домен E и домен R могут быть конъюгированы по меньшей мере с одним из вторых полипептидов, и где два первых полипептида могут быть связаны друг с другом посредством одной или более дисульфидных связей в шарнирной области. В некоторых вариантах осуществления конструкция слитого белка представляет собой конструкцию четырехвалентного гомодимерного слитого белка, содержащую два первых полипептида и два вторых полипептида, где домен F и домен R могут быть конъюгированы по меньшей мере с одним из вторых полипептидов, и где два первых полипептида могут быть связаны друг с другом посредством одной или более дисульфидных связей в шарнирной области. В некоторых вариантах осуществления конструкция слитого белка дополнительно содержит домен R1, где домен R1 включает второй полипептид модулятора комплемента, и где домен R1 и домен R могут быть одинаковыми или разными. В некоторых вариантах осуществления домен E и домен R могут быть конъюгированы, и домен F и домен R1 могут быть конъюгированы. В некоторых вариантах осуществления домен F и домен R могут быть конъюгированы, и домен E и домен R1 могут быть конъюгированы.
[0030] В некоторых вариантах осуществления конструкция слитого белка представляет собой конструкцию четырехвалентного гетеродимерного слитого белка, содержащую c) третий полипептид, который содержит: (i) домен A, домен B, шарнирную область, домен C и домен D, (ii) домен A, домен B, шарнирную область и домен C, или (iii) домен A, домен B и шарнирную область, где домены A, B, шарнирная область, C и D третьего полипептида могут быть расположены от N-конца к C-концу в ориентации A-B-шарнирная область-C-D; и d) четвертый полипептид, который содержит: домен E и домен F, где домены E и F четвертого полипептида могут быть расположены от N-конца к C-концу в ориентации E-F, где домен B третьего полипептида и домен F четвертого полипептида могут быть связаны посредством одной или более дисульфидных связей, и при этом первый и третий полипептиды могут быть связаны вместе посредством одной или более дисульфидных связей в шарнирной области.
[0031] В некоторых вариантах осуществления домен E и домен R могут быть конъюгированы в первом полипептиде. В некоторых вариантах осуществления домен F и домен R могут быть конъюгированы в первом полипептиде.
[0032] В некоторых вариантах осуществления конструкция слитого белка дополнительно содержит домен R1, где домен R1 включает второй полипептид модулятора комплемента, и где домен R1 и домен R могут быть одинаковыми или разными. В некоторых вариантах осуществления домен R1 конъюгирован с первым полипептидом. В некоторых вариантах осуществления домен R1 конъюгирован со вторым полипептидом. В некоторых вариантах осуществления домен R1 конъюгирован с третьим полипептидом. В некоторых вариантах осуществления домен R1 конъюгирован с четвертым полипептидом.
[0033] Еще один вариант осуществления обеспечивает конструкцию трехвалентного гетеродимерного слитого белка, которая связывает антиген, ассоциированный с комплементом, при этом конструкция трехвалентного гетеродимерного слитого белка содержит: первый полипептид, второй полипептид, третий полипептид и четвертый полипептид, где первый полипептид содержит: домен A, домен B, шарнирную область, домен C и домен D, где домены A, B, шарнирная область, домены C и D первого полипептида могут быть расположены от N-конца к C-концу в ориентации A-B-шарнирная область-C-D; второй полипептид содержит: домен E, домен F и домен R, где домены E и F могут быть расположены от N-конца к C-концу в ориентации E-F, где (1) домен E и домен R могут быть конъюгированы, или (2) домен F и домен R могут быть конъюгированы; третий полипептид содержит: (i) домен A, домен B, домен C, домен D и шарнирную область, (ii) домен A, домен B, домен C и шарнирную область, или (iii) домен A, домен B и шарнирную область, где домены A, B, шарнирная область, домены C и D третьего полипептида могут быть расположены от N-конца к C-концу в ориентации A-B-шарнирная область-C-D; четвертый полипептид содержит: домен E и домен F, где домены E и F четвертого полипептида могут быть расположены от N-конца к C-концу в ориентации E-F; где домен B первого полипептида и домен F второго полипептида могут быть связаны посредством одной или более дисульфидных связей, и где домен B третьего полипептида и домен F четвертого полипептида могут быть связаны посредством одной или более дисульфидных связей, где первый и третий полипептиды могут быть связаны друг с другом посредством одной или более дисульфидных связей в шарнирной области, и где домен А включает аминокислотную последовательность вариабельной области тяжелой цепи (VH), или его антигенсвязывающий фрагмент, домен В включает аминокислотную последовательность константной области тяжелой цепи CH1, домен С включает аминокислотную последовательность константной области тяжелой цепи CH2, домен D включает аминокислотную последовательность константной области тяжелой цепи CH3, домен R включает полипептид модулятора комплемента, домен E включает аминокислотную последовательность вариабельной области легкой цепи (VL), или его антигенсвязывающий фрагмент, и домен F включает аминокислотную последовательность константной области легкой цепи (CL1).
[0034] В некоторых вариантах осуществления домен E и домен R второго полипептида могут быть конъюгированы. В некоторых вариантах осуществления домен F и домен R второго полипептида могут быть конъюгированы.
[0035] Еще один вариант осуществления обеспечивает конструкцию трехвалентного гетеродимерного слитого белка, которая связывает антиген, ассоциированный с комплементом, при этом конструкция трехвалентного гетеродимерного слитого белка содержит: первый полипептид, второй полипептид, третий полипептид и четвертый полипептид, где первый полипептид содержит: домен A, домен B, шарнирную область и домен C, где домены A, B, шарнирная область и C первого полипептида могут быть расположены от N-конца к C-концу в ориентации A-B-шарнирная область-С; второй полипептид содержит: домен E, домен F и домен R, где домены E и F могут быть расположены от N-конца к C-концу в ориентации E-F, где (1) домен E и домен R могут быть конъюгированы, или (2) домен F и домен R могут быть конъюгированы; третий полипептид содержит: (i) домен A, домен B, домен C, домен D и шарнирную область, (ii) домен A, домен B, домен C и шарнирную область, или (iii) домен A, домен B и шарнирную область, где домены A, B, шарнирная область, C и D третьего полипептида могут быть расположены от N-конца к C-концу в ориентации A-B-шарнирная область-C-D; четвертый полипептид содержит: домен E и домен F, где домены E и F четвертого полипептида могут быть расположены от N-конца к C-концу в ориентации E-F; где домен B первого полипептида и домен F второго полипептида могут быть связаны посредством одной или более дисульфидных связей, и где домен B третьего полипептида и домен F четвертого полипептида могут быть связаны посредством одной или более дисульфидных связей, где первый и третий полипептиды могут быть связаны друг с другом посредством одной или более дисульфидных связей в шарнирной области, и где домен А включает аминокислотную последовательность вариабельной области тяжелой цепи (VH), или его антигенсвязывающий фрагмент, домен В включает аминокислотную последовательность константной области тяжелой цепи CH1, домен С включает аминокислотную последовательность константной области тяжелой цепи CH2, домен R включает полипептид модулятора комплемента, домен E включает аминокислотную последовательность вариабельной области легкой цепи (VL), или его антигенсвязывающий фрагмент, и домен F включает аминокислотную последовательность константной области легкой цепи (CL1).
[0036] В некоторых вариантах осуществления домен E и домен R второго полипептида могут быть конъюгированы. В некоторых вариантах осуществления домен F и домен R второго полипептида могут быть конъюгированы.
[0037] Еще один вариант осуществления обеспечивает конструкцию трехвалентного гетеродимерного слитого белка, которая связывает антиген, ассоциированный с комплементом, при этом конструкция трехвалентного гетеродимерного слитого белка содержит: первый полипептид, второй полипептид, третий полипептид и четвертый полипептид, где первый полипептид содержит: домен A, домен B и шарнирную область, где домены A, B и шарнирная область первого полипептида могут быть расположены от N-конца к C-концу в ориентации A-B-шарнирная область; второй полипептид содержит: домен E, домен F и домен R, где домены E и F могут быть расположены от N-конца к C-концу в ориентации E-F, где (1) домен E и домен R могут быть конъюгированы, или (2) домен F и домен R могут быть конъюгированы; третий полипептид содержит: (i) домен A, домен B, домен C, домен D и шарнирную область, (ii) домен A, домен B, домен C и шарнирную область, или (iii) домен A, домен B и шарнирную область, где домены A, B, шарнирная область, C и D третьего полипептида могут быть расположены от N-конца к C-концу в ориентации A-B-шарнирная область-C-D; четвертый полипептид содержит: домен E и домен F, где домены E и F четвертого полипептида могут быть расположены от N-конца к C-концу в ориентации E-F; где домен B первого полипептида и домен F второго полипептида могут быть связаны посредством одной или более дисульфидных связей, и где домен B третьего полипептида и домен F четвертого полипептида могут быть связаны посредством одной или более дисульфидных связей, где первый и третий полипептиды могут быть связаны друг с другом посредством одной или более дисульфидных связей в шарнирной области, и где домен А включает аминокислотную последовательность вариабельной области тяжелой цепи (VH), или его антигенсвязывающий фрагмент, домен В включает аминокислотную последовательность константной области тяжелой цепи CH1, домен R включает полипептид модулятора комплемента, домен E включает аминокислотную последовательность вариабельной области легкой цепи (VL), или его антигенсвязывающий фрагмент, и домен F включает аминокислотную последовательность константной области легкой цепи (CL1).
[0038] В некоторых вариантах осуществления домен E и домен R второго полипептида могут быть конъюгированы. В некоторых вариантах осуществления домен F и домен R второго полипептида могут быть конъюгированы.
[0039] Еще один вариант осуществления обеспечивает конструкцию слитого белка, которая связывает антиген, ассоциированный с комплементом, при этом конструкция слитого белка содержит: первый полипептид, второй полипептид и третий полипептид, где первый полипептид содержит домен R, шарнирную область, домен C и домен D, где домены R, шарнирная область, C и D могут быть расположены от N-конца к C-концу в ориентации R-шарнир-C-D, и где домен R включает полипептид модулятора комплемента, домен С включает аминокислотную последовательность константной области тяжелой цепи CH2, домен D включает аминокислотную последовательность константной области тяжелой цепи CH3; где домен R и шарнирный домен могут быть конъюгированы, второй полипептид содержит домен A, домен B, шарнирную область, домен C и домен D, где домены A, B, шарнирная область, домены C и D могут быть расположены от N-конца к C-концу в ориентации A-B-шарнир-C-D, и где домен А включает аминокислотную последовательность вариабельной области тяжелой цепи (VH), или его антигенсвязывающий фрагмент, и домен В включает аминокислотную последовательность константной области тяжелой цепи CH1; третий полипептид содержит домен E и домен F, где домены могут быть расположены от N-конца к C-концу в ориентации E-F, и где домен E включает аминокислотную последовательность вариабельной области легкой цепи (VL), или его антигенсвязывающий фрагмент, домен F включает аминокислотную последовательность константной области легкой цепи (CL1); где домен B второго полипептида и домен F третьего полипептида могут быть связаны посредством одной или более дисульфидных связей; и где первый и второй полипептиды могут быть связаны друг с другом посредством одной или более дисульфидных связей в шарнирной области.
[0040] Еще один вариант осуществления обеспечивает конструкцию мономерного слитого белка, которая связывает антиген, ассоциированный с комплементом, при этом конструкция мономерного слитого белка содержит: первый полипептид, содержащий: домен A, домен B и шарнирную область, расположенные от N-конца к C-концу в ориентации A-B-шарнир; второй полипептид, содержащий: домен E и домен F, расположенные от N-конца к C-концу в ориентации E-F, где по меньшей мере один из домена A, шарнирного домена, домена E или домена F конъюгирован с доменом R, и где: домен А включает аминокислотную последовательность вариабельной области тяжелой цепи (VH), или его антигенсвязывающий фрагмент, домен В включает аминокислотную последовательность константной области тяжелой цепи CH1, домен R включает полипептид модулятора комплемента, домен E включает аминокислотную последовательность вариабельной области легкой цепи (VL), или его антигенсвязывающий фрагмент, а домен F включает аминокислотную последовательность константной области легкой цепи (CL1), где домен B первого полипептида и домен F второго полипептида могут быть связаны посредством одной или более дисульфидных связей.
[0041] В некоторых вариантах осуществления первый полипептид содержит домен A, домен B, шарнирный домен и домен R, где домены первого полипептида могут быть расположены от N-конца к C-концу в ориентации R-A-B-шарнир, и при этом домен R и домен A могут быть конъюгированы. В некоторых вариантах осуществления первый полипептид содержит домен A, домен B, шарнирный домен и домен R, где домены первого полипептида могут быть расположены от N-конца к C-концу в ориентации A-B-шарнир-R, и при этом шарнирный домен и домен R могут быть конъюгированы. В некоторых вариантах осуществления второй полипептид содержит домен E, домен F и домен R, где домены второго полипептида могут быть расположены от N-конца к C-концу в ориентации R-E-F, и где домен E и домен R могут быть конъюгированы. В некоторых вариантах осуществления второй полипептид включает домен E, домен F и домен R, где домены второго полипептида могут быть расположены от N-конца к C-концу в ориентации E-F-R, и где домен F и домен R могут быть конъюгированы. В некоторых вариантах осуществления конструкция слитого белка дополнительно содержит второй полипептид модулятора комплемента, причем второй полипептид модулятора комплемента и домен R могут быть одинаковыми или разными.
[0042] Еще один вариант осуществления обеспечивает конструкцию мономерного слитого белка, которая связывает антиген, ассоциированный с комплементом, при этом конструкция мономерного слитого белка содержит: первый полипептид, содержащий: домен A, домен B, шарнирную область и домен C, расположенные от N-конца к С-концу в ориентации и A-B-шарнир-область C; второй полипептид, содержащий: домен E и домен F, расположенные от N-конца к C-концу в ориентации E-F, где по меньшей мере один из домена A, домена C, домена E или домена F конъюгирован с доменом R, и где: домен А включает аминокислотную последовательность вариабельной области тяжелой цепи (VH), или его антигенсвязывающий фрагмент, домен В включает аминокислотную последовательность константной области тяжелой цепи CH1, домен C содержит аминокислотную последовательность константной области тяжелой цепи CH2, домен R включает полипептид модулятора комплемента, домен E включает аминокислотную последовательность вариабельной области легкой цепи (VL), или его антигенсвязывающий фрагмент, а домен F включает аминокислотную последовательность константной области легкой цепи (CL1), где домен B первого полипептида и домен F второго полипептида могут быть связаны посредством одной или более дисульфидных связей.
[0043] В некоторых вариантах осуществления первый полипептид содержит домен A, домен B, шарнирный домен, домен C и домен R, где домены первого полипептида могут быть расположены от N-конца к C-концу в ориентации R-A-B-шарнир-C, и при этом домен R и домен A могут быть конъюгированы. В некоторых вариантах осуществления первый полипептид содержит домен A, домен B, шарнирный домен, домен C и домен R, где домены первого полипептида могут быть расположены от N-конца к C-концу в ориентации A-B-шарнир-C-R, и при этом домен C и домен R могут быть конъюгированы. В некоторых вариантах осуществления второй полипептид содержит домен E, домен F и домен R, где домены второго полипептида могут быть расположены от N-конца к C-концу в ориентации R-E-F, и где домен E и домен R могут быть конъюгированы. В некоторых вариантах осуществления второй полипептид включает домен E, домен F и домен R, где домены второго полипептида могут быть расположены от N-конца к C-концу в ориентации E-F-R, и где домен F и домен R могут быть конъюгированы. В некоторых вариантах осуществления конструкция слитого белка дополнительно содержит второй полипептид модулятора комплемента, причем второй полипептид модулятора комплемента и домен R могут быть одинаковыми или разными.
[0044] Еще один вариант осуществления обеспечивает конструкцию мономерного слитого белка, которая связывает антиген, ассоциированный с комплементом, при этом конструкция мономерного слитого белка содержит: a) первый полипептид, содержащий: домен A, домен B, шарнирную область, домен C и домен D, расположенные от N-конца к C-концу в ориентации A-B-шарнирная область-C-D; b) второй полипептид, содержащий: домен E и домен F, расположенные от N-конца к C-концу в ориентации E-F, где по меньшей мере один из домена A, домена D, домена E или домена F конъюгирован с доменом R, и где: (i) домен А включает аминокислотную последовательность вариабельной области тяжелой цепи (VH), или его антигенсвязывающий фрагмент, (ii) домен В включает аминокислотную последовательность константной области тяжелой цепи CH1, ( iii) домен С включает аминокислотную последовательность константной области тяжелой цепи CH2, (iv) домен D содержит аминокислотную последовательность константной области тяжелой цепи CH3, (v) домен R включает полипептид модулятора комплемента, (vi) домен E включает аминокислотную последовательность вариабельной области легкой цепи (VL), или его антигенсвязывающий фрагмент, и (vii) домен F включает аминокислотную последовательность константной области легкой цепи (CL1), где домен B первого полипептида и домен F второго полипептида могут быть связаны посредством одной или более дисульфидных связей.
[0045] В некоторых вариантах осуществления первый полипептид содержит домен A, домен B, шарнирный домен, домен C, домен D и домен R, где домены первого полипептида могут быть расположены от N-конца к C-концу в ориентации R-A-B-шарнир-C-D, и где домен R и домен A могут быть конъюгированы. В некоторых вариантах осуществления первый полипептид содержит домен A, домен B, шарнирный домен, домен C, домен D и домен R, где домены первого полипептида могут быть расположены от N-конца к C концу в ориентации A-B-шарнир-C-D-R, и где домен C и домен R могут быть конъюгированы. В некоторых вариантах осуществления второй полипептид содержит домен E, домен F и домен R, где домены второго полипептида могут быть расположены от N-конца к C-концу в ориентации R-E-F, и где домен E и домен R могут быть конъюгированы. В некоторых вариантах осуществления второй полипептид включает домен E, домен F и домен R, где домены второго полипептида могут быть расположены от N-конца к C-концу в ориентации E-F-R, и где домен F и домен R могут быть конъюгированы. В некоторых вариантах осуществления конструкция слитого белка дополнительно содержит второй полипептид модулятора комплемента, причем второй полипептид модулятора комплемента и домен R могут быть одинаковыми или разными.
[0046] В некоторых вариантах осуществления конъюгация включает связывание двух доменов пептидным линкером, связывание без линкера, ферментативную конъюгацию, химическую конъюгацию или любую их комбинацию. В некоторых вариантах осуществления ассоциированный с комплементом антиген представляет собой C3d, iC3b, C3dg или их фрагменты или их варианты. В некоторых вариантах осуществления конструкция слитого белка связывает C3 и C3b с более низкой аффинностью связывания, чем по отношению к C3d. В некоторых вариантах осуществления конструкция слитого белка связывает C3 и C3b с аффинностью в KD около 10-3 M или выше. В некоторых вариантах осуществления конструкция слитого белка связывает iC3b, C3dg или оба с аффинностью в KD 10-8 M или меньше. В некоторых вариантах осуществления конструкция слитого белка модулирует активность альтернативного пути комплемента у субъекта при введении субъекту конструкции слитого белка или фармацевтической композиции, содержащей конструкцию слитого белка. В некоторых вариантах осуществления конструкция слитого белка модулирует активность классического пути комплемента у субъекта при введении субъекту конструкции слитого белка или фармацевтической композиции, содержащей конструкцию слитого белка. В некоторых вариантах осуществления конструкция слитого белка модулирует активность лектинового пути комплемента у субъекта при введении субъекту конструкции слитого белка или фармацевтической композиции, содержащей конструкцию слитого белка. В некоторых вариантах осуществления конструкция слитого белка связывает домен белка аннексина млекопитающих.
[0047] В некоторых вариантах осуществления конструкция слитого белка связывает домен белка аннексина млекопитающего с аффинностью в KD 10-8 M или меньше. В некоторых вариантах осуществления домен представляет собой центральный домен аннексина. В некоторых вариантах осуществления центральный домен аннексина включает альфа-спиральный домен. В некоторых вариантах осуществления центральный домен аннексина содержит сайт связывания кальция и сайт связывания с мембраной. В некоторых вариантах осуществления центральный домен аннексина содержит по меньшей мере один повтор аннексина. В некоторых вариантах осуществления конструкция слитого белка связывает последовательность повтора аннексина в домене. В некоторых вариантах осуществления конструкция слитого белка связывает фосфолипид. В некоторых вариантах осуществления конструкция слитого белка связывает фосфолипид с аффинностью в KD 10-8 M или меньше. В некоторых вариантах осуществления фосфолипид выбран из группы, состоящей из фосфатидилэтаноламина (ФЭ), кардиолипина (КЛ), фосфатидилхолина (ФХ), фосфатидилинозитола, фосфатидилглицерина, фосфатидилсерина и фосфатидной кислоты, и малонового диальдегида (МДА). В некоторых вариантах осуществления пептид модулятора комплемента содержит домен А белка рецептора комплемента 1 (CR1) или его фрагмент, который сохраняет по меньшей мере три коротких консенсусных повтора (SCR) домена А. В некоторых вариантах осуществления конструкция слитого белка дополнительно содержит домен B белка CR1 или его фрагмента, который сохраняет по меньшей мере три SCR домена B.
[0048] В некоторых вариантах осуществления конструкция слитого белка дополнительно содержит домен C белка CR1 или его фрагмент, который сохраняет по меньшей мере три SCR домена C. В некоторых вариантах осуществления конструкция слитого белка дополнительно содержит домен D CR1 или его фрагмент, который сохраняет по меньшей мере три SCR домена D. В некоторых вариантах осуществления полипептид модулятора комплемента содержит первые три SCR домена A, первые три SCR домена B и первые три SCR домена C белка CR1. В некоторых вариантах осуществления полипептид модулятора комплемента представляет собой CR1 (1-10). В некоторых вариантах осуществления полипептид модулятора комплемента представляет собой CR1 (1-17). В некоторых вариантах осуществления пептид модулятора комплемента содержит аминокислотную последовательность SEQ ID NO: 41 или SEQ ID NO: 91, или его вариант с аминокислотной последовательностью, идентичной по меньшей мере на 85%. В некоторых вариантах осуществления полипептид модулятора комплемента содержит аминокислотную последовательность SEQ ID NO: 42 или SEQ ID NO: 92, или его вариант с аминокислотной последовательностью, идентичной по меньшей мере на 85%. В некоторых вариантах осуществления пептид модулятора комплемента представляет собой фактор ускорения распада (DAF) или его биологически активный фрагмент. В некоторых вариантах осуществления DAF представляет собой DAF человека. В некоторых вариантах осуществления биологически активный фрагмент DAF человека содержит по меньшей мере один из домена короткого консенсусного повтора (SCR) и богатого O-гликозилированным серином / треонином домена полноразмерного DAF человека.
[0049] В некоторых вариантах осуществления биологически активный фрагмент DAF содержит SCR 1-4 или SCR 2-4 полноразмерного DAF человека. В некоторых вариантах осуществления биологически активный фрагмент DAF содержит аминокислотную последовательность SEQ ID NO: 184 или его вариант с аминокислотной последовательностью, идентичной по меньшей мере на 85%. В некоторых вариантах осуществления пептид модулятора комплемента представляет собой фактор H или его биологически активный фрагмент. В некоторых вариантах осуществления фактор H представляет собой человеческий фактор H. В некоторых вариантах осуществления биологически активный фрагмент человеческого фактора H содержит одну или более групп коротких консенсусных повторов (SCR), включающих SCR 1-20, SCR 1-2, SCR 2-3, SCR 3-4, SCR 4-5, SCR 5-6, SCR 6-7, SCR 7-8, SCR 8-9, SCR 9-10, SCR 10-11, SCR 11-12, SCR 12-13, SCR 13-14, SCR 14-15, SCR 15-16, SCR 16-17, SCR 17-18, SCR 19-20 полноразмерного человеческого фактора H, или любую комбинацию SCR 1-20. В некоторых вариантах осуществления биологически активный фрагмент человеческого фактора H содержит SCR с 1 по 4 или SCR с 1 по 5 полноразмерного человеческого фактора H. В некоторых вариантах осуществления биологически активный фрагмент человеческого фактора H содержит участок аминокислот, выбранный из группы, состоящей из: аминокислот 21-266, аминокислот 21-320, аминокислот 21-509 или аминокислот 19-1106 SEQ ID NO: 9, или его вариант с аминокислотной последовательностью, идентичной по меньшей мере на 85% участку аминокислот.
[0050] В некоторых вариантах осуществления фактор H или его биологически активный фрагмент содержит аминокислотную последовательность SEQ ID NO: 72 или SEQ ID NO: 108 или его вариант с аминокислотной последовательностью, идентичной по меньшей мере на 85%. В некоторых вариантах осуществления пептид модулятора комплемента представляет собой МСР или его биологически активный фрагмент. В некоторых вариантах осуществления MCP представляет собой MCP человека. В некоторых вариантах осуществления биологически активный фрагмент MCP человека содержит по меньшей мере один из домена коротких консенсусных повторов (SCR) полноразмерного MCP человека. В некоторых вариантах осуществления биологически активный фрагмент MCP человека содержит SCR с 3 по 4 полноразмерного MCP человека. В некоторых вариантах осуществления MCP содержит аминокислотную последовательность SEQ ID NO: 187 или его вариант с аминокислотной последовательностью, идентичной по меньшей мере на 85%. В некоторых вариантах осуществления пептид модулятора комплемента представляет собой Map44 или его биологически активный фрагмент. В некоторых вариантах осуществления Map44 представляет собой Map44 человека. В некоторых вариантах осуществления Map44 содержит аминокислотную последовательность SEQ ID NO: 186 или его вариант с аминокислотной последовательностью, идентичной по меньшей мере на 85%. В некоторых вариантах осуществления пептид модулятора комплемента представляет собой CD59 или его биологически активный фрагмент.
[0051] В некоторых вариантах осуществления CD59 представляет собой CD59 человека.
[0052] В некоторых вариантах осуществления CD59 содержит аминокислотную последовательность SEQ ID NO: 185 или его вариант с аминокислотной последовательностью, идентичной по меньшей мере на 85%. В некоторых вариантах осуществления конструкция слитого белка содержит антитело человека или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления конструкция слитого белка содержит гуманизированное антитело или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления первый и третий полипептиды содержат по меньшей мере одну ортогональную модификацию, которая способствует образованию гетеродимера, а не гомодимера. В некоторых вариантах осуществления первый полипептид содержит модификацию выступа, а третий полипептид содержит модификацию типа «впадина»; или где третий полипептид содержит модификацию типа «выступ», а первый полипептид содержит модификацию типа «впадина». В некоторых вариантах осуществления первый и третий полипептиды содержат модификации, приводящие к зарядовой или поверхностной комплементарности.
[0053] В некоторых вариантах осуществления (а) первый полипептид содержит (i) три определяющие комплементарность области тяжелой цепи (CDR), имеющие аминокислотные последовательности SEQ ID NO: 11, 12 и 13; 17, 18 и 19; 23, 24 и 25; 29, 30 и 31; 35, 36 и 37; 147, 148 и 149; 188, 189 и 190; 196, 197 и 198; 204 или 343, 205 и 206; 212, 213 и 214; 220, 221 и 222; 228, 229 и 230; 29, 259 и 31; или 29, 260 и 31; или (ii) три CDR тяжелой цепи, имеющие аминокислотные последовательности, которые отличаются одной консервативной аминокислотной заменой в пределах одной из SEQ ID NO: 11, 12 и 13; 17, 18 и 19; 23, 24 и 25; 29, 30 и 31; 35, 36 и 37; 147, 148 и 149; 188, 189 и 190; 196, 197 и 198; 204 или 343, 205 и 206; 212, 213 и 214; 220, 221 и 222; 228, 229 и 230; 29, 259 и 31; или 29, 260 и 31; и (b) второй полипептид содержит (i) три определяющие комплементарность области легкой цепи (CDR), имеющие аминокислотные последовательности SEQ ID NO: 14, 15 и 16; 20, 21 и 22; 26, 27 и 28; 32, 33 и 34; 38, 39 и 40; 150, 151 и 152; 191, 192 и 193; 199, 200 и 201; 207, 208 и 209; 215, 216 и 217; 223, 224 и 225; или 231, 232 и 233, или (ii) три CDR легкой цепи, имеющие аминокислотные последовательности, которые отличаются одной консервативной аминокислотной заменой в одной из SEQ ID NO: 14, 15 и 16; 20, 21 и 22; 26, 27 и 28; 32, 33 и 34; 38, 39 и 40; 150, 151 и 152; 191, 192 и 193; 199, 200 и 201; 207, 208 и 209; 215, 216 и 217; 223, 224 и 225; или 231, 232 и 233.
[0054] В некоторых вариантах осуществления второй полипептид (легкая цепь, содержащая домены E и F) содержит по меньшей мере три CDR, при этом CDR легкой цепи определены как CDR-L1, CDR-L2, CDR-L3, соответственно: для SEQ ID NO: 279, 68, 287 и 59 CDR содержат остатки 27-37 (CDR-L1), 55-57 (CDR-L2) и 94-102 (CDR-L3); для SEQ ID NO: 289 CDR содержат остатки 27-38 (CDR-L1), 56-58 (CDR-L2), 95-102 (CDR-L3). В некоторых вариантах осуществления первый полипептид (тяжелая цепь, содержащая по меньшей мере домены A и B) содержит по меньшей мере три CDR, при этом CDR тяжелой цепи определены как CDR-H1, CDR-H2, CDR-H3, соответственно: для SEQ ID NO: 280, 281, 282, 284, 285, 286, 73 и 288 CDR содержат остатки 26-33 (CDR-H1), 51-58 (CDR-H2) и 97-100 (CDR-H3); для SEQ ID NO: 244 CDR содержат остатки 26-33 (CDR-H1), 51-58 (CDR-H2) и 97-102 (CDR-H3); для SEQ ID NO: 290 CDR содержат остатки 26-33 (CDR-H1), 51-58 (CDR-H2) и 97-110 (CDR-H3). В некоторых вариантах осуществления первый полипептид (тяжелая цепь, содержащая по меньшей мере домены A и B) содержит по меньшей мере три CDR, при этом CDR тяжелой цепи определены как CDR-H1, CDR-H2, CDR-H3, соответственно, для SEQ ID № 342, содержат SEQ ID № 23, SEQ ID № 24 и SEQ ID № 25. В некоторых вариантах осуществления второй полипептид (легкая цепь, содержащая по меньшей мере домены E и F) содержит по меньшей мере три CDR, при этом CDR легкой цепи определены как CDR-L1, CDR-L2, CDR-L3, соответственно, для легкой цепи, содержат SEQ ID № 26, SEQ ID № 27 и SEQ ID № 28.
[0055] В некоторых вариантах осуществления конструкция слитого белка дополнительно содержит по меньшей мере один аминокислотный линкер, где по меньшей мере один линкер содержит аминокислотную последовательность любой из SEQ ID NO: 138, SEQ ID NO: 161, SEQ ID NO: 162, SEQ ID NO: 163, SEQ ID NO: 164, SEQ ID NO: 165, SEQ ID NO: 166, SEQ ID NO: 167, SEQ ID NO: 168, SEQ ID NO: 169, SEQ ID NO: 170, SEQ ID NO: 171, SEQ ID NO: 172, SEQ ID NO: 173, SEQ ID NO: 174, SEQ ID NO: 175, SEQ ID NO: 176, SEQ ID NO: 177, SEQ ID NO: 178, SEQ ID NO: 179, SEQ ID NO: 180, SEQ ID NO: 181, SEQ ID NO: 182, SEQ ID NO: 183, SEQ ID NO: 241, или SEQ ID NO: 242.
[0056] В некоторых вариантах осуществления конструкция слитого белка может содержать аминокислотную последовательность по меньшей мере одной из SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 63, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 69, SEQ ID NO: 70, SEQ ID NO: 71, SEQ ID NO: 75, SEQ ID NO: 76, SEQ ID NO: 77, SEQ ID NO: 78, SEQ ID NO: 79, SEQ ID NO: 80, SEQ ID NO: 82, SEQ ID NO: 83, SEQ ID NO: 84, SEQ ID NO: 85, SEQ ID NO: 86, SEQ ID NO: 87, SEQ ID NO: 88, SEQ ID NO: 90, SEQ ID NO: 93, SEQ ID NO: 94, SEQ ID NO: 95, SEQ ID NO: 96, SEQ ID NO: 97, SEQ ID NO: 98, SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 105, SEQ ID NO: 106, SEQ ID NO: 107, SEQ ID NO: 109, SEQ ID NO: 110, SEQ ID NO: 111, SEQ ID NO: 113, SEQ ID NO: 114, SEQ ID NO: 115, SEQ ID NO: 116, SEQ ID NO: 117, SEQ ID NO: 118, SEQ ID NO: 119, SEQ ID NO: 120, SEQ ID NO: 121, SEQ ID NO: 122, SEQ ID NO: 123, SEQ ID NO: 124, SEQ ID NO: 125, SEQ ID NO: 126, SEQ ID NO: 127, SEQ ID NO: 128, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, и SEQ ID NO: 144. В некоторых вариантах осуществления первый полипептид содержит последовательность SEQ ID NO: 282 (домен A, домен B, домен C и домен D), конъюгированную с полипептидом модулятора комплемента, содержащим последовательность, выбранную из группы, состоящей из SEQ ID NO: 41, 42 и 72 (домен R); и где второй полипептид содержит последовательность SEQ ID NO: 279 (домен E и домен F). В некоторых вариантах осуществления первый полипептид содержит последовательность SEQ ID NO: 282 (домен A, домен B, домен C и домен D); и где второй полипептид содержит последовательность SEQ ID NO: 279 (домен E и домен F), конъюгированную с полипептидом модулятора комплемента, содержащим последовательность, выбранную из группы, состоящей из SEQ ID NO: 72 (домен R).
[0057] Другой вариант осуществления обеспечивает фармацевтическую композицию, содержащую конструкцию слитого белка по любому из вышеуказанных вариантов осуществления. Еще один вариант осуществления обеспечивает полинуклеотид, кодирующий слитый белок. Другой вариант осуществления обеспечивает способ лечения, включающий обеспечение субъекту терапевтически эффективного количества фармацевтической композиции.
[0058] В некоторых вариантах осуществления субъект имеет комплемент-опосредованное заболевание или комплемент-опосредованное воспаление. В некоторых вариантах осуществления конструкция слитого белка специфически связывается с C3d с аффинностью в KD 10-8 M или менее, и субъект имеет комплемент-опосредованное заболевание, при котором комплемент-опосредованное заболевание характеризуется повышенным отложением C3d. В некоторых вариантах осуществления конструкция слитого белка специфически связывается с фосфолипидом, реагирующим с антителом к C2, с аффинностью KD 10-8 M или менее, и субъект имеет комплемент-опосредованное заболевание, при котором комплемент-опосредованное заболевание характеризуется повышенным отложением реакционноспособного с антителом к C2 фосфолипида. В некоторых вариантах осуществления субъект имеет комплемент-опосредованное воспаление, при этом комплемент-опосредованное воспаление включает, и при этом воспалительное фиброзное заболевание включает фокально-сегментарный гломерулосклероз, первичный склерозирующий холангит или мембранопролиферативный гломерулонефрит. В некоторых вариантах осуществления субъект имеет комплемент-опосредованное аутоиммунное заболевание, включающее ревматоидный артрит, системную красную волчанку, волчаночный нефрит или обыкновенную пузырчатку. В некоторых вариантах осуществления субъект имеет комплемент-опосредованное заболевание почек, включая мембранопролиферативный гломерулонефрит или комплемент 3 - гломерулопатию. В некоторых вариантах осуществления субъект страдает комплемент-опосредованным сердечно-сосудистым заболеванием. В некоторых вариантах осуществления сердечно-сосудистое заболевание включает атеросклероз или тромбоз. В некоторых вариантах осуществления субъект имеет комплемент-опосредованное дерматологическое заболевание.
[0059] В некоторых вариантах осуществления дерматологическое заболевание включает псориаз, инверсное акне, красную волчанку, кожный васкулит мелких сосудов, крапивницу, уртикарный васкулит или буллезный пемфигоид. В некоторых вариантах осуществления субъект страдает от комплемент-опосредованного воспаления, и при этом комплемент-опосредованное воспаление связано с патологическим состоянием или заболеванием, выбранным из группы, состоящей из следующего: ишемически-реперфузионное повреждение, ожоговое поражение, эндотоксемия и септический шок, респираторный дистресс-синдром взрослых, искусственное кровообращение, гемодиализ, анафилактический шок, астма, ангионевротический отек, болезнь Крона, серповидноклеточная анемия, гломерулонефрит, мембранозный нефрит, панкреатит, отторжение трансплантата, сверхострое отторжение ксенотрансплантата, повторная угроза выкидыша, преэклампсия, лекарственная аллергия, индуцированный ИЛ-2 синдром транссудации, аллергия на рентгеноконтрастное вещество, миастения, болезнь Альцгеймера, рассеянный склероз, ревматоидный артрит, системная красная волчанка, инсулинозависимый сахарный диабет, острый диссеминированный энцефаломиелит, болезнь Аддисона, синдром антифосфолипидных антител, аутоиммунный гепатит, синдром Гудпасчера, болезнь Грейвса, синдром Гийена-Барре, болезнь Хашимото, идиопатическая тромбоцитопеническая пурпура, пузырчатка, синдром Шегрена, синдром Такаясу, инфаркт миокарда, инсульт, острый респираторный дистресс-синдром, сепсис, плазмаферез, тромбоцитаферез, лейкоферез, экстракорпоральная мембранная оксигенация, гепарин-индуцированная экстракорпоральная преципитация ЛПНП, воспаление кишечника, крапивница, васкулит и волчаночный нефрит.
[0060] В некоторых вариантах осуществления субъект имеет патологическое состояние или заболевание, выбранное из группы, состоящей из следующего: ишемически-реперфузионное повреждение, ревматоидный артрит (РА), волчаночный нефрит, ишемически-реперфузионное повреждение, атипичный гемолитико-уремический синдром (аГУС), типичный или инфекционный гемолитико-уремический синдром (тГУС), болезнь плотного осадка (БПО), пароксизмальная ночная гемоглобинурия (ПНГ), рассеянный склероз (РС), макулярная дегенерация, синдром гемолиза, повышения печеночных ферментов и низких тромбоцитов (HELLP), сепсис, дерматомиозит, диабетическая ретинопатия, тромботическая тромбоцитопеническая пурпура (ТТП), спонтанная угроза выкидыша, pauci - иммунный васкулит, буллезный эпидермолиз, повторная угроза выкидыша, рассеянный склероз (РС), черепно-мозговая травма, сердечно-сосудистое заболевание, миокардит, нарушение мозгового кровообращения, нарушение со стороны периферических сосудов, реноваскулярное заболевание, нарушение сосудистого генеза брыжейки/ кишечника, реваскуляризация трансплантатов и/или приживленных органов, васкулит, нефрит при пурпуре Шенлейна-Геноха, васкулит, связанный с системной красной волчанкой, васкулит, связанный с ревматоидным артритом, геморрагический васкулит, болезнь Такаясу, синдром капиллярной утечки, дилатационная кардиомиопатия, диабетическая ангиопатия, аневризм торако-абдоминальной аорты, синдром Кавасаки (артериит), венозная газовая эмболия (ВГЭ), и рестеноз после установки стента, ротационной атерэктомии, чрескожной транслюминальной коронарной ангиопластики (ЧТКА), миастения гравис, болезнь холодовых агглютининов (БХА), пароксизмальная холодовая гемоглобинурия (ПХГ), дерматомиозит, склеродермия, сердечная аутоиммунная гемолитическая анемия, болезнь Грейвса, тиреоидит Хашимото, сахарный диабет I типа, псориаз, пузырчатка, аутоиммунная гемолитическая анемия (АИГА), идиопатическая тромбоцитопеническая пурпура (ИТП), синдром Гудпасчера, антифосфолипидный синдром (АФС), синдром Дегоса и катастрофический антифосфолипидный синдром (КАФС).
[0061] В некоторых вариантах осуществления субъект имеет патологическое состояние или заболевание, выбранное из группы, состоящей из следующего: возрастная макулярная дегенерация (ВМД), мембранопролиферативный гломерулонефрит II типа (МПГН II), гемолитико-уремический синдром (ГУС), астма, амилоидоз и тромботическая тромбоцитопеническая пурпура. В некоторых вариантах осуществления гемолитико-уремический синдром (ГУС) представляет собой атипичный гемолитико-уремический синдром (аГУС). В некоторых вариантах осуществления субъект имеет ассоциированное с друзами заболевание или связанное с друзами заболевание. В некоторых вариантах осуществления связанное с друзами заболевание представляет собой амилоидоз, эластоз, болезнь плотного осадка, гломерулонефрит, атеросклероз или связанное с друзами глаз заболевание.
[0062] В другом варианте осуществления предложена фармацевтическая композиция, содержащая конструкцию четырехвалентного слитого белка для модуляции активности комплемента, при этом конструкция четырехвалентного слитого белка содержит: (i) антитело или его антигенсвязывающий фрагмент, которое связывает антиген, ассоциированный с комплементом; и (ii) первый пептид модулятора комплемента и второй пептид модулятора комплемента, где первый и второй пептиды модулятора комплемента могут быть одинаковыми или разными.
[0063] В некоторых вариантах осуществления по меньшей мере один из первого и второго пептидов модулятора комплемента конъюгирован с антителом или антигенсвязывающим фрагментом с помощью линкера.
[0064] В другом варианте осуществления предложена фармацевтическая композиция, содержащая конструкцию трехвалентного слитого белка для модуляции активности комплемента, при этом конструкция четырехвалентного слитого белка содержит: (i) антитело или его антигенсвязывающий фрагмент, которое связывает антиген, ассоциированный с комплементом; и (ii) один пептид модулятора комплемента.
[0065] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент и пептид модулятора комплемента могут быть конъюгированы с помощью линкера.
[0066] В еще одном варианте осуществления предложена фармацевтическая композиция, содержащая конструкцию трехвалентного слитого белка для модуляции активности комплемента, при этом конструкция трехвалентного слитого белка содержит: (i) Fab, который связывает антиген, ассоциированный с комплементом; (ii) домен Fc антитела; и (iii) пептид модулятора комплемента, конъюгированный с Fab или доменом Fc.
[0067] В некоторых вариантах осуществления Fab или домен Fc и пептид модулятора комплемента могут быть конъюгированы с помощью линкера.
[0068] В другом варианте осуществления предложена фармацевтическая композиция, содержащая конструкцию трехвалентного слитого белка, содержащую: a) первый полипептидный мономер, содержащий домен CH2 или CH3 антитела, где домен имеет по меньшей мере одну ортогональную модификацию, которая способствует образованию гетеродимера, а не гомодимера; b) второй полипептидный мономер, содержащий домен CH2 или CH3 антитела, где домен имеет по меньшей мере одну ортогональную модификацию, которая способствует образованию гетеродимера с первым полипептидным мономером, а не гомодимера; и где один из первого и второго полипептидов дополнительно содержит пептид модулятора комплемента, и где конструкция трехвалентного слитого белка связывает антиген, ассоциированный с комплементом.
[0069] В некоторых вариантах осуществления первый полипептид содержит модификацию типа «выступ», а второй полипептид содержит модификацию типа «впадина». В некоторых вариантах осуществления первый и второй полипептиды содержат модификации, приводящие к зарядовой или поверхностной комплементарности. В некоторых вариантах осуществления пептид модулятора комплемента соединен с одним из первого и второго полипептидов аминокислотным линкером.
[0070] Другой вариант осуществления обеспечивает фармацевтическую композицию, содержащую конструкцию слитого белка, которая содержит: антитело или его антигенсвязывающий фрагмент, содержащее (i) три определяющие комплементарность области тяжелой цепи (CDR), имеющие аминокислотные последовательности SEQ ID NO: 11, 12 и 13; 17, 18 и 19; 23, 24 и 25; 29, 30 и 31; 35, 36 и 37; 147, 148 и 149; 188, 189 и 190; 196, 197 и 198; 204 или 343, 205 и 206; 212, 213 и 214; 220, 221 и 222; 228, 229 и 230; 29, 259 и 31; 29, 260 и 31; остатки 26-33 (CDR-H1), 51-58 (CDR-H2) и 97-100 (CDR-H3) из SEQ ID NO: 280, 281, 282, 284, 285, 286, 73 или 288; остатки 26-33 (CDR-H1), 51-58 (CDR-H2) и 97-102 (CDR-H3) из SEQ ID NO: 244; или остатки 26-33 (CDR-H1), 51-58 (CDR-H2) и 97-110 (CDR-H3) из SEQ ID NO: 290, или (ii) три CDR тяжелой цепи, имеющие аминокислотные последовательности, которые отличаются одной консервативной аминокислотной заменой в пределах одной из SEQ ID NO: 11, 12 и 13; 17, 18 и 19; 23, 24 и 25; 29, 30 и 31; 35, 36 и 37; 147, 148 и 149; 188, 189 и 190; 196, 197 и 198; 204 или 343, 205 и 206; 212, 213 и 214; 220, 221 и 222; 228, 229 и 230; 29, 259 и 31; или 29, 260 и 31; остатков 26-33 (CDR-H1), 51-58 (CDR-H2) и 97-100 (CDR-H3) SEQ ID NO: 280, 281, 282, 284, 285, 286, 73 или 288; остатков 26-33 (CDR-H1), 51-58 (CDR-H2) и 97-102 (CDR-H3) из SEQ ID NO: 244; или остатков 26-33 (CDR-H1), 51-58 (CDR-H2) и 97-110 (CDR-H3) из SEQ ID NO: 290 и (ii) три определяющие комплементарность области легкой цепи (CDR), имеющие аминокислотные последовательности SEQ ID NO: 14, 15 и 16; 20, 21 и 22; 26, 27 и 28; 32, 33 и 34; 38, 39 и 40; 150, 151 и 152; 191, 192 и 193; 199, 200 и 201; 207, 208 и 209; 215, 216 и 217; 223, 224 и 225; или 231, 232 и 233; остатки 27-37 (CDR-L1), 55-57 (CDR-L2) и 94-102 (CDR-L3) SEQ ID NO: 279, 68, 287 или 59; или остатки 27-38 (CDR-L1), 56-58 (CDR-L2), 95-102 (CDR-L3) SEQ ID NO: 289 или (ii) три CDR легкой цепи, имеющие аминокислотные последовательности, которые отличаются одной консервативной аминокислотной заменой в пределах одной из SEQ ID NO: 14, 15 и 16; 20, 21 и 22; 26, 27 и 28; 32, 33 и 34; 38, 39 и 40; 150, 151 и 152; 191, 192 и 193; 199, 200 и 201; 207, 208 и 209; 215, 216 и 217; 223, 224 и 225; или 231, 232 и 233; остатков 27-37 (CDR-L1), 55-57 (CDR-L2) и 94-102 (CDR-L3) из SEQ ID NO: 279, 68, 287 или 59; или остатков 27-38 (CDR-L1), 56-58 (CDR-L2), 95-102 (CDR-L3) из SEQ ID NO: 289, и пептид модулятора комплемента.
[0071] В другом варианте осуществления предложена фармацевтическая композиция, содержащая конструкцию слитого белка, которая содержит: антитело или его антигенсвязывающий фрагмент, содержащее (а) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность по меньшей мере одной из SEQ ID NO: 54, 58, 67, 73, 74, 81, 88, 89, 98, 99, 112, 145, 153, 194, 202, 210, 218, 226, 234, 238, 243, 244, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 261, 262, 263, 264, 265, 270, 271, 272, 273, 274, 280, 281, 282, 283, 284, 285, 286, 288, 290 и 342; и (b) вариабельную область легкой цепи, содержащую аминокислотную последовательность по меньшей мере одной из SEQ ID NO: 45, 59, 68, 195, 203, 211, 219, 227, 235, 256, 257, 258, 266, 267, 268, 269, 275, 276, 277 и 278, 279, 287 и 289, или (c) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами в пределах по меньшей мере одной из SEQ ID NO: 54, 58, 67, 73, 74, 81, 88, 89, 98, 99, 112, 145, 153, 194, 202, 210, 218, 226, 234, 238, 243, 244, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 261, 262, 263, 264, 265, 270, 271, 272, 273, 274, 280, 281, 282, 283, 284, 285, 286, 288, 290 и 342; и (d) вариабельную область легкой цепи, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами в пределах по меньшей мере одной из SEQ ID NO: 45, 59, 68, 195, 203, 211, 219, 227, 235, 256, 257, 258, 266, 267, 268, 269, 275, 276, 277, и 278, 279, 287, и 289.
[0072] В еще одном варианте осуществления предложена фармацевтическая композиция, содержащая конструкцию слитого белка, которая содержит последовательность, выбранную из группы, состоящей из: SEQ ID NO: 45, 51, 54, 58, 59, 62, 64, 67, 68, 73, 74, 79, 75, 81, 88, 89, 98, 99, 112, 121, 194, 195, 202, 203, 210, 211, 218, 219, 237, 226, 226, 227, 234, 235, 238, 239, 240, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, и 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, и 342; и пептид модулятора комплемента.
[0073] В некоторых вариантах осуществления пептид модулятора комплемента связан с антителом или его антигенсвязывающим фрагментом с помощью аминокислотного линкера. В некоторых вариантах осуществления аминокислотный линкер содержит аминокислотную последовательность любой из SEQ ID NO: 138, SEQ ID NO: 161, SEQ ID NO: 162, SEQ ID NO: 163, SEQ ID NO: 164, SEQ ID NO: 165, SEQ ID NO: 166, SEQ ID NO: 167, SEQ ID NO: 168, SEQ ID NO: 169, SEQ ID NO: 170, SEQ ID NO: 171, SEQ ID NO: 172, SEQ ID NO: 173, SEQ ID NO: 174, SEQ ID NO: 175, SEQ ID NO: 176, SEQ ID NO: 177, SEQ ID NO: 178, SEQ ID NO: 179, SEQ ID NO: 180, SEQ ID NO: 181, SEQ ID NO: 182, SEQ ID NO: 183, SEQ ID NO: 241, или SEQ ID NO: 242. В некоторых вариантах осуществления фармацевтическая композиция содержит антигенсвязывающий фрагмент, где антигенсвязывающий фрагмент включает фрагмент Fv, Fab, Fab', F(ab')2, или scFv. В некоторых вариантах осуществления конструкция слитого белка модулирует активность альтернативного пути комплемента у субъекта при введении фармацевтической композиции субъекту. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент или Fab связывает домен белка аннексина млекопитающих. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент или Fab связывает домен белка аннексина млекопитающих с аффинностью в KD 10-8M или меньше. В некоторых вариантах осуществления домен представляет собой центральный домен аннексина. В некоторых вариантах осуществления центральный домен аннексина включает альфа-спиральный домен. В некоторых вариантах осуществления центральный домен аннексина содержит сайт связывания кальция и сайт связывания с мембраной. В некоторых вариантах осуществления центральный домен аннексина содержит по меньшей мере одну последовательность повтора аннексина. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент или Fab связывает по меньшей мере одну последовательность повтора аннексина.
[0074] В некоторых вариантах осуществления антиген, ассоциированный с комплементом, включает фосфолипид, и где антитело или его антигенсвязывающий фрагмент или Fab связывает фосфолипид. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент или Fab связывает фосфолипид с аффинностью KD 10-8M или менее. В некоторых вариантах осуществления фосфолипид выбран из группы, состоящей из фосфатидилэтаноламина (ФЭ), кардиолипина (КЛ), фосфатидилхолина (ФХ) и малонового диальдегида (МДА). В некоторых вариантах осуществления антиген, ассоциированный с комплементом, включает белок комплемента C3 или его фрагмент, и где антитело или его антигенсвязывающий фрагмент или Fab связывает белок комплемента C3 или его фрагмент. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент или Fab связывает белок комплемента C3 или его фрагмент с аффинностью в KD 10-8M или менее. В некоторых вариантах осуществления фрагмент белка комплемента C3 представляет собой C3d. В некоторых вариантах осуществления пептид модулятора комплемента содержит белок рецептора комплемента 1 (CR1). В некоторых вариантах осуществления пептид модулятора комплемента содержит домен A белка CR1 или его фрагмент, который сохраняет по меньшей мере три коротких консенсусных повтора (SCR) домена A. В некоторых вариантах осуществления пептид модулятора комплемента содержит домен B белка CR1 или его фрагмент, который сохраняет по меньшей мере три SCR домена B.
[0075] В некоторых вариантах осуществления пептид модулятора комплемента содержит домен C белка CR1 или его фрагмент, который сохраняет по меньшей мере три SCR домена C. В некоторых вариантах осуществления фармацевтическая композиция дополнительно содержит домен D белка CR1 или его фрагмент, который сохраняет по меньшей мере три SCR домена D. В некоторых вариантах осуществления пептид модулятора комплемента содержит первые три SCR домена A, первые три SCR домена B и первые три SCR домена C белка CR1. В некоторых вариантах осуществления белок CR1 представляет собой белок CR1 человека. В некоторых вариантах осуществления полипептид модулятора комплемента представляет собой CR1 (1-10). В некоторых вариантах осуществления полипептид модулятора комплемента представляет собой CR1 (1-17). В некоторых вариантах осуществления CR1 (1-10) содержит аминокислотную последовательность SEQ ID NO: 41 или SEQ ID NO: 91, или его вариант с аминокислотной последовательностью, идентичной по меньшей мере на 85%. В некоторых вариантах осуществления CR1 (1-17) содержит аминокислотную последовательность SEQ ID NO: 42 или SEQ ID NO: 92, или его вариант с аминокислотной последовательностью, идентичной по меньшей мере на 85%. В некоторых вариантах осуществления пептид модулятора комплемента представляет собой фактор ускорения распада (DAF) или его биологически активный фрагмент. В некоторых вариантах осуществления DAF представляет собой DAF человека.
[0076] В некоторых вариантах осуществления биологически активный фрагмент DAF человека содержит по меньшей мере один из домена короткого консенсусного повтора (SCR) и богатого O-гликозилированным серином / треонином домена полноразмерного DAF человека. В некоторых вариантах осуществления биологически активный фрагмент DAF человека содержит SCR 1-4 или SCR 2-4 полноразмерного DAF человека. В некоторых вариантах осуществления биологически активный фрагмент DAF человека содержит аминокислотную последовательность SEQ ID NO: 184 или его вариант с аминокислотной последовательностью, идентичной по меньшей мере на 85%. В некоторых вариантах осуществления пептид модулятора комплемента представляет собой фактор H или его биологически активный фрагмент. В некоторых вариантах осуществления фактор H представляет собой человеческий фактор H. В некоторых вариантах осуществления биологически активный фрагмент человеческого фактора H содержит участок аминокислот, выбранный из группы, состоящей из: аминокислот 21-266, аминокислот 21-320, аминокислот 21-509 или аминокислот 19-1106 из SEQ ID NO: 9, или его вариант с аминокислотной последовательностью, по меньшей мере на 85% идентичной участку аминокислот. В некоторых вариантах осуществления биологически активный фрагмент человеческого фактора H содержит одну или более групп коротких консенсусных повторов (SCR), включающих SCR 1-20, SCR 1-2, SCR 2-3, SCR 3-4, SCR 4-5, SCR 5-6, SCR 6-7, SCR 7-8, SCR 8-9, SCR 9-10, SCR 10-11, SCR 11-12, SCR 12-13, SCR 13-14, SCR 14-15, SCR 15-16, SCR 16-17, SCR 17-18, SCR 19-20 полноразмерного человеческого фактора H или любую комбинацию SCR 1-20.
[0077] В некоторых вариантах осуществления биологически активный фрагмент человеческого фактора H содержит SCR 1-4 полноразмерного человеческого фактора H. В некоторых вариантах осуществления биологически активный фрагмент человеческого фактора H содержит SCR 1-5 полноразмерного человеческого фактора H. В некоторых вариантах осуществления биологически активный фрагмент человеческого фактора H содержит аминокислотную последовательность SEQ ID NO: 72 или SEQ ID NO: 108, или его вариант с аминокислотной последовательностью, идентичной по меньшей мере на 85%. В некоторых вариантах осуществления пептид модулятора комплемента представляет собой МСР или его биологически активный фрагмент. В некоторых вариантах осуществления MCP представляет собой MCP человека. В некоторых вариантах осуществления биологически активный фрагмент MCP человека содержит по меньшей мере один из домена коротких консенсусных повторов (SCR) полноразмерного MCP человека. В некоторых вариантах осуществления биологически активный фрагмент MCP человека содержит SCR с 3 по 4 полноразмерного MCP человека. В некоторых вариантах осуществления биологически активный фрагмент MCP человека содержит аминокислотную последовательность SEQ ID NO: 187 или его вариант с аминокислотной последовательностью, идентичной по меньшей мере на 85%.
[0078] В некоторых вариантах осуществления пептид модулятора комплемента представляет собой Map44 или его биологически активный фрагмент. В некоторых вариантах осуществления Map44 представляет собой человека Map44. В некоторых вариантах осуществления Map44 содержит аминокислотную последовательность SEQ ID NO: 186 или его вариант с аминокислотной последовательностью, идентичной по меньшей мере на 85%. В некоторых вариантах осуществления пептид модулятора комплемента представляет собой CD59 или его биологически активный фрагмент. В некоторых вариантах осуществления CD59 представляет собой человека CD59. В некоторых вариантах осуществления CD59 содержит аминокислотную последовательность SEQ ID NO: 185 или его вариант с аминокислотной последовательностью, идентичной по меньшей мере на 85%. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент представляет собой антитело человека или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент представляет собой гуманизированное антитело или его антигенсвязывающий фрагмент.
[0079] В еще одном варианте осуществления предложен полинуклеотид, кодирующий слитый белок. Другой вариант осуществления обеспечивает способ лечения, включающий обеспечение субъекту терапевтически эффективного количества фармацевтической композиции. В некоторых вариантах осуществления субъект имеет комплемент-опосредованное воспаление. В некоторых вариантах осуществления комплемент-опосредованное воспаление включает воспалительное фиброзное заболевание, и при этом воспалительное фиброзное заболевание включает фокально-сегментарный гломерулосклероз, первичный склерозирующий холангит или мембранопролиферативный гломерулонефрит. В некоторых вариантах осуществления субъект имеет комплемент-опосредованное аутоиммунное заболевание, включающее ревматоидный артрит, системную красную волчанку, волчаночный нефрит или обыкновенную пузырчатку. В некоторых вариантах осуществления субъект имеет комплемент-опосредованное заболевание почек, включая мембранопролиферативный гломерулонефрит или комплемент 3 - гломерулопатию. В некоторых вариантах осуществления субъект страдает комплемент-опосредованным сердечно-сосудистым заболеванием. В некоторых вариантах осуществления сердечно-сосудистое заболевание включает атеросклероз или тромбоз. В некоторых вариантах осуществления субъект имеет комплемент-опосредованное дерматологическое заболевание. В некоторых вариантах осуществления дерматологическое заболевание включает псориаз, инверсное акне, красную волчанку, кожный васкулит мелких сосудов, крапивницу, уртикарный васкулит и буллезный пемфигоид.
[0080] В некоторых вариантах осуществления комплемент-опосредованное воспаление связано с патологическим состоянием или заболеванием, выбранным из группы, состоящей из следующего: ишемически-реперфузионное повреждение, ожоговое поражение, эндотоксемия и септический шок, респираторный дистресс-синдром взрослых, искусственное кровообращение, гемодиализ, анафилактический шок, астма, ангионевротический отек, болезнь Крона, серповидноклеточная анемия, гломерулонефрит, мембранозный нефрит, панкреатит, отторжение трансплантата, сверхострое отторжение ксенотрансплантата, повторная угроза выкидыша, преэклампсия, лекарственная аллергия, индуцированный ИЛ-2 синдром транссудации, аллергия на рентгеноконтрастное вещество, миастения, болезнь Альцгеймера, рассеянный склероз, ревматоидный артрит, системная красная волчанка, инсулинозависимый сахарный диабет, острый диссеминированный энцефаломиелит, болезнь Аддисона, синдром антифосфолипидных антител, аутоиммунный гепатит, синдром Гудпасчера, болезнь Грейвса, синдром Гийена-Барре, болезнь Хашимото, идиопатическая тромбоцитопеническая пурпура, пузырчатка, синдром Шегрена, синдром Такаясу, инфаркт миокарда, инсульт, острый респираторный дистресс-синдром, сепсис, плазмаферез, тромбоцитферез, лейкоферез, экстракорпоральная мембранная оксигенация, гепарин-индуцированная экстракорпоральная преципитация ЛПНП, воспаление кишечника, крапивница, и васкулит и волчаночный нефрит.
[0081] В некоторых вариантах осуществления субъект имеет патологическое состояние или заболевание, выбранное из группы, состоящей из следующего: ишемически-реперфузионное повреждение, ревматоидный артрит (РА), волчаночный нефрит, ишемически-реперфузионное повреждение, атипичный гемолитико-уремический синдром (аГУС), типичный или инфекционный гемолитико-уремический синдром (тГУС), болезнь плотного осадка (БПО), пароксизмальная ночная гемоглобинурия (ПНГ), рассеянный склероз (РС), макулярная дегенерация, синдром гемолиза, повышения печеночных ферментов и низких тромбоцитов (HELLP), сепсис, дерматомиозит, диабетическая ретинопатия, тромботическая тромбоцитопеническая пурпура (ТТП), спонтанная угроза выкидыша, pauci - иммунный васкулит, буллезный эпидермолиз, повторная угроза выкидыша, рассеянный склероз (РС), черепно-мозговая травма, сердечно-сосудистое заболевание, миокардит, нарушение мозгового кровообращения, нарушение со стороны периферических сосудов, реноваскулярное заболевание, нарушение сосудистого генеза брыжейки/ кишечника, реваскуляризация трансплантатов и/или приживленных органов, васкулит, нефрит при пурпуре Шенлейна-Геноха, васкулит, связанный с системной красной волчанкой, васкулит, связанный с ревматоидным артритом, геморрагический васкулит, болезнь Такаясу, синдром капиллярной утечки, дилатационная кардиомиопатия, диабетическая ангиопатия, аневризм торако-абдоминальной аорты, синдром Кавасаки (артериит), венозная газовая эмболия (ВГЭ), и рестеноз после установки стента, ротационной атерэктомии, чрескожной транслюминальной коронарной ангиопластики (ЧТКА), миастения гравис, болезнь холодовых агглютининов (БХА), пароксизмальная холодовая гемоглобинурия (ПХГ), дерматомиозит, склеродермия, сердечная аутоиммунная гемолитическая анемия, болезнь Грейвса, тиреоидит Хашимото, сахарный диабет I типа, псориаз, пузырчатка, аутоиммунная гемолитическая анемия (АИГА), идиопатическая тромбоцитопеническая пурпура (ИТП), синдром Гудпасчера, антифосфолипидный синдром (АФС), синдром Дегоса и катастрофический антифосфолипидный синдром (КАФС).
[0082] В некоторых вариантах осуществления субъект может иметь патологическое состояние или заболевание, выбранное из группы, состоящей из следующего: возрастная макулярная дегенерация (ВМД), мембранопролиферативный гломерулонефрит II типа (МПГН II), гемолитико-уремический синдром (ГУС), астма, амилоидоз и тромботическая тромбоцитопеническая пурпура. В некоторых вариантах осуществления гемолитико-уремический синдром (ГУС) представляет собой атипичный гемолитико-уремический синдром (аГУС). В некоторых вариантах осуществления субъект может иметь ассоциированное с друзами заболевание или связанное с друзами заболевание. В некоторых вариантах осуществления связанное с друзами заболевание может представлять собой амилоидоз, эластоз, болезнь плотного осадка, гломерулонефрит, атеросклероз или связанное с друзами глаз заболевание.
[0083] В дополнительном варианте осуществления предложена конструкция слитого белка, которая связывает антиген, ассоциированный с комплементом, при этом конструкция мономерного слитого белка содержит: первый полипептид, содержащий: домен A, и домен B, расположенные от N-конца к C-концу в ориентации A-B, второй полипептид, содержащий: домен E и домен F, расположенные от N-конца к C-концу в ориентации E-F, где по меньшей мере один из домена A и домена E может быть конъюгирован с доменом R, и где: домен A может включать аминокислотную последовательность вариабельной области тяжелой цепи (VH), или его антигенсвязывающий фрагмент, домен В включает аминокислотную последовательность константной области тяжелой цепи CH1, домен R включает полипептид модулятора комплемента, домен E может содержат аминокислотную последовательность вариабельной области легкой цепи (VL), или его антигенсвязывающий фрагмент, а домен F может включать аминокислотную последовательность константной области легкой цепи (CL1). В некоторых вариантах осуществления первый полипептид содержит домен A, домен B и домен R, где домены первого полипептида расположены от N-конца к C-концу в ориентации R-A-B, и где домен R и домен A конъюгированы. В некоторых вариантах осуществления второй полипептид содержит домен E, домен F и домен R, где домены второго полипептида расположены от N-конца к C-концу в ориентации R-E-F, и где домен E и домен R конъюгированы.
[0084] В еще одном варианте осуществления предложена конструкция слитого белка, содержащая: антитело или его антигенсвязывающий фрагмент, которое специфически связывается с белком комплемента 3d (c3d), и две молекулы полипептида модулятора комплемента, где каждая молекула полипептида модулятора комплемента содержит биологически активный фрагмент белка комплемента, выбранного из группы, состоящей из CR1, DAF, MCP, Crry, MAp44, MAp19, CD59 и фактора H, при этом конструкция слитого белка имеет более низкую концентрацию полумаксимального ингибирования в анализе комплемента по сравнению с конструкцией белка для сравнения, которая не содержит антитело, но в остальном идентична.
[0085] В некоторых вариантах осуществления каждая молекула полипептида модулятора комплемента может быть конъюгирована с тяжелой цепью антитела или его антигенсвязывающего фрагмента. В некоторых вариантах осуществления каждая молекула полипептида модулятора комплемента может быть конъюгирована с С-концом тяжелой цепи.
[0086] В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент может содержать первый полипептид и второй полипептид, где первый полипептид может содержать последовательность тяжелой цепи, содержащую аминокислотную последовательность по меньшей мере одного из: SEQ ID NO: 54, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 67, SEQ ID NO: 69, SEQ ID NO: 70, SEQ ID NO: 71, SEQ ID NO: 73, SEQ ID NO: 74, SEQ ID NO: 75, SEQ ID NO: 76, SEQ ID NO: 78, SEQ ID NO: 80, EQ ID NO: 81, SEQ ID NO: 82, SEQ ID NO: 85, SEQ ID NO: 87, SEQ ID NO: 88, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 243, SEQ ID NO: 282, SEQ ID NO: 284, SEQ ID NO: 285, и SEQ ID NO: 286; и второй полипептид может содержать последовательность легкой цепи, содержащую аминокислотную последовательность по меньшей мере одной из: SEQ ID NO: 59, SEQ ID NO: 68, SEQ ID NO: 77, SEQ ID NO: 79, SEQ ID NO: 84, SEQ ID NO: 86, SEQ ID NO: 135 и SEQ ID NO: 27.
[0087] В некоторых вариантах осуществления первый полипептид может содержать по меньшей мере две аминокислотные последовательности, выбранные из группы, состоящей из SEQ ID NO: 54, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 67, SEQ ID NO: 69, SEQ ID NO: 70, SEQ ID NO: 71, SEQ ID NO: 73, SEQ ID NO: 74, SEQ ID NO: 75, SEQ ID NO: 76, SEQ ID NO: 78, SEQ ID NO: 80, EQ ID NO: 81, SEQ ID NO: 82, SEQ ID NO: 85, SEQ ID NO: 87, SEQ ID NO: 88, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 243, SEQ ID NO: 282, SEQ ID NO: 284, SEQ ID NO: 285, и SEQ ID NO: 286; и второй полипептид может содержать по меньшей мере две аминокислотные последовательности, выбранные из группы, состоящей из SEQ ID NO: 59, SEQ ID NO: 68, SEQ ID NO: 77, SEQ ID NO: 79, SEQ ID NO: 84, SEQ ID NO: 86, SEQ ID NO: 135, и SEQ ID NO: 279.
[0088] В некоторых вариантах осуществления по меньшей мере две аминокислотные последовательности первого полипептида могут быть одной и той же аминокислотной последовательностью, и по меньшей мере две аминокислотные последовательности второго полипептида могут быть одной и той же аминокислотной последовательностью. В некоторых вариантах осуществления по меньшей мере две аминокислотные последовательности первого полипептида могут представлять собой SEQ ID NO: 282 или SEQ ID NO: 285, а по меньшей мере две аминокислотные последовательности второго полипептида могут представлять собой SEQ ID NO: 279.
[0089] В некоторых вариантах осуществления конструкция слитого белка дополнительно содержит линкер. В некоторых вариантах осуществления линкер может содержать аминокислотную последовательность любого из SEQ ID NO: 138, SEQ ID NO: 161, SEQ ID NO: 162, SEQ ID NO: 163, SEQ ID NO: 164, SEQ ID NO: 165, SEQ ID NO: 166, SEQ ID NO: 167, SEQ ID NO: 168, SEQ ID NO: 169, SEQ ID NO: 170, SEQ ID NO: 171, SEQ ID NO: 172, SEQ ID NO: 173, SEQ ID NO: 174, SEQ ID NO: 175, SEQ ID NO: 176, SEQ ID NO: 177, SEQ ID NO: 178, SEQ ID NO: 179, SEQ ID NO: 180, SEQ ID NO: 181, SEQ ID NO: 182, SEQ ID NO: 183, SEQ ID NO: 241, или SEQ ID NO: 242.
[0090] В некоторых вариантах осуществления белок комплемента представляет собой фактор H или его биологически активный фрагмент. В некоторых вариантах осуществления фактор H или его биологически активный фрагмент может содержать аминокислотную последовательность SEQ ID NO: 72 или SEQ ID NO: 108, или его вариант с аминокислотной последовательностью, идентичной по меньшей мере на 85%.
[0091] В некоторых вариантах осуществления белок комплемента представляет собой CR1 или его фрагмент. В некоторых вариантах осуществления белок комплемента может содержать аминокислотную последовательность SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 91 или SEQ ID NO: 92 или их вариант с аминокислотной последовательностью, идентичной по меньшей мере на 85%.
[0092] В некоторых вариантах осуществления конструкция слитого белка может содержать аминокислотную последовательность по меньшей мере одной из SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 63, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 69, SEQ ID NO: 70, SEQ ID NO: 71, SEQ ID NO: 72, SEQ ID NO: 75, SEQ ID NO: 76, SEQ ID NO: 77, SEQ ID NO: 78, SEQ ID NO: 79, SEQ ID NO: 80, SEQ ID NO: 82, SEQ ID NO: 83, SEQ ID NO: 84, SEQ ID NO: 85, SEQ ID NO: 86, SEQ ID NO: 87, SEQ ID NO: 88, SEQ ID NO: 90, SEQ ID NO: 93, SEQ ID NO: 94, SEQ ID NO: 95, SEQ ID NO: 96, SEQ ID NO: 97, SEQ ID NO: 98, SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 105, SEQ ID NO: 106, SEQ ID NO: 107, SEQ ID NO: 109, SEQ ID NO: 110, SEQ ID NO: 111, SEQ ID NO: 113, SEQ ID NO: 114, SEQ ID NO: 115, SEQ ID NO: 116, SEQ ID NO: 117, SEQ ID NO: 118, SEQ ID NO: 119, SEQ ID NO: 120, SEQ ID NO: 121, SEQ ID NO: 122, SEQ ID NO: 123, SEQ ID NO: 124, SEQ ID NO: 125, SEQ ID NO: 126, SEQ ID NO: 127, SEQ ID NO: 128, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 279, SEQ ID NO: 282, и SEQ ID NO: 285.
[0093] В другом варианте осуществления предложена конструкция слитого белка, содержащая: антитело или его антигенсвязывающий фрагмент, которое специфически связывается с антигеном, ассоциированным с комплементом, где антитело содержит первый полипептид и второй полипептид, причем каждый из первого полипептида и второго полипептида содержит тяжелую цепь и легкую цепь; и первую молекулу и вторую молекулу полипептида модулятора комплемента, причем первая молекула и вторая молекула каждая содержит биологически активный фрагмент белка комплемента, выбранный из группы, состоящей из: CR1, DAF, MCP, Crry, MAp44, MAp19, CD59 и фактора H, причем при введении конструкции слитого белка субъекту, страдающему заболеванием, соотношение альбумина к креатинину в образце мочи от субъекта, страдающего заболеванием, ниже, чем соотношение альбумина к креатину в образце мочи от субъекта, которому вводят сопоставимую конструкцию слитого белка, в которой сопоставимая конструкция слитого белка не содержит антитела или его антигенсвязывающего фрагмента, но в остальном идентична
[0094] В некоторых вариантах осуществления заболевание представляет собой комплемент-опосредованное заболевание почек. В некоторых вариантах осуществления комплемент-опосредованное заболевание почек представляет собой мембранопролиферативный гломерулонефрит или комплемент 3 - гломерулопатию.
[0095] В некоторых вариантах осуществления соотношение альбумина к креатинину в образце мочи субъекта, страдающего заболеванием, может быть по меньшей мере на 1%, 2%, 3%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85% ниже (например, чем у субъекта, которому вводят сопоставимую конструкцию слитого белка).
[0096] В еще одном варианте осуществления предложена конструкция слитого белка, которая содержит: антитело или его антигенсвязывающий фрагмент, содержащее: тяжелую цепь, содержащую аминокислотную последовательность по меньшей мере одной из SEQ ID NO: 54, 58, 60, 61, 64, 65, 67, 69, 70, 71, 73, 74, 75, 76, 78, 80, 81, 82, 85, 87, 88, 89, 98, 99, 112, 132, 133, 134, 145, 153, 194, 202, 210, 218, 226, 234, 238, 243, 244, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 261, 262, 263, 264, 265, 270, 271, 272, 273, 274, 280, 281, 282, 283, 284, 285, 286, 288, 290, и 342; и легкую цепь, содержащую аминокислотную последовательность по меньшей мере одного из SEQ ID NO: 45, 59, 68, 77, 79, 84, 86, 135, 195, 203, 211, 219, 227, 235, 256, 257, 258, 266, 267, 268, 269, 275, 276, 277, 278, 279, 287, и 289; или тяжелую цепь, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами в пределах по меньшей мере одной из SEQ ID NO: 54, 58, 60, 61, 64, 65, 67, 69, 70, 71, 73, 74, 75, 76, 78, 80, 81, 82, 85, 87, 88, 89, 98, 99, 112, 132, 133, 134, 145, 153, 194, 202, 210, 218, 226, 234, 238, 243, 244, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 261, 262, 263, 264, 265, 270, 271, 272, 273, 274, 280, 281, 282, 283, 284, 285, 286, 288, 290, и 342; и легкую цепь, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами в пределах по меньшей мере одной из SEQ ID NO:45, 59, 68, 77, 79, 84, 86, 135, 195, 203, 211, 219, 227, 235, 256, 257, 258, 266, 267, 268, 269, 275, 276, 277, 278, 279, 287, и 289.
[0097] В некоторых вариантах осуществления конструкция слитого белка может дополнительно содержать полипептид модулятора комплемента, где полипептид модулятора комплемента включает по меньшей мере один из белка рецептора комплемента 1 (CR1), DAF, MCP, Crry, MAp44, MAp19, CD59, фактора H и их биологически активных фрагментов.
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
[0098] Все публикации, патенты, заявки на патенты и номера доступа NCBI, упомянутые в данном описании, включены в данный документ посредством ссылки в той же степени, как если бы каждая отдельная публикация, патент или заявка на патент были конкретно и отдельно указаны для включения посредством ссылки, и как если бы они были изложены полностью. В случае противоречия между термином, используемым в данном документе, и термином, определенным во включенной ссылке, определение по этому изобретению имеет преимущественную силу.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0099] Новые свойства изобретения подробно изложены в прилагаемой формуле изобретения. Лучшее понимание свойств и преимуществ данного изобретения будет получено на основе следующего подробного описания, в котором изложены иллюстративные варианты осуществления, в которых используются принципы данного изобретения, и сопроводительных графических материалов, в которых:
[00100] На Фиг. 1 показана иллюстративная конструкция мономерного слитого белка по данному изобретению, содержащая связь между легкой цепью нацеливающего фрагмента и полипептидом модулятора комплемента. Полипептид модулятора комплемента соединен с N-концом легкой цепи через линкер.
[00101] На Фиг. 2 показана иллюстративная конструкция мономерного слитого белка по данному изобретению, содержащая связь между тяжелой цепью нацеливающего фрагмента и полипептидом модулятора комплемента. Полипептид модулятора комплемента соединен с N-концом тяжелой цепи через линкер.
[00102] На Фиг. 3 показана иллюстративная конструкция мономерного слитого белка по данному изобретению, содержащая связь между тяжелой цепью нацеливающего фрагмента и полипептидом модулятора комплемента. Полипептид модулятора комплемента соединен с C-концом тяжелой цепи через линкер.
[00103] На Фиг. 4 показана иллюстративная конструкция мономерного слитого белка по данному изобретению, содержащую связь между легкой цепью нацеливающего фрагмента и полипептидом модулятора комплемента. Полипептид модулятора комплемента соединен с C-концом легкой цепи через линкер.
[00104] На Фиг. 5 показана иллюстративная конструкция четырехвалентного гомодимерного слитого белка по данному изобретению, содержащая связь между тяжелой цепью нацеливающего фрагмента и полипептидом модулятора комплемента. Полипептид модулятора комплемента соединен с C-концом тяжелой цепи через линкер.
[00105] На Фиг. 6 показана иллюстративная конструкция четырехвалентного гомодимерного слитого белка по данному изобретению, содержащая связь между тяжелой цепью нацеливающего фрагмента и полипептидом модулятора комплемента. Полипептид модулятора комплемента соединен с N-концом тяжелой цепи через линкер.
[00106] На Фиг. 7 показана иллюстративная конструкция трехвалентного гетеродимерного слитого белка по данному изобретению, содержащая связь между тяжелой цепью нацеливающего фрагмента и полипептидом модулятора комплемента. Полипептид модулятора комплемента соединен с C-концом тяжелой цепи через линкер.
[00107] На Фиг. 8 показана иллюстративная конструкция трехвалентного гетеродимерного слитого белка по данному изобретению, содержащая связь между тяжелой цепью нацеливающего фрагмента и полипептидом модулятора комплемента. Полипептид модулятора комплемента соединен с N-концом тяжелой цепи через линкер.
[00108] На Фиг. 9 показана иллюстративная конструкция четырехвалентного гомодимерного слитого белка по данному изобретению, содержащая связь между легкой цепью нацеливающего фрагмента и полипептидом модулятора комплемента. Полипептид модулятора комплемента соединен с C-концом легкой цепи через линкер.
[00109] На Фиг. 10 показана иллюстративная конструкция четырехвалентного гомодимерного слитого белка по данному изобретению, содержащая связь между легкой цепью нацеливающего фрагмента и полипептидом модулятора комплемента. Полипептид модулятора комплемента соединен с N-концом легкой цепи через линкер.
[00110] На Фиг. 11 показана иллюстративная конструкция трехвалентного гетеродимерного слитого белка по данному изобретению, содержащая связь между легкой цепью нацеливающего фрагмента и полипептидом модулятора комплемента. Полипептид модулятора комплемента соединен с N-концом легкой цепи через линкер.
[00111] На Фиг. 12 показана иллюстративная конструкция трехвалентного гетеродимерного слитого белка по данному изобретению, содержащая связь между легкой цепью нацеливающего фрагмента и полипептидом модулятора комплемента. Полипептид модулятора комплемента соединен с C-концом легкой цепи через линкер.
[00112] На Фиг. 13 показана иллюстративная конструкция слитого белка по данному изобретению, содержащая связь между N-концом области Fc нацеливающего фрагмента и полипептидом модулятора комплемента.
[00113] На Фиг. 14 показаны иллюстративные схемы конструкций слитого белка анти-C2-модулятор комплемента по данному изобретению.
[00114] На Фиг. 15 показаны иллюстративные схемы конструкций слитого белка анти-C3d-модулятор комплемента по данному изобретению.
[00115] На Фиг. 16 показаны иллюстративные схемы конструкций слитого белка анти-C3d-модулятор комплемента по данному изобретению.
[00116] На Фиг. 17 показаны иллюстративные схемы конструкций слитого белка анти-C3d-модулятор комплемента по данному изобретению.
[00117] На Фиг. 18 показаны иллюстративные схемы конструкций слитого белка анти-C3d-модулятор комплемента по данному изобретению.
[00118] На Фиг. 19 показана иллюстративная конструкция слитого белка по данному изобретению, четырехвалентный гетеродимер, содержащий два разных полипептида модулятора комплемента, соединенных с С-концом тяжелой цепи через полипептидный линкер.
[00119] На Фиг. 20 показано картирование линейных эпитопов PEPperMAP® и результаты для пяти удлиненных антител IgG1 мыши против C3dg. Линейные эпитопы C3d определяли с использованием технологии PEPperPRINT (PEPperPRINT GmbH, Гейдельберг, Германия). Пептиды длиной 15 аминокислот, полученные из первичной последовательности C3dg, смещенной на одну аминокислоту, были синтезированы в двух повторностях на микроматрице PEPperPRINT. Затем чип последовательно инкубировали с антителами (например, 3d8b, 3d9a, 3d29) и окрашивали меченным красителем DyLight680 вторичным козьим антителом к IgG мыши (H + L). Микроматрицу считывали с использованием системы визуализации LI-COR Odyssey и анализировали с помощью PEPperPRINT.
[00120] На Фиг. 21 показано распознавание эпитопа на С-конце C3dg иллюстративным антителом 3d29 к C3d. На Фиг. 21 показаны SEQ ID NO: 301-341 на оси x графика, соответственно, по порядку и последовательность «NLDVSLQLPS» как SEQ ID NO: 299.
[00121] На Фиг. 22 показано распознавание эпитопа на С-конце C3dg иллюстративным антителом 3d8b к C3d. На Фиг. 22 показаны SEQ ID NO: 301-341 на оси x графика, соответственно, по порядку и последовательность «NLDVSLQLPS» как SEQ ID NO: 299.
[00122] На Фиг. 23 показано распознавание эпитопа на С-конце C3dg иллюстративным антителом 3d9a к C3d. На Фиг. 23 показаны SEQ ID NO: 301-341 на оси x графика, соответственно, по порядку и последовательность «NLDVSLQLPS» как SEQ ID NO: 299.
[00123] На Фиг. 24 показано картирование эпитопа с использованием отрицательного контрольного антитела к C3d, которое не связывало линейный эпитоп, протестированного при различных концентрациях. На Фиг. 24 показаны SEQ ID NO: 301-341 на оси x графика, соответственно, по порядку.
[00124] На Фиг. 25 показано картирование эпитопа с использованием отрицательного контрольного антитела к C4d, протестированного при различных концентрациях. На Фиг. 25 показаны SEQ ID NO: 301-341 на оси x графика, соответственно, по порядку
[00125] На Фиг. 26A-26L показаны иллюстративные схемы конструкций слитого белка анти-C2-модулятор комплемента (CR1) по данному изобретению. На Фиг. 26A показана конструкция слитого белка, содержащая полипептид CR1 (1-10) и иллюстративный scFv к C2, где полипептид CR1 (1-10) соединен с С-концом вариабельного домена легкой цепи иллюстративного scFv к C2. На Фиг. 26B показана конструкция слитого белка, содержащая полипептид Crry и иллюстративный scFv к C2, где полипептид Crry соединен с С-концом вариабельного домена легкой цепи иллюстративного scFv к C2. На Фиг. 26C показана конструкция слитого белка, содержащая полипептид Crry и иллюстративный C2-Fab, где полипептид Crry соединен с С-концом тяжелой цепи иллюстративного Fab к C2. . На Фиг. 26D показана конструкция слитого белка, содержащая полипептид CR1 (1-10) и иллюстративный Fab к C2, где полипептид CR1 (1-10) соединен с N-концом тяжелой цепи иллюстративного Fab к C2. На Фиг. 26E показана конструкция слитого белка, содержащая полипептид CR1 (1-10) и иллюстративный Fab к C2, где CR1 (1-10) соединен с С-концом тяжелой цепи иллюстративного Fab к C2. На Фиг. 26F показана конструкция слитого белка, содержащая полипептид CR1 (1-17) и иллюстративный Fab к C2, где полипептид CR1 (1-17) соединен с N-концом тяжелой цепи иллюстративного Fab к C2. На Фиг. 26G показана конструкция слитого белка, содержащая полипептид CR1 (1-17) и иллюстративный Fab к C2, где полипептид CR1 (1-17) соединен с C-концом тяжелой цепи иллюстративного Fab к C2. На Фиг. 26H показана конструкция слитого белка, содержащая один полипептид CR1 (1-10) и иллюстративное полноразмерное антитело к C2, где CR1 (1-10) соединен с С-концом одной из тяжелых цепей иллюстративного полноразмерного антитела к С2, где конструкция слитого белка содержит конструкцию гетеродимерного антитела типа «выступ-во-впадину». На Фиг. 26I показана конструкция слитого белка, содержащая два полипептида CR1 (1-10) и иллюстративное полноразмерное антитело к C2, где каждый C-конец каждой тяжелой цепи примерного полноразмерного антитела к C2 соединен с одним полипептидом CR1 (10), где конструкция слитого белка содержит конструкцию гетеродимерного антитела типа «выступ-во-впадину». На Фиг. 26J показана конструкция слитого белка, содержащая один полипептид CR1 (1-10) и иллюстративный фрагмент антитела к С2, содержащий вариабельную область тяжелой цепи, вариабельную область легкой цепи и константную область, где один полипептид CR1 (10) соединен с N-концом константной области CH2-CH3 иллюстративного фрагмента антитела к C2. На Фиг. 26K показана конструкция слитого белка, содержащая один полипептид CR1 (1-10) и иллюстративное полноразмерное антитело к C2, где один полипептид CR1 (10) соединен с N-концом одной из легких цепей иллюстративного полноразмерного антитела к C2. На Фиг. 26L показана конструкция слитого белка, содержащая один полипептид CR1 (1-10) и иллюстративное полноразмерное антитело к C2, где один полипептид CR1 (10) соединен с N-концом одной из тяжелых цепей иллюстративного полноразмерного антитела к C2.
[00126] На Фиг. 27A-27E показаны иллюстративные схемы конструкций слитого белка анти-C3d (3d29)-модулятор комплемента (CR1 или фактор H) по данному изобретению. На Фиг. 27A показана конструкция слитого белка, содержащая полипептид Crry и иллюстративный анти-C3d-Fab, где полипептид Crry соединен с С-концом тяжелой цепи иллюстративного анти-C3d-Fab. На Фиг. 27B показана конструкция слитого белка, содержащая полипептид CR1 (1-10) и иллюстративный анти-C3d Fab, где полипептид CR1 (1-10) соединен с С-концом тяжелой цепи иллюстративного анти-C3d Fab. На Фиг. 27C показана конструкция слитого белка, содержащая фактор H и иллюстративный анти-C3d Fab, где фактор H соединен с С-концом тяжелой цепи иллюстративного анти-C3d Fab. На Фиг. 27D показана конструкция слитого белка, содержащая один полипептид фактора H и иллюстративное полноразмерное антитело к C3d, где полипептид одного фактора H соединен с С-концом тяжелой цепи иллюстративного полноразмерного антитела к C3d. На Фиг. 27E показана конструкция слитого белка, содержащая два полипептида одного фактора H и иллюстративное полноразмерное антитело к C3d, где C-конец каждой тяжелой цепи иллюстративного полноразмерного антитела к C3d соединен с полипептидом единственного фактора H.
[00127] На Фиг. 28A-28H показаны иллюстративные схемы конструкций слитого белка анти-C3d (3d8b)-модулятор комплемента (CR1 или фактор H) по данному изобретению. На Фиг. 28A показана конструкция слитого белка, содержащая полипептид Crry и иллюстративный Fab против C3d, где Crry соединен с С-концом тяжелой цепи иллюстративного анти-C3d Fab. На Фиг. 28B показана конструкция слитого белка, содержащая полипептид CR1 (1-10) и иллюстративный анти-C3d Fab, где полипептид CR1 (1-10) соединен с С-концом тяжелой цепи иллюстративного анти-C3d Fab. На Фиг. 28C показана конструкция слитого белка, содержащая полипептид фактора H и иллюстративный анти-C3d Fab, где полипептид фактора H соединен с С-концом тяжелой цепи иллюстративного анти-C3d Fab. На Фиг. 28D показана конструкция слитого белка, содержащая один полипептид CR1 (1-10) и иллюстративное полноразмерное антитело к C3d, где единственный полипептид CR1 (1-10) соединен с С-концом одной из легких цепей иллюстративного полноразмерного антитела к C3d. На Фиг. 28E показана конструкция слитого белка, содержащая один полипептид CR1 (1-10) и иллюстративное полноразмерное антитело к C3d, где один полипептид CR1 (1-10) соединен с С-концом одной из тяжелых цепей иллюстративного полноразмерного антитела. На Фиг. 28F показана конструкция слитого белка, содержащая два полипептида CR1 (1-10) и иллюстративное полноразмерное антитело к C3d, где С-конец каждой тяжелой цепи иллюстративного полноразмерного антитела к C3d соединен с одним полипептидом CR1 (1-10). На Фиг. 28G показана конструкция слитого белка, содержащая полипептид одного фактора H и иллюстративное полноразмерное антитело к C3d, где полипептид одного фактора H соединен с С-концом одной из тяжелых цепей иллюстративного полноразмерного антитела к C3d. На Фиг. 28H показана конструкция слитого белка, содержащая два полипептида фактора H и иллюстративное полноразмерное антитело к C3d, где C-конец каждой тяжелой цепи иллюстративного полноразмерного антитела к C3d соединен с одним полипептидом фактора H.
[00128] На Фиг. 29A-29C показаны иллюстративные схемы конструкций слитого белка анти-C3d (3d8b)-модулятор комплемента (фактор H) по данному изобретению. На Фиг. 29A показан fH 1-5 - мышиный IgG1 3d8b с тяжелыми цепями (модулятор комплемента соединен с N-концом тяжелой цепи через линкер). На Фиг. 29B показана легкая каппа-цепь 3d8b - fH 1-5 (модулятор комплемента соединен с С-концом легкой цепи через линкер). На Фиг. 29C показана fH 1-5 - легкая каппа-цепь 3d8b (модулятор комплемента соединен с N-концом легкой цепи через линкер).
[00129] На Фиг. 30 показан иллюстративная схема конструкций слитого белка IgG1-модулятор комплемента (фактор H) по данному изобретению, где модулятор комплемента (фактор H) соединен с шарнирной областью IgG1 через линкер.
[00130] На Фиг. 31A-31F показаны иллюстративные схемы конструкций слитого белка анти-C3d (3d8b)-модулятор комплемента (CR1 1-17) по данному изобретению.На Фиг. 31A показана конструкция слитого белка, содержащая один полипептид CR1 (1-17) и иллюстративный фрагмент Fab антитела к C3d 3d8b, где C-конец тяжелой цепи иллюстративного фрагмента Fab соединен с одним полипептидом CR1 (1-17).На Фиг. 31B показана конструкция слитого белка, содержащая один полипептид CR1 (1-17) и иллюстративное полноразмерное антитело к C3d 3d8b, где С-конец одной из тяжелых цепей иллюстративного полноразмерного антитела к C3d 3d8b соединен с одним полипептидом CR1 (1-17).На Фиг. 31C показана конструкция слитого белка, содержащая два полипептида CR1 (1-17) и иллюстративное полноразмерное антитело к C3d 3d8b, где С-конец каждой из тяжелых цепей иллюстративного полноразмерного антитела к C3d 3d8b связан с одним полипептидом CR1 (1-17). На Фиг. 31D показана конструкция слитого белка, содержащая два полипептида CR1 (1-17) и иллюстративное полноразмерное антитело к C3d 3d8b, где С-конец каждой из легких цепей иллюстративного полноразмерного антитела к C3d 3d8b соединен с одним полипептидом CR1 (1-17). На Фиг. 31E показана конструкция слитого белка, содержащая два полипептида CR1 (1-17) и иллюстративное полноразмерное антитело к C3d 3d8b, где N-конец каждой из тяжелых цепей иллюстративного полноразмерного антитела к C3d 3d8b соединен с одним полипептидом CR1 (1-17). На Фиг. 31F показана конструкция слитого белка, содержащая два полипептида CR1 (1-17) и иллюстративное полноразмерное антитело к C3d 3d8b, где N-конец каждой из легких цепей иллюстративного полноразмерного антитела к C3d 3d8b соединен с одним полипептидом CR1 (1-17).
[00131] На Фиг. 32A - 32B показана количественная оценка C3-положительного окрашивания, которую выражают в виде процента от общей площади клубочков (анализ при помощи программного обеспечения ImageJ) или в виде полуколичественной оценки. На Фиг. 32A показано окрашивание гломерулярных отложений C3 в собранных почках, измеренное с помощью иммунофлуоресценции (ИФ). На Фиг. 32 B показаны отложения C3 собранных печеней с использованием ИФ.
[00132] На Фиг. 33A-33B показана количественная оценка C3-положительного окрашивания, которую выражают в виде процента от общей площади клубочков (анализ при помощи программного обеспечения ImageJ) или в виде полуколичественной оценки. На Фиг. 33A показано окрашивание гломерулярных отложений C3 в собранных почках, измеренное с помощью ИФ. На Фиг. 33B показаны отложения C3 собранных печеней с использованием ИФ.
[00133] На Фиг. 34 показан процент объема зоны инфаркта у мышей Balb/c.
[00134] На Фиг. 35 показана дельта в соотношении альбумин: креатинин в моче (uACR) у мышей, пораженных адриамицином, между 8 и 22 днями исследования. 8-й день предшествует лечению, а 22-й день представляет собой 12 дней после введения ингибиторов комплемента (после лечения).
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[00135] В данном изобретении предложены конструкции слитых белков, содержащие антитело или его антигенсвязывающий фрагмент и две молекулы полипептида модулятора комплемента. Антитело или его антигенсвязывающий фрагмент могут специфически связываться с белком комплемента. Белком комплемента может представлять собой, например, белок комплемента 3d (c3d). В некоторых случаях молекула полипептида модулятора комплемента может содержать по меньшей мере биологически активный фрагмент белка комплемента. Белком комплемента может представлять собой, например, CR1, DAF, MCP, Crry, MAp44, MAp19, CD59 или фактор Н. В некоторых случаях конструкция слитого белка имеет более низкую концентрацию полумаксимального ингибирования (на основе, например, анализа комплемента) по сравнению с конструкцией белка сравнения, которая не содержит антитела, но в остальном идентична. В некоторых случаях молекула полипептида модулятора комплемента может быть конъюгирована с тяжелой цепью антитела или его антигенсвязывающим фрагментом. В некоторых случаях молекула полипептида модулятора комплемента может быть конъюгирована с легкой цепью антитела или его антигенсвязывающего фрагмента. В некоторых случаях молекула полипептида модулятора комплемента конъюгирована с С-концом тяжелой цепи и/или легкой цепи. В некоторых случаях молекула полипептида модулятора комплемента конъюгирована с N-концом тяжелой цепи и/или легкой цепи.
[00136] В этом изобретении представлена конструкция слитого белка, содержащая антитело или его антигенсвязывающий фрагмент, который специфически связывается с ассоциированным с комплементом антигеном, а также первую молекулу и вторую молекулу полипептида модулятора комплемента. В некоторых случаях антитело может содержать первый полипептид и второй полипептид. В некоторых случаях каждый из первого полипептида и второго полипептида может содержать тяжелую цепь и легкую цепь. В некоторых случаях и первая молекула, и вторая молекула могут содержать биологически активный фрагмент белка комплемента. Белком комплемента может быть CR1, DAF, MCP, Crry, MAp44, MAp19, CD59 или фактор Н. В некоторых случаях отношение альбумина к креатину может быть измерено в биологическом образце от субъекта. В некоторых случаях отношение альбумина к креатину определяют в какой-то момент после введения конструкции слитого белка по данному изобретению или после введения сопоставимой конструкции слитого белка. В некоторых случаях отношение альбумина к креатинину сравнивается между двумя или более биологическими образцами от одного или другого субъекта. В некоторых случаях биологический образец представляет собой образец мочи. В некоторых случаях субъект страдает заболеванием, описанном в данном изобретении. В некоторых случаях субъект не имеет заболевания. В некоторых случаях отношение альбумина к креатинину в образце мочи после введения конструкции слитого белка по данному изобретению от субъекта, страдающего заболеванием (например, заболеванием почек), ниже, чем отношение альбумина к креатину в образце мочи от субъекта, которому вводили сопоставимую конструкцию слитого белка. В некоторых случаях сопоставимая конструкция слитого белка не содержит антитела или его антигенсвязывающего фрагмента, но в остальном идентична конструкциям слитого белка по данному изобретению.
[00137] В данном изобретении представлены конструкции слитого белка, содержащие по меньшей мере два компонента, которые слиты друг с другом: (i) нацеливающий фрагмент, который связывается с ассоциированным с комплементом антигеном, и (ii) модулятор комплемента. Компоненты конструкции могут быть слиты друг с другом посредством ковалентных или нековалентных взаимодействий. Белки слитой конструкции могут быть сконструированы для оптимизации и адаптации их валентности связывания с мишенью в зависимости от мишени, патологического состояния и количества желаемого модулятора комплемента. Например, конструкции слитого белка могут быть сконструированы как двухвалентные, трехвалентные или четырехвалентные, и каждая валентность может относиться к мишень-связывающему компоненту или модулятору комплемента. Когда валентность используется для описания конструкции слитого белка, это сумма валентностей каждого компонента. В некоторых случаях нацеливающий фрагмент может быть двухвалентным, тогда как модулятор комплемента является одновалентным, обеспечивая трехвалентную конструкцию слитого белка. В определенных других случаях нацеливающий фрагмент может быть моно- или двухвалентным, тогда как модулятор комплемента является двухвалентным, обеспечивая трехвалентную или четырехвалентную слитую конструкцию, соответственно.
[00138] Кроме того, нацеливающий фрагмент в конструкциях слитого белка может специфически связываться с более чем одним антигеном, таким самым превращая конструкцию слитого белка в биспецифическую, триспецифическую или полиспецифическую молекулу. Конструкции слитого белка по данному изобретению, имеющие свою повышенной специфичностью и повышенной валентностью, могут связываться с множеством мишеней. В определенных примерах конструкция слитого белка может обладать дополнительными полезными свойствами, такими как пригодность для производства и фармацевтического состава из-за их улучшенной стабильности, низкой агрегации, фармакокинетических и биологических свойств или любой их комбинации.
[00139] Нацеливающий фрагмент может представлять собой антитело или его антигенсвязывающий фрагмент, который способен специфически связывать один или более ассоциированных с комплементом антигенов, например, антиген, который представляется локально на сайте, связанном с активацией комплемента, или рядом с ним. Примеры нацеливающего фрагмента могут включать антитело или его антигенсвязывающий фрагмент, специфичный для домена белка аннексина млекопитающих. Альтернативно, нацеливающий фрагмент может включать антитело или его антигенсвязывающий фрагмент, специфичные для фосфолипида. Нацеливающий фрагмент может включать антитело или его антигенсвязывающий фрагмент, специфичный для белка комплемента, такой как фрагмент C3, связанный с активацией комплемента, например, C3b, iC3b, C3d и C3dg. Также возможно, что нацеливающий фрагмент представляет собой биспецифическое или триспецифическое антитело или его антигенсвязывающий фрагмент, который специфичен для любых комбинаций следующих мишеней: домен белка аннексина млекопитающих, фосфолипид и белок комплемента, такой как фрагмент из C3, например, C3d, iC3b, C3d, C3dg, C3a, C3b, C3c или C3f. Кроме того, предполагается, что нацеливающие фрагменты, которые являются поливалентными, такими как трехвалентные, четырехвалентные, являются частью конструкций слитых белков, описанных в данном документе.
[00140] Некоторые примеры конструкций слитых белков могут быть трехвалентными, биспецифическими и включать (i) двухвалентное антитело или его антигенсвязывающий фрагмент (например, область Fab антитела); (ii) домен Fc антитела; и (iii) модулятор комплемента, слитый с указанным антителом или его антигенсвязывающим фрагментом, или с указанным доменом Fc. Двухвалентное антитело или его антигенсвязывающий фрагмент может представлять собой нацеливающий фрагмент трехвалентной биспецифической конструкции слитого белка и может связываться с двумя молекулами-мишенями, такими как домен белка аннексина млекопитающих (например, аннексин IV, аннексин -2), фосфолипид, белок комплемента или фрагмент белка комплемента (например, iC3b, C3d, C3dg, C3a, C3b, C3c или C3f). Модулятор комплемента конструкции трехвалентного биспецифического слитого белка может быть ингибитором активации комплемента. Дополнительный вариант конструкции трехвалентного биспецифического слитого белка может включать конструкцию трехвалентного биспецифического гетеродимерного полипептида, включающую а) первый полипептидный мономер, содержащий домен CH2 или CH3 антитела, где указанный домен имеет по меньшей мере одну аминокислотную модификацию, приводящую к образованию полости (также называемой как «впадина»); b) второй полипептидный мономер, содержащий домен CH2 или CH3 антитела, где указанный домен имеет по меньшей мере одну аминокислотную модификацию, приводящую к выпуклости (также называемой как «выступ»); таким образом, что при гетеродимеризации указанных первого и второго полипептидных мономеров указанный выступ взаимодействует с указанной впадиной; и где один из указанных первого и второго полипептидов дополнительно слит с модулятором комплемента.
[00141] В еще одном примере конструкция слитого белка включает четырехвалентную конструкцию для модуляции активности комплемента, при этом указанная четырехвалентная конструкция содержит: (i) двухвалентное антитело или его антигенсвязывающий фрагмент; и (ii) два модулятора комплемента. Двухвалентные антитела четырехвалентной слитой конструкции могут быть полноразмерными двухвалентными антителами или их антигенсвязывающими фрагментами, например, фрагментами вариабельной области или двухвалентным одноцепочечным вариабельным фрагментом. Два модулятора комплемента могут быть одинаковыми или разными белками с образованием конструкции биспецифического четырехвалентного или триспецифического четырехвалентного слитого белка. В других примерах конструкция слитого белка является мономерной и содержит одну или более аминокислотных модификаций, которые устраняют дисульфидные связи, которые возникают при образовании гомодимерной конструкции.
[00142] Антитело состоит из четырех полипептидов: двух тяжелых цепей и двух легких цепей. Антигенсвязывающая часть антитела образована вариабельным доменом легкой цепи (VL) и вариабельным доменом тяжелой цепи (VH). На одном конце этих доменов шесть петель образуют антигенсвязывающий сайт, также называемый определяющими комплементарность областями (CDR). Три CDR расположены в домене VH (H1, H2 и H3), а три других - в домене VL (L1, L2 и L3). Во время развития В-клеток в результате соматической рекомбинации образуется уникальная область иммуноглобулина, известная как рекомбинация V(D)J. Вариабельная область тяжелой или легкой цепи иммуноглобулина кодируется разными генными сегментами. Тяжелая цепь кодируется тремя сегментами, называемыми сегментами вариабельности (V), разнообразия (D) и присоединения (J), тогда как вариабельная область легкой цепи образуется путем рекомбинации только двух сегментов V и J. Большое количество паратопов антител (также называемые в данном документе антигенсвязывающими сайтами) могут быть созданы путем рекомбинации между одной из множества копий сегментов V, D и J, которые присутствуют в геноме. Сегмент V кодирует CDR1 и CDR2, тогда как CDR3 генерируется явлениями рекомбинации. В ходе иммунного ответа в антигенсвязывающий сайт вносится дополнительное разнообразие посредством процесса, называемого соматической гипермутацией (SHM). Во время этого процесса точечные мутации вводятся в вариабельные гены тяжелой и легкой цепей и, в частности, в области, кодирующие CDR. Эта дополнительная вариабельность позволяет отобрать и размножить В-клетки, экспрессирующие варианты антител с улучшенной аффинностью к их родственному антигену. Подавляющее большинство иммуноглобулинов представляют собой двухвалентные и моноспецифические молекулы, имеющие одинаковую специфичность в обоих плечах, поскольку они состоят из двух идентичных полипептидов тяжелой цепи и двух идентичных полипептидов легкой цепи. Однако на очень раннем этапе разработки технологии гибридом было признано, что гибридные гибридомы могут быть созданы путем слияния двух гибридом (см., например, M.R. Suresh et al., Methods Enzymol 1986; 121: 210-228). Эти «квадромы» экспрессируют две разные тяжелые и две разные легкие цепи и, следовательно, продуцируют различные виды антител в результате случайного объединения тяжелых и легких цепей. Среди этих разных видов образуются биспецифические антитела (бсАт), имеющие различную специфичность на каждом плече. Другим естественным исключением является иммуноглобулин изотипа IgG4, который может подвергаться обмену тяжелых цепей из-за менее стабильной димеризации, опосредованной шарнирной областью этого изотипа (см., например, van der Neut Kolfschoten M et al., Science. 2007 317(5844):1554-7). Хотя этот обмен, по-видимому, происходит in vivo, его биологическое значение остается неясным. Моноклональные антитела стали успешным и привлекательным классом молекул для терапевтического вмешательства в нескольких областях заболеваний человека. Однако для достижения эффективности при определенных заболеваниях не всегда достаточно нацеливания или нейтрализации одного белка, что ограничивает терапевтическое применение моноклональных антител. Становится все более очевидным, что по ряду показаний для достижения эффективности недостаточно нейтрализации одного компонента биологической системы. Одним из решений этой проблемы является совместное введение нескольких моноклональных антител. Однако этот подход осложняется регуляторными аспектами, если антитела, которые необходимо комбинировать, не были ранее одобрены в отдельности. Более того, комбинированные подходы также дороги с точки зрения производства. Соответственно, существует потребность в антителах и терапевтических средствах, которые позволяют нацеливать множество антигенов с помощью одной молекулы.
[00143] Это изобретение, которое по меньшей мере включает конструкции двух-, трех- и четырехвалентного слитого белка, обеспечивает молекулы, которые обладают улучшенной терапевтической способностью бороться с заболеваниями, нарушениями или патологическими состояниями, связанными с системой комплемента.
Модулятор комплемента
[00144] Система комплемента является основным эффектором гуморального иммунитета и врожденного иммунитета. Система комплемента имеет три независимых пути активации комплемента: классический путь, альтернативный путь и лектиновый путь. Хотя все три пути различаются в отношении инициирующих событий, все три пути сходятся в расщеплении компонента комплемента C3. Ключом к активности системы комплемента является ковалентное присоединение фрагментов процессированного белка, полученных из сывороточного белка, комплемента C3 и/или C4, к участкам активации комплемента в тканях. Это необычное свойство связано с наличием тиоэфирной связи в C3, которая при расщеплении во время активации C3 превращает C3 в форму, обозначенную C3b, которая затем может использовать сложноэфирные или амидные связи для связывания с молекулами, присоединенных к клеткам и тканям. После ковалентного присоединения C3b он быстро преобразуется в формы iC3b, C3dg и C3d, каждая из которых остается ковалентно присоединенной к участку ткани-мишени. Этот процесс приводит к «мечению» ткани как ткани, в которой происходит воспалительное повреждение или другой процесс, связанный с комплементом.
[00145] Комплемент может активироваться любым из трех путей: классическим, лектиновым и альтернативным. Классический путь активируется посредством связывания белка системы комплемента C1q с комплексами антиген-антитело, пентраксинами или апоптотическими клетками. Пентраксины включают C-реактивный белок и амилоидный P-компонент сыворотки. Лектиновый путь инициируется связыванием углеводов со связывающим маннозу лектином или связыванием фиколинов или коллектинов с углеводами или ацетилированными молекулами.
[00146] Альтернативный путь активируется на поверхностях патогенов, которые не экспрессируют или не содержат ингибиторы комплемента. Это является результатом процесса, называемого «холостой активацией» C3, которая происходит спонтанно, включая взаимодействие конформационно измененного C3 с фактором B, и приводит к фиксации активного C3b на патогенах или других поверхностях. Альтернативный путь также может быть инициирован, когда определенные антитела блокируют эндогенные регуляторные механизмы, иммунными комплексами, содержащими IgA, или когда экспрессия регуляторных белков комплемента снижается. Кроме того, альтернативный путь активируется механизмом, называемым «амплификационной петлей», когда C3b, который откладывается на мишени посредством классического или лектинового пути, или, действительно, через сам процесс холостой активации, связывает фактор B. См. Muller-Eberhard (1988) Ann. Rev. Biochem. 57:321. Например, Холерс и его коллеги показали, что альтернативный путь усиливается в местах локального повреждения, когда воспалительные клетки рекрутируются после начальной активации комплемента. См. Girardi et al., J. Clin. Invest. 2003, 112:1644. Значительное усиление комплемента через альтернативный путь затем происходит через механизм, который включает либо дополнительное образование поврежденных клеток, которые фиксируют комплемент, локальный синтез компонентов альтернативного пути, либо, что более вероятно, потому что инфильтрация воспалительных клеток, несущих предварительно образованный C3 и пропердин, значительно увеличивает активацию, особенно в этом участке.
[00147] Амплификация альтернативного пути инициируется, когда циркулирующий фактор B связывается с активированным C3b. Затем этот комплекс расщепляется циркулирующим фактором D с образованием ферментативно активного комплекса C3-конвертазы, C3bBb. C3bBb расщепляет дополнительный C3, генерируя C3b, который вызывает воспаление, а также дополнительно усиливает процесс активации, создавая петлю положительной обратной связи. Фактор H является ключевым регулятором (ингибитором) механизмов активации и инициации альтернативного пути комплемента, который конкурирует с фактором B за связывание с конформационно измененным C3 в механизме переключения на холостую активацию и с C3b в амплификационной петле. Связывание C3b с фактором H также приводит к деградации C3b фактором I до неактивной формы iC3b (также обозначаемой C3bi), таким образом осуществляя дополнительную проверку активации комплемента. Фактор H регулирует комплемент в жидкой фазе, циркулируя в плазме с концентрацией около >400-600 мкг/мл, но его связывание с клетками является регулируемым явлением, усиленным наличием отрицательно заряженной поверхности, а также фиксированных C3b, iC3b, C3dg или C3d. См. Jozsi et al., Histopathol. (2004) 19:251-258.
[00148] Активация комплемента, фиксация фрагмента C3 и опосредованное комплементом воспаление вовлечены в этиологию и прогрессирование многих заболеваний. Было показано, что подавление активации комплемента эффективно при лечении нескольких заболеваний на животных моделях и в исследованиях ex vivo, включая, например, системную красную волчанку и гломерулонефрит (Y. Wang et al., Proc. Nat'l Acad. Sci. USA (1996) 93:8563-8568), ревматоидный артрит (Y. Wang et al., Proc. Nat'l Acad. Sci. USA (1995) 92:8955-8959), искусственное кровообращение и гемодиализ (C. S. Rinder, J. Clin. Invest. (1995) 96:1564-1572), сверхострое отторжение при трансплантации органов (T. J. Kroshus et al., Transplantation (1995) 60:1194-1202), инфаркт миокарда (J. W. Homeister et al., J. Immunol. (1993) 150:1055-1064; H. F. Weisman et al., Science (1990) 249:146-151), ишемию/реперфузионное повреждение (E. A. Amsterdam et al., Am. J. Physiol. (1995) 268:H448-H457), опосредованное антителами отторжение аллотрансплантата, например, в почках (J. B. Colvin, J. Am. Soc. Nephrol. (2007) 18(4):1046-56), и острый респираторный дистресс-синдром (R. Rabinovici et al., J. Immunol. (1992) 149:1744-1750). Более того, другие воспалительные состояния и аутоиммунные/иммунокомплексные заболевания также тесно связаны с активацией комплемента (B.P. Morgan. Eur. J. Clin. Invest. (1994) 24:219-228), включая, но не ограничиваясь ими, термическое повреждение, тяжелую астму, анафилактический шок, воспаление кишечника, крапивницу, ангионевротический отек, васкулит, рассеянный склероз, миастению гравис, миокардит, мембранопролиферативный гломерулонефрит, атипичный гемолитико-уремический синдром / синдром Шегрена, почечная и легочную ишемию / реперфузию и другие органоспецифические воспалительные заболевания. В настоящее время неясно, является ли активация комплемента существенной для патогенеза и повреждения при всех заболеваниях, при которых происходит локальная активация тканевого C3 и воспалительное повреждение; тем не менее, фиксация фрагмента C3 часто встречается как сопутствующее событие.
[00149] К эндогенным мембраносвязанным белкам, которые контролируют активацию альтернативного пути, относятся фактор ускорения распада (DAF/CD55), мембранный белок-кофактор (MCP/CD46) и рецептор комплемента 1 (CR1). Другие эндогенные белки, которые контролируют активацию альтернативного пути, включают фактор H, циркулирующий гликопротеин массой -155 кДа, который регулирует активацию альтернативного пути в жидкой фазе, а также на тканевых поверхностях. См. J.J. Alexander et al., Mol. Immunol. (2006) 44: 123-132. Неконтролируемая активация альтернативного пути вовлечена в патогенез различных групп заболеваний, включая возрастную макулярную дегенерацию (ВМД), атипичный гемолитико-уремический синдром (аГУС), мембранопролиферативный гломерулонефрит II типа (МПГН II), астму, и ишемию/реперфузионное повреждение почек (И/Р). См. J.M. Thurman et al., J. Immunol. (2006) 176:1305- 1310. Повреждение тканей хозяина альтернативным путем указывает на недостаточный локальный контроль альтернативного пути тканью-мишенью. Действительно, недавние исследования продемонстрировали, что мутации CRP являются сильными факторами риска аГУС (M.C. Pickering et al., J. Exp. Med. (2007) 204: 1249-1256) и МПГН II (RJ. Smith et al., J. Am. Soc. Nephrol. (2007) 18:2447- 2456), а функциональные полиморфизмы фактора H, циркулирующего в кровотоке регулятора альтернативного пути, связаны с развитием ВМД (R.J. Klein et al., Science (2005) 308:385-389; A.O. Edwards et al., Science (2005) 308:421-424; J.L. Haines et al., Science (2005) 308:419-421; G.S. Hageman et al., Proc. Nat'l Acad. Sci USA (2005) 102:7227- 7232).
[00150] Острое ишемическое повреждение почек (AKI) у грызунов (J.M. Thurman et al., J. Immunol. (2003) 170:1517-1523; J.M. Thurman et al., Am. Soc. Nephrol. (2006) 17:707-715) и у людей (J.M. Thurman et al., Kidney Int. (2005) 67:524-530) связано с активацией альтернативного пути на базолатеральной поверхности поврежденных клетках почечных канальцев. Было обнаружено, что связанный с рецептором-1 комплемента ген/белок y (Crry, аналог человеческих MCP и CR1 для грызунов) является единственным C-реактивным белком (CRP), экспрессируемым эпителиальными клетками проксимальных почечных канальцев у мышей, и что ишемия/реперфузия вызывает снижение поверхностной экспрессии этого белка. См. J.M. Thurman et al., J. Clin. Invest. (2006) 116:357-368. Мыши с врожденным дефицитом Crry (Crry+/-) более чувствительны, чем контрольные животные дикого типа, к ишемической острой почечной недостаточности (Id.), что подчеркивает важность Crry базолатеральной поверхности в отношении контроля альтернативного пути на этой поверхности. Пока не известно, могут ли полиморфизмы или мутации в CRP повышать риск развития AKI у людей. Тем не менее, неконтролируемая активация альтернативного пути в условиях пониженной поверхностной Crry указывает на то, что циркулирующий фактор H имеет ограниченную способность защищать поверхность гипоксических эпителиальных клеток почечных канальцев.
[00151] Фактор H циркулирует в высоких концентрациях (> 400-600 мкг/мл) и является мощным ингибитором альтернативного пути комплемента. См. J.J. Alexander et al., Mol. Immunol. (2006) 44: 123-132. Однако для ингибирования альтернативного пути на клеточной поверхности фактором H необходимо, чтобы он должным образом связывался с этой поверхностью. Некоторые области в белке фактора H связываются с анионными поверхностями, такими как мембраны, богатые сульфатом гепарина или сиаловой кислотой, а также с C3b на поверхности. См. S. Meri et al., Proc. Nat'l Acad. Sci USA (1990) 87:3982-3986; M.K. Pangburn et al., Immunol. (2000) 164:4742-4751. На активацию альтернативного пути на определенной поверхности сильно влияет аффинность фактора H к этой поверхности. Полиморфизмы и мутации, связанные с ВМД и аГУС, соответственно, наиболее часто затрагивают область фактора H, необходимую для связывания анионных поверхностей, а не регуляторную область комплемента. См. M.C. Pickering et al., J. Exp. Med. (2007) 204:1249-1256; A.P. Sjoberg et al., J. Biol. Chem. (2007) 282: 10894-10900. Таким образом, определенные ткани или типы клеток нуждаются в факторе H для регулирования активации альтернативного пути на их поверхности. Различные связывающие области белка фактора H могут быть необходимы для регуляции комплемента в этих тканях или типах клеток. В некоторых случаях на связывание фактора H с поверхностями в определенных тканях могут влиять другие белки. Идентификация предполагаемых тканеспецифичных партнеров по связыванию фактора H может обеспечить потенциальные механизмы для модуляции, то есть стимулирования или ингибирования активности альтернативного пути комплемента в различных тканях.
[00152] Соответственно, модулятор комплемента по данному изобретению может быть белком модулятора комплемента или полипептидом модулятора комплемента (например, полипептид ингибитора комплемента), такой как, например, мембранный белок-кофактор (MCP) (SEQ ID NO: 1) (номер доступа UniProtKB/Swiss-Prot. P15529), фактор ускорения распада (DAF) и CD59, Crry, CR1 и CR2, фактор H, или их варианты, или их фрагменты. Дополнительные модуляторы комплемента могут включать: антитело к C5, экулизумаб, пекселизумаб, антитело к C3b, антитело к C6, антитело к C7, антитело к C8, антитело к C9, антитело к фактору B, антитело к MASP, антитело к фактору D, и антитело к пропердину, антитело к MBL, фактор I, линейный пептид, циклический пептид, компстатин или его аналоги, N-ацетиласпартилглутаминовую кислоту (NAAGA), и биологически активный фрагмент по любому из предшествующих. В определенных случаях ингибитор комплемента может быть ингибитором комплемента человека (например, MCP человека, DAF человека, CD59 человека, CR1 человека, фактор H человека, Map44 человека, Map19 человека, или другой ингибитор комплемента, полученный от человека). В дополнительных случаях ингибитор комплемента может быть ингибитором комплемента млекопитающих (например, DAF мыши, CD59 мыши (также известный как изоформа A), изоформой B CD59 мыши, Crry мыши, фактором H мыши, Map44 мыши, Map19 мыши или другим ингибитором комплемента, полученным от мыши. Таким образом, полипептиды могут быть полипептидами человека или полипептидами отличных от человеческого видов. Например, полипептиды модулятора комплемента могут быть получены от приматов, кроме человека (например, орангутана, шимпанзе, макаки, гориллы, лемура или гиббона), лошади, коровы, свиньи, овцы, козы, собаки, кошки или грызуна (например, мыши, кролика, хомяка, песчанки, морской свинки или крысы).
[00153] Модулятор комплемента конструкции слитого белка может быть вариантом модулятора комплемента. Варианты полипептидов модулятора комплемента могут содержать одну или более аминокислотных замен по сравнению с соответствующей последовательностью дикого типа (например, не более 59, 58, 57, 56, 55, 54, 53, 52, 51, 50, 49, 48, 47, 46, 45, 44, 43, 42, 41, 40, 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, девяти, восьми, семи, шести, пяти, четырех, трех, двух или одной аминокислотной замены по сравнению с последовательностью дикого типа). Аминокислотные замены могут быть консервативными, неконсервативными или их сочетанием. Варианты полипептидов в некоторых вариантах осуществления могут содержать одну или более делеций или добавлений, или комбинацию одной или более делеций, добавлений и замен. В некоторых примерах варианты полипептидов модулятора комплемента могут содержать одну или более аминокислотных делеций, добавлений или замен на 100 аминокислот полипептида. В некоторых примерах, где полипептид модулятора комплемента содержит короткие консенсусные повторы (SCR), варианты полипептидов могут не содержать аминокислотных замен, делеций или добавлений в SCR полипептида модулятора комплемента.
[00154] Вариант полипептида модулятора комплемента может содержать аминокислотную последовательность, которая на по меньшей мере 70 (например, по меньшей мере 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, или 99) % идентична соответствующей аминокислотной последовательности дикого типа. Функциональные фрагменты полипептида модулятора комплемента или варианта полипептида, описанного в данном документе, короче, чем полноразмерные полипептиды. Вариант полипептида модулятора комплемента может содержать аминокислотную последовательность, которая на по меньшей мере 90%, 95% или 98% идентична одному или более функциональным (биологически активным) фрагментам или доменам полипептида модулятора комплемента, идентифицированного в данном документе. Варианты полипептидов и функциональные фрагменты белков или вариантов дикого типа сохраняют не менее 50 (например, по меньшей мере 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, или 99 или более) % модулирующей активности комплемента соответствующего полипептида дикого типа.
[00155] Вариант полипептида модулятора комплемента или функциональный фрагмент полипептида модулятора комплемента может иметь более 100% способности соответствующего белка дикого типа модулировать активность комплемента. Способы обнаружения и/или количественной оценки активности комплемента известны в данной области техники и описаны в данном документе.
[00156] Другие примеры последовательностей, используемых в качестве модуляторов комплемента в данном изобретении, включают один или более доменов коротких консенсусных повторов (SCR) из одного или более из следующих связанных с комплементом белков: фактора H; рецептора комплемента 1; рецептора комплемента 2; фактора B; DAF; и других. В некоторых случаях 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16 или 17 областей SCR включены в модуляторы комплемента, описанные в данном документе. В некоторых случаях, когда полипептид модулятора комплемента включает «мембранный белок-кофактор», «MCP» или «CD46», он может относиться к широко распространенному C3b/C4b-связывающему гликопротеину клеточной поверхности, который может ингибировать активацию комплемента на клетках-хозяевах и может служить кофактором опосредованного фактором I расщепления C3b и C4b, включая их гомологи. MCP может принадлежать к семейству, известному как регуляторы активации комплемента («RCA»). Члены семейства могут иметь общие структурные особенности, включая различное количество доменов коротких консенсусных повторов (SCR), длина которых обычно составляет от 60 до 70 аминокислот. Начиная со своего амино-конца, MCP может содержать четыре SCR, богатую серином/треонином/пролином область, область с неопределенной функцией, трансмембранный гидрофобный домен, цитоплазматический якорь и цитоплазматический хвост. Понятно, что для описанных пептидов, полипептидов и белков существуют вариации видов и штаммов, и что человеческий MCP или его биологически активные фрагменты могут охватывать все вариации видов и штаммов.
[00157] SEQ ID NO: 1 представляет собой иллюстративную последовательность полноразмерного MCP человека (см., например, номер доступа UniProtKB/Swiss-Prot. P15529). Аминокислоты 1-34 могут соответствовать сигнальному пептиду, аминокислоты 35-343 могут соответствовать внеклеточному домену, аминокислоты 344-366 могут соответствовать трансмембранному домену, а аминокислоты 367-392 могут соответствовать цитоплазматическому домену. Во внеклеточном домене аминокислоты 35-96 могут соответствовать SCR 1, аминокислоты 97-159 могут соответствовать SCR 2, аминокислоты 160-225 могут соответствовать SCR 3, аминокислоты 226-285 могут соответствовать SCR 4 и аминокислоты 302-326 могут соответствовать богатому серином/треонином домену. Понятно, что для описанных пептидов, полипептидов и белков существуют вариации видов и штаммов, и что MCP или его биологически активные фрагменты могут охватывать все вариации видов и штаммов. Используемый в данном документе термин «биологически активный» фрагмент MCP может относиться к любому растворимому фрагменту, лишенному как цитоплазматического домена, так и трансмембранного домена, включая фрагменты, содержащие, состоящие по существу из или состоящие из 1, 2, 3 или 4 доменов SCR, с или без богатого серином/треонином домена, обладающего частично или полностью ингибирующей комплемент активностью полноразмерного белка MCP человека. В некоторых вариантах осуществления ингибирующая комплемент часть содержит полноразмерный MCP человека (аминокислоты 35-392 из SEQ ID NO: 1), внеклеточный домен MCP человека (аминокислоты 35-343 из SEQ ID NO: 1) или SCR 1-4 MCP человека (аминокислоты 35-285 из SEQ ID NO: 1).
[00158] В некоторых случаях, когда полипептид модулятора комплемента включает фактор ускорения распада, также называемый CD55 (DAF/CD55) (SEQ ID NO: 2 и SEQ ID NO: 3), представляет собой мембраносвязанный гликопротеин, имеющий молекулярную массу около 70 килодальтон (кДа), что ингибирует активацию комплемента на клетках-хозяевах. Подобно нескольким другим регуляторным белкам комплемента, DAF содержит несколько повторяющихся мотивов из примерно 60 аминокислот, называемых коротким консенсусным повтором (SCR).
[00159] Используемый в данном документе термин «фактор ускорения распада», «DAF» или «CD55» относится к мембранному гликопротеину массой семьдесят килодальтон («кДа»), содержащему четыре домена коротких консенсусных повтора (SCR), за которыми следует сильно О-гликозилированный богатый серин/треонином домен на С-конце, который поднимает молекулу с поверхности мембраны, за которым следует якорь гликозилфосфатидилинозитол («ГФИ»)-якорь. DAF защищает клеточную поверхность от активации комплемента путем диссоциации связанных с мембраной C3-конвертаз, которые необходимы для расщепления белка комплемента C3 и для амплификации каскада комплемента. DAF предотвращает сборку или ускоряет распад как C3-, так и C5-конвертаз альтернативного и классического путей комплемента.
[00160] SEQ ID NO: 2 представляет собой иллюстративную последовательность полноразмерного DAF человека (см., например, номер доступа UniProtKB/Swiss-Prot. P08173); SEQ ID NO: 3 представляет собой иллюстративную последовательность полноразмерного DAF мыши (см., например, номер доступа UniProtKB/Swiss-Prot. Q61475). В последовательности DAF человека аминокислоты 1-34 могут соответствовать сигнальному пептиду, аминокислоты 35-353 могут наблюдаться в зрелом белке, а аминокислоты 354-381 могут быть удалены из полипептида после трансляции. В зрелом белке аминокислоты 35-96 могут соответствовать SCR 1, аминокислоты 96-160 могут соответствовать SCR 2, аминокислоты 161-222 могут соответствовать SCR 3, аминокислоты 223-285 могут соответствовать SCR 4 и аминокислоты 287-353 могут соответствовать богатому О-гликозилированным серином/треонином домену. ГФИ-якорь может быть присоединен к DAF человека в серине в положении 353. В последовательности DAF мыши аминокислоты 1-34 могут соответствовать сигнальному пептиду, аминокислоты 35-362 могут наблюдаться в зрелом белке, а аминокислоты 363-390 могут быть удалены из полипептида после трансляции. В зрелом белке аминокислоты 35-96 могут соответствовать SCR 1, аминокислоты 97-160 могут соответствовать SCR 2, аминокислоты 161-222 могут соответствовать SCR 3, аминокислоты 223-286 могут соответствовать SCR 4 и аминокислоты 288-362 могут соответствовать богатому О-гликозилированным серином/треонином домену. ГФИ-якорь может быть присоединен к DAF мыши в серине в положении 362. Понятно, что для описанных пептидов, полипептидов и белков существуют вариации видов и штаммов, и что DAF или его биологически активные фрагменты могут охватывать все вариации видов и штаммов. Используемый в данном документе термин «биологически активный» фрагмент DAF может относиться к любому фрагменту DAF, не имеющему ГФИ-якоря, аминокислоты, к которой он присоединен (например, Ser-353), или того и другого, включая любые фрагменты полноразмерного белка DAF, содержащего 1, 2, 3 или 4 домена SCR или состоящий из них, с О-гликозилированным богатым серином/треонином доменом или без него, который обладает частично или полностью ингибирующей комплемент активностью полноразмерного белка DAF.
[00161] SEQ ID NO: 4 представляет собой иллюстративную последовательность полноразмерного CD59 человека (см., например, номер доступа UniProtKB/Swiss-Prot. P13987); SEQ ID NO: 5 представляет собой иллюстративную последовательность полноразмерного CD59 мыши, изоформа А (см., например, номер доступа UniProtKB/Swiss-Prot. O55186); SEQ ID NO: 6 представляет собой иллюстративную последовательность полноразмерного CD59 мыши, изоформа B (см., например, номер доступа UniProtKB/Swiss-Prot. P58019). В последовательности CD59 человека аминокислоты 1-25 из SEQ ID NO: 4 могут соответствовать лидерному пептиду, аминокислоты 26-102 из SEQ ID NO: 4 могут соответствовать зрелому белку, а аминокислоты 103-128 из SEQ ID NO: 4 могут быть удалены после трансляции. ГФИ-якорь может быть присоединен к CD59 при аспарагине в положении 102 SEQ ID NO: 4. В изоформе A последовательности мышиного CD59 аминокислоты 1-23 SEQ ID NO: 5 могут соответствовать лидерному пептиду, аминокислоты 24-96 SEQ ID NO: 5 могут соответствовать зрелому белку, а аминокислоты 97-123 SEQ ID NO: 5 могут быть удалены после трансляции. ГФИ-якорь может быть присоединен к CD59 при серине в положении 96 SEQ ID NO: 5. В изоформе B последовательности CD59 мыши аминокислоты 1-23 SEQ ID NO: 6 могут соответствовать лидерному пептиду, аминокислоты 24-104 из SEQ ID NO: 6 могут соответствовать зрелому белку, а аминокислоты 105-129 из SEQ ID NO: 6 могут быть удалены после трансляции. ГФИ-якорь может быть присоединен к CD59 при аспарагине в положении 104 SEQ ID NO: 6. Понятно, что для описанных пептидов, полипептидов и белков существуют вариации видов и штаммов, и что CD59 или их биологически активные фрагменты могут охватывать все вариации видов и штаммов. Используемый в данном документе термин «биологически активный» фрагмент CD59 человека может относиться к любому фрагменту CD59 человека, не имеющему ГФИ-якоря, аминокислоты, к которой он присоединен (например, Asn-102), или того и другого, включая любые фрагменты полноразмерного белка CD59 человека, обладающего частично или полностью ингибирующей активностью комплемента полноразмерного белка CD59; и термин «биологически активный» фрагмент CD59 мыши может относиться к любому фрагменту изоформы A или изоформы B CD59 мыши, не имеющей ГФИ-якоря и/или аминокислоты, к которой он присоединен (например, Ser-96 изоформы A или Asp-104 изоформы B), включая любые фрагменты любой изоформы полноразмерного белка CD59 мыши, обладающего частично или полностью ингибирующей активностью комплемента полноразмерного белка CD59.
[00162] SEQ ID NO: 7 представляет собой иллюстративную последовательность полноразмерного белка Crry мыши. Аминокислоты 1-40 могут соответствовать лидерному пептиду, аминокислоты 41-483 из SEQ ID NO: 7 могут соответствовать зрелому белку, содержащему аминокислоты 41-405 из SEQ ID NO: 7, которые могут соответствовать внеклеточному домену, аминокислоты 406-426 из SEQ ID NO: 7, которые могут соответствовать трансмембранному домену, и аминокислоты 427-483 из SEQ ID NO: 7, которые могут соответствовать цитоплазматическому домену. Во внеклеточном домене аминокислоты 83-143 из SEQ ID NO: 7 могут соответствовать SCR 1, аминокислоты 144-205 из SEQ ID NO: 7 могут соответствовать SCR 2, аминокислоты 206-276 из SEQ ID NO: 7 могут соответствовать SCR 3, аминокислоты 277-338 из SEQ ID NO: 7 могут соответствовать SCR 4, а аминокислоты 339-400 из SEQ ID NO: 7 могут соответствовать SCR 5. Понятно, что существуют вариации видов и штаммов для описанных пептидов, полипептидов и белков, и этот белок Crry мыши или его биологически активные фрагменты могут охватывать все вариации видов и штаммов. Используемый в данном документе термин «биологически активный» фрагмент белка Crry мыши может относиться к любому растворимому фрагменту Crry мыши, лишенному трансмембранного домена и цитоплазматического домена, включая фрагменты, содержащие, состоящие в основном или состоящие из 1, 2, 3, 4 или 5 доменов SCR, включая любые фрагменты полноразмерного белка Crry мыши, обладающие частично или полностью ингибирующей активностью комплемента полноразмерного белка Crry.
[00163] Используемый в данном документе термин «рецептор-1 комплемента», «CR1» или «CD35» может относиться к человеческому гену, кодирующему белок из 2039 аминокислот с прогнозируемой молекулярной массой 220 килодальтон («кДа»), включая их гомологи. Ген может экспрессироваться в основном на эритроцитах, моноцитах, нейтрофилах и В-клетках, но также может присутствовать на некоторых Т-лимфоцитах, тучных клетках и подоцитах клубочков. Белок CR1, как правило, может экспрессироваться в количестве от 100 до 1000 копий на клетку. CR1 может быть основной системой для процессинга и удаления опсонизированных комплементом иммунных комплексов. CR1 может негативно регулировать каскад комплемента, опосредовать иммунную адгезию и фагоцитоз, а также ингибировать все пути комплемента. Полноразмерный белок CR1 может содержать сигнальный пептид из 42 аминокислот, внеклеточный домен из 1930 аминокислот, трансмембранный домен из 25 аминокислот и C-концевой цитоплазматический домен из 43 аминокислот. Внеклеточный домен CR1 может включать 25 потенциальных сигнальных последовательностей N-гликозилирования и может включать 30 доменов коротких консенсусных повторов («SCR»), также известных как повторы контрольного белка комплемента (CCP), или суши-домены, каждый длиной от 60 до 70 аминокислот. Гомология последовательностей между SCR может составлять от 60 до 99 процентов. 30 доменов SCR могут быть дополнительно сгруппированы в четыре более длинные области, называемые длинными гомологичными повторами («LHR»), каждая из которых кодирует приблизительно сегменты белка CR1 массой 45 кДа, обозначенные LHR-A, -B, -C и -D. (см., например, Krych-Goldberg et al., 274(44): 31160-31168, 1999). Первые три LHR могут содержать семь доменов SCR каждый, тогда как LHR-D может содержать 9 доменов SCR. Активные сайты во внеклеточном домене белка CR1 могут включать сайт связывания C4b с более низкой аффинностью в отношении C3b в SCR 1-3, содержащих аминокислоты 42-234, сайт связывания C3b с более низкой аффинностью в отношении C4b в SCR 8-11, содержащих аминокислоты 490-745, сайт связывания C3b с более низкой аффинностью в отношении C4b в SCR 15-18, содержащих аминокислоты 940-1196, и сайт связывания C1q в SCR 22-28, содержащих аминокислоты 1394-1842.
[00164] SEQ ID NO: 8 представляет собой иллюстративную последовательность полноразмерного CR1 человека (см., например, номер доступа UniProtKB/Swiss-Prot. P17927). Аминокислоты 1-41 могут соответствовать сигнальному пептиду, аминокислоты 42-2039 могут соответствовать зрелому белку, содержащему аминокислоты 42-1971, которые могут соответствовать внеклеточному домену, аминокислоты 1972-1996, которые могут соответствовать трансмембранному домену, и аминокислоты 1997-2039, которые могут соответствовать цитоплазматическому домену. Во внеклеточном домене аминокислоты 42-101 могут соответствовать SCR 1, 102-163 могут соответствовать SCR 2, аминокислоты 164-234 могут соответствовать SCR 3, аминокислоты 236-295 могут соответствовать SCR 4, аминокислоты 295-355 могут соответствовать SCR 5, аминокислоты 356-418 могут соответствовать SCR 6, аминокислоты 419-489 могут соответствовать SCR 7, аминокислоты 491-551 могут соответствовать SCR 8, аминокислоты 552-613 могут соответствовать SCR 9, аминокислоты 614-684 могут соответствовать SCR 10, аминокислоты 686-745 могут соответствовать SCR 11, аминокислоты 745-805 могут соответствовать SCR 12, аминокислоты 806-868 могут соответствовать SCR 13, аминокислоты 869-939 могут соответствовать SCR 14, аминокислоты 941-1001 могут соответствовать SCR 15, аминокислоты 1002-1063 могут соответствовать SCR 16, аминокислоты 1064-1134 могут соответствовать SCR 17, аминокислоты 1136-1195 могут соответствовать SCR 18, аминокислоты 1195-1255 могут соответствовать SCR 19, аминокислоты 1256-1318 могут соответствовать SCR 20, аминокислоты 1319-1389 могут соответствовать SCR 21, аминокислоты 1394-1454 могут соответствовать SCR 22, аминокислоты 1455-1516 могут соответствовать SCR 23, аминокислоты 1517-1587 могут соответствовать SCR 24, аминокислоты 1589-1648 могут соответствовать SCR 25, аминокислоты 1648-1708 могут соответствовать SCR 26, аминокислоты 1709-1771 могут соответствовать SCR 27, аминокислоты 1772-1842 могут соответствовать SCR 28, аминокислоты 1846-1906 могут соответствовать SCR 29, аминокислоты 1907-1967 могут соответствовать SCR 30. Понятно, что для описанных пептидов, полипептидов и белков существуют вариации видов и штаммов, и что белок CR1 или его биологически активные фрагменты могут охватывать все вариации видов и штаммов. Используемый в данном документе термин «биологически активный» фрагмент белка CR1 может относиться к любому растворимому фрагменту CR1, лишенному трансмембранного домена и цитоплазматического домена, включая фрагменты, содержащие, состоящие в основном из или состоящие из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 доменов SCR, включая любые фрагменты полноразмерного белка CR1, обладающие частично или полностью ингибирующей комплемент активностью полноразмерного белка CR1. Функциональные фрагменты могут включать SCR 1 и 2; SCR 1,2,3 и 4; SCR 1, 2, 3, 4, 5, 6, 7; SCR 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10 («CR1 1-10»); SCR 6, 7, 8, 9, 10, 11 и 12; SCR 8 и 9; SCR 8, 9, 10 и 11; SCR 8, 9, 10, 11, 12, 13 и 14; SCR 15 и 16; SCR 12, 13, 14, 15, 16 и 17; SCR 15, 16, 17, 18 и 19; SCR с 1 по 17 («CR1 1-17»); SCR с 1 по 23; SCR с 1 по 28. Иллюстративные варианты полипептидов содержат по меньшей мере три SCR каждого из доменов A и B; по меньшей мере три SCR каждого из доменов A, B и C; по меньшей мере первые три SCR из доменов A, B и C, или аминокислотные последовательности, по меньшей мере на 90% идентичные любому из вышеперечисленных.
[00165] Используемые в данном документе термины «фактор комплемента H», «фактор H» или «FH» могут относиться к фактору комплемента H, гликопротеину плазмы с одной полипептидной цепью, включая его гомологи. Белок может состоять из 20 доменов консервативных коротких консенсусных повторов (SCR) из приблизительно 60 аминокислот, расположенных непрерывно в виде нити гранул, разделенных короткими линкерными последовательностями из 2-6 аминокислот каждая. Фактор H может связываться с C3b, ускорять распад C3-конвертазы альтернативного пути (C3bBb), а также C5-конвертазы альтернативного пути (C3bBb3b) и действовать как кофактор протеолитической инактивации C3b. В присутствии фактора H протеолиз фактором I может привести к расщеплению и инактивации C3b. Фактор H может иметь по меньшей мере три отдельных связывающих домена для C3b, которые могут быть расположены в любой из SCR 1-20, SCR 1-4, SCR 5-8 и SCR 19-20. Каждый домен может связываться с отдельной областью в белке C3b: N-концевые сайты могут связываться с нативным C3b; второй сайт, расположенный в средней области фактора H, может связываться с фрагментом C3c, а сайт, расположенный внутри SCR19 и 20, может связываться с областью C3d. Кроме того, фактор H может также содержать сайты связывания для гепарина, которые могут располагаться в пределах SCR 7, SCR 5-12 и SCR 20 фактора H и могут перекрываться с сайтами связывания C3b. Структурный и функциональный анализ показал, что домены для ингибирующей комплемент активности фактора H могут располагаться в пределах первых четырех N-концевых доменов SCR.
[00166] SEQ ID NO: 9 представляет собой иллюстративную аминокислотную последовательность полноразмерного белка фактора H человека (см., например, номер доступа UniProtKB/Swiss-Prot. P08603); SEQ ID NO: 10 представляет собой иллюстративную аминокислотную последовательность полноразмерного белка фактора H мыши (см., например, номер доступа UniProtKB/Swiss-Prot. P06909). В последовательности фактора H человека аминокислоты 1-18 из SEQ ID NO: 9 могут соответствовать сигнальному пептиду, а аминокислоты 19-1231 из SEQ ID NO: 9 могут соответствовать зрелому белку. В этом белке аминокислоты 21-80 из SEQ ID NO: 9 могут соответствовать SCR 1, аминокислоты 85-141 из SEQ ID NO: 9 могут соответствовать SCR 2, аминокислоты 146-205 из SEQ ID NO: 9 могут соответствовать SCR 3, аминокислоты 210-262 SEQ ID NO: 9 могут соответствовать SCR 4, а аминокислоты 267-320 SEQ ID NO: 9 могут соответствовать SCR 5. В последовательности фактора H мыши аминокислоты 1-18 из SEQ ID NO: 10 могут соответствовать сигнальному пептиду, а аминокислоты 19-1234 из SEQ ID NO: 10 могут соответствовать зрелому белку. В этом белке аминокислоты 19-82 из SEQ ID NO: 10 могут соответствовать SCR 1, аминокислоты 83-143 из SEQ ID NO: 10 могут соответствовать SCR 2, аминокислоты 144-207 из SEQ ID NO: 10 могут соответствовать SCR 3, аминокислоты 208-264 из SEQ ID NO: 10 могут соответствовать SCR 4, а аминокислоты 265-322 из SEQ ID NO: 10 могут соответствовать SCR 5. Понятно, что существуют вариации видов и штаммов для описанных пептидов, полипептидов и белков, и этот фактор H мыши или его биологически активные фрагменты могут охватывать все вариации видов и штаммов. Используемый в данном документе термин «биологически активный» фрагмент фактора H может относиться к любой части белка фактора H, обладающей частично или полностью ингибирующей активностью комплемента полноразмерного белка фактора H, и может включать, но не ограничиваясь этим, фрагменты фактора H, содержащие SCR 1-4, SCR 1-5, SCR 1-8, SCR 1-18, SCR 19-20, или любой гомолог природного фактора H или его фрагмент, как подробно описано ниже. В некоторых примерах конструкций слитого белка биологически активный фрагмент фактора H может обладать одним или более из следующих свойств: (1) связывание с C-реактивным белком (CRP), (2) связывание с C3b и/или его фрагментами, (3) связывание с гепарином, (4) связывание с сиаловой кислотой, (5) связывание с поверхностью эндотелиальных клеток, (6) связывание с клеточным рецептором интегрина, (7) связывание с патогенами, (8) активность кофактора C3b, (9) активность ускорения распада конвертазы альтернативного пути C3 и C5 и (10) ингибирование альтернативного пути комплемента.
[00167] В некоторых примерах конструкций слитого белка модулирующая комплемент часть конструкции может содержать ингибитор комплемента или его биологически активный фрагмент. В некоторых примерах конструкций слитого белка ингибитор комплемента может быть выбран из MCP человека, DAF человека, DAF мыши, CD59 человека, изоформы A CD59 мыши, изоформы B CD59 мыши, белка Crry мыши, CR1 человека, фактора H человека, фактор H мыши, его биологически активные фрагменты и их варианты.
[00168] В некоторых случаях ингибирующая комплемент часть конструкции слитого белка может включать полноразмерный МСР человека (SEQ ID NO: 1). В некоторых случаях ингибирующая комплемент часть конструкции слитого белка может включать биологически активный фрагмент MCP человека (SEQ ID NO: 1). В некоторых случаях биологически активный фрагмент MCP человека может быть выбран из SCR 1-4 (аминокислоты 35-285 SEQ ID NO: 1), SCR 1-4 плюс богатый серином/треонином домен (аминокислоты 35- 326 из SEQ ID NO: 1) и внеклеточный домен MCP (аминокислоты 35-343 из SEQ ID NO: 1) и любые их комбинации.
[00169] В некоторых случаях ингибирующая комплемент часть конструкции слитого белка может включать полноразмерный DAF человека. В некоторых случаях ингибирующая комплемент часть конструкции слитого белка может включать биологически активный фрагмент DAF человека (SEQ ID NO: 2). В некоторых случаях биологически активный фрагмент DAF человека может быть выбран из SCR 1-4 (аминокислоты 25-285 SEQ ID NO: 2) и SCR 1-4 плюс O-гликозилированный богатый серин/треонином домен (аминокислоты 25-353 SEQ ID NO: 2) и любые их комбинации. В некоторых случаях ингибирующая комплемент часть конструкции может включать полноразмерный DAF мыши (SEQ ID NO: 3). В некоторых случаях ингибирующая комплемент часть конструкции может включать биологически активный фрагмент DAF мыши. В некоторых случаях биологически активный фрагмент DAF мыши может быть выбран из SCR 1-4 (аминокислоты 35-286 SEQ ID NO: 3) и SCR 1-4 плюс O-гликозилированный богатый серин/треонином домен (аминокислоты 35-362 SEQ ID NO: 3) и любые их комбинации.
[00170] В некоторых случаях ингибирующая комплемент часть конструкции слитого белка может включать полноразмерный CR1 человека (SEQ ID NO: 8). В некоторых случаях ингибирующая комплемент часть конструкции слитого белка может содержать биологически активный фрагмент CR1 человека (SEQ ID NO: 8). В некоторых случаях биологически активным фрагментом CR1 человека может быть SCR1 (аминокислоты 42-101 из SEQ ID NO: 8), SCR2 (аминокислоты 102-163 из SEQ ID NO: 8), SCR3 (аминокислоты 164-234 из SEQ ID NO: 8), SCR4 (аминокислоты 236-295 из SEQ ID NO: 8), SCR5 (аминокислоты 295-355 могут из SEQ ID NO: 8), SCR6 (аминокислоты 356-418 из SEQ ID NO: 8), SCR7 (аминокислоты 419-489 из SEQ ID NO: 8), SCR8 (аминокислоты 491-551 из SEQ ID NO: 8), SCR9 (аминокислоты 552-613 из SEQ ID NO: 8), SCR10 (аминокислоты 614-684 из SEQ ID NO: 8), SCR11 (аминокислоты 686-745 из SEQ ID NO: 8), SCR12 (аминокислоты 745-805 из SEQ ID NO: 8), SCR13 (аминокислоты 806-868 из SEQ ID NO: 8), SCR14 (аминокислоты 869-939 из SEQ ID NO: 8), SCR15 (аминокислоты 941-1001 из SEQ ID NO: 8), SCR16 (аминокислоты 1002-1063 из SEQ ID NO: 8), SCR17 (аминокислоты 1064-1134 из SEQ ID NO: 8), SCR18 (аминокислоты 1136-1195 из SEQ ID NO: 8), SCR19 (аминокислоты 1195-1255 из SEQ ID NO: 8), SCR20 (аминокислоты 1256-1318 из SEQ ID NO: 8), SCR21 (аминокислоты 1319-1389 из SEQ ID NO: 8), SCR22 (аминокислоты 1394-1454 из SEQ ID NO: 8), SCR23 (аминокислоты 1455-1516 из SEQ ID NO: 8), SCR24 (аминокислоты 1517-1587 из SEQ ID NO: 8), SCR25 (аминокислоты 1589-1648 из SEQ ID NO: 8), SCR26 (аминокислоты 1648-1708 из SEQ ID NO: 8), SCR 27 (аминокислоты 1709-1771 из SEQ ID NO: 8), SCR28 (аминокислоты 1772-1842 из SEQ ID NO: 8), SCR29 (аминокислоты 1846-1906 из SEQ ID NO: 8), SCR30 (аминокислоты 1907-1967 из SEQ ID NO: 8) или любые их комбинации.
[00171] В некоторых случаях ингибирующая комплемент часть конструкции слитого белка может включать полноразмерный фактор H человека (SEQ ID NO: 9). В некоторых случаях ингибирующая комплемент часть конструкции слитого белка может содержать биологически активный фрагмент фактора Н человека (SEQ ID NO: 9). В некоторых случаях ингибирующая комплемент часть конструкции слитого белка может включать полноразмерный фактор H мыши (SEQ ID NO: 10). В некоторых случаях ингибирующая комплемент часть конструкции слитого белка может включать биологически активный фрагмент фактора H мыши (SEQ ID NO: 10). Биологически активный фрагмент фактора H может содержать SCR 1-4, SCR 1-5, SCR 1-8, SCR 1-18, SCR 19-20 фактора H или любой гомолог природного фактора H или его фрагмент, или любые их комбинации.
Нацеливающий фрагмент
[00172] Нацеливающий фрагмент поливалентной конструкции может отвечать за целевую доставку модулятора системы комплемента к участкам действия, таким как участок активации комплемента. Модулятор комплемента может обладать терапевтической активностью, такой как специфическое ингибирование активации комплемента. Таким образом, описанная в данном документе поливалентная конструкция, как правило, выполняет двойную функцию: связывание с эпитопом, распознаваемым описанным в данном документе антителом, и проявление терапевтической активности посредством ингибирования активации комплемента. Нацеливающий фрагмент может представлять собой антитело или его антигенсвязывающий фрагмент, который является человеческим, мышиным, гуманизированным или верблюжьим.
[00173] Эпитоп, распознаваемый антителом или его антигенсвязывающим фрагментом, может быть доменом белка аннексина млекопитающего, фосфолипидом, таким как один или более из реакционно-способных в отношении антитела к C2 фосфолипидов, описанных ниже, или белком комплемента, таким как C3d, фрагменты C3 (например, депонированные фрагменты C3 - C3b, iC3b, C3d, C3dg; свободные или недепонированные фрагменты C3 - C3a, C3b, C3c или C3f).
[00174] Антитело или его антигенсвязывающий фрагмент могут специфически связываться с доменом белка аннексина млекопитающих. Аннексины представляют собой семейство кальций- (Ca2+) и фосфолипид-связывающих белков, которые отличаются от большинства других Ca2+ -связывающих белков своими Ca2+-связывающими сайтами. Ca2+-связывающий сайт семейства аннексинов имеет уникальную архитектуру, которая позволяет членам семейства аннексинов обратимо соединяться с периферией мембран клеток и/или органелл. Консервативный Ca2+-связывающий сайт, характерный для членов семейства аннексинов, расположен в центральном домене аннексина и содержит четыре повтора аннексина, каждый из семидесяти (70) аминокислот длиной. Центральный домен аннексина является α-спиральным и образует компактный изогнутый диск с выпуклой поверхностью, содержащей Ca2+- и мембран-связывающие сайты, и вогнутой стороной, ориентированной от мембраны, которая доступна для других типов взаимодействия. Члены семейства аннексина также обычно имеют аминоконцевой домен переменной длины, который предшествует центральному домену аннексина и отличается по последовательности и структуре. Двенадцать подсемейств аннексинов были охарактеризованы у позвоночных, включая аннексин IV и аннексин 2, каждое из которых имеет разные сплайс-варианты, с разными аминоконцевыми доменами и по-разному расположенными Ca2+-связывающими сайтами. Антитело или его антигенсвязывающий фрагмент, который специфически связывается с доменом в пределах белка или распознает эпитоп в белке аннексина IV, может представлять собой мкАт B4 или антигенсвязывающим фрагментом, полученным из мкАт к B4. Антитело или его антигенсвязывающий фрагмент, которое специфически связывается с доменом внутри белка аннексина IV или распознает эпитоп в пределах белка аннексина IV (например, белка аннексина IV человека), может представлять собой мкАт к B4 или антигенсвязывающий фрагмент, полученный из мкАт к B4, как описано в Kulik et al., J. Immunol. 182 (9): 5363 (2009). Иллюстративные CDR мкАт к B4 представлены в SEQ ID NO: 11-16. Нацеливающий фрагмент может дополнительно представлять собой антитело или его антигенсвязывающий фрагмент, который специфически связывается или распознает эпитоп в пределах белка аннексина-2 (например, белка аннексина-2 человека).
[00175] Антитело или его антигенсвязывающий фрагмент также может специфически связываться с фосфолипидом (например, фосфатидилэтаноламином (ФЭ), кардиолипином (КЛ), фосфатидилхолином (ФХ), фосфатидилинозитолом, фосфатидилглицерином, фосфатидилсерином или фосфатидной кислотой) или малондиальдегидом (МДА). Антитело или его антигенсвязывающий фрагмент, который специфически связывается с фосфолипидом, может быть мкАт к C2 или его производным. Фосфолипид может присутствовать на поверхности клетки, базальной мембране (например, мембране Бруха) или в патологической структуре (например, друзах) у человека и при этом находится внутри или рядом с тканью, подвергающейся (или подверженной риску) повреждению ткани (например, неишемическому повреждению), окислительному повреждению или любым их комбинациям. Фосфолипид может быть нейтральным, отрицательно или положительно заряженным или окисленным. Антитело или его антигенсвязывающий фрагмент, который специфически связывается с фосфолипидом, может представлять собой мкАт к C2 или антигенсвязывающий фрагмент, полученный из мкАт к C2, описанного в Elvington et al., J Immunol., 188(3): 1460-1468 (2012). Иллюстративные CDR мкАт к C2 представлены в SEQ ID NO: 17-22. мкАт к C2 распознает подмножество фосфолипидов, которые подвергаются воздействию после активации комплемента или ишемии; эта подгруппа фосфолипидов упоминается в данном документе как «реакционно-способные в отношении антитела к С2 фосфолипиды». Было показано, что мкАт к C2 распознает субпопуляцию фосфолипидов, которая включает фосфатидилхолин, фосфатидилэтаноламин и кардиолипин, но не фосфатидилглицерин или фосфатидилсерин.
[00176] Нацеливающий фрагмент в некоторых случаях может представлять собой антитело или его антигенсвязывающий фрагмент, который специфически связывается с депонированными или опсонизированными фрагментами C3, например, C3b, iC3b, C3d или C3dg, но может связываться или не связываться со свободными или циркулирующими или недепонированными фрагментами C3, например, C3a, C3b, C3c или C3f. В некоторых примерах конструкции слитых белков, содержащие антитело к C3d или C3dg или его антигенсвязывающий фрагмент, могут связываться с относительно более высокой аффинностью с депонированными фрагментами C3 по сравнению со свободными C3 или фрагментами C3. Например, антитело или его антигенсвязывающий фрагмент может связывать C3 и C3b с около 5-кратным, примерно 6-кратным, примерно 7-кратным, примерно 8-кратным, примерно 9-кратным или примерно 10-кратным снижением аффинности связывания по сравнению с C3d. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент связывает C3 и/или C3b с KD 10-4M или выше, 10-3M или выше, или 10-2M или выше, и связывает iC3b, C3dg или оба, с аффинностью связывания (KD) 10-8 М или менее, 10-9 М или менее, или 10-10 М или менее.
[00177] В некоторых примерах конструкции слитых белков, содержащие антитело к C3d или к C3dg или его антигенсвязывающий фрагмент, могут связываться с депонированными фрагментами C3, а также свободными C3 или фрагментами C3. Кроме того, возможно, что антитело к C3d или к C3dg или его антигенсвязывающий фрагмент иллюстративной конструкции слитого белка может связываться с фрагментом комплемента C3d и обладать способностью отличать связанные с тканью фрагменты C3 от циркулирующих C3 (например, C3, C3b или C3(H2O). Примеры антител к C3d или к C3dg или их антигенсвязывающих фрагментов включают, но не ограничиваются ими, мкАт к 3d9a, 3d29 и 3d8b (см., например, US9815890). В некоторых случаях антитела к C3d или к C3dg по данному изобретению могут связываться с C3d с большей специфичностью, чем коммерчески доступные антитела к C3d, такие как, например, антитела к C3d, обозначенные каталожными номерами Quidel A207 и A250, которые коммерчески доступны от Quidel Corporation (Quidel Corp., Сан-Диего и Санта-Клара, штат Калифорния). В некоторых случаях нацеливающий фрагмент может содержать антитело, специфичное к C3d и/или другим фрагментам C3 (C3b, iC3b, C3c, C3dg и т.д.), такое как антитело C8D3, как описано в публикации заявки на патент США № 2016/0333082. Антитело C8D3 может связываться с эпитопом на C3d с высокой аффинностью (см., например, Фиг. 3 и 8 в US 2016/0333082), который перекрывается со CR2-связывающим эпитопом. Последовательность тяжелой цепи C8D3 может представлять собой SEQ ID NO: 154, а последовательность легкой цепи - SEQ ID NO: 155; CDRH1, CDRH2 и CDRH3 C8D3 представляют собой SEQ ID NO: 156, 157 и 158 соответственно, а CDRL1, CDRL2 и CDRL3 представляют собой SEQ ID NO: 159, 160 и 161, соответственно. В этой публикации также описаны четыре клона гибридомы, которые продуцируют антитела к C3d (т.е. клоны B7, C2, C6 и C8). Последовательность тяжелой цепи к C6 представляет собой SEQ ID NO: 162, а последовательность легкой цепи - SEQ ID NO: 163; CDRH1, CDRH2 и CDRH3 к C6 представляют собой SEQ ID NO: 164, 165 и 166 соответственно, а CDRL1, CDRL2 и CDRL3 представляют собой SEQ ID NO: 167, 168 и 169, соответственно.
[00178] В некоторых примерах антитело к C3d может представлять собой антитело, которое связывает C3d, но не C3c («нео-анти-C3d»), как описано в публикации заявки на патент США № 2015/0139899. Связывание между антителом к C3d и его эпитопом с аффинностью от около 100 пМ до около 500 пМ, например, 447 пМ. Антитело к C3d также может представлять собой антитело, специфичное к неоэпитопу iC3b («нео-анти-iC3b»), и, в некоторых случаях, связывать его эпитоп с аффинностью от около 100 пМ до около 500 пМ, например, 262 пМ, однако, антитело не связывает C3c или C3d.
[00179] В некоторых примерах антитело к C3d может быть моноклональным антителом M130, которое специфично для антигенной детерминанты, экспрессируемой C3bi, C3dg и C3d, которая почти не обнаруживается в C3 и C3b. Было показано, что M130 имеет более высокую аффинность к C3d и iC3b, чем C3(H2O) (J.D. Tamerius et al., J. Immunol. 135(3): 2015-19 (1985)) и может связываться с C3d в остатках 1209-1236, и 1217-1232 (Lambris et al., PNAS, 82(12): 4235-9 (1985).
[00180] В некоторых примерах антитело к C3d может быть моноклональным антителом C3-12.2, которое связывается с фрагментами C3dg человека, крысы и мыши (Hidalgo et al., Eur. J. Immunol. 47(3): 504-15 (2017)). Он был приготовлен с использованием C3-дефицитных мышей, иммунизированных смесью белков C3b, iC3b и C3dg человека, и имел KD около 95 нМ, измеренную с помощью BiaCore. C3-12.2 и антитела 3d29, 3d8b и 3d9a могут распознавать один или более перекрывающихся фрагментов или вариантов C3, и Fab, по-видимому, связывается с тем же или соседним эпитопом, что и CR2.
[00181] В некоторых примерах антитело к C3d может быть моноклональным антителом 15-39-06, которое было выращено у крыс дикого типа с использованием синтетического пептида, полученного из C3dg человека и конъюгированного с токсином дифтерии (K.J. Rassmussen et al., J. Immunol. Methods, 444: 51-5 (2017)). Он может иметь специфичность к продукту расщепления комплемента C3dg.
[00182] В некоторых примерах антитело к C3d может быть коммерчески доступным антителом, специфичным к C3d и/или другим фрагментам C3 (т.е. C3b, iC3b, C3c, C3dg и т. д.). Примеры включают антитела, доступные от Quidel, сообщается, что моноклональные антитела A250 и A209 специфичны к неоэпитопам C3d и iC3b, соответственно. Было показано, что антитело A250 агглютинирует клетки EC3bi, EC3b и EC3d в анализе непрямой гемагглютинации, а также было показано, что оно связывается с радиоактивно меченными очищенными iC3b, C3b и C3d, но не с аналогично мечеными C3 или C3c. Было показано, что антитело A209 агглютинирует клетки EC3bi, но не клетки EC3b или EC3d, в анализе непрямой гемагглютинации, а также было показано, что оно связывается с радиоактивно меченным очищенным iC3b, но не с аналогично мечеными C3, C3b, C3d или C3c. Дополнительные примеры включают доступные от Abcam: антитело 7C10 к C3d с неизвестными эпитопами и антитело к C3d [E28-P] (ab136916), которое, как сообщается, связывается с эпитопом на N-конце C3d. В некоторых случаях коммерческие антитела могут быть антителами, доступными от BioRad, такими как антитело к C3d 053A-514.3.1.4 и антитело к iC3b 013III-1.16 (также называемое как MCA2607) специфичны для неоантигенов C3d и iC3b, соответственно. Сообщается, что доступное от Sigma антитело 3E7 распознает C3b и iC3b. Доступное от Origene моноклональное антитело AM26358PU-N реагирует с неоантигеном на iC3 (C3(H2O)), iC3b, C3dg и/или C3g и распознает iC3b, C3dg и C3g в плазме, но не распознает C3 или C3b. Компания U.S. Biological Life Sciences предлагает антитела C0010-19 крысиного анти-C3g (распознающие iC3, iC3b, C3dg). Также доступно от U.S. Biological Life Sciences мышиное антитело к инактивированному комплементу C3b C7850-13V-ML550. Сообщается, что это антитело распознает неоантиген инактивированного комплемента C3b (iC3b) человека в сыворотке крови. Компания Hycult предлагает ряд антител, включая антитело HM2199, мкАт 9 к C3g человека (YB2/90-5-20, которое реагирует с неоантигеном на iC3, iC3b, C3dg и C3g и которое распознает iC3b, C3dg и C3g в плазме, но не распознает C3 или C3b; моноклональное антитело HM2198 - антитело к C3d, мкАт 3 (YB2/39-11-1-7), которое, как сообщается, реагирует с линейной детерминантой в C3d, обнаруженной на C3, C3b, iC3b, C3dg и C3d и которое распознает C3, C3b, iC3b, C3dg и C3d, но не C3c; антитело HM2168 - антитело к активированному человеческому C3, клон bH6, которое специфично для неоэпитопа C3, экспрессируемого на фрагментах расщепления C3b, iC3b и C3c, но не C3dg и C3f (P. Garred et al., Scand J Immunol 1988, 27: 319); и антитело HM2257 - активированное человеческое C3, мкАт I3/15, которое распознает активированный белок комплемента C3 или, более конкретно, неоэпитоп на C3b, iC3b и C3dg, которых нет в нативном C3. Сообщается, что доступное от Meridian антитело H54189M реагирует с альфа-цепью C3b, но не с C3a или C3d, и позволяет продемонстрировать отложения C3 в ткани, на клетках, на микроорганизмах и в иммунных комплексах.
[00183] Каждое из антител 3d9a, 3d29 и 3d8b может быть способно связываться с участками ткани почек, проявляющими воспаление, при внутривенном введении мышам, и связываться с C3-опсонизированным зимозаном, который, как известно, экспрессирует iC3b, но не C3b. Таким образом, эти антитела могут различать связанный с тканью фрагмент C3d и циркулирующий в кровотоке нативный C3 и фрагмент C3b. C3-связывающее антитело или его антигенсвязывающий фрагмент может связываться с C3d или C3dg из нескольких видов (виды перекрестно реагируют). Антитело к C3d или к C3dg или его антигенсвязывающий фрагмент может связываться с C3d или C3dg по меньшей мере одного вида, выбранного из человека, млекопитающих, не являющихся человеком, (например, яванского макака или яванского макака, макака-резуса, обезьяны, павиана, шимпанзе, орангутана или гориллы), грызунов (например, мыши, крысы, хомяка, морской свинки, песчанки или кролика), крупного рогатого скота, овцы, козы, осла, свиньи, собаки, кошки, лошади и верблюда. Антитело к C3d или к C3dg или его антигенсвязывающий фрагмент может связываться с C3d или C3dg яванского макака. Описанные в данном документе антитела к C3d или к C3dg или их антигенсвязывающий фрагмент связываются с C3d или C3dg по меньшей мере двух видов, выбранных из приведенного выше списка. Антитело к C3d или к C3dg или его антигенсвязывающий фрагмент связывается как с C3d, так и с C3dg как человека, так и яванского макака. Антитело к C3d или к C3dg или его антигенсвязывающий фрагмент может быть антителом, выбранным из: 3d8b, 3d9a, 3d29, 3d11, 3d31, 3d3, 3d15, 3d10 и 3d16 (см., например, US9815890). Антитело к C3d или к C3dg или его антигенсвязывающий фрагмент может быть антителом, выбранным из: 3d9a, 3d29 и 3d8b. Антитело к C3d или к C3dg или его антигенсвязывающий фрагмент может быть 3d29.
[00184] В некоторых примерах антитело к C3d или к C3dg или его антигенсвязывающий фрагмент конструкции слитого белка может конкурировать с CR2 за связывание с C3d или C3dg. Такое антитело или его антигенсвязывающий фрагмент может снижать способность белка CR2 связываться с компонентом комплемента человека C3d или C3dg более чем на 50 (например, более чем на 55, 60, 65, 70, 75, 80, 85, 90, или 95 или более) %. Например, связывание CR2-C3d может быть уменьшено до по меньшей мере 60%, по меньшей мере 40% или до промежуточного значения в %. Антитело к C3d или к C3dg или его антигенсвязывающий фрагмент может значительно ингибировать или блокировать связывание CR2 с C3d. В некоторых вариантах осуществления такое антитело представляет собой 3d9a, 3d29 или 3d8b. Типичные конструкции слитых белков, содержащие нацеливающие домены к C3d или к C3dg и модулятор комплемента, в некоторых случаях могут лучше конкурировать со связыванием CR2 с C3d или C3dg, чем только с нацеливающим доменом к C3d или к C3dg.
Схемы конструкций слитых белков
[00185] Конструкции слитого белка, содержащие нацеливающий фрагмент и модулятор комплемента, могут включать антитело или его антигенсвязывающий фрагмент в качестве нацеливающего фрагмента. Примеры нацеливающего фрагмента включают, но не ограничиваются ими, моноклональное антитело или фрагмент антитела, диатело, химеризованное или химерное антитело или фрагмент антитела, гуманизированное антитело или фрагмент антитела, деиммунизированное человеческое антитело или фрагмент антитела, полностью человеческое антитело или фрагмент антитела, биспецифическое антитело или фрагмент антитела, моновалентное антитело или фрагмент антитела, одноцепочечное антитело, тяжелую цепь иммуноглобулина G1 (IgG1), одноцепочечный вариабельный фрагмент (например, scFv), sc(fv)2, тандемный scFv, диатело, домен VHH, домен VH, Fv, Fd, тяжелую цепь Fab, легкую цепь Fab, Fab ', легкую цепь Fab' и тяжелую цепь Fab', и F(ab')2. Антитело или антигенсвязывающие фрагменты, которые образуют нацеливающий фрагмент, могут быть человеческим антителом, гуманизированным антителом, мышиным антителом. Конструкции слитого белка могут включать один или более нацеливающих фрагментов, так что каждый нацеливающий фрагмент включает антитело или его антигенсвязывающий фрагмент, специфичный для мишени. Кроме того, возможно, что конструкции слитого белка включают более одного модулятора комплемента. Когда конструкция слитого белка включает более одного модулятора комплемента, она может включать несколько молекул одного и того же модулятора комплемента или может включать различные типы модуляторов комплемента. Точно так же конструкции слитого белка, которые имеют несколько нацеливающих фрагментов, могут содержать несколько молекул одного и того же типа нацеливающего фрагмента, таким образом, будучи поливалентными по отношению к нацеливающему фрагменту, или различными типами нацеливающих фрагментов, тем самым будучи полиспецифичными по отношению к нацеливающему фрагменту. Мишени конструкций слитого белка могут быть, например, белком комплемента или его фрагментом, доменом белка аннексина млекопитающего или фосфолипидом. Поскольку конструкции слитого белка могут обладать способностью специфически связываться с более чем одной мишенью, предполагается, что в некоторых примерах по меньшей мере две из вышеупомянутых мишеней могут быть специфически связаны с помощью описанных в данном документе конструкций слитого белка. Соответственно, конструкция слитого белка может быть биспецифической, триспецифической, тетраспецифической и т.д. Кроме того, конструкции слитого белка могут быть поливалентными, такими как двухвалентные, трехвалентные, четырехвалентные и т.д. Например, нацеливающий фрагмент конструкции слитого белка, который является биспецифическим, может быть специфичным для мишени, такой как домен аннексина млекопитающего, фосфолипид или фрагмент белка комплемента C3 (например, C3d), и модулятор комплемента слитого белка. Конструкция слитого белка может быть специфичной для другого белка в пути комплемента. Конструкция четырехвалентного слитого белка может иметь двухвалентный нацеливающий фрагмент, такой как двухвалентное антитело или его антигенсвязывающий фрагмент, который имеет две связывающие области для целевого белка и две молекулы модулятора комплемента. Кроме того, конструкция слитого белка может быть биспецифическим трехвалентным белком, где нацеливающий фрагмент включает двухвалентное антитело или его антигенсвязывающий фрагмент и константный домен (Fc) антитела, а модулятор комплемента слит с двухвалентным антителом или доменом Fc.
[00186] Другие примеры конструкции слитого белка включают гетеродимерную область Fc, содержащую различные модификации, которые способствуют образованию гетеродимерной области Fc, а не гомодимерной области Fc. См., например, JH Ha et al. Immunoglobulin Fc Heterodimer Platform Technology: From Design to Applications in Therapeutic Antibodies and Proteins. Front. Immuno. 7:394 (2016). Обычные антитела IgG являются поливалентными и моноспецифическими, сборка которых зависит от гомодимеризации in vivo двух идентичных тяжелых цепей (HC), которая опосредуется гомодимерными ассоциациями между доменами CH3 и впоследствии дисульфидными связями между каждой HC и каждой легкой цепью (LC), в B-клетках. Таким образом, разработка бсАт с использованием интактных форматов IgG с HC и LC дикого типа может включать проблемы неправильного объединения HC-HC и HCVH-CH1-LC. Кроме того, разработка трехвалентных слитых конструкций, которых есть модулятор комплемента, связанный только с одной из двух HC или только с одной из двух LC, может включать проблемы неправильного объединения. Соответственно, гетеродимерная область Fc нацеливающих фрагментов, описанных в данном документе, может быть полезной с точки зрения предотвращения проблемы неправильного объединения HC. Хотя область Fc дикого типа представляет собой гомодимер полипептидов, домены Fc, описанные в данном документе, в некоторых примерах, содержат аминокислотные замены, так что они не образуют гомодимеры. Мономерные домены Fc, Fc1 и Fc2, в некоторых вариантах осуществления представляют собой Fc IgG. В некоторых вариантах осуществления мономерные домены Fc, Fc1 и Fc2, относятся к другим подклассам иммуноглобулинов, включая IgA, IgE, IgD и IgM. Гетеродимерные области Fc нацеливающих групп, описанных в данном документе, содержат вариант константного домена CH3, содержащий аминокислотные мутации, которые способствуют образованию указанного гетеродимера со стабильностью, сравнимой со стабильностью нативного гомодимерного Fc, и константный домен CH2. Fc дикого типа является гомодимерным по природе, и эта особенность обусловлена как гидрофобными взаимодействиями в центре поверхности взаимодействия CH3, так и симметричными электростатическими взаимодействиями вокруг края гидрофобного ядра. Описанные в данном документе домены Fc могут содержать аминокислотные замены, так что они не образуют гомодимеры. Описанные в данном документе домены Fc могут содержать аминокислотные замены, которые способствуют образованию гетеродимеров по сравнению с гомодимерами. В определенных примерах гетеродимерный домен Fc создается с использованием (i) дизайна стерической комплементарности от симметричной к асимметричной (например, KiH, HA-TF, и ZW1) (см., например, Klein et al. Progress in overcoming the chain association issue in bispecific heterodimeric IgG antibodies. mAbs 4(6): 653-66 (2012); G.L. Moore et al. A novel bispecific antibody format enables simultaneous bivalent and monovalent co-engagement of distinct target antigens. mAbs 3(6) 546-557 (2011); T.S. von Kreudenstein et al. Improving biophysical properties of a bispecific antibody scaffold to aid developability: Quality by molecular design. mAbs 5(5): 646-654 (2013); H.J. Choi et al. A heterodimeric Fc-based bispecific antibody simultaneously targeting VEGFR-2 and Met exhibits potent antitumor activity. Mol Cancer Ther 12(12):2748-59 (2013), (ii) замены заряда на заряд (например, DD-KK), (iii) замены заряда на стерическую комплементарность с дополнительными дальнодействующими электростатическими взаимодействиями (например, EW-RVT) и (iv) замены изотипической цепи [например, сконструированный домен с заменой цепи (SEED)]. Мутации по типу «обмен цепей» включают, например, полученные из IgA 45 остатков на CH3-Fc1 IgG1 и полученные из IgG1 57 остатков на CH3-Fc2 IgA, или наоборот. Примеры мутации по типу «стерическая комплементарность от симметричной к асимметричной» включают HA-TF (S364H/F405A в Fc1-CH3 или CH3A и Y349T/T394F в Fc2-CH3 или CH3B), ZW1 (T350V/L351Y/F405A/Y407V в Fc1-CH3 или CH3A и T350V/T366L/K392L/T394W в Fc2-CH3 или CH3B). В других примерах вариант Fc может быть создан с использованием подхода «выступы-во-впадины (KiH)», где Fc1 содержит мутацию по типу «выступ» T366W в Fc1-CH3 или CH3A, а Fc2 содержит мутацию по типу «впадина» T366S/L368A/Y407V в Fc2-CH3 или CH3B. В дополнительных примерах вариант Fc может быть получен с использованием подхода «выступы-во-впадины (KiH)» плюс дисульфидная связь, KiHS-S, где Fc1 содержит мутацию по типу «выступ» T366W/S354C в Fc1-CH3 или CH3A, а Fc2 содержит мутации по типу «впадина» T366S/L368A/Y407V/Y349C в домене Fc2-CH3 или CH3B. В таких примерах гетеродимеризации благоприятствуют гидрофобные взаимодействия в центре поверхности взаимодействия Fc1-CH3 или CH3A и Fc2-CH3 или CH3B. Примеры мутаций с заменой заряда, в которых взаимодействие, благоприятствующее гетеродимеру Fc, основано на электростатической комплементарности, включают DD-KK (K409D/K392D в Fc1-CH3 или CH3A и D399K/E356K в Fc2-CH3 или CH3B, или наоборот). Примеры замены заряда на стерическую комплементарность плюс дополнительные мутации электростатического взаимодействия на больших расстояниях включают EW-RVT (K360E/K409W в Fc1-CH3 или CH3A и Q347R/D399V/F405T в Fc2-CH3 или CH3B, или наоборот); EW-RVTS-S (K360E/K409W/Y349C в Fc1-CH3 или CH3A и Q347R/D399V/F405T/S354C в Fc2-CH3 или CH3B, или наоборот), который содержит связь S-S между CH3. В других примерах вариант Fc может быть получен с использованием гидрофобной или стерической комплементарности и электростатической комплементарности, например 7.8.60 (K360D/D399M/Y407A в Fc1-CH3 или CH3A и E345R/Q347R/T366V/K409V в Fc2-CH3 или CH3B, или наоборот). Описанные в данном документе варианты Fc, образующие гетеродимер, также могут быть получены путем направленной эволюции в комбинации с дрожжевым поверхностным дисплеем и высокопроизводительным скринингом. Например, комбинаторная гетеродимерная система отображения библиотеки Fc может быть разработана путем скрещивания двух линий гаплоидных дрожжевых клеток; одна линия гаплоидных клеток, демонстрирующая библиотеку цепи Fc (CH3-Fc1 или CH3A) с мутациями в одном домене CH3 на поверхности дрожжевых клеток, а другая линия клеток секретирует библиотеку Fc цепи (CH3-Fc2 или CH3B) с мутациями в другом домене CH3. В спаренных клетках секретируемый CH3-Fc2 или CH3B может отображаться на поверхности клетки посредством гетеродимеризации с отображаемым CH3-Fc1 или CH3A. Обнаружение этого взаимодействия на основе флуоресценции позволяет проводить скрининг библиотеки на наличие гетеродимерных вариантов Fc с помощью проточной цитометрии. Антитело или его антигенсвязывающий фрагмент, которое содержит домен Fc дикого типа, обладает способностью взаимодействовать с неонатальным Fc-рецептором (FcRn) в зависимости от pH; это взаимодействие может увеличить период полужизни в сыворотке. Остатки, важные для высокоаффинного взаимодействия домена Fc и FcγR, расположены внутри домена CH2. Соответственно, в некоторых случаях гетеродимер Fc нацеливающих групп содержит домены CH2, которые имеют последовательность IgG дикого типа.
[00187] В некоторых примерах «домен CH3», включающий участок остатков с С-конца по отношению к домену CH2 в области Fc (т.е. от аминокислотного остатка примерно в положении 341 до аминокислотного остатка примерно в положении 447 IgG), может быть доменом CH3 с нативной последовательностью или вариантом домена CH3 (например, доменом CH3 с введенным «выступом» в одной его цепи и соответствующей введенной «впадиной» в его другой цепи). Такие вариантные домены CH3, в некоторых примерах, могут быть частью гетеродимерного домена Fc, как описано в данном документе. Соответственно, в некоторых примерах конструкция слитого белка содержит антитело «выступ в полость» или его антигенсвязывающий фрагмент.
[00188] В некоторых примерах область Fc может содержать последовательность IgG1 человека или мыши или IgG4 человека. В некоторых примерах область Fc может содержать последовательность IgG1 или IgG4 человека или IgG1 мыши, содержащую аминокислотные замены относительно последовательности дикого типа. Примеры таких областей Fc представлены в SEQ ID NO: 247 и 248.
Домены и структуры конструкций слитых белков
[00189] Конструкция слитого белка содержит один или более полипептидов, каждый из которых содержит домены и соединен, например, через одну или более дисульфидных связей. Например, в некоторых случаях конструкция слитого белка может содержать первую полипептидную цепь, которая содержит домен A, домен B, домен C, домен D и домен R, где домен А включает аминокислотную последовательность вариабельной области тяжелой цепи (VH) или его антигенсвязывающий фрагмент, домен В включает аминокислотную последовательность константной области тяжелой цепи CH1, домен С включает аминокислотную последовательность константной области тяжелой цепи CH2, домен D включает аминокислотную последовательность константной области тяжелой цепи CH3, и домен R представляет собой полипептид модулятора комплемента. В некоторых вариантах осуществления один или более доменов B, C и D являются необязательными. Первый полипептид может дополнительно содержать шарнирную область, и первый полипептид может дополнительно быть связан со вторым полипептидом, который содержит дополнительные домены, такие как домен E, который содержит аминокислотную последовательность вариабельной области легкой цепи (VL), или его антигенсвязывающий фрагмент, и необязательно домен F, который содержит аминокислотную последовательность константной области легкой цепи (CL1). Связь между первым и вторым полипептидом может быть посредством одной или более дисульфидных связей между доменами B и F. В некоторых примерах первый и второй полипептиды, как описано выше, комбинируются с использованием различных ориентаций для создания конструкций слитых белков, которые являются мономерными, трехвалентными гомодимерными, трехвалентными гомодимерными, четырехвалентными гомодимерными, четырехвалентными гетеродимерными и т. д.
[00190] В различных примерах конструкций поливалентных слитых белков (например, двухвалентных, трехвалентных, четырехвалентных) поливалентность конструкции слитого белка может повысить авидность конструкции слитого белка для конкретной мишени. Как описано в данном документе, «авидность» может относиться к общей силе взаимодействия между двумя или более молекулами, например, конструкцией слитого белка, которая содержит двухвалентный нацеливающий фрагмент, авидность может быть совокупной силой взаимодействия, обеспечиваемой аффинностью двух антигенсвязывающих сайтов. Авидность можно измерить, например, теми же методами, которые используются для определения аффинности. В некоторых примерах авидность может быть совокупной силой взаимодействий, обеспечиваемой аффинностью множества антигенсвязывающих сайтов в отношении отдельных антигенов на общей специфической мишени или комплексе, например, с отдельными антигенами, обнаруженными на отдельной клетке. В некоторых примерах авидность может быть совокупной силой взаимодействия, обеспечиваемой аффинностью множества антигенсвязывающих сайтов в отношении отдельных эпитопов на общем отдельном антигене.
Домен A (VH)
[00191] Домен А описанных в данном документе конструкций слитого белка может содержать аминокислотную последовательность VH, такую как последовательности вариабельного домена тяжелой цепи антитела. В типичной структуре антитела как в природе, так и в конструкциях слитых белков, описанных в данном документе, конкретная аминокислотная последовательность VH может связываться с конкретной аминокислотной последовательностью VL с образованием антигенсвязывающего сайта. В различных примерах аминокислотные последовательности VH представляют собой последовательности млекопитающих, включая последовательности человека, и синтезированные последовательности или комбинации последовательностей отличных от человека млекопитающих, млекопитающих и синтезированных последовательностей. В различных примерах аминокислотные последовательности VH могут быть мутированными последовательностями природных последовательностей, которые сохраняют достаточную последовательность CDR для сохранения желаемой антигенсвязывающей аффинности. В некоторых примерах последовательности VH могут быть из изотипа IgA1, IgA2, IgD, IgE, IgG1, IgG2, IgG3, IgG4 или IgM. В некоторых примерах последовательности VH могут быть из изотипа IgG1.
Домен E (VL)
[00192] Домен E описанных в данном документе конструкций слитого белка может содержать аминокислотную последовательность VL, такую как последовательности вариабельного домена легкой цепи антитела. В типичной структуре как в природных антителах, так и в конструкциях слитых белков, описанных в данном документе, конкретная аминокислотная последовательность VL может ассоциироваться с конкретной аминокислотной последовательностью VH с образованием антигенсвязывающего сайта. В различных примерах аминокислотные последовательности VL могут быть последовательностями млекопитающих, включая человеческие последовательности, синтезированные последовательности или комбинации последовательностей человека, отличных от человека млекопитающих, млекопитающих и синтезированных последовательностей. В различных примерах аминокислотные последовательности VL могут быть мутированными последовательностями природных последовательностей, которые сохраняют по меньшей мере 70%, 75%, 80%, 85%, 90%, 95% или более аминокислотной идентичности. В определенных примерах аминокислотные последовательности VL могут быть последовательностями вариабельного домена легкой цепи типа лямбда (λ). В определенных примерах аминокислотные последовательности VL могут быть последовательностями вариабельного домена легкой цепи типа каппа (κ). В некоторых примерах последовательности VL могут быть из изотипа IgA1, IgA2, IgD, IgE, IgG1, IgG2, IgG3, IgG4 или IgM. В некоторых примерах последовательности VL могут быть из изотипа IgG1.
Домен B (CH1)
[00193] Аминокислотные последовательности CH1 описанных в данном документе конструкций слитого белка могут быть последовательностями второго домена тяжелой цепи антитела со ссылкой от N-конца к C-концу. В определенных примерах последовательности CH1 могут быть эндогенными последовательностями или их мутированными последовательностями, которые сохраняют по меньшей мере 70%, 75%, 80%, 85%, 90%, 95% или более аминокислотной идентичности. В некоторых примерах последовательности CH1 могут быть последовательностями млекопитающих, включая, помимо прочего, последовательности мыши, крысы, хомяка, кролика, верблюда, осла, козы и человека. В некоторых примерах последовательности CH1 могут быть последовательностями человека. В некоторых примерах последовательности CH1 могут быть из изотипа IgA1, IgA2, IgD, IgE, IgG1, IgG2, IgG3, IgG4 или IgM. В некоторых примерах последовательности CH1 могут быть из изотипа IgG1. В некоторых примерах последовательности CH1 могут быть из изотипа IgG4.
Домен F (CL1)
[00194] Аминокислотные последовательности CL описанных в данном документе конструкций слитого белка могут быть последовательностями константного домена легкой цепи антитела. В определенных примерах последовательности CL могут быть эндогенными последовательностями или их мутированными последовательностями, которые сохраняют по меньшей мере 70%, 75%, 80%, 85%, 90%, 95% или более аминокислотной идентичности. В некоторых примерах последовательности CL могут быть последовательностями млекопитающих, включая, помимо прочего, последовательности мыши, крысы, хомяка, кролика, верблюда, осла, козы и человека. В некоторых примерах последовательности CL могут быть последовательностями человека. В определенных примерах аминокислотные последовательности CL могут быть последовательностями константного домена легкой цепи типа лямбда (λ). В некоторых примерах аминокислотные последовательности CL могут быть человеческими последовательностями константного домена легкой цепи типа лямбда. В определенных вариантах осуществления аминокислотные последовательности CL представляют собой последовательности константного домена легкой цепи типа каппа (κ). В предпочтительном варианте осуществления аминокислотные последовательности CL представляют собой человеческие последовательности константного домена легкой цепи типа каппа (κ).
Домен C (CH2)
[00195] В описанных в данном документе конструкциях слитого белка домен C может иметь аминокислотную последовательность CH2. Последовательности CH2 могут быть эндогенными последовательностями или их мутированными последовательностями, которые сохраняют по меньшей мере 70%, 75%, 80%, 85%, 90%, 95% или более аминокислотной идентичности. В некоторых примерах последовательности CH2 могут быть последовательностями млекопитающих, включая, но не ограничиваясь ими, последовательности человека. В некоторых примерах аминокислотная последовательность CH2 может иметь N-концевую шарнирную область, которая соединяет домен C с доменом B, например, соединяя C-конец домена B (последовательность CL1) с N-концом домена C (последовательность CH2). В некоторых примерах последовательности CH2 могут быть из изотипа IgA1, IgA2, IgD, IgE, IgG1, IgG2, IgG3, IgG4 или IgM. В некоторых примерах последовательности CH2 могут быть из изотипа IgG1. В некоторых примерах последовательности CH2 могут быть из изотипа IgG4.
Домен D (CH3)
[00196] В описанных в данном документе конструкциях слитого белка домен D может включать аминокислотную последовательность домена константной области, такую как аминокислотная последовательность CH3. Последовательности CH3 могут быть эндогенными последовательностями или их мутированными последовательностями, которые сохраняют по меньшей мере 70%, 75%, 80%, 85%, 90%, 95% или более аминокислотной идентичности. В некоторых примерах последовательности CH3 могут быть последовательностями млекопитающих, включая, но не ограничиваясь ими, последовательности человека. В некоторых примерах домен D может включать последовательность константной области, которая представляет собой последовательность CH3, содержащую ортогональные мутации по типу «выступ-во-впадину»; изоаллотипические мутации; и или мутация S354C, или мутация Y349C, которая образует сконструированный дисульфидный мостик с доменом CH3, содержащим ортогональную мутацию, или любые их комбинации. В некоторых примерах ортогональные мутации типа «выступ-во-впадину» в комбинации с изоаллотипическими мутациями могут включать следующие мутационные изменения: D356E, L358M, T366S, L368A и Y407V. В некоторых примерах последовательности CH3 могут быть из изотипа IgA1, IgA2, IgD, IgE, IgG1, IgG2, IgG3, IgG4 или IgM. В некоторых примерах последовательности CH3 могут быть из изотипа IgG1. В некоторых примерах последовательности CH3 могут быть из изотипа IgG4.В любом из этих примеров последовательности CH1, CH2 и CH3 могут быть из одного и того же изотипа, например, IgG1 или IgG3.
Определяющие комплементарность области в домене A и домене F
[00197] Аминокислотные последовательности VH (домен A) и VL (домен F) различных конструкций слитых белков, описанных в данном документе, могут содержать сильно вариабельные последовательности, называемые «определяющими комплементарность областями» (CDR), как правило, три CDR (CDR1, CD2 и CDR3). Во множестве примеров CDR могут быть последовательностями млекопитающих, включая, но не ограничиваясь ими, последовательности мыши, крысы, хомяка, кролика, верблюда, осла, козы и человека. В некоторых примерах CDR могут быть последовательностями человека. В некоторых примерах CDR могут быть природными последовательностями. В некоторых примерах CDR могут быть природными последовательностями, которые были мутированы для изменения аффинности связывания антигенсвязывающего сайта в отношении конкретного антигена или эпитопа. В определенных примерах природные CDR могли быть мутированы у хозяина in vivo в результате созревания аффинности и соматической гипермутации. В некоторых примерах CDR могли быть мутированы in vitro с помощью способов, включая, но не ограничиваясь, опосредованный ПЦР мутагенез и химический мутагенез. В различных примерах CDR могут содержать синтезированные последовательности, включая, но не ограничиваясь ими, CDR, полученные из библиотек CDR случайных последовательностей и библиотек рационально сконструированных CDR.
Каркасные области и прививания CDR
[00198] Аминокислотные последовательности VH и VL могут дополнительно содержать последовательности «каркасной области» (FR). FR, как правило, могут быть консервативными областями последовательности, которые могут действовать как каркас для перемежающихся CDR, как правило, в расположении FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4 (от N-конца к C-концу). Во множестве примеров FR могут быть последовательностями млекопитающих, включая, но не ограничиваясь ими, последовательности мыши, крысы, хомяка, кролика, верблюда, осла, козы и человека. В некоторых примерах FR могут быть последовательностями человека. В различных примерах FR могут быть природными последовательностями. В различных примерах FR могут быть синтезированными последовательностями, включая, но не ограничиваясь, рационально сконструированные последовательности.
[00199] Во множестве примеров и FR, и CDR могут быть получены из одной и той же природной последовательности вариабельного домена. В различных вариантах осуществления FR и CDR могут быть получены из различных последовательностей вариабельных доменов, где CDR могут быть привиты на каркасную область FR с CDR, обеспечивающими специфичность для конкретного антигена. В определенных примерах все привитые CDR могут быть получены из одной и той же природной последовательности вариабельного домена. В определенных примерах привитые CDR могут быть получены из различных последовательностей вариабельных доменов. В определенных примерах привитые CDR могут быть синтезированными последовательностями, включая, но не ограничиваясь ими, CDR, полученные из библиотек CDR случайных последовательностей и библиотек рационально сконструированных CDR. В определенных примерах привитые CDR и FR могут быть из одного и того же вида. В определенном примере привитые CDR и FR могут принадлежать разным видам. В определенных примерах различные домены конструкций слитого белка могут быть «гуманизированы», при этом привитые CDR представляют собой последовательности млекопитающих, отличных от человека, включая, помимо прочего, последовательности мыши, крысы, хомяка, кролика, верблюда, осла и козы, а FR представляют собой человеческие последовательности. В различных примерах части или конкретные последовательности FR одного вида могут использоваться для замены частей или конкретных последовательностей FR другого вида.
Гомодимерное или гетеродимерное объединение двух доменов D (домены CH3)
[00200] В описанных в данном документе конструкциях слитого белка два домена D могут быть связаны с образованием димерной конструкции. В различных примерах аминокислотные последовательности всех доменов D идентичны. В некоторых примерах домен D включает эндогенную последовательность CH3. В некоторых примерах, когда конструкции слитого белка являются гетеродимерами или гетеродимерами, два домена D с разными аминокислотными последовательностями могут ассоциироваться и по отдельности содержать соответственно ортогональные модификации в эндогенной последовательности CH3, где один домен D взаимодействует с другим доменом D, имеющим другую последовательность, и при этом ни один из двух доменов существенно не взаимодействует с еще одним доменом D (доменом CH3), не имеющим ортогональной модификации.
[002021] «Ортогональные модификации» или синонимично «ортогональные мутации», как описано в данном документе, могут представлять собой одну или более сконструированных мутаций в аминокислотной последовательности домена антитела, которые могут увеличивать аффинность связывания первого домена, имеющего ортогональную модификацию, для второго домена, имеющего комплементарную ортогональную модификацию. В некоторых примерах ортогональные модификации могут уменьшать аффинность домена, имеющего ортогональные модификации, в отношении домена, не имеющего дополнительных ортогональных модификаций. В некоторых примерах ортогональные модификации могут быть мутациями в последовательности домена эндогенного антитела. Во множестве примеров ортогональные модификации могут быть модификациями N-конца или C-конца последовательности эндогенного домена антитела, включая, помимо прочего, добавления или делеции аминокислот. В некоторых примерах ортогональные модификации могут включать, но не ограничиваются ими, сконструированные дисульфидные мостики, мутации типа «выступ-во-впадину» и мутации с изменением пары зарядов. В некоторых случаях ортогональные модификации могут включать комбинацию ортогональных модификаций, выбранных, но не ограничиваясь ими, сконструированных дисульфидных мостиков, мутаций типа «выступ -во-впадине» и мутаций с изменением пары зарядов. В некоторых примерах ортогональные модификации можно комбинировать с аминокислотными заменами, которые снижают иммуногенность, такими как изоаллотипические мутации.
[00202] В определенных примерах, где конструкции слитого белка являются гетеродимерами, ортогональные модификации могут включать мутации, которые создают сконструированные дисульфидные мостики между первым и вторым доменами. Как описано в данном документе, «сконструированные дисульфидные мостики» могут включать мутации, которые обеспечивают неэндогенные цистеиновые аминокислоты в двух или более доменах, так что при объединении двух или более доменов образуется ненативная дисульфидная связь. В определенных примерах сконструированные дисульфидные мостики могут улучшить ортогональную ассоциацию между конкретными доменами. В некоторых примерах мутации, которые могут образовывать сконструированные дисульфидные мостики, могут включать мутацию K392C в одном из первого или второго домена CH3 и D399C в другом домене CH3. В одном примере мутации, которые могут образовывать сконструированные дисульфидные мостики, могут включать мутацию S354C в одном из первого или второго доменов CH3 и Y349C в другом домене CH3. В еще одном примере мутации, которые могут образовывать сконструированные дисульфидные мостики, могут включать мутацию 447C как в первом, так и во втором доменах CH3, которые обеспечиваются удлинением C-конца домена CH3, включающего трипептидную последовательность KSC.
[00203] В некоторых примерах ортогональные модификации могут содержать мутации типа «выступ-впадина» (синоним «выступ-во-впадину»). Как описано в данном документе, мутации типа «выступ-во-впадину» могут включать мутации, которые изменяют стерические характеристики поверхности первого домена, так что первый домен будет предпочтительно ассоциироваться со вторым доменом, имеющим комплементарные стерические мутации, по сравнению с ассоциацией с доменами без комплементарных стерических мутаций. В различных примерах мутации типа «выступ-во-впадину» можно комбинировать с сконструированными дисульфидными мостиками. В различных вариантах осуществления мутации типа «выступ-во-впадину», изоаллотипические мутации и сконструированные дисульфидные мутации могут быть объединены для создания гетеродимерных конструкций слитого белка. В определенных примерах мутации типа «выступ-во-впадину» могут включать мутацию T366Y в одном домене CH3 и мутацию Y407T в другом домене CH3. В определенных примерах мутации типа «выступ-во-впадину» могут включать F405A в одном домене CH3 и T394W в другом домене CH3. В определенных вариантах осуществления мутации типа «выступ-во-впадине» могут включать мутацию T366Y и F405A в одном домене CH3, а также T394W и Y407T в другом домене CH3. В определенных примерах мутации типа «выступ-во-впадину» могут включать мутацию T366W в одном домене CH3 и Y407A в другом домене CH3. В определенных вариантах осуществления комбинированные мутации типа «выступ-во-впадине» и сконструированные дисульфидные мутации могут включать мутации S354C и T366W в одном домене CH3 и мутации Y349C, T366S, L368A и aY407V в другом домене CH3. В некоторых примерах объединенные мутации типа «выступ-во-впадине», изоаллотипические мутации и сконструированные дисульфидные мутации могут включать мутации S354C и T366W в одном домене CH3 и мутации Y349C, D356E, L358M, T366S, L368A и aY407V в другом домене CH3. В различных вариантах осуществления ортогональные модификации могут быть мутациями с изменением пары зарядов. В данном контексте мутации с изменением пары зарядов могут быть мутациями, которые влияют на заряд аминокислоты на поверхности домена, так что домен будет предпочтительно связываться со вторым доменом, имеющим дополнительные мутации с изменением пары зарядов по сравнению с ассоциацией с доменами без комплементарных мутаций с изменением пары зарядов. В определенных вариантах осуществления мутации с изменением пары зарядов могут улучшить ортогональную ассоциацию между конкретными доменами. В определенных вариантах осуществления мутации с изменением пары зарядов могут улучшить стабильность между конкретными доменами. В некоторых примерах мутации с изменением пары зарядов представляют собой мутацию T366K в одном домене CH3 и мутацию L351D в другом домене CH3.
Конструкции мономерных слитых белков
[00204] Иллюстративная конструкция мономерного слитого белка проиллюстрирована на Фиг. 2-3, содержащая первый и второй полипептиды, причем первый полипептид включает следующие домены: домен A, домен B и домен R; и второй полипептид содержит следующие домены: домен E и домен F. В проиллюстрированной конструкции слитого белка на Фиг. 2, домен А включает аминокислотную последовательность вариабельной области тяжелой цепи (VH), или его антигенсвязывающий фрагмент, домен В включает аминокислотную последовательность константной области тяжелой цепи CH1, а домен R включает полипептид модулятора комплемента, домен E включает аминокислотную последовательность вариабельной области легкой цепи (VL), или его антигенсвязывающий фрагмент, а домен F включает аминокислотную последовательность константной области легкой цепи (CL1). Кроме того, домены B и F первого и второго полипептидов, соответственно, могут быть связаны через одну или более дисульфидных связей. Домены первого полипептида расположены от N-конца к C-концу в ориентации A-B-R или R-A-B, а домены второго полипептида расположены от N-конца к C-концу в ориентации E-F. В примере, показанном на Фиг. 2, конструкция мономерного слитого белка включает связь между доменами A и R, например, химическую связь или через пептидный линкер. В дополнительном примере представлена конструкция мономерного слитого белка, как на Фиг. 3, включающий связь между доменом R и доменом B.
[00205] Еще один пример конструкции мономерного слитого белка проиллюстрирован на Фиг. 1 и 4, содержащий первый и второй полипептиды, причем первый полипептид включает следующие домены: домен A и домен B; и второй полипептид содержит следующие домены: домен E, домен F и домен R. Домены B и F первого и второго полипептидов, соответственно, могут быть связаны посредством одной или более дисульфидных связей. Домены первого полипептида расположены от N-конца к C-концу в ориентации A-B, а домены второго полипептида расположены от N-конца к C-концу в ориентации E-F. В примере, показанном на Фиг. 4, конструкция мономерного слитого белка включает связь между доменами F и R, например, химическую связь или через пептидный линкер. В дополнительном примере представлена конструкция мономерного слитого белка, как на Фиг. 1, содержащая связь между доменами E и R.
[00206] В дополнительных примерах представлены конструкции слитого белка, содержащие более одного полипептида модулятора комплемента, т.е. более одного домена R. В таких случаях конструкция слитого белка содержит первый полипептид с доменами A, B и первый полипептид модулятора комплемента (домен R1); второй полипептид с доменами E, F и второй полипептид модулятора комплемента (домен R2); где конструкция слитого белка имеет связь между доменом R1 и доменом A или между доменом R1 и доменом B; и между доменом R2 и доменом F или между доменом R2 и доменом E.
[00207] В дополнительном примере конструкция слитого белка содержит первый полипептид, содержащий домен A, домен B, первый полипептид модулятора комплемента (домен R1) и второй полипептид модулятора комплемента (домен R2); второй полипептид, содержащий домен E, домен F, третий полипептид модулятора комплемента (домен R3) и четвертый полипептид модулятора комплемента (домен R4). Конструкция слитого белка может иметь связи между доменом R1 и доменом B и между доменом R2 и доменом A, или между доменом R2 и доменом B, и между доменом R1 и доменом A; и между доменом R3 и доменом E, и между доменом R4 и доменом F; или между доменом R4 и доменом E, и между доменом R3 и доменом E.
Конструкции гомодимерных слитых белков, содержащие модуляторы комплемента, присоединенные к полипептиду тяжелой цепи
[00208] Иллюстративные конструкции четырехвалентных гомодимерных слитых белков показаны на Фиг. 5-6, содержащий два полипептида, каждый из которых содержит первый полипептид, содержащий домен A, домен B, шарнирную область, домен C, домен D и домен R; второй полипептид, содержащий домен E и домен F, при этом первый полипептид расположен от N-конца к C-концу в ориентации A-B-шарнирный домен-C-D-R со связью между доменом D и доменом R; или в ориентации R-A-B-шарнирная область-C-D со связью между доменом R и доменом A. Домены B и F первого полипептида и второго полипептида могут быть связаны через одну или более дисульфидных связей. Второй полипептид может быть расположен от N-конца к C-концу в ориентации E-F. Два первых полипептида могут быть связаны друг с другом через одну или более дисульфидных связей в шарнирной области. Дополнительные иллюстративные конструкции четырехвалентных гомодимерных слитых белков содержат два полипептида, каждый из которых содержит первый полипептид, содержащий домен A, домен B, шарнирную область, домен C и домен R; второй полипептид, содержащий домен E и домен F, при этом первый полипептид расположен от N-конца к C-концу в ориентации A-B-шарнирный домен-C-R со связью между доменом D и доменом R; или в ориентации R-A-B-шарнирная область-C со связью между доменом R и доменом A. Домены B и F первого полипептида и второго полипептида могут быть связаны через одну или более дисульфидных связей. Второй полипептид может быть расположен от N-конца к C-концу в ориентации E-F. Два первых полипептида могут быть связаны друг с другом через одну или более дисульфидных связей в шарнирной области.
[00209] Дополнительная иллюстративная конструкция четырехвалентного гомодимерного слитого белка содержит два полипептида, каждая полипептидная цепь включает первый полипептид, содержащий домен A, домен B, шарнирную область и домен R; второй полипептид, содержащий домен E и домен F, где первый полипептид расположен от N-конца к C-концу в ориентации A-B-шарнирный домен-R со связью между шарнирной областью и доменом R; или в ориентации R-A-B-шарнирная область со связью между доменом R и доменом A. Второй полипептид может быть расположен от N-конца к C-концу в ориентации E-F. Домены B и F первого полипептида и второго полипептида могут быть связаны одной или более дисульфидными связями. Два первых полипептида могут быть связаны друг с другом через одну или более дисульфидных связей в шарнирной области.
Конструкции гетеродимерных слитых белков, содержащие модуляторы комплемента, присоединенные к полипептиду тяжелой цепи
[00210] Иллюстративные конструкции трехвалентных гетеродимерных слитых белков, показанные на Фиг. 7-8, содержат первый полипептид, второй полипептид, третий полипептид и четвертый полипептид, причем первый полипептид содержит: домен A, домен B, шарнирную область, домен C, домен D и домен R, расположенные от N-конца к С-концу в ориентации R-A-B-шарнирная область-C-D со связью между доменом A и доменом R (как на Фиг. 8), или в ориентации A-B-шарнирная область-C-D-R со связью между доменом D и доменом R (как на Фиг. 7); второй полипептид, содержащий домен E и домен F, расположенные от N-конца к C-концу в ориентации E-F; третий полипептид, содержащий домен A, домен B, шарнирную область, домен C и домен D, расположенные от N-конца к C-концу в ориентации A-B-шарнирная область-C-D; и четвертый полипептид, содержащий домен E и домен F, расположенные от N-конца к C-концу в ориентации E-F. Домены B и F первого полипептида и второго полипептида могут быть связаны через одну или более дисульфидных связей, а домены B и F третьего и четвертого полипептида могут быть связаны через одну или более дисульфидных связей. Первый и третий полипептиды могут быть связаны друг с другом через одну или более дисульфидных связей в шарнирной области.
[00211] Дополнительные иллюстративные конструкции трехвалентных гетеродимерных слитых белков содержат первый полипептид, второй полипептид, третий полипептид и четвертый полипептид, причем первый полипептид содержит: домен A, домен B, шарнирную область, домен C и домен R, расположенные от N-конца к С-концу в ориентации R-A-B-шарнирная область-С со связью между доменом А и доменом R, или в ориентации А-В-шарнирная область-С со связью между доменом С и доменом R; второй полипептид, содержащий домен E и домен F, расположенные от N-конца к C-концу в ориентации E-F; третий полипептид, содержащий домен A, домен B, шарнирную область и домен C, расположенные от N-конца к C-концу в ориентации A-B-шарнирная область-C; и четвертый полипептид, содержащий домен E и домен F, расположенные от N-конца к C-концу в ориентации E-F. Домены B и F первого полипептида и второго полипептида могут быть связаны через одну или более дисульфидных связей, а домены B и F третьего и четвертого полипептида могут быть связаны через одну или более дисульфидных связей. Первый и третий полипептиды могут быть связаны друг с другом через одну или более дисульфидных связей в шарнирной области.
[00212] Дополнительная иллюстративная конструкция трехвалентного гетеродимерного слитого белка содержит первый полипептид, второй полипептид, третий полипептид и четвертый полипептид, причем первый полипептид содержит: домен A, домен B, шарнирную область и домен R, расположенные от N-конца к С-концу в ориентации R-A-B-шарнирная область со связью между доменом A и доменом R, или в ориентации A-B-шарнирная область-R со связью между шарнирной областью и доменом R; второй полипептид, содержащий домен E и домен F, расположенные от N-конца к C-концу в ориентации E-F; третий полипептид, содержащий домен A, домен B и шарнирную область, расположенные от N-конца к C-концу в ориентации A-B-шарнирная область; и четвертый полипептид, содержащий домен E и домен F, расположенные от N-конца к C-концу в ориентации E-F. Домены B и F первого полипептида и второго полипептида могут быть связаны через одну или более дисульфидных связей, а домены B и F третьего и четвертого полипептида могут быть связаны через одну или более дисульфидных связей. Третий полипептид может быть связан через одну или более дисульфидных связей в шарнирной области.
Конструкции слитых белков, содержащие модуляторы комплемента, присоединенные к полипептиду легкой цепи
[00213] Еще одна иллюстративная конструкция четырехвалентного гомодимерного слитого белка, проиллюстрированная на Фиг. 9, содержит два полипептида, каждый из которых содержит первый полипептид и второй полипептид, первый полипептид содержит домен A, домен B, шарнирную область, домен C и домен D; второй полипептид, содержащий домен E, домен F и домен R, где первый полипептид расположен от N-конца к C-концу в ориентации A-B-шарнирный домен-C-D; второй полипептид может быть расположен от N-конца к C-концу в ориентации E-F-R, имеющий связь между доменом F и доменом R (как показано на Фиг. 9), или в ориентации R-E-F, имеющей связь между доменом E и доменом R (как показано на Фиг. 10). Домены B и F первого полипептида и второго полипептида могут быть связаны одной или более дисульфидными связями. Два первых полипептида могут быть связаны друг с другом через одну или более дисульфидных связей в шарнирной области.
[00214] Дополнительные иллюстративные конструкции четырехвалентных гомодимерных слитых белков содержат два полипептида, каждый из которых содержит первый полипептид и второй полипептид, первый полипептид содержит домен A, домен B, шарнирную область и домен C; второй полипептид, содержащий домен E, домен F и домен R, где первый полипептид расположен от N-конца к C-концу в ориентации A-B-шарнирный домен-C; второй полипептид может быть расположен от N-конца к C-концу в ориентации E-F-R со связью между доменом F и доменом R, или в ориентации R-E-F со связью между доменом E и доменом R. Домены B и F первого полипептида и второго полипептида могут быть связаны одной или более дисульфидными связями. Два первых полипептида могут быть связаны друг с другом через одну или более дисульфидных связей в шарнирной области.
[00215] Дополнительные иллюстративные конструкции четырехвалентных гомодимерных слитых белков содержат два полипептида, каждый из которых содержит первый полипептид и второй полипептид, первый полипептид содержит домен A, домен B и шарнирную область; второй полипептид содержит домен E, домен F и домен R, где первый полипептид расположен от N-конца к C-концу в ориентации A-B-шарнирная область; второй полипептид может быть расположен от N-конца к C-концу в ориентации E-F-R со связью между доменом F и доменом R, или в ориентации R-E-F со связью между доменом E и доменом R. Домены B и F первого полипептида и второго полипептида могут быть связаны одной или более дисульфидными связями. Два первых полипептида могут быть связаны друг с другом через одну или более дисульфидных связей в шарнирной области.
[00216] Предложены иллюстративные гетеродимерные конструкции, содержащие первый полипептид, второй полипептид, третий полипептид и четвертый полипептид, причем первый полипептид содержит: домен A, домен B, шарнирную область, домен C, домен D; второй полипептид содержит домен E, домен F и домен R; третий полипептид содержит домен A, домен B, шарнирную область, домен C и домен D; четвертый полипептид содержит домен E и домен F; где первый полипептид и третьи полипептиды расположены от N-конца до C-концу в ориентации A-B-шарнирная область-C-D; второй полипептид расположен от N-конца к C-концу в ориентации E-F-R со связью между доменом F и доменом R (как показано на Фиг. 12), или в ориентации R-E-F со связью между доменом E и доменом R (как показано на Фиг. 11); и четвертый полипептид расположен от N-конца к C-концу в ориентации E-F. Домены B и F первого полипептида и второго полипептида могут быть связаны через одну или более дисульфидных связей, а домены B и F третьего и четвертого полипептида могут быть связаны через одну или более дисульфидных связей. Первый и третий полипептиды могут быть связаны друг с другом через одну или более дисульфидных связей в шарнирной области.
[00217] Предложены иллюстративные гетеродимерные конструкции, содержащие первый полипептид, второй полипептид, третий полипептид и четвертый полипептид, причем первый полипептид содержит: домен A, домен B, шарнирную область и домен C; второй полипептид содержит домен E, домен F и домен R; третий полипептид содержит домен A, домен B, шарнирную область и домен C; четвертый полипептид содержит домен E и домен F; где первый полипептид и третий полипептид расположены от N-конца к C-концу в ориентации A-B-шарнирная область-C; второй полипептид расположен от N-конца к C-концу в ориентации E-F-R со связью между доменом F и доменом R, или в ориентации R-E-F со связью между доменом E и доменом R; и четвертый полипептид расположен от N-конца к C-концу в ориентации E-F. Домены B и F первого полипептида и второго полипептида могут быть связаны через одну или более дисульфидных связей, а домены B и F третьего и четвертого полипептида могут быть связаны через одну или более дисульфидных связей. Первый и третий полипептиды могут быть связаны друг с другом через одну или более дисульфидных связей в шарнирной области.
[00218] Предложены иллюстративные гетеродимерные конструкции, содержащие первый полипептид, второй полипептид, третий полипептид и четвертый полипептид, причем первый полипептид содержит: домен A, домен B и шарнирную область; второй полипептид содержит домен E, домен F и домен R; третий полипептид содержит домен A, домен B и шарнирную область; четвертый полипептид содержит домен E и домен F; где первый полипептид и третий полипептид расположены от N-конца к C-концу в ориентации A-B-шарнирная область; второй полипептид расположен от N-конца к C-концу в ориентации E-F-R со связью между доменом F и доменом R, или в ориентации R-E-F со связью между доменом E и доменом R; и четвертый полипептид расположен от N-конца к C-концу в ориентации E-F. Домены B и F первого полипептида и второго полипептида могут быть связаны через одну или более дисульфидных связей, а домены B и F третьего и четвертого полипептида могут быть связаны через одну или более дисульфидных связей. Первый и третий полипептиды могут быть связаны друг с другом через одну или более дисульфидных связей в шарнирной области.
Конструкции слитых белков, содержащие модуляторы комплемента, присоединенные к константной области антитела
[00219] В данном документе предложен иллюстративный слитый белок, приведенный на Фиг. 13, содержащий первый полипептид, второй полипептид и третий полипептид; при этом первый полипептид содержит: домен R, шарнирную область, домен C и домен D; второй полипептид содержит: домен A, домен B, шарнирную область, домен C и домен D; третий полипептид содержит: домен E и домен F, где первый полипептид может быть расположен от N-конца к C-концу в ориентации R-шарнирная область-C-D со связью между доменом R и шарнирной областью; второй полипептид расположен от N-конца к C-концу в ориентации A-B-шарнирная область-C-D; третий полипептид может быть расположен от N-конца к C-концу в ориентации E-F. Домены B и F второго полипептида и третьего полипептида, соответственно, могут быть связаны через одну или более дисульфидных связей. Первый и второй полипептиды могут быть связаны друг с другом через одну или более дисульфидных связей в шарнирной области. В некоторых примерах слитый белок, содержащий связь между модулятором комплемента и константной областью, где модулятором комплемента может быть CR1 (1-10), CR1 (1-17), фактор H, MCP или DAF, связанный с константой областью молекулы иммуноглобулина, которая содержит, например, два домена CH3, два домена CH2 и шарнирную область.
Иллюстративные конструкции
[00220] Некоторые примеры конструкций слитых белков могут включать, но не ограничиваются ими, конструкции, приведенные на Фиг. 30 , содержащие модуляторы комплемента CR1 (1-10), CR1 (1-17) и слитые белки с антителами к C2 или их антигенсвязывающими фрагментами, такими как C2scFv-CR1 1-10, C2scFv-CR1 1-17, C2scFv-Crry, тяжелая цепь IgG1 к C2 - CR1 1-10, тяжелая цепь IgG1 к C2 - CR1 1-17, тяжелая цепь IgG1 к C2 (впадина) - CR1 1-10 [пары с областью Fc, содержащей выступ], тяжелая цепь IgG1 к C2 (впадина) - CR1 1-17 [пары с доменом Fc, содержащим выступ], тяжелая цепь IgG1 к C2 (выступ) [пары с доменом Fc, содержащим впадину)], тяжелая цепь Fab IgG1 к C2 - Crry, тяжелая цепь Fab IgG1 к C2 - CR1 1-10, тяжелая цепь Fab IgG1 к C2 - CR1 1-17, CR1 1-10- Fc IgG1 (впадина) [пары с доменом Fc, содержащим выступ], CR1 1-17- Fc IgG1 (впадина) [пары с доменом Fc, содержащим выступ], CR1 1-10 - тяжелая цепь IgG1 к C2 (впадина) [пары с конструкцией, содержащей домен Fc с выступом], CR1 1-17 - тяжелая цепь IgG1 к C2 (впадина) [пары с конструкцией, содержащей домен Fc с выступом], CR1 1-10 - тяжелая цепь Fab IgG1 к C2, CR1 1-17 - тяжелая цепь Fab IgG1 к C2, CR1 1-10 - легкая каппа-цепь к C2, CR1 1-17 - легкая каппа-цепь к C2; конструкции, проиллюстрированные на Фиг. 31, содержащие модулятор комплемента фактор H и слитые белки с антителом к C3d (3d29) или его антигенсвязывающими фрагментами, такие как, легкая каппа-цепь 3d29, тяжелая цепь мышиного Fab IgG1 3d29, тяжелая цепь мышиного Fab IgG1 3d29 - Crry, тяжелая цепь мышиного Fab IgG1 3d29 - CR1 1-10, тяжелая цепь мышиного Fab IgG1 3d29 - CR1 1-17, тяжелая цепь мышиного IgG1 3d29 - fH 1-5, тяжелая цепь мышиного IgG1 3d29 (выступ), тяжелая цепь мышиного IgG1 3d29 (впадина) - fH 1-5, тяжелая цепь мышиного IgG1 3d29 - fH 1-5; конструкты, проиллюстрированные на Фиг. 32, содержащие слитые белки с антителом против C3d (3d8b) или его антигенсвязывающими фрагментами, тяжелая цепь мышиного Fab IgG1 3d8b - Crry, тяжелая цепь мышиного Fab IgG1 3d8b - CR1 1-10, тяжелая цепь мышиного Fab IgG1 3d8b - fH 1-5, тяжелая цепь мышиного IgG1 3d8b, легкая каппа-цепь 3d8b - CR1 1-10, легкая каппа-цепь 3d8b - CR1 1-17, тяжелая цепь мышиного IgG1 3d8b (выступ), соединенная с тяжелой цепью мышиного IgG1 3d8b (впадина), тяжелая цепь мышиного IgG1 3d8b - CR1 1-10, тяжелая цепь мышиного IgG1 3d8b - CR1 1-17, тяжелая цепь мышиного IgG1 3d8b (впадина) - fH 1-5, соединенная с тяжелой цепью мышиного IgG1 3d8b (выступ), тяжелая цепь мышиного IgG1 3d8b - fH 1-5, CR1 1-10 - тяжелая цепь мышиного IgG1 3d8b, CR1 1-10 - легкая каппа-цепь 3d8b, CR1 1-17 - легкая каппа-цепь 3d8b, тяжелая цепь мышиного IgG1 3d29 - CR1 1-10, тяжелая цепь мышиного IgG1 3d29 - CR1 1-10 +His-метка, тяжелая цепь мышиного IgG1 3d29 (выступ) - CR1 1-10 +His-метка, тяжелая цепь мышиного IgG1 3d29 (впадина), тяжелая цепь мышиного IgG1 3d29 - CR1 1-17, тяжелая цепь мышиного IgG1 3d29 - CR1 1-17 +His-метка, тяжелая цепь мышиного IgG1 3d29 (впадина) - CR1 1-17 +His-метка, тяжелая цепь мышиного IgG1 3d29 (впадина), fH 1-5 - тяжелая цепь мышиного IgG1 3d8b, легкая каппа-цепь 3d8b - fH 1-5, и fH 1-5 - легкая каппа-цепь 3d8b; CR1 1-10- Fc мышиного IgG1 (выступ); тяжелая цепь мышиного IgG1 3d8b (впадина); легкая каппа-цепь 3d8b (мышиная); fH 1-5 - Fc мышиного IgG1 (выступ); тяжелая цепь Fab мышиного IgG1 3d8b - CR1 1-17; тяжелая цепь мышиного IgG1 3d8b (впадина) - CR1 1-17; тяжелая цепь мышиного IgG1 3d8b (выступ); тяжелая цепь мышиного IgG1 3d8b - CR1 1-17; тяжелая цепь мышиного IgG1 3d8b; легкая каппа-цепь 3d8b - CR1 1-17; CR1 1-17 - тяжелая цепь мышиного IgG1 3d8b; CR1 1-17 - легкая каппа-цепь 3d8b. Аминокислотные последовательности иллюстративных конструкций представлены в SEQ ID NO: 103-149, и на Фиг. 30-35 представлены их иллюстративные примеры.
[00221] В таблице 1 представлен перечень иллюстративных конструкций, содержащих антитела к C3d или их антигенсвязывающие фрагменты; и конструкции слитых белков, содержащие антитела к C3d или их антигенсвязывающие фрагменты и модуляторы комплемента или их биологически активные фрагменты. Последовательности представлены для тяжелой цепи и легкой цепи антител, включая последовательности полипептидов модулятора комплемента или их биологически активных фрагментов, которые конъюгированы с антителами к C3d (например, один или более модуляторов комплемента, конъюгированных с тяжелыми цепями иллюстративного антитела к C3d, на С-конце или на N-конце; один или более модуляторов комплемента, конъюгированных с легкими цепями иллюстративного антитела к C3d, на С-конце или на N-конце; один или более модуляторов комплемента, конъюгированных с шарнирной областью антитела к C3d). Конструкции слитого белка, содержащие антитела к C3d, в некоторых случаях содержат антитело к C3d, содержащее две тяжелые цепи и две легкие цепи; в некоторых случаях содержат фрагмент Fab к C3d, в некоторых случаях включают scFv к C3d. В некоторых случаях конструкции содержат две молекулы первого полипептида (две тяжелые цепи, идентифицированные в таблице как HC1 или HC1 + модулятор комплемента и HC2 или HC2 + модулятор комплемента) и две молекулы второго полипептида (две легкие цепи, идентифицированные в таблице как LC1 или LC1 + модулятор комплемента и LC2 или LC2 + модулятор комплемента).
[00222] Таблица 1: Иллюстративное белковые конструкции
Последовательности вариабельного домена и CDR в конструкциях слитых белков
[00223] В любой из описанных в данном документе конструкций слитого белка первый полипептид может содержать (i) три CDR тяжелой цепи, имеющие аминокислотные последовательности SEQ ID NO: 11, 12 и 13, или (ii) три CDR тяжелой цепи, имеющие аминокислотные последовательности. которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или более из SEQ ID NO: 11, 12 или 13; и второй полипептид может содержать (i) три CDR легкой цепи, имеющие аминокислотные последовательности SEQ ID NO: 14, 15 и 16, или (ii) три CDR легкой цепи, имеющие аминокислотные последовательности, которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или нескольких из SEQ ID NO: 14, 15 или 16. В некоторых вариантах осуществления существует одна консервативная аминокислотная замена в одной или более CDR. В других вариантах осуществления в CDR имеются одна, две, три или четыре дополнительных замены гистидина.
[00224] В некоторых вариантах осуществления конструкция слитого белка содержит первый полипептид, содержащий три CDR тяжелой цепи SEQ ID NO: 11, 12 и 13, с одной консервативной аминокислотной заменой в CDR1 тяжелой цепи, и второй полипептид, содержащий три CDR легкой цепи SEQ ID NO: 14, 15 и 16. В некоторых вариантах осуществления конструкция слитого белка содержит первый полипептид, содержащий три CDR тяжелой цепи SEQ ID NO: 11, 12 и 13, с одной консервативной аминокислотной заменой в CDR2 тяжелой цепи, и второй полипептид, содержащий три CDR легкие цепи SEQ ID NO: 14, 15 и 16. В некоторых вариантах осуществления конструкция слитого белка содержит первый полипептид, содержащий три CDR тяжелой цепи SEQ ID NO: 11, 12 и 13, с одной консервативной аминокислотной заменой в CDR3 тяжелой цепи, и второй полипептид, содержащий три CDR легкой цепи SEQ ID NO: 14, 15 и 16.
[00225] В любой из описанных в данном документе конструкций слитого белка первый полипептид может содержать (i) три CDR тяжелой цепи, имеющие аминокислотные последовательности SEQ ID NO: 17, 18 и 19, или (ii) три CDR тяжелой цепи, имеющие аминокислотные последовательности. которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или более из SEQ ID NO: 17, 18 или 19; и второй полипептид может содержать (i) три CDR легкой цепи, имеющие аминокислотные последовательности SEQ ID NO: 20, 21 и 22, или (ii) три CDR легкой цепи, имеющие аминокислотные последовательности, которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или нескольких из SEQ ID NO: 20, 21 или 22. В некоторых вариантах осуществления существует одна консервативная аминокислотная замена в одной или более CDR. В других вариантах осуществления в CDR имеются одна, две, три или четыре дополнительных замены гистидина.
[00226] В некоторых вариантах осуществления конструкция слитого белка содержит первый полипептид, содержащий три CDR тяжелой цепи SEQ ID NO: 17, 18 и 19, с одной консервативной аминокислотной заменой в CDR1 тяжелой цепи, и второй полипептид, содержащий три CDR легкой цепи SEQ ID NO: 20, 21 и 22. В некоторых вариантах осуществления конструкция слитого белка содержит первый полипептид, содержащий три CDR тяжелой цепи SEQ ID NO: 17, 18 и 19, с одной консервативной аминокислотной заменой в CDR2 тяжелой цепи, и второй полипептид, содержащий три CDR легкие цепи SEQ ID NO: 20, 21 и 22. В некоторых вариантах осуществления конструкция слитого белка содержит первый полипептид, содержащий три CDR тяжелой цепи SEQ ID NO: 17, 18 и 19, с одной консервативной аминокислотной заменой в CDR3 тяжелой цепи, и второй полипептид, содержащий три CDR легкой цепи SEQ ID NO: 20, 21 и 22.
[00227] В любой из описанных в данном документе конструкций слитого белка первый полипептид может содержать (i) три CDR тяжелой цепи, имеющие аминокислотные последовательности SEQ ID NO: 23, 24 и 25, или (ii) три CDR тяжелой цепи, имеющие аминокислотные последовательности. которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или более из SEQ ID NO: 23, 24 и 25; и второй полипептид может содержать (i) три CDR легкой цепи, имеющие аминокислотные последовательности SEQ ID NO: 26, 27 и 28, или (ii) три CDR легкой цепи, имеющие аминокислотные последовательности, которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или нескольких из SEQ ID NO: 26, 27 и 28. В некоторых вариантах осуществления существует одна консервативная аминокислотная замена в одной или более CDR. В других вариантах осуществления в CDR имеются одна, две, три или четыре дополнительных замены гистидина.
[00228] В некоторых вариантах осуществления конструкция слитого белка содержит первый полипептид, содержащий три CDR тяжелой цепи SEQ ID NO: 23, 24 и 25, с одной консервативной аминокислотной заменой в CDR1 тяжелой цепи, и второй полипептид, содержащий три CDR легкой цепи SEQ ID NO: 26, 27 и 28. В некоторых вариантах осуществления конструкция слитого белка содержит первый полипептид, содержащий три CDR тяжелой цепи SEQ ID NO: 23, 24 и 25, с одной консервативной аминокислотной заменой в CDR2 тяжелой цепи, и второй полипептид, содержащий три CDR легкие цепи SEQ ID NO: 26, 27 и 28. В некоторых вариантах осуществления конструкция слитого белка содержит первый полипептид, содержащий три CDR тяжелой цепи SEQ ID NO: 23, 24 и 25, с одной консервативной аминокислотной заменой в CDR3 тяжелой цепи, и второй полипептид, содержащий три CDR легкой цепи SEQ ID NO: 26, 27 и 28.
[00229] В любой из описанных в данном документе конструкций слитого белка первый полипептид может содержать (i) три CDR тяжелой цепи, имеющие аминокислотные последовательности SEQ ID NO: 29, 30 и 31, или (ii) три CDR тяжелой цепи, имеющие аминокислотные последовательности. которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или более из SEQ ID NO: 29, 30 и 31; и второй полипептид может содержать (i) три CDR легкой цепи, имеющие аминокислотные последовательности SEQ ID NO: 32, 33 и 34, или (ii) три CDR легкой цепи, имеющие аминокислотные последовательности, которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или нескольких из SEQ ID NO: 32, 33 и 34. В некоторых вариантах осуществления существует одна консервативная аминокислотная замена в одной или более CDR. В других вариантах осуществления в CDR имеются одна, две, три или четыре дополнительных замены гистидина.
[00230] В некоторых вариантах осуществления конструкция слитого белка содержит первый полипептид, содержащий три CDR тяжелой цепи SEQ ID NO: 29, 30 и 31, с одной консервативной аминокислотной заменой в CDR1 тяжелой цепи, и второй полипептид, содержащий три CDR легкой цепи SEQ ID NO: 32, 33 и 34. В некоторых вариантах осуществления конструкция слитого белка содержит первый полипептид, содержащий три CDR тяжелой цепи SEQ ID NO: 29, 30 и 31, с одной консервативной аминокислотной заменой в CDR2 тяжелой цепи, и второй полипептид, содержащий три CDR легкие цепи SEQ ID NO: 32, 33 и 34. В некоторых вариантах осуществления конструкция слитого белка содержит первый полипептид, содержащий три CDR тяжелой цепи SEQ ID NO: 29, 30 и 31, с одной консервативной аминокислотной заменой в CDR3 тяжелой цепи, и второй полипептид, содержащий три CDR легкой цепи SEQ ID NO: 32, 33 и 34.
[00231] В любой из описанных в данном документе конструкций слитого белка первый полипептид может содержать (i) три CDR тяжелой цепи, имеющие аминокислотные последовательности SEQ ID NO: 29, 259 и 31, или (ii) три CDR тяжелой цепи, имеющие аминокислотные последовательности. которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или более из SEQ ID NO: 29, 259 и 31; и второй полипептид может содержать (i) три CDR легкой цепи, имеющие аминокислотные последовательности SEQ ID NO: 32, 33 и 34, или (ii) три CDR легкой цепи, имеющие аминокислотные последовательности, которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или нескольких из SEQ ID NO: 32, 33 и 34. В некоторых вариантах осуществления существует одна консервативная аминокислотная замена в одной или более CDR. В других вариантах осуществления в CDR имеются одна, две, три или четыре дополнительных замены гистидина.
[00232] В некоторых вариантах осуществления конструкция слитого белка содержит первый полипептид, содержащий три CDR тяжелой цепи SEQ ID NO: 29, 259 и 31, с одной консервативной аминокислотной заменой в CDR1 тяжелой цепи, и второй полипептид, содержащий три CDR легкой цепи SEQ ID NO: 32, 33 и 34. В некоторых вариантах осуществления конструкция слитого белка содержит первый полипептид, содержащий три CDR тяжелой цепи SEQ ID NO: 29, 259 и 31, с одной консервативной аминокислотной заменой в CDR2 тяжелой цепи, и второй полипептид, содержащий три CDR легкие цепи SEQ ID NO: 32, 33 и 34. В некоторых вариантах осуществления конструкция слитого белка содержит первый полипептид, содержащий три CDR тяжелой цепи SEQ ID NO: 29, 259 и 31, с одной консервативной аминокислотной заменой в CDR3 тяжелой цепи, и второй полипептид, содержащий три CDR легкой цепи SEQ ID NO: 32, 33 и 34.
[00233] В любой из описанных в данном документе конструкций слитого белка первый полипептид может содержать (i) три CDR тяжелой цепи, имеющие аминокислотные последовательности SEQ ID NO: 29, 260 и 31, или (ii) три CDR тяжелой цепи, имеющие аминокислотные последовательности. которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или более из SEQ ID NO: 29, 260 и 31; и второй полипептид может содержать (i) три CDR легкой цепи, имеющие аминокислотные последовательности SEQ ID NO: 32, 33 и 34, или (ii) три CDR легкой цепи, имеющие аминокислотные последовательности, которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или нескольких из SEQ ID NO: 32, 33 и 34. В некоторых вариантах осуществления существует одна консервативная аминокислотная замена в одной или более CDR. В других вариантах осуществления в CDR имеются одна, две, три или четыре дополнительных замены гистидина.
[00234] В некоторых вариантах осуществления конструкция слитого белка содержит первый полипептид, содержащий три CDR тяжелой цепи SEQ ID NO: 29, 260 и 31, с одной консервативной аминокислотной заменой в CDR1 тяжелой цепи, и второй полипептид, содержащий три CDR легкой цепи SEQ ID NO: 32, 33 и 34. В некоторых вариантах осуществления конструкция слитого белка содержит первый полипептид, содержащий три CDR тяжелой цепи SEQ ID NO: 29, 260 и 31, с одной консервативной аминокислотной заменой в CDR2 тяжелой цепи, и второй полипептид, содержащий три CDR легкие цепи SEQ ID NO: 32, 33 и 34. В некоторых вариантах осуществления конструкция слитого белка содержит первый полипептид, содержащий три CDR тяжелой цепи SEQ ID NO: 29, 260 и 31, с одной консервативной аминокислотной заменой в CDR3 тяжелой цепи, и второй полипептид, содержащий три CDR легкой цепи SEQ ID NO: 32, 33 и 34.
[00235] В любой из описанных в данном документе конструкций слитого белка первый полипептид может содержать (i) три CDR тяжелой цепи, имеющие аминокислотные последовательности SEQ ID NO: 35, 36 и 37, или (ii) три CDR тяжелой цепи, имеющие аминокислотные последовательности. которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или более из SEQ ID NO: 35, 36 и 37; и второй полипептид может содержать (i) три CDR легкой цепи, имеющие аминокислотные последовательности SEQ ID NO: 38, 39 и 40, или (ii) три CDR легкой цепи, имеющие аминокислотные последовательности, которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или нескольких из SEQ ID NO: 38, 39 и 40. В некоторых вариантах осуществления существует одна консервативная аминокислотная замена в одной или более CDR. В других вариантах осуществления в CDR имеются одна, две, три или четыре дополнительных замены гистидина.
[00236] В некоторых вариантах осуществления конструкция слитого белка содержит первый полипептид, содержащий три CDR тяжелой цепи SEQ ID NO: 35, 36 и 37, с одной консервативной аминокислотной заменой в CDR1 тяжелой цепи, и второй полипептид, содержащий три CDR легкой цепи SEQ ID NO: 38, 39 и 40. В некоторых вариантах осуществления конструкция слитого белка содержит первый полипептид, содержащий три CDR тяжелой цепи SEQ ID NO: 35, 36 и 37, с одной консервативной аминокислотной заменой в CDR2 тяжелой цепи, и второй полипептид, содержащий три CDR легкие цепи SEQ ID NO: 38, 39 и 40. В некоторых вариантах осуществления конструкция слитого белка содержит первый полипептид, содержащий три CDR тяжелой цепи SEQ ID NO: 35, 36 и 37, с одной консервативной аминокислотной заменой в CDR3 тяжелой цепи, и второй полипептид, содержащий три CDR легкой цепи SEQ ID NO: 38, 39 и 40.
[00237] В любой из описанных в данном документе конструкций слитого белка первый полипептид может содержать (i) три CDR тяжелой цепи, имеющие аминокислотные последовательности SEQ ID NO: 147, 148 и 149, или (ii) три CDR тяжелой цепи, имеющие аминокислотные последовательности. которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или более из SEQ ID NO: 150, 151 и 152; и второй полипептид может содержать (i) три CDR легкой цепи, имеющие аминокислотные последовательности SEQ ID NO: 147, 148 и 149, или (ii) три CDR легкой цепи, имеющие аминокислотные последовательности, которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или нескольких из SEQ ID NO: 150, 151 и 152. В некоторых вариантах осуществления существует одна консервативная аминокислотная замена в одной или более CDR. В других вариантах осуществления в CDR имеются одна, две, три или четыре дополнительных замены гистидина.
[00238] В некоторых вариантах осуществления конструкция слитого белка содержит первый полипептид, содержащий три CDR тяжелой цепи SEQ ID NO: 147, 148 и 149, с одной консервативной аминокислотной заменой в CDR1 тяжелой цепи, и второй полипептид, содержащий три CDR легкой цепи SEQ ID NO: 150, 151 и 152. В некоторых вариантах осуществления конструкция слитого белка содержит первый полипептид, содержащий три CDR тяжелой цепи SEQ ID NO: 147, 148 и 149, с одной консервативной аминокислотной заменой в CDR2 тяжелой цепи, и второй полипептид, содержащий три CDR легкие цепи SEQ ID NO: 150, 151 и 152. В некоторых вариантах осуществления конструкция слитого белка содержит первый полипептид, содержащий три CDR тяжелой цепи SEQ ID NO: 147, 148 и 149, с одной консервативной аминокислотной заменой в CDR3 тяжелой цепи, и второй полипептид, содержащий три CDR легкой цепи SEQ ID NO: 150, 151 и 152.
[00239] В любой из описанных в данном документе конструкций слитого белка первый полипептид может содержать (i) три CDR тяжелой цепи, имеющие аминокислотные последовательности SEQ ID NO: 188, 199 и 190, или (ii) три CDR тяжелой цепи, имеющие аминокислотные последовательности. которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или более из SEQ ID NO: 188, 189 и 190; и второй полипептид может содержать (i) три CDR легкой цепи, имеющие аминокислотные последовательности SEQ ID NO: 191, 192 и 193, или (ii) три CDR легкой цепи, имеющие аминокислотные последовательности, которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или нескольких из SEQ ID NO: 191, 192 и 193. В некоторых вариантах осуществления существует одна консервативная аминокислотная замена в одной или более CDR. В других вариантах осуществления существует одна, две, три или четыре дополнительных замены гистидина (замена исходного остатка гистидином) в пределах CDR.
[00240] В любой из описанных в данном документе конструкций слитого белка первый полипептид может содержать (i) три CDR тяжелой цепи, имеющие аминокислотные последовательности SEQ ID NO: 196, 197 и 198, или (ii) три CDR тяжелой цепи, имеющие аминокислотные последовательности. которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или более из SEQ ID NO: 196, 197 и 198; и второй полипептид может содержать (i) три CDR легкой цепи, имеющие аминокислотные последовательности SEQ ID NO: 199, 200 и 201, или (ii) три CDR легкой цепи, имеющие аминокислотные последовательности, которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или нескольких из SEQ ID NO: 199, 200 и 201. В некоторых вариантах осуществления существует одна консервативная аминокислотная замена в одной или более CDR. В других вариантах осуществления в CDR имеются одна, две, три или четыре дополнительных замены гистидина.
[00241] В любой из описанных в данном документе конструкций слитого белка первый полипептид может содержать (i) три CDR тяжелой цепи, имеющие аминокислотные последовательности SEQ ID NO: 204 или 343, 205 и 206, или (ii) три CDR тяжелой цепи, имеющие аминокислотные последовательности. которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или более из SEQ ID NO: 204 или 343, 205 и 206; и второй полипептид может содержать (i) три CDR легкой цепи, имеющие аминокислотные последовательности SEQ ID NO: 207, 208 и 209, или (ii) три CDR легкой цепи, имеющие аминокислотные последовательности, которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или нескольких из SEQ ID NO: 207, 208 и 209. В некоторых вариантах осуществления существует одна консервативная аминокислотная замена в одной или более CDR. В других вариантах осуществления в CDR имеются одна, две, три или четыре дополнительных замены гистидина.
[00242] В любой из описанных в данном документе конструкций слитого белка первый полипептид может содержать (i) три CDR тяжелой цепи, имеющие аминокислотные последовательности SEQ ID NO: 212, 213 и 214, или (ii) три CDR тяжелой цепи, имеющие аминокислотные последовательности. которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или более из SEQ ID NO: 212, 213 и 214; и второй полипептид может содержать (i) три CDR легкой цепи, имеющие аминокислотные последовательности SEQ ID NO: 215, 216 и 217, или (ii) три CDR легкой цепи, имеющие аминокислотные последовательности, которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или нескольких из SEQ ID NO: 215, 216 и 217. В некоторых вариантах осуществления существует одна консервативная аминокислотная замена в одной или более CDR. В других вариантах осуществления в CDR имеются одна, две, три или четыре дополнительных замены гистидина.
[00243] В любой из описанных в данном документе конструкций слитого белка первый полипептид может содержать (i) три CDR тяжелой цепи, имеющие аминокислотные последовательности SEQ ID NO: 220, 221 и 222, или (ii) три CDR тяжелой цепи, имеющие аминокислотные последовательности. которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или более из SEQ ID NO: 220, 221 и 222; и второй полипептид может содержать (i) три CDR легкой цепи, имеющие аминокислотные последовательности SEQ ID NO: 223, 224 и 225, или (ii) три CDR легкой цепи, имеющие аминокислотные последовательности, которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или нескольких из SEQ ID NO: 223, 224 и 225. В некоторых вариантах осуществления существует одна консервативная аминокислотная замена в одной или более CDR. В других вариантах осуществления в CDR имеются одна, две, три или четыре дополнительных замены гистидина.
[00244] В любой из описанных в данном документе конструкций слитого белка первый полипептид может содержать (i) три CDR тяжелой цепи, имеющие аминокислотные последовательности SEQ ID NO: 228, 229 и 230, или (ii) три CDR тяжелой цепи, имеющие аминокислотные последовательности. которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или более из SEQ ID NO: 228, 229 и 230; и второй полипептид может содержать (i) три CDR легкой цепи, имеющие аминокислотные последовательности SEQ ID NO: 231, 232 и 233, или (ii) три CDR легкой цепи, имеющие аминокислотные последовательности, которые отличаются одной, двумя или тремя консервативными аминокислотными заменами в одной или нескольких из SEQ ID NO: 231, 232 и 233. В некоторых вариантах осуществления существует одна консервативная аминокислотная замена в одной или более CDR. В других вариантах осуществления в CDR имеются одна, две, три или четыре дополнительных замены гистидина.
[00245] В любой из описанных в данном документе конструкций слитого белка первый полипептид может содержать (i) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность по меньшей мере одной из SEQ ID NO: 194, 202, 210, 218, 226, 234, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 261, 262, 263, 264, 265, 270, 271, 272, 273 и 274; и (ii) вариабельную область легкой цепи, содержащую аминокислотную последовательность по меньшей мере одной из SEQ ID NO: 195, 203, 211, 219, 227, 235, 256, 257, 258, 266, 267, 268, 269, 275, 276, 277 и 278, или (i) вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами по меньшей мере в одной из SEQ ID NO: 194, 202, 210, 218, 226, 234, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 261, 262, 263, 264, 265, 270, 271, 272, 273 и 274; и (ii) вариабельную область легкой цепи, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами по меньшей мере в одной из SEQ ID NO: 195, 203, 211, 219, 227, 235, 256, 257, 258, 266, 267, 268, 269, 275, 276, 277 и 278.
[00246] В любой из описанных в данном документе конструкций слитого белка первый полипептид может содержать (i) гуманизированную вариабельную область тяжелой цепи, содержащую аминокислотную последовательность по меньшей мере одной из SEQ ID NO: 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 261, 262, 263, 264, 265, 270, 271, 272, 273, и 274; и (ii) гуманизированную вариабельную область легкой цепи, содержащую аминокислотную последовательность по меньшей мере одной из SEQ ID NO: 256, 257, 258, 266, 267, 268, 269, 275, 276, 277, и 278, или (i) гуманизированную вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами по меньшей мере в одной из SEQ ID NO: 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 261, 262, 263, 264, 265, 270, 271, 272, 273, и 274; и (ii) гуманизированную вариабельную область легкой цепи, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами по меньшей мере в одной из SEQ ID NO: 256, 257, 258, 266, 267, 268, 269, 275, 276, 277, и 278.
[00247] В любой из описанных в данном документе конструкций слитого белка первый полипептид может содержать (i) гуманизированную вариабельную область тяжелой цепи, содержащую аминокислотную последовательность по меньшей мере одной из SEQ ID NO: 246, 247, 248, 249, 250, 251, 252, 253, 254, и 255, и (ii) вариабельную область легкой цепи, содержащую аминокислотную последовательность по меньшей мере одной из SEQ ID NO: 256, 257, и 258, или (i) гуманизированную вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами по меньшей мере в одной из SEQ ID NO: 246, 247, 248, 249, 250, 251, 252, 253, 254, и 255; и (ii) гуманизированную вариабельную область легкой цепи, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами по меньшей мере в одной из SEQ ID NO: 256, 257, и 258.
[00248] В любой из описанных в данном документе конструкций слитого белка первый полипептид может содержать (i) гуманизированную вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 254; и (ii) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 258, или (i) гуманизированную вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами в SEQ ID NO: 254; и (ii) гуманизированную вариабельную область легкой цепи, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами в SEQ ID NO: 258.
[00249] В любой из описанных в данном документе конструкций слитого белка первый полипептид может содержать (i) гуманизированную вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 251; и (ii) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 258, или (i) гуманизированную вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами в SEQ ID NO: 251; и (ii) гуманизированную вариабельную область легкой цепи, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами в SEQ ID NO: 258.
[00250] В любой из описанных в данном документе конструкций слитого белка первый полипептид может содержать (i) гуманизированную вариабельную область тяжелой цепи, содержащую аминокислотную последовательность по меньшей мере одной из SEQ ID NO: 261, 262, 263, 264 и 265; и (ii) вариабельную область легкой цепи, содержащую аминокислотную последовательность по меньшей мере одной из SEQ ID NO: 266, 267, 268 и 269, или (i) вариабельную область гуманизированной тяжелой цепи, содержащую аминокислотную последовательность, которая отличается одну или более консервативных аминокислотных замен по меньшей мере в одной из SEQ ID NO: 261, 262, 263, 264 и 265; и (ii) гуманизированную вариабельную область легкой цепи, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами по меньшей мере в одной из SEQ ID NO: 266, 267, 268 и 269.
[00251] В любой из описанных в данном документе конструкций слитого белка первый полипептид может содержать (i) гуманизированную вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 264; и (ii) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 269, или (i) гуманизированную вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами в SEQ ID NO: 264; и (ii) гуманизированную вариабельную область легкой цепи, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами в SEQ ID NO: 269.
[00252] В любой из описанных в данном документе конструкций слитого белка первый полипептид может содержать (i) гуманизированную вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 264; и (ii) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 268, или (i) гуманизированную вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами в SEQ ID NO: 264; и (ii) гуманизированную вариабельную область легкой цепи, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами в SEQ ID NO: 268.
[00253] В любой из описанных в данном документе конструкций слитого белка первый полипептид может содержать (i) гуманизированную вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 263; и (ii) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 269, или (i) гуманизированную вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами в SEQ ID NO: 263; и (ii) гуманизированную вариабельную область легкой цепи, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами в SEQ ID NO: 269.
[00254] В любой из описанных в данном документе конструкций слитого белка первый полипептид может содержать (i) последовательность гуманизированной тяжелой цепи, содержащую аминокислотную последовательность по меньшей мере одной из SEQ ID NO: 280, 281, 282, 237, 283, 284, 285 и 286; и (ii) последовательность легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 279, или (i) последовательность гуманизированной тяжелой цепи, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами по меньшей мере в одном из SEQ ID NO: 280, 281, 282, 237, 283, 284, 285 и 286; и (ii) последовательность гуманизированной легкой цепи, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами в SEQ ID NO: 279.
[00255] Описанная в данном документе конструкция слитого белка содержит в некоторых вариантах осуществления последовательность гуманизированной тяжелой цепи, содержащую аминокислотную последовательность по меньшей мере одной из SEQ ID NO: 280, 281, 282, 283, 284, 285 и 286, или последовательность гуманизированной тяжелой цепи, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами в пределах по меньшей мере одной из SEQ ID NO: 280, 281, 282, 237, 283, 284, 285 и 286. Описанная в данном документе конструкция слитого белка содержит, в некоторых вариантах осуществления, последовательность гуманизированной легкой цепи, содержащую аминокислотную последовательность SEQ ID No. 279, или последовательность гуманизированной легкой цепи, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами в SEQ ID NO: 279.
[00256] В любой из описанных в данном документе конструкций слитого белка первый полипептид может содержать (i) последовательность тяжелой цепи мыши, содержащую аминокислотную последовательность по меньшей мере одной из SEQ ID NO: 73, 288, 244, 290 и 342; и (ii) последовательность легкой цепи мыши, содержащую аминокислотную последовательность по меньшей мере одной из SEQ ID NO: 68, 287, 59 и 289, или (i) последовательность тяжелой цепи мыши, содержащую аминокислотную последовательность, которая отличается одной или более консервативных аминокислотных замен по меньшей мере в одной из SEQ ID NO: 73, 288, 244, 290 и 342; и (ii) последовательность легкой цепи мыши, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами по меньшей мере в одной из SEQ ID NO: 68, 287, 59 и 289.
[00257] Описанная в данном документе конструкция слитого белка содержит, в некоторых вариантах осуществления, последовательность тяжелой цепи мыши, содержащую аминокислотную последовательность по меньшей мере одной из SEQ ID NO: 73, 288, 244, 290 и 342, или последовательность тяжелой цепи мыши, содержащую аминокислотную последовательность, которая отличается одной или более консервативными аминокислотными заменами по меньшей мере в одной из SEQ ID NO: 73, 288, 244, 290 и 342. Описанная в данном документе конструкция слитого белка содержит, в некоторых вариантах осуществления, последовательность легкой цепи мыши, содержащую аминокислотную последовательность по меньшей мере одной из SEQ ID NO: 68, 287, 59 и 289, или последовательность легкой цепи мыши, содержащую аминокислотную последовательность. которая отличается одной или более консервативными аминокислотными заменами по меньшей мере в одной из SEQ ID NO: 68, 287, 59 и 289.
[00258] Консервативная аминокислотная замена представляет собой замену, при которой данная аминокислота заменяется другой аминокислотой с аналогичными биохимическими свойствами (например, зарядом, гидрофобностью, размером). Например, любая из аминокислот в следующих категориях считается консервативной аминокислотной заменой: полярные (гидрофильные) нейтральные аминокислоты: серин (Ser), треонин (Thr), цистеин (Cys), гистидин (His), аспарагин (Asn), глутамин (Gln) и тирозин (Tyr); полярные отрицательно заряженные аминокислоты: аспарагиновая кислота (Asp), глутаминовая кислота (Glu); полярные положительно заряженные аминокислоты: гистидин (His), лизин (Lys), аргинин (Arg); гидрофобные аминокислоты: глицин (Gly), аланин (Ala), валин (Val), лейцин (Leu), изолейцин (Ile), пролин (Pro), фенилаланин (Phe), метионин (Met) и триптофан (Trp); гидрофобные аминокислоты с алифатическими боковыми цепями: аланин (Ala), валин (Val), лейцин (Leu), изолейцин (Ile); гидрофобные аминокислоты с ароматическими боковыми цепями: фенилаланин (Phe), триптофан (Trp); аминокислоты небольшого размера: аланин (Ala), цистеин (Cys), глицин (Gly), пролин (Pro), серин (Ser) и треонин (Thr).
Конъюгирование целевого фрагмента и модулятора комплемента
[00259] Связывание между нацеливающим фрагментом и модулятором комплемента может включать конъюгацию посредством: (1) прямого слияния двух белковых последовательностей; или (2) слияние с промежуточным линкером/линкерной последовательностью/спейсером/связывающей последовательностью. Термины «линкер», «линкерная последовательность», «спейсер» или «связывающая последовательность» в контексте данного изобретения могут означать молекулу или группу молекул (например, мономер или полимер), которые соединяют две молекулы и часто служат для размещения двух молекул в предпочтительной конфигурации. Для ковалентного связывания молекул вместе можно использовать ряд стратегий. Они включают, но не ограничиваются полипептидными линкерами между N- и C-концами белков или белковых доменов, линкером через дисульфидные сшивки и линкером через химические сшивающие реагенты. В одном аспекте линкер представляет собой пептидную связь, полученную рекомбинантными методами или пептидным синтезом.
[00260] В некоторых примерах модулятор комплемента и нацеливающий фрагмент могут быть конъюгированы через линкерный пептид, например, линкерный пептид, который может напрямую связывать нацеливающий фрагмент и модулятор комплемента. Линкерный пептид может содержать аминокислотные остатки, обеспечивающие гибкость. Таким образом, линкерный пептид может включать следующие аминокислотные остатки: глицин, серин, аланин или треонин. Линкерный пептид должен иметь длину, достаточную для связывания двух молекул таким образом, чтобы они принимали правильную конформацию относительно друг друга, чтобы они сохраняли желаемую активность. Подходящие для этой цели длины могут включать по меньшей мере от одного до около 100 аминокислотных остатков или более. Линкер может иметь длину от 1 до 30 аминокислот. Линкер может иметь длину от 1 до 20 аминокислот. Линкерные пептиды могут быть включены в качестве спейсеров между двумя белковыми фрагментами. Линкерные пептиды могут способствовать правильному фолдингу белка, стабильности, экспрессии и биологической активности фрагментов белковых фрагментов. Длинные гибкие линкерные пептиды могут состоять из глицина, серина или треонина с множественными остатками глицина, обеспечивающими очень гибкую конформацию. Остатки серина или треонина обеспечивают полярную площадь поверхности для ограничения гидрофобного взаимодействия внутри пептида или с фрагментами компонента слитого белка. Аминокислотные остатки, выбранные для включения в линкерный пептид, могут проявлять свойства, которые существенно не влияют на активность полипептида. Таким образом, линкерный пептид может не обладать зарядом, который несовместим с активностью полипептида, или мешать внутреннему фолдингу, или образовывать связи или другие взаимодействия с аминокислотными остатками в нацеливающем фрагменте или модуляторе комплемента, которые серьезно препятствовали бы связыванию фрагментов с их мишенями. Неограничивающие примеры последовательностей, которые могут служить линкером, могут включать короткие пептиды длиной от около 2 до около 15 аминокислот. Среди пептидных последовательностей, которые можно использовать в качестве линкеров в данном изобретении, есть (Gly-Ser)n, где n=0,1, 2, 3, 4, 5, 6, 7, или 8 (SEQ ID NO: 292); (GlyGlyGlySer)n, где n=1, 2, 3, или 4 (SEQ ID NO: 293); (GlySerSerGly)n, где n=1, 2, 3, или 4 (SEQ ID NO: 294). В некоторых конструкциях слитых белков линкерная последовательность представляет собой (GlyGlyGlyGlySerGlyGlyGlyGlySer) (SEQ ID NO: 138). В некоторых случаях глицин-аланиновые полимеры, аланин-сериновые полимеры и другие гибкие линкеры, такие как блокатор тетеринга для шейкер калиевого канала, включающие панель четвертичных аммониевых (QA), связанных с малеимидами, с полиглициновыми сшивками различной длины, см., например, T.J. Morin and W.R. Kobertz Tethering Chemistry and K+ Channels J. Biol. Chem. 283(37): 25105-25109 (2008), и можно использовать большое количество других гибких линкеров. Можно использовать глицин-сериновые полимеры, поскольку обе аминокислоты относительно неструктурированы и, следовательно, могут служить нейтральной сшивкой между компонентами. Во-вторых, серин является гидрофильным и, следовательно, способен солюбилизировать то, что может быть глобулярной глициновой цепью. В некоторых случаях линкер может содержать последовательность, представленную в любой из SEQ ID NO: 171-193, где в некоторых примерах n может быть равен по меньшей мере 4; в некоторых примерах n может быть равен от 1 до 8, от 1 до 5. Например, в SEQ ID NO: 161 n может быть равен по меньшей мере 4; в SEQ ID NO: 164 n = 1-8; в SEQ ID NO: 165 n = 1-5; в SEQ ID NO: 166, n = 1-5. В SEQ ID NO: 168 X может представлять собой A (аланин), K (лизин) или E (глутаминовая кислота), и n = 5-17. В некоторых случаях n в SEQ ID NO: 161, 164, 165, 166, 168, 170, 171, 174 и 179 может варьироваться от 1 до 17, от 1 до 8, от 1 до 5, по меньшей мере, 4 или от 5 до 17.
[00261] Подходящие линкеры также могут быть идентифицированы путем скрининга баз данных известных трехмерных структур на предмет встречающихся в природе мотивов, которые могут перекрывать разрыв между двумя полипептидными цепями, таких как линкеры, полученные из встречающихся в природе мультидоменных белков. В некоторых примерах линкер не является иммуногенным при введении пациенту-человеку. Таким образом, линкеры могут быть выбраны так, чтобы они имели низкую иммуногенность или считались обладающими низкой иммуногенностью. Например, может быть выбран линкер, который в природе существует у человека. В некоторых примерах линкер может иметь последовательность шарнирной области антитела, то есть последовательность, которая связывает области Fab и Fc антитела; альтернативно, линкер может иметь последовательность, которая содержит часть шарнирной области, или последовательность, которая по существу аналогична шарнирной области антитела. Другой способ получения подходящего линкера представляет собой оптимизацию простого линкера, например, (Gly4Ser)n (SEQ ID NO: 295), посредством случайного мутагенеза. Альтернативно, как только подходящий полипептидный линкер определен, могут быть созданы дополнительные линкерные полипептиды для выбора аминокислот, которые более оптимально взаимодействуют со связываемыми доменами. Другие типы линкеров, которые можно использовать в настоящем изобретении, включают искусственные полипептидные линкеры и интеины. В некоторых случаях модулятор комплемента и нацеливающий фрагмент могут быть конъюгированы с использованием метода ферментативной сайт-специфической конъюгации, который включает использование фермента трансглутаминазы млекопитающих или бактерий. Микробные трансглутаминазы (mTG) являются универсальными инструментами в современных исследованиях и биотехнологиях. Доступность больших количеств относительно чистых ферментов, простота использования и отсутствие регуляции кальцием и гуанозин-5'-трифосфатом (GTP) сделали mTG основным сшивающим ферментом, используемым как в пищевой промышленности, так и в биотехнологии. В настоящее время mTG используются во многих применениях для присоединения белков и пептидов к небольшим молекулам, полимерам, поверхностям, ДНК, а также к другим белкам. См., например, Pavel Strop, Veracity of microbial transglutaminase, Bioconjugate Chem. 25(5): 855-862.
[00262] В некоторых примерах представлена конструкция слитого белка, содержащая нацеливающие фрагменты, содержащие акцепторный глутамин в константной области, который затем может быть конъюгирован с белком комплемента через линкер на основе лизина (например, любая первичная аминовая цепь, которая является субстратом для ТГазы, например, включающий алкиламин, оксоамин), где конъюгация происходит исключительно на одном или более акцепторных остатках глутамина, присутствующих в нацеливающем фрагменте вне антигенсвязывающего сайта (например, вне вариабельной области, в константной области). Таким образом, конъюгация не происходит с глутамином, например, с глутамином, по меньшей мере частично экспонированным на поверхности, в вариабельной области. Конъюгат может быть образован путем взаимодействия нацеливающего фрагмента и линкера на основе лизина в присутствии ТГазы. Линкер на основе лизина может включать, например, в дополнение к первичному амину, например, алкиламин, оксоамин, пептид, полипептид, любую органическую молекулу, лекарственное средство или диагностический фрагмент, или может содержать реакционно-способный фрагмент, который впоследствии может вступать в реакцию с модулятором комплемента.
[00263] В еще одном аспекте могут быть созданы дисульфидные связи для связывания двух молекул. В некоторых случаях линкеры представляют собой химические сшивающие агенты. Например, можно использовать различные бифункциональные белковые связывающие агенты, включая, но не ограничиваясь ими, N-сукцинимидил-3-(2-пиридилдитиол) пропионат (SPDP), сукцинимидил-4-(N-малеимидометил) циклогексан-1-карбоксилат, иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCL), активные сложные эфиры (такие как дисукцинимидил суберат), альдегиды (такие как глутарельдегид), бис-азидосоединения (такие как бис (пара-бисидобензоил) гександиамин) производные диазония (такие как бис-(п-диазонийбензоил)-этилендиамин), диизоцианаты (такие как толиен 2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин может быть получен, как описано в Vitetta et al., 1971, Science 238:1098. Химические линкеры могут способствовать хелатированию изотопа. Например, меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) является типичным хелатирующим агентом для конъюгации радионуклеотида с антителом. (См., например, WO 94/11026). Линкер может быть расщепляемым, что способствует высвобождению цитотоксического лекарственного средства в клетке. Например, можно использовать кислотолабильный линкер, чувствительный к пептидазе линкер, диметиловый линкер или дисульфидсодержащий линкер (Chari et al., 1992, Cancer Research 52: 127-131). В качестве альтернативы, различные небелковые полимеры, включая, помимо прочего, полиэтиленгликоль (ПЭГ), полипропиленгликоль, полиоксиалкилены или сополимеры полиэтиленгликоля и полипропиленгликоля, могут найти применение в качестве линкеров, которые могут найти применение для связывания нацеливающих фрагментов по настоящему изобретению к партнеру по слиянию или конъюгату, такому как модулятор комплемента, для создания конструкции слитого белка по данному изобретению.
[00264] Если нацеливающий и активный фрагменты соединены напрямую, может быть получен гибридный вектор, в котором ДНК, кодирующая нацеливающий фрагмент, и модулятор комплемента сами непосредственно лигированы друг с другом. Если используется линкер, может быть получен гибридный вектор, в котором ДНК, кодирующая нацеливающий фрагмент, лигируется с ДНК, кодирующей один конец линкерного фрагмента; и ДНК, кодирующая модулятор комплемента, лигируется с другим концом линкерного фрагмента. Такое лигирование может выполняться либо последовательно, либо в виде трехстороннего лигирования.
Способы производства, очистки и способы определения характеристик
[00265] Описанные в данном документе конструкции слитого белка могут быть получены с использованием различных методик. Например, нуклеиновая кислота, кодирующая конструкцию слитого белка, описанную в данном документе, может быть вставлена в вектор экспрессии, который содержит последовательности регуляции транскрипции и трансляции, которые включают, например, промоторные последовательности, сайты связывания рибосом, последовательности начала и остановки транскрипции, последовательности начала и остановки трансляции, сигналы терминации транскрипции, сигналы полиаденилирования и последовательности энхансеров или активаторов. Регуляторные последовательности включают промотор и последовательности начала и остановки транскрипции. Кроме того, вектор экспрессии может включать более одной системы репликации, так что он может поддерживаться в двух разных организмах, например, в клетках млекопитающих или насекомых для экспрессии и в прокариотическом хозяине для клонирования и амплификации.
[00266] Доступно несколько возможных векторных систем для экспрессии слитых белков из нуклеиновых кислот в клетках млекопитающих. Один класс векторов основан на интеграции желаемых генных последовательностей в геном клетки-хозяина. Клетки, которые имеют стабильно интегрированную ДНК, могут быть отобраны путем одновременного введения генов лекарственной резистентности, таких как gpt E. coli (см. Mulligan and Berg Proc. Natl. Acad. Sci. USA 78:2072 (1981)) или neo Tn5 (см. Southern and Berg Mol. Appl. Genet. 1:327 (1982)). Селектируемый маркерный ген может быть либо связан с последовательностями гена ДНК, которые должны быть экспрессированы, либо введен в ту же клетку путем совместной трансфекции (Wigler et al. Cell 16:77 (1979)). Второй класс векторов использует ДНК-элементы, которые наделяют внехромосомную плазмиду способностью к автономной репликации. Эти векторы могут быть получены из вирусов животных, таких как вирус папилломы крупного рогатого скота (Sarver et al. Proc. Natl. Acad. Sci. USA, 79:7147 (1982)), вирус полиомы (Deans et al. Proc. Natl. Acad. Sci. USA 81:1292(1984)), или вирус SV40 (Lusky and Botchan Nature 293:79 (1981)).
[00267] Векторы экспрессии могут быть введены в клетки способом, подходящим для последующей экспрессии нуклеиновой кислоты. Способ введения в значительной степени зависит от типа клеток-мишеней, обсуждаемых ниже. Иллюстративные способы включают осаждение фосфатом кальция, слияние липосом, липофектин, электропорацию, вирусную инфекцию, трансфекцию, опосредованную декстраном, трансфекцию, опосредованную полибреном, слияние протопластов и прямую микроинъекцию.
[00268] Подходящие клетки-хозяева для экспрессии слитых белков включают клетки дрожжей, бактерий, насекомых, растений и, как описано выше, клетки млекопитающих. Представляют интерес бактерии, такие как E.coli, грибы, такие как Saccharomyces cerevisiae и Pichia pastoris, клетки насекомых, такие как SF9, линии клеток млекопитающих (например, линии клеток человека), а также первичные клеточные линии (например, первичные клетки млекопитающих). В некоторых вариантах осуществления слитые белки могут экспрессироваться в клетках яичника китайского хомячка (СНО) или в подходящей линии клеток миеломы, такой как (NS0). Подходящие линии клеток также включают, например, клетки HEK (клетки эмбриональной почки человека линии 293), клетки BHK-21 (почки детеныша хомячка); клетки 293 (эмбриональная почка человека); HMEpC (эпителиальные клетки молочной железы человека; клетки 3T3 (эмбриональные фибробласты мыши).
[00269] Как будет понятно специалисту в данной области техники, некоторые модуляторы комплемента, которые могут быть использованы в данном изобретении, встречаются в природе в виде секретируемых белков в сочетании с сигнальным или лидерным пептидом, в виде пропептида или того и другого, и подвергаются дальнейшему внутри- или внеклеточному процессингу. В таких случаях гибридные векторы по данному изобретению могут содержать одну или более последовательностей ДНК, кодирующих такие сигнальные или лидерные пептиды, одну или более последовательностей ДНК, кодирующих такую последовательность пропептида, или и то, и другое, в зависимости от того, является ли такая секреция, процессинг или комбинация секреции и процессинга необходимыми. Альтернативно, гибридные векторы по настоящему изобретению могут содержать последовательности ДНК, кодирующие другой сигнальный или лидерный пептид, пропептид или и то, и другое, последовательность, выбранную для оптимизации экспрессии и локализации слитого белка. В большинстве случаев сигнальный пептид может быть отсутствовать, так как нацеливающий фрагмент будет предоставлять достаточную информацию для нацеливания модулятора комплемента на желаемую ткань и клетки в организме субъекта.
[00270] В иллюстративных способах получения описанная в данном документе конструкция слитого белка может быть экспрессирована и очищена из трансгенных животных (например, трансгенных млекопитающих). Например, слитый белок, описанный в данном документе, может быть получен у трансгенных отличных от человека млекопитающих (например, грызунов, овец или коз), и выделен из молока, как описано, например, в Houdebine Curr. Opin. Biotechnol. 13(6):625-629 (2002); van Kuik-Romeijn et al. Transgenic Res. 9(2):155-159 (2000); и Pollock et al. J Immunol. Methods 231(1-2):147-157 (1999).
[00271] Описанные в данном документе конструкции слитых белков могут быть получены из клеток путем культивирования клетки-хозяина, трансформированной вектором экспрессии, содержащим нуклеиновую кислоту, кодирующую антитела или их антигенсвязывающие фрагменты, в условиях и в течение периода времени, достаточного для обеспечения экспрессии белков. Например, полипептиды, экспрессируемые в E. coli, могут быть повторно свернуты из телец включения (см., например, Hou et al. Cytokine 10:319-30 (1998)). Системы бактериальной экспрессии и способы их применения хорошо известны в данной области техники (см. Current Protocols in Molecular Biology, Wiley & Sons, и Molecular Cloning-A Laboratory Manual-3rd Ed., Cold Spring Harbor Laboratory Press, New York (2001)). Выбор кодонов, подходящих векторов экспрессии и подходящих клеток-хозяев будет варьироваться в зависимости от ряда факторов и может быть легко оптимизирован при необходимости. Описанная в данном документе конструкция слитого белка может быть экспрессирована в клетках млекопитающих или в других системах экспрессии, включая, помимо прочего, дрожжевые, бакуловирусные системы экспрессии и системы экспрессии in vitro (см., например, Kaszubska et al. Protein Expression and Purification 18:213-220 (2000)).
[00272] После экспрессии конструкции слитого белка могут быть выделены. Термин «очищенный» или «выделенный» применительно к любому из белков, описанных в данном документе (например, описанных в данном документе конструкций слитых белков), может относиться к полипептиду, который был отделен или очищен от компонентов (например, белков или других встречающихся в природе биологических или органических молекул), которые присутствуют вместе с ним в естественных условиях, например, другие белки, липиды и нуклеиновые кислоты в прокариотах, экспрессирующих эти белки. Как правило, полипептид очищается, когда он составляет по меньшей мере 60 (например, по меньшей мере 65, 70, 75, 80, 85, 90, 92, 95, 97 или 99) % по массе от общего белка в образце. Описанная в данном документе конструкция слитого белка может быть выделена или очищена различными способами в зависимости от того, какие другие компоненты присутствуют в образце. Стандартные способы очистки включают электрофоретические, молекулярные, иммунологические и хроматографические способы, включая ионообменную, гидрофобную, аффинную и обращенно-фазовую ВЭЖХ. Например, слитый белок можно очистить с использованием стандартной аффинной колонки с антителами к слитому белку. Применимы также методики ультрафильтрации и диафильтрации в сочетании с концентрированием белков. См., например, Scopes (1994) “Protein Purification, 3rd edition,” Springer-Verlag, New York City, N.Y. Необходимая степень очистки будет варьироваться в зависимости от желаемого применения. В некоторых случаях очистка экспрессированного полипептида не требуется.
[00273] Способы определения выхода или чистоты очищенного полипептида могут включать, например, анализ Брэдфорда, УФ-спектроскопию, биуретовый анализ белка, анализ белка методом Лоури, анализ белков амидочерным красителем, высокоэффективную жидкостную хроматографию (ВЭЖХ), масс-спектрометрию (МС) и метод гель-электрофореза (например, с использованием окрашивания белка, например, окрашивания кумасси синим или коллоидным серебром).
[00274] В других иллюстративных способах получения описанная в данном документе конструкция слитого белка может быть синтезирована de novo полностью или частично с использованием химических способов. Например, аминокислотные последовательности компонентов могут быть синтезированы твердофазными методами, отщеплены от смолы и очищены при помощи препаративной высокоэффективной жидкостной хроматографии с последующим химическим связыванием с образованием желаемого полипептида. Состав синтетических пептидов может быть подтвержден аминокислотным анализом или секвенированием.
[00275] После экспрессии, очистки или после очистки после экспрессии описанная в данном документе конструкция слитого белка может быть проанализирована на предмет любого из ряда желаемых свойств с использованием анализов in vitro или in vivo, таких как любые из описанных в данном документе. Например, слитый белок, описанный в данном документе, может быть проанализирован на его способность ингибировать С5-конвертазу, как описано, например, в Heinen et al. Factor H-related protein 1 (CFHR-1) inhibits complement C5 convertase activity and terminal complex formation. Blood 114(12):2439-47 (2009). Эндотоксины могут быть удалены из препаратов конструкции слитого белка с использованием различных коммерчески доступных реагентов, включая, помимо прочего, наборы для удаления эндотоксинов ProteoSpin™ (Norgen Biotek Corporation), гель для удаления эндотоксинов Detoxi-Gel (Thermo Scientific; Pierce Protein Research Products), набор для удаления эндотоксинов MiraCLEAN® (Mirus) или мембранe Acrodisc™-Mustang® E (Pall Corporation).
[00276] Способы обнаружения и/или измерения количества эндотоксина, присутствующего в образце (как до, так и после очистки), могут быть основаны на доступных коммерческих наборах. Например, концентрацию эндотоксина в образце белка можно определить с помощью набора QCL-1000 Chromogenic (BioWhittaker), наборов на основе лизата амебоцитов Limulus (LAL), таких как наборы Pyrotell®, Pyrotell®-T, Pyrochrome®, Chromo-LAL и CSE, доступные от Associates of Cape Cod Incorporated.
[00277] После экспрессии и очистки описанные в данном документе конструкции слитого белка могут быть модифицированы. Модификации могут быть ковалентными или нековалентными. Такие модификации могут быть введены в слитые белки, например, посредством реакции целевых аминокислотных остатков полипептида с органическим дериватизирующим агентом, который способен реагировать с выбранными боковыми цепями или концевыми остатками. Подходящие сайты для модификации могут быть выбраны с использованием любого из множества критериев, включая, например, структурный анализ или анализ аминокислотной последовательности слитых белков, описанных в данном документе.
[00278] В некоторых иллюстративных способах получения конструкция слитого белка, как описано в данном документе, может быть конъюгирована с гетерологичным фрагментом. Гетерологичный фрагмент может быть, например, гетерологичным полипептидом, терапевтическим агентом (например, токсином или лекарственным средством) или детектируемой меткой, такой как, без ограничения, радиоактивная метка, ферментативная метка, флуоресцентная метка или люминесцентная метка. Подходящие гетерологичные полипептиды могут включать, например, антигенную метку (например, FLAG, полигистидин, гемагглютинин (HA), глутатион-S-трансферазу (GST) или мальтоза-связывающий белок (MBP)) для использования при очистке антител. Гетерологичные полипептиды могут также включать полипептиды, которые можно использовать в качестве диагностических или детектируемых маркеров, например люциферазу, зеленый флуоресцентный белок (GFP) или хлорамфениколацетилтрансферазу (CAT). Если гетерологичный фрагмент представляет собой полипептид, этот фрагмент можно включить в описанный в данном документе слитый белок, в результате чего получится слитый белок.
Фармацевтические составы
[00279] В данном изобретении также представлены фармацевтические составы, содержащие конструкцию слитого белка, как описано в данном документе. Фармацевтические составы конструкций слитых белков по данному изобретению, как правило, составляют для парентерального введения, то есть болюсного, внутривенного, внутриопухолевого, подкожного введения фармацевтически приемлемого парентерального носителя и в однодозовой инъекционной форме. Конструкция слитого белка может быть необязательно смешана с фармацевтически приемлемыми разбавителями, носителями, эксципиентами или стабилизаторами (Remington's Pharmaceutical Sciences (1980) 16th edition, Osol, A. Ed.), в форме лиофилизированного состава или водного раствора. Приемлемые разбавители, носители, эксципиенты и стабилизаторы являются нетоксичными для реципиентов при используемых дозировках и концентрациях и включают в себя буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония, хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (менее чем около 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); неионные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (ПЭГ), или их комбинации.
[00280] Конструкции слитого белка также можно помещать в микрокапсулы, полученные, например, методом коацервации или межфазной полимеризации, например, в микрокапсулы из гидроксиметилцеллюлозы или желатина и микрокапсулы из поли(метилметакрилата), соответственно; в коллоидные системы для доставки лекарственных препаратов (например, в липосомы, микросферы альбумина, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методы раскрыты в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980).
[00281] Можно изготовить препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы твердых гидрофобных полимеров, содержащих конструкцию слитого белка, причем матрицы имеют форму изделий определенной формы, например, пленок или микрокапсул. Примеры матриц с замедленным высвобождением включают полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и гамма-этил-L-глутамата, неразлагаемый этиленвинилацетат, разлагаемые сополимеры молочной кислоты и гликолевой кислоты, такие как LUPRON DEPOT™ (инъецируемые микросферы, состоящие из сополимера молочной кислоты и гликолевой кислоты и ацетата лейпролида), и поли-D-(-)-3-гидроксимасляную кислоту.
[00282] Составы, используемые для введения in vivo, являются стерильными, что может быть достигнуто путем фильтрации через стерильные фильтрующие мембраны. Составы включают те, которые подходят для указанных выше способов введения. Составы для удобства могут быть представлены в виде единичной дозированной формы и могут быть приготовлены любым из способов, обычно применяемых при приготовлении фармацевтических составов в виде единичной дозированной формы. Методики и составы, как правило, можно найти в Remington's Pharmaceutical Sciences (Mack Publishing Co., Истон, штат Пенсильвания). Такое способы включают стадию объединения активного ингредиента с носителем, который состоит из одного или более дополнительных ингредиентов. Обычно препараты получают путем равномерного и тщательного перемешивания конструкции слитого белка с жидкими носителями или тонко измельченными твердыми носителями или теми и другими, и далее встряхивания продукта, если это необходимо.
[00283] Водные суспензии по данному изобретению содержат конструкции слитых белков в смесях с эксципиентами, подходящими для производства водных суспензий. Такие эксципиенты включают суспендирующий агент, такой как карбоксиметилцеллюлоза натрия, кроскармеллоза, повидон, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь и гуммиарабик, а также диспергирующие или смачивающие агенты, такие как встречающийся в природе фосфатид (например, лефацитин) продукт конденсации оксида алкилена с жирной кислотой (например, полиоксиэтиленстеарат), продукт конденсации оксида этилена с алифатическим спиртом с длинной цепью (например, гептадекаэтиленоксицетанол), продукт конденсации оксида этилена с неполным сложным эфиром, полученным из жирной кислоты и ангидрид гексита (например, моноолеат полиоксиэтиленсорбитана). Водная суспензия может также содержать один или более консервантов, таких как этил или н-пропил-пара-гидроксибензоат, один или более красителей, один или более ароматизаторов и один или более подсластителей, таких как сахароза или сахарин.
[00284] Фармацевтические составы, содержащие конструкции слитого белка, могут быть в форме стерильного препарата для инъекций, такого как стерильная водная или масляная суспензия для инъекций. Эта суспензия может быть приготовлена способами с использованием тех подходящих диспергирующих или смачивающих агентов и суспендирующих агентов, которые были упомянуты выше. Стерильный препарат для инъекций может находиться в виде стерильного раствора для инъекций или суспензии в нетоксичном парентерально-приемлемом разбавителе или растворителе, таком как раствор в 1,3-бутандиоле, или может быть приготовлен в виде лиофилизированного порошка. Среди приемлемых носителей и растворителей, которые могут быть использованы, являются вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла, как правило, можно использовать в качестве растворителя или суспендирующей среды. Для этой цели можно использовать любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, аналогичным образом могут использоваться при приготовлении инъекционных препаратов.
[00285] Количество действующего вещества, которое можно комбинировать с материалом носителя для получения единичной дозированной формы, могут варьироваться в зависимости от хозяина, который поддается лечению, и конкретного способа введения. Например, водный раствор, предназначенный для внутривенной инфузии, может содержать от около 3 до 500 мкг активного ингредиента на миллилитр раствора, чтобы можно было инфузировать подходящий объем со скоростью примерно 30 мл/час.
[00286] Составы, подходящие для парентерального введения, включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатические вещества и растворенные вещества, которые делают состав изотоничным с кровью предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и загустители.
[00287] Хотя пероральное введение терапевтических белков не является предпочтительным из-за гидролиза или денатурации в кишечнике, составы конструкций слитых белков, подходящие для перорального введения, могут быть приготовлены в виде дискретных единиц, таких как капсулы, крахмальные капсулы или таблетки, каждая из которых содержит заранее определенное количество конструкции слитого белка.
[00288] Составы могут быть упакованы в одноразовые или многодозовые контейнеры, например, запаянные ампулы и флаконы, и могут храниться в лиофилизированных (сублимированных) условиях, требующих только добавления стерильного жидкого носителя, например, воды, для инъекции непосредственно перед использованием. В некоторых случаях составы могут быть упаковками в инфузионном устройстве, таком как инфузионный насос, например, для контролируемой доставки. Инъекционные растворы и суспензии для немедленного приема готовят из стерильных порошков, гранул и таблеток, описанных ранее. Предпочтительными составы в виде единичной дозированной форме являются те, которые содержат суточную дозу или стандартную суточную часть дозы, как указано выше, или ее соответствующую часть активного ингредиента.
[00289] В изобретении также предлагаются композиции для ветеринарного применения, содержащие по меньшей мере один активный ингредиент, как определено выше, вместе с носителем для ветеринарного применения. Носители для ветеринарного применения представляют собой материалы, используемые для введения композиции, и могут быть твердыми, жидкими или газообразными материалами, которые в остальном инертны или приемлемы в ветеринарии и совместимы с активным ингредиентом. Эти композиции для ветеринарного применения можно вводить парентерально, перорально или любым другим желаемым путем.
Способы лечения ассоциированных с комплементом заболеваний, нарушений или патологических состояний
[00290] Описанные в данном документе конструкции слитого белка могут быть использованы для лечения различных ассоциированных с комплементом нарушений, таких как, но не ограничиваясь ими: ишемически-реперфузионное повреждение, ревматоидный артрит (РА); волчаночный нефрит; ишемически-реперфузионное повреждение; атипичный гемолитико-уремический синдром (аГУС); типичный или инфекционный гемолитико-уремический синдром (тГУС); болезнь плотного осадка (БПО); пароксизмальная ночная гемоглобинурия (ПНГ); рассеянный склероз (РС); макулярная дегенерацию (например, возрастная макулярная дегенерация (ВМД), географическая атрофия (также известная как атрофическая возрастная макулярная дегенерация или запущенная сухая ВМД); гемолиз, повышенные ферменты печени и синдром низких тромбоцитов (HELLP); сепсис; дерматомиозит; диабетическая ретинопатия; тромботическая тромбоцитопеническая пурпура (ТТП); спонтанная угроза выкидыша; pauci - иммунный васкулит; буллезный эпидермолиз; повторная угроза выкидыша; рассеянный склероз (РС) и черепно-мозговая травма.
[00291] Опосредованное комплементом нарушение со стороны сосудов также можно лечить с использованием конструкции слитого белка по данному изобретению, такое как, помимо прочего, сердечно-сосудистое заболевание, миокардит, нарушение мозгового кровообращения, нарушение со стороны периферических сосудов (например, скелетно-мышечное), реноваскулярное заболевание, нарушение сосудистого генеза брыжейки/ кишечника, реваскуляризация трансплантатов и/или приживленных органов, васкулит, нефрит при пурпуре Шенлейна-Геноха, васкулит, связанный с системной красной волчанкой, васкулит, связанный с ревматоидным артритом, геморрагический васкулит, болезнь Такаясу, синдром капиллярной утечки, дилатационная кардиомиопатия, диабетическая ангиопатия, аневризм торако-абдоминальной аорты, синдром Кавасаки (артериит), венозная газовая эмболия (ВГЭ) и рестеноз после установки стента, ротационной атерэктомии и чрескожной транслюминальной коронарной ангиопластики (ЧТКА).
[00292] Ассоциированное с комплементом нарушение также может представлять собой миастению, болезнь холодовых агглютининов (БХА), пароксизмальная холодовая гемоглобинурия (ПХГ), идиопатические воспалительные миопатии, включая дерматомиозит и полимиозит, склеродермию, сердечная аутоиммунная гемолитическая анемия, болезнь Грейвса, тиреоидит Хашимото, сахарный диабет I типа, псориаз, пузырчатка, аутоиммунная гемолитическая анемия (АИГА), идиопатическая тромбоцитопеническая пурпура (ИТП), синдром Гудпасчера, антифосфолипидный синдром (АФС), синдром Дегоса и катастрофический антифосфолипидный синдром (КАФС).
[00293] Ишемически-реперфузионное (И/Р) повреждение может относиться к повреждению ткани, вызванному возвращением кровоснабжения ткани после периода ишемии (ограничение кровоснабжения). Отсутствие кислорода и питательных веществ в крови создает состояние, при котором восстановление кровообращения приводит к воспалению и окислительному повреждению, а не к восстановлению нормальной функции. Ишемически-реперфузионное повреждение может быть связано с травматическим повреждением, включая геморрагический шок, а также со многими другими заболеваниями, такими как инсульт или окклюзия крупных сосудов (например, средней мозговой артерии), и является серьезной медицинской проблемой. В частности, ишемически-реперфузионное повреждение важно при сердечных приступах, инсульте, почечной недостаточности после сосудистой хирургии, посттрансплантационном повреждении и хроническом отторжении, а также при различных типах травматических повреждений, когда кровотечение приводит к гипоперфузии органа, а затем реперфузионному повреждению при жидкостной реанимации. Ишемически-реперфузионное повреждение или повреждение, вызванное реперфузией и ишемическими событиями, также наблюдается при различных аутоиммунных и воспалительных заболеваниях. Независимо от других факторов ишемически-реперфузионное повреждение может привести к увеличению смертности. Было показано, что ишемически-реперфузионное повреждение, а также гиповолемический шок и последующее повреждение тканей вызываются активацией комплемента и Fc-рецептора, а также набором и активацией нейтрофилов и других воспалительных клеток. См., например, S. Rehrig et al., 2001, J. Immunol. 167:5921-5927. Также было показано, что одиночные моноклональные антитела, которые широко реагируют с фосфолипидами и другими внеклеточными или внутриклеточными антигенами, такими как ДНК, могут вызывать ишемически-реперфузионное повреждение у мышей, у которых отсутствуют другие антитела (то есть у мышей с дефицитом В-клеток).
[00294] Заболевание почек, такое как альбуминурия или, в более широком смысле, протеинурия, может относиться к нарушениям функции почек, которые приводят к повышенному уровню экскреции белка с мочой. Повышенный уровень белка в моче является маркером почечной недостаточности или повреждения почек, вызванного иммунными нарушениями, гломерулонефритом, множественной миеломой, сердечно-сосудистыми заболеваниями или повреждением почек. Отношение альбумина и креатинина, присутствующих в моче, используется для выявления потенциальной почечной недостаточности; стойкий повышенный уровень белка в моче свидетельствует о почечной недостаточности.
[00295] В некоторых случаях определяется соотношение альбумина к креатинину. В некоторых вариантах осуществления отношение альбумина к креатинину определяют для субъекта, страдающего заболеванием (например, заболеванием почек). В некоторых вариантах осуществления в биологическом образце определяют отношение альбумина к креатинину. В некоторых вариантах осуществления биологический образец представляет собой мочу. В некоторых вариантах осуществления отношение альбумина к креатину, определенное для субъекта, страдающего заболеванием, сравнивается с отношением альбумина к креатину у другого субъекта или того же субъекта (например, другого субъекта с тем же заболеванием или одного и того же субъекта в разные моменты времени, или другого субъекта, который не болеет). В некоторых вариантах осуществление отношение альбумина к креатину определяют в какой-то момент после введения субъекту любой конструкции слитого белка по данному изобретению. В некоторых вариантах осуществления другому субъекту вводят сопоставимую конструкцию слитого белка. В некоторых вариант осуществления сопоставимая конструкция слитого белка не содержит антитела или его антигенсвязывающего фрагмента, но в остальном идентична конструкции слитого белка по данному изобретению. В некоторых вариантах осуществления отношение альбумина к креатинину определяется из биологического образца (например, образца мочи) от субъекта (например, субъекта, страдающего заболеванием). В некоторых вариантах осуществления отношение альбумина к креатинину у субъекта, страдающего заболеванием, составляет по меньшей мере около 1%, 2%, 3%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99% ниже, чем отношение альбумина к креатинину из сопоставимого биологического образца от того же субъекта, полученного в другой момент времени или от другого субъекта (например, другого субъекта, которому вводили сопоставимую конструкцию слитого белка).
[00296] В определенных случаях антитело к C3d/C3dg или его антигенсвязывающий фрагмент или конструкция слитого белка, содержащая такое антитело или его антигенсвязывающий фрагмент в качестве нацеливающего фрагмента, описанного в данном документе, отдельно или в комбинации со вторым противовоспалительным агентом, можно использовать для лечения воспалительного заболевания, такого как, помимо прочего, РА (см. выше), воспалительное заболевание кишечника, сепсис (см. выше), септический шок, острое повреждение легких, синдром диссеминированной внутрисосудистой коагуляции (ДВС-синдром) или болезнь Крона. В некоторых вариантах осуществления второй противовоспалительный агент может быть выбран из НПВП, кортикостероидов, метотрексата, гидроксихлорохина, агентов против ФНО, таких как этанерцепт и инфликсимаб, агента, истощающего В-клетки, такого как ритуксимаб, антагониста интерлейкина-1 и агента, блокирующего Т-клеточную костимуляцию, такого как абатацепт.
[00297] В некоторых вариантах осуществления ассоциированное с комплементом нарушение представляет собой ассоциированное с комплементом неврологическое нарушение, такое как, помимо прочего, боковой амиотрофический склероз (БАС), повреждение головного мозга, болезнь Альцгеймера и хроническая воспалительная демиелинизирующая невропатия.
[00298] К нарушениям, связанным с системой комплемента, также относятся легочные нарушения, связанные с системой комплемента, например, помимо прочего, астма, бронхит, хроническое обструктивное заболевание легких (ХОБЛ), интерстициальная легочная болезнь, дефицит альфа-1-антитрипсина, эмфизема, бронхоэктаз, облитерирующий бронхиолит, альвеолит, саркоидоз, фиброз легких и коллагеноз сосудов.
[00299] Конструкции слитых белков по данному изобретению могут быть использованы для лечения одного или более показаний, выбранных из следующего: пароксизмальная ночная гемоглобинурия (ПНГ), атипичная гемолитико-уремический синдром (аГУС), миастения, ассоциированный с антинейтрофильными цитоплазматическами антителами (АНЦА) васкулит (ААВ), C3-гломерулонефрит (C3G), болезни холодовых агглютининов (БХА), гемолитическая анемия с синдромом тепловых агглютининов, опосредованное антителами отторжение трансплантата, нейромиелит зрительного нерва (НЗН), болезнь плотного осадка, IgA-нефропатия (IgAN), мембранная нефропатия (МН), тромботическая микроангиопатия (ТМА), системная волчанка, волчаночный нефрит, дискоидная волчанка, псориатический артрит, псориаз, атопический дерматит, гнездная алопеция, гнойный гидраденит, витилиго, ревматоидный артрит, заболевания пародонта, заболевания костей (остеоартрит, перелом, остеомиелит), сухая макулярная дегенерация, влажная макулярная дегенерация, глаукома, увеит, географическая атрофия, операция на сердце и легких, регенерация сердца, рак легкого, нейродегенерация, БАС, рассеянный склероз, черепно-мозговая травма, повреждение спинного мозга, шизофрения, большое депрессивное расстройство, биполярное расстройство, склеродермия, склеродермальный почечный криз, кожный васкулит, кожные заболевания с образованием пузырей (эндемическая пузырчатка, буллезный пемфигоид, красная пузырчатка, обыкновенная пузырчатка) и связанные с друзами болезни.
[00300] Хотя в данном документе были показаны и описаны предпочтительные варианты осуществления этого изобретения, специалистам в данной области техники будет очевидно, что данные варианты осуществления приведены исключительно с целью иллюстрации. Множество вариаций, изменений и замен будут очевидны специалистам в данной области техники без отхода от объема и сущности данного изобретения. Следует понимать, что при осуществлении данного изобретения могут быть использованы различные альтернативы описанным в данном документе вариантам осуществления изобретения. Предполагается, что формула изобретения определяет объем изобретения, и что способы и структуры в рамках этой формулы изобретения и их эквиваленты охвачены ею.
Некоторые определения
[00301] Если в данном документе не определено иное, научные и технические термины, применяемые в связи с настоящим изобретением, имеют значения, которые обычно понимаются специалистами в данной области техники. Значение и объем терминов должны быть ясны, однако в случае любой скрытой двусмысленности определения, приведенные в данном документе, имеют приоритет над любым словарным или внешним определением. Кроме того, если иное не требуется по контексту, термины в единственном числе включают множественное число, а термины во множественном числе включают единственное число. В данной заявке использование «или» означает «и/или», если не указано иное. Кроме того, применение термина «в том числе», а также других форм, например, «включает» и «включительно», является неограничивающим.
[00302] Используемый в данном документе термин «модулятор комплемента» означает любую молекулу, которая может стимулировать или ингибировать активность пути комплемента.
[00303] Используемый в данном документе термин «антитело» означает любую антигенсвязывающую молекулу, содержащую по меньшей мере одну определяющую комплементарность область (CDR). Термин «антитело» включает молекулы иммуноглобулина, содержащие четыре полипептидные цепи, две тяжелые (H) цепи и две легкие (L) цепи, соединенные дисульфидными связями, а также их мультимеры (например, IgM). Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (сокращенно обозначаемую в данном документе как HCVR или VH) и константную область тяжелой цепи. Константная область тяжелой цепи содержит три домена, CH1, CH2 и CH3. Каждая легкая цепь содержит вариабельную область легкой цепи (сокращенно обозначаемую в данном документе как LCVR или VL) и константную область легкой цепи. Константная область легкой цепи содержит один домен (CL1). Области VH и VL могут быть дополнительно поделены на области гипервариабельности, называемые определяющими комплементарность областями (CDR), которые перемежаются более консервативными областями, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. В различных вариантах осуществления изобретения FR нацеливающего фрагмента (или ее антигенсвязывающей части) могут быть идентичны последовательностям зародышевой линии человека или могут быть модифицированы естественным или искусственным путем. Аминокислотная консенсусная последовательность может быть определена на основе параллельного анализа двух или более CDR.
[00304] Термины «антигенсвязывающая часть» антитела, «антигенсвязывающий фрагмент» антитела и т. п., используемые в данном документе, включают любой встречающийся в природе, ферментативно получаемый, синтетический или генетически сконструированный полипептид или гликопротеин, который специфично связывает антиген с образованием комплекса. Антигенсвязывающие фрагменты антитела могут быть получены, например, из молекул интактного антитела с использованием любых подходящих стандартных методик, таких как протеолитическое расщепление или методы рекомбинантной ДНК и генной инженерии, включающие манипулирование и экспрессию ДНК, кодирующей вариабельные и необязательно константные домены антитела. Такая ДНК известна и/или легко доступна, например, из коммерческих источников, библиотек ДНК (включая, например, фаговые библиотеки антител), или может быть синтезирована. ДНК может быть секвенирована и обработана химически или с использованием методов молекулярной биологии, например, для размещения одного или нескольких вариабельных и/или константных доменов в подходящей конфигурации или для введения кодонов, создания цистеиновых остатков, модификации, добавления или удаления аминокислот и т. д.
[00305] Неограничивающие примеры антигенсвязывающих фрагментов включают: (i) фрагменты Fab; (ii) фрагменты F(ab')2; (iii) фрагменты Fd; (iv) фрагменты Fv; (v) одноцепочечные молекулы Fv (scFv); (vi) фрагменты dAb; и (vii) минимальные единицы распознавания, состоящие из аминокислотных остатков, которые имитируют гипервариабельную область антитела (например, выделенную определяющую комплементарность область (CDR), такую как пептид CDR3) или пептид c ограниченной конформационной свободой FR3-CDR3-FR4.
[00306] Используемый в данном документе термин «вариабельная область» или «вариабельный домен» антитела или его фрагмента относится к частям легкой и тяжелой цепей молекул антитела, которые содержат аминокислотные последовательности определяющих комплементарность областей (CDR; т.е. CDR1, CDR2 и CDR3) и каркасные области (FR). VH соответствует вариабельному домену тяжелой цепи. VL соответствует вариабельному домену легкой цепи. Согласно методам, используемым в данном изобретении, аминокислотные положения, присвоенные CDR и FR, могут быть определены согласно Kabat et al. (Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, Md., 1987 and 1991)). Нумерация аминокислот антител или антигенсвязывающих фрагментов также соответствует нумерации по Kabat.
[00307] Используемый в данном документе термин «определяющие комплементарность области» или «CDR» относится к определяющей комплементарность области в вариабельных последовательностях антитела. В каждой из вариабельных областей тяжелой цепи и легкой цепи присутствует три CDR, которые обозначены как CDR1, CDR2 и CDR3, для каждой из вариабельных областей. Используемый в данном документе термин «набор CDR» относится к группе из трех CDR, которые встречаются в одной вариабельной области, способной связывать антиген. Точные границы этих CDR были определены по-разному согласно разным системам. Система, описанная Kabat (Kabat et al., Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, Md. (1987) и (1991)), не только обеспечивает однозначную систему нумерации остатков, применимую к любой вариабельной области антитела, но также обеспечивает точные границы остатков, определяющие три CDR. Эти CDR могут называться CDR по Kabat. Chothia с соавторами (Chothia et al., J. Mol. Biol. 196:901-917 (1987) и Chothia et al., Nature 342:877-883 (1989)) обнаружили, что некоторые части в CDR по Kabat принимают почти идентичные конформации пептидного остова, несмотря на большое разнообразие на уровне аминокислотной последовательности. Эти подчасти были обозначены как L1, L2 и L3 или H1, H2 и H3, где «L» и «H» обозначают области легкой цепи и тяжелой цепей, соответственно. Эти области могут называться CDR по Chothia, границы которых перекрываются с CDR по Kabat . Другие границы, определяющие CDR, перекрывающиеся с CDR по Kabat, были описаны Padlan (FASEB J. 9:133-139 (1995)) и MacCallum (J Mol Biol 262(5):732-45 (1996)). Тем не менее, другие определения границ CDR могут не строго соответствовать одной из описанных выше систем, но, тем не менее, будут перекрываться с CDR по Kabat, хотя они могут быть укорочены или удлинены в свете прогнозов или экспериментальных данных о том, что отдельные остатки или группы остатков или даже целые CDR существенно не влияют на связывание антигена. В используемых в данном документе способах могут использоваться CDR, определенные в соответствии с любой из этих систем, хотя в предпочтительных вариантах осуществления используются CDR, определенные по Kabat или Chothia.
[00308] ImMunoGeneTics (IMGT) также обеспечивает систему нумерации для вариабельных областей иммуноглобулина, включая CDR. См., например, M. P. Lefranc et al., Dev. Comp. Immunol. 27: 55-77(2003). Система нумерации IMGT основана на выравнивании более 5000 последовательностей, структурных данных и характеристик гипервариабельных петель и позволяет легко сравнивать вариабельные области и области CDR для всех видов. Согласно схеме нумерации IMGT, VH-CDR1 может находиться в положениях с 26 по 35, VH-CDR2 может находиться в положениях с 51 по 57, VH-CDR3 может находиться в положениях с 93 по 102, VL-CDR1 может находиться в положениях с 27 по 32, VL-CDR2 может находиться в положениях от 50 до 52, а VL-CDR3 может находиться в положениях от 89 до 97. В некоторых примерах антитела или их антигенсвязывающий фрагмент, описанные в данном изобретении, могут включать комбинацию определяющих комплементарность областей тяжелой цепи и легкой цепи (CDR), выбранных из последовательностей CDR, приведенных в таблице последовательностей, где CDR, показанные в таблице последовательностей определены в соответствии с номенклатурой IMGT. В некоторых случаях последовательности CDR антител или их антигенсвязывающих фрагментов анализировали на основе амплифицированных последовательностей кДНК с использованием программного обеспечения IMGT (во всемирной сети интернет по адресу http://imgt.org/IMGT_vquest/vquest).
[00309] Термин «каркасные области» (далее FR), используемый в данном документе, относится к тем остаткам вариабельного домена, которые отличаются от остатков CDR. Каждый вариабельный домен, как правило, имеет четыре FR, обозначенных как FR1, FR2, FR3 и FR4. Общие структурные особенности вариабельных областей антител или их функциональных фрагментов хорошо известны в данной области техники. Последовательность ДНК, кодирующую конкретное антитело, обычно можно найти с помощью хорошо известных методов, таких как методы, описанные в публикации Kabat, et al. 1987 Sequence of Proteins of Immunological Interest, U.S. Department of Health and Human Services, Bethesda MD, которая включена в данный документ посредством ссылки. Кроме того, общий метод клонирования функциональных вариабельных областей из антител можно найти в публикации V.K., et al., 1990 Proc. Natl. Acad. Sci. USA 87:1066, которая включена в данный документ посредством ссылки.
[00310] Используемый в данном документе термин «область Fc» означает полипептид, содержащий константную область антитела, за исключением первого иммуноглобулинового домена константной области и, в некоторых случаях, части шарнирной области. Таким образом, область Fc относится к двум последним доменам константной области иммуноглобулина IgA, IgD и IgG и к трем последним доменам константной области иммуноглобулина IgE и IgM, а также к гибкому шарнирному N-концу этих доменов. В случае IgA и IgM Fc может содержать J-цепь. Для IgG Fc может включать иммуноглобулиновые домены CH2 и CH3 и шарнир между CH1 и CH2 (Cγ 2). Fc может относиться к этой области отдельно или к этой области в контексте Fc-слитого белка. Термин область Fc включает, например, области Fc с нативной последовательностью, рекомбинантные области Fc и вариантные области Fc. Хотя границы области Fc тяжелой цепи антитела могут варьировать, область Fc тяжелой цепи IgG человека часто определяют как участок от аминокислотного остатка в положении Cys226 или от Pro230 до его карбокси-конца, при этом нумерация соответствует индексу EU, как в Kabat. C-концевой лизин (остаток 447 в соответствии с системой нумерации EU) области Fc может быть удален, например, во время получения или очистки антитела, или путем рекомбинантного конструирования нуклеиновой кислоты, кодирующей тяжелую цепь антитела. Соответственно, конструкции слитого белка, описанные в данном документе, могут содержать нацеливающие фрагменты, содержащие области Fc, из которых удалены остатки K447 или из которых не удалены остатки K447, или конструкции слитого белка, в которых некоторые из областей Fc имеют удаленные остатки K447, а некоторые не имеют удаленных остатков K447.
[00311] Используемый в данном документе термин «полипептид Fc» может относиться к полипептиду, который включает всю или часть области Fc. Полипептиды Fc могут включать антитела, Fc-слитые белки, выделенные Fc и фрагменты Fc. Иммуноглобулины могут быть полипептидами Fc. Используемый в данном документе термин «Fc-слитый белок» означает белок, в котором один или более полипептидов функционально связаны с Fc. Fc-слитый белок в данном документе означает синоним терминов «иммуноадгезин», «слитый белок Ig», «химера Ig» и «рецепторный глобулин» (или «рецептор-глобулин»), которые используются, например, в Chamow et al., 1996, Trends Biotechnol 14:52-60; Ashkenazi et al., 1997, Curr. Opin. Immunol 9:195-200. В Fc-слитом белке может объединяться область Fc иммуноглобулина с партнером по слиянию, которым может быть белок модулятора комплемента, полипептид или небольшая молекула. В некоторых примерах роль отличной от Fc части Fc-слитого белка, то есть партнера по слиянию, такого как белок модулятора комплемента, заключается в опосредовании связывания мишени, и, таким образом, он функционально аналогичен вариабельным областям антитела. Белковые партнеры по слиянию могут включать, но не ограничиваются ими, область связывания мишени рецептора, молекулу адгезии, лиганд, фермент, цитокин, хемокин, белок или полипептид модулятора комплемента или какой-либо другой белок или домен белка. Партнеры по слиянию в виде малых молекул могут включать любой терапевтический агент, который направляет Fc-слитый белок к терапевтической мишени. Такими мишенями может быть любая молекула, например, внеклеточный рецептор, который вовлечен в заболевание.
[00312] Термины «Fc-гамма-рецептор» или «FcγR», используемый в данном документе, может означать любой член семейства белков, связывают область Fc антитела IgG и по существу кодируются генами FcγR. У людей это семейство включает, но не ограничивается ими, FcγRI (CD64), включая изоформы FcγRIa, FcγRIb и Fcγ RIc; Fcγ RII (CD32), включая изоформы Fcγ RIIa (включая аллотипы H131 и R131), FcγRIIb (включая FcγRIIb-1 и FcγRIIb-2) и FcγRIIc; и FcγRIII (CD16), включая изоформы FcγRIIIa (включая аллотипы V158 и F158) и FcγRIIIb (включая аллотипы FcγRIIIb-NA1 и FcγRIIIb-NA2) (Jefferis et al., 2002, Immunol Lett 82:57-65, которая включена полностью посредством ссылки), а также любых неоткрытых человеческих Fcγ-рецепторов или изоформ или аллотипов FcγR. FcγR может быть получена из любого организма, включая, помимо прочего, людей, мышей, крыс, кроликов и обезьян. FcγR мыши включают, но не ограничиваются ими, FcγRI (CD64), FcγRII (CD32), FcγRIII (CD16) и FcγRIII-2 (CD16-2), а также любые неоткрытые мышиные FcγR или изоформы или аллотипы FcγR.
[00313] Используемый в данном документе термин «лиганд Fc» или «Fc-рецептор» может означать молекулу, например, полипептид, из любого организма, который связывается с областью Fc антитела с образованием комплекса Fc-лиганд. Лиганды Fc включают, но не ограничиваются ими, FcγR, FcγR, FcγR, FcRn, C1q, C3, маннан-связывающий лектин, рецептор маннозы, стафилококковый белок A, стрептококковый белок G и вирусный FcγR. Лиганды Fc также включают гомологи Fc-рецепторов (FcRH), которые представляют собой семейство Fc-рецепторов, гомологичных FcγR (Davis et al., 2002, Immunological Reviews 190:123-136). Лиганды Fc могут включать неоткрытые молекулы, которые связывают Fc.
[00314] Используемый в данном документе термин «гуманизированное антитело» может относиться к антителу или его варианту, производному, аналогу или фрагменту, которые могут иммуноспецифически связываться с представляющим интерес антигеном (например, доменом белка аннексина млекопитающих, фосфолипидом, белком комплемента или его фрагментом, таким как C3d), и который включает каркасную (FR) область, имеющую по существу аминокислотную последовательность человеческого антитела, и определяющую комплементарность область (CDR), имеющую по существу аминокислотную последовательность нечеловеческого антитела. Гуманизированные формы нечеловеческих (например, мышиных) антител представляют собой химерные иммуноглобулины, которые содержат минимальные последовательности, полученные из нечеловеческого иммуноглобулина. В общем, гуманизированное антитело будет содержать по существу все из по меньшей мере одного и, как правило, двух вариабельных доменов, в которых все или по существу все области CDR соответствуют доменам иммуноглобулина, не относящегося к человеку, и все или по существу все области FR являются областями последовательности человеческого иммуноглобулина. Гуманизированное антитело также может содержать по меньшей мере часть константной области (Fc) иммуноглобулина, как правило, консенсусную последовательность иммуноглобулина человека. Могут использоваться любые подходящие способы гуманизации антител. См., например, Riechmann et al., 1988, Nature 332:323-7; патенты США №№: 5530101; 5585089; 5693761; 5693762; и 6180370, выданные Queen et al.; EP239400; публикацию PCT WO 91/09967; патент США № 5225539; EP592106; EP519596; Padlan, 1991, Mol. Immunol., 28:489-498; Studnicka et al., 1994, Prot. Eng. 7:805-814; Roguska et al., 1994, Proc. Natl. Acad. Sci. 91:969-973; и патент США № 5565332, которые все в полном объеме включены в данный документ посредством ссылки.
[00315] В контексте данного документа термин «моноклональное антитело» относится к антителу, полученному из популяции в значительной степени однородных антител, то есть отдельные антитела в составе популяции являются идентичными, за исключением возможных мутаций, например, встречающихся в природе мутаций, которые могут присутствовать в незначительных количествах. Таким образом, модификатор «моноклональное» указывает на то, что антитело не является смесью отдельных антител. В определенных вариантах осуществления такое моноклональное антитело, как правило, включает антитело, содержащее полипептидную последовательность, связывающую мишень, при этом последовательность полипептида, связывающего мишень, была получена с помощью процесса, который включает отбор единственной последовательности полипептида, связывающего мишень, из множества последовательностей полипептида. Например, процесс отбора может представлять собой отбор уникального клона из множества клонов, таких как пул гибридомных клонов, фаговых клонов или клонов рекомбинантной ДНК. В отличие от препаратов поликлональных антител, которые, как правило, содержат различные антитела против различных детерминант (эпитопов), каждое моноклональное антитело из препарата моноклонального антитела направлено против одной эпитопа антигена.
[00316] Используемый в данном документе термин «химерное антитело» относится к антителам (иммуноглобулинам), которые имеют часть тяжелой и/или легкой цепи, идентичную или гомологичную соответствующим последовательностям в антителах, происходящих от определенного вида или принадлежащих к конкретному классу или подклассу антител, а остальная часть цепи (цепей) идентична или гомологична соответствующим последовательностям в антителах, происходящих от другого вида или принадлежащих к другому классу или подклассу антител, а также фрагментам таких антител при условии, что они проявляют желаемую биологическую активность (патент США № 4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)).
[00317] Используемый в данном документе термин «эпитоп» относится к антигенной детерминанте, которая взаимодействует со специфическим антигенсвязывающим сайтом в вариабельной области молекулы антитела, известной как паратоп. Один антиген может иметь более одного эпитопа. Таким образом, разные антитела могут связываться с разными участками антигена и иметь разные биологические эффекты. Эпитопы можно определить как структурные или функциональные. Функциональные эпитопы, как правило, представляют собой подмножество структурных эпитопов и имеют те остатки, которые непосредственно вносят вклад в аффинность взаимодействия. Эпитопы также могут быть конформационными, то есть состоять из нелинейных аминокислот. В определенных вариантах осуществления эпитопы могут включать детерминанты, которые представляют собой химически активные поверхностные группы молекул, такие как аминокислоты, боковые цепи сахаров, фосфорильные группы или сульфонильные группы, и, в определенных вариантах осуществления, могут иметь определенные трехмерные структурные характеристики, и/или удельные характеристики заряда.
[00318] Используемый в данном документе термин «аннексин» относится к большому семейству кальций-зависимых мембранно-связывающих белков, которые широко распространены среди эукариот, но, как правило, отсутствуют у прокариот и дрожжей. Термин «аннексин» включает более 100 аннексинов, которые к настоящему времени идентифицированы у многих видов. См., например, Gerke V, Moss SE. Annexins: from structure to function. Physiol Rev. 2002; 82:331-371. В значение термина «аннексин» включены белки аннексина, идентифицированные у людей, аннексины 1-11 и аннексин-13. Все аннексины разделяют консервативный C-концевой центральный домен, состоящий по меньшей мере из четырех одинаковых повторов, каждый длиной около 70 аминокислот. Эти субъединицы, как правило, содержат характерные сайты связывания кальция типа 2. Количество и расположение этих сайтов обычно различаются между разными семействами аннексинов, с вариациями и заменами другими мотивами. Кальций-независимые мембранные взаимодействия с аннексином включают переключение с мотива спираль-петля-спираль на трансмембранную спираль, которая управляет обратимым внедрением в мембраны. В отличие от центрального домена, отдельные аннексины позвоночных имеют уникальный N-концевой домен переменной длины, аминокислотные последовательности и детерминанты гидрофобности.
[00319] Термин «аннексин IV» относится к белкам подсемейства аннексинов A4, которые представляют собой самые маленькие члены семейства аннексинов, содержащие короткую N-концевую область, которые, как было показано, участвуют в репарации повреждений, вызванных стрессом плазматической мембраны. См., например, Boye et al., Nature Communications 8, Article No: 1623 (2017). Используемый в данном документе термин «биологически активный фрагмент» аннексина IV, аннексина 4, может относиться к фрагменту аннексина IV, который может распознаваться патогенными природными антителами, которые распознают аннексин IV, или антителами или их антигенсвязывающими фрагментами, которые являются производными от таких природных антител (например, антитело к C2, антитело к B4), которое приводит к развитию ишемически-реперфузионного повреждения кишечника, как было показано Kulik et al. J. Immunol. 2009; 182:5363-5373. Природные антитела существуют у иммунокомпетентного индивидуума и могут быть обнаружены в сыворотке или плазме индивидуума, который, как известно, не стимулировался специфическим антигеном, с которым связывается антитело. Предыдущие исследования авторов настоящего изобретения и коллег показали, что определенные типы природных антител распознают эпитопы на ишемической ткани и катализируют инициирование и последующее развитие ишемически-реперфузионного повреждения. См., например, Fleming et al., 2002, J. Immunol. 169:2126-2133; Rehrig et al., 2001, J. Immunol. 167:5921-5927). Способность биологически активного фрагмента аннексина IV взаимодействовать с такими патологическими природными антителами или связываться с ними может быть проанализирована множеством способов, включая анализы сдвига подвижности в геле, вестерн-блоттинг, иммунопреципитацию, поверхностный плазмонный резонанс и тому подобное.
[00320] Термины «аннексин А2», «аннексин II» или «аннексин 2» относятся к белкам подсемейства аннексинов А2, которые, как было показано, связаны с различными сайтами прикрепления актина на клеточных мембранах и служат рецепторами для плазминогена и тканевого активатора плазминогена, которые положительно модулируют фибринолитический каскад, среди прочего. Аннексин А2 также был идентифицирован как компонент друзы у обезьян, страдающих макулярной дегенерацией как с ранним, так и с поздним началом. См. S. Umeda et al., FASEB J. (2005) 19(12): 1683-1685. Используемый в данном документе термин «биологически активный фрагмент» аннексина А2, аннексина II или аннексина 2 относится к фрагменту аннексина А2, способному взаимодействовать или связываться с почечными канальцами в почках, а также взаимодействовать или связываться с фактором H или его биологически активным фрагментом. Способность биологически активного фрагмента аннексина А2 взаимодействовать или связываться с почечными канальцами или фактором H может быть проанализирована множеством способов, включая анализы сдвига подвижности в геле, вестерн-блоттинг, иммунопреципитацию, резонанс поверхностных плазмонов и т.п.
[00321] Используемый в данном документе процент (%) идентичности аминокислотных последовательностей определяют как процент аминокислот в кандидатной последовательности, которые идентичны аминокислотам в эталонной последовательности, после выравнивания последовательностей и введения гэпов, если необходимо, для достижения максимального процента идентичности последовательностей. Выравнивание в целях определения процента идентичности последовательностей можно осуществлять различными способами, находящимися в компетенции специалиста в данной области техники, например, с помощью общедоступного компьютерного программного обеспечения, такого как BLAST, BLAST-2, ALIGN, ALIGN-2 или Megalign (DNASTAR). Соответствующие параметры для измерения выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей, могут быть определены известными способами.
[00322] Специфичность конструкции слитого белка может относиться к селективному распознаванию конструкции для конкретного эпитопа антигена. Например, природные антитела являются моноспецифичными. «Биспецифические» в соответствии с изобретением относятся к конструкциям слитых белков или нацеливающим фрагментам в указанных конструкциях, которые обладают двумя разными антигенсвязывающими специфичностями. Если конструкция слитого белка имеет более одной специфичности, распознаваемые эпитопы могут быть связаны с одним антигеном или более чем с одним антигеном. Термин «валентный», используемый в данном изобретении, может обозначать присутствие определенного количества сайтов связывания в конструкции слитого белка или нацеливающего фрагмента в указанной конструкции. Например, природное антитело имеет два сайта связывания и является двухвалентным. По существу, термин «трехвалентный» означает наличие трех сайтов связывания в конструкции слитого белка или нацеливающего фрагмента в указанной конструкции, например, антитела или его антигенсвязывающего фрагмента. Используемый в данном документе термин «трехвалентное биспецифическое» антитело означает антитело, которое имеет три антигенсвязывающих сайта, два из которых связываются с одним и тем же антигеном (или одним и тем же эпитопом антигена), а третий связывается с другим антигеном или другим эпитопом того же антигена. Используемый в данном документе термин «четырехвалентный» относится к конструкции слитого белка, которая имеет четыре сайта связывания, которые способны связываться с одной и той же мишенью, такой как антиген. В некоторых случаях технология CrossMab, описанная в WO 2010/145792 A1, может использоваться для обеспечения правильного объединения легких цепей для биспецифических антител.
ПРИМЕРЫ
[00323] Приведенные ниже примеры дополнительно иллюстрируют описанные варианты осуществления, не ограничивая объем данного изобретения.
Пример 1. Создание иллюстративных конструкций слитого белка модулятора комплемента в соответствии с данным изобретением
[00324] Иллюстративная последовательность связывающего фосфолипид иммуноглобулина (например, антитела к C2) была получена из гибридом. Вариабельные области были слиты с каркасом мышиного IgG1 с использованием технологии рекомбинантной ДНК для получения IgG1 к C2 (SEQ ID NO: 51) и различных антигенсвязывающих фрагментов, таких как scFv к C2, Fab к C2. В таблице 2 представлен перечень иллюстративных антител к С2 или их антигенсвязывающих фрагментов. Такие иллюстративные антитела к С2 или антигенсвязывающие конструкции использовали для создания конструкций слитых белков, например, путем связывания белка модулятора комплемента (или его фрагмента) с антителом к С2 или его антигенсвязывающим фрагментом. В таблице 3 представлен перечень иллюстративных модуляторов комплемента, которые были использованы при создании конструкций слитого белка анти-C2-модулятор комплемента. В таблице 4 представлены иллюстративные линкеры, которые были использованы для связывания иллюстративных антител к C2 или их антигенсвязывающих фрагментов с иллюстративными модуляторами комплемента. Исследовали ориентацию слитого белка по отношению к N-концу или C-концу антител к C2 или их антигенсвязывающего фрагмента. После оптимизации кодонов и синтеза каждую конструкцию ДНК временно трансфицировали в бессывороточной среде с использованием стандартных способов. После сбора культурального супернатанта белковые конструкции очищали подходящим способом относительно их белковой структуры. Некоторые примеры созданных конструкций к C2 описаны в данном документе, включая фосфолипид-связывающую последовательность или ее фрагмент (иллюстративные последовательности показаны в таблице 2), слитые с модулятором комплемента (иллюстративные последовательности показаны в таблице 3), необязательно соединенные линкером (иллюстративные последовательности показаны в таблице 4). Конкретные примеры конструкций включают, например: scFv к C2-CR1 (1-10) представляет собой конструкцию мономерного слитого белка, содержащую белок модулятора комплемента CR1 (1-10), связанный с вариабельной областью легкой цепи scFv к C2; scFv к C2-Crry представляет собой конструкцию мономерного слитого белка, содержащую белок модулятора комплемента Crry, связанного с вариабельной областью легкой цепи scFv к C2; Fab к C2-Crry представляет собой конструкцию мономерного слитого белка, содержащую белок модулятора комплемента Crry, связанный с доменом CH1 Fab к C2; Fab к C2-CR1 (1-10) представляет собой мономерный слитый белок, содержащий белок комплемента CR1 (1-10), связанный с доменом CH1 Fab к C2; Fab к C2-CR1 (1-17) представляет собой мономерный слитый белок, содержащий белок комплемента CR1 (1-17), связанный с доменом CH1 Fab к C2; CR1 (1-10)-Fab к C2 представляет собой мономерный слитый белок, содержащий белок комплемента CR1 (1-10), связанный с доменом VH Fab к C2; CR1 (1-17)-Fab к C2 представляет собой мономерный слитый белок, содержащий белок комплемента CR1 (1-17), связанный с доменом VH Fab к C2; IgG1 к C2-CR1 (1-10), C-терм. HC x 2 представляет собой четырехвалентный гомодимерный слитый белок, содержащий два белка модулятора комплемента CR1 (1-10), каждый из которых связан с тяжелой цепью IgG1 к C2; IgG1 к C2-CR1 (1-10), C-терм. HC x 1 представляет собой трехвалентный гетеродимерный слитый белок, содержащий один белок-модулятор комплемента CR1 (1-10), связанный с тяжелой цепью IgG1 к C2; биспецифический белок CR1 к C2 представляет собой слитый белок, содержащий белок модулятора комплемента CR1, связанный с шарнирной областью фрагмента IgG1 к C2; IgG1 к C2-CR1 (1-10), N-терм. HC x 1 представляет собой трехвалентный гетеродимерный слитый белок, содержащий белок комплемента CR1 (1-10), связанный с доменом VH IgG1 к C2; IgG1 к C2-CR1 (1-10), N-терм. LC x 1 представляет собой трехвалентный гетеродимерный слитый белок, содержащий CR1 (1-10), связанный с доменом VL IgG1 к C2; IgG1 к C2-CR1 (1-10), N-терм. HC x 2 представляет собой конструкцию четырехвалентного гомодимерного слитого белка, содержащую два белка комплемента CR1 (1-10), каждый из которых связан с доменом VH IgG1 к C2; IgG1 к C2-CR1 (1-10), N-терм. LC x 2 представляет собой четырехвалентный гомодимерный слитый белок, содержащий два белка модулятора комплемента CR1 (1-10), каждый из них связан с доменом VL IgG1 к C2. На Фиг. 14 показаны структуры некоторых иллюстративных конструкций слитого белка к C2, как описано в этом примере. Предполагается, что дополнительные конструкции могут быть получены с использованием модуляторов комплемента, как описано в данном документе (например, MCP, DAF, фактор H, CD59)
[00325] Таблица 2. Антитела к C2 или их антигенсвязывающие фрагменты
[00326] Таблица 3. Модулятор комплемента
[00327] Таблица 4. Иллюстративные линкеры
Пример 2. Получение иллюстративных конструкций слитого белка анти-C3d-модулятор комплемента в соответствии с данным изобретением
[00328] Иллюстративные последовательности антитела к C3d были получены из гибридом. Вариабельные области тяжелой и легкой цепи лигировали в каркасные области константных доменов каппа-цепи IgG1 мыши, соответственно, с использованием технологии рекомбинантной ДНК. Были получены иллюстративные клоны, такие как полноразмерные антитела C3d8b, C3d29 или их антигенсвязывающие фрагменты. В таблице 5 представлен перечень иллюстративных антител к C3d или их антигенсвязывающих фрагментов. Такие иллюстративные антитела к C3d или антигенсвязывающие конструкции использовали для создания конструкций слитых белков, например, путем связывания белка модулятора комплемента (или его фрагмента) с антителом к C3d или его антигенсвязывающим фрагментом. В таблице 6 представлен перечень иллюстративных модуляторов комплемента, которые были использованы при создании конструкций слитого белка анти-C3d-модулятор комплемента. В таблице 7 представлены иллюстративные линкеры, которые были использованы для связывания иллюстративных антител к C3d или их антигенсвязывающих фрагментов с иллюстративными модуляторами комплемента. Исследовали ориентацию слитого белка по отношению к N-концу или C-концу антител к C3d или их антигенсвязывающих фрагментов. После оптимизации кодонов и синтеза каждую конструкцию ДНК временно трансфицировали в бессывороточной среде с использованием стандартных способов. После сбора культурального супернатанта белковые конструкции очищали подходящим способом относительно их белковой структуры. Некоторые примеры созданных конструкций к C3d описаны в данном документе, включая C3d-связывающую последовательность или ее фрагмент (иллюстративные последовательности показаны в таблице 5), слитые с модулятором комплемента (иллюстративные последовательности показаны в таблице 6), необязательно соединенные линкером (иллюстративные последовательности показаны в таблице 7). Конкретные примеры созданных анти-C3d конструкций описаны в данном документе, например: 3d29-Fab-Crry представляет собой конструкцию мономерного слитого белка, содержащую Fab к C3d, домен CH1 которого соединен с белком модулятора комплемента Crry. 3d29-Fab-CR1 1-10 представляет собой конструкцию мономерного слитого белка, содержащую Fab к C3d, домен CH1 которого соединен с фрагментом белка модулятора комплемента CR1 (1-10). 3d29-IgG1-CR1 (1-10), C-терм. HC x 1 представляет собой конструкцию трехвалентного гетеродимерного слитого белка, содержащую CR1 (1-10), связанный с доменом CH3 IgG1 к C3d. 3d29-IgG1-CR1 (1-10), C-терм. HC x 1, KIH представляет собой конструкцию трехвалентного гетеродимерного слитого белка, содержащую CR1 (1-10), связанный с доменом CH3 IgG1 к C3d, где область Fc IgG1 к C3d содержит структуру «выступ-во-впадину». 3d29-IgG1-CR1 (1-10), C-терм. HC x 2 представляет собой четырехвалентный гомодимерный слитый белок, содержащий два белка модулятора комплемента CR1 (1-10), каждый из которых связан с тяжелой цепью IgG1 к C3d. 3d8b-Fab-Crry представляет собой конструкцию мономерного слитого белка, содержащую Fab к C3d, домен CH1 которого соединен с белком модулятора комплемента Crry. 3d8b-Fab-CR1 (1-10) представляет собой конструкцию мономерного слитого белка, содержащую Fab к C3d, домен CH1 которого соединен с фрагментом белка модулятора комплемента CR1 (1-10). 3d8b Fab-fH 1-5 представляет собой конструкцию мономерного слитого белка, содержащую Fab к C3d, домен CH1 которого связан с фактором H фрагмента белка модулятора комплемента (1-5). 3d8b-IgG1-CR1 (1-10), С-терм. HC x 1, KIH представляет собой конструкцию трехвалентного гетеродимерного слитого белка, содержащую CR1 (1-10), связанный с доменом CH3 IgG1 к C3d, где область Fc IgG1 к C3d содержит структуру «выступ-во-впадину». 3d8b-IgG1-CR1 (1-10), C-терм. HC x 2 представляет собой четырехвалентный гомодимерный слитый белок, содержащий два белка модулятора комплемента CR1 (1-10), каждый из которых связан с тяжелой цепью IgG1 к C3d. 3d8b-IgG1-CR1 (1-10), N-терм. HC x 2 представляет собой четырехвалентный гомодимерный слитый белок, содержащий два белка-модулятора комплемента CR1 (1-10), каждый из которых связан с доменом VH тяжелой цепи IgG1 к C3d. 3d8b-IgG1-CR1 (1-10), N-терм. LC x 2 представляет собой четырехвалентный гомодимерный слитый белок, содержащий два белка модулятора комплемента CR1 (1-10), каждый из которых связан с доменом VL тяжелой цепи IgG1 к C3d. 3d8b-IgG1-CR1 (1-10), биспецифический белок представляет собой слитый белок, содержащий белок модулятора комплемента CR1, связанный с шарнирной областью фрагмента IgG1 к C3d, где область Fc IgG1 к C3d содержит структуру «выступ-во-впадину». 3d8b-IgG1-fH (1-5), C-терм. HC x 1, KIH представляет собой конструкцию трехвалентного гетеродимерного слитого белка, содержащую фактор H (1-5), связанный с доменом CH3 IgG1 к C3d, где область Fc IgG1 к C3d содержит структуру «выступ-во-впадину». 3d8b-IgG1-fH (1-5), C-терм. HC x 2 представляет собой четырехвалентный гомодимерный слитый белок, содержащий два белка-модулятора комплемента фактора H (1-5), каждый из которых связан с тяжелой цепью IgG1 к C3d. 3d8b-IgG1-fH (1-5), C-терм. LC x 2 представляет собой четырехвалентный гомодимерный слитый белок, содержащий два белка модулятора комплемента фактора H (1-5), каждый из которых связан с легкой цепью IgG1 к C3d. 3d8b-IgG1-fH (1-5), N-терм. HC x 2 представляет собой четырехвалентный гомодимерный слитый белок, содержащий два белка модулятора комплемента фактора H (1-5), каждый из которых связан с доменом VH тяжелой цепи IgG1 к C3d. 3d8b-IgG1-fH (1-5), N-терм. LC x 2 представляет собой четырехвалентный гомодимерный слитый белок, содержащий два белка модулятора комплемента фактора H (1-5), каждый из которых связан с доменом VL легкой цепи IgG1 к C3d. 3d8b-IgG1-fH (1-5), биспецифический белок представляет собой слитый белок, содержащий белок модулятор комплемента фактора H (1-5), связанный с шарнирной областью фрагмента IgG1 к C3d, где область Fc IgG1 к C3d содержит структуру «выступ-во-впадину». На Фиг. 15-18 показаны структуры некоторых иллюстративных конструкций слитого белка к C3d, как описано в этом примере. Примеры формата конструкции слитого белка, показанные на Фиг. 15-18 тестируются в нескольких анализах, включая гемолитические анализы, анализ ЛПС-активации, анализы, измеряющие отложение продуктов активации комплемента (таких как C3, C4), тесты на ингибиторы C1 с использованием количественных хромогенных анализов, иммунохимические анализы (такие как ИФА, вестерн-блоттинг) для отдельных компонентов комплемента, и каждая конструкция слитого белка проявляет активность, сравнимую с активностью только белка модулятора комплемента.
[00329] Таблица 5. Антитела к C3d или их антигенсвязывающие фрагменты
[00330] Таблица 6. Модулятор комплемента
[00331] Таблица 7. Иллюстративные линкеры
Пример 3. Создание иллюстративных конструкций слитого белка анти-B4-модулятор комплемента в соответствии с данным изобретением
[00332] Иллюстративные последовательности связывания домена аннексина (например, антитела к В4 или его фрагмента) получают из гибридом. Вариабельные области тяжелой и легкой цепи лигировали в каркасные области константных доменов каппа-цепи IgG1 мыши, соответственно, с использованием технологии рекомбинантной ДНК, чтобы получить иллюстративные полноразмерные антитела к B4 и их антигенсвязывающие фрагменты. В таблице 8 представлен перечень иллюстративных антител к B4 или их антигенсвязывающих фрагментов. Такие иллюстративные антитела к В4 или антигенсвязывающие конструкции использовали для создания конструкций слитых белков, например, путем связывания белка модулятора комплемента (или его фрагмента) с антителом к В4 или его антигенсвязывающим фрагментом. В таблице 9 представлен перечень иллюстративных модуляторов комплемента, которые были использованы при создании конструкций слитого белка анти-В4-модулятор комплемента. В таблице 10 представлены иллюстративные линкеры, которые были использованы для связывания иллюстративных антител к B4 или их антигенсвязывающих фрагментов с иллюстративными модуляторами комплемента. Исследовали ориентацию слитого белка по отношению к N-концу или C-концу антител к B4 или их антигенсвязывающих фрагментов.
[00333] Некоторые примеры созданных конструкций антител или фрагментов к В4 описаны в данном документе, включая связывающую домен аннексина последовательность или ее фрагмент (иллюстративные последовательности показаны в таблице 8), слитые с модулятором комплемента (иллюстративные последовательности показаны в таблице 9), необязательно соединенные линкером (иллюстративные последовательности показаны в таблице 10).
[00334] Таблица 8. Антитела к В4 или их антигенсвязывающие фрагменты
[00335] Таблица 9. Модуляторы комплемента
[00336] Таблица 10. Иллюстративные линкеры
Пример 4: Дизайн иллюстративной бифункциональной белковой конструкции в соответствии с данным изобретением, содержащей гетеродимерную область Fc со структурой «выступ-во-впадину»
[00337] Была разработана иллюстративная конструкция слитого белка, содержащая иллюстративное антитело к C3d (3d8b), связанное с полипептидом модулятора комплемента CR1 (1-10), показанным на Фиг. 13. Нумерация аминокислотных положений, упомянутых в приведенном ниже иллюстративном дизайне, соответствует индексу EU, как в Kabat. Антитело к C3d содержит легкую цепь (домены VL и CK), содержащую последовательность в SEQ ID NO: 69, первую тяжелую цепь (домены VH-шарнир-CH1-CH2-CH3; как в последовательности в SEQ ID NO: 89), содержащую аминокислотные замены Thr366Ser, Met368Ala и Tyr407Val, образующие область Fc, содержащую «впадину», которая объединяется с областью Fc второй тяжелой цепи (домены шарнир-CH2-CH3), содержащей аминокислотную замену Thr366Trp, которая образует область Fc с «выступом», вторую тяжелую цепь, соединенную с полипептидом модулятора комплемента CR1 (1-10) в шарнирной области через линкер (G4SG4S) (SEQ ID NO: 242), как в последовательности SEQ ID NO: 90.
Пример 5: Дизайн иллюстративной бифункциональной конструкции слитого белка мкАт в соответствии с данным изобретением, содержащей гетеродимерную область Fc со структурой «выступ-во-впадину»
[00338] Была разработана иллюстративная конструкция слитого белка мкАт, содержащая иллюстративное антитело к C3d (3d8b), связанное с полипептидом модулятора комплемента, таким как CR1 (1-10) CR1 (1-17), фактор H (1-5), MCP (1-4), DAF или CD59. В примере, показанном на Фиг. 19, полноразмерное иллюстративное антитело к C3d C3d8b связано с первым иллюстративным полипептидом модулятора комплемента (таким как фрагмент фактора H (1-5)) через один его домен CH3 и со вторым иллюстративным полипептидом модулятора комплемента (таким как фрагмент CR (1-10)) через другой домен CH3. Нумерация аминокислотных положений, упомянутых в приведенном ниже иллюстративном дизайне, соответствует индексу EU, как в Kabat. Иллюстративное антитело к C3d содержит легкие цепи (домены VL и CK), содержащие последовательность в SEQ ID NO: 69, первую тяжелую цепь (домены VH-CH1-шарнир-CH2-CH3), содержащую аминокислотные замены Thr366Ser, Met368Ala и Tyr407Val, образующие область Fc, содержащую «впадину», которая соединяется со второй областью Fc тяжелой цепи (домены VH-шарнир-CH1-CH2-CH3), содержащей аминокислотную замену Thr366Trp, образующую область Fc с «выступом», при этом первая тяжелая цепь соединена с фактором H в области CH3 через линкер (G4SG4S) (SEQ ID NO: 242), как и в последовательности SEQ ID NO: 139, вторая тяжелая цепь соединена с полипептидом модулятора комплемента CR1 (1-10) в области CH3 через линкер (G4SG4S) (SEQ ID NO: 242), как в последовательности SEQ ID NO: 140.
Пример 6: Дизайн иллюстративных конструкций слитых белков по данному изобретению, содержащих антитело к C3d или его антигенсвязывающий фрагмент
[00339] Конструировали иллюстративную конструкцию слитого белка мкАт, содержащую иллюстративное антитело к C3d (3d8b), связанное с иллюстративным полипептидом модулятора комплемента (таким как фактор ускорения распада, DAF (1-4)). Нумерация аминокислотных положений, упомянутых в приведенном ниже иллюстративном дизайне, соответствует индексу EU, как в Kabat. Антитело к C3d содержит легкие цепи (домены VL и CK), содержащие последовательность в SEQ ID NO: 69, и тяжелые цепи (домены VH-CH1-шарнир-CH2-CH3). Тяжелые цепи соединены с DAF (1-4) в областях CH3 через линкер (G4SG4S) (SEQ ID NO: 242), как в последовательности SEQ ID NO: 141.
[00340] Была разработана другая иллюстративная конструкция слитого белка мкАт, содержащая антитело к C3d (3d8b), соединенное с иллюстративным модулятором комплемента (таким как полипептид CD59). Нумерация аминокислотных положений, упомянутых в приведенном ниже иллюстративном дизайне, соответствует индексу EU, как в Kabat. Антитело к C3d содержит легкие цепи (домены VL и CK), содержащие последовательность в SEQ ID NO: 69, и тяжелые цепи (домены VH-CH1-шарнир-CH2-CH3). Тяжелые цепи соединены с CD59 в областях CH3 через линкер (G4SG4S) (SEQ ID NO: 242), как в последовательности SEQ ID NO: 142.
[00341] Была разработана еще одна иллюстративная конструкция слитого белка мкАт, содержащая иллюстративное антитело к C3d (3d8b), соединенное с иллюстративным модулятором комплемента (таким как полипептид MAp44). Нумерация аминокислотных положений, упомянутых в приведенном ниже иллюстративном дизайне, соответствует индексу EU, как в Kabat. Антитело к C3d содержит легкие цепи (домены VL и CK), содержащие последовательность в SEQ ID NO: 69, и тяжелые цепи (домены VH-CH1-шарнир-CH2-CH3). Тяжелые цепи соединены с MAp44 в областях CH3 через линкер (G4SG4S) (SEQ ID NO: 242), как в последовательности SEQ ID NO: 143.
[00342] Была разработана иллюстративная конструкция слитого белка мкАт, содержащая иллюстративное антитело к C3d (3d8b), соединенное с иллюстративным полипептидом (таким как полипептид MCP 1-4). Антитело к C3d содержит легкие цепи (домены VL и CK), содержащие последовательность в SEQ ID NO: 69, и тяжелые цепи (домены VH-CH1-шарнир-CH2-CH3). Тяжелые цепи соединены с MCP 1-4 в областях CH3 через линкер (G4SG4S) (SEQ ID NO: 242), как в последовательности SEQ ID NO: 144.
[00343] Дополнительные примеры любых конструкций слитых белков, приведенных на Фиг. 1-19 могут содержать (а) последовательности модулятора комплемента, указанные ниже, (b) CDR или последовательности VH и VL, указанные ниже, и (c) константные области, содержащие по меньшей мере один из доменов CH1, шарнира, CH2 или CH3 константных областей человеческого или мышиного иммуноглобулина или содержащие одну или более мутаций по меньшей мере в одном из доменов CH1, шарнира, CH2 или CH3 константных областей человеческого или мышиного иммуноглобулина.
[00344] Таблица 11.
Или VH-VL
Пример 7: Оценка связывания антитела к C3d, 3d8b, и его слитых белков
[00345] Связывание антитела к C3d, 3d8b, и его слитых белков регуляторов комплемента измеряли с помощью иммуноферментного анализа (ИФА). Аффинность связывания конструкций измеряли с помощью поверхностного плазмонного резонанса с использованием Biacore.
Получение антител
[00346] Fc мышиного IgG1, Fc человеческого IgG4, фрагменты антител, содержащие эпитопную метку His6 (SEQ ID NO: 296), или конструкции, содержащие партнера по слиянию CR1, получали в 1X PBS, содержащем 0,1% бычьего сывороточного альбумина (BSA).
[00347] Вторичные антитела использовали для обнаружения 1) мышиного IgG1, 2) человеческого IgG4, 3) фрагментов антител (эпитопная метка His6) (SEQ ID NO: 296) или 4) слитых белков антител, содержащих партнера по слиянию CR1. Вторичные антитела, специфичные в отношении Fc мышиного IgG1 (легкой каппа-цепи против мышиного IgG) (Novus), разводили 1: 20000 в 1X PBS, содержащем 0,1% BSA. Вторичные антитела, специфические к человеческому IgG4 (античеловеческий pFc') (Abcam), разводили 1: 30000 в 1X PBS, содержащем 0,1% BSA. Вторичные антитела, специфические к эпитопной метке His6 (Abcam) (SEQ ID NO: 296), разводили 1: 5000 в 1X PBS, содержащем 0,1% BSA. Вторичные антитела, специфические к CR1 (анти-CR1-биотин, Thermo Fisher)), разбавляли 1: 2500 1X PBS, содержащим 0,1% BSA. Для обнаружения биотинилированных антител стрептавидин-пероксидазу хрена (Strep-HRP, Thermo Fisher) разводили 1: 5000 в 1X PBS, содержащем 0,1% BSA.
[00348] Для обнаружения мышиного IgG1, человеческого IgG4 или фрагментов антител (эпитопная метка His6 (SEQ ID NO: 296)) или слитых белков антител, содержащих партнер по слиянию CR1, анализы методом ИФА выполняли в 1X PBS, если не указано иное. 2,5 мкг/мл C3d человека (Comptech Technologies), мыши (Genscript) или яванского макака (Atum) наносили на поверхность планшетов для микротитрования в бикарбонатном буфере натрия при pH 8 (Alfa Aesar) при 4 °C в течение ночи. Покрытые C3d планшеты для микротитрования (Thermo Fisher) трижды промывали 1X фосфатно-солевым буфером с 0,05% Твин-20 (Sigma) (PBS-T, KPL). Покрытые планшеты для микротитрования блокировали на ночь добавлением 1X PBS, содержащего 2% BSA. После блокировки покрытые планшеты трижды промывали PBS-T. Добавляли 100 мкл разведенных конструкций антител и инкубировали в течение 1-2 часов. Покрытые планшеты трижды промывали PBS-T. На покрытые планшеты добавляли 100 мкл соответствующих вторичных антител. При необходимости добавляли 100 мкл разбавленного стреп-ПХ. Планшеты трижды промывали PBS-T. Добавляли 100 мкл 3,3',5,5'-тетраметилбензидина (TMB, Surmodics) и инкубировали в темноте при комнатной температуре в течение 10-15 минут. Реакции прекращали добавлением равного объема стоп-раствора (Surmodics). Оптическую плотность каждой лунки измеряли при 450 нм.
[00349] Эксперименты по связыванию проводили на Biacore™ 3000 при 25 °C. Используемый буфер для анализа представлял собой буфер 10 мМ HEPES (pH 7,4), 150 мМ NaCl, 3 мМ ЭДТА, 0,05% P20 (полиоксиэтиленсорбитан); буфер для регенерации представлял собой 10 мМ глициновый буфер (pH 1,75); и использованный буфер для конъюгации представлял собой 10 мМ натрий-ацетатный буфер (pH 5). Скорость потока, используемая для захвата лиганда, составляла 10 мкл/мин. Скорость потока для кинетического анализа составляет 30 мкл/мин.
[00350] Проточные кюветы 2, 3 и 4 чипа CM5 были покрыты C3d человека на уровнях единиц ответа (RU), как указано с использованием способа сочетания с аминогруппой EDC/NHS (N-этил-N'-(3-диметиламинопропилкарбодиимид/N-гидроксисукцинимид) согласно инструкции производителя GE. Незанятые сайты блокировали 1 М этаноламином. Связывание иллюстративных гуманизированных антител с антигеном отслеживали в режиме реального времени. По наблюдаемым kon и koff была определена KD. Для взаимодействий с быстрой скоростью использовали стационарную кинетику для определения KD.
[00351] В таблицах 12, 13 и 14 показана значения ЕС50 по ИФА для различных иллюстративных антител к C3d и конструкций слитых белков, содержащих их. В таблице 15 показана KD иллюстративных слитых конструкций антител, измеренную с помощью BIAcore, которая измеряют связывание конструкций антител с иммобилизованным C3d человека.
[00352] Таблица 12: Данные EC50 C3d человека для различных конструкций слитых белков: сводка средних данных
*Если не указано иное, тестируемые белки были экспрессированы в клетках СНО
[00353] Таблица 13: Данные EC50 C3d человека: влияние гуманизации на целевую аффинность
[00354] Таблица 14. Данные EC50 C3d человека для гуманизированных слитых конструкций
[00355] Таблица 15. Данные поверхностного плазмонного резонанса от прибора Biacore™ 3000 с использованием сенсорного чипа CM5 с иммобилизованным антигеном C3d
Пример 8: Ингибирование комплемента антителом к C3d, 3d8b и слитыми белками
[00356] ИФА для альтернативного и классического пути Wieslab® (ALPCO) выполняли в соответствии с инструкциями производителя. Вкратце, консервированную человеческую сыворотку с комплементом (CompTech) разводили 1:18 или 1:101 в соответствующем буфере для разведения из набора для ИФА для альтернативного или классического пути, соответственно. Тестируемые аналоги разводили в PBS (Gibco) и получали зависимость доза-ответ путем разбавления тестируемых аналогов в 2-4 раза в PBS. Затем разбавленные тестируемые аналоги добавляли при 25Х к разбавленной сыворотке человека. 96-луночные плоскодонные планшеты Wieslab инкубировали в течение 1 часа при 37 °C (Thermo) и промывали 3 раза промывочным буфером, входящим в набор. Затем добавляли конъюгат антитела, и планшет инкубировали в течение 30 минут с последующей второй промывкой. Наконец, добавляли субстрат, планшет инкубировали еще 30 минут и считывали оптическую плотность при 405 нм. Кривые IC50 были построены с использованием программного обеспечения PRISM.
[00357] В таблице 16 показана активность комплемента различных слитых белков регуляторов комплемента CR11-10. В таблице 17 показана активность комплемента слитых белков CR11-17 для альтернативного и классического путей. В таблице 18 показана активность комплемента слитых белков fH1-5 в альтернативном и классическом путях.
[00358] Таблица 16. Функциональный анализ иллюстративных конструкций с модулятором комплемента CR11-10
[00359] Таблица 17. Функциональный анализ иллюстративных конструкций с модулятором комплемента CR11-17
[00360] Таблица 18. Функциональный анализ иллюстративных конструкций с модулятором комплемента фактора H
Пример 9. Анализ ингибирования альтернативного пути комплемента с использованием эритроцитов кролика с применением слитых белков антитела, содержащих регуляторы комплемента
Подготовка эритроцитов
[00361] 45 мл фосфатно-солевого буферного раствора Дульбекко (без Ca2+ или Mg2+) (dPBS, Life Technologies) добавляли к 0,5 мл цельной крови кролика (BioIVT) в конической пробирке на 50 мл. Клеточную суспензию центрифугировали при 4 °C в течение 10 минут при 2000 об/мин. Супернатант и лейкоцитарную пленку удаляли декантированием. Клеточный осадок ресуспендировали в 0,5 мл dPBS.
[00362] Для количественного определения количества эритроцитов в суспензии клеток 50 мкл суспендированных клеток добавляли к 700 мкл дистиллированной воды. Суспензию клеток встряхивали до тех пор, пока клетки не лизировались. Оптическую плотность лизата измеряли при 541 нм. ОП541 образца лизированных клеток использовали для доведения концентрации 0,5 мл ресуспендированных клеток до 2,9 x 109 клеток/мл путем деления ОП541 на 0,2 и умножения на 2,9 x 109.
Подготовка реагентов
[00363] Все реагенты хранили при 4 °C. Все пробирки, планшеты и растворы выдерживали на льду. Свежий раствор Mg-EGTA был приготовлен путем смешивания 0,25 мл 1M MgCl2 (Boston BioProducts) и 0,5 мл 0,5M EGTA (Boston BioProducts) при pH 7,4. Разбавленный раствор Mg-EGTA получали смешиванием 0,45 мл Mg-EGTA с 0,55 мл dPBS. 10 мкл разбавленного Mg-EGTA добавляли в каждую лунку для образца аналитического планшета. Сыворотку человека (BioIVT) размораживали на водяной бане при 37 °C. Контрольные образцы и контроли, необходимые для этого анализа, представляют собой положительный контроль, сывороточный фон и блокирующий CAP контроль. Растворы готовили в соответствующей концентрации и разводили в отдельном планшете. 100 мкл каждого контроля в двух повторностях переносили в соответствующие лунки на планшете для тестирования.
[00364] Тестируемые конструкции разводили в нормальной сыворотке человека до концентрации 10 мкМ. Серийные разведения готовили в соотношении 1: 2 с нормальной сывороткой человека. 100 мкл разбавленных ингибиторов добавляли в соответствующие лунки планшета для анализа (R&D Systems). В лунки с фоновой сывороткой добавляли 5 мкл dPBS. Во все оставшиеся лунки планшета для анализа добавляют 5 мкл разбавленных эритроцитов. Лунки осторожно перемешивали осторожным пипетированием. Планшет для анализа герметично закрывали и инкубировали в течение 30 минут при 37 °C.
Приготовление стоп-раствора
[00365] 25 мМ раствор ЭДТА в воде (ЭДТА-H2O) получали добавлением 20 мкл 0,5 M ЭДТА (Corning) в 380 мкл воды (1:20). 25 мМ раствор ЭДТА в dPBS (EDTA-PBS) получали добавлением 400 мкл 0,5 M ЭДТА в 7,6 мл dPBS (1:20).
[00366] Для прекращения активности комплемента к контрольным водным растворам добавляли 100 мкл ЭДТА-H2O, а в остальные лунки добавляли 100 мкл ЭДТА-PBS. Планшет вращали при 1800 об/мин в течение 10 минут при 4 ° 100 мкл объема лунки переносили в новый микропланшет и измеряли при 415 нм (SpectraFluorPlus, Tecan). Данные были экспортированы и проанализированы путем расчета процента лизиса по следующему уравнению:

[00367] Данные наносили на график в виде процент лизиса в зависимости от log (концентрация ингибитора) Данные были нормализованы к положительному и отрицательному контролям и рассчитывали IC50 с использованием следующих параметров и уравнений: вариабельный угловой коэффициент и 4-параметрическая аппроксимация.
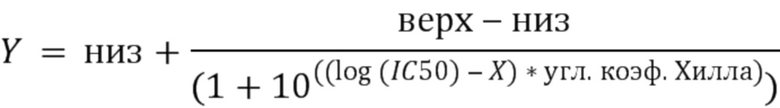
[00368] Значения IC50 для растворимых регуляторов комплемента CR11-10, CR11-17, и fH1-5 и их слитых белков показаны в таблицах 19, 20 и 21.
[00369] Таблица 19. Данные IC50: Нацеленные и ненацеленные конструкции CR11-10 из альтернативного пути комплемента, усредненные данные
[00370] Таблица 20. Данные IC50: нацеленные и ненацеленные конструкции CR11-17 из альтернативного пути комплемента, усредненные данные
[00371] Таблица 21. IC50: нацеленные и ненацеленные конструкции fH1-5 из альтернативного пути комплемента, усредненные данные
Пример 10. Анализ ингибирования классического пути комплемента с использованием эритроцитов барана
Сенсибилизация эритроцитов барана (SRBC) гемолизином
[00372] 2 мл SRBC (BioIVT) добавляли к 3 мл буфера GVB++ (Boston BioProducts) и осторожно перемешивали. Суспензию SRBC центрифугировали при 4 °C в течение 5 минут при 2000 об/мин. Супернатант декантировали и осадок ресуспендировали в буфере GVB++. Суспензию SRBC центрифугировали в течение 5 минут при 4 °C при 2000 об/мин. Супернатант снова декантировали. К осадку добавляли 9 мл буфера GVB++ для приготовления 10% клеточной суспензии. Гемолизин (Rockland) получали путем ресуспендирования сухого порошка в 2 мл воды milliQ и хранили при -20 °C с расчетной концентрацией около 80 мг/мл (лиофилизированный порошок, восстановленный в 2 мл в соответствии с инструкциями производителя). Равный объем гемолизина (равный объему 10% суспензии SRBC) был приготовлен путем разбавления исходного гемолизина 1:100 в буфере GVB++. Разбавленный гемолизин добавляли по каплям к 10% суспензии SRBC и осторожно перемешивали встряхиванием. Раствор инкубировали при 30 °C в течение 30 минут на водяной бане и перемешивали каждые 15 минут. Сенсибилизированные SRBC хранили в течение ночи при 4 °C.
Определение CH50
[00373] Тест CH50 использовали для определения оптимальной концентрации сыворотки для использования в анализе ингибитора. Готовили серию разведений 1: 2 сыворотки крови человека в буфере GVB++. Первоначально сыворотку разводили 1: 4 в буфере GVB++ (100 мкл сыворотки в 300 мкл GVB++). В пробирки для серии разведений добавляли 200 мкл разбавленной сыворотки. После получения разведений сыворотки в каждую пробирку с разведенной сывороткой добавляли 200 мкл сенсибилизированного SRBC барана (sSRBC). Добавляли 200 мкл воды для контроля со 100% лизисом. Отрицательный контроль готовили путем добавления sRBC к GVB++ без сыворотки. Образцы инкубировали на водяной бане при 37 °C. Образцы центрифугировали в течение 5 минут при 2000 об/мин для осаждения sSRBC. 100 мкл супернатанта переносили в 96-луночные планшеты для микротитрования и добавляли 100 мкл воды в каждую лунку. Оптическую плотность измеряли при 541 нм. 50% лизиса (CH50) рассчитывали путем построения графика зависимости % лизиса от разведения сыворотки.
Оценка ингибиторов классического пути комплемента
[00374] Тестируемые конструкции разводили в 2X человеческой сывороткой. Все тестируемые конструкции разводили до 10 мкМ. Серии разведений тестируемых конструкций по 12 точкам 1: 2 путем разбавления 2X человеческой сывороткой. 100 мкл образца переносили в свежую пробирку. В каждую пробирку добавляли 100 мкл буфера GVB++. В каждую пробирку добавляли 100 мкл sSRBC. Готовили соответствующие контроли со 100% лизисом и буфером GVB++. Образцы инкубировали при 37 °C в течение 30 минут на водяной бане. Образцы центрифугировали 10 минут при 2000 об/мин. 100 мкл супернатанта переносили в 96-луночный планшет для микротитрования. В каждую лунку добавляли 100 мкл diH2O и измеряли оптическую плотность при 541 нм.
[00375] Получали средние значения для каждого образца, и фоновую оптическую плотность вычитали из лунки контроля с буфером GVB++. Процент лизиса рассчитывали для каждого разведения по следующему уравнению:
% лизиса =
[00376] В таблице 22 показана IC50 тестируемых конструкций классического пути комплемента.
[00377] Таблица 22: Ингибирование классического пути комплемента
Пример 11. Оценка связывания антитела к фосфолипиду, C2, с кардиолипином
[00378] 96-луночные планшеты (Thermofisher) покрывали 50 мкл кардиолипина (Sigma) в покрывающем буфере (100% этанол) (Sigma). Планшеты инкубировали в течение ночи, пока они были неплотно накрыты (USA Scientific), чтобы обеспечить выпаривание этанола. Покрытые планшеты блокировали 300 мкл специального блокирующего буфера Echelon (Echelon) и инкубировали в течение по меньшей мере 2 часов при комнатной температуре. Содержимое лунок аспирировали и в каждую лунку добавляли 100 мкл разбавленного образца в специальном буфере Echelon. Лунки инкубировали по меньшей мере в течение 90 минут при комнатной температуре. Планшеты трижды промывали PBS и сушили на бумажных полотенцах. 100 мкл вторичных антител, разведенных PBS, добавляли в соответствующие лунки. Для обнаружения IgM к C2, козий антимышиный IgM (Southern Biotech) разводили до 1: 5000. Для обнаружения IgG1 к C2 (мышиный), кроличью антимышиную легкую каппа-цепь (Abcam) разводили в соотношении 1: 10000. Для обнаружения IgG1 к C2 (человека) мышиный античеловеческий pFc '(Abcam) разводили до 1:20 000. Для обнаружения фрагментов C2 с эпитопной меткой His6 (SEQ ID NO: 296) козьи анти-6XHis (Abcam) разводили в соотношении 1: 5000. После добавления и инкубации вторичных антител планшеты трижды промывали PBS. Планшеты проявляли добавлением 100 мкл BioFx Supersensitive TMB (Surmodics). Планшеты инкубировали в темноте в течение 15 минут. Реакции останавливали добавлением 100 мкл стоп-раствора (Surmodics) и измеряли оптическую плотность при 450 нм.
[00379] В таблице 23 показаны значения ЕС50, полученные для конструкций к C2, проанализированных в анализе связывания кардиолипина методом ИФА. В таблице 24 показаны значения ЕС50, полученные для гуманизированных вариантов (человеческий IgG4) в анализе связывания кардиолипина методом ИФА.
[00380] Таблица 23: EC50 кардиолипина для конструкций к C2
C-терм. HC x 1
N-терм. HC x 1
N-терм. LC x 1
N-терм. HC x 2
N-терм. LC x 2
[00381] Таблица 24: EC50 кардиолипина для гуманизированных вариантов к C2 на остове IgG4 человека
Пример 12: Оценка ингибирующей способности слитых белков 3d8b в анализе повреждения человеческих микрососудистых эндотелиальных клеток (HMEC)
[00382] 96-луночные планшеты покрывали коллагеном путем добавления 50 мкл раствора для покрытия на основе желатина (Cell Biologic) с концентрацией 0,1 мг/мл в течение по меньшей мере 5 минут. Суспензию клеток HMEC готовили при плотности клеток 320000 клеток/мл в полной культуральной среде. Раствор желатина удаляли и по 200 мкл клеточной суспензии распределяли в каждую лунку планшета для культивирования клеток TrueLine (MedSupply Partners). Засеянные клетки инкубировали в стандартных условиях культивирования в течение по меньшей мере 48 часов или до достижения слияния. Тестовую среду готовили путем смешивания раствора 0,1% декстрозы (Sigma), 28 мМ Trizma Base (Sigma), 0,5% BSA (Jackon Imm. Research) в среде HBSS (Fisher Scientific) при pH 7,3. Раствор 100 мМ M H2O2 готовили разбавлением 30% H2O2 1: 100 или 10 мкМ АДФ (Chrono) в тестовой среде. Монослой HMEC трижды осторожно промывали тестовой средой для удаления остатков культуральной среды, что обеспечивает сохранение монослоя неповрежденным. После промывки добавляли 50 мкл 100 мМ H2O2 или 10 мкM АДФ и планшеты инкубировали при 37 °C с добавлением 5% CO2 точно в течение 10 минут. 50 мкл 100 мМ 2O2 или 10 мкM АДФ удаляли, и монослой HMEC осторожно промывали тестовой средой три раза. Для оценки отложения фрагмента C3 (C3b/iC3b) в лунки добавляли 50 мкл 25% сыворотки крови человека (CompTech), разведенной в тестовой среде (предварительно смешанной со слитыми белками или без них). Планшеты инкубировали в течение 60 минут при 37 °C с 5% CO2. Клетки трижды промывали тестовой средой для удаления остатков сыворотки.
[00383] Обработанные клетки фиксировали 4% параформальдегидом в тестовой среде при комнатной температуре в течение 10 минут. Фиксированные клетки промывали тестовой средой трижды. Фиксированные клетки блокировали 5% BSA в тестовой среде при комнатной температуре в течение 30 минут и один раз промывали тестовой средой. Для окрашивания фрагмента C3 (C3b/iC3b) клетки окрашивали добавлением 50 мкл на лунку конъюгированного с FITC кроличьего антитела к C3c человека (Agilent/Dako) в разведении 1: 200. Окрашенные образцы инкубировали в течение 60 минут в темноте. После инкубации образцы трижды промывали тестовой средой и подвергали контрокрашиванию с добавлением 50 мкл разбавленного DAPI (1: 10000 DAPI в PBS) на лунку. Подвергнутые контрокрашиванию образцы инкубировали в темноте при комнатной температуре в течение 5 минут. Контрастный краситель DAPI заменяли 100 мкл PBS. Визуализацию окрашенных образцов проводили на станции визуализации BioTek Cytation1 в канале FITC или PE при 10-кратном увеличении с использованием программного обеспечения Gen5 3.05.
[00384] В таблице 25 показаны значения IC50 для тестируемых конструкций CR11-10 в анализе повреждения HMEC при помощи H2O2. В таблице 26 показаны значения IC50 для конструкций CR11-17, используемых в анализе повреждения HMEC при помощи H2O2. В таблице 27 показаны значения IC50 для конструкций CR11-10, протестированных в анализе повреждения HMEC при помощи АДФ. В таблице 28 показаны значения IC50 для конструкций CR11-17, используемых в анализе повреждения HMEC при помощи АДФ.
[00385] Таблица 25: Нацеленные и Ненацеленные конструкции CR11-10 в анализе повреждения HMEC при помощи H2O2
[00386] Таблица 26: Нацеленные и Ненацеленные конструкции CR11-17 в анализе повреждения HMEC при помощи H2O2
[00387] Таблица 27. Нацеленные и Ненацеленные конструкции CR1 (1-10) в анализе повреждения HMEC при помощи АДФ
[00388] Таблица 28: Нацеленные и Ненацеленные конструкции CR1 (1-17) в анализе повреждения HMEC при помощи АДФ
Пример 13: Оценка влияния ингибиторов комплемента на дефицитных по фактору H (cfh-/-) мышей
Влияние ингибиторов на cfh-/- мышей через 72 после лечения.
[00389] Самок cfh-/- мышей в возрасте 3-4 месяцев лечили следующим образом: 1) PBS, n = 6; 2) 3d8b - CR11-17, n = 5; 3) 3d8b-hfH1-5, n = 5; 4) растворимый CR11-17 (sCR1-17), n = 5; или 5) растворимый фактор H (sfH1-5), n = 5. Группы лечения получали однократную внутривенную (в/в) инъекцию и умерщвляли через 72 часа. Контрольной группе 4-месячных самок cfh-/- (n = 4) вводили одну внутривенную инъекцию растворимого 3d8b-G1 и через 72 часа умерщвляли. Неполучавших лечение мышей соответствующего возраста дикого типа также использовали в качестве контроля, следя за исследованием в течение того же периода времени.
[00390] Уровни C3 в сыворотке измеряли с помощью ИФА в начале и в конце исследования. Трансаминазы в плазме (АЛТ и АСТ) измеряли по завершении исследования с помощью теста Reflotron® (в тесте Reflotron® используются полоски с реагентами для специфического тестирования важных клинико-химических параметров непосредственно из цельной крови, плазмы или сыворотки. Прямое использование цельной крови стало возможным благодаря встроенному фильтру для отделения плазмы. Также можно проводить различные тесты с использованием мочи). После умерщвления собирали почки и печень и измеряли отложения C3 с помощью иммунофлуоресценции (ИФ).
[00391] На Фиг. 32A показано окрашивание гломерулярных отложений C3 в собранных почках, через 72 часа после лечения, измеренное с помощью ИФ. Количественную оценку C3-положительного окрашивания в 10 клубочках на срез ткани выражали в виде процента от общей площади клубочков (анализ при помощи программного обеспечения ImageJ). Данные выражены как среднее значение ± стандартная ошибка среднего. * p <0,05, ** p <0,0001 по сравнению с ДТ; ° p<0,0001 по сравнению с Cfh-/- + A и + D (односторонний дисперсионный анализ с апостериорным критерием Тьюки). На Фиг. 32B показаны отложения C3 в собранных печенях через 72 часа после лечения с использованием ИФ. Для количественной оценки печени при 400-кратном увеличении анализировали 10-15 неперекрывающихся полей. Полуколичественная оценка окрашивания печени выглядит следующим образом: 0 = отсутствует; 1 = слабое; 2 = умеренное; 3 = интенсивное окрашивание. Результаты являются средними ± стандартная ошибка. *р <0,05; **p <0,0001 по сравнению с ДТ; ° p <0,0001 по сравнению с Cfh-/- + и + D; $p <0,0001 по сравнению с Cfh-/- + B и + E (односторонний дисперсионный анализ с апостериорным критерием Тьюки).
Влияние ингибиторов на cfh-/- мышей через 72 после лечения
[00392] Самцов cfh-/- мышей в возрасте 4-5 месяцев лечили следующими средствами (все группы n = 3): 1) 3d8b-CR11-17, 2) 3d8b-mfH1-5, 3) 3d8b-Crry или 4) 3d8b. Соединения вводили посредством внутривенной инъекции на 1-й и 2-й дни. На 9-й день мышей умерщвляли. Уровни C3 в сыворотке измеряли с помощью ИФА на исходном уровне (до лечения) и в конце исследования. Трансаминазы в плазме (АЛТ и АСТ) измеряли с помощью теста Reflotron®. После умерщвления собирали почки и печени и измеряли отложения C3 с помощью ИФ.
[00393] На Фиг. 33A показано окрашивание клубочковых отложений C3 в собранных почках через 7 дней после последней инъекции, измеренное с помощью ИФ. Количественную оценку C3-положительного окрашивания в 10 клубочках на срез ткани выражали в виде процента от общей площади клубочков (анализ при помощи программного обеспечения ImageJ). Данные выражены как среднее значение ± стандартная ошибка среднего. * p <0,0001 по сравнению с мышами ДТ; °p <0,001, °°p <0,0001 по сравнению с Cfh-/- + I мышами (односторонний дисперсионный анализ с апостериорным критерием Тьюки).
[00394] На Фиг. 33B показаны отложения C3 собранных печеней с использованием ИФ. Для количественной оценки печени при 400-кратном увеличении анализировали 10-15 неперекрывающихся полей. Полуколичественная оценка окрашивания печени выглядит следующим образом: 0 = отсутствует; 1 = слабое; 2 = умеренное; 3 = интенсивное окрашивание. Данные выражены как среднее значение ± стандартная ошибка и проанализированы с использованием одностороннего дисперсионного теста с использованием апостериорного критерия Тьюки. *p <0,0001 по сравнению с мышами ДТ; ° p <0,001, °° p <0,0001 по сравнению с Cfh-/- + I мышами, #p<0,0001 по сравнению с Cfh-/- мышами + F.
[00395] В таблице 29 показаны уровни С3 в сыворотке у подопытных животных. В таблице 30 показаны уровни измеренных трансаминаз в плазме испытуемых животных.В таблице 31 показаны уровни С3 в сыворотке у подопытных животных. В таблице 32 показаны уровни измеренных трансаминаз в плазме испытуемых животных.
[00396] Таблица 29. Оценка уровней С3 в сыворотке у 4-месячных самок мышей дикого типа и cfh-/- мышей
[00397] Таблица 30: Уровни трансаминаз в плазме у 4-месячных самок дикого типа и cfh-/- самок через 72 часа после однократной инъекции
[00398] Таблица 31. Оценка уровней C3 в сыворотке у самцов cfh-/- мышей в возрасте 4-5 месяцев
[00399] Таблица 32: Уровни трансаминаз в плазме у самцов cfh-/- мышей в возрасте 4-5 месяцев через 1 неделю после 2-й инъекции
Пример 14. Оценка мкАт к C3d и ингибиторов комплемента в модели окклюзии средней мозговой артерии (MCAO)
Дизайн исследования
[00400] Девяносто восьми самцам мышей Balb/c массой 8-20 г (Charles River Laboratories, Уилмингтон, штат Массачусетс) обеспечивали свободный доступ к пище и воде и содержали в виварии с фильтрованным воздухом при температуре 21+/-5 °C и относительной влажности 50% +/- 30%. В комнате был установлен автоматический таймер на 12 часов света и 12 часов темноты. В качестве подстилки использовали кукурузные початки премиум-класса Shepherd's ® ¼, и в каждую клетку были помещены по 2 шт. Neslets от Ancare и Crink-l\'Nest™. Животных кормили кормом Lab Diet ® 5001. Воду давали ad libitum. В клетке содержалось по 4-5 животных. Для этого исследования использовали 9 экспериментальных групп, состоящих из 8-10 мышей в каждой.
Подготовка к операции
[00401] Все операции были выполнены в асептических условиях. Цефазолин (40 мг/кг; Hospira) вводили внутрибрюшинно (в/б) перед окклюзией средней мозговой артерии (MCAO) для предотвращения инфекций. Бупренорфин вводили подкожно (п/к) (~ 0,1 мг/кг, Par Pharmaceuticals) в качестве анальгетика до MCAO. Перед операцией на глаза наносили глазную мазь от гипертонуса с хлоридом натрия (стерильная офтальмологическая 5% мазь Muro 128).
Модель окклюзии средней мозговой артерии
[00402] В этом исследовании использовали модель реперфузии MCAO, модель острого инсульта. Мышей подвергали анестезии с использованием 2-3% изофлурана с N2O:O2 (2:1) и поддерживали с помощью дыхательного шланга с 1,5-2,5% изофлураном в положении лежа на спине. Середина шеи была выбрита электрической машинкой для стрижки и очищена многократным нанесением Hibiclens и спирта. Используя метод асептики над правой общей сонной артерией (ОСА) делали разрез кожи, мышцу оттягивали и обнажали бифуркацию ОСА. ОСА перевязывали, а дистальный сегмент наружной сонной артерии (НСА) временно пережимали. Затем через ОСА вводили нейлоновый шов и продвигали во внутреннюю сонную артерию (ВСА) на заданное расстояние в 8-9 мм. С помощью этой процедуры кончик шовного материала, покрытый силиконом, закрывает место возникновения MCA в головном мозге, вызывая отсутствие кровотока в области MCA. Зажим / шовный материал ECA удаляли. Разрез кожи закрывали хирургическими скобами, и животным позволяли проснуться от анестезии и помещали обратно в лабораторную клетку. После 60-минутного периода ишемии животных снова подвергали анестезии, рану повторно открывали и снимали внутрисосудистый шов с VVA. Кожную рану снова закрывали, и за животными наблюдали до тех пор, пока они полностью не пробуждались от анестезии, после чего их возвращали в их лабораторную клетку. Во время анестезии саморегулирующуюся грелку подключали к ректальному термометру, чтобы поддерживать внутреннюю температуру на уровне 37 °C +/- 1 °C.
Имитация операции MCAO
[00403] Также была выполнена имитация операции MCAO. Мышей подвергали анестезии с использованием 2-3% изофлурана с N2O:O2 (2: 1) и поддерживали с помощью дыхательного шланга с 1,5-2,5% изофлураном в положении лежа на спине. Середина шеи была выбрита электрической машинкой для стрижки и очищена многократным нанесением Hibiclens и спирта. Используя метод асептики над правой общей сонной артерией (ОСА) делали разрез кожи, мышцу оттягивали и обнажали бифуркацию ОСА. Выделяли ОСА, НСА и ВСА, затем кожный разрез закрывали хирургическими скобами. Животным дали проснуться от наркоза и помещали обратно в их лабораторную клетку. Во время анестезии использовали саморегулирующуюся грелку, подключенную к ректальному термометру, для поддержания внутренней температуры 37 °C +/- 1 °C.
Дозирование
[00404] Все растворы для дозирования хранили при 4 °C до использования.
Животные MCAO получали PBS, мкАт к C3d или C3d-CR11-17 посредством внутривенной инъекции в хвостовую вену через 60 минут после реперфузии. Животные, которым проводили имитацию операции, получали PBS через 60 минут после операции.
Рандомизация и ослепление
[00405] Лечение было случайным образом назначено каждому животному после операции другим человеком, который не выполнял операцию. Лечение раствором для дозирования распределяли равномерно каждый день.
Умерщвление
[00406] Через сорок восемь часов после MCAO мышей анестезировали смесью кетамин/ксилазин (~ 100/10 мг/кг) и перфузировали ледяным гепаринизированным PBS, а затем ледяным 4% параформальдегидом (PFA). Затем мозг извлекали и подвергали последующей фиксации в 4% PFA в холодильнике в течение двадцати четырех часов.
Подготовка ткани к гистологии:
[00407] Через 24 часов после фиксации 4% PFA мозг заменяли 30% раствором сахарозы и хранили в холодильнике еще 3 дня. Затем каждый мозг разрезали на пять корональных срезов толщиной 1 мм с использованием матрицы мозга мыши (1,1, -0,9, -1,9, -2,9, по сравнению с брегмой, соответственно, и заливали соединением Tissue-Tek® O.C.T. в стандартном CryoMold. Затем форму помещали в лоток, заполненный 2-метилбутаном в сухом льде. Когда соединение ОКТ было заморожено, образцы немедленно запечатывали в пакеты Ziplock и хранили при -80 °C до отправки в гистологическую лабораторию.
Визуализация и анализ изображений
[00408] Изображения были получены с помощью цифровой камеры, закрепленной на микроскопе с использованием программного обеспечения SPOT. Объемный анализ площади инфаркта выполняли с помощью ImageJ (программа NIH). Ручной инструмент использовали для определения площади ткани без инфаркта ипсилатерального (правого) полушария и ткани контралатерального (левого) полушария. Площадь инфаркта рассчитывали путем вычитания площади ипсилатерального полушария, не подвергшейся инфаркту, из площади неповрежденного контралатерального полушария. Затем рассчитывали объем каждого полушария, умножая площадь на толщину среза (1 мм) и добавляя количество срезов между каждой выборкой (5). Объем инфаркта выражали в процентах от объема интактного полушария.
Анализ данных
[00409] В таблице 33 приведены белки, протестированные в исследовании MCAO.
На Фиг. 34 показан рассчитанный процент площади инфаркта для исследования. Все данные были выражены как среднее значение +/- стандартная ошибка среднего. Данные анализировали с помощью однофакторного дисперсионного анализа.
[00410] Таблица 33: Сводка реагентов, протестированных в исследовании MCAO
Пример 15. Влияние слитых белков ингибитора комплемента на индуцированное адриамицином повреждение почек
[00411] Самцы мышей BALB/c OLA получали адриамицин (11 мг/кг) внутривенно через хвостовую вену на 0-й день. На 8-й день мышей помещали в метаболические клетки и собирали мочу в течение 16 часов. Образцы мочи анализировали на альбумин и креатинин с помощью анализатора Cobas c111. У всех мышей к 8-му дню обнаруживалась почечная недостаточность, определяемая по соотношению альбумин мочи: креатинин (uACR). Мышей рандомизировали в группы на основе uACR. На 10-й день мыши получали однократную внутривенную дозу PBS (n = 14) или полностью мышиных слитых белков мкАт к C3d-Crry (n = 14; 50 мг/кг), мкАт к C3d-fH1-5 (n = 13; 50 мг/кг) или ненацеленные контроли, содержащие белки fH1-5 или Crry. Мышей снова помещали в метаболические клетки для сбора мочи на 22-й день в течение 16 часов и определяли альбумин и креатинин в моче (Фиг. 35).
Пример 16: Исследование иллюстративного белка модулятора комплемента C3d по данному изобретению у пациента с прогрессирующим комплемент 3 - гломерулонефритом
[00412] Цель. Целью данного исследования является оценка эффективности, безопасности и переносимости лечения с помощью иллюстративной конструкции слитого белка антитело к C3d - модулятор комплемента у пациента с комплемент-опосредованным заболеванием или нарушением, например, и только для иллюстрации, прогрессирующим комплемент 3 - гломерулонефритом (C3).
[00413] Цели. Основной целью этого исследования в области безопасности является оценка безопасности и переносимости лечения с помощью иллюстративной конструкции слитого белка антитело к C3d - модулятор комплемента, например, для комплемент 3 (C3) - гломерулонефрита. Основная цель эффективности заключается в оценке эффективности лечения иллюстративной конструкцией слитого белка анти-C3d-модулятор комплемента на основе изменения от исходного уровня, например, в eGFR (MDRD, расчетная скорость клубочковой фильтрации) и протеинурии. Вторичные цели этого исследования включают оценку: 1. Изменения фармакодинамических маркеров в плазме и моче по сравнению с исходным уровнем, например, MCP-1, C3a, C5a, пропердина и sC5b-9; 2. Изменение по сравнению с исходным уровнем патологии клубочков на основании биопсии почек; 3. Оценка концентраций в плазме при лечении иллюстративной конструкцией слитого белка анти-C3d-модулятор комплемента при C3-гломерулонефрите.
[00414] Пациент с C3-гломерулонефритом получает лечение с помощью парентерально внутривенно вводимого (например, внутривенно, подкожно) иллюстративного слитого белка антитело к C3d - модулятор комплемента по данному изобретению, следуя протоколу, подробно описанному ниже. В некоторых случаях у пациента имеется рефрактерное заболевание, несмотря на трансплантацию почки и предшествующее лечение иммунодепрессивными препаратами широкого спектра действия, например ритуксимабом, циклофосфамидом, микофенолятмофетилом, такролимусом и стероидами. В некоторых случаях биопсию почечного аллотрансплантата берут перед приемом препарата через 2 и 7 месяцев во время терапии.
[00415] Методология: в некоторых случаях у пациента будет подтвержденный рецидив C3GN, подтвержденный биопсией, до начала приема препарата, и он будет считаться подходящим на основании критериев включения и исключения. Процедуры скрининга будут включать запись демографических данных, истории болезни, истории приема лекарственных средств, физикального обследования и показателей жизненно важных функций, химического состава сыворотки, гематологии, анализа мочи (включая измерение UPCR), вирусного скрининга (если он не проводился в течение предшествующих 12 недель) и оценку расчетной скорости клубочковой фильтрации (рСКФ) на основе креатинина сыворотки. Исходная рСКФ составляет, например, около 15-25 мл/мин/1,73 м2 для соответствия критериям участия в исследовании. В 1-й день пациент может начать лечение с получения иллюстративной конструкции слитого белка анти-C3d-модулятор комплемента. Пациенты будут проходить лечение иллюстративной конструкцией слитого белка антитело к C3d - модулятор комплемента путем парентерального введения в течение начального периода примерно 60-84 дней. Пациент будет регулярно посещать исследовательский центр для наблюдения. Если клиническое состояние пациента стабилизируется или улучшается и отсутствуют побочные эффекты, препятствующие дальнейшему лечению, пациента можно лечить в соответствии с другим циклом лечения, например, продолжительностью около 60-84 дней. В соответствии с этим протоколом циклы лечения могут повторяться в общей сложности до 4 циклов.
[00416] Во время визитов на 1-й день и после первого дня будут отбираться образцы крови и мочи для определения безопасности, эффективности и измерения фармакокинетических показателей. В течение всего исследования будут проводиться физикальные обследования и оценка основных показателей жизнедеятельности. Сопутствующие лекарственные средства и побочные эффекты будут оцениваться при каждом визите в целях исследования. Если возможно, после соответствующего периода наблюдения будет проведена биопсия почек для оценки изменений в гистологии почек.
[00417] Результаты. Ожидается, что состояние пациента улучшится в ответ на лечение иллюстративной конструкцией слитого белка анти-C3d-модулятор комплемента по данному изобретению. Улучшение, наблюдаемое при лечении конструкцией слитого белка анти-C3d-модулятор комплемента у этого пациента, основано на гистологических данных биопсии почки во время лечения, показывающих устранение клубочковой эндокапиллярной пролиферации и заметное уменьшение клубочковых воспалительных макрофагов по сравнению с биопсией до лечения. Протеинурия снижается примерно на 80% при лечении конструкцией слитого белка.
[00418] Расчетная скорость клубочковой фильтрации (рСКФ) может составлять, например, примерно 80-90 мл/мин/1,73 м2 за 14 месяцев до лечения иллюстративной конструкцией слитого белка к C3d и может ухудшаться, например, до около 30-50 мл/мин/1,73 м2, когда начинается лечение иллюстративной конструкцией слитого белка к C3d. Кроме того, лечение иллюстративной конструкцией слитого белка C3d ослабляет или останавливает снижение рСКФ. Ожидается, что после 1 месяца лечения снижение рСКФ будет уже ослаблено. Повторные биопсии демонстрируют устранение эндокапиллярной гиперклеточности клубочков и уменьшение количества клубочковых макрофагов. Таким образом, лечение иллюстративной конструкцией слитого белка к C3d стабилизирует рСКФ и снижает воспаление клубочков.
Пример 17. Исследование эффективности иллюстративной конструкции слитого белка по настоящему изобретению при лечении ишемии/реперфузии почек
[00419] Ишемически-реперфузионное (И/Р) повреждение почек при температуре тела имеет значение при нескольких клинических состояниях, включая гиповолемический шок, окклюзию почечной артерии и процедуры поперечного пережатия.
[00420] Ишемия/реперфузия почек (И/Р) является важной причиной острой почечной недостаточности, связанной с уровнем смертности до 50% (Levy et al., JAMA 275:1489-94, 1996; Thadhani et al., N. Engl. J. Med. 334:1448-60, 1996). Посттрансплантационная почечная недостаточность представляет собой частое и опасное осложнение после трансплантации почки (Nicholson et al., Kidney Int. 58:2585-91, 2000). Эффективное лечение FR повреждения почек в настоящее время недоступно, и гемодиализ является единственным доступным методом лечения. Патофизиология FR повреждения почек сложна. Недавние исследования показали, что лектиновый путь активации комплемента может играть важную роль в патогенезе И/Р повреждения почек (deVries et al., Am. J. Path. 165:1677-88, 2004).
[00421] Функцию почек оценивают через 24 и 48 часов после реперфузии у пациента, которому вводили иллюстративную конструкцию слитого белка по данному изобретению. Креатинин в крови определяют при помощи масс-спектрометрии, которая обеспечивает воспроизводимый показатель почечной функции. У пациента наблюдается значительное снижение количества мочевины в крови через 24 и 48 часов, что указывает на защитный функциональный эффект от повреждения почек. В целом, повышение уровня мочевины в крови наблюдается как через 24, так и через 48 часов после хирургической процедуры и ишемического инсульта.
Пример 18. Исследование эффективности иллюстративной конструкции слитого белка по данному изобретению при лечении макулярной дегенерации
[00422] Возрастная макулярная дегенерация (ВМД) является основной причиной слепоты после 55 лет в промышленно развитых странах. ВМД встречается в двух основных формах: неоваскулярной (влажной) ВМД и атрофической (сухой) ВМД. Неоваскулярная (влажная) форма составляет 90% тяжелой потери зрения, связанной с ВМД, хотя влажная форма развивается только у ~ 20% людей с ВМД. Клинические признаки ВМД включают множественные друзы, географическую атрофию и хориоидальную неоваскуляризацию (ХНВ). В декабре 2004 года FDA одобрило Macugen (пегаптаниб), новый класс офтальмологических препаратов для целенаправленного воздействия и блокирования эффектов фактора роста эндотелия сосудов (VEGF) для лечения влажной (неоваскулярной) формы ВМД (Ng et al., Nat Rev. Drug Discov 5:123-32 (2006)). Хотя Macugen представляет собой многообещающий новый терапевтический вариант для подгруппы пациентов с ВМД, по-прежнему существует острая необходимость в разработке дополнительных методов лечения этого сложного заболевания. Множественные независимые направления исследований указывают на центральную роль активации комплемента в патогенезе ВМД. Патогенез хориоидальной неоваскуляризации (ХНВ), наиболее серьезной формы ВМД, может включать активацию путей комплемента.
[00423] Группе пациентов, страдающих ВМД, вводят интраокулярно или парентерально иллюстративную конструкцию слитого белка по данному изобретению. В различные моменты времени после введения оценивают хориоидальную неоваскуляризацию. У пациентов, которым вводили иллюстративную конструкцию слитого белка по изобретению, наблюдается уменьшение площади ХНВ от 20% до 100% по сравнению с пациентами, которым вводили плацебо.
Пример 19. Исследование эффективности иллюстративной конструкции слитого белка по данному изобретению при лечении атипичного гемолитико-уремического синдрома (аГУС)
[00424] Атипичный гемолитико-уремический синдром (аГУС) характеризуется гемолитической анемией, тромбоцитопенией и почечной недостаточностью, вызванной тромбами в микроциркуляции почек и других органов. аГУС связан с нарушением регуляции комплемента и может быть спорадическим или семейным. аГУС связан с мутациями в генах, кодирующих активацию комплемента, включая фактор комплемента H, мембранный кофактор B и фактор I, а также родственный фактору комплемента H белок 1 (CFHR1) и родственный фактору комплемента H белок 3 (CFHR3). Zipfel, P. F., et al., PloS Genetics 3(3):e41 (2007).
[00425] Эффект иллюстративной конструкции слитого белка по данному изобретению для лечения аГУС определяют путем получения и лизиса эритроцитов от пациентов с аГУС, которых лечили с помощью иллюстративной конструкции слитого белка. Наблюдается, что лечение иллюстративной конструкцией слитого белка эффективно для блокирования лизиса красных кровяных телец у пациентов, страдающих аГУС, по сравнению с применением плацебо.
Пример 20. Картирование линейных эпитопов PEPperMAP® 5 мышиных антител IgG1 против C3dg_extended
[00426] Картирование линейных эпитопов PEPperMAP® мышиных антител IgG1 проводили против C3dg_extended, транслируемого в линейные перекрывающиеся пептиды из 15 аминокислот с перекрытием пептид-пептид из 14 аминокислот, а также против 15 дополнительных пептидов. Предварительное окрашивание микроматрицы пептидов C3dg проводили вторичным козьим антителом к IgG мыши (H+L) DyLight680 (1: 5000) для определения фоновых взаимодействий с линейными пептидами C3dg, которые могут мешать основным анализам. Микроматрицы пептидов C3dg инкубировали с иллюстративными мышиными антителами IgG1 3d29, 3d8b, 3d9a к C3d в концентрациях 1 мкг/мл, 10 мкг/мл или 100 мкг/мл в инкубационном буфере (например, промывочном буфере с 10% блокирующим буфером). с последующим окрашиванием вторичным козьим антителом к IgG мыши (H+L) DyLight680 (1: 5000) и контрольным мышиным моноклональным антителом к HA (12CA5) DyLight800 (1: 2000). Образцы CI использовали в качестве отрицательного контроля. Стадию инкубации выполняли в течение 16 часов при 4 °C со встряхиванием при 140 об/мин. Окрашивание вторичным антителом и контрольным антителом проводили в течение 45 мин в инкубационном буфере при комнатной температуре (RT). Считывание с помощью системы визуализации LI-COR Odyssey производили при интенсивности сканирования 7/7 (красный/зеленый). Дополнительные пептиды НА, обрамляющие микроматрицы пептидов, впоследствии окрашивали в качестве внутреннего контроля качества для подтверждения качества анализа и целостности микроматрицы пептидов.В таблице 34 более подробно описаны материалы и способы.
[00427] Таблица 34. Материалы и способы
[00428] Количественная оценка интенсивности пятен и аннотации пептидов была основана на 16-битных файлах TIFF с серой шкалой при интенсивностях сканирования 7/7, которые демонстрировали более высокий динамический диапазон, чем 24-битные цветные TIFF-файлы. Кроме того, анализ изображений микроматрицы, количественная оценка интенсивности пятен и аннотации пептидов были выполнены с помощью PepSlide® Analyzer. Короче говоря, программный алгоритм разбивает интенсивности флуоресценции каждого пятна на необработанный сигнал, основной и фоновый сигнал, и вычисляет среднюю медианную интенсивность переднего плана и отклонения от пятна к пятну для двух повторностей пятен. Карта интенсивности была сгенерирована на основе усредненных средних интенсивностей основного сигнала и взаимодействий на карте пептидов, выделенных цветовым кодом интенсивности с красным для высокой и белым для низкой интенсивности пятен. Было обнаружено, что максимальное отклонение от пятна к пятну в 40% является приемлемым (в противном случае соответствующее значение интенсивности обнуляли).
[00429] Кроме того, для визуализации общей интенсивности пятен и отношения сигнал/шум были нанесены на график усредненные интенсивности пятен анализов с мышиными антителами к последовательности антигена от N- к C-концу C3dg_extended. Графики интенсивности коррелировали с картами пептидов и интенсивности, а также с визуальной проверкой сканированных микроматриц для идентификации эпитопов образцов мышиных антител. Если не было ясно, вносит ли определенная аминокислота вклад в связывание антитела, соответствующие буквы таких аминокислот подчеркивали, как показано на Фиг. 21-23. В некоторых случаях базовые линии графиков интенсивности были выровнены. На Фиг. 24-25 показаны исследования картирования эпитопов, которые были выполнены с использованием антител отрицательного контроля к C3d или к C4d в концентрации 1, 10 и 100 мкг/мл, которые не распознали эпитопы, распознаваемые иллюстративными антителами к C3d 3d9a, 3d29, или 3d8b (как показано при помощи пиков на Фиг. 21-23).
[00430] Предварительное окрашивание микроматрицы пептидов C3dg вторичным козьим антителом к IgG мыши (H+L) DyLight680 не показало какого-либо фонового взаимодействия с линейными пептидами C3dg_extended, которое могло бы помешать основным анализам. Мышиные антитела IgG1 к C3d 3d29, 3d8b и 3d9a показали очень сильные ответы моноклональных антител с высокой интенсивностью пятен и соотношением сигнал/шум против соседних пептидов со сходными консенсусными мотивами NLDVSLQLPS (SEQ ID NO: 299), NLDVSLQLPS (SEQ ID NO: 299) и NLDVSLQLPS (SEQ ID NO: 299), как показано на Фиг. 21-23. 15 дополнительных пептидов не реагировали с антителами IgG1 мыши. В частности, когда микроматрицу пептидов C3dg инкубировали с 1 мкг/мл или мышиного антитела IgG1 к C3d 3d29, или антитела IgG1 к C3d 3d9a, наблюдали очень сильные ответы моноклональных антител с высоким соотношением сигнал/шум против смежных пептидов с консенсусным мотивом NLDVSLQLPS (SEQ ID NO: 299), как показано на Фиг. 21 и Фиг. 23, соответственно. Аналогичным образом, очень сильный ответ моноклональных антител с высоким соотношением сигнал/шум против смежных пептидов с консенсусным мотивом NLDVSLQLPS (SEQ ID NO: 299) наблюдали, когда микроматрицу пептидов C3dg инкубировали с мышиным антителом IgG1 к C3d 3d8b, при концентрации 1 мкг/мл, как показано на Фиг. 22. Все данные были получены путем считывания при интенсивностях сканирования 7/7 (красный/зеленый) после инкубации микроматрицы пептидов C3dg с антителом IgG1 мыши с последующим окрашиванием вторичными и контрольными антителами. Подчеркнутые аминокислоты соответствуют остаткам, вклад которых в связывание антител не ясен. Для всех Фиг. 21-23, окрашивание контрольных пептидов НА показано в прямоугольниках для контрольных окрашиваний на Фиг. 21-23). Кроме того, сканирование эпитопных замен PEPperMAP® можно использовать для исследования предложенных эпитопов, например, с помощью лежащих в основе пептидов дикого типа с заменой всех положений аминокислот на 20 основных аминокислот.
[00431] Таблица 35: Иллюстративная таблица белков
[00432] Таблица 36: ТАБЛИЦА ПОСЛЕДОВАТЕЛЬНОСТЕЙ
MEPPGRRECPFPSWRFPGLLLAAMVLLLYSFSDACEEPPTFEAMELIGKPKPYYEIGERVDYKCKKGYFYIPPLATHTICDRNHTWLPVSDDACYRETCPYIRDPLNGQAVPANGTYEFGYQMHFICNEGYYLIGEEILYCELKGSVAIWSGKPPICEKVLCTPPPKIKNGKHTFSEVEVFEYLDAVTYSCDPAPGPDPFSLIGESTIYCGDNSVWSRAAPECKVVKCRFPVVENGKQISGFGKKFYYKATVMFECDKGFYLDGSDTIVCDSNSTWDPPVPKCLKVLPPSSTKPPALSHSVSTSSTTKSPASSASGPRPTYKPPVSNYPGYPKPEEGILDSLDVWVIAVIVIAIVVGVAVICVVPYRYLQRRKKKGTYLTDETHREVKFTSL
MTVARPSVPAALPLLGELPRLLLLVLLCLPAVWGDCGLPPDVPNAQPALEGRTSFPEDTVITYKCEESFVKIPGEKDSVICLKGSQWSDIEEFCNRSCEVPTRLNSASLKQPYITQNYFPVGTVVEYECRPGYRREPSLSPKLTCLQNLKWSTAVEFCKKKSCPNPGEIRNGQIDVPGGILFGATISFSCNTGYKLFGSTSSFCLISGSSVQWSDPLPECREIYCPAPPQIDNGIIQGERDHYGYRQSVTYACNKGFTMIGEHSIYCTVNNDEGEWSGPPPECRGKSLTSKVPPTVQKPTTVNVPTTEVSPTSQKTTTKTTTPNAQATRSTPVSRTTKHFHETTPNKGSGTTSGTTRLLSGHTCFTLTGLLGTLVTMGLLT
MIRGRAPRTRPSPPPPLLPLLSLSLLLLSPTVRGDCGPPPDIPNARPILGRHSKFAEQSKVAYSCNNGFKQVPDKSNIVVCLENGQWSSHETFCEKSCVAPERLSFASLKKEYLNMNFFPVGTIVEYECRPGFRKQPPLPGKATCLEDLVWSPVAQFCKKKSCPNPKDLDNGHINIPTGILFGSEINFSCNPGYRLVGVSSTFCSVTGNTVDWDDEFPVCTEIHCPEPPKINNGIMRGESDSYTYSQVVTYSCDKGFILVGNASIYCTVSKSDVGQWSSPPPRCIEKSKVPTKKPTINVPSTGTPSTPQKPTTESVPNPGDQPTPQKPSTVKVSATQHVPVTKTTVRHPIRTSTDKGEPNTGGDRYIYGHTCLITLTVLHVMLSLIGYLT
MGIQGGSVLFGLLLVLAVFCHSGHSLQCYNCPNPTADCKTAVNCSSDFDACLITKAGLQVYNKCWKFEHCNFNDVTTRLRENELTYYCCKKDLCNFNEQLENGGTSLSEKTVLLLVTPFLAAAWSLHP
MRAQRGLILLLLLLAVFCSTAVSLTCYHCFQPVVSSCNMNSTCSPDQDSCLYAVAGMQVYQRCWKQSDCHGEIIMDQLEETKLKFRCCQFNLCNKSDGSLGKTPLLGTSVLVAILNLCFLSHL
MRAQRGLILLLLLLAVFCSTAVSLKCYNCLDPVSSCKINTTCSPNLDSCLYAVAGRQVYQQCWKLSDCNSNYIMSRLDVAGIQSKCCQWDLCNKNLDGLEEPNNAETSSLRKTALLGTSVLVAILKFCF
MEVSSRSSEPLDPVWLLVAFGRGGVKLEVLLLFLLPFTLGELRGGLGKHGHTVHREPAV
NRLCADSKRWSGLPVSAQRPFPMGHCPAPSQLPSAKPINLTDESMFPIGTYLLYECLPGYIKRQFSITCKQDSTWTSAEDKCIRKQCKTPSDPENGLVHVHTGIQFGSRINYTCNQGYRLIGSSSAVCVITDQSVDWDTEAPICEWIPCEIPPGIPNGDFFSSTREDFHYGMVVTYRCNTDARGKALFNLVGEPSLYCTSNDGEIGVWSGPPPQCIELNKCTPPPYVENAVMLSENRSLFSLRDIVEFRCHPGFIMKGASSVHCQSLNKWEPELPSCFKGVICRLPQEMSGFQKGLGMKKEYYYGENVTLECEDGYTLEGSSQSQCQSDGSWNPLLAKCVSRSISGLIVGIFIGIIVFILVIIVFIWMILKYKKRNTTDEKYKEVGIHLNYKEDSCVRLQSLLTSQENSSTTSPARNSLTQEVS
MGASSPRSPEPVGPPAPGLPFCCGGSLLAVVVLLALPVAWGQCNAPEWLPFARPTNLTDEFEFPIGTYLNYECRPGYSGRPFSIICLKNSVWTGAKDRCRRKSCRNPPDPVNGMVHVIKGIQFGSQIKYSCTKGYRLIGSSSATCIISGDTVIWDNETPICDRIPCGLPPTITNGDFISTNRENFHYGSVVTYRCNPGSGGRKVFELVGEPSIYCTSNDDQVGIWSGPAPQCIIPNKCTPPNVENGILVSDNRSLFSLNEVVEFRCQPGFVMKGPRRVKCQALNKWEPELPSCSRVCQPPPDVLHAERTQRDKDNFSPGQEVFYSCEPGYDLRGAASMRCTPQGDWSPAAPTCEVKSCDDFMGQLLNGRVLFPVNLQLGAKVDFVCDEGFQLKGSSASYCVLAGMESLWNSSVPVCEQIFCPSPPVIPNGRHTGKPLEVFPFGKTVNYTCDPHPDRGTSFDLIGESTIRCTSDPQGNGVWSSPAPRCGILGHCQAPDHFLFAKLKTQTNASDFPIGTSLKYECRPEYYGRPFSITCLDNLVWSSPKDVCKRKSCKTPPDPVNGMVHVITDIQVGSRINYSCTTGHRLIGHSSAECILSGNAAHWSTKPPICQRIPCGLPPTIANGDFISTNRENFHYGSVVTYRCNPGSGGRKVFELVGEPSIYCTSNDDQVGIWSGPAPQCIIPNKCTPPNVENGILVSDNRSLFSLNEVVEFRCQPGFVMKGPRRVKCQALNKWEPELPSCSRVCQPPPDVLHAERTQRDKDNFSPGQEVFYSCEPGYDLRGAASMRCTPQGDWSPAAPTCEVKSCDDFMGQLLNGRVLFPVNLQLGAKVDFVCDEGFQLKGSSASYCVLAGMESLWNSSVPVCEQIFCPSPPVIPNGRHTGKPLEVFPFGKAVNYTCDPHPDRGTSFDLIGESTIRCTSDPQGNGVWSSPAPRCGILGHCQAPDHFLFAKLKTQTNASDFPIGTSLKYECRPEYYGRPFSITCLDNLVWSSPKDVCKRKSCKTPPDPVNGMVHVITDIQVGSRINYSCTTGHRLIGHSSAECILSGNTAHWSTKPPICQRIPCGLPPTIANGDFISTNRENFHYGSVVTYRCNLGSRGRKVFELVGEPSIYCTSNDDQVGIWSGPAPQCIIPNKCTPPNVENGILVSDNRSLFSLNEVVEFRCQPGFVMKGPRRVKCQALNKWEPELPSCSRVCQPPPEILHGEHTPSHQDNFSPGQEVFYSCEPGYDLRGAASLHCTPQGDWSPEAPRCAVKSCDDFLGQLPHGRVLFPLNLQLGAKVSFVCDEGFRLKGSSVSHCVLVGMRSLWNNSVPVCEHIFCPNPPAILNGRHTGTPSGDIPYGKEISYTCDPHPDRGMTFNLIGESTIRCTSDPHGNGVWSSPAPRCELSVRAGHCKTPEQFPFASPTIPINDFEFPVGTSLNYECRPGYFGKMFSISCLENLVWSSVEDNCRRKSCGPPPEPFNGMVHINTDTQFGSTVNYSCNEGFRLIGSPSTTCLVSGNNVTWDKKAPICEIISCEPPPTISNGDFYSNNRTSFHNGTVVTYQCHTGPDGEQLFELVGERSIYCTSKDDQVGVWSSPPPRCISTNKCTAPEVENAIRVPGNRSFFSLTEIIRFRCQPGFVMVGSHTVQCQTNGRWGPKLPHCSRVCQPPPEILHGEHTLSHQDNFSPGQEVFYSCEPSYDLRGAASLHCTPQGDWSPEAPRCTVKSCDDFLGQLPHGRVLLPLNLQLGAKVSFVCDEGFRLKGRSASHCVLAGMKALWNSSVPVCEQIFCPNPPAILNGRHTGTPFGDIPYGKEISYACDTHPDRGMTFNLIGESSIRCTSDPQGNGVWSSPAPRCELSVPAACPHPPKIQNGHYIGGHVSLYLPGMTISYICDPGYLLVGKGFIFCTDQGIWSQLDHYCKEVNCSFPLFMNGISKELEMKKVYHYGDYVTLKCEDGYTLEGSPWSQCQADDRWDPPLAKCTSRTHDALIVGTLSGTIFFILLIIFLSWIILKHRKGNNAHENPKEVAIHLHSQGGSSVHPRTLQTNEENSRVLP
MRLLAKIICLMLWAICVAEDCNELPPRRNTEILTGSWSDQTYPEGTQAIYKCRPGYRSLGNVIMVCRKGEWVALNPLRKCQKRPCGHPGDTPFGTFTLTGGNVFEYGVKAVYTCNEGYQLLGEINYRECDTDGWTNDIPICEVVKCLPVTAPENGKIVSSAMEPDREYHFGQAVRFVCNSGYKIEGDEEMHCSDDGFWSKEKPKCVEISCKSPDVINGSPISQKIIYKENERFQYKCNMGYEYSERGDAVCTESGWRPLPSCEEKSCDNPYIPNGDYSPLRIKHRTGDEITYQCRNGFYPATRGNTAKCTSTGWIPAPRCTLKPCDYPDIKHGGLYHENMRRPYFPVAVGKYYSYYCDEHFETPSGSYWDHIHCTQDGWSPAVPCLRKCYFPYLENGYNQNYGRKFVQGKSIDVACHPGYALPKAQTTVTCMENGWSPTPRCIRVKTCSKSSIDIENGFISESQYTYALKEKAKYQCKLGYVTADGETSGSITCGKDGWSAQPTCIKSCDIPVFMNARTKNDFTWFKLNDTLDYECHDGYESNTGSTTGSIVCGYNGWSDLPICYERECELPKIDVHLVPDRKKDQYKVGEVLKFSCKPGFTIVGPNSVQCYHFGLSPDLPICKEQVQSCGPPPELLNGNVKEKTKEEYGHSEVVEYYCNPRFLMKGPNKIQCVDGEWTTLPVCIVEESTCGDIPELEHGWAQLSSPPYYYGDSVEFNCSESFTMIGHRSITCIHGVWTQLPQCVAIDKLKKCKSSNLIILEEHLKNKKEFDHNSNIRYRCRGKEGWIHTVCINGRWDPEVNCSMAQIQLCPPPPQIPNSHNMTTTLNYRDGEKVSVLCQENYLIQEGEEITCKDGRWQSIPLCVEKIPCSQPPQIEHGTINSSRSSQESYAHGTKLSYTCEGGFRISEENETTCYMGKWSSPPQCEGLPCKSPPEISHGVVAHMSDSYQYGEEVTYKCFEGFGIDGPAIAKCLGEKWSHPPSCIKTDCLSLPSFENAIPMGEKKDVYKAGEQVTYTCATYYKMDGASNVTCINSRWTGRPTCRDTSCVNPPTVQNAYIVSRQMSKYPSGERVRYQCRSPYEMFGDEEVMCLNGNWTEPPQCKDSTGKCGPPPPIDNGDITSFPLSVYAPASSVEYQCQNLYQLEGNKRITCRNGQWSEPPKCLHPCVISREIMENYNIALRWTAKQKLYSRTGESVEFVCKRGYRLSSRSHTLRTTCWDGKLEYPTCAKR
MRLSARIIWLILWTVCAAEDCKGPPPRENSEILSGSWSEQLYPEGTQATYKCRPGYRTLGTIVKVCKNGKWVASNPSRICRKKPCGHPGDTPFGSFRLAVGSQFEFGAKVVYTCDDGYQLLGEIDYRECGADGWINDIPLCEVVKCLPVTELENGRIVSGAAETDQEYYFGQVVRFECNSGFKIEGHKEIHCSENGLWSNEKPRCVEILCTPPRVENGDGINVKPVYKENERYHYKCKHGYVPKERGDAVCTGSGWSSQPFCEEKRCSPPYILNGIYTPHRIIHRSDDEIRYECNYGFYPVTGSTVSKCTPTGWIPVPRCTLKPCEFPQFKYGRLYYEESLRPNFPVSIGNKYSYKCDNGFSPPSGYSWDYLRCTAQGWEPEVPCVRKCVFHYVENGDSAYWEKVYVQGQSLKVQCYNGYSLQNGQDTMTCTENGWSPPPKCIRIKTCSASDIHIDNGFLSESSSIYALNRETSYRCKQGYVTNTGEISGSITCLQNGWSPQPSCIKSCDMPVFENSITKNTRTWFKLNDKLDYECLVGFENEYKHTKGSITCTYYGWSDTPSCYERECSVPTLDRKLVVSPRKEKYRVGDLLEFSCHSGHRVGPDSVQCYHFGWSPGFPTCKGQVASCAPPLEILNGEINGAKKVEYSHGEVVKYDCKPRFLLKGPNKIQCVDGNWTTLPVCIEEERTCGDIPELEHGSAKCSVPPYHHGDSVEFICEENFTMIGHGSVSCISGKWTQLPKCVATDQLEKCRVLKSTGIEAIKPKLTEFTHNSTMDYKCRDKQEYERSICINGKWDPEPNCTSKTSCPPPPQIPNTQVIETTVKYLDGEKLSVLCQDNYLTQDSEEMVCKDGRWQSLPRCIEKIPCSQPPTIEHGSINLPRSSEERRDSIESSSHEHGTTFSYVCDDGFRIPEENRITCYMGKWSTPPRCVGLPCGPPPSIPLGTVSLELESYQHGEEVTYHCSTGFGIDGPAFIICEGGKWSDPPKCIKTDCDVLPTVKNAIIRGKSKKSYRTGEQVTFRCQSPYQMNGSDTVTCVNSRWIGQPVCKDNSCVDPPHVPNATIVTRTKNKYLHGDRVRYECNKPLELFGQVEVMCENGIWTEKPKCRDSTGKCGPPPPIDNGDITSLSLPVYEPLSSVEYQCQKYYLLKGKKTITCRNGKWSEPPTCLHACVIPENIMESHNIILKWRHTEKIYSHSGEDIEFGCKYGYYKARDSPPFRTKCINGTINYPTCV
Последовательность
Последовательность
Последовательность
Последовательность
Последовательность
Последовательность
Последовательность
с сайтом расщепления TEV
C2scFv-Crry-His с сайтом расщепления TEV
Тяжелая цепь IgG1 к C2 - CR1 1-10
Тяжелая цепь IgG1 к C2 - CR1 1-10
Тяжелая цепь IgG1 к C2 (впадина) - CR1 1-10 [пары с #6C2 (выступ)]
Тяжелая цепь IgG1 к C2
Тяжелая цепь IgG1 к C2 (выступ) [пары с #5C2, впадина)]
Тяжелая цепь Fab IgG1 к C2 - Crry
Тяжелая цепь Fab IgG1 к C2 - CR1 1-10
Тяжелая цепь Fab IgG1 к C2 - CR1 1-17
CR1 1-10-Fc IgG1 (впадина) [пары с #6C2 (выступ)]
CR1 1-10 - тяжелая цепь IgG1 к C2 (впадина)[пары с #6C2 (выступ)]
CR1 1-10 - тяжелая цепь Fab IgG1 к C2
CR1 1-17 - тяжелая цепь Fab IgG1 к C2
CR1 1-10 - легкая каппа-цепь к C2
Ключ= В SEQ ID NO: 161, 164, 165, 166, 168, 170, 171, 174, и 179 n варьируется от 0 до 17, от 1 до 8, от 1 до 5, по меньшей мере 4, или от 5 до 17.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ADMIRX INC.
< 120> КОНСТРУКЦИИ СЛИТОГО БЕЛКА ДЛЯ ЗАБОЛЕВАНИЯ, СВЯЗАННОГО
С КОМПЛЕМЕНТОМ
<130> 53542-707.601
<140>
<141>
<150> 62/778014
<151> 2018-12-11
<160> 343
<170> PatentIn версии 3.5
<210> 1
<211> 392
<212> БЕЛОК
<213> Homo sapiens
<400> 1
Met Glu Pro Pro Gly Arg Arg Glu Cys Pro Phe Pro Ser Trp Arg Phe
1 5 10 15
Pro Gly Leu Leu Leu Ala Ala Met Val Leu Leu Leu Tyr Ser Phe Ser
20 25 30
Asp Ala Cys Glu Glu Pro Pro Thr Phe Glu Ala Met Glu Leu Ile Gly
35 40 45
Lys Pro Lys Pro Tyr Tyr Glu Ile Gly Glu Arg Val Asp Tyr Lys Cys
50 55 60
Lys Lys Gly Tyr Phe Tyr Ile Pro Pro Leu Ala Thr His Thr Ile Cys
65 70 75 80
Asp Arg Asn His Thr Trp Leu Pro Val Ser Asp Asp Ala Cys Tyr Arg
85 90 95
Glu Thr Cys Pro Tyr Ile Arg Asp Pro Leu Asn Gly Gln Ala Val Pro
100 105 110
Ala Asn Gly Thr Tyr Glu Phe Gly Tyr Gln Met His Phe Ile Cys Asn
115 120 125
Glu Gly Tyr Tyr Leu Ile Gly Glu Glu Ile Leu Tyr Cys Glu Leu Lys
130 135 140
Gly Ser Val Ala Ile Trp Ser Gly Lys Pro Pro Ile Cys Glu Lys Val
145 150 155 160
Leu Cys Thr Pro Pro Pro Lys Ile Lys Asn Gly Lys His Thr Phe Ser
165 170 175
Glu Val Glu Val Phe Glu Tyr Leu Asp Ala Val Thr Tyr Ser Cys Asp
180 185 190
Pro Ala Pro Gly Pro Asp Pro Phe Ser Leu Ile Gly Glu Ser Thr Ile
195 200 205
Tyr Cys Gly Asp Asn Ser Val Trp Ser Arg Ala Ala Pro Glu Cys Lys
210 215 220
Val Val Lys Cys Arg Phe Pro Val Val Glu Asn Gly Lys Gln Ile Ser
225 230 235 240
Gly Phe Gly Lys Lys Phe Tyr Tyr Lys Ala Thr Val Met Phe Glu Cys
245 250 255
Asp Lys Gly Phe Tyr Leu Asp Gly Ser Asp Thr Ile Val Cys Asp Ser
260 265 270
Asn Ser Thr Trp Asp Pro Pro Val Pro Lys Cys Leu Lys Val Leu Pro
275 280 285
Pro Ser Ser Thr Lys Pro Pro Ala Leu Ser His Ser Val Ser Thr Ser
290 295 300
Ser Thr Thr Lys Ser Pro Ala Ser Ser Ala Ser Gly Pro Arg Pro Thr
305 310 315 320
Tyr Lys Pro Pro Val Ser Asn Tyr Pro Gly Tyr Pro Lys Pro Glu Glu
325 330 335
Gly Ile Leu Asp Ser Leu Asp Val Trp Val Ile Ala Val Ile Val Ile
340 345 350
Ala Ile Val Val Gly Val Ala Val Ile Cys Val Val Pro Tyr Arg Tyr
355 360 365
Leu Gln Arg Arg Lys Lys Lys Gly Thr Tyr Leu Thr Asp Glu Thr His
370 375 380
Arg Glu Val Lys Phe Thr Ser Leu
385 390
<210> 2
<211> 381
<212> БЕЛОК
<213> Homo sapiens
<400> 2
Met Thr Val Ala Arg Pro Ser Val Pro Ala Ala Leu Pro Leu Leu Gly
1 5 10 15
Glu Leu Pro Arg Leu Leu Leu Leu Val Leu Leu Cys Leu Pro Ala Val
20 25 30
Trp Gly Asp Cys Gly Leu Pro Pro Asp Val Pro Asn Ala Gln Pro Ala
35 40 45
Leu Glu Gly Arg Thr Ser Phe Pro Glu Asp Thr Val Ile Thr Tyr Lys
50 55 60
Cys Glu Glu Ser Phe Val Lys Ile Pro Gly Glu Lys Asp Ser Val Ile
65 70 75 80
Cys Leu Lys Gly Ser Gln Trp Ser Asp Ile Glu Glu Phe Cys Asn Arg
85 90 95
Ser Cys Glu Val Pro Thr Arg Leu Asn Ser Ala Ser Leu Lys Gln Pro
100 105 110
Tyr Ile Thr Gln Asn Tyr Phe Pro Val Gly Thr Val Val Glu Tyr Glu
115 120 125
Cys Arg Pro Gly Tyr Arg Arg Glu Pro Ser Leu Ser Pro Lys Leu Thr
130 135 140
Cys Leu Gln Asn Leu Lys Trp Ser Thr Ala Val Glu Phe Cys Lys Lys
145 150 155 160
Lys Ser Cys Pro Asn Pro Gly Glu Ile Arg Asn Gly Gln Ile Asp Val
165 170 175
Pro Gly Gly Ile Leu Phe Gly Ala Thr Ile Ser Phe Ser Cys Asn Thr
180 185 190
Gly Tyr Lys Leu Phe Gly Ser Thr Ser Ser Phe Cys Leu Ile Ser Gly
195 200 205
Ser Ser Val Gln Trp Ser Asp Pro Leu Pro Glu Cys Arg Glu Ile Tyr
210 215 220
Cys Pro Ala Pro Pro Gln Ile Asp Asn Gly Ile Ile Gln Gly Glu Arg
225 230 235 240
Asp His Tyr Gly Tyr Arg Gln Ser Val Thr Tyr Ala Cys Asn Lys Gly
245 250 255
Phe Thr Met Ile Gly Glu His Ser Ile Tyr Cys Thr Val Asn Asn Asp
260 265 270
Glu Gly Glu Trp Ser Gly Pro Pro Pro Glu Cys Arg Gly Lys Ser Leu
275 280 285
Thr Ser Lys Val Pro Pro Thr Val Gln Lys Pro Thr Thr Val Asn Val
290 295 300
Pro Thr Thr Glu Val Ser Pro Thr Ser Gln Lys Thr Thr Thr Lys Thr
305 310 315 320
Thr Thr Pro Asn Ala Gln Ala Thr Arg Ser Thr Pro Val Ser Arg Thr
325 330 335
Thr Lys His Phe His Glu Thr Thr Pro Asn Lys Gly Ser Gly Thr Thr
340 345 350
Ser Gly Thr Thr Arg Leu Leu Ser Gly His Thr Cys Phe Thr Leu Thr
355 360 365
Gly Leu Leu Gly Thr Leu Val Thr Met Gly Leu Leu Thr
370 375 380
<210> 3
<211> 390
<212> БЕЛОК
<213> Mus musculus
<400> 3
Met Ile Arg Gly Arg Ala Pro Arg Thr Arg Pro Ser Pro Pro Pro Pro
1 5 10 15
Leu Leu Pro Leu Leu Ser Leu Ser Leu Leu Leu Leu Ser Pro Thr Val
20 25 30
Arg Gly Asp Cys Gly Pro Pro Pro Asp Ile Pro Asn Ala Arg Pro Ile
35 40 45
Leu Gly Arg His Ser Lys Phe Ala Glu Gln Ser Lys Val Ala Tyr Ser
50 55 60
Cys Asn Asn Gly Phe Lys Gln Val Pro Asp Lys Ser Asn Ile Val Val
65 70 75 80
Cys Leu Glu Asn Gly Gln Trp Ser Ser His Glu Thr Phe Cys Glu Lys
85 90 95
Ser Cys Val Ala Pro Glu Arg Leu Ser Phe Ala Ser Leu Lys Lys Glu
100 105 110
Tyr Leu Asn Met Asn Phe Phe Pro Val Gly Thr Ile Val Glu Tyr Glu
115 120 125
Cys Arg Pro Gly Phe Arg Lys Gln Pro Pro Leu Pro Gly Lys Ala Thr
130 135 140
Cys Leu Glu Asp Leu Val Trp Ser Pro Val Ala Gln Phe Cys Lys Lys
145 150 155 160
Lys Ser Cys Pro Asn Pro Lys Asp Leu Asp Asn Gly His Ile Asn Ile
165 170 175
Pro Thr Gly Ile Leu Phe Gly Ser Glu Ile Asn Phe Ser Cys Asn Pro
180 185 190
Gly Tyr Arg Leu Val Gly Val Ser Ser Thr Phe Cys Ser Val Thr Gly
195 200 205
Asn Thr Val Asp Trp Asp Asp Glu Phe Pro Val Cys Thr Glu Ile His
210 215 220
Cys Pro Glu Pro Pro Lys Ile Asn Asn Gly Ile Met Arg Gly Glu Ser
225 230 235 240
Asp Ser Tyr Thr Tyr Ser Gln Val Val Thr Tyr Ser Cys Asp Lys Gly
245 250 255
Phe Ile Leu Val Gly Asn Ala Ser Ile Tyr Cys Thr Val Ser Lys Ser
260 265 270
Asp Val Gly Gln Trp Ser Ser Pro Pro Pro Arg Cys Ile Glu Lys Ser
275 280 285
Lys Val Pro Thr Lys Lys Pro Thr Ile Asn Val Pro Ser Thr Gly Thr
290 295 300
Pro Ser Thr Pro Gln Lys Pro Thr Thr Glu Ser Val Pro Asn Pro Gly
305 310 315 320
Asp Gln Pro Thr Pro Gln Lys Pro Ser Thr Val Lys Val Ser Ala Thr
325 330 335
Gln His Val Pro Val Thr Lys Thr Thr Val Arg His Pro Ile Arg Thr
340 345 350
Ser Thr Asp Lys Gly Glu Pro Asn Thr Gly Gly Asp Arg Tyr Ile Tyr
355 360 365
Gly His Thr Cys Leu Ile Thr Leu Thr Val Leu His Val Met Leu Ser
370 375 380
Leu Ile Gly Tyr Leu Thr
385 390
<210> 4
<211> 128
<212> БЕЛОК
<213> Homo sapiens
<400> 4
Met Gly Ile Gln Gly Gly Ser Val Leu Phe Gly Leu Leu Leu Val Leu
1 5 10 15
Ala Val Phe Cys His Ser Gly His Ser Leu Gln Cys Tyr Asn Cys Pro
20 25 30
Asn Pro Thr Ala Asp Cys Lys Thr Ala Val Asn Cys Ser Ser Asp Phe
35 40 45
Asp Ala Cys Leu Ile Thr Lys Ala Gly Leu Gln Val Tyr Asn Lys Cys
50 55 60
Trp Lys Phe Glu His Cys Asn Phe Asn Asp Val Thr Thr Arg Leu Arg
65 70 75 80
Glu Asn Glu Leu Thr Tyr Tyr Cys Cys Lys Lys Asp Leu Cys Asn Phe
85 90 95
Asn Glu Gln Leu Glu Asn Gly Gly Thr Ser Leu Ser Glu Lys Thr Val
100 105 110
Leu Leu Leu Val Thr Pro Phe Leu Ala Ala Ala Trp Ser Leu His Pro
115 120 125
<210> 5
<211> 123
<212> БЕЛОК
<213> Mus musculus
<400> 5
Met Arg Ala Gln Arg Gly Leu Ile Leu Leu Leu Leu Leu Leu Ala Val
1 5 10 15
Phe Cys Ser Thr Ala Val Ser Leu Thr Cys Tyr His Cys Phe Gln Pro
20 25 30
Val Val Ser Ser Cys Asn Met Asn Ser Thr Cys Ser Pro Asp Gln Asp
35 40 45
Ser Cys Leu Tyr Ala Val Ala Gly Met Gln Val Tyr Gln Arg Cys Trp
50 55 60
Lys Gln Ser Asp Cys His Gly Glu Ile Ile Met Asp Gln Leu Glu Glu
65 70 75 80
Thr Lys Leu Lys Phe Arg Cys Cys Gln Phe Asn Leu Cys Asn Lys Ser
85 90 95
Asp Gly Ser Leu Gly Lys Thr Pro Leu Leu Gly Thr Ser Val Leu Val
100 105 110
Ala Ile Leu Asn Leu Cys Phe Leu Ser His Leu
115 120
<210> 6
<211> 129
<212> БЕЛОК
<213> Mus musculus
<400> 6
Met Arg Ala Gln Arg Gly Leu Ile Leu Leu Leu Leu Leu Leu Ala Val
1 5 10 15
Phe Cys Ser Thr Ala Val Ser Leu Lys Cys Tyr Asn Cys Leu Asp Pro
20 25 30
Val Ser Ser Cys Lys Ile Asn Thr Thr Cys Ser Pro Asn Leu Asp Ser
35 40 45
Cys Leu Tyr Ala Val Ala Gly Arg Gln Val Tyr Gln Gln Cys Trp Lys
50 55 60
Leu Ser Asp Cys Asn Ser Asn Tyr Ile Met Ser Arg Leu Asp Val Ala
65 70 75 80
Gly Ile Gln Ser Lys Cys Cys Gln Trp Asp Leu Cys Asn Lys Asn Leu
85 90 95
Asp Gly Leu Glu Glu Pro Asn Asn Ala Glu Thr Ser Ser Leu Arg Lys
100 105 110
Thr Ala Leu Leu Gly Thr Ser Val Leu Val Ala Ile Leu Lys Phe Cys
115 120 125
Phe
<210> 7
<211> 483
<212> БЕЛОК
<213> Mus musculus
<400> 7
Met Glu Val Ser Ser Arg Ser Ser Glu Pro Leu Asp Pro Val Trp Leu
1 5 10 15
Leu Val Ala Phe Gly Arg Gly Gly Val Lys Leu Glu Val Leu Leu Leu
20 25 30
Phe Leu Leu Pro Phe Thr Leu Gly Glu Leu Arg Gly Gly Leu Gly Lys
35 40 45
His Gly His Thr Val His Arg Glu Pro Ala Val Asn Arg Leu Cys Ala
50 55 60
Asp Ser Lys Arg Trp Ser Gly Leu Pro Val Ser Ala Gln Arg Pro Phe
65 70 75 80
Pro Met Gly His Cys Pro Ala Pro Ser Gln Leu Pro Ser Ala Lys Pro
85 90 95
Ile Asn Leu Thr Asp Glu Ser Met Phe Pro Ile Gly Thr Tyr Leu Leu
100 105 110
Tyr Glu Cys Leu Pro Gly Tyr Ile Lys Arg Gln Phe Ser Ile Thr Cys
115 120 125
Lys Gln Asp Ser Thr Trp Thr Ser Ala Glu Asp Lys Cys Ile Arg Lys
130 135 140
Gln Cys Lys Thr Pro Ser Asp Pro Glu Asn Gly Leu Val His Val His
145 150 155 160
Thr Gly Ile Gln Phe Gly Ser Arg Ile Asn Tyr Thr Cys Asn Gln Gly
165 170 175
Tyr Arg Leu Ile Gly Ser Ser Ser Ala Val Cys Val Ile Thr Asp Gln
180 185 190
Ser Val Asp Trp Asp Thr Glu Ala Pro Ile Cys Glu Trp Ile Pro Cys
195 200 205
Glu Ile Pro Pro Gly Ile Pro Asn Gly Asp Phe Phe Ser Ser Thr Arg
210 215 220
Glu Asp Phe His Tyr Gly Met Val Val Thr Tyr Arg Cys Asn Thr Asp
225 230 235 240
Ala Arg Gly Lys Ala Leu Phe Asn Leu Val Gly Glu Pro Ser Leu Tyr
245 250 255
Cys Thr Ser Asn Asp Gly Glu Ile Gly Val Trp Ser Gly Pro Pro Pro
260 265 270
Gln Cys Ile Glu Leu Asn Lys Cys Thr Pro Pro Pro Tyr Val Glu Asn
275 280 285
Ala Val Met Leu Ser Glu Asn Arg Ser Leu Phe Ser Leu Arg Asp Ile
290 295 300
Val Glu Phe Arg Cys His Pro Gly Phe Ile Met Lys Gly Ala Ser Ser
305 310 315 320
Val His Cys Gln Ser Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys
325 330 335
Phe Lys Gly Val Ile Cys Arg Leu Pro Gln Glu Met Ser Gly Phe Gln
340 345 350
Lys Gly Leu Gly Met Lys Lys Glu Tyr Tyr Tyr Gly Glu Asn Val Thr
355 360 365
Leu Glu Cys Glu Asp Gly Tyr Thr Leu Glu Gly Ser Ser Gln Ser Gln
370 375 380
Cys Gln Ser Asp Gly Ser Trp Asn Pro Leu Leu Ala Lys Cys Val Ser
385 390 395 400
Arg Ser Ile Ser Gly Leu Ile Val Gly Ile Phe Ile Gly Ile Ile Val
405 410 415
Phe Ile Leu Val Ile Ile Val Phe Ile Trp Met Ile Leu Lys Tyr Lys
420 425 430
Lys Arg Asn Thr Thr Asp Glu Lys Tyr Lys Glu Val Gly Ile His Leu
435 440 445
Asn Tyr Lys Glu Asp Ser Cys Val Arg Leu Gln Ser Leu Leu Thr Ser
450 455 460
Gln Glu Asn Ser Ser Thr Thr Ser Pro Ala Arg Asn Ser Leu Thr Gln
465 470 475 480
Glu Val Ser
<210> 8
<211> 2039
<212> БЕЛОК
<213> Homo sapiens
<400> 8
Met Gly Ala Ser Ser Pro Arg Ser Pro Glu Pro Val Gly Pro Pro Ala
1 5 10 15
Pro Gly Leu Pro Phe Cys Cys Gly Gly Ser Leu Leu Ala Val Val Val
20 25 30
Leu Leu Ala Leu Pro Val Ala Trp Gly Gln Cys Asn Ala Pro Glu Trp
35 40 45
Leu Pro Phe Ala Arg Pro Thr Asn Leu Thr Asp Glu Phe Glu Phe Pro
50 55 60
Ile Gly Thr Tyr Leu Asn Tyr Glu Cys Arg Pro Gly Tyr Ser Gly Arg
65 70 75 80
Pro Phe Ser Ile Ile Cys Leu Lys Asn Ser Val Trp Thr Gly Ala Lys
85 90 95
Asp Arg Cys Arg Arg Lys Ser Cys Arg Asn Pro Pro Asp Pro Val Asn
100 105 110
Gly Met Val His Val Ile Lys Gly Ile Gln Phe Gly Ser Gln Ile Lys
115 120 125
Tyr Ser Cys Thr Lys Gly Tyr Arg Leu Ile Gly Ser Ser Ser Ala Thr
130 135 140
Cys Ile Ile Ser Gly Asp Thr Val Ile Trp Asp Asn Glu Thr Pro Ile
145 150 155 160
Cys Asp Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Thr Asn Gly Asp
165 170 175
Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr
180 185 190
Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe Glu Leu Val
195 200 205
Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile
210 215 220
Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys Cys Thr Pro
225 230 235 240
Pro Asn Val Glu Asn Gly Ile Leu Val Ser Asp Asn Arg Ser Leu Phe
245 250 255
Ser Leu Asn Glu Val Val Glu Phe Arg Cys Gln Pro Gly Phe Val Met
260 265 270
Lys Gly Pro Arg Arg Val Lys Cys Gln Ala Leu Asn Lys Trp Glu Pro
275 280 285
Glu Leu Pro Ser Cys Ser Arg Val Cys Gln Pro Pro Pro Asp Val Leu
290 295 300
His Ala Glu Arg Thr Gln Arg Asp Lys Asp Asn Phe Ser Pro Gly Gln
305 310 315 320
Glu Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp Leu Arg Gly Ala Ala
325 330 335
Ser Met Arg Cys Thr Pro Gln Gly Asp Trp Ser Pro Ala Ala Pro Thr
340 345 350
Cys Glu Val Lys Ser Cys Asp Asp Phe Met Gly Gln Leu Leu Asn Gly
355 360 365
Arg Val Leu Phe Pro Val Asn Leu Gln Leu Gly Ala Lys Val Asp Phe
370 375 380
Val Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser Ser Ala Ser Tyr Cys
385 390 395 400
Val Leu Ala Gly Met Glu Ser Leu Trp Asn Ser Ser Val Pro Val Cys
405 410 415
Glu Gln Ile Phe Cys Pro Ser Pro Pro Val Ile Pro Asn Gly Arg His
420 425 430
Thr Gly Lys Pro Leu Glu Val Phe Pro Phe Gly Lys Thr Val Asn Tyr
435 440 445
Thr Cys Asp Pro His Pro Asp Arg Gly Thr Ser Phe Asp Leu Ile Gly
450 455 460
Glu Ser Thr Ile Arg Cys Thr Ser Asp Pro Gln Gly Asn Gly Val Trp
465 470 475 480
Ser Ser Pro Ala Pro Arg Cys Gly Ile Leu Gly His Cys Gln Ala Pro
485 490 495
Asp His Phe Leu Phe Ala Lys Leu Lys Thr Gln Thr Asn Ala Ser Asp
500 505 510
Phe Pro Ile Gly Thr Ser Leu Lys Tyr Glu Cys Arg Pro Glu Tyr Tyr
515 520 525
Gly Arg Pro Phe Ser Ile Thr Cys Leu Asp Asn Leu Val Trp Ser Ser
530 535 540
Pro Lys Asp Val Cys Lys Arg Lys Ser Cys Lys Thr Pro Pro Asp Pro
545 550 555 560
Val Asn Gly Met Val His Val Ile Thr Asp Ile Gln Val Gly Ser Arg
565 570 575
Ile Asn Tyr Ser Cys Thr Thr Gly His Arg Leu Ile Gly His Ser Ser
580 585 590
Ala Glu Cys Ile Leu Ser Gly Asn Ala Ala His Trp Ser Thr Lys Pro
595 600 605
Pro Ile Cys Gln Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Ala Asn
610 615 620
Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val
625 630 635 640
Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe Glu
645 650 655
Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val
660 665 670
Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys Cys
675 680 685
Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val Ser Asp Asn Arg Ser
690 695 700
Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg Cys Gln Pro Gly Phe
705 710 715 720
Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln Ala Leu Asn Lys Trp
725 730 735
Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys Gln Pro Pro Pro Asp
740 745 750
Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys Asp Asn Phe Ser Pro
755 760 765
Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp Leu Arg Gly
770 775 780
Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp Trp Ser Pro Ala Ala
785 790 795 800
Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe Met Gly Gln Leu Leu
805 810 815
Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln Leu Gly Ala Lys Val
820 825 830
Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser Ser Ala Ser
835 840 845
Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp Asn Ser Ser Val Pro
850 855 860
Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro Val Ile Pro Asn Gly
865 870 875 880
Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro Phe Gly Lys Ala Val
885 890 895
Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly Thr Ser Phe Asp Leu
900 905 910
Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp Pro Gln Gly Asn Gly
915 920 925
Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile Leu Gly His Cys Gln
930 935 940
Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys Thr Gln Thr Asn Ala
945 950 955 960
Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr Glu Cys Arg Pro Glu
965 970 975
Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu Asp Asn Leu Val Trp
980 985 990
Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser Cys Lys Thr Pro Pro
995 1000 1005
Asp Pro Val Asn Gly Met Val His Val Ile Thr Asp Ile Gln Val
1010 1015 1020
Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His Arg Leu Ile
1025 1030 1035
Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Thr Ala His
1040 1045 1050
Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly Leu
1055 1060 1065
Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
1070 1075 1080
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Leu Gly
1085 1090 1095
Ser Arg Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile
1100 1105 1110
Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro
1115 1120 1125
Ala Pro Gln Cys Ile Ile Pro Asn Lys Cys Thr Pro Pro Asn Val
1130 1135 1140
Glu Asn Gly Ile Leu Val Ser Asp Asn Arg Ser Leu Phe Ser Leu
1145 1150 1155
Asn Glu Val Val Glu Phe Arg Cys Gln Pro Gly Phe Val Met Lys
1160 1165 1170
Gly Pro Arg Arg Val Lys Cys Gln Ala Leu Asn Lys Trp Glu Pro
1175 1180 1185
Glu Leu Pro Ser Cys Ser Arg Val Cys Gln Pro Pro Pro Glu Ile
1190 1195 1200
Leu His Gly Glu His Thr Pro Ser His Gln Asp Asn Phe Ser Pro
1205 1210 1215
Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp Leu Arg
1220 1225 1230
Gly Ala Ala Ser Leu His Cys Thr Pro Gln Gly Asp Trp Ser Pro
1235 1240 1245
Glu Ala Pro Arg Cys Ala Val Lys Ser Cys Asp Asp Phe Leu Gly
1250 1255 1260
Gln Leu Pro His Gly Arg Val Leu Phe Pro Leu Asn Leu Gln Leu
1265 1270 1275
Gly Ala Lys Val Ser Phe Val Cys Asp Glu Gly Phe Arg Leu Lys
1280 1285 1290
Gly Ser Ser Val Ser His Cys Val Leu Val Gly Met Arg Ser Leu
1295 1300 1305
Trp Asn Asn Ser Val Pro Val Cys Glu His Ile Phe Cys Pro Asn
1310 1315 1320
Pro Pro Ala Ile Leu Asn Gly Arg His Thr Gly Thr Pro Ser Gly
1325 1330 1335
Asp Ile Pro Tyr Gly Lys Glu Ile Ser Tyr Thr Cys Asp Pro His
1340 1345 1350
Pro Asp Arg Gly Met Thr Phe Asn Leu Ile Gly Glu Ser Thr Ile
1355 1360 1365
Arg Cys Thr Ser Asp Pro His Gly Asn Gly Val Trp Ser Ser Pro
1370 1375 1380
Ala Pro Arg Cys Glu Leu Ser Val Arg Ala Gly His Cys Lys Thr
1385 1390 1395
Pro Glu Gln Phe Pro Phe Ala Ser Pro Thr Ile Pro Ile Asn Asp
1400 1405 1410
Phe Glu Phe Pro Val Gly Thr Ser Leu Asn Tyr Glu Cys Arg Pro
1415 1420 1425
Gly Tyr Phe Gly Lys Met Phe Ser Ile Ser Cys Leu Glu Asn Leu
1430 1435 1440
Val Trp Ser Ser Val Glu Asp Asn Cys Arg Arg Lys Ser Cys Gly
1445 1450 1455
Pro Pro Pro Glu Pro Phe Asn Gly Met Val His Ile Asn Thr Asp
1460 1465 1470
Thr Gln Phe Gly Ser Thr Val Asn Tyr Ser Cys Asn Glu Gly Phe
1475 1480 1485
Arg Leu Ile Gly Ser Pro Ser Thr Thr Cys Leu Val Ser Gly Asn
1490 1495 1500
Asn Val Thr Trp Asp Lys Lys Ala Pro Ile Cys Glu Ile Ile Ser
1505 1510 1515
Cys Glu Pro Pro Pro Thr Ile Ser Asn Gly Asp Phe Tyr Ser Asn
1520 1525 1530
Asn Arg Thr Ser Phe His Asn Gly Thr Val Val Thr Tyr Gln Cys
1535 1540 1545
His Thr Gly Pro Asp Gly Glu Gln Leu Phe Glu Leu Val Gly Glu
1550 1555 1560
Arg Ser Ile Tyr Cys Thr Ser Lys Asp Asp Gln Val Gly Val Trp
1565 1570 1575
Ser Ser Pro Pro Pro Arg Cys Ile Ser Thr Asn Lys Cys Thr Ala
1580 1585 1590
Pro Glu Val Glu Asn Ala Ile Arg Val Pro Gly Asn Arg Ser Phe
1595 1600 1605
Phe Ser Leu Thr Glu Ile Ile Arg Phe Arg Cys Gln Pro Gly Phe
1610 1615 1620
Val Met Val Gly Ser His Thr Val Gln Cys Gln Thr Asn Gly Arg
1625 1630 1635
Trp Gly Pro Lys Leu Pro His Cys Ser Arg Val Cys Gln Pro Pro
1640 1645 1650
Pro Glu Ile Leu His Gly Glu His Thr Leu Ser His Gln Asp Asn
1655 1660 1665
Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Ser Tyr
1670 1675 1680
Asp Leu Arg Gly Ala Ala Ser Leu His Cys Thr Pro Gln Gly Asp
1685 1690 1695
Trp Ser Pro Glu Ala Pro Arg Cys Thr Val Lys Ser Cys Asp Asp
1700 1705 1710
Phe Leu Gly Gln Leu Pro His Gly Arg Val Leu Leu Pro Leu Asn
1715 1720 1725
Leu Gln Leu Gly Ala Lys Val Ser Phe Val Cys Asp Glu Gly Phe
1730 1735 1740
Arg Leu Lys Gly Arg Ser Ala Ser His Cys Val Leu Ala Gly Met
1745 1750 1755
Lys Ala Leu Trp Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe
1760 1765 1770
Cys Pro Asn Pro Pro Ala Ile Leu Asn Gly Arg His Thr Gly Thr
1775 1780 1785
Pro Phe Gly Asp Ile Pro Tyr Gly Lys Glu Ile Ser Tyr Ala Cys
1790 1795 1800
Asp Thr His Pro Asp Arg Gly Met Thr Phe Asn Leu Ile Gly Glu
1805 1810 1815
Ser Ser Ile Arg Cys Thr Ser Asp Pro Gln Gly Asn Gly Val Trp
1820 1825 1830
Ser Ser Pro Ala Pro Arg Cys Glu Leu Ser Val Pro Ala Ala Cys
1835 1840 1845
Pro His Pro Pro Lys Ile Gln Asn Gly His Tyr Ile Gly Gly His
1850 1855 1860
Val Ser Leu Tyr Leu Pro Gly Met Thr Ile Ser Tyr Ile Cys Asp
1865 1870 1875
Pro Gly Tyr Leu Leu Val Gly Lys Gly Phe Ile Phe Cys Thr Asp
1880 1885 1890
Gln Gly Ile Trp Ser Gln Leu Asp His Tyr Cys Lys Glu Val Asn
1895 1900 1905
Cys Ser Phe Pro Leu Phe Met Asn Gly Ile Ser Lys Glu Leu Glu
1910 1915 1920
Met Lys Lys Val Tyr His Tyr Gly Asp Tyr Val Thr Leu Lys Cys
1925 1930 1935
Glu Asp Gly Tyr Thr Leu Glu Gly Ser Pro Trp Ser Gln Cys Gln
1940 1945 1950
Ala Asp Asp Arg Trp Asp Pro Pro Leu Ala Lys Cys Thr Ser Arg
1955 1960 1965
Thr His Asp Ala Leu Ile Val Gly Thr Leu Ser Gly Thr Ile Phe
1970 1975 1980
Phe Ile Leu Leu Ile Ile Phe Leu Ser Trp Ile Ile Leu Lys His
1985 1990 1995
Arg Lys Gly Asn Asn Ala His Glu Asn Pro Lys Glu Val Ala Ile
2000 2005 2010
His Leu His Ser Gln Gly Gly Ser Ser Val His Pro Arg Thr Leu
2015 2020 2025
Gln Thr Asn Glu Glu Asn Ser Arg Val Leu Pro
2030 2035
<210> 9
<211> 1231
<212> БЕЛОК
<213> Homo sapiens
<400> 9
Met Arg Leu Leu Ala Lys Ile Ile Cys Leu Met Leu Trp Ala Ile Cys
1 5 10 15
Val Ala Glu Asp Cys Asn Glu Leu Pro Pro Arg Arg Asn Thr Glu Ile
20 25 30
Leu Thr Gly Ser Trp Ser Asp Gln Thr Tyr Pro Glu Gly Thr Gln Ala
35 40 45
Ile Tyr Lys Cys Arg Pro Gly Tyr Arg Ser Leu Gly Asn Val Ile Met
50 55 60
Val Cys Arg Lys Gly Glu Trp Val Ala Leu Asn Pro Leu Arg Lys Cys
65 70 75 80
Gln Lys Arg Pro Cys Gly His Pro Gly Asp Thr Pro Phe Gly Thr Phe
85 90 95
Thr Leu Thr Gly Gly Asn Val Phe Glu Tyr Gly Val Lys Ala Val Tyr
100 105 110
Thr Cys Asn Glu Gly Tyr Gln Leu Leu Gly Glu Ile Asn Tyr Arg Glu
115 120 125
Cys Asp Thr Asp Gly Trp Thr Asn Asp Ile Pro Ile Cys Glu Val Val
130 135 140
Lys Cys Leu Pro Val Thr Ala Pro Glu Asn Gly Lys Ile Val Ser Ser
145 150 155 160
Ala Met Glu Pro Asp Arg Glu Tyr His Phe Gly Gln Ala Val Arg Phe
165 170 175
Val Cys Asn Ser Gly Tyr Lys Ile Glu Gly Asp Glu Glu Met His Cys
180 185 190
Ser Asp Asp Gly Phe Trp Ser Lys Glu Lys Pro Lys Cys Val Glu Ile
195 200 205
Ser Cys Lys Ser Pro Asp Val Ile Asn Gly Ser Pro Ile Ser Gln Lys
210 215 220
Ile Ile Tyr Lys Glu Asn Glu Arg Phe Gln Tyr Lys Cys Asn Met Gly
225 230 235 240
Tyr Glu Tyr Ser Glu Arg Gly Asp Ala Val Cys Thr Glu Ser Gly Trp
245 250 255
Arg Pro Leu Pro Ser Cys Glu Glu Lys Ser Cys Asp Asn Pro Tyr Ile
260 265 270
Pro Asn Gly Asp Tyr Ser Pro Leu Arg Ile Lys His Arg Thr Gly Asp
275 280 285
Glu Ile Thr Tyr Gln Cys Arg Asn Gly Phe Tyr Pro Ala Thr Arg Gly
290 295 300
Asn Thr Ala Lys Cys Thr Ser Thr Gly Trp Ile Pro Ala Pro Arg Cys
305 310 315 320
Thr Leu Lys Pro Cys Asp Tyr Pro Asp Ile Lys His Gly Gly Leu Tyr
325 330 335
His Glu Asn Met Arg Arg Pro Tyr Phe Pro Val Ala Val Gly Lys Tyr
340 345 350
Tyr Ser Tyr Tyr Cys Asp Glu His Phe Glu Thr Pro Ser Gly Ser Tyr
355 360 365
Trp Asp His Ile His Cys Thr Gln Asp Gly Trp Ser Pro Ala Val Pro
370 375 380
Cys Leu Arg Lys Cys Tyr Phe Pro Tyr Leu Glu Asn Gly Tyr Asn Gln
385 390 395 400
Asn Tyr Gly Arg Lys Phe Val Gln Gly Lys Ser Ile Asp Val Ala Cys
405 410 415
His Pro Gly Tyr Ala Leu Pro Lys Ala Gln Thr Thr Val Thr Cys Met
420 425 430
Glu Asn Gly Trp Ser Pro Thr Pro Arg Cys Ile Arg Val Lys Thr Cys
435 440 445
Ser Lys Ser Ser Ile Asp Ile Glu Asn Gly Phe Ile Ser Glu Ser Gln
450 455 460
Tyr Thr Tyr Ala Leu Lys Glu Lys Ala Lys Tyr Gln Cys Lys Leu Gly
465 470 475 480
Tyr Val Thr Ala Asp Gly Glu Thr Ser Gly Ser Ile Thr Cys Gly Lys
485 490 495
Asp Gly Trp Ser Ala Gln Pro Thr Cys Ile Lys Ser Cys Asp Ile Pro
500 505 510
Val Phe Met Asn Ala Arg Thr Lys Asn Asp Phe Thr Trp Phe Lys Leu
515 520 525
Asn Asp Thr Leu Asp Tyr Glu Cys His Asp Gly Tyr Glu Ser Asn Thr
530 535 540
Gly Ser Thr Thr Gly Ser Ile Val Cys Gly Tyr Asn Gly Trp Ser Asp
545 550 555 560
Leu Pro Ile Cys Tyr Glu Arg Glu Cys Glu Leu Pro Lys Ile Asp Val
565 570 575
His Leu Val Pro Asp Arg Lys Lys Asp Gln Tyr Lys Val Gly Glu Val
580 585 590
Leu Lys Phe Ser Cys Lys Pro Gly Phe Thr Ile Val Gly Pro Asn Ser
595 600 605
Val Gln Cys Tyr His Phe Gly Leu Ser Pro Asp Leu Pro Ile Cys Lys
610 615 620
Glu Gln Val Gln Ser Cys Gly Pro Pro Pro Glu Leu Leu Asn Gly Asn
625 630 635 640
Val Lys Glu Lys Thr Lys Glu Glu Tyr Gly His Ser Glu Val Val Glu
645 650 655
Tyr Tyr Cys Asn Pro Arg Phe Leu Met Lys Gly Pro Asn Lys Ile Gln
660 665 670
Cys Val Asp Gly Glu Trp Thr Thr Leu Pro Val Cys Ile Val Glu Glu
675 680 685
Ser Thr Cys Gly Asp Ile Pro Glu Leu Glu His Gly Trp Ala Gln Leu
690 695 700
Ser Ser Pro Pro Tyr Tyr Tyr Gly Asp Ser Val Glu Phe Asn Cys Ser
705 710 715 720
Glu Ser Phe Thr Met Ile Gly His Arg Ser Ile Thr Cys Ile His Gly
725 730 735
Val Trp Thr Gln Leu Pro Gln Cys Val Ala Ile Asp Lys Leu Lys Lys
740 745 750
Cys Lys Ser Ser Asn Leu Ile Ile Leu Glu Glu His Leu Lys Asn Lys
755 760 765
Lys Glu Phe Asp His Asn Ser Asn Ile Arg Tyr Arg Cys Arg Gly Lys
770 775 780
Glu Gly Trp Ile His Thr Val Cys Ile Asn Gly Arg Trp Asp Pro Glu
785 790 795 800
Val Asn Cys Ser Met Ala Gln Ile Gln Leu Cys Pro Pro Pro Pro Gln
805 810 815
Ile Pro Asn Ser His Asn Met Thr Thr Thr Leu Asn Tyr Arg Asp Gly
820 825 830
Glu Lys Val Ser Val Leu Cys Gln Glu Asn Tyr Leu Ile Gln Glu Gly
835 840 845
Glu Glu Ile Thr Cys Lys Asp Gly Arg Trp Gln Ser Ile Pro Leu Cys
850 855 860
Val Glu Lys Ile Pro Cys Ser Gln Pro Pro Gln Ile Glu His Gly Thr
865 870 875 880
Ile Asn Ser Ser Arg Ser Ser Gln Glu Ser Tyr Ala His Gly Thr Lys
885 890 895
Leu Ser Tyr Thr Cys Glu Gly Gly Phe Arg Ile Ser Glu Glu Asn Glu
900 905 910
Thr Thr Cys Tyr Met Gly Lys Trp Ser Ser Pro Pro Gln Cys Glu Gly
915 920 925
Leu Pro Cys Lys Ser Pro Pro Glu Ile Ser His Gly Val Val Ala His
930 935 940
Met Ser Asp Ser Tyr Gln Tyr Gly Glu Glu Val Thr Tyr Lys Cys Phe
945 950 955 960
Glu Gly Phe Gly Ile Asp Gly Pro Ala Ile Ala Lys Cys Leu Gly Glu
965 970 975
Lys Trp Ser His Pro Pro Ser Cys Ile Lys Thr Asp Cys Leu Ser Leu
980 985 990
Pro Ser Phe Glu Asn Ala Ile Pro Met Gly Glu Lys Lys Asp Val Tyr
995 1000 1005
Lys Ala Gly Glu Gln Val Thr Tyr Thr Cys Ala Thr Tyr Tyr Lys
1010 1015 1020
Met Asp Gly Ala Ser Asn Val Thr Cys Ile Asn Ser Arg Trp Thr
1025 1030 1035
Gly Arg Pro Thr Cys Arg Asp Thr Ser Cys Val Asn Pro Pro Thr
1040 1045 1050
Val Gln Asn Ala Tyr Ile Val Ser Arg Gln Met Ser Lys Tyr Pro
1055 1060 1065
Ser Gly Glu Arg Val Arg Tyr Gln Cys Arg Ser Pro Tyr Glu Met
1070 1075 1080
Phe Gly Asp Glu Glu Val Met Cys Leu Asn Gly Asn Trp Thr Glu
1085 1090 1095
Pro Pro Gln Cys Lys Asp Ser Thr Gly Lys Cys Gly Pro Pro Pro
1100 1105 1110
Pro Ile Asp Asn Gly Asp Ile Thr Ser Phe Pro Leu Ser Val Tyr
1115 1120 1125
Ala Pro Ala Ser Ser Val Glu Tyr Gln Cys Gln Asn Leu Tyr Gln
1130 1135 1140
Leu Glu Gly Asn Lys Arg Ile Thr Cys Arg Asn Gly Gln Trp Ser
1145 1150 1155
Glu Pro Pro Lys Cys Leu His Pro Cys Val Ile Ser Arg Glu Ile
1160 1165 1170
Met Glu Asn Tyr Asn Ile Ala Leu Arg Trp Thr Ala Lys Gln Lys
1175 1180 1185
Leu Tyr Ser Arg Thr Gly Glu Ser Val Glu Phe Val Cys Lys Arg
1190 1195 1200
Gly Tyr Arg Leu Ser Ser Arg Ser His Thr Leu Arg Thr Thr Cys
1205 1210 1215
Trp Asp Gly Lys Leu Glu Tyr Pro Thr Cys Ala Lys Arg
1220 1225 1230
<210> 10
<211> 1234
<212> БЕЛОК
<213> Mus musculus
<400> 10
Met Arg Leu Ser Ala Arg Ile Ile Trp Leu Ile Leu Trp Thr Val Cys
1 5 10 15
Ala Ala Glu Asp Cys Lys Gly Pro Pro Pro Arg Glu Asn Ser Glu Ile
20 25 30
Leu Ser Gly Ser Trp Ser Glu Gln Leu Tyr Pro Glu Gly Thr Gln Ala
35 40 45
Thr Tyr Lys Cys Arg Pro Gly Tyr Arg Thr Leu Gly Thr Ile Val Lys
50 55 60
Val Cys Lys Asn Gly Lys Trp Val Ala Ser Asn Pro Ser Arg Ile Cys
65 70 75 80
Arg Lys Lys Pro Cys Gly His Pro Gly Asp Thr Pro Phe Gly Ser Phe
85 90 95
Arg Leu Ala Val Gly Ser Gln Phe Glu Phe Gly Ala Lys Val Val Tyr
100 105 110
Thr Cys Asp Asp Gly Tyr Gln Leu Leu Gly Glu Ile Asp Tyr Arg Glu
115 120 125
Cys Gly Ala Asp Gly Trp Ile Asn Asp Ile Pro Leu Cys Glu Val Val
130 135 140
Lys Cys Leu Pro Val Thr Glu Leu Glu Asn Gly Arg Ile Val Ser Gly
145 150 155 160
Ala Ala Glu Thr Asp Gln Glu Tyr Tyr Phe Gly Gln Val Val Arg Phe
165 170 175
Glu Cys Asn Ser Gly Phe Lys Ile Glu Gly His Lys Glu Ile His Cys
180 185 190
Ser Glu Asn Gly Leu Trp Ser Asn Glu Lys Pro Arg Cys Val Glu Ile
195 200 205
Leu Cys Thr Pro Pro Arg Val Glu Asn Gly Asp Gly Ile Asn Val Lys
210 215 220
Pro Val Tyr Lys Glu Asn Glu Arg Tyr His Tyr Lys Cys Lys His Gly
225 230 235 240
Tyr Val Pro Lys Glu Arg Gly Asp Ala Val Cys Thr Gly Ser Gly Trp
245 250 255
Ser Ser Gln Pro Phe Cys Glu Glu Lys Arg Cys Ser Pro Pro Tyr Ile
260 265 270
Leu Asn Gly Ile Tyr Thr Pro His Arg Ile Ile His Arg Ser Asp Asp
275 280 285
Glu Ile Arg Tyr Glu Cys Asn Tyr Gly Phe Tyr Pro Val Thr Gly Ser
290 295 300
Thr Val Ser Lys Cys Thr Pro Thr Gly Trp Ile Pro Val Pro Arg Cys
305 310 315 320
Thr Leu Lys Pro Cys Glu Phe Pro Gln Phe Lys Tyr Gly Arg Leu Tyr
325 330 335
Tyr Glu Glu Ser Leu Arg Pro Asn Phe Pro Val Ser Ile Gly Asn Lys
340 345 350
Tyr Ser Tyr Lys Cys Asp Asn Gly Phe Ser Pro Pro Ser Gly Tyr Ser
355 360 365
Trp Asp Tyr Leu Arg Cys Thr Ala Gln Gly Trp Glu Pro Glu Val Pro
370 375 380
Cys Val Arg Lys Cys Val Phe His Tyr Val Glu Asn Gly Asp Ser Ala
385 390 395 400
Tyr Trp Glu Lys Val Tyr Val Gln Gly Gln Ser Leu Lys Val Gln Cys
405 410 415
Tyr Asn Gly Tyr Ser Leu Gln Asn Gly Gln Asp Thr Met Thr Cys Thr
420 425 430
Glu Asn Gly Trp Ser Pro Pro Pro Lys Cys Ile Arg Ile Lys Thr Cys
435 440 445
Ser Ala Ser Asp Ile His Ile Asp Asn Gly Phe Leu Ser Glu Ser Ser
450 455 460
Ser Ile Tyr Ala Leu Asn Arg Glu Thr Ser Tyr Arg Cys Lys Gln Gly
465 470 475 480
Tyr Val Thr Asn Thr Gly Glu Ile Ser Gly Ser Ile Thr Cys Leu Gln
485 490 495
Asn Gly Trp Ser Pro Gln Pro Ser Cys Ile Lys Ser Cys Asp Met Pro
500 505 510
Val Phe Glu Asn Ser Ile Thr Lys Asn Thr Arg Thr Trp Phe Lys Leu
515 520 525
Asn Asp Lys Leu Asp Tyr Glu Cys Leu Val Gly Phe Glu Asn Glu Tyr
530 535 540
Lys His Thr Lys Gly Ser Ile Thr Cys Thr Tyr Tyr Gly Trp Ser Asp
545 550 555 560
Thr Pro Ser Cys Tyr Glu Arg Glu Cys Ser Val Pro Thr Leu Asp Arg
565 570 575
Lys Leu Val Val Ser Pro Arg Lys Glu Lys Tyr Arg Val Gly Asp Leu
580 585 590
Leu Glu Phe Ser Cys His Ser Gly His Arg Val Gly Pro Asp Ser Val
595 600 605
Gln Cys Tyr His Phe Gly Trp Ser Pro Gly Phe Pro Thr Cys Lys Gly
610 615 620
Gln Val Ala Ser Cys Ala Pro Pro Leu Glu Ile Leu Asn Gly Glu Ile
625 630 635 640
Asn Gly Ala Lys Lys Val Glu Tyr Ser His Gly Glu Val Val Lys Tyr
645 650 655
Asp Cys Lys Pro Arg Phe Leu Leu Lys Gly Pro Asn Lys Ile Gln Cys
660 665 670
Val Asp Gly Asn Trp Thr Thr Leu Pro Val Cys Ile Glu Glu Glu Arg
675 680 685
Thr Cys Gly Asp Ile Pro Glu Leu Glu His Gly Ser Ala Lys Cys Ser
690 695 700
Val Pro Pro Tyr His His Gly Asp Ser Val Glu Phe Ile Cys Glu Glu
705 710 715 720
Asn Phe Thr Met Ile Gly His Gly Ser Val Ser Cys Ile Ser Gly Lys
725 730 735
Trp Thr Gln Leu Pro Lys Cys Val Ala Thr Asp Gln Leu Glu Lys Cys
740 745 750
Arg Val Leu Lys Ser Thr Gly Ile Glu Ala Ile Lys Pro Lys Leu Thr
755 760 765
Glu Phe Thr His Asn Ser Thr Met Asp Tyr Lys Cys Arg Asp Lys Gln
770 775 780
Glu Tyr Glu Arg Ser Ile Cys Ile Asn Gly Lys Trp Asp Pro Glu Pro
785 790 795 800
Asn Cys Thr Ser Lys Thr Ser Cys Pro Pro Pro Pro Gln Ile Pro Asn
805 810 815
Thr Gln Val Ile Glu Thr Thr Val Lys Tyr Leu Asp Gly Glu Lys Leu
820 825 830
Ser Val Leu Cys Gln Asp Asn Tyr Leu Thr Gln Asp Ser Glu Glu Met
835 840 845
Val Cys Lys Asp Gly Arg Trp Gln Ser Leu Pro Arg Cys Ile Glu Lys
850 855 860
Ile Pro Cys Ser Gln Pro Pro Thr Ile Glu His Gly Ser Ile Asn Leu
865 870 875 880
Pro Arg Ser Ser Glu Glu Arg Arg Asp Ser Ile Glu Ser Ser Ser His
885 890 895
Glu His Gly Thr Thr Phe Ser Tyr Val Cys Asp Asp Gly Phe Arg Ile
900 905 910
Pro Glu Glu Asn Arg Ile Thr Cys Tyr Met Gly Lys Trp Ser Thr Pro
915 920 925
Pro Arg Cys Val Gly Leu Pro Cys Gly Pro Pro Pro Ser Ile Pro Leu
930 935 940
Gly Thr Val Ser Leu Glu Leu Glu Ser Tyr Gln His Gly Glu Glu Val
945 950 955 960
Thr Tyr His Cys Ser Thr Gly Phe Gly Ile Asp Gly Pro Ala Phe Ile
965 970 975
Ile Cys Glu Gly Gly Lys Trp Ser Asp Pro Pro Lys Cys Ile Lys Thr
980 985 990
Asp Cys Asp Val Leu Pro Thr Val Lys Asn Ala Ile Ile Arg Gly Lys
995 1000 1005
Ser Lys Lys Ser Tyr Arg Thr Gly Glu Gln Val Thr Phe Arg Cys
1010 1015 1020
Gln Ser Pro Tyr Gln Met Asn Gly Ser Asp Thr Val Thr Cys Val
1025 1030 1035
Asn Ser Arg Trp Ile Gly Gln Pro Val Cys Lys Asp Asn Ser Cys
1040 1045 1050
Val Asp Pro Pro His Val Pro Asn Ala Thr Ile Val Thr Arg Thr
1055 1060 1065
Lys Asn Lys Tyr Leu His Gly Asp Arg Val Arg Tyr Glu Cys Asn
1070 1075 1080
Lys Pro Leu Glu Leu Phe Gly Gln Val Glu Val Met Cys Glu Asn
1085 1090 1095
Gly Ile Trp Thr Glu Lys Pro Lys Cys Arg Asp Ser Thr Gly Lys
1100 1105 1110
Cys Gly Pro Pro Pro Pro Ile Asp Asn Gly Asp Ile Thr Ser Leu
1115 1120 1125
Ser Leu Pro Val Tyr Glu Pro Leu Ser Ser Val Glu Tyr Gln Cys
1130 1135 1140
Gln Lys Tyr Tyr Leu Leu Lys Gly Lys Lys Thr Ile Thr Cys Arg
1145 1150 1155
Asn Gly Lys Trp Ser Glu Pro Pro Thr Cys Leu His Ala Cys Val
1160 1165 1170
Ile Pro Glu Asn Ile Met Glu Ser His Asn Ile Ile Leu Lys Trp
1175 1180 1185
Arg His Thr Glu Lys Ile Tyr Ser His Ser Gly Glu Asp Ile Glu
1190 1195 1200
Phe Gly Cys Lys Tyr Gly Tyr Tyr Lys Ala Arg Asp Ser Pro Pro
1205 1210 1215
Phe Arg Thr Lys Cys Ile Asn Gly Thr Ile Asn Tyr Pro Thr Cys
1220 1225 1230
Val
<210> 11
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 11
Gly Tyr Thr Phe Thr Asp Tyr Tyr
1 5
<210> 12
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 12
Ile Asn Pro Asn Asn Gly Gly Thr
1 5
<210> 13
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 13
Ala Arg Tyr Asp Tyr Ala Trp Tyr Phe Asp Val
1 5 10
<210> 14
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 14
Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
1 5 10
<210> 15
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 15
Lys Val Ser
1
<210> 16
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 16
Phe Gln Gly Ser His Val Pro Tyr Thr
1 5
<210> 17
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 17
Gly Tyr Thr Phe Thr Ser Tyr Trp
1 5
<210> 18
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 18
Ile Asn Pro Ser Asn Gly Gly Thr
1 5
<210> 19
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 19
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr
1 5 10
<210> 20
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 20
Gln Asp Val Gly Thr Ala
1 5
<210> 21
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 21
Trp Ala Ser
1
<210> 22
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 22
Gln Gln Tyr Ser Ser Tyr Pro Leu Thr
1 5
<210> 23
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 23
Gly Tyr Thr Phe Thr Ala Tyr Tyr
1 5
<210> 24
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 24
Ile Asn Pro Tyr Asn Gly Gly Thr
1 5
<210> 25
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 25
Ser Ser Pro Tyr
1
<210> 26
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 26
Gln Ser Leu Leu Asp Ser Asp Gly Lys Thr Tyr
1 5 10
<210> 27
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 27
Leu Val Ser
1
<210> 28
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 28
Trp Gln Gly Thr His Phe Pro Arg Thr
1 5
<210> 29
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 29
Gly Tyr Thr Phe Thr Asn Tyr Tyr
1 5
<210> 30
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 30
Ile Asn Pro Tyr Asn Gly Gly Thr
1 5
<210> 31
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 31
Ser Ser Pro Tyr
1
<210> 32
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 32
Gln Ser Leu Leu Asp Ser Asp Gly Lys Thr Tyr
1 5 10
<210> 33
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 33
Leu Val Ser
1
<210> 34
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 34
Trp Gln Gly Thr His Phe Pro Arg Thr
1 5
<210> 35
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 35
Gly Tyr Thr Phe Thr Asp Tyr Tyr
1 5
<210> 36
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 36
Ile Asn Pro Tyr Asn Gly Gly Thr
1 5
<210> 37
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 37
Ser Arg Gly Gly Pro Tyr
1 5
<210> 38
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 38
Gln Ser Leu Leu Asp Ser Asp Gly Lys Thr Tyr
1 5 10
<210> 39
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 39
Leu Val Ser
1
<210> 40
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 40
Trp Gln Gly Thr His Phe Pro Arg Thr
1 5
<210> 41
<211> 646
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 41
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
1 5 10 15
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
20 25 30
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
35 40 45
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
50 55 60
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
65 70 75 80
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
85 90 95
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
100 105 110
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
115 120 125
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
130 135 140
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
145 150 155 160
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
165 170 175
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
180 185 190
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
195 200 205
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
210 215 220
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
225 230 235 240
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
245 250 255
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
260 265 270
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
275 280 285
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
290 295 300
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
305 310 315 320
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
325 330 335
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
340 345 350
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
355 360 365
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
370 375 380
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
385 390 395 400
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
405 410 415
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
420 425 430
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
435 440 445
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
450 455 460
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
465 470 475 480
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
485 490 495
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
500 505 510
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
515 520 525
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
530 535 540
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
545 550 555 560
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
565 570 575
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
580 585 590
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
595 600 605
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
610 615 620
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
625 630 635 640
Cys Ile Ile Pro Asn Lys
645
<210> 42
<211> 1096
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 42
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
1 5 10 15
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
20 25 30
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
35 40 45
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
50 55 60
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
65 70 75 80
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
85 90 95
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
100 105 110
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
115 120 125
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
130 135 140
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
145 150 155 160
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
165 170 175
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
180 185 190
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
195 200 205
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
210 215 220
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
225 230 235 240
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
245 250 255
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
260 265 270
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
275 280 285
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
290 295 300
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
305 310 315 320
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
325 330 335
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
340 345 350
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
355 360 365
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
370 375 380
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
385 390 395 400
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
405 410 415
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
420 425 430
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
435 440 445
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
450 455 460
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
465 470 475 480
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
485 490 495
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
500 505 510
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
515 520 525
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
530 535 540
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
545 550 555 560
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
565 570 575
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
580 585 590
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
595 600 605
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
610 615 620
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
625 630 635 640
Cys Ile Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile
645 650 655
Leu Val Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu
660 665 670
Phe Arg Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys
675 680 685
Cys Gln Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg
690 695 700
Val Cys Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg
705 710 715 720
Asp Lys Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu
725 730 735
Pro Gly Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln
740 745 750
Gly Asp Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp
755 760 765
Asp Phe Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn
770 775 780
Leu Gln Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln
785 790 795 800
Leu Lys Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser
805 810 815
Leu Trp Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser
820 825 830
Pro Pro Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val
835 840 845
Phe Pro Phe Gly Lys Ala Val Asn Tyr Thr Cys Asp Pro His Pro Asp
850 855 860
Arg Gly Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr
865 870 875 880
Ser Asp Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys
885 890 895
Gly Ile Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys
900 905 910
Leu Lys Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu
915 920 925
Lys Tyr Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr
930 935 940
Cys Leu Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg
945 950 955 960
Lys Ser Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val
965 970 975
Ile Thr Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr
980 985 990
Gly His Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly
995 1000 1005
Asn Thr Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile
1010 1015 1020
Pro Cys Gly Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser
1025 1030 1035
Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg
1040 1045 1050
Cys Asn Leu Gly Ser Arg Gly Arg Lys Val Phe Glu Leu Val Gly
1055 1060 1065
Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile
1070 1075 1080
Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys
1085 1090 1095
<210> 43
<211> 897
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 43
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser His Lys Phe
130 135 140
Met Ser Thr Ser Val Gly Asp Arg Val Ser Ile Thr Cys Lys Ala Ser
145 150 155 160
Gln Asp Val Gly Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln
165 170 175
Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg His Thr Gly Val
180 185 190
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
195 200 205
Ile Ser Asn Val Gln Ser Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln
210 215 220
Tyr Ser Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu
225 230 235 240
Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Cys Asn Ala Pro
245 250 255
Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu Thr Asp Glu Phe Glu
260 265 270
Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys Arg Pro Gly Tyr Ser
275 280 285
Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn Ser Val Trp Thr Gly
290 295 300
Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg Asn Pro Pro Asp Pro
305 310 315 320
Val Asn Gly Met Val His Val Ile Lys Gly Ile Gln Phe Gly Ser Gln
325 330 335
Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu Ile Gly Ser Ser Ser
340 345 350
Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile Trp Asp Asn Glu Thr
355 360 365
Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Thr Asn
370 375 380
Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val
385 390 395 400
Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe Glu
405 410 415
Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val
420 425 430
Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys Cys
435 440 445
Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val Ser Asp Asn Arg Ser
450 455 460
Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg Cys Gln Pro Gly Phe
465 470 475 480
Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln Ala Leu Asn Lys Trp
485 490 495
Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys Gln Pro Pro Pro Asp
500 505 510
Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys Asp Asn Phe Ser Pro
515 520 525
Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp Leu Arg Gly
530 535 540
Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp Trp Ser Pro Ala Ala
545 550 555 560
Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe Met Gly Gln Leu Leu
565 570 575
Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln Leu Gly Ala Lys Val
580 585 590
Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser Ser Ala Ser
595 600 605
Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp Asn Ser Ser Val Pro
610 615 620
Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro Val Ile Pro Asn Gly
625 630 635 640
Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro Phe Gly Lys Thr Val
645 650 655
Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly Thr Ser Phe Asp Leu
660 665 670
Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp Pro Gln Gly Asn Gly
675 680 685
Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile Leu Gly His Cys Gln
690 695 700
Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys Thr Gln Thr Asn Ala
705 710 715 720
Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr Glu Cys Arg Pro Glu
725 730 735
Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu Asp Asn Leu Val Trp
740 745 750
Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser Cys Lys Thr Pro Pro
755 760 765
Asp Pro Val Asn Gly Met Val His Val Ile Thr Asp Ile Gln Val Gly
770 775 780
Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His Arg Leu Ile Gly His
785 790 795 800
Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala Ala His Trp Ser Thr
805 810 815
Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile
820 825 830
Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly
835 840 845
Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val
850 855 860
Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp
865 870 875 880
Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn
885 890 895
Lys
<210> 44
<211> 570
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 44
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser His Lys Phe
130 135 140
Met Ser Thr Ser Val Gly Asp Arg Val Ser Ile Thr Cys Lys Ala Ser
145 150 155 160
Gln Asp Val Gly Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln
165 170 175
Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg His Thr Gly Val
180 185 190
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
195 200 205
Ile Ser Asn Val Gln Ser Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln
210 215 220
Tyr Ser Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu
225 230 235 240
Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Cys Pro Ala Pro Ser
245 250 255
Gln Leu Pro Ser Ala Lys Pro Ile Asn Leu Thr Asp Glu Ser Met Phe
260 265 270
Pro Ile Gly Thr Tyr Leu Leu Tyr Glu Cys Leu Pro Gly Tyr Ile Lys
275 280 285
Arg Gln Phe Ser Ile Thr Cys Lys Gln Asp Ser Thr Trp Thr Ser Ala
290 295 300
Glu Asp Lys Cys Ile Arg Lys Gln Cys Lys Thr Pro Ser Asp Pro Glu
305 310 315 320
Asn Gly Leu Val His Val His Thr Gly Ile Gln Phe Gly Ser Arg Ile
325 330 335
Asn Tyr Thr Cys Asn Gln Gly Tyr Arg Leu Ile Gly Ser Ser Ser Ala
340 345 350
Val Cys Val Ile Thr Asp Gln Ser Val Asp Trp Asp Thr Glu Ala Pro
355 360 365
Ile Cys Glu Trp Ile Pro Cys Glu Ile Pro Pro Gly Ile Pro Asn Gly
370 375 380
Asp Phe Phe Ser Ser Thr Arg Glu Asp Phe His Tyr Gly Met Val Val
385 390 395 400
Thr Tyr Arg Cys Asn Thr Asp Ala Arg Gly Lys Ala Leu Phe Asn Leu
405 410 415
Val Gly Glu Pro Ser Leu Tyr Cys Thr Ser Asn Asp Gly Glu Ile Gly
420 425 430
Val Trp Ser Gly Pro Pro Pro Gln Cys Ile Glu Leu Asn Lys Cys Thr
435 440 445
Pro Pro Pro Tyr Val Glu Asn Ala Val Met Leu Ser Glu Asn Arg Ser
450 455 460
Leu Phe Ser Leu Arg Asp Ile Val Glu Phe Arg Cys His Pro Gly Phe
465 470 475 480
Ile Met Lys Gly Ala Ser Ser Val His Cys Gln Ser Leu Asn Lys Trp
485 490 495
Glu Pro Glu Leu Pro Ser Cys Phe Lys Gly Val Ile Cys Arg Leu Pro
500 505 510
Gln Glu Met Ser Gly Phe Gln Lys Gly Leu Gly Met Lys Lys Glu Tyr
515 520 525
Tyr Tyr Gly Glu Asn Val Thr Leu Glu Cys Glu Asp Gly Tyr Thr Leu
530 535 540
Glu Gly Ser Ser Gln Ser Gln Cys Gln Ser Asp Gly Ser Trp Asn Pro
545 550 555 560
Leu Leu Ala Lys Cys Val Ser Arg Ser Ile
565 570
<210> 45
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 45
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Val Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Ala Asp Ala Ala
100 105 110
Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln Leu Thr Ser Gly
115 120 125
Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr Pro Lys Asp Ile
130 135 140
Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln Asn Gly Val Leu
145 150 155 160
Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr Tyr Ser Met Ser
165 170 175
Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg His Asn Ser Tyr
180 185 190
Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro Ile Val Lys Ser
195 200 205
Phe Asn Arg Asn Glu Cys
210
<210> 46
<211> 551
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 46
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Gly Gly
210 215 220
Gly Gly Ser Gly Gly Gly Gly Ser Cys Pro Ala Pro Ser Gln Leu Pro
225 230 235 240
Ser Ala Lys Pro Ile Asn Leu Thr Asp Glu Ser Met Phe Pro Ile Gly
245 250 255
Thr Tyr Leu Leu Tyr Glu Cys Leu Pro Gly Tyr Ile Lys Arg Gln Phe
260 265 270
Ser Ile Thr Cys Lys Gln Asp Ser Thr Trp Thr Ser Ala Glu Asp Lys
275 280 285
Cys Ile Arg Lys Gln Cys Lys Thr Pro Ser Asp Pro Glu Asn Gly Leu
290 295 300
Val His Val His Thr Gly Ile Gln Phe Gly Ser Arg Ile Asn Tyr Thr
305 310 315 320
Cys Asn Gln Gly Tyr Arg Leu Ile Gly Ser Ser Ser Ala Val Cys Val
325 330 335
Ile Thr Asp Gln Ser Val Asp Trp Asp Thr Glu Ala Pro Ile Cys Glu
340 345 350
Trp Ile Pro Cys Glu Ile Pro Pro Gly Ile Pro Asn Gly Asp Phe Phe
355 360 365
Ser Ser Thr Arg Glu Asp Phe His Tyr Gly Met Val Val Thr Tyr Arg
370 375 380
Cys Asn Thr Asp Ala Arg Gly Lys Ala Leu Phe Asn Leu Val Gly Glu
385 390 395 400
Pro Ser Leu Tyr Cys Thr Ser Asn Asp Gly Glu Ile Gly Val Trp Ser
405 410 415
Gly Pro Pro Pro Gln Cys Ile Glu Leu Asn Lys Cys Thr Pro Pro Pro
420 425 430
Tyr Val Glu Asn Ala Val Met Leu Ser Glu Asn Arg Ser Leu Phe Ser
435 440 445
Leu Arg Asp Ile Val Glu Phe Arg Cys His Pro Gly Phe Ile Met Lys
450 455 460
Gly Ala Ser Ser Val His Cys Gln Ser Leu Asn Lys Trp Glu Pro Glu
465 470 475 480
Leu Pro Ser Cys Phe Lys Gly Val Ile Cys Arg Leu Pro Gln Glu Met
485 490 495
Ser Gly Phe Gln Lys Gly Leu Gly Met Lys Lys Glu Tyr Tyr Tyr Gly
500 505 510
Glu Asn Val Thr Leu Glu Cys Glu Asp Gly Tyr Thr Leu Glu Gly Ser
515 520 525
Ser Gln Ser Gln Cys Gln Ser Asp Gly Ser Trp Asn Pro Leu Leu Ala
530 535 540
Lys Cys Val Ser Arg Ser Ile
545 550
<210> 47
<211> 878
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 47
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Gly Gly
210 215 220
Gly Gly Ser Gly Gly Gly Gly Ser Gln Cys Asn Ala Pro Glu Trp Leu
225 230 235 240
Pro Phe Ala Arg Pro Thr Asn Leu Thr Asp Glu Phe Glu Phe Pro Ile
245 250 255
Gly Thr Tyr Leu Asn Tyr Glu Cys Arg Pro Gly Tyr Ser Gly Arg Pro
260 265 270
Phe Ser Ile Ile Cys Leu Lys Asn Ser Val Trp Thr Gly Ala Lys Asp
275 280 285
Arg Cys Arg Arg Lys Ser Cys Arg Asn Pro Pro Asp Pro Val Asn Gly
290 295 300
Met Val His Val Ile Lys Gly Ile Gln Phe Gly Ser Gln Ile Lys Tyr
305 310 315 320
Ser Cys Thr Lys Gly Tyr Arg Leu Ile Gly Ser Ser Ser Ala Thr Cys
325 330 335
Ile Ile Ser Gly Asp Thr Val Ile Trp Asp Asn Glu Thr Pro Ile Cys
340 345 350
Asp Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Thr Asn Gly Asp Phe
355 360 365
Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr Tyr
370 375 380
Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe Glu Leu Val Gly
385 390 395 400
Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile Trp
405 410 415
Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys Cys Thr Pro Pro
420 425 430
Asn Val Glu Asn Gly Ile Leu Val Ser Asp Asn Arg Ser Leu Phe Ser
435 440 445
Leu Asn Glu Val Val Glu Phe Arg Cys Gln Pro Gly Phe Val Met Lys
450 455 460
Gly Pro Arg Arg Val Lys Cys Gln Ala Leu Asn Lys Trp Glu Pro Glu
465 470 475 480
Leu Pro Ser Cys Ser Arg Val Cys Gln Pro Pro Pro Asp Val Leu His
485 490 495
Ala Glu Arg Thr Gln Arg Asp Lys Asp Asn Phe Ser Pro Gly Gln Glu
500 505 510
Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp Leu Arg Gly Ala Ala Ser
515 520 525
Met Arg Cys Thr Pro Gln Gly Asp Trp Ser Pro Ala Ala Pro Thr Cys
530 535 540
Glu Val Lys Ser Cys Asp Asp Phe Met Gly Gln Leu Leu Asn Gly Arg
545 550 555 560
Val Leu Phe Pro Val Asn Leu Gln Leu Gly Ala Lys Val Asp Phe Val
565 570 575
Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser Ser Ala Ser Tyr Cys Val
580 585 590
Leu Ala Gly Met Glu Ser Leu Trp Asn Ser Ser Val Pro Val Cys Glu
595 600 605
Gln Ile Phe Cys Pro Ser Pro Pro Val Ile Pro Asn Gly Arg His Thr
610 615 620
Gly Lys Pro Leu Glu Val Phe Pro Phe Gly Lys Thr Val Asn Tyr Thr
625 630 635 640
Cys Asp Pro His Pro Asp Arg Gly Thr Ser Phe Asp Leu Ile Gly Glu
645 650 655
Ser Thr Ile Arg Cys Thr Ser Asp Pro Gln Gly Asn Gly Val Trp Ser
660 665 670
Ser Pro Ala Pro Arg Cys Gly Ile Leu Gly His Cys Gln Ala Pro Asp
675 680 685
His Phe Leu Phe Ala Lys Leu Lys Thr Gln Thr Asn Ala Ser Asp Phe
690 695 700
Pro Ile Gly Thr Ser Leu Lys Tyr Glu Cys Arg Pro Glu Tyr Tyr Gly
705 710 715 720
Arg Pro Phe Ser Ile Thr Cys Leu Asp Asn Leu Val Trp Ser Ser Pro
725 730 735
Lys Asp Val Cys Lys Arg Lys Ser Cys Lys Thr Pro Pro Asp Pro Val
740 745 750
Asn Gly Met Val His Val Ile Thr Asp Ile Gln Val Gly Ser Arg Ile
755 760 765
Asn Tyr Ser Cys Thr Thr Gly His Arg Leu Ile Gly His Ser Ser Ala
770 775 780
Glu Cys Ile Leu Ser Gly Asn Ala Ala His Trp Ser Thr Lys Pro Pro
785 790 795 800
Ile Cys Gln Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Ala Asn Gly
805 810 815
Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val
820 825 830
Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe Glu Leu
835 840 845
Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly
850 855 860
Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys
865 870 875
<210> 48
<211> 1328
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 48
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Gly Gly
210 215 220
Gly Gly Ser Gly Gly Gly Gly Ser Gln Cys Asn Ala Pro Glu Trp Leu
225 230 235 240
Pro Phe Ala Arg Pro Thr Asn Leu Thr Asp Glu Phe Glu Phe Pro Ile
245 250 255
Gly Thr Tyr Leu Asn Tyr Glu Cys Arg Pro Gly Tyr Ser Gly Arg Pro
260 265 270
Phe Ser Ile Ile Cys Leu Lys Asn Ser Val Trp Thr Gly Ala Lys Asp
275 280 285
Arg Cys Arg Arg Lys Ser Cys Arg Asn Pro Pro Asp Pro Val Asn Gly
290 295 300
Met Val His Val Ile Lys Gly Ile Gln Phe Gly Ser Gln Ile Lys Tyr
305 310 315 320
Ser Cys Thr Lys Gly Tyr Arg Leu Ile Gly Ser Ser Ser Ala Thr Cys
325 330 335
Ile Ile Ser Gly Asp Thr Val Ile Trp Asp Asn Glu Thr Pro Ile Cys
340 345 350
Asp Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Thr Asn Gly Asp Phe
355 360 365
Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr Tyr
370 375 380
Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe Glu Leu Val Gly
385 390 395 400
Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile Trp
405 410 415
Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys Cys Thr Pro Pro
420 425 430
Asn Val Glu Asn Gly Ile Leu Val Ser Asp Asn Arg Ser Leu Phe Ser
435 440 445
Leu Asn Glu Val Val Glu Phe Arg Cys Gln Pro Gly Phe Val Met Lys
450 455 460
Gly Pro Arg Arg Val Lys Cys Gln Ala Leu Asn Lys Trp Glu Pro Glu
465 470 475 480
Leu Pro Ser Cys Ser Arg Val Cys Gln Pro Pro Pro Asp Val Leu His
485 490 495
Ala Glu Arg Thr Gln Arg Asp Lys Asp Asn Phe Ser Pro Gly Gln Glu
500 505 510
Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp Leu Arg Gly Ala Ala Ser
515 520 525
Met Arg Cys Thr Pro Gln Gly Asp Trp Ser Pro Ala Ala Pro Thr Cys
530 535 540
Glu Val Lys Ser Cys Asp Asp Phe Met Gly Gln Leu Leu Asn Gly Arg
545 550 555 560
Val Leu Phe Pro Val Asn Leu Gln Leu Gly Ala Lys Val Asp Phe Val
565 570 575
Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser Ser Ala Ser Tyr Cys Val
580 585 590
Leu Ala Gly Met Glu Ser Leu Trp Asn Ser Ser Val Pro Val Cys Glu
595 600 605
Gln Ile Phe Cys Pro Ser Pro Pro Val Ile Pro Asn Gly Arg His Thr
610 615 620
Gly Lys Pro Leu Glu Val Phe Pro Phe Gly Lys Thr Val Asn Tyr Thr
625 630 635 640
Cys Asp Pro His Pro Asp Arg Gly Thr Ser Phe Asp Leu Ile Gly Glu
645 650 655
Ser Thr Ile Arg Cys Thr Ser Asp Pro Gln Gly Asn Gly Val Trp Ser
660 665 670
Ser Pro Ala Pro Arg Cys Gly Ile Leu Gly His Cys Gln Ala Pro Asp
675 680 685
His Phe Leu Phe Ala Lys Leu Lys Thr Gln Thr Asn Ala Ser Asp Phe
690 695 700
Pro Ile Gly Thr Ser Leu Lys Tyr Glu Cys Arg Pro Glu Tyr Tyr Gly
705 710 715 720
Arg Pro Phe Ser Ile Thr Cys Leu Asp Asn Leu Val Trp Ser Ser Pro
725 730 735
Lys Asp Val Cys Lys Arg Lys Ser Cys Lys Thr Pro Pro Asp Pro Val
740 745 750
Asn Gly Met Val His Val Ile Thr Asp Ile Gln Val Gly Ser Arg Ile
755 760 765
Asn Tyr Ser Cys Thr Thr Gly His Arg Leu Ile Gly His Ser Ser Ala
770 775 780
Glu Cys Ile Leu Ser Gly Asn Ala Ala His Trp Ser Thr Lys Pro Pro
785 790 795 800
Ile Cys Gln Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Ala Asn Gly
805 810 815
Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val
820 825 830
Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe Glu Leu
835 840 845
Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly
850 855 860
Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys Cys Thr
865 870 875 880
Pro Pro Asn Val Glu Asn Gly Ile Leu Val Ser Asp Asn Arg Ser Leu
885 890 895
Phe Ser Leu Asn Glu Val Val Glu Phe Arg Cys Gln Pro Gly Phe Val
900 905 910
Met Lys Gly Pro Arg Arg Val Lys Cys Gln Ala Leu Asn Lys Trp Glu
915 920 925
Pro Glu Leu Pro Ser Cys Ser Arg Val Cys Gln Pro Pro Pro Asp Val
930 935 940
Leu His Ala Glu Arg Thr Gln Arg Asp Lys Asp Asn Phe Ser Pro Gly
945 950 955 960
Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp Leu Arg Gly Ala
965 970 975
Ala Ser Met Arg Cys Thr Pro Gln Gly Asp Trp Ser Pro Ala Ala Pro
980 985 990
Thr Cys Glu Val Lys Ser Cys Asp Asp Phe Met Gly Gln Leu Leu Asn
995 1000 1005
Gly Arg Val Leu Phe Pro Val Asn Leu Gln Leu Gly Ala Lys Val
1010 1015 1020
Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser Ser Ala
1025 1030 1035
Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp Asn Ser Ser
1040 1045 1050
Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro Val Ile
1055 1060 1065
Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro Phe
1070 1075 1080
Gly Lys Ala Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
1085 1090 1095
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser
1100 1105 1110
Asp Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys
1115 1120 1125
Gly Ile Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala
1130 1135 1140
Lys Leu Lys Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr
1145 1150 1155
Ser Leu Lys Tyr Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe
1160 1165 1170
Ser Ile Thr Cys Leu Asp Asn Leu Val Trp Ser Ser Pro Lys Asp
1175 1180 1185
Val Cys Lys Arg Lys Ser Cys Lys Thr Pro Pro Asp Pro Val Asn
1190 1195 1200
Gly Met Val His Val Ile Thr Asp Ile Gln Val Gly Ser Arg Ile
1205 1210 1215
Asn Tyr Ser Cys Thr Thr Gly His Arg Leu Ile Gly His Ser Ser
1220 1225 1230
Ala Glu Cys Ile Leu Ser Gly Asn Thr Ala His Trp Ser Thr Lys
1235 1240 1245
Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile
1250 1255 1260
Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr
1265 1270 1275
Gly Ser Val Val Thr Tyr Arg Cys Asn Leu Gly Ser Arg Gly Arg
1280 1285 1290
Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
1295 1300 1305
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys
1310 1315 1320
Ile Ile Pro Asn Lys
1325
<210> 49
<211> 878
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 49
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
1 5 10 15
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
20 25 30
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
35 40 45
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
50 55 60
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
65 70 75 80
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
85 90 95
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
100 105 110
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
115 120 125
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
130 135 140
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
145 150 155 160
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
165 170 175
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
180 185 190
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
195 200 205
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
210 215 220
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
225 230 235 240
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
245 250 255
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
260 265 270
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
275 280 285
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
290 295 300
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
305 310 315 320
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
325 330 335
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
340 345 350
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
355 360 365
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
370 375 380
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
385 390 395 400
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
405 410 415
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
420 425 430
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
435 440 445
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
450 455 460
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
465 470 475 480
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
485 490 495
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
500 505 510
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
515 520 525
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
530 535 540
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
545 550 555 560
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
565 570 575
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
580 585 590
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
595 600 605
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
610 615 620
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
625 630 635 640
Cys Ile Ile Pro Asn Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
645 650 655
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
660 665 670
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
675 680 685
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
690 695 700
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
705 710 715 720
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
725 730 735
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
740 745 750
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
755 760 765
Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
770 775 780
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
785 790 795 800
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
805 810 815
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
820 825 830
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
835 840 845
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
850 855 860
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly
865 870 875
<210> 50
<211> 1328
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 50
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
1 5 10 15
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
20 25 30
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
35 40 45
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
50 55 60
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
65 70 75 80
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
85 90 95
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
100 105 110
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
115 120 125
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
130 135 140
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
145 150 155 160
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
165 170 175
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
180 185 190
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
195 200 205
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
210 215 220
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
225 230 235 240
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
245 250 255
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
260 265 270
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
275 280 285
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
290 295 300
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
305 310 315 320
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
325 330 335
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
340 345 350
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
355 360 365
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
370 375 380
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
385 390 395 400
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
405 410 415
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
420 425 430
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
435 440 445
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
450 455 460
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
465 470 475 480
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
485 490 495
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
500 505 510
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
515 520 525
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
530 535 540
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
545 550 555 560
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
565 570 575
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
580 585 590
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
595 600 605
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
610 615 620
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
625 630 635 640
Cys Ile Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile
645 650 655
Leu Val Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu
660 665 670
Phe Arg Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys
675 680 685
Cys Gln Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg
690 695 700
Val Cys Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg
705 710 715 720
Asp Lys Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu
725 730 735
Pro Gly Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln
740 745 750
Gly Asp Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp
755 760 765
Asp Phe Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn
770 775 780
Leu Gln Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln
785 790 795 800
Leu Lys Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser
805 810 815
Leu Trp Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser
820 825 830
Pro Pro Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val
835 840 845
Phe Pro Phe Gly Lys Ala Val Asn Tyr Thr Cys Asp Pro His Pro Asp
850 855 860
Arg Gly Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr
865 870 875 880
Ser Asp Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys
885 890 895
Gly Ile Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys
900 905 910
Leu Lys Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu
915 920 925
Lys Tyr Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr
930 935 940
Cys Leu Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg
945 950 955 960
Lys Ser Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val
965 970 975
Ile Thr Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr
980 985 990
Gly His Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly
995 1000 1005
Asn Thr Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile
1010 1015 1020
Pro Cys Gly Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser
1025 1030 1035
Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg
1040 1045 1050
Cys Asn Leu Gly Ser Arg Gly Arg Lys Val Phe Glu Leu Val Gly
1055 1060 1065
Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile
1070 1075 1080
Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys Gly Gly
1085 1090 1095
Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Gln Gln Pro
1100 1105 1110
Gly Thr Glu Leu Val Lys Pro Gly Ala Ser Val Lys Leu Ser Cys
1115 1120 1125
Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Trp Met His Trp Val
1130 1135 1140
Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile Gly Asn Ile Asn
1145 1150 1155
Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe Lys Ser Lys
1160 1165 1170
Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr Met Gln
1175 1180 1185
Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys Ala
1190 1195 1200
Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
1205 1210 1215
Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val
1220 1225 1230
Tyr Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val
1235 1240 1245
Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr
1250 1255 1260
Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe
1265 1270 1275
Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val
1280 1285 1290
Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr Cys Asn
1295 1300 1305
Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile Val
1310 1315 1320
Pro Arg Asp Cys Gly
1325
<210> 51
<211> 442
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 51
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr Glu Lys Ser Leu Ser His Ser Pro Gly
435 440
<210> 52
<211> 1098
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 52
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr Glu Lys Ser Leu Ser His Ser Pro Gly Gly Gly Gly Gly Ser Gly
435 440 445
Gly Gly Gly Ser Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg
450 455 460
Pro Thr Asn Leu Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu
465 470 475 480
Asn Tyr Glu Cys Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile
485 490 495
Cys Leu Lys Asn Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg
500 505 510
Lys Ser Cys Arg Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val
515 520 525
Ile Lys Gly Ile Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys
530 535 540
Gly Tyr Arg Leu Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly
545 550 555 560
Asp Thr Val Ile Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro
565 570 575
Cys Gly Leu Pro Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn
580 585 590
Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro
595 600 605
Gly Ser Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile
610 615 620
Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala
625 630 635 640
Pro Gln Cys Ile Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn
645 650 655
Gly Ile Leu Val Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val
660 665 670
Val Glu Phe Arg Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg
675 680 685
Val Lys Cys Gln Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys
690 695 700
Ser Arg Val Cys Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr
705 710 715 720
Gln Arg Asp Lys Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser
725 730 735
Cys Glu Pro Gly Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr
740 745 750
Pro Gln Gly Asp Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser
755 760 765
Cys Asp Asp Phe Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro
770 775 780
Val Asn Leu Gln Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly
785 790 795 800
Phe Gln Leu Lys Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met
805 810 815
Glu Ser Leu Trp Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys
820 825 830
Pro Ser Pro Pro Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu
835 840 845
Glu Val Phe Pro Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His
850 855 860
Pro Asp Arg Gly Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg
865 870 875 880
Cys Thr Ser Asp Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro
885 890 895
Arg Cys Gly Ile Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe
900 905 910
Ala Lys Leu Lys Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr
915 920 925
Ser Leu Lys Tyr Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser
930 935 940
Ile Thr Cys Leu Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys
945 950 955 960
Lys Arg Lys Ser Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val
965 970 975
His Val Ile Thr Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys
980 985 990
Thr Thr Gly His Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu
995 1000 1005
Ser Gly Asn Ala Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln
1010 1015 1020
Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe
1025 1030 1035
Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr
1040 1045 1050
Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe Glu Leu
1055 1060 1065
Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val
1070 1075 1080
Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys
1085 1090 1095
<210> 53
<211> 1098
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 53
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Ser Cys Ala Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Val Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr Glu Lys Ser Leu Ser His Ser Pro Gly Gly Gly Gly Gly Ser Gly
435 440 445
Gly Gly Gly Ser Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg
450 455 460
Pro Thr Asn Leu Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu
465 470 475 480
Asn Tyr Glu Cys Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile
485 490 495
Cys Leu Lys Asn Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg
500 505 510
Lys Ser Cys Arg Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val
515 520 525
Ile Lys Gly Ile Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys
530 535 540
Gly Tyr Arg Leu Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly
545 550 555 560
Asp Thr Val Ile Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro
565 570 575
Cys Gly Leu Pro Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn
580 585 590
Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro
595 600 605
Gly Ser Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile
610 615 620
Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala
625 630 635 640
Pro Gln Cys Ile Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn
645 650 655
Gly Ile Leu Val Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val
660 665 670
Val Glu Phe Arg Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg
675 680 685
Val Lys Cys Gln Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys
690 695 700
Ser Arg Val Cys Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr
705 710 715 720
Gln Arg Asp Lys Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser
725 730 735
Cys Glu Pro Gly Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr
740 745 750
Pro Gln Gly Asp Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser
755 760 765
Cys Asp Asp Phe Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro
770 775 780
Val Asn Leu Gln Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly
785 790 795 800
Phe Gln Leu Lys Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met
805 810 815
Glu Ser Leu Trp Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys
820 825 830
Pro Ser Pro Pro Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu
835 840 845
Glu Val Phe Pro Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His
850 855 860
Pro Asp Arg Gly Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg
865 870 875 880
Cys Thr Ser Asp Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro
885 890 895
Arg Cys Gly Ile Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe
900 905 910
Ala Lys Leu Lys Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr
915 920 925
Ser Leu Lys Tyr Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser
930 935 940
Ile Thr Cys Leu Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys
945 950 955 960
Lys Arg Lys Ser Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val
965 970 975
His Val Ile Thr Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys
980 985 990
Thr Thr Gly His Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu
995 1000 1005
Ser Gly Asn Ala Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln
1010 1015 1020
Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe
1025 1030 1035
Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr
1040 1045 1050
Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe Glu Leu
1055 1060 1065
Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val
1070 1075 1080
Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys
1085 1090 1095
<210> 54
<211> 442
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 54
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Trp Cys Met Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr Glu Lys Ser Leu Ser His Ser Pro Gly
435 440
<210> 55
<211> 877
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 55
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
1 5 10 15
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
20 25 30
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
35 40 45
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
50 55 60
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
65 70 75 80
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
85 90 95
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
100 105 110
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
115 120 125
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
130 135 140
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
145 150 155 160
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
165 170 175
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
180 185 190
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
195 200 205
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
210 215 220
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
225 230 235 240
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
245 250 255
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
260 265 270
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
275 280 285
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
290 295 300
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
305 310 315 320
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
325 330 335
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
340 345 350
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
355 360 365
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
370 375 380
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
385 390 395 400
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
405 410 415
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
420 425 430
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
435 440 445
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
450 455 460
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
465 470 475 480
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
485 490 495
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
500 505 510
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
515 520 525
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
530 535 540
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
545 550 555 560
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
565 570 575
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
580 585 590
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
595 600 605
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
610 615 620
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
625 630 635 640
Cys Ile Ile Pro Asn Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
645 650 655
Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe
660 665 670
Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro
675 680 685
Lys Val Thr Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val
690 695 700
Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr
705 710 715 720
Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu
725 730 735
Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys
740 745 750
Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser
755 760 765
Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro
770 775 780
Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser Leu Ser Cys Ala Ile
785 790 795 800
Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly
805 810 815
Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp
820 825 830
Gly Ser Tyr Phe Val Val Ser Lys Leu Asn Val Gln Lys Ser Asn Trp
835 840 845
Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His
850 855 860
Asn His His Thr Glu Lys Ser Leu Ser His Ser Pro Gly
865 870 875
<210> 56
<211> 1098
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 56
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
1 5 10 15
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
20 25 30
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
35 40 45
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
50 55 60
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
65 70 75 80
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
85 90 95
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
100 105 110
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
115 120 125
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
130 135 140
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
145 150 155 160
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
165 170 175
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
180 185 190
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
195 200 205
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
210 215 220
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
225 230 235 240
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
245 250 255
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
260 265 270
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
275 280 285
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
290 295 300
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
305 310 315 320
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
325 330 335
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
340 345 350
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
355 360 365
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
370 375 380
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
385 390 395 400
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
405 410 415
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
420 425 430
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
435 440 445
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
450 455 460
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
465 470 475 480
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
485 490 495
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
500 505 510
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
515 520 525
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
530 535 540
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
545 550 555 560
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
565 570 575
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
580 585 590
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
595 600 605
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
610 615 620
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
625 630 635 640
Cys Ile Ile Pro Asn Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
645 650 655
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
660 665 670
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
675 680 685
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
690 695 700
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
705 710 715 720
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
725 730 735
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
740 745 750
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
755 760 765
Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
770 775 780
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
785 790 795 800
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
805 810 815
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
820 825 830
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
835 840 845
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
850 855 860
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
865 870 875 880
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
885 890 895
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
900 905 910
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
915 920 925
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
930 935 940
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
945 950 955 960
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
965 970 975
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
980 985 990
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
995 1000 1005
Gln Met Ala Lys Asp Lys Val Ser Leu Ser Cys Ala Ile Thr Asp
1010 1015 1020
Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln
1025 1030 1035
Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp
1040 1045 1050
Gly Ser Tyr Phe Val Val Ser Lys Leu Asn Val Gln Lys Ser Asn
1055 1060 1065
Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly
1070 1075 1080
Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser Pro Gly
1085 1090 1095
<210> 57
<211> 870
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 57
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
1 5 10 15
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
20 25 30
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
35 40 45
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
50 55 60
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
65 70 75 80
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
85 90 95
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
100 105 110
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
115 120 125
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
130 135 140
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
145 150 155 160
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
165 170 175
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
180 185 190
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
195 200 205
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
210 215 220
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
225 230 235 240
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
245 250 255
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
260 265 270
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
275 280 285
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
290 295 300
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
305 310 315 320
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
325 330 335
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
340 345 350
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
355 360 365
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
370 375 380
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
385 390 395 400
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
405 410 415
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
420 425 430
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
435 440 445
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
450 455 460
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
465 470 475 480
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
485 490 495
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
500 505 510
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
515 520 525
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
530 535 540
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
545 550 555 560
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
565 570 575
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
580 585 590
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
595 600 605
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
610 615 620
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
625 630 635 640
Cys Ile Ile Pro Asn Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
645 650 655
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
660 665 670
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
675 680 685
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
690 695 700
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp Arg Phe Thr Gly
705 710 715 720
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Val Gln Ser
725 730 735
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Leu
740 745 750
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Ala Asp Ala Ala
755 760 765
Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln Leu Thr Ser Gly
770 775 780
Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr Pro Lys Asp Ile
785 790 795 800
Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln Asn Gly Val Leu
805 810 815
Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr Tyr Ser Met Ser
820 825 830
Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg His Asn Ser Tyr
835 840 845
Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro Ile Val Lys Ser
850 855 860
Phe Asn Arg Asn Glu Cys
865 870
<210> 58
<211> 216
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 58
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Gly Gly Pro Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser
100 105 110
Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser
115 120 125
Ala Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr
165 170 175
Leu Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr
180 185 190
Val Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys
195 200 205
Lys Ile Val Pro Arg Asp Cys Gly
210 215
<210> 59
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 59
Asp Val Val Met Thr Gln Thr Pro Leu Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Lys Leu Glu Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Glu Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu
115 120 125
Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe
130 135 140
Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg
145 150 155 160
Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu
180 185 190
Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser
195 200 205
Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
210 215
<210> 60
<211> 545
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 60
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Gly Gly Pro Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser
100 105 110
Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser
115 120 125
Ala Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr
165 170 175
Leu Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr
180 185 190
Val Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys
195 200 205
Lys Ile Val Pro Arg Asp Cys Gly Gly Gly Gly Gly Ser Gly Gly Gly
210 215 220
Gly Ser Cys Pro Ala Pro Ser Gln Leu Pro Ser Ala Lys Pro Ile Asn
225 230 235 240
Leu Thr Asp Glu Ser Met Phe Pro Ile Gly Thr Tyr Leu Leu Tyr Glu
245 250 255
Cys Leu Pro Gly Tyr Ile Lys Arg Gln Phe Ser Ile Thr Cys Lys Gln
260 265 270
Asp Ser Thr Trp Thr Ser Ala Glu Asp Lys Cys Ile Arg Lys Gln Cys
275 280 285
Lys Thr Pro Ser Asp Pro Glu Asn Gly Leu Val His Val His Thr Gly
290 295 300
Ile Gln Phe Gly Ser Arg Ile Asn Tyr Thr Cys Asn Gln Gly Tyr Arg
305 310 315 320
Leu Ile Gly Ser Ser Ser Ala Val Cys Val Ile Thr Asp Gln Ser Val
325 330 335
Asp Trp Asp Thr Glu Ala Pro Ile Cys Glu Trp Ile Pro Cys Glu Ile
340 345 350
Pro Pro Gly Ile Pro Asn Gly Asp Phe Phe Ser Ser Thr Arg Glu Asp
355 360 365
Phe His Tyr Gly Met Val Val Thr Tyr Arg Cys Asn Thr Asp Ala Arg
370 375 380
Gly Lys Ala Leu Phe Asn Leu Val Gly Glu Pro Ser Leu Tyr Cys Thr
385 390 395 400
Ser Asn Asp Gly Glu Ile Gly Val Trp Ser Gly Pro Pro Pro Gln Cys
405 410 415
Ile Glu Leu Asn Lys Cys Thr Pro Pro Pro Tyr Val Glu Asn Ala Val
420 425 430
Met Leu Ser Glu Asn Arg Ser Leu Phe Ser Leu Arg Asp Ile Val Glu
435 440 445
Phe Arg Cys His Pro Gly Phe Ile Met Lys Gly Ala Ser Ser Val His
450 455 460
Cys Gln Ser Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Phe Lys
465 470 475 480
Gly Val Ile Cys Arg Leu Pro Gln Glu Met Ser Gly Phe Gln Lys Gly
485 490 495
Leu Gly Met Lys Lys Glu Tyr Tyr Tyr Gly Glu Asn Val Thr Leu Glu
500 505 510
Cys Glu Asp Gly Tyr Thr Leu Glu Gly Ser Ser Gln Ser Gln Cys Gln
515 520 525
Ser Asp Gly Ser Trp Asn Pro Leu Leu Ala Lys Cys Val Ser Arg Ser
530 535 540
Ile
545
<210> 61
<211> 872
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 61
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Gly Gly Pro Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser
100 105 110
Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser
115 120 125
Ala Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr
165 170 175
Leu Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr
180 185 190
Val Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys
195 200 205
Lys Ile Val Pro Arg Asp Cys Gly Gly Gly Gly Gly Ser Gly Gly Gly
210 215 220
Gly Ser Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr
225 230 235 240
Asn Leu Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr
245 250 255
Glu Cys Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu
260 265 270
Lys Asn Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser
275 280 285
Cys Arg Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys
290 295 300
Gly Ile Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr
305 310 315 320
Arg Leu Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr
325 330 335
Val Ile Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly
340 345 350
Leu Pro Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
355 360 365
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
370 375 380
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
385 390 395 400
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
405 410 415
Cys Ile Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile
420 425 430
Leu Val Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu
435 440 445
Phe Arg Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys
450 455 460
Cys Gln Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg
465 470 475 480
Val Cys Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg
485 490 495
Asp Lys Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu
500 505 510
Pro Gly Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln
515 520 525
Gly Asp Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp
530 535 540
Asp Phe Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn
545 550 555 560
Leu Gln Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln
565 570 575
Leu Lys Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser
580 585 590
Leu Trp Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser
595 600 605
Pro Pro Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val
610 615 620
Phe Pro Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp
625 630 635 640
Arg Gly Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr
645 650 655
Ser Asp Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys
660 665 670
Gly Ile Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys
675 680 685
Leu Lys Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu
690 695 700
Lys Tyr Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr
705 710 715 720
Cys Leu Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg
725 730 735
Lys Ser Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val
740 745 750
Ile Thr Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr
755 760 765
Gly His Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly
770 775 780
Asn Ala Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro
785 790 795 800
Cys Gly Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn
805 810 815
Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro
820 825 830
Gly Ser Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile
835 840 845
Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala
850 855 860
Pro Gln Cys Ile Ile Pro Asn Lys
865 870
<210> 62
<211> 436
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 62
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Gly Gly Pro Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser
100 105 110
Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser
115 120 125
Ala Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr
165 170 175
Leu Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr
180 185 190
Val Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys
195 200 205
Lys Ile Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val
210 215 220
Pro Glu Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val
225 230 235 240
Leu Thr Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile
245 250 255
Ser Lys Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val
260 265 270
Glu Val His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser
275 280 285
Thr Phe Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu
290 295 300
Asn Gly Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala
305 310 315 320
Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro
325 330 335
Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys
340 345 350
Val Ser Leu Thr Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr
355 360 365
Val Glu Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr
370 375 380
Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu
385 390 395 400
Asn Val Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser
405 410 415
Val Leu His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser
420 425 430
His Ser Pro Gly
435
<210> 63
<211> 1092
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 63
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Gly Gly Pro Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser
100 105 110
Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser
115 120 125
Ala Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr
165 170 175
Leu Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr
180 185 190
Val Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys
195 200 205
Lys Ile Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val
210 215 220
Pro Glu Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val
225 230 235 240
Leu Thr Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile
245 250 255
Ser Lys Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val
260 265 270
Glu Val His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser
275 280 285
Thr Phe Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu
290 295 300
Asn Gly Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala
305 310 315 320
Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro
325 330 335
Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys
340 345 350
Val Ser Leu Thr Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr
355 360 365
Val Glu Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr
370 375 380
Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu
385 390 395 400
Asn Val Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser
405 410 415
Val Leu His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser
420 425 430
His Ser Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Cys
435 440 445
Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu Thr Asp
450 455 460
Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys Arg Pro
465 470 475 480
Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn Ser Val
485 490 495
Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg Asn Pro
500 505 510
Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile Gln Phe
515 520 525
Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu Ile Gly
530 535 540
Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile Trp Asp
545 550 555 560
Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro Pro Thr
565 570 575
Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr
580 585 590
Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys
595 600 605
Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp
610 615 620
Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro
625 630 635 640
Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val Ser Asp
645 650 655
Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg Cys Gln
660 665 670
Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln Ala Leu
675 680 685
Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys Gln Pro
690 695 700
Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys Asp Asn
705 710 715 720
Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp
725 730 735
Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp Trp Ser
740 745 750
Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe Met Gly
755 760 765
Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln Leu Gly
770 775 780
Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser
785 790 795 800
Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp Asn Ser
805 810 815
Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro Val Ile
820 825 830
Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro Phe Gly
835 840 845
Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly Thr Ser
850 855 860
Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp Pro Gln
865 870 875 880
Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile Leu Gly
885 890 895
His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys Thr Gln
900 905 910
Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr Glu Cys
915 920 925
Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu Asp Asn
930 935 940
Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser Cys Lys
945 950 955 960
Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr Asp Ile
965 970 975
Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His Arg Leu
980 985 990
Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala Ala His
995 1000 1005
Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly Leu
1010 1015 1020
Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
1025 1030 1035
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly
1040 1045 1050
Ser Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile
1055 1060 1065
Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro
1070 1075 1080
Ala Pro Gln Cys Ile Ile Pro Asn Lys
1085 1090
<210> 64
<211> 436
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 64
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Gly Gly Pro Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser
100 105 110
Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser
115 120 125
Ala Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr
165 170 175
Leu Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr
180 185 190
Val Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys
195 200 205
Lys Ile Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val
210 215 220
Pro Glu Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val
225 230 235 240
Leu Thr Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile
245 250 255
Ser Lys Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val
260 265 270
Glu Val His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser
275 280 285
Thr Phe Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu
290 295 300
Asn Gly Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala
305 310 315 320
Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro
325 330 335
Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys
340 345 350
Val Ser Leu Ser Cys Ala Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr
355 360 365
Val Glu Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr
370 375 380
Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Val Ser Lys Leu
385 390 395 400
Asn Val Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser
405 410 415
Val Leu His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser
420 425 430
His Ser Pro Gly
435
<210> 65
<211> 1092
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 65
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Gly Gly Pro Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser
100 105 110
Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser
115 120 125
Ala Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr
165 170 175
Leu Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr
180 185 190
Val Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys
195 200 205
Lys Ile Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val
210 215 220
Pro Glu Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val
225 230 235 240
Leu Thr Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile
245 250 255
Ser Lys Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val
260 265 270
Glu Val His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser
275 280 285
Thr Phe Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu
290 295 300
Asn Gly Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala
305 310 315 320
Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro
325 330 335
Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys
340 345 350
Val Ser Leu Trp Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr
355 360 365
Val Glu Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr
370 375 380
Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu
385 390 395 400
Asn Val Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser
405 410 415
Val Leu His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser
420 425 430
His Ser Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Cys
435 440 445
Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu Thr Asp
450 455 460
Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys Arg Pro
465 470 475 480
Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn Ser Val
485 490 495
Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg Asn Pro
500 505 510
Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile Gln Phe
515 520 525
Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu Ile Gly
530 535 540
Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile Trp Asp
545 550 555 560
Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro Pro Thr
565 570 575
Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr
580 585 590
Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys
595 600 605
Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp
610 615 620
Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro
625 630 635 640
Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val Ser Asp
645 650 655
Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg Cys Gln
660 665 670
Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln Ala Leu
675 680 685
Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys Gln Pro
690 695 700
Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys Asp Asn
705 710 715 720
Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp
725 730 735
Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp Trp Ser
740 745 750
Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe Met Gly
755 760 765
Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln Leu Gly
770 775 780
Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser
785 790 795 800
Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp Asn Ser
805 810 815
Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro Val Ile
820 825 830
Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro Phe Gly
835 840 845
Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly Thr Ser
850 855 860
Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp Pro Gln
865 870 875 880
Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile Leu Gly
885 890 895
His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys Thr Gln
900 905 910
Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr Glu Cys
915 920 925
Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu Asp Asn
930 935 940
Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser Cys Lys
945 950 955 960
Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr Asp Ile
965 970 975
Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His Arg Leu
980 985 990
Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala Ala His
995 1000 1005
Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly Leu
1010 1015 1020
Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
1025 1030 1035
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly
1040 1045 1050
Ser Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile
1055 1060 1065
Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro
1070 1075 1080
Ala Pro Gln Cys Ile Ile Pro Asn Lys
1085 1090
<210> 66
<211> 1092
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 66
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Gly Gly Pro Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser
100 105 110
Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser
115 120 125
Ala Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr
165 170 175
Leu Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr
180 185 190
Val Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys
195 200 205
Lys Ile Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val
210 215 220
Pro Glu Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val
225 230 235 240
Leu Thr Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile
245 250 255
Ser Lys Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val
260 265 270
Glu Val His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser
275 280 285
Thr Phe Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu
290 295 300
Asn Gly Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala
305 310 315 320
Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro
325 330 335
Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys
340 345 350
Val Ser Leu Thr Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr
355 360 365
Val Glu Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr
370 375 380
Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu
385 390 395 400
Asn Val Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser
405 410 415
Val Leu His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser
420 425 430
His Ser Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Cys
435 440 445
Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu Thr Asp
450 455 460
Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys Arg Pro
465 470 475 480
Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn Ser Val
485 490 495
Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg Asn Pro
500 505 510
Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile Gln Phe
515 520 525
Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu Ile Gly
530 535 540
Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile Trp Asp
545 550 555 560
Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro Pro Thr
565 570 575
Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr
580 585 590
Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys
595 600 605
Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp
610 615 620
Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro
625 630 635 640
Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val Ser Asp
645 650 655
Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg Cys Gln
660 665 670
Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln Ala Leu
675 680 685
Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys Gln Pro
690 695 700
Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys Asp Asn
705 710 715 720
Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp
725 730 735
Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp Trp Ser
740 745 750
Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe Met Gly
755 760 765
Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln Leu Gly
770 775 780
Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser
785 790 795 800
Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp Asn Ser
805 810 815
Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro Val Ile
820 825 830
Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro Phe Gly
835 840 845
Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly Thr Ser
850 855 860
Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp Pro Gln
865 870 875 880
Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile Leu Gly
885 890 895
His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys Thr Gln
900 905 910
Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr Glu Cys
915 920 925
Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu Asp Asn
930 935 940
Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser Cys Lys
945 950 955 960
Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr Asp Ile
965 970 975
Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His Arg Leu
980 985 990
Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala Ala His
995 1000 1005
Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly Leu
1010 1015 1020
Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
1025 1030 1035
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly
1040 1045 1050
Ser Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile
1055 1060 1065
Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro
1070 1075 1080
Ala Pro Gln Cys Ile Ile Pro Asn Lys
1085 1090
<210> 67
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 67
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly
210
<210> 68
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 68
Asp Val Val Met Thr Gln Thr Pro Leu Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Arg
100 105 110
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu
115 120 125
Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe
130 135 140
Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg
145 150 155 160
Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu
180 185 190
Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser
195 200 205
Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
210 215
<210> 69
<211> 543
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 69
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
210 215 220
Cys Pro Ala Pro Ser Gln Leu Pro Ser Ala Lys Pro Ile Asn Leu Thr
225 230 235 240
Asp Glu Ser Met Phe Pro Ile Gly Thr Tyr Leu Leu Tyr Glu Cys Leu
245 250 255
Pro Gly Tyr Ile Lys Arg Gln Phe Ser Ile Thr Cys Lys Gln Asp Ser
260 265 270
Thr Trp Thr Ser Ala Glu Asp Lys Cys Ile Arg Lys Gln Cys Lys Thr
275 280 285
Pro Ser Asp Pro Glu Asn Gly Leu Val His Val His Thr Gly Ile Gln
290 295 300
Phe Gly Ser Arg Ile Asn Tyr Thr Cys Asn Gln Gly Tyr Arg Leu Ile
305 310 315 320
Gly Ser Ser Ser Ala Val Cys Val Ile Thr Asp Gln Ser Val Asp Trp
325 330 335
Asp Thr Glu Ala Pro Ile Cys Glu Trp Ile Pro Cys Glu Ile Pro Pro
340 345 350
Gly Ile Pro Asn Gly Asp Phe Phe Ser Ser Thr Arg Glu Asp Phe His
355 360 365
Tyr Gly Met Val Val Thr Tyr Arg Cys Asn Thr Asp Ala Arg Gly Lys
370 375 380
Ala Leu Phe Asn Leu Val Gly Glu Pro Ser Leu Tyr Cys Thr Ser Asn
385 390 395 400
Asp Gly Glu Ile Gly Val Trp Ser Gly Pro Pro Pro Gln Cys Ile Glu
405 410 415
Leu Asn Lys Cys Thr Pro Pro Pro Tyr Val Glu Asn Ala Val Met Leu
420 425 430
Ser Glu Asn Arg Ser Leu Phe Ser Leu Arg Asp Ile Val Glu Phe Arg
435 440 445
Cys His Pro Gly Phe Ile Met Lys Gly Ala Ser Ser Val His Cys Gln
450 455 460
Ser Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Phe Lys Gly Val
465 470 475 480
Ile Cys Arg Leu Pro Gln Glu Met Ser Gly Phe Gln Lys Gly Leu Gly
485 490 495
Met Lys Lys Glu Tyr Tyr Tyr Gly Glu Asn Val Thr Leu Glu Cys Glu
500 505 510
Asp Gly Tyr Thr Leu Glu Gly Ser Ser Gln Ser Gln Cys Gln Ser Asp
515 520 525
Gly Ser Trp Asn Pro Leu Leu Ala Lys Cys Val Ser Arg Ser Ile
530 535 540
<210> 70
<211> 870
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 70
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
210 215 220
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
225 230 235 240
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
245 250 255
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
260 265 270
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
275 280 285
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
290 295 300
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
305 310 315 320
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
325 330 335
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
340 345 350
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
355 360 365
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
370 375 380
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
385 390 395 400
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
405 410 415
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
420 425 430
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
435 440 445
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
450 455 460
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
465 470 475 480
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
485 490 495
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
500 505 510
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
515 520 525
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
530 535 540
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
545 550 555 560
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
565 570 575
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
580 585 590
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
595 600 605
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
610 615 620
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
625 630 635 640
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
645 650 655
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
660 665 670
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
675 680 685
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
690 695 700
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
705 710 715 720
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
725 730 735
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
740 745 750
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
755 760 765
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
770 775 780
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
785 790 795 800
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
805 810 815
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
820 825 830
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
835 840 845
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
850 855 860
Cys Ile Ile Pro Asn Lys
865 870
<210> 71
<211> 529
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 71
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
210 215 220
Glu Asp Cys Asn Glu Leu Pro Pro Arg Arg Asn Thr Glu Ile Leu Thr
225 230 235 240
Gly Ser Trp Ser Asp Gln Thr Tyr Pro Glu Gly Thr Gln Ala Ile Tyr
245 250 255
Lys Cys Arg Pro Gly Tyr Arg Ser Leu Gly Asn Val Ile Met Val Cys
260 265 270
Arg Lys Gly Glu Trp Val Ala Leu Asn Pro Leu Arg Lys Cys Gln Lys
275 280 285
Arg Pro Cys Gly His Pro Gly Asp Thr Pro Phe Gly Thr Phe Thr Leu
290 295 300
Thr Gly Gly Asn Val Phe Glu Tyr Gly Val Lys Ala Val Tyr Thr Cys
305 310 315 320
Asn Glu Gly Tyr Gln Leu Leu Gly Glu Ile Asn Tyr Arg Glu Cys Asp
325 330 335
Thr Asp Gly Trp Thr Asn Asp Ile Pro Ile Cys Glu Val Val Lys Cys
340 345 350
Leu Pro Val Thr Ala Pro Glu Asn Gly Lys Ile Val Ser Ser Ala Met
355 360 365
Glu Pro Asp Arg Glu Tyr His Phe Gly Gln Ala Val Arg Phe Val Cys
370 375 380
Asn Ser Gly Tyr Lys Ile Glu Gly Asp Glu Glu Met His Cys Ser Asp
385 390 395 400
Asp Gly Phe Trp Ser Lys Glu Lys Pro Lys Cys Val Glu Ile Ser Cys
405 410 415
Lys Ser Pro Asp Val Ile Asn Gly Ser Pro Ile Ser Gln Lys Ile Ile
420 425 430
Tyr Lys Glu Asn Glu Arg Phe Gln Tyr Lys Cys Asn Met Gly Tyr Glu
435 440 445
Tyr Ser Glu Arg Gly Asp Ala Val Cys Thr Glu Ser Gly Trp Arg Pro
450 455 460
Leu Pro Ser Cys Glu Glu Lys Ser Cys Asp Asn Pro Tyr Ile Pro Asn
465 470 475 480
Gly Asp Tyr Ser Pro Leu Arg Ile Lys His Arg Thr Gly Asp Glu Ile
485 490 495
Thr Tyr Gln Cys Arg Asn Gly Phe Tyr Pro Ala Thr Arg Gly Asn Thr
500 505 510
Ala Lys Cys Thr Ser Thr Gly Trp Ile Pro Ala Pro Arg Cys Thr Leu
515 520 525
Lys
<210> 72
<211> 305
<212> БЕЛОК
<213> Homo sapiens
<400> 72
Glu Asp Cys Asn Glu Leu Pro Pro Arg Arg Asn Thr Glu Ile Leu Thr
1 5 10 15
Gly Ser Trp Ser Asp Gln Thr Tyr Pro Glu Gly Thr Gln Ala Ile Tyr
20 25 30
Lys Cys Arg Pro Gly Tyr Arg Ser Leu Gly Asn Val Ile Met Val Cys
35 40 45
Arg Lys Gly Glu Trp Val Ala Leu Asn Pro Leu Arg Lys Cys Gln Lys
50 55 60
Arg Pro Cys Gly His Pro Gly Asp Thr Pro Phe Gly Thr Phe Thr Leu
65 70 75 80
Thr Gly Gly Asn Val Phe Glu Tyr Gly Val Lys Ala Val Tyr Thr Cys
85 90 95
Asn Glu Gly Tyr Gln Leu Leu Gly Glu Ile Asn Tyr Arg Glu Cys Asp
100 105 110
Thr Asp Gly Trp Thr Asn Asp Ile Pro Ile Cys Glu Val Val Lys Cys
115 120 125
Leu Pro Val Thr Ala Pro Glu Asn Gly Lys Ile Val Ser Ser Ala Met
130 135 140
Glu Pro Asp Arg Glu Tyr His Phe Gly Gln Ala Val Arg Phe Val Cys
145 150 155 160
Asn Ser Gly Tyr Lys Ile Glu Gly Asp Glu Glu Met His Cys Ser Asp
165 170 175
Asp Gly Phe Trp Ser Lys Glu Lys Pro Lys Cys Val Glu Ile Ser Cys
180 185 190
Lys Ser Pro Asp Val Ile Asn Gly Ser Pro Ile Ser Gln Lys Ile Ile
195 200 205
Tyr Lys Glu Asn Glu Arg Phe Gln Tyr Lys Cys Asn Met Gly Tyr Glu
210 215 220
Tyr Ser Glu Arg Gly Asp Ala Val Cys Thr Glu Ser Gly Trp Arg Pro
225 230 235 240
Leu Pro Ser Cys Glu Glu Lys Ser Cys Asp Asn Pro Tyr Ile Pro Asn
245 250 255
Gly Asp Tyr Ser Pro Leu Arg Ile Lys His Arg Thr Gly Asp Glu Ile
260 265 270
Thr Tyr Gln Cys Arg Asn Gly Phe Tyr Pro Ala Thr Arg Gly Asn Thr
275 280 285
Ala Lys Cys Thr Ser Thr Gly Trp Ile Pro Ala Pro Arg Cys Thr Leu
290 295 300
Lys
305
<210> 73
<211> 434
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 73
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
210 215 220
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
225 230 235 240
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
245 250 255
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
260 265 270
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
275 280 285
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
290 295 300
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
305 310 315 320
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
325 330 335
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
340 345 350
Leu Thr Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu
355 360 365
Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro
370 375 380
Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val
385 390 395 400
Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu
405 410 415
His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser
420 425 430
Pro Gly
<210> 74
<211> 434
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 74
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
210 215 220
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
225 230 235 240
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
245 250 255
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
260 265 270
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
275 280 285
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
290 295 300
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
305 310 315 320
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
325 330 335
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
340 345 350
Leu Trp Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu
355 360 365
Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro
370 375 380
Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val
385 390 395 400
Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu
405 410 415
His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser
420 425 430
Pro Gly
<210> 75
<211> 1090
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 75
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
210 215 220
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
225 230 235 240
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
245 250 255
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
260 265 270
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
275 280 285
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
290 295 300
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
305 310 315 320
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
325 330 335
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
340 345 350
Leu Ser Cys Ala Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu
355 360 365
Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro
370 375 380
Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Val Ser Lys Leu Asn Val
385 390 395 400
Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu
405 410 415
His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser
420 425 430
Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Cys Asn Ala
435 440 445
Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu Thr Asp Glu Phe
450 455 460
Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys Arg Pro Gly Tyr
465 470 475 480
Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn Ser Val Trp Thr
485 490 495
Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg Asn Pro Pro Asp
500 505 510
Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile Gln Phe Gly Ser
515 520 525
Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu Ile Gly Ser Ser
530 535 540
Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile Trp Asp Asn Glu
545 550 555 560
Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Thr
565 570 575
Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser
580 585 590
Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe
595 600 605
Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln
610 615 620
Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys
625 630 635 640
Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val Ser Asp Asn Arg
645 650 655
Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg Cys Gln Pro Gly
660 665 670
Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln Ala Leu Asn Lys
675 680 685
Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys Gln Pro Pro Pro
690 695 700
Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys Asp Asn Phe Ser
705 710 715 720
Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp Leu Arg
725 730 735
Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp Trp Ser Pro Ala
740 745 750
Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe Met Gly Gln Leu
755 760 765
Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln Leu Gly Ala Lys
770 775 780
Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser Ser Ala
785 790 795 800
Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp Asn Ser Ser Val
805 810 815
Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro Val Ile Pro Asn
820 825 830
Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro Phe Gly Lys Thr
835 840 845
Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly Thr Ser Phe Asp
850 855 860
Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp Pro Gln Gly Asn
865 870 875 880
Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile Leu Gly His Cys
885 890 895
Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys Thr Gln Thr Asn
900 905 910
Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr Glu Cys Arg Pro
915 920 925
Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu Asp Asn Leu Val
930 935 940
Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser Cys Lys Thr Pro
945 950 955 960
Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr Asp Ile Gln Val
965 970 975
Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His Arg Leu Ile Gly
980 985 990
His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala Ala His Trp Ser
995 1000 1005
Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly Leu Pro Pro
1010 1015 1020
Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
1025 1030 1035
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly
1040 1045 1050
Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
1055 1060 1065
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro
1070 1075 1080
Gln Cys Ile Ile Pro Asn Lys
1085 1090
<210> 76
<211> 1090
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 76
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
210 215 220
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
225 230 235 240
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
245 250 255
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
260 265 270
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
275 280 285
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
290 295 300
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
305 310 315 320
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
325 330 335
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
340 345 350
Leu Thr Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu
355 360 365
Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro
370 375 380
Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val
385 390 395 400
Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu
405 410 415
His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser
420 425 430
Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Cys Asn Ala
435 440 445
Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu Thr Asp Glu Phe
450 455 460
Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys Arg Pro Gly Tyr
465 470 475 480
Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn Ser Val Trp Thr
485 490 495
Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg Asn Pro Pro Asp
500 505 510
Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile Gln Phe Gly Ser
515 520 525
Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu Ile Gly Ser Ser
530 535 540
Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile Trp Asp Asn Glu
545 550 555 560
Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Thr
565 570 575
Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser
580 585 590
Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe
595 600 605
Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln
610 615 620
Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys
625 630 635 640
Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val Ser Asp Asn Arg
645 650 655
Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg Cys Gln Pro Gly
660 665 670
Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln Ala Leu Asn Lys
675 680 685
Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys Gln Pro Pro Pro
690 695 700
Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys Asp Asn Phe Ser
705 710 715 720
Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp Leu Arg
725 730 735
Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp Trp Ser Pro Ala
740 745 750
Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe Met Gly Gln Leu
755 760 765
Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln Leu Gly Ala Lys
770 775 780
Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser Ser Ala
785 790 795 800
Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp Asn Ser Ser Val
805 810 815
Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro Val Ile Pro Asn
820 825 830
Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro Phe Gly Lys Thr
835 840 845
Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly Thr Ser Phe Asp
850 855 860
Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp Pro Gln Gly Asn
865 870 875 880
Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile Leu Gly His Cys
885 890 895
Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys Thr Gln Thr Asn
900 905 910
Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr Glu Cys Arg Pro
915 920 925
Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu Asp Asn Leu Val
930 935 940
Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser Cys Lys Thr Pro
945 950 955 960
Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr Asp Ile Gln Val
965 970 975
Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His Arg Leu Ile Gly
980 985 990
His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala Ala His Trp Ser
995 1000 1005
Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly Leu Pro Pro
1010 1015 1020
Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
1025 1030 1035
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly
1040 1045 1050
Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
1055 1060 1065
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro
1070 1075 1080
Gln Cys Ile Ile Pro Asn Lys
1085 1090
<210> 77
<211> 875
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 77
Asp Val Val Met Thr Gln Thr Pro Leu Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Arg
100 105 110
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu
115 120 125
Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe
130 135 140
Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg
145 150 155 160
Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu
180 185 190
Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser
195 200 205
Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys Gly Gly Gly Gly Ser
210 215 220
Gly Gly Gly Gly Ser Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala
225 230 235 240
Arg Pro Thr Asn Leu Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr
245 250 255
Leu Asn Tyr Glu Cys Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile
260 265 270
Ile Cys Leu Lys Asn Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg
275 280 285
Arg Lys Ser Cys Arg Asn Pro Pro Asp Pro Val Asn Gly Met Val His
290 295 300
Val Ile Lys Gly Ile Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr
305 310 315 320
Lys Gly Tyr Arg Leu Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser
325 330 335
Gly Asp Thr Val Ile Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile
340 345 350
Pro Cys Gly Leu Pro Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr
355 360 365
Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn
370 375 380
Pro Gly Ser Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser
385 390 395 400
Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro
405 410 415
Ala Pro Gln Cys Ile Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu
420 425 430
Asn Gly Ile Leu Val Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu
435 440 445
Val Val Glu Phe Arg Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg
450 455 460
Arg Val Lys Cys Gln Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser
465 470 475 480
Cys Ser Arg Val Cys Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg
485 490 495
Thr Gln Arg Asp Lys Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr
500 505 510
Ser Cys Glu Pro Gly Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys
515 520 525
Thr Pro Gln Gly Asp Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys
530 535 540
Ser Cys Asp Asp Phe Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe
545 550 555 560
Pro Val Asn Leu Gln Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu
565 570 575
Gly Phe Gln Leu Lys Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly
580 585 590
Met Glu Ser Leu Trp Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe
595 600 605
Cys Pro Ser Pro Pro Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro
610 615 620
Leu Glu Val Phe Pro Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro
625 630 635 640
His Pro Asp Arg Gly Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile
645 650 655
Arg Cys Thr Ser Asp Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala
660 665 670
Pro Arg Cys Gly Ile Leu Gly His Cys Gln Ala Pro Asp His Phe Leu
675 680 685
Phe Ala Lys Leu Lys Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly
690 695 700
Thr Ser Leu Lys Tyr Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe
705 710 715 720
Ser Ile Thr Cys Leu Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val
725 730 735
Cys Lys Arg Lys Ser Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met
740 745 750
Val His Val Ile Thr Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser
755 760 765
Cys Thr Thr Gly His Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile
770 775 780
Leu Ser Gly Asn Ala Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln
785 790 795 800
Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile
805 810 815
Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg
820 825 830
Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu
835 840 845
Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser
850 855 860
Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys
865 870 875
<210> 78
<211> 1090
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 78
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
1 5 10 15
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
20 25 30
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
35 40 45
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
50 55 60
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
65 70 75 80
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
85 90 95
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
100 105 110
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
115 120 125
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
130 135 140
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
145 150 155 160
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
165 170 175
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
180 185 190
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
195 200 205
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
210 215 220
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
225 230 235 240
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
245 250 255
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
260 265 270
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
275 280 285
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
290 295 300
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
305 310 315 320
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
325 330 335
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
340 345 350
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
355 360 365
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
370 375 380
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
385 390 395 400
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
405 410 415
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
420 425 430
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
435 440 445
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
450 455 460
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
465 470 475 480
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
485 490 495
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
500 505 510
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
515 520 525
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
530 535 540
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
545 550 555 560
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
565 570 575
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
580 585 590
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
595 600 605
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
610 615 620
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
625 630 635 640
Cys Ile Ile Pro Asn Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
645 650 655
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
660 665 670
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
675 680 685
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
690 695 700
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
705 710 715 720
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
725 730 735
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
740 745 750
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
755 760 765
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
770 775 780
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
785 790 795 800
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
805 810 815
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
820 825 830
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
835 840 845
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
850 855 860
Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
865 870 875 880
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
885 890 895
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
900 905 910
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
915 920 925
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
930 935 940
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
945 950 955 960
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
965 970 975
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
980 985 990
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
995 1000 1005
Leu Thr Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val
1010 1015 1020
Glu Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr
1025 1030 1035
Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys
1040 1045 1050
Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr
1055 1060 1065
Cys Ser Val Leu His Glu Gly Leu His Asn His His Thr Glu Lys
1070 1075 1080
Ser Leu Ser His Ser Pro Gly
1085 1090
<210> 79
<211> 875
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 79
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
1 5 10 15
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
20 25 30
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
35 40 45
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
50 55 60
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
65 70 75 80
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
85 90 95
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
100 105 110
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
115 120 125
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
130 135 140
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
145 150 155 160
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
165 170 175
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
180 185 190
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
195 200 205
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
210 215 220
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
225 230 235 240
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
245 250 255
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
260 265 270
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
275 280 285
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
290 295 300
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
305 310 315 320
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
325 330 335
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
340 345 350
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
355 360 365
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
370 375 380
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
385 390 395 400
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
405 410 415
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
420 425 430
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
435 440 445
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
450 455 460
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
465 470 475 480
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
485 490 495
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
500 505 510
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
515 520 525
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
530 535 540
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
545 550 555 560
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
565 570 575
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
580 585 590
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
595 600 605
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
610 615 620
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
625 630 635 640
Cys Ile Ile Pro Asn Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
645 650 655
Asp Val Val Met Thr Gln Thr Pro Leu Thr Leu Ser Val Thr Ile Gly
660 665 670
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
675 680 685
Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser
690 695 700
Pro Lys Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
705 710 715 720
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
725 730 735
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly
740 745 750
Thr His Phe Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Arg
755 760 765
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu
770 775 780
Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe
785 790 795 800
Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg
805 810 815
Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser
820 825 830
Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu
835 840 845
Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser
850 855 860
Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
865 870 875
<210> 80
<211> 877
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 80
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
1 5 10 15
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
20 25 30
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
35 40 45
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
50 55 60
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
65 70 75 80
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
85 90 95
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
100 105 110
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
115 120 125
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
130 135 140
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
145 150 155 160
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
165 170 175
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
180 185 190
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
195 200 205
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
210 215 220
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
225 230 235 240
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
245 250 255
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
260 265 270
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
275 280 285
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
290 295 300
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
305 310 315 320
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
325 330 335
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
340 345 350
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
355 360 365
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
370 375 380
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
385 390 395 400
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
405 410 415
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
420 425 430
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
435 440 445
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
450 455 460
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
465 470 475 480
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
485 490 495
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
500 505 510
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
515 520 525
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
530 535 540
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
545 550 555 560
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
565 570 575
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
580 585 590
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
595 600 605
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
610 615 620
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
625 630 635 640
Cys Ile Ile Pro Asn Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
645 650 655
Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe
660 665 670
Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro
675 680 685
Lys Val Thr Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val
690 695 700
Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr
705 710 715 720
Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu
725 730 735
Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys
740 745 750
Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser
755 760 765
Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro
770 775 780
Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser Leu Trp Cys Met Ile
785 790 795 800
Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly
805 810 815
Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp
820 825 830
Gly Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp
835 840 845
Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His
850 855 860
Asn His His Thr Glu Lys Ser Leu Ser His Ser Pro Gly
865 870 875
<210> 81
<211> 434
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 81
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
210 215 220
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
225 230 235 240
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
245 250 255
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
260 265 270
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
275 280 285
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
290 295 300
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
305 310 315 320
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
325 330 335
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
340 345 350
Leu Ser Cys Ala Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu
355 360 365
Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro
370 375 380
Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Val Ser Lys Leu Asn Val
385 390 395 400
Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu
405 410 415
His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser
420 425 430
Pro Gly
<210> 82
<211> 749
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 82
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
210 215 220
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
225 230 235 240
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
245 250 255
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
260 265 270
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
275 280 285
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
290 295 300
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
305 310 315 320
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
325 330 335
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
340 345 350
Leu Ser Cys Ala Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu
355 360 365
Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro
370 375 380
Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Val Ser Lys Leu Asn Val
385 390 395 400
Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu
405 410 415
His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser
420 425 430
Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Asp Cys Asn
435 440 445
Glu Leu Pro Pro Arg Arg Asn Thr Glu Ile Leu Thr Gly Ser Trp Ser
450 455 460
Asp Gln Thr Tyr Pro Glu Gly Thr Gln Ala Ile Tyr Lys Cys Arg Pro
465 470 475 480
Gly Tyr Arg Ser Leu Gly Asn Val Ile Met Val Cys Arg Lys Gly Glu
485 490 495
Trp Val Ala Leu Asn Pro Leu Arg Lys Cys Gln Lys Arg Pro Cys Gly
500 505 510
His Pro Gly Asp Thr Pro Phe Gly Thr Phe Thr Leu Thr Gly Gly Asn
515 520 525
Val Phe Glu Tyr Gly Val Lys Ala Val Tyr Thr Cys Asn Glu Gly Tyr
530 535 540
Gln Leu Leu Gly Glu Ile Asn Tyr Arg Glu Cys Asp Thr Asp Gly Trp
545 550 555 560
Thr Asn Asp Ile Pro Ile Cys Glu Val Val Lys Cys Leu Pro Val Thr
565 570 575
Ala Pro Glu Asn Gly Lys Ile Val Ser Ser Ala Met Glu Pro Asp Arg
580 585 590
Glu Tyr His Phe Gly Gln Ala Val Arg Phe Val Cys Asn Ser Gly Tyr
595 600 605
Lys Ile Glu Gly Asp Glu Glu Met His Cys Ser Asp Asp Gly Phe Trp
610 615 620
Ser Lys Glu Lys Pro Lys Cys Val Glu Ile Ser Cys Lys Ser Pro Asp
625 630 635 640
Val Ile Asn Gly Ser Pro Ile Ser Gln Lys Ile Ile Tyr Lys Glu Asn
645 650 655
Glu Arg Phe Gln Tyr Lys Cys Asn Met Gly Tyr Glu Tyr Ser Glu Arg
660 665 670
Gly Asp Ala Val Cys Thr Glu Ser Gly Trp Arg Pro Leu Pro Ser Cys
675 680 685
Glu Glu Lys Ser Cys Asp Asn Pro Tyr Ile Pro Asn Gly Asp Tyr Ser
690 695 700
Pro Leu Arg Ile Lys His Arg Thr Gly Asp Glu Ile Thr Tyr Gln Cys
705 710 715 720
Arg Asn Gly Phe Tyr Pro Ala Thr Arg Gly Asn Thr Ala Lys Cys Thr
725 730 735
Ser Thr Gly Trp Ile Pro Ala Pro Arg Cys Thr Leu Lys
740 745
<210> 83
<211> 749
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 83
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
210 215 220
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
225 230 235 240
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
245 250 255
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
260 265 270
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
275 280 285
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
290 295 300
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
305 310 315 320
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
325 330 335
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
340 345 350
Leu Thr Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu
355 360 365
Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro
370 375 380
Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val
385 390 395 400
Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu
405 410 415
His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser
420 425 430
Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Asp Cys Asn
435 440 445
Glu Leu Pro Pro Arg Arg Asn Thr Glu Ile Leu Thr Gly Ser Trp Ser
450 455 460
Asp Gln Thr Tyr Pro Glu Gly Thr Gln Ala Ile Tyr Lys Cys Arg Pro
465 470 475 480
Gly Tyr Arg Ser Leu Gly Asn Val Ile Met Val Cys Arg Lys Gly Glu
485 490 495
Trp Val Ala Leu Asn Pro Leu Arg Lys Cys Gln Lys Arg Pro Cys Gly
500 505 510
His Pro Gly Asp Thr Pro Phe Gly Thr Phe Thr Leu Thr Gly Gly Asn
515 520 525
Val Phe Glu Tyr Gly Val Lys Ala Val Tyr Thr Cys Asn Glu Gly Tyr
530 535 540
Gln Leu Leu Gly Glu Ile Asn Tyr Arg Glu Cys Asp Thr Asp Gly Trp
545 550 555 560
Thr Asn Asp Ile Pro Ile Cys Glu Val Val Lys Cys Leu Pro Val Thr
565 570 575
Ala Pro Glu Asn Gly Lys Ile Val Ser Ser Ala Met Glu Pro Asp Arg
580 585 590
Glu Tyr His Phe Gly Gln Ala Val Arg Phe Val Cys Asn Ser Gly Tyr
595 600 605
Lys Ile Glu Gly Asp Glu Glu Met His Cys Ser Asp Asp Gly Phe Trp
610 615 620
Ser Lys Glu Lys Pro Lys Cys Val Glu Ile Ser Cys Lys Ser Pro Asp
625 630 635 640
Val Ile Asn Gly Ser Pro Ile Ser Gln Lys Ile Ile Tyr Lys Glu Asn
645 650 655
Glu Arg Phe Gln Tyr Lys Cys Asn Met Gly Tyr Glu Tyr Ser Glu Arg
660 665 670
Gly Asp Ala Val Cys Thr Glu Ser Gly Trp Arg Pro Leu Pro Ser Cys
675 680 685
Glu Glu Lys Ser Cys Asp Asn Pro Tyr Ile Pro Asn Gly Asp Tyr Ser
690 695 700
Pro Leu Arg Ile Lys His Arg Thr Gly Asp Glu Ile Thr Tyr Gln Cys
705 710 715 720
Arg Asn Gly Phe Tyr Pro Ala Thr Arg Gly Asn Thr Ala Lys Cys Thr
725 730 735
Ser Thr Gly Trp Ile Pro Ala Pro Arg Cys Thr Leu Lys
740 745
<210> 84
<211> 534
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 84
Asp Val Val Met Thr Gln Thr Pro Leu Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Arg
100 105 110
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu
115 120 125
Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe
130 135 140
Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg
145 150 155 160
Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu
180 185 190
Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser
195 200 205
Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys Gly Gly Gly Gly Ser
210 215 220
Gly Gly Gly Gly Ser Glu Asp Cys Asn Glu Leu Pro Pro Arg Arg Asn
225 230 235 240
Thr Glu Ile Leu Thr Gly Ser Trp Ser Asp Gln Thr Tyr Pro Glu Gly
245 250 255
Thr Gln Ala Ile Tyr Lys Cys Arg Pro Gly Tyr Arg Ser Leu Gly Asn
260 265 270
Val Ile Met Val Cys Arg Lys Gly Glu Trp Val Ala Leu Asn Pro Leu
275 280 285
Arg Lys Cys Gln Lys Arg Pro Cys Gly His Pro Gly Asp Thr Pro Phe
290 295 300
Gly Thr Phe Thr Leu Thr Gly Gly Asn Val Phe Glu Tyr Gly Val Lys
305 310 315 320
Ala Val Tyr Thr Cys Asn Glu Gly Tyr Gln Leu Leu Gly Glu Ile Asn
325 330 335
Tyr Arg Glu Cys Asp Thr Asp Gly Trp Thr Asn Asp Ile Pro Ile Cys
340 345 350
Glu Val Val Lys Cys Leu Pro Val Thr Ala Pro Glu Asn Gly Lys Ile
355 360 365
Val Ser Ser Ala Met Glu Pro Asp Arg Glu Tyr His Phe Gly Gln Ala
370 375 380
Val Arg Phe Val Cys Asn Ser Gly Tyr Lys Ile Glu Gly Asp Glu Glu
385 390 395 400
Met His Cys Ser Asp Asp Gly Phe Trp Ser Lys Glu Lys Pro Lys Cys
405 410 415
Val Glu Ile Ser Cys Lys Ser Pro Asp Val Ile Asn Gly Ser Pro Ile
420 425 430
Ser Gln Lys Ile Ile Tyr Lys Glu Asn Glu Arg Phe Gln Tyr Lys Cys
435 440 445
Asn Met Gly Tyr Glu Tyr Ser Glu Arg Gly Asp Ala Val Cys Thr Glu
450 455 460
Ser Gly Trp Arg Pro Leu Pro Ser Cys Glu Glu Lys Ser Cys Asp Asn
465 470 475 480
Pro Tyr Ile Pro Asn Gly Asp Tyr Ser Pro Leu Arg Ile Lys His Arg
485 490 495
Thr Gly Asp Glu Ile Thr Tyr Gln Cys Arg Asn Gly Phe Tyr Pro Ala
500 505 510
Thr Arg Gly Asn Thr Ala Lys Cys Thr Ser Thr Gly Trp Ile Pro Ala
515 520 525
Pro Arg Cys Thr Leu Lys
530
<210> 85
<211> 749
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 85
Glu Asp Cys Asn Glu Leu Pro Pro Arg Arg Asn Thr Glu Ile Leu Thr
1 5 10 15
Gly Ser Trp Ser Asp Gln Thr Tyr Pro Glu Gly Thr Gln Ala Ile Tyr
20 25 30
Lys Cys Arg Pro Gly Tyr Arg Ser Leu Gly Asn Val Ile Met Val Cys
35 40 45
Arg Lys Gly Glu Trp Val Ala Leu Asn Pro Leu Arg Lys Cys Gln Lys
50 55 60
Arg Pro Cys Gly His Pro Gly Asp Thr Pro Phe Gly Thr Phe Thr Leu
65 70 75 80
Thr Gly Gly Asn Val Phe Glu Tyr Gly Val Lys Ala Val Tyr Thr Cys
85 90 95
Asn Glu Gly Tyr Gln Leu Leu Gly Glu Ile Asn Tyr Arg Glu Cys Asp
100 105 110
Thr Asp Gly Trp Thr Asn Asp Ile Pro Ile Cys Glu Val Val Lys Cys
115 120 125
Leu Pro Val Thr Ala Pro Glu Asn Gly Lys Ile Val Ser Ser Ala Met
130 135 140
Glu Pro Asp Arg Glu Tyr His Phe Gly Gln Ala Val Arg Phe Val Cys
145 150 155 160
Asn Ser Gly Tyr Lys Ile Glu Gly Asp Glu Glu Met His Cys Ser Asp
165 170 175
Asp Gly Phe Trp Ser Lys Glu Lys Pro Lys Cys Val Glu Ile Ser Cys
180 185 190
Lys Ser Pro Asp Val Ile Asn Gly Ser Pro Ile Ser Gln Lys Ile Ile
195 200 205
Tyr Lys Glu Asn Glu Arg Phe Gln Tyr Lys Cys Asn Met Gly Tyr Glu
210 215 220
Tyr Ser Glu Arg Gly Asp Ala Val Cys Thr Glu Ser Gly Trp Arg Pro
225 230 235 240
Leu Pro Ser Cys Glu Glu Lys Ser Cys Asp Asn Pro Tyr Ile Pro Asn
245 250 255
Gly Asp Tyr Ser Pro Leu Arg Ile Lys His Arg Thr Gly Asp Glu Ile
260 265 270
Thr Tyr Gln Cys Arg Asn Gly Phe Tyr Pro Ala Thr Arg Gly Asn Thr
275 280 285
Ala Lys Cys Thr Ser Thr Gly Trp Ile Pro Ala Pro Arg Cys Thr Leu
290 295 300
Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Gln
305 310 315 320
Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala Ser Val Lys Met Ser
325 330 335
Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr Tyr Ile Asn Trp Val
340 345 350
Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile Gly Val Ile Asn Pro
355 360 365
Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe Lys Gly Lys Ala Thr
370 375 380
Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr Met Glu Leu Asn Ser
385 390 395 400
Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys Ser Ser Pro Tyr Trp
405 410 415
Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro
420 425 430
Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met
435 440 445
Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr
450 455 460
Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro
465 470 475 480
Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val
485 490 495
Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His
500 505 510
Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys
515 520 525
Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe
530 535 540
Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro
545 550 555 560
Lys Val Thr Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val
565 570 575
Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr
580 585 590
Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu
595 600 605
Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys
610 615 620
Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser
625 630 635 640
Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro
645 650 655
Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile
660 665 670
Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly
675 680 685
Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp
690 695 700
Gly Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp
705 710 715 720
Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His
725 730 735
Asn His His Thr Glu Lys Ser Leu Ser His Ser Pro Gly
740 745
<210> 86
<211> 534
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 86
Glu Asp Cys Asn Glu Leu Pro Pro Arg Arg Asn Thr Glu Ile Leu Thr
1 5 10 15
Gly Ser Trp Ser Asp Gln Thr Tyr Pro Glu Gly Thr Gln Ala Ile Tyr
20 25 30
Lys Cys Arg Pro Gly Tyr Arg Ser Leu Gly Asn Val Ile Met Val Cys
35 40 45
Arg Lys Gly Glu Trp Val Ala Leu Asn Pro Leu Arg Lys Cys Gln Lys
50 55 60
Arg Pro Cys Gly His Pro Gly Asp Thr Pro Phe Gly Thr Phe Thr Leu
65 70 75 80
Thr Gly Gly Asn Val Phe Glu Tyr Gly Val Lys Ala Val Tyr Thr Cys
85 90 95
Asn Glu Gly Tyr Gln Leu Leu Gly Glu Ile Asn Tyr Arg Glu Cys Asp
100 105 110
Thr Asp Gly Trp Thr Asn Asp Ile Pro Ile Cys Glu Val Val Lys Cys
115 120 125
Leu Pro Val Thr Ala Pro Glu Asn Gly Lys Ile Val Ser Ser Ala Met
130 135 140
Glu Pro Asp Arg Glu Tyr His Phe Gly Gln Ala Val Arg Phe Val Cys
145 150 155 160
Asn Ser Gly Tyr Lys Ile Glu Gly Asp Glu Glu Met His Cys Ser Asp
165 170 175
Asp Gly Phe Trp Ser Lys Glu Lys Pro Lys Cys Val Glu Ile Ser Cys
180 185 190
Lys Ser Pro Asp Val Ile Asn Gly Ser Pro Ile Ser Gln Lys Ile Ile
195 200 205
Tyr Lys Glu Asn Glu Arg Phe Gln Tyr Lys Cys Asn Met Gly Tyr Glu
210 215 220
Tyr Ser Glu Arg Gly Asp Ala Val Cys Thr Glu Ser Gly Trp Arg Pro
225 230 235 240
Leu Pro Ser Cys Glu Glu Lys Ser Cys Asp Asn Pro Tyr Ile Pro Asn
245 250 255
Gly Asp Tyr Ser Pro Leu Arg Ile Lys His Arg Thr Gly Asp Glu Ile
260 265 270
Thr Tyr Gln Cys Arg Asn Gly Phe Tyr Pro Ala Thr Arg Gly Asn Thr
275 280 285
Ala Lys Cys Thr Ser Thr Gly Trp Ile Pro Ala Pro Arg Cys Thr Leu
290 295 300
Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met Thr
305 310 315 320
Gln Thr Pro Leu Thr Leu Ser Val Thr Ile Gly Gln Pro Ala Ser Ile
325 330 335
Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser Asp Gly Lys Thr Tyr
340 345 350
Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser Pro Lys Arg Leu Ile
355 360 365
Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro Asp Arg Phe Thr Gly
370 375 380
Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
385 390 395 400
Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly Thr His Phe Pro Arg
405 410 415
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Arg Arg Ala Asp Ala Ala
420 425 430
Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln Leu Thr Ser Gly
435 440 445
Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr Pro Lys Asp Ile
450 455 460
Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln Asn Gly Val Leu
465 470 475 480
Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr Tyr Ser Met Ser
485 490 495
Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg His Asn Ser Tyr
500 505 510
Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro Ile Val Lys Ser
515 520 525
Phe Asn Arg Asn Glu Cys
530
<210> 87
<211> 536
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 87
Glu Asp Cys Asn Glu Leu Pro Pro Arg Arg Asn Thr Glu Ile Leu Thr
1 5 10 15
Gly Ser Trp Ser Asp Gln Thr Tyr Pro Glu Gly Thr Gln Ala Ile Tyr
20 25 30
Lys Cys Arg Pro Gly Tyr Arg Ser Leu Gly Asn Val Ile Met Val Cys
35 40 45
Arg Lys Gly Glu Trp Val Ala Leu Asn Pro Leu Arg Lys Cys Gln Lys
50 55 60
Arg Pro Cys Gly His Pro Gly Asp Thr Pro Phe Gly Thr Phe Thr Leu
65 70 75 80
Thr Gly Gly Asn Val Phe Glu Tyr Gly Val Lys Ala Val Tyr Thr Cys
85 90 95
Asn Glu Gly Tyr Gln Leu Leu Gly Glu Ile Asn Tyr Arg Glu Cys Asp
100 105 110
Thr Asp Gly Trp Thr Asn Asp Ile Pro Ile Cys Glu Val Val Lys Cys
115 120 125
Leu Pro Val Thr Ala Pro Glu Asn Gly Lys Ile Val Ser Ser Ala Met
130 135 140
Glu Pro Asp Arg Glu Tyr His Phe Gly Gln Ala Val Arg Phe Val Cys
145 150 155 160
Asn Ser Gly Tyr Lys Ile Glu Gly Asp Glu Glu Met His Cys Ser Asp
165 170 175
Asp Gly Phe Trp Ser Lys Glu Lys Pro Lys Cys Val Glu Ile Ser Cys
180 185 190
Lys Ser Pro Asp Val Ile Asn Gly Ser Pro Ile Ser Gln Lys Ile Ile
195 200 205
Tyr Lys Glu Asn Glu Arg Phe Gln Tyr Lys Cys Asn Met Gly Tyr Glu
210 215 220
Tyr Ser Glu Arg Gly Asp Ala Val Cys Thr Glu Ser Gly Trp Arg Pro
225 230 235 240
Leu Pro Ser Cys Glu Glu Lys Ser Cys Asp Asn Pro Tyr Ile Pro Asn
245 250 255
Gly Asp Tyr Ser Pro Leu Arg Ile Lys His Arg Thr Gly Asp Glu Ile
260 265 270
Thr Tyr Gln Cys Arg Asn Gly Phe Tyr Pro Ala Thr Arg Gly Asn Thr
275 280 285
Ala Lys Cys Thr Ser Thr Gly Trp Ile Pro Ala Pro Arg Cys Thr Leu
290 295 300
Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Cys Lys Pro Cys
305 310 315 320
Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro Pro Lys
325 330 335
Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr Cys Val
340 345 350
Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser Trp Phe
355 360 365
Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg Glu Glu
370 375 380
Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile Met His
385 390 395 400
Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn Ser Ala
405 410 415
Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg
420 425 430
Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met
435 440 445
Ala Lys Asp Lys Val Ser Leu Trp Cys Met Ile Thr Asp Phe Phe Pro
450 455 460
Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn
465 470 475 480
Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr Phe Val
485 490 495
Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr
500 505 510
Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His Thr Glu
515 520 525
Lys Ser Leu Ser His Ser Pro Gly
530 535
<210> 88
<211> 434
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 88
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
210 215 220
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
225 230 235 240
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
245 250 255
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
260 265 270
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
275 280 285
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
290 295 300
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
305 310 315 320
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
325 330 335
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
340 345 350
Leu Ser Cys Ala Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu
355 360 365
Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro
370 375 380
Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Val Ser Lys Leu Asn Val
385 390 395 400
Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu
405 410 415
His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser
420 425 430
Pro Gly
<210> 89
<211> 434
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 89
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
210 215 220
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
225 230 235 240
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
245 250 255
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
260 265 270
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
275 280 285
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
290 295 300
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
305 310 315 320
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
325 330 335
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
340 345 350
Leu Ser Cys Ala Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu
355 360 365
Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro
370 375 380
Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Val Ser Lys Leu Asn Val
385 390 395 400
Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu
405 410 415
His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser
420 425 430
Pro Gly
<210> 90
<211> 877
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 90
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
1 5 10 15
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
20 25 30
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
35 40 45
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
50 55 60
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
65 70 75 80
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
85 90 95
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
100 105 110
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
115 120 125
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
130 135 140
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
145 150 155 160
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
165 170 175
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
180 185 190
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
195 200 205
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
210 215 220
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
225 230 235 240
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
245 250 255
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
260 265 270
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
275 280 285
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
290 295 300
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
305 310 315 320
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
325 330 335
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
340 345 350
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
355 360 365
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
370 375 380
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
385 390 395 400
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
405 410 415
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
420 425 430
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
435 440 445
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
450 455 460
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
465 470 475 480
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
485 490 495
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
500 505 510
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
515 520 525
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
530 535 540
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
545 550 555 560
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
565 570 575
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
580 585 590
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
595 600 605
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
610 615 620
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
625 630 635 640
Cys Ile Ile Pro Asn Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
645 650 655
Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe
660 665 670
Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro
675 680 685
Lys Val Thr Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val
690 695 700
Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr
705 710 715 720
Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu
725 730 735
Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys
740 745 750
Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser
755 760 765
Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro
770 775 780
Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser Leu Trp Cys Met Ile
785 790 795 800
Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly
805 810 815
Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp
820 825 830
Gly Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp
835 840 845
Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His
850 855 860
Asn His His Thr Glu Lys Ser Leu Ser His Ser Pro Gly
865 870 875
<210> 91
<211> 659
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 91
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
1 5 10 15
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
20 25 30
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
35 40 45
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
50 55 60
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
65 70 75 80
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
85 90 95
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
100 105 110
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
115 120 125
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
130 135 140
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
145 150 155 160
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
165 170 175
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
180 185 190
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
195 200 205
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
210 215 220
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
225 230 235 240
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
245 250 255
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
260 265 270
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
275 280 285
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
290 295 300
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
305 310 315 320
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
325 330 335
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
340 345 350
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
355 360 365
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
370 375 380
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
385 390 395 400
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
405 410 415
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
420 425 430
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
435 440 445
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
450 455 460
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
465 470 475 480
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
485 490 495
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
500 505 510
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
515 520 525
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
530 535 540
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
545 550 555 560
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
565 570 575
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
580 585 590
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
595 600 605
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
610 615 620
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
625 630 635 640
Cys Ile Ile Pro Asn Lys Glu Asn Leu Tyr Phe Gln Gly His His His
645 650 655
His His His
<210> 92
<211> 1109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 92
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
1 5 10 15
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
20 25 30
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
35 40 45
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
50 55 60
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
65 70 75 80
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
85 90 95
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
100 105 110
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
115 120 125
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
130 135 140
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
145 150 155 160
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
165 170 175
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
180 185 190
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
195 200 205
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
210 215 220
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
225 230 235 240
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
245 250 255
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
260 265 270
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
275 280 285
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
290 295 300
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
305 310 315 320
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
325 330 335
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
340 345 350
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
355 360 365
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
370 375 380
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
385 390 395 400
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
405 410 415
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
420 425 430
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
435 440 445
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
450 455 460
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
465 470 475 480
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
485 490 495
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
500 505 510
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
515 520 525
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
530 535 540
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
545 550 555 560
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
565 570 575
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
580 585 590
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
595 600 605
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
610 615 620
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
625 630 635 640
Cys Ile Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile
645 650 655
Leu Val Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu
660 665 670
Phe Arg Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys
675 680 685
Cys Gln Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg
690 695 700
Val Cys Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg
705 710 715 720
Asp Lys Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu
725 730 735
Pro Gly Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln
740 745 750
Gly Asp Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp
755 760 765
Asp Phe Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn
770 775 780
Leu Gln Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln
785 790 795 800
Leu Lys Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser
805 810 815
Leu Trp Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser
820 825 830
Pro Pro Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val
835 840 845
Phe Pro Phe Gly Lys Ala Val Asn Tyr Thr Cys Asp Pro His Pro Asp
850 855 860
Arg Gly Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr
865 870 875 880
Ser Asp Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys
885 890 895
Gly Ile Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys
900 905 910
Leu Lys Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu
915 920 925
Lys Tyr Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr
930 935 940
Cys Leu Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg
945 950 955 960
Lys Ser Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val
965 970 975
Ile Thr Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr
980 985 990
Gly His Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly
995 1000 1005
Asn Thr Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile
1010 1015 1020
Pro Cys Gly Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser
1025 1030 1035
Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg
1040 1045 1050
Cys Asn Leu Gly Ser Arg Gly Arg Lys Val Phe Glu Leu Val Gly
1055 1060 1065
Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile
1070 1075 1080
Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys Glu Asn
1085 1090 1095
Leu Tyr Phe Gln Gly His His His His His His
1100 1105
<210> 93
<211> 910
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 93
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser His Lys Phe
130 135 140
Met Ser Thr Ser Val Gly Asp Arg Val Ser Ile Thr Cys Lys Ala Ser
145 150 155 160
Gln Asp Val Gly Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln
165 170 175
Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg His Thr Gly Val
180 185 190
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
195 200 205
Ile Ser Asn Val Gln Ser Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln
210 215 220
Tyr Ser Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu
225 230 235 240
Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Cys Asn Ala Pro
245 250 255
Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu Thr Asp Glu Phe Glu
260 265 270
Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys Arg Pro Gly Tyr Ser
275 280 285
Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn Ser Val Trp Thr Gly
290 295 300
Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg Asn Pro Pro Asp Pro
305 310 315 320
Val Asn Gly Met Val His Val Ile Lys Gly Ile Gln Phe Gly Ser Gln
325 330 335
Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu Ile Gly Ser Ser Ser
340 345 350
Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile Trp Asp Asn Glu Thr
355 360 365
Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Thr Asn
370 375 380
Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val
385 390 395 400
Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe Glu
405 410 415
Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val
420 425 430
Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys Cys
435 440 445
Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val Ser Asp Asn Arg Ser
450 455 460
Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg Cys Gln Pro Gly Phe
465 470 475 480
Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln Ala Leu Asn Lys Trp
485 490 495
Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys Gln Pro Pro Pro Asp
500 505 510
Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys Asp Asn Phe Ser Pro
515 520 525
Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp Leu Arg Gly
530 535 540
Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp Trp Ser Pro Ala Ala
545 550 555 560
Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe Met Gly Gln Leu Leu
565 570 575
Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln Leu Gly Ala Lys Val
580 585 590
Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser Ser Ala Ser
595 600 605
Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp Asn Ser Ser Val Pro
610 615 620
Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro Val Ile Pro Asn Gly
625 630 635 640
Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro Phe Gly Lys Thr Val
645 650 655
Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly Thr Ser Phe Asp Leu
660 665 670
Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp Pro Gln Gly Asn Gly
675 680 685
Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile Leu Gly His Cys Gln
690 695 700
Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys Thr Gln Thr Asn Ala
705 710 715 720
Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr Glu Cys Arg Pro Glu
725 730 735
Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu Asp Asn Leu Val Trp
740 745 750
Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser Cys Lys Thr Pro Pro
755 760 765
Asp Pro Val Asn Gly Met Val His Val Ile Thr Asp Ile Gln Val Gly
770 775 780
Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His Arg Leu Ile Gly His
785 790 795 800
Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala Ala His Trp Ser Thr
805 810 815
Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile
820 825 830
Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly
835 840 845
Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val
850 855 860
Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp
865 870 875 880
Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn
885 890 895
Lys Glu Asn Leu Tyr Phe Gln Gly His His His His His His
900 905 910
<210> 94
<211> 583
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 94
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser His Lys Phe
130 135 140
Met Ser Thr Ser Val Gly Asp Arg Val Ser Ile Thr Cys Lys Ala Ser
145 150 155 160
Gln Asp Val Gly Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln
165 170 175
Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg His Thr Gly Val
180 185 190
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
195 200 205
Ile Ser Asn Val Gln Ser Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln
210 215 220
Tyr Ser Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu
225 230 235 240
Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Cys Pro Ala Pro Ser
245 250 255
Gln Leu Pro Ser Ala Lys Pro Ile Asn Leu Thr Asp Glu Ser Met Phe
260 265 270
Pro Ile Gly Thr Tyr Leu Leu Tyr Glu Cys Leu Pro Gly Tyr Ile Lys
275 280 285
Arg Gln Phe Ser Ile Thr Cys Lys Gln Asp Ser Thr Trp Thr Ser Ala
290 295 300
Glu Asp Lys Cys Ile Arg Lys Gln Cys Lys Thr Pro Ser Asp Pro Glu
305 310 315 320
Asn Gly Leu Val His Val His Thr Gly Ile Gln Phe Gly Ser Arg Ile
325 330 335
Asn Tyr Thr Cys Asn Gln Gly Tyr Arg Leu Ile Gly Ser Ser Ser Ala
340 345 350
Val Cys Val Ile Thr Asp Gln Ser Val Asp Trp Asp Thr Glu Ala Pro
355 360 365
Ile Cys Glu Trp Ile Pro Cys Glu Ile Pro Pro Gly Ile Pro Asn Gly
370 375 380
Asp Phe Phe Ser Ser Thr Arg Glu Asp Phe His Tyr Gly Met Val Val
385 390 395 400
Thr Tyr Arg Cys Asn Thr Asp Ala Arg Gly Lys Ala Leu Phe Asn Leu
405 410 415
Val Gly Glu Pro Ser Leu Tyr Cys Thr Ser Asn Asp Gly Glu Ile Gly
420 425 430
Val Trp Ser Gly Pro Pro Pro Gln Cys Ile Glu Leu Asn Lys Cys Thr
435 440 445
Pro Pro Pro Tyr Val Glu Asn Ala Val Met Leu Ser Glu Asn Arg Ser
450 455 460
Leu Phe Ser Leu Arg Asp Ile Val Glu Phe Arg Cys His Pro Gly Phe
465 470 475 480
Ile Met Lys Gly Ala Ser Ser Val His Cys Gln Ser Leu Asn Lys Trp
485 490 495
Glu Pro Glu Leu Pro Ser Cys Phe Lys Gly Val Ile Cys Arg Leu Pro
500 505 510
Gln Glu Met Ser Gly Phe Gln Lys Gly Leu Gly Met Lys Lys Glu Tyr
515 520 525
Tyr Tyr Gly Glu Asn Val Thr Leu Glu Cys Glu Asp Gly Tyr Thr Leu
530 535 540
Glu Gly Ser Ser Gln Ser Gln Cys Gln Ser Asp Gly Ser Trp Asn Pro
545 550 555 560
Leu Leu Ala Lys Cys Val Ser Arg Ser Ile Glu Asn Leu Tyr Phe Gln
565 570 575
Gly His His His His His His
580
<210> 95
<211> 1098
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 95
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr Glu Lys Ser Leu Ser His Ser Pro Gly Gly Gly Gly Gly Ser Gly
435 440 445
Gly Gly Gly Ser Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg
450 455 460
Pro Thr Asn Leu Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu
465 470 475 480
Asn Tyr Glu Cys Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile
485 490 495
Cys Leu Lys Asn Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg
500 505 510
Lys Ser Cys Arg Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val
515 520 525
Ile Lys Gly Ile Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys
530 535 540
Gly Tyr Arg Leu Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly
545 550 555 560
Asp Thr Val Ile Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro
565 570 575
Cys Gly Leu Pro Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn
580 585 590
Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro
595 600 605
Gly Ser Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile
610 615 620
Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala
625 630 635 640
Pro Gln Cys Ile Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn
645 650 655
Gly Ile Leu Val Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val
660 665 670
Val Glu Phe Arg Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg
675 680 685
Val Lys Cys Gln Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys
690 695 700
Ser Arg Val Cys Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr
705 710 715 720
Gln Arg Asp Lys Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser
725 730 735
Cys Glu Pro Gly Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr
740 745 750
Pro Gln Gly Asp Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser
755 760 765
Cys Asp Asp Phe Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro
770 775 780
Val Asn Leu Gln Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly
785 790 795 800
Phe Gln Leu Lys Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met
805 810 815
Glu Ser Leu Trp Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys
820 825 830
Pro Ser Pro Pro Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu
835 840 845
Glu Val Phe Pro Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His
850 855 860
Pro Asp Arg Gly Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg
865 870 875 880
Cys Thr Ser Asp Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro
885 890 895
Arg Cys Gly Ile Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe
900 905 910
Ala Lys Leu Lys Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr
915 920 925
Ser Leu Lys Tyr Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser
930 935 940
Ile Thr Cys Leu Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys
945 950 955 960
Lys Arg Lys Ser Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val
965 970 975
His Val Ile Thr Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys
980 985 990
Thr Thr Gly His Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu
995 1000 1005
Ser Gly Asn Ala Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln
1010 1015 1020
Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe
1025 1030 1035
Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr
1040 1045 1050
Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe Glu Leu
1055 1060 1065
Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val
1070 1075 1080
Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys
1085 1090 1095
<210> 96
<211> 1098
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 96
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr Glu Lys Ser Leu Ser His Ser Pro Gly Gly Gly Gly Gly Ser Gly
435 440 445
Gly Gly Gly Ser Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg
450 455 460
Pro Thr Asn Leu Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu
465 470 475 480
Asn Tyr Glu Cys Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile
485 490 495
Cys Leu Lys Asn Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg
500 505 510
Lys Ser Cys Arg Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val
515 520 525
Ile Lys Gly Ile Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys
530 535 540
Gly Tyr Arg Leu Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly
545 550 555 560
Asp Thr Val Ile Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro
565 570 575
Cys Gly Leu Pro Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn
580 585 590
Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro
595 600 605
Gly Ser Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile
610 615 620
Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala
625 630 635 640
Pro Gln Cys Ile Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn
645 650 655
Gly Ile Leu Val Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val
660 665 670
Val Glu Phe Arg Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg
675 680 685
Val Lys Cys Gln Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys
690 695 700
Ser Arg Val Cys Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr
705 710 715 720
Gln Arg Asp Lys Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser
725 730 735
Cys Glu Pro Gly Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr
740 745 750
Pro Gln Gly Asp Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser
755 760 765
Cys Asp Asp Phe Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro
770 775 780
Val Asn Leu Gln Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly
785 790 795 800
Phe Gln Leu Lys Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met
805 810 815
Glu Ser Leu Trp Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys
820 825 830
Pro Ser Pro Pro Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu
835 840 845
Glu Val Phe Pro Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His
850 855 860
Pro Asp Arg Gly Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg
865 870 875 880
Cys Thr Ser Asp Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro
885 890 895
Arg Cys Gly Ile Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe
900 905 910
Ala Lys Leu Lys Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr
915 920 925
Ser Leu Lys Tyr Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser
930 935 940
Ile Thr Cys Leu Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys
945 950 955 960
Lys Arg Lys Ser Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val
965 970 975
His Val Ile Thr Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys
980 985 990
Thr Thr Gly His Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu
995 1000 1005
Ser Gly Asn Ala Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln
1010 1015 1020
Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe
1025 1030 1035
Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr
1040 1045 1050
Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe Glu Leu
1055 1060 1065
Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val
1070 1075 1080
Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys
1085 1090 1095
<210> 97
<211> 1098
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 97
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Ser Cys Ala Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Val Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr Glu Lys Ser Leu Ser His Ser Pro Gly Gly Gly Gly Gly Ser Gly
435 440 445
Gly Gly Gly Ser Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg
450 455 460
Pro Thr Asn Leu Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu
465 470 475 480
Asn Tyr Glu Cys Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile
485 490 495
Cys Leu Lys Asn Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg
500 505 510
Lys Ser Cys Arg Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val
515 520 525
Ile Lys Gly Ile Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys
530 535 540
Gly Tyr Arg Leu Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly
545 550 555 560
Asp Thr Val Ile Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro
565 570 575
Cys Gly Leu Pro Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn
580 585 590
Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro
595 600 605
Gly Ser Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile
610 615 620
Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala
625 630 635 640
Pro Gln Cys Ile Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn
645 650 655
Gly Ile Leu Val Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val
660 665 670
Val Glu Phe Arg Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg
675 680 685
Val Lys Cys Gln Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys
690 695 700
Ser Arg Val Cys Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr
705 710 715 720
Gln Arg Asp Lys Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser
725 730 735
Cys Glu Pro Gly Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr
740 745 750
Pro Gln Gly Asp Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser
755 760 765
Cys Asp Asp Phe Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro
770 775 780
Val Asn Leu Gln Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly
785 790 795 800
Phe Gln Leu Lys Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met
805 810 815
Glu Ser Leu Trp Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys
820 825 830
Pro Ser Pro Pro Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu
835 840 845
Glu Val Phe Pro Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His
850 855 860
Pro Asp Arg Gly Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg
865 870 875 880
Cys Thr Ser Asp Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro
885 890 895
Arg Cys Gly Ile Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe
900 905 910
Ala Lys Leu Lys Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr
915 920 925
Ser Leu Lys Tyr Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser
930 935 940
Ile Thr Cys Leu Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys
945 950 955 960
Lys Arg Lys Ser Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val
965 970 975
His Val Ile Thr Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys
980 985 990
Thr Thr Gly His Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu
995 1000 1005
Ser Gly Asn Ala Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln
1010 1015 1020
Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe
1025 1030 1035
Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr
1040 1045 1050
Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe Glu Leu
1055 1060 1065
Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val
1070 1075 1080
Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys
1085 1090 1095
<210> 98
<211> 442
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 98
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr Glu Lys Ser Leu Ser His Ser Pro Gly
435 440
<210> 99
<211> 442
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 99
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Trp Cys Met Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr Glu Lys Ser Leu Ser His Ser Pro Gly
435 440
<210> 100
<211> 551
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 100
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Gly Gly
210 215 220
Gly Gly Ser Gly Gly Gly Gly Ser Cys Pro Ala Pro Ser Gln Leu Pro
225 230 235 240
Ser Ala Lys Pro Ile Asn Leu Thr Asp Glu Ser Met Phe Pro Ile Gly
245 250 255
Thr Tyr Leu Leu Tyr Glu Cys Leu Pro Gly Tyr Ile Lys Arg Gln Phe
260 265 270
Ser Ile Thr Cys Lys Gln Asp Ser Thr Trp Thr Ser Ala Glu Asp Lys
275 280 285
Cys Ile Arg Lys Gln Cys Lys Thr Pro Ser Asp Pro Glu Asn Gly Leu
290 295 300
Val His Val His Thr Gly Ile Gln Phe Gly Ser Arg Ile Asn Tyr Thr
305 310 315 320
Cys Asn Gln Gly Tyr Arg Leu Ile Gly Ser Ser Ser Ala Val Cys Val
325 330 335
Ile Thr Asp Gln Ser Val Asp Trp Asp Thr Glu Ala Pro Ile Cys Glu
340 345 350
Trp Ile Pro Cys Glu Ile Pro Pro Gly Ile Pro Asn Gly Asp Phe Phe
355 360 365
Ser Ser Thr Arg Glu Asp Phe His Tyr Gly Met Val Val Thr Tyr Arg
370 375 380
Cys Asn Thr Asp Ala Arg Gly Lys Ala Leu Phe Asn Leu Val Gly Glu
385 390 395 400
Pro Ser Leu Tyr Cys Thr Ser Asn Asp Gly Glu Ile Gly Val Trp Ser
405 410 415
Gly Pro Pro Pro Gln Cys Ile Glu Leu Asn Lys Cys Thr Pro Pro Pro
420 425 430
Tyr Val Glu Asn Ala Val Met Leu Ser Glu Asn Arg Ser Leu Phe Ser
435 440 445
Leu Arg Asp Ile Val Glu Phe Arg Cys His Pro Gly Phe Ile Met Lys
450 455 460
Gly Ala Ser Ser Val His Cys Gln Ser Leu Asn Lys Trp Glu Pro Glu
465 470 475 480
Leu Pro Ser Cys Phe Lys Gly Val Ile Cys Arg Leu Pro Gln Glu Met
485 490 495
Ser Gly Phe Gln Lys Gly Leu Gly Met Lys Lys Glu Tyr Tyr Tyr Gly
500 505 510
Glu Asn Val Thr Leu Glu Cys Glu Asp Gly Tyr Thr Leu Glu Gly Ser
515 520 525
Ser Gln Ser Gln Cys Gln Ser Asp Gly Ser Trp Asn Pro Leu Leu Ala
530 535 540
Lys Cys Val Ser Arg Ser Ile
545 550
<210> 101
<211> 878
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 101
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Gly Gly
210 215 220
Gly Gly Ser Gly Gly Gly Gly Ser Gln Cys Asn Ala Pro Glu Trp Leu
225 230 235 240
Pro Phe Ala Arg Pro Thr Asn Leu Thr Asp Glu Phe Glu Phe Pro Ile
245 250 255
Gly Thr Tyr Leu Asn Tyr Glu Cys Arg Pro Gly Tyr Ser Gly Arg Pro
260 265 270
Phe Ser Ile Ile Cys Leu Lys Asn Ser Val Trp Thr Gly Ala Lys Asp
275 280 285
Arg Cys Arg Arg Lys Ser Cys Arg Asn Pro Pro Asp Pro Val Asn Gly
290 295 300
Met Val His Val Ile Lys Gly Ile Gln Phe Gly Ser Gln Ile Lys Tyr
305 310 315 320
Ser Cys Thr Lys Gly Tyr Arg Leu Ile Gly Ser Ser Ser Ala Thr Cys
325 330 335
Ile Ile Ser Gly Asp Thr Val Ile Trp Asp Asn Glu Thr Pro Ile Cys
340 345 350
Asp Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Thr Asn Gly Asp Phe
355 360 365
Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr Tyr
370 375 380
Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe Glu Leu Val Gly
385 390 395 400
Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile Trp
405 410 415
Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys Cys Thr Pro Pro
420 425 430
Asn Val Glu Asn Gly Ile Leu Val Ser Asp Asn Arg Ser Leu Phe Ser
435 440 445
Leu Asn Glu Val Val Glu Phe Arg Cys Gln Pro Gly Phe Val Met Lys
450 455 460
Gly Pro Arg Arg Val Lys Cys Gln Ala Leu Asn Lys Trp Glu Pro Glu
465 470 475 480
Leu Pro Ser Cys Ser Arg Val Cys Gln Pro Pro Pro Asp Val Leu His
485 490 495
Ala Glu Arg Thr Gln Arg Asp Lys Asp Asn Phe Ser Pro Gly Gln Glu
500 505 510
Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp Leu Arg Gly Ala Ala Ser
515 520 525
Met Arg Cys Thr Pro Gln Gly Asp Trp Ser Pro Ala Ala Pro Thr Cys
530 535 540
Glu Val Lys Ser Cys Asp Asp Phe Met Gly Gln Leu Leu Asn Gly Arg
545 550 555 560
Val Leu Phe Pro Val Asn Leu Gln Leu Gly Ala Lys Val Asp Phe Val
565 570 575
Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser Ser Ala Ser Tyr Cys Val
580 585 590
Leu Ala Gly Met Glu Ser Leu Trp Asn Ser Ser Val Pro Val Cys Glu
595 600 605
Gln Ile Phe Cys Pro Ser Pro Pro Val Ile Pro Asn Gly Arg His Thr
610 615 620
Gly Lys Pro Leu Glu Val Phe Pro Phe Gly Lys Thr Val Asn Tyr Thr
625 630 635 640
Cys Asp Pro His Pro Asp Arg Gly Thr Ser Phe Asp Leu Ile Gly Glu
645 650 655
Ser Thr Ile Arg Cys Thr Ser Asp Pro Gln Gly Asn Gly Val Trp Ser
660 665 670
Ser Pro Ala Pro Arg Cys Gly Ile Leu Gly His Cys Gln Ala Pro Asp
675 680 685
His Phe Leu Phe Ala Lys Leu Lys Thr Gln Thr Asn Ala Ser Asp Phe
690 695 700
Pro Ile Gly Thr Ser Leu Lys Tyr Glu Cys Arg Pro Glu Tyr Tyr Gly
705 710 715 720
Arg Pro Phe Ser Ile Thr Cys Leu Asp Asn Leu Val Trp Ser Ser Pro
725 730 735
Lys Asp Val Cys Lys Arg Lys Ser Cys Lys Thr Pro Pro Asp Pro Val
740 745 750
Asn Gly Met Val His Val Ile Thr Asp Ile Gln Val Gly Ser Arg Ile
755 760 765
Asn Tyr Ser Cys Thr Thr Gly His Arg Leu Ile Gly His Ser Ser Ala
770 775 780
Glu Cys Ile Leu Ser Gly Asn Ala Ala His Trp Ser Thr Lys Pro Pro
785 790 795 800
Ile Cys Gln Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Ala Asn Gly
805 810 815
Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val
820 825 830
Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe Glu Leu
835 840 845
Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly
850 855 860
Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys
865 870 875
<210> 102
<211> 1328
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 102
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Gly Gly
210 215 220
Gly Gly Ser Gly Gly Gly Gly Ser Gln Cys Asn Ala Pro Glu Trp Leu
225 230 235 240
Pro Phe Ala Arg Pro Thr Asn Leu Thr Asp Glu Phe Glu Phe Pro Ile
245 250 255
Gly Thr Tyr Leu Asn Tyr Glu Cys Arg Pro Gly Tyr Ser Gly Arg Pro
260 265 270
Phe Ser Ile Ile Cys Leu Lys Asn Ser Val Trp Thr Gly Ala Lys Asp
275 280 285
Arg Cys Arg Arg Lys Ser Cys Arg Asn Pro Pro Asp Pro Val Asn Gly
290 295 300
Met Val His Val Ile Lys Gly Ile Gln Phe Gly Ser Gln Ile Lys Tyr
305 310 315 320
Ser Cys Thr Lys Gly Tyr Arg Leu Ile Gly Ser Ser Ser Ala Thr Cys
325 330 335
Ile Ile Ser Gly Asp Thr Val Ile Trp Asp Asn Glu Thr Pro Ile Cys
340 345 350
Asp Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Thr Asn Gly Asp Phe
355 360 365
Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr Tyr
370 375 380
Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe Glu Leu Val Gly
385 390 395 400
Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile Trp
405 410 415
Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys Cys Thr Pro Pro
420 425 430
Asn Val Glu Asn Gly Ile Leu Val Ser Asp Asn Arg Ser Leu Phe Ser
435 440 445
Leu Asn Glu Val Val Glu Phe Arg Cys Gln Pro Gly Phe Val Met Lys
450 455 460
Gly Pro Arg Arg Val Lys Cys Gln Ala Leu Asn Lys Trp Glu Pro Glu
465 470 475 480
Leu Pro Ser Cys Ser Arg Val Cys Gln Pro Pro Pro Asp Val Leu His
485 490 495
Ala Glu Arg Thr Gln Arg Asp Lys Asp Asn Phe Ser Pro Gly Gln Glu
500 505 510
Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp Leu Arg Gly Ala Ala Ser
515 520 525
Met Arg Cys Thr Pro Gln Gly Asp Trp Ser Pro Ala Ala Pro Thr Cys
530 535 540
Glu Val Lys Ser Cys Asp Asp Phe Met Gly Gln Leu Leu Asn Gly Arg
545 550 555 560
Val Leu Phe Pro Val Asn Leu Gln Leu Gly Ala Lys Val Asp Phe Val
565 570 575
Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser Ser Ala Ser Tyr Cys Val
580 585 590
Leu Ala Gly Met Glu Ser Leu Trp Asn Ser Ser Val Pro Val Cys Glu
595 600 605
Gln Ile Phe Cys Pro Ser Pro Pro Val Ile Pro Asn Gly Arg His Thr
610 615 620
Gly Lys Pro Leu Glu Val Phe Pro Phe Gly Lys Thr Val Asn Tyr Thr
625 630 635 640
Cys Asp Pro His Pro Asp Arg Gly Thr Ser Phe Asp Leu Ile Gly Glu
645 650 655
Ser Thr Ile Arg Cys Thr Ser Asp Pro Gln Gly Asn Gly Val Trp Ser
660 665 670
Ser Pro Ala Pro Arg Cys Gly Ile Leu Gly His Cys Gln Ala Pro Asp
675 680 685
His Phe Leu Phe Ala Lys Leu Lys Thr Gln Thr Asn Ala Ser Asp Phe
690 695 700
Pro Ile Gly Thr Ser Leu Lys Tyr Glu Cys Arg Pro Glu Tyr Tyr Gly
705 710 715 720
Arg Pro Phe Ser Ile Thr Cys Leu Asp Asn Leu Val Trp Ser Ser Pro
725 730 735
Lys Asp Val Cys Lys Arg Lys Ser Cys Lys Thr Pro Pro Asp Pro Val
740 745 750
Asn Gly Met Val His Val Ile Thr Asp Ile Gln Val Gly Ser Arg Ile
755 760 765
Asn Tyr Ser Cys Thr Thr Gly His Arg Leu Ile Gly His Ser Ser Ala
770 775 780
Glu Cys Ile Leu Ser Gly Asn Ala Ala His Trp Ser Thr Lys Pro Pro
785 790 795 800
Ile Cys Gln Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Ala Asn Gly
805 810 815
Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val
820 825 830
Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe Glu Leu
835 840 845
Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly
850 855 860
Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys Cys Thr
865 870 875 880
Pro Pro Asn Val Glu Asn Gly Ile Leu Val Ser Asp Asn Arg Ser Leu
885 890 895
Phe Ser Leu Asn Glu Val Val Glu Phe Arg Cys Gln Pro Gly Phe Val
900 905 910
Met Lys Gly Pro Arg Arg Val Lys Cys Gln Ala Leu Asn Lys Trp Glu
915 920 925
Pro Glu Leu Pro Ser Cys Ser Arg Val Cys Gln Pro Pro Pro Asp Val
930 935 940
Leu His Ala Glu Arg Thr Gln Arg Asp Lys Asp Asn Phe Ser Pro Gly
945 950 955 960
Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp Leu Arg Gly Ala
965 970 975
Ala Ser Met Arg Cys Thr Pro Gln Gly Asp Trp Ser Pro Ala Ala Pro
980 985 990
Thr Cys Glu Val Lys Ser Cys Asp Asp Phe Met Gly Gln Leu Leu Asn
995 1000 1005
Gly Arg Val Leu Phe Pro Val Asn Leu Gln Leu Gly Ala Lys Val
1010 1015 1020
Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser Ser Ala
1025 1030 1035
Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp Asn Ser Ser
1040 1045 1050
Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro Val Ile
1055 1060 1065
Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro Phe
1070 1075 1080
Gly Lys Ala Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
1085 1090 1095
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser
1100 1105 1110
Asp Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys
1115 1120 1125
Gly Ile Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala
1130 1135 1140
Lys Leu Lys Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr
1145 1150 1155
Ser Leu Lys Tyr Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe
1160 1165 1170
Ser Ile Thr Cys Leu Asp Asn Leu Val Trp Ser Ser Pro Lys Asp
1175 1180 1185
Val Cys Lys Arg Lys Ser Cys Lys Thr Pro Pro Asp Pro Val Asn
1190 1195 1200
Gly Met Val His Val Ile Thr Asp Ile Gln Val Gly Ser Arg Ile
1205 1210 1215
Asn Tyr Ser Cys Thr Thr Gly His Arg Leu Ile Gly His Ser Ser
1220 1225 1230
Ala Glu Cys Ile Leu Ser Gly Asn Thr Ala His Trp Ser Thr Lys
1235 1240 1245
Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile
1250 1255 1260
Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr
1265 1270 1275
Gly Ser Val Val Thr Tyr Arg Cys Asn Leu Gly Ser Arg Gly Arg
1280 1285 1290
Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
1295 1300 1305
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys
1310 1315 1320
Ile Ile Pro Asn Lys
1325
<210> 103
<211> 877
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 103
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
1 5 10 15
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
20 25 30
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
35 40 45
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
50 55 60
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
65 70 75 80
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
85 90 95
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
100 105 110
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
115 120 125
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
130 135 140
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
145 150 155 160
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
165 170 175
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
180 185 190
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
195 200 205
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
210 215 220
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
225 230 235 240
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
245 250 255
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
260 265 270
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
275 280 285
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
290 295 300
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
305 310 315 320
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
325 330 335
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
340 345 350
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
355 360 365
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
370 375 380
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
385 390 395 400
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
405 410 415
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
420 425 430
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
435 440 445
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
450 455 460
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
465 470 475 480
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
485 490 495
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
500 505 510
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
515 520 525
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
530 535 540
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
545 550 555 560
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
565 570 575
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
580 585 590
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
595 600 605
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
610 615 620
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
625 630 635 640
Cys Ile Ile Pro Asn Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
645 650 655
Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe
660 665 670
Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro
675 680 685
Lys Val Thr Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val
690 695 700
Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr
705 710 715 720
Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu
725 730 735
Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys
740 745 750
Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser
755 760 765
Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro
770 775 780
Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser Leu Ser Cys Ala Ile
785 790 795 800
Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly
805 810 815
Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp
820 825 830
Gly Ser Tyr Phe Val Val Ser Lys Leu Asn Val Gln Lys Ser Asn Trp
835 840 845
Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His
850 855 860
Asn His His Thr Glu Lys Ser Leu Ser His Ser Pro Gly
865 870 875
<210> 104
<211> 1098
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 104
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
1 5 10 15
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
20 25 30
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
35 40 45
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
50 55 60
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
65 70 75 80
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
85 90 95
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
100 105 110
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
115 120 125
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
130 135 140
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
145 150 155 160
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
165 170 175
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
180 185 190
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
195 200 205
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
210 215 220
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
225 230 235 240
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
245 250 255
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
260 265 270
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
275 280 285
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
290 295 300
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
305 310 315 320
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
325 330 335
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
340 345 350
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
355 360 365
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
370 375 380
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
385 390 395 400
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
405 410 415
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
420 425 430
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
435 440 445
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
450 455 460
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
465 470 475 480
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
485 490 495
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
500 505 510
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
515 520 525
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
530 535 540
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
545 550 555 560
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
565 570 575
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
580 585 590
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
595 600 605
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
610 615 620
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
625 630 635 640
Cys Ile Ile Pro Asn Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
645 650 655
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
660 665 670
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
675 680 685
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
690 695 700
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
705 710 715 720
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
725 730 735
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
740 745 750
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
755 760 765
Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
770 775 780
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
785 790 795 800
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
805 810 815
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
820 825 830
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
835 840 845
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
850 855 860
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
865 870 875 880
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
885 890 895
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
900 905 910
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
915 920 925
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
930 935 940
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
945 950 955 960
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
965 970 975
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
980 985 990
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
995 1000 1005
Gln Met Ala Lys Asp Lys Val Ser Leu Ser Cys Ala Ile Thr Asp
1010 1015 1020
Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln
1025 1030 1035
Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp
1040 1045 1050
Gly Ser Tyr Phe Val Val Ser Lys Leu Asn Val Gln Lys Ser Asn
1055 1060 1065
Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly
1070 1075 1080
Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser Pro Gly
1085 1090 1095
<210> 105
<211> 878
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 105
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
1 5 10 15
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
20 25 30
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
35 40 45
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
50 55 60
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
65 70 75 80
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
85 90 95
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
100 105 110
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
115 120 125
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
130 135 140
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
145 150 155 160
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
165 170 175
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
180 185 190
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
195 200 205
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
210 215 220
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
225 230 235 240
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
245 250 255
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
260 265 270
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
275 280 285
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
290 295 300
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
305 310 315 320
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
325 330 335
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
340 345 350
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
355 360 365
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
370 375 380
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
385 390 395 400
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
405 410 415
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
420 425 430
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
435 440 445
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
450 455 460
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
465 470 475 480
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
485 490 495
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
500 505 510
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
515 520 525
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
530 535 540
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
545 550 555 560
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
565 570 575
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
580 585 590
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
595 600 605
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
610 615 620
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
625 630 635 640
Cys Ile Ile Pro Asn Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
645 650 655
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
660 665 670
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
675 680 685
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
690 695 700
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
705 710 715 720
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
725 730 735
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
740 745 750
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
755 760 765
Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
770 775 780
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
785 790 795 800
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
805 810 815
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
820 825 830
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
835 840 845
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
850 855 860
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly
865 870 875
<210> 106
<211> 1328
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 106
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
1 5 10 15
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
20 25 30
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
35 40 45
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
50 55 60
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
65 70 75 80
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
85 90 95
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
100 105 110
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
115 120 125
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
130 135 140
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
145 150 155 160
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
165 170 175
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
180 185 190
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
195 200 205
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
210 215 220
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
225 230 235 240
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
245 250 255
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
260 265 270
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
275 280 285
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
290 295 300
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
305 310 315 320
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
325 330 335
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
340 345 350
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
355 360 365
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
370 375 380
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
385 390 395 400
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
405 410 415
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
420 425 430
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
435 440 445
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
450 455 460
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
465 470 475 480
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
485 490 495
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
500 505 510
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
515 520 525
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
530 535 540
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
545 550 555 560
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
565 570 575
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
580 585 590
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
595 600 605
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
610 615 620
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
625 630 635 640
Cys Ile Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile
645 650 655
Leu Val Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu
660 665 670
Phe Arg Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys
675 680 685
Cys Gln Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg
690 695 700
Val Cys Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg
705 710 715 720
Asp Lys Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu
725 730 735
Pro Gly Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln
740 745 750
Gly Asp Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp
755 760 765
Asp Phe Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn
770 775 780
Leu Gln Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln
785 790 795 800
Leu Lys Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser
805 810 815
Leu Trp Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser
820 825 830
Pro Pro Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val
835 840 845
Phe Pro Phe Gly Lys Ala Val Asn Tyr Thr Cys Asp Pro His Pro Asp
850 855 860
Arg Gly Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr
865 870 875 880
Ser Asp Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys
885 890 895
Gly Ile Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys
900 905 910
Leu Lys Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu
915 920 925
Lys Tyr Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr
930 935 940
Cys Leu Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg
945 950 955 960
Lys Ser Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val
965 970 975
Ile Thr Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr
980 985 990
Gly His Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly
995 1000 1005
Asn Thr Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile
1010 1015 1020
Pro Cys Gly Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser
1025 1030 1035
Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg
1040 1045 1050
Cys Asn Leu Gly Ser Arg Gly Arg Lys Val Phe Glu Leu Val Gly
1055 1060 1065
Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile
1070 1075 1080
Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys Gly Gly
1085 1090 1095
Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Gln Gln Pro
1100 1105 1110
Gly Thr Glu Leu Val Lys Pro Gly Ala Ser Val Lys Leu Ser Cys
1115 1120 1125
Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Trp Met His Trp Val
1130 1135 1140
Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile Gly Asn Ile Asn
1145 1150 1155
Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe Lys Ser Lys
1160 1165 1170
Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr Met Gln
1175 1180 1185
Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys Ala
1190 1195 1200
Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
1205 1210 1215
Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val
1220 1225 1230
Tyr Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val
1235 1240 1245
Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr
1250 1255 1260
Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe
1265 1270 1275
Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val
1280 1285 1290
Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr Cys Asn
1295 1300 1305
Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile Val
1310 1315 1320
Pro Arg Asp Cys Gly
1325
<210> 107
<211> 870
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 107
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
1 5 10 15
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
20 25 30
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
35 40 45
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
50 55 60
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
65 70 75 80
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
85 90 95
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
100 105 110
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
115 120 125
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
130 135 140
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
145 150 155 160
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
165 170 175
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
180 185 190
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
195 200 205
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
210 215 220
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
225 230 235 240
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
245 250 255
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
260 265 270
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
275 280 285
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
290 295 300
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
305 310 315 320
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
325 330 335
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
340 345 350
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
355 360 365
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
370 375 380
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
385 390 395 400
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
405 410 415
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
420 425 430
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
435 440 445
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
450 455 460
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
465 470 475 480
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
485 490 495
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
500 505 510
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
515 520 525
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
530 535 540
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
545 550 555 560
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
565 570 575
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
580 585 590
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
595 600 605
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
610 615 620
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
625 630 635 640
Cys Ile Ile Pro Asn Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
645 650 655
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
660 665 670
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
675 680 685
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
690 695 700
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp Arg Phe Thr Gly
705 710 715 720
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Val Gln Ser
725 730 735
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Leu
740 745 750
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Ala Asp Ala Ala
755 760 765
Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln Leu Thr Ser Gly
770 775 780
Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr Pro Lys Asp Ile
785 790 795 800
Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln Asn Gly Val Leu
805 810 815
Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr Tyr Ser Met Ser
820 825 830
Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg His Asn Ser Tyr
835 840 845
Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro Ile Val Lys Ser
850 855 860
Phe Asn Arg Asn Glu Cys
865 870
<210> 108
<211> 318
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 108
Glu Asp Cys Asn Glu Leu Pro Pro Arg Arg Asn Thr Glu Ile Leu Thr
1 5 10 15
Gly Ser Trp Ser Asp Gln Thr Tyr Pro Glu Gly Thr Gln Ala Ile Tyr
20 25 30
Lys Cys Arg Pro Gly Tyr Arg Ser Leu Gly Asn Val Ile Met Val Cys
35 40 45
Arg Lys Gly Glu Trp Val Ala Leu Asn Pro Leu Arg Lys Cys Gln Lys
50 55 60
Arg Pro Cys Gly His Pro Gly Asp Thr Pro Phe Gly Thr Phe Thr Leu
65 70 75 80
Thr Gly Gly Asn Val Phe Glu Tyr Gly Val Lys Ala Val Tyr Thr Cys
85 90 95
Asn Glu Gly Tyr Gln Leu Leu Gly Glu Ile Asn Tyr Arg Glu Cys Asp
100 105 110
Thr Asp Gly Trp Thr Asn Asp Ile Pro Ile Cys Glu Val Val Lys Cys
115 120 125
Leu Pro Val Thr Ala Pro Glu Asn Gly Lys Ile Val Ser Ser Ala Met
130 135 140
Glu Pro Asp Arg Glu Tyr His Phe Gly Gln Ala Val Arg Phe Val Cys
145 150 155 160
Asn Ser Gly Tyr Lys Ile Glu Gly Asp Glu Glu Met His Cys Ser Asp
165 170 175
Asp Gly Phe Trp Ser Lys Glu Lys Pro Lys Cys Val Glu Ile Ser Cys
180 185 190
Lys Ser Pro Asp Val Ile Asn Gly Ser Pro Ile Ser Gln Lys Ile Ile
195 200 205
Tyr Lys Glu Asn Glu Arg Phe Gln Tyr Lys Cys Asn Met Gly Tyr Glu
210 215 220
Tyr Ser Glu Arg Gly Asp Ala Val Cys Thr Glu Ser Gly Trp Arg Pro
225 230 235 240
Leu Pro Ser Cys Glu Glu Lys Ser Cys Asp Asn Pro Tyr Ile Pro Asn
245 250 255
Gly Asp Tyr Ser Pro Leu Arg Ile Lys His Arg Thr Gly Asp Glu Ile
260 265 270
Thr Tyr Gln Cys Arg Asn Gly Phe Tyr Pro Ala Thr Arg Gly Asn Thr
275 280 285
Ala Lys Cys Thr Ser Thr Gly Trp Ile Pro Ala Pro Arg Cys Thr Leu
290 295 300
Lys Glu Asn Leu Tyr Phe Gln Gly His His His His His His
305 310 315
<210> 109
<211> 558
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 109
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Gly Gly Pro Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser
100 105 110
Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser
115 120 125
Ala Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr
165 170 175
Leu Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr
180 185 190
Val Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys
195 200 205
Lys Ile Val Pro Arg Asp Cys Gly Gly Gly Gly Gly Ser Gly Gly Gly
210 215 220
Gly Ser Cys Pro Ala Pro Ser Gln Leu Pro Ser Ala Lys Pro Ile Asn
225 230 235 240
Leu Thr Asp Glu Ser Met Phe Pro Ile Gly Thr Tyr Leu Leu Tyr Glu
245 250 255
Cys Leu Pro Gly Tyr Ile Lys Arg Gln Phe Ser Ile Thr Cys Lys Gln
260 265 270
Asp Ser Thr Trp Thr Ser Ala Glu Asp Lys Cys Ile Arg Lys Gln Cys
275 280 285
Lys Thr Pro Ser Asp Pro Glu Asn Gly Leu Val His Val His Thr Gly
290 295 300
Ile Gln Phe Gly Ser Arg Ile Asn Tyr Thr Cys Asn Gln Gly Tyr Arg
305 310 315 320
Leu Ile Gly Ser Ser Ser Ala Val Cys Val Ile Thr Asp Gln Ser Val
325 330 335
Asp Trp Asp Thr Glu Ala Pro Ile Cys Glu Trp Ile Pro Cys Glu Ile
340 345 350
Pro Pro Gly Ile Pro Asn Gly Asp Phe Phe Ser Ser Thr Arg Glu Asp
355 360 365
Phe His Tyr Gly Met Val Val Thr Tyr Arg Cys Asn Thr Asp Ala Arg
370 375 380
Gly Lys Ala Leu Phe Asn Leu Val Gly Glu Pro Ser Leu Tyr Cys Thr
385 390 395 400
Ser Asn Asp Gly Glu Ile Gly Val Trp Ser Gly Pro Pro Pro Gln Cys
405 410 415
Ile Glu Leu Asn Lys Cys Thr Pro Pro Pro Tyr Val Glu Asn Ala Val
420 425 430
Met Leu Ser Glu Asn Arg Ser Leu Phe Ser Leu Arg Asp Ile Val Glu
435 440 445
Phe Arg Cys His Pro Gly Phe Ile Met Lys Gly Ala Ser Ser Val His
450 455 460
Cys Gln Ser Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Phe Lys
465 470 475 480
Gly Val Ile Cys Arg Leu Pro Gln Glu Met Ser Gly Phe Gln Lys Gly
485 490 495
Leu Gly Met Lys Lys Glu Tyr Tyr Tyr Gly Glu Asn Val Thr Leu Glu
500 505 510
Cys Glu Asp Gly Tyr Thr Leu Glu Gly Ser Ser Gln Ser Gln Cys Gln
515 520 525
Ser Asp Gly Ser Trp Asn Pro Leu Leu Ala Lys Cys Val Ser Arg Ser
530 535 540
Ile Glu Asn Leu Tyr Phe Gln Gly His His His His His His
545 550 555
<210> 110
<211> 885
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 110
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Gly Gly Pro Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser
100 105 110
Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser
115 120 125
Ala Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr
165 170 175
Leu Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr
180 185 190
Val Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys
195 200 205
Lys Ile Val Pro Arg Asp Cys Gly Gly Gly Gly Gly Ser Gly Gly Gly
210 215 220
Gly Ser Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr
225 230 235 240
Asn Leu Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr
245 250 255
Glu Cys Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu
260 265 270
Lys Asn Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser
275 280 285
Cys Arg Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys
290 295 300
Gly Ile Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr
305 310 315 320
Arg Leu Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr
325 330 335
Val Ile Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly
340 345 350
Leu Pro Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
355 360 365
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
370 375 380
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
385 390 395 400
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
405 410 415
Cys Ile Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile
420 425 430
Leu Val Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu
435 440 445
Phe Arg Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys
450 455 460
Cys Gln Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg
465 470 475 480
Val Cys Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg
485 490 495
Asp Lys Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu
500 505 510
Pro Gly Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln
515 520 525
Gly Asp Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp
530 535 540
Asp Phe Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn
545 550 555 560
Leu Gln Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln
565 570 575
Leu Lys Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser
580 585 590
Leu Trp Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser
595 600 605
Pro Pro Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val
610 615 620
Phe Pro Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp
625 630 635 640
Arg Gly Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr
645 650 655
Ser Asp Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys
660 665 670
Gly Ile Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys
675 680 685
Leu Lys Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu
690 695 700
Lys Tyr Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr
705 710 715 720
Cys Leu Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg
725 730 735
Lys Ser Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val
740 745 750
Ile Thr Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr
755 760 765
Gly His Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly
770 775 780
Asn Ala Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro
785 790 795 800
Cys Gly Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn
805 810 815
Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro
820 825 830
Gly Ser Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile
835 840 845
Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala
850 855 860
Pro Gln Cys Ile Ile Pro Asn Lys Glu Asn Leu Tyr Phe Gln Gly His
865 870 875 880
His His His His His
885
<210> 111
<211> 544
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 111
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Gly Gly Pro Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser
100 105 110
Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser
115 120 125
Ala Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr
165 170 175
Leu Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr
180 185 190
Val Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys
195 200 205
Lys Ile Val Pro Arg Asp Cys Gly Gly Gly Gly Gly Ser Gly Gly Gly
210 215 220
Gly Ser Glu Asp Cys Asn Glu Leu Pro Pro Arg Arg Asn Thr Glu Ile
225 230 235 240
Leu Thr Gly Ser Trp Ser Asp Gln Thr Tyr Pro Glu Gly Thr Gln Ala
245 250 255
Ile Tyr Lys Cys Arg Pro Gly Tyr Arg Ser Leu Gly Asn Val Ile Met
260 265 270
Val Cys Arg Lys Gly Glu Trp Val Ala Leu Asn Pro Leu Arg Lys Cys
275 280 285
Gln Lys Arg Pro Cys Gly His Pro Gly Asp Thr Pro Phe Gly Thr Phe
290 295 300
Thr Leu Thr Gly Gly Asn Val Phe Glu Tyr Gly Val Lys Ala Val Tyr
305 310 315 320
Thr Cys Asn Glu Gly Tyr Gln Leu Leu Gly Glu Ile Asn Tyr Arg Glu
325 330 335
Cys Asp Thr Asp Gly Trp Thr Asn Asp Ile Pro Ile Cys Glu Val Val
340 345 350
Lys Cys Leu Pro Val Thr Ala Pro Glu Asn Gly Lys Ile Val Ser Ser
355 360 365
Ala Met Glu Pro Asp Arg Glu Tyr His Phe Gly Gln Ala Val Arg Phe
370 375 380
Val Cys Asn Ser Gly Tyr Lys Ile Glu Gly Asp Glu Glu Met His Cys
385 390 395 400
Ser Asp Asp Gly Phe Trp Ser Lys Glu Lys Pro Lys Cys Val Glu Ile
405 410 415
Ser Cys Lys Ser Pro Asp Val Ile Asn Gly Ser Pro Ile Ser Gln Lys
420 425 430
Ile Ile Tyr Lys Glu Asn Glu Arg Phe Gln Tyr Lys Cys Asn Met Gly
435 440 445
Tyr Glu Tyr Ser Glu Arg Gly Asp Ala Val Cys Thr Glu Ser Gly Trp
450 455 460
Arg Pro Leu Pro Ser Cys Glu Glu Lys Ser Cys Asp Asn Pro Tyr Ile
465 470 475 480
Pro Asn Gly Asp Tyr Ser Pro Leu Arg Ile Lys His Arg Thr Gly Asp
485 490 495
Glu Ile Thr Tyr Gln Cys Arg Asn Gly Phe Tyr Pro Ala Thr Arg Gly
500 505 510
Asn Thr Ala Lys Cys Thr Ser Thr Gly Trp Ile Pro Ala Pro Arg Cys
515 520 525
Thr Leu Lys Glu Asn Leu Tyr Phe Gln Gly His His His His His His
530 535 540
<210> 112
<211> 436
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 112
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Gly Gly Pro Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser
100 105 110
Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser
115 120 125
Ala Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr
165 170 175
Leu Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr
180 185 190
Val Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys
195 200 205
Lys Ile Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val
210 215 220
Pro Glu Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val
225 230 235 240
Leu Thr Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile
245 250 255
Ser Lys Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val
260 265 270
Glu Val His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser
275 280 285
Thr Phe Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu
290 295 300
Asn Gly Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala
305 310 315 320
Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro
325 330 335
Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys
340 345 350
Val Ser Leu Trp Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr
355 360 365
Val Glu Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr
370 375 380
Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu
385 390 395 400
Asn Val Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser
405 410 415
Val Leu His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser
420 425 430
His Ser Pro Gly
435
<210> 113
<211> 764
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 113
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Gly Gly Pro Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser
100 105 110
Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser
115 120 125
Ala Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr
165 170 175
Leu Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr
180 185 190
Val Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys
195 200 205
Lys Ile Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val
210 215 220
Pro Glu Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val
225 230 235 240
Leu Thr Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile
245 250 255
Ser Lys Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val
260 265 270
Glu Val His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser
275 280 285
Thr Phe Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu
290 295 300
Asn Gly Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala
305 310 315 320
Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro
325 330 335
Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys
340 345 350
Val Ser Leu Ser Cys Ala Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr
355 360 365
Val Glu Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr
370 375 380
Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Val Ser Lys Leu
385 390 395 400
Asn Val Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser
405 410 415
Val Leu His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser
420 425 430
His Ser Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Asp
435 440 445
Cys Asn Glu Leu Pro Pro Arg Arg Asn Thr Glu Ile Leu Thr Gly Ser
450 455 460
Trp Ser Asp Gln Thr Tyr Pro Glu Gly Thr Gln Ala Ile Tyr Lys Cys
465 470 475 480
Arg Pro Gly Tyr Arg Ser Leu Gly Asn Val Ile Met Val Cys Arg Lys
485 490 495
Gly Glu Trp Val Ala Leu Asn Pro Leu Arg Lys Cys Gln Lys Arg Pro
500 505 510
Cys Gly His Pro Gly Asp Thr Pro Phe Gly Thr Phe Thr Leu Thr Gly
515 520 525
Gly Asn Val Phe Glu Tyr Gly Val Lys Ala Val Tyr Thr Cys Asn Glu
530 535 540
Gly Tyr Gln Leu Leu Gly Glu Ile Asn Tyr Arg Glu Cys Asp Thr Asp
545 550 555 560
Gly Trp Thr Asn Asp Ile Pro Ile Cys Glu Val Val Lys Cys Leu Pro
565 570 575
Val Thr Ala Pro Glu Asn Gly Lys Ile Val Ser Ser Ala Met Glu Pro
580 585 590
Asp Arg Glu Tyr His Phe Gly Gln Ala Val Arg Phe Val Cys Asn Ser
595 600 605
Gly Tyr Lys Ile Glu Gly Asp Glu Glu Met His Cys Ser Asp Asp Gly
610 615 620
Phe Trp Ser Lys Glu Lys Pro Lys Cys Val Glu Ile Ser Cys Lys Ser
625 630 635 640
Pro Asp Val Ile Asn Gly Ser Pro Ile Ser Gln Lys Ile Ile Tyr Lys
645 650 655
Glu Asn Glu Arg Phe Gln Tyr Lys Cys Asn Met Gly Tyr Glu Tyr Ser
660 665 670
Glu Arg Gly Asp Ala Val Cys Thr Glu Ser Gly Trp Arg Pro Leu Pro
675 680 685
Ser Cys Glu Glu Lys Ser Cys Asp Asn Pro Tyr Ile Pro Asn Gly Asp
690 695 700
Tyr Ser Pro Leu Arg Ile Lys His Arg Thr Gly Asp Glu Ile Thr Tyr
705 710 715 720
Gln Cys Arg Asn Gly Phe Tyr Pro Ala Thr Arg Gly Asn Thr Ala Lys
725 730 735
Cys Thr Ser Thr Gly Trp Ile Pro Ala Pro Arg Cys Thr Leu Lys Glu
740 745 750
Asn Leu Tyr Phe Gln Gly His His His His His His
755 760
<210> 114
<211> 764
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 114
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Gly Gly Pro Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser
100 105 110
Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser
115 120 125
Ala Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr
165 170 175
Leu Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr
180 185 190
Val Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys
195 200 205
Lys Ile Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val
210 215 220
Pro Glu Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val
225 230 235 240
Leu Thr Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile
245 250 255
Ser Lys Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val
260 265 270
Glu Val His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser
275 280 285
Thr Phe Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu
290 295 300
Asn Gly Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala
305 310 315 320
Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro
325 330 335
Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys
340 345 350
Val Ser Leu Thr Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr
355 360 365
Val Glu Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr
370 375 380
Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu
385 390 395 400
Asn Val Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser
405 410 415
Val Leu His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser
420 425 430
His Ser Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Asp
435 440 445
Cys Asn Glu Leu Pro Pro Arg Arg Asn Thr Glu Ile Leu Thr Gly Ser
450 455 460
Trp Ser Asp Gln Thr Tyr Pro Glu Gly Thr Gln Ala Ile Tyr Lys Cys
465 470 475 480
Arg Pro Gly Tyr Arg Ser Leu Gly Asn Val Ile Met Val Cys Arg Lys
485 490 495
Gly Glu Trp Val Ala Leu Asn Pro Leu Arg Lys Cys Gln Lys Arg Pro
500 505 510
Cys Gly His Pro Gly Asp Thr Pro Phe Gly Thr Phe Thr Leu Thr Gly
515 520 525
Gly Asn Val Phe Glu Tyr Gly Val Lys Ala Val Tyr Thr Cys Asn Glu
530 535 540
Gly Tyr Gln Leu Leu Gly Glu Ile Asn Tyr Arg Glu Cys Asp Thr Asp
545 550 555 560
Gly Trp Thr Asn Asp Ile Pro Ile Cys Glu Val Val Lys Cys Leu Pro
565 570 575
Val Thr Ala Pro Glu Asn Gly Lys Ile Val Ser Ser Ala Met Glu Pro
580 585 590
Asp Arg Glu Tyr His Phe Gly Gln Ala Val Arg Phe Val Cys Asn Ser
595 600 605
Gly Tyr Lys Ile Glu Gly Asp Glu Glu Met His Cys Ser Asp Asp Gly
610 615 620
Phe Trp Ser Lys Glu Lys Pro Lys Cys Val Glu Ile Ser Cys Lys Ser
625 630 635 640
Pro Asp Val Ile Asn Gly Ser Pro Ile Ser Gln Lys Ile Ile Tyr Lys
645 650 655
Glu Asn Glu Arg Phe Gln Tyr Lys Cys Asn Met Gly Tyr Glu Tyr Ser
660 665 670
Glu Arg Gly Asp Ala Val Cys Thr Glu Ser Gly Trp Arg Pro Leu Pro
675 680 685
Ser Cys Glu Glu Lys Ser Cys Asp Asn Pro Tyr Ile Pro Asn Gly Asp
690 695 700
Tyr Ser Pro Leu Arg Ile Lys His Arg Thr Gly Asp Glu Ile Thr Tyr
705 710 715 720
Gln Cys Arg Asn Gly Phe Tyr Pro Ala Thr Arg Gly Asn Thr Ala Lys
725 730 735
Cys Thr Ser Thr Gly Trp Ile Pro Ala Pro Arg Cys Thr Leu Lys Glu
740 745 750
Asn Leu Tyr Phe Gln Gly His His His His His His
755 760
<210> 115
<211> 556
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 115
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
210 215 220
Cys Pro Ala Pro Ser Gln Leu Pro Ser Ala Lys Pro Ile Asn Leu Thr
225 230 235 240
Asp Glu Ser Met Phe Pro Ile Gly Thr Tyr Leu Leu Tyr Glu Cys Leu
245 250 255
Pro Gly Tyr Ile Lys Arg Gln Phe Ser Ile Thr Cys Lys Gln Asp Ser
260 265 270
Thr Trp Thr Ser Ala Glu Asp Lys Cys Ile Arg Lys Gln Cys Lys Thr
275 280 285
Pro Ser Asp Pro Glu Asn Gly Leu Val His Val His Thr Gly Ile Gln
290 295 300
Phe Gly Ser Arg Ile Asn Tyr Thr Cys Asn Gln Gly Tyr Arg Leu Ile
305 310 315 320
Gly Ser Ser Ser Ala Val Cys Val Ile Thr Asp Gln Ser Val Asp Trp
325 330 335
Asp Thr Glu Ala Pro Ile Cys Glu Trp Ile Pro Cys Glu Ile Pro Pro
340 345 350
Gly Ile Pro Asn Gly Asp Phe Phe Ser Ser Thr Arg Glu Asp Phe His
355 360 365
Tyr Gly Met Val Val Thr Tyr Arg Cys Asn Thr Asp Ala Arg Gly Lys
370 375 380
Ala Leu Phe Asn Leu Val Gly Glu Pro Ser Leu Tyr Cys Thr Ser Asn
385 390 395 400
Asp Gly Glu Ile Gly Val Trp Ser Gly Pro Pro Pro Gln Cys Ile Glu
405 410 415
Leu Asn Lys Cys Thr Pro Pro Pro Tyr Val Glu Asn Ala Val Met Leu
420 425 430
Ser Glu Asn Arg Ser Leu Phe Ser Leu Arg Asp Ile Val Glu Phe Arg
435 440 445
Cys His Pro Gly Phe Ile Met Lys Gly Ala Ser Ser Val His Cys Gln
450 455 460
Ser Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Phe Lys Gly Val
465 470 475 480
Ile Cys Arg Leu Pro Gln Glu Met Ser Gly Phe Gln Lys Gly Leu Gly
485 490 495
Met Lys Lys Glu Tyr Tyr Tyr Gly Glu Asn Val Thr Leu Glu Cys Glu
500 505 510
Asp Gly Tyr Thr Leu Glu Gly Ser Ser Gln Ser Gln Cys Gln Ser Asp
515 520 525
Gly Ser Trp Asn Pro Leu Leu Ala Lys Cys Val Ser Arg Ser Ile Glu
530 535 540
Asn Leu Tyr Phe Gln Gly His His His His His His
545 550 555
<210> 116
<211> 883
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 116
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
210 215 220
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
225 230 235 240
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
245 250 255
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
260 265 270
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
275 280 285
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
290 295 300
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
305 310 315 320
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
325 330 335
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
340 345 350
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
355 360 365
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
370 375 380
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
385 390 395 400
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
405 410 415
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
420 425 430
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
435 440 445
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
450 455 460
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
465 470 475 480
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
485 490 495
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
500 505 510
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
515 520 525
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
530 535 540
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
545 550 555 560
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
565 570 575
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
580 585 590
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
595 600 605
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
610 615 620
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
625 630 635 640
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
645 650 655
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
660 665 670
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
675 680 685
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
690 695 700
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
705 710 715 720
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
725 730 735
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
740 745 750
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
755 760 765
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
770 775 780
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
785 790 795 800
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
805 810 815
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
820 825 830
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
835 840 845
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
850 855 860
Cys Ile Ile Pro Asn Lys Glu Asn Leu Tyr Phe Gln Gly His His His
865 870 875 880
His His His
<210> 117
<211> 542
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 117
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
210 215 220
Glu Asp Cys Asn Glu Leu Pro Pro Arg Arg Asn Thr Glu Ile Leu Thr
225 230 235 240
Gly Ser Trp Ser Asp Gln Thr Tyr Pro Glu Gly Thr Gln Ala Ile Tyr
245 250 255
Lys Cys Arg Pro Gly Tyr Arg Ser Leu Gly Asn Val Ile Met Val Cys
260 265 270
Arg Lys Gly Glu Trp Val Ala Leu Asn Pro Leu Arg Lys Cys Gln Lys
275 280 285
Arg Pro Cys Gly His Pro Gly Asp Thr Pro Phe Gly Thr Phe Thr Leu
290 295 300
Thr Gly Gly Asn Val Phe Glu Tyr Gly Val Lys Ala Val Tyr Thr Cys
305 310 315 320
Asn Glu Gly Tyr Gln Leu Leu Gly Glu Ile Asn Tyr Arg Glu Cys Asp
325 330 335
Thr Asp Gly Trp Thr Asn Asp Ile Pro Ile Cys Glu Val Val Lys Cys
340 345 350
Leu Pro Val Thr Ala Pro Glu Asn Gly Lys Ile Val Ser Ser Ala Met
355 360 365
Glu Pro Asp Arg Glu Tyr His Phe Gly Gln Ala Val Arg Phe Val Cys
370 375 380
Asn Ser Gly Tyr Lys Ile Glu Gly Asp Glu Glu Met His Cys Ser Asp
385 390 395 400
Asp Gly Phe Trp Ser Lys Glu Lys Pro Lys Cys Val Glu Ile Ser Cys
405 410 415
Lys Ser Pro Asp Val Ile Asn Gly Ser Pro Ile Ser Gln Lys Ile Ile
420 425 430
Tyr Lys Glu Asn Glu Arg Phe Gln Tyr Lys Cys Asn Met Gly Tyr Glu
435 440 445
Tyr Ser Glu Arg Gly Asp Ala Val Cys Thr Glu Ser Gly Trp Arg Pro
450 455 460
Leu Pro Ser Cys Glu Glu Lys Ser Cys Asp Asn Pro Tyr Ile Pro Asn
465 470 475 480
Gly Asp Tyr Ser Pro Leu Arg Ile Lys His Arg Thr Gly Asp Glu Ile
485 490 495
Thr Tyr Gln Cys Arg Asn Gly Phe Tyr Pro Ala Thr Arg Gly Asn Thr
500 505 510
Ala Lys Cys Thr Ser Thr Gly Trp Ile Pro Ala Pro Arg Cys Thr Leu
515 520 525
Lys Glu Asn Leu Tyr Phe Gln Gly His His His His His His
530 535 540
<210> 118
<211> 888
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 118
Asp Val Val Met Thr Gln Thr Pro Leu Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Arg
100 105 110
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu
115 120 125
Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe
130 135 140
Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg
145 150 155 160
Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu
180 185 190
Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser
195 200 205
Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys Gly Gly Gly Gly Ser
210 215 220
Gly Gly Gly Gly Ser Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala
225 230 235 240
Arg Pro Thr Asn Leu Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr
245 250 255
Leu Asn Tyr Glu Cys Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile
260 265 270
Ile Cys Leu Lys Asn Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg
275 280 285
Arg Lys Ser Cys Arg Asn Pro Pro Asp Pro Val Asn Gly Met Val His
290 295 300
Val Ile Lys Gly Ile Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr
305 310 315 320
Lys Gly Tyr Arg Leu Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser
325 330 335
Gly Asp Thr Val Ile Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile
340 345 350
Pro Cys Gly Leu Pro Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr
355 360 365
Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn
370 375 380
Pro Gly Ser Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser
385 390 395 400
Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro
405 410 415
Ala Pro Gln Cys Ile Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu
420 425 430
Asn Gly Ile Leu Val Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu
435 440 445
Val Val Glu Phe Arg Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg
450 455 460
Arg Val Lys Cys Gln Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser
465 470 475 480
Cys Ser Arg Val Cys Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg
485 490 495
Thr Gln Arg Asp Lys Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr
500 505 510
Ser Cys Glu Pro Gly Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys
515 520 525
Thr Pro Gln Gly Asp Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys
530 535 540
Ser Cys Asp Asp Phe Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe
545 550 555 560
Pro Val Asn Leu Gln Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu
565 570 575
Gly Phe Gln Leu Lys Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly
580 585 590
Met Glu Ser Leu Trp Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe
595 600 605
Cys Pro Ser Pro Pro Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro
610 615 620
Leu Glu Val Phe Pro Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro
625 630 635 640
His Pro Asp Arg Gly Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile
645 650 655
Arg Cys Thr Ser Asp Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala
660 665 670
Pro Arg Cys Gly Ile Leu Gly His Cys Gln Ala Pro Asp His Phe Leu
675 680 685
Phe Ala Lys Leu Lys Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly
690 695 700
Thr Ser Leu Lys Tyr Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe
705 710 715 720
Ser Ile Thr Cys Leu Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val
725 730 735
Cys Lys Arg Lys Ser Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met
740 745 750
Val His Val Ile Thr Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser
755 760 765
Cys Thr Thr Gly His Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile
770 775 780
Leu Ser Gly Asn Ala Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln
785 790 795 800
Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile
805 810 815
Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg
820 825 830
Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu
835 840 845
Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser
850 855 860
Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys Glu Asn Leu Tyr Phe
865 870 875 880
Gln Gly His His His His His His
885
<210> 119
<211> 1103
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 119
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
210 215 220
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
225 230 235 240
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
245 250 255
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
260 265 270
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
275 280 285
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
290 295 300
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
305 310 315 320
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
325 330 335
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
340 345 350
Leu Ser Cys Ala Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu
355 360 365
Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro
370 375 380
Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Val Ser Lys Leu Asn Val
385 390 395 400
Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu
405 410 415
His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser
420 425 430
Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Cys Asn Ala
435 440 445
Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu Thr Asp Glu Phe
450 455 460
Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys Arg Pro Gly Tyr
465 470 475 480
Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn Ser Val Trp Thr
485 490 495
Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg Asn Pro Pro Asp
500 505 510
Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile Gln Phe Gly Ser
515 520 525
Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu Ile Gly Ser Ser
530 535 540
Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile Trp Asp Asn Glu
545 550 555 560
Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Thr
565 570 575
Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser
580 585 590
Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe
595 600 605
Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln
610 615 620
Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys
625 630 635 640
Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val Ser Asp Asn Arg
645 650 655
Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg Cys Gln Pro Gly
660 665 670
Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln Ala Leu Asn Lys
675 680 685
Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys Gln Pro Pro Pro
690 695 700
Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys Asp Asn Phe Ser
705 710 715 720
Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp Leu Arg
725 730 735
Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp Trp Ser Pro Ala
740 745 750
Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe Met Gly Gln Leu
755 760 765
Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln Leu Gly Ala Lys
770 775 780
Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser Ser Ala
785 790 795 800
Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp Asn Ser Ser Val
805 810 815
Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro Val Ile Pro Asn
820 825 830
Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro Phe Gly Lys Thr
835 840 845
Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly Thr Ser Phe Asp
850 855 860
Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp Pro Gln Gly Asn
865 870 875 880
Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile Leu Gly His Cys
885 890 895
Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys Thr Gln Thr Asn
900 905 910
Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr Glu Cys Arg Pro
915 920 925
Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu Asp Asn Leu Val
930 935 940
Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser Cys Lys Thr Pro
945 950 955 960
Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr Asp Ile Gln Val
965 970 975
Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His Arg Leu Ile Gly
980 985 990
His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala Ala His Trp Ser
995 1000 1005
Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly Leu Pro Pro
1010 1015 1020
Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
1025 1030 1035
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly
1040 1045 1050
Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
1055 1060 1065
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro
1070 1075 1080
Gln Cys Ile Ile Pro Asn Lys Glu Asn Leu Tyr Phe Gln Gly His
1085 1090 1095
His His His His His
1100
<210> 120
<211> 1103
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 120
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
210 215 220
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
225 230 235 240
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
245 250 255
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
260 265 270
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
275 280 285
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
290 295 300
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
305 310 315 320
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
325 330 335
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
340 345 350
Leu Thr Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu
355 360 365
Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro
370 375 380
Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val
385 390 395 400
Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu
405 410 415
His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser
420 425 430
Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Cys Asn Ala
435 440 445
Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu Thr Asp Glu Phe
450 455 460
Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys Arg Pro Gly Tyr
465 470 475 480
Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn Ser Val Trp Thr
485 490 495
Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg Asn Pro Pro Asp
500 505 510
Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile Gln Phe Gly Ser
515 520 525
Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu Ile Gly Ser Ser
530 535 540
Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile Trp Asp Asn Glu
545 550 555 560
Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Thr
565 570 575
Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser
580 585 590
Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe
595 600 605
Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln
610 615 620
Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys
625 630 635 640
Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val Ser Asp Asn Arg
645 650 655
Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg Cys Gln Pro Gly
660 665 670
Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln Ala Leu Asn Lys
675 680 685
Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys Gln Pro Pro Pro
690 695 700
Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys Asp Asn Phe Ser
705 710 715 720
Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp Leu Arg
725 730 735
Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp Trp Ser Pro Ala
740 745 750
Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe Met Gly Gln Leu
755 760 765
Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln Leu Gly Ala Lys
770 775 780
Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser Ser Ala
785 790 795 800
Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp Asn Ser Ser Val
805 810 815
Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro Val Ile Pro Asn
820 825 830
Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro Phe Gly Lys Thr
835 840 845
Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly Thr Ser Phe Asp
850 855 860
Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp Pro Gln Gly Asn
865 870 875 880
Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile Leu Gly His Cys
885 890 895
Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys Thr Gln Thr Asn
900 905 910
Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr Glu Cys Arg Pro
915 920 925
Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu Asp Asn Leu Val
930 935 940
Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser Cys Lys Thr Pro
945 950 955 960
Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr Asp Ile Gln Val
965 970 975
Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His Arg Leu Ile Gly
980 985 990
His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala Ala His Trp Ser
995 1000 1005
Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly Leu Pro Pro
1010 1015 1020
Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
1025 1030 1035
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly
1040 1045 1050
Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
1055 1060 1065
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro
1070 1075 1080
Gln Cys Ile Ile Pro Asn Lys Glu Asn Leu Tyr Phe Gln Gly His
1085 1090 1095
His His His His His
1100
<210> 121
<211> 762
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 121
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
210 215 220
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
225 230 235 240
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
245 250 255
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
260 265 270
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
275 280 285
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
290 295 300
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
305 310 315 320
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
325 330 335
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
340 345 350
Leu Ser Cys Ala Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu
355 360 365
Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro
370 375 380
Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Val Ser Lys Leu Asn Val
385 390 395 400
Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu
405 410 415
His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser
420 425 430
Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Asp Cys Asn
435 440 445
Glu Leu Pro Pro Arg Arg Asn Thr Glu Ile Leu Thr Gly Ser Trp Ser
450 455 460
Asp Gln Thr Tyr Pro Glu Gly Thr Gln Ala Ile Tyr Lys Cys Arg Pro
465 470 475 480
Gly Tyr Arg Ser Leu Gly Asn Val Ile Met Val Cys Arg Lys Gly Glu
485 490 495
Trp Val Ala Leu Asn Pro Leu Arg Lys Cys Gln Lys Arg Pro Cys Gly
500 505 510
His Pro Gly Asp Thr Pro Phe Gly Thr Phe Thr Leu Thr Gly Gly Asn
515 520 525
Val Phe Glu Tyr Gly Val Lys Ala Val Tyr Thr Cys Asn Glu Gly Tyr
530 535 540
Gln Leu Leu Gly Glu Ile Asn Tyr Arg Glu Cys Asp Thr Asp Gly Trp
545 550 555 560
Thr Asn Asp Ile Pro Ile Cys Glu Val Val Lys Cys Leu Pro Val Thr
565 570 575
Ala Pro Glu Asn Gly Lys Ile Val Ser Ser Ala Met Glu Pro Asp Arg
580 585 590
Glu Tyr His Phe Gly Gln Ala Val Arg Phe Val Cys Asn Ser Gly Tyr
595 600 605
Lys Ile Glu Gly Asp Glu Glu Met His Cys Ser Asp Asp Gly Phe Trp
610 615 620
Ser Lys Glu Lys Pro Lys Cys Val Glu Ile Ser Cys Lys Ser Pro Asp
625 630 635 640
Val Ile Asn Gly Ser Pro Ile Ser Gln Lys Ile Ile Tyr Lys Glu Asn
645 650 655
Glu Arg Phe Gln Tyr Lys Cys Asn Met Gly Tyr Glu Tyr Ser Glu Arg
660 665 670
Gly Asp Ala Val Cys Thr Glu Ser Gly Trp Arg Pro Leu Pro Ser Cys
675 680 685
Glu Glu Lys Ser Cys Asp Asn Pro Tyr Ile Pro Asn Gly Asp Tyr Ser
690 695 700
Pro Leu Arg Ile Lys His Arg Thr Gly Asp Glu Ile Thr Tyr Gln Cys
705 710 715 720
Arg Asn Gly Phe Tyr Pro Ala Thr Arg Gly Asn Thr Ala Lys Cys Thr
725 730 735
Ser Thr Gly Trp Ile Pro Ala Pro Arg Cys Thr Leu Lys Glu Asn Leu
740 745 750
Tyr Phe Gln Gly His His His His His His
755 760
<210> 122
<211> 762
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 122
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
210 215 220
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
225 230 235 240
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
245 250 255
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
260 265 270
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
275 280 285
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
290 295 300
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
305 310 315 320
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
325 330 335
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
340 345 350
Leu Thr Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu
355 360 365
Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro
370 375 380
Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val
385 390 395 400
Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu
405 410 415
His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser
420 425 430
Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Asp Cys Asn
435 440 445
Glu Leu Pro Pro Arg Arg Asn Thr Glu Ile Leu Thr Gly Ser Trp Ser
450 455 460
Asp Gln Thr Tyr Pro Glu Gly Thr Gln Ala Ile Tyr Lys Cys Arg Pro
465 470 475 480
Gly Tyr Arg Ser Leu Gly Asn Val Ile Met Val Cys Arg Lys Gly Glu
485 490 495
Trp Val Ala Leu Asn Pro Leu Arg Lys Cys Gln Lys Arg Pro Cys Gly
500 505 510
His Pro Gly Asp Thr Pro Phe Gly Thr Phe Thr Leu Thr Gly Gly Asn
515 520 525
Val Phe Glu Tyr Gly Val Lys Ala Val Tyr Thr Cys Asn Glu Gly Tyr
530 535 540
Gln Leu Leu Gly Glu Ile Asn Tyr Arg Glu Cys Asp Thr Asp Gly Trp
545 550 555 560
Thr Asn Asp Ile Pro Ile Cys Glu Val Val Lys Cys Leu Pro Val Thr
565 570 575
Ala Pro Glu Asn Gly Lys Ile Val Ser Ser Ala Met Glu Pro Asp Arg
580 585 590
Glu Tyr His Phe Gly Gln Ala Val Arg Phe Val Cys Asn Ser Gly Tyr
595 600 605
Lys Ile Glu Gly Asp Glu Glu Met His Cys Ser Asp Asp Gly Phe Trp
610 615 620
Ser Lys Glu Lys Pro Lys Cys Val Glu Ile Ser Cys Lys Ser Pro Asp
625 630 635 640
Val Ile Asn Gly Ser Pro Ile Ser Gln Lys Ile Ile Tyr Lys Glu Asn
645 650 655
Glu Arg Phe Gln Tyr Lys Cys Asn Met Gly Tyr Glu Tyr Ser Glu Arg
660 665 670
Gly Asp Ala Val Cys Thr Glu Ser Gly Trp Arg Pro Leu Pro Ser Cys
675 680 685
Glu Glu Lys Ser Cys Asp Asn Pro Tyr Ile Pro Asn Gly Asp Tyr Ser
690 695 700
Pro Leu Arg Ile Lys His Arg Thr Gly Asp Glu Ile Thr Tyr Gln Cys
705 710 715 720
Arg Asn Gly Phe Tyr Pro Ala Thr Arg Gly Asn Thr Ala Lys Cys Thr
725 730 735
Ser Thr Gly Trp Ile Pro Ala Pro Arg Cys Thr Leu Lys Glu Asn Leu
740 745 750
Tyr Phe Gln Gly His His His His His His
755 760
<210> 123
<211> 1103
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 123
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
1 5 10 15
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
20 25 30
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
35 40 45
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
50 55 60
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
65 70 75 80
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
85 90 95
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
100 105 110
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
115 120 125
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
130 135 140
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
145 150 155 160
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
165 170 175
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
180 185 190
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
195 200 205
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
210 215 220
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
225 230 235 240
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
245 250 255
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
260 265 270
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
275 280 285
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
290 295 300
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
305 310 315 320
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
325 330 335
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
340 345 350
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
355 360 365
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
370 375 380
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
385 390 395 400
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
405 410 415
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
420 425 430
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
435 440 445
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
450 455 460
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
465 470 475 480
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
485 490 495
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
500 505 510
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
515 520 525
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
530 535 540
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
545 550 555 560
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
565 570 575
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
580 585 590
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
595 600 605
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
610 615 620
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
625 630 635 640
Cys Ile Ile Pro Asn Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
645 650 655
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
660 665 670
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
675 680 685
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
690 695 700
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
705 710 715 720
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
725 730 735
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
740 745 750
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
755 760 765
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
770 775 780
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
785 790 795 800
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
805 810 815
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
820 825 830
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
835 840 845
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
850 855 860
Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
865 870 875 880
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
885 890 895
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
900 905 910
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
915 920 925
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
930 935 940
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
945 950 955 960
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
965 970 975
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
980 985 990
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
995 1000 1005
Leu Thr Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val
1010 1015 1020
Glu Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr
1025 1030 1035
Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys
1040 1045 1050
Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr
1055 1060 1065
Cys Ser Val Leu His Glu Gly Leu His Asn His His Thr Glu Lys
1070 1075 1080
Ser Leu Ser His Ser Pro Gly Glu Asn Leu Tyr Phe Gln Gly His
1085 1090 1095
His His His His His
1100
<210> 124
<211> 888
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 124
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
1 5 10 15
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
20 25 30
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
35 40 45
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
50 55 60
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
65 70 75 80
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
85 90 95
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
100 105 110
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
115 120 125
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
130 135 140
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
145 150 155 160
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
165 170 175
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
180 185 190
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
195 200 205
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
210 215 220
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
225 230 235 240
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
245 250 255
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
260 265 270
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
275 280 285
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
290 295 300
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
305 310 315 320
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
325 330 335
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
340 345 350
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
355 360 365
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
370 375 380
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
385 390 395 400
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
405 410 415
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
420 425 430
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
435 440 445
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
450 455 460
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
465 470 475 480
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
485 490 495
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
500 505 510
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
515 520 525
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
530 535 540
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
545 550 555 560
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
565 570 575
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
580 585 590
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
595 600 605
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
610 615 620
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
625 630 635 640
Cys Ile Ile Pro Asn Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
645 650 655
Asp Val Val Met Thr Gln Thr Pro Leu Thr Leu Ser Val Thr Ile Gly
660 665 670
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
675 680 685
Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser
690 695 700
Pro Lys Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
705 710 715 720
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
725 730 735
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly
740 745 750
Thr His Phe Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Arg
755 760 765
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu
770 775 780
Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe
785 790 795 800
Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg
805 810 815
Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser
820 825 830
Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu
835 840 845
Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser
850 855 860
Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys Glu Asn Leu Tyr Phe
865 870 875 880
Gln Gly His His His His His His
885
<210> 125
<211> 1092
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 125
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Gly Gly Pro Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser
100 105 110
Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser
115 120 125
Ala Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr
165 170 175
Leu Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr
180 185 190
Val Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys
195 200 205
Lys Ile Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val
210 215 220
Pro Glu Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val
225 230 235 240
Leu Thr Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile
245 250 255
Ser Lys Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val
260 265 270
Glu Val His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser
275 280 285
Thr Phe Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu
290 295 300
Asn Gly Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala
305 310 315 320
Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro
325 330 335
Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys
340 345 350
Val Ser Leu Thr Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr
355 360 365
Val Glu Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr
370 375 380
Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu
385 390 395 400
Asn Val Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser
405 410 415
Val Leu His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser
420 425 430
His Ser Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Cys
435 440 445
Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu Thr Asp
450 455 460
Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys Arg Pro
465 470 475 480
Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn Ser Val
485 490 495
Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg Asn Pro
500 505 510
Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile Gln Phe
515 520 525
Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu Ile Gly
530 535 540
Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile Trp Asp
545 550 555 560
Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro Pro Thr
565 570 575
Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr
580 585 590
Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys
595 600 605
Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp
610 615 620
Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro
625 630 635 640
Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val Ser Asp
645 650 655
Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg Cys Gln
660 665 670
Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln Ala Leu
675 680 685
Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys Gln Pro
690 695 700
Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys Asp Asn
705 710 715 720
Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp
725 730 735
Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp Trp Ser
740 745 750
Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe Met Gly
755 760 765
Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln Leu Gly
770 775 780
Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser
785 790 795 800
Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp Asn Ser
805 810 815
Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro Val Ile
820 825 830
Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro Phe Gly
835 840 845
Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly Thr Ser
850 855 860
Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp Pro Gln
865 870 875 880
Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile Leu Gly
885 890 895
His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys Thr Gln
900 905 910
Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr Glu Cys
915 920 925
Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu Asp Asn
930 935 940
Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser Cys Lys
945 950 955 960
Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr Asp Ile
965 970 975
Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His Arg Leu
980 985 990
Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala Ala His
995 1000 1005
Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly Leu
1010 1015 1020
Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
1025 1030 1035
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly
1040 1045 1050
Ser Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile
1055 1060 1065
Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro
1070 1075 1080
Ala Pro Gln Cys Ile Ile Pro Asn Lys
1085 1090
<210> 126
<211> 1098
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 126
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Gly Gly Pro Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser
100 105 110
Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser
115 120 125
Ala Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr
165 170 175
Leu Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr
180 185 190
Val Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys
195 200 205
Lys Ile Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val
210 215 220
Pro Glu Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val
225 230 235 240
Leu Thr Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile
245 250 255
Ser Lys Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val
260 265 270
Glu Val His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser
275 280 285
Thr Phe Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu
290 295 300
Asn Gly Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala
305 310 315 320
Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro
325 330 335
Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys
340 345 350
Val Ser Leu Thr Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr
355 360 365
Val Glu Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr
370 375 380
Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu
385 390 395 400
Asn Val Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser
405 410 415
Val Leu His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser
420 425 430
His Ser Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Cys
435 440 445
Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu Thr Asp
450 455 460
Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys Arg Pro
465 470 475 480
Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn Ser Val
485 490 495
Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg Asn Pro
500 505 510
Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile Gln Phe
515 520 525
Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu Ile Gly
530 535 540
Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile Trp Asp
545 550 555 560
Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro Pro Thr
565 570 575
Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr
580 585 590
Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys
595 600 605
Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp
610 615 620
Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro
625 630 635 640
Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val Ser Asp
645 650 655
Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg Cys Gln
660 665 670
Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln Ala Leu
675 680 685
Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys Gln Pro
690 695 700
Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys Asp Asn
705 710 715 720
Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp
725 730 735
Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp Trp Ser
740 745 750
Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe Met Gly
755 760 765
Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln Leu Gly
770 775 780
Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser
785 790 795 800
Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp Asn Ser
805 810 815
Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro Val Ile
820 825 830
Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro Phe Gly
835 840 845
Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly Thr Ser
850 855 860
Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp Pro Gln
865 870 875 880
Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile Leu Gly
885 890 895
His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys Thr Gln
900 905 910
Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr Glu Cys
915 920 925
Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu Asp Asn
930 935 940
Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser Cys Lys
945 950 955 960
Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr Asp Ile
965 970 975
Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His Arg Leu
980 985 990
Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala Ala His
995 1000 1005
Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly Leu
1010 1015 1020
Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
1025 1030 1035
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly
1040 1045 1050
Ser Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile
1055 1060 1065
Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro
1070 1075 1080
Ala Pro Gln Cys Ile Ile Pro Asn Lys His His His His His His
1085 1090 1095
<210> 127
<211> 1098
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 127
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Gly Gly Pro Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser
100 105 110
Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser
115 120 125
Ala Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr
165 170 175
Leu Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr
180 185 190
Val Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys
195 200 205
Lys Ile Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val
210 215 220
Pro Glu Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val
225 230 235 240
Leu Thr Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile
245 250 255
Ser Lys Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val
260 265 270
Glu Val His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser
275 280 285
Thr Phe Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu
290 295 300
Asn Gly Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala
305 310 315 320
Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro
325 330 335
Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys
340 345 350
Val Ser Leu Trp Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr
355 360 365
Val Glu Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr
370 375 380
Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu
385 390 395 400
Asn Val Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser
405 410 415
Val Leu His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser
420 425 430
His Ser Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Cys
435 440 445
Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu Thr Asp
450 455 460
Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys Arg Pro
465 470 475 480
Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn Ser Val
485 490 495
Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg Asn Pro
500 505 510
Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile Gln Phe
515 520 525
Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu Ile Gly
530 535 540
Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile Trp Asp
545 550 555 560
Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro Pro Thr
565 570 575
Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr
580 585 590
Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys
595 600 605
Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp
610 615 620
Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro
625 630 635 640
Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val Ser Asp
645 650 655
Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg Cys Gln
660 665 670
Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln Ala Leu
675 680 685
Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys Gln Pro
690 695 700
Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys Asp Asn
705 710 715 720
Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp
725 730 735
Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp Trp Ser
740 745 750
Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe Met Gly
755 760 765
Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln Leu Gly
770 775 780
Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser
785 790 795 800
Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp Asn Ser
805 810 815
Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro Val Ile
820 825 830
Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro Phe Gly
835 840 845
Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly Thr Ser
850 855 860
Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp Pro Gln
865 870 875 880
Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile Leu Gly
885 890 895
His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys Thr Gln
900 905 910
Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr Glu Cys
915 920 925
Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu Asp Asn
930 935 940
Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser Cys Lys
945 950 955 960
Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr Asp Ile
965 970 975
Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His Arg Leu
980 985 990
Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala Ala His
995 1000 1005
Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly Leu
1010 1015 1020
Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
1025 1030 1035
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly
1040 1045 1050
Ser Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile
1055 1060 1065
Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro
1070 1075 1080
Ala Pro Gln Cys Ile Ile Pro Asn Lys His His His His His His
1085 1090 1095
<210> 128
<211> 547
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 128
Asp Val Val Met Thr Gln Thr Pro Leu Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Arg
100 105 110
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu
115 120 125
Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe
130 135 140
Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg
145 150 155 160
Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu
180 185 190
Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser
195 200 205
Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys Gly Gly Gly Gly Ser
210 215 220
Gly Gly Gly Gly Ser Glu Asp Cys Asn Glu Leu Pro Pro Arg Arg Asn
225 230 235 240
Thr Glu Ile Leu Thr Gly Ser Trp Ser Asp Gln Thr Tyr Pro Glu Gly
245 250 255
Thr Gln Ala Ile Tyr Lys Cys Arg Pro Gly Tyr Arg Ser Leu Gly Asn
260 265 270
Val Ile Met Val Cys Arg Lys Gly Glu Trp Val Ala Leu Asn Pro Leu
275 280 285
Arg Lys Cys Gln Lys Arg Pro Cys Gly His Pro Gly Asp Thr Pro Phe
290 295 300
Gly Thr Phe Thr Leu Thr Gly Gly Asn Val Phe Glu Tyr Gly Val Lys
305 310 315 320
Ala Val Tyr Thr Cys Asn Glu Gly Tyr Gln Leu Leu Gly Glu Ile Asn
325 330 335
Tyr Arg Glu Cys Asp Thr Asp Gly Trp Thr Asn Asp Ile Pro Ile Cys
340 345 350
Glu Val Val Lys Cys Leu Pro Val Thr Ala Pro Glu Asn Gly Lys Ile
355 360 365
Val Ser Ser Ala Met Glu Pro Asp Arg Glu Tyr His Phe Gly Gln Ala
370 375 380
Val Arg Phe Val Cys Asn Ser Gly Tyr Lys Ile Glu Gly Asp Glu Glu
385 390 395 400
Met His Cys Ser Asp Asp Gly Phe Trp Ser Lys Glu Lys Pro Lys Cys
405 410 415
Val Glu Ile Ser Cys Lys Ser Pro Asp Val Ile Asn Gly Ser Pro Ile
420 425 430
Ser Gln Lys Ile Ile Tyr Lys Glu Asn Glu Arg Phe Gln Tyr Lys Cys
435 440 445
Asn Met Gly Tyr Glu Tyr Ser Glu Arg Gly Asp Ala Val Cys Thr Glu
450 455 460
Ser Gly Trp Arg Pro Leu Pro Ser Cys Glu Glu Lys Ser Cys Asp Asn
465 470 475 480
Pro Tyr Ile Pro Asn Gly Asp Tyr Ser Pro Leu Arg Ile Lys His Arg
485 490 495
Thr Gly Asp Glu Ile Thr Tyr Gln Cys Arg Asn Gly Phe Tyr Pro Ala
500 505 510
Thr Arg Gly Asn Thr Ala Lys Cys Thr Ser Thr Gly Trp Ile Pro Ala
515 520 525
Pro Arg Cys Thr Leu Lys Glu Asn Leu Tyr Phe Gln Gly His His His
530 535 540
His His His
545
<210> 129
<211> 547
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 129
Glu Asp Cys Asn Glu Leu Pro Pro Arg Arg Asn Thr Glu Ile Leu Thr
1 5 10 15
Gly Ser Trp Ser Asp Gln Thr Tyr Pro Glu Gly Thr Gln Ala Ile Tyr
20 25 30
Lys Cys Arg Pro Gly Tyr Arg Ser Leu Gly Asn Val Ile Met Val Cys
35 40 45
Arg Lys Gly Glu Trp Val Ala Leu Asn Pro Leu Arg Lys Cys Gln Lys
50 55 60
Arg Pro Cys Gly His Pro Gly Asp Thr Pro Phe Gly Thr Phe Thr Leu
65 70 75 80
Thr Gly Gly Asn Val Phe Glu Tyr Gly Val Lys Ala Val Tyr Thr Cys
85 90 95
Asn Glu Gly Tyr Gln Leu Leu Gly Glu Ile Asn Tyr Arg Glu Cys Asp
100 105 110
Thr Asp Gly Trp Thr Asn Asp Ile Pro Ile Cys Glu Val Val Lys Cys
115 120 125
Leu Pro Val Thr Ala Pro Glu Asn Gly Lys Ile Val Ser Ser Ala Met
130 135 140
Glu Pro Asp Arg Glu Tyr His Phe Gly Gln Ala Val Arg Phe Val Cys
145 150 155 160
Asn Ser Gly Tyr Lys Ile Glu Gly Asp Glu Glu Met His Cys Ser Asp
165 170 175
Asp Gly Phe Trp Ser Lys Glu Lys Pro Lys Cys Val Glu Ile Ser Cys
180 185 190
Lys Ser Pro Asp Val Ile Asn Gly Ser Pro Ile Ser Gln Lys Ile Ile
195 200 205
Tyr Lys Glu Asn Glu Arg Phe Gln Tyr Lys Cys Asn Met Gly Tyr Glu
210 215 220
Tyr Ser Glu Arg Gly Asp Ala Val Cys Thr Glu Ser Gly Trp Arg Pro
225 230 235 240
Leu Pro Ser Cys Glu Glu Lys Ser Cys Asp Asn Pro Tyr Ile Pro Asn
245 250 255
Gly Asp Tyr Ser Pro Leu Arg Ile Lys His Arg Thr Gly Asp Glu Ile
260 265 270
Thr Tyr Gln Cys Arg Asn Gly Phe Tyr Pro Ala Thr Arg Gly Asn Thr
275 280 285
Ala Lys Cys Thr Ser Thr Gly Trp Ile Pro Ala Pro Arg Cys Thr Leu
290 295 300
Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met Thr
305 310 315 320
Gln Thr Pro Leu Thr Leu Ser Val Thr Ile Gly Gln Pro Ala Ser Ile
325 330 335
Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser Asp Gly Lys Thr Tyr
340 345 350
Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser Pro Lys Arg Leu Ile
355 360 365
Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro Asp Arg Phe Thr Gly
370 375 380
Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
385 390 395 400
Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly Thr His Phe Pro Arg
405 410 415
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Arg Arg Ala Asp Ala Ala
420 425 430
Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Gln Leu Thr Ser Gly
435 440 445
Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe Tyr Pro Lys Asp Ile
450 455 460
Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg Gln Asn Gly Val Leu
465 470 475 480
Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser Thr Tyr Ser Met Ser
485 490 495
Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu Arg His Asn Ser Tyr
500 505 510
Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser Pro Ile Val Lys Ser
515 520 525
Phe Asn Arg Asn Glu Cys Glu Asn Leu Tyr Phe Gln Gly His His His
530 535 540
His His His
545
<210> 130
<211> 877
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 130
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
1 5 10 15
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
20 25 30
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
35 40 45
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
50 55 60
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
65 70 75 80
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
85 90 95
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
100 105 110
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
115 120 125
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
130 135 140
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
145 150 155 160
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
165 170 175
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
180 185 190
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
195 200 205
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
210 215 220
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
225 230 235 240
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
245 250 255
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
260 265 270
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
275 280 285
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
290 295 300
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
305 310 315 320
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
325 330 335
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
340 345 350
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
355 360 365
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
370 375 380
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
385 390 395 400
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
405 410 415
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
420 425 430
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
435 440 445
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
450 455 460
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
465 470 475 480
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
485 490 495
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
500 505 510
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
515 520 525
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
530 535 540
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
545 550 555 560
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
565 570 575
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
580 585 590
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
595 600 605
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
610 615 620
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
625 630 635 640
Cys Ile Ile Pro Asn Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
645 650 655
Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe
660 665 670
Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro
675 680 685
Lys Val Thr Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val
690 695 700
Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr
705 710 715 720
Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu
725 730 735
Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys
740 745 750
Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser
755 760 765
Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro
770 775 780
Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser Leu Trp Cys Met Ile
785 790 795 800
Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly
805 810 815
Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp
820 825 830
Gly Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp
835 840 845
Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His
850 855 860
Asn His His Thr Glu Lys Ser Leu Ser His Ser Pro Gly
865 870 875
<210> 131
<211> 536
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 131
Glu Asp Cys Asn Glu Leu Pro Pro Arg Arg Asn Thr Glu Ile Leu Thr
1 5 10 15
Gly Ser Trp Ser Asp Gln Thr Tyr Pro Glu Gly Thr Gln Ala Ile Tyr
20 25 30
Lys Cys Arg Pro Gly Tyr Arg Ser Leu Gly Asn Val Ile Met Val Cys
35 40 45
Arg Lys Gly Glu Trp Val Ala Leu Asn Pro Leu Arg Lys Cys Gln Lys
50 55 60
Arg Pro Cys Gly His Pro Gly Asp Thr Pro Phe Gly Thr Phe Thr Leu
65 70 75 80
Thr Gly Gly Asn Val Phe Glu Tyr Gly Val Lys Ala Val Tyr Thr Cys
85 90 95
Asn Glu Gly Tyr Gln Leu Leu Gly Glu Ile Asn Tyr Arg Glu Cys Asp
100 105 110
Thr Asp Gly Trp Thr Asn Asp Ile Pro Ile Cys Glu Val Val Lys Cys
115 120 125
Leu Pro Val Thr Ala Pro Glu Asn Gly Lys Ile Val Ser Ser Ala Met
130 135 140
Glu Pro Asp Arg Glu Tyr His Phe Gly Gln Ala Val Arg Phe Val Cys
145 150 155 160
Asn Ser Gly Tyr Lys Ile Glu Gly Asp Glu Glu Met His Cys Ser Asp
165 170 175
Asp Gly Phe Trp Ser Lys Glu Lys Pro Lys Cys Val Glu Ile Ser Cys
180 185 190
Lys Ser Pro Asp Val Ile Asn Gly Ser Pro Ile Ser Gln Lys Ile Ile
195 200 205
Tyr Lys Glu Asn Glu Arg Phe Gln Tyr Lys Cys Asn Met Gly Tyr Glu
210 215 220
Tyr Ser Glu Arg Gly Asp Ala Val Cys Thr Glu Ser Gly Trp Arg Pro
225 230 235 240
Leu Pro Ser Cys Glu Glu Lys Ser Cys Asp Asn Pro Tyr Ile Pro Asn
245 250 255
Gly Asp Tyr Ser Pro Leu Arg Ile Lys His Arg Thr Gly Asp Glu Ile
260 265 270
Thr Tyr Gln Cys Arg Asn Gly Phe Tyr Pro Ala Thr Arg Gly Asn Thr
275 280 285
Ala Lys Cys Thr Ser Thr Gly Trp Ile Pro Ala Pro Arg Cys Thr Leu
290 295 300
Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Cys Lys Pro Cys
305 310 315 320
Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro Pro Lys
325 330 335
Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr Cys Val
340 345 350
Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser Trp Phe
355 360 365
Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg Glu Glu
370 375 380
Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile Met His
385 390 395 400
Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn Ser Ala
405 410 415
Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg
420 425 430
Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met
435 440 445
Ala Lys Asp Lys Val Ser Leu Trp Cys Met Ile Thr Asp Phe Phe Pro
450 455 460
Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn
465 470 475 480
Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr Phe Val
485 490 495
Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr
500 505 510
Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His Thr Glu
515 520 525
Lys Ser Leu Ser His Ser Pro Gly
530 535
<210> 132
<211> 1333
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 132
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
210 215 220
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
225 230 235 240
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
245 250 255
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
260 265 270
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
275 280 285
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
290 295 300
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
305 310 315 320
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
325 330 335
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
340 345 350
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
355 360 365
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
370 375 380
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
385 390 395 400
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
405 410 415
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
420 425 430
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
435 440 445
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
450 455 460
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
465 470 475 480
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
485 490 495
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
500 505 510
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
515 520 525
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
530 535 540
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
545 550 555 560
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
565 570 575
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
580 585 590
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
595 600 605
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
610 615 620
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
625 630 635 640
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
645 650 655
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
660 665 670
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
675 680 685
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
690 695 700
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
705 710 715 720
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
725 730 735
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
740 745 750
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
755 760 765
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
770 775 780
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
785 790 795 800
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
805 810 815
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
820 825 830
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
835 840 845
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
850 855 860
Cys Ile Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile
865 870 875 880
Leu Val Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu
885 890 895
Phe Arg Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys
900 905 910
Cys Gln Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg
915 920 925
Val Cys Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg
930 935 940
Asp Lys Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu
945 950 955 960
Pro Gly Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln
965 970 975
Gly Asp Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp
980 985 990
Asp Phe Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn
995 1000 1005
Leu Gln Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe
1010 1015 1020
Gln Leu Lys Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met
1025 1030 1035
Glu Ser Leu Trp Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe
1040 1045 1050
Cys Pro Ser Pro Pro Val Ile Pro Asn Gly Arg His Thr Gly Lys
1055 1060 1065
Pro Leu Glu Val Phe Pro Phe Gly Lys Ala Val Asn Tyr Thr Cys
1070 1075 1080
Asp Pro His Pro Asp Arg Gly Thr Ser Phe Asp Leu Ile Gly Glu
1085 1090 1095
Ser Thr Ile Arg Cys Thr Ser Asp Pro Gln Gly Asn Gly Val Trp
1100 1105 1110
Ser Ser Pro Ala Pro Arg Cys Gly Ile Leu Gly His Cys Gln Ala
1115 1120 1125
Pro Asp His Phe Leu Phe Ala Lys Leu Lys Thr Gln Thr Asn Ala
1130 1135 1140
Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr Glu Cys Arg Pro
1145 1150 1155
Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu Asp Asn Leu
1160 1165 1170
Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser Cys Lys
1175 1180 1185
Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr Asp
1190 1195 1200
Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
1205 1210 1215
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn
1220 1225 1230
Thr Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro
1235 1240 1245
Cys Gly Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr
1250 1255 1260
Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys
1265 1270 1275
Asn Leu Gly Ser Arg Gly Arg Lys Val Phe Glu Leu Val Gly Glu
1280 1285 1290
Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile Trp
1295 1300 1305
Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys Glu Asn Leu
1310 1315 1320
Tyr Phe Gln Gly His His His His His His
1325 1330
<210> 133
<211> 1553
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 133
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
210 215 220
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
225 230 235 240
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
245 250 255
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
260 265 270
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
275 280 285
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
290 295 300
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
305 310 315 320
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
325 330 335
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
340 345 350
Leu Ser Cys Ala Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu
355 360 365
Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro
370 375 380
Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Val Ser Lys Leu Asn Val
385 390 395 400
Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu
405 410 415
His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser
420 425 430
Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Cys Asn Ala
435 440 445
Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu Thr Asp Glu Phe
450 455 460
Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys Arg Pro Gly Tyr
465 470 475 480
Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn Ser Val Trp Thr
485 490 495
Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg Asn Pro Pro Asp
500 505 510
Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile Gln Phe Gly Ser
515 520 525
Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu Ile Gly Ser Ser
530 535 540
Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile Trp Asp Asn Glu
545 550 555 560
Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Thr
565 570 575
Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser
580 585 590
Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe
595 600 605
Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln
610 615 620
Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys
625 630 635 640
Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val Ser Asp Asn Arg
645 650 655
Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg Cys Gln Pro Gly
660 665 670
Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln Ala Leu Asn Lys
675 680 685
Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys Gln Pro Pro Pro
690 695 700
Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys Asp Asn Phe Ser
705 710 715 720
Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp Leu Arg
725 730 735
Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp Trp Ser Pro Ala
740 745 750
Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe Met Gly Gln Leu
755 760 765
Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln Leu Gly Ala Lys
770 775 780
Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser Ser Ala
785 790 795 800
Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp Asn Ser Ser Val
805 810 815
Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro Val Ile Pro Asn
820 825 830
Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro Phe Gly Lys Thr
835 840 845
Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly Thr Ser Phe Asp
850 855 860
Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp Pro Gln Gly Asn
865 870 875 880
Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile Leu Gly His Cys
885 890 895
Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys Thr Gln Thr Asn
900 905 910
Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr Glu Cys Arg Pro
915 920 925
Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu Asp Asn Leu Val
930 935 940
Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser Cys Lys Thr Pro
945 950 955 960
Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr Asp Ile Gln Val
965 970 975
Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His Arg Leu Ile Gly
980 985 990
His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala Ala His Trp Ser
995 1000 1005
Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly Leu Pro Pro
1010 1015 1020
Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
1025 1030 1035
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly
1040 1045 1050
Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
1055 1060 1065
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro
1070 1075 1080
Gln Cys Ile Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn
1085 1090 1095
Gly Ile Leu Val Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu
1100 1105 1110
Val Val Glu Phe Arg Cys Gln Pro Gly Phe Val Met Lys Gly Pro
1115 1120 1125
Arg Arg Val Lys Cys Gln Ala Leu Asn Lys Trp Glu Pro Glu Leu
1130 1135 1140
Pro Ser Cys Ser Arg Val Cys Gln Pro Pro Pro Asp Val Leu His
1145 1150 1155
Ala Glu Arg Thr Gln Arg Asp Lys Asp Asn Phe Ser Pro Gly Gln
1160 1165 1170
Glu Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp Leu Arg Gly Ala
1175 1180 1185
Ala Ser Met Arg Cys Thr Pro Gln Gly Asp Trp Ser Pro Ala Ala
1190 1195 1200
Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe Met Gly Gln Leu
1205 1210 1215
Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln Leu Gly Ala
1220 1225 1230
Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser
1235 1240 1245
Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp Asn
1250 1255 1260
Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
1265 1270 1275
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe
1280 1285 1290
Pro Phe Gly Lys Ala Val Asn Tyr Thr Cys Asp Pro His Pro Asp
1295 1300 1305
Arg Gly Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys
1310 1315 1320
Thr Ser Asp Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro
1325 1330 1335
Arg Cys Gly Ile Leu Gly His Cys Gln Ala Pro Asp His Phe Leu
1340 1345 1350
Phe Ala Lys Leu Lys Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile
1355 1360 1365
Gly Thr Ser Leu Lys Tyr Glu Cys Arg Pro Glu Tyr Tyr Gly Arg
1370 1375 1380
Pro Phe Ser Ile Thr Cys Leu Asp Asn Leu Val Trp Ser Ser Pro
1385 1390 1395
Lys Asp Val Cys Lys Arg Lys Ser Cys Lys Thr Pro Pro Asp Pro
1400 1405 1410
Val Asn Gly Met Val His Val Ile Thr Asp Ile Gln Val Gly Ser
1415 1420 1425
Arg Ile Asn Tyr Ser Cys Thr Thr Gly His Arg Leu Ile Gly His
1430 1435 1440
Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Thr Ala His Trp Ser
1445 1450 1455
Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly Leu Pro Pro
1460 1465 1470
Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
1475 1480 1485
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Leu Gly Ser Arg
1490 1495 1500
Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
1505 1510 1515
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro
1520 1525 1530
Gln Cys Ile Ile Pro Asn Lys Glu Asn Leu Tyr Phe Gln Gly His
1535 1540 1545
His His His His His
1550
<210> 134
<211> 1553
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 134
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
210 215 220
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
225 230 235 240
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
245 250 255
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
260 265 270
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
275 280 285
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
290 295 300
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
305 310 315 320
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
325 330 335
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
340 345 350
Leu Thr Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu
355 360 365
Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro
370 375 380
Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val
385 390 395 400
Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu
405 410 415
His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser
420 425 430
Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Cys Asn Ala
435 440 445
Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu Thr Asp Glu Phe
450 455 460
Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys Arg Pro Gly Tyr
465 470 475 480
Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn Ser Val Trp Thr
485 490 495
Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg Asn Pro Pro Asp
500 505 510
Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile Gln Phe Gly Ser
515 520 525
Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu Ile Gly Ser Ser
530 535 540
Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile Trp Asp Asn Glu
545 550 555 560
Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Thr
565 570 575
Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser
580 585 590
Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe
595 600 605
Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln
610 615 620
Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys
625 630 635 640
Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val Ser Asp Asn Arg
645 650 655
Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg Cys Gln Pro Gly
660 665 670
Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln Ala Leu Asn Lys
675 680 685
Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys Gln Pro Pro Pro
690 695 700
Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys Asp Asn Phe Ser
705 710 715 720
Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp Leu Arg
725 730 735
Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp Trp Ser Pro Ala
740 745 750
Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe Met Gly Gln Leu
755 760 765
Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln Leu Gly Ala Lys
770 775 780
Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser Ser Ala
785 790 795 800
Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp Asn Ser Ser Val
805 810 815
Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro Val Ile Pro Asn
820 825 830
Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro Phe Gly Lys Thr
835 840 845
Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly Thr Ser Phe Asp
850 855 860
Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp Pro Gln Gly Asn
865 870 875 880
Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile Leu Gly His Cys
885 890 895
Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys Thr Gln Thr Asn
900 905 910
Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr Glu Cys Arg Pro
915 920 925
Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu Asp Asn Leu Val
930 935 940
Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser Cys Lys Thr Pro
945 950 955 960
Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr Asp Ile Gln Val
965 970 975
Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His Arg Leu Ile Gly
980 985 990
His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala Ala His Trp Ser
995 1000 1005
Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly Leu Pro Pro
1010 1015 1020
Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
1025 1030 1035
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly
1040 1045 1050
Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
1055 1060 1065
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro
1070 1075 1080
Gln Cys Ile Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn
1085 1090 1095
Gly Ile Leu Val Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu
1100 1105 1110
Val Val Glu Phe Arg Cys Gln Pro Gly Phe Val Met Lys Gly Pro
1115 1120 1125
Arg Arg Val Lys Cys Gln Ala Leu Asn Lys Trp Glu Pro Glu Leu
1130 1135 1140
Pro Ser Cys Ser Arg Val Cys Gln Pro Pro Pro Asp Val Leu His
1145 1150 1155
Ala Glu Arg Thr Gln Arg Asp Lys Asp Asn Phe Ser Pro Gly Gln
1160 1165 1170
Glu Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp Leu Arg Gly Ala
1175 1180 1185
Ala Ser Met Arg Cys Thr Pro Gln Gly Asp Trp Ser Pro Ala Ala
1190 1195 1200
Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe Met Gly Gln Leu
1205 1210 1215
Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln Leu Gly Ala
1220 1225 1230
Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser
1235 1240 1245
Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp Asn
1250 1255 1260
Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
1265 1270 1275
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe
1280 1285 1290
Pro Phe Gly Lys Ala Val Asn Tyr Thr Cys Asp Pro His Pro Asp
1295 1300 1305
Arg Gly Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys
1310 1315 1320
Thr Ser Asp Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro
1325 1330 1335
Arg Cys Gly Ile Leu Gly His Cys Gln Ala Pro Asp His Phe Leu
1340 1345 1350
Phe Ala Lys Leu Lys Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile
1355 1360 1365
Gly Thr Ser Leu Lys Tyr Glu Cys Arg Pro Glu Tyr Tyr Gly Arg
1370 1375 1380
Pro Phe Ser Ile Thr Cys Leu Asp Asn Leu Val Trp Ser Ser Pro
1385 1390 1395
Lys Asp Val Cys Lys Arg Lys Ser Cys Lys Thr Pro Pro Asp Pro
1400 1405 1410
Val Asn Gly Met Val His Val Ile Thr Asp Ile Gln Val Gly Ser
1415 1420 1425
Arg Ile Asn Tyr Ser Cys Thr Thr Gly His Arg Leu Ile Gly His
1430 1435 1440
Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Thr Ala His Trp Ser
1445 1450 1455
Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly Leu Pro Pro
1460 1465 1470
Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
1475 1480 1485
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Leu Gly Ser Arg
1490 1495 1500
Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
1505 1510 1515
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro
1520 1525 1530
Gln Cys Ile Ile Pro Asn Lys Glu Asn Leu Tyr Phe Gln Gly His
1535 1540 1545
His His His His His
1550
<210> 135
<211> 1338
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 135
Asp Val Val Met Thr Gln Thr Pro Leu Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Arg
100 105 110
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu
115 120 125
Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe
130 135 140
Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg
145 150 155 160
Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu
180 185 190
Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser
195 200 205
Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys Gly Gly Gly Gly Ser
210 215 220
Gly Gly Gly Gly Ser Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala
225 230 235 240
Arg Pro Thr Asn Leu Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr
245 250 255
Leu Asn Tyr Glu Cys Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile
260 265 270
Ile Cys Leu Lys Asn Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg
275 280 285
Arg Lys Ser Cys Arg Asn Pro Pro Asp Pro Val Asn Gly Met Val His
290 295 300
Val Ile Lys Gly Ile Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr
305 310 315 320
Lys Gly Tyr Arg Leu Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser
325 330 335
Gly Asp Thr Val Ile Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile
340 345 350
Pro Cys Gly Leu Pro Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr
355 360 365
Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn
370 375 380
Pro Gly Ser Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser
385 390 395 400
Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro
405 410 415
Ala Pro Gln Cys Ile Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu
420 425 430
Asn Gly Ile Leu Val Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu
435 440 445
Val Val Glu Phe Arg Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg
450 455 460
Arg Val Lys Cys Gln Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser
465 470 475 480
Cys Ser Arg Val Cys Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg
485 490 495
Thr Gln Arg Asp Lys Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr
500 505 510
Ser Cys Glu Pro Gly Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys
515 520 525
Thr Pro Gln Gly Asp Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys
530 535 540
Ser Cys Asp Asp Phe Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe
545 550 555 560
Pro Val Asn Leu Gln Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu
565 570 575
Gly Phe Gln Leu Lys Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly
580 585 590
Met Glu Ser Leu Trp Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe
595 600 605
Cys Pro Ser Pro Pro Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro
610 615 620
Leu Glu Val Phe Pro Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro
625 630 635 640
His Pro Asp Arg Gly Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile
645 650 655
Arg Cys Thr Ser Asp Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala
660 665 670
Pro Arg Cys Gly Ile Leu Gly His Cys Gln Ala Pro Asp His Phe Leu
675 680 685
Phe Ala Lys Leu Lys Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly
690 695 700
Thr Ser Leu Lys Tyr Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe
705 710 715 720
Ser Ile Thr Cys Leu Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val
725 730 735
Cys Lys Arg Lys Ser Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met
740 745 750
Val His Val Ile Thr Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser
755 760 765
Cys Thr Thr Gly His Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile
770 775 780
Leu Ser Gly Asn Ala Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln
785 790 795 800
Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile
805 810 815
Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg
820 825 830
Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu
835 840 845
Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser
850 855 860
Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys Cys Thr Pro Pro Asn
865 870 875 880
Val Glu Asn Gly Ile Leu Val Ser Asp Asn Arg Ser Leu Phe Ser Leu
885 890 895
Asn Glu Val Val Glu Phe Arg Cys Gln Pro Gly Phe Val Met Lys Gly
900 905 910
Pro Arg Arg Val Lys Cys Gln Ala Leu Asn Lys Trp Glu Pro Glu Leu
915 920 925
Pro Ser Cys Ser Arg Val Cys Gln Pro Pro Pro Asp Val Leu His Ala
930 935 940
Glu Arg Thr Gln Arg Asp Lys Asp Asn Phe Ser Pro Gly Gln Glu Val
945 950 955 960
Phe Tyr Ser Cys Glu Pro Gly Tyr Asp Leu Arg Gly Ala Ala Ser Met
965 970 975
Arg Cys Thr Pro Gln Gly Asp Trp Ser Pro Ala Ala Pro Thr Cys Glu
980 985 990
Val Lys Ser Cys Asp Asp Phe Met Gly Gln Leu Leu Asn Gly Arg Val
995 1000 1005
Leu Phe Pro Val Asn Leu Gln Leu Gly Ala Lys Val Asp Phe Val
1010 1015 1020
Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser Ser Ala Ser Tyr Cys
1025 1030 1035
Val Leu Ala Gly Met Glu Ser Leu Trp Asn Ser Ser Val Pro Val
1040 1045 1050
Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro Val Ile Pro Asn Gly
1055 1060 1065
Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro Phe Gly Lys Ala
1070 1075 1080
Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly Thr Ser Phe
1085 1090 1095
Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp Pro Gln
1100 1105 1110
Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile Leu
1115 1120 1125
Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
1130 1135 1140
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys
1145 1150 1155
Tyr Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr
1160 1165 1170
Cys Leu Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys
1175 1180 1185
Arg Lys Ser Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val
1190 1195 1200
His Val Ile Thr Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser
1205 1210 1215
Cys Thr Thr Gly His Arg Leu Ile Gly His Ser Ser Ala Glu Cys
1220 1225 1230
Ile Leu Ser Gly Asn Thr Ala His Trp Ser Thr Lys Pro Pro Ile
1235 1240 1245
Cys Gln Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Ala Asn Gly
1250 1255 1260
Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val
1265 1270 1275
Val Thr Tyr Arg Cys Asn Leu Gly Ser Arg Gly Arg Lys Val Phe
1280 1285 1290
Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp
1295 1300 1305
Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro
1310 1315 1320
Asn Lys Glu Asn Leu Tyr Phe Gln Gly His His His His His His
1325 1330 1335
<210> 136
<211> 1553
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 136
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
1 5 10 15
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
20 25 30
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
35 40 45
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
50 55 60
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
65 70 75 80
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
85 90 95
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
100 105 110
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
115 120 125
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
130 135 140
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
145 150 155 160
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
165 170 175
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
180 185 190
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
195 200 205
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
210 215 220
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
225 230 235 240
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
245 250 255
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
260 265 270
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
275 280 285
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
290 295 300
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
305 310 315 320
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
325 330 335
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
340 345 350
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
355 360 365
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
370 375 380
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
385 390 395 400
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
405 410 415
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
420 425 430
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
435 440 445
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
450 455 460
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
465 470 475 480
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
485 490 495
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
500 505 510
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
515 520 525
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
530 535 540
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
545 550 555 560
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
565 570 575
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
580 585 590
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
595 600 605
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
610 615 620
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
625 630 635 640
Cys Ile Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile
645 650 655
Leu Val Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu
660 665 670
Phe Arg Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys
675 680 685
Cys Gln Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg
690 695 700
Val Cys Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg
705 710 715 720
Asp Lys Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu
725 730 735
Pro Gly Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln
740 745 750
Gly Asp Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp
755 760 765
Asp Phe Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn
770 775 780
Leu Gln Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln
785 790 795 800
Leu Lys Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser
805 810 815
Leu Trp Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser
820 825 830
Pro Pro Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val
835 840 845
Phe Pro Phe Gly Lys Ala Val Asn Tyr Thr Cys Asp Pro His Pro Asp
850 855 860
Arg Gly Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr
865 870 875 880
Ser Asp Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys
885 890 895
Gly Ile Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys
900 905 910
Leu Lys Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu
915 920 925
Lys Tyr Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr
930 935 940
Cys Leu Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg
945 950 955 960
Lys Ser Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val
965 970 975
Ile Thr Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr
980 985 990
Gly His Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly
995 1000 1005
Asn Thr Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile
1010 1015 1020
Pro Cys Gly Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser
1025 1030 1035
Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg
1040 1045 1050
Cys Asn Leu Gly Ser Arg Gly Arg Lys Val Phe Glu Leu Val Gly
1055 1060 1065
Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile
1070 1075 1080
Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys Gly Gly
1085 1090 1095
Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Gln Gln Ser
1100 1105 1110
Gly Pro Val Leu Val Lys Pro Gly Ala Ser Val Lys Met Ser Cys
1115 1120 1125
Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr Tyr Ile Asn Trp Val
1130 1135 1140
Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile Gly Val Ile Asn
1145 1150 1155
Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe Lys Gly Lys
1160 1165 1170
Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr Met Glu
1175 1180 1185
Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys Ser
1190 1195 1200
Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
1205 1210 1215
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala
1220 1225 1230
Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly
1235 1240 1245
Tyr Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu
1250 1255 1260
Ser Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu
1265 1270 1275
Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro
1280 1285 1290
Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr
1295 1300 1305
Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys Pro
1310 1315 1320
Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
1325 1330 1335
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val
1340 1345 1350
Thr Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln
1355 1360 1365
Phe Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr
1370 1375 1380
Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser
1385 1390 1395
Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe
1400 1405 1410
Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys
1415 1420 1425
Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val Tyr
1430 1435 1440
Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
1445 1450 1455
Leu Thr Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val
1460 1465 1470
Glu Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr
1475 1480 1485
Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys
1490 1495 1500
Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr
1505 1510 1515
Cys Ser Val Leu His Glu Gly Leu His Asn His His Thr Glu Lys
1520 1525 1530
Ser Leu Ser His Ser Pro Gly Glu Asn Leu Tyr Phe Gln Gly His
1535 1540 1545
His His His His His
1550
<210> 137
<211> 1338
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 137
Gln Cys Asn Ala Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu
1 5 10 15
Thr Asp Glu Phe Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys
20 25 30
Arg Pro Gly Tyr Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn
35 40 45
Ser Val Trp Thr Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg
50 55 60
Asn Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile
65 70 75 80
Gln Phe Gly Ser Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu
85 90 95
Ile Gly Ser Ser Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile
100 105 110
Trp Asp Asn Glu Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro
115 120 125
Pro Thr Ile Thr Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
130 135 140
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly
145 150 155 160
Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser
165 170 175
Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile
180 185 190
Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val
195 200 205
Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg
210 215 220
Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln
225 230 235 240
Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys
245 250 255
Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys
260 265 270
Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly
275 280 285
Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp
290 295 300
Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe
305 310 315 320
Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln
325 330 335
Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys
340 345 350
Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp
355 360 365
Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro
370 375 380
Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro
385 390 395 400
Phe Gly Lys Thr Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly
405 410 415
Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp
420 425 430
Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile
435 440 445
Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys
450 455 460
Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr
465 470 475 480
Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu
485 490 495
Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser
500 505 510
Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr
515 520 525
Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His
530 535 540
Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala
545 550 555 560
Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly
565 570 575
Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu
580 585 590
Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser
595 600 605
Gly Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
610 615 620
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro Gln
625 630 635 640
Cys Ile Ile Pro Asn Lys Cys Thr Pro Pro Asn Val Glu Asn Gly Ile
645 650 655
Leu Val Ser Asp Asn Arg Ser Leu Phe Ser Leu Asn Glu Val Val Glu
660 665 670
Phe Arg Cys Gln Pro Gly Phe Val Met Lys Gly Pro Arg Arg Val Lys
675 680 685
Cys Gln Ala Leu Asn Lys Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg
690 695 700
Val Cys Gln Pro Pro Pro Asp Val Leu His Ala Glu Arg Thr Gln Arg
705 710 715 720
Asp Lys Asp Asn Phe Ser Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu
725 730 735
Pro Gly Tyr Asp Leu Arg Gly Ala Ala Ser Met Arg Cys Thr Pro Gln
740 745 750
Gly Asp Trp Ser Pro Ala Ala Pro Thr Cys Glu Val Lys Ser Cys Asp
755 760 765
Asp Phe Met Gly Gln Leu Leu Asn Gly Arg Val Leu Phe Pro Val Asn
770 775 780
Leu Gln Leu Gly Ala Lys Val Asp Phe Val Cys Asp Glu Gly Phe Gln
785 790 795 800
Leu Lys Gly Ser Ser Ala Ser Tyr Cys Val Leu Ala Gly Met Glu Ser
805 810 815
Leu Trp Asn Ser Ser Val Pro Val Cys Glu Gln Ile Phe Cys Pro Ser
820 825 830
Pro Pro Val Ile Pro Asn Gly Arg His Thr Gly Lys Pro Leu Glu Val
835 840 845
Phe Pro Phe Gly Lys Ala Val Asn Tyr Thr Cys Asp Pro His Pro Asp
850 855 860
Arg Gly Thr Ser Phe Asp Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr
865 870 875 880
Ser Asp Pro Gln Gly Asn Gly Val Trp Ser Ser Pro Ala Pro Arg Cys
885 890 895
Gly Ile Leu Gly His Cys Gln Ala Pro Asp His Phe Leu Phe Ala Lys
900 905 910
Leu Lys Thr Gln Thr Asn Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu
915 920 925
Lys Tyr Glu Cys Arg Pro Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr
930 935 940
Cys Leu Asp Asn Leu Val Trp Ser Ser Pro Lys Asp Val Cys Lys Arg
945 950 955 960
Lys Ser Cys Lys Thr Pro Pro Asp Pro Val Asn Gly Met Val His Val
965 970 975
Ile Thr Asp Ile Gln Val Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr
980 985 990
Gly His Arg Leu Ile Gly His Ser Ser Ala Glu Cys Ile Leu Ser Gly
995 1000 1005
Asn Thr Ala His Trp Ser Thr Lys Pro Pro Ile Cys Gln Arg Ile
1010 1015 1020
Pro Cys Gly Leu Pro Pro Thr Ile Ala Asn Gly Asp Phe Ile Ser
1025 1030 1035
Thr Asn Arg Glu Asn Phe His Tyr Gly Ser Val Val Thr Tyr Arg
1040 1045 1050
Cys Asn Leu Gly Ser Arg Gly Arg Lys Val Phe Glu Leu Val Gly
1055 1060 1065
Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln Val Gly Ile
1070 1075 1080
Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys Gly Gly
1085 1090 1095
Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met Thr Gln Thr
1100 1105 1110
Pro Leu Thr Leu Ser Val Thr Ile Gly Gln Pro Ala Ser Ile Ser
1115 1120 1125
Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser Asp Gly Lys Thr Tyr
1130 1135 1140
Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser Pro Lys Arg Leu
1145 1150 1155
Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro Asp Arg Phe
1160 1165 1170
Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg
1175 1180 1185
Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly Thr
1190 1195 1200
His Phe Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Arg
1205 1210 1215
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser
1220 1225 1230
Glu Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn
1235 1240 1245
Asn Phe Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly
1250 1255 1260
Ser Glu Arg Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp
1265 1270 1275
Ser Lys Asp Ser Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr
1280 1285 1290
Lys Asp Glu Tyr Glu Arg His Asn Ser Tyr Thr Cys Glu Ala Thr
1295 1300 1305
His Lys Thr Ser Thr Ser Pro Ile Val Lys Ser Phe Asn Arg Asn
1310 1315 1320
Glu Cys Glu Asn Leu Tyr Phe Gln Gly His His His His His His
1325 1330 1335
<210> 138
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 138
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 139
<211> 749
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 139
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
210 215 220
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
225 230 235 240
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
245 250 255
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
260 265 270
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
275 280 285
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
290 295 300
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
305 310 315 320
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
325 330 335
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
340 345 350
Leu Ser Cys Ala Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu
355 360 365
Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro
370 375 380
Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Val Ser Lys Leu Asn Val
385 390 395 400
Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu
405 410 415
His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser
420 425 430
Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Asp Cys Asn
435 440 445
Glu Leu Pro Pro Arg Arg Asn Thr Glu Ile Leu Thr Gly Ser Trp Ser
450 455 460
Asp Gln Thr Tyr Pro Glu Gly Thr Gln Ala Ile Tyr Lys Cys Arg Pro
465 470 475 480
Gly Tyr Arg Ser Leu Gly Asn Val Ile Met Val Cys Arg Lys Gly Glu
485 490 495
Trp Val Ala Leu Asn Pro Leu Arg Lys Cys Gln Lys Arg Pro Cys Gly
500 505 510
His Pro Gly Asp Thr Pro Phe Gly Thr Phe Thr Leu Thr Gly Gly Asn
515 520 525
Val Phe Glu Tyr Gly Val Lys Ala Val Tyr Thr Cys Asn Glu Gly Tyr
530 535 540
Gln Leu Leu Gly Glu Ile Asn Tyr Arg Glu Cys Asp Thr Asp Gly Trp
545 550 555 560
Thr Asn Asp Ile Pro Ile Cys Glu Val Val Lys Cys Leu Pro Val Thr
565 570 575
Ala Pro Glu Asn Gly Lys Ile Val Ser Ser Ala Met Glu Pro Asp Arg
580 585 590
Glu Tyr His Phe Gly Gln Ala Val Arg Phe Val Cys Asn Ser Gly Tyr
595 600 605
Lys Ile Glu Gly Asp Glu Glu Met His Cys Ser Asp Asp Gly Phe Trp
610 615 620
Ser Lys Glu Lys Pro Lys Cys Val Glu Ile Ser Cys Lys Ser Pro Asp
625 630 635 640
Val Ile Asn Gly Ser Pro Ile Ser Gln Lys Ile Ile Tyr Lys Glu Asn
645 650 655
Glu Arg Phe Gln Tyr Lys Cys Asn Met Gly Tyr Glu Tyr Ser Glu Arg
660 665 670
Gly Asp Ala Val Cys Thr Glu Ser Gly Trp Arg Pro Leu Pro Ser Cys
675 680 685
Glu Glu Lys Ser Cys Asp Asn Pro Tyr Ile Pro Asn Gly Asp Tyr Ser
690 695 700
Pro Leu Arg Ile Lys His Arg Thr Gly Asp Glu Ile Thr Tyr Gln Cys
705 710 715 720
Arg Asn Gly Phe Tyr Pro Ala Thr Arg Gly Asn Thr Ala Lys Cys Thr
725 730 735
Ser Thr Gly Trp Ile Pro Ala Pro Arg Cys Thr Leu Lys
740 745
<210> 140
<211> 1090
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 140
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
210 215 220
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
225 230 235 240
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
245 250 255
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
260 265 270
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
275 280 285
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
290 295 300
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
305 310 315 320
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
325 330 335
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
340 345 350
Leu Trp Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu
355 360 365
Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro
370 375 380
Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val
385 390 395 400
Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu
405 410 415
His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser
420 425 430
Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Cys Asn Ala
435 440 445
Pro Glu Trp Leu Pro Phe Ala Arg Pro Thr Asn Leu Thr Asp Glu Phe
450 455 460
Glu Phe Pro Ile Gly Thr Tyr Leu Asn Tyr Glu Cys Arg Pro Gly Tyr
465 470 475 480
Ser Gly Arg Pro Phe Ser Ile Ile Cys Leu Lys Asn Ser Val Trp Thr
485 490 495
Gly Ala Lys Asp Arg Cys Arg Arg Lys Ser Cys Arg Asn Pro Pro Asp
500 505 510
Pro Val Asn Gly Met Val His Val Ile Lys Gly Ile Gln Phe Gly Ser
515 520 525
Gln Ile Lys Tyr Ser Cys Thr Lys Gly Tyr Arg Leu Ile Gly Ser Ser
530 535 540
Ser Ala Thr Cys Ile Ile Ser Gly Asp Thr Val Ile Trp Asp Asn Glu
545 550 555 560
Thr Pro Ile Cys Asp Arg Ile Pro Cys Gly Leu Pro Pro Thr Ile Thr
565 570 575
Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe His Tyr Gly Ser
580 585 590
Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly Gly Arg Lys Val Phe
595 600 605
Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys Thr Ser Asn Asp Asp Gln
610 615 620
Val Gly Ile Trp Ser Gly Pro Ala Pro Gln Cys Ile Ile Pro Asn Lys
625 630 635 640
Cys Thr Pro Pro Asn Val Glu Asn Gly Ile Leu Val Ser Asp Asn Arg
645 650 655
Ser Leu Phe Ser Leu Asn Glu Val Val Glu Phe Arg Cys Gln Pro Gly
660 665 670
Phe Val Met Lys Gly Pro Arg Arg Val Lys Cys Gln Ala Leu Asn Lys
675 680 685
Trp Glu Pro Glu Leu Pro Ser Cys Ser Arg Val Cys Gln Pro Pro Pro
690 695 700
Asp Val Leu His Ala Glu Arg Thr Gln Arg Asp Lys Asp Asn Phe Ser
705 710 715 720
Pro Gly Gln Glu Val Phe Tyr Ser Cys Glu Pro Gly Tyr Asp Leu Arg
725 730 735
Gly Ala Ala Ser Met Arg Cys Thr Pro Gln Gly Asp Trp Ser Pro Ala
740 745 750
Ala Pro Thr Cys Glu Val Lys Ser Cys Asp Asp Phe Met Gly Gln Leu
755 760 765
Leu Asn Gly Arg Val Leu Phe Pro Val Asn Leu Gln Leu Gly Ala Lys
770 775 780
Val Asp Phe Val Cys Asp Glu Gly Phe Gln Leu Lys Gly Ser Ser Ala
785 790 795 800
Ser Tyr Cys Val Leu Ala Gly Met Glu Ser Leu Trp Asn Ser Ser Val
805 810 815
Pro Val Cys Glu Gln Ile Phe Cys Pro Ser Pro Pro Val Ile Pro Asn
820 825 830
Gly Arg His Thr Gly Lys Pro Leu Glu Val Phe Pro Phe Gly Lys Thr
835 840 845
Val Asn Tyr Thr Cys Asp Pro His Pro Asp Arg Gly Thr Ser Phe Asp
850 855 860
Leu Ile Gly Glu Ser Thr Ile Arg Cys Thr Ser Asp Pro Gln Gly Asn
865 870 875 880
Gly Val Trp Ser Ser Pro Ala Pro Arg Cys Gly Ile Leu Gly His Cys
885 890 895
Gln Ala Pro Asp His Phe Leu Phe Ala Lys Leu Lys Thr Gln Thr Asn
900 905 910
Ala Ser Asp Phe Pro Ile Gly Thr Ser Leu Lys Tyr Glu Cys Arg Pro
915 920 925
Glu Tyr Tyr Gly Arg Pro Phe Ser Ile Thr Cys Leu Asp Asn Leu Val
930 935 940
Trp Ser Ser Pro Lys Asp Val Cys Lys Arg Lys Ser Cys Lys Thr Pro
945 950 955 960
Pro Asp Pro Val Asn Gly Met Val His Val Ile Thr Asp Ile Gln Val
965 970 975
Gly Ser Arg Ile Asn Tyr Ser Cys Thr Thr Gly His Arg Leu Ile Gly
980 985 990
His Ser Ser Ala Glu Cys Ile Leu Ser Gly Asn Ala Ala His Trp Ser
995 1000 1005
Thr Lys Pro Pro Ile Cys Gln Arg Ile Pro Cys Gly Leu Pro Pro
1010 1015 1020
Thr Ile Ala Asn Gly Asp Phe Ile Ser Thr Asn Arg Glu Asn Phe
1025 1030 1035
His Tyr Gly Ser Val Val Thr Tyr Arg Cys Asn Pro Gly Ser Gly
1040 1045 1050
Gly Arg Lys Val Phe Glu Leu Val Gly Glu Pro Ser Ile Tyr Cys
1055 1060 1065
Thr Ser Asn Asp Asp Gln Val Gly Ile Trp Ser Gly Pro Ala Pro
1070 1075 1080
Gln Cys Ile Ile Pro Asn Lys
1085 1090
<210> 141
<211> 695
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 141
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
210 215 220
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
225 230 235 240
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
245 250 255
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
260 265 270
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
275 280 285
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
290 295 300
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
305 310 315 320
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
325 330 335
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
340 345 350
Leu Thr Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu
355 360 365
Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro
370 375 380
Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val
385 390 395 400
Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu
405 410 415
His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser
420 425 430
Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Cys Gly Leu
435 440 445
Pro Pro Asp Val Pro Asn Ala Gln Pro Ala Leu Glu Gly Arg Thr Ser
450 455 460
Phe Pro Glu Asp Thr Val Ile Thr Tyr Lys Cys Glu Glu Ser Phe Val
465 470 475 480
Lys Ile Pro Gly Glu Lys Asp Ser Val Ile Cys Leu Lys Gly Ser Gln
485 490 495
Trp Ser Asp Ile Glu Glu Phe Cys Asn Arg Ser Cys Glu Val Pro Thr
500 505 510
Arg Leu Asn Ser Ala Ser Leu Lys Gln Pro Tyr Ile Thr Gln Asn Tyr
515 520 525
Phe Pro Val Gly Thr Val Val Glu Tyr Glu Cys Arg Pro Gly Tyr Arg
530 535 540
Arg Glu Pro Ser Leu Ser Pro Lys Leu Thr Cys Leu Gln Asn Leu Lys
545 550 555 560
Trp Ser Thr Ala Val Glu Phe Cys Lys Lys Lys Ser Cys Pro Asn Pro
565 570 575
Gly Glu Ile Arg Asn Gly Gln Ile Asp Val Pro Gly Gly Ile Leu Phe
580 585 590
Gly Ala Thr Ile Ser Phe Ser Cys Asn Thr Gly Tyr Lys Leu Phe Gly
595 600 605
Ser Thr Ser Ser Phe Cys Leu Ile Ser Gly Ser Ser Val Gln Trp Ser
610 615 620
Asp Pro Leu Pro Glu Cys Arg Glu Ile Tyr Cys Pro Ala Pro Pro Gln
625 630 635 640
Ile Asp Asn Gly Ile Ile Gln Gly Glu Arg Asp His Tyr Gly Tyr Arg
645 650 655
Gln Ser Val Thr Tyr Ala Cys Asn Lys Gly Phe Thr Met Ile Gly Glu
660 665 670
His Ser Ile Tyr Cys Thr Val Asn Asn Asp Glu Gly Glu Trp Ser Gly
675 680 685
Pro Pro Pro Glu Cys Arg Gly
690 695
<210> 142
<211> 521
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 142
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
210 215 220
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
225 230 235 240
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
245 250 255
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
260 265 270
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
275 280 285
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
290 295 300
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
305 310 315 320
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
325 330 335
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
340 345 350
Leu Thr Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu
355 360 365
Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro
370 375 380
Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val
385 390 395 400
Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu
405 410 415
His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser
420 425 430
Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Leu Gln Cys Tyr
435 440 445
Asn Cys Pro Asn Pro Thr Ala Asp Cys Lys Thr Ala Val Asn Cys Ser
450 455 460
Ser Asp Phe Asp Ala Cys Leu Ile Thr Lys Ala Gly Leu Gln Val Tyr
465 470 475 480
Asn Lys Cys Trp Lys Phe Glu His Cys Asn Phe Asn Asp Val Thr Thr
485 490 495
Arg Leu Arg Glu Asn Glu Leu Thr Tyr Tyr Cys Cys Lys Lys Asp Leu
500 505 510
Cys Asn Phe Asn Glu Gln Leu Glu Asn
515 520
<210> 143
<211> 805
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 143
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
210 215 220
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
225 230 235 240
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
245 250 255
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
260 265 270
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
275 280 285
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
290 295 300
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
305 310 315 320
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
325 330 335
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
340 345 350
Leu Thr Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu
355 360 365
Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro
370 375 380
Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val
385 390 395 400
Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu
405 410 415
His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser
420 425 430
Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser His Thr Val Glu
435 440 445
Leu Asn Asn Met Phe Gly Gln Ile Gln Ser Pro Gly Tyr Pro Asp Ser
450 455 460
Tyr Pro Ser Asp Ser Glu Val Thr Trp Asn Ile Thr Val Pro Asp Gly
465 470 475 480
Phe Arg Ile Lys Leu Tyr Phe Met His Phe Asn Leu Glu Ser Ser Tyr
485 490 495
Leu Cys Glu Tyr Asp Tyr Val Lys Val Glu Thr Glu Asp Gln Val Leu
500 505 510
Ala Thr Phe Cys Gly Arg Glu Thr Thr Asp Thr Glu Gln Thr Pro Gly
515 520 525
Gln Glu Val Val Leu Ser Pro Gly Ser Phe Met Ser Ile Thr Phe Arg
530 535 540
Ser Asp Phe Ser Asn Glu Glu Arg Phe Thr Gly Phe Asp Ala His Tyr
545 550 555 560
Met Ala Val Asp Val Asp Glu Cys Lys Glu Arg Glu Asp Glu Glu Leu
565 570 575
Ser Cys Asp His Tyr Cys His Asn Tyr Ile Gly Gly Tyr Tyr Cys Ser
580 585 590
Cys Arg Phe Gly Tyr Ile Leu His Thr Asp Asn Arg Thr Cys Arg Val
595 600 605
Glu Cys Ser Asp Asn Leu Phe Thr Gln Arg Thr Gly Val Ile Thr Ser
610 615 620
Pro Asp Phe Pro Asn Pro Tyr Pro Lys Ser Ser Glu Cys Leu Tyr Thr
625 630 635 640
Ile Glu Leu Glu Glu Gly Phe Met Val Asn Leu Gln Phe Glu Asp Ile
645 650 655
Phe Asp Ile Glu Asp His Pro Glu Val Pro Cys Pro Tyr Asp Tyr Ile
660 665 670
Lys Ile Lys Val Gly Pro Lys Val Leu Gly Pro Phe Cys Gly Glu Lys
675 680 685
Ala Pro Glu Pro Ile Ser Thr Gln Ser His Ser Val Leu Ile Leu Phe
690 695 700
His Ser Asp Asn Ser Gly Glu Asn Arg Gly Trp Arg Leu Ser Tyr Arg
705 710 715 720
Ala Ala Gly Asn Glu Cys Pro Glu Leu Gln Pro Pro Val His Gly Lys
725 730 735
Ile Glu Pro Ser Gln Ala Lys Tyr Phe Phe Lys Asp Gln Val Leu Val
740 745 750
Ser Cys Asp Thr Gly Tyr Lys Val Leu Lys Asp Asn Val Glu Met Asp
755 760 765
Thr Phe Gln Ile Glu Cys Leu Lys Asp Gly Thr Trp Ser Asn Lys Ile
770 775 780
Pro Thr Cys Lys Lys Asn Glu Ile Asp Leu Glu Ser Glu Leu Lys Ser
785 790 795 800
Glu Gln Val Thr Glu
805
<210> 144
<211> 695
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 144
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
210 215 220
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
225 230 235 240
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
245 250 255
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
260 265 270
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
275 280 285
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
290 295 300
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
305 310 315 320
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
325 330 335
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
340 345 350
Leu Thr Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu
355 360 365
Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro
370 375 380
Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val
385 390 395 400
Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu
405 410 415
His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser
420 425 430
Pro Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Cys Glu Glu Pro
435 440 445
Pro Thr Phe Glu Ala Met Glu Leu Ile Gly Lys Pro Lys Pro Tyr Tyr
450 455 460
Glu Ile Gly Glu Arg Val Asp Tyr Lys Cys Lys Lys Gly Tyr Phe Tyr
465 470 475 480
Ile Pro Pro Leu Ala Thr His Thr Ile Cys Asp Arg Asn His Thr Trp
485 490 495
Leu Pro Val Ser Asp Asp Ala Cys Tyr Arg Glu Thr Cys Pro Tyr Ile
500 505 510
Arg Asp Pro Leu Asn Gly Gln Ala Val Pro Ala Asn Gly Thr Tyr Glu
515 520 525
Phe Gly Tyr Gln Met His Phe Ile Cys Asn Glu Gly Tyr Tyr Leu Ile
530 535 540
Gly Glu Glu Ile Leu Tyr Cys Glu Leu Lys Gly Ser Val Ala Ile Trp
545 550 555 560
Ser Gly Lys Pro Pro Ile Cys Glu Lys Val Leu Cys Thr Pro Pro Pro
565 570 575
Lys Ile Lys Asn Gly Lys His Thr Phe Ser Glu Val Glu Val Phe Glu
580 585 590
Tyr Leu Asp Ala Val Thr Tyr Ser Cys Asp Pro Ala Pro Gly Pro Asp
595 600 605
Pro Phe Ser Leu Ile Gly Glu Ser Thr Ile Tyr Cys Gly Asp Asn Ser
610 615 620
Val Trp Ser Arg Ala Ala Pro Glu Cys Lys Val Val Lys Cys Arg Phe
625 630 635 640
Pro Val Val Glu Asn Gly Lys Gln Ile Ser Gly Phe Gly Lys Lys Phe
645 650 655
Tyr Tyr Lys Ala Thr Val Met Phe Glu Cys Asp Lys Gly Phe Tyr Leu
660 665 670
Asp Gly Ser Asp Thr Ile Val Cys Asp Ser Asn Ser Thr Trp Asp Pro
675 680 685
Pro Val Pro Lys Cys Leu Lys
690 695
<210> 145
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 145
Gln Ala Tyr Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Lys Gln Thr Pro Arg Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Lys Gly Phe Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser
100 105 110
Ser
<210> 146
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 146
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Ser Gln Ser
85 90 95
Thr His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg
<210> 147
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 147
Gly Tyr Thr Phe Thr Ser Tyr Tyr
1 5
<210> 148
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 148
Ile Tyr Pro Gly Asn Gly Asp Thr
1 5
<210> 149
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 149
Ala Lys Gly Phe Asp Tyr
1 5
<210> 150
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 150
Gln Ser Leu Val Tyr Ser Asn Gly Asn Thr Tyr
1 5 10
<210> 151
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 151
Lys Val Ser
1
<210> 152
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 152
Ser Gln Ser Thr His Val Pro Tyr Thr
1 5
<210> 153
<211> 114
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 153
Gln Ala Tyr Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Lys Gln Thr Pro Arg Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Lys Tyr Gly Ser Gly Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
100 105 110
Ser Ser
<210> 154
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 154
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Ser Gln Ser
85 90 95
Thr His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg
<210> 155
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 155
Gly Tyr Thr Phe Thr Ser Tyr Tyr
1 5
<210> 156
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 156
Ile Tyr Pro Gly Asn Gly Asp Thr
1 5
<210> 157
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 157
Ala Lys Tyr Gly Ser Gly Tyr
1 5
<210> 158
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 158
Gln Ser Leu Val Tyr Ser Asn Gly Asn Thr Tyr
1 5 10
<210> 159
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 159
Lys Val Ser
1
<210> 160
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 160
Ser Gln Ser Thr His Val Pro Tyr Thr
1 5
<210> 161
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> MISC_FEATURE
<222> (1)..(17)
<223> Эта последовательность может охватывать 0-17 остатков
<220>
<223> См. описание, как подано для детального описания
замещений и предпочтительных вариантов осуществления
<400> 161
Gly Gly Gly Gly Gly Gly Gly Gly Gly Gly Gly Gly Gly Gly Gly Gly
1 5 10 15
Gly
<210> 162
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 162
Lys Glu Ser Gly Ser Val Ser Ser Glu Gln Leu Ala Gln Phe Arg Ser
1 5 10 15
Leu Asp
<210> 163
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 163
Glu Gly Lys Ser Ser Gly Ser Gly Ser Glu Ser Lys Ser Thr
1 5 10
<210> 164
<211> 85
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<220>
<221> MISC_FEATURE
<222> (1)..(85)
<223> Эта последовательность может охватывать 0-17 'Gly Gly Gly Gly Ser'
единицы повтора
<220>
<223> См. описание, как подано для детального описания
замещений и предпочтительных вариантов осуществления
<400> 164
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
20 25 30
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
35 40 45
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
50 55 60
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
65 70 75 80
Gly Gly Gly Gly Ser
85
<210> 165
<211> 85
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<220>
<221> MISC_FEATURE
<222> (1)..(85)
<223> Эта последовательность может охватывать 0-17 'Glu Ala Ala Ala Lys'
единицы повтора
<220>
<223> См. описание, как подано для детального описания
замещений и предпочтительных вариантов осуществления
<400> 165
Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu
1 5 10 15
Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala
20 25 30
Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala
35 40 45
Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala
50 55 60
Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys
65 70 75 80
Glu Ala Ala Ala Lys
85
<210> 166
<211> 87
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<220>
<221> MISC_FEATURE
<222> (2)..(86)
<223> Эта последовательность может охватывать 0-17 'Glu Ala Ala Ala Lys'
единицы повтора
<220>
<223> См. описание, как подано для детального описания
замещений и предпочтительных вариантов осуществления
<400> 166
Ala Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys
1 5 10 15
Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu
20 25 30
Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala
35 40 45
Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala
50 55 60
Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala
65 70 75 80
Lys Glu Ala Ala Ala Lys Ala
85
<210> 167
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 167
Gly Ser Ala Gly Ser Ala Ala Gly Ser Gly Glu Phe
1 5 10
<210> 168
<211> 34
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<220>
<221> МОД_ОСТ
<222> (1)..(1)
<223> Любая аминокислота
<220>
<221> MOD_RES
<222> (3)..(3)
<223> Любая аминокислота
<220>
<221> MOD_RES
<222> (5)..(5)
<223> Любая аминокислота
<220>
<221> MOD_RES
<222> (7)..(7)
<223> Любая аминокислота
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Любая аминокислота
<220>
<221> MOD_RES
<222> (11)..(11)
<223> Любая аминокислота
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Любая аминокислота
<220>
<221> MOD_RES
<222> (15)..(15)
<223> Любая аминокислота
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Любая аминокислота
<220>
<221> MOD_RES
<222> (19)..(19)
<223> Любая аминокислота
<220>
<221> MOD_RES
<222> (21)..(21)
<223> Любая аминокислота
<220>
<221> MOD_RES
<222> (23)..(23)
<223> Любая аминокислота
<220>
<221> MOD_RES
<222> (25)..(25)
<223> Любая аминокислота
<220>
<221> MOD_RES
<222> (27)..(27)
<223> Любая аминокислота
<220>
<221> MOD_RES
<222> (29)..(29)
<223> Любая аминокислота
<220>
<221> MOD_RES
<222> (31)..(31)
<223> Любая аминокислота
<220>
<221> MOD_RES
<222> (33)..(33)
<223> Любая аминокислота
<220>
<221> MISC_FEATURE
<222> (1)..(34)
<223> Эта последовательность может охватывать 0-17 'Xaa Pro'
единицы повтора
<220>
<223> См. описание, как подано для детального описания
замещений и предпочтительных вариантов осуществления
<400> 168
Xaa Pro Xaa Pro Xaa Pro Xaa Pro Xaa Pro Xaa Pro Xaa Pro Xaa Pro
1 5 10 15
Xaa Pro Xaa Pro Xaa Pro Xaa Pro Xaa Pro Xaa Pro Xaa Pro Xaa Pro
20 25 30
Xaa Pro
<210> 169
<211> 46
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 169
Ala Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys
1 5 10 15
Glu Ala Ala Ala Lys Ala Leu Glu Ala Glu Ala Ala Ala Lys Glu Ala
20 25 30
Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Ala
35 40 45
<210> 170
<211> 51
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<220>
<221> MISC_FEATURE
<222> (1)..(51)
<223> Эта последовательность может охватывать 0-17 'Pro Ala Ser'
единицы повтора
<220>
<223> См. описание, как подано для детального описания
замещений и предпочтительных вариантов осуществления
<400> 170
Pro Ala Ser Pro Ala Ser Pro Ala Ser Pro Ala Ser Pro Ala Ser Pro
1 5 10 15
Ala Ser Pro Ala Ser Pro Ala Ser Pro Ala Ser Pro Ala Ser Pro Ala
20 25 30
Ser Pro Ala Ser Pro Ala Ser Pro Ala Ser Pro Ala Ser Pro Ala Ser
35 40 45
Pro Ala Ser
50
<210> 171
<211> 34
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<220>
<221> MISC_FEATURE
<222> (1)..(34)
<223> Эта последовательность может охватывать 0-17 'Gly Ser'
единицы повтора
<220>
<223> См. описание, как подано для детального описания
замещений и предпочтительных вариантов осуществления
<400> 171
Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser
1 5 10 15
Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser
20 25 30
Gly Ser
<210> 172
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 172
Gly Gly Gly Gly Ser Leu Val Pro Arg Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 173
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 173
Gly Gly Ser Gly Gly His Met Gly Ser Gly Gly
1 5 10
<210> 174
<211> 51
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<220>
<221> MISC_FEATURE
<222> (1)..(51)
<223> Эта последовательность может охватывать 0-17 'Gly Gly Ser'
единицы повтора
<220>
<223> См. описание, как подано для детального описания
замещений и предпочтительных вариантов осуществления
<400> 174
Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly
1 5 10 15
Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly
20 25 30
Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser
35 40 45
Gly Gly Ser
50
<210> 175
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 175
Gly Gly Ser Gly Gly Gly Gly Gly
1 5
<210> 176
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 176
Gly Gly Gly Ser Glu Gly Gly Gly Ser Glu Gly Gly Gly Ser Glu
1 5 10 15
<210> 177
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 177
Ala Ala Gly Ala Ala Thr Ala Ala
1 5
<210> 178
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 178
Gly Gly Ser Ser Gly
1 5
<210> 179
<211> 34
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<220>
<221> MISC_FEATURE
<222> (1)..(34)
<223> Эта последовательность может охватывать 0-17 'Gly Thr'
единицы повтора
<220>
<223> См. описание, как подано для детального описания
замещений и предпочтительных вариантов осуществления
<400> 179
Gly Thr Gly Thr Gly Thr Gly Thr Gly Thr Gly Thr Gly Thr Gly Thr
1 5 10 15
Gly Thr Gly Thr Gly Thr Gly Thr Gly Thr Gly Thr Gly Thr Gly Thr
20 25 30
Gly Thr
<210> 180
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 180
Gly Ser Ser Ser Gly
1 5
<210> 181
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 181
Gly Ser Gly Gly Gly Thr Gly Gly Gly Ser Gly
1 5 10
<210> 182
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 182
Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser Gly Gly Ser
1 5 10
<210> 183
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 183
Gly Ser Gly Ser Gly Ser Gly Ser Gly Gly Ser Gly
1 5 10
<210> 184
<211> 251
<212> БЕЛОК
<213> Homo sapiens
<400> 184
Asp Cys Gly Leu Pro Pro Asp Val Pro Asn Ala Gln Pro Ala Leu Glu
1 5 10 15
Gly Arg Thr Ser Phe Pro Glu Asp Thr Val Ile Thr Tyr Lys Cys Glu
20 25 30
Glu Ser Phe Val Lys Ile Pro Gly Glu Lys Asp Ser Val Ile Cys Leu
35 40 45
Lys Gly Ser Gln Trp Ser Asp Ile Glu Glu Phe Cys Asn Arg Ser Cys
50 55 60
Glu Val Pro Thr Arg Leu Asn Ser Ala Ser Leu Lys Gln Pro Tyr Ile
65 70 75 80
Thr Gln Asn Tyr Phe Pro Val Gly Thr Val Val Glu Tyr Glu Cys Arg
85 90 95
Pro Gly Tyr Arg Arg Glu Pro Ser Leu Ser Pro Lys Leu Thr Cys Leu
100 105 110
Gln Asn Leu Lys Trp Ser Thr Ala Val Glu Phe Cys Lys Lys Lys Ser
115 120 125
Cys Pro Asn Pro Gly Glu Ile Arg Asn Gly Gln Ile Asp Val Pro Gly
130 135 140
Gly Ile Leu Phe Gly Ala Thr Ile Ser Phe Ser Cys Asn Thr Gly Tyr
145 150 155 160
Lys Leu Phe Gly Ser Thr Ser Ser Phe Cys Leu Ile Ser Gly Ser Ser
165 170 175
Val Gln Trp Ser Asp Pro Leu Pro Glu Cys Arg Glu Ile Tyr Cys Pro
180 185 190
Ala Pro Pro Gln Ile Asp Asn Gly Ile Ile Gln Gly Glu Arg Asp His
195 200 205
Tyr Gly Tyr Arg Gln Ser Val Thr Tyr Ala Cys Asn Lys Gly Phe Thr
210 215 220
Met Ile Gly Glu His Ser Ile Tyr Cys Thr Val Asn Asn Asp Glu Gly
225 230 235 240
Glu Trp Ser Gly Pro Pro Pro Glu Cys Arg Gly
245 250
<210> 185
<211> 77
<212> БЕЛОК
<213> Homo sapiens
<400> 185
Leu Gln Cys Tyr Asn Cys Pro Asn Pro Thr Ala Asp Cys Lys Thr Ala
1 5 10 15
Val Asn Cys Ser Ser Asp Phe Asp Ala Cys Leu Ile Thr Lys Ala Gly
20 25 30
Leu Gln Val Tyr Asn Lys Cys Trp Lys Phe Glu His Cys Asn Phe Asn
35 40 45
Asp Val Thr Thr Arg Leu Arg Glu Asn Glu Leu Thr Tyr Tyr Cys Cys
50 55 60
Lys Lys Asp Leu Cys Asn Phe Asn Glu Gln Leu Glu Asn
65 70 75
<210> 186
<211> 361
<212> БЕЛОК
<213> Homo sapiens
<400> 186
His Thr Val Glu Leu Asn Asn Met Phe Gly Gln Ile Gln Ser Pro Gly
1 5 10 15
Tyr Pro Asp Ser Tyr Pro Ser Asp Ser Glu Val Thr Trp Asn Ile Thr
20 25 30
Val Pro Asp Gly Phe Arg Ile Lys Leu Tyr Phe Met His Phe Asn Leu
35 40 45
Glu Ser Ser Tyr Leu Cys Glu Tyr Asp Tyr Val Lys Val Glu Thr Glu
50 55 60
Asp Gln Val Leu Ala Thr Phe Cys Gly Arg Glu Thr Thr Asp Thr Glu
65 70 75 80
Gln Thr Pro Gly Gln Glu Val Val Leu Ser Pro Gly Ser Phe Met Ser
85 90 95
Ile Thr Phe Arg Ser Asp Phe Ser Asn Glu Glu Arg Phe Thr Gly Phe
100 105 110
Asp Ala His Tyr Met Ala Val Asp Val Asp Glu Cys Lys Glu Arg Glu
115 120 125
Asp Glu Glu Leu Ser Cys Asp His Tyr Cys His Asn Tyr Ile Gly Gly
130 135 140
Tyr Tyr Cys Ser Cys Arg Phe Gly Tyr Ile Leu His Thr Asp Asn Arg
145 150 155 160
Thr Cys Arg Val Glu Cys Ser Asp Asn Leu Phe Thr Gln Arg Thr Gly
165 170 175
Val Ile Thr Ser Pro Asp Phe Pro Asn Pro Tyr Pro Lys Ser Ser Glu
180 185 190
Cys Leu Tyr Thr Ile Glu Leu Glu Glu Gly Phe Met Val Asn Leu Gln
195 200 205
Phe Glu Asp Ile Phe Asp Ile Glu Asp His Pro Glu Val Pro Cys Pro
210 215 220
Tyr Asp Tyr Ile Lys Ile Lys Val Gly Pro Lys Val Leu Gly Pro Phe
225 230 235 240
Cys Gly Glu Lys Ala Pro Glu Pro Ile Ser Thr Gln Ser His Ser Val
245 250 255
Leu Ile Leu Phe His Ser Asp Asn Ser Gly Glu Asn Arg Gly Trp Arg
260 265 270
Leu Ser Tyr Arg Ala Ala Gly Asn Glu Cys Pro Glu Leu Gln Pro Pro
275 280 285
Val His Gly Lys Ile Glu Pro Ser Gln Ala Lys Tyr Phe Phe Lys Asp
290 295 300
Gln Val Leu Val Ser Cys Asp Thr Gly Tyr Lys Val Leu Lys Asp Asn
305 310 315 320
Val Glu Met Asp Thr Phe Gln Ile Glu Cys Leu Lys Asp Gly Thr Trp
325 330 335
Ser Asn Lys Ile Pro Thr Cys Lys Lys Asn Glu Ile Asp Leu Glu Ser
340 345 350
Glu Leu Lys Ser Glu Gln Val Thr Glu
355 360
<210> 187
<211> 251
<212> БЕЛОК
<213> Homo sapiens
<400> 187
Cys Glu Glu Pro Pro Thr Phe Glu Ala Met Glu Leu Ile Gly Lys Pro
1 5 10 15
Lys Pro Tyr Tyr Glu Ile Gly Glu Arg Val Asp Tyr Lys Cys Lys Lys
20 25 30
Gly Tyr Phe Tyr Ile Pro Pro Leu Ala Thr His Thr Ile Cys Asp Arg
35 40 45
Asn His Thr Trp Leu Pro Val Ser Asp Asp Ala Cys Tyr Arg Glu Thr
50 55 60
Cys Pro Tyr Ile Arg Asp Pro Leu Asn Gly Gln Ala Val Pro Ala Asn
65 70 75 80
Gly Thr Tyr Glu Phe Gly Tyr Gln Met His Phe Ile Cys Asn Glu Gly
85 90 95
Tyr Tyr Leu Ile Gly Glu Glu Ile Leu Tyr Cys Glu Leu Lys Gly Ser
100 105 110
Val Ala Ile Trp Ser Gly Lys Pro Pro Ile Cys Glu Lys Val Leu Cys
115 120 125
Thr Pro Pro Pro Lys Ile Lys Asn Gly Lys His Thr Phe Ser Glu Val
130 135 140
Glu Val Phe Glu Tyr Leu Asp Ala Val Thr Tyr Ser Cys Asp Pro Ala
145 150 155 160
Pro Gly Pro Asp Pro Phe Ser Leu Ile Gly Glu Ser Thr Ile Tyr Cys
165 170 175
Gly Asp Asn Ser Val Trp Ser Arg Ala Ala Pro Glu Cys Lys Val Val
180 185 190
Lys Cys Arg Phe Pro Val Val Glu Asn Gly Lys Gln Ile Ser Gly Phe
195 200 205
Gly Lys Lys Phe Tyr Tyr Lys Ala Thr Val Met Phe Glu Cys Asp Lys
210 215 220
Gly Phe Tyr Leu Asp Gly Ser Asp Thr Ile Val Cys Asp Ser Asn Ser
225 230 235 240
Thr Trp Asp Pro Pro Val Pro Lys Cys Leu Lys
245 250
<210> 188
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 188
Gly His Ser Phe Thr Asn Tyr Leu
1 5
<210> 189
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 189
Ile Asn Pro Gly Ser Gly Gly Thr
1 5
<210> 190
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 190
Ala Ser Tyr Tyr Ser Asn Ser Tyr Ala Met Asp Tyr
1 5 10
<210> 191
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 191
Glu Asn Ile Tyr Ser Tyr
1 5
<210> 192
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 192
Lys Ala Lys
1
<210> 193
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 193
Gln His His Tyr Gly Ile Pro Tyr Thr
1 5
<210> 194
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 194
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Thr
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly His Ser Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Val Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Ser Tyr Tyr Ser Asn Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser
115
<210> 195
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 195
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Glu Thr Val Thr Ile Ala Cys Arg Ala Ser Glu Asn Ile Tyr Ser Tyr
20 25 30
Leu Ala Trp Tyr Leu Gln Lys Glu Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Ser Lys Ala Lys Thr Leu Ala Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Gly Gly Ser Gly Thr Gln Phe Ser Leu Lys Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Gly Thr Phe Tyr Cys Gln His His Tyr Gly Ile Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 196
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 196
Gly Tyr Ala Phe Ala His Tyr Leu
1 5
<210> 197
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 197
Ile Asn Pro Gly Thr Asp Gly Thr
1 5
<210> 198
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 198
Ala Arg Glu Glu Leu Gly Phe Ala Tyr
1 5
<210> 199
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 199
Gln Asp Ile Ser Asn His
1 5
<210> 200
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 200
Tyr Ile Ser
1
<210> 201
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 201
Gln Gln Gly Asp Thr Leu Pro Tyr Thr
1 5
<210> 202
<211> 116
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 202
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Thr
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ala His Tyr
20 25 30
Leu Ile Glu Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Thr Asp Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met His Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Glu Leu Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ala
115
<210> 203
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 203
Asp Ile Gln Met Thr Gln Ser Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Asn His
20 25 30
Leu Asn Trp Tyr Gln Gln Arg Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Ile Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asp Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Thr Leu Glu Ile Arg
100 105
<210> 204
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 204
Gly Tyr Thr Phe Thr Ser Tyr
1 5
<210> 205
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 205
Ser Asp Pro Ser Asp Thr Tyr Thr
1 5
<210> 206
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 206
Ala Arg Pro Gly Arg Val Ala Tyr Tyr Phe Asp Tyr
1 5 10
<210> 207
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 207
Gln Ser Leu Val His Ser Asn Gly Asn Thr Tyr
1 5 10
<210> 208
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 208
Lys Val Ser
1
<210> 209
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 209
Phe Gln Gly Ser His Val Pro Pro Thr
1 5
<210> 210
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 210
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg Pro Gly Thr
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ser Asp Pro Ser Asp Thr Tyr Thr Lys Asn Asn Gln Lys Phe
50 55 60
Thr Gly Lys Ala Thr Leu Thr Val Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Pro Gly Arg Val Ala Tyr Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 211
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 211
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Pro Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 212
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 212
Gly Tyr Ala Phe Thr Asn Tyr Leu
1 5
<210> 213
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 213
Ile Asn Pro Gly Ser Gly Gly Thr
1 5
<210> 214
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 214
Ala Thr Tyr Tyr Ser Asn Ser Phe Ala Met Asp Tyr
1 5 10
<210> 215
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 215
Gln Ser Leu Leu Asn Ser Ser Asn Gln Lys Asn Tyr
1 5 10
<210> 216
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 216
Phe Ala Ser
1
<210> 217
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 217
Gln Gln Tyr Tyr Ser Ile Pro Phe Thr
1 5
<210> 218
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 218
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Thr
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Ile Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met His Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Thr Tyr Tyr Ser Asn Ser Phe Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser
115
<210> 219
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 219
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Ala Met Ser Val Gly
1 5 10 15
Gln Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Ser Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Cys Pro Lys Val Leu Val Tyr Phe Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ile Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln
85 90 95
Tyr Tyr Ser Ile Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 220
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 220
Gly Tyr Ala Phe Ala His Tyr Leu
1 5
<210> 221
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 221
Ile Asn Pro Gly Thr Asp Gly Thr
1 5
<210> 222
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 222
Ala Arg Glu Glu Leu Gly Phe Ala Tyr
1 5
<210> 223
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 223
Gln Asp Ile Ser Asn His
1 5
<210> 224
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 224
Tyr Ile Ser
1
<210> 225
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 225
Gln Gln Gly Asp Thr Leu Pro Tyr Thr
1 5
<210> 226
<211> 116
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 226
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Thr
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ala His Tyr
20 25 30
Leu Ile Glu Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Thr Asp Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met His Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Glu Leu Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ala
115
<210> 227
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 227
Asp Ile Gln Met Thr Gln Ser Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Asn His
20 25 30
Leu Asn Trp Tyr Gln Gln Arg Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Ile Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asp Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Thr Leu Glu Ile Arg
100 105
<210> 228
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 228
Gly Tyr Ser Phe Thr Asp Tyr Asn
1 5
<210> 229
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 229
Ile Asn Pro Asn Tyr Gly Thr Thr
1 5
<210> 230
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 230
Ala Arg Asn Asp Tyr
1 5
<210> 231
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 231
Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
1 5 10
<210> 232
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 232
Lys Val Ser
1
<210> 233
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 233
Phe Gln Gly Ser His Val Pro Phe Thr
1 5
<210> 234
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 234
Glu Phe Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asp Tyr
20 25 30
Asn Met Asn Trp Val Lys Gln Ser Asn Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Asn Tyr Gly Thr Thr Phe Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Gln Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Asp Tyr Trp Gly Arg Gly Thr Thr Leu Thr Val Ser Ser
100 105 110
<210> 235
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 235
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Asp Trp Tyr Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Ile Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 236
<211> 226
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 236
Val Pro Arg Asp Ser Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
1 5 10 15
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
20 25 30
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
35 40 45
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
50 55 60
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
65 70 75 80
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
115 120 125
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
130 135 140
Leu Thr Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu
145 150 155 160
Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro
165 170 175
Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val
180 185 190
Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu
195 200 205
His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser
210 215 220
Pro Gly
225
<210> 237
<211> 228
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 237
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly
225
<210> 238
<211> 442
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 238
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys Lys
210 215 220
Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr
245 250 255
Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe Ser
260 265 270
Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile
290 295 300
Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val Asn
305 310 315 320
Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu
340 345 350
Gln Met Ala Lys Asp Lys Val Ser Leu Ser Cys Ala Ile Thr Asp Phe
355 360 365
Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro Ala
370 375 380
Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr
385 390 395 400
Phe Val Val Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala Gly
405 410 415
Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His His
420 425 430
Thr Glu Lys Ser Leu Ser His Ser Pro Gly
435 440
<210> 239
<211> 241
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 239
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser His Lys Phe
130 135 140
Met Ser Thr Ser Val Gly Asp Arg Val Ser Ile Thr Cys Lys Ala Ser
145 150 155 160
Gln Asp Val Gly Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln
165 170 175
Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg His Thr Gly Val
180 185 190
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
195 200 205
Ile Ser Asn Val Gln Ser Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln
210 215 220
Tyr Ser Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu
225 230 235 240
Lys
<210> 240
<211> 222
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 240
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr
115 120 125
Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr Leu
130 135 140
Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr Trp
145 150 155 160
Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser
180 185 190
Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro Ala Ser
195 200 205
Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly
210 215 220
<210> 241
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 241
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 242
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 242
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 243
<211> 436
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 243
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Gly Gly Pro Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser
100 105 110
Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser
115 120 125
Ala Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr
165 170 175
Leu Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr
180 185 190
Val Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys
195 200 205
Lys Ile Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val
210 215 220
Pro Glu Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val
225 230 235 240
Leu Thr Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile
245 250 255
Ser Lys Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val
260 265 270
Glu Val His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser
275 280 285
Thr Phe Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu
290 295 300
Asn Gly Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala
305 310 315 320
Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro
325 330 335
Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys
340 345 350
Val Ser Leu Trp Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr
355 360 365
Val Glu Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr
370 375 380
Gln Pro Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu
385 390 395 400
Asn Val Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser
405 410 415
Val Leu His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser
420 425 430
His Ser Pro Gly
435
<210> 244
<211> 216
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 244
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Gly Gly Pro Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser
100 105 110
Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser
115 120 125
Ala Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr
165 170 175
Leu Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr
180 185 190
Val Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys
195 200 205
Lys Ile Val Pro Arg Asp Cys Gly
210 215
<210> 245
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 245
Cys Lys Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile
1 5 10 15
Phe Pro Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys
20 25 30
Val Thr Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln
35 40 45
Phe Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln
50 55 60
Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu
65 70 75 80
Pro Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg
85 90 95
Val Asn Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
100 105 110
Thr Lys Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro
115 120 125
Lys Glu Gln Met Ala Lys Asp Lys Val Ser Leu Trp Cys Met Ile Thr
130 135 140
Asp Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln
145 150 155 160
Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly
165 170 175
Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu
180 185 190
Ala Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn
195 200 205
His His Thr Glu Lys Ser Leu Ser His Ser Pro Gly
210 215 220
<210> 246
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 246
Glu Val Gln Leu Val Gln Ser Gly Pro Val Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ala His Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 247
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 247
Glu Val Gln Leu Val Gln Ser Gly Ala Val Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Lys Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 248
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 248
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 249
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 249
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 250
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 250
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr His Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 251
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 251
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Ser Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 252
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 252
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 253
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 253
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Tyr His Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 254
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 254
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Tyr Ser Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 255
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 255
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 256
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 256
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 257
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 257
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Leu Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Arg Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 258
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 258
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Arg Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 259
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 259
Ile Asn Pro Tyr His Gly Gly Thr
1 5
<210> 260
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 260
Ile Asn Pro Tyr Ser Gly Gly Thr
1 5
<210> 261
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 261
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Arg Ala Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 262
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 262
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Arg Ala Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 263
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 263
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Arg Ala Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 264
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 264
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Arg Val Thr Met Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 265
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 265
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Ser Asn Gly Gly Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Ile Arg Leu Arg His Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 266
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 266
Asp Ile Val Met Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 267
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 267
Asp Ile Val Met Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 268
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 268
Asp Ile Gln Met Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 269
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 269
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 270
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 270
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ala His Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Asn Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Asp Tyr Ala Trp Tyr Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 271
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 271
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ala His Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Asn Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Asp Tyr Ala Trp Tyr Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 272
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 272
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Asn Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Asp Tyr Ala Trp Tyr Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 273
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 273
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Asn Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Asp Tyr Ala Trp Tyr Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 274
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 274
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Asn Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Asp Tyr Ala Trp Tyr Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 275
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 275
Asp Val Leu Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 276
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 276
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 277
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 277
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 278
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 278
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 279
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 279
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Arg Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 280
<211> 437
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 280
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
100 105 110
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser
115 120 125
Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
165 170 175
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr
180 185 190
Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg
195 200 205
Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu
210 215 220
Phe Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
225 230 235 240
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
245 250 255
Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
260 265 270
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
275 280 285
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
290 295 300
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
305 310 315 320
Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
325 330 335
Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn
340 345 350
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
355 360 365
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
370 375 380
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg
385 390 395 400
Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys
405 410 415
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
420 425 430
Ser Leu Ser Leu Gly
435
<210> 281
<211> 437
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 281
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
100 105 110
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser
115 120 125
Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
165 170 175
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr
180 185 190
Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg
195 200 205
Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu
210 215 220
Phe Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
225 230 235 240
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
245 250 255
Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
260 265 270
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
275 280 285
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
290 295 300
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
305 310 315 320
Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
325 330 335
Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn
340 345 350
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
355 360 365
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
370 375 380
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg
385 390 395 400
Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys
405 410 415
Ser Val Leu His Glu Ala Leu His Ser His Tyr Thr Gln Lys Ser Leu
420 425 430
Ser Leu Ser Leu Gly
435
<210> 282
<211> 437
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 282
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Tyr Ser Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
100 105 110
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser
115 120 125
Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
165 170 175
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr
180 185 190
Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg
195 200 205
Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu
210 215 220
Phe Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
225 230 235 240
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
245 250 255
Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
260 265 270
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
275 280 285
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
290 295 300
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
305 310 315 320
Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
325 330 335
Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn
340 345 350
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
355 360 365
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
370 375 380
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg
385 390 395 400
Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys
405 410 415
Ser Val Leu His Glu Ala Leu His Ser His Tyr Thr Gln Lys Ser Leu
420 425 430
Ser Leu Ser Leu Gly
435
<210> 283
<211> 228
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 283
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Leu His Glu Ala Leu His Ser His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly
225
<210> 284
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 284
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Tyr Ser Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
100 105 110
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser
115 120 125
Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
165 170 175
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr
180 185 190
Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg
195 200 205
Val Glu Ser Lys Tyr Gly
210
<210> 285
<211> 437
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 285
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Tyr Ser Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
100 105 110
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser
115 120 125
Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
165 170 175
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr
180 185 190
Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg
195 200 205
Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu
210 215 220
Phe Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
225 230 235 240
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
245 250 255
Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
260 265 270
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
275 280 285
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
290 295 300
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
305 310 315 320
Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
325 330 335
Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn
340 345 350
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
355 360 365
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
370 375 380
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg
385 390 395 400
Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys
405 410 415
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
420 425 430
Ser Leu Ser Leu Gly
435
<210> 286
<211> 437
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 286
Gln His Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe His Asn Tyr
20 25 30
Tyr Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Tyr Ser Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Val Asp His Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
100 105 110
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser
115 120 125
Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
165 170 175
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr
180 185 190
Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg
195 200 205
Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu
210 215 220
Phe Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
225 230 235 240
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
245 250 255
Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
260 265 270
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
275 280 285
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
290 295 300
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
305 310 315 320
Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
325 330 335
Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn
340 345 350
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
355 360 365
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
370 375 380
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg
385 390 395 400
Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys
405 410 415
Ser Val Leu His Glu Ala Leu His Ser His Tyr Thr Gln Lys Ser Leu
420 425 430
Ser Leu Ser Leu Gly
435
<210> 287
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 287
Asp Val Val Met Thr Gln Thr Pro Leu Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Lys Val Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Asn Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu
115 120 125
Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe
130 135 140
Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg
145 150 155 160
Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu
180 185 190
Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser
195 200 205
Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
210 215
<210> 288
<211> 434
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 288
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ala Tyr
20 25 30
Tyr Met Asn Trp Val Arg Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala
115 120 125
Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly
145 150 155 160
Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr
180 185 190
Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile
195 200 205
Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu
210 215 220
Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr
225 230 235 240
Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys
245 250 255
Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val
260 265 270
His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
275 280 285
Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly
290 295 300
Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile
305 310 315 320
Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val
325 330 335
Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser
340 345 350
Leu Thr Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu
355 360 365
Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro
370 375 380
Ile Met Asp Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val
385 390 395 400
Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu
405 410 415
His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser
420 425 430
Pro Gly
<210> 289
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 289
Asn Ile Met Met Thr Gln Ser Pro Ser Ser Leu Ala Val Ser Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys His Gln
85 90 95
Tyr Leu Ser Ser Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu
115 120 125
Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe
130 135 140
Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg
145 150 155 160
Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu
180 185 190
Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser
195 200 205
Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
210 215
<210> 290
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 290
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg Pro Gly Thr
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Ser
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asp Pro Ser Asp Ser Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Gly Ser Ser Tyr Asn Arg Tyr Phe Asp Val Trp Gly
100 105 110
Thr Gly Thr Thr Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser
115 120 125
Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val
130 135 140
Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro
180 185 190
Ser Ser Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val Ala His Pro
195 200 205
Ala Ser Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly
210 215 220
Cys Lys Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys
245 250 255
Val Thr Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln
260 265 270
Phe Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Gln
275 280 285
Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val Ser Glu Leu
290 295 300
Pro Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg
305 310 315 320
Val Asn Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
325 330 335
Thr Lys Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro
340 345 350
Lys Glu Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr
355 360 365
Asp Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln
370 375 380
Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly
385 390 395 400
Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu
405 410 415
Ala Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn
420 425 430
His His Thr Glu Lys Ser Leu Ser His Ser Pro Gly
435 440
<210> 291
<211> 305
<212> БЕЛОК
<213> Mus musculus
<400> 291
Glu Asp Cys Lys Gly Pro Pro Pro Arg Glu Asn Ser Glu Ile Leu Ser
1 5 10 15
Gly Ser Trp Ser Glu Gln Leu Tyr Pro Glu Gly Thr Gln Ala Thr Tyr
20 25 30
Lys Cys Arg Pro Gly Tyr Arg Thr Leu Gly Thr Ile Val Lys Val Cys
35 40 45
Lys Asn Gly Lys Trp Val Ala Ser Asn Pro Ser Arg Ile Cys Arg Lys
50 55 60
Lys Pro Cys Gly His Pro Gly Asp Thr Pro Phe Gly Ser Phe Arg Leu
65 70 75 80
Ala Val Gly Ser Gln Phe Glu Phe Gly Ala Lys Val Val Tyr Thr Cys
85 90 95
Asp Asp Gly Tyr Gln Leu Leu Gly Glu Ile Asp Tyr Arg Glu Cys Gly
100 105 110
Ala Asp Gly Trp Ile Asn Asp Ile Pro Leu Cys Glu Val Val Lys Cys
115 120 125
Leu Pro Val Thr Glu Leu Glu Asn Gly Arg Ile Val Ser Gly Ala Ala
130 135 140
Glu Thr Asp Gln Glu Tyr Tyr Phe Gly Gln Val Val Arg Phe Glu Cys
145 150 155 160
Asn Ser Gly Phe Lys Ile Glu Gly His Lys Glu Ile His Cys Ser Glu
165 170 175
Asn Gly Leu Trp Ser Asn Glu Lys Pro Arg Cys Val Glu Ile Leu Cys
180 185 190
Thr Pro Pro Arg Val Glu Asn Gly Asp Gly Ile Asn Val Lys Pro Val
195 200 205
Tyr Lys Glu Asn Glu Arg Tyr His Tyr Lys Cys Lys His Gly Tyr Val
210 215 220
Pro Lys Glu Arg Gly Asp Ala Val Cys Thr Gly Ser Gly Trp Ser Ser
225 230 235 240
Gln Pro Phe Cys Glu Glu Lys Arg Cys Ser Pro Pro Tyr Ile Leu Asn
245 250 255
Gly Ile Tyr Thr Pro His Arg Ile Ile His Arg Ser Asp Asp Glu Ile
260 265 270
Arg Tyr Glu Cys Asn Tyr Gly Phe Tyr Pro Val Thr Gly Ser Thr Val
275 280 285
Ser Lys Cys Thr Pro Thr Gly Trp Ile Pro Val Pro Arg Cys Thr Leu
290 295 300
Lys
305
<210> 292
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> MISC_FEATURE
<222> (1)..(16)
<223> Эта последовательность может охватывать 0-8 'Gly Ser'
единицы повтора
<400> 292
Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser
1 5 10 15
<210> 293
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> MISC_FEATURE
<222> (1)..(16)
<223> Эта последовательность может охватывать 1-4 'Gly Gly Gly Ser'
единицы повтора
<400> 293
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10 15
<210> 294
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<220>
<221> MISC_FEATURE
<222> (1)..(16)
<223> Эта последовательность может охватывать 1-4 'Gly Ser Ser Gly'
единицы повтора
<400> 294
Gly Ser Ser Gly Gly Ser Ser Gly Gly Ser Ser Gly Gly Ser Ser Gly
1 5 10 15
<210> 295
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 295
Gly Gly Gly Gly Ser
1 5
<210> 296
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
6xHis-метка
<400> 296
His His His His His His
1 5
<210> 297
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 297
Gly Ser Gly Ser Gly Ser Gly
1 5
<210> 298
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 298
Tyr Pro Tyr Asp Val Pro Asp Tyr Ala Gly
1 5 10
<210> 299
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 299
Asn Leu Asp Val Ser Leu Gln Leu Pro Ser
1 5 10
<210> 300
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 300
Val Pro Arg Asp Cys Gly
1 5
<210> 301
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 301
Gly Ser Gly Ser Gly Ser Gly Arg Leu Gly Arg Glu Gly Val Gln
1 5 10 15
<210> 302
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 302
Gly Arg Glu Gly Val Gln Lys Glu Asp Ile Pro Pro Ala Asp Leu
1 5 10 15
<210> 303
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 303
Ile Pro Pro Ala Asp Leu Ser Asp Gln Val Pro Asp Thr Glu Ser
1 5 10 15
<210> 304
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 304
Val Pro Asp Thr Glu Ser Glu Thr Arg Ile Leu Leu Gln Gly Thr
1 5 10 15
<210> 305
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 305
Ile Leu Leu Gln Gly Thr Pro Val Ala Gln Met Thr Glu Asp Ala
1 5 10 15
<210> 306
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 306
Gln Met Thr Glu Asp Ala Val Asp Ala Glu Arg Leu Lys His Leu
1 5 10 15
<210> 307
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 307
Glu Arg Leu Lys His Leu Ile Val Thr Pro Ser Gly Cys Gly Glu
1 5 10 15
<210> 308
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 308
Pro Ser Gly Cys Gly Glu Gln Asn Met Ile Gly Met Thr Pro Thr
1 5 10 15
<210> 309
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 309
Ile Gly Met Thr Pro Thr Val Ile Ala Val His Tyr Leu Asp Glu
1 5 10 15
<210> 310
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 310
Val His Tyr Leu Asp Glu Thr Glu Gln Trp Glu Lys Phe Gly Leu
1 5 10 15
<210> 311
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 311
Trp Glu Lys Phe Gly Leu Glu Lys Arg Gln Gly Ala Leu Glu Leu
1 5 10 15
<210> 312
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 312
Gln Gly Ala Leu Glu Leu Ile Lys Lys Gly Tyr Thr Gln Gln Leu
1 5 10 15
<210> 313
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 313
Gly Tyr Thr Gln Gln Leu Ala Phe Arg Gln Pro Ser Ser Ala Phe
1 5 10 15
<210> 314
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 314
Gln Pro Ser Ser Ala Phe Ala Ala Phe Val Lys Arg Ala Pro Ser
1 5 10 15
<210> 315
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 315
Val Lys Arg Ala Pro Ser Thr Trp Leu Thr Ala Tyr Val Val Lys
1 5 10 15
<210> 316
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 316
Thr Ala Tyr Val Val Lys Val Phe Ser Leu Ala Val Asn Leu Ile
1 5 10 15
<210> 317
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 317
Leu Ala Val Asn Leu Ile Ala Ile Asp Ser Gln Val Leu Cys Gly
1 5 10 15
<210> 318
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 318
Ser Gln Val Leu Cys Gly Ala Val Lys Trp Leu Ile Leu Glu Lys
1 5 10 15
<210> 319
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 319
Trp Leu Ile Leu Glu Lys Gln Lys Pro Asp Gly Val Phe Gln Glu
1 5 10 15
<210> 320
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 320
Asp Gly Val Phe Gln Glu Asp Ala Pro Val Ile His Gln Glu Met
1 5 10 15
<210> 321
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 321
Val Ile His Gln Glu Met Ile Gly Gly Leu Arg Asn Asn Asn Glu
1 5 10 15
<210> 322
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 322
Leu Arg Asn Asn Asn Glu Lys Asp Met Ala Leu Thr Ala Phe Val
1 5 10 15
<210> 323
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 323
Ala Leu Thr Ala Phe Val Leu Ile Ser Leu Gln Glu Ala Lys Asp
1 5 10 15
<210> 324
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 324
Leu Gln Glu Ala Lys Asp Ile Cys Glu Glu Gln Val Asn Ser Leu
1 5 10 15
<210> 325
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 325
Glu Gln Val Asn Ser Leu Pro Gly Ser Ile Thr Lys Ala Gly Asp
1 5 10 15
<210> 326
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 326
Ile Thr Lys Ala Gly Asp Phe Leu Glu Ala Asn Tyr Met Asn Leu
1 5 10 15
<210> 327
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 327
Ala Asn Tyr Met Asn Leu Gln Arg Ser Tyr Thr Val Ala Ile Ala
1 5 10 15
<210> 328
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 328
Tyr Thr Val Ala Ile Ala Gly Tyr Ala Leu Ala Gln Met Gly Arg
1 5 10 15
<210> 329
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 329
Leu Ala Gln Met Gly Arg Leu Lys Gly Pro Leu Leu Asn Lys Phe
1 5 10 15
<210> 330
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 330
Pro Leu Leu Asn Lys Phe Leu Thr Thr Ala Lys Asp Lys Asn Arg
1 5 10 15
<210> 331
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 331
Ala Lys Asp Lys Asn Arg Trp Glu Asp Pro Gly Lys Gln Leu Tyr
1 5 10 15
<210> 332
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 332
Pro Gly Lys Gln Leu Tyr Asn Val Glu Ala Thr Ser Tyr Ala Leu
1 5 10 15
<210> 333
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 333
Ala Thr Ser Tyr Ala Leu Leu Ala Leu Leu Gln Leu Lys Asp Phe
1 5 10 15
<210> 334
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 334
Leu Gln Leu Lys Asp Phe Asp Phe Val Pro Pro Val Val Arg Trp
1 5 10 15
<210> 335
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 335
Pro Pro Val Val Arg Trp Leu Asn Glu Gln Arg Tyr Tyr Gly Gly
1 5 10 15
<210> 336
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 336
Gln Arg Tyr Tyr Gly Gly Gly Tyr Gly Ser Thr Gln Ala Thr Phe
1 5 10 15
<210> 337
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 337
Ser Thr Gln Ala Thr Phe Met Val Phe Gln Ala Leu Ala Gln Tyr
1 5 10 15
<210> 338
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 338
Gln Ala Leu Ala Gln Tyr Gln Lys Asp Ala Pro Asp His Gln Glu
1 5 10 15
<210> 339
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 339
Ala Pro Asp His Gln Glu Leu Asn Leu Asp Val Ser Leu Gln Leu
1 5 10 15
<210> 340
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 340
Asp Val Ser Leu Gln Leu Pro Ser Arg Ser Ser Lys Ile Thr His
1 5 10 15
<210> 341
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 341
Ile Val Thr Pro Ser Gly Ser Gly Glu Gln Asn Met Ile Gly Met
1 5 10 15
<210> 342
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 342
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ala Tyr
20 25 30
Tyr Met Asn Trp Val Arg Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ser Ser Pro Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala
100 105 110
Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Cys Gly Asp
115 120 125
Thr Thr Gly Ser Ser Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe
130 135 140
Pro Glu Ser Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Ser
145 150 155 160
Val His Thr Phe Pro Ala Leu Leu Gln Ser Gly Leu Tyr Thr Met Ser
165 170 175
Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Gln Thr Val Thr
180 185 190
Cys Ser Val Ala His Pro Ala Ser Ser Thr Thr Val Asp Lys Lys Leu
195 200 205
Glu Pro Ser Gly Pro Ile Ser Thr Ile Asn Pro Cys Pro Pro Cys Lys
210 215 220
Glu Cys His Lys Cys Pro Ala Pro Asn Leu Glu Gly Gly Pro Ser Val
225 230 235 240
Phe Ile Phe Pro Pro Asn Ile Lys Asp Val Leu Met Ile Ser Leu Thr
245 250 255
Pro Lys Val Thr Cys Val Val Val Asp Val Ser Glu Asp Asp Pro Asp
260 265 270
Val Arg Ile Ser Trp Phe Val Asn Asn Val Glu Val His Thr Ala Gln
275 280 285
Thr Gln Thr His Arg Glu Asp Tyr Asn Ser Thr Ile Arg Val Val Ser
290 295 300
Ala Leu Pro Ile Gln His Gln Asp Trp Met Ser Gly Lys Glu Phe Lys
305 310 315 320
Cys Lys Val Asn Asn Lys Asp Leu Pro Ser Pro Ile Glu Arg Thr Ile
325 330 335
Ser Lys Ile Lys Gly Leu Val Arg Ala Pro Gln Val Tyr Ile Leu Pro
340 345 350
Pro Pro Ala Glu Gln Leu Ser Arg Lys Asp Val Ser Leu Thr Cys Leu
355 360 365
Val Val Gly Phe Asn Pro Gly Asp Ile Ser Val Glu Trp Thr Ser Asn
370 375 380
Gly His Thr Glu Glu Asn Tyr Lys Asp Thr Ala Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Tyr Phe Ile Tyr Ser Lys Leu Asp Ile Lys Thr Ser Lys
405 410 415
Trp Glu Lys Thr Asp Ser Phe Ser Cys Asn Val Arg His Glu Gly Leu
420 425 430
Lys Asn Tyr Tyr Leu Lys Lys Thr Ile Ser Arg Ser Pro Gly Lys
435 440 445
<210> 343
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
пептид
<400> 343
Gly Tyr Thr Phe Thr Ser Tyr Trp
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| МОЛЕКУЛА РЕЦЕПТОРА IL4/IL13 ДЛЯ ВЕТЕРИНАРНОГО ПРИМЕНЕНИЯ | 2018 |
|
RU2795591C2 |
| СЛИТЫЙ БЕЛОК GDF15 ДЛИТЕЛЬНОГО ДЕЙСТВИЯ И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2020 |
|
RU2836280C1 |
| АНТИТЕЛА, ПОДХОДЯЩИЕ ДЛЯ ПАССИВНОЙ ИММУНИЗАЦИИ ПРОТИВ ГРИППА, И ИХ КОМПОЗИЦИИ, КОМБИНАЦИИ И СПОСОБЫ ПРИМЕНЕНИЯ | 2015 |
|
RU2720282C1 |
| Белки, связывающие NKG2D, CD16 и опухолеассоциированный антиген | 2018 |
|
RU2816716C2 |
| АНТАГОНИСТЫ NGF ДЛЯ МЕДИЦИНСКОГО ИСПОЛЬЗОВАНИЯ | 2020 |
|
RU2829812C2 |
| МОДУЛЯЦИЯ АКТИВНОСТИ REP БЕЛКА ПРИ ПОЛУЧЕНИИ ДНК С ЗАМКНУТЫМИ КОНЦАМИ (ЗКДНК) | 2020 |
|
RU2812850C2 |
| АНТИТЕЛА, СОДЕРЖАЩИЕ ПОЛИПЕПТИД, ВСТРОЕННЫЙ В УЧАСТОК КАРКАСНОЙ ОБЛАСТИ 3 | 2019 |
|
RU2796254C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ, НАЦЕЛЕННЫЕ НА ПОДОБНЫЙ FC-РЕЦЕПТОРУ БЕЛОК 5, И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2779747C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ИЗБИРАТЕЛЬНОЙ ЭКСПРЕССИИ БЕЛКА | 2017 |
|
RU2795467C2 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2728861C1 |
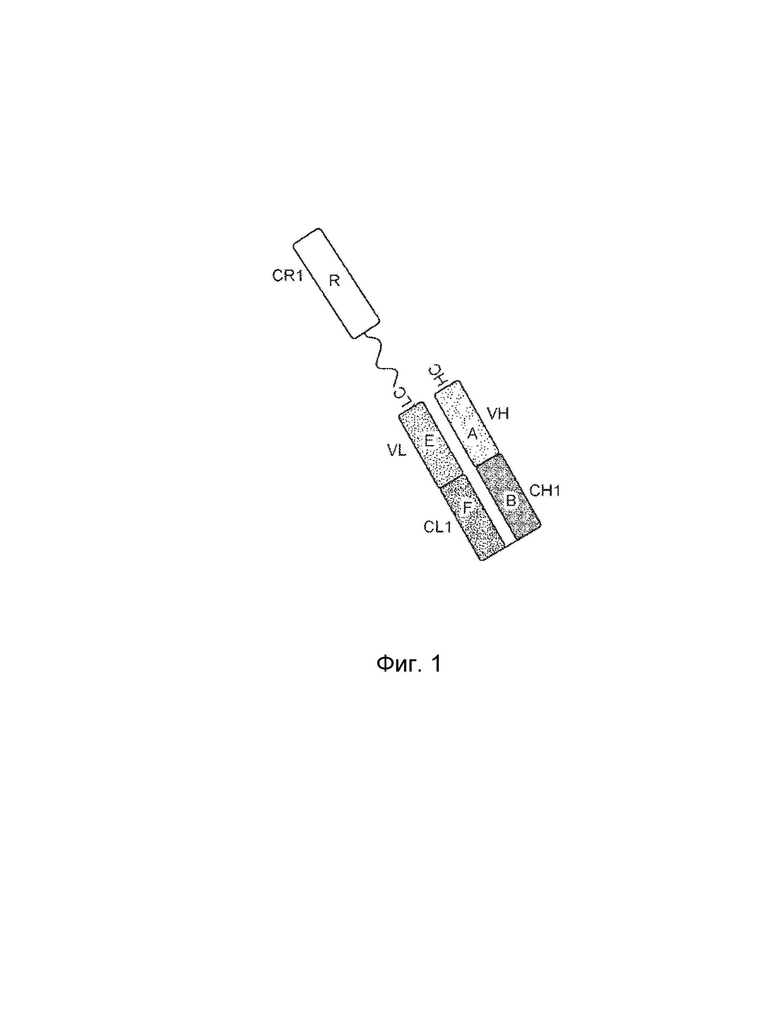
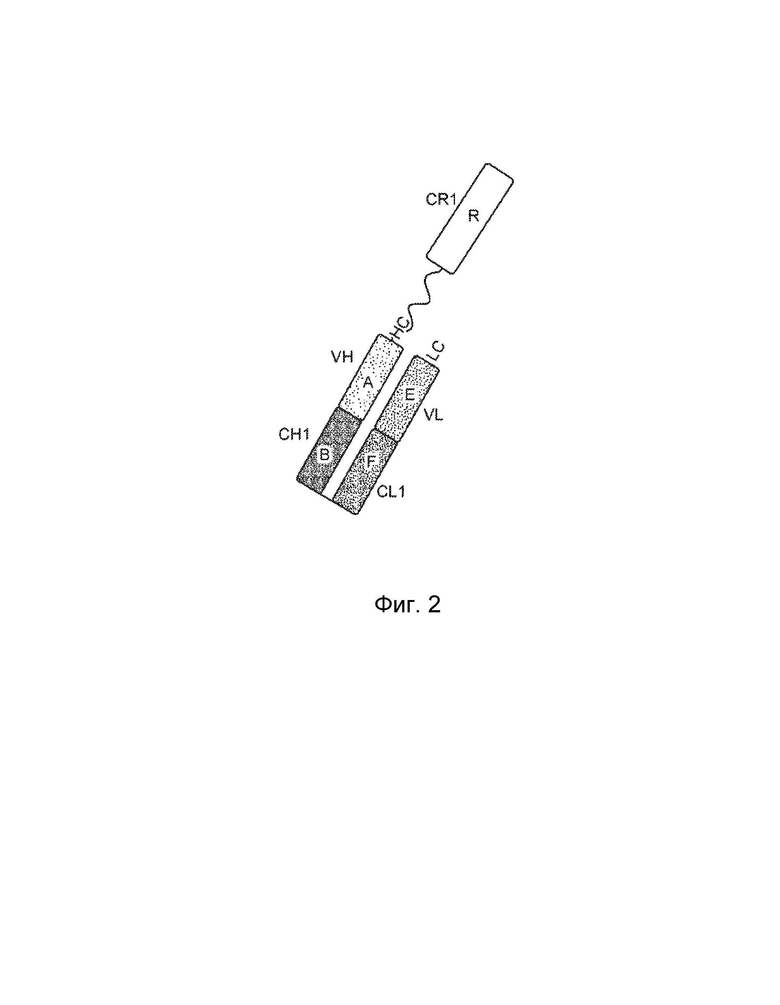
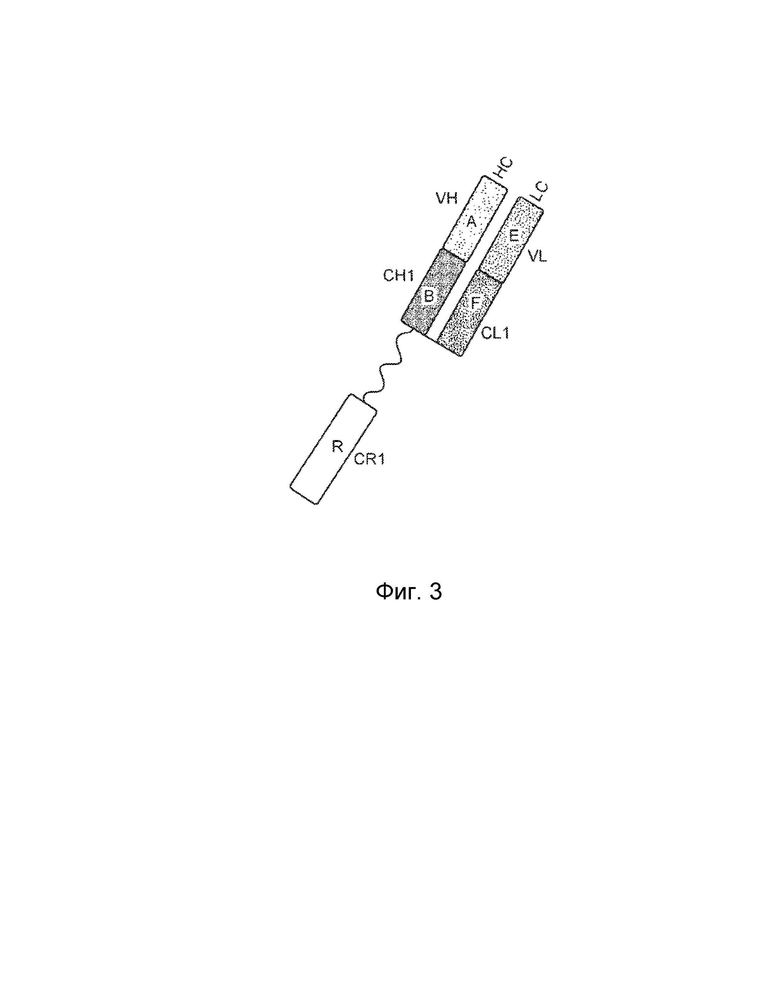
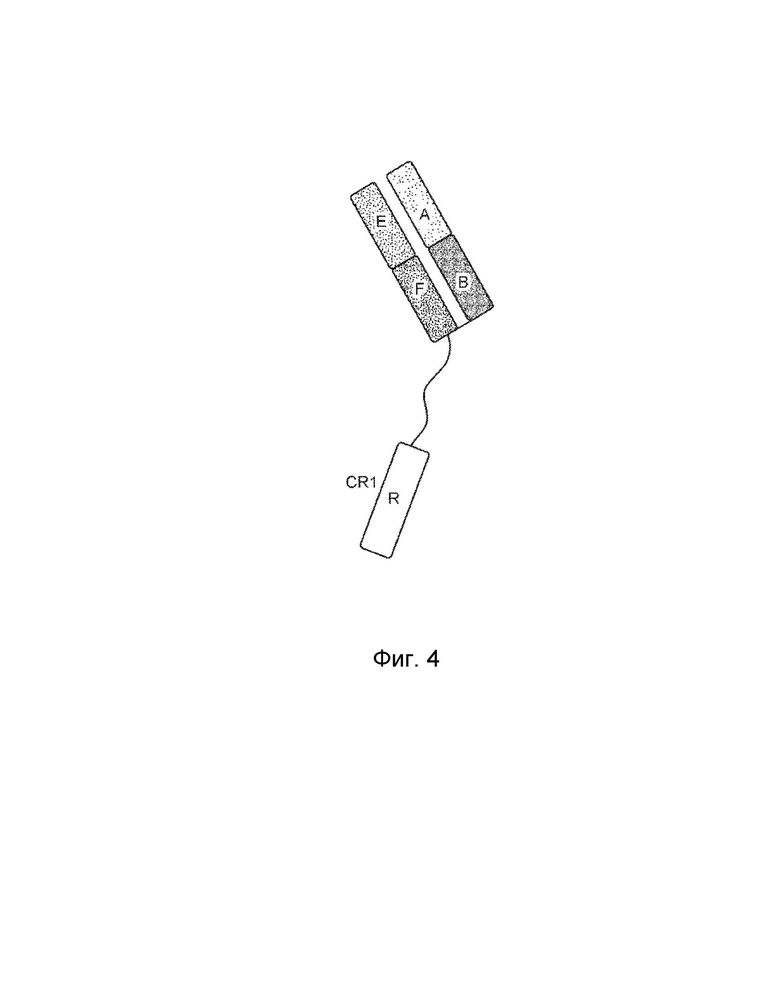
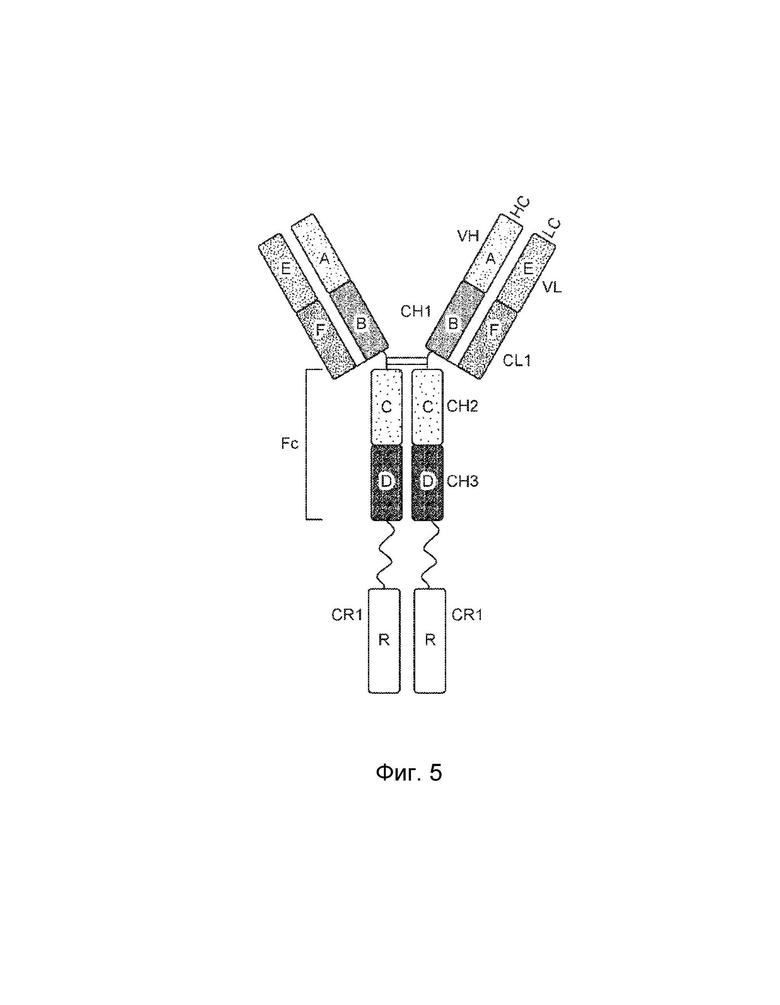
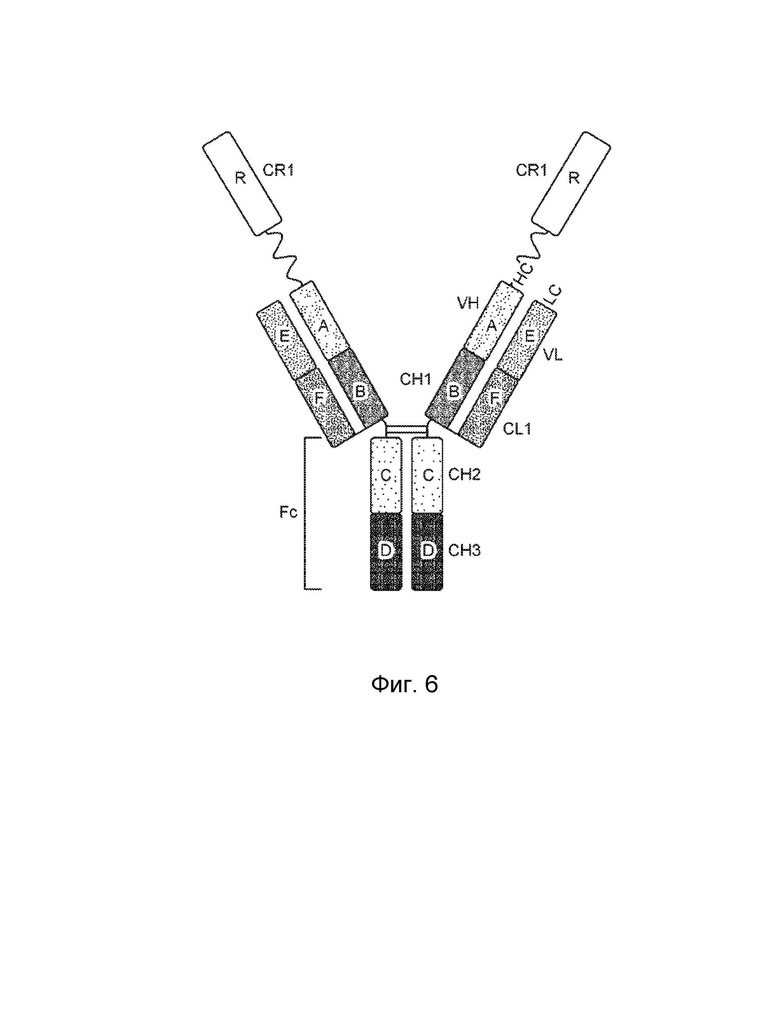
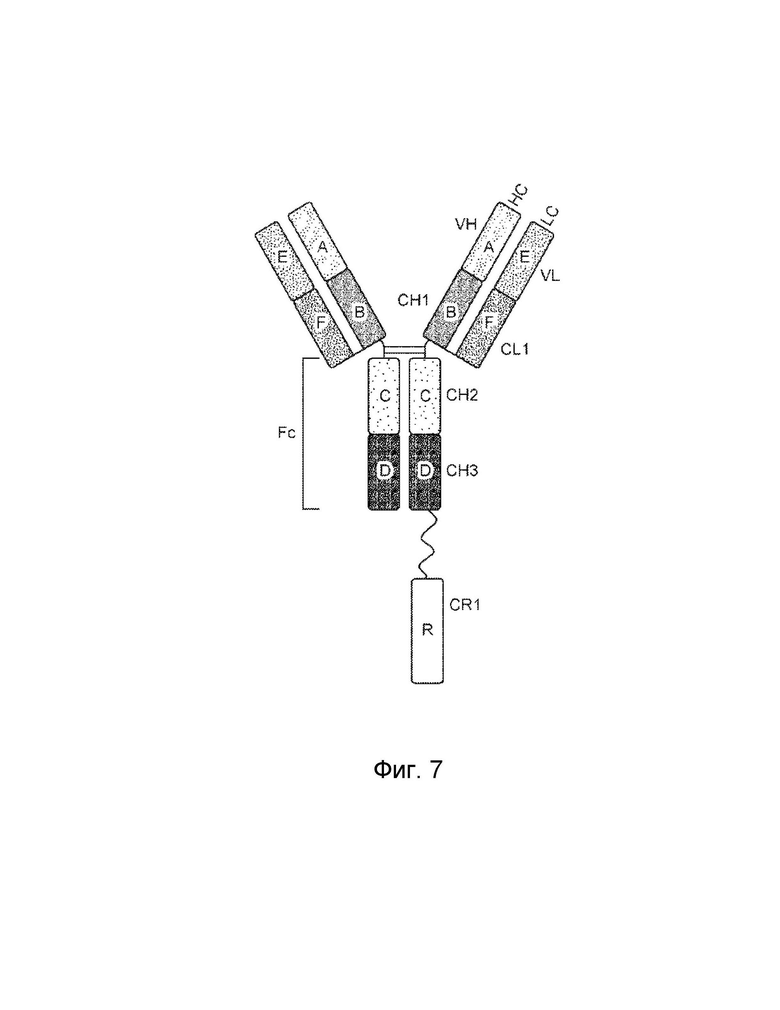
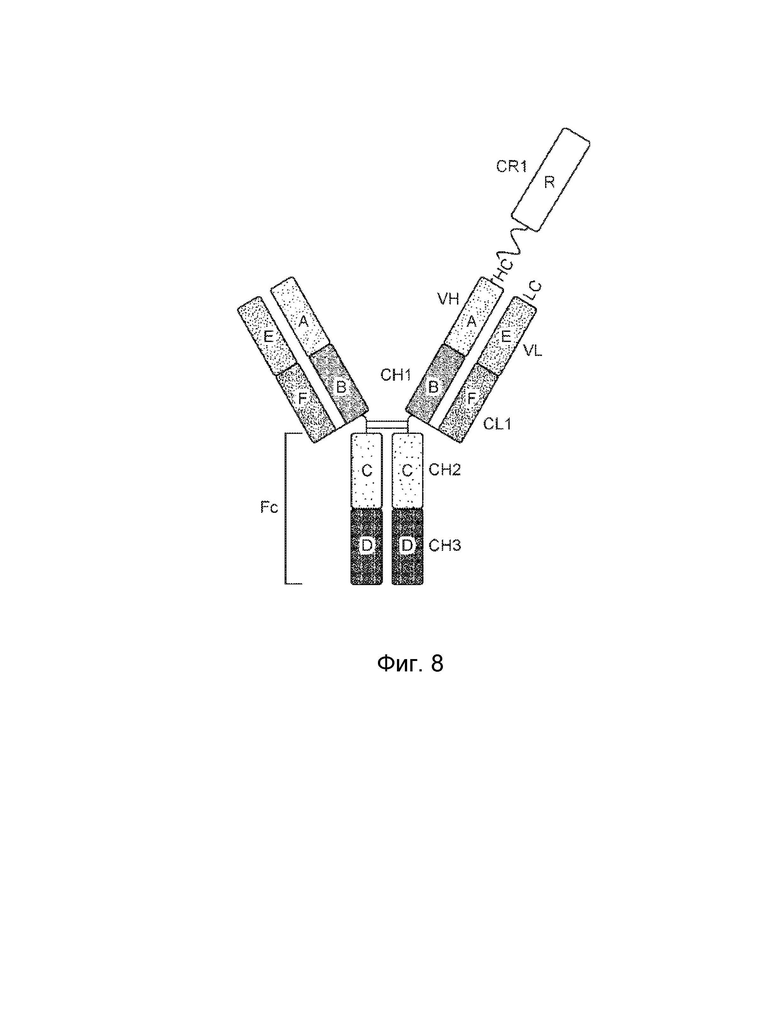
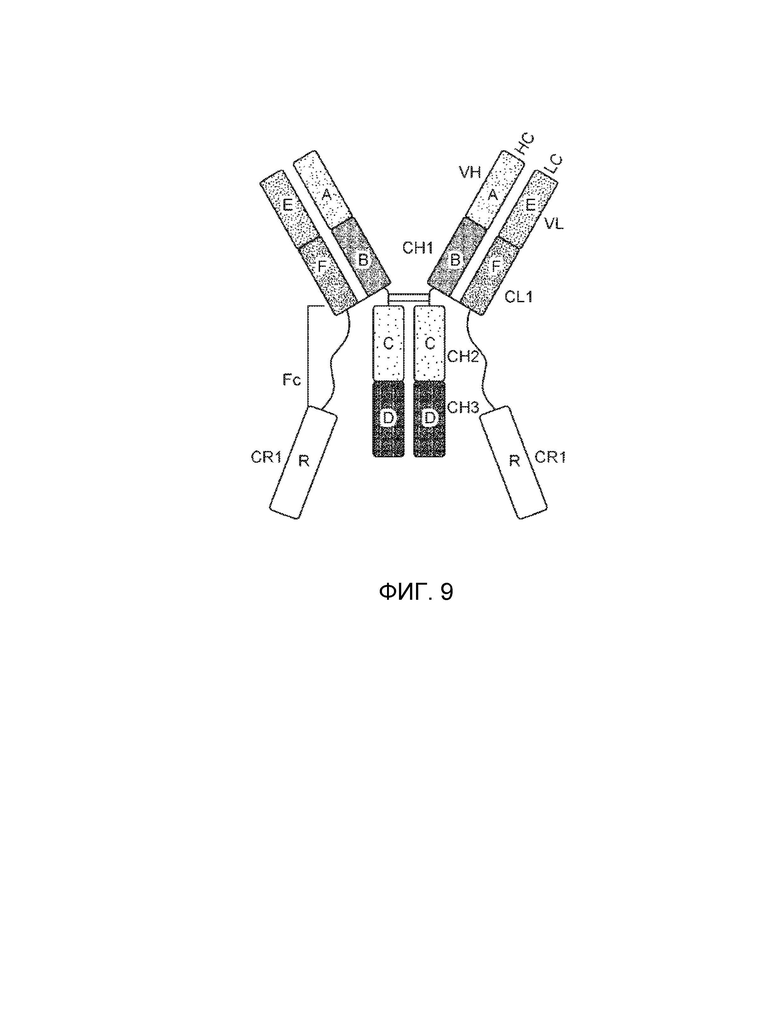
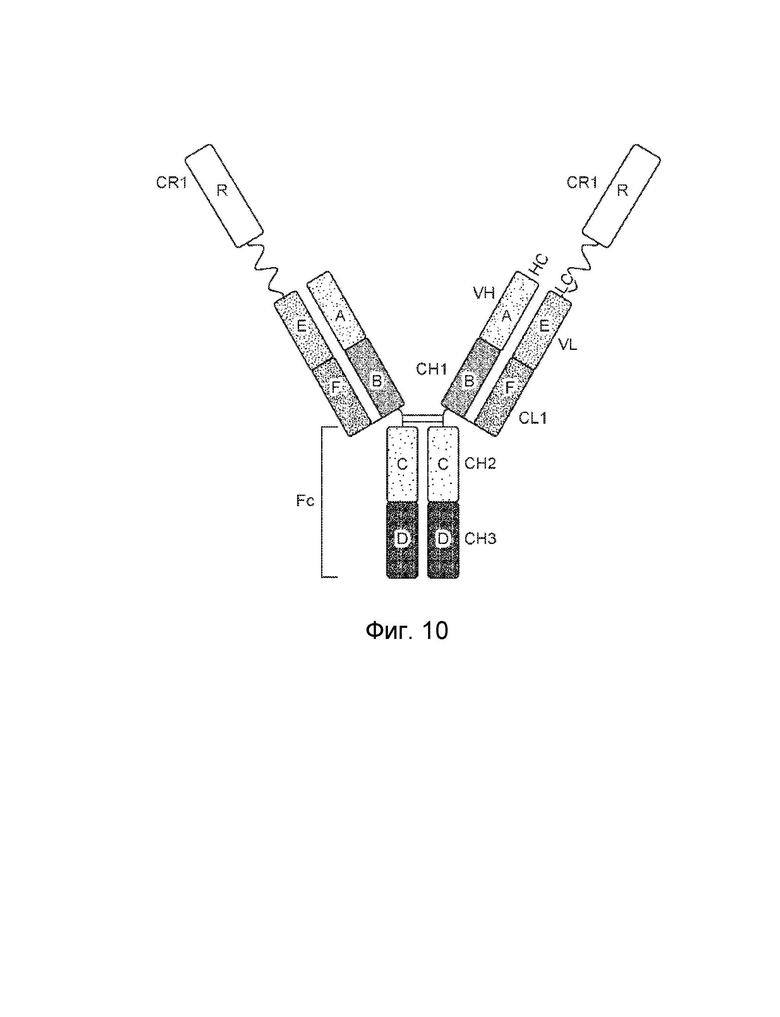

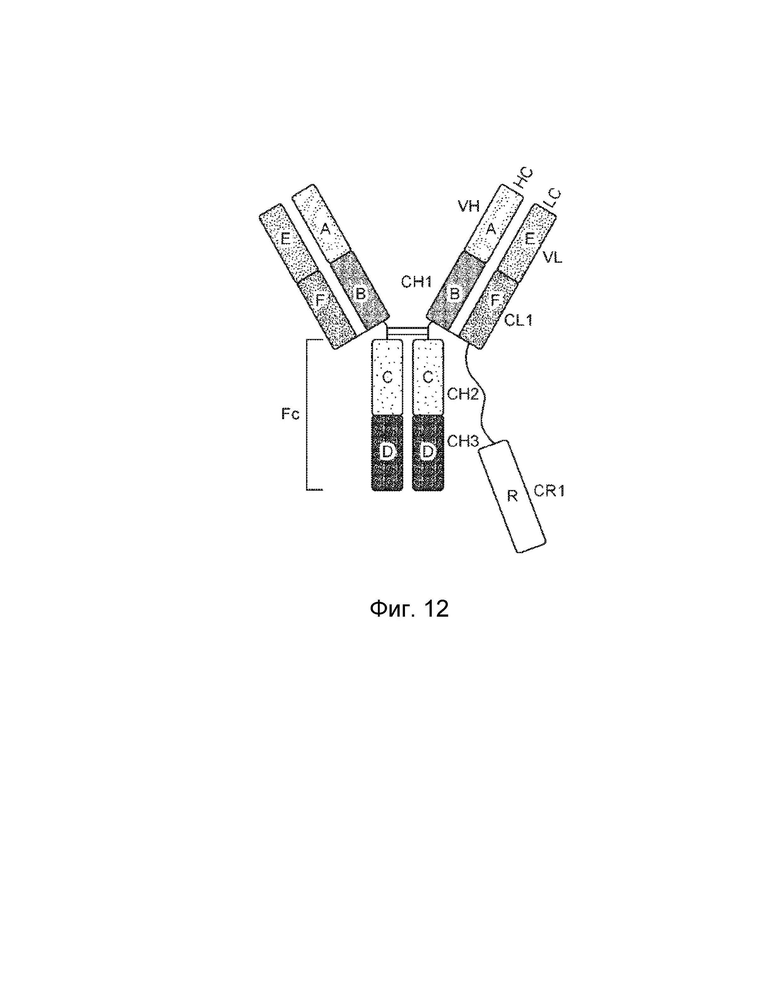
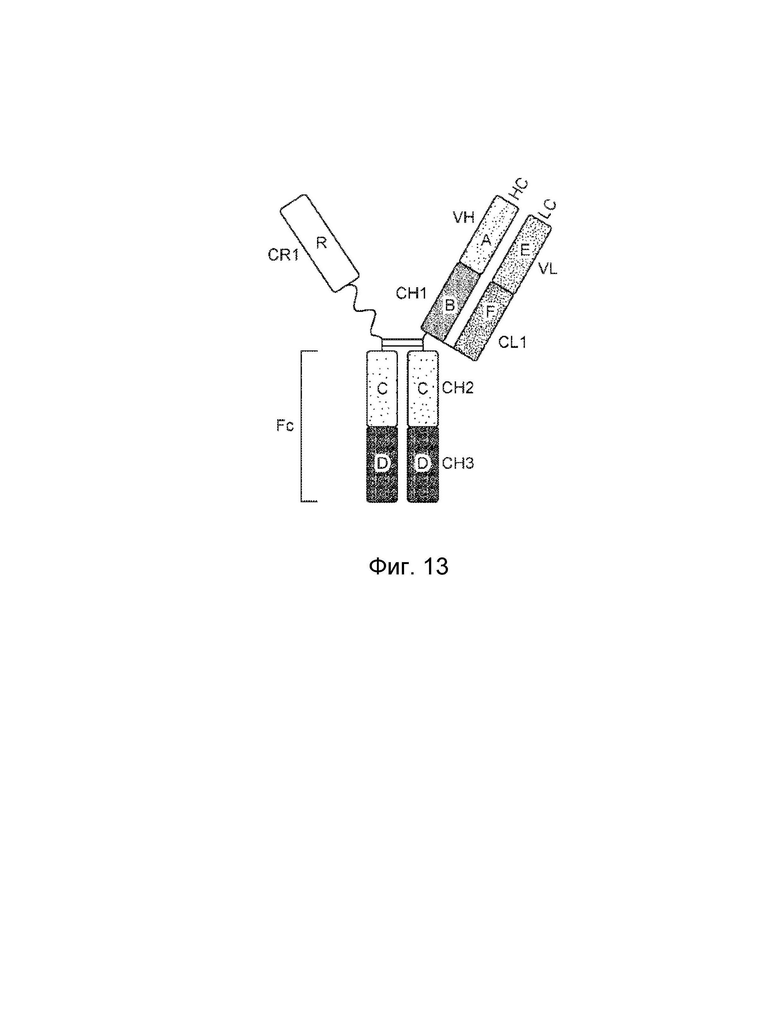
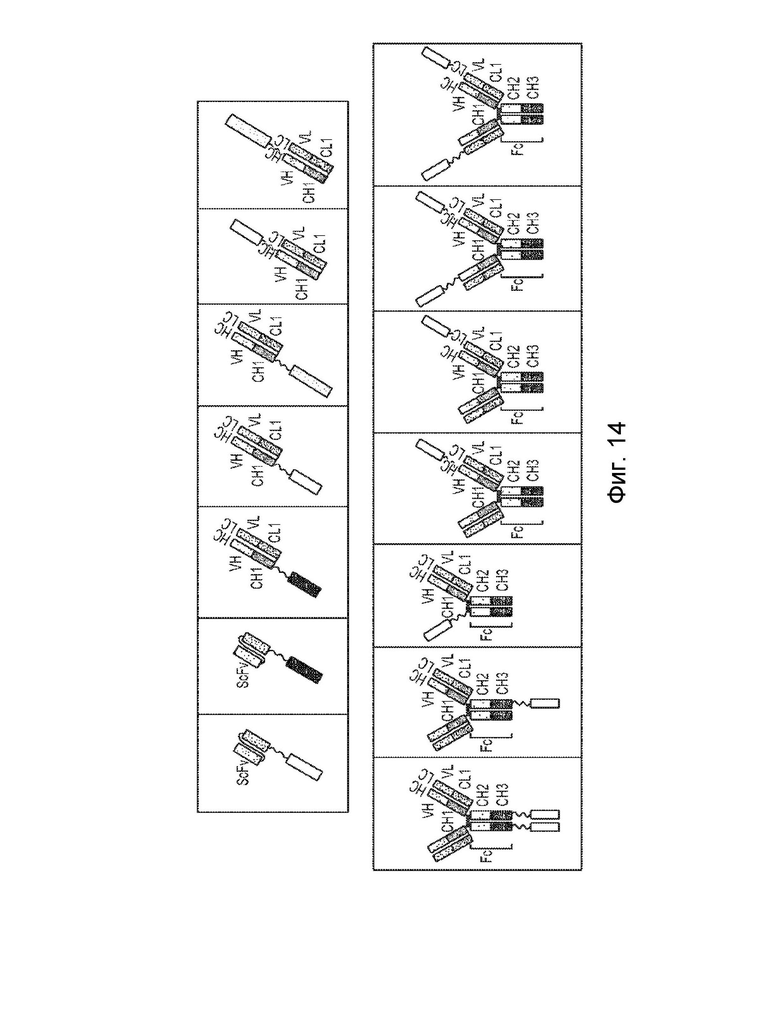
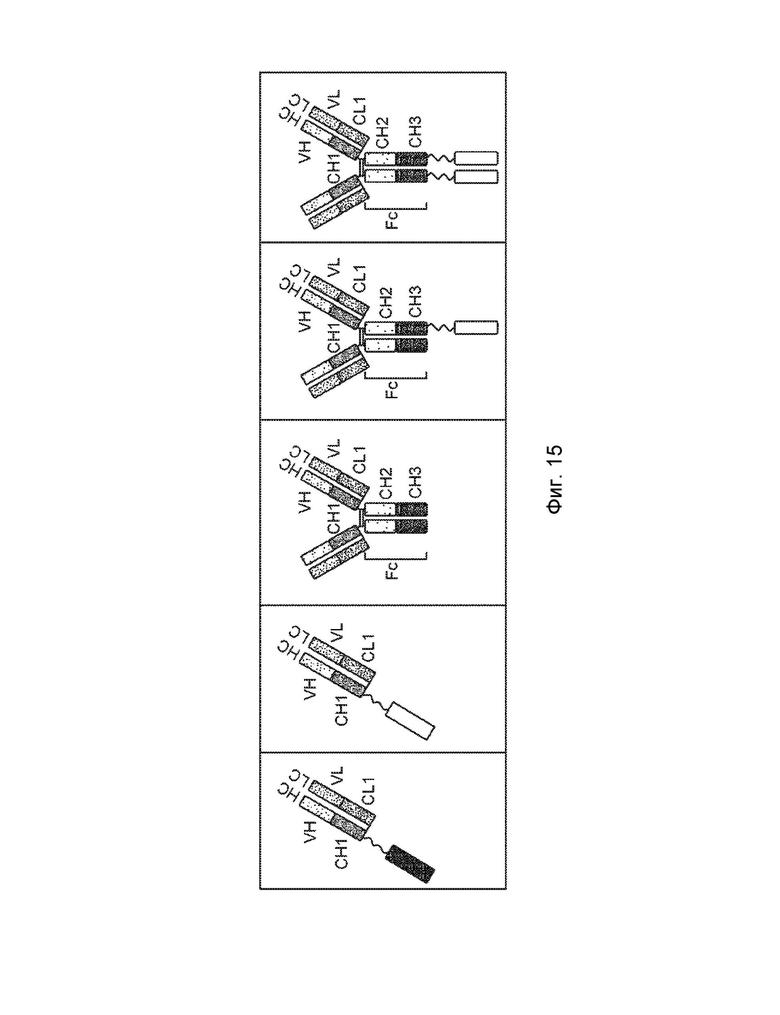
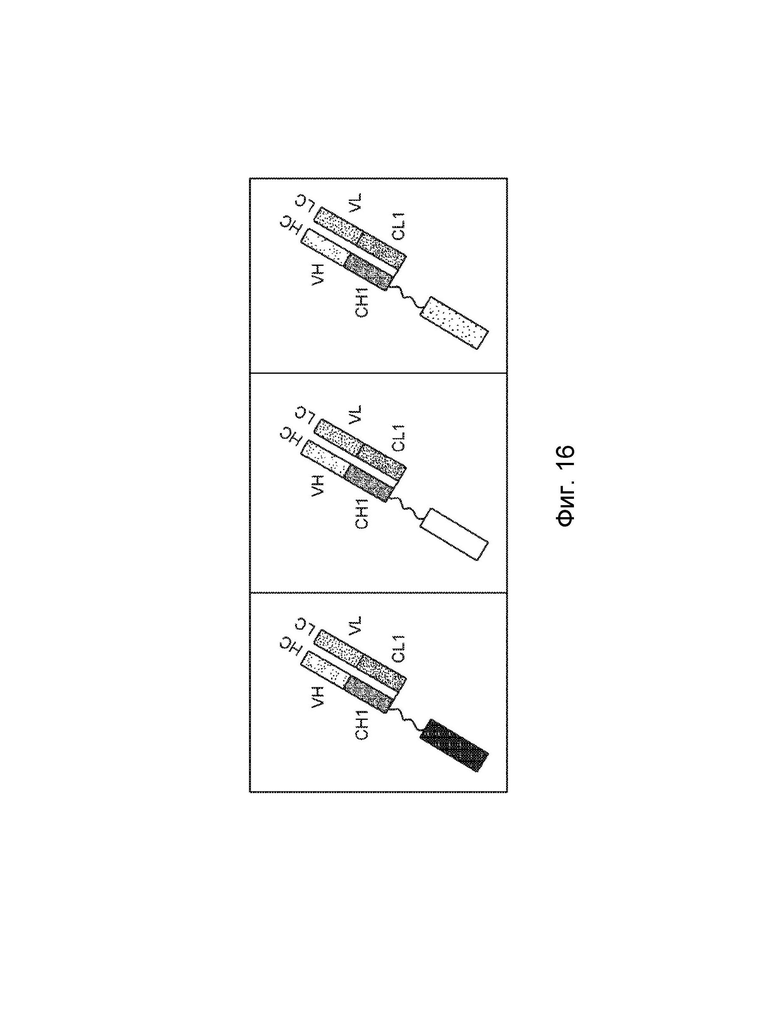
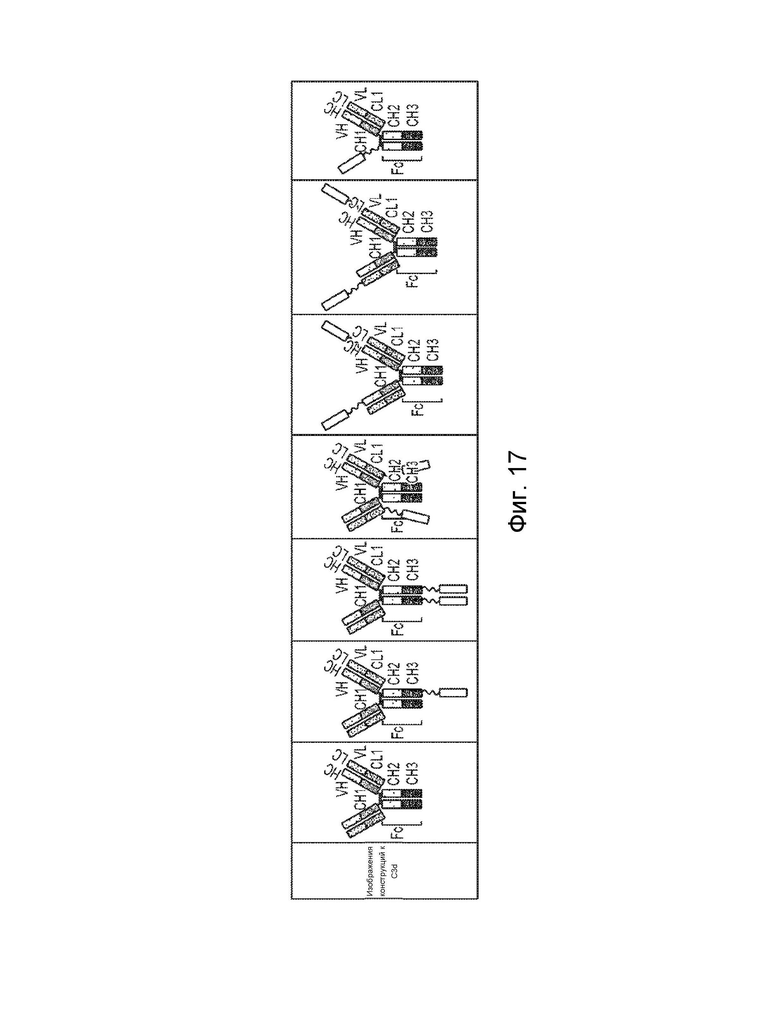
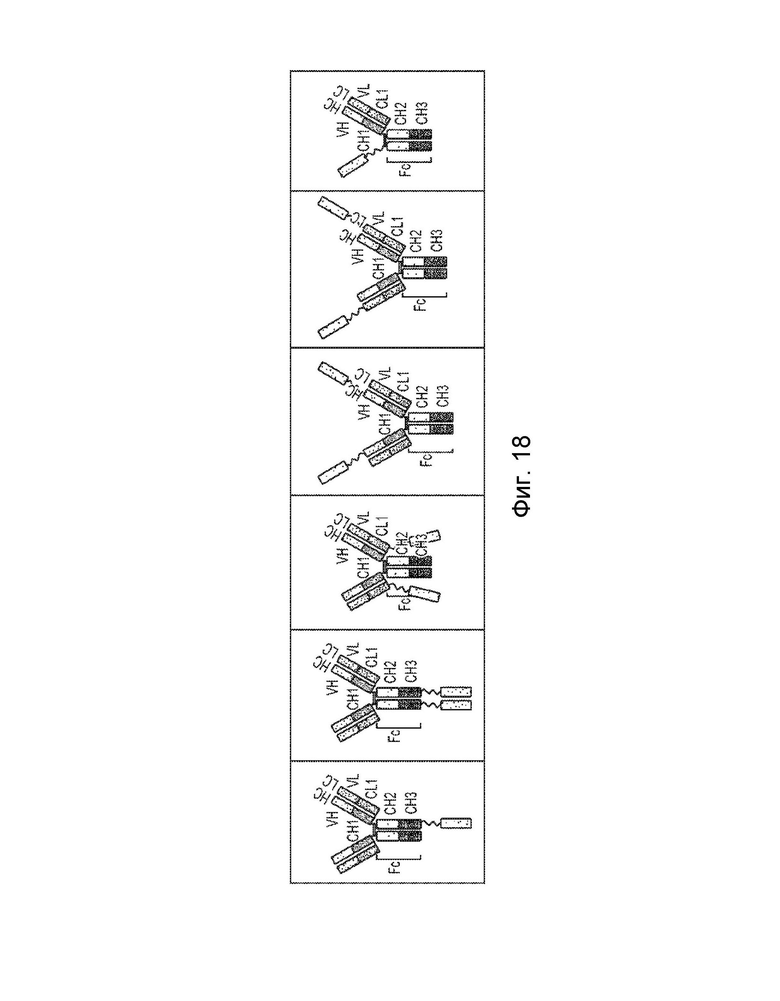
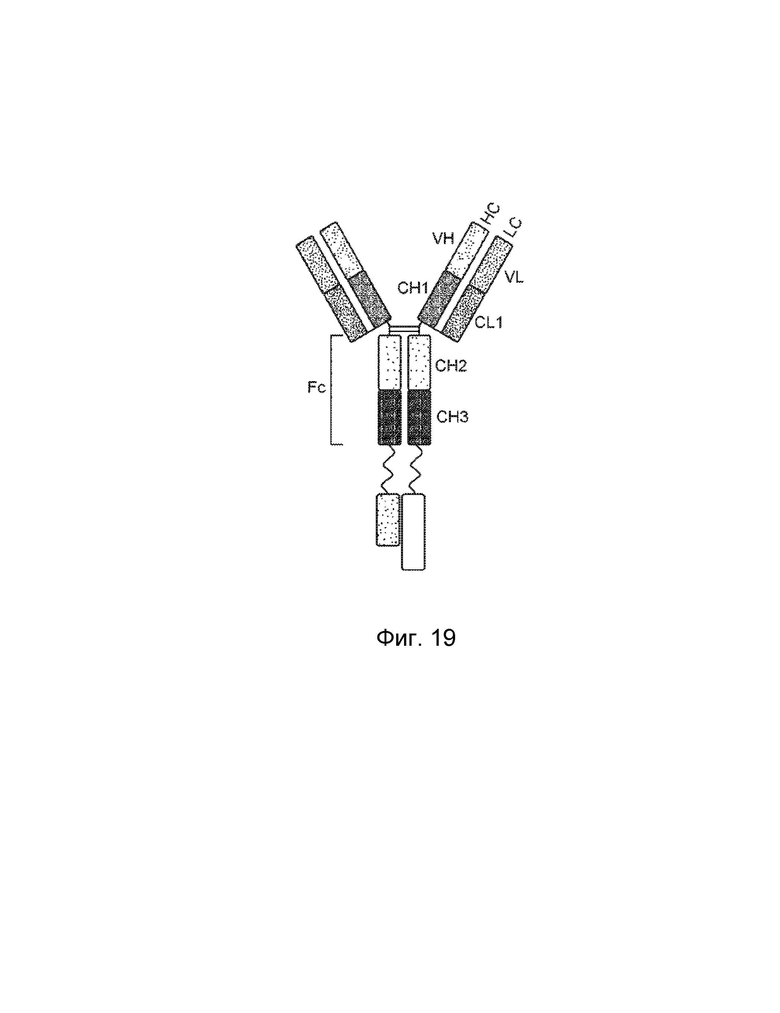
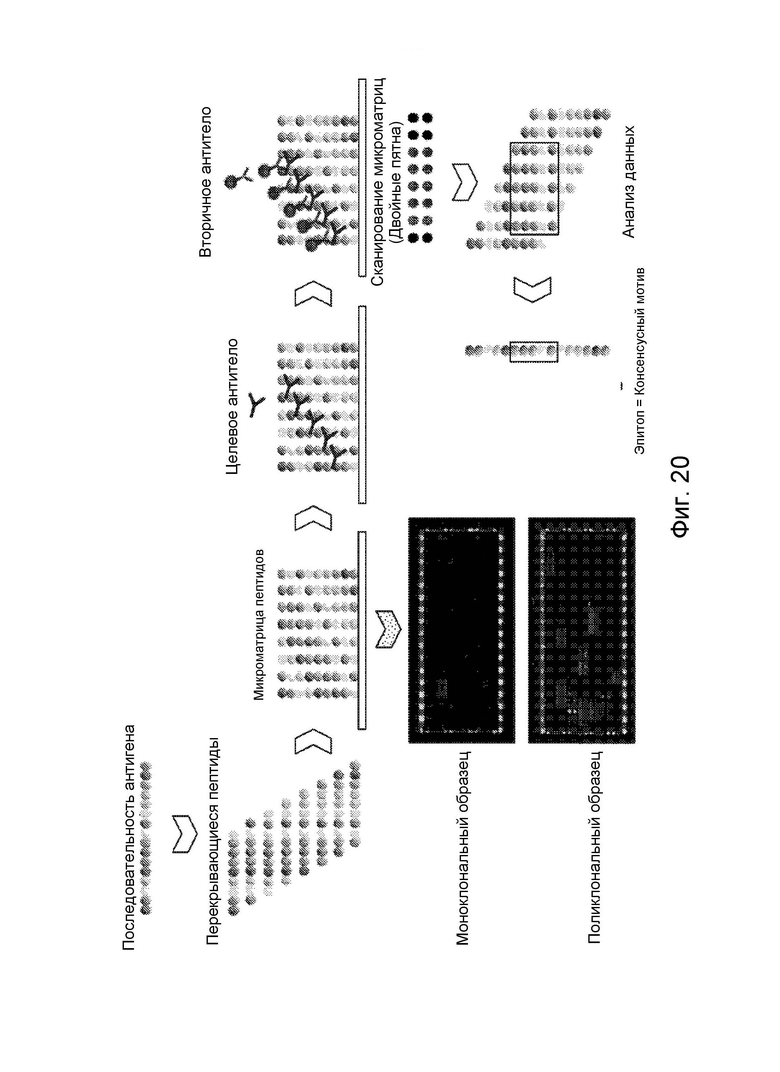





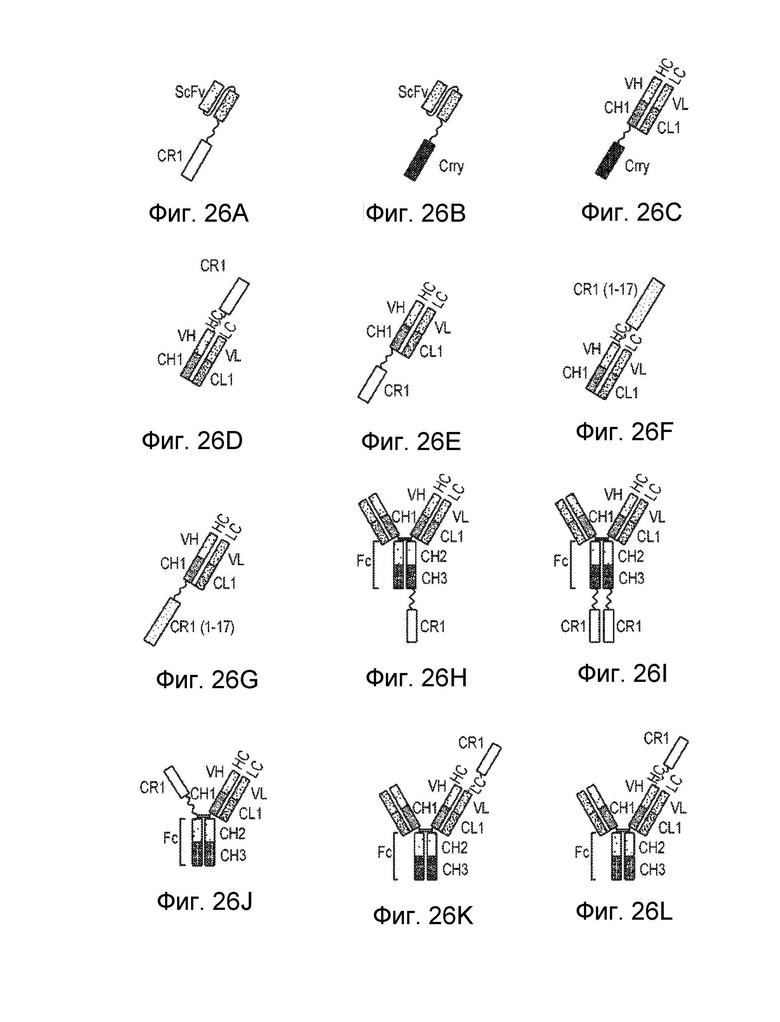
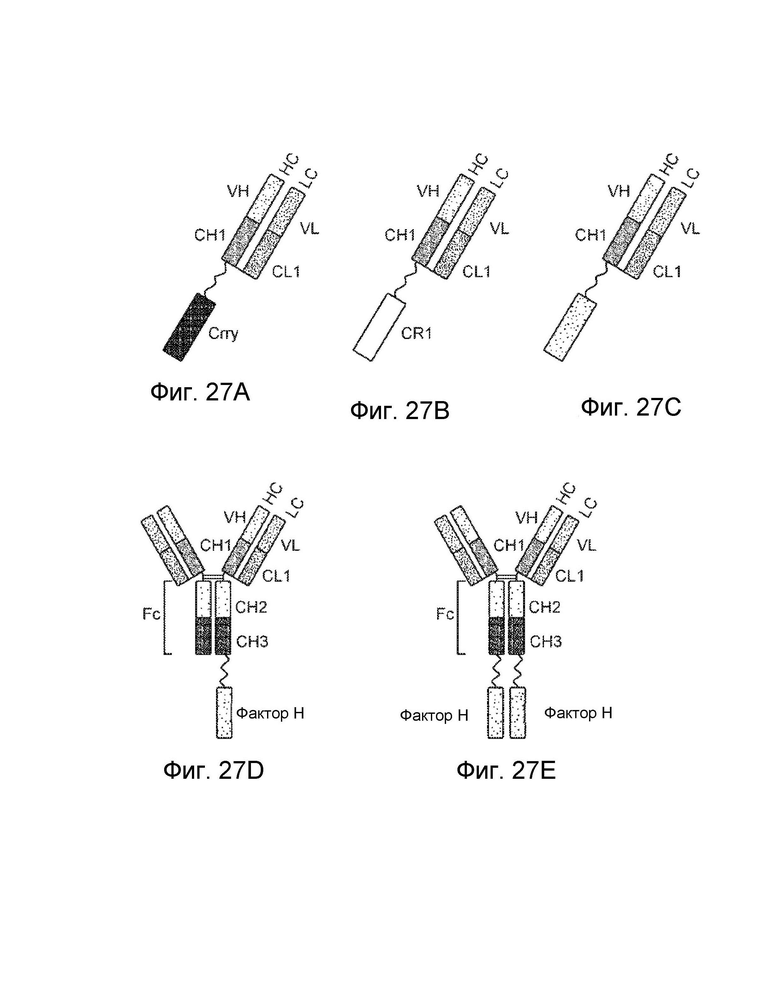
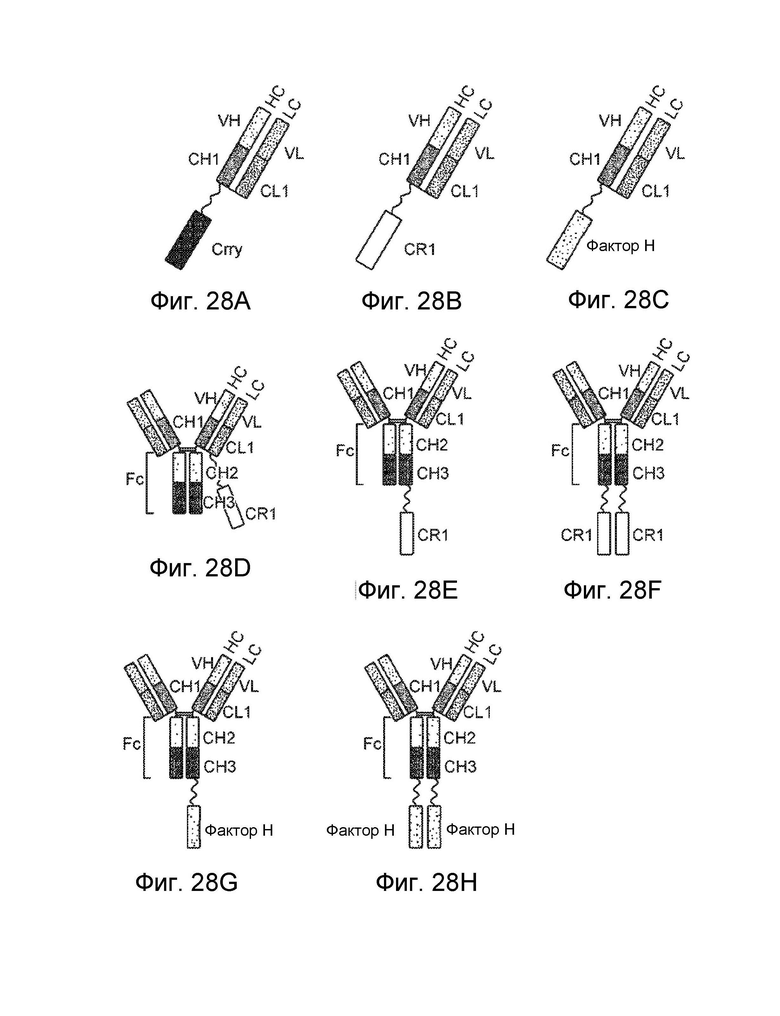
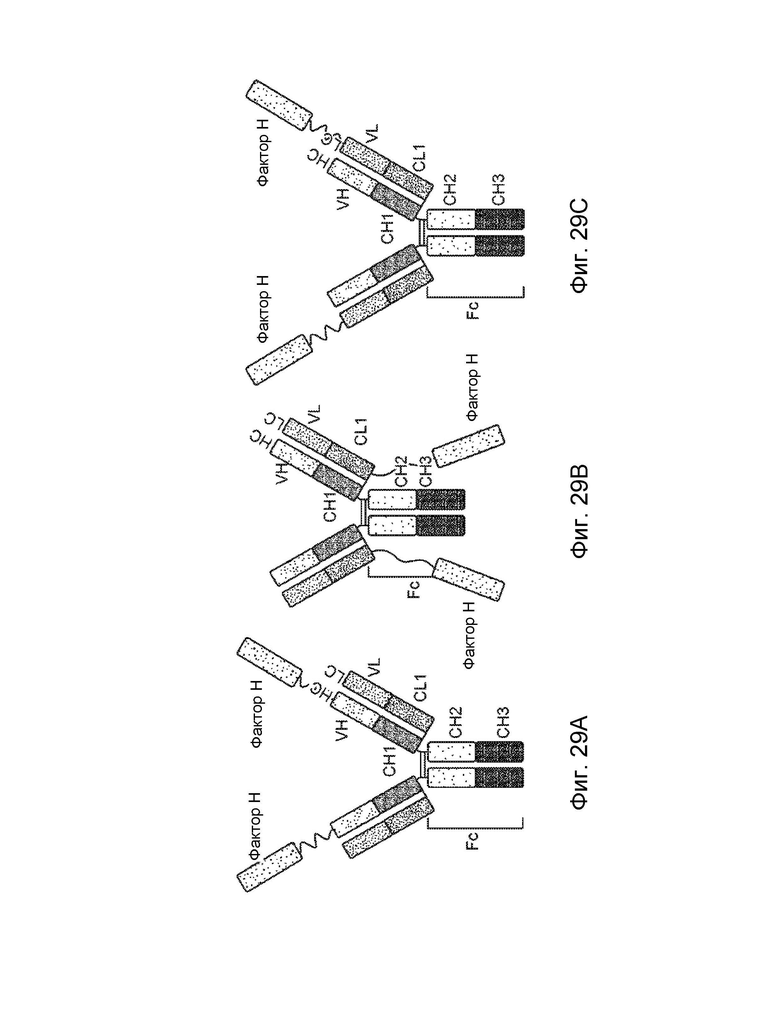
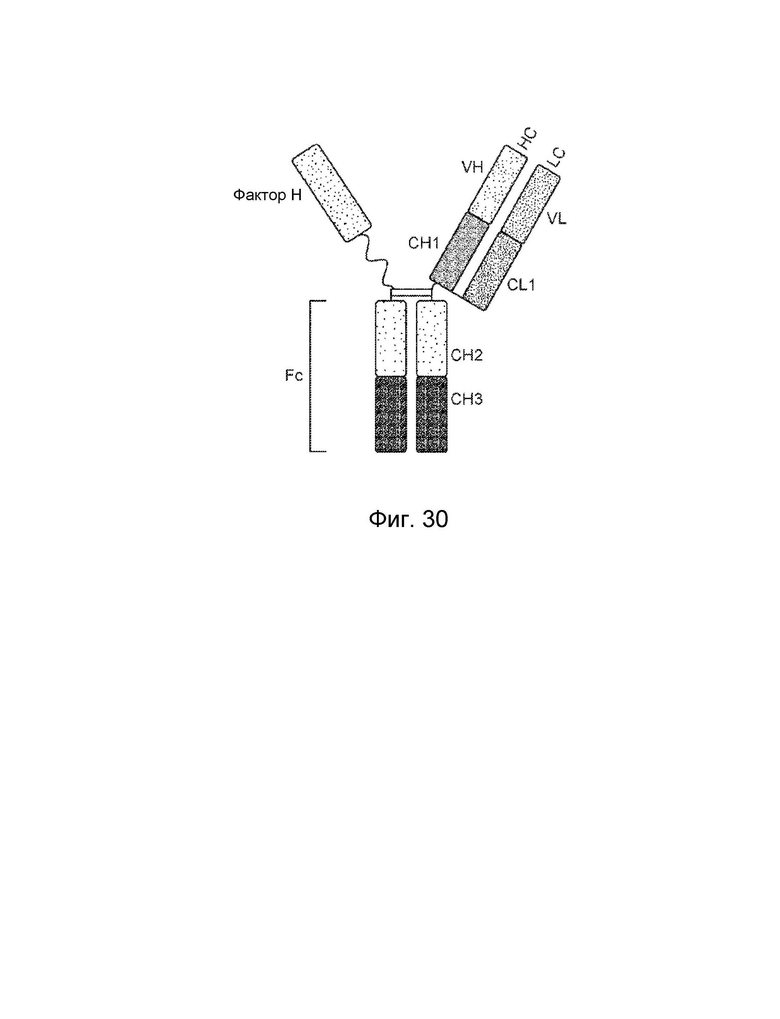
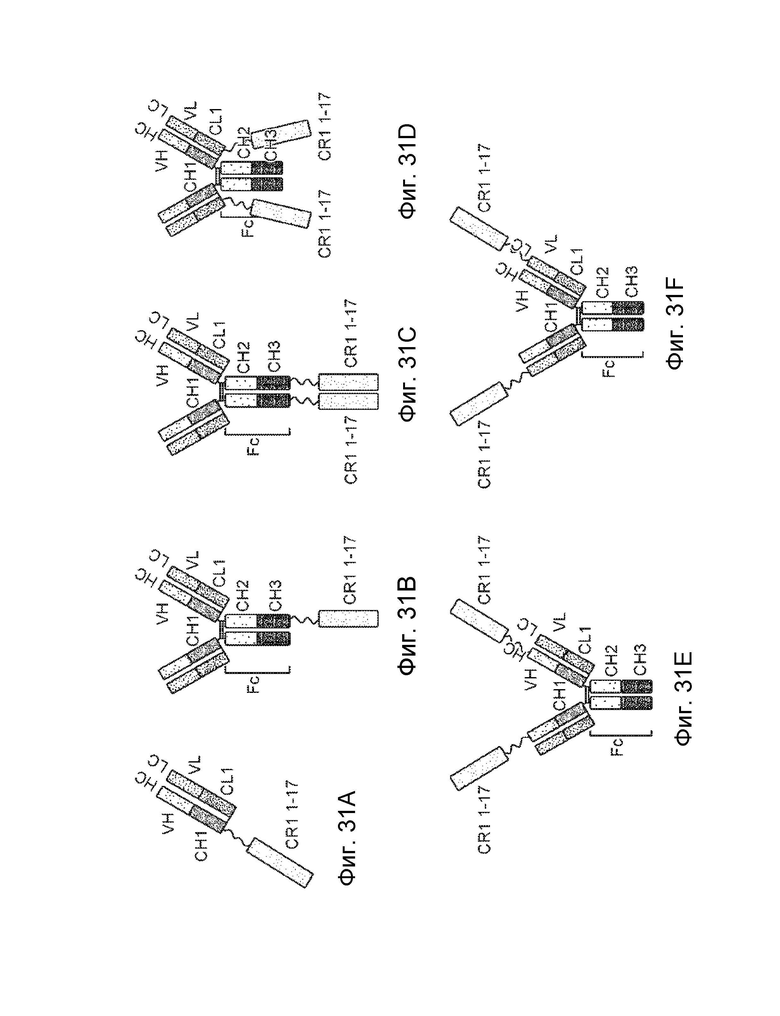
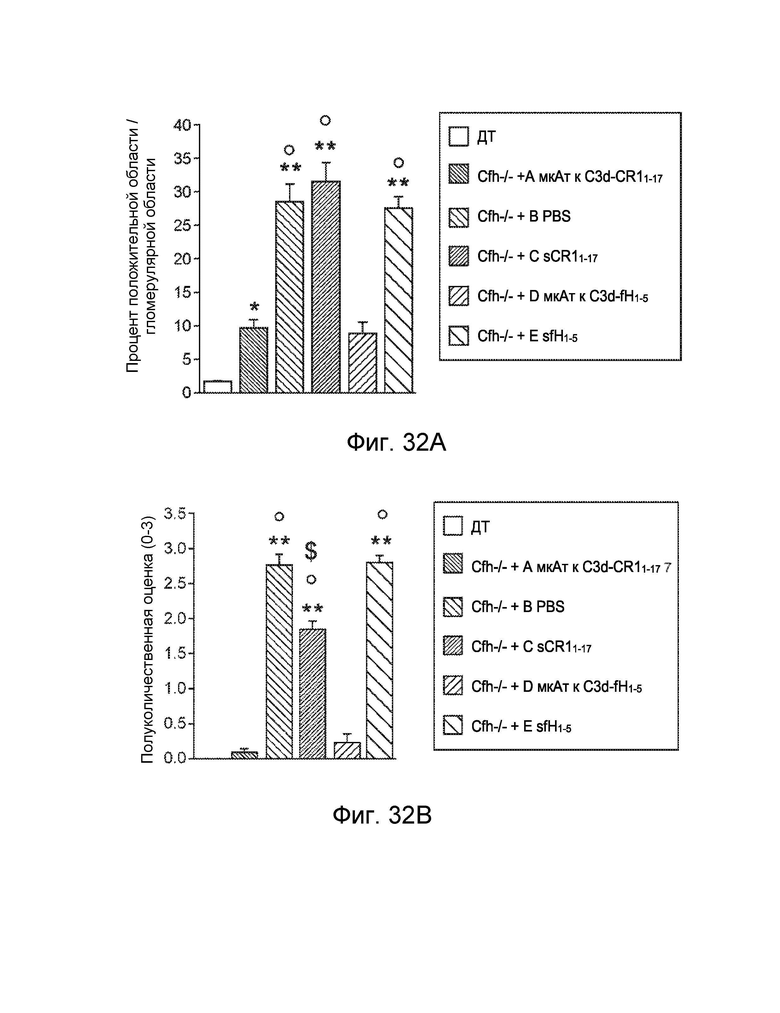
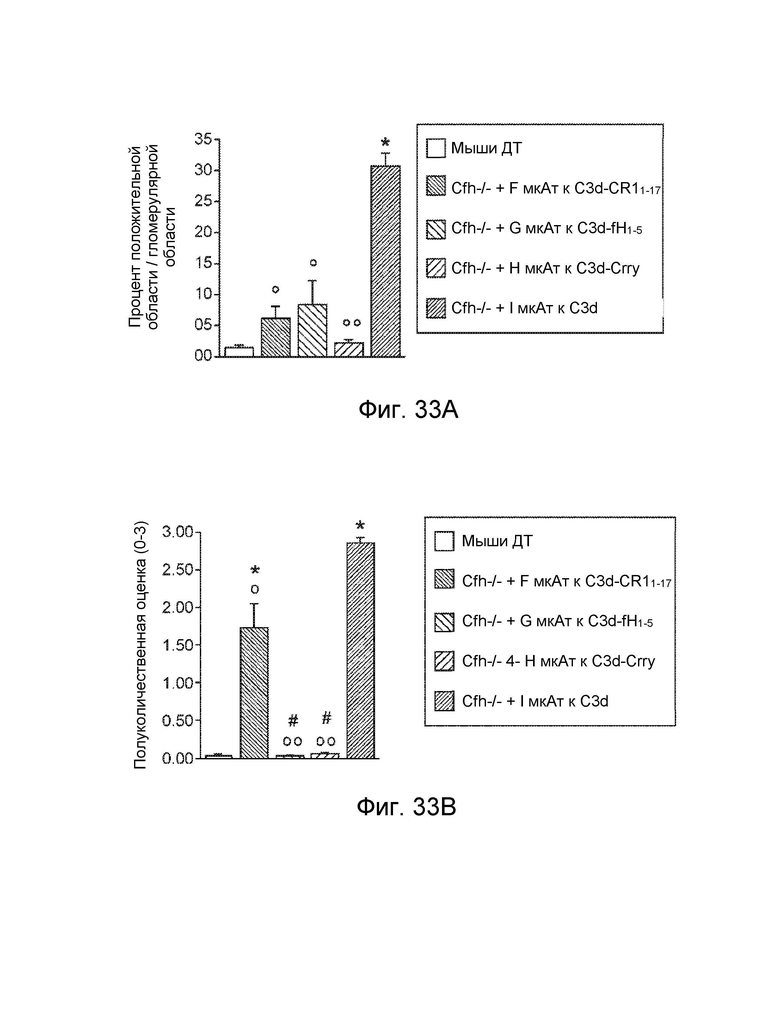
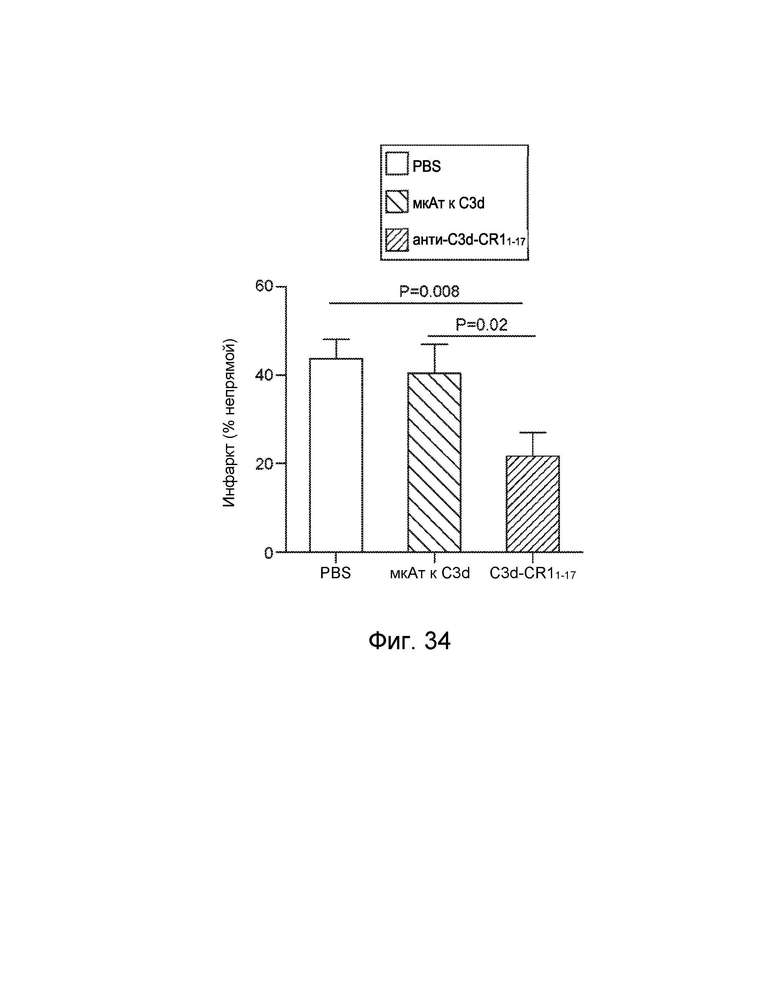
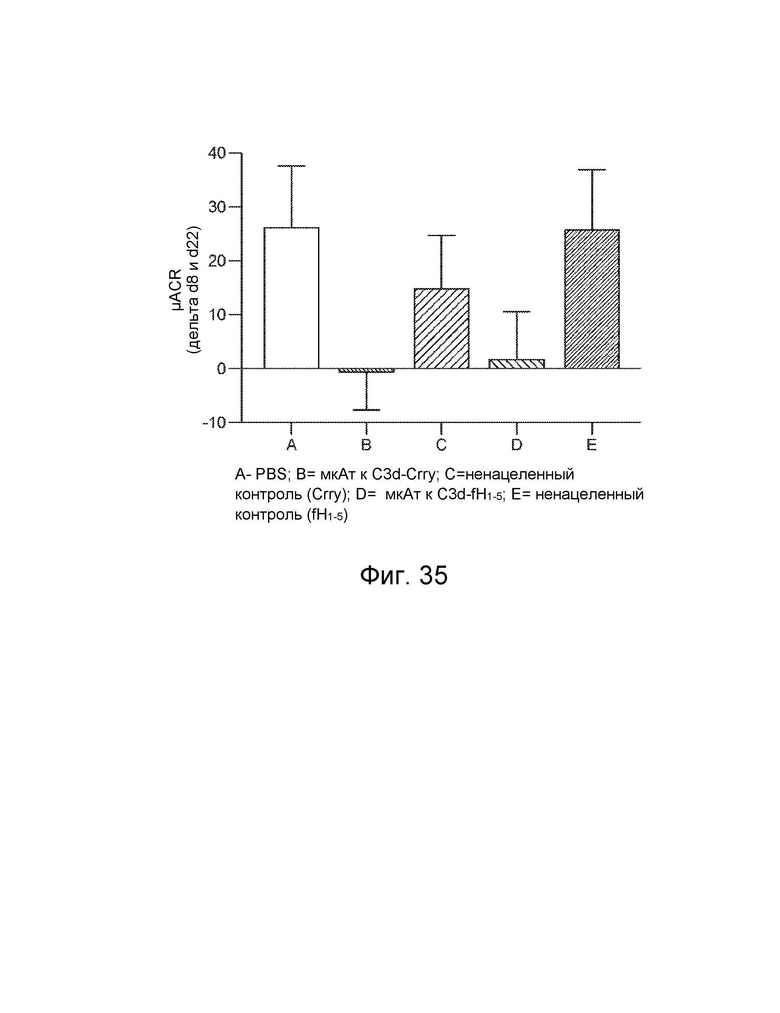
Изобретение относится к области биотехнологии, а именно к конструкции слитого белка, которая связывает фрагмент комплемента C3 C3d, содержащей антитело или его антигенсвязывающий фрагмент, которое специфически связывается с C3d, и полипептид модулятора комплемента, а также к композиции, ее содержащей. Также раскрыто антитело или его антигенсвязывающий фрагмент, которое специфически связывается с фрагментом комплемента C3 C3d. Изобретение эффективно для лечения заболевания, опосредованного фрагментом комплемента C3 C3d, а также для производства лекарственного средства для лечения заболевания, опосредованного фрагментом комплемента C3 C3d. 10 н. и 33 з.п. ф-лы, 35 ил., 36 табл., 20 пр.
1. Конструкция слитого белка, которая связывает фрагмент комплемента C3 C3d, причем указанная конструкция слитого белка содержит:
1) антитело или его антигенсвязывающий фрагмент, которое специфически связывается с C3d, причем антитело или его антигенсвязывающий фрагмент содержит:
(а) тяжелую цепь, включающую три определяющие комплементарность области тяжелой цепи (CDR) (CDR-H1, CDR-H2, CDR-H3), где CDR-H1 включает аминокислотную последовательность SEQ ID NO: 29, CDR-H2 включает аминокислотную последовательность SEQ ID NO: 260, а CDR-H3 включает аминокислотную последовательность SEQ ID NO: 31, и
(б) легкую цепь, включающую три определяющие комплементарность области легкой цепи (CDR) (CDR-L1, CDR-L2, CDR-L3), где CDR-L1 включает аминокислотную последовательность SEQ ID NO: 32, CDR-L2 включает аминокислотную последовательность SEQ ID NO: 33, а CDR-L3 включает аминокислотную последовательность SEQ ID NO: 34, и
2) полипептид модулятора комплемента, включающий белок, выбранный из группы, состоящей из: фактора H, CR1, DAF, MCP, Crry, MAp44, MAp19 и CD59, и его биологически активного фрагмента,
где полипептид модулятора комплемента конъюгирован с антителом или его антигенсвязывающим фрагментом.
2. Конструкция слитого белка по п. 1, где легкая цепь включает вариабельную область легкой цепи (LCVR), содержащую аминокислотную последовательность SEQ ID NO: 258.
3. Конструкция слитого белка по п. 2, где легкая цепь включает аминокислотную последовательность SEQ ID NO: 279.
4. Конструкция слитого белка по п. 1, где тяжелая цепь включает вариабельную область тяжелой цепи (HCVR), содержащую аминокислотную последовательность SEQ ID NO: 254.
5. Конструкция слитого белка по п. 4, где тяжелая цепь включает аминокислотную последовательность SEQ ID NO: 284.
6. Конструкция слитого белка по п. 5, где тяжелая цепь включает аминокислотную последовательность SEQ ID NO: 282.
7. Конструкция слитого белка по п. 5, где тяжелая цепь включает аминокислотную последовательность SEQ ID NO: 285.
8. Конструкция слитого белка по п. 1, где:
(a) легкая цепь включает вариабельную область легкой цепи (LCVR), содержащую аминокислотную последовательность SEQ ID NO: 258; и
(б) тяжелая цепь включает вариабельную область тяжелой цепи (HCVR), содержащую аминокислотную последовательность SEQ ID NO: 254.
9. Конструкция слитого белка по п. 8, где легкая цепь включает аминокислотную последовательность SEQ ID NO: 279.
10. Конструкция слитого белка по п. 9, где тяжелая цепь включает аминокислотную последовательность SEQ ID NO: 284.
11. Конструкция слитого белка по любому из пп. 1-10, где полипептид модулятора комплемента включает фактор H или его биологически активный фрагмент.
12. Конструкция слитого белка по любому из пп. 1-10, где полипептид модулятора комплемента включает CR1 или его биологически активный фрагмент.
13. Конструкция слитого белка по любому из пп. 1-10, где слитый белок содержит линкер, соединяющий антитело или его антигенсвязывающий фрагмент с полипептидом модулятора комплемента.
14. Конструкция слитого белка по п. 13, где линкер содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 138, SEQ ID NO: 161, SEQ ID NO: 162, SEQ ID NO: 163, SEQ ID NO: 164, SEQ ID NO: 165, SEQ ID NO: 166, SEQ ID NO: 167, SEQ ID NO: 168, SEQ ID NO: 169, SEQ ID NO: 170, SEQ ID NO: 171, SEQ ID NO: 172, SEQ ID NO: 173, SEQ ID NO: 174, SEQ ID NO: 175, SEQ ID NO: 176, SEQ ID NO: 177, SEQ ID NO: 178, SEQ ID NO: 179, SEQ ID NO: 180, SEQ ID NO: 181, SEQ ID NO: 182, SEQ ID NO: 183 и SEQ ID NO: 241.
15. Конструкция слитого белка по п. 14, где линкер связан с С-концом тяжелой цепи и содержит аминокислотную последовательность SEQ ID NO: 138.
16. Конструкция слитого белка по п. 1, где полипептид модулятора комплемента включает (а) аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 72 и SEQ ID NO: 108; или (б) аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 91 и SEQ ID NO: 92.
17. Конструкция слитого белка по п. 16, где полипептид модулятора комплемента включает (а) аминокислотную последовательность SEQ ID NO: 72; или (б) аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 41 и SEQ ID NO: 42.
18. Конструкция слитого белка, которая связывает фрагмент комплемента C3 C3d, причем указанная конструкция слитого белка содержит: (1) антитело или его антигенсвязывающий фрагмент, которое специфически связывается с фрагментом комплемента C3 C3d, и (2) полипептид модулятора комплемента, включающий белок, выбранный из группы, состоящей из: фактора H, CR1, DAF, MCP, Crry, MAp44, MAp19 и CD59, и его биологически активного фрагмента, где полипептид модулятора комплемента конъюгирован с антителом или его антигенсвязывающим фрагментом, где антитело или его антигенсвязывающий фрагмент содержит:
(a) первую тяжелую цепь и вторую тяжелую цепь, где каждая из первой и второй тяжелых цепей включает три определяющие комплементарность области тяжелой цепи (CDR-H1, CDR-H2, CDR-H3), где CDR-H1 содержит аминокислотную последовательность SEQ ID NO: 29, CDR-H2 содержит аминокислотную последовательность SEQ ID NO: 260 и CDR-H3 содержит аминокислотную последовательность SEQ ID NO: 31, и
(б) первую легкую цепь и вторую легкую цепь, где каждая из первой и второй легких цепей включает три определяющие комплементарность области легкой цепи (CDR-L1, CDR-L2, CDR-L3), где CDR-L1 содержит аминокислотную последовательность SEQ ID NO: 32, CDR-L2 содержит аминокислотную последовательность SEQ ID NO: 33 и CDR-L3 содержит аминокислотную последовательность SEQ ID NO: 34.
19. Конструкция слитого белка по п. 18, где каждая из первой и второй тяжелых цепей включает вариабельную область тяжелой цепи (HCVR), содержащую аминокислотную последовательность SEQ ID NO: 254, и где каждая из первой и второй легких цепей включает вариабельную область легкой цепи (LCVR), содержащую аминокислотную последовательность SEQ ID NO: 258.
20. Конструкция слитого белка по п. 19, где каждая из первой и второй тяжелых цепей включает аминокислотную последовательность SEQ ID NO: 284 и где каждая из первой и второй легких цепей включает аминокислотную последовательность SEQ ID NO: 279.
21. Конструкция слитого белка по п. 20, где каждая из первой и второй тяжелых цепей включает аминокислотную последовательность SEQ ID NO: 282.
22. Конструкция слитого белка по п. 20, где каждая из первой и второй тяжелых цепей включает аминокислотную последовательность SEQ ID NO: 285.
23. Конструкция слитого белка по п. 20, где слитый белок содержит линкер, соединяющий антитело или его антигенсвязывающий фрагмент с одним из полипептидов модулятора комплемента.
24. Конструкция слитого белка по п. 23, где линкер содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 138, SEQ ID NO: 161, SEQ ID NO: 162, SEQ ID NO: 163, SEQ ID NO: 164, SEQ ID NO: 165, SEQ ID NO: 166, SEQ ID NO: 167, SEQ ID NO: 168, SEQ ID NO: 169, SEQ ID NO: 170, SEQ ID NO: 171, SEQ ID NO: 172, SEQ ID NO: 173, SEQ ID NO: 174, SEQ ID NO: 175, SEQ ID NO: 176, SEQ ID NO: 177, SEQ ID NO: 178, SEQ ID NO: 179, SEQ ID NO: 180, SEQ ID NO: 181, SEQ ID NO: 182, SEQ ID NO: 183 и SEQ ID NO: 241.
25. Конструкция слитого белка по п. 23, содержащая:
(в) первый линкер, связанный с С-концом первой тяжелой цепи и включающий аминокислотную последовательность SEQ ID NO: 138; и
(г) второй линкер, связанный с С-концом второй тяжелой цепи и включающий аминокислотную последовательность SEQ ID NO: 138.
26. Конструкция слитого белка по п. 25, где полипептид модулятора комплемента включает (а) аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 72 и SEQ ID NO: 108, или (б) аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 91 и SEQ ID NO: 92.
27. Конструкция слитого белка по п. 18, где конструкция слитого белка выбрана из группы, состоящей из:
(1) два полипептида, содержащих тяжелую цепь, каждый из которых с N- до C-конца содержит аминокислотную последовательность SEQ ID NO: 282, аминокислотную последовательность SEQ ID NO: 138 и аминокислотную последовательность SEQ ID NO: 41 или 72; и
два полипептида, содержащих легкую цепь, каждый из которых включает аминокислотную последовательность SEQ ID NO: 279;
(2) два полипептида, содержащих тяжелую цепь, каждый из которых с N- до C-конца содержит аминокислотную последовательность SEQ ID NO: 285, аминокислотную последовательность SEQ ID NO: 138 и аминокислотную последовательность SEQ ID NO: 41 или 72; и
два полипептида, содержащих легкую цепь, каждый из которых включает аминокислотную последовательность SEQ ID NO: 279;
(3) полипептид, содержащий тяжелую цепь, включающий с N- до C-конца аминокислотную последовательность SEQ ID NO: 284, аминокислотную последовательность SEQ ID NO: 138 и аминокислотную последовательность SEQ ID NO: 41 или 72; и
полипептид, содержащий легкую цепь, включающий с N- до C-конца аминокислотную последовательность SEQ ID NO: 279, аминокислотную последовательность SEQ ID NO: 138 и аминокислотную последовательность SEQ ID NO: 41 или 72;
(4) полипептид, содержащий тяжелую цепь, включающий от N- до C-конца аминокислотную последовательность SEQ ID NO: 284, аминокислотную последовательность SEQ ID NO: 138 и аминокислотную последовательность SEQ ID NO: 41 или 72; и
легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 279;
(5) два полипептида, содержащих тяжелую цепь, каждый из которых с N- до С-конца включает аминокислотную последовательность SEQ ID NO: 282, аминокислотную последовательность SEQ ID NO: 138 и аминокислотную последовательность SEQ ID NO: 42 или 108; и
два полипептида, содержащих легкую цепь, каждый из которых включает аминокислотную последовательность SEQ ID NO: 279;
(6) два полипептида, содержащих тяжелую цепь, каждый из которых с N- до C-конца включает аминокислотную последовательность SEQ ID NO: 285, аминокислотную последовательность SEQ ID NO: 138 и аминокислотную последовательность SEQ ID NO: 42 или 108; и
два полипептида, содержащих легкую цепь, каждый из которых включает аминокислотную последовательность SEQ ID NO: 279;
(7) полипептид, содержащий тяжелую цепь, включающий с N- до C-конца аминокислотную последовательность SEQ ID NO: 284, аминокислотную последовательность SEQ ID NO: 138 и аминокислотную последовательность SEQ ID NO: 42 или 108; и
полипептид, содержащий легкую цепь, включающий с N- до C-конца аминокислотную последовательность SEQ ID NO: 279, аминокислотную последовательность SEQ ID NO: 138 и аминокислотную последовательность SEQ ID NO: 42 или 108; и
(8) полипептид, содержащий тяжелую цепь, включающий с N- до C-конца аминокислотную последовательность SEQ ID NO: 284, аминокислотную последовательность SEQ ID NO: 138 и аминокислотную последовательность SEQ ID NO: 42 или 108; и
легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 279.
28. Антитело или его антигенсвязывающий фрагмент, которое специфически связывается с фрагментом комплемента C3 C3d, где антитело или его антигенсвязывающий фрагмент включает:
тяжелую цепь, включающую три определяющие комплементарность области тяжелой цепи (CDR-H1, CDR-H2, CDR-H3), содержащие следующий набор аминокислотных последовательностей: SEQ ID NO: 29, 260 и 31, и
легкую цепь, включающую три определяющие комплементарность области легкой цепи (CDR-L1, CDR-L2, CDR-L3), содержащие следующий набор аминокислотных последовательностей: SEQ ID NO: 32, 33 и 34.
29. Антитело или его антигенсвязывающий фрагмент по п. 28, где
(a) тяжелая цепь включает вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 254; и
(б) легкая цепь включает вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 258.
30. Антитело или его антигенсвязывающий фрагмент по п. 29, где легкая цепь включает аминокислотную последовательность SEQ ID NO: 279.
31. Антитело или его антигенсвязывающий фрагмент по п. 30, где тяжелая цепь включает аминокислотную последовательность SEQ ID NO: 284.
32. Антитело или его антигенсвязывающий фрагмент по п. 31, где тяжелая цепь включает аминокислотную последовательность SEQ ID NO: 282.
33. Антитело или его антигенсвязывающий фрагмент по п. 31, где тяжелая цепь включает аминокислотную последовательность SEQ ID NO: 285.
34. Фармацевтическая композиция для лечения заболевания, опосредованного фрагментом комплемента C3 C3d, включающая конструкцию слитого белка по п. 1 и фармацевтически приемлемый носитель.
35. Фармацевтическая композиция для лечения заболевания, опосредованного фрагментом комплемента C3 C3d, включающая конструкцию слитого белка по п. 18 и фармацевтически приемлемый носитель.
36. Фармацевтическая композиция для лечения заболевания, опосредованного фрагментом комплемента C3 C3d, включающая конструкцию слитого белка по п. 27 и фармацевтически приемлемый носитель.
37. Конструкция слитого белка по п. 1, антитело по п. 28 или фармацевтическая композиция по п. 34, где указанный антигенсвязывающий фрагмент включает Fv, Fab, Fab', F(ab')2 или scFv.
38. Применение конструкции слитого белка по п. 1, антитела по п. 28 или фармацевтической композиции по п. 34 для производства лекарственного средства для лечения заболевания, опосредованного фрагментом комплемента C3 C3d.
39. Применение по п. 38, где:
(1) указанное комплемент-опосредованное заболевание представляет собой комплемент-опосредованное аутоиммунное заболевание, такое как ревматоидный артрит, системная красная волчанка, волчаночный нефрит или обыкновенная пузырчатка;
(2) указанное комплемент-опосредованное заболевание представляет собой комплемент-опосредованное заболевание почек, такое как мембранопролиферативный гломерулонефрит, комплемент 3 - гломерулопатия, фокально-сегментарный гломерулосклероз, гломерулонефрит, С3 гломерулонефрит (C3G), болезнь плотного осадка (БПО), мембранопролиферативный гломерулонефрит II типа (МПГН II), мембранная нефропатия (МН), IgA-нефропатия (IgAN), волчаночный нефрит (LN), гемолитико-уремический синдром (ГУС), атипичный гемолитико-уремический синдром (аГУС) или диабетическая ретинопатия;
(3) указанное комплемент-опосредованное заболевание представляет собой комплемент-опосредованное сердечно-сосудистое заболевание, такое как атеросклероз или тромбоз;
(4) указанное комплемент-опосредованное заболевание представляет собой комплемент-опосредованное дерматологическое заболевание такое как псориаз, инверсное акне, красную волчанку, кожный васкулит мелких сосудов, крапивницу, уртикарный васкулит, эндемическая пузырчатка, красная пузырчатка, обыкновенная пузырчатка или буллезный пемфигоид;
(5) указанное комплемент-опосредованное заболевание выбрано из группы, состоящей из следующего: ишемически-реперфузионное повреждение, псориатический артрит, ревматоидный артрит (РА), дискоидная волчанка, волчаночный нефрит, ишемически-реперфузионное повреждение, атипичный гемолитико-уремический синдром (аГУС), типичный или инфекционный гемолитико-уремический синдром (тГУС), болезнь плотного осадка (БПО), пароксизмальная ночная гемоглобинурия (ПНГ), макулярная дегенерация, глаукома, увеит, синдром гемолиза, повышения печеночных ферментов и низких тромбоцитов (HELLP), сепсис, дерматомиозит, диабетическая ретинопатия, тромботическая тромбоцитопеническая пурпура (ТТП), спонтанная угроза выкидыша, pauci – иммунный васкулит, буллезный эпидермолиз, повторная угроза выкидыша, боковой амиотрофический склероз (БАС), рассеянный склероз (РС), черепно-мозговая травма, повреждение спинного мозга, сердечно-сосудистое заболевание, миокардит, нарушение мозгового кровообращения, нарушение со стороны периферических сосудов, реноваскулярное заболевание, нарушение сосудистого генеза брыжейки/кишечника, реваскуляризация трансплантатов и/или приживленных органов, васкулит, ассоциированный с антинейтрофильными цитоплазматическами антителами (АНЦА), васкулит (ААВ), нефрит при пурпуре Шенлейна–Геноха, системная волчанка, васкулит, связанный с системной красной волчанкой, васкулит, связанный с ревматоидным артритом, геморрагический васкулит, болезнь Такаясу, синдром капиллярной утечки, дилатационная кардиомиопатия, диабетическая ангиопатия, аневризм торако-абдоминальной аорты, синдром Кавасаки (артериит), венозная газовая эмболия (ВГЭ) и рестеноз после установки стента, ротационной атерэктомии, чрескожной транслюминальной коронарной ангиопластики (ЧТКА), миастения гравис, болезнь холодовых агглютининов (БХА), пароксизмальная холодовая гемоглобинурия (ПХГ), дерматомиозит, склеродермия, сердечная аутоиммунная гемолитическая анемия, болезнь Грейвса, тиреоидит Хашимото, сахарный диабет I типа, псориаз, атопический дерматит, гнездная алопеция, гнойный гидраденит, витилиго, заболевания пародонта, пузырчатка, аутоиммунная гемолитическая анемия (АИГА), идиопатическая тромбоцитопеническая пурпура (ИТП), синдром Гудпасчера, антифосфолипидный синдром (АФС), синдром Дегоса, катастрофический антифосфолипидный синдром (КАФС), возрастная макулярная дегенерация (ВМД), мембранопролиферативный гломерулонефрит II типа (МПГН II), гемолитико-уремический синдром (ГУС), астма, амилоидоз, нейромиелит зрительного нерва (НЗН), тромботическая микроангиопатия, наследственный ангионевротический отек (НАЕ), остеоартрит, перелом, остеомиелит, географическая атрофия, операция на сердце и легких, регенерация сердца, рак легкого, нейродегенерация, шизофрения, большое депрессивное расстройство, биполярное расстройство, кожный васкулит или тромботическая тромбоцитопеническая пурпура;
(6) указанное комплемент-опосредованное заболевание представляет собой ассоциированное с друзами заболевание или связанное с друзами заболевание, такое как амилоидоз, эластоз, болезнь плотного осадка, гломерулонефрит, атеросклероз или ассоциированное с друзами глаз заболевание; или
(7) указанное комплемент-опосредованное заболевание характеризуется повышенным отложением реакционноспособного с антителом к C2 фосфолипида.
40. Применение конструкции слитого белка по п. 1, антитела по п. 28 или фармацевтической композиции по п. 34 для производства лекарственного средства для лечения воспаления, опосредованного фрагментом комплемента C3 C3d.
41. Применение по п. 40, где:
(1) указанное комплемент-опосредованное воспаление включает воспалительное фиброзное заболевание, которое необязательно включает фокально-сегментарный гломерулосклероз, первичный склерозирующий холангит или мембранопролиферативный гломерулонефрит;
(2) указанное комплемент-опосредованное воспаление связано с патологическим состоянием или заболеванием, выбранным из группы, состоящей из следующего: ишемически-реперфузионное повреждение, ожоговое поражение, эндотоксемия и септический шок, респираторный дистресс-синдром взрослых, искусственное кровообращение, гемодиализ, анафилактический шок, астма, ангионевротический отек, болезнь Крона, серповидноклеточная анемия, гломерулонефрит, мембранозный нефрит, панкреатит, отторжение трансплантата, сверхострое отторжение ксенотрансплантата, повторная угроза выкидыша, преэклампсия, лекарственная аллергия, индуцированный ИЛ-2 синдром транссудации, аллергия на рентгеноконтрастное вещество, миастения, болезнь Альцгеймера, рассеянный склероз, ревматоидный артрит, системная красная волчанка, инсулинозависимый сахарный диабет, острый диссеминированный энцефаломиелит, болезнь Аддисона, синдром антифосфолипидных антител, аутоиммунный гепатит, синдром Гудпасчера, болезнь Грейвса, синдром Гийена-Барре, болезнь Хашимото, идиопатическая тромбоцитопеническая пурпура, пузырчатка, синдром Шегрена, синдром Такаясу, инфаркт миокарда, инсульт, острый респираторный дистресс-синдром, сепсис, плазмаферез, тромбоцитферез, лейкоферез, экстракорпоральная мембранная оксигенация, гепарин-индуцированная экстракорпоральная преципитация ЛПНП, воспаление кишечника, крапивница, васкулит и волчаночный нефрит.
42. Применение конструкции слитого белка по п. 1, антитела по п. 28 или фармацевтической композиции по п. 34 для лечения заболевания, опосредованного фрагментом комплемента C3 C3d.
43. Применение конструкции слитого белка по п. 1, антитела по п. 28 или фармацевтической композиции по п. 34 для лечения воспаления, опосредованного фрагментом комплемента C3 C3d.
| WO 2014028865 A1, 20.02.2014 | |||
| MASHA FRIDKIS-HARELI et al., Design and development of TT30, a novel C3d-targeted C3/C5 convertase inhibitor for treatment of human complement alternative pathway-mediated diseases, Blood, 2011;118(17):4705-4713 | |||
| JOSHUA M | |||
| THURMAN et al., Detection of complement activation using monoclonal antibodies against C3d, J |
Авторы
Даты
2024-08-07—Публикация
2019-12-11—Подача