Изобретение относится к медицине, а именно к микробиологии, и может быть использовано для эпидемиологического надзора за объектами внешней среды и лабораторной диагностики легионеллеза.
Симптомы или сочетания симптомов, которые были бы специфичны исключительно для болезней легионеров, неизвестны. Правильный диагноз необходим для эффективного лечения и изучения легионеллезных вспышек. Важное значение имеет профилактический, эпидемиологический контроль за объектами внешней среды (водоисточники, кондиционеры) с целью обнаружения и идентифицирования легионелл в водной среде. Это представляет основную проблему в профилактике легионеллеза, так как источником инфицирования является вода, используемая для кондиционеров промышленных и бытовых объектов. Поскольку лабораторные критерии идентификации легионелл во внешней среде являются основной частью определения случая болезни, метод лабораторной идентификации легионелл заслуживает особого внимания. Чувствительность культуральных методов выделения легионелл из материала, полученного из органов дыхания и объектов внешней среды, значительно возросла после создания агара с рыбокостным гидролизатом с добавлением стимуляторов роста легионелл (1), который может быть использован также в качестве полуселективной среды в случае добавления полимиксина В и апизомицина (1). При наличии в материале большого количества контаминирующих микроорганизмов значительно затрудняется выделение изолятов и довольно много времени (до 4-5 сут) тратится на культивирование легионелл. В настоящее время по-прежнему чаще всего применяются иммунохимические методы для идентификации легионеллеза в клиническом материале и в объектах внешней среды. Конструирование таких систем включает создание диагностикумов.
Известен иммуноферментный анализ легионелл (ИФА), который утвержден только для идентификации Legionella Pneumophila серогруппы 1(2). Недостатком его является нестандартность и трудоемкость выполнения анализа. Получение такого диагностикума во многом зависит от качества конъюгата (специфические иммуноглобулины с пероксидазой хрена). Следует отметить, что постановка данной реакции затруднительна из-за большого количества дополнительных реагентов (чаще всего импортных), времени постановки (24 ч) и наличия высококвалифицированного персонала.
Известна тест-система для идентификации легионелл в реакции прямой иммунофлюоресценции (3). Количество микроорганизмов L. pneumophila в прямой иммунофлюоресценции, определяемое как 25 в поле зрения, дает основание считать результаты реакции положительными. Такого рода препараты представляют собой специфические иммуноглобулины, полученные к целой клетке Legionella pneumophila с меченными флюоресцинизоцианатом натрия (ФИТЦ). Результаты этой реакции учитываются только при люминисцентной микроскопии. Способ приготовления такого диагностикума включает следующие этапы.
1. Приготовление специфической антисыворотки L. pneumophila с ФИТЦ. Реакционную смесь инкубируют 1 ч при 27oC и затем центрифугируют 30 мин 1500g.
2. Очистка конъюгационной смеси от не связавшихся иммуноглобулинов и ФИТЦ с помощью гель-фильтрации на Сефадексе G-25.
Недостатком описанного диагностикума является его низкая специфичность, обусловленная тем, что иммуноглобулины получены к целой клетке легионелл, на наружной мембране которой находятся антигенные эпитопы, общие с антигенными эпитопами других микроорганизмов, таких как: F. tularensis, М. pneumophila, Str. pneumoniae, Н. influenzae. Кроме того, данный диагностикум обладает низкой чувствительностью из-за высокой аутофлюоресценции тканей в клиническом материале и в образцах внешней среды, такие микроорганизмы, как стафилококки, пневмококки и стрептококки дают неспецифическую флюоресценцию.
Недостатками диагностикума для прямой иммунофлюоресценции является также большое количество времени, необходимое для постановки реакции и трудности при стандартизации диагностических препаратов.
Задача изобретения - повысить специфичность, чувствительность, стандартность диагностикума и уменьшить трудоемкость при его использовании.
Для этого легионеллезный диагностикум содержит носитель и сенситин, в качестве носителя - окрашенный синим антрахиноновым жирорастворимый полистирольный латекс с активированными аминогруппами с размером частиц 0,804 мкм, с коэффициентом вариации 4,1-4,5% и коэффициентом дисперсии 1,003-1,006 и концентрацией аминогрупп 2,5•(104-105)моль/г, в качестве сенситина - специфические иммуноглобулины кролика к группоспецифическому белковому антигену внешних мембран L. pneumophila с мол. м. 45 kD.
Приготовление диагностикума проводят путем предварительной отмывки носителя, сенсибилизации, при этом латекс нагружают путем ковалентного связывания, причем предварительно отмытые частицы полистирольного латекса сшивают в концентрации 1% с раствором специфических иммуноглобулинов, реагирующих в реакции диффузной преципитации (РДП), с белковым антигеном с мол. м. 45 kD в разведении 1: 128, и перед повторной отмывкой его обрабатывают глициновым буфером при pH 8.2 для инактивации оставшихся аминогрупп, затем проводят повторную отмывку.
Получение специфических иммуноглобулинов к группоспецифическому белковому антигену внешних мембран L. pneumophila с мол.м. 45 kD.
1. Ферментация культуры L. pneumophila.
Рабочую культуру легионелл размораживают при комнатной температуре и засевают чашки Петри с твердой питательной средой. Выращивают при температуре (37±0,5)oC в течение 3 сут. Биомассу легионелл (объем 1500 см3) инкубируют со 100 см3, 0,5 мг/см3 формалина в течение 1 ч.
2. Осаждение биомассы.
Осаждение биомассы проводят на центрифуге при 10000 g в течение 10 мин при комнатной температуре. Отмывку биомассы проводят в физиологическом растворе pH 7,2 при 10000 g в течение 5 мин. Выход - 10 г сырой вес биомассы (из объема 1500 см3).
3. Разрушение биомассы.
10 г биомассы суспендируют в 2000 см3 буферного раствора (ТРИС-10 мг/см3 сернокислый магний - 10 мг/см3, pH 7,6). Порциями по 200 см3 суспензию обрабатывают с помощью ультразвукового дезинтегратора мощностью 60 Вт, пятикратно по 1 мин с интервалом по 2 мин. Осаждение неразрушенных клеток проводят путем центрифугирования при 10000 g в течение 10 мин при комнатной температуре. Дезинтеграт подвергают ультрафильтрации под давлением азота в ячейках объемом 1000 см3 до конечного объема 200 см3. Концентрат разводят буфером (ТРИС-10 мг/см3, сернокислый магний - 10 мг/см3, Тритон Х-100-4%, pH 7.6) до объема 400 см3. Инкубируют 1 г при комнатной температуре с перемешиванием. Суспензию мембран осаждают центрифугированием при 50000 g в течение 1 ч при комнатной температуре. Выход фракции внешних мембран - 1 г влажного осадка.
4. Выделение белковой фракции с мол. массой 45 kD.
Фракцию внешних мембран суспендируют в 100 см3 буфера (ТРИС HCL-50 мМ, Тритон Х-100-0,1%, pH 7,6) и инкубируют при температуре +10oC с перемешиванием. Осаждение внешних мембран проводят центрифугированием при 50000 g в течение 1 часа. Выход - 200 мг белка в 100 мл буфера. Комплекс белков внешних мембран фракционируют на ДЕАЕ-сефарозе. Элюцию проводят линейным градиентом 0,5%-1,5%, 0,9% раствора NaCl. Первая фракция содержит 20 мг белка с мол. массой 45 kD.
5. Иммунизация кроликов группоспецифическим белковым антигеном внешних мембран L. pneumophila с мол. массой 45 kD.
Для иммунизации берут кроликов весом 2,5-3 кг (пол безразличен). В качестве антигена используют белок с мол. массой 45 kD в концентрации 2,5 мг на 1 мл в физиологическом растворе pH 7,2.
Схема иммунизации. Первая иммунизация - в подушечки задних лап кролика подкожно вводят белковый антиген в объеме 1 см3 полного адъюванта Фрейда ("Difco" США).
Вторую, третью, четвертую иммунизации проводят внутривенно (в правую вену уха кролика) белковым антигеном в объеме 1 см3 с интервалом в два дня. После четвертой иммунизации через семь дней берут из вены правого уха кровь для выделения иммуноглобулинов.
6. Выделение специфических иммуноглобулинов.
Кровь объемом 100 см3 инкубируют при t - +4oC 18 ч. Отбирают надосадочную жидкость (сыворотка) объемом 40 см3 и добавляют 40% насыщенный раствор сульфата аммония pH 7,4 объемом 20 см3 при постоянном перемешивании. Инкубируют при t - 0 oC 18 ч. После инкубации осаждают иммуноглобулины центрифугированием 10000 g в течение 5 мин. Образовавшийся осадок растворяют в 2 см3 дистиллированной воды и проводят диализ против 400 см3 физиологического раствора pH 7,2 в течение 3 ч.
Иммуноглобулины должны соответствовать следующим требованиям:
pH белкового раствора 7,0-7,2
реакция диффузной преципитации-одна линия преципитации в разведении
1:128 с белковым антигеном внешних мембран L. pneumophila с мол. мас. 45 kD.
Диагностикум готовится следующим образом.
1. 2 мл 1%-ной взвеси латексных частиц отмывают ЗФР pH 8,0 два раза, осадок латекса центрифугируют в течение 20 мин при 4000 g.
2. К 2 мл 1%-ной взвеси латекса добавляют 2 мл специфических иммуноглобулинов, реагирующих в РДП в разведении 1:128, после чего получается 4 мл 0,5%-ной взвеси латекса в растворе иммуноглобулинов с титром в РДП 1:64, которую инкубируют в течение 2 ч в термостате при 37oC.
3. После инкубации частицы латекса центрифугируют в течение 20 мин при 4000 g.
4. К осадку латекса добавляют 2 мл глицинового буфера pH 8,2 для блокирования оставшихся связей на частицах латекса. Инкубация латекса в глициновом буфере длится 1 ч в термостате при 37oC.
5. После инкубации латекс центрифугируют в течение 30 мин при 600 g и отмывают фосфатным буфером pH 8,0. После этого готовят конечную концентрацию латекса 0,5% (4 мл). Хранят при 4oC с добавлением азида натрия.
Пример использования.
Приготовлено три вида диагностикумов.
1. Диагностикум для реакции прямой иммунофлюоресценции на основе специфических иммуноглобулинов к целым бактериальным клеткам L. pneumophila (прототип).
2. Латексный диагностикум на основе специфических иммуноглобулинов к целым бактериальным клеткам L. pneumophila.
3. Латексный диагностикум на основе специфических иммуноглобулинов к поверхностному белковому антигену L. pneumophila с мол. массой 45 kD.
Первый тип диагностикума исследован в реакции прямой иммунофлюоресценции, а латексные диагностикумы в реакции латекс-агглютинациисо стандартной живой культурой L. pneumophila, Philodelphia 1(1 серогруппа).
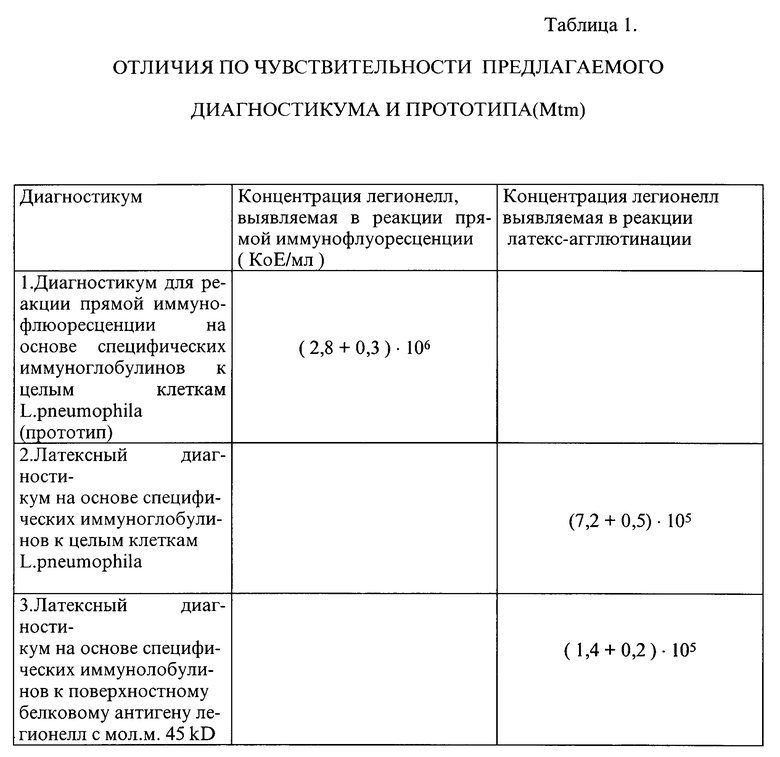
Прототип диагностикума давал положительную реакцию с данной культурой в концентрации 2,8•106 KoE/мл, второй тип диагностикума -7,2•105 KoE/мл, третий -1,4•105 KoE/мл. Это указывает на более высокую чувствительность латексного диагностикума, приготовленного на основе специфических иммуноглобулинов к поверхностному антигену с мол. массой 45 kD.
Результаты опыта приведены в таблице 1.
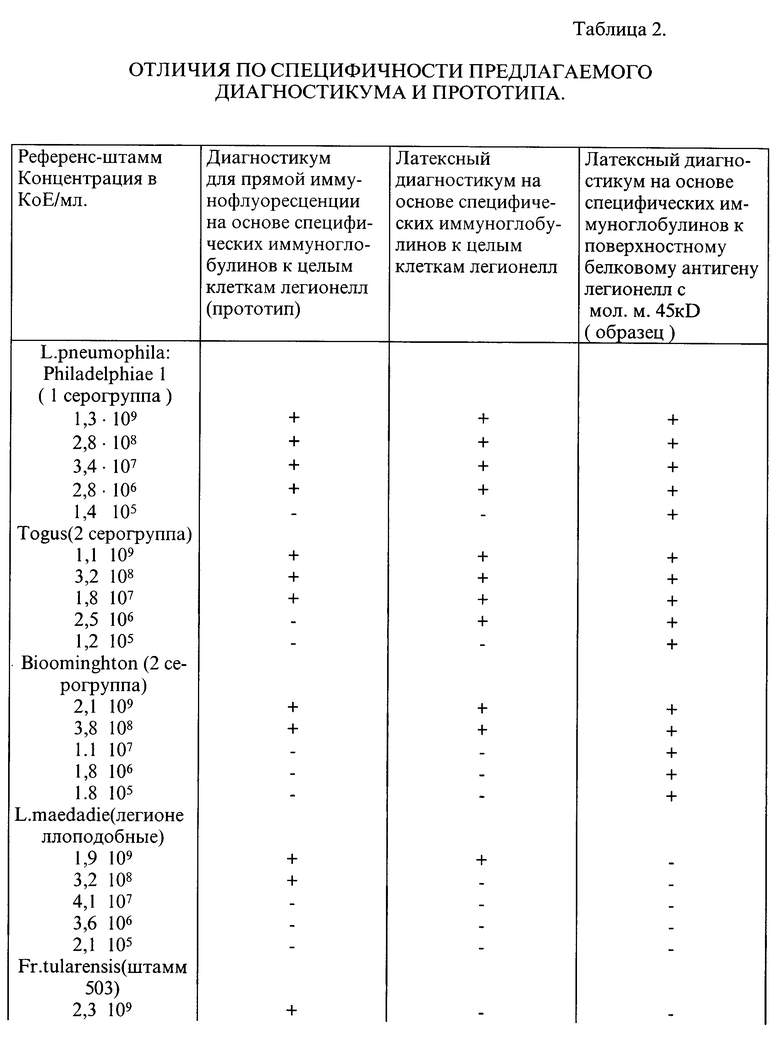
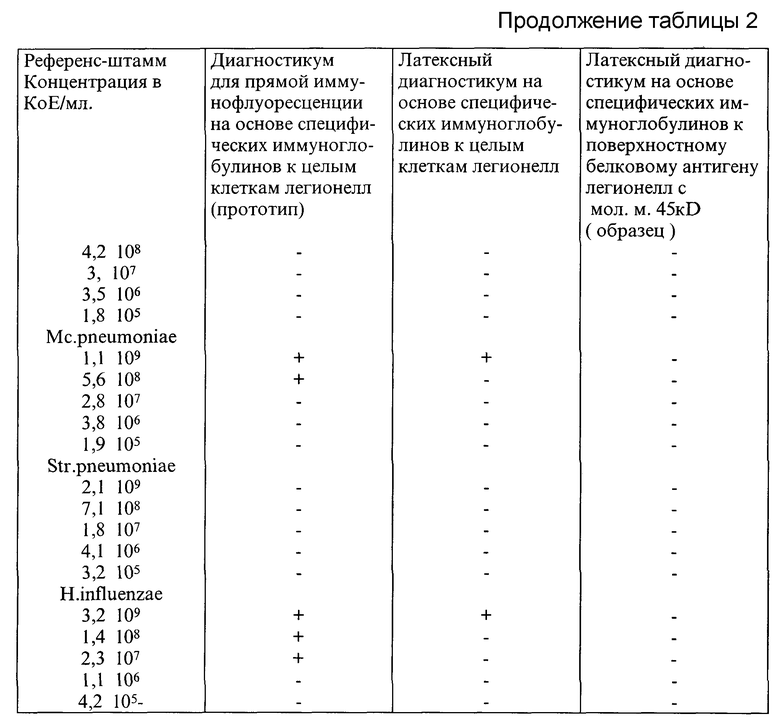
На следующем этапе была исследована специфичность диагностикумов в реакции прямой иммунофлюоресценции и реакции латекс-агглютинации. С этой целью раститровали референс-штаммы L. pneumophila, Philadelphia 1 (1 серогруппа), Togus (серогруппа 2), Bloominghton (серогруппа 3), L. maсdadia, Fr. tularensis, штамм 503. Mc. pneumoniae, Str. pneumoniae, H. influenzae тип b до концентрации 105 KoE/мл. Из каждого разведения на предметное стекло внесли стандартное количество микроорганизмов в объеме 0,02 мл, а затем к каждому объему микроорганизмов добавляли соответствующий диагностикум в объеме 0,02 мл. После 5 мин инкубации в термостате учитывали реакцию по образованию видимого агглютината, а в реакции прямой иммунофлюоресценции учитывали реакцию при наличии в поле зрения 25 флюоресцирующих микроорганизмов. Результаты опыта приведены в таблице 2.
Из приведенных данных следует, что латексный диагностикум на основе специфических иммуноглобулинов к поверхностному белковому антигену с мол. массой 45 kD образует агглютинаты только с культурой L. pneumophila, а диагностикум для реакции прямой иммунофлюоресценции реагирует с другими микроорганизмами.
Таким образом, показано, что специфические иммуноглобулины к поверхностному белковому антигену с мол. массой 45 kD являются оптимальным сенситином для нагрузки носителя
Источники информации, принятые во внимание при экспертизе.
1. Авторское свидетельство СССР N 1614494, 1990 г.
2. Control of legionellosis. Proposals for statutory action. London, Health and Safety Commussion, 1989 г.
3. Эпидемиология, профилактика легионеллеза и борьба с ним: Меморандум совещания ВОЗ-Бюллетень ВОЗ, т. 68, N 2, 1990, с. 7.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДИАГНОСТИКУМ ЛЕГИОНЕЛЛЕЗНЫЙ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1995 |
|
RU2124208C1 |
| ДИАГНОСТИКУМ ДЛЯ ИДЕНТИФИКАЦИИ ESCHERICHIA COLI O157 : H7 И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2001 |
|
RU2189253C1 |
| НАБОР ДЛЯ ИДЕНТИФИКАЦИИ ЭНТЕРОГЕМОРРАГИЧЕСКИХ ESCHERIHIA COLI | 2003 |
|
RU2270253C2 |
| Штамм гибридных культивируемых клеток животных Mus musculus 1F11PAL - продуцент мышиных моноклональных антител, специфичных к пептидогликан-ассоциированному липопротеину (PAL) Legionella pneumophila | 2018 |
|
RU2699983C1 |
| СПОСОБ КОНСТРУИРОВАНИЯ ПОЛИМЕРНОГО ИММУНОГЛОБУЛИНОВОГО ДИАГНОСТИКУМА ДЛЯ ВЫЯВЛЕНИЯ Legionella pneumophila 1,3 И 6 СЕРОГРУПП (ВАРИАНТЫ) | 2012 |
|
RU2505819C1 |
| ДИАГНОСТИКУМ ДЛЯ ОПРЕДЕЛЕНИЯ ПАПРИНА И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 1991 |
|
RU2008020C1 |
| МАРКЕР ДЛЯ ИММУНОХИМИЧЕСКОГО И ГИБРИДИЗАЦИОННОГО АНАЛИЗА | 1997 |
|
RU2133469C1 |
| Способ получения монодисперсных полимерных микросфер с альдегидными группами | 2020 |
|
RU2751881C1 |
| СПОСОБ ЭКСПРЕСС-ДИАГНОСТИКИ ТУБЕРКУЛЕЗА НА ОСНОВЕ РЕАКЦИИ ЛАТЕКС-АГГЛЮТИНАЦИИ | 1998 |
|
RU2130615C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS 13F8 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К КАПСУЛЬНОМУ F1 АНТИГЕНУ YERSINIA PESTIS | 2011 |
|
RU2460788C1 |
Изобретение относится к медицине, а именно к микробиологии, и может быть использовано для эпидемиологического надзора за объектами внешней среды и для лабораторной диагностики легионеллеза. Диагностикум содержит сенситин и дополнительно носитель. Носитель представляет собой окрашенный синим атрахиноновым полистирольный латекс с активированными аминогруппами. Указанный полистирольный латекс характеризуется размером частиц 0,804 мкм, коэффициентом вариации 4,1-4,5%%, коэффициентом дисперсии 1,003 - 1,006 и концентрацией аминогрупп 2,5•(104 - 105) моль/г. В качестве сенситина диагностикум содержит специфический кроличий иммуноглобулин к группоспецифическому поверхностному белковому антигену Legionella pneumophila, имеющему мол. м. 45 кД. Для получения диагностикума 1%-ную взвесь предварительно отмытых частиц указанного полистирольного латекса инкубируют с указанным специфическим кроличьим иммуноглобулином с титром разведения 1: 128. Инкубирование осуществляют при объемном соотношении перечисленных компонентов 1: 1. После инкубирования с последующей отмывкой осадок частиц латекса, ковалентно связанных со специфическим кроличьим иммуноглобулином, инкубируют с глициновым буфером при рН 8,2. Повторно отмывают и получают диагностикум в виде 0,5%-ной взвеси частиц латекса, ковалентно связанных с сенситином. Диагностикум обладает высокой специфичностью, чувствительностью и позволяет снизить трудозатраты при его использовании. 2 табл.
| Эпидемиология, профилактика легионеллеза и борьба с ним, Меморандум совещания ВОЗ, Бюллетень ВОЗ, 1990, vol | |||
| Способ получения смеси хлоргидратов опийных алкалоидов (пантопона) из опийных вытяжек с любым содержанием морфия | 1921 |
|
SU68A1 |
| Пожарный двухцилиндровый насос | 0 |
|
SU90A1 |
| Пожарный двухцилиндровый насос | 0 |
|
SU90A1 |
| US 5108745 А, 28.04.92 | |||
| Замкнутый регистр сдвига на магнитных элементах с прямоугольной петлей гистерезиса | 1958 |
|
SU119893A2 |
| US 4851333 А, 25.07.89 | |||
| US 4780407 А, 25.10.88 | |||
| US 5248594 А, 28.09.93 | |||
| Воспаление | |||
| Руководство для врачей/Под ред | |||
| В.В.Серова | |||
| - М.: Медицина, 25.08.95, с.384. | |||
Авторы
Даты
1999-04-20—Публикация
1995-11-23—Подача