Изобретение относится к медицинской и ветеринарной микробиологии, в частности к получению диагностических препаратов, используемых для эпидемиологического надзора и для лабораторной диагностики эшерихиозов, вызываемых энтерогеморрагическими Escherichia coli.
Энтерогеморрагические эшерихии (E.coli O157:Н7; Е coli O26:Н11; Е coli O55:Н7; Е coli O111:Н8; Е coli O113:Н21; Е coli O117:Н14) вызывают у человека тяжелое поражение толстого кишечника - геморрагический колит, а также поражение почек (гемолитико-уремический синдром), обусловленное синтезом вышеуказанными бактериями токсинов Stx 1 и Stx 2 (1).
Проблема инфекций энтерогеморрагических эшерихий в настоящее время приобрела интернациональный характер. Ее решение в значительной мере зависит от налаженной диагностики болезни, идентификации возбудителей, а также эффективности противоэпидемических мероприятий. В этом плане Российская Федерация существенно отстает от мирового сообщества. В России отсутствуют коммерческие препараты для диагностики энтерогеморрагических эшерихий, в силу чего на сегодня нет данных по эпидемиологии и эпизоотологии этого возбудителя в нашей стране. Совершенно очевидно, что для изучения эпидемиологической значимости энтерогеморрагических эшерихий, путей их распространения, диагностики вызываемого ими заболевания, вопрос совершенствования средств идентификации этих возбудителей чрезвычайно актуален.
Известна питательная среда с добавлением сорбитола (2), которая может быть использована в качестве полуселективной среды для выделения энтерогеморрагических эшерихий из клинического материала и продуктов питания.
Однако при контаминации образцов клинического материала или пищевых продуктов другими микроорганизмами процесс выделения чистых культур энтерогеморрагических E.coli значительно затрудняется и удлиняется по времени (до 3-х - 4-х суток). Выделенные таким методом культуры E.coli невозможно идентифицировать по их способности синтезировать токсины Stx 1 и Six 2.
Известны диагностикумы для идентификации одного из представителей энтерогеморрагических эшерихий E.coli О157:H7 в реакции латекс-агглютинации (3, 4).
Недостатками этих диагностикумов является низкая чувствительность из-за неспецифической сенсибилизации латексных частиц иммуноглобулинами. Возможна идентификация только антигенов O157 и Н7. Нельзя обеспечить идентификацию штаммов по экспрессии токсинов Stx 1 и Stx 2.
В настоящее время для выявления шигатоксин продуцирующих энтерогемморра-гических E.coli (STEC) в пищевых продуктах, клиническом материале и фекальных массах животных-носителей, используются различные тест-системы, принципиально основанные на идентификации бактерий либо по фенотипу, либо по генотипу. К ним относятся, соответственно, латексные иммуномагнитные тест-системы и ПЦР тест-системы.
Для идентификации E.coli O157:H7 по генотипу (наличие генов stx 1 и stx 2) применяются ПЦР тест-системы (5, 6). Наличие в клинических образцах и пищевых продуктах различных ингибирующих факторов (ингибирование taq полимеразы) затрудняет использовать эти тест-системы непосредственно для идентификации E.coli O157:H7 в испытуемых образцах.
Наиболее близкой к предлагаемому изобретению является иммуномагнитная разделительная тест-система для идентификации E.coli О157:H7, выпускаемая фирмой Dynal, Норвегия (7). Однако эта тест-система предназначена только для выделения E.coli O157:Н7 с использованием бактериологического метода (латексные частицы с сорбированными бактериями высеваются на питательные среды). Для получения окончательного результата требуется 20-24 часа. Тест-система предназначена только для идентификации E.coli O157:Н7 по фенотипическим признакам.
Задача настоящего изобретения - разработать комплексную тест-систему, которая позволит идентифицировать энтерогеморрагические эшерихии (STEC) серотипов O157:Н7; O26:H11; O55:Н7; O111:Н8; O113:Н2; O117:Н14, продуцирущие токсины Stx 1 и Stx 2, обеспечить стандартность операций и снизить сроки и трудоемкость их выполнения.
Поставленная задача решается тем, что предложен набор для идентификации энтерогеморагичсских Escherihia coli, состоящий из иммуномагнитной разделительной тест-системы, которая содержит магнитный латекс, ковалентно связанный с белком А, который ковалентно связан со специфическим кроличьим иммуноглобулином к полисахаридной фракции липополисахарида O157, O26, O55, O111, O113, O117 соответственно, с образованием шести групп 0,5% взвеси магнитного латекса, тест-системы для постановки мультиплексной полимеразной цепной реакции (ПЦР), содержащей буфер со специфическими праймерами для идентификации генов stx 1, stx 2, rfb, fliC энтерогоморагических E.coli и контрольные суспензии бактерий.
Иммуномагнитную разделительную тест-систему для идентификации энтерогеморрагичсских E.coli получают в два этапа:
1 этап - сенсибилизируют магнитные частицы латекса белком А в концентрации 40 мкг/мл при их соотношении 1:1;
2 этап - полученные частицы с этапа 1 отмывают и инкубируют со специфическими кроличьими иммуноглобулинами к полисахаридным фракциям липополисахаридов O157, O26, O55, O111, O113, O117, белковым жгутиковым антигенам Н7, Н11, Н8, Н21, H14 в концентрации 110 и 190 мкг/мл, соответственно, при их объемном соотношениии 1:1, с последующей отмывкой осадка. Таким образом, получают шесть групп взвеси магнитного латекса:
1-ая группа магнитных латексных частиц - магнитные латексные частицы, сенсибилизированные белком А, затем сенсибилизированные полисахаридной фракцией липополисахарида O157 и белковым жгутиковым антигеном Н7;
2-ая группа магнитных латексных частиц - магнитные латексные частицы, сенсибилизированные белком А, затем сенсибилизированные полисахаридной фракцией липополисахарида O26 и белковым жгутиковым антигеном Н11;
3-ая группа магнитных латексных частиц - магнитные латексные частицы, сенсибилизированные белком А, затем сенсибилизированные полисахаридной фракцией липополисахарида O55 и белковым жгутиковым антигеном Н7;
4-ая группа магнитных латексных частиц - магнитные латексные частицы, сенсибилизированные белком А, затем сенсибилизированные полисахаридной фракцией липополисахарида O111 и белковым жгутиковым антигеном Н8;
5-ая группа магнитных латексных частиц - магнитные латексные частицы, сенсибилизированные белком А, затем сенсибилизированные полисахаридной фракцией липополисахарида O113 и белковым жгутиковым антигеном Н21;
6-ая группа магнитных латексных частиц - магнитные латексные частицы, сенсибилизированные белком А, затем сенсибилизированные полисахаридной фракцией липополисахарида O117 и белковым жгутиковым антигеном Н14.
Затем частицы латекса, ковалентно связанные через белок А со специфическими кроличьими иммуноглобулинами, инкубируют с глициновым буфером при рН 8,2, отмывают и получают тест-систему в виде 0,5% взвеси частиц магнитного латекса.
Тест-система для постановки мультиплексной полимеразной цепной реакции (ПЦР) представляет раствор "мастер-микс", содержащий все необходимые для реакции ингредиенты: 20 мМ ТРИС-кальциевый буфер рН 8,4; трифосфаты dATP; dGTP; dCTP; dTTP; фермент Taq-полимеразу и праймеры. Праймеры представляют собой синтезированные последовательности нуклеотидов:
Rfb for 5'-CAGGTGAAGGTGGAATGGTTG-3'
Rfb rev 5'-GAGTACATTGGCATGGTGTGG-3'
stx 2 for 5'-ATCAGCAATGTGCTTCCGGAG-3'
stx 2 rev 5'-CTGAGCACTTTGCAGTAACGG-3'
Праймеры для детекции гена stx 1 разработаны согласно нуклеотидной последовательности, опубликованной Calderwood S.B. Праймеры на fliC ген рассчитаны по нуклеотидной последовательности генов, ответственных за синтез жгутиковых антигенов (флагеллинов).
Изобретение иллюстрируется следующими примерами.
Получение специфических иммуноглобулинов к полисахаридным фракциям ЛПС O157, O26, O55, O111, O113, O117 и белковым жгутиковым антигенам Н7, Н11, Н8, Н21, Н14.
1. Ферментация культур E.coli O157:Н7, O26:Н11, O55:Н7, O111:Н8, O113:Н21, O117:Н14.
Рабочие культуры эшерихий размораживают при комнатной температуре и засевают чашки Петри с твердой питательной средой. Культивируют при температуре 37°С в течение 24 ч. Полученную биомассу эшерихий (объем каждой культуры 1500 см3) инкубируют со 100 см3 0,5 мг/см3 формалина в течение 1 ч.
2. Осаждение биомассы.
Осаждение биомассы осуществляют центрифугированием при 10000g в течение 10 мин при 18-20°С. Отмывку биомассы проводят в физиологическом растворе рН 7,8, центрифугируя при 10000g в течение 5 мин. Выход биомассы по сухому весу - 10 г на 1500 см3.
3. Разрушение биомассы.
10 г биомассы суспендируют в 2000 см3 буферного раствора (ТРИС-10 мг/см3; сернокислый магний - 10 мг/см3, рН 7,6). Порциями по 200 см3 суспензию обрабатывают с помощью ультразвукового дизинтегратора мощностью 60 Вт пятикратно по 1 мин, делая интервалы по 2 мин. Осаждениие не разрушенных клеток производят путем центрифугирования при 10000g в течение 10 мин при 18-20°С. Дезинтеграт подвергают ультрафильтрации под давлением азота в ячейках объемом 1000 см3 до конечного объема 200 см3. Концентрат разводят буфером (ТРИС-10 мг/см3, сернокислый магний - 10 мг/см3, тритон Х-100 4%, рН 7,8) до объема 400 см3 и инкубируют 1 г биомассы при комнатной температуре с периодическим перемешиванием. Суспензию мембран осаждают центрифугированием при 10000g в течение 1 ч при 4±0,5°С. Выход фракции внешних мембран - 1 г влажного осадка.
4. Выделение полисахаридных фракций ЛПС O157, O26, O55, O111, O113, O117.
Каждую фракцию внешних мембран суспендируют в 100 см3 буфера (ТРИС HCL - 50 мМ, ЭДТА - 0,1 мМ, рН 7,2) и инкубируют в течение 24 ч при 4±0,5°С при перемешивании. Осаждение ЛПС осуществляют путем ультрацентрифугирования при 105000g в течение 3 ч. Полисахаридную фракцию ЛПС готовят путем кипячения 1 мг/см3 ЛПС в 1,5% растворе уксусной кислоты в течение 2 ч. Осажденную фракцию липида удаляют ценрифугированием при 400g. Полисахаридная фракция находится в надосадочной жидкости, ее выход - 5 мг. Полисахаридные антигены должны соответствовать следующим требованиям:
- рН полисахаридного раствора - 7,2-7,8;
- при электрофорезе в полисахаридном геле - одна линия, соответствующая полисахариду с мол. массой 29 кД;
- в реакции диффузной преципитации с поливалентной кроличьей сывороткой - одна линия.
5. Иммунизация кроликов целыми клетками E.coli серотипов: O157:Н7; O26:Н11; O55:Н7; O111:Н8; O113:Н21; O117:Н14.
Для иммунизации берут кроликов весом 2,5-3 кг (пол безразличен). В качестве антигенов используют клетки выше переписанных серогрупп в концентрации 109 м.кл/мл. на 1 см3 в физиологическом растворе рН 7,2.
Схема иммунизации.
При первой иммунизации в подушечки задних лап кроликов подкожно вводят суспензию бактерий в объеме 1 см3 полного адъюванта Фрейнда ("Difco", США). Вторую, третью, четвертую иммунизации проводят с интервалом в два дня. В краевую вену уха кролика вводят суспензию бактерий в объеме 1 см3.Через семь дней после четвертой иммунизации производят забор крови из краевой вены уха с целью выделения иммуноглобулинов.
6. Иммунизация кроликов полисахаридными фракциями ЛПС O157, O26, O55, O111, O113, O117.
Для иммунизации берут кроликов весом 2,5-3 кг (пол безразличен). В качестве антигенов используют полисахаридные фракции ЛПС O157, O26, O55, O111, O113, O117, в концентрации 1,5-2,0 мг на 1 см3 в физиологическом растворе рН 7,2.
Схема иммунизации.
При первой иммунизации в спину кроликов подкожно вводят вышеуказанные полисахаридные фракции в объеме 1 см3 полного объема адъюванта Фрсйнда ("Difco", США). Вторую, третью иммунизации проводят с интервалом в семь дней. В краевые вены уха вводят полисахаридную фракцию в объеме 1 см3. Через семь дней после третьей иммунизации производят забор крови из краевой вены уха с целью выделения иммуноглобулинов.
7. Выделение специфических иммуноглобулинов.
Кровь объемом 100 см3 инкубируют при температуре 4±1°С в течение 18 ч. Отбирают надосадочную жидкость (сыворотка) в объеме 40 см3 и добавляют 40%-ный насыщенный раствор сульфата аммония рН 7,4 объемом 20 см3 при постоянном перемешивании. Инкубируют при температуре 0°С в течение 18 ч. После инкубации осаждают иммуноглобулины центрифугированием при 10000g в течение 5 мин. Полученный осадок растворяют в 2 см3 дистиллированной воды и проводят диализ против 400 см3 физиологического раствора рН 7,2 в течение 3 ч.
Выделенные иммуноглобулины должны соответствовать следующим требованиям:
- рН белкового раствора 7,0-7,2;
- в реакции диффузной преципитации - одна линия преципитации с полисахаридными фракциями ЛПС O157, O26, O55, O111, O113, O117.
8. Получение специфических иммуноглобулинов против жгутиковых антигенов Н7, Н11, Н8, Н21, Н14.
Суспензии бактерий E.coli серотипов: O157:Н7, O26:Н11, O55:Н7, O111:Н8, O113:Н21, O117:Н14, в концентрации 109 м.кл./мл объемом 10 см3 в физиологическом растворе рН 7,2 инкубируют на водяной бане при 100°С в течение 15 мин (для деградации жгутиковых антигенов). Затем суспензию осаждают центрифугированием при 7000g в течение 15 мин. Осадки суспендируют в физиологическом растворе в объеме 8 см3.
Бактериальные суспензии объемом 2 см3 смешивают с 2 см3 раствора иммуноглобулинов, полученных против целых клеток и инкубируют 1 ч при 37°С при условии постоянного перемешивания. После инкубироваиия клетки осаждают центрифугированием при 10000g в течение 15 мин. Собирают надосадочную жидкость и повторяют адсорбцию два раза.
Полученные иммуноглобулины должны соответствовать следующим требованиям:
- давать отрицательные результаты в реакциях агглютинации с прогретыми культурами: Е.coli O157:Н7, O26:Н11, O55:Н7, O111:Н8, O113:Н21 в разведениях 1:2;
- давать положительные результаты в реакциях агглютинации с нативными клетками E.coli O157:Н7, O26:Н11, O55:Н7, O111:Н8, O113:Н21 в разведениях 1:256-1:512.
1. Иимуномагнитную разделительную тест-систему конструируют следующим образом:
1.1. Сенсибилизация белком А магнитных латексных частиц, 0,1 см3 10%-ной взвеси магнитных латексных частиц (Bangs Laboratories Inc.USA) отмывают центрифугированием в физиологическом растворе рН 7,2 дважды по 15 мин при 2500g. К осадку магнитных латексных частиц добавляют 1,0 см3 буферного раствора (ТРИС HCL - 10 мМ, ЭДТА - 1,0 мМ, NaCl - 1%, ТВИН-20 - 0,1%, рН 8,0) и тщательно ресуспендируют. Затем инкубируют при 37°±0,5°С в течение 20 мин. Центрифугируют взвесь магнитных латексных частиц при 2500g. К осадку латекса добавляют 1,0 см3 буферного раствора (Na2HPO4 - 0,1 М, NaH2PO4 - 0,1 М, NaCl - 0,9%, рН 7,4), содержащего 55 мкг белка А. Затем инкубируют при 37±0,5°С в течение 48 ч постоянным перемешиванием. После инкубации латекс отмывают дважды буферным раствором (Na2HPO4 - 0,1 М, NaH2PO4 - 0,1 М, NaCl - 0,9%, рН 7,4) с помощью центрифугирования при 2500g в течение 15 мин. Осадок латекса суспендируют в 1,0 см3 буферного раствора (Na2HPO4 - 0,1 М, NaH2PO4 - 0,1 М, бычий сывороточный альбумин - 0,1%, рН 7,8).
1.2. Сенсибилизация магнитных латексных частиц иммуноглобулинами. 6,0 см3 1%-ной взвеси магнитных латексных частиц, сенсибилизированных белком А с этапа 1.1, отмывают буферным раствором (Na2HPO4 - 0,1 М, NaH2PO4 - 0,1 М, NaCl - 0,9%, рН 7,4) с помощью центрифугирования при 2500g в течение 15 мин. К осадку латекса добавляют 6,0 см3 буферного раствора (ТРИС HCl - 10 мМ, ЭДТА - 10 мМ, NaCl - 0,9%, рН 8,0) и инкубируют в течение 10 мин при температуре 50±0,5°С.
1-ая группа. - После инкубации к магнитным частицам латекса (объем - 1 см3) добавляют 2,0 см3 буферного раствора (Na2HPO4 - 0,1 М, NaCl - 0,9%, рН 7,4), содержащего 180 мкг иммуноглобулинов против полисахаридной фракции O157 и 200 мкг иммуноглобулинов против белковых жгутиковых антигенов Н7.
2-ая группа. После инкубации к магнитным частицам латекса (объем - 1 см3) добавляют 2,0 см3 буферного раствора (Na2HPO4 - 0,1 М, NaCl - 0,9%, рН 7,4), содержащего 180 мкг иммуноглобулинов против полисахаридной фракции O26 и 200 мкг иммуноглобулинов против белковых жгутиковых антигенов Н11.
3-ая группа. После инкубации к магнитным частицам латекса (объем - 1 см3) добавляют 2,0 см3 буферного раствора (Na2HPO4 - 0,1 М, NaCl - 0,9%, рН 7,4), содержащего 180 мкг иммуноглобулинов против полисахаридной фракции O55 и 200 мкг иммуноглобулинов против белковых жгутиковых антигенов H7.
4-ая группа. После инкубации к магнитным частицам латекса (объем - 1 см3) добавляют 2,0 см3 буферного раствора (Na2HPO4 - 0,1 М, NaCl - 0,9%, рН 7,4), содержащего 180 мкг иммуноглобулинов против полисахаридной фракции O111 и 200 мкг иммуноглобулинов против белковых жгутиковых антигенов Н8.
5-ая группа. После инкубации к магнитным частицам латекса (объем - 1 см3) добавляют 2,0 см3 буферного раствора (Na2HPO4 - 0,1 М, NaCl - 0,9%, рН 7,4), содержащего 180 мкг иммуноглобулинов против полисахаридной фракции O113 и 200 мкг иммуноглобулинов против белковых жгутиковых антигенов Н21.
6-ая группа. После инкубации к магнитным частицам латекса (объем - 1 см3) добавляют 2,0 см3 буферного раствора (Na2HPO4 - 0,1 М, NaCl - 0,9%, рН 7,4), содержащего 180 мкг иммуноглобулинов против полисахаридной фракции O117 и 200 мкг иммуноглобулинов против белковых жгутиковых антигенов H14.
Инкубируют при 37°С±0,5°С в течение 36 ч с постоянным перемешиванием. После инкубации латексы отмывают дважды физиологическим раствором рН 7,2 с помощью центрифугирования при 2500g в течение 15 мин. К осадкам латекса добавляют по 1,0 см3 глицинового буфера рН 8,2 и инкубируют при 37±0,5°С в течение 1 ч. После этого готовят конечную концентрацию магнитных латексов каждой группы - 0,5% 6 мл.
Хранение латексов осуществляют при 4±0,5°С с добавлением азида натрия.
2. Тест-система для постановки мультиплексной полимеразной цепной реакции (ПЦР).
Раствор "мастер-микс" содержит: 20 мМ ТРИС-HCl, рН 8,4; 50 мМ KCl, 2,5 мМ MgCl2, 0,2 мМ (каждого) dATP, dGTP, dCTP, dTTP, 10 пмоль праймера, 0,5 ед Taq - полимеразы (MBG, Fermentas).
Пример использования.
Приготовлено четыре типа тест-систем.
1.Иммуноразделительная тест-система для идентификации E.coli O157 (Dypol, Норвегия).
2. Тест-система для определения Stx 1 и Stx 2 E.coli O157:H7 в реакции латекс агглютинации (Denka, Seiken, Япония).
3. Тест-система на основе латексных частиц, сенсибилизированных белком А и кроличьими иммуноглобулинами к полисахаридной фракции O157 и к белковому жгутиковому антигену Н7 (ГНЦПМ, РФ).
4. Предпагаемый набор для идентификации энтерогеморрагических E.coli.
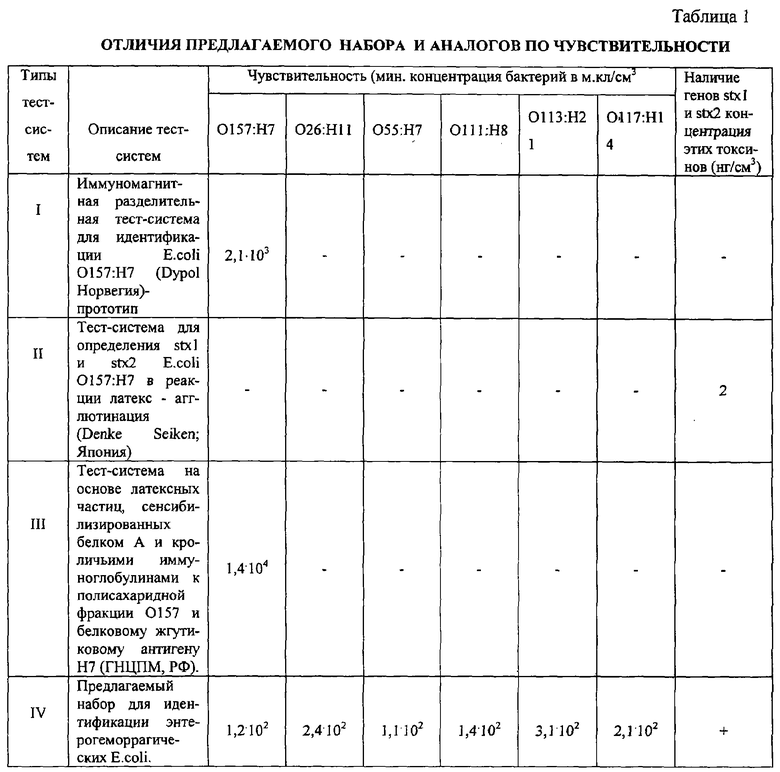
Первый тип тест-системы (прототип) дает положительную реакцию с культурой E.coli O157:H7 в концентрации 2,1·103 м.кл/см3. Чувствительность третьей тест-системы - 1,4·104 м.кл/см3 в отношении антигена O157 и 1,2·106 м.кл/см3 в отношении антигена Н7. Чувствительность предлагаемого набора для полисахаридных фракций O157, O26, O55, O111, O113, O117 и для белковых жгутиковых антигенов Н7, Н11, Н8, Н21, Н14 представлена в таблице и в среднем составляет 1,8·102 м.кл/см3 в иммуномагнитных разделительных реакциях. Первая и вторая тест-системы могут идентифицировать только E.coli O157:Н7, тогда как с помощью предлагаемого набора идентифицируются все энтерогеморрагические E.coli.
Была проверена чувствительность тест-систем на определение токсинов E.coli Stx 1 и Stx 2. Чувствительность второй тест-системы для определения токсинов Stx 1 и Stx 2 составляет 2 нг/см3, причем с помощью этой тест-системы можно определить только токсины E.coli O157:Н7. Время постановки реакции - 24 ч. С помощью предлагаемого набора можно определить гены токсинов Stx 1 и Stx 2 штаммов E.coli серотипов: O157:Н7, O26:Н11, O55:Н7, O111:Н8, O113:Н21, O117:Н14 в течение 3 ч.
Результаты опытов представленные в табл. №1, свидетельствуют о более высокой чувствительности предлагаемого набора для определения О и Н антигенов, а также токсинов Stx 1 и Stx 2 перечисленных выше энтерогеморрагических E.coli в течение 3 ч.
На следующем этапе работы была исследована специфичность тест-систем в реакции латекс-агглютинации, иммуномагнитной разделительной и полимеразной цепной реакциях. С этой целью раститровали культуры контрольных штаммов Salmonella typhimurium, Salmonella choleraesuis, Salmonella enteritidis, Yersinia enterocolitica, E.coli O157:Н7, E.coli O26:Н11, O55:Н7, O111:Н8, O113:Н21, O117:Н14. Стандартное количество микроорганизмов контрольных штаммов из каждого разведения в объеме 0,02 см3 наносили на предметное стекло, а затем к каждой пробе микроорганизмов добавляли по одной из тест-систем в объеме 0,02 см3. После 5 мин инкубации при температуре 37±0,5°С учитывали результаты реакции по образованию агглютината. К другой группе разведении (по 1 см3) микроорганизмов добавляли по 0,02 см3 иммуномагнитного латекса, инкубировали 20 мин, а затем отделяли латексные частицы с помощью магнита. Эти латексные частицы использовали в полимеразной цепной реакции. С этой целью для получения ДНК сорбированных бактерий готовили суспензию латексных частиц в 100 мкл стерильной деионизованной воды, инкубировали в кипящей водяной бане 15 мин с последующим охлаждением во льду. Далее пробирки центрифугировали 10 мин, при 10000g. В ПЦР использовали 5 мкл супернатантов. Амплификацию проводили в термоциклсре Progene (Techne, Англия) в буфере "мастер-микс". Применяли следующий режим амплификации: 95°С 5 мин; затем 25 циклов: 94°С - 60 с; 60°С - 60 с; 72°С - 60 с; с последующим охлаждением до 10°С. Продукт амплификации анализировали в 1,5% агарозном геле, в стандартном ТРИС - борат - ЭДГА буфере для электрофореза при напряженности электрического поля 5 В/см. Результаты эксперимента приведены в табл.2.
Из приведенных данных следует, что предлагаемый набор позволяет идентифицировать энтерогеморрагические эшерихии серотипов: O157:Н7, O26:Н11, O55:Н7, O111:Н8, O113:Н21, O117:Н14, тогда как указанные тест-системы - аналоги обеспечивают идентификацию только E.coli O157:Н7 с возможным перекрестным типированием S.enteritidis, Y.enterocolitica.
Таким образом, предлагаемый набор позволяет в течение трех часов идентифицировать все, в настоящее время известные, шигатоксинпродуцирующие энтерогеморрагические E.coli возбудители геморрагического колита.
Источники информации
1. Воусе Т.О., Swerdlow D.L., Griffin P.L. N Engl J Med 1995; 333: 6: 364-368.
2. Патент RU №2139343, С 12 Q 1/20. Бюл. №28,1999 г.
3. A Reagent Kit for detecting E.coli O157 by Reverst Passiv Latecs agglutination. For 20 tests. Prodact code: 342101 1993. 6 Draft. Danke Saiken Co., LTD. Japan.
4. Патент RU №2189253, A 61 К 39/108. Бюл. №26
5. Stewart D.S., Tortorello M.L., Gendel S.M. Lett. Appl. Microbiol. 1998; 26: 2: 93-97.
6. Obcrst R.D., Hays M.P., Bohra L.K., Phebus R.K., Ymashiro C.T., Paszko-Kolva C., Flood S. J.A., Sargeant J.M., Gillespie J.R. Applied Environmental Microbiol. 1998; 64: 9: 3389-3396.
7. Yu Hao., Stopa P.J. ACS Symp. Ser. 1996, Environmental Immunochemical Methods, 297-306 - прототип.
Специфичность тест-систем
2 нг/см3
102 наличие генов stx 1 stx 2
Изобретение относится к биотехнологии и может быть использовано для идентификации E.coli серотипов O157:Н7, O26:Н11, O55:Н7, O111:Н8, O113:Н21, O117:Н14. Набор состоит из иммуномагнитной разделительной тест-системы и тест-системы для постановки мультиплексной полимеразной цепной реакции (ПЦР). Иммуномагнитная разделительная тест-система содержит носитель - магнитные латексные частицы и сенситин - белок А, ковалентно связанный со специфическими иммуноглобулинами кролика к полисахаридным фракциям ЛПС O157, O26, O55, O113, O111, O117 и белковым жгутиковым антигенам Н7, H11, Н8, Н21, Н14. Набор представляет собой шесть групп 0,5% взвеси частиц магнитного латексного белково-полисахаридного комплекса. Тест-система для постановки ПЦР содержит буфер "мастер-микс" со специфическими праймерами для идентификации генов stx1, stx2, rfb, fliC энтерогеморрагических E.coli. Набор может быть использован для лабораторной диагностики геморрагического колита, гемолитико-уремического синдрома, а также для идентификации энтерогеморрагических E.coli в пищевых продуктах. Набор обладает высокой чувствительностью и специфичностью. 2 табл.
Набор для идентификации энтерогеморагических Escherihia coli, состоящий из иммуномагнитной разделительной тест-системы, которая содержит магнитный латекс, ковалентно связанный с белком А, который ковалентно связан со специфическим кроличьим иммуноглобулином к полисахаридной фракции липополисахарида O157, O26, O55, O111, O113 или O117 соответственно, с образованием шести групп 0,5% взвеси магнитного латекса, тест-системы для постановки мультиплексной ПЦР, содержащей буфер со специфическими праймерами для идентификации генов stx1, stx2, rfb, fliC энтерогеморрагических E.coli и контрольных суспензий бактерий.
| TU SL et | |||
| al | |||
| Соломорезка | 1918 |
|
SU157A1 |
| J.Ind Microbiol Biotechnol., 2001 Jun: 26 (6), pp.345-349 | |||
| ДИАГНОСТИКУМ ДЛЯ ИДЕНТИФИКАЦИИ ESCHERICHIA COLI O157 : H7 И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2001 |
|
RU2189253C1 |
| PATON AW et al | |||
| Говорящий кинематограф | 1920 |
|
SU111A1 |
| Microbiol., 1999 Oct; 37(10), pp.3362-3365. | |||
Авторы
Даты
2006-02-20—Публикация
2003-07-16—Подача