Изобретение относится к медицинской и ветеринарной микробиологии, в часности к получению диагностических препаратов, используемых для эпидемиологического надзора и для лабораторной диагностики эшерихиоза, вызываемого Escherichia coli O157:Н7.
Escherichia E. coli O157: Н7 - основной представитель энтерогеморрагических эшерихий, вызывающая у человека тяжелое поражение толстого кишечника - геморрагический колит [1].
Проблема инфекции E.coli O157:H7 в настоящее время приобрела интернациональный характер. Ее решение в значительной мере зависит от налаженной диагностики болезни, идентификации ее возбудителя, а также эффективности противоэпидемических мероприятий. В этом плане Российская Федерация существенно отстает от мирового сообщества. В России отсутствуют коммерческие препараты для диагностики эшерихиоза O157:H7, в силу чего на сегодня нет данных по эпидемиологии и эпизоотологии этого возбудителя в нашей стране. Совершенно очевидно, что для изучения эпидемической значимости E.coli O157: H7, путей ее распространения, дигностики заболевания, вопрос совершенствования средств идентификации этого возбудителя чрезвычайно актуален.
Известна питательная среда с добавлением сорбитола (2), которая может быть использована в качестве полуселективной среды для выделения E.coli O157:Н7 из клинического материала и продуктов питания.
Однако при контаминации образцов клинического материала или пищевых продуктов другими микроорганизмами процесс выделения чистой культуры E.coli О157:H7 значительно затрудняется и удлиняется по времени (до 3-4-х суток).
Для идентификации патогенных эшерихий в клиническом материале, продуктах питания и объектах внешней среды в настоящее время по-прежнему чаще всего применяются тест-системы, базирующиеся на иммунохимических методах.
Известна тест-система для иммуноферментного анализа E. coli O157:H7 (ИФА), которая используется только для идентификации E.coli по антигену О157.
Недостатком ее является трудоемкость и нестандартность процедур выполнения анализа. Результативность такого диагностикума во многом зависит от качества коньюгата (специфические иммуноглобулины с пероксидазой хрена). Постановка реакций затруднительна из-за большого количества реагентов (чаще всего импортных), занимает много времени (3 часа) и требует участия высококвалифицированного персонала.
Наиболее близкой к предлагаемому диагностикуму является тест-система для идентификации E.coli О157 в реакции латекс-агглютинации (Denke Seiken, Japan). Такого рода препараты представляют собой латексные частицы с диаметром 0,8 μm, сенсибилизированные иммуноглобулинами к липополисахариду (ЛПС) O157. Результаты этой реакции учитываются при образовании хорошо видимых агглютинатов. Постановка реакции занимает 5 минут, не требует дополнительного оборудования и высококвалифицированного персонала.
Способ приготовления такого диагностикума включает следующие этапы:
1) получение специфических кроличьих иммуноглобулинов к ЛПС E.coli О157;
2) сенсибилизация иммуноглобулинов на латексных частицах. С этой целью предварительно отмытые частицы инкубируют 2 часа при 37oС с иммуноглобулином, а затем центрифугируют 15 минут при 2500 g.
Недостатком описанного диагностикума является низкая специфичность, обусловленная тем, что он содержит иммуноглобулины к целой молекуле ЛПС O157, на которой находятся антигенные эпитопы, общие с антигенными эпитопами других возбудителей острых кишечных инфекций: ерсиниями, сальмонеллами, шигеллами, холерным вибрионом и другими. Кроме того, данный диагностикум обладает низкой чувствительностью из-за неспецифической сенсибилизации латексных частиц иммуноглобулинами (посадка на частицы активным центром иммуноглобулинов). Этот диагностикум пригоден для идентификации только антигена O157. При его использовании нельзя определить жгутиковый антиген Н7, следовательно нельзя обеспечить идентификацию E.coli O157:H7 в исследуемом материале.
Задача изобретения - повысить специфичность и чувствительность диагностикума, обеспечить стандартность операций и снизить трудоемкость при их выполнении.
Диагностикум для идентификации E.coli O157:Н7, включающий латекс и сенситин, в качестве сенситина содержит белок А, а также специфические иммуноглобулины кролика к полисахаридной фракции ЛПС O157 и белковому жгутиковому антигену Н7 и представляет собой 0,5% взвесь частиц латекса, ковалентно связанных через белок А с указанными специфическими кроличьими иммуноглобулинами.
Диагностикум для идентификации E.coli O157:H7 получают путем сенсибилизации латекса специфическими кроличьими иммуноглобулинами, причем сенсибилизацию 1%-ной взвеси предварительно отмытых частиц латекса осуществляют белком А в концентрации 55 мкг/мл при их равном соотношении 1:1, полученные частицы отмывают и инкубируют со специфическими кроличьими иммуноглобулинами к полисахаридной фракции липополисахарида O157, белковому жгутиковому антигену Н7 в концентрации 180 мкг и 210 мкг соответственно при их объемном соотношении 1: 1, с последующей отмывкой осадка, затем частицы латекса, ковалентно связанные через белок А со специфическими кроличьими иммуноглобулинами, инкубируют с глициновым буфером при рН 8,2, отмывают и получают диагностикум в виде 0,5%-ной взвеси частиц латекса.
Изобретение иллюстрируется следующими примерами.
Получение специфических иммуноглобулинов к полисахаридной фракции ЛПС O157 и белковому жгутиковому антигену Н7.
1. Ферментация культуры Е.соli O157:Н7.
Рабочую культуру эшерихий размораживают при комнатной температуре и засевают чашки Петри с твердой питательной средой. Культивируют при температуре 37oС в течение 24 часов. Полученную биомассу эшерихий (объем 1500 см3) инкубируют со 100 см3 0,5 мг/см3 формалина в течение 1 часа.
2. Осаждение биомасы.
Осаждение биомассы осуществляют центрифугированием при 10000 g 10 минут при 18-20oС. Отмывку биомассы проводят в физиологическом растворе рН 7,8, центрифугируя при 10000 g в течение 5 минут. Выход биомассы по сухому весу - 10 г на 1500 см3.
3. Разрушение биомассы.
10 г биомассы суспендируют в 2000 см3 буферного раствора (ТРИС - 10 мг/см3, сернокислый магний - 10 мг/см3, рН 7,6). Порциями по 200 см3 суспензию обрабатывают с помощью ультразвукового дезинтегратора мощьностью 60 Вт, пятикратно по 1 минуте, делая интервалы по 2 минуте. Осаждение неразрушенных клеток производят путем центрифугирования при 10000 g 10 минут при 18-20oС. Дезинтеграт подвергают ультрафильтрации под давлением азота в ячейках объемом 1000 см3 до конечного объема 200 см3. Концентрат разводят буфером (ТРИС - 10 мг/см3, сернокислый магний - 10 мг/см3, тритон Х-100 4%, рН 7,6) до объема 400 см3 и инкубируют 1 г биомассы при комнатной температуре с периодическим перемешиванием. Суспензию мембран осаждают центрифугированием при 10000 g в течение 1 часа при 4±0,5oС. Выход фракции внешних мембран - 1 г влажного осадка.
4. Выделение полисахаридной фракции ЛПС O157.
Фракцию внешних мембран суспендируют в 100 см3 буфера (ТРИС-НС1 -50 мМ, ЭДТА - 0,1 мМ, рН 7,2) и инкубируют в течение 24 часов при 4±0,5oС с перемешиванием. Осаждение ЛПС осуществляют путем ультрацентрифугирования при 105000 g в течение 3 часов. Полисахаридную фракцию ЛПС готовят путем кипячения 1 мг/см3 ЛПС в 1,5% растворе уксусной кислоты в течение 2 часов. Осажденную фракцию липида удаляют центрифугированием при 400 g. Полисахаридная фракция находится в надосадочной жидкости, ее выход - 5 мг.
Полисахаридный антиген должен соответствовать следующим требованиям:
рН полисахаридного раствора - 7,2-7,8;
при электрофорезе в полиакриламидном геле - одна линия, соответствующая полисахариду с мол. массой 29 кД;
в реакции диффузной преципитации с поливалентной кроличьей сывороткой - одна линия.
5. Иммунизация кроликов цельными клетками E.coli O157:Н7.
Для иммунизации берут кроликов весом 2,5-3 кг (пол безразличен). В качестве антигена используют клетки E.coli O157:H7 в концентрации 109м.кл/мл на 1 см3 в физиологическом растворе рН 7,2.
Схема иммунизации. При первой иммунизации в подушечки задних лап кролика подкожно вводят суспензию бактерий в объеме 1 см3 полного адьюванта Фрейнда ("Difco", США). Вторую, третью, четвертую иммунизации проводят с интервалом в два дня. В краевую вену уха кролика вводят суспензию бактерий в объеме 1 см3. Через семь дней после четвертой иммунизации производят забор крови из краевой вены уха с целью выделения иммуноглобулинов.
6. Иммунизация кроликов полисахаридной фракцией ЛПС E.coli O157:H7.
Для иммунизации берут кроликов весом 2,5-3 кг (пол безразличен). В качестве антигена используют полисахаридную фракцию ЛПС E.coli O157:Н7 в концентрации 1,5 мг на 1 см3 в физиологическом растворе рН 7,2.
Схема иммунизации. При первой иммунизации подкожно в спину кролика вводят полисахаридную фракцию ЛПС E. coli O157:H7 в объеме 1 см3 полного адьюванта Фрейнда ("Difco", США). Вторую, третью, иммунизации проводят с интервалом в семь дней. В краевую вену уха кролика вводят полисахаридную фракцию ЛПС E. coli O157: H7 в объеме 1 см3 Через семь дней после третьей иммунизации производят забор крови из краевой вены уха с целью выделения иммуноглобулинов.
7. Выделение специфических иммуноглобулинов.
Кровь объемом 100 см3 инкубируют при температуре 1±4oС в течение 18 часов. Отбирают надосадочную жидкость (сыворотка) в объеме 40 см3 и добавляют 40% насыщенный раствор сульфата аммония рН 7,4 объемом 20 см3 при постоянном перемешивании. Инкубируют при температуре 0oС в течение 18 часов. После инкубации осаждают иммуноглобулины центрифугированием при 10000 g в течение 5 минут. Полученный осадок растворяют в 2см3 дистилированной воды и проводят диализ против 400 см3 физиологического раствора рН 7,2 в течение 3 часов.
Выделенные иммуноглобулины должны соответствовать следующим требованиям:
рН белкового раствора 7,0-7,2;
в реакции диффузной преципитации - одна линия преципитации с полисахаридной фракцией ЛПС E.coli O157:Н7.
8. Получение специфических иммуноглобулинов против жгутикового антигена Н7.
Суспензию бактерий E.coli O157:H7 в концентрации 109 м.кл/мл объемом 10 см3 в физиологическом растворе рН 7,2 инкубируют в водяной бане при температуре 100oС в течение 15 минут (для деградации белкового антигена Н7). Затем осаждают суспензию центрифугированием при 7000 g в течение 15 минут. Осадок бактерий отмывают дважды в физиологическом растворе рН 7,2 15 минут. Осадок суспендируют в физиологическом растворе в объеме 8 см3.
Бактериальную суспензию объемом 2 см3 смешивают с 2 см3 раствора иммуноглобулинов, полученных против целых клеток E.coli O157:H7 и инкубируют 1 час при 37oС при условии постоянного перемешивания. После инкубирования клетки осаждают центрифугированием при 10000 g в течение 15 минут. Собирают надосадочную жидкость и повторяют адсорбцию два раза.
Полученные иммуноглобулины должны соответствовать следующим требованиям:
отрицательный результат в реакции агглютинации с прогретой культурой E. coli O157:H7 в разведении 1:2;
- положительный результат в реакции агглютинации с нативными клетками Е. coli O157:Н7 в разведении 1:512.
Диагностикум получают следующим образом.
1. Приготовление латексных частиц, сенсибилизированных белком А.
0,1 см3 10%-ной взвеси латексных частиц отмывают центрифугированием в физиологическом растворе рН 7,2 дважды по 15 минут при 2500 g. К осадку латексных частиц добавляют 1,0 см3 буферного раствора (ТРИС-НСl - 10 мМ, ЭДТА - 1,0 мМ, NaCl - 1%, ТВИН-20-0,1%, рН 8,0) и тщательно ресуспендируют. Затем инкубируют при 37±0,5oС в течение 20 минут. Центрифугируют взвесь латексных частиц при 2500 g в течение 15 минут.
К осадку латекса добавляют 1,0 см3 буферного раствора (Na2HPO4 - 0,1М, NaH2PO4 - 0,1М, NaCl - 0,9%, рН 7,4), содержащего 55 мкг белка А. Затем инкубируют при 37±0,5oС в течение 48 час. с постоянным перемешиванием. После инкубации латекс отмывают дважды буферным раствором (Na2HPO4 - 0,1М, NaH2PO4 - 0,1М, NaCl -0,9%, рН 7,4) с помощью центрифугирования при 2500 g в течение 15 мин. Осадок латекса суспендируют в 1,0 см3 буферного раствора (Na2HPO4 - 0,1М, NaH2PO4 - 0,1М, бычий сывороточный альбумин - 0,1%, рН 7,8).
2. Приготовление латексных частиц, сенсибилизированных иммуногло-булинами.
1,0 см3 1%-ной взвеси латексных частиц, сенсибилизированных белком А, отмывают буферным раствором (Na2HPO4 - 0,1М, NaH2PO4 - 0,1М, NaCl - 0,9%, рН 7,4) с помощью центрифугирования при 2500 g в течение 15минут. К осадку латекса добавляют 1,0 см3 буферного раствора (ТРИС-НСl - 10 мМ, ЭДТА - 10 мМ, NaCl - 0,9%, рН 8,0) и инкубируют в течение 10 минут при температуре (50±0,5oС). После инкубации частицы латекса центрифугируют при 2500 g в течение 15 минут и делят осадок на две части по 0,5 см3 каждая. К первой части осадка добавляют 1,0 см3 буферного раствора (Nа2НРO4 - 0,1М, NaCl - 0,9%, рН 7,4), содержащего 180 мкг иммуноглобулинов против полисахаридной фракции ЛПС O157; ко второй части осадка добавляют 1,0 см3 буферного раствора (Na2HPO4 - 0,1М, NaCl - 0,9%, рН 7,4), содержащего 210 мкг иммуноглобулинов против белкового жгутикового антигена Н7 и инкубируют при 37±0,5oС в течение 36 часов с постоянным перемешиванием. После инкубации латексы отмывают дважды физиологическим раствором рН 7,2 с помощью центрифугирования при 2500 g в течение 15 минут. К осадкам латекса добавляют по 1,0 см3 глицинового буфера рН 8,2 и инкубируют при 37±0,5oС в течение 1 часа. После этого готовят конечную концентрацию латексов - 0,5% (2 мл).
Хранение латексов осуществляют при 4±0,5oС с добавлением азида натрия.
Пример использования
Приготовлено три типа диагностикумов.
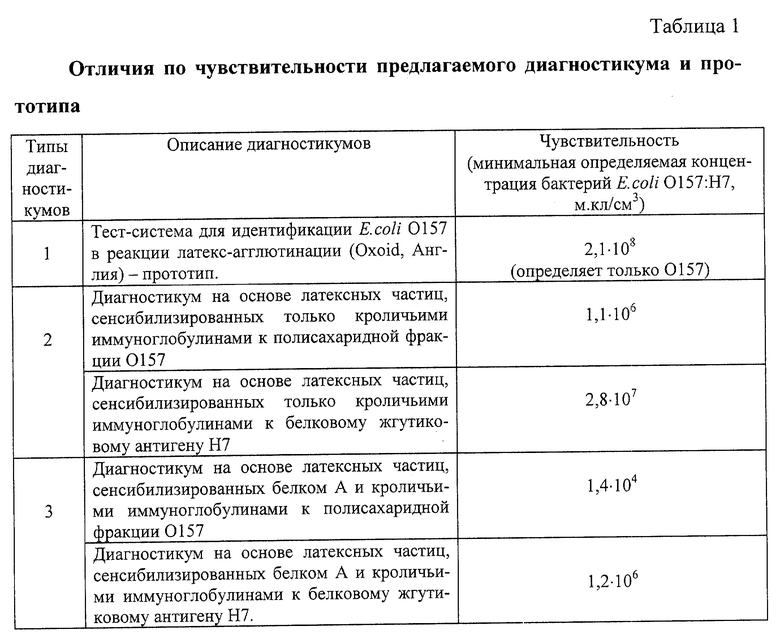
1. Тест-система для идентификации E.coli O157 в реакции латекс-агглютинации (Oxoid, Англия) - прототип.
2. Диагностикумы на основе латексных частиц, сенсибилизированных только кроличьими иммуноглобулинами к полисахаридной фракции O157 и к белковому жгутиковому антигену Н7.
3. Диагностикумы на основе латексных частиц, сенсибилизированных белком А и кроличьими иммуноглобулинами к полисахаридной фракции O157 и к белковому жгутиковому антигену Н7.
Первый тип диагностикума (прототип) в реакции латекс-агглютинации дает положительную реакцию с культурой E.coli O157:Н7 в концентрации 2,1•108 м. кл/см3; чувствительность второго типа диагностикумов - 1,1•106 м.кл/см3 в отношении антигена O157 и 2,8•107 м.кл/см3 в отношении антигена Н7; чувствительность третьего типа диагностикумов - 1,4•104 м.кл/см3 в отношении антигена O157 и 1,2•106 м.кл/см3 в отношении антигена Н7.
Представленные характеристики свидетельствуют о более высокой чувствительности латексных диагностикумов, приготовленных на основе белка А и иммуноглобулинов к полисахаридной фракции O157 а также белковому жгутиковому антигену Н7. Результаты опытов приведены в табл.1.
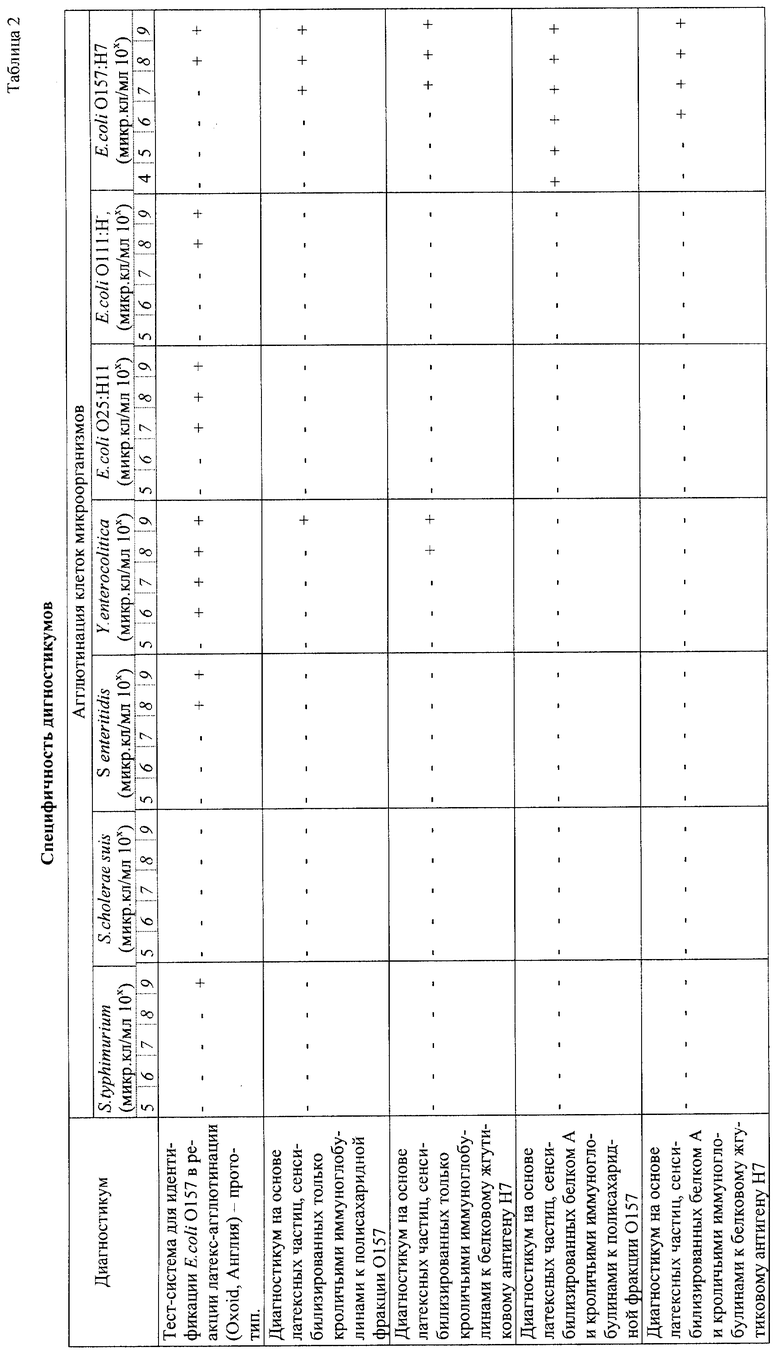
На следующем этапе работы была исследована специфичность дигностикумов в реакции латекс-агглютинации. С этой целью раститровали культуры референс-штаммов Salmonella typhimurium, Salmonella cholerae suis, Salmonella enteritidis, Yersinia enterocolitica, E. coli O25:H11, E.coli O111:H-, E.coli O157: H7. Стандартное количество микроорганизмов из каждого разведения в объеме 0,02 см3 наносят на предметное стекло, а затем к каждой пробе микроорганизмов добавляют по одному из испытываемых диагностикумов в объеме 0,02 см3. После 5 минут инкубации при температуре 37±0,5oС учитывают результаты реакции по образованию агглютината. Результаты эксперимента приведены в табл.2.
Из приведенных данных следует, что диагностикумы на основе латексных частиц, сенсибилизированных белком А и специфическими иммуноглобулинами к полисахаридной фракции O157 и белковому жгутиковому антигену Н7 образуют агглютинаты только с культурой E.coli O157:H7, в то время как диагностикум-прототип реагирует не только с E.coli, но и с иными микроорганизмами, например с Yersinia enterocolitica, E.coli O25:H11, E.coli O111:Н-.
Таким образом показано, что специфические иммуноглобулины к полисахаридной фракции O157, белковому жгутиковому антигену Н7 и белок А являются активными сенситинами для нагрузки носителя.
Источники информации
1. Boyce T. G., Swerdlow D.L., Griffin P.L. N Engl J Med 1995; 333: 6: 364-368.
2. Патент RU 2139343, С 12 N 1/20. Бюл. 28, 1999 г.
3. A Reagent Kit for detecting E.coli O157 by Reverst Passiv Latecs agglutination. For 20 tests. Prodact code: 342101 1993.6 Draft. Danke Saiken Co., LTD. Japan.
| название | год | авторы | номер документа |
|---|---|---|---|
| НАБОР ДЛЯ ИДЕНТИФИКАЦИИ ЭНТЕРОГЕМОРРАГИЧЕСКИХ ESCHERIHIA COLI | 2003 |
|
RU2270253C2 |
| ДИАГНОСТИКУМ ДЛЯ ИДЕНТИФИКАЦИИ ЛЕГИОНЕЛЛ В КЛИНИЧЕСКОМ МАТЕРИАЛЕ И ОБЪЕКТАХ ВНЕШНЕЙ СРЕДЫ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1995 |
|
RU2129279C1 |
| ДИАГНОСТИКУМ ЛЕГИОНЕЛЛЕЗНЫЙ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1995 |
|
RU2124208C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ НАЛИЧИЯ БАКТЕРИЙ Escherichia coli O157:H7 В БИОЛОГИЧЕСКИХ И ПИЩЕВЫХ ОБРАЗЦАХ НА ОСНОВЕ ИММУНОДЕТЕКЦИИ, СОПРЯЖЕННОЙ С ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИЕЙ | 2014 |
|
RU2569196C1 |
| ШТАММ ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS 10G4 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К КАПСУЛЬНОМУ FL АНТИГЕНУ YERSINIA PESTIS | 2011 |
|
RU2460787C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS 13F8 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К КАПСУЛЬНОМУ F1 АНТИГЕНУ YERSINIA PESTIS | 2011 |
|
RU2460788C1 |
| Способ получения бруцеллезного полистирольного латексного диагностикума | 2022 |
|
RU2798124C1 |
| СПОСОБ ИММУНОХРОМАТОГРАФИЧЕСКОГО ОПРЕДЕЛЕНИЯ БАКТЕРИИ ESCHERICHIA COLI В ВОДЕ | 2005 |
|
RU2300768C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОТИВОТУЛЯРЕМИЙНОЙ ГИПЕРИММУННОЙ СЫВОРОТКИ И СПОСОБ ПОЛУЧЕНИЯ ДИАГНОСТИКУМА ЭРИТРОЦИТАРНОГО ТУЛЯРЕМИЙНОГО ИММУНОГЛОБУЛИНОВОГО СУХОГО | 2002 |
|
RU2240822C2 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS 11D6-ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К ЛИПОПОЛИСАХАРИДАМ FRANCISELLA TULARENSIS | 2010 |
|
RU2451078C1 |
Изобретение относится к области медицины, в частности к созданию диагностикума, предназначенного для идентификации E.coli O157:Н7 с целью эпидемиологического надзора и диагностики геморрагического колита. Сущность изобретения: диагностикум содержит носитель и сенситин. В качестве носителя диагностикум содержит окрашенный жирорастворимым синим антрахиновым полистирольный латекс с активированными аминогруппами, имеющий размер частиц 0,502 мкм, коэффициент вариации - 4,1-4,5%, коэффициент дисперсии - 1,003-1,005, с концентрацией аминогрупп - 2,3•(10-3-10-4) моль/г, в качестве сенситина диагностикум содержит белок А, а также специфические иммуноглобулины кролика к полисахаридной фракции ЛПС O157 и белковому жгутиковому антигену Н7. Для получения указанного диагностикума 1%-ную взвесь предварительно отмытых частиц используемого в качестве носителя полистирольного латекса инкубируют вместе с используемым в качестве сенситина белком А в концентрации 55 мкг/мл при их равном соотношении 1:1, а затем отмытые частицы инкубируют со специфическими кроличьими иммуноглобулинами к полисахаридной фракции липополисахарида O157, белковому жгутиковому антигену Н7 в концентрации 180 мкг и 210 мкг соответственно, при их объемном соотношении: 1: 1. После инкубации частицы латекса обрабатывают глициновым буфером при рН 8,2 и повторно инкубируют. Полученный диагностикум представляет собой 0,5%-ную взвесь частиц латекса, которые ковалентно связаны через белок А с указанными специфическими кроличьими иммуноглобулинами. Диагностикум может быть использован для лабораторной диагностики геморрагического колита, а также для идентификации E. coli O157:Н7 в пищевых продуктах. Технический результат: диагностикум обладает высокой чувствительностью и специфичностью. 2 с.п. ф-лы, 2 табл.
| А Reagent Kit for detection, E | |||
| Соломорезка | 1918 |
|
SU157A1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ ВОЗБУДИТЕЛЯ ГЕМОРРАГИЧЕСКОГО КОЛИТА С ГЕМОЛИТИКО-УРЕМИЧЕСКИМ СИНДРОМОМ, ВЫЗЫВАЕМОГО КИШЕЧНОЙ ПАЛОЧКОЙ 0157:Н7 (СОРБИТОЛ E.COLI 0157:Н7АГАР) | 1997 |
|
RU2139343C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИГЕНА ИЗ КЛЕТОК MYCOBACTERIUM TUBERCULOSIS ДЛЯ СОЗДАНИЯ ДИАГНОСТИКУМА | 1994 |
|
RU2095816C1 |
Авторы
Даты
2002-09-20—Публикация
2001-04-09—Подача