Данное изобретение относится к вакцине, защищающей от инфекции, вызываемой Bordetella Bronchiseptica у собак, с помощью характерных полипептидов B. bronchiseptica и ее получение с помощью технологии с использованием рекомбинантных ДНК.
Род Bordetella включает четыре вида: Bordetella pertussis (B. pertussis), Bordetella parapertussis (B. parapertussis), Bordetella bronchiseptica (B. bronchiseptica), Bordetella avium (B. avium). Bordetella - это мелкие грамотрицательные коккобациллы, облигатные аэробы, часто биполярно окрашенные и положительные на цитохромоксидазу. Колонии на среде Борде-Жану окружены зоной гемолиза, за исключением B. avium.
Все виды Bordetella вызывают очень сходные заболевания в отношении контагиозности, пролиферации, клинических симптомов и гистопатологии. Младенцы людей и животных наиболее восприимчивы к инфекции, вызываемой Bordetella. У них заболевание протекает наиболее тяжело, и смертность наиболее высока.
B. bronchiseptica сначала считалась возбудителем инфекций у лабораторных, домашних и диких животных и только эпизодически у человека. Кролики, морские, свинки, крысы, нечеловекообразные приматы, собаки, свиньи, кошки, лошади и лисицы часто инфицируются во время эпидемии. Особенно часто B. bronchiseptica вызывает конурный кашель у собак и атрофический ринит у поросят. У собак инфекционный процесс ограничивается большей частью трахеобронхиальным деревом и характеризуется пролиферацией на трахеальном эпителии после прикрепления к ресничкам респираторного эпителия. Наиболее тяжелыми симптомами заболевания являются чрезмерное скопление слизи, рвота, патологические изменения в легких и потеря веса. У собак появляется сухой, резкий, отрывистый кашель. Инфекция у поросят, вызванная B. bronchiseptica, характеризуется атрофией носовых раковин, деформацией рыльца, пневмонией и сниженным повышением веса. Хотя, как кажется, ясно установлено, что B. bronchiseptica является возбудителем, ответственным на атрофический ринит, значительное число данных в настоящее время указывает на то, что главным возбудителем является Pasteurella multocida, а B. bronchiseptica возможно играет роль индивидуального или условно-патогенного возбудителя. Сообщения о состояниях носительства без клинических признаков заболевания встречаются с высокой частотой для собак, свиней и кроликов.
Несколько факторов вирулентности было идентифицировано у Bordetella. Они включают: коклюшный токсин, жгутиковый гемагглютинин, фимбрии, аденилатциклазу, дермонекротический токсин, трахеальный токсин и гемолизин. Эти факторы вирулентности экспрессируются не у всех видов, например ген, кодирующий коклюшный токсин B. pertussis, присутствует в виде молчащего гена хромосомы у B. parapertussis и B. bronchiseptica. Кроме этих факторов вирулентности, возможно, существуют и другие, еще не идентифицированные факторы, участвующие в патогенности бактерий.
Инфекция, вызываемая Bordetella, начинается на клетках мерцательного эпителия респираторного тракта. Прикрепление бактерий является предпосылкой для инициации инфекции, так как в противном случае смывающее действие ресничек удаляет бактерии вместе с другими частицами из трахеи. Прикрепление Bordetella к реснитчатым клеткам опосредуется серологически различными фимбриями и жгутиковым гемагглютинином /ФГА/ /ФГА не обнаружен, однако, у B. avium/, фимбрии являются волоскоподобными структурами, образованными идентичными белками из субъединиц, отходящими от поверхности бактериальной клетки. ФГА является связанным с поверхностью белком, также выделяемым во внеклеточную окружающую среду, и способным агглютинировать множество эритроцитов. Экспрессия как фимбрий, так и ФГА регулируется bvg-локусом, хотя на экспрессию генов фимбриальной субъединицы у B. pertussis также влияет длина участка из 13 - 15 цитозиновых остатков перед генами фимбриальной субъединицы. Все вирулентные Bordetella экспрессируют факторы прикрепления на их поверхности, тогда как невирулентные штаммы не экспрессируют их. Так как эти адгезины существенны для возникновения заболевания, они являются привлекательными вакцинными компонентами.
Цель данного изобретения состоит в том, чтобы создать рекомбинантную вакцину против инфекции, вызываемой B. bronchiseptica. Исследование было сфокусировано на факторах адгезии, так как предотвращение адгезии в результате иммунного ответа, направленного против факторов адгезии, будет предотвращать инфекцию. У B. bronchiseptica несколько серологически отличных фимбрий и ФГА ответственны за прикрепление бактерий к клеткам мерцательного эпителия трахеи. Когда у организма-хозяина существует иммунный ответ на факторы адгезии микроорганизма, колонизация будет невозможна. Бактерии будут уничтожены до того, как образовались какие-либо токсины, и клинические симптомы не разовьются.
Вакцина по этому изобретению, предотвращающая колонизацию B. bronchiseptica, предпочтительно содержит столько компонентов, необходимых для прикрепления, сколько возможно. Рекомбинантная вакцина может быть создана в виде вакцины из субъединиц. Однако неизвестно сколько серологически различных фимбрий продуцируется, и какое значение в прикреплении клетки каждого фактора /фимбрий и ФГА/. Для разработки вакцины необходимо исследовать значение для прикрепления всех компонентов отдельно. Белки, представляющие интерес, могут использоваться в качестве субъединичной вакцины после сверхпродукции в подходящем микробном организме.
В соответствии с данным изобретением выделены и охарактеризованы три различных гена субъединиц, кодирующие факторы прикрепления B. bronchiseptica.
Соответственно, данное изобретение относится к по существу чистому препарату фимбриального белка B. bronchiseptica или к полипептидным фрагментам фимбриального белка /фимбриальным полипептидам/, имеющим по крайней мере часть из одной из аминокислотных последовательностей, выбираемых из последовательностей ИД NN 2, 4 или 6.
Кроме того, данное изобретение имеет отношение не только к фимбриальному белку и полипептидам, но и также к ДНК из последовательностей ИД NN 1 - 3 и их фрагментам и к полинуклеотидам, которые гибридизутся с вышеназванной ДНК и ее фрагментами, и которые гибридизуются с указанными ДНК и их фрагментами, и которые кодируют полипептид, имеющий свойства фимбриального белка B. bronchiseptica
Данное изобретение относится также к полинуклеотиду, который кодирует полипептид, имеющий иммуногенные свойства фимбриального белка B. bronchiseptica, причем по крайней мере часть кодонов ДНК с последовательностями ИД NN 1, 3 или 5 или ее фрагментов, или вышеупомянутого гибридизующегося полинуклеотида замещается альтернативными кодонами для той же самой аминокислоты.
Фимбриальные белок и полипептиды, его производные, способны вызывать иммунный ответ на B. bronchiseptica.
Небольшие антигены часто бесполезны в качестве иммуногенов. Поэтому фимбриальные белок или полипептиды могут готовиться в виде гомополимеров /множество соединенных идентичных фимбриальных полипептидов/ или гетерополимеров /один или более фимбриальных полипептидов, соединенные с одним или более другими фимбриальными полипептидами, или соединенные с одним или более другими полипептидами, характерными для B. bronchiseptica или для другого возбудителя/, или могут соединяться с одним или более другими соединениями для повышения иммуногенности.
По данному изобретению фимбриальный полипептид в любой из модификаций, упомянутых выше, может быть получен с помощью методов генной инженерии или может быть получен синтетически, т.е. с помощью гомогенного или твердофазного полипептидного синтеза.
Конкретные аминокислотные последовательности подходящих иммуногенных фимбриальных полипептидов могут быть выведены из аминокислотной последовательности, соответствующей последовательности ИД NN: 2, 4 или 6 и, по желанию, также из пространственной конфигурации фимбриального белка.
Был разработан ряд методов для предсказания расположения иммуногеннозначимых эпитопов на белках. Результат из объединяемых предсказаний дает хороший прогноз антигенных сайтов.
Подходящие фимбриальные полипептиды могут выбираться из большинства гидрофильных частей фимбриального белка, т.е. с помощью применения методики, описанной Hopp и Woods /T.P. Hoppand K.R. Wood /1981/; Proc. Natl. Acad. Sci. , USA 78, 3824-3828/. Другой подходящий метод для отбора таких полипептидов описан Chou и Fasman (P. Y. Chou aug G.D. Fusman (1987), Advancos in Enzymology 47, 145-148).
Для окончательного предсказания антигеннозначимых областей на фимбриальном белке B. bronchiseptica могут использоваться различные дополнительные алгоритмы, такие как предсказание гибкости полипептидной цепи /P.A.Karpys and G.E.Schultz 1985, Naturwissenschaften 72, 212-213/, профиль вероятности бета-поворота в фимбриальном белке B. bronckiseptica по P.Y. Chou и G.D. Fasman 1979 /Biophys J, 26, 367-385/, профили вероятности 3-х конформаций для последовательности фимбриальных белков B. bronchiseptica no Gascuel O. и J. L. Golmard 1988, /Cabios 4, 357-365/, предсказание вторичной структуры последовательности фимбриального белка B. bronchiseptica no J. Novotny и C. Aubbray, 1984/ Nucleic Acids Research 12, 243-255/.
Дополнительная информация по расположению значимых эпитопов может быть получена путем применения метода разработанного Geysen и Meloen (H.M. Geysen, R. H. Meloen aud S.J. Barteling (1984); Proc. Natl. acad. Sci 81(13); 3998-4002). При этом методе используются пептиды достаточной длины для реакции при иммуносорбентном исследовании со связанным ферментом. Эти пептиды синтезируются в соответствии с данной последовательностью ДНК. Они характеризуются тем фактом, что первый пептид включает аминокислоты NN 1-9, второй пептид включает аминокислоты NN 2-10 и т.д. Каждый пептид испытывается на его реакционную способность с антисывороткой или моноклональными антителами. Реакционные пептиды должны в таком случае представлять иммуногенный эпитоп
Кроме того, чтобы идентифицировать иммунореактивные эпитопы /и скоррелировать эти реактивные эпитопы с физической картой фибриального белка/ фрагменты ДНК из гена фимбриального белка могут соэкспрессироваться в подходящих плазмидах, таких как плазмиды pEX /K. Stanley and J.P. Luzio, 1984, EMBO У. З. 1429-1434, и J.G.Kusters, E.Y. Jager and B.A.M. Vander Ziejst, 1989, Nud. Acids, Res. 17, 8007/. В этой системе гетерологичная экспрессия приводит к синтезу C-концевого удлиняющего сегмента гибридного белка Cro-β-галактозидазы. Сайты рестрикции эндонуклеазой в ДНК последовательностях фимбриального белка могут использоваться для получения фрагментов гена фимбриального белка для встройки в плазмиды pEX, pEX клоны, синтезирующие слитные белки, производные из различных перекрывающих областей фимбриального белка, затем используются для последующего определения свойств. Фрагменты фимбриального белка, кодируемых pEX, очищают, фракционируют с помощью электрофореза в полиакриламидном геле и наносят на нитроцеллюлозные мембраны. Эти мембраны затем подвергают реакции с сывороткой от свиней или собак, иммунной к B. bronchiseptica. Только фрагменты, содержащие иммунореактивные эпитопы, реагируют с этими сыворотками. Чтобы очертить минимальную длину эпитопов, вставки ДНК реактивных клонов могут постепенно укорачиваться путем отщепления эндонуклеазой III или путем клонирования синтетических олигонуклеотидов, кодирующих небольшие перекрывающие части фимбриального белка /J.G. Kusters, E.J. Jager, G. Koch, J.A. Lenston W.P.A. Posthumus, R.M.Meloen and B.A.M. Van der Zeijst., 1989, J. immunol, 143, 2692-2698/. Эпитопы могут затем испытываться на их защитные эффекты.
В соответствии с конкретным осуществлением данного изобретения специфичный полипептид из фимбриального протеина продуцируется путем экспрессии полинуклеотида, обладающего по крайней мере частью полинуклеотидов последовательности ИД N: 1,3 или 5, образующей часть рекомбинантного полинуклеотида. Рекомбинантный полинуклеотид предпочтительно может базироваться на векторе с встроенным в него специфичным для B. bronchiseptica полинуклеотидным фрагментом. Подходящими векторами являются плазмиды, бактериофаги, космиды, вирусы, михромосомы или прочно интегрирующие векторы; последний, в частности, для клеток растительных и животных. В основном эти векторы обладают свойством автономной репликации, за исключением прочно интегрирующих векторов, которые сами встраиваются в генетический материал клетки-хозяина и реплицируются с генетическим материалом клетки-хозяина. Подходящими клетками - хозяевами могут быть или прокариотические или аукариорические, такие как бактерии, дрожжи, микроплазмы, водоросли, растительные клетки или клетки животных. Растительные клетки или животных могут культивироваться in vitro или могут формировать часть интактного растения или животного, соответственно. Рекомбинантный полинуеклеотид может содержать в виде вставки полный полинуклеотид, кодирующий белок фимбрий или его фрагмент. Вставка может содержать единичную кодирующую последовательность или множественные копии одной и той же кодирующей последовательности или гибридный полинуклеотид, содержащий по крайней мере последовательность, кодирующую один фимбриальный белок, и по крайней мере одну вторую последовательность, такую как последовательность, кодирующую другую часть фимбриального протеина, или полинуклеотид, кодирующий белок, характерный для другого возбудителя, или инертный протеин, функционирующий в качестве носителя для по крайней мере одного небольшого фимбриального полипептида.
Частный случай вышеуказанного осуществления относится к рекомбинантным полинуклеотидам с вирусными векторами, непосредственно применяемыми в виде так называемых векторных вакцин. Вирусы, применимые для этой цели, должны обладать способностью реплицироваться у животных, которых нужно иммунизировать, т.е. у собак и/или свиней. Эти вирусы, кроме того, должны иметь геномную область, пригодную для встройки чужеродного гена /например, кодирующего фимбриальный белок или полипептид B. bronchiseptica/, который также должен экспрессироваться у вакцинированных животных. Подходящими вирусами для этой цели являются, например, энтеральные вирусы, такие как некоторые аденовирусы.
Как было указано выше, белки и полипетиды и рекомбинантные полинуклеотиды по этому изобретению пригодны для приготовления вакцин. Следовательно, эти вакцины также составляют часть этого изобретения.
Конкретное применение данного изобретения касается бактериальных векторных вакцин. При этом бактерии, способные к колонизации собак и/или свиней, трансформируются так, чтобы сделать их способными экспрессировать фимбриальный белок или фимбриальный полипептид так, что это будет приводить к иммуногенной реакции против B. bronchiseptica. Подходящими бактериями для этой цели являются, например, бактерии рода Salmonella.
Вакцина по этому изобретению может также содержать вспомогательные составляющие вакцины, такие как носители, буферы, стабилизаторы, растворители, адьюванты и консерванты. Преимущественно эти вакцины представляют собой лиофильно высушенные продукты, которые воспроизводятся добавлением подходящей жидкости /воды, буфера/ перед применением.
Вакцина может применяться перорально, интравазально или внутримышечно.
Вакцина может дополнительно содержать другие иммуногены для животных, которых нужно иммунизировать /собак и свиней/, такие как иммуногенный материал, характерный для вирусов, такие как вирус псевдобешенства /инфекционный бульбарный паралич, болезнь Ауески/, вирус гриппа, вирус трансмиссивного гастроэнтерита, парвовирус, вирус эндемичной диареи свиней, вирус холеты свиней или иммуногенный материал, характерный для микоплазмы, таких как Mycoplasma hyepneumoniae и Mycoplasma lyerhinis, или иммуногенный материал, характерный для бактерий, таких как Escherichia coli; Liptospira, Actinobacillus pleuropneumoniae, Pasteurella multocida, Streptococcus suis, Treponema hyodysenteriae.
Изобретение иллюстрируется следующими рабочими примерами.
Пример 1.
Описание характеристик гена Г1МХ, материалы и методы
Бактериальные штаммы, среды и условия роста.
Все использованные бактериальные штаммы перечислены в таблице 1 (см. в конце описания).
Все штаммы Bordetella выращивали на агаре Борде-Жану /Difco Laboratories, Detroit. M.I./, дополненной 1% глицерина и 20% дефибринированной бараньей крови, или в триптозофосфатном бульоне /ТФБ/ /Difco Laboratories, Detroit, M.I./. Чтобы подавить экспрессию генов вирулентности среды дополняли 20 ммоль/л MgSO4 B.bronchiseptica штамм 401 использован для получения препаратов ДНК. Escherichia coli штамм PC2495 использовали для размножения вектора Bluescript /Stratagene/ и его производных. Штамм PC2495 выращивали на бульоне Луреано-Бертони /ЛБ/ или на агаре ЛБ. Ампициллин /50-100 мкг/мл соот./, 50 мкг/мл 5-бром-4-хлор-3-индолил-β-D-галактопиренозида /X-гал/ и 20 мкг/мл изопропил-β-D-тиогалактопиранозида /ИПТГ/ использовали для идентификации штаммов, содержащих плазмиду, несущую вставку ДНК. Все бактериальные культуры выращивали при 37oC в течение 16 - 24 часов.
Методы рекомбинантной ДНК
Хромосомную ДНК выделяли из штаммов Bordetella, как описано у Maniatis et al., (T. Maniatis, E.F.Fritsch and J.Sambrook 1982, Molecular cloning: A Laboratory Manual. Cold Spring Harbor, New York: Cold Spring Harbor Laboratory Press).
после расщепления производили электрофорез ДНК в 1% агарозном геле на буфере TAE /40 ммоль/л Трис-ацетата, 2 ммоль/л ЭДТУ/, содержащем 1 мкг/мл стадия бромида. Для выделения фрагментов ДНК из агарозного геля использовали набор Geneglean /Bio Inc 101 Corp., La Jolla/. Концевое мечение олигонуклеотидов выполняли с помощью [γ-32p)d АТФ, используя T4 полинуклеотидкиназу /Maniatis et al./. Гибридизацию выполняли в 5 x PE, 5 х растворе Денхардта, 0,1% додецилсульфата натрия и 100 мкг/мл ДНК спермы сельди при 55%oC. Пятна промыли 5х PE и 0,1% додецилсульфатом натрия при 55oC.
Блот-анализ по Саузерну
Хромосомную ДНК из B. bronchiseptica штамм 401 очищали и расщепляли с помощью нескольких рестрикционных ферментов. Фрагменты разделяли путем электрофореза, переносили на нейлоновую мембрану и гибридизовали с пробой ДНК, полученной из гена фибриальной субъединицы fimX B.pertussis. Фрагменты ДНК, представляющие интерес, идентифицированные по показателям гибридизации, выделяли с помощью набора Gene Glean (Bio Inc. 101 Corp., La Jolla). После лигирования в вектор Bluescript (Strategene) фрагменты хромосомной ДНК трансформировали в Escherichia coli, штамм PC2495 до CaCl2 методу /Dagert, M. and Ehrlich S. D. , 1979. Prolonged incubation in calcium chloride improves the competence of Escherichia coli cells Gene 6: 23 - 28).
После гибридизации были идентифицированы положительные колонии.
Определение нуклеотидной последовательности
Плазмиду выделяли по методу щелочного лизиса /H.C.Birnboim and J.A.Doly 1979. A rapid alkaline extraction procedure for screening recombinant plasmid DNA, Nuclear Acids Res. J: 1513-1523).
Нуклеотидную последовательность клонированных вставок определяли с помощью метода терминации дидезоксицепи /F.Sanger, S.Nicklen, A.R. Coulson 1977. DNA sequencing with claim-terminating inhibitors. Proc. Natl. Acad. Sci USA 74: 5463-5467), используя набор T7 полимеразного секвенирования /Amersham/. Анализ данных по последовательности ДНК выполняли с помощью программного обеспечения PC/Gene /версия 6,5, Genofit, Heidelberg SA, Женева, Швейцария/.
Частичная очистка фимбрий
B. bronchiseptica штамм 401 выращивали на триптозно-фосфатном агаре /Difco Laboratories, Detroit, M.I./. Бактерии промывали в фосфатно-буферном физрастворе /ФБФР/. Осадок бактерий суспендировали в 15 мл фосфатно-буферного физраствора с добавлением 4 моль/л мочевины. Эту суспензию помещали в термостат при температуре 40oC на 30 мин. Бактерии выделяли из суспензии путем центрифугирования при 20000 об/мин /Beckman, JA20 ротор/ в течение 10 мин. Фимбрии выделяли из супернатанта после центрифугирования при 40000 об/мин /ультрацентрифуга Beckman, ротор TC 60/ в течение 16 часов. Осадок затем суспендировали в 5 мл фосфатно-буферного физраствора. Концентрацию белка определяли с помощью исследования с бицинхининовой кислотой /БЦК/ /Pierre Chemical Comp. , USA). Анализ белка выполняли в системе для электрофореза в 15% ДСН-полиакриламидном геле.
Результаты
Анализ последовательности и сравнительный анализ первичной структуры
Фрагмент ДНК BamHI-EcorI, полученный из гена fimX B.pertussis, использовали в качестве пробы для идентификации фрагментов хромосомной ДНК B. bronchiseptica содержащих fim гены. Pstl фрагмент ДНК 1,3 кв из B.bronchiseptica гибридизующийся с пробой fimX, выделяли и секвенировали. На этом фрагменте располагался полный ген fimX, включая промоторные последовательности перед геном /последовательность ИД N: 1/.
E. coli PC 2495, содержащие плазмиду plVB 3-420, включающую полный ген fimX, поместили на хранение в Centraal bureau voor Schimmelcultures dt Baarn, Нидерланды, 13 августа 1992 под номером хранения CBS 364.92.
Экспрессия гена fimX B.bronchiseptica
Чтобы идентифицировать продукт fimX, был сконструирован мутантный штамм с делецией, неспособный экспрессировать ген fimX. Этот мутантный штамм был сконструирован путем замены гена. К этому концу центрального фрагмента EcoRI гена fimX B.bronchiseptica замешали канамициновым геном и клонировали в вектор Bluescript. Эту конструкцию, изображенную на фиг. 1, использовали для замены гена в B.bronchiseptica. Устойчивый к канамицину мутантный штамм идентифицировали. Этот штамм больше не гибридизовался с фрагментом EcoRI. Из этого мутантного штамма готовили частично очищенные фимбрии. Это выделение фимбрий из штамма fimX - отрицательного по сравнению со штаммом дикого типа ясно показывает, что ген fimX экспрессируется на высоком уровне в B.bronchiseptica, как изображено на фиг. 2.
Пример 2
Описание характеристик гена фимбриальных субъединиц fim2 и fim3 Bordetella bronchiseptica
Бактериальные штаммы, плазмиды и условия роста
Использованный штамм B.bronchiseptica дикого типа был выделен от собак, страдающих от конурного кашля. Этот штамм был получен от доктора J.M.Musser /штамм N 685/ и обозначен N 401. Этот штамм выращивали в триптозно-фосфатном бульоне или агаре /Difco Laboratories, Detroit, M.I./. Штамм B.pertussis, Wellcome 28 /A. Robinson, L. A.E. Ashworth, A.Baskerville, and L.I.Irons, 1085, Proceedings of the 4th International Symposium on pertussis, Geneva, 1984. Dev. Bid. Stand. 61:165-172/ выращивали на агаре Борде-Жану /Difco Laboratories, Detroit, M. I./. Для невирулентных B.bronchiseptica ростовая среда дополнялась 20 ммоль/л MgSO4. Штамм E.coliK12 PC2495 использовали в качестве хозяина для клонирующего вектора p.Bluescript. Штамм E.coli выращивали на агаре LB или бульоне LB, дополненными 100 мкг/мл ампициллина; 50 мкг/мл X-Gal и 20 мкг/мл IPTG для идентификации рекомбинантных штаммов, содержащих клонированный фрагмент ДНК. Все культуры бактерий выращивали при 37oC в течение 16-48 часов.
Выделение ДНК и определение нуклеотидной последовательности
Выделение хромосомной ДНК проводили по Maniatis et al. Выделение плазмиды осуществляли методом Birnboim и Doly Фрагменты хромосомной ДНК выделяли из TAE /40 ммоль/л Трис-ацетата, 2 ммоль /л ЭДТУ/ агарозного геля, используя набор Gene Clean (Bio. Inc. 101 Corp., La Jolla/. Фрагменты ДНК лигировали в pBluescript KSMB+ и MB- (Strategene, La Jolla, CA) в целях клонирования. Определение нуклеотидной последовательности проводили с помощью набора для T7 полимеразного секвенирования /Amercham/ по методу терминации дидезоксицепи Sanger et al. Для анализа данных по последовательности ДНК использовали расчетное программное обеспечение PC /Gene/ версия 6,5, Genofit. Heidelberg S. A. Женева, Швейцария/. Рестрикционные ферменты и T4 ДНК-лигазу закупали в Pharmacia и использовали в соответствии с инструкциями производителя. Плазмиды трансформировали в E.coli штамм PC2495 по CaCl2 методу Dagert и Ehrilich.
Суазерн-болоттинг
Саузерн-блоттинг приводили по Maniatic et al.
Электрофорез в ДСН-полиакриламидном геле и иммунологические методики
Для SDS-PACE и вестерн-блот-анализа использовали равные количества бактерий. Бактерии собирали в фосфатно-буферном физрастворе /ФБФР/ и разбавляли до O600 = 1,0. 50 мкл этой суспензии лизировали в 20 мкл буфера Лэммли и подвергали электрофорезу в 15% полиакриламидном геле, как описано у Laemmli /Laemmli, U.K. 1970, Cleavage of Structurae proteins during the assembly of the head of bacteriophage T.U.Nature, 227: 680-585/. Перенос белков на нитроцеллюлозу проводили по существу как описано Van Embden et al. (J.D.A. van Embden, M.J. Van. der Dont, H.J. van Eijk, H.C. van der Heide. H.A. de Jong, M. F. Van Olderen, A.D. Osterhans, L.M. Schouls, 1983. Mdecular cloning and exoression of Treponema pallidum, DNA in E. coli K12 Infect. Immun. 42:187 - 196/. Поликлональные антитела, выработанные к денатурированным ДСН белкам фимбриальных субъединиц серотипов 2 или 3 B. pertussis, использовали для определения белков фимбриальных субъедиц B. bronchiseptica
Специфичные моноклональные антитела fim2 и fim3, выработанные к B.pertussis, использовали при ELISA в плоскодонных микротитровальных платах, покрытых целыми бактериями /OD600 = 0,1; разведенных 1:10 в 15 ммоль/л Na2 CO3, 35 ммоль/л NACO3. pH 9,6/. Связанный козий противомышиный IgG - пероксидазный конъюгат /Nordic/ определялся с помощью 2,2-азино-бис/3-этилбензтиазолин-6-сульфоновой кислотой /ABTC/ /Sigma/. Поглощение определяли при 405 нм.
Электронная микроскопия
Для электронной микроскопии культуру B. bronchiseptica разводили в ФБФР. Полиоформу, покрытую медными сетками, помещали на 50 мкл бактериальной суспензии на 5 минут. Сетки промывали 3 раза в H2O. Окрашивание проводили в течение 2 мин в 1% ВФК /вольфрамофосфорная кислота, Merck/. Сетки исследовали в электронном микроскопе PHilips EM 201.
Результаты
Нуклеотидная последовательность генов фимбриальной субъединицы fim 2 и fim 3.
Гены субъединицы fim 2 и fim 3 B. fronchiseptica могли идентифицироваться на основе их гомологии и генами fim 2 и fim 3 B.pertussis соответственно. Фрагмент ДНК из 1000 bp. ACCl-Pstl использовался в качестве пробы для гена fim2 /I.Livey, C.J.Dugglely and A.Robinson 1987. Cloning and nucleotide sequence analysis of the serotype 2 fimbrial subunit gene of Bordetella pertussis Mol.Microb 1: 203 - 209/.
Фрагмент ДНК Sall их 900 bp использовался в качестве пробы для гена fim 3 /Mooi, F.R., A. ter Avest and H.G.J. Van der Heide 1990. Structure of the Bordetella pertussis gene codyng serotype 3 fimbrial Subinit Fems Microb. Lett 66: 327 - 332/.
Гибридизация хромосомной ДНК из B. bronchiseptica, расщепленной с помощью рестрикционной эндонуклеазы Pstl давала несколько положительных сигналов с обеими пробами из-за гомологии между двумя пробами. Из хромосомной ДНК B. bronchiseptica были выделены две области фрагментов ДНК, дающие наиболее сильный сигнал или с fim 2 или с fim 3 пробой. Эти Pstl фрагменты ДНК, равные 2,3 кв и 2,8 кв соответственно, были клонированы в векторе Bluescript. После трансформации и развития колоний были идентифицированы два клона путем гибридизации с каждой из fim проб. Один клон со вставкой 2,3 кв кодировал ген fim 2 /p1 B3-402/. Другой клон со вставкой из 2,8 кв кодировал ген fim 3 /p1 B3-430/ B. bronchiseptica. Нуклеотидная последовательность обоих генов была определена, и они представлены как последовательность ИД N 3 /fim 2/ и последовательность ИД N 5 /fim 3/ соответственно. Бактерии E.coli PC 2495 /p1 B3-402/ и PC 2495 /p1 B3-430/ были помещены на хранении в Centraalbureau voor Shimmelculture в Баарне, Нидерланды, 13 августа 1992 года под ТТ CBS 362.92 и CBS 361.92 оответственно.
Пример 3
Конструирование двух штаммов Bordetella Bronchiseptica, которые дефицитны по продукции одного типа фимбрий
Были созданы штаммы Bordetella bronchiseptica, дефицитные по продукции фимбрий Fim X /Bbfx-/ или фимбрий Fim 2 (Bbf 2). Это было получено путем замены гена разорванными генами после гомологичной рекомбинации. Разорванные гены трансформировали в B.bronchiseptica путем электропорации. Деления в генах фимбриальной субъединицы создавалась путем замены фрагмента EcoPI в генах дикого типа геном резистентности к канамицину.
Материалы и методы
Бактериальные штаммы, плазмиды и условия роста
Штамм B. bronchiseptica N 401 дикого типа использовался во всех экспериментах. Бактерии были получены от доктора J.M.Musser /штамм N 685/. Этот штамм выращивали на триптознофосфатном агаре /ТФА/ /Difco Laboratories/ или на агаре Борде-Жану /БЖ/ /Difco Laboratories/, дополненном 15% свежих бараньих эритроцитов, при 37oC в течение 24 - 48 часов. В целях клонирования использовался штамм Escherichia coli K12 PC2495 с плазмидой Bluescript KSu Sk (Stratagene) E. coli PC 2495 выращивали на агаре Луриа-Бертони с соответствующими антибиотиками в течение 16 часов при 37oC. Для ампициллина и/или канамицина использовалась концентрация 100 мкг/мл.
Методика рекомбинантных ДНК
Процедуру клонирования выполняли, как описано Maniatis et al. Каждый ген фимбриальной субъединицы, включая примыкающие последовательности, был клонирован в вектор Bluescript. Эти векторы выделяли с помощью метода щелочной экстракции Birnboim и Doly. Фрагмент ДНК в гене субъединицы замещали геном резистентности к канамицину (J.F. Miller, W.J. Dower and L.S. Tompkins 1988, High-vol-voltage electroporation of bacteria: Genetic transformation of Compylobacter jejuni with plasmid DNA. Proc. Natl. Acad. Sci., USA. 169:5320-5323/. Эта последняя конструкция была использована в экспериментах электропорации.
Эксперименты по электропорации
Электропорацию выполняли по существу так, как описано Miller et al (J.F. Miller, W. J. Dower and L.S. Tompkins 1988. High voltage electroporation of bacteria: Genetic transformation of Compylobacter jejuni wit plasmid DNA. Proc. Natl. Acad. Sci., USA. 85: 856-860/. Штамм 401 B.bronchiseptica дикого типа выращивали на агаре БЖ в течение 16 часов. Клетки собирали в 1 мл раствора 15% глицерина - 272 ммоль/л сахарозы /ГлиСах/ /0oC/, промывали и ресуспендировали в 400 мкл ГлиСах. Образцы этой суспензии по 50 мкл замораживали при -80oC. Эти образцы использовали в экспериментах электропорации для трансформации B.bronchiseptica 1-3 мкг ДНК, растворенной в дистиллированной воде. Использованные условия электропорации были следующими: 0,7 к, 25 мкГ и 600 Ом /Biorad Gene Pulser, используя кюветы с зазором 0,56 мл от Biotechnologic an Experimental Research Inc., San Diego CA/. Измеренные временные константы находились между 3,5-7 мс. Клетки восстанавливали в 1 мл триптозофосфатного бульона /Difco Laboratories/ в течение 90 мин, при 37oC и высевали на чашки с ТФВ /Difco Laboratories/, содержащие 100 мкг/мл канамицина. Отбор рекомбинантных штаммов выполняли с помощью саузерн-блоттинга на препараты хромосомной ДНК.
Очистка хромосомой ДНК и саузерн-блот-анализ
Хромосомную ДНК очищали по Maniatis et al. Саузерн-блот-анализ выполняли, как описано ранее.
Пробы ДНК, использованные в экспериментах гибридизации
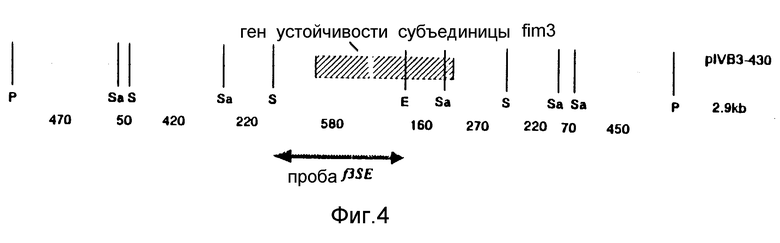
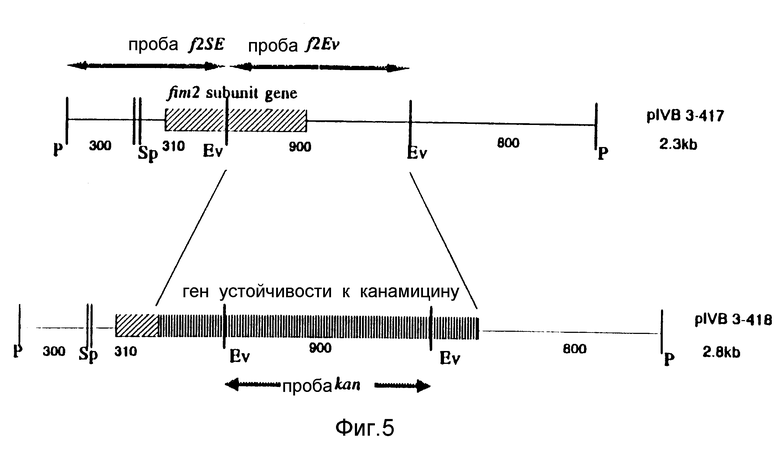
Для экспериментов гибридизации, касающихся гена fimX, были использованы две пробы, обозначенные fXEV и f3SE фрагмент ДНК 450 bp, используемый в качестве пробы fXEv, был выделен при расщеплении pI v B3-426 с помощью рестрикционной эндонуклеазы EcoRV /фиг. 3/. Фрагмент ДНК 580 bp пробы f3SE был получен после расщепления pIv B3-430 с помощью рестрикционных эндонуклеаз SpnI и EcoRI /фиг. 4/. Для экспериментов гибридизации, касающихся гена fim 2, были использованы три пробы, обозначенные f2Ev, kana и f2PE /фиг. 5/. Проба f2Ev была EcoRV фрагментом ДНК 900 bp, выделенным из pIV B3-417; проба капа была EcoRV фрагментом ДНК в 900 bp в гене устойчивости к канамицину, а проба f2PE была PSTl-EcoRV фрагментом ДНК в 610 bp из pIV B3-417.
Результаты
Две плазмиды с фрагментами ДНК, содержащими ген субъединицы фимбрий fimX или fim2, были использованы для трансформации бактерий B.bronchiseptica дикого типа путем электропорации. Гены обеих субъединиц были разрушены путем замены EcoRV фрагмента ДНК геном устойчивости к канамицину. До того, как это могло быть сделано, должен быть удален третий сайт EcoRV, присутствующий в полилинкере вектора Bluescript. Это было сделано путем субклонирования фрагментов ДНК в EcoRV Bluescript вектор, дающего в результате pIV B3-426 для fimX и pIV B3-417 для fimL /фиг. 3.5/. Оба клона затем расщепляли путем рестрикционной эндонуклеазы EcoRV. При этом расщеплении из клона гена fim X /pIV B3-426/ удалялся фрагмент в 450 bp, включая 5' промоторные последовательности /фиг. 3/. После удаления фрагмента EcoRV выделяли вектор с оставшимися последовательностями ДНК, и фрагмент ДНК Smal-Hincll в 1,4 kb, содержащий ген устойчивости к канамицину, клонировали в сайты EcoRV. Трансформация в E. coli PC2495 с последующим выделением плазмиды давала клон pIV B3-427 /фиг. 3/. Той же самой стратегии следовали в отношении гена фимбриальной субъединицы fim 2. Расщепление клона pIV B3-417 с помощью рестрикционной эндонуклеазы EcoRV /фиг. 5/ перемещало фрагмент ДНК в 900 bpк 3'-части гена вместе с примыкающими последовательностями. Лигирование гена устойчивости к канамицину в эту конструкцию давало клон pIV B3-418 /фиг. 5/.
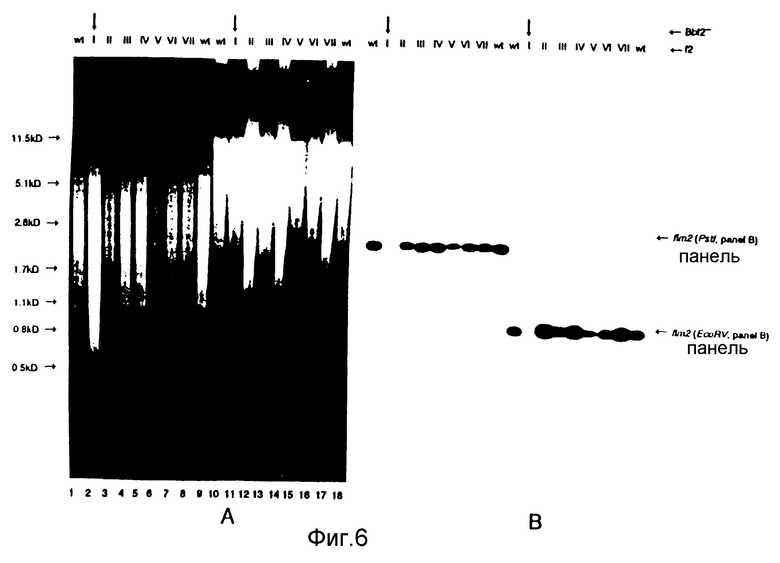
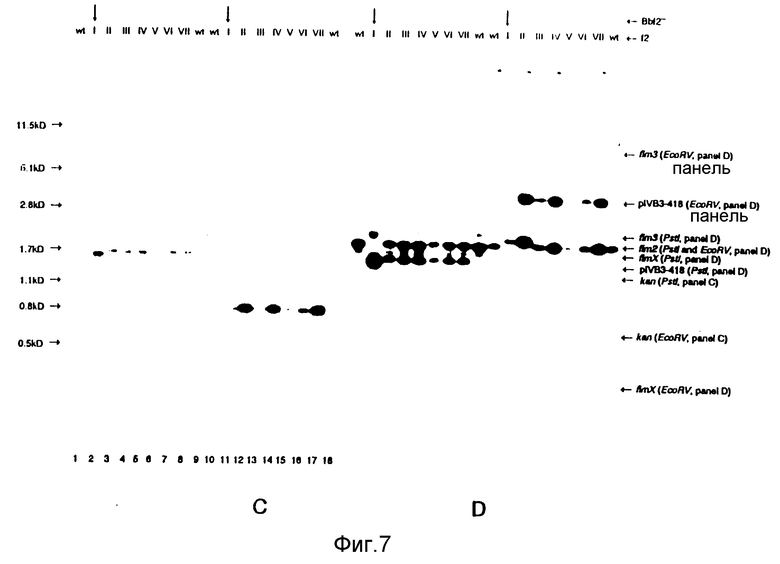
Обе плазмиды /pIV B3-427 и pIV B3-418/ выделяли и использовали отдельно в экспериментах электропорации для трансформации B.bronchiseptica. После каждого эксперимента электропорации наблюдалось до 102 колоний B.bronchiseptica устойчивых к канамицину. После электропорации с плазмидой pIV B3-427 /частичный ген фимбриальной субъединицы fim XI, было проанализировано 4 колонии /fXI-IV/. После электропорации с плазмидой pIV B3-418 /частичный ген фимбриальной субъединицы fim 2/, было проанализировано 7 колоний /f2 I-VII/. Из этих устойчивых к канамицину штаммов B.bronchiseptica была выделена хромосомная ДНК и расщеплена рестрикционными эндонуклеазами Pstl и EcoRV соответственно. Гибридизацию по Саузерну выполняли с расщепленной хромосомой ДНК, выделенной из штаммов, устойчивых к канамицину, и штамма B.bronchiseptica дикого типа. Расщепленная хромосомная ДНК из 4 штаммов, выделенная после электропорации с pIV B3-427, гибридизовалась с пробами fXEv и f3SE соответственно /фиг. 3, 4/. Расщепленная хромосомная ДНК из 7 штаммов, выделенных после электропорации с плазмидой pIV B3-18, гидридизовалась с пробами f2Ev, kan и f2SE, соответственно /фиг. 5/. Из образцов гибридизации с пробами fXEv и f2Ev было ясно, что были выделены рекомбинантные штаммы с отсутствующей или частью fimX /фиг. 6A, 6B/, или fim2 /фиг. 7A, 7B/ гена фимбриальной субъединицы. В экспериментах гибридизации с канамициновым геном в качестве пробы для гена fim2 было показано, что все выделенные штаммы /f2 I-VII/ содержат канамициновый ген /фиг. 7C/.
Так как канамициновый ген присутствовал во всех fim2 рекомбинантных штаммах, замена гена могла произойти в одном из других генов фимбриальных субъединиц благодаря гомологии между генами субъединиц. Чтобы определить, было ли это событие, эксперименты гибридизации проводили в условиях низкой жесткости, и тем самым могла наблюдаться кросогибридизация при использовании проб, полученных из генов других субъединиц. Эксперименты гибридизации на штаммах B. bronchiseptica fimX, устойчивых к канамицину /fX I-VI/, с пробой f3SE /ген субъединицы fim 3/ показали, что замена гена в гене фимбриальной субъединицы происходило только у штамма BbfX. У этого штамма, а также у других рекомбинантых штаммов /fX II-IV/ присутствовали сигналы гибридизации с фрагментами ДНК, содержащими гены fim3 и fim2 /фиг. 6C/. Так как эти последние сигналы были такими же, что и для B.bronchiseptica дикого типа, ни в одном из других генов субъединиц рекомбинации не наблюдалось /фиг. 6c/. Гибридизация мутантных штаммов fim2 с пробой f 2PE показала, что замена гена только в гене fim2 происходила в штамме B bF2 /фиг. 7/. При использовании этой пробы сигналы гибридизации наблюдались со всеми тремя генами субъединиц. Так как фрагмент Pstl -EcoRV/ проба f2PE/ присутствует в pIV B3-418, использованной для электропорации, в рекомбинантных штаммах /f2 II-VIII/ может наблюдаться четвертый сигнал гибридизации. Это показывает, что плазмида pIV B3-418 может все же присутствовать в штаммах, устойчивых к канамицину. Возможно, рекомбинация происходила где-то еще в хромосоме в неидентифицированном месторасположении вне гена фимбриальной субъединицы.
Пример 4
Эксперимент по вакцинации мышей мутантами Bordetella bronchiseptica BbfX- или Bbf2-
Материалы и методы
Три группы из 80 мышей каждая /мыши - самки BAL B/C, шестинедельного возраста/ интраназально инфицировали диким типом B.bronchiseptica, BbfX- и Bbf2-/ последние два получали в соответствии с примером 2/, соответственно /2 • 107 KOE каждую/. Число живых бактерий в распираторном тракте 8 мышей определяли в указанные временные интервалы /0, 1, 3, 7, 11 и на 36 день/. Носоглотку, нос, трахею и легкие каждой мыши исследовали на присутствие жизнеспособных B.bronchiseptica. Мышей забивали с помощью инъекции барбитуратов примерно через час после инфицирования /обозначенного как 0 день/ и через разное число дней, начиная с этого времени. Легкие и трахею удаляли и гомогенизировали в ФБФР с помощью гомогенизатора тканей. Мазки износа брали с помощью кетгута. Кетгут помещали в 0,5 мл ФБФР и взбалтывали вращением в течение 5 мин. Носоглотку смывали ФБФР до тех пор, пока не собиралось 5 капель /примерно 0,5 мл/. Разведения всех гомогенатов и капель из носоглотки высевали на чашки с триптозо-фосфатным агаром, и после 2-х дней инкубации подсчитывали KOE.
Через 52 дня после вакцинации группы, вакцинированные BbfX- или Bbf2-, и невакцинированную группу заражали вирулентным штаммом B.bronchiseptica. Колонизацию респираторного тракта определяли количественно на 0, 1, 4 и 14 день после заражения.
Результаты
Сравнили результаты колонизации верхнего распираторного тракта как мутантными штаммами, так и штаммом дикого типа. Не существует различий в колонизации различных органов верхнего респираторного тракта после заражения мутантными штаммами BbfX- или Bbf2- по сравнению со штаммом дикого типа.
На 36 день мышей из групп BbfX- и Bbf2- контролировали на присутствие Bordetella. Легкие и трахея были свободны от Bordetella, тогда как в носу и носоглотке еще присутстовали небольише количества.
На 52 день после вакцинации мышей вакцинировали мутантами BbfX- и Bbf2-, а контрольную группу заражали вирулентным штаммом B.bronchiseptica. Колонизация носоглотки вирулентным штаммом B.bronchiseptica не моглда прдотвращаться в обеих вакцинированных группах.
Колонизация легких и трахеи диким штаммом в вакцинированных группах могла обнаружиться только через час после заражения, тогда как в контрольной группе присутствовала сильная колонизация.
Колонизация носа мышей вакцинированных мутаннтных штаммов могла обнаруживаться только в 0 день и у некоторых мышей в 1-й день, тогда как у мышей контрольной группы наблюдалась сильная колонизация носа.
Информация по посл. N 1- 6 дана после формулы изобретения.




















Изобретение относится к вакцине для борьбы с инфекциями, вызываемыми В. bronchiseptica у восприимчивых животных (таких, как собаки и свиньи), содержащей белки или полипептиды, типичные для белка фимбрий В. bronchiseptica или содержащей рекомбинантные полинуклеотиды. Вакцину можно применять перорально, интраназально или внутримышечно. 7 с.п. ф-лы, 7 ил., 1 табл.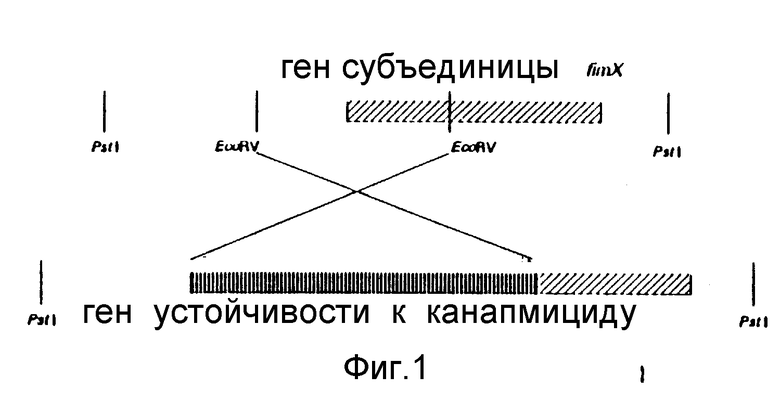
см.текст
| СПОСОБ ДИАГНОСТИРОВАНИЯ ЭЛЕКТРИЧЕСКИХ ЦЕПЕЙ, СОДЕРЖАЩИХ АКТИВНОЕ СОПРОТИВЛЕНИЕ И ИНДУКТИВНОСТЬ | 2010 |
|
RU2511599C2 |
| АНАЛОГОВЫЙ ИНТЕГРАТОР | 2014 |
|
RU2571618C1 |
| Пневматический отбрасыватель | 1929 |
|
SU15846A1 |
Авторы
Даты
1999-04-27—Публикация
1993-07-28—Подача