Изобретение относится к новым гетероциклическим амидосоединениям, обладающим превосходным антагонистическим действием к тахикининовым рецепторам, способу их получения и композиции, содержащей эти соединения.
Тахикинин является общим термином, обозначающим группу нейропептидов. У млекопитающих животных известны вещество P, нейрокинин-A, нейрокинин-B. Также известно, что путем их связывания с соответствующими рецепторами (нейрокинина-1, нейрокинина-2, нейрокинина-3), присутствующими в живом организме, эти пептиды проявляют разнообразную биологическую активность.
Среди них вещество P является одним из нейропептидов, известным на протяжении наиболее длительного времени из всех и изученным наиболее подробно. Наличие его было подтверждено в веществе, экстрагированном из кишечной нервной трубки лошадей в 1931 г., и структура пептида, состоящего из 11 аминокислот, была определена в 1971 г. Известно, что вещество P играет решающую роль в качестве медиатора как в периферической, так и в центральной нервной системе. Это вещество также, как считают, вовлечено в ряд патологических состояний (например, боль, воспаление, аллергия, частое мочеиспускание, расстройства респираторного тракта, психические расстройства и т. д.).
В качестве соединений, обладающих антагонистической активностью к рецепторам вещества P, известны следующие:
(1) в JPA HI (1989) - 287095 - соединение формулы:
R1 - A - Trp (R2) - Phe - R3,
где R1 обозначает H или аминозащищающую группу;
R2 обозначает H, амино-защищающую группу, карбамоил - (низший) алкильную группу, карбоксил (низший) алкильную группу или защищенную карбоксил (низший) алкильную группу;
R3 обозначает ар (низший) алкильную группу, группу, представленную формулой: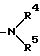
(где R4 и R5 соответственно обозначают H, арильную группу или факультативно замещенную низшую алкильную группу, или R4 и R5 связаны друг с другом с образованием сконденсированной с бензолом низшей алкиленовой группы), или группу, представленную формулой:
-OR6,
(где R6 обозначает H, арильную группу или факультативно замещенную низшую алкильную группу);
A обозначает одинарную связь или один или два аминокислотных остатка, при условии, что, если A обозначает один аминокислотный остаток, представленный - Trp-, тогда R4 не является водородом, и его соль, (2) в EP-A-436334, среди прочих, соединение представлено формулой:
(3) в EP-A-429366, среди прочих, соединение представлено формулой:
(4) в Journal of Medicinal Chemistry, 34, p. 1751 (1991), среди прочих, соединение представлено формулой:
(5) в WO 91/09844, среди прочих, соединение представлено формулой: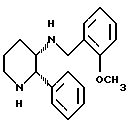
(6) в EP-A-522808, среди прочих, соединение представлено формулой: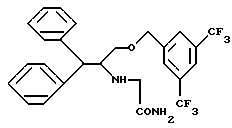
(7) в WO 93/01169, среди прочих, соединение представлено формулой: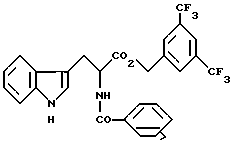
(8) в EP-A-522456, среди прочих, соединение представлено формулой: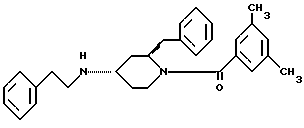
Однако не были раскрыты конденсированные гетероциклические амидосоединения, имеющие - CON<, связанную непосредственно с конденсированным гетероциклическим кольцом, которое обладает антагонистической активностью по отношению к тахикининовым рецепторам.
И для использования в качестве лекарственных средств для лечения вышеупомянутых различных заболеваний до сих пор не было обнаружено таких соединений, которые удовлетворительны с точек зрения сильной антагонистической активности к тахикининовым рецепторам, особенно антагонистической активности к рецепторам вещества P, а также другими благоприятными свойствами, такими как безопасность и достаточно длительная продолжительность действия после введения. При указанных выше обстоятельствах была желательна разработка по получению соединений, имеющих структуру, отличающуюся от структуры известных соединений, обладающих превосходной антагонистической активностью к тахикининовым рецепторам, и которые достаточно удовлетворительны в качестве терапевтических лекарственных средств для указанных заболеваний.
Данные изобретатели, принимая по внимание указанные выше обстоятельства, провели много кропотливых исследований и в результате впервые достигли успеха в синтезе, гетероциклического амидосоединения, обладающего характерной особенностью химического строения - CON<, непосредственно связанной с конденсированным гетероциклическим кольцом, и имеющего частную структуру, представляемую формулой:
где все символы имеют те же значения, которые даны здесь далее, и обнаружили, что соединение обладает неожиданно очень высокой антагонистической активностью к техикининовым рецепторам, особенно, антагонистической активностью к рецепторам субстанции P, и что оно полностью удовлетворяет требованиям к лекарственному веществу, применимому на основании его активности, тем самым, таким образом, достигнуто совершенство данного изобретения.
Формулируя более конкретно, данное изобретение касается:
(1) соединения, представляемого формулой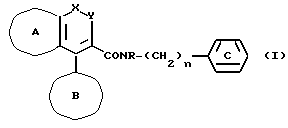
где кольцо A и кольцо B, соответственно, обозначают необязательно замещенное гомо- или гетероциклическое кольцо, и по крайней мере одно из них обозначает необязательно замещенное гетероциклическое кольцо; кольцо C обозначает необязательно замещенное бензольное кольцо;
R обозначает водородный атом или необязательно замещенный углеводородный остаток;
один из X и Y обозначает -NR1 - (R1 обозначает атом водорода или необязательно замещенный углеводородный остаток) или -O-, а другой обозначает - CO- или - CS-, или же один из них обозначает - N=, а другой обозначает - CR2-;
(R2 обозначает атом водорода, галогеновый атом, необязательно замещенный углеводородный остаток, необязательно замещенную аминогруппу или необязательно замещенную гидроксильную группу);
n обозначает 1 или 2, или его соли,
(2) соединения, которое описано выше в (1), в котором одно из колец A или B обозначает необязательно замещенное ароматическое кольцо, а другое обозначает необязательно замещенное ароматическое гетероциклическое кольцо,
(3) соединение, которое описано выше в (2), в котором заместитель или заместители необязательно замещенного ароматического кольца представляют от 1 до 4 заместителей, выбираемых из группы, состоящей из галогенового атома, необязательно галогенированной C1-4 алкильной группы, необязательно галогенированной C1-4 алкоксигруппы, необязательно галогенированных C1-4 алкилтиогрупп, C1-3 ацилоксигруппы, гидроксильной группы, аминогруппы, моно-C1-4 - алкиламиногруппы, ди-C1-4 - алкиламиногруппы, карбоксильной группы и C1-4 - алкоксикарбонильной группы,
(4) соединения, которое описано выше в (2), в котором ароматическое гетероциклическое кольцо представляет собой 5- или 6-членное кольцо, содержащее до двух видов гетероатомов, выбираемых из азота, серы или кислорода,
(5) соединения, которое описано выше в (2), в котором заместитель или заместители необязательно замещенного ароматического гетероциклического кольца представлены от 1 до 4 заместителей, выбираемых из группы, состоящей из атома галогена, необязательно галогенированной C1-4 алкильной группы, необязательно галогенированной C1-4 алкоксигруппы, необязательно галогенированной C1-4 алкилтиогруппы, C1-3 ацилоксигруппы, гидроксильной группы, аминогруппы, моно-C1-4 - алкиламиногруппы, ди-C1-4 - алкиламиногруппы, карбоксильной группы и C1-4 алкоксикарбонильной группы,
(6) соединение, которое описано выше в (1) по (5), в котором кольцо C может иметь от 1 до 3 заместителей, каждый из которых выбирается из группы, состоящей из атома галогена необязательно галогенированной C1-4 алкильной группы и необязательно галогенированной C1-4 алкокси группы,
(7) соединения, которое описано выше в с (1) по (5), в котором - X-Y - представляет собой - NR1a-CO-, -CO-NR1a - -O-CO-, -CO-O- или -N=C(R2a) - (R1a и R2a соответственно обозначают атом водорода или C1-6 алкильную группу),
(8) соединения, которое описано выше с (1) по (5), в котором R является C1-6 алкильной группой,
(9) соединения, которое описано выше с (1) по (5), в котором n является 1,
(10) соединение, которое описано выше в (1), в заместителе или заместителях произвольно замещенного гомо- или гетероциклического кольца которого находятся от 1 до 4 заместителей, выбираемых из группы, состоящей из галогенового атома, необязательно галогенированной алкильной группы, необязательно галогенированной C1-4 алкилтиогруппы, C1-3 ацилоксигруппы, гидроксильной группы, аминогруппы, моно-C1-4 - алкиламиногруппы, ди-C1-4 - алкиламиногруппы, карбоксильной группы, C1-4 алкоксикарбонильной группы и оксогруппы,
(11) соединение, которое описано выше в (1), в котором гетероциклическое кольцо является 5- или 6-членным кольцом, содержащим до двух видов гетероатомов, выбираемых из азота, серы и кислорода,
(12) соединение, которое описано выше в (1), в котором гомоциклическое кольцо является 5- или 6-членным циклическим углеводородом,
(13) соединение, которое описано выше в (1), в котором - X-Y - является -NR1a-CO-; -CO-NR1a- или -N=C(R2a)-(R1a и R2a соответственно обозначают галогеновый атом или C1-6 алкильную группу),
(14) соединение, которое описано в (1) выше, в котором гетероциклическое кольцо, представленное кольцом A или B, является 5- или 6-членным гетероциклическим кольцом, содержащим 1 или 2 гетероатома, выбираемые из азота и серы, гомоциклическое кольцо, представленное кольцом A или B, является 5 - или 6-членной циклической углеводородной группой, и гомоциклическое кольцо, представляемое кольцом A или B, соответственно может быть замещенным 1 или 2 заместителями, выбираемыми из группы, состоящей из галогенового атома и необязательно галогенированной C1-4 алкильной группы; кольцо C может быть замещенным от 1 до 3 заместителями, выбираемыми из группы, состоящей из галогенового атома, необязательно галогенированной C1-4 алкильной группы и необязательно галогенированной C1-4 алкоксигруппы,
R является атомом водорода или C1-4 алкильной группой; -X-Y - является - CO-NR1a-, -NR1a-CO или -N=C (R2a) - (R1a и R2a соответственно обозначают атом водорода или C1-4 алкильной группой); и n является 1,
(15) соединение, которое описано выше в (1), в котором кольцо A является пиридиновым кольцом; кольцо B является бензольным кольцом, которое может быть замещенным от 1 до 3 заместителями, выбираемыми из группы, состоящей из галогенового атома, необязательно галогенированной C1-4 алкильной группы и необязательно галогенированной C1-4 алкоксигруппы; кольцо C может быть замещенным от 1 до 3 заместителями, выбираемыми из группы, состоящей из галогенового атома, необязательно галогенированной C1-4 алкильной группы и необязательно галогенированной C1-4 алкоксигруппы, R является водородным атомом или C1-6 алкильной группой; X является - CO-; Y является -NR1a - (R1a обозначает атом водорода или C1-6 алкильную группу); и n является 1,
(16) N-[3,5-бис(трифторметил)бензил] -7,8-дигидро-N,7-диметил- 5-(4-метилфенил)-8-оксо-6-пиридо[3,4-b]пиридинкарбоксамид,
(17) N-[3,5-бис(трифторметил)бензил]-5-(4-фторфенил)- 7,8-дигидро-N,7-диметил-8-оксо-6-пиридо[3,4-b]пиридинкарбоксамид,
(18) N-[3,5-бис(трифторметил)бензил] -4-(4-фторфенил)-6,7 - дигидро-N, 6-диметил-7-оксо-5-тиено[2,3-c]пиридинкарбоксамид,
(19) N-[3,5-бис(трифторметил)бензил]-1,2,5,6,7,8-гексагидро- N,2,7-триметил-4-(4-метилфенил)-1-оксо-3- пиридо[3,4-c]пиридинкарбоксамид,
(20) способа получения соединения, которое описано в (1), который включает взаимодействие соединения, представленного формулой:
где все символы имеют те же значения, которые даны выше в (1) или его соли или его химически активного производного с соединением, представленным формулой: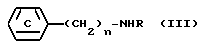
где все символы имеют те же значения, которые данные выше в (1), или его солью.
В вышеприведенной формуле кольцо A и кольцо B являются соответственно необязательно замещенным гомо- или гетероциклическим кольцом и, по крайней мере, одно из них является необязательно замещенным гетероциклическим кольцом.
"Гомо- или гетероциклическое кольцо" - это (1) ароматическое или неароматическое гетероциклическое кольцо, которые содержат, например, один или два вида гетероатомов, выбираемых из атома азота, атома серы и атома кислорода, предпочтительно, один или два из них в соединении с атомами углерода, или (11) циклический углеводород, состоящий из углеродных атомов.
В качестве "ароматического гетероциклического кольца" используется, например, 5- или 6-членное ароматическое гетероциклическое кольцо, содержащее один или два гетероатома, выбираемых из атома азота, атома кислорода и атома серы в соединении с атомами углерода (например, пиридиновое, пиразиновое, пиримидиновое, пиридазиновое, пиррольное, имидазольное, пиразольное, триазольное, тиофеновое, фурановое, тиазольное, оксазольное и изоксазольное кольцо и т.д.), предпочтительно, например, пиридиновое, пиразиновое и тиофеновое кольцо и т.д., и кроме того, тиазольное кольцо, например, является предпочтительным. Особенно обычно используются 6-членное гетероциклическое кольцо, содержащее один или два атома азота в соединении с атомами углерода, например, пиридиновое или пиразиновое кольцо и т.д., или 5-членное ароматическое гетероциклическое кольцо, содержащее один атом серы в соединении с атомами углерода, например, тиофеновое кольцо и т.д.
В качестве "неароматического гетероциклического кольца" используется 5- или 6-членное неароматическое гетероциклическое кольцо, содержащее один или два гетероатома, выбираемые из атома азота, атома кислорода и атома серы в соединении с углеродными атомами. Например, что касается кольца A, используется кольцо тетрагидропиридина, дигидропиридина, тетрагидропиразина, тетрагидропиримидина, тетрагидропиридазина, дигидропирана, дигидропиррола, дигидроимидазола, дигидропиразола, дигидротиофена, дигидрофурана, дигидротиазола, дигидроизотиазола, дигидрооксазола и дигидроизооксазола среди прочих, и что касается кольца B, используются, в дополнение к вышеупомянутым, пиперидиновое, пиперазиновое, гексагидропиримидиновое, гексагидропиридазиновое, тетрагидропирановое, морфолиновое, пирролидиновое, имидазолидиновое, пиразолидиновое, тетрагидротиофеновое и тетрагидрофурановое, тетрагидротиазольное, тетрагидроизотиазольное, тетрагидрооксазольное, тетрагидроизооксазольное кольцо и т.д. Предпочтительно, что касается кольца A, обычно используется 6-членное неароматическое гетероциклическое кольцо, содержащее один или два атома азота в соединении с атомами углерода, например, тетрагидропиримидиновое и тетрагидропиридазиновое кольцо и т.д. Особенно обычно используется, например, тетрагидропиридиновое кольцо.
Что касается кольцо B, например, используется 6-членное неароматическое гетероциклическое кольцо, содержащее один или два атома азота в соединении с атомами углерода, особенно обычно используется пиперазиновое кольцо или тому подобное.
В качестве "циклического углеводорода" используется, например, 5- или 6-членный циклический углеводород. Например, в качестве кольца A используется бензол, C5-6 циклоалкен (например, циклопентен, циклогексен и т.д.) и в качестве кольца B используется в дополнение к вышеупомянутым C5-6 циклоалкен (например, циклогексан, циклопентан и т.д.). В качестве кольца A, например, предпочтительно 6-членное гомоциклическое кольцо, такое как бензольное кольцо, циклогексеновое кольцо или тому подобное, и особенно обычно используется бензольное кольцо. В качестве кольца B предпочтительно 6-членное гомоциклическое кольцо, такое как бензольное кольцо, циклогексановое кольцо и т.д., и особенно часто используется бензольное кольцо.
Предпочтительно, чтобы когда одно из колец A или B является замещенным по выбору ароматическим кольцом, то другое представляет собой по выбору замещенное ароматическое гетероциклическое кольцо.
В качестве "ароматического кольца" используется, например, (1) 5-или 6-членное ароматическое гетероциклическое кольцо, содержащее один или два вида гетероатомов, выбираемых из атома азота, атома серы и атома кислорода, предпочтительно, один или два из них в соединении с атомами углерода (например, пиридиновое, пиразиновое, пиримидиновое, пиридазиновое, пиррольное, имидазольное, пиразольное, триазольное, тиофеновое, фурановое, тиазольное, изотиазольное, оксазольное и изооксазольное кольцо и т.д.), или (11) бензольное кольцо.
Заместители, которые необязательно имеет "ароматическое кольцо", включают таковые, сходные с заместителями, которые необязательно имеют кольца A и B, как описано в последующем.
В качестве "ароматического гетероциклического кольца" "произвольно замещенного ароматического гетероциклического кольца" используется вышеупомянутые "5- и 6-членное ароматические гетероциклические кольца".
В качестве заместителей "необязательно замещенного ароматического гетероциклического кольца" используются заместители, сходные с теми, которые необязательно имеют кольцо A и кольцо B, как описано в последующем.
Кольцо A и кольцо B являются, предпочтительно, когда одно из них представляет собой бензольное кольцо, то другое является 5- или 6-членным ароматическим гетероциклическим кольцом.
В качестве "ароматического гетероциклического кольца" используется, например, пиридиновое, пиразиновое, пиримидиновое, пиридазиновое, пиррольное, имидазольное, пиразольное, триазольное, тиофеновое, фурановое, тиазольное, изотиазольное и изоксазольное кольцо, предпочтительно, пиридиновое, пиразиновое и тиофеновое кольцо и т.д. обычно используются. И например, также предпочтительны пиррольные и тиазоловое кольца. Особенно обычно используются 6-членное содержащее N гетероциклическое кольцо, включающее один или два атома азота в соединении с атомами углерода, например, пиридиновое и пиразиновое кольцо и т.д., или 5-членное ароматическое гетероциклическое кольцо, содержащее один атом серы в соединении с атомами углерода, например, тиофеновое кольцо.
В качестве заместителей, которые могут иметь "гомо- и гетероциклическое кольцо", "ароматическое гетероциклическое кольцо", "неароматическое гетероциклическое кольцо", "циклический углеводород", "ароматическое кольцо" и "бензольное кольцо", представленное кольцом A и кольцом B, используются, например, атом галогена, произвольно замещенная алкильная группа, произвольно галогенированная алкоксигруппа, произвольно галогенированная алкилтиогруппа, C1-7 ациламиногруппа (например, формамино, ацетиламино, пропиониламино, бутириламино, бензоиламино и т.д.), C1-3 ацилоксигруппа (например, формилокси, ацетокси, пропинилокси и т.д.), гидроксильная группа, нитрогруппа, цианогруппа, аминогруппа, моно- или ди-C1-4 - алкиламиногруппа (например, метиламино, этиламино, пропиламино, диметиламино и т.д.), циклическая аминогруппа (например, 5 - 9 - членная циклическая аминогруппа, по выбору содержащая, кроме того, атом азота 1-3 гетероатома, такие как атом кислорода, атом серы и т.д., практически чаще такие, как пирролидино, пиперидино, морфолино и т.д.), C1-4 алкилкарбониламиногруппа (например, ацетиламино, пропиониламино, бутириламино и т.д.), C1-4 алкилсульфониламиногруппа (например, метилсульфониламино, этилсульфониламино и т.д.), C1-4 алкоксикарбонильная группа (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил и т. д. ), карбоксильная группа, C1-6 алкилкарбонильная группа (например, метилкарбонил, этилкарбонил, пропилкарбонил и т.д.), карбамоильная группа, моно- или ди- C1-4-алкилкарбамоильная группа (например, метилкарбамоил, этилкарбамоил, диметилкарбамоил, диэтилкарбамоил и т.д.), C1-6 алкилсульфонильная группа (например, метилсульфонил, этилсульфонил, пропилсульфонил и т.д.) и т.п. и также, например, оксогруппа.
Число заместителей составляет от 1 до 3.
В качестве "атома галогена", который может иметь кольцо A и кольцо B, используется, например, фтор, хлор, бром, иод и т.д., и предпочтительны те, которые включают фтор, хлор.
В качестве "необязательно замещенной алкильной группы", которую могут иметь кольцо A или кольцо B, обычно используется C1-6 алкильная группа (например, метил, этил, пропил, изопропил, бутил, изобутил, сек-бутил, трет-бутил и т.д.), которая может иметь от 1 до 4 заместителей, выбираемых из группы, состоящей из, например, гидроксильной группы, аминогруппы, карбоксильной группы, нитрогруппы, моно- или ди-C1-6-алкиламиногруппы (например, метиламино, этиламино, диметиламино, диэтиламино и т.д.), C1-6 алкилкарбонилоксигруппы (например, ацетокси, этилкарбонилокси и т.д.) и галогенового атома (например, фтора, хлора, брома и т.д.). Особенно предпочтительны по выбору галогенированная алкильная группа и C1-6 алкильная группа или эти группы, замещенные 1-5 таких галогеновых атомов, которые перечислены выше, примерами которых служат метил, хлорметил, дифторметил, трихлорметил, трифторметил, этил, 2-бромэтил, 2,2,2-трифторэтил, пентафторэтил, пропил, 3,3,3-трифторпропил, изопропил, 2-трифторметилэтил, бутил, 4,4,4-трифторбутил, изобутил, сек-бутил, трет-бутил, пентил, изопентил, неопентил, 5,5,5-трифторпентил, 4-трифторметилбутил, гексил, 6,6,6-трифторгексил, 5-трифторметилпентил и т.д., и предпочтительно, C1-4 алкильной группы или этой группы, замещенной 1-3 галогеновыми атомами, которые упомянуты выше, например, метил, хлорметил, дифторметил, трихлорметил, трифторметил, этил, 2-бромэтил, 2,2,2-трифторэтил, пропил, 3,3,3-трифторпропил, изопропил, 2-трифторметилэтил, бутил, 4,4,4-трифторбутил, изобутил, сек-бутил, трет-бутил и т.д.
В качестве "произвольно галогенированной алкоксигруппы", которую могут иметь кольцо A и кольцо B, обычно используется C1-6 алкоксигруппа или эта группа, замещенная 1-5 таких галогеновых атомов, которые упомянуты выше, например, метокси, дифторметокси, трифторметокси, этокси, 2,2,2-трифторэтокси, пропокси, изопропокси, бутокси, 4,4,4-трифторбутокси, изобутокси, сек-бутокси, пентокси, гексилокси и т.д., и предпочтительно, C1-4 алкоксигруппа или эта группа, замещенная 1-3 таких галогеновых атомов, которые упомянуты выше, например, метокси, дифторметокси, трифторметокси, этокси, 2,2,2-трифторэтокси, пропокси, изопропокси, бутокси, 4,4,4-трифторбутокси, изобутокси, сек-бутокси и т.д.
В качестве "произвольно галогенированной алкилтиогруппы", которой могут обладать кольцо A и кольцо B, обычно используется C1-6 алкилтиогруппа или эта группа, замещенная 1-5 таких галогеновых атомов, которые упомянуты выше, например, метилтио, дифторметилтио, трифторметилтио, этилтио, пропилтио, изопропилтио, бутилтио, 4,4,4-трифторбутилтио, пентилтио, гексилтио и т.д., и предпочтительно, C1-4 алкилтиогруппа или эта группа, замещенная 1-3 такими галогеновыми атомами, которые упомянуты выше, например, метилтио, дифторметилтио, трифторметилтио, этилтио, изопропилтио, бутилтио, 4,4,4-трифторбутилтио и т.д.
Здесь далее число галогеновых атомов в соответствии с термином "произвольно галогенированный", использованном в описании, колеблется в пределах от 1 до 5, предпочтительно от 1 до 3.
Примеры предпочтительных заместителей, которые могут иметь кольцо A и кольцо B, включают атом галогена (например, фтор, хлор, бром и т.д.), произвольно галогенированную C1-4 алкильную группу (например, метил, хлорметил, дифторметил, трихлорметил, трифторметил, этил, 2-бромэтил, 2,2,2-трифторэтил, пропил, 3,3,3-фторпропил, изопропил, 2-трифторметилэтил, бутил, 4,4,4-трифторбутил, изобутил, сек-бутил, трет-бутил и т.д.), произвольно галогенированная C1-4 алкоксигруппа (например, метокси, дифторметокси, трифторметокси, этокси, 2,2,2-трифторэтокси, пропокси, изопропокси, бутокси, 4,4,4-трифторбутокси, изобутокси, сек-бутокси и т.д.), произвольно галогенированная C1-4 алкилтиогруппа (например, метилтио, дифторметилтио, трифторметилтио, этилтио, пропилтио, изопропилтио, бутилтио, 4,4,4-трифторбутилтио и т.д.), C1-3 ацилоксигруппа (например, формилокси, ацетокси, пропионилокси и т. д. ), гидроксильная группа, аминогруппа, моно- или ди- C1-4 алкиламиногруппа (например, метиламино, этиламино, пропиламино, диметиламино, диэтиламино и т. д. ), карбоксильная группа и C1-4 алкоксикарбонильная группа (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил и т.д.), и оксогруппа.
В качестве более предпочтительных заместителей, которые могут иметь кольцо A и кольцо B, обычно используются атом галогена (например, фтор, хлор, бром и т.д.), произвольно галогенированная C1-4 алкильная группа (например, метил, хлорметил, дифторметил, трихлорметил, трифторметил, этил, 2-бромэтил, 2,2,2-трифторэтил, пропил, 3,3,3-трифторпропил, изопропил, 2-трифторметилэтил, бутил, 4,4,4-трифторбутил, изобутил, втор-бутил, трет-бутил и т.д.), произвольно галогенированная C1-4 алкоксигруппа (например, метокси, дифторметокси, трифторметокси, этокси, 2,2,2-трифторэтокси, пропокси, изопропокси, бутокси, 4,4,4-трифторбутокси, изобутокси, сек-бутокси и т.д.), гидроксильная группа, аминогруппа, моно- или ди- C1-4-алкиламиногруппа (например, метиламино, этиламино, пропиламино, диметиламино, диэтиламино и т.д.), C1-3 ацилоксигруппа (например, формилокси, ацетокси, пропионилокси и т.д.), оксогруппа и т.д. Среди них особенно обычно используются атом галогена (например, фтор, хлор, бром и т.д.), произвольно галогенированная C1-4 алкильная группа (например, метил, хлорметил, дифторметил, трихлорметил, трифторметил, этил, 2-бромэтил, 2,2,2-трифторэтил, пропил, 3,3,3-трифторпропил, изопропил, 2-фторметилэтил, бутил, 4,4,4-трифторбутил, изобутил, втор-бутил, трет-бутил и т. д. ) и произвольно галогенированные C1-4 алкоксигруппы (например, метокси, дифторметокси, трифторметокси, этокси, 2,2,2-трифторэтокси, пропокси, изопропокси, бутокси, 4,4,4-трифторбутокси, изобутокси, втор-бутокси и т.д.) и т.д.
Заместители в кольце A и кольце B могут помещаться в любом замещаемом положении колец, и когда присутствуют два или более заместителей, они являются одинаковыми или различными, и их число может меняться от 1 до 4. Предпочтительно, число заместителей составляет от 1 до 3.
Когда кольцо A и/или кольцо B имеют атом азота, они могут необязательно образовывать четвертичную аммониевую соль, например, они могут необязательно образовывать соли с анионом, например, галогеновым ионом (например, Cl-, Br-, I- и т.д.), сульфатным ионом, гидроксильным ионом и т.д.
В качестве предпочтительных вариантов, когда кольцо A представляет собой гомоциклическое кольцо, состоящее из атомов углерода (здесь далее ...... обозначает одинарную или двойную связь), используются группы, в частности, представляемые формулой: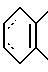
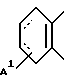
где A1 обозначает галогеновый атом, такой как фтор, хлор и т.д., произвольно галогенированную C1-4 алкильную группу, такую как метил, этил, изопропил, трифторметил и т.д., или произвольно галогенированную C1-4 алкоксигруппу, такую как метокси, трифторметокси, этокси и т.д., или формулу
где A2 и A3, независимо, обозначают галогеновый атом, такой как фтор, хлор и т.д., произвольно галогенированную C1-4 алкильную группу, такую как метил, этил, изопропил, трифторметил и т.д. или произвольную галогенированную C1-4 алкоксигруппу, такую как метокси, трифторметокси, этокси и т.д.
В более предпочтительных примерах, в частности, используются бензольное кольцо, представляемое формулой
или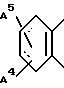
где A4 и A5 независимо обозначают галогеновый атом, такой как фтор, хлор, и т.д. или произвольно галогенированную C1-4 алкильную группу, такую как метил, трифторметил, этил, изопропил и т.д.
И обычно используются в качестве произвольно замещенного бензольного кольца, например, следующие
или
особенно
или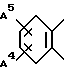
где каждый символ имеет то же самое значение, которое дано выше.
Из этих представленных выше формул, особенно предпочтительны среди других те, где
(1) AI является галогеновым атомом (например, фтора, хлора и т.д.) или произвольно галогенированной C1-4 алкильной группой (например, метилом, трифторметилом, этилом, изопропилом и т.д.),
(2) A2 и A3 являются, независимо, произвольно галогенированной C1-4 алкильной группой (например, метилом, трифторметилом, этилом, изопропилом и т. д. ) или произвольно галогенированной C1-4 алкоксигруппой (например, метокси, трифторметокси, этокси и т.д.),
(3) A4 и A5 является, независимо, C1-4 алкильной группой (например, метилом, этилом, изопропилом и т.д.),
(4) A1 представляет собой галогеновый атом (например, фтор, хлор и т.д. ),
(5) A2 и A3 являются, независимо, C1-4 алкоксигруппой (например, метокси, этокси и т.д.).
Примеры предпочтительных вариантов ароматического или неароматического гетероциклического кольца, представляемых кольцом A, включают 5 - или 6 - членные ароматические или неароматические кольца, такие как пиридиновое, пиразиновое, тиофеновое, тетрагидропиридиновое, пиррольное и тиазольное кольцо. В качестве конкретных примеров обычно используются следующие: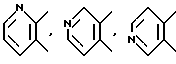

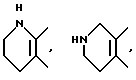
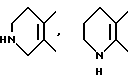
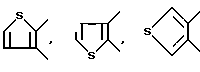
и так далее.
Кроме того, среди прочих, предпочтительны следующие: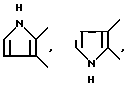
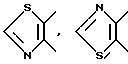
и так далее.
В качестве предпочтительных вариантов произвольно замещенных ароматических или неароматических гетероциклических колец приводятся пиридиновое, пиразиновое, тиофеновое, тетрагидропиридиновое, пиррольное и тиазольное кольца и т.д., которые по выбору имеют один или два заместителя, выбираемые из оксогруппы, произвольно замещенной алкильной группы (имеющей то же самое значение, которое дано для заместителей, возможных для кольца A и кольца B), C6-10 арильной группы (например, фенил и т. д. ) и галогенового атома (например, фтора, хлора, брома и т.д.). Более конкретно, предпочтительны те, среди прочих, которые имеют следующие формулы: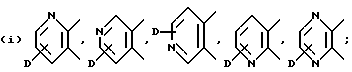
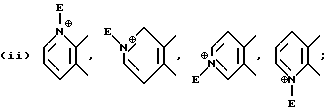
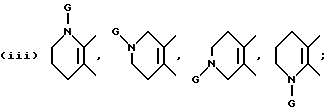
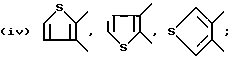
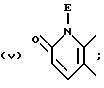

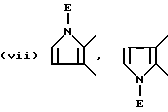
или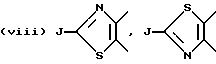
где D обозначает атом водорода, галогеновый атом (например, фтора, хлора, брома и т.д.); E обозначает C1-4 алкильную группу (например, метил, этил, пропил, изопропил и т.д.), соединение, имеющее частичное строение, представляемое (II) формами четвертичной соли аммония, соединенной вместе с галогеновым ионом (например, Cl-, Br-, I- и т.д.) , сульфатным ионом или гидроксильным ионом и т.д.; G обозначает, предпочтительно, атом водорода или C1-4 алкильную группу (например, метил, этил, пропил, изопропил и т.д.); обозначает атом водорода, C1-4 алкильная группа (например, метил, этил, пропил, изопропил и т.д.) или C6-10 арильную группу (например, фенил и т.д. ). Кольцо A более предпочтительно, является пиридиновым кольцом.
В качестве предпочтительного гомоциклического кольца, когда кольцо B состоит из углеводородных атомов (здесь далее ... обозначает одинарную или двойную связь), используются такие группы, которые представлены, например, формулой:
где B1 обозначает галогеновый атом, такой как фтор, хлор и т.д., произвольно галогенированную C1-4 алкильную группу, такую как метил, трифторметил, этил, изопропил и т.д., или произвольно галогенированную алкоксигруппу, такую как метокси, трифторметокси, этокси и т.д., формулу:
где B2 и B3, независимо, обозначают галогеновый атом, такой как фтор, хлор и т.д., произвольно галогенированную C1-4 алкильную группу, такую как метил, трифторметил, этил, изопропил и т.д., или произвольно галогенированную C1-4 алкоксигруппу, такую как метокси, трифторметокси, этокси и т.д., или формулу:
где B4, B5 и B6, независимо, обозначают галогеновый атом, такой как фтор, хлор и т.д., произвольно галогенированную C1-4 алкильную группу, такую как метил, трифторметил, этил, изопропил и т.д., или произвольно галогенированную C1-4 алкоксигруппу, такую как трифторметокси, этокси и т.д.
Более предпочтительно, используются группы, представляемые формулой:
или
где B7, B8 и B9, независимо, обозначают галоген, такой как фтор, хлор и т. д. , произвольно галогенированную C1-4 алкильную группу, такую как метил, трифторметил, этил, изопропил и т. д., или C1-4 алкоксигруппу, такую как метокси, трифторметокси, этокси, и т.д., и т.д.
Особенно обычно используются группы, представляемые формулами:
или
где B10 обозначает галогеновый атом, такой как фтор, хлор и т.д.
C1-4 алкильную группу, такую как метил, трифторметил, этил и т.д. или C1-4 алкоксигруппу, такую как метокси, трифторметокси, этокси и т.д.
А также предпочтительно, что когда кольцо B является произвольно замещенным бензольным кольцом, группы, например, представлены формулами:
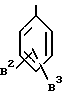
или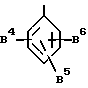
кроме того, предпочтительно, группы представлены формулами: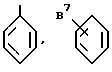
или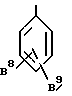
особенно предпочтительны группы, представленные формулами: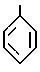
или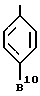
где все символы имеют те же самые значения, которые даны выше.
Среди заместителей в вышеупомянутых формулах особенно предпочтительные включают:
(1) B1, B2, B3, B4, B5 и B6 независимо обозначают атом галогена (например, фтора, хлора и т.д.) или произвольно галогенированную C1-4 алкильную группу (например, метил, трифторметил, этил, изопропил и т.д.),
(2) B1, B2, B3, B4, B5 и B6 независимо, обозначают произвольногалогенированную C1-4 алкоксигруппу (например, метокси, трифторметокси, этокси и т.д.),
(3) B7, B8 и B9 обозначают галогеновый атом (например, фтор, хлор и т.д. ),
(4) B10 обозначает атом фтора и
(5) B10 обозначает C1-4 алкильную группу (например, метил и т.д.)
Более предпочтительны те, которые включают
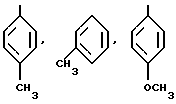
и т.д.
В качестве предпочтительных по выбору замещенных ароматических или неароматических гетероциклических колец, представляемых кольцом B, приводятся, например, 5- или 6-членные ароматические и неароматические гетероциклические кольца. Эти кольца могут иметь заместители, которые приведены в качестве предпочтительных примеров для указанного выше кольца A.
Особенно предпочтительны, например, те заместители, которые представлены формулами:
или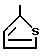
и они обычно используются.
Когда кольцо A и/или кольцо B являются (ются) гетероциклическими кольцами, также предпочтительно незамещенное гетероциклическое кольцо.
В вышеприведенных формулах кольцо C обозначает произвольно замещенное бензольное кольцо. Бензольное кольцо может иметь одинаковых или различных от 1 до 5 заместителей, предпочтительно 1-3. И эти кольца имеют заместители в произвольных положениях. Примеры таких заместителей включают произвольно галогенированную C1-4алкильную группу (например, метил, хлорметил, дифторметил, трихлорметил, трифторметил, этил, 2-бромэтил, 2,2,2-трифторэтил, пропил, изопропил, 3,3,3-трифторпропил, бутил и т.д.), C1-4алкильную группу, замещенную аминогруппой (например, аминометил, 2-аминоэтил и т. д. ), C1-4алкильную группу, замещенную моно- или ди-C1-4-алкиламиногруппой (например, метиламинометил, диметиламинометил, 2-метиламиноэтил, 2-диметиламиноэтил и т.д.), C1-4алкильную группу, замещенную карбоксильной группой (например, карбоксиметил, карбоксиэтил и т.д.), C1-4алкильную группу, замещенную C1-4алкоксикарбонильной группой (например, метоксикарбонилэтил, этоксикарбонилэтил и т.д.), C1-4алкильную группу, замещенную гидроксильной группой (например, гидроксиметил, гидроксиэтил и т.д.), C1-4алкильную группу, замещенную C1-4алкоксикарбонильной группой (например, метоксиметил, метоксиэтил, этоксиэтил и т.д.), C3-6циклоалкильную группу (например, циклопропил, циклобутил, циклопентил, циклогексил и т. д. ), галогеновый атом (например, фтор, хлор, бром, иод и т.д.), нитрогруппу, цианогруппу, гидроксильную группу, произвольно галогенированную C1-4алкоксигруппу (например, метокси, дифторметокси, трифторметокси, этокси, 2,2,2-трифторэтокси, пропокси, бутокси, изопропилокси и т.д.), произвольно галогенированную C1-4алкилтиогруппу (например, метилтио, дифторметилтио, трифторметилтио, этилтио, пропилтио, изопропилтио, бутилтио и т.д.), аминогруппу, моно- или ди-C1-4-алкиламиногруппу (например, метиламино, этиламино, пропиламино, диметиламино, диэтиламино и т.д.), циклическую аминогруппу (например, 5-9-членная циклическая аминогруппа, необязательно содержащая от 1 до 3 гетероатомов, таких как атом кислорода, и атом серы, кроме того, атом азота, конкретно, например, пирролидино, пиперидино, морфолино и т.д.), C1-4алкилкарбониламиногруппу (например, ацетиламино, пропиониламино, бутириламино и т.д.), аминокарбонилоксигруппу, моно- или ди-C1-4алкиламинокарбонилоксигруппу (например, метиламинокарбонилокси, этиламинокарбонилокси, диметиламинокарбонилокси, диэтиламинокарбонилокси и т.д.), C1-4алкилсульфониламиногруппу (например, метилсульфониламино, этилсульфониламино, пропилсульфониламино и т. д. ), C1-4алкоксикарбонильную группу (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, изобутоксикарбонил и т. д. ), бензилоксикарбонильную группу, карбоксильную группу, C1-6алкилкарбонильную группу (например, метилкарбонил, этилкарбонил, бутилкарбонил и т.д.), C3-6циклоалкилкарбонильную группу (например, циклогексилкарбонил и т.д.), карбамоильную группу, моно- или ди-C1-4-алкилкарбамоильную группу (например, метилкарбамоил, этилкарбамоил, пропилкарбамоил, бутилкарбамоил, диэтилкарбамоил, дибутилкарбамоил и т.д.), C1-6алкилсульфонильную группу (например, метилсульфонил, этилсульфонил, пропилсульфонил и т.д.).
Кроме того, существует также вариант, когда кольцо C замещено, в частности, 5- или 6-членной ароматической моногетероциклической группой (например, фурилом, тиенилом, оксазолилом, изоксазолилом, тиазолилом, изотиазолилом, имидазолилом, пиразолилом, 1,2,3-оксадиазолилом, 1,2,4-оксадиазолилом, 1,3,4-оксадиазолилом, фуразанилом, 1,2,3-тиадиазолилом, 1,2,4-тиадиазолилом, 1,3,4-тиадиазолилом, 1,2,3-триазолилом, 1,2,4-триазолилом, тетразолилом, пиридилом, пиридазинилом, пиримидинилом, пиразинилом, триазинилом и т.д.), 5- или 6-членная ароматическая моно- гетероциклическая группа может быть замещена, например, от одной до трех произвольно галогенированными C1-4алкильными группами (например, метильными, хлорметильными, дифторметильными, трихлориметильными, трифторметильными, этильными, изопропильными и т. д.).
В качестве предпочтительных заместителей в кольце C приводятся произвольно галогенированная C1-4алкильная группа (например, метил, хлорметил, дифторметил, трихлорметил, трифторметил, этил, 2-бромэтил, 2,2,2-трифторэтил, пропил, изопропил, 3,3,3-трифторпропил и т.д.), атом галогена (например, фтора, хлора, брома и т.д.), нитрогруппа, гидроксильная группа, произвольно галогенированная C1-4алкоксигруппа (например, метокси, дифторметокси, трифторметокси, этокси, 2,2,2-трифторэтокси, пропокси и т.д.), аминогруппа, C1-4алкильная группа, замещенная моно- или ди-C1-4алкиламиногруппа (например, метиламинометил, диметиламинометил и т. д. ), моно- или ди-C1-4-алкиламиногруппа (например, метиламино, этиламино, диметиламино, диэтиламино и т.д.), C1-4алкоксикарбонильная группа (например, метоксикарбонил, этоксикарбонил и т.д.), карбоксильная группа и карбамоильная группа и т.д., особенно обычно используются произвольно галогенированная C1-4алкильная группа (например, метил, хлорметил, дифторметил, трихлорметил, трифторметил, этил, 2-бромэтил, пропил, изопропил и т.д.), галогеновый атом (например, фтор, хлор, бром и т.д.) и произвольно галогенированная C1-4алкоксигруппа (например, метокси, трифторметокси, этокси, пропокси и т.д.). Число этих заместителей колеблется, предпочтительно, от 1 до 3.
В качестве более предпочтительного кольца C используется бензольное кольцо произвольно замещенное от 1 до 3 заместителями, выбираемыми из группы, состоящей из, например, галогенового атома (например, хлора, фтора, брома и т.д.), произвольно галогенированной C1-4алкильной группы (например, метила, трифторметила, этила, изопропила и т.д.), произвольно галогенированной C1-4алкоксигруппы (например, метокси, трифторметокси, этокси и т.д.), ди-C1-4-алкиламиногруппы (например, диметиламино и т.д.), C1-3ацилоксигруппы (например, ацетокси и т.д.) и гидроксильной группы. Более конкретно, используется произвольно замещенное бензольное кольцо, представленное, например, формулой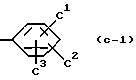
где C1, C2 и C3 независимо обозначают атом водорода, галогеновый атом (например, фтора, хлора, брома и т. д. ), произвольно галогенированную C1-4алкильную группу (например, метил, трифторметил, этил, изопропил, т-бутил и т.д.), произвольно галогенированную C1-4алкоксигруппу (например, метокси, трифторметокси, этокси, пропокси и т.д.), моно или ди-C1-4алкиламиногруппу (например, метиламино, этиламино, диметиламино, диэтиламино и т. д.), C1-3ацилоксигруппу (например, ацетокси и т.д.) или гидроксильную группу, или формулу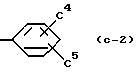
где C4 и C5 независимо обозначают атом водорода, галогеновый атом (например, фтор, хлор, бром и т.д.), произвольно галогенированную C1-4алкильную группу (например, метил, трифторметил, этил, изопропил, т-бутил и т.д.) или произвольно галогенированную C1-4алкоксигруппу (например, метокси, трифторметокси, этокси, пропокси и т.д.). Более предпочтительно использовать бензольные кольца, например, такие, как в вышеупомянутых формула (C-1), (C-2),
(1) C1, C2 и C3 независимо обозначают атом галогена, произвольно галогенированную C1-4алкильную группу или произвольно галогенированные C1-4алкоксигруппы.
(2) C1, C2 и C3 независимо обозначают галогеновый атом или произвольно галогенированную C1-4алкильную группу,
(3) C1, C2 и C3 независимо обозначают атом галогена,
(4) C1, C2 и C3 независимо обозначают произвольно галогенированную C1-4алкильную группу,
(5) C1, C2 и C3 независимо обозначают произвольно галогенированную C1-4алкоксильную группу,
(6) C4 и C6 независимо обозначают галогеновый атом,
(7) C4 и C5 независимо обозначают произвольно галогенированную C1-4алкильную группу или
(8) C4 и C5 независимо обозначают произвольно галогенированную C1-4алкоксигруппу.
В (1) - (8), в качестве примеров "произвольно галогенированной C1-4алкильной группы" приводятся метил, трифторметил, этил, пропил, изопропил и т.д.; в качестве примеров "произвольно галогенированной C1-4алкоксигруппы" приводятся метокси, трифторметокси, этокси, пропокси и т. д.; и в качестве примеров "атомов галогена" приводятся фтор, хлор, бром и т. д.
В качестве более предпочтительного кольца C используется бензольное кольцо, например, такое, как в вышеупомянутых формулах (C-1) и (C-2),
(a) C1, C2 и C3 одновременно обозначают фтор, метил, изопропил или метоксигруппу,
(b) или один из C4 и C5 обозначает атом водорода, а другой обозначает метоксигруппу,
(c) C1, C2 и C3 одновременно обозначают фтор,
(d) C4 и C5 одновременно обозначают изопропил или
(e) C4 и C5 обозначают трифторметильную группу.
В качестве предпочтительных примеров кольца A и кольца B приводятся такие, в которых одно из колец, A или B, является 5- или 6-членным гетероциклическим кольцом, содержащим один или два гетероатома, выбираемых из атома азота, атома серы в соединении с атомами углерода (например, пиридин, пиразин, тиофен, тетрагидропиридин, пиперидин, пиперазин и т.д.), которые может быть замещено C1-4алкильной группой (например, метилом, этилом, изопропилом и т.д.), а другое является бензольным кольцом, произвольно замещенным от одного до трех заместителями, выбираемыми из группы, состоящей из галогенового атома (например, фтора, хлора, брома и т.д.), произвольно галогенированной C1-4алкильной группой (например, метила, трифторметила, этила, пропила, изопропила и т. д. ) и произвольно галогенированной C1-4алкоксигруппы (например, метокси, трифторметокси, этокси, пропокси, изопропокси и т.д.).
В качестве предпочтительных примеров кольца A и кольца B приводятся те, в которых одно из колец, A или B, является 5- или 6-членным ароматическим гетероциклическим кольцом, содержащим один или два гетероатома, выбираемых из атома азота или атома серы в соединении с атомами углерода, и другое является бензольным кольцом, произвольно замещенным от одного до трех заместителей, выбираемых из группы, состоящей из галогенового атома (например, хлора, брома и т. д. ), произвольно галогенированной C1-4алкильной группы (например, метила, трифторметила, этила, пропила, изопропила и т.д.) и произвольно галогенированной C1-4алкоксигруппы (например, метокси, трифторметокси, этокси, пропокси, изопропокси и т.д.).
В вышеприведенных формулах один из X и Y является -NR1- (R1 обозначает атом водорода или произвольно замещенный углеводородный остаток) или -O-, а другой является -CO- или -C-; или один из них является -N=, а другой - =CR2- (R2 обозначает атом водорода, галогеновый атом, произвольно замещенный углеводородный остаток, по выбору замещенную аминогруппу или произвольно замещенную гидроксильную группу). Предпочтительно, в качестве - X-Y - приводятся - NR1a-CO-, -CO-NR1a - (R1a обозначает водородный атом или C1-6алкильную группу, такую как метил, пропил, изопропил, бутил, изобутил, сек-бутил, трет-бутил и т. д.), -O-CO-, -CO-O- или -N=C- (R2a) - (R2a обозначает атом водорода или C1-6алкильную группу, такую как метил, этил, пропил, изопропил, бутил, изобутил, сек-бутил, трет-бутил и т.д.), более предпочтительно, -CO-NR1a-, -NR1a - CO - (R1a имеет то же самое значение, которое дано выше), -N= C(R2a) - (R2a имеет то же самое значение, которое дано выше). Особенно предпочтительна - CO-NR1a - (R1a имеет то же самое значение, которое дано выше).
В качестве вышеупомянутого "атома галогена" приводятся, например, фтор, хлор, бром, иод и т.д., предпочтительно, например, фтор, хлор и т.д. обычно используются.
В качестве вышеприведенного(ой) "углеводородного остатка (или группы)" используется группа, полученная в результате удаления атома водорода от атома углерода в углеводороде.
"Углеводородный (ая) остаток (или группа)" включают алкильную группу, алкенильную группу, алкинильную группу, циклоалкильную группу и арильную группу и т. д., предпочтительно, алкильная группа, циклоалкильная группа и арильная группа, особенно предпочтительно алкильная группа, обычно используются.
В качестве "алкильной группы" используются C1-6 алкильная группа с прямой или разветвленной цепью, C1-4алкильная группа с прямой или разветвленной цепью, такие как метил, этил, пропил, изопропил, бутил, изобутил, сек-бутил, трет-бутил и т.д.
В качестве "алкенильной группы" используются C2-6алкенильная группа, такая как этенил, пропенил, изопропенил, бутенил, изобутенил, сек-бутенил и т. д. , предпочтительно C2-4алкенильная группа, такая как этенил, пропенил, изопропенил и т.д.
В качестве "алкильной группы" используется C2-6алкинильная группа, такая как этинил, пропинил, изопропинил, бутинил, изобутинил, сек-бутинил и т.д., предпочтительно C2-4алкильная группа, такая как этинил, пропинил, изопропинил и т.д.
В качестве "циклоалкильной группы" используется C3-8циклоалкильная группа, такая как циклопропил, циклобутил, циклопентил, циклогексил и т.д., предпочтительно, C3-6циклоалкильная группа, такая как циклопропил, циклобутил и т.д.
В качестве "циклоалкил-алкильной группы" используется C3-6циклоалкил C1-4алкильная группа, такая как циклопропилметил, циклопропилэтил и т.д.
В качестве "арильной группы" используется C6-14арильная группа, такая как фенил, 1-нафтил, 2-нафтил, антрил, фенантрил и т.д., предпочтительно, C6-10арильная группа, такая как фенил, 1-нафтил, 2-нафтил и т.д., особенно обычно используется фенил.
В качестве заместителей, которые может иметь "углеводородный остаток (или группа)" используются от одного до пяти, предпочтительно один или более (предпочтительно от 1 до 3) из заместителей, выбираемых из группы, состоящей из, например, атома галогена (например, фтора, хлора, брома, йода и т.д.), нитрогруппы, цианогруппы, гидроксильной группы, C1-4алкоксигруппы (например, метокси, этокси, пропокси, бутокси, изопропокси и т.д.), C1-4алкилтиогруппы (например, метилтио, этилтио, пропилтио и т.д.), аминогруппы, моно-, ди- или три-C1-4алкиламиногруппы (например, метиламино, этиламино, пропиламино, диметиламино, диэтиламино, триэтиламино и т.д.), циклической аминогруппы (например, 5-9-членной циклической аминогруппы по выбору, содержащей, кроме атома азота, от 1 до 3 гетероатомов, таких как атом кислорода, атом серы и т. д. , практически, например, пирролидино, пиперидино, морфолино и т.д.), C1-4алкилкарбониламиногруппы (например, ацетиламино, пропиониламино, бутириламино и т. д.), C1-4алкилсульфониламиногруппы (например, метилсульфониламино, этилсульфониламино и т.д.), C1-4алкоксикарбонильной группы (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил и т.д.), карбоксильной группы, C1-6алкилкарбонильной группы (например, метилкарбонил, пропилкарбонил и т.д.), карбамоильной группы, моно- или ди-C1-4алкилкарбамоильной группы (например, метилкарбамоил, этилкарбамоил и т.д.), C1-6алкилсульфонильной группы (например, метилсульфонил, этилсульфонил, пропилсульфонил и т.д.), фенильной группы, которая может быть замещена C1-3алкоксигруппой (например, фенил, метоксифенил, этоксифенил и т.д.), среди прочих.
Предпочтительные примеры заместителей, которые может иметь вышеупомянутый "углеводородный остаток (или группа)", включают гидроксильную группу, C1-4алкоксигруппу (например, метокси, этокси, пропокси и т.д.), аминогруппу, моно или ди-C1-4алкиламиногруппу (например, метиламино, этиламино, диэтиламино и т. д. ), C1-4алкоксикарбонильную группу (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил и т.д.), карбоксильную группу, карбамоильную группу и фенильную группу, особенно обычно используются карбоксильная группа, карбамоильная группа и т.д.
В качестве вышеупомянутой "по выбору замещенной гидроксильной группы" приводится, например, гидроксильная группа, C1-4алкоксигруппа (например, метокси, этокси, пропокси, изопропокси, бутокси, трет-бутокси и т.д.), C6-10арилоксигруппа (например, фенилокси, нафтилокси и т.д.), C1-4алкилкарбонилоксигруппа (например, формилокси, ацетокси, пропионилокси и т.д.) и C6-10арилкарбонилоксигруппа (например, бензилокси, нафтилокси и т.д. ), предпочтительно C1-4алкоксигруппа (например, метокси, этокси, пропокси, изопропокси и т.д.) обычно используются.
В качестве заместителей, которые могут иметь эти группы, используются такие, которые по существу являются теми же самыми, что и заместители вышеупомянутого (ой) "произвольно замещенного углеводородного остатка (или группы)", особенно обычно используется галогеновый атом (например, фтор, хлор, бром и т.д.).
В качестве вышеупомянутой "произвольно замещенной аминогруппы" приводятся, среди прочих, аминогруппа, которая может быть замещена от одного до трех заместителями, выбираемыми из группы, состоящей из (I) C1-4алкильной группы (например, метил, этил, пропил, изопропил и т.д.), (II) C1-4алкилкарбонильной группы (например, ацетил, пропионил, бутирил и т.д.), (III) C1-4алкоксикарбонильной группы (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил и т.д.), (IV) фенильной группы, (V) C1-4алкилфенильной группы (например, 4-метилфенил, 3-метилфенил, 2-метилфенил и т.д.), (VI) галогенированной фенильной группы (например, 4-хлорфенил, 3-хлорфенил, 2-хлорфенил и т. д. ) и (VII) C1-4алкоксифенильной группы (например, 4-метоксифенил, 3-метоксифенил, 2-метоксифенил и т.д.); особенно обычно используется аминогруппа, моно- и ди-C1-4алкиламиногруппа (например, метиламино, этиламино, пропиламино, диметиламино, диэтиламино и т.д.).
В качестве R1 предпочтительны C1-4 группы (например, метил, этил, пропил, изопропил и т.д.), особенно предпочтительна метильная группа.
В качестве R2 предпочтителен атом водорода.
В вышеприведенной формуле R обозначает атом водорода или произвольно замещенный углеводородный остаток.
В качестве "произвольно замещенного (ой) углеводородного (ой) остатка (или группы)", представленной R, используются остатки, подобные описанным для R1 и R2. В качестве R предпочтительны атом водорода или C1-6алкильная группа (например, метил, этил, пропил, изопропил и т.д., особенно метил и т. д.), особенно обычно используется атом водорода. В вышеприведенной формуле n обозначает 1 или 2, и вариант, когда n = 1, предпочтителен.
В качестве соединений (I) этого изобретения предпочтительны те, в которых одно из колец A или B является 5- или 6-членным гетероциклическим кольцом, содержащим гетероатомы, выбираемые из атома азота или атома серы, в соединении с атомами углерода, а другое является бензольным кольцом, эти кольца могут иметь один или два заместителя, выбираемых из группы, состоящей из галогенового атома и произвольно галогенированной C1-4алкильной группы;
кольцо C является бензольным кольцом, которое может быть замещенным от одного до трех заместителями, выбираемыми из группы, состоящей из галогенового атома, произвольно галогенированной C1-4алкильной группы и произвольно галогенированной C1-4алкоксигруппы;
R обозначает атом водорода или C1-6алкильную группу; -X-Y- является -CO-NR1a, -NR1a-CO- или -N=C(R2a) -(R1a и R2a соответственно обозначают атом водорода или C1-6алкильную группу); и n обозначает 1, или предпочтительны их фармацевтически приемлемые соли.
В качестве "5- или 6-членного гетероциклического кольца" приводятся, например, пиридин, пиразин, пиррол, тиофен, тиазол, тетрагидропиразин, пиперидин и т.д.,
и в качестве кольца A приводятся, конкретно, те, которые представлены формулами: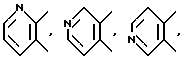
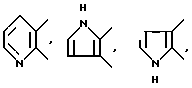

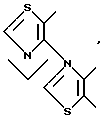
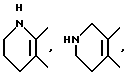
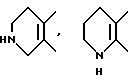
и так далее.
В качестве кольца B приводятся представляемые формулами: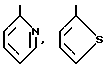
и так далее.
В качестве "атома галогена" приводятся, например, фтор, хлор, бром и т. д. В качестве "произвольно галогенированной C1-4алкильной группы" приводится, например, метил, хлорметил, дифторметил, трифторметил, трихлорметил, этил, 2-бромэтил, 2,2,2-трифторэтил, пропил, 3,3,3-трифтопропил, изопропил, 2-трифторметилэтил, бутил, 4,4,4-трифторбутил, изобутил, втор-бутил, трет-бутил и т.д.
В качестве "произвольно галогенированной C1-4алкоксигруппы" приводится, например, метокси, дифторметокси, трифторметокси, этокси, 2,2,2-трифторэтокси, пропокси, изопропокси, бутокси, 4,4,4-трифторбутокси, изобутокси, втор-бутокси и т.д. В качестве "C1-6алкильной группы" приводится, например, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил.
И примеры предпочтительных соединений включают также те, в которых кольцо A является 5- или 6-членное гетероциклическое кольцо, содержащее один атом азота или азотный атом в соединении с атомами углерода, представляемые, например, формулами: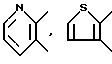
Кольцо B является бензольным кольцом, необязательно имеющим от 1 до 3 заместителей, выбираемых из группы, состоящей из галогенового атома (например, фтор, хлор и т.д.) и C1-4алкильной группы (например, метил, трифторметил, этил, пропил, изопропил и т.д.);
Кольцо C является бензольным кольцом, необязательно имеющим от 1 до 3 заместителей, выбираемых из группы, состоящей из галогенового атома (имеющего то же самое значение, что и выше), произвольно галогенированной C1-4алкильной группы (имеющей то же самое значение, что и выше) и C1-4алкоксигруппы (например, метокси, трифторметокси, этокси, пропокси, изопропокси и т.д.);
R является атомом водорода или C1-6алкильной группой (например, метил, этил, пропил, изопропил и т.д.);
-X-Y - является -CO-NR1a - (R1a обозначает атом водорода или C1-6алкильную группу, такую как метил, этил, пропил, изопропил и т.д.) и n обозначает 1.
Соединение (I) этого изобретения имеет, теоретически, изомеры на основе стерической конфигурации амидогруппы боковой цепи "-CONR(CH2)n-", и/или ротационные изомеры кольца B. Поскольку эти изомеры могут, в зависимости от вида, быть выделены, они включены в данное изобретение.
Когда соединение (I) образует соль, и она используется в качестве фармацевтического продукта, предпочтительно соль является фармацевтически приемлемой.
Примеры таких фармацевтически приемлемых солей включают такие, как соли с неорганическими кислотами, такие как гидрохлорид, сульфат, фосфат, дифосфат, гидробромид и нитрат, или соли с органическими кислотами, такие как ацетат, малат, малеат, фумарат, татрат, сукцинат, цитрат, лактат, метансульфонат, п-толуолсульфонат, пальмитат, салицилат и стеарат, но не ограничиваются этими солями.
Соединение (I) или его соли данного изобретения могут быть получены, например, когда дают возможность карбоновой кислоте, представляемой соединением (II), или ее соли, или ее реакционноспособному производному прореагировать с соединением (III) или его солью (реакция образования амидосвязывания). Например, в случае, когда соединение (III) или его соли (например, солям с неорганическими кислотами, такими как соляная кислота, серная кислота и т.д., или соли с органическими кислотами, такими как метансульфоновая кислота, бензолсульфоновая кислота, толуолсульфоновая кислота, щавелевая кислота, фумаровая кислота, малеиновая кислота и т.д.), дают прореагировать с соединением (II) или его солью (например, солями со щелочным или щелочноземельным металлами, такими как натрий, калий, магний и т.д., в основном, предпочтительно использовать подходящий конденсирующий агент, или соединение (II) или его соль сначала превращаются в реакционноспособное их производное, которому затем дают прореагировать с соединением (III) или его солью. В качестве конденсирующего средства используется, например, дициклогексилкарбодиимид, 1-этил-3-(3-диметиламинопропил)карбодиимид, диэтилцианофосфат, дифенилфосфорилазид и т.д. В случае использования этих конденсирующих средств особенно предпочтительно проводить реакцию в растворителе (например, эфирах простых, эфирах сложных, галогенированных углеводородах, углеводородах, амидах, сульфоксидах и т.д., таких как тетрагидрофуран, диоксан, диметоксиэтан, этилацетат, дихлорметан, 1,2-дихлорэтан, бензол, толуол, N,N-диметилформамид, диметилсульфоксид и т.д.). Эта реакция может проводиться в присутствии основания для ускорения реакции при температурах, находящихся в пределах примерно от -10oC до 100oC, предпочтительно от примерно 0oC до 60oC. Время реакции колеблется в пределах обычно от 1 до 96 часов, предпочтительно от 1 до 72 часов. Количества соединения (III) или его соли и конденсирующего средства находятся в пределах соответственно от 1 до 5 молярных эквивалентов, предпочтительно от 1 до 3 молярных эквивалентов на 1 моль соединения (II) или его соли. В качестве основания используются, например, алкиламины, такие как триэтиламин и т.д., циклические амины, такие как N-метилморфолин, пиридин и т.д., и количество его, которое необходимо применять, колеблется в пределах от 1 до 5 молярных эквивалентов, предпочтительно, от 1 до 3 молярных эквивалентов на 1 моль соединения (II) или его соли.
В качестве реакционноспособных производных соединений (II) используются, например, галогенангидриды (например, хлорид, бромид и т.д.), ангидриды карбоновых кислот, смешанные ангидриды карбоновых кислот (например, ангидрид с метилкарбонатом, ангидрид с этилкарбонатом, ангидрид с изобутилкарбонатом), активные эфиры (сложные) (например, сложный эфир с имидом гидроксиянтарной кислоты, эфир с 1-гидроксибензотриазолом, эфир с N-гидрокси-5-норборнен-2,3-дикарбоксиимидом, эфир с n-нитрофенолом, эфир с 8-оксихинолином и т.д.). Реакция соединения (III) или его соли с соединением (II) или его реакционноспособным производным проводится обычно в растворителе (например, галогенированных углеводородах, эфирах простых, сложных эфирах, углеводородах, амидах и т.д., таких как хлороформ, дихлорметан, 1,2-дихлорэтан, тетрагидрофуран, диоксан, диметоксиэтан, этилацетат, бензол, толуол, пиридин, N,N-диметилформамид и т.д.). Эта реакция может быть ускорена в присутствии основания. Время реакции колеблется обычно в пределах от 1 до 48 часов, предпочтительно, от 1 до 24 часов. Количество соединения (III) или его соли находится в пределах от 1 до 5 молярных эквивалентов, предпочтительно, от 1 до 3 молярных эквивалентов, на один моль реакционноспособного производного соединения (II). В качестве оснований используются, например, алкиламины, такие как триэтиламин и т.д., циклические амины, такие как N-метилморфолин, пиридин, и т.д., ароматические амины, такие как N,N-диметиланилин, N,N-диэтиланилин и т. д.; карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия и т.д., гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия, гидрокарбонат калия и т.д., и количество таких оснований, которое необходимо использовать, колеблется в пределах от 1 до 5 молярных эквивалентов, предпочтительно, от 1 до 3 молярных эквивалентов на 1 моль соединения (II) или его реакционноспособного производного. И при этой реакции, когда используется несмешиваемый с водой растворитель, реакция может проводиться путем добавления воды к реакционной системе, т.е. в бифазной системе растворителей.
И соединение (I) или его соли можно получить по следующей схеме реакции.
Схема реакции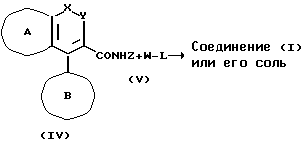
где L является удаляемой группой, а Z и W обозначает R или группу с формулой: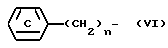
где символы в формуле имеют то же самое значение, которое дано выше, при условии, что по крайней мере один из Z и W обозначает группу, представляемую химической формулой (VI).
В качестве удаляемой группы L соединения (V) используются галогеновые атомы (например, хлора, брома, иода и т.д.) или замещенная сульфонилоксигруппа (например, метансульфонилокси, п-толуолсульфонилокси и т.д.).
Тогда, когда соединение (IV) может использоваться в его свободном состоянии, оно может подвергаться реакции в виде соли, например, соли щелочного металла, такого как литий, натрий, калий и т.д. На один моль соединения (IV) или его соли соединение W-L вводится в реакцию в количестве от 1 до 10 молей, предпочтительно от 1 до 5 молей. Обычно реакция проводится в растворителе. В качестве растворителя используется, например галогенированные углеводороды, такие как дихлорметан, хлороформ и т.д., нитрилы, такие как ацетонитрил и т.д., простые эфиры, такие как диметоксиэтан, тетрагидрофуран и т. д., диметилформамид, диметилсульфоксид, гексаметилфосфорамид и т.д. Добавление основания служит тому, чтобы дать возможность благоприятного протекания реакции. Предпочтительные примеры основания включают гидрокарбонат натрия, карбонат натрия, гидрокарбонат калия, карбонат калия, гидрид натрия, гидрид калия, амид натрия, метоксид натрия, триэтиламин, диизопропилэтиламин, пиридин и т.д. И в этой реакции, вместо применения основания, соединение (IV) превращается, например, в такую соль щелочного металла или соль щелочноземельного металла и т.д., которые упомянуты выше, и которые затем могут приводиться в реакцию с соединением W-L. Поскольку количество основания, которое необходимо использовать, изменяется в зависимости от вида соединения (IV), W-L и растворителя и других условий реакции, оно обычно колеблется от 1 до 10 молей, предпочтительно, от 1 до 5 молей на 1 моль соединения (IV). Температура реакции колеблется в пределах от -50oC до 200oC, предпочтительно от -20oC до 150oC. Поскольку время реакции меняется в зависимости от видов соединения (IV), вида соединения W-L или их солей или температуры реакции, оно колеблется от 1 до 72 часов, предпочтительно от 1 до 24 часов.
Среди соединений (I) этого изобретения, соединение, в котором кольцо A является тетрагидропиридиновым кольцом, может быть получено путем проведения восстановления соединения, в котором кольцо A является пиридиновым кольцом. Поскольку эта реакция может проводиться различными методами, предпочтительный способ включает восстановление в присутствии металлического катализатора для каталитического восстановления. Примеры катализаторов, которые нужно использовать для этого каталитического восстановления, включают платиновые катализаторы, такие как платиновая чернь, окись платины, платиновый уголь и т. д. , окись палладия, палладия-бария сульфат, палладиевый уголь и т.д., никелевые катализаторы, такие как восстанавливающий никель, никель Ренея (Raney) и т.д. Предпочтительные примеры растворителей включают спирты, такие как метанол, этанол, пропанол, изопропанол и т.д., эфиры, такие как тетрагидрофуран, диоксан и т.д., сложные эфиры, такие как этилацетат, среди прочих. Температура реакции колеблется в пределах от 0o до 200oC, предпочтительно, от 20oC до 110oC. Время реакции обычно колеблется в пределах от 0,5 до 48 часов, предпочтительно от 1 до 16 часов. Хотя реакция обычно проводится при нормальном атмосферном давлении, когда необходимо, она проводится при повышенном давлении (от 3 до 10 атмосфер). В то же время количество катализатора меняется в зависимости от его вида, и оно обычно колеблется от 0,1 до 10% (весовых) от количества соединения (I). Путем использования по существу того же самого метода, приведенного выше, любое другое ароматическое гетероциклическое кольцо может быть превращено в неароматическое гетероциклическое кольцо.
Кроме того, соединение, в котором кольцо A является тетрагидропиридиновым кольцом, может также быть получено при реакции соединения, в котором кольцо A является пиридиновым кольцом с алкилирующим средством, представленным Q-L', где Q обозначает произвольно замещенную алкильную группу и L' обозначает удаляемую группу (в качестве L' используется те же группы, что и для L), для получения четвертичной соли, и при последующем восстановлении этой четвертичной соли. В качестве алкилирующего средства Q-L', применяемого для превращения в четвертичную соль, используется галогенид алкана (например, хлорид, бромид, иодид и т.д.), сложный эфир серной кислоты или сложный эфир сульфоновой кислоты (например, метансульфонат, п-толуолсульфонат, бензолсульфонат и т.д.), особенно предпочтительно, используются алкилгалогениды. Количество алкилирующего средства, которое нужно использовать, колеблется в пределах от 1 до 100 эквивалентов на один моль субстрата, предпочтительно от 1 до 30 эквивалентов. Эта реакция обычно проводится в растворителе. В качестве растворителя используются спирты, такие как метанол, этанол, пропанол, изопропанол и т.д., простые эфиры, такие как тетрагидрофуран, диоксан и т.д., сложные эфиры, такие как этилацетат и т.д., галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и т.д., и, в зависимости от вида, алкилирующий агент сам может использоваться в качестве растворителя. Температура реакции колеблется в пределах от 10oC до 200oC, предпочтительно от 20oC до 110oC. Время реакции изменяется в пределах от 0,5 часов до 24 часов, предпочтительно от 1 до 16 часов.
Реакция восстановления в отношении таким образом полученного "тетрагидропиридинового кольца" четвертичной соли может проводиться в инертном растворителе с использованием гидрида металла, например, борогидрид натрия, борогидрид лития, борогидрид цинка, цианоборогидрид натрия, цианоборогидрид лития, гидрид алюминия-лития и т.д. Предпочтительно используется борогидрид натрия. В качестве растворителя для реакции используются низшие спирты, такие как метанол, этанол и т.д., простые эфиры, такие как диоксан, тетрагидрофуран и т. д. или углеводороды, такие как бензол, толуол и т.д., отдельно или в виде смеси. Температура реакции колеблется в пределах от -100oC до 40oC, предпочтительно от примерно -80oC до 25oC. Время реакции изменяется в пределах обычно от 5 минут до 10 часов, предпочтительно от 10 минут до 5 часов. Количество восстанавливающего агента обычно находится в пределах от 1 до 10 эквивалентов в отношении четвертичной соли, предпочтительно 1-2 эквивалента.
Хотя при реакции восстановления этой четвертичной соли, в зависимости от вариантов, одно из целевых соединений этого изобретения, дигидропиридиновое кольцо может быть получено, также может быть достигнуто превращение дополнительно восстановленного тетрагидропиридинового кольца путем, например, вышеупомянутого каталитического восстановления. И в случае, когда вышеупомянутое кольцо A является тетрагидропиридиновым кольцом, и его атом азота имеет атом водорода, соединение может быть образовано путем введения группы 0 к атому азота путем использования алкилирующего вещества, представленного формулой Q-L' (символы имеют те же самые значения, которые даны выше). Эта реакция алкилирования может быть проведена по существу тем же самым методом, что и в случае получения соединения (I) путем вышеприведенной реакции между соединением (IV) и (V).
И путем окисления соединения, в котором кольцо A является четвертичной солью пиридинового кольца, может быть также получено соединение, в котором кольцо A является пиридиновым кольцом. Реакция окисления может быть проведена известным методом "E.A. Prill et al, Organic Syntheses, Combined Book Vol. 2, p. 419 (1957)" или кроме того, аналогичным методом.
Когда кольцо B является гетероциклическим кольцом, путем проведения с ним подобной реакции восстановления может быть получено его превращение в неароматическое гетероциклическое кольцо.
Из соединений этого изобретения (I), одно из соединений, в котором один из X или Y является -CS-, может быть получено путем реакции соединения, в котором соответствующий заместитель является -CO-, с подходящим сульфидом. В качестве сульфида, применяемого для этой реакции, используется, например, фосфора пентасульфид, реактив Лоуессона (Lowesson) и т.д. Эта реакция проводится обычно в безводных условиях в растворителе таком, как дихлорметан, хлороформ, диоксан, тетрагидрофуран, бензол, толуол и т.д. Количество сульфида, которое нужно применить эквимолярно или больше, предпочтительно равно 2-5 молям, и температура реакции находится в пределах от 10oC до 120oC. Хотя время реакции меняется в зависимости от исходных соединений или вида сульфидов, температуры реакции и тому подобного, оно обычно колеблется от 1 до 8 часов.
В случае, когда соединение (I) или его соль, полученные вышеописанным методом, содержат низшую алкоксигруппу (C1-6) в бензольных кольцах в кольце A, B и C, эта алкоксигруппа может быть превращена, когда необходимо, в гидроксильную группу путем реакции алкоксигруппы, например, с трибромидом бора. Эта реакция проводится обычно в растворителе (например, галогенированных углеводородах, углеводородах и т.д., таких как дихлорметан, хлороформ, тетрахлористый углерод, бензол, толуол и т.д.) при температурах, находящихся в пределах от 20oC до 80oC, предпочтительно от примерно 0oC до 30oC. Количество трибромида бора колеблется в пределах от примерно 1 до 10 молярных эквивалентов, предпочтительно примерно от 1 до 5 молярных эквивалентов на одну низшую алкоксигруппу. Время реакции колеблется обычно в пределах от 15 минут до 24 часов, предпочтительно от 30 минут до 12 часов. И в случае, когда соединение (I) или его соль, полученная вышеописанным методом, содержит гидроксильную группу в бензольном кольце в группах, представленных кольцом A, кольцом B и кольцом C, она может быть превращена в алкокси- или ацилоксигруппу, соответственно, путем ее алкилирования, ацилирования, в зависимости от необходимости. Реакция алкилирования проводится путем реакции алкилирующего агента, например, галогенида произвольно замещенного алкана (например, хлорида, бромида, иодида и т.д.), сложного эфира серной кислоты или сложного эфира сульфоновой кислоты (например, метансульфоната, п-толуолсульфонат, бензолсульфонат и т.д.) с этой группой в растворителе (например, алкоголи, такие как метанол, этанол, пропанол и т.д., простые эфиры, такие как диметоксиэтан, диоксан, тетрагидрофуран и т.д., кетоны, такие как ацетон и т.д., амиды, такие как N,N-диметилформамид и т.д.) в присутствии основания (органического основания, такого как триметиламин, триэтиламин, N-метилморфолин, пиридин, пиколин, N,N-диметиланилин и т.д.) или неорганического основания, такого как карбонат калия, карбонат натрия, гидроксид калия, гидроксид натрия и т.д. Температура реакции меняется в пределах обычно от -10oC до 100oC, предпочтительно от примерно 0oC до 80oC. Количество этих алкилирующих средств меняется в пределах от примерно 1 до 5 молярных эквивалентов, предпочтительно от 1 до 3 молярных эквивалентов на один моль исходного фенольного производного. Время реакции колеблется в пределах обычно от 15 минут до 24 часов, предпочтительно от 30 минут до 12 часов.
Реакция ацилирования может проводиться путем проведения реакции с желаемой карбоновой кислотой или ее реакционноспособным производным. Эта реакция проводится при различных вариациях видов ацилирующих средств и исходных фенольных производных обычно в растворителе (например, углеводороды, простые эфиры, сложные эфиры, галогенированные углеводороды, амиды, ароматические амины и т. д., такие как бензол, толуол, этиловый эфир, этилацетат, хлороформ, дихлорметан, диоксан, тетрагидрофуран, N,N-диметилформамид, пиридин и т. д. ), и для ускорения реакции могут быть добавлены соответствующие основания (например, гидрокарбонаты, такие как гидрокарбонат натрия, гидрокарбонат калия и т.д., карбонаты, такие как карбонат натрия, карбонат калия и т.д., ацетаты, такие как ацетат натрия, третичные амины, такие как триэтиламин и т. д. , ароматические амины, такие как пиридин и т.д.) к реакционной системе. В качестве реакционноспособных производных карбоновых кислот используются ангидриды кислот, смешанные ангидриды кислот, галогенангидриды (например, хлорид, бромид), среди прочих. Количество этих ацилирующих агентов меняется в пределах от 1 до 5 молярных эквивалентов на один моль исходного фенольного производного, предпочтительно от 1 до 3 молярных эквивалентов. Температура реакции находится в пределах обычно от 0oC до 150oC, предпочтительно от примерно 10oC до 100oC. Время реакции обычно меняется в пределах от 15 минут до 12 часов, предпочтительно от 30 минут до 6 часов.
Когда соединение (I), полученное таким образом, является свободным соединением, оно может быть превращено в соль в соответствии с общепринятой методикой с неорганической кислотой (например, соляной кислотой, серной кислотой, бромистоводородной кислотой и т. д. ) органической кислотой (например, метансульфоновой кислотой, бензолсульфоновой кислотой, толуолсульфоновой кислотой, щавелевой кислотой, фумаровой кислотой, малеиновой кислотой, винной кислотой и т.д.), с неорганическим основанием (например, щелочным металлом, таким как натрий, калий, щелочноземельным металлом, таким как кальций, магний и т.д., алюминием или аммонием и т.д.) или органическим основанием (например, триэтиламин, пиридин, пиколин, этаноламин, диэтаноламин, триэтаноламин, дициклогексиламин или N,N'-дибензилэтилендиамин и т.д.), и когда соединение получают в форме соли, она может быть превращена в соответствии с общепринятой методикой в свободное соединение или любую другую соль.
Соединение (I) или его соли, полученные как описано выше, могут быть очищены и выделены с помощью уже известных способов для выделения и очистки (например, концентрирования, экстракции растворителем, колоночной хроматографии, перекристаллизации и т.д.)
Методы получения исходного соединения (II) или его солей, которые должны использоваться для получения соединения (I) или его солей данного изобретения, описаны ниже. Например, соединение, в котором кольцо A является тиофеновым кольцом, может быть получено методом, описанным в Европейской открыто опубликованной патентной заявке N 472116 (открытая публикация от 26 февраля 1992 г.), или, кроме того, аналогичными методами. В основном, способ синтеза соединения, представляемого общей формулой (II-1), в которой как кольцо A, так и кольцо B являются бензольными кольцами,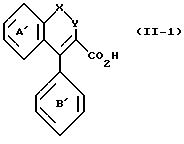
где кольцо A' и кольцо B' обозначают по выбору замещенное бензольное кольцо (то же самое значение, что и "по выбору замещенное бензольное кольцо", представляемое кольцом A и кольцом B), может применяться для синтеза соединения (II), в котором кольцо A и кольцо B содержат гетероциклическое кольцо. В качестве способов синтеза таких соединений, как (II-I), приведенные выше, приводятся, например, опубликованные в EP 421456 (публикация от 11 апреля 1991 г.) EP 354994 (публикация от 21 февраля 1990 г.) EP 481383 (публикация от 22 апреля 1992 г.) и PCT международная N WO 9112249 (публикация от 22 августа 1991 г.)
Соединение (II) может в некоторых случаях образовывать соли. В качестве этих солей используются, например, соли с неорганическими кислотами (например, хлористоводородная кислота, фосфорная кислота, гидробромистая кислота, серная кислота и т.д.) или соли с органическими кислотами (например, уксусная кислота, муравьиная кислота, пропионовая кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, винная кислота, лимонная кислота, яблочная кислота, щавелевая кислота, бензойная кислота, метансульфоновая кислота, бензолсульфоновая кислота и т.д.). Кроме того, в случае, когда эти соединения имеют кислотные группы, такие как - COOH, они могут образовывать соли с неорганическими основаниями (например, с щелочным металлом или щелочноземельным металлом, таким как натрий, калий, кальций, магний и т. д. , с аммонием среди прочих) или органическими основаниями (например, три-C1-3алкиламином, таким как триэтиламин).
В каждой из вышеописанных реакций в случае, когда исходное соединение имеет амино-, карбоксильную или гидроксильную группу в виде заместителя, могут использоваться эти группы в виде предварительно защищенных соответствующими защищающими группами, которые обычно используются, например, в пептидной химии, и если необходимо, целевое соединение может быть получено путем удаления защитной группы после реакции.
Примеры защищающих групп для таких аминогрупп включают произвольно замещенные C1-6алкилкарбонил (например, формил, метилкарбонил, этилкарбонил и т. д. ), фенилкарбонил, C1-6алкилоксикарбонил (например, метоксикарбонил, этоксикарбонил и т.д.), фенилоксикарбонил (например, бензоксикарбонил и т.д.), 7-10C аралкилкарбонил (например, бензилоксикарбонил и т.д.), тритил, фталоил и т.д. В качестве этих заместителей используются галогеновые атомы (например, фтора, хлора, брома, иода и т.д.), C1-6алкилкарбонил (например, метилкарбонил, этилкарбонил, бутилкарбонил и т.д.), и число заместителей колеблется от 1 до 3.
Примеры защитной группы для карбоксильной группы включают произвольно замещенный C1-6алкил (например, метил, этил, н-пропил, изопропил, н-бутил, трет-бутил и т.д.), фенил, тритил, силил и т.д. В качестве этих заместителей используются галогеновые атомы (например, фтора, хлора, брома, иода и т.д.), C1-6алкилкарбонил (например, формил, метилкарбонил, этилкарбонил, бутилкарбонил и т.д.), нитрогруппа или тому подобное, и число этих заместителей находится в пределах от 1 до 3.
В качестве защитных групп для гидроксильной группы используются, например, произвольно замещенный C1-6алкил (например, метил, этил, н-пропил, изопропил, н-бутил, трет-бутил и т.д.), фенил, C7-10аралкил (например, бензил и т.д.), C1-6алкилкарбонил (например, формил, метилкарбонил, этилкарбонил и т. д. ), фенилоксикарбонил (например, бензоксикарбонил и т.д.), C7-10аралкил-карбонил (например, бензилоксикар бонил и т.д.), пиранил, фуранил, силил и т. д. В качестве заместителей используются галогеновые атомы (например, фтора, хлора, брома, иода и т.д.), C1-6алкил, фенил, C7-10аралкил, нитрогруппа и т.д., и число заместителей находится в пределах от 1 до примерно 4.
И в качестве средств для удаления таких защитных групп используются уже известные средства, а также аналогичные им. Например, используются обработка кислотой или основанием, восстановление, облучение ультрафиолетовым светом, обработка гидразином, фенилгидразином, N-метилдитиокарбаматом натрия, фторидом тетрабутиламмония, ацетатом палладия или тому подобное.
Соединение (I) или соль, полученная вышеописанными методами, могут быть выделены и очищены общепринятыми способами, такими как перекристаллизация, дистилляция, хроматография. Когда соединение (I) полученное таким образом, находится в свободной форме, оно может быть превращено в соль с помощью уже известных методик, а также аналогичными методами (например, нейтрализацией и т.д.) и наоборот, когда продукт является солью, он может превращаться в свободную форму или в другую соль.
Соединение (I) или его соли, полученные в соответствии с данным изобретением, обладает превосходной антагонистической активностью к тахикининовым рецепторам, особенно сильной антагонистической активностью против субстанции P (здесь далее в некоторых случаях обозначаемой для краткости CP) и обладают низкой токсичностью, являясь таким образом полезными для медицины и безопасными веществами.
Соединение (I) или его соли обладают ингибирующим действием на трахеальную транссудацию плазмы, вызванную, например, капсаицином. Капсаицин известен как вещество, которое является основным компонентом, вызывающим жгучий вкус красного перца, и стимулирует избирательно среди первичных чувствительных нервов содержащие C-волокно, CP, нейрокинин A (HKH), кальцитониновый, связанный с геном пептид (CGRP) и как вещество для выделения эндогенного нейропептида из них. Это действие соединения (I) или солей по ингибирующему действию на сосудистую транссудацию, как считается, основано на антагонистической активности к тахикининовым рецепторам.
СР широко распространена в центральной и периферической нервной системе и, кроме того, является нейромедиатором первичных чувствительных нервов, обладает различной физиологической активностью, такой как сосудорасширяющей активностью, действием на сосудистую транссудацию, сократительной активностью на гладкую мускулатуру, возбуждающей нейроны активностью, стимулирующей слюноотделение активностью, диуретической активностью, иммунологической активностью и т.д., Было известно, что в частности, СР, выделившаяся при болевом импульсе на окончании задних корешков спинного мозга, передает информацию о боли вторичным нейронам, и что СР, выделившаяся из периферического нервного окончания, вызывает воспалительную реакцию в области болевого рецептора. Кроме того, СР, как предполагают, участвует в механизме слабоумия типа болезни Альцгеймера. (Обзорные статьи: "Physiological Reviews 73, p. 229 - 308, 1993". "Journal of Autonomic Pharmacology, 13, p. 23 - 93, 1993). Поэтому соединение (I) или его соли этого изобретения, имеющие сильную антагонистическую активность к рецепторам СР, как предполагают, будут полезны в качестве безопасных профилактических/ терапевтических лекарственных средств при воспалительных или аллергических заболеваниях (например, атопии, дерматите, герпесе, псориазе, астме, бронхите, влажном кашле, рините, ревматическом артрите, деформирующем артрите, остеопорозе, рассеянном склерозе, синдемите, цистите и т. д.), при боле, мигрени, невралгии, заболеваниях с зудом, при кашле и, кроме того, при заболеваниях центральной нервной системы, например шизофрении, болезни Паркинсона, психосоматических заболеваниях, слабоумии (например, болезни Альцгеймера), заболеваниях пищеварительного тракта (например, при синдроме воспаления кишечника, язвенном колите, болезни Крона (9) и т.д.), рвоте, расстройствах мочеиспускания (например, поллакиурия, недержание мочи и т.д.), нарушений кровообращения (например, стенокардия, гипертензия, сердечная недостаточность, тромбоз и т. д. ) и иммунопатии и т.д. у млекопитающих (например, мыши, крысы, хомячки, кролики, кошки, собаки, крупный рогатый скот, овцы, обезьяны, люди и т.д.).
В случае, когда соединение (I) или его соли этого изобретения используются в качестве вышеупомянутых медицинских продуктов, они производятся в виде лекарственной формы с использованием подходящих фармацевтически приемлемых носителей, наполнителей (например, крахмал, лактоза, сахароза, карбонат кальция, фосфат кальция и т.д.), связывающих веществ (например, крахмал, аравийская камедь, карбоксиметилцеллюлоза, гидроксипропилцеллюлоза, кристаллическая целлюлоза, альгиновая кислота, желатин, поливинилпирролидон и т.д. ), скользящих веществ (например, стеариновая кислота, стеарат магния, стеарат кальция, тальк и т.д.), дезинтеграторов (например, кальций-карбоксиметилцеллюлозы, талька и т. д. ), растворителей (например, физиологического раствора и т.д.) и т.д., которые могут вводиться перорально или другим образом в виде таких дозированных форм, как порошки, тонкие гранулы, гранулы, таблетки, капсулы, инъекции или тому подобное, с помощью общепринятых процедур. Поскольку дозировка зависит от вида соединения (I) или фармацевтически приемлемых солей, способа (пути) введения, симптомов заболевания, возраста пациента и других определяющих состояний, для перорального введения назначается взрослым пациентам с дизурией, например, суточная доза около 0,005 - 50 мг, в расчете на соединение (I) или его соль, на кг веса в день, предпочтительно, примерно от 0,05 до 10 мг, более предпочтительно, примерно от 0,2 до 4 мг с разделением на 1-3 дозы.
Нижеследующее представляет экспериментальные данные, демонстрирующие фармакологическую эффективность соединения (I) или его солей данного изобретения.
Ингибиторная активность связывания рецепторов радиолигандом.
Ингибиторная активность связывания с использованием рецепторов лимфобластных клеток человека (IM-9)
Был модифицирован и использовался метод A. Margaret "Molecular Pharmacology 42, p. 458 (1992)". Рецепторы были получены из человеческих лимфобластных клеток (IM-9), IM-9 клетки (2 • 105 клеток на мл) засевали и инкубировали в течение 3 дней (один литр), которые затем подвергали центрифугированию в течение 5 минут при 500 • g для получения осадка клеток. Осадок один раз промывали фосфатным буфером (Flow Laboratories, CAT. N 28-103-05), после чего осадок разрушали с использованием гомогенизатора Polytron "Kinematika Germany" в 30 мл 50 мМ Трис-HCl буфера (pH 7,4), содержащего 120 мМ хлорида натрия, 5 мМ хлорида калия, 2 мкг/мл химостатина, 40 мкг/мл бацитрацина, 5 мкг/мл фосфорамидона, 0,5 мМ фенилметилсульфонилфторида, 1 мМ этилендиаминтетрауксусной кислоты, после чего подвергали центрифугированию при 40000 • g в течение 20 минут. Осадок дважды промывали 30 мл вышеприведенного буфера, который затем замораживали для сохранения (-80oC) в качестве образца рецепторов.
Образец суспендировали в реакционном буфере (50 мМ Трис-HCl буфер (pH 7,4), 0,02% бычьего сывороточного альбумина, 1 мМ фенилметилсульфонилфторида, 2 мкг/мл химостатина, 40 мкг/мл бацитрацина, 3 мМ хлорида марганца) и 100 мкл порции суспензии использовали для реакции. После добавления образца и 125I-BHSP (0,46 KBq), реакции позволяли пройти в 0,2 мл реакционного буфера при 25oC в течение 30 минут. Уровень неспецифического связывания определяли путем добавления субстанции P до конечной концентрации, равной 2 • 10-6 М. После реакции, используя устройство для сбора клеток (290 PHD Cambridge Technology, Inc. U.S.A. проводили быструю фильтрацию через стеклянный фильтр (GF/B Whatman, USA.) для остановки реакции. После трехкратного промывания 250 мкл 50 мМ трис HCl буфера (pH 7,4), содержащего 0,02% бычьего сывороточного альбумина, оставшуюся на фильтре радиоактивность определяли при помощи гамма-счетчика. Перед использованием фильтр погружали в 0,1% полиэтиленимин на 24 часа и высушивали на воздухе. Антагонистическая активность каждого испытанного препарата в виде концентрации, необходимой, чтобы вызвать 50% подавление (IC50) при вышеописанных условиях, выражена в нМ (табл. 1 и 2 см. в конце описания). (Радиолиганд означает вещество P, меченое 125I.) Число этих экспериментов равно 1.
Из таблицы 1 видно, что соединение (I) или его соли данного изобретения обладают превосходной антагонистической активностью к рецепторам вещества P.
Подавляющее действие на транссудацию плазмы, вызванную капсаицином в трахее морских свинок
Морских свинок (тип Hartley, белые самцы морских свинок), (n = 6) анестезировали 35 мг/кг фенобарбитала, который вводили внутрибрюшинно (в/б), затем внутривенно (в/в) вводили испытуемые вещества. Через 5 минут вводили смешанный раствор капсаицина (150 мкг/кг) и синей краски Эванса (20 мг/кг) внутривенно, чтобы вызвать реакцию. Через десять минут испытуемых животных забивали путем перерезания аорты, затем перфузировали через легочную артерию 50 мл физиологического раствора хлорида натрия. Трахею иссекали и определяли ее сырой вес. Трахею инкубировали при комнатной температуре в 1 мл ацетона - 0,3% сульфата натрия (7:3) в течение ночи, и синий краситель Эванса экстрагировался из трахеи. Раствор экстракта центрифугировали при 2800 об/мин в течение 5 минут. Количество синего красителя Эванса в супернатанте определяли путем измерения поглощения при 620 нм.
Транссудацию плазмы выражали количеством синего красителя Эванса (мкг) по отношению к весу трахеи (г). Эффективность лекарственного препарата оценивали путем расчета % подавления по следующей формуле.
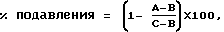
A: количество синего красителя Эванса (мкг/г) у каждого испытуемого животного
B: среднее количество синего красителя Эванса (мкг/г) у группы, которой не вводили капсаицин.
C: среднее количество синего красителя Эванса (мкг/г) у контрольной группы.
Из таблицы 2 видно, что соединение (I) или его соли данного изобретения обладают превосходным подавляющим действием на транссудацию плазмы, вызванную капсаицином.
Данное изобретение будет далее объяснено подробно с помощью последующих справочных примеров и примеров, но эти примеры являются просто примерами и совсем не ограничивают данного изобретения, и они могут быть модифицированы в пределах, которые не выходят за объем данного изобретения.
Элюирование при колоночной хроматографии в справочных примерах и примерах проводилось при контроле посредством ТСХ (тонкослойной хроматографии). При слежении (контроле) с помощью ТСХ применяли 60F254, производимый Мerck в виде пластинок для ТСХ, растворитель, используемый при колоночной хроматографии в качестве проявляющего элюента и УФ- детектор при обнаружении, соответственно.
В качестве силикагеля для колоночной хроматографии применяли силикагель 60 (зернистость 70-230), производимый Merck. "Комнатная температура" означает обычно температуры, находящиеся в интервале от примерно 10oC до 35oC.
Для высушивания раствора экстракта применяли сульфат натрия или сульфат магния.
В примерах и справочных примерах аббревиатуры означают следующее.
ЯМР (NMR): Спектр ядерно-магнитного резонанса
E1-MS: Масс-спектр при бомбардировке электронами SI-MS: Вторичный электронный ионный масс-спектр
ДМФ (DMF): диметилформамид, ТГФ (THF): тетрагидрофуран, ДМСО (DMSO): диметилсульфоксид, Гц (Hz): герц, J: константа взаимодействия, м: мультиплет, q: квартет, t: триплет, d: дуплет, s: синглет, b: широкий, подобный: приблизительный
Пример 1
N-[3,5-бис (трифторметил)бензил] -5-(4-фторфенил)-7,8-дигидро-N, 7-диметил-8-оксо-6-пиридо [3,4-b]пиридинкарбоксамид
К суспензии 5-(4-фторфенил)-7,8-дигидро-7-метил-8-оксо-6-пиридо [3,4-b] -пиридинкарбоновой кислоты (справочный пример 1) (1,50 г) в бензоле (70 мл) добавляли тионихлорид (3,0 мл) и ДМФ (одну каплю). Смесь нагревали в течение двух часов в колбе с обратным холодильником. Растворитель отгоняли и остаток промывали гексаном и затем суспендировали в ТГФ (40 мл). Эту суспензию добавляли к раствору N-3,5-бис (трифторметил) бензил метиламина (1,80 г) и триэтиламина (1,40 мл) в ТГФ (40 мл). Смесь перемешивали в течение 5 часов при нагревании в колбе с обратным холодильником. Растворитель отгоняли. К остатку добавляли этилацетат, и смесь промывали водой, водным раствором гидрокарбоната натрия и водой, последовательно, затем высушивали и растворитель отгоняли с получением названного в заглавии вещества в виде бесцветных кристаллов (0,80 г) т. пл. 211-212oC (перекристаллизованных из этилацетата - этилового эфира).
ЯМР (200 Гц, CDCl3) м.д.: 2,83 (3H, s), 3,67 (3H, s), 4,25 (1H, d, J = 14,4 Гц), 4,85 (1H, d, J = 14,4 Гц), 6,99 (2H, t-подобный, J = 8 Гц), 7,13 (1H, m), 7,37 (1H, m), 7,50 - 7,54 (2H, m), 7,55 (2H, s), 7,85 (1H, s) 8,94 (1H, dd, J = 2,0 4,0 Гц)
Элементный анализ для C26H18N3O2F7:
Расчетное: C, 58,11; H, 3,38; N 7,82
Обнаруженное: C, 58,03; H 3,34; N 7,72
Соединения из примеров 2 и 3 были получены путем использования 5-(4-фторфенил)-7,8-дигидро-7-метил-8-оксо-6-пиридо[3,4-b] пиридинкарбоновой кислоты и аминов, имеющих в нужных положениях соответствующие заместители, дающие возможность пройти реакции, и обработки реакционной смеси по существу тем же образом, как в примере 1.
Пример 2
N-[3,5-бис(трифторметил)бензил] -5-(4-фторфенил)-7,8-дигидро-7-метил-8- оксо-6-пиридо [3,4-b]пиридинкарбоксамид
Т. пл. 210 - 212oC (перекристаллизованный из метаноладихлорметана-этилацетата)
ЯМР (200 МГц, CDCl3) м.д.: 3,21 (3H, s), 4,55 (2H, d, J = 6,2 Гц), 6,98 (2H, t-подобное, J = 8,6 Гц), 7,25-7,45 (4H, m), 7,76 (2H, s), 7,84 (1H, s), 8,52 (1H, t-подобный, J = 5,8 Гц), 8,63 (1H, dd, J=2,0, 4,0 Гц)
Пример 3
5-(4-фторфенил)-7,8-дигидро-N-(2-метоксибензил)-7-метил-8-оксо- 6-пиридо[3,4-b]пиридинкарбоксамид
Т. пл. 254-256oC (перекристаллизованного из метанол- дихлорметанэтилацетата)
ЯМР (200 МГц, CDCl3), м.д.: 3,54, (3H, s), 3,77 (3H, s), 4,34 (2H, d, J = 6,0 Гц), 6,80 (2H, t-подобный, J=7,6 Гц), 6,86 - 7,00 (4H, m), 7,20 - 7,32 (3H, m), 7,37 (1H, dd, J = 4,2, 8,4 Гц), 7,50 (1H, dd, J = 1,6, 8,4 Гц), 8,77 (1H, dd, J = 1,6, 4,2 Гц).
Элементный анализ для C24H20N3O3F • 1/4H2O:
Расчетное: C 68,32; H 4,90; N 9,96
Обнаруженное: C 68,31; H 4,84; N 10,18
Пример 4
5-(4-фторфенил)-7,8-дигидро-N-(2-метоксибензил)-N, 7-диметил-8-оксо-6- пиридо[3,4-b]пиридинкарбоксамид
Смесь соединения, полученного в примере 3 (1,20 г) гидрида натрия (60% масло) (150 мг) и ДМФ (50 мл) перемешивали в течение 30 минут при комнатной температуре, после чего добавляли метилиодид (5,0 мл) с последующим перемешиванием в течение 4 часов при комнатной температуре. Растворитель отгоняли. К остатку добавляли этилацетат. Эту смесь промывали водой и высушивали, затем растворитель отгоняли так, что оставалось названное в заголовке вещество в виде бесцветных кристаллов (1,10 г).
Т. пл. 159 - 150oC (перекристализованное из метанолэтилового простого эфира)
ЯМР (200 Мгц, CDCl3) м.д.: 2,74 (3H, s); 3,67 (3H, s); 3,77 (3H, s); 4,38 (1H, d, J = 1,8 Гц), 4,68 (1H, d, J = 14,8 Гц), 6,46 (1H, dd, J = 1,6, 7,4 Гц), 6,78 (1H, dt, Jd = 1,2 Гц, Jt = 7,4 Гц), 6,82 (1H, d, J = 8,2 Гц), 7,04 - 7,30 (4Н, m), 7,42 - 7,56 (2H, m), 7,59 (1H, dd, J 1,8, 8,4 = Гц), 8,92 (1H, dd, J = 1,6, 4,2 Гц)
Элементный анализ для C25H22N3O3F:
Расчетное: C 65,59; H 5,14; N 9,74
Обнаруженное: C 69,23; H 5,12; N 9,75
Пример 5
N, N-бис[3,5-бис(трифторметил)бензил]-5-(4-фторфенил)-7,8-дигидро-7- метил-8-оксо-6-пиридо[3,4-b]пиридинкарбоксамид
5-(4-(фторфенил)-7,8-дигидро-7-метил-8-оксо-6-пиридо[3,4-b] пиридинкарбоксамиду (справочный пример 1 - способ 2, процесс 3) давали прореагировать и пройти обработку с 3,5-бис (трифторметил)-бензилбромидом в ДМФ в присутствии гидрида натрия, причем получается указанное выше в названии вещество в виде бесцветных кристаллов, т.пл. 252 - 254oC (перекристаллизованное из этилацетата-этилового эфира).
ЯМР (200 Мгц, CDCl3), м.д.: 3,67 (3H, s), 4,32 (1H, J = 14,6 Гц), 4,37 (1H, d, J = 15,4 Гц), 4,67 (1H, d, J = 15,4 Гц), 4,75 (1H, d, J = 14,6 Гц), 7,03 - 7,28 (5H, m), 7,34 (2H, s), 7,41 - 7,67 (3H, m), 7,75 (2H, s), 7,91 (1H, dd, J = 1,8, 4,2 Гц)
Элементный анализ для C34H20N3O2F13:
Расчетное: C 54,48; H 2,69; N 5,61
Обнаруженное: C 54,67; H 2,59; N 5,78
Пример 6
N-[3,5-бис(трифторметил)бензил] -3-хлор-5-(4-фторфенил)-7,8-дигидро- N, 7-дметил-8-оксо-6-пиридо[3,4-b]пиридинкарбоксамид
Маточную жидкость после сбора соединения из примера 1 объединяли с промыванием и затем подвергали хроматографии на колонке с силикагелем (гексан: этилацетат (1:2) - этилацетат - этилацетат: метанол (95:5)) для разделения и очистки. Из первой фракции было получено указанное в названии вещество в виде бесцветных кристаллов (0,16 г), т.пл. 114 - 115oC (перекристаллизованное из этилацетата - изопропилового эфира).
ЯМР (200 Мгц, CDCl3) м.д.: 2,83 (3H, s), 3,65 (3H, s), 4,25 (1H, d, J = 14,4 Гц), 4,84 (1H, d, J = 14,4 Гц), 7,01 (2H, t-подобное, J = 8,4 Гц), 7,12 (1H, m), 7,34 (1H, m), 7,47 (1H, d, J = 2,2 Гц), 7,55 (2H, s), 7,85 (1H, s), 8,82 (1H, d, J = 2,2 Гц)
Элементный анализ для C26H17N3O2ClF7• 1/4 изо Pr2O:
Расчетное: C 55,29; H 3,46; N 7,03
Обнаруженное: C 55,47, H 3,67; N 7,05
EI - MS, м/з: 571, 573 (M+)
Из следующей фракции получен N-[3,5-бис(трифторметил)бензил] -5-(4-фторфенил)-7,8-дигидро-N,7-диметил-8- оксо-6-пиридо[3,4-b]пиридинкарбоксамид в виде бесцветных кристаллов (0,30 г). Физико-химические константы этого соединения находились в согласии с константами соединения, полученного в примере 1.
Пример 7
N-[3,5-бис (трифторметил)-бензил] -8-(4-фторфенил)-5,6-дигидро-N, 6-диметил-5-оксо-7-пиридо[3,4-b]пиразинкарбоксамид
Смесь 8-(4-фторфенил)-5,6-дигидро-6-метил-5-оксо-7-пиридо[3,4-b] пиразинкарбоновой кислоты (справочный пример 2) (200 мг), ТГФ (10 мл), оксалилхлорида (0,20 мл) и ДМФ (каталитическое количество) перемешивали в течение 30 минут при комнатной температуре. Растворитель отгоняли и остаток растворяли в ТГФ (10 мл). Этот раствор добавляли к раствору N-[3,5-бис(трифторметил)бензил] метил-амина (200 мг) и триэтиламина (0,50 мл) в ТГФ (10 мл), что затем перемешивали в течение одного часа при комнатной температуре. Растворитель отгоняли. К остатку добавляли этилацетат. Смесь промывали водой, водным раствором гидрокарбоната натрия и водой, последовательно, высушивали, затем растворитель отгоняли. Остаток подвергали колоночной хроматографии на силикагеле (этилацетат) с получением указанного выше в названии вещества в виде бесцветных кристаллов (120 мг), т.пл. 220 -222oC (перекристаллизованное из этилацетата - этилового эфира).
ЯМР (200 Мгц, CDCl3) м.д.: 2,81 (3H, s), 3,68 (3H, s), 4,38 (1H, d, J = 7,3 Гц), 4,75 (1H, d, J = 7,3 Гц), 6,98 (2H, t-подобное, J = 8,7 Гц), 7,25 - 7,40 (2H, m), 7,59 (2H, s), 7,86 (1H, s), 8,84 (1H, d, J = 2,0 Гц), 8,86 (1H, d, J = 2,0 Гц)
Элементный анализ для C25H17N4O2F7:
Расчетное: M 55,77; H 3,18; N 10,41
Обнаруженное: C 55,81; H 3,22; N 10,33
Пример 8
N-[3,5-бис(трифторметил)бензил] -4-(4-фторметил)-1,2-дигидро-N, 2-диметил-1-оксо-2-пиридо[3,4-c]пиридинкарбоксамид
Используя 4-(4-фторфенил)-1,2-дигидро-2-метил-2-оксо-3-пиридо[3,4-c]пиридинкарбоновую кислоту (справочный пример 3) и N-[3,5-бис(трифтометил)бензил]метиламин, давали реакции пройти, и реакционную смесь обрабатывали по существу таким образом, как и в примере 1, с получением указанного выше в заглавии вещества в виде бесцветных кристаллов, т.пл. 179-181oC (перекристаллизованный из этилацетата - изопропилового эфира).
ЯМР (200 МГц, CDCl3) м.д.: 2,82 (3H, s) 3,60 (3H, s), 4,27 (1H, d, J = 14,6 Гц), 4,80 (1H, d, J = 14,6 Гц), 6,95 - 7,35 (5H, m), 7,55 (2H, s), 7,85 (1H, s), 8,67 (1H, d, J = 5,8 Гц), 9,68 (1H, s)
Элементный анализ для C26H18N3O2F7:
Расчетное: C 58,11; H 3,38; N 7,82
Обнаруженное: C 57,96; H 3,44; N 7,61
Пример 9
N-[3,5-бис(трифторметил)бензил]-4-(4-фторфенил)-1,2-дигидро-N,2-диметил- 1-оксо-3-пиридо[4,3-c]пиридинкарбоксамид
Используя 4-(4-фторфенил)-1,2-дигидро-2-метил-1-оксо-3-пиридо[4,3-c] пиридинкарбоновую кислоту (справочный пример 4) и N-[3,5-бис (трифторметил)бензил]метиламин, дают реакции пройти, и реакционную смесь обрабатывали по существу тем самым образом, как и в примере 1, с получением вещества, названного выше в заглавии, в виде бесцветных кристаллов, т.пл. 136-138oC (перекристаллизованное из ацетилацетата - изопропилового эфира).
ЯМР (200 МГц, CDCl3) м.д.: 2,82 (3H, s), 3,61 (3H, s), 4,31 (1H, d, J = 14,6 Гц), 4,77 (1H, d, J = 14,6 Гц), 6,95 - 7,37 (4H, m), 7,56 (2H, s), 7,85 (1H, s), 8,25 (1H, d, J = 5,4 Гц), 8,61 (1H, s), 8,75 (1H, d, J = 5,4 Гц)
Элементный анализ для C26H18N3O2F7:
Расчетное: C 58,11; H 3,38; N 7,82
Обнаруженное: C 58,23; H 3,53; N 7,76
Пример 10
N-[3,5-бис(трифтометил)бензил] -5,6-дигидро-N, 6-диметил-8-(2-метилфенил)-5-оксо-7-пиридо[4,3-b]пиридинкарбоксамид
Используя 5,6-дигидро-6-метил-8-(2-метилфенил)-5-оксо-7-пиридо [4,3-b] пиридинкарбоновую кислоту (справочный пример 5) и N-[3,5-бис(трифторметил)бензил]метиламин, давали пройти реакции и реакционную смесь обрабатывали по существу тем же самым образом, как и в примере 1, с получением смеси изомеров указанного в заголовке вещества (A:B=около 1:2) в виде бесцветных кристаллов, т.пл. 183 - 185oC (перекристаллизованное из этилацетата - изопропилового эфира).
EI - MS, м/з: 533 (M+)
Соединение A (ТСХ, SiO2) этилацетат:гексан=1:1); Rf больше)
ЯМР (200 МГц, CDCl3) м.д.: 2,02 (3H, s), 2,74 (3H, s), 3,61 (3H, s), 4,34 (1H, d, J = 14,4 Гц), 4,66 (1H, d, J = 14,4 Гц), 7,1 - 7,3 (4H, m), 7,43 (1H, dd, J = 4,6; 8,0 Гц), 7,51 (2H, s), 7,82 (1H, s), 8,74 (1H, dd, J = 1,8, 8,0 Гц), 8,89 (1H, dd, J = 1,8, 4,6 Гц)
Соединение в (ТСХ, SiO2) (этилацетат:гексан=1:1); Rf меньше)
ЯМР (200 МГц, CDCl3) м.д.: 2,11 (3H, s), 2,99 (3H, s), 3,59 (3H, s), 4,15 (1H, d, J = 14,4 Гц), 4,91 (1H, d, J = 14,4 Гц), 6,96 (2H, m), 7,18 (2H, m), 7,42 (1H, dd, J = 4,6, 8,0 Гц). 7,53 (2H, s), 7,82 (1H, s), 8,74 (1H, dd, J = 1,8, 8,0 Гц), 8,86 (1H, dd, J = 1,8, 4,6 Гц)
Кристаллы из этой смеси (A:B=примерно 1:2) нагревали в течение 30 минут при 180-190oC и тогда отношение в смеси изменялось на 1:1 (ЯМР, ТСХ).
Пример 11
N-[3,5-бис(трифторметил)бензил] -5-(хлор-2-метилфенил)-7,8-дигидро-N, 7-диметил-8-оксо-6-пиридо[3,4-b]пиридинкарбоксамид и его изомер
Используя соединение, полученное в справочном примере 6, и N[3,5-бис(трифторметил)бензил] метиламин давали пройти реакции по существу тем самым путем, что и в примере 1 (амидирование), затем реакционную смесь обрабатывали по существу тем же самым образом, как и в примере 1, с получением вышеназванного в заголовке вещества (соединение A:B=примерно, смесь 1:2) в качестве бесцветных кристаллов.
Соединение A (ТСХ, SiO2 (этилацетат); Rf больше)
ЯМР (200 МГц, CDCl3) м.д.: 2,07 (3H, s), 3,02 (3H, s), 3,65 (3H, s), 4,11 (1H, d, J = 14,4 Гц), 4,99 (1H, d, J = 14,4 Гц), 6,89 (1H, s-подобное), 7,12 (2H, s-подобное), 7,28 (1H, m), 7,48 (1H, dd, J = 4,4, 8,0 Гц), 7,58 (2H, s), 7,82 (1H, s), 8,93 (1H, dd, J = 1,6, 4,4 Гц)
EI - MS м/з: 567, 569 (M+)
Соединение B (TCX, Si O2 (этилацетат) : Rf меньше)
ЯМР (200 МГц CDCl3) м.д. : 2,14 (3H, s), 2,98 (3H, s), 3,64 (3H, s), 4,21 (1H, d, J = 14,6 Гц), 4,91 (1H, d, J = 14,6 Гц), 6,88 (1H, d - подобное), 6,99 (1H, t - подобное), 7,26 (1H, m), 7,37 (1H, d, J = 7 Гц), 7,47 (1H, dd, J = 4,2, 8,0 Гц), 7,52 (2H, s), 7,83 (1H, s), 8,94 (1H, m)
EI - MS м/з : 567, 569 (M+)
Пример 12
N-[3,5-бис (трифторметил) бензил] -N-метил-4-(2-пиридил)-3-хинолинкарбоксамид
Смесь N-метил-4-(2-пиридил)-3-хинолинкарбоксамида (справочный пример 7) (262 мг), гидрида натрия (60% маслянистый) (50 мг) и ДМФ (10 мл) перемешивали в течение 30 минут при комнатной температуре. Реакционную смесь охлаждали до 0oC и добавляли 3,5 - бис (трифторметил) бензилбромид (340 мл), и смесь перемешивали в течение 30 минут при комнатной температуре. Реакционную смесь вливали в воду, после чего экстрагировали этилацетатом. Экстракционный раствор промывали водой и высушивали, затем растворитель отгоняли.
Остаток подвергали хроматографии на колонке с силикагелем (этилацетат) с получением названного выше в заголовке вещества в виде маслянистого продукта (434 мг).
ЯМР (200 МГц, CDCl3) м.д. : 2,78 (2,25 H, s), 2,87 (0,75 H, s), 4,30 - 4,90 (2H, m), 7,30 (1H, m), 7,50 - 7,90 (8H, m), 8,18 (0,25 H, d, J = 8,4 Гц) 8,21 (0,75 H, d, J = 8,4 Гц), 8,58 (0,75, d, J = 4,8 Гц), 8,77 (0,25 H, d, J = 4,8 Гц), 8,92 (0,25 H, s), 8,96 (0,75 H, s)
Пример 13
N-[3,5-бис (трифторметил) бензил]-4-(4-фторфенил)-6,7-дигидро-N,6-диметил-7-оксо-5-тиено [2,3-c] пиридинкарбоксамид
Используя 4-(4-фторфенил)-6,7-дигидро-6-метил-7-оксо-5-тиено [2,3-c] пиридинкарбоновую кислоту (справочный пример 8) (202 мг) и N-[3,5 - бис (трифторфенил)бензил] метиламин давали пройти реакции по существу тем же самым образом, как и в примере 1 (амидирование), с последующей очисткой с помощью колоночной хроматографии на силикагеле (гексан - этилацетат = 1:1, причем получалось названное в заголовке вещество в виде бесцветных кристаллов (221 мг), т.пл. 196 - 197oC (перекристаллизованное из этилацетата - изопропилового эфира).
ЯМР (200 МГц, CDCl3) м.д.: 2,73 (3H, s), 3,63 (3H, s), 4,37 (1H, d, J = 15 Гц), 4,76 (1H, d, J = 15 Гц), 6,85 - 7,10 (2H, m), 6,93 (1H, d, J = 5,3 Гц), 7,20 - 7,40 (2H, m), 7,57 (2H, m), 7,68 (1H, d, J = 5,3 Гц), 7,84 (1H, s)
Элементный анализ для C25H17N2O2SF7:
Расчетное: 55,35; H 3,16; N 5,16
Обнаруженное: C 55,13; H 3,29; N 4,97
Соединение из примеров 14 по 23 были получены с применением карбоновой кислоты, имеющей заместители, соответствующие соответственным соединениям, и бензиламины, и давая реакции пройти по существу таким же образом, как и в примере 1 (амидирование), и затем путем обработки реакционной смеси по существу таким же образом, как и в примере 1.
Пример 14
4-(4-фторфенил)-6,7-дигидро-N-(2-метоксибензил)-6-метил-7-оксо-5-тиено [2,3-c] пиридинкарбоксамид
Т.пл. 266-268oC (перекристаллизованный из ТГФ-изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 3,60 (3H, s), 3,71 (3H, s), 4,32 (2H, d, J = 6,0 Гц), 6,45 (1H, bt) 6,9 - 7,05 (6H, m), 7,18 - 7,30 (3H, m), 7,60 (1H, d, J = 5,2 Гц)
Пример 15
4-(4-фторфенил)-6,7-дигидро-N-(2-метоксибензил)-N, 6-диметил-7-оксо-5-тиено [2,3-c]пиридинкарбоксамид
Т.пл. 140oC (перекристаллизованный из этилацетата - изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 2,66 (3H,s), 3,64 (3H, s), 3,76 (3H, s), 4,42 (1H, d, J = 15 Гц), 4,65 (1H, d, J = 15 Гц), 6,53 (1H, d, J = 7,6 Гц), 6,70 - 6,85 (2H, m), 6,94 (1H, d, J = 5,2 Гц), 7,00 - 7,50 (5H, m), 7,66 (1H, d, J = 5,2 Гц)
Пример 16
N-[3,5-бис (трифторметил)бензил] -4-(4-фторфенил)-6,7-дигидро-6-метил-7-оксо-5-тиено [2,3-c]пиридинкарбоксамид
Т.пл. 154oC (перекристаллизованный из этилацетат-изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д. : 3,34 (3H, s), 4,47 (2H, d, J = 5,8 Гц), 6,82 (1H, d, J = 5,2 Гц), 6,92 (2H, t - подобное, J = 8,6 Гц), 7,25 - 7,35 (2H, m), 7,56 (1H, d, J = 5,2 Гц), 7,57 (1H, m), 7,61 (2H, s), 7,82 (1H, s)
Пример 17
N-[3,5-бис (трифторметил)бензил]-7-(4-фторфенил)-4,5-дигидро-N,5-диметил-4-оксо-6-тиено [3,2-c]пиридинкарбоксамид
Т. пл. 188 - 189oC (перекристаллизованный из этилацетат-изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д. : 2,75 (3H, s), 3,61 (3H, s) 4,38 (1H, d, J = 15 Гц), 4,75 (1H, d, J = 15 Гц), 6,99 (2H, t - подобное, J = 8,4 Гц), 7,34 (1H, d, J = 5,6 Гц), 7,35 - 7,46 (2H, m), 7,56 (2H, s), 7,73 (1H, d, J = 5,6 Гц), 7,84 (1H, s)
Пример 18
N-[3,5-бис (трифторметил)бензил]-7-(4-фторфенил)-4,5-дигидро-N,5-диметил-4-оксо-6-тиено [3,4-c]пиридикарбоксамид
Т.пл. 130 - 132oC (перекристаллизация из этилового эфира - гексана)
ЯМР (200 МГц, CDCl3) м.д. : 2,78 (3H, s), 3,50 (3H, s), 4,37 (1H, d, J = 15 Гц), 4,71 (1H, d, J = 15 Гц), 6,90 - 7,15 (2H, m), 7,08 (1H, d, J = 3,3 Гц), 7,30 - 7,45 (2H, m), 7,55 (2H, m), 7,82 (1H, s), 8,44 (1H, d, J = 3,3 Гц)
Пример 19
N-[3,5-бис (трифторметил)бензил]-8-(4-фторфенил)-5,6-дигидро-N,6-диметил-5-оксо-7-пиридо [4,3-b]пиридинкарбоксамид
Т. пл. 149 - 150oC (перекристаллизованный из этилацетата-изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д. : 2,78 (3H, s), 3,61 (3H, s) 4,41 (1H, d, J = 14,6 Гц), 4,66 (1H, d, J = 14,6 Гц). 6,97 (2H, t - подобное), 7,33 (2H, m), 7,45 (1H, dd, J = 4,2, 8,0 Гц), 7,59 (2H, s), 7,85 (1H, s), 8,75 (1H, dd, J = 1,6, 8,0 Гц), 8,89 (1H, dd, J = 1,6, 4,4 Гц)
Пример 20
N-[3,5-бис(трифторметил)бензил] -5,6-дигидро-8-(2-метилфенил)- 6-метил-5-оксо-7-пиридо[4,3-b]пиридинкарбоксамид
Т.пл. 192 - 193oC (перекристаллизованный из ТГФ - изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 3,64 (3H, s), 4,25 (1H, dd, J = 5,8, 14,4 Гц), 4,39 (1H, dd, J = 6,2, 14,4 Гц), 6,05 (1H, b), 6,95 - 7,20 (4H, m), 7,78 (1H, dd, J = 4,6, 8,2 Гц), 7,57 (2H, s), 7,80 (1H, s), 8,67 (1H, d, J = 8,2 Гц), 8,84 (1H, m)
Пример 21
N-[3,5-бис(трифторметил)бензил] -1,2-дигидро-N, 2-диметил-1- оксо-4-(2-тиенил)-3-изохинолинкарбоксамид
Т. пл. 142 - 143oC (перекристаллизованный из этилацетат-изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 2,86 (3H, s), 3,60 (3H, s), 4,25 (1H, d, J = 14,2 Гц), 4,99 (1H, d, J = 14,2 Гц), 6,97 (2H, m), 7,04 (1H, m), 7,20 - 7,45 (3H, m), 7,50 - 7,67 (3H, m), 7,82 (1H, s), 8,49 (1H, m)
Пример 22
1,2-дигидро-N-(метоксибензил)-2-метил-1-оксо-4- (2-тиенил-3-изохинолинкарбоксамид
Т.пл. 237 - 238oC (перекристаллизованный из метанола - этилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 3,59 (3H, s), 3,80 (3H, s), 4,34 (2H, d, J = 6,0 Гц), 6,39 (1H, b), 6,75 - 6,92 (3H, м), 6,95 - 7,05 (2H, м), 7,18 - 7,31 (2H, м), 7,37 - 7,62 (3H, м), 8,43 (1H, м)
Пример 23
1,2-дигидро-N-(метоксибензил)-N, 2-диметил-1-оксо-4- (2-тиенил)-3-изохинолинкарбоксамид
Т.пл. 173 - 174oC (перекристаллизованный из метанола-этилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 2,79 (3H, s), 3,60 (3H, s), 3,80 (3H, s), 4,50 (1H, d, J = 15,0 Гц), 4,68 (1H, d, J = 15,0 Гц), 6,50 (1H, dd, J = 1,6, 7,7 Гц), 6,74 - 6,87 (2H, м), 7,09 - 7,24 (3H, м), 7,38 - 7,68 (4H, м), 8,48 (1H, м)
Соединения из примера 24 и 25 были получены путем использования производных N-метилкарбоксамида, имеющих заместители, соответствующие соответственным соединениям, и 3,5 - бис(трифторметил) - бензилбромида и путем проведения реакции по существу таким же образом, как и в примере 12.
Пример 24
N-[3,5-бис(трифторметил)бензил] -4-(4-фторфенил)-N- метил-5-тиено[2,3-b] пиридинкарбоксамид
Т.пл. 193 - 194oC (перекристаллизованный из этилацетата - гексана)
ЯМР (200 МГц, CDCl3) м.д.: 2,58 (2,4H, s), 2,86 (0,6H, s), 4,20 - 5,10 (2H, м), 7,00 - 7,30 (3H, м), 7,38 - 7,49 (2H, м), 7,55 - 7,65 (3H, м), 7,76 (0,2H, s), 7,83 (0,8H, s), 8,61 (0,8H, s), 8,62 (0,2H, s).
Пример 25
N-[3,5-бис(трифторметил)бензил] -1,2-дигидро-N, 1-диметил-2- оксо-4-(2-пиридил)-3-хинолинкарбоксамид
Т.пл. 122 - 124oC (перекристаллизованный из этилового эфира - гексана)
ЯМР (200 МГц, CDCl3) м. д. : 2,74 (0,75H, s), 2,91 (2,25H, s), 3,81 (0,75H, s), 3,84 (2,25H, s), 4,30 (0,75H, d, J = 15 Гц), 4,51 (0,25H, d, J = 16 Гц), 4,66 (0,25H, d, J = 16 Гц), 5,03 (0,75H, d, J = 15 Гц), 7,15 - 7,95 (10H, м), 8,58 (0,75H, м), 8,72 (0,25H, м)
Пример 26
N-[3,5-бис(трифторметил)бензил] -1,2,3,4,5,6-гексагидро-N, 6-диметил-8- (2-метилфенил)-5-оксо-7-пиридо[4,3-b]пиридинкарбоксамид.
Соединение, полученное в примере 10 (смесь изомеров примерно 1 : 2) (200 мг) растворяли в метаноле (200 мл). К раствору добавляли 10% Pd-C (50% гидрат) (100 мг), и смесь взбалтывали в течение 8 часов при комнатной температуре. Катализатор отфильтровывали. Из фильтрата отгоняли растворитель, так что оставалось названное в заголовке вещество (смесь изомеров (A : B = примерно 1 : 2)) в виде бесцветных кристаллов (125 мг).
ЯМР (200 МГц, CDCl3) сигналы (ppm - м.д.) каждого изомера являются следующими:
Изомер A (ТСХ, SiO2 (этилацетат: метанол = 10 : 1); Rf больше)
1,85 (2H, м), 2,15 (3H, s), 2,62 (2H, м), 2,72 (3H, s), 3,14 (2H, м), 3,43 (3H, s), 3,80 (1H, м), 4,13 (1H, d, J = 15 Гц), 4,82 (1H, d, J = 15 Гц), 6,80 - 7,00 (2H, м), 7,03 - 7,53 (4H, м), 7,76 (1H, s)
Изомер B (ТСХ, SiO2 (этилацетат: метанол = 10 : 1, Rf меньше)
1,85 (2H, м), 2,19 (3H, s), 2,62 (2H, м), 2,92 (3H, s), 3,14 (2H, м), 3,42 (3H, s), 3,64 (1H, м), 4,03 (1H, d, J = 15 Гц), 4,93 (1H, d, J = 15 Гц), 6,80 - 7,00 (2H, м), 7,03 - 7,53 (4H, м), 7,76 (1H, s)
Пример 27
N-[3,5-бис(трифторметил)бензил] -8-(4-фторфенил)-1,2,3,4,5,6- гексагидро-N,6-диметил-5-оксо-7-пиридо[4,3-b]пиридинкарбоксамид
В метаноле растворяли (8 мл) N-[3,5-бис(трифторметил)бензил] -8-(4-фторфенил(5,6-дигидро-N, 6-диметил-5-оксо-7-пиридо[4,3-b] пиридинкарбоксамид (пример 19) (50 мг). К арствору добавляли 10% Pd-C (50% водный) (40 мг). Смесь перемешивали в течение 3 часов при комнатной температуре в атмосфере водорода. Катализатор отфильтровали. Из фильтрата отгоняли растворитель с получением названного в заголовке вещества в виде бесцветных кристаллов (35 мг).
Т.пл. 226 - 228oC (перекристаллизованный из этилацетата - изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 1,86 (2H, м), 2,64 (2H, м), 2,78 (3H, s), 3,17 (2H, м), 3,42 (3H, s), 3,82 (1H, b), 4,16 (1H, d, J=14,2 Гц), 4,79 (1H, d, J=14,2 Гц), 6,9 - 7,3 (4H, м), 7,49 (2H, s), 7,80 (1H, s)
Пример 28
N-[3,5-бис(трифторметил)бензил] -8-(4-фторфенил)-1,2,3,4,5,6- гексагидро-N,1,6-триметил-5-оксо-7-пиридо[4,3-b]пиридинкарбоксамид
В ТГФ (3 мл) растворяли N-[3,5-бис(трифторметил)бензил]- 8-(4-фторфенил)-1,2,3,4,5,6-гексагидро-N,6-диметил-5-оксо-7-пиридо [4,3-b]пиридинкарбоксамид (пример 27) (68 мг). К раствору добавляли гидрид натрия (60% масло) (6 мг) и иодметан (1,5 мл). Смесь перемешивали в течение 15 часов при комнатной температуре. К реакционной смеси добавляли этилацетат и смесь промывали водой и высушивали, затем растворитель отгоняли с получением названного в заголовке соединения в виде бесцветных кристаллов (39 мг), т.пл. 230 - 232oC (перекристаллизованный из этилацетата - этилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 1,81 (2H, м), 2,16 (3H, s), 2,58 (3H, s), 2,62 (2H, м), 3,01 (2H, м), 3,44 (3H, s), 4,32 (1H, d, J=14,4 Гц), 4,57 (1H, d, J=14,4 Гц), 6,8 - 7,3 (4H, м), 7,54 (2H, s), 7,82 (1H, s)
Пример 29
6-[N-[3,5-бис(трифторметил)бензил] -N-метиламинокарбонил] -5-(4-фторфенил)-7,8-дигидро-1,7-диметил-8-оксопиридо[3,4-b]пиридиния иодид
Смесь N-[3,5-бис(трифторметил)бензил] -5-(4-фторфенил)-7,8 -дигидро-N, 7-диметил-8-оксо-6-пиридо[3,4-b] пиридинкарбоксамида (пример 1) (175 мг), иодметана (3 мл и диоксана (3 мл) нагревали в течение 16 часов в колбе с обратным холодильником. Растворитель отгоняли, так что оставалось названное в заголовке вещество в виде желтых кристаллов (200 мг), т.пл. 184 - 185oC (разлагается) (перекристаллизованное из диоксана - этилацетата).
ЯМР (200 МГц, CDCl3) м.д.: 3,10 (3H, s), 3,61 (3H, s), 4,20 (1H, d, J= 14,2 Гц), 4,81 (1H, d, J=14,2 Гц), 4,99 (3H, s), 6,97 (2H, м), 7,29 (1H, м), 7,52 (1H, м), 7,55 (2H, s), 7,84 (1H, s), 8,07 (2H, м), 9,27 (1H, d, J=4,4 Гц).
Пример 30
N-[3,5-бис(трифторметил)бензил]-5-(4-фторфенил)-1,2,3,4,7,8 -гексагидро-N,1,7-триметил-8-оксо-6-пиридо[3,4-b] пиридининкарбоксамид
К раствору соединения (310 мл), полученного в примере 29, в метаноле (15 мг) частями добавляли борогидрид натрия (50 мг) при комнатной температуре при перемешивании. Эту смесь перемешивали в течение 15 минут при комнатной температуре и затем концентрировали. К концентрату добавляли этилацетат, затем промывали водой и высушивали, растворитель отгоняли, так что оставался N-[3,5-бис(трифтофметил)бензил] -5-(4-фторфенил)1,2,7,8- тетрагидро-N,1,7-триметил-8-оксо-6-пиридо[3,4-b] пиридинкарбоксамид в виде бледно-желтого маслянистого продукта [ЯМР (200 МГц, CDCl3) пер/мин:
2,70 (3H, s), 3,16 (3H, s), 3,49 (3H, s), 3,49 (1H, м), 3,88 (1H, м), 4,29 (1H, d, J=14,6 Гц), 4,66 (1H, d, J=14,6 Гц), 5,62 (1H, м), 5,77 (1H, d, J=13 Гц), 6,84 - 7,26 (4H, м), 7,53 (2H, s), 7,81 (1H, s)].
Это маслянистое соединение растворяли в метаноле (15 мл) и к нему добавляли 10% Pd-C (50% водный) (200 мг). Смесь взбалтывали в течение 18 часов при комнатной температуре в атмосфере водорода. Катализатор отфильтровывали и из фильтрата отгоняли растворитель. Остаток очищали путем колоночной хроматографии на силикагеле (этилацетат-этилацетат:метанол=4:1) с получением названного в заголовке соединения в виде бесцветных кристаллов (125 мг), т. пл. 155 - 157oC (перекристаллизованное из этилацетата - изопропилового эфира).
ЯМР (200 МГц, CDCl3) м.д.: 1,68 (2H, м), 1,74 - 2,32 (2H, м), 2,66 (3H, s), 3,04 (3H, s), 3,05 (2H, м), 3,48 (3H, s), 4,21 (1H, d, J=14,4 Гц), 4,72 (1H, d, J=14,4 Гц), 6,83 - 7,27 (4H, м), 7,51 (2H, s), 7,81 (1H, s)
Пример 31
3-[N-[3,5-бис(трифторметил)бензил] -N-метиламинокарбонил] -4- (4-фторфенил)-1,2-дигидро-2,7-диметил-1-оксопиридо[3,4-c]пиридиния иодид
Смесь N-[3,5-бис(трифторметил)бензил] -4-(4-фторфенил)-1,2- дигидро-N, 2-диметил-1-оксо-3-пиридо-[3,4-c] пиридинкарбоксамида (пример 8) (240 мг), иодметана (4 мл) и диоксана (4 мл) нагревали в течение 1,5 часов в колбе с обратным холодильником. Растворитель отгоняли, так что оставалось указанное в заголовке вещество в виде желтых кристаллов (303 мг), т.пл. 155 - 158oC (разлагается) (перекристаллизованное из диоксана - этилового эфира).
ЯМР (200 МГц, CDCl3) м.д.: 2,93 (3H, s), 3,61 (3H, s), 4,24 (1H, d, J= 14,2 Гц), 4,68 (3H, s), 4,78 (1H, d, J=14,2 Гц), 6,9 - 7,6 (5H, м), 7,54 (2H, s), 7,85 (1H, s), 8,82 (1H, d, J=7 Гц), 9,72 (1H, s)
Пример 32
N-[3,5-бис(трифторметил)бензил] -4-(4-фторфенил)-1,2,5,6,7,8- гексагидро-N,2,7-триметил-1-оксо-3-пиридо-[3,4-c]пиридинкарбоксамид
Используя 3-[N-[3,5-бис(трифторметил)бензил]-N-метиламинокарбонил]- 4-(4-фторфенил)-1,2-дигидро-2,7-диметил-1-оксопиридо [3,4-c] пиридиния иодид (пример 31) (300 мг), проводили по существу ту же самую реакцию (восстановление) и обработку с получением указанного в заголовке соединения в виде бесцветных кристаллов (125 мг), т.пл. 156 - 157oC (перекристаллизованное из этилацетата-изопропилового эфира).
ЯМР (200 МГц, CDCl3) м.д.: 1,93 - 2,73 (4H, м), 2,48 (3H, s), 2,75 (3H, s), 3,24 (1H, d, J=17 Гц), 3,75 (1H, d, J=17 Гц), 4,18 (1H, d, J=14,3 Гц), 4,77 (1H, d, J=14,3 Гц), 6,84 - 7,25 (4H, м), 7,50 (2H, s), 7,81 (1H, s)
Пример 33
3-[N-[3,5-бис(трифторметил)бензил]-N-метиламино-карбонил]- 4-(4-фторфенил)-1,2-дигидро-2,6-диметил-1-оксопиридо[4,3-c]пиридиния иодид
Смесь N-[3,5-бис(трифторметил)бензил] -4-(4-фторфенил)-1,2- дигидро-N, 2-диметил-1-оксо-3-пиридо[4,3-c] пиридинкарбоксамида (пример 9) (90 мг), иодметана (1,5 мл) и диоксана (1,5 мл) нагревали в течение 3 часов в колбе с обратным холодильником. Растворитель отгоняли в получением названного в заголовке вещества в виде желтых кристаллов (105 мг), т.пл. 260 - 262oC (перекристаллизованное из диоксана - этилового эфира).
ЯМР (200 МГц), CDCl3+ДМСО-d6) м.д.: 2,75 (3H, s), 3,46 (3H, s), 4,04 (1H, s, J= 14 Гц), 4,34 (3H, s), 4,69 (1H, d, J=14 Гц), 6,7 - 7,2 (3H, м), 7,42 (2H, s), 7,65 (1H, s), 7,8 (1H, м), 8,60 (1H, s), 8,63 (2H, s)
Пример 34
N-[3,5-бис(трифторметил)бензил] -4-(4-фторфенил)-1,2,5,6,7,8 -гексагидро-N,2,6-триметил-1-оксо-3-пиридо[4,3-c]пиридинкарбоксамид
Используя 3-[N-[3,5-бис(трифторметил)бензил]-N- метиламинокарбонил]-4-(4-фторфенил)-1,2-дигидро-2,6-диметил-1- оксопиридо[4,3-c] пиридиния иодид (пример 33) (600 мг), по существу ту же самую реакцию (восстановление) и обработку проводили для получения названного в заголовке вещества в виде бесцветных кристаллов (300 мг), т.пл. 156 - 158oC(перекристаллизованное из этилацетат-изопропилового эфира).
ЯМР (200 МГц, CDCl3) м.д.: 2,97 (3H, s), 2,58 - 2,78 (5H, м), 2,78 (3H, s), 3,06 (1H, d, J=17 Гц), 3,50 (3H, s), 4,17 (1H, d, J=14,5 Гц), 4,79 (1H, d, J = 14,5 Гц), 6,86 - 7,25 (4H, м), 7,50 (2H, s), 7,82 (1H, s)
Пример 35
N-[3,5-бис(трифторметил)бензил] -5-(4-фторфенил)-1,2,7,8- тетрагидро-N, 1,7-триметил-2,8-диоксо-6-пиридо[3,4-b]пиридинкарбоксамид
Смесь 6-[N-[3,5-бис(трифторметил)бензил] -N- метиламинокарбонил]-5-(4-фторфенил)-7,8-дигидро-1,7-диметил-8-оксопиридо [3,4-b] пиридиния иодида пример 29) (100 мг), ТГФ (3 мл) феррицианида калия (500 мг) и IN-NaOH перемешивали в течение 15 часов. Растворитель отгоняли. К остатку добавляли этилацетат и смесь промывали водой и высушивали, затем растворитель отгоняли. Остаток подвергали колоночной хроматографии на силикагеле (этилацетат) для выделения и очистки с получением названного в заголовке соединения в виде бесцветных кристаллов (35 мг), т.пл. 210-212oC перекристаллизованное из этилацетата - изопропилового эфира).
ЯМР (200 МГц, CDCl3) м.д.: 2,79 (3H, s), 3,55 (3H, s), 4,17 (3H, s), 4,23 (1H, d, J = 14,6 Гц), 4,78 (1H, d, J = 14,6 Гц), 6,78 (1H, d, J = 9,8 Гц), 6,92 - 7,32 (4H, м), 7,08 (1H, d, J = 9,8 Гц), 7,53 (2H,s), 7,83 (1H, s)
Соединения из примеров с 36 по 47 были получены путем проведения с карбоновыми кислотами, имеющими заместители, соответствующие соответствующим соединениями и бензиламинами по существу той же самой реакции (амидирование) обработки, что и в примере 1.
Пример 36
N-[3,5-бис(трифторметил)бензил] -7,8-дигидро-N,7-диметил-8-оксо-5-фенил- 6-пиридо[3,4-b]пиридинкарбоксамид
Т.пл. 191-192oC (перекристаллизованный из метанола - этилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 2,79 (3H, s), 3,67 (3H, s) 4,24 (1H, d, J = 14,6 Гц), 4,82 (1H, d, J = 14,6 Гц), 7,05 - 7,63 (9H, м), 7,81 (1H, s), 8,93 (1H, М)
Пример 37
N-[3,5-бис(трифторметил)бензил] -1,2-дигидро-N, 2-диметил-1-оксо- 4-фенил-3-пиридо[3,4-с]пиридинкарбоксамид
Т.пл. 192-194oC (перекристаллизованный из этилацетата-изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 2,78 (3H, s), 3,60 (3H, s) 4,26 (1H, d, J = 14,6 Гц), 7,04 (1H, d, J = 5,6 Гц), 7,15 - 7,34 (5H, м), 7,49 (2H, s), 7,81 (1H, s), 8,6 (1H, d, J = 5,6 Гц), 9,69 (1H,s)
Пример 38
N-[3,5-бис(трифторметил)бензил] -5,6-дигидро-N,6-диметил-5-оксо-8- фенил-7-пиридо[4,3-b]пиридинкарбоксамид
Т.пл. 127-128oC (перекристаллизованный из этилацетата-изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 2,74 (3H, s), 3,62 (3H, s) 4,37 (1H, d, J = 14,6 Гц), 4,64 (1H, d, J = 14,6 Гц), 7,20 - 7,40 (5H, м), 7,44 (1H, dd, J = 4,6, 8,2 Гц), 7,53 (2H, s), 7,81 (1H, s), 8,76 (1H, dd, J = 2,0, 8,2 Гц), 8,90 (1H, dd, J = 2,0, 4,6 Гц)
Пример 39
N-[3,5-бис(трифторметил)бензил]-4-(4-фторфенил)-6,7-дигидро-N,1,6- триметил-7-оксо-5-пирроло[2,3-с]пиридинкарбоксамид
Т.пл. 160-161oC (перекристаллизованный из этилового эфирагексана)
ЯМР (200 МГц, CDCl3), м.д.: 2,66 (3H, s), 3,57 (3H, s) 4,21 (3H, s), 4,45 (1H, d, J = 14,5 Гц), 4,67 (1H, d, J = 14,5 Гц), 6,05 (1H, d, J = 3,0 Гц), 6,96 (2H, t-подобное, J = 8,4 Гц), 7,00 (1H, d, J = 3,0 Гц). 7,31 - 7,42 (2H, м), 7,58 (2H, s), 7,82 (1H, s)
Пример 40
N-[3,5-бис(трифторметил)бензил] -7-(4-фторфенил)-4,5-дигидро-N, 5- диметил-4-оксо-6-тиазоло[5,4-c]пиридинкарбоксамид
Т.пл. 189-190oC (перекристаллизованный из этилацетата-гексана)
ЯМР (200 МГц, CDCl3) м.д.: 2,73 (3H, s), 3,66 (3H, s), 4,47 (1H, d, J = 14,6 Гц), 4,70 (1H, d, J = 14,6 (Гц), 7,00 (2H, t-подобное, J = 8,4 Гц), 7,37 - 7,47 (2H, м), 7,60 (2H, s), 7,86 (1H, s), 9,12 (1H, s)
Пример 41
N-[3,5-бис(трифторметил)бензил] -7-(4-фторфенил)-4,5-дигидро-N, 5- диметил-4-оксо-6-тиазоло[4,5-c]пиридинкарбоксамид
Т.пл. 207-210oC (перекристаллизованный из этилацетата-изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 2,76 (3H, s), 3,67 (3H, s) 4,36 (1H, d, J = 14,7 Гц), 4,82 (1H, d, J = 14,7 Гц), 7,00 (2H, t-подобное, J = 8,6 Гц), 7,33 - 7,43 (2H, м), 7,56 (2H, s), 7,84 (1H, s), 8,87 (1H, s)
Пример 42
N-[3,5-бис(трифторметил)бензил] -4,5-дигидро-N, 5-диметил-4-оксо-7- фенил-6-тиазоло[5,4-c]пиридинкарбоксамид
Т.пл. 175-176oC (перекристаллизованный из этилацетата -гексана)
ЯМР (200 МГц, CDCl3) м.д.: 2,69 (3H, s), 3,67 (3H, s), 4,44 (1H, d, J = 14,6 Гц), 4,66 (1H, d, J = 14,6 Гц), 7,25 - 7,36 (3H, м), 7,38 - 7,48 (2H, м), 7,56 (2H, s), 7,82 (1H, s), 9,12 (1H, s)
Пример 43
N-[3,5-бис(трифторметил)бензил] -4,5-дигидро-N, 5-диметил- 4-оксо-7-фенил-6-тиазоло[4,5-c]пиридинкарбоксамид
Т. пл. 220-221oC (перекристаллизованный из этилацетата-изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 2,72 (3H, s), 3,68 (3H, s) 4,35 (1H, d, J = 14,6 Гц), 4,78 (1H, d, J = 14,6 Гц), 7,25 - 7,45 (5H, м), 7,53 (2H, s), 7,81 (1H, s), 8,86 (1H, s).
Пример 44
N-[3,5-бис(трифторметил)бензил] -6,7-дигидро-N, 6-диметил-7-оксо- 4-фенил-5-тиено[2,3-с]пиридинкарбоксамид
Т.пл. 194-196oC (перекристализованный из этилацетата)
ЯМР (200 МГц, CDCl3) м.д.: 2,69 (3H, s), 3,64 (3H, s), 4,36 (1H, d, J = 14,6 Гц), 4,72 (1H, d,J = 14,6 Гц), 6,98 (1H, d, J = 5,4 Гц), 7,3 (5H, м), 7,53 (2H, s), 7,67 (1H, d, J = 5,4 Гц), 7,81 (1H, s)
Пример 45
6,7-дигидро-N-(2-метоксибензил)-6-метил-7-оксо-4-фенил-5-тиено [2,3-c] пиридинкарбоксамид
Т.пл. 247-249oC (перекристаллизованный из этилацетата-ТГФ)
ЯМР (200 МГц, CDCl3) м.д.: 3,64 (3H, s), 3,70 (3H, s), 4,29 (2H, d, J = 6,4 Гц), 6,23 (1H, b), 6,7 - 6,9 (4H, м), 6,96 (1H, d, J = 5,6 Гц), 7,2 - 7,3 (5H, м), 7,60 (1H, d, J = 5,6 Гц)
Пример 46
6,7-дигидро-N-(2-метоксибензил)-N, 6-диметил-7-оксо- 4-фенил-5-тиено[2,3-c]пиридинкарбоксамид
Т.пл. 154,6 - 155,4oC (перекристаллизованный из этилацетата- изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 2,63 (3H, s), 3,65 (3H, s) 3,76 (3H, s), 4,48 (1H, d, J = 15,0 Гц), 4,60 (1H, d, J=15,0 Гц), 6,38 (1H, d, J = 6,6 Гц), 6,71 (1H, t, J = 7,6 Гц), 6,80 (1H, d, J = 8,0 Гц), 6,99 (1H, d, J = 5,2 Гц), 7,20 (1H, t, J = 7,0 Гц), 7,43 (5H, м), 7,65 (1H, d, J = 5,2 Гц)
Пример 47
N-[3,5-бис(трифторметил)бензил]-6,7-дигидро-N,6-диметил-4-(2-метилфенил) -7-оксо-5-тиено[2,3-с]пиридинкарбоксамид
Бесцветный маслянистый продукт
ЯМР (200 МГц, CDCl3) м. д.: 2,08 (3Hх2/5, s), 2,13 (3Hx3/5, s), 2,74 (3Hx2/5, s), 2,94 (3Hx3/5, s), 3,62 (3Hx3/5, s), 3,64 (3Hx 2/5, s), 4,12 (1Hx3/5, d, J = 14,6 Гц), 4,29 (1Hx2/5, d, J = 14,4 Гц), 4,78 (1Hx1/5, J 14,4 Гц), 4,98 (1Hx3,5, d, J = 14,6 Гц), 6,63 (1Hx3/5, d, J = 5,2 Гц), 6,72 (1Hx2/5, d, J=5,2 Гц), 6,96 (1H, м), 7,0 (2H, м), 7,5 (1H, м), 7,63 (1H, м), 7,81 (1H, м)
Пример 48
6-[N-[3,5-бис(трифторметил)бензил] -N-метиламинокарбонил] -7,8-дигидро- 1,7-диметил-8-оксо-5-фенилпиридо[3,4-b]пиридиния иодид
Используя соединение, полученное в примере 36 и иодметан, проводили по существу ту же самую реакцию и обработку, что и в примере 29 для получения названного в заголовке вещества в виде желтых кристаллов.
Т. пл. 173 - 175oC (разложение) (перекристаллизованное из диоксана - этилацетата)
ЯМР (200 МГц, CDCl3) м.д.: 3,04 (3H, s), 3,62 (3H, s), 4,19 (1H, d, J = 14 Гц), 4,79 (1H, d, J = 14 Гц), 5,01 (3H, s), 7,3 - 7,5 (7H, м), 7,80 (1H, s), 8,0 - 8,1 (2H, м), 9,32 (1H, bs)
Пример 49
N-[3,5-бис(трифторметил)бензил] -1,2,3,4,7,8-гексагидро-5-фенил- N,1,7-триметил-8-оксо-6-пиридо[4,3-b]пиридинкарбоксамид
Используя соединение, полученное в примере 47, проводили ту же самую реакцию (восстановление) и обработку, что и в примере 30 для получения указанного в заголовке вещества в виде бесцветных кристаллов.
Т.пл. 135 - 137oC (перекристаллизованное из этилацетата - изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 1,69 (2H, М), 1,87 - 2,38 (2H, м), 2,73 (3H, s), 3,04 (3H, s), 3,08 (2H, м), 3,49 (3H, s), 4,19 (1H, d, J = 14,4 Гц), 4,70 (1H, d, J = 14,4 Гц), 7,03 - 7,38 (5H, м), 7,46 (2H, s), 7,77 (1H, s)
Пример 50
N-[3,5-бис(трифторметил)бензил] -1,2,5,6,7,8-гексагидро- N, 2,7-триметил-1-оксо-4-фенил-3-пиридо[3,4-c]пиридинкарбоксамид
Используя соединение, полученное в примере 37, проводили по существу ту же самую реакцию (восстановление) и обработку, что и в примере 32, для получения вышеназванного вещества в виде бесцветных кристаллов.
Т. пл. 138 - 140oC (перекристаллизованное из этилацетат-изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 1,98 - 2,70 (4H, м), 2,47 (3H, s), 2,71 (3H, s), 3,24 (1H, d, J = 17 Гц), 3,51 (3H, s), 3,75 (1H, d, J = 17 Гц), 4,16 (1H, d, J = 14,5 Гц), 4,74 (1H, d, J = 14,5 Гц), 7,03 - 7,32 (5H, м), 7,44 (2H, s), 7,77 (1H, s)
Пример 51
N-[3,5-бис(трифторметил)бензил] -1,2,3,4,5,6-гексагидро- N,6-диметил-5-оксо-8-фенил-7-пиридо[4,3-b]пиридинкарбоксамид
Используя соединение, полученное в примере 38, проводили по существу ту же самую реакцию (восстановление) и обработку, что и в примере 27, для получения вышеназванного соединения в виде бесцветных кристаллов.
Т.пл. 229 - 231oC (перекристаллизованное из метанола - этилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 1,86 (2H, м), 2,64 (2H, t - подобное, J = 6,2 Гц), 2,74 (3H, s), 3,17 (2H, м), 3,43 (3H, s), 3,92 (1H, b), 4,14 (1H, d, J = 14,6 Гц), 4,77 (1H, d, J = 14,6 Гц), 7,13 (1H, м), 7,26 (4H, м), 7,44 (2H, s), 7,77 (1H, s)
Пример 52
N-[3,5-бис(трифторметил)бензил] -1,2,3,4,5,6-гексагидро- N, 1,6-триметил-5-оксо-8-фенил-7-пиридо[4,3-b]пиридинкарбоксамид
Используя соединение, полученное в примере 51, проводили по существу ту же самую реакцию (метилирование) и обработку, что и в примере 28, для получения вышеназванного вещества в виде бесцветных кристаллов.
Т.пл. 233 - 235oC (перекристаллизованное из метанола - этилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 1,82 (2H, м), 2,18 (3H, s), 2,53 (3H, s), 2,63 (2H, м), 3,03 (2H, м), 3,45 (3H, s), 4,30 (1H, d, J = 14,6 Гц), 4,56 (1H, d, J = 14,6 Гц), 7,18 (4H, s), 7,35 (1H, м), 7,50 (2H, s), 7,80 (1H, s)
Пример 53
N-[3,5-бис(трифторметил)бензил]-4-(4-фторфенил)-1,2,5,6,7,8- гексагидро-N,2-диметил-1-оксо-3-пиридо[3,4-c]пиридинкарбоксамид
К раствору соединения (270 мг), полученного в примере 8, в уксусной кислоте (15 мл) добавляли 5% Pt - C (270 мг) и смесь перемешивали в течение 6 часов при комнатной температуре в атмосфере водорода. Катализатор отфильтровывали и фильтрат промывали этилацетатом. Фильтрат и промывочную жидкость объединяли и затем растворитель отгоняли. К остатку добавляли этилацетат, и смесь промывали водным раствором гидрокарбоната натрия и водой, после чего высушивали. Растворитель отгоняли, так что оставалось вышеназванное вещество в виде бесцветных кристаллов (170 мг).
Т.пл. 178 - 180oC (перекристаллизованное из этилацетата - этилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 1,92 (1H, d-подобное, J = 17 Гц), 2,3 - 2,5 (1H, м), 2,7 - 2,9 (1H, м), 2,77 (3H, s), 3,0 - 3,1 (1H, м), 3,50 (3H, s), 3,81 (1H, d, J = 18 Гц), 3,98 (1H, d, J = 18 Гц), 4,19 (1H, d, J = 14,4 Гц), 4,77 (1H, d, J = 14,4 Гц), 6,8 - 7,2 (4H, м), 7,50 (2H, s), 7,81 (1H, s)
Пример 54
N-[3,5-бис(трифторметил)бензил] -1,2,5,6,7,8-гексагидро- N,2-диметил-1-оксо-4-фенил-3-пиридо[4,3-c]пиридинкарбоксамид
Соединение, полученное в примере 37, подвергали восстановлению и обрабатывали по существу тем же самым образом, как и в примере 53, для получения вышеназванного вещества в виде бесцветных кристаллов (выделенных в виде гидрохлорида).
Т.пл. 255 - 257oC (разложение) (перекристаллизованное из этанола)
ЯМР (200 МГц, CDCl3) м.д.: 2,2 - 2,7 (1H, м), 2,73 (3H, s), 2,9 - 3,1 (2H, м), 3,50 (3H, s), 3,5 (1H, м), 4,05 (1H, d, J = 18 Гц), 4,19 (1H, d, J = 14,5 Гц), 4,36 (1H, d, J = 18 Гц), 4,71 (1H, d, J = 14,5 Гц), 7,06 - 7,30 (5H, м), 7,45 (2H, s), 7,79 (1H, s), 10,3 (2H, b)
Пример 55
N-[3,5-бис(трифторметил)бензил] -1,2,3,4,7,8-гексагидро-5- фенил-N, 7-диметил-8-оксо-6-пиридо[3,4-b]пиридинкарбоксамид.
Соединение, полученное в примере 36, подвергали восстановлению и обработке по существу таким же образом, как и в примере 53, для получения вышеназванного вещества в виде бесцветных кристаллов.
Т.пл. 155 - 156oC (перекристаллизованное из этилового эфира - гексана)
ЯМР (200 МГц, CDCl3) м.д.: 1,59 - 2,10 (3H, м), 2,28 - 2,49 (1H, м), 2,67 (3H, s), 3,2 - 3,5 (2H, м), 3,56 (3H, s), 4,25 (1H, d, J = 14,6 Гц), 4,62 (1H, d, J = 14,6 Гц), 7,10 (1H, м), 7,22 (4H, м), 7,48 (2H, s), 7,77 (2H, s)
Пример 56
N-[3,5-бис(трифторметил)бензил] -7,8-дигидро-N, 7-диметил-5- (4-метилфенил)-8-оксо-6-пиридо[3,4-b]пиридинкарбоксамид
Соединение, полученное в справочном примере 25, подвергали реакции и обработке по существу таким же образом, что и в примере 1, для получения вышеназванного вещества в виде бесцветных кристаллов.
Т. пл. 197 - 199oC (перекристаллизованное из ацетона - изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 2,33 (3H, s), 2,80 (3H), 3,66 (3H, s), 4,27 (1H, d, J = 14,5 Гц), 4,79 (1H, d, J = 14,5 Гц), 7,01 - 7,28 (4H, м), 7,46 (1H, dd, J = 8,4 Гц), 7,57 (2H, s), 7,60 (1H, dd, J = 8,2 Гц), 7,81 (1H, s), 8,91 (1H, dd, J = 4,2 Гц)
Маточную жидкость подвергали колоночной хроматографии на силикагеле (метилацетат - дихлорметан = 4 : 1) для получения амид-ротамера вышеуказанного соединения в виде бесцветных кристаллов.
Т.пл. 164 - 166oC
ЯМР (200 МГц, CDCl3) м.д.: 2,46 (3H, s), 2,73 (3H, s), 3,69 (3H, s), 4,21 (1H, d, J = 16 Гц), 4,58 (1H, d, J = 16 Гц), 7,03 - 7,80 (9H, м), 8,92 (1H, dd, J = 4,4, 16 Гц)
Первое соединение было использовано для биологического испытания, представленного в таблице N 2.
Пример 57
N-[3,5-бис(трифторметил)бензил]-7,8-дигидро-5-(4-метоксифенил)- N,7-диметил-8-оксо-6-пиридо[3,4-b]пиридинкарбоксамид
Соединение, полученное в справочном примере 26, подвергали реакции и обработке по существу таким же самым образом, как и в примере 1, для получения вышеназванного вещества в виде бесцветных кристаллов.
Т.пл. 195-197oC (перекристаллизованное из этилацетата - этилового эфира)
ЯМР (200 МГц, CDCl3) м.д. ; 2,80 (3H, s), 3,66 (3H, s), 3,82 (3H, s), 4,42 (1H, d, J=14,4 Гц), 4,71 (1H, d, J=14,4 Гц), 6,8-7,6 (6H, м), 7,57 (2H, s), 7,81 (1H, s), 8,9 (1H, m)
Пример 58
N-[3,5-бис(трифторметил)бензил] -1,2-дигидро-N, 2-диметил-4- (4-метилфенил)-1-оксо-3-пиридо[3,4-с]пиридинкарбоксамид
Соединение, полученное в справочном примере 27, подвергали реакции и обработке по существу таким образом, как и в примере 1, для получения вышеназванного соединения в виде бесцветных кристаллов.
Т.пл. 166-168oC (перекристаллизованное из этилацетата - этилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 2,33 (3H, s), 2,80 (3H, s), 3,60 (3H, s), 4,32 (1H, d, J=14,4 Гц), 4,75 (1H, d, J=14,4 Гц), 7,00-7,30 (5H, m), 7,57 (2H, s), 7,82 (1H, s), 8,65 (1H, bd), 9,69 (1H, s)
Пример 59
N-[3,5-бис(трифторметил)бензил] -1,2,5,6,7,8-гексагидро-N, 2,7-триметил-4-(4-метилфенил)-1-оксо-3-пиридо[3,4-с] пиридинкарбоксамид
Соединение, полученное в примере 58, подвергали реакциям и обработкам по существу таким же образом, что и в примере 31 (N-метилирование) и в примере 32 (восстановление) и для получения вышеназванного вещества в виде бесцветных кристаллов.
Т.пл. 126-128oC (перекристаллизованное из этилового эфира - гексана)
ЯМР (200 МГц, CDCl3) м.д.: 1,90-2,80 (4H, m), 2,27 (3H, s), 2,47 (3H, s), 3,23 (1H, d, J=17 Гц), 3,50 (3H, s), 3,74 (1H, d, J=17 Гц), 4,23 (1H, d, J= 15 Гц), 4,71 (1H, d, J=15 Гц), 6,90-7,30 (4H, m), 7,52 (2H, s), 7,78 (1H, s)
Пример 60
N-[3,5-бис(трифторметил)бензил] -7,8-дигидро-N, 7-диметил- 5-(3-метилфенил)-8-оксо-6-пиридо[3,4-b]пиридинкарбоксамид
Соединение, полученное в справочном примере 28, подвергалось реакции и обработке по существу таким же образом, как и в примере 1, для получения вышеназванного вещества в виде бесцветных кристаллов.
Т.пл. 178-180oC (перекристаллизованное из ацетона - этилового эфира)
ЯМР (200 МГц, CDCl3) м.д.; 2,26 (3Hx 1/2, s), 2,33 (3Hx 1/2, s), 2,78 (3Hx 1/2, s) 2,81 (3Hx 1/2, s) 3,65 (3Hx 1/2, s), 3,67 (3Hx 1/2, s), 4,23 (1Hx 1/2, d, J=14,6 Гц), 4,37 (1Hx 1/2, d, J=14,65 Гц), 4,70 (1Hx 1/2, d, J= 14,6 Гц), 4,82 (1Hx 1/2, d, J=14,6 Гц), 6,94 (1H, bs), 7,1-7,2 (3H, m), 7,4-7,5 (3H, m), 7,56-7,64 (1H, m), 7,80 (1H, s), 8,91 (1H, dd, J=4,2 Гц)
Соединения из примеров с 61 по 72 были получены при использовании карбоновых кислот и бензиламинов, имеющих заместители, соответствующие соответственным соединениям, и путем проведения реакции по существу таким же образом, как и в примере 1 (амидирование), и затем подвергая реакционную смесь обработке, по существу таким образом, как в примере 1.
Пример 61
N-бензил-5-(4-фторфенил)-7,8-дигидро-N,7-диметил-8-оксо- 6-пиридо[3,4-b] пиридинкарбоксамид
Изомер (амид-ротамер) A (ТСХ, SiO2 (этилацетат: Ac OH : H2 = 8:1:1); Rf меньше)
Т.пл. 213-215oC (перекристаллизованный из этилацетата)
ЯМР (200 МГц, CDCl3) м.д.: 2,70 (3H, s), 3,68 (3H, s), 4,00 (1H, d, J=15 Гц), 5,00 (1H, d, J=15 Гц), 6,72 (2,72 (2H, m) 7,05-7,57 (9H, m), 8,92 (1H, dd, J=2,4 Гц)
Изомер (Амид-ротамер) B (ТСХ, SiO2 (этилацетат: Ac OH : H2O = 8:1:1); Rf, больше) (получен в виде вторых кристаллов)
Т.пл. 213-215oC (перекристаллизованный из этилацетатэтилового эфира: содержит около 2% изомера A)
ЯМР (200 МГц, CDCl3) м.д.: 2,75 (3H, s), 3,64 (3H, s), 3,89 (1H, d, J=15 Гц), 4,48 (1H, d, J=15 Гц), 6,82 (2H, м), 7,10-7,72 (9H, м), 8,93 (1H, dd, J=2,4 Гц)
Пример 62
N-(3,5-диметилбензил)-5-(4-фторфенил)-7,8-дигидро-N, 7-диметил-8-оксо-6-пиридо[3,4-b]пиридинкарбоксамид
Т.пл. 178-180oC (перекристаллизованный из метанолаэтилацетата)
ЯМР (200 МГц, CDCl3) м.д.: 2,25 (6H, s), 1,68 (3H, s), 3,67 (3H, s), 4,07 (1H, d, J=14 Гц), 4,74 (1H, d, J=14 Гц), 6,51 (2H, s), 6,90 (1H, s), 7,05-7,59 (6H, м), 8,91 (1H, м)
Пример 63
N-(2-хлорбензил)-5-(4-фторфенил)-7,8-дигидро-N, 7-диметил-8-оксо-6-пиридо[3,4-b]пиридинкарбоксамид
Т.пл. 243-245oC (перекристаллизованный из метанолацетона)
ЯМР (200 МГц, CDCl3) м.д.: 2,79 (3H, s), 3,70 (3H, s), 4,33 (1H, d, J=15 Гц), 5,02 (1H, d, J=15 Гц), 6,28 (1H, dd, J=2,8 Гц), 7,08-7,6 (9H, м), 8,93 (1H, м)
Пример 64
N-(3,5-диметилбензил)-7,8-дигидро-N, 7-диметил-5- (4-метилфенил)-8-оксо-6-пиридо[3,4-b]пиридинкарбоксамид
Т.пл. 140-141oC (перекристаллизованный из ацетона-этилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 2,24 (6H, s), 2,43 (3H, s), 2,67 (3H, s), 3,66 (3H, s), 4,22 (1H, d, J=14 Гц), 4,57 (1H, d, J-14 Гц), 6,55 (2H, ), 6,89 (1H, s), 7,05-7,65 (6H, м), 8,90 (1H, м)
Пример 65
N-(хлорбензил)-7,8-дигидро-N, 7-диметил-5- (4-метилфенил)-8-оксо-6-пиридо[3,4-b]пиридинкарбоксамид
Т.пл. 233-235oC (перекристаллизованный из ацетона-метанола)
ЯМР (200 МГц, CDCl3) м.д.: 2,49 (3H, s), 2,78 (3H, s), 3,70 (3H, s), 4,33 (1H, d, J=15 Гц), 5,02 (1H, d, J=15 Гц), 6,18 (1H, d, J=8 Гц), 6,89-7,65 (9H, м), 8,91 (1H, м)
Пример 66
7,8-Дигидро-N, 7-диметил-5-(4-метилфенил)-8-оксо- N-(2-трифторметилбензил)-6-пиридо[3,4-b]пиридинкарбоксамид
Т.пл. 220-222oC (перекристаллизованный из метанола)
Пример 67
7,8-Дигидро-N, 7-диметил-5-(4-метилфенил)-8-оксо- N-(3-трифторметилбензил)-6-пиридо[3,4-b]пиридинкарбоксамид
Т. пл. 134-135oC (перекристаллизованный из метанола- изопропилового эфира)
Пример 68
7,8-Дигидро-N, 7-диметил-5-(4-метилфенил)-8-оксо- N-(4-трифторметилбензил)-6-пиридо[3,4-b]пиридинкарбоксамид
Т. пл. 207-209oC (перекристаллизованный из метанола- изопропилового эфира)
Пример 69
N-(2,4-дифторбензил)-7,8-дигидро-N, 7-диметил-5-(4-метилфенил)-8-оксо- 6-пиридо[3,4-b]пиридинкарбоксамид
Т.пл. 198 - 199oC (перекристаллизованный из ацетона - метанола)
Пример 70
N-(2,6-дифторбензил)-7,8-дигидро-N, 7-диметил-5-(4-метилфенил)- 8-оксо-6-пиридо[3,4-b]пиридинкарбоксамид
Т.пл. 242 - 243oC (перекристаллизованный из ацетона)
Пример 71
N-(3,5-дифторбензил)-7,8-дигидро-N, 7-диметил-5-(4-метилфенил)- 8-оксо-6-пиридо[3,4-b]пиридинкарбоксамид
Т.пл. 210 - 212oC (перекристаллизованный из ацетона-этилового эфира)
Пример 72
N-(3,5-дихлорбензил)-7,8-дигидро-N, 7-диметил-5-(4-метилфенил)- 8-оксо-6-пиридо[3,4-b]пиридинкарбоксамид
Т.пл. 162 - 163oC (перекристаллизованный из ацетона-этилового эфира)
Пример 73
N-(3,5-бис-(трифторметил)бензил] -5-[4-N-(3,5-бис(трифторметил)- бензил] -N-метилкарбамоилфенил]-7,8-дигидро-N,7-диметил-8-оксо-6- пиридо[3,4-b]пиридинкарбоксамид
Используя соединение, полученное в справочном примере 29, и N-[3,5-бис(трифторметил)бензил]метиламин, проводили по существу ту же самую реакцию и обработку, что и в примере 1 (амидирование) с получением вещества, указанного в заголовке, в виде бесцветных кристаллов.
Т. пл. 190-191oC (перекристаллизованное из этилацетата и изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 2,78 (3H, s), 3,02 (3H, s), 3,62 (3H, s), 4,05-4,35 (1H, м), 4,70 - 5,00 (3H, м), 7,30 - 7,90 (12H, м), 8,95 (1H, dd, J = 4,2 1,6 Гц)
Пример 74
N-[3,5-бис(трифторметил)бензил]-5-(4-карбоксифенил]-7,8- дигидро-N,7-диметил-8-оксо-6-пиридо[3,4-b]пиридинкарбоксамид
Смесь соединения, полученного в примере 73 (0,37 г) конц. HCl (12 мл) и уксусной кислоты (12 мл) перемешивали в течение 6 часов в колбе с обратным холодильником. Растворитель отгоняли, остаток растворяли в 1 N NaOH. Раствор промывали этиловым эфиром - ТГФ. К водному слою добавляли к. HCl для доведения до pH 2 - 3 и затем экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором NaCl и высушивали. Растворитель отгоняли с получением названного в заголовке вещества в виде бесцветных кристаллов (121 мг).
Т.пл. 301 - 302oC (перекристаллизованное из ТГФ - изопропилового эфира).
ЯМР (200 МГц, CDCl3 + ДМСО-d6) м.д.: 2,80 (3H, s), 3,67 (3H, s), 4,44 (1H, d, J = 14,5 Гц), 4,58 (1H, d, J = 14,5 Гц), 7,27 (1H, м), 7,40 - 7,60 (3H, м), 7,59 (2H, s), 7,82 (1H, s), 8,03 (2H, t - подобное, J = 7,9 Гц), 8,94 (1H, dd, J = 4,2, 1,8 Гц)
Пример 75
N-[3,5-бис(трифторметил)бензил] -7,8-дигидро-5-(4-метоксикарбонилфенил- N,7-диметил-8-оксо-6-пиридо[3,4-b]пиридинкарбоксамид
К смеси соединения, полученного в примере 74 (50 мг) и ТГФ (15 мл) добавляли раствор диазометана (избыток) в этиловом эфире. После того, как смесь перемешивалась в течение 30 минут при комнатной температуре, растворитель выпаривали с получением названного в заголовке вещества в виде бесцветных кристаллов (25 мг).
Т.пл. 123 - 125oC (перекристаллизованное из этилацетата - изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д. : 2,81 (3H, s), 3,67 (3H, s), 3,97 (3H, s), 4,28 (1H, d, J = 14 Гц), 4,75 (1H, d, J = 14 Гц), 7,25 (1H, м), 7,40 - 7,60 (3H, м), 7,55 (2H, s), 7,79 (1H, s), 7,85 - 8,02 (2H, м), 8,94 (1H, dd, J = 4,0, 1,8 Гц)
Пример 76
N-[3,5-бис(трифторметил)бензил] -5-циклогексил-7,8-дигидро- N, 7-диметил-8-оксо-6-пиридо[3,4-b]пиридинкарбоксамид
Используя соединение, полученное в справочном примере 30 и N-3,5-бис(трифторметил) бензил метиламин, проводили по существу ту же самую реакцию и обработку, что и в примере 1 (амидирование) с получением названного в заголовке соединения в качестве бледно-желтого масла.
ЯМР (200 МГц, CDCl3) м.д.: 0,8 - 2,6 (11H, м), 2,97 (3H, s), 3,55 (3H, s), 4,47 (1H, d, J = 14 Гц), 5,28 (1H, d, J = 14 Гц), 7,50 - 7,62 (1H, м), 7,93 (1H, s), 7,95 (2H, s), 8,40 - 8,50 (1H, м), 8,90 - 9,00 (1H, м)
Справочный пример 1
5-(4-фторфенил)-7,8-дигидро-7-метил-8-оксо-6-пиридо[3,4-b] - пиридинкарбоновая кислота
Процесс 1
Стадия 1
К смеси 2,3-пиридинкарбонового ангидрида (16,5 г) и фторбензола (120 мл) добавляли при перемешивании при комнатной температуре безводный хлорид алюминия (23,1 г). Реакционную смесь перемешивали в течение 3 часов в колбе с обратным холодильником, после чего охлаждали и выливали в смесь хлористоводородной кислоты и ледяной воды. Эту смесь доводили до pH 2-3 с помощью водного раствора карбоната калия, и затем экстрагировали этилацетатом. Экстракционный раствор промывали водой и высушивали, затем растворитель отгоняли, так что оставалась 3-(4-фторбензол)-2-пиридинкарбоновая кислота и в виде бесцветных кристаллов (11,0 г).
Т.пл. 152 - 153oC (перекристаллизованная из метанола - этилацетата)
ЯМР (200 МГц, CDCl3) м.д.: 7,35 (2H, t - подобное, J = 8,8 Гц), 7,68 - 7,80 (3H, м), 7,99 (1H, dd, J = 1,8, 7,6 Гц), 8,84 (1H, dd, J = 1,8, 4,6 Гц)
Стадия 2
К раствору соединения (1,50 г), полученного на стадии 1, в дихлорметане (20 мл) добавляли тионилхлорид (1,8 мл) и ДМФ (одну каплю). Смесь взбалтывали в течение 40 минут при нагревании в колбе с обратным холодильником. Растворитель отгоняли и остаток растворяли в дихлорметане (15 мл). Этот раствор добавляли к смеси гидрохлорида N-метилглицин-бензилового эфира (1,30 г), триэтиламина (3,5 мл) дихлорметана (20 мл), и перемешивали в течение 20 минут при комнатной температуре. Растворитель отгоняли. К остатку добавляли воду и затем подвергали экстракции этилацетатом. Экстракционный растворитель промывали водным раствором гидрокарбоната натрия и водой и затем высушивали. Растворитель отгоняли, так что оставался N-бензилоксикарбонилметил-3-(4-фторбензил)-N-метил-2- пиридинкарбоксамид и в виде масляного продукта (1,94 г).
ЯМР (200 МГц, CDCl3) : м. д. : 3,13 3,19 (каждый 3H, s), 4,20, 4,30 (каждый 1H, s), 5,18, 5,25 (каждый 1H, s), 7,12 (2H, м), 7,22 - 7,50 (5H, м), 7,22 (1H, dd, J = 1,8, 7,6 Гц), 7,75 - 7,90 (2H, м), 8,39 (1H, dd, J = 1,8, 4,8 Гц), 8,74 (1H, dd, J = 1,8 4,8 Гц)
Стадия 3
Смесь соединения (1,94 г), полученного на стадии 2, толуола (100 мл) и 1,8 - диазабицикло 5,4, 0 ундец -7-ена (0,83 мл) перемешивали в течение 2 часов в колбе с обратным холодильником. Растворитель отгоняли. К остатку добавляли этилацетат, промывали водой, водным раствором гидрокарбоната натрия и водой, последовательно, с последующим высушиванием. Растворитель отгоняли, так что оставался 5-(4-фторфенил)-7,8-дигидро-7-метил-8-оксо-6-пиридо[3,4-b] пиридинкарбоновой кислоты бензилового эфира в виде бесцветных кристаллов (440 мг).
Т.пл. 217 - 218oC (перекристаллизованный из метанола - этилацетата)
ЯМР (200 МГц, CDCl3) м.д. 3,63 (3H, s): 5,06 (2H, s), 7,02 (2H, t -подобное, J = 8,8 Гц), 7,07 - 7,38 (7H, м), 7,48 (1H, dd, J = 4,2, 8,4 Гц), 7,55 (1H, dd, J = 1,8, 8,4 Гц), 8,92 (1H, dd, J = 1,8, 8,4 Гц)
Стадия 4
Смесь соединения (100 мг), полученного на стадии 3, 10% Pd-C (50% водного) (50 мг), метанола (5 мл) и ТГФ (1 мл) перемешивали в течение 20 минут в атмосфере водорода. Катализатор отфильтровывали и растворитель из фильтрата отгоняли, так что оставалось названное в заголовке вещество в виде бесцветных кристаллов (66 мг).
Т.пл. 238 - 239oC (перекристаллизованное из метанола - этилацетата)
ЯМР (200 МГц, ДМСО-d6) м.д.: 3,53 (3H, s), 7,21 (2H, t - подобное, J = 9,0 Гц), 7,39 (2H, м), 7,45 - 7,61 (2H, м), 8,68 (1H, dd, J = 1,8, 4,0 Гц)
Элементный анализ для C16H11N2O3F • 1/8 H2O :
Расчетное : C 63,95; H 3,73; N 9,32
Обнаруженное : C 63,91; H 3,57; N 9,32
Процесс 2
Стадия 1
К раствору 3-(4-фторбензоил)-2-пиридинкарбоновой кислоты (19,8 г) в дихлорметане (200 мл) добавляли тионилхлорид (29,1 мл) и ДМФ (одну каплю). Смесь перемешивали в течение 4 часов при комнатной температуре. Растворитель отгоняли и остаток растворяли в дихлорметане (10 мл). Этот раствор добавляли к смеси N-метиламиноацетонитрила гидрохлорида (9,46 г), триэтиламина (33,7 мл) и дихлорметана (150 мл) и перемешивали в течение 16 часов при комнатной температуре. Растворитель отгоняли. К остатку добавляли воду и экстрагировали этилацетатом. Экстракционный раствор промывали водным раствором гидрокарбоната натрия и водой и высушивали, после чего растворитель отгоняли, так что оставался N-цианометил-3-(4-фторбензоил)-N-метил-2-пиридинкарбоксамид (22,8 г)
ЯМР (200 МГц, CDCl3) м.д.: 3,16 (3Hх1/3, s), 3,21 (3Hх 2/3, s ), 4,44 (2Hх2/3, s), 4,55 (2Hх1,3 s), 7,17 (2H, t, J = 8,4 Гц), 7,50 (1H, м), 7,85 (3H, м), 8,75 (1H, dd, J = 1,6, 4,8 Гц)
Стадия 2
Смесь соединения, полученного на стадии (1) (22,8 г), толуола (300 мл) и 1,8-диазабицикло 5,4,0-7-ундецена (13,2 мл) перемешивали в течение 16 часов в колбе с обратным холодильником. Растворитель отгоняли. К раствору добавляли воду, затем полученный в результате кристаллический осадок собирали путем фильтрации. Кристаллы промывали водой, метанолом и этиловым эфиром с получением 5-(4-фторфенил)-7,8-дигидро-7-метил-8-оксо-6-пиридо[3,4-b] пиридинкарбонитрила в виде бесцветных кристаллов (14,9 г).
Т. пл. 231 - 232oC (перекристаллизованный из метанола-дихлорметана-этилового эфира).
ЯМР (200 МГц, CDCl3) м.д.: 3,92 (3H, s), 7,29 (2H, t - подобное, J = 8,8 Гц), 7,36- 7,48 (2H, м), 7,60 (1H, dd, J = 4,2, 8,4 Гц), 7,71 (1H, dd, J = 1,8, 8,4 Гц), 9,04 (1H, dd, J = 8,4, 4,2 Гц)
Стадия 3
Смесь соединения (14,37 г), полученного на стадии 2, этанола (100 мл) и 1N NaOH (100 мл) перемешивали в течение 3 часов в колбе с обратным холодильником. Реакционную смесь концентрировали, добавляли 1N HCl для доведения pH до 5, затем полученный в результате кристаллический осадок собирали путем отфильтровывания, промывали водой, метанолом и этиловым эфиром с получением 5-(4-фтор-фенил)-7,8-дигидро-7-метил-8-оксо-6-[3, 4 - b]пиридинкарбоксамида в виде бесцветных кристаллов (14,85 г).
Т. пл. 329 - 330oC (перекристаллизованный из метанола- дихлорметана-этилового эфира)
ЯМР (200 МГц, ДМСО-b6) м.д.: 3,56 (3H, s), 7,25 - 7,55 (5H, м), 7,66 (1H, dd, J = 4,2, 8,4 Гц), 7,86 (1H, bs), 8,11 (1H, bs), 8,83 (1Н,dd, J = 1,6, 4,2 Гц)
Стадия 4
К смеси соединения (2,36 г), полученного на стадии 3, и конц. HCl (30 мл) частями добавляют нитрит натрия (15,0 г) и перемешивали в течение 60 часов. К реакционной смеси добавляли воду, pH которой была доведена до 3,0 с помощью водного раствора карбоната калия. Растворитель отгоняли. Остаток элюировали водой: этанолом (1:0 - 0:4) при использовании Амберлита XAD-2 с получением вышеназванного вещества в виде бесцветных кристаллов (0,82 г).
Справочный пример 2
8-(4-фторфенил)-5,6-дигидро-6-метил-5-оксо-7-пиридо[3,4-b] пиразинкарбоновая кислота
Стадия 1
К суспензии магния (4,2 г) в ТГФ (20 мл) добавляли иод (каталитическое количество) при перемешивании при комнатной температуре в атмосфере аргона. К смеси затем по каплям добавляли раствор 1-бром-4-фторбензола (22,8 г) в ТГФ (60 мл) и смесь перемешивали в течение 30 минут. Смесь по каплям при перемешивании при комнатной температуре добавляли к раствору 2,3-пиразиндикарбонового ангидрида (20,0 г) в ТГФ (100 мл), с последующим перемешиванием в течение одного часа. Реакционную смесь выливали в разведенную HCl (доводя pH до 4 - 5) с последующей экстракцией этилацетатом. Экстракционный раствор промывали водой и высушивали, затем растворитель отгоняли с получением 3-(4-фторбензоил)-2-пиразинкарбоновой кислоты в виде бесцветного маслянистого продукта (25,8 г).
ЯМР (200 МГц, ДМСO-d6) м.д.: 7,31 (2H, t - подобное, J = 8,8 Гц), 7,60 - 7,75 (2H, м), 8,84 (1H, d, J = 2,5 Гц), 8,88 (1H, d, J = 2,5 Гц)
Это соединение использовали для следующей реакции без очистки.
Стадия 2
К суспензии соединения (15,8 г), полученного на стадии 1, в бензоле (200 мл) добавляли тионилхлорид (35 мл) и ДМФ (одну каплю). Смесь перемешивали в течение 2 часов в колбе с обратным холодильником. Растворитель отгоняли и остаток растворяли в ТГФ (50 мл). Этот раствор добавляли к смеси -N-метилглицин-этилового эфира гидрохлорида (15,0 г) триэтиламина (30,0 мл) и ТГФ (80 мл), которую перемешивали в течение 16 часов при комнатной температуре. Растворитель отгоняли. К остатку добавляли воду и экстрагировали этилацетатом. Экстракционный раствор промывали разведенной хлористоводородной кислотой и водой последовательно, высушивали и затем растворитель отгоняли. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан: этилацетат = 1:2) с получением N-этоксикарбонилметил-3-(4-фторбензоил) -N-метил-2-пиразинкарбоксамида в виде маслянистого продукта (5,07 г).
ЯМР (200 МГц, CDCl3): м.д. 1,31 (3H, t, J = 7,2 Гц), 3,19 (3H, s), 3,22 (3H, s ), 4,18 - 4,33 (4H, м), 7,16 (2H, t - подобное, J = 8,7 Гц), 7,95 - 8,10 (2H, м), 8,59 (2H, м)
Стадия 3
Смесь соединения (5,07 г), полученного на стадии 2, толуола (150 мл и 1,8-диазабицикло [5,4,0]-7-ундецена (2,5 мл) перемешивали в течение 16 часов в колбе с обратным холодильником. Реакционную смесь добавляли к разбавленной соляной кислоте (доведенной до pH 4-5) и экстрагировали этилацетатом - ТГФ. Экстракционный раствор промывали насыщенным водным раствором соли, высушивали и затем растворитель отгоняли. Остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ: ацетон = 10:1) с получением -8-(4-фторфенил)-5,6-дигидро-6-метил-5-оксо-7-пиридо[3,4-b] пиразинкарбоновой кислоты этилового эфира в виде бесцветных кристаллов (1,21 г).
Т. пл. 221 - 222oC (перекристаллизованный из этилацетата ТГФ-этилового эфира)
ЯМР (200 МГц, CDCl3) м.д.:1,04 (3H, t, J = 7,2 Гц), 3,70 (3H, s), 4,15 (2H, q, J = 7,2 Гц), 7,16 (2H, t - подобное, J = 8,7 Гц), 7,27 - 7,40 (2H, м), 8,87 (2H, s)
Стадия 4
Смесь соединения (1,10 г), полученного на стадии 3, этанола (25 мл), ТГФ (25 мл) и 1 N NaOH (15 мл) перемешивали в течение одного часа в колбе с обратным холодильником. Реакционную смесь охлаждали и добавляли разбавленную HCl для доведения pH до 3 - 4. Смесь насыщали NaCl, после чего следовала экстракция этилацетатом. Экстракционный раствор высушивали, затем растворитель отгоняли, так что оставалось названное в заголовке вещество в виде бесцветных кристаллов (0,93 г).
Т.пл. 247 - 249oC (перекристаллизованное из ТГФ - этилового эфира)
ЯМР (200 МГц, CDCl3) м.д. : 3,75 (3H, s), 4,95 (1H, bs), 7,14 (2H, t - подобное, J = 8,8 Гц), 7,34 - 7,48 (2H, м), 8,83 (1H, d, J = 2,0 Гц), 8,85 (1H, d, J = 2,0 Гц)
Элементный анализ для C15H10N3O3F • 0,2 H2O :
Расчетное: C 59,49; H 3,46 ; N 13,87
Обнаруженное: C 59,59; H 3,71; N 13,72
Справочный пример 3
4-(4-фторфенил)-1,2-дигидро-2-метил-1-оксо-3-пиридо[3,4-c] пиридинкарбоновая кислота
Стадия 1
К смеси 3,4-пиридинкарбонового ангидрида (8,50 г) и фторбензола (170 мл) добавляли при перемешивании при комнатной температуре безводный хлорид алюминия (12,0 г). Реакционную смесь перемешивали в течение 3 часов в колбе с обратным холодильником, которую затем охлаждали и выливали в смесь хлористоводородной кислоты и ледяной воды. Эту смесь доводили до pH 4 водным раствором гидрокарбоната натрия. Полученный кристаллический преципитат собирали с помощью фильтрации с получением 3-(4-фторбензоил)-4-пиридинкарбоновой кислоты в виде бесцветных кристаллов (1,51 г).
Т.пл. 305 - 310oC (разложение) (перекристаллизованная из метанола - этилацетата)
ЯМР (200 МГц, ДМСО-d6) м.д.: 7,36 (2H, d, J = 8,8 Гц), 7,76 (2H, t - подобное, J = 8,0 Гц), 7,88 (1H, d, J = 5,2 Гц), 8,73 (1H, s), 8,94 (1H, d, J = 2,5 Гц)
Маточную жидкость и фильтрат объединяли и затем экстрагировали. Экстракционный раствор промывали насыщенным водным раствором соли и высушивали, затем растворитель отгоняли с получением 4-(4-фторбензоил)-3-пиридинкарбоновой кислоты в виде бесцветных кристаллов (2,27 г).
Т.пл. 217-219oC (перекристаллизованная из метанола-этилового эфира)
ЯМР (200 МГц, ДМСО-d6) м.д.: 7,35 (2H, t - подобное, J = 8,5 Гц), 7,53 (1H, d, J= 5,0 Гц), 7,75 (2H, м), 8,92 (1H, d, J = 5,0 Гц), 9,17 (1H, s)
Стадия 2
Используя 4-(4-фторбензол)-3-пиридинкарбоновую кислоту, полученную на стадии 1 и N-метилглицинэтилового эфира гидрохлорида, проводили по существу ту же самую реакцию и процесс, как и в примере для справки 2, стадия 2, с получением N-метил-3-этоксикарбонилметил-4-(4-фторбензоил)-N-пиридинкарбоксамида в виде бесцветного маслянистого продукта.
ЯМР (200 МГц, СDCl3) м.д.: 1,29 (3H, t, J = 7,0 Гц), 3,07 (3H, s), 4,16 (2H, s), 4,22 (2H, q, J = 7,0 Гц), 7,16 (2H, t - подобное, J = 8,0 Гц), 7,27 - 7,37 (1H, м), 7,81 - 7,87 (2H, м), 8,75 - 8,82 (2H, м)
Стадия 3
Используя соединение, полученное на стадии 2 и 1,8 - диазабицикло [5,4,0]-7-ундецен проводили по существу ту же самую реакцию и процесс, что и в примере для справки 2, стадия 3, с полeчением 4-(4-фторфенил)-1,2-дигидро-2-метил-1-оксо-3-пиридо[3,4-c] пиридинкарбоновой кислоты этилового эфира в виде бесцветных кристаллов.
Т. пл. 158 - 160oC (перекристаллизованный из этилацетата-изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 1,01 (3H, t, J = 7,0 Гц), 3,61 (3H, s), 4,10 (2H, q, J = 7,0 Гц), 7,03 (1H, d, J = 5,6 Гц), 7,13 - 7,34 (4H, м), 8,69 (1H, d, J = 5,6 Гц), 9,69 (1H, s)
Стадия 4
Используя соединение, полученное на стадии 3, и водный раствор гидроксида натрия, проводили по существу ту же самую реакцию и процесс, что и в справочном примере 2, стадия 4, с получением названного в заголовке соединения в виде бесцветных кристаллов.
Т.пл. 246-247oC (разложение) перекристаллизованное из ТГФ - метанола)
ЯМР (200 МГц, ДМСО-d6) м.д.: 3,54 (3H, s), 7,00 (1H, d, J = 5,6 Гц), 7,33 - 7,38 (4H, м), 8,69 (1H, d, J = 5,6 Гц), 9,46 (1H, s)
Элементный анализ для C18H11N2O3F 1/4H2O:
Расчетное: C 63,47; H 3,83; N 9,25
Обнаруженное: C 63,37; H 3,80; N 9,30
Справочный пример 4
4-(4-фторфенил)-1,2-дигидро-2-метил-1-оксо-3-пиридо [4,3-c] -пиридинкарбоновая кислота
Стадия 1
Используя 3-(4-фторбензоил)-4-пиридинкарбоновую кислоту, полученную по методу из справочного примера 3, стадия 1, и N-метилглицинэтилового эфира гидрохлорид, проводили по существу ту же самую реакцию и процесс, что и в справочном примере 2, стадия 2, для получения N-этоксикарбонилметил-3-(4-фторбензоил)-N-метил-4-пиридинкарбоксамида в виде бесцветного маслянистого продукта.
ЯМР (200 МГц, CDCl3) м.д. : 1,31 (3H, t, J = 7,0 Гц), 3,00 (3H, s), 4,20 (2H, s), 4,24 (2H, q, J = 7,0 Гц), 7,18 (2H, t - подобное, J = 8,0 Гц), 7,40 - 7,48 (1H, м), 7,85 - 7,92 (2H, м), 8,77 - 8,86 (2H, м)
Стадия 2
Используя соединение, полученное на стадии 1, и 1,8 - диазабицикло [5,4, 0] -7-ундецен, проводили по существу ту же самую реакцию и процесс, что и в справочном примере для получения 4-(4-фтор-фенил)-1,2-дигидро-2-метил-1-оксо-3-пиридо [4,3-c] пиридинкарбоновой кислоты этилового эфира в виде бесцветных кристаллов, т. пл. 181 - 183oC (перекристаллизованный из этилацетата - изопропилового эфира).
ЯМР (200 МГц, CDCl3) м.д. : 1,01 (3H, t, J = 7,0 Гц), 3,63 (3H, s), 4,09 (2H, q, J = 7,0 Гц), 7,14 - 7,38 (4H, м), 8,26 (1H, d, J = 5,4 Гц), 8,63 (1H, s), 8,75 (2H, J = 5,4 Гц)
Стадия 3
Используя соединение, полученное на стадии 2, и водный раствор гидроксида натрия, проводили по существу ту же самую реакцию и процесс для получения вышеназванного соединения в виде бесцветных кристаллов, т.пл. 294 - 295oC (разложение) (перекристаллизованное из ТГФ-метанола).
ЯМР (200 МГц, CDCl3) м.д. : 3,55 (3H, s), 7,31 - 7,45 (4H, м), 8,13 (1H, d, J = 5,2 Гц), 8,47 (1H, s), 8,73 (1H, d, J = 5,2 Гц)
Элементный анализ для C16H11N2O3F • 1/4 H2O:
Расчетное: C 63,47; H 3,83; N 9,25
Обнаруженное: C 63,48; H 3,82; N 9,35
Справочный пример 5
5,6-дигидро-6-метил-8-(2-метилфенил)-5-оксо-7-пиридо[4,3-b] пиридинкарбоновая кислота
Стадия 1
Используя 2,3-пиридиндикарбоновый ангидрид (5,96 г) и 2-бромтолуол (8,2 г), проводили по существу ту же самую реакцию и процесс, что и в справочном примере 2, стадия 1 (реакция Гриньяра) для получения 2-(2-метилбензоил)-3-пиридинкарбоновой кислоты и 3-(2-метилбензоил)-2-пиридинкарбоновой кислоты в виде маслянистого продукта ( 6,45 г). (Это соединение использовалось для последующей реакции без очистки).
Стадия 2
Используя соединение (6,45 г.), полученное на стадии 1, и N-метиламиноацетонитрила гидрохлорид (3,7 г), проводили по существу те же самые реакцию и процесс, что и в справочном примере 1, процесс 2, стадия 1 (амидирование), для получения смеси N-цианометил-N-метил-2-(2-метилбензоил)-3-пиридинкарбоксамида и N-цианометил-N-метил-3-(2-метилбензоил)-2-пиридинкарбоксамида в виде маслянистого продукта (7,5 г). (Это соединение использовалось для последующей реакции без очистки).
Стадия 3
Используя соединение (7,5 г), полученное на стадии 2, и 1,8 - диазабицикло [5,4, O]-7-ундецен (4,0 мл), проводили по существу ту же самую реакцию, что и в справочном примере 1, процесс 2, стадия 2 (реакция циклодегидратации) (нагревание в колбе с обратным холодильником в течение 4 часов в толуоле), и реакционную смесь очищали в помощью колоночной хроматографии на силикагеле (гексан : этилацетат (2:1 --->1:1) - ацетон). Из первой фракции был получен 5,6-дигидро-6-метил-8-(2-метилфенил)-5-оксо-7-пиридо [4,3-b] пиридинкарбонитрил в виде бесцветных кристаллов (3,5 г), т.пл. 216 - 218oC (перекристаллизованный из этилацетата - изопропилового эфира).
ЯМР (200 МГц, CDCl3) м.д. 2,12 (3H, s) : 3,87 (3H, s) 7,26 - 7,44 (4H, м), 7,54 (1H, dd, J = 4,6, 8,1 Гц), 8,78 (1H, dd, J = 1,8, 8,1 Гц), 8,97 (1H, dd, J = 1,8, 4,6 Гц)
Из следующей фракции был получен 7,8-дигидро-7-метил -5-(2-метилфенил)-8-оксо-6-пиридо [3,4-b] пиридинкарбонитрил в виде бесцветных кристаллов (2,4 г), т.пл. 238 - 240oC (перекристаллизованный из этилацетата).
ЯМР (200 МГц, CDCl3) м.д. : 2,15 (3H, s), 3,92 (3H, s), 7,34 - 7,59 (6H, м), 9,02 (1H, dd, J = 1,8, 4,4 Гц)
Стадия 4
Используя 5,6-дигидро-6-метил-8-(2-метилфенил)-5-оксо-7-пиридо [4,3-b] пиридинкарбонитрил (3,5 г), полученный на стадии 3, и IN NaOH, проводили по существу ту же самую реакцию, что и в справочном примере 1, процесс 2, стадия 3 (гидролиз) (нагревание в колбе с обратным холодильником в течение 16 часов в этаноле) для получения 5,6-дигидро-6-метил-8-(2-метилфенил)-5-оксо-7-пиридо-[4,3-b] пиридинкарбоксамид в виде бесцветных кристаллов (2,2 г).
Т.пл. 315 - 320oC (перекристаллизованный из метанола)
ЯМР (200 МГц, ДМСО - d6) м.д.: 1,98 (3H, s), 3,56 (3H, s), 7,17 - 7,26 (4H, м), 7,54 (1H, dd, J = 4,4 8,0 Гц), 7,80 (1H, bs), 8,04 (1H, bs), 8,62 (1H, dd, J = 1,8, 8,0 Гц), 8,82 (1H, dd, J = 1,8, 4,4 Гц)
Стадия 5
К смеси соединения (2,2 г), полученного на стадии 4, и хлористоводородной кислоты (30 мл) добавляли в ограниченных количествах нитрит натрия (5,2 г) при перемешивании при 0oC. Эту смесь перемешивали в течение 3 часов при комнатной температуре и pH доводили до интервала от 5 до 6, используя карбонат натрия. Полученный в результате осадок отфильтровывали и фильтрату давали адсорбироваться на Амберлите XAD-2 и элюировали метанолом с получением вышеназванного вещества в виде бесцветных кристаллов (0,83 г), т.пл. 268 - 273oC (разлагается) (перекристаллизованное из метанола - ТГФ).
ЯМР (200 МГц, ДМСО-d6) м.д. : 1,96 (3H, s), 3,53 (3H, s), 7,08 - 7,14 (4H, м), 7,34 (1H, dd, J = 4,4 8,0 Гц), 8,50 (1H, dd, J = 1,2, 8,0 Гц), 8,69 (1H, dd, J = 1,2, 4,4 Гц)
SI - MS м/з : 295 (M+1)+
Справочный пример 6
5-(хлор-2-метилфенил)-7,8-дигидро-7-метил-8-оксо-6-пиридо [3,4-b]пиридинкарбоновая кислота и ее изомер
Стадия 1
Используя 7,8-дигидро-7-метил-5-(2-метилфенил)-8-оксо-6-пиридо [3,4-b] пиридинкарбонитрил (справочный пример 5, стадия 3) (2,40 г) и IN NaOH, проводили по существу те же самые реакции (гидролиз в этаноле путем нагревания в колбе с обратным холодильником в течение 16 часов) и процесс, что и в справочном примере 1, процесс 2, стадия 3, для получения 7,8-дигидро-7-метил-5-(2-метилфенил)-8-оксо-6-пиридо-[4,3-b] пиридинкарбоксамида в виде бесцветных кристаллов (1,57 г), т.пл. 305 - 307oC (перекристаллизованный из метанола - ТГФ).
ЯМР (200 МГц, ДМСО-d6) м.д. : 2,01 (3H, s), 3,57 (3H, s), 7,20 (1H, dd, J = 1,6, 8,2 Гц), 7,26 - 7,36 (4H, м), 7,63 (1H, dd, J = 4,4, 8,2 Гц), 7,78 (1H, bs), 8,04 (1H, bs), 8,82 (1H, dd, J = 1,6, 4,4 Гц)
Стадия 2
К смеси соединения (1,5 г), полученного на стадии 1, и хлористоводородной кислоты (30 мл) частями добавляли нитрит натрия (7,0 г), при 0oC и перемешивании. Эту смесь взбалтывали в течение 20 часов при комнатной температуре и pH доводили до интервала от 5 до 6 с помощью карбоната натрия. Полученный в результате осадок отфильтровали и фильтрат адсорбировали на Амберлите XAD - 2 и элюировали метанолом с получением вышеназванного вещества (смесь) в виде бесцветных кристаллов (0,9 г), т.пл. 290 - 295oC (разложение) (перекристаллизованное из метанола - ТГФ).
ЯМР (200 МГц, ДМСО-d6) м.д. : 1,97 (3Hx2/5, S), 2,03 (3Hx3/5, s), 3,56 (3H, s), 7,11 - 7,47 (4H, м), 7,54 (1H, dd, J = 4,2, 8,2 Гц), 8,68 (1H, dd, J = 1,6, 4,2 Гц)
SI-MS, м/з: 329, 331 (M+1)+
Справочный пример 7
N-метил-4-(2-пиридил)-3-хинолинкарбоксамид
Стадия 1
Смесь 2-(2-аминобензоил) пиридина (2,0 г.) и диэтилэтоксиметиленмалоната (2,7 г) перемешивали в течение 16 часов при 130oC, затем полученный в результате кристаллический осадок (3,0 г) собирали путем фильтрации. Смесь кристаллического продукта, хлорида лития (1,8 г) и ДМСО (30 мл) перемешивали в течение 2 часов при температурах в интервале от 180 до 190oC. Реакционную смесь охлаждали и выливали в воду с последующей экстракцией хлороформом. Экстракт промывали водой и высушивали, затем растворитель отгоняли. Остаток подвергали колоночной хроматографии на силикагеле (гексан : этилацетат =1 : 2) с получением этилового эфира 4-(2-пиридил)-3- хинолинкарбоновой кислоты в виде бесцветных кристаллов (1,28 г).
Т.пл. 70oC (перекристаллизованный из этилового эфира - гексана)
ЯМР (200 МГц, CDCl3) м.д.: 1,07 (3H, t, J = 7,2 Гц), 4,16 (2H, q, J = 7,2 Гц), 7,35 - 7,55 (4H, м), 7,70 - 7,95 (2H, м), 8,21 (1H, d, J = 8,4 Гц), 8,79 (1H, d, J = 4,4 Гц), 9,46 (1H, s)
Стадия 2
Смесь соединения (1,19 г), полученного на стадии 1, и 40% раствора метиламина в метаноле (30 мл) перемешивали в течение 3 дней при комнатной температуре. Растворитель отгоняли, так что оставалось вышеназванное соединение в виде бесцветных кристаллов (666 мг), т.пл. 171 - 172oC (перекристаллизованное из этилацетата - изопропилового эфира).
ЯМР (200 МГц, CDCl3) м.д.: 2,72 (3H, d, J = 5,0 Гц), 6,33 (1H, м), 7,40 - 7,55 (4H, м), 7,70 - 7,95 (2H, м), 8,17 (1H, d, J = 8,4 Гц), 8,79 (1H, м), 9,17 (1H, s)
Элементный анализ для C16H13N3O • 0,1 H2O
Расчетное: C 72,49; H 5,02; N 15,85
Обнаруженное: C 72,47; H 4,83; N 15,71
Справочный пример 8
-(4-фторфенил)-6,7-дигидро-6-метил-7-оксо-5-тиено[2,3-c] пиридинкарбоновая кислота
Стадия 1
К смеси 2,3-тиофендикарбонового ангидрида (1,98 г) и фторбензола (30 мл) добавляли при перемешивании при комнатной температуре безводный хлорид алюминия (2,7 г). Реакционную смесь перемешивали в течение 3,5 часов при нагревании в колбе с обратным холодильником, охлаждали и выливали в смесь хлористоводородной кислоты - ледяной воды. Эту смесь подвергали экстрагированию этилацетатом. Экстракционный раствор промывали насыщенным водным раствором поваренной соли и высушивали, затем растворитель отгоняли, так как оставалась 3-(4-фторбензоил)-2-тиофенкарбоновая кислота в виде бесцветных кристаллов (3,21 г), т. пл. 152oC (перекристаллизованная из этилового эфира - изопропилового эфира).
ЯМР (200 МГц, CDCl3) м.д.: 7,10 - 7,30 (3H, м), 7,66 (1H, d, J = 5,2 Гц), 7,80 - 7,95 (2H, м)
Стадия 2
К раствору соединения (3,21 г), полученного на стадии 1, в ТГФ (60 мл) добавляли оксалилхлорид (1,7 мл) и ДМФ (5 капель) и смесь перемешивали в течение 30 минут при комнатной температуре. Растворитель отгоняли и остаток растворяли в ТГФ (20 мл). Этот раствор добавляли к смеси N-метилглицин-этилового эфира гидрохлорида (2,5 г), триэтиламина (4 мл) и ТГФ (50 мл), которую затем экстрагировали этилацетатом. Экстракционный раствор промывали 2N HCl, водным раствором гидрокарбоната и водой и затем высушивали. Растворитель отгоняли и остаток подвергали колоночной хроматографии на силикагеле (гексан : этилацетат = 1 : 1) с получением N-этоксикарбонилметил-3-(4-фторбензоил)-N-метил-2- тиофенкарбоксамида в виде маслянистого продукта (0,38 г).
ЯМР (200 МГц, CDCl3) м.д.: 1,27 (3H, t, J = 7,1 Гц), 2,99 (3H, bs), 4,05 (2H, s), 4,19 (2H, q, J = 7,1 Гц), 7,05 - 7,30 (3H, м), 7,45 (1H, м), 7,80 - 7,95 (2H, м).
Стадия 3
Смесь соединения (0,98 г), полученного на стадии, толуола (50 мл) и 1,8-диазабицикло[5,4,0]-7-ундецена (1,5 мл) перемешивали в течение 3 часов в колбе с обратным холодильником. Реакционную смесь охлаждали и выливали в 2NHCl. Эту смесь подвергали экстракции этилацетатом. Экстракционный раствор промывали водой и высушивали, затем растворитель отгоняли. Остаток подвергали колоночной хроматографии на силикагеле (гексан : этилацетат = 1 : 1) с получением 4-(4-фторфенил)-6,7-дигидро-6-метил-7-оксо-5- тиено[2,3-c]пиридинкарбоновой кислоты этилового эфира, т. пл. 145 - 147o (перекристаллизованный из этилацетат-гексана).
ЯМР (200 МГц, CDCl3) м.д.: 1,01 (3H, t, J = 7,2 Гц), 3,65 (3H, s), 4,10 (2H, q, J = 7,2 Гц), 6,92 (1H, d, J = 5,1 Гц), 7,13 (2H, t - подобное, J = 8,6 Гц), 7,25 - 7,40 (2H, м), 7,67 (1H, d, J = 5,1 Гц).
Стадия 4
Используя соединение (304 мг), полученное на стадии 3, проводили по существу ту же самую реакцию (гидролиз) и процесс, что и в справочном примере 2, стадия 4, для получения вышеназванного соединения в виде бесцветных кристаллов (240 мг), т. пл. 205oC (перекристаллизованное из этилацетата - изопропилового эфира).
ЯМР (200 МГц, CDCl3) м.д.: 3,70 (3H, s), 6,93 (1H, d, J = 5,3 Гц), 7,14 (2H, t - подобное, J = 8,6 Гц), 7,37 - 7,49 (2H, м), 7,70 (1H, d, J = 5,3 Гц)
Элементный анализ для C15H10NO3SF:
Расчетное: C 59,40; H 3,32; N 4,62
Обнаруженное: C 59,24; H 3,42; N 4,55
Справочный пример 9
7-(4-фторфенил)-4,5-дигидро-5-метил-4-оксо-6-тиено[3,2-c] пиридинкарбоновая кислота
Используя фильтрат после сбора кристаллов, полученных в справочном примере 8, стадия 1, проводили по существу те же самые реакции и процесс, что и в справочном примере 8, стадия 2, для получения N-этоксикарбонилметил-2-(4-фторбензоил)-N-метил- 3-тиофенкарбоксамида в виде бледно-желтого маслянистого вещества. С этим маслянистым веществом (1,4 г) проводили по существу ту же самую реакцию и процесс, что и в примере для справки 8, стадия 3, для получения этилового эфира 7-(4-фторфенил)-4,5-дигидро-5-метил-4-оксо-6-тиено[3,2-c] пиридинкарбоновой кислоты в виде бесцветных кристаллов (1,27 г). Т. пл. 127 - 129oC (перекристаллизованный из этилацетата - изопропилового эфира).
ЯМР (200 МГц, CDCl3) м.д.: 1,01 (3H, t, J = 7,2 Гц), 3,63 (3H, s), 4,10 (2H, q, J = 7,2 Гц), 7,14 (2H, t - подобное, J = 8,7 Гц), 7,35 - 7,50 (2H, м), 7,36 (1H, d, J = 5,3 Гц), 7,73 (1H, d, J = 5,3 Гц)
Этот этиловый эфир (1,08 г) подвергали по существу той же самой реакции и процессу, что и в справочном примере 8, стадия 4, с получением вышеназванного соединения в виде бесцветных кристаллов (0,65 г). Т. пл. 233oC (перекристаллизованный из этилацетата - ТГФ - изопропилового эфира).
ЯМР (200 МГц, CDCl3) м.д.: 3,69 (3H, s), 5,08 (1H, bs), 7,14 (2H, t - подобное, J = 8,8 Гц), 7,33 (1H, d, J = 5,4 Гц), 7,43 - 7,55 (2H, м), 7,70 (1H, d, J = 5,4 Гц)
Справочный пример 10
7-(4-фторфенил)-4,5-дигидро-5-метил-4-оксо-6-тиено[3,4-c] пиридинкарбоновая кислота
Используя 3,4-тиофендикарбоновый ангидрид в качестве исходного материала, проводили по существу ту же самую реакцию и обработку, что и на стадиях с 1 по 4 справочного примера 8, с получением вышеназванного вещества. Соединения, полученные из каждой стадии, и соответствующие физико-химические константы являются следующими:
Стадия 1
4-(4-фторбензоил)-3-тиофенкарбоновая кислота
Т.пл. 161 - 162oC (перекристаллизованная из этилацетата - изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 7,18 (2H, t - подобное, J = 8,6 Гц), 7,76 (1H, d, J = 3,3 Гц), 7,80 - 7,95 (2H, м), 8,39 (1H, d, J = 3,3 Гц), 9,90 (1H, bs)
Стадия 2
N-Этоксикарбонилметил-4-(4-фторбензоил)-N-метил-3- тиофенкарбоксамид
Бледно-желтое маслянистое вещество (используемое для последующей реакции без очистки)
Стадия 3
7-(4-фторфенил)-4,5-дигидро-5-метил-4-оксо-6-тиено[3,4-c] пиридинкарбоновой кислоты этиловый эфир
Т.пл. 128 - 129oC (перекристаллизованный из этилацетата - изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 1,00 (3H, t, J = 7,2 Гц), 3,52 (3H, s), 4,07 (2H, q, J = 7,2 Гц), 7,05 - 7,20 (3H, м), 7,30 - 7,45 (2H, м), 8,42 (1H, d, J = 2,6 Гц)
Стадия 4
7-(4-фторфенил)-4,5-дигидро-5-метил-4-оксо-6-триено[3,4-c] пиридинкарбоновая кислота (вышеназванное вещество)
Т.пл. 217 - 218oC (перекристаллизованная из этилацетата - изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 3,58 (3H, s), 7,06 (1H, d, J = 3,3 Гц), 7,12 (2H, t-подобное, J = 8,8 Гц), 7,40 -7,50 (2H, м), 8,40 (1H, d, J = 3,3 Гц)
Справочный пример 11
8-(4-фторфенил)-5,6-дигидро-6-метил-5-оксо-7-пиридо-[4,3-b] -пиридинкарбоновая кислота
Стадия 1
К раствору 2,3-пиридинкарбонового ангидрида (18,6 г) в ТГФ (150 мл) добавляли при перемешивании при комнатной температуре раствор п-фторфенил-магний-бромида [полученного из п-бромфторбензола (13,6 мл) и магния (13,6 мл) и магния (3,91 г)] в ТГФ (100 мл). Реакционную смесь перемешивали в течение одного часа при комнатной температуре, после чего выливали в HCl-ледяную воду, pH которой доводили до значения в интервале 2-3 с помощью IN водного раствора гидроксида натрия, с последующей экстракцией этилацетатом. Экстракционный раствор промывали водой и высушивали, затем растворитель отгоняли, так что оставалась смесь 3-(4-фторбензоил)-2-пиридинкарбоновая кислота (справочный пример 1, процесс 1, стадия 1) и 2-(4-фторбензоил)-3-пиридинкарбоновая кислота в виде бесцветного маслянистого вещества (10,5 г). Это маслянистое вещество подвергали колоночной хроматографии на силикагеле, чтобы отделить эти соединения одно от другого. Физико-химические константы последнего соединения являются следующими.
Т.пл. 179-181oC (перекристаллизованное из метанола - этилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 7,12 (2H, t-подобное), 7,55 (1H, dd, J = 4,8, 8,2 Гц), 7,81 (2H, dd-подобное), 8,39 (1H, dd, J = 1,6, 8,2 Гц), 8,84 (1H, dd, J = 1,6, 5,0 Гц)
Стадия 2
C 2-(4-фторбензоил)-3-пиридинкарбоновой кислотой (1,50 г), полученной на стадии 1, проводили по существу ту же самую реакцию и процесс, что и в справочном примере 1, процесс 2, стадия 1, с получением N-цианометил-1-метил-2-(4-фторбензоил)-3-пиридинкарбоксамида в виде маслянистого продукта (1,8 г).
ЯМР (200 МГц, CDCl3) м.д.: 3,02 (3H, s), 4,52 (2H, s), 7,15 (t-подобное), 7,55 (1H, м), 7,81 (1H, d, J = 7,61 Гц), 8,08 (2H, м), 8,73 (1H, dd, J = 1,6, 4,8 Гц)
Стадия 3
С соединением (2,04 г), полученным на стадии 2, проводили по существу ту же самую реакцию и процесс, что и в справочном примере 1, процесс 2, стадия 2, с получением 8-(4-фторфенил)-5,6-дигидро-6-метил-5-оксо-7-пиридо[4,3-b] пиридинкарбонитрил в виде бесцветных кристаллов (1,55 г)
Т.пл. 258-259oC (перекристаллизованный из дихлорметана- этилацетата)
ЯМР (200 МГц, CDCl3) м.д.: 3,88 (3H, s), 7,24 (2H, t-подобное), 7,44 - 7,62 (3H, м), 8,79 (1H, dd, J = 1,8, 8,4 Гц), 8,99 (1H, dd, J = 1,8, 4,4 Гц)
Стадия 4
С соединением (1,00 г), полученным на стадии 3, проводили по существу ту же самую реакцию и процесс, что и в справочном примере 1, процесс 2, стадия 3, с получением 8-(4-фторфенил)-5,6-дигидро-6-метил-5-оксо-7-пиридо[4,3-b] пиридинкарбоксамида в виде бесцветных кристаллов (1,00 г).
Т.пл. 300-301oC (перекристаллизованный из метанола - этилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: (3H, s), 5,42 - 5,67 (2H, b), 7,16 (2H, t-подобное), 7,45 (3H, м), 8,75 (1H, dd, J = 1,8, 8,0 Гц), 8,90 (1H, dd, J = 1,8, 4,4 Гц)
Стадия 5
С соединением (900 мг), полученным на стадии 4, проводили по существу ту же самую реакцию и процесс, что и в справочном примере 1, процесс 2, стадия 4, с получением вышеназванного соединения в виде бесцветных кристаллов (561 мг).
Т. пл. 237oC (разложение) (перекристаллизованное из метанола - этилового эфира)
ЯМР (200 МГц, DMCO - d6) м.д.: 3,54 (3H, s), 7,25 (2H, t - подобное), 7,37 (2H, м), 7,58 (1H, dd, J = 4,4, 8,2 Гц), 8,62 (1H, dd, J = 1,8, 8,2 Гц), 8,88 (1H, dd, J = 1,8, 4,4 Гц)
Справочный пример 12
1,2 - Дигидро-2-метил-1-оксо-4-(2-тиенил)-3-изохинолинкарбоновая кислота
Стадия 1
К смеси фталевого ангидрида (2,96 г) дихлорметана (10 мл) и хлорида алюминия (5,87 г) добавляли раствор тиофена (1,6 г) в дихлорметане в ограниченном количестве при перемешивании при комнатной температуре, затем реакционную смесь перемешивали в течение одного часа при комнатной температуре. Реакционную смесь выливали в HCl - ледяную воду с последующей экстракцией этилацетатом. Экстракционный раствор промывали водой и высушивали, затем растворитель отгоняли, так что оставалась 2-(2-тиенилкарбонил) бензойной кислоты в виде бесцветных кристаллов (2,72 г).
Т. пл. 142-143oC (перекристаллизованная из этилацетата -изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 7,06 (1H, dd, J = 3,6, 4,8 Гц), 7,25 (1H, dd, J = 1,2, 3,8 Гц), 7,46 (1H, dd, J = 1,6, 7,2 Гц), 7,52 - 7,74 (3H, м), 8,09 (1H, dd, J = 1,2, 7,8 Гц)
Соединения со стадии 2 по стадию 4 были получены путем использования соединения, полученного на стадии 1, в виде исходного материала и проведения по существу тех же самых реакций и процессов, что и в справочном примере 8, стадии со 2 по 4. Соединения, полученные на соответствующих стадиях и их физико-химические константы являются следующими.
Стадия 2
N-Этоксикарбонилметил-N-метил-2-(2-тиенилкарбонил)-бензолкарбоксамид
Бледно-желтый маслянистый продукт
ЯМР (200 МГц, CDCl2) м.д.: 1,19 - 1,37 (3H, м), 2,99 (3 Hx3/5, s), 3,09 (3Hx2/5, s), 4,00 (2Hx2/5, s), 4,09 - 4,30 (2H + 2Hx3/5, м), 7,13 (1H, t- подобное), 7,40 - 7,66 (4H, м), 7,66 - 7,77 (2H, м)
Стадия 3
1,2-Дигидро-2-метил-1-оксо-4-(2-тиенил)-3-изохинолинкарбоновой кислоты этиловый эфир
Т. пл. 137-138oC (перекристаллизованный из этилацетата-изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 1,08 (3H, t, J = 7,4 Гц), 3,61 (3H, s), 4,14 (2H, q, J = 7,4 Гц), 7,03 - 7,15 (2H, м), 7,40 - 7,68 (4H, м), 8,49 (1H, м)
Стадия 4
1,2-Дигидро-2-метил-1-оксо-4-(2-тиенил)-3-изохинолинкарбоновая кислота (вышеназванное соединение)
Т. пл. 259=260oC (перекристаллизованная из этилацетата - изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 3,65 (3H, s), 7,12 (2H, м), 7,39 - 7,70 (4H, м), 8,46 (1H, м)
Справочный материал 13
4-(4-фторфенил)-N-метил-5-тиено[2,3-b]пиридинкарбоксамид
Стадия 1
Смесь 4-фторбензоилацетонитрила (2,84 г), 2,5-дигидрокси-1,4-дитиана (1,31 г), триэтиламина (2,2 мл) и этанола (15 мл) перемешивали в течение 40 минут при 50oC. Реакционную смесь охлаждали для получения 2-(амино-3-(4-фторбензоил)тиофена в виде желтых кристаллов (2,22 г).
Т.пл. 178oC (перекристаллизованный из этилового эфира-гексана)
ЯМР (200 МГц, CDCl3) : 6,15 (1H, d, J = 5,8 Гц), 6,85 (1H, d, J = 5,8 Гц), 6,94 (2H, bs), 7,00 - 7,20 (2H, м), 7,60 - 7,80 (2H, м)
Стадия 2
С соединением (872 мг), полученным на стадии 1, проводили по существу ту же самую реакцию и процесс, что и в справочном примере 7, стадия 1, для получения этилового эфира 4-(4-фторфенил)-5-тиено[2,3-b] пиридинкарбоновой кислоты в виде бледно-желтого маслянистого продукта (576 мг).
ЯМР (200 МГц, CDCl3): 1,10 (3H, t, j = 7,1 Гц), 4,17 (2H, q, J = 7,1 Гц), 7,03 (1H, d, J = 6,0 Гц), 7,10 - 7,40 (4H, м), 7,54 (1H, d, J = 6,0 Гц), 9,09 (1H, s)
Стадия 3
С соединением (576 мг), полученным на стадии 2, проводили по существу ту же самую реакцию и процесс, что и в справочном примере 7, стадия 2, для получения вышеназванного соединения в виде бесцветных кристаллов (297 мг).
Т. пл. 188-189oC (перекристаллизованный из этилацетата - изопропилового эфира)
ЯМР (200 МГц, CDCl3) : 2,77 (3H, d, J = 5,0 Гц), 5,43 (1H, bs), 7,10 (1H, d, J = 6,1 Гц), 7,15 - 7,30 (2H, м), 7,40 - 7,50 (2H, м), 7,56 (1H, d, J = 6,1 Гц), 8,82 (1H, s)
Справочный пример 14
1,2-Дигидро-N,I-диметил-2-оксо-4-(2-пиридил)-3-хинолинкарбоксамид
Стадия 1
Смесь 2-(2-аминобензоил) пиридина (4,36 г), диэтилмалоната (3,92 мл) и 1,9-диазабицикло[5,4,0] -7-ундецена (0,5 мл) нагревали в течение 3 часов при 180oC. Реакционную смесь охлаждали для получения этилового эфира 1,2-дигидро-2-оксо-4-(2-пиридил)-3-хинолинкарбоновой кислоты в виде кристаллов (6,1 г: неочищенный). Кристаллический продукт растворяли в ДМФ (100 мл), куда добавляли гидрид натрия (60% масляный) (1,5 г) и смесь перемешивали в течение одного часа при комнатной температуре. Смесь охлаждали до 0oC, затем при перемешивании добавляли иодметан (10 мл). Смесь перемешивали в течение одного часа при комнатной температуре и затем концентрировали. К концентрату добавляли этилацетат. Смесь промывали водой и высушивали. Растворитель затем отгоняли. Остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат) с получением этилового эфира 1,2-дигидро-1-метил-2-оксо-4-(2-пиридил)- 3-хинолинкарбоновой кислоты в виде бледно-желтых кристаллов (2,6 г).
Т. пл. 145-146oC (перекристаллизованная из этилацетата - этилового эфира).
ЯМР (200 МГц, CDCl3): 1,03 (3H, t, J = 7,1 Гц), 3,81 (3H, s), 4,12 (2H, q, J = 7,1 Гц), 7,18 (1H, м), 7,30 - 7,52 (4H, м), 7,62 (1H, м), 7,83 (1H, м), 8,77 (1H, м).
Стадия 2
Смесь соединения (1,0 г), полученного на стадии 1, и 40% метиламин-метанола (30 мл) нагревали в течение 16 часов в запаянной трубке при 140oC. Растворитель отгоняли. К остатку добавляли этилацетат и раствор промывали насыщенным водным раствором соли и высушивали. Затем растворитель отгоняли с получением вышеназванного вещества в виде бесцветных кристаллов (0,60 г).
Т.пл. 239 - 240oC (перекристаллизованное из ТГФ - этилацетата)
ЯМР (200 МГц, CDCl3): 2,81 (3H, d, J=4,8 Гц), 3,84 (3H, s), 7,02 - 7,20 (2H, м), 7,30 - 7,50 (3H, м), 7,64 (1H, м), 7,81 (1H, м), 8,73 (1H, м), 8,81 (1H, м)
Справочный пример 15
7,8-Дигидро-7-метил-8-оксо-5-фенил-6-пиридо[3,4-b] пиридинкарбоновая кислота.
Стадия 1
К смеси 2,3-пиридиндикарбонового ангидрида (21,0 г) и бензола (210 мл) добавляли безводный хлорид алюминия (30,0 г) и перемешивали в течение 4 часов при нагревании в колбе с обратным холодильником. Реакционную смесь охлаждали и выливали в ледяную воду с хлористоводородной кислотой. Полученный в результате кристаллический осадок собирали фильтрованием, промывали небольшим объемом воды, затем этиловым эфиром с получением 3-бензоил-2-пиридинкарбоновой кислоты гидрохлорида в виде бледно-желтых кристаллов (23,7 г).
Т.пл. 149 - 153oC (разложение) (перекристаллизованный из метанола - этилового эфира)
ЯМР (200 МГц, CDCl3) М.Д: 7,44 (2H, t-подобное, J=7,9 Гц), 7,59 (1H, м), 7,78 (3H, м), 7,88 (1H, dd, J=1,5, 7,7 Гц), 8,78 (1H, dd, J=1,5, 4,7 Гц)
На стадиях со 2 по 4, используя соединение, полученное на стадии 1, проводили по существу ту же самую реакцию и обработку, что и в справочном примере 1, процесс 1, стадия 2 - 4, для получения соответствующих веществ. Соединения и их физико-химические константы с соответствующих стадий описаны ниже.
Стадия 2
3-бензоил-N-бензилоксикарбонилметил-N-метил-2-пиридинкарбоксамид
Бесцветный маслянистый продукт
ЯМР (200 МГц, CDCl2) м. д.: 3,12 (3Hx4/9, s), 3,18 (3Hx5/9, s), 4,24 (2Hx5/9, s), 4,26 (2Hx4/9H, s), 5,15 (2Hx5/9, s), 5,18 (2Hx4/5, s), 7,23 - 7,85 (7H, м), 8,40 (1Hx4/9, dd, J=1,4, 4,8 Гц), 8,74 (1Hx5/9, dd, J=1,4, 4,8 Гц)
Стадия 3
7,8-Дигидро-7-метил-8-оксо-5-фенил-6-пиридо[3,5-b] пиридинкарбоновой кислоты бензиловый эфир
Т.пл. 127 - 128oC (перекристаллизованный из дихлорметана- этилацетата)
ЯМР (200 МГц, CDCl3) м.д.: 3,63 (3H, s), 4,99 (2H, s), 7,03 - 7,08 (2H, м), 7,23 - 7,55 (9H, м), 7,62 (1H, dd, J=1,4, 8,3 Гц), 8,92 (1H, dd, J=1,4, 4,2 Гц)
Стадия 4
7,8-Дигидро-7-метил-8-оксо-5-фенил-6-пиридо[3,4-b] пиридинкарбоновая кислота (вышеназванное соединение)
Т. пл. 230 - 233oC (разложение) (перекристаллизованная из метанола - этилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 3,50 (3H, s), 7,10 - 7,80 (7H, м), 8,82 (1H, м)
Справочный пример 16
1,2-Дигидро-2-метил-1-оксо-4-фенил-3-пиридо[3,4-c] пиридинкарбоновая кислота
Стадия 1
К суспензии 3,4-пиридиндикарбонового ангидрида (8,94 г) в ТГФ (100 мл) по каплям добавляли раствор фенил-магний бромида, полученного из магния (2,02 г) и бромбензола (11,30 г)) в ТГФ (45 мл) при перемешивании при комнатной температуре. Реакционную смесь перемешивали в течение одного часа при комнатной температуре и затем выливали в разбавленную соляную кислоту при охлаждении. К этой смеси добавляли водный раствор карбоната натрия для доведения pH до 2 с последующей экстракцией этилацетатом. Экстракционный раствор промывали водой, затем высушивали и растворитель отгоняли с получением 4-бензоил-3-пиридинкарбоновой кислоты в виде бесцветного кристаллического продукта (5,80 г).
Т.пл. 240 - 241oC (перекристаллизованная из ацетона)
ЯМР (200 МГц, CDCl3+ДМСО-d6) м.д.: 7,27 - 7,74 (6H, м), 8,86 (1H, d, J= 4,0 Гц), 9,30 (1H, s)
В маточной жидкости и промывных жидкостях присутствовали дополнительно 4-бензоил-3-пиридинкарбоновая кислота и ее изомер, 3-бензоил-4-пиридинкарбоновая кислота.
На стадиях со 2 по 4, используя соединение, полученное на стадии 1, проводили по существу ту же самую реакцию и обработку, что и в справочном примере 3, стадии со 2 по 4, для получения желаемых соединений. Соединения, полученные на соответствующих стадиях, и их физико-химические константы описаны ниже.
Стадия 2
4-Бензоил-N-этоксикарбонилметил-N-метил-3-пиридинкарбоксамид
Бледно-желтый маслянистый продукт
ЯМР (200 МГц, CDCl3) м.д.: 1,29 (3H, t, J=7,2 Гц), 3,05 (3Hx1/4, s), 3,06 (3Hx3/4, s), 4,02 (3Hx1/4, s), 4,14 (3Hx3/4, s), 4,21 (2H, q, J=7,2 Гц), 7,27 - 7,80 (4H, м), 7,81 (2H, d, J=7,0 Гц), 8,78 (2H, м)
Стадия 3
1,2-Дигидро-2-метил-1-оксо-4-фенил-3-пиридо[3,4-c] пиридинкарбоновой кислоты этиловый эфир
Т.пл. 128 - 130oC (перекристаллизованный из этилацетата-этилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 0,94 (3H, t, J = 7,0 Гц), 3,61 (3H, s), 4,06 (2H, q, J=7,0 Гц), 7,07 (1H, d, J=5,6 Гц), 7,28 - 7,48 (5H, м), 8,67 (1H, d, J=5,6 Гц), 9,68 (1H, s)
Стадия 4
1,2-Дигидро-2-метил-1-оксо-4-фенил-3-пиридо[3,4-c] пиридинкарбоновая кислота (вышеназванное соединение)
Т.пл. 255 - 257oC (разложение) (перекристаллизованная из ТГФ - метанола)
ЯМР (200 МГц, CDCl3+ДМСО-d6) м.д.: 3,67 (3H, s), 7,05 (1H, d, J=5,6 Гц), 7,35 - 7,49 (5H, м), 8,64 (1H, d, J=5,6 Гц), 9,62 (1H, s)
Справочный пример 17
5,6-Дигидро-6-метил-5-оксо-8-фенил-7-пиридо[4,3-b] пиридинкарбоновая кислота
Это соединение было получено путем использования вместо п-фторфенил-магния бромида в справочном примере 11, стадия 1, фенилмагния бромида и проведения с последним по существу той же самой реакции и процесса, что и на стадиях с 1 по 5 справочного примера 11. Соединения, полученные на соответствующих стадиях, и их физико-химические константы описаны ниже.
Стадия 1
2-Бензоил-3-пиридинкарбоновая кислота
Т.пл. 190 - 193oC (перекристаллизованная из метанола-этилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 7,28 - 7,63 (4H, м), 7,76 (2H, d-подобное, J= 7 Гц), 8,37 (1H, dd, J=1,6, 8,0 Гц), 8,83 (1H, dd, J=1,6, 4,9 Гц)
Стадия 2
2-Бензоил-N-цианометил-N-метил-3-пиридинкарбоксамид
Бледно-желтый маслянистый продукт
ЯМР (200 МГц, CDCl3) м. д.: 3,02 (3Hx3/4, s), 3,21 (3Hx1/4, s), 4,18 (2Hx1/4, s), 4,50 (2Hx3/4, s), 7,35 - 7,70 (4H, м), 7,79 (1H, d-подобное, J= 7,4 Гц), 7,99 (2H, м), 8,73 (1H, dd, J=1,6, 4,8 Гц)
Стадия 3
5,6-Дигидро-6-метил-5-оксо-8-фенил-7-пиридо[4,3-b]пиридинкарбонитрил
Т.пл. 256 - 258oC (перекристаллизованный из метанола-этилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 3,88 (3H, s), 7,45 - 7,60 (6H, м), 8,79 (1H, dd, J=1,9, 8,1 Гц), 8,99 (1H, dd, J=1,9, 9,4 Гц)
Стадия 4
5,6-Дигидро-6-метил-5-оксо-8-фенил-7-пиридо[4,8-b]пиридинкарбоксамид
Т.пл. 280 - 282oC (перекристаллизованный из метанола-этилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 3,72 (3H, s), 5,46 (1H, b), 5,55 (1H, b), 7,46 (6H, м), 8,76 (1H, dd, J=1,9, 8,1 Гц), 8,91 (1H, dd, J=1,9, 4,5 Гц)
Стадия 5
5,6-Дигидро-6-метил-5-оксо-8-фенил-7-пиридо[4,3-b] пиридинкарбоновая кислота (вышеназванное вещество)
Т. пл. 254 - 259oC (разложение) (перекристаллизованная из метанола-этилового эфира)
ЯМР (200 МГц, ДМСО-d6 м.д.: 3,55 (3H, s), 7,28 - 7,50 (5H, bs), 7,87 (1H, d, J=4,8, 8,0 Гц), 8,63 (1H, dd, J=1,8, 8,2 Гц), 8,88 (1H, dd, J=2,0, 4,4 Гц)
Справочный пример 18
4-(4-Фторфенил)-6,7-дигидро-1,6-диметил-7-оксо-5-пирроло[2,3- c] пиридинкарбоновая кислота
Стадия 1
С 1-Метил-2,3-пирролдикарбоновым ангидридом и фторбензилом проводили по существу ту же самую реакцию и процесс, что и в справочном примере 1, процесс 1, в присутствии хлорида алюминия с получением 3-(4-фторбензоил)-1-метил-2-пирролкарбоновой кислоты в виде бесцветных кристаллов
ЯМР (200 МГц, CDCl3) м.д: 4,11 (3H, s), 6,51 (1H, d, J=2,9 Гц), 6,85 (1H, d, J=2,9 Гц), 7,20 (2H, t-подобное, J=8,6 Гц), 7,80 - 7,90 (2H, м)
На стадиях со 2 по 4, используя соединение, полученное на стадии 1, проводили по существу те же самые реакции и процессы, что и на стадиях со 2 по 4 справочного примера 2, для получения желаемых веществ. Соединения, полученные на соответствующих стадиях и их физико-химические константы описаны ниже.
Стадия 2
N-этоксикарбонилметил-3-(4-фторбензоил)-N,1-диметил-2- пирролкарбоксамид
Бледно-желтый маслянистый продукт
ЯМР (200 МГц, CDCl3) м.д.: 1,22 (0,9H, t, J = 7,3 Гц), 1,31 (2,1H, t, J = 7,1 Гц), 2,93 (2, 1H, s), 3,08 (0,9H, s), 3,30 - 3,90 (1H, м), 3,74 (2,1H, s), 4,00 - 4,50 (1H, м), 4,12 (0,6H, q, J = 7,3 Гц), 4,23 (1,4H, q, J = 7,1 Гц), 6,40 (0,3H, d, J = 2,6 Гц), 6,44 (0,7H, d, J = 2,8 Гц), 6,63 (0,3H, d, J = 2,6 Гц), 6,66 (0,7H, d, J = 2,8 Гц), 7,12 (2H, t - подобное, J = 8,8 Гц), 7,78 - 7,92 (2H, м)
Стадия 3
4-(4-фторфенил)-6,7-дигидро-1,6-диметил-7-оксо-5-пиррол[2,3-c] - пиридинкарбоновой кислоты этиловый эфир.
Бледно-желтый маслянистый продукт
ЯМР (200 МГц, CDCl3) м.д.: 0,99 (3H, t, J = 7,2 Гц), 3,60 (3H, s), 4,07 (2H, q, J = 7,2 Гц), 4,20 (3H, s), 6,03 (1H, d, J = 2,9 Гц), 6,98 (1H, d, J = 2,9 Гц), 7,00 - 7,40 (4H, м)
Стадия 4
4-(4-фторфенил)-6,7-дигидро-1,6-диметил-7-оксо-5-пиррол[2,3-c] - пиридинкарбоновой кислота (вышеназванное вещество)
Бесцветные кристаллы
ЯМР (200 МГц, CDCl3) м.д.: 3,65 (3H, s), 4,20 (3H, s), 6,02 (1H, d, J = 2,8 Гц), 6,98 (1H, d, J = 2,8 Гц), 7,09 (2H, t, J = 8,8 Гц), 7,38 - 7,50 (2H, м)
Справочник пример 19
7-(4-фторфенил)-4,5-дигидро-5-метил-4-оксо-6-тиазоло[5,4-c] - пиридинкарбоновая кислота
Стадия 1
С 4,5 - тиазолдикарбоновым ангидридом и фторбензолом проводили по существу ту же самую реакцию и процесс, что и в справочном примере 1, процесс 1, стадия 1, в присутствии хлорида алюминия для получения смеси 5-(4-фторбензоил)-4-тиазолкарбоновой кислоты и 4-(4-фторбензоил)-5-тиазолкарбоновой кислоты. Эту смесь использовали на последующей стадии 2.
Стадия 2
Используя смесь, полученную на стадии 1, проводили по существу ту же самую реакцию и процесс, что и в справочном примере 2, стадия 2, для получения смеси N-этоксикарбонилметил-5-(4-фторбензоил)-N- метил-4-тиазолкарбоксамида и N-этоксикарбонилметил-4-(4- фторбензоил)-N-метил-5-тиазолкарбоксамида в виде бледно-желтого маслянистого продукта.
ЯМР (200 МГц, CDCl3) м.д.: 1,20 - 1,40 (3H, м), 3,00, 3,04, 3,15, 3,23 (общее 3H, каждый), 4,0 - 4,40 (4H, м), 7,16 (2H, t-подобное, J = 8,6 Гц), 7,84 - 7,95 (1,2H, м), 8,24 - 8,34 (0,8H, м), 8,86, 8,90, 8,94, 8,96 (общее 1H, каждый)
Эту смесь использовали на следующей стадии 3.
Стадия 3
Используя смесь, полученную на стадии 2, проводили по существу ту же самую реакцию и процесс, что и в справочном примере 2, стадия 3, затем реакционную смесь нагревали в колбе с обратным холодильником в толуоле в присутствии п-толуолсульфоновой кислоты для получения смеси 7-(4-фторфенил)-4,5-дигидро-5-метил-4-оксо-6-тиазоло- [5,4-c] пиридинкарбоновой кислоты этилового эфира и 7-(4-фторфенил)-4,5-дигидро-5-метил-4-оксо-6-тиазоло[4,5-c] - пиридинкарбоновой кислоты этилового эфира. Эту смесь подвергали колоночной хроматографии на силикагеле (гексан-этилацетат = 1:2). Из первой фракции первый из двух был получен в виде бесцветных кристаллов.
Т. пл. 129 - 130oC (перекристаллизованный из этилацетата-изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 1,04 (3H, t, J = 7,1 Гц), 3,68 (3H, s), 4,15 (2H, q, J = 7,1 Гц), 7,16 (1H, t-подобное, J = 8,7 Гц), 7,38 - 7,48 (2H, м), 9,12 (1H, s)
Из следующей фракции был получен последний из двух в виде бесцветных кристаллов.
Т. пл. 209-212oC (перекристаллизованный из этилацетат - изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 1,04 (3H, t, J = 7,1 Гц), 3,70 (3H, s), 4,15 (2Н, q, J = 7,1 Гц), 7,17 (2H, t-подобное, J = 8,6 Гц), 7,35 - 7,45 (2H, м), 8,90 (1H, s)
Стадия 4
7-(4-фторфенил)-4,5-дигидро-5-метил-4-оксо-6-тиазоло[5,4-c] - пиридинкарбоновой кислоты этиловый эфир, полученный на стадии 3, подвергали гидролизу в 70% H2SO4 при температурах, находящихся в интервале от 120 до 130oC, для получения вышеназванного соединения в виде бесцветных кристаллов.
Т. пл. 214 - 217oC (перекристаллизованное из этилацетат-изопропилового эфира)
ЯМР (200 МГц, ДМСО-d6) м.д.: 3,58 (3H, s), 7,28 (2H, t-подобное, J = 9,0 Гц), 7,40 - 7,52 (2H, м), 9,53 (1H, s)
Справочный пример 20
7-(4-фторфенил)-4,5-дигидро-5-метил-4-оксо-6-тиазоло[4,5-c] - пиридинкарбоновая кислота
Используя 7-(4,5-дигидро-5-метил-4-оксо-6-тиазоло[4,5-c] - пиридинкарбоновой кислоты этиловый эфир, полученный в справочном примере 19, стадии 3, проводили по существу ту же самую реакцию (кислотный гидролиз), что и в справочном примере 19, стадия 4, для получения вышеназванного соединения в виде бесцветных кристаллов.
Т. пл. 192-194oC (перекристаллизованное из этилацетат - ТГФ - изопропилового эфира)
ЯМР (200 Гц, ДМСО-d6): м.д.: 3,57 (3H, s), 7,34 (2H, t-подобное, J = 8,8 Гц), 7,46 - 7,57 (2H, м), 9,23 (1H, s)
Справочный пример 21
4,5-Дигидро-5-метил-4-оксо-7-фенил-6-тиазоло[5,4-c] - пиридинкарбоновая кислота
Стадия 1
С 4,5-тиазолкарбоновым ангидридом и бензилом проводили по существу ту же самую реакцию и процесс, что и в справочном примере, процесс 1, стадия 1, в присутствии хлорида алюминия для получения смеси 4-бензоил-5-тиазолкарбоновой кислоты и 5-бензоил-4-тиазолкарбоновой кислоты. Эту смесь использовали на следующей стадии 2.
Стадия 2
Используя смесь, полученную на стадии 1, проводили по существу ту же самую реакцию и процесс, что и в справочном примере 2, стадия 2, для получения смеси 4-бензоил-1-этоксикарбонилметил-N-метил-5- тиазолкарбоксамида и 5-бензоил-N-этоксикарбонилметил-N-метил-4- тиазолкарбоксамида в виде бледно-желтого маслянистого продукта. Эту смесь использовали на последующей стадии 3.
Стадия 3
Используя соединение, полученное на стадии 2, проводили по существу ту же самую реакцию и процесс, что и в справочном примере 19, стадия 3, для получения смеси 4,5-дигидро-5-метил-4-оксо-7- фенил-6-тиазоло[5,4-c]пиридинкарбоновой кислоты этилового эфира и 4,5-дигидро-5-метил-4-оксо-7-фенил-6-тиазоло[4,5-c] пиридинкарбоновой кислоты этилового эфира. Эту смесь подвергали колоночной хроматографии на силикагеле (гексан - этилацетат = 1:2). Из первой фракции было получено первое из названных вещество в виде бесцветных кристаллов.
Т.пл. 121 - 122oC (перекристаллизованное из этилового эфира - изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 0,96 (3H, t, J = 7,1 Гц), 3,69 (3H, s), 4,10 (2H, q, J = 7,1 Гц), 7,44 (5H, s), 9,11 (1H, s)
Из следующей фракции было получено последнее из названных соединений в виде бесцветных кристаллов.
Т. пл. 186-188oC (перекристаллизованное из этилацетата - изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 0,97 (3H, t, J=7,1 Гц), 3,71 (3H, s), 4,11 (2H, g, J=7,1 Гц), 7,40-7,50 (5H м), 8,89 (1H,s)
Стадия 4
Используя 4,5-дигидро-5-метил-4-оксо-7-фенил-6-тиазоло [5,4-c]пиридинкарбоновой кислоты этиловый эфир, проводили по существу ту же самую реакцию (кислотный гидролиз) и процесс, что и в справочном примере 19, стадия 4, для получения вышеназванного соединения в виде бесцветных кристаллов.
Т. пл. 155-157oC (перекристаллизованное из этилацетат-изопропилового эфира)
ЯМР (200 МГц, DMCO-d6)м.д.: 3,59 (3H, s), 7,43 (5H, s), 9,53 (1H, s)
Справочный пример 22
4,5-Дигидро-5-метил-4-оксо-7-фенил-6-тиазоло[4,5-c] пиридинкарбоновая кислота
С этиловым эфиром 4,5-дигидро-5-метил-4-оксо-7-фенил-6-тиазол [4,5-c] пиридинкарбоновой кислоты, полученным в справочном примере 21, стадия 3, проводили по существу ту же самую реакцию и процесс, что и в справочном примере 19, стадия 4, для получения вышеназванного соединения в виде бесцветных кристаллов.
Т.пл. 228-230oC (перекристаллизованное из ТГФ - этилового эфира)
ЯМР (200 МГц, ДМСО-d6) м.д.: 3,58 (3H, s), 7,48 (5H, s), 9,23 (1H, s)
Справочный пример 23
6,7-Дигидро-6-метил-7-оксо-4-фенил-5-тиено-[2,3-c] пиридинкарбоновая кислота
Стадия 1
Используя 2,3-тиофенкарбоновый ангидрид и бензол проводили по существу ту же самую реакцию и обработку, что и в справочном примере 8, стадия 1, в присутствии хлорида алюминия для получения 3-бензоил-2-тиофенкарбоновой кислоты в виде бесцветных кристаллов.
Т. пл. 141-143oC (перекристаллизованная из этилацетата - изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 7,33 (1H, d, J=5,4 Гц), 7,5-7,6 (2H, м), 7,65 (1H, d, J=5,4 Гц), 7,68 (1H, м), 7,8-7,9 (2H, м)
На стадиях со 2 по 4, используя соединение, полученное на стадии 1, проводили по существу ту же самую реакцию и процесс, что и на стадиях со 2 по 4 справочного примера 8, для получения желаемых веществ. Соединения, полученные на соответствующих стадиях, и их физико-химические константы описаны ниже.
Стадия 2
3-Бензоил-N-этоксикарбонилметил-N-метил-2-тиофенкарбоксамид.
Бледно-желтый маслянистый продукт
ЯМР (200 МГц, CDCl3) м.д. : 1,27 (3H, t, J=7,2 Гц), 2,96 (3H, bs), 4,00 (2H, s), 4,19 (2H, q, J=7,2 Гц), 7,27 (1H, м), 7,4-7,6 (4H, м), 7,83 (2H, м)
Стадия 3
6,7-Дигидро-6-метил-7-оксо-4-фенил-5-тиено[2,3-c] пиридинкарбоновой кислоты этиловый эфир
Т.пл. 92-94oC (перекристаллизованный из этилацетата)
ЯМР (200 МГц, CDCl3) м.д.: 0,94 (3H, t, J=7,2 Гц), 3,67 (3H, s), 4,07 (2H, g, J=7,2 Гц), 6,97 (1H, dd, J=5,2 Гц), 7,3-7,5 (5H, м), 7,66 (1H, d, J= 5,2 Гц)
Стадия 4
6,7-Дигидро-6-метил-7-оксо-4-фенил-5-тиено[2,3-c] пиридинкарбоновая кислота (вышеназванное соединение)
Т.пл. 185-186oC (перекристаллизованная из этилацетата)
ЯМР (200 МГц, CDCl3) м.д.: 3,65 (3H, s), 6,95 (1H, d, J=5,2 Гц), 7,40 (5H, s), 7,65 (1H, d, J=5,2 Гц)
Справочный пример 24
6,7-Дигидро-6-метил-4-(2-метилфенил)-7-оксо-5-тиено[2,3-c] пиридинкарбоновая кислота
Стадия 1
2,3-тиофендикарбоновому ангидриду давали прореагировать с 2-метилфенил-магний бромидом в ТГФ и реакционную смесь обрабатывали с получением 3-(2-метилбензоил)-2-тиофенкарбоновой кислоты в виде бесцветных кристаллов.
Т. пл. 115-117oC (перекристаллизованная из этилацетат - изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 2,42 (3H, s), 7,17 (1H, d, J=5,2 Гц), 7,3-7,5 (4H, м), 7,56 (1H, d, J=5,4 Гц)
На стадиях со 2 по 4 с соединением, полученным на стадии 1, проводили по существу те же самые реакции и процессы, что и в справочном примере 8 для получения желаемых соединений. Соединения, полученные на соответствующих стадиях, и их физико-химические константы представлены.
Стадия 2
N-этоксикарбонилметил-N-метил-3-(2-метилбензоил)-2- тиофенкарбоксамид
Бледно-желтое маслянистое соединение
ЯМР (200 МГц, CDCl3): м.д.: 1,28 (3Н, t, J=7,4 Гц), 2,42 (3H, s), 2,97 (3Hx 3/5, s), 3,01 (3Hx 2/5, s), 3,99 (2Hz 2/5, s), 4,07 (2Hx 3/5, s), 4,22 (2H, g, J=7,4 Гц), 7,2-7,5 (6H, м)
Стадия 3
6,7-Дигидро-6-метил-4-(2-метилфенил)-7-оксо-5-тиено[2,3-c] пиридинкарбоновой кислоты этиловый эфир
Бледно-желтое маслянистое вещество
ЯМР (200 МГц, CDCl3) м.д.: 0,88 (3H, t, 7,4 Гц), 2,12 (3H, s), 3,67 (2H, s), 4,01 (2H, g, J=7,4 Гц), 6,71 (1H, d, J= 5,4 Гц), 7,2-7,3 (4H, м), 7,63 (1H, d, J=5,4 Гц)
Стадия 4
6,7-Дигидро-6-метил-4-(2-метилфенил)-7-оксо-5-тиено[2,3-c] пиридинкарбоновая кислота (вышеназванное соединение)
Т.пл. 124-128oC (перекристаллизованная из этилацетата)
ЯМР (200 МГц, CDCl3) м.д.: 2,11 (3H, s), 3,66 (3H, s), 6,70 (1H, d, J= 5,2 Гц), 7,2-7,3 (4H, м), 7,64 (1H, d, J=5,2 Гц)
Справочный пример 25
7,9-Дигидро-7-метил-5-(4-метилфенил)-8-оксо-6-пиридо[3,4-bn] пиридинкарбоновой кислоты гидрохлорид
Стадия 1
Используя 2,3-пиридинкарбоновый ангидрид (10,0 г), толуол (125 мл) и алюминия хлорид (15,0 г), проводили по существу ту же самую реакцию и процесс, что и в справочном примере 1, процесс 1 и стадия 1, с получением -3-(4-метилбензоил)-2-пиридинкарбоновой кислоты в виде бесцветных кристаллов (7,8 г).
Т.пл. 168-170oC (перекристаллизованная из дихлорметана-этилацетата)
ЯМР (200 МГц, CDCl3) м.д.: 2,41 (3H, s), 7,24 (2H, d, J=8,4 Гц), 7,62 (2H, d, J=8,4 Гц), 7,70 (1H, dd, J=8, 4,8 Гц), 7,85 (1H, dd, J=8, 1,5 Гц), 8,77 (1H, dd, J=4,8, 1,5 Гц)
Стадия 2
Используя соединение, полученное на стадии I, проводили по существу ту же самую реакцию и процесс, что и в справочном примере 1, процесс 2, стадия 1, с получением N-цианометил-N-метил-3-(4- метилбензоил)-2-пиридинкарбоксамида в виде бледно-коричневатого маслянистого вещества.
ЯМР (200 МГц, CDCl3) м.д.: 2,43 (3H, s), 3,13 (3Hx 1/3, s) 3,18 (3Hx 2/3, s), 4,42 (2Hx 2/3, s), 4,49 (2Hx 1/3, s), 7,28 (2H, d, J=8,4 Гц), 7,42-7,52 (1H, м), 7,63-7,73 (2H, м), 7,81-7,94 (1H, м), 8,70-8,75 (1H, м).
Стадия 3
Используя соединение, полученное на стадии 2, проводили по существу те же самые реакцию и процесс, что и в справочном примере 1, процесс 1 и стадия 2, с получением 7,8-дигидро-7-метил-5-(4-метилфенил) -8-оксо-6-пиридо[3,4-b] пиридинкарбонитрила в виде бесцветных кристаллов.
Т.пл. 268-270oC (перекристаллизованный из этилацетат - этилового эфира.
ЯМР (200 МГц, CDCl3) м.д.: 2,47 (3Н, s), 3,92 (3H, s), 7,28 (2H, d, J=8 Гц), 7,38 (2H, d, J=8 Гц), 7,56 (1H, dd, J=8,4 Гц), 7,75 (1H, dd, J=8,2 Гц), 9,01 (1H, dd, J=4,2 Гц)
Стадия 4
Используя соединение, полученное на стадии 3, проводили по существу те же самые реакцию и процесс, что и в справочном примере 1, процесс 2, стадия 3, с получением 7,8-дигидро-7-метил-5-(4- метилфенил)-8-оксо-6-пиридо[3,4-b] пиридинкарбоксамида в виде бесцветных кристаллов
Т.пл. > 310o (перекристаллизованный из метанола).
ЯМР (200 МГц, CDCl3+DMCO-d6) м.д.: 2,43 (3H, s), 3,66 (3H, s), 6,08 (1H, b), 6,92 (1H, b), 7,2-7,3 (4H, м), 7,40 (1H, dd, J = 8,4 Гц), 7,56 (1H, dd, J = 8,2 Гц), 8,82 (1H, dd, J = 4,2 Гц)
Стадия 5
Смесь соединения (7,3 г), полученного на стадии 4, уксусной кислоты (150 мл), хлористоводородной кислоты (300 мл) и нитрита натрия (73 г) перемешивали в течение 15 часов при комнатной температуре. Полученный в результате кристаллический осадок (неорганическая соль) отделяли фильтрованием и промывали соляной кислотой. Фильтрат и промывную жидкость объединяли и концентрировали. Эту процедуру повторяли три раза для удаления неорганической соли. Остаток обрабатывали ТГФ с получением вышеназванного соединения в виде желтых кристаллов (5,9 г).
Т.пл. 178-183oC (после размягчения затвердевало в виде белого вещества), 249 - 151oC (разложение) (перекристаллизованное из метанола - ТГФ)
ЯМР (200 МГц, CDCl3 + DMCO - d6) м.д.: 2,43 (3H, s), 3,77 (3H, s), 7,29 (4H, s), 7,88 (1H, dd, J = 8,5, 4,8 Гц), 8,02 (1H, dd, J = 8,5, 1,4 Гц), 9,04 (1H, dd, J = 4,8, 1,4 Гц)
Справочный пример 26
7,8-Дигидро-5-(4-метоксифенил)-7-метил-8-оксо-6-пиридо[3,4-b] пиридинкарбоновая кислота
Стадия 1
Используя 2,3-пиридинкарбоновый ангидрид и 4-метокси-фенил магний бромид, проводили по существу те же самые реакцию и процесс, что и в справочном примере 5, стадия 1, с получением смеси 3-(4-метоксибензоил)-2-пиридинкарбоновой кислоты и 2-(4-метоксибензоил)-3-пиридинкарбоновой кислоты. Эту смесь подвергали распределению между этиловым эфиром и IN HCl. Слой IN HCl обрабатывали с получением первого из названных веществ в виде бледно-желтого порошкообразного продукта.
ЯМР (200 МГц, CDCl3+DMCO-d6) м.д.: 3,87 (3H, s), 6,91 (2H, d, J = 8,6 Гц), 7,6 (1H, м), 7,67 (2H, d, J = 8,6 Гц), 7,79 (1H, d, J = 9 Гц), 8,75 (1H, b)
Стадия 2
Используя соединение, полученное на стадии 1, проводили по существу те же самые реакцию и процесс, что и в справочном примере 1, процесс 2, стадия 1, с получением N-цианометил-3-(4-метоксибензоил)-N-метил-2-пиридинкарбоксамида в виде бледного коричневого маслянистого вещества.
ЯМР (200 МГц, CDCl3) м.д.: 3,17 (3Hx1/4, s), 3,19 (3Hx3/4, s), 3,88 (3H, s), 4,44 (2Hx3/4, s), 4,48 (2Hx1/4, s), 6,96 (2H, d, J = 8 Гц), 7,43 - 7,52 (1H, м), 7,76 - 7,91 (3H, м), 8,73 (1H, dd, J = 5,1, 1,6 Гц)
Стадия 3
Используя соединение, полученное на стадии 2, проводили по существу ту же самую реакцию и процесс, что и в справочном примере 1, процесс 2, стадия 2, с получением 7,8-дигидро-5-(4-метоксифенил)-7-метил-8-оксо-6-пиридо[3,4-b] пиридинкарбонитрила в виде бесцветных кристаллов.
Т.пл. 248 - 150oC (перекристаллизованный из этанола)
ЯМР (200 МГц, CDCl3) м.д.: 3,90 (3H, s), 3,91 (3H, s), 7,08 (2H, d, J = 8,8 Гц), 7,33 (2H, d, J = 8,8 Гц), 7,57 (1H, dd, J = 8,2, 4,4 Гц), 7,77 (1H, dd, J = 8,2, 1,8 Гц), 9,01 (1H, dd, J = 4,4, 1,8 Гц)
Стадия 4
Используя соединение, полученное на стадии 3, проводили по существу те же самые реакцию и процесс, что и в справочном примере 1, процесс 2, стадия 3, с получением 7,8 - дигидро-5-(4-метоксифенил)-7-метил-8-оксо-6-пиридо[3,4-b] пиридинкарбоксамида в виде бесцветных кристаллов.
Т.пл. > 310oC (перекристаллизованный из метанола - ТГФ)
ЯМР (200 МГц, CDCl3+DMCO-d6) м.д.: 3,73 (3H, s), 3,87 (3H, s), 6,64 (1H, b), 6,98 (2H, d, J = 8,8 Гц), 7,25 (1H, b), 7,32 (2H, d, J = 8,8 Гц), 7,48 (1H, dd, J = 8,4, 4,2 Гц), 7,63 (1H, d, J = 8,4, 1,6 Гц), 8,86 (1H, dd, J = 4,1, 1,6 Гц)
Стадия 5
Используя соединение, полученное на стадии 4, проводили по существу ту же самую реакцию и процесс, что и в справочном примере 25, стадия 5, с получением вышеназванного соединения в виде желтого порошковидного вещества.
ЯМР (200 МГц, CDCl3 + DMCO - d6) м.д.: 3,75 (3H, s), 3,87 (3H, s), 6,99 (2H, d, J = 8 Гц), 7,31 (2H, d, J = 8 Гц), 7,6 - 7,8 (2H, м), 8,95 (1H, b)
Справочный пример 27
1,2-Дигидро-2-метил-4-(4-метилфенил)-1-оксо-3-пиридо[3,4-c] пиридинкарбоновой кислоты гидрохлорид
Процесс 1:
Стадия 1
Используя 3,4-пиридинкарбоновый ангидрид (10,0 г) и 4-метилфенил-магния бромид, проводили по существу те же самые реакцию и процесс, что и в справочном примере 2, стадия 1, с получением 4-(4-метилбензоил)-3-пиридинкарбоновой кислоты в виде бесцветных кристаллов.
Т.пл. 230 - 231oC (перекристаллизованная из метанола)
ЯМР (200 МГц, CDCl3) м.д.: 2,41 (3H, s), 7,24 (2H, d, J = 8,0 Гц), 7,28 (1H, d, J = 5,0 Гц), 7,63 (2H, d, J = 8,0 Гц), 8,84 (1H, d, J = 5,0 Гц), 9,30 (1H, s)
Стадия 2
Используя соединение, полученное методом со стадии 1, проводили по существу те же самые реакцию и процесс, что и в справочном примере 2, стадия 2, с получением N-этоксикарбонил-метил-N-метил-4-(4-метилбензоил)-3-пиридинкарбоксамида в виде бледно-коричневого маслянистого вещества.
ЯМР (200 МГц, CDCl2) м.д.: 1,29 (3H, t, J=7,1), 2,43 (3H, s), 3,05 (3H, s), 4,00 - 4,20 (2H, м), 4,22 (2H, q, J = 7,1 Гц), 7,25 - 7,40 (1H, м), 7,28 (2H, d, J = 8,2 Гц), 7,71 (2H, d, J = 8,2 Гц), 8,71 - 8,83 (2H, m)
Стадия 3
Используя соединение, полученное на стадии 2, проводили по существу те же самые реакцию и процесс, что и в справочном примере 2, стадия 3, с получением 1,2-дигидро-2-метил-4-(4-метилфенил)-1-оксо-3-пиридо[3,4-c] пиридинкарбоновой кислоты этилового эфира в виде бесцветных кристаллов.
Т. пл. 134 - 136oC (перекристаллизованный из этилацетата-изопропилового эфира).
ЯМР (200 МГц, CDCl3) м.д.: 0,99 (3H, t, J = 7,1 Гц), 2,43 (3H, s), 3.61 (3H, s), 4,09 (2H, q, J = 7,1 Гц), 7,09 (1H, q, J = 5,4 Гц), 7,18 (2H, d, J = 8,2 Гц), 7,27 (2H, d, J = 8,2 Гц), 8,66 (1H, d, J = 5,4 Гц), 9,68 (1H, s)
Стадия 4
Используя соединение, полученное на стадии 3, проводили по существу те же самые реакцию и обработку (была добавлена обработка HCl), что и в справочном примере 2, стадия 4, с получением вышеназванного вещества в виде желтых кристаллов.
Т.пл. 240 - 242oC (снова затвердевшее разлагалось около 280oC) (перекристаллизованное из метанола - ТГФ)
ЯМР (200 МГц, DMCO-d6) м.д.: 2,40 (3H, s), 3,57 (3H, s), 7,26 (2H, d, J = 8,0 Гц), 7,34 (1H, d, J = 6,4 Гц), 7,35 (2H, d, J = 8,0 Гц), 8,75 (1H, d, J = 6,4 Гц), 9,53 (1H, s)
Процесс 2:
Стадия 1
Используя соединение, полученное на стадии 1, проводили по существу те же самые реакцию и процесс, что и в справочном примере 1, процесс 2, стадия 1, с получением N-цианометил-N-метил-4-(4-метилбензоил)-3-пиридинкарбоксамида в виде бледно-коричневатого маслянистого продукта.
ЯМР (200 МГц, CDCl3) м.д.: 2,44 (3H, s), 3,10 (3H, s), 4,38 (2H, bs), 7,30 (2H, d, J = 8,2 Гц), 7,43 (1H, d, J = 5,0 Гц), 7,70 (2H, d, J = 8,2 Гц), 8,75 (1H, s), 8,88 (1H, d, J = 5,0 Гц)
Стадия 2
Используя соединение, полученное на стадии 1, проводили по существу те же самые реакцию и процесс, что и в справочном примере 1, процесс 2, стадия 2, с получением 1,2-дигидро-2-метил-4-(4-метилфенил)-1-оксо-3-пиридо[3,4-c] пиридинкарбонитрила в виде бесцветных кристаллов.
Т.пл. 201-202oC (перекристаллизованный из этилацетата-изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 2,47 (3H, s), 3,86 (3H, s, 7,20 (1H, d, J = 5,9 Гц), 7,29 (2H, d, J = 8,2 Гц), 7,38 (2H, d, J = 8,2 Гц), 8,79 (1H, d, J = 8,9 Гц), 9,73 (1H, s)
Стадия 3
Используя соединение, полученное на стадии 2, проводили по существу те же самые реакцию и процесс, что и в справочном примере 1, процесс 2, стадия 2, с получением 1,2-дигидро-2-метил-4-(4-метилфенил)-1-оксо-3-пиридо[3,4-c] пиридинкарбоксамида в виде бесцветных кристаллов.
Т.пл. 329 - 330oC (перекристаллизованный из дихлорметана-метанола)
ЯМР (200 МГц, ДМСО-d6) м.д.: 2,38 (3H, s), 3,54 (3H, s), 6,97 (1H, d, J = 5,4 Гц), 7,23 (2H, d, J = 8,6 Гц), 7,29 (2H, d, J = 8,6 Гц), 7,85 (1H, bs), 8,11 (1H, bs), 8,66 (1H, d, J = 5,4 Гц), 9,44 (1H, s)
Стадия 4
Используя соединение, полученное на стадии 3, проводили по существу те же самые реакцию и процесс, что и в справочном примере 25, стадия 5, с получением вышеназванного вещества в виде желтых кристаллов. Физико-химические константы этого соединения находятся в хорошем согласии с константами соединения, полученного при процесса 1 на стадии 4.
Справочный пример 28
7,8-дигидро-7-метил-5-(3-метилфенил)-8-оксо-6-пиридо [3,4-b] пиридинкарбоновой кислоты гидрохлорид
Стадия 1
Используя 2,3-пиридинкарбоновой ангидрид и 3-метилфенил-магния бромид, проводили по существу те же самые реакцию и процесс, что и в справочном примере 6, стадия 1, с получением смеси 3-(3-метилбензоил)-2-пиридинкарбоновой кислоты и 2-(3-метилбензоил)-3-пиридинкарбоновой кислоты.
Стадия 2
Используя смесь, полученную на стадии 1, проводили по существу те же самые реакцию и процесс, что и в справочном примере 1, процесс 2, стадия 1, с получением смеси N-цианометил-N-метил-3-(3-метилбензоил)-2-пиридинкарбоксамида и N-цианометил-2-(3-метилбензоил)-3-пиридинкарбоксамида.
Стадия 3
Используя смесь, полученную на стадии 2, проводили по существу те же самые реакцию и процесс, что и в справочном примере 1, процесс 2, стадия 2. Реакционную смесь подвергали колоночной хроматографии на силикагеле (ацетон : гексан 1:1 - ацетон) для разделения на фракции. Из первой фракции получали 5,6-дигидро-6-метил-8-(3-метилфенил)-5-оксо-7-пиридо [4,3-b] пиридинкарбонитрил (т.пл. : 234 - 236oC (перекристаллизованный из ацетона).
ЯМР (200 Мгц, CDCl3) м.д. : 2,44 (3H, s), 3,87 (3H, s), 7,26 - 7,47 (4H, м), 7,54 (1H, dd, J = 8,5 Гц), 8,78 (1H, dd, J = 8,2 Гц), 8,99 (1H, dd, J = 5,2 Гц), и из следующей фракции был получен 7,8 - дигидро-7-метил-5-(3-метил-фенил)-8-оксо-6-пиридо [3,4-b] пиридинкарбонитрил (Т.пл.: 253 - 255oC (перекристаллизованный из ацетона),
ЯМР (200 МГц, CDCl3) м.д. : 2,45 (3H, s) 7,2 - 7,5 (4H, м), 7,57 (1H, dd, J = 8,4 Гц), 7,73 (1H, d, J = 8 Гц), 9,02 (1H, d, J = 4 Гц), соответственно, в виде бесцветных кристаллов.
Стадия 4
Используя 7,8-дигидро-7-метил-5-(3-метилфенил)-8-оксо-6-пиридо [3,4-b} пиридинкарбонитрил, полученный на стадии 3, проводили по существу ту же самую реакцию и процесс, что и в справочном примере 1, процесс 2, стадия 3, с получением 7,8-дигидро-7-метил-5-(3-метилфенил)-8-оксо-6-пиридо [3,4-b] пиридинкарбоксамида в виде бесцветных кристаллов.
Т.пл. > 310oC (перекристаллизованный из метанола)
ЯМР (200 МГц, CDCl3) м.д. : 2,42 (3H, s), 3,57 (3H, s), 5,70 (1H, bs) 6,78 (1H, bs), 7,23 - 7,41 (5H, м), 7,52 (1H, dd, J = 8,2 Гц), 8,79 (1H, dd, J = 4,2 Гц)
Стадия 5
Используя соединение, полученное на стадии 4, проводили по существу те же самые реакцию и процесс, как и в справочном примере 25, стадия 5, с получением вышеназванного соединения в виде бледных желто-оранжевых кристаллов.
Т.пл. около 220oC (разложение) (перекристаллизованное из метанола - ТГФ)
ЯМР (200 МГц, CDCl3 + ДМСО - d6) м.д. : 2,41 (3H, s), 3,78 (3H, s), 7,22 - 7,42 (4H, м), 7,95 (1H, dd, J = 8,4 Гц), 8,07 (1H, d, J = 8 Гц), 9,09 (1H, d, J = 4 Гц)
Справочный пример 29
5-(4-Карбоксифенил)-7,8-дигидро-7-метил-8-оксо-6-пиридо [3,4-b] пиридинкарбоновая кислота
Стадия 1
К смеси 3-(4-метилбензоил)-2-пиридинкарбоновой кислоты (6,0 г) и 0,1 N NaOH (340 мл) порциями добавляли КМnO4 (8,0 г) при перемешивании при комнатной температуре. После этого смесь нагревали при 90-100oC в течение 1,5 часов, к смеси добавили изопропанол и полученный в результате осадок отфильтровали. К фильтрату добавляли конц. HCl, чтобы довести до pH 2. Раствор насыщали NaCl и экстрагировали этилацетатом - ТГФ (примерно 3:1). Экстракт промывали водным раствором NaCl, высушивали и растворитель выпаривали с получением 3-(4-карбоксибензоил)-2-пиридинкарбоновой кислоты в виде бесцветных кристаллов (1,50 г).
Т. пл. 210 - 213oC (разложение) (перекристаллизованная из ТГФ - изопропилового эфира)
ЯМР (200 МГц, CDCl3 + ДМСО - d6) м.д. : 7,64 (1H, dd, J = 4,8, 7,8 Гц), 7,77 (2H, d, J = 8,6 Гц), 7,83 (1H, dd, J = 7,8, 1,6 Гц), 8,10 (2H, d, J = 8,6 Гц), 8,86 (1H, dd, J = 4,8, 1,6 Гц)
Стадия 2
Используя соединение, полученное на стадии 1 (1,46 г) и N-метилглицина этиловый эфир (3,0 г), проводили по существу те же самые реакцию и обработку, что и в справочном примере 2, стадия 2, с получением N-этоксикарболнилметил-3-[4-(N-этоксикарбонилметил-N-метилкарбамоил)бензоил] - N-метил-2-пиридинкарбоксамида в виде бесцветного масла (2,5 г).
ЯМР (200 МГц, CDCl3) м.д. : 1,20 - 1,40 (6H, м), 3,02, 3,13, 3,21 (общее 6H, каждый s), 3,96, 4,10-4,40 (общее 8H, м), 7,40 - 7,60 (3H, м), 7,70 - 7,90 (3H, м), 8,63 (1Hx 2/5, d - подобное), 8,75 (1Hx 2/5, d - подобное), 8,75 (1Hx3/5, d - подобное)
Стадия 3
Используя соединение, полученное на стадии 2 (2,2 г) и 1,8 - диазабицикло [5,4, 0] ундец-7-ен (2 мл), проводили по существу ту же самую реакцию и обработку, что и в справочном примере 2, стадия 3, с получением 5-(4-(N-этоксикарбонилметил-N-метилкарбамоил)фенил)-7,8-дигидро-7 -метил-8-оксо-6-пиридо [3,4-b] пиридинкарбоновой кислоты этилового эфира в виде бесцветных кристаллов (0,82 г).
Т.пл. 195 - 197oC (перекристаллизованный из этилацетата - изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д. : 1,01 (3H, t, J = 7,1 Гц), 1,30 (1H, t, J = 7,2 Гц), 1,34 (2H, t, J = 6,8 Гц), 3,12 (2H, s), 3,17 (1H, s), 3,68 (3H, s), 4,09 (2H, q, J = 7,1 Гц), 4,15 - 4,35 (4H, м), 7,10 - 7,65 (6H, м), 8,94 (1H, dd, J = 4,0, 1,2 Гц)
Стадия 4
Используя соединение, полученное на стадии 3 (0,77 г), проводили по существу те же самые реакцию и обработку, что и в справочном примере 2, стадия 4, с получением вышеназванного соединения в виде бледно-желтого масла, которое использовали для реакции из примера 73.
Справочный пример 30
5-Циклогексил-7,8-дигидро-7-метил-8-оксо-6-пиридо [3,4-b] пиридинкарбоновая кислота
Используя в качестве исходных материалов-3-циклогексилкарбонил-2-пиридинкарбоновую кислоту, которую получили из 2,3-пиридиндикарбонового ангидрида, и циклогексилмагния хлорид, проводили по существу те же самые реакцию и обработку, что и в примере 1, процесс 2, стадии с 1 по 4, с получением вещества, названного в заголовке, в виде бледно-желтого масла, которое использовали для реакции из примера 76.
Справочный пример 31
7,8-Дигидро-7-метил-5-(4-метилфенил)-8-оксо-6-пиридо [3,4-b] пиридинкарбоновой кислоты гидрохлорид
Стадия 1
К смеси 2,3-пиридиндикарбонового ангидрида (1,50 г) и ТГФ (25 мл) по каплям добавляли при перемешивании при комнатной температуре диметилацеталь метиламиноацетальдегида (2,90 мл). Смесь перемешивали в течение 3 часов при комнатной температуре и затем концентрировали. К концентрату добавляли дихлорметанкалия гидросульфат (2,7 г) и воду. Дихлорметановый слой отделяли, а водный слой экстрагировали дихлорметаном. Органические слои объединяли, промывали водным раствором NaCl, высушивали и выпаривали с получением 2-[N-(2,2-диметоксиэтил)-N-метил] карбамоил-3-пиридинкарбоновой кислоты в виде бесцветных кристаллов (2,10 г).
Т. пл. 128 - 130oC (разложение) (перекристаллизованная из ацетона - этилового эфира).
Стадия 2
К перемешиваемому раствору этого соединения (1,35 г), полученного на стадии 1, карбоната калия (0,42 г) и ацетона (30 мл), добавляли йодметан (10 мл). Смесь перемешивали в течение 14 часов при комнатной температуре и концентрировали. К концентрату добавляли дихлорметан. Смесь промывали водой и высушивали, и растворитель выпаривали с получением 2-[N-(2,2-диметоксиэтил)-N-метил] карбамоил -3-пиридинкарбоновой кислоты метилового эфира в виде бледно-желтого масла (0,90 г).
ЯМР (200 МГц, CDCl3) м.д.: 2,90 (3X2/3, s), 3,23 (3H, x 1/3, s), 3,23 (2Hx1/3, d, J = 5 Гц), 3,29 (3Hx2/3, s), 3,51 (3Hx2/3 + 3Hx1/3x2, s), 3,68 (2Hx2/3, d, J = 5 Гц), 3,92 (3Hx1/3, s), 3,93 (3Hx2/3, s), 4,54 (1Hx1/3, t, J = 5 Гц), 4,77 (1Hx2/3, t, J = 5 Гц), 7,42 (1H, dd, J = 5,8 Гц), 8,31 (1Hx1/3, dd, J = 2,8 Гц), 8,32 (1Hx2/3, dd, J = 2,8 Гц), 8,73 (1Hx1/3, dd, J = 2,5 Гц), 8,76 (1Hx2/3, dd, J = 2,5 Гц)
Стадия 3
К смеси магния (2,0 г), иода (каталитическое количество) ТГФ (20 мл) при перемешивании при комнатной температуре по каплям добавляли раствор 4 - бромтолуола (12 г) в ТГФ (30 мл), и смесь перемешивали в течение 30 минут. Смесь по каплям при перемешивании при -78oC добавляли к раствору соединения (5,8 г), полученного методом, описанным в разделе стадии 2, в ТГФ, с последующим перемешиванием в течение 30 минут при -78oC. К смеси добавляли водный раствор NaCl и смесь экстрагировали этилацетатом. Экстракт промывали водой, высушивали и растворитель выпаривали с получением N -(2,2-диметоксиэтил)-N-метил-3-(4-метилбензоил)-2-пиридинкарбоксамида в виде бледно-коричневого масла, с которым проводили реакцию со стадии 4 без очистки.
ЯМР (200 МГц, CDCl3) м. д. : 2,43 (3H, s), 3,09 (3H x 1/3, s), 3,11 (3Hx2/3, s), 3,37 (6H x 1/3, s), 3,44 (6Hx2/3, s), 3,50 (2Hx2/3, d, J = 5,6 Гц), 3,52 (2Hx1/3, d, J = 5,4 Гц), 4,51 (1Hx2/3, t, J = 5,6 Гц), 4,77 (1Hx1/3, t, J = 5,4 Гц), 7,27 (2H, d, J = 8,0 Гц), 7,40 (1H, dd, J = 7,8, 4,8 Гц), 7,71 (2H, d, J = 8,0 Гц), 8,76 -8,87 (1H, м), 8,65 - 8,75 (1H, м).
Физико-химические константы этого соединения были идентичными константам соединения, полученного путем амидирования 3-(4-метилбензоил)-2-пиридинкарбоновой кислоты (через хлорид кислоты) с помощью диметилацеталя метиламиноацетальдегида.
Стадия 4
Смесь соединения (неочищенного), полученного на стадии 3, ТГФ (30 мл), H2O (30 мл) и конц. HCl (20 мл) перемешивали в течение 1 часа при комнатной температуре. После промывания этилацетатом смесь обрабатывали водным раствором K2CO3 для доведения до pH 9-10 и затем экстрагировали этилацетатом. Экстракт промывали водой, высушивали и растворитель выпаривали с получением N-формилметил-N-метил-3-(4-метилбензоил)-2-пиридинкарбоксамида в виде бледно-коричневого масла (3,2 г).
ЯМР (200 МГц, CDCl3) м.д.: 2,43 (3H, s), 3,16 (3Hx2/5, s), 3,17 (3Hx3/5, s), 4,14 (2H, м), 7,28 (2H, d, J = 8,0 Гц), 7,35 - 7,50 (1H, м), 7,70 (2H, d, J = 8,0 Гц), 7,79 (1Hx2/5, dd, J = 7,8, 1,6 Гц), 7,88 (1Hx3/5, dd, J = 7,8, 1,6 Гц), 8,61 (1Hx2/5, dd, J = 5,0, 1,6 Гц), 8,75 (1Hx3/5, dd, J = 5,0, 1,6 Гц), 9,52 (1Hx3/5, м), 9,88 (1Hx2/5, м)
Стадия 5
Смесь соединения, полученного на стадии 4 (30 г), толуола (60 мл) и 1,8-диазабицикло[5,4,0] ундец-7-ена (0,3 мл) перемешивали в течение 30 минут при нагревании в колбе с обратным холодильником. Смесь охлаждали и выделившиеся кристаллы собирали фильтрованием, промывали этиловым эфиром с получением 7,8-дигидро-7-метил-5-(4-метил-фенил)-8-оксо-6-пиридо[3,4-b] пиридинкарбоксальдегида в виде бледно-желтых кристаллов (1,98 г).
Т.пл. 282-284oC (перекристаллизованный из ТГФ - изопропилового эфира)
ЯМР (200 МГц, CDCl3) м.д.: 2,48 (3H, s), 3,95 (3H, s), 7,24 (2H, d, J = 8,0 Гц), 7,36 (2H, d, J = 8,0 Гц), 7,53 (1H, dd, J = 8,2, 4,4 Гц), 7,68 (1H, dd, J=8,2, 1,6 Гц), 9,01 (1H, dd, J = 4,4, 1,6 Гц), 9,61 (1H, s)
Стадия 6
К смеси соединения, полученного на стадии 5 (1,0 г), 0,25 N NaOH (20 мл) и 2-метил-2-пропанола (20 мл) добавляли перманганат калия (0,6 г) при перемешивании при 0oC и к смеси добавляли EtOH (5 мл) с последующим перемешиванием в течение 10 мин. После отфильтровывания полученного в результате преципитата фильтрат обрабатывали конц. HCl для доведения до pH 2 и затем растворитель выпаривали с получением вышеназванного соединения в виде желтых кристаллов (1,1 г), физико-химические константы которых были идентичными константам соединения, полученного в справочном примере 25.
Пример приготовления лекарственной формы 1
Таблетки с покрытием (1000 таблеток)
Соединение из примера 1 - 10,0 г
Лактоза - 60,0 г
Кукурузный крахмал - 35,0 г
Желатин - 3,0 г
Стеарат магния - 2,0 г
Смесь соединения, полученного в примере 1, лактозы и кукурузного крахмала гранулировали, используя 10% водный раствор желатина, через сито с размером отверстий 1 мм и гранулят высушивали при 40oC и снова просеивали. Полученные таким образом гранулы смешивали со стеаратом магния и эту смесь прессовали. Полученные таким образом ядра таблеток покрывали сахарной оболочкой с помощью водной суспензии из сахарозы, диоксида титана, талька и водного раствора аравийской камеди. Покрытые таким образом таблетки полировали с помощью воска.
Пример приготовления лекарственной формы 2
Таблетки (1000 таблеток)
Соединение из примера 1 - 10,0 г
Лактозы - 70,0 г
Кукурузный крахмал - 50,0 г
Растворимый крахмал - 7,0 г
Соединение, полученное в примере 1, и стеарат магния гранулировали с помощью водного раствора растворимого крахмала и высушивали. Гранулы смешивали с лактозой и кукурузным крахмалом. Смесь прессовали в таблетки.
Эффекты изобретения
Соединения этого изобретения обладают превосходной антагонистической активностью к тахикининовым рецепторам и активностью по подавлению выхода плазмы из сосудов в ткани, вызванного капсаицином, и, таким образом, будут широко использоваться в качестве медикаментов, таких как средства для лечения или уменьшения расстройств мочеиспускания.



Изобретение относится к новым гетероциклическим соединениям формулы I, где кольцо А и кольцо В обозначают необязательно замещенное бензольное или циклоалкановое кольцо или необязательно замещенное 5- или 6-членное ароматическое гетероциклическое кольцо, содержащее от одного до двух гетероатомов, выбираемых из азота, серы и кислорода. Кольцо С обозначает бензольное кольцо, которое может быть замещено от 1 до 3 заместителями, выбранными из галогена, галогенированного С1-С4 алкила, галогенированного С1-С4 алкокси; R обозначает водород или С1-С6 алкил, один из Х или У обозначает -NR1, а другой обозначает -СО-, или один из них обозначает - N =, а другой обозначает = СR2-, где R1 - водород, С1-С6 алкил, R2 - водород, галоген, С1-С6 алкил, карбоксильная или алкоксикарбоксильная группа, n обозначает 1 или 2, или их солям. Соединения формулы I обладают превосходным антагонистическим действием к тахикининовым рецепторам и могут найти применение в медицине. Соединение формулы I получают взаимодействием соответствующей карбоновой кислоты с соединением формулы II. Изобретение относится также к композиции, проявляющей активность антагониста рецептора тахикинина, содержащей в качестве активного компонента соединение формулы I в эффективном количестве. Изобретение относится к способу противодействия тахикининовым рецепторам путем введения эффективного количества соединения формулы I. 4 с. и 10 з.п. ф-лы, 2 табл.
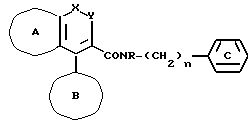
где кольцо A и кольцо B соответственно обозначают необязательно замещенное бензольное или циклоалкановое кольцо или необязательно замещенное 5- или 6-членное ароматическое гетероциклическое кольцо, содержащее от одного до двух гетероатомов, выбираемых из атома азота, серы и кислорода;
кольцо C обозначает бензольное кольцо, которое может быть замещено от 1 до 3 заместителями, выбранными из галогена, произвольно галогенированного C1-C4алкила, произвольно галогенированного C1-C4алкокси;
R обозначает атом водорода или C1-C6алкил;
один из X или Y обозначает -NR1-, а другой обозначает -CO- или один из них обозначает -N-, а другой обозначает =CR2-, где R1 обозначает атом водорода или C1-C6алкил;
R2обозначает атом водорода, атом галогена, C1-C6алкил, карбоксильную или алкоксикарбоксильную группу;
n обозначает 1 или 2,
или его соль.
N-[3,5-бис(трифторметил)бензил]-4-(4-торфенил)-6,7-дигидро-N, 6-диметил-7-оксо-5-тиено[2,3-c]пиридинкарбоксамид,
N-[3,5-бис(трифторметил)бензил] -1,2,5,6,7,8-гексагидро-N,2,7-триметил-4-(4-метилфенил)-1-оксо-3-пиридо[3,4-c] пиридинкарбоксамид,
N-[3,5-бис(трифторметил)бензил] -7,8-дигидро-N, 7-диметил-5-(4-метилфенил)-8-оксо-6-пиридо[3,4-b] пиридинкарбоксамид,
N-[3,5-бис(трифторметил)бензил] -5-(4-фторфенил)-7,8-дигидро-N, 7-диметил-8-оксо-6-пиридо[3,4-b] пиридинкарбоксамид.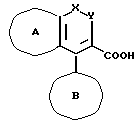
где все символы имеют те же самые значения, которые даны в пункте 1,
или его соли или реакционноспособного производного с соединением формулы
где все символы имеют те же самые значения, которые даны в пункте 1,
или его солью.
Приоритет по пунктам:
10.11.93. по пп.1, 2, 3, 6, 10, 11, 12, 13 и 14;
28.12.93 - по пп.4, 5 и 7, разновидность радикалов;
03.03.94 - по п.8, разновидность радикалов;
21.06.94 - по п.9, разновидность радикалов.
| Способ получения производных 1,6-нафтиридина в виде рацематов или энантиомеров,или их кислотно-аддитивных солей | 1985 |
|
SU1395143A3 |
| Способ получения производных пиридо (1,2-а) пиримидина | 1977 |
|
SU698532A3 |
| СПОСОБ ИЗМЕРЕНИЯ ФИЗИЧЕСКИХ ВЕЛИЧИН | 1971 |
|
SU429366A1 |
| Огнетушитель | 0 |
|
SU91A1 |
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| ТЕРМОРЕГУЛИРУЕМОЕ КРИОСТАТИОЕ УСТРОЙСТВО | 1970 |
|
SU436334A1 |
Авторы
Даты
1999-08-27—Публикация
1994-11-09—Подача