Изобретение относится к производным 4,1-бензоксазепин-2-она или их солям, которые являются полезными для ингибирования скваленсинтетазы и роста грибков, и к их применению.
Гиперхолестеринемия, высокое кровяное давление и курение являются тремя основными известными факторами, вызывающими ишемические заболевания. Адекватный контроль концентрации холестерина в крови является крайне важным для профилактики или лечения помимо ишемической болезни также и коронарного склероза.
В качестве фармацевтических композиций для понижения холестерина в крови было обращено внимание на композиции для контроля биосинтеза холестерина наряду с теми, что ингибируют его абсорбцию путем связывания желчной кислоты, включая, наряду с другими, холестерин, колестипол (описанный, например, в патенте США 4 027 009), и теми, что подавляют кишечное поглощение холестерина путем ингибирования ацикофермента А холестерин ацилтрансферазы (АСАТ), включая мелинамид (описанный во французском патенте N 1 476 569). В качестве фармацевтических препаратов для контроля биосинтеза холестерина предназначены для медицинского использования ловастатин (описан в патенте США 4 231 938), симвастатин (описан в патенте США 4 444 784), правастатин (патент США 4 346 227) и т.д., которые способны ингибировать особенно 3-окси-3-метилглутарилкофермент (HMG-CoA) редуктазу. Однако при ингибировании HMG-CoA редуктазы ингибируется не только биосинтез холестерина, но и биосинтез некоторых других компонентов, таких как убихинон, долихол и гем А, которые являются необходимыми для живого организма, так что имеется опасность возникновения вызванных в результате нежелательных побочных эффектов.
Скваленсинтетаза является ферментом, вовлеченным в фиксированную стадию "де ново" биосинтетического холестеринового пути. Этот фермент катализирует восстановительную димеризацию двух молекул фамезилпирофосфата в форму сквалена.
С другой стороны, соединения, предполагаемые в качестве ингибиторов биосинтеза холестерина при ингибировании скваленсинтетазы, описаны в JPA H1 (1989) - 213 288, JPA H2 (1990) - 101 088, JPA H2 (1990) - 235 820, JPA H2 (1990) - 235 821, JPA H3 (1991) - 20 226, JPA H3 (1991) - 68 591, JPA H3 (1991) - 48 288, патенте США 5 019 390, Journal of Medicinal Chemistry 51(10), стр. 1869 - 1871 (1988), патенте США 5 135 935 и WO 9 215 579.
Также, соединения, предполагаемые как ингибиторы роста грибков при ингибировании скваленсинтетазы, описаны в JPA Н4 (1992) - 279 589, EP 475 706 - A, EP 494 622 - А и EP 503 520 - A.
Среди производных 4,1-бензоксазепина производные 4,1-бензоксазепин-2-она, у которых 2-положение замещено кетогруппой, те, у которых один из атомов водорода в 3-положении замещен другим заместителем, описаны в JPA 557 (1982) - 345 765 и в Chem. Pharm. Bull., 34, 140 (1986).
Известно, что убихинон, долихол и гем А синтезируются из фарнезилпирофосфата по пути биосинтеза холестерина. Следовательно, чтобы избежать побочных эффектов из-за отсутствия этих веществ желательно ингибировать ферменты после фарнезилпирофосфата, особенно скваленсинтетазу, по пути биосинтеза холестерина.
После интенсивных исследований с приведенной выше точки зрения настоящие изобретатели нашли, что производные 4,1-бензоксазепин-2-она обладают отличным ингибирующим скваленсинтетазу действием и противогрибным действием, и разработали настоящее изобретение.
Следовательно, настоящее изобретение обеспечивает:
(1) производные 4,1-бензоксазепин-2-она общей формулы I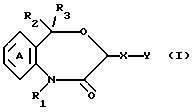
где R1 является атомом водорода или необязательно замещенной углеводородной группой; R2 и R3 независимо являются атомом водорода, необязательно замещенным низшим алкилом, необязательно замещенным фенилом или необязательно замещенным гетероциклом; X является связью или спейсером, имеющим цепь длиной 1 - 7 атомов; Y является необязательно этерифицированной или тиоэтерифицированной карбоксильной группой, необязательно замещенным гидроксилом, необязательно замещенной аминогруппой, необязательно замещенным фенилом, необязательно замещенным карбамоилом или N-содержащим гетероциклическим остатком, имеющим атом водорода, способный быть депротонированным, при условии, что, когда X является метиленом и R1 не является алкилом, имеющим более 4 атомов углерода, Y не является ни карбоксилом, ни алкоксикарбонилом, и кольцо А может быть необязательно замещено, или их соли;
(2) производные 4,1-бензоксазепин-2-она формулы I'
где R1 является атомом водорода или необязательно замещенной углеводородной группой; R2 и R3 независимо являются атомом водорода, необязательно замещенным низшим алкилом, необязательно замещенным фенилом, или необязательно замещенным гетероциклом; X является связью или спейсером с длиной цепи 1 - 7 атомов; Y является необязательно этерифицированным или тиоэтерифицированным карбоксилом, необязательно замещенным гидроксилом, необязательно замещенной аминогруппой, необязательно замещенным фенилом, необязательно замещенным карбамоилом или N-содержащим гетероциклическим остатком, имеющим атом водорода, способный к депротонизации, при условии, что, когда X является метиленом, Y не является ни карбоксилом, ни алкоксикарбонилом; и кольцо A необязательно может быть замещено, или его соли;
(3) ингибитор скваленсинтетазы, состоящий в качествe активного ингредиента из производного 4,1-бензоксазепин-2-она общей формулы I''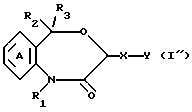
где R1 является атомом водорода или необязательно замещенной углеводородной группой, R2 и R3 независимо являются атомом водорода, необязательно замещенным низшим алкилом, необязательно замещенным фенилом или необязательно замещенным ароматическим гетероциклом; X является связью или спейсером, имеющим длину цепи 1 - 7 атомов; Y является необязательно этерифицированным или тиоэтерифицированным карбоксилом, необязательно замещенным гидроксилом, необязательно замещенной аминогруппой, необязательно замещенным фенилом, необязательно замещенным карбамоилом или N-содержащим гетероциклическим остатком, имеющим атом водорода, способный к депротонизации; и кольцо A может быть необязательно замещено, или их соли;
(4) ингибитор роста грибков, состоящий в качестве активного ингредиента из производного 4,1-бензоксазепин-2-она общей формулы I''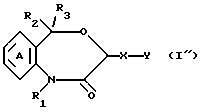
где R1 является атомом водорода или необязательно замещенной углеводородной группой; R2 и R3 независимо являются атомом водорода, необязательно замещенным низшим алкилом, необязательно замещенным фенилом или необязательно замещенным ароматическим гетероциклом; X является связью или спейсером с длиной цепи 1 - 7 атомов; Y является необязательно этерифицированным или тиоэтерифицированным карбоксилом, необязательно замещенным гидроксилом, необязательно замещенной аминогруппой, необязательно замещенным фенилом, необязательно замещенным карбамоилом или N-содержащим гетероциклическим остатком, имеющим атом водорода, способный к депротонизации; и кольцо A может быть необязательно замещено, или его соли.
Далее настоящее изобретение обеспечивает способ получения новых соединений, представленных общими формулами I или I', или их солей.
В приведенных выше формулах I, I' и I'' в качестве углеводородной группы - "необязательно замещенной углеводородной группы", представленной R1, упоминаются углеводородные группы с алифатической цепью, алициклические углеводородные группы и арильные группы, предпочтение имеют углеводородные группы с алифатической цепью.
В качестве углеводородной группы с алифатической цепью указанной углеводородной группы упоминаются углеводородные группы с прямой или разветвленной алифатической цепью, например алкилы, алкенилы и алкинилы, предпочтительными являются низшие алкилы, низшие алкенилы и низшие алкинилы. В качестве низших алкильных групп предпочтительными являются C1-C7-низшие алкилы, примерами которых являются метил, этил, пропил, изопропил, бутил, изобутил, втор.бутил, трет.бутил, пентил, изопентил, неопентил, трет.пентил, 1-этилпропил, гексил, изогексил, 1,1-диметилбутил, 2,2-диметилбутил, 3,3-диметилпропил, 3,3-диметилбутил, 2-этилбутил и 1-этилпропил, предпочтительными являются C2-C5-алкилы, более предпочтительными являются C4-C5-алкилы. В качестве низших алкенильных групп предпочтительными являются C2-C6-низшие алкенилы, примерами которых являются винил, аллил, 2-метилаллил, изопропенил, 1-пропенил, 2-метил-1-пропенил, 2-метил-2-пропенил, 1-бутенил, 2-бутенил, 3-бутенил, 2-этил-1-бутенил, 2-метил-2-бутенил, 3-метил-2-бутенил, 1-пентенил, 2-пентенил, 3-пентенил, 4-пентенил, 4-метил-3-пентенил, 1-гексенил, 2-гексeнил, 3-гексенил, 4-гексенил и 5-гексенил. Среди них особенно предпочтительными являются винил, аллил, изопропенил, 2-метилаллил, 2-метил-1-пропенил, 2-метил-2-пропенил и 3-метил-2-бутенил. В качестве низших алкинильных групп предпочтительными являются C2-C6-низшие алкинильные группы, примерами которых являются этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил, 1-пентинил, 2-пентинил, 3-пентинил, 4-пентинил, 1-гексинил, 2-гексинил, 3-гексинил, 4-гексинил и 5-гексинил. Среди них особенно предпочтительными являются этинил, 1-пропинил и 2-пропинил.
В качестве алициклической углеводородной группы указанной углеводородной группы упоминаются насыщенные и ненасыщенные алициклические углеводородные группы, примерами которых являются циклоалкильные группы, циклоалкенильные группы или циклоалкадиенильные группы. В качестве циклоалкильных групп предпочтительными являются C3-C9-циклоалкильные группы, примерами которых являются циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и циклононил. Среди них особенно предпочтительными являются C3-C9-циклоалкильные группы, такие как циклопропил, циклобутил, циклопентил и циклогексил. Примеры циклоалкенильных групп включают 2-циклопентен-1-ил, 3-циклопентен-1-ил, 2-циклогексен-1-ил, 3-циклогексен-1-ил, 1-циклобутен-1-ил и 1-циклопентен-1-ил. Примерами циклоалкадиенильных групп являются 2,4-циклопентадиен-1-ил, 2,4-циклогексадиен-1-ил и 2,5-циклогексадиен-1-ил.
В качестве арильной группы указанных углеводородных групп упоминаются моноциклические и конденсированные полициклические ароматические углеводородные группы, примерами которых являются фенил, нафтил, антрил, фенантрил и аценафтилен. Среди них особенно предпочтительными являются фенил, 1-нафтил и 2-нафтил.
В качестве заместителя "необязательно замeщенной углеводородной группы", представленной R1, упоминаются необязательно замещенные арильные группы, необязательно замещенные циклоалкильные группы, или циклоалкенильные группы, необязательно замещенные гетероциклические группы, необязательно замещенные аминогруппы, необязательно замещенные гидроксильные группы, необязательно замещенные тиольные группы и атомы галоида (например, фтор, хлор, бром и иод). Количество этих необязательных заместителей находится в интервале от 1 до 5 (предпочтительно 1-3). В качестве арильных групп указанных необязательно замещенных арильных групп, упоминаются фенил, нафтил, антрил, фенантрил и аценафтиленил. Среди них предпочтительными являются фенил, 1-нафтил и 2-нафтил. В качестве заместителя на указанной необязательно замещенной арильной группе могут быть упомянуты C1-C3-алкоксигруппы (например, метокси, этокси и пропокси), атомы галоида (например, фтор, хлор, бром и иод) и C1-C3-алкильные группы (например, метил, этил и пропил). Количество этих необязательных заместителей колеблется от 1 до 2. В качестве циклоалкильной группы указанной необязательно замещенной циклоалкильной группы могут быть упомянуты C3-C7-циклоалкилы, такие как циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Вид и количество заместителей на необязательно замещенной циклоалкильной группе являются такими же, как и упомянутые заместители для вышеупомянутых необязательно замещенных арильных групп. В качестве циклоалкенильной группы необязательно замещенной циклоалкенильной группы могут быть упомянутые C3-C6-циклоалкенильные группы, включая циклопропанил, циклобутенил, циклопентенил и циклогексенил. Вид и количество заместителей на необязательно замещенной циклоалкенильной группе являются такими же, как упоминалось для заместителей вышеупомянутых необязательно замещенных арильных групп. В качестве гетероциклической группы необязательно замещенной гетероциклической группы упоминаются ароматические гетероциклические группы и насыщенные и ненасыщенные неароматические гетероциклические группы (алифатические гетероциклические группы), имеющие по крайней мере один гетероатом, выбранный среди кислорода, серы и азота, предпочтение отдается ароматическим гетероциклическим группам. В качестве указанной ароматической гетероциклической группы упоминаются ароматические моноциклические гетероциклические группы (например, фурил, тиенил, пирролил, оксазолил, изоксазолил, тиазолил, изотиазолил, имидазолил, пиразолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил, фуразанил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,3,4-тиадиазолил, 1,2,3-триазолил, 1,2,4-триазолил, тетразолил, пиридил, пиридазинил, пиримидинил, пиразинил, триазинил и т.п.) и ароматические конденсированные гетероциклические группы (например, бензофуранил, изо-бензофуранил, бензо(b)тиенил, индолил, изоиндолил, 1H-индазолил, бензимидазолил, бензоксазолил, 1,2-бензоизоксазолил, бензотиазолил, 1,2-бензоизотиазолил, 1H-бензотриазолил, хинолил, изохинолил, циннолинил, хиназолинил, хиноксалинил, фталазинил, нафтилидинил, пуринил, птеридинил, карбазолил, α-карболинил, β-карболинил, γ-карболинил, акридинил, феноксазинил, фенотиазинил, феназинил, феноксaтинил, тиантренил, фенантридинил, фенантролинил, индолидинил, пирроло(1,2-b)пиридазинил, пиразоло(1,5-a)пиридил, имидазо-(1,2-a)пиридил, имидазо(1,5-a)пиридил, имидазо(1,2-b)пиридазинил, имидазо(1,2-a)пиримидинил, 1,2,4-триазоло(4,3-a)пиридил, 1,2,4-триазоло(4,3-b)пиридазинил и т.д.), предпочтение отдается фурилу, тиенилу, пиридилу, пиримидинилу, пиразинилу, индолилу и изоиндолилу. В качестве указанных неароматических гетероциклических групп можно упомянуть, например, оксиранил, азетидинил, оксетанил, тиетанил, пирролидинил, тетрагидрофурил, тиоранил, пиперидил, тетрагидропиранил, морфолинил, тиоморфолинил, пиперазинил и т.д. В качестве заместителя указанных необязательно замещенных гетероциклических групп упоминаются C1-C3-алкилы (например, метил, этил, пропил). В качестве заместителя указанной необязательно замещенной аминогруппы, необязательно замещенного гидроксила или необязательно замещенной тиольной группы могут быть упомянуты C1-C3-алкилы (например, метил, этил, пропил). В случае когда углеводородная группа в необязательно замещенной углеводородной группе, представленной R1, является алициклической углеводородной группой или арилом, она может дополнительно иметь C1-C3-алкильную группу (например, метил, этил, пропил).
В вышеупомянутых формулах I, I' и I'' в качестве необязательно замещенных низших алкильных групп, представленных R2 и R3, можно упомянуть C1-C6-низшие алкильные группы (например, метил, этил, н-пропил, изопропил, бутил, изобутил, втор.бутил, трет.бутил, пентил, изопентил, неопентил, гексил и изогексил), предпочтительно C1-C4-алкильные группы, такие как метил, этил, пропил, изопропил, бутил и трет.бутил. В качестве заместителя указанных необязательно замещенных низших алкильных групп можно упомянуть атомы галоида (например, фтор, хлор, бром и иод), C1-C4-низшую алкоксигруппу (например, метокси, этокси, пропокси, изопропокси, бутокси и трет.бутокси) наряду с другими.
Заместителями "необязательно замещенной фенильной группы", представленной R2 и R3, являются независимо представленные атом галоида (например, фтор, хлор, бром и иод), необязательно замещенные C1-C4-низшие алкильные группы (например, метил, этил, пропил, изопропил, бутил и трет.бутил), необязательно замещенные C1-C4-низшие алкоксигруппы (например, метокси, этокси, пропокси, изопропокси, бутокси и трет.бутокси), необязательно замещенные гидроксил, нитрогруппа и цианогруппа, и "необязательно замещенная фенильная группа" может иметь 1 - 3 таких заместителя. В качестве заместителя указанной необязательно замещенной низшей C1-C4-алкильной группы или необязательно замещенной низшей C1-C4-алкоксигруппы можно среди других упомянуть атомы галоида (например, фтор, хлор, бром или иод), и 1 - 3 из них могут быть замещены в произвольных положениях. В качестве заместителя необязательно замещенной гидроксильной группы среди других можно упомянуть низшие C1-C4-алкильные группы (например, метил, этил, пропил, изопропил, бутил и трет.бутил), C3-C6-циклоалкильные группы (например, циклопропил, циклобутил, циклопентил и циклогексил), арильные группы (например, фенил, 1-нафтил и 2-нафтил) и аралкильные группы (например, бензил, фенетил). Далее два соседних заместителя в фенильной группе могут объединяться вместе с образованием кольца. Примерами таких колец являются следующие формулы: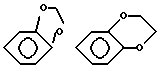
В качестве ароматической гетероциклической группы "необязательно замещенной гетероциклической группы", представленной R2 и R3, можно упомянуть те же самые ароматические гетероциклические группы, что приводились для R1. Среди них предпочтительными являются фурин, тиенил, имидазолил, пиридил, пиримидинил, пиразинил, индолил и изоиндолил. В качестве заместителя указанной ароматической гетероциклической группы можно привести низшие C1-C3-алкильные группы (например, метил, этил и пропил) наряду с другими.
В качестве спейсера, имеющего цепь длиной 1 - 7 атомов, представленного X, может быть приведена двухвалентная цепь, у которой число атомов, составляющих прямую цепь, равно 1 - 7, она может иметь боковую цепь.
Например, указанный спейсер включает спейсер, представленный формулой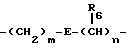
где m и n означают независимо 0, 1, 2 или 3; E является связью или атомом кислорода, атомом серы, сульфоксидом, сульфоном, 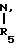 -NHCO-,
-NHCO-,  или -NHCONH-, где R6 и R7 независимо означают атом водорода, необязательно замещенный низший алкил, необязательно замещенный аралкил или необязательно замещенный фенил, R5 является атомом водорода, низшим алкилом, аралкилом или ацилом.
или -NHCONH-, где R6 и R7 независимо означают атом водорода, необязательно замещенный низший алкил, необязательно замещенный аралкил или необязательно замещенный фенил, R5 является атомом водорода, низшим алкилом, аралкилом или ацилом.
В качестве алкильных групп в "необязательно замещенных низших алкилах", представленных R6 и R7, могут быть C1-C6-алкильные группы с прямой или разветвленной цепью (например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет. бутил, н-пентил, изопентил, неопентил и т.п.). В качестве заместителей необязательно замещенных алкильных групп можно упомянуть ароматические гетероциклические группы (например, фурил, тиенил, пиридил, пиримидинил, пиразинил, индолил, имидазолил и изоиндолил), необязательно замещенные аминогруппы, необязательно замещенные гидроксильные группы, необязательно замещенные тиольные группы, необязательно этерифицированные карбоксильные группы и атомы галоида (например, фтора, хлора, брома и иода). В качестве заместителя необязательно замещенной аминогруппы, необязательно замещенной гидроксильной группы или необязательно замещенной тиольной группы могут быть приведены низшие C1-C3-алкильные группы (например, метил, этил и пропил). В качестве необязательно этерифицированной карбоксильной группы можно упомянуть метоксикарбонил, этоксикарбонил, пропоксикарбонил, феноксикарбонил, 1-нафтоксикарбонил, 2-нафтоксикарбонил, предпочтительными являются метоксикарбонил, этоксикарбонил, пропоксикарбонил.
В качестве аралкильной группы "необязательно замещенных аралкильных групп", представленных R6 и R7, можно упомянуть бензил, нафтилметил, фенилэтил, фенилпропил, фенилбутил и т.п. В качестве заместителя указанной "необязательно замещенной аралкильной группы" можно упомянуть атомы галоида (например, фтор, хлор, бром и иод), C1-C3-алкоксигруппы (например, метокси, этокси, пропокси и т.п.), гидроксил, аминогруппу, карбоксил, сульфoгидрил и т.п.
В качестве заместителя необязательно замещенной фенильной группы, представленной R6 и R7, можно упомянуть атомы галоида (например, фтор, хлор, бром и иод), C1-C3-алкоксигруппы (например, метокси, этокси, пропокси и т.п. ) и C1-C3-алкильные группы (например, метил, этил, пропил и т.п.).
R6 может быть различным в зависимости от соответствующей метиленовой цепи.
Примерами "низших алкильных групп" и "аралкильной группы", представленных R5, являются C1-C4 низший алкил (например, метил, этил, пропил, бутил, трет. бутил и т. п.), C7-C15-аралкил (например, бензил, фенетил, фенилпропил, фенилбутил, нафтилметил и т.п.).
В качестве ацильной группы, представленной R5, можно упомянуть низшие алканоильные группы (формил, ацетил, пропионил, бутирил, изобутирил, валерил, изовалерил, пивалоил и гексаноил), низшие алкеноильные группы (акрилоил, метакрилоил, кротоноил и изокротоноил), циклоалканкарбонил (циклопропанкарбонил, циклобутанкарбонил, циклопентанкарбонил и циклогексанкарбонил), низшие алкансульфонильные группы (мезил, этансульфонил и пропансульфонил), ароильные группы (бензоил, п-толуоил, 1-нафтоил, 2-нафтоил), арил низший алканоильные группы (фенилацетил, фенилпропионил, гидроатропоил и фенилбутирил), арил низший алкеноильные группы (циннамоил и атропоил) и аренсульфонильные группы (бензолсульфонил и п-толуолсульфонил) наряду с другими.
Примеры необязательно этерифицированных карбоксильных групп, представленных Y, включают низшие алкоксикарбонильные группы (метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, трет. бутоксикарбонил, втор. бутоксикарбонил, пентилоксикарбонил, изопентилоксикарбонил, неопентилоксикарбонил и трет.пентилоксикарбонил) и арилоксикарбонильные группы (феноксикарбонил, 1-нафтоксикарбонил и бензилоксикарбонил).
Указанные низшиe алкоксикарбонильные группы могут иметь 1 и более заместителей в любых возможных положениях. Примеры таких заместителей включают необязательно замещенный гидроксил, необязательно этерифицированные карбоксильные группы, необязательно замещенные карбамоильные группы, необязательно замещенные фенильные группы, необязательно замещенные C3-C6-циклоалкильные группы (например, циклопропил, циклобутил, циклопентил и циклогексил), низшиe C1-C3-алкенильные группы (например, винил, аллил и т. п.) и 5-членный гетероциклический остаток, содержащий 1 - 3 атома кислорода. В качестве заместителя указанной необязательно замещенной гидроксильной группы можно упомянуть низшие алканоильные группы (например, пивалоил и т.п. ), и необязательно этерифицированные карбоксильные группы (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил и циклогексилоксикарбонил). В качестве заместителя в указанной необязательно этерифицированной карбоксильной группе можно упомянуть низшие C1-C4-алкоксикарбонильные группы (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, трет.бутоксикарбонил и втор. бутоксикарбонил). В качестве заместителя в указанной необязательно замещенной карбамоильной группе можно упомянуть низшие C1-C3-алкильные группы (например, метил, этил и пропил), C3-C6-циклоалкильные группы (например, циклопропил, циклобутил, циклопентил и циклогексил), фенил, бензил и необязательно этерифицированные карбоксильные группы (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил). В качестве заместителя в указанных необязательно замещенной фенильной группе или необязательно замещенной C3-C6-циклоалкильной группе можно привести низшие C1-C3-алкильные группы (например, метил, этил, пропил) и низшие C1-C3-алкоксигруппы (например, метокси, этокси и пропокси). Указанный 5-членный гетероциклический остаток может иметь 1 или более заместителей в любом возможном положении. Примеры таких заместителей включают низшие C1-C3-алкильные группы (например, метил, этил и пропил) и оксо. Далее указанная гетероциклическая группа может быть объединена с бензольным кольцом с образованием сконденсированного цикла.
Указанная арилоксикарбонильная группа может иметь один или более заместителей в любом возможном положении. Примеры таких заместителей включают низшие C1-C3-алкильные группы (например, метил, этил и пропил), низшие C1-C3-алкоксигруппы (например, метокси, этокси, пропокси) и необязательно этерифицированные карбоксильные группы (например, метоксикарбонил, этоксикарбонил и пропоксикарбонил).
Также необязательно этерифицированная карбоксильная группа, представленная Y, может быть тиоэтерифицированной.
Примеры заместителей в необязательно замещенной гидроксильной группе, представленной Y, включают C1-C4-низший алкил (например, метил, этил, пропил, изопропил, бутил и трет.бутил), C3-C6-циклоалкильные группы (циклопропил, циклобутил, циклопентил и циклогексил), арильные группы (например, фенил, 1-нафтил и 2-нафтил) и аралкильные группы (например, бензил и фенетил).
Примеры заместителей в необязательно замещенной аминогруппе, представленной Y, включают низшие C1-C4-алкильные группы (например, метил, этил, пропил, изопропил, бутил и трет. бутил), C3-C6-циклоалкильные группы (циклопропил, циклобутил, циклопентил и циклогексил), арильные группы (например, фенил, 1-нафтил и 2-нафтил), и аралкильные группы (например, бензил и фенетил). Также два заместителя у атома азота могут быть объединены с образованием циклической аминогруппы. Примеры таких циклических аминогрупп включают 1-азетидинил, 1-пирролидинил, пиперидино, морфолино, 1-пиперазинил и 1-пиперазинил, имеющий низшую C1-C3-алкильную группу (например, метил, этил, пропил и т.п.), аралкильную группу (например, бензил, фенетил и т.п.), арильную группу (например, фенил и т.п.) или подобную в 4-положении.
Примеры заместителей в необязательно замещенной фенильной группе, представленной Y, включают необязательно замещенный низший C1-C4-алкил (например, метил, этил, пропил, изопропил, бутил и трет.бутил), низшую C1-C4-алкоксигруппу (например, метокси, этокси, пропокси, изопропокси, бутокси, трет. бутокси), необязательно этерифицированную карбоксильную группу (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, трет.бутоксикарбонил и втор.бутоксикарбонил), необязательно замещенный фенил, необязательно замещенные аминогруппы и N-содержащий гетероциклический остаток, имеющий атом водорода, способный к депротонизации.
В качестве заместителя в необязательно замещенной низшей C1-C4-алкильной группе или необязательно замещенной фенильной группе могут быть упомянуты необязательно этерифицированные карбоксильные группы (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, трет.бутоксикарбонил и втор.бутоксикарбонил). В качестве заместителя в указанной необязательно замещенной аминогруппе можно упомянуть низшие C1-C3-алкильные группы (например, метил, пропил и этил). Указанный N-содержащий гетероциклический остаток включает тетразол-5-ил, 2,5-дигидро-5-оксо-1,2,4-оксадиазол-3-ил, 2,5-дигидро-5-оксо-1,2,4-тиадиазол-3-ил.
Примеры заместителей в необязательно замещенной карбамоильной группе, представленной Y, включают низшие C1-C4-алкильные группы (например, метил, этил, пропил, изопропил, бутил и трет.бутил), C3-C6-циклоалкильные группы (циклопропил, циклобутил, циклопентил и циклогексил), арильные группы (например, фенил, 1-нафтил и 2-нафтил) и аралкильные группы (например, бензил и фенетил). Также два заместителя у атома азота могут быть объединены с образованием циклической аминогруппы. Примеры таких циклических аминогрупп включают 1-азетидинил, 1-пирролидинил, пиперидино, морфолино, 1-пиперазинил и 1-пиперазинил, имеющий низшую C1-C3-алкильную группу (например, метил, этил, пропил и т.п.), аралкильную группу (например, бензил, фенетил и т.п.), арильную группу (например, фенил и т.п.), необязательно замещенную галоидом (например, фтором, хлором, бромом или иодом), или т.п. в 4-положении. Далее указанный пиперидинo может быть объединен с бензольным кольцом с образованием конденсированного цикла.
Примеры N-содержащего гетероциклического остатка, имеющего атом водорода, способный к протонизации, представленного Y, включают тетразол-5-ил, 2,5-дигидро-5-оксо-1,2,4-оксадиазол-3-ил, 2,5-дигидро-5-оксо-1,2,4-тиадиазол-3-ил.
В качестве заместителя кольца A можно привести атомы галоида (например, фтор, хлор, бром, иод), C1-C4 необязательно замещенные алкильные группы (например, метил, этил, пропил, бутил и трет.бутил), C1-C4 необязательно замещенные алкоксигруппы (например, метокси, этокси, пропокси, изопропокси, бутокси и трет.бутокси), нитрогруппы и цианогруппы. Кольцо A может иметь 1 - 3, предпочтительно один или два таких заместителя. И эти заместители могут образовать цикл с каждым из соседних заместителей. В качестве заместителя в необязательно замещенной низшей алкильной группе или необязательно замещенной низшей алкоксигруппе может быть упомянут атом галоида (например, фтор, хлор, бром, иод), и 1 - 3 таких атома галоида могут быть замещены в произвольных положениях.
И когда X имеет формулу
где символы имеют указанные ранее значения, E предпочтительно является связью или -CONH-. Когда E является -CONH-, предпочтительно m = 1, n = 1 или m = 2, n = 1, особенно m = 1, n = 1. В этом случае R6 предпочтительно является водородом, бензилом и 3-индолилметилом, особенно атомом водорода и 3-индолилметилом. Когда E является -CONH-, Y предпочтительно является карбоксилом и этерифицированным карбоксилом, особенно карбоксилом.
Далее предпочтительные заместители кольца A включают отсутствие заместителя, низшую алкоксигруппу или атом галоида, особенно предпочтительными являются метокси или атом хлора.
В качестве солей соединений I, I' или I'' можно упомянуть фармацевтически приемлемые соли, включающие неорганические соли, такие как гидрохлорид, гидробромид, сульфат, нитрат, фосфат и т.п., соли органических кислот, такие как ацетат, тартрат, цитрат, фумарат, малеат, толуолсульфонат, метансульфонат и т.п., соли металлов, такие как натриевая соль, калиевая соль, кальциевая соль, алюминиевая соль и т.п., и основные соли, такие как триэтиламинная соль, гуанидиновая соль, аммонийная соль, гидразиновая соль, хининовая соль, цинхониновая соль и т.п.
Далее настоящее изобретение обеспечивает способ получения соединения, представленного формулой I или формулой I'
где каждый из символов имеет значения, определенные выше, или их фармацевтически приемлемых солей, заключающийся в реакции циклизации соединения, представленного формулой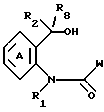
где W означает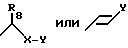
где R1 - галоген (например, фтор, хлор, бром и иод) или группа -OSO3CH3, а другие символы имеют значения, указанные выше.
Способы получения соединений настоящего изобретения описаны ниже.
Среди соединений формул I и I' соединения формулы Ia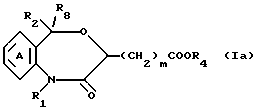
где R4 является C1-C8-алкилом или аралкилом, а другие символы имеют указанные ранее значения, могут быть получены способами A, B, C (см. в конце описания).
2-Аминобензофеноны в качестве исходного материала могут быть синтезированы по или в соответствии со способом, описанным D.A. Walsh, Synthesis, 677 (1980) или по способу, указанному в приведенной ссылке.
Реакции между соединениями формулы II и формулы IV и формулы VIII с соединением формулы IX в способе A или реакции соединения формулы X с соединением формулы XI и соединения формулы XIV с соединением формулы XII в способе B могут быть проведены при использовании известной вообще реакции ацилирования. Например, реакция ацилирования настоящего изобретения может быть проведена в растворителе, примером которого является растворитель типа простого эфира, такого как диэтиловый эфир, тетрагидрофуран, диоксан и т.п., растворителе галоидированного типа, таком как дихлорметан, дихлорэтан, хлороформ, четыреххлористый углерод и т.п., растворителе углеводородного типа, таком как бензол, толуол, гексан, гептан и т.п., диметилформамиде, диметилсульфоксиде и т.п., и в зависимости от необходимости в присутствии воды и основания (например, органического основания, такого как 4-диметиламинопиридин, триэтиламин, триэтилендиамин, тетраметилэтилендиамин и т.п., неорганического основания, такого как бикарбонат натрия, бикарбонат калия, карбонат натрия, карбонат калия, гидроксид натрия, гидроксид калия и т.п., гидрид натрия, гидрид калия) среди других. Относительно одного моля соединения, представленного формулами II, VIII, X и XIV, хлорангидрид кислоты и метансульфонилхлорид формулы III и сложный эфир 4-хлорформилмасляной кислоты обычно применяют в количестве от 1 до 10 моль, предпочтительно 1 - 3 моль. Время реакции обычно находится в интервале от примерно 1 до 48 ч, предпочтительно от примерно 5 до 10 ч. Температура реакции находится в интервале от -50 до 100oC, предпочтительно от примерно 0 до 50oC.
И реакцию соединения формулы IV с соединением формулы VI в способе А, и реакции соединения формулы II с соединением формулы X и соединения формулы XIII с соединением формулы XIV в способе В можно проводить в растворителе типа простого эфира, такого как диэтиловый эфир, тетрагидрофуран, диоксан и т.п., растворителе типа углеводорода, таком как бензол, толуол, гексан, гептан и т.п., растворителе типа спирта, таком как метанол, этанол, пропанол, бутанол и т.п., ацетоне или диметилформамиде, и в зависимости от необходимости в присутствии основания (например, бикарбоната натрия, бикарбоната калия, карбоната натрия, карбоната калия, гидрида натрия, гидрида калия или т. п. ). В отношении одного моля соединения, представленного формулой II, формулой IV или формулой XIII, соединение формулы V обычно используют в количестве от 1 до 10 моль, предпочтительно примерно 1 - 2 моль. Температура реакции находится в интервале от 0 до 100oC, предпочтительно от примерно 20 до 50oC. Время реакции находится в интервале от 1 до 24 ч, предпочтительно оно составляет примерно 3 - 10 ч.
И реакция восстановления карбонильной группы в соединении формулы IX в соединение формулы Iа' в cпособе А, в соединении формулы II в соединение формулы XIII и в соединении формулы XI в соединение формулы XII в cпособе В может быть проведена в протонном растворителе (например, метаноле, этаноле, пропаноле, бутаноле и т.п.) или в апротонном растворителе (например, этиловом эфире, тетрагидрофуране, диоксане и т.п.) в присутствии комплексного гидрида металла (например, литийалюминийгидрида, натрийалюминийгидрида, натрийтриэтоксиалюминийгидрида, боргидрида натрия и т.п.). По отношению к 1 моль каждого из соединений, представленных формулой IX, формулой II и формулой XI, такой комплекс гидрида металла, как приведено выше, применяют в количестве, обычно находящемся в интервале от 0.3 до 5 мольных эквивалентов, предпочтительно от 0.5 до 2 мольных эквивалентов. Температура реакции находится в интервале от -20 до 100oC, предпочтительно от 20 до 50oC.
Реакцию циклизации соединения формулы XII в соединение формулы Ia' в способе B можно проводить в растворителе, например, типа простого эфира, такого как диэтиловый эфир, тетрагидрофуран, диоксан и т.п., растворителе типа углеводорода, такого как бензол, толуол, гексан, гептан и т.п., растворителе типа спирта, таком как метанол, этанол, пропанол, бутанол и т.п., ацетоне, диметилформамиде или т.п., в присутствии в зависимости от необходимости основания (например, бикарбоната натрия, бикарбоната калия, карбоната натрия, карбоната калия, гидрида натрия, гидрида калия и т.п.). По отношению на 1 моль соединения, представленного формулой XII, основание, как указано выше, применяют обычно в количестве от 1 до 5 моль, предпочтительно от примерно 1 до 2 моль. Температура реакции обычно находится в интервале от -20 до 200oC, предпочтительно от 20 до 100oC. Время реакции обычно составляет от 1 до 20 ч, предпочтительно 2 - 5 ч.
Реакция соединения формулы VI в соединение VIII в способе A может быть проведена в спирте, представленном формулой VII, и в зависимости от необходимости в присутствии неорганической кислоты, такой как азотная кислота, соляная кислота, бромистоводородная кислота или серная кислота, или органической кислоты, такой как толуолсульфокислота или метансульфоновая кислота, при температуре от -20 до 100oC, предпочтительно от 20 до 50oC. Время реакции составляет от 10 до 100 ч, предпочтительно 10-48 ч.
Соединение формулы Ia'' может быть получено в соответствии с традиционным способом.
Среди соединений, представленных формулами I и I', соединение формулы Ib
где символы имеют указанные ранее значения, может быть получено при гидролизе соединения формулы Ia, например при обработке соединения формулы Ia кислотой или основанием. Более конкретно, соединение формулы Ia обрабатывают водным раствором минеральной кислоты (например, азотной кислоты, соляной кислоты, бромистоводородной кислоты, ионной кислоты, серной кислоты или т. п. ) или гидроксида щелочного металла (гидроксида натрия, гидроксида калия, гидроксида бария, гидроксида лития) при температуре, лежащей в интервале от 0 до 150oC, предпочтительно от 20 до 50oC. Сила кислоты или основания обычно находится в интервале от 1 до 10 Н, предпочтительно 4 - 10 Н. Время реакции варьирует в зависимости от температуры реакции, но обычно оно находится в интервале от 1 до 24 ч, предпочтительно 2 - 10 ч.
Соединение общей формулы Ib'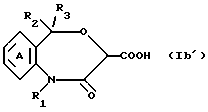
где символы имеют значения, указанные ранее, может быть получено при окислении соединения формулы Ic'
где символы имеют значения, указанные ранее. Используемый растворитель может быть любым, который не вредит реакции, примерами которого являются ацетон, диоксан, тетрагидрофуран, дихлорметан, дихлорэтан или хлороформ. В качестве окисляющего агента может быть использован перманганат, хромовая кислота или пероксид никеля. В этом случае окисляющий агент используют в количестве в интервале от 0.5 до 20 мольных эквивалентов, предпочтительно от 1 до 3 мольных эквивалентов на моль соединения формулы Ic', температура реакции находится в интервале от 0 до 100oC, предпочтительно от 15 до 50oC при времени реакции от 0.5 до 5 ч, предпочтительно от 1 до 2 ч.
Среди соединений, используемых в качестве промежуточных продуктов для синтеза соединений формулы I или I', соединение формулы XIX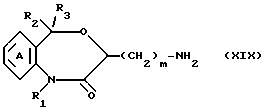
где символы имеют указанные ранее значения, может быть получено при взаимодействии соединения формулы Ib с дифенилфосфорилазидом в среде растворителя в присутствии основания с последующей обработкой полученного в результате продукта кислотой в растворителе. Растворитель, используемый в реакции между соединением формулы Ib и дифенилфосфорилазидом, может быть любым, поскольку он не мешает проведению реакции, например диметилформамидом, растворителем галоидированного типа, таким как дихлорметан, хлороформ или дихлорэтан, и растворителем типа простого эфира, таким как эфир, тетрагидрофуран или диоксан. Типичные примеры используемых оснований включают триэтиламин, 4-диметиламинопиридин, триэтилендиамин, тетраметилэтилендиамин. На 1 моль соединения формулы Ib используют 1 - 10 мольных эквивалентов, предпочтительно 1.5 - 3 мольных эквивалента дифенилфосфорилазида. Температура реакции находится в интервале от -20 до 50oC, предпочтительно от 0 до 20oC, а время реакции составляет от 0.5 до 5 ч, предпочтительно 1 - 2 ч. В случае переработки продукта, полученного по приведенной выше реакции, используемым растворителем может быть вода, диоксан, диметилформамид и т.д., а в качестве используемой кислоты может быть такая минеральная кислота, как серная кислота, соляная кислота, азотная кислота или бромистоводородная кислота. Температура реакции находится в интервале от 20 до 200oC, предпочтительно от примерно 50 до 100oC, а время реакции составляет от 0.5 до 5 ч, предпочтительно 1 - 2 ч.
Среди соединений формул I и I' соединение формулы Ic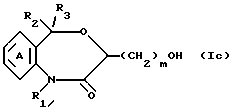
где символы имеют указанные ранее значения, может быть получено при восстановлении соединения формулы Ia. Более конкретно, соединение формулы Ic может быть получено при обработке соединения формулы Ia комплексным гидридом металла (например, литийалюминийгидридом, натрийалюминийгидридом, боргидридом натрия) в протонном растворителе (например, метаноле, этаноле, пропаноле, бутаноле и т.п.) или в апротонном растворителе (например, этиловом эфире, тетрагидрофуране, диоксане и т.п.). На 1 моль соединения формулы Ia такое комплексное металлгидридное соединение используют в количестве обычно от 0.3 до 5 мольных эквивалентов, предпочтительно от 0.5 до 2 мольных эквивалентов. Температура реакции находится в интервале от -20 до 100oC, предпочтительно от 0 до 20oC. Время реакции составляет от 0.5 до 10 ч, предпочтительно 1 - 3 ч. И соединения формулы Ic могут быть получены также при превращении аминной части соединений формулы XIX в гидроксильную группу. Например, соединение формулы Ic может быть получено при добавлении нитрита натрия к соединению формулы XIX в растворителе в присутствии кислоты с последующей обработкой полученного в результате азида в растворителе в присутствии основания. В способе азидирования, например, используют 0.5 - 3, предпочтительно 1 - 1.5 мольных эквивалента нитрита натрия на 1 моль соединения XIX. В качестве кислоты может быть использована любая, если она не вредит реакции, обычно применяют уксусную кислоту или серную кислоту. Температура реакции находится в интервале от -20 до 20oC, предпочтительно 0 - 5oC, а время реакции составляет от 5 до 60 мин, предпочтительно 10 - 30 мин. Способ превращения азида полученного таким образом азидного соединения в гидроксильную группу заключается, например, в использовании в качестве основания, например бикарбоната натрия, бикарбоната калия, гидроксида натрия, карбоната натрия, карбоната калия, гидроксида калия или т.п. в воде или в водном органическом растворителе (например, растворителе типа спирта, таком как метанол, этанол, пропанол, бутанол или т.п., растворителе эфирного типа, таком как тетрагидрофуран, диоксан или т.п.) диметилформамиде и т.п. Температура реакции находится в интервале от 20 до 200oC, предпочтительно 50 - 100oC, время реакции составляет от 5 мин до 2 ч, предпочтительно от 15 до 30 мин.
Соединение общей формулы XX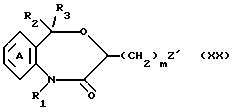
где символы имеют указанные ранее значения, а Z' является галоидом (хлором, бромом и иодом), которое является промежуточным продуктом для синтеза соединения формулы I, может быть получено подобно способу, использованному в случае получения соединения Ic из соединения XIX, путем диазотирования соединения формулы XIX нитритом натрия в соляной кислоте, бромистоводородной кислоте или иодистоводородной кислоте с последующим нагреванием диазотированного соединения. Температура реакции находится в интервале от 20 до 200oC, предпочтительно 50 - 100oC, а время реакции составляет от 5 мин до 2 ч, предпочтительно примерно 15 - 30 мин.
Среди соединений формулы I и I' соединение формулы Id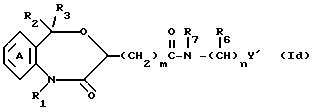
где Y' является, помимо определений, приведенных выше для Y, этерифицированной карбоксильной группой, а другие символы имеют указанные ранее значения, может быть получено при конденсации соединения формулы Ib с соединением формулы XXI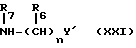
где символы имеют указанные ранее значения, более конкретно, соединение Ib и соединение XXI конденсируют в растворителе с использованием конденсирующего агента, а при необходимости, и в присутствии основания. Применяют растворители типа углеводородных растворителей, таких как бензол, толуол, гексан, гептан и т.п., типа галоидированных растворителей, таких как дихлорметан, дихлорэтан, хлороформ, четыреххлористый углерод и т.п., типа простых эфиров, таких как этиловый эфир, тетрагидрофуран, диоксан и т.п., ацетонитрил, диметилформамид и т. п. В качестве основания среди прочих используют триэтиламин, 4-диметиламинопиридин, триэтилендиамин и тетраметилэтилендиамин. В качестве конденсирующего агента можно привести те, что используют для пептидного синтеза, и среди них циклогексилкарбодиимид, диэтилцианофосфат и 1-этил-3-(3-диметиламинопропил)карбодиимид. На 1 моль соединения формулы Ib используют соединение формулы XXI в количестве от 0.5 до 2 мольных эквивалентов, предпочтительно от 1 до 1,2 мольного эквивалента, и конденсирующий агент используют в количестве от 0.5 до 5 мольных эквивалентов, предпочтительно 1-2 мольных эксивалентов. Температура реакции находится в интервале от 0 до 100oC, предпочтительно от 20 до 50oC, а время реакции составляет от 0,5 до 24 ч, предпочтительно от 1 до 5 ч.
Среди соединений формулы I и I' соединение формулы Ie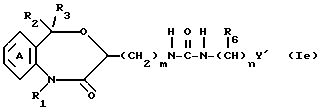
где символы имеют указанные ранее значения, может быть получено при взаимодействии соединения Ib с дифенилфосфорилазидом в растворителе в присутствии основания с последующим взаимодействием полученного в результате соединения с соединением XXI. В качестве растворителя, применяемого для реакции между соединением Ib и дифенилфосфорилазидом, может быть использован любой растворитель, который не оказывает вредного влияния на реакции, примерами их могут быть диметилформамид или растворитель галоидированного типа, такой как дихлорметан, хлороформ, дихлорэтан и т.п., и растворитель типа простого эфира, такой как простой эфир, тетрагидрофуран, диоксан и т.п. Примерами используемого основания являются триэтиламин, 4-диметиламинопиридин, триэтилендиамин или тетраметилэтилендиамин. На 1 моль соединения формулы Ib применяют 1-10, предпочтительно 1.5-3 мольных эквивалента дифенилфосфорилазида. Температура реакции находится в интервале от -20 до 50oC, предпочтительно от 0 до 20oC, а время реакции составляет 0.5-5 ч, предпочтительно 1-2 ч.
Примерами растворителей, применяемых для реакции между соединением, полученным таким образом выше, и соединением формулы XXI, являются растворитель галоидированного типа, такой как дихлорметан, дихлорэтан, хлороформ и т. п. , растворитель типа простого эфира, такой как эфир, тетрагидрофуран, диоксан и т.п., ацетонитрил, диметилформамид, среди других. В зависимости от необходимости применяют основание. В качестве основания можно привести органическое основание, включая триэтиламин, 4-диметиламинопиридин, триэтилендиамин и тетраметилэтилендиамин. На 1 моль соединения I используют 0.5-3, предпочтительно 1-1.5 мольных эквивалента соединения XXI. Температура реакции находится в интервале от 0 до 150oC, предпочтительно от 30 до 100oC, а время реакции находится в интервале от 0.5 до 24 ч, предпочтительно 1-3 ч.
Среди соединений формул I и I' соединение формулы If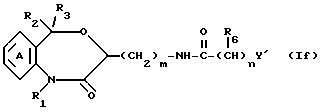
где символы имеют указанные ранее значения, может быть получено при конденсации соединения XIX с соединением формулы XXII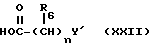
где символы имеют значения, указанные ранее. Эта реакция может быть проведена точно так же, как и при получении соединения Id.
Среди соединений формул I и I' соединение формулы Ig
где E' является, среди других определений, приведенных выше, атомом кислорода или -NH-, а другие символы имеют значения, указанные ранее, может быть получено при взаимодействии соединения формулы Iс или соединения формулы XIX с соединением формулы XXIII
где символы имеют указанные ранее значения. Более конкретно, соединение Iс или соединение XIX вводят в реакцию с соединением XIII в спиртовом растворителе, таком как метанол, этанол, пропанол, бутанол и т.п., растворителем типа простого эфира, таком как диэтиловый эфир, тетрагидрофуран, диоксан и т.п., или диметилформамиде, наряду с другими, в присутствии основания, включая неорганическое основание, такое как бикарбонат натрия, бикарбонат калия, карбонат натрия, карбонат калия и т.п., органическое основание, такое как триэтиламин, 4-диметиламинопиридин, триэтилендиамин, тетраметилэтилендиамин и т.п., или гидрид натрия. На 1 моль соединения Iс или XIX используют 0.5-1.5 мольных эквивалента соединения XXIII, а на 1 моль соединения Iс или XIX используют 1-5, предпочтительно 1-2 мольных эквивалента основания; температура реакции находится в интервале от 0 до 200oC, предпочтительно от 20 до 100oC, а время реакции составляет от 0.5 до 24 ч, предпочтительно 1-3 ч.
Среди соединений формул I и I' соединение формулы Ih
где символы имеют указанные ранее значения, может быть получено при взаимодействии соединения формулы XX с соединением формулы XXV
где символы имеют указанные ранее значения. Применяют апротонный растворитель, примерами которого являются этиловый эфир, тетрагидрофуран, диоксан, ацетонитрил, диметилформамид или подобные. При необходимости может быть использовано неорганическое основание, такое как бикарбонат натрия, бикарбонат калия, карбонат натрия или карбонат калия, органическое основание, такое как триэтиламин, 4-диметиламинопиридин, триэтилендиамин и тетраметилэтилендиамин, гидрид натрия, фторид цезия или т.п. На 1 моль соединения XX применяют 0.5-5, предпочтительно 1-2 мольных эквивалентов соединения XXV. Температура реакции находится в интервале от 0 до 200oC, предпочтительно 20-100oC, а время реакции составляет от 10 мин до 5 ч, предпочтительно от 30 мин до 2 ч.
Среди соединений, представленных формулами I и I', соединение формулы Ii
где символы имеют указанные ранее значения, может быть получено при гидролизе соединения формулы Ij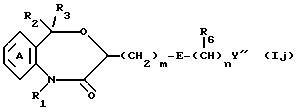
где Y'' является, среди других указанных ранее значений для Y, этерифицированной карбоксильной группой, а другие символы имеют указанные ранее значения. Более конкретно, гидролиз проводят в таком растворителе, как вода, метанол, этанол, пропанол или бутанол, в присутствии гидроксида щелочного металла (например, гидроксида натрия, гидроксида калия, гидроксида бария или гидроксида лития), бикарбоната натрия, бикарбоната калия, карбоната натрия или карбоната калия, или в присутствии минеральной кислоты (например, азотной кислоты, соляной кислоты, бромистоводородной кислоты, йодной кислоты или серной кислоты) или трифторуксусной кислоты, при температуре от 10 до 150oC, предпочтительно от 10 до 50oC. Хотя время реакции варьирует в зависимости от температуры реакции, оно обычно составляет от 1 до 24 ч, предпочтительно примерно 2-10 ч.
Хотя соединение, представленное формулой I'', настоящего изобретения обладает способностью ингибировать скваленсинтетазу и противогрибковым действием, среди соединений, использованных в настоящем изобретении, имеются соединения, способные ингибировать другие ферменты по пути биосинтеза холестерина. По существу можно сказать, что соединение формулы I'' настоящего изобретения ингибирует биосинтез холестерина, оно является полезным для профилактики или лечения гиперхолестеринемии или коронарного склероза у млекопитающих (например, мышей, крыс, кроликов, собак, кошек, коров, свиней и людей) и, кроме того, для профилактики или лечения грибковых инфекций.
Указанное соединение I'' может быть введено человеку орально или неорально. Вводимые орально композиции могут быть в твердой или в жидкой форме, более конкретно, в виде таблеток (включая покрытые сахаром таблетки и таблетки, покрытые пленкой), сиропов, эмульсий, суспензий или т.п. Эти композиции могут быть приготовлены известными вообще способами и содержат носители или экципиенты, обычно используемые для фармацевтических препаратов, например такие носители или экципиенты, как лактоза, крахмал, сахароза или стеарат магния, при производстве таблеток.
Примерами композиции для неорального введения являются препараты для инъекций и свечи, а инъекции включают гиподермические инъекции, интрадермальные инъекции, внутримышечные инъекции. Эти препараты для инъекций могут быть приготовлены известными вообще способами, более конкретно, путем суспендирования или эмульгирования соединения настоящего изобретения в стерильной воде или масле, обычно используемом для приготовления композиций для инъекций. Водные жидкости, используемые для приготовления препаратов для инъекций, включают физиологический солевой раствор и изотонический раствор и при необходимости подходящий суспендирущий агент, такой как натрийкарбоксиметилцеллюлозу, неионное поверхностно-активное вещество или т.п. также могут быть использованы. В качестве масла можно привести кунжутное масло, соевое масло и т.п., и бензилбензоат, бензиловый спирт и т.п. можно использовать в качестве солюбилизатора. Приготовленные таким образом препараты для инъекций обычно заливают в соответствующие ампулы.
Соединение формулы I'' или его соль может быть безопасно использовано при низкой токсичности. Хотя ежедневная доза варьирует в зависимости от состояния и массы пациента, вида соединения, пути введения и других факторов, например в случае введения соединения настоящего изобретения для лечения гиперхолестеринемии ежедневная оральная доза для взрослого человека составляет примерно 1 - 500 мг, предпочтительно примерно 10 - 200 мг. В этом интервале совсем не наблюдалось токсичности.
Соединения формулы I'' в качестве ингибиторов скваленсинтетазы эффективно применяются по отношению к млекопитающим, например человеку, в терапевтически эффективном количестве, что обычно обеспечивается оральной ежедневной дозой для взрослого человека от примерно 1 до примерно 500 мг, предпочтительно примерно 10 - 200 мг. В случае неорального применения (например, в виде инъекции или свечей) терапевтически эффективное количество ежедневной дозы составляет от примерно 0.1 до примерно 100 мг, предпочтительно примерно 1 - 20 мг.
Соединения настоящего изобретения также показывают широкий спектр противогрибковой активности, как определено по методам разбавления в бульоне или на агаре.
В случае введения соединения настоящего изобретения для лечения грибковых инфекций обычно применяют 2-5 мг/кг в виде единичной дозы при противогрибковом лечении.
Соединения формулы I'' при противогрибковом лечении эффективно применяются к млекопитающему, например человеку, в терапевтически эффективном количестве, которое обычно обеспечивается оральной дневной дозой для взрослого человека от примерно 0.1 до примерно 100 мг, предпочтительно примерно 1 - 50 мг. При неоральном применении, таком как инъекции или свеча, терапевтически эффективная дневная доза составляет примерно 0,1 - 100 мг, предпочтительно примерно 1 - 50 мг.
Сокращения для аминокислот и другие, использованные в настоящем описании, основаны на сокращениях, определенных Комиссией по номенклатуре ЮПАК-ЮБ, или сокращениях, обычно используемых в родственных областях. Некоторые примеры приведены ниже. Когда в аминокислоте может присутствовать оптический изомер, он имеет L-конфигурацию, если нет других указаний.
Trp или Y - Триптофан
Ser или S - Серин
Asp или D - Аспаргиновая кислота
Clu или E - Глютаминовая кислота
Me - Метил
Et - Этил
Ph - Фенил
Следующие примеры, ссылочные примеры, примеры рецептур и примеры испытаний предназначены для иллюстрации настоящего изобретения более детально и не должны рассматриваться как определяющие границы и область изобретения.
В последующем описании получают два типа рацемических диастереоизомеров в зависимости от вида соединений, которые получают благодаря наличию асимметрического атома углерода в 3- и 5-м положениях. Изомеры, у которых заместители в 3-м и 5-м положениях ориентированы в одинаковом направлении по отношению к плоскости 7-членного кольца, называются цис-изомерами, тогда как те, у которых заместители в 3-м и 5-м положениях ориентированы в противоположных друг другу направлениях, называются транс-изомерами.
Ссылочный пример 1
Транс-7-хлор-5-(2-хлорфенил)-1,2,3,5-тетрагидро-1-метил-2-оксо-4,1-бензоксазепин-3-уксусная кислота, этиловый эфир
(1) Этил-3-(N-(2-хлорбензоил)-4-хлорфенил)карбамоил)акрилат
К суспензии 5,0 г 2-амино-5-хлор-2'-хлорбензофенона и 2,5 г бикарбоната натрия в 100 мл метиленхлорида прибавляют по каплям 3,3 г моноэтилового эфира полухлорангидрида фумаровой кислоты в течение 30 мин. Смесь перемешивают 2 ч при комнатной температуре, затем туда прибавляют воду, потом встряхивают. Отделяют органический слой, который сушат над сульфатом натрия, потом отгоняют растворитель при пониженном давлении, получают 4,8 г этилового эфира 3-(N-(2-(2-хлорбензоил)-4-хлорфенил)карбамоил)-акриловой кислоты в виде кристаллов с т.пл. 113 - 114oC.
Элементный анализ для C19H15Cl2NO4:
Вычислено, %: C 58,18; H 3,85; N 3,57
Найдено, %: C 58,27; H 3,88; N 3,48
(2) Этиловый эфир 3-(N-(2-(2-хлорбензоил)-4-хлорфенил)-N-карбамоил)-акриловой кислоты
К суспензии 0,15 г гидрида натрия в 20 мл N,N-диметилформамида прибавляют при перемешивании и охлаждении льдом 3,0 г полученных ранее кристаллов. Смесь перемешивают 10 мин при 0oC, затем прибавляют туда 2,0 г метилиодида, затем смесь перемешивают 2 ч при комнатной температуре. Реакционную смесь выливают в лед-воду, затем экстаргируют этилацетатом. Этилацетный слой промывают водой и сушат, отгоняют растворитель при пониженном давлении, получают 2,8 г этилового эфира 3-(N-(2-(2-хлорбензоил)-4-хлорфенил)-N-метилкарбамоил)акриловой кислоты в виде масла.
ИК-спектр ν
ЯМР-спектр (200 МГц, CDCl3) δ : 1,27 (3H, т, CH2 ) 3,18 (3H, с, -N
) 3,18 (3H, с, -N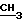 ), 4,18 (2H, к,
), 4,18 (2H, к, 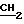 CH3), 6,78 (2H, д, -CH=CH-), 7,1 - 7,7 (7H, м).
CH3), 6,78 (2H, д, -CH=CH-), 7,1 - 7,7 (7H, м).
(3) Этиловый эфир 3-(N-(4-хлор-2-α-окси-2-хлорбензил)фенил)-N-метилкарбамоил)акриловой кислоты
В 50 мл метанола растворяют 2,8 г маслянистого продукта, полученного ранее, прибавляют туда 0,2 г боргидрида натрия, перемешивают смесь 30 мин при комнатной температуре. Реакционную смесь концентрируют при пониженном давлении, затем экстрагируют этилацетатом. Органический слой промывают водой, сушат, перегоняют при пониженном давлении. При кристаллизации остатка получают 2,4 г этилового эфира 3-(N-(4-хлор-2-α-окси-2-хлорбензил)фенил)-N- карбамоил)акриловой кислоты, т.пл. 128 - 130oC.
Элементный анализ для C20H19Cl2NO4•1/4 H2O:
Вычислено, %: C 58,19; H 4,76; N 3,39
Найдено, %: C 58,38; H 4,79; N 3,31
(4) Этил-транс-7-хлор-5-(2-хлорфенил)-1,2,3,5-тетрагидро-1-метил-2-оксо-4,1-бензоксазепин-3-ацетат
Растворяют в 30 мл этанола 2,2 г полученных выше кристаллов, прибавляют туда 1,5 г карбоната калия и перемешивают смесь 3 ч при комнатной температуре. Реакционную смесь концентрируют при пониженном давлении. К концентрату прибавляют воду, затем экстрагируют этилацетатом. Органический слой промывают водой и сушат, затем отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на силикагеле (элюент: гексанэтилацетат = 3:1), получают 1,85 г этилового эфира транс-7-хлор-5-(2-хлорфенил)-1,2,3,5-тетрагидро-1-метил-2-оксо-4,1-бензоксазепин-3-уксусной кислоты в виде кристаллов с т.пл. 147 - 148oC.
Элементный анализ для C20H19Cl2NO4:
Вычислено, %: C 58,64; H 4,69; N 3,43
Найдено, %: C 58,76; H 4,79; N 3,28
Ссылочный пример 2
Этил-транс-7-хлор-5-(2-хлорфенил)-1-циклогексилметил-1,2-3,5-тетрагидро-2-оксо-4,1-бензоксазепин-3-ацетат
(1) N-Циклогексилметил-4-хлор-2-(α-окси-(2-хлорфенил)метил)анилин
Растворяют в 50 мл ледяной уксусной кислоты 5,0 г 4-хлор-2-(α-окси-(2-хлорфенил)метил)анилина. К раствору прибавляют 2,5 г циклогексанкарбоксальдегида. К смеси прибавляют при перемешивании и охлаждении льдом 1,06 г боргидрида натрия в течение 40 мин. Реакционную смесь выливают в лед-воду, затем экстрагируют этилацетатом. Органический слой промывают разбавленным раствором гидроксида натрия, потом водой, после чего сушат. Отгоняют растворитель при пониженном давлении, получают 6,2 г N-циклогексиметил-4-хлор-2-(α-окси-(2-хлорфенил)метил)анилина в виде кристаллов с т.пл. 91 - 92oC.
Элементный анализ для C20H23Cl2NO:
Вычислено, %: C 65,94; H 6,36; N 3,84
Найдено, %: C 65,79; H 6,32; N 3,71
(2) Этиловый эфир 3-(N-(4-хлор-2-(α-окси-2-хлорфенилметил)-фенил)-N-циклогексилметилкарбамоил)акриловой кислоты
Растворяют в 80 мл метиленхлорида 6,0 г полученных выше кристаллов. Прибавляют к раствору при перемешивании и охлаждении льдом по каплям раствор 2,8 г моноэтилового эфира хлорангидрида фумаровой кислоты в 20 мл метиленхлорида в течение 30 мин. Реакционную смесь перемешивают 20 мин при комнатной температуре, промывают водой, сушат и концентрируют при пониженном давлении. Концентрат очищают хроматографией на силикагеле (элюент: гексанэтилацетат = 3: 1), получают 6,5 г этилового эфира 3-(N-(4-(хлор-2-(α-окси-2-хлорфенилметил)-N-циклогексилметилкарбамоил)акриловой кислоты в виде маслянистого продукта.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ : 0,8 - 2,0 (14H, мультиплет, CH2CH3, -циклогексан), 2,6 - 3,5 (2H, мультиплет, -N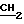 циклогексан), 4,0 - 4,5 (2H, мультиплет,
циклогексан), 4,0 - 4,5 (2H, мультиплет, 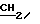 CH3), 6,05 - 7,7 (10H, мультиплет).
CH3), 6,05 - 7,7 (10H, мультиплет).
(3) Этиловый эфир транс-7-хлор-5-(2-хлорфенил)-1-циклогексилметил-1,2,3,5-тетрагидро-2-оксо-4,1-бензоксазепин-3-уксусной кислоты
Растворяют в 100 мл эталона 6,5 г маслянистого продукта, полученного выше, прибавляют к нему 5 г карбоната калия и перемешивают смесь 15 ч при комнатной температуре. Реакционную смесь концентрируют при пониженном давлении. Концентрат экстрагируют этилацетатом. Органический слой промывают водой и сушат, отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на силикагеле (элюент:гексил-этилацетат = 8:1), получают 5,2 г этилового эфира 3,5-транс-7-хлор-5-(2-хлорфенил)-1-циклогексилметил-1,2,3,5-тетрагидро-2-оксо-4,1-бензоксазепин-3-уксусной кислоты в виде порошка.
ИК-спектр ν
Элементный анализ для C26H29Cl2NO4:
Вычислено, %: C 63,68; H 5,96; N 2,86
Найдено, %: C 63,48; H 5,98; N 2,71
Ссылочный пример 3
Работая по методике ссылочного примера 2, получают соединения, приведенные в таблицах 1 - 4.
Пример 1
Работают по методике ссылочного примера 2, получают соединения, приведенные в таблицах 5 и 6.
В таблицах 1 - 12 приведены физико-химические характеристики промежуточных продуктов, полученных в ссылочном примере 3 и примере 1.
Ссылочный пример 4
Транс-7-хлор-5-(2-хлорфенил)-1-метил-1,2,3,5-тетрагидро-2-оксо-4,1-бензоксазепин-3-уксусная кислота
В смеси 10 мл метанола и 4 мл воды суспендируют 0,5 этилового эфира 3,5-транс-7-хлор-5-(2-хлорфенил)-1-метил-1,2,3,5-тетрагидро-2-оксо-4,1-бензоксазепин-3-уксусной кислоты. К суспензии прибавляют 0,8 г карбоната калия и перемешивают смесь 3 ч при 60oC. Реакционную смесь концентрируют при пониженном давлении, затем прибавляют воду, после чего экстрагируют эфиром. Водный слой подкисляют разбавленной соляной кислотой, потом экстрагируют этилацетатом. Органический слой промывают водой и сушат, потом концентрируют при пониженном давлении. Концентрат очищают хроматографией на силикагеле, получают 0,21 г 3,5-транс-7-хлор-5-(2-хлорфенил)-1-метил-1,2,3,5-тетрагидро-2-оксо-4,1-бензоксазепин-3-уксусной кислоты в виде кристаллов с т.пл. 211 - 213oC.
Элементный анализ для C18H15Cl2NO4:
Вычислено, %: C 56,86; H 3,98; N 3,68
Найдено, %: C 56,86; H 4,24; N 3,53
Ссылочный пример 5
Работают по методике ссылочного примера 4, получают соединения, приведенные в таблицах 13 - 15.
Пример 2
Работают по методике ссылочного примера 4, получают соединения, приведенные в таблицe 16.
Ссылочный пример 6
Транс-1-бензил-7-хлор-5-фенил-2-оксо-1,2,3,5-тетрагидро-4,1- бензоксазепин-3-уксусная кислота
Проводят гидролиз 0.3 г этилового эфира транс-1-бензил-7-хлор-5-фенил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, описанного в JPA S57(1982)-35576, по методике, описанной в ссылочном примере 4, получают 0.12 г транс-1-бензил-7-хлор-5-фенил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты в виде белого порошка.
Пример 3
Этиловый эфир транс-1-изобутил-2-оксо-5-(o-толил)-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты
(1) 2-Изобутиламино-α-(o-толил)бензиловый спирт
Используя 2,5 г 2-амино-α-(o-толил)бензилового спирта и 1.17 мл изобутилового альдегида, проводят реакцию по методике ссылочного примера 2(1), получают 3.1 г 2-изобутиламино-α-(o-толил)бензилового спирта в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (CDCl3) δ : 0,7 - 1,1 (6H, м), 1,21 (3H, т, J = 7,0 Гц), 1,5 - 2,0 (1H, м), 2,29 (3H, с), 2,0 - 2,3 и 2,9 - 3,1 (1H, каждый м), 3,9 - 4,5 (3H, м), 5,9 - 6,4 (2H, м), 6,6 - 6,9 (1H, м), 6,95 - 7,9 (8H, м).
(2) Этиловый эфир 3-(N-(2-(α-окси-2-метилбензил)фенил-N-изобутил)карбамоил)акриловой кислоты
Работают по методике ссылочного примера 2(2), 1,3 г 2-изобутиламино-α-(o-толил)бензилового спирта вводят в реакцию с моноэтиловым эфиром хлорангидрида фумаровой кислоты, получают 3,1 г этилового эфира 3-(N-(2-(α-окси-2-метилбензил)фенил-N-изобутил)-карбамоил)акриловой кислоты в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ : 0,7 - 1,1 (6H, м), 1,21 (3H, т, J = 7,0 Гц), 1,5 - 2,0 (1H, м), 2,29 (3H, с), 2,0 - 2,3 и 2,9 - 3,1 (1H, каждый м), 3,9 - 4,5 (3H, м), 5,9 - 6,4 (2H, м), 6,6 - 6,9 (1H, м), 6,95 - 7,9 (8H, м).
(3) Этиловый эфир транс-1-изобутил-2-оксо-5-(o-толил)-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты
Работают по методике ссылочного примера 2(3), вводят в реакцию 1,8 г этилового эфира 3-(N-(2-( α- окси-2-метилбензил)фенил-N-изобутил)карбамоил)акриловой кислоты. Реакционный продукт кристаллизуют из воды-этанола, получают 2,41 г этилового эфира транс-1-изобутил-2-оксо-5-(o-толил)-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты в виде призм с т.пл. 88 - 90oC.
ИК-спектр ν
Элементный анализ для C24H29NO4:
Вычислено, %: C 72,89; H 7,39; N 3,54
Найдено, %: C 73,18; H 7,25; N 3,54
Пример 4
Работают по методике примера 3, получают соединения, приведенные в таблицах 17 и 18.
В таблицах 19 - 22 приведены физико-химические свойства промежуточных продуктов.
Пример 5
Транс-1-изобутил-2-оксо-5-(o-толил)-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусная кислота
Работают по методике ссылочного примера 4, проводят гидролиз 2,0 г этилового эфира транс-1-изобутил-2-оксо-5-(o-толил)-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, получают 1,23 г транс-1-изобутил-2-оксо-5-(o-толил)-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты в виде призм с т.пл. 192 - 195oC.
ИК-спектр ν
Элементный анализ для C22H25NO4:
Вычислено, %: C 71,91; H 6,66; N 3,81
Найдено, %: C 71,86; H 6,78; N 3,80
Пример 6
Работают по методике ссылочного примера 4, используя соединения, полученные в примере 4, получают соединения, приведенные в таблице 23.
Пример 7
Транс-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусная кислота, пивалоилоксиметиловый эфир
Растворяют в 10 мл N,N-диметилформамида 0,5 г транс-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученной в примере 2. К раствору прибавляют 0,43 мл пивалоилоксиметилхлорида, 0,52 мл N,N-диизобутилэтиламина и 0,2 г KI. Смесь всю ночь перемешивают при комнатной температуре, К реакционной смеси прибавляют 100 мл воды и 100 мл этилацетата, потом экстрагируют. Этилацетатный слой промывают водным раствором бисульфата калия, водным раствором бикарбоната натрия и воды последовательно, потом сушат над безводным сульфатом магния. Затем отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на силикагеле (гексан-этилацетат = 10:1 до 5:1), получают 0,55 г пивалоилоксиметилового эфира транс-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро- 4,1-бензоксазепин-3-уксусной кислоты.
ИК-спектр ν
Элементный анализ для C27H31Cl2NO6:
Вычислено, %: C 60,45; H 5,82; N 2,61
Найдено, %: C 60,38; H 5,93; N 2,48
Ссылочный пример 7
Этиловый эфир транс-7-хлор-5-(2-хлорфенил)-1-(2,4-диметоксибензил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты
(1) 5-Хлор-α-(2-хлорфенил)-2-(2,4-диметоксибензил)аминобензиловый спирт
К раствору 5,0 г 2-амино-5-хлор-α-(2-хлорфенил)бензилового спирта и 3,72 г 2,4-диметоксибензальдегида в 50 мл уксусной кислоты прибавляют при охлаждении льдом 0,94 г боргидрида натрия. Смесь перемешивают 1 ч при комнатной температуре, затем выливают в 200 мл воды и экстрагируют 2 х 200 мл этилацетата. Этилацетатный слой промывают 1H гидроксидом натрия, сушат над безводным сульфатом магния и отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на силикагеле (гексан-этилацетат = 5:1), получают 7,5 г 5-хлор-α-(2-хлорфенил)-2-(2,4-диметоксибензил)аминобензилового спирта в виде масла.
1H-ЯМР-спектр (CDCl3) δ: 3,78 (3H, с), 3,79 (3H, с), 3,65 - 3,95 (1H, м), 4,27 (2H, с), 6,15 (1H, с), 6,35 - 7,55 (10H, м).
(2) Этиловый эфир 3-(N-(4-хлор-2-α-оксибензил)фенил)-N-(2,4-диметоксибензил)карбамоил)акриловой кислоты
Раствор 2,24 г моноэтилового эфира фумаровой кислоты и 3,4 мл тионилхлорида в 10 мл толуола перемешивают 30 мин при 90oC. Затем отгоняют растворитель при пониженном давлении, получают хлорангидрид моноэтилового эфира фумаровой кислоты. Этот продукт и 5,0 г 5-хлор-α-(2-хлорфенил)-2-(2,4-диметоксибензил)аминобензилового спирта, полученного в (1), растворяют в 100 мл метиленхлорида. К раствору прибавляют 2,01 г бикарбоната натрия и перемешивают смесь 30 мин при комнатной температуре. Реакционную смесь промывают водой и сушат над безводным сульфатом магния, затем отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на силикагеле (гексан-этилацетат = 2: 1), получают 5,5 г этилового эфира 3-(N-(4-хлор-2-(2-хлор-α-оксибензил)фенил)-N-(2,4-диметоксибензил)карбамоил)акриловой кислоты в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 1,2 - 1,4 (3H, м), 3,4 - 3,9 (6H, м), 3,95 - 4,4 (3H, м), 4,45 - 4,75 (1H, м), 5,25 - 5,6 (1H, м), 6,0 - 8,05 (13H, м).
(3) Этиловый эфир транс-7-хлор-5-(2-хлорфенил)-1-(2,4-диметоксибензил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты
В 50 мл этанола растворяют 5,5 г этилового эфира 3-(N-(4-хлор-2-(2-хлор-α-оксибензил)фенил)-N-(2,4-диметоксибензил)карбамоил)акриловой кислоты, полученного в (2). К раствору прибавляют 1,4 г карбоната калия и перемешивают смесь 2 ч. К реакционной смеси прибавляют 200 мл воды и 300 мл этилацетата. Смесь экстрагируют. Этилацетатный слой промывают водой и сушат над безводным сульфатом магния, затем отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, получают этиловый эфир транс-7-хлор-5-(2-хлорфенил)-1-(2,4-диметоксибензил)-2-оксо- 1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты в виде масла.
ИК-спектр ν
Элементный анализ для C28H27Cl2NO6:
Вычислено, %: C 61,77; H 5,00; N 2,57
Найдено, %: С 62,06; H 5,26; N 2,61
Ссылочный пример 8
Транс-7-хлор-5-(2-хлорфенил)-1-(2,4-диметоксибензил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусная кислота
К раствору 1.0 г этилового эфира транс-7-хлор-5-(2-хлорфенил)-1-(2,4-диметоксибензил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученного в ссылочном примере 7, в 20 мл метанола прибавляют 10 мл водного раствора 0.51 г карбоната калия, затем перемешивают 1 ч при 60oC. Реакционную смесь подкисляют 50 мл 1H соляной кислоты и экстрагируют 100 мл этилацетата. Этилацетатный слой промывают водой и сушат над безводным сульфатом магния, затем отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (гексан-этилацетат =1: 1 ~ гексан-метиленхлорид-этанол = 5:5:1), получают 0.43 г транс-7-хлор-5-(2-хлорфенил)-1-(2,4-диметоксибензил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты в виде порошкообразного продукта.
ИК-спектр ν
Элементный анализ для С26H23Cl2NO6:
Вычислено, %: С 60,48; H 4,49; N 2,71
Найдено, %: С 60,21; H 4,73; N 2,72
Пример 8
Этиловый эфир 1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензокcазепин-3-пропионовой кислоты
(1) 2-(5-оксотетрагидрофуран-2-карбонил)аминобензофенон
Смесь 4.9 г 5-оксотетрагидрофуран-2-карбоновой кислоты и 5.5 мл тионилхлорида кипятят с обратным холодильником в течение 2 ч. Затем отгоняют тионилхлорид при пониженном давлении, получают 5- оксотетрагидрофуран-2-карбонилхлорид. Этот продуют смешивают с 5.0 г 2-аминобензофенона, 200 мл этилацетата и 200 мл насыщенного водного раствора бикарбоната натрия, все перемешивают 1 ч при комнатной температуре. Этилацетатный слой промывают водой и сушат над безводным сульфатом магния, затем отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 2: 1), получают 6.5 г 2-(5-oксотетрагидрофуран-2-карбонил)аминобензофенона в виде игл с т.пл. 100-102oC.
ИК-спектр ν
Элементный анализ для С18H15NO4:
Вычислено, %: С 69,89; H 4,88; N 4,53
Найдено, %: C 69,98; H 5,01; N 4,41
(2) 2-(N-бензил-N-(5-оксотетрагидрофуран-2-карбонил))аминобензофенон
Растворяют в 20 мл N,N-диметилформамида 3.0 г 2-(5-оксотетрагидрофуран-2-карбонил)аминобензофенона, полученного в (1). К раствору прибавляют 1.73 мл бензилбромида, 2.67 г карбоната калия и 0.1 г тетрабутиламмонийиодида. Смесь всю ночь перемешивают при комнатной температуре. Реакционную смесь экстрагируют смесью 200 мл этилацетата и 100 мл воды. Этилацетатный слой промывают 0,1 H соляной кислоты и водным раствором бикарбоната натрия, затем сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 2:1), получают кристаллы. При перекристаллизации из гексана-этилацетата получают 3.71 г 2-(N-бензил-N-(5-оксотетрагидрофуран-2-карбонил))аминобензофенона в виде игл с т.пл. 142 - 143oC.
ИК-спектр ν
Элементный анализ для C25H21NO4:
Вычислено, %: С 75,17; H 5,30; N 3,51
Найдено, %: C 75,05; H 5,59; N 3,49
(3) 3-(N-бензил-N-(4-этоксикарбонил-2-окси)бутирил)аминобензофенон
В 100 мл этанола растворяют 5.0 г 2-(N-бензил-N-(5-оксотетрагидрофуран-2-карбонил))аминобензофенона, полученного в (2). К раствору прибавляют 0.2 мл концентрированной серной кислоты и оставляют смесь на 7 дней. Отгоняют этанол при пониженном давлении. Остаток экстрагируют смесью 100 мл воды и 200 мл этилацетата. Этилацетатный слой промывают водным раствором бикарбоната натрия, затем сушат над безводным сульфатом магния. Затем отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке (элюент: гексан-этилацетат = 2:1), получают 2.8 г 2-(N-бензил-N-(4-этоксикарбонил-2-окси)бутирил)аминобензофенона в виде масла.
ИК-спектр ν
Масс-спектр (м/е): 445 (М+).
1H-ЯМР-спектр (200 МГц, CDCl3) δ : 1,20 (3H,т,J=7.2 Гц ), 1,65 - 3,0 (2H, м), 2,2 - 2,6 (2H,м), 3,65 - 3,7 (1H, шир.), 4,05 (2H, к, J= 7,2 Гц,), 4,0 - 4,35 (1H, м), 4,69 (1H, д, J=14.4 Гц), 4,87 (1H, д, J=14,4 Гц), 6,9 - 7,9 (14H, м).
(4) 2-(N-бензил-N-(4-этоксикарбонил-2-метансульфонилокси)-бутирил)аминобензофенон
Растворяют 2.8 г 2-(N-бензил-N-(4-этоксикарбонил-2-oкси)-бутирил)аминобензофенона, полученного в (3), растворяют в 30 мл этилацетата. К раствору прибавляют при охлаждении льдом 0.73 мл метансульфонилхлорида и 1.31 мл триэтиламина. Смесь перемешивают 2 ч при комнатной температуре. Затем реакционную смесь промывают 1H соляной кислотой и водным раствором бикарбоната натрия последовательно, затем сушат над безводным сульфатом магния, потом отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент:гексан-этилацетат =2:1), получают 3.2 г 2-(N-бензил-N-(4-этоксикарбонил-2-метансульфонилокси)бутирил)аминобензофенона в виде масла.
ИК-спектр ν
Мacc-спектр (м/е): 523 (М+).
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 1,1 - 1,35 (3H, м), 2,0 - 2,6 (4H, м), 3,14 + 3,36 (3H, каждый с), 3,9 - 4,7 (3H, м), 4,93 (д, J = 14,2 Гц) + 5,53 (д, J = 14,8 Гц) (1H), 5,05-5,15 (м) 5,15 - 5,3 (м)(1H), 7,0 - 7,85 (14H, м).
(5) Этил-цис-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионат и этил-транс-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионат
В 30 мл этанола растворяют 3.2 г 2-(N-бензил-N-(4-этокси-карбонил-2-метансульфонилокси)бутирил)аминобензофенона, полученного в (4). К раствору прибавляют при охлаждении льдом 0.32 г боргидрида натрия. Реакционную смесь перемешивают 45 мин при 50oC, затем охлаждают реакционную смесь до комнатной температуры. Реакционную смесь подкисляют добавлением 100 мл 1H соляной кислоты, затем экстрагируют 200 мл этилацетата. Экстракт промывают водным раствором бикарбоната натрия, сушат над сульфатом магния, затем отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 10:1 до 5:1), получают в виде первой фракции 0.73 г этилового эфира цис-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты в виде игл с т. пл. 107 - 108oC.
ИК-спектр ν
Элементный анализ для С27H27NO4:
Вычислено, %: C 75,50; H 6,34; N 3,26
Найдено, %: C 75,21; H 6,44; N 3,27
1H-ЯМР-спектр (200 МГц, CDCl3) δ : 1,21 (3H, т, J=7,2 Гц), 2,2 - 2,4 (2H, м), 2,55 (2H, т, J=7.0 Гц), 3,72 (1H, д, J=16,0 Гц), 4,10 (2H, к, J=7,2 Гц), 4,23 (1H, т, J= 6,5 Гц), 4,70 (1H, д, J = 16,0 Гц), 5,95 (1H, с), 7,0 - 7,5 (14H, м).
B качестве второй фракции получают 0.3 г этилового эфира транс-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты в виде масла.
ИК-спектр ν
Масс-спектр (м/е): 429 (М+).
1H-ЯМР (200 МГц, CDCl3) δ : 1,17 (3H, т, J=7,1 Гц), 2,05 - 2,4 (2H, м), 2,49 (2H, т, J= 7,0 Гц), 4,06 (2H, к, J = 7,1 Гц), 3,95 - 4,05 (1H, м), 4,86 (1H, д, J=14,6 Гц), 5,46 (1H, с), 5,50 (1H, д, J= 14,6 Гц), 6,53 (1H, д, J = 7,8 Гц), 7,0 - 7,45 (13H, м).
Пример 9
Этиловый эфир цис-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты
(1) 2',5-Дихлор-2-(5-окcoтетрагидрофуран-2-карбонил)аминобензофенон
Работают по методике примера 8(1), вводят в реакцию 15 г 2-амино-2',5-дихлорбензофенона с 5-оксотетрагидрофуран-2-карбонилхлоридом, получают 18.1 г 2', 5-дихлор-2-(5-оксотетрагидрофуран-2-карбонил)аминобензофенона, т.пл. 170 - 173oC.
ИК-спектр ν
Элементный анализ для C18H13Cl2NO4:
Вычислено, %: C 57,16; H 3,46; N 3,70
Найдено, %: C 57,29; H 3,55; N 3,57
(2) 2-[N-бензил-N-(5-оксотетрагидрофуран-2-карбонил)]амино-2',5-дихлорбензофенон
Работают по методике примера 8(2), вводят в реакцию 20 г 2',5-дихлор-2-(5-оксотетрагидрофуран-2-карбонил) аминобензофенона, полученного в (1), с бензилбромидом, получают 24.5 г 2-[N-бензил-N-(5-оксотетрагидрофуран-2-карбонил)]амино-2',5-дихлорбензофенона в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 2.1 - 2.55 (2H, м), 2.65 - 3.0 (2H, м), 4.01 (д. J = 14.4 Гц) + 4.29 (д, J = 14.4 Гц) (1H), 4.75 - 4.9 (1H, м), 5.29 (д, J=14.4 Гц) + 5.47 (д, J = 14.4 Гц)(1H), 6.6 - 7.6 (13H, м).
(3) 2-(N-бензил-N-(4-этоксикарбонил-2-окси)бутирил)амино-2,5-дихлорбензофенон
Работают по методике примера 8(3), исходя из 23 г 2-(N-бензил-N-(5-оксотетрагидрофуран-2-карбонил))амино-2', 5-дихлорбензофенона, полученного в (2), получают 17 г (2-(N-бензил-N-(4-этоксикарбонил-2-окси)-бутирил)-амино-2',5-дихлорфенона.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 1.1- 1.35 (3H, м), 1.6 - 2.0 (2H, м), 2.3 - 2.8 (2H, м), 3,9 - 4,8 (4H, м), 5.34 (д, J=14.4 Гц) + 5.69 (д, J =14.4 Гц) (1H), 6.8 - 7.6 (12H, м).
(4) 2-(N-бензил-N-(4-этоксикарбонил-2- метансульфонилокси)-бутирил)амино-2',5-дихлорбензофенон
Работают по методике примера 8(4), исходя из 17 г 2-(N-бензил-N-(4-этоксикарбонил-2-окси)бутирил)амино-2', 5-дихлорбензофенона, получают 19 г 2-(N-бензил-N-(4-этоксикарбонил-2-метансульфонилокси)бутирил)амино-2',5-дихлорбензофенона в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 1.1-1.35 (3H, м), 1.9 - 2.6 (4H, м), 3.17 + 3.32 (3H, каждый с), 4.85 - 5.0 (м) + 5.05 - 5.15 (м) (1H), 5.45 (д, J = 14.4 Гц) + 5.72 (д, J = 14.4 Гц) (1H), 6.9 - 7.6 (12H, м).
(5) Этиловый эфир цис-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,3-бензоксазепин-3-пропионовой кислоты и этиловый эфир транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты
Работают по методике примера 8(5), исходя из 19 г 2-(N-бензил-N-(4-этоксикарбонил-2-метансульфонилокси) бутирил)амино-2',5-дихлорфенона. Реакционную смесь очищают хроматографией на колонке с силикагелем. В качестве первой фракции получают 3.1 г этилового эфира цис-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5- тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты в виде масла.
ИК-спектр ν
В качестве второй фракции получают 3.3 г этилового эфира транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро- 4,1-бензоксазепин-3-пропионовой кислоты в виде призм с т.пл. 122-123oC.
ИК-спектр ν
Элементный анализ для C27H25Cl2NO4:
Вычислено, %: C 65.07; H 5.06; N 2.81
Найдено, %: C 65.30; H 5.09; N 2.81
Пример 10
Этиловый эфир 7-хлор-5-(2-хлорфенил)-1-метил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты
(1) 2', 5-Дихлор-2-(N-метил-N-(5-оксотетрагидрофуран-2- карбонил аминобензофенон
Растворяют в 100 мл ацетона 15 г 2',5-дихлор-2-(5-оксотетрагидрофуран-2-карбонил)аминобензофенона, полученного в примере 9(1). Прибавляют к раствору 4.96 мл метилиодида и 11 г карбоната калия, смесь перемешивают 3 дня при комнатной температуре. Реакционную смесь разгоняют при пониженном давлении. Остаток экстрагируют, добавлял 200 мл воды и 300 мл этилацетата. Этилацетатный слой промывают водой и сушат над безводным сульфатом магния, затем отгоняют растворитель при пониженном давлении. Очищают остаток хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 2:1 до 1:1), получают 13.5 г 2', 5-дихлор-2-(N-метил-(5-оксотетрагидрофуран-2-карбонил))аминобензофенона в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 2.1 - 3.0 (4H, м), 3.08 + 3.14 (3H, каждый с), 4.75 - 4.9 (1H, м), 7.1 - 7.7 (7H, м).
(2) 2',5-Дихлор-2-(N-(4-этоксикарбонил-2-окси)бутирил-N-метил)аминобензофенон
Работают по методике примера 8(3), исходя из 13.5 г 2',5-дихлор-2-(N-метил-N-(5-оксотетрагидрофуран-2-карбонил))аминобензофенона, получают 9.5 г 2', 5-дихлор-2-(N-(4-этоксикарбонил-2-окси)бутирил)-N-метил)аминобензофенона в виде масла.
ИК-cпектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ : 1.1 - 1.4 (3H, м), 1.5.-1.9 (2H, м), 2.0 - 2.75 (2H, м), 3.0-3.5 (3H, м), 3.95-4.05 (4H, м), 7.2 - 7.7 (7H, м).
(3) 2',5-Дихлор-2-(N-(4-этоксикарбонил-3- метанcульфонилокси)-бутирил-N-метил)аминобензофенон
Работают по методике примера 8(4), 9.5 г 2',5-дихлор-2-(N-(4-этоксикарбонил-2-окси)бутирил-N -метил)аминобензофенона, полученного в (2), вводят в реакцию с метансульфонилхлоридом, получают 11.0 г 2',5-дихлор-3-(N-(4-этоксикарбонил-2-метансульфонилокси)бутирил-N-метил)аминобензофенона в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ : 1.1 - 1.35 (3H, м), 1.9 - 2.7 (4H, м), 3.0 - 3.7 (6H, м), 3.9 - 4.25 (2H, м), 4.9 - 5.7 (1H, м), 7.3 - 7.75 (7H, м).
(4) Этиловый эфир 7-хлор-5-(2-хлорфенил)-1-метил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты.
Работают по методике примера 8(5), исходя из 11.0 г 2',5-дихлор-2-(N-(4-этоксикарбонил-2-метансульфонилокси)бутирил-N-метил)аминобензофенона, полученного в (3), продукт реакции очищают хроматографией на колонке с силикагелем, получают 4.17 г смеси цис- и транс-изомеров этилового эфира 7-хлор-5-(2-хлорфенил)-1-метил-2-оксо-1,2,3,5-тетрагидро-4,1- бензоксазепин-3-пропионовой кислоты в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ : 1.19 (3H, т, J = 7.2 Гц), 1.21 (3H, т, J = 7.2 Гц), 2.0 - 2.4 (4H, м), 2.4 - 2.6 (4H, м), 3.15 (3H, с), 3.51 (3H, с), 3.95 - 4.2 (5H, м), 4.36 (1H, т, J = 6.6 Гц), 5.99 (1H, с), 6.16 (1H, с), 6.50 (1H, д, J = 2.4 Гц), 7.05-7.8 (13H, м).
Пример 11
Этиловый эфир 1-бензил-5-(4-метоксифенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты
(1) 4'-Метокси-2-(5-оксотетрагидрофуран-2-карбонил) аминобензофенон
Работают по методике примера 8(1), исходя из 8 г 2-амино-4'-метоксибензофенона, который вводят в реакцию с 5-оксотетрагидрофуран-2-карбонилхлорида, получают 12 г 4'-метокси-2-(5-оксотетрагидрофуран-2-карбонил)аминобензофенона в виде масла.
ИК-спектр ν
1Н-ЯМР-спектр (200 МГц, CDCl3) δ: 2.3 - 2.8 (4H, м), 3.89 (3H, с), 4.9 - 5.05 (1H, м), 6.9 - 7.85 (7H, м), 8.5 - 8.6 (1H, м), 11.2 (1H, шир).
(2) 2-(N-бензил-N-(5-оксотетрагидрофуран-2-карбонил))амино-4'-метоксибензофенон
Работают по методике примера 8(2), 12 г 4'-метокси-2-(5-оксотетрагидрофуран-2-карбонил)аминобензофенона, полученного в (1), вводят в реакцию с бензолбромидом, получают 13.2 г 2-(N- бензил-N-(5-оксотетрагидрофуран-2-карбонил)амино-4'- метоксибензофенона в виде призм c т.пл. 137 - 138oC.
ИК-спектр ν
Элементный анализ для C26H23NO5:
Вычислено, %: С 72.71; H 5.40; N 3.26
Найдено, %: С 72.98; H 5.46; N 3.22
(3) 2-(N-бензил-N-(4-этоксикарбонил-2-окси)бутирил) амино-4'-аминобензофенон
Работают по методике 8(3), исходя из 13.0 г 2-(N-бензил-N-5-оксотетрагидрофуран-2-карбонил))амино-4'-метоксибензофенона, полученного в (2), получают 10.5 г 2-(N-бензил-N-(4-этоксикарбонил-2-окси)бутирил)амино-4'-метоксибензофенона в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 1.1 - 1.35 (3H, м), 1.7 - 2.1 (2H, м), 2.2 - 2.55 (2H, м), 3.88 (3H, с), 3.9 - 4.3 (3H, с), 4.52 (1H, д, J = 14.4 Гц), 4.99 (1H, д, J = 14.4 Гц), 6.8 - 7.9 (13H, м).
(4) 2-(N -бензил-N-(4-этоксикарбонил-2-метансульфонилокси)-бутирил)амино-4-метоксибензофенон
Работают по методике примера 8(4), вводят в реакцию с метансульфонилхлоридом 10.5 г 2-(N-бензил-N-(4-этоксикарбонил-2-окси)бутирил)амино-4'-метоксибензофенона, получают 8.5 г 2-(N-бензил-N-(4-этоксикарбонил-2-метансульфонилокси)бутирил)амино-4' -метоксибензофенона в виде масла.
ИК-спектр ν
1Н-ЯМР-спектр (200 МГц, CDCl3) δ: 1.1 - 1.3 (3H, м), 2.0 - 2.6 (4H, м), 3.14 + 3.38 (3H, с), 3.89 + 3.91 (3H, с), 3.9 - 4.6 (3H, м), 4.9 - 5.65 (2H, м), 6.8 - 7.9 (13H, м).
(5) Этиловый эфир цис-1-бензил-5-(4-метоксифенил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты и этиловый эфир транс-1-бензил-5-(4-метоксифенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты
Работают по методике примера 8(5), исходя из 8.5 г 2-(N-бензил-N-(4-этоксикарбонил-2-метансульфонилокси)бутирил) амино-4'-метоксибензофенона, полученного в (4), получают смешанный продукт, который очищают хроматографией на колонке с силикагелем, получая в качестве первой фракции 2.0 г этилового эфира цис-1-бензил-5-(4-метоксифенил)-2-оксо-1,2,3,5-тетрагидро-4,1- бензоксазепин-3-пропионовой кислоты в виде игл с т.пл. 95 - 96oC.
ИК-спектр ν
Элементный анализ для C28H29NO5:
Вычислено, %: С 73.18; H 6.36; N 3.05
Найдено, %: С 73.09; H 6.42; N 3.19
В качестве второй фракции получают 0.88 г этилового эфира транс-1- бензил-5-(4-метоксифенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 1.17 (3H, т, J=7.1 Гц), 2.1 - 2.4 (2H, м), 2.47 (2H, т, J = 7.1 Гц), 3.82 (1H, с), 3.95 - 4.2 (3H, м), 4.87 (1H, д, J= 14.6 Гц), 5.42 (1H, с), 6.58 (1H, д, J = 7.2 Гц), 6.8-7.5 (12H, м).
Пример 12
Метиловый эфир 1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты
(1) 2-(N-бензил-N-(2-хлор-4-метоксикарбонил)бутирил)аминобензофенон
Смесь 7.6 г 2-хлор-4-метоксикарбонилвалериановой кислоты, 9.2 мл тионилхлорида и 30 мл толуола перемешивают 30 мин при 80oC, затем отгоняют растворитель при пониженном давлении, получают 2-хлор-4- метоксикарбонилбутирилхлорид. Смесь этого соединения, 5.0 г 2-бензиламинобензофенона, 100 мл этилацетата и 100 мл насыщенного водного раствора бикарбоната натрия перемешивают 30 мин при комнатной температуре. Этилацетатный слой промывают водой и сушат безводным сульфатом магния, затем отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 5.1), получают 1.2 г 2-(N -бензил- N -(2-хлор-4-метоксикарбонил)бутирил)аминобензофенона в виде масла.
ИК-спектр ν
Масс-спектр (м/е): 449 (М+).
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 2.3 - 2.8 (4H, м), 3.62 (3H, с), 4.2 - 4.3 (1H, м), 4.53 (1H, д, J - 14.4 Гц), 4.92 (IH, д, J = 14.4 Гц), 6.9 - 7.75 (14H, м).
(2) 2-(N-бензил-N-(2-хлор-4-метоксикарбонил)бутирил) аминодифенилметанол
(Способ А)
В 30 мл метанола растворяют 1.2 г 2-(N-бензил-N-(2-хлор-4-метоксикарбонил)бутирил)аминобензофенона. К раствору прибавляют при охлаждении льдом 0.135 г боргидрида натрия. Смесь перемешивают 30 мин при комнатной температуре, затем отгоняют растворитель при пониженном давлении. К остатку прибавляют 100 мл 1H соляной кислоты для подкисления раствора, который затем экстрагируют 100 мл этилацетата. Этилацетатный слой промывают водным раствором бикарбоната натрия и сушат над безводным сульфатом магния, затем отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 2:1), получают 1.1 г 2- (N-бензил-N-(2-хлор-метоксикарбонил)бутирил) аминодифенилметанола.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 1.95 - 2.65 (4H, м), 3.2 - 4.4 (6H, м), 5.1 - 5.5 (1H, м), 5.75 - 6.15 (1H, м), 6.5 - 7.85 (14H, м).
(Способ В)
Смесь 6.2 г 2-хлор-4-метоксикарбонилвалериановой кислоты и 12.6 мл тионилхлорида кипятят с обратным холодильником 30 мин, затем отгоняют растворитель при пониженном давлении, получают 2-хлор-4-метоксикарбонилбутирилхлорид. Смесь этого продукта, 5.0 г 2-бензиламинодифенилметанола, 100 мл этилацетата и 100 мл насыщенного водного раствора бикарбоната натрия перемешивают 1 ч при комнатной температуре. Этилацетатный слой промывают водой и сушат над безводным сульфатом магния, затем отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 2:1), получают 5.3 г 2-(N-бензил-N-(2-хлор-4-метоксикарбонил)бутирил)аминодифенилметанола в виде масла.
(3) Метиловый эфир цис-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты и метиловый эфир транc-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты
В 20 мл тетрагидрофурана растворяют 1.1 г 2-(N-бензил-N-(2-хлор-4-метоксикарбонил)бутирил)аминодифенилметанола. К раствору прибавляют 107 мг гидрида натрия (60% в масле), смесь перемешивают 1 ч при комнатной температуре. К реакционной смеси прибавляют 50 мл 1H соляной кислоты для подкисления раствора, который затем экстрагируют 100 мл этилацетата. Этилацетатный слой промывают водным раствором бикарбоната натрия и сушат над сульфатом магния, затем отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 5:1). Из первой фракции выделяют 0.4 г метилового цис-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты в виде пластин с т.пл. 134 - 135oC.
ИК-спектр ν
Элементный анализ для C25H25NO4:
Вычислено, %: C 75.16; H 6,06; N 3.37
Найдено, %: C 74.74; H 5.97; N 3.38
Из второй фракции выделяют 0.18 г метилового эфира транс-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты в виде игл с т.пл. 116 - 118oC.
ИК-спектр ν
Элементный анализ С26H25NO4:
Вычислено, %: C 75.16; H 6.06; N 3.73
Найдено, %: C 75.22; H 5.94; N 3.58
Пример 13
Цис-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин- 3-пропионовая кислота
В 20 мл метанола растворяют 0.5 г этилового эфира цис-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты, полученного в примере 8. К раствору прибавляют 7 мл 1H гидроксида натрия и перемешивают смесь 30 мин при комнатной температуре. Реакционную смесь подкисляют 100 мл 1H соляной кислоты, затем экстрагируют 150 мл этилацетата. Этилацетатный слой промывают водой и сушат над безводным сульфатом магния. Затем отгоняют растворитель при пониженном давлении, получают 0.46 г цис-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты в виде пластин с т.пл. 112- 114oC.
ИК-спектр ν
Элементный анализ для C25H23NO4:
Вычислено, %: C 74.80; H 5.77; N 3.49
Найдено, %: C 74.52; H 5.85; N 4.42
Пример 14
Транс-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовая кислота
Работают по методике примера 13, 1.0 г этилового эфира транс-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты, полученного в примере 8, подвергают гидролизу, получают 0.81 г транс-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты в виде пластин с т.пл. 148 -150oC.
ИК-спектр ν
Элементный анализ для C25H23NO4:
Вычислено, %: С 74.80; H 5.77; N 3.49
Найдено, %: C 74.66; H 5.78; N 3.55
Работая по приведенной выше методике, 0.9 г метилового эфира транс-1-бензил-2-оксо-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты, полученного в примере 12, подвергают гидролизу, получают 0.86 г транс-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты.
Пример 15
Цис-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовая кислота
Работают по методике примера 13, 3.1 г этилового эфира цис-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты, полученного в примере 9, подвергают гидролизу, получают 2.9 г цис-1-бензил-7-хлор-5-(2- хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты в виде призм с т.пл. 135 - 137oC.
ИК-спектр ν
Элементный анализ для C25H21Cl2NO4:
Вычислено, %: C 63.84; H 4.50; N 2.98
Найдено, %: C 64.02; H 4.76; N 2.88
Пример 16
Транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксo-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовая кислота
Работают по методике примера 13, 2.7 г этилового эфира тpaнc-1-бeнзил-7-xлоp-5-(2-xлopфенил)-2-oкco-1,2,3,5- тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты, полученного в примере 9, подвергают гидролизу, получают 2.5 г транс-1-бензил- 7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1- бензоксазепин-3-пропионовой кислоты в виде призм с т.пл. 192 - 194oC.
ИК-спектр ν
Элементный анализ для C25H21Cl2NO4:
Вычислено, %: С 63.84; H 4.50; N 2.98
Найдено, %: C 63.99; H 4.57; N 2.92
Пример 17
7-Хлор-5-(2-хлорфенил)-1-метил-2-оксo-1,2,3,5- тетрагидро-4,1-бензоксазепин-3-пропионовая кислота
Работают по методике примера 13, 4.1 г этилового эфира 7-хлор-5-(2-хлорфенил)-1-метил-2-оксo-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты, полученного в примере 10, подвергают гидролизу, получают 3.7 г 7-хлор-5-(2-хлорфенил)-1- метил 2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты в виде масла из смеси цис- и транс-соединений (1:1).
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 2.0-2.4 (4H, м), 2.45 - 2.7 (4H, м), 3.14 (3H, с), 3.50 (3H, с),4.00 (1H, дд, J= 7.2 x 5.4 Гц), 4.35 (1H, т, J= 6.7 Гц), 5.99 (1H, с), 6.16 (1H, с), 6.50 (1H, д, J = 2.2 Гц), 7.0 - 7.81 (13H, м).
Пример 18
Цис-1-бензил-5-(4-метоксифенил)-2-оксо-1,2,3,5- тетрагидро-4,1-бензоксазепин-3-пропионовая кислота
Работают по методике 13, 1.7 г этилового эфира цис-1-бензил-5-(4-метоксифенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты, полученного в примере 11, подвергают гидролизу, получают 1.5 г цис-1-бензил-5-(4-метоксифенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты в виде призм с т.пл. 107 - 109oC.
ИК-спектр ν
Элементный анализ для C26H25NO5:
Выделено, %: С 72.35; H 5.84; N 3.25
Найдено, %: C 72.26; H 5.90; N 3.10
Пример 19
Транс-1-бензил-5-(4-метоксифенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовая кислота
Работают по методике примера 13, 0.85 г этилового эфира транс-1-бензил-5-(4-метоксифенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-З-пропионовой кислоты подвергают гидролизу, получают 0.78 г транс-1-бензил-5-(4-метоксифенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 2.05 - 2.35 (2H, м), 2.52 (2H, т, J = 7.1 Гц), 3.81 (1H, с), 4.00 (1H, дд, J = 7.3 х 5.7 Гц), 4.39 (1H, д, J = 14.4 Гц), 5.40 (1H, с), 5.49 (1H, д, J = 14.4 Гц), 6.57 (1H, д, J=7.2 Гц), 6.8 - 7.5 (12H, м).
Пример 20
Транс-1-бензил-3-(3-оксипропил)-5-фенил-1,5-дигидро-4,1-бензоксазепин-2(3H)-он
Смесь 0.4 г метилового эфира транс-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-оксазепин-3-пропионовой кислоты, полученного в примере 12, 0.16 г боргидрида натрия и 0.16 г хлорида лития в 15 мл тетрагидрофурана перемешивают 10 мин при комнатной температуре. К полученной смеси прибавляют 30 мл этанола, перемешивают 2 ч при 60oC. К реакционной смеси прибавляют 100 мл 1H соляной кислоты и 150 мл этилацетата. Этилацетатный слой промывают водным раствором бикарбоната натрия, затем сушат над безводным сульфатом магния, после чего отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 2: 1), получают 0.19 г транс-1-бензил-3-(3-оксипропил)-5-фенил-1,5-дигидро-4,1-бензоксазепин-2(3H)-она в виде игл с т.пл. 59 - 62oC.
ИК-спектр ν
Элементный анализ для C25H25NO3:
Вычислено, %: C 77.49; H 6.50; N 3.61
Найдено, %: C 77.12; H 6.44; N 3.87
Пример 21
Цис-1-бензил-3-(3,3-оксипропил)-5-фенил-1,5-дигидро-4,1- бензоксазепин-2(3H)-он
Работают по методике примера 20, 0.23 г метилового эфира цис-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты, полученного в примере 12, подвергают восстановлению, получая 0.09 г цис-1-бензил-3-(3-оксипропил)-5-фенил-1,5-дигидро-4,1-бензоксазепин-2(3H)-она в виде игл с т. пл. 94 - 95oC.
ИК-спектр ν
Элементный анализ для C25H25NO3:
Вычислено, %: С 77.49; H 6.50; N 3.61
Найдено, %: С 77.44; H 6.49; N 3.76
Пример 22
N-(цис-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионил)аминоэтанол
В 5 мл N,N-диметилформамида растворяют 0.3 г цис- 1-бензил-2-oксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты, полученной в примере 13, и 0.054 мл этаноламина. К раствору прибавляют при охлаждении льдом 0.17 г диэтилфосфороцианидата и 0.14 мл триэтиламина. Смесь перемешивают 30 мин при комнатной температуре, затем прибавляют 100 мл воды. Смесь экстрагируют 2 х 100 мл этилацетата. Этилацетатный слой промывают 1H соляной кислотой и водным раствором бикарбоната натрия последовательно, затем сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-метиленхлорид-этанол = 5:5:1), получают 0.28 г N-(цис-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионил)-аминоэтанола в виде игл с т.пл. 117 - 119oC.
ИК-спектр ν
Элементный анализ для C27H28N2O4 • 0.5 H2O:
Вычислено, %: C 71.50; H 6.44; N 6.18
Найдено, %: C 71.29; H 6.47; N 5.98
Пример 23
N-(транс-1-бензил-1-2-оксo-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионил)аминоэтанол
Работают по методике примера 22, 0.25 г транс-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты, полученной в примере 14, конденсируют с этаноламином, получают 0.20 г N-(транс-1-бензил-2-оксо-5-фенил-1,2,3,5- тетpaгидро-4,1-бeнзoкcaзeпин-3-пpoпиoнил)aминоэтaнoл в виде пластин с т.пл. 125 -127oC.
ИК-спектр ν
Элементный анализ для C27H28N2O4:
Вычислено, %: C 72.95; H 6.35; N 6.30
Найдено, %: C 72.70; H 6.36; N 6.19
Пример 24
Метиловый эфир N(цис-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1,-бензоксазепин-3-пропионил)-L-триптофан
В 10 мл N,N-диметилформамида растворяют 0.35 г цис-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты, полученной в примере 13, и 0.23 г солянокислого метилового эфира L-триптофана. К раствору прибавляют при охлаждении льдом 0.15 г диэтилфосфороцианидата и 0.24 мл триэтиламина. Смесь перемешивают 30 мин при комнатной температуре, затем экстрагируют, добавляя 100 мл воды и 100 мл этилацетата. Этилацетатный слой промывают 1H соляной кислотой и водным раствором бикарбоната натрия последовательно, затем сушат над безводным сульфатом магния. Отгоняют растворитель и остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 1: 1), получают 0.50 г метилового эфира N-(цис-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-З-пропионил)-L-триптофана в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 2.15 - 2.5 (4H, м), 3.27 (2H, т, J=4.7 Гц), 3.62 + 3.63 (3H, каждый, с), 3.71 (1H, д, J=16.0 Гц), 4.15 - 4.3 (1H, м), 4.68 (1H, д, J = 16.0 Гц), 4.8 - 5.0 (1H, м), 5.85 (1H, с), 6.15 - 6.35 (1H, м), 6.9 - 7.6 (19H, м), 8.13 (1H, шир).
Пример 25
N -(цис-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионил)-L-триптофан
Растворяют в 10 мл метанола 0.5 г метилового эфира N-(цис-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионил)-L-триптофана, полученного в примере 24. К раствору прибавляют 5 мл 1H гидроксида натрия и перемешивают смесь 1 ч при комнатной температуре. Реакционную смесь подкисляют добавлением 100 мл 1H соляной кислоты, затем экстрагируют 100 мл этилацетата. Этилацетатный слой промывают водой и сушат над безводным сульфатом магния. Затем отгоняют растворитель при пониженном давлении, получают 0.24 г N-(цис-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионил)-L-триптофана в виде порошкообразного продукта.
ИК-спектр ν
Элементный анализ для C36H33N3O5:
Вычислено, %: C 73.58; H 5.66; N 7.15
Найдено, %: C 73.56; H 6.07; N 6.79
Пример 26
Метиловый эфир N-(транc-1-бензол-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионил)-L-триптофан
Работают по методике примера 24, 0.2 г транс-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионовой кислоты конденсируют с солянокислым метиловым эфиром L-триптофана, получают 0.28 г метилового эфира N-(транс-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3- пропионил)-L-триптофана в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 2.1 - 2.4 (4H, м), 3.15 - 3.3 (2H, м), 3.6 - 3.7 (3H, м), 3.95 - 4.15 (1H, м), 4.8 - 5.0 (2H, м), 5.45 (1H, с), 5.49 (1H, д, J = 14.2 Гц), 6.05 - 6.2 (1H, м), 6.45 - 6.6 (1H, м), 6.9 - 7.6 (18H, M), 8.03 (1H, шир).
Пример 27
N-(транс-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионил)-L-триптофан
Работают по методике примера 25, подвергают гидролизу 0.28 г метилового эфира N-(транс-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионил)-L-триптофана, полученного в примере 26, получают 0,24 г N-(транс-1-бензил-2-оксо-5-фенил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионил)-L- триптофана в виде порошкообразного продукта.
ИК-спектр ν
Элементный анализ C36H33N3O5:
Вычислено, %: С 72.69; H 5.73; N 7.06
Найдено, %: C 72.82; H 5.84; N 6.79
Пример 28
Метиловый эфир N-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-oкco-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионил)-L-триптофана
Работают по методике примера 24, конденсируют 0.3 г транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-2-пропионовой кислоты, полученной в примере 16, с солянокислым метиловым эфиром L-триптофана, получают 0.41 г метилового эфира N-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо- 1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионил)-L триптофана в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 2.1 - 2.45 (4H, м), 3.2 - 3.35 (2H, м), 3.64 + 3.66 (3H, каждый с), 3.95 - 4.15 (1H, м), 4.65 - 4.8 (1H, м), 4.8 - 5.0 (1H, м), 5.5 - 5.65 (1H, м), 5.76 (1H, с), 6.0 - 6.2 (1H, м), 6.35 - 6.45 (1H, м), 6.9 -7.7 (16H, м), 8.16 (1H, шир).
Пример 29
N-(тpaнc-1-бeнзил-7-хлор-5-(2-хлорфенил)-2-оксo-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионил)-L-триптофан
Работают по методике примера 25, подвергают гидролизу 0.41 г метилового эфира N-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионил)-L-триптофана, полученного в примере 28, получают 0.31 г N-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1- бензоксазепин-3-пропионил)-L-триптофана в виде порошкообразного продукта.
ИК-спектр ν
Элементный анализ для C36H31Cl2N3O5:
Вычислено, %: C 65.86; H 4.76; N 6.40
Найдено, %: С 66.13; H 5.02; N 6.24
Пример 30
Этиловый эфир N-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-окco-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионил)-D-триптофана
Работают по методике примера 24, проводят конденсацию 0.3 г транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1- бензоксазепин-3-пропионовой кислоты с солянокислым эфиром D-триптофана, получают 0.43 г этилового эфира N-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бeнзoксазепин-3-пpoпиoнил)-D-тpиптофана в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 1.1 - 1.3 (3H, м), 2.1 - 2.45 (4H, м), 3.2 - 3.35 (2H, м), 3.95 - 4.2 (3H, м), 4.65 - 4.8 (1H, м), 4.8 - 5.0 (1H, м), 5.5 - 5.65 (1H, м), 5.76 (1H, с), 6.0 - 6.2 (1H, м), 6.35 - 6.45 (1H, м), 6.9 - 7.7 (16H, м), 8.13 (1H, шир).
Пример 31
N-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионил)-D-триптофан
Работают по методике примера 25, проводят гидролиз 0.43 г этилового эфира N-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-пропионил)-D-триптофана, полученного в примере 30, получают 0.38 г N-(транс-1- бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1- бензоксазепин-3-пропионил)-D-триптофана в виде порошкообразного продукта.
ИК-спектр ν
Элементный анализ для C36H31Cl2N3O5:
Вычислено, %: C 65.86; H 4.76; N 6.40
Найдено, %: C 65.30; H 5.15; N 6.03
Пример 32
Метиловый эфир N-(транс-7-хлор-5-(2-хлорфенил)-1-метил-2-окcо-1,2,3,5-тетрагидрo-4,1-бензоксазепин-3-илацетил)-L-триптофан
К смеси 0.6 г транс-7-хлор-5-(2-хлорфенил)-1-метил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученной в cсылочном примере 4, прибавляют 0.42 г солянокислого метилового эфира триптофана и 10 мл диметилформамида при перемешивании при охлаждении льдом, и 0,73 г диэтилфосфорцианидата. К полученной в результате смеси затем добавляют 0.55 мл триэтиламина. Реакционную смесь перемешивают 40 мин при комнатной температуре, затем выливают в лед-воду, после чего экстрагируют этилацетатом. Органический слой промывают разбавленным водным раствором бисульфата калия, водным раствором бикарбоната натрия и водой последовательно, сушат и концентрируют при пониженном давлении. Концентрат очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 1:1 до 1:3). Из первой фракции элюата получают 0.33 г метилового эфира N-(транс-7-хлор-5-(2-хлорфенил)-1-метил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3- илацетил)триптофана в виде кристаллов с т.пл. 236 - 237oC.
Элементный анализ для C30H27Cl2N3O5:
Вычислено, %: С 62.08; H 4.69; N 7.24
Найдено, %: C 61.82; H 4.71; N 6.95
Из последующей фракции элюата получают 0.28 г стерического изомера приведенного выше соединения, т.пл. 159 - 160oC.
Элементный анализ для C30H27Cl2N3O5:
Вычислено, %: С 62.08; H 4.69; N 7.24
Найдено, %: С 61.94; H 4.50; N 6.69
Пример 33
Работают по методике примера 32, получают соединения, приведенные в таблицах 24 - 28, используя соединения ссылочных примеров 5 и 2.
Пример 34
N-(транс-7-хлор-5-(2-хлорфенил)-1-метил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-илацетил)-L-триптофан
Растворяют в смеси 8 мл метанола и 4 мл тетрагидрофурана 0.2 г метилового эфира N-(транс-7-хлор-5-(2-хлорфенил)-1-метил-1, 2,3,5-тетрагидро-4,1-бензоксазепин-3-илацетил)-L-триптофана, полученного из первой фракции примера 32. К раствору прибавляют 200 мг карбоната калия и 5 мл воды, смесь перемешивают 3 ч при 60oC. Реакционную смесь концентрируют при пониженном давлении. Устанавливают pH концентрата равным 3 с помощью 1H соляной кислоты, затем экстрагируют этилацетатом. Органический слой промывают водой и сушат, растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: метиленхлорид-метанол-вода = 100: 15: 1), получают 0.13 г N-(транс-7-хлор-5-(2-хлорфенил)-1-метил-1,2,3,5-тетрагидро-2-оксо-4,1-бензоксазепин-3-илацетил)-L-триптофана в виде бесцветного порошкообразного продукта.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 2.2-3.2 (4H, м), 3.24 (3H, с,  ), 4.2 (1H, м, C3-H), 4,63 (1H, м), 5.73 (1H, с, C5-H), 6.34 (1H, д, C6-H), 6.6-7.7 (10H, м).
), 4.2 (1H, м, C3-H), 4,63 (1H, м), 5.73 (1H, с, C5-H), 6.34 (1H, д, C6-H), 6.6-7.7 (10H, м).
Элементный анализ для C29H25Cl2N3O5 • 1/2 C4H8O2 • 1/2 H2O:
Вычислено, %: С 60.10; H 4.88; N 6.78
Найдено, %: С 60.11; H 4.89; N 6.69
Гидролизуют по описанной выше методике 0.2 г соединения, элюированного впоследствии при хроматографии на колонке с силикагелем, получают 0.11 г кристаллов стерического изомера, т.пл. 165 - 167oC.
Элементный анализ для C29H25Cl2N3O5 •1/2 C4H8O2• 1/2 H2O:
Вычислено, %: С 60.53; H 4.84; N 6.83
Найдено, %: С 60.44; H 4.88; N 6.83
Пример 35
Работают по методике примера 34, получают соединения, приведенные в таблицах 29 - 33.
Пример 36
(Транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ил)метиламин
В 5 мл диметилформамида растворяют 1.0 г транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-оксазепин-3-уксусной кислоты, полученной в cсылочном примере 5. К раствору прибавляют 0.3 мл триэтиламина, затем по каплям при охлаждении льдом прибавляют 0.6 г дифенилфосфорилазида. Реакционную смесь перемешивают 1 ч при комнатной температуре, затем выливают в лед-воду. Смесь экстрагируют с эфиром. Органический слой промывают водой и сушат, затем концентрируют при пониженном давлении. Концентрат растворяют в 100 мл бензола, затем кипятят с обратным холодильником в течение 30 мин. Реакционную смесь концентрируют при пониженном давлении. К концентрату прибавляют 6 мл концентрированной соляной кислоты, смесь 1 ч кипятят с обратным холодильником. Реакционную смесь концентрируют при пониженном давлении. Концентрат подщелачивают добавлением 5%-ного водного раствора карбоната калия, затем экстрагируют этилацетатом. Органический слой промывают водой и сушат, затем отгоняют растворитель при пониженном давлении. К остатку прибавляют этанольный раствор 4H соляной кислоты, чтобы получить гидрохлорид, получают 0.85 г гидрохлорида (транс-1-бензил-7-хлор-5-(2- хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ил)метиламина в виде кристаллов с т. пл. 245 - 250oC.
Элементный анализ для С23H20Cl2N2O2•HCl•3/2H2O:
Вычислено, %: C 56.34; H 4.82; N 5.71
Найдено, %: С 56.65; H 4.44; N 6.09
Пример 37
Работают по методике примера 36, получают соединения, приведенные в таблице 34.
Пример 38
Этиловый эфир N-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ил)метиламинокарбонил)глицин.
В 4 мл диметилформамида растворяют 0.3 г транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-оксазепин-3-уксусной кислоты, полученной в ссылочном примере 5. К раствору прибавляют 0.15 мл триэтиламина. К смеси прибавляют при перемешивании и охлаждении льдом 0.18 г дифенилфосфорилазида. Реакционную смесь перемешивают 1 ч при комнатной температуре, затем прибавляют лед-воду и экстрагируют этилацетатом. Органический слой промывают водой, сушат и концентрируют при пониженном давлении. К концентрату прибавляют 10 мл бензола, смесь кипятят с обратным холодильником 1 ч при перемешивании. К реакционной смеси прибавляют 0,14 г солянокислого этилового эфира глицина и 0.15 мл триэтиламина. Затем смесь 3 ч кипятят с обратным холодильником. Реакционную смесь концентрируют при пониженном давлении. Концентрат экстрагируют этилацетатом. Органический слой промывают водой и сушат, затем отгоняют растворитель при пониженном давлении. Перекристаллизовывают кристаллы, полученные из остатка из смеси этилацетата и гексана, получают 0.33 г целевого соединения в виде белых кристаллов с т.пл. 200 - 201oC.
Элементный анализ для С28H27Cl2N3O5:
Вычислено, %: С 60.44; H 4.89; N 7.55
Найдено, %: С 60.29; H 4.82; N 7.68
Пример 39
B 8 мл метанола растворяют 0.2 г этилового эфира N-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ил)метиламинокарбонил) глицина. К раствору прибавляют 0.2 г карбоната калия и 2 мл воды, смесь перемешивают 3 ч при 60oC. Реакционную смесь концентрируют при пониженном давлении, добавляют воду и экстрагируют эфиром. Водный слой подкисляют до pH 3 разбавленной соляной кислотой, затем экстрагируют этилацетатом. Органический слой промывают водой и сушат, затем отгоняют растворитель при пониженном давлении для получения кристаллического остатка. Перекристаллизация из этилацетата дает 0.18 г N-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ил-метиламинокарбонил)-глицина в виде бесцветных кристаллов с т.пл. 153 - 155oC.
Элементный анализ для C26H23Cl2N3O5•1/4H2O:
Вычислено, %: С 58.60; H 4.45; N 7.88
Найдено, %: С 58.63; H 4.42; N 7.58
Пример 40
Этиловый эфир N-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бeзоксазепин-3-илметил)глицина
В 10 мл ацетонитрила растворяют 0.4 г транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метиламина, полученного в примере 36. К раствору прибавляют 0.15 г этилхлорацетата и 0.5 г карбоната калия. Смесь кипятят с обратным холодильником 15 ч при перемешивании. Реакционную смесь концентрируют при пониженном давлении и экстрагируют концентрат этилацетатом. Органический слой промывают водой и сушат, затем отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 3:2 до 1:2), получают 0.28 г этилового эфира N-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-илметил)глицина в виде масла. Этот продукт переводят в его солянокислую соль, получают белые кристаллы с т.пл. 182 - 184oC.
Элементный анализ для C27H26Cl2N2O4•HCl:
Вычислено, %: С 58.98; H 4.95; N 5.09
Найдено, %: C 58.70; H 4.98; N 5.07
Пример 41
N-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо- 1,2,3,5-тетрагидро-4,1-бензоксазепин-3-илметил)глицин
В 6 мл метанола растворяют 0.15 г этилового эфира N-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-илметил)глицина, полученного в примере 40. К раствору прибавляют 0.4 г карбоната калия и 2 мл воды. Смесь перемешивают 2 ч при 50oC. Реакционную смесь концентрируют при пониженном давлении, затем устанавливают pH 3 добавлением разбавленной соляной кислоты, экстрагируют метиленхлоридом. Органический слой промывают водой и сушат, затем отгоняют растворитель при пониженном давлении. Из остатка получают 0.13 г N-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-илметил)глицина в виде кристаллов с т.пл. 224 - 226oC.
Элементный анализ для C25H22Cl2N2O4•1/2H2O:
Вычислено, %: С 60.74; H 4.69; N 5.67
Найдено, %: C 60.74; H 4.48; N 5.70
Пример 42
N-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-илметил)-N-метилглицин
К 0.13 г этилового эфира N-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-окco-1,2,3,5-тетрагидро-4,1-бензoкcaзeпин-3-илметил)глицина, полученного в примере 40, прибавляют 2 мл формалина и 2 мл щавелевой кислоты. Смесь 2 ч нагревают при 80oC. Реакционную смесь концентрируют при пониженном давлении, и концентрат экстрагируют этилацетатом. Органический слой промывают водным раствором бикарбоната натрия, затем водой, потом сушат. Отгоняют растворитель при пониженном давлении. Остаток растворяют в 6 мл метанола. К раствору прибавляют 0.2 г карбоната калия и 2 мл воды. Смесь перемешивают 2 ч при 60oC. Реакционную смесь концентрируют при пониженном давлении, затем прибавляют воду и экстрагируют эфиром. Водный слой подкисляют до pH 4 разбавленной соляной кислотой, потом экстрагируют метиленхлоридом. Органический слой промывают водой и сушат, затем отгоняют растворитель при пониженном давлении. Из остатка получают 0.1 г N-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-оксазепин-3-илметил)-N-метилглицина в виде кристаллов с т.пл. 195 - 197oC.
Элементный анализ для C26H24Cl2N2O4• 1/4H2O:
Вычислено, %: С 61.97; H 4.90; N 5.56
Найдено, %: С 61.90; H 4.73; N 5.67
Пример 43
N-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-илметил)-N-ацетилглицин
B 4 мл метанола растворяют 60 мг этилового эфира N-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-илметил)глицина, полученного в примере 40. К раствору прибавляют 0.2 мл уксусного ангидрида и 0.2 мл триэтиламина. Смесь 1 ч кипятят c обратным холодильником при перемешивании. Реакционную смесь концентрируют при пониженном давлении, затем экстрагируют этилацетатом. Органический слой промывают водным раствором бисульфата калия, водным раствором бикарбоната натрия и водой, затем сушат и отгоняют растворитель. Остаток растворяют в 4 мл метанола, затем прибавляют 2 мл 5%-ного водного раствора карбоната калия. Смесь 30 мин перемешивают при 60oC. Реакционную смесь концентрируют при пониженном давлении, затем добавляют 1H соляную кислоту для подкисления раствора и экстрагируют этилацетатом. Органический слой промывают водой и сушат, затем отгоняют растворитель при пониженном давлении. Из остатка получают 45 мг N-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-окco-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-илметил)-N-ацетилглицина в виде кристаллов с т.пл. 143 - 145oC.
Элементный анализ для C27H24Cl2N2O5• 1/4H2O:
Вычислено, %: C 60.96; H 4.64; N 5.27
Hайдено, %: C 60.90; H 4.39; N 5.32
Пример 44
N-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-оксазепин-3-илметил)-N-бензоилглицин
В 10 мл метиленхлорида растворяют 0.15 г этилового эфира N-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1- бензоксазепин-3-илметил)глицина, полученного в примере 40. К раствору прибавляют 90 мг бензойного ангидрида, 0.1 мл триэтиламина и 10 мг 4-диметиламинопиридина. Реакционную смесь перемешивают 15 мин при комнатной температуре. Реакционную смесь концентрируют при пониженном давлении, и остаток экстрагируют этилацетатом. Органический слой промывают водой и сушат, затем отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 3:2), получают масло. Масло растворяют в смеси 5 мл метанола и 2 мл тетрагидрофурана. К раствору прибавляют 0.2 г карбоната калия и 2 мл воды. Затем смесь 2 ч перемешивают при 60oC. Реакционную смесь концентрируют при пониженном давлении. К концентрату прибавляют разбавленную соляную кислоту, чтобы установить pH 2, затем экстрагируют этилацетатом. Органический слой промывают водой и сушат, затем отгоняют растворитель при пониженном давлении. Из остатка получают 75 мг N-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-илметил)-N- бензоилглицина в виде аморфного твердого продукта.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 3.8 - 5.1 (6H, м), 5.75 (1H, с, С5-H), 6.40 (1H, с, С6-Н), 7.0 - 7.8 (16H, м).
Элементный анализ для C32H26Cl2N2O5 •2/3H2O:
Вычислено, %: С 62.34; H 4.74; N 4.54
Найдено, %: С 62.40; H 4.44; N 4.32
Пример 45
Транс-1-бензил-7-хлор-5-(2-хлорфенил)-3-(3-метоксикарбонил-метилкарбамоил)метил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин
К смеси 0.25 г (транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ил)метиламина, полученного в примере 36, прибавляют 0.1 г калиевой соли полуэфира радоновой кислоты и 4 мл диметилформамида, при перемешивании и охлаждении на льду, 0.13 г диэтилфосфороцианидата и 0.23 мл триэтиламина. Реакционную смесь перемешивают 40 мин при комнатной температуре, затем прибавляют лед-воду, затем экстрагируют этилацетатом. Органический слой промывают водным раствором бисульфата натрия, водным раствором бикарбоната натрия и водой последовательно, затем сушат. Растворитель отгоняют, остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат-этанол = 10: 10: 1), получают 0.22 г транс-1-бензил-7-хлор-5-(2-хлорфенил)-3-(3- метоксикарбонил-метилкарбaмoил)мeтил-2-оксо-1,2,3,5- тeтpaгидpo-4,1-бензoксазепинa в виде белого порошка.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 3.31 (2H, c,  CO2), 3.74 (3H, c, OCH3), 3.7 - 4.2 (3H, м), 4.8 (1H, д), 5.6 (1H, д), 5.8 (1H, c, C5-H), 6.42 (1H, д, C6-Н), 7.2 -7.8 (1H, м).
CO2), 3.74 (3H, c, OCH3), 3.7 - 4.2 (3H, м), 4.8 (1H, д), 5.6 (1H, д), 5.8 (1H, c, C5-H), 6.42 (1H, д, C6-Н), 7.2 -7.8 (1H, м).
Элементный анализ для C27H24Cl2N2O5•1/2H2O:
Вычислено, %: C 60.46; H 4.70; N 5.22
Найдено, %: C 60.27; H 4.85; N 4.95
Растворяют в 5 мл метанола 0.15 г белого порошка, полученного выше. К раствору прибавляют 0.2 г карбоната калия и 1.5 мл воды, затем смесь перемешивают 2 ч при 50oC. Реакционную смесь концентрируют при пониженном давлении. Концентрат нейтрализуют разбавленной соляной кислотой и экстрагируют этилацетатом. Органический слой промывают водой и сушат, затем отгоняют растворитель при пониженном давлении. Из остатка получают 0.14 г транс-1-бензил-7-хлор-5-(2-хлорфенил)-3-(3-оксикарбонилметилкарбамоил)метил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепина в виде белого порошка.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 3.31 (2H, с, -СО COOH), 3.7 - 4.2 (3H, м), 4.75 (1H, д), 5.62 (1H, д), 5.77 (1H, с, C5-Н), 6.44 (1H, д, C6-H), 7.04 (1H, т, NH), 7.2 -7.7 (11H,м).
COOH), 3.7 - 4.2 (3H, м), 4.75 (1H, д), 5.62 (1H, д), 5.77 (1H, с, C5-Н), 6.44 (1H, д, C6-H), 7.04 (1H, т, NH), 7.2 -7.7 (11H,м).
Элементный анализ для С26H22Cl2N2O5 •1/2H2O:
Вычислено, %: C 59.78; H 4.44; N 5.36
Найдено, %: С 59.47; H 4.69; N 5.13
Пример 46
Транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метанол и 3,5-транс-7-хлор-3-хлорметил-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензoксазепин
В смеси 12 мл ледяной уксусной кислоты и 10 мл воды суспендируют 2.0 г (транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ил)метиламина гидрохлорида, полученного в примере 36. К суспензии прибавляют по каплям при охлаждении льдом и перемешивании 1 мл водного раствора 1.0 г нитрита натрия в течение 10 мин. Реакционную смесь перемешивают 1 ч при комнатной температуре, затем выливают на лед-воду и экстрагируют этилацетатом. Органический слой промывают водным раствором бикарбоната натрия и водой последовательно, затем сушат, растворитель отгоняют при пониженном давлении. Остаток растворяют в 50 мл метанола, затем прибавляют 5 мл 10%-ного водного раствора карбоната калия. Смесь перемешивают 15 мин при 60oC. Реакционную смесь концентрируют при пониженном давлении. Концентрат экстрагируют этилацетатом. Органический слой промывают водой и сушат, затем отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 4:1 до 1: 1). Из первой порции элюата выделяют 0.2 г транс-7-хлор-3-хлорфенил-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепина в виде бесцветных кристаллов с т.пл. 177 - 179oC.
Масс-спектр (м/е): 445 (М+).
Элементный анализ для С23H18Cl3NO2:
Вычислено, %: С 61.83; H 4.06; N 3.14
Найдено, %: C 62.11; H 4.01; N 3.38
Из последующей части элюата выделяют 1.05 г транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метанола в виде бесцветных игл с т.пл. 158 - 159oC.
Масс-спектр (м/е): 427, 429 (М+).
Элементный анализ для С23H19Cl2NO3:
Вычислено, %: C 64.49; H 4.47; N 3.27
Найдено, %: C 64.36; H 4.39; N 3.34
Пример 47
Работают по методике примера 46, получают соединения, приведенные в таблице 35.
Пример 48
Транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо -1,2,3,5-тетрагидро-4,1-бекзоксазепин-3-карбоновая кислота.
Растворяют в 20 мл ацетона 0.5 г транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-oксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метанола, полученного в примере 46. К раствору прибавляют по каплям при перемешивании при комнатной температуре 0.5 мл реактива Джонса. Реакционную смесь 1 ч перемешивают при комнатной температуре, затем концентрируют при пониженном давлении. Концентрат экстрагируют этилацетатом. Органический слой промывают водой и сушат, затем отгоняют растворитель при пониженном давлении. Из остатка получают 0.23 г транс-1-бензил-7-хлор-5-(2- хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-карбоновой кислоты в виде белых кристаллов с т.пл. 177 - 178oC.
Элементный анализ для С23H17Cl2NO4:
Вычислено, %: C 62.46; H 3.87; N 3.17
Найдено, %: C 62.24; H 3.93; N 3.30
Пример 49
Работают по методике примера 48, получают соединения, приведенные в таблице 36.
Пример 50
Этиловый эфир 3-(транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-илметил)тиогликолевая кислота
Растворяют в 6 мл ацетонитрила 0.2 г транс-1-бензил-7-хлор-5-(2-хлорфенил)-3-хлорметил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепина. К раствору прибавляют 0.08 г этилтиогликолята и 0.1 г фторида цезия. Смесь кипятят с обратным холодильником в течение 40 мин при перемешивании. Реакционную смесь концентрируют при пониженном давлении. Концентрат экстрагируют этилацетатом. Органический слой промывают водой и сушат, затем отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 4:1), получают 0.16 г этил-3-[транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-илметил]-тиогликолята в виде бесцветных игл с т. пл. 153 - 154oC.
Элементный анализ для С27H25Cl2NO4S:
Вычислено, %: C 61.13; H 4.75; N 2.64
Найдено, %: C 61.04; H 4.72; N 2.54
Пример 51
3-[Транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-оксазепин-3-илметил]гликолевая кислота
В смеси 4 мл метанола и 2 мл тетрагидрофурана растворяют 0.11 г эфира 3-[транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-илметил] тиогликолевой кислоты. К раствору прибавляют 0.2 г карбоната калия и 2 мл воды, затем смесь перемешивают 1 ч при 60oC. Реакционную смесь концентрируют при пониженном давлении. Концентрат подкисляют разбавленной соляной кислотой, затем экстрагируют этилацетатом. Органический слой промывают водой и сушат, затем отгоняют растворитель при пониженном давлении. Из остатка получают 90 мг 3-(транс-7-хлор-1-бензил-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-илметил)тиогликолевой кислоты в виде белых кристаллов с т.пл. 148 - 149oC.
Элементный анализ для С25H21Cl2NO4S:
Вычислено, %: С 59.77; H 4.21; N 2.79
Найдено, %: С 59.89; H 4.31; N 2.77
Пример 52
3-[Транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-илметил]гликолевая кислота
К суспензии 50 мг гидрида натрия в 4 мл диметилформамида прибавляют 0.2 г транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метанола при перемешивании и охлаждении льдом. Смесь перемешивают 10 мин при этой же температуре, затем прибавляют 0.1 г этилхлорацетата, затем 30 мин перемешивают при этой же температуре. Реакционную смесь выливают в лед-воду и экстрагируют этилацетатом. Органический слой промывают водным раствором бисульфата калия, водным раствором бикарбоната натрия и водой последовательно и сушат, затем отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 5:1), получают кристаллы. Кристаллы растворяют в 5 мл метанола. К раствору прибавляют 0.2 г карбоната калия и 2 мл воды. Смесь перемешивают 5 ч при 60oC. Реакционную смесь концентрируют при пониженном давлении. Подкисляют концентрат разбавленной соляной кислотой, затем экстрагируют этилацетатом. Органический слой промывают водой и сушат, затем отгоняют растворитель при пониженном давлении. Из остатка получают 50 мг 3-[транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-илметил]гликолевой кислоты в виде белых кристаллов с т.пл. 92 - 94oC.
Элементный анализ для С25H21Cl2NO5 • 1/2 C4H10O • 1/2H2O:
Вычислено, %: С 60.91; H 5.11; N 2.63
Найдено, %: C 60.95; H 4.99; N 2.77
Пример 53
Метиловый эфир N-[транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-илкарбонил]триптофан
Работают по методике примера 32, в реакцию вводят 0.4 г 3,5-транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-карбоновой кислоты, полученной в примере 48, получают сырой продукт, который очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат-метиленхлорид = 9:3:1). Из первой порции элюата получают 0.25 г продукта в виде белого порошка.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 3.44 (2H, д), 3.64 (3H, с, OCH3), 4.55 (1H, C3-H), 4.70 (1H, д, PhCH2), 5.03 (1H, м), 5.69 (1H, д, PhCH2), 5.79 (1H, с, С5-H), 6.37 (1H, д, С6-H), 6.9 - 8.2 (15H, м),
Из последующей порции элюата получают 0.22 г целевого соединения в виде аморфного продукта.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 3.2 - 3.55 (2H, м), 3.70 (3H, с, OCH3), 4.53 (1H, с, C3-H), 4.62 (1H, д), 5.06 (1H, м), 5.63 (1H, д), 5.76 (1H, с, С5-H), 6.33 (1H, д, С6-H), 6.8 - 8.4 (15H, м).
Пример 54
N-[транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-илкарбонил]триптофан
Работают по методике примера 34, исходя из этилового эфира N-[транс-1-бензил-7-хлор-5-(2-хлорфенил)-2-оксо-1,2,3,5-тетрагидро-4,1- бензоксазепин-3-илкарбонил]триптофана, полученного в примере 53. Из 0.25 г соединения, полученного в виде первого элюата, получают 70 мг бесцветного кристаллического продукта с т.пл. 250 - 255o (с разл.).
Элементный анализ для C34H27Cl2N3O5 • H2O:
Вычислено, %: C 63.16; H 4.52; N 6.50
Найдено, %: C 63.34; H 4.63; N 6.42
Из 0.22 г соединения, элюированного впоследствии, получают 0.11 г бесцветного аморфного твердого продукта.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 3.40 (2H, м), 4.54 (1H, с), 4.63 (1H, д), 5.05 (1H, м), 5.63 (1H, д), 5.70 (1H, с, C5-H), 6.31 (1H, д, C6-H), 6.8 - 8.4 (15H, м).
Элементный анализ для C34H27Cl2N3O5:
Вычислено, %: C 64.97; H 4.33; N 6.67
Найдено, %: С 64.70; H 4.58; N 6.49
Пример 55
N-(трис-7-хлор-1-изопропил-5-фенил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-илацетил]глицин этиловый эфир
Растворяют в 5 мл метанола 0.3 г этилового эфира 3,5-цис-7-хлор-1-изопропил-5-фенил-1,2,3,5-тетрагидро-2-оксо-4,1-бензоксазепин-3-укусной кислоты, описанного в JPA S57(1982)-35576. К раствору прибавляют 0.3 г карбоната калия и 2 мл воды. Смесь перемешивают 8 ч при комнатной температуре. Реакционную смесь концентрируют при пониженном давлении. К концентрату прибавляют воду, затем экстрагируют эфиром. Водный слой отделяют, добавляют к нему разбавленную соляную кислоту до pH 3. Органический слой промывают водой и сушат, затем отгоняют растворитель при пониженном давлении. Из остатка получают 0.15 г порошкообразного продукта. Продукт и 0.07 г солянокислого этилового эфира глицина растворяют в 4 мл диметилформамида. К раствору прибавляют при перемешивании и охлаждении льдом 0.1 г диэтилфосфороцианидата, а затем 0.2 мл триэтиламина. Реакционную смесь перемешивают 1 ч при комнатной температуре, затем выливают в лед-воду, экстрагируют этилацетатом. Органический слой промывают водным раствором бисульфата калия, водным раствором бикарбоната натрия и водой последовательно, затем сушат. Отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 2:1 до 3:2), получают 0.11 г N-(цис-7-хлор-1-изопропил-5-фенил-2-оксо-1,2,3,5- тетрагидро-4,1-бензоксазепин-3-илацетил)-глицин этилового эфира в виде кристаллического продукта с т. пл. 188-190oC.
Элементный анализ для C24H27ClN2O5:
Вычислено, %: C 62.81; H 5.93; N 6.10
Найдено, %: С 62.52; H 6.10; N 6.04
Пример 56
N-[цис-7-хлор-1-изопропил-5-фенил)-1,2,3,5-тетрагидро-2-оксо-4,1-бензоксазепин-3-илацетил]глицин
В смеси 2 мл метанола и 1 мл воды суспендируют 48 мг этилового эфира N -(транс-7-хлор-1-изопропил-5-фенил-1,2,3,5-тетрагидро-2-оксо-4,1-бензоксазепин-3-илацетил)глицина, полученного в примере 55. К суспензии прибавляют 0.1 г карбоната калия. Смесь перемешивают 6 ч при комнатной температуре. Устанавливают pH реакционной смеси равным 4 с помощью разбавленной соляной кислоты, затем экстрагируют этилацетатом. Органический слой промывают водой и сушат, затем отгоняют растворитель при пониженном давлении. Кристаллы, полученные из остатка, перекристаллизовывают из эфира и гексана, получают 29 мг N-(цис-7-хлор-1-изопропил-5-фенил-1,2,3,5-тетрагидро-2-оксо-4,1-оксазепин-3-илацетил)глицина в виде белых игл.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 2.7 - 3.4 (2H, м), 4.4 (1H, дд, C3-H), 4.75 (1H, д), 5.34 (1H, с, C5-H), 5.5 (1H, д), 6.48 (1H, с, C6-H), 6.9 - 7.6 (12H, м).
Элементный анализ для C24H20ClNO4•3/4H2O:
Вычислено, %: C 66.20; H 4.98; N 3.22
Найдено, %: С 66.12; H 5.19; N 2.97
Пример 57
Этиловый эфир транс-7-хлор-5-(2-хлорфенил)-1-изопропил-2- оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-масляной кислоты
(1) Раствор 0.72 мл оксалилхлорида в 10 мл метиленхлорида охлаждают до -65oC, прибавляют туда по каплям раствор 0.63 мл диметилсульфоксида в 2 мл метиленхлорида в течениe 5 мин, затем 5 мин перемешивают. К смеси прибавляют по каплям в течение 15 мин раствор 2.5 г транс-7-хлор-5-(2-хлорфенил)-1-изопропил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этанола, полученного в примере 47, в 15 мл метиленхлорида, затем 10 мин перемешивают. К полученной смеси прибавляют 3.45 мл триэтиламина в течение 5 мин, затем удаляют охлаждающую баню. Смесь перемешивают 10 мин при комнатной температуре, затем прибавляют 50 мл 1н. соляной кислоты, потом перемешивают. Метиленхлоридный слой сушат над безводным сульфатом магния, а затем отгоняют растворитель при пониженном давлении, получают 2,3 г транс-7-хлор-5-(2-хлорфенил)-1-изопропил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетальдегида в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 1.29 (3H, т, J=7.1 Гц), 1.29 (3H, д, J = 7.0 Гц), 1.56 (3H, д, J =6.8 Гц), 2.7 - 2.85 (2H, м), 3.91 (1H, т, J= 6.5 Гц), 4.19 (2H, к, J=7.1 Гц), 4.75 - 5.0 (1H, м), 5.90 (1H, дт, J=15.6, 1.5 Гц), 6.01 (1H, с), 6.51 (1H, д, J = 2.4 Гц), 6.97 (1H, дт, J = 15.6, 7.2 Гц), 7.2 - 7.8 (6H, м), 9.83 (1H, с).
(2) Растворяют в 20 мл толуола 1.5 г транс-7-хлор-5-(2-хлорфенил)-1-изопропил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетальдегида. К раствору прибавляют 2.0 г (этоксикарбонил-метилен)трифенилфосфорана и перемешивают смесь 3 ч при 90oC. Отгоняют растворитель и очищают остаток хроматографией на колонке с силикагелем (гексан-этилацетат = 10:1), получают 1.28 г этилового эфира транс-7-хлор-5-(2-хлорфенил)-1-изопропил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-кротоновой кислоты в виде призм с т. пл. 126 - 127oC.
ИК-спектр ν
Элементный анализ для C24H25Cl2NO4:
Вычислено, %: С 62.34; H 5.45; N 3.03
Найдено, %: С 62.47; H 5.28; N 3.08
(3) Растворяют в 20 мл этилацетата 0.45 г транс-7-хлор-5-(2-хлорфенил)-1-изопропил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-кротоновой кислоты. К раствору прибавляют 1 г 10%-ного палладия на угле и подвергают смесь каталитическому восстановлению при комнатной температуре и атмосферном давлении. Позволяют поглотиться теоретическому количеству водорода, затем удаляют катализатор и отгоняют этилацетат при пониженном давлении. Остаток кристаллизуют из малого объема гексана, получают 0.37 г этилового эфира 7-транс-7-хлор-5-(2-хлорфенил)-1-изопропил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-масляной кислоты в виде призм с т.пл. 100 - 101oC.
ИК-спектр ν
Элементный анализ для C24H27Cl2NO4:
Вычислено, %: C 62.07; H 5.86; N 3.02
Найдено, %: C 62.35; H 5.93; N 2.95
Пример 58
Транс-7-хлор-5-(2-хлорфенил)-1-изопропил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-масляная кислота
Растворяют в 5 мл этанола 0.25 г этилового эфира транс-7-хлор-5-(2-хлорфенил)-1-изопропил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-масляной кислоты. К раствору прибавляют 4 мл 1H гидроксида натрия, затем смесь перемешивают 30 мин при комнатной температуре. Смесь подкисляют 1H водным раствором соляной кислоты (50 мл), затем экстрагируют 100 мл этилацетата. Этилацетатный слой промывают водой и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении, получают 0,20 г транс-7-хлор-5-(2-хлорфенил)-1-изопропил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-масляной кислоты в виде призм с т.пл. 158 - 160oC.
ИК-спектр ν
Элементный анализ для C22H23Cl2NO4:
Вычислено, %: C 60,56; H 5,31; N 3,21
Найдено, %: C 60,62; H 5,18; N 3,23
Пример 59
Этиловый эфир N-[транс-1-изобутил-2-оксо-5-(о-толил)-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]аминоуксусной кислоты
Работают по методике примера 24, исходя из 0,4 г транс-1-изобутил-2-оксо-5-(о-толил)-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты и солянокислого этилового эфира глицина, получают 0,47 г этилового эфира N-[транс-1-изобутил-2-оксо-5-(о-толил)-1,2,3,5- тетрагидро-4,1-бензоксазепин-3-ацетил]аминоуксусной кислоты в виде игл с т.пл. 137 - 138oC.
ИК-спектр ν
Элементный анализ для C26H32N2O5:
Вычислено, %: C 69,01; H 7,13; N 6,19
Найдено, %: C 69,01; H 7,18; N 6,26
Пример 60
N-[транс-1-изобутил-2-оксо-5-(о-толил)-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]аминоуксусная кислота
Работают по методике примера 35, исходя из 0,3 г этилового эфира N-[транс-1-изобутил-2-оксо-5-(о-толил)-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]аминоуксусной кислоты, полученного в примере 59, проводят гидролиз, получают 0,26 г N-[транс-1-изобутил-2-оксо-5-(о-толил)-1,2,3,5-тетрагидро-4,1- бензоксазепин-3-ацетил]аминоуксусной кислоты в виде призм с т.пл. 220 - 223oC.
ИК-спектр ν
Элементный анализ для C24H26N2O5:
Вычислено, %: C 67,91; H 6,65; N 6,60
Найдено, %: C 67,96; H 6,86; N 6,69
Пример 61
Этиловый эфир N-[транс-5-(2-фторфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]аминоуксусной кислоты
Вводят в реакцию с солянокислым этиловым эфиром глицина 0,4 г транс-5-(2-фторфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученной по методике примера 6, работают по методике примера 24, получают 0,45 г этилового эфира N-[транс-5-(2-фторфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]аминоуксусной кислоты в виде игл с т.пл. 166 - 168oC.
ИК-спектр ν
Элементный анализ для C25H29FN2O5:
Вычислено, %: C 65,78; H 6,40; N 6,14
Найдено, %: C 65,89; H 6,34; N 6,15
Пример 62
N-[транс-5-(2-фторфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]аминоуксусная кислота
Проводят гидролиз 0,3 г этилового эфира N-[транс-5-(2-фторфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро- 4,1-бензоксазепин-3-ацетил]аминоуксусной кислоты, полученного в примере 61, по методике примера 25, получают 0,27 г N-[транс-5-(2-фторфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]аминоуксусной кислоты в виде призм с т.пл. 201 - 203oC.
ИК-спектр ν
Элементный анализ для C23H25FN2O5:
Вычислено, %: C 64,48; H 5,88; N 6,54
Найдено, %: C 64,54; H 5,95; N 6,51
Пример 63
Этиловый эфир N-[транс-1-изобутил-5-(2-метоксифенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]аминоуксусной кислоты
Растворяют в 10 мл N,N-диметилформамида 0,4 г транс-1-изобутил-5-(2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученной в примере 6, и 0,18 г солянокислого этилового эфира глицина. К раствору прибавляют при охлаждении льдом 0,22 г диэтилфосфороцианидата и 0,35 мл триэтиламина. Смесь 30 мин перемешивают при комнатной температуре, затем прибавляют 100 мл воды и 100 мл этилацетата, потом экстрагируют. Этилацетатный слой промывают 1H соляной кислотой и водным раствором бикарбоната натрия, затем сушат над безводным сульфатом магния, отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (гексан-этилацетат - 1:1), получают 0,45 г этилового эфира N-[транс-1-изобутил-5-(2-метоксифенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]аминоуксусной кислоты в виде игл с т.пл. 135 - 137oC.
ИК-спектр ν
Элементный анализ для C26H32N2O6:
Вычислено, %: C 66,65; H 6,88; N 5,98
Найдено, %: C 66,72; H 6,91; N 5,98
Пример 64
N-[транс-1-изобутил-5-(2-метоксифенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]аминоуксусная кислота
Растворяют в 5 мл этанола 0,3 г этилового эфира N-[транс-1-изобутил-5-(2-метоксифенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепина-3-ацетил]аминоуксусной кислоты, полученного в примере 63. К раствору прибавляют 1H гидроксид натрия и перемешивают смесь 15 мин, затем ее подкисляют добавлением 50 мл 1H соляной кислоты, после чего экстрагируют 100 мл этилацетата. Этилацетатный слой промывают водой, затем сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении, получают 0,27 г N-[транс-1-изобутил-5-(2-метоксифенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]аминоуксусной кислоты в виде призм с т.пл. 210 - 211oC.
ИК-спектр ν
Элементный анализ для C24H28N2O6:
Вычислено, %: C 65,44; H 6,41; N 6,36
Найдено, %: C 65,32; H 6,38; N 6,33
Пример 65
Транс-7-хлор-5-(2-хлорфенил)-1-изопропил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этанол
Растворяют в 7 мл тетрагидрофурана 0,5 г транс-7-хлор-5-(2-хлорфенил)-1-изопропил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученной в ссылочном примере 5, и 0,15 мл N-метилморфолина. К раствору прибавляют 0,13 мл этилхлоркарбоната при -10oC и перемешивают смесь 10 мин. К смеси прибавляют 0,15 г боргидрида натрия, затем по каплям прибавляют в течение 5 мин метанол и перемешивают 30 мин при 0oC. Реакционную смесь выливают в 50 мл 1H соляной кислоты, потом экстрагируют 100 мл этилацетата. Этилацетатный слой промывают водным раствором бикарбоната натрия, потом сушат над сульфатом магния, отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, получают 0,41 г транс-7-хлор-5-(2-хлорфенил)-1-изопропил-2-оксо-1,2,3,5-тетрагидро- 4,1-бензоксазепин-3-этанола в виде призм с т.пл. 188 - 189oC.
ИК-спектр ν
Элементный анализ для C20H21Cl2NO3:
Вычислено, %: C 60,92; H 5,37; N 3,55
Найдено, %: C 61,12; H 5,39; N 3,72
Пример 66
Этиловый эфир N-[транс-7-хлор-5-(2-хлорфенил)-1-изопропил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]аминоуксусной кислоты
Растворяют в 10 мл N,N-диметилформамида 0,3 г транс-7-хлор-5-(2-хлорфенил)-1-изопропил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты и 0,12 г солянокислого этилового эфира глицина. К раствору прибавляют при охлаждении льдом 0,15 г диэтилфосфороцианидата и 0,24 мл триэтиламина. Смесь перемешивают 30 мин при комнатной температуре, затем прибавляют 100 мл воды и 100 мл этилацетата, потом экстрагируют. Этилацетатный слой промывают 1H соляной кислотой и водным раствором бикарбоната натрия, затем сушат над безводным сульфатом магния, потом отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке (гексан-этилацетат = 1:1), получают 0,31 г этилового эфира N-[транс-7-хлор-5-(2-хлорфенил)-1-изопропил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]аминоуксусной кислоты в виде игл с т.пл. 197 - 199oC.
ИК-спектр ν
Элементный анализ для C24H26Cl2N2O5:
Вычислено, %: C 58,43; H 5,31; N 5,68
Найдено, %: C 58,73; H 5,33; N 5,80
Пример 67
N-[транс-7-хлор-5-(2-хлорфенил)-1-изопропил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]аминоуксусная кислота
Растворяют в 10 мл этанола 0,2 г этилового эфира N-[транс-7-хлор-5-(2-хлорфенил)-1-изопропил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] аминоуксусной кислоты, полученного в примере 66. К раствору прибавляют 2 мл 1H гидроксида натрия и перемешивают смесь 15 мин. К реакционной смеси прибавляют 100 мл 1H водного раствора соляной кислоты, чтобы сделать раствор кислым, потом экстрагируют 100 мл этилацетата. Этилацетатный слой промывают водой, затем сушат над безводным сульфатом магния, потом отгоняют растворитель при пониженном давлении, получают 0,18 г N-[транс-7-хлор-5-(2-хлорфенил)-1-изопропил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] аминоуксусной кислоты в виде кристаллов с т.пл. 134 - 135oC.
ИК-спектр ν
Элементный анализ для C22H22Cl2N2O5 • 1/2Et2O:
Вычислено, %: C 57,38; H 5,42; N 5,58
Найдено, %: C 57,48; H 5,59; N 5,58
Пример 68
Работают по методике примера 66, получают соединения, приведенные в таблицах 37 и 38 в виде кристаллических или маслообразных продуктов.
Пример 69
Работают по методике примера 67, получают соединения, приведенные в таблицах 39 и 40.
Пример 70
Работают по методике Ссылочного примера 2, получают соединение, приведенное в таблице 41.
В таблице 42 приводятся физико-химические свойства промежуточных продуктов.
Пример 71
Этиловый эфир транс-7-хлор-5-(2,4,6-триметоксифенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты
(1) 2-ацетиламино-5-хлор-2',4',6'-триметоксибензофенон
Раствор 2,41 г 1,3,5-триметоксибензола в 10 мл сухого тетрагидрофурана охлаждают до -78oC и прибавляют по каплям 9,1 мл н-бутиллития (1,58 М раствор в гексане) в течение 10 мин. Этот раствор по каплям прибавляют к раствору 2,0 г 6-хлор-4-метил-4H-3,1-бензоксазин-4-она в 20 мл сухого тетрагидрофурана. Потом смесь перемешивают при 0oC в течение 1 ч, отгоняют растворитель, подкисляют остаток разбавленной соляной кислотой и экстрагируют этилацетатом. Потом промывают экстракт разбавленной соляной кислотой и водным раствором бикарбоната натрия, отгоняют растворитель и остаток хроматографируют на колонке с силикагелем, получают 1,28 г кристаллов. Точка плавления 159 - 160oC.
Элементный анализ для C18H18ClNO5:
Вычислено, %: C 59,44; H 4,99; N 3,85
Найдено, %: C 59,39; H 4,94; N 3,86
(2) 2-амино-5-хлор-2',4',6'-триметоксибензофенон
Смесь 4,7 г 2-ацетиламино-5-хлор-2',4',6'-триметоксибензофенона, 50 мл 6H соляной кислоты и 50 мл этанола кипятят с обратным холодильником в течение 1 ч. Потом отгоняют растворитель при пониженном давлении, остаток подщелачивают водным раствором бикарбоната натрия и экстрагируют этилацетатом. Затем экстракт промывают водой и сушат, удаляют растворитель и остаток хроматографируют на колонке с силикагелем, получают 3,75 г кристаллов.
(3) 2-амино-5-хлор-α-2,4,6-триметоксифенил)бензиловый спирт
К раствору 3,0 г 2-амино-5-хлор-2',4',6'-триметоксибензофенона в 50 мл тетрагидрофурана прибавляют 0,43 г литийалюминий гидрида, затем перемешивают в течение 1 ч. Потом прибавляют воду и экстрагируют раствор этилацетатом, сушат над безводным сульфатом магния, после чего удаляют растворитель при пониженном давлении и хроматографируют остаток на колонке с силикагелем, получают 2,9 г кристаллов.
(4) 5-хлор-α-(2,4,6-триметоксифенил)-2-(неoпентиламино)-бензиловый спирт
После перемешивания раствора 2,5 г 2-амино-5-хлор-α-(2,4,6-триметоксифенил)бензилового спирта, 1,01 мл триметилацетальдегида и 0,56 г уксусной кислоты в 30 мл этанола в течение 1,5 ч прибавляют 0,81 г цианоборгидрида натрия и перемешивают всю ночь. После концентрирования и последующего разбавления водой раствор экстрагируют этилацетатом. После удаления растворителя остаток хроматографируют на колонке с силикагелем, получают 2,2 г кристаллов.
(5) Этиловый эфир 3-[N-(4-хлор-2-(α-окси-2,4,6-триметоксибензил)фенил] -N-неопентилкарбамоил акриловой кислоты
В 30 мл дихлорметана вносят 2,0 г 5-хлор-α-(2,4,6-триметоксифенил)-2-(неопентиламино)бензилового спирта, 0,99 моноэтилового эфира хлорфумаровой кислоты и 0,85 г бикарбоната натрия, смесь перемешивают 30 мин. К реакционной смеси прибавляют воду и органический слой сушат, после чего удаляют растворитель и остаток хроматографируют на колонке с силикагелем, получают 2,5 г масла.
(6) Этиловый эфир транс-7-хлор-5-(2,4,6-триметоксифенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты
В 30 мл этанола вносят 2,5 г этилового эфира 3-[N-4-хлор-2-(α-окси-2,4,6-триметоксибензил)фенил] -N-неопентилкарбамоил-акриловой кислоты и 1,33 г карбоната калия, смесь перемешивают всю ночь при комнатной температуре. После прибавления этилацетата смесь промывают водой и сушат, затем удаляют растворитель и остаток хроматографируют на колонке с силикагелем, получают 2,0 г кристаллов. Т.пл. 154 - 155oC.
Элементный анализ для C22H34ClNO2:
Вычислено, %: C 62,36; H 6,59; N 2,69
Найдено, %: C 62,51; H 6,32; N 2,67
Пример 72
Работают по методике примера 71, получают соединения, приведенные в таблицах 43 и 44.
Пример 73
Работают по методике примера 71 с тем исключением, что используют изобутиловый альдегид вместо триметилацетальдегида, получают соединения, приведенные в таблицах 45 - 47.
Пример 74
Соединения, полученные в примерах 71 и 72, гидролизуют по методике ссылочного примера 5 и примера 2, получают соединения, приведенные в таблицах 48 и 49.
Пример 75
Гидролизуют соединения, полученные в примере 73, по методике cсылочного примера 5 и примера 2, получают соединения, приведенные в таблицах 50 и 51.
Пример 76
н-Бутиловый эфир транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты
Раствор 0,4 г транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученной в примере 2, 0,21 мл н-бутилиодида и 0,21 мл триэтиламина в 5 мл диметилформамида перемешивают всю ночь при комнатной температуре. После добавления этилацетата смесь промывают разбавленной соляной кислотой, водным раствором бикарбоната натрия и водой. Затем раствор сушат, отгоняют растворитель и остаток хроматографируют на колонке с силикагелем, получают 0,25 г кристаллов. Т. пл. 106 - 109oC.
Элементный анализ для C26H31Cl2NO4:
Вычислено, %: C 63,42; H 6,35; N 2,84
Найдено, %: C 63,42; H 6,39; N 2,71
Пример 77
Работают по методике примера 76, получают соединения, приведенные в таблицах 52 - 54.
Пример 78
Фениловый эфир транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты
Растворяют 0,3 г транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученной в примере 2, и 0,072 г фенола в 12 мл дихлорметана и прибавляют 10 мл 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида, потом 1,5 ч перемешивают при комнатной температуре. Реакционную смесь концентрируют, прибавляют этилацетат и смесь промывают водой, затем органический слой сушат и отгоняют растворитель. Остаток хроматографируют на колонке с силикагелем, получают 0,28 г кристаллов. Т. пл. 147 - 148oC.
Элементный анализ для C28H27Cl2NO4:
Вычислено, %: C 65,63; H 5,31; N 2,73
Найдено, %: C 65,55; H 5,45; N 2,46
Пример 79
Соединение, полученное в примере 2, обрабатывают по методике примера 78, получают соединение, приведенное в таблице 55.
Пример 80
Циклогексилтиоэфир транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты
Работают по методике примера 78, исходя из 0,3 г транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученной в примере 2, и 0,09 г циклогексилмеркаптана, получают 0,19 г кристаллического соединения. Т.пл. 157 - 158oC.
Элементный анализ для C28H33Cl2NO3S:
Вычислено, %: C 62,91; H 6,22; N 2,62
Найдено, %: C 62,94; H 6,08; N 2,40
Пример 81
т-Бутиловый эфир транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты
К раствору 1,2 г транса-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученной в примере 2, в 40 мл дихлорметана, прибавляют 10 мл изобутена и 0,1 мл концентрированной серной кислоты, смесь выдерживают при комнатной температуре 3 дня. После концентрирования реакционной смеси прибавляют этилацетат и водный раствор бикарбоната натрия, органический слой промывают водой и сушат, после чего удаляют растворитель и остаток хроматографируют на колонке с силикагелем, получают 1,07 г кристаллов с т.пл. 141 - 142oC.
Элементный анализ C26H31ClNO4:
Вычислено, %: C 63,42; H 6,35; N 2,84
Найдено, %: C 63,52; H 6,37; N 2,80
Пример 82
Карбоксиметиловый эфир транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3.5-тетрагидро-4,1- бензоксазепин-3-уксусной кислоты
Растворяют 0,3 г трет.бутоксикарбонилметилового эфира транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученного в примере 77, в 3 мл трифторуксусной кислоты, и этот раствор выдерживают при комнатной температуре 30 мин. После концентрирования раствора прибавляют этилацетат, затем промывают водой и затем сушат, после чего удаляют растворитель и остаток перекристаллизовывают из петролейного эфира, получают 0,24 г кристаллов с т.пл. 186 - 190oC.
Элементный анализ для C24H25Cl2NO6 • 1/2H2O:
Вычислено, %: C 57,27; H 5,21; N 2,78
Найдено, %: C 57,38; H 5,05; N 2,78
Пример 83
Метиловый эфир 2-[транс-7-хлор-5-(2-хлорфенил)-1-изопропил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]аминобензойной кислоты
Растворяют 0,35 г транс-7-хлор-5-(2-хлорфенил)-1-изопропил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученной в cсылочном примере 5, в 10 мл толуола, прибавляют 0,63 мл тионилхлорида, затем 30 мин перемешивают при 90oC. Раствор концентрируют и растворяют остаток в 10 мл дихлорметана, прибавляют 0,13 мл метилового эфира 2-аминобензойной кислоты и 0,14 мл триэтиламина, затем 30 мин перемешивают при комнатной температуре. После концентрирования раствора прибавляют этилацетат и промывают смесь разбавленной соляной кислотой, водным раствором бикарбоната натрия и водой. Удаляют растворитель и остаток хроматографируют на колонке с силикагелем, получают 0,25 г кристаллов. Т. пл. 188 - 190oC.
Элементный анализ для C28H26Cl2N2O5:
Вычислено, %: C 62,11; H 4,91; N 5,24
Найдено, %: C 61,94; H 4,91; N 5,24
Пример 84
Работают по методике примера 83, получают соединения, приведенные в таблицах 56 и 57.
Пример 85
2-[транс-7-хлор-5-(2-хлорфенил)-1-изопропил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]аминобензойной кислоты
Проводят гидролиз 0,15 г метилового эфира 2-[транс-7-хлор-5-(2-хлорфенил)-1-изопропил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]аминобензойной кислоты, полученного в примере 83, по методике примера 34, получают 0,11 г кристаллов с т.пл. 208 - 211oC.
Элементный анализ для C27H24Cl2N2O5:
Вычислено, %: C 61,49; H 4,59; N 5,31
Найдено, %: C 61,22; H 4,68; N 5,35
Пример 86
Проводят гидролиз соединения, полученных в примере 84, по методике примера 34, получают соединения, приведенные в таблице 58.
Пример 87
Этиловый эфир 4-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] аминобензойной кислоты
Работают по методике примера 83, исходя из 0,6 г транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученной в примере 2, и 0,27 г этилового эфира 4-аминобензойной кислоты, получают 0,43 г кристаллов с т.пл. 218 - 220oC.
Элементный анализ для C31H32Cl2N2O5:
Вычислено, %: C 63,81; H 5,53; N 4,80
Найдено, %: C 63,79; H 5,38; N 4,70
Пример 88
Работают по методике примера 82, получают соединения, приведенные в таблицах 59 и 60.
Пример 89
Соединения, полученные в примерах 87 и 88, обрабатывают по методике примеров 24 и 82, получают соединения, приведенные в таблицах 61 и 62.
Пример 90
Транс-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетамид
Растворяют 1,0 г транс-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты и 0,5 г хлористого аммония в 8 мл диметилформамида, и прибавляют 0,46 г 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида и 0,7 мл триэтиламина, затем 30 мин перемешивают при комнатной температуре. После добавления воды раствор экстрагируют этилацетатом, потом промывают водой, после чего отгоняют растворитель и перекристаллизовывают остаток, получают 0,75 г кристаллов с т.пл. 271 - 272oC.
Элементный анализ для C21H22Cl2N2O3:
Вычислено, %: C 59,87; H 5,26; N 6,65
Найдено, %: C 59,91; H 5,33; N 6,91
Пример 91
Работают по методике примера 90, исходя из соединения, полученного в примере 2 и ссылочном примере 5, и различных аминов, получают соединения, приведенные в таблицах 63 - 67.
Пример 92
Этиловый эфир 7-хлор-5-(2-хлорфенил)-1-изобутил-5-метил-1,2,3,5-тетрагидро-4-бензоксазепин-3-уксусной кислоты
(1) 4-хлор-2-[α-окси-α-метил-(2-хлорфенил)метил]анилин
Прибавляют по каплям тетрагидрофурановый раствор реактива Гриньяра, приготовленного из 0,45 г магния и 1,2 г метилиодида, к раствору 2,0 г 2-амино-5-хлор-2'-хлорбензофенона в 20 мл тетрагидрофурана. После кипячения с обратным холодильником в течение 10 мин смесь охлаждают водой и прибавляют насыщенный водный раствор хлористого аммония, смесь экстрагируют этилацетатом. Отгоняют растворитель и остаток хроматографируют на колонке с силикагелем, получают 1,5 г масла.
1H-ЯМР-спектр (CDCl3) δ: 2,04 (3H, с, CH3), 7,0 - 7,8 (7H, м).
(2) N-изобутил-4-хлор-2-[α-оксо-α-метил-(2-хлорфенил)метил] анилин
К раствору 1,2 г 4-хлор-2-[α-оксо-α-метил-(2-хлорфенил)-метил]анилин и 0,32 г изобутилальдегида в 8 мл уксусной кислоты, прибавляют 0,25 г боргидрида натрия, затем 40 мин перемешивают при комнатной температуре. После прибавления воды реакционную смесь экстрагируют этилацетатом, потом отгоняют растворитель и остаток хроматографируют на колонке с силикагелем, получают 1,4 г масла.
1H-ЯМР-спектр (CDCl3) δ: 0,75, 0,80 (6H, каждый, д, CH3), 1,67 (1H, м), 1,99 (3H, с, CH3), 2,74 (2H, д), 7,05 - 7,8 (7H, м).
(3) Этиловый эфир 3-[N-хлор-2-[α-окси метил-(2-хлорфенил) метил]фенил] -N-изобутилкарбамоил]акриловая кислота
метил-(2-хлорфенил) метил]фенил] -N-изобутилкарбамоил]акриловая кислота
Растворяют 1,4 г N-изобутил-4-хлор-2-[α-оксо-α-метил-(2-хлорфенил)метил] анилина в 15 мл дихлорметана и прибавляют 0,7 г бикарбоната натрия, после чего прибавляют по каплям раствор 0,68 г монометилового эфира хлорфумаровой кислоты в 4 мл дихлорметана в течение 20 мин. После промывки смеси водой и сушки отгоняют растворитель и остаток хроматографируют на колонке с силикагелем, получают 0,65 г кристаллов с т.пл. 153 - 154oC.
Элементный анализ для C24H27Cl2NO4:
Вычислено, %: C 62,07; H 5,86; N 3,02
Найдено, %: C 62,19; H 5,86; N 2,90
(4) Этиловый эфир 7-хлор-3-(2-хлорфенил)-1-изобутил-5-метил-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты
1,0 г этилового эфира 3-[N-хлор-2-[α-окси-α-(2-хлор-фенилметил)фенил]-N-изобутилкарбамоил] акриловой кислоты растворяют в 10 мл этанола и прибавляют 0,35 г карбоната калия, потом 12 ч перемешивают. После добавления воды реакционную смесь экстрагируют этилацетатом и сушат, отгоняют растворитель и остаток хроматографируют на колонке с силикагелем, получают 0,8 г кристаллов, т.пл. 119 - 120oC.
Элементный анализ для C24H27Cl2NO4:
Вычислено, %: C 62,07; H 5,86; N 3,02
Найдено, %: C 62,08; H 5,93; N 2,98
Пример 93
7-Хлор-5-(2-хлорфенил)-1-изобутил-5-метил-1,2,3,5-тетрагидро-2-оксо-4,1-бензоксазепин-3-уксусная кислота
Растворяют 0,3 г этилового эфира 7-хлор-5-(2-хлорфенил)-1-изобутил-5-метил-1,2,3,5-тетрагидро-2-оксо-4,1-бензоксазепин-3-уксусной кислоты в 10 мл метанола и прибавляют 2 мл 10%-ного водного раствора карбоната калия, затем 40 мин перемешивают при 70oC. После подкисления разбавленной соляной кислотой реакционную смесь экстрагируют этилацетатом. После сушки экстракта удаляют растворитель и остаток перекристаллизовывают из этилацетата-гексана, получают 0,16 г кристаллов с т.пл. 153 - 154oC.
Элементный анализ для C22H23Cl2NO4:
Вычислено, %: C 60,56; H 5,31; N 3,21
Найдено, %: C 60,59; H 5,32; N 2,92
Ссылочный пример 9
Этиловый эфир транс-7-хлор-5-(2-хлорфенил)-1-(2,2,2-трифторэтил)-1,2,3,5-тетрагидро-2-оксо-4,1-бензоксазепин-3-уксусной кислоты
(1) 5-хлор-α-(2-хлорфенил)-2-трифторацетиламино бензиловый спирт
К раствору 1,0 г 2-амино-5-хлор-α-(2-хлорфенил)бензилового спирта в 12 мл дихлорметана прибавляют раствор 0,8 г безводной трифторуксусной кислоты в 2 мл дихлорметана. После реакции прибавляют водный раствор бикарбоната натрия и органический слой сушат, после чего удаляют растворитель и остаток перекристаллизовывают из гексана, получают 1,3 г кристаллов.
(2) 5-хлор-α-(2-хлорфенил)-2-(2,2,2-трифторэтиламино) бензиловый спирт
К суспензии 0,25 г литийалюминийгидрида в 20 мл абсолютного этилового эфира прибавляют по каплям раствор 1,2 г 5-хлор-α-(2-хлорфенил)-2-(трифторацетиламино)бензилового спирта в 5 мл тетрагидрофурана. После перемешивания смеси при комнатной температуре в течение 1 ч органический слой сушат, потом отгоняют растворитель и остаток хроматографируют на колонке с силикагелем, получают 1,0 г масла.
(3) Этиловый эфир 3-[N-[4-хлор-2-α-окси-2-хлорфенилметил)-фенил] -N-(2,2,2-трифторэтил)карбамоил]акриловой кислоты
Работают по методике ссылочного примера 1, исходя из 5-хлор-α-(2-хлорфенил)-2-(2,2,2-трифторэтиламино)бензилового спирта и монометилового эфира хлорфумаровой кислоты, получают масло.
(4) Этиловый эфир транс-7-хлор-5-(2-хлорфенил)-1-(2,2,2-трифторэтил)-1,2,3,5-тетрагидро-2-оксо-4,1-бензоксазепин-3-уксусной кислоты.
Этиловый эфир 3-[N-[4-хлор-2-α-окси-2-хлорфенилметил)-фенил]-N-(2,2,2-трифторэтил)карбоксил] акриловой кислоты обрабатывают по методике ссылочного примера 2, получают кристаллы с т.пл. 163 - 164oC.
Элементный анализ для C21H18Cl2NO4F3:
Вычислено, %: C 52,96; H 3,81; N 2,94
Найдено, %: C 52,93; H 3,88; N 2,91
Ссылочный пример 10
Работают по методикам ссылочных примеров 2 и 9, получают соединения, приведенные в таблице 68.
Пример 94
Работают по методикам ссылочных примеров 2 и 9, получают соединения, приведенные в таблице 69.
Ссылочный пример 11
Обрабатывают соединения, полученные в ссылочных примерах 9 и 10, по методике ссылочного примера 4, получают соединения, приведенные в таблице 70.
Пример 95
Соединения, полученные в примере 94, обрабатывают по методике cсылочного примера 4, получают соединения, приведенные в таблице 71.
Физико-химические свойства промежуточных продуктов, полученных в ссылочных примерах 9 и 10 и примере 94, представлены в таблицах 72 и 73.
Пример 96
Этиловый эфир транс-7-хлор-5-(2-хлорфенил)-1-неопентил-1,2,3,5-тетрагидро-2-оксо-4,1-бензоксазепин-3-пропионовой кислоты
(1) Транс-7-хлор-5-(2-хлорфенил)-3-(2-цианоэтил)-1-неопентил-1,2,3,5-тетрагидро-2-оксо-4,1-безоксазепин
Суспендируют 0,3 г 7-хлор-3-(2-хлорэтил)-5-(2-хлорфенил)-1-неопентил-1,2,3,5-тетрагидро-2-оксо-4,1-бензоксазепин и 0,1 г цианида натрия суспендируют в 6 мл диметилсульфоксида, затем 1 ч перемешивают при 100oC. Добавляют воду и суспензию экстрагируют этилацетатом, после чего отгоняют растворитель и остаток хроматографируют в колонке на силикагеле, получают 0,25 г кристаллов, т.пл. 194-195oC.
Элементный анализ для C23H24Cl2N2O2:
Вычислено, %: C 64,04; H 5,61; N 6,49
Найдено, %: C 63,96; H 5,55; N 6,66
(2) Этиловый эфир транс-7-хлор-5-(2-хлорфенил)-1-неопентил-1,2,3,5-тетрагидро-2-оксо-4,1-бензоксазепин-3-пропионовой кислоты
К 0,2 г транс-7-хлор-5-(2-хлорфенил)-3-(2-цианоэтил)-1-неопентил-1,2,3,5-тетрагидро-2-оксо-4,1-бензоксазепина прибавляют 6 мл этанольного раствора 6H хлористого водорода, затем 6 ч кипятят с обратным холодильником. После удаления растворителя прибавляют воду и этилацетат, органический слой сушат, удаляют растворитель и остаток хроматографируют на колонке с силикагелем, получают 0,18 г кристаллов с т.пл. 130 - 131oC.
Элементный анализ для C25H29Cl2NO4:
Вычислено, %: C 62,76; H 6,11; N 2,93
Найдено, %: C 62,78; H 6,12; N 2,68
Пример 97
Транс-7-хлор-5-(2-хлорфенил)-1-неопентил-1,2,3,5-тетрагидро-2-оксо-4,1-бензоксазепин-3-пропионовая кислота
90 мг этилового эфира транс-7-хлор-5-(2-хлорфенил)-1-неопентил-1,2,3,5-тетрагидро-2-оксо-4,1-бензоксазепин-3-пропионовой кислоты, полученной в примере 96, обрабатывают по методике cсылочного примера 4, получают 80 мг кристаллов с т.пл. 225-227oC.
Элементный анализ для C23H25Cl2NO4:
Вычислено, %: C 61,34; H 5,60; N 3,11
Найдено, %: C 61,34; H 5,65; N 2,89
Пример 98
Транс-7-хлор-5-(2-хлорфенил)-1-изобутил-1,2,3,5-тетрагидро-2-оксо-4,1-бензоксазепин-3-этанол
Работают по методике примера 65, исходя из транс-7-хлор-5-(2-хлорфенил)-1-изобутил-1,2,3,5-тетрагидро-2-оксо-4,1-бензоксазепин-3-уксусной кислоты, полученной в примере 2, получают 1,5 г кристаллов.
Пример 99
Этиловый эфир 3-[транс-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-илэтил]тиогликолевой кислоты
(1) Транс-7-хлор-3-(2-хлорэтил)-5-(2-хлорфенил)-1-изобутил-1,2,3,5-тетрагидро-2-оксо-4,1-бензоксазепин
Растворяют 1,0 г транс-7-хлор-5-(2-хлорфенил)-1-изобутил-1,2,3,5-тетрагидро-2-оксо-4,1-бензоксазепин-3-этанола, полученного в примере 98, в 25 мл толуола и прибавляют 0,1 мл пиридина и 0,4 мл тионилхлорида, затем перемешивают 30 мин при 100oC. После удаления растворителя при пониженном давлении остаток растворяют в этилацетате и промывают водным раствором бикарбоната натрия и сушат, после удаления растворителя остаток хроматографируют на колонке с силикагелем, получают 0,8 г кристаллов с т.пл. 138-140oC.
Элементный анализ для C21H22Cl3NO2:
Вычислено, %: C 59,10; H 5,20; N 3,28
Найдено, %: C 59,17; H 5,22; N 2,25
(2) Этиловый эфир 3-[транс-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-илэтил]тиогликолевой кислоты
Прибавляют 0,15 г транс-7-хлор-3-(2-хлорэтил)-5-(2-хлорфенил)-1-изобутил-1,2,3,5-тетрагидро-2-оксо-4,1-безоксазепина, 0,08 г этилового эфира тиогликолевой кислоты и 0,1 г фторида цезия к 5 мл ацетонитрила, затем кипятят с обратным холодильником в течение 40 мин. После добавления ледяной воды и экстракции этилацетатом органический слой сушат, удаляют растворитель и остаток хроматографируют на колонке с силикагелем, получают 0,17 г масла.
1H-ЯМР-спектр (CDCl3) δ: 0,93 1,03 (6H, каждый, д), 1,26 (3H, т), 1,8-2,4 (3H, м), 2,8 (2H, м), 3,19 (2H, с), 3,42 (1H, дд), 4,0-4,4 (4H, м), 6,12 (1H, с), 6,51 (1H, д), 7,2-7,8 (6H, м).
Пример 100
3-[транс-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ил]тиогликолевая кислота
Работают по методике примера 51, исходя из 0,17 г этилового эфира 3-[транс-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-илэтил] тиогликолевой кислоты, полученного в примере 99, получают 0,18 г кристаллов с т.пл. 194-195oC.
Элементный анализ для C23H25Cl2NO4S:
Вычислено, %: C 57,26; H 5,22; N 2,90
Найдено, %: C 57,27; H 5,20; N 2,96
Пример 101
3-[транс-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-илэтил]сульфонилуксусной кислота
Растворяют 0,18 г этилового эфира 3-[транс-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-илэтил] тиогликолевой кислоты в 8 мл дихлорметана, полученного в примере 99, и прибавляют 0,25 г м-хлорпербензойной кислоты, затем перемешивают 1 ч. К реакционной смеси прибавляют водный раствор бикарбоната натрия, затем промывают и сушат органический слой, удаляют растворитель, после чего остаток хроматографируют на колонке с силикагелем, получают 0,18 г масла, которое затем подвергают процедуре гидролиза этилового эфира по методике примера 51, получают 0,13 г кристаллов с т.пл. 171-172oC.
Элементный анализ для C23H25Cl2NO6S:
Вычислено, %: C 5,70; H 4,90; N 2,72
Найдено, %: C 53,62; H 4,95; N 2,68
Пример 102
Транс 7-хлор-5-(2-хлорфенил)-1-неопентил-3-[3-(тетразол-5-ил)-фениламинокарбонилметил]-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин
(1) Транс 7-хлор-5-(2-хлорфенил)-3-(3-цианофениламинокарбонилметил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин
К раствору 0,5 г транс-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученной в примере 2, и 0,15 г м-цианоанилина в 10 мл дихлорметана прибавляют 0,35 г 1-этил-3-(диметиламинопропил)карбодиимида гидрохлорида и 20 мг диметиламинопиридина, затем перемешивают при комнатной температуре 4 ч. Раствор концентрируют и растворяют остаток в этилацетате, потом промывают водой, после чего удаляют растворитель и остаток хроматографируют на колонке с силикагелем, получают 0,48 г кристаллов с т.пл. 213 - 214oC.
Элементный анализ для C29H27Cl2N3O3:
Вычислено, %: C 64,93; H 5,07; N 7,83
Найдено, %: C 64,68; H 4,96; N 7,90
(2) Транс-7-хлор-5-(2-хлорфенил)-1-неопентил-3-[3-тетразол-5-ил) фениламинокарбонилметил]-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин
Раствор 0,2 г транс-7-хлор-5-(2-хлорфенил)-3-(3- цианофениламинокарбонилметил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепина и 80 мг азида натрия в 5 мл диметилформамида перемешивают 60 ч при 90oC. После добавления воды смесь промывают водой, после чего удаляют растворитель и остаток хроматографируют на колонке с силикагелем, получают 0,11 г кристаллов с т.пл. 218-220oC.
Элементный анализ для C29H28Cl2N6O3:
Вычислено, %: C 59,64; H 4,92; N 14,39
Найдено, %: C 59,44; H 4,87; N 14,30
Пример 103
Транс-7-хлор-5-(2-хлорфенил)-1-неопентил-3-[4-(тетразол-5-ил) фениламинокарбонилметил]-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин. Целевое соединение синтезируют по методике примера 102.
(1) Транс-7-хлор-5-(2-хлорфенил)-3-(4-цианофениламинокарбонилметил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин. Т.пл. 257-259oC.
Элементный анализ для C29H27Cl2N3O3 • 1/4H2O:
Вычислено, %: C 64,39; H 5,12; N 7,77
Найдено, %: C 64,33; H 5,13; N 7,64
(2) Транс-7-хлор-5-(2-хлорфенил)-1-неопентил-3-[4-(тетразол-5-ил) фениламинокарбонилметил] -оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин. Т.пл. 206 - 210oC.
Элементный анализ для C29H28Cl2N6O3 • 1/4 H2O:
Вычислено, %: C 59,64; H 4,92; N 14,39
Найдено, %: C 59,71; H 4,96; N 14,34
Пример 104
Транс-7-хлор-5-(2-хлорфенил)-1-изопропил-3-[(тетразол-5-ил) метиламинокарбонилметил]-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин
(1) Транс-7-хлор-5-(2-хлорфенил)-3-(цианометиламинокарбонилметил)-1-изопропил- 2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин
Растворяют 0,3 г транс-7-хлор-5-(2-хлорфенил)-1-изопропил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученной в cсылочном примере 5, и 0,1 г сернокислой соли аминоацетонитрила в 5 мл диметилформальдегида, прибавляют 0,18 диэтилфосфороцианидата и 0,17 мл триэтиламина, потом 1 ч перемешивают при комнатной температуре. После добавления воды смесь экстрагируют этилацетатом, промывают водой и затем сушат. После удаления растворителя остаток хроматографируют на колонке с силикагелем, получают 0,31 г кристаллов с т.пл. 216 - 217oC.
Элементный анализ для C22H21Cl2N3O3:
Вычислено, %: C 59,20; H 4,74; N 9,41
Найдено, %: C 58,92; H 4,68; N 9,12
(2) Транс-7-хлор-5-(2-хлорфенил)-1-изопропил-3-[(тетразол-5-ил) метиламинокарбонилметил]-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин
Транс-7-хлор-5-(2-хлорфенил)-3-(цианометиламинокарбонилметил)-1-изопропил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин и азид натрия обрабатывают по методике примера 102, получают кристаллы с т.пл. 253 - 254oC.
Элементный анализ для C22H22Cl2N6O3:
Вычислено, %: C 54,00; H 4,53; N 17,17
Найдено, %: C 53,85; H 4,68; N 17,02
Пример 105
Транс-7-хлор-5-(2-хлорфенил)-1-изобутил-3-[(тетразол-5-ил) метиламинокарбонилметил]-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин
Транс-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-усусную кислоту, полученную в примере 2, обрабатывают по методике примера 102 и 104, получают кристаллическое соединение
(1) Транс-7-хлор-5-(2-хлорфенил)-3-(цианометиламинокарбонилметил)-1- изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин. Т.пл. 168-169oC
Элементный анализ для C23H23Cl2N3O3:
Вычислено, %: C 60,01; H 5,04; N 9,13
Найдено, %: C 60,11; H 5,28; N 9,15
(2) Транс-7-хлор-5-(2-хлорфенил)-1-изобутил-3-[(тетразол-5-ил)метиламинокарбонилметил] -2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин. Т. пл. 234 - 235oC.
Элементный анализ для C23H24Cl2N6O3:
Вычислено, %: C 54,88; H 4,81; N 16,69
Найдено, %: C 55,07; H 4,84; N 16,92
Пример 106
Транс-7-хлор-5-(2-хлорфенил)-1-изобутил-3-[(тетразол-5-ил)метил] -2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин
(1) Транс-7-хлор-5-(2-хлорфенил)-3-цианометил-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин
Растворяют 0,5 г транс-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетамида, полученного в примере 91, 0,38 г карбонилдиимидазола и 1,14 г аллилбромида в 10 мл ацетонитрила, затем 4 ч кипятят с обратным холодильником. Раствор концентрируют и прибавляют этилацетат, потом промывают водой, после чего отгоняют растворитель и остаток хроматографируют на колонке с силикагелем, получают 0,44 г кристаллов с т.пл. 158 - 159oC.
Элементный анализ для C21H20Cl2N2O2:
Вычислено, %: C 62,54; H 5,00; N 6,95
Найдено, %: C 62,68; H 5,13; N 7,22
(2) Транс-7-хлор-5-(2-хлорфенил)-1-изобутил-3-[(тетразол-5-ил)метил] -2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин
Работают по методике примера 102, исходя из 0,2 г транс-7-хлор-5-(2-хлорфенил)-3-цианометил-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепина, получают 90 мг кристаллов с т.пл. 202 - 203oC.
Элементный анализ для C21H21Cl2N5O2:
Вычислено, %: C 56,51; H 4,74; N 15,69
Найдено, %: C 56,29; H 4,70; N 15,67
Пример 107
Транс-7-хлор-5-(2-хлорметил)-1-изобутил-3-[2-(тетразол-5-ил)этил]-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин
(1) Транс-7-хлор-5-(2-хлорфенил)-1-изобутил-3-(2-цианоэтил)-1- изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин
Прибавляют 0,5 г транс-7-хлор-3-(2-хлорэтил)-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепина, полученного в примере 99, и 0,4 г цианида натрия к 8 мл диметилсульфоксида, затем перемешивают 40 мин при 100oC. После добавления воды реакционную смесь экстрагируют этилацетатом, органический слой промывают водой и сушат, после чего удаляют растворитель и остаток хроматографируют в колонке с силикагелем, получают 0,45 г масла.
1H-ЯМР-спектр (CDCl3) δ: 0,93, 1,03 (6H, каждый, д), 1,85 - 2,4 (3H, м), 2,59 (2H, т), 3,43 (1H, дд), 4,05 (1H, дд), 4,33 (1H, дд), 6,14 (1H, с), 6,53 (1H, д), 7,3 - 7,8 (6H, м).
(2) Транс-7-хлор-5-(2-хлорфенил)-1-изобутил-3-[2-(тетразол-5-ил)этил]-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин
Работают по методике примера 102, исходя из транс-7-хлор-5-(2-хлорфенил)-3-(2-цианоэтил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепина, получают 0,22 г кристаллов с т.пл. 125 - 127oC.
Элементный анализ для C22H23Cl2N5O2:
Вычислено, %: C 57,40; H 5,04; N 15,21
Найдено, %: C 57,15; H 5,26; N 14,97
Пример 108
Транс-7-хлор-5-(2-хлорфенил)-3-[2-(4,5-дигидро-5-оксо-1,2,4-оксадиазол-3-ил)этил]-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин
В 5 мл этанола прибавляют 0,25 г транс-7-хлор-5-(2-хлорфенил)-3-(2-цианоэтил)-1-изобутил-1,2,3,5-тетрагидро-2-оксо-4,1-бензоксазепина, полученного в примере 107, 120 мг солянокислого гидроксиламина и 0,23 г карбоната натрия, потом 18 ч кипятят с обратным холодильником. После удаления растворителя добавляют этилацетат, смесь промывают водой и сушат, после удаления растворителя остаток перекристаллизовывают из этилацетата. Т. пл. 212 - 214oC.
Элементный анализ для C22H25Cl2N3O3:
Вычислено, %: C 58,67; H 5,60; N 9,33
Найдено, %: C 58,84; H 5,68; N 9,24
К 5 мл этилацетата прибавляют 0,1 г этого амидоксима, 0,1 г карбонилдиимидазола и 0,5 мл триэтиламина, потом кипятят с обратным холодильником 24 ч. Раствор концентрируют и остаток растворяют в этилацетате, промывают водой и сушат, после чего удаляют растворитель и остаток перекристаллизовывают из этилацетата, получают 85 мг кристаллов с т.пл. 241 - 242oC.
Элементный анализ для C22H23Cl2N3O4:
Вычислено, %: C 57,99; H 4,87; N 8,82
Найдено, %: C 57,79; H 5,07; N 9,00
Пример 109
Трет.бутиловый эфир N-[(3S,5R)-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] -L-аланина и трет.бутиловый эфир N-[(3R, 5S)-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]-L-аланина
В 20 мл N,N-диметилформамида растворяют 0,5 г транс-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1- бензоксазепин-3-уксусной кислоты, полученной в примере 2, и 0,26 г солянокислого трет.бутилового эфира аланина, при охлаждении льдом к этому раствору прибавляют 0,26 г диэтилфосфороцианидата и 0,41 мл триэтиламина. После 30 мин перемешивания при комнатной температуре проводят экстракцию, добавляя 100 мл воды и 150 мл этилацетата. Этилацетатный слой промывают 5%-ным водным раствором бисульфата калия и бикарбоната натрия, и после сушки над безводным сульфатом магния его разгоняют при пониженном давлении. Остаток затем очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 2:1), чтобы получить в виде первой фракции 0,17 г трет.бутилового эфира N-[(3S,5R)-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] -L-аланина в виде пластинчатых кристаллов с т.пл. 146 - 147oC.
Элементный анализ для C28H34Cl2N2O5:
Вычислено, %: C 61,20; H 6,24; N 5,10
Найдено, %: C 61,20; H 6,33; N 5,15
Так же в виде второй фракции получают 0,22 г трет-бутилового эфира N-[(3R, 5S)-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]-L-аланина в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 0,93 (3H, дд, J = 6,8 Гц), 1,03 (3H, д, J = 6,8 Гц), 1,34 (3H, т, J = 7,0 Гц), 1,46 (9H, с, т.Вu), 1,85 - 2,1 (1H, м), 2,71 (1H, дд, J = 14,6, 6,2 Гц), 2,89 (1H, дд, J = 14,6, 7,2 Гц), 3,43 (1H, дд, J = 14,0, 5,4 Гц), 4,25 - 4,55 (3H, м), 6,13 (1H, с), 6,31 (1H, шир, HH), 6,51 (1H, д, J = 2,2 Гц), 7,2 - 7,85 (6H, м).
Пример 110
N-[(3S, 5R)-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]-L-аланин
В 10 мл 4H раствора соляной кислоты в диоксане растворяют 0,16 г трет-бутилового эфира N-[(3S, 5R)-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] -L-аланина, полученного в примере 109, и раствор всю ночь перемешивают при комнатной температуре. После разгонки при пониженном давлении проводят кристаллизацию из гексана-диэтилового эфира, получают 0,12 г N-[(3S,5R)-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5- тетрагидро-4,1-бензоксазепин-3-ацетил] -L-аланина в виде порошкообразного продукта.
Элементный анализ для C24H26Cl2N2O5:
Вычислено, %: C 58,43; H 5,31; N 5,68
Найдено, %: C 58,43; H 5,65; N 5,54
1H-ЯМР-спектр (200 МГц, d6-ДМСО) δ: 0,89 (3H, д, J = 6,8 Гц), 0,94 (3H, д, J = 6,6 Гц), 1,25 (3H, д, J = 7,2 Гц), 1,7 - 1,9 (1H, м), 2,4 - 2,55 (2H, м), 3,58 (1H, дд, J = 14,0, 5,0 Гц), 4,1 - 4,4 (3H, м), 5,99 (1H, с), 6,30 (1H, д, J = 2,4 Гц), 7,45 - 7,8 (4H, м), 8,33 (1H, д, J = 7,6 Гц), 12,53 (1H, шир, HH).
Пример 111
N-[(3R, 5S)-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]-L-аланин
В 10 мл 4H раствора соляной кислоты в диоксане растворяют 0,2 г трет. бутилового эфира N-[(3R, 5S)-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] -L-аланина, полученного в примере 109, и перемешивают смесь 4 ч при комнатной температуре. После разгонки при пониженном давлении проводят кристаллизацию из гексана-диэтилового эфира, получают 0,17 г N-[(3R,5S)-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро- 4,1-бензоксазепин-3-ацетил]-L-аланина в виде пластинчатых кристаллов с т.пл. 120 - 124oC.
Элементный анализ для C24H26Cl2N2O5•1/2H2O:
Вычислено, %: C 57,37; H 5,42; N 5,57
Найдено, %: C 57,37; H 5,69; N 5,48
Пример 112
Метиловый эфир (R)-O-[(3R, 5S)-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] -молочной кислоты и метиловый эфир (R)-O-[(3S, 5R)-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]молочной кислоты
В 50 мл метиленхлорида растворяют 2,0 г транс-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученной в примере 2, и 0,59 г метилового эфира (R)-молочной кислоты, к этому раствору прибавляют 1,09 г 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида и 0,2 г 4-диметиламинопиридина, перемешивают смесь 1,5 ч при комнатной температуре. Реакционную смесь промывают 1H растворами водными соляной кислоты и бикарбоната натрия, после сушки над безводным сульфатом магния отгоняют растворитель при пониженном давлении. Отделяют остаток и очищают его хроматографией на колонке с силикагелем (элюент: гексан-диэтиловый эфир = 3:1), получают в виде первой фракции 0,46 г метилового эфира (R)-O-[(3S, 5R)-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]-молочной кислоты в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 0,93 (3H, д, J = 6,8 Гц), 1,02 (3H, д, J = 6,6 Гц), 1,49 (3H, д, J = 7,2 Гц), 1,85 - 2,1 (1H, м), 2,91 (1H, дд, J = 17,0, 5,4 Гц), 3,72 (3H, с), 4,31 (1H, дд, J = 13,8, 8,4 Гц), 3,19 (1H, дд, J = 17,0, 8,0 Гц), 3,44 (1H, дд, J = 13,8, 5,4 Гц), 4,44 (1H, дд, J = 8,0, 5,4 Гц), 5,07 (1H, к, J = 7,2 Гц), 6,14 (1H, с), 6,52 (1H, д, J = 2,2 Гц), 7,2 - 7,8 (6H, м).
В виде второй фракции получают 0,63 г метилового эфира (R)-O-[(3R,5S)-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]-молочной кислоты в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 0,93 (3H, д, J = 6,8 Гц), 1,03 (3H, д, J = 6,6 Гц), 1,48 (3H, д, J = 7,0 Гц), 1,85 - 2,1 (1H, м), 2,93 (1H, дд, J = 16,8, 7,2 Гц), 3,10 (1H, дд, J = 16,8, 6,2 Гц), 3,43 (1H, дд, J = 13,8, 5,4 Гц), 3,28 (3H, с), 4,34 (1H, дд, J = 13,8, 5,4 Гц), 4,45 (1H, т, J = 6,6 Гц), 5,12 (1H, к, J = 7,0 Гц), 6,16 (1H, с), 6,52 (1H, д, J = 2,2 Гц), 7,2 - 7,8 (6H, м).
Пример 113
(3S, 5R)-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусная кислота
В 20 мл метанола растворяют 0,45 г метилового эфира (R)-O-[(3S,5R)-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил)-молочной кислоты, полученного в примере 112, прибавляют туда 10 мл водного раствора, содержащего 0,37 г карбоната калия, эту смесь перемешивают 40 мин при 60oC. Эту смесь концентрируют при пониженном давлении и концентрат экстрагируют, добавляя 50 мл 1H соляной кислоты и 100 мл этилацетата. Этилацетатный слой промывают водой, сушат над безводным сульфатом магния и разгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 3:1; элюент: гексан-этиленхлорид-этанол = 5: 5: 1), получают 53 мг (3S,5R)-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты в виде призматических кристаллов с т.пл. 183 - 186oC.
[α]
Элементный анализ для C21H21Cl2NO4:
Вычислено, %: C 59,73; H 5,01; N 3,32
Найдено, %: C 59,36; H 5,09; N 3,19
Пример 114
(3R, 5S)-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусная кислота
В 20 мл метанола растворяют 0,6 г метилового эфира (R)-O-[(3R,5S)-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] -молочной кислоты, полученного в примере 112, прибавляют туда 10 мл водного раствора, содержащего 0,49 г карбоната калия, эту смесь перемешивают 40 мин при 60oC. Смесь концентрируют при пониженном давлении и концентрат экстрагируют, добавляя 50 мл 1H соляной кислоты и 100 мл этилацетата. Этилацетатный слой промывают водой, сушат над безводным сульфатом магния и перегоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 3:1; элюент: гексан-метиленхлорид-этанол = 5: 5:1), получают 54 мг (3R,5S)-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты в виде призматических кристаллов с т.пл. 182 - 185oC.
[α]
Элементный анализ для C21H21Cl2NO4•1/4H2O:
Вычислено, %: C 59,10; H 5,08; N 3,28
Найдено, %: C 59,05; H 5,07; N 3,53
Пример 115
Метиловый эфир (R)-O-[(3R,5S)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] -молочной кислоты и метиловый эфир (R)-O-[(3S, 5R)-7-хлор-5-(2-хлорфенил)-1- неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]-молочной кислоты
В 50 мл метиленхлорида растворяют 2,0 г транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученной в примере 2, и 0,57 г метилового эфира (R)-молочной кислоты. К раствору прибавляют 1,05 г 1-этил-3-(3-диметиламинопропил)-карбодиимида гидрохлорида и 0,2 г 4-диметиламинопиридина; смесь 3 ч перемешивают при комнатной температуре. Реакционную смесь промывают 1H растворами соляной кислоты и бикарбоната натрия и сушат над безводным сульфатом магния; затем растворитель отгоняют при пониженном давлении. Остаток отделяют и очищают хроматографией на колонке с силикагелем (элюент: гексан-диэтиловый эфир = 3: 1), получают в виде первой фракции 0,48 г метилового эфира (R)-O-[(3S,5R)-7-хлор-5-(2-хлорфенил)-1-неопентил-2- оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] -молочной кислоты в виде кристаллических призм с т.пл. 155 - 157oC.
[α]
Элементный анализ для C26H29Cl2NO6:
Вычислено, %: C 59,78; H 5,60; N 2,68
Найдено, %: C 59,87; H 5,75; N 2,41
В качестве второй фракции получают 0,6 г метилового эфира (R)-O-[(3R, 5S)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-бензоксазепин-3-ацетил]-молочной кислоты в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 0,94 (9H, с, т.Вu), 1,47 (3H, д, J = 7,0 Гц), 2,92 (1H, дд, J = 16,8, 7,2 Гц), 3,08 (1H, дд, J = 16,8, 6,0 Гц), 3,39 (1H, д, J = 14,0 Гц), 3,72 (3H, с), 4,45 (1H, дд, J = 7,2, 6,0 Гц), 4,52 (1H, д, J = 14,0 Гц), 5,11 (1H, к, J = 7,0 Гц), 6,28 (1H, с), 6,52 (1H, с), 7,3 - 7,8 (6H, м).
Пример 116
Метиловый эфир (S)-O-[(3R,5S)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] -молочной кислоты и метиловый эфир (S)-O-[(3S, 5R)-7-хлор-5-(2-хлорфенил)-1- неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]молочной кислоты
В 150 мл метиленхлорида растворяют 10 г транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученной в примере 2, и 4,77 г метилового эфира (S)-молочной кислоты. К раствору прибавляют при охлаждении льдом 5,27 г 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида и 0,3 г 4-диметиламинопиридина. Смесь перемешивают 2 ч при комнатной температуре, затем промывают 1H растворами соляной кислоты и бикарбоната натрия, сушат над сульфатом магния. Затем отгоняют растворитель при пониженном давлении. Остаток отделяют и очищают с помощью хроматографии на колонке с силикагелем (элюент: гексан-диэтиловый эфир = 3:1), получают в виде первой фракции 2,7 г метилового эфира (S)-O-[(3R, 5S)-7-хлор-5-(2-хлорфенил)-1-неопентил- 2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] -молочной кислоты в виде кристаллических призм с т.пл. 155 - 157oC.
[α]
Элементный анализ для C26H29Cl2NO6:
Вычислено, %: C 59,78; H 5,60; N 2,68
Найдено, %: C 59,82; H 5,69; N 2,51
В виде второй фракции получают 2,8 г метилового эфира (S)-O-[(3S,5R)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] -молочной кислоты в виде кристаллических призм с т.пл. 119 - 120oC.
[α]
Элементный анализ для C26H29Cl2NO6:
Вычислено, %: C 59,78; H 5,60; N 2,68
Найдено, %: C 59,69; H 5,63; N 2,67
Пример 117
(3S, 5R)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусная кислота
В 20 мл метанола растворяют 0,4 г метилового эфира (R)-O-[(3S,5R)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] -молочной кислоты, полученного в примере 115. К раствору прибавляют 10 мл водного раствора, содержащего 0,32 г карбоната калия; реакционную смесь затем перемешивают 2 ч при 60oC и концентрируют при пониженном давлении, затем экстрагируют добавлением 50 мл 1H соляной кислоты и 50 мл этилацетата. Этилацетатный слой промывают водой, сушат над безводным сульфатом магния, затем разгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 2:1, метиленхлорид-метанол = 3:1), получают 0,15 г (3S,5R)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты в виде игл с т.пл. 241 - 245oC.
[α]
Элементный анализ для C22H23Cl2NO4•1/4H2O:
Вычислено, %: C 59,94; H 5,37; N 3,18
Найдено, %: C 60,19; H 5,47; N 2,97
Пример 118
(3R, 5S)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусная кислота (1) и этиловый эфир (3R,5S)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты (2)
В 45 мл метанола растворяют 2,2 г метилового эфира (S)-O-[(3R,5S)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]-молочной кислоты, полученного в примере 116, прибавляют туда 15 мл водного раствора, содержащего 1,75 г карбоната калия; смесь затем перемешивают 2 часа при 60oC, концентрируют при пониженном давлении и экстрагируют добавлением 100 мл 1H соляной кислоты и 100 мл этилацетата. Этилацетатный слой промывают водой, сушат над безводным сульфатом магния и разгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 2: 1, метиленхлорид-метанол = 3:1), получают кристаллы. Перекристаллизация из гексана-этанола дает 0,85 г (3R,5S)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты в виде игл, т.пл. 250 - 252oC.
[α]
Элементный анализ для C22H23Cl2NO4:
Вычислено, %: C 59,94; H 5,37; N 3,28
Найдено, %: C 59,84; H 5,28; N 3,31
Фильтрат разгоняют при пониженном давлении, остаток затем растворяют в 30 мл этанола, прибавляют туда 0,3 мл концентрированной серной кислоты, затем смесь перемешивают 2 дня. Разгоняют при пониженном давлении, затем проводят экстракцию, добавляя 100 мл воды и 100 мл этилацетата. Этилацетатный слой промывают водным бикарбонатом натрия и водой, сушат над безводным сульфатом магния и разгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 5:1), получают 0,63 г этилового эфира (3R, 5S)-7-хлор-5-(2-хлорфенил)-1-неопентил- 2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты в виде кристаллических призм, т.пл. 120-121oC.
[α]
Элементный анализ для C24H27Cl2NO4:
Вычислено, %: C 62,07; H 5,86; N 3,02
Найдено, %: C 62,10; H 5,95; N 2,93
Также, работая по приведенной выше методике, проводят гидролиз 0,6 г метилового эфира (R)-O-[(3R, 5S)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] -молочной кислоты, получают 0,37 г (3R, 5S)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1- бензоксазепин-3-уксусной кислоты.
Пример 119
Этиловый эфир N-[(3R, 5S)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]аминоуксусной кислоты
Растворяют в 5 мл N,N-диметилформамида 0,15 г (3R, 5S)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученной в примере 118, и 58 мг солянокислого этилового эфира глицина. К раствору прибавляют при охлаждении льдом 71 мг диэтилфосфороцианидата и 0,12 мл триэтиламина. После 30 мин перемешивания реакционной смеси при комнатной температуре ее экстрагируют добавлением 50 мл воды и 50 мл этилацетата. Этилацетатный слой промывают 1H соляной кислотой и водным раствором бикарбоната натрия, сушат над безводным сульфатом магния и разгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 1:1), получают 0,16 г этилового эфира N-[(3R, 5S)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] аминоуксусной кислоты в виде пластинчатых кристаллов с т.пл. 138-139oC.
[α]
Элементный анализ для C26H30Cl2N2O5:
Вычислено, %: C 59,89; H 5,80; N 5,37
Найдено, %: C 59,86; H 5,94; N 5,12
Пример 120
N-[(3R, 5S)-7-хлор-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]аминоуксусная кислота
В 5 мл этанола растворяют 0,12 г этилового эфира N-[(3R, 5S)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро- 4,1-бензоксазепин-3-ацетил] аминоуксусной кислоты, полученного в примере 119, прибавляют туда 2 мл 1H гидроксида натрия. Реакционную смесь перемешивают 15 мин при комнатной температуре, проводят затем экстракцию, добавляя 50 мл 1H соляной кислоты и 50 мл этилацетата. Этилацетатный слой промывают водой, сушат над безводным сульфатом магния и разгоняют при пониженном давлении, получают 0,10 г N-[(3R, 5S)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] аминоуксусной кислоты в виде порошкообразного продукта.
[α]
Элементный анализ для C24H26Cl2N2O5:
Вычислено, %: C 58,43; H 5,31; N 5,68
Найдено, %: C 58,56; H 5,63; N 5,57
Пример 121
(3S, 5R)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусная кислота и (3R, 5S)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусная кислота
В этаноле растворяют 10 г 7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1- бензоксазепин-3-уксусной кислоты, полученной в примере 2, и хинин равной молярности. Потом эту смесь концентрируют, прибавляют 150 мл этилацетата и проводят кристаллизацию при охлаждении льдом. Полученные таким образом кристаллы растворяют в смеси этанола и этилового эфира и позволяют пройти перекристаллизации. Удаляют маточную жидкость от образовавшихся при этом кристаллов концентрируют и получают остаток. Этот остаток перекристаллизовывают из гексана, и полученные таким образом кристаллы растворяют в этилацетате. Хинин из этого раствора удаляют разбавленной соляной кислотой. Остаток после удаления растворителя от перекристаллизации с использованием гексана представляет собой в результате (3S, 5R)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусную кислоту в виде кристаллов. Затем удаляют растворитель из маточной жидкости, оставшейся от первой кристаллизации. Остаток растворяют в этилацетате, и удаляют хинин соляной кислотой. Удаляют растворитель, получают остаток, который перекристаллизовывают, используя смесь этанола и этилового эфира. После удаления образовавшихся таким образом кристаллов концентрируют маточную жидкость и перекристаллизовывают остаток, используя гексан, в результате получают (3R, 5S)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусную кислоту в виде кристаллов.
Пример 122
Этиловый эфир (3S, 5R)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусная кислота и этиловый эфир (3R, 5S)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты
К этилиодиду в диметилформамиде как растворителю и в присутствии карбоната калия прибавляют как отдельные реакции (3S, 5R)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусную кислоту и (3R, 5S)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусную кислоту, полученные в примере 121, в результате получают указанные выше соединения. Этиловый эфир (3S, 5R)-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты имеет т.пл. 117-118oC.
[α]
Элементный анализ для C24H27Cl2NO4:
Вычислено, %: C 62,07; H 5,86; N 3,02
Найдено, %: C 62,01; H 5,88; N 2,97
Пример 123
Этиловый эфир транс-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты
(1) 2-амино-5-хлор-2'-оксибензофенон
Смесь 2,15 г 2-амино-5-хлор-2'-метоксибензофенона и 20 мл 47%-ного бромистого водорода кипятят 1 ч с обратным холодильником. Раствор нейтрализуют бикарбонатом натрия и экстрагируют 100 мл этилацетата. Экстракционный раствор промывают водой и сушат над безводным сульфатом магния, отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 10:1), получают 1,9 г 2-амино-5-хлор-2'-оксибензофенона в виде игл с т.пл. 51 - 52oC.
Элементный анализ для C13H10ClNO2:
Вычислено, %: C 63,04; H 4,07; N 5,66
Найдено, %: C 62,90; H 4,04; N 5,61
Смесь 10 г 2-ацетиламино-5-хлор-2'-метоксибензофенона и 100 мл 47%-ного бромистого водорода 2 ч кипятят с обратным холодильником. Раствор нейтрализуют гидроксидом натрия и экстрагируют 200 мл этилацетата. Экстракционный раствор промывают водой и сушат над безводным сульфатом магния, затем отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 5:1), получают 8,0 г 2-амино-5-хлор-2'-оксибензофенона в виде игл.
(2) 2-амино-5-хлор-2'-этоксибензофенон
В 10 мл N,N-диметилформамида растворяют 1,5 г 2-амино-5-хлор-2'-оксибензофенона, полученного в (1), прибавляют туда 1,26 г карбоната калия и 0,63 мл этилиодида. Реакционную смесь 3 ч перемешивают при комнатной температуре, после чего экстрагируют 100 мл воды и 100 мл этилацетата. Этилацетатный слой промывают водой, сушат над безводным сульфатом магния и отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 5:1), получают 1,6 г 2-амино-5-хлор-2'-этоксибензофенона в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 1,21 (3H, т, J = 7,0 Гц), 4,04 (2H, к, J = 7,0 Гц), 6,1 - 6,5 (2H, шир, NH2), 6,65 (1H, д, J = 8,8 Гц), 6,9 - 7,1 (2H, м), 7,15 - 7,35 (3H, м), 7,35 - 7,5 (1H, м).
(3) 2-амино-5-хлор-α-(2-этоксифенил)бензиловый спирт
Растворяют в 30 мл этанола 1,5 г 2-амино-5-хлор-2'-этокси бензофенона, полученного в (2), затем прибавляют 0,34 г боргидрида натрия. Реакционную смесь перемешивают всю ночь при комнатной температуре. Затем этанол отгоняют при пониженном давлении, и после диссоциации при добавлении водного раствора соляной кислоты проводят экстракцию 100 мл этилацетата. Этилацетатный слой промывают водой, сушат над безводным сульфатом магния и отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 3:1), получают 1,35 г 2-амино-5-хлор-α-(2-этоксифенил)бензилового спирта в виде кристаллических призм с т. пл. 80 - 81oC.
Элементный анализ для C15H16ClNO2:
Вычислено, %: C 64,87; H 5,81; N 5,04
Найдено, %: C 64,77; H 5,81; N 4,85
(4) 5-хлор-α-(2-этокси-фенил)-2-изобутиламинобензиловый спирт
Растворяют в 10 мл уксусной кислоты 1,3 г 2-амино-5-хлор-α-(2-этоксифенил)бензилового спирта, полученного в (3), и прибавляют 0,47 г изобутилальдегида, к которым прибавляют при охлаждении льдом 0,24 г боргидрида натрия. Реакционную смесь перемешивают 30 мин при комнатной температуре, после чего проводят экстракцию при добавлении 100 мл воды и 100 мл этилацетата. Этилацетатный слой промывают 1H гидроксидом натрия, сушат над безводным сульфатом магния и отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 20:1 до 5: 1), получают 1,5 г 5-хлор-α-(2-этоксифенил)-2-изобутиламинобензилового спирта в виде масла.
ИК-спектр ν
1H-спектр (200 МГц, CDCl3) δ: 0,90 (3H, д, J = 6,8 Гц), 0,91 (3H, д, J = 6,6 Гц), 1,41 (3H, т, J = 7,0 Гц), 1,7 - 2,0 (1H, м), 2,89 (2H, д, J = 6,8 Гц), 3,2 - 3,6 (1H, шир), 4,13 (2H, к, J = 7,0 Гц), 4,7 - 5,1 (1H, шир), 5,97 (1H, с), 6,55 (1H, д, J = 8,6 Гц), 6,85 - 7,4 (6H, м).
(5) Этиловый эфир 3-[N-[4-хлор-2-(2-этокси-α-оксибензил)-фенил]-N-изобутилкарбамоил]акриловой кислоты
Раствор, содержащий 0,84 г моноэтилового эфира фумаровой кислоты и 1,28 мл тионилхлорида в 10 мл толуола, перемешивают 30 мин при 90oC. Отгоняют растворитель при пониженном давлении, получают моноэтиловый эфир хлорангидрида фумаровой кислоты. Этот продукт и 1,5 г 5-хлор-α-(2-метоксифенил)-2-изобутиламино-бензилового спирта, полученного в (4), затем растворяют в 30 мл метиленхлорида, прибавляют туда 0,75 г бикарбоната натрия и перемешивают смесь 30 мин при комнатной температуре. Реакционную смесь промывают водой и сушат над безводным сульфатом магния, отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 4:1), получают 1,95 г этилового эфира 3-[N-[4-хлор-2-(2-этокси-α-оксибензил)фенил] -N-изобутилкарбамоил] акриловой кислоты в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 0,65 - 1,0 (6H, м), 1,15 - 1,5 (6H, м), 1,6 - 2,0 (1H, м), 2,3 - 3,0 (2H, м), 3,9 - 4,4 (5H, м), 5,8 - 6,3 (3H, м), 6,6 - 8,05 (7H, м).
(6) Этиловый эфир транс-7-хлор-5-(2-этоксифенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1- бензоксазепин-3-уксусной кислоты.
Растворяют в 30 мл этанола 1,95 г этилового эфира 3-[N-[4-хлор-2-(2-этокси-α-оксибензил)фенил]-N-изобутилкарбамоил] акриловой кислоты, полученного в (5), добавляют туда 1,17 г карбоната калия и перемешивают смесь всю ночь. Реакционную смесь экстрагируют, добавив 100 мл воды и 100 мл этилацетата. Этилацетатный слой промывают водой, сушат над безводным сульфатом магния и разгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 5:1), получают 1,55 г этилового эфира транс-7-хлор-5-(2-этоксифенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты в виде кристаллических призм с т.пл. 129 - 130oC.
Элементный анализ для C25H30ClNO5:
Вычислено, %: C 65,28; H 6,67; N 3,05
Найдено, %: C 65,38; H 6,44; N 2,91
Пример 124
Транс-7-хлор-5-(2-этоксифенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусная кислота
Растворяют в 30 мл метанола 1,25 г этилового эфира транс-7-хлор-5-(2-этоксифенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученной в примере 123, прибавляют туда 10 мл водного раствора, содержащего 0,75 г карбоната калия, затем смесь перемешивают 3 ч при 60oC. После концентрирования реакционной смеси при пониженном давлении ее подкисляют, добавляя 50 мл 1H соляной кислоты, и экстрагируют 100 мл этилацетата. Экстракционный раствор промывают водой и сушат над безводным сульфатом магния, затем отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 2: 1; элюент, гексан-дихлорметан-этанол = 5:5:1), получают 0,66 г транс-7-хлор-5-(2-этоксифенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1- бензоксазепин-3-уксусной кислоты в виде кристаллических призм с т.пл. 190 - 192oC.
Элементный анализ для C23H25ClNO5:
Вычислено, %: C 63,96; H 6,07; N 3,24
Найдено, %: C 63,64; H 5,96; N 3,58
Пример 125
Этиловый эфир транс-5-(2-бензилоксифенил)-7-хлор-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1- бензоксазепин-3-уксусной кислоты.
(1) 2-амино-2'-бензилокси-5-хлорбензофенон
Растворяют в 30 мл N,N-диметилформамида 5,0 г 2-амино-5-хлор-2'-оксибензофенона, полученного в примере 123 (1), прибавляют туда 4,2 г карбоната калия и 2,9 мл бензилбромида; затем смесь перемешивают 2 ч при комнатной температуре. Смесь экстрагируют 150 мл воды и 200 мл этилацетата, этилацетатный слой промывают водой и сушат над безводным сульфатом магния, затем разгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 10:1 до 5:1), получают 6,4 г 2-амино-2-бензилокси-5-хлорбензофенона в виде призм с т.пл. 110 - 111oC.
Элементный анализ для C20H16ClNO2:
Вычислено, %: C 71,11; H 4,77; N 4,15
Найдено, %: C 71,34; H 4,80; N 4,23
(2) 2-амино (2-бензилоксифенил)-5-хлорбензиловый спирт
(2-бензилоксифенил)-5-хлорбензиловый спирт
Растворяют в 50 мл метанола 6,0 г 2-амино-2'-бензилокси-5-хлорбензофенона, полученного в (1), туда прибавляют 1,12 г боргидрида натрия и перемешивают смесь 4 ч при комнатной температуре. После отгонки этанола при пониженном давлении проводят диссоциацию при добавлении водного раствора соляной кислоты, нейтрализуют реакционную смесь добавлением 50 мл 1H гидроксида натрия и экстрагируют 200 мл этилацетата. Этилацетатный слой промывают водой, сушат над безводным сульфатом магния, затем разгоняют при пониженном давлении, получают 5,9 г 2-амино-α-(2-бензилоксифенил)-5-хлорбензилового спирта в виде пластинчатых кристаллов, т.пл. 120 - 121oC.
Элементный анализ для C20H18ClNO2:
Вычислено, %: C 70,69; H 5,34; N 4,12
Найдено, %: C 70,85; H 5,16; N 4,24
(3) α-(2-бензилоксифенил)-5-хлор-2-изобутиламинобензиловый спирт
Растворяют в 50 мл уксусной кислоты 5,0 г 2-амино-α-(2-бензилоксифенил)-5-хлорбензилового спирта, полученного в (2), и 1,47 мл изобутилальдегида. Прибавляют к раствору при охлаждении льдом 0,74 г боргидрида натрия. Реакционную смесь перемешивают 30 мин при комнатной температуре, после чего добавляют 150 мл воды и проводят экстракцию 200 мл этилацетата. Экстракционный раствор промывают 1H гидроксидом натрия и сушат над безводным сульфатом магния, затем отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 20: 1 до 5:1), получают 5,6 г α-(2-бензилоксифенил)-5-хлор-2-изобутиламинобензилового спирта в виде кристаллических призм с т.пл. 79 - 80oC.
Элементный анализ для C24H26ClNO2:
Вычислено, %: C 72,81; H 6,62; N 3,54
Найдено, %: C 72,95; H 6,62; N 3,62
(4) Этиловый эфир 3-[N-[4-хлор-2-(2-бензилокси-α-оксибензил)фенил]-N-изобутилкарбамоил]акриловой кислоты
Раствор, состоящий из 2,65 г моноэтилового эфира фумаровой кислоты и 4,0 мл тионилхлорида, в 30 мл толуола перемешивают 1 ч при 90oC. Затем разгоняют его при пониженном давлении, получают моноэтиловый эфир хлорангидрида фумаровой кислоты. Этот продукт и 5,6 г α-(2-бензилоксифенил)-5-хлор-2-изобутиламинобензилового спирта, полученного в (3), растворяют в 100 мл метиленхлорида, потом прибавляют 2,38 г бикарбоната натрия и перемешивают смесь 30 мин при комнатной температуре. Реакционную смесь промывают водой и сушат над безводным сульфатом магния; затем отгоняют растворитель при пониженном давлении, получают 6,4 г этилового эфира 3-[N-[4-хлор-2-(2-бензилокси-α-оксибензил)фенил] -N-изобутилкарбамоил] акриловой кислоты в виде кристаллических призм с т.пл. 169 - 171oC.
Элементный анализ для C30H32ClNO5:
Вычислено, %: C 69,02; H 6,18; N 2,68
Найдено, %: C 69,24; H 6,04; N 2,71
(5) Этиловый эфир транс-5-(2-бензилоксифенил)-7-хлор-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1- бензоксазепин-3-уксусной кислоты
Растворяют в 150 мл этанола 6,0 г этилового эфира 3-[N-[4-хлор-2-(2-бензилокси-α-оксибензил)фенил] -N-изобутилкарбамоил] акриловой кислоты, полученного в (4), прибавляют туда 3,18 г карбоната калия, затем смесь перемешивают всю ночь. Отгоняют растворитель при пониженном давлении и экстрагируют остаток, добавляя 150 мл воды и 200 мл этилацетата. Этилацетатный слой промывают водой и сушат над безводным сульфатом магния, затем разгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 5: 1), получают 5,8 г этилового эфира транс-5-(2-бензилоксифенил)-7-хлор-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты в виде кристаллических призм с т.пл. 146 - 147oC.
Элементный анализ для C30H32ClNO5:
Вычислено, %: C 69,02; H 6,18; N 2,68
Найдено, %: C 69,20; H 6,21; N 2,95
Пример 126
Транс-5-(2-бензилоксифенил)-7-хлор-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусная кислота
Растворяют в смеси 20 мл метанола и 10 мл тетрагидрофурана 0,5 г этилового эфира транс-5-(2-бензилоксифенил)-7-хлор-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученной в примере 125. К этому раствору прибавляют 10 мл водного раствора, содержащего 0,66 г карбоната калия, и перемешивают смесь 6 ч при 60oC. Реакционную смесь концентрируют при пониженном давлении, подкисляют ее добавлением 50 мл 1H соляной кислоты и экстрагируют 100 мл этилацетата. Экстракционный раствор промывают водой и сушат над безводным сульфатом магния, затем отгоняют при пониженном давлении. Остаток хроматографируют на колонке с силикагелем (элюент: гексан-этилацетат = 3:1, элюент: гексан-дихлорметан-этанол = 5:5:1), получают 0,21 г транс-5-(2-бензилоксифенил)-7-хлор-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1- бензоксазепин-3-уксусной кислоты в виде кристаллических призм с т.пл. 194 - 197oC.
Элементный анализ для C28H28ClNO5:
Вычислено, %: C 68,08; H 5,71; N 2,84
Найдено, %: C 68,07; H 5,75; N 2,85
Пример 127
Этиловый эфир транс-7-хлор-5-(2-хлорфенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты
Растворяют в 50 мл этилацетата 3,5 г этилового эфира транс-5-(2-бензилоксифенил)-7-хлор-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1- бензоксазепин-3-уксусной кислоты, полученной в примере 125. К этому раствору прибавляют 1,0 г 10%-ного палладия на угле и проводят гидрогенолиз при нормальной температуре и давлении. После поглощения расчетного количества водорода удаляют катализатор и отгоняют этилацетат при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 3: 1), получают 2,8 г этилового эфира транс-7-хлор-5-(2-оксифенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1- бензоксазепин-3-уксусной кислоты в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 0,90 (3H, д, J = 6,6 Гц), 0,99 (3H, д, J = 6,6 Гц), 1,24 (3H, т, J = 7,2 Гц), 1,9 - 2,2 (1H, м), 2,85 (1H, дд, J = 17,8 Гц, 5,0 Гц), 2,97 (1H, д, J = 17,8, 8,2 Гц), 3,41 (1H, дд, J = 13,8, 6,4 Гц), 4,16 (2H, к, J = 7,2 Гц), 4,30 (1H, дд, J = 13,8, 7,8 Гц), 4,49 (1H, дд, J = 8,2, 4,8 Гц), 5,97 (1H, с), 6,85 (1H, д, J = 2,4 Гц), 6,85 - 7,5 (6H, м), 7,54 (1H, шир, OH).
Пример 128
Транс-7-хлор-5-(2-оксифенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусная кислота
Растворяют в 10 мл метанола 0,4 г этилового эфира транс-7-хлор-5-(1-оксифенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученного в примере 127, прибавляют туда 5 мл водного раствора, содержащего 0,51 г карбоната калия, затем смесь перемешивают 1 ч при 60oC. Реакционную смесь конденсируют при пониженном давлении, подкисляют добавлением 50 мл 1H соляной кислоты и экстрагируют 100 мл этилацетата. Экстракционный раствор промывают водой и сушат над безводным сульфатом магния, отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 2:1; элюент: гексан-дихлорметан-этанол = 5:5:2), получают 0,11 г транс-7-хлор-5-(2-оксифенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1- бензоксазепин-3-уксусной кислоты в виде кристаллических призм с т.пл. 238 - 242oC (разлож.).
Элементный анализ для C21H22ClNO5:
Вычислено, %: C 62,45; H 5,49; N 3,47
Найдено, %: C 62,55; H 5,68; N 3,41
Пример 129
Этиловый эфир транс-7-хлор-1-изобутил-5-(2-изоприлоксифенил)-2-оксо-1,2,3,5-тетрагидро-4,1- бензоксазепин-3-уксусной кислоты.
Растворяют в 10 мл N,N-диметилформамида 0,7 г этилового эфира транс-7-хлор-5-(2-оксифенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученного в примере 127, прибавляют туда 0,34 г карбоната калия и 0,24 мл изопропилиодида, затем смесь перемешивают всю ночь при комнатной температуре. Смесь экстрагируют 100 мл воды и 150 мл этилацетата. Этилацетатный слой промывают 1H соляной кислотой и бикарбонатом натрия, сушат над безводным сульфатом магния и разгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 3:1), получают 0,55 г этилового эфира транс-7-хлор-1-изобутил-5-(2-изопропилоксифенил)-2-оксо-1,2,3,5- тетрагидро-4,1-бензоксазепин-3-уксусной кислоты в виде игл с т.пл. 135 - 137oC.
Элементный анализ для C26H32ClNO5:
Вычислено, %: C 65,88; H 6,80; N 2,96
Найдено, %: C 66,09; H 6,83; N 3,24
Пример 130
Транс-7-хлор-1-изобутил-5-(2-изопропилоксифенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусная кислота
Растворяют в 20 мл метанола 0,4 г этилового эфира транс-7-хлор-5-(2-изопропилоксифенил)-1-изобутил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученного в примере 129. К этому раствору прибавляют 10 мл водного раствора, содержащего 0,23 г карбоната калия, затем смесь перемешивают 3 ч при 80oC. Реакционную смесь концентрируют при пониженном давлении, подкисляют добавлением 50 мл 1H соляной кислоты и экстрагируют 100 мл этилацетата. Экстракционный раствор промывают водой и сушат над безводным сульфатом магния, затем отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 3: 1, элюент: гексан-дихлорметан-этанол = 5:5:1), получают 0,24 г транс-7-хлор-1-изобутил-5-(2-изопропилоксифенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты в виде кристаллических призм с т.пл. 146 - 149oC.
Элементный анализ для C24H28ClNO5 • 0,2H2O:
Вычислено, %: C 64,12; H 6,37; N 3,11
Найдено, %: C 64,18; H 6,37; N 3,28
Пример 131
Этиловый эфир транс-7-бром-1-неопентил-2-оксо-5-(2-пиридил)-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты
(1) 2-Амино-5-бром-α-(2-пиридил)бензиловый спирт
Растворяют в 100 мл метанола 10 г 2-амино-5-бромфенил-2-пиридилкетона. К раствору прибавляют 1,7 г боргидрида натрия и перемешивают 30 мин. Метанол отгоняют при пониженном давлении. Остаток обрабатывают водным раствором соляной кислоты. Разложенный остаток затем нейтрализуют 200 мл водного раствора бикарбоната натрия и экстрагируют этилацетатом. Этилацетатный слой промывают водой, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 2:1), получают 9,0 г 2-амино-5-бром-α-(2-пиридил)бензилового спирта в виде призм с т.пл. 104 - 105oC.
Элементный анализ для C12H11BrN2O:
Вычислено, % 5: C 51,64; H 3,97; N 10,04
Найдено, %: C 51,61; H 3,93; N 10,04
(2) 5-Бром-2-неопентиламино-α-(2-пиридил)бензиловый спирт
Растворяют в 20 мл уксусной кислоты 2,0 г 2-амино-5-бром-α-(2-пиридил)бензилового спирта, полученного в (1), вместе с 0,86 мл триметилацетальдегида. К раствору прибавляют 0,36 г боргидрида натрия при охлаждении льдом. Реакционную смесь перемешивают в течение 30 мин при комнатной температуре и экстрагируют смесь 100 мл воды и 150 мл этилацетата. Этилацетатный слой промывают 1H гидроксидом натрия, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 5:1), получают 2,4 г 5-бром-2-неопентиламино-α-(2-пиридил)бензилового спирта в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl2) δ: 0,80 (9H, с, But), 2,68 (2H, с), 5,69 (1H, с), 6,48 (1H, д, J = 8,4 Гц), 7,1 - 7,35 (4H, м), 7,55 - 7,7 (1H, м), 8,5 - 8,6 (1H, м).
(3) Этил-3-[N-[4-бром-2-α-(2-пиридил)оксиметил] фенил]- N-неопентилкарбамоил]акрилат
Растворяют в 50 мл дихлорметана 2,4 г 5-бром-2-неопентиламино-α-(2-пиридил)бензилового спирта, полученного в (2). К раствору прибавляют 1,15 г боргидрида натрия и 1,23 г монометилфумаратхлорангидрида. После 2 ч перемешивания при комнатной температуре реакционную смесь промывают водой и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 2: 1), получают этил-3-[N-[4-бром-2-[α-(2-пиридил)оксиметил] фенил]-N-неопентилкарбамоил]акрилат в виде призм с т.пл. 165 - 166oC.
Элементный анализ для C23H27BrN2O4:
Вычислено, %: C 58,11; H 5,72; N 5,89
Найдено, %: C 58,21; H 5,65; N 6,14
(4) Этил-транс-7-бром-1-неопентил-5-(2-пиридил)-2-оксо- 1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетат
Растворяют в 30 мл этанола 2,0 г этил-3-[N-[4-бром-2-[α-(2-пиридил)оксиметил]фенил]-N-неопентилкарбамоил]акрилата, полученного в (3). К раствору прибавляют 1,16 г карбоната калия и смесь всю ночь перемешивают при комнатной температуре. Растворитель отгоняют при пониженном давлении. Остаток экстрагируют 100 мл воды и 100 мл этилацетата. Органический слой промывают водой, сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем (элюент: гексан-этилацетат = 3:1), получают 1,9 г этил-транс-7-бром-1-неопентил-5-(2-пиридил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетата в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (CDCl3) δ: 0,94 (3H, с, т.-Bu), 1,25 (3H, т, J = 7,2 Гц), 2,80 (1H, дд, J = 16,6, 5,8 Гц), 3,07 (1H, дд, J = 16,6, 7,8 Гц), 3,31 (1H, д, J = 13,8 Гц), 4,13 (2H, к, J = 7,2 Гц), 4,44 (1H, дд, J = 7,8, 5,8 Гц), 4,49 (1H, д, J = 13,8 Гц), 6,07 (1H, с), 6,59 (1H, д, J = 2,2 Гц), 7,2 - 7,9 (5H, м), 8,6 - 8,7 (1H, м).
Пример 132
Транс-7-бром-1-неопентил-5-(2-пиридил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусная кислота
Растворяют в 20 мл метанола 1,9 этил-транс-7-хлор-1-неопентил-5-(2-пиридил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетата, полученного в примере 131. К раствору прибавляют 10 мл водного раствора, содержащего 1,1 г карбоната калия. Смесь 30 мин кипятят с обратным холодильником и концентрируют при пониженном давлении. Концентрат кристаллизуют при добавлении 30 мл водного раствора соляной кислоты. Продукт отфильтровывают и перекристаллизовывают из гексана и этанола, получают 1,25 г транс-7-бром-1-неопентил-5-(2-пиридил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты в виде призм, т.пл. 263oC (с разлож.).
Элементный анализ для C21H23BrN2O4:
Вычислено, %: C 56,39; H 5,18; N 6,26
Найдено, %: C 56,39; H 5,18; N 6,10
Пример 133
Этил-N-бензил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]аминоацетат
Растворяют в 10 мл диметилформамида 0,3 г транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученной в примере 2, и 0,27 г этилового эфира N-бензилглицина. К раствору прибавляют 0,24 г диэтилфосфороцианидата вместе с 0,19 мл триэтиламина при охлаждении льдом. Смесь перемешивают 30 мин при комнатной температуре, затем экстрагируют 100 мл воды и 100 мл этилацетата. Этилацетатный слой промывают 1H соляной кислотой и водным раствором бикарбоната натрия, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 3: 1), получают 0,56 г этил-N-бензил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] аминоацетата в виде призм, т.пл. 195 - 197oC.
Элементный анализ для C33H36Cl2N2O5:
Вычислено, %: C 64,81; H 5,93; N 4,58
Найдено, %: C 64,84; H 5,97; N 4,45
Пример 134
N-Бензил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]аминоуксусная кислота
В 15 мл метанола растворяют 0,3 г этил-N-бензил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] аминоацетата, полученного в примере 133. К раствору прибавляют 4 мл раствора гидроксида натрия и смесь перемешивают 20 мин. Реакционную смесь после подкисления 50 мл 1H HCl экстрагируют 100 мл этилацетата. Этилацетатный слой промывают водой и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении, получают N-бензил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил- 2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] аминоуксусную кислоту в
виде призм с т.пл. 190 - 192oC.
Элементный анализ для C31H32Cl2N2O5:
Вычислено, %: C 63,81; H 5,53; N 4,80
Найдено, %: C 64,02; H 5,85; N 4,81
Пример 135
Метил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил- 2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]-N-фениламиноацетат
Смесь 0,6 г транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученной в примере 2, 10 мл тионилхлорида и 10 мл толуола перемешивают 30 мин при 90oC, затем концентрируют при пониженном давлении. Концентрат транс-7-хлор-5-(2-хлорфенил)-1-неопентил- 1,2,3,5-тетрагидро-2-оксо-4,1-бензоксазепин-3-ацетилхлорида растворяют в 10 мл метиленхлорида. К раствору прибавляют 0,27 г метилового эфира N-фенилглицина и 0,23 мл триэтиламина. Смесь перемешивают 1 ч при комнатной температуре и экстрагируют 100 мл этилацетата. Органический слой промывают 1H HCl и водным раствором бикарбоната натрия, сушат над сульфатом магния и концентрируют при пониженном давлении.
Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 3: 1), получают 0,35 г метил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] -N-фениламиноацетата в виде призм с т.пл. 226 - 228oC.
Элементный анализ для C31H32Cl2N2O5:
Вычислено, %: C 63,81; H 5,53; N 4,80
Найдено, %: C 63,78; H 5,59; N 4,60
Пример 136
N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]-N- фениламиноуксусная кислота
Растворяют в 3 мл метанола 0,25 г метил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] -N- фениламиноацетата, полученного в примере 135. К раствору прибавляют 1 мл 1H гидроксида натрия. Смесь перемешивают 1,5 ч при 60oC, затем подкисляют 50 мл 1H HCl для экстракции этилацетатом. Этилацетатный слой промывают водой, сушат над сульфатом магния и концентрируют при пониженном давлении, получают 0,23 г N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]-N- фениламиноуксусной кислоты в виде призм с т.пл. 238 - 240oC.
Элементный анализ для C30H30Cl2N2O5:
Вычислено, %: C 63,27; H 5,31; N 4,92
Найдено, %: C 63,46; H 5,54; N 4,70
Пример 137
Этил N-[транс-7-хлор-5-(2-метоксифенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил]аминоацетат
Растворяют в 10 мл диметилформамида 0,3 г транс-7-хлор-5-(2-метоксифенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученной в примере 74, и 0,12 г солянокислого этилового эфира глицина. К раствору прибавляют 0,14 г диэтилфосфороцианидата и 0,24 мл триэтиламина при охлаждении льдом. Смесь перемешивают 30 мин при комнатной температуре и затем экстрагируют 100 мл воды и 100 мл этилацетата. Этилацетатный слой промывают 1H HCl и водным раствором бикарбоната натрия, сушат над безводным сульфатом магния. Этилацетат отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 1:1), получают 0,33 г этил-N-[транс-7-хлор-5-(2-метоксифенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] аминоацетат в виде игл с т.пл. 233 - 236oC.
Элементный анализ для C27H33ClN2O6:
Вычислено, %: C 62,72; H 6,43; N 5,42
Найдено, %: C 62,54; H 6,47; N 5,28
Пример 138
N-[Транс-7-хлор-5-(2-метоксифенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3- ацетил]аминоуксусная кислота
Растворяют в 5 мл этанола 0,25 г этил-N-[транс-7-хлор-5-(2-метоксифенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] аминоацетата, полученного в примере 137. К раствору прибавляют 2 мл 1H гидроксида натрия. После 15 мин перемешивания реакционную смесь подкисляют 100 мл 1H HCl и экстрагируют этилацетатом. Органический слой промывают водой и сушат над сульфатом магния. Этилацетат отгоняют при пониженном давлении, получают N-[транс-7-хлор-5-(2-метоксифенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетил] аминоуксусную кислоту в виде призм с т.пл. 239 - 242oC.
Элементный анализ для C25H29ClN2O5:
Вычислено, %: C 61,41; H 5,98; N 5,73
Найдено, %: C 61,38; H 5,91; N 5,83
Пример 139
Транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метиламин гидрохлорид
Работают по методике примера 36, обрабатывают 1,0 г транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученной в примере 2. Продукт представляет собой 0,9 г транс-7-хлор-5-(2-хлорфенил)-1-неопентил- 2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метиламин гидрохлорид в виде пластинчатых кристаллов, т.пл. 173 - 175oC.
Элементный анализ для C21H24Cl2N2O2 • HCl • H2O:
Вычислено, %: C 54,62; H 5,89; N 6,06
Найдено, %: C 54,77; H 5,95; N 5,83
Пример 140
Метил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил]карбамоилацетат
Растворяют в 10 мл N,N-диметилформамида 0,3 г транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метиламина гидрохлорида, полученного в примере 139, и 0,12 г монометилмалонатной калиевой соли. К раствору прибавляют 0,13 г диэтилфосфороциaната вместе с 0,11 мл триэтиламина при охлаждении льдом. После 30 мин перемешивания при комнатной температуре реакционную смесь экстрагируют 100 мл воды и 100 мл этилацетата. Этилацетатный слой промывают 1H HCl и водным раствором бикарбоната натрия, сушат над безводным сульфатом магния. Затем отгоняют этилацетат при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 1:1), получают 0,28 г метил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил]карбамоилацетата в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 0,94 (9H, с, т.-Вu), 3,28 (2H, с), 3,38 (1H, д, J=13,9 Гц), 3,74 (3H, с), 3,7 - 3,85 (2H, м), 3,99 (1H, т, J= 6,1 Гц), 4,54 (1H, д, J=13,9 Гц), 6,25 (1H, с), 6,52 (1H, д, J=1,9 Гц), 7,2 - 7,9 (7H, м, NH).
Пример 141
N-[Транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил]карбамоилуксусная кислота
Растворяют в 5 мл этанола 0,28 г метил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил] карбамоилацетата, полученного в примере 140. К раствору прибавляют 2 мл 1H гидроксида натрия и смесь перемешивают 10 мин при комнатной температуре. Реакционную смесь подкисляют 50 мл 1H соляной кислоты и затем экстрагируют 50 мл этилацетата. Этилацетатный слой промывают водой, сушат над сульфатом магния и концентрируют при пониженном давлении, получают 0,23 г N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил] карбамоилуксусной кислоты в виде пластинчатых кристаллов с т. пл. 135 - 138oC.
Элементный анализ для C24H26Cl2N2O5:
Вычислено, %: C 58,43; H 5,31; N 5,68
Найдено, %: C 58,48; H 5,42; N 5,52
Пример 142
Трет. бутил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил]аминоацетат
Смесь 2,5 г транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метиламина гидрохлорида, полученного в примере 139, 0,93 мл этилхлорацетата, 1,87 г карбоната калия и 50 мл ацетонитрила кипятят с обратным холодильником всю ночь. Реакционную смесь концентрируют при пониженном давлении, и концентрат экстрагируют 100 мл воды и 150 мл этилацетата. Органический слой промывают водой и сушат над безводным сульфатом магния. Этилацетат выпаривают при пониженном давлении, получают 1,95 г трет. бутил-N-[транс-7-хлор-5-(2-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил]-аминоацетата в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 0,94 (9H, с, т.By), 1,44 (9H, с, т. By), 3,00 (1H, дд, J=12,2, 6,4 Гц), 3,11 (1H, дд, J=12,2, 6,2 Гц), 3,33 (2H, с), 3,36 (1H, д, J=14,0 Гц), 4,04 (1H, т, J=6,3 Гц), 4,52 (1H, д, J=14,0 Гц), 6,26 (1H, с), 6,52 (1H, д, J=1,8 Гц), 7,2 - 7,85 (6H, м).
Пример 143
N-[Транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил]аминоуксусная кислота гидрохлорид
Растворяют в 15 мл 4H HCl-диоксанового раствора 0,3 г трет.бутил N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил]аминоацетата, полученного в примере 142. После 8 ч перемешивания при комнатной температуре реакционную смесь концентрируют при пониженном давлении. При добавлении гексана и этилацетата к остатку получают 0,23 г порошкообразного гидрохлорида N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метиламиноуксусной кислоты.
Элементный анализ для C23H26Cl2N2O4•HCl:
Вычислено, %: C 55,05; H 5,42; N 5,58
Найдено, %: C 55,38; H 5,77; N 5,39
1H-ЯМР-спектр (200 МГц, d6-ДМСО) δ: 0,89 (9H, т.By), 3,2 - 3,55 (2H, м), 3,68 (1H, д, J=14,0 Гц), 3,88 (2H, с), 4,32 (1H, д, J=14,0 Гц), 4,3 - 4,5 (1H, м), 6,19 (1H, с), 6,39 (1H, д, J=2,42 Гц), 7,5 - 8,1 (6H, м).
Пример 144
Трет. бутил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил]-N-метансульфониламиноацетат
Растворяют 5 мл N, N-диметилформамида 0,44 г трет.бутил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил] аминоацетата, полученного в примере 142. К раствору прибавляют 0,072 мл метансульфонилхлорида и 0,14 мл триэтиламина при охлаждении льдом. После 30 мин перемешивания при комнатной температуре реакционную смесь экстрагируют 100 мл воды и 100 мл этилацетата. Этилацетатный слой промывают 5%-ным раствором бисульфата калия и водным раствором бикарбоната натрия и сушат над безводным сульфатом магния. Этилацетат выпаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (гексан-этилацетат = 3:1), получают 0,37 г трет.бутил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил]-N- метансульфониламиноацетата в виде призм с т.пл. 178 - 180oC.
Элементный анализ для C28H36Cl2N2O6S:
Вычислено, %: C 56,09; H 6,05; N 4,67
Найдено, %: C 55,92; H 6,06; N 4,47
Пример 145
N-[Транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил]-N-метансульфониламиноуксусная кислота
Растворяют в 20 мл 4H HCl-диоксанового раствора 0,25 г трет.бутил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил] -N-метансульфониламиноацетата, полученного в примере 144. После 8 ч перемешивания при комнатной температуре реакционную смесь концентрируют при пониженном давлении. Остаток обрабатывают гексаном и этилацетатом, получают 0,21 г N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил] -N-метансульфониламиноуксусной кислоты в виде призм с т.пл. 236 - 238oC.
Элементный анализ для C24H28Cl2N2O6S:
Вычислено, %: C 53,04; H 5,19; N 5,15
Найдено, %: C 53,32; H 5,42; N 5,02
Пример 146
Трет. бутил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил]-N-(п-толуолсульфонил)аминоацетат
Растворяют в 10 мл N, N-диметилформамида 0,5 г трет.бутил-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил] аминоацетата, полученного в примере 142. К раствору прибавляют 0,22 г п-толуолсульфонилхлорида вместе с 0,16 мл триэтиламина при охлаждении льдом.
Смесь перемешивают 1 ч при комнатной температуре, затем экстрагируют 100 мл воды и 100 мл этилацетата. Этилацетатный слой промывают 5%-ным раствором бисульфата калия и водным раствором бикарбоната натрия, сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 5: 1), получают трет.бутил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил]-N-(п-толуолсульфонил) аминоацетат в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 0,92 (9H, с, т.-Bu), 2,39 (3H, с), 3,36 (1H, д, J=14,0 Гц), 3,66 (1H, дд, J=15,6 6,4 Гц), 3,84 (1H, дд, J=15,6, 5,9 Гц), 3,98 (1H, д, J=18,4 Гц), 4,2 - 4,3 (1H, м), 4,29 (1H, д, J=18,4 Гц), 4,45 (1H, д, J=14,0 Гц), 6,20 (1H, с), 6,46 (1H, с, J=2,1 Гц), 7,15 - 7,7 (10H, м).
Пример 147
N-[Транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил]-N-(п-толуолсульфонил)-аминоуксусная кислота.
Растворяют в 15 мл 4H HCl-диоксанового раствора 0,5 г трет.бутил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил] -N-(п-толуолсульфонил) аминоацетата, полученного в примере 146. После 4 ч перемешивания при комнатной температуре реакционный раствор концентрируют при пониженном давлении. Остаток обрабатывают гексаном и диэтиловым эфиром, получают 0,41 г N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил] -N-(п-толуолсульфонил) аминоуксусной кислоты в виде игл с т.пл. 132 - 134oC.
Элементный анализ для C30H32Cl2N2O6S:
Вычислено, %: C 58,16; H 5,21; N 4,52
Найдено, %: C 58,01; H 5,32; N 4,55
Пример 148
Трет. бутил-N-ацетил- N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил]-аминоацетат
Растворяют в 10 мл N,N-диметилформамида 0,5 г трет.бутил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил] аминоацетата, полученного в примере 142. К раствору прибавляют 0,082 мл ацетилхлорида и 0,16 мл триэтиламина при охлаждении льдом.
Смесь 30 мин перемешивают при комнатной температуре и потом экстрагируют 100 мл воды и 100 мл этилацетата. Этилацетатный слой промывают 5%-ным раствором бисульфата калия и водным раствором бикарбоната натрия, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 1: 1), получают 0,5 г трет.бутил-N-ацетил-N[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил]аминоацетата в виде масла.
ИК-спектр ν
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 0,92 и 0,94 (9H, каждый с, т.-Bu), 1,95 и 2,15 (3H, каждый с, т.-Bu), 3,35 и 3,38 (1H, каждый д, J = 14,0 Гц), 3,7 - 4,3 (5H, м), 4,45 и 4,48 (1H, каждый д, J = 14,0 Гц), 6,23 и 6,28 (1H, каждый с), 6,45 - 6,55 (1H, м), 7,3 - 7,8 (6H, м).
Пример 149
N-Ацетил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил]аминоуксусная кислота
Растворяют в 20 мл 4H HCl-диоксанового раствора 0,5 г трет.бутил-N-ацетил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил] аминоацетата, полученного в примере 148. После перемешивания в течение ночи при комнатной температуре смесь концентрируют при пониженном давлении. Концентрат обрабатывают гексаном и диэтиловым эфиром, получают 0,37 г порошкообразной N-ацетил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил- 2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил] аминоуксусной кислоты.
Элементный анализ для C25H28Cl2N2O5:
Вычислено, %: C 59,18; H 5,56; N 5,52
Найдено, %: C 59,36; H 5,70; N 5,50
1H-ЯМР-спектр (200 МГц, CDCl3) δ: 0,92 и 0,94 (9H, каждый с. т.-Bu), 2,00 и 2,20 (3H, каждый с), 3,3 - 3,5 (1H, м), 3,7 - 4,5 (6H, м), 6,22 и 6,28 (1H, каждый с), 6,45 - 6,55 (1H, м), 7,3 - 7,8 (6H, м).
Пример 150
Метиловый эфир 4-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил]аминометилбензойной кислоты
(A) Смешивают в 30 мл ацетонитрила 1,0 г транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метиламина гидрохлорида; полученного в примере 139, с 0,6 г метил-4-бромметилбензоата и 0,75 г карбоната калия. Смесь кипятят 2 ч с обратным холодильником. После добавления 0,2 г метил-4-бромметилбензоата продолжают кипячение с обратным холодильником еще 5 ч, потом концентрируют при пониженном давлении. Концентрат экстрагируют 100 мл воды и 150 мл этилацетата. Этилацетатный слой промывают водой и сушат над безводным сульфатом магния. Выпаривают растворитель при пониженном давлении и очищают остаток хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 10:1 - 1:2), получают 0,15 г метилового эфира 4-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро- 4,1-бензоксазепин-3-метил] аминометилбензойной кислоты в виде призм с т.пл. 171 - 173oC.
Элементный анализ для C30H32Cl2N2O4:
Вычислено, %: C 64,87; H 5,81; N 5,04
Найдено, %: C 64,88; H 5,97; N 4,76
(B) Растворяют в 20 мл этанола 0,45 г транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метиламина гидрохлорида, полученного в примере 139. К раствору прибавляют 0,19 г метилового эфира терефталальдегидной кислоты вместе с 0,5 мл уксусной кислоты. После 30 мин перемешивания при комнатной температуре к смеси прибавляют 82 мг цианоборгидрида натрия. После дополнительного перемешивания в течение 2 ч при комнатной температуре смесь концентрируют при пониженном давлении и экстрагируют концентрат 100 мл воды и 100 мл этилацетата. Органический слой промывают водой и сушат над безводным сульфатом магния. Органический растворитель отгоняют при пониженном давлении и очищают остаток хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 1:1), получают 0,31 г метилового эфира 4-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил]аминометилбензойной кислоты.
Пример 151
Метиловый эфир 4-[N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил] -N- метансульфонил] аминометилбензойной кислоты
Растворяют в 5 мл N, N-диметилформамида 0,3 г метилового эфира 4-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил] аминобензойной кислоты, полученного в примере 150. К раствору прибавляют 0,05 мл метансульфонилхлорида и 0,09 мл триэтиламина. После 1 ч перемешивания при комнатной температуре реакционную смесь экстрагируют 100 мл воды и 100 мл этилацетата. Этилацетатный слой промывают 1H соляной кислотой и водным раствором бикарбоната натрия, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 2:1), получают 0,27 г метилового эфира 4-[N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-бензоксазепин-2-метил]-N-метансульфонил]аминометилбензойной кислоты в виде игл с т.пл. 173 - 174oC.
Элементный анализ для C31H34Cl2N2O6S:
Вычислено, %: C 58,77; H 5,41; N 4,42
Найдено, %: C 58,59; H 5,68; N 4,19
Пример 152
4-[N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил] -N-метансульфонил] аминометилбензойная кислота
Растворяют в 10 мл метанола 0,17 г метилового эфира 4-[N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил] -N-метансульфонил] аминометилбензойной кислоты, полученного в примере 151. После добавления 4 мл 1H гидроксида натрия раствор 1 ч перемешивают при 60oC. Реакционную смесь затем подкисляют 50 мл 1H соляной кислоты и экстрагируют 50 мл этилацетата. Этилацетатный слой промывают водой, сушат над безводным сульфатом магния и концентрируют при пониженном давлении, получают 0,16 г 4-[N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-метил] -N- метансульфонил] аминометилбензойной кислоты в виде призм с т.пл. 235 - 237oC.
Элементный анализ для C30H32Cl2N2O6S:
Вычислено, %: C 58,16; H 5,21; N 4,52
Найдено, %: C 58,25; H 5,49; N 4,29
Пример 153
Транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этанол
Растворяют в 200 мл тетрагидрофурана 14,7 г транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусной кислоты, полученной в примере 2, и 4,51 мл N-метилморфолина. К раствору прибавляют 3,92 мл этилхлоркарбоната при -10oC, затем смесь перемешивают 15 мин. После добавления 3,86 г боргидрида натрия 200 мл метанола прибавляют по каплям к раствору. Смесь перемешивают 1 ч при комнатной температуре, а затем концентрируют. После добавления 200 мл 1H соляной кислоты концентрат экстрагируют 200 мл этилацетата. Органический слой промывают насыщенным водным раствором бикарбоната натрия и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией с силикагелем (элюент: гексан-этилацетат = 1:1), получают 14,2 г транс-7-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1- бензоксазепин-3-этанола в виде бесцветных кристаллов с т.пл. 157 - 159oC.
Элементный анализ для C22H25Cl2NO3:
Вычислено, %: C 62,56; H 5,97; N 3,32
Найдено, %: C 62,30; H 6,02; N 3,17
Пример 154
Этиловый эфир N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил]аминоуксусной кислоты
(1) Транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетальдегид
К 25 мл дихлорметанового раствора, содержащего 0,70 мл оксалилхлорида, прибавляют 5 мл дихлорметанового раствора, содержащего 0,71 мл диметилсульфоксида, при -78oC, затем 5 мин перемешивают. К раствору медленно прибавляют 10 мл дихлорметанового раствора, содержащего 1,69 г транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этанола, полученного в примере 160, потом 15 мин перемешивают при -78oC. К реакционной смеси прибавляют 2,79 мл триэтиламина и перемешивают еще 1 ч при 0oC и 1,5 ч при комнатной температуре. После добавления 100 мл воды проводят экстракцию 100 мл дихлорметана. Дихлорметановый слой промывают насыщенным рассолом и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 1:1), получают 1,08 г транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетальдегида в виде светло-желтых кристаллов с т.пл. 173 - 176oC.
Элементный анализ для C22H23Cl2NO3 • 0,5H2O:
Вычислено, %: C 61,55; H 5,63; N 3,26
Найдено, %: C 61,27; H 5,49; N 3,17
(2) Этиловый эфир N-[транс-7-(хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил]аминоуксусной кислоты
К 40 мл этанола, содержащего 1,12 г транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетальдегида, полученного в примере 161(1), и 0,56 г солянокислого этилового эфира глицина прибавляют 10 мл этанола, содержащего 0,13 г цианоборгидрида натрия, по каплям в течение 1,5 ч. После 3 ч дополнительного перемешивания реакционную смесь экстрагируют 200 мл воды и 200 мл этилацетата. Этилацетатный слой промывают насыщенным рассолом и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении и очищают остаток хроматографией на колонке с силикагелем (элюент: этилацетат), получают 0,75 г аморфного твердого этилового эфира N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил]аминоуксусной кислоты.
Элементный анализ для C26H32Cl2N2O4:
Вычислено, %: C 61,54; H 6,36; N 5,53
Найдено, %: C 61,16; H 6,29; N 5,56
1H-ЯМР-спектр (CDCl3) δ: 0,93 (9H, с, т.-Bu), 1,26 (3H, т, J = 7,2 Гц), 1,90 - 2,15 (3H, м), 2,76 (2H, дд, J = 7,2, 6,6 Гц), 3,38 (1H, д, J = 13,9 Гц), 3,38 (2H, с), 4,03 (1H, дд, J = 6,6, 6,2 Гц), 4,17 (2H, к, J = 7,2 Гц), 4,51 (1H, д, J = 13,9 Гц), 6,24 (1H, с), 6,51 (1H, д, J = 1,6 Гц), 7,30 - 7,50 (5H, м), 7,70 - 7,80 (1H, м).
Пример 155
Этиловый эфир N-ацетил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил]-аминоуксусной кислоты
В 5 мл N, N-диметилформамида растворяют 0,15 г этилового эфира N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил] аминоацетата, полученного в примере 154. К раствору прибавляют 0,031 мл ацетилхлорида и 0,050 мл триэтиламина при охлаждении льдом. После 30 мин перемешивания при охлаждении льдом реакционную смесь экстрагируют 40 мл воды и 40 мл этилацетата. Этилацетатный слой промывают насыщенным рассолом и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 1:3), получают 0,15 г аморфного твердого этилового эфира N-ацетил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил]аминоуксусной кислоты.
Элементный анализ для C28H34Cl2N2O5 • 0,4H2O:
Вычислено, %: C 60,41; H 6,30; N 5,03
Найдено, %: C 60,44; H 6,43; N 4,96
1H-ЯМР-спектр (CDCl3) δ: 0,93 и 0,94 (9H, каждый с, т.-Bu), 1,20 - 1,32 (3H, м), 1,95 - 2,20 (2H, м), 1,95 и 2,13 (все 3H, каждый с), 3,32 - 3,68 (3H, м), 3,90 - 4,27 (5H, м), 4,48 и 4,50 (всего 1H, каждый д, J = 13,8 Гц), 6,22 и 6,24 (всего 1H, каждый с), 6,50 и 6,53 (всего 1H, каждый д, J = 2,0 Гц), 7,29 - 7,50 (5H, м), 7,65 - 7,80 (1H, м).
Пример 156
N-Ацетил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил]аминоуксусная кислота
К 5 мл метанола, содержащего 0,11 г этилового эфира N-ацетил-N-[транс-7-хлор-5-(2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил] аминоацетата, полученного в примере 155, прибавляют 1 мл 0,5 М водного раствора карбоната калия. После 30 мин перемешивания при 60oC реакционную смесь подкисляют 0,5 мл 1H соляной кислоты и проводят экстракцию 20 мл воды и 20 мл этилацетата. Этилацетатный слой промывают насыщенным рассолом и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток обрабатывают эфиром, получают 0,07 г белой порошкообразной N-ацетил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-бензоксазепин-3-этил]аминоуксусной кислоты, т.пл. 210-212oC.
Элементный анализ для C26H30Cl2N2O5:
Вычислено, %: C 59,89; H 5,80; N 5,37
Найдено, %: C 59,78; H 5,85; N 5,13
Пример 157
Этиловый эфир N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил] -N-метансульфониламиноуксусной кислоты
B 5 мл N, N-диметилформамида растворяют 0,15 г этилового эфира N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил] -аминоуксусной кислоты, полученного в примере 154. К раствору прибавляют 0,028 мл метансульфонилхлорида и 0,050 мл триэтиламина при охлаждении льдом. После 30 мин перемешивания при охлаждении льдом проводят экстракцию 40 мл воды и 40 мл этилацетата. Этилацетатный слой промывают насыщенным рассолом и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении, и остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 2:1), получают 0,12 г этилового эфира N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро- 4,1-бензоксазепин-2-этил]-N-метансульфониламиноуксусной кислоты в виде белого порошка с т.пл. 134 - 135oC.
Элементный анализ для C27H34Cl2N2O6S:
Вычислено, %: C 55,38; H 5,85; N 4,78
Найдено, %: C 55,66; H 5,98; N 4,61
Пример 158
N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил]-N-метансульфониламиноуксусная кислота
Работают по методике примера 156, гидролизуют 0,12 г этилового эфира N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил] -N-метансульфониламиноуксусной кислоты, полученного в примере 157, получают 0,10 г белого порошка N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил] -N-метансульфонилуксусной кислоты с т.пл. 135 - 137oC.
Элементный анализ для C25H30Cl2N2O6S • 0,5H2O:
Вычислено, %: C 53,00; H 5,52; N 4,94
Найдено, %: C 53,25; H 5,78; N 4,71
Пример 159
Этиловый эфир N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил]-N-(п-толуолсульфонил)аминоуксусной кислоты
В 5 мл N, N-диметилформамида растворяют 0,15 г этилового эфира N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил]аминоуксусной кислоты, полученного в примере 154. К раствору прибавляют 0,069 г п-толуолсульфонилхлорида вместе с 0,050 мл триэтиламина при охлаждении льдом. После 30 мин перемешивания при охлаждении льдом реакционную смесь экстрагируют 40 мл воды и 40 мл этилацетата. Этилацетатный слой промывают насыщенным рассолом и сушат над безводным сульфатом магния. Этилацетатный слой разгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: гексан-этилацетат = 3: 1), получают 0,17 г аморфного этилового эфира N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил] -N-п-толуолсульфониламиноуксусной кислоты.
Элементный анализ для C33H38Cl2N2O6S:
Вычислено, %: C 59,91; H 5,79; N 4,23
Найдено, %: C 60,25; H 6,01; N 4,04
1H-ЯМР-спектр (CDCl3) δ: 0,94 (9H, с, т.-Bu), 1,15 (3H, т, J = 7,2 Гц), 1,90 - 2,30 (2H, м), 2,41 (3H, с), 3,20 - 3,60 (2H, м), 3,41 (1H, д, J = 140 Гц), 3,97 - 4,18 (5H, м), 4,50 (1H, д, J = 14,0 Гц), 6,23 (1H, с), 6,52 (1H, с), 7,21 - 7,50 (7H, м), 7,62 - 7,80 (3H, м).
Пример 160
N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил]-N-п-толуолсульфониламиноуксусная кислота
Работают по методике примера 156, проводят гидролиз 0,15 г этилового эфира N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил] -N-п- толуолсульфониламиноуксусной кислоты в виде белого порошка с т.пл. 274-277oC.
Элементный анализ для C31H34Cl2N2O6S:
Вычислено, %: C 58,77; H 5,41; N 4,42
Найдено, %: C 58,70; H 5,59; N 4,13
Пример 161
Метиловый эфир 4-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил]аминометилбензойной кислоты
Смесь 0,42 г транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ацетальдегида, полученного в примере 154(1), 0,30 г солянокислой соли метилового эфира 4-аминометилбензойной кислоты и 30 мл этанола перемешивают 2 ч при комнатной температуре. Потом к смеси медленно по каплям прибавляют 5 мл этанола, содержащего 0,06 цианборгидрида натрия. После 2 ч перемешивания реакционную смесь экстрагируют 100 мл воды и 100 мл этилацетата. Этилацетатный слой промывают насыщенным рассолом и сушат над безводным сульфатом магния. Органический растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (элюент: этилацетат), получают аморфный метиловый эфир 4-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил] аминометилбензойной кислоты.
Элементный анализ для C31H34Cl2N2O4:
Вычислено, %: C 65,38; H 6,02; N 4,92
Найдено, %: C 64,99; H 6,11; N 5,19
1H-ЯМР-спектр (CDCl3) δ: 0,94 (9H, с, т.-Bu), 1,98 - 2,26 (3H, м), 2,65 - 2,90 (2H, м), 3,38 (1H, д, J = 14,0 Гц), 3,83 (2H, с), 3,91 (3H, с), 4,06 (1H, т, J = 6,2 Гц), 4,49 (1H, д, J = 14,0 Гц), 6,21 (1H, с), 5,51 (1H, д, J = 2,0 Гц), 7,26 - 7,62 (8H, м), 7,92 - 8,02 (2H, м).
Пример 162
Метиловый эфир 4-[N-ацетил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил]]-аминометилбензойной кислоты
Работают по методике примера 155, 0,13 г метилового эфира 4-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил] -аминометилбензойной кислоты, полученного в примере 161, обрабатывают 0,13 г аморфного метилового эфира 4-[N-ацетил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил]]-аминометилбензойной кислоты.
Элементный анализ для C33H36Cl2N2O5:
Вычислено, %: C 64,81; H 5,93; N 4,58
Найдено, %: C 65,14; H 6,12; N 4,11
1H-ЯМР-спектр (CDCl3) δ: 0,93 (9H, с, т.-Bu), 2,00 - 2,20 (2H, м), 2,02 и 2,18 (всего 3H, каждый с), 3,20 - 3,60 (3H, м), 3,78 - 4,00 (1H, м), 3,91 и 3,93 (всего 3H, каждый с), 4,42 - 4,76 (3H, м), 6,21 (1H, с), 6,50 (1H, д, J = 1,86 Гц), 7,17 - 7,70 (8H, м), 7,95 (1H, д, J = 8,0 Гц), 8,02 (1H, д, J = 8,2 Гц).
Пример 163
4-[N-ацетил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил]]-аминометилбензойная кислота
Работают по методике примера 156, гидролизуют 0,10 г метилового эфира 4-[N-ацетил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил]]-аминометилбензойной кислоты, полученного в примере 162, получают 0,08 г белого порошка 4-[N-ацетил-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил]]-аминометилбензойной кислоты с т.пл. 242 - 244oC.
Элементный анализ для C32H34Cl2N2O5:
Вычислено, %: C 64,32; H 5,74; N 4,69
Найдено, %: C 64,34; H 5,87; N 4,66
Пример 164
Метиловый эфир 4-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил]-N-метансульфонил]аминобензойной кислоты
Работают по методике примера 157, обрабатывают 0,13 г метилового эфира 4-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил] аминобензойной кислоты, полученного в примере 161, получают 0,12 г метилового эфира 4-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил] -N-метансульфонил] аминометилбензойной кислоты в виде бесцветных кристаллов с т.пл. 172 - 174oC.
Элементный анализ для C32H36Cl2N2O6S:
Вычислено, %: C 59,35; H 5,60; N 4,33
Найдено, %: C 59,15; H 5,79; N 4,16
Пример 165
4-N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил]-N-метансульфонил]аминометилбензойная кислота
Работают по методике примера 156, гидролизуют 0,09 г метилового эфира 4-[N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил] -N-метансульфонил] аминометилбензойной кислоты, полученного в примере 164, получают 0,06 г 4-[N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-бензоксазепин-3-этил] -N-метансульфонил]аминометилбензойной кислоты в виде бесцветных кристаллов с т. пл. 185 - 187oC.
Элементный анализ для C31H34Cl2N2O6S•0.5H2O:
Вычислено, %: C 57,95; H 5,49; N 4,36
Найдено, %: C 58,30; H 5,83; N 4,19
Пример 166
Метиловый эфир 4-[N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил] -N-п- толуолсульфонил]аминометилбензойной кислоты
Работают по методике примера 159, обрабатывают 0,13 г метилового эфира 4-[N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-бензоксазепин-3-этил] аминометилбензойной кислоты, полученного в примере 161, получают 0,14 г метилового эфира 4-[N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил] -N-п-толуолсульфонил]аминометилбензойной кислоты в виде бесцветных кристаллов с т.пл. 145 - 147oC.
Элементный анализ для C38H40Cl2N2O6S:
Вычислено, %: C 63,07; H 5,57; N 3,87
Найдено, %: C 63,09; H 5,50; N 3,93
Пример 167
4-[N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил] -N--п-толуолсульфонил] аминометилбензойная кислота
Работают по методике примера 156, гидролизуют 0,12 г метилового эфира 4-[N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-этил] -N-п-толуолсульфонил] аминометилбензойной кислоты, полученного в примере 166, получают 0,09 г 4-[N-[транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5- тетрагидро-4,1-бензоксазепин-3-этил]-N-п-толуолсульфонил] аминометилбензойной кислоты в виде бесцветного порошка с т. пл. 265 - 268oC.
Элементный анализ для C37H38Cl2N2O6S:
Вычислено, %: C 62,62; H 5,40; N 3,95
Найдено, %: C 62,67; H 5,36; N 3,96
Пример 168
Транс-7-хлор-5-(2-хлорфенил)-1-неопентил-3-[(тетразол-5-ил)-метиламинокарбонилметил] -2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусная кислота
Работают по методике примера 104, обрабатывают транс-7-хлор-5-(2-хлорфенил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-уксусную кислоту, полученную в примере 2, получают следующие кристаллические соединения:
(1) Транс-7-хлор-5-(2-хлорфенил)-3-(цианометиламинокарбонилметил)-1-неопентил-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин, т.пл. 171 - 172oC.
Элементный анализ для C24H25Cl2N3O3:
Вычислено, %: C 60,77; H 5,31; N 8,86
Найдено, %: C 60,68; H 5,24; N 8,62
(2) Транс-7-хлор-5-(2-хлорфенил)-1-неопентил-3-[(тетразол-5-ил)метиламинокарбонилметил] -2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин, т. пл. 251 - 252oC.
Элементный анализ для C24H26Cl2N6O3:
Вычислено, %: C 55,71; H 5,06; N 16,24
Найдено, %: C 56,38; H 5,22; N 16,03
Материалы и промежуточные соединения, включенные в примеры, приведены в таблицах 74 - 88.
2-Аминобензофеноны в качестве исходного материала могут быть синтезированы по или в соответствии с методикой, описанной D.A. Walsh, Synthesis, 677 (1980), или методикой, приведенной в указанной ссылке.
Экспериментальный пример 1
Метод анализа на ингибирующую активность скваленсинтетазы.
Проверяют ингибирующую активность скваленсинтетазы следующим образом, используя растворы фермента, описанные ниже в экспериментальных примерах 2 и 3.
Более конкретно, раствор фермента (содержание белка 0,8 мкг), приготовленный в экспериментальном примере 1 или 2, прибавляют к раствору (суммарный объем 50 мкл), содержащему 5 мкМ (1-3H) фарнезилпирофосфата (удельная активность 25 мкКи/моль), 1 мМ NADPH, 5 мМ MgCl2, 6 мМ глютатиона, 100 мМ буферного раствора фосфата калия (pH 7,4) и исследуемого лекарства (использовано в виде водного раствора или раствора в ДМСО), затем проводят реакцию при 37oC в течение 45 мин. К реакционной смеси прибавляют 150 мкл смеси хлороформа и метанола (1:2), чтобы суспендировать реакцию, потом прибавляют 50 мкл хлороформа и 50 мкл 3H водного раствора гидроксида натрия. Смешивают 50 мкл хлороформенного слоя (нижний слой), содержащего реакционную смесь, имеющую сквален в качестве основного компонента, и 3 мл жидкого сцинциллятора на основе толуола и определяют ее радиоактивность с помощью жидкостного сцинцилляционного счетчика.
Ингибирование активности скваленсинтетазы выражают как концентрацию, ингибирующую 50% радиоактивности, имеющейся в хлороформенном слое (ИК50, молярная концентрация (М)).
Экспериментальный пример 2
Приготовление фермента, происходящего из крыс.
Умерщвляют самца SD-крысы (6-недельного), спуская кровь, и извлекают печень. Примерно 10 г печени промывают физиологическим солевым раствором, охлажденным на льду, затем гомогенизируют ее в 15 мл охлажденного на льду буферного раствора (100 мМ фосфата калия (pH 7,4), 15 мМ никотинамида, 2 мМ MgCl2), затем центрифугируют 20 мин (4oC) при 10000g. Отделяют надосадочный слой и проводят дополнительное центрифугирование в течение 90 мин (4oC) при 105000g. Осадок затем суспендируют в охлажденном на льду 100 мМ фосфатном буферном растворе (pH 7,4), затем снова центрифугируют в течение 90 мин (4oC) при 105000g. Полученный таким образом осадок суспендируют в охлажденном на льду 100 мМ калийфосфатном буфере (pH 7,4) (концентрация белка около 40 мг/мл определена с помощью ВСА аналитического белкового набора фирмы Пиас Ко., Лтд). Эту суспензию используют в качестве раствора фермента.
Экспериментальный пример 3
Приготовление фермента, происходящего от человека.
Человеческие клетки гепатитной карциномы HepG2 (примерно 1•109 клеток), полученные при инкубации на модифицированной среде Дальбеко-Игла (37oC в присутствии 5% CO2) суспендируют в 10 мл охлажденного на льду буферного раствора (100 мМ калийфосфатного буфера (pH 7,4), 30 мМ никотинамида и 2,5 мМ MgCl2). Клетки разрывают с помощью ультразвукового озвучивания (30 с, дважды). Полученную при таком озвучивании микросомную фракцию получают по той же процедуре, что и в экспериментальном примере 1, затем ее суспендируют в охлажденном на льду 100 мМ калийфосфатном буфере (pH 7,4) (примерно концентрация белка 4 мг/мл). Эту суспензию используют в качестве ферментного раствора. Результаты приведены в таблице 89.
Экспериментальный пример 4
Действие.
Противогрибковые активности соединений I'' были оценены по следующей методике: диск из листа фильтровальной бумаги (производства "Тойо Сейсакушо", 8 мм в диаметре), смоченный 100 мкг/мл раствора соединения I'' в метаноле, помещают на агаровую пластину, которую инкубируют при 28oC в течение 2 дней, и измеряют зону ингибирования роста вокруг диска фильтровальной бумаги. Используют следующие культуральные среды:
A: агаровая среда на основе азота дрожжей (pH 7,0);
B: агаровая среда пептон-дрожжевой экстракт-глюкоза (pH 7,0).
Противогрибной спектр соединения I'' показан в таблице 90.
Упомянутые ниже тест-грибы депонированы в Институте ферментации. Осака, Япония (ИФО). Их номера хранения приведены в таблице 90.
Экспериментальный пример 5
In vivo холестериногенезис в печени.
Шестинедельным самцам крыс Спраг-Доули давали 5%-ный холестиламин в качестве кормовой добавки в течение 4 дней. Им вводят соединение в дозе 30 мг/кг в виде суспензии 0,5%-ного метилцеллюлозного раствора и внутривенно дают 2 мкКи (14C)ацетата через 1 ч после введения. Через час крыс умерщвляют и извлекают печень. Экстрагируют гепатитные стеролы петролейным эфиром после омыления и измеряют радиоактивность фракции, осажденной дигитонином. Соединение примера 1-(4) ингибирует гепатитный холестереогенезис на 38% по сравнению с контрольной группой, получавшей только 5%-ный раствор метилцеллюлозы.
Примеры рецептур
Агенты, ингибирующие скваленсинтетазу, содержащие в качестве своего эффективного компонента производное 4,1-бензоксазепин-2-она, показанное формулой I настоящего изобретения, или его соль, в случае когда его используют в качестве терапевтического агента при гиперхолистеринемии, могут быть сформулированы в соответствии, например, со следующими предписаниями.
1. Капсулы, мг:
(1) Соединение, полученное в примере 29 - 19 - 10
(2) Лактоза - 90
(3) Микрокристаллическая целлюлоза - 70
(4) Стеарат магния - 10
Одна капсула - 180
Смешивают (1), (2) и (3) и половину (4), смесь гранулируют, затем прибавляют до баланса (4). Смесью заполняют желатиновую капсулу.
2. Таблетки, мг:
(1) Соединение, полученное в примере 28 - 19 - 10
(2) Лактоза - 35
(3) Кукурузный крахмал - 150
(4) Микрокристаллическая целлюлоза - 30
(5) Стеарат магния - 5
Oдна таблетка - 230
Смешивают (1), (2) и (3) и две трети (4) и половину (5), смесь гранулируют, затем прибавляют до баланса (4) и (5). Смесь формуют прессованием, получают таблетки.
3. Инъекции, мг:
(1) Натриевая соль соединения, полученного в примере 28 - 19 - 10
(2) Инозит - 100
(3) Бензиловый спирт - 20
Одна ампула - 130
Растворяют в дистиллированной воде для инъекций (1), (2) и (3), чтобы получить общий объем 2 мл, раствор переносят в ампулу и ампулу запаивают. Все процессы проводят в стерильных условиях.
4. Капсулы, мг:
(1) Соединение, полученное в примере 1 - 4 - 10
(2) Лактоза - 90
(3) Микрокристаллическая целлюлоза - 70
(4) Стеарат магния - 10
Одна капсула - 180
Смешивают (1), (2) и (3) и половину (4), смесь гранулируют, затем до баланса прибавляют (4). Смесью заполняют желатиновые капсулы.
5. Таблетки, мг:
(1) Соединение, полученное в примере 1 - 4 - 10
(2) Лактоза - 35
(3) Кукурузный крахмал - 150
(4) Микрокристаллическая целлюлоза - 30
(5) Стеарат магния - 5
Одна таблетка - 230
Смешивают (1), (2), (3) и две трети (4) и половину (5), смесь гранулируют, затем прибавляют до баланса (4) и (5). Смесь формуют прессованием, получают таблетки.
6. Инъекции, мг:
(1) Натриевая соль соединения, полученного в примере 1 - 4 - 10
(2) Инозит - 100
(3) Бензиловый спирт - 20
Одна ампула - 130
Растворяют (1), (2) и (3) в дистиллированной воде для инъекций, чтобы получить суммарный объем 2 мл, раствор переносят в ампулу, ампулу запаивают. Все процессы ведут в стерильных условиях.
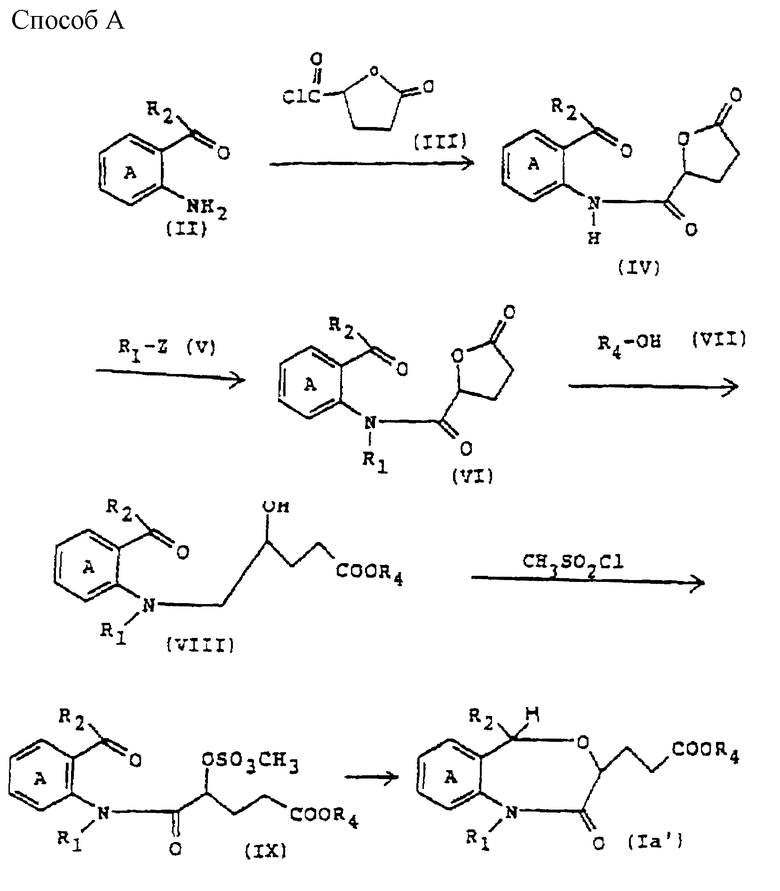
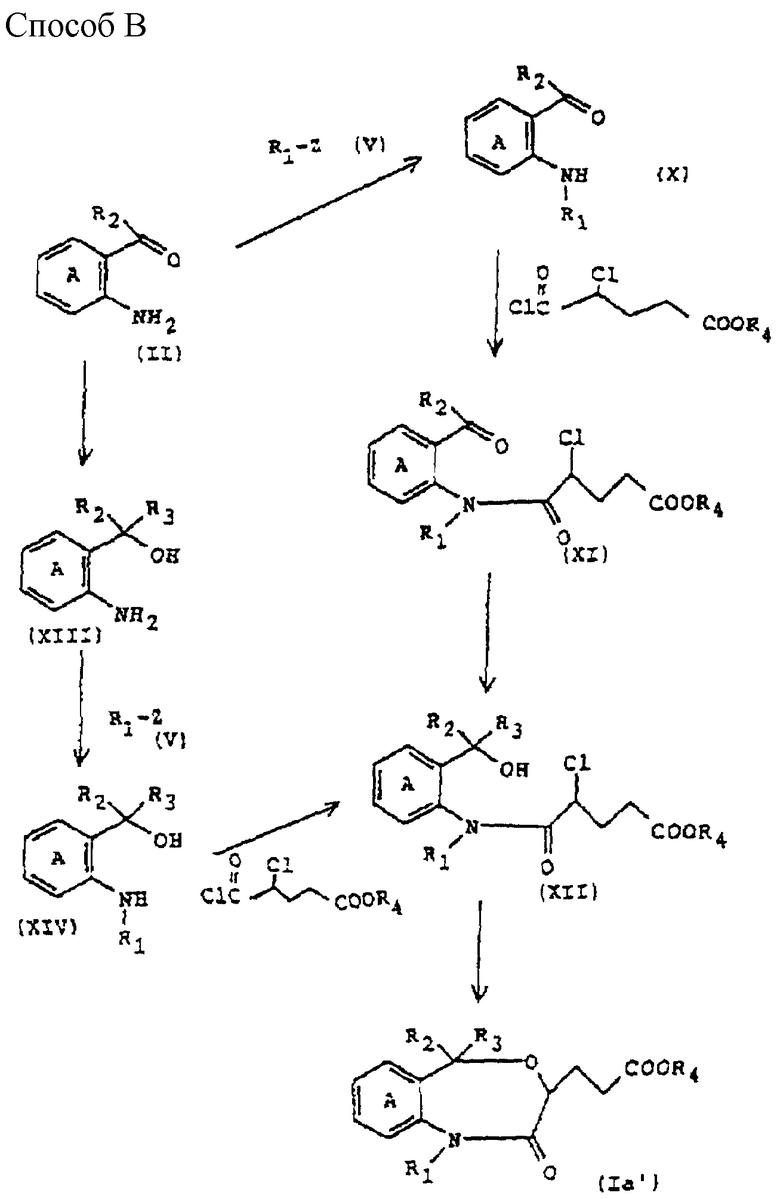

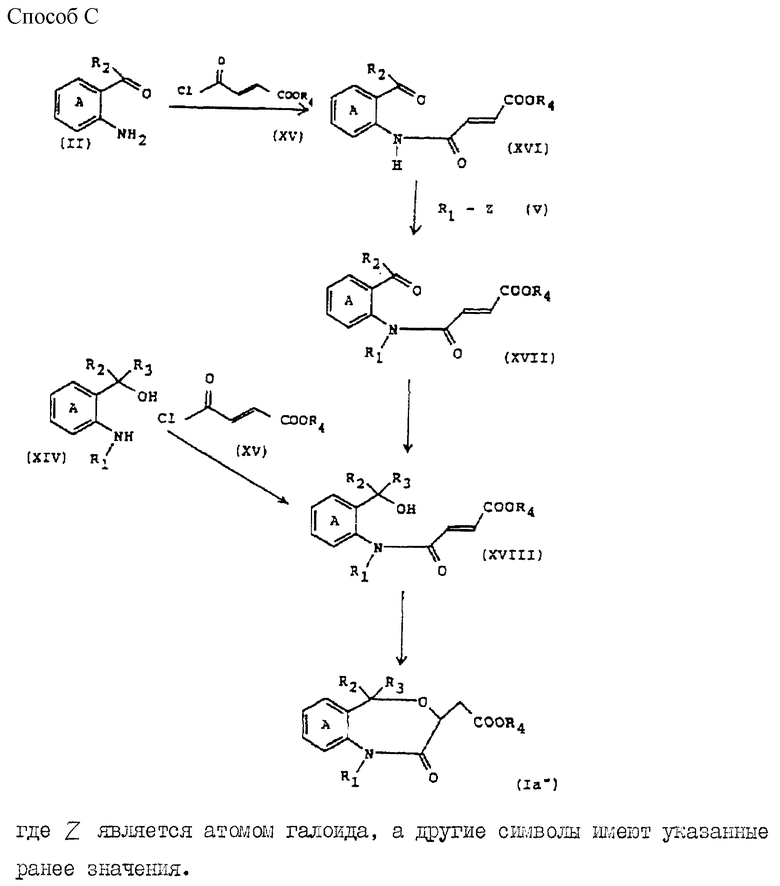
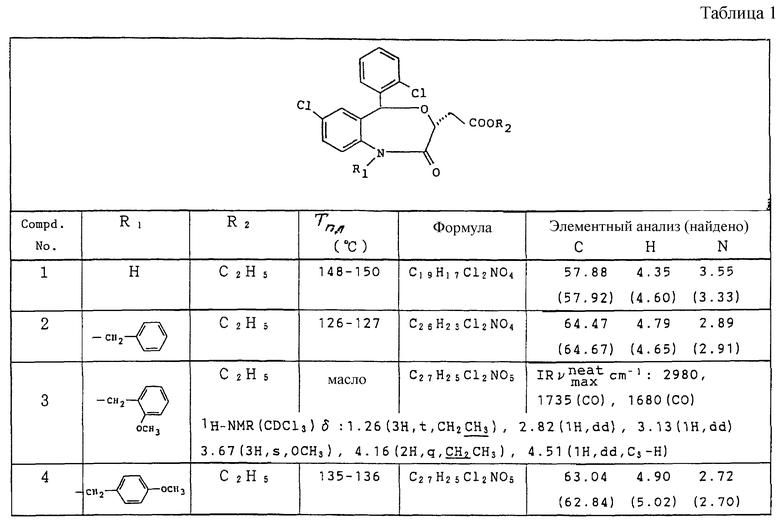
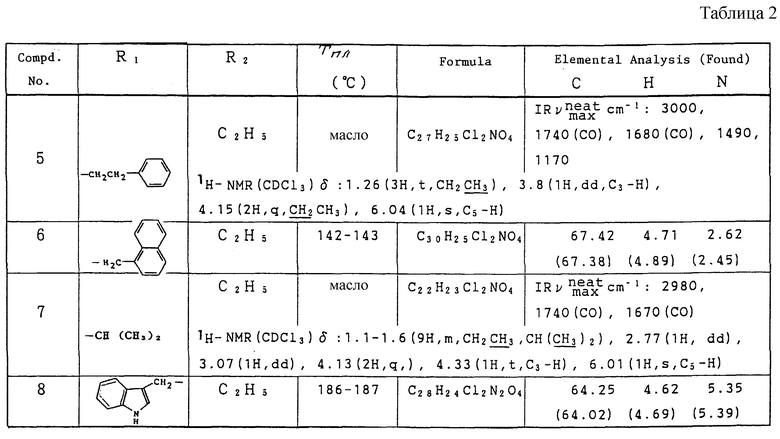

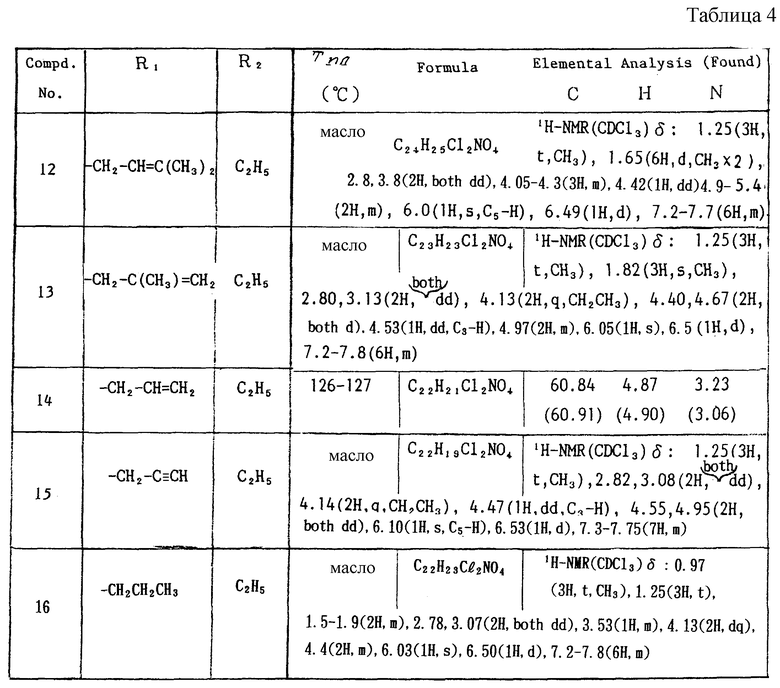
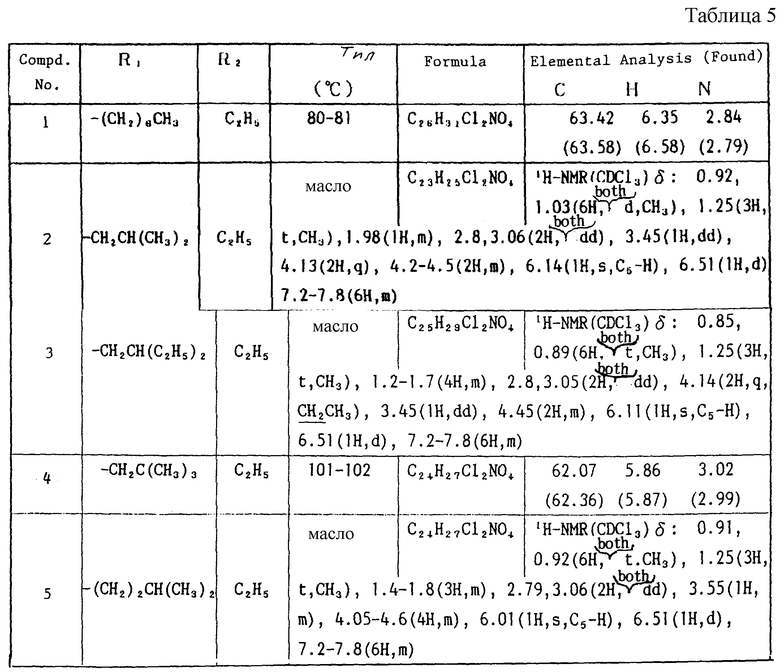
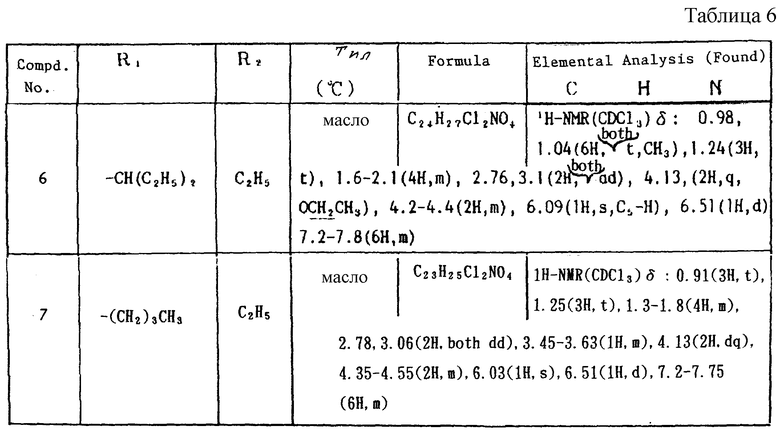
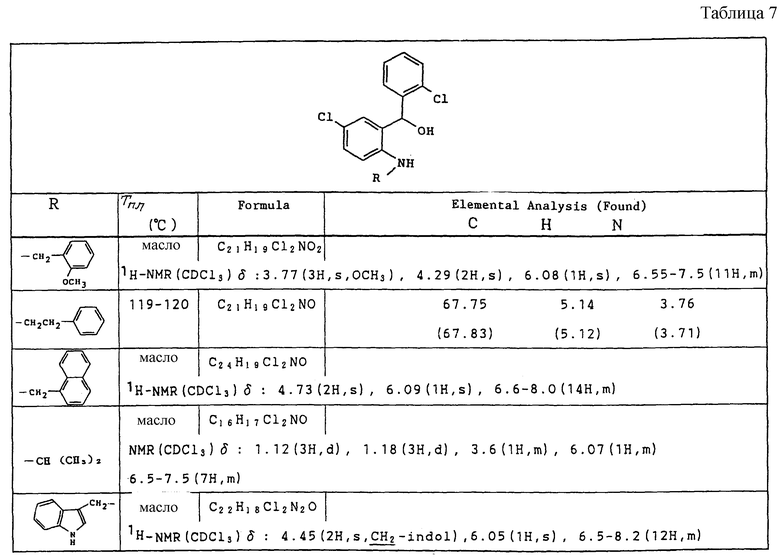
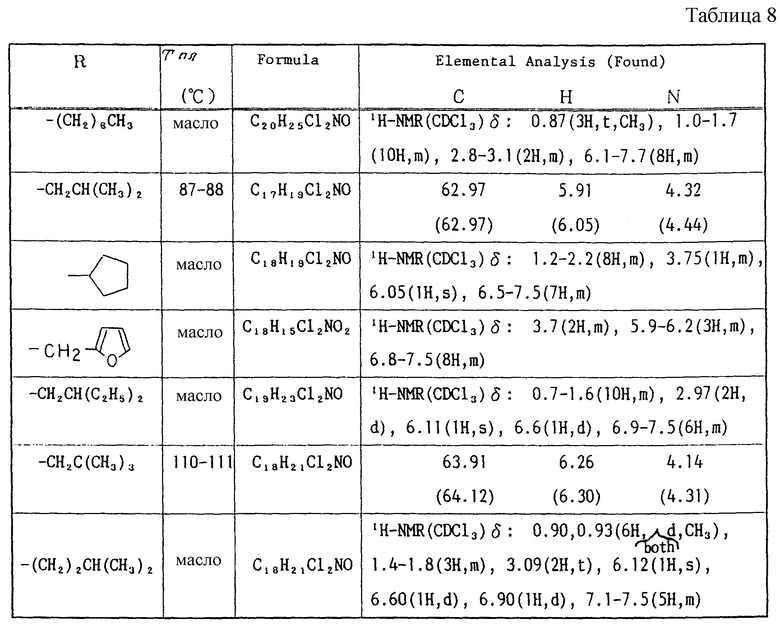
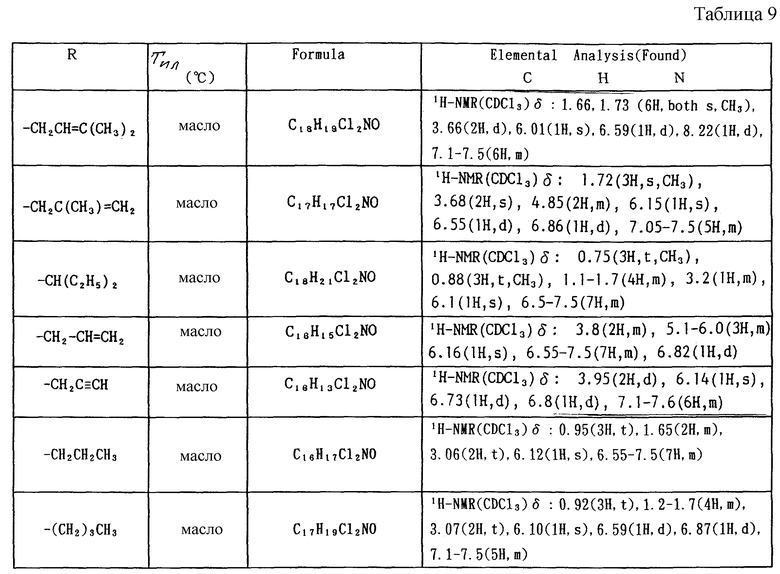
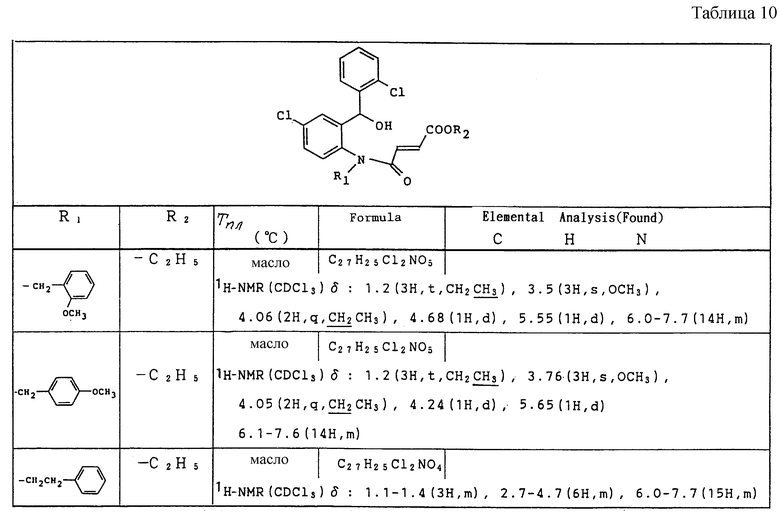
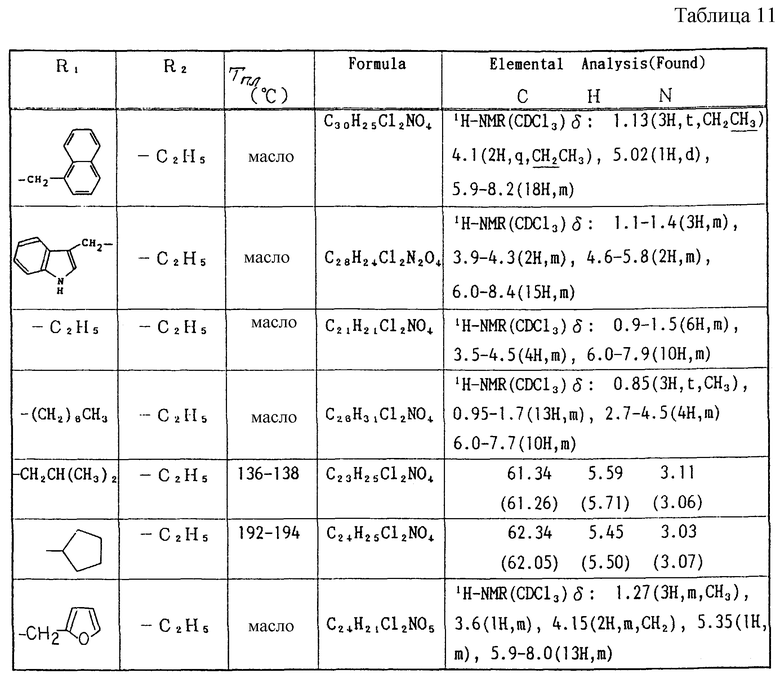

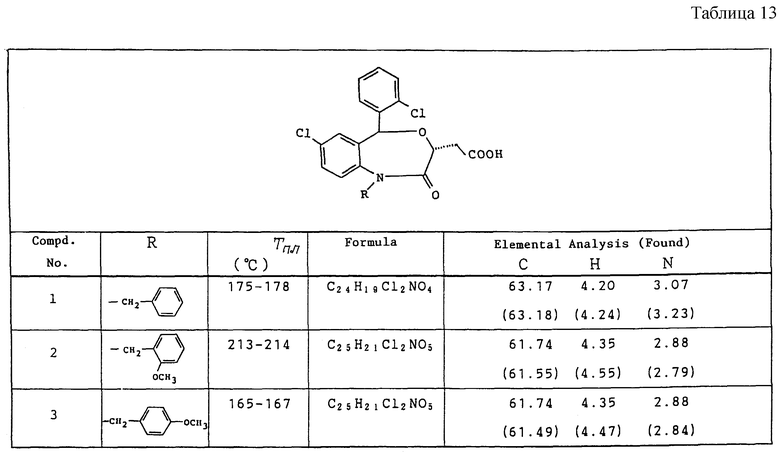
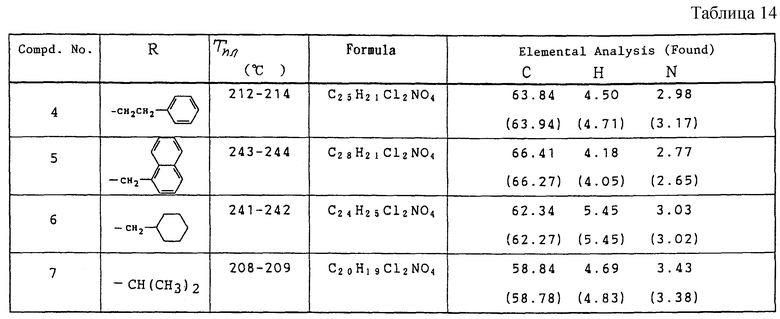


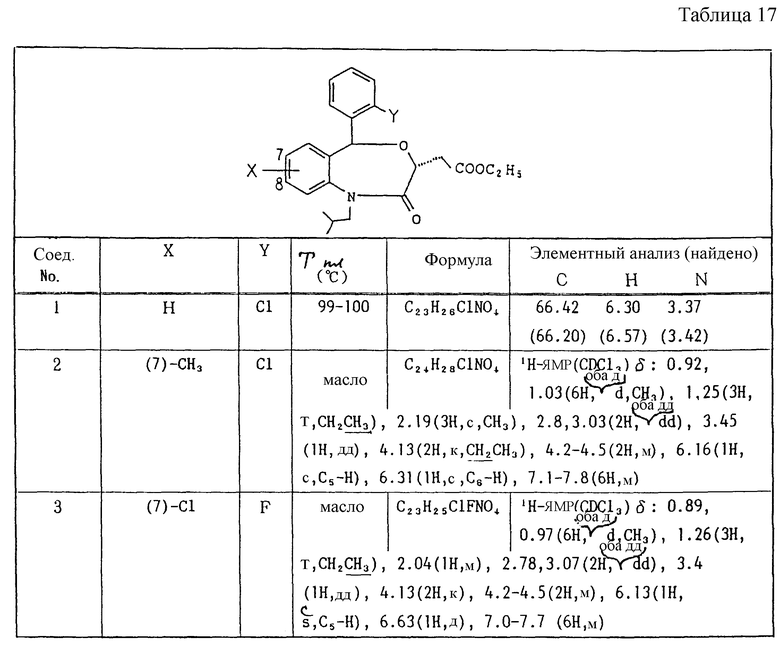
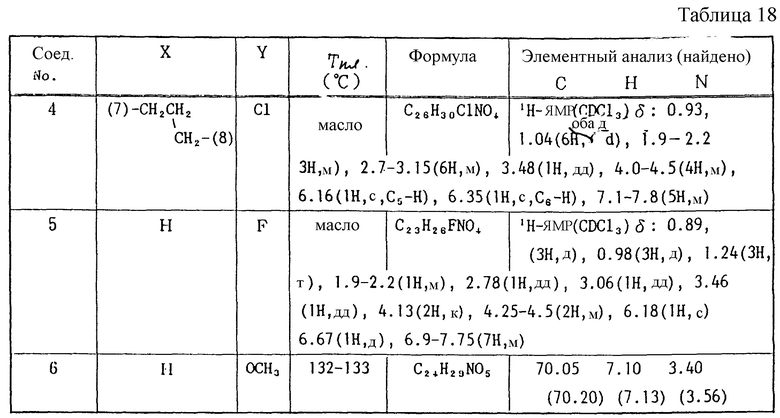


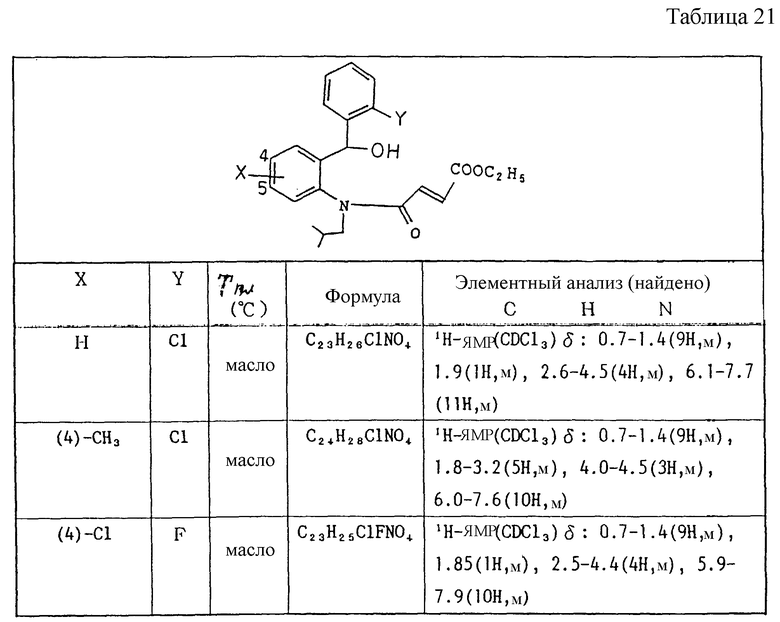


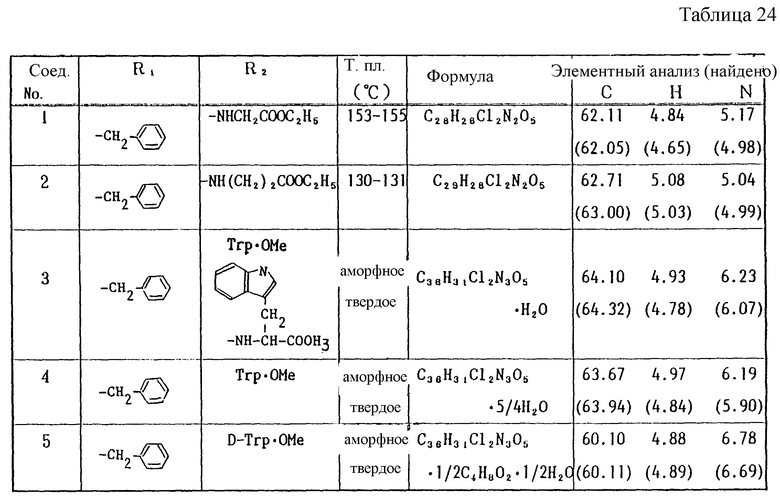
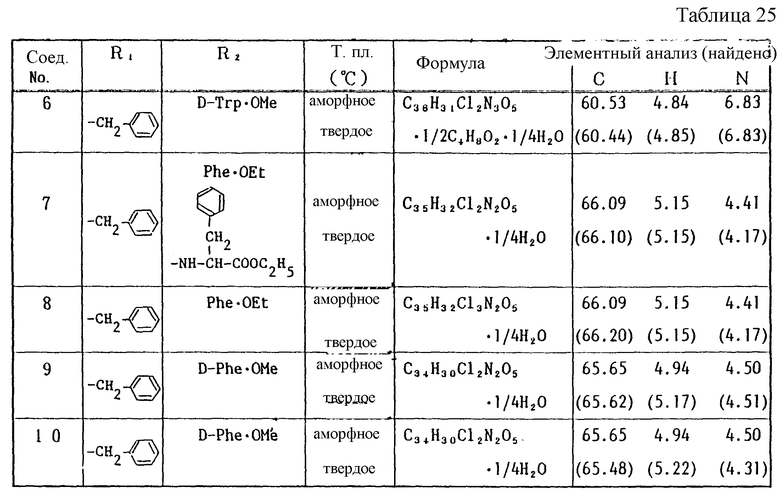

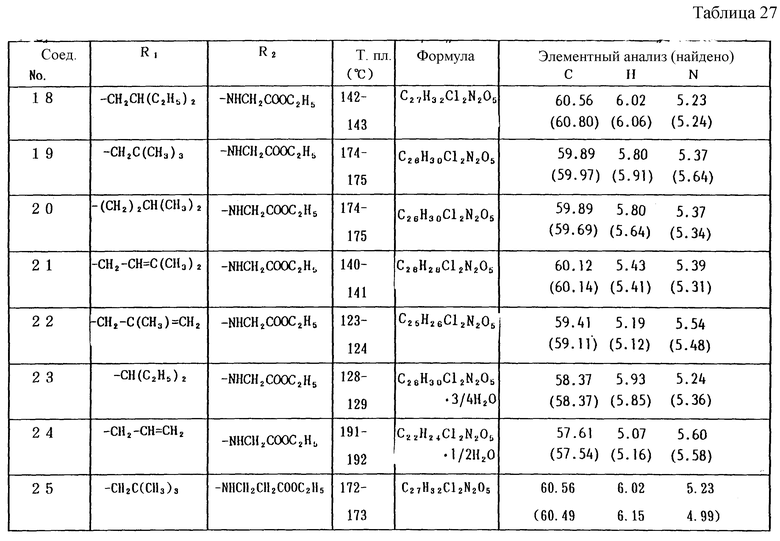

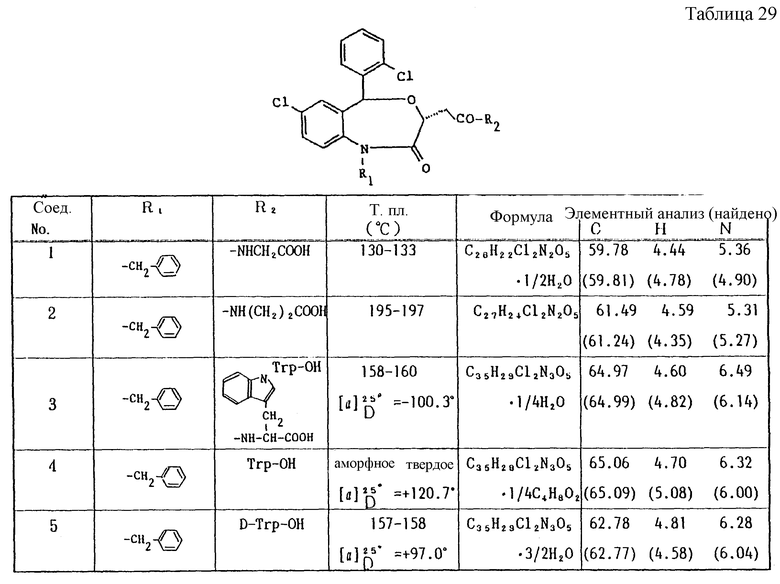
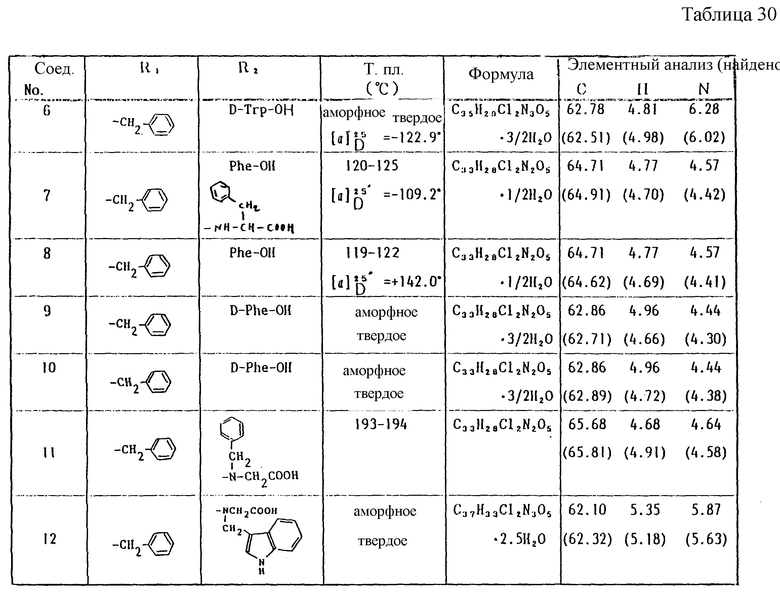

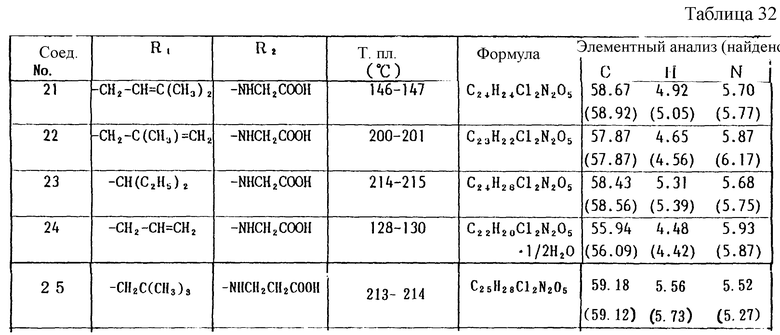

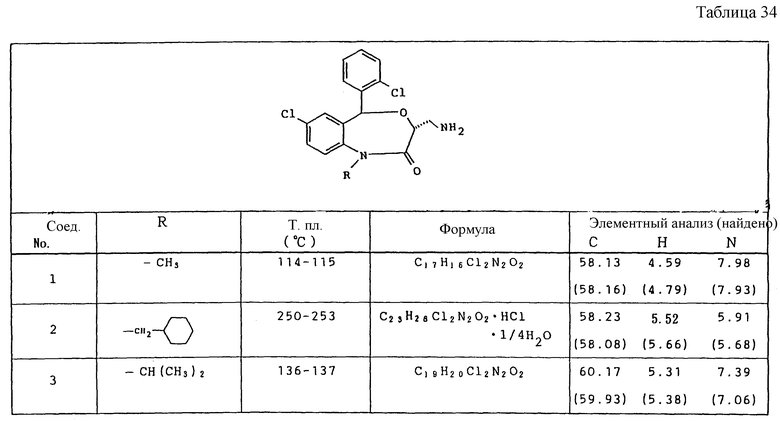

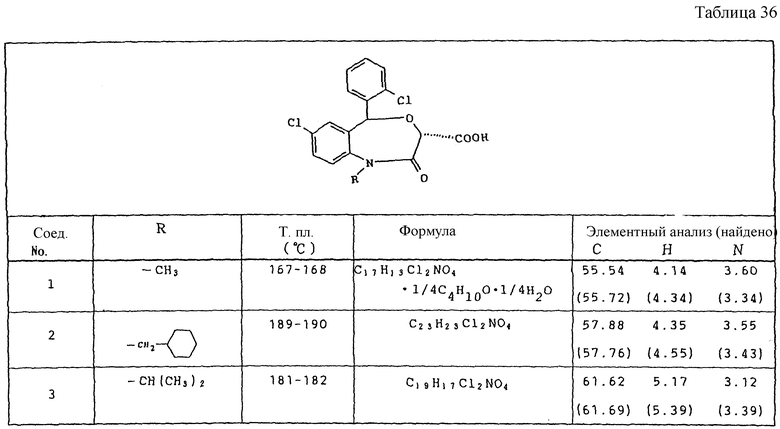
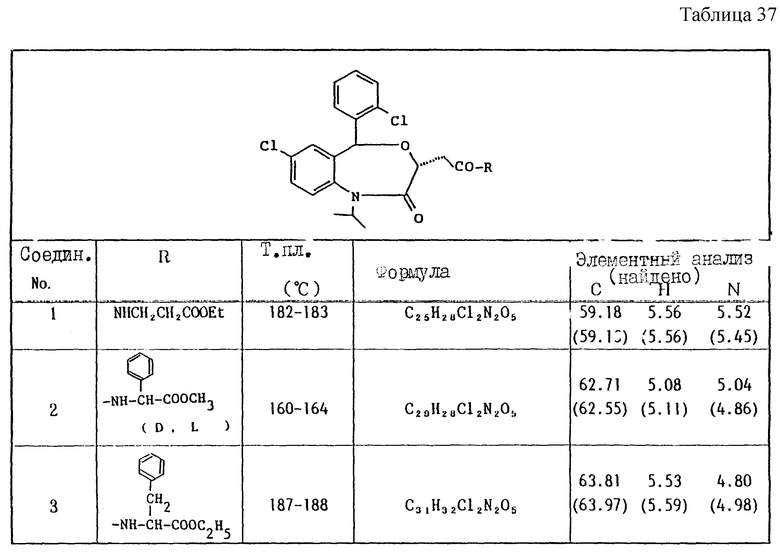



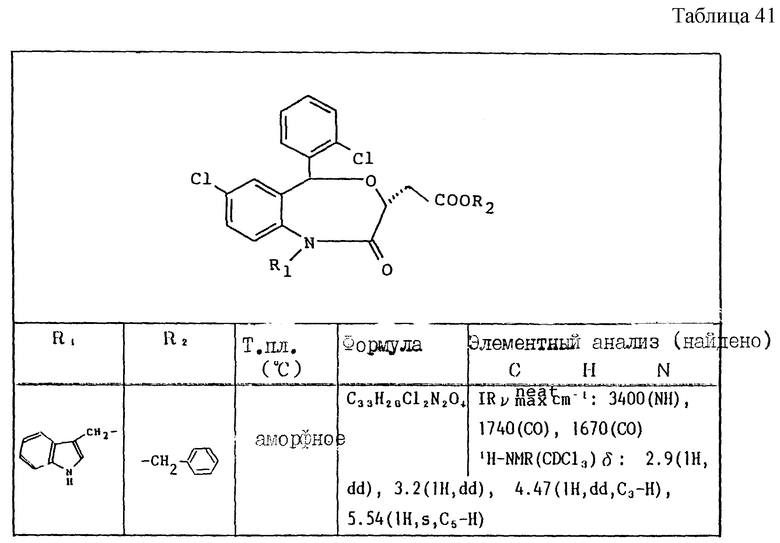

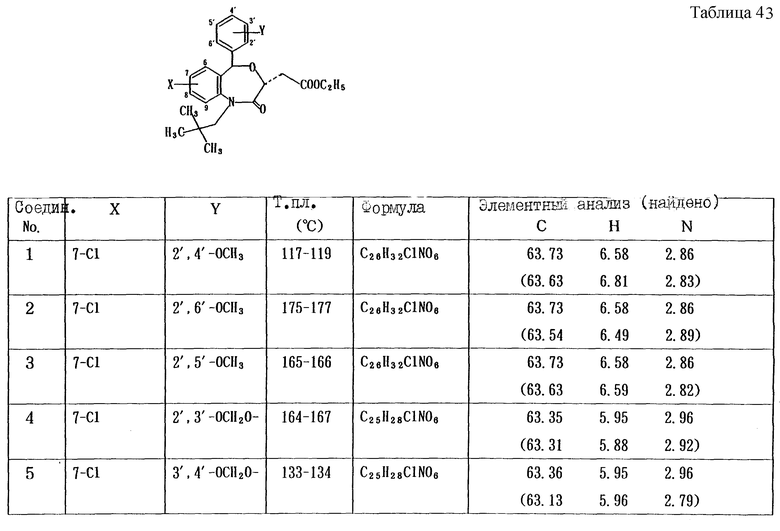
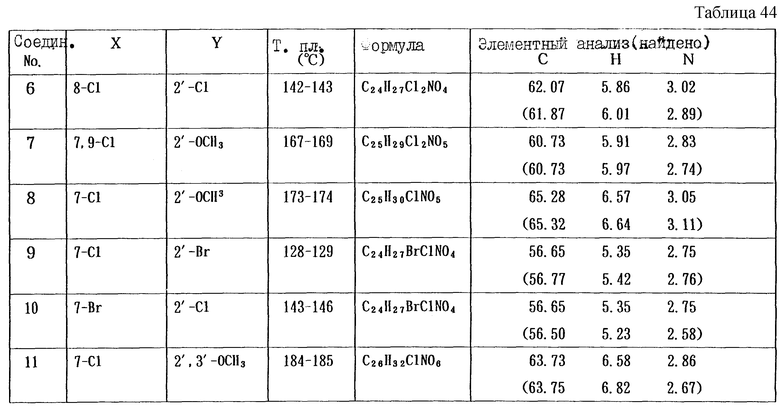
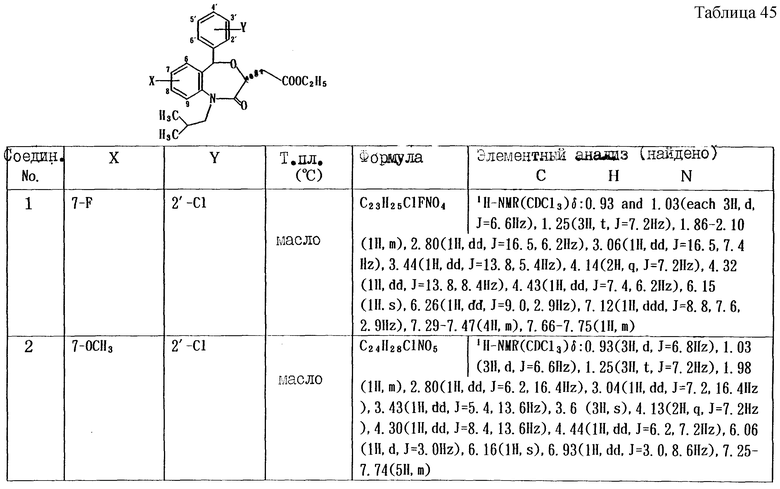
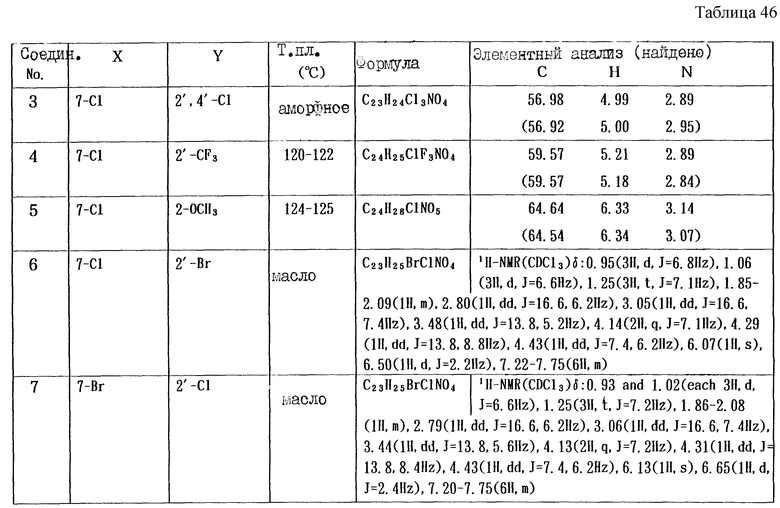
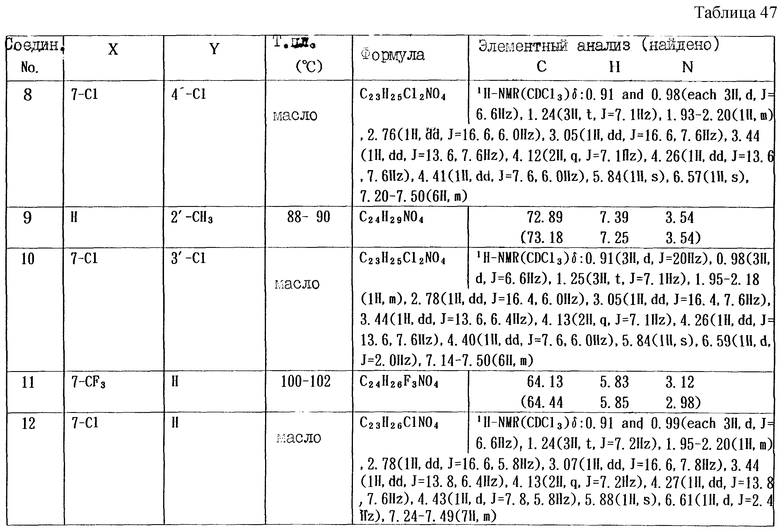
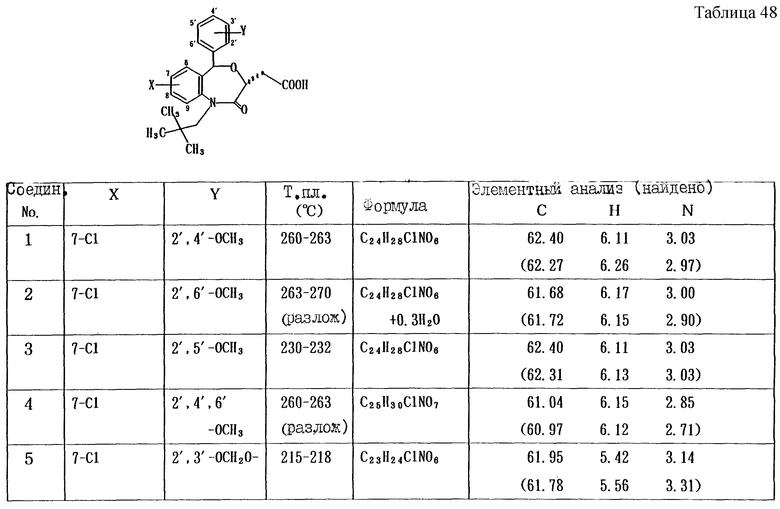

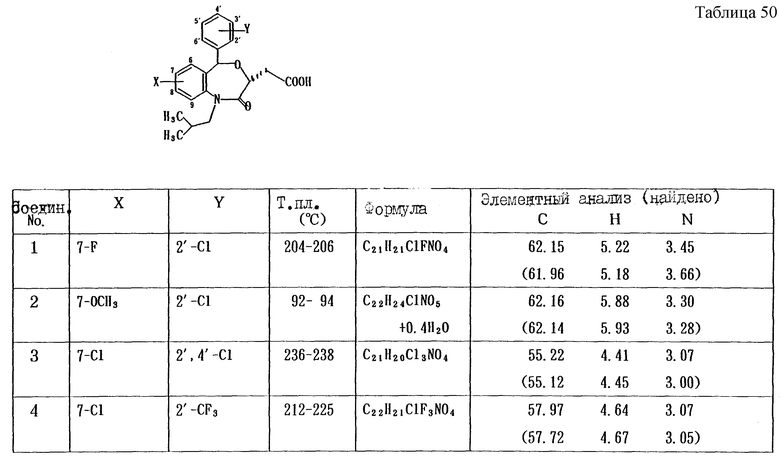
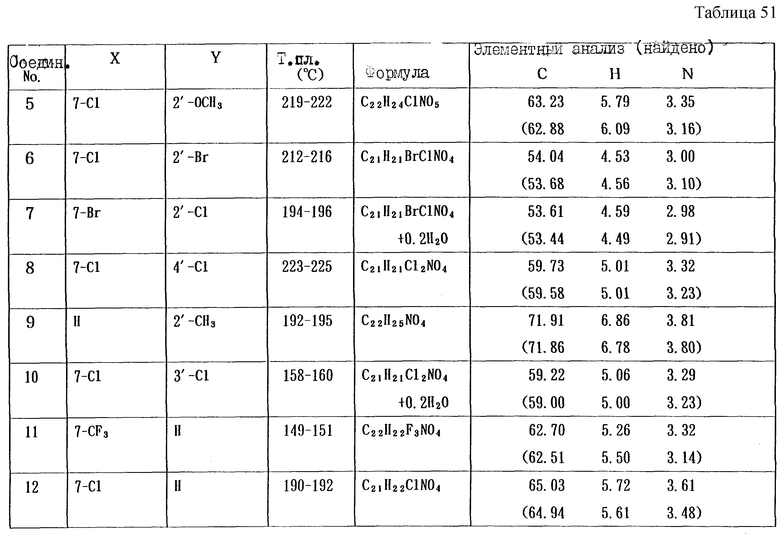
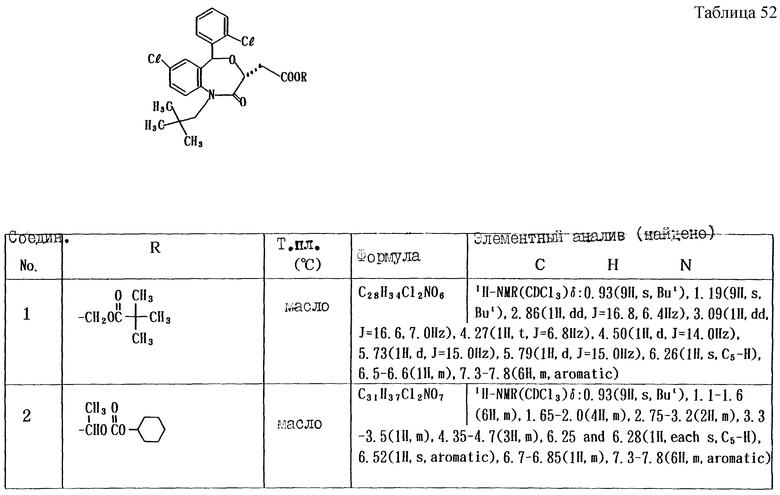
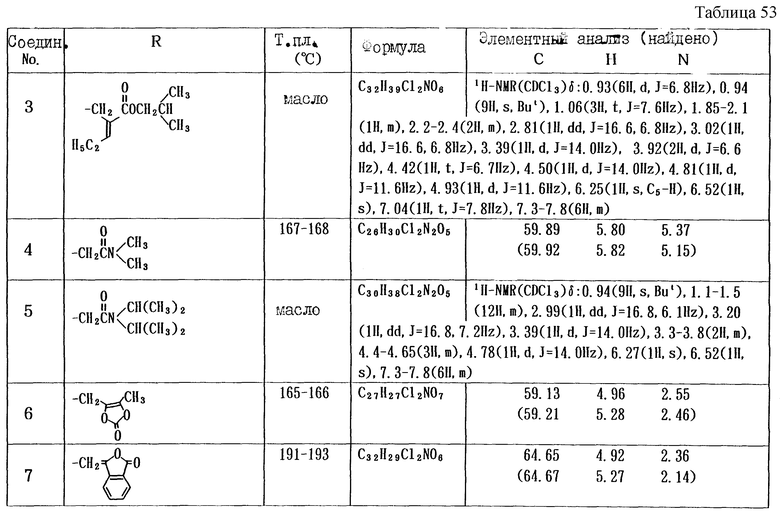
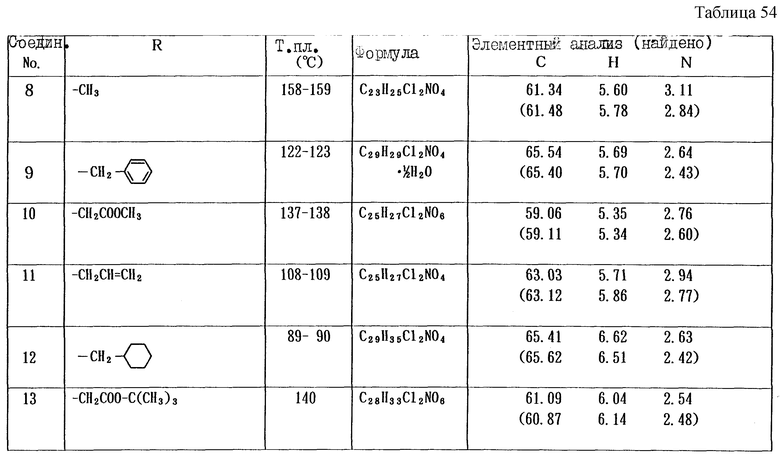




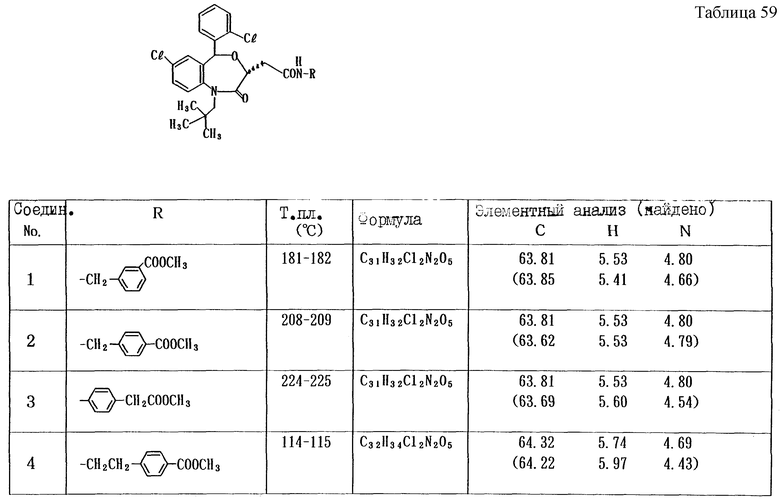
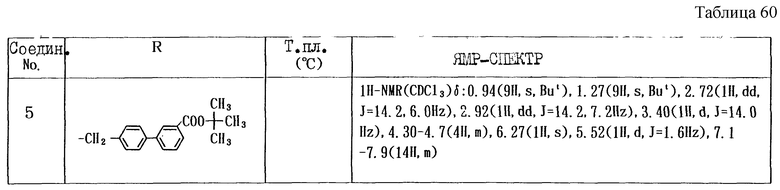

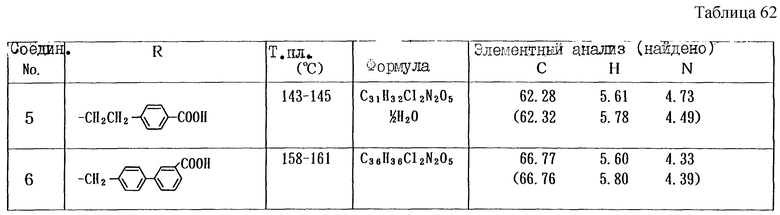
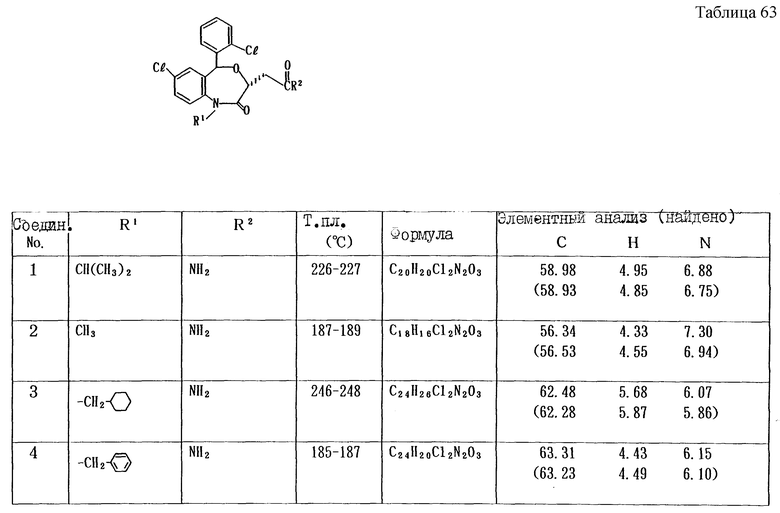
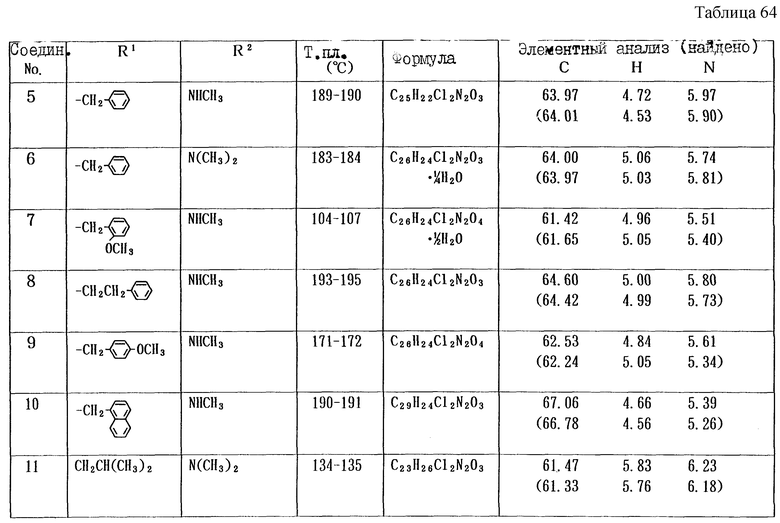
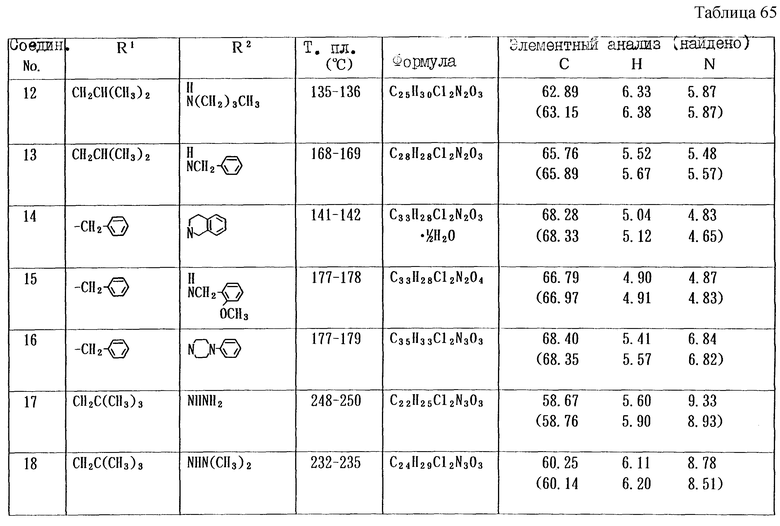
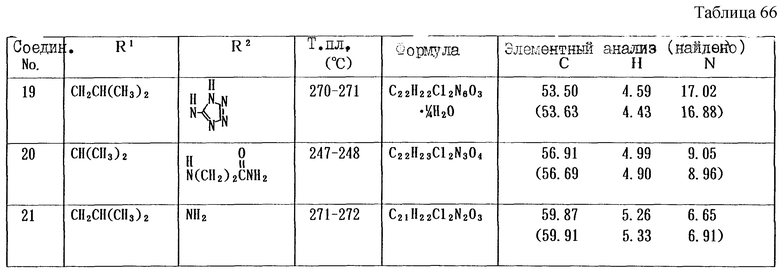

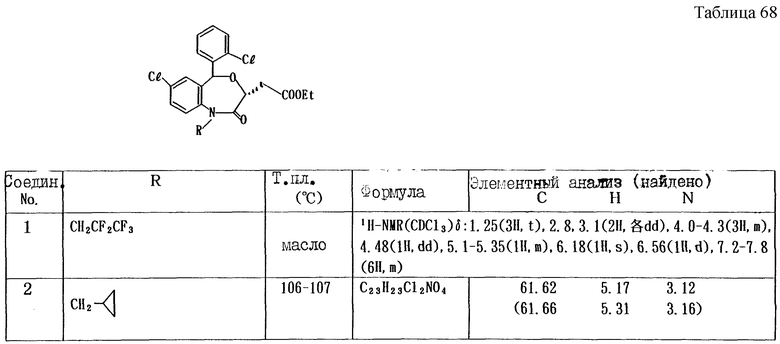
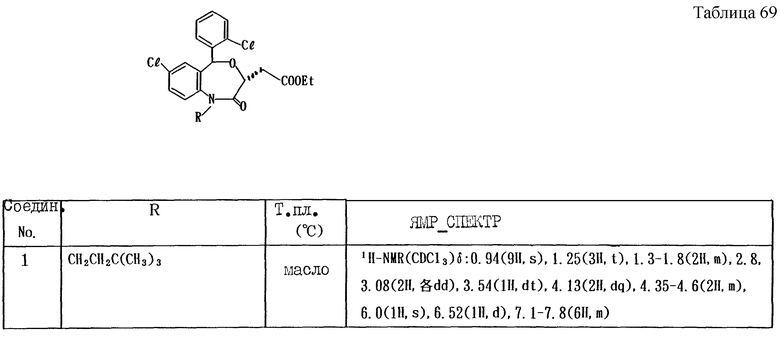
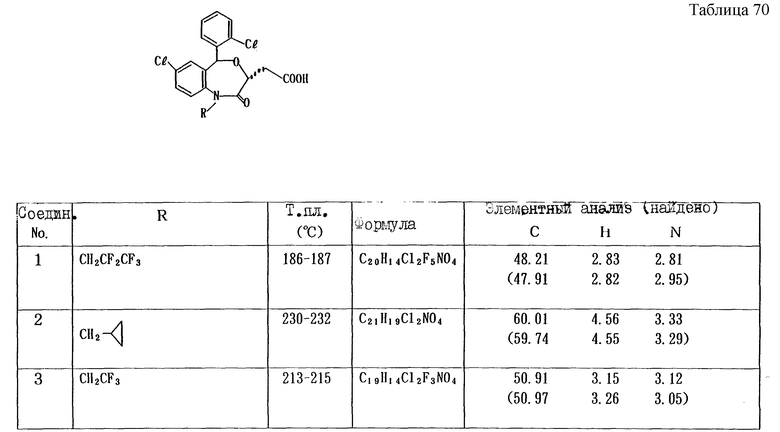
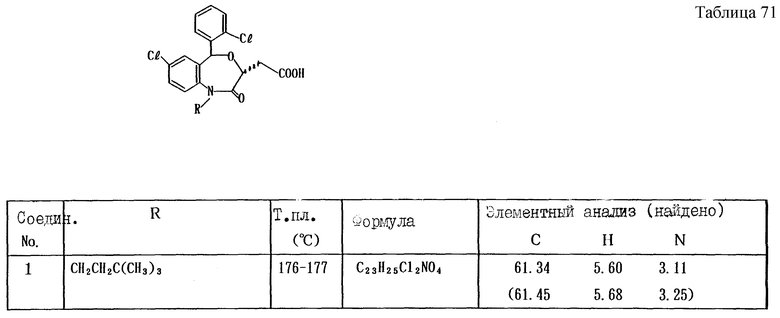
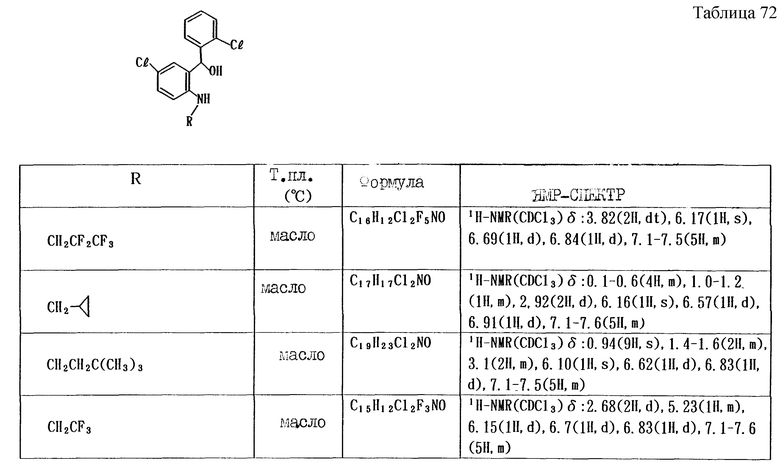
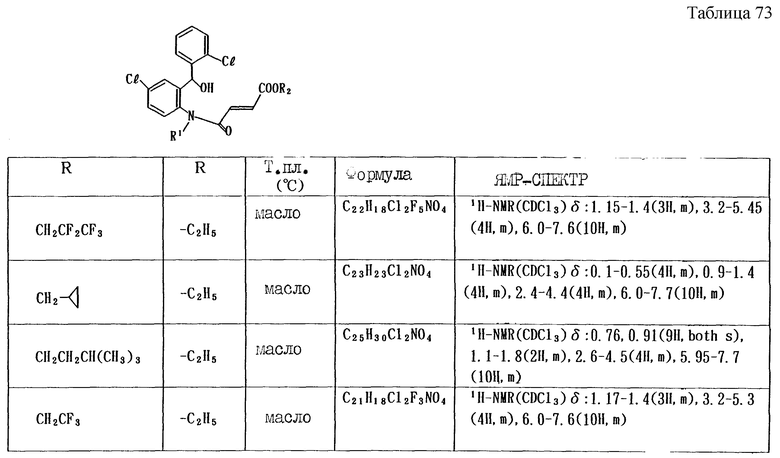
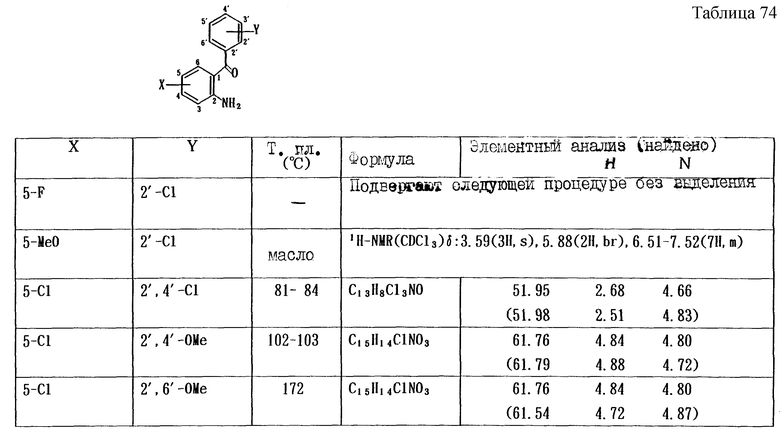

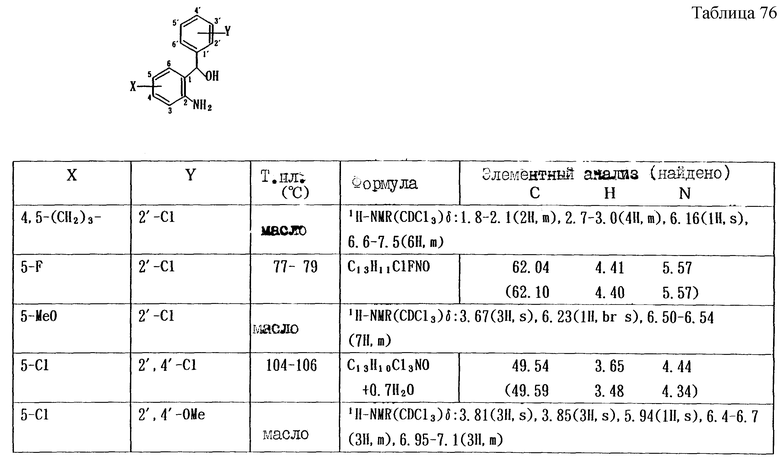

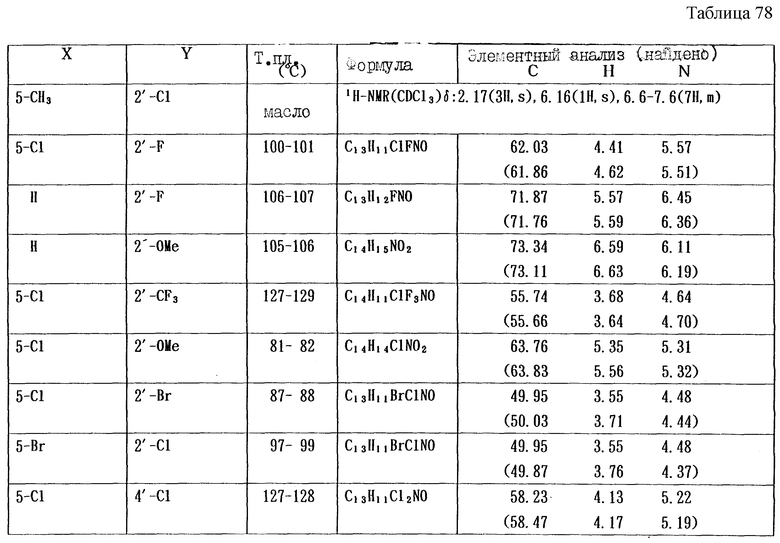
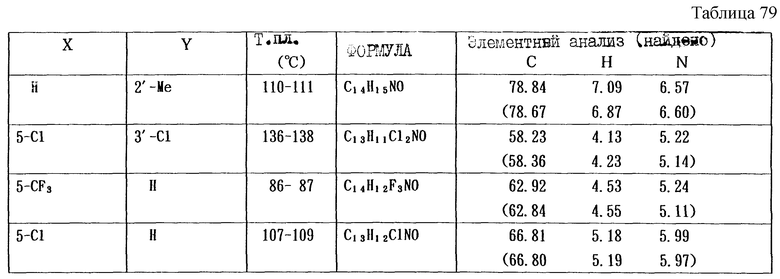

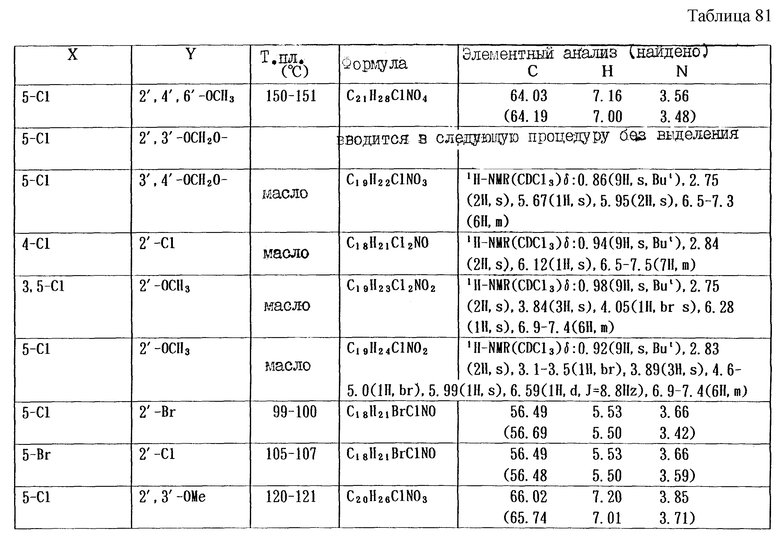
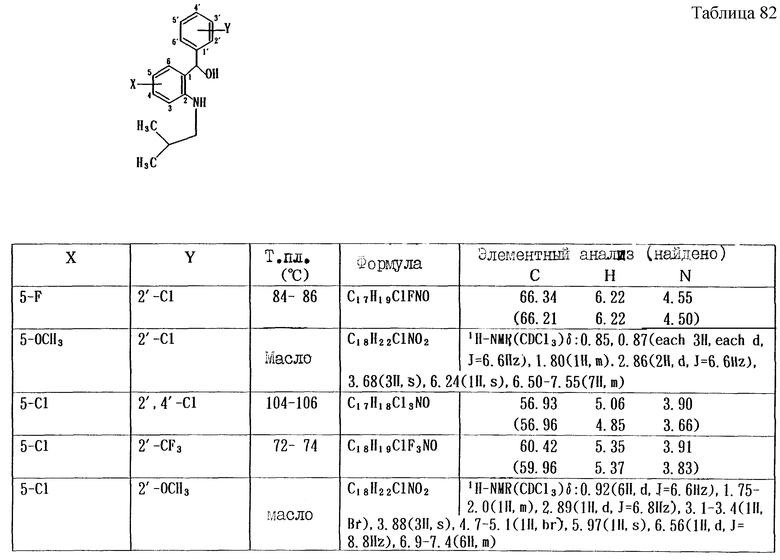




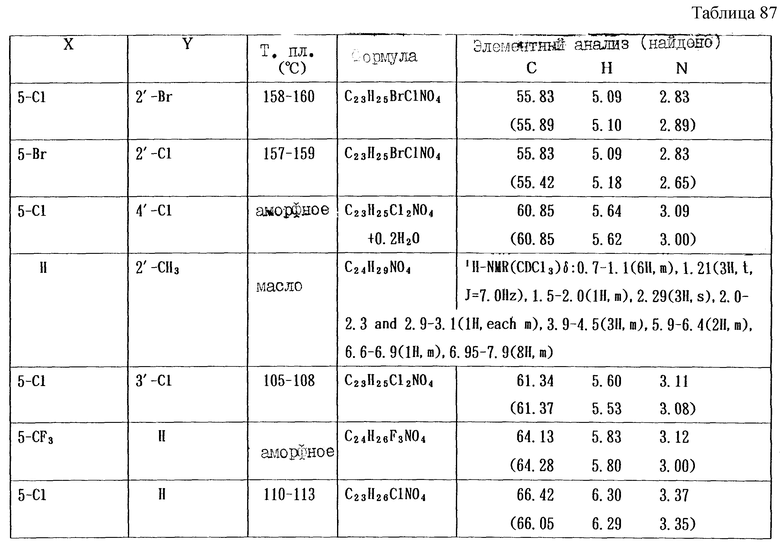
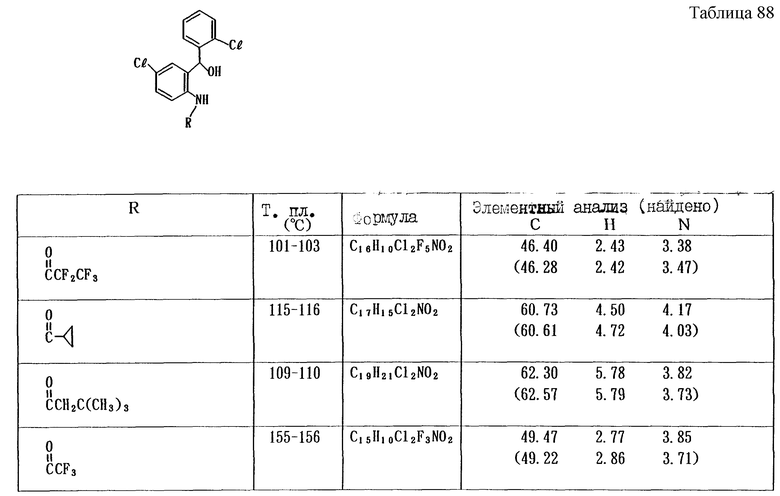
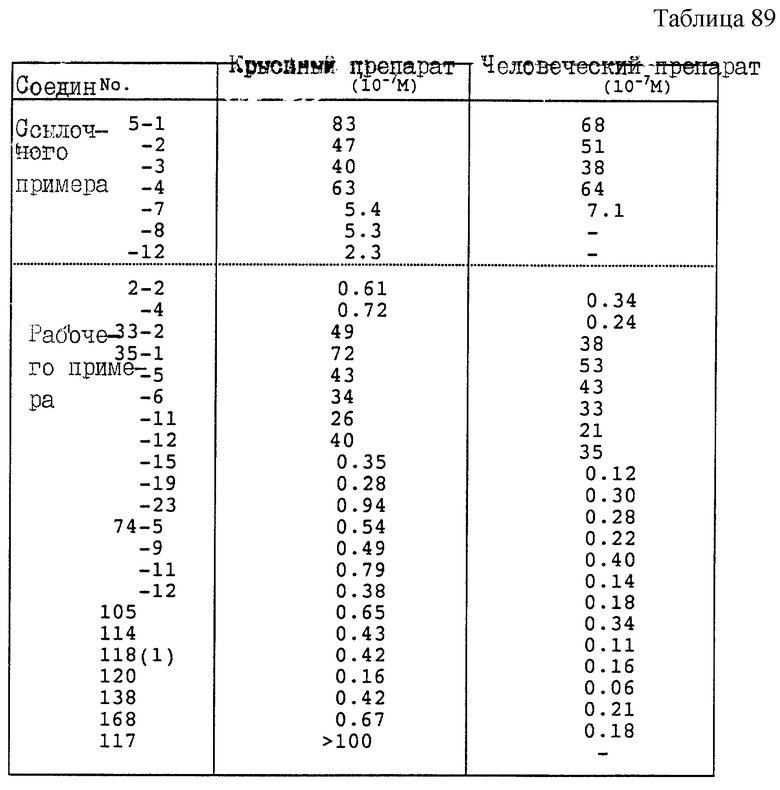
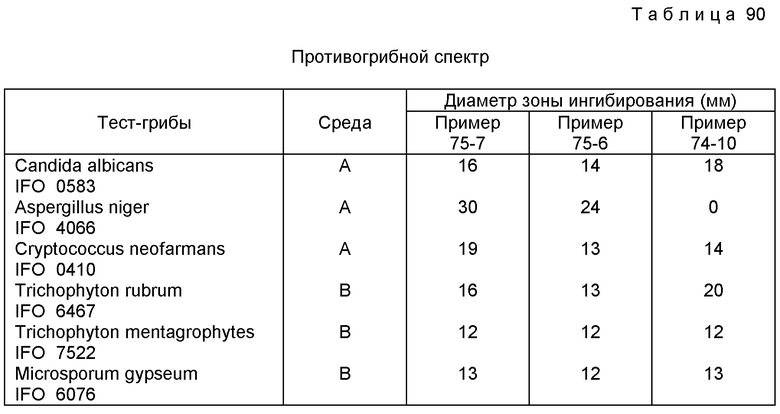
Производное 4,1-бензоксазeпин-2-она формулы I, где R1 - водород или низший алкил, алкен, алкин, C3 - C9-циклоалкил, возможно замещенные 1 - 5 заместителями, такими как фенил, нафтил, C1-C6-циклоалкил, фурил, индолин или галоген; R2 и R3 - водород, низший алкил, фенил, возможно замещенный 1 - 3 заместителями, такими как галоген, алкил, галоген, C1 - C4-алкокси, гидрокси, и два соседних заместителя на фенильной группе могут вместе образовывать кольцо или пиридил; Х - связь или группа -(CH2)m-E-(CHR6)n-, m и n = 0, 1, 2 или 3, E - связь или атом кислорода, серы, сульфоксид, сульфон, -NR5-, -NHCO-, -CONR7-, -NHCONH- (другие обозначения см. в п.1 ф-лы изобретения). Соединения формулы I полезны для ингибирования скваленсинтетазы и роста грибков. 5 с. и 17 з.п. ф-лы, 90 табл.
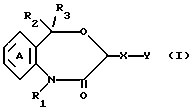
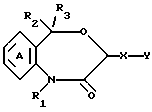
где R1 - (i) атом водорода или (ii) углеводородная группа, выбранная из группы, содержащей алифатическую цепочечную углеводородную группу, такую, как низшие алкилы, низшие алкены и низшие алкины, и алицеклическую углеводородную группу, такую, как C3-C9-циклоалкильная группа, причем углеводородная группа является незамещенной или замещенной 1 - 5 заместителями, выбранными из группы, содержащей: 1) фенил и нафтил, 2) C1-C6-циклоалкил, 3) гетероциклическую группу, выбранную из группы, содержащей фурил и индолил, и 4) атома галогена, в которой группа 1) является незамещенной или замещенной 1 - 2 C1-C3-алкоксигруппами;
R2 и R3 независимо друг от друга - (i) водород, (ii) низший алкил, (iii) фенил, который незамещен или замещен 1 - 3 заместителями, выбранными из группы, содержащей: 1) атомы галогенов, 2) низшие C1-C4-алкилы, 3) низшие C1-C4-алкоксигруппы, 4) гидроксигруппу, где группа 2) незамещена или замещена 1 - 3 атомами галогенов, группа 4) незамещена или замещена заместителями, выбранными из группы, содержащей низшие C1-C4-алкилы и бензил; и два соседних заместителя на фенильной группе могут вместе образовывать кольцо, или (iv) пиридил;
Х - связь или связующая группа с длиной цепи 1 - 7 атомов, выбранная из группы, содержащей - (CH2)m-E-(CHR6)n-, где m и n обозначают независимо друг от друга 0, 1, 2 или 3, Е - связь или атом кислорода, атом серы, сульфоксид, сульфон, -NR5-, -NHCO-, -CONR7- или -NHCONH-, где R5 - водород, низший алкил, метилсульфонил, 4-метилбензолсульфонил или ацил, R6 и R7 независимо друг от друга - (i) водород, (ii) низший алкил, который незамещен или замещен заместителями, выбранными из группы, содержащей гетероциклическую группу, выбранную из группы, содержащей: 1) индолил, 2) гидроксигруппу, 3) возможно этерифицированные карбоксигруппы и 4) фенил; (iii) бензил; (iv) фенил;
Y представляет (I) возможно этерифицированную или тиоэтерифицированную карбоксигруппу, (II) гидроксигруппу, (III) аминогруппу, которая незамещена или замещена заместителями, выбранными из группы, содержащей низшие C1-C4-алкилы, в которой два заместителя у атома азота вместе образуют циклическую группу, (IV) фенил, который незамещен или замещен заместителями, выбранными из группы, содержащей: 1) низшие C1-C4-алкилы, 2) низшие C1-C4-алкоксигруппы, 3) возможно этерифицированные карбоксигруппы, 4) фенил, 5) аминогруппу, которая незамещена или замещена низшими C1-C3-алкилами, и 6) N-содержащий гетероциклический остаток, имеющий атом водорода, способный депротонироваться, такой, как тетразол-5-ил, в которой каждая из групп 1) и 4) незамещена или замещена возможно этерифицированными карбоксигруппами, (V) карбамоил, который незамещен или замещен заместителями, выбранными из группы, содержащей низшие C1-C4-алкилы и бензил, в которой два заместителя у атома азота могут вместе образовывать циклическую аминогруппу, которая необязательно объединена с фенилом, незамещенным или замещенным атомами галогена; (VI) N-содержащий гетероциклический остаток, имеющий атом водорода, способный депротонироваться, который выбирают из группы, содержащей тетразол-5-ил и 2,5-дигидро-5-оксо-1,2,4-оксадиазол-3-ил;
при условии, что если Х - метилен и R1 отличен от алкила с числом атомов углерода больше 4, то Y отличен от карбоксигруппы и алкоксикарбонила; и
кольцо А незамещено или замещено 1 - 3 заместителями, выбранными из группы, содержащей: 1) атомы галогенов, 2) низшие C1-C4-алкилы и 3) низшие C1-C4-алкоксигруппы, в которой группа 2) незамещена или замещена 1 - 3 атомами галогена, и эти заместителя могут образовывать кольцо с каждым из соседних заместителей или его соль.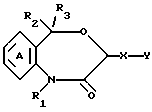
где R1 - (i) атом водорода или (ii) углеводородная группа, выбранная из группы, содержащей алифатическую цепочечную углеводородную группу, такую, как низшие алкилы, низшие алкены и низшие алкины, и алициклическую углеводородную группу, такую, как C3-C9-циклоалкил, причем углеводородная группа является незамещенной или замещенной 1 - 5 заместителями, выбранными из группы, содержащей: 1) фенил и нафтил, 2) C3-C6-циклоалкил, 3) гетероциклическую группу, выбранную из группы, содержащей фурил и индолил, и 4) атом галогена, в которой группа 1) является незамещенной или замещенной 1 - 2 C1-C3-алкоксигруппами;
R2 и R3 независимо друг от друга - (i) водород, (ii) низший алкил, (iii) фенил, который незамещен или замещен 1 - 3 заместителями, выбранными из группы, содержащей: 1) атомы галогенов, 2) низшие C1-C4-алкилы, 3) низшие C1-C4-алкоксигруппы, 4) гидроксигруппу, в которой группа 2) незамещена или замещена 1 - 3 атомами галогенов, группа 4) незамещена или замещена заместителями, выбранными из группы, содержащей низшие C1-C4-алкилы и бензил; и два соседних заместителя на фенильной группе могут вместе образовывать кольцо, или (iv) пиридил;
Х - связь или связующая группа с длиной цепи 1 - 7 атомов, выбранная из группы, содержащей - (CH2)m-E-(CHR6)n-, где m и n обозначают независимо друг от друга 0, 1, 2 или 3, Е - связь или атом кислорода, атом серы, сульфоксид, сульфон, -NR5-, NHCO-, CONR7- или -NHCONH-, где R5 - водород, низший алкил, метилсульфонил, 4-метилбензолсульфонил или ацил, R6 и R7 независимо друг от друга - (i) водород, (ii) низший алкил, который незамещен или замещен заместителями, выбранными из группы, содержащей: 1) индолил, 2) гидроксигруппу, 3) возможно этерифицированные карбоксигруппы и 4) фенил, (iii) бензил; (iv) фенил;
Y представляет: (I) возможно этерифицированную или тиоэтерифицированную карбоксигруппу, (II) гидроксигруппу, (III) аминогруппу, которая незамещена или замещена заместителями, выбранными из группы, содержащей низшие C1-C4-алкилы, в которой два заместителя вместе образуют циклическую группу, (IV) фенил, который незамещен или замещен заместителями, выбранными из группы, содержащей: 1) низшие C1-C4-алкилы, 2) низшие C1-C4-алкоксигруппы, 3) возможно этерифицированные карбоксигруппы, 4) фенил, 5) аминогруппу, которая незамещена или замещена низшими C1-C4-алкилами, и 6) N-содержащий гетероциклический остаток, имеющий атом водорода, способный депротонироваться, такой, как тетразол-5-ил, в которых каждая из групп 1) и 4) незамещена или замещена возможно этерифицированными карбоксигруппами, (V) карбамоил, который незамещен или замещен заместителями, выбранными из группы, содержащей низшие C1-C4-алкилы и бензил, в которой два заместителя у атома азота могут вместе образовывать циклическую аминогруппу, которая необязательно объединена с фенилом, незамещенным или замещенным атомами галогена; (VI) N-содержащий гетероциклический остаток, имеющий атом водорода, способный депротонироваться, который выбирают из группы, содержащей тетразол-5-ил и 2,5-дигидро-5-оксо-1,2,4-оксадиазол-3-ил;
при условии, что если Х - метилен, то Y отличен от карбоксигруппы и алкоксикарбонила; и
кольцо А незамещено или замещено 1 - 3 заместителями, выбранными из группы, содержащей: 1) атомы галогенов, 2) низшие C1-C4-алкилы и 3) низшие C1-C4-алкоксигруппы, в которой группа 2) незамещена или замещена 1 - 3 атомами галогена, и эти заместителя могут образовывать кольцо с каждым из соседних заместителей;
или его соль.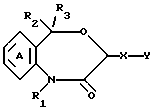
где R1 - (i) атом водорода или (ii) углеводородная группа, выбранная из группы, содержащей алифатическую цепочечную углеводородную группу, такую, как низшие алкилы, низшие алкены и низшие алкины, и алициклическую углеводородную группу, такую, как C3-C9-циклоалкильная группа, причем углеводородная группа является незамещенной или замещенной 1 - 5 заместителями, выбранными из группы, содержащей: 1) фенил и нафтил, 2) C3-C6-циклоалкил, 3) гетероциклическую группу, выбранную из группы, содержащей фурил и индолил, и 4) атом галогена, в которой группа 1) является незамещенной или замещенной 1 - 2 C1-C3-алкоксигруппами;
R2 и R3 независимо друг от друга - (i) водород, (ii) низший алкил, (iii) фенил, который незамещен или замещен 1 - 3 заместителями, выбранными из группы, содержащей 1) атомы галогенов, 2) низшие C1-C4-алкилы, 3) низшие C1-C4-алкоксигруппы, 4) гидроксигруппу, в которой группа 2) незамещена или замещена 1 - 3 атомами галогенов, группа 4) незамещена или замещена заместителями, выбранными из группы, содержащей низшие C1-C4-алкилы и бензил; и два соседних заместителя на фенильной группе могут вместе образовывать кольцо, или (iv) пиридил;
Х - связь или связующая группа с длиной цепи 1 - 7 атомов, выбранная из группы, содержащей - (CH2)m-E-(CHR6)n-, где m и n обозначают независимо друг от друга 0, 1, 2 или 3, Е - связь или атом кислорода, атом серы, сульфоксид, сульфон, -NR5-, -NHCO-, -CONR7- или -NHCONH-, где R5 - водород, низший алкил, метилсульфонил, 4-метилбензолсульфонил или ацил, R6 и R7 независимо друг от друга - (i) водород, (ii) низший алкил, который незамещен или замещен заместителями, выбранными из группы, содержащей: 1) индолил, 2) гидроксигруппу, 3) возможно этерифицированные карбоксигруппы, 4) фенил, (iii) бензил; или (iv) фенил;
Y представляет: (I) возможно этерифицированную или тиоэтерифицированную карбоксигруппу, (II) гидроксигруппу, (III) аминогруппу, которая незамещена или замещена заместителями, выбранными из группы, содержащей низшие C1-C4-алкилы, в которой два заместителя у атома азота вместе образуют циклическую группу, (IV) фенил, который незамещен или замещен заместителями, выбранными из группы, содержащей: 1) низшие C1-C4-алкилы, 2) низшие C1-C4-алкоксигруппы, 3) возможно этерифицированные карбоксигруппы, 4) фенил, 5) аминогруппу, которая незамещена или замещена низшими C1-C4-алкилами, и 6) N-содержащий гетероциклический остаток, имеющий атом водорода, способный депротонироваться, такой, как тетразол-5-ил, в которой каждая из групп 1) и 4) незамещена или замещена возможно этерифицированными карбоксигруппами, (V) карбамоил, который незамещен или замещен заместителями, выбранными из группы, содержащей низшие C1-C4-алкилы и бензил, в которой два заместителя у атома азота могут вместе образовывать циклическую аминогруппу, которая необязательно объединена с фенилом, незамещенным или замещенным атомами галогена; или (VI) N-содержащий гетероциклический остаток, имеющий атом водорода, способный депротонироваться, который выбирают из группы, содержащей тетразол-5-ил и 2,5-дигидро-5-оксо-1,2,4-оксадиазол-3-ил;
кольцо А незамещено или замещено 1 - 3 заместителями, выбранными из группы, содержащей: 1) атомы галогенов, 2) низшие C1-C4-алкилы и 3) низшие C1-C4-алкоксигруппы, в которой группа 2) незамещена или замещена 1 - 3 атомами галогена, и эти заместителя могут образовывать кольцо с каждым из соседних заместителей;
или его соль.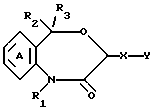
где R1 - (i) атом водорода или (ii) углеводородная группа, выбранная из группы, содержащей алифатическую цепочечную углеводородную группу, такую, как низшие алкилы, низшие алкены, низшие алкины, и алициклическую углеводородную группу, такую, как C3-C9-циклоалкильная группа, причем углеводородная группа является незамещенной или замещенной 1 - 5 заместителями, выбранными из группы, содержащей: 1) фенил и нафтил, 2) C3-C6-циклоалкил, 3) гетероциклическую группу, выбранную из группы, содержащей фурил и индолил, и 4) атомы галогена, в которой группа 1) является незамещенной или замещенной 1 - 2 C1-C3-алкоксигруппами;
R2 и R3 независимо друг от друга - (i) водород, (ii) низший алкил, (iii) фенил, который незамещен или замещен 1 - 3 заместителями, выбранными из группы, содержащей: 1) атомы галогенов, 2) низшие C1-C4-алкилы, 3) низшие C1-C4-алкоксигруппы, 4) гидроксигруппу, где группа 2) незамещена или замещена 1 - 3 атомами галогенов, группа 4) незамещена или замещена заместителями, выбранными из группы, содержащей низшие C1-C4-алкилы и бензил; и два соседних заместителя на фенильной группе могут вместе образовывать кольцо, или (iv) пиридил;
Х - связь или связующая группа с длиной цепи 1 - 7 атомов, выбранная из группы, содержащей -(CH2)m-E-(CHR6)n-, где m и n обозначают независимо друг от друга 0, 1, 2 или 3, Е - связь или атом кислорода, атом серы, сульфоксид, сульфон, -NR5-, -NHCO-, -CONR7- или -NHCONH-, где R5 - водород, низший алкил, метилсульфонил, 4-метилбензолсульфонил или ацил, R6 и R7 независимо друг от друга - (i) водород, (ii) низший алкил, который незамещен или замещен заместителями, выбранными из группы, содержащей 1) индолил, 2) гидроксигруппу, 3) возможно этерифицированные карбоксигруппы, 4) фенил, (iii) бензил или (iv) фенил;
Y - (I) возможно этерифицированная или тиоэтерифицированная карбоксигруппа, (II) гидроксигруппа, (III) аминогруппа, которая незамещена или замещена заместителями, выбранными из группы, содержащей низшие C1-C4-алкилы, в которой два заместителя у атома азота вместе образуют циклическую группу, (IV) фенил, который незамещен или замещен заместителями, выбранными из группы, содержащей: 1) низшие C1-C4-алкилы, 2) низшие C1-C4-алкоксигруппы, 3) возможно этерифицированные карбоксигруппы, 4) фенил, 5) аминогруппу, которая незамещена или замещена низшими C1-C4-алкилами, и 6) N-содержащий гетероциклический остаток, имеющий атом водорода, способный депротонироваться, такой, как тетразол-5-ил, где группа 1) и 4) незамещена или замещена возможно этерифицированными карбоксигруппами, (V) карбамоил, который незамещен или замещен заместителями, выбранными из группы, содержащей низшие C1-C4-алкилы и бензил, в которой два заместителя у атома азота могут вместе образовывать циклическую аминогруппу, которая необязательно объединена с фенилом, незамещенным или замещенным атомами галогена; или (VI) N-содержащий гетероциклический остаток, имеющий атом водорода, способный депротонироваться, который выбирают из группы, содержащей тетразол-5-ил и 2,5-дигидро-5-оксо-1,2,4-оксадиазол-3-ил;
кольцо А незамещено или замещено 1 - 3 заместителями, выбранными из группы, содержащей: 1) атомы галогенов, 2) низшие C1-C4-алкилы и 3) низшие C1-C4-алкоксигруппы, в которой группа 2) незамещена или замещена 1 - 3 атомами галогена, и эти заместители могут образовывать кольцо с каждым из соседних заместителей:
или его соль.
Приоритет по пунктам:
20.04.92 по пп.1 - 20;
21.12.92 по пп.1 - 20, разновидности радикалов;
19.04.93 по пп.21 и 22.
| Patent Abstracts of Japan | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| 2-Фенацилиден-2,5-дигидро-4,1-бензоксазепиноны-3, проявляющие противомикробную активность, и способ их получения | 1977 |
|
SU666799A1 |
| Способ получения 4,1-бензоксазепинов или их тиааналогов | 1980 |
|
SU1005660A3 |
| GB 2075012 A, 1981 | |||
| НАДУВНАЯ ЛОДКА И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 1991 |
|
RU2046729C1 |
| Устройство для ультразвукового каротажа буровых скважин | 1961 |
|
SU142361A1 |
| US 5026554 A, 1991 | |||
| US 5096923 A, 17.03.92 | |||
| Машковский М.Д | |||
| Лекарственные средства.-М.: Медицина, 1993, т.2, с | |||
| Способ уравновешивания движущихся масс поршневых машин | 1925 |
|
SU427A1 |
Авторы
Даты
2000-02-20—Публикация
1993-04-19—Подача