Данное изобретение относится к новому способу получения некоторых углеводосодержащих соединений, относящихся к гликоконъюгатам, а именно производных лактозамина и их производных. В соответствии с другим аспектом, данное изобретение относится к продуктам, полученным указанным выше способом, а также к способу применения этих продуктов.
Гликоконъюгаты содержат цепочки сахаридов, включающие от одного до двадцати моносахаридных звеньев, которые при соединении в определенной последовательности, как было показано, обладают биологической активностью, например в процессах связывания различных клеток, патогенов, токсинов, а также антител и других белков с поверхностями клеток в раковых метастазах, в воспалительных процессах, например во взаимодействии селекцина с углеводами в процессе соединения лейкоцитов со стенками кровеносных сосудов, в качестве модификатора биологической активности и стабильности гликопротеинов, в качестве иммуногенных веществ, которые обладают способностью действовать как вакцина против различных заболеваний (см., например, Annual Reviek of Biochemistry, Vol. 58 (1989), pages 309 - 350, и Current Opinion in Structural Biology, например, обзорные статьи в Vol. 3 и ссылки в них).
Структуры, содержащие последовательность вида Ga1β1-4GlcNAc, названные ниже N-ацетиллактозамином, играет важную роль: их обнаруживают, например, в гликоконъюгатах олигосахаридов лактозаминного типа. Эту структуру обнаруживают в структурах групп крови, например в структуре Lewis-x (например, Galβ1-4(Fucβ1-3) GlcNAc), сиалилированной Lewis-x и 3'-сульфированной Lewis-x, и она важна, например, в процессе взаимодействия селекцина с углеводами (как описано J.B. Lowe: Molecular Glycobiology, pages 163 - 205, Eds. Fukuda and Hindsgaul, IRL Press at Oxford University Press, Oxford 1994; см. также Curr. Opin. Struct. Biol. Vol. 3 (1993)).
Возможность получать производные лактозамина в больших количествах для биологических/клинических исследований и испытаний представляет особый интерес, например для ингибирования селекцин-углевод взаимодействия в опытах in vivo по ингибированию/модификации клеточно-проводимых воспалительных процессов (например, в остром септическом шоке, респираторном дистресс-синдроме у взрослых, реперфузионных повреждениях, ревматоидных артритах, вирусной пневмонии, псориазе и т.п.)
Химические способы получения N-ацетиллактозамина и его производных, известные до настоящего времени, представляют собой многостадийные синтезы и зачастую являются дрогостоящими и трудоемкими. Ферментативные способы получения, используемые до сих пор, были основаны, главным образом, на применении галактозилтрансферазы (EC 2.4), ко-факторзависимого фермента, для которого необходимо применение УДФ-галактозы в качестве гликозильного донора (например, как описано в публикации Wong et al., J. Prg. Chem. (1982), pages 5416-5418). Недостатками этого фермента являются высокая акцепторная селективность и низкая эффективность при взаимодействии с акцепторами неприродного происхождения, например при взаимодействии с производными глюкозамина (как описано Khan and Hindsgaul: Molecular Glycobiology, pages 206-229, Eds. Fukuda and Hindsgaul, IRL Press at Oxfogd University Press, Oxford, 1994). Общий обзор ферментативных способов получения приведен в публикации: K.G.I. Nilsson, Trends in Biotechnology, 1988, p. 256-264 (номенклатура этой статьи и данного изобретения соответствует одним и тем же правилам IUPAC). Для получения N-ацетиллактозамина и N-ацетилаллолактозамина из галактозидов и N-ацетилгликозамина используют гликозидазы (Sakae et al., J. Carbohyd. Chem. 11: 553-565, 1992).
Применяемые ранее методы получения производных N-ацетиллактозамина с использованием гликозидаз (EC 3.2) в общем случае приводили к низким выходам вследствие низкой или неправильной региоселективности. Таким образом, например β-галактозидаза, полученная из E.coli или из окси-естов, дает только Galβ1-6 GlcNPht (K.G.I.Nisson, неопубликованный результат; где Pht - фталимидогруппа, которая в общем случае используется в качестве временной защитной группы аминогруппы гликозамина) при использовании в качестве гликозильного донора - лактозы, а в качестве акцептора - GlcNPht.
Данное изобретение относится к способу, который с неожиданно высокой избирательностью дает образование β1-4 связи в синтезе различных производных лактозамина при использовании избытка донорных веществ, таких как лактоза, или других галактозильных доноров низкой стоимости. В одном воплощении изобретения способ осуществляют, используя в качестве катализатора дрожжи Bullera singularis (классифицированы как Bullera singularis в соответствии с Xeasts, second edition by Barnett et al., Cambridge University Press. 1990).
Во втором воплощении способ данного изобретения осуществляют при использовании ферментов (которые относятся к группе гликозидаз, EC группа 3.2), предпочтительно в виде технического частично очищенного или очищенного продукта, в частности β-галактозидазы из группы Bullera singularis, а также другой β-галактозидазы, например рекомбинанта этой же структуры или аналогичной структуры (например содержащей активный сайт аналогичной структуры) в качестве одной галактозидазы из группы Bullera singularis.
В соответствии с более подробными аспектами данного изобретения, способ получения лактозаминопроизводных может осуществляться как по равновесной реакции (обратимый гидролиз), так и, что более предпочтительно, с помощью кинетической реакции (реакция трансгликозилирования). Принципы проведения равновесной реакции и кинетической реакции хорошо изучены и описаны в литературе (см. , например, K. G.I. Nilsson, Trends in Biotecnol (1988), pages 256-264).
В том случае, когда реакцию осуществляют как реакцию трансгликозилирования, гликозильным донором является гликозид, например D-лактоза (Gal), модифицированная в C-1 положении (аномерное положение), но в качестве гликозильного донора может также использоваться олигосахарид, такой как лактоза (Galβ1-4 Glc) или его агликозид, например:
GalβOR+GlcNR″-R″′_ _ _ → Galβ1-4GlcNR″-R″′+ROH,
R может представлять собой гликозидно связанную органическую группу, например сахар (например, CnH2nOn или CnH2n-2On-1, такой как глюкоза), низший алкил (например, метил, этил) или ароматическую группу (например, фенил (-Ph), умберриферил или м-, о- или п-нитрофенил), предпочтительно R представляет собой Glc (глюкозу) или нитрофенил. Могут также использоваться и другие гликозиды (например, F-, N- или S-гликозиды).
Известно, что гликозидазы могут в некоторой степени модифицировать гликольную часть гликозильного донора (в данном изобретении этой частью является галактозильная часть). Следовательно, квалифицированный специалист может выбрать помимо GalβOR другие доноры, в которых галактозильная часть является частично модифицированной в такой степени, что реакция трансгликозилирования может быть осуществлена с образованием β1-4 связи между гликольной частью гликозильного донора и глюкозаминопроизводным. Примерами таких модификаций гликона являются модификации, в которых по меньшей мере одна из гидроксильных групп имеет инвертированную конфигурацию (например, инверсия в положении 4 означает, что Gal замещена на Glc, в качестве донора используется GlcβOR, т.е. β-гликозид) или модификации, в которых одна из гидроксильных групп Gal модифицирована или замещена неорганической группой (например, -F, -H) или неорганической группой, например низшим алкилом (метилом), аллилом или ацетильной группой. Выбор такого донора в способе данного изобретения приводит к получению β1-4 связанного продукта, в котором галактозильная часть является соответственно модифицированной. Следовательно, продукты вида R'-Galβ1-4GlcNR''-R''' могут быть получены в том случае, когда R'-Gal относится к модифицированному гликону гликозильного донора. В случае реакции трансгликозилирования гликозильным донором в схеме, данной ниже, R'-Gal-R, является β-гликозид: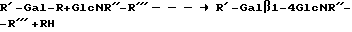
В реакции трансгликозилирования
GalβOR+GlcNR″-R″′_ _ _ → Galβ1-4GlcNR″-R″′+ROH
скорость реакции выше, чем в равновесной реакции, так как гликозид или дисахарид является более реакционноспособным, чем неактивированный сахар D-галактоза, используемая в качестве донора в равновесной реакции. В реакции можно использовать фермент меньшей чистоты, чем неочищенный фермент, так как ферменты являются субстрат/связь-специфичными, а ферменты, которые являются примесями (например, α-галактозидаза), не будут реагировать с GalβOR с образованием β-связанного продукта. Следовательно, могут использоваться интактные клетки (например, дрожжи), также как и частично очищенный фермент или фермент высокой степени чистоты.
Гидролиз GalβOR также будет в некоторой степени зависеть от условий реакции. Можно использовать как более низкие, так и более высокие температуры (например, комнатную температуру или более высокие температуры, т.е. 25-65oC), органические (со)растворители (ацетон, ацетонитрил, тетрагидрофуран), значение pH обычно выбирается из интервала от 4 до 8, концентрации субстрата обычно составляют от 30 мМ до нескольких молей (например, 7 М) в зависимости от растворимости субстратов, стабильности фермента в реакционной смеси и конкретной цели реакции и типа субстратов.
Реакция будет протекать через максимум образования продукта и ход ее можно контролировать (например, предпочтительно высокоэффективной хроматографией) и по прошествии соответствующего времени останавливать с помощью, например, тепловой обработки при температуре, например, 80-100oC, проводимой в течение, например, 3 минут. В общем случае, контролируют расход донора и реакцию прекращают спустя определенное время, которое зависит от условий, обычно при более чем 40% расходовании донора. Продолжительность реакции может составлять от нескольких минут до нескольких часов в зависимости от роста дрожжевых клеток (в случае применения ферментативных условий), количества фермента, температуры, pH концентрации субстратов и некоторых других факторов.
Ход реакции можно контролировать с помощью тонкослойной хроматографии (ТХ), высокоэффективной жидкостной хроматографии (ВЖХ) или спектрофотометрическим измерением количества высвобожденного агликона (например, нитрофенола, 400 нм). Для обнаружения сахаров можно использовать явление обугливания пластинок для тонкослойной хроматографии под действием серной кислоты. По достижении необходимого выхода продукта реакцию останавливают денатурированием фермента с помощью, например, тепловой обработки. Нагревание до 85oC и более в течение 3 - 5 минут (с последующим добавлением этанола с концентрацией приблизительно 80%) обычно является достаточным. Если используется иммобилизованный фермент, реакцию можно остановить центрифугированием или фильтрованием.
В реакциях всех перечисленных выше типов в качестве акцептора используют D-глюкопиранозаминопроизводное (GlcNR''-R'''), где R'' и R''' принимают указанные ниже значения.
В случае применения N-ацетилглюкозамина (R'' = -HAc группа во втором положении, т.е. в N-положении 2-глюкозамина; во втором положении глюкозамина находится - NHAc группа), R''' представляет собой агликон, отличный от аномерной гидроксильной группы (т.е. R''' не является OH). Если R'' не является -HAc группой, тогда R''' может представлять собой OH, но может представлять собой модификацию аномерной гидроксильной группы, как и в случае, когда R'' является -HAc.
Способ данного изобретения можно применять для получения продукта Galβ1-4 GlcNR''-R''' высокой чистоты (методом ЯМР при 400 МГц не обнаружено других связей), который после выделения может использоваться для биологических/терапевтических целей или для дальнейшего синтеза в соответствии с данным изобретением. Способ можно применять для получения Galβ1-4 Galβ-4GlcN R'' - R'''. Следовательно, с помощью этого же фермента при последующем взаимодействии будет получены Galβ1-4 Galβ1-4GlcNR'' - R''', в соответствии с уравнением реакции: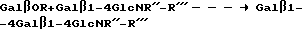
GlcNR'' - R''' (производное глюкозамина, которое используется в качестве акцептора) имеет общее строение, представленное ниже: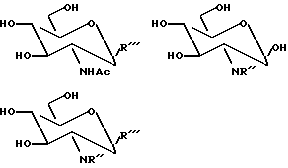
где NR'' можно получить из соединений, содержащих неорганическую группу (например, N3, NHSO3H) и/или органическую группу, находящуюся во втором положении глюкозамина, такую как: (a) N-фталимидогруппа; (b) органическая карбонильная группа NH-C(O)-R, где R представляет собой водород или соединение, содержащее органическую группу, например алифатическую, такую как алкил (например, метил, этил пропил), алкоксигруппу (например, метокси-, этоксигруппу), аллилоокси, аминокислотный или полипептидный остаток и/или ароматическую, такую как фенил, бензил или фенокси, предпочтительными являются N-хлорметоксиацетил, N-феноксиацетил, NHBoc (Boc = трет-бутилоксикарбонил), NHAc и NHC(O) (CH2)nCH3 (n принимает значения целых чисел от 1 более); (c) NHR, где R представляет алифатическую и/или ароматическую группу, как описано выше, например низший алкил, предпочтительные примеры включают NH(CH3)nCH3 (n принимает значения целых чисел от 1 и более); или (d) NRR', где R и R' независимо друг от друга выбирают из алифатической и/или ароматической групп, которые описаны выше; предпочтительно NR' представляет собой азидогруппу, 2-N-ацетил- или 2-N-фталимидогруппу, и где R''' выбирают из гликозидно связанного неорганического фрагмента, например фтора, или выбирают из O-, C-, N- или S-гликозидно связанного фрагмента, представляющего собой алифатическую и/или ароматическую группу, например, низшую алкоксигруппу (например, метоксигруппу (-OMe), этоксигруппу (-OEt)), низший тиоалкил (например, β-связанный тиоэтил (-SEt)), тиоароматическую (например, тиофенил-), -OEtBr, нитогруппу, аминокислотную группу, пептидную группу или производную из них группу, либо другую органическую группу, представляющую интерес для применения, или R''' может представлять собой -OH, если NR'' не является NHAc, но R''' не является OH, если NR'' представляет собой NHAc.
Продукт, содержащий Galβ1-4 GlcN (лактозамин), полученный способом данного изобретения с GalβOR, используемым в качестве донора, имеет общее строение, представленное ниже: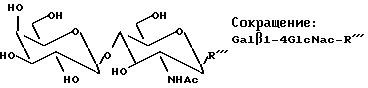
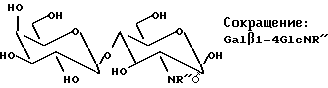
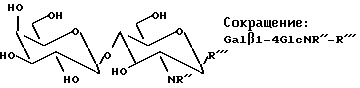
Такие конъюгаты, где лактозамин или высшие олигосахариды, содержащие лактозаминную структуру, являются N- или O-гликозидно связанными через глюкозаминный остаток в лактозамине и его производных, описанных выше, с аминокислотами или пептидными рядами, представляют интерес для синтетического получения с целью фундаментального изучения и последующего синтеза фрагментов гликопротеинов, биологически активных и/или полезных для медицинского применения, например в качестве вакцины или терапевтических лекарственных средств. Важна также возможность синтезировать аналоги/производные олигосахаридов представленных выше структур и в соответствии с данным изобретением возможность модифицировать или улучшить биологическую активность конъюгата.
Синтез в соответствии с данным изобретением может проводиться в самых разных условиях, отличающихся, например, по pH, типу буфера, по температуре и концентрации реагентов. В смеси с водой могут использоваться различные сорастворители (N, N-диметилформамид, ацетонитрил, диметилсульфоксид, диоксан, пиридин, метанол, этанол, этиленгликоль и т.д.). В общем случае, гидрофобные акцепторные вещества более легко растворяются при применении органических сорастворителей или повышенной температуры. Кроме того, реакции могут проводиться в двухфазных системах, таких как, например, водo-органический растворитель или водo-водный полимер. Применение акцепторов, модифицированных органическими группами, способствует получению продукта в органической фазе.
Условия реакции не являются определяющими, но их выбирают, главным образом, на основании свойств применяемых в синтезе реагентов, а также исходя из практического опыта. Например, можно указать, что удобно применять температуру реакции в интервале 25-75oC и, в случае обогащенной водой среды, pH обычно заключается в интервале от 4 до 8.
Для влияния на выход продукта и активность и стабильность фермента можно менять температуру реакции, и она не ограничивается областью данного изобретения. Наиболее часто используемая температура заключается в интервале от 4o до 75oC, но можно применять и более низкие температуры, а при использовании органических сорастворителей можно применять температуры ниже 0oC. Преимуществом высоких температур является, например, то, что в этом случае можно использовать субстрат высокой концентрации, который уменьшает активность воды и таким образом повышает выход продукта. Другим преимуществом высоких температур является то, что активность фермента возрастает, что приводит к уменьшению времени реакции. Верхний предел температуры определяется термостабильностью фермента и субстрата в специфической реакционной среде. В некоторых реакциях термостабильность фермента повышают применением сахарозного субстрата высокой концентрации. Высокую концентрацию субстрата, например лактозы (> 15 мас./мас.%), можно получить при растворении ее в теплой, содержащей буфер воде с последующим охлаждением до температуры проведения реакции.
Концентрация акцептора является параметром, который можно использовать для влияния на выход продукта реакции в соответствии с данным изобретением. Высокие концентрации акцептора обычно предпочтительны как в равновесной реакции, так и в реакции трансгликозилирования, для сведения до минимума побочных реакций гидролиза, и обычно, в зависимости от растворимости акцептора, используют концентрации ca. 0,05-7 М. В общем случае, высокие концентрации субстратов получают нагреванием реакционной смеси до температуры, близкой к температуре кипения, с выдерживанием при этой температуре в течение нескольких минут и последующим самопроизвольным охлаждением раствора до температуры реакции (обычно в интервале от 4o до 75oC в зависимости от температуры оптимального выхода и термостабильности смеси фермент/субстрат), после чего добавляют фермент. Для повышения растворимости субстратов с гидрофобными группами можно использовать сорастворители.
Концентрацию гликозильного донора в реакционной смеси подбирают, исходя из того, какое лактозамин-производное нужно получить, а также с учетом свойств фермента и, следовательно, она не ограничивается данным изобретением. В некоторых случаях добавление донора в небольших количествах может быть выгодно для уменьшения опасности того, что донор будет реагировать также и как акцептор (если это является нежелательным). В общем случае в качестве донора используется лактоза, так как представляет собой дешевый субстрат. Отношение массы донора к массе акцептора предпочтительно составляет ≥ 1:1, хотя акцептор может использоваться с избытком.
Фермент может использоваться in situ или после частичной или полной очистки. Фермент можно выделять до применения, например, гомогенизацией, осаждением и/или хроматографически (например, ионообменной, аффинной хроматографией и хроматографией по размеру). Фермент может присутствовать, например, в растворенной, иммобилизованной, сшитой, кристаллической форме или может быть помещен внутри мицелл. В общем случае, гликозидаза может использоваться in vivo или in vitro в более или менее очищенной форме и в клетках различных типов (т.е. клонироваться в клетки подходящего типа). Фермент можно получать методами рекомбинации. Для оптимизации свойств фермента (например, термостабильности, каталитической эффективности и/или стабильности в органических растворителях) в последовательности аминокислот фермента может быть изменена одна или более аминокислот. В способе данного изобретения наряду с гликозидазой природного происхождения могут использоваться также различные гликозидазы, полученные методами рекомбинации и имеющие по меньшей мере 70% гомологии с пептидной цепью природного варианта.
Синтез можно проводить с ферментом in vivo, концентрация которого в условиях ферментации с интактными клетками дрожжей, лактозой и акцептором заключается в интервале от 0,5 до 25% (мас./объем). В некоторых случаях для улучшения галактозилирования акцептора и/или для получения трисахаридов указанного выше типа возможно использование избытка лактозы. Это и другие условия ферментации с использующейся питательной средой и солями могут быть легко установлены квалифицированным специалистом и не ограничиваются областью данного изобретения.
В качестве гликозильного донора может использоваться лактоза или β-гликозид галактозы, такой как алкил- или ароматический гликозид (например, нитрофенил β-галактозид).
Выделение продукта можно проводить в одну или более стадий, включающих один или несколько следующих способов очистки: экстракция, хроматография (обычными твердыми носителями, которые могут применяться, являются Sephadex®, кремнезем, кремнезем обращенной фазы, уголь-броунмелит), осаждение.
В зависимости от того, используются ли интактные дрожжевые клетки или технический, частично очищенный или очищенный фермент, а также с учетом растворимости и стабильности субстратов, реакцию можно проводить в различных условиях, наиболее подходящих для конкретной реакции. Такие условия выбираются специалистом и не ограничиваются областью данного изобретения. Можно использовать подходящие значения pH (например, 4 - 8, которые получают, используя ацетатный или фосфатный буфер) и пониженную, комнатную или повышенные температуры (например, в интервале от 0o до 50oC), если применяется технический, частично очищенный или очищенный фермент.
Реакцию можно проводить в присутствии инертных органических сорастворителей для повышения растворимости акцептора (например, гидрофобного акцептора) или для исключения реакций гидролиза. Если вместе с содержащей буфер водой используют органические сорастворители (например, ацетон, ацетонитрил, тетрагидрофуран), то в некоторых случаях можно применять температуры ниже 0o (например, -30oC). Тогда концентрация субстратов будет заключаться в интервале от 30 мМ до 7 М.
Фермент можно применять в растворимой форме или он может быть иммобилизован посредством, например, адсорбции, инкапсулирования, хелатирования, осаждения или ковалентного связывания с твердым носителем, например полимерным веществом или его производным, которое нерастворимо в протонных или апротонных растворителях (Methods in Enzymology, Vol. 135, Academic Press). Выбор формы фермента не является определяющим, в соответствии с данным изобретением. В том случае, когда фермент используется в растворимой форме, он может, если это необходимо, сначала химически модифицироваться подходящим образом для, например, повышения термостабильности или стабильности в органических растворителях. Фермент, иммобилизованный на нерастворимый полимер, включающий, например, агарозу, целлюлозу, гидроксиэтилакрилат, стекло, кремнезем, полиакриламид, полиакрилат-основные пластики и т.д., легко выделяется из реакционной смеси, и таким образом фермент может использоваться повторно.
Примерами иммобилизации являются адсорбция или ковалентное связывание фермента на подходящую твердую фазу, такую как стекло, броунмиллерит, кремнезем, полисахариды (например, целлюлозу, агарозу) или палстики (например, полистирол), активированные подходящей реакционноспособной группой для ковалентного связывания фермента известными способами (см., например, Methods in Enzymology, volum 44, 104, 135).
Если в качестве фермента используются интактные дрожжевые клетки, условия реакции выбираются самим специалистом и не ограничиваются областью данного изобретения. Предпочтительными условиями обычно являются pH 4-7, 20-35oC в воде, содержащей буфер и питательную среду для дрожжевых клеток, и описаны ниже в примерах.
Могут использоваться микроорганизмы, которые продуцируют фермент такой же или подобной структуры (например, содержащий аналогичного размера третичные структуры и структуру активного сайта), одними из которых являются Bullera Singularis.
В том случае, когда используется высокая концентрация лактозы с техническими, частично очищенным или очищенным ферментом, будет образовываться значительное количество глюкозы (в условиях ферментации с интактными дрожжевыми клетками значительное количество глюкозы будет потребляться в качестве питания). Образованная глюкоза будет конкурировать с акцептором (и с водой) по отношению к галактозил-фермент промежуточному продукту, ингибируя таким образом синтез продукта. Поэтому, можно применять второй фермент, такой как изомераза (например, глюкоизомераза) или оксидаза, который специфически удаляет глюкозу в процессе реакции в соответствии с данным изобретением. Продукт можно также удалять применением другого специфического фермента, трансферазы, сульфатазы, которая высокого специфично превращает продукт в другой нужный продукт, тем самым сводя на минимум вторичный гидролиз продукта и/или устраняя необходимость выделения лактозаминного продукта перед его применением в последующем синтезе.
Продукты могут использоваться для последующего ферментативного синтеза с гликозидазами или гликозилтрансферазами. Например, α-сиалкилтрансфераза может применяться для катализирования образования сиалилированных Gal-GlcN Ac производных и α-фукозилтрансфераза может применяться для получения олигосахарид-производных типа Gal-(FUC) GlcN Ac-R, которая затем может быть в конечном итоге сульфирована, сиалилирована и/или использоваться для дальнейшего химического синтеза и т.д.
Продукты, полученные способом в соответствии с данным изобретением, могут быть использованы непосредственно для биологических целей или могут использоваться в последующем синтезе различных продуктов, содержащих лактозаминную группу, с применением ферментативных и/или химических методов (см. пример 7, ниже), которые представляют интерес с точки зрения клинического, диагностического применения или для добавки в продукты питания. В качестве ссылок, относящихся к химической модификации глюкозамина и к примерам возможных химических превращения модифицированного лактозамина см. Binkley: Modern Carbohydrate Chemistry, Marcel Dekker, 1988 - со ссылками; Paulsen, Chem. Soc. Rev. 13, pages 15 - 45; Khan and Hidsgaul in Molecular Glycobiology, pages 206-229; Fukuda and Hindsgaul Editors, IRL Press, Oxford. Ссылки по применению тиоэтилгликозидов в синтезе различных гликозидов и в качестве гликозильных доноров в конвергентном блок-синтезе три-, тетра- и больших сахаридов приводятся в статье Khan and Hindsgaul.
Продукт, полученный в соответствии с данным изобретением, можно также превращать ферментативными способами с использованием, например, липаз, сульфатаз, гликозилтрансфераз и оксидаз. В этом способе гидроксильные группы галактозильного или глюкозаминильного фрагмента могут быть селективно модифицированы, например, с помощью ацильных групп, сульфатных групп, сахаридных групп и других органических групп, соответственно, что расширяет сферу применения способа данного изобретения для получения различных производных и высших сахаридов, содержащих лактозаминную группу. Конкретные примеры выбора подходящего лактозамин-производного, полученного способом согласно данному изобретению для реакции, например, с сиалилтрансферазой или сульфатазой для получения, например, (α 2-3) сиалилированного лактозамин-производного или 3'-O-сульфатированного производного, содержащего лактозаминную группу, см., например, в публикациях Khan and Hindsgaul, указанной выше (гликозилтрансферазы) и Wоng and Whitesides in Fnzymes in Synthetic Organic Chemistry, Pergamon (1994), Elsevier Science Lnd; а также Enzyme Nomenciatyre, Academic Press (1984).
Агликон лактозаминосодержащего продукта, полученного в соответствии с данным изобретением, можно использовать не только в реакциях гликозилирования (для образования других гликозидов или для синтеза олигосахаридов, содержащих лактозаминные ряды), но может также использоваться для ковалентного связывания с другой молекулой, такой как белок, гранулированный или твердый носитель, и образующийся продукт может затем использоваться для различных целей. Таким образом, нитрофенилгликозиды используют, например, после восстановления до аминофенилгликозида для ковалентного связывания с различными белками или твердым носителем, которые затем можно использовать в диагностике, в технологической переработке для разделения различных белков и ферментов, включая гликозилтрансферазы со спецификой различных белков и ферментов, включая гликозилтрансферазы со специфичностью акцепторов, содержащих лактозаминную последовательность, или для твердофазного синтеза олигосахаридов (см., например Wong and Whiteside, указанную выше для ссылок, относящихся к твердофазному синтезу олигосахаридов).
Приведенные далее примеры иллюстрируют данное изобретение:
Пример 1. Синтез Galβ1-4GlcN Phtβ-SEt может быть осуществлен по следующей методике:
Bullera singularis выращивают при 25oC при перемешивании в среде следующего состава: 5% лактозы, 1% GlcN Phtβ-SEt, которую фильтруют в стерильных условиях с дрожжевым экстрактом (Difco, 0,75 мас./мас.% в ацетате натрия, pH 5,0). Реакцию проводят при температуре 27oC до потребления определенного количества лактозы. Продукт отмывают для получения гомогенного вещества (другой сахар не обнаруживают методом ЯМР) с помощью следующей процедуры: после отделения дрожжевых клеток центрифугированием или фильтрованием проводят экстракцию водной фазой и этилацетатом для удаления избытка акцептора с последующей экстракцией бутанолом водной фазы и упариванием бутанольной фракции, а затем растворяют остаток в смеси воды с этанолом, упаривают этанол и осаждают продукт из воды.
Продукт выделяют, например, экстракцией водной фазы подходящим растворителем, например этилацетатом, с удалением непрореагировавшего акцептора, затем водную фазу можно экстрагировать более полярным растворителем, таким как н-бутанол. Осадок продукта из среды, такой как вода, можно использовать для дальнейшей очистки. Примерами других способов выделения продукта, которые можно использовать в сочетании с экстракцией, являются колоночная хроматография с применением обычных материалов, таких как кремнезем, активированный уголь или Sephadex® в качестве твердой фазы, осаждение или кристаллизация. Можно применять любой другой способ разделения, которые хорошо описаны в литературе.
Важным преимуществом ферментативного способа в соответствии с данным изобретением является то, что акцептор не разрушается (особенно в мягких условиях реакции и выделенный фермент используется повторно), как это может происходить с немодифицированными акцепторами или в тех случаях, когда применяются химические методы синтеза. Следовательно, непрореагировавший акцептор может быть выделен обычными способами, например прямой экстракцией, методика которой описана выше.
Пример 1. Синтез Galβ1-4GlcNPhtβ-SEt (соединение I) (SEt = SCH2CH2 группа)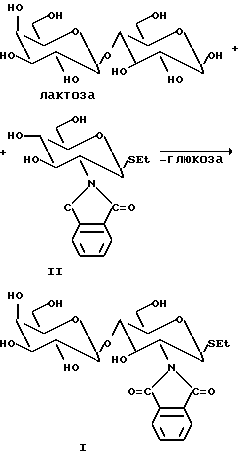
Обычно соединение I получают реакцией ферментации или с частично очищенным препаратом β-галактозидазы (полученным после разрушения дрожжевых клеток под высоким давлением (600 бар)) и центрифугированием твердого материала, который затем используют для синтеза). В обычной реакции начальная концентрация лактозы (гликозильного донора) и GlcNPht β- SЕt (акцептор; соединение II) составляет 5 и 1,2% (мас./объем), соответственно, в дрожжевой среде (как описано выше). Добавляют клетки дрожжей Bullera Singularis (OD 600 (оптическая плотность) после добавления клеток составляет приблизительно 1) и ферментацию проводят при 27oC при легком встряхивании (150 об/мин) при pH 5,5 в течение 5 дней.
Другим вариантом является способ, в котором в качестве катализатора реакции используют частично очищенный препарат галактозидазы. Вместо лактозы в качестве гликозильного донора может использоваться β-связанный нитрофенилгликозид галактозы (например, Galβ-OPhNO2-o или Galβ-OphNO2-п).
Ход реакции контролируется методом тонкослойной хроматографии и измерением количества высвобожденного нитрофенила при 405 нм (для нитрофенильных субстратов). Для каждой из указанных выше реакций, выделение продукта осуществляют экстракцией II этилацетатом, экстракцией продукта бутанолом, упариванием растворителя с последующей хроматографией (обычно на Sephadex® G10) и/или кристаллизацией.
Продукт идентифицируют методом ЯМР (400 МГц, Jeol), связанные положения определяют в перацетилированной форме по стандартным методикам (характерные сдвиги связанных положений определяют с помощью 1H-1H COSY ЯМР). Полученные данные ЯМР (13C; нескорректированные) для продукта 1:
Дисахаридная часть продукта: 103,93 (C'-1), 80,32 (C-1), 70,21 (C-3), 79,61 (C-4), 55,65 (C-2);
Фталимидогруппа: 123.33, 123.61, 130.76, 130.96, 135.02, 135.09, 167.39, 167.63 (2 C=0 группы);
SEt группа: 14.92 и 23.37.
Пример 2. Синтез Galβ-1-4-GlcNPht β-OMe (соединение III OMe = OCH3)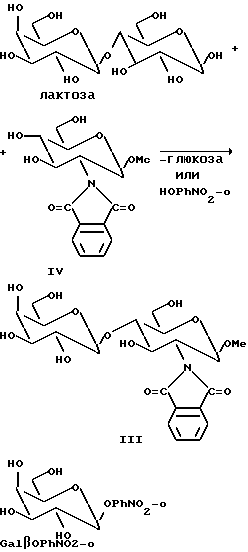
Обычно соединение III получают по методике, описанной в примере 1, с помощью реакции ферментации или с техническим препаратом β-галактозидазы (получен после измельчения дрожжевых клеток в ацетате натрия, 50 мM, pH 5, под высоким давлением 600 бар). После центрифугирования получают твердый материал, который используют для синтеза. В обычной реакции начальные концентрации лактозы (гликозильный донор) и GlcNPhtβ-SEt (акцептор: соединение IV) составляют 7 и 2,5% (мас./объем) соответственно, в 40 мл 50 мМ-ного раствора ацетата натрия с pH 6,0. Добавляют технический препарат β-галактозидазы и реакцию проводят при температуре 30oC с небольшим перемешиванием при pH 6,0 в течение двух дней. В качестве гликозильного донора вместо лактозы используют β-связанный нитрофенилгликозид галактозы, Galβ-OPhNO2-o (0,15 М).
Ход реакции контролируют методом тонкослойной хроматографии и измерением высвобожденного нитрофенола при 405 нм (для нитрофенильных субстратов). В каждой из вышеуказанных реакций продукт выделяют экстракцией IV этилацетатом с последующей хроматографией и сушкой вымораживанием. В этом способе получают продукт 1, в непрореагировавший акцептор регенерируют и могут использовать повторно.
Продукт идентифицируют методом ЯМР (400 МГц, Jeol), положения связанных групп определяют стандартными методиками (характерный сдвиг связанных положений определяют H1-H1). Для продукта III получают:
Дисахаридная часть продукта: 103.94 (C'-1), 99,90 (C-1), 70.44 (C-3), 79.96 (C-4), 57.03 (C-2)
Фталимидогруппа: 123.71, 124.44, 131.68 (2C); 135.89 (2C); 170.36 (2C; C=0);
Метильная группа 57.44.
Пример 3. Синтез Galβ/ 1-4 GlcNPht (соединение V):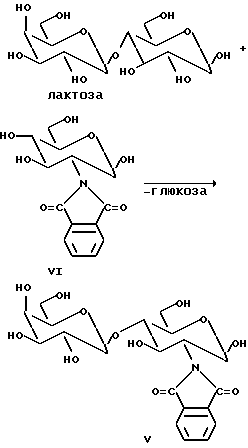
Обычно соединение V получают по методике, описанной в примере 1, с помощью ферментации или с техническим препаратом β-галактозидазы (получен после измельчения дрожжевых клеток в ацетате натрия, 50 мM, pH 5, под высоким давлением 600 бар). После центрифугирования получают твердый материал, который используют для синтеза. В обычной реакции начальные концентрации лактозы (гликозильный донор) и GlcNPht (акцептор; соединение VI) составляют 7 и 3 % (мас./объем) соответственно, в 75 мл 50 мМ-ного раствора ацетата натрия при pH 6,0. Добавляют технический препарат β-галактозидазы (около 6 г) и реакцию проводят при температуре 30oC с небольшим перемешиванием при pH 6,0 в течение двух дней. В качестве гликозильного донора вместо лактозы используют β-связанный нитрофенилгликозид галактозы, GalβOPhNO2-o.
За ходом реакции следят с помощью тонкослойной хроматографии и измерения высвобожденного нитрофенола при 405 нм (для нитрофенильных субстратов). Для каждой из вышеуказанных реакций продукт выделяют с помощью хроматографии (Sephadex и C18-кремнезем).
Продукт идентифицируют методом ЯМР (400 МГц, Jeol) и положения связывания определяют стандартными методиками (характерный сдвиг связанных положений определяют 1H-1H COSY ЯМР). Для продукта V получают:
Дисахаридная часть продукта: 105.14 (C'-1), 93,84 (C-1), 71.09 (C-3); 81.46 (C-4); 59.22 (C-2);
Фталимидогруппа: 124.04; 124.27; 133.05 (2C), 135.50 (2C), 169.76 (2C; C=0).
Пример 4. Синтез Galβ1-4 GlcN3β-OMe (соединение VII); N3 = азидо-группа);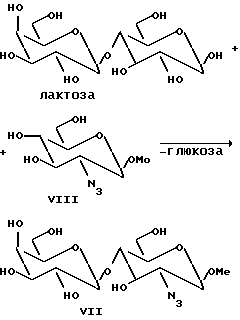
Обычно соединение VII получают по методике, описанной в примере 1, реакцией ферментации или с техническим препаратом β-галактозидазы (получен после измельчения дрожжевых клеток в ацетате натрия, 50 мM, pH 5, под высоким давлением 600 бар). После центрифугирования получают твердый материал, который используют для синтеза. В обычной реакции начальные концентрации лактозы (гликозильный донор) и GlcN3β/ OMe (акцептор; соединение VIII) составляют 7 и 3% (мас./объем) соответственно, в 75 мл 50 мМ-ного раствора ацетата натрия при pH 6,0. Добавляют технический препарат β-галактозидазы (приблизительно 6 г) и реакцию проводят при температуре 30oC с небольшим перемешиванием при pH 6,0 в течение двух дней. В качестве гликозильного донора вместо лактозы используют β-связанный нитрофенилгликозид галактозы, Galβ-OPhNO2-o.
Ход реакции контролируют методом тонкослойной хроматографии и измерением количества высвобожденного нитрофенола при 405 нм (для нитрофенильных субстратов). Для каждой из вышеуказанных реакций продукт выделяют и непрореагировавшие субстраты выделяют и регенерируют с помощью хроматографии (C18-кремнезем Sephadex).
Продукт идентифицируют методом ЯМР (400 МГц, Jeol) и положения связывания в перацетилированной форме определяют по стандартным методикам (характеристический сдвиг связанных положений определяют 1H-1H COSY ЯМР). Для продукта VII получают:
Дисахаридная часть продукта: 103.87 (C'-1), 102.90 (C-1), 73.44 (C-3), 79.12 (C-4), 66.03 (C-2);
Метильная группа: 58.11.
Пример 5. Синтез Galβ1-4 GlcNAcβ-SEt (соединение IX):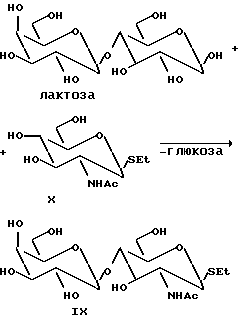
Обычно соединение IX получают по методике, описанной в примере 1, реакцией ферментации или с техническим препаратом β-галактозидазы (получен после измельчения дрожжевых клеток в ацетате натрия, 50 мМ, pH 5, под высоким давлением (600 бар) и центрифугирования в виде твердого материала, который затем используют для синтеза). В обычной реакции начальные концентрации лактозы (гликозильный донор) и GlcNAc β-SEt (акцептор; соединение X) составляют 7 и 5% (мас./объем) соответственно, а 75 мл 50 мМ-ного раствора ацетата натрия при pH 6,0. Добавляют технический препарат β-галактозидазы (приблизительно 6 г) и реакцию проводят при температуре 30oC с небольшим перемешиванием при pH 6,0 в течение двух дней. В качестве гликозильного донора вместо лактозы используют β-связанный нитрофенилгликозид галактозы, Galβ-OPhNO2-o.
Ход реакции контролируют методом тонкослойной хроматографии и измерением количества высвобожденного нитрофенола при 405 нм (для нитрофенильных субстратов). Для каждой из вышеуказанных реакций регенерацию непрореагировавших субстратов выделение продукта проводят хроматографии (Sephadex) и кристаллизацией. Таким способом получают продукт IX, а непрореагировавшие субстраты можно использовать повторно.
Продукт идентифицируют методом ЯМР (400 МГц, Jeol) и положения связывания определяют стандартными методами (характеристический сдвиг связанных положений определяют 1H-1H COSY ЯМР). Для продукта IX:
Дисахаридная часть продукта: 103.76 (C'-1); 84.85 (C-1), 76.27 (C-3), 74.66 (C-4), 61.93; 61.14 (C-6,6'), 55.24 (C-2), 175.30 (C=0 из NHAc группы);
25.39; 23.13; 15.21 (SEt группа и метильная группа в NHAc).
Пример 6. Синтез Galβ1-4 GlcNAcβPhN O-p (соединение XI):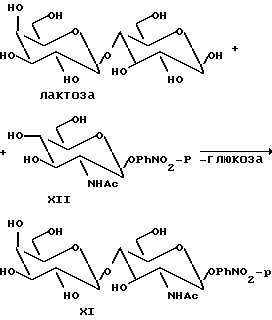
Обычно это соединение получают из лактозы (7 мас./мас.%) и с п-нитрофенил β-D-N-ацетилгликозаминидом (0,6 мас./мас.%) в качестве акцептора, используют техническую β-галактозидазу, полученную, как описано выше, при температуре 30oC в течение двух дней. Соединение выделяют экстракцией этилацетатом с последующей колоночной хроматографией водной фазы (Sephadex G 10). Продукт характеризуют методом ЯМР, как описано выше.
Во всех описанных выше реакциях, если в качестве донора используют Galβ-OPhNO2-o, то в качестве дополнительного продукта получают дисахарид - гликозид Galβ/ 1-4 Galβ-OPhNO2-o.
Акцепторное вещество в примерах 1-3 получают стандартными химическими способами, которые хорошо известны квалифицированным специалистам, из 2-амино-2-диокси-D-глюкозамина (GlcNH2) через перацетилированное фталимидопроизводное (перацетилированный GlcNPht). Субстрат азидоакцептора в примере 4 получают из глюкозы через глюкаль с последующим азидонитрированием в соответствии со стандартными химическими способами, хорошо известными специалистам данной области. Акцепторные субстраты в примерах 5 и 6 получают через перацетилированный GlcNAc также с использованием стандартных методик, хорошо известных специалистам.
Соединения, полученные выше, представляют интерес для применения либо непосредственно в качестве биологически активных веществ, либо для синтеза других лактозаминопроизводных, высших олигосахаридов (R1 = сахарид; R2 - может представлять собой H2, ацетильную или другую группу: другие заместители R представляют собой гидроксильные группы) и/или для конъюгации в молекулы других типов, включая белки, антитела, пептиды, аминокислоты и ферменты (R1 = белок, антитело, пептид, аминокислота, модифицированная аминокислота или фермент, гликозидно связанный с лактозаминным рядом).
Пример 7. Синтез продукта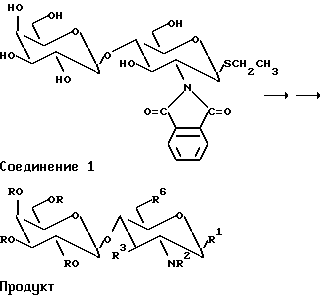
Перацилирование и другая модификация соединения I, III или V с помощью стандартных методов приводит к получению после выделения защищенного соединения со свободной 3-OH группой в глюкозаминной части. Такое модифицированное соединение может применяться для получения соединений вида Lewis-x (Lexis-x = Galβ1-4(Fucα1-3) GlcNAc; т.е. R3 в приведенной выше формуле представляет собой α-связанную фукопиранозильную группу; R2 - ацетильная группа и RO-группы представляют собой гидроксильные группы) и их производных, а также других соединений, модифицированных в 2-N-группе, 3-OH группе (R3 - сахар, отличный от L-фруктозы, например вместо α-фукопиранозила 3-OH положение может быть модифицировано другим сахаром, маннозой, галактозой и т.д., связанной в α- или β-конфигурацию, иди другой группой) и/или в аномерное положение гликозамино-остатка. Тиоэтилдисахариды используются направленно для синтеза других дисахаридных гликозидов, таких как аминокислотные гликозиды (R1 = аминокислота) или в качестве гликозильных доноров с акцепторными сахаридами или сходящегося блок-синтеза трисахаридов или полисахаридов более высокого порядка.
Таким образом, для получения соединений структуры Lewis-x и их производных химическим способом, соединение I, III или V можно сначала частично модифицировать в гидроксильные группы посредством, например, перацетилирования (пиридин + ангидрид уксусной кислоты). В результате после отделения от других продуктов получают перацетилированное соединение I, III или V со свободной гидроксильной группой и - SEt, - OMe или OAc группой, соответственно в положение R1. Полученное соединение может далее реагировать с фукопиразонильным соединением (например, перацетилированной L-фукопиразовой) с получением производного структуры Lewis-x. После удаления R групп и других защитных групп, и ацетилирования NH2 - группы получают соединение вида Galβ1-4 (Furα1-3) GlcNAc (Lewis-x).
Более точно, тиоэтил в соединении I (GaIβ1-4GlcNPht β- SEt) или предпочтительно перацетилированное соединение I (IB) может быть превращено в перацетилированное соединение Galβ1- 4 GlcNPhtβOR1 или Galβ1-4 GlNPhtβS R1, где R1 представляет собой органическую группу, содержащую моно-, дисахарид или олигосахарид более высокого порядка. N-фталимидогруппа может быть удалена известными стандартными способами (например, с помощью гидразина) и образованная группа NH2 может использоваться для превращения, например, в соединение вида Galβ1-4GlcNC(O)R, где R представляет собой метил, этил или другую органическую группу (см.определение значений для NR'', приведенные выше), или в соединение Galβ1-4GlcNR, где R представляет собой неорганическую группу (например, сульфат) или фрагмент, содержащий органическую группу (алифатическую и/или ароматическую).
Соединение I может быть перацетилировано (пиридин + ангидрид уксусной кислоты) для получения соединения (IB) следующего типа: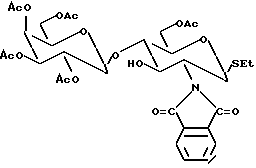
Соединение IB может реагировать, например, с перацетилированной L-фукопиразовой с образованием соединения IC: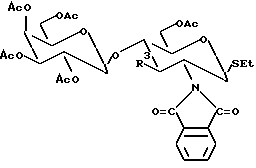
Для получения других соединений или для достижения более высоких выходов можно использовать другую модифицированную форму соединения IB, L-фукозу, или другой сахар, отличный от фукозы.
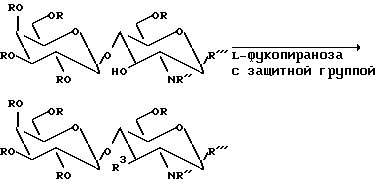
Для получения более высоких выходов специалист может подобрать защитные группы других типов.
Ацетильные группы и фталимидо-группа соединения IC могут удаляться стандартными способами, и NH2 группу ацетилируют для получения соединения ID (Galβ1 - 4 (FuCα1 - 3) G1cNACβ-SEt, тиолэтилгликозид структуры Lewis-x); SEt также может быть удалена с получением соединения IE (Gal β1 - 4FuCα1-3) GlcNAc; Lewis-x).
Фталимидная группа соединения IC может быть снята и присоединена группа NH2 r R-X и/или используют SEt группу для присоединения к сахару или к гидроксильной группе соединения R1OH для получения соединения IF (Galβ1-4 (FuCα1-3) GlcNR-R1, производное структуры Lewis-x), где R представляет собой неорганическую или органическую группу и R1 - сахар, OH или органическая группа, содержащая аминокислоты или пептиды.
Пример 8. Хемоферментативная модификация для получения лактозамин-содержащего продукта
Некоторые гликозилтрансферазы (относящиеся согласно ЕС к группе 2.4), такие как Galβ1-3/4 GlcNAcα2-3-сиалилтрансфераза и Galβ-3/4 GlcNAcα3/4-фруктозилтрансфераза, могут вносить сиалильные группы и фукозильные группы, соответственно, в различные типы лактозаминопроизводных, модифицированных в 2-N-положении. Термин "сиалил", сокращенно NeUAc, используется здесь для сокращенного обозначения структур сиаловой кислоты и аналогов сиаловой кислоты, которые вводятся с помощью сиалилтрансферазы. Термин "фукозил", сокращенно FuC, используется здесь для сокращенного обозначения структур L-фукопиранозы и аналогов L-фукопиранозы, которые вводятся с помощью фукотрансферазы.
Таким образом, для получения соответствующего α2-3-сиалилированного лактозаминопроизводного вида NeUAcα2-3 Galβ4GlcNR''-R''' в качестве акцептора может быть выбрано (или получено в результате химической или ферментативной конверсии гидроксильной группы, R'' и/или R''' групп ферментативно полученного лактозаминопроизводного, например с применением липазы для частичного ацилирования, например, глюкозаминной части) подходящее лактозаминопроизводное, полученное с помощью Bullera singularis или с помощью гликозидазы в соответствии с данным изобретением, при использовании в качестве катализатора α2-3-сиалилтрансферазы и в качестве гликозильного донора соединения CMP-NeUAc.
Аналогично, для получения соответствующего 2-3-сиалилированного лактозаминопроизводного вида Galβ1-4(FuCα1-3)-GlcNR''-R''' может использоваться в качестве акцептора подходящее лактозаминопроизводное, полученное с помощью Bullera singularis или гликозидазы в соответствии с данным изобретением (или в результате химической или ферментативной конверсии гидроксильной группы, R'' и/или R''' группы ферментативно полученного лактозамин-производного, например с применением липазы для частичного ацилирования, например, глюкозаминной части) при использовании в качестве катализатора α1-3-фукозилтрансферазы и в качестве гликозильного донора GDP-FuC.
Для получения производного вида NeUAcα2-3Galβ1- 4(FuС- α1-3) GlcNR''-R''' можно использовать сочетание двух реакций гликозилтрансфераз с лактозамин-производным в качестве первого акцептора.
Производные, указанные выше, могут затем превращаться в другие производные (например, химической модификацией R''- и/или R''' групп, как описано выше, или с помощью последующих фенментативных реакций). Указанные выше производные могут использоваться для различных целей. Примерами такого применения являются клиническое, диагностическое применение, а также использование для последующей технологической переработки.
Дополнительные изменения и модификации процессов, описанных выше, очевидны для специалиста и такие изменения и модификации включаются в формулу изобретения, которая прилагается.
Приоритетная заявка Швеции 94000346 от 06.01.94 включена в ссылки данного изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ГЛИКОЗИДОВ АКРИЛАТНЫХ ПРОИЗВОДНЫХ С ПРИМЕНЕНИЕМ САХАРИДОВ И ГЛИКОЗИДАЗ | 2011 |
|
RU2575609C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГЛИКОЗИДОВ АКРИЛАТНЫХ ПРОИЗВОДНЫХ С ИСПОЛЬЗОВАНИЕМ ПОЛИСАХАРИДОВ И ГЛИКОЗИДАЗ ИЛИ ГЛИКОЗИЛТРАНСФЕРАЗ | 2011 |
|
RU2570556C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГЛОБОТРИОЗЫ | 2011 |
|
RU2514661C2 |
| СПОСОБ ПОЛУЧЕНИЯ СИАЛИЛИРОВАННЫХ ОЛИГОСАХАРИДОВ | 2007 |
|
RU2473695C2 |
| ГЛИКОПЭГИЛИРОВАННЫЙ ГРАНУЛОЦИТАРНЫЙ КОЛОНИЕСТИМУЛИРУЮЩИЙ ФАКТОР | 2004 |
|
RU2400490C2 |
| ПРОДУКТЫ ПИТАНИЯ, СОДЕРЖАЩИЕ ОЛИГОСАХАРИДЫ ЧЕЛОВЕЧЕСКОГО МОЛОКА, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2591123C2 |
| СПОСОБ ПОЛУЧЕНИЯ ФУКОЗИЛИРОВАННОГО УГЛЕВОДА, СПОСОБ ПОЛУЧЕНИЯ ФУКОЗИЛИРОВАННОЙ СИАЛИЛИРОВАННОЙ УГЛЕВОДНОЙ МОЛЕКУЛЫ, РЕАКЦИОННАЯ СИСТЕМА IN VITRO | 1992 |
|
RU2125092C1 |
| ФЕРМЕНТАТИВНЫЙ СПОСОБ ПОЛУЧЕНИЯ 4-О-БЕТА-D-ГАЛАКТОПИРАНОЗИЛ-D-КСИЛОЗЫ | 2002 |
|
RU2316593C2 |
| ПРОИЗВОДНЫЕ ГЕКСОЗЫ, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2015 |
|
RU2731563C2 |
| ГЛИЦЕРИН-СВЯЗАННЫЕ ПЭГИЛИРОВАННЫЕ САХАРА И ГЛИКОПЕПТИДЫ | 2007 |
|
RU2460543C2 |
Способ получения соединения с β1-4 связью, которое содержит лактозаминную структуру, включает взаимодействие по меньшей мере одного донорного вещества Ga1βOR, где R представляет собой органическую группу, и по меньшей мере одного акцепторного вещества, которое представляет собой глюкопиранозамино-производное формулы G1cNR''-R'''представляет собой азидо, 2-N-ацетил-, 2-N-фталимидо или органическую группу, присоединенную к 2-N-группе глюкозамина, в которой R''' - глюкозидно соединенный фтор или О-, С-, N- или S-глюкозидно присоединенное алифатическое или ароматическое соединение. Если NR'' представляет собой NHAc, то R''' не является ОН, а если NR'' не является NHAc, то R"' может представлять собой ОН. Способ осуществляют в присутствии Bullera singularis, или гликозидазы ЕС группы 3.2, особенно имеющей такую же структуру, что и глюкозидаза ЕС группы 3.2, полученная из Bullera singularis, для получения лактозамин-производного. Предпочтительно проводят выделение соединения с β1-4 связью, которое содержит лактозаминную структуру. Использование изобретения позволяет повысить выход целевого продукта. 3 c. и 23 з.п.ф-лы.
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| Огнетушитель | 0 |
|
SU91A1 |
| Источник постоянного напряжения | 1975 |
|
SU598051A1 |
| СПОСОБ ПОЛУЧЕНИЯ О-РИБУЛОЗО-1,5-ДИФОСФАТА | 0 |
|
SU309610A1 |
Авторы
Даты
1999-08-27—Публикация
1995-01-09—Подача