Изобретение относится к новым гетероциклическим соединениям, обладающим биологической активностью, в частности к производным пирона, обладающим антибактериальной и антивирусной активностью.
Известны производные пирона, в частности 3-анизоил-4-окси-6-(п- метоксифенил)2Н-пиран-2-он, которые обладают биологической активностью (см. Bull. Soc. Chim. Франции, N 75, 1962 г., стр. 365-369).
Задачей изобретения является разработка новых производных пирона, обладающих антибактериальной и антивирусной активностью.
Поставленная задача решается предлагаемыми производными пирона общей формулы (I)
где X - группа формулы OR1, NHR1 СО2R4 или CH2OR1, где R1 - радикал R4 или COR4,
A и A1 - независимы друг от друга и означают химическую связь, фенил, нафтил, 5- или 6-членный гетероцикл, содержащий в качестве гетероатомов азот и/или кислород, циклоалкил с 5 или 6 атомами углерода, алкилциклоалкил с 1 - 6 атомами углерода в алкильной группе и 5 или 6 атомами углерода в циклоалкильной группе, возможно замещенные, по меньшей мере, одним заместителем, выбранным из группы, включающей фтор, хлор, бром, OR4, R4, CO2R4, где R4 означает водород, алкил с 1 - 6 атомами углерода, циклоалкил с 5 или 6 атомами углерода, фенил, незамещенные или замещенные, по меньшей мере, одним заместителем, выбранным из группы, включающей OR2, фенил, нафтил, трифторметил,
R2 - водород, алкил с 1 - 6 атомами углерода или циклоалкил с 5 или 6 атомами углерода,
R5 - водород, алкил с 1 - 6 атомами углерода,
R3 - независимо означает водород, (CH2)pR4, где R4 имеет указанное значение, а p означает целое число 0 - 2;
W, W1 и W3 - независимо друг от друга означают химическую связь, группу формулы NR3, СО, S(O)p, SO2NR3, где R3 и p имеют вышеуказанное значение,
W2 - зависит от значения индекса n группы формулы (CH2)nW2A1(CH2)mW3R3: если n > 0, то остаток W2 выбран из группы, включающей химическую связь, NR3 S(O)p, SO2NR3,
если n = 0, то остаток W2 означает CO,
m и n - независимо означают целое число 0 - 4,
при этом, если оба остатка W и W1 представляют собой гетероатомы, то m - целое число 2 - 4; а группа формулы R3W1(CH2)mW(CH2)nA не может означать метил или этил,
или их фармацевтически приемлемыми солями.
В первую группу предпочтительных производных пирона формулы (I) входят соединения, у которых
X означает гидроксил или амино, а
W2 - химическая связь.
Во вторую группу предпочтительных производных пирона формулы (I) входят соединения, у которых радикал A в группе формулы R3W1(CH2)mWC(CH2)nA означает спироцикл.
В частности предпочитаются соединения формулы (I), выбранные из группы, включающей:
4-окси-3-[3-метил-1-(фенилтио)бутил]-6-фенил-2Н-пиран-2-он,
4-окси-6-фенил-3-[фенил[(фенилметил)тио]метил]-2Н-пиран-2-он,
4-окси-6-фенил-3-[фенил(фенилтио)метил]-2Н-пиран-2-он,
4-окси-3-[2-нафталенил(фенилтио)метил]-6-фенил-2Н-пиран-2-он,
6-(3,5-диметилфенил)-4-окси-5-метил-3-[2-фенил-1-[(фенилметил)тио] - этил]-2Н-пиран-2-он,
4-окси-6-[4-(2-метоксифенокси)фенил] -3-[фенил[(фенилметил)тио] метил] - 2Н-пиран-2-он,
4-окси-6-[5-(феноксиметил)-2-фуранил] -3-[2-фенил-1-[(фенилметил)тио] - этил]-2Н-пиран-2-он,
4-окси-6-фенил-3-[фенил[(фенилметил)тио]метил]-2Н-пиран-2-он,
4-окси-3-[3-метил-1-(фенилтио)бутил]-6-фенил-2Н-пиран-2-он,
4-окси-3-[4-метил-1-(фенилтио)пентил]-6-фенил-2Н-пиран-2-он,
3-[1-[(2,6-диметилфенил)тио]-3-метилбутил]-4-окси-6-фенил-2Н-пиран-2-он,
3-[1-[(2,6-дихлорфенил)тио]-3-метилбутил]-4-окси-6-фенил-2Н-пиран-2-он,
3-[1-(циклогексилтио)-3,3-диметилбутил]-4-окси-6-фенил-2Н-пиран-2-он,
3-[1-(циклопентилтио)-3-метилбутил]-4-окси-6-фенил-2Н-пиран-2-он,
3-[1-(циклогексилтио)-3-метилбутил] -6-(2,3-дигидро-1,4-бензодиоксин- 6-ил)-4-окси-2Н-пиран-2-он,
4-окси-3-[1-[(2-метоксифенил)тио]-3-метилбутил]-6-фенил-2Н-пиран-2-он,
4-окси-3-[1-[(фенилметил)тио]-3-метилбутил]-6-фенил-2Н-пиран-2-он,
3-[1-(циклогексилтио)-3-метилбутил]-4-окси-6-фенил-2Н-пиран-2-он,
3-[2-циклогексил-1-(фенилтио)этил]-4-окси-6-фенил-2Н-пиран-2-он,
3-[1,4-бис(фенилтио)бутил]-4-окси-6-фенил-2Н-пиран-2-он,
3-[2-циклогексил-1-(фенилтио)этил]-4-окси-6-фенил-2Н-пиран-2-он,
3-[2-циклогексил-1-(циклогексилтио)этил]-4-окси-6-фенил-2Н-пиран-2-он,
3-[1-(циклогексилтио)-2-циклопропилэтил]-4-окси-6-фенил-2Н-пиран-2-он,
3-[1-(циклогексилтио)-2-(циклопентил)этил]-4-окси-6-фенил-2Н-пиран-2-он,
3-[2-циклопропил-1-[(фенилметил)тио]этил]-4-окси-6-фенил-2Н-пиран-2-он,
6-(1-бензилциклопропил)-3-[циклопентил(циклопропилметилтио)метил]- 4-окси-2Н-пиран-2-он,
6-(1-бензилциклобутил)-3-[циклопентил(циклопропилметилтио)метил] - 4-окси-2Н-пиран-2-он,
6-(1-бензилциклопентил)-3-[1-(циклопентилтио)-2-циклопропилэтил] -4- окси-2Н-пиран-2-он,
6-(1-бензилциклопентил)-3-[1-(циклопентилтио)-3-метилбутил] -4-окси- 2Н-пиран-2-он,
[4-[4-окси-3-[3-метил-2-(фенилтио)бутил] -2-оксо-2Н-тиопиран- 6-ил]фенокси]уксусную кислоту,
N-[3-[циклопропил[6-(1,1-диметил-3-фенилпропил)-4-окси-2-оксо-2Н- пиран-3-ил]метил]фенил]бензолсульфонамид,
3-(циклопропилфенилметил)-6-(1,1-диметил-3-фенилпропил)-4-окси-2Н- пиран-2-он,
N-[3-[циклопропил[6-(1,1-диметил-3-фенилпропил)-4-окси-2-оксо-2Н- пиран-3-ил]метил]фенил]бензолсульфонамид,
N-[3-[циклопропил[6-(1,1-диметил-2-фенилэтил)-4-окси-2-оксо-2Н- пиран-3-ил]метил]фенил]бензолсульфонамид,
N-[3-[циклопропил[4-окси-6-(1-метил-1-фенилэтил)-2-оксо-2Н-пиран- 3-ил] метил]фенил]бензолсульфонамид,
N-[3-[циклопропил[6-(1,1-диэтил-3-фенилпропил)-4-окси-2-оксо-2Н- пиран-3-ил]метил]фенил]бензолсульфонамид,
N-[3-[циклопропил[6-[1-этил-1-(фенилметил)пропил] -4-окси-2-оксо-2Н- пиран-3-ил]метил]фенил]бензолсульфонамид,
N-[3-[циклопропил[6-(1-этил-1-фенилпропил)-4-окси-2-оксо-2Н-пиран-3- ил] метил]фенил]бензолсульфонамид,
3-(циклопропилфенилметил)-6-(1,1-диметил-3-фенилпропил)-4-окси-2Н- пиран-2-он,
3-(циклопропилфенилметил)-6-(1,1-диметил-2-фенилэтил)-4-окси-2Н- пиран-2-он,
3-(циклопропилфенилметил)-4-окси-6-(1-метил-1-фенилэтил)-2Н-пиран-2-он,
3-(циклопропилфенилметил)-6-(1,1-диэтил-3-фенилпропил)-4-окси-2Н- пиран-2-он,
6-(1-бензил-1-этилпропил)-3-(циклопропилфенилметил)-4-окси-2Н-пиран-2-он,
3-(циклопропилфенилметил)-6-[1-этил-1-фенилпропил]-4-окси-2Н-пиран-2-он.
Под термином "фармацевтически приемлемые соли" понимаются как фармацевтически приемлемые кислотно-аддитивные соли, так и фармацевтически приемлемые соли с основаниями.
Фармацевтически приемлемые кислотно-аддитивные соли соединений формулы (I) включают соли с нетоксичными неорганическими кислотами, такими, как, например, хлористоводородная кислота, азотная кислота, фосфорная кислота, серная кислота, бромистоводородная кислота, йодистоводородная кислота, фтористоводородная кислота, фосфористая кислота и т.п., а также соли с нетоксичными органическими кислотами, такими, как, например, алифатические моно- и дикарбоновые кислоты, замещенные фенилом алканкарбоновые кислоты, гидроксиалканкарбоновые кислоты, алкандикарбоновые кислоты, ароматические кислоты, алифатические и ароматические сульфокислоты и т.д. Таким образом соли включают сульфат, пиросульфат, бисульфат, сульфит, бисульфит, нитрат, фосфат, вторичный фосфат, первичный фосфат, метафосфат, пирофосфат, хлорид, бромид, йодид, ацетат, трифторацетат, пропионат, каприлат, изобутират, оксалат, малонат, сукцинат, суберат, себацат, фумарат, малеат, манделат, бензоат, хлорбензоат, метилбензоат, динитробензоат, фталат, бензолсульфонат, толуолсульфонат, фенилацетат, цитрат, лактат, малеат, тартрат, метансульфонат и т. п. Данным изобретением также охватываются соли с аминокислотой, такие, как, например, аргинат и т.п., а также глюконат и галактуронат.
Кислотно-аддитивные соли основных соединений получают в результате взаимодействия свободного основания с достаточным количеством желаемой кислоты для получения соли стандартным приемом.
Фармацевтически приемлемые соли с основанием представляют собой соли с металлами или аминами, такими, как, например, щелочные металлы или щелочноземельные металлы или органические амины. В качестве металлов, пригодных для применения в качестве катионов, можно называть, например, натрий, калий, магний, кальций и т.п. В качестве подходящих аминов можно называть, например, N,N'-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, дициклогексиламин, этилендиамин, N-метилглюкамин, прокаин.
Соли кислотных соединений с основанием получают в результате взаимодействия свободной кислоты с достаточным количеством желаемого основания для получения соли стандартным приемом.
Некоторые соединения настоящего изобретения могут иметься как в несольватированных формах, так и в сольватированных формах, включая гидратированные формы. В общем сольватированные формы, включая гидратированные формы, проявляют такую же активность, что и несольватированные формы предлагаемых соединений. Поэтому они также охватываются настоящим изобретением.
Некоторые из предлагаемых соединений имеют один или несколько хиральных центров, каждый из которых может иметься в виде конфигурации R(D) или S(L). Настоящее изобретение включает все энантиомерные и эпимерные формы, а также их смеси.
Благодаря вышеуказанной биологической активности дальнейшим объектом изобретения является фармацевтическая композиция с антибактериальной или антивирусной активностью, которая помимо по меньшей мере одного фармацевтически приемлемого носителя содержит по меньшей мере одно производное пирона формулы (I) или его фармацевтически приемлемую соль в эффективном количестве.
Предлагаемая фармацевтическая композиция представляет собой любой стандартный препарат, пригодный для оральной или парентеральной аппликации. Предлагаемые соединения можно апплицировать путем инъекции, т.е. внутривенно, внутримышечно, внутрикожно, подкожно, интрадуоденально или внутрибрюшинно. Предлагаемые соединения также можно апплицировать путем ингаляции, например, через нос. Кроме того, предлагаемые соединения можно апплицировать трансдермально. Описанные в нижеследующем препараты разного вида дозирования в качестве активного вещества могут содержать либо соединение формулы (I), либо соответствующую фармацевтически приемлемую соль соединения формулы (I).
Фармацевтически приемлемые носители, используемые для изготовления фармацевтических композиций, содержащих предлагаемые соединения, могут быть либо в твердом, либо в жидком состоянии.
Твердыми препаратами являются, например, порошки, таблетки, пилюли, капсулы, суппозитории, диспергируемые гранулы. В качестве твердого носителя можно применять одно или несколько веществ, которые могут также выполнять функции разбавителя, вкусового вещества, связующего, консерванта, дезинтегрирующего таблетки вещества, или вещества для заключения активного начала.
В случае порошка носитель представляет собой тонкоизмельченное вещество, имеющееся в виде смеси с тонкоизмельченным активным началом.
Для приготовления таблеток активное начало смешивают с подходящим носителем в пригодных соотношениях, после чего смесь прессуют с получением таблеток желаемых размеров и конфигураций.
Порошки и таблетки предпочтительно содержат от 5 или 10 приблизительно до 70% активного начала. Подходящими носителями являются, например, карбонат магния, стеарат магния, тальк, сахар, лактоза, пектин, декстрин, крахмал, желатина, трагакант, метилцеллюлоза, карбоксиметилцеллюлоза натрия, низкоплавкий воск, масло какао и т.п.
Под термином "препарат" понимаются также капсулы с размещенным в них активным началом, отдельно или в виде смеси с носителями, при этом материал, из которого выполнены капсулы, представляет собой носитель активного начала. Кроме того, под термином "препарат" также понимаются крахмальные капсулы и лепешки. Таблетки, порошки, капсулы, пилюли, крахмальные капсулы и лепешки представляют собой твердые препараты, пригодные для оральной дачи.
Суппозитории можно приготовлять за счет того, что низкоплавкий воск, такой, как, например, смесь глицеридов жирных кислот, или масло какао, сначала расплавляют и, размешивая, в получаемом расплаве гомогенно диспергируют активное начало. Получаемый гомогенный расплав вливают в формы подходящих размеров, где ему дают охлаждаться и отверждаться.
В качестве жидких препаратов можно назвать растворы, суспензии и эмульсии, например, водные растворы или растворы воды и пропиленгликоля. Для парентеральной инъекции жидкие препараты представляют собой растворы в водном полиэтиленгликоле.
Пригодные для оральной аппликации водные растворы можно получать путем растворения активного начала в воде и добавления подходящих целевых добавок, таких, как, например, красители, вкусовые вещества, стабилизаторы, сгустители.
Пригодные для оральной аппликации водные суспензии можно получать путем диспергирования тонкоизмельченного активного начала в воде в присутствии вязкого вещества, такого, как, например, естественные или синтетические смолы, резины, метилцеллюлоза, карбоксиметилцеллюлоза натрия и другие широко известные суспендирующие агенты.
В объем изобретения также входят твердые препараты, которые предназначены для переведения в жидкие препараты непосредственно перед оральной аппликацией. Такие жидкости представляют собой растворы, суспензии и эмульсии. Кроме активного начала эти препараты могут также содержать красители, вкусовые вещества, стабилизаторы, буферы, естественные или синтетические подслащивающие вещества, диспергаторы, сгустители, способствующие солюбилизации агенты и т.п.
Фармацевтическая композиция предпочтительно выпускается в виде препарата, включающего дозировочные единицы, каждая из которых содержит соответствующее количество активного начала. Дозировочная единица может представлять собой упакованный препарат, причем упаковка содержит подходящее количество препарата, например, упакованные таблетки, упакованные капсулы, порошки в оболочках или ампулах. Дозировочной единицей могут также являться капсула или таблетка как таковые, или же упакованное подходящее количество таблеток или капсул.
Количество активного начала в дозировочной единице может колебаться в пределах 0,1 - 100 мг, предпочтительно 0,5 - 100 мг, в зависимости от конкретного назначения и от эффективности активного начала. Кроме того, препарат может содержать еще другие совместимые терапевтические агенты.
Ниже приводятся возможные составы конкретных препаратов, которые получают путем простого смешивания указанных ингредиентов
Гранулы для оральной дачи
Ингредиент - мг
Производное пирона формулы (I) - 50 - 250
Некристаллическая целлюлоза - 30
Поливинилпирролидон - 50
Мальтодекстрин - 200
Гранулированная фруктоза - 375
Таблетки
Ингредиент - мас.%
Производное пирона формулы (I) - 10
Поливинилпирролидон - 3
Мальтодекстрин - 10
Сорбит - 30
Маннит - 45
Подслащивающее вещество - 1
Стеарат магния - 1
Капсулы
Ингредиент - мас.%
Производное пирона формулы (I) - 18,22
Пропиленгликоль - 12,49
Хлористоводородная кислота - 1,26
Торговый продукт Кремофор EL - 11,24
Торговый продукт Майглиол 812 - 5,05
Торговый продукт Твин 80 - 5,14
Безводный этанол - 14,12
Торговый продукт Gelucire 50/13 - 32,48
Раствор для оральной дачи
Ингредиент - мас.%
Производное пирона формулы (I) - 7,88
Пропиленгликоль - 31,31
Безводный этанол - 32,00
Порошковая безводная лимонная кислота - 0,27
Вода для впрыскивания - 14,18
Торговый продукт Кремофор EL - 10,42
Порошковый дигидрат сахарина в виде натриевой соли - 0,98
Искусственное подслащивающее вещество со вкусом дикой вишни - 2,87
Торговый продукт Просвит Ликвид "К" - 0,08
Краситель, красный Д+С N 33 - 0,01
Дополнительным объектом изобретения является способ лечения вызванных ретровирусом инфекции или заболевания путем дачи пациенту по меньшей мере одного соединения общей формулы (I) или его фармацевтически приемлемой соли в дозе 0,01 - 10 мг/кг.
От указанных доз можно отклоняться в зависимости от состояния пациента, серьезности заболевания и апплицируемого соединения. Специалист в данной области может определять подходящую дозировку в каждом конкретном случае. Обычно поступают так, что в начале лечения дают маленькие дозы предлагаемых соединений, которые меньше оптимальной дозы. Затем дозу постепенно повышают до достижения оптимального терапевтического эффекта. При необходимости общая суточная доза может разделяться и порциями даваться в течение дня.
Производные пирона формулы (I) или их фармацевтически приемлемую соль можно также использовать в комбинации с ингибитором обратной транскриптазы ВИЧа и/или АЗТ и/или ddC.
В нижеследующем описывается получение производных пирона формулы (I).
При этом в используемых для иллюстрации реакционных схемах применяются следующие условные сокращения и термины:
150 psi - 10,55 кг см2
Ac - ацетил
Aryl, Ar - арил
Base - основание
DMF - диметилформамид
electrophile - электрофил
equiv. base - экв. основаания
Et - этил
HOAc - уксусная кислота
MeOH - метанол
NBS - N-бромсукцинимид
NEt3 - триэтиламин
or - или
OSiMe3 - триметилсилил
piperidine - пиперидин
pyr. - пиридин
quinolone - хинолон
reducing - восстановитель
agent
reduction - восстановитель
TMS-Cl - хлортриметилсилан
TMS-OTf - триметилсилилтрифторметансульфонат
TsCl - пара-толуолсульфонилхллорид
E - алкильные группы; CO2H; бензоил
Нижеприведенная схема (I) иллюстрирует получение замещенных в положениях 6 и 3 пиронов.
Кетон формулы (I) подвергают взаимодействию с подходящим основанием, таким, как, например, диизопропиламид лития или бис(триметилсилил)амид лития, при температуре от -78oC до -45oC в диэтиловом эфире или тетрагидрофуране. После окончания депротонирования реакционную смесь смешивают с хлортриметил-силаном при температуре от -78oC до 0oC, при этом получают простой силил-эноловый эфир формулы (II). В качестве альтернативы соединение формулы (I) подвергают взаимодействию с триметилсилилтрифторметансульфонатом и триэтиламином при температуре 0oC в дихлорметане, при этом получают промежуточный продукт формулы (II). Соединение формулы (II) подвергают взаимодействию с замещенным малонатом и нагревают либо как таковое, либо в среде ксилола при температуре 130 - 160oC с получением целевого продукта формулы (III).
Для вышеописанного приема, а также для других приемов получения предлагаемых соединений реакционноспособные функциональные группы в исходных, промежуточных или целевых продуктах во время химических реакций можно защищать с помощью защитных групп, при этом реакционноспособные функциональные группы становятся в основном инертными в условиях реакции (см., например, Protective Groups in Organic Synthesis, 2-ое издание, T.W. Green и P.G. Wuts, издательство John Wiley & Sons, Нью-Йорк, 1991 г.). В качестве групп для защиты амино-группы, гидроксила и других групп, обладающих соответствующей реакционноспособностью, можно называть, например: карбоксильные ацильные группы, такие, как, например, формил, ацетил, трифторацетил; алкоксикарбонильные группы, например, этоксикарбонил, трет. бутоксикарбонил, β,β,β- трихлорэтоксикарбонил, β- йодэтоксикарбонил; арилоксикарбонильные группы, например, бензилоксикарбонил, пара-метоксибензилоксикарбонил, феноксикарбонил; триалкилсилильные группы, например, триметилсилил и трет.бутилдиметилсилил; а также такие группы, как, например, тритил, тетрагидропиранил, винилоксикарбонил, орто-нитрофенилсульфенил, дифенилфосфинил, пара-толуолсульфонил, бензил. После окончания соответствующей реакции синтеза защитные группы можно удалять известными приемами. Например, трет.бутоксикарбонил удаляют путем ацидолиза, тритил - путем гидрогенолиза, трет.бутилдиметилсилил - путем обработки ионами фтора, а β,β,β- трихлорэтоксикарбонил - путем обработки цинком.
В качестве альтернативы в схеме (II) иллюстрируется другой способ получения содержащих функциональные группы пиронов:
Простой триметилсилил-эноловый эфир формулы (II) подвергают взаимодействию с малонилдихлоридом в среде сухого растворителя, такого, как, например, диэтиловый эфир или тетрагидрофуран при низкой температуре, предпочтительно -78oC - -35oC. При этом получают пирон формулы (IV), который путем взаимодействия с замещенным пара-толуолтиосульфонатом переводят в серусодержащее производное формулы (V) (см. патент США N 3931235, 1976 г.). В качестве альтернативы, тиотозилаты получают описанным в источнике M.G. Ranasinghe и P. L. Fuchs, Syn. Comm. 18(3): 227, 1988 г., образом. Необходимые для этого тиолы получают из соответствующего фенола .путем перегруппировки Ньюмана-Кварта (см. , например, Н. Kwart и Н. Omura, J.Amer. Chem. Soc. 93: 7250, 1971 г.; M.S. Newman и F.W. Hetzel, Org. Synth. Coll.: том VI: 824, 1988 г.; M.S. Newman и H.A. Karnes, J. Org. Chem. 31: 3980, 1966 г.) или же из соответствующего йодбензола путем нуклеофильной замены с использованием тиомочевины в присутствии никелевого катализатора (см. К. Takagi, Chem. Letters, 1307, 1985 г.).
Получение пиронов, таких, как, например, соединение формулы (VIII), иллюстрируется в схеме (III). При этом заместителем R6 соединения формулы (VII) является арил, алкил или замещенный алкил.
Сложный замещенный бета-кетоэфир формулы (VI) подвергают депротонированию с одним эквивалентом подходящего основания, такого, как, например, гидрид металла, например, гидрид натрия, в среде подходящего растворителя, например, диэтилового эфира или тетрагидрофурана. Второй эквивалент более сильного основания, такого, как, например, алкиллитий, например, н-бутиллитий или диизопропиламид лития, добавляют к раствору малоната с получением дианиона, который подвергают взаимодействию с подходящим агентом ацилирования, таким, как, например, амид, при температуре 0 - 25oC с получением сложного дионового эфира формулы (VII). Циклизацию соединения формулы (VII) до пирона формулы (VIII) можно осуществлять разными приемами, например, с применением сильной кислоты, такой, как, например, серная кислота или метансульфоновая кислота, путем нагревания реакционной смеси в среде высококипящего растворителя, такого, как, например, ксилол, или путем использования небольшого количества основания, предпочтительно основания с пониженной реакционноспособностью, такого, как, например, 1,8-диазабицикло[5.4.0]ундец-7-ен. Если R3 означает водород, то пирон формулы (VIII) можно подвергать дальнейшей дериватизации по вышеуказанной схеме (II).
В схеме (IV) иллюстрируется получение O-ацильных производных пирона.
Пирон, например формулы (VIII), подвергают взаимодействию с подходящим основанием, таким, как, например, гидридом металла, например, гидрид натрия, или алкоксидом, в среде подходящего растворителя, такого, как, например, тетрагидрофуран, диоксан или диэтиловый эфир, а получаемый при этом анион подвергают взаимодействию с ацилхлоридом или другим агентом ацилирования. При этом получают целевое производное ацила формулы (IX).
В нижепредставленной схеме (V) иллюстрируется получение разных производных 3-алкил-пирона.
Пирон формулы (VIII) в среде спирта, например, этанола, объединяют с подходящими альдегидом и нуклеофилом, например, HSR9 или NH2R9, в присутствии смеси кислоты, например, уксусной кислоты, и основания, например, пиперидина. Получаемую смесь нагревают до температуры 60 - 90oC с получением пирона формулы (X), который может представлять собой одно из вышеуказанных предпочтительных соединений.
В качестве альтернативы, в том случае, если Y - сера, то соединение формулы (X) можно восстановлять путем реакции восстановления металлом в жидкой среде, например, с использованием натрия в жидком аммиаке, или путем восстановления с использованием системы никеля Ренея в среде растворителя, например, ацетона. При этом получают целевые 3-алкил-пироны формулы (XI).
В схеме (VI) иллюстрируется получение разных 3-амино-пиронов.
Нитрование пирона формулы (VIII) осуществляют с использованием азотной кислоты, предпочтительно дымящей азотной кислоты в кислотном растворе, например, как описано в патенте США N 3206476, 1965 г. В результате восстановления нитропирона формулы (XII) оловом и кислотой получают аминопирон формулы (XIII), который можно переводить в целый ряд разных производных. Например, соединение формулы (XIII) можно подвергать взаимодействию с замещенным альдегидом в присутствии восстановителя, такого, как, например, боргидрид натрия или, предпочтительно, цианоборгидрид натрия, с получением N-алкилированного производного формулы (XIV). Ацилирование соединения формулы (XIII) можно осуществлять одним из следующих приемов:
1. путем взаимодействия с гидридом натрия с последующим сочетанием со смесью подходящей карбоновой кислоты, N-метилморфолина и подходящего агента конденсации, такого, как, например, 1-(3-диметиламинопропил)-3-этилкарбодиимид, при подходящей температуре, например, -35 - 0oC;
2. путем взаимодействия с подходящим хлорангидридом кислоты или другим агентом ацилирования в присутствии основания, такого, как, например, триэтиламин, и 4-диметиламинопиридина; или
3. путем депротонирования с использованием гидрида натрия и последующего взаимодействия с подходящим хлорангидридом кислоты в присутствии избытка аминооснования, обычно триэтиламина, при повышенной температуре, например, 40 - 60oC. Мочевины, например формулы (XVI), можно получать из аминопирона формулы (XIII) путем взаимодействия с подходящим изоцианатом и основанием, таким, как, например, N-метилморфолин, в среде инертного растворителя, такого, как, например, этилацетат.
В схеме (VII) иллюстрируется другой способ получения 6-замещенных производных.
6-метилпирон формулы (XVII) подвергают взаимодействию с 2 эквивалентами сильного основания, такого, как, например, амид натрия в жидком аммиаке или диизопропиламид лития в тетрагидрофуране, с последующим смешиванием с электрофильным веществом, выбранным из большой группы, включающей, например, галоидалкилы, агенты ацилирования и т.д. При этом получают пирон формулы (XVIII) (см. М.Р. Wachter и Т.М. Harris, Tetrahedron 26: 1685, 1970 г.). В качестве альтернативы осуществляют бромирование аллил-содержащим агентом соединения формулы (XVII) в условиях образования свободных радикалов, например с использованием N-бромсукцинимида в присутствии инициатора образования свободных радикалов и при облучении. При этом получают промежуточный продукт формулы (XIX), который дальше можно переводить в амин формулы (XX), как описано в источнике Jones и др., Tetrahedron Letters, 30: 3217, 1989 г., затем в спирт формулы (XXI), как описано в источнике R. Bacardit и др., J. Heterocyclic Chem. 19: 157, 1982 г., а в конце концов - в сульфид формулы (XXII), как описано в источнике R. Bacardit и др., J. Heterocyclic Chem. 26: 1205, 1989 г. Аминовые и гидроксильные заместители соединений формул (XX) и (XXI) можно переводить в другие производные стандартными приемами, например, путем алкилирования, ацилирования и т.д.
В схеме (VIII) иллюстрируется получение разных 4-замещенных производных пирона.
Пирон формулы (VIII) активизируют, например, путем тозилирования до соединения формулы (XXIII) с использованием пара-толуолсульфонилхлорида в пиридине. Получаемый при этом тозилат подвергают взаимодействию с подходящим серусодержащим нуклеофилом (см. А. М. Bittencourt и др., Tetrahedron, 27: 1043, 1971 r.) c получением сульфида формулы (XXIV). Подобным приемом пирон формулы (VIII) переводят в 4-бром-соединение формулы (XXV), с использованием агента бромирования, такого, как, например, смесь трибромида фосфора и диметилформамида. В результате замены брома в соединении формулы (XXV) азидом и последующего восстановления (предпочтительно, например, путем гидрирования в присутствии катализатора в виде смеси палладия и триарилфосфина в среде подходящего растворителя) получают 4-амин-замещенное производное формулы (XXIX). Введение дальнейших функциональных групп в амино-группу соединения формулы (XXIX) осуществляют описанным в схеме (VI) приемом.
В качестве альтернативы 4-бромпирон формулы (XXV) можно подвергать взаимодействию с метанолом в присутствии катализатора в виде смеси палладия и триарилфосфина в атмосфере окиси углерода с получением сложного эфира формулы (XXVI). Сложный эфир можно подвергать гидролизу, например, в кислотном растворе при температуре 0 - 25oC, с получением соответствующей карбоновой кислоты, или же восстановлять, например, с использованием гидрида в качестве реагента, такого, как, например, алюмогидрид лития в тетрагидрофуране или диэтиловом эфире при температуре 0 - 25oC, при этом получают спирт формулы (XXVII).
В схеме (IX) иллюстрируется получение производных 2Н-тиопиран-2-она.
Замещенный β- меркапто-акрилат, например, формулы (XXX), конденсируют с желаемым малонилдихлоридом в среде инертного растворителя, например, толуола, при температуре от 0oC до точки кипения применяемого в реакции растворителя, при этом получают тиопиран-2-он формулы (XXXI). Тиопирон формулы (XXXI) можно переводить в производное формулы (XXXII) в подходящих условиях, например, путем основного гидролиза с последующим декарбоксилированием (см., например, F.K. Splinter и Н. Arold, J. Prakt. Chem., 38, 3-4, 142-146). Тиопироны формулы (XXXII), где R3 - атом водорода, можно переводить в их замещенные производные описанными в схемах (II), (X) и (VI) методами дериватизации аналогичных пиронов.
Защищенные пироны, например, формулы (XVII), а также аналогичные соединения, содержащие атом серы вместо атома кислорода в положении 1 пиронового кольца, можно подвергать введению серусодержащей группы, т.е. карбонил в положении 2 гетероцикла заменяют тиокарбонилом (C=O ---> C=S) стандартными методами модифицирования групп, например, с использованием подходящего реактива, такого, как, например, реактив Лаувессона, в подходящих условиях реакции (см. Monatsh. Chem., 115: 769, 1984 г., и Chem. Rev. 84: 17,1984 г.)
Общие данные по получению содержащих функциональные группы пиронов
Метод А: Синтез путем взаимодействия простых силилэноловых эфиров с 2-замещенными сложными эфирами пропандикарбоновой кислоты
1. Получение простых триметилсилилэноловых эфиров
К раствору 10 ммоль (1 эквивалент) соответствующего кетона в 100 мл сухого тетрагидрофурана при температуре 78oC добавляют 11 ммоль (1,1 эквивалента) гексаметилдисилазида лития. Реакционную смесь перемешивают в течение 1 часа при температуре -78oC, а в течение еще 0,5 часов - при температуре -35oC. При температуре -78oC по каплям добавляют триметилхлорсилан, и получаемую при этом смесь перемешивают в течение 1 часа при температуре -78oC, а в течение еще 0,5 часов - при температуре 0oC. Реакцию прекращают добавлением насыщенного раствора бикарбоната натрия и реакционную смесь экстрагируют этилацетатом, взятым в количестве 300 мл. Этилацетатную фазу промывают насыщенным раствором бикарбоната натрия и солевым раствором и сушат над безводным сульфатом натрия. Этилацетатный раствор сгущают под пониженным давлением, а выделенное при этом вещество сушат в вакууме в течение 1 часа и используют без очистки.
2. Конденсация простых триметилсилилэноловых эфиров со сложными диалкиловыми эфирами 2-замещенной пропандикарбоновой кислоты
11 ммоль (1,1 эквивалента) сырого простого триметилсилилэнолового эфира, полученного аналогичным вышеописанной стадии приемом, объединяют с 10 ммоль (1,0 эквивалент) сложного диалкилового эфира 2- замещенной пропандикарбоновой кислоты, и получаемую смесь в течение ночи нагревают при температуре 150oC, при этом через реакционную смесь непрерывно подают газообразный азот. Реакционную смесь охлаждают до комнатной температуры и продукт очищают путем хроматографии на силикагеле. Путем элюации смесью этилацетата и гексанов с содержанием этилацетата, равным 10 - 15%, удаляют непрореагировавшееся исходное вещество и другие примеси, а путем элюации смесью этилацетата, метиленхлорида и гексанов с содержанием этилацетата, равным 30 - 50%, и метиленхлорида - 5%, осуществляют дальнейшую очистку с получением целевого пирона. При этом выход может колебаться в пределах от 20 до 75%.
Метод Б: Сульфенилирование 6-арил-4-окси-2Н-пиран-2-она
1. Получение 6-арил-4-окси-2-пирона
20 ммоль (1 эквивалент) простого триметилсилилэнолового эфира, полученного аналогичным методу А приемом (или имеющегося в виде торгового продукта), подают в безводный этиловый эфир и охлаждают до температуры -78oC - -40oC. К смеси прикапывают 30 - 40 ммоль (1,5 - 2 экв.) малонилдихлорида. Реакционную смесь постепенно нагревают до комнатной температуры и в течение ночи перемешивают при комнатной температуре. Получаемое твердое вещество фильтруют и промывают безводным диэтиловым эфиром.
2. Сульфенилирование 6-арил-4-окси-2Н-пиран-2-она
1,62 ммоль (1 экв.) 6-арил-4-окси-2-пирона, полученного вышеописанным приемом, растворяют в этаноле. В раствор последовательно подают 1,72 мл (1,04 экв. ) 1 н. гидроокиси натрия или 2 эквивалента триэтиламина, и 1,72 ммоль (1,04 экв. ) соответствующего тиолсульфоната. Реакционную смесь нагревают с обратным холодильником в течение ночи. Растворители упаривают, реакционную смесь подкисляют 1 н. соляной кислотой, и продукт экстрагируют этилацетатом. После упаривания растворителей сырой продукт очищают путем хроматографии на силикагеле с размером частиц 230 - 400 меш с применением в качестве элюента смеси этилацетата и гексанов с содержанием этилацетата, равным 30 - 50%, с получением целевого продукта. При этом выход может колебаться в пределах от 40 до 80%.
Метод В: Получение (6-арил-4-окси-2-оксо-2Н-пиран-3-ил)арилтиометана
В 2,16 ммоль (1 экв.) 6-арил-4-окси-2Н-пиран-2-она в 10 мл этанола подают 2,37 ммоль (1,1 экв.) соответствующего альдегида, 5,62 ммоль (2,6 экв.) соответствующего тиола, 0,50 мл пиперидина и 0,50 мл уксусной кислоты. Реакционную смесь держат при температуре 80oC в течение 24 часов. Этанол упаривают, остаток подкисляют 1 н. соляной кислотой и очищают путем хроматографии на силикагеле с размерами частиц 230 - 400 меш с получением целевого продукта. При этом выход может колебаться в пределах от 35 до 60%.
Метод Г: Получение 6-арил-3-алкиламино-4-окси-2Н-пиран-2-она
1. 6-арил-4-окси-3-нитро-2Н-пиран-2-он
Работают аналогично методу, описанному в патенте США N 3206476 (1965 г.) для нитрования и восстановления. В суспензию 2,65 ммоль 6-арил-4-окси-2Н-пиран-2-она в 2,77 мл уксусной кислоты при комнатной температуре подают 0,222 мл дымящей азотной кислоты. Реакционную смесь перемешивают в течение 5 минут, охлаждают до температуры 0oC, и продукт фильтруют. Продукт очищают путем перекристаллизации из кипящей уксусной кислоты. 1H-ЯМР (250 МГц, d-трифторацетат): δ = 7,02 (с, 1H), 7,65 (с, 3H), 7,99 (м, 2H).
2. 3-амино-6-арил-4-окси-2Н-пиран-2-он
К суспензии 10,5 ммоль (1 экв.) 6-арил-4-окси-3-нитро-2Н-пиран-2-она в 15 мл уксусной кислоты и 7,34 мл концентрированной соляной кислоты добавляют 20,6 ммоль (1,96 экв.) ворсистого олова. Получаемую смесь нагревают с обратным холодильником, при этом получают гомогенную смесь. Реакционную смесь нагревают с обратным холодильником в течение 7 минут, после чего ее охлаждают на ледяной бане. Добавляют концентрированную соляную кислоту, при этом осаждается 3-амино-6-арил-4-окси-2Н-пиран-2-он в виде гидрохлорида, который собирают и сушат. 1H-ЯМР (250 МГц, D2O): δ = 6,74 (с, 1H), 7,53 (м, 3H), 7,84 (м, 2H).
3. 3-алкиламино-6-арил-4-окси-2Н-пиран-2-он
В раствор 2 ммоль (1 экв.) 3-амино-6-арил-4-окси-2Н-пиран-2-она в виде гидрохлорида в 20 мл диметилформамида с содержанием уксусной кислоты, равным 1%, последовательно подают 2,1 - 4,2 ммоль (1,05 - 2,1 экв.) альдегида и 2,1 - 4,2 ммоль (1,05 - 2,1 экв.) цианоборгидрида натрия. Реакционную смесь перемешивают в течение 5 минут, затем смешивают с водой и сгущают в вакууме. Масляный остаток разбавляют 100 мл этилацетата, последовательно промывают водой и насыщенным раствором хлорида натрия и сушат над безводным сульфатом магния. Растворители упаривают в вакууме и сырой продукт очищают либо путем колоночной хроматографии на силикагеле с размерами частиц 230 - 400 меш, либо путем перекристаллизации, с получением целевого продукта.
Метод Д: 3-ациламино-6-арил-4-окси-2Н-пиран-2-он
Для амидирования 3-амино-6-арил-4-окси-2Н-пиран-2-она применяют следующие операции.
а) В раствор 0,84 ммоль (1,0 экв.) 3-амино-6-арил-4-окси-2Н-пиран-2-она в виде гидрохлорида в 10 мл тетрагидрофурана подают 0,92 ммоль (1,1 экв.) 60%-ного раствора гидрида натрия. Перемешивают в течение 30 минут при комнатной температуре. В другой колбе в 1,67 ммоль (2 экв.) соответствующей карбоновой кислоты в 20 мл тетрагидрофурана при температуре -20oC последовательно подают 0,92 ммоль (1,1 экв.) N-метилморфолина и 0,92 ммоль (1,1 экв.) 1-(3-диметиламинопропил)-3- этилкарбодиимида в виде гидрохлорида. Реакционную смесь перемешивают при температуре -20oC в течение 1 часа. Получаемый при этом раствор подают в вышеуказанный 3-амино-6-арил-4-окси-2Н-пиран-2-он, после чего добавляют еще 0,918 ммоль (1,1 экв.) N-метилморфолина. Реакционную смесь перемешивают при комнатной температуре в течение ночи. К реакционнионной смеси добавляют солевой раствор и разбавляют этилацетатом. Органический слой последовательно промывают 1 н. соляной кислотой, водой и насыщенным раствором хлорида натрия, после чего сушат над безводным сульфатом магния. Растворители упаривают в вакууме, и сырой продукт очищают путем колоночной хроматографии на силикагеле с размерами частиц 230 - 400 меш с получением целевого продукта.
б) В суспензию 0,83 ммолль (1,0 экв.) 3-амино-6-арил-4-окси-2Н- пиран-2-она в виде моногидрохлорида в 8 мл метиленхлорида последовательно подают 3,3 ммоль (4,0 экв.) триэтиламина, каталитическое количество (0,08 ммоль, 0,1 экв. ) 4-диметиламинопиридина и 0,92 ммоль (1,1 экв.) соответствующего хлорангидрида кислоты. Реакционную смесь перемешивают при комнатной температуре в течение 6 часов. К смеси добавляют 1 н. хлористоводородную кислоту, после чего реакционную смесь разбавляют метиленхлоридом. Органическую фазу промывают водой и насыщенным раствором хлорида натрия и сушат над безводным сульфатом магния. Растворители упаривают в вакууме и сырой продукт перекристаллизуют из кипящей уксусной кислоты.
в) В раствор 0,63 ммоль (1,0 экв.) 3-амино-6-арил-4-окси-2Н-пиран-2-она в виде моногидрохлорида в 6 мл тетрагидрофурана при температуре 0oC подают 0,69 ммоль (1,1 экв.) 60%-ного раствора гидрида натрия. Получаемую смесь перемешивают при комнатной температуре в течение 15 минут. В реакционную смесь подают 0,69 ммоль (1,1 экв.) соответствующего хлорангидрида кислоты. Реакционную смесь в течение 1 часа нагревают до температуры 50oC, а в течение ночи держат ее при комнатной температуре. К реакционной смеси добавляют 1 н. хлористоводородную кислоту и разбавляют этилацетатом. Органическую фазу промывают насыщенным раствором хлорида натрия и сушат над безводным сульфатом магния. Растворители упаривают в вакууме и сырой продукт перекристаллизуют из кипящего нитрометана с получением чистого продукта.
Метод Е: Получение 3-алкил-6-арил-4-окси-2Н-пиран-2-она
(6-арил-4-окси-2-оксо-2Н-пиран-3-ил)арилтиометаны получают вышеуказанным методом В. Никель Ренея (торговый продукт "Grace 3100") кипятят в ацетоне в течение 45 минут, после чего ацетон заменяют этанолом, взятым в количестве 20 мл. Добавляют 1,0 ммоль (1 экв.) (4-окси-6-замещенного 2-оксо-2Н-пиран-3-ил)арилтиометана и получаемую при этом суспензию нагревают с обратным холодильником в течение ночи. Смесь фильтруют на силикате марки "Celite" и промывают горячим этанолом. Фильтрат сгущают в вакууме с получением чистого продукта.
Метод Ж: Получение сложного 4-ацилокси-эфира 4-окси-3-арилтио-6- арил-2Н-пиран-2-она или же 4-ацилокси-эфира 4-окси-3-арилалкилтио- 6-арил-2Н-пиран-2-она
3 ммоль (1 экв.) 4-окси-3-арилтио-6-арил-2Н-пиран-2-она или же 4-окси-3-арилалкилтио-6-арил-2Н-пиран-2-она растворяют в 20 мл тетрагидрофурана и охлаждают до температуры 0oC. В получаемую смесь медленно подают 3,3 ммоль (1,1 экв.) гидрида натрия и поучаемую смесь перемешивают при комнатной температуре в течение 15 минут. Прикалывают 6 ммоль (2 экв.) соответствующего хлорангидрида кислоты и реакционную смесь перемешивают при комнатной температуре в течение ночи. К реакционной смеси добавляют насыщенный раствор хлорида натрия и разбавляют этилацетатом, взятым в количестве 100 мл. Объединенную органическую фазу промывают раствором бикарбоната натрия и солевым раствором и сушат над безводным сульфатом натрия. Растворители упаривают и сырой продукт очищают путем колоночной хроматографии на силикагеле с размерами частиц 230 - 400 меш с применением в качестве элюента смеси этилацетата и гексана в соотношении 1 : 9. При этом получают сложный эноловый эфир. Выход может колебаться в пределах от 70 до 85%.
Получение исходных соединений
Примеры А - Д: получение пропандикарбоновых кислот
Нижеследующие ключевые промежуточные продукты синтезировали согласно методу, описанному в источнике Comptus rendus 255: 2611 (1962).
Применяются следующие условные сокращения:
УИ = ударная ионизация
ИК = инфракрасный
МС = масс-спектр
ТГФ = тетрагидрофуран
Пример A
Сложный диэтиловый эфир [(фенилметил)тио]-пропандикарбоновой кислоты
Т.к. 160 - 162oC / 6 мм рт. ст.;
1H-ЯМР (250 МГц, ДМСО-d6): δ = 1,18 (т, 6H), 3,93 (с, 2H), 4,13 (кв, 4H), 4,44 (с, 1H), 7,31 (м, 5H).
Пример Б
Сложный диметиловый эфир [(2-нафталенилметил)тио] -пропандикарбоновой кислоты
Сырой продукт очищают хроматографией на силикагеле с размерами частиц 230 - 400 меш.
1H-ЯМР (250 МГц, ДМСО-d6): δ = 3,65 (с, 6H), 4,10 (с, 2H), 4,55 (с, 1H), 7,51 (м, 3H), 7,87 (м, 4H).
Пример В
Сложный диэтиловый эфир [(3-фенилпропил)тио]-пропандикарбоновой кислоты
Т.к. 185 - 190oC / 1 мм рт. ст.;
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,17 (т, 6H), 1,82 (м, 2H), 2,65 (кв, 4H), 4,14 (кв, 4H), 4,62 (с, 1H), 7,23 (м, 5H).
Пример Г
Сложный диэтиловый эфир [(2-нафталенил)тио]-пропандикарбоновой кислоты
Сырой продукт очищают хроматографией на силикагеле с размерами частиц 230 - 400 меш.
1H-ЯМР (250 МГц, ДМСО-d6): δ = 1,09 (т, 6H), 4,12 (кв, 4H), 5,27 (с, 1H), 7,58 (м, 3H), 7,90 (м, 3H), 8,80 (с, 1H).
Пример Д
Сложный диэтиловый эфир [(2-фенилэтил)тио]-пропандикарбоновой кислоты
Т.к. 160 - 165oC / 1 мм рт. ст.;
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,19 (т, 6H), 2,89 (м, 2H), 4,16 (кв, 4H), 4,68 (с, 1H), 7,25 (м, 5H).
Примеры Е - М: получение сложных эфиров п-толуолтиосульфокислоты
Нижеследующие п-толуолтиосульфонаты синтезировали согласно методу, описанному в патенте US N 3931235 (1976 г.).
Пример E
Сложный 2-феноксиэтиловый эфир п-толоуолтиосульфокислоты
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,41 (с, 3H), 3,41 (т, 2H), 4,13 (т, 2H), 6,83 (д. 2H), 6,94 (т, 1H), 7,27 (т, 2H), 7,48 (д, 2H), 7,85 (д, 2H).
Пример Ж
Сложный 3-фенил-2-пропениловый эфир п-толоуолтиосульфокислоты
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,32 (с, 3H), 3,93 (д, 2H), 6,00 (дт, 1H), 6,58 (д, 1H), 7,29 (м, 5H), 7,38 (д, 2H), 7,81 (д, 2H).
Пример З
Сложный 2-[2-метоксифенил]этиловый эфир п-толоуолтиосульфокислоты
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,43 (с, 3H), 2,80 (т, 2 Н), 3,19 (т, 2H), 3,75 (с, 3H), 6,83 (т, 1H), 6,93 (д, 1H), 7,02 (д, 1H), 7,21 (т, 1H), 7,49 (д, 2H), 7,81 (д, 2H).
Пример И
Сложный 4-фенилбутиловый эфир п-толоуолтиосульфокислоты
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,53 (м, 4H), 2,43 (с, 3H), 2,50 (т, 2H), 3,03 (т, 2H), 7,12 (д, 1H), 7,18 (д, 2H), 7,25 (т, 2H), 7,45 (д, 2H), 7,80 (д, 2H).
Пример Й
Сложный 2-[3-метоксифенил]этиловый эфир п-толоуолтиосульфокислоты
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,43 (с, 3H), 2,79 (т, 2H), 3,25 (т, 2H), 3,73 (с, 3H), 6,73 (м, 3H), 7,19 (м, 1H), 7,49 (д, 2H), 7,83 (д, 2H).
Пример К
Сложный 2-[4-метоксифенил]этиловый эфир п-толоуолтиосульфокислоты
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,50 (с, 3H), 2,76 (т, 2H), 3,21 (т, 2H), 3,71 (с, 3H), 6,83 (т, 2H), 7,03 (д, 2H), 7,50 (т, 2H), 7,82 (д, 2H).
Пример Л
Сложный 2-(2-хлорфенил)этиловый эфир п-толоуолтиосульфокислоты
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,43 (с, 3H), 2,86 (т, 2H), 3,28 (т, 2H), 7,22 (м, 4H), 7,49 (д, 2H), 7,83 (д, 2H).
Пример М
Сложный [4-(фенилметокси)фенил]метиловый эфир п-толоуолтиосульфокислоты
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,41 (с, 3H), 4,28 (с, 2H), 5,06 (с, 2H), 6,87 (д, 2H), 7,13 (д, 2H), 7,37 (м, 7H), 7,72 (д, 2H).
Пример Н
6-(3-хлорфенил)-4-окси-2Н-пиран-2-он
Суспензию 0,790 г (19,7 ммоль) 60%-ного раствора гидрида натрия в 50 мл тетрагидрофурана в атмосфере азота охлаждают до 0oC и обрабатывают 2,51 мл (19,7 ммоль) этилового эфира ацетоуксусной кислоты. Получаемый раствор обрабатывают 12,3 мл (19,7 ммоль) н- бутиллития и перемешивают в течение 20 минут при 0oC с получением оранжевого раствора, к которому добавляют с помощью канюли 2,50 г (15,15 ммоль) раствора 3-хлор-N-метокси-N-метилбензамида в 5,0 мл тетрагидрофурана. Смеси дают нагреваться до комнатной температуры, перемешивают в течение 14 часов, после чего смешивают с 2,0 н. соляной кислотой. Продукт три раза экстрагируют этилацетатом, взятым в количестве по 50 мл, слои объединяют, сушат над сульфатом натрия и растворитель удаляют в вакууме. Остаток обрабатывают 20 мл концентрированной серной кислоты, получаемую смесь перемешивают в течение 18 часов при комнатной температуре, после чего разбавляют 200 мл воды. Продукт три раза экстрагируют этилацетатом, взятым в количестве по 100 мл, с тем, чтобы собирать все твердое вещество. Слои объединяют и разбавляют ацетоном с получением гомогенного раствора, который сушат над сульфатом натрия. Растворитель удаляют в вакууме и твердый продукт перекристаллизуют из смеси ацетона и гексана с получением 1,33 г целевого соединения (т.п. 254 - 256oC).
1H-ЯМР (400 МГц, ДМСО-d6): δ = 11,957 (шир.с, 1H), 7,889 (т, 1 Н, J = 1,5 Гц), 7,839 - 7,813 (м, 1H), 7,598 - 7,524 (м, 2H), 7,876 (д, 1H, J = 2 Гц), 5,450 (д, 1H, J = 2 Гц).
Пример О
6-(4-хлорфенил)-4-окси-2Н-пиран-2-он
1,56 г целевого соединения (т.п. 247 - 249oC) получают по примеру Н с применением 0,904 г (22,6 моль) 60%-ного раствора гидрида натрия, 50 мл тетрагидрофурана, 3,00 г (22,6 ммоль) этилового эфира ацетоуксусной кислоты, 39,8 мл (24 ммоль) диизопропиламина лития в тетрагидрофуране, 3,73 r (22,6 ммоль) 4-хлор-N-метокси-N-метилбензамида и 20 мл 90%-ной серной кислоты.
1H-ЯМР (300 МГц, ДМСО-d6): δ = 11,950 (шир.с, 1H), 7,878 (д, 1H, J = 9 Гц), 7,584 (д, 1H, J = 9 Гц), 6,812 (д, 1H, J = 2 Гц), 5,409 (д, 1H, J = 2 Гц).
Пример П
Сложный циклопропилметиловый эфир п-толуолтиосульфокислоты
К раствору 4,00 г (29,6 ммоль) метилциклопропилбромида в 20,0 мл этанола добавляют 10,0 г (44,4 ммоль) тиотозилата калия, после чего смесь нагревают до 90oC в течение 10 часов. Потом смесь подают в смесь 50 мл воды и 50 мл простого диэтилового эфира. Слои разделяют и органический слой промывают 50 мл солевого раствора. Органический слой сушат над сульфатом магния и сгущают в вакууме с получением 5,2 г целевого соединения в виде твердого продукта (т.п. 46 - 48oC).
1H-ЯМР (400 МГц, CDCl3): δ = 7,816 (д, 2H, J = 8,8 Гц), 7,308 (д, 2H, J = 8,8 Гц), 2,945 (д, 2H, J = 7,6 Гц), 2,451 (с, 3H), 1,010 - 0,933 (м, 1H), 0,592 - 0,545 (м, 2H), 0,236 - 0,197 (м, 2H).
Пример P
Сложный метиловый эфир 4-(1-оксоэтил)фенокси]уксусной кислоты
Смесь 10,0 г (60,24 ммоль) 4-оксипропиофенона, 21,6 г (66,3 ммоль) карбоната цезия и 150,0 мл ацетона в атмосфере азота обрабатывают 7,26 мл (78,3 ммоль) метилбромацетата и нагревают с обратным холодильником в течение 4 часов. Затем смеси дают охлаждаться до комнатной температуры, разбавляют 150 мл воды и два раза экстрагируют дихлорметаном, взятым в количестве по 300 мл. Органические слои объединяют, сушат над сульфатом натрия и растворитель удаляют в вакууме с получением 12,75 г целевого соединения (т.п. 64 - 66oC).
1H-ЯМР (400 МГц, ДМСО-d6): δ = 9,35 (д, 2H, J = 8,9 Гц), 7,040 (д, 2H, J = 8,9 Гц), 4,920 (с, 2H), 3,715 (с, 3H), 2,981 (кв, 2H, J = 7,2 Гц), 1,071 (т, 3H, J = 7,2 Гц).
Получение целевых производных пирона
Пример 1
6-(3-хлорфенил)-4-окси-3-[(фенилметил)тио]-2Н-пиран-2-он
По методу А раствор 1,50 г (11,6 ммоль) 3'-хлорацетофенона в 10,0 мл тетрагидрофурана охлаждают до -78oC в атмосфере азота и обрабатывают 1,0 М раствором 12,5 мл (12,5 ммоль) гексаметилдисилазида лития в тетрагидрофуране. Раствор нагревают до 0oC, перемешивают в течение 15 минут и обрабатывают 1,47 мл (11,6 ммоль) триметилсилилхлорида. Реакционную смесь перемешивают в течение 30 минут при комнатной температуре, после чего ее подают в смесь 50 мл простого диэтилового эфира и 20 мл насыщенного водного раствора бикарбоната натрия. Слои разделяют и органический слой промывают смесью солевого раствора и 20 мл насыщенного раствора бикарбоната натрия в соотношении 1:1. Эфирный раствор сушат над сульфатом натрия и растворитель удаляют в вакууме. Получаемый силил-эноловый эфир подают в колбу, содержащую 1,63 г (5,80 ммоль) сложного диэтилового эфира 2-(тиобензил)пропан-1,3-дикарбоновой кислоты. Смесь нагревают до 160oC в течение 16 часов, после чего ей дают охлаждаться до комнатной температуры. Затем смесь разбавляют 20 мл простого диэтилового эфира и три раза экстрагируют насыщенным раствором карбоната натрия, взятым в количестве по 20 мл. Водный слой подкисляют концентрированной соляной кислотой до достижения pH 0 и три раза экстрагируют этилацетатом, взятым в количестве по 100 мл. Органические слои объединяют, сушат над сульфатом натрия и растворитель удаляют в вакууме. Остаток очищают хроматографией на силикагеле с размерами частиц 230 - 400 меш с применением в качестве элюента сперва 100% дихлорметана, а затем его смеси с метанолом в соотношении 99: 1. Получают 0,436 г целевого соединения (т.п. 136 - 137oC) в виде твердого продукта, рекристаллизованного из смеси ацетона и гексана.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 11,950 (шир.с, 1H), 7,814 (с, 1H), 7,761 (д, 1H, J = 7,5 Гц), 7,616 - 7,534 (м, 2H), 7,271 - 7,185 (м, 5H), 6,811 (с, 1H), 4,023 (с, 2H).
Пример 2
6-(2-хлорфенил)-4-окси-3-[(фенилметил)тио]-2Н-пиран-2-он
0,210 r целевого соединения (т.п. 99 - 101oC) получают по методу А с применением 1,50 мл (11,6 ммоль) 2'-хлорацетофенона, 6,80 мл (12,7 ммоль) 1,87 м. гексаметилдисилазида калия, 1,47 мл (11,6 ммоль) триметилсилилхлорида, 10,0 мл тетрагидрофурана и 1,3 г (4,63 ммоль) сложного диэтилового эфира 2-(тиобензил)пропан-1,3-дикарбоновой кислоты.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 12,153 (шир.с, 1H), 7,639 (т, 2H, J = 9 Гц), 7,572 - 7,477 (м, 2H), 7,276 - 7,206 (м, 5H), 6,558 (с, 1H), 4,029 (с, 2H).
Пример 3
6-(3,4-дихлорфенил)-4-окси-3-[(фенилметил)тио]-2Н-пиран-2-он
0,201 r целевого соединения (т.п. 185 - 186oC) получают по методу А с применением 1,5 г (7,9 ммоль) 3',4'-дихлорацетофенона, 8,7 мл (8,69 ммоль) 1,0 м. гексаметилдисилазида лития, 1,0 мл (7,9 ммоль) триметилсилилхлорида, 10,0 мл тетрагидрофурана и 0,89 г (3,2 ммоль) сложного диэтилового эфира 2-(тиобензил)пропан-1,3-дикарбоновой кислоты.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 12,000 (шир.с, 1H), 8,018 (с, 1H), 7,784 (с, 2H), 7,265 - 7,179 (м, 5H), 6,839 (с, 1H), 4,017 (с, 2H).
Пример 4
4-окси-6-(3-метоксифенил)-3-[(фенилметил)тио]-2Н-пиран-2-он
0,400 r целевого соединения (т.п. 146 - 147oC) получают по методу А с применением 1,5 мл (10,9 ммоль) 3'-метоксиацетофенона, 6,41 мл (12,0 ммоль) гексаметилдисилазида калия, 1,38 мл (10,9 ммоль) триметилсилилхлорида, 10,0 мл тетрагидрофурана и 1,23 г (4,36 ммоль) сложного диэтилового эфира 2-(тиобензил)пропан-1,3-дикарбоновой кислоты.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 11,880 (шир.с, 1H), 7,445 (т, 1H, J = 8 Гц), 7,370 (д, 1Н, J = 8 Гц), 7,286 - 7,094 (м, 6H), 7,109 (м, 1H), 6,770 (с, 1H), 4,020 (с, 2H), 3,831 (с, 3H).
Пример 5
4-окси-3-[(фенилметил)тио]-6-(3,4,5-триметоксифенил)-2Н-пиран-2-он
0,385 г целевого соединения (т.п. 156 - 157oC) получают по методу А с применением 2,0 г (9,5 ммоль) 3',4',5'-триметоксиацетофенона, 5,6 мл (10,45 ммоль) гексаметилдисилазида калия, 1,2 мл (9,5 ммоль) триметилсилилхлорида, 15 мл тетрагидрофурана и 1,07 г (3,80 ммоль) сложного диэтилового эфира 2-(тиобензил)пропан-1,3-дикарбоновой кислоты.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 11,778 (шир.с, 1H), 7,265 - 7,181 (м, 5H), 7,054 (с, 2H), 6,792 (с, 1H), 3,997 (с, 2H), 3,861 (с, 6H), 3,727 (с, 3H).
Пример 6
6-(3-хлорфенил)-4-окси-3-[(2-фенилэтил)тио]-2Н-пиран-2-он
0,138 г целевого соединения (т.п. 125 - 127oC) получают по методу Б с применением 0,250 г (1,10 ммоль) 6-(3-хлорфенил)-4-окси-2Н- пиран-2-она, 0,43 г (1,46 ммоль) сложного фенэтилового эфира п-толуолтиосульфокислоты, 0,35 мл (2,5 ммоль) триэтиламина и 5,0 мл этанола.
1H-ЯМР (400 МГц, CDCl3): δ = 7,838 (т, 1H, J = 1,5 Гц), 7,710 (д, 1H, J = 8 Гц), 7,530 (шир.с, 1H), 7,475 - 7,392 (м, 2H), 7,308 - 7,260 (м, 2H), 7,207 - 7,171, (м, 3H), 6,604 (с, 1H), 3,125 (т, 2H, J = 7 Гц), 2,897 (т, 2H, J = 7 Гц).
Пример 7
6-(4-хлорфенил)-4-окси-3-[(2-фенилэтил)тио]-2Н-пиран-2-он
0,242 г целевого соединения (т.п. 161 - 163oC) получают по методу Б с применением 0,250 г (1,12 ммоль) 6-(4-хлорфенил)-4-окси-2Н- пиран-2-она, 0,390 г (1,35 ммоль) сложного фенэтилового эфира п-толуолтиосульфокислоты, 0,31 мл (2,24 ммоль) триэтиламина и 10,0 мл этанола.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 12,085 (шир.с, 1H), 7,827 (д, 2H, J = 9 Гц), 7,605 (д, 2H, J = 9 Гц), 7,259 - 7,142 (м, 5H), 6,830 (с, 1H), 3,017 (т, 2H, J = 7,5 Гц), 2,785 (т, 2H, J = 7,5 Гц).
Пример 8
4-окси-6-фенил-3-[(фенилметил)]тио]-2Н-пиран-2-он
Целевое соединение получают по методу А с использованием 1,00 г (5,19 ммоль) 1-фенил-1-(триметилсилилокси)этилена и 0,977 г (3,46 ммоль) сложного диэтилового эфира [(фенилметил)тио]-пропандикарбоновой кислоты. Т.п. 155-160oC.
1H-ЯМР (250 МГц, ДМСО-d6): δ = 4,00 (с, 2H), 6,74 (с, 1H), 7,23 (м, 5H), 7,53 (м, 3H), 7,78 (м, 2H).
Пример 9
4-окси-6-фенил-3-[(фенилметил)амино]-2Н-пиран-2-он
Целевое соединение получают по методу Г с использованием 0,500 г (2,08 ммоль) гидрохлорида 3-амино-4-окси-6-фенил-2Н-пиран-2-она, 20 мл 1%-ного раствора уксусной кислоты в диметилформамиде, 0,233 мл (2,29 ммоль) бензальдегида и 0,144 г (2,29 ммоль) цианоборгидрида натрия. Т.п. 205oC (разл. ).
1H-ЯМР (250 МГц, ДМСО-d6): δ = 4,37 (с, 2H), 6,56 (с, 1H), 7,27 (м, 5H), 7,45 (м, 3H), 7,67 (м, 2H).
Пример 10
N-(1,1-диметилэтил)-N'-(4-окси-2-оксо-6-фенил-2Н-пиран-3-ил)- N'-(фенилметил)мочевина
К суспензии 0,153 ммоль моногидрохлорида 4-окси-6-фенил- 3-(фенилметил)-амино-2Н-пиран-2-она в 10 мл этилацетата добавляют 2,0 мл N-метилморфолина и 2,0 мл трет.бутилизоцианата. Реакционную смесь перемешивают в течение 2,5 часов и разбавляют этилацетатом. Органический слой промывают 5%-ной лимонной кислотой и насыщенным раствором хлорида натрия и сушат над безводным сульфатом магния. После упаривания растворителей в вакууме сырой продукт очищают путем колоночной хроматографии на силикагеле с размерами
частиц 230 - 400 меш с применением в качестве элюента дихлорметана, содержащего 5% метанола.
1H-ЯМР (250 МГц, ДМСО-d6): δ = 1,24 (с, 9H), 4,47 (дд, 2H), 5,45 (шир.с, 1H), 7,23 (м, 5H), 7,51 (м, 3H), 7,75 (м, 2H).
Пример 11
4-окси-3-[(2-нафталенилметил)тио]-6-фенил-2H-пиран-2-он
Целевое соединение получают по методу А с применением 0,475 г (2,46 ммоль) 1-фенил-1-(триметилсилилокси)этилена и 0,500 г (1,64 ммоль) сложного диметилового эфира [(2-нафталенилметил)тио]пропандикарбоновой кислоты. Т.п. > 250oC (разл.).
1H-ЯМР (250 МГц, ДМСО-d6): δ = 4,06 (с, 2H), 6,47 (с, 1H), 7,46 (м, 6H), 7,78 (м, 6H).
Пример 12
4-окси-3-[(2-нафталенил)тио]-6-фенил-2H-пиран-2-он
Целевое соединение получают по методу А с применением 1,33 г (6,90 ммоль) 1-фенил-1-(триметилсилилокси)этилена и 2,00 г (6,29 ммоль) сложного диэтилового эфира [(2-нафталенил)тио] пропандикарбоновой кислоты. Т.п. 246oC (разл.).
1H-ЯМР (250 МГц, ДМСО-d6): δ = 6,95 (с 1), 7,38 (м, 3H), 7,56 (м, 4H), 7,85 (м, 5H).
Пример 13
4-окси-3-[(фенилметил)тио]-6-(2,4,6-триметилфенил)- 2H-пиран-2-он
Целевое соединение получают по методу А с применением 1,86 г (11,5 ммоль) 2',4',6'-триметилацетофенона, 2,11г (12,65 ммоль) бис(триметилсилил)амида лития, 1,60 мл (12,65 ммоль) хлортриметилсилана, 127 мл тетрагидрофурана и 2,95 г (10,4 ммоль) сложного диэтилового эфира [(фенилметил)тио]пропандикарбоновой кислоты. Т.п. 134 - 136oC.
1H-ЯМР (250 МГц, ДМСО-d6): δ = 2,11 (с, 6H), 2,26 (с, 3H), 3,98 (с, 2H), 6,03 (с, 1H), 6,96 (с, 2H), 7,25 (м, 5H), 11,85 (шир.с. 1H).
Пример 14
4-окси-6-[4-[2-(4-морфолинил)этокси] фенил] -3- [(фенилметил)тио]-2H-пиран-2-он
Целевое соединение получают по методу А с применением 1,31 г (5,29 ммоль) 4'-[2-(4- морфолинил)этокси]ацетофенона, 0,972 г (5,81 ммоль) бис(триметилсилил)амида лития, 0,738 мл (5,81 ммоль) хлортриметилсилана, 58 мл тетрагидрофурана и 1,35 г (4,80 ммоль) сложного диэтилового эфира [(фенилметил)-тио]пропандикарбоновой кислоты. Т.п. 207oC (разл.).
1H-ЯМР (250 МГц, ДМСО-d6): δ = 2,54 (с, 2H), 6,89 (м, 4H), 2,83 (т, 2H), 3,55 (м, 4H), 3,96 (с, 2H), 4,22 (т, 2H), 6,58 (с, 1H), 7,08 (д, 2H), 7,23 (м, 5H), 7,73 (д, 2H).
Пример 15
4-окси-6-(2-нафталенил)-3-[(фенилметил)тио]- 2H-пиран-2-он
Целевое соединение получают по методу А с применением 1,97 г (11,6 ммоль) 2-ацетилнафталена, 2,13 г (12,76 ммоль) бис(триметилсилил)амида лития, 1,61 мл (12,76 ммоль) хлортриметилсилана, 127 мл тетрагидрофурана и 2,90 г (10,5 ммоль) сложного диэтилового эфира [(фенилметил)тио]пропандикарбоновой кислоты. Т.п. 203oC (разл.).
1H-ЯМР (250 МГц, ДМСО-d6): δ = 4,04 (с, 2H), 6,89 (с, 1H), 7,23 (м, 5H), 7,61 (м, 2H), 7,84 (д, 2H), 8,05 (м, 3H), 8,43 (с, 1H), 11,95 (шир.с, 1H).
Пример 16
4-окси-6-фенил-3-[(фенилтио)метил]-2H-пиран-2-он
Целевое соединение получают по методу В с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 10 мл этанола, 0,175 г (5,80 ммоль) параформальдегида, 1,40 мл (13,8 ммоль) тиофенола, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. 211oC (разл.).
1H-ЯМР (400 МГц, ДМСО-d6): δ = 3,98 (с, 2H), 6,73 (с, 1H), 7,17 (м, 1H), 7,30 (м, 2H), 7,37 (м, 2H), 7,54 (м, 3H), 7,77 (м, 2H), 12,05 (шир.с, 1H).
Пример 17
4-окси-6-(4-оксифенил)-3-[(фенилметил)тио]-2H-пиран-2-он
Целевое соединение получают по методу А с применением 0,722 г (5,31 ммоль) 4'-оксиацетофенона, 1,95 г (11,6 ммоль) бис(триметилсилил)амида лития, 1,48 мл (11,6 ммоль) хлортриметилсилана, 116 мл тетрагидрофурана и 1,00 г (3,54 ммоль) сложного диэтилового эфира [(фенилметил)тио]- пропандикарбоновой кислоты, т.п. 204oC (разл.).
1H-ЯМР (250 МГц, ДМСО-d6): δ = 3,96 (с, 2H), 6,55 (с, 1H), 6,88 (д, 2H), 7,39 (м, 5H), 7,63 (д, 2H), 10,28 (с, 1H), 11,75 (шир.с, 1H).
Пример 18
4-окcи-6-(4-мeтoкcифeнил)-3[(фeнилмeтил)тиo]-2H-пиpaн- 2-oн
Целевое соединение получают по методу А с применением 0,797 г (5,31 ммоль) 4'-метоксиацетофенона, 0,977 г (5,84 ммоль) бис(триметилсилил)амида лития, 0,741 мл (5,84 ммоль) хлортриметилсилана, 58 мл тетрагидрофурана и 1,00 г (3,54 ммоль) сложного диэтилового эфира [(фенилметил)тио]пропандикарбоновой кислоты. Т.п. 187oC (разл.).
1H-ЯМР (400 МГц, ДМСО-d6): δ = 3,83 (с, 3H), 3,98 (с, 2H), 6,62 (с, 1H), 7,06 (м, 2H), 7,22 (м, 5H), 7,73 (м, 2H), 11,76 (шиp.c, 1H).
Пример 19
4-окси-6-(4-метилфенил)-3-[(фенилметил)тио]-2H-пиран-2-он
Целевое соединение получают по методу А с применением 0,712 г (5,31 ммоль) 4'-метилацетофенона, 0,977 г (5,84 ммоль) бис(триметилсилил)амида лития, 0,741 мл (5,84 ммоль) хлортриметилсилана, 58 мл тетрагидрофурана и 1,00 г (3,54 ммоль) сложного диэтилового эфира [(фенилметил)тио]пропандикарбоновой кислоты. Т.п. 205oC (разл.).
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,37 (с, 3H), 3,99 (с, 2H), 6,69 (с, 1H), 7,26 (м, 7H), 7,68 (м, 2H), 11,83 (шир.с, 1H).
Пример 20
3-[бис(фенилметил)амино]-4-окси-6-фенил-2H-пиран-2-он
Целевое соединение получают по методу Г с применением 0,150 г (0,626 ммоль) гидрохлорида 3-амино-4-окси-6-фенил-2H-пиран-2-она, 7 мл 1%-ного раствора уксусной кислоты в диметилформамиде, 0,133 мл (1,33 ммоль) бензальдегида и 0,083 мл (1,31 ммоль) цианоборгидрида натрия. Т.п. 130 - 135oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 4,26 (с, 4H), 6,44 (с, 1H), 7,24 (м, 6H), 7,44 (м, 7H), 7,69 (м, 2H).
Пример 21
4-окси-6-фенил-3- [(2-фенилэтил)тио]-2H-пиран-2-он
Целевое соединение получают по методу 6 с применением 0,500 г (2,65 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 7 мл этанола, 2,65 мл 1 н. гидроокиси натрия и 0,770 г (2,65 ммоль) сложного 2-фенилэтилового эфира п-толуолтиосульфокислоты. Т.п.121 - 124oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,78 (т, 2H), 2,99 (т, 2H), 6,80 (с, 1H), 7,24 (м, 5H), 7,54 (м, 3H), 7,80 (м, 2H).
Пример 22
4-окси-6-фенил-3-[(3-фенилпропил)тио]-2H-пиран-2-он
Целевое соединение получают по методу А с применением 0,922 г (4,83 ммоль) 1-фенил-1-(триметилсилилокси)этилена и 1,00 г (3,22 ммоль) сложного диэтилового эфира [(3-фенилпропил)тио]пропандикарбоновой кислоты, т.п. 114 - 116oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,74 (м, 2H), 2,71 (м, 4H), 6,82 (м, 1H), 7,16 (м, 3H), 7,25 (м, 2H), 7,54 (м, 3H), 7,81 (м, 2H), 11,95 (шир.с, 1H).
Пример 23
4-окси-3-[(2-феноксиэтил)тио]-6-фенил-2H-пиран-2-он
Целевое соединение получают по методу Б с использованием 0,500 г (2,65 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 7 мл этанола, 2,65 мл (2,65 ммоль) 1 н. гидроокиси натрия, 0,816 г (2,65 ммоль) сложного 2-феноксиэтилового эфира п-толуолтиосульфокислоты. Т.п. 146 - 149oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 3,12 (т, 2H), 4,11 (т, 2H), 6,81 (с, 1H), 6,88 (м, 3H), 7,24 (м, 2H), 7,54 (м, 3H), 7,81 (м, 2H), 12,04 (шир.с, 1H).
Пример 24
4-окси-6-(2-метилфенил)-3-[(фенилметил)тио]-2H-пиран-2-он
Целевое соединение получают по методу А с применением 0,712 г (5,31 ммоль) 2'-метилацетофенона, 0,977 г (5,84 ммоль) бис(триметилсилил)амида лития, 0,741 мл (5,84 ммоль) хлортриметилсилана, 58 мл тетрагидрофурана и 1,00 г (3,54 ммоль) сложного диэтилового эфира [(фенилметил)тио]пропандикарбоновой кислоты.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,34 (с, 3H), 4,01 (с, 2H), 6,32 (с, 1H), 7,32 (м, 9H).
Пример 25
4-окси-6-(2-фенилэтил)-3-[(фенилметил)тио]-2H-пиран-2-он
Целевое соединение получают по методу А с применением 0,786 г (5,31 ммоль) 4-фенэтилацетофенона, 0,977 г (5,84 ммоль) бис(триметилсилил)амида лития, 0,741 мл (5,84 ммоль) хлортриметилсилана, 58 мл тетрагидрофурана и 1,00 г (3,54 ммоль) сложного диэтилового эфира [(фенилметил)тио]пропандикарбоновой кислоты. Т.п. 164 - 166oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,75 (т, 3H), 2,85 (т, 2H), 3,92 (с, 2H), 5,92 (с, 1H), 7,23 (м, 9H), 11,69 (шир.с, 1H).
Пример 26
4-окси-6-(3-оксифенил)-3-[(фенилметил)тио]-2H-пиран-2-он
Целевое соединение получают по методу А с применением 0,722 г (5,31 ммоль) 3'-оксиацетофенона, 1,95 г (11,6 ммоль) бис(триметилсилил)амида лития, 1,48 мл (11,6 ммоль) хлортриметилсилана, 116 мл тетрагидрофурана и 1,00 г (3,54 ммоль) сложного диэтилового эфира [(фенилметил)тио]пропандикарбоновой кислоты. Т.п. 185oC (разл.).
1H-ЯМР (400 МГц, ДМСО-d6): δ = 4,00 (с, 2H), 6,66 (с, 1H), 6,92 (м, 1H), 7,21 (м, 7H), 7,32 (м, 1H).
Пример 27
4-окси-6-(4-оксифенил)-3-[(фенилэтил)тио]-2H-пиран-2-он
Целевое соединение получают по методу А с применением 0,688 г (5,06 ммоль) 4'-оксиацетофенона, 1,84 г (11,1 ммоль) бис(триметилсилил)амида лития, 1,41 мл (11,1 ммоль) хлортриметилсилана, 111 мл тетрагидрофурана и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]- пропандикарбоновой кислоты.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,78 (т, 2H), 2,95 (т, 2H), 6,62 (с, 1H), 6,89 (дд, 2H), 7,21 (м, 5H), 7,65 (д, 2H), 10,22 (с, 1H), 11,05 (шир.с, 1H).
Пример 28
(E)-4-окси-6-фенил-3-[3-(фенил-2-пропенил)тио]-2H-пиран-2-он
Целевое соединение получают по методу Б с применением 0,500 г (2,65 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 7 мл этанола, 2,65 мл 1 н. гидроокиси натрия и 0,808 г (2,65 ммоль) сложного 3-фенил-2- пропенилового эфира п-толуолтиосульфокислоты. Т.п. 133 - 136oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 3,57 (д, 2H), 6,24 (дт, 2H), 6,76 (с, 1H), 7,24 (м, 5H), 7,51 (м, 3H), 7,78 (м, 2 H).
Пример 29
4-окси-3-[(2-фенилэтил)тио]-6-[4-(фенилметокси)фенил]- 2H-пиран-2-он
Целевое соединение получают по методу А с применением 1,14 г (5,06 ммоль) 4'-бензилоксиацетофенона, 0,930 г (5,56 ммоль) бис(триметилсилил)амида лития, 0,705 мл (5,56 ммоль) хлортриметилсилана, 57 мл тетрагидрофурана и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 139 - 142oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,77 (т, 2H), 2,98 (т, 2H), 5,19 (с, 2H), 6,68 (с, 1H), 7,26 (м, 7H), 7,43 (м, 5H), 7,76 (д, 2H).
Пример 30
4-окси-6-[4-(2-фенилэтокси)фенил]-3-[(2-фенилэтил)тио]-2H- пиран-2-он
Целевое соединение получают по методу А с применением 1,21 г (5,06 ммоль) 4'-(2-фенилэтокси)ацетофенона, 0,930 г (5,56 ммоль) бис(триметилсилил)амида лития, 0,705 мл (5,56 ммоль) хлортриметилсилана, 57 мл тетрагидрофурана и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 103 - 106oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,76 (т, 2H), 2,97 (т, 2H), 3,06 (т, 2H), 4,27 (т, 2H), 6,67 (с, 1H), 7,21 (м, 12H), 7,73 (д, 2H).
Пример 31
4-окси-3-[(2-фенилэтил)тио]-6-[4-(3-фенилпропокси)фенил]-2H- пиран-2-он
Целевое соединение получают по методу А с применением 1,28 г (5,06 ммоль) 4'-(3- фенилпропокси)ацетофенона, 0,930 г (5,56 ммоль) бис(триметилсилил)амида лития, 0,705 мл (5,56 ммоль) хлортриметилсилана, 57 мл тетрагидрофурана и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)-тио]пропандикарбоновой кислоты. Т.п. 139 - 142oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,04 (м, 2H), 2,84 (м, 4H), 2,98 (т, 2H), 4,40 (т, 2H), 6,68 (с, 1H), 7,18 (м, 12H), 7,75 (д, 2H), 11,86 (шир.с, 1H).
Пример 32
4-окси-6-(2-оксифенил)-3-[(фенилметил)тио]-2H-пиран-2-он
Целевое соединение получают по методу А с применением 0,722 г (5,31 ммоль) 2'-оксиацетофенона, 1,95 г (11,6 ммоль) бис(триметилсилил)амида лития, 1,48 мл (11,6 ммоль) хлортриметилсилана, 116 мл тетрагидрофурана и 1,00 г (3,54 ммоль) сложного диэтилового эфира [(фенилметил)тио]- пропандикарбоновой кислоты. Т.п. 189oC (разл.).
1H-ЯМР (400 МГц ДМСО-d6): δ = 4,01 (с, 2H), 6,97 (с, 1H), 7,25 (м, 7H), 7,71 (д, 1H), 10,75 (с, 1H), 11,85 (шир.с, 1H).
Пример 33
4-окси-6-[3-(2-фенилэтокси)фенил]-3-[(2-фенилэтил)тио]- 2H-пиран-2-он
Целевое соединение получают по методу А с применением 0,336 г (1,40 ммоль) 3'-(2-фенилэтокси)ацетофенона, 0,257 г (1,54 ммоль) бис(триметилсилил)амида лития, 0,195 мл (1,54 ммоль) хлортриметилсилана, 15 мл тетрагидрофурана и 0,417 г (1,40 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 104 - 106oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,75 (т, 2H), 2,97 (т, 2H), 3,04 (т, 2H), 4,25 (т, 2H), 6,79 (с, 1H), 7,25 (м, 14H), 11,95 (шир.с, 1H).
Пример 34
(+/-)-4-окси-6-фенил-3-[фенил(фенилтио)метил]-2H-пиран-2-он
Целевое соединение получают по методу Д с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 10 мл этанола, 0,593 мл (5,84 ммоль) бензальдегида, 1,40 мл (13,8 ммоль) тиофенола, 0,5 мл пиперидина и 0,5 мл уксусной кислоты, т.п. > 220oC (разл.).
1H-ЯМР (400 МГц, ДМСО-d6): δ = 5,80 (с, 1H), 6,70 (с, 1H), 7,23 (м, 8H), 7,54 (м, 4H), 7,74 (м, 2H).
Пример 35
4-окси-3-[[2-(2-метоксифенил)этил]тио]-6-фенил-2H-пиран-2-он
Целевое соединение получают по методу Б с применением 0,500 г (2,65 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 7 мл этанола, 2,65 мл 1 н. гидроокиси натрия, 0,856 г (2,65 ммоль) сложного 2-(2- метоксифенил)этилового эфира п-толуолтиосульфокислоты. Т.п. 114 - 115oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,74 (т, 2H), 2,94 (т, 2H), 3,73 (с, 1H), 6,85 (м, 3H), 7,15 (м, 2H), 7,54 (м, 3H), 7,82 (м, 2H).
Пример 36
4-окси-6-фенил-3-[(4-фенилбутил)тио]-2H-пиран-2-он
Целевое соединение получают по методу Б с применением 0,500 г (2,65 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 7 мл этанола, 2,65 мл 1 н. гидроокиси натрия, 0,851 г (2,65 ммоль) сложного 4-фенилбутилового эфира п-толуолтиосульфокислоты. Т.п. 103 - 105oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,47 (м, 2H), 1,66 (м, 2H), 2,54 (т, 2H), 2,77 (т, 2H), 6,80 (с, 1H), 7,17 (м, 5H), 7,53 (м, 3H), 7,81 (м, 2H).
Пример 37
4-окси-3-[[2-(3-метоксифенил)этил]тио]-6-фенил-2H-пиран-2-он
Целевое соединение получают по методу Б с применением 0,500 г (2,65 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 7 мл этанола, 2,65 мл 1 н. гидроокиси натрия, 0,856 г (2,65 ммоль) сложного 2-(3- метоксифенил)этилового эфира п-толуолтиосульфокислоты. Т.п. 112 - 113oC.
1H-ЯМP (400 МГц, ДМСО-d6): δ = 2,75 (т, 2H), 3,01 (т, 2H), 3,34 (с, 3H), 6,75 (с, 1H), 7,16 (т, 1H), 7,54 (м, 3H), 7,80 (м, 2H).
Пример 38
4-окси-3-[[2-(4-метоксифенил)этил]тио]-6-фенил-2H-пиран- 2-он
Целевое соединение получают по методу Б с применением 0,500 г (2,65 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 7 мл этанола, 2,65 мл 1 н. гидроокиси натрия, 0,856 г (2,65 ммоль) сложного 2-(4- метоксифенил)этилового эфира п-толуолтиосульфокислоты. Т.п. 144 - 145oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,71 (т, 2H), 2,96 (т, 2H), 3,66 (с, 3H), 6,77 (с, 1H), 6,80 (д, 2H), 7,12 (д, 2H), 7,54 (м, 3H), 7,80 (м, 2H).
Пример 39
3-[[2-(3-хлорфенил)этил]тио]-4-окси-6-фенил-2H-пиран-2-он
Целевое соединение получают по методу Б с применением 0,500 г (2,65 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 7 мл этанола, 2,65 мл 1 н. гидроокиси натрия, 0,868 г (2,65 ммоль) сложного 2-(2- хлорфенил)этилового эфира п-толуолтиосульфокислоты. Т.п. 133 - 134oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,79 (т, 2H), 3,02 (т, 2H), 6,77 (с, 1H), 7,25 (м, 4H), 7,55 (м, 3H), 7,81 (м, 2H).
Пример 40
4-окси-6-фенил-3-(2-фенилэтил)-2H-пиран-2-он
Целевое соединение получают по методу Е с применением никеля Ренея (марки Grace 3100), 20 мл этанола, 0,425 г (1,06 ммоль) 4-окси-6-фенил-3-[2-фенил-1-(фенилтио)этил]-2H-пиран-2-она. Т.п. > 255oC (разл.).
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,65 (дд, 2H), 2,71 (дд, 2 H), 6,68 (с, 1H), 7,23 (м, 3H), 7,52 (м, 3H), 7,76 (м, 2H), 11,85 (шир.с, 1H).
Пример 41
4-окси-6-фенил-3-(3-фенилпропил)-2H-пиран-2-он
Целевое соединение получают по методу Е с применением никеля Ренея (марки Grace 3100), 15 мл этанола, 0,150 г (0,362 ммоль) 4-окси-6-фенил-3-[3-фенил-1-(фенилтио)пропил]-2H-пиран-2-она. Т.п. 195 - 196oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,73 (м, 2H), 2,40 (т, 2H), 2,60 (т, 2H), 6,68 (с, 1H), 7,23 (м, 5H), 7,52 (м, 3H), 7,74 (м, 2H).
Пример 42
6-(2,6-диметилфенил)-4-окси-3-[(фенилметил)тио]-2H-пиран-2-он
Целевое соединение получают по методу А с применением 0,785 г (5,31 ммоль) 2',6'-диметилацетофенона, 0,977 г (5,84 ммоль) бис(триметилсилил)амида лития, 0,741 мл (5,84 ммоль) хлортриметилсилана, 58 мл тетрагидрофурана и 1,00 г (3,54 ммоль) сложного диэтилового эфира [(фенилметил)тио]пропандикарбоновой кислоты. Т.п. 140 - 143oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,15 (с, 6H), 3,99 (с, 2H), 6,12 (с, 1H), 7,22 (м, 8H).
Пример 43
4-oкcи-6-[2-oкcи-3-мeтил-4-(фeнилмeтoкcи)фeнил] -3- [(2-фeнилэтил)тиo]-2H-пиран-2-он
Целевое соединение получают по методу А с применением 1,29 г (5,06 ммоль) 4'-(бензилокси-2'-окси-3'-метилацетофенона, 2,11 г (12,6 ммоль) бис(триметилсилил)амида лития, 1,60 мл (12,6 ммоль) хлортриметилсилана, 127 мл тетрагидрофурана и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 147 - 148oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,14 (с, 3H), 2,77 (т, 2H), 2,98 (т, 2H), 5,17 (с, 2H), 5,29 (с, 1H). 6,79 (д, 1H), 7,30 (м, 13H), 9,36 (с, 1H), 11,85 (шир.с, 1H).
Пример 44
4-окси-3-[(2-фенилэтил)тио]-6-[3-(фенилметокси)фенил]- 2H-пиран-2-он
Целевое соединение получают по методу А с применением 1,14 г (5,06 ммоль) 3'-бензилоксиацетофенона, 0,930 г (5,56 ммоль) бис(триметилсилил)амида лития, 0,705 мл (5,56 ммоль) хлортриметилсилана, 57 мл тетрагидрофурана и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 126 - 127oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,78 (т, 2H), 3,01 (т, 2H), 5,20 (с, 2H), 6,81 (с, 1H), 7,22 (м, 6H), 7,41 (м, 7H).
Пример 45
4-окси-6-[4-(2-нафталенилметокси)фенил] -3-[(2-фенилэтил)тио] - 2H-пиран-2-он
Целевое соединение получают по методу А с применением 1,39 г (5,06 ммоль) 4'-(2-нафталенилметокси)ацетофенона, 0,930 г (5,56 ммоль) бис(триметилсилил)амида лития, 0,705 мл (5,56 ммоль) хлортриметилсилана, 57 мл тетрагидрофурана и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 152 - 154oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,77 (т, 2H), 2,98 (т, 2H), 5,38 (с, 2H), 6,68 (с, 1H), 7,21 (м, 7H), 7,54 (м, 2H), 7,60 (д, 1H), 7,96 (м, 4H).
Пример 46
6-(3-хлор-4-метоксифенил)-4-окси-3-[(фенилметил)тио]-2H- пиран-2-он
Целевое соединение получают по методу А с применением 0,979 г (5,31 ммоль) 3'-хлор-4'-метоксиацетофенона, 0,977 г (5,84 ммоль) бис(триметилсилил)амида лития, 0,741 мл (5,84 ммоль) хлортриметилсилана, 58 мл тетрагидрофурана и 1,00 г (3,54 ммоль) сложного диэтилового эфира [(фенилметил)тио]пропандикарбоновой кислоты. Т.п. 171oC (разл.).
1H-ЯМР (400 МГц, ДМСО-d6): δ = 3,93 (с, 3H), 3,99 (с, 2H), 6,68 (с, 1H), 7,32 (м, 6H), 7,77 (д, 1H), 7,83 (д, 1H).
Пример 47
4-окси-6-фенил-3-[(фенилметил)сульфонил]-2H-пиран-2-он
Целевое соединение получают в результате окисления 310 мг (1 ммоль) 4-окси-6-фенил-3-[(фенилметил)тио]-2H-пиран-2-она, 1,99 г (3 ммоль) оксона при комнатной температуре в 10 мл метанола и 10 мл воды. После перемешивания при комнатной температуре в течение 4 часов реакционную смесь разбавляют водой и экстрагируют 50 мл дихлорметана. Органический слой сушат над безводным сульфатом магния. Растворители упаривают и остаток очищают путем тонкослойной хроматографии с получением твердого продукта. Выход: 90%. Т.п. 152 - 153oC.
1H-ЯМР (400 МГц, CDCl3): δ = 11,34 (с, 1H), 7,8 (м, 2H), 7,5 (м, 3H), 7,37 (м, 3H), 7,27 (м, 2 H), 6,37 (с, 1H), 6,23 (с, 1H), 4,75 (с, 1H), 4,34 (кв, 2H); ИК (KBr) 3421, 3059, 1726, 1698, 1628, 1559, 1497, 1230, 957, 770, 689 см-1; MC (УИ) m/e 343 (6,8), 327 (15,54), 278 (15,99), 219 (40,99), 91 (100).
Пример 48
4-окси-6-(3-метилфенил)-3-[(фенилметил)тио]-2H-пиран-2-он
Целевое соединение получают в результате конденсации 1 г (3,54 ммоль) сложного диэтилового эфира [(фенилметил)тио]-пропандикарбоновой кислоты с 1,46 г (7,09 ммоль) соответствующего триметилсилил-энолового эфира 3'-метилацетофенона описанным в методе А образом. Выход: 65%. Т.п. 137 - 138oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 11,9 (шир.с, 1H), 7,6 (м, 2H), 7,39 (т, 1H), 7,35 (д, 1H). 7,25 (д, 4H), 7,2 (м, 1H), 6,7 (с, 1H), 4,0 (с, 2H), 2,38 (с, 3H); ИК (KBr) 3030, 2585, 1617, 1536, 1402, 1100, 787, 696 см-1; MC (УИ) m/e 325 (65), 291 (2), 233 (4), 119 (9), 91 (100).
Пример 49
Сложный эфир 2-оксо-6-фенил-3-[(фенилметил)тио] -2H- пиран-4-ил-пропановой кислоты
Целевое соединение получают в результате обработки 310 мг (1 ммоль) натриевой соли 4-окси-6-фенил-3-[(фенилметил)тио]-2H-пиран- 2-она, 222 мг (2,4 ммоль) пропионилхлорида описанным в методе Ж образом. Выход: 72%.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 7,77 (м, 2H), 7,51 (м, 3H), 7,22 (м, 4H), 7,17 (м, 1H), 6,7 (с, 1H), 3,98 (с, 2H), 2,19 (кв, 2H), 0,96 (т, 3H): ИК (KBr) 3438, 3027, 2923, 1772, 1731, 1617, 1528, 1494, 1453, 1323, 1153, 1087, 1045, 979, 873, 767, 702 см-1; MC (УИ) m/e 366 (4), 311 (79), 189 (26), 105 (20), 91 (100).
Пример 50
4-окси-6-[3-метил-4-(фенилметилокси)фенил] -3-[(2- фенилэтил)тио] -2H-пиран-2-он
Осуществляют конденсацию 1,06 г (3,6 ммоль) сложного диэтилового эфира [(фенилэтил)тио] пропандикарбоновой кислоты с 2,24 г (7,2 ммоль) простого триметилсилил-энолового эфира 3'-метокси-4'-бензилоксиацетофенона описанным в методе А образом. Выход: 78%. Т.п. 147 - 148oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 7,63 (м, 2H), 7,11 - 7,53 (м, 11H), 6,68 (с, 1H), 5,22 (с, 1H), 2,98 (т, 2H), 2,77 (т, 2H), 2,27 (с, 3H); ИК (KBr) 3432, 3030, 2922, 1717, 1626, 1503, 1408, 1262, 1140, 1024, 696 см-1; MC (УИ) m/e 445 (2,12), 3553,34, 309 (3,81), 189 (8,33), 156 (14,78), 137 (16,19), 105 (94,34), 91 (100);
рассчит.: C 72,95: H 5,44;
найд.: C 72,25; H 5,43.
Пример 51
4-окси-6-(4-окси-2-метилфенил)-3-[(2-фенилэтил)тио]-2H-пиран- 2-он
Целевое соединение получают в результате конденсации 1 г (3,38 ммоль) сложного диэтилового эфира [(фенилэтил)тио]пропандикарбоновой кислоты с 2,94 г (10 ммоль) соответствующего простого триметилсилил-энолового эфира 4'-окси-2'-метилацетофенона описанным в методе А образом. Выход: 52%. Т.п. 85 - 87oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 11,89 (шир.с, 1H), 9,97 (с, 1H), 7,35 (д. 1H), 7,23 (м, 5H), 6,72 (с, 2H), 6,33 (с, 1H), 3,0 (т, 2H), 2,78 (т, 2H), 2,34 (с, 3H); ИК (KBr) 3300, 2926, 1672, 1604, 1541, 1244, 1194, 1120, 698 см-1; MC (УИ) m/e 355 (36), 250 (27), 105 (93), 91 (30), 85 (100);
рассчит.: C 67,78; H 5,12;
найд.: C 67,53; H 5,40.
Пример 52
4-окси-6-(4-метокси-3-метилфенил)-3-[(фенилметил)тио]- 2H-пиран-2-он
Целевое соединение получают в результате конденсации 1 г сложного диэтилового эфира [(фенилметил)тио]пропандикарбоновой кислоты с соответствующим простым триметилсилил-эноловым эфиром 4'-метокси-3'-метилацетофенона описанным в методе А образом. Выход: 68%. Т.п. 159 - 160oC.
1H-ЯМР (400 МГц, CDCl3): δ = 7,67 (дд, 1H), 7,61 (с, 1H), 7,2 (м, 5H), 6,8 (д, 1H), 6,38 (с, 1H), 3,96 (с, 2H), 3,89 (с, 3H), 2,25 (с, 3H); ИК (KBr) 3432, 2945, 1613, 1507, 1402, 1262, 1142, 1030, 812, 704 см-1; MC (УИ) m/e 355 (78,3), 263 (19,6), 235 (11,8), 149 (12,7), 91(100);
рассчит.: C 67,78; H 5,12;
найд.: C 67,35: H 5,17.
Пример 53
Сложный эфир 2-оксо-6-фенил-3-[(фенилметил)тио]-2H-пиран- 4-ил-уксусной кислоты
Целевое соединение получают в результате обработки 310 мг (1,00 ммоль) натриевой соли 4-окси-6-фенил-3-[(фенилметил)тио] - 2H-пиран-2-она, 188 мг (2,4 ммоль) ацетилхлорида описанным в методе Ж образом. Выход: 72%.
1H-ЯМР (400 МГц, ДМСО-d6): δ 7,81 (м, 2H), 7,53 (м, 3H), 7,22 (м, 4H), 7,16 (м, 1H), 3,99 (с, 2H), 1,92 (с, 3H).
Пример 54
Сложный эфир 2-оксо-6-фенил-2H-пиран-4-ил-1-нафталенкарбоновой кислоты
Соединение получают по методу Ж с применением 0,250 г (1,32 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 15 мл тетрагидрофурана, 0,585 г (1,46 ммоль) 60%-ного раствора гидрида натрия и 0,278 г (1,46 ммоль) 1-нафтоил-хлорида. Т.п. 123,5 - 125oC.
1H-ЯМР (250 МГц, ДМСО-d6): δ = 6,54 (с, 1H), 7,49 (с, 1H), 7,65 (м, 6H), 7,95 (м, 2H), 8,13 (д, 1H), 8,34 (д, 1H), 8,50 (д, 1H).
Пример 55
3,3'-тиобис[4-окси-6-фенил-2H-пиран-2-он]
Целевое соединение получают по следующему методу: 0,250 г (1,33 ммоль) 4-окси-6-фенил-2H-пиран-2-она постепенно добавляют к 0,585 мл тионилхлорида. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Hепрореагировавший тионилхлорид удаляют в вакууме и остаток перекристаллизуют из кипящего метанола. Т.п. > 240oC.
1H-ЯМР (250 МГц, d-ТГф): δ = 7,03 (с, 2H), 7,56 (м, 6H), 7,89 (м, 4H).
Пример 56
3,3'-дитиобис[4-окси-6-фенил-2H-пиран-2-он]
0,105 мл (1,32 ммоль) полухлористой серы растворяют в 1 мл бензола. Раствор прикапывают к суспензии 0,500 г (2,65 ммоль) 4-окси-6-фенил-2H-пиран-2-она в 7 мл бензола при одновременном нагреве с обратным холодильником в течение 1,5 часов. Реакционную смесь смешивают с несколькими каплями воды и темный продукт собирают путем фильтрации. Твердое вещество перекристаллизуют из кипящей уксусной кислоты. Т.п. > 280oC (разл.).
1H-ЯМР (250 МГц, ДМСО-d6): δ = 6,77 (с, 2H), 7,52 (м, 6H), 7,81 (м, 4H).
Пример 57
3-бензоил-4-окси-6-фенил-2H-пиран-2-он
К раствору 150 г (0,88 ммоль) этилбензоилацетата в 150 мл 1,2-дихлорбензола добавляют небольшое количество бикарбоната натрия. Реакционную смесь нагревают с обратным холодильником. Собирают приблизительно 20 мл этанольного дистиллята. Реакционную смесь охлаждают до 0oC, после чего добавляют 100 мл диэтилового эфира для побуждения кристаллизации. Реакционную смесь хранят в холодильнике в течение ночи. Образовавшийся твердый продукт собирают и промывают диэтиловым эфиром. Т.п. 171 - 173oC.
1H-ЯМР (250 МГц, ДМСО-d6): δ = 6,91 (с, 1H), 7,59 (м, 6H), 7,87 (м, 4H).
Пример 58
N-(4-окси-2-оксо-6-фенил-2H-пиран-3-ил)бензолацетамид
Целевое соединение получают по методу Д с применением 0,150 г (0,626 ммоль) гидрохлорида 3-амино-4-окси-6-фенил-2H-пиран-2-она, 6 мл хлористого метилена, 0,348 мл (2,50 ммоль) триэтиламина, каталитического количества 4-диметиламинопиридина и 0,106 г (0,626 ммоль) фенацетилхлорида. Т.п. 213oC (разл.).
1H-ЯМР (250 МГц, ДМСО-d6): δ = 3,69 (с, 2H), 6,85 (с, 1H), 7,29 (м, 4H), 7,53 (м, 3H), 7,83 (м, 2H), 9,40 (шир.с, 1H).
Пример 59
Сложный эфир 2-оксо-6-фенил-2H-пиран-4-ил-2- нафталенкарбоновой кислоты
Целевое соединение получают по методу Ж с применением 0,200 г (0,835 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 8 мл хлористого метилена, 0,348 мл (2,50 ммоль) триэтиламина, каталитического количества 4-диметиламинопиридина и 0,175 г (0,918 ммоль) 2-нафтоилхлорида. Т.п. 143,5 - 144oC (разл.).
1H-ЯМР (250 МГц, ДМСО-d6): δ = 6,51 (с, 1H), 7,51 (м, 3H), 7,72 (м, 3H), 8,80 (м, 7H), 8,89 (шир.с, 1H).
Пример 60
3-[бис(2-нафталенилметил)амино]-4-окси-6-фенил-2H-пиран-2-он
Целевое соединение получают по методу Г с применением 0,250 г (1,04 ммоль) гидрохлорида 3-амино-4-окси-6-фенил-2H-пиран-2-она, 10 мл 1%-ного раствора уксусной кислоты в диметилформамиде, 0,407 г (2,60 ммоль) 2-нафтальдегида и 0,164 г (2,60 ммоль) цианоборгидрида натрия. Т.п. 209oC (разл.).
1H-ЯМР (250 МГц, ДМСО-d6): δ = 4,46 (с, 4H), 6,38 (с, 1H), 7,44 (м, 8H), 7,77 (м, 13H).
Пример 61
N-(4-oкcи-2-oкco-6-фeнил-2H-пиpaн-3-ил)-2-нaфтaлeнaцeтaмид
Целевое соединение получают по методу Д с применением 0,200 г (0,835 ммоль) гидрохлорида 3-амино-4-окси-6-фенил-2H-пиран-2- она, 9 мл тетрагидрофурана, 0,037 мл (0,918 ммоль) 60%-ного раствора гидрида натрия, 0,080 мл (0,918 ммоль) оксалилхлорида и 0,170 г (0,918 ммоль) 2-нафталилуксусной кислоты. Т.п. 227oC (разл.).
1H-ЯМР (250 МГц, ДМСО-d6): δ = 4,17 (с, 2H), 6,84 (с, 1H), 7,50 (м, 6H), 7,83 (м, 4H), 7,93 (д, 1H), 8,17 (д, 1H), 9,58 (с, 1H).
Пример 62
N-(4-окси-2-оксо-6-фенил-2H-пиран-3-ил)-2-нафталенкарбоксамид
Целевое соединение получают по методу Д с применением 0,150 г (0,626 ммоль) гидрохлорида 3-амино-4-окси-6-фенил- 2H-пиран-2-она, 6 мл тетрагидрофурана, 0,028 мл (0,688 ммоль) 60%-ного раствора гидрида натрия и 0,131 г (0,688 ммоль) 2-нафтоил-хлорида. Т.п. 219oC (разл.).
1H-ЯМР (250 МГц, ДМСО-d6): δ = 6,92 (с, 1H), 7,61 (м, 5H), 7,97 (м, 6H), 8,62 (с, 1H), 9,61 (с, 1H).
Пример 63
N-(4-окси-2-oкco-6-фeнил-2H-пиpaн-3-ил)бeнзoл-пpoпaнaмид
Целевое соединение получают по методу Д с применением 0,150 г (0,626 ммоль) гидрохлорида 3-амино-4-окси-6-фенил-2H-пиран-2-она, 6 мл тетрагидрофурана, 0,028 мл (0,688 ммоль) 60%-ного раствора гидрида натрия и 0,131 г (0,688 ммоль) гидроциннамилхлорида. Т.п. 191 - 193oC.
1H-ЯМР (250 МГц, ДМСО-d6): δ = 2,65 (т, 2H), 2,89 (т, 2H), 6,86 (с, 1H), 7,26 (м, 5H), 7,53 (м, 3H), 7,84 (м, 2H), 9,28 (с, 1H).
Пример 64
6-(1,3-бензодиоксол-5-ил)-4-окси-3-[(фенилметил)тио]-2H- пиран-2-он
Целевое соединение получают по методу А с применением 0,871 г (5,31 ммоль) 3',4'-(метилендиокси)ацетофенона, 0,977 г (5,84 ммоль) бис(триметилсилил)-амида лития, 0,741 мл (5,84 ммоль) хлортриметилсилана, 58 мл тетрагидрофурана и 1,00 г (3,54 ммоль) сложного диэтилового эфира [(фенилметил)тио]-пропандикарбоновой кислоты. Т.п. 170oC (разл.).
1H-ЯМР (400 МГц, ДМСО-d6): δ = 3,98 (с, 2H), 6,13 (с, 2H), 6,61 (с, 1H), 7,05 (д, 2H), 7,27 (м, 7H).
Пример 65
6-[4-(бензоилокси)фенил]-4-окси-3-[(фенилметил)тио]- 2H-пиран-2-он
Целевое соединение получают по методу А с применением 1,27 г (5,31 ммоль) 4'-бензоилоксиацетофенона, 0,977 г (5,84 ммоль) бис(триметилсилил)амида лития, 0,741 мл (5,84 ммоль) хлортриметилсилана, 58 мл тетрагидрофурана и 1,00 г (3,54 ммоль) сложного диэтилового эфира [(фенилметил)тио]пропандикарбоновой кислоты. Т.п. 205oC (разл.).
1H-ЯМР (400 МГц, ДМСО-d6): δ = 4,01 (с, 2H), 6,75 (с, 1H), 7,21 (м, 1H), 7,25 (д, 4H), 7,47 (д, 2H), 7,63 (т, 2H), 7,77 (т, 1H), 7,90 (д, 2H), 8,16 (д, 2H).
Пример 66
3-[циклогексил(фенилтио)метил]-4-окси-6-фенил-2H-пиран- 2-он
Целевое соединение получают по методу В с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 10 мл этанола, 0,707 мл (5,84 ммоль) циклогексан-карбоксальдегида, 1,40 мл (13,8 ммоль) тиофенола, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. 87 - 90oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,46 (м, 5H), 1,61 (м, 4H), 2,15 (м, 1H), 2,31 (д, 1H), 4,26 (д, 1H), 6,65 (с, 1H), 7,16 (т, 1H), 7,27 (т, 2H), 7,37 (д, 2H), 7,52 (м, 3H), 7,74 (м, 2H), 11,80 (шир.с, 1H).
Пример 67
4-окси-3-[(2-фенилэтил)тио]-6-[4-(фенилтио)-фенил]-2H- пиран-2-он
Целевое соединение получают по методу А с применением 1,15 г (5,06 ммоль) 4'-(фенилтио)ацетофенона, 0,930 г (5,56 ммоль) бис(триметилсилил)амида лития, 0,705 мл (5,56 ммоль) хлортриметилсилана, 56 мл тетрагидрофурана и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 120 - 121oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,76 (т, 2H), 2,98 (т, 2H), 6,72 (с, 1H), 7,24 (м, 7H), 7,45 (м, 5H), 7,74 (д, 2H).
Пример 68
4-окси-6-[4-[(2-метоксифенил)метокси] фенил] -3-[(2-фенилэтил)тио]- 2H-пиран-2-он)
Целевое соединение получают по методу А с применением 1,29 г (5,06 ммоль) 4'-[(2-метоксифенил)метокси] фенилацетофенона, 0,930 г (5,56 ммоль) бис(триметилсилил)амида лития, 0,705 мл (5,56 ммоль) хлортриметилсилана, 56 мл тетрагидрофурана и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]пропандикарбоновой кислоты. Т.П. 138 - 139oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,77 (т, 2H), 2,98 (т, 2H), 3,83 (с, 3H), 5,14 (с, 2H), 6,68 (с, 1H), 6,97 (т, 1H), 7,08 (д, 1H), 7,20 (м, 7H), 7,53 (т, 1H), 7,40 (д, 1H), 7,76 (д, 2H), 11,85 (шир.с, 1H).
Пример 69
4-окси-6-[4-[(2-метоксифенил)метокси] -3-метилфенил] - 3-[(2-фенилэтил)тио]-2H-пиран-2-он
Целевое соединение получают по методу А с применением 1,36 г (5,06 ммоль) 4'-[(2- метоксифенил)метокси] -3'-метилацетофенона, 0,930 г (5,56 ммоль) бис-(триметилсилил)амида лития, 0,705 мл (5,56 ммоль) хлортриметилсилана, 56 мл тетрагидрофурана и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 170oC (разл.).
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,25 (с, 3H), 2.77 (т, 2H), 2,97 (тт, 2H), 3,84 (с, 3H), 5,17 (с, 2H), 6,67 (с, 1H), 6,98 (т, 1H), 7,70 (д, 1H), 7,27 (м, (6H), 7,41 (т, 1H), 7,43 (д, 1H), 7,65 (м, 2H), 11,81 (шир.с, 1H).
Пример 70
6-(3,5-диметилфенил)-4-окси-3-[(фенилметил)тио]-2H- пиран-2-он
Целевое соединение получают по методу А с применением 0,785 г (5,31 ммоль) 3',5'-диметилацетофенона, 0,977 г (5,84 ммоль) бис(триметилсилил)амида лития, 0,741 мл (5,84 ммоль) хлортриметилсилана, 58 мл тетрагидрофурана и 1,00 г (3,54 ммоль) сложного диэтилового эфира [(фенилметил)тио]пропандикарбоновой кислоты. Т.п. 170oC (разл.).
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,33 (с, 6H), 3,99 (с, 2H), 6,67 (с, 1H), 7,21 (м, 6H), 7,39 (с, 2H).
Пример 71
4-окси-6-(4-феноксифенил)-3-[(2-фенилэтил)тио]-2H-пиран- 2-он
Целевое соединение получают по методу А с применением 1,07 г (5,06 ммоль) 4'-феноксиацетофенона, 0,930 г (5,56 ммоль) бис(триметилсилил)амида лития, 0,705 мл (5,56 ммоль) хлортриметилсилана, 56 мл тетрагидрофурана и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 127 - 128oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,77 (т, 2 H), 2,99 (т, 2H), 6,72 (с, 1H), 7,18 (м, 10H), 7,46 (т, 2H), 7,82 (д, 2H).
Пример 72
4-окси-6-фенил-3-[[[4-(фенилметокси]фенил]метил]тио]-2H-пиран- 2-он
Целевое соединение получают по методу Б с применением 0,500 г (2,65 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 7 мл этанола, 2,65 мл 1 н. гидроокиси натрия и 1,01 г (2,65 ммоль) сложного [4-(фенилметокси)фенил]метилового эфира п-толуолтиосульфокислоты. Т.п. 185 - 186oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 3,94 (с, 2H), 5,03 (с, 2H), 6,72 (с, 1H), 6,89 (д, 2H), 7,18 (д, 2H), 7,34 (м, 5H), 7,46 (м, 3H), 7,80 (м, 3H).
Пример 73
4-окси-3-[(2-фенилэтил)тио] -6-[4-(2-пиридинилметокси)фенил]-2H- пиран-2-он
Целевое соединение получают по методу А с применением 1,14 г (5,06 ммоль) 4'-(2-пиридинилметокси]ацетофенона, 0,930 г (5,56 ммоль) бис(триметилсилил)амида лития, 0,705 мл (5,56 ммоль) хлортриметилсилана, 56 мл тетрагидрофурана и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2- фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 179oC (разл.).
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,77 (т, 2H), 2,98 (т, 2H), 5,27 (с, 2H), 6,68 (с, 1H), 7,22 (м, 7H), 7,36 (м, 1H), 7,53 (д, 1H), 7,77 (д, 2H), 7,85 (т, 1H), 8,60 (д, 2H), 11,88 (шир.с. 1H).
Пример 74
Сложный этиловый эфир 4-[4-окси-2-оксо-3-[(2-фенилэтил)тио]-2H- пиран-6-ил]фенокси-уксусной кислоты
К 3 мл раствора 0,500 г (1,47 ммоль) 4-окси-6-(4-оксифенил)-3- [(2-фенил-этил)тио]-2H-пиран-2-она в метаноле добавляют 0,955 г (2,94 ммоль) карбоната цезия. Реакционную смесь перемешивают в течение 3 часов и сгущают в вакууме. К смеси добавляют 15 мл диметилформамида и остаток сгущают в вакууме досуха. Затем твердый продукт разбавляют 3 мл диметилформамида и 0,491 мл (2,94 ммоль) бромэтилацетата. Суспензию перемешивают в течение 3 часов. Реакционную смесь разбавляют 100 мл этилацетата. Органический слой последовательно промывают 1 н. соляной кислотой, водой и насыщенным раствором хлористого натрия, после чего сушат над безводным сульфатом магния. Растворители упаривают в вакууме. Сырой продукт очищают путем колоночной флеш-хроматографии на силикагеле с размерами частиц 230 - 400 меш с применением в качестве элюента сначала 15%-ного этилацетата в гексанах и 50%-ного этилацетата в гексанах, и затем смеси этилацетата, гексанов и хлористого метилена в соотношении до 30 : 30 : 40. Т.п. 169 - 171oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,20 (т, 3H), 2,75 (т, 2H), 2,96 (т, 2H), 4,16 (кв, 2H), 4,87 (с, 2H), 6,69 (с, 1H), 7,06 (д, 2H), 7,19 (м, 5H), 7,73 (д, 2H), 11,85 (шир.с, 1H).
Пример 75
4-oкcи-3-[2-нaфтaлeнил(фeнилтиo)мeтил]-6-фeнил-2H-пиpaн-2-oн
Целевое соединение получают по методу В с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 10 мл этанола, 0,912 г (5,84 ммоль) 2-нафтальдегида, 1,40 мл (13,8 ммоль) тиофенола, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. 98 - 101oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 5,96 (с, 1H), 6,73 (с, 1H), 7,18 (т, 1H), 7,36 (м, 4H), 7,52 (м, 5H), 7,88 (м, 3H), 8,07 (с, 1H).
Пример 76
4-окси-3-[(2-нафталенилтио)фенилметил]-6-фенил-2H-пиран-2-он
Целевое соединение получают по методу В с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 10 мл этанола, 0,593 мл (5,84 ммоль) бензальдегида, 2,21 мл (13,8 ммоль) 2-нафталентиола, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. 200oC (разл.).
1H-ЯМР (400 МГц, ДМСО-d6): δ = 5,9 (с, 1H), 6,71 (с, 1H), 7,20 (м, 5H), 7,44 (м, 7H), 7,75 (м, 3H), 7,82 (м, 2H).
Пример 77
4-[4-окси-2-оксо-3-[(2-фенилэтил)тио] -2H-пиран-6-ил] - феноксиуксусной кислоты
К 10 мл раствора (0,939 ммоль) сложного этилового эфира 4-[4-окси-2-оксо-3-[(2-фенилэтил)тио] -2H-пиран-6-ил] феноксиуксусной кислоты в тетрагидрофуране добавляют 2,34 ммоль 1н. гидроокиси натрия. Реакционную смесь перемешивают в течение 5 часов, после чего смешивают с 10 мл воды и подкисляют конц. хлористоводородной кислотой до достижения значения pH 2. Водный слой дважды экстрагируют этилацетатом, взятым в количестве по 100 мл. Объединенные органические экстракты промывают насыщенным раствором хлористого натрия и сушат над безводным сульфатом магния. Растворители упаривают в вакууме. Сырой продукт очищают колоночной хроматографией на силикагеле с размерами частиц 230 - 400 меш с применением в качестве элюента смеси хлористого метилена, метанола и уксусной кислоты в соотношении 94 : 5 : 1. Т.п. 182 - 183oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,76 (т, 2H), 2,97 (т, 2H), 4,78 (с, 2H), 6,67 (с, 1H), 7,06 (д, 2H), 7,21 (м, 5H), 7,75 (д, 2H).
Пример 78
4-окси-3-[(2-фенилэтил)тио] -6-[4-(3-пиридинилметокси)фенил]-2H- пиран-2-он
Целевое соединение получают по методу А с применением 1,14 г (5,06 ммоль) 4'-(3-пиридинилметокси)ацетофенона, 0,930 г (5,56 ммоль) бис(триметилсилил)амида лития, 0,705 мл (5,56 ммоль) хлортриметилсилана, 56 мл тетрагидрофурана и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 178 - 179oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,76 (т, 2H), 2,98 (т, 2H), 5,25 (с, 2H), 6,69 (с, 1H), 7,21 (м, 7H), 7,45 (кв, 1H), 7,77 (д, 2H), 7,91 (д, 1H), 8,57 (шир.с, 1H), 8,70 (шир.с, 1H).
Пример 79
6-[4-(циклогексилметокси)фенил] -4-окси-3-[(2-фенилэтил)тио]-2H- пиран-2-он
Целевое соединение получают по методу А с применением 2,50 г (10,77 ммоль) 4'-(циклогексилметокси)ацетофенона, 2,70 г (16,16 ммоль) бис(триметилсилил)амида лития, 2,05 мл (16,16 ммоль) хлортриметилсилана, 107 мл тетрагидрофурана и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 130 - 132oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,15 (м, 5H), 1,81 (м, 6H), 2,77 (т, 2H), 2,97 (т, 2H), 3,85 (д, 2H), 6,67 (с, 1H), 7,21 (м, 5H), 7,45 (кв, 1H), 7,74 (д, 2H).
Пример 80
4-окси-3-[(2-фенилэтил)тио]-6-[4-(фенилсульфонил)фенил]-2H- пиран-2-он
Целевое соединение получают по методу А с применением 2,50 г (9,61 ммоль) 4'-(фенилсульфонил)ацетофенона, 2,41 г (14,42 ммоль) бис(триметилсилил)амида лития, 1,83 мл (14,42 ммоль) хлортриметилсилана, 96 мл тетрагидрофурана и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]-пропандикарбоновой кислоты. Т.п. 194 - 195oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,76 (т, 2H), 3,01 (т, 2H), 6,87 (с, 1H), 7,19 (м, 5H), 7,68 (м, 3H), 8,04 (м, 6H), 12,05 (шир.с, 1H).
Пример 81
4-окси-3-[(2-фенилэтил)тио]-6-[4-бензоилокси)фенил]-2H- пиран-2-он
Целевое соединение получают по методу А с применением 2,50 г (10,41 ммоль) 4'-бензоилоксиацетофенона, 2,61 г (15,62 ммоль) бис(триметилсилил)амида лития, 1,98 мл (15,62 ммоль) хлортриметилсилана, 100 мл тетрагидрофурана и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 164 - 166oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,78 (т, 2H), 3,01 (т, 2H), 6,81 (с, 1H), 7,21 (м, 5H), 7,49 (д, 2H), 7,63 (т, 2H), 7,77 (т, 1H), 7,92 (д, 2H), 12,00 (шир.с, 1H).
Пример 82
4-окси-3-[(2-фенилэтил)тио]-6-[4-(фенилсульфинил)фенил]- 2H-пиран-2-он
Целевое соединение получают по методу А с применением 2,50 г (10,24 ммоль) 4'-(фенилсульфинил)ацетофенона, 2,57 г (15,36 ммоль) бис(триметилсилил)амида лития, 1,94 мл (15,36 ммоль) хлортриметилсилана, 100 мл тетрагидрофурана и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)- тио]пропандикарбоновой кислоты. Т.п. 171 - 173oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,76 (т, 2H), 3,01 (т, 2H), 6,83 (с, 1H), 7,19 (м, 5H), 7,54 (м, 3H), 7,75 (д, 2H), 7,86 (д, 2H), 7,95 (д, 2H), 12,05 (шир.с, 1H).
Пример 83
4-окси-3-[(2-фенилэтил)тио]-6-(4-пиридинил)-2H-пиран-2-он
Целевое соединение получают по методу А с применением 2,50 г (20,63 ммоль) 4-ацетилпиридина, 5,17 г (30,94 ммоль) бис(триметилсилил)амида лития, 3,92 мл (30,94 ммоль) хлортриметилсилана, 200 мл тетрагидрофурана и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 149- 152oC (разл.).
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,78 (т, 2H), 3,04 (т, 2H), 6,98 (с, 1H), 7,20 (м, 5H), 7,74 (д, 2H), 8,74 (д, 2H).
Пример 84
(+/-)-3-[1,4-бис(фенилтио)бутил]-4-окси-6-фенил-2H-пиран-2-он
Целевое соединение получают по методу В с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 10 мл этанола, 0,436 мл (5,84 ммоль) циклопропилкарбоксальдегида, 1,40 мл (13,8 ммоль) тиофенола, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. 75 - 77oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 5,9 (с, 1H), 6,71 (с, 1H), 7,20 (м, 5H), 7,44 (м, 7H), 7,75 (м, 3H), 7,82 (м, 2H).
Пример 85
(+/-)-4-окси-6-фенил-3-[фенил[(фенилметил)тио]метил]-2H-пиран- 2-он
Целевое соединение получают по методу В с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 10 мл этанола, 0,593 мл (5,84 ммоль) бензальдегида, 1,62 мл (13,8 ммоль) бензилмеркаптана, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. 189 - 191oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 3,70 (дд, 2H), 5,29 (с, 1H), 6,65 (с, 1H), 7,23 (м, 8H), 7,50 (м, 5H), 7,73 (м, 2H), 11,96 (шир.с, 1H).
Пример 86
(+/-)-4-окси-3-[[(2-метоксифенил)тио]фенилметил]-6- фенил-2H-пиран-2-он
Целевое соединение получают по методу В с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 10 мл этанола, 0,593 мл (5,84 ммоль) бензальдегида, 1,93 мл (13,8 ммоль) 2-метокситиофенола, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. 165-170oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 3,870 (с, 3H), 5,81 (с, 1H), 6,70 (с, 1H), 6,84 (т, 1H), 7,19 (м, 3H), 7,28 (т, 2H), 7,53 (м, 3H), 7,75 (м, 2H), 12,13 (шир.с, 1H).
Пример 87
(+/-)-4-окси-3-[3-метил-1-(фенилтио)бутил]-6-фенил-2H- пиран-2-он
Целевое соединение получают по методу В с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 10 мл этанола, 0,626 мл (5,84 ммоль) изовалерянового альдегида, 1,40 мл (13,8 ммоль) тиофенола, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. 154 - 156oC.
1H-ЯМР (400 МГц, ацетон-d6): δ = 0,89 (д, 3H), 0,93 (д, 3H), 1,63 (м, 1H), 1,80 (м, 1H), 2,32 (м, 1H), 4,82 (дд, 2H), 6,70 (с, 1H), 7,24 (м, 3H), 7,82 (м, 2H), 10,49 (шир.с, 1H).
Пример 88
(+/-)-3-[2-циклoгeкcил-1-(фeнилтиo)этил]-4-oкcи-6-фeнил- 2H-пиpaн-2-oн
Целевое соединение получают по методу B с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 10 мл этанола, 0,735 мл (5,84 ммоль) циклогексилметилкарбоксальдегида, 1,40 мл (13,8 ммоль) тиофенола, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. 205oC (разл.).
1H-ЯМР (400 МГц, ацетон-d6): δ = 0,91 (д, 3H), 1,25 (м, 5H), 1,73 (м, 5H), 2,58 (м, 1H), 4,83 (дд, 1H), 6,69 (с, 1H), 7,22 (м, 3H), 7,48 (м, 5H), 7,82 (м, 2H).
Пример 89
4-окси-6-(3-феноксифенил)-3-[(2-фенилэтил)тио]-2H-пиран- 2-он
Целевое соединение получают по методу А с применением 2,00 г (9,43 ммоль) 3'-феноксиацетофенона, 2,36 г (14,15 ммоль) бис(триметилсилил)амида лития, 1,79 мл (14,15 ммоль) хлортриметилсилана, 100 мл тетрагидрофурана и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 114 - 115oC (разл.).
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,76 (т, 2H), 2,99 (т, 2H), 6,76 (с, 1H), 7,09 (м, 7H), 7,34 (с, 1H), 7,44 (т, 2H), 7,56 (м, 2H).
Пример 90
4-окси-6-[3-метокси-4-(фенилметокси)фенил] -3-[(2- фенилэтил)тио]-2H-пиран-2-он
Целевое соединение получают по методу А с применением 2,00 г (7,81 ммоль) 4'-бензилокси-3'-метоксиацетофенона, 1,96 г (11,71 ммоль) бис(триметилсилил)амида лития, 1,48 мл (11,71 ммоль) хлортриметилсилана, 80 мл тетрагидрофурана и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 114 - 115oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,77 (т, 2H), 2,98 (т, 2H), 3,86 (с, 1H), 6,75 (с, 1H), 7,21 (м, 7H), 7,40 (м, 6H).
Пример 91
6-(3,5-диметилфенил)-4-окси-3-[(2-фенилэтил)тио]-2H-пиран-2-он
Целевое соединение получают по методу А с применением 1,75 г (11,82 ммоль) 3', 5'-диметилацетофенона, 1,89 г (17,73 ммоль) диизопропиламида лития, 2,25 мл (17,73 ммоль) хлортриметилсилана, 120 мл тетрагидрофурана и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 155 - 157oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,34 (с, 6H), 2,77 (т, 2H), 2,99 (т, 2H), 6,72 (с, 1H), 7,21 (м, 6H), 7,41 (с, 2H), 8,74 (д, 2H).
Пример 92
4-окси-3-[[(3-метоксифенил) метил)тио]-6-фенил-2H-пиран-2-он
Целевое соединение получают по методу Б с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 15 мл этанола, 5,31 мл 1 н. гидроокиси натрия и 2,12 г (6,90 ммоль) сложного [3-(метокси)фенил]метилового эфира п-толуолтиосульфокислоты. Т.п. 134 - 136oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 3,69 (с, 3H), 3,99 (с, 2H), 6,75 (м, 2H), 6,83 (м, 2H), 7,16 (т, 1H), 7,53 (м, 3H), 7,79 (м, 2H).
Пример 93
(+/)-4-oкcи-3-[4-мeтил-1-(фeнилтиo)пeнтил]-6-фeнил-2H-пиpaн-2-oн
Целевое соединение получают по методу В с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 10 мл этанола, 0,584 мл (5,84 ммоль) 4-метил-пентаналя, 1,40 мл (13,8 ммоль) тиофенола, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. 144- 145oC (разл.).
1H-ЯМР (400 МГц, ДМСО-d6): δ = 0,80 (д, 3H), 0,81 (д, 3H), 1,07 (м, 1H), 1,18 (м, 1H), 1,49 (м, 1H), 1,89 (м, 1H), 2,19 (м, 1H), 4,51 (дд, 1H), 6,68 (с, 1H), 7,19 (т, 1H), 7,29 (т, 2H), 7,35 (д, 2H), 7,53 (м, 3H), 7,76 (м, 2H).
Пример 94
4-окси-6-фенил-3-[[[(3-(фенилметокси)фенил]метил]тио]-2H-пиран- 2-он
Целевое соединение получают по методу Б с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 15 мл этанола, 5,31 мл 1 н. гидроокиси натрия и 2,65 г (6,90 ммоль) сложного [3-(бензоксил)фенил]метилового эфира п-толуолтиосульфокислоты. Т.п. 140 - 141oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 3,98 (с, 2H), 5,01 (с, 2H), 6,75 (с, 1H), 6,83 (м, 2H), 6,91 (м, 1H), 7,28 (т, 1H), 7,34 (м, 4H), 7,52 (м, 3H), 7,80 (м, 2H).
Пример 95
3-[(1,3-бензодиоксол-5-илметил)тио]-4-окси-6-фенил-2H-пиран-2-он
Целевое соединение получают по методу Б с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 15 мл этанола, 5,31 мл 1 н. гидроокиси натрия и 2,22 г (6,90 ммоль) сложного 1,3- бензодиоксоил-5-ил-метилового эфира п-толуолтиосульфокислоты. Т.п. 162 - 164oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 3,92 (с, 2H), 5,95 (с, 2H), 6,75 (м, 4H), 7,53 (м, 3H), 7,79 (м, 2H).
Пример 96
4-окси-3-[[(2-метоксифенил)метил)тио]-6-фенил-2H-пиран-2-он
Целевое соединение получают по методу Б с применением 0,500 г (2,65 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 7 мл этанола, 2,65 мл 1 н. гидроокиси натрия и 0,816 г (2,65 ммоль) сложного (2-метоксифенил)метилового эфира п-толуолтиосульфокислоты. Т.п. 152 - 153oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 3,73 (с, 3H), 3,95 (с, 2H), 6,71 (с, 1H), 6,81 (т, 1H), 6,91 (д, 1H), 7,13 (д, 1H), 7,17 (т, 1H), 7,53 (м, 3H), 7,79 (м, 2H).
Пример 97
4-окси-3-[[(2-метилфенил) метил)тио]-6-фенил-2H-пиран-2-он
Целевое соединение получают по методу Б с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 15 мл этанола, 5,31 мл 1 н. гидроокиси натрия и 1,55 г (5,31 ммоль) сложного (2- метилфенил)метилового эфира п-толуолтиосульфокислоты. Т.п. 176 - 178oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,42 (с, 3H), 3,99 (с, 2H), 6,74 (с, 1H), 7,09 (м, 4H), 7,53 (м, 3H), 7,79 (м, 2H).
Пример 98
4-окси-3-[[(3-метилфенил) метил)тио]-6-фенил-2H-пиран-2-он
Целевое соединение получают по методу Б с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 15 мл этанола, 5,31 мл 1 н. гидроокиси натрия и 1,55 г (5,31 ммоль) сложного (3- метилфенил)метилового эфира п-толуолтиосульфокислоты. Т.п. 139 - 140oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,23 (с, 3H), 3,96 (с, 2H), 6,74 (с, 1H), 7,07 (м, 4H), 7,54 (м, 3H), 7,79 (м, 2H).
Пример 99
4-окси-3-[[(4-метилфенил)метил]тио]-6-фенил-2H-пиран-2-он
Целевое соединение получают по методу Б с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 15 мл этанола, 5,31 мл 1 н. гидроокиси натрия и 1,55 г (5,31 ммоль) сложного (4- метилфенил)метилового эфира п-толуолтиосульфокислоты. Т.п. 164 - 165oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,23 (с, 3H), 3,96 (с, 2H), 6,74 (с, 1H), 7,06 (д, 2H), 7,14 (д, 2H), 7,53 (м, 3H), 7,79 (м, 2H).
Пример 100
6-[1,1'-бифенил]-3-ил-4-окси-3-[(2-фенилэтил)тио]-2H-пиран-2-он
Целевое соединение получают по методу А с применением 2,00 г (10,21 ммоль) 3'-фенилацетофенона, 2,36 мл (12,24 ммоль) триметилсилилтрифторацетата, 2,84 мл (20,40 ммоль) триэтиламина, 26 мл хлористого метилена и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио] пропандикарбоновой кислоты. Т.п. 93 - 94oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,79 (т, 2H), 3,1 (т, 2H), 6,92 (с, 1H), 7,21 (м, 5H), 7,42 (т, 1H), 7,52 (т, 2H), 7,64 (т, 1H), 7,75 (д, 2H), 7,82 (т, 2H), 8,02 (с, 1H).
Пример 101
4-окси-3-[[(4-метоксифенил)метил]тио]-6-фенил-2H-пиран-2-он
Целевое соединение получают по методу Б с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 15 мл этанола, 5,31 мл 1 н. гидроокиси натрия и 2,21 г (6,90 ммоль) сложного (4-метоксифенил)метилового эфира п-толуолтиосульфокислоты. Т.п. 168 - 170oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 3,96 (с, 3H), 3,95 (с, 2H), 6,73 (с, 1H), 6,81 (д, 2H), 7,17 (д, 2H), 7,53 (м, 3H), 7,79 (м, 2H).
Пример 102
(+/-)-3-[2-циклогексил-1-(циклогексилтио)этил] -4-окси-6-фенил- 2H-пиран-2-он
Целевое соединение получают по методу В с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 10 мл этанола, 0,735 г (5,84 ммоль) циклогексилметилкарбоксальдегида, 1,60 г (13,8 ммоль) циклогексилмеркаптана, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. 220oC (разл.).
1H-ЯМР (400 МГц, ДМСО-d6): δ = 0,86 (м, 2H), 1,18 (м, 9H), 1,66 (м, 10H), 2,03 (м, 2H), 2,58 (м, 2H), 4,25 (м, 1H), 6,68 (с, 1H), 7,53 (м, 3H), 7,75 (м, 2H).
Пример 103
(+/-)-3-[1-[(2,6-диметилфенил)тио] -3-метилбутил] -4-окси-6- фенил-2H-пиран-2-он
Целевое соединение получают по методу В с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 10 мл этанола, 0,63 мл (5,84 ммоль) изовалерянового альдегида, 1,90 г (13,8 ммоль) 2,6-диметилтиофенола, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. 166 - 167oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 0,78 (д, 3H), 0,83 (д, 3H), 1,42 (м, 1H), 1,47 (м, 1H), 2,46 (м, 1H), 2,51 (с, 6H), 4,37 (м, 1H), 6,51 (с, 1H), 7,70 (м, 3H), 7,52 (м, 3H), 7,74 (м, 2H).
Пример 104
(+/-)-3-[1-(циклогексилтио)-2-циклопропилэтил] -4-окси- 6-фенил-2H-пиран-2-он
Целевое соединение получают по методу В с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 10 мл этанола, 0,67 г (5,84 ммоль) циклопропилметилкарбоксальдегида, 1,68 мл (13,8 ммоль) циклогексилмеркаптана, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. 69 - 71oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 0,02 (м, 1H), 0,05 (м, 1H), 0,34 (м, 2H), 0,64 (м, 2H), 1,22 (м, 5H), 1,52 (м, 1H), 1,67 (м, 3H), 1,84 (м, 1H), 1,97 (м, 2H), 2,64 (м, 1H), 4,21 (т, 1H), 6,69 (с, 1H), 7,52 (м, 3H), 7,75 (м, 2H).
Пример 105
(+/-)-3-[1-[(2,6-дихлорфенил)тио] -3-метилбутил] -4-окси-6-фенил- 2H-пиран-2-он
Целевое соединение получают по методу В с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 10 мл этанола, 0,62 г (5,84 ммоль) изовалерянового альдегида, 2,74 г (13,8 ммоль) 2,6-дихлортиофенола, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. 158 - 162oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 0,83 (д, 3H), 0,87 (д, 3H), 1,49 (м, 1H), 1,74 (м, 1H), 2,39 (м, 1H), 4,68 (м, 1H), 6,769 (с, 1H), 7,49 (м, 5H), 7,74 (м, 3H).
Пример 106
(+/-)-3-[1-(циклогексилтио)-3,3-диметилбутил] -4-окси-6- фенил-2H-пиран-2-он
Целевое соединение получают по методу В с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2H-пиран-2-она, 10 мл этанола, 0,73 мл (5,84 ммоль) 3,3-диметилбутаналя, 1,86 мл (13,8 ммоль) циклогексилмеркаптана, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. > 225oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 0,85 (с, 9H), 1,25 (м, 5H), 1,65 (м, 7H), 4,30 (м, 1H), 6,69 (с, 1H), 7,54 (м, 3H), 7,75 (м, 2H).
Пример 107
Сложный этиловый эфир 4-[4-окси-2-оксо-3-[(2-фенилэтил)тио]- 2H-пиран-6-ил]-2-метилфенокси-уксусной кислоты
Целевое соединение получают по методу А с применением 2,00 г (8,47 ммоль) сложного этилового эфира 4-ацетил-2-метилфенокси-уксусной кислоты, 3,92 мл (20,33 ммоль) триметилсилилтрифторацетата, 4,72 мл (33,88 ммоль) триэтиламина, 22 мл хлористого метилена и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 154 - 156oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,22 (т, 3H), 2,26 (с, 3H), 2,77 (т, 2H), 2,97 (т, 2H), 4,17 (т, 2H), 4,91 (с, 2H), 6,66 (с, 1H), 6,99 (д, 1H), 7,21 (м, 5H), 7,61 (м, 2H).
Пример 108
6-[3,5-диметил-4-[[диметил(1,1-диметилэтил)силил] окси] фенил]- 4-окси-3-[(фенилметил)тио]-2Н-пиран-2-он
Целевое соединение получают по методу A с применением 1,50 г (5,39 ммоль) 3',5'-диметил-4'-[[диметил(1,1- диметилэтил)силил]окси]ацетофенона, 1,24 мл (6,47 ммоль) триметилсилилтрифторацетата, 1,50 мл (10,78 ммоль) триэтиламина, 13 мл хлористого метилена и 1,00 г (3,54 ммоль) сложного диэтилового эфира [(фенилметил)тио]пропандикарбоновой кислоты, Т.п. 137 - 139oC.
1H-ЯМР (400 МГц, ДMСО-d6): δ = 0,21 (с, 6H), 0,99 (с, 9H), 2,22 (с, 6H), 3,96 (с, 2H), 6,54 (с, 1H), 6,99 (д, 1H), 7,21 (м, 5H), 7,44 (м, 2H).
Пример 109
4-окси-3-[(2-фенилэтил)тио] -6-[4-(4-пиридинилметокси)фенил]- 2Н-пиран-2-он
Целевое соединение получают по методу A с применением 2,00 г (8,81 ммоль) 4'-(4-пиридинилметокси)ацетофенона, 2,04 мл (10,57 ммоль) триметилсилилтрифторацетата, 2,45 мл (17,62 ммоль) триэтиламина, 22 мл хлористого метилена и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]-пропандикарбоновой кислоты, Т.п. 212oC (разл.).
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,73 (т, 2H), 2,88 (т, 2H), 5,29 (с, 2H), 6,48 (с, 1H), 7,18 (м, 5H), 7,45 (д, 2H), 7,74 (д, 2H), 8,90 (д, 2H).
Пример 110
(+/-)-3-[1-(циклопентилтио)-3-метилбутил]-4-окси-6-фенил-2Н- пиран-2-он
Целевое соединение получают по методу B с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2Н-пиран-2-она, 10 мл этанола, 0,62 мл (5,84 ммоль) изовалерянового альдегида, 1,43 мл (13,8 ммоль) циклопентилмеркаптана, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. 146 - 149oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 0,85 (д, 2H), 0,87 (д, 2H), 1,32 (м, 1H), 1,54 (м, 7H), 1,85 (м, 1H), 2,00 (м, 2H), 3,04 (м, 1H), 4,20 (дд, 1H), 6,69 (с, 1H), 7,53 (м, 3H), 7,76 (м, 2H), 11,69 (шир.с, 1H).
Пример 111
[4-[4-окси-2-оксо-3[(2-фенилэтил)тио] -2Н-пиран-6-ил]- 2-метилфенокси]-уксусной кислоты
К раствору 0,20 г (0,45 ммоль) сложного этилового эфира [4-[4- окси-2-оксо-3[(2-фенилэтил)тио]-2Н-пиран-6-ил]-2- метилфенокси]уксусной кислоты в 10 мл тетрагидрофурана добавляют 1,13 мл (1,13 ммоль) 1 н. гидроокиси натрия. Реакционную смесь перемешивают в течение 5 часов, после чего смешивают с 10 мл воды. Подкисляют конц. хлористоводородной кислотой до достижения значения pH 2. Водный слой дважды экстрагируют этилацетатом, взятым в количестве по 100 мл. Объединенные органические экстракты промывают насыщенным раствором хлористого натрия и сушат над безводным сульфатом магния. Растворители упаривают в вакууме. Сырой продукт очищают путем колоночной хроматографии на силикагеле с размерами частиц 230 - 400 меш с применением в качестве элюента смеси хлористого метилена, метанола и уксусной кислоты в соотношении 94 : 5 : 1. Т.п. 210oC (разл.).
1H-ЯМР (400 МГц, ДMCO-d6): δ = 2,26 (с, 3 Н), 2,78 (т, 2H), 2,98 (т, 2H), 4,81 (с, 2H), 6,67 (с, 1H), 6,97 (д, 2H), 7,21 (м, 5H), 7,61 (д, 2H).
Пример 112
(+/-)-3-[1-(циклогексилтио)-2-циклопентилэтил] -4-окси-6-фенил- 2Н-пиран-2-он
Целевое соединение получают по методу B с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2Н-пиран-2-она, 10 мл этанола, 0,65 г (5,84 ммоль) циклопентилметилкарбоксальдегида, 1,68 мл (13,8 ммоль) циклогексилмеркаптана, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. 157 - 160oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,44 (м, 18H), 2,01 (м, 1H), 2,19 (м, 1H), 2,60 (м, 1H), 4,16 (м, 1H), 6,68 (с, 1H), 7,53 (м, 3H), 7,75 (м, 2H), 11,66 (шир.с, 1H).
Пример 113
4-окси-6-(4-окси-3,5-диметилфенил)-3-[(фенилметил)тио]-2Н- пиран-2-он
К раствору 6-[3,5-диметил-4-[[диметил(1,1- диметилэтил)силил]окси]фенил] -4-окси-3-[(фенилметил)тио] -2Н-пиран- 2-она в 10 мл тетрагидрофурана при температуре 0oC добавляют 9,0 мл 3 н. соляной кислоты. Реакционную смесь перемешивают в течение 48 часов при комнатной температуре, после чего смесь подают в этилацетат и последовательно промывают водой и насыщенным раствором хлористого натрия. Сушат над безводным сульфатом магния. Растворители упаривают в вакууме. Сырой продукт очищают путем колоночной флеш-хроматографии на силикагеле с размерами частиц 230 - 400 меш с применением в качестве элюента смеси этилацетата и гексанов в соотношении 1:1. Т.п. 174 - 176oC.
1H-ЯМР (250 МГц, ДМСО-d6): δ = 2,21 (с, 6H), 2,60 (м, 1H), 3,96 (с, 2H), 6,52 (с, 1H), 7,23 (с, 5H), 7,38 (с, 2H), 9,06 (с, 1H).
Пример 114
4-окси-6-фенил-3-[[[3-(2-фенилэтокси)фенил]метил]тио]-2Н- пиран-2-он
Целевое соединение получают по методу Б с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2Н-пиран-2-она, 15 мл этанола, 5,31 мл 1 н. гидроокиси натрия и 2,11 г (5,31 ммоль) сложного [3- (2-(фенилэтокси)фенил]метилового эфира п-толуолтиосульфокислоты. Т.п. 85 - 90oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,96 (т, 2H), 3,96 (с, 2H), 4,09 (т, 2H), 6,77 (м, 4H), 7,19 (м, 5H), 7,53 (м, 3H), 7,77 (м, 2H).
Пример 115
4-окси-6-[4-(2-фенилэтинил)фенил]-3-[(2-фенилэтил)тио]-2Н- пиран-2-он
Целевое соединение получают по методу A с применением 1,50 г (6,81 ммоль) 4'-(2-фенэтинил)ацетофенона, 1,57 мл (8,17 ммоль) триметилсилилтрифторацетата, 1,89 мл (13,62 ммоль) триэтиламина, 17 мл хлористого метилена и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 181 - 182oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,78 (т, 2H), 3,02 (т, 2H), 6,85 (с, 1H), 7,21 (м, 5H), 7,45 (м, 3H), 7,59 (д, 2H), 7,86 (д, 2H).
Пример 116
4-окси-6-[4-(2-фенилэтил)фенил]-3-[(2-фенилэтил)тио]-2Н-пиран- 2-он
Целевое соединение получают по методу A с применением 1,50 г (6,68 ммоль) 4'-(2-фенэтил)ацетофенона, 1,55 мл (8,02 ммоль) триметилсилилтрифторацетата, 1,86 мл (13,36 ммоль) триэтиламина, 17 мл хлористого метилена и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 122 - 123oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,77 (т, 2H), 2,93 (м, 4H), 2,99 (т, 2H), 6,75 (с, 1H), 7,26 (м, 5H), 7,38 (д, 2H), 7,71 (д, 2H).
Пример 117
(+/-)-3-[(циклогексилтио)фенилметил]-4-окси-6-фенил-2Н-пиран- 2-он
Целевое соединение получают по методу B с применением 1,00 г (5,31 ммоль) 4-окси-6-фенил-2Н-пиран-2-она, 10 мл этанола, 0,593 мл (5,84 ммоль) бензальдегида, 1,68 мл (13,8 ммоль) циклогексилмеркаптана, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. 189 - 191oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,21 (м, 5H), 1,52 (м, 1H), 1,91 (м, 2H), 2,58 (м, 2H), 5,37 (с, 1H), 6,70 (с, 1H), 7,17 (т, 1H), 7,53 (м, 5H), 7,74 (м, 2H), 11,96 (шир.с, 1H).
Пример 118
4-окси-3-[(фенилметил)тио]-6-[3-(трифторметокси)фенил]-2Н- пиран-2-он
Целевое соединение получают по методу A с применением 3 г (14,7 ммоль) 3'-трифторметоксиацетофенона, 2,45 г (14,7 ммоль) бис(триметилсилил)амида лития, 2,47 г (14,7 ммоль) хлортриметилсилана и 1,00 г (3,54 ммоль) сложного диэтилового эфира [(фенилметил)тио] пропандикарбоновой кислоты. Т.п. 128 - 132oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 4,03 (с, 2H), 6,81 (с, 1H), 7,2 (м, 2H), 7,28 (м, 3H), 7,56 (дд, 1H), 7,69 (т, 1H), 7,75 (с, 1H), 7,86 (д 1H); ИК (KBr) 2963, 1651, 1550, 1394, 1369, 1395, 1263, 1098, 1024, 800 см-1; МС (УИ): m/e 395 (M+H, 37), 309 (8), 273 (7), 205 (3), 119 (10);
C19H13O4S1F3 • H2O:
рассчит.: C 55,34; H 3,67;
найд.: C 54,94; H 4,03.
Пример 119
3-[(циклогексилметил)тио]-4-окси-6-фенил-2Н-пиран-2-он
Целевое соединение получают по методу Б с применением 0,5 г (2,66 ммоль) 4-окси-6-фенил-2Н-пиран-2-она, 7 мл этанола, 2,66 мл 1 н. гидроокиси натрия и 0,756 г (2,66 ммоль) циклогексилметил-п- толуолтиосульфоната. Т.п. 141 - 143oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ= 0,92 (м, 2H), 1,14 (м, 3H), 1,19 (м, 1H), 1,61 (м, 3H), 1,83 (м, 2H), 2,64 (д, 2H), 6,78 (с, 1H), 7,53 (м, 3H), 7,81 (м, 2H); ИК (KBr) 3106, 2922, 1651, 1547, 1396, 1099, 766 см-1; МС (УИ): m/e 317 (M+H, 16), 279 (83), 242 (77), 201 (27), 177 (19), 134 (54), 105 (65), 97 (100).
Пример 120
4-окси-3-[(2-фенилэтил)тио] -6-[3-метил-4-(3- пиридинилметокси)фенил]-2Н-пиран-2-он
Целевое соединение получают по методу A с применением 2,0 г (8,29 ммоль) 3'-метил-4'-(3-пиридинилметокси)ацетофенона, 1,53 г (9,13 ммоль) бис(триметилсилил)амида лития, 1,54 г (9,13 ммоль) хлортриметилсилана и 1,00 г (3,37 ммоль) сложного диэтилового эфира [2-(фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 149 - 151oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,25 (с, 3H), 2,78 (т, 2H), 2,97 (т, 2H), 5,28 (с, 2H), 6,69 (с, 1H), 7,22 (м, 6H), 7,44 (дд, 1H), 7,67 (с + д, 2H), 7,92 (д, 1H), 8,58 (шир.с, 1Н), 8,72 (шир.с, 1H); ИК (KBr) 3430, 2926, 1713, 1626, 1505, 1263, 1136, 1028, 808, 705 см-1; МС (УИ): m/e 446 (M+H), 341 (15), 200 (6), 105 (100);
C26H33O4S1N1:
рассчит.: C 70,09; H 5,20; N 3,14;
найд.: C 70,31; H 5,27; N 2,95.
Пример 121
6-(2,3-дигидро-1,4-бензодиоксин-6-ил)-4-окси-3- [(фенилметил)тио]-2Н-пиран-2-он
Целевое соединение получают по методу A с применением 2,5 г (14,25 ммоль) 1,4-бензодиоксин-6-ил-метилкетона, 2,35 г (14,25 ммоль) бис(триметилсилил)-амида лития, 2,47 г (14,25 ммоль) хлортриметилсилана и 1,00 г (3,55 ммоль) сложного диэтилового эфира [(фенилметил)тио]пропандикарбоновой кислоты. Т.п. 192 - 193oC.
1H-ЯМР (400 МГц, ДMCO-d6): δ = 3,99 (с, 2H), 4,17 (м, 4H), 6,8 (с, 1H), 7,0 (д, 1H), 7,2 (м, 1H), 2,28 (м, 7H); ИК (KBr) 3435, 2924, 1649, 1624, 1508, 1288, 1066, 698 см-1; МС (УИ): m/e 369 (M+H), 277 (12), 233 (12), 163 (9), 107 (10), 91 (76);
C20H16O5S1:
рассчит.: C 65,21; H 4,38;
найд.: C 64,80; H 4,17.
Пример 122
4-окси-3-[(2-фенилэтил)тио]-6-[3-(трифторметил)фенил]-2Н- пиран-2-он
Целевое соединение получают по методу A с применением соответствующего простого триметилсилил-энолового эфира (4,5 ммоль) и 1,33 г (4,55 ммоль) сложного диэтилового эфира [(2- фенилэтил)тио]пропандикарбоновой кислоты. Т. п. 117 - 118oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,8 (т, 2H), 3,03 (т, 2H), 6,94 (с, 1H), 7,2 (м, 5H), 7,8 (т, 1H), 7,94 (т, 1H), 8,08 (с, 1H), 8,14 (д, 1H); ИК (KBr) 3435, 3026, 2924, 1720, 1635, 1543, 1327, 1171, 1130, 696 см-1; МС (УИ): m/e 393 (M+H, 100), 373 (9), 288 (38), 256 (20), 224 (11), 105 (62);
C20H15S1O3F3 • H2O:
рассчит.: C 58,53; H 4,18;
найд.: C 59,28; H 3,81.
Пример 123
4-окси-3-[(фенилметил)тио]-6-[3-(трифторметил)фенил]-2Н-пиран- 2-он
Целевое соединение получают по методу A с применением соответствующего простого триметилсилил-энолового эфира (9,8 ммоль) и 2,76 г (9,88 ммоль) сложного диэтилового эфира [(фенилметил)тио]пропандикарбоновой кислоты. Т.п. 152 - 153oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 3,97 (с, 2H), 6,53 (с, 1H), 7,25 (м, 5H), 7,61 (т, 1H), 7,75 (д, 1H), 8,03 (д, 1H), 8,08 (с, 1H): ИК (KBr) 3434, 3244, 1678, 1628, 1535, 1522, 1435, 1341, 1316, 1192, 1132, 936, 706 см-1; МС (УИ): m/e 379 (M+H), 257 (1), 91 (100);
C19H13O3S1F3:
рассчит.: C 60,31; H 3,46;
найд.: C 60,53: H 3,57.
Пример 124
4-окси-3-[(фенилметил)тио]-6-[2,3,4-(триметоксифенил]-2Н- пиран-2-он
Целевое соединение получают по методу A с применением 1,5 г (7,13 ммоль) 2', 3',4'-триметоксиацетофенона, 1,43 г (8,56 ммоль) бис(триметилсилил)амида лития, 1,8 мл (10,67 ммоль) хлортриметилсилана и 1,00 г (3,54 ммоль) сложного диэтилового эфира [(фенилметил)тио]пропандикарбоновой кислоты.
Пример 125
N-[4-[4-окси-2-оксо-3-[(2-фенилэтил)тио]-2Н-пиран-6-ил] фенил]-бензолсульфонамид
Целевое соединение получают по методу A с применением 3,0 г (10,91 ммоль) соответствующего бензолсульфонамида, 3,65 г (21,82 ммоль) бис(триметилсилил)амида лития, 3,68 мл (21,82 ммоль) хлортриметилсилана и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 89 - 91oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,78 (т, 2H), 3,03 (т, 2H), 6,86 (с, 1H), 7,25 (м, 6H), 7,72 (т, 3H), 7,86 (м, 5H); ИК (KBr) 3443, 3335, 1725, 1632, 1543, 1383, 1171, 912, 729, 581, 552 см-1;
C25H21N1S2O5 • H2O:
рассчит.: C 60,35; H 4,66; N 2,81;
найд.: C 60,13; H 4,47; N 3,23.
Пример 126
6-[4-[(3,5-диметил-4-изоксазолил)метокси] фенил]-4-окси-3-[(2- фенилэтил)тио]-2Н-пиран-2-он
Целевое соединение получают по методу A с применением 1,65 г (6,74 ммоль) 4'-(3,5-диметил-4-изоксазолил)ацетофенона, 1,13 г (6,74 ммоль) бис(триметилсилил)амида лития, 1,14 мл (6,74 ммоль) хлортриметилсилана и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 152 - 154oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,22 (с, 3H), 2,31 (с, 3H), 2,78 (т, 2H), 2,99 (т, 2H), 5,03 (с, 2H), 6,69 (с, 1H), 7,17 (д, 3H), 7,25 (м, 4Н), 7,78 (д, 2Н); ИК (KBr) 2936, 2979, 1640, 1510, 1406, 1182, 988, 820, 764 см-1; МС (УИ): m/e 450 (M+H), 341 (10), 236 (9), 112 (76), 105 (100);
C25H23N1O5S1:
рассчит.: C 66,80; H 5,16; N 3,12;
найд.: C 66,42; H 5,20; N 2,74.
Пример 127
(+/-)-3-[(циклогексилтио)фенилметил] -4-окси-6-[3-метил-4- (3-пиридинилметокси)фенил]-2Н-пиран-2-он
Целевое соединение получают по методу B с применением 0,5 г (1,62 ммоль) 4-окси-6-[3-метил-4-(3-пиридинилметокси)фенил] -2Н- пиран-2-она, 0,189 г (1,78 ммоль) бензальдегида, 0,489 г (4,212 ммоль) циклогексилмеркаптана, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. 84 - 87oC (разл.). ИК (KBr) 3059, 2930, 2853, 1676, 1601, 1449, 1260, 1134, 700 см-1; МС (УИ): m/e 446 (2), 331 (9), 226 (61), 205 (24), 135 (44):
Пример 128
Сложный метиловый эфир 2-[[(4-окси-2-оксо-6-фенил-2Н-пиран-3- ил)тио] метил]-бензойной кислоты
Целевое соединение получают по методу Б с применением 2,0 г (10,63 ммоль) 4-окси-6-фенил-2Н-пиран-2-она, 3,57 г (10,63 ммоль) сложного [2-(карбометокси)фенил]метилового эфира п-толуолтиосульфокислоты, 10,63 мл 1 н. гидроокиси натрия и 20 мл этанола. Т.п. 122 - 123oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 3,81 (с, 3H), 4,31 (с, 2H), 6,67 (с, 1H), 7,25 (д, 1H), 7,31 (т, 1H), 7,44 (т, 1H), 7,44 (м, 3H), 7,53 (д, 1H), 7,99 (м, 3H); ИК (KBr) 3005, 2951, 1721, 1653, 1543, 1400, 1267, 1078, 966, 766, 711, 520 см-1; МС (УИ): m/e 397 (M+29,4), 369 ((M+H), 40), 337 (34), 191 (26), 149 (100), 105 (14).
Пример 129
(+/-)-3-[1-(циклогексилтио)-3-метилбутил]-6-(2,3-дигидро-1,4- бензодиоксин-6-ил)-4-окси-2Н-пиран-2-он
Целевое соединение получают по методу B с применением 1,0 г (4,06 ммоль) 4-окси-6-[1,4-бензодиоксин-6-ил] -2Н-пиран-2-она, 0,35 г (4,06 ммоль) изовалерянового альдегида, 0,944 г (8,12 ммоль) циклогексилмеркаптана, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. 161 - 162oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 0,85 (д, 3H), 0,88 (д, 3H), 1,2 (м, 5H), 1,39 (м, 1H), 1,53 (м, 2H), 1,65 (м, 2H), 1,81 (шир.м, 1H), 2,04 (м, 2H), 4,2 (кв, 1H), 4,32 (шир.кв, 4H), 6,53 (с, 1H), 6,99 (д, 1H), 7,2 (д, 1H), 7,25 (дд, 1H); ИК (KBr) 1099, 2930, 2853, 1649, 1564, 1510, 1397, 1314, 1289, 1260, 1140, 1069, 891, 771, 608 см-1.
Пример 130
Сложный метиловый эфир 2-[[4-(4-окси-2-оксо-3-[(2- фенилэтил)тио]-2Н-пиран-6-ил]фенокси]метил]-бензойной кислоты
Целевое соединение получают по методу A с применением 2,0 г (7,04 ммоль) сложного метилового эфира 2-[[(4- ацетил)фенокси]метил]бензойной кислоты, 1,57 г (7,04 ммоль) триметилсилилтрифторметилсульфоната, 1,42 г (14,08 ммоль) триэтиламина и 1,04 г (3,52 ммоль) сложного диэтилового эфира [(2- фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 161 - 162oC.
1H-ЯМР (400 МГц, ДMCO-d6): δ = 2,78 (т, 2H), 2,97 (т, 2H), 3,81 (с, 3 Н), 5,5 (с, 2H), 6,69 (с, 1H), 7,14 (м, 3H), 7,25 (м, 4H), 7,5 (м, 2H), 7,78 (м, 2H), 7,78 (д, 2H), 7,94 (д, 1H); ИК (KBr) 3028, 2949, 2909, 2675, 1715, 1638, 1510, 1402, 1291, 1267, 1181, 1030, 828, 747 см-1; МС (УИ) m/e 489 (M+H, 51), 384 (3), 353 (1), 149 (100), 135 (47), 105 (33).
Пример 131
4-окси-3-[(2-фенилэтил)тио] -6-[4-(1Н-тетразол-5- илметокси)фенил]-2Н-пиран-2-он
Целевое соединение получают с применением 0,5 г (1,32 ммоль) соединения примера 143 и 0,543 г (2,64 ммоль) азида триметилолова, 10 мл толуола и 10 мл этанола при температуре флегмы в течение 24 часов. Растворители упаривают. Остаток обрабатывают 1 н. соляной кислотой, после чего перемешивают при комнатной температуре в течение 2 часов. Остаток подают в метанол, растворители упаривают и получаемое твердое вещество промывают этилацетатом с получением чистого соединения, т.п. 195 - 196oC (разл.).
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,78 (т, 2H), 2,99 (т, 3H), 5,6 (с, 2H), 6,72 (с, 1H), 7,22 (м, 7H), 7,81 (д, 2H); ИК (KBr) 3121, 3028, 1657, 1549, 1512, 1410, 1256, 1186, 1059, 831, 696 см-1; MC (УИ) m/e 423 (M+H, 8), 341 (3), 137 (11), 105 (100).
Пример 132
4-окси-6-[3-метил-4-[(2-пиридинил)метокси] фенил] -3- [(2-фенилэтил)тио] -2Н-пиран-2-он
Целевое соединение получают по методу A с применением 2,0 г (8,29 ммоль) 4-(2-пиридинилметокси)-3-метилацетофенона, 1,84 г (8,29 ммоль) триметилсилилтрифторметилсульфоната, 1,68 г (16,58 ммоль) триэтиламина и 1,22 г (4,15 ммоль) сложного диэтилового эфира [(2- фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 75 - 77oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,32 (с, 3H), 2,78 (т, 3H), 2,97 (т, 2H), 5,29 (с, 2H), 6,67 (с, 1H), 7,14 - 7,29 (м, 4H), 7,38 (м, 1H), 7,56 (м, 2H), 7,67 (м, 2H), 7,86 (т, 2H), 8,61 (д, 1H); ИК (KBr) 3063, 2924, 1719, 1603, 1505, 1267, 1138, 1039, 760 см-1; МС (УИ) m/e 446 (M+H, 90), 341 (16), 279 (17), 242 (21), 151 (25), 105 (100).
C26H23O4N1S1:
рассчит.: C 70,09; H 5,2; N 3,4;
найд.: C 70,68; H 5,28 N 3,14.
Пример 133
(+/-)-3-[2-циклопропил-1-[(фенилметил)тио] этил] -4-окси-6- фенил-2Н-пиран-2-он
Целевое соединение получают по методу B с использованием 1,5 г (7,98 ммоль) 4-окси-6-фенил-2Н-пиран-2-она, 0,67 г (7,98 ммоль) 2-циклопропилметилкарбоксальдегида, 1,98 г (15,96 ммоль) бензилмеркаптана, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. 59 - 61oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 0,97 (м, 2 H), 0,28 (м, 2H), 0,58 (м, 1 H), 1,61 (м, 1H), 2,01 (м, 1H), 3,72 (АВХ кв, 2H), 4,22 (кв, 1H), 6,67 (с, 1H), 7,18 (т, 1H), 7,25 (д, 2H), 7,31 (т, 2H), 7,53 (м, 3H), 7,75 (м, 2H); ИК (KBr) 3061, 2919, 2631, 1649, 1564, 1404, 1267, 766, 691 см-1: МС (УИ) m/e 255 (M-SBzl, (19), 201 (5), 147(2);
C23H22O3S1:
рассчит.: C 72,99; H 5,86;
найд.: C 72,31; H 6,08.
Пример 134
(+/-)-4-окси-3-[1-[(2-метоксифенил)тио]-3-метилбутил]-6-фенил- 2Н-пиран-2-он
Целевое соединение получают по методу B с использованием 1,5 г (7,98 ммоль) 4-окси-6-фенил-2Н-пиран-2-она, 0,69 г (7,98 ммоль) изовалерянового альдегида, 2,24 г (15,96 ммоль) 2-метокситиофенола, 1,0 мл пиперидина, 1,0 мл уксусной кислоты и 15 мл этанола. Т.п. 75 - 78oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 0,86 (д, 3H), 0,89 (д, 3H), 1,53 (м, 1H), 1,69 (м, 1H), 2,19 (м, 1H), 3,64 (с, 3H), 4,69 (кв, 1H), 6,64 (с, 1H), 6,89 (т, 1H), 6,94 (д, 1H), 7,17 (т, 1H), 7,33 (д, 1 Н), 7,53 (м, 3H), 7,78 (м, 2H); ИК (KBr) 3063, 2955, 2635, 1649, 1564, 1406, 1242, 1026, 768, 750, 691 см-1; МС (УИ) m/e 257 (M-SPh(OMe), (11), 201 (3), 169 (5), 141 (88);
C23H24O4S1:
рассчит.: C 69,67; H 6,10;
найд.: C 69,63; H 5,92.
Пример 135
(+/-)-4-окси-3-[1-[(фенилметил)тио]-3-метилбутил]-6-фенил-2Н- пиран-2-он
Целевое соединение получают по методу B с использованием 1,5 г (7,98 ммоль) 4-окси-6-фенил-2Н-пиран-2-она, 0,69 г (7,98 ммоль) изовалерянового альдегида, 1,98 г (15,96 ммоль) бензилмеркаптана, 1,0 мл пиперидина и 1,0 мл уксусной кислоты. Т.п. 153 - 155oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 0,64 (д, 3H), 0,81 (д, 3H), 1,25 (м, 1H), 1,53 (м, 1H), 2,04 (м, 1H), 3,69 (ABX кв, 2H), 4,22 (кв, 1H), ИК (KBr) 3086, 2955, 1651, 1566, 1497, 1404, 1311, 1127, 912, 766, (8).
Пример 136
Сложный метиловый эфир 4-[[4-[4-окси-2-оксо-3-[(2- фенилэтил)тио]-2Н-пиран-6-ил]фенокси]метил]бензойной кислоты
Целевое соединение получают по методу A с использованием 2,0 г (7,04 ммоль) сложного метилового эфира 4-[[(4- ацетил)фенокси]метил]бенэойной кислоты, 2,36 г (14,08 ммоль) гексаметилдисилазида лития, 2,38 г (14,08 ммоль) хлортриметилсилана и 1,0 г (3,05 ммоль) сложного диэтилового эфира [(2- фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 157 - 158oC.
1H-ЯМР (400 МГц, ДMCO-d6): δ = 2,78 (т, 2H), 2,97 (т, 2H), 3,86 (с, 2H), 5,31 (с, 2H), 6,67 (с, 1H), 7,17 (кв, 4H), 7,25 (м, 3H), 7,61 (д, 2H), 7,78 (д, 2H), 8,0 (д, 2H); ИК (KBr) 3023, 2936, 2581, 1632, 1510, 1404, 1258, 1184, 1098, 1009, 818, 718 см-1; МС (УИ) m/e 517 (M+29, 7), 489 (M+H, 55), 384 (19), 149 (40), 105 (100).
Пример 137
Сложный метиловый эфир 3-[[4-[4-окси-2-оксо-3-[(2- фенилэтил)тио]-2Н-пиран-6-ил]фенокси]метил]бензойной кислоты
Целевое соединение получают по методу A с использованием 2,0 г (7,04 ммоль) сложного метилового эфира 3-[[(4- ацетил)фенокси]метил]бензойной кислоты, 2,36 г (14,08 ммоль) гексаметилдисилазана лития, 2,38 г (14,08 ммоль) хлортриметилсилана и 1,0 г (3,05 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 147 - 149oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,78 (т, 2H), 2,97 (т, 2H), 3,86 (с, 2H), 5,31 (с, 2H), 6,69 (с 1H), 7,2 (м, 7H), 7,58 (т, 1H), 7,75 (м, 3H), 7,78 (д, 1H), 7,94 (д, 1H), 8,08 (с, 1H); ИК (KBr) 3081, 2950, 1726, 1632, 1609, 1512, 1406, 1345, 1306, 1290, 1209, 1098, 1004, 820, 748, 696 см-1; МС (УИ) m/e 489 (M+H, 48), 384 (16), 341 (7), 236 (6), 149 (39), 119 (11), 105 (100).
Пример 138
6-[4-[3,4-дихлорфенилметокси] фенил] -4-окси-3-[(2- фенилэтил)тио]-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 2,0 г (6,80 ммоль) 4-[(3,4-дихлорфенил)метокси] ацетофенона, 2,28 г (13,61 ммоль) гексаметилдисилазида лития, 2,3 г (13,61 ммоль) хлортриметилсилана и 1,0 г (3,40 ммоль) сложного диэтилового эфира [(2- фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 168 - 169oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,78 (т, 2H), 2,97 (т, 2H), 5,22 (с, 1H), 6,69 (с, 1H), 7,17 (м, 8H), 7,47 (дд, 1H), 7,69 (д, 1H), 7,78 (д, 1H); ИК (KBr) 3054, 2602, 1713, 1611, 1512, 1399, 1291, 1179, 1109, 1042, 818, 754 см-1; МС (УИ) m/e 501 (17), 499 (24), 394 (12), 353 (1), 161 (20), 159 (27), 105 (100).
Пример 139
Сложный метиловый эфир 3-[[(4-окси-2-оксо-6-фенил-2Н-пиран-3- ил)тио] метил]бензойной кислоты
Целевое соединение получают по методу Б с использованием 2,0 г (10,63 ммоль) 4-окси-6-фенил-2Н-пиран-2-она, 3,57 г (10,63 ммоль) сложного 3-(карбометокси)фенил)метилового эфира п-толуолтиосульфокислоты, 10,63 мл 1 н. гидроокиси натрия и 20 мл этанола. Т.п. 170 - 171oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 3,78 (с, 3H), 4,06 (с, 2H), 6,72 (с, 1H), 7,42 (т, 1H), 7,53 (м, 4H), 7,78 (м, 3H), 7,83 (с, 1H); ИК (KBr) 3108, 2947, 1716, 1644, 1549, 1400, 1302, 1100, 770, 713, 523 см-1; МС (УИ) m/e 369 (M+H, 7), 337 (8), 235 (6), 189 (4), 149 (11), 85 (100).
Пример 140
Сложный метиловый эфир 4-[[(4-окси-2-оксо-6-фенил-2Н-пиран-3- ил)тио] метил]бензойной кислоты
Целевое соединение получают по методу Б с использованием 2,0 г (10,63 ммоль) 4-окси-6-фенил-2Н-пиран-2-она, 3,57 г (10,63 ммоль) сложного [4-(карбометокси)фенил]метилового эфира п-толуолтиосульфокислоты, 10,63 мл 1 н. гидроокиси натрия и 20 мл этанола. Т.п. 215 - 216oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 3,81 (с, 3H), 4,06 (с, 2H), 6,69 (с, 1H, J = Гц), 7,39 (д, 2H), 7,67 (м, 3H), 7,81 (м, 2H), 7,86 (д, 2H); ИК (KBr) 3110, 3038, 1717, 1644, 1547, 1402, 1279, 1103, 720, 526 см-1; МС (УИ) m/e 369 (M+H, 22), 235 (100), 207 (18), 189 (37), 151 (55), 119 (20), 105 (21), 85 (28).
Пример 141
6-[3,5-бис(трифторметил)фенил]-4-окси-3-[(фенилметил)тио]-2Н- пиран-2-он
Целевое соединение получают по методу A с применением 2,16 г (7,1 ммоль) триметилсилилового эфира 3',5'- трифторметилацетофенона (полученного в результате взаимодействия 15 г (58,55 ммоль) 3,5-дитрифторметилацетофенона и 13,01 г (58,55 ммоль) триметилсилилтриметилсульфоната в присутствии 11,84 г (117,10 ммоль) триэтиламина с последующей перегонкой) и 1,0 г (3,55 ммоль) сложного диэтилового эфира [(фенилметил)тио]пропандикарбоновой кислоты. Т.п. 80 - 82oC.
1H-ЯМР (400 МГц, CDCl3): δ = 4,0 (с, 2H), 6,61 (с, 1H), 7,22 (м, 2H), 7,28 (м, 3H), 7,97 (с, 1H), 8,25 (с, 2Н); ИК (KBr) 3090, 1726, 1682, 1638, 1549, 1530, 1385, 1281, 1182, 1138, 902, 700 см-1; МС (УИ) m/e 475 (M+29, 3), 447 (M+H, 21), 213 (1), 149 (2), 91 (100).
Пример 142
(+/-)-3-[1-[циклогексил)тио]-3-метилбутил]-4-окси-6-фенил-2Н- пиран-2-он
Целевое соединение получают по методу B с применением 1,5 г (7,98 ммоль) 4-окси-6-фенил-2Н-пиран-2-она, 0,76 г (8,78 ммоль) изовалерянового альдегида, 2,04 г (17,56 ммоль) циклогексилмеркаптана, 1,0 мл пиперидина, 1,0 мл уксусной кислоты и 20 мл этанола. Т.п. 210 - 212oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 0,89 (т, 6H), 1,36 (м, 6H), 1,44 (м, 1H), 1,56 (м, 2H), 1,69 (м, 2H), 1,81 (м, 1H), 2,08 (м, 2H), 2,61 (шир. м, 1Н), 4,22 (м, 1H), 6,67 (с, 1 H), 7,53 (м, 3H), 7,78 (м, 2H); ИК (KBr) 3106, 2928, 2851, 1659, 1568, 1404, 1125, 766, 569 см-1; МС (УИ) m/e 259 (50), 257 (49), 201 (46), 189 (16), 147 (8), 105 (28), 83 (100).
Пример 143
[4-[4-окси-2-оксо-3-[(2-фенилэтил)тио] -2H-пиран-6- ил] фенокси] ацетонитрил
Целевое соединение получают по методу A с применением 3,0 г (17,12 ммоль) подходящего ацетофенона, 3,8 г (17,12 ммоль) триметилсилилтрифторметил-сульфоната, 3,46 г (34,24 ммоль) триэтиламина и 2,53 г (8,56 ммоль) сложного диэтилового эфира [2-(фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 157 - 159oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,92 (т, 2H), 3,11 (т, 2H), 4,86 (с, 2 H), 6,56 (с, 2H), 7,08 (д, 2 H), 7,19 (т, 3H), 7,3 (м, 3 H), 7,86 (д, 2H); ИК (KBr) 2993, 2577, 1634, 1510, 1404, 1342, 1302, 1226, 1188, 1098, 1051, 833, 717, 505 см-1; МС (УИ) m/e 380 (100), 275 (60), 205 (8), 105 (94).
Пример 144
4-окси-3-[(2-изопропилфенил)тио]-6-фенил-2H-пиран-2-он
Целевое соединение получают по методу A с применением 1,24 г (6,45 ммоль) 1-фенил-1-(триметилсилилокси)этилена и 1,0 г (3,23 ммоль) сложного диэтилового эфира (2-изопропилфенил)тио] пропандикарбоновой кислоты.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,25 (д, 6H), 3,42 (м, 1H), 6,89 (с, 1H), 6,92 (дд, 1H), 7,06 (т, 1H), 7,13 (т, 1H), 7,28 (д, 1H), 7,56 (м, 3H), 7,85 (м, 2H); ИК (KBr) 3117, 2962, 1661, 1551, 1406, 1365, 1101, 760 см-1; МС (УИ): m/e 339 (100), 305 (4), 219 (25), 189 (11), 147 (9), 105 (9);
C20H18O3S1:
рассчит.: C 70,98; H 5,36;
найд.: C 70,82; H 5,24.
Пример 145
3-[(циклопропилметил)тио]-4-окси-6-фенил-2Н-пиран-2-он
0,053 г целевого соединения (т.п. 136 - 137oC) получают по методу Б с использованием 0,250 г (1,33 ммоль) 4-окси-6-фенил-2Н- пиран-2-она, 0,585 г (2,261 ммоль) циклопропилметил-п- толуолтиосульфоната, 0,158 г (1,46 ммоль) триэтиламина, 0,110 г (1,33 ммоль) бикарбоната натрия и 10,0 мл этанола.
1H-ЯМР (250 МГц, CDCl3): δ = 7,994 - 7,726 (м, 2H), 7,683 - 7,406 (м, 3H), 6,665 (с, 1H), 2,724 - 2,694 (д, 2 Н, J = 7,3 Гц), 1,063 - 0,903 (м, 1H), 0,608 - 0,533 (м, 2H), 0,270 - 0,208 (м, 2H).
Пример 146
6-(3-хлорфенил)-4-окси-3-[(4-фенилбутил)тио]-2Н-пиран-2-он
0,024 г целевого соединения (т.п. 123 - 124oC) получают по методу Б с использованием 0,250 г (1,13 ммоль) 6-(3-хлорфенил)-4- окси-2Н-пиран-2-она, 0,45 г (1,93 ммоль) 4-фенилбутил-п- толуолтиосульфоната, 0,115 г (1,13 ммоль) триэтиламина, 0,094 r (1,13 ммоль) бикарбоната натрия и 5,0 мл этанола.
1H-ЯМР (400 МГц, CDCl3): δ = 7,848 - 7,839 (м, 1H), 7,729 (м, 1H), 7,479 - 7,392 (м, 2H), 7,276 - 7,239 (м, 2H), 7,174 - 7,137 (м, 3H), 6,631 (с, 1H), 2,831 -2,794 (т, 2H), 2,633 - 2,596 (т, 2H), 1,747 - 1,686 (м, 2H), 1,649 - 1,591 (м, 2H).
Пример 147
4-окси-3-[(2-оксо-2-фенилэтил)тио]-6-фенил-2Н-пиран-2-он
Раствор 0,175 г (0,840 ммоль) 4-окси-3-меркапто-6-фенил-2- пирона (полученного описанным в источнике R.F. Harris, J.E. Dunbar, патент США N 3818 046, образом) в 3,0 мл дихлорметана в атмосфере азота обрабатывают сначала 0,12 мл (0,84 ммоль) триэтиламина, а потом 0,167 г (0,840 ммоль) бром-ацетофенона. Смесь перемешивают в течение 30 минут при комнатной температуре, после чего растворитель удаляют в вакууме. Остаток разбавляют диэтиловым эфиром и три раза экстрагируют насыщенным раствором карбоната натрия, взятым в количестве по 50 мл. Объединенные водные слои подкисляют конц. соляной кислотой и три раза экстрагируют дихлорметаном, взятым в количестве по 100 мл. Органические слои объединяют и сушат над сульфатом натрия. Растворитель удаляют в вакууме. При этом получают 0,066 r целевого соединения, которое сушат в вакууме. Т.п. 164 - 166oC.
1H-ЯМР (300 МГц, CDCl3): δ = 9,900 (шир.с, 1H), 7,970 (д, 2 Н, J=7,1 Гц), 7,810 (д, 2 H, J = 8 Гц), 7,615 (т, 1H, J = 4 Гц), 7,505 - 7,443 (м, 5H), 6,619 (с, 1H), 4,334 (с, 2H).
Пример 148
4-окси-3-[(2-фенилэтан-2-ол)тио-6-фенил-2Н-пиран-2-он
К перемешиваемому раствору 0,021 г (0,060 ммоль) 4-окси-3-[(2-оксо-2- фенил-этил)тио] -6-фенил-2Н-пиран-2-она в 1,0 мл тетрагидрофурана, охлажденного до 0oC, в атмосфере азота шприцем добавляют 0,05 мл (0,05 ммоль) 1,0 м. раствора BH3•ДМС в тетрагидрофуране. Смесь перемешивают в течение часа, после чего подают в смесь 4 н. соляной кислоты и метанола в соотношении 1:1. Смесь экстрагируют диэтиловым эфиром. Слои объединяют и сушат над сульфатом натрия. Растворитель удаляют в вакууме с получением 0,015 г целевого соединения в виде масла.
1H-ЯМР (200 МГц, CDCl3): δ = 7,873 - 7,777 (м, 4H), 7,516 - 7,153 (м, 6H), 6,667 (с, 1H), 4,820 - 4,755 (дд, 1H, J = 9,8 Гц, 3,2 Гц), 3,212 - 3,127 (дд, 1H, J = 13,8 Гц, 3,2 Гц), 2,920 (дд, 1H, J = 9,8 Гц, 13,8 Гц).
Пример 149
4-окси-5-метил-6-фенил-3-[фенилтио]-2Н-пиран-2-он
Раствор 1,50 мл (11,3 ммоль) пропиофенона в 40,0 мл дихлорметана охлаждают до 0oC в атмосфере азота и обрабатывают сначала 3,14 мл (22,6 ммоль) триэтиламина, потом 2,60 мл (13,5 ммоль) триметилсилилтрифторацетата. Раствор нагревают до комнатной температуры и перемешивают в течение 15 минут. Потом раствор подают в смесь 50 мл диэтилового эфира и 20 мл насыщенного водного раствора бикарбоната натрия. Слои разделяют и органический слой промывают 20 мл смеси солевого раствора и насыщенного раствора бикарбоната натрия в соотношении 1: 1. Эфирный раствор сушат над сульфатом натрия и растворитель удаляют в вакууме. Получаемый силилэноловый эфир подают в колбу, содержащую 1,00 г (3,76 ммоль) сложного диэтилового эфира 2-(тиофенил)пропан-1,3-дикарбоновой кислоты. Смесь нагревают до 140oC в течение 16 часов. Затем смеси дают охлаждаться до комнатной температуры, после чего смесь разбавляют диэтиловым эфиром и три раза экстрагируют насыщенным раствором карбоната натрия, взятым в количестве по 20 мл. Водные слои объединяют, три раза промывают диэтиловым эфиром, взятым в количестве по 75 мл, и осторожно подкисляют конц. соляной кислотой. Потом смесь три раза экстрагируют дихлорметаном, взятым в количестве по 200 мл, органические слои объединяют и сушат над сульфатом натрия. Растворитель удаляют в вакууме с получением 0,350 г целевого соединения. Т.п. 166 - 167oC.
1H-ЯМР (400 МГц, ДMCO-d6): δ = 6,309 - 6,285 (м, 2H), 6,227 - 6,211 (м, 3H), 5,983 (т, 2H, J=8 Гц) 5,862 (д, 3H, J=8 Гц), 0,705 (с, 3 H).
Пример 150
[4-[4-окси-2-оксо-3-(фенилтио)-2Н-пиран-6-ил]фенокси]-уксусная кислота
Раствор 2,50 г (10,86 ммоль) сложного метилового эфира 4-(1- оксоэтил)феноксиуксусной кислоты в 25,0 мл дихлорметана охлаждают до 0oC в атмосфере азота и обрабатывают сначала 3,03 мл (21,7 ммоль) триэтиламина, потом 2,52 мл (13,0 ммоль) триметилсилилтрифторацетата. Раствор нагревают до комнатной температуры и перемешивают в течение 15 минут. Потом раствор подают в смесь 50 мл диэтилового эфира и 20 мл насыщенного водного раствора бикарбоната натрия. Слои разделяют и органический слой промывают 20 мл смеси солевого раствора и насыщенного раствора бикарбоната натрия в соотношении 1: 1. Эфирный раствор сушат над сульфатом натрия и растворитель удаляют в вакууме. Получаемый силилэноловый эфир подают в колбу, содержащую 0,97 г (3,6 ммоль) сложного диэтилового эфира 2-(тиофенил)пропан-1,3-дикарбоновой кислоты. Смесь нагревают до 140oC в течение 16 часов. Затем смеси дают охлаждаться до комнатной температуры, после чего смесь подвергают хроматографии на силикагеле с размерами частиц 230 - 400 меш с применением в качестве элюента сначала 100%-ного дихлорметана, а затем его смесь с метанолом в соотношении до 98:2. Получают твердый продукт, который разбавляют 20 мл диэтилового эфира и три раза экстрагируют насыщенным раствором карбоната натрия, взятым в количестве по 20 мл. Водные слои объединяют, три раза промывают диэтиловым эфиром, взятым в количестве по 100 мл, и осторожно подкисляют конц. соляной кислотой до достижения pH 0. Потом смесь три раза экстрагируют этилацетатом, взятым в количестве по 100 мл, органические слои объединяют и сушат над сульфатом натрия. Растворитель удаляют в вакууме с получением 0,695 г целевого соединения. Т.п. 186 -188oC.
1H-ЯМР (300 МГц, ДМСО-d6): δ = 13,175 (шир.с, 1Н), 12,425 (шир.с, 1H), 7,809 (д, 2H, J = 9 Гц), 7,298 - 7,247 (м, 2H), 7,149 - 7,004 (м, 5H) 6,785 (с, 1H), 4,804 (с, 2H).
Пример 151
[4-[4-окси-5-метил-2-оксо-3-(фенилтио)-2Н-пиран-6-ил] фенокси]- уксусная кислота
0,691 г (т.п. 194 - 197oС) целевого соединения получают подобным образом, что и [4- [4-окси-2-оксо-3-(фенилтио)-2Н-пиран-6- ил]фенокси]-уксусную кислоту. При этом применяют 2,00 г (8,81 ммоль) сложного метилового эфира 4-(1-оксо-этил)феноксиуксусной кислоты, 3,68 мл (26,4 ммоль) триэтиламина, 2,38 мл (12,3 ммоль) триметилсилилтрифторацетата, 20,0 мл дихлорметана и 1,34 г (5,00 ммоль) сложного диэтилового эфира 2-(тиофенил)пропан-1,3- дикарбоновой кислоты.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 7,585 (д, 2H, J = 9 Гц), 7,325 - 7,286 (м, 2H), 7,178 (д, 3H, J=7,5 Гц), 7,063 (д, 2 Н, J = 9 Гц), 4,784 (с, 2H), 2,042 (с, 3H).
Пример 152
4-окси-3-фенокси-6-фенил-2Н-пиран-2-он
B автоклав подают 8,11 г (0,032 моль) сложного диэтилового эфира 2-феноксипропандикарбоновой кислоты и 12,35 г (0,064 моль) 1-фенил-1- (триметилсилилокси)этилена. Давление в реакторе доводят до 42,19 кг/см2 в атмосфере азота. Смесь кипятят при 100oC в течение 8 часов, потом еще в течение 63,5 часов при температуре 147 - 154oC. Реактор охлаждают до комнатной температуры и промывают этилацетатом. Сырой продукт подвергают флеш-хроматографии с применением в качестве элюента смеси гексана и этилацетата в соотношении 1 : 1 с получением частично очищенного продукта, который потом подвергают флеш-хроматографии на силикагеле с применением в качестве элюента смесей гексана и этилацетата в соотношениях 95:5-40:60. Получаемое твердое вещество перекристаллизуют из диэтилового эфира и этилацетата с получением 1,64 г (18%) целевого соединения, т.п. 215 - 219oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 6,90 (с, 1H), 6,95 (дд, 2H), 7,02 (т, 1H), 7,28 - 7,33 (м, 2H), 7,52 - 7,56 (м, 3H), 7,80 - 7,856 (м, 2H), 12,0 (шир.с, 1H).
Пример 153
4-окси-3-[(фенилметил)тио]-6-(3-пиридинил)-2Н-пиран-2-он
Целевое соединение получают по методу A в результате конденсации триметилсилилэнолового эфира 3-ацетилпиридина со сложным диэтиловым эфиром [(фенилметил)тио]пропандикарбоновой кислоты. Т.п. 183 - 184oC.
ЯМР (ДМСО-d6): δ = 4,02 (с, 2H), 6,83 (с, 1H), 7,20 (м, 1H), 7,26 (д, 4H), 7,55 (м, 1H) 8,16 (м, 1H), 8,69 (м, 1H), 8,98 (д, 1H).
Пример 154
6-(2,6-диметил-4-пиридинил)-4-окси-3-[(фенилметил)тио]-2Н- пиран-2-он
Целевое соединение получают по методу A в результате конденсации триметилсилилэнолового эфира 4-ацетил-2,6- диметилпиридина со сложным диэтиловым эфиром [(фенилметил)тио]пропандикарбоновой кислоты. Т.п. 88 - 90oC.
ЯМР (ДМСО-d6): δ = 2,55 (с, 6H), 4,02 (с, 2H), 6,85 (с, 1H), 7,16- 7,28 (м, 5H), 7,40 (с, 2H).
Пример 155
4-окси-3-[(фенилметил)тио]-6-(3-тиенил)-2Н-пиран-2-он
Целевое соединение получают по методу A в результате конденсации триметилсилилэнолового эфира 3-ацетилтиофена со сложным диэтиловым эфиром [(фенилметил)тио]пропандикарбоновой кислоты. Т.п. 150 - 151oC.
ЯМР (ДМСО-6): δ = 3,98 (с, 2H), 6,58 (с, 1H), 7,24 (м, 5H), 7,48 (м, 1H), 7,72 (м, 1H) 8,13 (д, 1H).
Пример 156
3-[(2,6-диметилфенил)метил]тио]-4-окси-6-фенил-2Н-пиран-2-он
Целевое соединение получают по методу Б с использованием 1,00 г (5,31 ммоль) 4-окси-6-фенил-2Н-пиран-2-она, 15 мл этанола, 5,31 мл 1 н. гидроокиси натрия и 1,62 г (5,31 ммоль) (2,6- диметилфенил)метил-п-толуолтиосульфоната. Т.п. 231 - 233oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,34 (6H, с), 4,01 (с, 2H), 6,81 (м, 2H), 7,03 (м, 3H), 7,53 (м, 3H) 7,82 (м, 2H).
Пример 157
4-окси-6-фенил-3-[[(3-феноксифенил) метил)тио]-2Н-пиран-2-он
Целевое соединение получают по методу Б с использованием 1,00г (5,31 ммоль) 4-окси-6-фенил-2Н-пиран-2-она, 15 мл этанола, 5,31 мл 1 н. гидроокиси натрия и 1,96 г (5,31 ммоль) (3-феноксифенил)метил- п-толуолтиосульфоната. Т.п. 131 - 133oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 3,97 (с, 2H), 6,73 (с, 1H), 6,87 (м, 4H), 7,03 (м, 2H), 7,27 (м, 3H) 7,53 (м, 3H), 7,78 (м, 2H).
Пример 158
(+/-)3-[1-[(циклогексилметил)тио] -3-метилбутил] -4-окси-6- фенил-2Н-пиран-2-он
Целевое соединение получают по методу B с использованием 1,00 г (5,31 ммоль) 4-окси-6-фенил-2Н-пиран-2-она, 10 мл этанола, 0,462 мл (5,84 ммоль) изовалерянового альдегида, 1,79 г (13,8 ммоль) циклогексилметилтиола, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. 146 - 148oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 0,58 (д, 6H), 1,11 (м, 5H), 1,57 (м, 8H), 2,07 (м, 1H), 2,28 (дд, 1H), 2,38 (дд, 1 н), 4,17 (дд, 1H), 6,69 (с, 1H), 7,54 (м, 3H), 7,75 (м, 2H), 11,71 (шир. с, 1H).
Пример 159
(+/-)-3-[1-[циклогексилметил)тио] фенилметил]-4-окси-6-фенил- 2Н-пиран-2-он
Целевое соединение получают по методу B с использованием 1,00 г (5,31 ммоль) 4-окси-6-фенил-2Н-пиран-2-она, 10 мл этанола, 0,593 мл (5,84 ммоль) бензальдегида, 1,79 г (13,8 ммоль) циклогексилметилтиола, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. 138 - 141oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 0,89 (м, 2H), 1,21 (м, 3H), 1,42 (м, 1H), 1,61 (м, 3H), 1,75 (м, 2H), 2,39 (м, 2H), 5,30 (с, 1H), 6,71 (с, 1H), 7,26 (т, 1H), 7,28 (т, 2H), 7,53 (м, 5H), 7,74 (м, 2H).
Пример 160
4-окси-6-[4-(2-оксиэтокси)фенил]-3-[(2-фенилэтил)тио]-2Н- пиран-2-он
К раствору 0,30 г (0,70 ммоль) сложного этилового эфира [4-[4-окси-2-оксо-3-[(2-фенилэтил)тио] -2Н-пиран-6-ил] - фенокси]уксусной кислоты в 7 мл тетрагидрофурана добавляют 0,5 мл (1,00 ммоль) 2,0 м. боргидрида лития. Реакционную смесь перемешивают в течение ночи. Затем к смеси добавляют 2,0 мл 1 н. хлористоводородной кислоты и разбавляют 50 мл этилацетатом. Органический слой отделяют, промывают насыщенным раствором хлористого натрия и сушат над безводным сульфатом магния. Растворители упаривают в вакууме и сырой продукт очищают путем колоночной хроматографии на силикагеле с размерами частиц 230 - 400 меш с применением в качестве элюента сначала смеси этилацетата и гексанов в соотношении 50:50, а потом 100% этилацетата. Т.п. 123 - 125oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,77 (т, 2H), 2,97 (т, 2H), 3,37 (м, 2H), 4,07 (т, 2H), 4,92 (шир. с, 1H), 6,68 (с, 1H), 7,09 (д, 2H), 7,19 (м, 5H), 7,75 (д, 2H).
Пример 161
Сложный этиловый эфир 3-[4-окси-2-оксо-3-[(2-фенилэтил]тио]- 2Н-пиран-6-ил]фенокси]уксусной кислоты
Целевое соединение получают по методу A с использованием 2,00 г (9,00 ммоль) (3-ацетилфенокси)ацетата, 4,18 мл (21,62 ммоль) триметилсилилтрифторацетата, 5,01 мл (36,00 ммоль) триэтиламина, 23 мл хлористого метилена и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 116 - 119oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,22 (т, 3H), 2,77 (т, 2H), 3,05 (т, 2H), 4,89 (д, 2H), 6,80 (с, 1H), 7,20 (м, 7H), 7,44 (м, 2H).
Пример 162
4-окси-6-[4-[(5-метил-3-фенил-4-изоксазолил)метокси] фенил]-3- [(2-фенилэтил)тио]-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 2,00 г (6,51 ммоль) 4'-[(5-метил-3-фенил-4- изоксазолил)метокси] ацетофенона, 1,51 мл (7,81 ммоль) триметилсилилтрифторацетата, 1,81 мл (13,02 ммоль) триэтиламина, 16 мл хлористого метилена и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]пропандикарбоновой кислоты, т.п. 126 - 128oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,54 (с, 3H), 2,77 (т, 2H), 2,98 (т, 2H), 5,08 (с, 2H), 6,69 (с, 1H) 7,21 (м, 7H), 7,49 (м, 3H), 7,71 (м, 2H), 7,77 (д, 2H).
Пример 163
6-(3,5-диметилфенил)-4-окси-3-(фенилтио)-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 1,43 г (9,70 ммоль) 3', 5'-диметилацетофенона, 2,24 мл (11,64 ммоль) триметилсилилтрифторацетата, 2,70 мл (19,40 ммоль) триэтиламина, 24 мл хлористого метилена и 1,00 г (7,46 ммоль) сложного диэтилового эфира (фенилтио)-пропандикарбоновой кислоты. Т.п. 210 - 211oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,35 (с, 6H), 6,83 (с, 1H), 7,12 (м, 3H), 7,21 (с, 1H), 7,27 (т, 2H), 7,46 (с, 2H).
Пример 164
(+/-)-3-[1-[циклопентилтио]-2-циклопропилэтил]-4-окси-6- фенил-2H-пиран-2-он
Целевое соединение получают по методу B с использованием 1,00 г (5,31 ммоль) 4-окси-6-фенил-2Н-пиран-2-она, 10 мл этанола, 0,892 г (10,62 ммоль) циклопропилметилкарбоксальдегида, 1,43 мл (13,8 ммоль) циклопентилтиола, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. 75 - 80oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 0,04 (м, 2H), 0,07 (м, 2H), 0,66 (м, 1H), 1,53 (м, 7H), 1,94 (м, 3H), 3,19 (м, 1H), 4,21 (дд, 1H), 6,71 (с, 1H), 7,54 (м, 3H), 7,76 (м, 2H).
Пример 165
N-[3-[4-окси-2-оксо-3-[(2-фенилэтил)тио] -2Н-пиран-6-ил] фенил] -4-метил-бензолсульфонамид
Целевое соединение получают по методу A с использованием 1,38 г (5,06 ммоль) 3'-(п-толуолсульфонамид)ацетофенона, 2,34 мл (12,41 ммоль) триметилсилилтрифторацетата, 2,82 мл (20,24 ммоль) триэтиламина, 18 мл хлористого метилена и 1,00 г (3,37 ммоль) сложного диэтилового эфира [(2-фенил-этил)тио]пропандикарбоновой кислоты. Т.п. 133 - 135oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,32 (с, 3H), 2,77 (т, 2H), 3,09 (т, 2H), 6,68 (с, 1H), 7,19 (м, 6H), 7,40 (м, 4H), 7,53 (с, 1H), 7,67 (д, 2H), 10,50 (с, 1H), 12,03 (шир.с, 1H).
Пример 166
(+/-)-3-[циклопентил(циклопентилтио)метил]-4-окси-6-фенил-2Н- пиран-2-он
Целевое соединение получают по методу B с использованием 1,00 г (5,31 ммоль) 4-окси-6-фенил-2Н-пиран-2-она, 10 мл этанола, 0,780 г (7,96 ммоль) циклопентанкарбоксальдегида, 1,43 мл (13,8 ммоль) циклопентилтиола, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. 139 - 142oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,03 (м, 1H), 1,64 (м, 15H), 2,64 (м, 1H), 3,00 (м, 1H), 3,84 (д, 1H), 6,69 (с, 1H), 7,52 (м, 3H), 7,76 (м, 2H), 11,55 (шир.с, 1H).
Пример 167
6-(1,1'-бифен-3-ил)-4-окси-3-[(2-изопропилфенил)тио]-2Н-пиран- 2-он
Целевое соединение получают по методу A с использованием 0,946 г (4,83 ммоль) 3'-фенилацетофенона, 1,12 мл (5,79 ммоль) триметилсилилтрифторацетата, 1,34 мл (9,66 ммоль) триэтиламина, 17 мл хлористого метилена и 1,00 г (3,22 ммоль) сложного диэтилового эфира [(2-изопропилфенил)тио]-пропандикарбоновой кислоты. Т.п. 193 - 195oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,25 (д, 6H), 3,43 (м, 1H), 6,95 (д, 1H), 7,02 (с, 1H), 7,06 (т, 1H), 7,13 (т, 1H), 7,28 (д, 1H), 7,42 (т, 1H), 7,51 (т, 2H), 7,66 (т, 1H), 7,75 (д, 2H), 7,85 (т, 2H), 8,07 (с, 1H).
Пример 168
4-окси-6-фенил-3-[(2-пропилфенил)тио]-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 0,990 мл (4,83 ммоль) 1-фенил-1-(триметилсилилокси)этилена и 1,00 г (3,22 ммоль) сложного диэтилового эфира [(2-пропилфенил)тио]- пропандикарбоновой кислоты. Т.п. 158 - 160oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 0,972 (т, 3H), 1,64 (м, 2H), 2,71 (т, 2H), 6,87 (с, 1H), 6,92 (м, 1H), 7,06 (м, 2H), 7,16 (м, 1H), 7,55 (м, 3H), 7,85 (м, 2H).
Пример 169
6-(3,5-диметилфенил)4-окси-3-[(2-изопропилфенил)тио]-2Н-пиран- 2-он
Целевое соединение получают по методу A с использованием 0,714 r (4,83 ммоль) 3', 5'-диметилацетофенона, 1,12 мл (5,79 ммоль) триметилсилилтрифторацетата, 1,34 мл (9,66 ммоль) триэтиламина, 17 мл хлористого метилена и 1,00 r (3,22 ммоль) сложного диэтилового эфира [(2-изопропилфенил)тио]-пропандикарбоновой кислоты. Т.п. 154 - 155oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,24 (д, 6H), 2,35 (с, 6 Н), 3,40 (м, 1H), 6,90 (д, 1H), 7,05 (т, 1H), 7,11 (дт, 2H), 7,20 (с, 1H), 7,27 (д, 1H), 7,45 (с, 2H).
Пример 170
4-окси-6-(4-оксифенил)-3-[(2-изопропилфенил)тио]-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 0,657 г (4,83 ммоль) 4'-оксиацетофенона, 2,05 мл (10,62 ммоль) триметилсилилтрифторацетата, 2,69 мл (19,32 ммоль) триэтиламина, 20 мл хлористого метилена и 1,00 г (3,22 ммоль) сложного диэтилового эфира [(2-изопропилфенил)тио]-пропандикарбоновой кислоты. Т.п. 250oC (разл.).
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,24 (д, 6H), 3,40 (м, 1H), 6,70 (с, 1H), 6,90 (т, 3H), 7,05 (т, 1H) 7,10 (т, 1H), 7,26 (д, 1H), 7,70 (д, 2H).
Пример 171
3-[(2-(циклопропилметил)фенил]тио]-4-окси-6-фенил-2Н-пиран-2- он
Целевое соединение получают по методу A с использованием 0,990 мл (4,83 ммоль) 1-фенил-1-(триметилсилилокси)этилена и 1,00 г (3,10 ммоль) сложного диэтилового эфира [[(2- (циклопропилметил)фенил]тио]-пропандикарбоновой кислоты. Т.п. 165 - 167oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 0,25 (дд, 2H), 0,52 (дд, 2H), 1,21 (м, 1H), 2,50 (д, 2H), 6,87 (с, 1H), 6,92 (м, 1H), 7,05 (м, 2H), 7,32 (м, 1H), 7,56 (м, 3H), 7,86 (м, 2H).
Пример 172
4-окси-3-[(2-изопропилфенил)тио] -6-[4-(пиридин-3- илметокси)фенил]-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 1,09 г (4,83 ммоль) 4'-(пиридин-3-илметокси)ацетофенона, 1,12 мл (5,79 ммоль) триметилсилилтрифторацетата, 1,34 мл (9,66 ммоль) триэтиламина, 17 мл хлористого метилена и 1,00 г (3,22 ммоль) сложного диэтилового эфира [(2-изопропилфенил)тио]-пропандикарбоновой кислоты. Т.п. 225oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,23 (д, 6H), 3,41 (м, 1H), 5,26 (с, 2H), 6,78 (с, 1H), 6,90 (д, 1H), 7,08 (дт, 2H), 7,21 (д, 2H), 7,29 (д, 1H), 7,45 (дд, 1H), 7,82 (д, 2H), 7,91 (д, 1H), 8,56 (д, 1H), 8,71 (с, 1H).
Пример 173
Сложный этиловый эфир 4-[4-окси-5-[(2-изопропилфенил)тио]-6- оксо-6Н-пиран-2-ил]феноксиуксусной кислоты
Целевое соединение получают по методу A с использованием 2,14 г (9,67 ммоль) сложного этилового эфира (4-ацетил-фенокси)уксусной кислоты, 4,48 мл (23,20 ммоль) триметилсилилтрифторацетата, 12,93 мл (38,6 ммоль) триэтиламина, 20 мл хлористого метилена и 2,00 г (6,45 ммоль) сложного диэтилового эфира [(2-изопропилфенил)тио]- пропандикарбоновой кислоты. Т.п. 194-196oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,57 (м, 9H), 3,41 (м, 1H), 4,81 (кв, 2H), 4,89 (с, 2H), 6,75 (с, 1H), 6,90 (д, 1H), 7,05 (м, 4H), 7,26 (д, 1H), 7,79 (д, 2H).
Пример 174
4-[4-окси-5-[(2-изопропилфенил)тио] -6-оксо-6Н-пиран-2-ил] - феноксиуксусной кислоты
К 0,319 г (0,75 ммоль) сложного этилового эфира 4-[4-окси-5- [(2-изопропилфенил)тио]-6-оксо-6Н-пиран-2-ил]феноксиуксусной кислоты в 10 мл тетрагидрофурана добавляют 1,80 мл (1,81 ммоль) 1 н. гидроокиси натрия. Реакционную смесь перемешивают в течение 1,5 часов, после чего к смеси добавляют 10 мл воды с последующим подкислением конц. хлористоводородной кислотой до достижения pH 2. Водный слой два раза экстрагируют этилацетатом, взятым в количестве по 100 мл. Объединенные органические экстракты промывают насыщенным раствором хлористого натрия и сушат над безводным сульфатом магния. После упаривания растворителей в вакууме сырой продукт очищают путем колоночной хроматографии на силикагеле с размерами частиц 230-400 меш с применением в качестве элюента смеси хлористого метилена, метанола и уксусной кислоты в соотношении 94 : 5 : 1. Т.п. 217oC (разл.).
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,25 (д, 6H), 3,42 (м, 1H), 4,79 (с, 2H), 6,75 (с, 1H), 6,90 (д, 1H), 7,06 (м, 4H), 7,26 (д, 1H), 7,79 (д, 2H).
Пример 175
4-окси-3-[(2-изопропилфенил)тио]-6-(4-метоксифенил)-2Н-пиран- 2-он
Целевое соединение получают по методу A с использованием 2,26 г (15,1 ммоль) 4'-метоксиацетофенона, 3,5 мл (18,1 ммоль) триметилсилилтрифторацетата, 4,26 мл (30,6 ммоль) триэтиламина, 30 мл хлористого метилена и 3,11 г (10,0 ммоль) сложного диэтилового эфира [(2-изопропилфенил)тио]-пропандикарбоновой кислоты. Т.п. 221 - 223oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,25 (д, 6H), 3,40 (м, 1H), 3,85 (с, 3H), 6,78 (с, 1H), 6,92 (м, 1H), 7,10 (м, 4H), 7,27 (м, 1H), 7,81 (д, 2H), 12,38 (шир.с, 1H).
Пример 176
4-окси-3-[(2-изопропилфенил)тио]-6-(4-метилфенил)-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 2,02 г (15,1 ммоль) 4'-метилацетофенона, 3,5 мл (18,1 ммоль) триметилсилилтрифторацетата, 4,26 мл (30,6 ммоль) триэтиламина, 30 мл хлористого метилена и 3,11 г (10,0 ммоль) сложного диэтилового эфира [(2-изопропилфенил)тио]пропандикарбоновой кислоты. Т.п. 191 - 193oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,25 (д, 6H), 2,39 (с, 3H), 3,41 (м, 1H), 6,84 (с, 1H), 6,92 (м, 1H), 7,10 (м, 2H), 7,27 (м, 1H), 7,37 (м, 2H), 7,75 (д, 2H).
Пример 177
6-(3,4-дихлорфенил)-4-окси-3-[(2-изопропилфенил)тио]-2Н-пиран- 2-он
Целевое соединение получают по методу A с использованием 2,46 г (12,8 ммоль) 3', 4'-дихлорацетофенона, 3,0 мл (15,4 ммоль) триметилсилилтрифторацетата, 3,6 мл (26,0 ммоль) триэтиламина, 30 мл хлористого метилена и 4,0 г (12,8 ммоль) сложного диэтилового эфира [(2-изопропилфенил)тио]пропандикарбоновой кислоты. Т.п. 204 - 207oC.
1H-ЯМР (400 МГц, CDCl3): δ = 1,33 (д, 6H), 3,55 (м, 1H), 6,71 (с, 1H), 7,00 (м, 1H), 7,08 (м, 1H), 7,20 (м, 1H), 7,30 (м, 1H), 7,56 (д, 1H), 7,69 (м, 1H), 7,74 (шир. 1H), 7,98 (с, 1H).
Пример 178
6-(4-хлорфенил)-4-окси-3-[(2-изопропилфенил)тио]-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 2,33 г (15,1 ммоль) 4'-хлорацетофенона, 3,5 мл (18,1 ммоль) триметилсилилтрифторацетата, 4,26 мл (30,6 ммоль) триэтиламина, 30 мл хлористого метилена и 3,11 г (10,0 ммоль) сложного диэтилового эфира [(2-изопропилфенил)тио]пропандикарбоновой кислоты. Т.п. 148 - 151oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,25 (д, 6H), 3,41 (м, 1H), 6,86 (с, 1H), 6,92 (м, 1H), 7,08 (м, 2H), 7,27 (м, 1H), 7,62 (м, 2H), 7,86 (м, 2H).
Пример 179
Сложный этиловый эфир 4-[4-окси-5-[(2-изопропилфенил)тио]-6- оксо-6Н-пиран-2-ил]бензойной кислоты
Целевое соединение получают по методу A с использованием 2,93 г (15,1 ммоль) сложного этилового эфира 4-ацетилбензойной кислоты, 3,5 мл (18,1 ммоль) триметилсилилтрифторацетата, 4,26 мл (30,6 ммоль) триэтиламина, 30 мл хлористого метилена и 3,11 г (10,0 ммоль) сложного диэтилового эфира [(2- изопропилфенил)тио]пропандикарбоновой кислоты. Т.п. 201 - 203oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,25 (д, 6H), 1,35 (т, 3H), 3,42 (м, 1H), 4,35 (кв, 2H), 6,94 (м, 1H), 7,00 (с, 1H), 7,10 (м, 2H), 7,28 (м, 1H), 7,99 (м, 2H), 8,11 (м, 2H).
Пример 180
4-окси-6-(3-оксифенил)-3-[(2-изопропилфенил)тио]-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 2,06 г (15,1 ммоль) 3'-оксиацетофенона, 7,0 мл (36,2 ммоль) триметилсилилтрифторацетата, 8,52 мл (61,1 ммоль) триэтиламина, 30 мл хлористого метилена и 3,11 г (10,0 ммоль) сложного диэтилового эфира [(2-изопропилфенил)тио]пропандикарбоновой кислоты. Т.п. 201 - 204oC.
1H-ЯМР (250 МГц, ДМСО-d6): δ = 1,25 (д, 6H), 3,41 (м, 1H), 6,82 (с, 1H), 6,93 (м, 2H), 7,09 (м, 2H), 7,30 (м, 4H), 9,91 (шир., 1H).
Пример 181
4-окси-3-[(2-изопропилфенил)тио]-2Н-6-(2-фенилэтил-1-ен)- пиран-2-он
Целевое соединение получают по методу A с использованием 2,23 г (15,1 ммоль) транс-4-фенил-3-бутен-2-она, 3,5 мл (18,1 ммоль) триметилсилилтрифторацетата, 4,26 мл (30,6 ммоль) триэтиламина, 30 мл хлористого метилена и 3,11 г (10,0 ммоль) сложного диэтилового эфира [(2- изопропилфенил)тио]-пропандикарбоновой кислоты. Т.п. 190 - 192oC.
1H-ЯМР (400 МГц, ДMCO-d6): δ = 1,25 (д, 6H), 3,40 (м, 1H), 6,44 (с, 1H), 6,89 (м, 1H), 7,10 (м, 3H), 7,27 (м, 1H), 7,40 (м, 4H), 7,71 (д, 2H).
Пример 182
6-(1,1'-бифен-4-ил)-4-окси-3-[(2-изопропилфенил)тио]-2Н-пиран- 2-он
Целевое соединение получают по методу A с использованием 3,06 г (15,1 ммоль) 4-ацетилбифенила, 3,5 мл (18,1 ммоль) триметилсилилтрифторацетата, 4,26 мл (30,6 ммоль) триэтиламина, 30 мл хлористого метилена и 3,11 г (10,0 ммоль) сложного диэтилового эфира [(2-изопропилфенил)тио]пропандикарбоновой кислоты. Т.п. 203 - 206oC.
1H-ЯМР (250 МГц, ДМСО-d6): δ = 1,26 (д, 6H), 3,40 (м, 1H), 6,94 (м, 2H), 7,10 (м, 2H), 7,28 (м, 1H), 7,51 (м, 3H), 7,77 (м, 2H), 7,91 (кв, 4H).
Пример 183
6-(1,1'-бифенил-3-ил)-4-окси-3-[(нафтален-2-ил)тио]-2Н-пиран- 2-он
Целевое соединение получают по методу A с использованием 2 г (10,20 ммоль) 3'-фенилацетофенона, 2,27 г (10,20 ммоль) триметилсилилтрифторацетата, 2,06 г (20,40 ммоль) триэтиламина, 20 мл хлористого метилена и 1,62 г (5,1 ммоль) сложного диэтилового эфира [2-(нафтален-2-ил)тио]пропандикарбоновой кислоты. Т.п. 183 - 185oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 7,07 (с, 1H), 7,33 (дд, 1H), 7,39 - 7,58 (м, 5H), 7,66 (с, 1H), 7,69 (д, 1H), 7,78 (д, 1H), 7,81 - 7,92 (м, 6H), 8,11 (с, 1H).
Пример 184
4-окси-3-[(нафтален-1-ил)тио]-6-фенил-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 1,95 г (10,14 ммоль) 1-фенил-1-(триметилсилилокси)этилена и 1,61 г (5,07 ммоль) сложного диэтилового эфира [(1-нафтил)тио] пропандикарбоновой кислоты. Т.п. 242 - 243oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 6,83 (с, 1H), 7,19 (д, 1H), 7,39 (т, 1H), 7,64 - 7,42 (м, 5H), 7,69 (д, 1H), 7,83 (м, 2H), 7,94 (д, 1H), 8,28 (д, 1H).
Пример 185
6-(1,1'-бифенил-3-ил)-3-[[2-(циклопропилметил)фенил] тио] - 4-окси-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 2 г (10,20 ммоль) 3'-фенилацетофенона, 2,27 г (10,20 ммоль) триметилсилилтрифторацетата, 2,06 г (20,40 ммоль) триэтиламина, 20 мл хлористого метилена и 1,14 г (5,1 ммоль) сложного диэтилового эфира [[2-(циклопропилметил)фенил]тио]-пропандикарбоновой кислоты. Т.п. 88oC.
1H-ЯМР (400 МГц, ДMCO-d6): δ = 0,25 (д, 2H), 0,53 (дд, 2H), 1,14 (м, 1H), 2,67 (д, 2H), 6,94 (м, 1H), 7,03 (с, 1H), 7,11 (м, 2H), 7,33 (м, 1H), 7,44 (д, 1H), 7,53 (т, 2H), 7,67 (т, 1H), 7,75 (д, 2H), 7,86 (м, 2H), 8,08 (с, 1H).
Пример 186
3-[[2-(циклопропилметил)фенил] тио]-6-(3,5-диметил-фенил)-4- окси-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 2 г (13,51 ммоль) 3,3'-диметилацетофенона, 3 г (13,1 ммоль) триметилсилилтрифторацетата, 2,73 г (27,02 ммоль) триэтиламина, 20 мл хлористого метилена и 2,18 г (6,76 ммоль) сложного диэтилового эфира [[2- (циклопропилметил)фенил]-тио] пропандикарбоновой кислоты, т.п. 168oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 0,28 (д, 2H), 0,39 (дд, 2H), 1,13 (м, 1H), 2,36 (с, 6H), 2,67 (д, 2H), 6,85 (с, 1H), 6,92 (м, 1H), 7,11 (м, 2H), 7,22 (с, 1H), 7,33 (м, 1H), 7,47 (с, 2 Н).
Пример 187
6-(1,1'-бифенил-3-ил)-4-окси-3-[(2-изобутилфенил)тио]-2Н- пиран-2-он
Целевое соединение получают по методу A с использованием 2 г (10,20 ммоль) S'-фенилацетофенона, 2,27 г (10,2 ммоль) триметилсилилтрифторацетата, 2,06 г (20,40 ммоль) триэтиламина, 20 мл хлористого метилена и 1,14 г (5,1 ммоль) сложного диэтилового эфира [(2-изобутилфенил)тио]пропандикарбоновой кислоты. Т.п. 187 - 188oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 0,83 (д, 6H), 1,78 (м, 1H), 2,4 (д, 2H), 7,03 (с, 1H), 7,08 (с, 4H), 7,44 (т, 1H), 7,53 (т, 2H), 7,67 (т, 1H), 7,75 (с, 1H), 7,78 (с, 1H), 7,86 (м, 2H), 8,08 (с, 1H).
Пример 188
4-окси-3-[(2-изобутилфенил)тио]-6-фенил-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 1,96 г (10,20 ммоль) 1-фенил-1-(триметилсилилокси)этилена и 1,64 г (5,1 ммоль) сложного диэтилового эфира [(2-изобутилфенил)тио] пропандикарбоновой кислоты, Т.п. 195oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 0,83 (д, 6H), 1,64 (м, 1H), 2,39 (д, 2H), 6,89 (с, 1H), 7,06 (с, 4H), 7,56 (м, 3H), 7,86 (м, 2H).
Пример 189
4-окси-3-[(2-изопропилфенил)тио] -6-[4-(пиридин-3-ил)фенил] -2Н- пиран-2-он
Целевое соединение получают по методу A с использованием 1 г (3,22 ммоль) сложного диэтилового эфира [(2-изопропилфенил)тио]пропандикарбоновой кислоты, 1,18 г (5,31 ммоль) триметилсилилтрифторацетата, 0,98 г (9,66 ммоль) триэтиламина и 0,95 г (4,83 ммоль) 3-(пиридин-3-ил)ацетофенона. Т.п. 145 -147oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,25 (д, 6H), 3,4 (м, 1H), 6,89 (с, 1H), 6,92 (д, 1H), 7,06 (м, 2H), 7,25 (д, 1H), 7,53 (м, 1H), 7,69 (т, 1H), 7,89 (д, 2H), 8,14 (с, 1H), 8,22 (д, 1H), 8,61 (шир.с, 1H), 8,97 (шир.с, 1H).
Пример 190
4-окси-3-[(2-изопропилфенил)тио]-6-(3-метилфенил)-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 0,87 г (6,46 ммоль) 3'-метилацетофенона, 1,44 г (6,46 ммоль) триметилсилилтрифторацетата, 0,653 г (6,46 ммоль) триэтиламина, 20 мл хлористого метилена и 1,0 г (3,23 ммоль) сложного диэтилового эфира [(2-изопропилфенил)тио]пропандикарбоновой кислоты. Т.п. 161 - 162oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,25 (д, 6H), 2,39 (с, 3H), 3,42 (м, 1H), 6,86 (с, 1H), 6,92 (д, 1H), 7,07 (т, 1H), 7,13 (т, 1H), 7,28 (д, 1H), 7,39 (д, 1H), 7,4 (т, 1H), 7,64 (д, 1H), 7,67 (с, 1H).
Пример 191
4-окси-3-(2-изопропилфенокси)-6-фенил-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 2,62 г (13,6 ммоль) 1-фенил-1-(триметилсилилокси)этилена и 2,0 г (6,8 ммоль) сложного диэтилового эфира 2-(изопропил)феноксипропандикарбоновой кислоты.
1H-ЯМР (250 МГц, ДМСО-d6): δ = 1,25 (д, 6H), 3,44 (м, 1H), 6,67 (д, 1H), 6,89 (с, 1H), 7,0 (т, 1H), 7,09 (т, 1H), 7,29 (д, 1H), 7,53 (м, 3H), 7,83 (м, 2H).
Пример 192
6-(3-хлорфенил)-4-окси-3-[(2-изопропилфенил)тио]-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 3 г (19,41 ммоль) 3'-хлорацетофенона, 4,31 г (19,41 ммоль) триметилсилилтрифторацетата, 3,92 г (38,82 ммоль) триэтиламина, 20 мл хлористого метилена и 3,0 г (9,71 ммоль) сложного диэтилового эфира [(2-изопропилфенил)тио]пропандикарбоновой кислоты. Выход: 70 %. Т.п. 177 - 178oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 0,28 (д, 6H), 3,42 (м, 1H), 6,92 (д, 1H), 6,94 (с, 1H), 7,06 (т, 1H), 7,13 (т, 1H), 7,28 (д, 1H), 7,58 (т, 1H), 7,63 (т, 1H), 7,83 (д, 1H), 7,89 (с, 1H).
Пример 193
6-(3,5-дихлорфенил)-4-окси-3-[(2-изопропилфенил)тио]-2Н-пиран- 2-он
Целевое соединение получают по методу A с использованием 2 г (10,58 ммоль) 3,5-дихлорацетофенона, 2,35 г (10,58 ммоль) триметилсилилтрифторацетата, 2,14 г (21,16 ммоль) триэтиламина, 20 мл хлористого метилена и 1,64 г (5,29 ммоль) сложного диэтилового эфира [(2-изопропилфенил)тио]пропанди-карбоновой кислоты. Выход: 70 %. Т.п. 168 - 169oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,25 (д, 6H), 3,42 (м, 1H), 6,92 (д, 1H), 7,01 (с, 1H), 7,06 (т, 1H), 7,13 (т, 1H), 7,28 (д, 1H), 7,83 (м, 1H), 7,88 (м, 2H).
Пример 194
3-[(2,6-диметилфенил)тио]-4-окси-6-фенил-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 1,95 г (10,14 ммоль) 1-фенил-1-(триметилсилилокси)этилена и 2,0 г (6,8 ммоль) сложного диэтилового эфира [(2,6-диметилфенил)тио] пропандикарбоновой кислоты. Т.п. 248-249oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,47 (с, 6H), 6,75 (с, 1H), 7,08 (м, 3H), 7,39 (м, 3H), 7,78 (м, 2H).
Пример 195
4-окси-3-[(2-метилфенил)тио]-6-фенил-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 1,95 г (10,14 ммоль) 1-фенил-1-(триметилсилилокси)этилена и 1,43 г (5,07 ммоль) сложного диэтилового эфира [(2-метилфенил)тио]пропандикарбоновой кислоты. Т.п. 210 - 211oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ= 2,47 (с, 3H), 6,82 (с, 1H), 6,86 (д, 1H), 7,04 (м, 2H), 7,17 (д, 1H), 7,56 (м, 3H), 7,86 (м, 2H).
Пример 196
3-(2,6-дихлорфенил)тио]-4-окси-6-фенил-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 1,72 г (8,93 ммоль) 1-фенил-1-(триметилсилилокси)этилена и 1,5 г (4,46 ммоль) сложного диэтилового эфира [(2,6-дихлорфенил)тио]пропандикарбоновой кислоты. Т.п. 264 - 265oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 6,75 (с, 1H), 7,31 (т, 1H), 7,49 (д, 2H), 7,56 (м, 3H), 7,78 (м, 2H).
Пример 197
Сложный этиловый эфир (+/-)-4-[5-(1-циклопентилтио-3- метилбутил)-4-окси-6-оксо-6Н-пиран-2-ил]бензойной кислоты
Целевое соединение получают по методу B с использованием 1,50 г (5,77 ммоль) 4-окси-6-(4'-карбэтоксифенил)-2Н-пиран-2-она, 15 мл этанола, 0,497 г (5,77 ммоль) изовалерянового альдегида, 1,18 г (11,54 ммоль) циклопентилтиола, 1,0 мл пиперидина и 1,0 мл уксусной кислоты. Т.п. 174 - 176oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,05 - 0,72 (м, 10H), 1,81 - 1,14 (м, 7H), 2,13 - 1,81 (м, 3H), 3,04 (т, 1H), 4,22 (м, 1H), 4,36 (кв, 2H), 6,8 (с, 1H), 7,90 (д, 1H), 7,97 (кв, 1H), 8,15 (м, 2H).
Пример 198
(+/-)-3-[[(бензилтио)пиридин-3-ил]метил]-4-окси-6-фенил-2Н- пиран-2-он
Целевое соединение получают по методу B с использованием 1,50 г (7,98 ммоль) 4-окси-6-фенил-2Н-пиран-2-она, 10 мл этанола, 0,86 г (7,98 ммоль) пиридин-3-карбоксальдегида, 1,98 г (15,96 ммоль) бензилмеркаптана, 0,5 мл пиперидина и 0,5 мл уксусной кислоты. Т.п. 103 - 106oC.
1H-ЯМР (400 МГц, ДMCO-d6): δ = 3,75 (кв, 2H), 5,31 (с, 1H), 6,33 (с, 1H), 7,2 (м, 1H), 7,28 (м, 5H), 7,36 (м, 3H), 7,72 (м, 2H), 7,89 (д, 1H), 8,38 (дд, 1H), 8,57 (с, 1H).
Пример 199
3-(1-циклопентилтио-2-циклопропилэтил)-6-(2,3- дигидробензо[1,4] диоксин-6-ил)-4-окси-2Н-пиран-2-он
Целевое соединение получают по методу B с использованием 1,00 г (4,06 ммоль) 4-окси-6-(2,3-дигидробензо[1,4] диоксин-6-ил)-2Н-пиран- 2-она, 15 мл этанола, 0,34 г (4,06 ммоль) циклопропилметилкарбоксальдегида, 0,83 г (8,12 ммоль) циклопентилтиола, 1,0 мл пиперидина и 1,0 мл уксусной кислоты. Т.п. 80 - 82oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 0,03 (м, 2H), 0,33 (м, 2H), 0,64 (м, 1H), 1,28 - 1,74 (м, 7H), 1,83 - 2,06 (м, 3H), 3,06 (м, 1H), 4,2 (м, 1H), 4,31 (м, 4H), 6,53 (с, 1H), 7,0 (д, 1H), 7,24 (д, 1H), 7,24 (дд, 2H).
Пример 200
4-[[(4-(окси-6-оксо-5-[(фенилэтил)тио] -6Н-пиран-2- ил)-фенокси] метил] бензойная кислота
К 0,25 г сложного метилового эфира 4-[[[4-окси-2-оксо-3-[(2- фенилэтил)тио] -2Н-пиран-6-ил]фенокси]метил]бензойной кислоты в 20 мл диоксана добавляют 2 н. гидроокись натрия, а затем метанол для обеспечения гомогенности реакционной смеси. Смесь перемешивают при комнатной температуре в течение 24 часов. Растворители упаривают и остаток подкисляют 3 н. хлористоводородной кислотой. Выпавший продукт фильтруют, промывают диэтиловым эфиром и сушат в вакууме. Т.п. 227oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,78 (т, 2H), 2,97 (т, 2H), 5,29 (с, 2H), 6,72 (с, 1H), 7,14 - 7,32 (м, 7H), 7,58 (д, 2H), 7,78 (д, 2H), 7,97 (д, 2H).
Пример 201
Сложный этиловый эфир 4-(4-окси-6-оксо-5-[(2-фенилэтил)тио]- 6Н-пиран-2-ил)-бензойной кислоты
Целевое соединение получают по методу A с использованием 3 г (15,61 ммоль) 4-карбоэтоксиацетофенона, 3,47 г (15,61 ммоль) триметилсилилтрифторацетата, 3,16 г (31,22 ммоль) триэтиламина, 20 мл хлористого метилена и 2,31 г (7,81 ммоль) сложного диэтилового эфира [(2-фенилэтил)тио]пропандикарбоновой кислоты. Т.п. 156 - 158oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,36 (т, 3H), 2,78 (т, 2H), 3,01 (т, 2H), 4,35 (кв, 2H), 6,86 (с, 1H), 7,11 - 7,28 (м, 5H), 7,92 (д, 2H), 8,08 (д, 2H).
Пример 202
4-(4-окси-6-оксо-5-[(2-фенилэтил)тио]-6Н-пиран-2-ил)-бензойная кислота
0,2 г сложного этилового эфира 4-(4-окси-6-оксо-5-(2- фенилэтил)тио-6Н-пиран-2-ил)бензойной кислоты омыляют описанным в примере 200 образом. Т. п. 231oC.
1H-ЯМР (400 МГц, ДMCO-d6): δ = 2,94 (т, 2H), 3,03 (т, 2H), 6,64 (с, 1H), 7,11-7,33 (м, 5H), 7,92 (д, 1H), 7,99 (д, 1H), 8,05 (д, 1H), 8,08 (д, 1H).
Пример 203
6-(2,3-дигидробензо[1,4] диоксин-6-ил)-4-окси-3-[(2- изопропилфенил)тио] -2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 2 г (11,22 ммоль) 1,4-бензодиоксин-6-ил-метилкетона, 2,5 г (11,22 ммоль) триметилсилилтрифторацетата, 2,27 г (22,44 ммоль) триэтиламина, 20 мл хлористого метилена и 1,73 г (5,61 ммоль) сложного диэтилового эфира [(2-изопропилфенил)тио]- пропандикарбоновой кислоты. Т.п. 246 - 248oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,25 (д, 6H), 3,4 (м, 1H), 4,32 (м, 4H), 6,72 (с, 1H), 6,89 (д, 1H), 7,01 (д, 1H), 7,06 (т, 1H), 7,11 (т, 1H), 7,26 (д, 1H), 7,31 (д, 1H), 7,35 (дд, 1H).
Пример 204
(+/-)-3-(1-бензилтио-3-метилбутил)-6-(2,3- дигидробензо[1,4]диоксин-6-ил)-4-окси-2Н-пиран-2-он
Целевое соединение получают по методу B с использованием 1,00 г (4,06 ммоль) 4-окси-6-(2,3-дигидробензо[1,4] диоксин-6-ил)-2Н-пиран- 2-она, 15 мл этанола, 0,35 г (4,06 ммоль) изовалерянового альдегида, 1,0 г (8,12 ммоль) бензилмеркаптана, 0,5 мл пиперидина и 0,5 мл уксусной кислоты.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 0,78 (т, 6H), 1,36 (м, 1H), 1,5 (м, 1H), 2,06 (м, 1H), 4,2 (м, 1H), 4,31 (шир.м, 6H), 6,56 (с, 1H), 7,03 (д, 2H), 7,36 - 7,25 (м, 6H).
Пример 205
(+/-)-3-[[(циклогексилтио)пиридин-4-ил] метил] -4-окси-6-фенил- 2Н-пиран-2-он
Целевое соединение получают по методу B с использованием 1,5 г (7,98 ммоль) 4-окси-6-фенил-2Н-пиран-2-она, 10 мл этанола, 0,86 г (7,98 ммоль) пиридин-4-карбоксальдегида, 1,86 г (7,98 ммоль) циклогексилтиола, 0,5 мл пиперидина и 0,5 мл уксусной кислоты.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,25 (м, 5H), 1,53 (м, 1H), 1,67 (м, 2H), 1,92 (м, 2H), 2,71 (м, 1H), 5,33 (с, 1H), 6,69 (с, 1H), 7,5 (м, 5H), 7,75 (м, 2H), 8,47 (д, 2H).
Пример 206
(+/-)-3-[[(циклогексилтио)пиридин-3-ил] метил] -4-окси-6- фенил-2Н-пиран-2-он
Целевое соединение получают по методу B с использованием 1,5 г (7,98 ммоль) 4-окси-6-фенил-2Н-пиран-2-она, 10 мл этанола, 0,86 г (7,98 ммоль) пиридин-3-карбоксальдегида, 1,86 г (7,98 ммоль) циклогексилтиола, 0,5 мл пиперидина и 0,5 мл уксусной кислоты.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,25 (м, 5H), 1,53 (м, 1H), 1,67 (м, 2H), 1,92 (м, 2H), 2,69 (м, 1H), 5,39 (с, 1H), 6,72 (с, 1H), 7,33 (м, 1H), 7,53 (м, 3H), 7,73 (м, 2H), 7,97 (д, 1H), 8,39 (д, 1H), 8,67 (д, 1H).
Пример 207
4- [[(4-окси-2-оксо-6-фенил-2Н-пиран-3-ил)тио]метил] бензойная кислота
Целевое соединение получают в результате омыления 0,1 г сложного метилового эфира 4-[[(4-окси-2-оксо-6-фенил-2Н- пиран-3-ил)тио]метил]бензойной кислоты описанным в примере 200 образом.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 4,06 (с, 2H), 6,72 (с, 1H), 7,36 (д, 2H), 7,58 (м, 3H), 7,86 (м, 4H).
Пример 208
3-[[(4-окси-2-оксо-6-фенил-2Н-пиран-3-ил)тио]метил]бензойная кислота
Целевое соединение получают в результате омыления 0,1 г сложного метилового эфира 3-[[(4-окси-2-оксо-6-фенил-2Н-пиран-3- ил)тио]метил]бензойной кислоты описанным в примере 200 образом.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 4,4 (д, 1H), 4,72 (д, 1H), 6,72 (с, 1H), 7,4 (т, 1H), 7,44 - 7,61 (м, 5H), 7,74 - 7,92 (м, 4H).
Пример 209
2-[[(4-окси-2-оксо-6-фенил-2Н-пиран-3-ил)тио]метил]бензойная кислота
Целевое соединение получают в результате омыления 0,2 г сложного метилового эфира 2-[[(4-окси-2-оксо-6-фенил-2Н-пиран-3- ил)тио]метил]бензойной кислоты описанным в примере 200 образом.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 4,36 (с, 2H), 6,69 (с, 1H), 7,18 (д, 1H), 7,29 (т, 1H), 7,39 (т, 1H), 7,53 (м, 3H), 7,79 (м, 3H).
Пример 210
3-[(2-хлорфенилтио)-4-окси-6-фенил-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 1,95 г (10,14 ммоль) 1-фенил-1-(триметилсилилокси)этилена и 1,53 г (5,07 ммоль) сложного диэтилового эфира [(2-хлорфенил)тио]пропандикарбоновой кислоты. Т.п. 275 - 280oC.
1H-ЯМР (400 МГц, ДMCO-d6): δ = 6,78 (с, 1 H), 6,89 (дд, 1H), 7,08 (тт, 1H), 7,19 (тт, 1H), 7,42 (дд, 1H), 7,56 (м, 3H), 8,06 (м, 2H).
Пример 211
4-окси-3-[(2-метоксифенил)тио]-6-фенил-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 1,95 г (10,14 ммоль) 1-фенил-1-(триметилсилилокси)этилена и 1,51 г (5,07 ммоль) сложного диэтилового эфира [(2- метоксифенил)тио]пропандикарбоновой кислоты. Т.п. 208 - 209oC.
1H-ЯМР (400 МГц, ДMCO-d6): δ = 3,83 (с, 3H), 6,74 (дд, 1H), 6,82 (д, 1H), 6,86 (с, 1H), 6,97 (д, 1H), 7,08 (т, 1H), 7,56 (м, 3H), 7,86 (м, 2H).
Пример 212
6-(4-бензилоксифенил)-4-окси-3-[(2-изопропилфенил)тио]-2Н- пиран-2-он
Целевое соединение получают по методу A с использованием 0,3 г (0,675 ммоль) 4-бензилоксиацетофенона, 0,15 г (0,675 ммоль) триметилсилилтрифторацетата, 0,14 г (1,35 ммоль) триэтиламина, 20 мл хлористого метилена и 0,210 г (0,675 ммоль) сложного диэтилового эфира [(2-изопропилфенил)тио]-пропандикарбоновой кислоты. Т.п. 163 - 165oC.
1H-ЯМР (400 МГц, ДMCO-d6): δ = 1,28 (д, 6H), 3,4 (м, 1H), 5,22 (с, 2H), 6,64 (с, 1H), 6,92 (д, 1H), 7,06 (т, 1H), 7,11 (т, 1H), 7,19 (д, 1H), 7,28 (д, 1H), 7,36 (кв, 2H), 7,42 (д, 2H), 7,49 (д, 2H), 7,83 (д, 2H).
Пример 213
3-[(3-хлорфенил)тио]-4-окси-6-фенил-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 1,95 г (10,14 ммоль) 1-фенил-1-(триметилсилилокси)этилена и 1,53 г (5,07 ммоль) сложного диэтилового эфира [(3-хлорфенил)тио]пропандикарбоновой кислоты. Т.п. 181 - 182oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 6,88 (с, 1H), 7,13 (дт, 2H), 7,19 (дт, 1H), 7,29 (т, 1H), 7,56 (м, 3H), 7,86 (м, 2H).
Пример 214
4-окси-3-[(3-метоксифенил)тио]-6-фенил-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 1,95 г (10,14 ммоль) 1-фенил-1-(триметилсилилокси)этилена и 1,51 г (5,07 ммоль) сложного диэтилового эфира [(3-метоксифенил)тио]пропандикарбоновой кислоты. Т.п. 130 - 131oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 3,69 (с, 3H), 6,69 (дд, 1H), 6,72 (дд, 1H), 6,89 (с, 1H), 7,2 (дт, 2H), 7,58 (м, 3H), 7,88 (м, 2H).
Пример 215
4-окси-3-[(3-метилфенил)тио]-6-фенил-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 1,95 г (10,14 ммоль) 1-фенил-1-(триметилсилилокси)этилена и 1,43 г (5,07 ммоль) сложного диэтилового эфира [(3-метилфенил)тио]пропандикарбоновой кислоты, т.п. 197-198oC.
1H-ЯМР (400 МГц, ДMCO-d6): δ = 2,24 (с, 3H), 6,89 (с, 1H), 6,93 (т, 1H), 6,97 (с, 1H), 7,14 (т, 2H), 7,56 (м, 3H), 7,86 (м, 2H).
Пример 216
3-[(2-этилфенил)тио]-4-окси-6-фенил-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 4,17 г (21,72 ммоль) 1-фенил-1-(триметилсилилокси)этилена и 1,5 г (10,86 ммоль) сложного диэтилового эфира [(2-этилфенил)тио]пропандикарбоновой кислоты. Т.п. 190 - 192oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,25 (т, 3H), 2,78 (кв, 2H), 6,89 (с, 1H), 6,92 (м, 1H), 7,08 (м, 2H), 7,2 (м, 1H), 7,58 (м, 3H), 7,86 (м, 2H).
Пример 217
Сложный 3-[(2-изопропилфенил)тио]-2-оксо-6-фенил-2Н-пиран-4- иловый эфир уксусной кислоты
Целевое соединение получают по методу Ж в результате обработки 0,2 г (0,59 ммоль) натриевой соли 4-окси-3-[(2-изопропилфенил)тио]- 6-фенил-2Н-пиран-2-она хлорангидридом уксусной кислоты, взятым в количестве 0,09 г (1,18 ммоль). Т.п. 113 - 115oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,26 (д, 6H), 1,89 (с, 3H), 3,42 (м, 1H), 6,89 (с, 1H), 6,94 (дд, 1H), 7,04 (дт, 1H), 7,13 (дт, 1H), 7,28 (дд, 1H), 7,58 (м, 3H), 7,86 (м, 2H).
Пример 218
4-окси-6-фенил-3-[(3-трифторметилфенил)тио]-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 1,72 г (8,92 ммоль) 1-фенил-1-(триметилсилилокси)этилена и 1,5 г (4,46 ммоль) сложного диэтилового эфира [[3-(трифторметил)фенил]тио]пропандикарбоновой кислоты. Т. п. 228 - 229oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 6,89 (с, 1H), 7,4 - 7,61 (м, 7H), 7,89 (м, 2H).
Пример 219
3-[3,5-диметилфенил)тио]-4-окси-6-фенил-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 1,3 г (6,76 ммоль) 1-фенил-1-(триметилсилилокси)этилена и 1,0 r (3,38 ммоль) сложного диэтилового эфира [(3,5-диметилфенил)тио] пропандикарбоновой кислоты. Т.п. 214 - 216oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 2,2 (с, 6H), 6,75 (шир.с, 3H), 6,89 (с, 1H), 7,56 (м, 3H), 7,86 (м, 2H).
Пример 220
6-[4-(циклогексилметокси)фенил] -4-окси-3-[(2- изопропилфенил)тио]-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 2,0 г (8,61 ммоль) 4-циклогексилметоксиацетофенона, 1,91 г (8,61 ммоль) триметилсилилтрифторацетата, 1,74 г (17,22 ммоль) триэтиламина, 20 мл хлористого метилена и 4,0 г (12,92 ммоль) сложного диэтилового эфира [(2-изопропилфенил)тио]пропандикарбоновой кислоты. Т.п. 187 - 188oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 0,96 - 1,33 (м + 1,24 д, 11H), 1,61 - 1,87 (м, 6H), 3,4 (м, 1H), 3,86 (д, 2H), 6,76 (с, 1H), 6,92 (дд, 1H), 7,11 (м, 4H), 7,29 (дд, 1H), 7,81 (д, 2H).
Пример 221
6-(3-бензилоксифенил)-4-окси-3-(2-изопропилфенил)тио]-2Н- пиран-2-он
Целевое соединение получают по методу A с использованием 2,0 г (8,84 ммоль) 3-бензилоксиацетофенона, 1,96г (8,84 ммоль) триметилсилилтрифторацетата, 1,79 г (17,68 ммоль) триэтиламина и 0,210 г (0,675 ммоль) сложного диэтилового эфира [(2- изопропилфенил)тио]пропандикарбоновой кислоты, т.п. 162-164oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,25 (д, 6H), 3,42 (м, 1H), 5,35 (с, 2H), 6,89 (с, 1H), 6,92 (д, 1H), 7,06 (дт, 1H), 7,11 (дт, 1H), 7,22 (дд, 1H), 7,28 (дд, 1H), 7,39-7,51 (м, 8H).
Пример 222
4-окси-3-[(2-изопропилфенил)тио]-6-[4-(3-фенилпропокси)фенил]- 2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 2,0 г (7,86 ммоль) 4-фенилпропилоксиацетофенона, 1,75 г (7,86 ммоль) триметилсилилтрифторацетата, 1,59 г (15,72 ммоль) триэтиламина и 3,66 г (11,79 ммоль) сложного диэтилового эфира [(2-изопропилфенил)тио]пропандикарбоновой кислоты. Т.п. 132 - 133oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 1,25 (д, 6H), 2,06 (м, 2H), 2,75 (т, 2H), 3,39 (м, 1H), 4,08 (т, 2H), 6,78 (с, 1H), 6,90 (д, 1H), 7,05 (дт, 2H), 7,08 (кв, 2H), 7,11 - 7,31 (м, 6H), 7,81 (д, 2H).
Пример 223
(+/-)-3-[(2-втор.бутилфенил)тио]-4-окси-6-фенил-2Н-пиран-2-он
Целевое соединение получают по методу A с использованием 1,0 г (6,17 ммоль) 1-фенил-1-(триметилсилилокси)этилена и 1,0 г (3,09 ммоль) сложного диэтилового эфира [(2-втор.бутилфенил)тио]пропандикарбоновой кислоты. Т.п. 170-171oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 0,86 (т, 3H), 1,22 (д, 3H), 1,57 (м, 1H), 1,67 (м, 1H), 3,22 (м, 1H), 6,89 (с, 1H), 6,97 (д, 1H), 7,06 (т, 1H), 7,13 (т, 1H), 7,22 (д, 1H), 7,56 (м, 3H), 7,86 (м, 2H).
Определение торможения протеазы ВИЧа
4.5.1 Подготовка опыта
Дитиотреитольный буфер: каждый день приготовляют раствор 1,0 ммоль дитиотреитола в 0,1%-ном полиэтиленгликоле (с молекулярным весом 8000), 80 ммоль натриевой соли уксусной кислоты, 160 ммоль хлористого натрия, 1,0 ммоль этилендиаминтетрауксусной кислоты, который доводят до pH 4,7 с применением соляной кислоты.
Протеаза ВИЧа 1: Энзим получают от фирмы Bachem Bioscience Inc. Замороженный при -80oC неразбавленный энзим оттаивают и разбавляют 50-кратным количеством дитиотреитольного буфера. Раствор хранят при 0oC на ледяной воде и используют в тесте в течение 20 минут после оттаивания.
Субстрат энзима: Субстратом III, полученным от фирмы Bachem Bioscience Inc. , является ундекапептид H-His-Lys- Ala-Arg-Val-Leu-п-нитрофенилаланин-Glu-Ala-норлейцин-Ser-NH2 (чистотой более 97%). Готовят 200 мкмоль основного раствора в дитиотреитольном буфере и хранят на льду. Раствор субстрата приготовляют каждый день.
Исследуемое соединение: 10 ммоль ингибитора вышеуказанной формулы (I) в диметилсульфоксиде разбавляют дитиотреитольным буфером до концентрации 200 мкмоль. Этот основной раствор разбавляют 2%-ным раствором диметилсульфоксида в дитиотреитольном буфере до концентрации 10 мкмоль. B каждой чашке раствор ингибитора разбавляют 2%-ным раствором диметилсульфоксида в дитиотреитольном буфере до концентрации 100, 50, 20, 10, 5, 2, 1, 0,5 и 0 мкмоль. Общий объем ингибитора составляет 50 мкл.
Испытание
B каждую чашку подают 20 мкл субстрата окончательной концентрацией в 40 мкмоль, 50 мкл ингибитора такой концентрации, чтобы окончательным разбавлением получить рабочую концентрацию, а также 20 мкл дитиотреитольного буфера. Титровальную пластинку с 96 чашками размещают в инкубаторе при температуре 37oC на по крайней мере 5 минут.
B каждую чашку прибавляют 10 мкл разбавленной протеазы с одновременным встряхиванием титровальной пластинки. После 10-секундного встряхивания титровальную пластинку ставят обратно в инкубатор при температуре 37oC. Конечный реакционный объем составляет 100 мкл.
Титровальную пластинку инкубируют при 37oC в течение 5 минут. Реакцию прекращают подачей титровальной пластинки на встряхиватель и прибавлением 20 мкл 10%-ной трифторуксусной кислоты с последующим встряхиванием в течение 10 секунд. Степень протеолиза определяют разделением нерасщепленного субстрата и двух расщепленных продуктов с помощью обратнофазной жидкостной хроматографии под давлением с одновременным измерением абсорбции при 220 нм. Таким образом определяют относительные площади пика трех компонентов и вычисляют процент превращения в продукт как функция концентрации ингибитора. Данные наносят на график как процент контроля (процент конверсии в присутствии и отсутствии ингибитора, умноженный на 100) по отношению к концентрации ингибитора. Полученные данные используют для уравнения Y = 100/1+(X/KT50)A, где KT50 представляет собой концентрацию ингибитора при 50%-ном торможении, а A - линия кривой торможения.
Результаты сведены в табл. 1.
Действие против ВИЧа 1
C учетом общих данных методов Поулса и др. (см. "Journal of Virological Methods", 16, стр. 171-185, 1987 г.) и Манна и др. (см. "AIDS Research and Human Retroviruses", стр. 253-255, 1989 г) проводили антивирусные тесты на активное заражение ВИЧом 1 в клеточной линии Н9. Культуры заражали в 1 мл раствора 10%-ной эмбриональной телячьей сыворотки в буфере RPMI 1640, содержащего 107 клеток и 105 инфекционных доз ВИЧа 1iiib, с целью эффективного размножения инфекции на 0,01. После 2 часов вирусной абсорбции клетки промывали один раз и подавали в микротитровальные пластинки с 96 чашками (104 клеток на чашку). Исследуемые соединения подавали в чашки с тем, чтобы получить требуемую концентрацию активного начала, а также 0,2%-ный диметилсульфоксид. Конечный объем среды составлял 200 мкл. Незараженные культуры хранили для определения цитотоксичности через 7 дней после заражения. В культурах определяли репликацию вируса с помощью обратной транскриптазы через 4 и 7 дней после заражения. Результаты сведены в табл. 2.
Комбинации ингибитора протеазы с другими антивирусными препаратами, такими, как, например, ингибиторы обратной транскриптазы ВИЧа AZT и ddC могут проявлять синергетический эффект. CM J.C. Craig и др. в литературе "Antiviral Chem. Chemother"., 4/3, стр. 161-166, 1993 г.; E.V. Connell и др. в литературе "Antimicrob. Agents Chemother.", 38, стр. 348-352, 1994 г.; D. М. Lambert и др. в литературе "Antiviral Res.", 21, стр. 327-342, 1993 г; A. М. Cali-endo и др. в литературе "Clin. Infect. Dis.", 18/4: стр. 516-524, 1994 г.
Предлагаемые соединения проявляют антибактериальную активность, о чем свидетельствуют результаты микротитровального разведения, описанного Хайфетцом и др. в литературе "Antimicr. Agents & Chemoth.", 6, стр. 124, 1974 г. По этому методу определяли нижеследующие минимальные концентрации торможения в мкг/мл предлагаемых соединений, применяемых в борьбе с клинически значимыми грамположительными возбудителями болезни, которые за последние годы стали резистентными к стандартным средствам. (табл. 3).
Само собой разумеется, что и другие композиции, которые специально не упоминаются в рамках данного описания, входят в объем настоящего изобретения. Следовательно, изобретение не ограничивается вышеприведенным описанием определенных форм исполнения изобретения, а только формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ПИРОНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С АНТИВИРУСНОЙ И АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ ВЫЗВАННЫХ РЕТРОВИРУСОМ ИНФЕКЦИИ ИЛИ ЗАБОЛЕВАНИЯ | 1994 |
|
RU2153497C2 |
| ПРОИЗВОДНЫЕ ПИРОНА И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С АНТИВИРУСНОЙ И АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ НА ИХ ОСНОВЕ, СПОСОБ ЛЕЧЕНИЯ ВЫЗВАННЫХ РЕТРОВИРУСОМ ИНФЕКЦИИ ИЛИ ЗАБОЛЕВАНИЯ | 1994 |
|
RU2160733C2 |
| ПРОИЗВОДНЫЕ 5,6-ДИГИДРОПИРОНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1994 |
|
RU2140917C1 |
| ГЕТЕРОАРИЛЬНЫЕ СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ ИХ КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ С ПРИМЕНЕНИЕМ ЭТИХ СОЕДИНЕНИЙ | 2007 |
|
RU2478635C2 |
| БЕНЗОПИРАНЫ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ | 1994 |
|
RU2122000C1 |
| СПОСОБ МИНИМИЗАЦИИ ГИСТЕРОТРОФНОГО ЭФФЕКТА ТАМОКСИФЕНА И АНАЛОГОВ ТАМОКСИФЕНА | 1995 |
|
RU2158589C2 |
| ФЕНИЛОКСАЗОЛИДИНОНЫ, ИМЕЮЩИЕ С-С-СВЯЗЬ С 4-8-ЧЛЕННЫМИ ГЕТЕРОЦИКЛИЧЕСКИМИ КОЛЬЦАМИ | 1996 |
|
RU2175324C2 |
| СОЕДИНЕНИЯ ИНДОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ КЛЕТОЧНОГО НЕКРОЗА | 2008 |
|
RU2477282C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2734390C2 |
| ПРОИЗВОДНЫЕ 1-КАРБА-(1-ДЕТИА)-ЦЕФЕМА | 1993 |
|
RU2107067C1 |



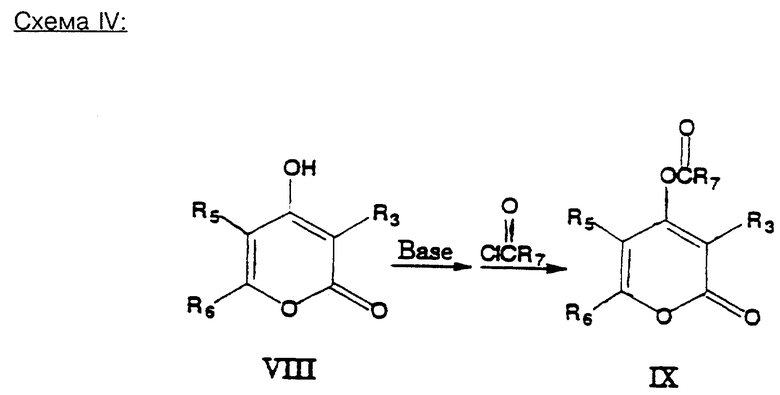
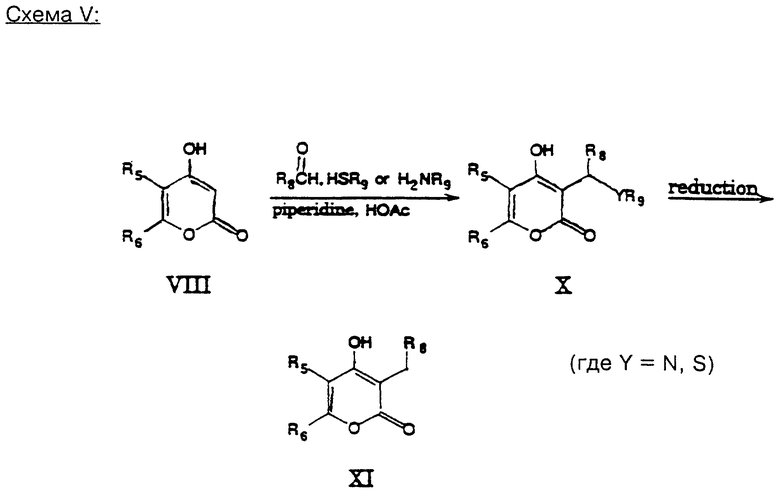

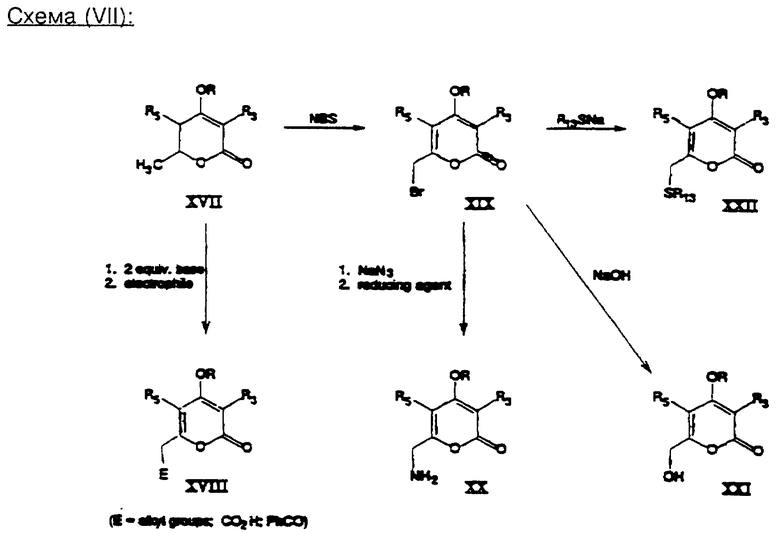
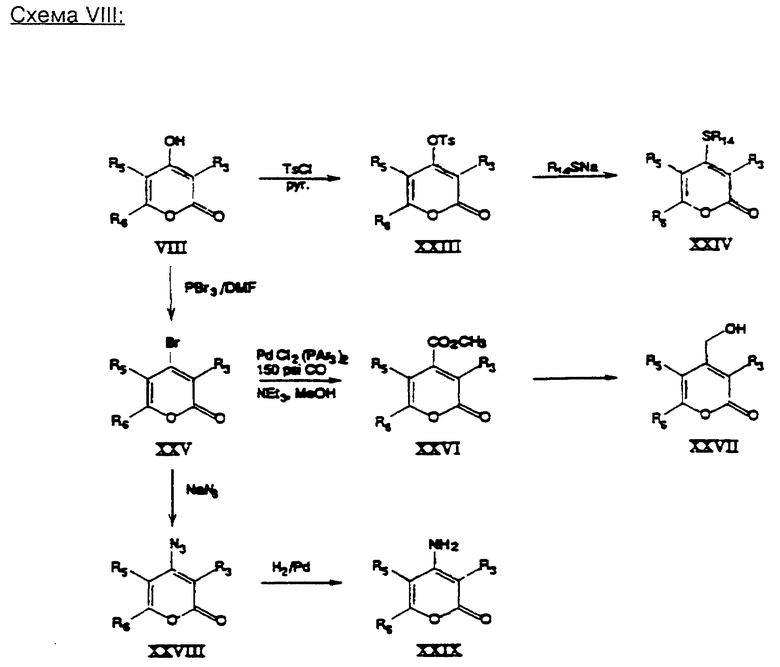

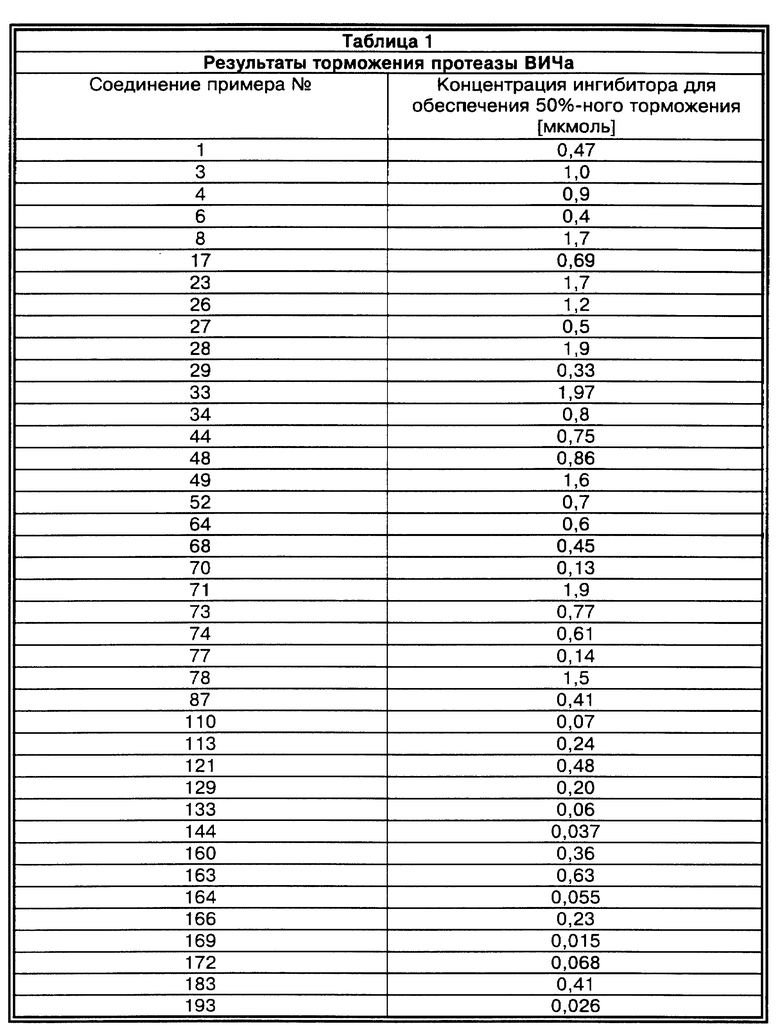

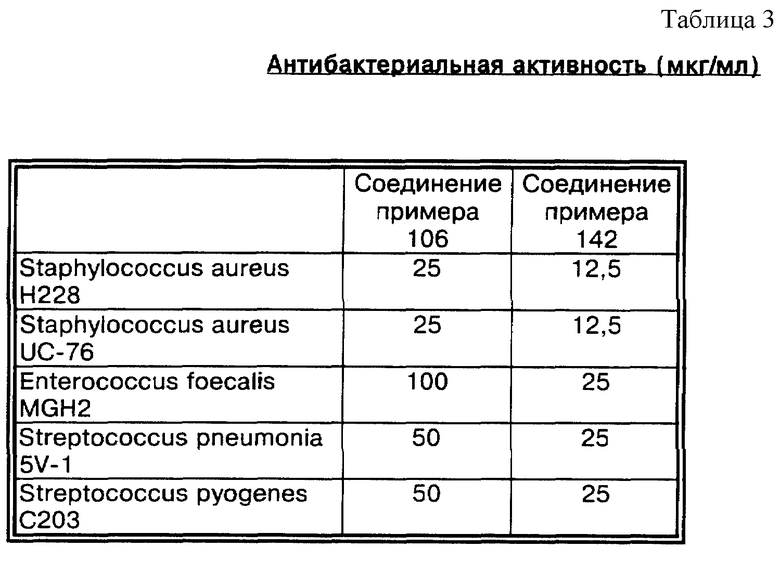
Производные пирона формулы I,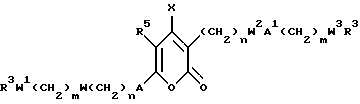
где Х - группа OR1, NHR1, CO2R4 или CH2R4 или CH2OR1, R1 = R4 или COR4, R2 - водород, С5-6циклоалкил, R5 - водород, С1-6алкил (другие обозначения см. в п. 1 формулы изобретения) пригодны в качестве антивирусных средств, для лечения инфекций, вызванных вирусом иммунодефицита человека или другими ретровирусами, пользующимися аспартилпротеазами. 3 с. и 5 з.п. ф-лы, 3 табл.

где X - группа формулы OR1, NHR1, CO2R4, или CH2OR1, где R1 - радикал R4 или COR4;
A и A1 - независимы друг от друга и означают химическую связь, фенил, нафтил, 5- или 6-членный гетероцикл, содержащий в качестве гетероатомов азот и/или кислород, циклоалкил с 5 или 6 атомами углерода, алкилциклоалкил с 1 - 6 атомами углерода в алкильной группе и 5 или 6 атомами углерода в циклоалкильной группе, возможно замещенные по меньшей мере одним заместителем, выбранным из группы, включающей фтор, хлор, бром, OR4, R4, CO2R4, где R4 означает водород, алкил с 1 - 6 атомами углерода, циклоалкил с 5 или 6 атомами углерода, фенил, незамещенные или замещенные по меньшей мере одним заместителем, выбранным из группы, включающей OR2, фенил, нафтил, трифторметил;
R2 - водород, алкил с 1 - 6 атомами углерода или циклоалкил с 5 или 6 атомами углерода,
R5 - водород, алкил с 1 - 6 атомами углерода,
R3 - независимо означает водород, (CH2)pR4, где R4 имеет указанное значение, а p означает целое число 0 - 2,
W, W1 и W3 - независимо друг от друга означают химическую связь, группу формулы NR3, CO, S(O)p, SO2NR3, где R3 и p имеют вышеуказанное значение, m и n означают целые числа 0 - 4, W2 - зависит от значения индекса n группы формулы (CH2)nW2A1 (CH2)mW3R3; если n > 0, то остаток W2 выбран из группы, включающей химическую связь, NR3, S(O)p, SO2NR3, если n = 0, то остаток W2 означает CO,
при этом, если оба остатка W и W1 представляют собой гетероатомы, то m - целое число 2 - 4, а группа формулы R1W1(CH2)mW(CH2)n A не может означать метил или этил, или их фармацевтически приемлемые соли.
| ТКАЦКИЙ СТАНОК | 1925 |
|
SU3724A1 |
| FR 1422494 A, 15.11.65 | |||
| Аппарат для механической очистки загрязненных вод | 1921 |
|
SU36994A1 |
| Способ получения 2-метил-3-ацетил-6-арилпиран-4-онов | 1986 |
|
SU1425192A1 |
Авторы
Даты
1999-09-10—Публикация
1994-10-26—Подача