Изобретение относится к новым кислородсодержащим гетероциклическим соединениям с биологической активностью, в частности к производным пирона, фармацевтической композиции с антивирусной и антибактериальной активностью на их основе и способу лечения вызванных ретровирусом инфекции или заболевания.
В заявке WO 89/07939 описываются производные кумарина, которые обладают биологической активностью, в частности антивирусной и антибактериальной активностью.
Задачей изобретения является расширение ассортимента кислородсодержащих гетероциклических соединений, обладающих биологической активностью, в частности антивирусной и антибактериальной активностью.
Поставленная задача решается предлагаемыми производными пирона общей формулы (I)
где X - группа формулы OR4, где R4, водород, неразветвленный алкил с 1 - 6 атомами углерода, разветвленный или циклический алкил с 3-7 атомами углерода,
Y - кислород, группа C(R4)2, или NR4, где R4 имеет вышеуказанные значения,
R1 и R2 независимо означают группу [CH2]n1-[W1]n2-[Ar]n1- [CH2]n3-[W2] n4-R5, где n1 - n4 и R5 имеют нижеуказанное значение, при этом если радикал W1 означает гетероатом, то n1 - число 1 - 4,
R1 и R2 вместе могут образовать 3-, 4-, 5-, 6- или 7- членное кольцо, незамещенное или замещенное по меньшей мере одним из нижеуказанных остатков R5,
R3 - группа формулы [W3]-[CH2]n3-[W4]n4-[Ar]n2-[CH2]n3-[W2]n4-R5, где n1, n2, n3, n4 и n5 независимы и означают число 0-4, 0-1, 0-4, 0-1, 0-2 соответственно.
W1, W2 и W4 независимы и означают кислород, группы OCONR5, S(O)n5, CO, NR5, C(R5)2,
W3 выбран из группы, включающей кислород, S(O)n5, NR5,
R5 независимо означает водород или остаток Ar и неразветвленный или разветвленный алкил с 1-6 атомами углерода, незамещенные или замещенные по меньшей мере одним остатком, выбранным из группы, включающей CO2R4, CON(R4)2, OR4 хлор, бром, фтор, трифторметил, радикал Ar,
или же 2 радикала R5 вместе образуют незамещенное кольцо с 3-7 атомами, а
Ar независимо означает фенил, нафтил, бензо[1,3]диоксол, имидазолил, пиримидинил, тиенил, циклоалкил с 3-6 атомами, незамещенные или замещенные остатками, выбранными из группы, включающей фтор, хлор, бром, циано, амино, трифторметил и радикал формулы (CH2)n6R4, (CH2)n6OR4, где n6 независимо означает число 0-3, а R4 имеет вышеуказанное значение,
или их фармацевтически приемлемые соли.
В первую группу предпочтительных производных пирона общей формулы (I) входят соединения, у которых
X - группа формулы OR4,
Y - группа формулы C(R4)2 или NR4.
Примерами таких соединений являются
5-(3-хлорфенил)-2-[(2-фенилэтил)тио]-1,3-циклогександион,
5,6-дигидро-4-окси-6-фенил-3-[(2-фенилэтил)тио]-2(1H)- пиридинон,
5,6-дигидро-4-окси-1-метил-6-фенил-3-[(2-фенилэтил)тио] -2(1H)- пиридинон,
4-окси-3-[(2-изопропил-5-метилфенил)тио]-6-фенил-5,6-дигидро-1H- пиридин-2-он,
4-окси-3-[(2-изопропил-5-метилфенил)тио] -6-фенил-6-(2-фенилэтил)- 5,6-дигидро-1H-пиридин-2-он,
3-окси-2-[(2-изопропил-5-метилфенил)тио] -5-фенил-5-(2-фенилэтил)- циклогекс-2-енон,
3-окси-2-[(2-изопропил-5-метилфенил)тио]-5-фенил-циклогекс-2-енон.
Во вторую группу предпочтительных производных пирона общей формулы (I) входят соединения, у которых
X - группа формулы OR4,
Y - кислород,
R1 и R2 - часть 3-, 4-, 5-, 6- или 7-членного кольца, незамещенного или замещенного остатками, выбранными из группы, включающей водород и неразветвленный или разветвленный алкил с 1-6 атомами углерода.
Примерами таких соединений являются
2,3-дигидро-4'-окси-3,3-диметил-5'-[(2-изопропилфенил)тио] - спиро[4H-1-бензопиран-4,2'-[2H]пиран]-6'(3'H)-он,
2,3-дигидро-4'-окси-2,2-диметил-5'-[(5-метил-2-изопропилфенил) тио] -спиро[1H-инден-1,2'-[2H]пиран]-6'(3'H)-он,
2,3-дигидро-4'-окси-5'-[(5-метил-2-изопропилфенил)тио] - спиро[1H-инден-1,2'-[2H]пиран]-6'(3'H)-он,
4''-окси-5''-[(5-метил-2-изопропилфенил)тио] -диспиро [циклопропан-1,2'(3'H)-[1 H]инден-1',2''-[2H]пиран]-6''(3''H)-он,
3,4-дигидро-4'-окси-5'-[(5-метил-2-изопропилфенил)тио]- спиро[нафтален-1(2H), 2'-[2H]пиран]-6'(3'H)-он,
3,4-дигидро-4'-окси-2,2'диметил-5'-[(5-метил-2- изопропилфенил)тио] -спиро[нафтален-1,2'-[2H]пиран]-6'(3'H)-он,
3', 4'-дигидро-4''-окси-5''-[(5-метил-2-изопропилфенил)тио] - диспиро[циклопропан-1,2'(1'H)-нафтален-1,2''[2H]пиран]-6''(3''H)-он.
В третью группу предпочтительных производных пирона общей формулы (1) входят соединения, у которых
X - OR4,
Y - кислород,
R2 - водород.
Примерами таких соединений являются
5,6-дигидро-4-окси-6-фенил-3-[(фенилметил)тио-2H]-пиран-2-он,
5,6-дигидро-4-окси-6-фенил-3-[(2-фенилэтил)тио]-2H-пиран-2-он,
5,6-дигидро-4-окси-6-фенил-3-[(3-фенилпропил)тио]-2H-пиран-2-он,
5,6-дигидро-4-окси-6-фенил-3-[(2-феноксиэтил)тио]-2H-пиран-2-он,
5,6-дигидро-4-окси-6-(4-метоксифенил)-3-[(фенилметил)тио] -2H- пиран-2-он,
5,6-дигидро-4-окси-6-(4-метилтиофенил)-3-[(фенилметил)тио] -2H- пиран-2-он,
5,6-дигидро-4-окси-6-(4-метилфенил)-3-[(фенилметил)тио]-2H- пиран-2-он,
5,6-дигидро-4-окси-6-[4-(1,1 -диметилэтил)фенил]-3-[(фенилметил) тио]-2H-пиран-2-он,
6-(4-хлорфенил)-5,6-дигидро-4-окси-3-[(фенилметил)тио]-2H-пиран- 2-он,
6-(3-хлорфенил)-5,6-дигидро-4-окси-3-[(фенилметил)тио]-2H- пиран-2-он,
5,6-дигидро-3-1(2-фенилэтил)тио] -6-[4-(фенилметокси)фенил] -2H- пиран-2-он,
5,6-дигидро-6-(4-метоксифенил)-3-[(2-фенилэтил)тио]-2H-пиран-2-он,
5,6-дигидро-6-(4-метилтиофенил)-3-[(2-фенилэтил)тио]- 2H-пиран-2-он,
5,6-дигидро-6-(4-метилфенил)-3-[(2-фенилэтил)тио]- 2H-пиран-2-он,
6-[1,1'-бифенил]-4-ил-5,6-дигидро-3-[(2-фенилэтил)тио]-2H-пиран- 2-он,
5,6-дигидро-6-[4-(1,1 -диметилэтил)фенил] -3-[(2-фенилэтил) тио]-2H-пиран-2-он,
6-(3-хлорфенил)-5,6-дигидро-3-[(2-фенилэтил)тио]-2H-пиран-2-он,
6-[([1.1'-бифенил] -4-илокси)метил] -5,6-дигидро-3-[(2-фенилэтил) тио]-2H-пиран-2-он,
4-[2,3-дигидро-4-окси-6-оксо-5-[(фенилметил)тио] -2H-пиран-2- ил]бензонитрил,
6-(4-трифторметилфенил)-5,6-дигидро-4-окси-3-[(фенилметил)тио] - 2H-пиран-2-он,
6-(3,5-дихлорфенил)-5,6-дигидро-4-окси-3-[(фенилметил)тио] -2H- пиран-2-он,
6-(пентафторфенил)-5,6-дигидpo-4-oкcи-3-[(фенилметил)тиo] -2H- пиpaн-2-он,
5,6-дигидро-4-окси-6-(3-метилфенил)-3-[(2-фенилэтил)тио]-2H- пиран-2-он,
6-(2-хлорфенил)-5,6-дигидро-4-окси-3-[(фенилметил)тио]-2H-пиран- 2-он,
1-[4-[3,6-дигидро-4-окси-6-оксо-5-[(2-фенилэтил)тио] -2H-пиран- 2-ил]-фенил]-5-фенил-1H-пиррол-2-пропановую кислоту,
5,6-дигидро-4-окси-6-(4-оксифенил)-3-[(фенилметил)тио]-2H-пиран-2-он,
5,6-дигидро-4-окси-6-(4-оксифенил)-3-[(2-фенилэтил)тио)-2H-пиран- 2-он,
[4-[5,6-дигидро-4-окси-2-оксо-3-[(фенилметил)тио] -2H-пиран-6-ил] фенокси]уксусную кислоту,
[4-[5,6-дигидро-4-окси-2-оксо-3-[(2-фенилэтил)тио] -2H-пиран- 6-ил]-фенокси]уксусную кислоту,
сложный этиловый эфир [4-[5,6-дигидро-4-окси-2-оксо-3- [(фенилметил)-тио]-2H-пиран-6-ил]фенокси]уксусной кислоты,
сложный этиловый эфир [4-[5,6-дигидро-4-окси-2-оксо-3- [(2-фенилэтил)-тио]-2H-пиран-6-ил]фенокси]уксусной кислоты,
5,6-дигидро-4-окси-6-[4-(2-оксиэтокси)фенил]-3-[(фенилметил) тио]-2H-пиран-2-он,
5,6-дигидро-4-окси-6-[4-(2-оксиэтокси)фенил] -3- [(2-фенилэтил)тио]-2H-пиран-2-он,
4-[5,6-дигидро-4-окси-2-оксо-3-[(фенилметил)тио] -2H-пиран-6- ил]-бензойную кислоту,
4-[5,6-дигидро-4-окси-2-оксо-3-[(2-фенилметил)тио]-2H-пиран-6-ил]- бензойную кислоту,
5,6-дигидро-4-окси-6-[4-(оксиметил)фенил]-3-[(фенилметил)тио]- 2H-пиран-2-он,
5,6-дигидро-4-окси-6-[4-(оксиметил)фенил] -3-[(2-фенилэтил)тио] - 2H-пиран-2-он.
В четвертую группу предпочтительных производных пирона общей формулы (I) входят соединения, у которых
X - OR4,
Y - кислород,
R3 - группа формулы -S(O)n5-[CH2]n3- [W4]g4-[Ar]n2-[CH2]n3- [W2]n4-R5, в частности группы формул -S-[CH2]n3-[W4]-[Ar]n2-[CH2]n3- [W2]n4-R5 или -S-[Ar]n2-[CH2]n3- [W2]n4-R5,
R1 и R2 не означают водород и не являются частями незамещенного или замещенного 3-, 4-, 5-, 6- или 7-членного кольца.
Примерами таких соединений являются
6-[1,1'-бифенил] -4-ил-6-бутил-5,6-дигидро-4-окси-3-[(2- фенилэтил)тио] -2H-пиран-2-он,
5,6-дигидро-4-окси-6-(2-метилпропил)-6-фенил-3-[(фенилметил)тио]- 2H-пиран-2-он,
5,6-дигидро-4-окси-6-(2-метилпропил)-6-фенил-3-[(2- фенилэтил)тио]-2H-пиран-2-он,
6-бутил-5,6-дигидро-4-окси-6-фенил-3-[(фенилметил)тио]-2H- пиран-2-он,
6-[1,1'-бифенил] -4-ил-6-бутил-5,6-дигидро-4-окси-3-[(фенилметил) тио]-2H-пиран-2-он,
5,6-дигидро-4-окси-6-фенил-3-[(фенилметил)тио]-6-пропил-2H-пиран- 2-он,
5,6-дигидро-4-окси-6-фенил-3-[(2-фенилэтил)тио]-6-пропил-2H-пиран- 2-он,
5,6-дигидро-4-окси-6-пентил-6-фенил-3-[(фенилметил)тио]-2H- пиран-2-он,
5,6-дигидро-4-окси-6-пентил-6-фенил-3-[(2-фенилэтил)тио]-2H- пиран-2-он,
5,6-дигидро-4-окси-6-(3-метилбутил)-6-фенил-3-[(фенилметил)тио] - 2H-пиран-2-он,
5,6-дигидро-4-окси-6-(3-метилбутил)-6-фенил-3-[(2-фенилэтил)тио]- 2H-пиран-2-он,
5,6-дигидро-4-окси-6,6-дифенил-3-[(фенилметил)тио]-2H-пиран-2-он,
5,6-дигидро-4-окси-6,6-дифенил-3-[(2-фенилэтил)тио]-2H-пиран-2-он,
5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-3-[(фенилметил)тио] - 2H-пиран-2-он,
5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-3-[(2-фенилэтил)тио] - 2H-пиран-2-он,
5,6-дигидро-4-окси-6-[4-[2-(4-морфолинил)этокси] фенил] -6-(2- фенилэтил)-3-[(2-фенилэтил)тио]-2H-пиран-2-он,
N-(1,1-диметилэтил)-1-[[3,6-дигидро-4-окси-6-оксо-2-фенил-5- [(2-фенилэтил)-тио]-2H-пиран-2-ил]метил]циклогексанкарбоксамид,
сложный фенилметиловый эфир 2-(1-метилэтил)-2-[[3,6-дигидро-4- окси-6-оксо-2-фенил-5-[(2-фенилэтил)тио]-2H-пиран-2-ил]метил] гидразинкарбоновой кислоты,
5,6-дигидро-4-окси-6-(3-метилбутил)-3-[[2-(1-метилэтил)фенил] тио]-6-фенил-2H-пиран-2-он,
3-[[5-этил-2-(1-метил-2-оксиэтил)фенил] тио] -5,6-дигидро-4- окси-6,6-дифенил-2H-пиран-2-он,
5-[5-[(2-циклопентил-5-изопропилфенил)тио] -3,6-дигидро-4- окси-6-оксо-2-фенил-2H-пиран-2-ил]пентановую кислоту,
5,6-дигидро-4-окси-3-[[5-(2-оксиэтил)-3-(2-фенилэтил)-2- изопропилфенил] -тио]-6-фенил-6-(2-фенилэтил)-2H-пиран-2-он,
4-[[5,6-дигидро-4-окси-2-оксо-6,6-дифенил-2H-пиран-3- ил]тио]-2-оксииндан,
3-[[4,5-диэтил-2-(1-оксиэтил)фенил] тио]-5,6-дигидро-4-окси-6- фенил-6-(2-фенилэтил)-2H-пиран-2-он,
3-[(1,4-ди-трет. бутил-1H-имидазол-2-ил)тио] -5,6-дигидро-4-окси- 6-(2-фенилэтил)-6-фенил-2H-пиран-2-он,
1-окси-4-[2-[4-окси-5-[(2-изопропил-5-метилфенил)тио] -6-оксо-2- фенил-3,6-дигидро-2H-пиран-2-ил]этил]-1H-пиридин-2-он,
5,6-дигидро-4-окси-6-[2-(1H-индол-5-ил)этил] -3-[(2-изопропил-5- метилфенил)тио]-6-фенил-2H-пиран-2-он,
5,6-дигидро-4-окси-3-[(2-изопропилфенил)тио]-6-фенил-6-[5- (фенилметил)амино-2,2-диметил-пентил]-2H-пиран-2-он,
бензиламид 5-[4-окси-5-[(2-изопропилфенил)тио]-6-оксо-2-фенил- 3,6-дигидро-2H-пиран-2-ил]-4,4-диметил-пентановой кислоты,
5,6-дигидро-4-окси-6-(5-оксипентил)-3-[(2-изопропилфенил)тио] -6- фенил-2H-пиран-2-он,
сложный трет. бутиловый эфир 5-[4-окси-5-[(2-изопропил-5- метилфенил)-тио]-6-оксо-2-фенил-3,6-дигидро-2H-пиран-2- ил]пентановой кислоты,
сложный метиловый эфир 5-[4-окси-5-[(2- изопропилфенил)тио]-6-оксо-2-фенил-3,6-дигидро-2H-пиран-2- ил]пентановой кислоты,
сложный этиловый эфир 5-[4-окси-5-[(2- изопропилфенил)тио]-6-оксо-2-фенил-3,6-дигидро-2H-пиран-2- ил]пентановой кислоты,
сложный пропиловый эфир 5-[4-окси-5-[(2- изопропилфенил)тио]-6-оксо-2-фенил-3,6-дигидро-2H-пиран-2- ил]пентановой кислоты,
сложный изопропиловый эфир 5-[4-окси-5-[(2- изопропилфенил)тио]-6-оксо-2-фенил-3,6-дигидро-2H-пиран-2- ил]пентановой кислоты,
сложный трет. бутиловый эфир 5-[4-окси-5- [(2-изопропилфенил)тио]-6-оксо-2-фенил-3,6-дигидро-2H-пиран-2- ил]пентановой кислоты,
сложный бензиловый эфир 5-[4-окси-5-[(2- изопропилфенил)тио]-6-оксо-2-фенил-3,6-дигидро-2H-пиран-2- ил]пентановой кислоты,
4-окси-3-[(2-изопропилфенил)тио] -6-(2-фенилэтил)-6-пропил- 5,6-дигидро-2H-пиран-2-он,
4-окси-6-изобутил-3-[(2-изопропил-5-метилфенил)тио] -6-(2- фенилэтил)-5,6-дигидро-2H-пиран-2-он,
сложный эфир 5-[(2-изопропил-5-метилфенил)тио] -6-оксо- 2-фенил-2-(2-фенилэтил)-3,6-дигидро-2H-пиран-4-ил-уксусной кислоты,
сложный эфир 2-[2-(бензо[1,3]диоксол-5-ил)этил]-5-[(2- изопропил-5-метилфенил)тио]-6-оксо-2-фенил-3,6-дигидро-2H-пиран- 4-ил-пропионовой кислоты,
5-[4-изобутирилокси-5-[(2-изопропилфенил)тио] -6-оксо-2-фенил- 3,6-дигидро-2H-пиран-2-ил]-пентановую кислоту.
В пятую группу предпочтительных производных пирона общей формулы (I) входят соединения, у которых
X - OR4,
Y - кислород,
R1 и R2 не означают водород и не являются частями незамещенного или замещенного 3-, 4-, 5-, 6- или 7-членного кольца,
R3 - группа формулы [W3]-[CH2]n3- [W4]n4-[Ar]n2-[CH2]n3- [W2]n4-R5, где
W3 означает кислород.
Примерами таких соединений являются
5,6-дигидро-4-окси-3-[5-метил-2-(1-метилэтил)фенокси] -6-фенил- 6-(2-фенилэтил)-2H-пиран-2-он,
4-окси-3-(2-изопропилфенокси)-6-фенил-6-(2-фенилэтил)-5,6-дигидро- 2H-пиран-2-он,
4-окси-3-(2-изопропил-5-метилфенокси)-6-фенил-6-(2-фенилэтил)- 5,6-дигидро-2H-пиран-2-он,
3-(2-трет. бутилфенокси)-4-окси-6-фенил-6-(2-фенилэтил)-5,6- дигидро-2H-пиран-2-он,
5-[5-(2-циклопентилфенокси)-4-окси-6-оксо-2-фенил-3,6-дигидро- 2H-пиран-2-ил]пентановую кислоту,
4-окси-3-(2-изопропил-5-метилфенокси)-6-(2-фенилэтил)-6-пропил- 5,6-дигидро-2H-пиран-2-он,
6-циклопентилметил-4-окси-3-(2-изопропилфенокси)-6-фенил-5,6- дигидро-2H-пиран-2-он.
В шестую группу предпочтительных производных пирона общей формулы (I) входят соединения, у которых
X - OR4,
Y - кислород,
R1 и R2 не означают водород и не являются частями незамещенного или замещенного 3-, 4-, 5-, 6- или 7-членного кольца,
W3 - группа формулы NR5.
Примерами таких соединений являются:
5,6-дигидро-4-окси-6-(3-метилбутил)-3-[(4-метилпентил) (фенилметил)-амино]-6-фенил-2H-пиран-2-он,
3-диизобутиламино-5,6-дигидро-4-окси-6,6-дифенил-2H-пиран-2-он,
5,6-дигидро-4-окси-6-(2-фенилэтил)-6-фенил-3-(N-фенил- N-пропиламино)-2H-пиран-2-он,
5,6-дигидро-4-окси-3-[(2-изопропил-5-метилфенил)амино] -6,6- дифенил-2H-пиран-2-он,
6-бутил-3-[(1,4-ди-трет. бутил-1H-имидаэол-2-ил)амино]-5,6- дигидро-4-окси-6-фенил-2H-пиран-2-он,
3-(циклопропилфениламино)-4-окси-6-фенил-6-(2-фенилэтил)-5,6- дигидро-2H-пиран-2-он,
N-[3-[циклопропил[4-окси-2-оксо-6-фенил-6-(2-фенилэтил)-5,6- дигидро-2H-пиран-3-ил]амино]фенил]-бензолсульфонамид,
3-(циклопропилфениламино)-4-окси-6-(2-фенилэтил)-6-пропил-5,6- дигидро-2H-пиран-2-он,
4-окси-6-изобутил-6-(2-фенилэтил)-3-(фенилпропиламино)-5,6- дигидро-2H-пиран-2-он,
N-[4-окси-2-оксо-6-фенил-6-(2-фенилэтил)-5,6-дигидро-2H-пиран-3- ил] -N-фенилметансульфонамид,
N-[6-(2-бензо[1,3] диоксол-5-ил-этил)-4-окси-2-оксо-6-фенил-5,6- дигидро-2H-пиран-3-ил]-N-(3-метилбутил)бензолсульфонамид,
3-[циклопентил(циклопентилметил)амино] -4-окси-6-фенил-6-(2- фенилэтил)-5,6-дигидро-2H-пиран-2-он.
В седьмую группу предпочтительных производных пирона общей формулы (I) входят соединения, выбранные из группы, включающей
5,6-дигидро-6-фенил-6-(2-фенилэтил)-2H-пиран-2-он,
6-(2-бензо[1,3] диоксол-5-ил-этил)-5,6-дигидро-4-окси-6-фенил- 2H-пиран-2-он,
6-(циклопентилметил)-5,6-дигидро-4-окси-6-фенил-2H-пиран-2-он,
5-(3,6-дигидро-4-окси-6-оксо-2-фенил-2H-пиран-2-ил)-пентановую кислоту.
Соединения согласно изобретению являются нетоксичными в концентрациях, равных или больше 100 мкм.
Некоторые соединения общей формулы (I) способны к образованию фармацевтически приемлемых кислотно-аддитивных солей, и/или фармацевтически приемлемых солей с основаниями.
Фармацевтически приемлемые кислотно-аддитивные соли соединений общей формулы (I) включают соли с нетоксичными неорганическими кислотами, такими как, например, хлористоводородная кислота, азотная кислота, фосфорная кислота, серная кислота, бромистоводородная кислота, йодистоводородная кислота, фтористоводородная кислота, фосфористая кислота и т.п., а также соли с нетоксичными органическими кислотами, такими как, например, алифатические моно- и дикарбоновые кислоты, замещенные фенилом алканкарбоновые кислоты, оксиалканкарбоновые кислоты, алкандикарбоновые кислоты, ароматические кислоты, алифатические и ароматические сульфокислоты и т.д. Таким образом соли включают сульфат, пиросульфат, бисульфат, сульфит, бисульфит, нитрат, фосфат, вторичный фосфат, первичный фосфат, метафосфат, пирофосфат, хлорид, бромид, йодид, ацетат, трифторацетат, пропионат, каприлат, изобутират, оксалат, малонат, сукцинат, суберат, себацат, фумарат, малеат, манделат, бензоат, хлорбензоат, метилбензоат, динитробензоат, фталат, бензолсульфонат, толуолсульфонат, фенилацетат, цитрат, лактат, малеат, тартрат, метансульфонат и т.п. Данным изобретением также охватываются соли с аминокислотой, такие как, например, аргинат и т.п., а также глюконат и галактуронат (см., например, S. M. Berge, и др., "Pharmaceutical Salts", Journal of Pharmaceutical Science, 66:1 -19, 1977 г.).
Кислотно-аддитивные соли основных соединений получают в результате взаимодействия свободного основания с достаточным количеством желаемой кислоты для получения соли стандартным приемом.
Фармацевтически приемлемые соли с основанием представляют собой соли с металлами или аминами, такими как, например, щелочные металлы или щелочноземельные металлы или органические амины. В качестве металлов, пригодных для применения в качестве катионов, можно называть, например, натрий, калий, магний, кальций и т.п. В качестве подходящих аминов можно называть, например, N, N'-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, дициклогексиламин, этилендиамин, N-метилглюкамин, прокаин (см., например, S.M. Berge, и др. , "Pharmaceutical Salts", Journal of Pharmaceutical Science, 66: 1-19, 1977 г.).
Соли кислотных соединений с основанием получают в результате взаимодействия свободной кислоты с достаточным количеством желаемого основания для получения соли стандартным приемом.
Некоторые соединения настоящего изобретения могут иметься как в несольватированных формах, так и в сольватированных формах, включая гидратированные формы. В общем сольватированные формы, включая гидратированные формы, проявляют такую же активность, что и несольватированные формы предлагаемых соединений. Поэтому они также охватываются настоящим изобретением.
Некоторые из предлагаемых соединений имеют один или несколько хиральных центров, каждый из которых может иметься в виде конфигурации R(D) или S(L).
Настоящее изобретение включает все энантиомерные и эпимерные формы, а также их смеси.
Дальнейшим объектом изобретения являются производные пиранона, выбранные из группы, включающей
3-бром-5,6-дигидро-4-окси-6,6-дифенил-2H-пиран-2-он,
3-бром-5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-2H-пиран-2-он,
6-(2-бензо[1,3] диоксол-5-ил-этил)-3-бром-5,6-дигидро-4-окси-6- фенил-2H-пиран-2-он,
3-бром-5,6-дигидро-4-окси-(3-метилбутил)-6-фенил-2H-пиран-2-он,
5-[5-бром-4-окси-6-оксо-2-фенил-3,6-дигидро-2H-пиран-2-ил] пентановую кислоту,
представляющие собой промежуточные продукты для получения соединений вышеприведенной формулы (I).
Соединения вышеприведенной формулы (I) могут представлять собой активное вещество фармацевтической композиции с антивирусной и антибактериальной активностью, которая помимо эффективного количества активного вещества содержит еще по меньшей мере один фармацевтически приемлемый носитель. Данная фармацевтическая композиция является дальнейшим объектом настоящего изобретения. Она может иметься в виде стандартных препаратов, пригодных для оральной или парентеральной аппликации. Предлагаемые соединения можно апплицировать путем инъекции, т.е. внутривенно, внутримышечно, интрадермально, подкожно, интрадуоденально или внутрибрюшинно. Предлагаемые соединения также можно апплицировать путем ингаляции, например, через нос. Кроме того, предлагаемые соединения можно апплицировать трансдермально. Описанные в нижеследующем препараты разного вида дозирования в качестве активного вещества могут содержать либо соединение общей формулы (I), либо соответствующую фармацевтически приемлемую соль соединения формулы (I).
Фармацевтически приемлемые носители, используемые для изготовления фармацевтических композиций, содержащих предлагаемые соединения, могут быть либо в твердом, либо в жидком состоянии.
Твердыми препаратами являются, например, порошки, таблетки, пилюли, капсулы, суппозитории, диспергируемые гранулы. В качестве твердого носителя можно применять одно или несколько веществ, которые могут также выполнять функции разбавителя, вкусового вещества, связующего, консерванта, дезинтегрирующего таблетки вещества, вещества для заключения активного начала.
В случае порошка носитель представляет собой тонкоизмельченное вещество, имеющееся в виде смеси с тонкоизмельченным активным началом.
Для приготовления таблеток активное начало смешивают с подходящим носителем в пригодных соотношениях, после чего смесь прессуют с получением таблеток желаемых размеров и конфигураций.
Порошки и таблетки предпочтительно содержат от 5 или 10 приблизительно до 70% активного начала. Подходящими носителями являются, например, карбонат магния, стеарат магния, тальк, сахар, лактоза, пектин, декстрин, крахмал, желатина, трагакант, метилцеллюлоза, карбоксиметилцеллюлоза натрия, низкоплавкий воск, масло какао и т.п. Под термином "препарат" понимаются также капсулы с размещенным в них активным началом, отдельно или в виде смеси с носителями, при этом материал, из которого выполнены капсулы, представляет собой носитель активного начала. Кроме того, под термином "препарат" также понимаются крахмальные капсулы и лепешки. Таблетки, порошки, капсулы, пилюли, крахмальные капсулы и лепешки представляют собой твердые препараты, пригодные для оральной дачи.
Суппозитории можно приготовлять за счет того, что низкоплавкий воск, такой как, например, смесь глицеридов жирных кислот, или масло какао, сначала расплавляют и, размешивая, в получаемом расплаве гомогенно диспергируют активное начало. Получаемый гомогенный расплав вливают в формы подходящих размеров, где ему дают возможность охлаждаться и отверждаться.
В качестве жидких препаратов можно назвать растворы, суспензии и эмульсии, например, водные растворы или растворы воды и пропиленгликоля. Для парентеральной инъекции жидкие препараты представляют собой растворы в водном полиэтиленгликоле.
Пригодные для оральной аппликации водные растворы можно получать путем растворения активного начала в воде и добавления подходящих целевых добавок, таких как, например, красители, вкусовые вещества, стабилизаторы, сгустители.
Пригодные для оральной аппликации водные суспензии можно получать путем диспергирования тонкоизмельченного активного начала в воде в присутствии вязкого вещества, такого как, например, естественные или синтетические смолы, резины, метилцеллюлоза, карбоксиметилцеллюлоза натрия и другие широко известные суспендирующие агенты.
В объем изобретения также входят твердые препараты, которые предназначены для переведения в жидкие препараты непосредственно перед оральной аппликацией. Такие жидкости представляют собой растворы, суспензии и эмульсии. Кроме активного начала эти препараты также могут содержать красители, вкусовые вещества, стабилизаторы, буферы, естественные или синтетические подслащивающие вещества, диспергаторы, сгустители, способствующие солюбилизации агенты и т.п.
Фармацевтическая композиция предпочтительно выпускается в виде препарата, включающего дозировочные единицы, каждая из которых содержит соответствующее количество активного начала. Дозировочная единица может представлять собой упакованный препарат, причем упаковка содержит подходящее количество препарата, например, упакованные таблетки, упакованные капсулы, порошки в оболочках или ампулах. Дозировочной единицей могут также являться капсула, таблетка, крахмальная капсула или лепешка как таковые, или же упакованное подходящее количество их.
Количество активного начала в дозировочной единице может колебаться в пределах 0,1 мг - 100 мг, предпочтительно 0,5 мг - 100 мг, в зависимости от конкретного назначения и от эффективности активного начала. Кроме того, препарат может также содержать еще другие, совместимые терапевтические агенты.
При применении в качестве антагониста ретровирусной протеазы, активного начала для лечения вызванных ретровирусом, в том числе ВИЧем, инфекций, или в качестве активного начала для лечения заболеваний вследствие СПИДа соединения по предлагаемому фармацевтическому способу сначала дают в дозах примерно 0,01 - 100 мг/кг в сутки. Предпочтительная суточная доза активного начала составляет примерно 0,01 - 10 мг/кг. Однако от указанных доз можно отклоняться в зависимости от состояния пациента, серьезности заболевания, апплицируемого соединения. Специалист в данной области может определять подходящую дозировку в каждом конкретном случае. Обычно поступают так, что в начале лечения дают маленькие дозы предлагаемых соединений, которые меньше оптимальной дозы. Затем дозу постепенно повышают до достижения оптимального терапевтического эффекта. При необходимости общая суточная доза может разделяться и порциями даваться в течение дня.
В следующем приводятся примеры конкретных препаратов.
Препарат А
5 мг активного вещества формулы (I), например, примера 1, растворяют в 1 л дистиллированной воды для приготовления готового к применению раствор.
Препарат Б
5 мг активного вещества формулы (I), например, примера 167, растворяют в 10%-ном ДМА, содержащемся в буфере 50 ммоль молочной кислоты, pH 4,0. Получают готовый к применению раствор.
Препарат В
250 мг активного вещества формулы (I) смешивают со стеаратом магния, силикатом кальция и поливинилпирролидоном, взятым в количестве до 1 г, и получаемую смесь перерабатывают в таблетки.
Препарат Г
В растворе 700 мл пропиленгликоля и 200 мл дистиллированной воды для инъекции растворяют 20,0 г активного вещества формулы (I), например, примера 170. Значение pH раствора хлористоводородной кислотой доводят до 5,5 и объем доводят до 1000 мл добавлением дистиллированной воды. Композицию стерилизуют, разливают в ампулы емкостью 5,0 мл, каждая из которых содержит 2,0 мл композиции (что представляет собой 40 мг активного вещества) и герметизуют в атмосфере азота.
Далее приводятся общие данные по получению производных 5,6-дигидропирона. Схема (I) иллюстрирует получение замещенного дигидропирона (I) (см. в конце текста).
Сложный метиловый эфир ацетоуксусной кислоты (1) последовательно обрабатывают гидридом металла, предпочтительно гидридом натрия, в тетрагидрофуране или диэтиловом эфире при температуре -20oC - +10oC, и более сильным основанием, обычно н-бутиллитием, в среде растворителя, такого как, например, тетрагидрофуран или диэтиловый эфир, при температуре -20oC - +10oC, с получением дианиона. Реакционную смесь резко охлаждают добавлением замещенного альдегида или кетона, смеси дают реагировать в течение еще 15 минут - 24 часов и перерабатывают с получением β-кетолактона (дигидропирона) формулы (2). Соединение (II) переводят в целевой пирон формулы (I) путем обработки подходящим электрофилом, таким как, например, тиотозилат, алкилгалогенид и т.п., в растворе этанола или диметилформамида, содержащего инертное основание, например, триэтиламин и/или бикарбонат натрия, при температуре 25 - 80oC.
Для вышеописанного приема, а также для других приемов получения предлагаемых соединений, реакционноспособные функциональные группы в исходных, промежуточных или целевых продуктах во время химических реакций можно защищать с помощью защитных групп, при этом реакционноспособные функциональные группы становятся в основном инертными в условиях реакции (см., например, Protective Groups in Organic Synthesis, 2-е издание, T.W. Green и P.G. Wuts, издательство John Wiley & Sons, Нью-Йорк, 1991 г.). В качестве группы, защищающей аминогруппу, гидроксил и другие группы, обладающие соответствующей реакционноспособностью, можно называть, например: карбоксильные ацильные группы, такие как, например, формил, ацетил, трифторацетил; алкоксикарбонильные группы, например, этоксикарбонил, трет.бутоксикарбонил, β,β,β-трихлорэтоксикарбонил, β-йодэтоксикарбонил; арилоксикарбонильные группы, например, бензилоксикарбонил, пара-метоксибензилоксикарбонил, феноксикарбонил; триалкилсилильные группы, например, триметилсилил и трет.бутилдиметилсилил; а также такие группы как, например, тритил, тетрагидропиранил, винилоксикарбонил, орто-нитрофенилсульфенил, дифенилфосфинил, пара-толуолсульфонил, бензил. После окончания соответствующей реакции синтеза защитные группы можно удалять известными приемами. Например, трет.бутоксикарбонил удаляют путем ацидолиза, тритил - путем гидрогенолиза, трет.бутилдиметилсилил - путем обработки ионами фтора, а β,β,β-трихлорэтоксикарбонил - путем обработки цинком.
В качестве альтернативы в схеме (II) иллюстрируется другой метод получения замещенного в положении 3 дигидропирона (cм. в конце текста).
Сложный эфир ацетоуксусной кислоты формулы (2) обрабатывают основанием, таким как, например, гидрид натрия или этоксид натрия, в среде подходящего растворителя, такого как, например, тетрагидрофуран, диэтиловый эфир или спирт, при температуре -20oC - +10oC, а получаемый при этом анион резко охлаждают добавлением замещенного алкила или галоидбензила, обычно в виде бромида или йодида, с получением кетоэфира формулы (5), при этом Y' означает группу CH2. В качестве альтернативы сложный эфир хлорацетоуксусной кислоты формулы (4) подвергают взаимодействию с тиолом, причем реакцию предпочтительно осуществляют в присутствии подходящего основания, такого как, например, триэтиламин, пиперидин или пиридин, и в среде подходящего растворителя, например, дихлорметана, при температуре -10oC - +25oC. При этом получают сложный кетоэфир формулы (5), где Y' означает атом серы (см. Z. Yoshida и др. , Tetrahedron 26: 2987, 1970 г.). Необходимый для этого тиол получают из соответствующего фенола путем перегруппировки Ньюманна-Кварта (см., например, Н. Kwart и Н. Omura, J. Amer. Chem. Soc. 93: 7250, 1971 г.; M.S. Newman и F. W. Hetzel, Org. Synth. Coll.: том VI: 824, 1988 г.; M.S. Newman и H.A. Karnes, J. Org. Chem. 31: 3980, 1966 г.) или же из соответствующего йодбензола путем нуклеофильной замены с использованием тиомочевины в присутствии никелевого катализатора (К. Takagi, Chem. Letters, 1307, 1985 г.).
Соответственно, в результате взаимодействия соединения формулы (4) с алкоксидом в среде подходящего растворителя, такого как, например, бензол, диметилформамид или смесь тетрагидрофурана и гексаметилфосфорамида, при температуре -10oC - +25oC получают сложный эфир ацетоуксусной кислоты формулы (5), где Y означает атом кислорода (см. Т. Sasaki и др., Tetrahedron 38: 85, 1982 г. ). Промежуточный продукт формулы (5) по общему методу, иллюстрированному в схеме (I), переводят в дигидропирон формулы (I).
Замещенные в положении 3 амино-группой производные получаются по схеме (III) (см. в конце текста).
Сложный эфир формулы (6) подвергают взаимодействию с подходящим основанием, таким как, например, диизопропиламид лития, в среде подходящего растворителя, такого как, например, тетрагидрофуран или диэтиловый эфир, при температуре -78oC - +0oC, а получаемый при этом анион подвергают взаимодействию с подходящим замещенным агентом ацилирования, таким как, например, сложный эфир формулы (7), при этом получают сложный кетоэфир формулы (8). В результате циклизации соединения формулы (8), например, путем взаимодействия с подходящим основанием, таким как, например, гидроокись натрия или алкоголят натрия, получают целевой дигидропирон формулы (I).
Каждый 4-окси-2H-пиран-2-он может содержать соответствующую удаляемую группу, такую как, например, галоид, ацетат, тозилат и т.д., в одном из заместителях R1 и R2. Такие удаляемые группы можно заменять первичными или вторичными аминами. Такая замена осуществляется в среде спирта, диметилформамида или диметилсульфоксида при температуре -10oC - 125oC. Также, если остатки R1 и R2 содержат группу, представляющую собой производное карбоновой кислоты, то эту группу можно переводить в другую группу с получением дальнейших остатков R1 и R2, входящих в вышеуказанный перечень их значений. Такие реакции включают этерификацию и образование амина общеизвестными методами.
Далее нижеуказанные 4-окси-2(1Н)-пиридиноны, например, формулы (9), известны (см., например, M.J. Ashton и др., Heterocycles 28: (2) 1015, 1989 г. ), и их можно переводить в ингибиторы протеазы и антивирусные агенты, аналогичные 5,6- дигидропиронам, путем реакций, аналогичным тем, используемым для переработки соединения формулы (2) в соединение формулы (I) по схеме (I).

Замещенные 1,3-циклогександионы можно получать известными методами, например, методами, описанными в источнике Werbel, J. Med. Chem. 35: 3429 - 3447, 1992 г. 1,3-циклогександионы можно переводить в замещенные производные путем реакций, аналогичных тем, которыми соединения формулы (2) переводят в соединения формулы (I).
Производные тетрагидро(тио)пиран-2,4-диона получаются известными методами, например, методом, описанным в патенте США N 4 842 638. Тетрагидро(тио)пиран-2,4-дионы можно переводить в разные замещенные производные путем реакций, аналогичных тем, которыми соединения формулы (2) переводят в соединения формулы (I).
Производные, содержащие тио-группу в положении 3, также можно получать методом, иллюстрированным в схеме (IV) (cм в конце текста).
Дигидропирон формулы (10) в течение 1 - 18 часов подвергают взаимодействию с подходящим агентом бромирования, таким как, например, N-бромсукцинимид, в среде подходящего растворителя, такого как, например, трет.бутанол. Получаемое при этом бромсодержащее соединение формулы (11) подвергают взаимодействию с тиолом, причем реакцию обычно осуществляют в присутствии подходящего основания, такого как, например, пиридина или пиперидина, и в среде подходящего растворителя, например, дихлорметана, при температуре 0oC - +25oC, при этом получают целевой продукт формулы (I).
Другой метод получения производных, содержащих заместитель атома углерода в положении 3, иллюстрируется в схеме (V) (cм. в конце текста).
Дигидропирон формулы (10) подвергают взаимодействию с подходящим хлорангидридом кислоты, и получаемый при этом продукт подвергают перегруппировке по методам, описанным в патенте США N 4 842 638 (1989 г.) с получением промежуточного продукта формулы (11). Кетоновую группу соединения формулы (12) восстанавливают до метилена с помощью подходящего восстановителя, такого как, например, цианоборгидрид натрия или водород в присутствии катализатора, при этом получают соединение формулы (I).
Далее приводятся подробные данные по проведению способов получения производных 5,6-дигидропирона.
Общий метод 1
Сложный метиловый эфир ацетоуксусной кислоты по каплям подают в суспензию гидрида натрия, промытого гексаном, в неводном тетрагидрофуране при температуре 0oC, и реакционную смесь перемешивают при температуре 0oC в течение 15 минут - 1 часа. При температуре 0oC добавляют н-бутиллитий и реакционную смесь перемешивают при температуре 0oC в течение 15 минут - 1 часа. В дианион подают альдегид или кетон в тетрагидрофуране, реакционную смесь перемешивают при температуре 0oC в течение 15 минут - 24 часов, после чего смеси в течение 15 минут - 24 часов дают нагреваться до комнатной температуры. В реакционную смесь подают воду и смесь перемешивают в течение по меньшей мере 15 минут, а максимально - в течение ночи. Экстрагируют диэтиловым эфиром, и водный слой при температуре 0oC подкисляют 2 н. - 6 н. соляной кислотой до достижения pH 1-2. Водный слой экстрагируют этилацетатом или дихлорметаном. Органические экстракты кислотного раствора объединяют, сушат над сульфатом магния и сгущают.
Пример А
(±)5,6-дигидро-4-окси-6-фенил-2H-пиран-2-он
Целевое соединение получают по общему методу 1 с применением 13,67 г сложного метилового эфира ацетоуксусной кислоты, 8,5 г 60%-ной дисперсии гидрида натрия в масле, 73,6 мл 1,6 м. раствора н-бутиллития в гексане, 10 г бензальдегида и 300 мл тетрагидрофурана. После добавления альдегида реакционную смесь перемешивают в течение 15 минут при температуре -78oC. Смеси дают нагреваться до комнатной температуры в течение ночи. Смесь сгущают и фильтруют, при этом получают твердое вещество с точкой плавления 145 - 146oC.
1H-ЯМР (CDCl3): δ = 2,8 - 3,05 (м, 2H), 3,5 (д, 1H), 3,7 (д, 1H), 5,7 (дд, 1H), 7,3-7,5 (м, 5H).
Пример Б
(±)5,6-дигидро-4-окси-6-(2-метилпропил)-6-фенил-2H-пиран- 2-он
Целевое соединение получают по общему методу 1 с применением 12 г сложного метилового эфира ацетоуксусной кислоты, 4,3 г 60%-ной дисперсии гидрида натрия в масле, 64,5 мл 1,6 м. раствора н-бутиллития в гексане, 10 г изо-валерофенона и 300 мл тетрагидрофурана. После добавления фенона реакционную смесь перемешивают в течение 15 минут при температуре -78oC и в течение еще 2 часов при комнатной температуре. Сырую реакционную смесь подвергают флеш-хроматографии с применением в качестве элюента смеси гексана и этилацетата в соотношении 60:40 - 40:60. Продукт с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 123,5 - 125oC.
1H-ЯМР (CDCl3): δ = 0,81 (д, 3H), 0,89 (д, 3H), 1,6-1,7 (м, 1H), 1,91 (м, 2H), 2,90 (д, 1H), 2,95 (д, 1H), 3,25 (д, 1H), 3,35 (д, 1H), 7,25 - 7,45 (м, 5H).
Пример В
(±)5,6-дигидро-4-окси-6-(4-метоксифенил)-2H-пиран-2-он
Целевое соединение получают по общему методу 1 с применением 5 мл сложного метилового эфира ацетоуксусной кислоты, 2,0 г 60%-ной дисперсии гидрида натрия в масле, 25 мл 2,0 м. раствора н-бутиллития в гексане, 7,0 мл 4-метоксибензальдегида и 150 мл тетрагидрофурана. После добавления альдегида реакционную смесь перемешивают в течение 15 минут при температуре 0oC. Смеси дают нагреваться в течение ночи до комнатной температуры. Сырой продукт с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 159 - 162oC (разлож.).
1H-ЯМР (CDCl3): δ = 2,91 (дд, 2H), 3,57 (дд, 2H), 3,83 (с, 3H), 5,66 (дд, 1H), 6,93 - 6,97 (м, 2H), 7,30 - 7,34 (м, 2H).
Пример Г
(±)5,6-дигидро-4-окси-6-[4-(метилтио)фенил]2H-пиран-2-он
Целевое соединение получают по общему методу 1 с применением 10 мл сложного метилового эфира ацетоуксусной кислоты, 4,0 г 60%-ной дисперсии гидрида натрия в масле, 60 мл 1,6 м. раствора н-бутиллития в гексане, 18,8 мл 4-метилтиобензальдегида и 200 мл тетрагидрофурана. После добавления альдегида реакционную смесь перемешивают в течение 15 минут при температуре 0oC. Смеси дают нагреваться в течение ночи до комнатной температуры. Сырой продукт с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 139-141oC.
1H-ЯМР (CDCl3): δ = 2,51 (с, 3H), 2,92 (дд, 2H), 3,58 (дд, 2H), 5,68 (дд, 1H), 7,27 - 7,31 (м, 4H).
Пример Д
(±)5,6-дигидро-4-окси-6-(4-метилфенил)-2H-пиран-2-он
Целевое соединение получают по общему методу 1 с применением 10 мл сложного метилового эфира ацетоуксусной кислоты, 3,7 г 60%-ной дисперсии гидрида натрия в масле, 58 мл 1,6 м. раствора н-бутиллития в гексане, 10,9 мл п-толуальдегида и 250 мл тетрагидрофурана. После добавления альдегида реакционную смесь перемешивают в течение 15 минут при температуре 0oC. Смеси дают нагреваться в течение ночи до комнатной температуры. Сырой продукт с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 138 - 139oC.
1H-ЯМР (CDCl3): δ = 2,39 (с, 3H), 2,93 (дд, 2H), 3,58 (дд, 2H), 5,69 (дд, 1H), 7,23 - 7,31 (м, 4H).
Пример E
(±)6-[4-(1,1-диметилэтил)фенил]-5,6-дигидро-4-окси-2H- пиран-2-он
Целевое соединение получают по общему методу 1 с применением 5,0 мл сложного метилового эфира ацетоуксусной кислоты, 2,0 г 60%-ной дисперсии гидрида натрия в масле, 31,5 мл 1,6 м. раствора н-бутиллития в гексане, 9,0 г 4-(1,1-диметилэтил)бензальдегида и 100 мл тетрагидрофурана. После добавления альдегида реакционную смесь перемешивают в течение 15 минут при температуре 0oC. Смеси дают нагреваться в течение ночи до комнатной температуры. Сырой продукт с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 164 - 165oC.
1H-ЯМР (CDCl3): δ = 1,33 (с, 9H), 2,94 (дд, 2H), 3,59 (дд, 2H), 5,69 (дд, 1H), 7,31 - 7,47 (м, 4H).
Пример Ж
(±)6-(4-хлорфенил)-5,6-дигидро-4-окси-2H-пиран-2-он
Целевое соединение получают по общему методу 1 с применением 10 мл сложного метилового эфира ацетоуксусной кислоты, 3,9 г 60%-ной дисперсии гидрида натрия в масле, 58 мл 1,6 м. раствора н-бутиллития в гексане, 13,5 г 4-хлорбензальдегида и 250 мл тетрагидрофурана. После добавления альдегида реакционную смесь перемешивают в течение 15 минут при температуре 0oC. Смеси дают нагреваться в течение ночи до комнатной температуры. Сырой продукт с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 149 - 150oC.
1H-ЯМР (CDCl3): δ = 2,83 (дд, 1H), 2,95 (дд, 1H), 3,60 (дд, 2H), 5,67 (дд, 1H), 7,33 - 7,44 (м, 4H).
Пример З
(±)6-(3-[хлорфенил)-5,6-дигидро-4-окси-2H-пиран-2-он
Целевое соединение получают по общему методу 1 с применением 5,0 мл сложного метилового эфира ацетоуксусной кислоты, 2,0 г 60%-ной дисперсии гидрида натрия в масле, 25 мл 2,0 м. раствора н-бутиллития в гексане, 6,5 мл 3-хлорбензальдегида и 150 мл тетрагидрофурана. После добавления альдегида реакционную смесь перемешивают в течение 15 минут при температуре 0oC. Смеси дают нагреваться в течение ночи до комнатной температуры. Сырой продукт с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 122 - 124oC.
1H-ЯМР (CDCl3): δ = 2,83 (дд, 1H), 2,96 (дд, 1H), 3,60 (дд, 2H), 5,68 (дд, 1 H), 7,25 - 7,42 (м, 4H).
Пример И
(±)5,6-дигидро-4-окси-6-[4-(фенилметокси)фенил]-2H-пиран- 2-он
Целевое соединение получают по общему методу 1 с применением 5,0 мл сложного метилового эфира ацетоуксусной кислоты, 2,0 г 60%-ной дисперсии гидрида натрия в масле, 25 мл 2,0 м. раствора н-бутиллития в гексане, 12,0 г 4-бензилоксибензальдегида и 150 мл тетрагидрофурана. После добавления альдегида реакционную смесь перемешивают в течение 15 минут при температуре 0oC. Смеси дают нагреваться в течение ночи до комнатной температуры. Сырой продукт с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 165 - 166oC.
1H-ЯМР (CDCl3): δ = 2,91 (дд, 2H), 3,56 (дд, 2H), 5,09 (с, 2H), 5,65 (дд, 1H), 6,98 -7,04(м,2Н), 7,30 - 7,44 (м, 7Н).
Пример Й
(±)6-[1,1'-бифенил]-4-ил-5,6-дигидро-4-окси-2H-пиран-2-он
Целевое соединение получают по общему методу 1 с применением 13,0 г сложного этилового эфира ацетоуксусной кислоты, 5,3 г 50%-ной дисперсии гидрида натрия в масле, 60 мл 1,6 м. раствора н-бутиллития в гексане, 16,3 г 4-бифенилкарбоксальдегида и 300 мл тетрагидрофурана. После добавления альдегида реакционную смесь перемешивают в течение 15 минут при температуре 0oC. Смеси дают нагреваться в течение ночи до комнатной температуры. Сырой продукт с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 150 - 152oC.
1H-ЯМР (CDCl3): δ = 2,97 (дд, 2H), 3,60 (дд, 2H), 5,77 (дд, 1H), 7,27 - 7,68 (м, 9H).
Пример К
(±)6-[[(1,1'-бифенил)-4-илокси]метил]-5,6-дигидро-4-окси- 2H-пиран-2-он
Целевое соединение получают по общему методу 1 с применением 4,76 г сложного метилового эфира ацетоуксусной кислоты, 1,97 г 50%-ной дисперсии гидрида натрия в масле, 19,5 мл 2,1 м. раствора н-бутиллития в гексане, 8,7 г [[1,1'-бифенил]-4-илокси]- ацетальдегида и 200 мл тетрагидрофурана. После добавления альдегида реакционную смесь перемешивают в течение 60 минут при температуре 0oC. Смеси дают нагреваться в течение ночи до комнатной температуры. Сырой продукт с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 152 - 154oC.
1H-ЯМР (CDCl3): δ = 2,83 (дд, 1H), 2,95 (дд, 1H), 3,61 (дд, 2H), 4,23 (дд, 1H), 4,38 (дд, 1H), 5,03 - 5,07 (м, 1H), 6,94 - 6,98 (м, 2H), 7,30 - 7,57 (м, 7H).
Пример Л
(±)6-[1,1'-бифенил]-4-ил-6-бутил-5,6-дигидро-4-окси-2H- пиран-2-он
Целевое соединение получают по общему методу 1 с применением 13 г сложного этилового эфира ацетоуксусной кислоты, 5,3 г 60%-ной дисперсии гидрида натрия в масле, 60 мл 1,6 м. раствора н-бутиллития в гексане, 21 г 1-[1,1'-бифенил] -4-ил-1-пентанона и 300 мл тетрагидрофурана. После добавления кетона реакционную смесь перемешивают в течение 15 минут при температуре -78oC и в течение 2 часов при комнатной температуре. Из сырой реакционной смеси получают твердое вещество, которое раз промывают дихлорметаном и дважды этилацетатом. Точка плавления продукта 165 - 170oC.
1H-ЯМР (ДМСО-d6): δ = 0,7 - 1,9 (м, 7H), 2,0 (м, 2H), 3,0 (с, 2H), 4,9 (с, 1H), 7,3-7,8 (м, 9H), 11,3 (с, 1H).
Пример М
(±)4-[2,3-дигидpo-4-oкcи-6-oкco-2H-пиpaн-2-ил]-бензонитpил
Целевое соединение получают по общему методу 1 с применением 5,0 мл сложного метилового эфира ацетоуксусной кислоты, 2,0 г 60%-ной дисперсии гидрида натрия в масле, 25 мл 2,0 м. раствора н-бутиллития в гексане, 7,6 г 4-цианобензальдегида и 150 мл тетрагидрофурана. После добавления альдегида реакционную смесь перемешивают в течение 10 минут при температуре 0oC. Смеси дают нагреваться в течение ночи до комнатной температуры. Сырой продукт с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 149 - 152oC.
1H-ЯМР (CDCl3): δ = 2,80 (дд, 1Н), 2,99 (дд, 1H), 3,65 (дд, 2H), 5,75 (дд, 1H), 7,55 (д, 2H), 7,75 (д, 2H).
Пример H
(±)6-(4-тpифтopмeтилфeнил)-5,6-дигидpo-4-oкcи-2H-пиpaн- 2-oн
Целевое соединение получают по общему методу 1 с применением 10 мл сложного метилового эфира ацетоуксусной кислоты, 3,7 г 60%-ной дисперсии гидрида натрия в масле, 58 мл 1,6 м. раствора н-бутиллития в гексане, 11,5 г 4-трифторметилбензальдегида и 250 мл тетрагидрофурана. После добавления альдегида реакционную смесь перемешивают в течение 10 минут при температуре 0oC, и в течение 30 минут при комнатной температуре. Сырой продукт с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 155 - 156oC.
1H-ЯМР (CDCl3): δ = 2,83 (дд, 1H), 2,99 (дд, 1H), 3,58 (дд, 2H), 5,76 (дд, 1H), 7,50 - 7,76 (м, 4H).
Пример О
(±)6-(3,5-дихлорфенил)-5,6-дигидро-4-окси-2H-пиран-2-он
Целевое соединение получают по общему методу 1 с применением 2,5 мл сложного метилового эфира ацетоуксусной кислоты, 1,0 г 60%-ной дисперсии гидрида натрия в масле, 12,5 мл 2,0 м. раствора н-бутиллития в гексане, 5,1 г 3,5-дихлорбензальдегида и 75 мл тетрагидрофурана. После добавления альдегида реакционную смесь перемешивают в течение 10 минут при температуре 0oC. Смеси дают нагреваться в течение ночи до комнатной температуры. Сырой продукт с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 135 - 137oC.
1H-ЯМР (CDCl3): δ = 2,78 (дд, 1H), 2,97 (дд, 1H), 3,63 (дд, 2H), 5,64 (дд, 1H), 7,31 - 7,40 (м, 3H).
Пример П
(±)5,6-дигидро-4-окси-6-(пентафторфенил)-2H-пиран-2-он
Целевое соединение получают по общему методу 1 с применением 2,5 мл сложного метилового эфира ацетоуксусной кислоты, 1,0 г 60%-ной дисперсии гидрида натрия в масле, 12,5 мл 2,0 м. раствора н-бутиллития в гексане, 3,4 мл пентафторбензальдегида и 75 мл тетрагидрофурана. После добавления альдегида реакционную смесь перемешивают в течение 10 минут при температуре 0oC. Смеси дают нагреваться в течение ночи до комнатной температуры. Сырой продукт с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 176 - 178oC.
1H-ЯМР (CDCl3): δ = 2,89 (дд, 1H), 3,15 (дд, 1H), 3,70 (дд, 2H), 6,02 (дд, 1H).
Пример P
(±)5,6-дигидро-4-окси-6-(3-метилфенил)-2H-пиран-2-он
Целевое соединение получают по общему методу 1 с применением 2,0 мл сложного метилового эфира ацетоуксусной кислоты, 0,8 г 60%-ной дисперсии гидрида натрия в масле, 10 мл 2,0 м. раствора н-бутиллития в гексане, 2,6 мл 3-метилбензальдегида и 100 мл тетрагидрофурана. После добавления альдегида реакционную смесь перемешивают в течение 10 минут при температуре 0oC. Смеси дают нагреваться в течение ночи до комнатной температуры. Сырой продукт с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 137 - 138oC.
1H-ЯМР (CDCl3): δ = 2,38 (с, 3H), 2,88 (дд, 1H), 2,95 (дд, 1H), 3,57 (дд, 2H), 5,68 (дд, 1H), 7,16 - 7,33 (м, 4H).
Пример С
(±)6-(2-хлорфенил)-5,6-дигидро-4-окси-2H-пиран-2-он
Целевое соединение получают по общему методу 1 с применением 2,5 мл сложного метилового эфира ацетоуксусной кислоты, 1,0 г 60%-ной дисперсии гидрида натрия в масле, 12,5 мл 2,0 м. раствора н-бутиллития в гексане, 3.3 мл 2-хлорбензальдегида и 75 мл тетрагидрофурана. После добавления альдегида реакционную смесь перемешивают в течение 10 минут при температуре 0oC, после чего смесь перемешивают при комнатной температуре в течение 2 часов. Сырой продукт с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 124 - 125oC.
1H-ЯМР(CDCl3): δ = 2,63 (дд, 1H), 3,10 (дд, 1H), 3,68 (дд, 2H), 6,07 (дд, 1H), 7,3 - 7,65 (м, 4H).
Пример Т
(±)6-бутил-5,6-дигидро-5-окси-6-фенил-2H-пиран-2-он
Целевое соединение получают по общему методу 1 с применением 2,7 мл сложного метилового эфира ацетоуксусной кислоты, 1,1 г 60%-ной дисперсии гидрида натрия в масле, 12,5 мл 2,0 м. раствора н-бутиллития в гексане, 5,1 мл валерофенона и 125 мл тетрагидрофурана. После добавления кетона реакционную смесь перемешивают в течение 10 минут при температуре 0oC, после чего смеси дают нагреваться в течение ночи до комнатной температуры. Сырой продукт с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 124 - 126oC.
1H-ЯМР (CDCl3): δ = 0,85 (т, 3H), 1,28 (м, 4H), 1,97 (м, 2H), 2,90 (дд, 2H), 3,30 (дд, 2H), 7,28 - 7,42 (м, 5H).
Пример У
(±)5,6-дигидро-4-окси-6-фенил-6-пропил-2H-пиран-2-он
Целевое соединение получают по общему методу 1 с применением 5 ммоль сложного метилового эфира ацетоуксусной кислоты, 5,5 ммоль 60%-ной дисперсии гидрида натрия в масле, 5,5 ммоль 1,6 м. раствора н-бутиллития в гексане, 5,5 ммоль бутирофенона и 14 мл тетрагидрофурана. После добавления кетона реакционную смесь перемешивают в течение 90 минут при температуре 0oC. Реакционную смесь подают в насыщенный раствор хлорида аммония и экстрагируют этилацетатом. Органический слой сушат над сульфатом магния, сгущают и остаток подвергают флеш-хроматографии с применением в качестве элюента смеси гексана и этилацетата в соотношении 8:2. Получаемый при этом альдоль в 100 мл 0,1 н. гидроокиси натрия перемешивают в течение 3,5 часов при комнатной температуре. Реакционную смесь перерабатывают как описано в общем методе 1. Получаемый при этом продукт с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 131,5-132oC.
1H-ЯМР (CDCl3): δ = 0,88 (т, 3H), 1,1 - 1,4 (м, 2H), 1,95 (м, 2H), 2,90 (д, 1H), 2,92 (д, 1H), 3,25 (д, 1H), 3,35 (д, 1H), 7,2 - 7,4 (м, 5H).
Пример Ф
(±)5,6-дигидро-6-пентил-6-фенил-2H-пиран-2-он
Целевое соединение получают по общему методу 1 с применением 10 ммоль сложного метилового эфира ацетоуксусной кислоты, 11 ммоль 60%-ной дисперсии гидрида натрия в масле, 10,5 ммоль 1,6 м. раствора н-бутиллития в гексане, 10 ммоль гексанфенона и 28 мл тетрагидрофурана. При сгущении реакционной смеси выпадает твердое вещество, которое с помощью диэтилового эфира растирают в порошок и фильтруют. Точка плавления продукта 123 - 124oC.
1H-ЯМР (CDCl3): δ = 0,83 (т, 3H), 1,1-1,4 (м, 6H), 1,9-2,0 (м, 2H), 2,90 (д, 1H), 2,92 (д, 1H), 3,25 (д, 1H), 3,35 (д, 1H), 7,2 - 7,5 (м, 5H).
Пример X
(±)5,6-дигидро-6-(3-метилбутил)-6-фенил-2H-пиран-2-он
Целевое соединение получают по общему методу 1 с применением 25 ммоль сложного метилового эфира ацетоуксусной кислоты, 27,5 ммоль 60%-ной дисперсии гидрида натрия в масле, 26,25 ммоль 1,6 м. раствора н-бутиллития в гексане, 25 ммоль изогексанфенона и 70 мл тетрагидрофурана. При сгущении реакционной смеси выпадает твердое вещество, которое с помощью диэтилового эфира растирают в порошок и фильтруют. Точка плавления продукта 134 - 136oC.
1H-ЯМР (CDCl3): δ = 0,83 (дд, 6H), 1,1-1,3 (м, 2H), 1,4-1,6 (м, 1H), 1,9-2,1 (м, 2H), 2,90 (д, 1H), 2,92 (д, 1H), 3,25 (д, 1H), 3,35 (д, 1H), 7,2 - 7,5 (м, 5H).
Пример Ц
(±)5,6-дигидро-6,6-дифенил-2H-пиран-2-он
Целевое соединение получают по общему методу 1 с применением 20 ммоль сложного метилового эфира ацетоуксусной кислоты, 22 ммоль 60%-ной дисперсии гидрида натрия в масле, 21 ммоль 1,6 м. раствора н-бутиллития в гексане, 20 ммоль бензофенона и 70 мл тетрагидрофурана. При сгущении реакционной смеси выпадает твердое вещество, которое с помощью диэтилового эфира растирают в порошок и фильтруют. Точка плавления продукта 170,5 - 173oC.
1H-ЯМР (CDCl3): δ = 3,18 (с, 2H), 3,4 (с, 2H), 7,3 - 7,5 (м, 10H).
Пример Ч
(±)5,6-дигидро-6-фенил-6-(2-фенилэтил)-2H-пиран-2-он
Целевое соединение получают по общему методу 1 с применением 25 ммоль сложного метилового эфира ацетоуксусной кислоты, 27,5 ммоль 60%-ной дисперсии гидрида натрия в масле, 26,25 ммоль 1,6 м. раствора н-бутиллития в гексане, 25 ммоль 3-фенилпропиофенона и 70 мл тетрагидрофурана. При сгущении реакционной смеси выпадает твердое вещество, которое с помощью диэтилового эфира растирают в порошок и фильтруют. Точка плавления продукта 130 - 130,55oC.
1H-ЯМР (CDCl3): δ = 2,2 - 2,4 (м, 2H), 2,4 - 2,6 (м, 1H), 2,6 - 2,8 (м, 1H), 2,9 (д, 1H), 3,0 (д, 1H), 3,3 (д, 1H), 3,4 (д, 1H), 7,0 - 7,5 (м, 15H).
Пример Ш
(±)5,6-дигидро-4-окси-6-фенил-2(1H)-пиридинон
Целевое соединение получают путем декарбоксилирования сложного метилового эфира 6-фенил-2-,4-диоксопиперидин-3-карбоновой кислоты, полученного по методу, описанному в источнике Ashton и др., Heterocycles 28: (2) 1015, 1989 г. , путем кипячения в ацетонитриле (как описано в источнике Toda и др., J. Antibiotics 23: (2) 173, 1980 г.). После удаления растворителя получают твердое вещество с точкой плавления 166 -169oC.
1H-ЯМР (CDCl3): δ = 2,77 (дд, 1H), 2,90 (дд, 1H), 3,38 (с, 2H), 4,80 (дд, 1H), 6,40 (с, 1H), 7,32-7,46 (м, 5H).
Пример Щ
(±)5,6-дигидро-4-окси-6-феноксиметил-6-фенил-2H-пиран-2-он
Целевое соединение получают по общему методу 1 с применением 0,85 мл сложного метилового эфира ацетоуксусной кислоты, 350 мг 60%-ной дисперсии гидрида натрия в масле, 5 мл 1,6 м. раствора н-бутиллития в гексане, 2,0 г 2-фенокси-1-фенил-этанона и 60 мл тетрагидрофурана. После добавления кетона реакционную смесь перемешивают в течение 15 минут при температуре 0oC, после чего смеси дают нагреваться до комнатной температуры и перемешивают в течение 1 часа. Сырой продукт с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 133 - 135oC.
1H-ЯМР (ДМСО-d6): δ = 3,03 (д, 1H), 3,35 (д, 1H), 4,18 (дд, 2H), 4,90 (с, 1H), 6,92 - 6,95 (м, 3H), 7,24 - 7,49 (м, 7H), 11,56 (с, 1H).
Пример Э
(±)6-(2-бензо[1,3] диоксол-5-ил-этил)-5,6-дигидро-4-окси-6- фенил-2H-пиран-2-он
Целевое соединение получают по общему методу 1 с применением 0,22 мл сложного метилового эфира ацетоуксусной кислоты, 90 мг 60%-ной дисперсии гидрида натрия в масле, 1 мл 2,1 м. раствора н-бутиллития в гексане, 500 мг 3-(3,4-метилендиоксифенил)пропиофенона и 15 мл тетрагидрофурана. После добавления кетона реакционную смесь перемешивают в течение 15 минут при температуре 0oC, после чего смеси дают нагреваться до комнатной температуры и перемешивают в течение 2 часов. Сырой продукт с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 112-114oC.
1H-ЯМР (CDCl3): δ = 2,20 - 2,28 (м, 2H), 2,37 - 2,44 (м, 1H), 2,61 - 2,69 (м, 1H), 2,95 (дд, 2H), 3,32 (дд, 2H), 5,90 (с, 2H), 6,52 - 6,70 (м, 3H), 7,33 - 7,44 (м, 5H).
Пример Ю
(±)6-[2-(3,4-дихлорфенил)-этил] -5,6-дигидро-4-окси-6-фенил- 2H-пиран-2-он
Целевое соединение получают по общему методу 1 с применением 1,7 мл сложного метилового эфира ацетоуксусной кислоты, 630 мг 60%-ной дисперсии гидрида натрия в масле, 9,85 мл 1,6 м. раствора н-бутиллития в гексане, 4,0 г 3-(3,4-дихлорфенил)пропиофенона и 150 мл тетрагидрофурана. После добавления кетона реакционную смесь перемешивают в течение 15 минут при температуре 0oC, после чего смеси дают нагреваться до комнатной температуры и перемешивают в течение 4 часов. Сырой продукт с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 145 - 147oC.
1H-ЯМР (CDCl3): δ = 2,18 - 2,35 (м, 2H), 2,39 - 2,50 (м, 1H), 2,68 - 2,80 (м, 1H), 2,96 (дд, 2H), 3,36 (дд, 2H), 6,90 - 7,50 (м, 8H).
Пример Я
(±)6-[2-(4-фторфенил)-этил]-5,6-дигидро-4-окси-6-фенил-2H- пиран-2-он
Целевое соединение получают по общему методу 1 с применением 3,1 мл сложного метилового эфира ацетоуксусной кислоты, 1,2 г 60%-ной дисперсии гидрида натрия в масле, 18 мл 1,6 м. раствора н-бутиллития в гексане, 6,0 г 3-(4-фторфенил)пропиофенона и 200 мл тетрагидрофурана. После добавления кетона реакционную смесь перемешивают в течение 15 минут при температуре 0oC, после чего смеси дают нагреваться до комнатной температуры и перемешивают в течение 4 часов. Сырой продукт с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 155 - 157oC.
1H-ЯМР (CDCl3): δ = 2,23 - 2,29 (м, 2H), 2,42 - 2,52 (м, 1H), 2,67 - 2,78 (м, 1H), 2,97 (дд, 2H), 3,35 (дд, 2H), 7,34 - 7,47 (м, 5H), 6,91 - 7,07 (м, 4H).
Пример А1
(±)5,6-дигидро-6-гексил-4-окси-6-фенил-2H-пиран-2-он
Целевое соединение получают по общему методу 1 с применением 25 ммоль сложного метилового эфира ацетоуксусной кислоты, 27,5 ммоль 60%-ной дисперсии гидрида натрия в масле, 26,25 ммоль 1,6 м. раствора н-бутиллития в гексане, 25 ммоль гептанфенона и 70 мл тетрагидрофурана. При сгущении реакционной смеси выпадает твердое вещество, которое с применением диэтилового эфира растирают в порошок и фильтруют. Точка плавления продукта 119 - 120,5oC.
1H-ЯМР (CDCl3): δ = 0,84 (т, 3H), 1,1-1,4 (м, 8H), 1,9-2,0 (м, 2H), 2,89 (д, 1H), 2,93 (д, 1H), 3,24 (д, 1H), 3,35 (д, 1H), 7,2 - 7,5 (м, 5H).
Пример Б1
(±)5,6-дигидро-4-окси-6-(4-метилпентил)-6-фенил-2H-пиран- 2-он
Целевое соединение получают по общему методу 1 с применением 14,2 ммоль сложного метилового эфира ацетоуксусной кислоты, 15,6 ммоль 60%-ной дисперсии гидрида натрия в масле, 14,9 ммоль 1,6 м. раствора н-бутиллития в гексане, 14,2 ммоль изогептанфенона и 50 мл тетрагидрофурана. Изогептанфенон получают путем взаимодействия соответствующего, хлорангидрида кислоты с хлоридом алюминия в бензоле, как описано в источнике Vogel, Practical Organic Chemistry 1978 г. , 770 - 775. При сгущении реакционной смеси выпадает твердое вещество, которое рекристаллизуют из этилацетата. Точка плавления продукта 124 - 125oC.
1H-ЯМР (CDCl3): δ = 0,80 (дд, 6H), 1,1-1,2 (м, 2H), 1,15-1,40 (м, 2H), 1,4-1,5 (м, 1H), 1,9 - 2,0 (м, 2H), 2,88 (д, 1H), 2,9 (д, 1H), 3,2 (д, 1H), 3,3 (д, 1H), 7,2 - 7,5 (м, 5H).
Пример В1
(±)6-(циклопентилметил)-5,6-дигидро-4-окси-6-фенил-2H- пиран-2-он
Целевое соединение получают по общему методу 1 с применением 25 ммоль сложного метилового эфира ацетоуксусной кислоты, 27,5 ммоль 60%-ной дисперсии гидрида натрия в масле, 26,25 ммоль 1,6 м. раствора н-бутиллития в гексане, 25 ммоль 2-циклопентил-1-фенил-этанона и 70 мл тетрагидрофурана. 2-Циклопентил-1-фенил-этанон получают путем взаимодействия соответствующего хлорангидрида кислоты с хлоридом алюминия в бензоле, как описано в источнике Vogel, Practical Organic Chemistry 1978 г., 770 - 775. При сгущении реакционной смеси выпадает твердое вещество, которое рекристаллизуют из этилацетата. Точка плавления продукта 158 - 160oC.
1H-ЯМР (ДМСО-d6): δ = 0,8 - 0,9 (м, 1H), 1,0 - 1,1 (м, 1H), 1,2 - 1,8 (м, 7H), 1,9-2,1 (м, 2H), 2,9 (AB, кв, 2H), 4,8 (с, 1H), 7,2 - 7,4 (м, 5H), 11,3 (с, 1H).
Пример Г1
(±)3,4-дигидро-4'-окси-спиро[нафтален-1(2H),2'-[2H]пиран]- 6'(3'H)-он
Целевое соединение получают по общему методу 1 с применением 25 ммоль сложного метилового эфира ацетоуксусной кислоты, 27,5 ммоль 60%-ной дисперсии гидрида натрия в масле, 26,25 ммоль 1,6 м. раствора н-бутиллития в гексане, 25 ммоль α -тетралона и 70 мл тетрагидрофурана. Продукт рекристаллизуют из смеси сложного этилового эфира уксусной кислоты и диэтилового эфира. Точка плавления продукта 117 - 119oC.
1H-ЯМР (CDCl3): δ = 1,7-1,9 (м, 1H), 1,9-2,1 (м, 2H), 2,1-2,3 (м, 1H), 2,7-3,0 (м, 2H), 2,95 (д, 1H), 3,1 (д, 1H), 3,5 (с, 2H), 7,1 - 7,2 (м, 1H), 7,2 - 7,3 (м, 2H), 7,4-7,5 (м, 1H).
Пример Д1
(±)3-(3,6-дигидро-4-окси-6-оксо-2-фенил-2H-пиран-2-ил)- пропановая кислота
Целевое соединение получают по общему методу 1 с применением 25 ммоль сложного метилового эфира ацетоуксусной кислоты, 27,5 ммоль 60%-ной дисперсии гидрида натрия в масле, 26,25 ммоль 1,6 м. раствора н-бутиллития в гексане в 50 мл тетрагидрофурана и 25 ммоль 3-бензоилпропионовой кислоты в виде натриевой соли в 60 мл тетрагидрофурана. 3-Бензоилпропионовую кислоту в виде натриевой соли получают путем взаимодействия 25 ммоль кислоты с 26,25 ммоль гидрида натрия, промытого гексаном, в тетрагидрофуране при температуре 0oC в течение 30 минут. Сырой продукт подвергают флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и уксусной кислоты в соотношении 90:10:0,2. При этом получают вязкую смолу.
1H-ЯМР (CDCl3): δ = 2,1-2,6 (м, 4H), 2,9 (д, 1H), 3,0 (д, 1H), 3,3 (д, 1H), 3,4 (д, 1H), 7,2-7,5 (м, 5H).
Пример Е1
(±)4-(3,6-дигидро-4-окси-6-оксо-2-фенил-2H-пиран-2-ил)- масляная кислота
Целевое соединение получают по общему методу 1 с применением 25 ммоль сложного метилового эфира ацетоуксусной кислоты, 27,5 ммоль 60%-ной дисперсии гидрида натрия в масле, 26,25 ммоль 1,6 м. раствора н-бутиллития в гексане в 50 мл тетрагидрофурана и 25 ммоль 4-бензоилмасляной кислоты в виде натриевой соли в 100 мл тетрагидрофурана. 4-Бензоилмасляную кислоту в виде натриевой соли получают путем взаимодействия 25 ммоль кислоты с 17,5 ммоль гидрида натрия, промытого гексаном, в тетрагидрофуране при температуре 0oC в течение 25 минут. Сырой продукт подвергают флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и уксусной кислоты в соотношении 99: 1:0,1 - 97,5:2,5:0,1. При этом получают твердое вещество, которое рекристаллизуют из этилацетата. Точка плавления продукта 134 - 137oC.
1H-ЯМР (ДМСО-d6): δ = 1,1 - 1,2 (м, 1H), 1,4 - 1,6 (м, 1H), 1,8 - 2,0 (м, 2H), 2,0 - 2,2 (м, 2H), 2,9 (AB, кв, 2H), 4,85 (с, 1H), 7,2 - 7,4 (м, 5H).
Пример Ж1
(±)5-(3,6-дигидро-4-окси-6-оксо-2-фенил-2H-пиран-2-ил)- пентановая кислота
Целевое соединение получают по общему методу 1 с применением 25 ммоль сложного метилового эфира ацетоуксусной кислоты, 27,5 ммоль 60%-ной дисперсии гидрида натрия в масле, 26,25 ммоль 1,6 м. раствора н-бутиллития в гексане в 50 мл тетрагидрофурана и 25 ммоль 5-бензоилпентановой кислоты в виде натриевой соли в 100 мл тетрагидрофурана. 5-Бензоилпентановую кислоту в виде натриевой соли получают путем взаимодействия 25 ммоль кислоты с 27,5 ммоль гидрида натрия, промытого гексаном, в тетрагидрофуране при температуре 0oC в течение 25 минут. Сырой продукт рекристаллизуют из этилацетата. Точка плавления продукта 136 - 140oC.
1H-ЯМР (ДМСО-d6): δ = 0,8 - 1,0 (м, 1H), 1,1 - 1,3 (м, 1H), 1,3 - 1,5 (м, 2H), 1,8 - 2,0 (м, 2 H), 2,1 (т, 2H), 2,9 (AB, кв, 2H), 4,85 (с, 1H), 7,2 -7,4 (м, 5 H), 11,4 (шир.с, 1H), 12,0 (шир.с, 1H).
Пример 31
(±)5,6-дигидро-4-окси-6-фенил-6-пиридин-4-ил-2H-пиран- 2-он
Целевое соединение получают по общему методу 1 с применением 90 ммоль сложного этилового эфира ацетоуксусной кислоты, 99 ммоль 60%-ной дисперсии гидрида натрия в масле, 95 ммоль 1,6 м. раствора н-бутиллития в гексане в 90 ммоль 4-бензоилпиридина и 250 мл тетрагидрофурана. Реакционную смесь подкисляют уксусной кислотой, и сырое твердое вещество промывают ледяной водой. Точка плавления продукта 148 - 150oC.
Пример И1
(±)5,6-дигидро-4-окси-6-[(метилфениламино)метил]-6-фенил- 2H-пиран-2-он
2-(метилфениламино)-1-фенил-этанон получают путем взаимодействия 50 ммоль N-метиланилина, 50 ммоль бромацетофенона и 55 ммоль триэтиламина в диэтиловом эфире при комнатной температуре в течение ночи. Диэтиловый эфир упаривают, заменяют п-диоксаном, и смесь нагревают с обратным холодильником в течение 15 часов. Твердый триэтиламин в виде гидрохлорида отфильтровывают. Фильтрат сгущают и твердое вещество рекристаллизуют из этилацетата. При этом получают 2-(метилфениламино)-1-фенил-этанон в качестве твердого вещества с точкой плавления 118-120oC. Целевое соединение получают по общему методу 1 с применением 6,7 ммоль сложного метилового эфира ацетоуксусной кислоты, 7,3 ммоль 60%-ной дисперсии гидрида натрия в масле, 7,0 ммоль 1,6 м. раствора н-бутиллития в гексане, 6,7 ммоль 2-(метилфениламино)-1- фенилэтанона и 40 мл тетрагидрофурана. Реакционную смесь подкисляют концентрированной соляной кислотой до pH 7, после чего pH доводят до 3 путем добавления уксусной кислоты. Продукт подвергают флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99:1, при этом получают твердое вещество с точкой плавления 152 - 153oC.
1H-ЯМР (CDCl3): δ = 2,9 (д, 1H), 3,05 (с, 3H), 3,1 (д, 1H), 3,2 (д, 1H), 3,3 (д, 1H), 3,7 (АВ, кв, 2H), 6,7 - 6,8 (м, 3H), 7,2 - 7,3 (м, 2H), 7,3 - 7,5 (м, 5H).
Пример Й1
(±)N-бензил-4-(3,6-дигидро-4-окси-6-оксо-2-фенил- 2H-пиран-2-ил)-N-метил-бутирамид
Бензилметиламид 5-оксо-5-фенилпентановой кислоты получают путем кипячения 10,5 ммоль N-метилбензиламина и 10,5 ммоль 6- фенил-3,4-дигидропиран-2-она в толуоле в течение 1 часа. Смесь перемешивают в течение ночи при комнатной температуре. Смесь подают в 100 мл этилацетата и 100 мл 1 н. соляной кислоты. Органические экстракты промывают 100 мл 1 н. гидроокиси натрия, 100 мл воды и сушат над сульфатом магния. Сырой продукт подвергают флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 98:2, при этом получают жидкость.
1H-ЯМР (CDCl3): δ = 2,0 - 2,2 (м, 2H), 2,5 (т, 2H), 2,93/2,96 (с/с, 3H), 3,0 - 3,2 (м, 2H), 4,5/4,6 (с/с, 2H), 7,1 - 7,6 (м, 8H), 7,8 - 8,0 (м, 2H).
Целевое соединение получают по общему методу 1 с применением 5,6 ммоль сложного метилового эфира ацетоуксусной кислоты, 6,1 ммоль 60%-ной дисперсии гидрида натрия в масле, 5,9 ммоль 1,6 м. раствора н-бутиллития в гексане, 5,6 ммоль бензилметиламида 5-оксо-5-фенилпентановой кислоты и 25 мл тетрагидрофурана. Продукт подвергают флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 98:2, при этом получают твердое вещество с точкой плавления 47-51oC.
1H-ЯМР (ДМСО-d6): δ = 1,1-1,3 (м, 1H), 1,4-1,6 (м, 1H), 1,8-2,0 (м, 2H), 2,2-2,4 (м, 2H), 2,75/2,81 (с/с, 3H), 2,85-3,1 (м, 2H), 4,4/4,5 (с/с, 2H), 4,85/4,9 (с/с, 2H), 7,1-7,4 (м, 10H), 11,36/11,38 (с/с, 1H).
Общий метод 2
Тиотозилат получают путем взаимодействия эквимолярных количеств галоидалкила и тиотозилата калия в абсолютном этаноле и кипячения смеси в течение 24 часов или в диметилформамиде с перемешиванием смеси при комнатной температуре в течение 12-72 часов. Растворитель упаривают и остаток подают в этилацетат и промывают водой.
В качестве альтернативы добавляют воду, и водный слой экстрагируют диэтиловым эфиром или этилацетатом. Органические экстракты сушат над сульфатом магния и сгущают в вакууме.
В качестве альтернативы тиотозилат получают по методу, описанному в источнике M.G. Ranasinghe и P.L. Fuchs, Syn.Comm. 18(3): 227, 1988 г.
Пример АА
Бензил-п-толуолтиосульфонат
Целевое соединение получают по общему методу 2 с применением 0,05 моль бензилхлорида и 0,05 моль тиотозилата калия в 150 мл этанола. Остаток растворяют в гексане и в раствор вносят затравку в виде кристалла продукта. При этом получают 10,8 г бензил-п-толуолтиосульфоната с точкой плавления 52 -56,5oC. Выход 77%.
1H-ЯМР (CDCl3): δ = 2,45 (с, 3H), 4,26 (с, 2H), 7,18-7,30 (м, 7H), 7,74 (д, 2H).
Пример ББ
2-фенилэтил-п-толуолтиосульфонат
Целевое соединение получают по общему методу 2 с применением 0,088 ммоль фенэтилбромида, 0,088 моль тиотозилата калия и 250 мл абсолютного этанола. Получают прозрачную жидкость, которую применяют без дальнейшей очистки.
1H-ЯМР (CDCl3): δ = 2,47 (с, 3H), 2,92 (т, 2H), 3,24 (т, 2H), 7,1 - 7,4 (м, 7H), 7,84 (д, 2H).
Пример ВВ
3-фенилпропил-п-толуолтиосульфонат
Целевое соединение получают по общему методу 2 с применением 0,044 ммоль 1-бром-3-фенилпропана, 0,044 моль тиотозилата калия и 125 мл абсолютного этанола. Получают масло, которое применяют без очистки.
1H-ЯМР (CDCl3): δ = 1,95 (квинт, 2H), 2,459 (с, 3H), 2,63 (т, 2H), 2,95 (т, 2H), 7,0-7,4 (м, 8H), 7,7 (д, 2H).
Пример ГГ
2-феноксиэтил-п-толуолтиосульфонат
Целевое соединение получают по общему методу 2 с применением 0,025 ммоль 2-феноксиэтил-бромида, 0,025 моль тиотозилата калия и 100 мл диметилформамида. Получают твердое вещество.
1H-ЯМР (CDCl3): δ = 2,45 (с, 3H), 3,34 (т, 2H), 4,14 (т, 2H), 6,80 (д, 2H), 6,95 (т, 1H), 7,26 (т, 2H), 7,35 (д, 2H), 7,82 (д, 2H).
Общий метод 3
3-бром-5,6-дигидро-4-окси-2H-пиран-2-он в качестве промежуточного продукта получают путем взаимодействия эквимолярных количеств соответствующего 6-замещенного 5,6-дигидро-4-окси-2H- пиран-2-она (полученного по общему методу 1) с N-бромсукцинимидом (1,0 экв.) в сухом т-бутаноле в темноте. Растворитель упаривают и остаток распределяют между хлороформом и водой. Органический слой промывают рассолом, сушат над сульфатом магния и сгущают.
Пример ААА
3-бром-5,6-дигидро-4-окси-6,6-дифенил-2H-пиран-2-он
Целевое соединение получают по общему методу 3 с применением 4,0 ммоль 5,6-дигидро-4-окси-6,6-дифенил-2H-пиран-2-она (полученного в примере Ц) и 4,0 ммоль N-бромсукцинимида. Получают продукт в виде твердого вещества.
1H-ЯМР (ДМСО-d6): δ = 3,68 (с, 2H), 7,27 - 7,40 (м, 10H).
Пример БББ
(±)3-бром-5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-2H- пиран-2-он
Целевое соединение получают по общему методу 3 с применением 2,0 ммоль 5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-2H-пиран-2- она (полученного в примере Ч) и 2,0 ммоль N-бромсукцинимида.
1H-ЯМР (ДМСО-d6): δ = 2,16 - 2,58 (м, 4H), 3,30 (м, 2H), 7,04 - 7,60 (м, 10H).
Пример BBB
(±)3-бром-5,6-дигидро-4-окси-(3-метилбутил)-6-фенил-2H- пиран-2-он
Целевое соединение получают по общему методу 3 с применением 2,0 ммоль 5,6-дигидро-4-окси-6-(3-метилбутил)-6-фенил-2H-пиран-2- она (полученного в примере X) и 2,0 ммоль N-бромсукцинимида.
1H-ЯМР (ДМСО-d6): δ = 0,80 (м, 6H), 1,00 (м, 1H), 1,14 (м, 1H), 1,42 (м, 1H), 1,95 (м, 2H), 3,35 (м, 2H), 7,25 - 7,52 (м, 5H).
Пример ГГГ
(±)5-[5-6ром-4-окси-6-оксо-2-фенил-3,6-дигидро-2H-пиран-2- ил]пентановая кислота
Целевое соединение получают по общему методу 3 с применением 1,4 ммоль 5-[4-окси-6-оксо-2-фенил-3,6-дигидро-2H-пиран-2-ил] пентановой кислоты (полученной в примере Ж1) и 1,4 ммоль N-бромсукцинимида.
1H-ЯМР (ДМСО-d6): δ = 0,94 (м, 1H), 1,22 - 1,40 (м, 3H), 1,92 (м, 2H), 2,13 (т, 2H), 3,28 (кв, 2H), 7,16-7,52 (м, 5H).
Общий метод 4
Целевое соединение получают путем подачи 5,6-дигидро-2H- пиран-2-она, абсолютного этанола, п-толуолтиосульфоната и триэтиламина в реакционный сосуд. Раствор перемешивают при температуре, от комнатной до температуры кипения реакционной смеси, в течение 4 часов - 1 недели. Растворитель упаривают и остаток распределяют между 1 н. соляной кислотой и дихлорметаном или этилацетатом. Слои разделяют и водный слой экстрагируют дихлорметаном или этилацетатом. Органические слои объединяют и сушат над сульфатом магния.
Пример 1
(±)5,6-дигидро-4-окси-6-фенил-3-[(фенилметил)тио]- 2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 2,1 ммоль 5,6-дигидро-4-окси-6-фенил-2H-пиран-2-она, 10 мл абсолютного этанола, 2,3 ммоль бензил-п-толуолтиосульфоната и 2,3 ммоль триэтиламина в 5 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение 3 дней, после чего сгущают в вакууме. При этом получают твердое вещество, которое измельчают и суспендируют в диэтиловом эфире и этилацетате. Твердое вещество отфильтровывают, маточные растворы сгущают и подвергают флеш-хроматографии на силикагеле с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99:1 - 97:3. Фракции объединяют, при этом получают 0,365 г целевого продукта в виде твердого вещества с точкой плавления 150 - 151,5oC. Выход 55%.
1H-ЯМР (CDCl3): δ = 2,65 (дд, 1H), 2,78 (дд, 1H), 3,85 (д, 1H), 3,94 (д, 1H), 5,29 (дд, 1H), 7,2 - 7,4 (м, 11H).
Пример 2
(±)5,6-дигидро-4-окси-6-фенил-3-[(2-фенилэтил)тио]- 2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 2,1 ммоль 5,6-дигидро-4-окси-6-фенил-2H-пиран-2-она, 6 мл абсолютного этанола, 2,3 ммоль 2-фенилэтил-п-толуолтиосульфоната в 6 мл абсолютного этанола и 2,3 ммоль триэтиламина в 3 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение 4 дней. Продукт подвергают флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99:1 - 97:3. Выделяют вязкую пасту, которую с помощью диэтилового эфира растирают в порошок с получением твердого вещества с точкой плавления 98 - 99oC.
1H-ЯМР (CDCl3): δ = 2,8 - 3,1 (м, 6H), 5,3 (дд, 1H), 7,1 - 7,7 (м, 11H).
Пример 3
(±)5,6-дигидро-4-окси-6-фенил-3-[(3-фенилпропил)тио]-2H- пиран-2-он
Целевое соединение получают по общему методу 4 с применением 2,63 ммоль 5,6-дигидро-4-окси-6-фенил-2H-пиран-2-она, 7 мл абсолютного этанола, 2,76 ммоль 3-фенилпропил-п-толуолтиосульфоната в 6 мл абсолютного этанола и 2,89 ммоль триэтиламина в 2 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение 2 дней. Получаемый при этом продукт с помощью этилацетата растирают в порошок, при этом получают твердое вещество с точкой плавления 134 - 135oC.
1H-ЯМР (CDCl3): δ = 1,8 (квинт., 2H), 2,6 - 2,8 (м, 4H), 2,87 (дд, 1H), 3,01 (дд, 1H), 5,43 (дд, 1H), 7,1 - 7,5 (м, 10H), 7,81 (шир.с, 1H).
Пример 4
(±) 5,6-дигидро-4-окси-6-фенил-3-[(2-феноксиэтил)тио]-2H- пиран-2-он
Целевое соединение получают по общему методу 4 с применением 0,54 ммоль 5,6-дигидро-4-окси-6-фенил-2H-пиран-2-она, 7 мл абсолютного этанола, 0,57 ммоль 2-феноксиэтил-п-толуолтиосульфоната в 6 мл абсолютного этанола и 0,06 ммоль триэтиламина в 2 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение 2 дней. Продукт подвергают флеш-хроматографии и с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 107 - 108oC.
1H-ЯМР (ДМСО-d6): δ = 2,80 (дд, 1H), 2,9 - 3,0 (м, 2H), 3,08 (дд, 1H), 4,07 (т, 2H), 5,47 (дд, 1H), 6,9 - 7,0 (м, 3H), 7,2 - 7,5 (м, 7H).
Пример 5
(±)5,6-дигидро-4-окси-6-(2-метилпропил)-6-фенил-3- [(фенилметил)тио] -2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 0,61 ммоль 5,6-дигидро-4-окси-6-(2- метилпропил)-6-фенил-2H-пиран-2-она, 5 мл абсолютного этанола, 0,67 ммоль бензил-п-толуолтиосульфоната в 3 мл абсолютного этанола и 0,67 ммоль триэтиламина в 2 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение 18 часов. Продукт подвергают флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99,5:0,5, при этом получают вязкое масло.
1H-ЯМР (CDCl3): δ = 0,72 (д, 3H), 0,90 (д, 3H), 1,5 - 1,7 (м, 1H), 1,81 (дд, 1H), 1,91 (дд, 1H), 2,95 (AB, кв, 2H), 3,53 (д, 1H), 3,75 (д, 1H), 6,8 - 6,9 (м, 2H), 7,1 - 7,4 (м, 8H).
Пример 6
(±)5,6-дигидро-4-окси-6-(2-метилпропил)-6-фенил- 3-[(2-фенилэтил)тио]-2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 0,61 ммоль 6-изобутил-5,6-дигидро-4- окси-6-(2-метилпропил)-6-фенил-2H-пиран-2-она, 5 мл абсолютного этанола, 0,67 ммоль 2-фенилэтил-п-толуолтиосульфоната в 3 мл абсолютного этанола и 0,67 ммоль триэтиламина в 2 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение 18 часов. Продукт подвергают флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99,5:0,5, при этом получают вязкое масло.
1H-ЯМР (CDCl3): δ = 0,75 (д, 3H), 0,89 (д, 3H), 1,5 - 1,7 (м, 1H), 1,87 (дд, 1H), 1,95 (дд, 1H), 2,2 - 2,3 (м, 1H), 2,4 - 2,5 (м, 1H), 2,6 - 2,8 (м, 1H), 3,13 (AB, кв, 2H), 6,90 - 6,95 (м, 2H), 7,1 - 7,4 (м, 8H).
Пример 7
5-(3-хлорфенил)-2-[(2-фенилэтил)тио]-1,3-циклогександион
5-(3-хлорфенил)-1,3-цикогександион могут получать по методу, описанному в J.Med.Chem. 1992 г., 35, 19, 3429 - 3447.
В реакционный сосуд емкостью 50 мл подают 0,30 г (1,35 ммоль) 5-(3-хлорфенил)-1,3-циклогександиона в 5 мл абсолютного этанола, 0,43 г (1,48 ммоль) 2-фенилэтил-п-толуолтиосульфоната в 3 мл абсолютного этанола и 0,16 г (1,62 ммоль) триэтиламина в 2 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение 27 часов. Этанол удаляют в вакууме и остаток растворяют в 200 мл диэтилового эфира и 100 мл 1 н. соляной кислоты. Водный слой дважды экстрагируют диэтиловым эфиром, взятым в количестве по 100 мл. Органические экстракты объединяют, сушат над сульфатом магния и сгущают. Остаток подвергают флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99:1, при этом получают твердое вещество с точкой плавления 69 - 73oC.
1H-ЯМР (CDCl3): δ = 2,5 - 3,1 (м, 8H), 3,3 (м, 1H), 7,1 - 7,4 (м, 9H), 7,9 (шир.с, 1H).
Пример 8
(±)5,6-дигидро-4-окси-6-(4-метоксифенил)-3-[(фенилметил) тио] -2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 300 мг 5,6-дигидро-4-окси-6-(4-метоксифенил)-2H-пиран-2-она, 500 мг бензил-п-толуолтиосульфоната и 1,0 мл триэтиламина в 10 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение ночи, после чего продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100:0 - 95:5. Получают вязкое масло, которое с помощью диэтилового эфира растирают в порошок. При этом получают твердое вещество с точкой плавления 168 - 170oC.
1H-ЯМР (CDCl3): δ = 2,60 (дд, 1H), 2,77 (дд, 1H), 3,82 (с, 3H), 3,89 (дд, 2H), 5,23 (дд, 1H), 6,89 - 7,33 (м, 10H).
Пример 9
(±)5,6-дигидро-4-окси-6-(4-метилтиофенил)-3-[(фенилметил) тио]-2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 480 мг 5,6-дигидро-4-окси-6-(4-метилтиофенил)-2H- пиран-2-она, 620 мг бензил-п-толуолтиосульфоната и 0,34 мл триэтиламина в 10 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение 3 дней, после чего продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100:0 - 95:5. Получают вязкое масло, которое с помощью диэтилового эфира растирают в порошок. При этом получают твердое вещество с точкой плавления 185 - 188oC.
1H-ЯМР (CDCl3): δ = 2,49 (с, 3H), 2,62 (дд, 1H), 2,75 (дд, 1H), 3,90 (дд, 2H), 5,25 (дд, 1H), 7,19 - 7,32 (м, 10H).
Пример 10
(±)5,6-дигидро-4-окси-6-(4-метилфенил)-3-[(фенилметил) тио] -2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 123 мг 5,6-дигидро-4-окси-6-(4- метилфенил)-2H-пиран-2-она, 170 мг бензил-п-толуолтиосульфоната и 0,90 мл триэтиламина в 3 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение 18 часов, после чего продукт с помощью диэтилового эфира растирают в порошок. При этом получают твердое вещество с точкой плавления 166-167oC.
1H-ЯМР (CDCl3): δ = 2,36 (с, 3H), 2,62 (дд, 1H), 2,77 (дд, 1H), 3,94 (дд, 2H), 5,25 (дд, 1H), 7,19-7,32 (м, 10H).
Пример 11
(±)5,6-дигидро-4-окси-6-[4-(1,1-диметилэтил)фенил] -3- [(фенилметил)тио] -2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 445 мг 5,6-дигидро-4-окси-6-[4-(1,1-диметилэтил)фенил] -2H-пиран-2-она, 550 мг бензил-п-толуолтиосульфоната и 0,3 мл триэтиламина в 10 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение 3 дней, после чего сырой продукт с помощью диэтилового эфира растирают в порошок. При этом получают твердое вещество с точкой плавления 140 - 142oC.
1H-ЯМР (CDCl3): δ = 1,32 (с, 9H), 2,65 (дд, 1H), 2,79 (дд, 1H), 3,89 (дд, 2H), 5,27 (дд, 1H), 7,18-7,43 (м, 10H).
Пример 12
(±)6-(4-хлорфенил)-5,6-дигидро-4-окси-3-[(фенилметил) тио]-2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 250 мг 6-(4-хлорфенил)-5,6-дигидро-4-окси-2H-пиран-2-она, 315 мг бензил-п-толуолтиосульфоната и 0,16 мл триэтиламина в 8 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение ночи, после чего продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100:0 - 95:5. При этом получают вязкое масло, которое с помощью диэтилового эфира растирают в порошок. Получают твердое вещество с точкой плавления 167 - 170oC.
1H-ЯМР (CDCl3): δ = 2,62 (дд, 1H), 2,74 (дд, 1H), 3,90 (дд, 2H), 5,21 (дд, 1H), 7,23 - 7,41 (м, 10H).
Пример 13
(±)6-(3-хлорфенил)-5,6-дигидро-4-окси-3-[(фенилметил)тио]- 2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 300 мг 6-(3-хлорфенил)-5,6-дигидро-4-окси-2H-пиран-2-она, 450 мг бензил-п-толуолтиосульфоната и 1,0 мл триэтиламина в 10 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение ночи, после чего продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100:0 - 95:5. При этом получают вязкое масло, которое с помощью диэтилового эфира растирают в порошок. Получают твердое вещество с точкой плавления 139 - 142oC.
1H-ЯМР (CDCl3): δ = 2,64 (дд, 1H), 2,73 (дд, 1H), 3,89 (дд, 2H), 5,25 (дд, 1H), 7,18-7,41 (м, 10H).
Пример 14
(±)5,6-дигидро-3-[(2-фенилэтил)тио]-6-[4-(фенилметокси) фенил]-2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 109 мг 5,6-дигидро-4-окси-6-[4-(фенилметокси)фенил]- 2H-пиран-2-она, 114 мг 2-фенил-этил-п-толуолтиосульфоната и 0,06 мл триэтиламина в 3 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100:0 - 95:5, при этом получают вязкое масло, которое с помощью диэтилового эфира растирают в порошок. Получают твердое вещество с точкой плавления 99-101oC.
1H-ЯМР (CDCl3): δ = 2,78 (дд, 1H), 2,85 (дд, 1H), 2,92 - 3,11 (м, 4H), 5,07 (с, 2H), 5,30 (дд, 1H), 6,97 - 7,44 (м, 14H), 7,62 (с, 1H).
Пример 15
(±)5,6-дигидро-6-(4-метоксифенил)-3-[(2-фенилэтил)тио]- 2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 300 мг 5,6-дигидро-4-окси-6-(4-метоксифенил)-2H-пиран-2-она, 500 мг 2-фенилэтил-п- толуолтиосульфоната и 1,0 мл триэтиламина в 10 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение ночи. Сырой продукт с помощью диэтилового эфира растирают в порошок. При этом получают твердое вещество с точкой плавления 112-115oC.
1H-ЯМР (CDCl3): δ = 2,78 (дд, 1H), 2,86 (дд, 1H), 2,92 - 3,11 (м, 4H), 3,81 (с, 3H), 5,31 (дд, 1H), 6,91 - 7,35 (м, 10H).
Пример 16
(±)5,6-дигидро-6-(4-метилтиофенил)-3-[(2-фенилэтил)тио]- 2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 430 мг 5,6-дигидро-4-окси-6-(4-метилтиофенил)-2H-пиран-2-она, 585 мг 2-фенилэтил-п-толуолтиосульфоната и 0,3 мл триэтиламина в 10 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение 3 дней. Сырой продукт с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 135 - 137oC.
1H-ЯМР (CDCl3): δ = 2,48 (с, 3H), 2,77 -3,10 (м, 6H), 5,32 (дд, 1H), 7,16-7,33 (м, 9H), 7,63 (с, 1H).
Пример 17
(±)5,6-дигидро-6-(4-метилфенил)-3-[(2-фенилэтил)тио]-2H- пиран-2-он
Целевое соединение получают по общему методу 4 с применением 500 мг 5,6-дигидро-4-окси-6-(4-метилфенил)-2H-пиран-2-она, 720 мг 2-фенилэтил-п-толуолтиосульфоната и 0,4 мл триэтиламина в 12 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100:0 - 95:5, при этом получают вязкое масло, которое с помощью диэтилового эфира растирают в порошок. Получают твердое вещество с точкой плавления 112 - 113oC.
1H-ЯМР (CDCl3): δ = 2,36 (с, 3H), 2,79 (дд, 1H), 2,84 (дд, 1H), 2,91 - 3,10 (м, 4H), 5,33 (дд, 1H), 7,16 - 7,33 (м, 9H), 7,61 (с, 1H).
Пример 18
(±)6-[1,1'-бифенил]-4-ил-5,6-дигидро-3-[(2-фенилэтил)тио]- 2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 200 мг 5,6-дигидро-4-окси-6-[1,1'-бифенил] -4-ил-2H-пиран-2-она, 300 мг 2-фенилэтил-п-толуолтиосульфоната и 1,0 мл триэтиламина в 10 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100:0 - 95:5, при этом получают вязкое масло, которое с помощью диэтилового эфира растирают в порошок. Получают твердое вещество с точкой плавления 130 - 133oC.
1H-ЯМР (CDCl3): δ = 2,84 - 2,89 (м, 2H), 2,96 - 3,12 (м, 4H), 5,42 (дд, 1H), 7,08-7,67 (м, 15H).
Пример 19
(±)5,6-дигидро-6-[4-(1,1-диметилэтил)фенил]-3- [(2-фенилэтил)тио]-2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 430 мг 5,6-дигидро-4-окси-6-[4-(1,1-диметилэтил)фенил]-2H-пиран-2-она, 560 мг 2-фенилэтил-п-толуолтиосульфоната и 0,28 мл триэтиламина в 10 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение 3 дней. Сырой продукт с помощью диэтилового эфира растирают в порошок. При этом получают твердое вещество с точкой плавления 130-131oC.
1H-ЯМР (CDCl3): δ = 1,31 (с, 9H), 2,79 - 2,88 (м, 2H), 2,94 - 3,11 (м, 4H), 5,34 (дд, 1H), 7,16 - 7,43 (м, 9H), 7,61 (с, 1H).
Пример 20
(±)6-(3-хлорфенил)-5,6-дигидро-3-[(2-фенилэтил)тио]-2H- пиран-2-он
Целевое соединение получают по общему методу 4 с применением 300 мг 6-(3-хлорфенил)-5,6-дигидро-4-окси-2H-пиран-2-она, 500 мг 2-фенилэтил-п-толуолтиосульфоната и 1,0 мл триэтиламина в 10 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100:0 - 95:5, при этом получают вязкое масло, которое с помощью диэтилового эфира растирают в порошок. Получают твердое вещество с точкой плавления 99 - 100oC.
1H-ЯМР (CDCl3): δ = 2,78 - 2,91 (м, 2H), 2,97 - 3,13 (м, 4H), 5,32 (дд, 1H), 7,17 - 7,43 (м, 9H), 7,62 (с, 1H).
Пример 21
(±)6-[[(1,1'-бифенил)-4-илокси] метил]-5,6-дигидро-3- [(2-фенилэтил)тио] -2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 150 мг 6-[[(1,1'-бифенил)-4-илокси] метил] -5,6-дигидро-4-окси-2H-пиран-2-она, 185 мг 2-фенилэтил-п-толуолтиосульфоната и 1,0 мл триэтиламина в 5 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100:0 - 95:5, при этом получают вязкое масло, которое с помощью диэтилового эфира растирают в порошок. Получают твердое вещество с точкой плавления 124 - 126oC.
1H-ЯМР (CDCl3): δ = 2,77 (дд, 1H), 2,88 (дд, 1H), 2,95 - 3,10 (м, 4H), 4,19 - 4,28 (м, 2H), 4,71 - 4,76 (м, 1H), 6,96 - 7,56 (м, 14H), 7,65 (с, 1H).
Пример 22
(±)6-[1,1'-бифенил] -4-ил-6-бутил-5,6-дигидро-4-окси-3- [(2-фенилэтил)тио]-2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 0,388 ммоль 6-[1,1'-бифенил]-4-ил-6-бутил-5,6- дигидро-4-окси-2H-пиран-2-она, 5 мл абсолютного этанола, 0,407 ммоль 2-фенилэтил-п-толуолтиосульфоната в 3 мл абсолютного этанола и 0,426 ммоль триэтиламина в 2 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99:1, при этом получают твердое вещество, которое рекристаллизуют из смеси этилацетата и диэтилового эфира. Точка плавления продукта 100 - 104oC.
1H-ЯМР (CDCl3): δ = 0,86 (т, 3H), 1,15 - 1,5 (м, 4H), 1,9 - 2,1 (м, 2H), 2,2 - 2,5 (м, 2H), 2,5 - 2,8 (м, 2H), 3,2 (AB, кв, 2H), 6,8 - 6,9 (м, 2H), 7,1 - 7,2 (м, 3H), 7,3 - 7,7 (м, 9H).
Пример 23
(±)4-[2,3-дигидро-4-окси-6-оксо-5-[(фенилметил)тио] -2H- пиран-2-ил] бензонитрил
Целевое соединение получают по общему методу 4 с применением 250 мг 4-[2,3-дигидро-4-окси-6-оксо-2H-пиран-2-ил] бензонитрила, 385 мг бензил-п-толуолтиосульфоната и 1,0 мл триэтиламина в 10 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100:0 - 95:5, при этом получают вязкое масло, которое с помощью диэтилового эфира растирают в порошок. Получают твердое вещество с точкой плавления 148-151oC.
1H-ЯМР (CDCl3): δ = 2,66 - 2,75 (м, 2H), 3,91 (дд, 2H), 5,33 (дд, 1H), 7,20 - 7,72 (м, 10H).
Пример 24
(±)6-(4-трифторметилфенил)-5,6-дигидро-4-окси- 3-[(фенилметил)тио]-2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 211 мг 6-(4-трифторметилфенил)-5,6-дигидро-4-окси-2H-пиран-2-она, 273 мг бензил-п-толуолтиосульфоната и 1,0 мл триэтиламина в 10 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100:0 - 95:5, при этом получают вязкое масло, которое с помощью диэтилового эфира растирают в порошок. Получают твердое вещество с точкой плавления 183 - 186oC.
1H-ЯМР (CDCl3): δ = 2,65 - 2,77 (м, 2H), 3,92 (дд, 2H), 5,35 (дд, 1H), 7,19 - 7,68 (м, 10H).
Пример 25
(±)6-(3,5-дихлорфенил)-5,6-дигидро-4-окси-3-[(фенилметил) тио]-2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 250 мг 6-(3,5-дихлорфенил)-5,6-дигидро-4-окси-2H- пиран-2-она, 320 мг бензил-п-толуолтиосульфоната и 1,0 мл триэтиламина в 10 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100:0 - 95:5, при этом получают вязкое масло, которое с помощью диэтилового эфира растирают в порошок. Получают твердое вещество с точкой плавления 147 - 149oC.
1H-ЯМР (CDCl3): δ = 2,61 - 2,74 (м, 2H), 3,90 (дд, 2H), 5,21 (дд, 1H), 7,18 - 7,36 (м, 9H).
Пример 26
(±)6-(пентафторфенил)-5,6-дигидро-4-окси-3-[(фенилметил) тио] -2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 226 мг 6-(пентафторфенил)-5,6-дигидро-4-окси-2H-пиран-2-она, 269 мг бензил-п-толуолтиосульфоната и 1,0 мл триэтиламина в 10 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100:0 - 95:5, при этом получают вязкое масло, которое с помощью диэтилового эфира растирают в порошок. Получают твердое вещество с точкой плавления 113 - 115oC.
1H-ЯМР (CDCl3): δ = 2,50 (дд, 1H), 3,14 (дд, 1H), 3,90 (дд, 2H), 5,57 (дд, 1H), 7,19 - 7,365 (м, 6H).
Пример 27
(±)5,6-дигидро-4-окси-6-(3-метилфенил)-3-[(2-фенилэтил) тио]-2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 300 мг 5,6-дигидро-4-окси-6-(3-метилфенил)-2H-пиран-2-она, 515 мг 2-фенилэтил-п-толуолтиосульфоната и 1,0 мл триэтиламина в 10 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100:0 - 95:5, при этом получают вязкое масло, которое с помощью диэтилового эфира растирают в порошок. Получают твердое вещество с точкой плавления 81 - 83oC.
1H-ЯМР (CDCl3): δ = 2,38 (с, 3H), 2,78 - 3,10 (м, 6H), 5,35 (дд, 1H), 7,17 - 7,34 (м, 9H), 7,61 (с, 1H).
Пример 28
(±)6-(2-хлорфенил)-5,6-дигидро-4-окси-3-[(фенилметил)тио]- 2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 200 мг 6-(2-хлорфенил)-5,6-дигидро-4-окси-2H-пиран-2-она, 300 мг бензил-п-толуолтиосульфоната и 1,0 мл триэтиламина в 10 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100:0 - 95:5, при этом получают вязкое масло, которое с помощью диэтилового эфира растирают в порошок. Получают твердое вещество с точкой плавления 89 - 91oC.
1H-ЯМР (CDCl3): δ = 2,58 (дд, 1H), 2,80 (дд, 1H), 3,92 (дд, 2H), 5,64 (дд, 1H), 7,20-7,67 (м, 10H).
Пример 29
(±)6-бутил-5,6-дигидро-4-окси-6-фенил-3-[(фенилметил) тио]-2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 400 мг 6-бутил-5,6-дигидро-4-окси-6-фенил-2H-пиран-2-она, 540 мг бензил-п-толуолтиосульфоната и 1,0 мл триэтиламина в 10 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100:0 - 95:5, при этом получают вязкое масло.
1H-ЯМР (CDCl3): δ = 0,82 (т, 3H), 1,0-1,4 (м, 4H), 1,83 - 1,99 (м, 2H), 2,97 (дд, 2H), 3,63 (дд, 2H), 6,83 - 7,41 (м, 11H).
Пример 30
(±)6-[1,1'-бифенил]-4-ил-6-бутил-5,6-дигидро-4-окси-3- [(фенилметил)тио] -2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 0,388 ммоль 6-[1,1'-бифенил]-4-ил-6-бутил-5,6- дигидро-4-окси-2H-пиран-2-она, 5 мл абсолютного этанола, 0,407 ммоль бензил-п- толуолтиосульфоната в 3 мл абсолютного этанола и 0,426 ммоль триэтиламина в 2 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99:1, при этом получают твердое вещество с точкой плавления 45 - 52oC.
1H-ЯМР (CDCl3): δ = 0,85 (т, 3H), 1,15 - 1,7 (м, 5H), 1,9 - 2,1 (м, 2H), 3,0 (AB, кв, 2H), 3,5 (д, 1H), 3,7 (д, 1H), 6,8 - 6,9 (м, 2H), 7,0 - 7,7 (м, 12H).
Пример 31
(±)5,6-дигидро-4-окси-6-фенил-3-[(фенилметил)тио] -6-пропил- 2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 1,08 ммоль 5,6-дигидро-4-окси-6-фенил-6-пропил-2H-пиран-2-она, 5 мл абсолютного этанола, 1,29 ммоль бензил-п-толуолтиосульфоната в 10 мл абсолютного этанола и 1,51 ммоль триэтиламина в 5 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси гексана и этилацетата в соотношении 75:25. При этом получают вязкое масло.
1H-ЯМР (CDCl3): δ = 0,83 (т, 3H), 1,0-1,2 (м, 1H), 1,3-1,5 (м, 1H), 1,8-2,0 (м, 2H), 2,97 (AB, кв, 2H), 3,5 (д, 1H), 3,7 (д, 1H), 6,8 - 6,9 (м, 2H), 7,0 - 7,5 (м, 9H).
Пример 32
(±)5,6-дигидро-4-окси-6-фенил-3-[(2-фенилэтил)тио] -6- пропил-2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 1,08 ммоль 5,6-дигидро-4-окси-6-фенил-6-пропил-2H-пиран-2-она, 5 мл абсолютного этанола, 1,29 ммоль 2-фенилэтил-п-толуолтиосульфоната в 10 мл абсолютного этанола и 1,51 ммоль триэтиламина в 5 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси гексана и этилацетата в соотношении 60:40, при этом получают вязкое масло.
1H-ЯМР (CDCl3): δ = 0,85 (т, 3H), 1,1 - 1,3 (м, 1H), 1,3 - 1,5 (м, 1H), 1,8 - 2,0 (м, 2H), 2,2 - 2,3 (м, 1H), 2,3 - 2,5 (м, 1H), 2,6 - 2,8 (м, 2H), 3,1 (AB, кв, 2H), 6,9 (д, 2H), 7,1-7,5 (м, 9H).
Пример 33
(±)5,6-дигидро-4-окси-6-пентил-6-фенил-3-[(фенилметил)тио] - 2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 0,96 ммоль 5,6-дигидро-6-пентил-6-фенил-2H-пиран-2-она, 5 мл абсолютного этанола, 1,05 ммоль бензил-п-толуолтиосульфоната в 10 мл абсолютного этанола и 1,05 ммоль триэтиламина в 5 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси гексана и этилацетата в соотношении 75:25, при этом получают вязкое масло.
1H-ЯМР (CDCl3): δ = 0,81 (т, 3H), 1,0-1,4 (м, 6H), 1,8 - 2,0 (м, 2H), 2,97 (AB, кв, 2H), 3,5 (д, 1H), 3,7 (д, 1H), 6,8 - 6,9 (м, 2H), 7,0 - 7,4 (м, 9H).
Пример 34
(±)5,6-дигидро-4-окси-6-пентил-6-фенил-3-[(2-фенилэтил) тио]-2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 0,96 ммоль 5,6-дигидро-6-пентил-6-фенил-2H-пиран-2-она, 5 мл абсолютного этанола, 1,05 ммоль 2-фенэтил-п-толуолтиосульфоната в 10 мл абсолютного этанола и 1,05 ммоль триэтиламина в 5 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси гексана и этилацетата в соотношении 70:30, при этом получают вязкое масло.
1H-ЯМР (CDCl3): δ = 0,82 (т, 3H), 1,0-1,4 (м, 6H), 1,8-2,0 (м, 2H), 2,2-2,3 (м, 1H), 2,3 - 2,5 (м, 1H), 2,6 - 2,8 (м, 2H), 3,13 (AB, кв, 2H), 6,8 - 6,9 (м, 2H), 7,1 -7,5 (м, 9H).
Пример 35
(±)5,6-дигидро-4-окси-6-(3-метилбутил)-6-фенил-3- [(фенилметил)тио] -2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 0,96 ммоль 5,6-дигидро-6-(3-метилбутил)-6-фенил-2H- пиран-2-она, 5 мл абсолютного этанола, 1,05 ммоль бензил-п- толуолтиосульфоната в 10 мл абсолютного этанола и 1,15 ммоль триэтиламина в 5 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси гексана и этилацетата в соотношении 80:20, при этом получают вязкое масло.
1H-ЯМР (CDCl3): δ = 0,80 (д, д, 6H), 0,9 - 1,1 (м, 1H), 1,2 - 1,3 (м, 1H), 1,3 - 1,5 (м, 1H), 1,8 - 2,0 (м, 2H), 2,97 (AB, кв, 2H), 3,5 (д, 1H), 3,7 (д, 1H), 6,8 - 6,9 (м, 2H), 7,0-7,4 (м, 9H).
Пример 36
(±)5,6-дигидро-4-окси-6-(3-метилбутил)-6-фенил- 3-[(2-фенилэтил)тио] -2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 0,96 ммоль 5,6-дигидро-6-(3-метилбутил)-6-фенил-2H-пиран-2-она, 5 мл абсолютного этанола, 1,05 ммоль 2-фенилэтил-п-толуолтиосульфоната в 10 мл абсолютного этанола и 1,05 ммоль триэтиламина в 5 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси гексана и этилацетата в соотношении 80:20, при этом получают вязкое масло.
1H-ЯМР (CDCl3): δ = 0,80 (д, д, 6H), 1,1-1,15 (м, 1H), 1,2 - 1,3 (м, 1H), 1,4 - 1,5 (м, 1H), 1,9 - 2,0 (м, 2H), 2,2 - 2,3 (м, 1H), 2,3 - 2,5 (м, 1H), 2,6 - 2,8 (м, 2H), 3,15 (AB, кв, 2H), 6,8 - 6,9 (м, 2H), 7,1 - 7,5 (м, 9H).
Пример 37
5,6-дигидро-4-окси-6,6-дифенил-3-[(фенилметил)тио]-2H-пиран- 2-он
Целевое соединение получают по общему методу 4 с применением 0,94 ммоль 5,6-дигидро-4-окси-6,6-дифенил-2H-пиран-2- она, 5 мл абсолютного этанола, 1,13 ммоль бензил-п- толуолтиосульфоната в 10 мл абсолютного этанола и 1,31 ммоль триэтиламина в 5 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100: 0 - 98:2, при этом получают твердое вещество с точкой плавления 44 - 47,5oC.
1H-ЯМР (CDCl3): δ = 3,34 (с, 2H), 3,63 (с, 2H), 6,8-6,9 (м, 2H), 7,1-7,5 (м, 14H).
Пример 38
5,6-дигидро-4-окси-6,6-дифенил-3-[(2-фенилэтил)тио]-2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 0,94 ммоль 5,6-дигидро-4-окси-6,6-дифенил- 2H-пиран-2-она, 5 мл абсолютного этанола, 1,13 ммоль 2-фенилэтил- п-толуолтиосульфоната в 10 мл абсолютного этанола и 1,31 ммоль триэтиламина в 5 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Получаемый при этом твердый продукт с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 153 - 154,5oC.
1H-ЯМР (CDCl3): δ = 2,3 (т, 2H), 2,6 (т, 2H), 3,49 (с, 2H), 6,8 - 6,9 (м, 2H), 7,1 - 7,6 (м, 14H).
Пример 39
(±)5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)- 3-[(фенилметил)тио]-2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 0,85 ммоль 5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-2H-пиран-2-она, 5 мл абсолютного этанола, 1,02 ммоль бензил-п-толуолтиосульфоната в 10 мл абсолютного этанола и 1,19 ммоль триэтиламина в 5 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси гексана и этилацетата в соотношении 80:20, при этом получают вязкое масло.
1H-ЯМР (CDCl3): δ = 2,1 - 2,4 (м, 3H), 2,7 - 2,8 (м, 1H), 3,0 (AB, кв, 2H), 3,5 (д, 1H), 3,8 (д, 1H), 6,8 - 6,9 (м, 2H), 7,0 - 7,5 (м, 14H).
Пример 40
(±)5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-3-[(2- фенилэтил)тио] -2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 0,85 ммоль 5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)- 2H-пиран-2-она, 5 мл абсолютного этанола, 1,02 ммоль 2-фенилэтил- п-толуолтиосульфоната в 10 мл абсолютного этанола и 1,19 ммоль триэтиламина в 5 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Получаемый при этом твердый продукт с помощью диэтилового эфира растирают в порошок, при этом получают твердое вещество с точкой плавления 56 - 58oC.
1H-ЯМР (CDCl3): δ = 2,2 - 2,5 (м, 5H), 2,6 - 2,8 (м, 3H), 3,2 (AB, кв, 2H), 6,8 - 6,9 (м, 2H), 7,0 - 7,5 (м, 14H).
Пример 41
(±)5,6-дигидро-4-окси-6-фенил-3-[(2-фенилэтил)тио]-2(1H)- пиридинон
Целевое соединение получают по общему методу 4 с применением 105 мг 5,6-дигидро-4-окси-6-фенил-2(1H)-пиридинона, 175 мг 2- фенилэтил-п-толуолтиосульфоната и 0,1 мл триэтиламина в 5 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100:0 - 97:3, при этом получают вязкое масло, которое с помощью диэтилового эфира растирают в порошок. Получают твердое вещество с точкой плавления 111 - 113oC.
1H-ЯМР (CDCl3): δ = 2,80 - 3,03 (м, 6H), 4,70 (т, 1H), 5,75 (с, 1H), 7,16 - 7,40 (м, 11H).
Пример 42
(±)5,6-дигидро-4-окси-6-феноксиметил-6-фенил-3- [(фенилметил)тио]-2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 200 мг 5,6-дигидро-4-окси-6- феноксиметил-6-фенил-2H-пиран-2-она, 210 мг бензил-п-толуолтиосульфоната и 0,125 мл триэтиламина в 5 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100:0 - 95:5, при этом получают твердое вещество с точкой плавления 161 - 163oC.
1H-ЯМР (CDCl3): δ = 3,10 (д, 1H), 3,52 (д, 1H), 3,54 (д, 1H), 3,75 (д, 1H), 3,97 (д, 1H), 4,23 (д, 1H), 6,84 - 7,52 (м, 16H).
Пример 43
(±)6-[2-(бензо[1,3] диоксол-5-ил)этил] -5,6-дигидро-4-окси- 6-фенил-3-[(фенилметил)тио]-2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 165 мг 6-[2-(бензо(1,3]диоксол-5-ил)этил]-5,6-дигидро-4-окси-6-фенил-2H- пиран-2-она, 150 мг бензил-п-толуолтиосульфоната и 0,075 мл триэтиламина в 5 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100:0 - 95:5, при этом получают твердое вещество с точкой плавления 45 - 50oC.
1H-ЯМР (CDCl3): δ = 2,08 - 2,30 (м, 3H), 2,62 - 2,71 (м, 1H), 2,98 (дд, 2H), 3,53 (д, 1H), 3,76 (д, 1H), 5,89 (с, 2H), 6,50 - 6,86 (м, 5H), 7,06 - 7,26 (м, 4H), 7,33 - 7,44 (м, 5H).
Пример 44
(±)6-[2-(3,4-дихлорфенил)этил]-5,6-дигидро-4- окси-6-фенил-3-[(фенилметил)тио]-2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 365 мг 6-[2-(3,4-дихлорфенил)этил]-5,6-дигидро-4-окси-6-фенил-2H-пиран- 2-она, 310 мг бензил-п-толуолтиосульфоната и 0,15 мл триэтиламина в 5 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100:0 - 95:5, при этом получают твердое вещество с точкой плавления 43 - 50oC.
1H-ЯМР (CDCl3): δ = 2,07 - 2,16 (м, 1H), 2,21 - 2,28 (м, 2H), 2,71 - 2,77 (м, 1H), 2,99 (дд, 2H), 3,54 (д, 1H), 3,78 (д, 1H), 6,84 - 6,91 (м, 3H), 7,10 - 7,45 (м, 11H).
Пример 45
(±)6-[2-(4-фторфенил)этил]-5,6-дигидро-4-окси- 6-фенил-3-[(фенилметил)тио]-2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 312 мг 6-[2-(4-фторфенил)этил] -5,6-дигидро-4-окси-6-фенил-2H-пиран-2-она, 310 мг бензил-п-толуолтиосульфоната и 0,15 мл триэтиламина в 5 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100:0 - 95:5, при этом получают твердое вещество с точкой плавления 86 - 90oC.
1H-ЯМР (CDCl3): δ = 2,08 - 2,35 (м, 3H), 2,70 - 2,77 (м, 1H), 2,99 (дд, 2H), 3,54 (д, 1H), 3,77 (д, 1H), 6,85 - 7,44 (м, 15H).
Пример 46
(±)5,6-дигидро-6-гексил-4-окси-6-фенил-3-[(фенилметил) тио] -2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 0,91 ммоль (±) 5,6-дигидро-6-гексил-4-окси-6-фенил-2H-пиран-2-она, 5 мл абсолютного этанола, 1,1 ммоль бензил-п-толуолтиосульфоната в 5 мл абсолютного этанола и 1,27 ммоль триэтиламина в 5 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99,5:0,5, при этом получают вязкую смолу.
1H-ЯМР (CDCl3): δ = 0,81 (т, 3H), 1,0-1,4 (м, 8H), 1,8-2,0 (м, 2H), 2,97 (AB, кв, 2H), 3,5 (д, 1H), 3,7 (д, 1H), 6,8 - 6,9 (м, 2H), 7,0 - 7,4 (м, 9H).
Пример 47
(±)5,6-дигидро-6-гексил-4-окси-6-фенил-3-[(2-фенилэтил) тио]-2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 0,91 ммоль (±) 5,6-дигидро-6-гексил-4-окси-6-фенил-2H-пиран-2-она, 5 мл абсолютного этанола, 1,09 ммоль фенэтил-п-толуолтиосульфоната в 5 мл абсолютного этанола и 1,27 ммоль триэтиламина в 5 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99,75:0,25 - 99:1, при этом получают вязкую смолу.
1H-ЯМР (CDCl3): δ = 0,84 (т, 3H), 1,0 - 1,4 (м, 8H), 1,8 - 2,0 (м, 2H), 2,2 - 2,3 (м, 1H), 2,3 - 2,5 (м, 1H), 2,6 - 2,8 (м, 2H), 3,13 (AB, кв, 2H), 6,9 (дд, 2H), 7,1 - 7,5 (м, 8H).
Пример 48
(±)5,6-дигидро-4-окси-6-(4-метилпентил)-6-фенил-3- [(фенилметил)тио] -2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 1 ммоль (±) 5,6-дигидро-4-окси-6-(4-метилпентил)-6- фенил-2H-пиран-2-она, 5 мл абсолютного этанола, 1,2 ммоль бензил- п-толуолтиосульфоната в 5 мл абсолютного этанола и 4 ммоль бикарбоната натрия в 5 мл абсолютного этанола. Реакционную смесь нагревают до температуры 50oC в течение 1,5 часов, после чего перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100:0 - 99:1, при этом получают вязкую смолу.
1H-ЯМР (CDCl3): δ = 0,78 (д, 6H), 1,0-1,5 (м, 5H), 1,8-2,0 (м, 2H), 2,97 (AB, кв, 2H), 3,5 (д, 1H), 3,7 (д, 1H), 6,8 - 6,9 (м, 2H), 7,0 - 7,4 (м, 9H).
Пример 49
(±)5,6-дигидро-4-окси-6-(4-метилпентил)-6-фенил- 3-[(2-фенилэтил)тио]-2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 1 ммоль (±) 5,6-дигидро-4-окси-6-(4-метилпентил)-6-фенил-2H-пиран- 2-она, 5 мл абсолютного этанола, 1,2 ммоль фенэтил-п-толуолтиосульфоната в 5 мл абсолютного этанола и 1,4 ммоль триэтиламина в 5 мл абсолютного этанола. Реакционную смесь перемешивают при температуре 50oC в течение 2 часов. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси гексана и этилацетата в соотношении 80:20, при этом получают вязкую смолу.
1H-ЯМР (CDCl3): δ = 0,79 (д, 6H), 1,0 - 1,5 (м, 5H), 1,8 - 2,0 (м, 2H), 2,2 - 2,3 (м, 1H), 2,3 - 2,5 (м, 1H), 2,6 - 2,8 (м, 2H), 3,14 (AB, кв, 2H), 6,9 (д, 2H), 7,1 - 7,5 (м, 8H).
Пример 50
(±)6-циклопентилметил-5,6-дигидро-4-окси-6-фенил- 3-[(фенилметил)тио]-2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 1 ммоль (±) 6-циклопентилметил-5,6-дигидро-4-окси-6- фенил-2H-пиран-2-она, 5 мл абсолютного этанола, 1,2 ммоль бензил- п-толуолтиосульфоната в 5 мл абсолютного этанола и 4 ммоль бикарбоната натрия в 5 мл абсолютного этанола. Реакционную смесь нагревают до температуры 120oC в течение 15 минут. Продукт очищают путем флеш-хроматографии, при этом в качестве элюента последовательно применяют смесь гексана и этилацетата в соотношении 75:25 и смесь дихлорметана и метанола в соотношении 99,5:0,5. Получают вязкую смолу.
1H-ЯМР (CDCl3): δ = 0,8 - 1,0 (м, 1H), 1,0 - 1,2 (м, 1H), 1,3 - 1,6 (м, 5H), 1,6 - 1,8 (м, 2H), 1,97 (дд, 1H), 2,07 (дд, 1H), 2,97 (AB, кв, 2H), 3,5 (д, 1H), 3,7 (д, 1H), 6,8 - 6,9 (м, 2H), 7,0 - 7,4 (м, 9H).
Пример 51
(±)6-циклопентилметил-5,6-дигидро-4-окси-6-фенил- 3-[(2-фенилэтил)тио] -2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 1 ммоль (±) 6-циклопентилметил-5,6-дигидро-4-окси-6- фенил-2H-пиран-2-она, 5 мл абсолютного этанола, 1,2 ммоль фенэтил-п-толуолтиосульфоната в 5 мл абсолютного этанола и 1,4 ммоль триэтиламина в 5 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение 2 дней. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси гексана и этилацетата в соотношении 75:25 - 60:40, при этом получают вязкую смолу.
1H-ЯМР (ДМСО-d6): δ = 0,8-1,0 (м, 1H), 1,0-1,1 (м, 1H), 1,2-1,8 (м, 7H), 1,9 - 2,1 (м, 2H), 2,3 (т, 2H), 2,5 - 2,6 (м, 2H), 3,25 (с, 2H), 6,95 (д, 2H), 7,1 - 7,4 (м, 8H).
Пример 52
(±)3,4-дигидpo-4'-oкcи-5'-[(фенилметил)тио] -спиpо [нафтален-1(2H),2'-[2H]-пиран]-6'(3'H)-он
Целевое соединение получают по общему методу 4 с применением 1,1 ммоль (±) 3,4-дигидро-4'-окси-спиро[нафтален-1(2H), 2'- [2H]пиран]-6'(3'H)-она, 5 мл абсолютного этанола, 1,3 ммоль бензил-п-толуолтиосульфоната в 5 мл абсолютного этанола и 1,5 ммоль триэтиламина в 5 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с помощью в качестве элюента смеси гексана и этилацетата в соотношении 90:10 - 60:40, после чего получаемый при этом продукт с применением диэтилового эфира растирают в порошок. Получают твердое вещество с точкой плавления 143 - 145oC.
1H-ЯМР (CDCl3): δ = 1,5 - 1,8 (м, 2H), 1,8 - 2,1 (м, 2H), 2,6 (д, 1H), 2,7 - 2,9 (м, 2H), 3,0 (дд, 1H), 3,9 (AB, кв, 2H), 7,0 - 7,2 (м, 1H), 7,2 - 7,4 (м, 7H), 7,4 - 7,5 (м, 1H).
Пример 53
(±)3,4-дигидро-4'-окси-5'-[(2-фенилэтил)тио] -спиро[нафтален- 1(2H),2'-[2H]-пиран]-6'(3'H)-он
Целевое соединение получают по общему методу 4 с применением 1,1 ммоль (±) 3,4-дигидро-4'-окси-спиро[нафтален-1(2H), 2'-[2H]пиран]- 6'(3'H)-она, 5 мл абсолютного этанола, 1,3 ммоль фенэтил-п-толуолтиосульфоната в 5 мл абсолютного этанола и 1,5 ммоль триэтиламина в 5 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Продукт очищают путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 100:0 - 98:2, при этом получают твердое вещество, которое рекристаллизуют из смеси дихлорметана и диэтилового эфира с получением твердого вещества с точкой плавления 125 - 126,5oC.
1H-ЯМР (CDCl3): δ = 1,6 - 1,9 (м, 1H), 1,9 - 2,1 (м, 1H), 2,1 - 2,3 (м, 2H), 2,7 - 3,3 (м, 8H), 7,1 - 7,4 (м, 7H), 7,5 - 7,7 (м, 2H).
Пример 54
(±)3-(3,6-дигидро-4-окси-6-оксо-2-фенил-5-[(2- фенилэтил)тио] -2H-пиран-2-ил)пропановая кислота
Целевое соединение получают по общему методу 4 с применением 0,95 ммоль (±) 3-(3,6-дигидро-4-окси-6-оксо-2-фенил-2H-пиран- 2-ил)-пропановой кислоты, 5 мл абсолютного этанола, 1,1 ммоль фенэтил-п-толуолтиосульфоната в 5 мл абсолютного этанола и 2,3 ммоль триэтиламина в 5 мл абсолютного этанола. Реакционную смесь нагревают с обратным холодильником в течение 2 часов. Продукт подвергают флеш- хроматографии с применением в качестве элюента смеси дихлорметана, метанола и уксусной кислоты в соотношении 95:5:0,05, при этом получают твердое вещество, которое рекристаллизуют из этилацетата. Точка плавления 150,5 - 152oC.
1H-ЯМР (CDCl3): δ = 2,1 - 2,9 (м, 8H), 3,15 (AB, кв, 2H), 6,9 (д, 2H), 7,1 - 7,4 (м, 8H).
Пример 55
(±)4-(3,6-дигидро-4-окси-6-оксо-2-фенил-5-[(2- фенилэтил)тио] -2H-пиран-2-ил) масляная кислота
Целевое соединение получают по общему методу 4 с применением 1,8 ммоль (±) 4-(3,6-дигидро-4-окси-6-оксо-2-фенил-2H-пиран-2-ил)- масляной кислоты, 5 мл абсолютного этанола, 2,1 ммоль фенэтил-п-толуолтиосульфоната в 5 мл абсолютного этанола и 4,3 ммоль триэтиламина в 5 мл абсолютного этанола. Реакционную смесь нагревают с обратным холодильником в течение 3 часов. Продукт подвергают флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и уксусной кислоты в соотношении 95:5:0,05, при этом получают аморфное твердое вещество.
1H-ЯМР (CDCl3): δ = 1,4 - 1,6 (м, 1H), 1,6 - 1,8 (м, 1H), 1,9 - 2,1 (м, 2H), 2,2 - 2,4 (м, 3H), 2,4 - 2,5 (м, 1H), 2,6 - 2,8 (м, 2H), 3,15 (AB, кв, 2H), 6,9 (д, 2H), 7,1 - 7,5 (м, 8H).
Пример 56
(±)5-(3,6-дигидро-4-окси-6-оксо-2-фенил-5-[(2-фенилэтил) тио] -2H-пиран-2-ил)пентановая кислота
Целевое соединение получают по общему методу 4 с применением 1,8 ммоль (±) 5-(3,6-дигидро-4-окси-6-оксо-2-фенил-2H-пиран-2-ил)- пентановой кислоты, 10 мл абсолютного этанола, 2,2 ммоль фенэтил-п-толуолтиосульфоната в 10 мл абсолютного этанола и 4,3 ммоль триэтиламина в 10 мл абсолютного этанола. Реакционную смесь нагревают с обратным холодильником в течение 3 часов. Продукт подвергают флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и уксусной кислоты в соотношении 99:1:0,05, при этом получают твердое веществом точкой плавления 113 - 119,5oC.
1H-ЯМР (CDCl3): δ = 0,8-1,1 (м, 1H), 1,1 -1,3 (м, 1H), 1,3 - 1,5 (м, 2H), 1,8 - 2,0 (м, 2H), 2,1 (т, 2H), 2,2 (т, 2H), 2,5 - 2,8 (м, 2H), 3,2 (AB, кв, 2H), 6,9 (д, 2H), 7,1 - 7,4 (м, 8H), 11,5 (шир.с, 1H), 11,9 (шир.с, 1H).
Пример 57
(±)5,6-дигидро-4-окси-6-фенил-3-[(2-фенилэтил)тио] -6- пиридил-4-ил-2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 0,47 ммоль (±) 5,6-дигидро-4-окси-6-фенил-6-пиридин-4-ил-2H- пиран-2-она, 0,56 ммоль фенэтил-п-толуолтиосульфоната в 5 мл абсолютного этанола, 2 ммоль бикарбоната натрия и 0,65 ммоль триэтиламина в 5 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Твердый продукт с помощью этилацетата растирают в порошок. Точка плавления 203 - 205oC.
1H-ЯМР (ДМСО-d6): δ = 2,1 (т, 2H), 2,5 (т, 2H), 3,7 (AB, кв, 2H), 6,9 (д, 2H), 7,1 -7,6 (м, 10H), 8,6 (д, 2H).
Пример 58
(±)5,6-дигидро-4-окси-6-[(метилфениламино)метил] - 6-фенил-3-[(2-фенил-этил)тио]-2H-пиран-2-он
Целевое соединение получают по общему методу 4 с применением 0,55 ммоль (±) 5,6-дигидро-4-окси-6-[(метилфениламино)метил] - 6-фенил-2H-пиран-2-она, 0,61 ммоль фенэтил-п-толуолтиосульфоната в 5 мл абсолютного этанола, 2,2 ммоль бикарбоната натрия и 0,61 ммоль триэтиламина в 5 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение ночи и при температуре 50oC в течение еще 2 часов. Твердый продукт подвергают флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99: 1, при этом получают твердое вещество с точкой плавления 48 - 57oC.
1H-ЯМР (CDCl3): δ = 2,2 - 2,3 (м, 1H), 2,3 - 2,5 (м, 1H), 2,6 - 2,8 (м, 2H), 3,08 (с, 3H), 3,15 (д, 1H), 3,35 (д, 1H), 3,7 (AB, кв, 2H), 6,7 - 6,9 (м, 3H), 7,1 - 7,6 (м, 12H).
Пример 59
(±)4-(3,6-дигидро-4-окси-6-оксо-2-фенил-5-[(фенилметил)тио] - 2H-пиран-2-ил)бутирамид
В реакционный сосуд емкостью 50 мл подают 0,75 ммоль (±) 4-(3,6-дигидро-4-окси-6-оксо-2-фенил-2H-пиран-2- ил)пропановой кислоты, 1,5 ммоль 4-метил-морфолина и 7,5 мл дихлорметана. Реакционную смесь охлаждают до температуры 0oC. В смесь подают 1,5 ммоль сложного метилового эфира хлормуравьиной кислоты в 3,5 мл дихлорметана. Реакционную смесь перемешивают при температуре 0oC в течение 2 часов. В реакционный сосуд в течение 10-15 минут подают аммиак, и реакционную смесь перемешивают в течение 30 минут при температуре 0oC и в течение 1,5 часов при комнатной температуре. Реакционную смесь подают в этилацетат и 1 н. соляную кислоту, водный слой дважды экстрагируют этилацетатом, сушат над сульфатом магния и сгущают. Сырую реакционную смесь подвергают флеш-хроматографии с применением в качестве элюента смеси дихлорметана, метанола и уксусной кислоты в соотношении 98:2:0,05, при этом получают (±) 4-(3,6-дигидро-4-окси-6-оксо-2-фенил-2H- пиран-2-ил)бутирамид в виде твердого вещества с точкой плавления 51 - 54oC.
1H-ЯМР (ДМСО-d6): δ = 1,0 - 1,2 (м, 1H), 1,3 - 1,6 (м, 1H), 1,8 - 2,0 (м, 4H), 2,9 (AB, кв, 2H), 4,8 (с, 1H), 6,6 (с, 1H), 7,2 (с, 1H), 7,2 - 7,5 (м, 5H), 11,4 (шир.с, 1H).
Целевое соединение получают по общему методу 4 с применением 0,42 ммоль (±) 4-(3,6-дигидро-4-окси-6-оксо-2-фенил-2H-пиран-2- ил)-бутирамида, 5 мл абсолютного этанола, 0,58 ммоль бензил-п- толуолтиосульфоната в 5 мл абсолютного этанола, 1,67 ммоль бикарбоната натрия и 0,42 ммоль триэтиламина в 5 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Продукт подвергают флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 90:10, при этом получают целевое соединение в виде твердого вещества с
точкой плавления 47,5 - 53oC.
1H-ЯМР (ДМСО-d6): δ = 1,0-1,3 (м, 1H), 1,3-1,6 (м, 1H), 1,7-2,1 (м, 4H), 3,1 (с, 2H), 3,5 (AB, кв, 2H), 6,7 (c, 1H), 7,0 -7,5 (м, 11H), 11,4 (c, 1H).
Пример 60
(±) Амид 5-(3,6-дигидро-4-окси-6-оксо-2-фенил-5-[(2- фенилэтил)тио]-2H-пиран-2-ил)пентановой кислоты
В реакционный сосуд емкостью 50 мл подают 1,2 ммоль (±) 5-(3,6-дигидро-4- окси-6-оксо-2-фенил-2H-пиран-2-ил)пентановой кислоты, 2,4 ммоль 4-метилморфолина и 10 мл дихлорметана. Реакционную смесь охлаждают до температуры 0oC. В смесь подают 2,4 ммоль сложного метилового эфира хлормуравьиной кислоты в 3 мл дихлорметана. Реакционную смесь перемешивают при температуре 0oC в течение 2 часов. В реакционный сосуд в течение 10-15 минут подают аммиак и реакционную смесь перемешивают в течение 30 минут при температуре 0oC. Реакционную смесь подают в этилацетат и 1 н. соляную кислоту, водный слой экстрагируют этилацетатом, сушат над сульфатом магния и сгущают. Сырое твердое вещество с помощью дихлорметана растирают в порошок, при этом получают (±) амид 5-(3,6-дигидро-4-окси-6-оксо-2-фенил-2H-пиран-2-ил)пентановой кислоты в виде твердого вещества с точкой плавления 173-174oC.
1H-ЯМР (ДМСО-d6): δ = 0,8-1,0 (м, 1H), 1,1-1,3 (м, 1H), 1,3-1,5 (м, 2H), 1,8 - 2,0 (м, 4H), 2,9 (AB, кв, 2H), 4,8 (c, 1H), 6,6 (с, 1H), 7,2 (с, 1H), 7,2 - 7,5 (м, 5H), 11,4(с, 1H).
Целевое соединение получают по общему методу 4 с применением 0,60 ммоль (±) амида 5-(3,6-дигидро-4-окси-6-оксо-2-фенил-2H- пиран-2-ил)-пентановой кислоты, 5 мл абсолютного этанола; 0,85 ммоль фенэтил-п-толуолтиосульфоната, 2,4 ммоль бикарбоната натрия и 0,60 ммоль триэтиламина в 5 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Продукт подвергают флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 90:10, после чего продукт с помощью диэтилового эфира растирают в порошок. При этом получают твердое вещество. Температура размягчения 100 - 105oC. Точка плавления 120oC.
1H-ЯМР (ДМСО-d6): δ = 0,9 - 1,1 (м, 1H), 1,1 - 1,3 (м, 1H), 1,3 - 1,5 (м, 2H), 1,8 - 2,0 (м, 4H), 2,2 (т, 2H), 2,5 - 2,6 (м, 2H), 3,2 (с, 2H), 6,6 (c, 1H), 6,9 (д, 2H), 7,1 - 7,6 (м, 9H), 11,5 (шир.с, 1H).
Пример 61
(±) N-бензил-4-(3,6-дигидро-4-окси-6-оксо-2-фенил- 5-[(фенилметил)тио] -2H-пиран-2-ил)бутирамид
В реакционный сосуд емкостью 50 мл подают 0,75 ммоль (±) 4-(3,6-дигидро-4-окси-6-оксо-2-фенил-2H-пиран-2-ил)пропановой кислоты, 1,5 ммоль 4-метилморфолина и 7,5 мл дихлорметана. Реакционную смесь охлаждают до температуры 0oC. В смесь подают 1,5 ммоль сложного метилового эфира хлормуравьиной кислоты в 3,5 мл дихлорметана. Реакционную смесь перемешивают при температуре 0oC в течение 2 часов. Добавляют 1,6 ммоль бензиламина в 5 мл дихлорметана и реакционную смесь перемешивают в течение 30 минут при температуре 0oC и в течение 1,5 часов при комнатной температуре. Реакционную смесь подают в этилацетат и 1 н. соляную кислоту, водный слой дважды экстрагируют этилацетатом, сушат над сульфатом магния и сгущают. Сырую реакционную смесь подвергают флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99:1. 200 мг получаемого карбамата гидролизуют путем обработки 20 мл 0,1 н. соляной кислоты в 4 мл п-диоксана в течение 1 часа при комнатной температуре. При этом получают (±) N-бензил-4-(3,6-дигидро-4-окси-6- оксо-2-фенил-2H-пиран-2-ил)-бутирамид.
Целевое соединение получают по общему методу 4 с применением 0,33 ммоль (±) N-бензил-4-(3,6-дигидро-4-окси-6-оксо-2-фенил- 2H-пиран-2-ил)бутирамида, 5 мл абсолютного этанола, 0,47 ммоль бензил-п-толуолтиосульфоната в 5 мл абсолютного этанола, 1,33 ммоль бикарбоната натрия и 0,33 ммоль триэтиламина в 5 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Продукт подвергают флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 95:5. При этом получают целевое соединение в виде твердого вещества с точкой плавления 48 - 52oC.
1H-ЯМР (ДМСО-d6): δ = 1,1 - 1,3 (м, 1H), 1,4 - 1,6 (м, 1H), 1,8 - 1,9 (м, 2H), 2,0 - 2,2 (м, 2H), 3,1 (с, 2H), 3,6 (AB, кв, 2H), 4,2 (д, 2H), 7,0 (м, 2H), 7,1 - 7,5 (м, 13H), 8,3 (т, 1H), 11,4 (шир.с, 1H).
Пример 62
(±) Бензиламид 5-(3,6-дигидро-4-окси-6-оксо-2- фенил-5-[(2-фенилэтил)тио]-2H-пиран-2-ил)пентановой кислоты
В реакционный сосуд емкостью 50 мл подают 0,83 ммоль (±) 5-(3,6-дигидро-4-окси-6-оксо-2-фенил-2H-пиран-2-ил)пентановой кислоты, 1,65 ммоль 4-метилморфолина и 10 мл дихлорметана. Реакционную смесь охлаждают до температуры 0oC. В смесь подают 1,65 ммоль сложного метилового эфира хлормуравьиной кислоты в 5 мл дихлорметана. Реакционную смесь перемешивают при температуре 0oC в течение 2 часов. Добавляют 1,7 ммоль бензиламина в 5 мл дихлорметана, и реакционную смесь перемешивают в течение 2 часов при комнатной температуре. Реакционную смесь подают в этилацетат и 1 н. соляную кислоту, водный слой дважды экстрагируют этилацетатом, сушат над сульфатом магния и сгущают. Сырую реакционную смесь применяют без очистки. 200 мг получаемого карбамата гидролизуют путем обработки 20 мл 0,1 н. соляной кислоты в 4 мл п-диоксана в течение 8 часов при комнатной температуре. При этом получают (±) бензиламид 5-(3,6-дигидро-4-окси-6-оксо-2-фенил- 2H-пиран-2-ил)-пентановой кислоты.
1H-ЯМР (ДМСО-d6): δ = 0,8-1,0 (м, 1H), 1,1-1,3 (м, 1H), 1,3-1,5 (м, 2H), 1,8 - 2,0 (м, 2H), 2,0 - 2,2 (м, 2H), 2,9 (AB, кв, 2H), 4,2 (AB, кв, 2H), 4,85 (c, 1H), 7,1 - 7,5 (м, 10H), 8,2 (шир.т, 1H), 11,4 (с, 1H).
Целевое соединение получают по общему методу 4 с применением 0,58 ммоль (±) амида N-бензил-5-(3,6-дигидро-4-окси-6-оксо-2- фенил-2H-пиран-2-ил)пентановой кислоты, 5 мл абсолютного этанола, 0,82 ммоль бензил-п-толуолтиосульфоната, 2,34 ммоль бикарбоната натрия и 0,82 ммоль триэтиламина в 5 мл абсолютного этанола. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Продукт подвергают флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99:1. При этом получают целевое соединение в виде твердого вещества с точкой плавления 47 - 49oC.
1H-ЯМР (CDCl3): δ = 1,0-1,2 (м, 1H), 1,3 - 1,5 (м, 1H), 1,5 - 1,7 (м, 2H), 1,8 - 2,0 (м, 2H), 2,0 - 2,2 (м, 2H), 2,9 (AB, кв, 2H), 3,5 (д, 1H), 3,7 (д, 1H), 4,4 (м, 2H), 5,7 (шир.т, 1H), 6,8-6,9 (м, 2H), 7,0-7,5 (м, 13H).
Пример 63
(±) N-бензил-4-(3,6-дигидро-4-окси-6-оксо-2-фенил- 5-[(фенилметил)тио] -2H-пиран-2-ил)-N-метилбутирамид
Целевое соединение получают по общему методу 4 с применением 0,66 ммоль (±) N-бензил-4-(3,6-дигидро-4-окси-6-оксо-2-фенил- 2H-пиран-2-ил)-N-метил-бутирамида, 0,92 ммоль бензил-п-толуолтиосульфоната в 5 мл абсолютного этанола, 2,63 ммоль бикарбоната натрия и 0,92 ммоль триэтиламина в 5 мл абсолютного этанола. Реакционную смесь нагревают при температуре 50oC в течение 2 часов. Твердый продукт подвергают флеш-хроматографии с применением в качестве элюента смеси дихлорметана и метанола в соотношении 99:1 - 98:2. При этом получают твердое вещество с точкой плавления 47 - 49oC.
1H-ЯМР (CDCl3): δ = 1,5-1,8 (м, 2H), 1,9-2,1 (м, 2H), 2,3 (AB, кв, 2 H), 2,84/2,91 (с/с, 3H), 2,98 - 3,02 (м, 2H), 3,5 (дд, 1H), 3,7 (дд, 1H), 4,46/4,55 (с/с, 2H), 6,8 - 6,9 (м, 2H), 7,0 - 7,5 (м, 13H).
Общий метод 5
Целевое соединение получают путем добавления 1,05 экв. соответствующего хлорангидрида кислоты к раствору 1,0 экв. 5,6-дигидро-2H-пиран-2-она, 1,05 экв. триэтиламина и тетрагидрофурана при температуре 5oC. Суспензию перемешивают при комнатной температуре в течение ночи, после чего разбавляют этилацетатом и водой. Органическую фазу промывают ледяной 1 н. соляной кислотой и рассолом, сушат над сульфатом магния и сгущают. Остаток растворяют в толуоле, обрабатывают диметиламинопиридином в качестве катализатора и нагревают при температуре 80 - 85oC в течение 4 - 8 часов. Раствор охлаждают до комнатной температуры и разбавляют водой. Органическую фазу промывают ледяной 1-н. соляной кислотой и рассолом, сушат над сульфатом магния и сгущают. Продукт подвергают хроматографии на силикагеле с применением в качестве элюента смеси гексана и этилацетата в соотношении 5:1, при этом получают 3-ацилированный промежуточный продукт, который растворяют в ледяной уксусной кислоте, обрабатывают 2 экв. цианоборгидрида натрия и перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь разбавляют водой, подкисляют концентрированной соляной кислотой и экстрагируют этилацетатом. Экстракт промывают рассолом, сушат над сульфатом магния и сгущают с получением целевого соединения.
Пример 64
5,6-дигидро-4-окси-6,6-дифенил-3-(2-фенилэтил)-2H-пиран-2-он
Целевое соединение получают по общему методу 5 с применением 2,0 ммоль 5,6-дигидро-4-окси-6,6-дифенил-2H-пиран-2- она, 2,1 ммоль фенилацетилхлорида, 2,1 ммоль триэтиламина и 10 мл тетрагидрофурана, после чего добавляют 10 мл толуола и каталитическое количество диметиламинопиридина. В результате хроматографии остатка получают 1,5 ммоль промежуточного 3-ацилового соединения, которое восстанавливают с помощью 3 ммоль цианоборгидрида натрия. Продукт растирают в порошок с помощью диэтилового эфира. Точка плавления: 158 - 159oC.
1H-ЯМР (ДМСО-d6): δ 1= 2,31 (м, 4H), 3,37 (м, 2H), 6,93 (д, 1H), 7,07 - 7,17 (м, 3H), 7,24 - 7,28 (м, 2H), 7,35 (м, 8H).
В качестве альтернативы целевое соединение можно получать следующим образом. Суспензию 0,25 г (6,2 ммоль) гидрида натрия в 5 мл сухого тетрагидрофурана в атмосфере азота охлаждают до температуры 0oC и обрабатывают раствором 1,40 г (6,0 ммоль) сложного этилового эфира 2-(2-фенил-этил)ацетоуксусной кислоты в 2 мл тетрагидрофурана. Раствор перемешивают при температуре 0oC в течение 10 минут, обрабатывают 4,3 мл 1,4 м. н-бутиллития и перемешивают в течение еще 15 минут. Сразу добавляют раствор 0,55 г (3,0 ммоль) бензофенона в 3 мл тетрагидрофурана. Реакционную смесь перемешивают при комнатной температуре в течение 2 часов. Добавляют 75 мл воды и смесь перемешивают при комнатной температуре в течение ночи. Раствор промывают диэтиловым эфиром. Водный слой подкисляют 6 н. соляной кислотой до достижения pH 2 и экстрагируют этилацетатом. Экстракт промывают рассолом, сушат над сульфатом магния и сгущают. Остаток с помощью смеси диэтилового эфира и гексана в соотношении 1:1 растирают в порошок, твердое вещество отфильтровывают и сушат с получением целевого соединения.
Пример 65
(±) 5,6-дигидро-4-окси-6-(3-метилбутил)-6-фенил- 3-(2-фенилэтил)-2H-пиран-2-он
Целевое соединение получают по общему методу 5 с применением 2,0 ммоль 5,6-дигидро-4-окси-6-(3-метилбутил)-6-фенил-2H-пиран-2-она, 2,1 ммоль фенилацетилхлорида, 2,1 ммоль триэтиламина и 10 мл тетрагидрофурана, после чего добавляют 10 мл толуола и каталитическое количество диметиламинопиридина. В результате хроматографии остатка получают 1,0 ммоль промежуточного ацилового соединения, которое восстанавливают с помощью 2 ммоль цианоборгидрида натрия. Получают целевое соединение в виде твердого вещества с точкой плавления 125 - 126oC.
1H-ЯМР (ДМСО-d6): δ = 0,76 (м, 7H), 1,12 (м, 1H), 1,38 (м, 1H), 1,87 (м, 2H), 2,27 - 2,46 (м, 4H), 2,97 (кв, 2H), 6,98 - 7,38 (м, 10H).
Пример 66
5,6-дигидро-4-окси-6,6-дифенил-3-(3-фенилпропил)-2H-пиран-2-он
Целевое соединение получают по общему методу 5 с применением 2,5 ммоль 5,6-дигидро-4-окси-6,6-дифенил-2H-пиран-2-она, 2,7 ммоль фенилацетилхлорида, 2,8 ммоль триэтиламина и 20 мл тетрагидрофурана, после чего добавляют 20 мл толуола и каталитическое количество диметиламинопиридина. В результате хроматографии остатка получают 1,0 ммоль промежуточного 3-ацилового соединения, которое восстанавливают с помощью 3 ммоль цианоборгидрида натрия. Продукт растирают в порошок с помощью диэтилового эфира, при этом получают целевое соединение с точкой плавления 61 - 63oC.
1H-ЯМР (ДМСО-d6): δ = 1,35 (м, 2H), 2,05 (т, 2H), 2,14 (т, 2H), 3,42 (шир.с, 2H), 6,92 (м, 2 H), 7,17 - 7,40 (м, 13H).
Пример 67
(±) 5,6-дигидро-4-окси-6-фенил-3,6-бис(2-фенилэтил)-2H- пиран-2-он
Целевое соединение получают по общему методу 5 с применением 3,0 ммоль 5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)2H-пиран-2-она, 3,2 ммоль гидроциннамоилхлорида, 3,2 ммоль триэтиламина и 30 мл тетрагидрофурана, после чего добавляют 30 мл толуола и каталитическое количество диметиламинопиридина. В результате хроматографии остатка получают 1,5 ммоль промежуточного 3-ацилового соединения, которое восстанавливают с помощью 3 ммоль цианоборгидрида натрия. Продукт растирают в порошок с помощью смеси диэтилового эфира и гексана в соотношении 1:5, при этом получают целевое соединение с точкой плавления 68 - 70oC.
1H-ЯМР (ДМСО-d6): δ = 2,20 (м, 2H), 2,35 (м, 2H), 2,42 - 2,59 (м, 4H плюс ДМСО), 3,06 (кв, 2H), 7,00 (дд, 2H), 7,07 - 7,43 (м, 13H).
Общий метод 6
Целевое соединение получают путем добавления 1,05 экв. пиперидина к охлажденному на ледяной бане раствору 1,0 ммоль 3-бром-5,6-дигидро-4-окси-2H-пиран-2-она (полученного по общему методу 3), 1,05 ммоль соответствующего тиола и 20 мл дихлофметана. Смесь перемешивают при комнатной температуре в течение 8 - 48 часов. Добавляют воду, органическую фазу отделяют, сушат над сульфатом магния и сгущают.
Пример 68
4-окси-3-(2-изопропилфенилтио)-5,6-дигидро-6,6-дифенил-2H-пиран- 2-он
Целевое соединение получают по общему методу 6 с применением 1,0 ммоль 3-бром-5,6-дигидро-4-окси-6,6-дифенил-2H-пиран-2-она (полученного в примере ААА), 1,05 ммоль 2-изопропилбензолтиола и 1,05 ммоль пиперидина в 20 мл дихлорметана. Продукт растирают в порошок с помощью диэтилового эфира, при этом получают твердое вещество с точкой плавления 216- 217oC.
1H-ЯМР (ДМСО-d6): δ = 1,17 (д, J = 6,8 Гц, 6H), 3,20 (м, 1H), 3,77 (шир. с, 2H), 5,64 (д, 1H), 6,45 (т, 1H), 6,92 (т, 1H), 7,12 (д, 1H), 7,32 - 7,48 (м, 10H).
Пример 69
5,6-дигидро-4-окси-6,6-дифенил-3-фенилтио-2H-пиран-2-он
Целевое соединение получают по общему методу 6 с применением 0,96 ммоль 3-бром-5,6-дигидро-4-окси-6,6-дифенил-2H-пиран-2-она (полученного в примере ААА), 1,0 ммоль бензолтиола и 1,0 ммоль пиперидина в 20 мл дихлорметана. Продукт растирают в порошок с помощью смеси гексана и диэтилового эфира в соотношении 1:1, при этом получают твердое вещество с точкой плавления 78 - 80oC.
1H-ЯМР (ДМСО-d6): δ = 3,37 (шир.с, 2H), 6,35 (м, 2H), 6,93 (м, 3H), 7,29 - 7,49 (м, 10H).
Пример 70
5,6-дигидро-4-окси-3-(3-метилфенилтио)-6,6-дифенил-2H-пиран-2-он
Целевое соединение получают по общему методу 6 с применением 1,3 ммоль 3-бром-5,6-дигидро-4-окси-6,6-дифенил- 2H-пиран-2-она (полученного в примере ААА), 1,4 ммоль 3- метилбензолтиола и 1,4 ммоль пиперидина в 25 мл дихлорметана. Продукт растирают в порошок с помощью смеси гексана и диэтилового эфира в соотношении 1:1, при этом получают твердое вещество, которое растворяют в 2 н. гидроокиси натрия, промывают диэтиловым эфиром, подкисляют до достижения pH 2 и экстрагируют этилацетатом. Экстракт промывают водой, сушат над сульфатом магния и сгущают с получением твердого вещества с точкой плавления 58 - 60oC.
1H-ЯМР (ДМСО-d6): δ = 2,07 (с, 3H), 3,77 (с, 2H), 6,06 (м, 1H), 6,45 (с, 1H), 6,78 (м, 2H), 7,25 - 7,47 (м, 10H).
Пример 71
(±) 5,6-дигидро-4-окси-6-фенил-6-[2-фенилэтил]- 3-фенилтио-2H-пиран-2-он
Целевое соединение получают по общему методу 6 с применением 1,50 ммоль 3-бром-5,6-дигидро-4-окси-6- фенил-6-(2-фенилэтил)-2H-пиран-2-она (полученного в примере БББ), 1,60 ммоль бензолтиола и 1,60 ммоль пиперидина в 30 мл дихлорметана. Продукт растирают в порошок с применением смеси гексана и диэтилового эфира в соотношении 1:1, при этом получают твердое вещество. Сырой продукт подвергают хроматографии на силикагеле, при этом в качестве элюента последовательно применяют хлороформ и смесь метанола и хлороформа в соотношении 5:95, при этом получают целевое соединение с точкой плавления 58 - 60oC.
1H-ЯМР (ДМСО-d6): δ = 2,22 - 2,39 (м, 3H), 2,62 (м, 1H), 3,46 (кв, 2H), 6,48 (м, 2H), 6,98 (м, 3H), 7,15 (м, 3H), 7,25 (м, 2H), 7,46 (м, 5H).
Пример 72
(±) 5,6-дигидро-4-окси-3-(2-изопропилфенилтио)- 6-фенил-6-(2-фенилэтил)-2H-пиран-2-он
Целевое соединение получают по общему методу 6 с применением 1,50 ммоль 3-бром-5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-2H-пиран- 2-она (полученного в примере БББ), 1,60 ммоль 2-изопропилбензолтиола и 1,60 ммоль пиперидина в 30 мл дихлорметана. Продукт растирают в порошок с помощью смеси гексана и диэтилового эфира в соотношении 1:1 с получением твердого вещества. Сырой продукт подвергают хроматографии на силикагеле, при этом в качестве элюента последовательно применяют хлороформ и смесь метанола и хлороформа в соотношении 5:95. Получают целевое соединение с точкой плавления 66 - 67oC.
1H-ЯМР (ДМСО-d6): δ = 1,16 (т, 6H), 2,21 - 2,35 (м, 3H), 2,60 (м, 1H), 3,21 (м, 1H), 3,42 (кв, 2H), 5,88 (д, 1H), 6,56 (т, 1H), 6,94 (т, 1H), 7,13 (м, 4H), 7,25 (м, 2H), 7,45 (м, 5H).
Пример 73
(±) 5,6-дигидро-4-окси-3-(3-метилфенилтио)-6-фенил-6-(2- фенилэтил)-2H-пиран-2-он
Целевое соединение получают по общему методу 6 с применением 2,0 ммоль 3-бром-5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-2H-пиран-2-она (полученного в примере БББ), 2,2 ммоль 3-метилбензолтиола и 2,2 ммоль пиперидина в 30 мл дихлорметана. Сырой продукт подвергают хроматографии на силикагеле, при этом в качестве элюента последовательно применяют хлороформ и смесь метанола и хлороформа в соотношении 5:95. Получают целевое соединение с точкой плавления 68 - 70oC.
1H-ЯМР (ДМСО-d6): δ = 2,06 (с, 3H), 2,18 - 2,36 (м, 3H), 2,60 (м, 1H), 3,38 (2H + H2O), 6,26 (д, 1H), 6,46 (с, 1H), 6,75 (м, 1H), 6,83 (т, 1H), 7,15 (м, 3H), 7,24 (м, 2H), 7,45 (м, 5H).
Пример 74
(±) 5-[3,6-дигидро-4-окси-5-(2-изопропилфенилтио)-6-оксо- 2-фенил-2H-пиран-2-ил]пентановая кислота
Целевое соединение получают по общему методу 6 с применением 1,1 ммоль 5-[5-бром-3,6-дигидро-4-окси-6-оксо-2-фенил-2H-пиран-2- ил]пентановой кислоты (полученной в примере ГГГ), 1,3 ммоль 2- изопропилбензолтиола и 1,3 ммоль пиперидина в 20 мл дихлорметана. Сырой продукт подвергают хроматографии на силикагеле, при этом в качестве элюента последовательно применяют смесь метанола и хлороформа в соотношении 5:95 и смесь хлороформа, метанола и уксусной кислоты в соотношении 9:1:0,5. Получают целевое соединение с точкой плавления 145 - 146oC.
1H-ЯМР (ДМСО-d6): δ = 1,07 - 1,19 (т+ м, 7H), 1,25 (м, 1H), 1,43 (м, 2H), 1,91 (м, 2H), 2,15 (т, 2H), 3,19 (м, 1H), 3,41 (2H+H2O), 5,81 (д, 1H), 6,54 (т, 1H), 6,93 (т, 1H), 7,12 (д, 1H), 7,29 - 7,44 (м, 5H).
Пример 75
(±) 5,6-дигидро-4-окси-6-(3-метилбутил)-6-фенил- 3-(2-изопропилфенилтио)-2H-пиран-2-он
Целевое соединение получают по общему методу 6 с применением 2,0 ммоль 3-бром-5,6-дигидро-4-окси-6-(3-метилбутил)-6-фенил-2H-пиран-2-она (полученного в примере ВВВ), 2,2 ммоль 2-изопропилбензолтиола и 2,2 ммоль пиперидина в 30 мл дихлорметана. Сырой продукт подвергают хроматографии на силикагеле, при этом в качестве элюента последовательно применяют хлороформ и смесь метанола и хлороформа в соотношении 5:95. Получают целевое соединение с точкой плавления 64 - 66oC.
1H-ЯМР (ДМСО-d6): δ = 0,80 (м, 6H), 0,95 (м, 1H), 1,17 (т, 7H), 1,42 (м, 1H), 1,93 (м, 2H), 3,20 (м, 1H), 3,45 (2H+H2O), 5,84 (д, 1H), 6,55 (т, 1H), 6,93 (т, 1H), 7,12 (д, 1H), 7,40 (м, 5H).
Пример 76
(±) 5,6-дигидро-4-окси-6-(3-метилбутил)-6-фенил- 3-фенилтио-2H-пиран-2-он
Целевое соединение получают по общему методу 6 с применением 1,5 ммоль 3-бром-5,6-дигидро-4-окси-6-(3- метилбутил)-6-фенил-2H-пиран-2-она (полученного в примере ВВВ), 1,6 ммоль бензолтиола и 1,6 ммоль пиперидина в 20 мл дихлорметана. Сырой продукт подвергают хроматографии на силикагеле, при этом в качестве элюента последовательно применяют хлороформ и смесь метанола и хлороформа в соотношении 5:95. Получают целевое соединение с точкой плавления 154 - 155oC.
1H-ЯМР (ДМСО-d6): δ = 0,80 (м, 6H), 0,97 (м, 1H), 1,16 (м, 2H), 1,42 (м, 1H), 1,91 (м, 2H), 3,40 (2H + H2O), 6,45 (м, 2H), 6,93 (м, 3H), 7,37 (м, 5H).
Пример 77
Сложный метиловый эфир 2-[[5,6-дигидро-4-окси-6-(3-метилбутил)- 2-оксо-6-фенил-2H-пиран-3-ил]тио]бензойной кислоты
Целевое соединение получают по общему методу 6 с применением 1,9 ммоль 3-бром-5,6-дигидро-4-окси-6-(3-метилбутил)-6-фенил-2H-пиран-2-она (полученного в примере ВВВ), 2,2 ммоль сложного метилового эфира тиосалициловой кислоты и 2,1 ммоль пиперидина в 30 мл дихлорметана. Сырой продукт подвергают хроматографии на силикагеле, при этом в качестве элюента последовательно применяют хлороформ и смесь метанола и хлороформа в соотношении 5: 95. Получают целевое соединение с точкой плавления 115 - 116oC.
1H-ЯМР (ДМСО-d6): δ = 0,80 (м, 6H), 1,0 (м, 1H), 1,17 (м, 1H), 1,43 (м, 1H), 1,96 (м, 2H), 3,4 (2H+H2O), 3,81 (с, 3H), 6,02 (шир.д, 1H), 6,88 (т, 1H), 7,05 (т, 1H), 7,42 (м, 5H), 7,80 (дд, 1H).
Пример 78
(±) 2-[[5,6-дигидро-4-окси-6-(3-метилбутил)-2-оксо-6-фенил- 2H-пиран-3-ил]-тио]бензойная кислота
Раствор 0,3 ммоль полученного в примере 77 соединения в 15 мл 1 н. гидроокиси натрия перемешивают при комнатной температуре в течение 3 часов. Раствор промывают диэтиловым эфиром и подкисляют 6 н.соляной кислотой до достижения pH 2,0. Раствор экстрагируют этилацетатом, экстракт промывают рассолом, сушат над сульфатом магния и сгущают с получением целевого соединения с точкой плавления 99- 101oC.
1H-ЯМР (ДМСО-d6): δ = 0,80 (м, 6H), 0,95 (м, 1H), 1,15 (м, 1H), 1,43 (м, 1H), 1,91 (м, 2H), 3,4 (2H+H2O), 6,05 (д, 1H), 6,85 (шир.т, 1 H), 7,03 (т, 1H), 7,42 (м, 5H), 7,79 (дд, 1H).
Пример 79
(±) 5,6-дигидро-3-(2-втор.бутилфенилтио)-4-окси- 6,6-дифенил-2H-пиран-2-он
Целевое соединение получают по общему методу 6 с применением 1,6 ммоль 3-бром-5,6-дигидро-4-окси-6,6-дифенил-2H-пиран-2-она (полученного в примере ААА), 1,7 ммоль 2-втор.бутилбензолтиола и 1,7 ммоль пиперидина в 25 мл дихлорметана. Сырой продукт подвергают хроматографии на силикагеле, при этом в качестве элюента последовательно применяют хлороформ и смесь метанола и хлороформа в соотношении 5:95. Получают целевое соединение с точкой плавления 161 - 162oC.
1H-ЯМР (ДМСО-d6): δ 1= 0,81 (т, 3H), 1,15 (д, 3H), 1,43 - 1,64 (м, 2H), 2,98 (м, 2H), 3,77 (с, 2H), 5,65 (дд, 1H), 6,47 (т, 1H), 6,92 (т, 1H), 7,07 (д, 1H), 7,34 -7,48 (м, 10H), 12,4 (шир.с, 1H).
Пример 80
5,6-дигидро-4-окси-3-(2-метоксифенилтио)-6,6-дифенил-2H-пиран-2-он
Целевое соединение получают по общему методу 6 с применением 1,5 ммоль 3-бром-5,6-дигидро-4-окси-6,6-дифенил- 2H-пиран-2-она (полученного в примере ААА), 1,6 ммоль 2- метоксибензолтиола и 1,6 ммоль пиперидина в 25 мл дихлорметана. Продукт подвергают хроматографии на силикагеле, при этом в качестве элюента последовательно применяют хлороформ и смесь метанола и хлороформа в соотношении 5:95. Получают целевое соединение с точкой плавления 170 - 172oC (разлож.).
1H-ЯМР (ДМСО-d6): δ = 3,76 (шир.с, 5H), 5,44 (дд, 1H), 6,26 (т, 1H), 6,85 (м, 1H), 6,91 (т, 1H), 7,34 - 7,50 (м, 10H).
Пример 81
(±) 5,6-дигидро-3-(2-втор. бутилфенилтио)-4-окси- 6-фенил-6-(2-фенилэтил)-2H-пиран-2-он
Целевое соединение получают по общему методу 6 с применением 2,0 ммоль 3-бром-5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-2H-пиран-2-она (полученного в примере БББ), 2,1 ммоль 2-втор.бутилбензолтиола и 2,1 ммоль пиперидина в 25 мл дихлорметана. Продукт подвергают хроматографии на силикагеле, при этом в качестве элюента последовательно применяют хлороформ и смесь метанола и хлороформа в соотношении 5:95. Получают целевое соединение с точкой плавления 67 - 68oC.
1H-ЯМР (ДМСО-d6): δ = 0,82 (кв, 3H), 1,09 (т, 3H), 1,46 - 1,61 (м, 2H), 2,26 (м, 2H), 2,35 (м, 1H), 2,62 (м, 1H), 2,98 (м, 1H), 3,47 (кв, 2H), 5,90 (т, 1H), 6,56 (т, 1H), 6,94 (т, 1H), 7,07 - 7,18 (м, 4H), 7,25 (м, 2H), 7,45 (м, 5H).
Пример 82
5,6-дигидро-4-окси-3-(4-метил-2-изопропилфенилтио)- 6,6-дифенил-2H-пиран-2-он
Целевое соединение получают по общему методу 6 с применением 2,0 ммоль 3-бром-5,6-дигидро-4-окси-6,6- дифенил-2H-пиран-2-она (полученного в примере ААА), 2,1 ммоль 4-метил-2-изопропилбензолтиола и 2,1 ммоль пиперидина в 30 мл дихлорметана. Продукт подвергают хроматографии на силикагеле, при этом в качестве элюента последовательно применяют хлороформ и смесь метанола и хлороформа в соотношении 5:95. Точка плавления 185-186oC.
1H-ЯМР (ДМСО-d6): δ = 1,17 (д, J = 10 Гц, 6H), 2,15 (с, 3H), 3,17 (м, 1H), 3,76 (шир.с, 2H), 5,56 (д, 1H), 6,29 (д, 1H), 6,94 (с, 1H), 7,32 - 7,47 (м, 10H).
Пример 83
5,6-дигидро-4-окси-3-(3-метоксифенилтио)-6,6-дифенил-2H- пиран-2-он
Целевое соединение получают по общему методу 6 с применением 1,8 ммоль 3-бром-5,6-дигидро-4-окси-6,6-дифенил-2H-пиран-2-она (полученного в примере ААА), 2,0 ммоль 3-метоксибензолтиола и 2,0 ммоль пиперидина в 25 мл дихлорметана. Продукт подвергают хроматографии на силикагеле, при этом в качестве элюента последовательно применяют хлороформ и смесь метанола и хлороформа в соотношении 5:95. Точка плавления 61 - 62oC.
1H-ЯМР (ДМСО-d6): δ = 3,63 (с, 3H), 3,76 (с, 2H), 5,64 (шир.д, 1H), 6,42 (с, 1H), 6,54 (д, 1H), 6,74 (т, 1H), 7,32 - 7,47 (м, 10H).
Пример 84
5,6-дигидро-4-окси-3-(5-метил-2-изопропилфенилтио)- 6,6-дифенил-2H-пиран-2-он
Целевое соединение получают по общему методу 6 с применением 2,0 ммоль 3-бром-5,6-дигидро-4-окси-6,6-дифенил-2H-пиран-2-она (полученного в примере ААА), 2,1 ммоль 5-метил-2-изопропилбензолтиола и 2,1 ммоль пиперидина в 30 мл дихлорметана. Продукт подвергают хроматографии на силикагеле, при этом в качестве элюента последовательно применяют хлороформ и смесь метанола и хлороформа в соотношении 5:95. Точка плавления 183 - 184oC.
1H-ЯМР (ДМСО-d6): δ = 1,15 (д, 6H), 1,85 (с, 3H), 3,22 (м, 1H), 3,80 (шир. с, 2H), 5,88 (шир.с, 1H), 6,77 (д, 1H), 7,03 (д, 1H), 7,32 - 7,47 (м, 10H).
Пример 85
(±) 5,6-дигидро-4-окси-3-(5-метил-2-изопропилфенилтио)-6- фенил-6-(2-фенил-этил)-2H-пиран-2-он
Целевое соединение получают по общему методу 6 с применением 2,0 ммоль 3-бром-5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-2H-пиран-2-она (полученного в примере БББ), 2,1 ммоль 5-метил-2- изопропилбензолтиола и 2,1 ммоль пиперидина в 30 мл дихлорметана. Продукт подвергают хроматографии на силикагеле, при этом в качестве элюента последовательно применяют хлороформ и смесь метанола и хлороформа в соотношении 5:95. Точка плавления 66 - 67oC.
1H-ЯМР (ДМСО-d6): δ = 1,16 (м, 6H), 1,87 (с, 3H), 2,26 (м, 3H), 2,57 (м, 1H), 3,23 (м, 1H), 3,43 (кв, 2H), 6,01 (шир.с, 1H), 6,78 (д, 1H), 7,03 - 7,27 (м, 6H), 7,37 - 7,47 (м, 5H).
Пример 86
5,6-дигидро-3-(4-хлор-2-изопропилфенилтио)-4-окси- 6,6-дифенил-2H-пиран-2-он
Целевое соединение получают по общему методу 6 с применением 2,0 ммоль 3-бром-5,6-дигидро-4-окси-6,6- дифенил-2H-пиран-2-она (полученного в примере ААА), 2,1 ммоль 4- хлор-2-изопропилбензолтиола и 2,1 ммоль пиперидина в 30 мл дихлорметана. Продукт подвергают хроматографии на силикагеле, при этом в качестве элюента последовательно применяют хлороформ и смесь метанола и хлороформа в соотношении 5:95. Точка плавления 95 - 96oC.
1H-ЯМР (ДМСО-d6): δ = 1,16 (д, 6H), 3,23 (м, 1H), 3,73 (шир.с, 2H), 5,60 (д, 1H), 6,45 (д, 1H), 7,14 (д, 1H), 7,32 - 7,48 (м, 10H).
Пример 87
(±) 5,6-дигидро-4-окси-3-(4-метил-2-изопропилфенилтио)-6- фенил-6-(2-фенилэтил)-2H-пиран-2-он
Целевое соединение получают по общему методу 6 с применением 2,0 ммоль 3-бром-5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-2H-пиран-2-она (полученного в примере БББ), 2,1 ммоль 4-метил-2- изопропилбензолтиола и 2,1 ммоль пиперидина в 30 мл дихлорметана. Продукт подвергают хроматографии на силикагеле, при этом в качестве элюента последовательно применяют хлороформ и смесь метанола и хлороформа в соотношении 5:95. Точка плавления 75 - 76oC.
1H-ЯМР (ДМСО-d6): δ = 1,15 (м, 6H), 2,16 (с, 3H), 2,19 - 2,36 (м, 3H), 2,62 (м, 1H), 3,21 (м, 1H), 3,44 (кв, 2H), 5,82 (д, 1H), 6,40 (дд, 1H), 6,95 (д, 1H), 7,10 -7,18 (м, 3H), 7,25 (м, 2H), 7,44 (м, 5H).
Пример 88
(±) Сложный метиловый эфир 2-[[5,6-дигидро-4-окси-2-оксо- 6-(2-фенилэтил)-6-фенил-2H-пиран-3-ил]тио]бензойной кислоты
Целевое соединение получают по общему методу 6 с применением 1,9 ммоль 3-бром-5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-2H- пиран-2-она (полученного в примере БББ), 2,2 ммоль сложного метилового эфира тиосалициловой кислоты и 2,1 ммоль пиперидина в 30 мл дихлорметана. Сырой продукт подвергают хроматографии на силикагеле, при этом в качестве элюента последовательно применяют хлороформ и смесь метанола и хлороформа в соотношении 5: 95. Получают целевое соединение с точкой плавления 91 - 92oC.
1H-ЯМР (ДМСО-d6): δ = 2,25 (м, 2H), 2,38 (м, 1H), 2,62 (м, 1H), 3,44 (кв, 2H), 3,82 (с, 3H), 6,06 (шир.д, 1H), 6,90 (т, 1H), 7,05 - 7,52 (м, 11H), 7,81 (дд, 1H).
Общий метод 7
Целевое соединение получают путем подачи 5,6-дигидропиро-2H- пиран-2-она, абсолютного этанола, п-толуолтиосульфоната (полученного по общему методу 2), бикарбоната натрия и триэтиламина в реакционный сосуд с последующим нагреванием смеси до температуры 40oC в течение 4 - 48 часов. Смесь разбавляют водой, подкисляют концентрированной соляной кислотой и продукт экстрагируют диэтиловым эфиром, дихлорметаном или этилацетатом. Органические слои объединяют и сушат над сульфатом натрия.
Пример 89
(±) 5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-3-[(2- трифторметилфенил)-метилтио]-2H-пиран-2-он
Целевое соединение получают по общему методу 1 с применением 0,250 г (0,850 ммоль) 5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-2H-пиран-2-она, 0,350 г (1,02 ммоль) (2-трифторметил)бензил-п-толуолтиосульфоната, 0,280 мл (2,00 ммоль) триэтиламина, 0,68 ммоль бикарбоната натрия и 3,0 мл абсолютного этанола. Смесь в течение 16 часов нагревают до температуры 40oC, после чего разбавляют 100 мл диэтилового эфира и промывают водой. Растворитель удаляют в вакууме и остаток подвергают колоночной хроматографии на силикагеле, при этом в качестве элюента последовательно применяют дихлорметан и смесь метанола и дихлорметана в соотношении до 2:98. Получают 0,316 г твердого вещества с точкой плавления 59 - 62oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 7,603 - 7,581 (м, 1H), 7,432 - 7,026 (м, 13H), 3,780 (д, 1H, J = 14 Гц), 3,69 (д, 1H, J = 14 Гц), 3,310 (д, 1H, J = 17,5 Гц), 3,220 (д, 1H, J = 17,5 Гц), 2,567 - 2,505 (м, 1H), 2,253 - 2,157 (м, 3H).
Пример 90
(±) 5,6-дигидро-4-окси-3-[(2,5-диметилфенил)метилтио] - 6-фенил-6-(2-фенилэтил)-2H-пиран-2-он
Целевое соединение получают по общему методу 7 с применением 0,250 г (0,850 ммоль) 5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-2H- пиран-2-она, 0,312 г (1,02 ммоль) 2,5-диметилбензил-п- толуолтиосульфоната, 0,230 мл (1,60 ммоль) триэтиламина, 0,071 г (0,85 ммоль) бикарбоната натрия и 3,0 мл абсолютного этанола. Смесь в течение 16 часов нагревают до температуры 40oC, после чего разбавляют 100 мл диэтилового эфира и промывают водой. Растворитель удаляют в вакууме и остаток подвергают колоночной хроматографии на силикагеле, при этом в качестве элюента последовательно применяют дихлорметан и смесь метанола и дихлорметана в соотношении до 2:98. Получают 0,116 г твердого вещества с точкой плавления 54 - 56oC. Целевой продукт сушат в вакууме.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 11,498 (шир.с, 1H), 7,405 - 7,380 (м, 4H), 7,327 - 7,285 (м, 1H), 7,258 - 7,221 (м, 2H), 7,168 - 7,128 (м, 1H), 7,090 (д, 2H, J = 7,5 Гц), 6,970 (д, 1H, J = 8 Гц), 6,890 (д, 1H, J = 8 Гц), 6,821 (с, 1H), 3,600 (д, 1H, J = 11 Гц), 3,505 (д, 1H, J = 11 Гц), 3,250 (д, 1H, J = 17 Гц), 3,176 (д, 1H, J = 17 Гц), 2,619 - 2,564 (м, 1H), 2,235 - 2,168 (м, 9H).
Пример 91
(±) 5,6-дигидро-4-окси-3-(нафтален-1-илметилтио)-6-фенил- 6-(2-фенилэтил)-2H-пиран-2-он
Целевое соединение получают по общему методу 7 с применением 0,20 г (0,68 ммоль) 5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-2H- пиран-2-она, 0,27 г (0,82 ммоль) (1-нафтален-1-илметил)-п- толуолтиосульфоната, 0,18 мл (1,3 ммоль) триэтиламина, 0,68 ммоль бикарбоната натрия и 3,0 мл абсолютного этанола. Смесь в течение 16 часов нагревают до температуры 40oC, после чего разбавляют 100 мл диэтилового эфира и промывают водой. Растворитель удаляют в вакууме и остаток подвергают колоночной хроматографии на силикагеле с применением дихлорметана в качестве элюента. При этом получают 0,158 г твердого вещества с точкой плавления 132 - 134oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 11,533 (шир.с, 1H), 8,177 (д, 1H, J = 8 Гц), 7,886 (дд, 1H, J = 2 Гц, J = 7 Гц), 7,761 (д, 1H, J = 8 Гц), 7,501 - 7,05 (м, 14H), 4,120 (д, 1H, J = 12 Гц), 3,995 (д, 1H, J = 12 Гц), 3,274 (д, 1H, J = 18 Гц), 3,194 (д, 1H, J = 18 Гц), 2,636 - 2,581 (м, 1H), 2,288 - 2,169 (м, 3H).
Пример 92
(±) 3-(бифенил-2-илметилтио)-5,6-дигидро-4-окси- 6-фенил-6-(2-фенилэтил)-2H-пиран-2-он
Целевое соединение получают по общему методу 7 с применением 0,250 г (0,85 ммоль) 5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-2H- пиран-2-она, 0,360 г (1,02 ммоль) (бифен-2-илметил)-п- толуолтиосульфоната, 0,14 мл (1,0 ммоль) триэтиламина, 0,85 ммоль бикарбоната натрия и 5,0 мл абсолютного этанола. Смесь в течение 16 часов нагревают до температуры 40oC, после чего разбавляют 100 мл диэтилового эфира и промывают водой. Растворитель удаляют в вакууме и остаток подвергают колоночной хроматографии на силикагеле, при этом в качестве элюента последовательно применяют дихлорметан и смесь метанола и дихлорметана в соотношении до 1:99. Получают 0,317 г твердого вещества с точкой плавления 58 - 60oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 11,569 (шир.с, 1H), 7,429 - 7,066 (м, 19H), 3,528 (д, 1H, J = 12 Гц), 3,477 (д, 1H, J = 12 Гц), 3,280 (дд, 1H, J = 17 Гц), 3,183 (д, 1H, J = 17 Гц), 2,607 - 2,502 (м, 1H), 2,246 - 2,144 (м, 3H).
Пример 93
(±) 3-(2-хлорфенилметилтио)-5,6-дигидро-4-окси- 6-фенил-6-(2-фенилэтил)-2H-пиран-2-он
Целевое соединение получают по общему методу 7 с применением 0,250 г (0,85 ммоль) 5,6-дигидро- 4-окси-6-фенил-6-(2-фенилэтил)-2H-пиран-2-она, 0,320 г (1,02 ммоль) (2-хлорбензил)-п-толуолтиосульфоната, 0,14 мл (1,0 ммоль) триэтиламина, 5,0 мл абсолютного этанола. Смесь в течение 16 часов нагревают до температуры 40oC, после чего разбавляют 100 мл диэтилового эфира и промывают водой. Растворитель удаляют в вакууме и остаток подвергают колоночной хроматографии на силикагеле, при этом в качестве элюента последовательно применяют дихлорметан и смесь метанола и дихлорметана в соотношении до 2: 98. Получают 0,317 г твердого вещества с точкой плавления 53 - 55oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 11,551 (шир.с, 1H), 7,435 - 7,005 (м, 13H), 6,800 (дд, 1H, J = 1,5 Гц, J = 7,5 Гц), 3,750 (д, 1H, J = 13 Гц), 3,620 (д, 1H, J = 13 Гц), 3,251 (д, 1H, J = 17 Гц), 3,171 (д, 1H, J = 17 Гц), 2,595 - 2,542 (м, 1H), 2,233 - 2,125 (м, 3H).
Пример 94
(±) 3-(2-хлорфенилметилтио)-5,6-дигидро-4-окси- 6-(3-метилбутил)-6-фенил-2H-пиран-2-он
Целевое соединение получают по общему методу 7 с применением 0,250 г (0,85 ммоль) 5,6-дигидро-4-окси-6-фенил-6-(3-метилбутил)- 2H-пиран-2-она, 0,390 г (1,24 ммоль) (2-хлорбензил)-п-толуолтиосульфоната, 0,17 мл (1,24 ммоль) триэтиламина, 5,0 мл абсолютного этанола и 0,5 г бикарбоната натрия. Смесь в течение 16 часов нагревают до температуры 40oC, после чего разбавляют 100 мл диэтилового эфира и промывают водой. Растворитель удаляют в вакууме и остаток подвергают колоночной хроматографии на силикагеле, при этом в качестве элюента последовательно применяют дихлорметан и смесь метанола и дихлорметана в соотношении до 2:98. Получают 0,36 г вязкого масла, которое сушат в вакууме.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 7,388 - 7,267 (м, 6H), 7,181 (тд, 1H, J = 1,5 Гц, J = 7,5 Гц), 7,052 (т, 1H, J = 7,5 Гц), 6,800 (дд, 1 H, J = 1,5 Гц, J = 7,5 Гц), 3,718 (д, 1H, J = 13 Гц), 3,596 (д, 1 H, J = 13 Гц), 3,112 (с, 2H), 1,921 - 1,797 (м, 2H), 1,402 - 1,320 (м, 1H), 1,156 - 1,065 (м, 1H), 0,844 - 0,739 (м, 7H).
Пример 95
(±) 3-(бифен-2-илметилтио)-5,6-дигидро-4-окси- 6-(3-метилбутил)-6-фенил-2H-пиран-2-он
Целевое соединение получают по общему методу 7 с применением 0,250 г (0,96 ммоль) 5,6-дигидро-4-окси-6-фенил-6-(3-метилбутил)-2H-пиран-2-она, 0,439 г (1,24 ммоль) (2-метилбифенил)-п-толуолтиосульфоната, 0,17 мл (1,24 ммоль) триэтиламина, 3,0 мл абсолютного этанола и 0,5 г бикарбоната натрия. Смесь в течение 16 часов нагревают до температуры 40oC, после чего разбавляют 100 мл диэтилового эфира и промывают водой. Растворитель удаляют в вакууме и остаток подвергают колоночной хроматографии на силикагеле, при этом в качестве элюента последовательно применяют дихлорметан и смесь метанола и дихлорметана в соотношении до 2: 98. Получают 0,33 г твердого вещества с точкой плавления 49-51oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 7,425 - 7,153 (м, 13H), 7,74 (дд, 1H, J = 1 Гц, J = 7 Гц), 3,480 (дд, 2H, J = 12 Гц, J = 17 Гц), 3,149 (дд, 2H, J = 17 Гц, J = 22 Гц), 1,921 - 1,821 (м, 2H), 1,402 - 1,336 (м, 1H), 1,161 - 1,071 (м, 1H), 0,847 - 0,707 (м, 7H).
Пример 96
(±) 5,6-дигидро-3-(2,5-диметилфенилметилтио)-4- окси-6-(3-метилбутил)-6-фенил-2H-пиран-2-он
Целевое соединение получают по общему методу 7 с применением 0,250 г (0,96 ммоль) 5,6-дигидро-4-окси-6-(3-метилбутил)-6-фенил-2H- пиран-2-она, 0,380 г (1,24 ммоль) (2,5-диметилбензил)-п-толуолтиосульфоната, 0,17 мл (1,24 ммоль) триэтиламина, 3,0 мл абсолютного этанола и 0,5 г бикарбоната натрия. Смесь в течение 16 часов нагревают до температуры 40oC, после чего разбавляют 100 мл диэтилового эфира и промывают водой. Растворитель удаляют в вакууме и остаток подвергают колоночной хроматографии на силикагеле, при этом в качестве элюента последовательно применяют дихлорметан и смесь метанола и дихлорметана в соотношении до 2:98. Получают 0,286 г вязкого масла.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 11,433 (шир.с, 1H), 7,380 - 7,251 (м, 5H), 6,973 (д, 1H, J = 7,5 Гц), 6,905 (д, 1H, J = 7,5 Гц), 6,187 (с, 1H), 3,584 (д, 1H, J = 11,5 Гц), 3,481 (д, 1H, J = 11,5 Гц), 3,133 (с, 2H), 2,209 (с, 3H), 2,184 (с, 3H), 1,933 - 1,858 (м, 2H), 1,421 - 1,355 (м, 1H), 1,177 - 1,086 (м, 1H), 0,870 - 0,751 (м, 7H).
Пример 97
(±) 5,6-дигидро-4-окси-3-(3-метоксифенилметилтио)-6-фенил- 6-(2-фенилэтил)-2H-пиран-2-он
Целевое соединение получают по общему методу 7 с применением 0,250 г (0,85 ммоль) 5,6-дигидро-4-окси-6-фенил-(2-фенилэтил)-2H- пиран-2-она, 0,340 г (1,11 ммоль) (3-метоксибензил)-п- толуолтиосульфоната, 0,25 мл (1,81 ммоль) триэтиламина, 3,0 мл абсолютного этанола и 0,5 г бикарбоната натрия. Смесь в течение 16 часов нагревают до температуры 40oC, после чего разбавляют 100 мл диэтилового эфира и промывают водой. Растворитель удаляют в вакууме и остаток подвергают колоночной хроматографии на силикагеле, при этом в качестве элюента последовательно применяют дихлорметан и смесь метанола и дихлорметана в соотношении до 2:98. Получают 0,286 г вязкого масла.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 7,411 - 7,376 (м, 4H), 7,361 - 7,280 (м, 1H), 7,235 (т, 2H, J = 7 Гц), 7,146 (т, 1H, J = 7 Гц), 7,078 - 7,019 (м, 3H), 6,769 (д, 1H, J = 2 Гц), 6,762 - 6,698 (м, 1H), 6,555 (д, 1H, J = 7 Гц), 3,694 (с, 3H), 3,670 (д, 1H, J = 13 Гц), 3,585 (д, 1H, J = 13 Гц), 3,220 (д, 1H, J = 17 Гц), 3,158 (д, 1H, J = 17 Гц), 2,590 - 2,525 (м, 1H), 2,219 - 2,141 (м, 3H).
Пример 98
3-(бифенил-2-илметилтио)-5,6-дигидро-4-окси-6,6-дифенил-2H- пиран-2-он
Целевое соединение получают по общему методу 7 с применением 0,250 г (0,94 ммоль) 5,6-дигидро-4-окси-6,6- дифенил-2H-пиран-2-она, 0,389 г (1,1 ммоль) (2-метилбифенил)-п- толуолтиосульфоната, 0,26 мл (1,9 ммоль) триэтиламина, 5,0 мл абсолютного этанола и 0,5 г бикарбоната натрия. Смесь в течение 16 часов нагревают до температуры 40oC, после чего разбавляют 100 мл диэтилового эфира и промывают водой. Растворитель удаляют в вакууме и остаток подвергают колоночной хроматографии на силикагеле, при этом в качестве элюента последовательно применяют дихлорметан и смесь метанола и дихлорметана в соотношении до 2:98. Получают 0,286 г вязкого масла.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 11,770 (шир.с, 1H), 7,434 - 7,148 (м, 18H), 6,969 (д, 1H, J = 7 Гц), 3,595 (с, 2H), 3,407 (с, 2H).
Пример 99
(±) 3-(3-хлорфенилметилтио)-5,6-дигидро-4-окси- 6-фенил-6-(2-фенилэтил)-2H-пиран-2-он
Целевое соединение получают по общему методу 7 с применением 0,250 г (0,85 ммоль) 5,6-дигидро-4-окси-6-фенил-(2-фенилэтил)-2H- пиран-2-она, 0,340 г (1,11 ммоль) [(3-хлорфен-1-ил)метил]-п- толуолтиосульфоната, 0,25 мл (1,81 ммоль) триэтиламина, 3,0 мл абсолютного этанола и 0,5 г бикарбоната натрия. Смесь в течение 16 часов нагревают до температуры 40oC, после чего разбавляют 100 мл диэтилового эфира и промывают водой. Растворитель удаляют в вакууме и остаток подвергают колоночной хроматографии на силикагеле, при этом в качестве элюента последовательно применяют дихлорметан и смесь метанола и дихлорметана в соотношении до 2:98. Получают 0,155 г вязкого масла.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 7,420 - 7,060 (м, 13H), 6,848 (д, 1H, J = 7 Гц), 3,688 (д, 1H, J = 13 Гц), 3,597 (д, 1H, J = 13 Гц), 3,219 (д, 1H, J = 17 Гц), 3,153 (д, 1H, J = 17 Гц), 2,592 - 2,526 (м, 1H), 2,241 - 2,120 (м, 3H).
Пример 100
(±) 5,6-дигидро-4-окси-6-(2-фенилэтил)-6-фенил-3-[((3- трифторметил)фенил)-метилтио]-2H-пиран-2-он
Целевое соединение получают по общему методу 7 с применением 0,250 г (0,85 ммоль) 5,6-дигидро-4-окси-6-фенил-(2-фенилэтил)-2H- пиран-2-она, 0,380 г (1,11 ммоль) [(3-трифторметилфен-1-ил)метил]-п- толуолтиосульфоната, 0,25 мл (1,81 ммоль) триэтиламина, 3,0 мл абсолютного этанола и 0,5 г бикарбоната натрия. Смесь в течение 16 часов нагревают до температуры 40oC, после чего разбавляют 100 мл диэтилового эфира и промывают водой. Растворитель удаляют в вакууме и остаток подвергают колоночной хроматографии на силикагеле, при этом в качестве элюента последовательно применяют дихлорметан и смесь метанола и дихлорметана в соотношении до 2:98. Получают 0,273 г вязкого масла.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 11,60 (шир.с, 1H), 7,523 - 7,481 (м, 2H), 7,392 - 7,124 (м, 9H), 7,064 (д, 2H, J = 8 Гц), 3,794 (д, 1 H, J = 13 Гц), 3,703 (д, 1H, J = 13 Гц), 3,162 (с, 2H), 2,583 - 2,525 (м, 1H), 2,233 - 2,124 (м, 3H).
Пример 101
(±) 5,6-дигидро-4-окси-3-(3-метилфенилметилтио)-6-фенил-6- (2-фенилэтил)-2H-пиран-2-он
Целевое соединение получают по общему методу 7 с применением 0,250 г (0,85 ммоль) 5,6-дигидро-4-окси-6-фенил-(2-фенилэтил)-2H-пиран-2-она, 0,298 г (1,02 ммоль) [(3-метилфен-1-ил)метил] -п- толуолтиосульфоната, 0,25 мл (1,81 ммоль) триэтиламина, 5,0 мл абсолютного этанола и 0,5 г бикарбоната натрия. Смесь в течение 16 часов нагревают до температуры 40oC, после чего разбавляют 100 мл диэтилового эфира и промывают водой. Растворитель удаляют в вакууме и остаток подвергают колоночной хроматографии на силикагеле, при этом в качестве элюента последовательно применяют дихлорметан и смесь метанола и дихлорметана в соотношении до 2:98. Получают 0,242 г вязкого масла.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 11,427 (шир.с, 1H), 7,423 - 7,374 (м, 4H), 7,330 - 7,288 (м, 1H), 7,238 (т, 2H, J = 7 Гц), 7,145 (т, 1H, J = 8 Гц), 7,086 - 7,007 (м, 2H), 6,952 (д, 2H, J = 6 Гц), 6,790 (д, 1H, J = 7 Гц), 3,630 (д, 1H, J = 12,5 Гц), 3,544 (д, 1H, J = 12,5 Гц), 3,227 (д, 1H, J = 17,5 Гц), 3,153 (д, 1H, J = 17,5 Гц), 2,567 (шир.т, 1H, J = 12 Гц), 2,244 - 2,132 (м, 3H).
Пример 102
(±) 3-[4-окси-2-оксо-6-(2-фенилэтил)-6-фенил- 5,6-дигидро-2H-пиран-3-илтиометил]бензонитрил
Целевое соединение получают по общему методу 7 с применением 0,250 г (0,85 ммоль) 5,6-дигидро-4-окси-6-фенил-(2-фенилэтил)-2H-пиран-2-она, 0,309 г (1,02 ммоль) [(3-цианофен-1-ил)метил]-п-толуолтиосульфоната, 0,25 мл (1,81 ммоль) триэтиламина, 5,0 мл абсолютного этанола и 0,5 г бикарбоната натрия. Смесь в течение 16 часов нагревают до температуры 40oC, после чего разбавляют 100 мл диэтилового эфира и промывают водой. Растворитель удаляют в вакууме и остаток подвергают колоночной хроматографии на силикагеле, при этом в качестве элюента последовательно применяют дихлорметан и смесь метанола и дихлорметана в соотношении до 2:98. Получают 0,242 г твердого вещества с точкой плавления 58 - 60oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 11,572 (шир.с, 1H), 7,585 (д, 1H, J = 7 Гц), 7,499 (с, 1H), 7,426 - 7,078 (м, 10H), 7,066 (д, 2H, J = 7 Гц), 3,736 (д, 1H, J = 13,5 Гц), 3,637 (д, 1H, J = 13,5 Гц), 3,185 (AB, 2H, JAB = 17,5 Гц), 2,570 - 2,511 (м, 1H), 2,207 - 1,074 (м, 3H).
Пример 103
3-(2-хлорфенилметилтио)-5,6-дигидро-4-окси-6,6-дифенил- 2H-пиран-2-он
Целевое соединение получают по общему методу 7 с применением 0,250 г (0,94 ммоль) 5,6-дигидро-4-окси-6,6-дифенил- 2H-пиран-2-она, 0,304 г (1,10 ммоль) [(2-хлорфен-1-ил)метил] -п- толуолтиосульфоната, 0,26 мл (1,9 ммоль) триэтиламина, 5,0 мл абсолютного этанола и 0,5 г бикарбоната натрия. Смесь в течение 16 часов нагревают до температуры 40oC, после чего разбавляют 100 мл диэтилового эфира и промывают водой. Растворитель удаляют в вакууме и остаток подвергают колоночной хроматографии на силикагеле, при этом в качестве элюента последовательно применяют дихлорметан и смесь метанола и дихлорметана в соотношении до 2:98. Получают 0,123 г твердого вещества с точкой плавления 153 - 155oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 7,415 - 7,271 (м, 11H), 7,187 (тд, 1H, J = 1,3 Гц, J = 7 Гц), 7,047 (тд, 1H, J = 1,3 Гц, J = 7 Гц), 6,658 (дд, 1H, J = 1,5 Гц, J = 7 Гц), 3,610 (с, 2H), 3,582 (с, 2 H).
Пример 104
(±) 5,6-дигидро-4-окси-6-(3-метилбутил)-6-фенил-3- [(трифторметилфенил)-метилтио]-2H-пиран-2-он
Целевое соединение получают по общему методу 7 с применением 0,250 г (0,94 ммоль) 5,6-дигидро-4-окси-6-фенил-6-(3-метилбутил)- 2H-пиран-2-она, 0,43 г (1,24 ммоль) (3-трифторметилбензил)-п- толуолтиосульфоната, 0,17 мл (1,24 ммоль) триэтиламина, 5,0 мл абсолютного этанола и 0,5 г бикарбоната натрия. Смесь в течение 16 часов нагревают до температуры 40oC, после чего разбавляют 100 мл диэтилового эфира и промывают водой. Растворитель удаляют в вакууме и остаток подвергают колоночной хроматографии на силикагеле, при этом в качестве элюента последовательно применяют дихлорметан и смесь метанола и дихлорметана в соотношении до 1,5:98,5. Получают 0,364 г вязкого масла.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 7,523 - 7,503 (м, 2H), 7,318 - 7,232 (м, 6H), 7,188 (д, 1H, J = 7,5 Гц), 3,781 (д, 1H, J = 13 Гц), 3,689 (д, 1H, J = 13 Гц), 3,076 (AB, 2H, JAB = 14 Гц), 1,869 - 1,783 (м, 2H), 1,380 - 1,314 (м, 1H), 1,141 -1,040 (м, 1H), 0,828 - 0,727 (м, 7H).
Пример 105
(±) 5,6-дигидро-4-окси-3-(метоксифенилметилтио)-6-(3- метилбутил)-6-фенил-2H-пиран-2-он
Целевое соединение получают по общему методу 7 с применением 0,250 г (0,94 ммоль) 5,6-дигидро-4-окси-6-фенил-6-(3-метилбутил)-2H- пиран-2-она, 0,385 г (1,24 ммоль) (3-метоксибензил)-п- толуолтиосульфоната, 0,17 мл (1,24 ммоль) триэтиламина, 3,0 мл абсолютного этанола и 0,5 г бикарбоната натрия. Смесь в течение 16 часов нагревают до температуры 40oC, после чего разбавляют 100 мл диэтилового эфира и промывают водой. Растворитель удаляют в вакууме и остаток подвергают колоночной хроматографии на силикагеле, при этом в качестве элюента последовательно применяют дихлорметан и смесь метанола и дихлорметана в соотношении до 1,5:98,5. Получают 0,364 г вязкого масла.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 7,365 - 7,243 (м, 5H), 7,071 (т, 1H, J = 8 Гц), 7,754 - 6,715 (м, 2H), 6,562 (д, 1H, J = 7,5 Гц), 3,699 (с, 3H), 3,651 (д, 1H, J = 12 Гц), 3,567 (д, 1H, J = 12 Гц), 3,098 (с, 2H), 1,869 - 1,819 (м, 2H), 1,387 - 1,321 (м, 1H), 1,125 - 1,066 (м, 1H), 0,809 - 0,702 (м, 7H).
Пример 106
(±) 5,6-дигидро-4-окси-3-(3-метилфенилметилтио)-6-(3- метилбутил)-6-фенил-2H-пиран-2-он
Целевое соединение получают по общему методу 7 с применением 0,250 г (0,94 ммоль) 5,6-дигидро-4-окси-6-фенил-6-(3-метилбутил)-2H-пиран-2-она, 0,36 г (1,24 ммоль) [(3-метилфен-1-ил)метил]-п-толуолтиосульфоната, 0,17 мл (1,24 ммоль) триэтиламина, 3,0 мл абсолютного этанола и 0,5 г бикарбоната натрия. Смесь в течение 16 часов нагревают до температуры 40oC, после чего разбавляют 100 мл диэтилового эфира и промывают водой. Растворитель удаляют в вакууме и остаток подвергают колоночной хроматографии на силикагеле, при этом в качестве элюента последовательно применяют дихлорметан и смесь метанола и дихлорметана в соотношении до 1,5:98,5. Получают 0,290 г вязкого масла.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 7,384 - 7,262 (м, 5H), 7,054 (т, 1H, J = 7,5 Гц), 6,979 (д, 1H, J = 7,5 Гц), 6,937 (с, 1H), 6,782 (д, 1H, J = 7,5 Гц), 3,609 (д, 1H, J = 12,5 Гц), 3,542 (д, 1H, J = 12,5 Гц), 3,108 (с, 2H), 2,226 (с, 3H), 1,902 - 1,803 (м, 2H), 1,398 - 1,332 (м, 1H), 1,149 - 1,059 (м, 1H), 0,849 - 0,709 (м, 7H).
Пример 107
(±) 3-(бензо[1,3]диоксол-5-илметилтио)-5,6-дигидро-4- окси-6-фенил-(2-фенилэтил)-2H-пиран-2-он
Целевое соединение получают по общему методу 7 с применением 0,250 г (0,85 ммоль) 5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)- 2H-пиран-2-она, 0,36 г (1,02 ммоль) бензо[1,3]диоксол-5-илметил-п- толуолтиосульфоната, 0,25 мл (1,81 ммоль) триэтиламина, 3,0 мл абсолютного этанола и 0,5 г бикарбоната натрия. Смесь в течение 16 часов нагревают до температуры 40oC, после чего разбавляют 100 мл диэтилового эфира и промывают водой. Растворитель удаляют в вакууме и остаток подвергают колоночной хроматографии на силикагеле, при этом в качестве элюента последовательно применяют дихлорметан и смесь метанола и дихлорметана в соотношении до 1,5:98,5. Получают 0,290 г твердого вещества с точкой плавления 53 - 55oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 11,404 (шир.с, 1H), 7,449 - 7,249 (м, 5H), 7,239 - 7,216 (м, 2H), 7,168 - 7,124 (м, 1H), 7,077 (д, 2H, J = 7 Гц), 6,683 (д, 1H, J = 1,5 Гц), 6,607 (д, 1H, J = 8 Гц), 6,390 (дд, 1H, J = 1,5 Гц, J = 8 Гц), 5,942 (д, 2H, J = 2 Гц), 3,600 (д, 1H, J = 13 Гц), 3,509 (д, 1H, J = 13 Гц), 3,195 (AB, 2H, JAB = 17 Гц), 2,595 - 2,511 (м, 1H), 2,244 - 2,094 (м, 3H).
Общий метод 8
Целевое соединение получают путем подачи 5,6-дигидро-2H- пиран-2-она и сухого дихлорметана в реакционный сосуд с последующим добавлением хлорангидирида кислоты и триэтиламина. Смесь перемешивают в течение 15 минут, после чего смесь разбавляют диэтиловым эфиром и дважды промывают насыщенным раствором бикарбоната натрия. Органический слой сушат над сульфатом магния. Растворитель удаляют в вакууме, остаток растворяют в ацетонитриле и обрабатывают триэтиламином и ацетонцианогидрином. Смесь перемешивают в течение 18 часов, после чего смесь разбавляют диэтиловым эфиром, промывают 1,0 н. соляной кислотой, сушат над сульфатом натрия и растворитель удаляют в вакууме. Остаток растворяют в ледяной уксусной кислоте и обрабатывают цианидом борана натрия. Реакции дают продолжаться в течение 30 минут, после чего реакционную смесь обрабатывают солевым раствором. Смесь экстрагируют этилацетатом, органические слои объединяют, сушат над сульфатом магния и растворитель удаляют в вакууме.
Пример 108
5,6-дигидро-4-окси-6,6-дифенил-3-фенилметил-2H-пиран-2-он
Целевое соединение получают по общему методу 8 с применением 0,250 г (0,940 ммоль) 5,6-дигидро-4-окси-6,6-дифенил-2H-пиран-2-она, 0,13 мл (0,94 ммоль) триэтиламина, 0,109 мл (0,94 ммоль) бензоилхлорида, 2,0 мл дихлорметана, 5,0 мл ацетонитрила, 0,01 мл (0,09 ммоль) ацетонцианогидрина, 0,27 мл (1,9 ммоль) триэтиламина, 10,0 мл ледяной уксусной кислоты и 0,133 г (2,11 ммоль) цианоборана натрия. Получаемый остаток очищают путем колоночной хроматографии на силикагеле, при этом в качестве элюента применяют смесь гексана и этилацетата в соотношении 4:1 - 3:2. При этом получают 0,105 г твердого вещества с точкой плавления 63 - 65oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 11,136 (с, 1H), 7,501 - 7,280 (м, 11H), 6,997 - 6,932 (м, 2H), 6,566 (д, 2 H, J = 7 Гц), 3,530 (с, 2H), 3,432 (с, 2H).
Пример 109
(±) 5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)- 3-фенилметил-2H-пиран-2-он
Целевое соединение получают по общему методу 8 с применением 0,250 г (0,850 ммоль) 5,6-дигидро-4-окси-6- фенил-6-(2-фенилэтил)-2H-пиран-2-она, 0,26 мл (1,94 ммоль) триэтиламина, 0,109 мл (0,94 ммоль) бензоилхлорида, 2,0 мл дихлорметана, 5,0 мл ацетонитрила, 0,04 мл (0,43 ммоль) ацетонцианогидрина, 0,26 мл (1,9 ммоль) триэтиламина, 10,0 мл ледяной уксусной кислоты и 0,151 г (2,4 ммоль) цианоборана натрия. Получаемый остаток очищают путем колоночной хроматографии на силикагеле, при этом в качестве элюента последовательно применяют сначала дихлорметан и затем его смесь с метанолом в соотношении до 98:2. При этом получают 0,384 г вязкого масла.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 10,922 (шир.с, 1H), 7,395- 7,315 (м, 5H), 7,297 - 7,126 (м, 3H), 7,084 - 7,028 (м, 5H), 6,775 - 6,611 (м, 2H), 3,423 (с, 2H), 3,248 (д, 1H, J = 17 Гц), 3,175 (д, 1H, J = 17 Гц), 2,619 - 2,551 (м, 1H), 2,292 - 2,227 (м, 3H).
Пример 110
(±) 5,6-дигидро-4-окси-3-[(2-метилфенил)метил] -6-фенил- 6-(2-фенилэтил)-2H-пиран-2-он
Целевое соединение получают по общему методу 8 с применением 0,250 г (0,850 ммоль) 5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)- 2H-пиран-2-она, 0,12 мл (0,85 ммоль) триэтиламина, 0,11 мл (0,85 ммоль) 2- метилбензоилхлорида, 5,0 мл дихлорметана, 4,0 мл ацетонитрила, 0,04 мл (0,43 ммоль) ацетонцианогидрина, 0,24 мл (1,7 ммоль) триэтиламина, 10,0 мл ледяной уксусной кислоты и 0,151 г (2,4 ммоль) цианоборана натрия. Получаемый остаток очищают путем колоночной хроматографии на силикагеле, при этом в качестве элюента последовательно применяют сначала дихлорметан и затем его смесь с метанолом в соотношении до 98:2. При этом получают 0,195 г твердого вещества с точкой плавления 109 - 111oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 10,886 (шир.с, 1H), 7,457 - 7,359 (м, 5H), 7,242 (т, 2H, J = 7 Гц), 7,169 - 7,130 (м, 1H), 7,097 (д, 2 H, J = 7,5 Гц), 7,001 (д, 1H, J = 7,5 Гц), 6,937 (т, 1H, J = 7,5 Гц), 6,695 (т, 1H, J = 7 Гц), 6,215 (д, 1H, J = 7,5 Гц), 3,292 (д, 1H, J = 17 Гц), 3,169 (д, 1H, J = 17 Гц), 2,643 - 2,584 (м, 1H), 2,50 - 2,475 (2H + растворитель), 2,296 - 2,182 (м, 3H), 2,125 (c, 3H).
Пример 111
(±) 5,6-дигидро-4-окси-3-[(3-метилфенил)метил] - 6-фенил-6-(2-фенилэтил)-2H-пиран-2-он
Целевое соединение получают по общему методу 8 с применением 0,250 г (0,850 ммоль) 5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)- 2H-пиран-2-она, 0,12 мл (0,85 ммоль) триэтиламина, 0,12 мл (0,89 ммоль) 3-метилбензоилхлорида, 3,0 мл дихлорметана, 5,0 мл ацетонитрила, 0,037 мл (0,40 ммоль) ацетонцианогидрина, 0,24 мл (1,8 ммоль) триэтиламина, 5,0 мл ледяной уксусной кислоты и 0,16 г (2,6 ммоль) цианоборана натрия. Получаемый остаток очищают путем колоночной хроматографии на силикагеле, при этом в качестве элюента последовательно применяют сначала дихлорметан и затем его смесь с метанолом в соотношении 98: 2. При этом получают 0,250 г твердого вещества с точкой плавления 53 - 55oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 10,884 (шир.с, 1H), 7,418 - 7,310 (м, 5H), 7,231 (т, 2H, J = 7,5 Гц), 7,148 - 7,122 (м, 1H), 7,071 (д, 2H, J = 7 Гц), 6,929 (т, 1H, J = 7,5 Гц), 6,843 (д, 1H, J = 7,5 Гц), 6,587 (д, 1H, J = 7,5 Гц), 6,545 (с, 1H), 3,398 (AB, 2H, JAB =15,5 Гц), 3,248 (д, 1H, J = 17 Гц), 3,125 (д, 1H, J = 17 Гц), 2,607 - 2,511 (м, 1H), 2,338 - 2,159 (м, 3H), 2,094 (c, 3H).
Пример 112
5,6-дигидро-4-окси-3-[(3-метилфенил)метил]-6,6-дифенил-2H-пиран- 2-он
Целевое соединение получают по общему методу 8 с применением 0,300 г (1,13 ммоль) 5,6-дигидро-4-окси-6,6-дифенил-2H-пиран-2- она, 0,16 мл (1,15 ммоль) триэтиламина, 0,15 мл (1,13 ммоль) 3- метилбензоилхлорида, 4,0 мл дихлорметана, 4,0 мл ацетонитрила, 0,05 мл (0,58 ммоль) ацетонцианогидрина, 0,32 мл (2,3 ммоль) триэтиламина, 4,0 мл ледяной уксусной кислоты и 0,28 г (4,5 ммоль) цианоборана натрия. Получаемый остаток очищают путем колоночной хроматографии на силикагеле, при этом в качестве элюента последовательно применяют сначала дихлорметан и затем его смесь с метанолом в соотношении до 99: 1. При этом получают 0,223 г твердого вещества с точкой плавления 57 - 59oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 11,112 (шир.с, 1H), 7,414 - 7,270 (м, 10H), 6,875 - 6,812 (м, 2H), 6,429 - 6,392 (м, 2H), 3,527 (с, 2H), 3,409 (с, 2H), 2,060 (с, 3H).
Пример 113
5,6-дигидро-4-окси-3-[(2-метилфенил)метил]-6,6-дифенил-2H-пиран- 2-он
Целевое соединение получают по общему методу 8 с применением 0,300 г (1,13 ммоль) 5,6-дигидро-4-окси-6,6-дифенил-2H-пиран-2-она, 0,16 мл (1,15 ммоль) триэтиламина, 0,15 мл (1,13 ммоль) 2- метилбензоилхлорида, 4,0 мл дихлорметана, 4,0 мл ацетонитрила, 0,05 мл (0,58 ммоль) ацетонцианогидрина, 0,32 мл (2,3 ммоль) триэтиламина, 4,0 мл ледяной уксусной кислоты и 0,28 г (4,5 ммоль) цианоборана натрия. Получаемый остаток очищают путем колоночной хроматографии на силикагеле, при этом в качестве элюента применяют сначала дихлорметан и затем его смесь с метанолом в соотношении до 99:1. При этом получают 0,135 г твердого вещества с точкой плавления 169 -171oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 11,102 (шир.с, 1H), 7,444 - 7,260 (м, 10H), 6,981 (д, 1H, J = 7,5 Гц), 6,900 (т, 1H, J = 7,5 Гц), 6,577 (т, 1H, J = 7 Гц), 5,897 (д, 1H, J = 7,5 Гц), 3,557 (с, 2H), 3,341 (с, 2H), 2,115 (с, 3H).
Пример 114
5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-3-[(2- трифторметилфенил)метил]-2H-пиран-2-он
Целевое соединение получают по общему методу 8 с применением 0,300 г (1,02 ммоль) 5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-2H- пиран-2-она, 0,15 мл (1,1 ммоль) триэтиламина, 0,21 мл (1,02 ммоль) 2-трифторметилбензоилхлорида, 4,0 мл дихлорметана, 4,0 мл ацетонитрила, 0,04 мл (0,47 ммоль) ацетонцианогидрина, 0,29 мл (2,1 ммоль) триэтиламина, 3,0 мл ледяной уксусной кислоты и 0,20 г (3,1 ммоль) цианоборана натрия. Получаемый остаток очищают путем колоночной хроматографии на силикагеле, при этом в качестве элюента применяют сначала дихлорметан и затем его смесь с метанолом в соотношении до 99:1. При этом получают 0,102 г масла.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 11,21 (шир.с, 1H), 7,584 (д, 1H, J = 8 Гц), 7,457 - 7,030 (м, 12H), 6,179 (д, 1H, J = 7,5 Гц), 3,594 (с, 2H), 3,362 (д, 1H, J = 17 Гц), 3,249 (д, 1H, J = 17 Гц), 2,686 - 2,603 (м, 1H), 2,374 - 2,182 (м, 3H).
Пример 115
5,6-дигидро-4-окси-3-[(2-изопропилфенил)метил] - 6,6-дифенил-2H-пиран-2-он
Целевое соединение получают по общему методу 8 с применением 0,300 г (1,15 ммоль) 5,6-дигидро-4-окси- 6,6-дифенил-2H-пиран-2-она, 0,17 мл (1,2 ммоль) триэтиламина, 1,02 мл (1,02 ммоль) 2-изопропилбензоилхлорида, 4,0 мл дихлорметана, 4,0 мл ацетонитрила, 0,05 мл (0,5 ммоль) ацетонцианогидрина, 0,35 мл (2,5 ммоль) триэтиламина, 5,0 мл ледяной уксусной кислоты и 0,50 г (8,5 ммоль) цианоборана натрия. Получаемый остаток очищают путем колоночной хроматографии на силикагеле, при этом в качестве элюента применяют сначала дихлорметан и затем его смесь с метанолом в соотношении до 99:1. При этом получают 0,128 г твердого вещества с точкой плавления 224 - 226oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 11,180 (шир.с, 1H), 7,445 - 7,235 (м, 10H), 7,109 (д, 1H, J = 7,5 Гц), 6,970 (т, 1H, J = 7,5 Гц), 6,515 (т, 1H, J = 7,5 Гц), 5,841 (д, 1H, J = 7,5 Гц), 3,560 (с, 2H), 3,463 (с, 2H), 1,174 - 1,094 (м, 7H).
Пример 116
(±) 5,6-дигидро-4-окси-6-(3-метилбутил)-3-[(3-метилфенил) метил]-6-фенил-2H-пиран-2-он
Целевое соединение получают по общему методу 8 с применением 0,300 г (1,15 ммоль) 5,6-дигидро-4-окси-6-фенил-6- (3-метилбутил)-2H-пиран-2-она, 0,17 мл (1,2 ммоль) триэтиламина, 1,15 мл (1,15 ммоль) 3-метилбензоилхлорида, 4,0 мл дихлорметана, 4,0 мл ацетонитрила, 0,05 мл (0,5 ммоль) ацетонцианогидрина, 0,35 мл (2,5 ммоль) триэтиламина, 4,0 мл ледяной уксусной кислоты и 0,51 г (8,1 ммоль) цианоборана натрия. Получаемый остаток очищают путем колоночной хроматографии на силикагеле, при этом в качестве элюента применяют сначала дихлорметан и затем его смесь с метанолом в соотношении 99,5: 0,5. При этом получают 0,252 г твердого вещества с точкой плавления 53 - 55oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 7,376 - 7,244 (м, 5H), 6,915 (т, 1H, J = 7,5 Гц), 6,831 (д, 1H, J = 7,5 Гц), 6,549 (д, 1H, J = 7,5 Гц),6,509 (с, 1H), 3,369 (AB, 2H, JAB = 14,4 Гц), 3,112 (AB, 2H, JAB = 17,5 Гц), 2,088 (с, 3H), 1,962 (м, 2H), 1,416 - 1,333 (м, 1H), 1,152 - 1,061 (м, 1H), 0,898 - 0,726 (м, 7H).
Пример 117
(±) 5,6-дигидро-4-окси-6-(3-метилбутил)-6- фенил-3-фенилметил-2H-пиран-2-он
Целевое соединение получают по общему методу 8 с применением 0,300 г (1,15 ммоль) 5,6-дигидро-4- окси-6-(3-метилбутил)-6-фенил-2H-пиран-2-она, 0,17 мл (1,2 ммоль) триэтиламина, 0,13 мл (1,15 ммоль) бензоилхлорида, 4,0 мл дихлорметана, 4,0 мл ацетонитрила, 0,05 мл (0,5 ммоль) ацетонцианогидрина, 0,35 мл (2,5 ммоль) триэтиламина, 4,0 мл ледяной уксусной кислоты и 0,51 г (8,1 ммоль) цианоборана натрия. Получаемый остаток очищают путем колоночной хроматографии на силикагеле, при этом в качестве элюента применяют сначала дихлорметан и затем его смесь с метанолом в соотношении до 99:1. При этом получают 0,215 г твердого вещества с точкой плавления 46 - 48oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 10,864 (шир.с, 1H), 7,375 - 7,248 (м, 7H), 7,026 - 7,000 (м, 2 H), 6,737 - 6,713 (м, 1H), 3,393 - 3,332 (2H, + растворитель), 3,110 (AB, 2H, JAB = 17 Гц), 1,933 - 1,870 (м, 2H), 1,402 - 1,353 (м, 1H), 1,132 - 1,084 (м, 1H), 0,891 - 0,710 (м, 7H).
Пример 118
(±) 5,6-дигидро-4-окси-6-(3-метилбутил)-3-[(2- метилфенил)метил]-6-фенил-2H-пиран-2-он
Целевое соединение получают по общему методу 8 с применением 0,300 г (1,15 ммоль) 5,6-дигидро-4-окси-(3-метилбутил)-6-фенил-2H- пиран-2-она, 0,17 мл (1,2 ммоль) триэтиламина, 0,15 мл (1,15 ммоль) 2-метилбензоилхлорида, 4,0 мл дихлорметана, 4,0 мл ацетонитрила, 0,05 мл (0,5 ммоль) ацетонцианогидрина, 0,35 мл (2,5 ммоль) триэтиламина, 4,0 мл ледяной уксусной кислоты и 0,51 г (8,1 ммоль) цианоборана натрия. Получаемый остаток очищают путем колоночной хроматографии на силикагеле, при этом в качестве элюента применяют сначала дихлорметан и затем его смесь с метанолом в соотношении до 99:1. При этом получают 0,215 г твердого вещества с точкой плавления 46 - 48oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 10,829 (шир.с, 1H), 7,395 - 7,303 (м, 5H), 6,994 (д, 1H, J = 7 Гц), 6,927 (т, 1H, J = 7 Гц), 6,674 (т, 1H, J = 7 Гц), 6,149 (д, 1H, J = 7 Гц), 3,305 (AB, 2H, JAB = 17 Гц), 3,158 (AB, 2H, JAB = 17,5 Гц), 2,115 (с, 3H), 1,988 - 1,854 (м, 2H), 1,439 - 1,356 (м, 1H), 1,177 - 1,087 (м, 1H), 0,943 - 0,852 (м, 1H), 0,792 - 0,767 (м, 6H).
Пример 119
(±) 5,6-дигидро-4-окси-3-[(3-метоксифенил)метил] -6-фенил- 6-(2-фенилэтил)-2H-пиран-2-он
Целевое соединение получают по общему методу 8 с применением 0,300 г (1,02 ммоль) 5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-2H- пиран-2-она, 0,15 мл (1,1 ммоль) триэтиламина, 0,17 г (1,02 ммоль) 2-метоксибензоилхлорида, 4,0 мл дихлорметана, 4,0 мл ацетонитрила, 0,05 мл (0,5 ммоль) ацетонцианогидрина, 0,35 мл (2,5 ммоль) триэтиламина, 5,0 мл ледяной уксусной кислоты и 0,47 г (7,5 ммоль) цианоборана натрия. Получаемый остаток очищают путем колоночной хроматографии на силикагеле, при этом в качестве элюента применяют сначала дихлорметан и затем его смесь с метанолом в соотношении до 99: 1. При этом получают 0,227 г твердого вещества с точкой плавления 62 - 64oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 10,823 (шир.с, 1H), 7,436 - 7,362 (м, 5H), 7,265 (т, 2H), 7,176 - 7,098 (м, 3H), 7,022 (тд, 1H, J = 1 Гц, J = 8 Гц), 6,815 (д, 1H, J = 7,5 Гц), 6,400 (тд, 1H, J =1 Гц, J = 7,5 Гц), 5,952 (дд, 1H, J = 1 Гц, J = 7 Гц), 3,716 (с, 3H), 3,391 - 3,169 (м, 4H), 2,650 - 2,582 (м, 1H), 2,354 - 2,182 (м, 3H).
Пример 120
5,6-дигидро-4-окси-3-[(нафтален-1-ил)метил]-6,6- дифенил-2H-пиран-2-он
Целевое соединение получают по общему методу 8 с применением 0,300 г (1,13 ммоль) 5,6-дигидро-4-окси-6,6-дифенил-2H-пиран-2- она, 0,160 мл (1,15 ммоль) триэтиламина, 1,13 ммоль 1- нафтоилхлорида, 6,0 мл дихлорметана, 4,0 мл ацетонитрила, 0,05 мл (0,5 ммоль) ацетонцианогидрина, 0,35 мл (2,5 ммоль) триэтиламина, 6,0 мл ледяной уксусной кислоты и 0,50 г (7,9 ммоль) цианоборана натрия. Получаемый остаток очищают путем колоночной хроматографии на силикагеле, при этом в качестве элюента применяют сначала дихлорметан и затем его смесь с метанолом в соотношении до 98,5:1,5. При этом получают 0,120 г твердого вещества с точкой плавления 203 - 205oC (разл.).
1H-ЯМР (400 МГц, ДМСО-d6): δ = 11,223 (шир.с, 1H), 8,057 (д, 1H, J = 7 Гц), 7,855 - 7,821 (м, 1 H), 7,603 (д, 1H, J = 8 Гц), 7,514 - 7,302 (м, 12H), 6,866 (дд, 1H, J = 6,5 Гц, J = 8 Гц), 5,975 (д, 1H, J = 7 Гц), 3,874 (с, 2 H), 3,621 (с, 2H).
Пример 121
(±) 5,6-дигидро-4-окси-3-[(2-изопропилфенил)метил] -6-(3- метилбутил)-6-фенил-2H-пиран-2-он
Целевое соединение получают по общему методу 8 с применением 0,300 г (1,15 ммоль) 5,6-дигидро-4-окси-6-(3-метилбутил)-6-фенил-2H- пиран-2-она, 0,17 мл (1,2 ммоль) триэтиламина, 1,15 ммоль 2-изопропилбензоилхлорида, 4,0 мл дихлорметана, 4,0 мл ацетонитрила, 0,05 мл (0,5 ммоль) ацетонцианогидрина, 0,35 мл (2,5 ммоль) триэтиламина, 5,0 мл ледяной уксусной кислоты и 0,50 г (8,1 ммоль) цианоборана натрия. Получаемый остаток очищают путем колоночной хроматографии на силикагеле с применением в качестве элюента дихлорметана. При этом получают 0,118 г твердого вещества с точкой плавления 124 - 126oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 10,855 (шир.с, 1H), 7,395 - 7,306 (м, 5H), 7,115 (дд, 1H, J =1 Гц, J = 7,5 Гц), 6,991 (т, 1H, J = 7 Гц), 6,622 (тд, 1H, J = 1 Гц, J = 7 Гц), 6,123 (д, 1H, J = 7 Гц), 3,422 (с, 2H), 3,210 - 3,102 (м, 3H), 1,975 - 1,871 (м, 2 H), 1,437 - 1,371 (м, 1H), 1,142 - 1,084 (м, 7H), 0,938 - 1,807 (м, 1H), 0,791 - 0,766 (м, 6H).
Пример 122
(±) 5,6-дигидро-4-окси-3-[(2-изопропилфенил)метил] -6-фенил- 6-(2-фенилэтил)-2H-пиран-2-он
Целевое соединение получают по общему методу 8 с применением 0,300 г (1,02 ммоль) 5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-2H- пиран-2-она, 0,17 мл (1,2 ммоль) триэтиламина, 1,02 ммоль 2- изопропилбензоилхлорида, 4,0 мл дихлорметана, 4,0 мл ацетонитрила, 0,05 мл (0,5 ммоль) ацетонцианогидрина, 0,35 мл (2,5 ммоль) триэтиламина, 4,0 мл ледяной уксусной кислоты и 0,45 г (7,1 ммоль) цианоборана натрия. Получаемый остаток очищают путем колоночной хроматографии на силикагеле с применением в качестве элюента дихлорметана. При этом получают 0,130 г твердого вещества с точкой плавления 73 - 74oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 7,424 - 7,328 (м, 6H), 7,259 - 7,222 (м, 2H), 7,197 - 7,082 (м, 3H), 6,996 (т, 1H, J = 7 Гц), 6,638 (тд, 1H, J = 1,5 Гц, J = 8 Гц), 6,195 (д, 1H, J = 7 Гц), 3,440 (c, 2H), 3,268 - 3,133 (м, 2H), 2,630 - 2,528 (м, 1H), 2,332 - 2,147 (м, 3H), 2,332 - 2,147 (м, 7H).
Пример 123
(±) 3-[(2-хлорфенил)метил] -5,6-дигидро-4-окси-6-(3- метилбутил)-6-фенил-2H-пиран-2-он
Целевое соединение получают по общему методу 8 с применением 0,300 г (1,15 ммоль) 5,6-дигидро-4-окси-6-(3- метилбутил)-6-фенил-2H-пиран-2-она, 0,17 мл (1,2 ммоль) триэтиламина, 0,15 мл (1,15 ммоль) 2-хлорбензоилхлорида, 4,0 мл дихлорметана, 4,0 мл ацетонитрила, 0,05 мл (0,5 ммоль) ацетонцианогидрина, 0,35 мл (2,5 ммоль) триэтиламина, 4,0 мл ледяной уксусной кислоты и 0,720 г (11,5 ммоль) цианоборана натрия. Получаемый остаток очищают путем колоночной хроматографии на силикагеле с применением в качестве элюента дихлорметана. При этом получают 0,165 г твердого вещества с точкой плавления 51 - 53oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 11,062 (шир.с, 1H), 7,425 - 7,275 (м, 6H), 7,072 (тд, 1H, J = 1,5 Гц, J = 7,5 Гц), 6,774 (тд, 1H, J = 1,2 Гц, J = 7,5 Гц), 6,059 (дд, 1H, J = 1,2 Гц, J = 7,5 Гц), 3,428 (AB, 2H, JAB = 16,5 Гц), 3,191 (AB, 2H, JAB= 17 Гц), 1,9648 - 1,884 (м, 2H), 1,450 - 1,384 (м, 1H), 1,163 - 1,118 (м, 1H), 0,951 (м, 1H), 0,802 - 0,776 (м, 6H).
Пример 124
(±) 3-[(2-хлорфенил)метил]-5,6-дигидро-4-окси- 6,6-дифенил-2H-пиран-2-он
Целевое соединение получают по общему методу 8 с применением 0,300 г (1,13 ммоль) 5,6-дигидро-4-окси-6,6-дифенил-2H-пиран-2-она, 0,17 мл (1,2 ммоль) триэтиламина, 0,14 мл (1,15 ммоль) 2-хлорбензоилхлорида, 4,0 мл дихлорметана, 4,0 мл ацетонитрила, 0,05 мл (0,5 ммоль) ацетонцианогидрина, 0,35 мл (2,5 ммоль) триэтиламина, 4,0 мл ледяной уксусной кислоты и 0,50 г (7,9 ммоль) цианоборана натрия. Получаемый остаток очищают путем колоночной хроматографии на силикагеле с применением в качестве элюента сначала дихлорметана и затем его смеси с метанолом в соотношении 99,5:0,5. При этом получают 0,130 г твердого вещества с точкой плавления 185 - 187oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 11,351 (шир.с, 1H), 7,464 - 7,282 (м, 11H), 7,054 (т, 1H, J = 7 Гц), 6,679 (тд, 1H, J = 1 Гц, J = 7,5 Гц), 5,797 (д, 1H, J = 7 Гц), 3,586 (с, 2H), 3,472 (с, 2H).
Пример 125
(±) 6-циклопентилметил-5,6-дигидро-4-окси-6-фенил-3- фенилметил-2H-пиран-2-он
Целевое соединение получают по общему методу 8 с применением 0,300 г (1,10 ммоль) 6-циклопентилметил-5,6-дигидро-4-окси-6-фенил- 2H-пиран-2-она, 0,17 мл (1,2 ммоль) триэтиламина, 0,13 мл (1,10 ммоль) бензоилхлорида, 4,0 мл дихлорметана, 4,0 мл ацетонитрила, 0,05 мл (0,5 ммоль) ацетонцианогидрина, 0,35 мл (2,5 ммоль) триэтиламина, 4,0 мл ледяной уксусной кислоты и 0,50 г (7,9 ммоль) цианоборана натрия. Получаемый остаток очищают путем колоночной хроматографии на силикагеле с применением в качестве элюента дихлорметана. При этом получают 0,188 г твердого вещества с точкой плавления 53 - 55oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 10,849 (шир.с, 1H), 7,371 - 7,284 (м, 5H), 7,040 - 7,004 (с, 3H), 6,747 - 6,724 (м, 2H), 3,395 (с, 2H), 3,117 (AB, 2H, JAB = 17,5 Гц), 2,059 - 1,950 (м, 2H), 1,652 - 1,578 (м, 2H), 1,561 -1,289 (м, 5H), 1,021 - 0,844 (м, 2H).
Пример 126
(±)5,6-дигидро-4-окси-6-пентил-6-фенил-3-фенилметил-2H-пиран- 2-он
Целевое соединение получают по общему методу 8 с применением 0,300 г (1,15 ммоль) 5,6-дигидро-4-окси-6- н-пентил-6-фенил-2H-пиран-2-она, 0,17 мл (1,2 ммоль) триэтиламина, 0,13 мл (1,15 ммоль) бензоилхлорида, 4,0 мл дихлорметана, 4,0 мл ацетонитрила, 0,05 мл (0,5 ммоль) ацетонцианогидрина, 0,35 мл (2,5 ммоль) триэтиламина, 4,0 мл ледяной уксусной кислоты и 0,50 г (7,9 ммоль) цианоборана натрия. Получаемый остаток очищают путем колоночной хроматографии на силикагеле с применением в качестве элюента дихлорметана. При этом получают 0,215 г масла.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 10,850 (шир.с, 1H), 7,367 - 7,287 (м, 5H), 7,018 - 7,002 (м, 3H), 6,724 - 6,700 (м, 2H), 3,380 (AB, 2 H, JAB = 14 Гц), 3,096 (AB, 2H, JAB = 17 Гц), 1,950 - 1,820 (м, 2H), 1,230 - 1,100 (м, 5H), 1,080 - 0,920 (м, 1H), 0,775 (т, 3H, J=7 Гц).
Пример 127
(±) 3-[(3-хлорметилфенил)метил] -5,6-дигидро-4- окси-6,6-дифенил-2H-пиран-2-он
Целевое соединение получают по общему методу 8 с применением 0,300 г (1,13 ммоль) 5,6-дигидро-4-окси-6,6-дифенил-2H-пиран-2-она, 0,17 мл (1,2 ммоль) триэтиламина, 0,13 мл (1,13 ммоль) 3-(хлорметил)бензоилхлорида, 5,0 мл дихлорметана, 5,0 мл ацетонитрила, 0,05 мл (0,5 ммоль) ацетонцианогидрина, 0,35 мл (2,5 ммоль) триэтиламина, 6,0 мл ледяной уксусной кислоты и 0,50 г (7,9 ммоль) цианоборана натрия. Получаемый остаток очищают путем колоночной хроматографии на силикагеле с применением в качестве элюента смеси гексана и этилацетата в соотношении 4:1 - 3:2. При этом получают 0,118 г твердого вещества с точкой плавления 135 - 137oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 11,211 (с, 1H), 7,418 - 7,280 (м, 10H), 7,088 (д, 1H, J = 7,5 Гц), 6,975 (т, 1H, J = 7,5 Гц), 6,689 (с, 1 H), 6,513 (д, 1H, J = 7,5 Гц), 4,498 (с, 2H), 3,540 (с, 2H), 3,447 (с, 2H).
Пример 128
5,6-дигидро-3-(бензоилкарбонил)-4-окси-6,6-дифенил-2H-пиран-2-он
Целевое соединение получают путем подачи 0,500 г (1,88 ммоль) 5,6-дигидро-4-окси-6,6-дифенил-2H-пиран-2-она и 10,0 мл сухого дихлорметана в реакционный сосуд с последующим добавлением 0,22 мл (1,88 ммоль) бензоилхлорида и 0,28 мл (2,0 ммоль) триэтиламина. Смесь перемешивают в течение 15 минут, после чего смесь разбавляют диэтиловым эфиром и дважды промывают насыщенным раствором бикарбоната натрия. Органический слой сушат над сульфатом магния. Растворитель удаляют в вакууме, остаток растворяют в ацетонитриле и обрабатывают 0,56 мл (4,0 ммоль) триэтиламина и ацетонсианогидрином. Смесь перемешивают в течение 18 часов, после чего смесь разбавляют диэтиловым эфиром, промывают 1,0 н. соляной кислотой, сушат над сульфатом натрия и растворитель удаляют в вакууме. Получаемый остаток очищают путем колоночной хроматографии на силикагеле с применением в качестве элюента смеси гексана и этилацетата в соотношении 3:2. При этом получают 0,357 г твердого вещества с точкой плавления 66 - 68oC.
1H-ЯМР (400 МГц, CDCl3): δ = 7,495 - 7,208 (м, 15H), 3,558 (с, 2H).
Пример 129
5,6-дигидро-4-окси-6,6-дипентил-3-фенилметилтио-2H-пиран-2-он
Целевое соединение получают по общему методу 4. При этом получают масло.
1H-ЯМР (400 МГц, CDCl3): δ = 7,3 - 7,14 (м, 5H), 3,8 (с, 2H), 2,54 (с, 2H), 1,5 - 1,35 (м, 4H), 1,26 - 1,11 (м, 12H), 0,87 - 0,80 (т, 6H).
Пример 130
(±) 5,6-дигидро-4-окси-6-фенил-3-[(2-изопропил-5- метилфенил)тио] -2(1H)-пиридинон
Целевое соединение получают по общему методу III с применением 95,6 мг 5,6-дигидро-4-окси-6-фенил-2-(1H)-пиридинона, 180 мг сложного S-(2-изопропил-5-метилфенилового) эфира толуол-4-тиосульфоновой кислоты (полученного по методу, описанному в источнике Ranasinghe и Fuchs, Synthetic Communications 18: 227, 1988 г.) и 0,08 мл триэтиламина в 5 мл абсолютного этанола. Раствор перемешивают при комнатной температуре в течение ночи. В результате очистки путем флеш-хроматографии с применением в качестве элюента смеси дихлорметана и изопропанола в соотношении 99:1 - 95:5 получают твердое вещество с точкой плавления 184 - 186oC.
1H-ЯМР (CDCl3): δ = 1,28 (д, 3 H), 1,29 (д, 3H), 2,23 (с, 3H), 2,98 (д, 2H), 3,52 (квн, 1H), 4,85 (т, 1H), 5,63 (с, 1H), 6,78 (с, 1H), 6,96 (м, 1H), 7,14 (д, 1H), 7,35 - 7,44 (м, 5H), 7,55 (с, 1H).
Пример 131
4-окси-3-[(1-изопропил-4,4-диметил-4,5-дигидро-1H-имидазол-2-ил) тио]-6-фенил-5,6-дигидро-2H-пиран-2-он
Целевое соединение получают путем подачи 0,250 г (0,85 ммоль) 4-окси-6,6-дифенил-5,6-дигидро-2H-пиран-2-она и 4,5 мл сухого т-бутанола в реакционный сосуд с последующим добавлением 0,151 г (0,850 ммоль) N-бромсукцинимида. Смесь перемешивают в течение 1 часа в темноте, после чего растворитель удаляют в вакууме. Остаток растворяют в дихлорметане и смесь промывают водой. Органический слой сушат над сульфатом натрия и растворитель удаляют в вакууме. Получаемый при этом остаток растворяют в 6,0 мл дихлорметана и последовательно обрабатывают 0,184 г (1,28 ммоль) 1-изопропилимидазолидин-2-тиона (полученного по методу, описанному в источнике A.F. McKay и др., J. Am.Chem.Soc. 1956, 78, 1618) и 0,084 мл (0,85 ммоль) пиперидина. Смесь перемешивают в течение 14 часов в темноте, после чего ее разбавляют дихлорметаном и промывают водой. Органический слой сушат над сульфатом натрия и растворитель удаляют в вакууме. Получаемое твердое вещество очищают путем колоночной хроматографии на силикагеле с применением в качестве элюента сначала смеси дихлорметана и этилацетата в соотношении 1:1 и затем смеси дихлорметана, этилацетата и метанола в соотношении до 14:4:1. При этом получают твердое вещество, которое снова растворяют в дихлорметане, фильтруют через стекловолокнистый фильтр и растворитель удаляют в вакууме. Получают 0,234 г целевого соединения с точкой плавления 160 - 162oC (разлож.).
1H-ЯМР (400 МГц, ДМСО-d6): δ = 7,732 (с, 1H), 7,420 - 7,336 (м, 4H), 7,277 - 7,212 (м, 3H), 7,137 (т, 1H, J = 7 Гц), 7,080 - 7,060 (м, 2H), 3,970 - 3,904 (м, 1H), 3,842 (т, 2H, J = 10 Гц), 3,602 - 3,517 (м, 2H), 2,925 (AB, 2H, JAB = 16 Гц), 2,617 - 2,540 (м, 1H), 2,315 - 2,240 (м, 1H), 2,160 - 2,025 (м, 2H), 1,206 - 1,180 (м, 6H).
Пример 132
4-окси-3-[(1-изопропил-1,4,5,6-тетрагидропиримидин-2-ил)тио] - 6-фенил-5,6-дигидро-2H-пиран-2-он
Целевое соединение получают по примеру 41 с применением 0,250 г (0,850 ммоль) 5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-2H-пиран-2- она, 3,5 мл т-бутанола, 0,151 г (0,850 ммоль) N-бромсукцинимида, 6,0 мл дихлорметана, 0,270 г (1,70 ммоль) 1-изопропилтетрагидропиримидин- 2-тиона (полученного по методу, описанному в источнике A.F. McKay и др., J.Am.Chem.Soc. 78, 1618, 1956 г.) и 0,084 мл (0,85 ммоль) пиперидина. Получаемый остаток очищают путем колоночной хроматографии на силикагеле с применением в качестве элюента сначала смеси дихлорметана и этилацетата в соотношении 1:1 и затем смеси этилацетата, дихлорметана и метанола в соотношении до 2:14:1. При этом получают твердое вещество, которое снова растворяют в дихлорметане, фильтруют через стекловолокнистый фильтр и растворитель удаляют в вакууме. Получают 0,356 г целевого соединения с точкой плавления 103 - 105oC.
1H-ЯМР (400 МГц, ДМСО-d6): δ = 7,440 - 7,371 (м, 4H), 7,296 (т, 1H, J = 7 Гц), 7,233 (т, 2H, J = 7 Гц), 7,139 (т, 1H, J = 7 Гц), 7,077 (д, 2H, J = 7 Гц), 6,515 (шир.с, 1H), 4,365 - 4,300 (м, 1H), 3,335 - 3,308 (м, 2H), 3,024 - 2,924 (м, 4H), 2,624 - 2,548 (м, 1H), 2,341 - 2,265 (м, 1H), 2,156 - 2,061 (м, 2H), 1,763 - 1,737 (м, 2H), 1,201-1,180 (м, 6H).
Пример 133
(±) 6-(2-бензо[1,3] диоксол-5-ил-этил)-5,6-дигидро-4-окси- 6-фенил-3-[(2-изопропил-5-метил-фенил)тио]-2H-пиран-2-он
Целевое соединение получают по общему методу III с применением 400 мг 6-(2-бензо[1,3] диоксол-5-ил-этил)-5,6-дигидро- 4-окси-6-фенил-2H-пиран-2-она, 415 мг сложного S-(2-изопропил-5- метилфенилового) эфира толуол-4-тиосульфоновой кислоты и 0,17 мл триэтиламина в 20 мл абсолютного этанола. Раствор перемешивают в течение ночи при комнатной температуре. В результате очистки путем флеш-хроматографии с применением в качестве элюента смеси гексанов и изопропанола в соотношении 90:10 - 50:50 получают твердое вещество с точкой плавления 83 - 85oC.
1H-ЯМР (400 МГц, CDCl3): δ = 1,21 (д, 3H), 1,25 (д, 3H), 1,93 (с, 3H), 2,20 - 2,40 (м, 3H), 2,60 - 2,75 (м, 1H), 3,30 (дд, 2H), 3,42 (кв, 1H), 5,89 (с, 2H), 6,11 (с, 1H), 6,52 (д, 1H), 6,56 (с, 1 H), 6,69 (д, 1H), 6,87 (д, 1H), 7,07 (д, 1H), 7,30 - 7,50 (м, 5H), 7,64 (шир.с, 1H).
Аналогично предыдущим примерам получают соединения, сведенные в таблице 1.
Определение торможения протеазы ВИЧа
Подготовка опыта
Дитиотреитольный буфер: каждый день приготовляют раствор 1.0 ммоль дитиотреитола в 0.1%-ном полиэтиленгликоле (с молекулярным весом 8000), 80 ммоль натриевой соли уксусной кислоты, 160 ммоль хлористого натрия, 1.0 ммоль этилендиаминтетрауксусной кислоты, который доводят до pH 4.7 с применением соляной кислоты.
Протеаза ВИЧа 1: Энзим получают от фирмы Bachem Bioscience Inc. Замороженный при -80oC неразбавленный энзим оттаивают и разбавляют 50-кратным количеством дитиотреитольного буфера. Раствор хранят при 0oC на ледяной воде и используют в тесте в течение 20 минут после оттаивания.
Субстрат энзима: Субстратом III, полученным от фирмы Bachem Bioscience Inc. , является ундекапептид H-His-Lуs-Ala-Arg-Val-Leu-п- нитpофенилаланин-Glu-Ala-Norleucine-Ser-NH2 (чистотой более 97%). 200 мкмоль основного раствора в дитиотреитольном буфере производят и хранят на льду. Раствор субстрата приготовляют каждый день.
Исследуемое соединение: 10 ммоль ингибитора вышеуказанной формулы (I) в диметилсульфоксиде разбавляют дитиотреитольным буфером до концентрации 200 мкмоль. Этот основной раствор разбавляют 2%-ным раствором диметилсульфоксида в дитиотреитольном буфере до концентрации 10 мкмоль. В каходой чашке раствор ингибитора разбавляют 2%-ным раствором диметилсульфоксида в дитиотреитольном буфере до концентрации 100, 50, 20, 10, 5, 2, 1, 0.5 мкмоль. Общий объем ингибитора составляет 50 мкл.
Проведение испытания
В каждую чашку подают 20 мкл субстрата окончательной концентрацией в 40 мкмоль, 50 мкл ингибитора такой концентрацией, чтобы окончательным разбавлением получать рабочую концентрацию, а также 20 мкл дитиотреитольного буфера. Титровальную пластинку с 96 чашками размещают в инкубаторе при температуре 37oC на по крайней мере 5 минут.
В каждую чашку прибавляют 10 мкл разбавленной протеазы с одновременным встряхиванием титровальной пластинки. После 10-секундного встряхивания титровальную пластинку ставят обратно в инкубатор при температуре 37oC. Конечный реакционный объем составляет 100 мкл.
Титровальную пластинку инкубируют при 37oC в течение 5 минут. Реакцию прекращают подачей титровальной пластинки на встряхиватель и прибавлением 20 мкл 10%-ной трифторуксусной кислоты с последующим встряхиванием в течение 10 секунд. Степень протеолиза определяют разделением нерасщепленного субстрата и двух расщепленных продуктов с помощью обратнофазной жидкостной хроматографии под давлением с одновременным измерением абсорбции при 220 нм. Таким образом определяют площади относительного пика трех компонентов и вычисляют процент превращения в продукт как функция концентрации ингибитора. Данные наносят на график как процент контроля (процент конверсии в присутствии и отсутствии ингибитора, умноженный на 100) по отношению к концентрации ингибитора. Полученные данные используют для уравнения Y=100/1+(X/KT50)A, где KT50 представляет собой концентрацию ингибитора при 50%-ном торможении, а A - линия кривой торможения. Результаты сведены в таблице 2.
Действие против ВИЧа 1
С учетом общих данных методов Поулса и др. (см. "Journal of Virological Methods", 16, стр. 171-185, 1987 г.) и Манна и др. (см. "AIDS Research and Human Retroviruses", стр. 254-255, 1989 г.) проводили антивирусные тесты на активное заражение ВИЧем 1 в клеточной линии H9. Культуры заражали в 1 мл раствора 10%-ной эмбриональной телячьей сыворотки в буфере RPMI 1640, содержащего 105 доз ВИЧа 1iiib, с целью эффективного размножения инфекции на 0.01. После 2 часов вирусной абсорбции клетки промывали один раз и подавали в микротитровальные пластинки с 96 чашками (104 клеток на чашку). Исследуемые соединения подавали в чашки с тем, чтобы получить требуемую концентрацию активного начала, а также 0.1%-ный диметилсульфоксид. Конечный объем среды составлял 200 мкл. Незараженные культуры хранили для определения цитотоксичности через 7 дней после заражения. В культурах определяли репликацию вируса с помощью обратной транскриптазы через 4 и 7 дней после заражения. Результаты опыта сведены в таблице 3.
Комбинации ингибитора протеазы с другими антивирусными препаратами, такими, как, например, ингибиторы обратной транскриптазы ВИЧа AZT и ddC могут проявлять синергетический эффект (см. J. C. Craig и др. в литературе "Antiviral Chem. Chemother"., 4/3, стр. 161-166, 1993 г.; E.V. Connell и др. в литературе "Antimicrob. Agents Chemother.", 38, стр. 348-352, 1994 г.; D. M. Lambert и др. в литературе "Antiviral Res.", 21, стр. 327-342, 1993 г.; A. M. Caliendo и др. в литературе "Clin. Infect. Dis.", 18/4, стр. 516-524, 1994 г.).
Предлагаемые соединения проявляют антибактериальную активность, о чем свидетельствуют результаты микротитровального разведения, описанного Хайфетцом и др. в литературе "Antimicr. Agents & Chemoth.", 6, стр. 124, 1974 г.
По этому методу определяли нижеследующие минимальные концентрации торможения в мкг/мл предлагаемых соединений, применяемых в борьбе с клинически значительными грамположительными возбудителями болезни, которые за последние годы стали резистентными к стандартным средствам. Результаты опыта сведены в таблице 4.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 5,6-ДИГИДРОПИРОНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1994 |
|
RU2140917C1 |
| ПРОИЗВОДНЫЕ ПИРОНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С АНТИБАКТЕРИАЛЬНОЙ И АНТИВИРУСНОЙ АКТИВНОСТЬЮ, СПОСОБ ЛЕЧЕНИЯ ВЫЗВАННЫХ РЕТРОВИРУСОМ ИНФЕКЦИИ ИЛИ ЗАБОЛЕВАНИЯ | 1994 |
|
RU2136674C1 |
| ПРОИЗВОДНЫЕ ПИРОНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С АНТИВИРУСНОЙ И АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ ВЫЗВАННЫХ РЕТРОВИРУСОМ ИНФЕКЦИИ ИЛИ ЗАБОЛЕВАНИЯ | 1994 |
|
RU2153497C2 |
| БЕНЗОПИРАНЫ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ | 1994 |
|
RU2122000C1 |
| ФЕНИЛОКСАЗОЛИДИНОНЫ, ИМЕЮЩИЕ С-С-СВЯЗЬ С 4-8-ЧЛЕННЫМИ ГЕТЕРОЦИКЛИЧЕСКИМИ КОЛЬЦАМИ | 1996 |
|
RU2175324C2 |
| ПРОИЗВОДНЫЕ ДИАЗЕПИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ АРИТМИИ | 1994 |
|
RU2155587C2 |
| ЗАМЕЩЕННЫЕ ПИРИМИДИНТИОАЛКИЛЬНЫЕ ИЛИ АЛКИЛЭФИРНЫЕ СОЕДИНЕНИЯ И СПОСОБ ИНГИБИРОВАНИЯ ОБРАТНОЙ ТРАНСКРИПТАЗЫ ВИРУСОВ | 1996 |
|
RU2167155C2 |
| 4-ГИДРОКСИПИРАН-2-ОНЫ, ЦИКЛООКТИЛ-ИЛИ БЕНЗОПИРАН-2-ОНЫ, 4-ГИДРОКСИ-2Н-ПИРАН-2-ОНЫ И 4-ГИДРОКСИ-ЦИКЛООКТАПИРАН-2-ОНЫ | 1995 |
|
RU2139284C1 |
| СПОСОБ МИНИМИЗАЦИИ ГИСТЕРОТРОФНОГО ЭФФЕКТА ТАМОКСИФЕНА И АНАЛОГОВ ТАМОКСИФЕНА | 1995 |
|
RU2158589C2 |
| АЗОТСОДЕРЖАЩИЕ АРОМАТИЧЕСКИЕ ПРОИЗВОДНЫЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИХ СОДЕРЖАЩАЯ, СПОСОБ ЛЕЧЕНИЯ И ПРИМЕНЕНИЕ | 2003 |
|
RU2310651C2 |



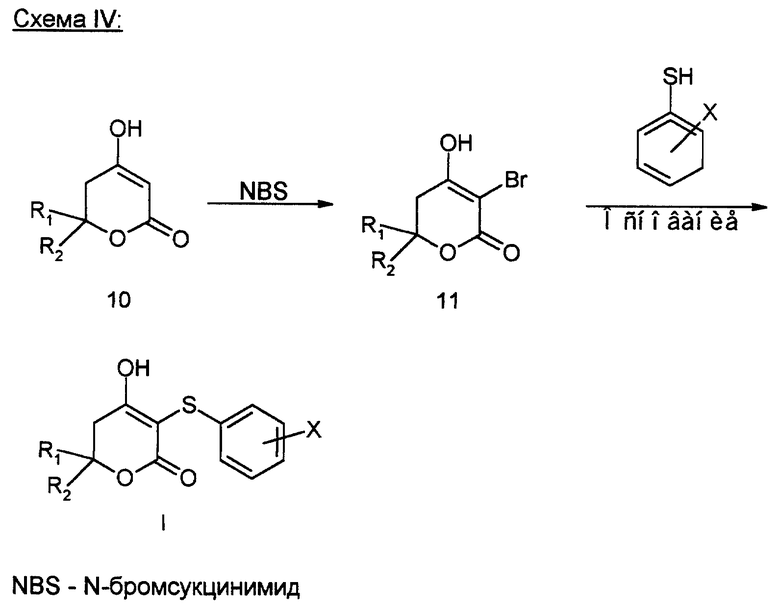

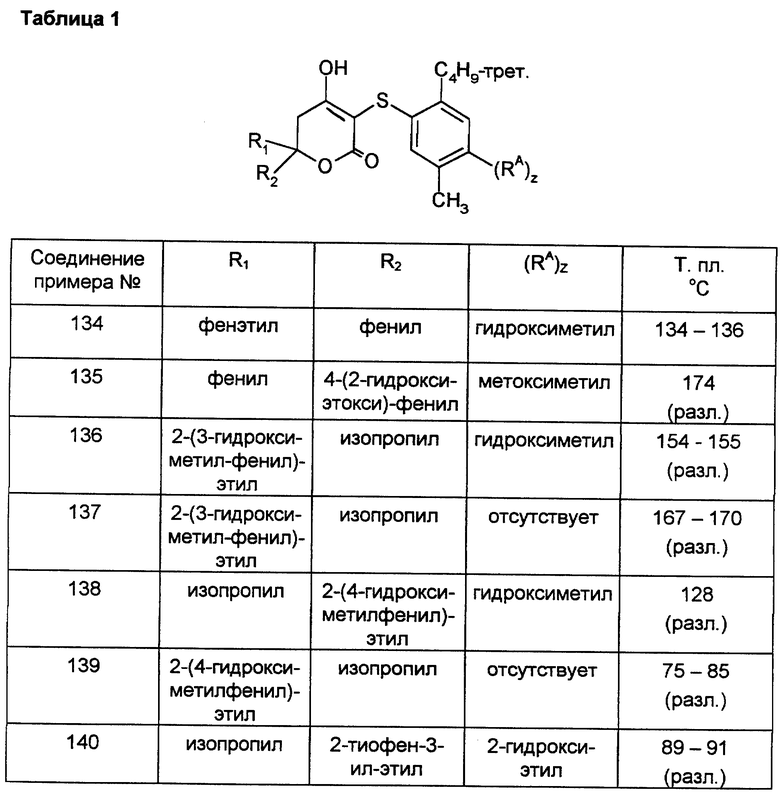



Описываются новые производные пирона общей формулы I, где X - группа формулы OR4, где R4 означает водород, неразветвленный алкил с 1 - 6 атомами углерода, разветвленный или циклический алкил с 3 - 7 атомами углерода, Y - кислород, группа C(R4)2 или NR4, где R4 имеет вышеуказанное значение, R1 и R2 независимо означают группу [CH2]n1 - [W1]n2 - [Ar]n2 - [CH2]n3 - [W2]n4 - R5, где n1 - n4 и R5 имеют нижеуказанное значение, при этом, если радикал W1 означает гетероатом, то n1 - число 1 - 4, или R1 и R2 вместе могут образовать 3-, 4-, 5-, 6- или 7-членное кольцо, незамещенное или замещенное по меньшей мере одним из нижеуказанных остатков R5, R3 - группа формулы [W3] - [CH2] n3 - [W4]n4 - [Ar]n2 - [CH2]n3 - [W2]n4 - R5, где n1, n2, n3, n4 и n5 независимы и означают число 0-4,0 - 1,04-4, 0-1 и 0-2 соответственно. W1, W2 и W4 независимы и означают кислород, группы OCONR5, S(O)n5, CO, NR5, C(R5)2, W3 выбран из группы, включающей кислород, S(O)n5, NR5, R5 независимо означают водород или остаток Ar и неразветвленный или разветвленный алкил с 1 - 6 атомами углерода, незамещенные или замещенные по меньшей мере одним остатком, выбранным из группы, включающей CO2R4, CON(R4)2, OR4, хлор, бром, фтор, трифторметил, радикал Ar, или же 2 радикала R5 вместе образуют незамещенное кольцо с 3 - 7 атомами, а Ar независимо означает фенил, нафтил, бензо[1,3] диоксол, имидазолил, пиримидинил, тиенил, циклоалкил с 3 - 6 атомами, незамещенные или замещенные остатками, выбранными из группы, включающей фтор, хлор, бром, циано, амино, трифторметил и радикал формулы (CH2)n6R4 и (CH2)n6OR4, где n6 независимо означает число 0 - 3, а R4 имеет вышеуказанное значение, или их фармацевтически приемлемые соли. Соединения могут представлять собой активное вещество фармацевтической композиции, обладающей антивирусной и антибактериальной активностью. Описываются также промежуточные соединения для получения производных пирона формулы I, а также способ лечения вызванных ретровирусом инфекции или заболевания путем введения производных пирона формулы I в терапевтически эффективном количестве. 4 с. и 16 з.п. ф-лы, 4 табл.
где Х - группа формулы ОR4, где R4 означает водород, неразветвленный алкил с 1 - 6 атомами углерода, разветвленный или циклический алкил с 3 - 7 атомами углерода;
Y - кислород, группа С(R4)2 или NR4, где R4 имеет вышеуказанное значение;
R1 и R2 независимо означают группу [СН2]n1-[W1]n2-[Аr]n2-[СН2]n3-[W2] n4-R5, где n1 - n4 и R5 имеют нижеуказанное значение, при этом, если радикал W1 означает гетероатом, то n1 - число 1 - 4, или R1 и R2 вместе могут образовать 3-, 4-, 5-, 6- или 7-членное кольцо, незамещенное или замещенное по меньшей мере одним из нижеуказанных остатков R5;
R3 - группа формулы [W3]-[СН2]n3-[W4]n4-[Аr]n2-[СН2]n3-[W2]n4-R5, где n1, n2, n3, n4 и n5 независимы и означают число 0 - 4, 0 - 1, 0 - 4, 0 - 1 и 0 - 2 соответственно, W1, W2 и W4 независимо и означают кислород, группы ОСОNR5, S(О)n5, СО, NR5, С(R5)2, W3 выбран из группы, включающей кислород, S(О)n5, NR5, R5 независимо означает водород или остаток Аr и неразветвленный или разветвленный алкил с 1 - 6 атомами углерода, незамещенные или замещенные по меньшей мере одним остатком, выбранным из группы включающей СО2R4, СОN(R4)2, ОR4, хлор, бром, фтор, трифторметил, радикал Аr, или же 2 радикала R5 вместе образуют незамещенное кольцо с 3 - 7 атомами, а Аr независимо означает фенил, нафтил, бензо[1,3]диоксол, имидазолил, пиримидинил, тиенил, циклоалкил с 3 - 6 атомами, незамещенные или замещенные остатками, выбранными из группы, включающей фтор, хлор, бром, циано, амино, трифторметил и радикал формулы (СН2)n6R4, и (СН2)n6ОR4, где n6 независимо означает число 0 - 3, а R4 имеет вышеуказанное значение,
или их фармацевтически приемлемые соли.
5-(3-хлорфенил)-2-[(2-фенилэтил)тио]-1,3-циклогександион,
5,6-дигидро-4-окси-6-фенил-3-[(2-фенилэтил)тио]-2-(1Н)-пиридинон,
5,6-дигидро-4-окси-1-метил-6-фенил-3-[(2-фенилэтил)тио] -2-(1Н)-пиридинон,
4-окси-3-[(2-изопропил-5-метилфенил)тио] -6-фенил-5,6-дигидро-1Н-пиридин-2-он,
4-окси-3-[(2-изопропил-5-метилфенил)тио] -6-фенил-6-(2-фенилэтил)-5,6-дигидро-1Н-пиридин-2-он,
3-окси-2-[(2-изопропил-5-метилфенил)тио] -5-фенил-5-(2-фенилэтил)-циклогекс-2-енон,
3-окси-2-[(2-изопропил-5-метилфенил)тио]-5-фенил-циклогекс-2-енон.
2,3-дигидро-4'-окси-3,3-диметил-5'-[(2-изопропилфенил)тио] -спиро[4Н-1-бензопиран-4,2'-[2Н]пиран]-6'(3'Н)-он,
2,3-дигидро-4'-окси-2,2-диметил-5'-[(5-метил-2-изопропилфенил)тио] -спиро[1Н-инден-1,2'-[2Н]пиран]-6'(3'Н)-он,
2,3-дигидро-4'-окси-5'-[(5-метил-2-изопропилфенил)тио] -спиро[1Н-инден-1,2'-[2Н]пиран]-6'(3'Н)-он,
4''-окси-5''-[(5-метил-2-изопропилфенил)тио] -диспиро[циклопропан-1,2'-[3'Н)-[1Н]инден-1',2''-[2Н]пиран]-6''(3''Н)-он,
3,4-дигидро-4'-окси-5'-[(5-метил-2-изопропилфенил)тио] -спиро[нафтален-1(2Н),2'-[2Н]пиран]-6'(3'Н)-он,
3,4-дигидро-4'-окси-2,2-диметил-5'-[(5-метил-2-изопропилфенил)тио] -спиро[нафтален-1,2'-[2Н]пиран]-6'(3'Н)-он,
3', 4'-дигидро-4''-окси-5''-[(5-метил-2-изопропилфенил)тио] диспиро[циклопропан-1,2'(1'Н)-нафтален-1,2''[2Н]пиран]-6''(3''Н)-он.
5,6-дигидро-4-окси-6-фенил-3-[(фенилметил)тио-2Н]-пиран-2-он,
5,6-дигидро-4-окси-6-фенил-3-[(2-фенилэтил)тио]-2Н-пиран-2-он,
5,6-дигидро-4-окси-6-фенил-3-[(3-фенилпропил)тио]-2Н-пиран-2-он,
5,6-дигидро-4-окси-6-фенил-3-[(2-феноксиэтил)тио]-2H-пиран-2-он,
5,6-дигидро-4-окси-6-(4-метоксифенил)-3-[(фенилметил)тио]-2Н-пиран-2-он,
5,6-дигидро-4-окси-6-(4-метилтиофенил)-3-[(фенилметил)тио] -2Н-пиран-2-он,
5,6-дигидро-4-окси-6-(4-метилфенил)-3-[(фенилметил)тио]-2Н-пиран-2-он,
5,6-дигидро-4-окси-6-[4-(1,1-диметилэтил)фенил] -3-[(фенилметил)тио] -2Н-пиран-2-он,
6-(4-хлорфенил)-5,6-дигидро-4-окси-3-[(фенилметил)тио]-2Н-пиран-2-он,
6-(3-хлорфенил)-5,6-дигидро-4-окси-3-[(фенилметил)тио]-2Н-пиран-2-он,
5,6-дигидро-3-[(2-фенилэтил)тио] -6-[4-(фенилметокси)фенил]-2Н-пиран-2-он,
5,6-дигидро-6-(4-метоксифенил)-3-[(2-фенилэтил)тио]-2Н-пиран-2-он,
5,6-дигидро-6-(4-метилтиофенил)-3-[(2-фенилэтил)тио]-2Н-пиран-2-он,
5,6-дигидро-6-(4-метилфенил)-3-[(2-фенилэтил)тио]-2Н-пиран-2-он,
6-[1,1'-бифенил]-4-ил-5,6-дигидро-3-[(2-фенилэтил)тио]-2Н-пиран-2-он,
5,6-дигидро-6-[4-(1,1-диметилэтил)фенил] -3-[(2-фенилэтил)тио] -2Н-пиран-2-он,
6-(3-хлорфенил)-5,6-дигидро-3-[(2-фенилэтил)тио]-2Н-пиран-2-он,
6-[([1,1'-бифенил] -4-илокси)метил] -5,6-дигидро-3-[(2-фенилэтил)тио] -2Н-пиран-2-он,
4-[3-дигидро-4-окси-6-оксо-5-[(фенилметил)тио] -2Н-пиран-2-ил] бензонитрил,
6-(4-трифторметилфенил)-5,6-дигидро-4-окси-3-[(фенилметил)тио] -2Н-пиран-2-он,
6-(3,5-дихлорфенил)-5,6-дигидро-4-окси-3-[(фенилметил)тио] -2Н-пиран-2-он,
6-(пентафторфенил)-5,6-дигидро-4-окси-3-[(фенилметил)тио]-2Н-пиран-2-он,
5,6-дигидро-4-окси-6-(3-метилфенил)-3-[(2-фенилэтил)тио]-2Н-пиран-2-он,
6-(2-хлорфенил)-5,6-дигидро-4-окси-3-[(фенилметил)тио]-2Н-пиран-2-он,
1-[4-[3,6-дигидро-4-окси-6-оксо-5-[(2-фенилэтил)тио]-2Н-пиран-2-ил]-фенил]-5-фенил-1Н-пиррол-2-пропановую кислоту,
5,6-дигидро-4-окси-6-(4-оксифенил)-3-[(фенилметил)тио]-2Н-пиран-2-он,
5,6-дигидро-4-окси-6-(4-оксифенил)-3-[(2-фенилэтил)тио]-2Н-пиран-2-он,
[4-[5,6-дигидро-4-окси-2-оксо-3-[(фенилметил)тио]-2Н-пиран-6-ил]фенокси] уксусную кислоту,
[4-[5,6-дигидро-4-окси-2-оксо-3-[(2-фенилэтил)тио]-2Н-пиран-6-ил]-фенокси]уксусную кислоту,
сложный этиловый эфир [4-[5,6-дигидро-4-окси-2-оксо-3-[(фенилметил)тио] -2Н-пиран-6-ил]фенокси]уксусной кислоты,
сложный этиловый эфир [4-[5,6-дигидро-4-окси-2-оксо-3-[(2-фенилэтил)тио] -2Н-пиран-6-ил]фенокси]уксусной кислоты,
5,6-дигидро-4-окси-6-[4-(2-оксиэтокси)фенил] -3-[(фенилметил)тио]-2Н-пиран-2-он,
5,6-дигидро-4-окси-6-[4-(2-оксиэтокси)фенил]-3-[(2-фенилэтил)тио]-2Н-пиран-2-он,
5,6-дигидро-4-окси-3-[(фенилметил)тио] -6-[4-[2-(4-тиоморфолинил)этокси] фенил]-2Н-пиран-2-он-S,S-диоксид,
4-[5,6-дигидро-4-окси-2-оксо-3-[(фенилметил)тио]-2Н-пиран-6-ил]бензойную кислоту,
4-[5,6-дигидро-4-окси-2-оксо-3-[(фенилметил)тио]-2Н-пиран-6-ил]бензойную кислоту,
5,6-дигидро-4-окси-6-[4-(оксиметил)фенил] -3-[(фенилметил)тио] -2Н-пиран-2-он,
5,6-дигидро-4-окси-6-[4-(оксиметил)фенил] -3-[(2-фенилэтил)тио] -2Н-пиран-2-он.
6-[1,1'-бифенил] -4-ил-6-бутил-5,6-дигидро-4-окси-3-[(2-фенилэтил)тио]-2Н-пиран-2-он,
5,6-дигидро-4-окси-6-(2-метилпропил)-6-фенил-3-[(фенилметил)тио] -2Н-пиран-2-он,
5,6-дигидро-4-окси-6-(2-метилпропил)-6-фенил-3-[(2-фенилэтил)тио] -2Н-пиран-2-он,
6-бутил-5,6-дигидро-4-окси-6-фенил-3-[(фенилметил)тио]-2Н-пиран-2-он,
6-[1,1'-бифенил] -4-ил-6-бутил-5,6-дигидро-4-окси-3-[(фенилметил)тио] -2Н-пиран-2-он,
5,6-дигидро-4-окси-6-фенил-3-[(фенилметил)тио]-6-пропил-2Н-пиран-2-он,
5,6-дигидро-4-окси-6-фенил-3-[(2-фенилэтил)тио]-6-пропил-2Н-пиран-2-он,
5,6-дигидро-4-окси-6-пентил-6-фенил-3-[(фенилметил)тио]-2Н-пиран-2-он,
5,6-дигидро-4-окси-6-пентил-6-фенил-3-[(2-фенилэтил)тио]-2Н-пиран-2-он,
5,6-дигидро-4-окси-6-(3-метилбутил)-6-фенил-3-[(фенилметил)тио] -2Н-пиран-2-он,
5,6-дигидро-4-окси-6-(3-метилбутил)-6-фенил-3-[(2-фенилэтил)тио] -2Н-пиран-2-он,
5,6-дигидро-4-окси-6,6-дифенил-3-[(фенилметил)тио]-2Н-пиран-2-он,
5,6-дигидро-4-окси-6,6-дифенил-3-[(2-фенилэтил)тио]-2Н-пиран-2-он,
5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-3-[(фенилметил)тио] -2Н-пиран-2-он,
5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-3-[(2-фенилэтил)тио] -2Н-пиран-2-он,
5,6-дигидро-4-окси-6-[4-[2-(4-морфолинил)этокси] фенил] -6-(2-фенилэтил)-3-[(2-фенилэтил)тио]-2Н-пиран-2-он,
N-(1,1-диметилэтил)-1-[[3,6-дигидро-4-окси-6-оксо-2-фенил-5-[(2-фенилэтил)тио]-2Н-пиран-2-ил]метил]циклогексанкарбоксамид,
сложный фенилметиловый эфир 2-(1-метилэтил)-2-[[3,6-дигидро-4-окси-6-оксо-2-фенил-5-[(2-фенилэтил)тио] -2Н-пиран-2-ил] метил] гидразинкарбоновой кислоты.
5,6-дигидро-4-окси-6-(3-метилбутил)-3-[[2-(1-метилэтил)фенил] тио]-6-фенил-2Н-пиран-2-он,
3-[[5-этил-2-(1-метил-2-оксиэтил)фенил] тио] -5,6-дигидро-4-окси-6,6-дифенил-2Н-пиран-2-он,
5-[5-[(2-циклопентил-5-изопропилфенил)тио] -3,6-дигидро-4-окси-6-оксо-2-фенил-2Н-пиран-2-ил]пентановую кислоту,
5,6-дигидро-4-окси-3-[[5-(2-оксиэтил)-3-(2-фенилэтил)-2-изопропилфенил] -тио]-6-фенил-6-(2-фенилэтил)-2Н-пиран-2-он,
4-[[5,6-дигидро-4-окси-2-оксо-6,6-дифенил-2Н-пиран-3-ил] тио] -2-оксииндан,
3-[[4,5-диэтил-2-(1-оксиэтил)фенил] тио] -5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-2Н-пиран-2-он,
3-[(1,4-ди-трет. бутил-1Н-имидазол-2-ил)тио] -5,6-дигидро-4-окси-6-(2-фенилэтил)-6-фенил-2Н-пиран-2-он,
1-окси-4-[2-[4-окси-5-[(2-изопропил-5-метилфенил)тио] -6-оксо-2-фенил-3,6-дигидро-2Н-пиран-2-ил]этил]-1Н-пиридин-2-он,
5,6-дигидро-4-окси-6-[2-(1Н-индол-5-ил)этил] -3-[(2-изопропил-5-метилфенил)тио]-6-фенил-2Н-пиран-2-он,
5,6-дигидро-4-окси-3-[(2-изопропилфенил)тио]-6-фенил-6-[5-(фенилметил)амино-2,2-диметил-пентил]-2Н-пиран-2-он,
бензиламид 5-[4-окси-5-[(2-изопропилфенил)тио] -6-оксо-2-фенил-3,6-дигидро-2Н-пиран-2-ил]-4,4-диметил-пентановой кислоты,
5,6-дигидро-4-окси-6-(5-оксипентил)-3-[(2-изопропилфенил)тио] -6-фенил-2Н-пиран-2-он,
сложный трет.бутиловый эфир 5-[4-окси-5-[(2-изопропил-5-метилфенил)-тио] -6-оксо-2-фенил-3,6-дигидро-2Н-пиран-2-ил]пентановой кислоты,
сложный метиловый эфир 5-[4-окси-5-[(2-изопропилфенил)тио]-6-оксо-2-фенил-3,6-дигидро-2Н-пиран-2-ил]пентановой кислоты,
сложный этиловый эфир 5-[4-окси-5-[(2-изопропилфенил)тио]-6-оксо-2-фенил-3,6-дигидро-2Н-пиран-2-ил]пентановой кислоты,
сложный пропиловый эфир 5-[4-окси-5-[(2-изопропилфенил)тио]-6-оксо-2-фенил-3,6-дигидро-2Н-пиран-2-ил]пентановой кислоты,
сложный изопропиловый эфир 5-[4-окси-5-[(2-изопропилфенил)тио]-6-оксо-2-фенил-3,6-дигидро-2Н-пиран-2-ил]пентановой кислоты,
сложный трет. бутиловый эфир 5-[4-окси-5-[(2-изопропилфенил)тио]-6-оксо-2-фенил-3,6-дигидро-2Н-пиран-2-ил]пентановой кислоты,
сложный бензиловый эфир 5-[4-окси-5-[(2-изопропилфенил)тио]-6-оксо-2-фенил-3,6-дигидро-2Н-пиран-2-ил]пентановой кислоты,
4-окси-3-[(2-изопропилфенил)тио] -6-(2-фенилэтил)-6-пропил-5,6-дигидро-2Н-пиран-2-он,
4-окси-6-изобутил-3-[(2-изопропил-5-метилфенил)тио] -6-(2-фенилэтил)-5,6-дигидро-2Н-пиран-2-он,
сложный эфир 5-[(2-изопропил-5-метилфенил)тио]-6-оксо-2-фенил-2-(2-фенилэтил)-3,6-дигидро-2Н-пиран-4-ил-уксусной кислоты,
сложный эфир 2-[2-(бензо[1,3] диоксол-5-ил)этил]-5-[(2-изопропил-5-метилфенил)тио]-6-оксо-2-фенил-3,6-дигидро-2Н-пиран-4-ил-пропионовой кислоты,
5-[4-изобутирилокси-5-[(2-изопропилфенил)тио] -6-оксо-2-фенил-3,6-дигидро-2Н-пиран-2-ил]-пентановую кислоту.
5,6-дигидро-4-окси-3-[5-метил-2-(1-метилэтил)фенокси] -6-фенил-6-(2-фенилэтил)-2Н-пиран-2-он,
4-окси-3-(2-изопропилфенокси)-6-фенил-6-(2-фенилэтил)-5,6-дигидро-2Н-пиран-2-он,
4-окси-3-(2-изопропил-5-метилфенокси)-6-фенил-6-(2-фенилэтил)-5,6-дигидро-2Н-пиран-2-он,
3-(2-трет. бутилфенокси)-4-окси-6-фенил-6-(2-фенилэтил)-5,6-дигидро-2Н-пиран-2-он,
5-[5-(2-циклопентилфенокси)-4-окси-6-оксо-2-фенил-3,6-дигидро-2Н-пиран-2-ил]пентановую кислоту,
4-окси-3-(2-изопропил-5-метилфенокси)-6-(2-фенилэтил)-6-пропил-5,6-дигидро-2Н-пиран-2-он,
6-циклопентилметил-4-окси-3-(2-изопропилфенокси)-6-фенил-5,6-дигидро-2Н-пиран-2-он.
5,6-дигидро-4-окси-6-(3-метилбутил)-3-[(4-метилпентил)(фенилметил)амино] -6-фенил-2Н-пиран-2-он,
3-диизобутиламино-5,6-дигидро-4-окси-6,6-дифенил-2Н-пиран-2-он,
5,6-дигидро-4-окси-6-(2-фенилэтил)-6-фенил-3-(N-фенил-N-пропиламино)2Н-пиран-2-он,
5,6-дигидро-4-окси-3-[(2-изопропил-5-метилфенил)амино] -6,6-дифенил-2Н-пиран-2-он,
6-бутил-3-[(1,4-ди-трет. бутил-1Н-имидазол-2-ил)амино] -5,6-дигидро-4-окси-6-фенил-2Н-пиран-2-он,
3-(циклопропилфениламино)-4-окси-6-фенил-6-(2-фенилэтил)-5,6-дигидро-2Н-пиран-2-он,
N-[3-[циклопропил[4-окси-2-оксо-6-фенил-6-(2-фенилэтил)-5,6-дигидро-2Н-пиран-3-ил]амино]фенил]-бензолсульфонамид,
3-(циклопропилфениламино)-4-окси-6-(2-фенилэтил)-6-пропил-5,6-дигидро-2Н-пиран-2-он,
4-окси-6-изобутил-6-(2-фенилэтил)-3-(фенилпропиламино)-5,6-дигидро-2Н-пиран-2-он,
N-[4-окси-2-оксо-6-фенил-6-(2-фенилэтил)-5,6-дигидро-2Н-пиран-3-ил] -N-фенил-метансульфонамид,
N-[6-(2-бензо[1,3] диоксол-5-ил-этил)-4-окси-2-оксо-6-фенил-5,6-дигидро-2Н-пиран-3-ил]-N-(3-метилбутил)бензолсульфонамид,
3-[циклопентил(циклопентилметил)амино] -4-окси-6-фенил-6-(2-фенилэтил)-5,6-дигидро-2Н-пиран-2-он.
5,6-дигидро-6-фенил-6-(2-фенилэтил)-2Н-пиран-2-он,
6-(2-бензо[1,3] диоксол-5-ил-этил)-5,6-дигидро-4-окси-6-фенил-2Н-пиран-2-он,
6-(циклопентилметил)-5,6-дигидро-4-окси-6-фенил-2Н-пиран-2-он,
5-(3,6-дигидро-4-окси-6-оксо-2-фенил-2Н-пиран-2-ил)-пентановую кислоту.
3-бром-5,6-дигидро-4-окси-6,6-дифенил-2Н-пиран-2-он,
3-бром-5,6-дигидро-4-окси-6-фенил-6-(2-фенилэтил)-2Н-пиран-2-он,
6-(2-бензо[1,3] диоксол-5-ил-этил)-3-бром-5,6-дигидро-4-окси-6-фенил-2Н-пиран-2-он,
3-бром-5,6-дигидро-4-окси-(3-метилбутил)-6-фенил-2Н-пиран-2-он,
5-[5-бром-4-окси-6-оксо-2-фенил-3,6-дигидро-2Н-пиран-2-ил]пентановую кислоту, представляющие собой промежуточные продукты для получения соединений по п.1.
Приоритет по пунктам:
19.11.93 по пп.1 - 20;
12.10.94 по пп.1 - 20 (разновидности радикалов).
| Способ получения 6-арил-3-ароил-4-окси-5-бромпиран-2-онов | 1981 |
|
SU950728A1 |
| Инсектицидное средство | 1976 |
|
SU628818A3 |
| US 3818046 А, 18.06.1974 | |||
| Способ формования покрышек пневматических шин | 1974 |
|
SU588137A1 |
| WO 8907939 А, 24.08.1989. | |||
Авторы
Даты
2000-12-20—Публикация
1994-10-26—Подача