Настоящее изобретение относится к новым производным действующего начала (фактора), ингибирующего липогенез (AGIF), также, как и к способам их получения и к их применению. Оно относится также к применению некоторых известных производных AGIF.
AGIF представляет собой протеин, который, как было показано, ингибирует дифференциацию предадипоцитов в адипоциты. Протеин, который иначе известен как интерлейкин 11 (IL- 11), выделен из стромальной клетки линии KM-102, которая получена из костного мозга человека (Последовательность ID N 4, Kawashima et al. , FEBS Letters, 283 (1991) 13-16). Показано, что выделенный протеин ингибирует дифференциацию предадипоцитной клетки линии H-I/A, которая получена из костного мозга мыши, в адипоциты.
Заявка по договору о патентной кооперации (РСТ) ВОИС 92/13955, опубликованная позднее самой ранней даты приоритета настоящей заявки, описывает слитый протеин между тиоредоксином и производным IL-11 (AGIF), в котором происходит делеция N-концевого остатка пролина IL-11. В этой заявке не обсуждается ни производное AGIF само по себе, ни активность этого соединения.
Известно, что все гемопоэтические клетки (т.е. клетки, вовлеченные в образование крови), например, эритроциты, нейтрофилы, моноциты, эозинофилы, базофилы, тромбоциты и лимфоциты, образуются из материнских клеток в костном мозге путем дифференциации, известной также как гемопоэз. Эти материнские клетки обычно более известны как полипотентные стволовые клетки. Известно, что гемопоэз и пролиферация полипотентных стволовых клеток регулируются различными гемопоэтическими факторами, а также взаимодействием от клетки к клетке (cell-to-cell) со стромальными клетками костного мозга. Примерами таких гемопоэтических факторов являются колониестимулирующие факторы, например, гранулоцит-макрофаговый колониестимулирующий фактор (GM-CSF), макрофаговый колониестимулирующий фактор (M-CSF) и гранулоцитный колониестимулирующий фактор (G-CSF). Гемопоэз обычно происходит в "гемопоэтической микросреде", как описано в Dexter and Spooncer, Ann. Rev. Cell. Biol. 3 (1987) 423-441.
Известно, что предадипоциты имеют поддерживающую функцию в гемопоэтической микросреде, но когда они дифференцируют в адипоциты, эта поддерживающая функция теряется [Hiroaki Kodama "SOSHIKI BAIYO (Tissue Culture)", 12 (1986) 191-195). Это демонстрируется с использованием мышиных предадипоцитных клеток линии PA 6. Эта клеточная линия способна поддерживать гемопоэз, но эта поддерживающая функция ослабевает, когда клетки PA6 дифференцируют в адипоциты (Kodama et al., Cell. Physiol., 118, (1984) 233-240).
Также известно, что культивированные клетки PA6 вместе с клетками костного мозга мыши, т.е. с полипотентными стволовыми клетками, будут приводить в результате к образованию колоний бластных клеток, колоний мегакариоцитов и колоний макрофагов (Hiroaki Kodama, "JIKKEN IGAKU (Eхperimental Medicine)", (1987) 826-830). Считают, что если AGIF выделен из клеток костного мозга человека, такой протеин воздействует непосредственно на предадипоциты костного мозга, ингибируя их дифференциацию и позволяя таким образом предадипоцитам поддерживать гемопоэз полипотентных стволовых клеток костного мозга.
Кроме того, эксперименты показали, что предадипоцитные клетки линии H-I/A, которые получают из костного мозга, образуют колониестимулирующий фактор (GSF) - известный гемопоэтический фактор. Количество CSF, образованного предадипоцитами, уменьшается, когда они дифференцируют в адипоциты (Nakamura et al., Proc. Soc. Exp. Biol. Med., 179 (1985) 283-287).
Поэтому предполагается, что благодаря ингибированию дифференциации предадипоцитов в адипоциты, AGIF допускает расширенное образование CSF предадипоцитами, за счет чего промотируется гемопоэз полипотентных стволовых клеток (Ohsumi et al., FEBS Letters, 288, (1991) 13-16).
Возрастание гемопоэза стволовых клеток действительно дает в результате возрастание образования клеточных элементов в крови. Поэтому ожидается, что ингибитор липогенеза будет иметь практическое значение при лечении состояний, в которых снижается число кровяных клеток, по любой причине. Примеры таких состояний включают цитопению (т.е. уменьшение клеточных элементов в крови или в других тканях, возникающее при каком-либо заболевании) и анемию. Кроме того, ингибирование липогенеза будет приводить в результате к уменьшению числа адипоцитов, или жировых клеток, поэтому предполагается, что ингибиторы липогенеза будут иметь значение для лечения таких состояний, как ожирение.
Принимая во внимание преимущества, которые достигаются благодаря ингибированию дифференциации предадипоцитов в адипоциты, существует необходимость в дальнейших разработках таких ингибиторов липогенеза.
Краткое изложение сущности изобретения
Следовательно, целью настоящего изобретения является предложить ингибитор дифференциации адипоцитов.
В частности, целью настоящего изобретения является предложить полипептиды, имеющие активность зрелого AGIF.
Настоящее изобретение предлагает в качестве новых соединений человеческий полипептид, выбранный из группы, состоящей из производного фактора, ингибирующего липогенез человека, в котором недостает от 2 до 9 N-концевых аминокислот, его функционально эквивалентных производных и его предшественников.
Изобретение также предлагает фармацевтическую композицию для лечения или профилактики цитопении, или для лечения или профилактики паталогического ожирения, и эта композиция содержит эффективное количество соединения, противодействующего цитопении или паталогическому ожирению, в смеси с фармацевтически приемлемым носителем или разбавителем, и упомянутое противодействующее цитопении или паталогическому ожирению соединение представляет собой человеческий полипептид, выбираемый из группы, состоящей из производного фактора, ингибирующего липогенез человека, в котором недостает от 1 до 9 N-концевых аминокислот, его функционально эквивалентных производных и его предшественников.
Изобретение также предлагает способ лечения или профилактики цитопении, или лечения паталогического ожирения у млекопитающего, которое может быть человеком, и этот способ включает введение эффективного количества соединения, противодействующего цитопении или патологическому ожирению, упомянутому млекопитающему, и упомянутое соединение, противодействующее цитопении или паталогическому ожирению, представляет собой человеческий полипептид, выбираемый из группы, состоящей из производного фактора, ингибирующего липогенез человека, в котором недостает от 1 до 9 N-концевых аминокислот, его функционально эквивалентных производных и его предшественников.
Настоящее изобретение также предлагает нуклеотидные последовательности, кодирующие эти полипептиды, векторы, включающие такие нуклеотидные последовательности, и клетки-хозяев, трансформированные такими нуклеотидными последовательностями или векторами, а также способы получения таких полипептидов. Такие варианты осуществления изобретения подробнее описаны далее.
Краткое описание рисунков
При дальнейшем описании настоящего изобретения при необходимости будут делаться ссылки на прилагаемые рисунки.
На фиг. 1 показаны результаты вестерн-блоттирования ограниченного расщепления (переваривания) трипсином завершенной формы AGIF.
Фиг. 2 демонстрирует биологическую активность супернатанта культуры клеток COS-I, обработанных трипсином.
Фиг. 3 представляет схему получения плазмиды M13 mp19 (20-2) μ , содержащей кДНК, кодирующей завершенный AGIF (последовательность ID N 9, последовательность ID N 10, последовательность ID N 13).
Фиг. 4 изображает основную последовательность вблизи участка (сайта) рестрикции StuI M13 mp19 (20-2) μ (последовательность ID N 12, последовательность ID N 13).
Фиг. 5 представляет собой диаграмму экспрессии плазмиды pMAL -c-20-2 Δ Pro, содержащей последовательность AGIF Δ Pro (последовательность ID N 14, последовательность ID N 15).
На фиг. 6 проводится сравнение ДНК-последовательностей, содержащихся в M13 mp19 (20-2) и M13 mp19 (20-2) Δ Pro (последовательность ID N 18, последовательность ID N 19).
На фиг. 1 проход (Iane) 1 относится к супернатанту культуры необработанных клеток COS-I, проход 2 относится к супернатанту культуры клеток COS-I, обработанных трипсином, и проход 3 относится к супернатанту культуры клеток COS-I, в которых реакция остановлена ингибитором трипсина вслед за обработкой трипсином. Величины молекулярно-массовых маркеров указаны с правой стороны.
На фиг. 2 сплошная полоса  относится к супернатанту культуры клеток COS-I, трансфектированных негативной управляющей плазмидой (pcDL-SR α 296), полоса, заштрихованная пунктиром
относится к супернатанту культуры клеток COS-I, трансфектированных негативной управляющей плазмидой (pcDL-SR α 296), полоса, заштрихованная пунктиром  , относится к тому случаю, когда к супернатанту культуры клеток COS-I, трансфектированных pcDL-SR α 296, добавлен ингибитор трипсина, заштрихованная
, относится к тому случаю, когда к супернатанту культуры клеток COS-I, трансфектированных pcDL-SR α 296, добавлен ингибитор трипсина, заштрихованная  полоса представляет супернатант культуры клеток COS-I, трансфектированных pSR α -20-2, и полоса, заштрихованная косыми линиями
полоса представляет супернатант культуры клеток COS-I, трансфектированных pSR α -20-2, и полоса, заштрихованная косыми линиями  , представляет супернатант культуры клеток COS-I, трансфектированных pSR α -20-2, в который добавлен ингибитор трипсина. Чистая полоса
, представляет супернатант культуры клеток COS-I, трансфектированных pSR α -20-2, в который добавлен ингибитор трипсина. Чистая полоса  представляет супернатант культуры, к которой ингибитор трипсина добавлен вслед за обработкой трипсином супернатанта культуры клеток COS-I, трансфектированных pSR α -20-2.
представляет супернатант культуры, к которой ингибитор трипсина добавлен вслед за обработкой трипсином супернатанта культуры клеток COS-I, трансфектированных pSR α -20-2.
Активность липопротеина липазы (LPL) выражается в процентах, причем за 100%-ную активность принимается величина, получающаяся в результате добавления среды Дульбекко, модифицированной средой Игла, без образца.
Подробное описание изобретения
Полипептиды настоящего изобретения предпочтительно выбирают из группы, состоящей из полипептидов, содержащих аминокислоты 3-178 и до аминокислот 10-178 с последовательность ID N 2 (см. в конце текста описания) их эквивалентов, мутантов и вариантов, их предшественников и их производных.
В качестве иллюстрации вышесказанного настоящее изобретение предлагает производные AGIF, причем в каждом производном недостает специфических аминокислот N-концевой зрелой формы AGIF. Из представленной выше последовательности можно видеть, что настоящее изобретение предлагает производные AGIF, имеющие последовательности, включающие аминокислоты с номерами с 3 по 178, с 4 по 178, с 5 по 178, с 6 по 178, с 7 по 178, с 8 по 178, с 9 по 178 и с 10 по 178 вышеприведенной последовательности, а также их эквиваленты, мутанты, производные и варианты, и их предшественников.
Полипептиды настоящего изобретения, таким образом, содержат в своей активной форме от 169 до 176 аминокислотных остатков. Полипептиды настоящего изобретения имеют приблизительную молекулярную массу в области от 22000 до 23000 дальтон, при измерении с помощью электрофореза в системе додецилсульфат натрия - полиакриламидный гель в условиях восстановления.
Настоящее изобретение предлагает производные AGIF, как описано выше, а также их функционально эквивалентные производные и их предшественников.
Использованные здесь термины "функционально эквивалентные производные" и "эквиваленты" означают любое производное AGIF настоящего изобретения, в котором одна или более аминокислот из последовательности модифицированы либо искусственно, либо естественным путем, и в котором модифицированный полипептид еще сохраняет по крайней мере значительную часть биологической активности немодифицированного производного. Биологическая активность полипептидов настоящего изобретения подробнее описана далее. Коротко, такая биологическая активность включает одно или все из следующих положений: способность подавлять активность липопротеина липазы адипоцитов, способность индуцировать образование колониестимулирующего фактора предадипоцитами, способность промотировать образование антител B-клетками, способность промотировать образование колоний мегакариоцитов и тромбоцитов и способность уменьшать Go-фазу гемопоэтических стволовых клеток.
Вообще, следует принять во внимание, что активность любого данного протеина зависит от некоторых сохранившихся участков молекулы, пока другие участки имеют небольшое значение, связанное с их конкретной последовательностью, и может быть совершенно или полностью избыточной. Соответственно, настоящее изобретение включает также любые варианты или мутанты с последовательностью производного AGIF, которые еще сохраняют достаточную активность AGIF-типа. Такие варианты и мутанты включают, например, делеции, присоединения, вставки, инверсии, дупликации и типа замещения (например, замещение одного гидрофильного остатка на другой, за исключением, как правило, того случая, когда остаток является сильно гидрофильным или сильно гидрофобным). Небольшие изменения обычно будут иметь небольшое действие на активность, тем не менее, они являются существенной частью молекулы и могут представлять побочный продукт генетического воздействия. Примеры таких небольших изменений включают генерацию дополнительных сайтов рестрикции, как желательных. Следует принять во внимание, что кодирующая последовательность для полипептидов настоящего изобретения может быть модифицирована любым желательным способом, при условии, что при этом отсутствует вредное воздействие на активность образующегося полипептида. Местные мутации и другие изменения могут быть осуществлены, например, для того, чтобы содействовать генетической манипуляции, путем добавления или делеции сайтов рестрикции, или иным способом, чтобы увеличить или модифицировать молекулу.
Например, уже известно, что во многих полипептидах остатки цистеина могут быть превращены в остатки серина без существенной потери активности. Это продемонстрировано по отношению к интерлейкину 2 (IL - 2) в Wang et al., Science 224 (1984) 1431-1433.
Варианты производных AGIF настоящего изобретения включают встречающиеся в природе производные AGIF, которые разделяют последовательность зрелого AGIF при нехватке от 2 до 9 N-концевых остатков аминокислот, но которые, как ожидается, разнятся с ними до некоторой степени в пределах широкой совокупности. В рамках этого определения лежат аллельные вариации и пептиды других видов, показывающие подобный тип активности и имеющие родственную последовательность.
Предшественники AGIF производных настоящего изобретения включают, например, предшественников, имеющих N-концевые заместители, а также слитые белки. N-концевые заместители, предпочтительно, выбираются таким образом, чтобы быть расщепленными, разложившимися или удаленными иными способами до или по достижении места назначения (мишени) в теле. Такие заместители могут самопроизвольно разлагаться или расщепляться в телесной среде, например, вследствие изменения pH или концентрации ионов и т.д., или они могут быть активно расщеплены при воздействии, например, ферментов или до, или после введения.
Подходящие N-концевые заместители включают лидирующие последовательности и группы, такие как сложноэфирные, а также остатки метионина или формилметионина.
Заместители, такие как лидирующие последовательности, а также слитые белки, в основном будут представлять собой побочные продукты любой системы экспрессии, использованной для получения производного AGIF. Такие лидирующие последовательности или слитые белки будут нормально расщепляться в системе экспрессии, но, альтернативно, они могут расщепляться в теле, например, в месте назначения. Такие последовательности имеют склонность обслуживать не конкретную функцию, касающуюся активности производных AGIF, но скорее имеют склонность быть преимущественно вовлеченными в экспрессию полипептида.
В настоящем изобретении, где используется лидирующая последовательность, может оказаться подходящим использование лидирующей последовательности, встречающейся в природе, например, такой, которая иллюстрируется аминокислотами с номерами с -21 до 0 в вышеупомянутой последовательности (последовательность ID N 2). Однако, может быть использована любая подходящая последовательность, особенно если она разработана для данной системы экспрессии.
Производное AGIF настоящего изобретения может быть получено в виде слитого белка, что желательно, и обычно в качестве вспомогательного средства в экспрессии полипептида. Такие слитые белки обычно расщепляются в системе экспрессии или самопроизвольно, или после добавления, например, подходящего фермента, что приводит в результате к образованию производного AGIF. Выбор партнера для слияния не существеннен для настоящего изобретения, но имеется некоторая тенденция к зависимости его от выбора системы экспрессии. Так, для экспрессии в некоторых прокариотических клетках, таких как Е. coli, что далее дается в качестве примера, может оказаться подходящим использование протеина, связывающего мальтозу, или его производного, в качестве партнера для слияния с производным AGIF настоящего изобретения.
Предпочтительным полипептидом настоящего изобретения является полипептид, представленный последовательностью ID N 7 (см. в конце текста описания), а также его эквиваленты, мутанты, варианты и его предшественники, как упоминалось выше.
Настоящее изобретение также предлагает нуклеотидные последовательности, кодирующие все или часть производных AGIF настоящего изобретения. Такие последовательности могут быть либо ДНК, либо РНК, и они могут быть получены стандартными техническими приемами, например, путем обратной инженерии полипептидной последовательности, как предлагается здесь; путем химического синтеза с применением триэфирфосфитного метода (Hunkapiller et al. Nature 310 (1984) 105-111) или путем синтеза кДНК, с применением фермента обратной транскриптазы, из матрицы РНК, полученной из клеток, экспрессирующих зрелый AGIF, с последующей селекцией и амплификацией кДНК полимеразной пенной реакции (PCR), с использованием затравок для смысловых и антисмысловых цепей (нитей), полученных с применением кДНК-последовательности. Последовательность кДНК зрелого AGIF описана в литературе (Kawashima et al. FEBS Letters 283 (1991) 199-202). Специалист в этой области техники должен уметь использовать эту опубликованную кДНК последовательность, например, при получении олигонуклеотидных затравок для использования в полимеразной цепной реакции, для того, чтобы получить последовательности, подходящие для применения в настоящем изобретении.
Следует принять во внимание, что любая данная, полученная обратной инженерией последовательность, не будет обязательно хорошо гибридизировать, или вообще, с любой данной комплементарной последовательностью, полученной обратной инженерией из того же самого пептида, благодаря вырождению (дегенерации) генетического кода. Это является фактором, распространенным в расчетах специалистов, и вырождение любой данной последовательности зачастую является настолько широким, что крайне затрудняет синтез даже короткой комплементарной олигонуклеотидной последовательности, чтобы она служила в качестве пробы для олигонуклеотидной последовательности, встречающейся в природе.
Вырождение кода является таковым, что, например, могут существовать четыре, или больше, возможных кодонов для часто встречающихся аминокислот. Соответственно, поэтому, можно видеть, что число возможных кодирующих последовательностей для любого данного пептида может возрастать экспоненциально с числом остатков в этом пептиде. По существу, следует принять во внимание, что число возможных кодирующих последовательностей для производных AGIF настоящего изобретения может быть очень большим, и мало возможностей для выбора между последовательностями. Однако, может возникнуть необходимость принять в расчет некоторые факторы, которые могут воздействовать на выбор кодирующей последовательности, например, выбор системы экспрессии и частоты использования кодона этой системой. Также может быть желательным сбалансировать содержание G+C последовательности, соответствующей интересующей системе экспрессии.
Отбор кодонов при конструировании нуклеотидной последовательности может быть осуществлен, до некоторой степени, произвольно, и подходящие кодоны могут быть отобраны с использованием стандартных методов, таких, как методы, описанные в Grantham et al., Nucleic Acids ReS. 9 (1981) r43 - r47. Внимание должно быть уделено, например, частоте использования кодонов в конкретном хозяине.
Предпочтительную кодирующую последовательность выбирают из группы, состоящей из нуклеотидов с номерами 87-614 до нуклеотидов с номерами 108-614 последовательности lD N 1 (см. в конце текста описания), а также из их мутантов, вариантов и комплементарных последовательностей.
Настоящее изобретение, следовательно, включает нуклеотидные последовательности, которые включают нуклеотиды с числами 87-614, 90-614, 93-614, 96-614, 99-614, 102-614, 105-614 и 108-614 вышеупомянутой последовательности.
Термины "мутант" и "вариант", использованные выше, имеют те же значения, которые они имеют в связи с пептидной последовательностью mutatis mutandis. Изменение нуклеотидов в выбранных кодирующих последовательностях может быть осуществлено с использованием стандартных технических приемов, таких, например, как сайтовый специфический мутагенез. Такая техника, которая описана в Mark et al., P.N.A.S. 81 (1984) 5662-5666, включает использование праймера (затравки), составленного из синтезированных олигонуклеотидов, кодирующих желательное изменение.
Следует принять во внимание, что, пока мутант или вариант пептидной последовательности всегда будут отражаться в кодирующей нуклеотидной последовательности, обратный процесс не является обязательно истинным. Соответственно, может появиться возможность для нуклеотидной последовательности стать существенно измененной (например, как описано выше при рассмотрении дегенерации генетического кода) без воздействия на пептидную последовательность каким-либо путем. Вообще, известно, что такой полиморфизм демонстрируют гены эукариотов например, как это иллюстрируется геном интерферона (Nishi et al., J. Biochem. 97 (1985) 153-159). Полиморфизм может также существовать в зависимости от типа клетки, из которой происходит РНК. Такие мутанты и варианты входят в объем изобретения.
Настоящее изобретение также предлагает нуклеотидные последовательности, которые гибридизируют с последовательностью ID N 1, и предпочтительно такие последовательности должны показывать 50% избыток, предпочтительнее - 70%, и наиболее предпочтительно - 80%, гомологии с последовательностью, упомянутой выше.
Нуклеотидные последовательности настоящего изобретения предпочтительно, представляют собой последовательности ДНК. Такие последовательности могут использоваться одни, например, в качестве проб, но, как правило, предпочтительно, чтобы они образовывали часть системы экспрессии. Таким образом, предпочтительно, чтобы последовательность ДНК составляла часть вектора, подходящего для системы экспрессии.
Природа векторов для применения в соответствии с настоящим изобретением не является существенной для изобретения. Вообще, для специалистов вопрос о подходящих векторах, векторах экспрессии и их строении ясен.
Подходящие векторы экспрессии могут основываться на фагах или плазмидах, которые обычно являются специфическими хозяевами, хотя они часто могут быть сделаны для других хозяев. Другие подходящие векторы включают космиды и ретровирусы и любые другие носители, которые могут или не могут являться специфическими для данной системы. Регулирующие последовательности, такие как распознающие, стимуляторы, операторы, индукторы, терминаторы и другие последовательности, существенные и/или пригодные для регулировки или экспрессии, будут ясны для специалистов, и могут связываться с последовательностью природного AGIF или с используемым вектором или могут образовываться из любого другого подходящего источника. Векторы могут быть модифицированы или сделаны любым подходящим способом.
Особенно подходящей нуклеотидной последовательностью, кодирующей производное AGIF настоящего изобретения, является последовательность ID N 7 а (см. в конце текста описания) и ее мутанты, варианты и комплементарные последовательности, например, такие, как определено выше.
Настоящее изобретение также предлагает способ получения полипептида, о котором упоминалось выше, и этот способ включает получение носителя экспрессии, содержащего последовательность ДНК, кодирующую производное AGIF, как упоминалось выше, трансфекцию соответствующей клетки-хозяина с упомянутым вектором, выращивание упомянутой клетки-хозяина в условиях, в которых возможна экспрессия упомянутого производного AGIF, необязательную обработку культуры ферментом, способным расщеплять экспрессированное производное AGIF в специфическом сайте, и выделение упомянутого экспрессированного производного AGIF из культуры. Этот способ позволяет получать требуемое производное AG1F в промышленном масштабе, достигая как высокого выхода, так и высокой чистоты.
Вообще, существует ряд способов, которые можно использовать для получения пептида и нуклеотидных последовательностей настоящего изобретения.
В одном из вариантов осуществления изобретения встречающийся в природе пептид может быть получен обычным способом и переварен (расщеплен) для удаления желаемого числа аминокислот из N-концов. Такое переваривание может быть облегчено изменением нуклеотидной последовательности, чтобы создать сайт, такой как термо- или хладонеустойчивый, например, или распознаваемый остаток или последовательность в кодированном пептиде, где может быть осуществлено, например, химическое расщепление или ферментное расщепление. Подходящие пептидазы хорошо известны специалистам, и в иных случаях подходящим является использование трипсина.
Одним из подходящих способов получения полипептидов настоящего изобретения является получение ДНК, кодирующей зрелую форму AGIF, с использованием способов, описанных в литературе [Kawashima et al., FEBS. Letters 283 (1991 199-202)] . На эту ДНК затем воздействуют такими техническими приемами, как мутагенез in vitro, для того, чтобы достичь последовательности ДНК, кодирующей желаемый полипептид, т.е., полипептид, который эквивалентен зрелому AGIF, но в котором недостает от 2 до 9 N-концевых аминокислотных остатков. Образующаяся в результате последовательность затем может быть выражена непосредственно, или, напротив, слита с другой ДНК-последовательностью, таким образом, чтобы слитый белок являлся результатом экспрессии. Затем, чтобы получить желаемый полипептид, слитый белок может быть переварен стандартным образом, например, путем использования подходящего фермента. К числу партнеров для образования слитого белка с производным AGIF настоящего изобретения относятся, например, любые полипептиды, которые включают распознаваемую для специфического энзима последовательность в C-конце. Одним из таких подходящих партнеров является протеин, связывающий мальтозу, или его производные. После образования слитого белка между протеином, связывающим мальтозу, и производным AGIF настоящего изобретения и после добавления фактора коагуляции крови Xa слитый белок расщепляют и получают в результате желаемое производное AGIP.
Кодирующая ДНК для производного AGIF настоящего изобретения может быть введена в подходящий вектор, и клетки-хозяева прокариотов и эукариотов затем могут быть трансформированы с таким вектором. Используя технические приемы, стандартные для технологии построения вектора и экспрессии протеина в клетке-хозяине, ДНК, кодирующая производное AGIF, может быть выражена в клетках-хозяевах.
Культуры, пригодные для получения производных AGIF настоящего изобретения, соответственно, могут быть культурами любых живых клеток и могут меняться от прокариотических систем экспрессии до эукариотических систем экспрессии.
Предпочтительные прокариотические хозяева включают, например, Escherichia coli u Bacillus subtilis. Для того, чтобы выразить ген-значения в этих клетках-хозяевах, клетки-хозяева трансформируются с носителем, содержащим ДНК-последовательность, которая выражается, например, вектором плазмиды. Этот вектор обычно будет содержать репликон, который является источником репликации, произведенной из видов, имеющих совместимость с хозяином, и регуляторные последовательности. Кроме того, желательно, чтобы вектор содержал последовательность, придающую селективность характеру экспрессии, или фенотипу, трансформированных клеток.
Выбор вектора и/или клетки-хозяина не является существенным для настоящего изобретения и этот выбор будет зависеть, как обсуждалось выше, от различных факторов. Вообще, мы считаем, что когда в качестве клетки-хозяина используется E. coli, широко доступная линия K12 является подходящей, в то время как в качестве векторов подходящими являются широко доступные плазмиды pBR322 и pUC.
Как обсуждалось выше, часто необходимо, или по крайней мере желательно, включать различные регулирующие последовательности, когда осуществляется экспрессия протеинов, таких как производные AGIF настоящего изобретения. При использовании в качестве клетки-хозяина E. coli, подходящие промоторы включают триптофановый промотор (trp), лактозный (lac) промотор, триптофан-лактозный (tac) промотор, липопротеиновый (lpp) промотор, происходящий от бактериофага лямбда ( λ ) PL промотор и промотор - фактор TU, удлиняющий (extending) полипептидную цепь (tufB). Любой из этих промоторов может быть использован при получении производных AGIF настоящего изобретения.
При использовании в качестве клетки-хозяина B. subtilis мы обычно предпочитаем применять широко доступную линию 207-25. Подходящим вектором для использования с этой клеткой-хозяином является pTUB228, описанная в Ohmura et al. in J. Biochem. 95 (1984) 87-93. В качестве промотора в этом векторе часто используется регуляторная последовательность λ -амилазного гена B. subtilis. Если желательна экспрессия вне клетки, т.е., если полипептид должен быть выделен из клетки, кодирующая последовательность ДНК для сигнальной последовательности α -амилазы может быть связана с кодирующей последовательностью производного AGIF с использованием стандартных технических приемов.
Эукариотические клетки, которые могут быть использованы для экспрессии полипептидов настоящего изобретения, включают клетки позвоночных, насекомых, дрожжей и т.д. Как упоминалось выше, выбор клетки не является существенным для настоящего изобретения. Однако обычно для экспрессии протеинов в клетках позвоночных наиболее часто используют COS клетки, которые получают от обезьян (Gluzman, Cell 23 (1981) 175-182), и лишенную дигидрофолат-редуктазы линию яичниковых клеток китайского хомяка (CHO) (Urlaub and Chasin, P.N.A.S. USA, 77 (1980) 4216-4220, и мы нашли, что они являются особенно подходящими для использования в связи с настоящим изобретением.
Обычно желательно для экспрессии в клетке позвоночного включать стандартные регуляторные последовательности в вектор экспрессии, такие как промоторная последовательность, локализированная из верхней части (upstream) гена, который выражается, сайт стыковки РНК, сайт полиаденилации, последовательность окончания транскрипции, и т.д. Этот вектор также может иметь источник репликации, когда необходимо. Типичным примером такого вектора экспрессии является pSV2dhfr, который имеет раннеспелый (early) промотор SV40 (Subramani et al., Mol. Cell. Biol. 1 (1981) 854-864).
Клетки дрожжей также типично используются в качестве эукариотического микроорганизма-хозяина. Виды Saccharomyces, такие как Saccharomyces cerevisiae, являются особенно предпочтительными в качестве хозяев экспрессии. Известны многие векторы, которые являются подходящими для
экспрессии протеинов в дрожжевых клетках. Предпочтительно, чтобы такие векторы также включали регуляторные последовательности. Предпочтительно для настоящего изобретения использовать промотор гена спиртовой дегидрогеназы (Bennetzen and Hall, J.Biol. Chem. 257 (1982) 3018-3025) или промотор гена кислой фосфотазы (Miyanohara et al., P.N.A.S. USA 80., (1983) 1-5).
В способе настоящего изобретения особенно предпочтительно выражать полипептиды в клетках COS. Вектор, содержащий последовательность ДНК, которая выражается, в таком случае, как правило, содержит SV40 источник репликации (который дает возможность автономной репликации вектора в клетках COS), а также промотор транскрипции, сигнал окончания транскрипции и сайт стыковки (сращивания) РНК. Такие последовательности являются стандартными в технологии и должны быть известны специалистам.
Вектор экспрессии может быть введен в клетки-хозяева с использованием технических приемов, которые являются стандартными в технологии. Так, например, вектор экспрессии может быть введен в клетки COS с использованием метода с диэтиламиноэтилдекстраном (DEAE - декстран), как описано в Luthman and Magnusson in Nucleic Acids Res. 11 (1983) 1295-1308, метода соосаждения фосфата кальция и ДНК, описанного в Graham and von der Ed in Virology 52 (1973) 456-457, или метода электропунктуры или электропорации, описанного в Neumann et al., in EMBO J., 1 (1982) 841-845. Подходящие технические приемы введения вектора экспрессии в клетки CHO, так, чтобы трансформированные клетки могли стабильно продуцировать производное AGIF, включает сотрансфекцию вектора, способного выражать неоген, функционирующий как устойчивый маркер G418, такой как pRSVneo (Sambrook et al., "Molecular Cloning - A Laboratory Manval", Cold Spring Harbor Laboratory, NY (1989), или pSV2-neo (Sovthern and Berg, J. Mol. Appl. Cenet., 1 (1982) 327-341), вместе с вектором экспрессии, сопровождаемым селекцией устойчивых колоний G418.
В зависимости от выбранной клетки-хозяина выраженное производное AGIF будет оставаться внутри клетки или выделяться из клетки в питательную среду. Выбор среды для выращивания и условия выращивания не являются существенными для настоящего изобретения, но в большей степени зависят от выбранной клетки-хозяина. Подходящие среды хорошо известны в технике и являются очевидными для специалистов. Мы вообще считаем, что в настоящем изобретении желаемый полипептид достаточно выражается в клетках COS, когда среда представляет собой либо среду RPMI-1640, либо среду Дульбекко, модифицированную средой Игла (DMEM), к которой, при необходимости, добавляют компонент сыворотки, такой как эмбриональная коровья сыворотка (FBS).
Полипептиды настоящего изобретения могут быть выделены и очищены из клеток или питательной среды с использованием какого-либо одного или сочетания различных известных методик выделения, основываясь, например, на физических и химических свойствах протеина. Специфические примеры таких методов включают обработку обычными осадителями протеина, ультрафильтрацию, различные виды хроматографии, такие как хроматография на молекулярных ситах (гель-фильтрация), адсорбционная хроматография, ионообменная хроматография и высокопроизводительная жидкостная хроматография (HPLC), диализ или сочетания тех или иных методов.
Биологическая активность
Настоящее изобретение, кроме того, предлагает также применение вышеописанных производных AGIF в качестве фармацевтических препаратов. Кроме того, настоящее изобретение предлагает новое фармацевтическое применение известного производного AGIF, которое является зрелой формой AGIF, лишенной N-концевой аминокислоты.
Соответственно, настоящее изобретение предлагает применение в качестве фармацевтического препарата человеческого полипептида, выбираемого из группы, состоящей из производного фактора, ингибирующего липогенез, лишенного от 1 до 9 N-концевых аминокислот, его функционально эквивалентных производных и их предшественников.
Конкретнее, настоящее изобретение предлагает применение в качестве фармацевтического препарата человеческого полипептида, выбираемого из группы, состоящей из полипептидов, содержащих аминокислоты со 2-178 по 10-178 последовательности ID N 2 а (см. в конце текста описания), а также их эквивалентов, мутантов и вариантов их предшественников и производных, как упоминалось выше,
Предпочтительные полипептиды для вышеупомянутого применения имеют одну из приведенных далее последовательностей (см. последовательности ID N 8 и ID N 6 в конце текста описания), а также их эквиваленты, мутанты, варианты, их предшественники и их производные, такие, как описано выше.
Производные AGIF настоящего изобретения, и, в частности, те производные, которые упоминаются далее в качестве примеров, проявляют разного вида активность. Эти виды активности, вкратце, следующие:
1) подавление липопротеин-липазной активности адипоцитов,
2) индуцирование производства предадипоцитами колониестимулирующего фактора (CSF).
3) промотирование образования антитела клетками B,
4) промотирование образования колоний мегакариоцитов,
5) промотирование производства тромбоцитов,
6) способность уменьшать Go-фазу гемопоэтических стволовых клеток.
Принимая во внимание перечисленные выше виды активности, ожидается, что производные AGIF настоящего изобретения будут иметь большое значение как лечебные средства. В частности, ожидается, что они будут иметь значение для лечения цитопений, таких как тромбоцитопения и лейкопения, для усиления функции иммунной системы, для предупреждения или облегчения состояния при ожирении, препятствующего нормальному функционированию организма, для лечения и диагностики различных анемий, таких как апластическая анемия, и других заболеваний крови, и для лечения и диагностики инфекционных заболеваний, вызываемых вирусами, бактериями и паразитами. Также ожидается, что применение производных AGIF настоящего изобретения будет допускать экономию при переливании компонентов крови.
Использованный здесь термин "цитопения" должен распространяться на уменьшение клеточных элементов в крови или в других тканях, являющееся следствием какого-либо заболевания, такого как тромбоцитопения, упорная панцитопения, лейкопения, вызванная токсинами или радиацией, цитопения, следующая за пересадкой костного мозга или цитопения, следующая за химиотерапией, вызванная канцеростатическими средствами, и т.д., а также являющееся следствием какого-либо иммунного заболевания, которое может случайно иметь место в таких условиях.
Использованный здесь термин "активность AGIF" включает какой-либо один или более видов активности, которые обозначены номерами с 1 по 6 в списке, приведенном выше.
Активность производных AGIF настоящего изобретения, которые представляют собой эквиваленты зрелого AGIF, но лишенного 1-9 N-концевых аминокислот, иллюстрируется следующими далее примерами.
Полипептиды настоящего изобретения получают из соединений, встречающихся в природе в теле, и, как таковые, они имеют низкие уровни токсичности. При введении взрослому самцу мыши линии DDY (при весе тела приблизительно 20 г) и после наблюдений в течение 5 дней, показано, что полипептиды настоящего изобретения не имеют поддающейся оценки токсичности при дозах 500 мг/кг тела и менее.
Принимая во внимание их активность, производные AGIF настоящего изобретения, которые представляют собой полипептиды, эквивалентные зрелому AGIF, но лишенные 1-9 N-концевых аминокислот, являются подходящими для применения в качестве терапевтических средств при цитопении и паталогическом ожирении.
Производные AGIF настоящего изобретения, которые представляют собой полипептиды, эквивалентные зрелому AGIF, но лишенные 1-9 N-концевых аминокислот, могут применяться либо отдельно, либо в комбинации с другими лекарственными средствами.
Когда производные AGIF настоящего изобретения применяются для лечения ожирения, препятствующего нормальному функционированию организма, композиция может содержать только такие производные или их сочетание с другими подходящими лекарствами против ожирения, примеры которых включают препараты, подавляющие аппетит, супрессоры парентеральной абсорбции, ингибиторы пищеварительных ферментов, гормоны, ускоряющие метаболизм, ингибиторы синтеза липидов и супрессоры секреции инсулина. Кроме того, композиция может также использоваться в сочетании с лечением диетой и/или лечебной гимнастикой. В этом случае композиция способна усиливать активность или лечебное воздействие других лекарств против ожирения, а также усиливать лечебное действие лекарств, не относящихся к лечебным препаратам против ожирения.
Когда производные AGIF настоящего изобретения используются для лечения цитопений, композиция может быть приготовлена таким образом, чтобы содержать или чтобы использоваться в сочетании с другими подходящими гемопоэтическими факторами, примеры которых включают IL-1 - IL-10, фактор, ингибирующий лейкемию (LIF), фактор стволовых клеток, GM-GSF, G-CSF, M-CSF, фактор, стимулирующий колонии мегакариоцитов (Meg-CSF), фактор отмирания опухоли (TNE) интерферон (IFN) и эритропротеин (EPO). Комбинированное введение, либо в форме отдельных композиций либо в форме комбинированной композиции дает в результате усиление активности гемопоэтического фактора полипептидом настоящего изобретения.
Полипептиды настоящего изобретения могут вводиться любым обычным путем, применяемым для соединений такого типа активности, и лекарственная форма может быть приготовлена в смеси с обычными добавками и адъювантами, применяемыми для этих целей. Например, для орального применения они могут быть изготовлены в виде таблеток, капсул, гранул, порошков или сиропов, в то время, как для парентерального введения они могут формулироваться в виде препаратов для инъекций, внутривенного капельного вливания или в виде суппозиториев.
Эти фармацевтические препараты могут быть получены любыми обычными способами с применением таких добавок, как носители, связующие, дезинтеграторы, смазывающие вещества, стабилизаторы и корригенты.
Когда фармацевтический препарат приготовлен для введения посредством инъекции или внутривенного капельного вливания, он должен быть в форме фармацевтически приемлемого водного раствора, т.е., в виде раствора, который не содержит никаких пирогенов. Такие растворы могут быть приготовлены обычными путями, с учетом таких факторов, как pH, изотоничность и устойчивость, и все это находится в сфере деятельности специалистов.
Дозировка может изменяться в зависимости от, например, возраста, пола, веса тела, диеты, симптомов и тяжести инфекционного заболевания пациента, а также от периода введения и других факторов клинического воздействия. Однако для взрослого человека подходящая дневная доза может составлять от 0,01 до 1000 мг/кг веса тела в день, и она может быть введена как единичная доза (одноразово) или разделена на несколько доз. Для парентерального введения подходящая дневная доза составляет от 0,01 до 100 мг/кг веса тела и вводится путем либо внутримышечной, либо подкожной, либо внутривенной инъекции.
Настоящее изобретение далее описывается с помощью примеров, не являющихся ограничивающими, из которых примеры A-D описывают различные методы определения активности полипептидов настоящего изобретения, и примеры 1-4 описывают способы получения полипептидов настоящего изобретения.
В следующих далее примерах клетки 3T3-LI, которые получают из эмбриональных фибробластов мышей, являются такими, как описано в Green and Kehinde in Cell, 1 (1974) 113-116, и закуплены в American Cell Type CuIture Collection (АТСС). В случае ссылки в следующих далее примерах на клетки культуры ЗТ3-11, эти клетки являются выращенными при 37oC в увлажненной газовой смеси 10 об.% CO2 и 90 об.% воздуха. Субкультура клеток получена в среде A.
Среда A
Среда Дульбекко, модифицированная средой Игла (DMEM), содержащая 4,5 г/л глюкозы (произведена Gibco),
10 об.% иммобилизованной сыворотки коровьего эмбриона (FBS), (произведена Hyclone), и
10 мМ N-2-оксиэтилпиперазин-N'-этансульфокислоты (HEPES), pH 7,2, (произведена Sigma).
Дифференциация клеток 3T3-LI в адипоциты индуцируется в соответствии со способом Rubin et al., J. Biol. Chem. 253 (1978) 7570-7578.
Пример A
Ингибирование трансформации клеток 3T3-LI в адипоциты
Клетки 3T3-LI выращивают суспендированием клеток в среде A, о которой упоминалось выше, при плотности 1,0 • 104 клеток/мл. Переносят пипеткой по 0,5 мл этой культуральной среды в каждую ячейку 48-ячеистой чашки (изготовлена Costar), и клетки выращивают до тех пор, пока они достигнут состояния слияния, т. е. приблизительно 3 дня. Среду затем заменяют свежей средой A и клетки выращивают еще 2 дня. По окончании этого времени среду замещают эквивалентным количеством среды B-среды для индуцирования липогенной дифференциации.
Среда B
DMEM, содержащая 4,5 г/л глюкозы,
10 мМ HEPES (pH 7,2),
3 об.% иммобилизованной FBS,
5 мкг/мл коровьего инсулина (произведен Sigma),
8 мкг/мл d-биотина (изготовлен Sigma),
4 мкг/мл пантотеновой кислоты (произведена Sigma),
1,0 мкМ дексаметазона (изготовлен Sigma), и
0,5 мМ изобутилметилсантина (изготовлен Aldrich).
Образец испытуемого материала добавляют в ячейки одновременно со средой B. В каждую ячейку добавляют небольшое количество образца, причем это количество должно составлять менее одной десятой количества использованной среды B.
После добавления среды B и образца продолжают дальнейшее выращивание клеток, заменяя среду B на свежую среду B каждые 2 дня. Также, каждый раз, когда заменяют среду, добавляют свежий образец. Через четыре - семь дней после первого добавления среды B и образца, среду замещают эквивалентным количеством среды C - среды для сохранения адипоцитов.
Среда C
DMEM, содержащая 4,5 г/л глюкозы,
5 об.% иммобилизованной FBS,
10 мМ HEPES (pH 7,2), и
100 нг/мл коровьего инсулина.
Клетки выращивают в течение 2 дней в среде C и затем их фиксируют 5 об.% формальдегида. Липидные капельки, которые собираются внутри клеток, и клеточное ядро подкрашивают красным нейтральным маслом O и гематоксилином, соответственно, согласно способам, описанным в Mitomo and Takayama ["RINSHOKENSAKOZA" (Clinical Testing Seminar)", vol. 12, "Pathology" (1982), Ishiyaku Publishing].
В частности, при окрашивании красным нейтральным маслом O фиксированные клетки сначала промывают дистиллированной водой, затем промывают 60%-ным раствором изопропилового спирта в воде, после чего клетки окрашивают в течение 10 минут, 0,3% раствором нейтрального красного масла O в 60%-ном изопропиловом спирте. По окончании этого времени клетки снова промывают раствором изопропилового спирта и дистиллированной водой.
Берут фотографии окрашенных клеток, полученные на микроскопе, и считают окрашенные клетки. Считают как клетки, содержащие красные жирные зернышки, так и клетки, содержащие окрашенные ядра. Степень липогенной дифференциации рассчитывают, используя следующую формулу:
Степень липогенной дифференциации % = 100 • Число, клеток, содержащих жирные капельки /Число ядросодержащих клеток
Пример B
Подавление активности липопротеина липазы
Способность образца подавлять активность липопротеина липазы (LPL) может быть измерена с использованием известных методов. В дальнейшем, клетки получают и испытывают, следуя методу, описанному в Beutler et al., in J.Immunal., 135 (1985) 3972-3977. Коротко, это выполняется следующим образом.
Дифференцированные адипоциты 3T3-L1 получают, используя способ, описанный выше в примере A. Однако среда B используется одна, т.е. образец не добавляется к дифференцирующим клеткам на этой стадии. После роста в среде B эту среду замещают свежей средой C, имеющей состав, указанный выше в примере A. На этой стадии также добавляют испытуемый образец в количестве, составляющем примерно одну восьмую объема среды, и клетки выращивают в течение 18 часов (см. фиг. 2). По окончании этого времени среду удаляют и клетки дважды промывают буфером PBS (-) /фосфатная буферная соль без Mg2+ и Ca2+, изготовленная Nissui Seiyaku/. Затем в каждую ячейку добавляют 300 мкл среды D.
Среда D
DMEM, содержащая 4,5 г/л глюкозы,
5 об.% иммобилизованной FBS,
10 мМ HEPES (pH 7,2),
100 нг/мл коровьего инсулина, и
10 U/мл гепарина натрия (изготовлен Novo Industies).
Клетки затем выращивают в течение 1 часа, после чего собирают 100 мкл супернатанта культуры и используют для измерения активности. Измерения выполняют трижды для каждого образца, и окончательный результат получают, определяя среднее из трех измерений.
Активность липопротеина липазы измеряют, используя метод Нильсона-Эля (NiIsson-Ehle) и Schotz описанный в J.Lipid Res. 17 (1976) 536-541. Этот способ кратко может быть изложен следующим образом. Смешивают 100 мкл супернатанта культуры, полученного так, как описано выше, с равным объемом раствора субстрата, имеющего следующий состав:
13 мМ глицерол-три /9,10 (n)-3H/ олеиновой кислоты (51,8 KB eq/мкмол, изготовлена Amersham),
1,3 мг/мл L- α - фосфатидилхолиндистеароила (изготовлен Sigma),
20 мг/мл коровьего сывороточного альбумина (изготовлен Sigma),
135 мМ трис-гидрохлорида (трис-HCl, pH 8,1, изготовлен Sigma),
16,5 об.% глицерина, и
16,5 об.% иммобилизованной FBS.
Получают 13 мМ глицерол-три (9,10(n)-3H/ олеиновой) кислоты (51,8 KB eq/мкмол), разбавляя глицерол-три /9,10(n)-3H/-олеиновую кислоту 370 GB eq/ммол) (изготовлена Amersham ) триолеином (изготовлен Sigma), с последующей очисткой с использованием колоночной хроматографии на силикагеле.
Смеси позволяют реагировать при 37oC в течение 120 минут. По окончании этого времени реакцию останавливают путем добавления 1,05 мл буфера карбонат калия - борная кислота (pH 10,5) и 3,25 мл смеси метанола, хлороформа и гептана с объемным соотношением 141:125:100. После энергичного перемешивания реакционную смесь центрифугируют при 3000 • g в течение 15 минут. Затем измеряют количество 3H в воднометанольном слое, используя жидкостной сцинтилляционный счетчик. Определяют 1 единицу активности липопротеина липазы как активность, продуцирующую 1 мкмол жирной кислоты за 1 минуту.
Пример C
Увеличение количества тромбоцитов
750 мкг AGIF Δ Pro, полученного так, как описано в примерах 3 и 4, растворяют в 3,75 мл буфера PBS (-), содержащего 0,1% (вес/объем) коровьего сывороточного альбумина.
Приобретают семинедельных самцов крысы Sprague-Dawley (Nippon SLC Co. Ltd. ), содержат в хорошем состоянии в течение недели перед экспериментом и разбивают наугад на две группы по 5 крыс в каждой группе. Одну группу выбирают для обработки AGIF Δ Pro и другую группу предполагают использовать как контрольную. Крысы в группе для обработки получают 100 мкг AGIF Δ Pro на кг веса подкожно. Концентрацию раствора AGIF Δ Pro подбирают в соответствии с весом каждой крысы таким образом, чтобы объем вводимого раствора составлял 1 мл. Крысам контрольной группы вводят по 1 мл только буферного носителя. Обработку крыс в той и другой группе проводят один раз в день в течение 5 дней, и каждый раз их перед обработкой взвешивают.
По окончании периода обработки отбирают образцы крови и определяют количество тромбоцитов. Через двадцать четыре часа после последнего введения препаратов крыс усыпляют эфиром и, используя шприцы, содержащие 0,5 мл 3,8% раствора дигидрата тринатрийцитрата, отбирают 4,5 мл крови путем кардиальной пункции. Тотчас определяют количество тромбоцитов, лейкоцитов и эритроцитов в различных образцах, используя счетчик Coulter (модель T5/40, изготовлен Coulter Electric Inc.). Ниже представлены результаты.
Обработанная группа: число тромбоцитов = 1 123 000 ± 66500
Контрольная группа: число тромбоцитов = 893 000 ± 23700
Расчеты даются на кубический миллиметр образца как среднее ± стандартная ошибка.
Количества, полученные для контрольной и обработанной групп, сравнивают, используя метод кратного сравнения, описанный в Dunnet et al., in Biometrics, September (1964) 482-489. В результате такого сравнения устанавливают, что количество тромбоцитов в обработанной группе, т.е. в группе, получающей AGIF Δ Pro, оказывается существенно выше, чем в контрольной группе (с вероятностью менее 5%).
Отсутствует существенное различие в количестве лейкоцитов и эритроцитов у крыс той и другой группы. Кроме того, в течение эксперимента крысы каждой группы набирали вес с одинаковой скоростью.
Также показано, что AGIF Δ Pro увеличивает число тромбоцитов у мышей в нормальном состоянии.
К тому же введение 200 мг/кг AGIF Δ Pro в течение 10 дней крысам, обработанным канцеростатическим средством Carboplatin, ускоряет восстановление от тромбоцитопении, вызванной обработкой AGIF Δ Pro
Пример D
Производное AGIF, полученное так, как описано в примере 2, т.е. производное, в котором отсутствуют 9 N-концевые аминокислоты зрелого протеина, испытывают по способу, описанному выше в примере C. Подобным образом, это соединение показывает способность увеличивать число тромбоцитов.
Пример 1
Экспрессия AGIF
(a) Конструирование вектора экспрессии для AGIF
Действуют по способу, описанному в Kawashima et al., FEBS Letters, 283 (1991) 199-202, чтобы получить плазмиду pcD -20-2. В соответствии с этим способом готовят библиотеку кДНК в векторе экспрессии pcD из поли(A)+РНК, выделенной из стромальной клетки линии KM-102. Стромальную клеточную линию KM-102 получают из костного мозга человека. Библиотеку скринируют олигонуклеотидом, селективным для AGIF, и выделяют соответствующие клоны. После испытания этих клонов (например, используя способ испытания, описанный выше в примере A), из клона выделяют плазмиду, которая способна направлять экспрессию протеина, обладающего активностью типа AGIF в клетках COS-1 (широко доступная клеточная линия, получаемая из клеток обезьян), и обозначают ее pcD -20-2. Затем из клона pcD -20-2 экстрагируют кДНК, кодирующую AGIF, используя стандартные технологические приемы. Эту кДНК затем вводят в вектор высокой экспрессии pcDL - SR α 296 (описан в Takebe et al., Mol. Cell. Biol. , 8 (1988) 466-472), используя методику, описанную в Ohusmi et al., FEBS Letters, 288 (1991) 13-16. Образующийся в результате вектор, обозначенный pSR α -20-2, обеспечивает высокий уровень экспрессии полипептида AGIF в клетках, таких как клетки COS-1.
(b) Экспрессия AGIF в клетках COS-1
Плазмиду, полученную так, как описано на стадии (а), затем трансфектируют в клетки COS-1. Трансфекцию выполняют путем электропорации, используя установку внедрения гена GTE-1, производимую Shimadzu Seisakusho Ltd. Клетки COS-1 готовят для трансфекции путем выращивания клеток в колбе (клетки выращивают в среде Дульбекко, модифицированной средой Игла, содержащей 10% сыворотки коровьего эмбриона, в течение 3 дней при 37oC) до тех пор, пока клетки не достигнут состояния полуслияния. Клетки затем собирают из колбы путем обработки трипсин-этилендиаминтетрауксусной кислотой (трипсин-ЭДТА), после чего собранные клетки дважды промывают буферной фосфатной солью (-) /PBS (-)/ (изготовлена Nissui Seiyaku). После этого промытые клетки суспендируют в буфере PBS (-) при концентрации 1 • 108 клеток/мл. Плазмиду ДНК, т. е. плазмиду PSR α -20-2, полученную так, как описано на стадии (a), готовят для трансфекции путем обработки в соответствии с цезийхлоридным способом, после чего раствор, содержащий обработанные плазмиды, корректируют до концентрации 200 мкг/м путем добавления буфера PBS (-).
Для осуществления трансфекции 20 мкл суспензии клеток COS-1, полученной так, как описано выше, и 20 мкл раствора содержащего плазмиды, полученного так, как описано выше, смешивают, и смесь затем помещают в камеру прибора для электропорации FCT-13 (изготовлен Shimadzu Seisakusho Ltd), в котором расстояние между электродами составляет 2 мм. Затем на прибор подают два импульса в 600 в/50 мкс с интервалом в 1с между импульсами. Затем смесь из камеры прибора для электропорации добавляют к 20 мл раствора среды Дульбекко, модифицированной средой Игла, содержащей 10 об.% сыворотки коровьего эмбриона, после чего образовавшуюся смесь переносят в чашку Петри (диаметр 150 мм). Это все затем культивируют в течение ночи в атмосфере, содержащей 5% об. % CO2, причем температуру при этом поддерживают на уровне 37oC. По окончании этого времени супернатант культуры удаляют аспирацией, клетки и чашку Петри промывают свободной от выворотки средой Дульбекко, модифицированной средой Игла, и к промытым клеткам добавляют 20 мл среды Дульбекко, модифицированной средой Игла. Клетки затем выращивают в тех же условиях еще в течение 3 дней.
По окончании этого времени из культуры удаляют супернатант культуры и проводят испытания путем вестерн-блотанализа, чтобы подтвердить присутствие AGIF (последовательность ID N 4). В этом вестерн-блотанализе используют антитела AGIF p15, которые получают так, как описано в Ohusmi et al., FEBS Letters, 288 (1991) 13-16.
Пример 2
Получение полипептида, обладающего активностью AGIF
Добавляют 0,5 мкг трипсина (произведен Sigma) к 500 мкл супернатанта культуры клеток COS-1, содержащих AGIF, полученного в соответствии со стадией (b) примера 1, и образовавшуюся в результате смесь инкубируют при 37oC в течение 20 минут. По окончании этого времени для инактивации трипсина к смеси добавляют 0,5 мкг ингибитора трипсина из фасоли лима (произведен Sigma). Раствор затем анализируют методом вестерн-блот и результаты этого вестерн-блотанализа показаны на фиг. 1. Как показано на фиг. 1, зрелая форма AGIF демонстрирует кажущуюся молекулярную массу порядка 23000 дальтон, как определено электрофорезом в системе додецилсульфат натрия - полиакриламидный гель (SDS -Page) в условиях восстановления. После обработки этого зрелого AGIF трипсином образуется полипептид, демонстрирующий молекулярную массу порядка 22000 дальтон, что определено электрофорезом в системе додецилсульфат натрия - полиакриламидный гель в условиях восстановления, диализ индуцированного трипсином переваривания зрелого AGIF с применением денситометра (CS-930, изготовлен Shimadzu Seiakusho Ltd.) показывает, что приблизительно 60% зрелой формы AGIF переваривается трипсином в полипептид, имеющий молекулярную массу порядка 22000 дальтон, что установлено электрофорезом в системе додецилсульфат натрия - полиакриламидный гель в условиях восстановления.
Известно, что трипсин обычно демонстрирует субстратную специфичность, т. е., что он "узнает" некоторые аминокислоты. В частности, трипсин будет разрезать пептидную связь в полипептиде только со стороны карбоксильных групп аминокислот - либо аргинина, либо лизина. Поэтому предполагается, что производное зрелого AGIF с более низкой молекулярной массой будет образовываться в результате гидролиза трипсином связи между остатком аргинина в положении 9 в N-конце зрелого A6LF и аминокислотным остатком в положении 10 N-конца.
Чтобы подтвердить это теоретическое предположение, получают вариант зрелого AGIF, в котором остаток аргинина из N-конца в положении 9 замещают другой аминокислотой (но не лизином), например, аспарагином. Этот мутант получают, используя in vitro систему мутагенеза (изготовлена Amersham). После приготовления мутант обрабатывают трипсином в тех же условиях, какие описаны выше. После обработки этим ферментом снижения молекулярной массы полипептида не наблюдается, следовательно, отсутствует и переваривание. Это подтверждает тот факт, что производное AGIF, т.е. полипептид, имеющий молекулярную массу порядка 22000 дальтон, что определено электрофорезом в системе додецилсульфат натрия - полиакриламидный гель в условиях восстановления, который получен в результате обработки трипсином зрелой формы AGIF, имеет валин в качестве N-концевой аминокислоты, т.е., 10-й аминокислоты в N-конце зрелой формы AGIF.
После того как супернатант культуры, полученный трансфекцией клеток COS-1 с pSR α -20-2, обработан трипсином, как описано выше, трипсин инактивируют путем добавления ингибитора трипсина фасоли лима (изготовлен Sigma) до конечной концентрации 1 мкг/мл. Как показано на фиг. 1, этот раствор содержит приблизительно 60% полипептида, имеющего молекулярную массу порядка 22000 дальтон, что определено электрофорезом в системе додецилсульфат натрия - полиакриламидный гель в условиях восстановления.
Способность этого раствора подавлять активность липопротеина липазы (LPL) измеряют, используя методики, описанные выше в примере B. Результаты этих испытаний иллюстрирует фиг. 2. Этими испытаниями продемонстрировано, что способность раствора протеина, обработанного трипсином, подавлять активность LPL, эквивалентна способности, которую показывает зрелый AGIF. Помимо такого типа активности, демонстрируется (используя технические приемы, описанные ранее), что раствор обработанного трипсином протеина подавляет трансформацию клеток 3T3-L1 эмбрионного фибробласта мыши в адипоциты, причем также подавляется дифференциация предадипоцитных клеток линии H-1/A) костного мозга мыши в адипоциты, демонстрируют, используя способ, описанный Nakamura et al., Proc. Soc. Exp. Biol. Med., 179 (1985) 283-287.
Раствор обработанного трипсином протеина, полученного так, как описано выше, разделяют на две фракции, используя ультрафильтрационную мембрану (Centricon C-10, изготовлена Amicon), имеющую фракционную молекулярную массу порядка 10000 дальтон, т. е. на фракцию, содержащую полипептиды с молекулярной массой менее 10000 дальтон (фракция, проникающая сквозь мембрану), и фракцию, содержащую полипептиды с молекулярной массой более 10000 дальтон (фракция, не проникающая сквозь мембрану). Испытывают обе полученные фракции, чтобы определить способность фракций подавлять активность LPL в адипоцитах 3T3-L1. Результаты этих испытаний показывают, что активность типа активности AGIF присуща только фракции, не проникающей сквозь мембрану, т.е. той фракции, которая содержит протеины с молекулярной массой, превышающей 10000 дальтон. Это показывает, что активность типа активности AGIF присутствует в полипептиде, имеющем молекулярную массу порядка 22000 дальтон, образовавшемся в результате обработки трипсином зрелой формы AGIF, и что такая активность не присутствует в пептиде, содержащем 9-аминокислоты, удаленные трипсином из N-конца зрелого AGIF.
Пример 3
Экспрессия полипептида, обладающего активностью AGIF в Escherichia coli
Этот пример показывает получение и экспрессию производного AGIF, которое соответствует зрелому AGIF за вычетом N-концевой аминокислоты.
Вектор M13 mp19 RFI ДНК (изготовлен Toyobo), который представляет собой двухцепочечную ДНК, расщепляют (переваривают) ферментом рестрикции Bam HI, после чего расщепленную ДНК обрабатывают щелочной фосфотазой, чтобы удалить концевые фосфатные группы.
Плазмиду pSR α -20-2, полученную так, как описало в примере 1, расщепляют ферментами рестрикции Bam HI и BGl II. Выделяют и очищают три фрагмента, образовавшиеся в результате этого расщепления, и фрагмент с приблизительно 750 парами азотистых оснований, содержащий кДНК AGIF. Фрагмент, содержащий кДНК AGIF, затем связывают с расщепленной плазмидой M13 mp19, используя лигазу T4 ДНК. Образующуюся ДНК затем используют для трансформации линии DH5 α F' Escherichia coli /приобретена у Gibco/BRL Life TechnoIogies Inc. /, чтобы получить рекомбинантные стерильные пятна. Из образовавшихся тромбоцитов отбирают наугад 12 клонов, после чего для каждого клона выделяют и очищают одноцепочечную ДНК и двухцепочечную RF (репликативная форма) ДНК, используя обычные технические приемы. RF ДНК каждого из 12 клонов расщепляют ферментом рестрикции SmaI и отбирают клон, обозначенный M13 mp19 (20-2), чей продукт расщепления SmaI содержит фрагмент с приблизительно 750 парами азотистых оснований, т.е., содержащий кДНК AGIF.
Синтезируют олигонуклеотид, имеющий последовательность ДНК 5'-CCAGATACAGCTGTCAGGCCTGGGCCACCACCT-3' (последовательность ID N 13), используя in vitro систему мутагенеза (изготовлена Amersham) и следуя методикам, рекомендованным изготовителем, и этот олигонуклеотид ренатурируют до одноцепочечной ДНК клона M13 mp19 (20-2), полученного так, как описано выше, причем посредством этого получают мутант клона фага, обозначаемый M13 mp19 (20-2) μ (фиг. 3). Эта процедура дает сайт рестрикции для фермента рестрикции /рестриктазы/ StuI (сайт AGGCCT), которую вводят в ДНК, и дает возможность получить ДНК, кодирующую зрелый AGIF (последовательность ID N 3) из RF ДНК этого мутантного клона. Сайт StuI вводят в начало кодирующей последовательности для зрелого полипептида AGIF.
ДНК, сформированную в прямую цепь путем расщепления вектора репрессии Е. coli pMAL-C (изготовлен New EngIand Biolabs) ферментами рестрикции StuI и Hind III, и фрагмент, содержащий кДНК AGIF, полученный расщеплением двухцепочечной RF ДНК M13 mp19 (20-2) μ (полученной так, как описано выше) также с StuI и Hind III, присоединяют друг к другу, используя лигазу T4 ДНК. Вектор pMAL-C выбирают потому, что он содержит структурный ген (malE), кодирующий связывающий мальтозу протеин (MBP) из нижней части (downstream) промотора. Линию E. coli TB1 трансформируют этой ДНК, чтобы получить невосприимчивые к ампициллину колонии, способные расти в среде L-агара, содержащей ампициллин (100 мкг/мл).
L-агар
в дистиллированной воде
1% бактотриптона,
0,5% дрожжевого экстракта,
1% NaCI, и
1,5% бактоагара.
Из образовавшихся колоний отбирают наугад 12 клонов и отбирают плазмидный клон, обозначенный pMAL -с-20-2 μ , содержащий кДНК AGIF, как показано картированием ферментом рестрикции (фиг. 5) /последовательность ID N 14, последовательность ID N 15/.
После этого синтезируют два типа взаимно комплементарных олигонуклеотидов. Эти олигонуклеотиды состоят из нуклеотидной последовательности, кодирующей зрелый AGIF (но в который не включен триплет оснований, кодирующий N-концевой остаток пролина зрелого AGIF: последовательность ID N 5), а также из нуклеотидной последовательности, кодирующей аминокислотную последовательность, распознаваемую фактором свертывания крови Xa. Эти олигонуклеотиды затем ренатурируют, чтобы получить связывающую ДНК, имеющую сайт рестрикции BamHI на одном конце, и сайт рестрикции XhoI на другом конце (фиг. 5). Эту синтетическую связывающую ДНК затем присоединяют к вектору ДНК, полученной расщеплением плазмиды pMAL-c-20-2 μ , приготовленной так, как описано выше, с Bam HI и Xho I, и полученный вектор используют для трансформации линии TB1 E. coli. Из образовавшихся устойчивых к ампициллину колоний затем отбирают клон, имеющий связанную мишень, и плазмиду, содержащуюся в отобранном клоне, называют pMAL-c-20-2 Δ Pro (фиг. 5).
Линию TB1, содержащую pMAL-c-20-2 Δ Pro, инокулируют в 50 мл среды E.
Среда E
в дистиллированной воде
1% бактотриптона,
0,5% дрожжевого экстракта,
0,5% NaCl, и
0,2% глюкозы.
Инокулированную среду затем выращивают в течение ночи при 30oC и при встряхивании. По окончании этого времени 10 мл культуральной жидкости инокулируют в 1 л свежей среды E и выращивают далее при 30oC и встряхивании. Когда оптическая плотность культуральной жидкости при 600 нм достигнет 0,5, добавляют изопропил - β - D - тиогалактопиранозид до конечной концентрации 0,3 мМ, после чего инокулированную среду выращивают в течение ночи при 30oC.
По окончании периода выращивания бактерии собирают центрифугированием и суспендируют в 50 мл буфера A.
Буфер A
в дистиллированной воде
10 мМ трис(оксиметил)аминометан-HCl (трис-HCl),
0,2 М NaCl,
1 мМ азида натрия,
10 мМ 2-меркаптоэтанола, и
1 мМ этилендиаминтетрауксусной кислоты (ЭДТК), pH 7,4.
Образовавшуюся суспензию обрабатывают ультразвуком в течение 2 минут, чтобы раздробить бактерии, после чего раздробленные бактерии отделяют центрифугированием при 9000 • g при 4oC в течение 30 минут. Супернатант затем собирают и разбавляют четырехкратным объемом буфера A, после чего разбавленный супернатант фильтруют через фильтр Milex GV (производства Millipore), имеющий размер пор 0,22 мкм. Отфильтрованный раствор собирают и вводят в колонку с амилозной смолой, с объемом слоя 10 мл, и колонку промывают приблизительно 80 мл буфера A. Слитый протеин, состоящий из связывающего мальтозу протеина и AGIF, лишенного N-концевого пролина (AGIF Δ Pro), элюируют из колонки, используя буфер A, содержащий 10 мМ мальтозы, и собирают примерно 2 мл высшей фракции.
Добавляют одну единицу (1 мкг) фактора свертывания крови Ха к 20 мкл сырой фракции слитого протеина MBP-AGIF Δ Pro (содержащего 90 мкг протеина), полученного так, как описано выше, и смесь оставляют перевариваться на 2-24 часа при комнатной температуре. Вслед за реакцией проводят электрофорез в системе додецилсульфат натрия - полиакриламидный гель в условиях восстановления и применяя гель, содержащий 12,5% (в/об) акриламида. Первоначально наблюдают полосу, соответствующую полипептиду с молекулярной массой порядка 62000 дальтон, которая ответственна за слитый протеин AGIEΔPro и еще одну полосу, соответствующую полипептиду с молекулярной массой порядка 23000 дальтон и ответственную за AG IF Δ Pro. В ходе реакции расщепления (переваривания) интенсивность полосы с м.м. 62000 дальтон снижается, в то время, как интенсивность полосы с м.м. 23000 дальтон возрастает. Вестерн-блотанализ полипептида полосы с м.м. 23000 дальтон показывает, что полипептид этой полосы взаимодействует с антителом AGIF p15.
Добавляют 40 единиц (40 мкг) фактора свертывания крови Xa к 800 мкл сырой фракции слитого протеина MBP-AGIF Δ Pro /содержащей 3,6 мг протеина/, полученной так, как описано выше,
и смесь оставляют на ночь при комнатной температуре. По окончании этого времени реакционную смесь концентрируют путем осаждения при обработке трихлоруксусной кислотой (TXK), после чего ее подвергают электрофорезу в системе додецилсульфат натрия - полиакриламидный гель, используя гель, содержащий 12,5% (вес/об), в условиях восстановления. После электрофореза протеиновую полосу переносят с полиакриламидного геля на поливинилидендифторидную (PVDF) мембрану /торговое наименование ImmobiIon, производства Millipore/, используя прибор для гель-мембранного переноса (KS-8441, изготовлен Marisol), в буфере для переноса /0,02% SDS, 20% метанола и 25 мМ трисборной кислоты /pH 9,5/, работая при 0,8 мА/см2, при 4oC в течение 15 часов. После переноса мембрану промывают в течение 5 минут в 10 мМ натрийборатном буфере, содержащем 25 мМ NaCl, и затем в течение 5 минут в чистой воде при постоянном встряхивании. Затем ее высушивают. После этого отрезают часть мембраны, на которую перенесена полоса с молекулярной массой порядка 23000 дальтон, и определяют последовательность от N-конца до 9-го аминокислотного остатка, используя газофазный секвенсер для определения ковалентных формул белков /модель 475A, производства AppIied Biosystems/. Отделяют фенилтиогидантоиновые (PTH) аминокислоты, полученные в каждом реакционном цикле, и идентифицируют посредством высокопроизводительной жидкостной хроматографии с обращенной фазой (HPLC) /применяемая хроматографическая аппаратура представляет собой аппаратуру модели 120A, изготовленной Applied Biosystems/. Аминокислотная последовательность, определенная таким способом, имеет вид
Gly-Pro-Pro-Pro-Gly-Pro-Pro-Xaa-Val-
/Xaa изображает неидентифицированный аминокислотный остаток. Последов. ID N 11/.
На основании этого результата утверждают, что выделенный протеин представляет собой AGIF Δ Pro, в котором отсутствует пролиновый остаток N-конца зрелой формы AGIF.
Перед тем как приступить к биологическим испытаниям, на сырой фракции слитого протеина MBP-AGIF Δ Pro, полученной в соответствии с описанным выше способом, выполняют реакцию расщепления, используя фактор свертывания крови Xa. Полученный в результате этого расщепления AGIF Δ Pro затем выделяют путем очистки сырого образца. Используют технические приемы, включающие сочетание гель-фильтрационной колоночной хроматографии и колоночной хроматографии на CM Toyoperl Pack 650M (производства Tosoh). В ходе электрофореза в системе додецилсульфат натрия - полиариламидный гель при применении геля, содержащего 12,5% (вес/об.) акриламида, и в условиях восстановления протеин в образце перемещается в положение, эквивалентное молекулярной массе порядка 23000 дальтон. Затем определяют биологическую активность полученного таким способом AGIF Δ Pro. Используя вестерн-блотанализ подтверждают, что протеин взаимодействует с антителом AGIF p15 и что очищенный таким способом протеин также демонстрирует способность подавлять дифференциацию предадипоцитов в адипоциты в клетках 3T3-L1 мышей. Более того, этот протеин, что удивительно, также подавляет активность липопротеина липазы (LPL) клеток 3T3-L1, которые уже продифференцированы в адипоциты. Более того, подавление специфической активности этого липопротеина липазы (LPL), по существу, является равным подавлению ее известным зрелым AGIF, как описано в опубликованной заявке по договору о патентной кооперации ВОИС N 92/08735.
Пример 4
Экспрессия полипептида, обладающего активностью AGIF в клетках COS-1
Следующий далее пример показывает получение и экспрессию производного FGIF, которое соответствует зрелому AGIF за вычетом N-концевой аминокислоты.
Следуя процедурам, подобным тем, которые описаны в примере 3, но используя синтетическую олигонуклеотидную последовательность, обозначаемую PRO-DEL 1, имеющую последовательность
5'-GATACAGCTGTCGCCGGGCCCCCACCTGC-3'
/последовательность ID N 16/, и одноцепочечную векторную ДНК M13 mp19 (20-2) /получена так, как описано в примере 3/, получают мутантный фаговый клон, обозначаемый M13 mp19 (20-2)ΔPro. Эта процедура позволяет ввести в ДНК сайт рестрикции для фермента рестрикции Apa 1 /сайт: GGGCCC/ и также позволяет получить кодирующую AGIF Δ Pro ДНК из RF ДНК этого мутантного клона. Сайт Apa I вводят в начало кодирующей последовательности полипептида AGIF Δ Pro. Мутантный клон отбирают путем рестрикционного картирования для сайта Apa I, присутствующего в последовательности PRO-DEL1 Анализ нуклеотидной последовательности доказывает, что этот M13 mp19(20-2) Δ Pro содержит ДНК, кодирующую AGIF Δ Pro, т.е. зрелый AGIF без N-кониевого пролинового остатка (фиг. 6).
Линейную векторную ДНК длиной порядка 4,5 кв, лишенную фрагмента со 190 дарами азотистых оснований, включающего N-концевую область зрелого AGIF, получают путем расщепления плазмиды pSR α -20-2, плазмиды экспрессии клеток COS-1, зрелого AGIF /получена, как описано в примере 1/ ферментом расщепления BaI 1. Подобным образом расщепляют с BaI 1 двухцепочечную RF ДНК M13 mp19(20-2) Δ Pro, полученную так, как описано выше. Удаляют путем расщепления с BaI 1 вектора клонирования фрагмент со 187 парами азотистых оснований, включающий N-концевую область AGIF Δ Pro, и этот фрагмент связывают с линейным вектором, полученным так, как описано выше. Образующуюся в результате ДНК вводят в E. coli DH5 α и отбирают невосприимчивые к ампициллину колонии, которые могут расти в чашках с L-агаровой средой, содержащей ампициллин при концентрации 100 мкг/мл. Отбирают наугад 20 клонов и каждую плазмиду из этих 20 клонов экстрагируют и очищают. Отбирают клон, содержащий фрагмент со 187 парами азотистых оснований, присоединенный с той же ориентацией, что и кДНК AGIF в плазмиде pSR α -20-2, посредством анализа сайта Ара 1 ДНК каждой плазмиды. В результате получают один клон и плазмиду, содержащуюся в этом клоне, обозначают pSRα-(20-2)ΔPro.
Полученная так, как описано выше, pSRα-(20-2)ΔPro представляет собой плазмиду экспрессии для AGIF Δ Pro. Эту плазмиду трансфектируют в клетки COS-1, используя технические приемы, подобные тем, что описаны в примере 1, получают AGIF Δ Pro и переносят в культуральную среду. Таким путем получают один литр свободного от сыворотки культурального супернатанта клеток COS-1, трансфектированных pSRα-(20-2)ΔPro После диализа культурального супернатанта с 20-кратным объемом диализного буфера /10 мМ борная кислота - NaOH (pH 9,0) и 13 мМ KCl/ при 4oC в течение 15 часов, выполняют слабокатионообменную хроматографию, используя систему быстрой жидкостной хроматографии протеинов (FPLC) /производства Pharmacia/. Условия хроматографии следующие:
колонка: CM-ToyopearI Pack 650M (2,2 х 20 см, производство Tosoh),
буфер для элюирования:
раствор A: 10 мМ борная кислота - NaOH (pH 9,0), 13 мМ KCl,
раствор B: раствор A, содержащий 300 мМ NaCl,
скорость потока 3 мл/мин,
объем фракции 3 мл,
градиент концентрации: линейный градиент концентрации - от 100% раствора A до 100% раствора B /в течение 50 минут/.
Фракции, полученные хроматографией и содержащие AGIF Δ Pro идентифицируют вестерн-блоттированием, используя известное антитело AGIF p15. Три последовательные фракции, которые, как определяется этим методом, содержат наибольшее количество AGIF Δ Pro, объединяют, концентрируют осаждением трихлоруксусной кислотой и затем анализируют посредством электрофореза в системе додецилсульфат натрия - полиакриламидный гель, используя гель, содержащий 12,5% (вес/об. ) акриламида, и в условиях восстановления. После завершения электрофореза полосы протеина из полиакриламидного геля блоттируют на поливинилидендифторидную мембрану (Prp BIott, производства AppIied Biosystems/ при 18 в/см, при 4oC, в течение 2,5 часов. Блоттирование осуществляют, используя блоттер гель-мембрана /KS-8441, производство Marisol/, в буфере переноса /0,02% SDS, 20% метанола и 25 мМ трис-бората (pH 9,5)/. После промывания блоттированной мембраны в течение 5 минут 10 мМ натрийборатным буфером (pH 8,0), содержащим 25 мМ NaCI, и затем в течение 5 минут дистиллированной водой, причем при постоянном встряхивании, мембрану сушат на воздухе. После этого часть мембраны, на которую перенесен AGIF Δ Pro /т.е. часть, эквивалентная молекулярной массе порядка 23000 дальтон/, отрезают от этой мембраны и определяют последовательность шести концевых аминокислот протеина, используя газофазный секвенсер для определения ковалентных формул белков /модель 475A, производство Applied Biosystems).
Фенилтиогидантоиновые аминокислоты (PTH-аминокислоты) полученные в реакционных циклах секвенсера, отделяют и идентифицируют высокопроизводительной жидкостной хроматографией с обращенной фазой (HPLC), используя систему 120A /производство Applied Biosystems/. Определенная такой процедурой аминокислотная последовательность имеет вид
Gly-Pro-Pro-Pro-Gly-Pro
/последовательность ID N 17/. Эта последовательность идентична последовательности аминокислот 2-7 зрелого AGIF, и посредством этого подтверждают, что выделенный протеин представляет собой зрелый AGIF, лишенный N-концевого остатка пролина.
Очищают AGIF Δ Pro от свободной от сыворотки среды клеток COS-1, трансфектированных с pSR α -(20-2) Δ Pro, используя способы, подобные тем, которые описаны для очистки зрелого AGIF в Ohsumi et al., FEBS Letters 288 (1991) 13-16. Испытания продукта, полученного таким образом, показывают, что протеин способен подавлять активность липопротеина липазы в клетках 3T3-L1, которые уже дифференцированы в адипоциты. Специфическая активность протеина в этих испытаниях является, по существу, такой же, как активность зрелого AGIF при таких же испытаниях, как описано в опубликованной заявке по договору о патентной кооперации ВОИС N 92/08735.
Информация о последовательности ID N 1
i/ Характеристики последовательности
/A/ Длина: 1065 пар азотистых оснований
/B/ Тип: нуклеиновая; кислота
/C/ Цепочечность: двойная
/D/ Топология: линейная
ii/ Тип молекул: кДНК -мДНК
iii/ Гипотетические: нет
iii/ Антисмысловые: нет
ix/ Признак
/A/ Ключевое название (Name/Key): CDS
/B/ Размещение: 18 .. 614
ix/ Признак
/A/ Ключевое название: зрелый/mat/ пептид
/B/ Размещение: 81 .. 614
ix/ Признак
/A/ Ключевое название: sig nenmug
/B/ Размещение: 18.. 80
Описания последовательностей N 1 - 19 приведены в конце описания.
/2/ Информация о последовательности ID N 2
i/ Характеристики последовательности
/A/ Длина: 199 аминокислот
/B/ Тип: аминокислота
/D/ Топология: линейная
ii/ Тип молекулы: протеин
/2/ Информация о последовательности N 3
i/ Характеристики последовательности
/A/ Длина: 534 пары азотистых оснований
/B/ Тип: нуклеиновая кислота
/C/ Цепочечность: двойная
/D/ Топология: линейная
ii/ Тип молекул: кДНК - мРНК
iii/ Гипотетические: нет
iv/ Антисмысловые: нет
ix/ Признак
/A/ Ключевое название: CDS
/B/ Размещение: 1 .. 534
/2/ Информация о последовательности ID N 4
i/ Характеристики последовательности
/A/ Длина: 178 аминокислот
/B/ Тип: аминокислота
/D/ Топология: линейная
ii/ Тип молекул: протеин
Информация о последовательности ID N 5
i/ Характеристики последовательности
/A/ Длина: 531 пара азотистых оснований
/B/ Тип: нуклеиновая кислота
/C/ Цепочечность: двойная
/D/ Топология: линейная
ii/ Тип молекул: кДНК - мРНК
iii/ Гипотетические: нет
iv/ Антисмысловые: нет
ix/ Признак
/A/ Ключевое название: CDS
/B/ Размещение: 1 .. 531
/2/ Информация о последовательности ID N 6
i/ Характеристики последовательности
/A/ Длина: 177 аминокислот
/B/ Тип: аминокислота
/D/ Топология: линейная
ii/ Тип молекул: протеин
/2/ Информация о последовательности N 7
i/ Характеристики последовательности
/A/ Длина: 507 пар азотистых оснований
/B/ Тип: нуклеиновая кислота
/C/ Цепочечность: двойная
/D/ Топология: линейная
ii/ Тип молекул: кДНК - мРНК
iii/ Гипотетические: нет
iv/ Антисмысловые: нет
ix/ Признак
/A/ Ключевое название: CDS
/B/ Размещение: 1 .. 507
/2/ Информация о последовательности ID N 8
i/ Характеристики последовательности
/A/ Длина: 169 аминокислот
/B/ Тип: аминокислота
/D/ Топология: линейная
ii/ Тип молекул: протеин
/2/ Информация о последовательности ID N 9
i/ Характеристики последовательности
/A/ Длина: 33 пары азотистых оснований
/B/ Тип: нуклеиновая кислота
/C/ Цепочечность: одинарная
/D/ Топология: линейная
ii) Тип молекул: кДНК
iii/ Гипотетические: нет
iv/ Антисмысловые: нет
ix/ Признак
/A/ Ключевое наименование: CDS
/В/ Размещение: 1 .. 33
/2/ Информация о последовательности ID N 10
i/ Характеристики последовательности
/A/ Длина: 11 аминокислот
/B/ Тип: аминокислота
/D/ Топология: линейная
ii/ Тип молекул: протеин
/2/ Информация о последовательности ID N 11
i/ Характеристики последовательности
/A/ Длина: 9 аминокислот
/B/ Тип: аминокислота
/C/ Цепочечность: одинарная
/D/ Топология: линейная
ii/ Тип молекул: пептид
iii/ Гипотетические: нет
iv/ Антисмысловые: нет
v/ Тип фрагмента: N-концевой
(2) INFORMATION FOR SEQ ID NO: 12:
/2/ Информация о последовательности ID N 12
i/ Характеристики последовательности
/A/ Длина: 33 пары азотистых оснований
/B/ Тип: нуклеиновая кислота
/C/ Цепочечность: двойная
/D/ Топология: линейная
ii/ Тип молекулы кДНК
iii/ Гипотетические: нет
iv/ Антисмысловые: нет
/2/ Информация о последовательности ID N 13
i/ Характеристики последовательности
/A/ Длина: 33 пары азотистых оснований
/B/ Тип: нуклеиновая кислота
/C/ Цепочечность: двойная
/D/ Топология: линейная
ii/ Тип молекул: кДНК
iii/ Гипотетические: нет
iv/ Антисмысловые: нет
/2/ Информация о последовательности ID N 14
i/ Характеристики последовательности
/A/ Длина: 37 пар азотистых оснований
/B/ Тип: нуклеиновая кислота
/C/ Цепочечность: одинарная
/D/ Топология: линейная
ii/ Тип молекул: кДНК
iii/ Гипотетические: нет
xi/ Антисмысловые: нет
/2/ Информация о последовательности ID N 15
i/ Характеристики последовательности
/A/ Длина: 37 пар азотистых оснований
/B/ Тип: нуклеиновая кислота
/C/ Цепочечность: одинарная
/D/ Топология: линейная
ii/ Тип молекул: кДНК
iii/ Гипотетические: нет.
iv/ Антисмысловые: есть
/2/ Информация о последовательности ID N 16
/A/ Длина: 30 пар азотистых оснований
/B/ Тип: нуклеиновая кислота
/C/ Цепочечность: одинарная
/D/ Топология: линейная
ii/ Тип молекул: кДНК
iii/ Гипотетические: нет
iv/ Антисмысловые: нет
/2/ Информация о последовательности ID N 17
i/ Характеристики последовательности
/A/ Длина: 6 аминокислот
/B/ Тип: аминокислота
/C/ Цепочечность: одинарная
/D/ Топология: линейная
ii/ Тип молекул: пептид
/ Гипотетические: нет
iv/ Антисмысловые: нет
v/ Тип фрагмента: N-концевой
/2/ Информация о последовательности ID N 18
i/ Характеристики последовательности
/A/ Длина: 33 пары азотистых оснований
/B/ Тип: нуклеиновая кислота
/C/ Цепочечность: двойная
/D/ Топология: линейная
ii/ Тип молекул: кДНК
iii/ Гипотетические: нет
iv/ Антисмысловые: нет
/2/ Информация о последовательности ID N 19
i/ Характеристики последовательности
/A/ Длина: 30 пар азотистых оснований
/B/ Тип: нуклеиновая кислота
/C/ Цепочечность: двойная
/D/ Топология: линейная
ii/ Тип молекул: кДНК
iii/ Гипотетические: нет
iv/ Антисмысловые: нетC





























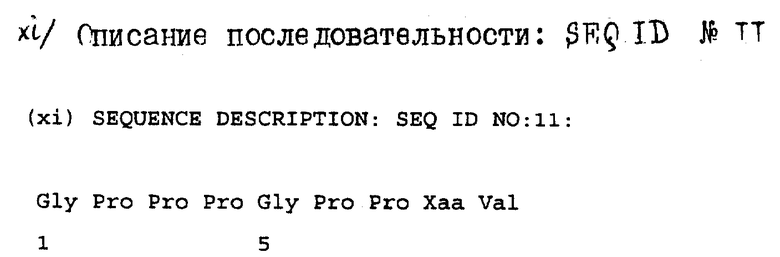





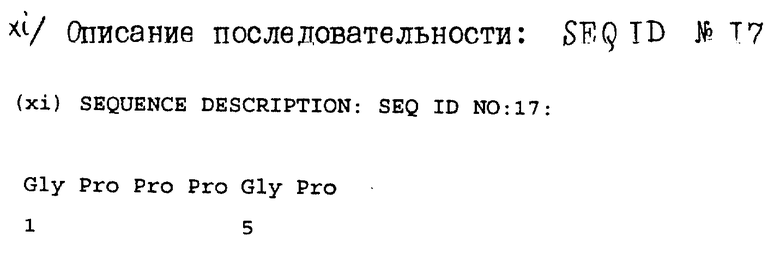


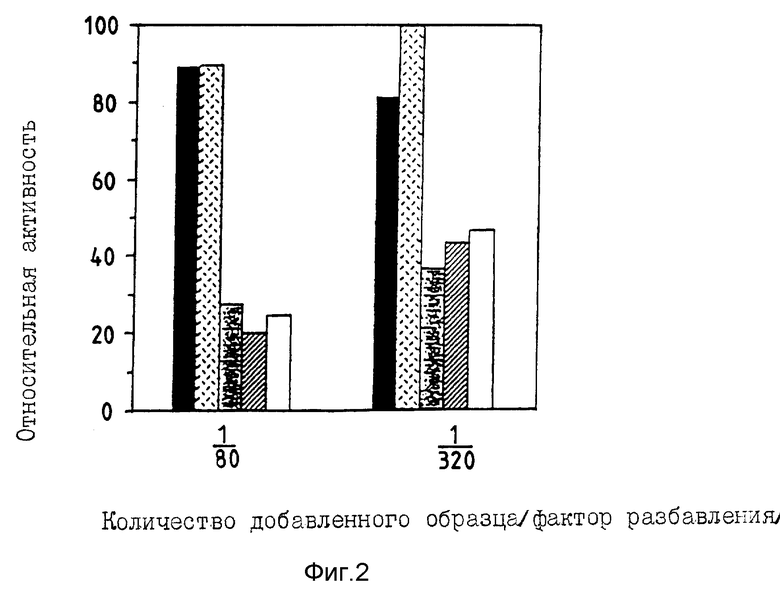

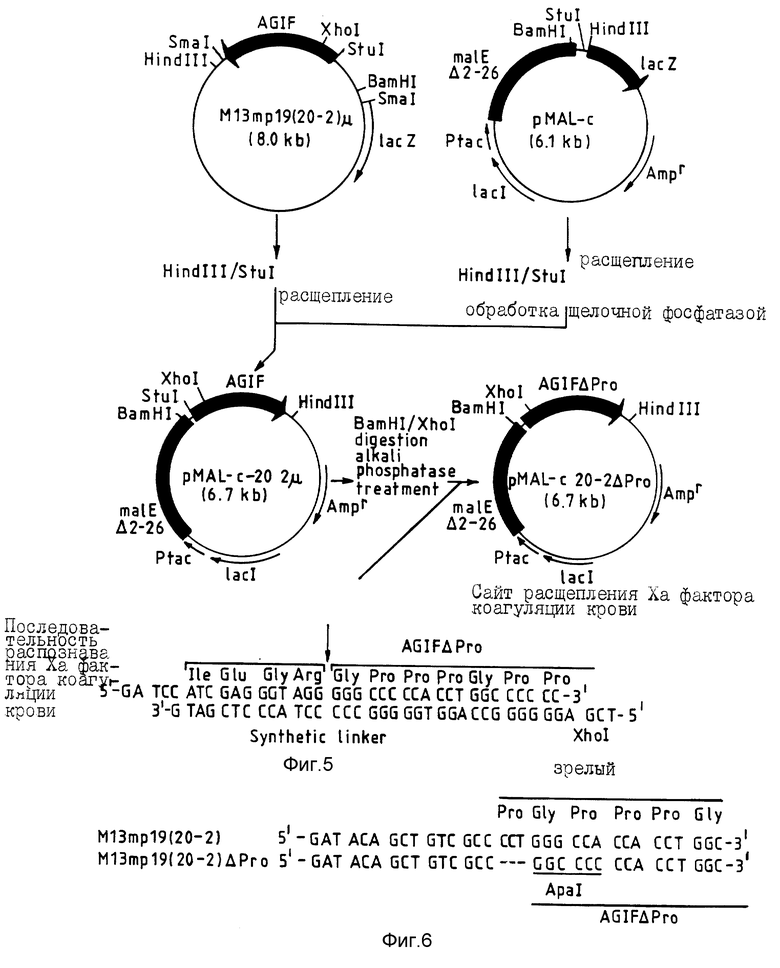
Изобретение относится к биотехнологии и генной инженерии. Полипептид, являющийся производным фактора, ингибирующего липогенез у человека, получают рекомбинантным способом или расщеплением трипсином. У данного полипептида отсутствуют от 1 до 9 N-концевых аминокислот. Получают вектор экспрессии, содержащий AGIF. Данным вектором трансформируют хозяйские клетки. культивируют хозяйские клетки в условиях, разрешающих экспрессию указанного производного AGIF. Выделяют указанное экспрессируемое производное AGIF из культуры. Слитый белок содержит АGIF с делецией от 1 до 9 аминокислот N-конца, слит с белком, связующим мальтозу. Конструируют вектор экспрессии, содержащий ДНК-последовательность, кодирующую слитый белок. Трансформируют соответствующие хозяйские клетки указанным вектором. Культивируют хозяйские клетки в условиях, разрешающих экспрессию указанного слитого белка. Обрабатывают культуру ферментом, способным расщеплять экспрессируемый слитый белок в специфическом сайте. Выделяют целевой продукт из культуры. Изобретение позволяет получить ингибитор дифференциации адипоцитов, а также новые полипептиды, имеющие активность зрелого АGIF. 6 с. и 6 з.п.ф-лы, 6 ил.
| Огнетушитель | 0 |
|
SU91A1 |
| Способ получения чистой окиси железа | 1961 |
|
SU139660A1 |
Авторы
Даты
1999-09-27—Публикация
1993-04-16—Подача