Область техники, к которой относится изобретение
Изобретение касается ранее неизвестного отдельного белка, который способен подавлять дифференцировку клеток на адипоциты, способен подавлять липопротеидную липазу и который (одновременно или по отдельности) способен индуцировать колониестимулирующий фактор. Настоящее изобретение касается также ДНК, которая кодирует упомянутый белок, вектора экспрессии рекомбинантной ДНК, включающего в себя упомянутую ДНК, хозяина, который трансформируется согласно упомянутому вектору экспрессии рекомбинантной ДНК, и белкового состава, включающего в себя эффективное количество упомянутого белка.
Известный уровень техники
Хорошо известно, что существование стромальных клеток костного мозга, которые поддерживают протекание гомопоэза, в дополнение к гемопоэтическим ствольным клеткам и гемопоэтическим различным факторам, или, иначе говоря, гемопоэтическую микросреду, является необходимым для протекания гемопоэза у живого организма. У людей в момент их рождения гемопоэз активно совершается в костном мозге по всему телу. Однако, когда гомопоэз перестает быть необходимым с вырастанием его или ее, костный мозг постепенно оказывается захваченным адипоцитами, распространяющимися от краев конечностей вследствие разрастания мозгового пространства. Костный мозг, в котором протекает гомопоэз, называют красным костным мозгом, а костный мозг, где произошла замена на адипоциты, называют желтым костным мозгом. При ускорении протекания гомопоэза из-за кровотечения или гемолиза гемопоэз возобновляется в желтом костном мозге (Kashiwamura, М. (1988), "IGAKUNO AYOMI (History of Medicine)", 146, 264-268).
Клетки, которые обладают гемопоэтической функцией в гемопоэтической микросреде, в основном представляют собой преадипоциты. Известно, что при дифференцировке этих клеток на адипоциты они теряют эту функцию (Kodama, H. (1986), "SOSHIKI BAIYO (Tissue Culture)", 12, 191-195).
Например, преадипоцитная клетка линии PA6 типа мышиного костного мозга способна поддерживать пролиферацию гемопоэтических ствольных клеток. Однако при дифференцировке этих клеток на адипоциты эта активность уменьшается (Kodama, H. et al. (1984), J. Cell. Physiol. 118, 233-240). Известно, что бластные клеточные мегакариоцитные и макрофаговые колонии могут индуцироваться при совместном культивировании клеток PA6 и клеток мышиного костного мозга (Kodama, H. (1987), "YIKKEN IGAKU" (Experimental medicine)", 5, 826-830). Таким образом, белок, способный подавлять липогенез, воздействует на преадипоциты и адипоциты костного мозга, промотируя их гемопоэтическую способность, или, иначе говоря, он промотирует их способность индуцировать лейкоциты, макрофаги и тромбоциты (возникающие в мегакариоцитах).
Кроме того, сообщают, что величина колониестимулирующего фактора, продуцируемого в преадипоцитной клеточной линии H-I/A, происходящей из мышиного костного мозга, понижается при дифференцировке этих клеток на адипоциты (Nakamura M. et al. (1985), Proc. Soc. Exp. Biol. Med., 179, 283-287).
Как будет показано ниже, ингибирующий липогенез фактор, отвечающий настоящему изобретению, воздействует на клетки линии H-I/A, ускоряя продуцирование макрофагового колониестимулирующего фактора. Помимо стимулирующего воздействия в отношении моноцитов и макрофагов макрофаговый колониестимулирующий фактор оказывается также способным выступать в роли мегакариоцитного потенцирующего фактора (Teramura, M. et al. (1990), Int. J. Cell Cloning, 8, 245-252). Известно также, что макрофаговый колониестимулирующий фактор проявляет способность воздействовать на моноциты, ускоряя продуцирование ими мегакариоцитного потенцирующего фактора. Более того, из данных, полученных при проведении клинической терапии, следует, что макрофаговый колониестимулирующий фактор способствует выздоровлению от нейтропении и тромбоцитопении, сопутствующих проведению карциномной химиотерапии (Motoyoshi, K. (1986), " GAN TO KAGAKURYOHO (Cancer and chemotherapy)", 16, 3531-3536).
Таким образом, ингибирующий липогенез фактор, отвечающий настоящему изобретению, воздействует на костно-мозговые или периферические преадипоциты и адипоциты, усиливая их способность поддерживать протекание гемопоэза.
Примерами белков, которые были известны до появления настоящего изобретения и которые подавляют адипоцитную дифференцировку и липопротеидную липазу у адипоцитов, является опухолевый некрозный фактор- α (Price, S.R. et al. (1986), Arch. Biochem. Biophys., 251, 738-746 and Kawakami, M. et al. (1987), J. Biochem., 101, 331-338), интерлейкин-I (Beutler, B.A. and Cerami, A. (1985), J. Immunol., 135, 3969-3971), интерфероны (Keay, S. and Grossberg, S.E. (1980), Proc. Natl. Acad. Sci. USA, 77, 4099-4103, and Patton, J. S. et al., (1986), Proc. Natl. Acad. Sci. USA, 83, 8313-8317) и ингибирующий лейкоз фактор (Mori, M. et al. (1989), Biochem. Biophys. Res. Commun., 160, 1085-1092). Кислоты кДНК этих факторов уже были клонированы, и их полные структуры уже подтверждены.
Кроме того, хотя до даты приоритета настоящего изобретения и появилось сообщение, в котором описываются выделение и экспрессия кДНК предшественника обезьянего интерлейкина-II наряду с раскрытием природы активности в отношении стимулирования плазмацитомного роста и активности в отношении образования мегакароцитной колонии применительно к надосадочной жидкости культуры (Proc. Natl. Acad. Sci. USA. 87, 7512-7516 (1990)), отсутствует прямая корреляция с настоящим изобретением, поскольку в этом сообщении нечетко проведена существенная идентификация обезьянего интерлейкина-II, а также нечетко подтверждены экспрессия и активность человеческого интерлейкина-II.
Раскрытие существа изобретения
Настоящие изобретатели раскрыли ранее неизвестный отдельный белок, преимущественно обладающий активностью в отношении подавления дифференцировки клеток на адипоциты, в отношении подавления протекания липопротеидной липазы на адипоциты, а также в отношении индуцирования колониестимулирующего фактора (фактор, индуцирующий колониестимулирующий фактор), и тем самым оказались в состоянии получить большие количества упомянутого белка, используя способ генной инженерии, результатом чего явилось настоящее изобретение.
Настоящее изобретение позволяет получать большие количества фактора, ингибирующего липогенез. Как таковой, упомянутый фактор может быть эффективно использован в терапии и диагностике различных типов анемий и других заболеваний крови. Например, упомянутый фактор может быть использован в случае апластической анемии, лейкопении, вызванной токсином или радиацией, инфекцией, вызванных вирусами, бактериями и паразитами, цитопении, возникающей после трансплантации костного мозга, и цитопении, вызванной химиотерапией канциростатическими средствами, и т.д. Кроме того, упомянутый фактор может быть также применен при консервации компонентов переливаемой крови, что в настоящее время находит широкое использование. Более того, помимо этих иммунологических усиливающих воздействий упомянутый фактор может быть также использован для предотвращения ожирения, препятствующего нормальному функционированию организма, или в качестве терапевтического препарата при лечении болезни.
Термин "цитопения", используемый в настоящем изобретении, распространяется на все эти заболевания, а также на различные заболевания иммунной системы, иногда вызываемые этими заболеваниями. Термин "цитопениевый амелиорант (улучшатель)" является родовым названием этих лекарственных препаратов, обладающих свойствами, эффективными в отношении предотвращения и терапии цитопении.
Кроме того, по крайней мере, одна из разновидностей активности, включающая в себя подавление морфологической дифференцировки преадипоцитных клеток на адипоциты, подавление липопротеидной липазы у адипоцитов и поддержание и промотирование способности у преадипоцитов продуцировать колониестимулирующий фактор, может быть названа как "ингибирующая липогенез активность", и белок, обладающий такой активностью, может быть назван как "ингибирующий липогенез фактор".
Настоящее изобретение касается следующих аспектов.
1. Изобретение касается белка, получаемого способом генной инженерии, который в существенной мере не содержит другие белки человеческого происхождения, обладает активностью в отношении ингибирования липогенеза и обладает свойствами, указанными ниже:
1) обладает кажущимся молекулярным весом порядка 23000, установленным электрофорезом в полиакриламидном геле с додецилсульфатом натрия при восстанавливающих условиях с использованием 12,5%-ного геля;
2) он обладает N-концевой аминокислотной последовательностью в виде ряда из аминокислот 1 - 10, указанного в последовательности номер 2 перечня последовательностей, и
3) он подвергается элюированию при концентрациях хлорида натрия в области от 220 до 290 мМ в случае проведения слабой катионообменной хроматографии в следующих условиях:
а) в колонке используется вещество СМ-тойоперлпэк 650М (2,2 на 20 см, фирма "Тосох корпорейшн"),
б) для приготовления элюирующего буферного раствора используют раствор A (раствор борной кислоты с концентрацией 10 мМ в гидрооксиде натрия (pH 9,0) при содержании 13 мМ хлорида калия) и раствор B (раствор A, содержащий 300 мМ хлорида натрия),
в) скорость потока составляет 3 мл/мин,
г) градиент концентрации при проведении упомянутой хроматографии устанавливается линейно изменяющимся с переходом за 50 мин от раствора A с концентрацией 100% к раствору B с концентрацией 100%.
2. Изобретение касается белка, получаемого способом генной инженерии, который в существенной мере не содержит другие белки человеческого происхождения, обладает активностью в отношении ингибирования липогенеза и состоит из аминокислотной последовательности, составленной из аминокислот с числами 1 - 178 с образованием последовательности, указанной в аминокислотной последовательности номер 2 перечня последовательностей, или представляет собой вещество с теми же свойствами, что и упомянутый белок, у которого один или несколько аминокислотных остатков удалено, вставлено или замещено в одном или нескольких сайтах упомянутого белка.
3. Изобретение касается белка, получаемого способом генной инженерии, который в существенной мере не содержит другие белки человеческого происхождения, состоит из аминокислотной последовательности, составленной из аминокислот с числами 1 - 178 с образованием последовательности, указанной в аминокислотной последовательности номер 2 перечня последовательностей, и обладает активностью в отношении ингибирования липогенеза.
4. Изобретение касается белка по пп. 1, 2 или 3, содержащего атом водорода или группу Met (метильная группа) в N-концевом положении.
5. Изобретение касается ДНК-кодирования для белка по пп. 1, 2, 3 или 4.
6. Изобретение касается ДНК-кодирования для белка по п. 1 или п. 2, состоящего из нуклеотидной последовательности с номерами нуклеотидов от 81 до 614 с образованием последовательности, указанной в нуклеотидной последовательности номер 1 перечня последовательностей, или последовательности, обладающей эквивалентными свойствами.
7. Изобретение касается ДНК-кодирования для белка по п. 1 или п. 3, состоящего из нуклеотидной последовательности с номерами нуклеотидов от 81 до 614 с образованием последовательности, указанной в нуклеотидной последовательности номер 1 перечня последовательностей.
8. Изобретение касается ДНК с группой ATG в 5'-концевом положении у ДНК по пп. 5, 6 или 7.
9. Изобретение касается вектора экспрессии рекомбинантной ДНК, включающего в себя ДНК по пп. 5, 6, 7 или 8, в случае чего упомянутая ДНК может быть экспрессирована и репликатирована.
10. Изобретение касается хозяина, трансформированного посредством вектора экспрессии рекомбинантной ДНК по п. 9.
11. Изобретение касается способа продуцирования белка, который включает в себя культивирование хозяина, трансформированного под воздействием вектора экспрессии рекомбинантной ДНК, включающего в себя ДНК-кодирование для белка по пп. 1, 2, 3 или 4, в случае чего упомянутая ДНК может быть экспрессирована и репликатирована, и выделение упомянутого белка из клеточного экстракта или раствора культуры.
12. Изобретение касается фармацевтического состава, содержащего терапевтически эффективное количество белка по пп. 1, 2, 3 и (одновременно или по отдельности) 4 наряду с фармацевтически приемлемым носителем или наполнителем.
13. Изобретение касается цитопениевого амелиоранта, содержащего терапевтически эффективное количество белка по пп. 1, 2, 3 и (одновременно или по отдельности) 4 наряду с фармацевтически приемлемым носителем или наполнителем.
14. Изобретение касается препарата против ожирения, содержащего терапевтически эффективное количество белка по пп. 1, 2, 3 и (одновременно или по отдельности) 4 наряду с фармацевтически приемлемым носителем или наполнителем.
15. Изобретение касается терапевтического или превентивного способа подавления дифференцировки преадипоцитов на адипоциты посредством введения терапевтически эффективного количества белка по пп. 1, 2, 3 и (одновременно или по отдельности) 4 пациентам с цитопенией.
16. Изобретение касается терапевтического или превентивного способа подавления дифференцировки преадипоцитов на адипоциты посредством введения терапевтически эффективного количества белка по пп. 1, 2, 3 и (одновременно или по отдельности) 4 пациентам, страдающим ожирением.
Желательно, чтобы белок, отвечающий настоящему изобретению, представлял собой белок по п. 2 или п. 3, причем лучше по п. 3.
При этом желательно, чтобы ДНК отвечала ДНК-кодированию для белка по п. 2 или п. 3, а лучше - ДНК-кодированию для белка по п. 3.
Определение белка по п. 1 может быть иным.
17. Изобретение касается белка, получаемого способом генной инженерии, который в существенной мере не содержит другие белки человеческого происхождения, обладает активностью в отношении ингибирования липогенеза и обладает свойствами, указанными ниже:
1) он обнаруживает кажущийся молекулярный вес порядка 23000, установленный электрофорезом в полиакриламидном геле с додецилсульфатом натрия при восстанавливающих условиях с использованием 12,5%-ного геля;
2) он обладает N-концевой аминокислотной последовательностью вида (N)-Pro-Gly-Pro-Pro-Pro-Gly-Pro-Pro-Arg-Val: и
3) он подвергается элюированию при концентрациях хлорида натрия в области от 220 до 290 мМ в случае проведения слабой катионообменной хроматографии в следующих условиях:
а) в колонке используется вещество СМ-тойоперлпэк 650М (2,2 на 20 см, фирма "Тосох корпорейшн"),
б) для приготовления элюирующего буферного раствора используют раствор A (раствор борной кислоты с концентрацией 10 мМ в гидрооксиде натрия (pH 9,0) при содержании 13 мМ хлорида калия) и раствор B (раствор A, содержащий 300 мМ хлорида натрия),
в) скорость потока составляет 3 мл/мин,
г) градиент концентрации при проведении упомянутой хроматографии устанавливается линейно изменяющимся с переходом за 50 мин от раствора A с концентрацией 100% к раствору B с концентрацией 100%.
Определение белка по п. 2 может быть иным.
18. Изобретение касается белка, получаемого способом генной инженерии, который в существенной мере не содержит другие белки человеческого происхождения, обладает активностью в отношении ингибирования липогенеза и состоит из аминокислотной последовательности со следующей общей формулой (I), приведенной в конце описания, или касается вещества с такими же свойствами, что и у упомянутого белка, в случае которого один или несколько аминокислотных остатков удалено, вставлено или замещено в одном или нескольких сайтах упомянутого белка.
Описание белка по п. 3 может быть иным.
19. Изобретение касается белка, получаемого способом генной инженерии, который в существенной мере не содержит другие белки человеческого происхождения, обладает активностью в отношении ингибирования липогенеза и состоит из аминокислотной последовательности со следующей общей формулой (I), приведенной в конце описания.
Описание ДНК по п. 6 может быть иным.
20. Изобретение касается ДНК-кодирования для белка по п. 17 или п. 18, состоящего из нуклеотидной последовательности по следующей общей формуле (II), приведенной в конце описания, или нуклеотидной последовательности с эквивалентными свойствами.
Описание ДНК по п. 7 может быть иным.
21. Изобретение касается ДНК-кодирования для белка по п. 17 или п. 19, сводящегося к образованию нуклеотидной последовательности со следующей общей формулой (II), приведенной в конце описания.
Кислоту ДНК, отвечающую настоящему изобретению, получают, например, готовя мРНК, кодирующую белок, обладающий активностью в отношении ингибирования липогенеза, делая это из клеток млекопитающего, которые обладают способностью продуцировать упомянутый белок, с последующим превращением мРНК в двухцепочечную кДНК, используя известный способ. Хотя для животных клеток, которые служат в качестве источника упомянутой выше мРНК, отвечающей настоящему изобретению, и предпочитают использовать линию клеток КМ-102 человеческого костно-мозгового стромального происхождения (Harigaya, K. and Handa, H. (1985), Proc. Natl. Acad. Sci. USA, 82, 3477-3480), могут быть использованы не только опухолевые клеточные штаммы, но также могут быть использованы клетки и ткань, которые могут быть выделены из млекопитающих, или же иные установленные клеточные линии.
Хотя при проведении экстракции мРНК и может быть использован гуанидиновый тиоцианатный горячий фенольный способ или гуанидиновый тиоционатный-гуанидиновый хлористоводородный кислотный способ, предпочтение следует отдавать гуанидиновому тиоционатному хлористоцезиевому способу.
Поскольку известно, что большая часть мРНК, присутствующей в цитоплазме эукариотных клеток, обладает поли-A-последовательностью в 3'-концевой области, мРНК адсорбируют в олиго (dT)-целлюлозной колонке, с преимуществом используя эту характеристику, и затем уже очищают элюированием. Эта мРНК может быть далее подвергнута фракционированию центрифугированием в градиенте плотности сахарозы и т.д.
Чтобы быть уверенным, что полученная таким способом мРНК кодирует белок, обладающий активностью в отношении ингибирования липогенеза, мРНК может быть транслирована в белок с проверкой его физиологической активности или же белок может быть идентифицирован с использованием антитела, являющегося специфическим в отношении упомянутого белка. Например, это может быть осуществлено инжекцией мРНК в ооциты Африканской древесной лягушки (Xenopus Iaevis), чтобы произошла трансляция мРНК в белок (Gurdon, J.B. et al., (1972), Nature, 233, 177-182), или использованием трансляционной реакции, в случае которой применяют ретикулоцитную лизатную систему или систему с экстрактом из семян пшеницы (Schleif, R.F. and Wensink, P.C. (1981), "Practical Method in Molecular Biology", Springer-Verlag, NY).
Тест на активность в отношении ингибирования липогенеза может быть осуществлен измерением активности в отношении морфологического изменения-подавления перехода предадипоцитов в адипоциты, что достигается использованием, например, мышиной клеточной линии 3T3-LI и т.д., или измерением липопротеидной липазой активности (Beutler, B.A. et al. (1985), J. Immunol., 135, 3972-2977).
После осуществления синтеза одноцепочечной кДНК из полученной таким способом мРНК посредством обратной транскриптазы, где мРНК играет роль матрицы, из одноцепочечной кДНК синтезируют двухцепочечную кДНК. Хотя к способам, которые могут быть использованы для проведения этого синтеза, и относятся SI-нуклеазный способ (Efstratiadis, A. et al. (1976), Cell, 7, 279-288), способ Ланда (Land, H. et al. (1981), Nucleic Acids. Res., 9, 2251-2266) и способ О. Жун Ео (Yoo, O, J. et al. (1983), Proc. Natl. Acad. Sci. USA, 79, 10449-1053), предпочтение следует отдавать способу Окаяма-Берга (Okayama, H. and Berg, P. (1982), Mol. Cell. Biol., 2, 161-170), если говорить об объекте, являющемся предметом настоящего изобретения.
Далее, результирующие рекомбинантные плазмиды вводят в культуру Escherichia coli, например, в штамм DH5 α, что необходимо для трансформации упомянутого хозяина. Требуемая рекомбинанта может быть избирательно получена с использованием тетрациклиновой невосприимчивости или ампициллиновой невосприимчивости в качестве индекса. Например, в случае, когда клеткой хозяина является культура Escherichia coli, трансформация клетки хозяина может быть произведена использованием способа Ханахана (Hanahan, D. (1983), J. Mol. Biol., 166, 557-580). Точнее, трансформация может быть осуществлена добавлением упомянутой рекомбинантной ДНК к компетентным клеткам, приготовленным в присутствии CaCl2, MgCl2 или RbCl. Между прочим, фаговые векторы лямбда-штамма и т.д. могут быть также использованы в качестве вектора вместо плазмиды.
Для селекции штамма со способностью ДНК-кодирования в отношении требуемого фактора, ингибирующего липогенез, из трансформированного хозяина, полученного указанным выше способом, могут быть использованы различные способы, указанные ниже.
1. Отборочный способ с использованием синтетической олигонуклеотидной пробы
В том случае, когда аминокислотная последовательность требуемого белка полностью или частично известна (какая-либо область требуемого белка, если упомянутая последовательность состоит из большого числа продолжающихся специфических последовательностей), синтезируют олигонуклеотид, который соответствует упомянутым аминокислотам (нуклеотидная последовательность может быть сконструирована по частоте использования кодона или же она может состоять из большого числа нуклеотидных последовательностей, где нуклеотидные последовательности могут быть смешанными; в последнем случае число упомянутых последовательностей может быть снижено встраиванием инозина). Этот олигонуклеотид используют в качестве пробы (меченой фосфором-32 или серой-35) при гибридизации с использованием денатурированной ДНК трансформированного штамма, который был подвергнут иммобилизации на нитроцеллюлозном фильтре, после чего проводят поиск и селекцию результирующего положительного штамма.
2. Отбор с использованием пробы, приготовленной проведением полимеразной цепной реакции
В том случае, когда аминокислотная последовательность целевого белка полностью или частично известна, синтезируют олигонуклеотиды спиралей одного и обратного направлений, соответствующие белку упомянутых аминокислот. Полимеразную цепную реакцию (Saiki, R.K. et al., (1988), Science, 239, 487-491) проводят, используя эти олигонуклеотиды для амплификации ДНК-фрагмента, кодирующего требуемый фактор, ингибирующий липогенез. Кислоту кДНК синтезируют обратной транскрипцией из мРНК клеток, которые продуцируют фактор, ингибирующий липогенез, или геномная ДНК может быть использована для матричной ДНК, применяемой в этом способе. После введения метки в виде фосфора-32 или серы-35 в приготовленный таким способом ДНК-фрагмент требуемый клон подвергают селекции, проводя колониевую гибридизацию, или бляшковую гибридизацию с использованием ДНК-фрагмента с меткой в качестве пробы.
3. Отбор с продуцированием фактора, ингибирующего липогенез, при использовании других животных клеток
Штамм с кислотой кДНК, кодирующей требуемый фактор, ингибирующий липогенез, выбирают из исходных трансформированных клеточных штаммов, либо культивируя трансформированный штамм, амплифицируя ген, трансфектируя ген в животные клетки (в этом случае прибегают либо к саморепликатируемой плазмиде, содержащей транскрипционную промоторную область, либо к плазмиде, которая может быть внедрена в животную клеточную хромосому), продуцируя белок, кодированный геном, и измеряя ингибирующую липогенез активность у надосадочной жидкости с культурой или у клеточного экстракта, либо, как возможный вариант, обнаруживая ингибирующий липогенез фактор, используя антитело, пригодное для этого фактора.
4. Селекция с использованием антитела для фактора, ингибирующего липогенез
Требуемый штамм подвергают селекции, заблаговременно вводя кДНК в вектор экспрессии, продуцируя белок в пределах трансформанты и обнаруживая трансформанту, продуцирующую фактор, ингибирующий липогенез, используя при этом антитело для фактора, ингибирующего липогенез, и вторичное антитело для упомянутого антитела.
5. Способ с использованием селективной гибридизационной трансляционной системмы
В этом методе после нанесения пятна из кДНК, полученной из трансформанты, на нитроцеллюлозный фильтр или что-то, ему подобное, что необходимо для гибридизации мРНК или клеток, продуцирующих фактор, ингибирующий липогенез, мРНК, связанную с кДНК, подвергают диссоциации и извлечению. Извлеченную мРНК затем либо инжектируют в белковую трансляционную систему, такую как ооциты Африканской древесной лягушки, либо транслируют в белок, используя свободную от клеток систему, такую как кроликовый ретикулоцитный лизат или пшеничный зерновой экстракт, что делают с целью проверки активности такого белка в отношении ингибирования липогенеза, либо, как возможный вариант, фактор, ингибирующий липогенез, может быть обнаружен посредством использования антитела для упомянутого фактора, чем обеспечивается селекция требуемого штамма.
Как это будет описано в последующих примерах, после осуществления первичного отбора с использованием синтетической олигонуклеотидной пробы, сконструированной с учетом существования AUUUA-мотива (Shaw, G. and Kamen, R. (1986), Cell, 46, 659-667), присутствующего наряду с кислотами мРНК цитокинов, что делается еще до применения описанных выше способов, требуемая трансформанта может быть также выбрана применением описанного выше способа 3 в отношении выбранных положительных трансформант, а точнее, продуцированием ингибирующего липогенез фактора в других животных клетках, после чего следует отбор.
Способ получения ДНК, кодирующей фактор, ингибирующий липогенез, из полученной таким способом трансформанты, представляющей интерес, может находиться в согласии с известным способом (Maniatis, T. et al., (1982), "Molecular Cloning - A Laboratory Manual", Cold Spring Harbor Laboratory, NY). Например, это может быть достигнуто выделением плазмидной ДНК из клеток и выделением кДНК-области из упомянутой плазмидной ДНК.
Последовательность, существующая у ДНК, полученной этим способом, может быть определена, например, использованием химического модифицированного способа Максама-Гильберта (Maxam, A.M. and Gilbert, W. (1980), "Methods in Enzymology", 65, 499-559) или использованием способа завершения дидезоксинуклеотидной цепи посредством применения фага M13 (Messing, J. and Vieira, J. (1982), Gene, 19, 269-276).
И здесь, вводя фрагмент, содержащий ген, кодирующий фактор, который ингибирует липогенез, клонированный в этом способе в подходящую векторную ДНК, можно трансформировать клетки хозяина у других прокариотов и эукариотов. Более того, посредством введения надлежащего промотора и последовательности, связанной с экспрессией гена, в эти векторы, ген может быть выражен в надлежащих клетках хозяина.
Примерами прокариотных клеточных хозяев являются, допустим, культуры Escherichia coli и Bacillus subtilis. Чтобы осуществить экспрессию гена, представляющего интерес, в этих клетках хозяина, клетки хозяина могут быть трансформированы с участием репликона, выделенного из частиц, совместимых с хозяином, или, иначе говоря с плазмидным вектором, содержащим точку начала репликации и регуляторные последовательности. Кроме того, желательно, чтобы вектор обладал последовательностью, способной давать трансформированные клетки с избирательным экспрессионным характером (фенотип).
Например, штамм K12 культуры E. coli часто используют для получения хозяина, тогда как плазмиды pBR322 и pUC обычно используют для получения вектора. Однако настоящее изобретение не ограничивается использованием этих образований, и могут быть использованы любые из различных известных типов бактериальных штаммов и векторов. Примерами промоторов являются триптофановый промотор, лактозный промотор, триптофан-лактозный промотор, липопротеидный промотор, лямбда (λ) PL-промотор бактериофагового происхождения и промотор в виде фактора TU со спрямленной полипептидной цепью, находящийся в культуре Eschirichia coli. Любой из этих промоторов может быть использован при продуцировании ингибирующего липогенез фактора, отвечающего настоящему изобретению.
Например, штамм 207-25 желательно использовать для культуры Bacillus subtilis и pTUB228 (Ohmura, K. et al. (1984), J. Biochem., 95, 87-93) и т.д. - использовать для вектора. Однако настоящее изобретение не ограничивается этими образованиями. Часто для промотора используют регуляторную последовательность α-амилазного гена культуры Bacillus subtilis. Секреция вне бактерий может быть, далее, осуществлена использованием ДНК-последовательности, кодирующей сигнальную пептидную последовательность у α-амилазы, как это необходимо.
К эукариотным клеткам хозяина относятся клетки позвоночных, насекомых, дрожжей и т.д. Хотя COS-клетки, которые являются клетками обезьяны (Gluzman, Y. (1981), Cell, 23, 175-182), и штамм с недостаточным содержанием редуктазы фолевой кислоты от яичниковых клеток Китайского хомяка (Urlaub, G. and Chasin, L.A. (1980), Proc. Natl. Acad. Sci. USA, 77, 4216-4220) и т.д. часто и используют в качестве клеток позвоночных, настоящее изобретение не ограничивается этими клетками.
Векторы с промотором, расположенным выше гена, который должен быть экспрессирован, РНК-стыкующий сайт, сайт полиадениляции или транскрипционная завершающая последовательность и т.д. могут быть использованы для вектора экспрессии у клетки позвоночных. Этот вектор может также обладать репликационным началом, как это необходимо. Вектор экспрессии может быть проиллюстрирован образованием pSV2dhfr, имеющим ранний промотор SV40 (Subramani, S. et al. (1981). Mol. Cell. Biol., 1, 854-864). Однако настоящее изобретение не ограничивается упомянутым вектором экспрессии.
Между тем дрожжевую культуру в типичном случае используют для хозяина эукариотного микроорганизма. В частности, желательно использовать дрожжевую культуру вида сахаромицинов, такую как Saccharomyces cerevisiae. В качестве векторов экспрессии для эукариотных микроорганизмов, таких как дрожжи, может быть, например, использован спиртовый дегидрогеназный генный промотор (Bennetzen, J.L. and Hall, B.D. (1982), J. Biol. Chem., 257, 3018-3025) или кислортный фосфатазный генный промотор (Miyanohara, A. et al. (1983), Proc. Natl. Acad. Sci. USA., 80, 1-5).
Что касается клеток хозяина, то для вектора экспрессии, если, к примеру, говорить о COS-клетках, могут быть использованы вектор, способный автономно претерпевать репликацию в COS-клетках и имеющий SV40-репликационное начало, транскрипционной и РНК-связующий сайт. Упомянутый вектор экспрессии может быть введен в COS-клетки использованием DEAE-декстранового способа (Luthman, H. and Magnusson, G. (1983), Nucleic Acids Res., 11, 1295-1308), кальциевофосфатным-ДНК-соосадительным способом (Graham, F. and Van der Ed., A.J. (1973), Virology, 52, 456-457) или электропорационным способом (Neumann, E. et al. (1982), EMBO J., 1, 841-845), чем обеспечивается получение требуемых трансформированных клеток. Между тем, в случае использования яичниковых клеток Китайского хомяка для клеток хозяина трансформированные клетки, которые стабильно продуцируют фактор, ингибирующий липогенез, могут быть получены котрансфекцией вектора, способного экспрессировать неогенное функционирование, как в случае резистентного маркера G418: такого как pRSVneo (Sambrook, J. et al. (1989), "Molecular Cloning-A Laboratory Manual", Cold Spring Harbor Laboratory, NY) или pSV2-neo (Southern, P.J. and Berg, P. (1982), J. Mol. Appl. Cenet. 1, 327-341), наряду с вектором экспрессии, с последующей селекцией G418-резистентных колоний.
Требуемая трансформанта, полученная таким способом, может быть культивирована обычным способом, и тем самым фактор, ингибирующий липогенез, может быть продуцирован либо внутри, либо вне клеток. Среда, используемая при проведении упомянутого культивирования, может быть с успехом выбрана из тех различных типов, которые обычно используют с учетом характера взятых клеток хозяина. Примерами сред, которые могут быть использованы в случае, когда упомянутые выше COS-клетки применяют в качестве клеток хозяина, являются среда RPMI-1640 и минимальная питательная среда Игла (Eagle), модифицированная Далбекко (Dulbecco), к которой при необходимости добавляют сывороточную компоненту, такую как сыворотка коровьего плода.
Так, фактор, ингибирующий липогенез, который продуцирован либо внутри, либо вне клеток трансформанты, может быть выделен и очищен самыми разными известными способами выделения, применяемыми с учетом физических свойств, химических свойств и т.д. фактора, ингибирующего липогенез. Практические варианты реализации упомянутых способов включают обработку обычными белковыми осадителями, ультрафильтрацию, различные типы жидкостной хроматографии, такой как хроматография на молекулярных ситах (гель-фильтрация), адсорбционная хроматография, ионообменная хроматография, хроматография по сродству и высокоэффективная жидкостная хроматография, диализ и использование этих методов в совокупности.
По описанному выше способу требуемый фактор, ингибирующий липогенез, может быть легко произведен в промышленном масштабе, причем как с высоким выходом, так и с высокой чистотой. Различные физические свойства рекомбинантного ингибирующего липогенез фактора, отвечающего настоящему изобретению, который получен этим способом, подробно описаны в последующих примерах. Этот фактор является полезным в различных областях, указанных ранее, что следует из его биологической активности.
Чтобы вещество, полученное способом генной инженерии с использованием ДНК, отвечающей настоящему изобретению, по способу, описанному выше, экспрессировало активность в отношении ингибирования липогенеза, не всегда оказывается необходимым, чтобы упомянутое вещество обладало всеми аминокислотными последовательностями предшественника (белка, составленного из аминокислот с аминокислотными числами от -21 до +178), указанными в последовательности с номером 2 перечня последовательностей; необходимой может быть лишь часть последовательности, к примеру, и эти аминокислотные последовательности включаются в белок, отвечающий настоящему изобретению, поскольку упомянутая последовательность проявляет активность в отношении ингибирования липогенеза.
Примерами такого белка, который проявляет активность в отношении ингибирования липогенеза, являются белки, состоящие из 178 аминокислот с аминокислотой Pro (пролин), которая представляет собой аминокислоту с номером 1 у аминокислотной последовательности, указанной в последовательности с номером 2 перечня последовательностей, и является N-концевой, или, иначе говоря, сюда входят те белки, которые, как это считается, представляют собой факторы с четко проявляемой активностью в отношении ингибирования липогенеза. Между прочим, этот белок обладает кажущимся молекулярным весом порядка 23000, установленным электрофорезом в полиакрилламидном геле с додецилсульфатом натрия при восстанавливающих условиях.
В добавление к сказанному, ДНК, кодирующая упомянутый развившийся фактор с активностью в отношении ингибирования липогенеза, служит также примером ДНК, отвечающей настоящему изобретению. Более желательно, чтобы упомянутая ДНК представляла собой ДНК с номерами от 81 до 614 у нуклеотидной последовательности, указанной последовательностью с номером 1 перечня последовательностей.
В общем случае считают, что гены у эукариотов проявляют полиморфизм, типа известного в случае гена интерферона и т.д. (см., например, работу Nishi, T. et al. (1985), J. Biochem., 97, 153-159). При проявлении этого полиморфизма в виде замещения одной или нескольких аминокислот появляются случаи, когда все разные аминокислоты остаются теми же самыми, несмотря на изменение в нуклеотидной последовательности.
Даже те белки, у которых один или несколько аминокислотных остатков удалено, введено или замещено, по крайней мере, в одном сайте аминокислотной последовательности предшественника фактора с ингибирующей активностью в отношении липогенеза, состоящего из аминокислот с номерами от -21 до +178 у аминокислотной последовательности, указанной последовательностью с номером 2 в перечне последовательностей, а также фактора с уже проявляемой активностью в отношении ингибирования липогенеза, состоящего из аминокислот с номерами от +1 до +178 у аминокислотной последовательности, указанной последовательностью с номером 2, могут также обладать активностью в отношении ингибирования липогенеза. Эти белки называются здесь эквивалентами фактора с ингибирующей активностью в отношении липогенеза.
Например, известно, что белок, полученный конвертированием нуклеотидной последовательности, отвечающей цистеину гена интерлейкина-2, в нуклеотидную последовательность, отвечающую серину, поддерживают свою IL-2-активность (Wang, A et al., (1984), Science, 224, 1431-1433). По этой причине, пока такие белки либо природного, либо синтетического происхождения обладают активностью в отношении ингибирования липогенеза, все они подпадают под настоящее изобретение.
В дополнение к сказанному ДНК, кодирующая эти белки и состоящая из нуклеотидных последовательностей с эквивалентными свойствами, также подпадает под настоящее изобретение.
Различные типы ДНК, отвечающей настоящему изобретению, могут быть изготовлены нуклеиновокислотным химическим синтезом с применением обычного способа, такого как фосфит-триэфирный способ (Hunkapiller, M. et al., (1984),
Nature, 310, 105-111), основываясь на данных об упомянутом выше факторе, ингибирующем липогенез.
Между прочим, для требуемых аминокислот известны также индивидуальные кодоны. Подходящий кодон может быть выбран произвольно, и он может быть определен согласно общепринятым способам (Grantham, R. et al., (1981), Nucleic Acids Res. , 9, 43-74) рассмотрением, к примеру, частоты использования кодона у взятого хозяина. Частичное изменение кодонов у этих нуклеотидных последовательностей может быть произведено обычным способом, таким как специфичный к сайту мутагенез (Mark, D.F. et al. (1984), Proc. Natl. Acad. Sci. USA, 81, 5662-5666), в случае которого используют пример, состоящий из синтезированных олигонуклеотидов, которые кодируют требуемое изменение.
Краткое описание чертежей
На фиг. 1 показана карта ферментного ограничивания у кДНК, кодирующей фактор, ингибирующий липогенез, на которой обозначение ORF характеризует область, допускающую считывание.
На фиг. 2 схематически показана конструкция плазмиды, которая экспрессирует фактор, ингибирующий липогенез, в соответствии с примером 6 настоящего описания.
На фиг. 3 показаны картинка, полученная в случае анализа с проведением электрофореза в полиакриламидном геле с додецилсульфатом натрия, и картинка, полученная при проведении точечного анализа по Уэстерну (Western) с использованием антипептидного антитела при восстанавливающих условиях применительно к суммарным белкам, содержащимся в надосадочной жидкости с культурой из клеток COS-1, трансфектированных с применением ΔΛ-ΣΡα 296 и pSR α-20-2.
Лучший вариант осуществления изобретения
Настоящее изобретение далее будет описываться более специфично посредством рассмотрения примеров, не ограничивающих рамки изобретения, и препаративных примеров. Прежде всего следует заметить, что способ, примененный для измерения активности в отношении ингибирования липогенеза, будет объяснен в сравнительных примерах.
Сравнительный пример
Способ, использованный в настоящем изобретении для измерения активности у фактора, ингибирующего липогенез, сводится к следующему. Клетки, использованные при проведении измерения, представляет собой эмбриональные фибробластовые клетки мышиной линии ЗTЗ-LI (Green, H. and Kehinde, O. (1974), Cell, 1, 113-116), которые были приобретены из Американской коллекции типовых культур микроорганизмов. Культуру всех клеток подвергали воздействию температуры в 37oC при нахождении в увлажненной газовой смеси, содержащей 10% диоксида углерода и 90% воздуха. Клеточную культуру обрабатывали с использованием среды A (среда DMEM (минимальная питательная среда Игла, модифицированная Далбекко) с содержанием глюкозы 4,5 г/л, которую выпускает фирма "Джибко"), содержащей 10% иммобилизированной сыворотки коровьего плода (производства фирмы "Хиклоун") и 10 мМ HEPES (pH 7,2, производства фирмы "Сигма"). Дифференцировку 3T3-LI-клеток на адипоциты индуцировали по способу, описанному Рубином и др. (Rubin, C. et al. (1978), J. Biol. Chem., 253, 7570-7578).
Измерение связанного с ингибирующим действием морфологического изменения клеток линии ЗTЗ-L1 на адипоциты
Культивирование клеток линии ЗTЗ-L1 проводили суспендированием упомянутых клеток в среде A при плотности 1,0•104 клеток на 1 мл, после чего пипеткой отбирали 0,5 мл клеточной суспензии и этот объем помещали в углубление на пластину, на которой было 48 углублений (производства фирмы "Костар"). Клетки становились пригодными для сливания по истечении трех дней культивирования. Среду затем заменяли по свежую среду A, и после культивирования еще в течение двух дней среду заменяли на среду B, индуцирующую липогенную дифференцировку (среда DMEM (минимальная питательная среда Игла, модифицированная Далбекко, с содержанием глюкозы 4,5 г/л), содержащая 10 мМ HEPES (pH 7,2), 3% сыворотки плода коровы, 5 мкг/мл бычьего инсулина (производства фирмы "Сигма"), 8 мкг/мл α-биотина (производства фирмы "Сигма"), 4 мкг/мл пантотеновой кислоты (производства фирмы "Сигма"), 1,0 мкМ дексаметазона (производства фирмы "Сигма") и 0,5 мМ изобутилметилксантина (производства фирмы "Олдрич")). В это время одновременно добавляли образец. Впоследствии среду заменяли свежей средой B каждые два дня, и образец добавляли. На четвертый-седьмой день после добавления среды B и образца, сделанного впервые, среду заменяли на среду C, необходимую для подтверждения существования адипоцитов (среда DMEM (минимальная питательная среда Игла, модифицированная Далбекко, с содержанием глюкозы 4,5 г/л), содержащая 5% иммобилизированной сыворотки плода коровы, 10 мМ HEPES (pH 7,2) и 100 нг/мл бычьего инсулина).
По истечении культивирования в среде C в течение двух дней клетки фиксировали 5%-ным раствором формальдегида. Капельки жира, которые накапливались в клетках и клеточных ядрах, соответственно окрашивали масляным красным O-красителем и гематоксилином. После взятия микрофагов подсчитывали число клеток, в которых происходило красное окрашивание капелек жира, что просматривалось на фотографиях, что делали наряду с подсчетом числа нуклеированных клеток, окрашенных гаматоксилином. Скорость липогенной дифференцировки рассчитывали затем по формуле, приведенной ниже: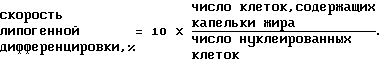
Между прочим, фиксацию клеток, окрашивание масляным красным O-красителем и гематоксилиновое окрашивание проводили в соответствии с требованиями экспериментального руководства (Mitomo, Y. and Takayama, S. "RINSHOKENSAKOZA (clinical Testing Seminar)", Vol. 12, "Pathology" (1982), Ishiyaku Publishing).
Измерение активности в отношении подавления липопротеидной липазы
Измерение проводили по способу, описанному ниже, в соответствии с методикой Бьютлера и др. (Beutler B. A. et al., (1985), J. Immunol., 135, 3972-3977). Жировые клеточные адипоциты трансформированной линии клеток ЗTЗ-LI готовили по способу, описанному в разделе с названием "Измерение связанного с ингибирующим действием морфологического изменения клеток линии ЗTЗ-L1 на адипоциты". Однако при этом не добавляли образец при индуцировании дифференцировки на адипоциты. Среду затем заменяли на свежую среду C, и туда добавляли образец. После культивирования в течение 18 ч среду удаляли, и клетки дважды промывали PBS(-) (фосфатно-солевым буферным раствором; производства фирмы "Ниссуи Сейяки"). Затем в каждое углубление добавляли 300 мкл среды D (среда DMEM (минимальная питательная среда Игла, модифицированная Далбекко, с содержанием глюкозы 4,5 г/л), содержащая 5% иммобилизированной сыворотки плода коровы, 10 мМ HEPES (pH 7,2), 100 нг/мл бычьего инсулина и 10 ед. на 1 ил натриевого гепарина (производства фирмы "Нобо индастриз")). После культивирования в течение одного часа собирали 100 мкл надосадочной жидкости с культурой, и эту жидкость использовали для измерения липопротеидной липазной активности. Измерение активности в отношении подавления липопротеидной липазы проводили на трех пробах каждого образца, после чего по трем измеренным величинам находили среднее значение.
Измерение липопротеидной липазной активности проводили по способу Нилсона-Иле и Шоца (Nilson-Ehle, P. and Schotz, M.С. (1976), J. Lipid Res., 17, 536-541). Для этого 100 л надосадочной жидкости с культурой, приготовленной по способу, описанному выше, смешивали с равным объемом субстратного раствора (13 мМ глицеролтри[9,10(n)-3H]олеиновой кислоты (51,8 кБек/мкмоль, производства фирмы "Амершам"), 1,3 мг/мл L-α-госфатидилхолиндистеароила (производства фирмы "Сигма"), 20 мг/мл бычьего сывороточного альбумина (производства фирмы "Сигма"), 135 мМ трис-гидрохлорида (Tris-HCl, pH 8,1, производства фирмы "Сигма"), 16,5% (объем по объему) глицерина и 16,5% (объем по объему) иммобилизированной сыворотки плода коровы) и оставляли реагировать при 37oC в течение 120 мин. Реакцию останавливали добавлением 1,05 мл 0,1 М карбонатнокалиевого раствора в борной кислоте (буферный раствор с величиной pH 10,5) и 3,25 мл смеси, состоящей из метанола, хлороформа и гептана, взятых по объему в соотношении 141:125:100. После энергичного перемешивания реакционную смесь центрифугировали при 3000 G в течение 15 мин. Счет трития у водно-метанольного слоя проводили с использованием жидкого сцинтилляционного счетчика. Липопротеидную липазную активность в 1 ед. определяли как количество активности, продуцируемой 1 мкмолем жирной кислоты за 1 мин. Между прочим, 13 мкМ глицеролтри[9,10(n)-3H]олеиновой кислоты, содержащейся в субстратном растворе, готовили разбавлением глицеролтри[9,10(n)-3H]олеиновой кислоты (производства фирмы "Амершам", 370 ГБек/моль) триолеином (производства фирмы "Сигма"), после чего проводили очистку методом хроматографии на колонке с силикагелем.
Пример 1
Выделение поли(A)-+РНК из KM-102-клеток
Клетки линии KM-102 культивировали на 36 пластиковых чашках для культивирования (диаметром 15 см) с использованием модифицированной минимальной питательной среды Искова (Iscove) (производства фирмы "Боерингер-Маннгейм), содержащей 10% сыворотки плода коровы. После выращивания клеток до слияния добавляли форболмиристатацетат и кальциевый ионофор A23187, доводя их концентрации соответственно до 10 нг/мл и 0,2 мкМ. Культивирование затем продолжали, причем в этот период клетки на 12 чашках в определенные моменты времени лизировали гуанидинтиоцианатным раствором (4 М гуанидинтиоцианата, 1% саркозила, 20 мМ этилендиаминтетрауксусной кислоты, 25 мМ цитрата натрия (pH 7,0), 100 мМ 2-меркаптоэтанола и 0,1% пеногасителя A), что делали соответственно по истечении 3, 6 и 14 ч; затем раствор извлекали.
Выделение поли(A)+-РНК в основном проводили так, как это описано в руководствах (Maniatis, T. et al. (1982) "Molecular Cloning-A Laboratory Manual", pp. 196-198). Точнее, выделение проводили по методике, описанной ниже.
Выделенные лизированные клеточные растворы многократно отбирали и сливали, что делали несколько раз с использованием шприцов на 10 мл, снабженных соответственно иглами калибра 21G. Раствор, содержащий 5,7 М хлорида цези и 0,1 М этилендиаминтетрауксусной кислоты (pH 7,5), добавляли в количестве 3 мл в каждую полиаломаровую центрифужную пробирку, совместимую с роторной корзиной центрифуги типа RPS-40T, выпускаемой фирмой "Хитати Коки", после чего упомянутые выше лизированные клеточные растворы присоединяли, наливая сверху, к ранее добавленному раствору, что делали до тех пор, пока пробирки не наполнялись. После центрифугирования этих растворов в течение 18 ч при 20oC со скоростью 30000 об/мин результирующие осадки растворяли в 400 мкл дистиллированной воды, а затем проводили осаждение этанолом; и туда добавляли равный объем смеси хлороформа с 1-бутанолом (взятым в соотношении 4:1), после чего осуществляли перемешивание. Водный слой затем извлекали, проводя разделение центрифугированием. После осаждения из водного слоя этанолом осажденные осадки растворяли в 600 мкл дистиллированной воды, чем обеспечивалось получение всей РНК. Из каждого образца, подвергнутого воздействию PMAA23187 в течение 3, 6 и 14 ч, получали в каждом случае примерно 4,5 мг суммарной РНК.
Эти суммарные кислоты РНК, полученные описанным выше способом и взятые в количестве по 600 мкг, смешивали, и смесь подвергали хроматографии на олиго(dT)целлюлозной колонке, чем достигалась очистка поли(A)+-РНК. Иначе говоря, после растворения суммарной РНК в адсорбционном буферном растворе (0,5 М хлорида натрия, 20 мМ Tris-HCl (pH 7,5), 1 мМ этилендиаминтетрауксусной кислоты и 0,1% додецилсульфата натрия) и прогрева при 65oC в течение 5 мин результирующий раствор подавали в олиго(dT)целлюлозную колонку (производства фирмы "Фармация", тип 7), заполненную тем же раствором. Кислоту поли(A)+-РНК извлекали элюированием элюентом (10 мМ Tris-HCl (pH 7,5), 1 мМ этилендиаминтетрауксусной кислоты и 0,05% додецилсульфата натрия), в результате чего получали 100 мкг поли(A)+-РНК.
Пример 2
Получение библиотечных данных для кДНК
Библиотечные данные для кДНК получали по способу Окаяма-Берга. Точнее, 5 мкг поли(A)+-РНК и 24 ед. обратной транскриптазы приводили во взаимодействие в реакционной смеси (50 мМ Tris-HCl (pH 8,3), 8 мМ хлорида магния, 30 мМ хлорида калия, 0,3 мМ дитиотреитола, 2 мМ дАТФ, 2 мМ дГТФ, 2 мМ дЦТФ, 2 мМ дТТФ, 10 мкКи [α-32P] дЦТФ и 1,4 мкг векторной примерной ДНК (3'-олиго(dT)-концевой pcDV-1; производства фирмы "Фармация")) при 42oC в течение 60 мин.
После прерывания взаимодействия добавлением 2 мкл 0,25 М этилендиаминтетрауксусной кислоты и 1 мкл 10%-ного додецилсульфата натрия белок удаляли обработкой 20 мкл смеси, состоящей из равных объемов фенола и хлороформа. К водному слою, полученному центрифугированием, добавляли 20 мкл 4 М ацетата аммония и 80 мкл этанола, после чего раствор охлаждали при -70oC в течение 15 мин. Далее, осадок собирали, проводя разделение центрифугированием, и осадок промывали 75%-ным этанолом, после чего сушили при пониженном давлении.
Затем высушенный осадок растворяли в 15 мкл концевой трансферазной реакционной смеси (140 мМ какодилата калия, 30 мМ Tris-HCl (pH 6,8), 1 мМ CoCl2, 0,5 мМ дитиотреитола, 0,2 мкг поли-A (полиадениловой кислоты) и 100 мМ дЦТФ). После выдерживания реакционной смеси при 37oC в течение 3 мин туда добавляли 18 ед. дезоксинуклеотидильной трансферазы и смеси давали реагировать в течение 5 мин. Затем после прерывания взаимодействия добавлением 1 мкл 0,25 М этилендиаминтетрауксусной кислоты и 0,5 мкл 10%-ного додецилсульфата натрия белок извлекали смесью фенола с хлороформом. После центрифугирования реакционной смеси водный слой отделяли и туда добавляли 15 мкл 4 М ацетата аммония и 60 мкл этанола, после чего проводили тщательное перемешивание. После охлаждения смеси при -70oC в течение 15 мин полученный таким способом осадок собирали центрифугированием.
Этот осадок затем растворяли в 10 мкл ограничительного ферментативного буферного раствора (50 мМ хлорида натрия, 10 мМ Tris-HCl (pH 7,5), 10 мМ хлорида магния и 1 мМ дитиотреитола), и туда добавляли 2,5 ед. ограничительного фермента HindIII, чтобы происходило расщепление осадка, которое проводили при 37oC в течение примерно 1 ч. Затем после удаления белков обработкой смесью фенола с хлороформом проводили осаждение этанолом. После охлаждения реакционной смеси при -70oC в течение 15 мин осадок собирали центрифугированием и растворяли в 10 мкл буферного TE-раствора (10 мМ Tris-HCl (pH 7,5) и 1 мМ этилендиаминтетрауксусной кислоты). К 9 мкл реакционной смеси (10 мМ Tris-HCl (pH 7,5), 1 мМ этилендиаминтетрауксусной кислоты и 100 мМ хлорида натрия) добавляли 1 мкл этого раствора, куда добавляли 10 нг олиго(dG)-концевой связующей дНК (3'-олиго(dG)-концевой связыватель типа pL-1 Hind 3; производства фирмы "Фармация"), после чего грели при 65oC в течение 5 мин. Реакционную смесь затем оставляли стоять при 42oC в течение 30 мин. После охлаждения реакционной смеси в воде со льдом туда добавляли 10 мкл 10х-лигазного буферного раствора (10 мМ АТФ, 660 мМ Tris-HCl (pH 7,5), 66 мМ хлорида магния и 100 мМ дитиотреитола), 78 мкл дистиллированной воды и 8 ед. T4-ДНК-лигазы, после его оставляли стоять при 12oC на ночь.
Затем добавляли 10 мкл 1 М хлорида калия, 1 ед. рибонуклеазы H, 33 ед. ДНК-полимеразы 1, 4 ед. ДНК-лигазы T4, 0,5 мкл нуклеотидного раствора (20 мМ дАТФ, 20 мМ дГТФ, 20 мМ дЦТФ и 20 мМ дТТФ) и 0,1 мкл бычьего сывороточного альбумина с концентрацией 50 мкг/мкл, и смесь выдерживали при 12oC в течение 1 ч и затем при 25oC в течение 1 ч. После пятикратного разбавления реакционной смеси дистиллированной водой штамм DH5 α культуры Escherichia coli сразу же трансформировали, делая это по способу Ханахана (Hanahan, D. (1983), J. Mol. Biol. 166, 557-580), в результате чего получали библиотечные данные для кДНК клеток линии KM-102.
Пример 3
Приготовление олигонуклеотидной пробы
Олигонуклеотид из 15 оснований вида 5'-TAAATAAATAAATAA-3', обозначенный как ATT-3, химически синтезировали, исходя из последовательности AUUUA, сохраненной в нетранслируемой 3'-области мРНК цитокинов. Синтез проводили, используя автоматический синтезатор ДНК типа 380B, выпускаемый фирмой "Эплайд биосистемз", что делали согласно методикам, приведенным в руководстве. Этот способ основывается на принципе, описанном Карутерзом и др. (Metteucci, M. D. and Caruthers, M.H. (1981), J. Am. Chem. Soc. 103, 3185-3191), и он называется фосфоамидитным способом. После синтеза 15 нуклеотидов они были деблокированы посредством отделения от подложечной смолы, и результирующая смесь была подвергнута сушке вымораживанием, в результате чего был получен олигонуклеотидный порошок. Порошок растворяли в дистиллированной воде и до момента использования хранили в замороженном состоянии при -20oC.
Пример 4
Отбор библиотечных данных для кДНК
На нитроцеллюлозном фильтре фиксировали 6500 штаммов рекомбинантных кислот ДНК, взятых из упомянутой выше библиотеки для кДНК клеток линии KM-102, что делали по способу, описанному Грунштейном и Хогнессом (Grunstein, M. and Hogness, D.S. (1975), Proc. Natl. Acad. Sci. USA, 72, 3961-3965). Далее, колониевую гибридизацию проводили после введения метки у 5'-конца пробы (ATT-3) с использованием фосфора-32, что делали по обычной методике (см. руководство "Molecular Cloning-A Laboratory Manual"). Предгибридизацию проводили в растворе, содержащем состав 6 X SSC (в состав 1 X SSC входят 150 мМ хлорида натрия и 15 мМ трехнатриевого цитрата), 1-X-раствор Денгардта (Denhardt), 0,25% додецилсульфата натрия, 0,05% пирофосфата натрия и 100 мкг/мл денатурированной ДНК лососевой спермы, что делали при 37oC в течение 3 ч, после чего гибридизацию проводили в реакционной смеси, состоящей из состава 6 X SSC, содержащего пробу из радиоактивной метки в виде фосфора-32 (ATT-3), 1-X-раствор Денгардта, 17 мкг/мл дрожжевой тРНК и 0,05% пирофосфата натрия, что делали при 31oC в течение ночи. После завершения реакции нитроцеллюлозный фильтр промывали раствором 6 X SSC, содержащим 0,05% пирофосфата натрия, что делали при комнатной температуре в течение двух часов, после чего проводили авторадиографию. В результате сказанного получали 33 положительных клона. Проводя выделение плазмидной ДНК из этих клонов с использованием обычной методики, произвольно выбирали несколько клонов, после чего проводили определение состава у частной нуклеотидной последовательности кДНК, для чего использовали дидезокси-метод. Используя персональный компьютер, проводили затем поиск гомологов из нуклеотидных последовательностей, у которых нуклеотидные последовательности зарегистрированы в банке данных Генбанка или лаборатории EMBL. Было, тем самым, определено, что область, подвергнутая гибридизации под воздействием ATT-3-пробы, является гомологичной некоторым членам AIu-повторной последовательности (Schmid, C.W. and Jelinek, W.R. (1982), Science 216, 1065-1070).
Следовательно, введя метку в виде фосфора-32 в ДНК-фрагмент, содержащий AIu-повторную последовательность, полученную из человеческой геномной ДНК, при проведении колониевой гибридизации упомянутых выше 33 клонов с использованием этого фрагмента для образования пробы, установили, что 12 клонов обладают AIu-повторными последовательностями. При обследовании длины кДНК-вставки у оставшихся 21 клонов установили, что вставки содержат от 50 до 3600 оснований. После проведения картирования ограничительными ферментами кислоты кДНК у 21 клона были частично определены нуклеотидные последовательности у упомянутой кДНК. Для этих нуклеотидных последовательностей было проверено наличие гомологических последовательностей в упомянутом выше банке данных для оснований, и были выбраны клоны с новыми последовательностями, не зарегистрированными в указанном банке данных для оснований.
Поскольку эти плазмиды содержат ранний SV40-промотор и репликационное начало, они являются приемлемыми для экспрессирования кДНК у COS-1-клеток. По этой причине плазмидную ДНК вводили в клетки COS-1, делая это для клонов, выбранных так, как об этом говорили выше. Трансфекцию клеток COS-1 проводили электропорацией, используя имплантационное устройство типа GTE-1 фирмы "Симадзу". Иначе говоря, клетки COS-1 выращивали в колбе до полуслившегося состояния, и клетки собирали посредством обработки их трипсинэтилендиаминтетрауксусной кислотой и дважды промывали фосфатно-солевым буферным (-) раствором (производства фирмы "Ниссуи Сейяку"). Далее, эти клетки суспендировали в фосфатно-солевом буферном (-) растворе при концентрации 6•107 клеток на 1 мл. С другой стороны, каждую плазмидную ДНК, приготовленную цезиевым хлоридным методом, доводили до концентрации 200 мкг/мл, добавляя фосфатно-солевой буферный (-) раствор. Совместно смешивали по 20 мкл каждой из упомянутых выше клеточных суспензий и раствора ДНК и затем помещали в камеру, в которой расстояние между электродами составляло 2 мм. Затем с интервалами в 1 с дважды прикладывали импульсы длительностью 30 мкс с величиной 600 B. После охлаждения камеры при 4oC в течение примерно 5 мин смесь из клеток и ДНК, находящуюся в камере, добавляли к 10 мл DMEM (минимальная питательная среда Игла, модифицированная Далбекко), содержащую 10% сыворотки плода коровы. Результирующую смесь затем переносили на чашку и культивировали в присутствии 5% CO2 при 37oC в течение ночи. Затем надосадочную жидкость с культурой удаляли, клетки промывали свободной от сыворотки средой DMEM (минимальная питательная среда Игла, модифицированная Далбекко) и добавляли 10 мл DMEM, после чего культивировали в течение трех дней. После извлечения надосадочной жидкости с культурой из клеточной культуры, полученной этим способом, у надосадочной жидкости определяли упомянутую ранее активность у ингибирующего морфологического изменения на адипоциты.
В результате сказанного адипоцитная ингибирующая активность была специально определена у надосадочной жидкости с культурой в случае клеток COS-1, трансфектированных плазмидой (pcD-20-2) клона с номером 20-2. Некоторые данные по активности в отношении ингибирования липогенезной трансформации приведены в табл. 1.
Образование pUC-CAT представляет собой плазмиду, полученную введением хлорамфениколацетилтрансферазного гена в pUC-вектор, и используется в качестве негативного контрольного образования, поскольку не содержит промотор, который может действовать в клетках млекопитающих. Трансфекцию проводили тем же способом, что и в случае плазмиды pcD-20-2. Как видно из табл. 1, активность, которая ингибирует морфологическое изменение клеток линии ЗTЗ-LI на адипоциты, обнаруживается в надосадочной жидкости с культурой из COS-1-клеток, трансфектированных плазмидой pcD-20-2. Кроме того, касательно клеток линии ЗTЗ-LI, вынужденных к дифференцировке на адипоциты (см. табл. 2), то здесь оказывается сильно подавленной липопротеидная липазная активность. Величины, представленные в таблице 2, являются относительными (выражены в процентах), и они получены из соображения, что липопротеидная липазная активность в 100% (холостой опыт) имеет место только тогда, когда используют среду DMEM, свободную от сыворотки.
В соответствии со сказанным была построена ограничительная ферментативная карта для кДНК, вставленной в плазмиду pcD-20-2 (см. фиг. 1). Далее, дидезоксиметодом была определена вся нуклеотидная последовательность у кДНК, и была получена нуклеотидная последовательность с номером последовательности 1 в перечне последовательностей. Было установлено, что кДНК, введенная в плазмиду pcD-20-2, состоит из 1065 оснований и хвостовой поли(A)-части (41 кислотных остатков). Было также установлено, что кДНК содержит интервал открытого считывания, состоящий из 199 аминокислот и начинающийся с метионина. При сопоставлении результирующей нуклеотидной последовательности с последовательностями, имеющимися в банке данных по основаниям лаборатории EMBL и Генобанка, не была установлена гомология с какими-либо известными последовательностями. Кроме того, при сопоставлении аминокислотной последовательности, кодированной для интервала открытого считывания, с последовательностями, содержащимися в NBPF и SWISS-банке данных по белкам, было также замечено отсутствие гомологии с известными последовательностями. Учитывая сказанное, было подтверждено, что интервал открытого считывания, имеющийся у кДНК, вставленной в плазмиду pcD-20-2, кодирует ранее неизвестный полипептид. Аминокислотная последовательность, кодированная этим интервалом открытого считывания, указана последовательно с номером 2 в перечне последовательностей.
Область, содержащая сильно гидрофобные аминокислоты (сигнальный пептид), наблюдаемые в различных секреторных белках, находится в N-концевой области, которая начинается с метионина. Отсюда следует, что этот белок представляет собой секреторный белок.
Пример 5
Синтез пептида и приготовление антипептидной антисыворотки
Пептид, отвечающий аминокислотной последовательности с аминокислотами от 27-й до 41-й, считая от метионина, в N-концевой области (NH2-Gly-Pro-Pro-Arg-Val-Ser-Pro-Asp-Pro-Arg-Ala-Glu-Leu-Asp-Ser-COOH), синтезировали с целью подтверждения соображения, что ранее неизвестный пептид, кодированный интервалом открытого считывания у кДНК-вставки плазмиды pcD-20-2, представляет собой секреторный белок, а также с целью обнаружения фактора, ингибирующего липогенез, при проведении очистки такого фактора, описанного ниже. Такой синтезированный пептид использовали затем в качестве антигена при иммунизации кролика и приготовлении антисыворотки. Синтез пептида проводили по tBOC-аминокислотному твердофазному способу (Merrifield, R.B. (1963), J. Am. Chem. Soc. , 85, 2149-2154), что сопровождалось использованием стандартной автоматической программы синтеза с применением пептидного синтезатора типа 430A, выпускаемого фирмой "Эплад биосистемз". После блокирования и удаления смолы пептид очищали на анионообменной колонке. Подтверждение характера спектра у основного пика получали проведением высокоэффективной жидкостной хроматографии с использованием колонки с обращенной фазой. Далее, проводя последующее концентрирование пептида посредством сушки вымораживанием, пики разделяли и вещество собирали, делая это способом высокоэффективной жидкостной хроматографии с использованием колонки с обращенной фазой. После нового концентрирования белка посредством сушки вымораживанием проводили анализ способом высокоэффективной жидкостной хроматографии и определение аминокислотного состава. Аминокислотный состав устанавливали, используя Pico-Tag-систему, представляющую собой автоматизированный аминокислотный анализатор производства фирмы "Уэйтерз".
Замочноскваженный блюдечковый гемоцианин (пигмент моллюска блюдечка, имеющего форму колпачка от замочной скважины), служащий в качестве белка-носителя, сочетали с результирующим пептидом посредством глутаральдегидного способа (Konopka, J.B. et al. (1984), J. Virol., 51, 223-232). Это образование использовали в качестве антигена в случае кроликовой иммобилизации. Антиген гомогенно суспендировали в полном стимуляторе Фрейда и кролика иммунизировали введением суспензии под кожу спины. Цельную кровь собирали после введения суспензии три раза с интервалами примерно в две недели. Измерение титра антител в сыворотке кролика проводили, используя иммуноферментный твердофазный анализ. Иммуноглобулиновую фракцию IgG готовили из результирующей антисыворотки, используя белковую A-сефарозную 6MB-колонку, выпускаемую фирмой "Фармация". Это образование использовали затем в качестве первичного антитела.
Пример 6
Получение и очистка ингибирующего липогенез фактора в COS-1-клетках
1. Конструирование вектора высокой экспрессии и экспрессия в COS-1-клетках
Последующим расщеплением плазмиды pcD-20-2 посредством BamHI выделяли фрагмент состоящий из 1240 пар оснований и содержащий кДНК-вставку, и подвергали его очистке. Тем временем, проводя расщепление вектора высокой экспрессии pcDL-SR α 296 (Takebe, J. et al. (1988), Mol. Cell. Biol., 8, 466-472) посредством BamHI, получали фрагмент из 3400 пар оснований, содержащий промотор SR α, и BamHI-фрагмент, содержащий кДНК, присоединяли проведением реакции с использованием T4 ДНК-лигазы. Эту ДНК затем использовали для трансформации штамма DH5 α культуры Escherichia coli, и проводили анализ плазмиды у результирующей трансформанты. Выбирали штамм, у которого направление кДНК-транскрипции было таким же, что и направление у промотора SR α, и эту плазмиду называли pSR α-20-2 (см. фиг. 2).
Между прочим, промотор SRα включает в себя ранний промотор SV40 и последовательность R-U5 длинной концевой дупликации образования HTLV-1 и обнаруживает промоторную активность, в 10-100 раз превышающую таковую у раннего промотора SV40.
Далее, клетки COS-1 трансформировали результирующей плазмидой pSR α-20-2, чтобы, используя антитело, полученное в примере 5, убедиться в том, что фактор, ингибирующий липогенез, секретируется в надосадочную жидкость с культурой. Трансфекцию клеток COS-1 проводили либо электропорационным способом, либо DEAE-декстрановым способом (Luthman, H. and Magnusson, G. (1983), Nucleic Acids Res., 11, 1295-1308). Каждую надосадочную жидкость, свободную от сыворотки, с культурой клеток COS-1, полученных трансфекцией отрицательной контрольной плазмидой pcDL-SRα-296, не содержащей кДНК, и плазмидой pSRα-20-2, экспрессирующей фактор, ингибирующий липогенез, соответственно обрабатывали, беря жидкости по 160 мкл, трихлоруксусной кислотой с целью осаждения белка, после чего, разделяя центрифугированием,
получали осадок. После промывки осадка ацетоном, охлажденным льдом, и сушки на воздухе осадок растворяли в пробном буферном растворе, содержащем 2-меркаптоэтанол, что было необходимо для проведения электрофореза в полиакриламидном геле с додецилсульфатом натрия, после чего анализ этим способом проводили в восстанавливающих условиях с использованием 12,5%-ного геля. Обнаружение белковых полос, сопутствующих электрофорезу, проводили посредством окрашивания серебром с использованием силбест-стейна, выпускаемого фирмой "Накалаи Теск" (см. пластинку на левой стороне фиг. 3). Единственная полоса со специфическим рисунком была обнаружена в месте, указанном стрелкой (молекулярный вес примерно составляет 23000), при использовании надосадочной жидкости с культурой клеток COS-1, трансфектированных плазмидой pSR α-20-2.
Кроме того, после точечного нанесения белковых полос, аналогично возникающих при проведении электрофореза в полиакриламидном геле, на нитроцеллюлозную мембрану с использованием гелиевого мембранного пятнонаносителя (производства фирмы "Мэрисол", тип KS-8441), что делали по способу Тоубина и др. (Towbin, H. et al. (1979), Proc. Natl. Acad. Sci. USA, 76, 4350-4354), проводили точечный анализ по Уэстерну (Western) с использованием первичного антитела, приготовленного в примере 5. Операцию точечного нанесения по Уэстерну осуществляли с использованием Immun-Blot-комплекта для тестирования (GAR-HRP), выпускаемого фирмой "Био-Рад", поступая согласно инструкциям изготовителя (см. пластину на правой стороне фиг. 3). Лишь специфическая полоса, обнаруженная окрашиванием серебром (для молекулярного веса порядка 23000), характеризовалась взаимодействием с антипептидным антителом, тем самым свидетельствуя, что белок, кодированный интервалом открытого считывания у кДНК, вставленной в плазмиду pcD-20-2, представляет собой секреторный белок.
Далее, проводили исследование характера поведения активности в отношении ингибирования липогенезной дифференцировки с использованием надосадочной жидкости культуры клеток COS-1, трансформированных плазмидой pSR α-20-2. Некоторые данные по активности приведены в табл. 3.
Хотя активность в отношении ингибирования липогеназной дифференцировки и не была замечена у надосадочной жидкости с культурой клеток COS-1, трансформированных плазмидой pSDL-SRα296, которая служила в качестве негативного контрольного образования, не содержащего кДНК-вставку, значительная активность была обнаружена в случае плазмиды pSR α-20-2. Кроме того, липопротеидная липазная активность была также сильно подавлена в случае клеток линии ЗTЗ-L1, которые были индуцированы претерпеть дифференцировку на адипоциты (см. табл. 4). Ингибирующая активность, указанная в табл. 3 и табл. 4, оказалась заметно сильнее, чем в случае использования плазмиды pcD-20-2 (табл. 1 и табл. 2).
II. Очистка и анализ N-концевой аминокислотной последовательности
После проведения диализа на 7 л свободной от сыворотки надосадочной жидкости с культурой, полученной трансфекцией клеток COS-1 плазмидой pSR α-20-2 по способу, описанному выше, при 20-кратном объеме диализного буферного раствора (10 мМ борной кислоты в гидроксиде натрия (pH 9,0) и 13 мМ хлорида калия), что делали при 4oC в течение 15 ч, проводили слабую катионообменную хроматографию с использованием высокоэффективного жидкостного хроматографа, выпускаемого фирмой "Фармация"; это делали при указанных ниже условиях:
колонка - вещество CM-тойоперлпэк 650M (2,2 на 20 см, производства фирмы "Тосох");
элюирующий буферный раствор -
раствор A: раствор борной кислоты с концентрацией 10 мМ в гидроксиде натрия (pH 9,0) при содержании 13 мМ хлорида калия,
Раствор B: раствор A, содержащий 300 мМ хлорида натрия;
скорость потока - 3 мл/мин;
объем фракции - 3 мл на пробирку;
градиент концентрации - линейный концентрационный градиент с переходом за 50 мин от раствора A (100%) к раствору B (100%).
Точечное нанесение по Устерну осуществляли для каждой из фракций, которые были получены, что делали с использованием антипептидного антитела, приготовленного в примере 5, проводя идентификацию фракции, содержащей фактор, ингибирующий липогенез (с номерами 35 - 45). Всю пиковую фракцию (номер 41), содержащую наибольшее количество фактора, ингибирующего липогенез, которая была элюирована с использованием 260 мМ хлорида натрия, концентрировали, подвергая осадительной обработке трихлоруксусной кислотой, и анализировали проведением электрофореза в полиакриламидном геле с додецилсульфатом натрия при использовании 12,5%-ного геля в восстанавливающих условиях. После проведения электрофореза белковые полосы из полиакриламидного геля точечно наносили на поливинилиденфторидную мембрану (производства фирмы "Миллипор", материал иммобилон), делая это при плотности тока 0,8 мА/см2 с использованием гелиевого мембранного устройства для нанесения точек (фирма "Мэрисол", тип KS-8441) в передаточном буферном растворе (0,02% додецилсульфата натрия, 20% метанола и 25 мМ трисбората (pH 9,5)), что осуществляли при 4oC в течение 15 ч. После промывки мембраны с точками в течение 5 мин 10 мМ натриевоборатным буферным раствором (pH 8,0), содержащим 25 мМ хлорида натрия, и затем дистиллированной водой в условиях встряхивания в течение 5 мин мембрану сушили на воздухе. Далее, часть, на которую был перенесен фактор, ингибирующий липогенез, выделяли из мембраны, и последовательность с числом аминокислотных остатков до десяти, считая от N-конца, определяли, используя газофазный белковый секвенсер (производства фирмы "Эплайд биосистемз", модель 475A).
Фенилтиогидантоин-аминокислоты, полученные в соответствующих реакционных циклах, разделяли и идентифицировали проведением высокоэффективной жидкостной хроматографии на колонке с обращенной фазой (хроматограф производства фирмы "Эплайд биосистемз", модель 120A). Аминокислотная последовательность, установленная указанным выше способом, показана ниже:
Pro-Gly-Pro-Pro-Pro-Gly-Pro-Pro-Arg-Val-.
Отсюда следует, что человеческий фактор, ингибирующий липогенез, секретируется вне клетки в зрелой форме, начинаясь с Pro-остатка, что происходит после биосинтеза предшественника, состоящего из 199 аминокислот, и теряя сигнальный пептид, состоящий из 21 аминокислоты и находящийся на N-конце, что обусловлено жесткостью.
Пример 7
Биологическая активность очищенного фактора, ингибирующего липогенез
Фактор, ингибирующий липогенез, очищали от свободной от сыворотки надосадочной жидкости с культурой, полученной трансфекцией клеток COS-1 плазмидой pSR α-20-2, следуя известным методикам, использованным в сочетании, таким как катионообменная хроматография, гидрофобная хроматография и гелиевая фильтрационная колонная хроматография и т.д., и упомянутый фактор обнаруживали в виде единичной полосы, что делали проведением анализа с электрофорезом в полиакриламидном геле с додецилсульфатом натрия. Была обнаружена поразительная активность, установленная при изучении активности в отношении ингибирования липогенезной дифференцировки и активности в отношении подавления липопротеидной липазы, что было осуществлено при использовании этого очищенного фактора, ингибирующего липогенез.
Таким образом, был сделан вывод, что фактор, ингибирующий липогенез, который отвечает настоящему изобретению, является следствием наличия отдельного белка, который обладает активностью в отношении ингибирования липогенеза.
Пример 8
Секреторное продуцирование фактора, ингибирующего липогенезную трансформацию в яичниковых клетках китайского хомяка
Яичниковые клетки китайского хомяка, находящиеся в фазе логарифмического роста, котрансфектировали, проводя кальциевофосфатное ДНК-соосаждение с использованием pSR α-20-2 и pSRneo при ДНК-отношении 5:1. Селекцию трансформированных штаммов проводили культивированием с использованием среды HamF12 (производства фирмы "Ниссуи Сейяку"), содержащей 400 мкг/мл вещества G418 (фирма "Джибко ориентал") и 10% сыворотки плода коровы, что происходило в течение 9 дней. После селекции 15 штаммов из результирующих резистентных колоний колонии переносили на пластину с 24 углублениями, что делали с использованием клонирующего кольца, и культивирование продолжали. Затем те клетки, которые достигли слитого состояния, переносили в квадратные флаконы и субкультивировали; у 15 штаммов продуцирование фактора, ингибирующего липогенез, изучали, используя упомянутый выше способ точечного нанесения по Уэстерну.
Результатом сказанного явился выбор одного клона, характеризовавшегося наивысшим продуцированием фактора, ингибирующего липогенез. Этот клон затем культивировали способом лимитирующего разбавления с использованием пластины на 96 углублений, и были выбраны 4 клона, выработанные из этой единственной клетки. После переноса этих четырех штаммов клеток в чашки для культивирования и культивирования до состояния слияния некоторое количество фактора, ингибирующего липогенез, было подвергнуто изучению с использованием точечного способа Уэстерна, что делали для каждой надосадочной жидкости с культурой. Секреторно продуцируемые количества фактора, ингибирующего липогенез, были стабильными, и отсутствовало существенное различие у количеств в случае этих четырех штаммов. Кроме того, следствием изучения поведения надосадочных жидкостей с культурой, полученных ранее при нахождении липопротеидной липазной активности клеток линии ЗTЗ-L1, для всех четырех клонов у надосадочных жидкостей с культурой была определена активность в отношении подавления липопротеидной липазы. Далее, один из четырех штаммов культивировали в свободной от сыворотки среде (полная питательная система CHO-1, выпускаемая фирмой "Вентрекс"). После культивирования штамма в свободной от сыворотки среде в течение двух дней субкультивирование проводили посредством обработки трипсин-этилендиаминтетрауксусной кислотой, после чего культивирование продолжали еще в течение трех дней. При извлечении надосадочной жидкости с культурой и изучении ее с использованием точечного способа Уэстерна было установлено, фактор, ингибирующий липогенез, стабильно продуцируется.
Пример 9
Ингибирующее воздействие на липогенную дифференцировку мышиного костного мозга; выделенная преадипоцитная клеточная линия H-I/A
Преадипоцитную клеточную линию H-I/A, выделенную из мышиного костного мозга (Nakamura, M. et al. (1985), Soc. Exp. Biol. Med., 179, 283-287), суспендировали при плотности 2,0•104 клеток на 1 мл в среде E (среда Фишера (Fischer) (производства фирмы "Джибко"), содержащая 10%-ную иммобилизированную сыворотку плода коровы (производства фирмы "Гиклон")). Эту клеточную суспензию переносили затем пипеткой на пластину целлтайт C-1 плейт 48F (производства фирмы "Сумитомо бакелит") в количестве 0,5 мл на углубление и культивировали при 33oC в увлажненной газовой среде, содержащей 5% диоксида углерода и 95% воздуха. По прошествии трех дней среду заменяли на среду F (среда E, содержащая 1 мкМ гидрокортизона (производства фирмы "Сигма")), что делали с целью индуцирования липогенезной дифференцировки. Тогда же надосадочную жидкость с культурой клеток COS-1, трансформированных плазмидой pSR α-20-2, надосадочную жидкость с культурой клеток COS-1, трансфектированных плазмидой pSDL-SRα296, или свободную от сыворотки среду DMEM (минимальная питательная среда Игла, модифицированная Далбекко) добавляли в среду. Среду заменяли свежей средой F, и надосадочную жидкость с культурой клеток COS-1 и среду DMEM добавляли снова, что делали каждые четыре дня. После фиксации клеток 5%-ным формальдегидом, что делали на 26-й день после добавления среды F, капельки жира, которые аккумулировались в клетках, и клеточные ядра окрашивали соответственно красителем масляным красным O и гематоксилином. Скорость липогенной дифференцировки рассчитывали затем, используя тот же способ, что и использованный при оценке ингибирующего воздействия на липогенную дифференцировку клеток линии ЗTЗ-LI. Как показано в табл. 5, в надосадочной жидкости с культурой клеток COS-1, трансфектированных плазмидой pSR α-20-2, обнаруживается сильное ингибирование липогенной дифференцировки у клеток линии H-I/A. Между тем, очищенный фактор, ингибирующий липогенез, который был очищен от надосадочной жидкости с культурой клеток COS-1, трансфектированных плазмидой pSR α-20-2, также в значительной мере ингибирует липогенную дифференцировку клеток линии H-I/A.
Пример 10
Воздействие индуцированного колониестимулирующего фактора на костный мозг; выделенная преадипоцитная клеточная линия H-I/A
Клетки линии H-I/A суспендировали при плотности 1,0•104 клеток на 1 мл в среде E и пипеткой переносили в чашку для культивирования на 6 углублений (производства фирмы "Коусейр") в количестве 3 мл на углубление. Клетки культивировали при 33oC в увлажненной газовой смеси, содержащей 5% диоксида углерода и 95% воздуха. После культивирования клеток в течение шести дней среду заменяли свежей средой E. В это время добавляли надосадочную жидкость с культурой клеток COS-1, трансфектированных плазмидой pSR α-20-2, надосадочную жидкость с культурой клеток COS-1, трансфектированных плазмидой pcDL-SR 296, или свободную от сыворотки среду DMEM (минимальная питательная среда Игла, модифицированная Далбекко), после чего проводили культивирование в течение 5 ч.
Далее, после трехкратной промывки клеток свободной от сыворотки средой Фишера (Fischer) в каждое углубление добавляли 3 мл свежей среды E, после чего культивирование вели еще в течение 14 дней; и надосадочную жидкость с культурой собирали из каждого углубления. Полученную таким способом надосадочную жидкость с культурой фильтровали, используя миллексовый GV-фильтр с размером пор 0,22 мкм (производства фирмы "Ниппон миллипор индастриз"), и фильтрат затем использовали для проведения теста на колониестимулирующую активность. Тест на колониестимулирующую активность проводили по способу, предложенному Кубота и др. (Kubota, K. et al., (1981), Cancer Res., 41, 3052-3057). Клетки бедренного костного мозга, взятые у женских особей мышиной линии CЗH He/N (приобретены у фирмы "Джэпэн Чарлз Ривер"), суспендировали при плотности 1,0•105 клеток на 1 мл в среде RPMI 1640 (производства фирмы "Джибко"), к которой было добавлено 0,3% бактоагара (производства фирмы "Дайфко"), 20% сыворотки плода коровы и 10% надосадочной жидкости с культурой клеток H-I/A. Каждую из этих суспензий отбирали в количестве 1 мл и помещали в пластиковые чашки размером 35 на 10 мм (производства фирмы "Лакс"). После культивирования клеток при 37oC в увлажненной газовой смеси, содержащей 5% диоксида углерода и 95% воздуха, в течение семи дней измеряли соответственно число колоний, образовавшихся в чашках.
Надосадочная жидкость с культурой клеток линии H-I/A, обработанных средой E, к которой была добавлена надосадочная жидкость с культурой клеток COS-1, трансфектированных плазмидой pSR α-20-2, обнаруживали значительно более высокую колониестимулирующую активность (p<0,01) в сравнении с надосадочной жидкостью с культурой клеток H-I/A, обработанных средой E, к которой была добавлена надосадочная жидкость с культурой клеток COS-1, трансфектированных плазмидой pcDL-SR 296, или свободная от сыворотки среда DMEM (минимальная питательная среда Игла, модифицированная Далбекко). Полученные результаты суммированы в табл. 6.
Клетки линии H-I/A, взятые в количестве 5,0•106, суспендировали в 50 мл среды E и культивировали в колбе Акселя (AcceI) (производства фирмы "Костар") в течение пяти дней. Далее, среду заменяли свежей средой E, и одновременно добавляли надосадочную жидкость с культурой клеток COS-1, трансфектированных плазмидой pSR α-20-2, надосадочную жидкость с культурой клеток COS-1, трансфектированных плазмидой pcDL-SRα296, или свободную от сыворотки среду DMEM (минимальная питательная среда Игла, модифицированная Далбекко). После культивирования смеси в течение 18 ч суммарную РНК выделяли из клеток, поступая так, как это делали в примере 1. Некоторое количество мРНК макрофагового колониестимулирующего фактора анализировали Нордерным (Northern) гибридизационным способом (Thomas, P. (1980). Proc. Natl. Acad. Sci. USA. , 77, 5201-5205), для чего в каждом случае использовали 20 мкг суммарной РНК. Мышиную кДНК макрофагового колониестимулирующего фактора, полученную проведением полимеразной цепной реакции (Ladner, M.B. et al., (1988), 85, 6706-6710), метили фосфором-32, для чего использовали систему Малтипрайм ДНК-лейбеллинг систем (производства фирмы "Амершам"), и это образование использовали в качестве пробы. Количество гибридизированной пробы с меткой в виде фосфора-32 устанавливали, используя анализатор изображений (производства фирмы "Фуджи фото филм"). Пробу с меткой в виде фосфора-32 гибридизировали с РНК, размер которой составлял примерно 2500 оснований и примерно 4500 оснований. При сопоставлении суммарных количеств пробы, гибридизированных с РНК этих размеров, было установлено, что количество мРНК макрофагового колониестимулирующего фактора, приходящееся на единицу суммарной РНК, является повышенным в случае клеток линии H-I/A, обработанных средой E, к которой было добавлено 5% надосадочной жидкости с культурой клеток COS-1, трансфектированных плазмидой pSR α-20-2, если проводить сравнение со случаем обработки средой E, к которой было добавлено 5% надосадочной жидкости с культурой клеток COS-1, трансфектированных плазмидой pcDL-SRα296 (см. табл. 7).
Пример 11
Воздействие индуцированного колониестимулирующего фактора на клетки линии H-I/A, дифференцированные на адипоциты
Клетки линии H-I/A в количестве 5,0•106 суспендировали в 50 мл среды F и культивировали при 33oC в течение 12 дней в колбе Акселя (AcceI). На протяжении этого времени культивирования среду заменяли свежей средой F один раз в каждые четыре дня. Далее, среду заменяли средой E, и культивирование продолжали еще в течение трех дней. В результате этого замечали, что маслянистые капельки накапливаются в 40%-тах или в большем количестве клеток, указывая на протекание дифференцировки на адипоциты. Среду затем заменяли на среду E, к которой было добавлено 5% надосадочной жидкости с культурой клеток COS-1, трансфектированных плазмидой pSR α-20-2, надосадочной жидкостью с культурой клеток COS-1, трансфектированных плазмидой pcDL-SRα296, или свободной от сыворотки средой DMEM (минимальная питательная среда Игла, модифицированная Далбекко), после чего культивирование проводили в течение 18 ч. После культивирования среду удаляли и клетки промывали дважды фосфатно-солевым буфером (-), после чего добавляли 25 мл среды E, к которой был добавлен натриевый гепарин, доведенный до конечной концентрации в 10 ед. на 1 мл. Смесь культивировали при 33oC в течение 15 мин. При измерении липопротеидной липазной активности у надосадочной жидкости с культурой значительное липопротеидное липазное подавление наблюдали только в случае добавления надосадочной жидкости с культурой клеток COS-1, трансфектированных плазмидой pSR α-20-2 (см. табл. 8).
Далее, тем же способом, что и в примере 1, выделяли суммарную РНК из клеток, приготовленных, как это было описано ранее. Количество мРНК у макрофагового колониестимулирующего фактора определяли затем тем же способом, что и в примере 10, исключая лишь то, что каждый раз использовали 10 мкг суммарной РНК. Клетки линии H-I/A, обработанные средой E, содержащей 5% надосадочной жидкости с культурой клеток COS-1, трансфектированных плазмидой pSR α-20-2, обнаруживали значительный рост количества мРНК макрофагового колониестимулирующего фактора в расчете на единицу суммарной РНК, если проводить сопоставление со случаем обработки средой E, содержащей 5% надосадочной жидкости с культурой клеток COS-1, трансфектированных плазмидой pcDL-SRα296 (см. табл. 9).
Препаративный пример 1
Приготовление гранул с энтеросолюбильной оболочкой, содержащих 50% фактора, ингибирующего липогенез
Взвешивали 70 частей (по весу; аналогичное справедливо и далее) очищенного фактора, ингибирующего липогенез, который был получен в примере 8, 10 частей лактозы и 20 частей микрокристаллической целлюлозы и тщательно перемешивали в ступке, после чего растирали с достаточным количеством воды. Растертую смесь затем подвергали экструзии, что делали через цилиндрический гранулятор, снабженный сеткой с размером отверстий в 1,2 мм, что было необходимо для образования гранул. Гранулы пропускали через марумерайзер (MARUMERIZER), чем обеспечивалось получение гранул. После сушки этих гранул при 40oC в течение двух часов в сушильном шкафу с циркуляцией воздуха результирующие сухие гранулы классифицировали пропусканием через сита калибром 35 меш (0,5 мм по гранулометрической шкале Американского общества по испытанию материалов). Те гранулы, размер которых превышал 35 меш (0,5 мм), использовали для изготовления гранул с энтеросолюбильной оболочкой. Прежде всего, по обычной методике готовили раствор 5%-ной гидроксипропилметилцеллюлозы в равных количествах хлористого метилена и этанола, и 100 частей упомянутых выше сухих гранул покрывали распылением 100 частями этого раствора, что делали в устройстве для покрывания. Далее, обработанные таким способом гранулы покрывали распылением, делая это как и ранее, 300 частями раствора, содержащего 10% гидроксипропилметилцеллюлозного фталата (производства фирмы "Син-Эцу кемикал", марка HP-55), 1,5% стеариновой кислоты, 50% ацетона и 38,5% этанола, который был приготовлен по обычной методике. Покрытые гранулы, полученные этим способом, сушили при 40oC в течение часа в сушильном шкафу с циркуляцией воздуха, в результате чего получали энтеросолюбильный препарат фактора, ингибирующего липогенез. Эти гранулы содержат 50% фактора, ингибирующего липогенез.
Препаративный пример 2
Капсулы
Упомянутые выше гранулы с энтеросолюбильным покрытием, содержащие 50% фактора, ингибирующего липогенез, брали в количестве 200 мг и помещали в капсулы N 3, в результате чего получали жесткие капсулы, содержащие 100 мг фактора, ингибирующего липогенез, в расчете на ампулу.
Препаративный пример 3
Инъекция
Фактор, ингибирующий липогенез, может быть использован в форме ампулы, содержащей стерильный раствор фактора, растворенного или суспендированного в воде или в иных фармацевтически приемлемых жидкостях. Или же ампула, содержащая стерильный порошковый препарат (предпочтение следует отдавать фактору, ингибирующему липогенез, который подвергнут сушке вымораживанием), может быть при использовании наполнена фармацевтически приемлемой жидкостью.
Промышленное применение
Фактор, ингибирующий липогенез, который отвечает настоящему изобретению, вводят либо как таковой, либо совместно с другими терапевтическими лекарственными препаратами при лечении апластической анемии, лейкопении, вызванной токсинами или радиацией, инфекций, вызванных вирусами, бактериями и паразитами, цитопении, возникающей после трансплантации костного мозга, а также рефрактерной панцитопении наряду с другими иногда возникающими иммунологическими нарушениями. Фактор, ингибирующий липогенез, используют также либо как таковой, либо в сочетании с другими терапевтическими лекарственными препаратами для профилактики и терапии патологического ожирения.
Состав цитопениевого амелиоранта или состав препарата против ожирения, отвечающие настоящему изобретению и используемые в терапии упомянутых выше состояний, включают в себя смесь приемлемого в медицинском отношении носителя и терапевтически эффективного количества фактора, ингибирующего липогенез. Упомянутый состав может быть введен в различных формах, например в виде таблеток, капсул, гранул, порошков или сиропа, предназначенных для орального введения и инъекций, внутривенного капельного введения, или в виде суппозиторий, предназначенных для парентерального введения.
В случае введения посредством инъекции или посредством внутривенного капельного вливания терапевтический состав, отвечающий настоящему изобретению, находится в форме непирогенного парентерально приемлемого водного раствора. Вопрос приготовления парентерально приемлемого белкового раствора в отношении величины pH, изотоничности и стабильности находится в пределах обычных возможностей специалистов, работающих в этой области техники.
Дозировка и способ введения при терапии указанных выше состояний могут быть определены врачом путем учета тех факторов, которые влияют на действие упомянутого препарата, таких как состояние пациента, вес тела, пол, возраст, питание, возможность воздействия других инфекций, время введения, а также других факторов, имеющих клинически важное значение. Обычно при оральном введении в день взрослому пациенту может быть примерно введено от 0,01 до 1000 мг, что может быть сделано либо сразу, либо несколькими частями. Между тем, в случае неорального введения за один раз может быть инъектировано примерно от 0,01 до 100 мг, что может быть сделано либо подкожно, либо внутримышечно, либо внутривенно.
Состав цитопениевого амелиоранта, отвечающий настоящему изобретению, может быть использован в сочетании с другими гемопоэтическими факторами, такими как интерлейкины от IL-I до IL-10, фактор, ингибирующий лейкоз, ствольный клеточный фактор, колониестимулирующие факторы GM-CSF, G-CSF, M-CSF, Meg-CSF, опухолевый некрозный фактор, интерферон или эритропэтин. В этом случае, хотя другие гомопоэтические факторы и могут выступать в роли одного из примешанных компонентов цитопениевого амелиорантного состава, отвечающего настоящему изобретению, они могут быть также введены тому же пациенту в виде отдельного состава. Дополнительное использование настоящего состава может промотировать активность или повышать эффективность терапии, достигаемой с использованием только одних иных гомопоэтических факторов.
Между тем, состав, применяемый против ожирения, который отвечает настоящему изобретению, может быть использован в сочетании с другими приемлемыми лекарственными препаратами, применяемыми против ожирения, такими как аноректики, ингибиторы кишечной абсорбции, пищеварительные ферментные ингибиторы, метаболические ускорительные гормонные препараты, ингибиторы жирового синтеза или ингибиторы инсулиновой секреции. Кроме того, он может быть также использован в сочетании с диетотерапией и физиотерапией. В этом случае состав, применяемый против ожирения, может промотировать активность или повышать эффективность терапии, достигаемой с использованием только одних иных противоожирительных лекарственных препаратов, а также повышать эффективность терапии, достигаемой в случае проведения только одних иных противоожирительных терапий.
Поскольку цитопениевый амелиорант или противоожирительные препараты, используемые в настоящем изобретении, являются биологического происхождения или генетической рекомбинантой, они характеризуются низкими уровнями токсичности. По результатам наблюдений, проведенных в течение пяти дней после орального введения взрослой мужской особи мышиной линии DDY (с весом тела порядка 20 г), может быть сделан вывод, что ни один из белков, отвечающих настоящему изобретению, не обнаруживает токсичность при уровнях 500 мг/кг или менее.
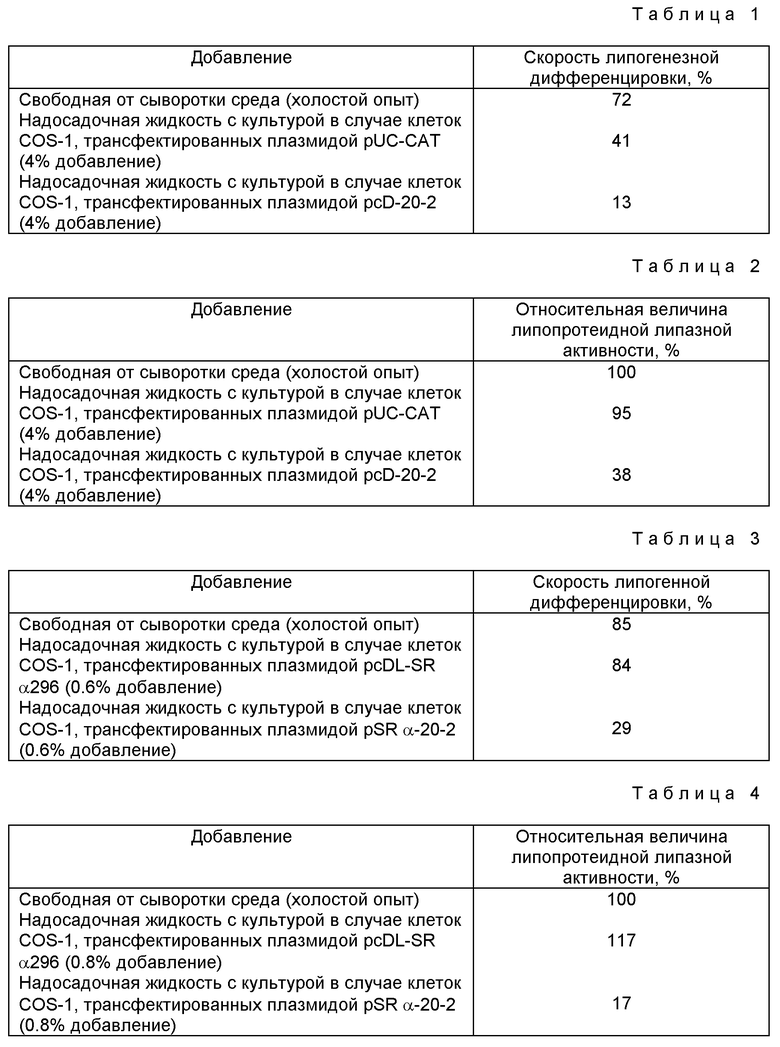


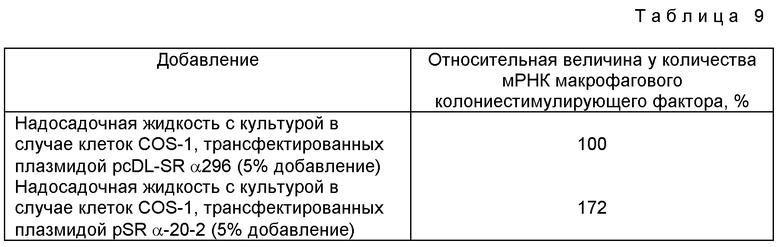










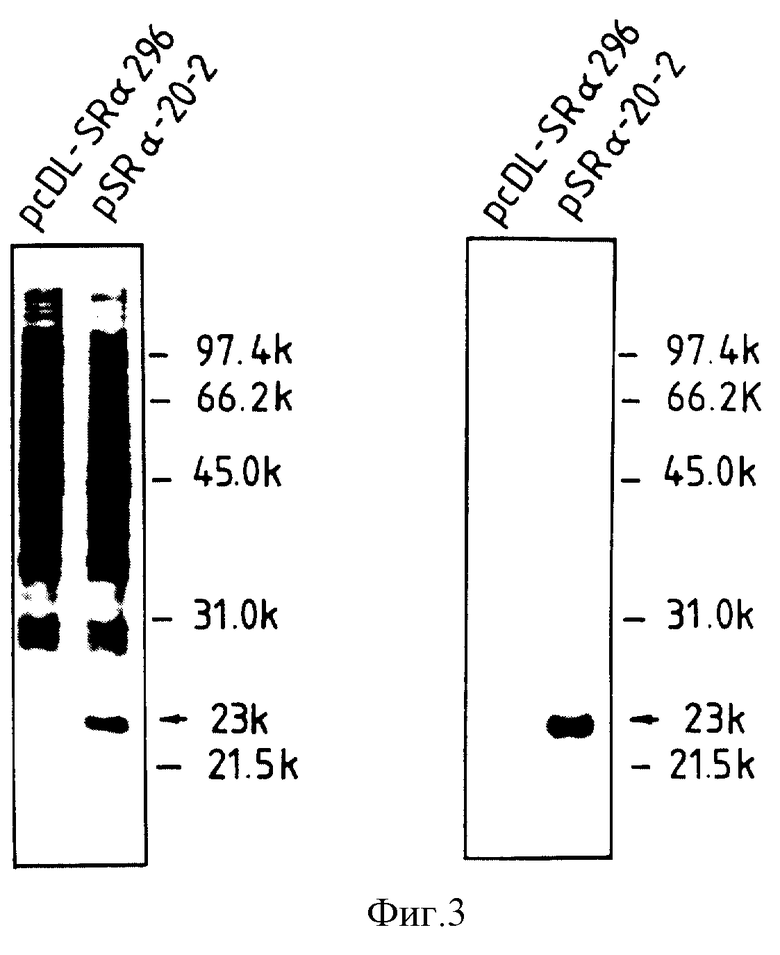
Изобретение относится к биотехнологии. Получен рекомбинантный белок - фактор ингибирования липогенеза с молекулярным весом 23 кДа, установлена нуклеотидная последовательность фрагмента ДНК, кодирующая полученный белок. Белок получен культивированием клеток млекопитающих COS 1, трансформированных вектором экспрессии pSRα-20-2, содержащим установленный фрагмент ДНК. Рекомбинантный белок используется в композиции, обладающей активностью ингибирования липогенеза. Изобретение обеспечивают возможность проведения терапии и диагноза различных цитопений. 6 с. и 4 з.п. ф-лы, 3 ил., 9 табл.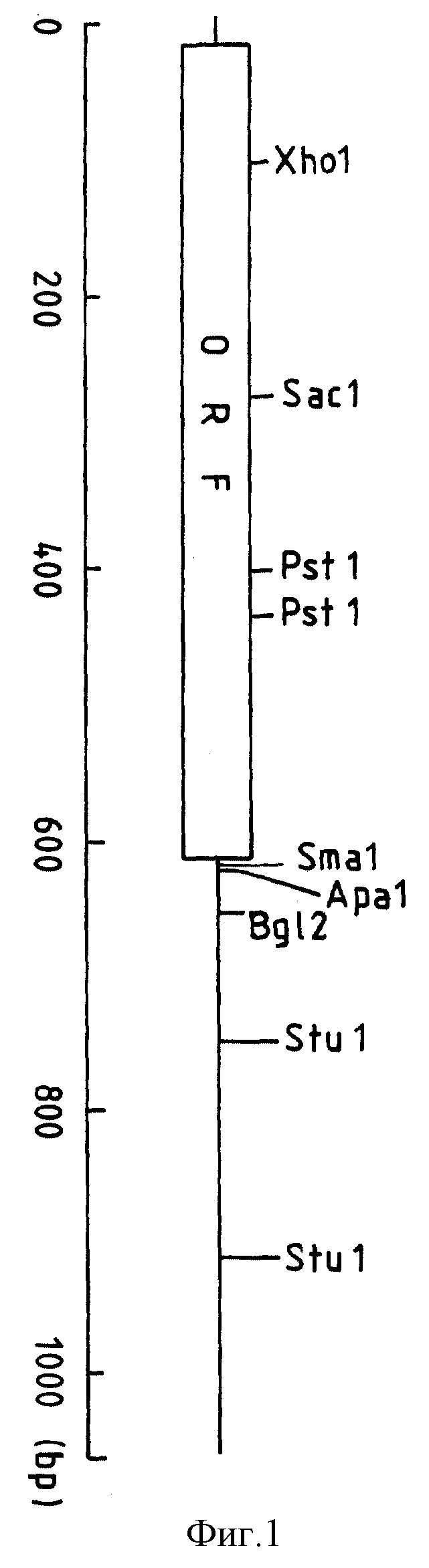
и молекулярный вес около 23000, установленный электрофорезом в полиакриламидном геле с додецилсульфатом натрия в восстанавливающих условиях с использованием 12,5% геля.
9. Способ получения рекомбинантного белка по пп.1 - 4, предусматривающий трансформацию клеток млекопитающих рекомбинантным вектором экспрессии, содержащим фрагмент ДНК, кодирующий названный белок в форме его предшественника, и культивирование трансформированных клеток, отличающийся тем, что вектор экспрессии содержит фрагмент ДНК по пп.5 и 6, полученный блок очищают.
| Proceedings of the National Academy of Science, USA, 1990, v.87, N 19, p.7512-7516 | |||
| Biochimica et Biophysica Acta, 1985, v.846, p.185-191. |
Авторы
Даты
2000-10-27—Публикация
1991-11-07—Подача