Изобретение относится, в основном, к цитокинам. Более подробно, настоящее изобретение касается нового цитокина с широкой противоопухолевой активностью.
Баланс между ростом клеток-стимуляторов и ростом клеток-ингибиторов реагирует рост клеток. Предлагают, что одним из механизмов роста опухолей является нарушение баланса такого роста регуляторных цитокинов.
Описано несколько цитокинов, которые стмулируют рост клеток спухолей и нормальных клеток. Они включают, например, эпидермальный фактор роста (EGF), фактор роста фибробластов (FGF), тромбоцитарный фактор роста (PDGF), инсулиноподобные факторы роста (IGF), интерлейкины (IL), колониестимулирующий фактор (CSF), и трансформирующие факторы роста (TGF-α и TGF-β).
В противоположность этому другие цитокины селективно ингибируют рост определенных опухолевых клеток. Такие цитокины включают, например, интерфероны (IFR), лимфотоксин (LT), фактор некроза опухолей (TNF), онкостатин M, амфирегулин, интерлейкин-I (IL-I), интерлейкин-6 (IL-6) и TGF -β.
Такие стимуляторы роста и цитоксины, ингибирующие рост, можно дифференцировать на основании их происхождения, их специфичности по отношению к опухолевым объектам, их физико-химическим свойствам и их первичной структуры. Таким образом, критически важным для понимания клеточного роста, включая рост опухолей, является идентификация и характеристика регуляторных цитокинов роста.
В одном варианте настоящего изобретения предлагается новый состав. Этот новый состав вещества, названного Онкоингибином, выделяется человеческими эритробластоидными клетками, имеет молекулярный вес приблизительно 28 kDa на SDA-PAGE (анализ методом электрофореза в полиакриламидном геле с додецилсульфатом натрия) и демонстрирует различную противоопухолевую активность.
В одном варианте настоящего изобретения предлагается способ получения нового человеческого цитокина, названного Онкоингибин. Способ включает инкуюацию человеческих эритробластоидных клеток, индуцирование производства Онкоингибина и сбор полученных клеточных супернатантов.
Еще один вариант настоящего изобретения обеспечивает способ очистки человеческого Онкоингибина. Этот способ включает стадии ультрафильтрации полученных клеточных супернатантов, содержащих человеческий Онкоингибин. Затем проводят диализ ультрафильтрованных супернатантов, содержащих человеческий Онкоингибин. Затем для очистки человеческого Онкоингибина проводят хроматографию (DEAE Affigel blue chromatography), электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDA-PAGE) и высокоэффективную жидкостную хроматографию на обращенной фазе.
В другом варианте настоящего изобретения предлагается новый иммуномодулятор для активации лимфоцитов, моноцитов и нейрофилов для поражения опухолевых клеток. Новый иммуномодулятор включачает человеческий Онкоингибин. Предложен также новый фактор роста для стимулирования роста нормальных клеток. Этот фактор роста включает человеческий Онкоингибин.
В других вариантах настоящего изобретения предложены фармацевтические композиции Онкоингибина и способы обработки опухолевых клеток, включающие введение эфективной дозы Онкоингибина.
Для того, чтобы понять в деталях сущность изобретения с вышеуказанными признаками, преимуществами и целями изобретения (также как и другими, которые будут ясным далее), более подробное описание изобретения, кратко суммированного выше, ссылается на конкретные варианты изобретения, иллюстрированные приложенными чертежами. Эти чертежи образуют часть данного описания. Однако необходимо отметить, что приложенные чертежи иллюстрируют предпочтительные варианты, но не ограничивают области изобретения. Изобретение состоит из равно эффективных эквивалентных вариантов.
Фиг. 1 показывает, что кондиционированные супернатанты клеток К-562 ингибируют рост клеток MCF-7.
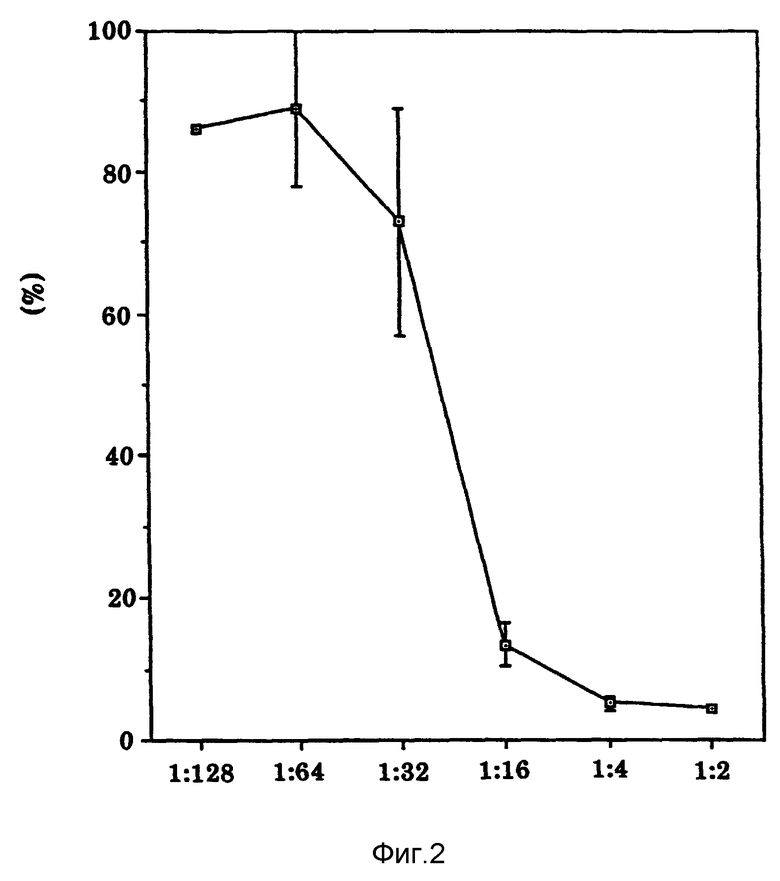
Фиг. 2 изображает стандартное биоисследование для Онкоингибина.
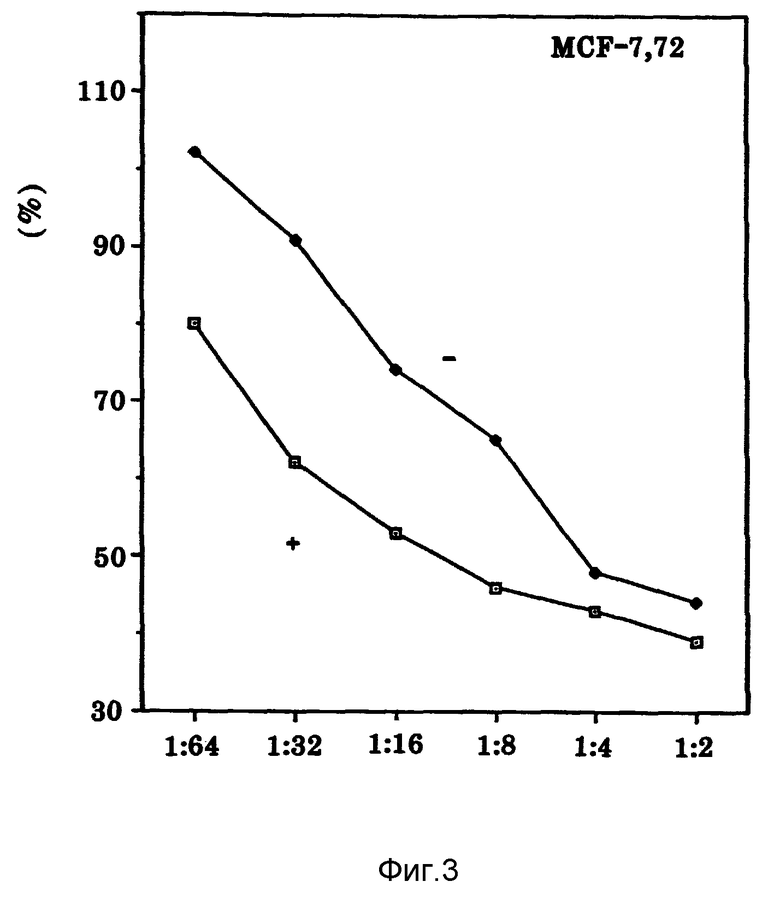
Фиг. 3 показывает продуцирование Онкоингибина клетками к-562 в присутствии и отсутствии сыворотки.
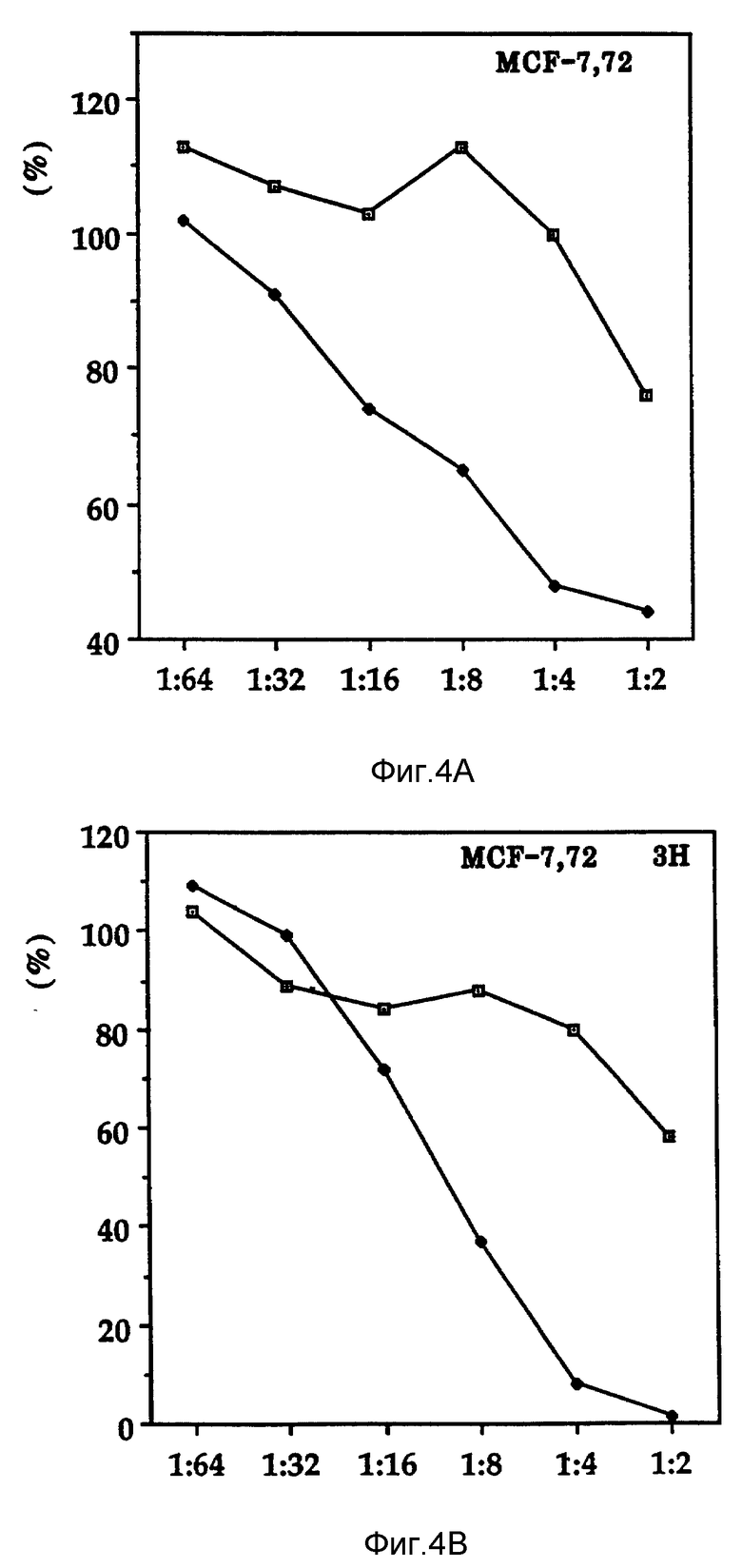
Фиг. 4 изображает эффекты форболового эфира на индуцирование Онкоингибина.
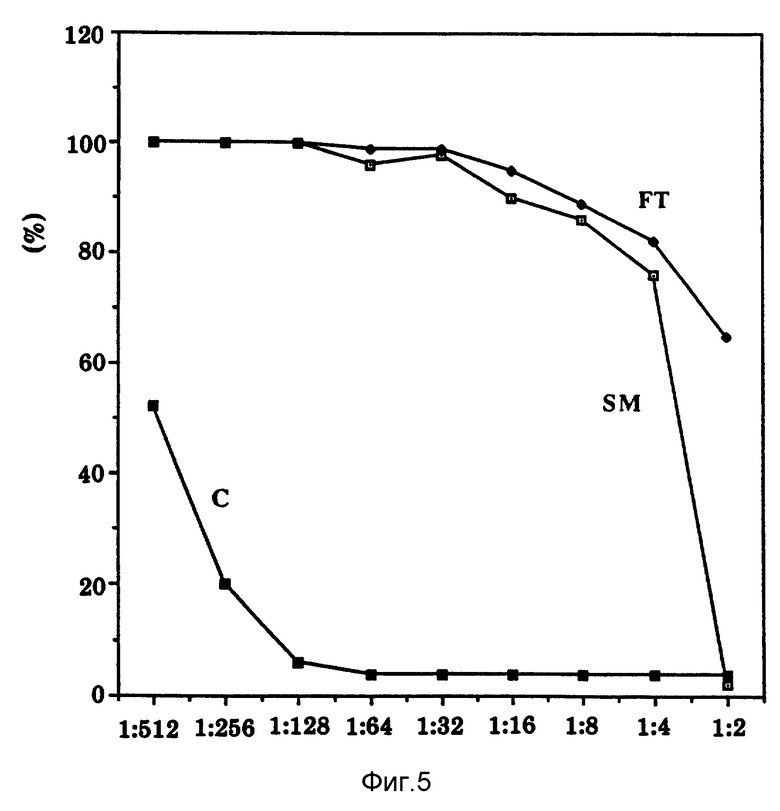
Фиг. 5 показывает эффекты ультрафильтрации на активность Онкоингибина.
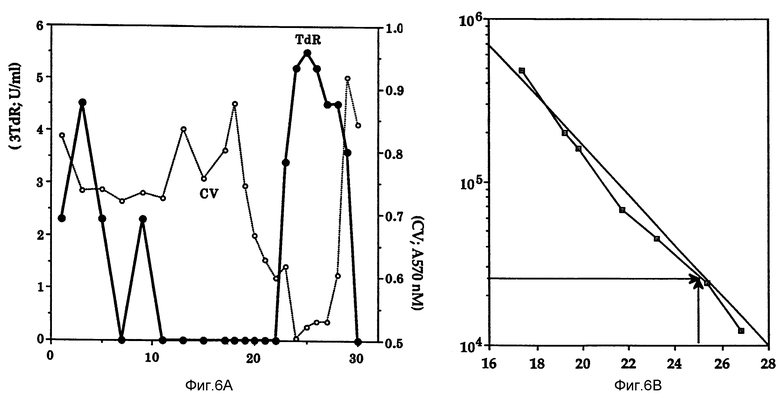
Фиг. 6 представляет характеристику Онкоингибина методом гель-проникающей хроматографии.
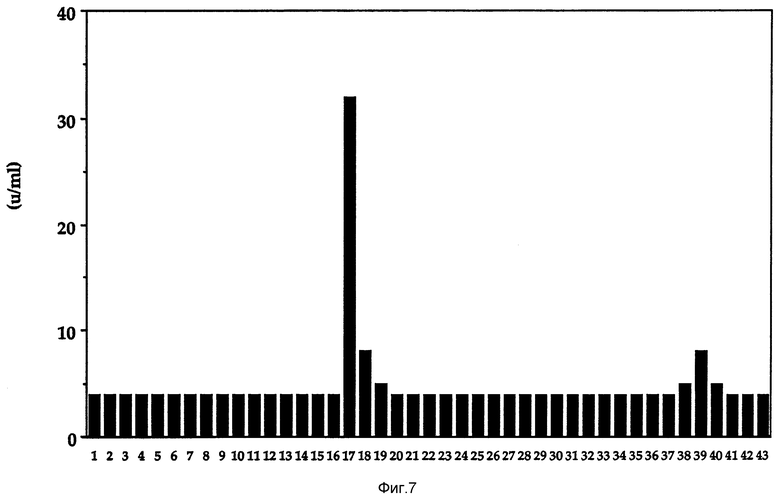
Фиг. 7 показывает элюирование активности Онкоингибина из электрофореза на полиакриламидном геле с SDS.
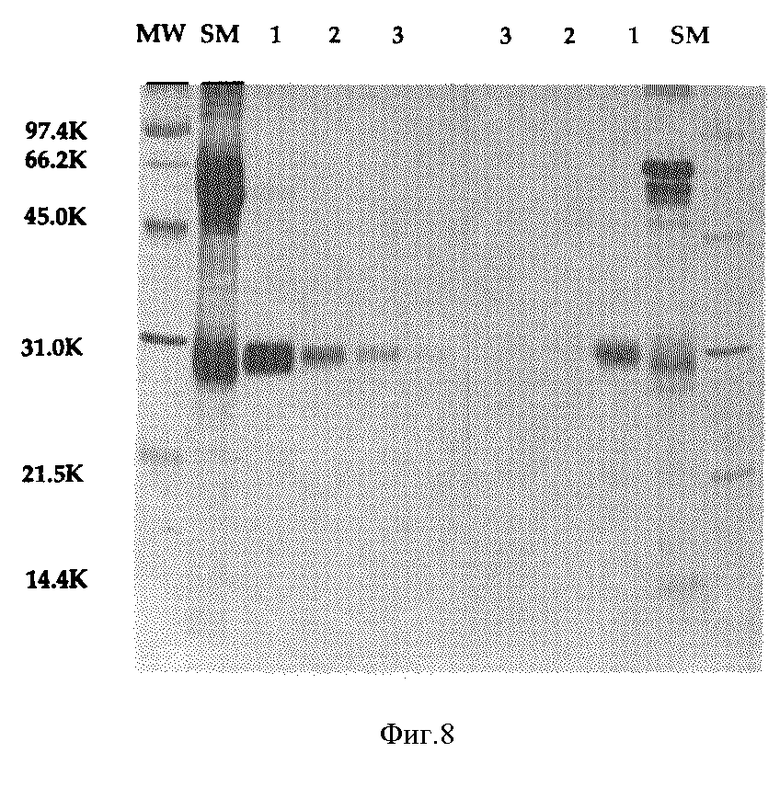
Фиг. 8 изображает SPS-PAGE анализ Онкоингибина.
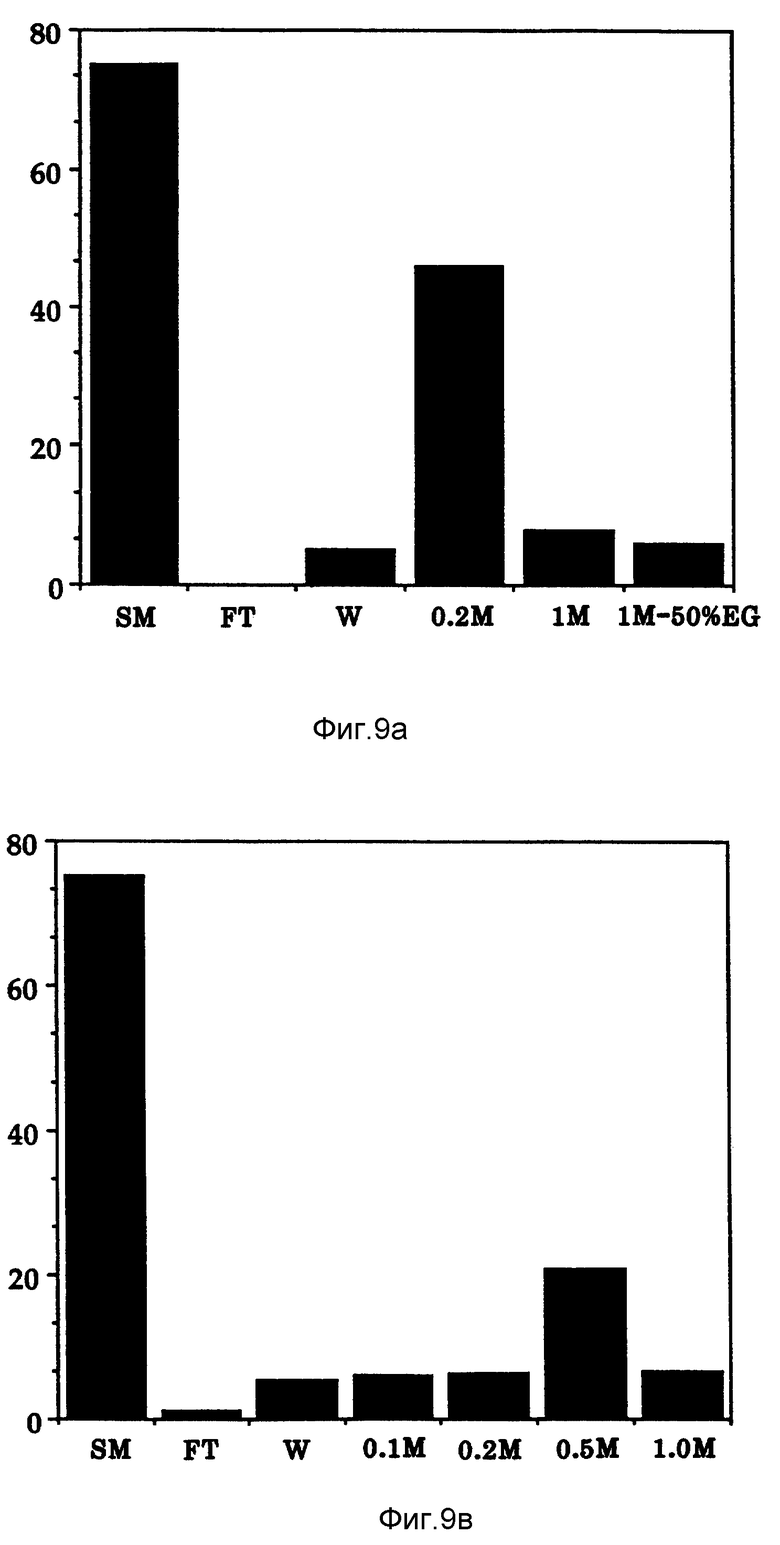
Фиг. 9 показывает связывающее элюирование активности Онкоингибина из колонки с DEAE Affigel blue (верхний рисунок) и колонки с Q-сефарозой (нижний рисунок).
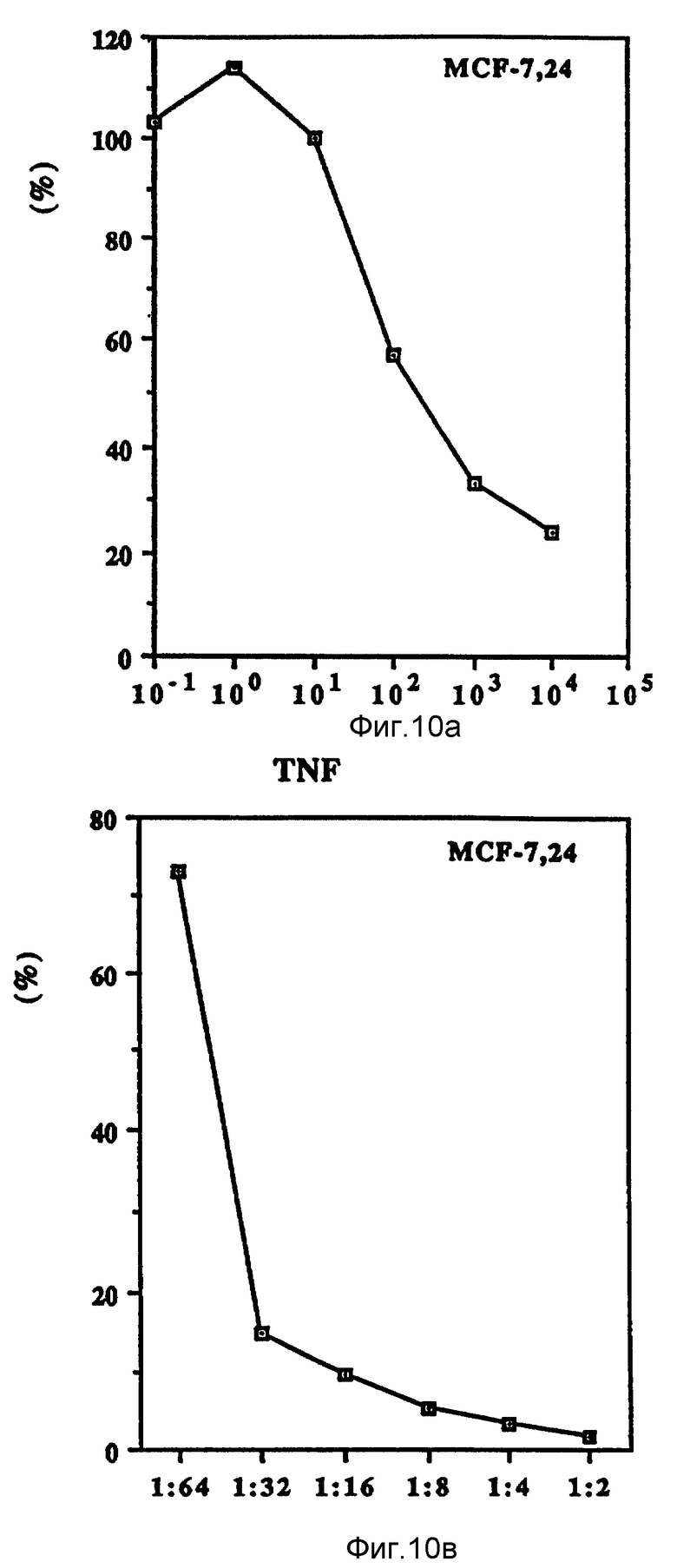
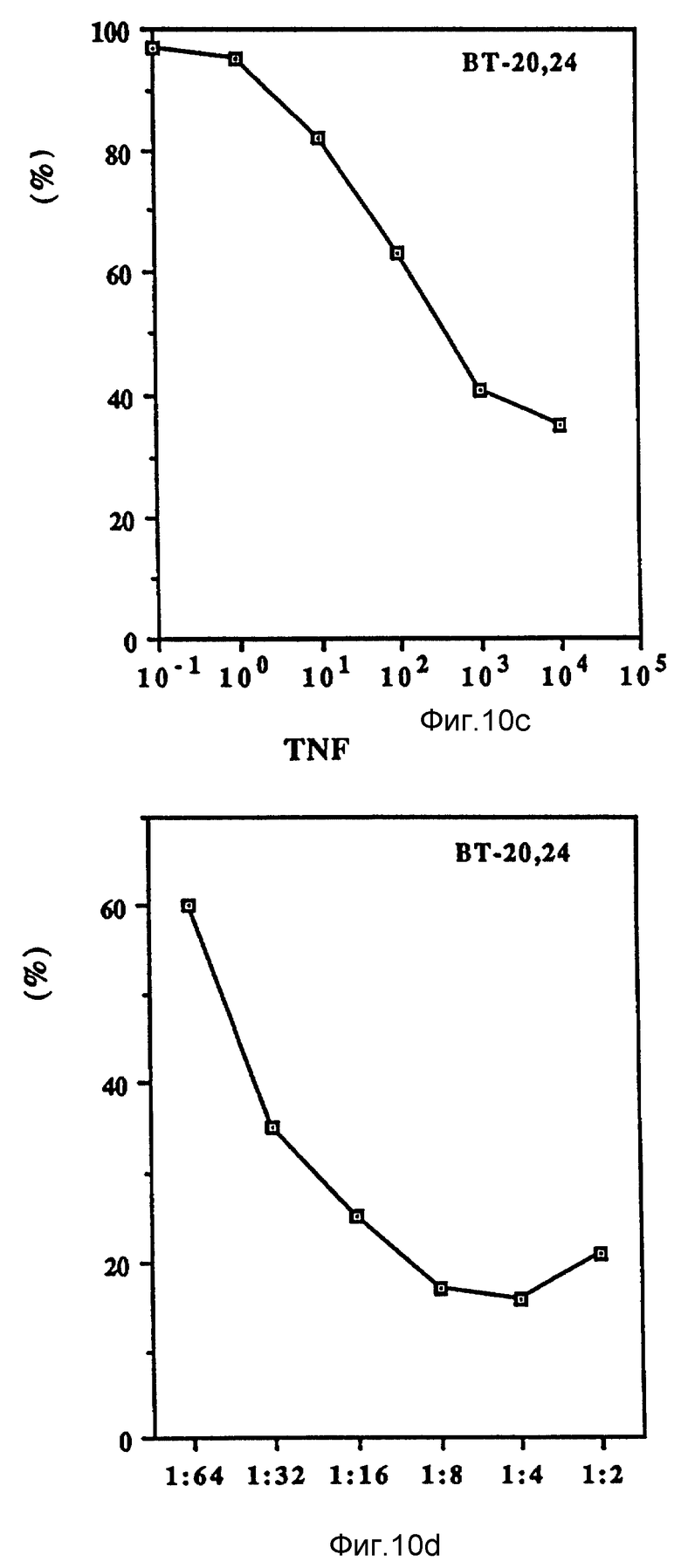
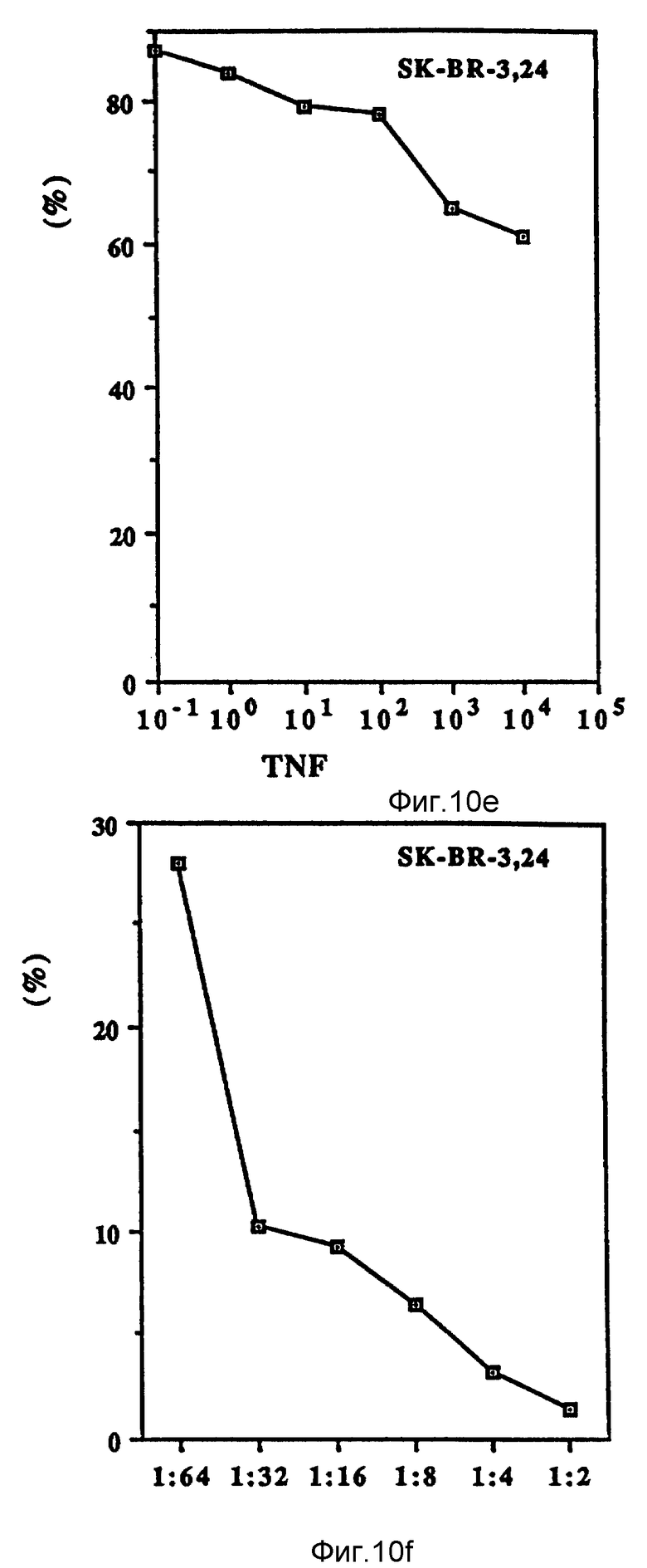
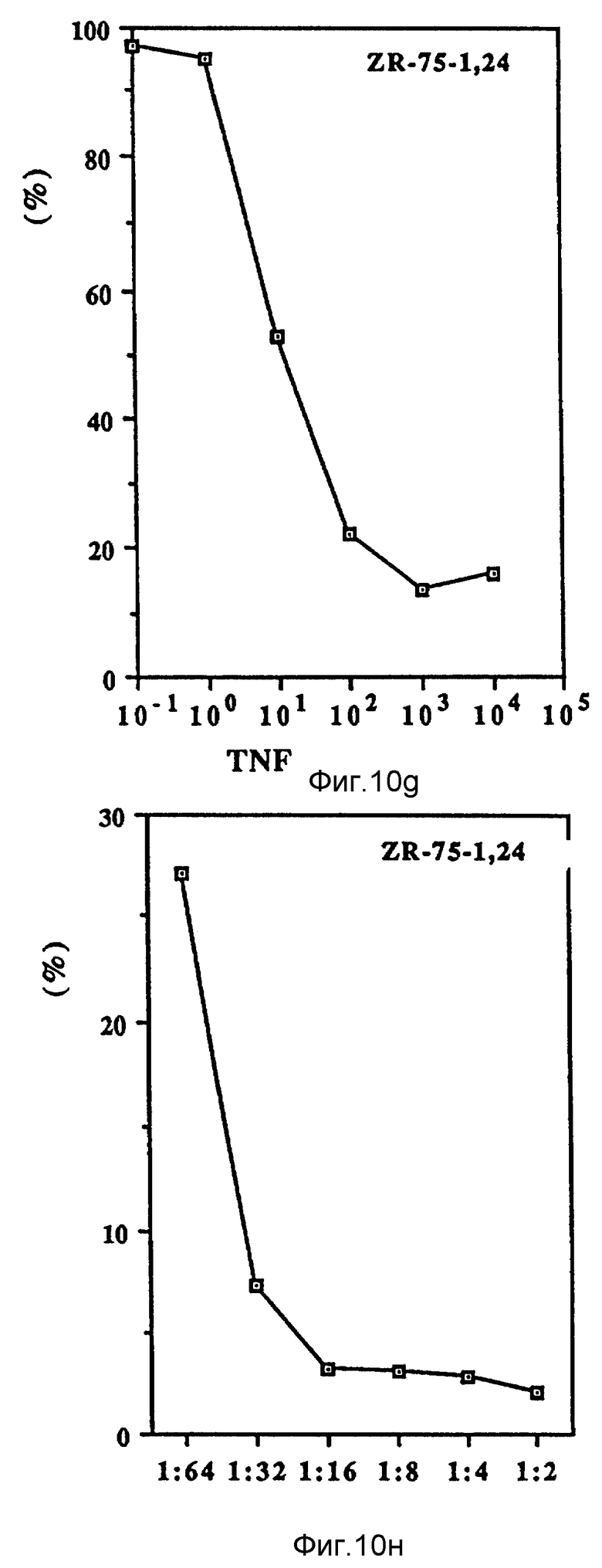
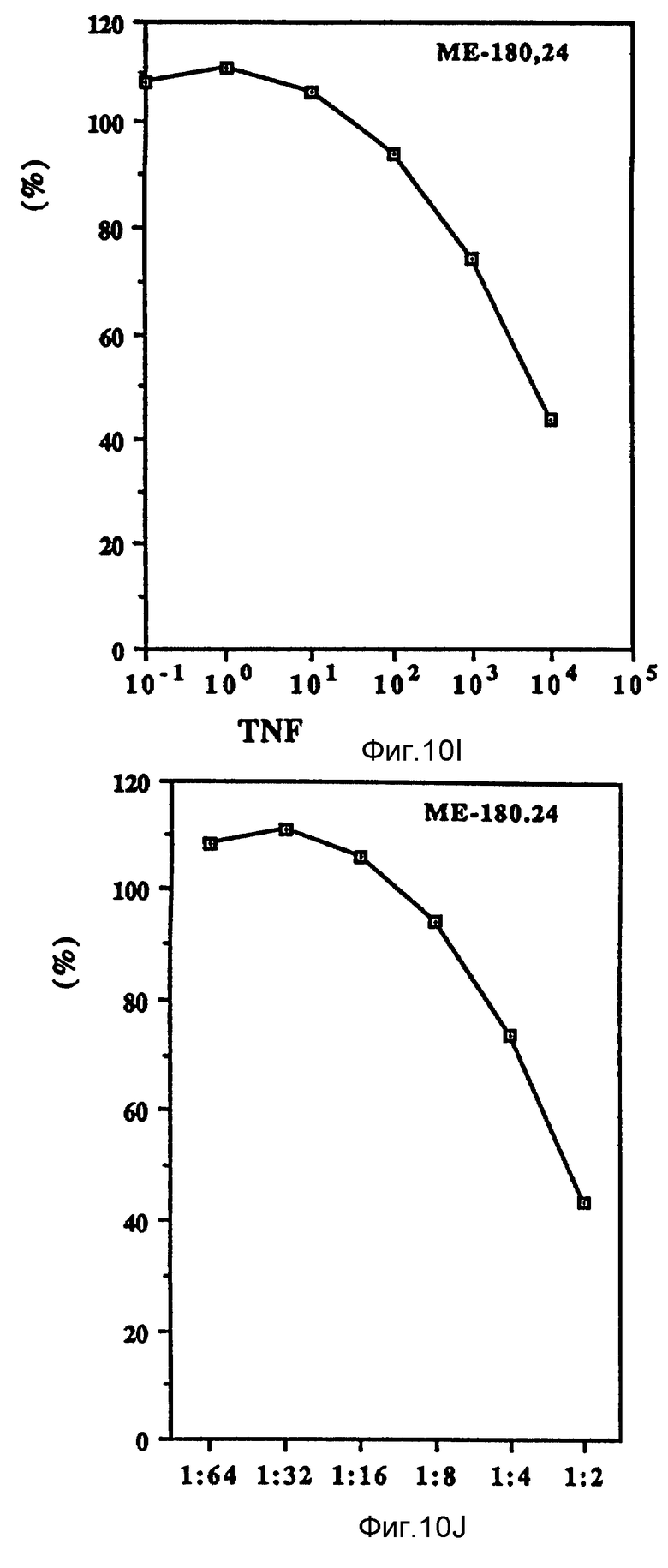
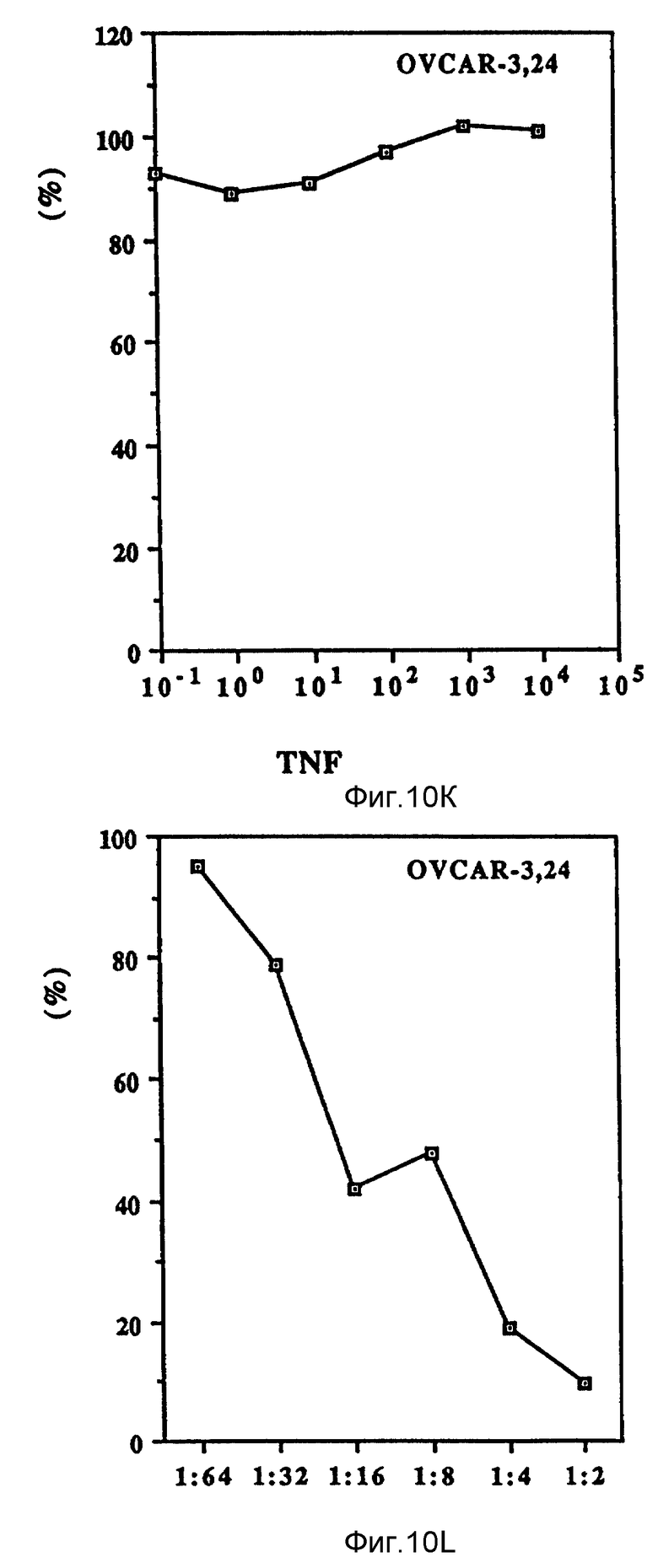
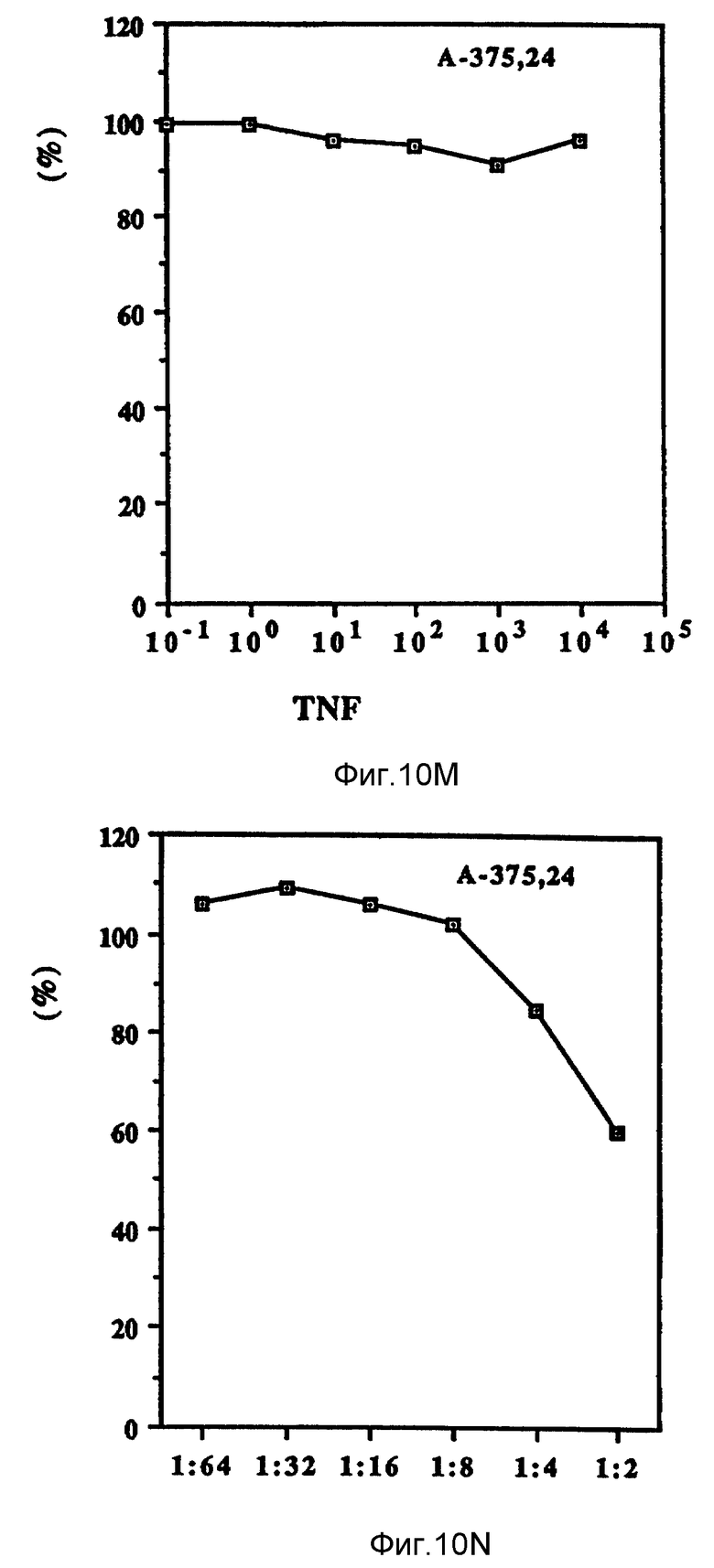
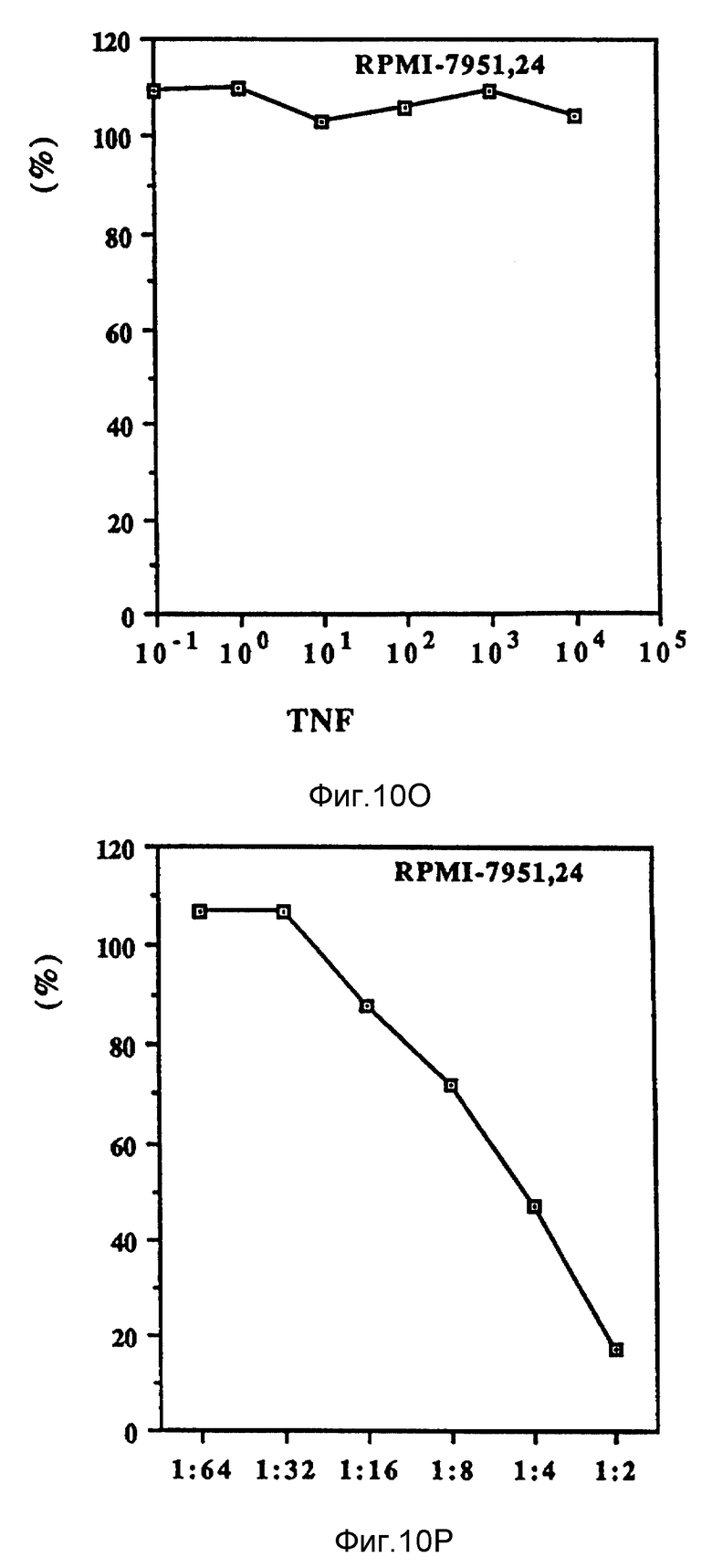
Фиг. 10 иллюстрирует зависящие от дозы антипролиферационные эффекты Онкоингибина и TNF.
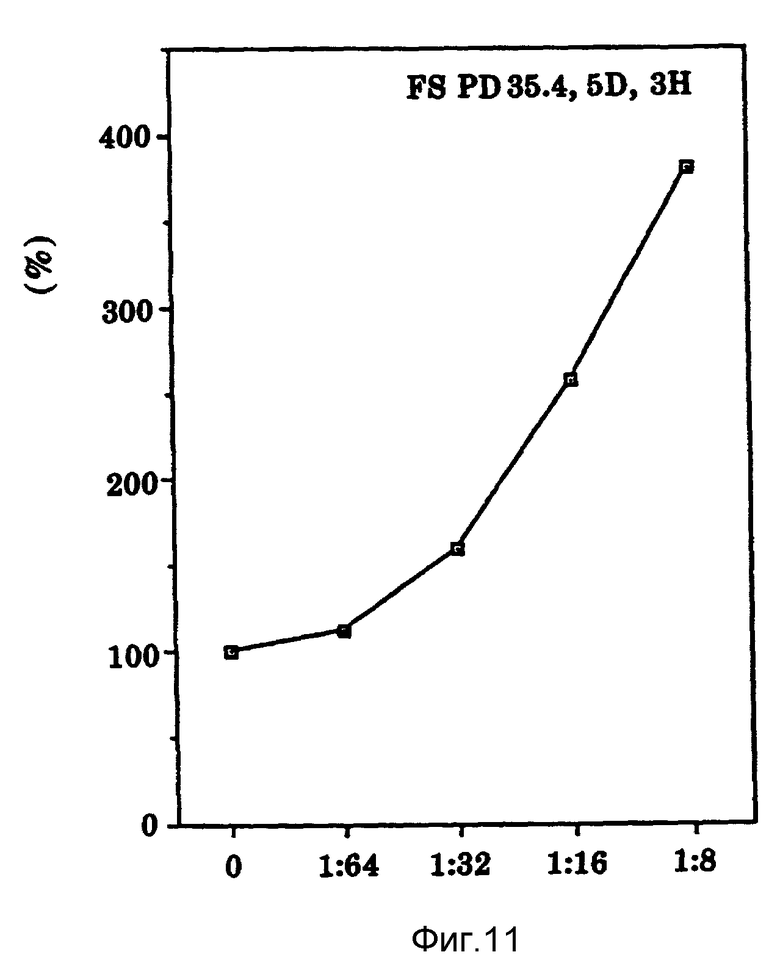
Фиг. 11 иллюстрирует зависящие от дозы пролиферационные эффекты Онкоингибина на нормальные человеческие фибробласты крайней плоти.
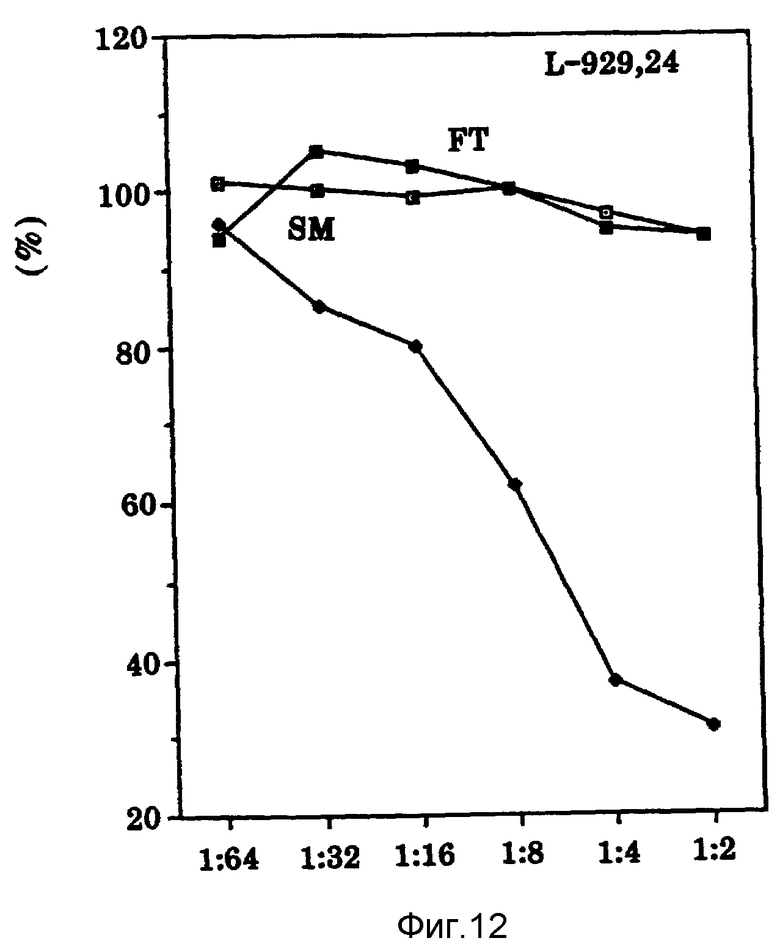
Фиг. 12 показывает влияние Онкоингибина на L-929 клетки мыши, обработанные актиномицином D.
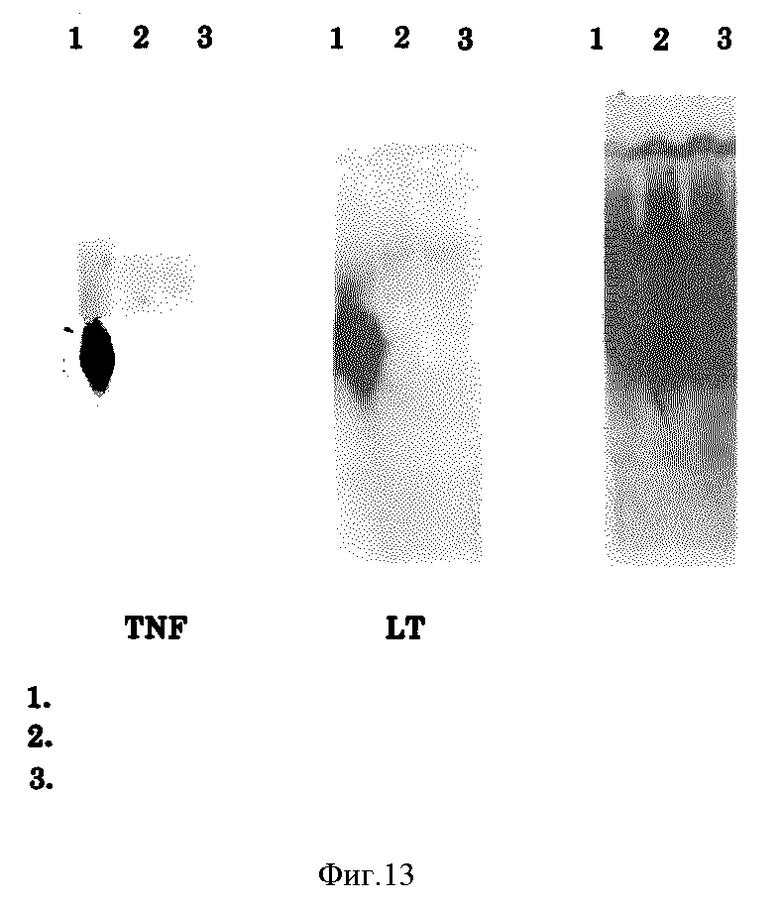
Фиг. 13 показывает нортерн-блот анализ для TNF и LT клеток К-562 необработанных и обработанных форболовыми эфирами (phorbol esters).
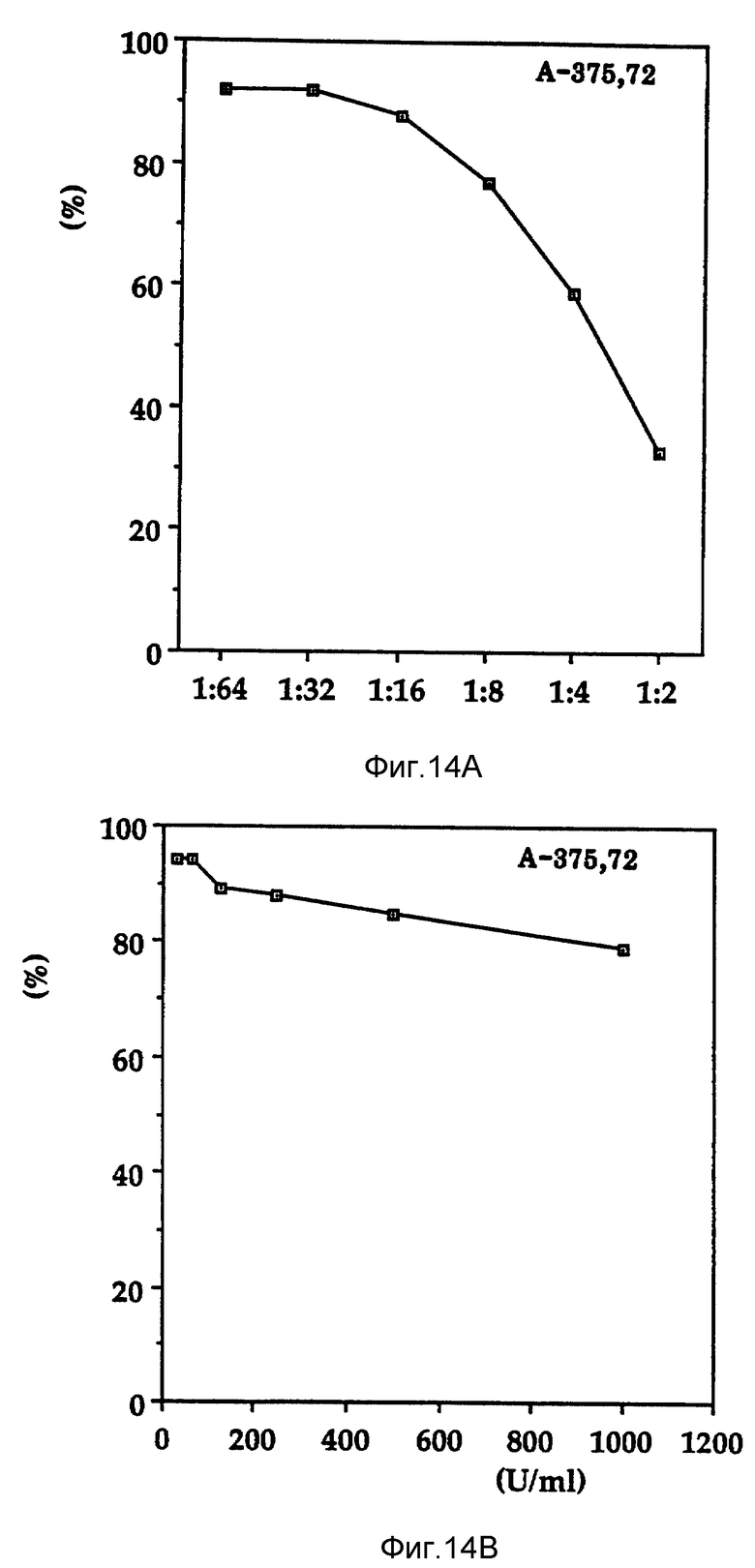
Фиг. 14 дает сравнение эффектов ингибирования роста Онкоингибина (рисунок A) и онкостатина (рисунок B) на клетки A-375 меланомы человека.
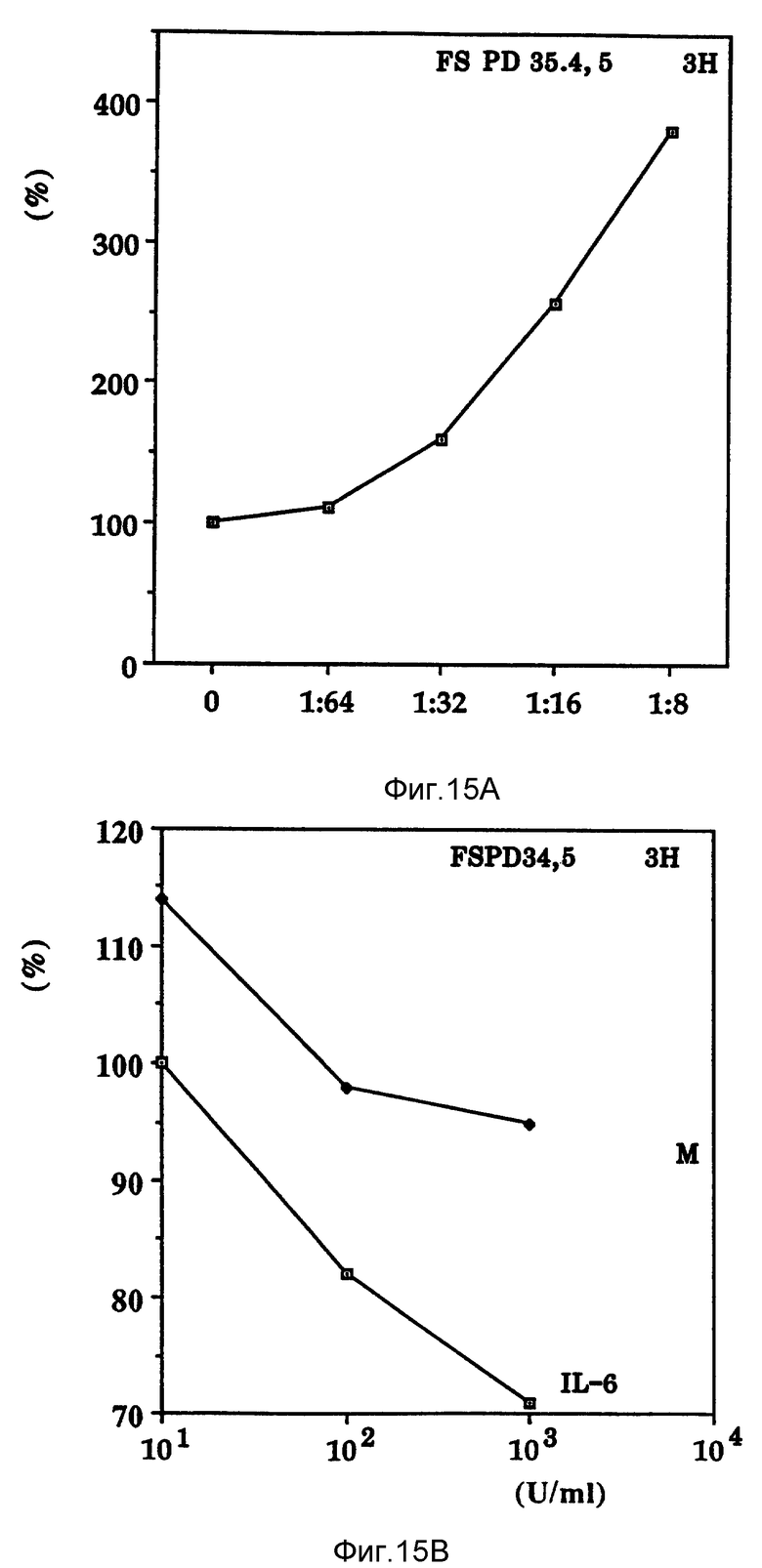
Фиг. 15 показывает влияние ингибирования роста онкостатина M и IL-6 на нормальные фибробласты.
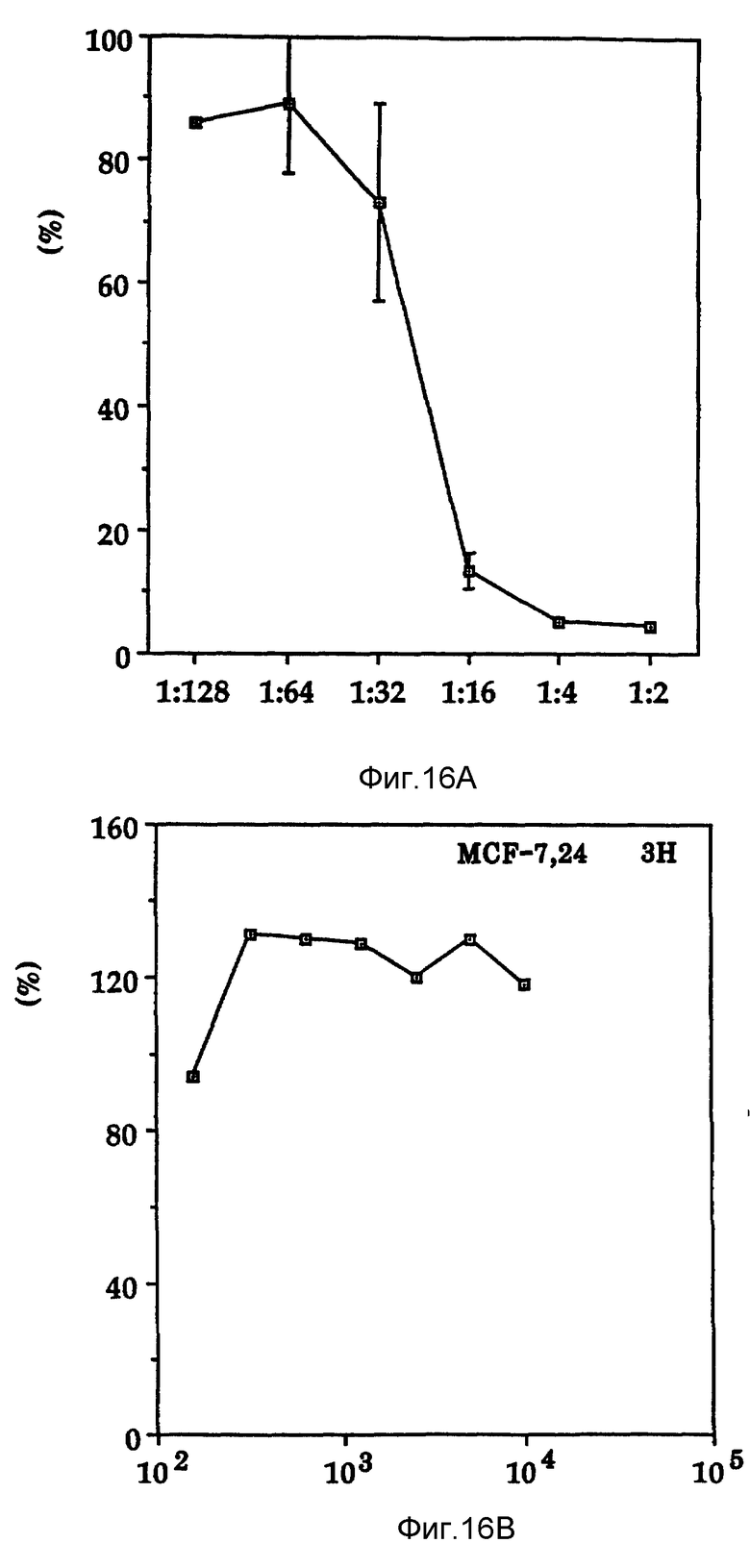
Фиг. 16 показывает влияние IL-6 на клетки MCF-7 опухоли молочной железы человека.
Фиг. 17 изображает влияние антител против γ-интерферона на активность Онкоингибина по отношению к клеткам MCF-7 опухоли молочной железы человека.
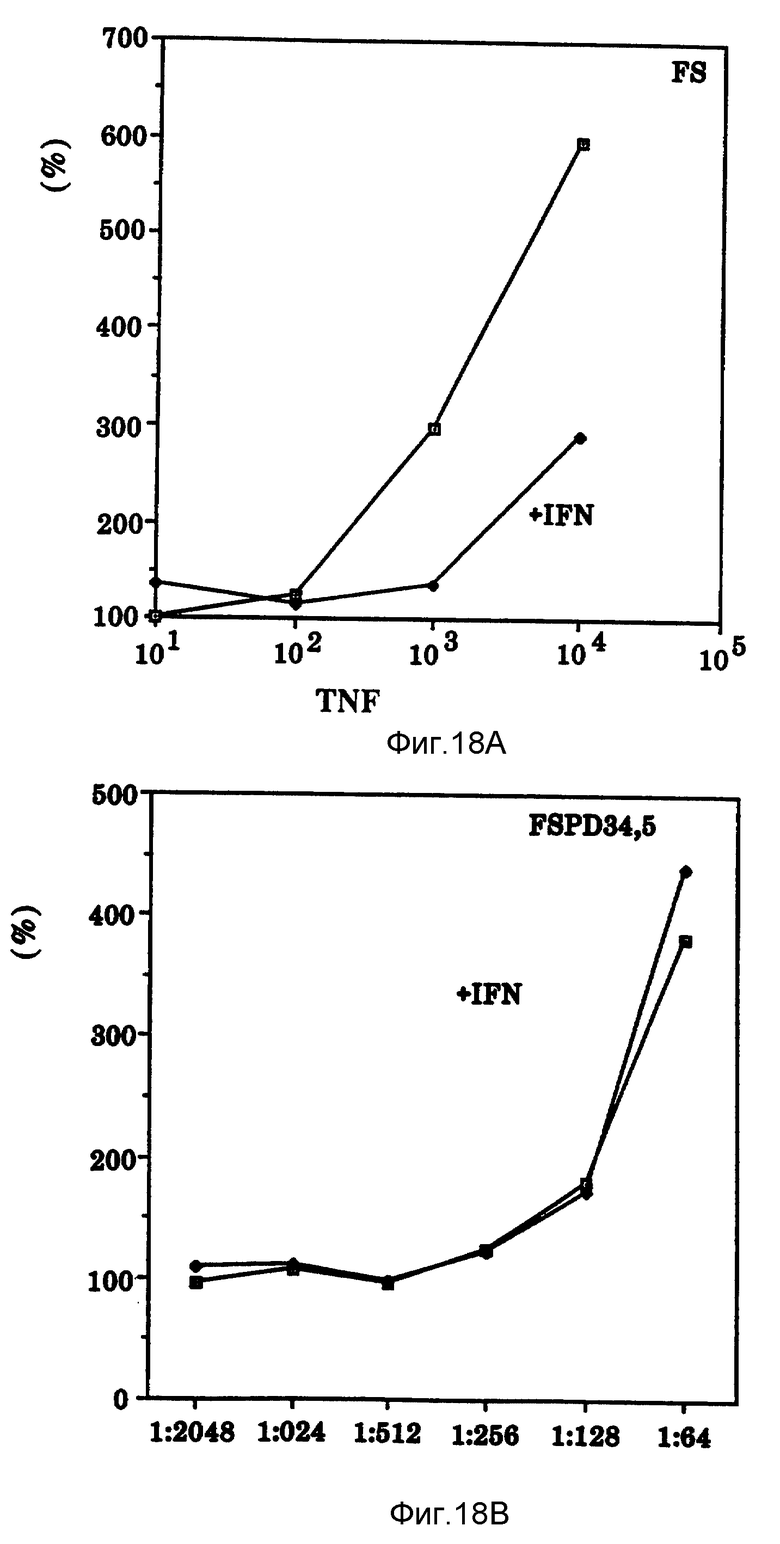
Фиг. 18 показывает ингибирующее влияние γ-интерферона на TNF (верхний рисунок) и отсутствие такого влияния на Онкоингибин (нижний рисунок) на человеческих фибробластах крайней плоти.
Фиг. 19 показывает скорость роста клеток MCF-6 опухоли молочной железы человека в отсутствие и в присутствии Онкоингибина.
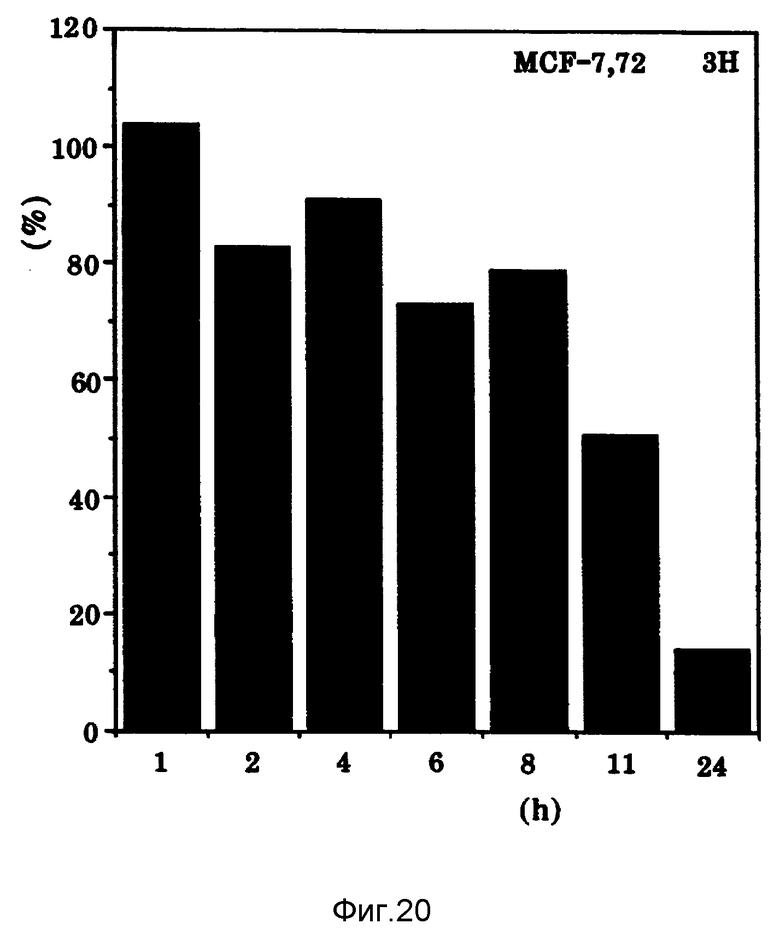
Фиг. 20 показывает влияние времени выдерживания MCF-7 клеток на Онкоингибин.
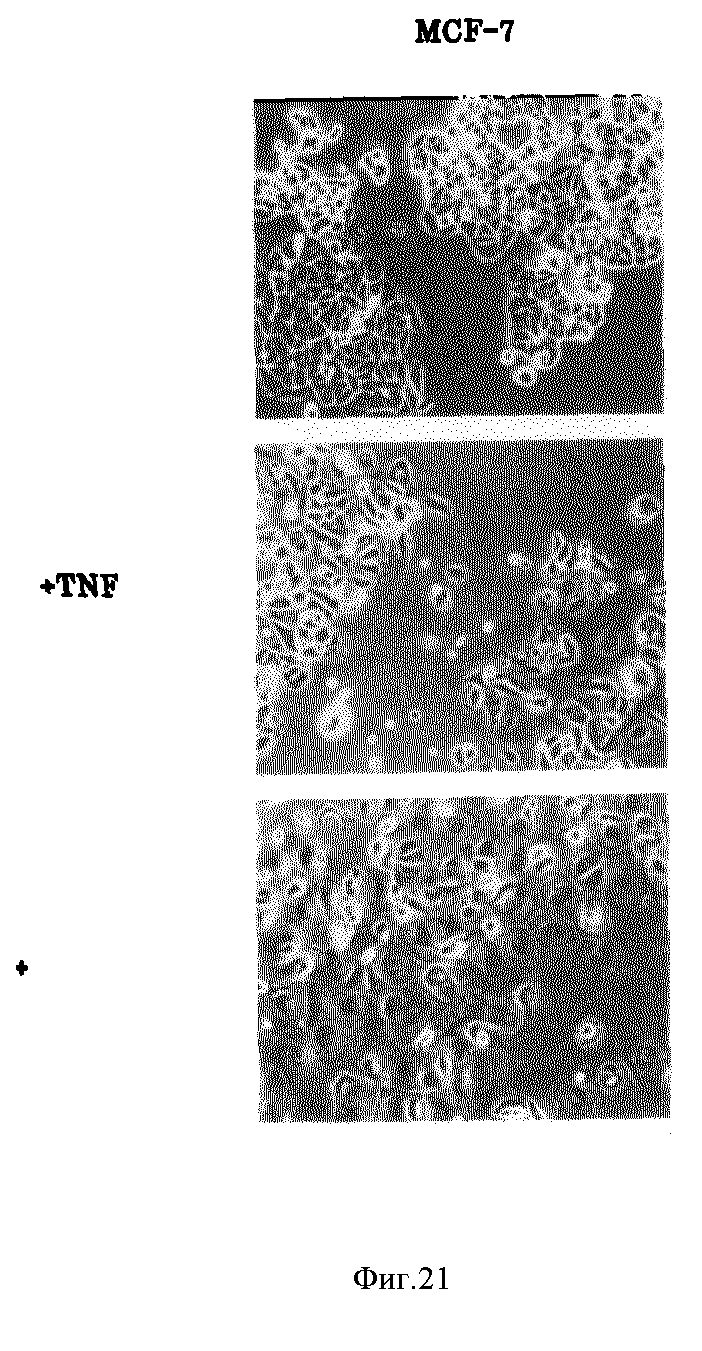
Фиг. 21 дает сравнение эффекта Онкоингибина с TNF на морфологию клеток MCF-7 опухоли молочной железы человека.
Различные клеточные линии, включая клеточные линии соединительных тканей мышей L 929 (CCL1), K - 562 (CCL-243), U-937 (CRL - 1543), HL-60 (CCL - 240), Raji (CCL - 86), Jurkat (CRL - 8163), BT 20 (HTB - 19), MCF-7 (HTB - 22), SK-BR-3 (HTB - 30), ZR-75-1 (CRL - 1500), RPMI 7951 (HTB - 66), A 375 (CRL-1619), A-431 (CRL - 1555), ME-1-80 (HTB 83), OVCAR-3 (HTB - 161), HeLa (CCL-2), Hep-2 (HB - 8065), и NIH 3T3 (CRL - 1618)
получали от American Type Culture /collection (Rockvillee, MD). TNF-устойчивые клетки NIH 3T3 выделяют, как описано K.Totpal, R.LaPushin, H.N. Ananthaswamy and B.B. Aggatwal Lymphokine and Cytokine Res. 11110(1991) 359 - 367. Клетки проверяли на загрязнение микоплазмой, применяя экспериментальный набор на основе ДНК, приобретенный у Gen-Probe (San-Diego, CA).
Все клеточные культуры содержат в состоянии непрерывного роста в слабом потоке. Некоторые культуры субкультивируют дважды в неделю. Клетки выращивают обычным образом в среде RPMI 1640, снабженной глутамином (2 мМ), пенициллином (10 единиц/мл), стрептомицином (100 мкг/мл) и сывороткой зародыша теленка (10%) во влажном инкубаторе в атмосфере 5% CO2.
Кондиционированные супернатанты клеточной линии К-562 эритробластоидов человека продуцируют активность, ингибирующую рост клеточной линии MCF-7 опухоли молочной железы человека. Вследствие способности ингибировать рост опухолевых клеток и не действовать на нормальные клетки эту активность называют "Онкоингибин".
Для продуцирования и индуцирования Онкоингибина выращивают клеточную линию К-562 эритробластоидов человека в среде RPMI-1640, содержащей 10% сыворотку зародыша теленка, снабженную глутамином (2 мМ), пенициллином (100% единиц/мл) и стрептомицином (100 мкг/мл). Клетки собирают центрифугированием, когда содержание клеток/мл достигает 0,8•106, клетки промывают один раз средой без сыворотки и переносят в среду RPMI-1640, не содержащую сыворотки и содержащую глутамин, пенициллин и стрептомицин. Для производства Онкоингибина 1•106 таких клеток/мл инкубируют в течение 48 часов в Т175-склянке (Falcon) в станционарных условиях культивирования в среде RPMI-1640 без сыворотки и затем обрабатывают форболовым эфиром (phorbol ester), 100 нг/мл, в течение 48 часов при 37oC. После этого кондиционированные клеточные супернатанты собирают центрифугированием, фильтруют через 0,22-микронный фильтр (Falcon) и хранят при 4oC до следующего этапа получения характеристики. Для концентрирования среду кондиционирования Онкоингибина отделяют ультрафильтрацией от клеточных линий К-562 посредством PM-10 мембраны (Amicon Corp.) и затем подвергают диализу 20 мМ Tris, pH 8,0.
Ингибирующую активность Онкоингибина на рост опухолевых клеток проверяют тремя независимыми способами, см. рисунок 1. Эти способы включают (I) подсчет клеток на гемоцитометре после окрашивания трипиновым голубым, (2) способ с применением кристаллического фиолетового красителя и (3) способ с включением тритий-содержащего тимидина. Всеми тремя способами ясно показано, что Онкоингибин ингибирует рост MCF-клеток, и степень ингибирования зависит от дозы. MCF-клеточную линию используют в качестве модели для разработки способа биологической проверки Онкоингибина вследствие ее удобства и чувствительности. Обнаружено, что ингибирование Онкоингибином включения тритий-содержащего тимидина является высоко чувствительным методом детектирования этого цитокина.
Биологическое исследование Онкоингибина включает инкубирование 5•103 клеток на дно кюветы с 96 ячейками в 0,1 мл среды RPMI-1640 10% FCS в течение ночи при 37oC в CO2 ингубаторе. Затем среду удаляют, общий финальный объем 0,1 мл разбавляют в два, четыре, восемь и т.д. раз и продолжают инкубацию в течение 24 часов при 37oC. В течение последних 6 часов добавляют тритий-содержащий тимидин (0,5 μ Cl/0,05 мл/ на ячейку). В конце 24-часового периода инкубации среду выливают и клетки отделяют, обрабатывая 0,1 мл трипсина (0,5%) и EDTA (5,3 мМ) в течение 30 минут при 37oC. Клетки собирают, используя устройство PHD Cambridge cell harvester, и определяют радиоактивность клеток, при помощи бета-счетчика. Данные выражены в % относительной жизнеспособности, которую определяют как число распадов в минуту (dpm) у клеток в присутствии Онкоингибина, деленное на dpm, включенное в присутствии только среды, умноженное на 100. Количество Онкоингибина, необходимое для ингибирования, соответствующего жизнеспособности в 50%, определяют как одну единицу цитокина. Как показано на фиг. 1, Онкоингибин оказывает ингибирующее действие на рост опухолевых клеток, зависящее от дозы, что проиллюстрировано всеми тремя способами.
Как показано на фиг. 2, в течение 24 часов можно наблюдать чистый зависящий от дозы ответ MCF-7 Онкоингибин. Обратную величину разбавления образца, необходимого для достижения 50% ингибирования включения тимидина, определяют как одну единицу Онкоингибина.
Как показано на фиг. 3, проверяли продуцирование Онкоингибина в отсутствие сыворотки. Условия культивирования без сыворотки использовали вследствие трудности очистки протеинов от образцов, содержащих сыворотку. Эти результаты ясно показывают, что клетки К-562 выделяют Онкоингибин даже в отсутствие сыворотки.
Проверяли могут ли различные агенты индуцировать производство Онкоингиина. Были проверены ионофор кальция, конканавалин А, фитогемаглутинин и форболовый эфир. Фиг. 4 показывает, что форболовый эфир может увеличивать производство Онкоингибина. Таким образом, форболовый эфир можно использовать для оптимизации производства Онкоингибина из клеток К-562. Когда клетки выдерживают в присутствии форболового эфира (100 нг/мл), наблюдают приблизительно 4-кратное увеличение производства Онкоингибина. Оптимальное индуцирование Онкоингибина наблюдают, когда клетки инкубирют с форболовым эфиром в течение 48 часов (таблица 1) и плотность клеток составляет 1 • 106 клеток на мл среды (таблица II) (табл. I-VIII см. в конце описания).
К-562 клетки (1•106/мл) культивируют в среде (RPMI-1640) без сыворотки либо в присутствии форболового эфира (100 нг/мл), либо в его отсутствии при 37oC в CO2 инкубаторе в течение различного времени, затем собирают кондиционированную среду при помощи центрифугирования. Образцы проверяют на MCF-7 клетки при разбавлении в 2, 4, 8 и т.д. раз, как указано в разделе Материалы и Методы.
Как показано на фиг. 5, для очистки и характеристики Онкоингибина, клеточную кондиционированную среду концентрируют ультрафильтрацией, используя мембрану РМ-10, отсекающую молекулярный вес 10,000. Активность во фракции (протекающей сквозь или FT) не сохраняется при фильтре более низком, тогда как активность в оставшейся фракции или концентрате (C) пропорционально выше, чем активность стандартного буфера (исходный материал, SM). Результаты указывают, что активность Онкоингибина сохраняется и концентрируется. Эти результаты также указывают, что молекулярный вес Онкоингибина, выше, чем 10,000.
В эксперименте по гель-проникающей жидкостной хроматографии закрепленных протеинов (фиг. 6, a и b) образец Онкоингибина вносят в колонну Superose-6 (Pharmacia), уравновесив предварительно физиологическим раствором с фосфатным буфером, содержащим 0,1% бычьего сывороточного альбумина и 0,01% азида натрия. Колонку промывают при комнатной температуре со скоростью тока 0,5 мл/мин и объемом каждой фракции 0,5 мл. Колонку калибруют по стандартным молекулярным весам (Schwarz/Mann, Cambridge, MA).
Стандарты включают следующие Апоферритин (480 kDa), альфа амилазы (20 kDa), гамма-глобулин (160 kDa), бычий сывороточный альбумин (67 kDa), овальбумин (45 kDa), химотрипсиноген (24 kDa) и цитохором C (12,4 kDa).
Из фиг. 6 ясно, что Онкоингибин имеет молекулярный вес приблизительно 25 kDа. Молекулярный вес Онкоингибина проверяют способом гель-проникающей жидкостной хроматографии закрепленных протеинов на колонке Superose - 6 при неденатурирующих условиях. Результаты гель-фильтрации с использованием соляного раствора с фосфатным буфером (pH 7,4) показывают два основных пика активности, один, соответствующий исключенному объему, и второй пик, соответствующий среднему молекулярному весу приблизительно 25 kDa (фиг. 6b).
В экспериментах по электрофорезу в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE), представленных на фиг. 7 и 8, 15% полиакриламидный гель проходит в основном согласно U.K.Laemmli (Nature 227 (1970) 680-685 и протеины становятся визуально наблюдаемыми при подкрашивании серебром. Для препаративного гель-электрофореза и элюирования активности перед закреплением и подкрашиванием часть геля разрезают бритвой на слои (более 40), элюируют в тестовой пробирке 50 мМ раствором бикарбоната аммония посредством диффузии в течение ночи, фракции подвергают диализу относительно 20 мМ Tris, pH 8,0, и затем исследуют на биологическую активность.
Как показано на фиг. 7, для дополнительного подтверждения молекулярного веса Онкоингибина, проводят SDS-PAGE анализ. После электрофореза гель разрезают на слои, элюируют в 50 мМ бикарбонате аммония в течение ночи и исследуют на активность Онкоингибина. Более 50% активности Онкоингибина выделяют в диапазоне молекулярного веса около 30 kDa. Менее 10% активности обнаружено также в области около фронта красителя.
Как показано на фиг. 8, повторное прохождение биологически активной фракции SDS-PAGE и окрашивание гелей серебром дает одиночный основной пик, соответствующий молекулярному весу около 28 kDa.
Как показано на фиг. 9 (а и b), проверяют связывание Онкоингибина с анион-обменной смолой и элюирование со смолы. Одну колонку (1 см х 5 см) набивают анион-обменной смолой Q-сефарозой и затем уравновешивают 20 мМ Tris, pH 8,0 (уравновешивающий буфер). Образец Онкоингибина после проведения диализа относительно уравновешивающего буфера загружают в колонку со скоростью тока 0,5 мл/минуту. Колонку ополаскивают уравновешивающим буфером и затем проводят градиентное элюирование раствором NaCl (0-1 M). Разные фракции анализируют на концентрацию протеина и биологическую активность.
DEAE Affigel Blue - хроматография: вторую колонку (1 см х 5 см) набивают смолой DEAE Affigel Blue и затем уравновешивают 20 мМ Tris, pH 8.0 (уравновешивающий буфер). Образец Онкоингибина, предварительно, уравновешенный по буферу посредством диализа, загружают в колонку со скоростью тока 0,5 мл/мин. Колонку ополаскивают уравновешивающим буфером и затем проводят градиентное элюирование раствором NaCl (0-1 M). Различные фракции анализируют на концентрацию протеинов и биологическую активность.
Фиг. 9a и 9b показывают, что Онкоингибин связывается и его можно элюировать с анион-обменной смолы. К обеим смолам (Q-сефароза и DEAE affigel blue) активность Онкоингибина привязывается в 20 мМ Tris, буфер с pH 8,0. Связанный Онкоингибин можно элюировать с DEAE affigel blue посредством 0,2 М NaCl в 20 мМ Tris - буфере, а с Q-сефарозы - 0,5 М NaCl.
Онкоингибин ингибирует рост разнообразных опухолевых клеток.
(Таблица III) Антипролиферационную активность Онкоингибина проверяли посредством включения тритий-содержащего тимидина.
Опухолевые клетки (5000/на ячейку) инкубируют с TNF (0,2 мкг/мл) или Онкоингибином (индуцированным форболовым эфиром и концентрированным) в течение 72 часов при 37oC и затем определяют относительную жизнеспособность клеток (%) по включению тимидина, как описано ранее.
Как показано на фиг. 10 (A-D), проверяли действие Онкоингибина, зависящее от дозы, на некоторые из перечисленных в таблице VII клеточные линии и сравнивали его с TNF. Из результатов, представленных в таблице VII и на фиг. 10, ясно, что кроме MCF-7 Онкоингибин может ингибировать рост некоторых различных типов лейкозов, меланом, карцином и гепатом. Рост крысиных клеток также ингибируется. Таким образом, ясно, что в отличие от интерферонов Онкоингибин не является специфическим для образцов.
Как показано на фиг. 11 и 12, для исследования роста клетки помещают на ночь в 0,1 мл среды (RPMI-1640 c 10% FBS) в кювету с 96 ячейками (FaIcon). После чего среду удаляют и производят серию разбавлений 0,1 мл человеческого Онкоингибина. Через 72 часа инкубации при 37oC среду удаляют и следят за жизнеспособными клетками, окрашивая их кристаллическим фиолетовым красителем, согласно процедуре, описанной в работе B.B.Aggarwal, Human Iymphotoxin, Meth. of Enzymol., 116:441-448 (1985), включенной здесь при цитировании. Метод проверки жизнеспособности клеток с окрашиванием красителем коррелирует с количеством клеток, определенным путем выделения с использованием раствора трипсина и подсчета под микроскопом, применяя гемоцитометр. Процент относительной жизнеспособности клеток рассчитывают как оптическую плотность в присутствии тестового образца, деленную на оптическую плотность в отсутствие тестового образца (среда) и умноженную на 100. Для LT и TNF проводят исследование цитотоксичности аналогично исследованию ингибирования роста, за исключением того, что 20 • 103 клеток L-929 обрабатывают актиномицином D (1 мкг/мл) параллельно с цитокином в течение 24 часов.
Исследование стимулирования роста клеток. Исследования стимулирования роста клеток проводили, в основном, согласно процедуре, описанной в работе Vilcek и др., J.Exp, Med. 163:632-643 (1986). Коротко говоря, для исследований стимулирования роста клеток используют конфлюэнтные диплоидные фибробласты крайней плоти человека при уровне пассирования 12-16 (что приблизительно соответствует уровню удвоения популяции 24-32). Для определения действия человеческого Онкоингибина клетки (8 • 103/на ячейку) помещают в 0,1 мл среды (RPMI-1640 + 10% FBS) в кювете на 96 ячеек (FaIcon). После инкубации в течение ночи в CO2-инкубаторе при 37oC среду удаляют и проводят серию разбавлений цитокина в 0,2 мл объеме. Через пять дней инкубации среду декантируют и подкрашивают клетки кристаллическим фиолетовым красителем. Все измерения выполняют трижды. Процент относительной жизнеспособности клеток рассчитывают, как указано в опытах по исследованию ингибирования роста.
Для опытов по включению (3H) TdR фибробласты человека культивируют и обрабатывают цитокином в течение 5 дней. В течение последних 24 часов к каждой ячейке добавляют тритий-содержащий тимидин (6,7 Ci/ммоль, New England Nuclear, Boston, MA), 0,5 μCi/ на ячейку. После этого удаляют культуральную среду, ячейки промывают дважды соляным раствором с фосфатным буфером и отделяют клетки, добавляя раствор трипсина (0,5%) с EDTA (5.3 мМ). Затем собирают суспензию клеток при помощи PDH-сборщика клеток (Cambridge Techno-Cogy Inc. Watertown, MA) и лизируют, промывая дистиллированной водой. Измеряют связанную с фильтром радиоактивность в жидкостном сцинтилляционном счетчике (модель 1600 TR, Packard Co., Meriden, CT). Включение тимидина в фибробласты, определенное этим способом, коррелирует с ростом клеток. При излучении ингибирования роста опухолевых клеток клетки инкубируют с цитокином в течение 3 дней при общем конечном объеме 0,1 мл, а затем определяют включение тимидина.
Как показано на фиг. 11, ясно что Онкоингибин стимулирует рост нормальных фибробластов крайней плоти человека. При ингибировании роста опухолевых клеток Онкоингибин увеличивает пролиферацию нормальных фибробластов крайней плоти человека.
Как показано на фиг. 12, аналогично TNF и LT Онкоингибин осуществляет цитолиз актиномицина D при обработке L-929 клеток. Противоопухолевую активность Онкоингибина против клеток L-929 нельзя нейтрализовать ни анти-LT, ни анти-TNF антителами (таблица IV). При исследовании EL ISA в препаратах Онкоингибина не обнаруживают существенных количеств TNF или LT (таблица V). Таблица III показывает, что некоторые типы опухолевых клеток (например, SK-BR-3, HeLa, A-431, OYCAR-3, A365 и RPMI-7951), устойчивые к TNF/LT, остро чувствительны к Онкоингибину. Онкоингибин также можно отличить от TNF/LT на том основании, что, как обнаружено, клеточные линии, выделенные по своей устойчивости к TNF/LT (NIH 3T3-LTR и BT-20 TNFR), чувствительны к Онкоингибину (таблица III).
В качестве источника Онкоингибина используют свободную от сыворотки среду кондиционирования клеток K-562 и определяют уровень различных цитокинов стандартными способами EL ISA (R & D система). ND не определяют.
TNF и LT являются продуктами моноцитов и лимфоцитов, соответственно, и ингибируют рост разнообразных клеток. Подобно Онкоингибину лимфотоксин и TNF ингибируют рост клеток MCF-7, но для этого требуется большая концентрация TNF и LT (10000 ед/мл).
Для дополнительного подтверждения того, что Онкоингибин не является ни TNF, ни LT, проводят Noethern blot анализ с целью поиска генов для каждого цитокина. При проведении Northern blot анализа культуры клеток K-562, обработанные и необработанные форболовым эфиром, высевают при плотности 1•106 клеток/мл в склянки на 75-см, инкубируют с активатором протеинкиназой C в течение 24 часов и затем собирают центрифугированием. Вся РНК экстрагируется из клеток способом с применением гуанидинизотиоцианатфенола-хлороформа, описанным в работах Chirgwin и др., Biochem. 18: 5294-5299 (1979) и Maniatis и др., Molecular Cleoning 188-209 (1982). Обычно получают РНК с соотношением оптического поглощения 260 нм/280 нм более 1,9 и выходом приблизительно 100 мкг РНК на 20•106 клеток.
Для электрофореза фракционируют 20 мкг РНК на 0,8% гелеагарозы, содержащем 2,2 М формальдегид при 75-100 B в течение приблизительно 3 часов. После чего на гель действуют водой, обработанной диэтилпирокарбонатом, при 68oC в течение 1 часа и затем переносят РНК на Hybond нейлоновые мембраны (Amersham Corp., Arlington Heights, IL).
После переноса (3 часа) фильтр промывают дважды раствором SSC (SSC: 0,15 M хлорид натрия, 0,15 мМ ацетат натрия, 15 мМ цитрат натрия, pH 7.0) и помещают в футляр (microseal bag).
Предварительную гибридизацию проводят при 65oC в течение 1 часа в буфере, содержащем 7% SDS, 500 мМ фосфата натрия, 1 мМ EDTA, pH 7,2 (гибридизационный буфер). Затем фильтры гибридизуют за счет проб TNF или LT лДНК (специфическая активность 2•108 число импульсов в минуту /мкг/ ДНК). После гибридизации мембраны промывают несколько раз при 65oC в гибридизационном буфере, содержащем ДНК спермы лосося (200 мкг/мл). На фильтры накладывают Kodak XAR-5 пленку при 70oC в течение 1-3 дней. Осуществляют процедуры последовательных циклов предварительной гибридизации, гибридизации, промывания и освобождение фильтра. Была показана равная нагрузка линий при проверке гелей после подкрашивания с применением ethidium bromide, а также при повторной гибридизации тех же фильтров за счет кДНК для актина или глицеральдегид-3-фосфатдегидрогеназы (GAPDH). Проводят денситометрию полос путем сканирования фильтра для подсчета радиоактивности, применяя блот-анализатор Betascope 603 (Betagen Corp., Waltham, MA), или посредством сканирующей ауторадиограммы для определения оптической плотности, применяя сканирующий денситометр (Helena Laboratories Inc. Beaumont, TX).
Как показано на фиг. 13, ни для LT, ни для NTF не обнаружено экспрессии мРНК в клетках K-562. Кроме того, гельфильтрация и SDS-PAGE эксперименты подтверждают, что молекулярный вес Онкоингибина отличается от молекулярного веса TNF и LT.
Как показано на фиг. 19, опухолевые клетки молочной железы человека быстро растут в культуральной среде. Однако, когда к культуре добавляют Онкоингибин, роста этих клеток не наблюдают. Для определения времени выдерживания, необходимого для ингибирования роста этих клеток, клетки подвергали воздействию Онкоингибина в течение различного времени. Как показано на фиг. 20, действие Онкоингибина по ингибированию роста заканчивается, когда цитокин удаляют из среды. Эти результаты предполагают необходимость постоянного присутствия Онкоингибина.
Как показано на фиг. 21, после обработки Онкоингибином и сравнении с NTF проверяют морфологию клеток MCF-7. Результаты показывают различие способов, которыми TNF и Онкоингибин ингибируют рост опухолевых клеток молочной железы. TNF индуцирует окружение клеток, которое ведет к их отрыву от чашки, в то время как Онкоингибин индуцирует разрастание или разбухание клеток. Последнее может быть результатом действия Онкоингибина на проницаемость клеток. Онкоингибин также ингибирует образование колонии опухолевых клеток молочной железы человека.
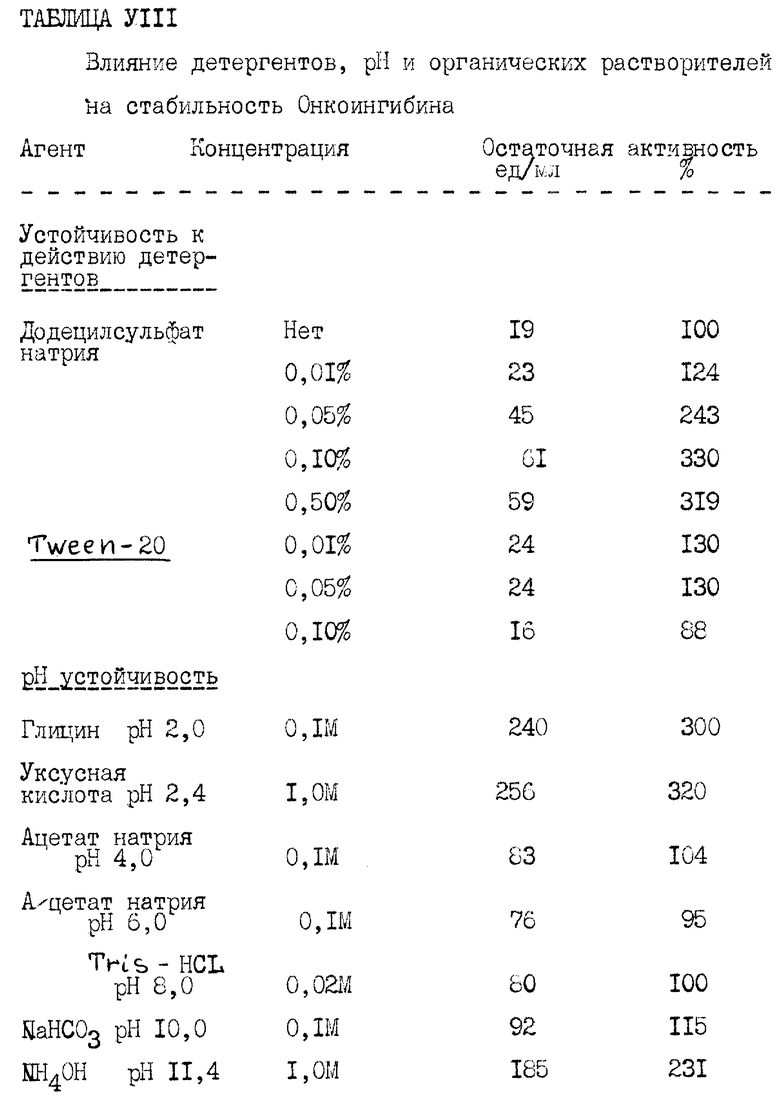
Изучение стабильности Онкоингибина. Онкоингибин обрабатывают органическим растворителем (ацетонитрилом, или метанолом, или пропанолом), кислотными растворителями (HCL, трихлоруксусной кислотой или уксусной кислотой), щелочными растворителями (NaOH, гидроокисью аммония) или детергентами (Sds, Tween 10) в течение двух часов при комнатной температуре, затем подвергают диализу относительно 20 мМ Tris-HCl, pH 8,0 в течение ночи в холодной комнате и исследуют на биологическую активность (таблицы VI и VIII).
Для экспериментов по проверке термостабильности Онкоингибин выдерживают при различных температурах в течение различного времени и сразу определяют биологическую активность. Обнаружено, что биологическая активность Онкоингибина остается постоянной до 80oC в течение 60 минут, но при выдерживании при 100oC в течение 30 минут наблюдается 50% потеря активности (таблица VI).
В таблице VII Онкоингибин обрабатывают проназой E. трипсином, химотрипсином и Y8 Staph протеазой и затем анализируют на биологическую активность. Результаты показывают, что активность Онкоингибина можно полностью уничтожить проназой E, предполагая, таким образом, что это протеин. Найдено, что это протеин. Найдено, что его активность частично чувствительна к обработке трипсином и полностью устойчива к действию химотрипсина и Y8 протеазы.
Дезоксирибонуклеаза также не оказывает никакого действия на активность Онкоингибина.
Онкоингибин инкубируют с различными ферментами при 37oC в течение 24 часов в 20 мМ Tris-буфере при PH 8,0, затем реакцию останавливают добавлением 10% сыворотки и исследуют на активность Онкоингибина.
Устойчивость Онкоингибина к действию детергентов. Образец Онкоингибина обрабатывают различными концентрациями SDS, отрицательно заряженного детергента или Tween 20, нейтрального детергента в течение 2 часов, диализуют и затем исследуют на биологическую активность. В качестве контроля используют бычий сывороточный альбумин, обработанный таким же детергентом. Результаты этих экспериментов показаны в таблице V. При обработке протеина SDS или Tween 20 не наблюдается потери биологической активности. В случае SDS ясно видно увеличение биологической активности Онкоингибина, зависящее от дозы. При использовании Tween 20 наблюдают незначительное увеличение активности.
Образцы Онкоингибина обрабатывают при комнатной температуре различными агентами в течение 1 часа в 20 мМ Tris-буфере, pH 8.0, диализуют в течение ночи и затем исследуют на остаточную биологическую активность, S и P обозначают фракции супернатанта и осадка.
Устойчивость онкоингибина к действию восстановителей. Онкоингибин обрабатывают различными концентрациями дитиотреита в течение 2 часов, затем диализуют и исследуют на биологическую активность. Результаты этих экспериментов показаны в таблице IX. Ясно, что активность Онкоингибина неустойчива к действию DTT. Наблюдают 50% потери активности при 1 мМ DTT и 67% потери активности при 100 мМ DTT.
Образцы Онкоингибина обрабатывают различными агентами, диализуют и затем исследуют на биологическую активность.
Онкоингибин можно концентрировать трихлоруксусной кислотой и сульфатом аммония. Онкоингибин обрабатывают растворами различных концентраций TCA или NH4SO4, центрифугируют, повторно суспендируют, диализуют и затем исследуют на биологическую активность. Результаты, представленные в таблице IX, указывают, что активность Онкоингибина можно осадить либо 5% TCA, либо 70% сульфатом аммония (SAS). Таким образом, эти результаты также предполагают белковую природу Онкоингибина.
Амфирегулин является гликопротеидом, который выделяют из клеток MCF-7, обработанных форболовым эфиром, и который ингибирует рост клеток 4431. Амфирегулин имеет кажущийся молекулярный вес 22kDa. И Онкоингибин, и амфирегулин ингибируют рост опухолевых клеток. Однако, Онкоингибин не продуцируют обработанные форболовым эфиром клетки MCF-7. Во-вторых, даже при том, что и Онкоингибин, и амфирегулин демонстрируют антипролиферационную активность относительно клеток A431 (таблица III), амфирегулин, в отличие от Онкоингибина, неактивен относительно меланомы человека (A375), аденокарциномы молочной железы человека (ZR-75-1 или MCF-7), аденокарциномы легких человека (A-549), карциномы позвоночника человека (H3347), человеческих лимфобастоидных клеток (CEM), человеческих EBY-трансформированных B клеток, человеческой эпидермальной карциномы гортани (Hep 2), эндотелиальных клеток сердца бычьего зародыша (CRL-1395), крысиных BAL B/3T3 и клеток легких норки (CCL-64). Аналогично Онкоингибину амфирегулин стимулирует пролиферацию человеческих фибробластов. Кроме человеческих фибробластов амфирегулин стимулирует также рост некоторых опухолевых клеток, включая опухолевые клетки гипофиза человека (CRL 7386), клетки карциномы яичников человека (HTB 77), клетки почек Африканских зеленых мартышек (BSC-1) и клетки крысиных почек (NRK). Однако, молекулярный вес Онкоингибина также существенно отличается от молекулярного веса амфиругелина, зрелая форма последнего составляет протеин длиной в 84 аминокислоты.
Онкоингибин устойчив как к кислотным, так и к щелочным условиям в диапазоне pH от 2.0 до 10.0 (таблица VIII). Сообщается о некоторых цитокинах, которые стабильны при pH 2, включая IFN-α, IFN-β, IL-2, IL-4, IL-8, CSF-1, GM-CSF, TGF -β,Онкостатин M и амфирегулин. Обнаружено также, что Онкостатин M, афирегулин, CSF-1 и IL-4 стабильны к щелочным условиям (pH 12). В настоящее время фактор промотирования липолиза (LPF), белок с молекулярным весом приблизительно 6kDa, выделен из клеточной линии меланомы A375, устойчивой к нагреванию при 96oC в течение 10 минут, протеаза K (10 мк/мл), трипсину, проназе РНКазе, ДНК и окислению периодатом. LPF можно осадить трихлоруксусной кислотой (10%) без потери биологической активности. Найдено, что Онкоингибин устойчив к нагреванию до 80oC в течение 30 минут, а при 100oC только частично теряет свою активность (Таблица VI). Обработка Онкоингибина 10% (вес/вес) трипсином в течение 24 часов при 37oC ведет к частичной потере биологической активности. Это аналогично тому, что наблюдают для CSF-1, GM-CSF и LT. Обнаружена также биологическая устойчивость активности Онкоингибина к 0,5% STS.
Онкоингибин отличается от фактора поражения опухоли TKF), цитокина, идентифицируемого из гибридомы макрофаг-моноцит человека, в которой TKF является основным белком (pH 8-9.0), имеет кажущийся молекулярный вес 56 kDa, определенный гельфильтрацией, и его можно элюировать с Конконавалин A-сефарозы 0,4 М α- метилманнозидом.
Онкостатин M является цитокином, выделенным из клеток U-937, обработанных форболовым эфиром, и ингибирует рост клеточной линии меланомы человека A375 в исследованиях с включением тимидина. Нестимулированные клетки U-937 не экспрессируют ген или не выделяют эту активность. Периферические кровяные T лимфоциты человека, активированные фитогемагглутинином, экспрессируют ген и выделяют этот цитокин. Онкостатин M является гликопротеидом с молекулярным весом 28kDa, определенным методом SDS-PAGE и 18 kDa по методу гель-фильтрации. Он синергичен с TGF -β,но не с интерферронами. Показано, что Онкостатин M ингибирует пролиферацию клеток нейробластомы HTB 10, клеток карциномы легких A-549 также, как A375 и клеток меланомы SKMEL-28; однако, не ингибирует пролиферацию клеток L-929. В противоположность этому, Онкоингибин продуцируется клетками K-562 (не продуцируется клетками U-937) как в присутствии, так и в отсутствие форболового эфира, и действует на клетки L-929. Кроме того, в противоположность Онкоингибину, Онкостатин M является относительно слабым ингибитором клеток A375 (фиг. 14).
Трансформирующий β- фактор роста TGF -β) является цитокином, который является гомодимером с молекулярным весом 25 kDa по методу SDS-PAGE, и ингибирует рост некоторых типов клеток эпителиальной и мезенхимальной природы, включая клетки эндотелия сосудов человека, T и B лимфоциты, TGF-β ингибирует также ацтокринным способом клетки A-549, MCF-7. Однако в отличие от Онкоингибина, TGF-β продуцируется разнообразными клетками, включая тромбоциты, соединительные ткани и лимфоциты, и требует кислотной активации перед проверкой активности. В дополнение к этому, TGF -βимеет молекулярный вес 12,5 kDa по SDS-PAGE при восстановительных условиях.
EL ISA исследование цитокинов. Коммерчески доступный (R & D системы) способ количественного иммунологического исследования "сэндвичевых" ферментов применяют для проверки присутствия известных цитокинов (TNF, LT, IL - 1, IL - 6 и IL - 8) в препаратах Онкоингибина. Используют стандартную процедуру при наличии устройства подачи. Моноклональное антитело, специфическое для различных цитокинов, наносят на пластинки для микротитрования и оставляют на ночь для иммобилизации антител. Затем пипеткой переносят образцы в ячейки и фиксируют наличие какого-либо цитокина посредством иммобилизованного антитела. После отмывки несвязанных белков образца в ячейку добавляют связанное ферментом поликлональное антитело, специфическое для данного цитокина, и дают присоединиться цитокину, который был связан при первой инкубации. После промывания для удаления несвязанного взаимодествием "поликлональное антитело-фермент" реагента к ячейкам добавляют раствор субстрата, развивается окрашивание, пропорциональное количеству связанного на первой стадии цитокина. Параллельно с проверяемыми образцами готовят серии ячеек с известными концентрациями стандартных цитокинов. Записывают кривую оптической плотности от концентрации цитокина в этих стандартных препаратах, сравнивая оптическую плотность исследуемых образцов с этой стандартной кривой. Затем рассчитывают концентрацию цитокина в неизвестных образцах (таблица V).
Интерлейкин-1 является цитокином, продуцируемым активированными моноцитами и фибробластами, имеет молекулярный вес 17 kDa и ингибирует рост опухолевых клеточных линий, включая карциному яичников, A375 меланому, K-562 и некоторые клеточные линии опухолей молочной железы. Однако Онкоингибин отличается от интерлейкина-1 в отношении источника его получения, молекулярного веса и специфичности относительно опухолей. Сырые препараты Онкоингибина проверяли на присутствие IL-1 методом EL ISA. Результаты, представленные в таблице V, демонстрируют отсутствие белка IL-1 в препаратах Онкоингибина.
Интерлейкин-6 является цитокином, продуцируемым клетками разнообразных типов в ответ на различное стимулирование и имеет молекулярный вес 26 kDa по SDS-PAGE. Характерно, что IL - 6 также продуцируется нормальными человеческими фибробластами, U-937, клеточными линиями меланомы человека A375, RPMI-7951 и т.д IL-6 ингибирует рост клеточных линий миелоидного лейкоза и карциномы молочной железы. Судя по источнику получения, способу индуцирования и специфичности относительно опухолевых клеток, ясно, что IL-6 является цитокином, отличающимся от Онкоингибина. Кроме того, обычно используют клетки MCF-7 в качестве меток для Онкоингибина, нечувствительного к действию интерлейкина-6 (фиг. 16 ). Также в отличие от Онкоингибина, найдено, что IL-6 ингибирует рост нормальных человеческих фибробластов (фиг. 15).
γ-Интерферон, цитокин с молекулярным весом 20-25 kDa по SDS-PAGE, продуцируется T-лимфоцитами при активации различными митогенами и ингибирует рост некоторых опухолевых клеточных линий. Этот цитокин высоко чувствителен к кислотным значениям pH. Онкоингибин отличается от γ-интерферона в отношении источника получения, способа индуцирования и pH устойчивости. γ-Интерферон также отличается от Онкоингибина в отношении его действия на нормальные человеческие фибробласты. Онкоингибин стимулирует пролиферацию, в то время как γ-интерферон ингибирует вызванную TNF пролиферацию фибробластов, но не пролиферацию, вызванную Онкоингибином (фиг. 18). Кроме того, антитела к γ-интерферону не снижают активности Онкоингибина, а усиливают ее (фиг.17).
Таким образом, настоящее изобретение обеспечивает новый цитокин, демонстрирующий различную противоопухолевую активность. Цитокин Онкоингибин выделяется человеческими эритробластоидными клетками и имеет молекулярный вес приблизительно 28 kDa по SDS-PAGE. Оказывается, что производство Онкоингибина увеличивается в присутствии форболового эфира. Оказывается, что Онкоингибин устойчив к действию различных веществ, в широком диапазоне pH и к действию высоких температур.
Понятно, что вследствие активности по отношению к различным опухолям Онкоингибин будет иметь терапевтическое применение при лечении разнообразных опухолевых заболеваний, включая карциномы и лимфомы. Онкоингибин можно давать людям или другим животным как часть фармацевтической композиции, которая содержит фармацевтически пригодный носитель. Вследствие своей широкой противоопухолевой активности Онкоингибин будет полезен в профилактике рецидивов опухолевых заболеваний. Кроме того, введен Онкоингибина в организм-носитель опухолевых клеток может продлевать жизнь больного. С другой стороны, опухолевые клетки можно обрабатывать Онкоингибином in vitro, например, обрабатывая и очищая костный мозг, содержащий опухолевые клетки. Эти описанные здесь способы обработки опухолевых клеток хорошо известны в практике хемотерапии рака и, следовательно, специалист без дополнительных экспериментов может определить подходящую дозу и курс введения Онкоингибина.
Онкоингибин также может быть полезен как новый иммуномодулятор. Онкоингибин активирует лимфоциты, моноциты и нейрофилы для поражения опухолевых клеток. В добавок к этому Онкоингибин может быть терапевтически полезен как фактор роста. Онкоингибин стимулирует рост нормальных клеток.
В заключение, понятно, что настоящее изобретение и раскрытые здесь варианты приспособлены для осуществления определенных целей и получения набора результатов, указанных в данной заявке. Не изменяя духа и области настоящего изобретения, можно сделать определенные изменения в способе и приборах. Понятно, что изменения возможны, и, кроме того, подразумевается, что каждый элемент или стадию по любому их пунктов формулы изобретения нужно понимать как ссылку на все эквивалентные элементы или стадии для достижения, в основном, аналогичных результатов эквивалентным по существу способом. Подразумевается широко распространить изобретение, в какой бы форме ни применялись его принципы. Кроме того, среди прочих неотъемлемых частей настоящее изобретение хорошо приспособлено для осуществления определенных задач и получения упомянутых в нем результатов и преимуществ.













Изобретение относится к медицине, а именно к области препаративной биохимии, и касается онкоингибина, способа его получения и фармацевтической композиции, содержащей онкоингибин. Сущность изобретения включает очищенный и изолированный человеческий белок онкоингибин, продуцируемый эритробластоидными клетками, обладающий антинеопластической активностью против клеточных линий карциномы груди (МСF7) и карципомы матки Heha и пролиферативным эффектом на нормальные фибробласты крайней плоти человека. Способ его получения заключается в инкубации человеческих эритробластоидных клеток (К-562) в средах, сбор кондиционных клеточных сред, изолирование и очистку человеческого онкоингибина. Фармацевтическая композиция включает онкоингибин и фармацевтически приемлемый носитель. Технический результат заключается в получении нового фактора для стимулирования роста нормальных клеток. 3 с. и 4 з.п.ф-лы, 45 ил., 9 табл.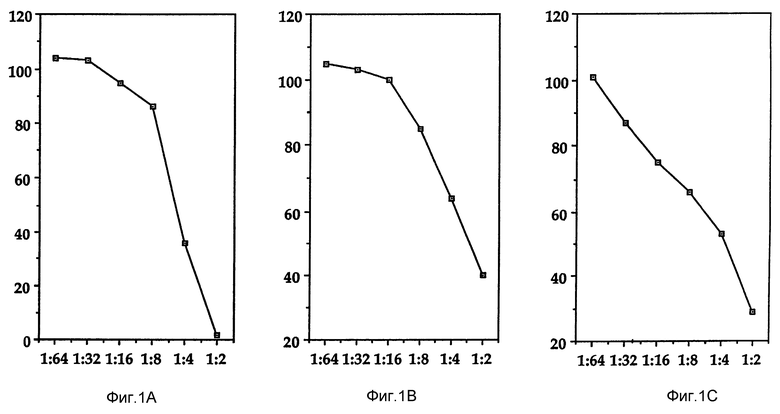
| US 4874746 A, 17.10.89 | |||
| US 4868902 A, 05.09.89. |
Авторы
Даты
1999-10-10—Публикация
1993-04-23—Подача