Изобретение относится в общем к областям иммунологии и белковой химии. Более конкретно, данное изобретение относится к выделению, очистке и характеристике нового антипролиферативного белка из Bacillus thuringiensis var. thuringiensis.
Агенты, проявляющие антипролиферативные свойства избирательно против опухолевых клеток, обладают потенциалом в качестве противораковых лекарственных средств. Эти типы агентов пытались получить как из синтетических, так и из природных источников. Подобные соединения с антипролиферативными свойствами могли бы иметь либо белковую, либо небелковую природу.
Известно, что как грамотрицательные, так и грамположительные бактерии синтезируют белки, которые являются токсичными для эукариотических клеток. Bacillus thuringiensis представляет собой грамположительную бактерию, которая во время споруляции синтезирует большие количества белка, который при проглатывании может убивать насекомых (Hofte and Whiteley, 1989). Этот белок использовали в качестве микробного пестицида в течение более 30 лет и его считали безопасным для людей (Green et al, 1990). Эти инсектицидные белки собираются в бактериях в виде кристаллических параспоральных тел и подразделяются по размерам на три класса, 133-145 кДа, 65-67 кДа и 27 кДа. Различные подвиды Bacillus thuringiensis могут экспрессировать один или более классов размеров. Белок 133-145 кДа является пиротоксином, который при расщеплении протеазами средней части желудочно-кишечного тракта дает аминоконцевой фрагмент приблизительно 67 кДа, который содержит токсиновую часть молекулы (Ogiwara et al, 1992). Токсин 67 кДа имеет значительную структурную гомологию с токсинами из различных других подвидов Bacillus thuringiensis. Однако токсин 27 кДа не обнаруживает гомологии с любым токсином из других классов токсинов, но является высокогомологичным в пределах этого подвида (Luthy et al, 1982). Ген для токсина 27 кДа из подвидов israeliensis (Bacillus thuringiensis israeliensis), kyushunsis (Bacillus thuringiensis kursataki) и morrisoni (Bacillus thuringiensis morrisoni) были клонированы и было обнаружено, что токсин Bacillus thuringiensis israeliensis отличается одним основанием от токсина Bacillus thuringiensis morrisoni; тогда как он только на 39% идентичен токсину Bacillus thuringiensis kursataki (Waalaijk et al, 1985); Ward and Ellar, 1986; Ward et al. , 1986; Galjart et al. , 1987; Koni and Ellar, 1993). Было показано, что токсины из различных подвидов являются цитолитическими в отношении клеток насекомых в культуре.
Почти 20 лет назад сообщалось, что токсин, полученный из подвида Bacillus thuringiensis thuringiensis, обладает противоопухолевой активностью в отношении некоторых опухолей мышей, таких как асцитная саркома Иошида, in vivo. Затем было показано, что токсин, полученный из Bacillus thuringiensis israeliensis, также обладает противоопухолевой активностью против определенного типа мышиных опухолевых клеток in vitro. Белок Bacillus thuringiensis thuringiensis усиливает гуморальную иммунную систему у крыс и морских свинок и индуцирует продолжительный противоопухолевый иммунитет, оцениваемый по отторжению последующего опухолевого трансплантата. Структурные характеристики этого противоопухолевого белка неизвестны и неизвестно, близок ли он функционально к инсектицидным токсинам, описанным выше, из различных других подвидов.
В предшествующей области знаний отсутствуют эффективные средства ингибирования роста широкого круга опухолей. Данное изобретение удовлетворяет эту давнюю потребность и стремление получить такие средства в данной области знаний.
Данное изобретение описывает выделение и характеристику белка, названного онкотоксином, из грамположительной бактерии Bacillus thuringiensis var. thuringiensis. Идентификация онкотоксина была основана, отчасти, на его антипролиферативной активности против клеток гис-тиоцитарной лимфомы человека U-937. С использованием этого теста онкотоксин был выделен дифференциальным ультрацентрифугированием в градиенте бромида натрия, протеолитическим расщеплением с последующей аффинной хроматографией на DEAE-affigel blue. Активность онкотоксина связывалась с DEAE-affigel blue и ее можно было элюировать 0,05 М NaCl. Онкотоксин имеет приблизительную молекулярную массу 20 кДа при денатурирующих условиях.
Биологическая активность очищенного белка была чувствительна к различным протеолитическим ферментам, в том числе к трипсину, химотрипсину и проназе, чувствительна к кислым условиям (рН менее 4), чувствительна к трифторуксусной кислоте (0,1%) и к ацетонитрилу (50%). Однако активность онкотоксина была устойчивой к повышенным температурам (30 минут при 100oС) и к восстанавливающим условиям (1 мМ дитиотреитол). Аминоконцевая аминокислотная последовательность этого белка состояла из NH2-Pro-Ser-Thr-Val-Val-Asn-Val-Ser-Asn-Leu-Lys-Pro-Gly-Asp-Thr-Ile-Glu-Lys-Glu-Phe-. Эта последовательность была уникальной при сравнении с опубликованными последовательностями других белков. Синтетический пептид на основе этой последовательности использовали для получения поликлональных антител в кроликах, и эти антитела полностью нейтрализовали биологическую активность онкотоксина даже при разведении антисыворотки 1: 10000. Вестерн-блот-анализ с этими антителами также выявил полосу онкотоксина при 20 кДа.
Кроме способа включения тимидина способы вытеснения трипана синего и МТТ также показали полное ингибирование долговременного роста клеток U-937 высокоочищенным онкотоксином. Последний проявлял антипролиферативные действия против широкого круга линий различных опухолевых клеток, в том числе миелоидных (U-937, THP-1, HL-60), лимфоидных (Raji, Jurkat), эритробластоидных (К-562), клеток рака молочной железы (CLO, MCF-7), рака яичника (OVCA429, OVCA 432, OVCA 433), почек (А-293) и гепатомы (Нер3В, HepG2). Однако при одинаковых условиях глиобластома человека (U-251) и фибросаркома мыши (L-929) были устойчивы к онкотоксину. Диплоидный фибробласт крайней плоти здорового человека и лимфоциты периферической крови здорового человека были также резистентны к онкотоксину даже до концентрации 100 мкг/мл. Обработка клеток U-937 онкотоксином в течение 24 часов привела к фрагментации ДНК, как показано мониторингом при помощи электрофореза в агарозном геле, что предполагает, что механизм гибели клеток под влиянием онкотоксина происходит, по-видимому, через апоптоз. В целом, данное изобретение демонстрирует выделение нового бактериального белка, который обладает антипролиферативным действием против широкого круга опухолевых клеток.
В одном варианте данного изобретения обеспечена композиция, содержащая выделенный и очищенный белок, полученный из подвида Bacillus thuringiensis thuringiensis, имеющий молекулярную массу приблизительно 20 кДа согласно электрофорезу в ДСН-ПААГ, причем упомянутый белок имеет частичную аминокислотную последовательность, показанную в SEQ ID 1, и проявляет цитотоксическое действие против опухолевых клеток.
В другом варианте данного изобретения обеспечена фармацевтическая композиция, содержащая новый белок данного изобретения и фармацевтически приемлемый носитель.
Еще в одном варианте данного изобретения обеспечен способ получения белка данного изобретения.
И еще в одном варианте данного изобретения обеспечен способ обработки неопластической клетки, предусматривающий введение терапевтически эффективной дозы композиции данного изобретения в эту клетку.
Другие и дополнительные аспекты, признаки и преимущества данного изобретения будут очевидными из следующего далее описания предпочтительных в настоящее время вариантов изобретения, даваемого для описательной цели.
Для того чтобы материал, в котором приведены вышеописанные признаки, преимущества и цели изобретения, а также другие особенности, которые станут ясными, были восприняты и могли быть понятными в деталях, более конкретные описания данного изобретения, кратко резюмированного выше, будут даны со ссылкой на некоторые его варианты, которые иллюстрируются в прилагаемых чертежах. Эти чертежи составляют часть этой заявки. Следует отметить, однако, что прилагаемые чертежи иллюстрируют предпочтительные варианты данного изобретения и, следовательно, не должны рассматриваться как ограничительные в отношении объема изобретения.
Фиг. 1 показывает анализ онкотоксина при помощи электрофореза в полиакриламидном геле с додецилсульфатом натрия. Один мкг онкотоксина разделяли на 15% акриламидных гелях, как описано ниже.
Фиг. 2 показывает анализ аминоконцевой аминокислотной последовательности онкотоксина.
Фиг. 3 показывает обнаружение онкотоксина при помощи Вестерн-блот-анализа и показывает нейтрализацию биологической активности онкотоксина антителами против синтетического пептида онкотоксина.
Фиг. 4 показывает сравнение действия онкотоксина с действием синтетического пептида, основанного на аминокислотной последовательности онкотоксина.
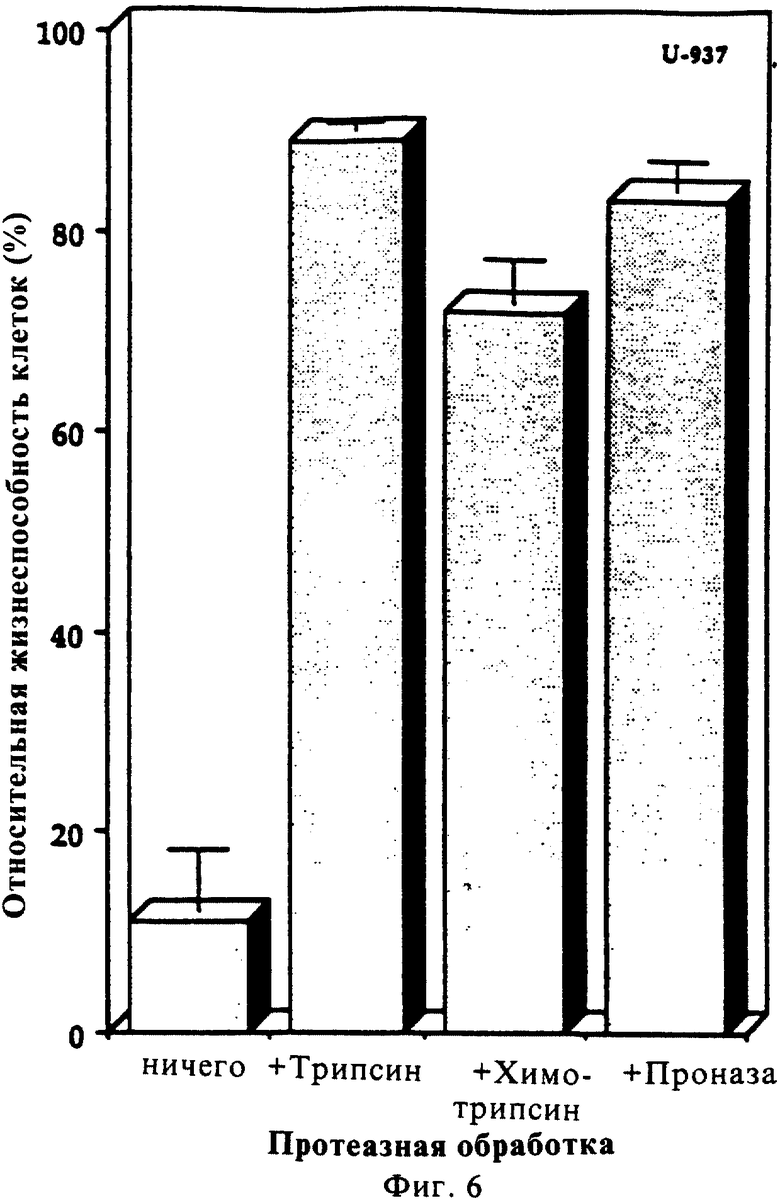
Фиг. 5 показывает действие различных протеаз на биологическую активность онкотоксина.
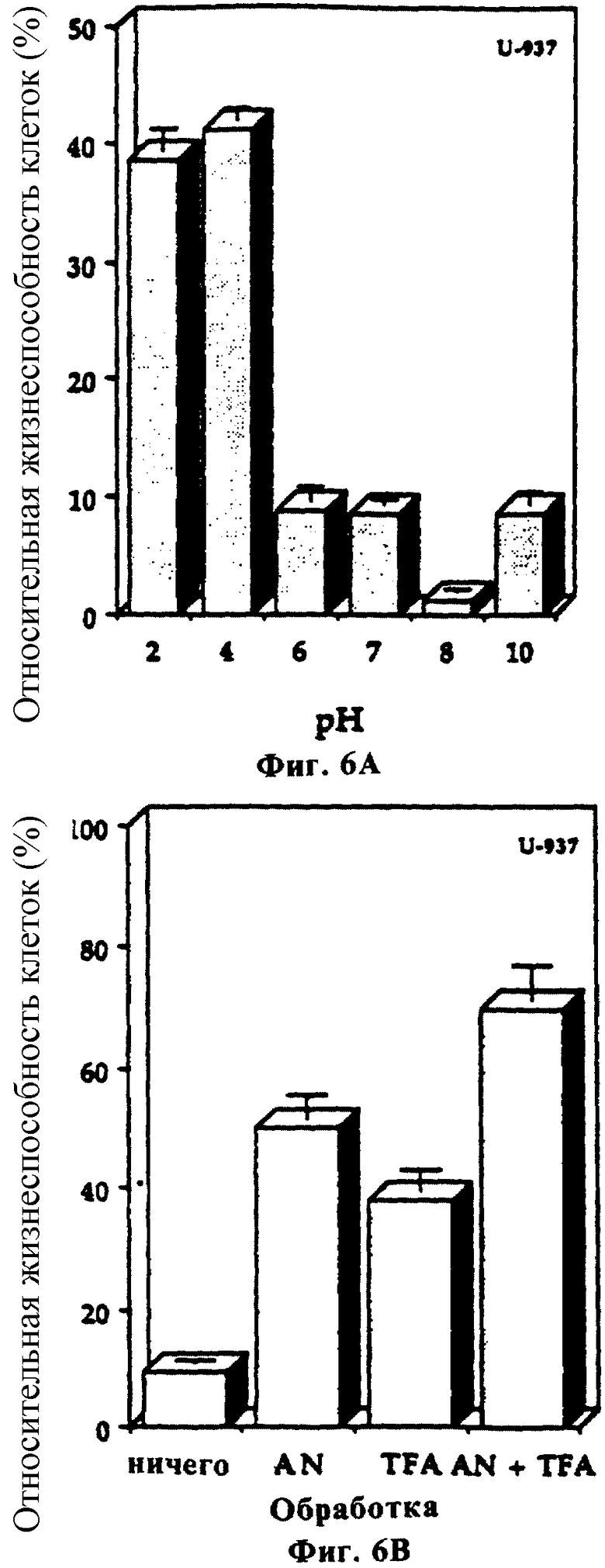
Фиг. 6 показывает влияние рН (фиг. 6А) и органических растворителей (фиг. 6В) на биологическую активность онкотоксина.
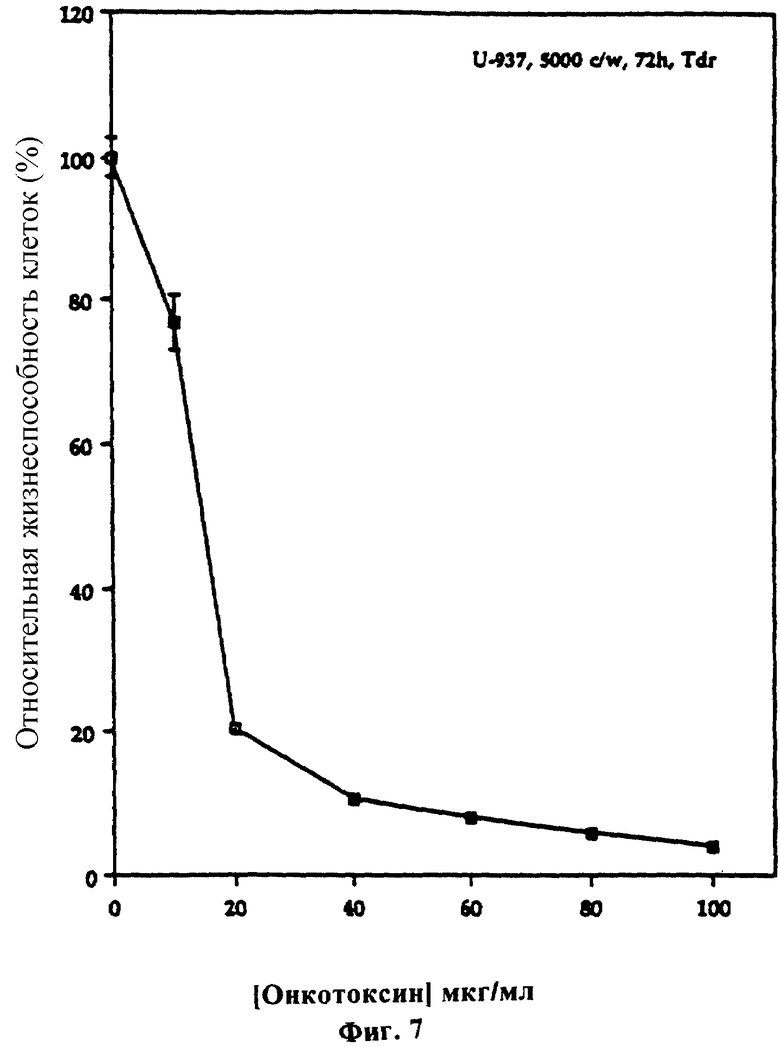
Фиг. 7 показывает биотест на онкотоксин. 5•103 клеток (0,2 мл) в 96-луночных планшетах инкубировали с онкотоксином при 37oС в течение 72 часов и затем определяли жизнеспособность клеток по включению тимидина, меченого 3Н (тритием), как описано ниже. Все определения делали в трех повторностях.
Фиг. 8 (A-C) показывает зависимое от дозы действие онкотоксина на различные линии миелоидных клеток.
Фиг. 9А и 9А(1) показывает зависимое от дозы действие онкотоксина на различные линии лимфоидных клеток.
Фиг. 9В показывает зависимое от дозы действие онкотоксина на линию эритробластоидных клеток.
Фиг. 10 (А и В) показывает зависимое от дозы действие онкотоксина на различные линии опухолевых клеток молочной железы.
Фиг. 11 (А-С) показывает зависимое от дозы действие онкотоксина на различные линии опухолевых клеток яичника.
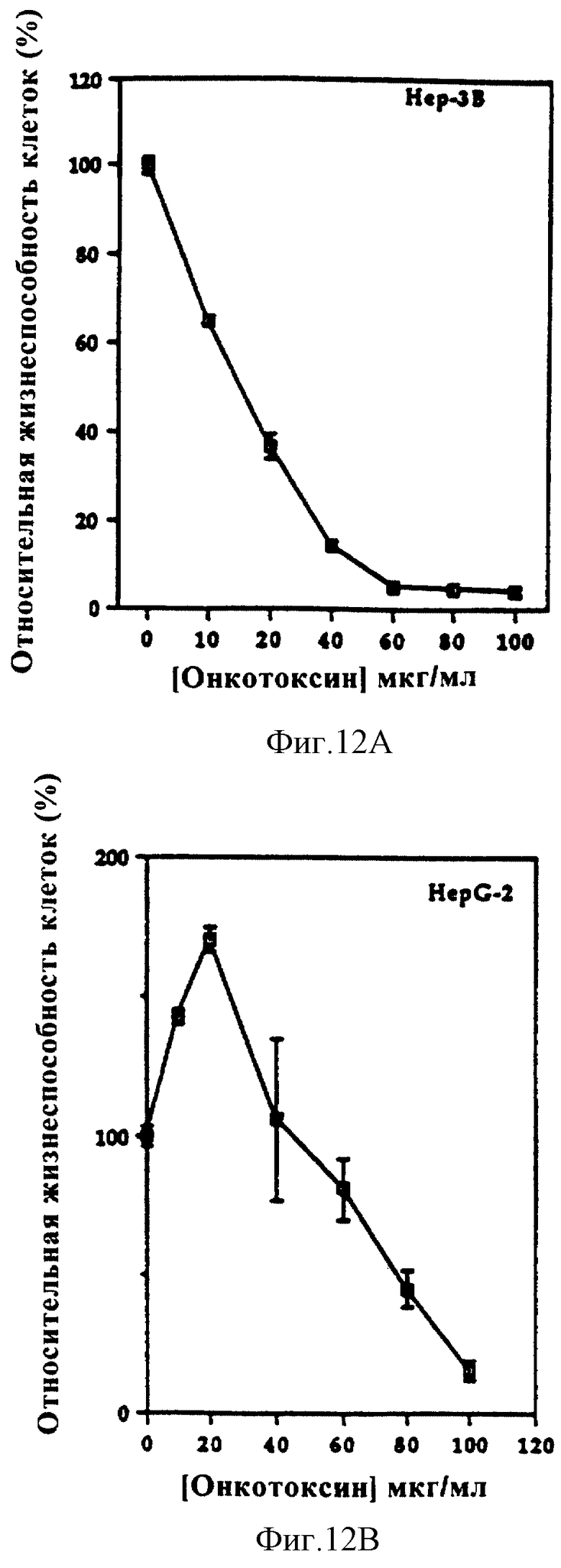
Фиг. 12 (А и В) показывает зависимое от дозы действие онкотоксина на различные линии клеток гепатомы.
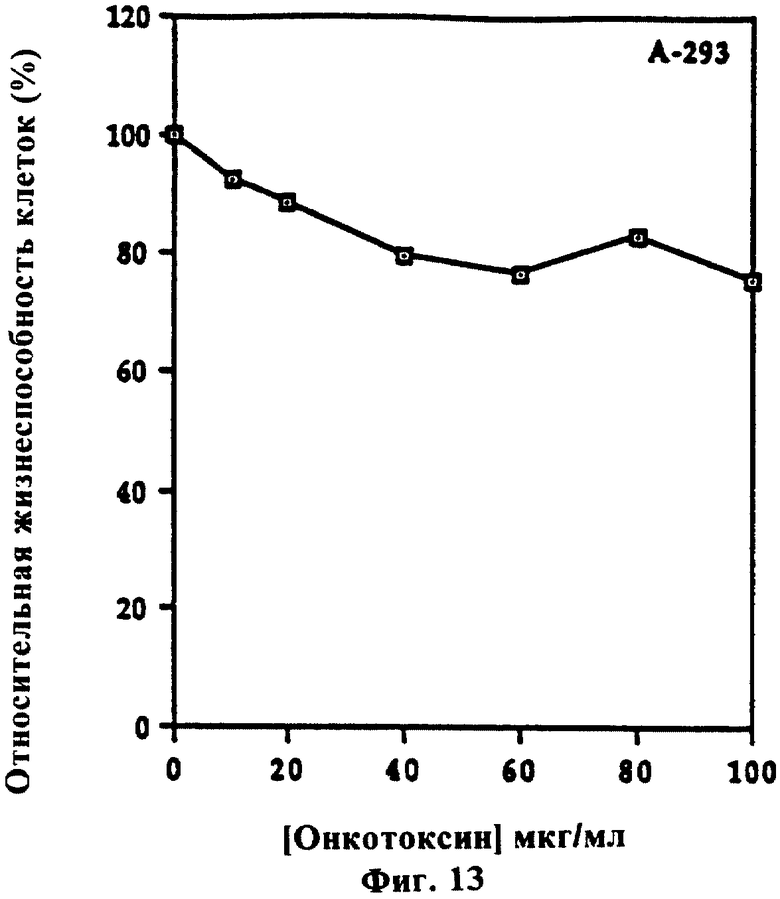
Фиг. 13 показывает зависимое от дозы действие онкотоксина на линию эмбриональных почечных клеток человека.
Фиг. 14 показывает зависимое от дозы действие онкотоксина на клетки глиобластомы человека.
Фиг. 15 показывает зависимое от дозы действие онкотоксина на фибросаркому мыши.
Фиг. 16 показывает зависимое от дозы действие онкотоксина на рост клеток U-937 гистиоцитарной лимфомы человека согласно способу вытеснения трипана синего (фиг. 16А) и способа МТТ (фиг. 16В).
Фиг. 17 показывает зависимое от дозы действие онкотоксина на диплоидный фибробласт здорового человека (фиг. 17А) и лейкоциты периферической крови здорового человека (фиг. 17В).
Фиг. 18 показывает временную зависимость действия онкотоксина на фрагментацию ДНК в клетках U-937.
Фиг. 19 показывает сравнение активности онкотоксина с токсином Cry IIА из Bacillus thuringiensis kursataki.
Данное изобретение относится к композиции, содержащей выделенный и очищенный белок, полученный из подвида Bacillus thuringiensis thuringiensis, имеющий молекулярную массу приблизительно 20 кДа согласно электрофорезу в ДСН-ПААГ, причем этот белок имеет частичную аминокислотную последовательность, показанную в SEQ ID 1, и проявляет цитотоксическое действие против опухолевых клеток. Как полностью описано ниже, этот новый белок чувствителен к протеазам и кислым условиям и цитотоксические эффекты устойчивы к обработке дитиотреитолом или выдерживанию при температуре 100oС.
Хотя новый белок данного изобретения может быть цитотоксичным для очень широкого круга опухолевых клеток, он, как правило, цитотоксичен в отношении клеток U-937, миелоидных клеток, лимфоидных клеток, Т-лимфоидных клеток, эритробластоидных клеток, опухолевых клеток молочной железы, опухолевых клеток яичника и клеток гепатомы. Этот белок не цитотоксичен в отношении здоровых клеток человека, таких как лимфоциты периферической крови и фибробластные клетки крайней плоти человека. Цитотоксические эффекты ингибируются антителом, направленным против этого белка.
Конкретно обсуждается, что с использованием нового белка данного изобретения могут быть приготовлены фармацевтические композиции. В этом случае фармацевтическая композиция содержит новый белок данного изобретения и фармацевтически приемлемый носитель. Специалист с обычной квалификацией в данной области мог бы легко определить, без чрезмерного экспериментирования, подходящие дозы и пути введения нового белка данного изобретения.
При использовании in vivo для терапии белок данного изобретения вводят пациенту или животному в терапевтически эффективных количествах, т. е. в количествах, которые устраняют или уменьшают бремя опухоли. Обычно его вводят парентерально, предпочтительно внутривенно, но могут использоваться другие пути введения, если это удобно. Доза и схема приема будут зависеть от характера рака (первичного или метастатического) и его популяции, свойств конкретного иммунотоксина, например, его терапевтического индекса, от пациента, истории болезни пациента и других факторов. Количество вводимого белка, как правило, будет находиться в пределах приблизительно 0,1-10 мг/кг веса пациента. Схема применения будет продолжаться для оптимизации эффективности с одновременным уравновешиванием против негативных эффектов лечения. См. Remington's Pharmaceutical Science, 17th Ed. (1990) Mark Publishing Co. , Easton, Penn. ; и Goodman and Gilman's: The Pharmacological Basis of Therapeutics 8th Ed. (1990) Pergamon Press; которые включены здесь в качестве ссылки.
Для парентерального введения белок, наиболее типично, готовят в инъецируемой форме стандартной дозы (раствора, суспензии, эмульсии) в соединении с фармацевтически приемлемым носителем для паренерального введения. Такие носители предпочтительно являются нетоксичными и нетерапевтическими. Примерами таких носителей являются вода, солевой раствор, раствор Рингера, раствор декстрозы и 5% человеческий сывороточный альбумин. Можно также использовать неводные носители, такие как нелетучие масла и этилолеат. В качестве носителей могут быть использованы липосомы. Носитель может содержать минорные количества добавок, таких как вещества, усиливающие изотоничность и химическую стабильность, например буферы и консерванты. Как правило, иммунотоксин готовят в таких носителях при концентрации приблизительно 0,1 мг-10 мг/мл.
Уровень обычной квалификации среднего научного работника в области молекулярной биологии существенно повысился в последние годы. Специалист с обычной квалификацией в данной области мог бы легко клонировать ген для этого нового цитотоксического белка согласно рекомендациям данной заявки.
Данное изобретение относится также к способу обработки (лечения) неопластической клетки, предусматривающему введение терапевтически эффективной дозы композиции данного изобретения в эту клетку. Предпочтительно, неопластическая клетка выбрана из группы, состоящей из миелоидных клеток, В-лимфоидных клеток, Т-лимфоидных клеток, эритробластоидных клеток, опухолевых клеток молочной железы, опухолевых клеток яичника и клеток гепатомы. Как правило, неопластическая клетка может быть клеткой человека или животного. Конкретно предполагается, что новая композиция будет задерживать рецидив неопластического состояния и продлевать время выживания хозяина неопластической клетки.
Белок данного изобретения может также использоваться в способе in vitro. Например, этот способ может быть использован в убивании опухолевых клеток из спинного мозга. В этом способе костный мозг сначала удаляют из индивидуума, имеющего неопластическое заболевание. Затем костный мозг обрабатывают цитоцидно-эффективной дозой белка данного изобретения для элиминации остаточных опухолевых клеток. Обработанные клетки костного мозга опять вводят пациенту для облегчения повторного восстановления иммунной системы после проведения интенсивной химиотерапии и/или лучевой терапии для исключения всех эндогенных неопластических гемотоксических клеток.
Следующие далее примеры даны для целей иллюстрации различных вариантов данного изобретения и не предназначены для какого бы то ни было ограничения данного изобретения.
ПРИМЕР 1
Материалы
RPMI-1640 получали из Whittaker MA Bioproducts (Walkersville, MD). Фетальная телячья сыворотка (FBS) и гентамицин были из GIBKO (Grand Island, NY). Другие химикалии и биохимикалии получали из Sigma Chemical Co. (St. Louis, МО). Клеточные линии U-937 (гистиоцитарной лимфомы, CRL 1593), промиелоцитарного лейкоза HL-60 (CCL 240), острого миелогенного лейкоза KG-1a (CCL 246.1), аденокарциномы молочной железы MCF-7 (НТВ 22), эпидермальной карциномы HepG-2 (CCL 23), карциномы молочной железы ВТ-20 (НТВ 19), лимфомы Беркитта Raji (CCL 86) и Jurkat (острого Т-клеточного лейкоза, TIB 152) получали из American Type Cell Collection (Rockville, MD). Клетки выращивали рутинным образом в среде RPMI 1640 с добавлением глутамина (2 мМ), гентамицина (50 мг/мл) и фетальной телячьей сыворотки (10%). Токсин Bacillus thuringiensis kursataki, приготовленный по способу рекомбинантных ДНК (названный Cry IIА) (Donovan et al, 1988), получали от доктора Williams P. Donovan из Ecogen Inc. (Langhorne, PA).
ПРИМЕР 2
Биотест на онкотоксин
Биологическую активность онкотоксина подвергали мониторингу определением его способности ингибировать включение тимидина в клетки U-937 гистиоцитарной лимфомы человека в течение периода времени 72 часа. Этот тест проводили, как описано ранее (Higuchi and Aggarval, 1992). Вкратце, клетки (5•103/0,1 мл) высевали в 96-луночные планшеты Falcon. Серийные разведения онкотоксина добавляли к клеткам-мишеням и инкубировали в течение 72 часов при 37oС. Во время последних 6 часов 72-часового инкубирования в каждую лунку добавляли тимидин, меченый тритием (6,7 Ки/ммоль; New England Nuclear, Boston, MA) (0,5 мКи/лунку). Затем клеточную суспензию собирали при помощи харвестера клеток Packard Filtermate 196 на фильтр из стекловолокна и радиоактивность, связанную с фильтром, измеряли в прямом бета-счетчике Packard Matrix 9600 (Packard Co. , Meriden, CT). Относительную жизнеспособность клеток рассчитывали как количество метки, включенной в обработанные клетки, деленное на количество метки, включенной в необработанные клетки, и выраженное в процентах.
Рост клеток U-937 измеряли при помощи теста с модифицированной солью тетразолия (МТТ) (Hansen et al, 1989). Вкратце, клетки (5000 клеток/лунку) инкубировали в присутствии или в отсутствие различных концентраций онкотоксина в конечном объеме 0,1 мл в течение различного числа дней при 37oС. После этого в каждую лунку добавляли 0,025 мл раствора МТТ (5 мг/мл в ЗФР). После 2 часов инкубирования при 37oС добавляли 0,1 мл буфера для экстракции (20% додецилсульфат натрия, 50% диметилформамид). После инкубирования в течение ночи при 37oС измеряли оптические плотности при 570 нм при помощи 96-луночного мультисканнера-ауторидера (Dynatech MR 5000) с буфером для экстракции в качестве контроля (слепого опыта).
ПРИМЕР 3
Микроорганизм и условия выращивания
Bacillus thuringiensis var. thuringiensis получали из Лаборатории иммунологии и вирусологии факультета биологических наук, Autonoma University, Nuevo Leon. Бактерии поддерживали на косяке питательного агара при 4oС и субкультивировали каждые три месяца, как описано (Cheung and Hammock, 1985).
ПРИМЕР 4
Получение кристаллов и спор
Получение кристаллов и спор проводили, как описано ранее (Yamamoto and McLaughlin, 1981; Yamamoto and Ilzuka, 1983). Вкратце, бактерии культивировали в питательном бульоне в течение 18 часов при 30oС при постоянном встряхивании. Пробу этой культуры использовали для инокуляции культуральной колбы с агаровой средой в течение 72 часов при 30oС и затем собирали кристаллы в 1 М NaCl центрифугированием (Beckman) при 10000 об/мин, при 4oС. Осадок промывали три раза в 1 М NaCl и хранили при -20oС.
ПРИМЕР 5
Выделение белкового кристалла
Кристаллы отделяли от спор дифференциальным ультрацентрифугированием с использованием градиентов бромида натрия (30, 31,5, 33, 34,5 и 36%) при 25000 об/мин (центрифуга Beckman L5-50E, ротор SW-2Т) в течение 90 минут при 4oС. Полосы, содержащие кристаллы, объединяли, промывали три раза деионизованной водой, лиофилизировали и хранили при -20oС (Ang and Nickerson, 1978).
ПРИМЕР 6
Солюбилизация кристаллов
Эту стадию проводили, как описано Prasad and Shethna, 1974. Вкратце, 100 мг кристаллического белка суспендировали в 20 мл 1 М NaOH в 0,1 М глицине в течение 5 часов при комнатной температуре и затем центрифугировали (20000 об/мин в течение 30 минут при 4oС). Супернатант, называемый солюбилизированными щелочью кристаллами, диализовали против забуференного фосфатом солевого раствора рН 7,2. Пробу лиофилизировали и хранили при -20oС.
ПРИМЕР 7
Активация солюбилизированных щелочью кристаллов трипсином
Для этой стадии выбирали процедуру Choma et al. (1990). Вкратце, солюбилизированные щелочью фракции (5 мг/мл) обрабатывали трипсином (10%; масс/масс) в 0,1 М глициновом буфере рН 7,2 в течение 30 минут при 37oС. Пробу центрифугировали при 20000 об/мин (центрифуга Beckman) в течение 30 минут при 4oС и затем супернатант диализовали против забуференного фосфатом солевого раствора рН 7,2.
ПРИМЕР 8
Афинная хроматография на DEAE-Affigel blue
Фракцию онкотоксина (приблизительно 2 мг/мл), полученную из вышеописанной стадии, наносили на колонку с DEAE-Affigel blue (1x6,5 см), предварительно уравновещенную в 20 мМ Трисе, рН 8. Колонку промывали буфером для уравновешивания и затем элюировали ступенчатыми градиентами 0,05-1,0 М NaCl. Фракции онкотоксина идентифицировали при помощи биотестов и концентрацию белка измеряли по способу Biorad.
ПРИМЕР 9
Анализ фрагментации ДНК
Клетки (5•106мл) обрабатывали онкотоксином (50 мкг/мл) в течение 24 часов или 72 часов и затем откручивали, промывали ЗФР и ресуспендировали в 10 мМ Трис-Cl, рН 7,4, и 1 мМ ЭДТА, рН 8. Затем эти клетки лизировали буфером для лизиса (10 мМ Трис-С1 рН 8, 100 мМ NaCl, 25 мМ ЭДТА и 0,5% ДСН) и РНК удаляли добавлением РНКазы (1 мкл 10 мг/мл). После инкубирования при 50oС в течение 30 минут во все пробирки добавляли 1 мкл протеиназы К (20 мг/мл) и инкубирование продолжали в течение дополнительных 30 минут при 50oС. После добавления 0,4 мкл красителя для нанесения на гель (0,025% бромфеноловый синий, 0,25% ксилолцианол FF и 30% глицерин в воде) пробы разделяли на 1,2% агарозном геле в ТАЭ-буфере (0,04 М Трис-ацетат, 0,001 М ЭДТА).
ПРИМЕР 10
Анализ аминокислотной последовательности
Анализ аминокислотной последовательности онкотоксина проводили с использованием оборудования для секвенирования белков в Baylor College of Medicine (Houston, TX), Из гелей электрофореза в ДСН-ПААГ белок переносили на ПВДФ-мембраны и затем подвергали анализу секвенирования на микросеквенаторе модели 473А (Applied Biosystems Inc. , Foster City, CA). Поиски гомологии последовательности выполняли в Национальном Центре Информации Биотехнологии (NCBI) с использованием системы массового обслуживания (Blast network service).
ПРИМЕР 11
Синтез пептида
На основе аминокислотной последовательности онкотоксина пептид длиной 18 аминокислот синтезировали на оборудовании Центра Белковой химии Baylor College of Medicine (Houston, TX). Fmoc-защищенные смолы с множественными антигенными пептидами (MAP) использовали для синтеза пептида онкотоксина. Синтетический пептид очищали ВЖХ с обращенной фазой и характеризовали по аминокислотному составу.
ПРИМЕР 12
Получение антител
Пептид, синтезированный, как описано выше, использовали для получения антител (Bethyl Laboratories, Montgomery, TX) путем иммунизации кроликов подкожно (во множественных участках) 100 мкг антигена в полном адъюванте Фрейнда. После этого проводили две внутримышечные инъекции по 50 мкг каждая в неполном адъюванте Фрейнда на 14-ый день и на 21-ый день. После этого сыворотку тестировали на титры нейтрализации в биотесте на онкотоксин и на иммунореактивность при помощи Вестерн-блот-анализа.
ПРИМЕР 13
Вестерн-блот-анализ
Пробы белка подвергали электрофорезу на ДСН-полиакриламидном геле (15%). После электрофореза пробы переносили на нитроцеллюлозную фильтровальную бумагу в буфере, содержащем Трис-НСl (25 мМ, рН 8,3), глицин (192 мМ) и метанол (20%, об/об). Неспецифическое связывание на нитроцеллюлозной фильтровальной бумаге сводили к минимуму блокирующим буфером, содержащим БСА (5%) и Твин 20 (0,1%, об/об) в ЗФР, (ЗФР-Твин-буфером), в течение 1 часа при комнатной температуре. После трех промывок ЗФР-Твин-буфером фильтровальную бумагу инкубировали с антителом против онкотоксина (разведение 1: 10000) в течение 1 часа при комнатной температуре. Фильтровальную бумагу опять промывали и затем инкубировали с конъюгатом козьих антител против кроличьего IgG с пероксидазой хрена (разведение 1: 10000) в течение 1 часа при комнатной температуре. После этого фильтровальную бумагу промывали четыре раза и полосы визуализировали при помощи системы усиленной хемилюминесценции (Amersham).
ПРИМЕР 14
Выделение и физико-химическая характеристика онкотоксина
С применением биотеста цитотоксичности для U-937 и протокола очистки, состоящего из градиентного ультрацентрифугирования, протеолитической активации и аффинной хроматографии на DEAE-Affigel blue, выделяли белок, который элюировался из ДЭАЭ 0,05 М NaCl. Этот белок называют здесь онкотоксином. Анализ при денатурирующих условиях при помощи электрофореза в ДСН-ПААГ с окрашиванием как Кумасси синим, так и серебром выявил одну основную полосу при молекулярной массе ~ 20 кДа (фиг. 1). Онкотоксин переносили электроблоттингом на ПВДФ-мембрану и затем проводили анализ аминокислотной последовательности. Полученная аминоконцевая последовательность показана в фиг. 2. При исследовании с использованием базы данных как пептидных, так и нуклеотидных последовательностей было обнаружено, что последовательность онкотоксина является новой.
На основе этой последовательности синтезировали пептид и этот пептид использовали затем для иммунизации кроликов. Антитела, полученные против пептида онкотоксина, перекрестно реагировали с белком онкотоксином при Вестерн-блот-анализе (фиг. 3). Это антитело было также способно нейтрализовать биологическую активность онкотоксина даже при разведении антисыворотки 1 к 10000 (фиг. 3). Хотя синтетический пептид онкотоксина был гораздо меньше, чем полноразмерный белок, он имел некоторую активность против клеток U-937 (фиг. 4).
Обработка онкотоксина различными протеазами, а именно трипсином, химотрипсином и проназой (10%, масс/масс), в течение 24 часов упраздняла активность этого белка (фиг. 5). Эти результаты указывают на то, что биологическая активность свойственна полноразмерному белку. Кроме протеаз, было обнаружено также, что активность онкотоксина чувствительна к кислым условиям. Хотя и не все, но значительное количество активности разрушалось при экспонировании онкотоксина при рН 2 (фиг. 6А). Было также обнаружено, что активность онкотоксина чувствительна к обработке трифторуксусной кислотой (0,1%) или ацетонитрилом (50%) (фиг. 6В). Однако активность была устойчива к обработке дитиотреитолом (1 мМ в течение 2 часов) или при экспонировании при температуре 100oС в течение 30 минут (данные не показаны).
ПРИМЕР 15
Биологическая характеристика онкотоксина
Обработка клеток U-937 онкотоксином в течение 72 часов ингибировала рост этих клеток, как определено по включению тимидина (фиг. 7). При концентрации онкотоксина 15 мкг/мл наблюдали 50% ингибирование. Действие онкотоксина испытывали также на нескольких клеточных линиях другого типа. Онкотоксин был ингибитором для других миелоидных клеток (фиг. 8), лимфоидных (как В, так и Т) клеток (фиг. 9А), эритробластоидных клеток (фиг. 9В), опухолевых клеток молочной железы (фиг. 10), опухолевых клеток яичника (фиг. 11) и гепатомы (фиг. 12). Эмбриональные клетки почек были относительно устойчивы к онкотоксину (фиг. 13). Было обнаружено, что клетки глиобластомы человека и клетки фибросаркомы мышей полностью резистентны к онкотоксину (фиг. 14 и фиг. 15). При анализе количества онкотоксина, необходимого для индукции 50% ингибирования клеточного роста, это количество значительно варьировало в зависимости от типа опухолевых клеток (таблица).
Клетки (5•103/0,1 мл) в 96-луночных планшетах инкубировали в течение 72 часов при 37oС. Во время последних 6 часов клетки импульсно метили 3H-тимидином. Все определения выполняли в трех повторностях.
Кроме определения включения тимидина наблюдали также рост клеток по способу вытеснения трипана синего и по окрашиванию МТТ. Кривая роста клеток U-937, полученная этими двумя способами, с онкотоксином или без него, показана в фиг. 16. Эти результаты также показывают полное ингибирование клеточного роста онкотоксином.
Кроме опухолевых клеток несколько нормальных клеток испытывали на чувствительность к онкотоксину (фиг. 17). Было обнаружено, что как нормальные свежие лимфоциты периферической крови, так и фибробласт крайней плоти человека были устойчивы к онкотоксину даже при концентрации 100 мкг/мл. Эти результаты демонстрируют, что онкотоксин является ингибирующим только в отношении опухолевых клеток.
Морфологически существуют два типа смерти клеток: апоптоз, который характеризуется фрагментацией ДНК, дезинтеграцией мембран и конденсацией хромосом, тогда как некротическая смерть клеток включает в себя набухание митохондрий. Обработка клеток U-937 онкотоксином приводит к фрагментации ДНК (фиг. 18), свидетельствуя, таким образом, что смерть клеток происходит через апоптоз.
Активность онкотоксина сравнивали также с токсином, выделенным из другого подвида Bacillus thuringiensis. Была клонирована кДНК для токсина из Bacillus thuringiensis var. kursataki. Его предсказанная аминокислотная последовательность отличается от онкотоксина. Токсин Bacillus thuringiensis kursataki, полученный по способу рекомбинантной ДНК, имеет молекулярную массу 66 кДа (назван Cry IIА) (Donavan et al, 1988). Токсин Cry IIА не обнаруживал действия в этом биотесте (фиг. 19).
Описанное здесь изобретение показывает, что Bacillus thuringiensis var. thuringiensis экспрессирует новый белок с приблизительной молекулярной массой 20 кДа. Этот белок, названный онкотоксином, имеет уникальную аминокислотную последовательность и убивает широкое разнообразие опухолевых клеток, но не нормальные клетки, наиболее вероятно, через механизм апоптоза.
Аминокислотная последовательность онкотоксина, полученного из подвида Bacillus thuringiensis var. thuringiensis, является совершенно уникальной. Был клонирован ген для кристаллического белка Cry A4 из Bacillus thuringiensis thuringiensis (молекулярный размер 130 кДа) (Brizzard and Whiteley, 1988). Последовательность онкотоксина совершенно отличается от этого белка. Также был сообщен кислый токсин с молекулярной массой 13 кДа, происходящий из Bacillus thuringiensis thuringiensis, который обнаруживает как противоопухолевую, так и инсектицидную активность. Этот противоопухолевый белок Bacillus thuringiensis thuringiensis не является онкотоксином вследствие различия в молекулярной массе (13 кДа против 20 кДа) и присутствия большого числа кислых остатков (42% Asp и Glu). Процедура их выделения также отличалась от процедуры, использованной здесь, тем, что их активная фракция элюировалась при 0,27 М NaCl на ДЭАЭ целлюлозе (онкотоксин элюируется при 0,05 М NaCl), и эта процедура не включала в себя стадии расщепления трипсином. Этот кислый токсин также не содержит серусодержащих аминокислотных остатков и имеет кристаллическую морфологию. Аминокислотная последовательность токсина 13 кДа Bacillus thuringiensis thuringiensis не была сообщена.
Другим сообщенным белком из Bacillus thuringiensis thuringiensis является протоксин, который протеолитически активируется трипсином с высвобождением токсина с молекулярной массой 70000, который разрушается далее до второго токсина с молекулярной массой 55000 (Huber-Lukas et al. , 1983). Этот токсин инактивируется нагреванием и алкилированием, что позволяет предположить роль специфической конформации и сульфгидрильных групп. В противоположность этому онкотоксин имеет молекулярную массу 20 кДа и стабилен как к нагреванию (100oС в течение 30 минут), так и к восстанавливающим условиям. Токсин из Bacillus thuringiensis kursataki требует высокощелочных условий для полного проявления биологической активности (Gringorten et al. , 1992), и это свойство также отличается от свойств онкотоксина. Кроме того, не было показано, что белок Bacillus thuringiensis kursataki проявляет противоопухолевую активность. Это согласуется с наблюдением, сообщенным здесь для рекомбинантного токсина Bacillus thuringiensis kursataki. Другой белок, происходящий из Bacillus thuringiensis israeliensis, с молекулярным размером 20 кДа ускоряет образование кристалла белка CytA (27,3 кДа) и это приводит к ингибированию токсичности CytA (Wu and Federici, 1993).
Большинство кристаллических белков из различных подвидов Bacillus thuringiensis содержат структуры двух доменов, аминоконцевую половину с α-спиральной структурой, которая имеет активность токсина, и карбоксил-концевую половину с перемежающимися β-цепью и скрученной структурой, которая важна для сборки и стабильности кристаллической структуры (Convents et al, 1990). Кристаллическая структура d-эндотоксина (cry IIIA, 60-70 кДа) обнаружила, что она состоит из трех доменов, пучка с семью спиралями, трехпластинчатого домена и β-сэндвича (Li et al, 1991). Было сделано предположение, что спирали служат для образования пор в мембране, а пластинчатый домен ответственен за связывание рецептора.
Очень мало известно о цитотоксической активности против опухолевых клеток белков, полученных из Bacillus thuringiensis. Было показано, что токсин Bacillus thuringiensis israeliensis с размером 25 кДа сам по себе является цитотоксичным для мышиных опухолевых клеток и он усиливает цитотоксические эффекты некоторых противоопухолевых агентов in vitro и in vivo (Thomas and Eller, 1983; Yokoyama et al, 1988; Yokoyama et al, 1991). Среди различных химиотерапевтических агентов наивысшую синергию наблюдали с блеомицином. Было показано также, что белок, полученный из Bacillus thuringiensis thuringiensis, является цитотоксичным для мышиных опухолевых клеток in vivo (Prasad and Shethna, 1973, 1974).
Механизм, при помощи которого полученные из Bacillus thuringiensis белки убивают опухолевые клетки, неизвестен, но было показано, что происходящий из Bacillus thuringiensis israeliensis токсин связывает специфические липиды плазматической мембраны, вызывает детергент-подобную перегруппировку липидов, приводящую к нарушению целостности мембраны и в конце концов к лизису (Thomas and Ellar, 1983). В клетках насекомых этот токсин ингибирует (Na, К)-АТФазу (English et al. , 1986). Неизвестно, убивает ли онкотоксин такое широкое разнообразие клеток при помощи подобного механизма. Онкотоксин индуцирует фрагментацию ДНК в клетках, что является характерным свойством апоптотического механизма смерти клеток. Кроме того, было обнаружено, что онкотоксин не является токсичным для нормальных клеток. Однако было обнаружено, что не все опухолевые клетки чувствительны к онкотоксину.
Здесь цитируются следующие ссылки (см. в конце описания).
Любые патенты или публикации, упомянутые в этой заявке, являются показательными в отношении уровней квалификации специалистов в данной области, к которым имеет отношение данное изобретение. Эти патенты и публикации включены здесь в качестве ссылки в такой степени, как если бы каждая отдельная публикация была специфически и отдельно указана в качестве ссылки.
Специалисту в данной области будет понятно, что данное изобретение хорошо приспособлено для выполнения целей и достижения задач и преимуществ, упомянутых в изобретении, а также присущих ему. Данные примеры вместе со способами, обработками, молекулами и специфическими соединениями, описанными здесь, являются в настоящее время типичными предпочтительными вариантами, являются примерами и не предназначены для ограничения объема изобретения. Изменения и другие применения могут быть осуществлены специалистами в данной области, и все они объединяются идеей данного изобретения, определенной объемом приведенной формулы изобретения.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
(1) ОБЩАЯ ИНФОРМАЦИЯ:
(i) ЗАЯВИТЕЛИ: Aggarwal, Bharat В. и Padilla, Christina Rodrigez
(ii) НАЗВАНИЕ ИЗОБРЕТЕНИЯ: НОВЫЙ АНТИПРОЛИФЕРАТИВНЫЙ БЕЛОК ИЗ BACILLUS THURINGIENSIS VAR. THURINGIENSIS
(iii) ЧИСЛО ПОСЛЕДОВАТЕЛЬНОСТЕЙ: 1
(iv) АДРЕС ДЛЯ КОРРЕСПОНДЕНЦИИ:
(А) АДРЕСАТ: James F. Weiler, Attorney-at-Law
(D) УЛИЦА: One Riverway, Suite 1560
(C) ГОРОД: Houston
(D) ШТАТ: Texas
(E) СТРАНА: USA
(F)ZIP: 77056
(v) ФОРМА СЧИТЫВАНИЯ КОМПЬЮТЕРОМ:
(A) ТИП СРЕДЫ: DS, HD 1.44 Mb/1.44 Мо
(B) КОМПЬЮТЕР: IBM PC совместимый
(C) ОПЕРАЦИОННАЯ СИСТЕМА: PC-DOC/MS-DOC
(D) ПРОГРАММНОЕ ОБЕСПЕЧЕНИЕ: WordPerfect 6.0
(vi) Данные настоящей заявки:
(A)НОМЕР ЗАЯВКИ:
(B) ДАТА РЕГИСТРАЦИИ:
(C) КЛАССИФИКАЦИЯ:
(viii) ИНФОРМАЦИЯ ПОВЕРЕННОГО/АГЕНТА:
(A) ИМЯ: Weiler, James F.
(B) РЕГИСТРАЦИОННЫЙ НОМЕР: 16 040
(С) REFERENCE/DOCKET NUMBER: D-5789
(ix) ИНФОРМАЦИЯ ДЛЯ ТЕЛЕКОММУНИКАЦИИ:
(A) ТЕЛЕФОН: 713-626-8646
(B) ТЕЛЕФАКС: 713-963-5853
(2) ИНФОРМАЦИЯ ДЛЯ SEQ ID 1:
(i) ХАРАКТЕРИСТИКИ ПОСЛЕДОВАТЕЛЬНОСТИ:
(A) ДЛИНА: 20
(B) ТИП: аминокислота
(C) КОЛИЧЕСТВО ЦЕПЕЙ:
(D) ТОПОЛОГИЯ: линейная
(ii) ТИП МОЛЕКУЛЫ:
(A) Описание: белок
(iii) ГИПОТЕТИЧЕСКАЯ: Нет
(iv) АНТИСМЫСЛОВАЯ: Нет
(v) (vi) ИСХОДНЫЙ ИСТОЧНИК:
(B) ШТАММ:
(C) ИНДИВИДУАЛЬНЫЙ ИЗОЛЯТ:
(D) СТАДИЯ РАЗВИТИЯ:
(F) ТИП ТКАНИ:
(G) ТИП КЛЕТКИ:
(Н) КЛЕТОЧНАЯ ЛИНИЯ:
(xi) ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТИ: SEQ ID 1:









Изобретение относится к областям иммунологии и белковой химии и касается нового антипролиферативного белка из Bacillus thuringiensis var. thuringiensis. Выделенный и очищенный белок, полученный из подвида Bacillus thuringiensis thuringiensis, чувствителен к протеазам и кислым условиям и имеет молекулярную массу приблизительно 20 кДа. Проявляет цитотоксическое действие против опухолевых клеток, устойчив к обработке дитиотреитолом или экспонированию до температуры 100оС. 1 з. п. ф-лы, 19 ил. , 1 табл.
| ШТАММ БАКТЕРИЙ BACILLUS THURINGIENSIS VAR KURSTAKI ДЛЯ ПОЛУЧЕНИЯ БИОИНСЕКТИЦИДА | 1991 |
|
RU2033721C1 |
| Yokoyama et | |||
| al | |||
| Anticancer Research | |||
| "Potentiation of antitumor activity of bleomycin towards solid tumors in mice by Bacillus thuringiensis subsp | |||
| Israelensis toxin", Vol.11, p | |||
| Цепной ветряный двигатель | 1923 |
|
SU1625A1 |
| US 5407825, 18.04.1995. | |||
Авторы
Даты
2002-01-27—Публикация
1996-05-31—Подача