Реконструкция кости является динамическим процессом, посредством которого сохраняется тканевая масса и строение скелета. Этот процесс характеризуется равновесием между резорбцией и новообразованием кости при участии двух клеточных типов, играющих, как предполагают, главные роли.
Этими клетками являются остеокласты и остеобласты. Остеобласты синтезируют и откладывают новую костную ткань в полостях, образованных остеокластами. Активность остеобластов и остеокластов регулируется множеством факторов как системных, так и местных, в том числе факторами роста.
Предполагают, что одним из факторов роста, участвующих в поддержании гомеостаза кости, является фактор роста, полученный из тромбоцитов (ФРПТ). Биологически активный ФРПТ обнаружен в форме гомодимера и гетеродимера цепей компонентов A и B.
Исследования in vitro показали, что ФРПТ является митогенным фактором для остеобластов (Abdennagy и др., Cell Bid. Internal. Rep. 16 (3):235-247, 1992). Митогенная активность, а также хемотаксические свойства, связанные с ФРПТ, были продемонстрированы при добавлении фактора роста к нормальным остеобластоподобным клеткам (Tuskamota и др., Biochem. Biophys. Res. Comm., 175 (3): 745-747, 1991) и первичным культурам остеобластов (Centerella и др. , Endocrinol. 125 (1):13-19, 1989).
Недавние исследования показали, что остеобласты вырабатывают AA изоформу ФРПТ (Zhang и др. Am. J. Physiol. 261: с. 348-354, 1991). Точный механизм, посредством которого ФРПТ воздействует на рост остеобластов, еще не вполне ясен, однако существует согласие в вопросе о том, что этот фактор роста играет ключевую роль в регулировании как нормальной реконструкции скелета, так и заживления переломов.
Терапевтическое применение ФРПТ включает, например, лечение травм, требующих для заживления пролиферации остеобластов, таких как переломы. Стимулирование пролиферации мезенхимальных клеток и синтез интрамембранозной кости обозначают как аспекты заживления перелома кости (Joyce и др., 36-я годовая конференция Ортопедического научного общества, 5-8 февраля 1990 г.) Новый Орлеан, Луизиана).
Витамин D традиционно считается необходимым для предотвращения рахита, болезни неадекватной минерализации костей. Необходимость эта связана с ролью, которую играет витамин D, в облегчении всасывания кальция в желудочно-кишечном тракте, и значимостью уровней кальция в сыворотке крови для гомеостаза костной ткани.
Недавние наблюдения наводят на мысль, что остеобласты имеют рецепторы для метаболита витамина D 1α, 25-дигидроксихолекальциферола, что указывает на них, как на главные мишени этого гормона (Suda и др., J. Cell. Biochem., 49:53-58,1992).
Полагают, что витамин D играет важную роль в активировании остеобластом резорбции, опосредованной остеокластом (Watrous и др., Sem. in Arthritis anl Rheum., 19 (1): 45-65, 1989). Витамин D применяли в культуре остеобластов in vitro (Kurihara и др., Endocrinol. 118 (3): 940-947, 1986), что сопровождалось возрастанием количества щелочной фосфатазы-маркера дифференцировки клеток в остеобласты.
Однако в костных клетках человека стимуляция щелочной фосфатазы связана со снижением пролиферации клеток (Huffer, Lab. Investig. 59(4):418-442, 1988). В культурах костных клеток свода черепа добавление витамина D увеличивает высвобождение кальция в культуральную среду и связывается с резорбционной активностью кости (Bell, J. Clinical Investig. 76:1-6, 1985).
Экстрессия остеокальцина, маркера остеобластов, требует индукции витамином D (Yoon и др., Biochem. 27:8521-8526, 1988). Точная роль витамина D в гомеостазе кости и то, каким образом он воздействует на остеобласты и остеокласты, нуждается в уточнении.
Вследствие важной роли остеобластов в заживлении и процессах регенерации кости, возможность усиливать пролиферацию этих клеток является весьма желательной. Настоящее изобретение создает такую возможность, а также имеет другие преимущества, которые становятся очевидными благодаря нижеследующему подробному описанию и прилагаемым рисункам.
Настоящее изобретение нацелено на способы стимулирования роста остеобластов путем применения композиции, которая включает фактор роста, полученный из тромбоцитов (ФРПТ), и витамин D. В одном из вариантов осуществления изобретения эта композиция практически не содержит цепь A ФРПТ. В родственном варианте осуществления изобретения композиция включает в себя рекомбинантный ФРПТ-ВВ. В другом варианте осуществления изобретения клетки выращиваются in vitro.
Другой особенностью настоящего изобретения является создание способов стимулирования роста кости у пациента посредством введения этому пациенту эффективного количества композиции, которая включает в себя ФРПТ и витамин D. В некоторых предпочтительных вариантах осуществления изобретения витамин D представляет 9,10-секо-холеста-5,7,10[19] -триен-3-ол или 1α, 25-дигидроксихолекальциферол.
Еще одной особенностью настоящего изобретения является создание способов стимулирования роста остеобластов посредством культивирования этих клеток в присутствии эффективного количества композиции, которая включает ФРПТ и витамин D; при этом названная композиция практически не содержит A-цепи ФРПТ.
Эти и другие особенности настоящего изобретения становятся очевидными благодаря нижеследующему подробному описанию и прилагаемым чертежам.
Фиг. 1 показывает, что витамин D увеличивает стимулирование ФРПТ-ВВ поглощения первичными остеобластами свиньи 3H-тимидина.
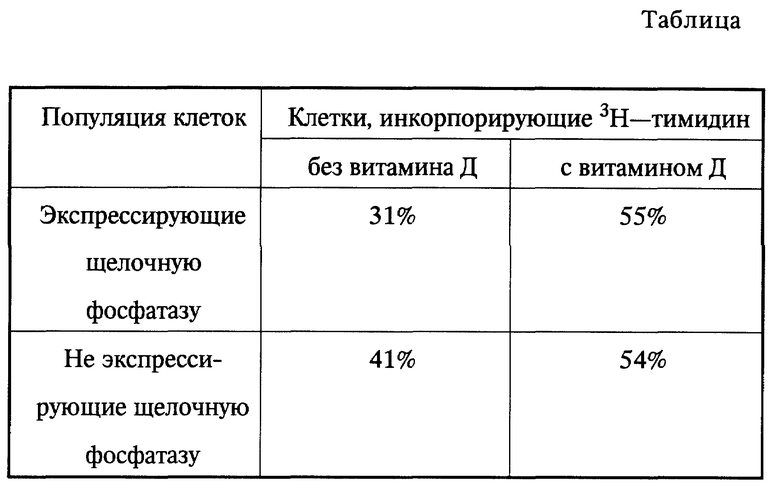
Фиг. 2 показывает, что для двукратного возрастания митогенеза необходимо одновременное присутствие ФРПТ и витамина D.
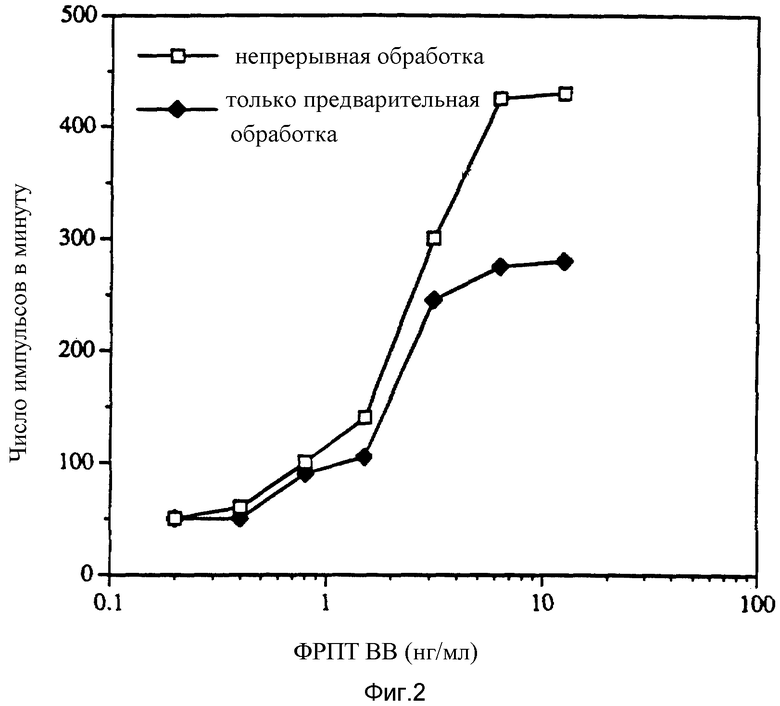
Фиг. 3 показывает, что синергистический эффект ФРПТ и витамина D изменяется в зависимости от концентрации витамина D.
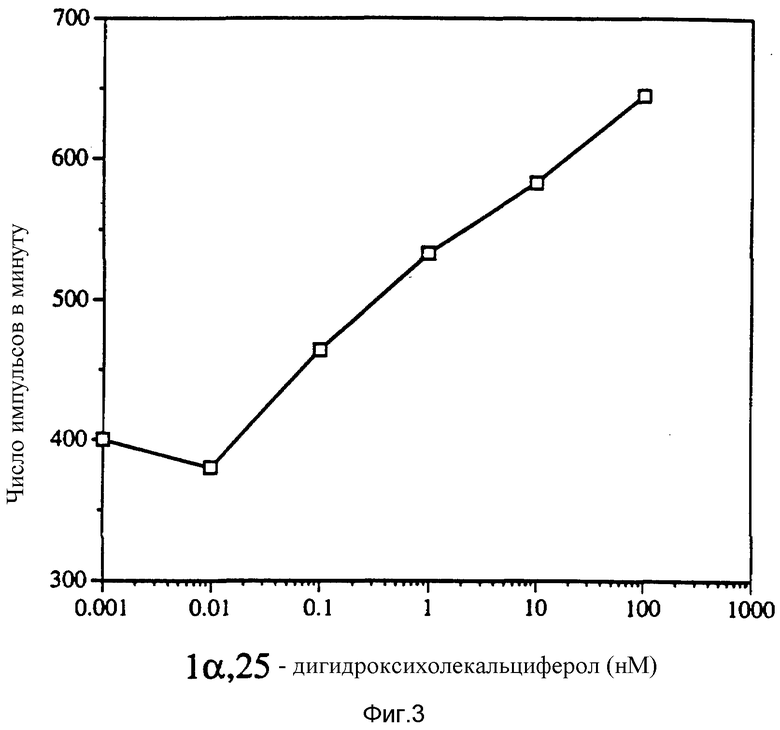
Фиг. 4 показывает, что при использовании основного ФРФ и витамина D синергистический эффект не наблюдается.
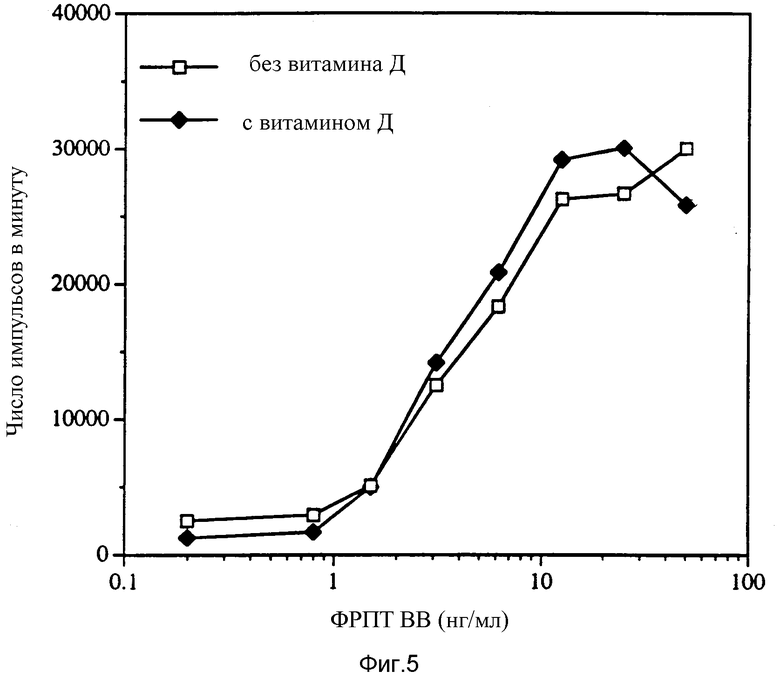
Фиг. 5 показывает, что витамин D влияет на ФРПТ-индуцированный митогенез фибробластов Swiss ЗТЗ.
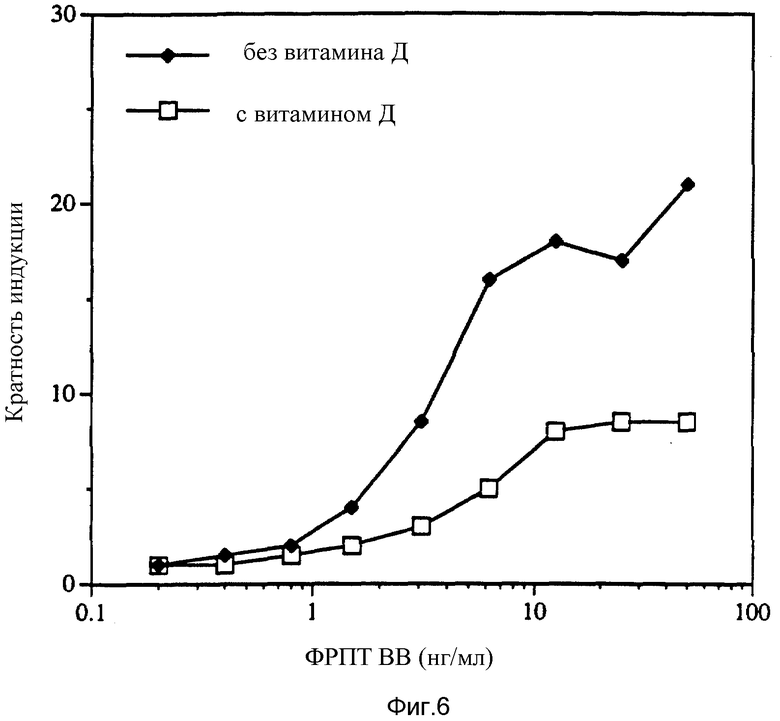
Фиг. 6 показывает, что ФРПТ вызывает многократно более сильную индукцию в присутствии вита мина D, чем в отсутствии витамина D в клеточной линии мышиных остеобластов МСЗТЗ.
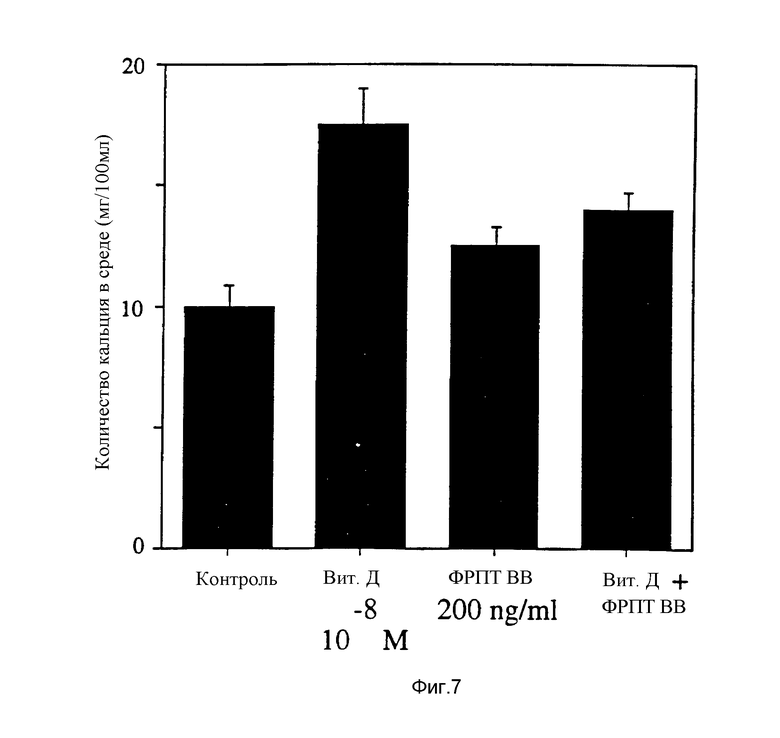
Фиг. 7 показывает, что ФРПТ и витамин D стимулируют резорбцию кости при раздельном добавлении в культуры клеток свода черепа, но при одновременном добавлении к культуре клеток свода черепа демонстрируют снижение резорбции кости.
Настоящее изобретение частично основано на открытии того факта, что ФРПТ и витамин D демонстрируют синергистический эффект в отношении роста остеобластов. Помимо этого, было обнаружено, что ФРПТ может ингибировать резорбцию кости, индуцированную витамином D.
Как было отмечено выше, остеобласты играют центральную роль в образовании кости и поддержании гомеостаза кости в целом. Способы настоящего изобретения пригодны для стимулирования роста остеобластов в клеточных культурах in vitro, а также iv vivo (например, при сращении переломов), способствуя, таким образом, заживлению.
В контексте настоящего изобретения подразумевается, что ФРПТ включает AA, BB и AB изоформы ФРПТ, отдельно или в комбинациях, а также их биологически активные аналоги. Помимо этого, подразумевается, что BB изоформа ФРПТ включает его вирусный гомолог (генный продукт v-sis).
ФРПТ можно получить как из естественных, так и из рекомбинантных источников. Способы получения рекомбинантного ФРПТ и аналогов ФРПТ описаны в патентах США NN 4769322; 4801542 и 4766073 и в ЕР 282317, включенных целиком в настоящий документ в качестве ссылок. ФРПТ может быть получен также из бактерий (смотри Tackney и др. WO 90/04035).
Способы выделения ФРПТ из естественных источников описаны Raines и Ross (J. Biol. Chem. 257:5154-5160, 1982), Hart и др. (Biochemistry 29:166-172, 1990) и в патенте США N 4479896.
В некоторых вышеназванных выданных патентах говорится, что можно непосредственно получить биологически активный материал, используя секреторный путь эукариотических клеток, экспрессирующий рекомбинантный ФРПТ. Экспрессия и секреция соответствующего генного продукта эукариотическими клетками предоставляет возможность должной обработки и сборки, в результате чего получаются молекулы нативной и биологически активной структуры.
При условии использования соответствующего промотора транскрипции и секреторных сигнальных последовательностей, как правило, любая эукариотическая клетка может экспрессировать и секретировать ФРПТ в биологически активной форме для применения согласно настоящему изобретению. С другой стороны, полипептидные цепи ФРПТ могут экспрессироваться прокариотическими клетками, изолированными и культивируемыми in vitro для получения биологически активных молекул.
Для экспрессии ФРПТ дрожжевыми клетками последовательность ДНК, кодирующую полипептид ФРПТ (например, цепь А ФРПТ или цепь В ФРПТ), сшивают с соответствующим промотором и секреторной сигнальной последовательностью. Промоторы, которые могут быть использованы для дрожжевых клеток, включают промотор альба-фактора (MF α 1) дрожжей и промотор триозофосфатизомеразы дрожжей (ТФИ1) (патент США N 4559311).
Промоторы могут быть получены также из других дрожжевых генов, например, алкогольдегидрогеназы 1 (АДГ1) или алкогольдегидрогеназы 2 (АДГ2). Могут использоваться соответствующие промоторы для других видов эукариотов, хорошо известные специалистам в данной области.
Секреция генных продуктов ФРПТ может выполняться посредством использования пре-про секреторной сигнальной последовательности альфа-фактора дрожжевого феромона скрещивания (Kurjan и Herskowitz, Cell 30:933, 1982; Julius и др. , Cell 36:309, 1984; и Brake и др., Proc. Natl. Acad. Sci. USA 81:4642, 1984) или использования лидера гена BAR1 дрожжей и последовательностей третьего домена (смотри патент США N 5037743), хотя можно применить и другие сигналы секреции.
Для гарантии эффективного окончания транскрипции и полиаденилирования мРНК можно добавить терминирующую последовательность дрожжевых клеток, такую как терминатор триозофосфатизомеразы (Alber и Kawasaki, J. Molec. Appl. Genet. 1: 419, 1982).
Способы сшивания фрагментов ДНК достаточно полно описаны (Sambrook и др. , Molecular Cloning: A Laboratory Manual. 2 Edition, Cold Spring Harbor Laboratory Press, 1989) и входят в обычную компетенцию специалистов данной области. После приготовления конструкций единиц экспрессии их вставляют в соответствующий вектор экспрессии.
Предпочтительно использовать вектор экспрессии, который стабильно сохраняется в клетке-хозяине, чтобы получать больше биологически активного вещества на единицу культуры. В этом смысле удобными секторами экспрессии дрожжей являются плазмиды pCPOT (ATCC 39685 и pMPOT2 (ATCC 67788), которые включают ген Schizosaccharomyces/pombe, кодирующий фермент гликолиза триозофосфатизомеразу (ген POT1).
Включение гена POT1 гарантирует стабильное сохранение плазмиды в клетке-хозяине, имеющей делецию гена ТФИ, благодаря ее способности комплементарно восполнять делецию гена в клетке-хозяине, как раскрывает патент США N 4931373, включенный в настоящий документ в качестве ссылки.
После приготовления конструкции ДНК, включающей в себя избирательный маркер POT1 и единицу экспрессии, включающую, например, промотор ТФИ1, лидерную последовательность BAR1 и последовательности третьего домена, соответствующую последовательность ДНК, кодирующую ФРПТ и терминатор ТФИ1, ее переносят в дрожжевую клетку-хозяин, имеющую делецию гена ТФИ1. Методики трансформирования дрожжевых клеток хорошо известны и широко освещены в литературе.
Трансформированные дрожжевые клетки можно отбирать путем выращивания на стандартной сложной среде, содержащей глюкозу, если в качестве селектируемого маркера используется ген POT1. Можно использовать стендартную среду, такую как JEPD (20 граммов глюкозы, 20 граммов Бакто-пептона, 10 граммов экстракта дрожжей на литр).
Отобранные трансформанты, содержащие соответствующие экспрессирующие конструкции, выращивают до стационарной базы на стандартных сложных средах, клетки удаляют центрифугированием или фильтрованием, а среду концентрируют. Поскольку ФРПТ является гидрофобным белком с высоким положительным зарядом (Rainer и Ross, там же: Antoniades, Proc, Natl. Acad. Sci. USA 78:7314, 1981; Deuel и др., J. Biol. Chem. 256:8896, 1981), рекомбинантный ФРПТ обладает теми же характеристиками, позволяющими использовать для его выделения ионообменную хроматографию. Например, рекомбинантный ФРПТ-ВВ в бульоне для культивирования дрожжей отделяют от клеток и фракционируют посредством катионообменной хроматографии.
ФРПТ, десорбированный из колонки, подкисляют и вновь фракционируют посредством хроматографии с обращенной фазой в серийном режиме. Выходящий продукт, содержащий ФРПТ, подкисляют, пропускают через мощную катионообменную колонку и элюируют ступенчатым градиентом NaCl. Элюат собирают, и ФРПТ-ВВ осаждают с помощью (NH4)2SO4.
Полученный материал обессоливают путем гель-фильтрации и разделяют согласно заряду. Элюат подкисляют, помещают в мощную катионообменную колонку и элюируют линейным градиентом NH4HCO3 при pH 8-10. Элюат собирают, и ФРПТ-ВВ осаждают путем добавления (NH4)2SO4. Полученный осадок растворяют в уксусной кислоте и фракционируют посредством гель-фильтрации. Элюат обессоливают и лиофилизируют.
Экспрессия биологически активных белков эукариотическими клетками (иными, чем дрожжи) может быть произведена специалистом посредством использования соответствующих сигналов экспрессии/регулирования.
Промоторы транскрипции, способные управлять экспрессией последовательностей ФРПТ, выбирают по их способности обеспечивать эффективную и/или регулируемую экспрессию в конкретном типе эукариотических клеток. Сигнальные последовательности, способные направлять генный продукт по пути секреции клеткой, выбирают по их функции в клетке-хозяине. Выбор других полезных регуляторных сигналов, таких как сигналы окончания транскрипции, сигналы полиаденилирования и усилители транскрипции, является очевидным для специалиста.
Показано, что рекомбинантный ФРПТ обладает практической той же биологической активностью, что и нативный ФРПТ. Главная биологическая активность ФРПТ, в частности, индукция хемотаксиса и митогенеза в чувствительных типах клеток (включая фибробласты, остеобласты и гладкомышечные клетки), лежит в основе большой части физиологических ролей этого белка, включая его роль в тканевой регенерации.
В предпочтительных вариантах осуществления настоящего изобретения ФРПТ практически не содержит цепи A. Поскольку гомодимерные изоформы ФРПТ (AA и BB) являются гомологичными, но не идентичными, а мономеры имеют молекулярные веса 12,5-14,3 кДа (цепь A) и 13-14 кДа (цепь B), чистота продукта подтверждается получением единичной большой полосы в полиакриламидном геле.
Композиции с ФРПТ, которые используются в некоторых вариантах осуществления настоящего изобретения, предпочтительно являются чистыми, т.е. в целом не содержащими загрязнений, которые могли бы помешать их терапевтическому применению. Особенно предпочтительны препараты, не содержащие токсических, антигенных, вызывающих воспаление, пирогенных или других вредных веществ более чем 90%, предпочтительно более чем 99% чистоты.
Упоминаемый в настоящем документе витамин D относится как к биологически активным формам этого соединения, так и к их предшественникам, которые могут iv vivo превращаться в биологически активные формы. Следовательно, под витамином D подразумеваются, среди прочих, витамин D2, витамин D3 и их активные метаболиты.
Витамин D2 (9,10-секо-эргоста-5,7,10[19],22-тетра-ен-3-ол) является синтетической формой витамина D (Inhoffen, Angew. Chem. 72:875, 196), а его биологически активный метаболит представляет 25-гидроксиэргокальциферол (Suda и др., Biochem. Biophys. Res. Comm. 35:1182, 1969).
Можно использовать также другие метаболизируемые формы и аналоги этих соединений, включая 1-α-гидрокси витамин D3, 25-гидрокси витамин D3, 24,25-гидрокси витамин D3, 1,25-дигидрокси витамин D3, 25-гидрокси витамин D3, 1,25-дигидрокси витамин D2, 24,25-дигидрокси витамин D2 и другие известные соединения.
Предпочтительным соединением является витамин D3 (9,10-секо-холеста-5,7,10[19] -триен-3-ол), а наиболее предпочтительной является биологически активная форма этого соединения, 1α,25-дигидроксихолекальциферол, коммерчески доступные соединения.
В одном из вариантов осуществления настоящее изобретение предназначено для стимулирования роста остеобластов in vitro. Зачастую остеобласты выделяют из первичных культур, то есть культур, полученных непосредственно из ткани, содержащей гетерогенную популяцию клеточных типов.
Первичные культуры из костной ткани могут содержать остеокласты, фибробласты, клетки-предшественники остеобластов и клетки эндотелия. Первичные культуры можно получить несколькими различными способами. Например, для получения первичной культуры можно использовать свод черепа плода, который измельчают и инкубируют в присутствии коллагеназы.
Клетки, высвобожденные воздействием коллагеназы, собирают и культивируют (Aubin и др. , J. of Cell Biol, 92: 452-461, 1982). Альтернативные способы используют свежеизолированные кусочки кости, на которые воздействуют коллагеназой и которые затем отмывают, культивируют, позволяя клеткам мигрировать из кусочков кости, и используют среду, содержащую малое количество Ca2+, которая является избирательной для роста остеобластов после воздействия коллагеназой (Robey и др., Calif. Tiss. 35: 453-460, 1985).
Индентификация остеобластов в первичной культуре первоначально является фенотипической. Фенотипические маркеры остеобластов включают экспрессию щелочной фосфатазы (Manduca и др., J. Bone Min. Res. 8: 281, 1993), синтез коллагена типа 1 (Kurihara и др., Endocrinol. 118 (3): 940-947, 1986), выработку остеокальцина (Yoon и др., там же) и чувствительность к паратгормону (Aubin и др., там же).
Остеобласты обычно культивируют при температуре 37oC в атмосфере, содержащей 5% CO2, в среде, включающей источник углерода, источник азота, незаменимые аминокислоты, витамины, минеральные вещества и факторы роста, обычно находящиеся в сыворотке плода коровы. Специалистам известно множество подходящих культуральных сред.
Настоящее изобретение также может использоваться для стимулирования роста выделенных клеточных линий остеобластов. Примеры таких клеточных линий включают: Saos-2, первичную остеогенную саркому человека (ATCC N HTB 85); U-2 OS, первичную остеогенную саркому человека (ATCC N HTB 964); HOS (TE 85), остеогенную саркому человека (ATCC N CRZ 1543); MG-63, остеосаркому человека (ATCC N CRL 1427) и UMR 106, остеосаркому крысы (ATCC N CRZ 1661).
В другом варианте осуществления настоящего изобретения композиция, включающая в себя ФРПТ и витамин D, применяется в качестве лекарственного средства для усиления остеобласт-опосредованного образования кости. Способы настоящего изобретения могут применяться для ускорения регенерации костных дефектов и повреждений, таких как закрытые, открытые и несросшиеся переломы; для ускорения заживления кости в пластической хирургии; для стимулирования врастания кости в нецементированные протезы суставов и зубные имплантаты; для лечения болезней и дефектов периодонта; для повышения костеобразования во время остеогенеза вытяжением и для лечения других поражений скелета, которые можно лечить путем стимулирования активности остеобластов, таких как остеопороз и артриты.
Композиция настоящего изобретения можно вводить местно или системно. Местное введение может осуществляться инъекцией в место поражения или дефекта или введением или прикреплением твердого носителя в место повреждения, или прямой местной аппликацией вязкой жидкости.
Доставка биологически активного ФРПТ и витамина D в поврежденные места может облегчаться путем применения композиций с дозированным высвобождением лекарственного агента, таких, например, которые описаны в патентной заявке США N 07/871246, находящейся на рассмотрении (соответствующей WIPO публикации WO 93/20859), которая полностью включена в настоящий документ в качестве ссылки.
Вкратце, изготавливают биоразлагаемые полиэфирные пленки, такие как пленки из полимолочной кислоты, полигликолевой кислоты, полидиоксана или сополимерные пленки из полимолочной кислоты/полигликолевой кислоты, содержащие ФРПТ, и покрывают ими пластинки, штифты, винты и т.п. для прикрепления к кости или для помещения в кость.
Такие композиции обеспечивают постепенное высвобождение ФРПТ в участке-мишени. Предпочтительны пленки 50:50 ПМК/ПГК. Эти пленки могут дополнительно включать носитель, такой как альбумин, детергент полиоксиэтиленсорбитан или глутаминовую кислоту.
В случае включения в композицию альбумина соотношение ФРПТ и альбумина должно поддерживаться, как правило, на уровне между 0,125 и 2,5 мкг/мг. В принципе, в качестве носителя можно использовать любое вещество, которое облегчает деградацию полимера, образует поры в пленке или уменьшает адсорбцию фактора роста (факторов роста) пленкой.
Альбумин является особенно предпочтительным носителем. Полиоксиэтиленсорбитановые детергенты, пригодные в качестве носителей, включают полиоксиэтиленсорбитана моноолеат, полиоксиэтиленсорбитана монолауреат, полиоксиэтиленсорбитана монопальмитат, полиоксиэтиленсорбитана моностеарат и полиоксиэтиленсорбитана триолеат.
Пленки этого типа особенно пригодны для покрытия протезных устройств и хирургических имплантатов. Эти пленки, например, могут обертывать наружные поверхности хирургических болтов, штифтов, пластинок, стержней и т.п. Имплантируемые устройства этого типа широко используются в ортопедической хирургии.
Эти пленки можно также использовать для покрытия материалов, пломбирующих кость, таких как гидроксиапатитные блоки, тампоны из деминерализованного вещества кости, коллагеновые матрицы и т.п. Обычно пленки или устройства, описанные здесь, применяют к кости в месте перелома. Обычно это имплантация в кость или прикрепление к поверхности с помощью стандартной хирургической техники.
В добавление к сополимерам, факторам роста и носителям, упомянутым выше, биоразлагаемые пленки могут включать в себя другие активные или инертные компоненты. Особый интерес представляют агенты, стимулирующие рост ткани или инфильтрацию. Особенно предпочтительны агенты, которые стимулируют рост кости, такие как морфогенные белки кости (патент США N 4761471; PCT публикация WO 90/11366), остеогенин (Sampath и др., Proc. Natl. Acad. Sci. USA 84: 7109-7113, 1987) и NaF (Tencer и др., J. Biomed. Mat. Res. 23: 571-589, 1989).
Для того, чтобы нагрузить пленку ФРПТ и носителем, используют порошки или жидкие растворы. Например, лиофилизированный ФРПТ и альбумин могут быть равномерно диспергированы на одной поверхности пленки, после чего пленку свертывают. По-другому, белки могут наноситься в виде водного раствора (например, в физиологическом растворе с фосфатным буфером или 0,1 М уксусной кислоте), который остается до высыхания.
Биоразлагаемые материалы, содержащие ФРПТ, могут формировать различные имплантаты, согласно методикам, известным специалистам. Можно изготавливать стержни, пластинки, блоки, болты и т.п. для прикрепления или помещения в кость в месте перелома или иного дефекта.
Рецептуры биоразлагаемых материалов составляют таким образом, чтобы количество ФРПТ составляло от 0,0375 до 1,25 мкг на мг сополимера.
Альтернативные способы локальной доставки ФРПТ и/или витамина D включают осмотические мининасосы ALZET (Alza Corp. Palo Alto, CA); материалы с постепенным высвобождением матрикса, такие как описанные Wang и др. (WO 90/11366); декстрановые гранулы с электрическим зарядом, описанные Bao и др. , (WO 92/03125); системы доставки на основе коллагена, как описано Ksaznder и др. (Ann. Surg. 211(3): 288-294, 1990); системы на основе геля метилцеллюлозы, как описано Beck и др. (J. Bone Min. Res 6(11): 1257-1265, 1991), и системы на основе альгината, как описано Edelman и др. (Biomaterials 12: 619-626, 1991).
Другие известные способы местной доставки с постепенным высвобождением активного агента в кость включают металлические протезы, покрытые пористой пленкой, которая может быть импрегнирована, и твердые пластиковые стержни с включенными в них лекарственными средствами.
Доставку композиций настоящего изобретения для резорбтивного действия можно облегчить посредством конъюгирования ФРПТ, витамина D или обоих вместе, с нацеливающей молекулой. "Нацеливающая молекула" относится к молекуле, которая связывается с тканью, представляющей интерес.
Например, молекулы, нацелившие на кость, включают тетрациклины; кальцеин; биофосфонаты; полиаспарагиновую кислоту; полиглутаминовую кислоту; амино-фосфосахара; пептиды, связанные с фазой минерализации кости, такие как остеонектин, костный сиалопротеин и остеопонтин; антитела к костной ткани; белки, содержащие домены, присоединяющиеся к минеральным веществам кости и т. п. Смотри, например, описания Bentz и др., (ЕР 0512844) и Murakami и др. (ЕР 0341961).
Композиции, применяемые согласно настоящему изобретению, могут находиться в форме фармацевтически приемлемых солей, особенно кислых добавочных солей, включая соли органических и неорганических кислот. Примеры таких кислот включают органические кислоты, такие как муравьиная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, янтарная кислота, яблочная кислота, винная кислота, лимонная кислота, бензойная кислота, салициловая кислота и т.п.
Добавочные кислые соли основных аминокислотных остатков получают обработкой пептида соответствующей кислотой или неорганическим веществом по методикам, хорошо известным специалистам; или желаемая соль может быть получена непосредственно, путем лиофилизации из соответствующей кислоты. Эти соли в дальнейшем можно использовать для приготовления инъецируемых, местных и водных растворов для местного или системного введения композиции настоящего изобретения.
Материалы и методы для производства препаратов для инъекций и препаратов для местного применения можно найти в Remington's Pharmaceutical Sciences, 17 изд., 1985, включенном в настоящий документ целиком в качестве ссылки.
Согласно настоящему изобретению, "эффективное количество" композиции означает такое количество, которое обеспечивает статистически значимый эффект. При использовании для стимулирования роста остеобластов in vitro обычно желательно получить увеличение роста по меньшей мере на 50%, что измеряется инкорпорацией 3H-тимидина, по сравнению с клетками, растущими в присутствии ФРПТ и в отсутствии витамина D. Для терапевтических целей "эффективное количество" представляет количество композиции, содержащей ФРПТ и витамин D, которое требуется для получения клинически значимого повышения скорости заживления перелома, обратного развития потери костной ткани при остеопорозе, стимулирования и/или нарастания образования кости в несросшихся переломах и при остеогенезе путем вытяжения, повышения и/или ускорения роста кости внутрь протезных устройств и восстановления зубных дефектов.
Такие количества частично будут зависеть от конкретного состояния человека, подвергаемого лечению, и других факторов, очевидных для специалиста. Например, при остеопорозе увеличение образования кости выражается в статистически значимой разнице костной массы между контрольными группами и группами, подвергаемыми лечению.
Можно наблюдать, например, 10-20% или большее возрастание массы кости. Другие измерения клинически значимого повышения заживления могут включать, например, тесты на разрыв и напряжение, на разрыв и скручивание, изгиб по 4 точкам и другие биомеханические тесты, хорошо известные специалистам. Общее руководство по схемам лечения получено в результате экспериментов на животных с моделями интересующих исследователей заболеваний.
Предпочтительная доза витамина D для системного лечения 70-кг пациента составляет приблизительно от 1 нг до 1 мг, предпочтительно приблизительно от 10 нг до 500 мкг и наиболее предпочтительно приблизительно от 20 нг до 1 мкг. Предпочтительная доза витамина D для местного применения его в комбинации с ФРПТ составляет приблизительно от 1 нг до 1 мг, предпочтительно приблизительно от 5 нг до 500 нг и наиболее предпочтительно приблизительно от 10 нг до 100 нг.
Предпочтительная доза ФРПТ для системного лечения 70-кг пациента составляет приблизительно от 1 пг до 10 мг, предпочтительно приблизительно от 100 пг до 1 мг и наиболее предпочтительно приблизительно от 10 нг до 100 мкг.
Предпочтительная доза ФРПТ для местного применения в комбинации с витамином D составляет приблизительно от 1 нг до 10 мг, предпочтительно, приблизительно от 1 мкг до 1 мг и наиболее предпочтительно приблизительно от 10 мкг до 500 мкг. В целом, композиции с постепенным высвобождением активного агента должны приготавливаться таким образом, чтобы обеспечивать дозы в районе верхнего предела указанных доз. Дозы должны быть приспособлены к скорости высвобождения. Жидкие композиции содержат обычно от 1 до 1000 мкг/мл ФРПТ, предпочтительно 10-500 мкг/мл.
In vitro концентрации ФРПТ предпочтительно составляют приблизительно от 1 нг/мл до 100 нг/мл, предпочтительно от 5 нг/мл до 40 нг/мл и наиболее предпочтительно от 6 нг/мл до 20 нг/мл.
Было обнаружено, что наилучший синергистический эффект ФРПТ и витамина D получается при комбинировании ФРПТ и витамина D в отношении от 6:0,1 до 6: 1000 (ФРПТ: витамин D), предпочтительно от 6:1 до 6:500, более предпочтительно от 6:10 до 6:100, наиболее предпочтительно приблизительно 6:40.
Композиции, описанные выше, вводятся в течение периода времени, варьирующего от одного дня до 6 месяцев или более, в зависимости от состояния, подвергаемого лечению. В целом, дозы вводят с частотой от 5 раз в день до одного раза в месяц, предпочтительно от одного раза в день до одного раза в месяц, вплоть до фактического окончания заживления. Действенная схема лечения будет зависеть от таких факторов, как возраст и общее состояние пациента, заболевания, по поводу которого проводится лечение, и способа введения. Определение схемы лечения находится в компетенции специалиста.
Настоящее изобретение иллюстрируется следующими неограничивающими примерами.
Пример 1. Выделяли первичную культуру остеобластов свиньи. У подсвинков (весом приблизительно 30 фунтов) из бедренных костей удаляли участки трабекулярной кости. Кость разрезали на небольшие кусочки, приблизительно 2х2 мм, и отмывали много раз при комнатной температуре в фосфатно-солевом буфере (ФСБ) для полного удаления крови.
Кусочки кости помещали в раствор, содержащий 1 мг/мл коллагеназы типа 11 Clostridium histolyticum (Sigma Chemical Co., St. Louis, MO) в среде Дульбекко (DMEM) (Fred Hutchinson Cancer Research Center, Seattle WA), перед употреблением простерилизованный фильтрованием. Кусочки инкубировали в среде с коллагеназой в течение 2 часов при 37oC и стряхивании. После инкубации с коллагеназой среду удаляли, а кусочки кости помещали в ФСБ и отмывали до тех пор, пока в отмывочной среде не оставалось клеток.
Кусочки помещали в минимальную поддерживающую среду Игла (GIBCO-BRL, Gaithersbutg, MD), содержащую 10% сыворотки плода коровы (СПК) (Hyclone Logan, UT), 1 мМ пирувата натрия и 0,29 мг/мл L-глутамина, при низкой плотности и инкубировали при температуре 37oC в атмосфере, содержащей 5% CO2.
Среду меняли каждые 4-5 дней. Миграция остеобластов из кусочков кости наблюдалась в течение 7-10 дней. Клетки использовались для исследований немедленно после образования монослоя, затем уничтожались.
Клетки испытывались на экспрессию щелочной фосфатазы для подтверждения остеобластического фенотипа. Гистохимическое окрашивание производилось набором для гистохимического окрашивания АР 86R (Sigma, St. Louis, MO), согласно инструкции производителя. Результаты свидетельствовали о том, что 30-70% гетерогенных первичных клеток вырабатывали щелочную фосфатазу и возрастание плотности клеток соответствовало увеличению количества клеток ЩФ+.
Пример 2. Первичные остеобласты свиньи (приготовленные как описано выше) испытывали в отношении относительной митогенной активности в присутствии ФРПТ-ВВ, ФРПТ-ВВ и zα, 25-дигидроксихолекальциферола и 1α, 25-дигидроксихолекальциферола отдельно. Митогенная активность из мерялась по инкорпорации 3H-тимидина по методике Rainer и Ross (Meth. Enzymology 109: 749-773, 1985).
Вкратце, неактивные первичные остеобласты свиньи получали путем посева клеток при плотности 3•104 клеток/мл на минимальную поддерживающую среду Игла (GIBCO-BRL, Gaithersburg, MD), содержащую 10% сыворотки плода коровы (СПК), в 96-луночные планшеты, после чего давали им расти 3-4 дня.
Среду удаляли, и в каждую лунку добавляли 180 мкг DFC* (таблица 1), содержащей 0,1% СПК. К половине всего количества лунок добавляли 1α, 25-дигидроксихолекальциферол (Biomol. Research Labs, Plymouth Meeting, PA) до концентрации 10 нМ. Клетки инкубировали в течение 3 дней при температуре 37oC в атмосфере, содержащей 5% CO2.
Поскольку 1α, 25-дигидроксихолекальциферол растворяли в этаноле, остальные лунки служили контролем, содержащим эквивалентное количество этанола, как в лунках, где он был добавлен как растворитель 1α, 25-дигидроксихолекальциферола. Затем добавляли двадцать микролитров 10 Х ФРПТ так, чтобы конечная концентрация находилась в пределах от 0,2 до 50 нг/мл.
Отрицательные контроли ставили без добавления ФРПТ-ВВ и +/-витамин D. Планшеты инкубировали 20 часов при температуре 37oC, затем среду удаляли. В каждую лунку добавляли сто микролитров DFC*, содержащей 0,1% СПК и 2μКю/мл 3H-тимидина, и планшеты инкубировали еще 3 часа при температуре 37oC.
Среду отсасывали, и в каждую лунку добавляли 150 μл л трипсина. Планшеты инкубировали при температуре 37oC до тех пор, пока клетки не отсоединялись (по меньшей мере 10 минут). Отсоединившиеся клетки собирали на фильтре с по мощью харвестера LKB Wallac 1295-001 (LKB Wallec, Pharmacia, Gaithersbirg, MD).
Фильтры высушивали нагреванием в микроволновой печи в течение 10 минут и подсчитывали на сцинтилляционном счетчике LKB Betaplate 1250 (LKB Wallac), согласно инструкции изготовителя.
Таблица 1
250 мл модифицированной по способу Дульбекко среды Игла (DMEM)
250 мл среды Хэма F12
0,29 мг/мл L-глутамина
1 мМ пирувата натрия
25 мМ Гэпэс (Sigma, St. Louis, MO)
10 мкг/мл fetuin** (Aldrich, Milwaukee, W1)
50 мкг/мл инсулина (GIB CO-BRL)
3 нг/мл селена (Aldrick, Milwaukee, W1)
20 мкг/мл трансферрина (JRH, Lenexa, KS)
Результаты, представленные на фиг. 1, показывают, что ФРПТ-ВВ стимулирует поглощение тимидина в первичных культурах остеобластов свиньи. Максимальное стимулирование наблюдалось при концентрациях 6-10 нг/мл. ФРПТ вместе с 1α, 25-дигидроксихолекальциферолом удваивал максимальное поглощение тимидина. В присутствии одного только 1α, 25-дигидроксихолекальциферола стимулирования роста не наблюдалось.
Пример 3. С целью определить, нужно ли одновременное присутствие 1α, 25-дигидроксихолекальциферола и ФРПТ для получения синергистического воздействия на рост, предприняли исследование митогенности, как описано в примере 2, со следующими модификациями: а) конечная концентрация 1α, 25-дигидрохолекальциферола составляла 100 нМ; b) подготавливали дополнительное количество лунок без 1α, 25-дигидроксихолекальциферола в присутствии ФРПТ путем удаления среды, использованной для предварительной обработки клеток 1α, 25-дигидроксихолекальциферолом, и добавления свежей среды, содержащей только соответствующие разведения ФРПТ.
Результаты, приведенные на фиг. 2, свидетельствуют о том, что ФРПТ и 1α, 25- дигидроксихолекальциферол должны присутствовать одновременно для получения двукратного возрастания митогенеза.
Пример 4. С целью определить, является ли эффект 1α, 25-дигидроксихолекальциферола и ФРПТ-индуцированный митогенез первичных остеобластов свиньи дозозависимым, предприняли исследование, описанное в примере 11, со следующими модификациями: а) концентрация 1α, 25-дигидроксихолекальциферола варьировала от 0,01 нМ до 100 нМ и b) ФРПТ присутствовал только в одной кон центрации, а именно 6,2 нг/мл.
Результаты, представленные на фиг. 3, свидетельствуют о том, что синергистический эффект ФРПТ и 1α, 25-дигидроксихолекальциферола изменялись в зависимости от концентрации 1α, 25-дигидроксихолекальциферола.
Пример 5. С целью определить, являются ли эффекты, наблюдаемые с витамином D, специфичными для ФРПТ, витамин D испытывали в комбинации с основным фактором роста фибробластов (ФРФ).
Рекомбинантный основной ФРФ человека (BPL-GIBCO) испытывали в концентрациях от 0,4 нг/мл до 100 нг/мл в тесте на митогенность, как описано в примере 2. Результаты, представленные на фиг. 4, свидетельствуют об отсутствии эффекта при использовании основного ФРФ и 1α, 25-дигидроксихолекальциферола.
Пример 6. Предприняли исследование с целью определить, могли ли фибробласты, потенциально контаминирующий тип клеток в первичных культурах, полученных из кости, вызывать синергистический эффект, наблюдавшийся при использовании ФРПТ и 1α, 25-дигидроксихолекальциферола.
Исследование выполнялось, как описано в примере 2, с использованием мышиных фибробластов клеточной линии Swiss ЗТЗ (ATCC N CCL92), за исключением того, что фибробласты помещали в среду DMEM, содержащую 10% СПК, при плотности 2•104 клеток на мл. Результаты, представленные на рисунке 5, свидетельствуют о том, что 1α, 25-дигидроксихолекальциферол не оказывал влияния на ФРПТ-индуцированный митогенез фибробластов.
Пример 7. Для подтверждения факта, что синергистический эффект 1α, 25-дигидроксихолекальциферола и ФРПТ наблюдается на остеобластах, использовали стабильную клеточную линию мышиных остеобластов, МСЗТЗ (Suda и др., L. Cell Biol. 96:191-198, 1983).
Исследование выполняли, в основном, как описано в примере 2, за исключением того, что клетки помещали в среду α-MEM (GIBCO-BRL), содержащую 10% СПК, при плотности 3•104 клеток на мл. В противоположность фибробластам Swiss ЗТЗ и первичным остеобластам свиньи, 1α, 25-дигидроксихолекальциферол ингибировал рост клеток МСЗТЗ.
Таким образом, данные анализировались с точки зрения кратности индукции поглощения тимидина. Кратность индукции определяется как отношение числа импульсов в минуту 3H-тимидина, инкорпорированного в присутствии ФРПТ, к таковому в отсутствии ФРПТ. Результаты, приведенные на фиг. 6, свидетельствуют о том, что ФРПТ индуцирует большую кратность индукции в присутствии 1α, 25-дигидроксихолекальциферола, чем в отсутствии этого витамина.
Пример 8. Для проверки ответа остеобластов в первичных культурах кости свиньи на ФРПТ и 1α, 25-дигидроксихолекальциферол предприняли исследования митогенеза и экспрессии щелочной фосфатазы. Исследовали поглощение 3H-тимидина и экспрессию маркера остеобластов, щелочной фосфатазы, первичными костными клетками свиньи.
Первичные костные клетки свиньи высевали на планшеты и обрабатывали, как описано выше, за исключением того, что: а) клетки помещали на предметные стекла с камерами Lab-tek N 177445 (ALL World Scientific, Seattle, WA); b) использовали только одну концентрацию 10 нМ 1α, 25-дигидроксихолекальциферола и с) использовали только одну концентрацию 100 нг/мл ФРПТ-ВВ.
После инкорпорации 3H-тимидина предметные стекла трижды отмывали ФСБ и окрашивали на щелочную фосфатазу, как описано ранее. После окрашивания стекла высушивали на воздухе и покрывали эмульсией NTB3 (Kodak, Rochester NY). Эмульсию высушивали на воздухе и стекла выдерживали одну неделю при температуре 4oC.
Затем стекла проявляли 5 минут в проявителе D-19 (Kodak) при комнатной температуре, промывали в воде и фиксировали в быстром фиксаже (Kodak) в течение 5 минут. Затем производили контрокрашивание стекол метиленовым синим (Sigma) путем разведения исходного раствора 1:100 в воде и нанесения на клетки на одну минуту.
Клетки, экспрессирующие щелочную фосфатазу (ЩФ+), идентифицировали по розовому окрашиванию, в то время как клетки, инкорпорировавшие 3H-тимидин, идентифицировали по накоплению зерен серебра около ядер. В отсутствии ФРПТ-ВВ только 2-4% клеток инкорпорировали 3H-тимидин, и на это количество добавление 1α, 25-дигидроксихолекальциферола не влияло.
Добавление ФРПТ-ВВ повышало процент клеток, инкорпорироваших 3H-тимидин, приблизительно в десять раз. Как ЩФ+, так и ЩФ-клетки были чувствительны к ФРПТ- ВВ. Подсчитывали процент ЩФ+клеток, которые инкорпорировали 3H-тимидин в ответ на воздействие ФРПТ, в присутствии и в отсутствии 1α, 25-дигидроксихолекальциферола. Такие же подсчеты производили и для ЩФ-клеток.
Результаты суммировали в таблице 2. Добавление 1α, 25-дигидроксихолекальциферола увеличивало количество ЩФ+клеток, которые инкорпорировали 3H-тимидин, почти в два раза, в то время как клетки ЩФ- демонстрировали более умеренное повышение. Эти результаты свидетельствуют о том, что остеобласты в культуре, по результатам экспрессии ЩФ, демонстрируют синергистический ответ на 1α, 25-дигидроксихолекальциферол и ФРПТ-ВВ.
ЩФ-клетки, демонстрирующие синергистический ответ на 1α, 25-дигидроксихолекальциферол и ФРПТ-ВВ, могут являться или не являться остеобластами, поскольку остеобласты не экспрессируют ЩФ ни на одной из стадии своей дифференцировки.
Пример 9. Известно, что витамин D является мощным стимулятором костной резорбции, когда его добавляют in vitro в эксперименте к клеткам свода черепа, в то время как ФРПТ в том же эксперименте демонстрирует умеренное влияние на резорбцию кости. Поскольку резорбция кости является противопоказанием для стимулирования образования кости, было проведено исследование по оценке взаимодействия ФРПТ и витамина D при резорбции кости.
У 4-дневных мышей CD-1 (Charles River Laboratories, San Diego, CA) брали свод черепа, который включал теменную часть с сагиттальным швом. Кости помещали в 6-луночные чашки Петри (American Science Products McGraw Park, IL) с 1 мл ростовой среды (DMEM, 0,29 мг/мл L-глутамина, 1 мМ пирувата натрия и 15% инактивированной прогреванием лошадиной сыворотки (ИПЛО) и инкубировали при температуре 37oC в атмосфере, содержавшей 5% CO2, в течение 24 часов при легком встряхивании.
После инкубации среду удаляли из лунок и заменяли ее на 1,5 мл ростовой среды, содержащей или 200 нг/мл ФРПТ-ВВ, или 10-8М 1α, 25-дигидроксихолекальциферола, или и ФРПТ и витамин D. В каждой группе было по пять костей, и группы инкубировали при покачивании в течение 72 часов, при температуре 37oC в атмосфере, содержавшей 5% CO2.
После инкубации среду удаляли из лунок и определяли уровни Ca2+ с помощью анализатора общего кальция NOVA-7 (Nova Biomedical, Waltham, MA), согласно инструкции изготовителя. В добавление к среде, в которой находились образцы, анализировали также среду после 24-часовой инкубации, чтобы убедиться в том, что кости не разрушились во время процесса сбора. Разрушенные кости высвобождают в среду большие количества кальция и поэтому в конечном анализе их не использовали.
Результаты, приведенные на фиг. 7, свидетельствуют о том, что как ФРПТ, так и 1α, 25-дигидроксихолекальциферол, добавленные к костям раздельно, стимулировали резорбцию кости. Однако при одновременном добавлении уровни высвобождения Ca2+ вследствие резобции кости, наблюдавшиеся с витамином Д, снижались, что указывает на ингибирующий эффект ФРПТ.
Пример 10. Для проверки способности ФРПТ и витамина Д синергистически увеличивать врастание кости в пористый имплантат из гидроксиапатита изготавливали цилиндрические имплантаты длиной 25 мм и номинальным диаметром 4 мм (Interpore, Iwine, CA) из гидроксиапатитного матеирала с размером пор 190 - 230 мкм.
Эти цилиндры содержали вырезки диаметром 10 мм и 3 мм. Имплантаты нагружали ФРПТ погружением в раствор ФРПТ, в результате чего получали дозы 0,5 - 50 нг на имплантат. Витамин Д вводили локально с помощью микронасоса ALZET (Alza Corp.), в результате чего получали дозы витамина Д 10 - 100 нг на имплантат. Соотношение доз ФРПТ и витамина Д было 1 : 6.
Имплантаты, нагруженные веществом-носителем, использовали в качестве контроля. В исследовании использовали 24 новозеландских белых кролика с законченным формированием скелета, весом 3,5 кг. Анестезию производили путем инъекции 5,0 мг/кг ксилазина и 35,0 мг/кг кетамина в каждую из параспинальных мышц по половине дозы. Животных затем инкубировали, анестезию поддерживали фторотаном.
Интрамедуллярные имплантаты вставляли, используя дистальный доступ (Anderson и др. , J/Orthop Res. 10 : 588 - 595, 1992). Производили 2,5 см боковой парапателлярный разрез, получая доступ к колленному суставу вдоль латерального края сухожилия надколенника. Надколенник смещали в медиальном направлении при вытянутой конечности.
Острие 4,0 мм сверла помещали между бедренными мыщелками, непосредственно проксимально. Отверстие просверливали сквозь суставной хрящ и метафизную кость для закрепления интрамедуллярного положения. Имплантат вставляли и проталкивали проксимально до конечного положения. Для закрытия дистального входного отверстия использовали костный хирургический воск. Рану закрывали послойно 4 - 0 рассасывающимся шовным материалом и скобками из нержавеющей стали.
Исследования производили гистологические и биомеханические. Производили поперечные срезы бедренной кости длиной 3,5 мм, содержащие имплантаты, таким образом, чтобы можно было изучать следующие участки: прилегающий к трабекулярной части проксимальной области бедренной кости, в области отверстия и прилегающей к эндостальной коре среднепроксимальной части бедренной кости.
Для каждого участка образец разрезали на две части, одну из которых использовали для гистологического анализа, а другую - для биомеханического исследования. Каждый экспериментальный участок сравнивали с контрольным участком, нагруженным только веществом-носителем, из противоположной бедренной кости.
Гистологические образцы фиксировали в формалине с фосфатным буфером и обезвоживали возрастающими концентрациями этанола: 95% этанол в течение 25 часов, затем три смены 100% этанола по 24 часа каждая. После последней обработки 100% этанолом образцы просветляли двумя сменами ксилола по 24 часа каждая.
Выполняли заливку ткани пластиком. Образцы подготавливали для поперечных срезов в пластиковых стержнях и заливали в метакрилат при комнатной температуре в вакуумном эксикаторе в атмосфере азота, как описано Bain и др. (Stain Technol. 65 (4): 159, 1990).
Из каждого образца приготавливали срезы толщиной 150 μм с помощью низкоскоростного алмазного дискового ножа (Struwrs Accutom-2, Torrance, CA). Толстые срезы затем нарезали вручную на более тонкие, приблизительно 30 мкм, между двумя стеклами, покрытыми абразивной пленкой 1200. Гистологические препараты срезов помещали из стекла с помощью Immuno-Mount (Shandon, Pittsburgh, PA).
Поверхностные свойства для врастания кости в имплантат и динамические индексы костеобразования определяли с помощью морфометрической программы для кости Bioquant (Biometrics, Inc., Nashville, TN), сопряженной через camera luceda со световым/эпифлюоресцентным микроскопом Olympus BH-2 (Scientific Instruments, Inc., Redmond, WA).
Общее врастание кости в имплантат измеряли под флюоресцентным микроскопом при 40-кратном увеличении. Параметры минеральной оппозиции и костеобразования определяли по флюорохромным меткам при 100-кратном увеличении in vivo. Для подсчета скорости минеральной оппозиции средние расстояния между метками на внутренней поверхности имплантата делили на промежуток времени между метками.
Общую скорость образования кости определяли путем обводки контуров площади новообразованной кости (т.е., кости, ограниченной флюорохромной меткой) и деления общей площади новообразованной кости на промежуток времени между метками.
Врастание кости оценивали механическими способами, используя тест выталкивания. Образцы помещали в тестирующее устройство Instron и к центру имплантата прикладывали постоянную силу 0,5 мм/сек. Силу, необходимую для выталкивания имплантатов, определяли с помощью биомеханических тестирующих методик, хорошо известных специалистам, как описано Knowler и др. (Biomaterials, 13 (8): 491 - 496, 1992).
Пример 11. Определяли способность ФРПТ-ВВ и витамина Д стимулировать периостальное костеобразование в бедренных костях новорожденных крысят и сводах черепов 5-недельных мышей, используя ФРПТ, витамин Д или сочетание ФРПТ и витамина Д. Для экспериментов на бедренных костях дозы ФРПТ составляли от 2 до 200 нг в день. Дозы витамина Д составляли от 20 нг до 2 мкг в день.
Эти соединения инъецировали в периост средней части передней поверхности левой бедренной кости новорожденных крысят (2 - 3-дневного возраста) десять дней подряд. Противоположное бедро служило контролем вещества-носителя. Кости метили для гистоморфометрии путем интраперитонеальной инъекции тетрациклина (10 мг/кг) на 5 день и интраперитонеальных инъекций кальцеина (10 мг/кг) на 17 и 22 дни.
В каждой экспериментальной группе использовали по восемь крысят. На 24 день животных умерщвляли, удаляли обе бедренные кости и обрабатывали для гистоморфометрии недекальцифицированной кости.
Исследование костеобразования в сводах черепа производилось путем инъекции ФРПТ, витамина Д или комбинации ФРПТ и витамина Д подкожно в периостальные ткани, покрывающие сагиттальный шов. Инъекции делали один раз в день в течение 10 дней. Доза ФРПТ составляла от 2 до 200 нг в день. Доза витамина Д составляла от 20 нг до 2 мкг в день.
Новообразованную кость метили для измерений путем интраперитонеальной инъекции тетрациклина на 1 день и интраперитонеальных инъекций кальцеина на 18 и 25 дни. Мышей умерщвляли на 28 день, собирали своды черепа и обрабатывали для гистологической оценки.
Несмотря на то, что настоящее изобретение было описано с некоторыми подробностями посредством иллюстраций и примеров для большей ясности понимания, является очевидным, что определенные изменения и модификации могут производиться в пределах объема прилагаемой формулы изобретения.
Изобретение относится к медицине, а именно к химико-фармацевтической промышленности и касается композиции, стимулирующей рост остеобластов, содержащая ФРПТ и витамин D. Сущность изобретения включает композицию, содержащую фактор роста, полученный из тромбоцитов, и витамин D в количестве, достаточном для стимулирования роста остеобластов и стимулирования роста кости у пациента. Технический результат заключается в усилении пролиферации остеобластов и тем самым интенсификации процессов регенерации кости. 4 с. и 16 з. п.ф-лы, 7 ил., 2 табл.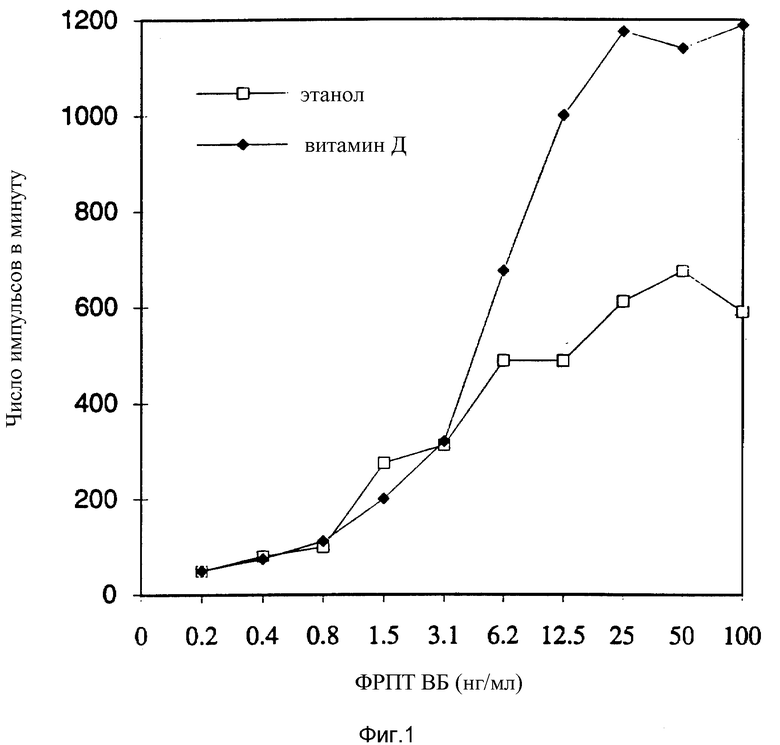
| Шланговое соединение | 0 |
|
SU88A1 |
| БЛИОТЕКА Iво1^со;ознАя 1Пл]1Н;1Ш'ГГХШ'{Еи{Ап! | 0 |
|
SU322249A1 |
| US 4350687 A, 21.09.82 | |||
| US 5149691 A, 22.09.92. | |||
Авторы
Даты
1999-10-27—Публикация
1994-03-29—Подача