Изобретение относится к локальным препаратам, содержащим в качестве активного компонента торемифен иди один из его метаболитов N-деметилторемифен (4-хлор-1,2-дифенил-1-[4-[2-(N-метиламино)-этокси] фенил] -1-бутен) или 4-гидрокситоремифен (4-хлор-1-(4-гидроксифенил)-2-фенил-1-[4-[2-(N, N-диметиламино)этокси]-фенил]-1-бутен) или их фармацевтически приемлемые нетоксичные соли.
Использование подобных локальных препаратов, например, для лечения злокачественных опухолей, локализованных в коже или на малом расстоянии от кожи, например, метастатических образований рака молочной железы, также входит в объем изобретения.
Кроме того, использование этих локальных препаратов для дополнительных лечебных мероприятий при раке молочной железы, а также их использование для изменения многолекарственной устойчивости клеток злокачественной опухоли к цитотоксическим лекарствам также находятся в объеме изобретения. Локальное применение торемифена или его метаболитов представляет особый интерес при лечении меланомы, лимфомы, саркомы Капоши и грибовидного микоза.
Тамоксифен и торемифен представляют собой трифенилэтиленовые антиэстрогены, используемые при лечении рака молочной железы, положительного в отношении экстрагенорецепторов. Эти лекарства наиболее часто используют в качестве эндокринного средства для лечения рака молочной железы. Тамоксифен и торемифен ингибируют вызванное эстрогеном развитие при помощи конкурирующего антагонизма эстрогенорецепторов опухоли (ER).
Антиэстрогенная терапия является эффективной при продлении безболезненного состояния и общей продолжительности жизни женщин после первичного хирургического вмешательства. Антиэстрогенная терапия замедляет рецидив и продлевает продолжительность жизни у пациентов с первичным раком молочной железы, подвергающихся дополнительным лечебным мероприятиям после мастэктомии. Около двух третей пациентов с метастатическим раком молочной железы, положительным в отношении эстрогенорецепторов (ER), будут иметь временную ремиссию при использовании тамоксифена.
Хотя тамоксифен считают лекарством относительно слабого действия, недавние наблюдения наводят на мысль, что женщины, принимающие тамоксифен в качестве дополнительного лечебного мероприятия, могут иметь повышенный риск развития внутриматочных опухолей (Fornander Т. et al. Lancet 1989, 21:117-120).
Гистопатология определяет эти опухоли, как проникающие внутриматочные опухоли, не относящиеся к метастазу опухоли молочной железы. Факторы, способствующие этому, не поняты в достаточной степени. Однако ряд исследований связал внутриматочную злокачественную опухоль со средствами, обладающими эстрогенной активностью (Smith Dc. et al, N. England J. Med. 1975; 293; 1164-67).
Развитие многолекарственной устойчивости (MDR) представляет собой один из основных механизмов, посредством которого злокачественная опухоль становится резистентной к химотерапевтическим средствам, особенно к антрациклинам и винка алкалоидам. Классическую MDP связывают с повышенным проявлением гена MDR-1, осуществляющим кодирование Р-гликопротеина клеточных оболочек (р170). Полагают, что проявление гена MDR-1 связано с пониженным клеточным накоплением лекарства, вследствие обусловленного действующего механизма эманации.
Хотя известно, что многие средства, включая верапамил, трифторперизины и циклоспорины, изменяют многолекарственную устойчивость in vitro, большинство средств не достигают in vivo достаточно высоких для изменения концентраций без значительной токсичности для пациента. Это особенно справедливо для верапамила, который связывают со значительной кардиотоксичностью.
Нестероидные трифенилэтиленовые антиэстрогены продемонстрировали in vitro активность по индуцированию чувствительности к химиотерапии, по-видимому, не связанную с их антиэстрогенным действием. Торемифен и его метаболиты N-деметилторемифен и 4-гидрокситоремифен представляют собой примеры новых трифенилэтиленов, обладающих активностью по индуцированию чувствительности к химиотерапии в MDR-положительных клетках при концентрациях, которые достигаются у людей без существенной токсичности.
Торемифен, по-видимому, является уникальным в том, что концентрации, которые изменяют устойчивость in vitro (5 мкмоль), могут быть достигнуты in vivo после оральной терапии без существенной токсичности (Wiebe VJ. et al. Cancer Chemother. Pharmacol., 1990, 25:247-251).
Концентрации торемифена и N-деметилторемифена в плазме после больших оральных доз составляют порядка 10 мкмоль. Однако плазменные концентрации могут не отражать эффективной анти-MDR активности на опухолевом уровне. Хотя общее токсическое действие торемифена в высоких дозах (400 мг/день) обычно ограничивают головокружением, тошнотой и приступообразным ощущением жара, сочетание терапии с другими цитотоксическими средствами может изменить общую характеристику токсичности.
Поэтому способы повышения концентрации торемифена и его метаболитов в опухоли при минимизации общего воздействия могут улучшить эффективность анти-MDR терапии этими лекарствами.
Итак, было обнаружено, что локальное применение торемифена и его метаболитов можно использовать для достижения очень высоких локальных опухолевых концентраций без риска общей токсичности. Такие локальные препараты торемифена и его метаболитов полезны при обработке злокачественных опухолей, локализованных в коже или на малом расстоянии от кожи, например, меланомы, лимфомы, саркомы Копоши, грибовидного микоза и локальных метастатических образований рака молочной железы.
Кроме того, локальное применение может дать эффективный способ профилактики рецидива рака молочной железы у пациентов высокого риска при минимизации опасности внутриматочных опухолей и общей токсичности.
Чрезкожное применение торемифена и его метаболитов можно осуществить в основном двумя различными способами:
(i) посредством смешивания терапевтически активного соединения или его нетоксичной фармацевтически приемлемой соли с соответствующими фармацевтическими носителями и необязательно средствами-усилителями проникновения с получением мазей, эмульсий, примочек, растворов, кремов, гелей и т.п., причем предпочтительно количество указанного препарата наносят на определенную область кожи, или
(ii) посредством включения терапевтически активного вещества в пластыри или системы чрезкожной доставки, согласно известной технологии.
Примеры пригодных наполнителей включают наполнители, хорошо известные в области приготовления локальных препаратов, например, диметилсульфоксид, растительные и животные масла, нелетучие жирные спирты, кислоты, сложные эфиры, например, цетостеариловый спирт и цетиловый спирт; летучие спиртовые соединения, например, этанол или изопропанол; гликоли или эфиры гликолей, полиэтиленгликоль, полипропиленгликоль, глицерол или эфиры глицерола, производные целлюлозы, например, метилцеллюлоза, или карбоксиметилцеллюлоза.
Также могут быть включены эмульгирующие средства, например, стеарат сорбита или полисорбат 60, и консервирующие средства и средства-усилители проникновения, известные в области фармакологии.
Свойства растворения в водной среде торемифена и его метаболитов можно значительно улучшить посредством образования комплексов лекарственного вещества с циклодекстринами. Циклодекстрины (включая альфа, бета- и гамма-циклодекстрины и их производные) все представляют собой циклические олигомеры глюкозы. Циклодекстрины могут образовывать комплексы включения с лекарствами, в которых молекула лекарства включается в липофильные полости молекулы циклодекстрина. Поэтому циклодекстрины эффективно солюбилизируют липофильные лекарства в водную среду.
Использование циклодекстринов в фармацевтической области было описано, например, в Drug Development and Industrial Pharmacy, 17(11), 1503-1549, 1991.
Пределы дозы торемифена или его метаболитов для профилактики (дополнительных лечебных мероприятий у людей составляют порядка 1-200 мг/день) на человека в зависимости от биологической доступности лекарства. Предпочтительная доза могла бы быть близка к вспомогательной оральной дозе в 60 мг/день, или к одноразовой недельной дозе в 300-500 мг/пластырь. Для короткого курса с высокими дозами торемифена (или метаболита торемифена) предполагается доза в 400-1000 мг/день, предпочтительно 500-600 мг/день.
Эксперименты/
Следующие широкие исследования осуществлялись в соответствии с настоящим изобретением.
Эксперимент 1 описывает распределение торемифена и его метаболитов в тканях после короткого курса локального применения с высокими дозами по сравнению с внутрибрюшинным (IP) применением у мыши, а также распределение в тканях антиэстрогенных доз торемифена и его метаболитов после локального применения с одноразовой дозой по сравнению с внутрибрюшинным.
Эксперимент 2 описывает эффективность торемифена и его метаболитов после локального применения при профилактике роста опухоли рака молочной железы у мыши.
Эксперимент 3 описывает эффективность локально примененного в высоких дозах торемифена в усилении цитотоксичности доксорубицина в MDR опухолях у мыши.
Эксперимент 4 описывает эффективность торемифена и его метаболитов после локального применения при профилактике роста лимфомы у бабуина.
Эксперимент 5 описывает распределение торемифена в тканях после локального Применения у Monodelphis domestica и цитостатическое действие торемифена у клеточных линий меланомы.
Фиг. 1 показывает результаты исследований по клонированию, проведенных на опухолях, иссеченных из мыши, обработанной локальным и внутрибрюшинным торемифеном.
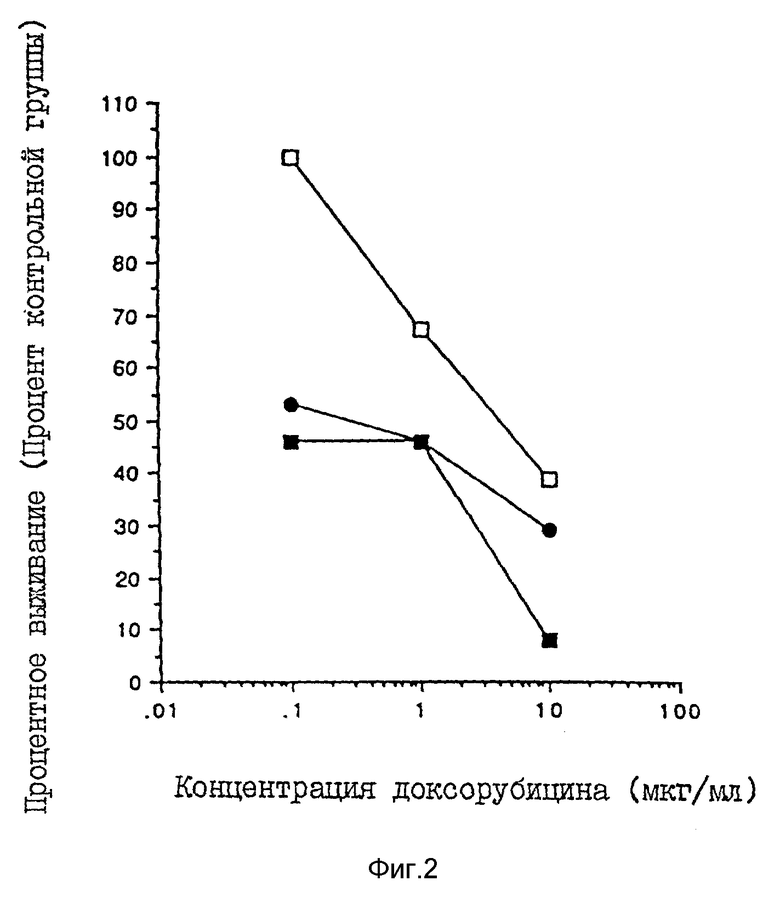
Фиг. 2 показывает результаты исследований по клонированию, проведенных на опухолях, иссеченных из мышей, обработанных и необработанных локальным торемифеном.
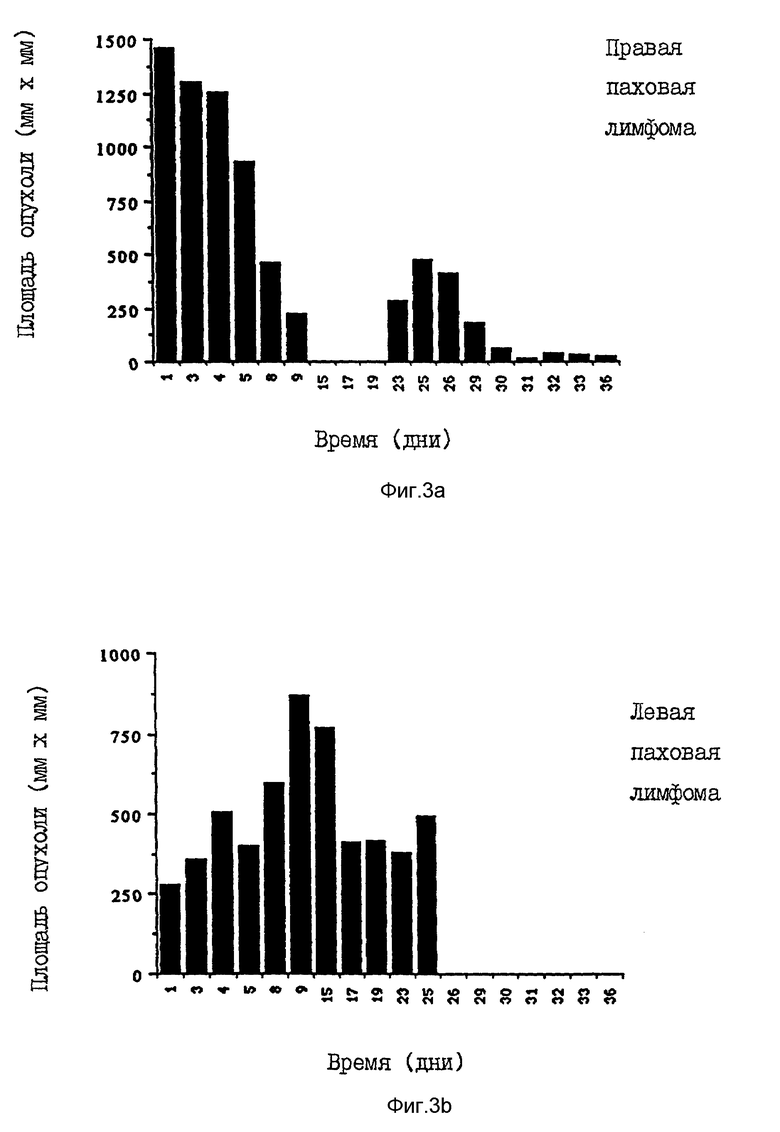
Фиг. 3a показывает реакцию, наблюдаемую в правой паховой лимфоме бабуина, обработанной локальным торемифеном.
Фиг. 3b показывает реакцию, наблюдаемую в необработанной левой паховой лимфоме бабуина.
Эксперимент 1.
Методика.
Шестнадцати самкам атимических лишенных шерсти мышей вводили подкожно иглой 20 калибра 5 • 106 MDA A-1 клеток в область левой лопатки. Опухолям до обработки давали расти в течение 3 недель.
Для IP применения цитрат торемифена суспендировали в арахисовом масле. Каждой из трех мышей в течение 5 дней вводили внутрибрюшинно, используя иглу 18 калибра, 50 мкл, подавая 1 мг/день. Локальный торемифен применяли в смеси диметилсудьфоксид/этанол/метилцеллюлоза/вода (10: 25: 7: 58) при дозе 2,5 мг/животное/день в течение 5 дней. Цитрат торемифена сначала растворяли в диметилсульфоксиде, а затем разбавляли в смеси этанола, метилцеллюлозы и воды.
Всех мышей умерщвляли на пятый день обработки через два часа после последней дозы. Образцы крови собирали капиллярной пипеткой после перерезания подмышечных сосудов и помещали в гепаринизированные трубки центрифуги. Мозг, печень и матку удаляли хирургически и помещали в отдельные трубки.
Одноразовую дозу торемифена применяли внутрибрюшинной в соответствии с вышеописанным, или локально с диметилсульфоксид/этанол/метилцеллюлоза/вода в качестве разбавителей. Доза внутрибрюшинного или локального торемифена составляла 500 мкг. Образцы тканей собирали как описывалось выше.
Все образцы крови центрифугировали при 1000 г. Плазму собирали, измеряли ее объем и помещали в чистые экстракционные трубки. Все остающиеся образцы тканей взвешивали, помещали в экстракционные трубки и помечали внутренним стандартом нафоксидином. Ткани тщательно гомогенизировали перед добавлением 6 мл экстракционной жидкости.
Образцы собирали и сушили в соответствии с нижеописанным. Перед впрыскиванием в колонку жидкостной хроматографии высокого разрешения каждый образец составляли повторно при помощи 200 мкл метанола. Все образцы помещали в кварцевую кювету для УФ активации. Образцы мозга требовали фильтрования посредством фильтров со шприц-тюбиками. Концентрации торемифена рассчитывали для всех образцов на основе стандартной кривой.
Количество торемифена и его метаболитов определяли при помощи жидкостной хроматографии высокого разрешения (HPLC).
Результаты.
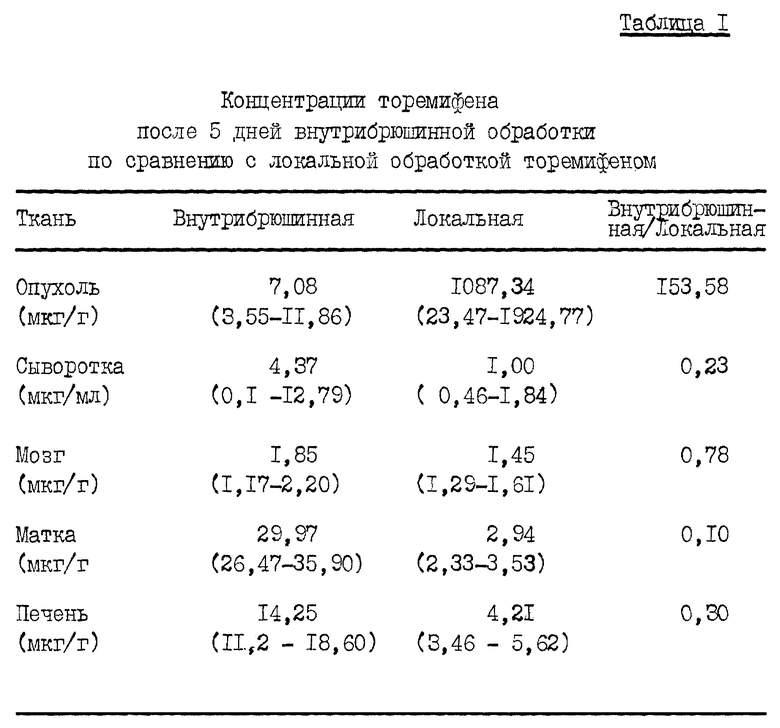
Таблица 1 показывает, что при дозе в 2,5 раза превышающей дозу внутрибрюшинного применения локально обработанные опухоли содержат в 150 раз более высокие концентрации торемифена при более низкой концентрации в сыворотке. Это указывает на явное фармакологическое преимущество. Интересно, что мыши, получающие локальный торемифен имели одну десятую концентрации торемифена в матке, по сравнению с мышами, получающими внутрибрюшинный торемифен. В печени локально обработанные мыши также демонстрировали более низкие концентрации торемифена, предполагая меньшее общее распределение. Концентрации торемифена в мозговых тканях были эквивалентны.
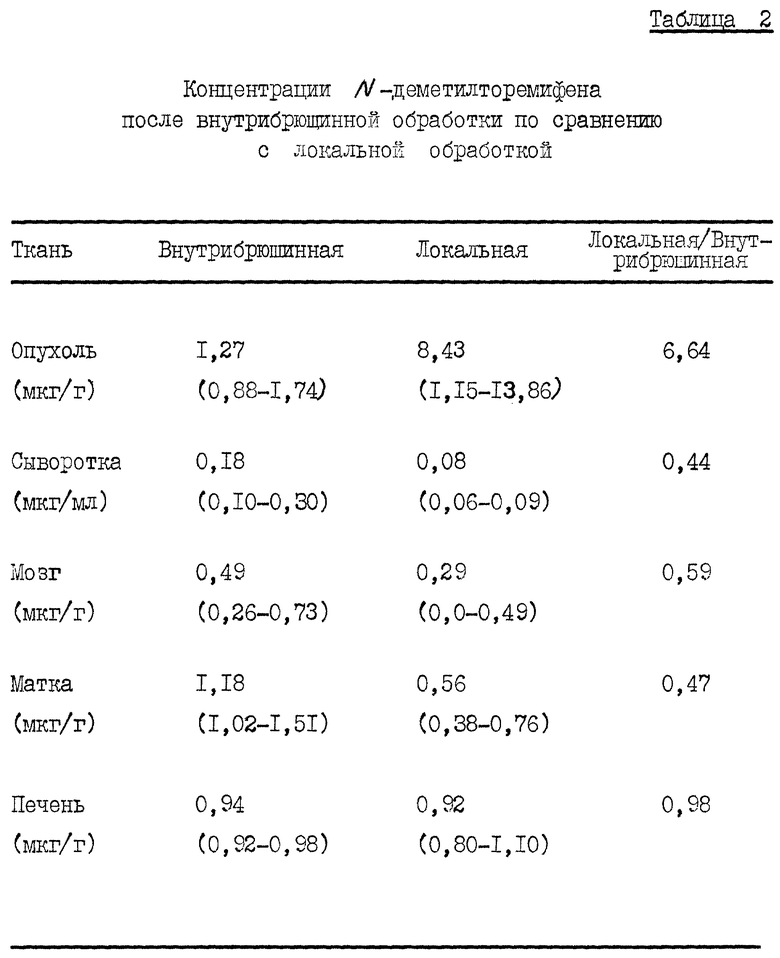
Таблица 2 показывает, что локально обработанные опухоли имели более высокую концентрацию N-деметилторемифена при более низкой концентрации в сыворотке. Это указывает, что MDA A-1 опухолевые клетки могут метаболизировать торемифен. По существу, не было разницы в концентрации в печени между мышами с внутрибрюшинно и локально обработанными опухолями. Мозг и матка локально обработанных мышей также демонстрировали меньшую концентрацию N-деметилторемифена, чем у внутрибрюшинно обработанной группы.
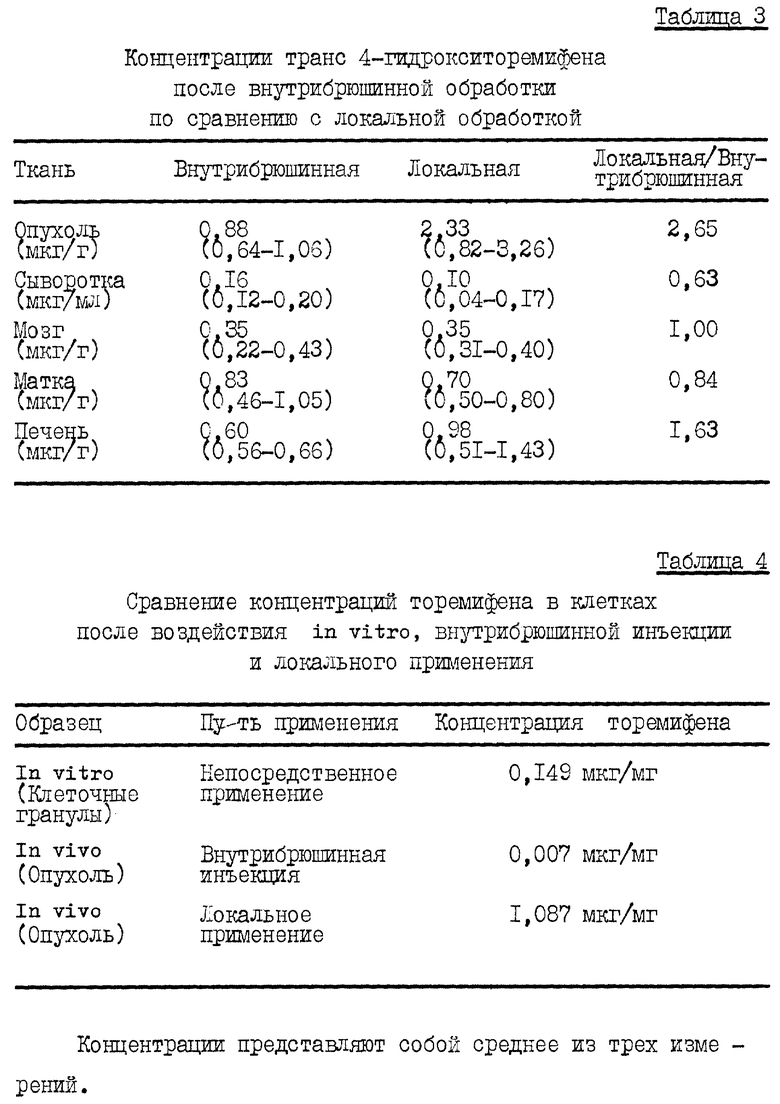
Таблица 3 показывает, что локально обработанные опухоли имели более высокие концентрации транс-4-гидрокситоремифена, чем опухоли, обработанные внутрибрюшинно. Этот метаболит представляет собой наиболее сильнодействующий антиэстрогенный метаболит. Сывороточные содержания в локально обработанных опухолях были ниже, тогда как в мозге концентрации были идентичны.
Было исследовано также поглощение торемифена в клетках MCF-7 ER+ in vitro при эффективной антиэстрогенной дозе лекарства и сравнили эти исследования с результатами вышеописанных исследований по распределению in vivo. После 20 часовой инкубации с 6,6 мкмоль торемифена, клетки промывали, считали, взвешивали и при помощи жидкостной хроматографии высокого разрешения измеряли клеточные концентрации торемифена. Концентрация торемифена (мкг/мг) представлена в Таблице 4.
При сравнении концентраций торемифена, достигнутых в опухолях после локального и внутрибрюшинного способов применения, наибольшие концентрации наблюдаются после локального применения торемифена. Локальное применение приводило к концентрации торемифена, более чем в 7 раз превышающей концентрацию торемифена, обнаруживаемую после экспозиции in vitro, и более чем в 150 раз превышающей концентрацию, обнаруживаемую после внутрибрюшинной инъекции.
Эти результаты наводят на мысль о том, что эти концентрации торемифена можно легко получить после локального применения к подкожным опухолям, тогда как внутрибрюшинное применение составляло 1/20 от данных поглощения in vitro, тем самым предполагая дополнительное кинетическое преимущество локальной терапии.
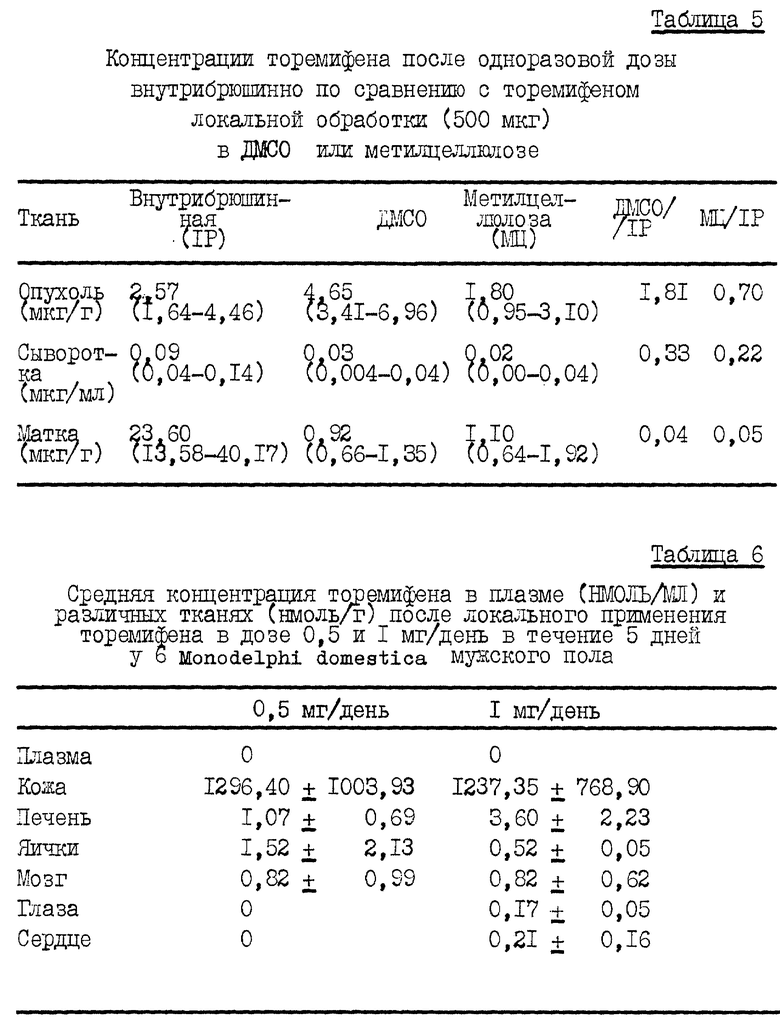
Таблица 5 показывает концентрации торемифена после одноразовой внутрибрюшинной дозы в 500 мкг по сравнению с 500 мкг, примененными локально. В качестве разбавителей использовали диметилсульфоксид и метилцеллюлозу. Оба локально примененных способа имели в сравнении с внутрибрюшинными одинаковые содержания торемифена в опухоли, но намного меньшее общее распределение. Это представляло собой тенденцию, наблюдаемую как для сыворотки, так и для матки.
Таким образом, экспериментом было доказано, что торемифен легко подвергается чрезкожному проникновению и достигает очень высоких опухолевых концентраций при ограничении общего воздействия. Интересно, что в то время как больше торемифена могло бы быть доставлено к опухолям локальным способом, концентрации в сыворотке были намного ниже, что указывает на значительное терапевтическое преимущество для локального поступления торемифена.
Кроме того, как активные N-деметил-, так и 4-гидроксиметаболиты торемифена присутствовали в ткани опухоли в более высоких концентрациях после локального поступления, чем после внутрибрюшинного, что наводит на мысль о том, что метаболизм в эти активные метаболиты может также происходить на уровне тканей, а не исключительно в печени.
Матка и печень содержали значительно более низкие концентрации торемифена после локального поступления, чем после внутрибрюшинного, предоставляя дополнительное доказательство уменьшенного общего воздействия в случае локальной терапии.
Уменьшенное воздействие на матку может представлять собой значительное клиническое преимущество, вследствие потенциального риска вторичных опухолей у антиэстрогенов. Известно о внутриматочной дисплазии, кровотечении, образовании полипов и опухолей после длительного вспомогательного лечения тамоксифеном (Nouvo MA et al, Int. J. Gyn. Pathol.1989; 8:125-131). Метаболиты самоксифена (бисфенол и метаболит Е), присутствующие в маточной ткани после тамоксифенной терапии, можно потенциально связывать с развитием вторичной маточной неоплазии (Nuovo MA et al. Int. J. Gyn. Pathol., 1989; 21; 117-120). Локальное применение торемифена может исключить возможность возникновения этих побочных явлений.
Эксперимент 2.
Методика.
В этом исследовании 12 мышам трансплантировали клетки MCF-7 и позволяли клеткам расти до тех пор, пока у всех мышей не обнаруживали небольшую опухоль (< 1 мм3). В этотмомент мышей делили на три группы из четырех мышей каждая.
Одна группа получала локально один разбавитель (ДМСО, 20 мкл), вторая группа получала посредством локального применения 500 мкг 4-гидрокситоремифена, а третья получала 500 мкг/день торемифена посредством локального применения. Все мыши получали одинаковое количество разбавителя в день 20 мкл). Исследование проводили после 15 дней обработки.
Результаты. 2
Все четыре контрольные мыши имели развитые опухоли (> 6 х 8 мм). В других группах только у одной мыши в 4-гидрокситоремифеновой группе развилась небольшая опухоль (< 2 x 1 мм). Этот эксперимент наглядно показывает, что локальное применение 4-гидрокситоремифена или торемифена предотвращало рост опухоли.
Т. о. , этот эксперимент наглядно показывает, что вспомогательные дозы локально примененного торемифена или его метаболитов могут предотвратить рост опухоли рака молочной железы в модели in vivo у мышей.
Этот результат в сочетании с кинетическим преимуществом локального применения (Эксперимент 1) наводит на мысль о том, что локальный торемифен может достичь желательного антиэстрогенного действия без общего распределения.
Эксперимент 3.
Методика
Цитрат торемифена локального применения растворяли в 1,0 мл диметилсульфоксида (ДМСО), получая раствор, доставляющий 2,5 мг торемифена/60 мкл.
Лекарство применяли по каплям непосредственно на поверхность кожи и вокруг опухоли. Каждой капле давали полностью испариться. Эту обработку применяли один раз в день в одинаковое время в течение всего пяти дней. Всех мышей умерщвляли на пятый день обработки через два часа после последней дозы. Опухоли собирали в стерильных условиях и обрабатывали для клоногенного анализа.
После применения торемифена опухоли иссекали, и часть каждой опухоли экстрагировали для анализа при помощи жидкостной хроматографии высокого разрешения. Остающуюся часть клонировали после 1-часового воздействия 1 мкг/мл доксорубицина. Процентное ингибирование определяли через 14 дней, и строили графическую зависимость от концентрации торемифена в каждой отдельной опухоли.
Результаты.
Фиг. 1 показывает результаты исследований по клонированию, проведенных на опухолях, иссеченных у мышей, обработанных локальным и внутрибрюшинным торемифеном.
Как показано на графике, наблюдалась хорошая корреляция между процентным ингибированием и концентрацией торемифена в клетках через 14 дней (r = 0,77). Кроме того, все три локально обработанные опухоли достигали > 30% ингибирования, тогда как все три внутрибрюшинно обработанные опухоли имели < 30% ингибирование.
Фиг. 2 показывает результаты исследований по клонированию, проведенных на опухолях, иссеченных у мышей, обработанных и необработанных локальным торемифеном. Верхняя кривая показывает опухоль, устойчивую к доксорубицину у мыши, необработанной торемифеном. Нижние две кривых показывают опухоли, которые обрабатывали торемифеном. Очевидно, что торемифен, по-видимому, повышает чувствительность этих MDR MDA A-1 опухолей к доксорубицину.
Т. о. эти результаты показывают, что, чем выше достижимые концентрации торемифена в опухоли, наблюдаемые в присутствии локального торемифена in vivo, тем выше будет синергическое действие при изменении приобретенной лекарственной устойчивости к доксорубицину.
Эксперимент 4
Методика.
Оценивали локальную торемифеновую терапию 15-летней самки бабуина с самозародившейся не-Ходжкиновой лимфомой. Увеличенные лимфатические узлы диаметром 1-2 см были очевидны в обеих паховых областях. Торемифен растворяли в смеси диметилсульфоксида, этанола и метилцеллюлозы.
За период в 8 дней всего 1,4 г торемифена применили в основном на правой области опухоли. Через 15 дней от начала локальной терапии начали оральную обработку с применением 1 г торемифена на 15, 17, 19 и 23 дни, при общей дозе в 4 г. На 25 день после начала обработки еще раз начали локальную терапию правой паховой области, продолжая оральную обработку.
За это время всего 1,4 г торемифена применили чрезкожно и 11 г орально. Реакцию на терапию определяли, измеряя размеры опухолей в двух перпендикулярных направлениях.
Результаты
Реакция на терапию приводится на фиг. 3a и 3b. Очевидную реакцию наблюдали в обработанной правой паховой лимфоме, тогда как необработанная левая лимфома увеличилась в размерах за время локальной обработки.
Во время оральной торемифеновой терапии левая паховая лимфома стабилизировалась, тогда как правая паховая лимфома снова начала расти. Поэтому на этой опухоли была снова начата локальная торемифеновая терапия. Аналогично начальной реакции на локальную терапию лимфома уменьшилась с площади опухоли в 476 мм2 до 24 мм2.
Лечение регионарной Т-клеточной лимфомы у самки бабуина показало, что локальный торемифен может давать противоопухолевую реакцию in vivo.
Эксперимент 5.
Методика.
Торемифен в виде цитрата торемифена сначала растворяли в ДМСО, после чего добавляли к 3%-ному раствору метилцеллюлозы в этаноле до конечной концентрации 1 мг/мл.
Шести Monodelphis domestica мужского пола В течение 5 дней давали торемифен локально. Доза составляла 0,5 мг/день у 3 и 1 мг/день - у 3-х животных. Торемифен применяли локально к выбритой коже на площади поверхностью 1 см2 нижней части спины. На 5 день животных умерщвляли, и измеряли концентрации торемифена и его метаболитов в плазме, коже, яичках, печени, глазах, мозге и сердце.
Три клеточные линии меланомы человека (TD 36, TD 30A и SK-MEL-31) и три экспериментальные клеточные линии (TD 1,4, TD 7,2 и TD 8), полученных из вызванного ультрафиолетовым облучением меланоцитического вируса у Monodelphis domestica выращивали in vitro, чтобы оценить цитостатические величины 10-50 для торемифена. Клеточную линию метастатической меланомы SC-MBL-31 получали из American Type Culture Collection (Rockville, MD).
Две дополнительных клеточных линии человека получали из частей хирургически иссеченных поверхностных меланом большого диаметра. TD 1,4 развивали из доброкачественной меланомы, тогда как TD 7,2 и TD 8 получали из меланоцитических гиперплазий. Величины IC-50 определяли из полулогарифмических графических зависимостей процентного содержания выживших клеток от концентрации цитрата торемифена.
Результаты.
Средние концентрации торемифена в плазме и ткани у 6 животных после локального применения 0,5 и 1 мг/день в течение 5 дней представлены в Таблице 6. Концентрация торемифена в коже была более, чем 500-кратной, по сравнению с другими тканями.
Концентрации 50% ингибирования роста (IC-50) человеческих и экспериментальных клеточных линий для торемифена представлены в Таблице 7. Действие торемифена по ингибированию роста было очень похоже во всех шести клеточных линиях меланоцитного источника. IC-50 имели пределы 5,8-9,6 мкмоль.
Т. о. , эксперимент показывает, что торемифен обладает явным цитостатическим действием на человеческие и экспериментальные меланомные клеточные линии in vitro. Хотя цитостатическое действие наблюдали во всех клеточных линиях, концентрации, необходимые для получения этого действия, были относительно высокими.
Однако локальное применение торемифена дает концентрации в коже, значительно превышающие эти in vitro концентрации, наводя на мысль о том, что явное цитостатическое действие можно было бы получить на кожной меланоме in vivo.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СЕНСИБИЛИЗАЦИИ РАКОВЫХ КЛЕТОК К ЛИЗИСУ, ОПОСРЕДОВАННОМУ КЛЕТКАМИ-КИЛЛЕРАМИ | 1994 |
|
RU2153332C2 |
| ПРИМЕНЕНИЕ АТИПАМЕЗОЛА ДЛЯ ЛЕЧЕНИЯ МУЖСКОЙ СЕКСУАЛЬНОЙ ИМПОТЕНЦИИ | 1992 |
|
RU2111749C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННОГО ИМИДАЗОЛА | 1992 |
|
RU2045519C1 |
| СПОСОБ ИНГИБИРОВАНИЯ АТРОФИИ ИЛИ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ СИМПТОМОВ, РОДСТВЕННЫХ АТРОФИИ, У ЖЕНЩИН | 2003 |
|
RU2317816C2 |
| ПРОИЗВОДНЫЕ АРАБИНОФУРАНОЗИЛ-ЦИТОЗИНА И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1996 |
|
RU2165260C2 |
| СПОСОБ ЛЕЧЕНИЯ АЛКОГОЛИЗМА | 1991 |
|
RU2090190C1 |
| СПОСОБ ЛЕЧЕНИЯ РАКА (ВАРИАНТЫ) | 2006 |
|
RU2447889C2 |
| СПОСОБ ЛЕЧЕНИЯ КЛИМАКТЕРИЧЕСКИХ РАССТРОЙСТВ У ЖЕНЩИН ВО ВРЕМЯ ИЛИ ПОСЛЕ МЕНОПАУЗЫ | 2001 |
|
RU2268035C2 |
| НОНАПЕПТИД С ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2503685C2 |
| Способ получения алкеновых производных или их солей | 1983 |
|
SU1508955A3 |

Изобретение относится к фармакологии. Препарат включает локальное использование в качестве активного компонента торемифен или один из его метаболитов N-деметилторемифен или 4-гидрокситоремифен или их фармацевтически приемлемые нетоксичные соли, для лечения злокачественных опухолей, локализованных в коже или на малом расстоянии от кожи, например, метастатических образований рака молочной железы. Его можно также использовать в дополнительных лечебных мероприятиях рака молочной железы и при изменении многолекарственной устойчивости раковых клеток к цитотоксическим лекарствам. Подобные локальные препараты представляют особый интерес при лечении меланомы и лимфомы. Способ позволяет уменьшить нежелательные побочные эффекты при лечении. 8 з.п.ф-лы, 3 ил., 7 табл.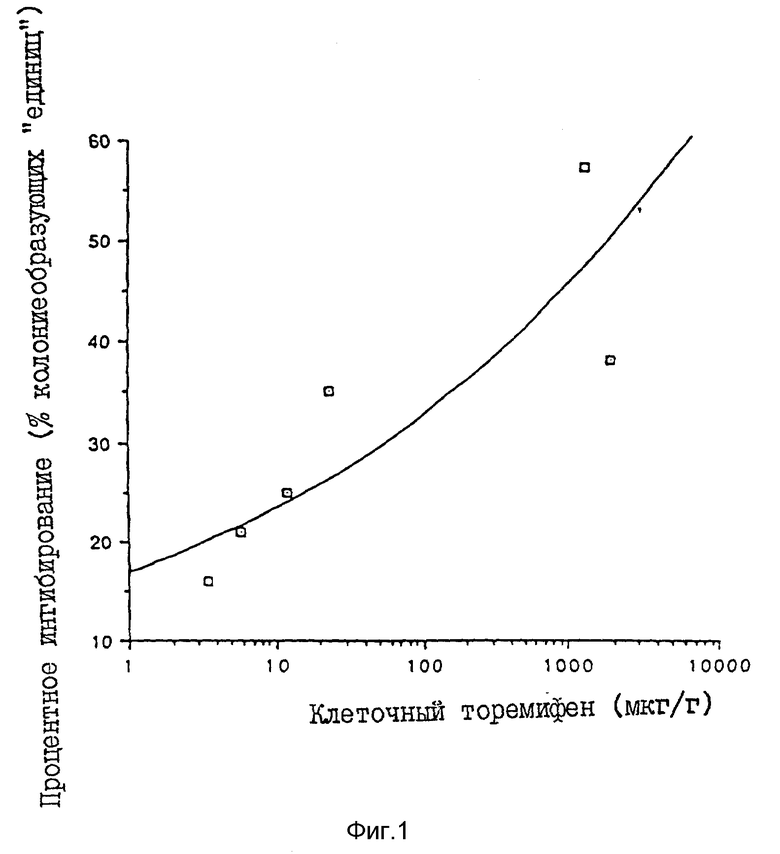
| US 4990536, 05.02.91 | |||
| US 4919937, 24.04.90 | |||
| DE 3046719, 02.12.32 | |||
| DE 3705894 А1, 27.08.87 | |||
| Вопросы онкологии, 1990, 36, № 10, с.1182. |
Авторы
Даты
1999-11-10—Публикация
1993-03-25—Подача