Раковые заболевания представляют серьезную угрозу для современного общества. Злокачественный раковый рост, за счет своих уникальных особенностей, представляет серьезную проблему для современной медицины. К указанным особенностям относятся неконтролируемая пролиферация клеток, которая приводит к нерегулируемому росту злокачественной ткани, способность к распространению в близлежащие и отдаленные ткани, низкая дифференцировка, отсутствие выраженных симптомов и, что наиболее важно, отсутствие эффективных способов профилактики и лечения.
Раковый процесс может развиваться в любой ткани организма и в любом возрасте. Этиология рака в настоящее время неясна, однако было показано, что некоторые механизмы и факторы, такие как генетическая предрасположенность, хромосомные нарушения, вирусы, факторы окружающей среды и иммунологические нарушения, могут влиять на злокачественный клеточный рост и трансформацию клеток. Под раком понимается большая категория заболеваний, от которых страдают миллионы людей по всему миру. Раковые клетки могут появиться практически в любой ткани и/или органе. Рак развивается, когда клетки в какой-либо части организма начинают бесконтрольно расти и/или дифференцироваться. Все типы рака начинаются с неконтролируемого роста аномальных клеток.
Выделяют множество типов раковых заболеваний, включая рак груди, легких, яичников, желчного пузыря, предстательной железы, поджелудочной железы, шейки матки и лейкоза. В настоящее время основными способами лечения раковых заболеваний является хирургическое вмешательство, лучевая терапия и химиотерапия. Хирургический способ лечения обычно является паллиативной мерой и имеет серьезные последствия. Например, все варианты лечения рака яичников могут привести к бесплодию. Некоторые способы лечения рака шейки матки или рака желчного пузыря могут приводить к бесплодию и/или сексуальной дисфункции. Хирургическое вмешательство по поводу рака поджелудочной железы обычно заключается в полном или частичном удалении поджелудочной железы и сопровождается большим риском для пациента. Хирургическое лечение рака груди обычно включает удаление части органа или всего органа целиком. Некоторые хирургические способы лечения рака предстательной железы сопровождаются риском развития недержания мочи и импотенции. Операции по поводу рака легких требуют удаления ребер, что необходимо во время хирургического доступа, кроме того, пациенты страдают от выраженного болевого синдрома в послеоперационном периоде. Кроме того, у пациентов с раком обоих легких или другими заболеваниями легких, такими как эмфизема или хронический бронхит, обычно усиливается одышка в послеоперационном периоде.
Лучевая терапия имеет преимущество, поскольку убивает раковые клетки, однако при этом повреждаются здоровые ткани организма. Химиотерапия включает введение различных противоопухолевых лекарственных средств, однако сопровождается тяжелыми побочными эффектами.
По всему миру каждый год регистрируется около 10 миллионов новых случаев раковых заболеваний, при этом установлено, что с каждым годом число пациентов будет расти и к 2020 году оно составит 15 миллионов человек. Каждый год от раковых заболеваний умирает шесть миллионов человек, показатель смертности составляет 12% по всему миру. Эти данные свидетельствуют о необходимости поиска новых способов лечения рака. Такие способы могут основываться на фармацевтических композициях, предназначенных для профилактики и лечения рака у людей и других млекопитающих.
В настоящее время известно множество противоопухолевых лекарственных средств. К указанным агентам относятся нитро- и нитрозосоединения и их метаболиты, которые, например, являются объектом патента США No.5464871 от 7 ноября 1995 "Ароматические нитро- и нитрозосоединения и их метаболиты как противовирусные и противоопухолевые агенты", патента США No. 5670518 от 23 сентября 1997, "Ароматические нитро- и нитрозосоединения и их метаболиты как противовирусные и противоопухолевые агенты", патента США No.6004978 от 21 декабря 1999, "Способы лечения рака при помощи ароматических нитро- и нитрозосоединений и их метаболитов".
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение в целом относится к способам лечения опухолевых заболеваний, которые включают использование ароматических соединений нитробензамида и их метаболитов. Более детально, настоящее изобретение относится к применению нитро соединения 4-йодо-3-нитробензамида или его соли, сольвата, изомера, таутомера, метаболита, аналога или пролекарства для подавления или ингибирования опухолевого роста у млекопитающих.
Согласно одному аспекту настоящего изобретения способ лечения рака или заболеваний, ассоциированных с раком, включает введение фармацевтических композиций, содержащих соединение, имеющее формулу (Ia), в комбинации с одним или более дополнительным фармакологически активным агентом. Согласно другому варианту осуществления настоящего изобретения способ лечения рака и заболеваний, ассоциированных с раком, включает введение комбинации соединения, имеющего формулу (Ia) и бутионин сульфоксимина (BSO, от англ. Bithionine Sulfoximine). Соединение, имеющее формулу (Ia), также может вводиться в комбинации с соединением бензопирона (формула II) вместе с BSO или без него.
Согласно некоторым предпочтительным вариантам осуществления настоящего изобретения к раковым заболеваниям относятся: рак яичников, рак эндометрия, рак шейки матки, рак поджелудочной железы, рак мочевого пузыря, рак глаза, рак центральной нервной системы, рак почки, рак щитовидной железы и рак легких. Согласно некоторым предпочтительным вариантам осуществления настоящего изобретения к раковым заболеваниям относятся: карцинома протоков молочной железы, инфильтрирующая карцинома молочной железы лобулярного типа, внутрипротоковая карцинома молочной железы, мукоидная карцинома молочной железы, промиелоцитарный лейкоз периферической крови, аденокарцинома яичников, аденокарцинома яичников с прорастанием в брюшную полость, аденокарцинома простаты, переходноклеточная карцинома мочевого пузыря, эпителиоидная карцинома панкреатических протоков, аденокарцинома панкреатического протока, аденокарцинома эпителия шейки матки и рак легких. Согласно некоторым предпочтительным вариантам осуществления настоящего изобретения к раковым заболеваниям относятся: инфильтрирующая карцинома молочной железы лобулярного типа, внутрипротоковая карцинома молочной железы и мукоидная карцинома молочной железы. Согласно некоторым предпочтительным вариантам осуществления настоящего изобретения к раковым заболеваниям относятся: рак толстой кишки, рак предстательной железы, рак печени, лейкоз, глиома и меланома.
Согласно некоторым предпочтительным вариантам осуществления изложенных выше аспектов настоящего изобретения, лечение дополнительно включает хирургическое вмешательство, лучевую терапию, химиотерапию, генную терапию, иммунотерапию или комбинацию указанных способов. Согласно некоторым предпочтительным вариантам осуществления настоящего изобретения соединение вводится внутривенно. Согласно некоторым предпочтительным вариантам осуществления настоящего изобретения заявленное соединение ингибирует поли-АДФ-рибозополимеразу (PARP, от англ. Poly-ADP-Ribose Polymerase). Согласно некоторым предпочтительным вариантам осуществления настоящего изобретения после введения заявленного соединения происходит апоптоз опухолевых клеток, прерывание клеточного цикла и/или некроз опухолевой ткани.
Настоящее изобретение относится к указанным композициям и фармацевтическим композициям, а также к способам их использования для лечения рака. Например, композиция, заявленная в соответствии с настоящим изобретением, может включать комбинацию одного или более нового соединения, и/или комбинацию двух или более форм нового соединения. Фармацевтическая композиция, заявленная в соответствии с настоящим изобретением, может представлять собой композицию, подходящую для введения в организм субъекта.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На Рис.1 представлен эффект соединения нитробензамида на клеточную линию рака молочной железы ВТ474 при введении отдельно и в комбинации с бутионин сульфоксимом (BSO).
На Рис.2 представлен эффект соединений нитробензамида и бензопирона на клеточные линии рака яичников Ovcar3 и Skov3 при введении отдельно и в комбинации с BSO.
На Рис.3А и 3В представлен эффект соединений нитробензамида и бензопирона на клеточную линию рака легких при введении отдельно и в комбинации с BSO.
На Рис.4 представлен эффект соединений нитробензамида и бензопирона на клеточную линию рака легких при введении отдельно и в комбинации с BSO.
На Рис.5 представлен эффект соединения нитробензамида на клеточную линию рака мочевого пузыря TCCSUP.
На Рис.6 представлен эффект соединений нитробензамида и бензопирона на клеточную линию рака предстательной железы при введении отдельно и в комбинации с BSO.
На Рис.7 представлен эффект соединений нитробензамида и бензопирона на клеточную линию рака предстательной железы при введении отдельно и в комбинации с BSO.
На Рис.8 представлен эффект соединений нитробензамида и бензопирона на клеточную линию рака поджелудочной железы при введении отдельно и в комбинации с BSO.
На Рис.9 представлен эффект соединений нитробензамида и бензопирона на клеточную линию рака поджелудочной железы при введении отдельно и в комбинации с BSO.
На Рис.10 представлен эффект соединений нитробензамида и бензопирона на клеточную линию рака поджелудочной железы при введении отдельно и в комбинации с BSO.
На Рис.11 представлен эффект соединений нитробензамида и бензопирона на клеточную линию рака шейки матки при введении отдельно и в комбинации с BSO.
На Рис.12 представлен эффект соединений нитробензамида и бензопирона на in vivo модель подкожного рака груди при введении отдельно и в комбинации с BSO.
На Рис.13 представлен эффект 4-йодо-3-нитробензамида на модель OVCAR3 (ксенотрансплантат аденокарциномы яичника человека) у голых мышей.
На Рис.14 представлено влияние 4-йодо-3-нитробезнамида на массу тела голых мышей, являющихся моделью OVCAR3 (ксенотрансплантат аденокарциномы яичника человека).
На Рис.15 показан эффект 6-амино-5-йодо-2Н-1-бензопирана-2-он (BP) и 4-йодо-нитробензамида (ВА) на рак молочной железы у голых мышей (ксенотрансплантат MDA MB 231).
На Рис.16 показан эффект 6-амино-5-йодо-2Н-1-бензопиран-2-она (BP) на рак молочной железы у голых мышей (ксенотрансплантат MDA MB 231).
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Под "соединениями нитробензамида" понимаются соединения, имеющие формулу (Ia)

где R1, R2, R3, R4 и R5, независимо друг от друга, выбраны из группы, включающей: водород, гидрокси-, амино-, нитро-, йодо- (С1-С6)алкил, (С1-С6)алкокси, (С3-С7)циклоалкил, и фенил, при этом, по крайней мере два радикала из пяти R1, R2, R3, R4 и R5 заместителей всегда представляют собой водород, по крайней мере один из пяти заместителей представляет собой нитрогруппу, по крайней мере, один из заместителей, смежный с нитрогруппой, представляет собой йод;
а также их фармацевтически доступные соли, сольваты, изомеры, таутомеры. метаболиты, аналоги или пролекарства. R1, R2, R3, R4 и R5 также могут представлять собой галоген, такой как хлор, фтор или бром.
Термин "хирургическое вмешательство" обозначает любую лечебную или диагностическую процедуру, которая подразумевает воздействие рук или инструментов на тело человека или другого млекопитающего с получением лечебного, восстановительного или диагностического эффекта.
Термин "лучевая терапия" обозначает воздействие на пациента высокоэнергетического облучения, включая, без ограничений указанными, рентгеновское облучение, гамма-лучи и нейтроны. К данному типу терапии относятся, без ограничения указанными, дистанционная лучевая терапия, внутренняя лучевая терапия, имплантационное облучение, близкофокусная лучевая терапия (брахитерапия), системная лучевая терапия и радиотерапия.
Термин "химиотерапия" обозначает введение одного или более противоопухолевого средства, такого как антинеопластические химиотерапевтические агенты, химиопрофилактические агенты и/или другие агенты, направленные против раковых клеток, пациенту различными способами, включая внутривенное, пероральное, внутримышечное, интраперитонеальное, внутрисосудистое, подкожное, чрескожное, буккальное или ингаляционное введение, либо введение препаратов в форме суппозиториев. Химиотерапия может проводиться перед хирургическим лечением для уменьшения объема опухоли, после хирургического вмешательства или лучевой терапии для предотвращения роста оставшихся в организме раковых клеток.
Термины "эффективное количество" или "фармацевтически эффективное количество" обозначают нетоксичное количество агента, которого при этом достаточно для обеспечения желаемого биологического, терапевтического и/или профилактического результата. Результат может заключаться в уменьшении или подавлении проявлений, симптомов или случаев заболевания, или в любом другом желаемом изменении со стороны биологической системы. Например, "эффективным количеством" в случае лечебных целей является такое количество соединения нитробензамида, которое необходимо для появления клинически значимого регресса заболевания. Подходящее эффективное количество в каждом конкретном случае подбирается специалистом при помощи стандартных и хорошо разработанных методик.
Под "фармацевтически доступным" или "фармакологически доступным" материалом понимается такой материал, который не является биологически нежелательным, то есть материал, который может вводиться в организм пациента без каких-либо неблагоприятных побочных эффектов, а также который, при взаимодействии с другими компонентами композиции, не вызывает неблагоприятных изменений.
Термин "лечение" и его грамматические эквиваленты подразумевает достижение благоприятного терапевтического или профилактического эффекта. Под благоприятным терапевтическим эффектом подразумевается исчезновение или подавление заболевания, которое подлежит лечению. Например, в случае пациентов, страдающих от раковых заболеваний, благоприятный терапевтический эффект подразумевает исчезновение или подавление роста имеющейся раковой опухоли. Также благоприятный терапевтический эффект достигается в том случае, когда происходит исчезновение или подавление одного или более симптома имеющегося заболевания, например, наблюдаемое улучшение состояния пациента, при том, что факт наличия заболевания у пациента не вызывает сомнений. Для достижения профилактического эффекта способ, заявленный в соответствии с настоящим изобретением (введение заявленной композиции), может применяться у пациентов, у которых имеется риск развития раковых заболеваний, один или более физиологический симптом данного заболевания, даже если сам диагноз ракового заболевания еще не установлен.
Соединения нитробензамида
Соединения, полезные для использования в соответствии с настоящим изобретением, имеют Формулу (Ia):

где R1, R2, R3, R4 и R5, независимо друг от друга, выбраны из группы, включающей: водород, гидрокси-, амино-, нитро-, йодо- (С1-С6)алкил, (С1-С6)алкокси, (С3-С7)циклоалкил, и фенил, при этом, по крайней мере два радикала из пяти R1, R2, R3, R4 и R5 заместителей всегда представляют собой водород, по крайней мере, один из пяти заместителей представляет собой нитрогруппу, по крайней мере, один из заместителей, смежный с нитрогруппой, представляет собой йод;
а также их фармацевтически доступные соли, сольваты, изомеры, таутомеры, метаболиты, аналоги или пролекарства. R1, R2, R3, R4 и R5 также могут представлять собой галоген, такой как хлор, фтор или бром.
Предпочтительным соединением, имеющим формулу 1а является:

4-йодо-3-нитробензамид (ВА)
Настоящее изобретение подразумевает использование указанных выше соединений нитробензамида для лечения рака груди, включая протоковую карциному молочной железы, другие формы лейкоза, включая острый промиелоцитарный лейкоз периферической крови, рак яичников, рак легких, рак мочевого пузыря, рак предстательной железы и рак шейки матки, а также другие типы рака, описанные здесь. Настоящее изобретение также относится к применению указанных соединений нитробензамида для лечения пациентов, устойчивых к Гливаку (иманитиб мезилат). Гливак представляет собой ингибитор тирозинкиназы.
Согласно некоторым предпочтительным вариантам осуществления настоящего изобретения соединения нитробензамида, заявленные в соответствии с настоящим изобретением, используются для лечения рака груди, в частности рака протоков молочной железы, инфильтрирующей карциномы лобулярного типа, внутрипротоковой карциномы груди и мукоидной карциномы груди. Согласно некоторым предпочтительным вариантам осуществления настоящего изобретения заявленные соединения нитробензамида используются для лечения рака яичников и эндометрия. Согласно некоторым предпочтительным вариантам осуществления настоящего изобретения заявленные соединения нитробензамида используются для лечения рака легких и толстого кишечника.
Согласно некоторым предпочтительным вариантам осуществления настоящего изобретения заявленные соединения нитробензамида используются для лечения рака желчного пузыря и рака предстательной железы. Согласно некоторым предпочтительным вариантам осуществления настоящего изобретения заявленные соединения нитробензамида используются для лечения рака печени и поджелудочной железы. Согласно некоторым предпочтительным вариантам осуществления настоящего изобретения заявленные соединения нитробензамида используются для лечения лейкоза, рака шейки матки, глиомы и меланомы.
Согласно некоторым предпочтительным вариантам осуществления настоящего изобретения заявленные соединения нитробензамида используются для лечения рака, происходящего из стволовых клеток. В случае рака груди и других злокачественных новообразований, часть опухолевых клеток - 'раковые стволовые клетки' - обладают большим потенциалом для избыточной пролиферации и метастазирования. Повреждение линии стволовых клеток и нарушение их роста может играть важную роль в туморогенезе. Эпителиальные стволовые клетки обладают продолжительностью жизни такой же, как и целый организм, и поэтому считается, что они наиболее подвержены множественным генетическим мутациям, которые, в случае накопления, могут приводить к формированию опухоли. Многие типы раков, включая рак кожи и кишечника, берут свое начало из тканей, которые постоянно обновляются в течение жизни. Однако считается, что мутации, которые приводят к развитию заболевания, происходят в период формирования тканей, когда клетки делятся экспоненциально.
Популяция стволовых клеток, которую в настоящее время можно идентифицировать практически в любой ткани, может быть определена как подкласс исключительных клеток, которые обладают эксклюзивной способностью к самообновлению и персистенции в течение всей жизни организма, в отличие от дифференцированных клеток, формирующих ткани и обладающих постмитотическими особенностями поведения и более короткой продолжительностью жизни. Тот факт, что для превращения здоровой клетки в канцерогенную требуется несколько мутаций, позволяет предположить, что во многих тканях мутации могут накапливаться в стволовых клетках. Раковые стволовые клетки самообновляются, из этого следует, что они могут быть получены как из самообновляющихся нормальных стволовых клеток, так и из более дифференцированных клеток, которые приобретают уникальные свойства стволовых клеток. Таким образом, опухоль может быть определена как ткань, содержащая как "дифференцированные" клетки, так и подкласс "злокачественных стволовых клеток", которые поддерживают опухолевую массу, и, по-видимому, ответственны за формирование вторичных опухолей (метастазов). Следовательно, соединения нитробензамида, заявленные в соответствии с настоящим изобретением, могут использоваться для лечения раковых опухолей, происходящих из стволовых клеток.
В настоящем изобретении раскрывается неклиническая фармакология 4-йодо-3-нитробензамида (ВА) в отношении опухолей и нормальных первичных клеток у человека, а также у мышей, крыс и собак. In vitro ВА ингибирует пролиферацию различных опухолевых клеток у человека, включая опухоли груди, толстого кишечника, предстательной железы, шейки матки, легких, яичников, меланому, лимфому и лейкоза. In vivo эффекты ВА оценивают на нескольких животных моделях канцерогенеза. При введении один раз в день или дважды в неделю ВА ингибирует опухолевый рост ксенотрансплантата аденокарциномы яичников человека у модельных мышей, "голых" и линии SCID, а также позитивно влияет на выживаемость животных, получавших лекарство один раз в день или дважды в неделю.
Режим введения ВА, заключающийся во введении препарата дважды в неделю в течение 3-х недель с последующим периодом вымывания в течение недели, основан на результатах доклинических испытаний эффективности и безопасности ВА.
Сообщается, что соединения нитробензамида обладают селективной цитотоксичностью по отношению к злокачественным раковым клеткам, но не по отношению к незлокачественным клеткам. См. Rice et al., Proc Natl. Acad. Sci.USA 89:7703-7707 (1992). Согласно одному варианту осуществления настоящего изобретения соединения нитробензамида, используемые в соответствии со способами, заявленными в настоящем изобретении, могут демонстрировать более селективную цитотоксичность по отношению к опухолевым клеткам, чем к неопухолевым клеткам.
Было показано, что эффективность нитробензамида и его соединений по отношению к опухолевым клеткам усиливается при одновременном введении в раковые клетки BSO. См. Mendeleyev et al., Biochemicfl Pharmacol. 50(5):705-714(1995). Бутионина сульфоксимин (BSO) ингибирует гамма-глутамилцистеинсинтетазу, ключевой фермент в биосинтезе глутатиона, который, частично, отвечает за устойчивость клеток к химиотерапии. См. Chen et al., Chem Bid. Interact. Apr. 24,111-112:263-75 (1998). Настоящее изобретение также относится к способу лечения рака, который заключается во введении нитробензамида и/или соединения бензопирона в комбинации с BSO.
Помимо BSO, могут использоваться другие ингибиторы гамма-глутамилцистеинсинтетазы в комбинации с нитробензамидом и/или соединениями бензопирона. К другим подходящим аналогам BSO относятся, без ограничений указанными, пропротионина сульфоксимин, метионина сульфоксимина, этионина сульфоксимин, метилбутионина сульфоксимин, γ-глутамил-α-аминобитурат и γ-глутамилцистеин.
Соединениями бензопирона (кумарина)
Согласно некоторым вариантам осуществления настоящего изобретения соединения вводятся в комбинации с соединениями бензопирона, имеющими формулу II. Соединениями бензопирона, имеющими формулу II, являются:
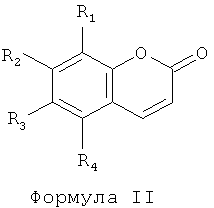
где R1, R2, R3 и R4 ,независимо друг от друга, выбраны из группы, включающей Н, галоген, факультативно замещенный гидрокси, факультативно замещенный амин, факультативно замещенный низший алкил, факультативно замещенный фенил, факультативно замещенный С4-С10 гетероарил или факультативно замещенный С3-C8 циклоалкил или же соли, сольваты, изомеры, таутомеры, метаболиты или пролекарства указанных соединений (патент США No 5484951 включен в настоящее описание в качестве ссылки).
Согласно предпочтительному варианту своего осуществления изобретение относится к следующему соединению бензопирона, имеющему формулу II

Механизм действия соединений нитробензамида
Считается, что соединения, описанные здесь, оказывают противоопухолевое действие путем модуляции активности фермента поли(АДФ-рибозо)полимеразы, хотя предполагается, что их активность не ограничивается одним механизмом действия. Механизм действия лекарственных средств основан на их способности функционировать в качестве лигандов для ядерного фермента поли(АДФ-рибозо)полимеразы (PARP-1).См. Mendeleyev et al., supra, (1995). PARP-1 экспрессируется в ядре и катализирует превращение β-никотинамидадениндинуклеотида (НАД+) в никотинамид и поли-АДФ-рибозу (PAR). Роль PARP-1 в поддержании гомеостаза, по-видимому, ограничивается транскрипцией и репарацией ДНК. Однако, когда клетка подвергается стрессовым воздействиям и происходит повреждение ДНК, активность PARP-1 значительно повышается, что, по-видимому, необходимо для целостности генома. Shall et al., Mutat Rts. Jun 30;460(1): 1-15(2000).
Одна из функций PARP-1 заключается в синтезе биополимера, поли-(АДФ-рибозы). Как поли(АДФ-рибоза) так и PARP-1 связаны с репарацией ДНК, апоптозом клеток, поддержанием стабильности генома и канцерогенезом. См. Masutani et al., Genes, Chromosomes, and Cancer 38:339-348 (2003). PAPR-1 играет роль в репарации ДНК. конкретно в процессе эксцизионной репарации оснований (BER. от англ. Base Excision Repair). BER представляет собой механизм защиты клеток млекопитающих от повреждений ДНК, связанных с одним основанием. PARP-1 связывается с концевыми участками фрагментов ДНК посредством доменов "цинковых пальцев" с высокой аффинностью и функционирует как сенсор повреждений ДНК. Gradwoht et al. Proc. Natl. Acad. Sci. USA 87:2990-2994 (1990); Muricia et al., Trends Biochem Sci 19: 172-176 (1994). Повреждение ДНК запускает процесс прикрепления PARP-1 к месту повреждения. PARP-1 затем увеличивает свою каталитическую активность в сотни раз (См. Simonin et al. J. Biol. Chem. 278: 13454-13461 (1993)) и начинает процесс поли-АДФ-рибозилирования (Desmarais et al. Biochim. Biophys. Acta 1078: 179-186 (1991)) и превращения BER-белков, таких как ДНК-ПК (DNA-PKcs) и молекулярный каркасный белок XRCC-1. См. Ruscetti et al., 7. Biol. Chem. Jun 5; 273 (23): 14461-14467 (1998) и Masson et al., Mol.Cell Biol. Jun; 18 (6):3563-71 (1998). BER-белки быстро поступают к месту повреждения ДНК. El-Kaminsy et al., Nucleic Acid Res 31 (19):5526-5533(2003); Okano et al., Mol. Cell Biol. 23 (11):3974-3981 (2003). PARP-1 диссоциирует из места повреждения ДНК, но остается в непосредственной близости ДНК на случай, если вновь произойдет ее повреждение.
Ингибирование активности PARP молекулы включает подавление активности этой молекулы. Термин "ингибирование" и его грамматические аналоги, например "ингибиторный", не подразумевают полного подавления активности PARP. Такое подавление активности, предпочтительно, происходит на 50%, более предпочтительно, на 75%, еще более предпочтительно, на 90%, еще более предпочтительно, на 95% активности молекулы в отсутствие ингибирующего эффекта, например в отсутствие ингибитора, такого как соединения нитробензамида, заявленного в соответствии с настоящим изобретением. Более предпочтительно, термин относится к наблюдаемому или измеряемому подавлению активности. В случае лечения, предпочтительно, ингибирования активности достаточно для достижения терапевтического и/или профилактического результата в отношении заболевания или состояния, подлежащего лечению. Фраза "не ингибирует" и его грамматические варианты не подразумевает полного отсутствия эффекта на активность. Например, он обозначает ситуации, когда активность PARP подавляется менее чем на 20%, менее чем на 10% и, предпочтительно, менее чем на 5% в присутствии ингибитора, такого как соединение нитробензамида, заявленное в соответствии с настоящим изобретением.
ИСПОЛЬЗОВАНИЕ СОЕДИНЕНИЙ БЕНЗАМИДА
Типы раковых опухолей
Настоящее изобретение относится к способу лечения различных специфических раковых заболеваний и злокачественных опухолей. Например, к раковым заболеваниям относятся рак надпочечников, рак анального канала, апластическая анемия, рак желчных протоков, рак мочевого пузыря, рак костей, метастазы костей, опухоли ЦНС у взрослых, опухоли НЦН у детей, болезнь Кастельмана, рак шейки матки, неходжкинские лимфомы у детей, рак толстой и прямой кишки, рак эндометрия, рак пищевода, семейство опухолей Юинга, рак глаза, рак желчного пузыря, карциноидные опухоли желудочно-кишечного тракта, стромальные опухоли желудочно-кишечного тракта, трофобластическая болезнь беременных, болезнь Ходжкина, саркома Калоши, рак почки, рак гортани и глотки, острый лимфоцитарный лейкоз, острый миелоидный лейкоз, лейкозы у детей, хронический лимфоцитарный лейкоз, хронический миелоидный лейкоз, рак печени, рак легких, карциноидные опухоли легких, неходжкинские лимфомы, рак груди у мужчин, злокачественная мезотелиома, множественная миелома, миелодиспластический синдром, рак носовых и околоносовых пазух, назофарингеальный рак, нейробластома, рак ротовой полости и ротоглотки, остеосаркома, рак яичников, рак поджелудочной железы, рак полового члена, опухоли гипофиза, рак предстательной железы, ретинобластома, рабдомиосаркома, рак слюнных желез, саркома (опухоль мягких тканей у взрослых), меланома кожи, немеланомные раки кожи, рак желудка, рак яичек, рак тимуса, рак щитовидной железы, саркома матки, рак влагалища, рак вульвы и макроглобулинемия Вальденстрема.
Карцинома щитовидной железы является самой частой злокачественной патологией эндокринной системы. Карцинома щитовидной железы включает дифференцированные опухоли (папиллярные или фолликулярные) и низкодифференцированные опухоли (медуллярные или анапластические). Карцинома влагалища включает плоскоклеточную карциному, аденокарциному, меланому и саркому. Рак яичек классифицируется на семиному и опухоли несеминомного типа.
Тимомы представляют собой эпителиальные опухоли тимуса, которые могут быть полностью инфильтрированы нонеопластическими лимфоцитами. Термин "тимома" обычно используется для описания неоплазм, у которых не наблюдается полной атипии эпителиального компонента. Эпителиальная опухоль тимуса, для которой характерна явная цитологическая атипия и гистологическая картина, неспецифичная для тимуса, обозначается термином карцинома тимуса (также известная под названием тимома С типа).
Способ, заявленный в соответствии с настоящим изобретением, может включать введение соединений нитробензамида в комбинации с другими способами лечения. Выбор терапии, которая будет осуществляться одновременно с введением композиций. заявленных в соответствии с настоящим изобретением, будет зависеть, частично, от самого заболевания, на которое терапия направлена. Например, лечение острого миелоидного лейкоза, может включать введение соединений бензамида, заявленных в соответствии с настоящим изобретением, и лучевую терапию, терапию моноклональными антителами, химиотерапию, трансплантацию костного мозга, генную терапию, иммунотерапию, или их комбинации.
Рак груди
Согласно одному аспекту настоящее изобретение относится к способу лечения рака груди, предпочтительно, дуктальной карциномы протоков молочной железы.
Существует несколько типов рака груди, которые можно лечить при помощи способов, заявленных в соответствии с настоящим изобретением. Лобулярная карцинома in situ и протоковая карцинома in situ представляют собой опухоли, развивающиеся в дольках и протоках молочной железы, соответственно, при этом они не захватывают жировую ткань, окружающую грудную железу, и другие участки тела. Инфильтрирующая (или инвазивная) лобулярная и протоковая карцинома представляют собой опухоли, развивающиеся в дольках и протоках молочной железы, соответственно, при этом они распространяются как на жировую ткань грудных желез, так и в другие области тела. К другим типам опухолей, которые можно с успехом лечить при помощи способа, заявленного в соответствии с настоящим изобретением, относятся медуллярные карциномы, коллоидные карциномы, тубулярные карциномы и воспалительный рак молочной железы.
Возможные способы лечения пациентов, страдающих раком груди, включают хирургическое лечение, иммунотерапию, лучевую терапию, химиотерапию, гормональную терапию, или комбинацию указанных способов. Возможными операциями, выполнимыми у таких пациентов, являются лампэктомия и мастэктомия.
Химиотерапия включает использование противоопухолевых агентов, которые препятствуют размножению, инвазии и метастазированию раковых клеток и гибели пациента. Для лечения рака груди существует несколько химиотерапевтических препаратов, включая цитотоксические агенты, такие как доксорубицин, циклофосфамид, метотрексат, паклитаксел, тиотепа, митоксантрон, винкристин или их комбинации. Гормональная терапия может быть достаточно эффективной в том случае, когда оставшаяся ткань молочной железы сохраняет восприимчивость к гормонам. К агентам, которые используются для гормональной терапии, относятся тамоксифен, мегестрола ацетат, аминоглютетимид, флуоксиместерон, леупролид, гозерелин и преднизолон.
Способы, заявленные в соответствии с настоящим изобретением, могут оказывать благоприятный эффект у пациентов с раком молочной железы и включают введение соединения нитробензамида или комбинированную терапию: введение соединения нитробензамида и хирургическое лечение, лучевую терапию, химиотерапию или гормональную терапию.
Рак яичников
Согласно другому аспекту настоящее изобретение относится к способу лечения рака яичников, включая эпителиальные опухоли яичников. Предпочтительно, настоящее изобретение относится к способу лечения рака яичника, к которому относятся: аденокарцинома яичника и аденокарцинома с прорастанием в брюшную полость.
Хирургическое лечение, иммунотерапия, химиотерапия, гормональная терапия, лучевая терапия могут также применяться для лечения рака яичников как самостоятельно, так и в комбинации. К возможным хирургическим операциям относятся операции по уменьшению объема опухоли, а также унилатеральная или билатеральная овариоэктомия и/или унилатеральная или билатеральная сальпингоэктомия.
К противоопухолевым агентам, которые могут использоваться для лечения рака яичников относятся циклофосфамид, этопозид, альтретамин и ифосфамид. Гормональная терапия препаратом тамоксифен может использоваться для уменьшения объема опухолей яичников. Лучевая терапия может включать наружную лучевую терапию и/или брахитерапию.
Способы, заявленные в соответствии с настоящим изобретением, могут оказывать благоприятный эффект у пациентов с раком яичников и включают введение соединения нитробензамида или комбинированную терапию: введение соединения нитробензамида и хирургическое лечение, лучевую терапию, химиотерапию или гормональную терапию.
Рак шейки матки
Согласно другому варианту своего осуществления настоящее изобретение относится к способу лечения рака шейки матки, предпочтительно, к способу лечения аденокарциномы цервикального эпителия. Существует два основных типа рака шейки матки: плоскоклеточная карцинома и аденокарцинома. Первая форма встречается в 80-90% случаев и развивается, когда эктоцервикс (часть эпителия, ближайшая к влагалищу) и эндоцервикс (часть эпителия, ближайшая к матке) соединяются. Последняя форма развивается из слизеобразуюших железистых клеток эндоцервикса. Некоторые формы рака шейки матки имеют черты обеих указанных форм и обозначаются как аденосквамозные карциномы или смешанные карциномы.
Доступными способами лечения рака шейки матки в настоящее время является хирургическое вмешательство, иммунотерапия, лучевая терапия и химиотерапия. Основными возможными операциями при раке шейки матки являются криодеструкция, гистроэктомия и радикальная гистероэктомия. Лучевая терапия для таких пациентов заключается либо в дистанционной лучевой терапии, либо в брахитерапии. К противоопухолевым лекарствам, которые могут применяться для лечения рака шейки матки относятся цисплатин, карбоплатин, гидроксимочевина, иринотекан, блеомицин, винкристин, митомицин, ифосфамид, фторурацил, этопозид, метотрексат и их комбинации.
Способы, заявленные в соответствии с настоящим изобретением, могут оказывать благоприятный эффект у пациентов с раком яичников и включают введение соединения нитробензамида или комбинированную терапию: введение соединения нитробензамида и хирургическое лечение, лучевую терапию или химиотерапию.
Рак предстательной железы
Согласно другому варианту своего осуществления, настоящее изобретение относится к способу лечения рака предстательной железы, предпочтительно, к способу лечения аденокарциномы или аденокарциномы с метастазами в кости. Рак предстательной железы развивается у мужчин, указанная железа окружает первый отдел мочеиспускательного канала. Ткань предстательной железы состоит из нескольких типов клеток, однако 99% всех опухолей данного органа являются аденокарциномами, которые образуются из железистых клеток, отвечающих за секрецию слизистого компонента семенной жидкости.
Для лечения таких пациентов применяется оперативное лечение, иммунотерапия. лучевая терапия, криодеструкция, гормональная терапия и химиотерапия. К возможным способам хирургического лечения рака предстательной железы относятся радикальная ретролобковая простатэктомия, радикальная брюшная простатэктомия и лапароскопическая радикальная простатэктомия. Возможными вариантами лучевой терапии являются дистанционная лучевая терапия, включая пространственную трехмерную конформную лучевую терапию, интенсивно-модуляционную лучевую терапию и конформную протонную лучевую терапию. Брахитерапия (имплантация датчика или внутритканевое облучение) также может применяться для лечения рака предстательной железы. Криодеструкция также является возможным способом лечения локализованного рака предстательной железы.
Гормональная терапия, иначе называемая андроген-депривационной или андроген-супрессирующей терапией, может использоваться для лечения рака предстательной железы. Доступно несколько способов осуществления гормональной терапии, включая орхэктомию или удаление яичек, в которых синтезируется 90% всех андрогенов. Другой способ заключается во введении аналогов лютеинизирующего рилизинг-гормона (LHRH, от англ. Luteinizing Hormone-Releasing Hormone) для понижения уровня андрогенов. К доступным аналогам LHRH относятся лейпролид, гозерелин, трилорелин и гистрелин. Также могут использоваться антагонисты LHRH, такие как абареликс.
Лечение антиандрогенными агентами, которые блокируют активность андрогенов в организме, также является возможным способом лечения. К таким агентам относятся флутамид, бикалутамид и нилутамид. Такую терапию обычно комбинируют с введением аналогов LHRH или орхэктомией, что обозначается термином комбинированная андрогенная блокада (CAB, от англ. Combined Androgen Biockade).
Химиотерапия может использоваться в том случае, когда опухоль предстательной железы распространяется за пределы органа и гормональная терапия является неэффективной. Для замедления роста опухоли, уменьшения симптомов и улучшения качества жизни пациентов могут использоваться такие лекарственные средства, как доксорубицин, эстрамустин, этопозид, митоксантрон, винбластин, паклитаксел, доцетаксел, карбоплатин и преднизолон.
Способы, заявленные в соответствии с настоящим изобретением, могут оказывать благоприятный эффект у пациентов с раком предстательной железы и включают введение соединения нитробензамида или комбинированную терапию: введение соединения нитробензамида и хирургическое лечение, лучевую терапию, химиотерапию и гормональную терапию.
Рак поджелудочной железы
Согласно другому варианту своего осуществления настоящее изобретение относится к способу лечения рака поджелудочной железы, предпочтительно, к способу лечения эпителиоидной карциномы в тканях протока железы или аденокарциномы панкреатического протока.
Наиболее распространенным типом рака поджелудочной железы является аденокарцинома, которая возникает из эпителия выводящего протока. Возможными способами лечения рака поджелудочной железы является хирургический, иммунотерапия, лучевая терапия и химиотерапия. Возможными хирургическими вмешательствами при раке поджелудочной железы являются дистальная или тотальная панкреатэктомия и панкреатодуоденальная резекция (операция Уипла).
Лучевая терапия может быть терапией выбора для пациентов с раком предстательной железы, в особенности дистанционная лучевая терапия, когда лучи фокусируют на опухоли при помощи аппарата, расположенного за пределами организма. Другим выбором является интраоперационная электронная лучевая терапия, применяемая во время оперативного пособия.
Для лечения пациентов с раком поджелудочной железы может использоваться химиотерапия. К подходящим противоопухолевым агентам относятся 5-фторурацил (5-FU), митомицин, ифосфамид, доксорубицин, стептозоцин, хлорзотоцин и их комбинации.
Способы, заявленные в соответствии с настоящим изобретением, могут оказывать благоприятный эффект у пациентов с раком поджелудочной железы и включают введение соединения нитробензамида или комбинированную терапию: введение соединения нитробензамида и хирургическое лечение, лучевую терапию или химиотерапию.
Рак мочевого пузыря
Согласно другому варианту своего осуществления, настоящее изобретение относится к способу лечения рака мочевого пузыря, предпочтительно, к способу лечения переходноклеточной карциномы мочевого пузыря. Рак мочевого пузыря обычно представлен карциномами мочевого эпителия (переходноклеточные карциномы) или опухолями мочевого эпителия, которые выстилают мочевой пузырь. В остальных случаях это обычно плоскоклеточные карциномы, аденокарциномы и мелкоклеточный рак. Карциномы мочевого пузыря подразделяют на несколько подтипов, в зависимости от того, являются они инвазивными или нет, палилпярными или плоскими. Неинвазивные опухоли локализуются в мочевом эпителии, самом внутреннем слое мочевого пузыря, в то время как инвазивные опухоли распространяются в более глубокие слои мочевого пузыря, в частности в мышечную стенку. Инвазивные папиллярные карциномы мочевого пузыря представляют собой тонкие выросты, напоминающие пальцы, которые разветвляются в полости мочевого пузыря, а также прорастают в его стенку. Неинвазивные папиллярные опухоли растут только по направлению к центру мочевого пузыря. В то время как неинвазивные, плоские опухоли мочевого пузыря (также называемые плоскими карциномами in situ) локализуются в клеточном слое, который выстилает полость мочевого пузыря, инвазивные плоские карциномы прорастают в более глубокие слои, в частности в мышечный слой.
Для лечения рака мочевого пузыря применяются хирургические операции, лучевая терапия, иммунотерапия, химиотерапия или их комбинации. Возможными хирургическими пособиями являются трансуретральная резекция, цистэктомия или радикальная цистэктомия. Лучевая терапия включает дистанционную лучевую терапию и брахитерапию.
Для лечения пациентов с раком мочевого пузыря может применяться иммунотерапия. Обычно она включает интравезикулярную терапию, когда агент вводится непосредственно в мочевой пузырь при помощи катетера. Один способ заключается в использовании бацилл Кальметта-Герина (БЦЖ), когда бактерии, применяемые для вакцинации против туберкулеза, вводят в мочевой пузырь при помощи катетера. В ответ на введение бактерий возникает мощный иммунный ответ, который воздействует и на раковые клетки.
Другим способом иммунотерапии является введение интерферонов, гликопротеинов, которые модулируют иммунный ответ. Для лечения рака мочевого пузыря обычно интерферон-альфа.
Для химиотерапии могут использоваться такие лекарственные агенты, как титепа, метотрексат, винбластин, доксорубицин, циклофосфамид, паклитаксел, карбоплатин, цисплатин, ифосфамид, гемцитабин или их комбинации.
Способы, заявленные в соответствии с настоящим изобретением, могут оказывать благоприятный эффект у пациентов с раком мочевого пузыря и включают введение соединения нитробензамида или комбинированную терапию: введение соединения нитробензамида и хирургическое лечение, лучевую терапию, иммунотерапию или химиотерапию.
Острый миелоидный лейкоз
Согласно другому варианту своего осуществления настоящее изобретение относится к способу лечения острого миелоидного лейкоза (AML, от англ. Acute Myeloid Leukemia), предпочтительно, острого промиелоцитарного лейкоза периферической крови. AML начинается в костном мозге, но может распространяться и в другие части организма, включая лимфатические узлы, печень, селезенку, центральную нервную систему и яички. Термин "острый" лейкоз подразумевает быстрое начало и летальный исход, в случае отсутствия адекватного лечения в первые несколько месяцев. AML характеризуется наличием незрелых клеток костного мозга, обычно гранулоцитов или моноцитов, которые продолжают размножаться и аккумулировать.
Для лечения AML применяется иммунотерапия, лучевая терапия, химиотерапия, трансплантация костного мозга или стволовых клеток периферической крови или их комбинации. Лучевая терапия включает дистанционную лучевую терапию и может иметь серьезные побочные эффекты. Для химиотерапии используются такие лекарственные средства, как цитарабин, антрациклин, антраценедион, идарубицин, даунорубицин, идарубицин, митоксантрон, тиогуанин, винкристин, преднизолон, этопозид или их комбинации.
Для лечения пациентов с AML могут использоваться моноклональные антитела. Малые молекулы или радиоактивные соединения могут быть прикреплены к указанным антителам перед введением пациенту для обеспечения гибели злокачественных клеток. Моноклональное антитело, гемтизумаба озогамицин, который связывается с CD33 на поверхности AML клеток, может использоваться для лечения пациентов с AML, для облегчения их состояния во время последующей химиотерапии.
Для лечения больных с AML может использоваться трансплантация костного мозга или стволовых клеток периферической крови. Возможна как аллогенная, так и аутологичная трансплантация.
Способы, заявленные в соответствии с настоящим изобретением, могут оказывать благоприятный эффект у пациентов с лейкозами и включают введение соединения нитробензамида или комбинированную терапию: введение соединения нитробензамида и хирургическое лечение, лучевую терапию, химиотерапию или трансплантацию.
Способы, заявленные в соответствии с настоящим изобретением, могут также использоваться для лечения лейкозов другого типа, включая, без ограничений указанными, острый лимфоцитарный лейкоз, острый миелоидный лейкоз, хронический лимфоцитарный лейкоз, хронический миелоидный лейкоз, волосатоклеточный лейкоз, миелодисплазию и миелопролиферативные заболевания.
Рак легких
Согласно другому аспекту настоящее изобретение относится к способам лечения рака легких. Наиболее часто встречается так называемый немелкоклеточный рак легких (NSCLC, от англ. Non-Small Cell Lung Cancer), который составляет 80-85% всех опухолей легких и подразделяется на плоскоклеточные карциномы, аденокарциномы и крупноклеточные недифференцированные карциномы. Мелкоклеточный рак легких встречается в 15-20% случаев.
К возможным способам лечения рака легких относятся хирургическое лечение, иммунотерапия, лучевая терапия, химиотерапия, фотодинамическая терапия или их комбинации. Возможными оперативными пособиями при раке легких являются сегментарная или краевая резекция, лобэктомия или пневмонэктомия. Лучевая терапия включает дистанционную лучевую терапию или брахитерапию.
Некоторые химиотерапевтические агенты, которые могут использоваться в терапии рака легких, включают цисплатин, карбоплатин, паклитаксел, доцетаксел, гемцитабин, винорелбин, иринотекан, этопозид, винбластин, гефитиниб, ифосфамид, метотрексат или их комбинации. Для лечения пациентов с раком легких может применяться фотодинамическая терапия (PDT, от англ. Photodynamic Therapy).
Способы, заявленные в соответствии с настоящим изобретением, могут оказывать благоприятный эффект у пациентов с раком легких и включают введение соединения нитробензамида или комбинированную терапию: введение соединения нитробензамида и хирургическое лечение, лучевую терапию, химиотерапию или фотодинамическую терапию.
Рак кожи
Согласно еще одному аспекту настоящее изобретение относится к способам лечения рака кожи. Существует несколько типов рака, которые поражают кожу. Наиболее распространенными типами является базальноклеточная карцинома и плоскоклеточная карцинома, которые относятся к группе немеланомных раков кожи. Актинический кератоз кожи представляет собой патологическое состояние, на фоне которого в некоторых случаях развивается плоскоклеточная карцинома. Немеланомные раки кожи редко метастазируют в другие органы организма. Меланома, наиболее редкая форма рака кожи, часто инвазирует близлежащие ткани и распространяется в другие части организма. Для пациентов с меланомами, немеланомными раками кожи и актинокератозом существует несколько вариантов лечения, включая хирургическое лечение, лучевую терапию, химиотерапию и фотодинамическую терапию. Возможными хирургическими вариантами лечения являются микрографическая хирургия, простая эксцизия, фильгурация и кюретаж, криохирургия и лазерная хирургия. Лучевая терапия может включать дистанционную лучевую терапию или брахитерапию. В клинических исследованиях изучаются другие возможные варианты лечения, такие как биологическая терапия или иммунотерапия, химиоиммунотерапия, местная химиотерапия фторурацилом и фотодинамическая терапия.
Способы, заявленные в соответствии с настоящим изобретением, могут оказывать благоприятный эффект у пациентов с раком кожи и включают введение соединения нитробензамида или комбинированную терапию: введение соединения нитробензамида и хирургическое лечение, лучевую терапию, химиотерапию или фотодинамическую терапию.
Рак тканей глаза, ретинобластома
Согласно другому аспекту настоящее изобретение относится к способам лечения ретинобластомы глаза. Ретинобластома представляет собой злокачественную опухоль сетчатки. И хотя ретинобластома может возникнуть в любом возрасте, чаще всего она встречается у детей моложе 5 лет. Опухоль может поражать как один глаз, так и оба глаза сразу. Ретинобластома обычно локализуется в глазу и не распространяется на другие части организма. Возможные варианты лечения и сохранения зрения включают энуклеацию глаза (хирургическая операция по удалению глазного яблока), лучевую терапию, криотерапию, фотокоагуляцию, иммунотерапию, термотерапию и химиотерапию. Лучевая терапия может быть как дистанционной лучевой терапией, так и брахитерапией.
Способы, заявленные в соответствии с настоящим изобретением, могут оказывать благоприятный эффект у пациентов с ретинобластомой и включают введение соединения нитробензамида или комбинированную терапию: введение соединения нитробензамида и хирургическое лечение, лучевую терапию, криотерапию, фотокоагуляцию, термотерапию и химиотерапию.
Рак тканей глаза, интраокулярная меланома
Согласно другому аспекту настоящее изобретение относится к способам лечения интраокулярной меланомы. Интраокулярная меланома, очень редкая форма рака, представляет собой заболевание, при котором раковые клетки можно обнаружить в части глаза, называемой сосудистой оболочкой. Сосудистая оболочка состоит из следующих частей: радужка, ресничное тело и собственно сосудистая оболочка. Интраокулярная меланома чаще всего встречается у людей среднего возраста. К способам лечения интраокулярной меланомы относятся хирургическое вмешательство, иммунотерапия, лучевая терапия и лазерная терапия. Хирургический способ чаще всего применяется для лечения интраокулярной меланомы. Возможные операции включают иридэктомию, иридотрабекулоэктомию, иридоциклоэктомию, хороидэктомию, энуклеацию и орбитальную эвисцерацию. Лучевая терапия может представлять собой как дистанционную лучевую терапию, так и брахитерапию.
Способы, заявленные в соответствии с настоящим изобретением, могут оказывать благоприятный эффект у пациентов с интраокулярной меланомой и включают введение соединения нитробензамида или комбинированную терапию: введение соединения нитробензамида и хирургическое лечение, лучевую терапию и лазерную терапию.
Рак эндометрия
Согласно другому варианту своего осуществления настоящее изобретение относится к способу лечения рака эндометрия. Рак эндометрия представляет собой злокачественный процесс, который начинается в эндометрии, внутреннем слое. выстилающем полость матки. Некоторыми примерами вариантов рака эндометрия и матки являются, без ограничений указанными, аденокарциномы, аденоакантомы, аденосквамозные карциномы, аденоплоскоклеточные карциномы, папиллярные серозные аденокарциномы, светлоклеточные аденокарциномы, саркомы матки, стромальные саркомы, злокачественные смешанные мезодермальные опухоли и лейомиосаркомы.
Способы, заявленные в соответствии с настоящим изобретением, оказывают благоприятный эффект у пациентов с раком эндометрия и включают введение соединения нитробензамида или комбинированную терапию: введении соединения нитробензамида и хирургическое лечение, лучевую терапию, химиотерапию, генную терапию, фотодинамическую терапию, антиангиогенетическую терапию и иммунотерапию.
Рак печени
Согласно другому варианту своего осуществления настоящее изобретение относится к способу лечения первичного рака печени (рака тканей печени). Первичный рак печени может возникать как у детей, так и у взрослых. Для пациентов с первичным раком печени доступно несколько способов лечения, включая хирургическое лечение, иммунотерапию, лучевую терапию, химиотерапию и подкожное введение этанола. К возможным хирургическим вмешательствам относятся криодеструкция, частичная гепатэктомия, тотальная гепатэктомия и радиочастотная аблация. Лучевая терапия может представлять собой дистанционную лучевую терапию, близкофокусную лучевую терапию, применение радиосенсибилизаторов или антител, меченных радиоактивными метками. Другими вариантами лечения является гипертермия и иммунотерапия.
Способы, заявленные в соответствии с настоящим изобретением, оказывают благоприятный эффект у пациентов с раком печени и включают введение соединения нитробензамида или комбинированную терапию: введении соединения нитробензамида и хирургическое лечение, лучевую терапию, химиотерапию, подкожное введение этанола, гипертермическую терапию и иммунотерапию.
Рак почек
Согласно другому варианту своего осуществления настоящее изобретение относится к способу лечения рака почек. Рак почек (также называемый почечноклеточным раком или почечной аденокарциномой) представляет собой заболевание, при котором злокачественные клетки обнаруживаются в тканях, выстилающих почечные канальцы почек. Способами лечения рака почек является хирургический, лучевая терапия, химиотерапия и иммунотерапия. Возможными оперативными вмешательствами являются резекция почки, простая нефрэктомия и радикальная нефрэктомия. Лучевая терапия может представлять собой дистанционную лучевую терапию или близкофокусную лучевую терапию. Для лечения рака почек может применяться трансплантация стволовых клеток.
Способы, заявленные в соответствии с настоящим изобретением, оказывают благоприятный эффект у пациентов с раком почек и включают введение соединения нитробензамида или комбинированную терапию: введении соединения нитробензамида и хирургическое лечение, лучевую терапию, химиотерапию, иммунотерапию и трансплантацию стволовых клеток.
Рак щитовидной железы
Согласно другому варианту своего осуществления настоящее изобретение относится к способу лечения рака щитовидной железы. При раке щитовидной железы злокачественные клетки обнаруживаются в тканях щитовидной железы. Выделяют четыре основных типа рака щитовидной железы: папиллярный рак, фолликулярный рак, медуллярный рак и анапластический рак. Способы лечения рака щитовидной железы включают хирургический способ, иммунотерапию, лучевую терапию, гормональную терапию и химиотерапию. Наиболее распространенным способом является хирургический способ. Возможными оперативными пособиями являются лобэктомия, субтотальная тиреоидэктомия, тотальная тиреоидэктомия и диссекция лимфатических узлов. Лучевая терапия включает такие способы, как дистанционная лучевая терапия, или введение жидкости, содержащей радиоактивный йод. Гормональная терапия используется для прекращения роста раковых клеток. Для лечения рака щитовидной железы гормональная терапия подразумевает введение гормонов, которые препятствуют синтезу тех гормонов в организме, которые стимулируют рост раковых клеток.
Способы, заявленные в соответствии с настоящим изобретением, оказывают благоприятный эффект у пациентов с раком щитовидной железы и включают введение соединения нитробензамида или комбинированную терапию: введении соединения нитробензамида и хирургическое лечение, лучевую терапию, гормональную терапию и химиотерапию.
СПИД-ассоциированные опухоли
СПИД-ассоциированная лимфора
Согласно другому варианту своего осуществления настоящее изобретение относится к способу лечения СПИД-ассоциированной лимфомы. СПИД-ассоциированная лимфома представляет собой заболевание, при котором злокачественные клетки появляются в лимфатической системе пациентов, страдающих от приобретенного синдрома иммунодефицита (СПИДа). СПИД возникает при инфицировании вирусом иммунодефицита человека (ВИЧ), который атакует и ослабляет иммунную систему. Иммунная система теряет способность противостоять инфекциям и заболеваниям, которые поражают организм. У людей, страдающих от ВИЧ-инфекции, имеется повышенный риск развития инфекций, лимфом и других типов рака. Лимфомы представляют собой опухоли, которые поражают белые кровяные клетки в лимфатической системе. Лимфомы подразделяют на два основных типа: лимфому Ходжкина и неходжкинские лимфомы. У пациентов, страдающих СПИД, могут возникать как неходжкинские лимфомы, так и лимфома Ходжкина, однако неходжкинские лимфомы встречаются чаще. Когда у пациента, страдающего СПИДом, имеется неходжкинская лимфома, ее называют СПИД-ассоциированной лимфомой. Неходжкинские лимфомы могут быть неактивными (медленнорастущими) или агрессивными (быстрорастущими). СПИД-ассоциированная лимфома обычно является агрессивной. Выделяют три основных типа СПИД-ассоциированной лимфомы: диффузная крупно-В-клеточная лимфома, В-клеточная иммунобластическая лимфома и мелкоклеточная с расщепленными ядрами лимфома.
Лечение СПИД-ассоциированных лимфом включает комбинированное лечение лимфомы и лечение собственно СПИДа. У пациентов со СПИДом иммунная система очень ослаблена и лечение может приносить дополнительный вред. По этой причине пациентов, которые страдают СПИД-ассоциированной лимфомой обычно лечат более низкими дозами препаратов, чем пациентов с лимфомами, но без СПИДа. Высокоактивная антиретровирусная терапия (HAART, от англ. Highly-Active Antiretroviral Therapy) используется для замедления прогрессирования ВИЧ-инфекции. Лекарственные средства, предназначенные для профилактики и лечения инфекционных болезней, которые могут быть серьезными, также используются. Для лечения СПИД-ассоциированных лимфом могут использоваться химиотерапия, иммунотерапия, лучевая терапия и химиотерапия высокими дозами с трансплантацией стволовых клеток. Лучевая терапия может представлять собой дистанционную лучевую терапию и брахитерапию. Для лечения СПИД-ассоциированных лимфом может использоваться терапия моноклональными антителами.
Способы, заявленные в соответствии с настоящим изобретением, оказывают благоприятный эффект у пациентов со СПИД-ассоциированной лимфомой и включают введение соединения нитробензамида или комбинированную терапию: введении соединения нитробензамида и химиотерапию, лучевую терапию и химиотерапию высоких доз.
Саркома Капоши
Согласно другому аспекту настоящее изобретение относится к способам лечения саркомы Калоши. Саркома Капоши представляет собой заболевание, при котором злокачественные клетки можно обнаружить в подкожных тканях или слизистых оболочках полости рта, носа и ануса. Классическая саркома Капоши обычно встречается у пожилых мужчин, живущих в Израиле, Италии и странах Средиземноморья. Данный тип саркомы Калоши прогрессирует медленно, иногда в течение 10-15 лет. Саркома Капоши может возникать у людей, принимающих иммуносупрессирующие препараты. Саркому Капоши, которая возникает у людей с синдромом приобретенного иммунодефицита (СПИДом) называют эпидемической саркомой Капоши. Саркома Капоши у людей со СПИДом обычно развивается гораздо быстрее, чем другие типы саркомы Капоши и может быть обнаружена в различных частях организма. Лечение саркомы Капоши включает хирургическое лечение, химиотерапию, лучевую терапию и иммунотерапию. Наиболее распространенным способом лечения является дистанционная лучевая терапия. Возможными хирургическими способами лечения саркомы Капоши являются локальная эксцизия, электродесикация и кюретаж, а также криотерапия.
Способы, заявленные в соответствии с настоящим изобретением, оказывают благоприятный эффект у пациентов с саркомой Капоши и включают введение соединения нитробензамида или комбинированную терапию: введении соединения нитробензамида и хирургическое лечение, химиотерапию, лучевую терапию и иммунотерапию.
Вирус-индуцированные раки
Согласно другому варианту своего осуществления, настоящее изобретение относится к способам лечения вирус-индуцированных раков. Известно несколько типов вирусов, которые являются установленными или предположительными этиологическими факторами специфических злокачественных новообразований. Такие вирусные инфекции протекают обычно латентно и могут приобретать перетистирующий характер. Онкогенез, вероятно, связан с повышенным уровнем вирусной активации в инфицированной клетке, что приводит к высокой вирусной дозе и нарушению иммунного контроля. Основными известными системами вирус-злокачественного новообразования являются: вирус гепатита В (HBV, от англ. Hepatitis В Virus), вирус гепатита С (HCV, от англ. Hepatitis С Virus) и печеночно-клеточная карцинома; лимфотропный вирус человека 1-го типа (HTLV-1, от англ. Human Lymphotropic Virus-Туре-1) и Т-клеточный лейкоз/лимфома взрослых; вирус папилломы человека (HPV, от англ. Human Papilloma Virus) и рак шейки матки. Обычно указанные злокачественные новообразования возникают на ранних этапах жизни, в среднем возрасте или ранее.
Вирус-индуцированная печеночно-клеточная
Причинно-следственные связи между вирусами HBV и HCV и печеночно-клеточной карциномой или раком печени устанавливаются посредством последовательных эпидемиологических событий. Оба вируса действуют за счет хронической репликации в клетках печени, вызывая гибель последних и последующую регенерацию. Для пациентов с раком печени доступно несколько способов лечения. К ним относятся хирургический способ, иммунотерапия, лучевая терапия, химиотерапия и подкожная инъекция этанола. К возможным способам хирургического лечения относится криодеструкция, частичная гепатэктомия, тотальная гепатэктомия и радиочастотная аблация. Лучевая терапия может включать дистанционную лучевую терапию, брахитерапию, введение радиосенсибилизирующих веществ и антител, меченных радиоактивными метками.
Другими вариантами лечения являются гипертермия и иммунотерапия. Способы, заявленные в соответствии с настоящим изобретением, могут оказывать благоприятный эффект у пациентов с вирус-индуцированной печеночно-клеточной карциномой и включают введение соединения нитробензамида или комбинированную терапию: введение соединения нитробензамида и хирургическое лечение, лучевую терапию, химиотерапию, подкожное введение этанола, гипертермию и иммунотерапию.
Вирус-индуцированный Т-клеточный лейкоз/лимфома взрослых
Причинно-следственная связь между HTLV-1 и Т-клеточным лейкозом взрослых (ATL, от англ. Adult T-ceU Leukemia) прочно установлена. В отличие от других онкогенных вирусов, которые встречаются по всему миру, HTLV-1 имеет строгую географическую зависимость и встречается главным образом в южной Японии, Карибском бассейне, восточной и центральной Африке и южных островах Тихого океана. Данные в пользу того, что этиологическим фактором является вирус, включают наличие моноклональной интеграции вирусного генома практически во всех случаях ATL. Факторами риска для HTLV-1-ассоциированных злокачественных заболеваний считаются перинатальная инфекция, высокая вирусная нагрузка и мужской пол.
Т-клеточный лейкоз взрослых представляет собой рак крови и костного мозга. Стандартными способами лечения Т-клеточного лейкоза и лимфомы взрослых являются лучевая терапия, иммунотерапия и химиотерапия. Лучевая терапия может включать дистанционную лучевую терапию или брахитерапию. Другими способами лечения Т-клеточного лейкоза/лимфомы взрослых являются иммунотерапия и химиотерапия высоких доз с трансплантацией стволовых клеток.
Способы, заявленные в соответствии с настоящим изобретением, могут оказывать благоприятный эффект у пациентов с Т-клеточным лейкозом взрослых и включают введение соединения нитробензамида или комбинированную терапию: введение соединения нитробензамида и лучевую терапию, химиотерапию, иммунотерапию и химиотерапию высоких доз с трансплантацией стволовых клеток.
Вирус-индуцированный рак шейки матки
Инфекция шейки матки, вызванная вирусом папилломы человека (HPV), является наиболее частной причиной рака шейки матки. Однако далеко не у всех женщин с папиллома-вирусной инфекцией развивается рак шейки матки. Рак шейки матки обычно развивается очень медленно. Прежде чем появятся злокачественные изменения в шейке матки, клетки проходят стадийные изменения, такие как дисплазия, указанные изменения включают появление аномальных клеток. Затем раковые клетки начинают расти и распространяются в более глубокие слои шейки и в окружающие области. Стандартными способами лечения рака шейки матки является хирургический способ, иммунотерапия, лучевая терапия и химиотерапия. Возможными способами хирургического лечения являются конизация шейки матки, тотальная гистерэктомия, билатеральная сальпингоовариоэктомия, радикальная гистерэктомия, тазовая экстирпация матки, криодеструкция, лазерная хирургия и электрохирургическая эксцизия при помощи петли.
Могут использоваться такие варианты лучевой терапии, как дистанционная лучевая терапия и брахитералия.
Способы, заявленные в соответствии с настоящим изобретением, могут оказывать благоприятный эффект у пациентов с раком шейки матки у взрослых и включают введение соединения нитробензамида или комбинированную терапию: введение соединения нитробензамида и лучевую терапию и химиотерапию.
Опухоли ЦНС
Опухоли головного и спинного мозга представляют собой аномальные разрастания тканей внутри черепной коробки или позвоночного канала, указанные ткани являются первичными компонентами центральной нервной системы (ЦНС). Доброкачественные опухоли не являются раковыми, а злокачественные опухоли обычно представляют собой рак. ЦНС заключена в ригидные костные структуры (то есть череп и позвоночный канал), поэтому любое аномальное разрастание тканей, независимо от того, доброкачественное или злокачественное, может приводить к сдавлению нервной ткани и нарушению функции. Опухоли, которые возникают в головном или спинном мозге, называют первичными. Большинство первичных опухолей возникают при бесконтрольном росте клеток, которые окружают и поддерживают нейроны. У небольшого числа пациентов первичные опухоли возникают в результате специфических генетических заболеваний (например, нейрофиброматоза, туберозного склероза) или в результате воздействия радиации или вызывающих рак химических соединений. Причина большинства первичных опухолей ЦНС остается загадкой.
Основной способ диагностики опухолей спинного и головного мозга заключается в исследовании неврологической симптоматики. Специфические методы визуализации (компьютерная томография, магнитно-резонансная томография, позитронно-эмиссионная томография) также используются. Инструментальные тесты включают ЭЭГ (электроэнцефалографию) и спинномозговую пункцию. Биопсия, при которой берется образец ткани предполагаемой опухоли, помогает докторам определить тип опухоли.
Опухоли классифицируют на основании типа клеток, которые дают начало опухолям. Наиболее часто встречающейся первичной опухолью у взрослых является опухоль, происходящая из астроцитов, которые составляют гематоэнцефалический барьер и обеспечивают питание центральной нервной системы. Опухоли, называемые глиомами (астроцитомы, анапластические астроцитомы, или мультиформные глиобластомы), составляют приблизительно 65% всех первичных опухолей центральной нервной системы. Некоторыми примерами опухолей являются, без ограничений указанными, олигодендроглиома, эпендимома, менингиома, лимфома, шваннома и медуллобластома.
Нейроэпителиальные опухоли ЦНС
Астроцитарные опухоли, такие как астроцитома; анапластическая (злокачественная) астроцитома, такая как гемисферическая, диэнцефальная, оптическая, ствола мозга, мозжечка, мультиформная глиобластома; пилоидная астроцитома, такая как гемисферическая, диэнцефальная, оптическая, ствола мозга, мозжечка; субэпендимальная гигантоклеточная астроцитома; и плеоморфная ксантоастроцитома. Олигодендроглиальные опухоли, такие как олигодендроглиома; и анапластическая (злокачественная) олигодендроглиома. Эпендимальные клеточные опухоли, такие как эпендимома; анапластическая эпендимома; миксопапиллярная эпендимома; и субэпендимома. Смешанные глиомы, такие как смешанная олигоастроцитома; анапластическая (злокачественная) олигоастроцитома; и другие (например, эпендимо-астроцитомы). Нейроэпителиальные опухоли неопределенного происхождения, такие как полярная спонгиобластома; астробластома и нейроглиоматоз. Опухоли хориоидного сплетения, такие как папиллома хороидального сплетения и карцинома хороидального сплетения (анапластическая папиллома хороидального сплетения). Нейрональные и смешанные нейроглиальные опухоли, такие как ганглиоцитома, диспластическая ганглиоцитома мозжечка (Лермитта-Дуклоса); ганглиоглиома, анапластическая (злокачественная) ганглиоглиома; десмопластическая инфантильная ганглиоглиома; такая как десмопластическая инфантильная астроцитома; центральная нейроцитома; дисэмбриопластическая нейроэпителиальная опухоль; ольфакторная нейробластома (эстезионейробластома). Опухоли паренхимы шишковидного тела, такие как пинеоцитома, пинеобластома и смешанная пинеоцитома/пинеобластома. Опухоли с нейробластическими или глиобластическими элементами (эмбриональные опухоли), такие как медуллоэпителиома, эмбриональные нейроэктодермальные опухоли с мультипотентной дифференцировкой, такие как медуллобластома; церебральная эмбриональная нейроэктодермальная опухоль; нейробластома; ретинобластома и эпендимобластома.
Опухоли турецкого седла, такие как аденома гипофиза; карцинома гипофиза и краниофарингиома. Гематопоэтические опухоли, такие как первичные злокачественные лимфомы; плазмацитомы и гранулоцитарная саркома. Опухоли зародышевых клеток, такие как герминома; эмбриональная карцинома; опухоль желточного мешка (эндодермальная синусовая опухоль); хориокарцинома; тератома; и смешанные опухоли из зародышевых клеток. Опухоли мозговых оболочек, такие как менингиома, атипичная менингиома и анапластическая (злокачественная) менингиома. Неменинготелиальные опухоли мозговых оболочек, такие как доброкачественные мезенхимальные, злокачественные мезенхимальные; первичные меланоцитарные поражения; гемопоэтические неоплазмы; и опухоли неопределенного гистогенеза, такие как гемангиобластомы (капиллярная гемангиобластома). Опухоли черепных и спинальных нервов, такие как шваннома (невринома, неврилеммома); нейрофиброма, злокачественные опухоли оболочек периферических нервов (злокачественная шваннома), такая как эпителиоид, дивергентная мезенхимальная или эпителиальная дифференцировка и меланотические опухоли. Локальные Extensions региональных опухолей, такие как параганглиома (хемодектома), хордома, ходрома, хондросаркома и карцинома. Метастатические опухоли, неклассифицируемые опухоли и кисты и опухолеподобные изменения, такие как киста кармана Ратке; Эпидермоид, дермоид, коллоидная киста третьего желудочка, энтерогенная киста, нейроглиальная киста, гранулярно-клеточная опухоль (хористома, питуицитома); гипоталамическая нейрональная гамартома; назальная глиальная гертеротопия; и плазмоцитарная гранулема.
Возможными химиотерапевтическими агентами являются, без ограничений указанными, алкилирующие агенты, такие как циклофосфамид, ифосфамид, мелфалан, хлорамбуцил, BCNU, CCNU, декарбазин, прокарбазин, бисульфан и тиотепа;
антиметаболиты, такие как метотрексат, 5-фторурацил, цитарабин, гемцитабин (Gemzar®), 6-меркаптопурин, 6-тиогуанин, Флударабин и Кладрибин; антрациклины, такие как даунорубицин, доксорубицин, идарубицин, эпирубицин и митоксантрон, антибиотики, такие как блеомицин, камптотецины, такие как иридотекан и топотекан, таксаны, такие как паклитаксел и доцетаксел, и производные платины, такие как цисплатин, карбоплатин и оксалиплатин.
Возможными способами лечения являются хирургический, лучевая терапия, иммунотерапия, гипертермия, генная терапия, химиотерапия и комбинированное применение лучевой и химиотерапии. Доктора также обычно прописывают стероиды для уменьшения отека мозговых структур ЦНС.
Способы, заявленные в соответствии с настоящим изобретением, могут оказывать благоприятный эффект у пациентов с опухолями ЦНС и включают введение соединения нитробензамида или комбинированную терапию: введение соединения нитробензамида и лучевую терапию и химиотерапию.
Опухоли ПНС
Периферическая нервная система состоит из нервных стволов, которые выходят из спинного и головного мозга и разветвляются в тканях. Указанные нервные стволы создают коммуникационную сеть между ЦНС и всеми частями организма. Периферическая нервная система в свою очередь делится на соматическую нервную систему и автономную нервную систему. Соматическая нервная система включает нервные стволы, которые направляются к коже и мышцам и участвуют в контролируемой деятельности. Автономная нервная система включает нервные волокна, которые связывают ЦНС с висцеральными органами, такими как сердце, желудок и кишечник. Она отвечает за неконтролируемую активность.
Акустическая невринома представляет собой доброкачественное разрастание оболочки вестибулярного нерва, называемого также 8-й парой черепно-мозговых нервов или вестибулокохлеарным нервом. Указанная опухоль не является злокачественной, это означает, что она не метастазирует в другие части организма. Эта опухоль располагается в глубине черепной коробки в непосредственной близости от жизненно важных центров ствола головного мозга. По мере увеличения своего размера опухоль распространяется на окружающие ткани и структуры, которые отвечают за жизненно важные функции. В большинстве случаев такие опухоли растут медленно в течение длительного периода времени.
Злокачественная опухоль оболочки периферических нервов (MPNST, от англ. Malignant Peripheral Nerve Sheath Tumor) является злокачественным аналогом доброкачественных опухолей мягких тканей, таких как нейрофибромы и шванномы. В большинстве случаев такие опухоли располагаются в глубине мягких тканей в непосредственной близости от нервных стволов. Наиболее часто встречаются опухоли седалищного нерва, плечевого сплетения и крестцового сплетения. Наиболее распространенным симптомом является боль, которая обычно требует биопсии. Наиболее редко встречающейся, но очень агрессивной опухолью является летальная орбитальная неоплазия, которая обычно происходит из чувствительных ветвей тройничного нерва у взрослых. Злокачественные опухоли ПНС распространяются вдоль нервных волокон с вовлечением мозга, большинство таких пациентов умирают в течение 5 лет после постановки диагноза. MPNST можно классифицировать на три основные категории: эпителиальные опухоли, мезенхимальные опухоли и железистые опухоли. Некоторыми примерами MPNST являются, без ограничений указанными, подкожная злокачественная эпителиоидная шваннома с хрящевой дифференцировкой, железистая злокачественная шваннома, злокачественные опухоли оболочки периферических нервов с периневральной дифференцировкой, кожная эпителиоидная злокачественная опухоль оболочки периферических нервов с чертами палочкоклеточной опухоли, поверхностная эпителиоидная MPNST, опухоль Тритона (MPNST с рабдомиобластической дифференцировкой), шваннома с рабдомиопластической дифференцировкой. Редкими формами MPNST являются множественные саркоматозные тканевые типы, в особенности остеосаркома, хондросаркома и ангиосаркома. Эти опухоли иногда неотличимы от злокачественных мезенхимальных опухолей.
Другими типами опухолей ПНС являются, без ограничений указанными, злокачественная фиброцитома, злокачественная фиброгистиоцитома, злокачественная менингиома, злокачественная мезотелиома и злокачественная смешанная опухоль Мюллера.
Лечение включает хирургическое лечение, лучевую терапию, иммунотерапию, химиотерапию и комбинированную терапию: лучевую и химиотерапию.
Способы, заявленные в соответствии с настоящим изобретением, могут оказывать благоприятный эффект у пациентов с опухолями ПНС и включают введение соединения нитробензамида или комбинированную терапию: введение соединения нитробензамида и лучевую терапию и химиотерапию.
Опухоли ротовой полости и ротоглотки
Лечение пациентов с опухолями центральной нервной системы(ЦНС) представляет собой трудную задачу. Для лечения опухолей такой локализации, как рак гипофарингеальный рак, рак гортани, рак носоглотки, рак ротоглотки и т.п., обычно применяют хирургическое лечение, иммунотерапию, химиотерапию, комбинацию лучевой и химиотерапии. Этопозид и актиномицин D, два наиболее часто применяемых в онкологии агента, которые ингибируют топоизомеразу II, к сожалению, не проходят через гематоэнцефалический барьер в нужном количестве.
Способы, заявленные в соответствии с настоящим изобретением, могут оказывать благоприятный эффект у пациентов с опухолями ротовой полости и ротоглотки и включают введение соединения нитробензамида или комбинированную терапию: введение соединения нитробензамида и лучевую терапию и химиотерапию.
Рак желудка
Рак желудка является следствием патологических изменений в клетках слизистой оболочки желудка. Выделяют три основных типа рака желудка: лимфомы, гастральные стромальные опухоли и карциноидные опухоли. Лимфомы представляют собой опухоли иммунных тканей, которые иногда встречаются в стенке желудка. Гастральные стромальные опухоли развиваются из тканей стенки желудка. Карциноидные опухоли представляют собой опухоли гормон продуцирующих клеток желудка.
Причины рака желудка в настоящее время обсуждаются. Считается, что особую роль играет наследственность и факторы окружающей среды (питание, курение и т.д.). Для лечения рака желудка обычно применяется хирургическое вмешательство, иммунотерапия, химиотерапия, лучевая терапия, а также комбинированная химиотерапия, лучевая терапия и биологическая терапия.
Способы, заявленные в соответствии с настоящим изобретением, могут оказывать благоприятный эффект у пациентов с опухолями желудка и включают введение соединения нитробензамида или комбинированную терапию: введение соединения нитробензамида и лучевую терапию, а также химиотерапию.
Рак яичек
Рак яичек обычно развивается в одном или обоих яичках у молодых мужчин. Рак яичек развивается из определенных клеток, которые называют половыми клетками. Двумя основными типами опухолей половых клеток (GCTs, от англ. Germ Cell Tumors), которые встречаются у мужчин, являются семиномы (60%) и несеминомные опухоли (40%). Опухоли могут также происходить из поддерживающих и гормонопродуцирующих тканей, или стромы яичек. Такие опухоли известны как гонадные стромальные опухоли. Двумя основными типами являются опухоли клеток Людвига и опухоли клеток Сертолли. Вторичные опухоли яичек представляют собой опухоли, которые развиваются в других органах, а затем метастазируют в яички. Наиболее часто встречаемой вторичной опухолью яичек является лимфома.
Для лечения рака яичек чаще всего применяется хирургическое лечение, иммунотерапия, химиотерапия, лучевая терапия, комбинированная терапия, включающая химиотерапию, лучевую терапию и биологическую терапию. Для лечения рака яичек обычно применяются такие препараты, как платинол (цисплатин), вепезид или VP-16 (этопозид) и бленоксан (блеомицина сульфат). Кроме того, могут применяться ифекс (ифосамид) и велбан (винбластина сульфат).
Способы, заявленные в соответствии с настоящим изобретением, могут оказывать благоприятный эффект у пациентов с раком яичек и включают введение соединения нитробензамида или комбинированную терапию: введение соединения нитробензамида и лучевую терапию, а также химиотерапию.
Рак тимуса
Тимус представляет собой небольшой орган, расположенный в передне-верхнем отделе грудной клетки от основания гортани до передней поверхности сердца. Тимус содержит 2 основных типа клеток, тимические эпителиальные клетки и лимфоциты. Из тимических эпителиальных клеток происходят карциномы тимуса. Лимфоциты, находящиеся как в тимусе, так и в лимфатических узлах, могут приобретать признаки злокачественности и давать начало лимфоме Ходжкина и неходжкинским лимфомам. В тимусе также имеются клетки другого типа, называемые клетками Кульчитского или нейроэндокринными клетками, которые в норме секретируют определенные гормоны. Из данных клеток также могут развиваться опухоли, называемые карциноидами или карциноидными опухолями, которые обычно секретируют те же гормоны и аналогичны другим опухолям, происходящим из нейроэндокринных клеток, расположенных по всему организму.
Традиционные способы лечения рака тимуса включают хирургическое вмешательство, иммунотерапию, химиотерапию, лучевую терапию, комбинацию лучевой, химиотерапии и биологической терапии. Для лечения тимом и карцином тимуса применяют такие противоопухолевые средства как доксорубицин (Адриамицин), цисплатин, ифосфамид и кортикостероиды (преднизолон). Обычно для повышения эффективности указанные лекарственные средства применяют в комбинации. Для лечения рака тимуса применяют следующие комбинации лекарственных средств: цисплатин, доксорубицин, этопозид и циклофосфамид; а также циплатин, доксорубицин, циклофосфамид и винкристин.
Способы, заявленные в соответствии с настоящим изобретением, могут оказывать благоприятный эффект у пациентов с раком тимуса и включают введение соединения нитробензамида или комбинированную терапию: введение соединения нитробензамида и лучевую терапию и химиотерапию.
КОМБИНИРОВАННАЯ ТЕРАПИЯ
Согласно одному варианту своего осуществления настоящее изобретение относится к способам лечения рака с использованием различных комбинаций лечебных режимов. Например, указанная комбинация может включать, без ограничения указанными, использование одного или более соединения нитробензамида в сочетании с одним или более различными противоопухолевыми химиотерапевтическими агентами, химиопрофилактичсскими агентами и/или агентами для уменьшения неблагоприятных побочных эффектов.
Противоопухолевые химиотерапевтические агенты
К противоопухолевым лекарственным агентам, которые могут использоваться в соответствии с настоящим изобретением, относятся (без ограничений указанными): алкилирующие агенты, антиметаболиты, природные противоопухолевые агенты, гормональные противоопухолевые агенты, ингибиторы ангиогенеза, реагенты дифференцировки, ингибиторы РНК, антитела или иммунотерапевтические агенты, агенты генной терапии, ферментные ингибиторы малых молекул, модификаторы биологического агента и антиметастатические агенты.
Алкилизирующие агенты
Известно, что механизм действия алкилирующих агентов заключается в алкилировании макромолекул, таких как ДНК раковых клеток; указанные соединения являются сильными электрофилами. Указанная активность может нарушать синтез ДНК и деление клеток. Примерами алкилирующих агентов, которые могут использоваться с соответствии с настоящим изобретением, являются азотистые иприты и их аналоги и производные, включая циклофосфамид, ифосфамид, хлорамбуцил, эстрамустин, мехлорэтамина гидрохлорид, мелфалан и производные урацила. Другими примерами аликилирующих агентов являются алкил сульфонаты (например, бисульфан), соединения нитрозомочевины (например, кармустин, ломустин и стрептозоцин), триазены (например, дакарбазин и темозоломид), этиленимины/метилмеламины (например, альтретамин и тиотепа), и производные метилгидразина (например, прокарбазин). В группу алкилирующих агентов также включены подобные алкилирующим агентам соединения платины, такие как карбоплатин, цисплатин и оксалиплатин.
Антиметаболиты
Противоопухолевые агенты из группы антиметаболитов по своей структуре напоминают естественные метаболиты, которые принимают участие в нормальных метаболических процессах раковых клеток, таких как синтез нуклеиновых кислот и белков. При этом они в достаточной степени отличаются от природных метаболитов и поэтому обладают способностью нарушать метаболические процессы в раковых клетках. Антиметаболические агенты, подходящие для использования в соответствии с настоящим изобретением, классифицируют в зависимости от того, на какой метаболический процесс они влияют; к ним относятся, без ограничений указанными, аналоги и производные фолиевой кислоты, пиримидины, пурины и цитидин. К группе аналогов фолиевой кислоты, которые могут использоваться в соответствии с настоящим изобретением, относятся, без ограничений указанными, цитарабин, флоксуридин, фторурацил (5-фторурацил), капецитабин, гемцитабин и другие аналоги или производные. К классу пуринов, которые могут использоваться в соответствии с настоящим изобретениям, относятся, без ограничений указанными, меркаптопурин (6-меркаптопурин), пентостатин, тиогуанин, кладрибин и другие аналоги и производные пурина. К цитидиновым агентам, которые могут использоваться в соответствии с настоящим изобретениям, относятся, без ограничений указанными, цитарабин (арабинозид цитозина), азацитидин (5-азацитидин) и их аналоги и производные.
Природные противоопухолевые агенты
К природным противоопухолевым агентам относятся антимитотические агенты, антибиотики с противоопухолевым действием, аналоги камптотецина и ферменты. К подходящим антимитотическим агентам, которые могут использоваться в соответствии с настоящим изобретением, относятся, без ограничений указанными, алкалоиды барвинка, такие как винбластин, винкристин, виндезин, винорелбин и их аналоги и производные. Указанные соединения получают из растения барвинка, которое растет на Мадагаскаре, они являются специфичными для М-фазы клеточного цикла, связываются с тубулином микротрубочек раковых клеток. К другим антимитотическим агентам, которые могут использоваться в соответствии с настоящим изобретением, относятся подофиллотоксины, которые включают, без ограничений указанными, этопозид, тенипози и их аналоги и производные. Указанные агенты главным образом действуют на G2 и позднюю S фазу клеточного цикла.
Также к природным противоопухолевым агентам относятся антибиотики с противоопухолевым действием. Антибиотики с противоопухолевым действием представляют собой антимикробные агенты, которые обладают противоопухолевой активностью, которая проявляется взаимодействием с ДНК раковых клеток. К противоопухолевым антибиотикам относятся, без ограничений указанными, блеомицин, дактиномицин, доксорубицин, идарубицин, эпирубицин, митомицин, митоксантрон, пентостатин, пликамицин и их аналоги и производные.
К природным противоопухолевым агентам по классификации также относятся аналоги и производные камптотецина, которые могут использоваться в соответствии с настоящим изобретением и включают камптотецин, топотекан и иринотекан. Указанные агенты действуют, главным образом, за счет взаимодействия с ядерным ферментом топоизомеразой I. Другим подклассом природных противоопухолевых агентов являются ферменты, L-аспарагиназа и ее варианты. Действие L-аспарагиназы заключается в том, что она лишает раковые клетки L-аспарагина, катализируя гидролиз циркулирующего аспарагина до аспарагиновой кислоты и аммиака.
Гормональные противоопухолевые агенты
Гормональные противоопухолевые агенты действуют главным образом на гормонально-зависимые раки, такие как рак предстательной железы, рак эндометрия, рак яичников, лимфома и лейкозы. Указанные органы и ткани могут быть восприимчивыми и зависимыми от таких гормональных агентов, как глюкокортикоиды, прогестины, эстрогены и андрогены. Для лечения опухолей, в соответствии со способом, описанном в настоящем изобретении, могут использоваться как антагонисты, так и агонисты указанных гормонов, а также их аналоги и производные. Примерами агонистов/антагонистов глюкокортикоидов, которые могут использоваться в соответствии с настоящим изобретением, относятся дексаметазон, кортизол, кортикостерон, преднизолон, мифепристон (RU486), а также их аналоги и производные. К классу агонистов/антагонистов прогестинов, которые могут использоваться в соответствии с настоящим изобретением, относятся, без ограничений указанными, гидроксипрогестерон, медроксипрогестерон, мегестрола ацетат, мифепристон (RU486), ZK98299, их аналоги и производные. Примерами агонистов/антагонистов эстрогена, которые могут использоваться в соответствии с настоящим изобретениям, являются, без ограничений указанными, эстроген, тамоксифен, торемифен, RU58668, SR16234, ZD164384, ZK191703, фулвестрант, их аналоги или производные. Примерами ингибиторов ароматазы, которые нарушают синтез эстрогенов и могут использоваться в соответствии с настоящим изобретением, относятся, без ограничений указанными, андростендион, форместан, эксеместан, аминоглутетимид, анастрозол, летрозол, их аналоги и производные. Примерами подкласса агонистов/антагонистов андрогенов, которые могут использоваться в соответствии с настоящим изобретением, являются, без ограничений указанными, тестостерон, дигидротестостерон, флуоксиместерон, тестолактон, тестостерона энантат, тестостерона пропионат, агонисты/антагонисты гонадотропин-рилизинг гормона (например, лейпролид, гозерелин, трипторелин, бузерелин), диэтилстибестрол, абареликс, ципротерон, флутамид, нилутамид, бикалутамид, их аналоги и производные.
Ингибиторы ангиогенеза
Ингибиторы ангиогенеза действуют, ингибируя васкуляризацию опухолей. К ингибиторам ангиогенеза относится большое количество агентов, включая синтетические агенты, антитела и агенты, которые нарушают функцию РНК. Примерами ингибиторов ангиогенеза, которые могут использоваться в соответствии с настоящим изобретением, являются, без ограничений указанными, ранибизумаб, бевацизимаб. SU11248, РТК787, ZK222584, СЕР-7055, ангиозим, дальтепарин, талидомид, сурамин, СС-5013, фосфат А4 комбретастатина, LY317615, изофлавоны сои, АЕ-941, интерферон альфа, PTK787/ZK 222584, ZD6474, EMD 121974, ZD6474, BAY 543-9006, целекоксиб, галофугинона гидробромид, бевацизумаб, их аналоги, варианты и производные.
Реагенты дифференцировки
Агенты дифференцировки ингибируют рост опухолей за счет механизмов, которые индуцируют дифференцировку раковых клеток. Одним подклассом указанных агентов, который может использоваться в соответствии с настоящим изобретением, является подкласс аналогов витамина А или ретиноидов, а также подкласс агонистов рецепторов, активируемых пролифераторами пероксисом (PPARs, от англ. Peroxisome Proliferator-Activated Receptor). К ретиноидам, которые могут использоваться в соответствии с настоящим изобретением, относятся витамин А, альдегид витамина А (ретиналь), ретиноевая кислота, фенретинид, 9-цис-ретиноевая кислота, 13-цис-ретиноевая кислота, полностью-транс-ретиноевая кислота, изотретиноин, третиноин, ретинила пальмитат, их аналоги и производные. К агонистам PPARs, подходящим для использования в соответствии с настоящим изобретением, относятся, без ограничений указанными, троглитазон, циглитазон, тезаглитазар, их аналоги и производные.
Ингибиторы РНК
Для ингибирования экспрессии или трансляции информационной РНК ('mRNA'). которая ассоциируется с раковым фенотипом. Примерами агентов, которые могут использоваться в соответствии с настоящим изобретением, являются, без ограничений указанными, короткие интерферирующие РНК ('siRNA'), рибозимы и антисмысловые олигонуклеотиды. Специфическими РНК-ингибирующими агентами, подходящими для использования в соответствии с настоящим изобретением, являются, без ограничений указанными, Cand5, Sima-027, фомивирсен и ангиозим.
Антитела/Иммунотерапевтические агенты
Антительные агенты селективно связываются с мишенями, которые экспрессируются на поверхности раковых клеток, и могут также образовывать конъюгаты для ликвидации клеток, ассоциированных с мишенью, либо стимулировать иммунный ответ в организме для разрушения раковых клеток. Иммунотерапевтические агенты могут включать как поликлональные, так и моноклональные антитела. Антитела могут включать элементы человеческих антител и элементы антител других животных (например, мыши), либо полностью состоять из элементов человеческих антител ("гуманизированные антитела"). Примерами моноклональных иммунотерапевтических агентов, которые могут использоваться в соответствии с настоящим изобретением, являются, без ограничений указанными, ритуксимаб, тозибтимомаб, ибритимомаб, которые связываются с CD-20 белком. Другими примерами агентов, которые могут использоваться в соответствии с настоящим изобретением, являются трастузумаб, эдреколомаб, бевацизумаб, цетуксимаб, антитела к карциноэмбриональному антигену, гемтузумаб, алемтузумаб, мапатумумаб, панитумумаб, EMD 72000, Thera CIM hR3, 2C4, HGS-TR2J и HGS-ETR2.
Агенты для генной терапии
Агенты для генной терапии встраивают копии генов в специфический набор клеток пациента и могут атаковать как раковые, так и здоровые клетки. Целью генной терапии является замещение поврежденных генов функциональными, чтобы стимулировать иммунный противоопухолевый ответ организма и сделать раковые клетки более восприимчивыми к химиотерапии, а также встраивание "суицидальных" генов в раковые клетки и ингибирование ангиогенеза. Гены могут доставляться в раковые клетки при помощи вирусов, липосом или других носителей или векторов. Это может осуществляться путем введения композиции ген-носитель непосредственно в организм пациента, или ex vivo, когда в организм пациента вводят уже инфицированные клетки. Указанные композиции подходят для использования в соответствии с настоящим изобретением.
Синтетические ингибиторы ферментов
Определенные синтетические терапевтические агенты обладают способностью воздействовать на активность фермента тирозинкиназы или понижать регуляцию передачи сигналов с определенных клеточных рецепторов, таких как рецептор эпидермального фактора роста (EGFR, от англ. Epidermal Growth Factor Receptor) или рецептор эндотелиального васкулярного фактора роста ("VEGFR", от англ. Vascular Endothelial Growth Factor Receptor). Такое воздействие маломолекулярных терапевтических агентов может оказывать противоопухолевое действие. Примерами указанных агентов, которые могут использоваться в соответствии с настоящим изобретением, являются, без ограничений указанными, иматиниб, гефитиниб, ерлотиниб, лапатиниб, канертиниб, ZD6474, сорафениб (BAY 43-9006), ERB-569 и их аналоги и производные.
Модификаторы биологического ответа
Определенные белковые или маломолекулярные агенты могут использоваться для терапии рака, поскольку они оказывают как прямое, так и непрямое противоопухолевое действие. Примерами агентов с прямым действием, которые могут использоваться в соответствии с настоящим изобретением, являются, без ограничений указанными, реагенты дифференцировки, такие как ретиноиды или производные ретиноидов. Примерами агентов с непрямым действием, которые могут использоваться в соответствии с настоящим изобретением, являются, без ограничений указанными, агенты, которые усиливают или модифицируют иммунную систему и другие системы организма, а также активность таких активных молекул, как интерфероны, интерлейкины, гемопоэтические факторы роста (например, эритропоэтин), и антитела (моноклональные и поликлональные).
55555
Антиметастические агенты
Процесс, при котором раковые клетки распространяются из места первичной опухоли в другие части организма, называется метастазированием. Определенные агенты обладают антиметастатическим действием и специально разработаны для ингибирования распространения раковых клеток. Примерами таких агентов, которые могут использоваться в соответствии с настоящим изобретением, являются, без ограничений указанными, маримастат, бевацизумаб, трастузумаб, ритуксимаб, ерлотиниб, MMI-166, GRN163L, пептиды "поиска и уничтожения" ("hunter-killer"), тканевые ингибиторы металлопротеиназ (TIMPs. от англ. Tissue Inhibitors of Metalloproteinases), их аналоги и производные.
Химиопрофилактические агенты
Определенные фармацевтические агенты могут использоваться для профилактики первичного возникновения опухоли, а также для профилактики рецидивов и метастазирования. Введение указанных химиопрофилактических агентов в комбинации с одним или более другим противоопухолевым лекарственным средством, включая соединения нитробензамида, может оказывать как лечебное, так и профилактическое действие и способствовать профилактике рецидивов. К химиопрофилактическим агентам, которые могут использоваться в соответствии с настоящим изобретением, относятся, без ограничений указанными, тамоксифен, ралоксифен, тиболон, бисфосфонат, ибандронат, модуляторы рецепторов эстрогенов, ингибиторы ароматазы (летрозол, анастрозол), агонисты лютеинизирующего рилизинг-гормона, гозерелин, витамин А, ретиналь, ретиноевая кислота, фенретинид, 9-цис-ретиноевая кислота, 13-цис-ретиноевая кислота, полностью-транс-ретиноевая кислота, изотретионин, третиноид, витамин В6, витамин В 12, витамин С, витамин D, витамин Е, ингибиторы циклооксигеназы, нестероидные противовоспалительные средства (НПВС), аспирин, ибупрофен, целекоксиб, полифенолы, полифенол Е, экстракт чайного дерева, фолиевая кислота, глукаровая кислота, интерферон альфа, анэтола дитиолэтионин, цинк, пиридоксин, финастерид, доксазозин, селен, индол-3-карбиналь, альфа-дифторметилорнитин, каротеноиды, бета-каротин, ликопен, антиоксиданты, коензим Q10, флавоноиды, кверцетин, циркумин, катехины, эпигаллокатехина галлат, N-ацетилцистеин, индол-3-карбинол, инозитола гексафосфат, изофлавоны, глукановая кислота, розмарин, соя, пальма сереноа и кальций. Еще одним примером химиопрофилактических агентов, которые могут использоваться в соответствии с настоящим изобретением, являются противоопухолевые вакцины. Они могут быть получены путем иммунизации пациента целой клеткой ракового типа или ее частью, против которой затем и будет действовать вакцина.
Агенты для уменьшения побочных эффектов
Лечение рака при помощи соединений нитробензамида как самостоятельно, так и в комбинации с другими противоопухолевыми агентами может сопровождаться введением дополнительных фармацевтических агентов, которые позволяют уменьшить нежелательные побочные эффекты, которыми обычно сопровождается лечение противоопухолевыми агентами. К таким агентам, которые могут использоваться в соответствии с настоящим изобретением, относятся, без ограничений указанными, противорвотные средства, средства для уменьшения воспаления слизистых оболочек, агенты для уменьшения боли, агенты для борьбы с сопутствующими инфекциями, противоанемические средства и средства для борьбы с тромбоцитопенией. Примерами противорвотных средств, которые могут использоваться в соответствии с настоящим изобретением, являются, без ограничений указанными, антагонисты рецептора 5-гидрокситриптамина 3, метоклопрамид, стероиды, лоразепам, ондансетрон, каннабиноиды, их аналоги и производные. Примерами агентов для уменьшения воспаления слизистых оболочек являются, без ограничений указанными, палифермин (фактор роста кератиноцитов), подобный глюкагону пептид-2, тедуглутид, L-глутамин, амифостин и фактор роста фибробластов 20. Примерами агентов для купирования боли, которые могут использоваться в соответствии с настоящим изобретением, являются, без ограничений указанными, опиоиды, опиаты и нестероидные противовоспалительные средства. Примерами агентов, которые применяются для борьбы с сопутствующими инфекциями, являются, без ограничений указанными, антибактериальные средства, такие как аминогликозиды, пенициллины, цефалоспорины, тетрациклины, клиндамицин, линкомицин, макролиды, ванкомицин, карбапенемы, монобактамы, фторхинолоны, сульфонамиды, нитрофураны, их аналоги и производные. Примерами агентов, которые используются для лечения анемии или тромбоцитопении, ассоциированной с химиотерапией, и могут использоваться в соответствии с настоящим изобретением, являются, без ограничений указанными, эритропоэтин и тромбопоэтин.
Для комбинированной терапии, включающей введение соединений нитробензамида и других соединений, описанных в тексте, могут применяться и другие способы лечения рака. Например, см. Goodman & Gilman's The Pharmacological Basis of Therapeutics 11 th ed. Brunton LL, Lazo JS, and Parker KI, ed. McGraw-Hill. New York, 2006.
КОМПОЗИЦИИ, СПОСОБЫ ВВЕДЕНИЯ И ЭФФЕКТИВНЫЕ ДОЗЫ
Согласно другому аспекту, настоящее изобретение относится к композициям и способам введения фармацевтических композиций, содержащих соединение нитробензамида. Указанные фармацевтические композиции могут использоваться для лечения рака, в соответствии со способами, заявленными в соответствии с настоящим изобретением.
Соединение по формуле la может быть представлено в форме пролекарства и/или может принимать форму нитробензамида in vivo после введения. Таким образом, для создания композиции, заявленной в соответствии с настоящим изобретением, могут применяться соединения в форме нитробензамида и/или в форме нитрозобензамида, либо их фармацевтически доступные соли. Кроме того, согласно некоторым вариантам осуществления настоящего изобретения соединение может использоваться в комбинации с одним или более другим соединением, либо тем же соединением, но в другой форме. Например, композиция может содержать как соединение нитробензамида, а также его кислотные формы в определенных пропорциях, в зависимости от относительной активности каждого соединения и показаний для введения композиции. Две формы соединения могут быть объединены вместе, в одной лекарственной форме, например в креме, суппозитории, таблетке, капсуле или порошке для растворения в напитке; либо каждая форма соединения может входить в состав отдельной лекарственной формы, таким образом получается два крема, два суппозитория, две таблетки, две капсулы, таблетка и жидкость для растворения таблетки, порошок и жидкость для растворения порошка и т.д.
Композиции, включающие комбинации соединения нитробензамида и другого активного агента, могут быть эффективными. Два соединения и/или две формы соединения могут быть объединены вместе в одной лекарственной форме, например, в одном креме, суппозитории, таблетке, капсуле или порошке для растворения в напитке; либо каждая форма соединения может входить в состав отдельной лекарственной формы, таким образом, получается два крема, два суппозитория, две таблетки, две капсулы, таблетка и жидкость для растворения таблетки, порошок и жидкость для растворения таблетки, и т.д.
Термин "фармацевтически доступная соль" относится к солям, которые сохраняют биологическую эффективность и свойства соединений, используемых в соответствии с настоящим изобретением, и при этом не являются биологически или иначе нежелательными. Например, фармацевтически доступная соль не препятствует реализации благоприятного эффекта соединения, заявленного в соответствии с настоящим изобретением и предназначенного для лечения рака.
Обычно применяются соли неорганических ионов, таких как, например, ионы натрия, калия, кальция и магния. Кроме того, указанные соли включают соли неорганических и органических кислот, например соляной кислоты, бромисто-водородной кислоты, фосфорной кислоты, азотной кислоты, серной кислоты. метансульфоновой кислоты, р-толуолсульфоновой кислоты, уксусной кислоты, фумаровой кислоты, янтарной кислоты, молочной кислоты, миндальной кислоты, яблочной кислоты, лимонной кислоты, винной кислоты или малеиновой кислоты. Кроме того, в том случае, если соединения, используемые в соответствии с настоящим изобретением, содержат карбоксигруппу или другую кислотную группу, они могут быть преобразованы в фармацевтически доступную аддитивную соль с неорганическим или органическим основанием. Примерами подходящих оснований являются гидроксид натрия, гидроксид калия, аммиак, циклогексиламин, дициклогексиламин, этаноламин, диэтаноламин и триэтаноламин.
Для перорального введения, соединения могут быть быстро сформированы с лекарственную форму путем объединения активного соединения (соединений) с фармацевтически доступным носителем, обычно применяемым для таких целей. Указанные носители используются для придания соединениям, заявленным в соответствии с настоящим изобретением, приемлемой лекарственной формы, например таблетки, включая жевательные таблетки, пилюли, драже, капсулы, пластинки, твердые леденцы, жидкости, гели, сиропы, пасты, порошки, суспензии, эликсиры, вафли и т.п., указанные лекарственные формы могут употребляться пациентом перорально. Указанные композиции могут содержать фармацевтически доступные носители, включая твердые носители или наполнители, стерильную водную среду и различные нетоксичные органические растворители. В целом, концентрация соединений, заявленных в соответствии с настоящим изобретением, варьирует, приблизительно, от 0.5% до, приблизительно, 5%, до, приблизительно, 10%, до, приблизительно, 20% или, приблизительно, от 30% до 50%, приблизительно, до 60%, до 70%, до 80% или до 90% от общего веса композиции в составе пероральной лекарственной формы, в количестве, достаточном для создания нужной лекарственной формы.
Водные суспензии могут содержать соединение нитробензамида совместно с фармацевтически доступным наполнителем, таким как суспендирующий агент (например, метилцеллюлоза), увлажняющий агент (например, лецитин, лизолецитин и/или спирт длинноцепочечной жирной кислоты), а также краситель, консервант, ароматизатор и т.п.
Согласно одному варианту осуществления настоящего изобретения, для создания раствора активных соединений могут применяться масла или неводные растворители, поскольку в них присутствует большое количество липофильных молекул. Альтернативно, эмульсии, суспензии или другие лекарственные формы, например, липосомальные композиции, могут использоваться в соответствии с настоящим изобретением. Если иметь в виду липосомальные композиции, для создания липосом, предназначенных для лечения вышеозначенных состояний, могут быть получены при помощи любого известного способа. См., например, Bangham et al. J. Mol. Biol., 23: 238-252 (1965) и Szoka et al., Proc. Natl. Acad. Sci. 75: 4194-4198 (1978). Указанные источники включены в настоящее изобретение в качестве ссылок. Для того чтобы композиции достигли места своего действия, к липосомам могут быть присоединены лиганды. Соединения, заявленные в соответствии с настоящим изобретением, также могут быть включены в пищевые продукты, например плавленый сыр, масло, заправку для салата или мороженое, для того чтобы улучшить усвоение у определенных групп пациентов.
Фармацевтические композиции для перорального введения могут быть получены, например, в форме твердого наполнителя, путем измельчения полученной смеси, получения смеси гранул после добавления вспомогательного агента, если это необходимо, для получения таблеток или ядер драже. Подходящими наполнителями являются, в частности, наполнители, такие как сахара, включая лактозу, сахарозу, маннитол или сорбитол; ароматические агенты, композиции на основе целлюлозы, такие как маисовый крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовая камедь, метилцеллюлоза, гидроксипропилметилцеллюлоза, натриевая карбоксиметилцеллюлоза и/или поливинилпирролидон (PVP). Если необходимо, могут быть добавлены дезинтегрирующие агенты, такие как перекрестно-связанный поливинилпирролидон, агар, или альгиновая кислота, или их соли, такие как альгинат натрия. Соединения, заявленные в соответствии с настоящим изобретением, могут входить в состав композиций с замедленным высвобождением активного соединения.
Для ядер драже могут быть созданы подходящие оболочки. Для этой цели могут использоваться концентрированные сахарные растворы, которые могут содержать гуммиарабик, тальк, поливинилпирролидон, карбополовый гель, полиэтиленгликоль и/или диоксид титана, растворы для создания глазури и подходящие органические растворители или смеси растворителей. Для того чтобы дифференцировать различные комбинации активных соединений или различные их дозы, в смесь для создания оболочки таблетки или драже могут быть добавлены различные пигменты или красители.
К фармацевтическим композициям, которые могут вводиться перорально, относятся плотные ("push-fit") капсулы, созданные на основе желатина, а также мягкие, герметичные капсулы, созданные на основе желатина и пластификатора, такие как глицерол или сорбитол. Плотные капсулы могут содержать активные ингредиенты в смеси с наполнителями, такими как лактоза, связующими агентами, такими как крахмалы, и/или любрикантами, такими как тальк или магния стеарат, и, при необходимости, стабилизаторами. Для получения мягких капсул активные соединения могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкий парафин или жидкий полиэтиленгликоль. Кроме того, могут быть добавлены стабилизаторы. Все композиции для перорального введения должны входить в состав лекарственных форм, подходящих для указанного способа введения.
Для инъекционного введения ингибиторы, заявленные в соответствии с настоящим изобретением, могут быть включены в водные растворы, предпочтительно, в физиологические буферные растворы, такие как раствор Ханка, раствор Рингера или физиологический солевой буфер. Указанные композиции также могут включать один или более наполнитель, например консерватор, солюбилизатор, уплотнитель. любрикант, стабилизатор, альбумин и т.п. Способы получения указанных композиций хорошо известны специалистам в данной области и описаны, например, в "Remington's Pharmaceutical Sciences", последнее издание. Mack Publishing Co., Easton P. Указанные соединения также могут входить в состав лекарственных форм для нанесения на слизистые, для буккального введения, для ингаляционного введения, для парентерального введения, для чрескожного введения и ректального введения.
Помимо описанных выше композиций могут использоваться так называемые депо-композиции, содержащие заявленные активные соединения. Такие композиции с длительным действием могут вводиться в организм путем трансплантации или путем чрескожного введения (например, подкожного или внутримышечного), внутримышечного введения или использования трансдермального пластыря. Таким образом, например, соединения могут быть объединены с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в подходящем масле), или ионообменной смолой, или плохо растворимым производным, например, таким как плохо растворимая соль.
К фармацевтическим композициям, заявленным в соответствии с настоящим изобретением, относятся композиции, в которых активные ингредиенты присутствуют в эффективном количестве, то есть в количестве, эффективном для достижения терапевтического и/или профилактического благоприятного действия в отношении, по крайней мере, одной формы рака, описанной здесь. Актуальное количество, эффективное при определенном применении, будет зависеть от патологического состояния, для лечения которого применяется соединение, общего состояния субъекта, композиции и пути введения, а также от многих других факторов, хорошо известных специалистам. Процесс определения эффективного количества соединения нитробензамида легко осуществляется специалистом в данной области, в свете изложенного в тексте, при помощи стандартных оптимальных технологий.
ПРИМЕРЫ
ПРИМЕР 1
Исследование In Vitro - Анализ цитотоксичности
Различные типы раковых клеточных линий различного происхождения или первичные клетки высевают на 48-луночные планшеты (5×104) или 96-луночные планшеты (2×104). Клетки культивируют в подходящей среде. Культуры клеток поддерживают в инкубаторе при 37°С в увлажненной атмосфере 95% O2/5% CO2. После того как клетки высевают (24 часа), среду удаляют и замещают культуральной средой в присутствии различных концентраций INO2BA или INH2BP, а также 200 мкМ BSO, или без него. После 6 дней инкубации при 37°С, жизнеспособность клеток измеряют при помощи прибора Cell Titer-Blue, анализатора выживаемости клеток (Promega) (См. O'Brien, J. et al., (2000). Определяют флуоресцентный краситель аламарский голубой для оценки цитотоксичности клеток млекопитающих. Eur. J. Biochem.267, 5421-26 and Gonzales, R.J. and Tarloff, J.B. (2001). Оценка печеночной субклеточной фракции для аламарского голубого и МТТ редуктазы). Указанное исследование включает флуометрический/колометрический индикатор роста, основанный на определении восстановления витального красителя. Цитотоксичность измеряют на основании ингибирования роста.
Цитотоксичность также оценивают путем подсчета количества выживших клеток. Клетки выращивают путем отмывания монослоя PBS с последующей короткой инкубацией в 0.25% трипсине и 0.02% ЭДТА. Затем клетки собирают, отмывают дважды центрифугированием и повторно суспендируют в ЭДТА. Количество клеток и их жизнеспособность определяют путем окрашивания небольшого количества клеточной суспензии 0.2% трипановым голубым в солевом растворе и изучением клеток в гемоцитометре. См. Kerley-Hamilton et al. (2005) р53-доминантный транскрипционный ответ на цисплатин в эмбриональной карциноме человека, выделенной из опухоли половых клеток яичек, и Cheol et al. (2005). Индукция апоптоза и ингибирование экспрессии циклооксигеназы-2 N-метил-N'-нитро-N-нитрозогуанидина в лейкозных клетках у человека.
Результаты указанного исследования клеточной пролиферации с использованием различных клеточных линий показаны на рисунках 1-10.
ПРИМЕР 2
Клеточная пролиферация, измеренная при помощи BrdU-ELISA
Клетки инкубируют в присутствии различных концентраций тестируемой субстанции (лекарственного средства) в черном 96-луночном микропланшете (МР) (косая тканевая культура; плоское, чистое дно) до финального объема 100 мкл/лунку в увлажненной атмосфере при 37°С. 10 мкл на лунку BrdU-меченого раствора добавляют, если клетки культивируют в 100 мкл на лунку (конечная концентрация: 10 мкМ BrdU), после чего клетки повторно инкубируют в течение дополнительного времени от 2-х до 24 часов при 37°С (если клетки культивируют в 200 мкл на лунку; добавляют 20 мкл на лунку Brd-меченого раствора). МР центрифугируют при 300 об/мин в течение 10 минут и меченую среду удаляют путем высасывания при помощи пипетки. Клетки высушивают при помощи фена в течение 15 минут или, альтернативно, при 60°С в течение 1 часа. К клеткам добавляют 200 мкл на лунку реактива FixDenat и инкубируют в течение 30 минут при 15-25°С. Раствор FixDenat тщательно удаляют путем встряхивания и пункции. Добавляют рабочий раствор Анти-Brd-POD в концентрации 100 мкл на лунку. Полученную среду инкубируют приблизительно 90 минут при 15-25°С. Альтернативно, указанный период инкубации варьировал от 30 до 120 минут в зависимости от индивидуальных требований. Конъюгат антител удаляют путем встряхивания, а лунки промывают трижды отмывающим раствором в количестве 200-300 мкл на лунку. Отмывающий раствор удаляют при помощи пункции. Чистое дно покрывают черной адгезирующей фольгой и в каждую лунку добавляют 100 мкл раствора субстрата при помощи многоканальной пипетки. Световое излучение образцов измеряют в люминометре для прочитывания планшетов с использованием фотоэлектронного умножителя.
Результаты описанного исследования пролиферации клеток с использованием различных клеточных линий и лекарственных средств представлены на Рисунке 11.
ПРИМЕР 3
План исследования
100 мышам женского пола линии NU/NU-nuBR (Charles River, 5-6 недель) имплантируют капсулы, содержащие 0.72 мг 17-β-эстрадиола (человека), животных помечают, прикрепляя клипсы на уши, и взвешивают за 24-28 часа перед имплантацией опухолевых клеток. Опухолевые клетки, ВТ474 (2×107 клеток одному животному), вводят в подлопаточную жировую подушку молочной железы (объем 0.2 мл). Измерения циркулем начинают на 21 день эксперимента и затем производят трижды в неделю (в понедельник, среду, пятницу). Животных разделяют вначале на основании наличия или отсутствия опухоли, а затем на основании размера опухоли. Животных взвешивают дважды в неделю, начиная с 3-й недели после имплантации (понедельник и пятница). Лечение лекарственными препаратами начинают, когда размер опухоли достигает 150-250 мм2 (L*W*Н; Длина×Ширина×Высота). Введение лекарства и носителя осуществляют дважды в день через желудочный зонд (ВР+BSO) и один раз в день интраперитонеально (ВА) в течение 5 дней. Перед началом следующего этапа лечения делают двухдневный перерыв, затем лечение продолжают в течение 4-8 недель путем перорального введения доз препаратов: кукурузное масло: PEG 400 или ВР. В Эксперименте 2 ВР сравнивают с химиотерапевтическими агентами, используемыми в клинике. Голым мышам женского пола, имеющим опухоли размером 20-30 мм3 (MDA MB 231) пять раз в неделю перорально вводят дозы либо композиции кукурузное масло: PEG 400, ВР, либо циклофосфамида (СТХ, позитивный контроль для MDA MB 231).
Лечение для MDA MB 231 опухолей продолжают до тех пор, пока опухоль у каждого животного достигнет размера ≥1600 мм3 или не начнет разрушаться. Некоторые MDA MB 231 опухоли в Эксперименте 2 не достигли размера 1600 мм3. Отдаленные результаты регресса опухоли изучают в течение 3 месяцев.
MDA MB 231 опухоли молочной железы отвечали на лечение ВР и СТХ (позитивный контроль). В Эксперименте 1 было показано, что ВР в дозе 300 мг/кг и 1000 мг/кг препятствует формированию опухоли у 2/9 и 2/10 животных соответственно. У всех 8-ми контрольных животных сформировались опухоли. В Эксперименте 2 лечение животных ВР (1000 мг/кг или 2000 мг/ кг массы тела) приводило к регрессу 3/5 опухолей.
ОБЩИЕ МЕТОДЫ
Клетки рака молочной железы человека линии MDA MB 231 вводят подкожно в правый бок голых мышей женского пола. Для Эксперимента 1 ВР вводят в течение 5 дней последовательно перед имплантацией опухоли и затем 5 раз в неделю в течение 4-8 недель после имплантации. Для Эксперимента 2 раковые клетки вводят, когда средний размер опухоли достигает 50-60 мм3, затем животных разделяют на следующие группы: группу из 8 животных и группы, получавшие препарат кукурузный сироп: PEG 400 (контроль), ВР или СТХ (MDA MB 231 позитивный контроль). Объем опухолей контролируют в течение 90 дней (для MDA MB 231) после начала лечения.
ОСУЩЕСТВЛЕНИЕ ЭКСПЕРИМЕНТОВ
Клеточные линии
MDA MB 231 представляет собой линию раковых клеток молочной железы человека, которую впервые выделили в 1973 году из плеврального выпота пациента, который получал лечение 5-FU, доксорубицином, метотрексатом и СТХ в течение 3-х месяцев до того, как было инициировано развитие клеточной линии. Эта линия является негативной по рецепторам эстрогена и используется для скрининга противоопухолевых лекарственных средств, которые не действуют как антагонисты гормонов. MDA MB 231 выращивают на среде Игла, модифицированной по способу Дульбекко (DMEM, от англ. Dulbecco's Modified Eagle Medium) с добавлением 1.5 г NaHCO3/л, 10% фетальной телячьей сыворотки (FBS) и 2 мМ L-глутамина и хранят при 37°С в инкубаторе с увлажненной 5% CO2/воздух атмосфере.
Экспериментальная модель опухоли на животных
Голых мышей линии Swiss NCr (nu/nu), в возрасте 4-5 недель, получают в лаборатории Taconic (Germantown, NY). Животных содержат в стерильных клетках, покрытых фильтром, (Bio Bubble, Inc. [Fort Collins, CO]) в чистой огражденной комнате, по трое животных в клетке. Поддерживают температуру 72±5°F и относительной влажности 35-70%, используют 12-часовой цикл смены света и темноты. Мышей кормят стерильной, автоклавируемой, сертифицированной смесью для грызунов Purina ad libitum. Питьевую воду закисляют и автоклавируют, а воду из источника перегоняют, деионизируют, обрабатывают УФ и фильтруют через 5 мкм фильтр.
После того как мышей снимают с карантина, им подкожно в правый бок вводят 1 или 5×106 клетки MDA MB 231 (0.1 мл - инъекционный объем). В Эксперименте 1 животные в течение 5 дней до введения клеток получают предварительное лечение. Размеры опухоли и массу тела мышей измеряют дважды в неделю. Для измерения размера опухолей используют штангенциркуль с нониусом и измеряют три величины, в итоге получают объем опухоли (V) следующим образом: V=π(x·у·z)/6, где x, у и z - размеры опухоли минус толщина кожи. В конце эксперимента мышей умерщвляют при помощи ингаляции СО: с последующим вывихом шеи.
Фармацевтические препараты
ВР приготавливают в носителе: кукурузное масло: PEG 400 (2:1, V/V) в концентрации 30 мг/мл и 100 мг/мл. Лекарственное средство представляет собой суспензию с указанными концентрациями. Лекарственное средство для позитивного контроля получают на фосфатно-буферном солевом растворе (PBS) и СТХ в концентрации 15 мг/мл. Оба лекарственных средства перед использованием подвергают фильтр-стерилизации (0.2 мкм-фильтр).
Схема лечения
Для Эксперимента 1, мышам, которым впоследствии имплантируют опухолевые клетки MDA MB 231, проводят предварительное лечение ВР (300 или 1000 мг/кг) в течение 5 дней, а после подкожного введения клеточной суспензии лечение продолжают минимум 4 недели с введением препарата 5 раз в неделю (с понедельника по пятницу).
Для Эксперимента 2, после того как опухоли достигнут установленного размера (средний объем опухоли 50-60 мм3), мышей разделяют на лечебные группы, по восемь животных в каждой группе. Всем группам животных, которые получали ВР, вводили препарат 5 раз в неделю (с понедельника по пятницу) в течение, по крайней мере, 4 недель. СТХ вводят интраперитонеально однократно в дозе 150 мг/кг. ВР всем животным вводили перорально; доза составляла от 1000 до 2000 мг/кг для животных, которым имплантировали MDA MB 231 клетки. Во всех экспериментах лечение начинают в один и тот же день.
После первого курса лечения размер опухолей измеряют дважды в неделю в течение, по крайней мере, 9 недель (MDA MB 231). Средний размер опухолей в каждой группе рассчитывают в каждой временной точке. Сравнение между группами в специфические отрезки времени осуществляют при помощи непарного, двухстороннего критерия Студента, а результаты анализируют при помощи анализа вариаций (ANOVA). Для Эксперимента 2, индивидуальный размер опухоли (V0) выражают как фракцию объема опухоли на 0 день, первый день лечения (Vo). Ответ на лечение оценивают двумя способами, в зависимости от того, как опухоль реагирует на лечение. Время удвоения объема опухоли (VDT, от англ. Volume Doubling Time) и время увеличения объема опухоли в 4 раза (VQT, от англ. Volume Quadrupling Time) для каждой опухоли определяют путем линейной регрессии на графике времени как функцию tog (объем опухоли) в тех группах, где наблюдался ответ на лечение. Определяют замедление роста опухолей в каждой лечебной группе, сравнение между группами осуществляют при помощи ANOVA.
Системную токсичность оценивают, измеряя уменьшение массы тела животных после лечения. Мышей умерщвляют по окончании периода изучения отдаленных результатов, или ранее, если объем опухоли достигает 1600 мм3 или опухоль начинает разрушаться.
Статистический анализ
Описанный выше статистически анализ осуществляют при помощи программы InStat (Graphpad Software, San Diego, CA).
ОПУХОЛЕВЫЙ РОСТ
Опухоли MDA MB 231 можно заметить уже через 3 недели после введения опухолевых клеток, они растут медленно, время удвоения объема опухоли составляет 7 дней. Указанные величины рассчитывают на основе контрольной группы. Средние объемы опухолей и средняя масса тела животных на момент начала лечения показаны в Таблице 1 для Эксперимента 1 и в Таблице 2 для Эксперимента 2.
Ответ опухоли на лечение
Предварительное лечение мышей, которым имплантировали MDA MB 231, предотвратило образование опухоли у 1/9 мышей и привело регрессии одной небольшой опухоли, которая достигла размера 10 мм3 перед тем, как исчезнуть. Предварительное лечение мышей ВР в дозе 1000 мг/кг предотвращает опухолевый рост у 2/10 мышей (20%); одна опухоль, которая на 63 день достигла размера 195 мм3, регрессировала до 93 мм3 на 86 день, когда исследование завершилось. Средняя продолжительность жизни животных, получавших предварительное лечение ВР в дозе 1000 мг/кг, составляла 115 дней, по сравнению с продолжительностью жизни контрольной группы (72 дня, р=0.01), если учитывать, что продолжительность жизни животных, у которых не сформировались опухоли, составляла 6 месяцев (180 дней).
MDA MB 231 опухоли в Эксперименте 2 отвечали на оба варианта лечения. СТХ (150 мг/кг) и ВР (1000 или 2000 мг) последовательно замедляли опухолевый рост, лечение индуцировало полную регрессию опухолей при использовании обоих лекарственных средств. У двух животных, получавших РВ в дозе 1000 мг/кг, не было отмечено уменьшения скорости роста опухолей по сравнению с контрольными животными, в то время как 2 опухоли полностью регрессировали. У всех трех животных, получавших ВР в дозе 2000 мг/кг, была отмечена полная регрессия имплантированных опухолей. Лечение завершили на 24 день, когда 2 опухоли полностью регрессировали, а одна относительно большая опухоль начала регрессировать (с 310 мм3 на 31 день до 163 мм3 на 45 день). Ни одна из полностью регрессировавших опухолей не возобновила свой рост в течение 3-месячного периода изучения отдаленных результатов, однако те опухоли, которые к моменту окончания лечения регрессировали не полностью, вновь начинали расти и достигли размера 1835 мм3 на момент окончания эксперимента. Была отмечена тенденция к увеличению средней продолжительности жизни животных, получавших ВР в дозе 2000 мг/кг.
Результаты экспериментов представлены на Рисунках 15 и 16.
ПРИМЕР 6
Неклиническая токсикология
Программа неклинической токсикологии, поддерживающая применение 4-йодо-3-нитробензамида (ВА) в онкологии, включает следующие исследования: острой токсичности препарата (одна-доза), двухнедельной токсичности (множественные дозы), токсичности при распределении доз и токсичности множественных доз (4-недели) у крыс и собак, которым ВА вводят интраперитонеально. В указанных исследованиях ВА вводят совместно с бета-гидроксипропилциклодекстрином (25%) (Клептоза).
Дефинитивное 4-недельное исследование включает введение ВА дважды в неделю в дозе 60 мг/кг в день с последующим всесторонним клиническим обследованием и/или микроскопической оценкой полного набора тканей. Изучение токсичности множественных доз включает электрокардиографическое исследование и физический осмотр, включая определение параметров сердечной деятельности и дыхания, а также измерение температуры тела. Токсикокинетические данные собирают на 4 неделе исследования множественных доз у крыс и собак. Кроме того, проводят два специальных исследования: in vitro исследование гемолитического потенциала/совместимости плазмы с кровью и плазмой собак и людей; и исследование в/в локальной толерантности у кроликов. Также проводят изучение токсичности одной дозы препарата у крыс для того, чтобы оценить влияние дозировок на возникновение ВА-индуцированных неврологических и поведенческих реакций на данных моделях.
ВА хорошо переносится после однократного внутривенного введения в дозе 50 мг/кг крысами и собаками. После однократного внутривенного болюсного введение в дозе 100 мг/кг появляются клинические симптомы, включая судороги у крыс и атаксию у собак. Повторное введение препарата в дозе 100 мг/кг приводит к клиническим изменениям, которые включают сначала появление избыточного слюноотделения, а затем отказ от приема пищи и уменьшение массы тела.
ПРИМЕР 7
Название: 1-фазное, первое у человека, открытое исследование высоких доз, направленное на оценку безопасности и фармакокинетики ВА у субъектов с прогрессирующими солидными опухолями.
Фаза исследования: 1
Показания: Лечение солидных прогрессирующих опухолей
Первичные цели: Оценить безопасность, установить максимальную переносимую дозу (MTD, от англ. Maximum Tolerated Dose) и создать фармакокинетический профиль ВА после в/в введения у взрослых субъектов с гистологическим подтверждением солидной прогрессирующей опухоли, которая устойчива к стандартной терапии или для которой стандартная терапия недоступна.
Вторичные цели: Оценить ответ у изучаемых субъектов (по критерию RECIST) с "измеряемым" заболеванием. Оценить профиль безопасности: существенное изменение лабораторных показателей и нежелательные явления, неблагоприятные реакции на применение лекарства (AEs, от англ. Adverse Events), которые не расцениваются как дозолимитирующая токсичность (DLT, от англ. Dose Limiting Toxicity).
Исследовательские цели: Оценить эффект лечения на биологические маркеры опухолевого статуса.
Протокол исследования: Первое у человека, 1-фазное, открытое исследование повышения дозы осуществляют для того, чтобы определить безопасность, MTD и РК профиль ВА. ВА вводят внутривенно дважды в неделю (1 и 4 день каждой недели) в течение 3-х недель с последующим 1-недельным перерывом на один 28-дневный цикл. Первый цикл (с 1-го по 28-й день) определяют как фазу изучения безопасности исследования, во время которой определяют MTD. Оставшийся период исследования обозначают как поддерживающую фазу. Субъекты могут принимать участие в исследовании до тех пор, пока не возникнут симптомы непереносимости лекарства либо прогрессирование заболевания.
Оценку безопасности осуществляют согласно критериям, изложенным в документе "Общие Критерии Терминологии для обозначения Нежелательных Явлений" (СТСАЕ, от англ. Common Terminology Criteria for Adverse Events) Версия 3.0, датированная Декабрем 2003 года. Первую оценку ответа опухоли на лечение, для "измеримого" заболевания, осуществляют на 8 неделю исследования и приблизительно каждые 8 недель после. Для подтверждения прогрессирования заболевания используют критерии, изложенные в руководстве "Критерии оценки ответа при солидных опухолях" (RECIST, от англ. Response Evaluation Criteria in Solid Tumors). Для "неизмеримых" заболеваний определение времени прогрессирования заболевания будут осуществлять опытные врачи.
Первичные и вторичные клинические результаты: Первичными клиническими результатами являются: безопасность/толерантность для характеристики DLT и РК профилей: период полувыведения ВА (t ½), максимальная наблюдаемая концентрация (Сmах), площадь под фармакокинетической кривой "концентрация-время" (AUC) и клиренс (CL). Вторичными клиническими результатами являются: ответ опухоли по критериям RECIST; профили безопасности: существенные лабораторные изменения и другие AEs (не идентифицированные как DLT). Также оценивают уменьшение уровня циркулирующих опухолевых клеток (СТС, от англ. Circulating Tumor Cells).
Размер образцов: В исследовании участвует не менее 36 человек. Субъектов исследования разделяют на последовательные группы, включающие 1, 3 или 6 субъектов, в зависимости от вводимой дозы. Для установления MTD может понадобиться минимум 10 групп.
Краткое изложение критериев отбора субъектов исследования
Критерии включения: (а) ≥ 18 лет с гистологически подтвержденной прогрессирующей твердой опухолью, устойчивой к стандартной терапии, или для которой стандартная терапия недоступна, (b) общий статус больного ≤ 2 согласно критериям Восточной Объединенной Группы Онкологов (ECOG, от англ. Eastern Oncology Cooperative Group) и (с) абсолютным количеством нейтрофилов (ANC) ≥1.5×109/л (без GCF поддержки в течение 2-х недель исследования, 1 день); число тромбоцитов ≥ 100.0×109/л (без трансфузии в течение 2 недель, день 1); и гемоглобин ≥ 9.0 г/дл (позволяется применение эритропоэтинов).
Критерии исключения: субъект принимает участие в другом исследовании какого-либо устройства или лекарственного препарата, или получает другие изучаемые агенты; гематологические злокачественные заболевания; наличие метастазов в головной мозг, имеющих симптоматику или требующих сопутствующего лечения; MI в течение 6 месяцев исследования день 1, нестабильная ангина, застойная сердечная недостаточность (CHF)>II класса согласно критериям Нью-йоркской Ассоциации Кардиологов (NYHA), неконтролируемая гипертензия; сопутствующая или предшествующая (в течение 7 дней до 1-го дня исследования) терапия антикоагулянтами; щелочная фосфатаза >2.5×ULN (верхняя граница нормы) или >5.0, вторичные изменения за счет метастазов в печень или кости; общий билирубин >1.5×UTL(верхняя граница нормы); системная химиотерапия за 28 дней до 1-го дня исследования (период отмывания 42 дня для BCNU или митомицина С); лучевая терапия за 28 дней до 1-го дня исследования; терапия антителами для лечения основной опухоли за 1 месяц до 1-го дня исследования и; сопутствующая химиотерапия любым агентом, но не ВА; и лучевая терапия также не разрешаются во время исследования.
Установленные дозы препаратов и их введение: ВА в концентрации 10 мг/мл предоставляют во флаконах объемом 10 мл; t оценивают с учетом того, что для определения MTD может потребоваться не мене 10 групп субъектов.
Начальные дозы (Группа А): В Группе А 1 субъект получает ВА дважды в неделю в дозе 0.5 мг/кг с учетом веса субъекта, измеренном во время скрининга. В том случае, если у субъекта регистрируется 2 степень токсичности и более, в группу дополнительно включают еще 3-х субъектов. В том случае, если у дополнительных субъектов не регистрируется DLT, тогда повышение дозы осуществляют как описано ниже.
Повышение дозы до достижения 2-й степени токсичности (потенциальные группы B-J): До тех пор, пока не будет регистрироваться 2-я степень токсичности или выше, субъекта последовательно включают в группы с планируемым 100% увеличением дозы, с возможным расширением группы, как описано для группы А. Данные по безопасности оценивают после введение 6 доз ВА, решение о повышении дозы и переходе к следующей группе принимают, если ни у одного из субъектов не регистрируется 2-я степень токсичности или выше. В том случае, если у 1 субъекта регистрируется 2-я степень токсичности или выше, в группу включают еще 3-х субъектов. Если ни у кого из указанных трех субъектов не регистрируется DLT. тогда осуществляют дополнительное повышение дозы. Если хотя бы у одного из 3-х субъектов отмечается DTL, тогда в эту же группу включают дополнительно еще трех субъектов и вводят им ту же дозу. Если ни у кого из указанных трех субъектов не наблюдается DTL, тогда вновь повышают дозу препарата. Если хотя бы у одного или более из дополнительных субъектов определяется DTL, тогда предварительную меньшую дозу определяют как MTD. Дополнительные субъекты могут оставаться на MTD препарата, для того чтобы обеспечить получение ВА, по крайней мере, 18 субъектами в течение исследования.
Повышение дозы после достижения 2-й степени токсичности (потенциальные группы B-J): После того как устанавливают дозу, ассоциированную с первичной 2-й степенью токсичности и отфильтровывают ее повышение на следующих этапах исследования, составляют следующие экспериментальные группы, состоящие из 3-х субъектов (группы В, С, D, E, F, G, Н, I или J). Если ни у кого из 3-х субъектов не регистрируется DTL, продолжают повышение дозы в следующей группе. Если хотя бы у 1 субъекта из 3-х отмечается DTL, тогда в эту же группу включают еще 3-х участников и вводят им ту же дозу препарата. Если ни у кого из указанных трех дополнительных участников не отмечается DTL, осуществляют повышение дозы. Если хотя бы у одного или более из дополнительных субъектов определяется DTL, тогда предварительную меньшую дозу определяют как MTD. Дополнительные субъекты могут оставаться на MTD препарата, для того чтобы обеспечить получение ВА, по крайней мере, 18 субъектами в течение исследования.
Повышение дозы у субъектов: После того как определенная доза ВА устанавливается как безопасная и толерантная, на основании описанных выше критериев, становится возможным повысить дозу препарата до высшей безопасной дозы (устанавливается законным исследователем) для всех субъектов, получающих меньшую дозу. После определения MTD, все субъекты исследования могут считаться подходящими для получения MTD.
Ограничения общего повышения дозы: После того как наблюдается 2-й уровень токсичности и будет последовательно оттитрована доза, индивидуальное повышение дозы группам становится более консервативным и ограничивается, приблизительно, максимальным 40% увеличением по сравнению с предыдущей дозой до тех пор, пока не отмечается 3-я степень токсичности, с последующим повышением дозы, ограниченным приблизительно 25% от предыдущей. Абсолютное повышение дозы определяется после исследования безопасности во всех группах и оценки всех доступных данных.
Контрольная группа: отсутствует
Процедуры:
Скрининг: Скрининговые тесты, предшествующие отбору, и оценку осуществляют только после подписания документа экспертного совета организации (IRB, от англ. Institutional Review Board), подтверждающего добровольное информированное согласие каждого субъекта на участие в исследовании. Все процедуры осуществляют в течение первых 2-х недель исследования, начиная с 1-го дня, если дополнительно не оговаривается иное. Клиническое обследование включает полный сбор анамнеза, физическое обследование, ECOG статус, рост, массу тела, витальные знаки и документирование сопутствующих медицинских процедур. Лабораторные исследования включают: анализ крови (с дифференцировкой, числом ретикулоцитов и тромбоцитов); протромбиновое время (РТ) и частичное тромбопластиновое время (РТТ); развернутый биохимический анализ крови (натрий, калий, хлор, CO2, креатинин, кальций, фосфор, магний, BUN, мочевая кислота, альбумин, ACT, АЛТ, щелочная фосфатаза, общий билирубин и холестерин, HDL и ЛДГ), общий анализ мочи с микроскопическим исследованием, сывороточные опухолевые маркеры, а также тест на беременность у женщин детородного возраста (анализ сыворотки и мочи). Исследование функции сердца включает: определение уровня креатинкиназы (СК) и электрокардиограмму в 12-ти отведениях (ЭКГ). Клиническое обследование включает визуализацию проявлений заболевания при помощи компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ) за 4 недели до 1-го дня исследования. Также осуществляют документацию симптомов "неизмеримых" раковых заболеваний.
Лечение: Подходящих субъектов включают в исследование. Субъекты начинают получать лекарство на 1 день исследования. Обследования до введения первой дозы и после ее введения осуществляют, как описано в протоколе исследования. Введение ВА осуществляют дважды в неделю на 1, 4, 8. 11, 15 и 18 день 28-дневного цикла; путем инфузии в течение 2-х часов. На 29 день начинается 2-й цикл исследования, субъекты получают препарат на 1, 4, 8, 11. 15 и 18 день каждого последующего цикла. Субъекты могут принимать участие в исследовании до тех пор, пока не появятся признаки непереносимости препарата или прогрессирования заболевания, при условии согласия субъекта. Субъекты, у которых определяются модифицированные RECIST критерии или признаки прогрессирования заболевания, могут продолжать участие в исследовании, если у них отмечается клинический благоприятный результат.
Первое измерение ответа опухоли на лечение (для "измеримых" опухолей) осуществляют на 8 неделе исследования (день исследования 50±5 дней), и на каждой последующей 8-й неделе исследования. Ответ опухоли на лечение, согласно критериям RECIST, используют для подтверждения прогрессирования заболевания при помощи КТ и МРТ. Для "неизмеримых" заболеваний для определения времени начала прогрессирования заболевания применяют результаты обследования опытным специалистом.
Окончание исследования: Все субъекты прекращают свое участие в исследовании, как описано в протоколе, не позднее чем через 30 дней после введения последней дозы ВА. Если в течение 30 дней до введения последней дозы ВА пациентам не проводится полное клиническое обследование с визуализацией патологических изменений на предмет установления ответа опухоли на лечение, указанное обследование осуществляют в конце исследования.
Статистические данные: Количественный показатель распределения рассчитывают для безопасности, РК и PD. Данные ответа опухолей на лечения, позволяющие установить время прогрессирования, представляют в виде подробного списка. Данные, касающиеся прогрессирования заболевания, разделяют на категории в соответствии с критериями RECIST.
Параметры РК оценивают при помощи не-компартментного анализа. Параметры РК объединяют арифметической средней, стандартным отклонением, коэффициентом вариации, максимальной, минимальной, медианой и геометрической средней. Общие статистические данные рассчитывают при помощи программы SPlus версия 5.1 (или более поздняя версия).
Если необходимо для сравнительного анализа, все данные могут анализироваться при помощи нелинейного моделирования смешанных эффектов (популяционный подход). Другие варианты анализа осуществляют описательно в установленном порядке. Результаты оценивают после того, как все субъекты пройдут, по крайней мере, один цикл (6 доз) приема ВА в MTD дозе (или в наибольшей дозе, установленной в исследовании). Это будет соответствовать завершению фазы изучения безопасности. Дополнительный анализ осуществляют на текущей основе, что необходимо для получения информации для будущих исследований.
Все представленные примеры приведены с иллюстративной целью и ни коим образом не ограничивают объема и сущности изобретения. Кроме того, раскрытые в описании и другие модификации и варианты настоящего изобретения могут быть осуществлены специалистом в данной области знаний без выхода за пределы объема изобретения, который отражен в формуле.
Кроме того, должно быть понятно, что различные аспекты и воплощения изобретения могут быть частично или полностью изменены без изменения его сущности.


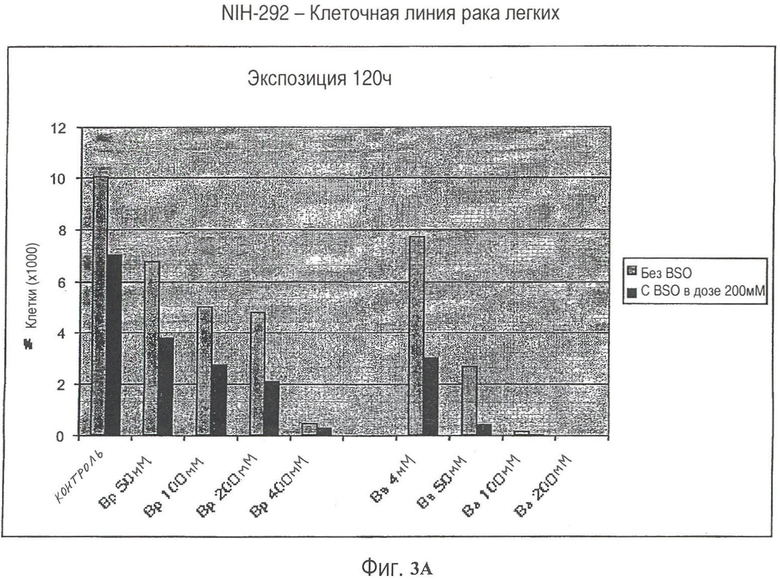




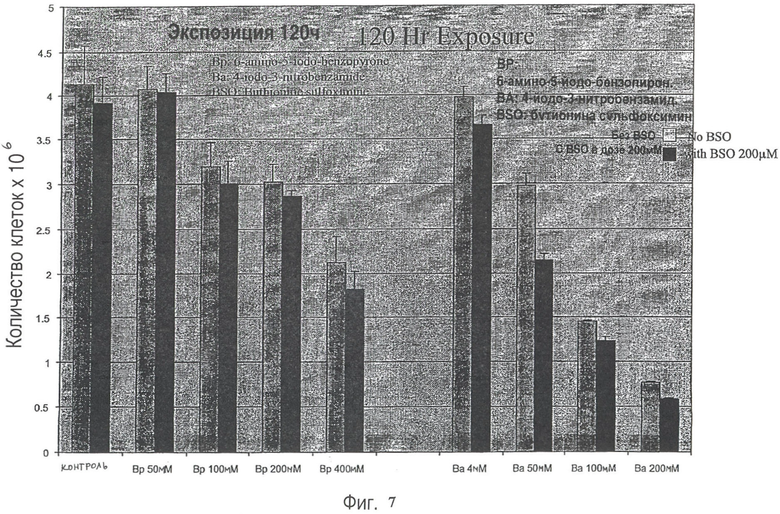





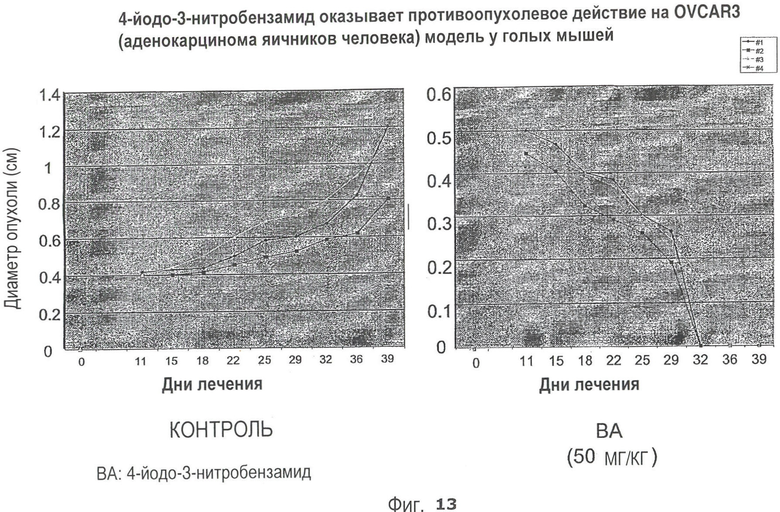

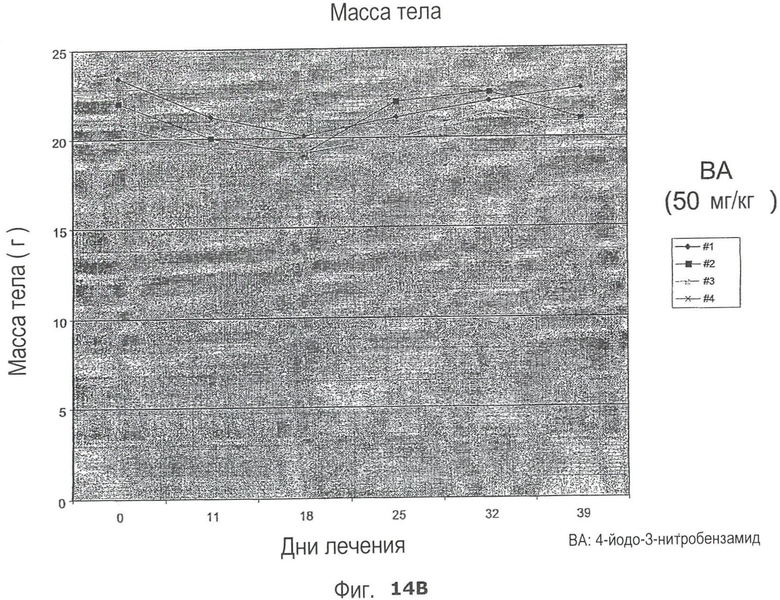


Изобретение относится к медицине, а именно к онкологии, и может быть использовано для лечения рака яичников. Для этого пациенту вводят эффективное количество композиции, содержащей соединение формулы

или его фармацевтически приемлемую соль. Введение данного соединения, ингибирующего поли-АДФ-рибозополимеразу, приводит к нарушению клеточного цикла опухолевых клеток рака яичников различных линий и их апоптозу, что позволяет эффективно лечить рак указанной локализации. 12 з.п.ф-лы, 3 табл., 7 пр., 18 ил.
1. Способ лечения рака яичников, включающий введение субъекту, страдающему раком яичников, эффективного количества композиции, содержащей соединение формулы

или его фармацевтически приемлемую соль.
2. Способ по п.1, где рак яичников представляет собой аденокарциному яичников или аденокарциному яичников с прорастанием в брюшную полость.
3. Способ по п.2, где рак яичников представляет собой аденокарциному яичников.
4. Способ по п.2, где рак яичников представляет собой аденокарциному яичников с прорастанием в брюшную полость.
5. Способ по п.1, где рак яичников представляет собой рак, принадлежащий к типу линии клеток OVCAR3.
6. Способ по п.1, где рак яичников представляет собой рак, принадлежащий к типу линии клеток Skov3.
7. Способ по п.1, где рак яичников представляет собой эпителиальный рак яичников.
8. Способ по п.1, дополнительно включающий гормональную терапию.
9. Способ по любому из пп.1 и 2, дополнительно включающий применение хирургического вмешательства, лучевой терапии, химиотерапии, генной терапии, иммунотерапии или их комбинаций.
10. Способ по любому из пп.1 и 2, дополнительно включающий введение эффективного количества бутионина сульфоксимина.
11. Способ по любому из пп.1 и 2, где композицию вводят внутривенно.
12. Способ по любому из пп.1 и 2, где происходит апоптоз опухолевых клеток, нарушение клеточного цикла опухолевых клеток и/или некроз опухоли у указанного субъекта.
13. Способ по любому из пп.1 и 2, где соединение предназначено для перорального введения.
| US 5464871 А, 07.11.1995 | |||
| Экономайзер | 0 |
|
SU94A1 |
| RAMONAS K | |||
| et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| BRYANT H.E | |||
| et al | |||
| Poly(ADP-ribose) polymerase inhibitors as potential chemotherapeutic | |||
Авторы
Даты
2012-04-20—Публикация
2006-07-18—Подача