Изобретение относится к соединениям, обладающим селективной антагонистической активностью против NK2-рецепторов.
Известно, что NK1-рецепторы, NK2-рецепторы и NK3-рецепторы действуют как тахикининовые рецепторы. Что касается антагонистов тахикининов, то в последние годы обнаружены соединения, проявляющие селективную антагонистическую активность в отношении одного из NK1-рецепторов, NK2-рецепторов и NK3-рецепторов и соединения, проявляющие антагонистическую активность в отношении нескольких субтипов рецепторов (например, против как NK1-рецепторов, так и NK2-рецепторов). В случае намерения полностью ингибировать действие тахикининов важно использовать соединение, демонстрирующее антагонистическое действие против нескольких типов рецепторов.
Однако поскольку вообще предсказывается, что частота иного действия, чем нужное фармакологическое действие, возрастает при ингибирующем действии в отношении нескольких типов рецепторов, также важны соединения, проявляющие селективное и сильное антагонистическое действие против определенного рецептора.
Соединения, рассматриваемые как подобные по строению соединениям настоящего изобретения, описаны в ЕР-776893, но эти соединения демонстрируют антагонистическое действие как против NK1-рецепторов, так и против NK2-рецепторов, и, следовательно, они должны рассматриваться как совершенно отличающиеся от соединений настоящего изобретения, которые демонстрируют антагонистическое действие селективно против NK2-рецепторов.
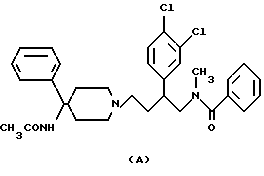
Что касается селективного антагонистического действия против NK2-рецепторов, то в настоящее время начаты клинические исследования с соединением SR48968 (соединение, имеющее структурную формулу А, приведенную ниже). Кроме того, сообщается, что SR144190 (соединение, имеющее структурную формулу В, приведенную ниже) обладает селективной антагонистической активностью в отношении NK2-рецепторов, которая более сильная, чем у SR48968 (X. Emonds- Alt et al., Tachykinins in Health and Disease,. September 7-11, 1997 in Cairns, Australia, Abstract p.5).

В результате проведения широких исследований антагонистов тахикининов авторы настоящего изобретения обнаружили, что новые ацилированные гетероалициклические производные обладают превосходной антагонистической активностью селективно против NK2, в результате чего и создано настоящее изобретение.
Кроме того, другой целью настоящего изобретения является новое лечебное средство, содержащее вышеуказанное соединение в качестве активного ингредиента. Примерами болезней, в случае которых можно применять такое лечебное средство, являются болезни центральной нервной системы, такие как страх, депрессия, психоз и шизофрения; нейродегенеративные заболевания, такие как деменция при СПИДе, старческая деменция Альцгеймера, болезнь Альцгеймера, синдром Дауна, демиелинизирующее заболевание, боковой амиотрофический склероз, невропатия, периферическая невропатия и невралгия; респираторные заболевания, такие как хроническая обструктивная болезнь легких, бронхит, пневмония, бронхоконстрикция, астма и кашель; воспалительные заболевания, такие как воспалительное заболевание кишечника (IBD), псориаз, фиброз, эрифизит, дегенеративный артрит и ревматоидный артрит; экзема; аллергические заболевания, такие как ринит; аллергозы, такие как повышенная чувствительность к вьющимся растениям; офтальмологические заболевания, такие как конъюнктивит, весенний конъюнктивит, весенний катар, разрушение гематоофтальмического барьера, вызванное различными воспалительными болезнями глаз, повышенное внутриглазное давление и миоз; кожные болезни, такие как контактный дерматит, атопический дерматит, крапивница и другие экзематозные дерматиты; аддикции, такие как алкогольная зависимость; соматические болезни, вызванные стрессом; симпатическая рефлекторная дистрофия, такая как плечевой синдром; дистимия; нежелательные иммунные реакции, такие как отторжение трансплантатов, болезни, связанные с иммуностимуляцией, такие как системная красная волчанка или иммуносупрессия; болезни пищеварительной системы, такие как болезни, вызванные нарушениями нервной регуляции органов, колит, неспецифический язвенный колит и болезнь Крона; рвота, такая как рвота, вызванная вредным воздействием рентгеновского излучения и химиотерапии, ядами, токсинами, беременностью, вестибулярными расстройствами, послеоперационными расстройствами, желудочно-кишечной окклюзией, ослабленной желудочно-кишечной подвижностью, висцеральной болью, мигренью, повышенным внутричерепным давлением, пониженным внутричерепным давлением или побочными реакциями, вызванными введением различных лечебных средств; функциональные болезни мочевого пузыря, такие как цистит и недержание мочи; эозинофилия, вызванная коллагеновыми болезнями, склеродермией или инфекцией Fasciola hepatica; болезни, вызванные нарушениями кровотока вследствие вазодилатации или вазоконстрикции, такие как стенокардия, мигрень и болезнь Рейно; и боль при болевой ноцицептивной рецепции, такой как мигрень, головная боль и зубная боль; и апноэ во сне. Новое лечебное средство по настоящему изобретению можно применять, в частности, как профилактическое средство или лечебное средство в случае астмы и/или бронхита, ринита, аллергических заболеваний и недержания мочи.
(1) Данное изобретение относится к соединению формулы (1)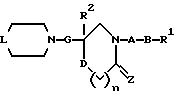
или
{где
R1 представляет (C3-C7)-циклоалкильную группу, 3-7-членную насыщенную гетероциклическую группу, (C3-C7)-циклоалкильную группу, замещенную 1-3 заместителями, выбранными среди заместителей группы А и заместителей группы В, или 3-7-членную насыщенную гетероциклическую группу, замещенную 1 или 2 заместителями, выбранными среди заместителей группы А и заместителей группы В,
R2 представляет арильную группу, гетероарильную группу, арильную группу, замещенную 1-3 заместителями, выбранными среди заместителей группы А, или гетероарильную группу, замещенную 1-3 заместителями, выбранными среди заместителей группы А,
А представляет метиленовую группу, карбонильную группу или сульфонильную группу,
В представляет простую связь, (C1-C4)-алкиленовую группу или (C2-C4)-алкениленовую группу,
D представляет атом кислорода или атом серы,
G представляет (C1-C4)-алкиленовую группу или (C2-C4)-алкениленовую группу,
L представляет группу формулы -N(R3)- или -C(R4) (R5)-
[где R3 представляет арильную группу, гетероарильную группу, арильную группу, замещенную 1-3 заместителями, выбранными среди заместителей группы А, или гетероарильную группу, замещенную 1-3 заместителями, выбранными среди заместителей группы А,
R4 представляет атом водорода, арильную группу, гетероарильную группу, арильную группу, замещенную 1-3 заместителями, выбранными среди заместителей группы А, гетероарильную группу, замещенную 1-3 заместителями, выбранными среди заместителей группы А, (C3-C7-циклоалкильную группу, 3-7-членную насыщенную гетероциклическую группу, (C3-C7)-циклоалкильную группу, замещенную 1-3 заместителями, выбранными среди заместителей группы А и заместителей группы В, или 3-7- членную насыщенную гетероциклическую группу, замещенную 1 или 2 заместителями, выбранными среди заместителей группы А и заместителей группы В,
R5 представляет низшую алкильную группу, аминогруппу, ациламиногруппу, ациламино (низшую алкильную) группу, ациламиногруппу, где атом азота замещен низшей алкильной группой, гидроксигруппу, гидрокси (низшую алкильную) группу, где атом кислорода необязательно замещен аралкильной группой, низшую алкоксигруппу или группу формулы -CO-R6 (где R6 представляет низшую алкильную группу, низшую алкоксигруппу, остаток амина, арильную группу, замещенную 1-3 заместителями, выбранными среди заместителей группы А, или гетероарильную группу, замещенную 1-3 заместителями, выбранными среди заместителей группы А), или
R4 и R5, вместе с атомом углерода, к которому они присоединены, образуют (C5-C8)-циклоалкановое кольцо, (C5-C8)-циклоалкеновое кольцо или 5-8-членное насыщенное гетероциклическое кольцо (любое из этих колец может быть, необязательно, замещено 1 или 2 заместителями, выбранными среди заместителей группы А и заместителей группы В, и, необязательно, может быть сконденсировано с арильным кольцом, гетероарильным кольцом, арильным кольцом, замещенным 1-3 заместителями, выбранными среди заместителей группы А, или гетероарильным кольцом, замещенным 1-3 заместителями, выбранными среди заместителей группы А)],
R7 представляет низшую алкильную группу,
Z представляет два атома водорода или атом кислорода,
n = 0, 1 или 2}
и к его фармацевтически приемлемой соли, сложному эфиру или другому производному;
[заместители группы А] представляют собой
атомы галогенов, низшие алкильные группы, галогенсодержащие низшие алкильные группы, низшие алкоксигруппы, низшие алкоксикарбонильные группы, карбоксильные группы, гидроксигруппы, низшие алифатические ацильные группы, низшие алифатические ациламиногруппы, аминогруппы и цианогруппы,
[заместители группы В] представляют собой
оксогруппы и тиольные группы; и, как заместители у атома азота, низшие алкильные, арильные и аралкильные группы, которые, необязательно, могут быть замещены заместителем, выбранным среди заместителей группы А, низшие алкансульфонильные группы и ацильные группы.
Среди соединений формулы (I) предпочтительными являются
(2) соединения, где R1 представляет собой (C3-C6)-циклоалкильную группу, 5- или 6-членную насыщенную гетероциклическую группу, (C3-C6)-циклоалкильную группу, замещенную 1-3 заместителями, выбранными среди заместителей группы А и заместителей группы В, или 5- или 6-членную насыщенную гетероциклическую группу, замещенную 1 или 2 заместителями, выбранными среди заместителей группы А и заместителей группы В,
(3) соединения, где R1 представляет собой (C3-C6)-циклоалкильную группу, 5- или 6-членную насыщенную гетероциклическую группу или 5- или 6-членную насыщенную гетероциклическую группу, замещенную 1 или 2 заместителями, выбранными среди заместителей группы А и заместителей группы В,
(4) соединения, где R2 представляет собой арильную группу, или арильную группу, замещенную 1-3 заместителями, выбранными среди заместителей группы А,
(5) соединения, где R2 представляет собой арильную группу, замещенную 1-3 атомами галогена,
(6) соединения, где А представляет собой метиленовую группу или карбонильную группу,
(7) соединения, где А представляет собой карбонильную группу, и Z представляет собой два атома водорода, или где А представляет собой метиленовую группу, и Z представляет собой атом кислорода,
(8) соединения, где А представляет собой карбонильную группу,
(9) соединения, где В представляет собой простую связь,
(10) соединения, где D представляет собой атом кислорода,
(11) соединения, где G представляет собой (C1-C4)-алкиленовую группу,
(12) соединения, где G представляет собой (С2-С3)-алкиленовую группу,
(13) соединения, где R3 представляет собой гетероарильную группу или арильную группу, замещенную 1-3 заместителями, выбранными среди заместителей группы А,
(14) соединения, где L представляет собой группу формулы -C(R4) (R5)-,
(15) соединения, где R4 и R5, вместе с атомом углерода, к которому они присоединены, образуют (C5-C8)-циклоалкановое кольцо, (C5-C8) -циклоалкеновое кольцо или 5-8-членное насыщенное гетероциклическое кольцо (любое из этих колец может быть, необязательно, замещено 1 или 2 заместителями, выбранными среди заместителей группы А и заместителей группы В, и, необязательно, может быть сконденсировано с арильным кольцом, гетероарильным кольцом, арильным кольцом, замещенным 1-3 заместителями, выбранными среди заместителей группы А, или гетероарильным кольцом, замещенным 1-3 заместителями, выбранными среди заместителей группы А),
(16) соединения, где R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют (С5-С6)-циклоалкановое кольцо, (С5-С6)-циклоалкеновое кольцо или 5- или 6-членное насыщенное гетероциклическое кольцо (любое из этих колец может быть, необязательно, замещено 1 или 2 заместителями, выбранными среди заместителей группы А и заместителей группы В, и, необязательно, может быть сконденсировано с арильным кольцом, гетероарильным кольцом, арильным кольцом, замещенным 1-3 заместителями, выбранными среди заместителей группы А, или гетероарильным кольцом, замещенным 1-3 заместителями, выбранными среди заместителей группы А),
(17) соединения, где R4 и R5, вместе с атомом углерода, к которому они присоединены, образуют циклопентановое кольцо, циклопентеновое кольцо, тетрагидротиофеновое кольцо, тетрагидротиофенсульфоксидное кольцо, тетрагидротиофенсульфоновое кольцо или пиперидиновое кольцо (любое из этих колец может быть, необязательно, замещено 1 или 2 заместителями, выбранными среди заместителей группы А и заместителей группы В, и, необязательно, может быть сконденсировано с арильным кольцом, гетероарильным кольцом, арильным кольцом, замещенным 1-3 заместителями, выбранными среди заместителей группы А, или гетероарильным кольцом, замещенным 1-3 заместителями, выбранными среди заместителей группы А),
(18) соединения, где Z представляет собой два атома водорода,
(19) соединения, где n = 0 или 1,
(20) соединения, где n = 1,
и их фармацевтически приемлемые соли, сложные эфиры или другие производные.
Кроме того, также предпочтительными являются соединения, включающие сочетание факторов, произвольно выбранных из каждой из десяти групп, которыми являются (2) и (3); (4) и (5); (6)-(8); (9); (10); (11) и (12); (13); (14)-(17); (18); и (19) и (20).
Особенно предпочтительными соединениями являются
(21) соединения, выбранные среди перечисленных далее соединений, или их фармацевтически приемлемых солей, сложных эфиров или других производных:
1-{ 2-[(2R)-(3, 4-дихлорфенил)-4-(циклопропанкарбонил)-морфолин-2-ил] этил}спиро[бензо[с]тиофен-1(3H),4'-пиперидин]-(2S)-оксид,
1-{ 2-[(2R)-(3,4-дихлорфенил)-4- (циклoбутaнкapбoнил)мopфoлин-2-ил]этил} спиро[бензо[с] тиофен-1(3H),4'-пиперидин]-(2S)-оксид,
1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(циклопентанкарбонил)-морфолин-2-ил] этил}спиро[бензо[с]тиофен-1(3H),4'-пиперидин]-(2S)-оксид,
1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(циклогексанкарбонил) -морфолин-2-ил] этил}спиро[бензо[с]тиофен-1(3H),4'- пиперидин]-(2S)оксид,
1-{ 2-[(2R)-(3,4-дифторфенил)-4- (циклопропанкарбонил)-морфолин-2-ил] этил}спиро[бензо[с] тиофен-1(3H),4'-пиперидин]-(2S)оксид,
1-{ 2-[(2R)-(3,4-дифторфенил)-4-(циклобутанкарбонил)морфолин-2-ил] этил} спиро[бензо[с]тиофен-1(3H),4'-пиперидин]-(2S)-оксид,
1-{ 2-[(2R)-(3,4-дифторфенил)-4-(циклопентанкарбонил)-морфолин-2- ил] этил}спиро[бензо[с]тиофен-1(3H),4'-пиперидин]-(2S)- оксид,
1-{ 2-[(2R)-(3,4-дифторфенил)-4-(циклогексанкарбонил) -морфолин-2-ил] этил}спиро[бензо[с]тиофен-1(3H),4'- пиперидин]-(2S)-оксид,
1-{ 2-[(2R)-(3,4-дихлорфенил)-4- (циклопропанкарбонил)-морфолин-2-ил] этил}спиро[((2S)- гидрокси)индан-1,4'-пиперидин],
1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(циклобутанкарбонил)морфолин-2-ил] этил} спиро[((2S)-гидрокси)индан-1,4'-пиперидин],
1-{2-[(2R)-(3,4-дихлорфенил)-4-(циклопентанкарбонил)-морфолин-2-ил]этил} спиро [((2S)-гидрокси)индан-1,4'-пиперидин],
1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(циклогексанкарбонил)-морфолин-2-ил] этил}спиро[((2S)-гидрокси)индан-1,4'-пиперидин],
1-{ 2-[(2R)-(3,4-дифторфенил)-4-(циклопропанкарбонил)-морфолин-2-ил] этил}спиро[((2S)-гидрокси)индан-1,4'-пиперидин],
1-{ 2-[(2R)-(3,4-дифторфенил)-4-(циклобутанкарбонил)морфолин-2-ил] этил} спиро[((2S)-гидрокси)индан-1,4'-пиперидин],
1-{ 2-[(2R)-(3,4-дифторфенил)-4-(циклопентанкарбонил) -морфолин-2-ил] этил}спиро[((2S)-гидрокси)индан-1,4' -пиперидин],
1-{ 2-[(2R)-(3,4-дифторфенил)-4-(циклогексанкарбонил) -морфолин-2-ил] этил}спиро[((2S)-гидрокси)индан-1,4' -пиперидин],
1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(циклопропанкарбонил) -морфолин-2-ил] этил}-4-фенилпиперидин-4-карбоксамид и
1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(циклопентанкарбонил) -морфолин-2-ил] этил}-4-(2-пиридил)пиперидин-4-карбоксамид.
Кроме того, новое лечебное средство настоящего изобретения содержит в качестве активного ингредиента соединение или его фармацевтически приемлемую соль, сложный эфир или другое производное, описанные в любой группе, выбранной среди вышеуказанных групп (1)-(21). Его можно использовать, в частности, в качестве профилактического или лечебного средства при тахикининопосредованных заболеваниях (например, при астме и/или бронхите, рините, аллергических заболеваниях и недержании мочи).
Далее приводится более конкретное определение групп, входящих в формулу (1).
Подразумевается, что используемые в определении R1 и R4 "(C3-C7)-циклоалкильная группа" и (C3-C7)-циклоалкильная группа в термине "(C3-C7)-циклоалкильная группа, замещенная 1-3 заместителями, выбранными среди заместителей группы А и заместителей группы В" включают циклопропильную, циклобутильную, циклопентильную, циклогексильную и циклогептильную группы.
Указанная выше "(C3-C7)-циклоалкильная группа" может быть, необязательно, конденсирована с "арильным кольцом", "гетероарильным кольцом", "арильным кольцом, замещенным 1-3 заместителями, выбранными среди заместителей группы А" или "гетероарильным кольцом, замещенным 1-3 заместителями, выбранными среди заместителей группы А".
(Подразумевается, что "арильное кольцо" и арильное кольцо в термине "арильное кольцо, которое может быть, необязательно, замещено 1-3 заместителями, выбранными среди заместителей группы А" включают (C6-C14) -ароматические углеводородные кольца, такие как бензольное кольцо, инденовое кольцо, нафталиновое кольцо, фенантреновое кольцо и антраценовое кольцо, предпочтительно - бензольное кольцо. Подразумевается, что "гетероарильное кольцо" и гетероарильное кольцо в определении "гетероарильное кольцо, которое может быть, необязательно, замещено 1-3 заместителями, выбранными среди заместителей группы А", включают 5-7-членные гетероарильные кольца, содержащие 1-3 атома серы, кислорода и/или азота, такие как фурановое кольцо, тиофеновое кольцо, пиррольное кольцо, азепиновое кольцо, пиразольное кольцо, имидазольное кольцо, оксазольное кольцо, изоксазольное кольцо, тиазольное кольцо, изотиазольное кольцо, 1,2,3-оксадиазольное кольцо, триазольное кольцо, тетразольное кольцо, тиадиазольное кольцо, пирановое кольцо, пиридиновое кольцо, пиридазиновое кольцо, пиримидиновое кольцо и пиразиновое кольцо; предпочтительными кольцами являются 5-7-членные гетероарильные кольца, которые содержат по меньшей мере один атом азота и также могут содержать, необязательно, атом серы или атом кислорода, например, пиррольное кольцо, азепиновое кольцо, пиразольное кольцо, имидазольное кольцо, оксазольное кольцо, изоксазольное кольцо, тиазольное кольцо, изотиазольное кольцо, 1,2,3- оксадиазольное кольцо, триазольное кольцо, тетразольное кольцо, тиадиазольное кольцо, пирановое кольцо, пиридиновое кольцо, пиридазиновое кольцо, пиримидиновое кольцо и пиразиновое кольцо; более предпочтительными гетероарильными группами являются пиридиновое кольцо, имидазольное кольцо, оксазольное кольцо, пиразиновое кольцо и тиазольное кольцо.) В качестве примеров (C3-C7)-циклоалкильной группы, конденсированной с одной из таких циклических систем, можно назвать бензоциклобутенильную, инданильную, 4,5,6,7-тетрагидроинданильную, тетрагидронафтильную, 5,6,7,8-тетрагидрохинолильную и 5,6,7,8- тетрагидроизохинолильную группы.
В определении R1 и R4 термин "3-7-членная насыщенная гетероциклическая группа" и 3-7-членная насыщенная гетероциклическая группа в термине "3-7-членная насыщенная гетероциклическая группа, замещенная 1 или 2 заместителями, выбранными среди заместителей группы А и заместителей группы В", обозначают 3-7-членную неароматическую гетероциклическую группу, содержащую 1-3 атома серы, кислорода и/или азота, предпочтительно - 5-6-членную неароматическую гетероциклическую группу, содержащую 1-3 атома серы, кислорода и/или азота, предпочтительнее - 5-6-членную неароматическую группу, содержащую 1 или 2 атома серы, кислорода и/или азота. Примерами таких групп являются пирролидинильная, тетрагидрофуранильная, тетрагидротиенильная, оксазолидинильная, тиазолидинильная, пиперидинильная, морфолинильная, тиоморфолинильная, пиперазинильная и азепинильная группы.
Эти группы, необязательно, могут быть конденсированы с циклической системой, такой же, как в случае "арильного кольца", "гетероарильного кольца", "арильного кольца, замещенного 1-3-заместителями, выбранными среди заместителей группы А", и "гетероарильного кольца, замещенного 1- 3 заместителями, выбранными среди заместителей группы А", описанных выше. Примерами такой группы являются 1,2,3,4- тетрагидроизохинолильная группа и подобные группы.
Кроме того, примеры "5-7-членной насыщенной гетероциклической группы, замещенной 1 или 2 заместителями, выбранными среди заместителей группы А и заместителей группы В" включают 2-оксо-оксазолидинильную группу, 2-оксотиазолидинильную группу и подобные группы.
"Арильная группа" в определении R2, R3 и R4, "арильная группа" в термине "арильная группа, замещенная 1-3 заместителями, выбранными среди заместителей группы А", в определении R2, R3, R4 и R6 и "арильная группа" в определении "в качестве заместителей у атома азота,... арильная группа..., которая необязательно может быть замещена заместителем, выбранным среди заместителей группы А", в определении [заместители группы В] обозначают (C5-C14)-ароматическую углеводородную группу, такую как фенильная, инденильная, нафтильная, фенантрильная и антраценильная группы, предпочтительно - фенильную группу.
Кроме того, вышеуказанная "арильная группа" может быть, необязательно, конденсирована с (C3-C10)-циклоалкильной группой, и примерами такой группы являются 5-инданильная группа и подобные группы.
"Гетероарильная группа" в определении R2, R3 и R4 и "гетероарильная группа" в термине "гетероарильная группа, замещенная 1-3 заместителями, выбранными среди заместителей группы А" в определении R2, R3, R4 и R6 обозначают 5-7-членную гетероарильную группу, содержащую 1-3 атома серы, кислорода и/или азота, такую как фурильная, тиенильная, пироллильная, азепинильная, пиразолильная, имидазолильная, оксазолильная, изоксазолильная, тиазолильная, изотиазолильная, 1,2,3-оксадиазолильная, триазолильная, тетразолильная, тиадиазолильная, пиранильная, пиридильная, пиридазинильная, пиримидинильная и пиразинильная группы, предпочтительно - 5-7-членную гетероарильную группу, содержащую по меньшей мере один атом азота и, необязательно, содержащую атом серы или атом кислорода, например, пироллил, азепинил, пиразолил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, 1,2,3-оксадиазолил, триазолил, тетразолил, тиадиазолил, пиридил, пиридазинил, пиримидинил и пиразинил, и предпочтительнее - пиридил, имидазолил, оксазолил, пиразинил и тиазолил.
Кроме того, вышеуказанная "гетероарильная группа" может быть, необязательно, конденсирована с другой циклической системой, и примерами такой группы являются индолильная, бензофурильная, бензотиенильная, бензоксазолильная, бензимидазолильная, изохинолильная, хинолильная и хиноксалильная группы и подобные группы.
В определении В и G термин "(C1-C4)-алкиленовая группа" обозначает линейную или разветвленную (C1-C4)-алкиленовую группу, такую как метилен, метилметилен, этилен, пропилен, триметилен, тетраметилен, 1-метилтриметилен, 2-метилтриметилен и 3-метилтриметилен.
Что касается В, то предпочтительной является линейная или разветвленная (C1-C3)алкиленовая группа.
Что касается G, то предпочтительной является линейная или разветвленная (C1-C3)алкиленовая группа, и более предпочтительны этилен и триметилен, а наиболее предпочтителен этилен.
В определении В и G термин "(C2-C4)алкениленовая группа" обозначает линейную или разветвленную (C2-C4)алкениленовую группу, такую как этенилен, 2- пропенилен, 1-метил-2-пропенилен, 2-метил-2-пропенилен, 2-этил-2- пропенилен и 2-бутенилен, предпочтительно - этенилен, 2-пропенилен или 3-бутенилен, и более предпочтительно - этенилен или 2- пропенилен.
"Низшая алкильная группа" в определении R5, R6 и R7 и в определении [заместители группы А]; "низшая алкильная группа" в термине "ациламиногруппа, где атом азота замещен низшей алкильной группой" в определении R5; "низшая алкильная группа" в термине "гидрокси (низшая алкильная) группа, где атом кислорода необязательно замещен аралкильной группой" в определении R5; "низшая алкильная группа" в термине "ациламино (низшая алкильная) группа" в определении R5; "низшая алкильная группа" в термине "в качестве заместителей у атома азота,... низшая алкильная,... которая может быть замещена заместителями, выбранными среди заместителей группы А" в определении [заместители группы В] обозначают линейную или разветвленную (C1-C6) алкильную группу, такую как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, 2-метилбутил, неопентил, 1-этилпропил, н-гексил, изогексил, 4-метилпентил, 3- метилпентил, 2-метилпентил, 1-метилпентил, 3,3-диметилбутил, 2,2- диметилбутил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3- диметилбутил, 2,3-диметилбутил и 2-этилбутил. Более предпочтительной является линейная или разветвленная (C1-C4)-алкильная группа.
"Ацил" в "ациламиногруппе", "ацил" в "ациламино (низшей алкильной) группе" и "ацил" в термине "ациламиногруппа, где атом азота замещен низшей алкильной группой" в определении R; и "ацил" в термине "в качестве заменителей у атома азота, ... ацильные группы" в определении [заменители группы В] обозначают, например, "алифатическую ацильную группу", включающую алкилкарбонильную группу, такую как формил, ацетил, пропионил, бутирил, изобутирил, пентаноил, пивалоил, валерил, изовалерил, октаноил, нонилкарбонил, децилкарбонил, 3-метилнонилкарбонил, 8-метилнонилкарбонил, 3-этилоктилкарбонил, 3,7-диметилоктилкарбонил, ундецилкарбонил, додецилкарбонил, тридецилкарбонил, тетрадецилкарбонил, пентадецилкарбонил, гексадецилкарбонил, 1- метилпентадецилкарбонил, 14-метилпентадецилкарбонил, 13,13- диметилтетрадецилкарбонил, гептадецилкарбонил, 15-метилгекса- децилкарбонил, октадецилкарбонил, 1-метилгептадецилкарбонил, нонадецилкарбонил, икозилкарбонил и генейкозилкарбонил; галогенсодержащую алкилкарбонильную группу, такую как хлорацетил, дихлорацетил, трихлорацетил и трифторацетил; низшую алкоксиалкилкарбонильную группу, такую как метоксиацетил; и ненасыщенную алкилкарбонильную группу, такую как акрилкарбонил, пропионилкарбонил, метакрилкарбонил, кротонилкарбонил, изокротонилкарбонил, (Е)-2-метил-2-бутеноил; "ароматическую ацильную группу", включающую арилкарбонильную группу, такую как бензоил, α-нафтоил и β-нафтоил; галогенсодержащую арилкарбонильную группу, такую как 2-бромбензоил и 4-хлорбензоил; низшую алкилированную арилкарбонильную группу, такую как 2,4,6-триметилбензоил и 4-толуоил; низшую алкоксилированную арилкарбонильную группу, такую как 4-анизоил; нитросодержащую арилкарбонильную группу, такую как 4-нитробензоил и 2- нитробензоил; низшую алкоксикарбонилированную арилкарбонильную группу, такую как 2-(метоксикарбонил)бензоил; и арилированную арилкарбонильную группу, такую как 4-фенилбензоил; "алкоксикарбонильную группу", включающую низшую алкоксикарбонильную группу, такую как метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил, втор-бутоксикарбонил, трет-бутоксикарбонил и изобутоксикарбонил; и низшую алкоксикарбонильную группу, замещенную атомами галогена или три (низший алкил)силильной группой, такую как 2,2,2-трихлорэтоксикарбонил и 2-триметилсилилэтоксикарбонил; "алкенилкарбонильную группу", такую как винилкарбонил и аллилкарбонил; "аралкилкарбонильную группу", в которой арильное кольцо может быть, необязательно, замещено 1 или 2 низшими алкокси- или нитрогруппами, такую как бензилкарбонил, фенацил, 4- метоксибензилкарбонил, 3,4-диметоксибензилкарбонил, 2- нитробензилкарбонил и 4-нитробензилкарбонил; "низшую алкансульфонильную группу", такую как метансульфонил, этансульфонил и 1-пропансульфонил; фторсодержащую "низшую алкансульфонильную группу", такую как трифторметансульфонил и пентафторэтансульфонил; и "арилсульфонильную группу", такую как бензолсульфонил и п-толуолсульфонил. Среди таких групп предпочтительными являются "алифатическая ацильная группа", "ароматическая ацильная группа" и "низшая алкансульфонильная группа".
"Низшая алкоксигруппа" в определении R5, R6 и [заместители группы А] и "низшая алкоксигруппа" в термине "низшая алкоксикарбонильная группа" в определении [заместители группы А] обозначают группу, где вышеописанная "низшая алкильная группа" присоединена к атому кислорода, например, линейную или разветвленную (C1-C6)-алкоксигруппу, такую как метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, н-пентокси, изопентокси, 2-метилбутокси, неопентокси, н-гексилокси, 4-метилпентокси, 3-метилпентокси, 2-метилпентокси, 3,3-диметилбутокси, 2,2-диметилбутокси, 1,1- диметилбутокси, 1,2-диметилбутокси, 1,3-диметилбутокси и 2,3-диметилбутокси. Предпочтительно, такая группа представляет собой линейную или разветвленную (C1-C4)-алкоксигруппу.
"Аралкильная группа" в термине "гидрокси (низшая алкильная) группа, где атом кислорода необязательно замещен аралкильной группой" в определении R5 и "аралкильная группа" в термине "в качестве заместителей у атома азота, низшая алкильная, арильная и аралкильная группы, которые необязательно могут быть замещены заместителями, выбранными среди заместителей группы А" в определении [заместители группы В] обозначают группу, где вышеописанная "арильная группа" присоединена к вышеописанной "алкильной группе", например бензил, α- нафтилметил, β-нафтилметил, инденилметил, фенантренилметил, антраценилметил, дифенилметил, трифенилметил, 1-фенетил, 2-фенетил, 1- нафтилэтил, 2-нафтилэтил, 1-фенилпропил, 2-фенилпропил, 3-фенилпропил, 1-нафтилпропил, 2-нафтилпропил, 3-нафтилпропил, 1-фенилбутил, 2-фенилбутил, 3-фенилбутил, 4-фенилбутил, 1-нафтилбутил, 2-нафтилбутил, 3-нафтилбутил, 4-нафтилбутил, 1-фенилпентил, 2-фенилпентил, 3-фенилпентил, 4-фенилпентил, 5-фенилпентил, 1-нафтилпентил, 2-нафтилпентил, 3-нафтилпентил, 4-нафтилпентил, 5-нафтилпентил, 1-фенилгексил, 2-фенилгексил, 3-фенилгексил, 4-фенилгексил, 3-фенилгексил, 6-фенилгексил, 1-нафтилгексил, 2-нафтилгексил, 3-нафтилгексил, 4-нафтилгексил, 5-нафтилгексил и 6-нафтилгексил. Предпочтительно, это группа, где составляющая "арильная группа" представляет собой фенильную группу, а составляющая "алкильная группа" представляет собой (C1-C4)-алкильную группу. Более предпочтительными являются бензильная группа или фенетильная группа.
"(C5-C8)-Циклоалкановое кольцо", которое R4 и R5 образуют вместе с атомом углерода, к которому они присоединены, означает, например, циклопропановое кольцо, циклобутановое кольцо, циклопентановое кольцо, циклогексановое кольцо, циклогептановое кольцо и циклооктановое кольцо. Предпочтительно, это (C5-C6)-циклоалкановое кольцо, и более предпочтительно - такой цикл является циклопентановым циклом.
"(C5-C8)-Циклоалкеновое кольцо", которое R4 и R5 образуют вместе с атомом углерода, к которому они присоединены, означает, например, циклопропеновое кольцо, циклобутеновое кольцо, циклопентеновое кольцо, циклогексеновое кольцо циклогептеновое кольцо и циклооктеновое кольцо. Предпочтительно, это (C5-C6)- циклоалкеновое кольцо. Более предпочтительно, такой цикл является циклопентеновым циклом.
"5-8-Членное насыщенное гетероциклическое кольцо" "5-8-членного насыщенного гетероциклического кольца", которое R4 и R5 образуют вместе с атомом углерода, к которому они присоединены, означает 5-8-членное насыщенное гетероциклическое кольцо, содержащее 1-3 атома серы, кислорода и/или азота (где атом серы может находиться в сульфоксиде или сульфоне, если кольцо содержит атом серы). Предпочтительно, это 5-6-членное насыщенное гетероциклическое кольцо, содержащее 1-3 атома серы, кислорода и/или азота. Более предпочтительно, такое кольцо представляет собой 5-членное насыщенное гетероциклическое кольцо, содержащее 1-2 атома серы, кислорода и/или азота, такое как имидазолидиновое кольцо, оксазолидиновое кольцо, пирролидиновое кольцо, тетрагидрофурановое кольцо, тетрагидротиофеновое кольцо, тетрагидротиофенсульфоксидное кольцо, тетрагидротиофенсульфоновое кольцо и пиперидиновое кольцо.
Кроме того, "(C5-C8)-циклоалкановое кольцо", "(C5-C8)-циклоалкеновое кольцо" и "5-8-членное насыщенное гетероциклическое кольцо" могут быть, необязательно, замещены 1 или 2 заместителями, выбранными среди заместителей группы. А и заместителей группы В, и могут быть, необязательно, конденсированы с описанными выше "арильным кольцом", "гетероарильным кольцом", "арильным кольцом, замещенным 1-3 заместителями, выбранными среди заместителей группы А и заместителей группы В" или "гетероарильным кольцом, замещенным 1-3 заместителями, выбранными среди заместителей группы А и заместителей группы В". Примерами такой группы являются 4-оксо-1-фенилимидазолидиновое кольцо, 2-оксо-3- фенилоксазолидиновое кольцо, 3-бензил-2-оксооксазолидиновое кольцо, 1- метилсульфонил-2,3-дигидроиндольное кольцо, 1,3- дигидроизобензофурановое кольцо, 1-оксо-2,3- дигидробензо[b] тиофеновое кольцо, 1,3-дигидробензо-[с] -тиофеновое кольцо, 2-оксо-1,3-дигидробензо[с] тиофеновое кольцо, 2,2-диоксо-1,3-дигидробензо[с] тиофеновое кольцо, 1,4-дигидро-3-изохинолиновое кольцо, индановое кольцо, 1-гидроксииндановое кольцо, 2- гидроксииндановое кольцо, 1-оксоиндановое кольцо, 2-оксоиндановое кольцо, 1,2-диоксоиндановое кольцо, инденовое кольцо и подобные группы.
"Остаток амина" в определении R6 означает остаток амина, который присоединяется через свой атом азота, включающий аминогруппу; аминогруппу, замещенную 1 или 2 "низшими алкильными группами", такую как метиламино, этиламино, изопропиламино, бутиламино, диметиламино, диэтиламино, диизопропиламино и дибутиламино; аминогруппу, замещенную 1 или 2 "(C5-C7)-циклоалкильными группами", такую как циклопентиламино, циклогексиламино, дициклопентиламино и дициклогексиламино; остаток насыщенного циклического амина, содержащего по меньшей мере один атом азота в кольце, такой как пирролидино, пиперидино, пиперазино, N-метилпиперазино, морфолино и тиоморфолино; ариламино- или аралкиламиногруппу, необязательно замещенную у атома азота "низшей алкильной группой", такую как анилино, бензиламино, N-метиланилино и N-метилбензиламино; гетероариламиногруппу, необязательно замещенную у атома азота "низшей алкильной группой", такую как пиридиламино, N-метилпиридиламино и N-этилпиридиламино; и подобные группы. Предпочтительно, такой остаток представляет собой аминогруппу; аминогруппу, замещенную 1 или 2 "низшими алкильными группами", остаток насыщенного циклического амина, содержащего по меньшей мере один атом азота в кольце, такой как пирролидино, пиперидино, пиперазино, N-метилпиперазино, морфолино и тиоморфолино; или ариламино- или аралкиламиногруппу, необязательно замещенную у атома азота "низшей алкильной группой", такую как анилино, бензиламино, N-метиланилино и N-метилбензиламино.
Подразумевается, что "атомы галогена" в определении [заместители группы А] представляют собой атомы фтора, атомы хлора, атомы брома и атомы иода, и предпочтительными являются атомы фтора и хлора.
"Галогенсодержащие низшие алкильные группы" в определении [заместители группы А] означают группы, где описанная выше "низшая алкильная группа" замещена описанными выше "атомами галогена", такие как трифторметил, трихлорметил, дифторметил, дихлорметил, дибромметил, фторметил, 2,2,2-трихлорэтил, 2,2,2-трифторэтил, 2- бромэтил, 2-хлорэтил, 2-фторэтил или 2,2-дибромэтил. Среди таких групп предпочтительными являются трифторметил, 2-бромэтил, 2- хлорэтил и 2-фторэтил.
"Низшие алифатические ацильные группы" в определении [заместители группы А] и "низшие алифатические ацильные группы" в "низших алифатических ациламиногруппах" в определении [заместители группы А] означают (C2-C7)-алифатические ацильные группы, такие как формил, ацетил, пропионил, бутирил, изобутирил, пентаноил, пивалоил, валерил и изовалерил. Среди них предпочтительными являются ацетил и пропионил.
Что касается "арильной группы, замещенной 1-3 заместителями, выбранными среди заместителей группы А" в определении R2, то предпочтительной является арильная группа, замещенная 1-3 "атомами галогена", и предпочтительнее фенильная группа, замещенная 1-3 "атомами галогена".
Так как соединение (I) настоящего изобретения может быть преобразовано в форму соли, термин "фармацевтически приемлемая соль" обозначает такую соль.
Предпочтительными примерами солей, составленных соединениями (I) настоящего изобретения и кислотами, являются соли галогеноводородных кислот, такие как соли фтороводородной кислоты, соли хлороводородной кислоты, соли бромоводородной кислоты и соли иодоводородной кислоты, соли неорганических кислот, такие как соли азотной кислоты, соли перхлорной кислоты, соли серной кислоты и соли фосфорной кислоты; соли низших алкилсульфоновых кислот, такие как соли метансульфоновой кислоты, соли трифторметансульфоновой кислоты и соли этансульфоновой кислоты, соли арилсульфоновых кислот, такие как соли бензолсульфоновой кислоты и соли п-толуолсульфоновой кислоты; соли органических кислот, такие как соли уксусной кислоты, соли яблочной кислоты, соли фумаровой кислоты, соли янтарной кислоты, соли лимонной кислоты, соли винной кислоты, соли щавелевой кислоты и соли малеиновой кислоты; и соли аминокислот, такие как соли глицина, соли лизина, соли аргинина, соли орнитина, соли глутаминовой кислоты и соли аспарагиновой кислоты.
С другой стороны, предпочтительными примерами солей, составленных соединениями (I) настоящего изобретения и основаниями, являются соли металлов, такие как соли, образованные щелочными металлами, например, натриевые соли, калиевые соли и литиевые соли, соли, образованные щелочноземельными металлами, например, кальциевые соли и магниевые соли, соли алюминия и соли железа; соли, образованные с аминами, такие как неорганические соли, например, аммониевые соли, органические соли, например, соли трет-октиламина, соли дибензиламина, соли морфолина, соли глюкозамина, соли алкилэфиров фенилглицина, соли этилендиамина, соли N-метилглюкамина, соли гуанидина, соли диэтиламина, соли триэтиламина, соли дициклогексиламина, соли N,N'-дибензилэтилендиамина, соли хлоропрокаина, соли прокаина, соли диэтаноламина, соли N-бензилфенэтиламина, соли пиперазина, соли тетраметиламмония и соли трис-(гидроксиметил)аминометана; и соли аминокислот, такие как соли глицина, соли лизина, соли аргинина, соли орнитина, соли глутаминовой кислоты и соли аспарагиновой кислоты.
Кроме того, из соединения (I) настоящего изобретения можно получить четвертичный амин посредством модификации в его молекуле атома азота пиперидиногруппы группой R3, катионсодержащее соединение и анион (на который нет ограничения при условии что это анион и ион галогена, и в качестве примеров такого аниона можно назвать хлорид-ион и иодид-ион) могут образовывать соль, и такая соль также входит в объем настоящего изобретения.
Соединение (I) настоящего изобретения иногда может превратиться в гидрат посредством поглощения воды или адгезии адсорбированной воды, когда оно остается в атмосферных условиях, и такой гидрат также входит в объем настоящего изобретения.
"Сложный эфир" означает эфир, в который можно преобразовать в соединение (I) настоящего изобретения, и включает "сложный эфир по гидроксигруппе" и "эфир по карбоксильной группе", и этот термин указывает на эфир, когда эфирообразующая группа является "обычной защитной группой" или "защитной группой, которую можно отщепить биологическим способом, таким как гидролиз in vivo".
Термин "обычная защитная группа" обозначает защитную группу, которую можно удалить химическим способом, таким как гидрогенолиз, гидролиз, электролиз и фотолиз.
Предпочтительными примерами "обычной защитной группы" для "сложного эфира по гидроксильной группе" являются вышеуказанная "низшая алифатическая ацильная группа"; вышеуказанная "ароматическая ацильная группа"; "тетрагидропиранильные или тетрагидропиратионильные группы", такие как тетрагидропиран-2-ил, 3-бромтетрагидропиран-2-ил, 4-метокситетрагидропиран-4-ил, тетрагидротиопиран-2-ил и 4- метокситетрагидротиопиран-4-ил; "силильные группы", такие как три (низший алкил)силильные группы, например, триметилсилил, триэтилсилил, изопропилдиметилсилил, трет-бутилдиметилсилил, метилдиизопропилсилил, ди-трет-бутилметилсилил и триизопропилсилил, и три (низший алкил) силильные группы, замещенные 1 или 2 арильными группами, например, дифенилметилсилил, дифенилбутилсилил, дифенилизопропилсилил и фенилдиизопропилсилил; "алкоксиметильные группы", такие как низшие алкоксиметильные группы, например, метоксиметил, 1,1-диметил-1-метоксиметил, этоксиметил, пропоксиметил, изопропоксиметил, бутоксиметил и трет-бутоксиметил, низшие алкоксилированные низшие алкоксиметильные группы, например, 2-метоксиэтоксиметил, и галогенсодержащие низшие алкоксиметильные группы, например, 2,2,2-трихлорэтоксиметил и бис (2-хлорэтокси) метил; "замещенные этильные группы", такие как низшие алкоксиэтильные группы, например, 1-этоксиэтил и 1-(изопропокси) этил, и галогеноэтильные группы, например, 2,2,2-трихлорэтил; "аралкильные группы", такие как низшие алкильные группы, замещенные 1-3 арильными группами, например, бензил, α-нафтилметил, β-нафтилметил, дифенилметил, трифенилметил, α-нафтилдифенилметил или 9-антрилметил, и низшая алкильная группа, замещенная 1-3 арильными группами, которые являются замещенными низшим алкилом, галогенсодержащим низшим алкилом, низшей алкокси- или нитрогруппой, атомом галогена или цианогруппой, например, 4-метилбензил, 2,4,6-триметилбензил, 3,4,5-триметилбензил, 3,5-ди-(трифторметил) бензил, 4- метоксибензил, 4-метоксифенилдифенилметил, 2-нитробензил, 4- нитробензил, 4-хлорбензил, 4-бромбензил и 4-цианобензил; вышеуказанная "низшая алкоксикарбонильная группа"; вышеуказанная "алкенилоксикарбонильная группа"; и вышеуказанная "аралкилоксикарбонильная группа".
Предпочтительными примерами "обычной защитной группы" для "сложного эфира по карбоксильной группе" являются вышеуказанные "низшая алкильная группа", низшие алкенильные группы, такие как этенил, 1-пропенил, 2-пропенил, 1- метил-2-пропенил, 1-метил-1- пропенил, 2-метил-1-пропенил, 2- метил-2-пропенил, 2-этил-2-пропенил, 1-бутенил, 2-бутенил, 1-метил-2-бутенил, 1-метил-1-бутенил, 3-метил-2-бутенил, 1-этил-2-бутенил, 3-бутенил, 1-метил-3-бутенил, 2-метил-3-бутенил, 1-этил-3-бутенил, 1-пентенил, 2-пентенил, 1-метил-2-пентенил, 2-метил-2-пентенил, 3-пентенил, 1-метил-3-пентенил, 2-метил-3-пентенил, 4-пентенил, 1-метил-4-пентенил, 2-метил-4-пентенил, 1-гексенил, 2-гексенил, 3-гексенил, 4-гексенил и 5-гексенил; низшие алкинильные группы, такие как этинил, 2-пропинил, 1-метил-2-пропинил, 2-метил-2-пропенил, 2-этил-2-пропенил, 2-бутинил, 1-метил-2-бутинил, 2-метил-2-бутинил, 1-этил-2-бутинил, 3-бутинил, 1-метил-3-бутинил, 2-метил-3-бутинил, 1-этил-3-бутинил, 2-пентинил, 1-метил-2-пентинил, 2-метил-2-пентинил, 3-пентинил, 1-метил-3-пентинил, 2-метил-3-пентинил, 4-пентинил, 1-метил-4-пентинил, 2-метил-4-пентинил, 2-гексинил, 3-гексинил, 4-гексинил и 5-гексинил; вышеуказанная "галогенсодержащая низшая алкильная группа"; гидрокси ("низшие алкильные) группы", такие как 2-гидроксиэтил, 2,3- дигидроксипропил, 3-гидроксипропил, 3,4-дигидроксибутил и 4- гидроксибутил; ("низший алифатический ацил") ("низшие алкильные) группы", такие как ацетилметил; вышеуказанная "аралкильная группа" и вышеуказанная "силильная группа".
Термин "защитная группа, которую можно отщепить биологическим способом, таким как гидролиз in vivo", обозначает группу, которая отщепляется биологическим способом, таким как гидролиз в организме человека, и дает свободную кислоту или ее соль. Является ли соединение таким производным или нет можно определить следующим образом: соединение вводят внутривенно подопытному животному, такому как крыса или мышь, и затем исследуют жидкость организма животного. Если исходное соединение или его фармакологически приемлемую соль можно обнаружить в жидкости организма, соединение, исследуемое таким образом, считают производным.
Предпочтительными примерами "защитной группы, которую можно отщепить биологическим способом, таким как гидролиз in vivo" для гидроксигруппы являются "карбонилоксиалкильная группа", такая как 1-(ацилокси) ("низшие алкильные) группы", включающие (1-("низший алифатический ацил")окси) ("низшие алкильные) группы", например, формилоксиметил, ацетоксиметил, диметиламиноацетоксиметил, пропионилоксиметил, бутирилоксиметил, пивалоилоксиметил, валерилоксиметил, изовалерилоксиметил, гексаноилоксиметил, 1-формилоксиэтил, 1-ацетоксиэтил, 1-пропионилоксиэтил, 1-бутирилоксиэтил, 1-пивалоилоксиэтил, 1-валерилоксиэтил, 1-изовалерилоксиэтил, 1-гексаноилоксиэтил, 1-формилоксипропил, 1-ацетоксипропил, 1-пропионилоксипропил, 1-бутирилоксипропил, 1-пивалоилоксипропил, 1-валерилоксипропил, 1- изовалерилоксипропил, 1-гексаноилоксипропил, 1-ацетоксибутил, 1- пропионилоксибутил, 1-бутирилоксибутил, 1-пивалоилоксибутил, 1- ацетоксипентил, 1-пропионилоксипентил, 1-бутирилоксипентил, 1- пивалоилоксипентил и 1-пивалоилоксигексил, 1- ("циклоалкил" карбонилокси) ("низшие алкильные) группы", например, циклопентилкарбонилоксиметил, циклогексилкарбонилоксиметил, 1- циклопентилкарбонилоксиэтил, 1-циклогексилкарбонилоксиэтил, 1- циклопентилкарбонилоксипропил, 1-циклогексилкарбонилоксипропил, 1- циклопентилкарбонилоксибутил и 1-циклогексилкарбонилоксибутил; 1- (("ароматический ацил")окси) ("низшие алкильные) группы", например, бензоилоксиметил; (низший алкоксикарбонилокси) алкильные группы, например, метоксикарбонилоксиметил,
этоксикарбонилоксиметил, пропоксикарбонилоксиметил, изопропоксикарбонилоксиметил, бутоксикарбонилоксиметил, изобутоксикарбонилоксиметил, пентилоксикарбонилоксиметил, гексилоксикарбонилоксиметил, циклогексилоксикарбонилоксиметил, циклогексилоксикарбонилокси (циклогексил) метил, 1-(метоксикарбонилокси) этил, 1-(этоксикарбонилокси)этил, 1-(пропоксикарбонилокси) этил, 1-(изопропоксикарбонилокси)этил, 1-(бутоксикарбонилокси) этил, 1-(изобутоксикарбонилокси)этил, 1-(трет-бутоксикарбонилокси) этил, 1-(пентилоксикарбонилокси)этил, 1-(гексилоксикарбонилокси) этил, 1-(циклопентилоксикарбонилокси)-этил, 1-(циклопентилоксикарбонилокси) пропил, 1-(циклогексилоксикарбонилокси)пропил, 1-(циклопентилоксикарбонилокси)бутил, 1-(циклогексилоксикарбонилокси)бутил, 1-(циклогексилоксикарбонилокси)этил, 1-(этоксикарбонилокси)пропил, 2-(метоксикарбонилокси)-этил, 2-(этоксикарбонилокси)этил, 2-(пропоксикарбонилокси)этил, 2-(изопропоксикарбонилокси)этил, 2-(бутоксикарбонилокси)этил, 2-(изобутоксикарбонилокси)этил, 2-(пентилоксикарбонилокси)этил, 2-(гексилоксикарбонилокси)этил, 1-(метоксикарбонилокси)пропил, 1-(этоксикарбонилокси)пропил, 1-(пропоксикарбонилокси)пропил, 1-(изопропоксикарбонилокси) пропил, 1-(бутоксикарбонилокси)пропил, 1-(изобутоксикарбонилокси)пропил, 1-(пентилоксикарбонилокси) пропил, 1-(гексилоксикарбонилокси)пропил, 1-(метоксикарбонилокси)бутил, 1-(этоксикарбонилокси)бутил, 1-(пропоксикарбонилокси)бутил, 1-(иэопропоксикарбонилокси)бутил, 1-(бутоксикарбонилокси)бутил, 1- (изобутоксикарбонилокси)бутил, 1-(метоксикарбонилокси)пентил, 1-(этоксикарбонилокси)пентил, 1-(метоксикарбонилокси)гексил и 1-(этоксикарбонилокси)гексил; оксодиоксоленилметильные группы, например, (5-фенил-2-оксо-1,3-диоксолен-4-ил) метил, [5-(4-метилфенил)-2-оксо-1,3-диоксолен-4-ил] метил, [5-(4-метоксифенил)-2-оксо-1,3-диоксолен-4-ил] метил, [5-(4-фторфенил) -2-оксо-1,3-диоксолен-4-ил] метил, [5-(4-хлорфенил)-2-оксо-1,3-диоксолен-4-ил] -метил, (2-оксо-1,3-диоксолен-4-ил)метил, (5-метил-2-оксо-1,3-диоксолен-4-ил) метил, (5-этил-2-оксо-1,3-диоксолен-4-ил) метил, (5-пропил-2-оксо-1,3-диоксолен-4-ил) метил, (5-изопропил-2-оксо-1,3-диоксолен-4-ил) метил и (5-бутил- 2-оксо-1,3-диоксолен-4-ил) метил; и подобные группы; "фталидильные группы", например, фталидил, диметилфталидил и диметоксифталидил; вышеуказанная "низшая алифатическая ацильная группа"; вышеуказанная "ароматическая ацильная группа"; "остатки солей полуэфиров янтарной кислоты"; "остатки солей эфиров фосфорной кислоты"; "эфирообразующие остатки аминокислот или подобные группы"; карбамоильные группы; карбамоильные группы, замещенные 1 или 2 низшими алкильными группами; и 1-(ацилокси)алкилоксикарбонильные группы, например, пивалоилоксиметилоксикарбонил. Среди таких групп более предпочтительной является "карбонилоксиалкильная группа".
Предпочтительными примерами "защитной группы, которую можно отщепить биологическим способом, таким как гидролиз in vivo" в случае карбоксильной группы являются "алкокси (низшие алкильные) группы", такие как (низший алкокси) (низшие алкильные) группы, например, метоксиэтил, 1-этоксиэтил, 1-метил-1-метоксиэтил, 1-(изопропокси) этил, 2-метоксиэтил, 2-этоксиэтил, 1,1-диметил-1-метоксиэтил, этоксиметил, н-пропоксиметил, изопропоксиметил, н-бутоксиметил или трет-бутоксиметил; ((низший алкокси) (низший алкокси)) алкильные группы, такие как 2-метоксиэтоксиметил; (низший алкоксилированный низший алкокси) (низшие алкильные) группы, например, 2-метоксиэтоксиметил; ("арил" окси) ("низшие алкильные) группы", например, феноксиметил; и галогенсодержащие (низший алкокси) (низшие алкильные) группы, например, 2,2,2- трихлорэтоксиметил и бис(2-хлорэтокси)метил; ("низший алкокси") карбонил ("низшие алкильные) группы", например, метоксикарбонилметил; "циано" ("низшие алкильные) группы", например, цианометил или 2-цианометил; "("низший алкил") тиометильные группы", например, метилтиометил или этилтиометил; "арил" "тиометильные группы", например, фенилтиометил или нафтилтиометил; "(("низший алкил")сульфонил ("низшие алкильные) группы, необязательно замещенные атомами галогена")", например, 2-метансульфонилэтил или 2-трифторметансульфонилэтил; "(("арил"сульфонил) ("низшие алкильные) группы")", например, 2- бензолсульфонилэтил или 2-толуолсульфонилэтил; вышеуказанные "(("1-(ацилокси)") ("низшие алкильные) группы")", вышеуказанные "фталидильные группы"; вышеуказанные "арильные группы"; вышеуказанные "низшие алкильные группы"; "карбоксиалкильные группы", например, карбоксиметильные группы; и "амидообразующие остатки аминокислот", например, фенилаланина.
Так как соединение (I) настоящего изобретения можно преобразовать в иное производное, чем вышеуказанная "фармацевтически приемлемая соль" и вышеуказанный "сложный эфир", когда в нем есть аминогруппа и/или карбоксигруппа, термин "другое производное" обозначает такое производное. Примерами таких производных являются амиды.
Соединение (I) настоящего изобретения имеет некоторые асимметрические центры, и вследствие R- и S-конфигурации при каждом асимметрическом центре могут существовать стереоизомеры. Настоящее изобретение включает все отдельные изомеры и смеси таких изомеров в любых соотношениях.
Способ осуществления изобретения
Ацилированные гетероалициклические производные настоящего изобретения можно получить так, как описано далее.
[Способ А]
Способ А является способом получения соединения (I), где Z представляет собой два атома водорода.



На приведенной выше схеме R1, R2, A, B, D, G, L и n имеют указанные выше значения.
Y и Y' представляют, предпочтительно, хотя для них нет ограничений при условии что они являются группами, способными отщепляться как нуклеофильная группа, атомы галогена, такие как атомы хлора, брома и иода; тригалогенометилоксигруппы, такие как трихлорметокси; низшие алкансульфонилоксигруппы, такие как метансульфонилокси и этансульфонилокси; галогеносодержащие низшие алкансульфонилоксигруппы, такие как трифторметансульфонилокси и пентафторэтансульфонилокси; и арилсульфонилоксигруппы, такие как бензолсульфонилокси, п- толуолсульфонилокси и п-нитробензолсульфонилокси. Среди таких групп более предпочтительными являются атомы галогена и низшие алкансульфонилоксигруппы.
R8 представляет атом водорода или группу, защищающую гидроксильную группу. Группа, защищающая гидроксильную группу, означает "группу, защищающую при реакции", которую можно удалить химическим способом, таким как гидрогенолиз, гидролиз, электролиз и фотолиз, и примерами такой группы являются такие же группы, как "обычная защитная группа для сложного эфира по гидроксильной группе".
Стадия A1 представляет собой способ, при котором соединение (II) вводят во взаимодействие с соединением (III) в растворителе в присутствии основания с образованием соединения (IV), при этом иминогруппа соединения (II) модифицируется группой формулы -A-B-R1 (где А, В и R1 имеют значения, указанные выше).
Используемый растворитель не имеет особых ограничений при условии, что он не оказывает вредного влияния на реакцию и может растворять исходные вещества до некоторой степени, и предпочтительными примерами являются алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенсодержащие углеводороды, такие как метиленхлорид, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол и дихлорбензол; сложные эфиры, такие как этилформиат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; кетоны, такие как ацетон, метилэтилкетон, метилизобутилкетон, изофорон и циклогексанон; нитросоединения, такие как нитроэтан и нитробензол; и нитрилы, такие как ацетонитрил и изобутиронитрил. Среди таких растворителей более предпочтительными являются галогенсодержащие углеводороды и простые эфиры, и наиболее предпочтительны метиленхлорид и тетрагидрофуран.
Используемое основание не имеет особых ограничений при условии, что представляет собой основание, используемое в качестве основания в обычных реакциях. Предпочтительными примерами являются органические основания, такие как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N, N-диметиламино) пиридин, 2,6-ди(трет-бутил)-4-метилпиридин, хинолин, N,N-диметиланилин, N,N-диэтиланилин, 1,5-диазабицикло [4.3.0]нон-5-ен (DBN), 1,4-диазабицикло [2.2.2]октан (DABCO) и 1,8-диазабицикло[5.4.0] ундец- 7-ен (DBU). Среди таких оснований более предпочтительными являются триэтиламин и диизопропилэтиламин.
Взаимодействие можно осуществить при температуре от -20oC до 100oC, предпочтительно - от 0oC до 20oC.
Время реакции изменяется в зависимости от температуры реакции, исходных веществ, реагентов и растворителя и составляет, как правило, от 5 минут до 24 часов, предпочтительно - от 10 минут до 12 часов.
Кроме того, в случае, когда соединение (II) вводят во взаимодействие с соединением (III), где А представляет собой карбонильную группу, способ можно осуществить посредством проведения реакции с использованием соединения формулы R1-B-А-ОН (где А, В и R1 имеют указанные выше значения) и конденсирующего агента в растворителе, в присутствии или в отсутствие основания.
Примерами используемого "конденсирующего агента" являются
(1) сочетание фосфоната (например, диэтилцианофосфата или дифенилфосфорилазида) и основания, описанного ниже;
(2) карбодиимид (например, 1,3- дициклогексилкарбодиимид, 1,3-диизопропилкарбодиимид или 1-этил-3- (3-диметиламинопропил)-карбодиимид); сочетание одного из вышеуказанных карбодиимидов и основания, описанного ниже; или сочетание одного из вышеуказанных карбодиимидов и N- гидроксисоединения (например, N-гидроксисукцинимида, 1- гидроксибензотриазола или N-гидрокси-5-норборнен-2,3- дикарбоксиимида);
(3) сочетание дисульфида (например, 2,2'- дипиридилдисульфида или 2,2'-дибензотиазолилдисульфида и т.п.) и фосфина (например, трифенилфосфина или трибутилфосфина);
(4) карбонат [например, N,N'-дисукцинимидилкарбонат, ди-2- пиридилкарбонат или 3,3'-бис(1-фенил-1H-тетраэол-5-ил) дитиокарбонат];
(5) хлорангидрид фосфиновой кислоты [например, хлорангидрид N,N'-бис (2-оксо-3-оксазолидинил) фосфиновой кислоты];
(6) оксалат [например, N,N'-дисукцинимидилоксалат, N,N'-дифталимидоксалат, N,N'-бис (5-норборнен-2,3-дикарбоксиимидил)оксалат, 1,1'-бис(бензотриазолил) оксалат, 1,1'-бис(6-хлорбензотриазолил)оксалат или 1,1'-бис (6-трифторметилбензотриазолил)оксалат];
(7) сочетание вышеуказанного фосфина и азодикарбоксилата или азодикарбоксамида [например, диэтилазодикарбоксилата, 1,1'- (азодикарбонил)дипиперидина];
или сочетание вышеуказанного фосфина и основания, описанного ниже;
(8) 3'-сульфонат N-(низший алкил)-5-арилизоксазолия (например, 3'-сульфонат N-этил-5-фeнилизoкcaзoлия);
(9) дигетероарилдиселенид (например, ди-2-пиридилдиселенид);
(10) арилсульфонилтриазолид (например, п-нитробензолсульфонилтриазолид);
(11) галогенид 2-галоген-1-(низший алкил)пиридиния (например, 2-хлор-1-метилпиридинийиодид);
(12) имидазол (например, 1,1'-оксалилдиимидазол или N,N'-карбонилдиимидазол);
(13) фторборат 3-(низший алкил)-2-галогенбензотиазолия (например, фторборат 3-этил-2-хлорбензотиазолия);
(14) 3-(низший алкил)-бензотиазол-2-серон (например, 3-метилбензотиазол-2-серон);
(15) фосфат (например, фенилдихлорфосфат или полифосфат);
(16) галогенсульфонилизоцианат (например, хлорсульфонилизоцианат);
(17) галогенсилан (например, триметилсилилхлорид или триэтилсилилхлорид);
(18) сочетание низшего алкансульфонилгалогенида (например, метансульфонилхлорида) и основания, описанного ниже; и
(19) N,N,N',N'-тетра(низший алкил)галогенформамидийхлорид (например, N, N,N',N'-тeтpaмeтилxлopфopмaмидийxлopид).
Из перечисленных агентов более предпочтителен агент, указанный выше в (1).
Используемый растворитель не имеет особых ограничений при условии, что он не оказывает вредного влияния на взаимодействие и может растворять исходные вещества до некоторой степени, и предпочтительными примерами являются алифатические углеводороды, такие как гексан и гептан; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенсодержащие углеводороды, такие как метиленхлорид, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол и дихлорбензол; сложные эфиры, такие как этилформиат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; нитрилы, такие как ацетонитрил и изобутиронитрил; и амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидон, N-метилпиролидинон и триамид гексаметилфосфорной кислоты.
Используемое основание не имеет особых ограничений при условии, что представляет собой основание, используемое в качестве основания в обычных реакциях. Предпочтительными примерами являются органические основания, такие как N-метилморфолин, триэтиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N, N-димeтилaминo)пиридин, 2,6-ди(трет-бутил)-4-метилпиридин, хинолин, N, N-димeтилaнилин и N,N-диэтиланилин.
Кроме того, можно использовать каталитическое количество 4-(N,N-диметиламино) пиридина или 4- пирролидинопиридина в сочетании с другим основанием, и для того, чтобы осуществить реакцию эффективно, можно добавить обезвоживающее средство, такое как молекулярные сита, соли четвертичного аммониевого основания, такие как хлорид бензилтриэтиламмония и хлорид тетрабутиламмония, краун-эфиры, такие как дибензо-18-краун-6, и поглотители кислот, такие как 3,4- дигидро-2Н-пиридо[1,2-а] пиримидин-2-он.
Взаимодействие можно осуществить при температуре от -20oC до 80oC, предпочтительно - от 0oC до комнатной температуры.
Время реакции изменяется в зависимости, главным образом, от температуры реакции, исходных веществ, реагентов и растворителя и составляет, как правило, от 10 минут до 3 суток, предпочтительно - от 30 минут до 1 суток.
Стадия A2 представляет собой способ получения соединения (V) посредством удаления группы R8 из соединения (IV) и последующего преобразования гидроксигруппы, в присутствии или в отсутствие основания, в удаляемую группу Y'.
Реакция удаления R8 изменяется в зависимости от природы группы и осуществляется так, как показано ниже, способами, известными специалистам в этой области техники.
В случае, когда R8 представляет собой силильную группу, ее можно удалить посредством обработки соединением, образующим фторид-анион, таким как фторид тетрабутиламмония, фтороводород, фтороводород-пиридин или фторид калия; или посредством обработки органической кислотой, такой как уксусная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота, трифторуксусная кислота, трифторметансульфоновая кислота или B-бромокатехолборан, или неорганической кислотой, такой как хлороводородная кислота.
Кроме того, в случае удаления с помощью фторид-аниона реакцию иногда можно промотировать посредством добавления органической кислоты, такой как муравьиная кислота, уксусная кислота или пропионовая кислота.
Используемый растворитель не имеет особых ограничений при условии, что он не оказывает вредного влияния на взаимодействие и может растворять исходные вещества до некоторой степени, и предпочтительными примерами являются простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, ди-метоксиэтан и диметиловый эфир диэтиленгликоля; нитрилы, такие как ацетонитрил и изобутиронитрил; вода; органические кислоты, такие как уксусная кислота, и их смеси.
Взаимодействие можно осуществить при температуре от 0oC до 150oC (предпочтительно - от 10oC до 100oC) за время от 1 часа до 48 часов (предпочтительно - от 2 часов до 12 часов).
В случае, когда R8 представляет собой аралкильную или аралкилоксикарбонильную группу, ее, предпочтительно, можно удалить посредством приведения в контакт с восстановителем (предпочтительно, посредством каталитического гидрирования при комнатной температуре в присутствии катализатора) в растворителе или посредством использования окислителя.
Используемый растворитель при удалении посредством каталитического гидрирования не имеет особых ограничений при условии, что он не оказывает вредного влияния на взаимодействие, и предпочтительными примерами являются спирты, такие как метанол, этанол и изопропанол, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан, ароматические углеводороды, такие как толуол, бензол и ксилол, алифатические углеводороды, такие как гексан и циклогексан, сложные эфиры, такие как этилацетат и пропилацетат, амиды, такие как формамид, диметилформамид, диметилацетамид, N-метил- 2-пирролидон и триамид гексаметилфосфорной кислоты, алифатические кислоты, такие как муравьиная кислота и уксусная кислота, вода, или их смеси. Из таких растворителей более предпочтительными являются спирты, алифатические кислоты, смеси спиртов и простых эфиров, смеси спиртов и воды или смеси алифатических кислот и воды.
Не существует особых ограничений в отношении используемого катализатора при условии, что это катализатор, используемый, как правило, в реакции каталитического гидрирования, и предпочтительными примерами являются палладий-на-угле, палладиевая чернь, никель Ренея, оксид платины, платиновая чернь, родий на оксиде алюминия, трифенилфосфин-хлорид родия и палладий-сульфат бария.
Давление не имеет особых ограничений и составляет, как правило, от 1 до 10 атмосфер.
Время реакции и температура изменяются в зависимости от исходных веществ, растворителя и катализатора, но, как правило, реакцию осуществляют при температуре от 0oC до 100oC (предпочтительно - от 20oC до 70oC) за время от 5 минут до 48 часов (предпочтительно - от 1 часа до 24 часов).
Растворитель, используемый при удалении посредством окисления, не имеет особых ограничений при условии, что он не оказывает вредного влияния на взаимодействие, и предпочтительно используют водосодержащий органический растворитель.
Предпочтительными примерами такого органического растворителя являются кетоны, такие как ацетон, галогенсодержащие углеводороды, такие как метиленхлорид, хлороформ и тетрахлорид углерода, нитрилы, такие как ацетонитрил, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан, амиды, такие как диметил-формамид, диметилацетамид и триамид гексаметилфосфорной кислоты, и сульфоксиды, такие как диметилсульфоксид.
Не существует особых ограничений в отношении используемого окислителя при условии, что это окислитель, обычно применяемый в реакциях окисления, и предпочтительными примерами являются персульфат калия, персульфат натрия, церийаммонийнитрат (CAN) и 2,3-дихлор- 5,6-дициано-п-бензохинон (DDQ).
Время реакции и температура изменяются в зависимости от исходных веществ, растворителя и катализатора, но, как правило, реакцию осуществляют при температуре от 0oC до 150oC за время от 10 минут до 24 часов.
Эту группу также можно удалить с помощью щелочного металла, такого как металлический литий или металлический натрий, в жидком аммиаке или спирте, таком как метанол или этанол, при температуре от -78oC до -20oC.
Кроме того, эту группу также можно удалить с использованием хлорида алюминия и иодида натрия или алкилсилилгалогенида, такого как триметилсилилиодид, в растворителе.
Используемый растворитель не имеет особых ограничений при условии, что не оказывает вредного влияния на реакцию, и предпочтительно используются нитрилы, такие как ацетонитрил, галогенсодержащие углеводороды, такие как метиленхлорид или хлороформ, или их смеси.
Время реакции и температура изменяются в зависимости от исходных веществ и растворителя, но, как правило, реакцию осуществляют при температуре от 0oC до 50oC за время от 5 минут до 3 суток.
Когда субстрат в реакции содержит атом серы, предпочтительно использовать хлорид алюминия и иодид натрия.
В случае, когда R8 представляет собой алифатическую ацильную группу, ароматическую ацильную группу или низшую алкоксикарбонильную группу, ее можно удалить посредством обработки основанием в растворителе.
Используемое основание не имеет особых ограничений при условии, что оно не действует на какую-либо другую часть соединения, и предпочтительными примерами являются алкоксиды металлов, такие как метоксид натрия; карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия и карбонат лития; гидроксиды щелочных металлов, такие как гидроксид натрия, гидроксид калия, гидроксид лития и гидроксид бария; и аммиак, такой как водный аммиак и концентрированный раствор аммиака в метаноле.
Не существует особых ограничений в отношении используемого растворителя при условии, что это растворитель, обычно используемый при реакциях гидролиза, и предпочтительными примерами являются вода; органические растворители, такие как спирты (например, метанол, этанол и н-пропанол) и простые эфиры (например, тетрагидрофуран и диоксан); или смеси воды и описанных выше органических растворителей.
Время реакции и температура изменяются в зависимости от исходных веществ, растворителя и используемого основания, но, как правило, реакцию осуществляют при температуре от 0oC до 150oC за время от 1 часа до 10 часов для того, чтобы ингибировать побочные реакции.
В случае, когда R8 представляет собой низшую алкоксиметильную группу, тетрагидропиранильную группу, тетрагидротиопиранильную группу, тетрагидрофуранильную группу, тетрагидротиофуранильную группу или замещенную этильную группу, ее, как правило, можно удалить посредством обработки кислотой в растворителе.
Используемая кислота не имеет особых ограничений при условии, что она обычно используется как кислота Бренстеда или кислота Льюиса, и предпочтительными примерами являются кислоты Бренстеда, такие как хлороводород; неорганические кислоты (например, хлороводородная кислота, серная кислота или азотная кислота); и органические кислоты (например, уксусная кислота, трифторуксусная кислота, метансульфоновая кислота или п-толуолсульфоновая кислота); и кислоты Льюиса, такие как трифторид бора. Также могут использоваться сильнокислотные катионообменные смолы, такие как Dowex 50W.
Используемый растворитель не имеет особых ограничений при условии, что он не оказывает вредного влияния на реакцию и может растворять исходные вещества до некоторой степени, и предпочтительными примерами являются алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенсодержащие углеводороды, такие как метиленхлорид, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол и дихлорбензол; сложные эфиры, такие как этилформиат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол и метилцеллозольв; кетоны, такие как ацетон, метилэтилкетон, метилизобутилкетон, изофорон и циклогексанон; вода, и их смеси. Из таких растворителей более предпочтительными являются галогенсодержащие углеводороды, сложные эфиры и простые эфиры.
Температура реакции и время изменяются в зависимости от исходных веществ, растворителя и природы и концентрации используемой кислоты, но, как правило, реакцию осуществляют при температуре от -10oC до 100oC (предпочтительно - от -5oC до 50oC) за время от 5 минут до 48 часов (предпочтительно - от 30 минут до 10 часов).
В случае, когда R8 представляет собой алкенилоксикарбонильную группу, ее можно удалить посредством обработки основанием в условиях реакции, подобных описанным для случая, когда R8 представляет собой алифатическую ацильную группу, ароматическую ацильную группу или низшую алкоксикарбонильную группу, указанные выше.
Кроме того, в случае аллилоксикарбонильной группы удобным является способ с использованием палладия и трифенилфосфина или гексафторфосфата бис(метилфенилфосфин) (1,5-циклооктадиен) иридия (I), и реакцию можно осуществить с незначительными побочными реакциями.
На последнем этапе стадии A2 используемый растворитель не имеет особых ограничений при условии, что он не оказывает вредного влияния на реакцию и может растворять исходные вещества до некоторой степени, и предпочтительными примерами являются ароматические углеводороды, такие как бензол, толуол и ксилол; галогенсодержащие углеводороды, такие как метиленхлорид и хлороформ; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан и диметоксиэтан; нитрилы, такие как ацетонитрил; и амиды, такие как формамид, N, N-диметилформамид, N, N-диметилацетамид, N-метил-2-пирролидон, N-метилпирролидинон и триамид гексаметилфосфорной кислоты. Из них более предпочтительными являются амиды.
Используемое основание не имеет особых ограничений при условии, что представляет собой основание, используемое в качестве основания в обычных реакциях. Предпочтительными примерами являются органические основания, такие как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино) пиридин, 2,6-ди(трет-бутил) -4-метилпиридин, хинолин, N, N- димeтилaнилин, N,N-диэтиланилин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диаэабицикло[2.2.2]октан (DABCO) и 1,8-диазабицикло[5.4.0] ундец-7-ен (DBU). Среди таких оснований предпочтительными являются триэтиламин, пиридин и 4-(N, N- диметиламино) пиридин, и наиболее предпочтительно, реакцию осуществляют с использованием пиридина в качестве растворителя и с добавлением каталитического количества 4-(N,N-диметиламино) пиридина.
Взаимодействие можно осуществить при температуре от - 20oC до 50oC, предпочтительно - от -10oC до 20oC.
Время реакции изменяется в зависимости от температуры реакции, исходных веществ, реагентов и растворителя, и составляет, как правило, от 15 минут до 24 часов, предпочтительно - от 30 минут до 6 часов.
В качестве реагента для образования удаляемой группы Y' используют соответствующий галогенид, и примером такого реагента является сульфонилгалогенид, такой как метансульфонилхлорид или п-толуолсульфонилхлорид.
Стадия A3 представляет собой способ получения соединения (I) по настоящему изобретению посредством взаимодействия соединения (V) с соединением (VI) в растворителе в присутствии основания.
Используемый растворитель не имеет особых ограничений при условии, что он не оказывает вредного влияния на реакцию и может растворять исходные вещества до некоторой степени, и предпочтительными примерами являются алифатические углеводороды, такие как гексан, гептан, лигроин и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенсодержащие углеводороды, такие как метиленхлорид, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол и дихлорбензол; сложные эфиры, такие как этилформиат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; кетоны, такие как ацетон, метилэтилкетон, метилизобутилкетон, изофорон и циклогексанон; нитросоединения, такие как нитроэтан и нитробензол; нитрилы, такие как ацетонитрил и изобутиронитрил; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2- пирролидон, N-метилпирролидинон и триамид гексаметилфосфорной кислоты; и сульфоксиды, такие как диметилсульфоксид и сульфоран. Из них предпочтительными являются амиды, простые эфиры и нитрилы, и наиболее предпочтительны амиды.
Используемое основание не имеет особых ограничений при условии, что оно является основанием, используемым в обычных реакциях. Предпочтительными примерами являются сочетание иодида металла (например, иодида калия) и неорганического основания, такого как карбонат щелочного металла (например, карбонат натрия, карбонат калия или карбонат лития), гидрокарбонат щелочного металла (например, гидрокарбонат натрия, гидрокарбонат калия или гидрокарбонат лития), гидрид щелочного металла (например, гидрид лития, гидрид натрия или гидрид калия), гидроксид щелочного металла (например, гидроксид натрия, гидроксид калия, гидроксид бария или гидроксид лития) или фторид щелочного металла (например, фторид натрия или фторид калия); или органическое основание, такое как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, дииэопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино) пиридин, 2,6-ди(трет-бутил)-4-метилпиридин, хинолин, N,N-диметиланилин, N,N- диэтиланилин, 1,5-диазабицикло[4.3.0] нон-5-ен (DBN), 1,4-диазабицикло [2.2.2] октан (DABCO) и 1,8-диазабицикло [5.4.0] ундец-7-ен (DBU). Из них более предпочтительным является сочетание иодида металла и неорганического основания, и наиболее предпочтительно сочетание иодида металла и гидрокарбоната щелочного металла.
Взаимодействие можно осуществить при температуре от 0oC до 150oC, предпочтительно - от 20oC до 120oC.
Время реакции изменяется в зависимости от температуры реакции, исходных веществ, реагентов и растворителей, и составляет, как правило, от 30 минут до 48 часов, предпочтительно - от 1 часа до 12 часов.
[Способ В]
Соединение (I), где n равен 0, и Z представляет собой атом кислорода, можно получить по способу В.



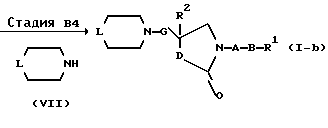
На вышеуказанной схеме R1, R2, A, B, D, G, L и Y' имеют указанные выше значения.
R2 представляет группу, защищающую гидроксильную группу, которая определена при определении R8 как "защитная группа в реакции".
R10 представляет группу, защищающую иминогруппу, и примерами являются вышеуказанные "алифатические ацильные группы"; вышеуказанные "ароматические ацильные группы"; вышеуказанные "низшие алкоксикарбонильные группы"; вышеуказанные "алкенилоксикарбонильные группы"; вышеуказанные "аралкилоксикарбонильные группы" и вышеуказанные "силильные группы". Из них более предпочтительными являются низшие алкоксикарбонильные группы, и наиболее предпочтительна третбутоксикарбонильная группа.
Стадия B1 представляет собой способ получения аминосоединения (X) посредством преобразования первичной гидроксигруппы диола (VIII) в удаляемую группу и последующего замещения этой группы аминогруппой амина (IX).
Реакцию преобразования первичной гидроксигруппы диола (VIII) в удаляемую группу осуществляют способом, подобным способу, описанному для реакции последнего этапа стадии A2.
Последнюю реакцию замещения осуществляют, как правило, в растворителе с использованием соли металла.
Используемый растворитель не имеет особых ограничений при условии, что он не оказывает вредного влияния на реакцию и может растворять исходные вещества до некоторой степени, и предпочтительными примерами являются ароматические углеводороды, такие как бензол, толуол и ксилол; галогенсодержащие углеводороды, такие как метиленхлорид, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол и дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; кетоны, такие как ацетон, метилэтилкетон, метилизобутилкетон, изофорон и циклогексанон; нитрилы, такие как ацетонитрил, пропионитрил и изобутиронитрил; и амиды, такие как формамид, N,N-диметилформамид, N, N- диметилацетамид, N-метил-2-пирролидон, N-метилпирролидинон и триамид гексаметилфосфорной кислоты. Из них предпочтительными являются нитрилы, и наиболее предпочтителен ацетонитрил.
Примерами используемой соли металла являются перхлораты, такие как перхлорат лития, перхлорат магния и перхлорат натрия; хлориды металлов, такие как хлорид кальция, хлорид цинка и хлорид кобальта; тетрафторбораты металлов, такие как тетрафторборат лития и тетрафторборат калия; и трифторметансульфонат цинка. Из них предпочтительными являются перхлораты металлов, и наиболее предпочтителен перхлорат лития.
Взаимодействие можно осуществить при температуре от -20oC до 150oC, предпочтительно - от комнатной температуры до 100oC.
Время реакции изменяется в зависимости от температуры реакции, исходных веществ, реагентов и растворителей, и составляет, как правило, от 30 минут до 2 суток, предпочтительно - от 2 часов до 1 суток.
Стадия B2 представляет собой способ получения соединения (XI) посредством защиты вторичной аминогруппы полученного амина (X) с последующим осуществлением циклизации.
Защиту вторичной аминогруппы группой R10 можно осуществить способами, описанными далее.
[Способ 1]
Способ, когда полученное соединение вводят во взаимодействие с 1-4 эквивалентами (предпочтительно - 2-3 эквивалентами) соединения формулы R10-X или соединения формулы R10-O-R10 (в случае, когда R10 представляет собой ацильную группу) в растворителе, в присутствии или в отсутствие основания;
[где
R10 имеет указанные выше значения, и
Х представляет удаляемую группу, и указанная удаляемая группа не имеет особых ограничений при условии, что ее можно отщепить, как правило, в виде нуклеофильной группы. Предпочтительными примерами являются атомы галогена, такого как хлор, бром и иод; низшие алкоксикарбонилоксигруппы, такие как метоксикарбонилокси и этоксикарбонилокси; галогенсодержащие алкилкарбонилоксигруппы, такие как хлорацетилокси, дихлорацетилокси, трихлорацетилокси и трифторацетилокси;
низшие алкансульфонилоксигруппы, такие как метансульфонилокси и этансульфонилокси; галогенсодержащие низшие алкансульфонилоксигруппы, такие как трифторметансульфонилокси и пентафторэтансульфонилокси; и арилсульфонилоксигруппы, такие как бензолсульфонилокси, п-толуолсульфонилокси и п-нитробензолсульфонилокси. Из них предпочтительными являются атомы галогена, галогенсодержащие низшие алкансульфонилоксигруппы и арилсульфонилоксигруппы]; или
[пособ 2]
Способ, при котором полученное соединение вводят во взаимодействие с соединением формулы R10-OH (в случае, когда R10 представляет собой ацильную группу) в растворителе, в присутствии или в отсутствие вышеуказанного "конденсирующего агента" и каталитического количества основания.
[Способ 3]
Способ, когда, в частности, R10 представляет собой трет-бутоксикарбонильную группу или бензилоксикарбонильную группу, и защиту вторичной аминогруппы группой R10 можно осуществить посредством взаимодействия полученного соединения с реагентом трет-бутоксикарбонилирования или реагентом бензилоксикарбонилирования в растворителе в присутствии основания.
Растворитель, используемый в [способе 1], не имеет особых ограничений при условии, что он не оказывает вредного влияния на реакцию и может растворять исходные вещества до некоторой степени, и предпочтительными примерами являются алифатические углеводороды, такие как гексан и гептан; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенсодержащие углеводороды, такие как метиленхлорид, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол и дихлорбензол; сложные эфиры, такие как этилформиат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; нитрилы, такие как ацетонитрил и изобутиронитрил; и амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидон, N-метилпирролидинон и триамид гексаметилфосфорной кислоты.
Основание, используемое в [способе 1], не имеет особых ограничений при условии, что представляет собой основание, используемое в качестве основания в обычных реакциях. Предпочтительными примерами являются органические основания, такие как N-метилморфолин, триэтиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N,N- диметиламино) пиридин, 2,6-ди(трет-бутил)-4-метил-пиридин, хинолин, N,N-диметиланилин и N,N-диэтиланилин.
Кроме того, можно использовать каталитическое количество 4-(N,N-диметиламино) пиридина или 4-пирролидинопиридина в сочетании с другим основанием. Более того, для того, чтобы осуществить взаимодействие эффективно, можно добавить соль четвертичного аммониевого основания, такую как хлорид бензилтриэтиламмония или хлорид тетрабутиламмония, или краун-эфир, такой как дибензо-18-краун-6.
Взаимодействие можно осуществить при температуре от -20oC до температуры кипения используемого растворителя, предпочтительно - от 0oC до комнатной температуры.
Время реакции изменяется в зависимости от температуры реакции, исходных веществ, основания и растворителя, и составляет, как правило, от 10 минут до 3 суток, предпочтительно - от 1 часа до 1 суток.
Примерами соединения формулы R10-X являются ацилгалогениды, такие как галогенангидриды алифатических кислот (например, ацетилхлорид, пропионилхлорид, бутирилбромид, валерилхлорид и гексаноилхлорид); низшие алкоксикарбонилгалогениды (например, метоксикарбонилхлорид, метоксикарбонилбромид, этоксикарбонилхлорид, пропоксикарбонилхорид, бутоксикарбонилхлорид и гексилоксикарбонилхлорид); арилкарбонилгалогениды (например, бензоилхлорид, бензоилбромид и нафтоилхлорид); силилгалогениды, такие как трет-бутилдиметилсилилхлорид, триметилсилилхлорид, триэтилсилилхлорид, триэтилсилилбромид, триизопропилсилилхлорид, диметилизопропилсилилхлорид, диэтилизопропилсилилхлорид, трет- бутилдифенилсилилхлорид, дифенилметилсилилхлорид и трифенилсилилхлорид; соответствующие силилтрифторметансульфонаты; аралкилгалогениды, такие как бензилхлорид и бензилбромид; и карбонилокси (низший алкил)галогениды, такие как пивалоилоксиметилхлорид и этоксикарбонилоксиметилхлорид.
Примерами соединения формулы R10-O-R10 являются ангидриды алифатических карбоновых кислот, такие как уксусный ангидрид, пропионовый ангидрид, валериановый ангидрид или капроновый ангидрид; и смешанные ангидриды, такие как смешанный ангидрид муравьиной и уксусной кислот.
Растворитель, используемый в [способе 2], не имеет особых ограничений при условии, что он не оказывает вредного влияния на реакцию и может растворять исходные вещества до некоторой степени, и предпочтительными примерами являются ароматические углеводороды, такие как бензол, толуол и ксилол; галогенсодержащие углеводороды, такие как метиленхлорид, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол и дихлорбензол; сложные эфиры, такие как этилформиат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; нитрилы, такие как ацетонитрил и изобутиронитрил; и амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2- пирролидон, N-метилпирролидинон и триамид гексаметилфосфорной кислоты.
Основание, описанное в способе 1, можно использовать в качестве основания в способе 2.
Взаимодействие можно осуществить при температуре от -20oC до 80oC, предпочтительно - от 0oC до комнатной температуры.
Время реакции изменяется в зависимости от температуры реакции, исходных веществ, основания и растворителя, и составляет, как правило, от 10 минут до 3 суток, предпочтительно - от 30 минут до 1 суток.
Растворитель, используемый в [способе 3], не имеет особых ограничений при условии, что он не оказывает вредного влияния на реакцию и может растворять исходные вещества до некоторой степени, и предпочтительными примерами являются алифатические углеводороды, такие как гексан и гептан; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенсодержащие углеводороды, такие как метиленхлорид, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол и дихлорбензол; сложные эфиры, такие как этилформиат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; нитрилы, такие как ацетонитрил и изобутиронитрил; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2- пирролидон, N-метилпирролидинон и триамид гексаметилфосфорной кислоты; вода и смеси воды и одного из вышеуказанных органических растворителей.
Основание, описанное в способе 1, можно использовать в качестве основания в способе 3.
Предпочтительными примерами реагента для трет-бутоксикарбонилирования являются ди-трет-бутилдикарбонат, 2- (трет-бутоксикарбонилоксиимино)-2-фенилацетонитрил, трет-бутил-S-(4,6-диметилпиридин-2-ил)тиолкарбоксилат, 1,2,2,2-тетрахлорэтил и -трет-бутилкарбонат. Из них более предпочтительным является ди-трет-бутилдикарбонат.
Предпочтительными примерами реагента для бензилоксикарбонилирования являются бензилоксикарбонилхлорид, бензилоксикарбонилцианид и дибензилдикарбонат.
Взаимодействие можно осуществить при температуре от -20oC до 80oC, предпочтительно - от 0oC до комнатной температуры.
Время реакции изменяется в зависимости от температуры реакции, исходных веществ, основания и растворителя, и составляет, как правило, от 10 минут до 3 суток, предпочтительно - от 30 минут до 1 суток.
Реакцию циклизации на последнем этапе осуществляют, как правило, в растворителе в присутствии основания.
Используемый растворитель не имеет особых ограничений при условии, что он не оказывает вредного влияния на реакцию и может растворять исходные вещества до некоторой степени, и предпочтительными примерами являются алифатические углеводороды, такие как гексан и гептан; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенсодержащие углеводороды, такие как метиленхлорид, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол и дихлорбензол; сложные эфиры, такие как этилформиат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; нитрилы, такие как ацетонитрил и изобутиронитрил; и амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидон, N-метилпирролидинон и триамид гексаметилфосфорной кислоты.
Используемое основание не имеет особых ограничений при условии, что оно является основанием, используемым в обычных реакциях. Предпочтительными примерами являются неорганические основания, такие как карбонаты щелочных металлов (например, карбонат натрия, карбонат калия и карбонат лития); гидрокарбонаты щелочных металлов (например, гидрокарбонат натрия, гидрокарбонат калия и гидрокарбонат лития); гидриды щелочных металлов (например, гидрид лития, гидрид натрия и гидрид калия); гидроксиды щелочных металлов (например, гидроксид натрия, гидроксид калия, гидроксид бария и гидроксид лития); фториды щелочных металлов (например, фторид натрия и фторид калия); и алкоксиды щелочных металлов, такие как метоксид натрия, этоксид натрия, метоксид калия, этоксид калия, трет-бутоксид калия и метоксид лития. Из них более предпочтительными являются гидриды щелочных металлов и алкоксиды щелочных металлов.
Взаимодействие можно осуществить при температуре от -20oC до 80oC, предпочтительно - от 0oC до комнатной температуры.
Время реакции изменяется в зависимости от температуры реакции, исходных веществ, основания и растворителя, и составляет, как правило, от 10 минут до 3 суток, предпочтительно - от 30 минут до 1 суток.
Стадия B3 представляет собой способ получения соединения (XII) посредством удаления защиты гидроксигруппы соединения (XI) и последующего преобразования полученной гидроксигруппы в удаляемую группу, которое можно осуществить так, как это описано для последнего этапа стадии A2.
Стадия B4 представляет собой способ получения соединения (l-b) настоящего изобретения посредством осуществления реакции конденсации между соединением (XII) и соединением (VII), которую можно осуществить так, как это описано для стадии A3.
[Способ С]
Соединение (1), где n равен 1 или 2, и Z представляет собой атом кислорода, можно получить способом С.


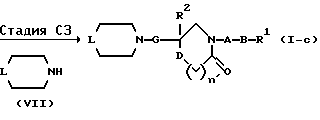
В указанных формулах R1, R2, R3, A, B, D, G, L и Y' имеют указанные выше значения;
X и X' представляют удаляемые группы, имеющие те же значения, что и указанные выше для Y'; и
n равен 1 или 2.
Стадия C1 представляет собой способ получения циклического амида (XIV) посредством взаимодействия вторичной аминогруппы амина (X) с соединением (XIII) в растворителе в присутствии основания и последующего алкилирования по группе DH.
Растворитель, используемый на первом этапе, не имеет особых ограничений при условии, что он не оказывает вредного влияния на реакцию и может растворять исходные вещества до некоторой степени, и предпочтительными примерами являются алифатические углеводороды, такие как гексан и гептан; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенсодержащие углеводороды, такие как метиленхлорид, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол и дихлорбензол; сложные эфиры, такие как этилформиат, этилацетат, пропилацетат, бутилацетат и диэтилкарбонат; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; нитрилы, такие как ацетонитрил и изобутиронитрил; и амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидон, N-метилпирролидинон и триамид гексаметилфосфорной кислоты.
Используемое основание не имеет особых ограничений при условии, что представляет собой основание, используемое в качестве основания в обычных реакциях. Предпочтительными примерами являются органические основания, такие как N-метилморфолин, триэтиламин, трибутиламин, диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 4-(N,N-диметиламино) пиридин, 2,6-ди(трет-бутил)-4-метилпиридин, хинолин, N, N-димeтилaнилин и N,N-диэтиланилин.
Кроме того, можно использовать каталитическое количество 4-(N,N-диметиламино) пиридина или 4-пирролидинопиридина в сочетании с другим основанием, и для того, чтобы осуществить взаимодействие эффективно, можно добавить водоотнимающее средство, такое как молекулярные сита, соли четвертичного аммониевого основания, такие как хлорид бензилтриэтиламмония и хлорид тетрабутиламмония, краун-эфиры, такие как дибензо-18-краун-6, и поглотители кислот, такие как 3,4-дигидро-2Н-пиридо [1,2-а] пиримидин-2-он.
Взаимодействие можно осуществить при температуре от -20oC до 80oC, предпочтительно - от 0oC до комнатной температуры.
Время реакции изменяется в зависимости от температуры реакции, исходных веществ, реагента и растворителя, и составляет, как правило, от 10 минут до 3 суток, предпочтительно - от 30 минут до 1 суток.
Растворитель, используемый при реакции алкилирования на последнем этапе, не имеет особых ограничений при условии, что он не оказывает вредного влияния на реакцию и может растворять исходные вещества до некоторой степени, и предпочтительными примерами являются ароматические углеводороды, такие как бензол, толуол и ксилол; галогенсодержащие углеводороды, такие как метиленхлорид, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол и дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и диметиловый эфир диэтиленгликоля; нитрилы, такие как ацетонитрил, пропионитрил и изобутиронитрил; амиды, такие как формамид, N, N-диметилформамид, N,N-димeтилaцeтaмид, N-метил-2- пирролидон, N-метилпирролидинон и триамид гексаметилфосфорной кислоты; и сульфоксиды, такие как диметилсульфоксид и сульфолан. Из них более предпочтительными являются простые эфиры и амиды, и наиболее предпочтительны тетрагидрофуран и N,N-диметилформамид.
Используемое основание не имеет особых ограничений при условии, что представляет собой основание, используемое в качестве основания в обычных реакциях. Предпочтительными примерами являются неорганические основания, такие как карбонаты щелочных металлов (например, карбонат натрия, карбонат калия и карбонат лития); гидрокарбонаты щелочных металлов (например, гидрокарбонат натрия, гидрокарбонат калия и гидрокарбонат лития); гидриды щелочных металлов (например, гидрид лития, гидрид натрия и гидрид калия); гидроксиды щелочных металлов (например, гидроксид натрия, гидроксид калия, гидроксид бария и гидроксид лития); фториды щелочных металлов (например, фторид натрия и фторид калия); и алкоксиды щелочных металлов, такие как метоксид натрия, этоксид натрия, метоксид калия, этоксид калия, трет-бутоксид калия и метоксид лития. Из них более предпочтительными являются гидриды щелочных металлов и алкоксиды щелочных металлов.
Взаимодействие можно осуществить при температуре от -20oC до 100oC, предпочтительно - от 0oC до 50oC.
Время реакции изменяется в зависимости от температуры реакции, исходных веществ, основания и растворителя, и составляет, как правило, от 10 минут до 24 часов, предпочтительно - от 30 минут до 12 часов.
Стадия C2 представляет собой способ получения соединения (XV) настоящего изобретения посредством удаления защиты гидроксигруппы соединения (XIV), и последующего преобразования полученной гидроксигруппы в удаляемую группу, и может быть осуществлена так, как это описано для последнего этапа стадии A2.
Стадия C3 представляет собой способ получения соединения (l-b) настоящего изобретения посредством осуществления реакции конденсации между соединением (XV) и соединением (VII), и может быть осуществлена так, как это описано для стадии A3.
После завершения каждой из описанных выше реакций из реакционной смеси обычными способами выделяют нужное соединение.
Например, его получают посредством нейтрализации реакционной смеси, как это необходимо, удаления нерастворимых веществ посредством фильтрации, если это требуется, добавления органических растворителей, которые не смешиваются друг с другом, таких как вода и этилацетат, промывания водой или подобным растворителем, отделения органического слоя, содержащего нужное соединение, сушки его над безводным сульфатом магния или подобным осушителем, и последующей отгонки растворителя.
При необходимости, полученное таким образом нужное соединение можно выделить и очистить с использованием обычного способа, такого как перекристаллизация или переосаждение, и хроматографии, при необходимом сочетании способа, обычно используемого для выделения и очистки органического соединения, и элюирования с использованием надлежащего элюента. Примерами хроматографии являются адсорбционная колоночная хроматография с использованием носителя, такого как силикагель, оксид алюминия или магний на силикагеле типа Florisil, хроматография с использованием синтетического адсорбента, например, распределительная колоночная хроматография с использованием носителя, такого как Sephadex LH-20 (продукт Pharmacia), Amberlite XAD-11 (продукт Rohm & Haas) или Diaion HP-20 (продукт Mitsubishi Chemical), ионообменная хроматография или колоночная хроматография, обычная и с обращенной фазой (высокоэффективная жидкостная хроматография), с использованием силикагеля или алкилированного силикагеля.
Кроме того, исходные вещества являются или коммерчески доступными, или их можно легко получить известными методами (например, так, как описано в ЕР-776893 и патенте США 5641777, и подобными способами) из коммерчески доступных исходных веществ.
Новые ацилированные гетероалициклические производные настоящего изобретения обладают высокой NK2-селективной антагонистической активностью и имеют низкую токсичность, и, таким образом, они полезны в качестве лекарственных средств. Например, они полезны в качестве профилактических и лечебных средств в случае заболеваний центральной нервной системы, таких как страх, депрессия, психоз и шизофрения; апноэ во сне; нейродегенеративных заболеваний, таких как деменция при СПИДе, старческая деменция Альцгеймера, болезнь Альцгеймера, синдром Дауна, демиелинизирующее заболевание, боковой амиотрофический склероз, невропатия, периферическая невропатия и невралгия; респираторных заболеваний, таких как хроническая обструктивная болезнь легких, бронхит, пневмония, бронхоконстрикция, астма и кашель; воспалительных заболеваний, таких как воспалительное заболевание кишечника (IBD), псориаз, фиброз, эрифизит, дегенеративный артрит и ревматоидный артрит; экземы; аллергических заболеваний, таких как ринит; аллергозов, таких как повышенная чувствительность к вьющимся растениям; офтальмологических заболеваний, таких как конъюнктивит, весенний конъюнктивит, весенний катар, разрушение гематоофтальмического барьера, вызванное различными воспалительными болезнями глаз, повышенное внутриглазное, давление и миоз; кожных болезней, таких как контактный дерматит, атопический дерматит, крапивница и другие экзематозные дерматиты; аддикций, таких как алкогольная зависимость; соматических болезней, вызванных стрессом; симпатической рефлекторной дистрофии, такой как плечевой синдром; дистимии; нежелательных иммунных реакций, таких как отторжение трансплантатов, болезни, связанные с иммуностимуляцией, такие как системная красная волчанка или иммуносупрессия; болезней пищеварительной системы, таких как болезни, вызванные нарушениями нервной регуляции органов, колит, неспецифический язвенный колит и болезнь Крона; рвоты, такой как рвота, вызванная вредным воздействием рентгеновского излучения и химиотерапии, ядами, токсинами, беременностью, вестибулярными расстройствами, послеоперационными расстройствами, желудочно-кишечной окклюзией, ослабленной желудочно-кишечной подвижностью, висцеральной болью, мигренью, повышенным внутричерепным давлением, пониженным внутричерепным давлением или побочными реакциями, вызванными введением различных лечебных средств; функциональных болезней мочевого пузыря, таких как цистит и недержание мочи; эозинофилии, вызванной коллагеновыми болезнями, склеродермией или инфекцией Fasciola hepatica; болезней, вызванных нарушениями кровотока вследствие вазодилатации или вазоконстрикции, таких как стенокардия, мигрень и болезнь Рейно; и боли при болевой ноцицептивной рецепции, такой как мигрень, головная боль и зубная боль.
Способ введения соединения (I) настоящего изобретения включает пероральное введение в форме таблеток, капсул, гранул, порошков или сиропов, или парентеральное введение в форме инъекций или суппозиториев. Такие композиции можно получить известными способами с использованием добавок, таких как эксципиенты (например, органические эксципиенты, в том числе, сахара, такие как лактоза, сахароза, глюкоза, маннит или сорбит; крахмалы, такие как кукурузный крахмал, картофельный крахмал, α-крахмал, декстрин или карбоксиметилкрахмал; производные целлюлозы, такие как кристаллическая целлюлоза, гидроксипропилцеллюлоза с низкой степенью замещения, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза, кальцийкарбоксиметилцеллюлоза или карбоксиметилцеллюлозанатрий с внутримолекулярной трехмерной структурой; аравийская камедь; декстран и пуллулан; и неорганические эксципиенты, такие как слабообезвоженная кремниевая кислота, синтетический алюмосиликат или алюминат-метасиликат магния; фосфаты, такие как фосфат кальция; карбонаты, такие как карбонат кальция; и сульфаты, такие как сульфат кальция), смазывающие вещества (например, стеариновая кислота и соли металлов стеариновой кислоты, такие как стеарат кальция и стеарат магния; тальк; коллоидный диоксид кремния; воски, такие как пчелиный воск и спермацет; борная кислота; адипиновая кислота; сульфаты, такие как сульфат натрия; гликоль; фумаровая кислота; бензоат натрия; DL-лейцин; натриевые соли алифатических кислот; лаурилсульфаты, такие как лаурилсульфат натрия и лаурилсульфат магния; кремниевые кислоты, такие как обезвоженная кремниевая кислота и силикаты-гидраты; и описанные выше крахмалы), связующие вещества (например, поливинилпирролидон, макрогель и те же соединения, какие описаны выше в качестве эксципиентов), дезинтеграторы (например, те же соединения, какие описаны выше в качестве эксципиентов, и химически модифицированные крахмалцеллюлозы, такие как кроскармелозанатрий, карбоксиметилкрахмалнатрий и сшитый поливинилпирролидон), стабилизаторы (например, параоксибензоаты, такие как метилпарабен и полипарабен; спирты, такие как хлорбутанол, бензиловый спирт и фенетиловый спирт; безалконийхлорид; фенолы, такие как фенол и крезол; тимеросаль; дегидроацетовая кислота; и сорбиновая кислота), корригенты (например, обычно применяемые подслащиватели, подкисляющие вещества и отдушки) и разбавители.
Дозировка соединения (I) будет изменяться в зависимости от характера и тяжести заболевания, возраста пациента и способа введения. Подходящая однократная стандартная доза соединения (I) в случае перорального введения составляет от 0,01 мг на кг массы тела (предпочтительно - 0,1 мг на кг массы тела), как нижнего предела, до 100 мг на кг массы тела (предпочтительно - до 50 мг на кг массы тела) как верхнего предела. В случае внутривенного введения доза составляет от 0,01 мг на кг массы тела (предпочтительно - 0,05 мг на кг массы тела), как нижнего предела, до 100 мг на кг массы тела (предпочтительно - до 50 мг на кг массы тела) как верхнего предела. Желательно вводить вышеуказанную дозу один или несколько раз в сутки, в зависимости от характера и тяжести заболевания.
Наилучший способ осуществления изобретения
Приведенные далее примеры, ссылочные примеры, примеры композиций и примеры испытаний предназначены для дополнительного пояснения настоящего изобретения и не предназначены для какого-либо ограничения объема данного изобретения.
Пример 1
1-{ 2-[(2R)-(3,4-Дихлорфенил)-4- (циклобутанкарбонил)морфолин-2-ил]этил} спиро[бензо[с]тиофен-1 (3H),4'-пиперидин]-(2S)-оксид
Пример 1(а)
2-[(2R)-(3,4-Дихлорфенил)-4-(циклобутанкарбонил) морфолин-2- ил]этанол
Водорастворимый гидрохлорид карбодиимида (WSC.HCl, 166 мг, 0,87 ммоль), 1-гидроксибензотриазол (117 мг, 0,87 ммоль) и триэтиламин (0,15 мл, 1,09 ммоль) при 0oC в атмосфере азота по очереди добавляют к раствору циклобутанкарбоновой кислоты (80 мг, 0,80 ммоль) в метиленхлориде (5 мл), и к полученной смеси добавляют 2-[(2R)-(3,4-дихлорфенил)морфолин-2-ил]этанол (200 мг, 0,72 ммоль), полученный в ссылочном примере 1. Смесь перемешивают при комнатной температуре в течение 6 часов. Реакционную смесь промывают по очереди насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушат над безводным сульфатом магния, и затем растворитель отгоняют при пониженном давлении. Остаток очищают тонкослойной хроматографией на силикагеле с использованием в качестве проявляющего растворителя смеси н-гексана и этилацетата (1:4), и получают нужное соединение (254 мг, 98%) в виде белого аморфного твердого вещества.
Спектр ядерного магнитного резонанса (270 МГц, CDCl3) δ м.д.:
7,59 (1H, ушс), 7,44 (1H, д, J=8,4 Гц), 7,29 (1H, ушл, J=8,4 Гц), 4,55 (1H, д, J=13,9 Гц), 3,71-3,80 (1H, м), 3,32-3,62 (6H, м), 3,09-3,22 (1H, м), 2,28-2,42 (1H, м), 1,79-2,18 (8H, м).
Инфракрасный спектр, νмакс, см-1 (CHCl3): 3624, 2954, 1640, 1441.
Масс-спектрометрический анализ (FAB), m/z: 358 ((М+Н)+).
Пример 1 (b)
Эфир 2-[(2R)-(3,4-дихлорфенил)-4-(циклобутанкарбонил)-морфолин-2-ил] этанола и метансульфоновой кислоты
Метансульфонилхлорид (0,071 мл, 0,92 ммоль) и 4-диметиламинопиридин (каталитическое количество) при охлаждении льдом и в атмосфере азота добавляют к раствору 2-[(2R)-(3,4- дихлорфенил) -4- (циклобутанкарбонил)морфолин-2- ил]этанола (219 мг, 0,61 ммоль), полученного в примере 1(а), в пиридине (2 мл). Смесь перемешивают при той же температуре в течение 30 минут. Реакционную смесь подкисляют охлажденной льдом соляной кислотой (10%) и экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом магния. Этилацетат отгоняют при пониженном давлении. Остаток очищают посредством тонкослойной хроматографии на силикагеле с использованием в качестве проявляющего растворителя смеси н-гексана и этилацетата (1:4), и получают нужное соединение (255 мг, 96%) в виде белого аморфного твердого вещества.
Спектр ядерного магнитного резонанса (270 МГц, CDCl3) δ м.д.:
7,57 (1H, ушс), 7,46 (1H, д, J=8,5 Гц), 7,20-7,30 (1H, м), 3,14-4,31 (9H, м), 2,93 (3H, с), 2,26-2,42 (2H, м), 1,82-2,22 (6H, м).
Инфракрасный спектр, νмакс, см-1 (CHCl3): 2971, 1641, 1440.
Масс-спектрометрический анализ (FAB), m/z: 436 ((M+H)+).
Пример 1 (с)
1-{ 2-[(2R)-(3,4-Дихлорфенил)-4- (циклобутанкарбонил)морфолин-2-ил]этил} спиро[бензо[с]тиофен-1 (3H),4'-пиперидин]-(2S)-оксид
Эфир 2-[(2R)-(3,4-дихлорфенил)-4-(циклобутанкарбонил) морфолин-2-ил]этанола и метаносульфоновой кислоты (114 мг, 0,26 ммоль), полученный в примере 1(b), гидрохлорид спиро[бензо [с] тиофен-1(3H),4'-пиперидин]-(2S)-оксида (74 мг, 0,29 ммоль), гидрокарбонат натрия (66 мг, 0,78 ммоль) и иодид калия (65 мг, 0,39 ммоль) суспендируют в безводном диметилформамиде (2 мл), и смесь перемешивают при 80oC в атмосфере азота в течение 8 часов. К реакционной смеси добавляют воду, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении. Остаток очищают посредством тонкослойной хроматографии на силикагеле с использованием в качестве проявляющего растворителя смеси метиленхлорида и метанола (10:1), и получают названное в заголовке соединение (111 мг, 76%) в виде белого кристаллического вещества.
Т.пл. 99-101oC.
[α]
Спектр ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
7,22-7,59 (7H, м), 4,52 (1H, д, J=13,8 Гц), 4,31 (1H, д, J= 16,8 Гц), 3,99 (1H, д, J= 16,8 Гц), 3,13-3,83 (6H, м), 2,72-2,96 (2H, м), 2,02-2,45 (11Н, м), 1,82-1,99 (4H, м), 1,52-1,56 (1H, м).
Инфракрасный спектр, νмакс см-1 (KBr):
3432, 2949, 1643, 1436.
Масс-спектрометрический анализ (FAB), m/z: 561 ((М+Н)+).
Элементный анализ (%):
для C29H34N2O3SCl2 • 0,5 H2O
вычислено: С - 61,04; H - 6,18; N-4,90; S - 5,61; Cl -12,43;
найдено: С - 61,75; H - 6,40; N - 4,86; S - 5,52; C l - 11,72.
Пример 2
1-{ 2-[(2R)-(3,4-Дихлорфенил)-4- (циклопропанкарбонил)-морфолин-2-ил] этил}спиро[бензо[с]тиофен- 1(3H),4'-пиперидин]-(2S)-оксид
Пример 2 (а)
2-[(2R)-(3,4-Дихлорфенил)-4-(циклопропанкарбонил)морфолин-2-ил]этанол
Нужное соединение (230 мг, 92%) получают в виде белого аморфного твердого вещества в соответствии с процедурой, описанной в примере 1(а), с использованием циклопропанкарбоновой кислоты (69 мг, 0,80 ммоль) и 2-[(2R)-(3,4-дихлорфенил)морфолин-2-ил]-этанола (200 мг, 0,72 ммоль).
Спектр ядерного магнитного резонанса (270 МГц, CDCl3) δ м.д.:
7,58 (1H, ушс), 7,43 (1H, д, J=8,7 Гц), 7,28 (1H, ушд, J=8,7 Гц), 4,54 (1H, д, J= 13,9 Гц), 3,5-3,9 (8H, м), 1,9-2,2 (2H, м), 1,5-1,7 (1H, ушс), 0,7-1,0 (4H, м).
Инфракрасный спектр, νмакс, см-1 (CHCl3): 3623, 2968, 1732, 1637, 1471.
Масс-спектрометрический анализ (FAB), m/z: 344 ((M+H)+).
Пример 2(b)
Эфир 2-[(2R)-(3,4-дихлорфенил)-4- (циклопропанкарбонил)-морфолин-2-ил] этанола и метансульфоновой кислоты
Нужное соединение (257 мг, 95%) получают в виде белого аморфного твердого вещества в соответствии с процедурой, описанной в примере 1(b), с использованием 2-[(2R)-(3,4- дихлорфенил)-4-(циклопропанкарбонил)морфолин-2-ил] этанола (220 мг, 0,64 ммоль).
Спектр ядерного магнитного резонанса (270 МГц, CDCl3) δ м.д.:
7,57 (1H, ушс), 7,45 (1H, д, J=7,9 Гц), 7,25-7,32 (1H, м), 3,48-4,30 (8H, м), 2,92 (3H, с), 2,09-2,49 (2H, м), 0,65-1,12 (4H, м).
Инфракрасный спектр, νмакс, см-1 (CHCl3): 2973, 1731, 1678, 1471.
Масс-спектрометрический анализ (FAB), m/z: 422 ((М+Н)+).
Пример 2 (с)
1-{ 2-[(2R)-(3,4-Дихлорфенил)-4- (циклопропанкарбонил)-морфолин-2-ил] этил}спиро[бензо[с] тиофен-1(3H),4'-пиперидин]-(2S)-оксид
Нужное соединение (63 мг, 45%) получают в виде белого кристаллического вещества в соответствии с процедурой, описанной в примере 1(с), с использованием эфира 2-[(2R)-(3,4-дихлорфенил)-4- (циклопропанкарбонил)морфолин-2-ил]этанола и метаносульфоновой кислоты (109 мг, 0,26 ммоль) и гидрохлорида спиро[бензо[с] тиофен-1(3H),4'-пиперидин]-(2S)-оксида (71 мг, 0,28 ммоль).
Т.пл. 96-99oC.
[α]
Спектр ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
7,23-7,59 (7H, м), 4,31 (1H, д, J=16,8 Гц), 3,99 (1H, д, J=16,8 Гц), 3,44-4,52 (5H, м), 2,73-2,96 (2H, м), 1,52-2,40 (12H, м), 0,75-1,15 (4H, м).
Инфракрасный спектр, νмакс, см-1 (KBr): 3414, 2922, 1639, 1470.
Масс-спектрометрический анализ (FAB), m/z: 547 ((М+Н)+).
Элементный анализ (%):
для С28H32N2SO3Cl2 • 0,5H2O
вычислено: С - 60,42; H - 5,98; N - 5,03; S - 5,76; Cl - 12,74;
найдено: С - 60,92; H - 6,32; N - 4,84; S - 5,71; Cl - 12,35.
Пример 3
1-{ 2-[(2R)-(3,4-Дихлорфенил)-4- (циклопентанкарбонил)-морфолин-2-ил] этил}спиро[бензо[с] тиофен-1(3H),4'-пиперидин]-(2S)-оксид
Пример 3(а)
2-[(2R)-(3,4-Дихлорфенил)-4-(циклопентанкарбонил)морфолин-2-ил]этанол
Нужное соединение (389 мг, 96%) получают в виде белого аморфного твердого вещества в соответствии с процедурой, описанной в примере 1 (а), с использованием циклопентанкарбоновой кислоты (186 мг, 1,63 ммоль) и 2-[(2R)-(3,4-дихлорфенил)морфолин-2-ил]этанола (300 мг, 1,09 ммоль).
Спектр ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
7,59 (1H, д, J=20 Гц), 7,43 (1H, д, J=8,4 Гц), 7,28 (1H, дд, J=8,4 и 2,0 Гц), 4,62 (1H, д, J=13,9 Гц), 3,3-3,9 (7H, м), 3,37 (1H, д, J=13,9 Гц), 2,78 (1H, м), 1,4-2,1 (9H, м).
Инфракрасный спектр, νмакс см-1 (CHCl3): 3622, 2960, 1732,. 1637, 1440.
Масс-спектрометрический анализ (FAB), m/z: 372 ((M+H)+).
Пример 3(b)
Эфир 2-[(2R)-(3,4-дихлорфенил)-4- (циклопентанкарбонил)-мopфoлин-2-ил] этaнoлa и метансульфоновой кислоты
Нужное соединение (435 мг, 95%) получают в виде белого аморфного твердого вещества в соответствии с процедурой, описанной в примере 1(b), с использованием 2-[(2R)- (3,4-дихлорфенил)-4-(циклопентанкарбонил)морфолин-2-ил] этанола (380 мг, 1,02 ммоль).
Спектр ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
7,57 (1H, д, J=2,0 Гц), 7,45 (1H, д, J=8,4 Гц), 7,27 (1H, дд, J=8,4 и 2,0 Гц), 4,38 (1H, д, J= 3,9 Гц), 4,19-4,25 (1H, м), 3,94-4,00 (1H, м), 3,74-3,79 (1H, м), 3,45-3,62 (4H, м), 2,89-2,94 (4H, м), 2,79 (IH, м), 2,27-2,34 (IH, м), 2,13-2,21 (1H, м), 1,53-1,91 (7H, м).
Инфракрасный спектр, νмакс, см-1 (CHCl3): 2964, 1640, 1440, 1362, 1175.
Масс-спектрометрический анализ (FAB), m/z: 450 ((М+Н)+).
Пример 3(с)
1-{ 2-[(2R)-(3,4-Дихлорфенил)-4- (циклопентанкарбонил)-морфолин-2-ил] этил}спиро[бензо[с] тиофен-1(3H),4'-пиперидин]-(2S)-оксид
Нужное соединение (132 мг, 49%) получают в виде белого кристаллического вещества в соответствии с процедурой, описанной в примере 1(c), с использованием эфира 2-[(2R)-(3,4- дихлорфенил)-4-(циклопентанкарбонил)морфолин-2-ил] этанола и метансульфоновой кислоты (210 мг, 0,47 ммоль) и гидрохлорида спиро[бензо [с] тиофен-(3H),4'-пиперидин]-(2S)-оксида (144 мг, 0,56 ммоль).
Т.пл. 99-100oC.
[α]
Спектр ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
7,55-7,59 (1H, м), 7,41-7,48 (1H, м), 7,20-7,36 (5H, м), 4,59 (1H, д, J= 13,8 Гц), 4,31 (1H, д, J=16,8 Гц), 3,98 (1H, д, J=16,8 Гц), 3,43-3,82 (4H, м), 3,36 (1H, д, J=13,8 Гц), 2,89-2,94 (1H, м), 2,73-2,84 (2H, м), 2,17-2,43 (6H, м), 2,04-2,15 (1H, м), 1,48-1,99 (11, м).
Инфракрасный спектр, νмакс, см-1 (KBr): 3441, 2952, 1640, 1435, 1227.
Масс-спектрометрический анализ (FAB), m/z: 575 ((M+H)+).
Элементный анализ (%):
для C30H36N2O3SCl2 • 0,5H2O
вычислено: С - 61,63; H - 6,38; N - 4,79; S - 5,49; Cl - 12,13;
найдено: С - 61,46; H - 6,28; N - 4,69; S - 5,40; Cl - 11,57.
Пример 4
1-{ 2-[(2R)-(3,4-Дихлорфенил)-4-(циклогексанкарбонил)-морфолин-2-ил] этил}спиро[бензо[с]тиофен-1(3H),4'-пиперидин]-(2S)-оксид
Пример 4(a)
2-[(2R)-(3,4-Дихлорфенил)-4- (циклогексанкарбонил)морфолин-2-ил]этанол
Нужное соединение (405 мг, 96%) получают в виде белого аморфного твердого вещества в соответствии с процедурой, описанной в примере 1(а), с использованием циклогексанкарбоновой кислоты (147 мг, 1,15 ммоль) и 2-[(2R)-(3,4-дихлорфенил)морфолин-2-ил]этанола (300 мг, 1,09 ммоль).
Спектр ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
7,58 (1H, д, J=20 Гц), 7,42 (1H, д, J=8,0 Гц), 7,28 (1H, м), 4,63 (1H, д, J= 14,0 Гц), 3,40-3,93 (6H, м), 3,34 (1H, д, J=14,0 Гц), 1,15-2,55 (13H, м).
Инфракрасный спектр,  см-1 (CHCl3): 3623, 3536, 2936, 2858, 1711, 1634.
см-1 (CHCl3): 3623, 3536, 2936, 2858, 1711, 1634.
Масс-спектрометрический анализ (FAB), m/z: 386 ((М+Н)+).
Пример 4(b)
Эфир 2-[(2R)-(3,4-дихлорфенил)-4- (циклогексанкарбонил)-морфолин-2-ил] этанола и метансульфоновой кислоты
Нужное соединение (450 мг, 94%) получают в виде белого аморфного твердого вещества в соответствии с процедурой, описанной в примере 1(b), с использованием 2-[(2R)-(3,4-дихлорфенил)-4- (циклогексанкарбонил)морфолин-2-ил] этанола (400 мг, 1,04 ммоль).
Спектр ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.;
7,56 (1H, д, J=2,0 Гц), 7,44 (1H, д, J=8,0 Гц), 7,26 (1H, дд, J=8,0 и 2,0 Гц), 4,39 (1H, д, J=14,0 Гц), 4,22 (1H, м), 3,97 (1H, дт, J=10,0 и 7,0 Гц), 3,77 (1H, дт, J=12,0 и 4,0 Гц), 3,60 (IH, м), 3,48 (1H, м), 3,43 (1H, д, J=14,0 Гц), 2,94 (3H, с), 2,12-2,60 (3H, м), 1,15-1,85 (10H, м).
Инфракрасный спектр, νмакс, см-1 (CHCl3): 2936, 2858, 1634.
Масс-спектрометрический анализ (FAB), m/z: 464 ((M+H)+).
Пример 4(с)
1-{ 2-[(2R)-(3,4-Дихлорфенил)-4- (циклогексанкарбонил)-морфолин-2-ил] этил}спиро[бензо[с] тиофен-1(3H),4'-пиперидин]-(2S)-оксид
Нужное соединение (168 мг, 70%) получают в виде белого кристаллического вещества в соответствии с процедурой, описанной в примере 1(c), с использованием эфира 2-[(2R)-(3,4-дихлорфенил)-4- (циклогексанкарбонил)морфолин-2-ил] этанола и метансульфоновой кислоты (190 мг, 0,41 ммоль) и гидрохлорида спиро[бензо[с] тиофен-1(3H),4'-пиперидин]-(2S)-оксида (127 мг, 0,49 ммоль).
Т.пл. 119-123oC.
[α]
Спектр ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
7,25-7,60 (7H, м), 4,60 (1H, д, J=14,0 Гц), 4,30 (1H, д, J= 17,0 Гц), 3,99 (1H, д, J=17,0 Гц), 3,40-3,90 (4H, м), 3,32 (1H, д, J=14,0 Гц), 2,94 (1H, м), 2,74 (1H, м), 1,15-2,60 (21H, м).
Инфракрасный спектр, νмакс, см-1 (KBr): 3438, 2928, 2855, 1642.
Масс-спектрометрический анализ (FAB), m/z: 589 ((M+H)+).
Элементный анализ (%):
для C32H38N2O3SCl2 • 0,2H2O
вычислено: С - 62,96; H - 6,51; N - 4,74; S - 5,42; Cl - 11,99;
найдено: С - 62,80; H - 6,69; N - 4,65; S - 5,39; C l- 12,07.
Пример 5
1-{ 2-[(2R)-(3,4-Дихлорфенил)-4- (циклопропанкарбонил)-морфолин-2-ил] этил}-4-фенилпиперидин-4- карбоксамид
Нужное соединение (93 мг, 69%) получают в виде белого кристаллического вещества в соответствии с процедурой, описанной в примере 1(с), с использованием эфира 2-[(2R)-(3,4-дихлорфенил) -4-(циклопропанкарбонил) морфолин-2-ил] этанола и метаносульфоновой кислоты (107 мг, 0,25 ммоль) и гидрохлорида 4- фенилпиперидинкарбоксамида (627 мг, 0,30 ммоль).
Т.пл. 94-96oC.
[α]
Спектр ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
7,22-7,55 (8H, м), 5,17 (2H, с), 1,85-4,43 (19H, м), 0,65-1,15 (4H, м).
Инфракрасный спектр, νмакс, см-1 (KBr): 3350, 2927, 1676, 1633, 1470.
Масс-спектрометрический анализ (FAB), m/z: 530 ((M+H)+).
Элементный анализ (%):
для C28H33N3O3Cl2 • 0,5H2O
вычислено: С - 62,34; H - 6,35; N - 7,79; Cl - 13,14;
найдено: С - 62,40; H - 6,54; N - 7,47; Cl - 13,81.
Пример 6
1-{ 2-[(2R)-(3,4-Дихлорфенил)-4- (циклопентанкарбонил)-морфолин-2-ил] этил}-(2-пиридил) пиперидин-4-карбоксамид
Нужное соединение (129 мг, 69%) получают в виде белого кристаллического вещества в соответствии с процедурой, описанной в примере 1(с), с использованием эфира 2-[(2R)-(3,4- дихлорфенил)-4-(циклопентанкарбонил) морфолин-2-ил] этанола и метаносульфоновой кислоты (150 мг, 0,33 ммоль) и дигидрохлорида 4- (2-пиридил)пиперидин-4-карбоксамида (102 мг, 0,37 ммоль).
Т.пл. 189-190oC.
[α]
Спектр ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
8,57 (1H, д, J=4,7 Гц), 7,15-7,68 (6H, м), 6,40 (1H, ушс), 5,14 (1H, ушс), 4,57 (1H, д, J=13,5 Гц), 3,20-3,95 (5H, м), 1,45-2,98 (21H, м).
Инфракрасный спектр, νмакс, см-1 (KBr): 3412, 2953, 1679, 1639, 1468, 1433.
Масс-спектрометрический анализ (FAB), m/z: 559 ((M+H)+).
Элементный анализ (%):
для C29H36N4O3Cl2
вычислено: С - 62,25; H - 6,49; N - 10,01; Cl - 12,67;
найдено: С - 62,06; H - 6,43; N - 9,89; Cl - 12,67.
Пример 7
N, N-Диметил-1-{2-[(2R)-(3,4-дихлорфенил)-4-(циклопентанкарбонил) морфолин-2-ил]этил}-4-(циклогексил)пиперидин-4-карбоксамид
Нужное соединение (152 мг, 77%) получают в виде белого кристаллического вещества в соответствии с процедурой, описанной в примере 1(с), с использованием эфира 2-[(2R)-(3,4-дихлорфенил)-4- (циклопентанкарбонил)морфолин-2-ил] этанола и метаносульфоновой кислоты (150 мг, 0,33 ммоль) и гидрохлорида N,N-диметил-4- (циклогексил) пиперидин-4-карбоксамида (101 мг, 0,37 ммоль).
Т.пл. 98-102oC,
[α]
Спектр ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
7,21-7,53 (3H, м), 4,53 (1H, д, J=13,8 Гц), 2,60-3,95 (8H, м), 3,02 (6H, с), 1,40-2,35 (22H, м), 1,00-1,35 (7H, м).
Инфракрасный спектр, νмакс, см-1 (KBr): 3441, 2932, 2855, 1630, 1450.
Масс-спектрометрический анализ (FAB), m/z: 591 ((M+H)+).
Элементный анализ (%):
для С32H47N3O3Cl2 • 0,5H2O
вычислено: С - 63,88; H - 8,04; N - 6,98; Cl - 11,79;
найдено: С - 64,06; H - 7,97; N - 6,84; Cl - 11,72.
Пример 8
1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(циклопентанкарбонил)-морфолин-2-ил] этил}спиро[((2S)-гидрокси)индан-1,4'-пиперидин]
Нужное соединение (817 мг, 78%) получают в виде белого кристаллического вещества в соответствии с процедурой, описанной в примере 1(с), с использованием эфира 2-[(2R)-(3,4-дихлорфенил)- 4-(циклопентанкарбонил) морфолин-2-ил] этанола и метаносульфоновой кислоты (850 мг, 1,89 ммоль) и гидрохлорида [((2S)-гидрокси)-индан-1,4'-пиперидина] (497 мг, 2,08 ммоль).
Т.пл. 192-193oC.
[α]
Спектр ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
7,16-7,58 (7H, м), 4,60 (1H, д, J=13,6 Гц), 4,40 (1H, д, J= 3,3 Гц), 3,24-3,98 (7H, м), 2,64-3,01 (4H, м), 1,42-2,43 (18H, м).
Инфракрасный спектр, νмакс, см-1 (KBr): 3423, 2949, 1640, 1434.
Масс-спектрометрический анализ (FAB), m/z: 557 ((М+Н)+).
Элементный анализ (%):
для C32H38N2O3Cl2
вычислено: С - 66,78; H - 6,87; N - 5,02; Cl - 12,72;
найдено: С - 66,77; H - 6,79; N - 5,07; Cl - 12,41.
Пример 9
Дигидрохлорид 1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(L-пролил)-морфолин-2-ил] этил}спиро[((2S)-гидрокси)индан-1,4'-пиперидина]
Пример 9 (а)
2-[(2R)-(3,4-Дихлорфенил)-4-(L-пролил)морфолин-2-ил]этанол
Нужное соединение (314 мг, 92%) получают в виде белого аморфного твердого вещества в соответствии с процедурой, описанной в примере 1(а), с использованием 2-[(2R)-(3,4- дихлорфенил)-морфолин-2-ил] этанола (200 мг, 0,72 ммоль) и N- трет-бутоксикарбонил-L-пролина (171 мг, 0,80 ммоль).
Спектр ядерного магнитного резонанса (270 МГц, CDCl3) δ м.д.:
7,20-7,62 (3H, м), 3,98-4,94 (2H, м), 3,10-3,91 (9H, м), 1,55-2,25 (7H, м), 1,46 (3H, с), 1,38 (3H, с), 1,14 (3H, с).
Инфракрасный спектр, νмакс, см-1 (KBr): 3442, 2975, 2876, 1695, 1401.
Масс-спектрометрический анализ (FAB), m/z: 473 ((M+H)+).
Пример 9(b)
Эфир 2-[(2R)-(3,4-дихлорфенил)-4-(L-пролил)морфолин-2-ил]-этанола и метансульфоновой кислоты
Нужное соединение (313 мг, 94%) получают в виде белого аморфного твердого вещества в соответствии с процедурой, описанной в примере 1(b), с использованием 2-[(2R)-(3,4-дихлорфенил)-4-(L-пролил)морфолин-2-ил] этанола (286 мг, 0,60 ммоль).
Спектр ядерного магнитного резонанса (270 МГц, CDCl3) δ м.д.:.
7,20-7,60 (3H, м), 4,10-4,77 (2H, м), 3,30-4,00 (9H, м), 2,93 (3H, с), 1,75-2,40 (6H, м), 1,46 (3H, с), 1,40 (3H, с), 1,16 (3H, с).
Инфракрасный спектр, νмакс, cм-1 (KBr): 2976, 1695, 1659, 1401, 1359, 1175.
Масс-спектрометрический анализ (FAB), m/z: 551 ((M+H)+).
Пример 9(с)
1-{2-[(2R)-(3,4-Дихлорфенил)-4-(N-трет- бутоксикарбонил-L-пролил) морфолин-2-ил] этил}спиро [((2S)- гидрокси)индан-1,4'-пиперидин]
Нужное соединение (175 мг, 73%) получают в виде белого кристаллического вещества в соответствии с процедурой, описанной в примере 1(c), с использованием эфира 2-[(2R)-(3,4-дихлорфенил)-4-(L-пролил)морфолин-2-ил]этанола и метаносульфоновой кислоты (200 мг, 0,36 ммоль) и гидрохлорида [((2S)-гидрокси)индан-1,4'-пиперидина] (95 мг, 0,40 ммоль).
Т.пл. 108-110oC.
[α]
Спектр ядерного магнитного резонанса (400 МГц, CDCl3) δ м. д.:
7,20-7,62 (7H, м), 4,30-4,84 (3H, м), 3,20-3,98 (10H, м), 1,58-2,90 (16H, м), 1,46 (3H, с), 1,40 (3H, с), 1,17 (3H, с).
Инфракрасный спектр, νмакс, см-1 (KBr): 3442, 2928, 1696, 1661, 1400.
Масс-спектрометрический анализ (FAB), m/z: 658 ((M+H)+).
Элементный анализ (%):
для C35H45N3O5Cl2 • 0,5H2O
вычислено: С - 62,96; H - 6,94; N - 6,29; Cl - 10,62;
найдено: С - 63,09; H - 7,10; N - 6,27; Cl - 10,50.
Пример 9(d)
Дигидрохлорид 1-{2-[(2R)-(3,4-дихлорфенил)- 4-(L-пролил)-морфолин-2-ил] этил}спиро[((2S)-гидрокси)индан- 1,4' -пиперидина]
Дигидрохлорид 1-{2-[(2R)-(3,4-дихлорфенил)-4-(L-пролил)- морфолин-2-ил] этил[cпиpo[((2S)-гидрокси)-индан-1,4'- пиперидина]
Раствор хлороводорода в диоксане (4 N, 1,5 мл) при охлаждении льдом добавляют к раствору в этаноле (2 мл) 1-{2-[(2R) -(3,4-дихлорфенил)-4-(N-трет-бутоксикарбонил-L-пролил)морфолин-2-ил] -этил} спиро[((2S)-гидрокси)индан-1,4'- пиперидина], полученного в примере 9(d) (131 мг, 0,20 ммоль). Раствор перемешивают при комнатной температуре в течение 3 часов. Растворитель отгоняют при пониженном давлении. К остатку добавляют диэтиловый эфир. После отгонки досуха получают нужное соединение (127 мг, 100%) в виде белых кристаллов.
Т.пл. 290-294oC.
[α]
Спектр ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
9,83-11,20 (2H, м), 8,45-8,63 (1H, м), 7,43-7,98 (3H, м), 7,05-7,25 (4H, м), 3,60-5,05 (8H, м), 2,85-3,58 (8H, м), 1,48-2,80 (13H, м).
Инфракрасный спектр, νмакс, см-1 (KBr): 3350, 2925, 2677, 2574, 1653, 1476.
Масс-спектрометрический анализ (FAB), m/z: 558 ((М+Н)+), свободная форма).
Элементный анализ (%):
для C30H37N3O3Cl2 • 2HCI • 0,5H2O
вычислено: С - 56,26; H - 6,29; N - 6,56; Cl - 22,14;
найдено: С - 56,02; H - 6,31; N - 6,55; Cl - 21,94.
Пример 10
Дигидрохлорид 1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(4-пиперидинкарбонил)морфолин-2-ил] этил}спиро[((2S)-гидрокси)индан-1,4'-пиперидина]
Пример 10(а)
2-[(2R)-(3,4-Дихлорфенил)-4-(N-трет-бутоксикарбонил-4-пиперидинкарбонил) морфолин-2-ил] этанол
Нужное соединение (226 мг, 85%) получают в виде аморфного твердого вещества в соответствии с процедурой, описанной в примере 1(а), с использованием 2-[(2R)-(3,4-дихлорфенил)-морфолин-2-ил] этанола (150 мг, 0,54 ммоль) и N-трет-бутоксикарбонил-4-пиперидинкарбоновой кислоты (137 мг, 0,60 ммоль).
Спектр ядерного магнитного резонанса (270 МГц, CDCl3) δ м. д.:
7,57 (1H, д, J=1,9 Гц), 7,43 (1H, д, J=8,5 Гц), 7,26 (1H, дд, J=8,5, 1,9 Гц), 4,69 (1H, д, J=14,2 Гц), 3,99-4,22 (2H, м), 3,73-3,85 (1H, м), 3,40-3,64 (5H, м), 3,32 (1H, д, J=14,2 Гц), 2,60-2,82 (2H, м), 2,45-2,58 (1H, м), 1,88-2,12 (2H, м), 1,50-1,85 (3H, м), 1,45 (9H, с), 1,30-1,50 (2H, м).
Инфракрасный спектр, νмакс, см-1 (KBr): 3447, 2930, 1690, 1640, 1427.
Масс-спектрометрический анализ (FAB), m/z: 487 ((M+H)+).
Пример 10(b)
Эфир 2-[(2R)-(3,4-дихлорфенил)-4-(N-трет-бутоксикарбонил-4- пиперидинкарбонил)морфолин-2-ил]этанола и метансульфоновой кислоты
Нужное соединение (216 мг, 93%) получают в виде белого аморфного твердого вещества в соответствии с процедурой, описанной в примере 1(b), с использованием 2-[(2R)-(3,4- дихлорфенил)-4-(N-трет-бутоксикарбонил-4- пиперидинкарбонил)морфолин-2-ил]этанола (200 мг, 0,41 ммоль).
Спектр ядерного магнитного резонанса (270 МГц, CDCl3) δ м.д.:
7,55 (1H, д, J=1,8 Гц), 7,45 (1H, д, J=8,3 Гц), 7,26 (1H, дд, J=8,3, 1,8 Гц), 4,43 (1H, д, J=13,9 Гц), 3,43 (1H, д, J=13,9 Гц), 3,40-4,30 (8H, м), 2,94 (3H, с), 2,60-2,82 (2H, м), 2,45-2,60 (1H, м), 2,10-2,35 (2H, м), 1,50-1,80 (2H, м), 1,46 (9H, с), 1,35-1,50 (2H, м).
Инфракрасный спектр, νмакс, см-1 (KBr): 2974, 2932, 1689, 1642, 1175.
Масс-спектрометрический анализ (FAB), m/z: 565 ((M+H)+).
Пример 10(с)
1-{ 2-[(2R)-(3,4-Дихлорфенил)-4-(N-трет- бутоксикарбонил-4-пиперидинкарбонил)морфолин-2-ил]этил}спиро [((2S)-гидрокси)-индан-1,4'-пиперидин]
Нужное соединение (193 мг, 83%) получают в виде белого кристаллического вещества в соответствии с процедурой, описанной в примере 1(с), с использованием эфира 2-[(2R)-(3,4-дихлорфенил)-4- (N-трет-бутоксикарбонил-4-пиперидинкарбонил)морфолин-2-ил] этанола и метаносульфоновой кислоты (195 мг, 0,35 ммоль) и гидрохлорида [((2S)-гидрокси)индан-1,4'-пиперидина] (91 мг, 0,38 ммоль).
Т.пл. 105-107oC.
[α]
Спектр ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
7,56 (1H, д, J= 1,7 Гц), 7,42 (1H, д, J=8,5 Гц), 7,20-7,30 (5H, м), 3,20-4,75 (8H, м), 2,45-2,90 (6H, м), 1,46 (9H, с), 1,35-2,40 (15H, м).
Инфракрасный спектр, νмакс, см-1 (KBr): 3448, 2926, 1693, 1644, 1426, 1169.
Масс-спектрометрический анализ (FAB), m/z: 672 ((М+Н)+).
Элементный анализ (%):
для C36H47N3O5Cl2 • 0,3H2O
вычислено: С - 63,77; H - 7,08; N - 6,20; Cl - 10,46;
найдено: С - 63,81; H - 7,04; N - 6,05; Cl - 10,56.
Пример 10(d)
Дигидрохлорид 1-{ 2-[(2R)-(3,4-дихлорфенил) -4-(4-пиперидинкарбонил)морфолин-2-ил]этил}спиро[((2S) - гидрокси)индан-1,4'-пиперидина]
Нужное соединение (141 мг, 100%) получают в виде белого кристаллического вещества в соответствии с процедурой, описанной в примере 9 (d), с использованием 1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(N-трет-бутоксикарбонил-4-пиперидинкарбонил) морфолин-2-ил] этил}-спиро[((2S)-гидрокси)индан-1,4' -пиперидина] (147 мг, 0,22 ммоль).
Т.пл. 216-220oC.
[α]
Спектр ядерного магнитного резонанса (400 МГц, ДМСО-d6) δ м.д.:
10,40-11,93 (1H, м), 8,60-9,27 (1H, м), 7,40-7,90 (3H, м), 7,05-7,25 (4H, м), 4,99 (1H, yшc), 2,40-4,43 (22H, м), 2,12-2,40 (2H, м), 1,75-2,12 (4H, м), 1,48-1,75 (3H, м).
Инфракрасный спектр, νмакс, см-1 (KBr): 3381, 2933, 2712, 1636, 1457.
Масс-спектрометрический анализ (FAB), m/z: 572 ((M+H)+), свободная форма).
Элементный анализ (%):
для C31H39N3O3Cl2 • 2HCl • 1,5H2O
вычислено: С - 55,36; H - 6,59; N - 6,25; Cl - 21,09;
найдено: С - 55,65; H - 6,89; N - 6,19; Cl - 20,70.
Пример 11
1-{2-[(2R)-(3,4-дихлорфенил)-4-(2-оксо-(4R) -тиазолидинкарбонил)морфолин-2-ил]этил}спиро [((2S)-гидрокси) индан-1,4'-пиперидин]
Пример 11(а)
2-[(2R)-(3,4-Дихлорфенил)-4-(2-оксо-(4R)-тиазолидинкарбонил)морфолин-2- ил]этанол
Нужное соединение (92 мг, 31%) получают в виде белого твердого вещества в соответствии с процедурой, описанной в примере 1(а), с использованием 2-оксо-(4R)-тиазолидинкарбоновой кислоты (107 мг, 0,724 ммоль) и 2-[(2R)-(3,4-дихлорфенил)морфолин-2-ил]-этанола (200 мг, 0,724 ммоль).
Спектр ядерного магнитного резонанса (270 МГц, CDCl3) δ м.д.:
7,53 (1H, д, J=2,0 Гц), 7,46 (1H, д, J=8,3 Гц), 7,28 (1H, д, J=8,3, 2,0 Гц), 5,85 (1H, ушс), 4,53-4,81 (2H, м), 3,28-3,91 (9H, м), 1,93-2,10 (2H, м).
Инфракрасный спектр, νмакс, см-1 (KBr): 3251, 1680, 1470, 1375, 1239, 1092.
Масс-спектрометрический анализ (FAB), m/z: 405 ((М+Н)+).
Пример 11(b)
Эфир 2-[(2R)-(3,4-дихлорфенил)-4-(2-оксо- (4R)-тиазолидинкарбонил)морфолин-2-ил]этанола и метансульфоновой кислоты
Нужное соединение (62 мг, 61%) получают в виде белого твердого вещества в соответствии с процедурой, описанной в примере 1(b), с использованием 2-[(2R)-(3,4-дихлорфенил)-4-(2-оксо-(4R)- тиазолидинкарбонил)морфолин-2-ил] этанола (85 мг, 0,21 ммоль).
Спектр ядерного магнитного резонанса (270 МГц, CDCl3) δ м.д.:
7,56 (1H, д, J=1,9 Гц), 7,48 (1H, д, J=8,3 Гц), 7,27 (1H, дд, J=8,3, 1,9 Гц), 5,78 (1H, ушс), 4,18-4,66 (3H, м), 3,37-3,96 (8H, м), 2,96 (3H, с), 2,13-2,32 (2H, м).
Инфракрасный спектр, νмакс, см-1 (KBr): 2934, 1687, 1468, 1352, 1241, 1174, 1095.
Масс-спектрометрический анализ (FAB), m/z: 483 ((M+H)+).
Пример 11 (с)
1-{2-[(2R)-(3,4-Дихлорфенил)-4-(2-оксо- (4R)-тиазолидинкарбонил)морфолин-2-ил]этил}спиро [((2S) - гидрокси)индан-1,4'-пиперидин]
Нужное соединение (32 мг, 44%) получают в виде белого твердого вещества в соответствии с процедурой, описанной в примере 1(c), с использованием эфира 2-[(2R)-(3,4-дихлорфенил)-4- (2-оксо-(4R)-тиазолидинкарбонил) морфолин-2-ил]этанола и метансульфоновой кислоты (60 мг, 0,124 ммоль) и гидрохлорида [((2S)-гидрокси)ин-дан-1,4'-пиперидина] (31 мг, 0,130 ммоль).
Т.пл. 155-156oC.
[α]
Спектр ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
7,57 (1H, д, J=2,1 Гц), 7,44 (1H, д, J=8,3 Гц), 7,14-7,29 (5H, м), 5,68 (1H, ушс), 4,32-4,76 (3H, м), 3,22-3,85 (8H, м), 2,57-2,83 (3H, м), 1,41-2,43 (11H, м).
Инфракрасный спектр, νмакс, см-1 (KBr): 3400, 2924, 1683, 1472, 1238, 1090, 759.
Масс-спектрометрический анализ (FAB), m/z: 590 ((М+Н)+).
Элементный анализ (%):
для C29H33N3O4SCl2 • H2O
вычислено: С - 57,23; H - 5,80; N - 6,90; Cl - 11,65; S - 5,27;
найдено: С - 56,54; H - 5,73; N - 6,53; Cl - 11,48; S - 5,61.
Пример 12
1-{ 2-[4-(Циклогексилметил)-(2R)-(3,4- дихлорфенил)-5-оксоморфолин-2-ил] этил}спиро[((2S)- гидрокси)индан-1,4'-пиперидин]
Пример 12(а)
(2R)-(3,4-Дихлорфенил)-4-(трифенилметокси)бутан-1,2-диол (DHQD)2PHAL (85 мг, 0,11 ммоль), феррицианид калия (10,75 мг, 32,7 ммоль) и карбонат калия (4,51 г, 32,7 ммоль) добавляют к смеси трет-бутанола (200 мл) и воды (200 мл). К смеси добавляют тетраоксид осмия (55 мкл (0,02 ммоль) 0,393 М раствора в толуоле), и затем добавляют трифенилметиловый эфир 3- (3,4-дихлорфенил)-3-бутен-1-ола (5,00 г, 10,9 ммоль). Эту смесь перемешивают при комнатной температуре в течение 3 суток. После добавления к реакционной смеси сульфита натрия (15 г) смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния, и затем растворитель отгоняют при пониженном давлении. Остаток очищают посредством флэш-хроматографии на колонке с силикагелем с использованием в качестве элюента смеси н-гексана и этилацетата (50: 1 - 2:1), и получают названное в заголовке соединение (3,56 г, 66%) в виде белых кристаллов.
Спектр ядерного магнитного резонанса (270 МГц, CDCl3) δ м.д.:
7,43 (1H, д, J= 2,0 Гц), 7,19-7,39 (16H, м), 7,03 (1H, дд, J=8,5, 2,0 Гц), 4,69 (1H, с), 3,48-3,66 (2H, м), 3,34-3,45 (1H, м), 2,94 (1H, м), 2,49 (1H, м), 2,32 (1H, м), 1,92 (1H, м).
Инфракрасный спектр, νмакс, см-1 (KBr): 3446, 3059, 2932, 1449, 1062.
Масс-спектрометрический анализ (FAB), m/z: 513 ((M+Na)+).
Пример 12(b)
4-(Трифенилметокси)-(2R)-(3,4-дихлорфенил)-1-[N-(хлорацетил)-N- (циклогексилметил)амино]-2-бутанол
К раствору (2R)-(3,4-дихлорфенил)-4-(трифенилметокси) бутан-1,2-диола (3,51 г, 7,11 ммоль), полученного в примере 12(а), в пиридине (17 мл) добавляют п-толуолсульфонилхлорид (2,03 г, 10,7 ммоль). Смесь перемешивают при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и экстрагируют смесь этилацетатом. Органический слой сушат над безводным сульфатом магния и затем отгоняют растворитель при пониженном давлении. Остаток растворяют в ацетонитриле (50 мл) и к раствору добавляют тригидрат перхлората лития (3,42 г, 21,3 ммоль) и циклогексилметиламин (2,78 мл, 21,3 ммоль). Смесь перемешивают при 100oC в течение ночи. К реакционной смеси добавляют этилацетат и промывают ее насыщенным водным раствором хлорида натрия. Органический слой сушат над безводным сульфатом магния, и затем отгоняют растворитель при пониженном давлении. Половину остатка, по массе, растворяют в метиленхлориде (30 мл). К этому раствору при охлаждении льдом добавляют триэтиламин (2,48 мл, 17,8 ммоль) и хлорацетилхлорид (1,42 мл, 17,8 ммоль). Смесь перемешивают при 0oC в течение 1 часа. К реакционной смеси добавляют метиленхлорид, органический слой промывают водой и затем насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом магния. После перегонки при пониженном давлении полученный остаток очищают посредством флэш-хроматографии на колонке с силикагелем с использованием в качестве элюента смеси н-гексана и этилацетата (20:1 - 10:1), и получают названное в заголовке соединение (1,49 г, 63%).
Спектр ядерного магнитного резонанса (270 МГц, CDCl3) δ м.д.:
6,98-7,62 (18H, м), 4,84 и 4,99 (общий 1H, каждый ушс), 3,97-4,38 (3H, м), 2,81-3,72 (5H, м), 1,93-2,37 (2H, м), 1,40- 1,80 (6H, м), 1,10-1,30 (3H, м), 0,75-1,00 (2H, м).
Инфракрасный спектр, νмакс, см-1 (KBr): 3455, 2926, 2853, 1649, 1469, 1449, 1073, 1029.
Масс-спектрометрический анализ (FAB), m/z: 664 ((M+H)+).
Пример 12(с)
Трифенилметиловый эфир 2-[4-(циклогексилметил)-(2R)-(3,4-дихлорфенил)-3-оксоморфолин-2-ил] этанола
Гидрид натрия (127 мг (3,18 ммоль) 60% суспензии в масле) при охлаждении льдом добавляют к раствору 4-(трифенилметокси)-(2R) -(3,4-дихлорфенил)-1-[N-(хлорацетил)-N-(циклогексилметил)- амино] -2-буганола (1,41 г, 2,12 ммоль), полученного в примере 12(b), в диметилформамиде (15 мл). Смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь выливают в воду со льдом и затем экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния и затем отгоняют растворитель при пониженном давлении. Остаток очищают посредством флэш-хроматографии на колонке с силикагелем с использованием в качестве элюента смеси н-гексана и этилацетата (10:1 - 5:1) и получают названное в заголовке соединение (1,08 г, 81%).
Спектр ядерного магнитного резонанса (270 МГц, CDCl3) δ м.д.:
7,19-7,35 (17H, м), 6,89 (1H, дд, J=8,4, 2,2 Гц), 4,13 (1H, д, J=17,0 Гц), 3,88 (1H, д, J=17,0 Гц), 3,80 (1H, д, J=13,4 Гц), 3,70 (1H, д, J=13,4 Гц), 3,39 (1H, дд, J=13,4, 7,0 Гц), 3,18 (1H, м), 3,02 (1H, дд, J=13,4, 7,3 Гц), 2,67 (1H, м), 2,13-2,24 (2H, м), 1,10-1,80 (9H, м), 0,85-1,08 (2H, м).
Инфракрасный спектр, νмакс, см-1 (KBr): 2924, 2852, 1664, 1490, 1449.
Масс-спектрометрический анализ (FAB), m/z: 628 ((М+Н)+).
Пример 12(d)
Эфир 2-[4-циклогексилметил)-(2R)-(3,4- дихлорфенил)-3-оксо-морфолин-2-ил]этанола и метансульфоновой кислоты
Раствор хлороводорода в диоксане (4N, 4,1 мл) при охлаждении льдом добавляют к раствору трифенилметилового эфира 2- [(4-циклогексилметил)-(2R)-(3,4-дихлорфенил)-3-оксоморфолин- 2-ил] этанола (1,04 г, 1,65 ммоль), полученного в примере 12(с), в этаноле (10 мл). Смесь перемешивают при комнатной температуре в течение 1 часа. К реакционной смеси добавляют воду и затем смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. После отгонки растворителя при пониженном давлении остаток очищают посредством флэш-хроматографии на колонке с силикагелем с использованием в качестве элюента смеси н-гексана и этилацетата (10:1 - 0:1) и получают спиртовое производное (440 мг, 69%). Спиртовое производное (418 мг, 1,08 ммоль) растворяют в метиленхлориде (10 мл) и к раствору добавляют триэтиламин (0,23 мл, 1,62 ммоль) и метансульфонилхлорид (0,10 мл, 1,30 ммоль. Смесь перемешивают при комнатной температуре в течение 2 суток. К реакционной смеси добавляют метиленхлорид, смесь промывают водой и затем насыщенным водным раствором хлорида натрия и органический слой сушат над безводным сульфатом магния. После отгонки растворителя при пониженном давлении остаток очищают посредством флэш-хроматографии на колонке с силикагелем с использованием в качестве элюента смеси н-гексана и этилацетата (1:1 - 1:3), и получают названное в заголовке соединение (500 мг, 99%).
Спектр ядерного магнитного резонанса (270 МГц, CDCl3) δ м. д.:
7,49 (1H, д, J=8,4 Гц), 7,46 (1H, д, J=2,1 Гц), 7,20 (1H, дд, J=8,4, 2,1 Гц), 4,27 (1H, д, J=17,0 Гц), 4,23 (1H, м), 4,15 (1H, д, J=17,0 Гц), 4,00 (1H, ддд, J=10,5, 7,3, 7,3 Гц), 3,69 (1H, д, J=13,2 Гц), 3,61 (1H, д, J=13,2 Гц), 3,28 (1H, дд, J=13,6, 7,0 Гц), 3,22 (1H, дд, J=13,6, 7,7 Гц), 2,92 (3H, с), 2,40 (1H, ддд, J=14,6, 6,4, 6,4 Гц), 2,26 (1H, ддд, J=14,6, 7,3, 7,3 Гц), 1,46-1,78 (6H, м), 1,12-1,29 (3H, м), 0,88-1,04 (2H, м).
Инфракрасный спектр, νмакс, см-1 (чистый): 2926, 2853, 1657, 1474, 1450, 1356, 1176.
Масс-спектрометрический анализ (El), m/z: 463 (М+).
Пример 12(е)
1-{ 2 [4-(Циклогексилметил)-(2R)-(3,4- дихлорфенил)-5-оксоморфолин-2-ил] этил}спиро[((2S)- гидрокси)индан-1,4'-пиперидин]
Нужное соединение (94 мг, 76%) получают в виде белого кристаллического вещества в соответствии с процедурой, описанной в примере 1(с), с использованием эфира 2-[4- (циклогексилметил)-(2R)-(3,4-дихлорфенил)-3-оксоморфолин-2- ил]этанола и метансульфоновой кислоты (100 мг, 0,22 ммоль) и гидрохлорида [((2S)-гидрокси)индан-1,4'-пиперидина] (57 мг, 0,24 ммоль).
Т.пл. 84-86oC.
[α]
Спектр ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
7,47 (1H, д, J=2,l Гц), 7,47 (1H, д, J=8,5 Гц), 7,17- 7,24 (5H, м), 4,41 (1H, дд, J=5,2, 1,8 Гц), 4,24 (1H, д, J=17,0 Гц), 4,12 (1H, д, J=17,0 Гц), 3,78 (1H, д, J=12,9 Гц), 3,58 (1H, д, J=12,9 Гц), 3,23-3,31 (3H, м), 2,55-2,87 (3H, м), 1,45-2,40 (17H, м), 1,15-1,32 (3H, м), 0,91-1,08 (2H, м).
Инфракрасный спектр, νмакс, см-1 (KBr): 3417, 2924, 2851, 1654, 1474, 1450, 1381.
Масс-спектрометрический анализ (FAB), m/z: 571 ((М+Н)+).
Элементный анализ (%):
для С32H40N2O3Cl2 • 0,3H2O
вычислено: С - 66,61; H - 7,09; N - 4,86; Cl - 12,29;
найдено: С - 66,89; H - 6,85; N - 4,83; Cl - 11,83.
Пример 13
1-{ 2-[3-(Циклогексилметил)-(5R)-(3,4- дихлорфенил)-2-оксооксазолидин-5-ил]этил}спиро[((2S)- гидрокси)индан-1,4'-пиперидин]
Пример 13(а)
Трифенилметиловый эфир 2-[3-(циклогексилметил)-(5R)-(3,4- дихлорфенил)-2-оксооксазолидин-5-ил]этанола
К раствору (2R)-(3,4-дихлорфенил)-4- (трифенилметокси)бутан-1,2-диола (3,51 г, 7,11 ммоль), полученного в примере 12(а), в пиридине (17 мл) добавляют п-толуолсульфонилхлорид (2,03 г, 10,7 ммоль). Смесь перемешивают при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и затем экстрагируют смесь этилацетатом. Органический слой сушат над безводным сульфатом магния и отгоняют растворитель при пониженном давлении. Остаток растворяют в ацетонитриле (50 мл) и к раствору добавляют тригидрат перхлората лития (3,42 г, 21,3 ммоль) и циклогексилметиламин (2,78 мл, 21,3 ммоль). Смесь перемешивают при 100oC в течение ночи. К реакционной смеси добавляют этилацетат и промывают ее насыщенным водным раствором хлорида натрия, и отгоняют растворитель при пониженном давлении. Половину остатка, по массе, растворяют в метиленхлориде (30 мл) и к раствору при охлаждении льдом добавляют триэтиламин (2,48 мл, 17,8 ммоль) и ди-трет-бутилдикарбонат (3,88 мг, 17,8 ммоль). Смесь перемешивают при комнатной температуре в течение ночи. К реакционной смеси добавляют метиленхлорид, смесь промывают водой и органический слой сушат над безводным сульфатом магния. После отгонки растворителя полученный остаток растворяют в диметилформамиде (30 мл). К раствору при охлаждении льдом добавляют гидрид натрия (213 мг (5,34 ммоль) 60% суспензии в масле). Смесь перемешивают при комнатной температуре в течение 4 часов. Реакционную смесь выливают в воду со льдом и затем экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом магния. После отгонки растворителя остаток очищают посредством флэш-хроматографии на колонке с силикагелем с использованием в качестве элюента смеси н-гексана и этилацетата (20:1 - 5:1) и получают названное в заголовке соединение (1,76 г, 81%).
Спектр ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
7,21-7,37 (17H, м), 7,04 (1H, дд, J=8,3, 2,3 Гц), 3,90 (1H, д, J=8,8 Гц), 3,53 (1H, д, J=8,8 Гц), 3,31 (1H, ддд, J=10,9, 5,4, 5,4 Гц), 3,07 (1H, дд, J=13,9, 7,3 Гц), 2,93-3,00 (2H, м), 2,29 (1H, ддд, J=14,0, 7,0, 7,0 Гц), 2,15 (1H, ддд, J=14,0, 5,4, 5,4 Гц), 1,44-1,76 (6H, м), 1,07-1,22 (3H, м), 0,84-0,99 (2H, м).
Инфракрасный спектр, νмакс, см-1 (KBr): 3059, 2924, 2852, 1759, 1449, 1265, 1064.
Масс-спектрометрический анализ (FAB), m/z: 612 ((M-H)+).
Пример 13(b)
Эфир 2-[3-(циклогексилметил)-(5R)-(3,4- дихлорфенил)-2-оксооксазолидин-5-ил]этанола и метансульфоновой кислоты
Получают спиртовое производное (930 мг, 91%) в соответствии с процедурой, описанной в примере 12(d), с использованием трифенилметилового эфира 2-[3-циклогексилметил)- (5R)-(3,4-дихлорфенил)-2-оксооксазолидин-5-ил]этанола (1,69 г, 2,75 ммоль) и раствора хлороводорода в диоксане (4N, 6,9 мл). Спиртовое производное (880 мг, 2,36 ммоль) растворяют в метиленхлориде (18 мл) и к раствору добавляют триэтиламин (0,50 мл, 3,55 ммоль) и метансульфонилхлорид (0,22 мл, 2,84 ммоль). Смесь перемешивают при комнатной температуре в течение ночи. К реакционной смеси добавляют метиленхлорид и смесь промывают водой, а затем насыщенным водным раствором хлорида натрия. Органический слой сушат над безводным сульфатом магния и отгоняют растворитель при пониженном давлении. Остаток очищают посредством флэш-хроматографии на колонке с силикагелем с использованием в качестве элюента смеси н-гексана и этилацетата (4: 1 - 1:1), и получают названное в заголовке соединение (1,03 г, 97%).
Спектр ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
7,52 (1H, д, J=8,4 Гц), 7,51 (1H, д, J=2,3 Гц), 7,22 (1H, дд, J=8,4, 2,3 Гц), 4,33 (1H, ддд, J=10,7, 7,6, 7,6 Гц), 4,10 (1H, ддд, J=10,7, 6,9, 6,9 Гц), 3,79 (1H, д, J=8,9 Гц), 3,59 (1H, д, J=8,9 Гц), 3,13 (1H, дд, J=13,9, 7,3 Гц), 3,05 (1H, дд, J= 13,9, 7,1 Гц), 2,94 (3H, с), 2,48-2,54 (2H, м), 1,48-1,78 (6H, м), 1,12-1,28 (3H, м), 0,86-1,02 (2H, м).
Инфракрасный спектр, νмакс, см-1 (CHCl3): 2927, 2856, 1757, 1365, 1264, 1176.
Масс-спектрометрический анализ (FAB), m/z: 450 ((М+Н)+).
Пример 13(с)
1-{ 2-[3-(Циклогексилметил)-(5R)-(3,4- дихлорфенил)-2-оксооксазолидин-5-ил]этил}спиро[((2S)- гидрокси)индан-1,4'-пиперидин]
Нужное соединение (85 мг, 69%) получают в виде белого кристаллического вещества в соответствии с процедурой, описанной в примере 1(с), с использованием эфира 2-[3- (циклогексилметил)-(5R)-(3,4-дихлорфенил)-3-оксооксазолидин-5- ил] этанола и метансульфоновой кислоты (100 мг, 0,22 ммоль) и гидрохлорида [((2S)-гидрокси)индан-1,4'-пиперидина] (58 мг, 0,24 ммоль).
Т.пл. 67-69oC.
[α]
Спектр ядерного магнитного резонанса (400 МГц, CDCl3) δ м.д.:
7,50 (1H, д, J=2,2 Гц), 7,48 (1H, д, J=8,4 Гц), 7,16-7,23 (5Н, м), 4,43 (1H, дд, J= 5,4, 2,0 Гц), 3,80 (1H, д, J=8,8 Гц), 3,56 (1H, д, J=8,8 Гц), 3,28 (1H, дд, J=16,6, 5,4 Гц), 3,14 (1H, дд, J=13,9, 7,4 Гц), 3,02 (1H, дд, J=13,9, 6,8 Гц), 2,82 (1H, дд, J=16,6, 2,0 Гц), 2,15-2,90 (8H, м), 1,47-2,10 (11H, м), 1,10-1,30 (3H, м), 0,85-1,02 (2H, м).
Инфракрасный спектр, νмакс, см-1 (KBr): 3437, 2924, 2852, 1752, 1475, 1449, 1268.
Масс-спектрометрический анализ (FAB), m/z: 557 ((M+H)+).
Элементный анализ (%):
для C31H38N2O3Cl2 • 0,5H2O
вычислено: С - 65,72; H - 6,94; N - 4,94; Cl - 12,51;
найдено: С - 65,75; H - 6,70; N - 5,20; Cl - 12,72.
Соединения, перечисленные далее в табл. 1, можно получить способами, подобными описанным в приведенных выше примерах.

В табл. 1 каждый заместитель (указанный в таблице как "зам") представляет одну из приведенных далее групп (см. табл. A).
Среди перечисленных выше соединений предпочтительными являются соединения, приведенные в качестве примеров соединения под NN 1-180, 631-1230, 1681-2100, 3151-3330 и 3781-4200. Более предпочтительными являются соединения, приведенные в качестве примеров соединения под NN 1051-1230, 1681-2100 и 3871-3874. Наиболее предпочтительными являются соединения, приведенные в качестве примеров соединения под NN 1051-1054, 1081-1084, 1111-1114, 1141-1144, 1171-1174, 1201-1204, 1771-1774, 1921-1924, 1951-1954 и 3871-3874.
Настоящее изобретение поясняется далее с помощью ссылочного примера.
Ссылочный пример
Ссылочный пример 1
2-[(2R)-(3,4-Дихлорфенил) морфолин-2-ил]этанол
Раствор хлороводорода в диоксане (4 N, 500 мл), содержащий трет-бутилдиметилсилиловый эфир 2-[4-трет-бутоксикарбонил-(2R)-(3,4-дихлорфенил)морфолин-2-ил] этанола (38,6 г, 78,7 ммоль), перемешивают при 60oC в течение 3 часов. Растворитель отгоняют при пониженном давлении. Остаток растворяют в 1 N соляной кислоте и раствор промывают диэтиловым эфиром. Водный слой подщелачивают 2 N водным раствором гидроксида натрия и затем экстрагируют метиленхлоридом. После промывания органического слоя насыщенным водным раствором хлорида натрия его сушат над безводным сульфатом магния и отгоняют растворитель при пониженном давлении. Остаток перекристаллизовывают из смеси н-гексана (210 мл) и этилацетата (175 мл) и получают названное в заголовке соединение (18,0 г, 83%) в виде белого кристаллического вещества.
Т.пл. 90-91oC.
[α]
Спектр ядерного магнитного резонанса
Инфракрасный спектр, νмакс, см-1 (KBr): 3261, 3098, 2940, 1471, 1085, 1047.
Масс-спектрометрический анализ (El), m/z: 275 (М+).
Примеры композиции
[Пример композиции 1] Порошки
Порошки можно получить посредством смешивания соединения примера 1 (5 г), лактозы (895 г) и кукурузного крахмала (100 г) в смесителе.
[Пример композиции 2] Гранулы
Гранулы можно получить посредством смешивания соединения примера 2 (5 г), лактозы (865 г) и гидроксипропилцеллюлозы с низкой степенью замещения (100 г), добавления к смеси 300 г 10% водного раствора гидроксипропилцеллюлозы, перемешивания смеси, гранулирования перемешанной массы с использованием экструзионного гранулятора и последующей сушки гранулированного продукта.
[Пример композиции 3] Капсулы
Капсулы можно получить посредством смешивания соединения примера 3 (5 г), лактозы (115 г), кукурузного крахмала (58 г) и стеарата магния (2 г) в V-образном смесителе и последующего наполнения полученной смесью капсул N 3 порциями по 180 мг.
[Пример композиции 4] Таблетки
Таблетки можно получить посредством смешивания соединения примера 4 (5 г), лактозы (90 г), кукурузного крахмала (34 г), кристаллической целлюлозы (20 г) и стеарата магния (1 г) в смесителе и последующего таблетирования полученной смеси с использованием таблетировочной машины.
Примеры испытаний
[Пример испытаний 1] Испытание на связывание NK1-рецепторов
(а) Получение неочищенной легочной мембранной фракции
Получают неочищенную мембранную фракцию из легких самцов морских свинок Hartley. А именно, морским свинкам спускают кровь из брюшной полости под хлороформной анестезией и сразу же извлекают ткань легочных воздушных путей.
Извлеченные легкие перфузируют буфером (1) (50 мМ трис-HCl, pH 7,4), мелко измельчают в этом буфере и затем гомогенизируют в буфере (2) [буфер (1), содержащий 120 мМ хлорида натрия и 5 мМ хлорида калия] с использованием гомогенизатора Polytron.
Тканевую массу извлекают из гомогената посредством фильтрации через нейлоновое сито (50 мкм) и супернатант центрифугируют (30000 х g, 30 минут, 4oC).
Полученный осадок ресуспендируют в охлажденном льдом буфере (3) [буфер (1), содержащий 10 мМ ЭДТК и 300 мМ хлорида калия], оставляют стоять при 4oC в течение 60 минут и затем промывают дважды с центрифугированием (30000 х g, 15 минут, 4oC).
Неочищенную мембранную фракцию хранят до применения при -80oC.
(b) Испытание на связывание рецепторов
К смешанному раствору (250 мкл) испытываемого соединения и [3H]-вещества P (конечная концентрация 1 нМ) (50 мМ трис-HCI, pH 7,4, 6 мМ хлорида марганца, 800 мкг/мл BSA, 8 мкг/мл химостатина, 8 мкг/мл лейпептина, 80 мкг/мл бацитрацина, 20 мкг/мл фосфорамидона) добавляют раствор неочищенной легочной мембранной фракции (250 мкл), и затем проводят инкубацию при комнатной температуре в течение 30 минут.
После завершения реакции мембранный ингредиент извлекают на стекловолоконном фильтре GF/B (Whatman Со.) с использованием устройства для автоматической фильтрации (Brandel Co.).
Стеклянный фильтр используют после предварительной обработки 0,1% раствором полиэтиленимина в течение примерно 4 часов, для того, чтобы ингибировать неспецифическое связывание, насколько это возможно.
Извлеченный на фильтре мембранный ингредиент переносят в пластиковый минифлакон, содержащий pico flow (4 мл), и измеряют радиоактивность с использованием жидкостного сцинтиляционного счетчика (Beckman Co., LSC3500) для определения концентрации лекарственного средства для 50% связывания (IC50).
Величины IC50 соединений настоящего изобретения составляют 1000 нг/мл или выше.
[Пример испытаний 2] Испытание на связывание NK2-рецепторов
(а) Получение неочищенной мембранной фракции подвздошной кишки
Получают неочищенную мембранную фракцию из подвздошной кишки самцов морских свинок Hartley. А именно, морским свинкам спускают кровь из брюшной полости под хлороформной анестезией и сразу же извлекают подвздошную кишку.
После выскабливания содержимого, секретов и эпителия с использованием предметного стекла, извлеченную подвздошную кишку мелко измельчают в буфере (1) (50 мМ трис-HCI, pH 7,4), и затем гомогенизируют в буфере (2) [буфер (1), содержащий 120 мМ хлорида натрия и 5 мМ хлорида калия] с использованием гомогенизатора Polytron.
Тканевую массу извлекают из гомогената посредством фильтрации через нейлоновое сито (50 мкм) и супернатант центрифугируют (30000 х g, 30 минут, 4oC).
Полученный осадок ресуспендируют в охлажденном льдом буфере (3) [буфер (1), содержащий 10 мМ ЭДТК и 300 мМ хлорида калия], оставляют стоять при 4oC в течение 60 минут и затем промывают дважды с центрифугированием (30000 х g, 15 минут, 4oC).
Неочищенную мембранную фракцию хранят до применения при - 80oC.
(b) Испытание на связывание рецепторов
К смешанному раствору (250 мкл) испытываемого соединения и [3H]-SR-48968 (Amasham Co. , конечная концентрация 1 нМ) (50 мМ трис-HCI, pH 7,4, 6 мМ хлорида марганца, 800 мкг/мл BSA, 8 мкг/мл химостатина, 8 мкг/мл лейпептина, 80 мкг/мл бацитрацина, 20 мкг/мл фосфорамидона) добавляют раствор неочищенной мембранной фракции подвздошной кишки (250 мкл) и затем проводят инкубацию при комнатной температуре в течение 30 минут.
После завершения реакции мембранный ингредиент извлекают на стекловолоконном фильтре GF/B (Whatman Со.) с использованием устройства для автоматической фильтрации (Brandel Co.).
Стеклянный фильтр используют после предварительной обработки 10% раствором полиэтиленимина в течение примерно 4 часов, для того, чтобы ингибировать неспецифическое связывание, насколько это возможно.
Извлеченный на фильтре мембранный ингредиент переносят в пластиковый минифлакон, содержащий pico flow (4 мл), и измеряют радиоактивность с использованием жидкостного сцинтиляционного счетчика (Beckman Co., LSC3500) для определения концентрации лекарственного средства для 50% связывания (IC50).
Как видно из табл. 2, соединения настоящего изобретения демонстрируют сильную связывающую активность в отношении NK2-рецепторов.
Промышленная применимость
Соединения настоящего изобретения обладают отличным NK2-селективным антагонистическим действием и имеют низкую токсичность, и, таким образом, они полезны в качестве лекарственного средства. Например, такие соединения полезны в качестве профилактического и лечебного средства в случае болезней центральной нервной системы, таких как страх, депрессия, психоз и шизофрения; нейродегенеративных заболеваний, таких как деменция при СПИДе, старческая деменция Альцгеймера, болезнь Альцгеймера, синдром Дауна, демиелинизирующее заболевание, боковой амиотрофический склероз, невропатия, периферическая невропатия и невралгия; респираторных заболеваний, таких как хроническая обструктивная болезнь легких, бронхит, пневмония, бронхоконстрикция, астма и кашель; воспалительных заболеваний, таких как воспалительное заболевание кишечника (IBD), псориаз, фиброз, эрифизит, дегенеративный артрит и ревматоидный артрит; экземы; аллергических заболеваний, таких как ринит; аллергозов, такие как повышенная чувствительность к вьющимся растениям; офтальмологических заболеваний, таких как конъюнктивит, весенний конъюнктивит, весенний катар, разрушение гематоофтальмического барьера, вызванное различными воспалительными болезнями глаз, повышенное внутриглазное давление и миоз; кожных болезней, таких как контактный дерматит, атопический дерматит, крапивница и другие экзематозные дерматиты; аддикций, таких как алкогольная зависимость; соматических болезней, вызванных стрессом; симпатической рефлекторной дистрофии, такой как плечевой синдром; дистимии; нежелательных иммунных реакций, таких как отторжение трансплантатов, болезни, связанные с иммуностимуляцией, такие как системная красная волчанка или иммуносупрессия; болезней пищеварительной системы, таких как болезни, вызванные нарушениями нервной регуляции органов, колит, неспецифический язвенный колит и болезнь Крона; рвоты, такой как рвота, вызванная вредным воздействием рентгеновского излучения и химиотерапии, ядами, токсинами, беременностью, вестибулярными расстройствами, послеоперационными расстройствами, желудочно-кишечной окклюзией, ослабленной желудочно-кишечной подвижностью, висцеральной болью, мигренью, повышенным внутричерепным давлением, пониженным внутричерепным давлением или побочными реакциями, вызванными введением различных лечебных средств; функциональных болезней мочевого пузыря, таких как цистит и недержание мочи; эозинофилии, вызванной коллагеновыми болезнями, склеродермией или инфекцией Fasciola hepatica; болезней, вызванных нарушениями кровотока вследствие вазодилатации или вазоконстрикции, таких как стенокардия, мигрень и болезнь Рейно; и боли при болевой ноцицептивной рецепции, такой как мигрень, головная боль и зубная боль; и апноэ во сне. Т Те
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ СПИРОПИПЕРИДИНА, ЛЕКАРСТВЕННОЕ СРЕДСТВО, СПОСОБ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ | 1999 |
|
RU2184735C2 |
| СОЛИ СОЕДИНЕНИЙ, ЛЕКАРСТВЕННОЕ СРЕДСТВО, КОМПОЗИЦИЯ, СПОСОБ ПРОФИЛАКТИКИ, СПОСОБ ЛЕЧЕНИЯ | 1998 |
|
RU2190615C2 |
| ПРОИЗВОДНЫЕ ИНДАНОЛА | 2005 |
|
RU2323937C1 |
| ТРИАЗОЛОВЫЕ СОЕДИНЕНИЯ ИЛИ ИХ ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И ПРОТИВОГРИБКОВАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2146250C1 |
| α,ω ДИАРИЛАЛКАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2105752C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, ПРОЯВЛЯЮЩАЯ АНТАГОНИСТИЧЕСКОЕ ДЕЙСТВИЕ В ОТНОШЕНИИ РЕЦЕПТОРОВ ТАХИКИНИНА | 1996 |
|
RU2135494C1 |
| ПЕПТИДНОЕ СОЕДИНЕНИЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1993 |
|
RU2106357C1 |
| ПРОИЗВОДНЫЕ ОКТАГИДРОНАФТАЛИНОКСИМА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2125043C1 |
| АНАЛОГИ ЛИПИДА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1992 |
|
RU2076107C1 |
| ПРОИЗВОДНЫЕ АМИНОСПИРТОВ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ И СПОСОБ ПОЛУЧЕНИЯ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ | 2001 |
|
RU2233839C1 |



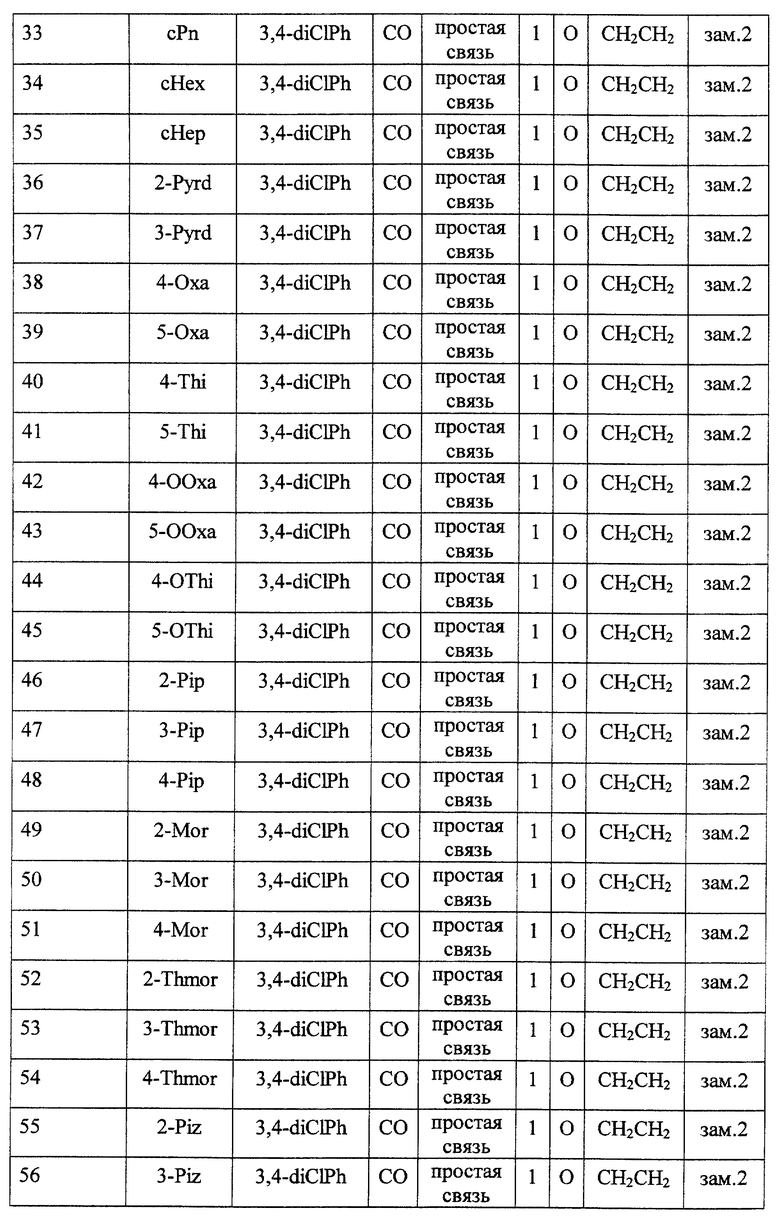



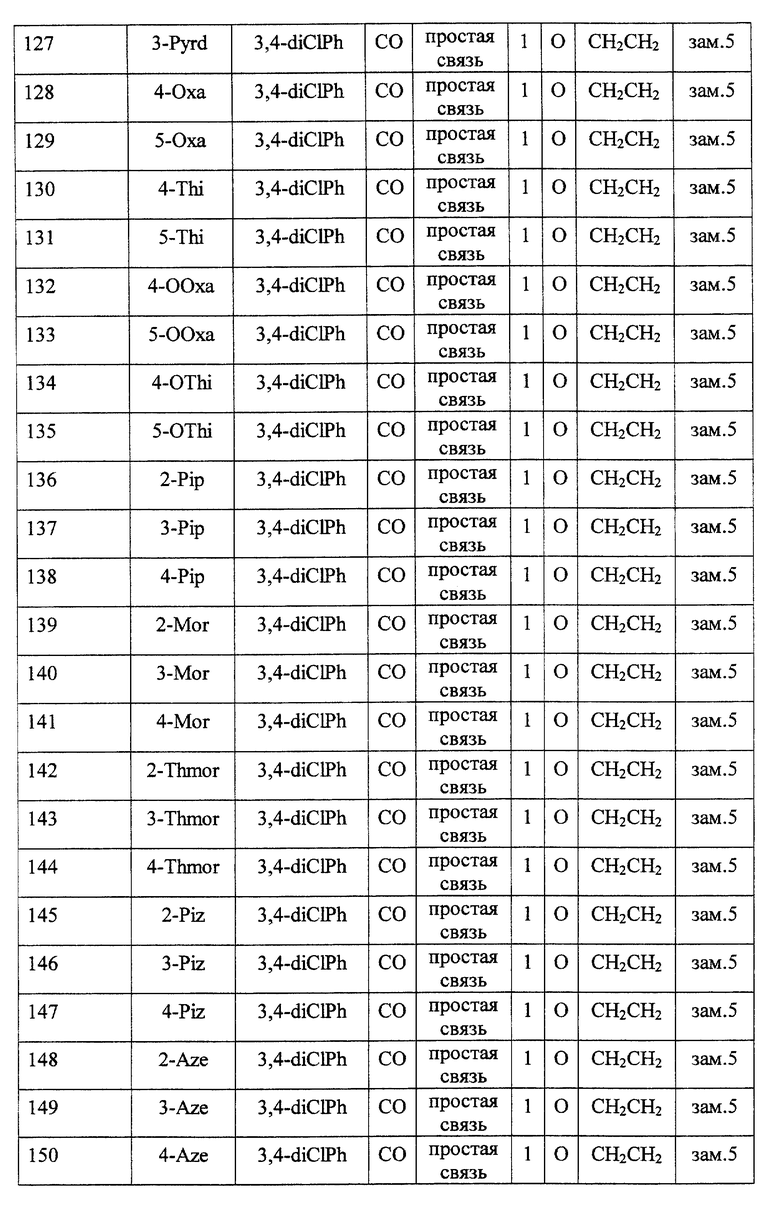
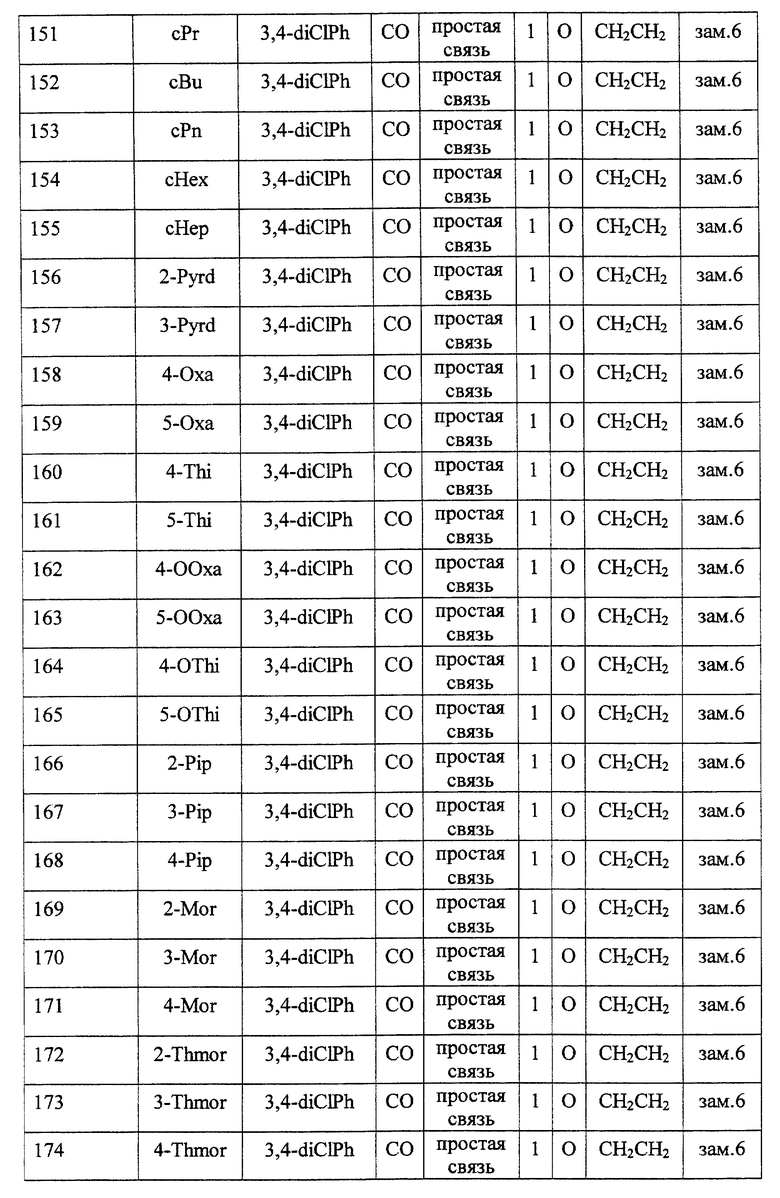


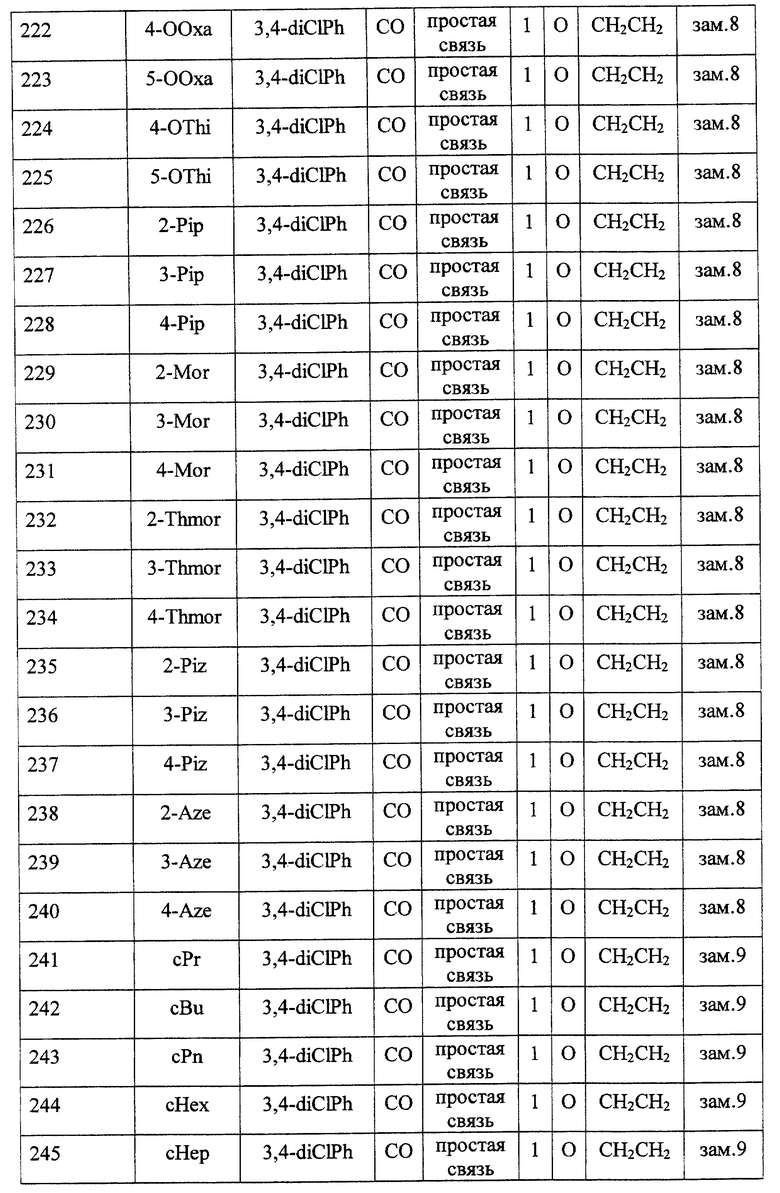















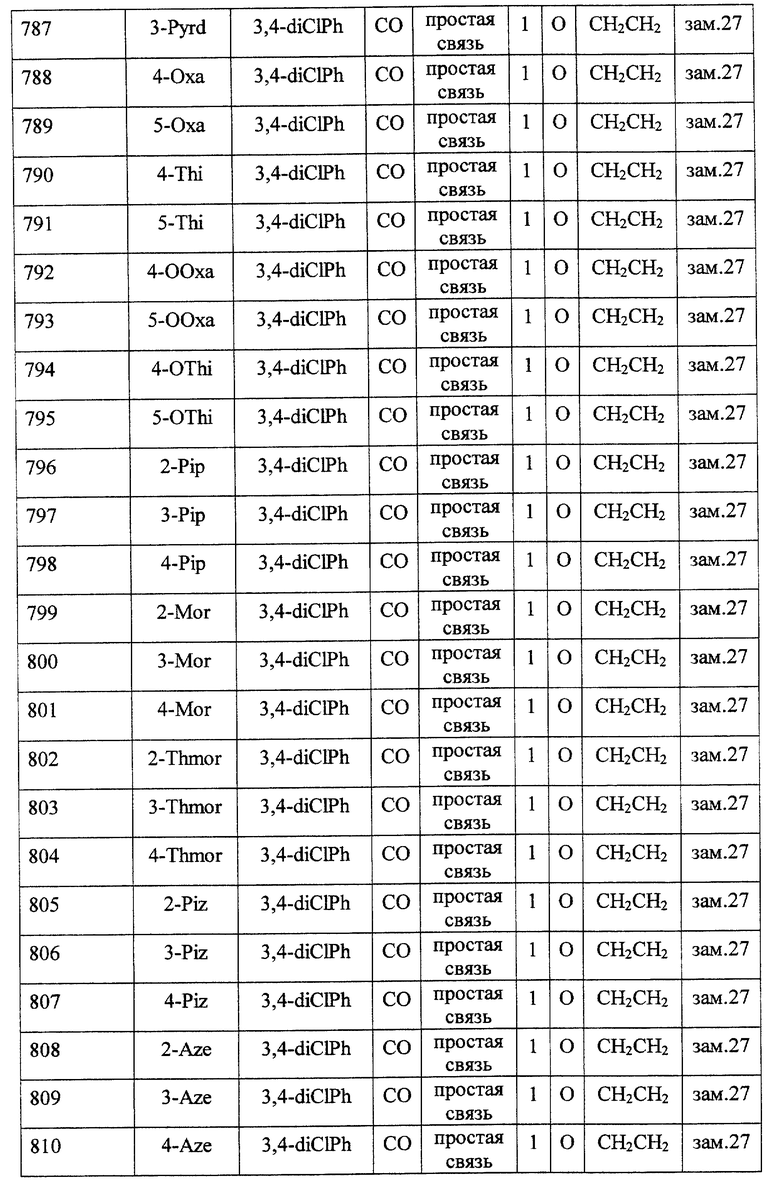
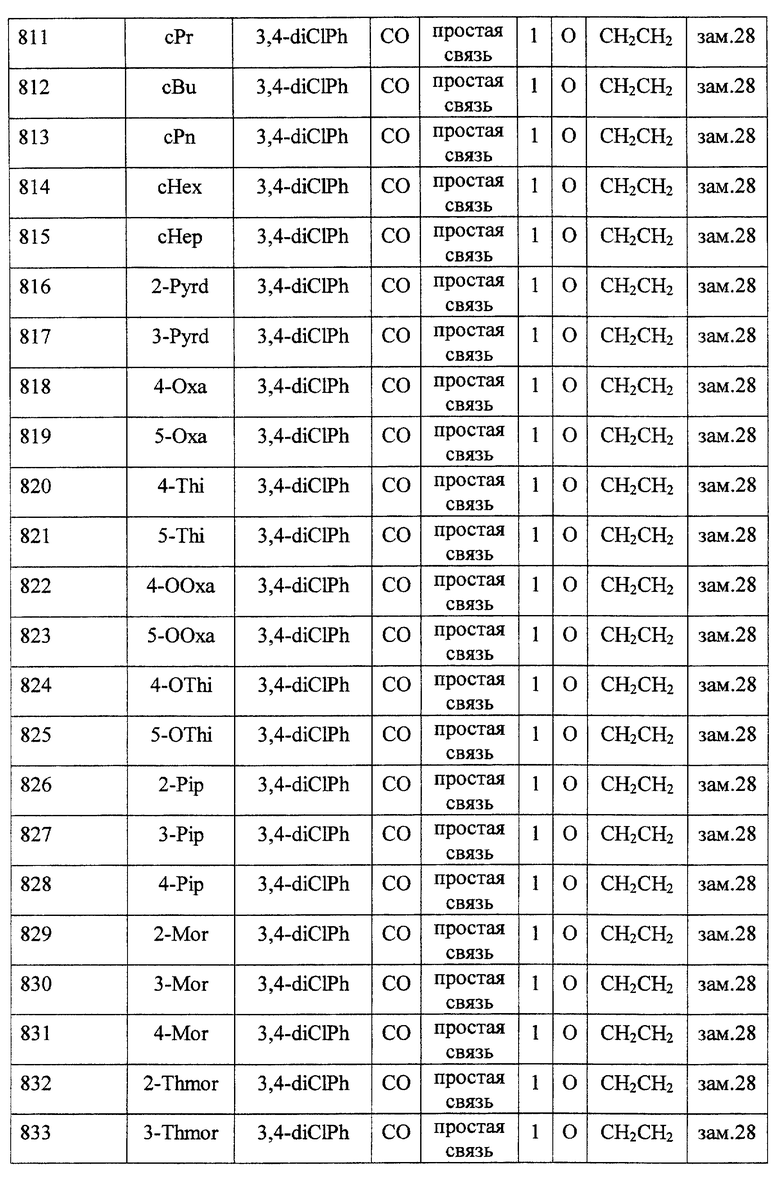






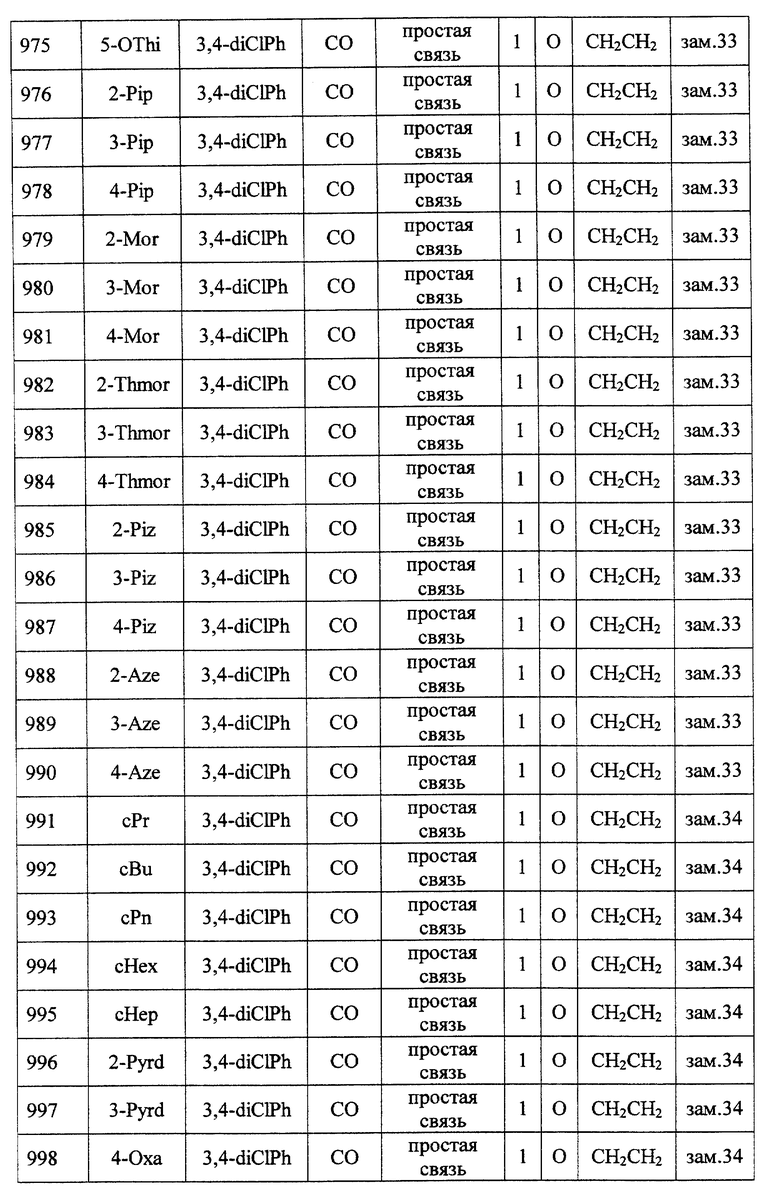







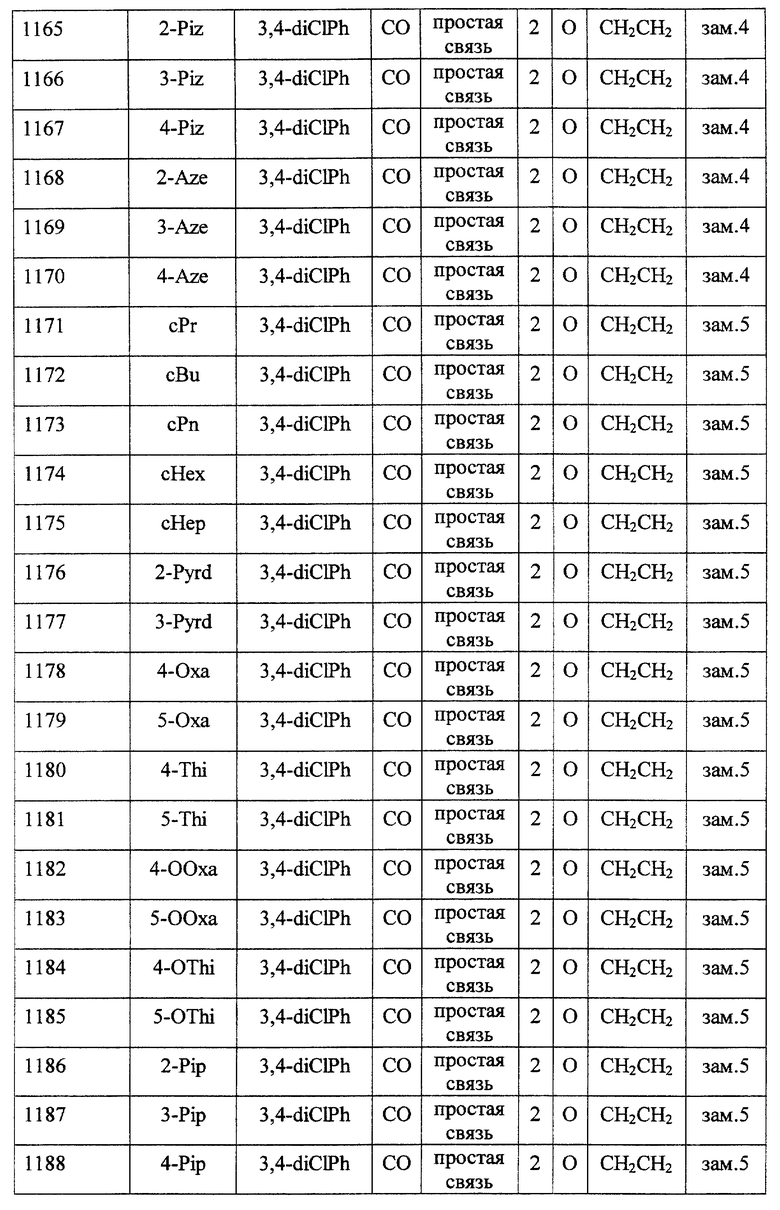

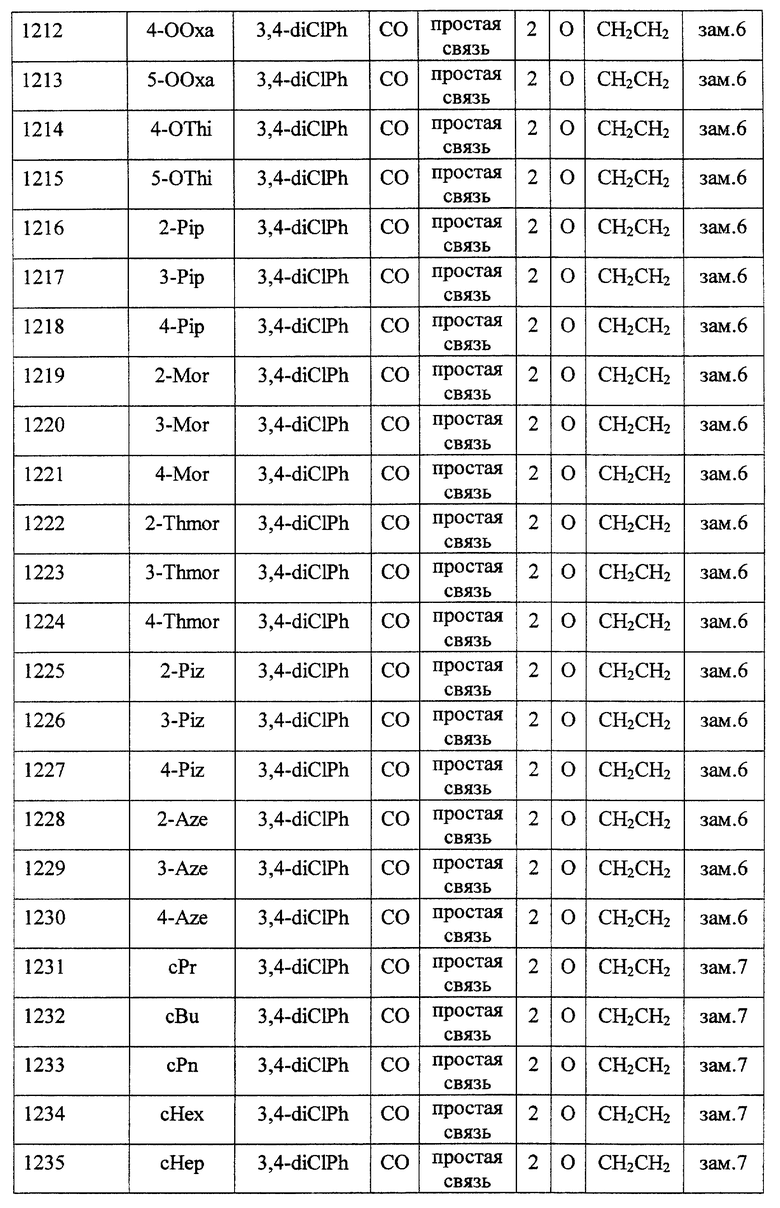


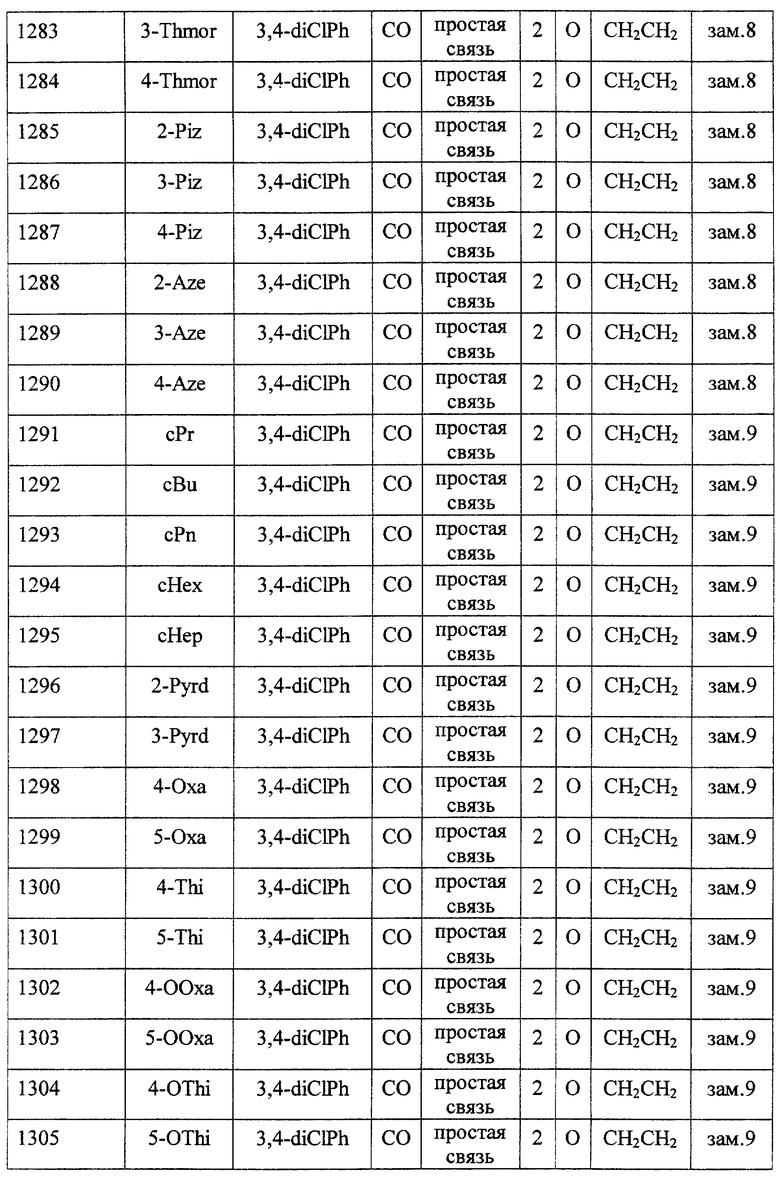
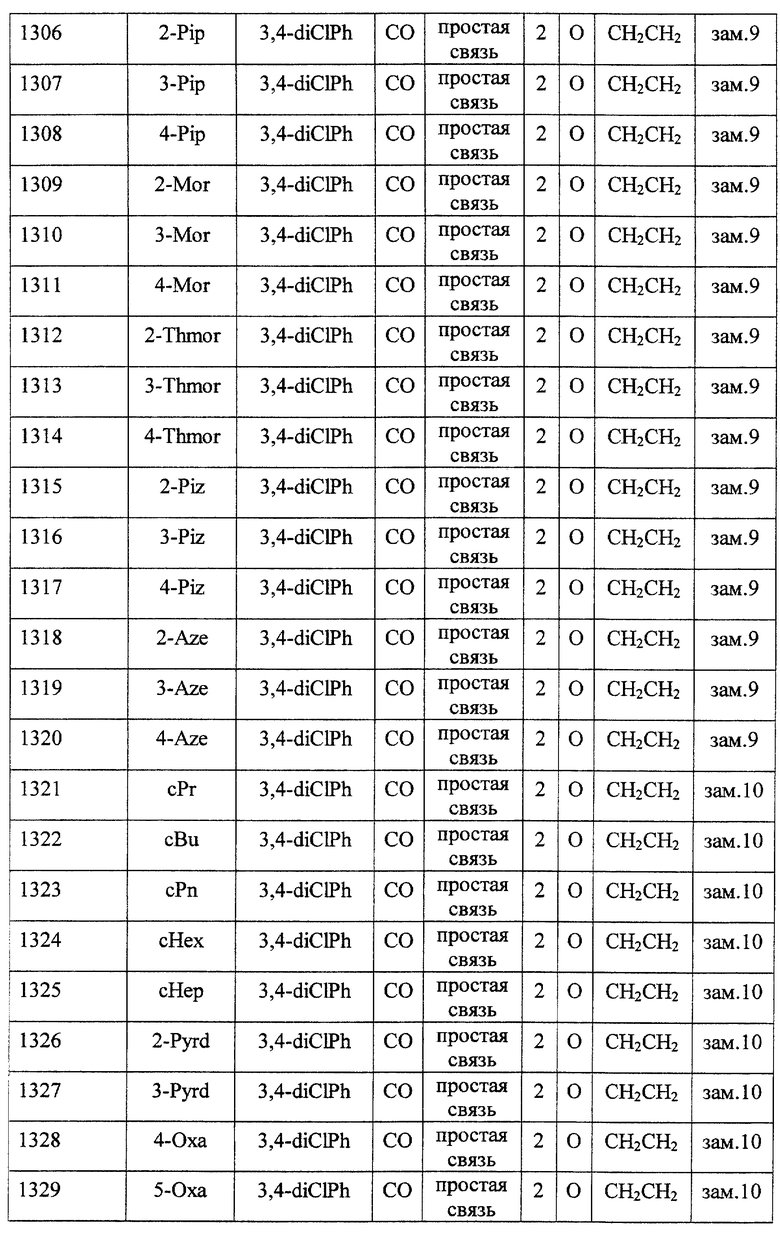
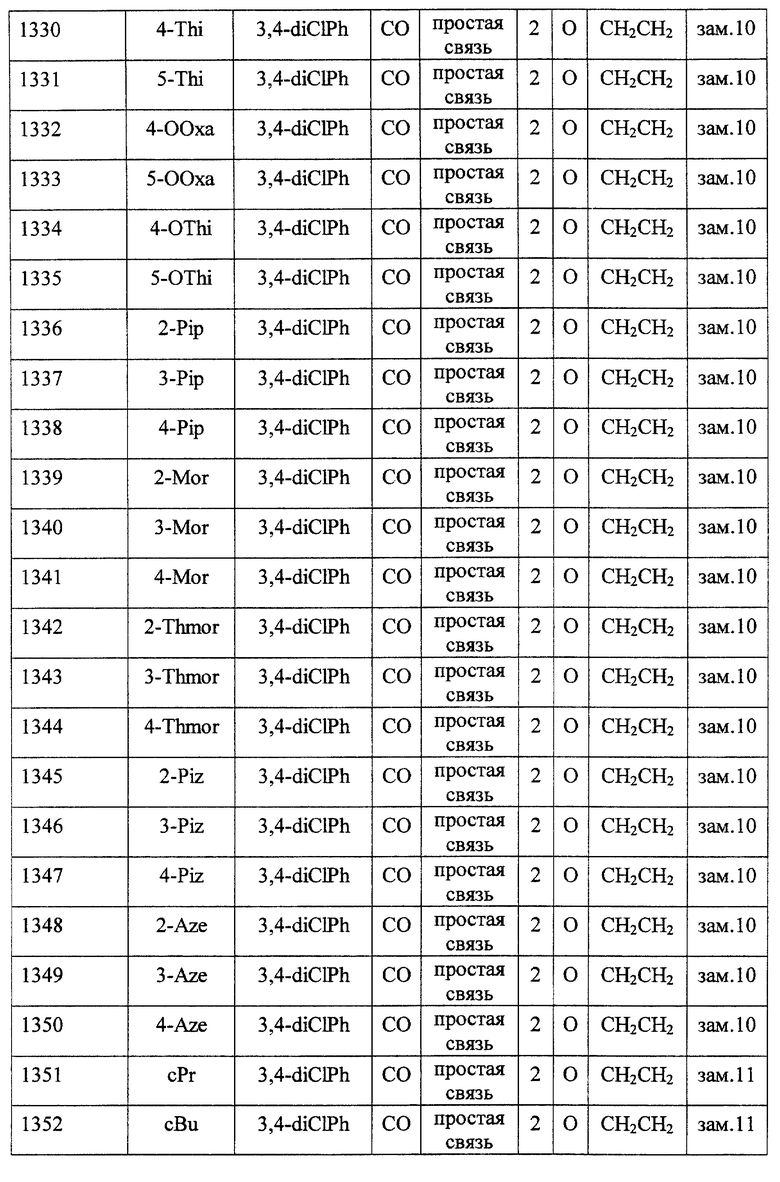
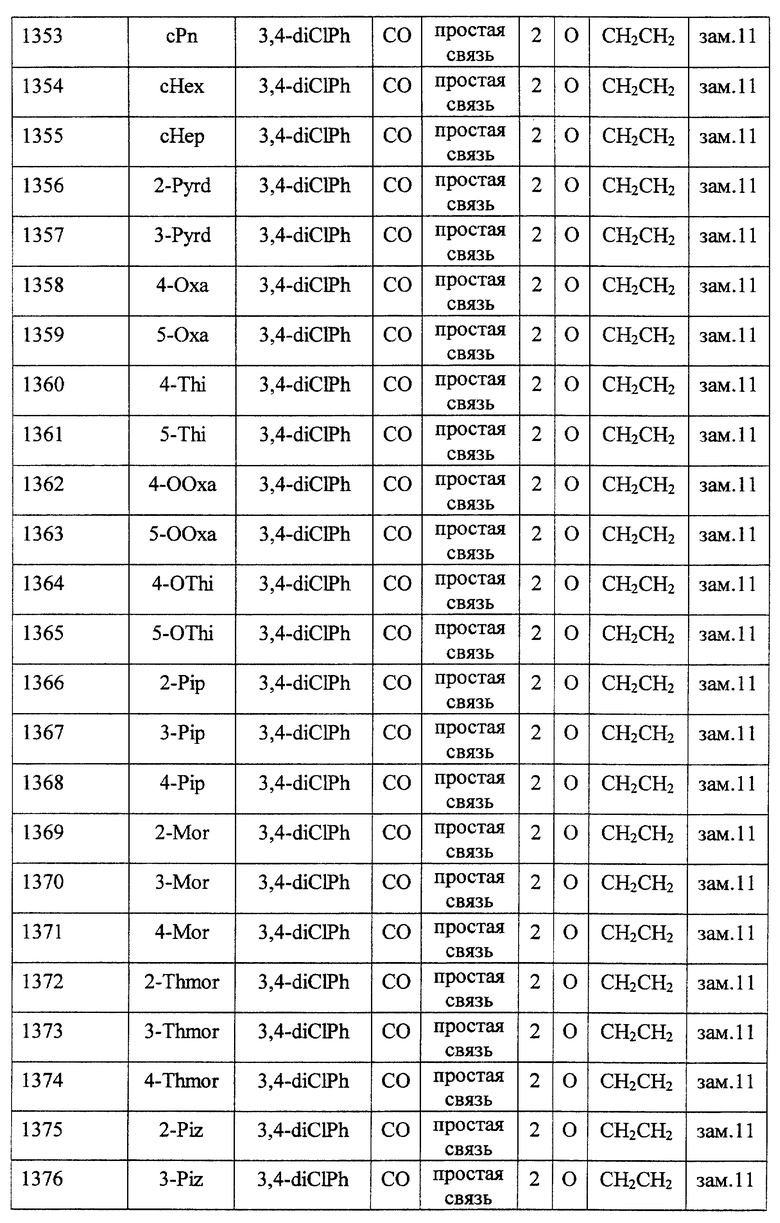





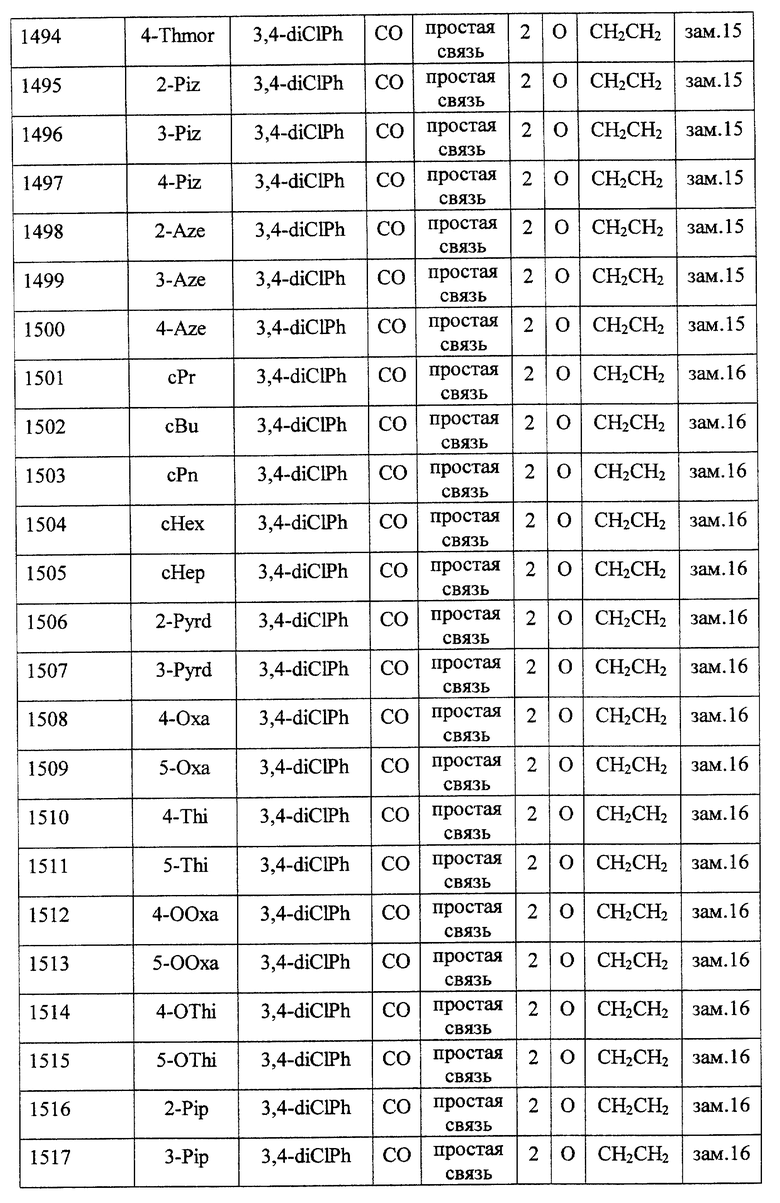







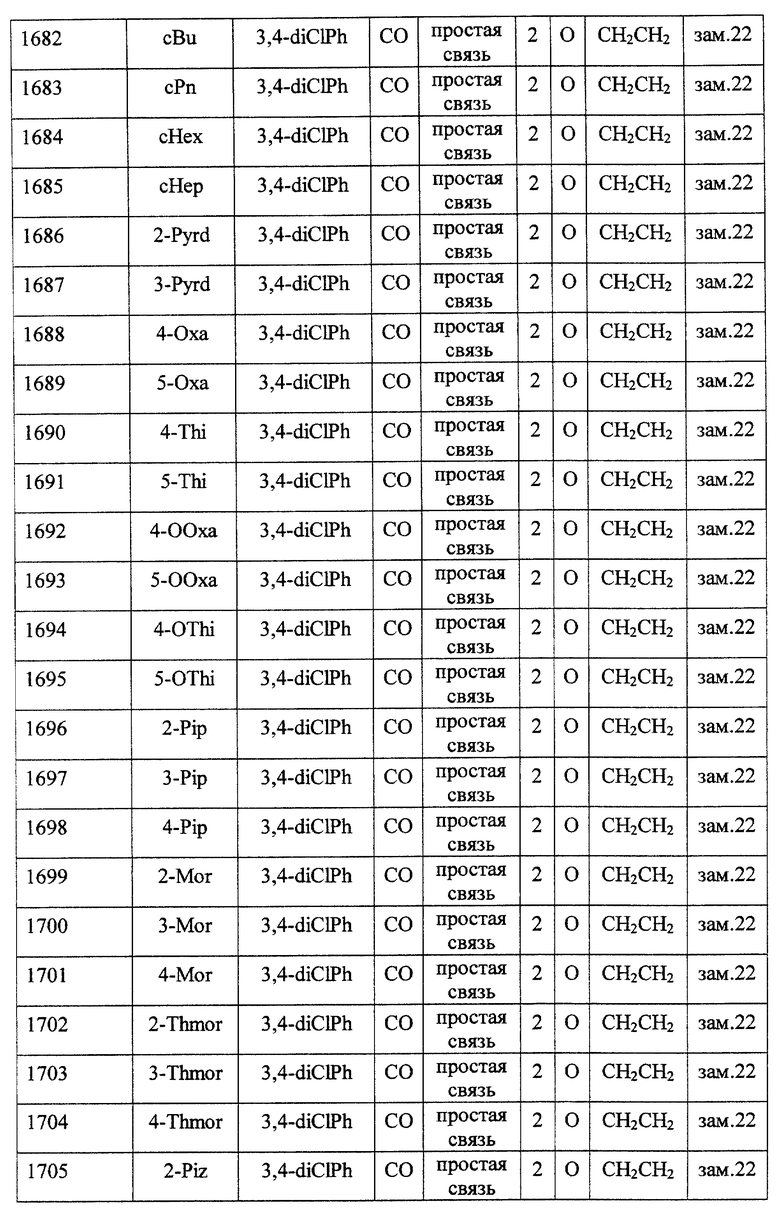

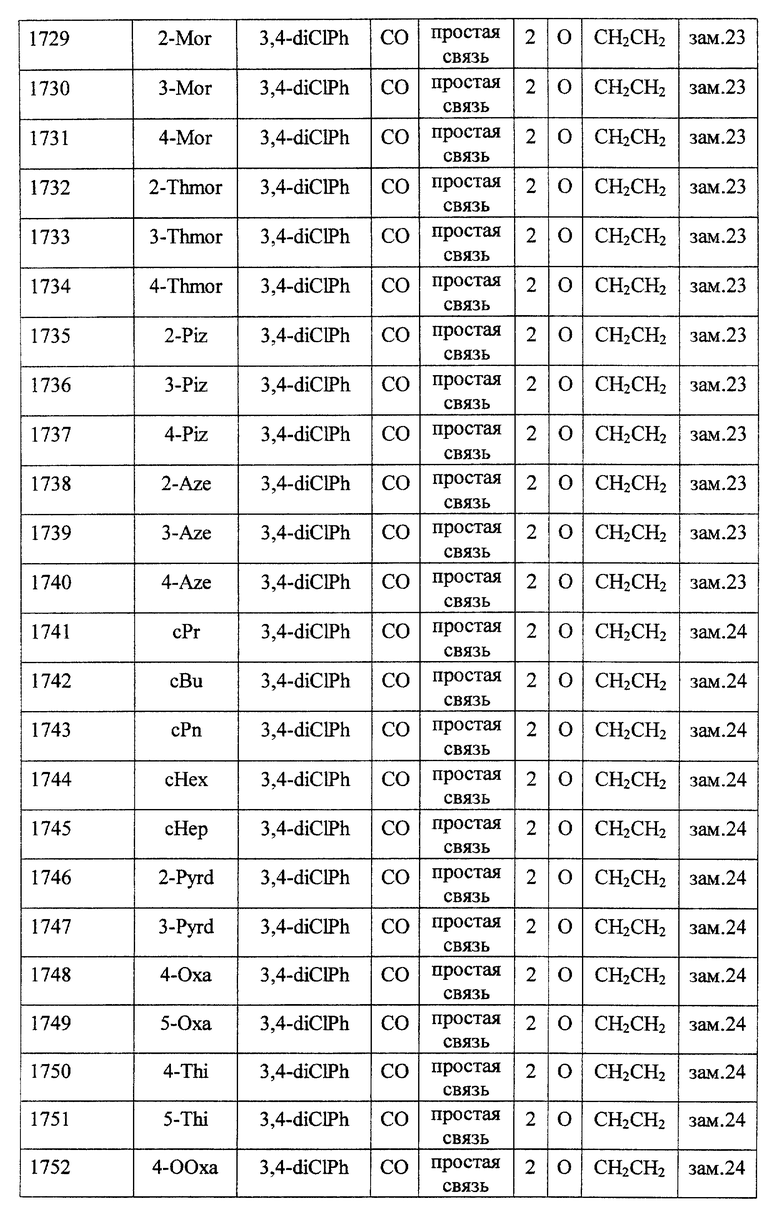




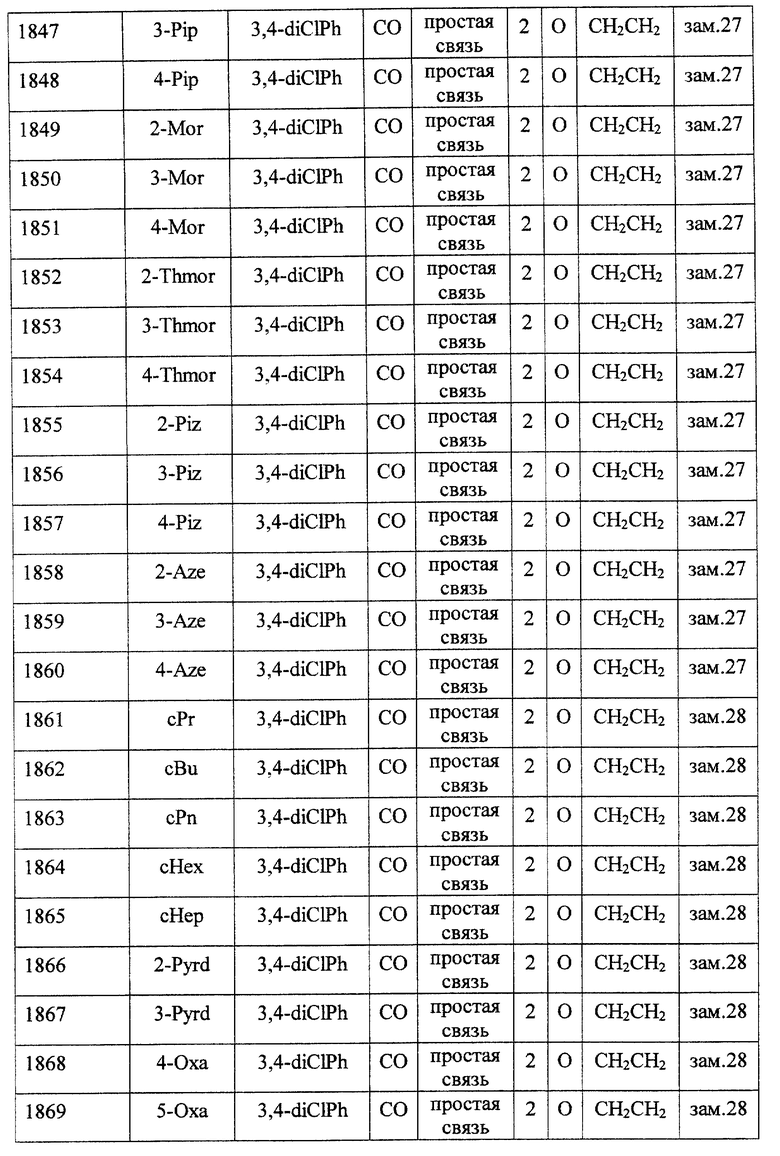







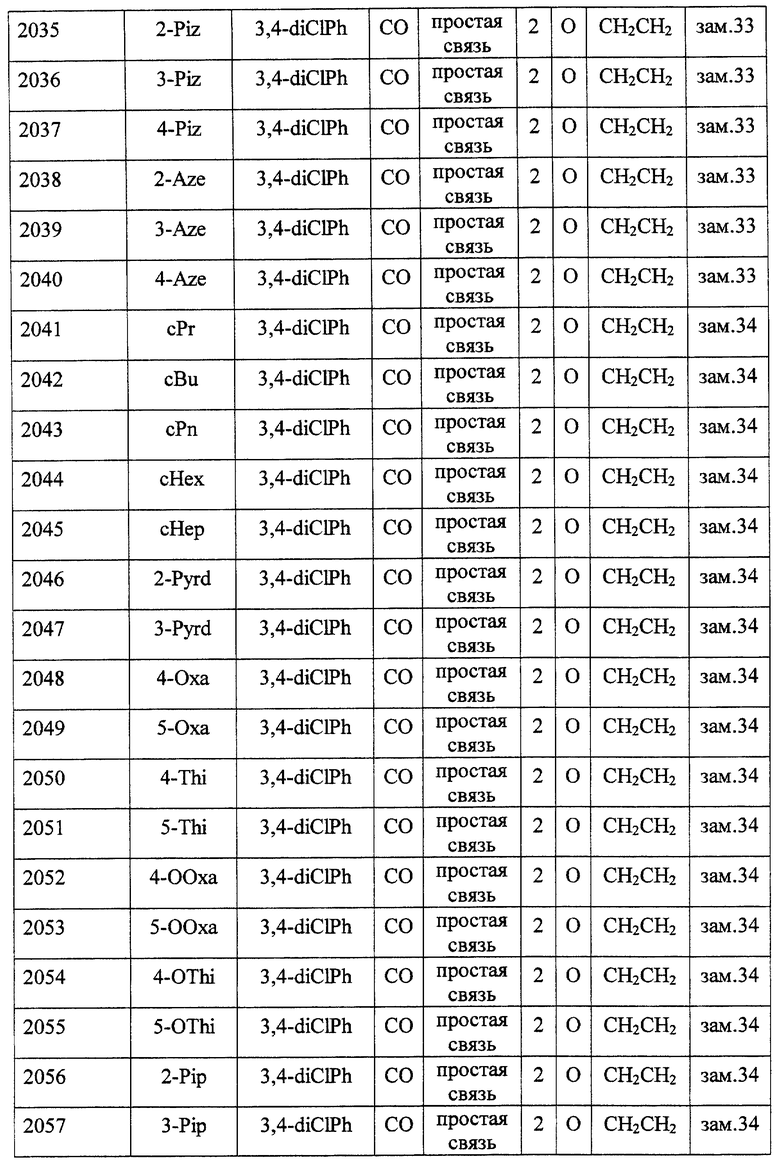



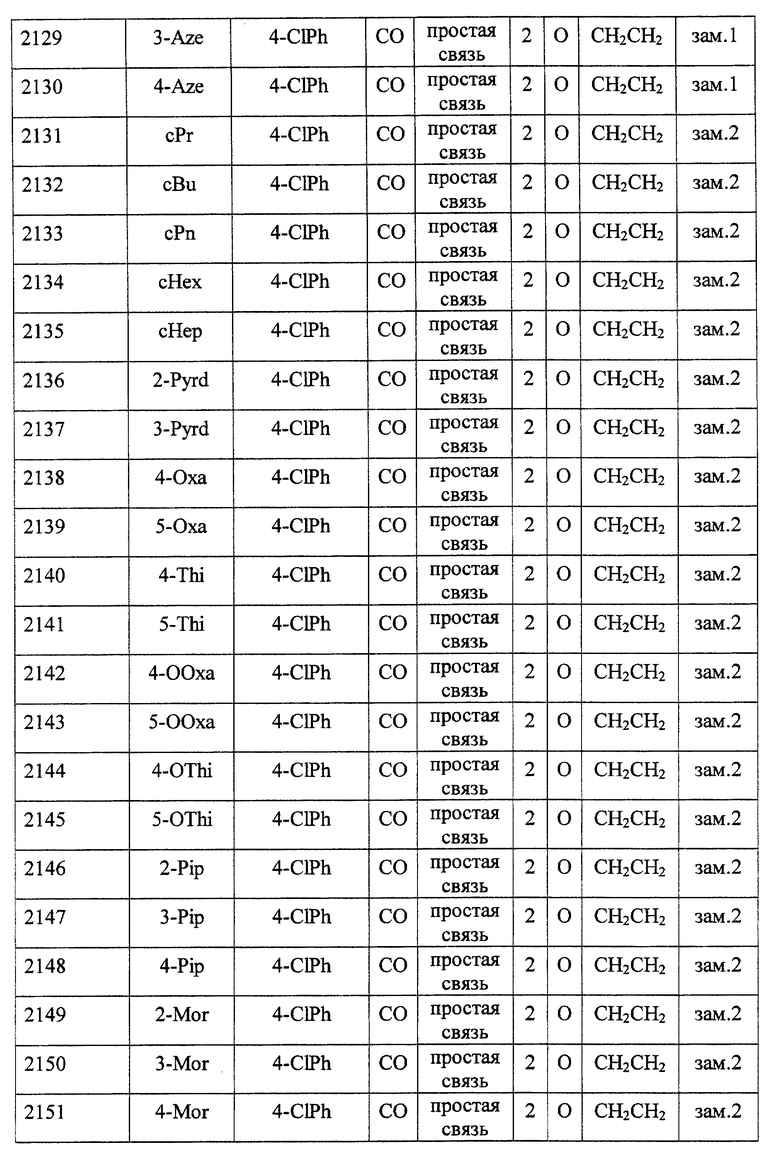


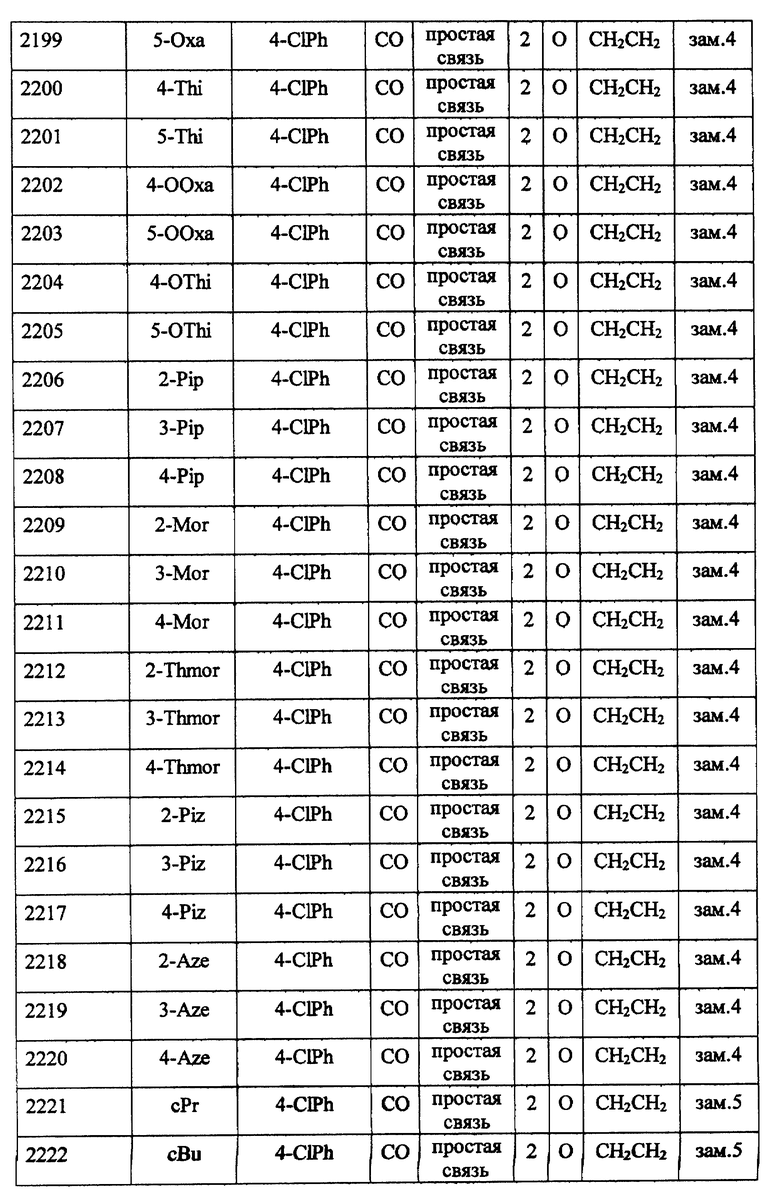
















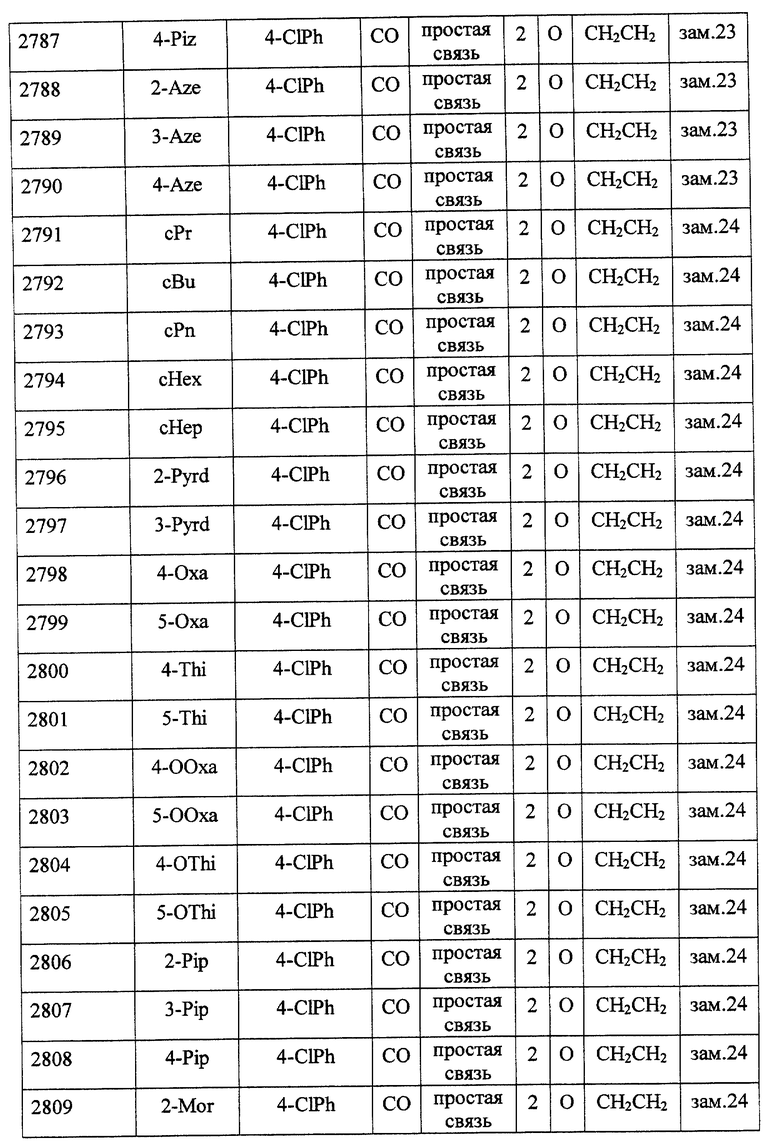


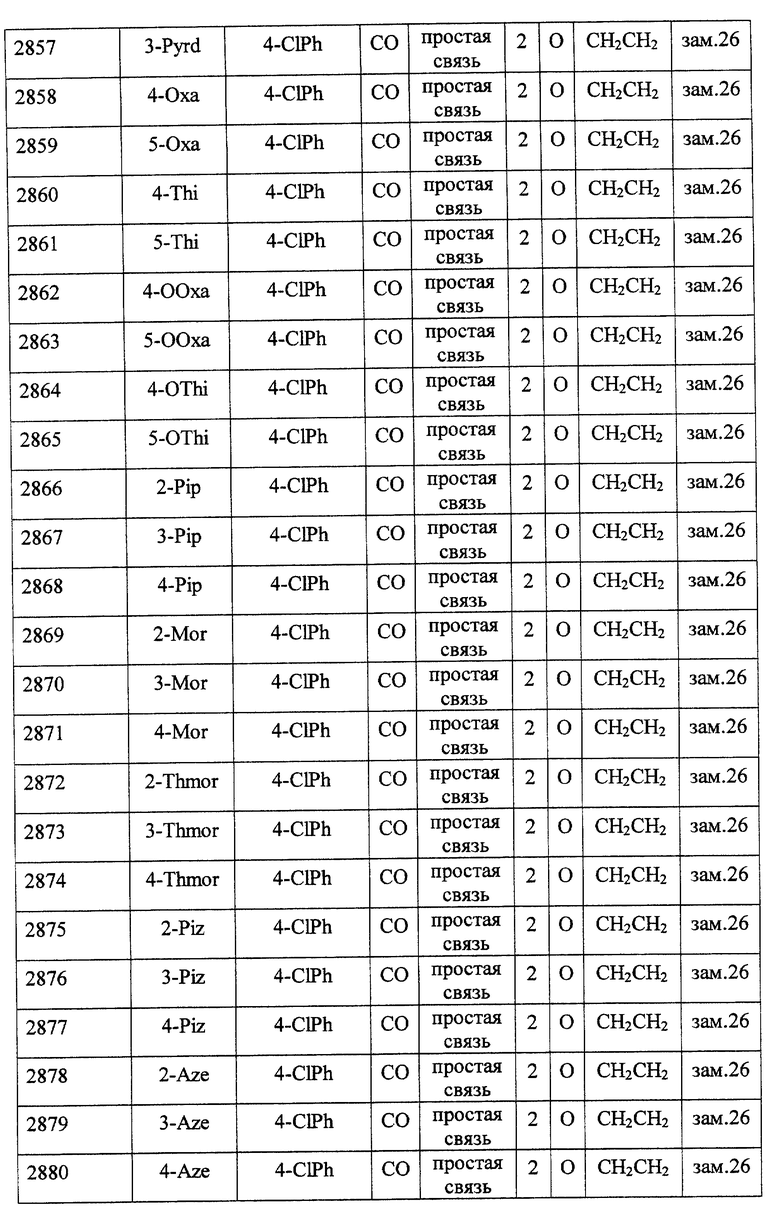



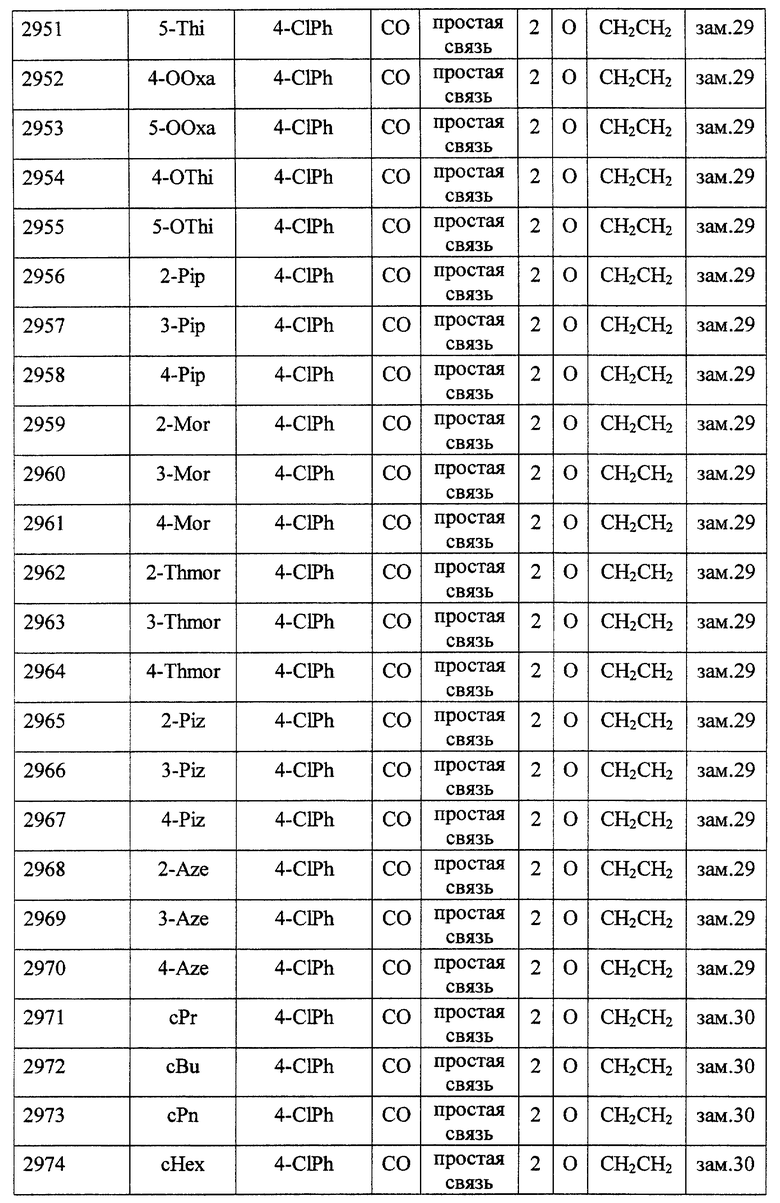
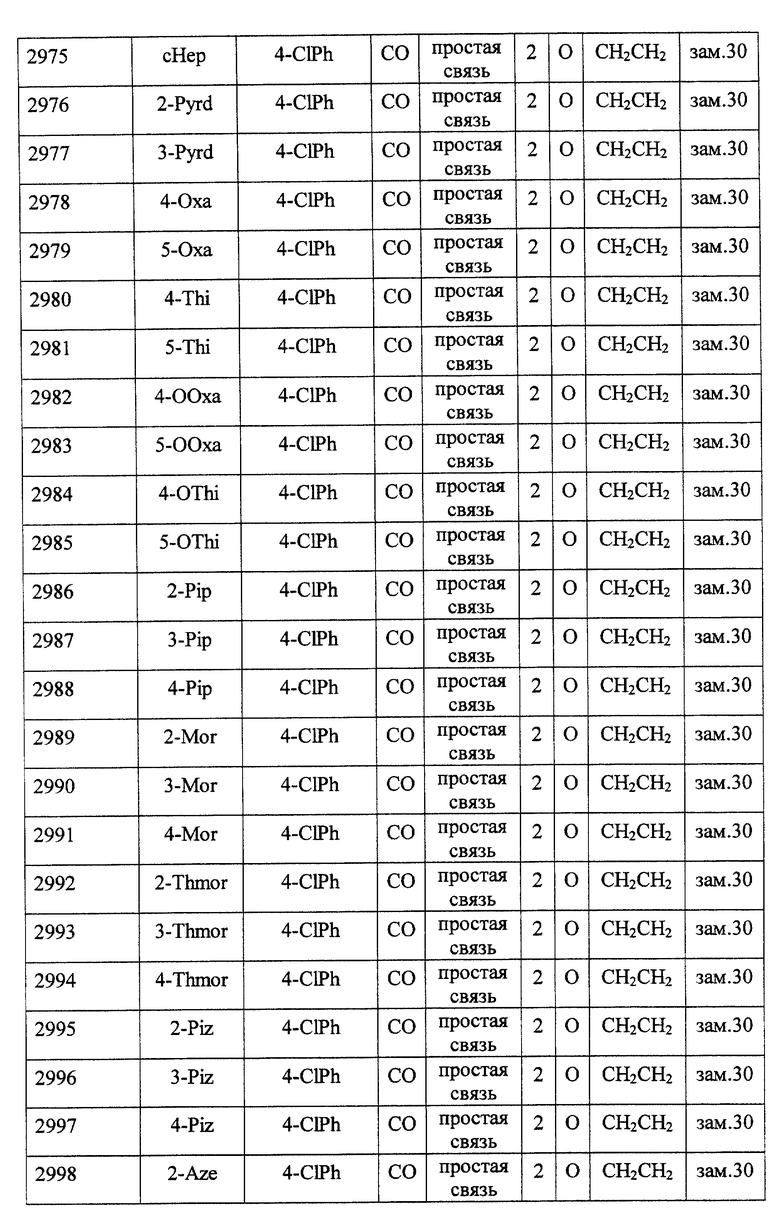












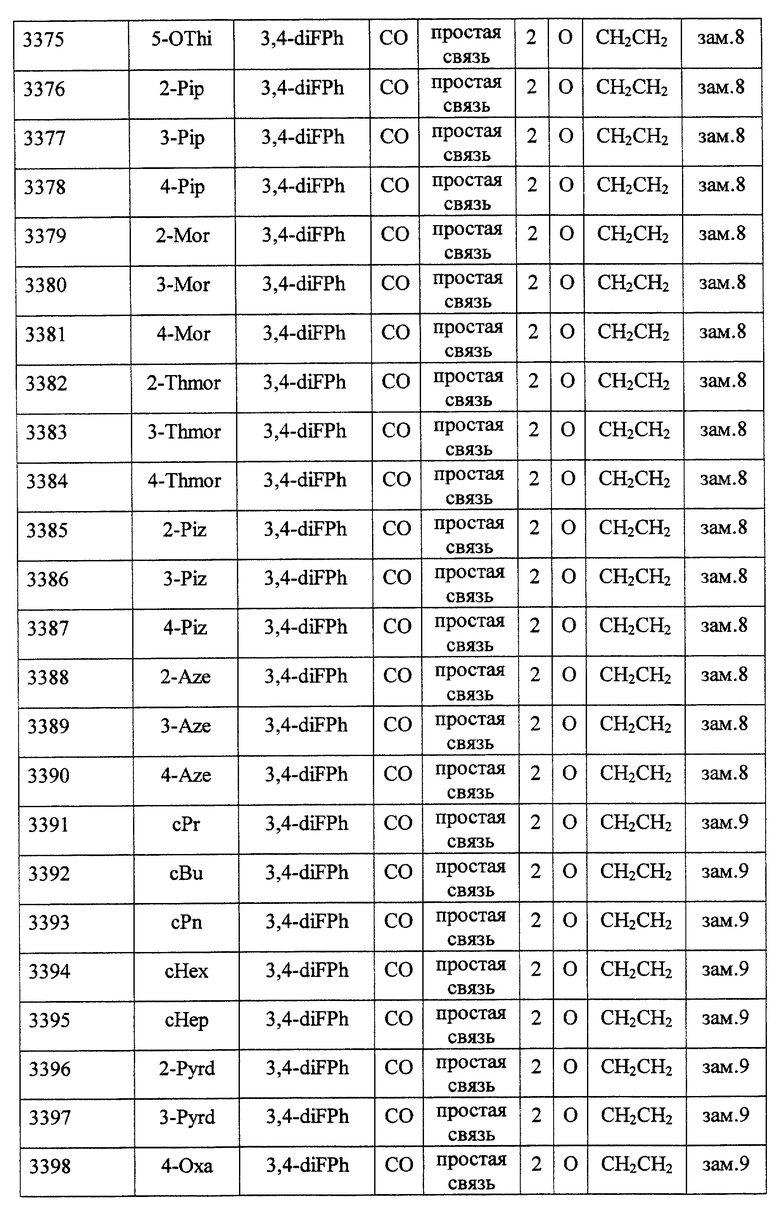

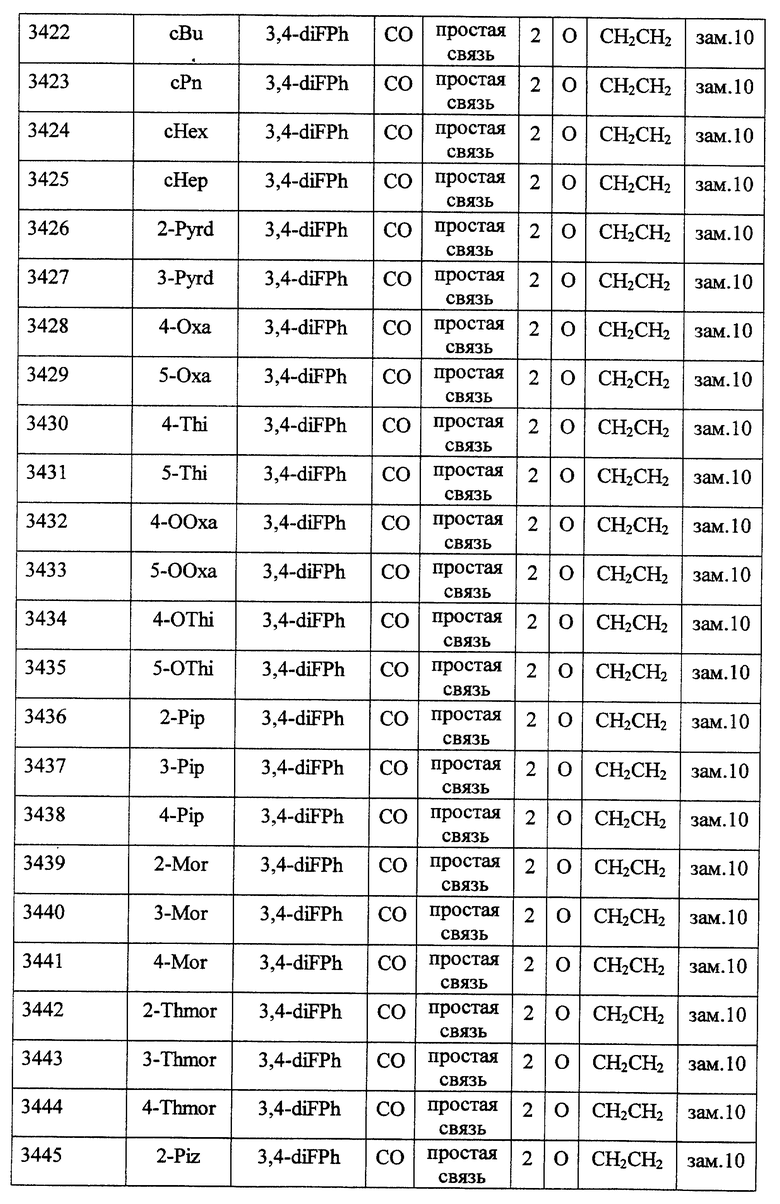




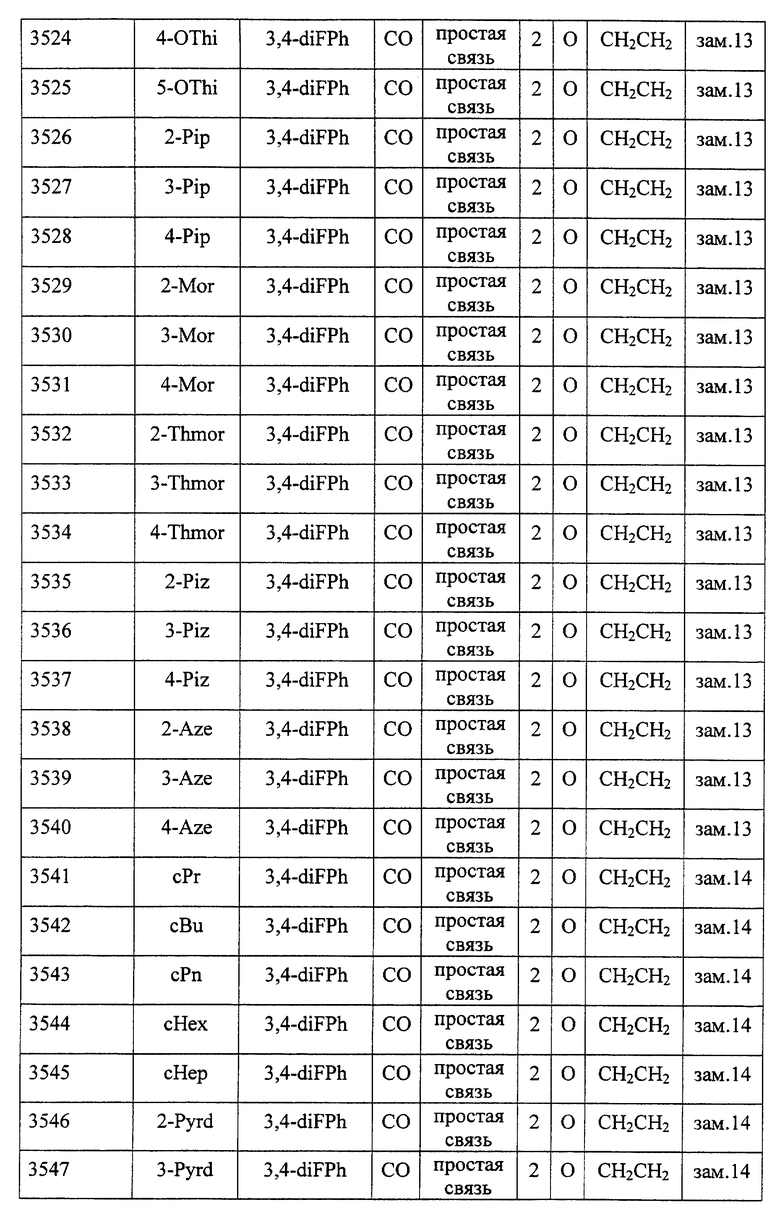

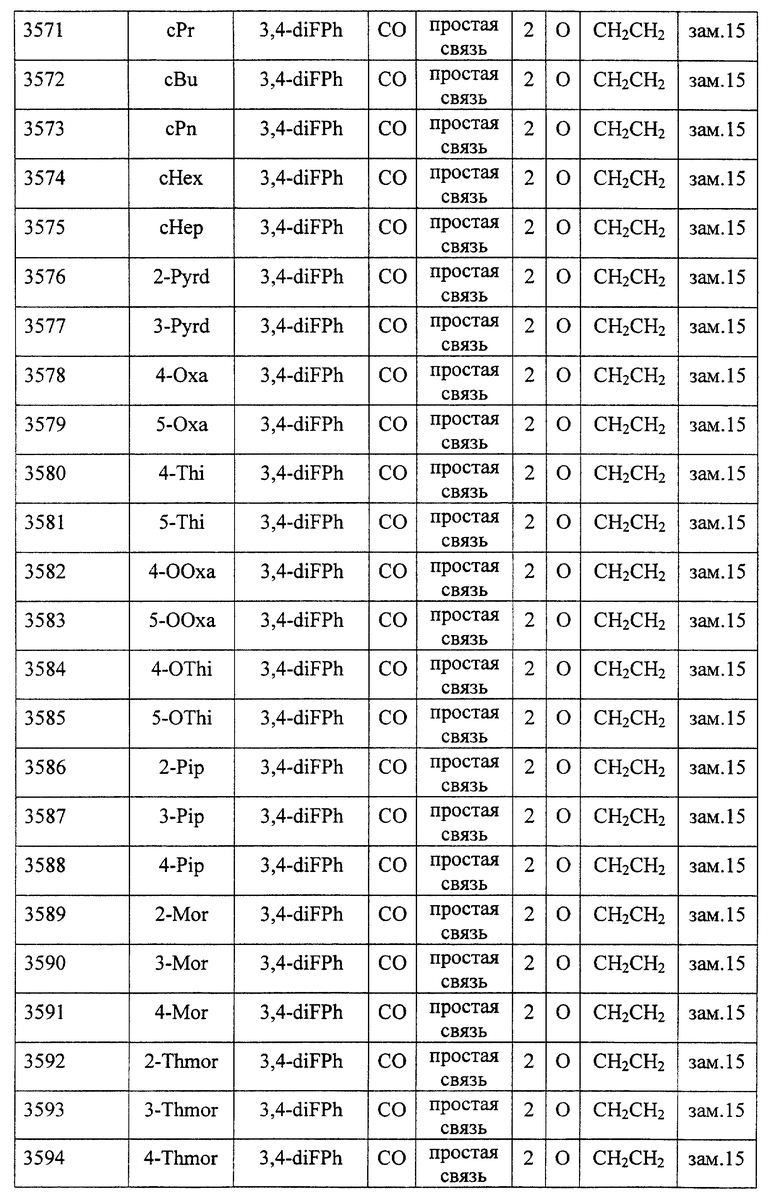





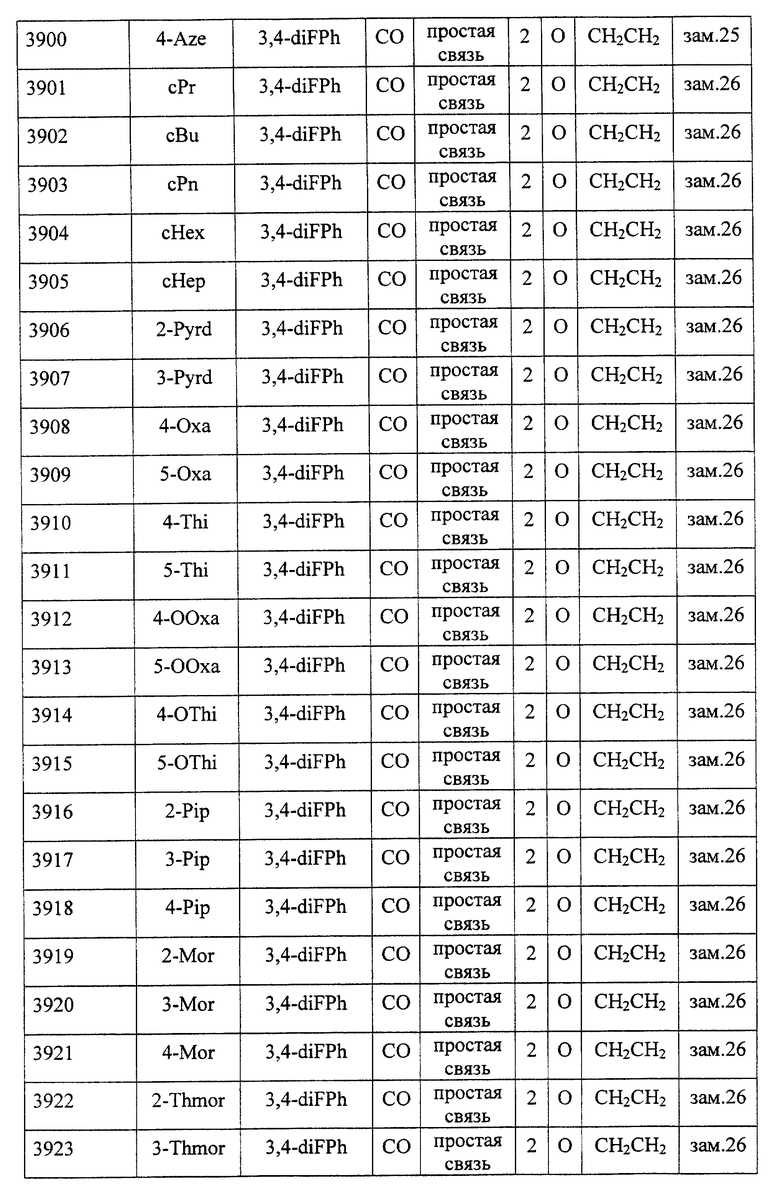


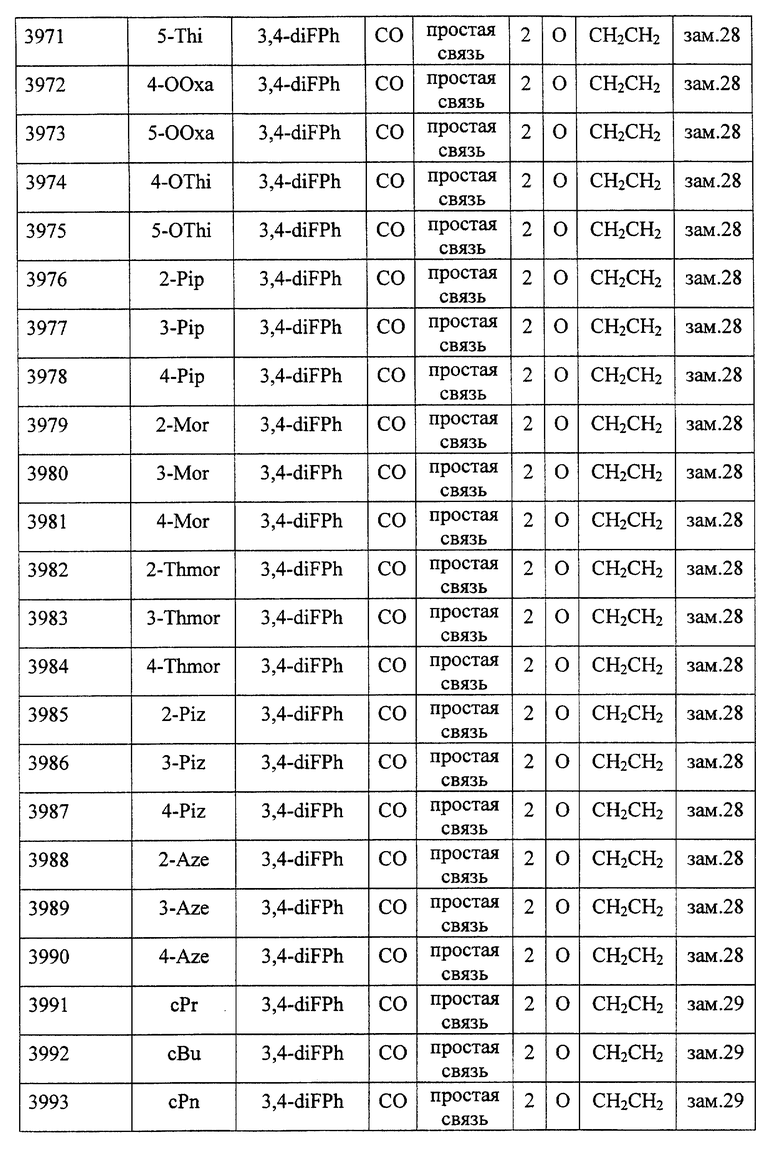



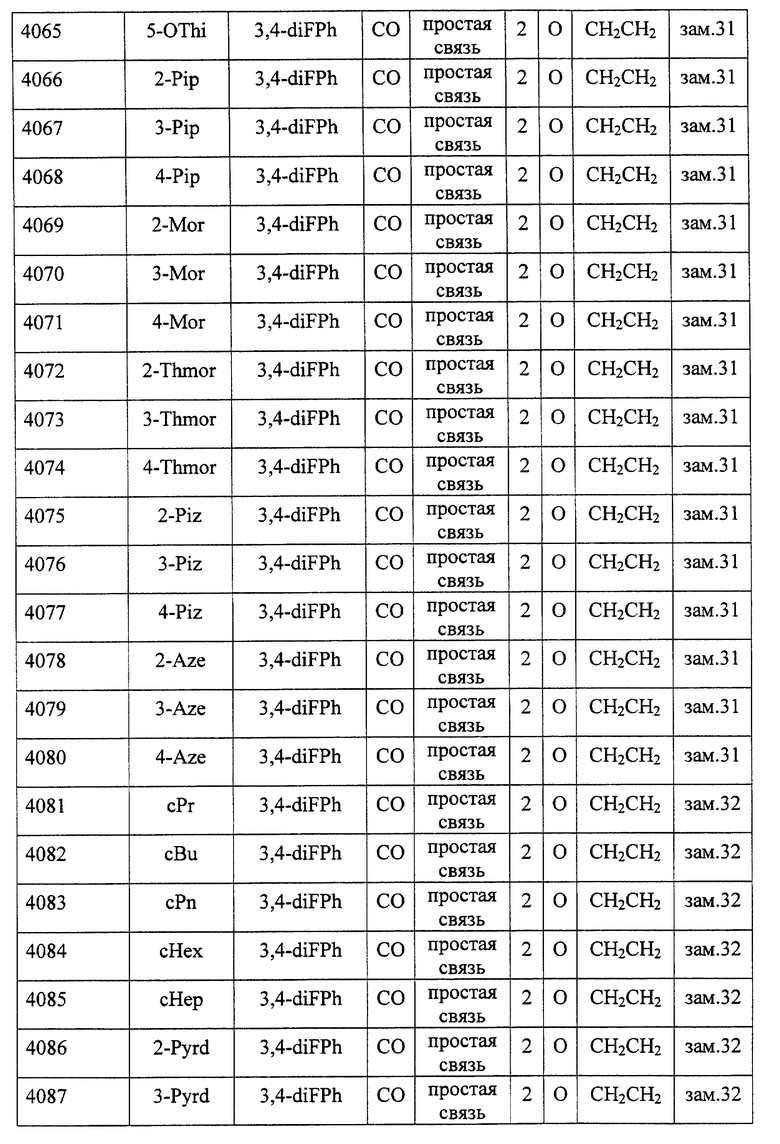
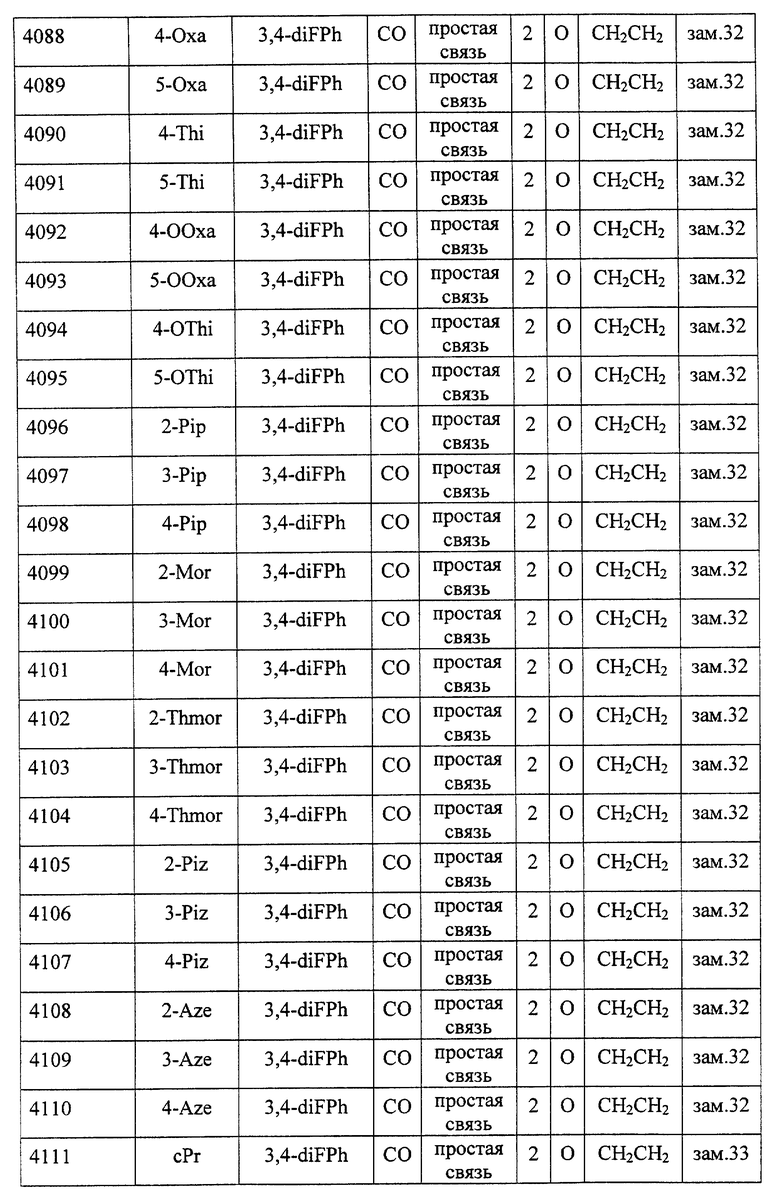







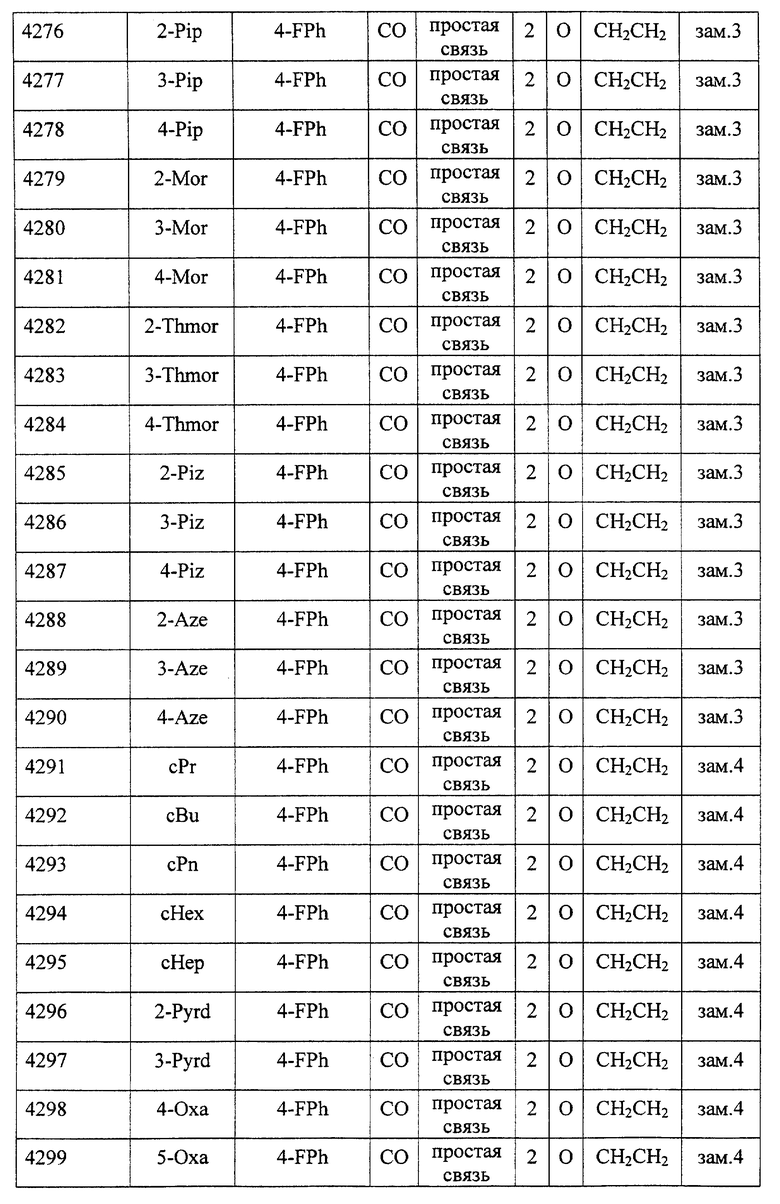

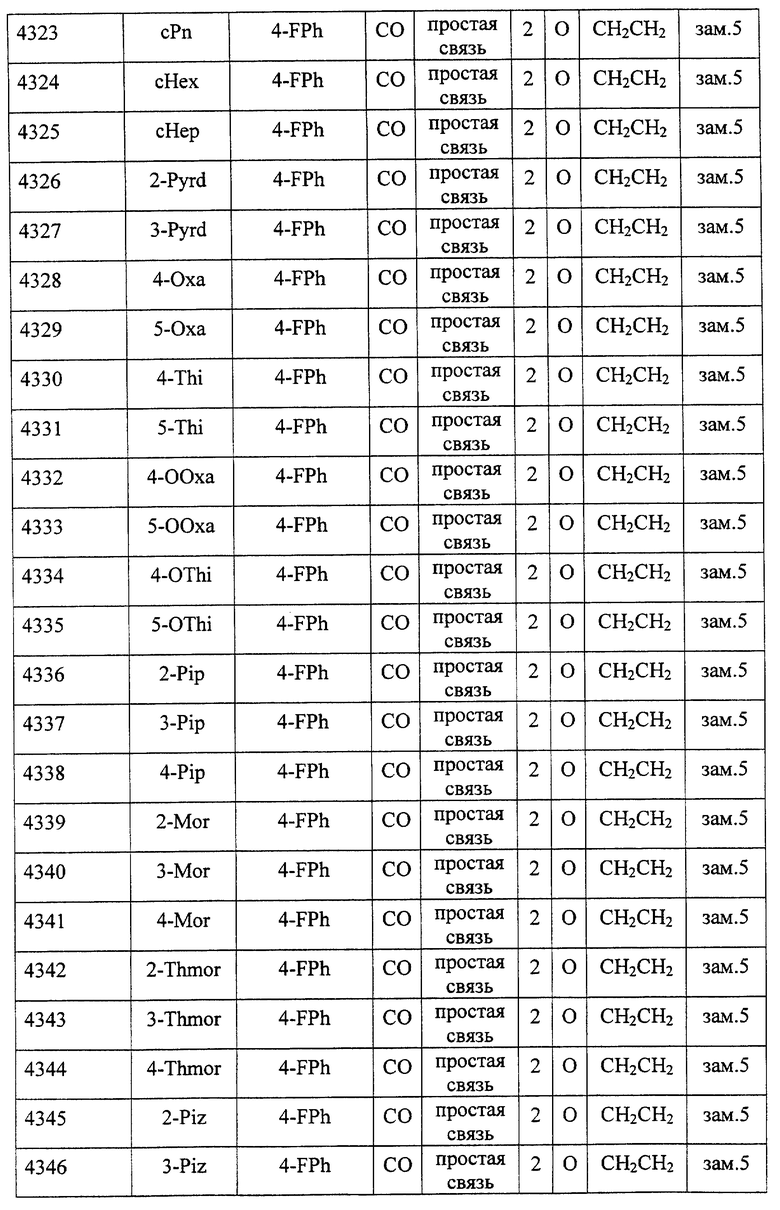

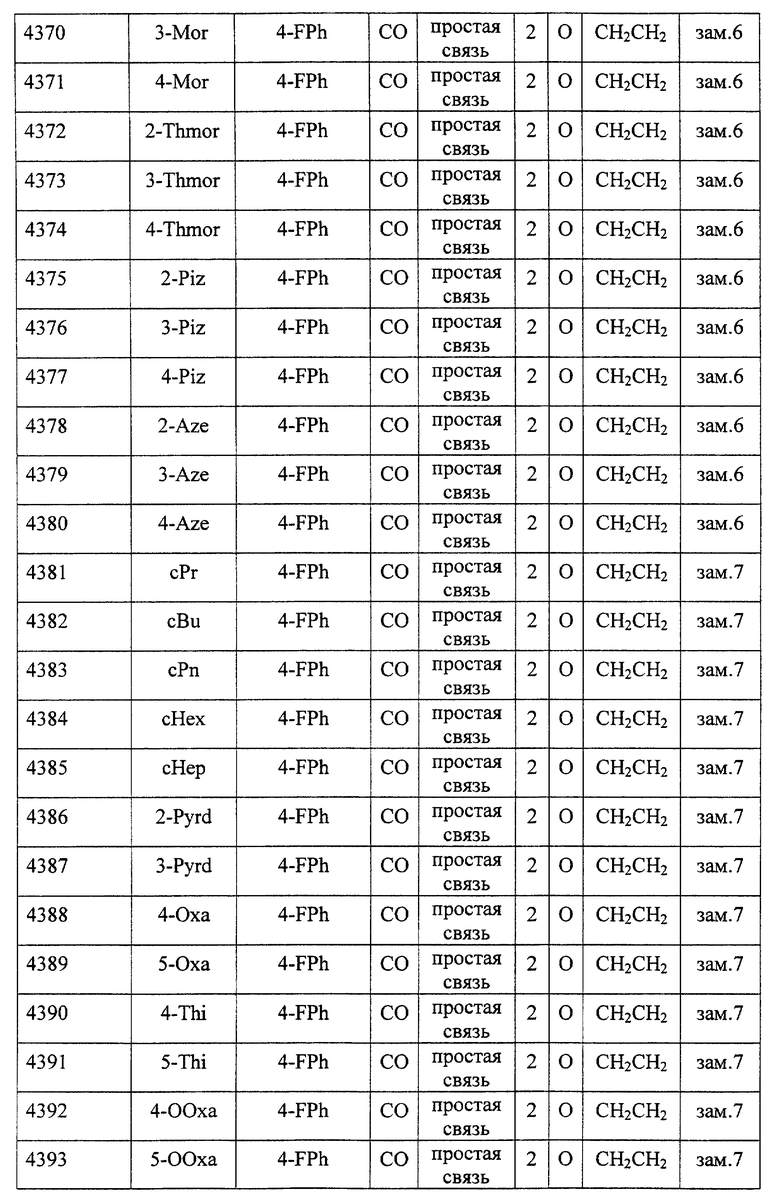
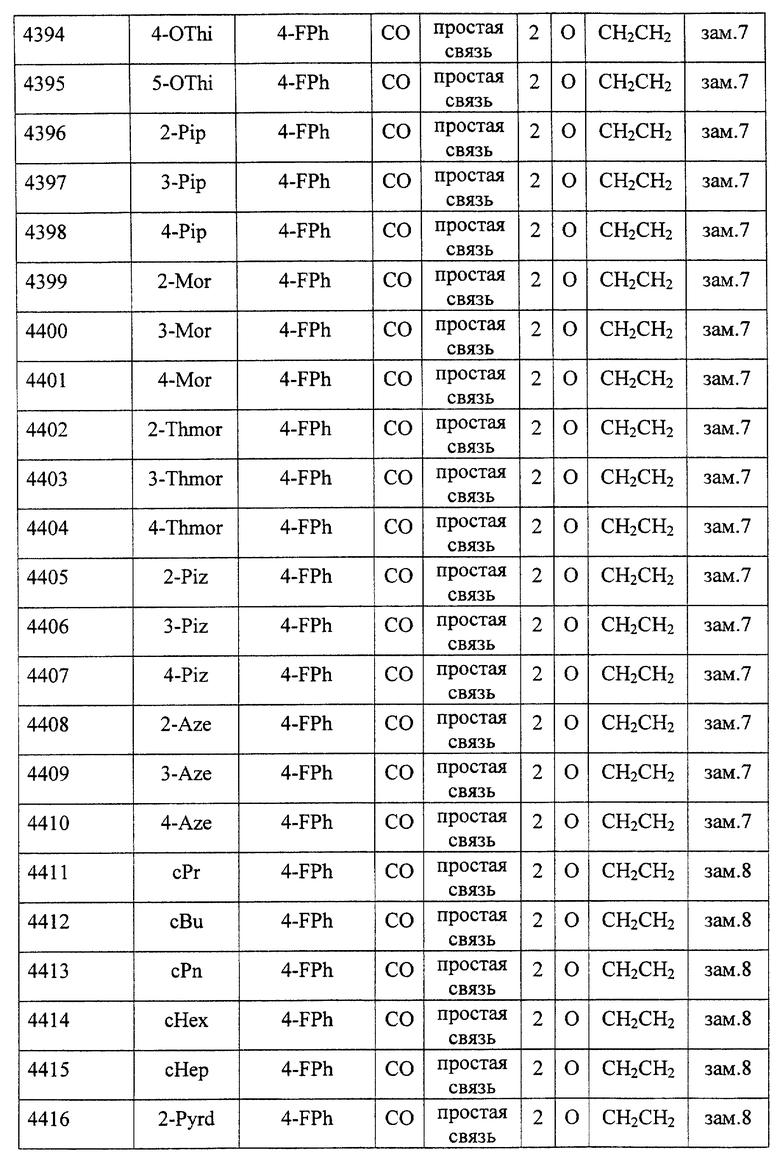


















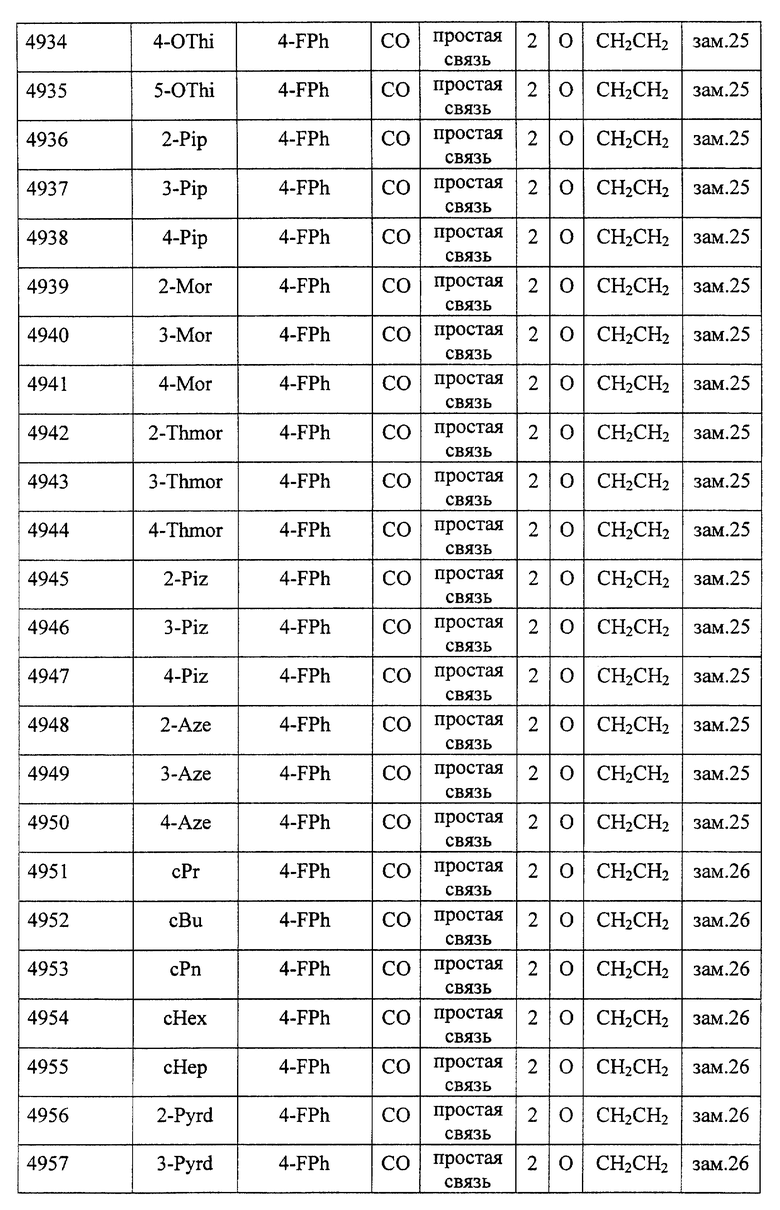
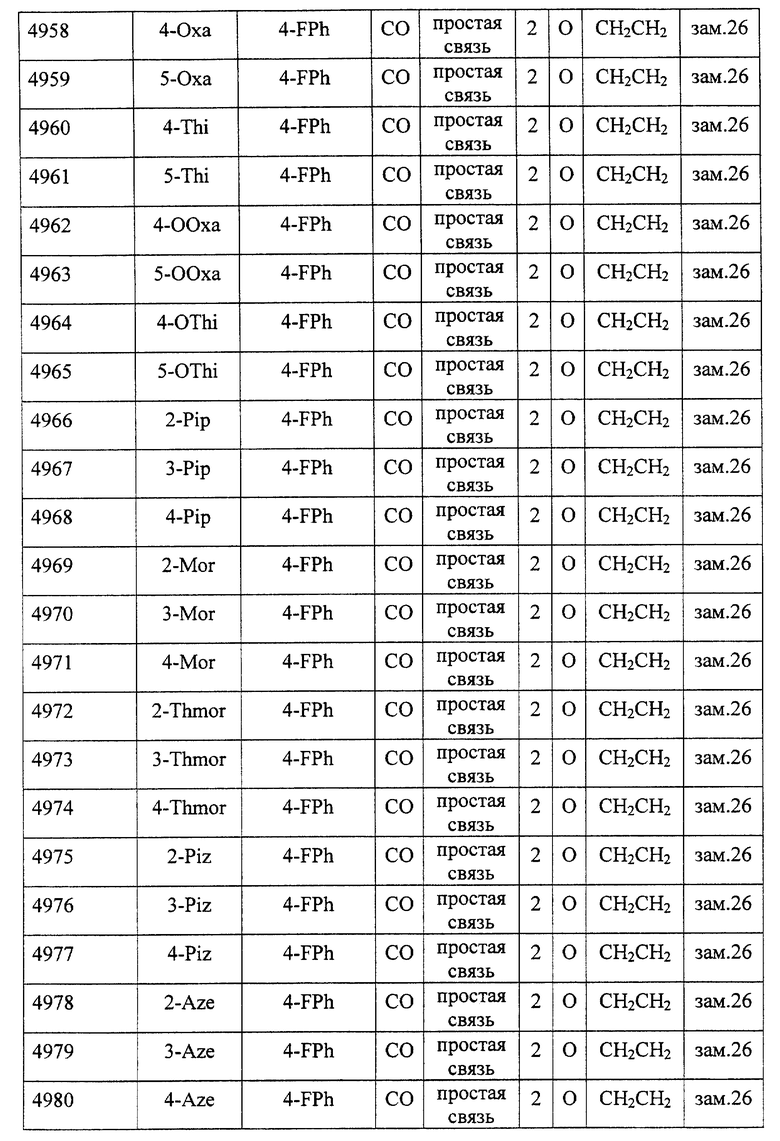





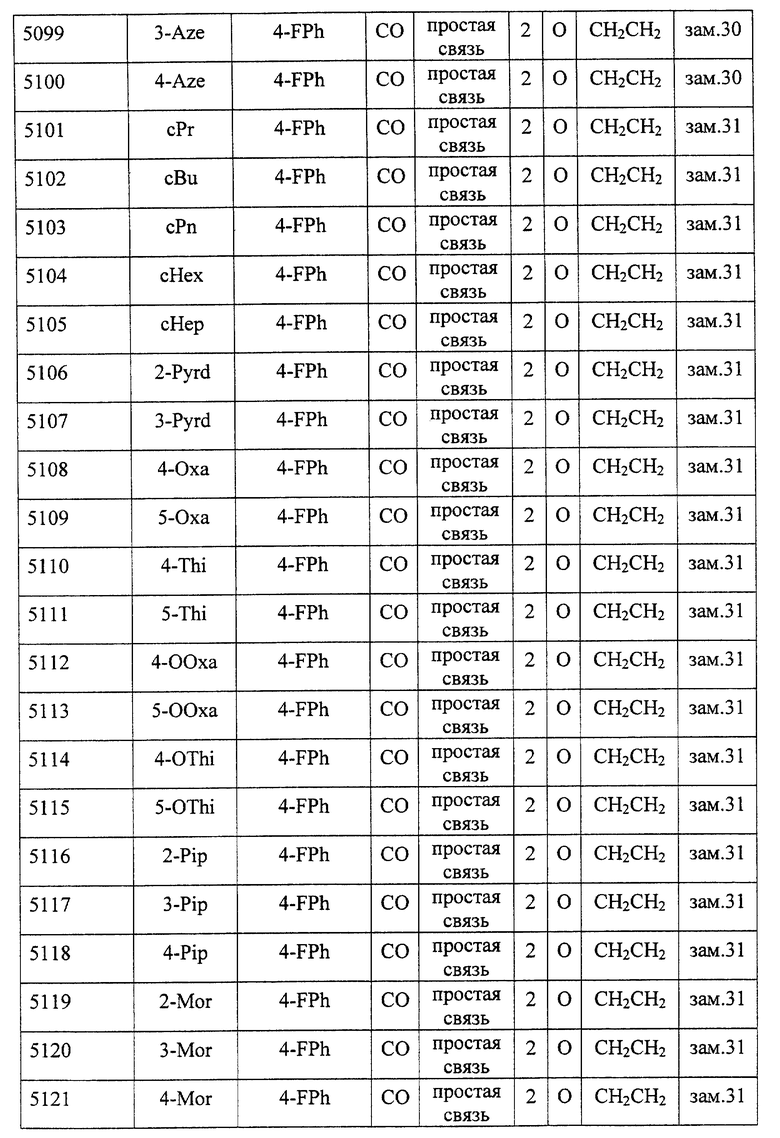
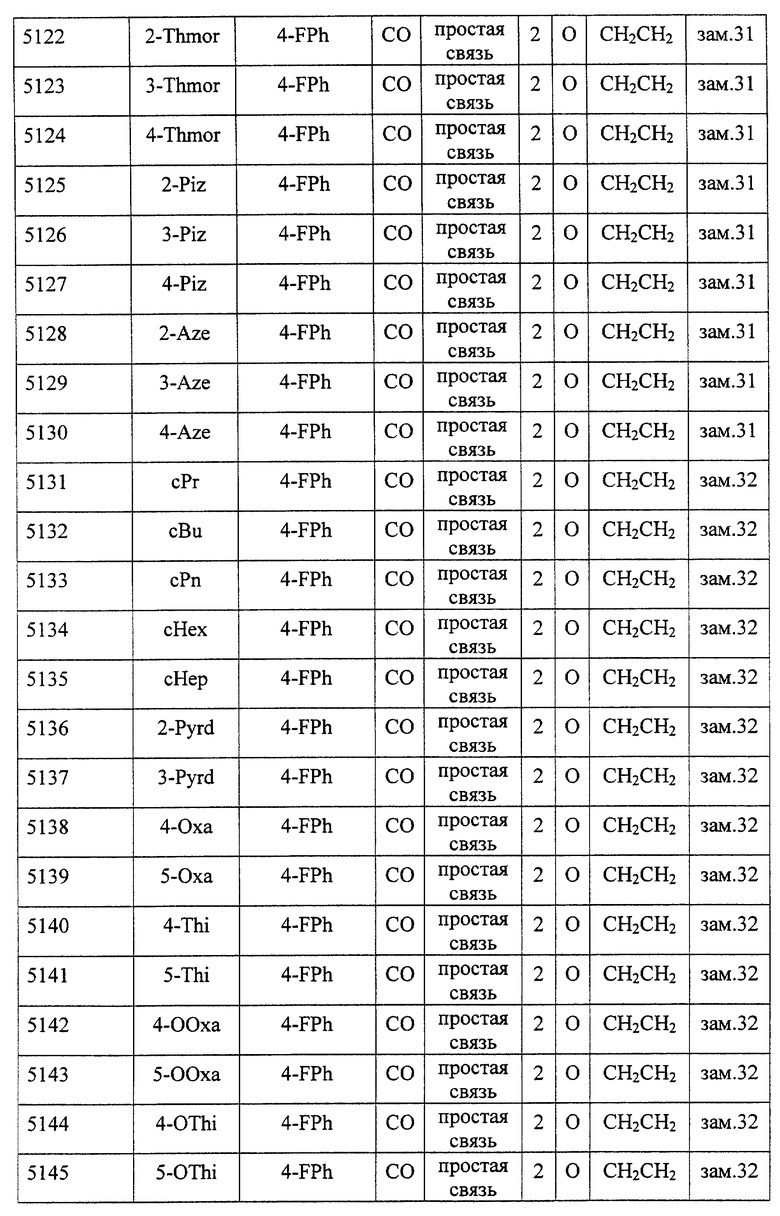





Изобретение относится к новым соединениям формулы (I), где R1 представляет (С3-С7)циклоалкильную группу или 3-7-членную насыщенную гетероциклическую группу, содержащую 1 или 2 гетероатома, выбранных из азота, кислорода или серы, которая может быть необязательно замещена оксогруппой; R2 - арильную группу, которая необязательно может быть замещена 1-3 атомами галогена; А - метиленовую или карбонильную группу; В - простую связь; D - атом кислорода или серы; G - (C1-С4)алкиленовую группу; L - группу формулы -C(R4)(R5)-, где R4 и R5 определены в формуле изобретения, Z - два атома водорода или атом кислорода, n = 0 или 1, или к его фармацевтически приемлемым солям, сложным эфирам, четвертичным аминам или гидратам. Также раскрыты лекарственное средство на основе указанных соединений, обладающее селективной антагонистической активностью против NK2-рецепторов, и способ профилактики или лечения заболеваний. Изобретение может быть использовано в медицине для лечения, например, болезней центральной нервной системы. 3 с. и 17 з.п. ф-лы, 3 табл.
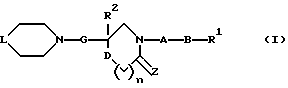
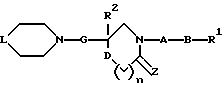
где R1 представляет собой (C3-C7)циклоалкильную группу или 3-7-членную насыщенную гетероциклическую группу, содержащую 1 или 2 гетероатома, выбранных из атомов азота, кислорода и серы, которая может быть необязательно замещена оксогруппой;
R2 - арильную группу, определенную далее, которая необязательно может быть замещена 1-3 атомами галогена;
А - метиленовую группу или карбонильную группу;
В - простую связь;
D - атом кислорода или атом серы;
G - (C1-C4)алкиленовую группу,
L - группу формулы -С(R4)(R5)-, где
R4 атом водорода, арильная группа, определенная далее, 5-8-членная гетероарильная группа, содержащая 1 или 2 гетероатома, выбранных из атомов азота, кислорода и серы, или (C3-C7)циклоалкильная группа, R5 - группа формулы -CO-R6 (где R6 представляет собой аминогруппу, которая необязательно может быть замещена 1 или 2 алкильными группами, содержащими 1 - 6 атомов углерода), или R4 и R5 вместе с атомом углерода, к которому они присоединены, образуют (C5-C8)циклоалкановое кольцо или 5-8-членное насыщенное гетероциклическое кольцо, содержащее 1 или 2 гетероатома, выбранных из атомов азота, кислорода или серы (каждый из указанных циклоалкановых или гетероциклических колец необязательно может быть замещено оксогруппой или гидроксигруппой, и указанные кольца могут быть также необязательно конденсированы с арильным кольцом, определенным далее);
Z - два атома водорода или атом кислорода;
n=0 или 1;
или его фармацевтически приемлемая соль, сложный эфир, четвертичный амин, амид или гидрат; арильные группы, указанные в определении заместителей R2, R4 и R5 представляет собой ароматические углеводородные группы.
1-{2-[(2R)-(3,4-дихлорфенил)-4-(циклопропанкарбонил)-морфолин-2-ил]этил} спиро[бензо[c]тиофен-1(3Н),4'-пиперидин]-(2S)-оксид,
1-{ 2-[(2R)-(3,4-дихлорфенил)-4-(циклобутанкарбонил)-морфолин-2-ил]этил} спиро[бензо[c]тиофен-1(3Н),4'-пиперидин]-(2S)-оксид,
1-{2-[(2R)-(3,4-дихлорфенил)-4-(циклопентанкарбонил)-морфолин-2-ил]этил} спиро[бензо[c]тиофен-1(3Н),4'-пиперидин]-(2S)-оксид,
1-{2-[(2R)-(3,4-дихлорфенил)-4-(циклогексанкарбонил)-морфолин-2-ил]этил} спиро[бензо[c]тиофен-1(3Н),4'-пиперидин]-(2S)-оксид,
1-{2-[(2R)-(3,4-дихлорфенил)-4-(циклопентанкарбонил)-морфолин-2-ил]этил} спиро[((2S)-гидрокси)индан-1,4'-пиперидин],
1-{2-[(2R)-(3,4-дихлорфенил)-4-(циклопропанкарбонил)-морфолин-2-ил]этил} -4-фенилпиперидин-4-карбоксамид и
1-{2-[(2R)-(3,4-дихлорфенил)-4-(циклопентанкарбонил)-морфолин-2-ил]этил} -4-(2-пиридил)пиперидин-4-карбоксамид.
| Способ получения производных 2,3-дигидро-1,4-бензоксазина в виде смеси изомеров или в виде индивидуальных изомеров или их фармацевтически приемлемых солей | 1989 |
|
SU1826968A3 |
| Оправка для крепления хонинговальной головки | 1978 |
|
SU776893A1 |
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
Авторы
Даты
2001-09-27—Публикация
1998-12-04—Подача