Изобретение относится к иммунологии и, в частности, к инактивированным вакцинам респираторно-синцитиального (RS) вируса.
Эта заявка является частичным продолжением находящейся в процессе одновременного рассмотрения United States Patent Application Serial N 08/102742, поданной 6 августа 1993 г.
Человеческий респираторно-синцитиальный вирус является основной причиной инфекций нижних дыхательных путей у младенцев и детей младшего возраста. В целом ежегодно наблюдаются 65 млн инфекций, приводящих к 160000 смертей. Только в США 100000 детей за один год могут требовать госпитализации из-за пневмонии и бронхиолита (капиллярного бронхита), вызываемых RS вирусом. Обеспечение стационарного и амбулаторного лечения для детей с RS вирусными инфекциями стоит в США ежегодно более 340 млн долларов. Серьезное заболевание нижних дыхательных путей, вызываемое инфекцией RS вируса, имеет место у младенцев 2-6 месяцев. Приблизительно 4000 младенцев умирают в США каждый год от осложнений, возникающих при тяжелом заболевании дыхательных путей, вызываемом инфекцией RS вирусом и вирусом парагриппа типа 3 (PIV-3). Всемирная организация здоровья (WHO) и Национальный институт аллергических и инфекционных заболеваний (NIAID) (vaccine advisory committees) поставили RS вирус на второе место после ВИЧ (HIV) по необходимости разработки вакцин против него.
RS вирус является членом семейства Paramyhoviridae рода Pneumovirus. Двумя основными защитными антигенами являются гликопротеин слияния (F) и гликопротеин присоединения (G) оболочки. F белок синтезируется в виде молекулы-предшественника 68 кДа (F0), который протеолитически расщепляется на связанные дисульфидными связями F1 (48 кДа) и F2 (20 кДа) полипептидные фрагменты. G белок (33 кДа) является сильно О-гликозилированным, что повышает среднюю молекулярную массу гликопротеина до 90 кДа. Были определены два обширных подтипа RS вируса: A и B. Основные антигенные различия между этими подтипами были обнаружены в G гликопротеине.
Надежной и эффективной вакцины RS вируса не существует и крайне необходима ее разработка. Подходы к разработке вакцин RS вируса включали инактивацию вируса формальдегидом, выделение адаптированных к холоду и/или чувствительных к температуре мутантных вирусов и выделение защитных антигенов этого вируса. Результаты клинических испытаний показали, что как живые ослабленные, так и инактивированные формалином вакцины не могли адекватно защищать вакцинированных больных против RS вирусной инфекции. Проблемы, возникающие при интраназальном введении адаптированных к холоду и/или чувствительных к температуре мутантов RS вируса, включают клиническую заболеваемость, генетическую нестабильность и избыточную аттенуацию. Живая вакцина RS вируса, вводимая подкожно, также не была эффективной. Инактивированные RS вирусные вакцины обычно готовили с применением формальдегида в качестве инактивирующего агента. Murphy et al. сообщили данные об иммунной ответной реакции у младенцев и детей, иммунизированных инактивированным формалином RS вирусом. Младенцы (2-6-месячного возраста) обнаружили высокий титр антител к F гликопротеину, но слабый иммунный ответ на G протеин. Младенцы 7-40 месяцев обнаружили титры F и G антител, сравнимые с титрами у детей, которые были инфицированы RS вирусом. Однако как младенцы, так и дети имели более низкий уровень нейтрализующих антител, чем индивидуумы сравнимого возраста с естественными RS вирусными инфекциями. Несбалансированный иммунный ответ с высокими титрами антител к основным иммуногенным белкам RS вируса F (слияния) и G (присоединения), но низким титром нейтрализующих антител может быть отчасти обусловлен изменениями важных эпитопов в гликопротеинах F и G в результате обработки формалином. Кроме того, некоторые младенцы, получившие инактивированную формалином RS вирусную вакцину, обнаружили более тяжелое заболевание нижних дыхательных путей после последующего контакта с природным RS вирусом, чем неиммунизированные индивидуумы. Поэтому инактивированные формалином RS вирусные вакцины считаются неприемлемыми для использования для человека.
Доказательство отклоняющегося от нормы иммунного ответа получено также на хлопковых хомяках, иммунизированных инактивированным формалином RS вирусом. Кроме того, оценка инактивированной формалином RS вирусной вакцины на хлопковых хомяках показала также, что при заражении живым вирусом иммунизированные животные развили усиленную легочную патологическую гистологию.
Механизм потенциирования заболевания, вызываемого препаратами инактивированной формалином RS вирусной вакцины, еще требует выяснения, но он является основным препятствием в разработке эффективной RS вирусной вакцины. Потенциирование болезни может быть частично обусловлено действием формалина на гликопротеины F и G. Кроме того, высказывалось предположение о неспецифическом для RS вируса механизме потенциирования болезни, согласно которому в обострении болезни частично может участвовать иммунологическая реакция на примесные клеточные или сывороточные компоненты, присутствующие в препарате вакцины. Действительно, мыши и хлопковые хомяки, вакцинированные лизатом Hep-2 клеток и зараженные RS вирусом, росшим на Hep-2 клетках, обнаружили повышенную легочную воспалительную ответную реакцию.
Кроме того, гликопротеины RS вируса, очищенные иммуноаффинной хроматографией с применением элюции при кислом pH, были иммуногенными и защитными, но также вызывали иммунопотенциирование в хлопковых хомяках.
Очевидно, что остается необходимость в иммуногенных препаратах, в том числе в вакцинах, которые не только эффективно защищают против заболеваний, вызываемых RS вирусом, но также не вызывают нежелательных побочных эффектов, таких как иммунопотенциирование. Также имеется необходимость в антигенах для диагностики инфекции RSV и иммуногенов для генерирования антител (в том числе моноклональных антител), специфически узнающих белки RSV, для использования, например, в диагностике заболевания, вызываемого RS вирусом.
Принятые в данной области подходы для разработки RSV вакцин суммированы в недавних обзорных статьях, из которых ни одна не предлагает разработку инактивированной RSV вакцины.
Краткое изложение существа изобретения.
Данное изобретение обеспечивает новый подход к получению таких антигенов и иммуногенов путем инактивации очищенного RS вируса.
В одном аспекте данного изобретения обеспечен способ получения иммуногенной композиции, способной вызывать специфический иммунный ответ на респираторно-синцитиальный (RS) вирус в иммунизированном этой композицией хозяине, в частности в человеке, причем способ предусматривает множество стадий. Сначала RS вирус выращивают на подходящей клеточной линии, и вирус собирают. Собранный вирус очищают при неденатурирующих условиях для получения очищенного вируса, практически не содержащего клеточных и сывороточных компонентов. Затем очищенный вирус инактивируют инактивирующим агентом, получая неинфекционный, неиммуностимулирующий и иммуногенный RS вирус. Затем этот RS вирус готовят в виде иммуногенной композиции.
Инактивирующим агентом может быть β-пропиолактон; неионный детергент, в том числе н-октил-α-D-глюкопиранозид и н-октил-β-D-глюкопиранозид; или аскорбиновая кислота.
Стадия очистки, проводимая на собранном вирусе, может выполняться посредством микрофильтрования для удаления клеточных остатков, тангенциальной проточной ультрaфильтрации для удаления сывороточных компонентов, в частности с применением отсекающей номинальную молекулярную массу приблизительно 100-300 кДа мембраны, осаждения ультрафильтрованного материала ультрацентрифугированием для дальнейшего удаления сывороточных компонентов и центрифугированием осажденного материала на градиенте плотности сахарозы. Альтернативно, удержанный при тангенциальной проточной ультрафильтрации материал может быть подвергнут гель-фильтрации с последующей ионообменной хроматографией для дальнейшего удаления сывороточных компонентов.
Этот способ обеспечивает новую иммуногенную композицию, способную вызывать специфический для RS вируса иммунный ответ в иммунизированном ею хозяине, которая является дальнейшим аспектом данного изобретения. Такая иммуногенная композиция содержит очищенный инактивированный RS вирус, по существу не содержащий клеточных и сывороточных компонентов и являющийся неинфекционным, неиммунопотенциирующим, иммуногенным и защитным, и его носитель. Эта иммуногенная композиция может быть приготовлена в виде вакцины для введения in vivo хозяину-человеку для защиты человека от заболевания, вызываемого RS вирусом. Носитель для иммуногенной композиции может содержать адъювант. Иммуногенная композиция может быть приготовлена в виде вакцины для введения в инъецируемой форме для интраназального или перорального введения.
Далее данное изобретение обеспечивает способ иммунизации хозяина, в частности человека, против заболевания, вызываемого RS вирусом, предусматривающий введение хозяину эффективного количества обеспечиваемой изобретением иммуногенной композиции. Хозяин, иммунизированный таким способом, может быть выбран из младенцев, детей младшего возраста, беременных женщин, женщин репродуктивного возраста, пожилых людей, индивидуумов с нарушенным иммунитетом и других восприимчивых лиц.
Обеспеченный данным изобретением инактивированный RS вирус можно также использовать в качестве диагностического реагента для обнаружения инфекции RS вирусом. Поэтому данное изобретение включает в себя способ определения присутствия антител, специфически реагирующих с белками RS вируса, в пробе, предусматривающий следующие стадии:
(a) контактирование пробы с иммуногенной композицией изобретения для образования комплексов, содержащих неинфекционный, неиммунопотенциирующий и иммуногенный RS вирус и антитела, присутствующие в пробе и специфически реагирующие с ним; и
(b) определение образования этих комплексов.
Кроме того, данное изобретение обеспечивает способ определения присутствия белков RS вируса в пробе, предусматривающий следующие стадии:
(a) иммунизация субъекта иммуногенной композицией изобретения для получения антител, специфических для белков вируса;
(b) контактирование пробы с этими антителами для получения комплексов, содержащих любой из белков RS вируса, присутствующих в пробе, и специфические для белков RS вируса антитела; и
(c) определение образования таких комплексов.
Далее данное изобретение обеспечивает диагностический набор для определения присутствия антител в пробе, специфически реагирующих с белками RS вируса, содержащий:
(a) иммуногенную композицию изобретения;
(b) средства для контактирования неинфекционного, неиммунопотенциирующего и иммуногенного RS вируса с пробой для образования комплексов, содержащих неинфекционный, неиммунопотенциирующий и иммуногенный RS вирус и любое из упомянутых антител, присутствующих в пробе; и
(с) средства для определения образования таких комплексов.
В связи с трудностями в получении препаратов RS вирусных вакцин в предшествующих исследованиях, удивительно, что описанные здесь способы обеспечивают иммуногенные композиции, обнаруживающие иммуногенность и защитную способность, оставаясь неинфекционными и неиммунопотенциирующими.
Подробное описание изобретения.
В одном аспекте данное изобретение касается получения инактивированного респираторно-синцитиального вируса при условиях, приемлемых для применения в вакцинах для человека. RS вирус, подтипы A и B выращивают в культуре ткани в контролируемых ферментерах на клеточной линии вакцинного качества, которая может быть, в частности, линией VERO клеток. После сбора вируса его очищают и затем инактивируют, получая инактивированную RS вирусную вакцину.
Рост клеток.
Клеточные линии вакцинного качества, такие как клетки почек Африканской зеленой мартышки (VERO), в основном выращивают на гранулах микроносителя (Cytodex-1). Такие гранулы подвергают набуханию в буферном растворе, таком как содержащий фосфат солевой раствор (PBS), pH приблизительно 6.9-8.2, без кальция и магния, в течение 2-4 ч при комнатной температуре с осторожным перемешиванием (30-50 об/мин). Промытые гранулы стерилизуют при 110-130oC в течение 30-60 мин и кондиционируют в клеточной культуральной среде, такой как CMRL 1969, во вращаемых колбах или небольших (2-10 л) или больших (20-2000 л) контролируемых ферментерах. Затем сосуд засевают (например, 0.5•105-2•105 клеток/мл) VERO клетками вакцинного качества в культуральной среде, такой как CMRL 1969, к которой добавляют фетальную телячью сыворотку (FBS).
Выращивание RS вируса.
Когда клетки становятся конфлюентными (то есть сливаются) на 80-90% (через 3-5 дней после засева) культуральный супернатант декантируют и клетки промывают один раз культуральной средой, такой как CMRL 1969. Затем клетки инфицируют RS вирусом в CMRL 1969 в отсутствие FBS. После поглощения вируса инфицированные клетки промывают в культуральной среде, и рост вируса наблюдают в течение 5-7 дней постинфекции.
Обработка и концентрирование вируса.
Собранный вирус затем очищают при неденатурирующих условиях для освобождения его от клеточных и сывороточных компонентов. Такую очистку можно выполнять любым подходящим способом. В одной из таких процедур супернатант RS вируса микрофильтруют (фильтры с размером пор 0.22-8 мкм) для удаления клеточных остатков. Затем ставшую прозрачной вирусную жидкость можно сконцентрировать тангенциальным проточным ультрафильтрованием с применением ультрафильтрационной мембраны с отсеканием молекулярной массы между 100 и 300 кДа для удаления сывороточных компонентов.
Концентрированный RS вирус подвергают дальнейшей очистке для использования в иммуногенных препаратах и в качестве антигенов. В одной процедуре концентрированный вирус можно осадить ультрацентрифугированием с выбрасыванием супернатанта, полученного при ультрацентрифугировании, для удаления оставшихся сывороточных компонентов. Осажденный вирус ресуспендируют в PBS или другой подходящей среде. Затем концентрированный вирус очищают ультрацентрифугированием в градиенте плотности сахарозы. Альтернативно, удерживаемый на стадии тангенциальной проточной ультрафильтрации материал можно подвергнуть гель-фильтрации с последующей ионообменной хроматографией для дальнейшего удаления сывороточных компонентов. Полученный RS вирусный материал может быть далее осажден ультрацентрифугированием. Осажденный очищенный RS вирус можно ресуспендировать в PBS и хранить при -70oC до использования.
Инактивация вируса.
Затем очищенный RS вирус инактивируют. Такую инактивацию выполняют при помощи материалов, обеспечивающих очищенный вирус в неинфекционной, неиммунопотенциирующей и иммуногенной форме. Инактивирующий агент, применяемый на этой стадии, в основном включает β-пропиолактон, аскорбиновую кислоту или неионогенный детергент. Такими неионогенными детергентами, которые можно применять на стадии инактивации, являются некоторые глюкопиранозиды, в том числе н-октил-α-D-глюкопиранозид и н-октил-β-D-глюкопиранозид.
Любое подходящее количество инактивирующего агента и любые желаемые условия реакции, согласующиеся с целью обеспечения неинфекционного, неиммунопотенциирующего и иммуногенного материала, могут быть применены.
Например, RS вирус можно инактивировать при помощи приблизительно 0.1%-ного раствора β-пропиолактона (BPL) в течение приблизительно 30-120 мин или аскорбиновой кислоты в течение приблизительно 24 ч при приблизительно 37oC с постоянным встряхиванием. Оставшийся BPL можно удалить из инактивированной пробы диализом против PBS с применением мембраны для 10000-20000 мол. м.
Исследования иммуногенности на хлопковых хомяках.
Очищенный и инактивированный RS вирусный материал, полученный этим способом, является иммуногенным и защищающим, оставаясь неинфекционным. Это определяли оценкой иммуногенности RS вирусных материалов в хлопковых хомяках, в том числе способности этих материалов защищать этих животных от заражения живым вирусом, как сообщается ниже. Обеспеченные здесь вакцинные препараты вызывали образование RS вирус-специфических нейтрализующих антител и защищали хлопковых хомяков от заражения живым вирусом.
Специалисту в данной области вполне очевидно, что различные варианты данного изобретения имеют много приложений в областях вакцинации, диагностики, лечения заболеваний, вызываемых респираторно-синцитиальным вирусом, и получении иммунологических реагентов. Неограничивающая дискуссия таких применений представлена далее ниже.
Приготовление и применение вакцины.
Иммуногенные композиции, пригодные для использования в качестве вакцин, могут быть приготовлены из инактивированного RSV, как описано здесь. Такая вакцина вызывает иммунную ответную реакцию в субъекте, которая продуцирует антитела против RSV. При заражении вакцинированного субъекта RSV эти антитела связываются с вирусом и инактивируют его.
Иммуногенные композиции, в том числе вакцины, могут быть приготовлены в виде инъецируемых препаратов, в виде жидких растворов или эмульсий. Инактивированный RSV можно смешать с фармацевтически приемлемыми наполнителями, которые совместимы с ними. Такие наполнители могут включать воду, солевой раствор, декстрозу, глицерин, этанол и их комбинации. Иммуногенные композиции и вакцины могут, кроме того, содержать вспомогательные вещества, такие как смачивающие или эмульгирующие агенты, регулирующие pH агенты, или адъюванты для увеличения их эффективности. Способы достижений адъювантного действия включают применение таких агентов, как гидроксид или фосфат алюминия (alum), обычно применяемых в виде 0.05-0.1%-ного раствора в забуференном фосфатом солевом растворе. Иммуногенные композиции и вакцины можно вводить парентерально, путем инъекции, подкожно или внутримышечно. Альтернативно иммуногенные композиции, приготовляемые согласно данному изобретению, могут изготовляться и доставляться таким образом, чтобы вызвать иммунный ответ на поверхностях слизистых оболочек. Так, иммуногенная композиция может быть введена к слизистой поверхности назальным или пероральным путем. Альтернативно могут быть желательны другие способы введения, в том числе посредством суппозиториев и пероральных препаратов. В случае суппозиториев связывающие вещества и носители могут включать, например, обычно применяемые наполнители, такие, например, как сахарин, целлюлоза и карбонат магния фармацевтической чистоты. Эти композиции могут иметь форму растворов, суспензий, таблеток, пилюль, капсул, препаратов пролонгированного действия или порошков и содержат приблизительно 1-95% инактивированного RSV данного изобретения. Иммуногенные препараты и вакцины вводят способом, совместимым с лекарственной формой, и в таком количестве, которое будет терапевтически эффективным, защищающим и иммуногенным. Вводимое количество зависит от подвергаемого лечению субъекта, в том числе, например, от способности иммунной системы индивидуума синтезировать антитела и, если необходимо, продуцировать клеткоопосредованный иммунный ответ. Точные количества активного ингредиента, которые должны быть введены, зависят от оценки практикующего врача. Однако необходимые пределы доз могут быть легко определены специалистом, квалифицированным в этой области. Подходящие схемы первоначального введения и доз для ревакцинации также варьируют, но могут включать первоначальную вакцинацию, за которой следуют последующие введения. Доза может также зависеть от пути введения и будет варьировать в соответствии с размерами хозяина.
Концентрация инактивированного RS вируса в иммуногенной композиции согласно изобретению равна, как правило, приблизительно 1-95%. Вакцина, содержащая антигенный материал только одного патогена, является моновалентной вакциной. Вакцины, содержащие антигенный материал нескольких патогенов, являются комбинированными вакцинами и также принадлежат к данному изобретению. Такие комбинированные вакцины содержат, например, материал из различных патогенов или из различных штаммов одного и того же патогена или из комбинаций различных патогенов.
Иммунотесты.
Инактивированные препараты RSV данного изобретения применимы в качестве иммуногенов для генерирования антител (в том числе моноклональных антител), специфически реактивных с белками RSV в качестве антигенов в иммуноанализах, в том числе в твердофазном иммуноферментном анализе (ELISA), радиоиммуноанализах (RIA) и других неферментных анализах связывания антител или процедурах, известных в данной области, для обнаружения бактериальных антител. В тестах ELISA инактивированный RSV иммобилизуют на выбранной поверхности, например на поверхности, способной связывать белки, такой как лунки микротитрационного планшета из полистирола. После промывания для удаления неполностью адсорбированного вируса неспецифический белок, такой как бычий сывороточный альбумин (BSA) в растворе, который, как известно, антигенно нейтрален в отношении тест-пробы, может быть связан с выбранной поверхностью. Это позволяет блокировать сайты неспецифической адсорбции на иммобилизирующей поверхности и, следовательно, снижать фон, обусловленный неспецифическим связыванием на этой поверхности.
Затем иммобилизирующую поверхность приводят в контакт с пробой, такой как клинические или биологические материалы, которая должна быть испытана способом, приводящим к образованию иммунного (антиген/антитело) комплекса. Способ может включать разбавление пробы разбавителями, такими как растворы BSA, бычьего гамма-глобулина (BGG) и/или содержащий фосфатный буфер солевой раствор (PBS/Tween). Затем пробу инкубируют в течение 2-4 ч при температурах порядка приблизительно 25-37oC. После инкубирования контактировавшую с пробой поверхность промывают для удаления не образующего иммунный комплекс материала. Процедура промывки может включать промывание таким раствором, как PBS/Tween, или боратным буфером. После образования специфических иммунокомплексов между тест-пробой и связанным инактивированным RSV и последующего промывания наличие и даже количество образования иммунокомплекса можно определить действием на иммунокомплекс вторым антителом, имеющим специфичность относительно первого антитела. Если тест-проба происходит из человека, вторым антителом является антитело, имеющее специфичность относительно человеческих иммуноглобулинов и обычно относительно IgG. Для целей детектирования второе антитело может иметь ассоциированную с ним активность, например, ферментную активность, которая будет генерировать, например, развитие окраски при инкубировании с подходящим хромогенным субстратом. Затем количественное определение может быть достигнуто измерением степени генерирования окраски при помощи, например, спектрофотометра для видимого света.
Примеры.
Выше изобретение было описано в общих чертах. Более полно оно поясняется со ссылкой на следующие далее характерные примеры. Эти примеры даны лишь для иллюстрации и не имеют в виду ограничение объема изобретения. Предполагаются изменения формы и замена элементов на эквиваленты, когда обстоятельства могут предполагать или увеличивать целесообразность. Хотя здесь были использованы специфические термины, они были использованы для целей описания, но не для целей ограничения изобретения.
Способы определения инфекционной дозы для культуры ткани (TCID50/мл), титров бляшек и нейтрализации, не описанные подробно в этом описании, достаточно часто сообщались в научной литературе и хорошо известны специалистам в данной области. Концентрацию белка определяли способом бицинхониновой кислоты (BCA), как описано в Pierce Manual (23220, 23225; Pierce Chemical Company, USA); включено здесь в виде ссылки.
Культуральная среда CMRL 1969 была использована для клеточной культуры и выращивания вируса. Клетки, применяемые в этом исследовании, представляют собой клетки почек Африканской зеленой мартышки вакцинного качества (VERO, 1ot М6), полученные из Institut Merieux. В качестве вируса использовали подтип A RS вируса (штаммы Long и A2), полученные из American Type Culture Collection (ATCC), и новые клинические изоляты подтипа A, названные Tracy и RSV-3-DIT. С каждым из RSV были получены сравнимые результаты в следующих примерах.
Пример I.
Этот пример иллюстрирует выращивание клеток почек Африканской зеленой мартышки (VERO, 1ot М6).
Клетки почек Африканской зеленой мартышки (VERO) выращивали на гранулах микроносителя (Cytodex-1, Pharmacia). Гранулы, применяемые при концентрации 2.5 г/л, набухали в содержащем фосфатный буфер солевом растворе (PBS), pH 8.0, в отсутствие кальция и магния в течение 3 ч при комнатной температуре при осторожном перемешивании (50 об/мин). После этого периода инкубации раствор PBS декантировали и гранулы промывали один раз 1.5 л PBS. Супернатант декантировали и объем PBS доводили до 2 л. Гранулы микроносителя стерилизовали при 121oC в течение 45 мин и кондиционировали в среде для культуры клеток CMRL 1969 в большом (40 л) ферментере. Культуральный сосуд засевали (105 клеток/мл) клетками VERO, М6 в культуральной среде CMRL 1969 с добавлением фетальной телячьей сыворотки (конечная концентрация 5%).
Пример II.
Этот пример иллюстрирует выращивание RS вируса в культуре ткани.
Как только клетки достигали конфлюентности примерно 90%, супернатант культуры декантировали и клетки промывали культуральной средой CMRL 1969. Эти клетки инфицировали RS вирусом при множественности заражения (moi) 0.001 в культуральной среде, не содержащей экзогенно добавленной FBS. Вирусу давали адсорбироваться клетками в течение 1 ч при 37oC при осторожном перемешивании. После периода адсорбции клетки промывали один раз CMRL 1969 и инкубировали со средой CMRL 1969. После 10 дней постинфекции собирали культуральную жидкость (сбор 1), обрабатывали, как описано в примере III, и хранили при -70oC в присутствии 20% сахарозы. Затем в ферментер добавляли CMRL 1969, и инфицированные вирусом клетки инкубировали в течение дополнительных 4 дней для сбора вируса (cбор II). Этот второй сбор вируса обрабатывали затем как описано в примере III. Титр инфекционного вируса, присутствующего в жидкостях, наблюдали при помощи анализа бляшкообразования.
Пример III.
Этот пример иллюстрирует обработку RS вируса.
Вирусную жидкость из инфицированных RS вирусом клеток VERO, собранную на 10-й и 14-й дни после инфекции (cбор I и cбор II) обрабатывали по отдельности. Каждый вирусный сбор микрофильтровали при помощи фильтра с размером пор 5 мкм (фильтрование до конца) для удаления клеточных остатков. Осветленный вирусный супернатант затем концентрировали тангенциальной проточной ультрафильтрацией (Sartorius) с применением мембраны, отсекающей молекулярную массу 100 кДа. Удерживаемый RS вирусный материал хранили при -70oC.
Пример IV.
Этот пример иллюстрирует концентрирование RS вируса ультрацентрифугированием.
Удерживаемый мембраной RS вирусный материал центрифугировали при 45000 об/мин с применением углового ротора 50.2 Ti Beckman в течение 2 ч при 4oC. Супернатант отбрасывали и осажденный вирус ресуспендировали в содержащем фосфатный буфер солевом растворе (PBS) pH 7.3.
Пример V.
Этот пример иллюстрирует очистку RS вируса центрифугированием в градиенте плотности сахарозы.
Далее ресуспендированный осажденный вирус очищали скоростным зонным центрифугированием (2 ч при 24000 об/мин, Beckman SW28 ротор) на линейных 10-60%-ных (масса/объем) сахарозных градиентах. Диффузную вирусную полосу, собранную из зоны 35-40%, разбавляли в PBS до конечной концентрации 10% сахарозы. Далее очищенный вирус концентрировали ультрацентрифугированием при 45000 об/мин в течение 90 мин в Beckman 50.2 Ti роторе. Супернатант выбрасывали. Осажденный вирус ресуспендировали в PBS до концентрации белка приблизительно 1 мг/мл и хранили при -70oC. Этот очищенный вирус анализировали электрофорезом в полиакриламидном геле и иммуноблоттингом с применением анти-RSV специфических антител и нашли, что он имеет чистоту не менее 60%, что позволяет его считать по существу не содержащим клеточных и сывороточных компонентов.
Пример VI.
Этот пример иллюстрирует очистку и концентрирование RS вируса гель-фильтрацией и хроматографией.
Удержанный материал (ретентат) вируса из RSV-3-DIT, полученный, как описано в примере III, очищали и концентрировали гель-фильтрацией и колоночной хроматографией следующим образом.
Вирусный ретентат из примера IV пропускали через гель-фильтрационную колонку (Sephacryl S-500), уравновешенную в 10 мМ фосфатном буфере, pH 7.3, содержащем 10 мМ хлорид натрия и 20%-ный глицерин, для удаления основного загрязнения, бычьего сывороточного альбумина (BSA). Далее вирус очищали и концентрировали на ионообменной колонке (DE-52, Whatman), уравновешенной в указанном выше буфере. Смолу промывали уравновешивающим буфером и затем пятью колоночными объемами буфера, содержащего 10 мМ фосфат натрия, pH 7.3, 100 мМ хлорид натрия и 20%-ный глицерин. На этой стадии элюировали невирусные компоненты, в основном BSA, все еще присутствующие в вирусной фракции, очищенной гель-фильтрацией. Вирус элюировали из колонки 50 мМ фосфатом натрия и 1.5 М хлоридом натрия.
Пример VII.
Этот пример иллюстрирует инактивацию вируса н-октил-β-D-глюкопиранозидом (OG).
RS вирус, полученный, как описано в примерах V и VI, инактивировали обработкой н-октил-β-глюкопиранозидом (1%, масса/объем) в течение 2 ч при комнатной температуре. Пробу вируса затем диализовали против забуференного фосфатом солевого раствора для удаления детергента из белковой смеси. Инфекционность инактивированного вируса тестировали анализом TCID50 и не обнаружили инфекционного вируса.
Пример VIII.
Этот пример иллюстрирует иммуногенность препарата, инактивированного н-октил-β-D-глюкопиранозидом (OG) RS вируса.
Шестинедельные хлопковые хомяки были инъецированы внутримышечно 30 мкг/кг адсорбированным фосфатом алюминия, инактивированным OG RS вирусом, полученным, как описано в примере VI, или посторонним антигеном (плацебо). Одну группу животных инокулировали интраназально приблизительно 100 инфекционными дозами (CRID50) для хлопковых хомяков живого RS вируса в 100 мкл. На 28-й день у всех животных извлекали пробы крови и всех, кроме получивших живой вирус, повторно вакцинировали той же самой дозой снабженного адъювантом антигена, которую применяли при первичной инокуляции. Пробы сыворотки брали также через неделю после бустерной дозы (35-й день). Определяли титры специфической нейтрализации RS вируса, которые представлены в таблице 1.
Как можно видеть из таблицы 1, данные первого кровоизвлечения (28-й день) показали, что инактивированный OG RS вирус вызывал сильную первичную иммунную реакцию. Сыворотки из животных, ревакцинированных при 4 неделях равноценной дозой снабженного адъювантом инактивированного OG вируса, имели титры нейтрализующих антител на 35-й день, которые были сравнимы с титрами, полученными в сыворотках животных, инокулированных живым вирусом. Представленные здесь данные показывают, что инактивированный OG RS вирус был высокоиммуногенным.
Пример IX.
Этот пример иллюстрирует способность инактивированного OG RS вируса индуцировать защитную реакцию в иммунизированных хлопковых хомяках без индуцирования повышенной легочной патологии.
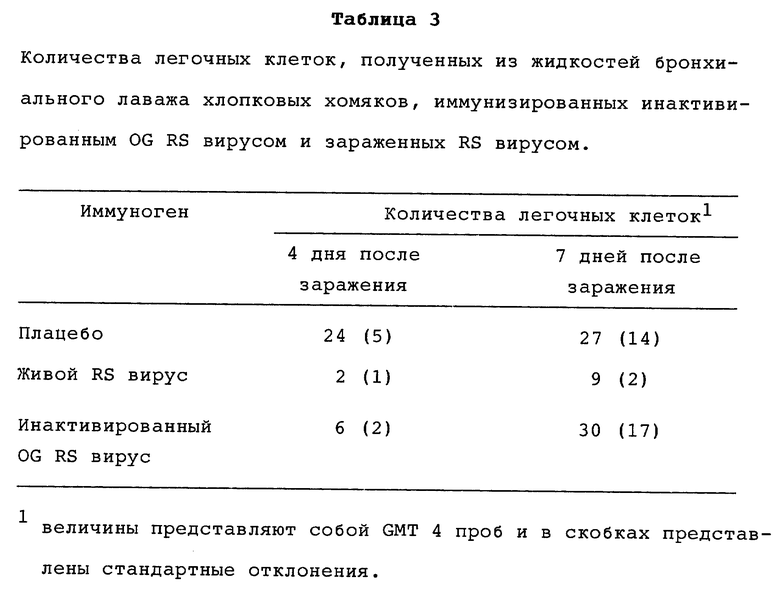
Для оценки защитной способности препарата инактивированного н-октил-β-D-глюкопиранозидом RS вируса хлопковых хомяков инокулировали либо живым RS вирусом, либо инъецировали двумя дозами по 30 мкг инактивированного RS вируса или постороннего антигена (плацебо), после чего заражали интраназально (через 7 дней после бустерной дозы) приблизительно 100 инфекционными для хлопковых хомяков дозами (CRID50) штамма A2 RS вируса, росшего в Hep-2 клетках. На 4-й день после вирусного заражения половину животных убивали. Их легкие удаляли, подвергали лаважу, и полученные жидкости оценивали как в отношении легочных титров вируса, так и в отношении количества лейкоцитов (как меры легочного воспаления). На 7-й день после вирусного заражения оставшихся животных умерщвляли, их легкие извлекали и оценивали на уровни вируса. Также определяли присутствие клеток легочно-бронхиального лаважа. Гистопатологию выполняли на срезах легких с применением гематоксилиновых и эозиновых красителей на парафиновых срезах.
Легочные титры RS вируса на 4-й день после заражения суммированы в таблице 2. Контрольные животные (плацебо), инъецированные препаратом постороннего белка, поддерживали репликацию 6.6 log10 TCID50 единиц вируса на грамм легочной ткани. В легких животных, иммунизированных инактивированным OG RS вирусом, вирус не обнаруживали. Эти результаты показывают защитную способность инактивированного OG RS вируса. Легочные титры RS вируса на 7-й день (данные не приведены) были минимальными во всех испытанных легких. Это не является неожиданным, т.к. RS вирус обычно выводится из легких спустя 7 дней после заражения.
Количества клеток легочного лаважа (таблица 3) животных, иммунизированных препаратом инактивированного OG RS вируса, были значительно более низкие, чем количества клеток из легких животных, инокулированных препаратом постороннего белка (плацебо). Кроме того, количества клеток на 7-й день инокулированных инактивированным OG RS вирусом животных незначительно отличались от количеств клеток контроля, получившего плацебо. Поскольку количества клеток легочного лаважа на 7-й день были лишь немного выше, чем количества в контроле (плацебо), можно сделать вывод, что препарат инактивированного OG RS вируса не вызывал усиления воспаления легких в иммунизированных животных после заражения живым вирусом.
Окрашенные гематоксилином и эозином срезы показали, что легкие животных, получивших препарат постороннего белка (плацебо), имели максимальные признаки инфекции и воспаления, тогда как легкие хлопковых хомяков, иммунизированных либо препаратом живого вируса, либо препаратом инактивированного OG RS вируса, имели минимальное проявление инфекции или воспаления. Эти результаты суммированы в таблице 3.
На основании этих результатов можно сделать вывод, что препарат инактивированного OG RS вируса может вызывать защитную иммунную ответную реакцию без обострения легочной патологии.
Пример X.
Этот пример иллюстрирует инактивирование RS вируса β-пропиолактоном (BPL).
Инактивирующий агент, β-пропиолактон (0.1%-ный (масса/объем) раствор в дистиллированной воде) стерилизовали фильтрованием через фильтр с размером пор 0.22 Am. Очищенный RS вирус, полученный, как описано в примере V, смешивали с инактивирующим агентом в отношении 1:1 (об./об.) и инкубировали в течение 2 ч при 37oC с непрерывным встряхиванием. Эту вирусную пробу затем диализовали в течение ночи при 4oC против PBS с применением отсекающей молекулярную массу 12000 мембраны для удаления остаточного BPL. Инфекционность обработанной вирусной пробы оценивали анализом бляшкообразования и не обнаружили инфекционного вируса. Диализованную пробу хранили при -70oC.
Пример XI.
Этот пример иллюстрирует иммуногенность и защищающую способность инактивированного β-пропиолактоном RS вируса и показывает, что он не вызывает повышенной легочной патологии.
Шестинедельных самок хлопковых хомяков инъецировали внутримышечно 10 мкг/кг инактивированного BPL RS вируса, адсорбированного на фосфате алюминия. Контрольные животные, получившие плацебо, были иммунизированы PBS плюс фосфат алюминия. Группу животных инокулировали инстиляцией в нос 100 CRID50 RS вируса. На 28-й день у животных извлекали кровь и всех животных, за исключением хлопковых хомяков, иммунизированных живым вирусом, ревакцинировали той же самой дозой препарата антигена. Пробы сывороток брали на 84-й день и определяли титры RS вирус-специфических нейтрализующих антител. Для оценки способности инактивированного RS вирусного препарата защищать животных от заражения живым вирусом хлопковых хомяков заражали интраназально приблизительно 100 CRID50 изолята RS вируса Tracy, собранного из легких хлопковых хомяков. Через 4 дня после заражения животных убивали, их легкие извлекали, подвергали лаважу и полученные жидкости оценивали в отношении легочных титров RS вируса.
Титры RS вирус-специфических нейтрализующих антител в сыворотках животных, иммунизированных инактивированным BPL RS вирусом, суммированы в таблице 4. Результаты из первого кровоизвлечения (28-й день) показали, что препарат инактивированного BPL RS вируса индуцировали хороший первичный иммунный ответ. Кроме того, сыворотки из животных, реиммунизированных при 4 неделях эквивалентной дозой инактивированного RS вируса, имели титры нейтрализующих антител, которые были сравнимы с титрами, полученными в животных, инокулированных живым вирусом.
Препарат инактивированного BPL RS вируса также был эффективен в защите хлопковых хомяков от заражения RS вирусом, как показали легочные титры RS вируса, приведенные в таблице 5. Так, животные, иммунизированные двумя дозами препарата BPL-инактивированного RS вируса, были защищены от заражения живым RS вирусом. Снижение легочных титров вируса было сравнимо со снижением, наблюдаемым в хлопковых хомяках, иммунизированных живым RS вирусом (0.6 log10/г легких).
Повышение легочной патологии для препарата, инактивированного β-пропиолактоном RSV определяли, как описано в примере IX.
Результаты, полученные в этих исследованиях, показывают, что инактивированный BPL RS вирус является высокоиммуногенным и защищающим.
Пример XII.
Этот пример описывает инактивацию RS вируса аскорбиновой кислотой.
Растворы (10 мг/мл) аскорбиновой кислоты и сульфата меди (0.5 мг/мл) стерилизовали фильтрованием через фильтр с размером пор 0.22 мкм. Вирус, очищенный, как описано в примере VI, смешивали с этими растворами, получая конечную концентрацию 1 мг/мл аскорбиновой кислоты и 50 мкг/мл сульфата меди (4 части вируса и 0.5 части каждого раствора), и смесь инкубировали при 37oC в течение 24 ч при качании.
Инфекционность обработанной вирусной пробы оценивали в анализе бляшкообразования и не обнаружили инфекционного вируса. Диализованную пробу хранили при -70oC.
Пример XIII.
Этот пример описывает иммуногенность и защитную способность инактивированного аскорбиновой кислотой RS вируса и показывает, что он не вызывает повышенной легочной патологии.
Хлопковых хомяков (5-8-недельного возраста) инъецировали внутримышечно 10 мкг/кг инактивированного аскорбиновой кислотой RSV (AAI-RSV) с добавленным в качестве адъюванта фосфатом алюминия или плацебо (алюм. плюс PBS). Другую группу животных инокулировали интраназально приблизительно 100 инфекционными для хлопковых хомяков дозами (CRID50) (в 100 мкл) живого RS вируса. На 28-й день у всех животных извлекали кровь и всех животных, кроме получавших живые вирусы, реиммунизировали той же самой дозой содержащего адъювант антигена, которую применяли при первичной инокуляции. Пробы сыворотки также брали через одну неделю после бустер-иммунизации (на 35-й день). Титры RS вирус-специфических нейтрализующих антител определяли и они представлены в таблице 6.
Результаты из первого взятия крови (28 дней), представленные в этой таблице 6, показывают, что препарат инактивированного аскорбиновой кислотой вируса индуцировал сильный первичный иммунный ответ. Кроме того, результаты, полученные после второй иммунизации, показывают, что сыворотки этих животных имели титры вирус-нейтрализующих антител, которые были сравнимы с титрами, полученными в сыворотках животных, инокулированных живым вирусом.
Пример XIV.
Этот пример иллюстрирует способность препарата инактивированного аскорбиновой кислотой RS вируса индуцировать защитную реакцию в иммунизированных хлопковых хомяках.
Хлопковых хомяков инокулировали живым RS вирусом или инъецировали двумя дозами по 10 мкг AAI-RSV или плацебо (PBS + алюм.) (контроль). Через 7 дней после бустер-иммунизации животных заражали приблизительно 100 CRID50 штамма A2 RS вируса, росшего на Hep-2 клетках. На 4-й день после вирусного заражения половину животных убивали. Их легкие извлекали, подвергали лаважу и полученные жидкости оценивали на легочные титры вируса. Гистопатологию оценивали как описано выше. Титры вируса в тканях легких контрольных (плацебо) животных были равны 4.0 log10 TCID50-единиц на грамм легочной ткани (таблица 7). Вирус не обнаружили в легких хлопковых хомяков, иммунизированных препаратом инактивированного аскорбиновой кислотой RS вируса. Эти результаты показывают защитную способность вакцинного препарата инактивированного аскорбиновой кислотой RS вируса (AAI-RSV) против RS вирусного заражения без усиления легочной патологии.
Титры RS вирус-специфических нейтрализующих антител в сыворотках животных, иммунизированных инактивированным аскорбиновой кислотой RS вирусом (AAI-RSV), суммированы в таблице 6. Результаты из первого кровоизвлечения (28-й день) показали, что препарат инактивированного аскорбиновой кислотой RS вируса вызывал хороший первичный иммунный ответ. Кроме того, сыворотки из животных, реиммунизированных при 4 неделях инактивированной вакциной, имели титры нейтрализующих антител, сравнимые с титрами, полученными у животных, инокулированных живым вирусом.
Препарат инактивированного аскорбиновой кислотой RS вируса был эффективен также в защите хлопковых хомяков от заражения RS вирусом, как показано легочными титрами RS вируса, приведенными в таблице 7. Так, животные, иммунизированные двумя дозами препарата инактивированного аскорбиновой кислотой RS вируса, были защищены от заражения живым RS вирусом. Снижение титров вируса в легких было сравнимо со снижением, наблюдаемым в хлопковых хомяках, иммунизированных живым вирусом, и вирус не обнаруживали.
На основании этих данных было сделано предположение, что препарат AAI-RSV может вызывать образование вирус-специфических нейтрализующих антител в сыворотках иммунизированных животных и защищать хлопковых хомяков от заражения живым вирусом.
Данное изобретение обеспечивает новую иммуногенную композицию, способную вызывать RS вирус-специфический иммунный ответ в иммунизированном этой композицией хозяине, содержащую очищенный инактивированный RS вирус, а также способы получения и использования этой композиции. В сфере действия изобретения возможны модификации.




Изобретение относится к медицине, а именно к иммунологии, и касается иммуногенной композиции, способной вызывать специфический для респираторно-синцитиального вируса человека иммунный ответ, которая может применяться в виде вакцины для введения хозяину-человеку. Сущность изобретения включает иммуногенную композицию, способную вызывать специфический для респираторно-синцитиального вируса человека иммунный ответ в иммунизированном ею хозяине, представляющую собой очищенный инактивированный RS вирус, который по существу не содержит клеточных и сывороточных компонентов и который является неинфекционным, неиммунопотенциирующим, иммуногенным и защищающим от инфекции. Вирус выращивают на клеточной линии вакцинного качества, и собранный вирус очищают при неденатурирующих условиях для освобождения от клеточных и сывороточных компонентов. Очищенный RS вирус инактивируют при помощи β-пропиолактона, неионного детергеита, н-октил-β-D-глюкопиранозида и н-октил-α-D-глю- копиранозида или аскорбиновой кислоты. Иммуногенная композиция может быть использована также в диагностических целях. Технический результат заключается в повышении иммуногенности. 4 с. и 11 з.п. ф-лы, 7 табл.
| Камерная сушильная часть бумагоделательной машины | 1934 |
|
SU43272A1 |
| US 5223254 A, 29.06.93 | |||
| Способ измерения температур движущихся деталей | 1971 |
|
SU567100A1 |
| Руководство по вакцинному и сывороточному делу | |||
| / Под ред | |||
| П.Н | |||
| Бургасова | |||
| - М.: Медицина, 1978, с.176-195 | |||
| Pauluzzi S | |||
| L' attuale problematica in tema di vaccinazion, Ann | |||
| Sclavo, 1979, v.21, N 6, 823-835. | |||
Авторы
Даты
1999-12-20—Публикация
1994-08-04—Подача