Изобретение относится к новым замещенным бензопиранонам, которые обладают антиатеросклеротическим и антитромботическим действием.
Атеросклероз у млекопитающих является болезнью, характеризующейся отложением атеросклеротической бляшки на артериальных стенках. В то время как атеросклероз проявляет много различных форм и последствий, типичные последствия атеросклеротических заболеваний включают грудную жабу, инфаркт миокарда, "удар" и временные нарушения мозгового кровообращения. Другие формы атеросклеротических заболеваний включают некоторое периферические васкулярные болезни и другие ишемии (например, кишечные и почечные).
Медицинская наука в настоящее время признает, что некоторые формы атеросклероза могут предотвращаться или быть обратимы. Вещества, способные предотвращать или делать обратимым атеросклероз, характеризуются как проявляющие антиатеросклеротическую активность. Поскольку сывороточные липиды имеют признанную связь с атерогенезом, важным классом антиатеросклеротических веществ являются те, которые имеют эффекты модификации сывороточных липидов. Сывороточные липиды, вовлеченные в атерогенез, включают сывороточный холестерин, сывороточные триглицериды и сывороточные липопротеины.
Что касается сывороточных липопротеинов, то по меньшей мере три различных класса этих веществ охарактеризованы в данной области техники: высокоплотные липопротеины (HDL), низкоплотные липопротеины (LDL) и липопротеины с очень высокой плотностью (VLDL). HDL очень часто упоминаются как альфалипопротеины, тогда как LDL и VLDL очень часто упоминаются как беталипопротеины. Повышение уровней HDL (гиперальфалипопротеиновая активность) обусловлено требованием прямых антиатеросклеротических воздействий. См. Eaton R. P. , J. Chron. Dis. 31:131-135 (1978). Наоборот, вещества, снижающие сывороточные LDL и VLDL (гипобеталипопротеиновые агенты), также ассоциируются с антиатеросклеротическими эффектами. См. Haust M.D. "Reaction Patterns of Intimal Mesenchyme to Injury and Repair in Atheros." Abv. Exp. Med. Biol. 43: 35-57 (1974), что постулирует, что сывороточный LDL является фактором образования атеросклеротического поражения.
Для оценки антиатеросклеротической активности разработаны многочисленные животные модели. Среди них основным являются модели для оценки гиполипопротеиновой активности на крысах и антиатеросклеротической активности на японской куропатке. Для описания работы модели гипобеталипопротеиновой крысы следует обратиться к известным методам Schurr P.E. et al., "High Volume Screening Procedure for Lypobetalipoproteinemia Activity in Rats", Adv. Exp. Med. Biol. 67: Atherosclerotic Drug Discovery, pp. 215 - 229, Plenum Press (1975). Для описания модели японской куропатки следует обратиться к Day C.E. et al. , "Utility of a Selected Line (SEA) of the Japanese Quail (Corturnic Corturnix japonica) for the Discovery of New Anti-Atherocslerosis Drugs", Labor. Animal Science 27: 817-821 (1977).
2-Аминохромоны (4H-1-бензопиран-4-оны) известны в литературе. Например, противоаллергическая активность 2-аминохромонов описана в литературе Mazzei, Balbi, Ermili, Sottofattori and Roma (Mazzei M., Ballbi A., Ermili A., Sottofattori E. and Roma G. Farmaco, Ed. Sci., (1985) 40, 895, и Mazzei M., Ermili A. , Balbi A., Di Braccio M., Farmaco Ed. Sci., (1986), 41, 611; CA 106: 18313 w). Также описана CNS-активность 2-аминохромонов (Balbi A., Roma G., Ermili A., Farmaco. Ed. Sci., (1982) 37, 582; Ermili, Mazzei M., Roma G. , Cacciatore, Farmaco. Ed. Sci. , (1977) 32, 375 и 713). Недавно описаны нитропроизводные различных 2-аминохромонов (Balbi, Roma G., Mazzei M., Ermili A. , Farmaco. Ed. Sci., (1983) 38, 784) и Farmaco. Ed. Sci. 41(7), 548 - 557). 2-Амино-3-гидроксихромоны описаны в патенте ФРГ 2205913 и патенте Великобритания 1389186.
Патент США 4092416 (см. также патент ФРГ 2555290 и CA 87:102383 r) раскрывает различные производные бензопирона, проявляющие противоаллергическую активность, включая 2{ 2-[4-(2-метоксифенил)пиперазинил-1-]-этил}-5-метокси-4-оксо-4H-1- бензопиран и 2-{2-[4-(2-метоксифенил)пиперазинил-1-]-этил} -5- (2-гидрокипропокси)-4-оксо-4H-1-бензопиран.
Заявка на патент Японии 025657 и патент Японии 259603 раскрывают различные 2-амино-3-карбоксамидпроизводные и 3-фенил (по выбору замещенный)-2-аминохромонпроизводные в качестве пригодных онкостатических и иммуносупрессивных агентов.
Фармакомодуляция α-адренергических блокирующих агентов ряда бензопиранов, включая 2-(1-пиперидинилметилен)-4H-1-бензопиран-4-он, описана в Eur. J. Med. Chem., 1987, 22(6), 539-44; CA 109: 92718k.
Полагают, что структурно близкими в литературе к 2-(4-морфолинил)-4H-1-бензопиран-4-ону (соед. 2) являются аналоги 3-гидрокси, 3-метокси и 3-ацетилокси (т. е. 2-(4-морфолинил)-3-гидроксихромон, 2-(4-морфолинил)-3-метоксихромон и 3-(ацетилокси)-2-(4-морфолинил)хромон), приведенные Eiden F. и Dolcher D. (Eiden F., Dolcher D., Arch. Pharm. (Weinheim Ger.) (1975) 308, 385) и в патенте ФРГ 2205913; а также в CA 83(11): 96942w и 79(9): 115440s 6,7-Диметокси-2-(4-морфолинил)хромон раскрывается в J. Chem. Soc., Perkins Trans. l, (2), 173-3; CA 78(9): 58275v. 3-Ацетил-2-(4-морфолинил)хромон раскрывается в Arch. Pharm. 316(1), 34 - 42; CA 98(15): 12915g.
3-Гидрокси-2-[4-(2-гидроксиэтил)-1-пиперазинил] -4H-1-бензопиран -4-он и 3-гидрокси-2-(4-метил-1-пиперазинил)-4H-1-бензопиран-4- он раскрывается в Arch. Pharm. 308(5), 385 - 388; CA 83(11): 96942w. 5,8-Диметокси-2-(4-метил-1-пиперазинил)-4H-1-бензопиран-4-он раскрывается в J. Heterocycl. Chem. 18(4), 679-84; CA 95(17): 150348v.
Синтез 2-аминохромонов из соответствующих аналогов 2-сульфонила и 2-сульфинила изложен Bantick и Suschitzky (Bantick J.R., Suschitzky J.L., J. Heterocyclic Chem., (1981) 18, 679). В данной работе также раскрывается получение солей HCl и H2SO4 нескольких 2-аминохромонов.
Антитромбоцитарная активность некоторых 2-(диалкиламино)хромонов, а именно: 2-(диэтиламино)-5,6-диметил-4H-1- бензопиран-4-она, 2-(диэтиламино)-6,7-диметил-4H-1-бензопиран-4-она, 2-(диэтиламино)-7-гидрокси-5-метил-4H-1-бензопиран-4-она, 2-(диэтиламино)-5-гидрокси-7-метил-4H-1-бензопиран-4-она, 2-(диэтиламино)-6-хлоро-8-изопропил-4H-1-бензопиран-4-она, 2-(диэтиламино)-5,7-метокси-4H-1-бензопиран-4-она, 2-(этиламино)-5- гидрокси-4H-1-бензопиран-4-она, 2-(этиламино)-7-гидрокси-4H-1-бензопиран-4-она, 2-(диэтиламино)-7-гидрокси-6-нитро-4H-1-бензопиран-4-она, 2-(диэтиламино)-4H-1-бензопиран-4-она, 2-(диэтиламино)-7-метокси-4H-1-бензопиран-4-она, 2-(диэтиламино)-7-метокси-4H-1-бензопиран-4-она, 2-(диэтиламино)-7-метокси-4H-1-бензопиран-4-она, 2-(1-пирролидинил)-7-метокси-4H-1-бензопиран-4-она, 2-(1-пиперидинил)-7-метокси-4H-1-бензопиран-4-она, 2-(диэтиламино)-7-гидрокси-4H-1-бензопиран-4-она, 2-(1-пиперидинил)-7-гидрокси-4H-1-бензопиран-4-она, 2-(этиламино)-7-метокси-4H-1-бензопиран-4-она, 2-(диэламино)-5-гидрокси-4H-1-бензопиран-4-она, 2-(диэтиламино)-5-метил-8-изопропил-4H-1-бензопиран-4-она и 2-(диэтиламино)-3-(4-морфолинометил)-7-метокси-4H-1-бензопиран-4-она, приводится Mazzei et al., in Eur. J. Med. Chem. 23, 237 - 242 (май - июнь 1988); CA 110: 75246h.
Использование инамина в синтезе 2-аминохромонов приведено Tronchet, Bachler и Bonenfant (Tronchet J.M.J., Bachler B., Bonenfant A., Helv. Chim. Acta (1976), 59, 941). В данной работе получают 2-амино-3-гликозилхромон.
В литературе также известны 2-амино-1,3-бензоксазин-4-оны. Конкретно 2-морфолинил-4H-1,3-бензоксазин-4-он (соед. 98) и 8-метил-2-(4- морфолинил)-4H-1,3-бензоксазин-4-он (соед. 84) раскрываются в заявке на патент Нидерландов 6412966 (см. также патент США 3,491,092) и в литературе (Grigat E., Putter R., Schneider K., Wedemeyer K., Chem. Ber., (1964) 97, 3036).
Фунгицидная и аналгетическая активность 2-амино-1,3-бензоксазин-4-онов также заявлена Sankyo в Japn. Tokyo Koho 79 20504 (CA 91: 157755b) и в Japan (Kokai 72, 17, 781 (CA 77: 140107e).Т Эти патенты охватывают 2-(4-морфолинил)-4H-1,3-бензоксазин-4-оны (соед. 98) и 6,7-замещенные-2-(4-морфолинил)-аналоги для вышеприведенных соединений.
Синтез 2-диалкиламино-1,3-бензоксазин-4-онов описан Kokel et al., (см. Tet. Letters (1984) 3837).
2-N-Алкил и 2-N-арил-1,3-бензоксазин-4-оны описаны Pallazo и Giannola (Pallazo S. , Giannola L.I. Atti., Accad. Sci. Lett. Arti Palermo, Parte 1, (1976) 34(2), 83-87).
2-Бензамидино-1,3-бензоксазин -4-он описан Brunetti H. и Luthi C.E. (в Helv. Chim. Acta (1972) 55, 1566).
Настоящее изобретение касается новых замещенных бензопиранонов формулы I, которые являются пригодными в соединении с фармацевтическим носителем в качестве антиатеросклеротических веществ. Кроме того, различные соединения формулы I являются пригодными ингибиторами пролиферации клеток и/или агрегации тромбоцитов.
Замещенные бензопираноны представляют собой соединения формулы I
где
X означает CZ, где Z представляет собой H, C1-C5-алкил, аминогруппу или атом галогена;
Y выбран из группы, состоящей из -(CH2)nNR9R10, где R9 и R10 одинаковые или различные, выбираются из групп, состоящих из
(a) атом водорода, при условии, что R9 и R10 оба вместе не являются атомами водорода;
(b) C1 - C12 алкил;
(c) фенил, необязательно замещенный одним, двумя или тремя остатками C1 - C4-аклкила, C1 - C4-алкоксила, галогена, группой OH, трифторметильной или -CO2(C1-C4-алкил);
(d) (CH2)n-фенил [где фенил, необязательно замещен одним, двумя или тремя остатками C1-C4-алкила, C1-C4-аклкоксила, галогена, группой OH, трифторметильной или -CO2(C1-C4-алкильной)];
(e) -(CH2)n-пиридинил; или
(f) где R9 и R10, взятые вместе с N, образуют насыщенное или ненасыщенное гетероциклическое аминовое кольцо, выбранное из группы, состоящей из
(aa) 4-морфолина, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1 - C4-алкила, C1-C4-алкоксила, галогена или трифторметила,
(bb) 4-тиоморфолина, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1 - C4-алкила, C1-C4-алкоксила, галогена или трифторметила,
(cc) 3-амино-1-пирролидина,
(dd) 1-пирролидин, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из C1 - C4-алкила, C1-C4-алкоксила, галогена, OH, CH2OH или трифтометила,
(ee) 1-пиперидин, необязательно замещенный одним или двумя заместителями, выбранными из группы, содержащей C1 - C4-алкил, C1-C4-алкоксил, галоген, трифторметил, -(CH2)qOH, -COOH, -CO2CH3-, CO2CH2CH3 или фенил (где фенил необязательно замещен одним, 2 или 3 C1-C4-алкилом, C1-C4-алкоксилом, галогеном или трифторметилом),
(ff) 1-пиперазин, 4-метил-1-пиперазин, 4-фенил-1-пиперазин (где фенил может быть необязательно замещен одним, 2 или 3 C1 - C4-алкилом, C1-C4-алкоксилом, галогеном или трифторметилом) или 4-пиридинил-1-пиперазин, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из C1 - C4-алкила, C1 - C4-алкоксила, галогена, трифторметила, -COOH, CH2OH, -CO2CH3 или -CO2CH2CH3, и
(gg) тиазолидин, тиазолидин-4-карбоновая кислота, пипеколиновая кислота, п-пиперазинацетофенон, 1-гомопиперазин, 1-метилгомопиперазин, 4-фенил-1,2,3,6-тетрагидропиридин, пролин, тетрагидрофуриламин, 1-(3-гидрокси)пирролидин, нипекотамид, 1,2,3,4-тетрагидроизохинолин или имидазол;
R5, R6, R7 и R8 - одинаковые или различные, выбраны из группы, состоящей из атома водорода, C1-C8-алкила, -(CH2)nфенила [где фенил может быть необязательно замещен одним, двумя или тремя C1-C4-алкилом, C1-C4-алкоксилом, галогеном, OH, трифторметилом или -CO2(C1-C4-алкилом)], -(CH2)n-нафтила, -(CH2)n-пиридила-, -(CH2)qNR9R10, -CH=CH-фенила [где фенил необязательно замещен одним, двумя или тремя C1-C4-алкилом, C1-C4-алкоксилом, галогеном, OH, трифторметилом или -CO2(C1 - C4-алкилом)], -CH2-CH=CH2, -CH=CH-CH3, -O-CH2-CH=CH2, -C ≡ C-фенила [где фенил может быть необязательно замещен одним, двумя или тремя C1 - C4-алкилом, C1 - C4-алкоксилом, галогеном, OH, трифторметилом или -CO2(C1 - C4-алкилом)], -O(CH2)p(N-метилпиперидин-3-ила), -O-(CH2)pNR9R10, -O-CH2CH(OCH3)2, -O-(CH2)pOR15, -(CH2)nC(O)-(CH2)nR9,
-(CH2)nC(O)O-(CH2)pR9, -(CH2)nC(O)O-(CH2)pNR9R10, (CH2)nC(O)(CH2)nNR9R10, NO2, -O-(CH2)nC(O)-(CH2)pR9, -O-(CH2)nC(O)O-(CH2)pR9, -O-(CH2)nC(O)-(CH2)nNR9R10, -NR9R10-, N(R9)(CH2)nC(O)-(CH2)nR10, -N(R9)-(CH2)nC(O)O-(CH2)nR10, N(R9(CH2)nC(O)-(CH2)nR9R10, -O-(CH2)n-фенила [где фенил необязательно замещен одним, двумя или тремя C1 - C4-алкилом, C1 - C4-алкоксилом, галогеном, OH, трифторметилом или -CO2(C1 - C4-алкилом)], -O-(CH2)n-пиридина, -O-(CH2)nC(O)-(CH2)n-пиридина, -O-(CH2)nC(O)O-(CH2)n-пиридина, -O-(CH2)nC(O)-N(R9)(CH2)n-пиридина, -O(CH2)n-хиноксалинила, -O-(CH2)n-хинолинила, -O-(CH2)n-пиразинила, -O-(CH2)n-нафтила, -O-(CH2)n-C(O)-(CH2)n-нафтила, -O-(CH2)n-C(O)O-(CH2)n-нафтила, -O-(CH2)n-C(O)NR9-(CH2)n-нафтила, галогена (фтор, хлор, бром, иод), OH, (CH2)q-OH, -(CH2)qOC(O)R9, -(CH2)qOC(O)-NR9R10, -(1-циклогексил-1H-тетразол-5-ил)-C1 - C4-алкоксила, -[1-(C1 - C5-алкил)-1H-тетразол-5-ил]-C1- C4-алкоксила, -[1-(фенил)-1H-тетразол-5-ил]C1-C4-алкоксила [где фенил необязательно замещен одним, двумя или тремя C1-C4-алкилом, C1-C4-алкоксилом, галогеном, OH, трифторметилом или -CO2(C1-C4-алкилом)], -[1-(пиридинил)-1H-тетразол-4-ил] -C1-C4-алкоксила, -[1-(1-фенилэтил)-1H-тетразол-5-ил] -C1-C4-алкоксила, -C1-C4-алкоксила, группа формулы II
где
R' - метил или карбоксил;
R'' - водород;
R''' выбран из бензила [необязательно замещенного одной, двумя или тремя группами, выбранными из гидрокси, галогена или фенокси (необязательно замещенной одной, двумя или тремя группами, выбранными из гидроксильной или галогена)],
C1-C5-алкила, -(CH2)nCOOH, -CH2SH, -CH2SCH3, имидазолинилметилена, идолинилметилена, CH3CH(OH), CH2OH, H2N(CH2)4- (необязательно в защищенном виде), или H2NC(NH)NH(CH2)3 (необязательно в защищенном виде); при условии, что, когда R5, R6 и R8 выбраны из H, C1-C8-алкила или галогена, а Z означает H или C1-C5-алкил, тогда R7 отличен от -O-(CH2)nC(O)O-(CH2)pR9 или -O-(CH2)nC(O)-NR9R10, где n имеет значение, отличное от 0, а R9 и R10 выбраны из H или C1-C12-алкил; при общем условии, что, когда Y отличен от (CH2)nморфолинила, по меньшей мере один из заместителей R5, R6, R7 или R8 отличен от атома водорода, C1-C8-алкила, NO2, OH, C1- C4-алкокси, атома галогена, фенила, бензила, 4-морфолинилметила, NH2 или диметиламиногруппы, и еще при условии, что когда Y равен 4-морфолинилу, в соединения формулы I не входят:
6,7-диметокси-2-(4-морфолинил)4H-1-бензопиран-4-он;
7,8-(бис)-(3-трифторметил)фенилметокси-2-(4-морфолинил)-4H-1- бензопиран-4-он;
N-циклогексил-2-[[8-метил-2-(4-морфолинил)-4-оксо-4H-1-бензопиран- 7-ил] окси]-ацетамид;
2-[[8-метил-2-(4-морфолинил)-4-оксо-4H-1-бензопиран-7-ил]окси]- N-фенилацетамид;
6-[(1-циклогексил-1H-тетразол-5-ил)метокси] -2-(4-морфолинил)-4H- 1-бензопиран-4-он;
2-[[8-метил-2-(4-морфолинил)-4-оксо-4H-1-бензопиран-7-ил] окси] -N- (1-фенилэтил)-ацетамид;
при дополнительном условии, что, когда Y означает диметиламино, в соединения не входят:
диметиловый эфир 2-(диметиламино)-8-метил-4-оксо-4H-1-бензопиран-7- илкарбаминовой кислоты;
диметиловый эфир 2-(диметиламино)-4-оксо-4H-1-бензопиран-6- илкарбаминовой кислоты;
диметиловый эфир 2-(диметиламино)-4-оксо-4H-1-бензопиран-7- илкарбаминовой кислоты;
метиловый эфир [[8-метил-2-(4-морфолинил)-4-окси-4H-1-бензопиран-7- илкарбаминовой кислоты;
диметиловый эфир (диметиламино)-4-оксо-4H-1-бензопиран-6- илкарбаминовой кислоты;
диметиловый эфир 2-(диметиламино)-4-оксо-4H-1-бензопиран-7- илкарбаминовой кислоты;
метиловый эфир [[8-метил-2-(4-морфолинил)-4-окси-4H-1-бензопиран-7- ил] окси]уксусной кислоты;
литиевая соль [(8-метил-2-(4-морфолинил)-4-окси-4H-1-бензопиран-7- ил] оксиуксусной кислоты;
R15 выбран из групп: C1-C5-алкил, (CH2)n-фенил [где фенил необязательно замещен одним, двумя или тремя C1-C4-алкилом, C1-C4-алкоксилом, галогеном, OH, трифторметилом или -CO2(C1-C4)-алкилом)] , -(CH2)n-пиридин-1-ил или (CH2)p-пиперидин-1-ил;
n = 0-5;
p = 2-5;
q = 1-5;
и их фармацевтически приемлемые соли и гидраты;
X предпочтительно обозначает CZ, где Z обозначает H или C1-C5-алкил, более предпочтительно H или метил, наиболее предпочтительно H.
Когда X обозначает CZ, Y предпочтительно выбирают из группы, состоящей из (CH2)nNR9R10, где R9 и R10, взятые вместе с N, образуют насыщенное или ненасыщенное гетероциклическое аминовое кольцо, выбранное из группы, состоящей из:
(aa) 4-морфолина, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-C4-алкила, C1-C4-алкоксила, галогена или трифторметила,
(bb) 4-тиоморфолина, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-C4-алкила, C1-C4-алкоксила, галогена или трифторметила,
(cc) 3-амино-1-пирролидина,
(dd) 1-пирролидина, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-C4-алкила, C1-C4-алкоксила, галогена, OH, CH2OH или трифтометила,
(ee) 1-пиперидина, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-C4-алкила, C1-C4-алкоксила, галогена, трифторметила, -(CH2)qOH, -CO2H, -CO2CH3-, CO2CH2CH3 или фенила (где фенил необязательно замещен одним, двумя или тремя заместителями из C1-C4-алкила, C1-C4-алкоксила, галогена или трифторметила), и
(ff) 1-пиперазина, 4-метил-1-пиперазина, 4-фенил-1-пиперазина (где фенил необязательно замещен одним, двумя или тремя заместителями из C1-C4-алкила, C1-C4-алкоксила, галогена или трифторметила) или 4-пиридинил-1-пиперазина, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C1-C4-алкила, C1-C4-алкоксила, галогена, трифторметила, CH2OH, -CO2H, -CO2CH3 или -CO2CH2CH3,
Когда X обозначает CZ, где Z обозначает H или C1-C5-алкил (наиболее предпочтительно H), Y более предпочтительно выбирают из группы, состоящей из (CH2)nNR9R10, где n равно 0 или 1 (наиболее предпочтительно 1), и R9 и R10, взятые вместе с N, образуют:
(aa) морфолин (предпочтительно 4-морфолин), необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из C1-C4-алкила или фенила (где фенил по выбору замещен одним или двумя членами из C1-C4-алкила, C1-C4-алкоксила, галогена или трифторметила); и предпочтительно по крайней мере один заместитель, выбранный из R5, R6, R7 или R8, выбирают из группы, состоящей из -(CH2)p-фенила [где фенил необязательно замещен одним, двумя или тремя заместителями из C1-C4-алкила, C1-C4-алкоксила, галогена, OH, трифторметила или -CO2(C1-C4-алкила)], -(CH2)n-нафтила, -(CH2)n-пиридила-, -(CH2)qNR9R10, -CH= CH-фенила [где фенил необязательно замещен одним, двумя или тремя заместителями из C1-C4-алкила, C1-C4-алкоксила, галогена, OH, трифторметила или -CO2(C1-C4-алкила)], -CH2-CH= CH2, -CH= CH-CH3, -O-CH2-CH=CH2, -C ≡ C-фенила [где фенил необязательно замещен одним, двумя или тремя заместителями из C1-C4-алкила, C1-C4-алкоксила, галогена, OH, трифторметила или -CO2(C1 - C4-алкила)], -O(CH2)p(N-метилпиперидин-3-ила), -O-(CH2)pNR9R10, -O-CH2CH(OCH3)2, -O-(CH2)pOR15 [где R15 выбирают из C1-C5алкила, -((CH2)n-фенила [фенила, необязательно замещенного одним, двумя или тремя членами из C1-C4-алкила, C1-C4-алкоксила, галогена, OH, трифторметила или -CO2(C1-C4-алкила)], -(CH2)n-пиридин-1-ила или (CH2)p-пиперидин-1-ила, -(CH2)nC(O)-(CH2)nR9,
-(CH2)nC(O)O-(CH2)pR9, -(CH2)nC(O)O-(CH2)pNR9R10, (CH2)nC(O)(CH2)nNR9R10,
-O-(CH2)nC(O)-(CH2)pR9, -O-(CH2)nC(O)O-(CH2)pR9, -O-(CH2)nC(O)-(CH2)nNR9R10, -NR9R10-, N(R9)(CH2)nC(O)-(CH2)nR10, -N(R9)-(CH2)nC(O)O-(CH2)nR10, N(R9(CH2)nC(O)-(CH2)nR9R10, -O-(CH2)n-фенила [где фенил необязательно замещен одним, двумя или тремя C1-C4-алкилом, C1-C4-алкоксилом, галогеном, OH, трифторметилом или -CO2(C1-C4-алкилом)], -O-(CH2)n-пиридина, -O-(CH2)nC(O)-(CH2)n-пиридина, -O-(CH2)nC(O)-(CH)n-пиридина, -O-(CH2)nC(O)O-(CH2)n-пиридина, -O-(CH2)nC(O)-N(R9)(CH2)n-пиридина, -O(CH2)n-хиноксалинила, -O-(CH2)n-хинолинила, -O-(CH2)n-пиразинила, -O-(CH2)n-нафтила, -O-(CH2)n-C(O)-(CH2)n-нафтила, -O-(CH2)n-C(O)O-(CH2)n-нафтила, -O-(CH2)n-C(O)NR9-(CH2)n-нафтила, -(CH2)q-OH, -(CH2)qOC(O)R9, -(CH2)qOC(O)-NR9R10, -(1-циклогексил-1H-тетразол-5-ил)C1-C4-алкоксила, -[1-(C1-C5-алкил)-1H-тетразол-5-ил] -C1-C4- алкоксила, -[1-(фенил)-1H-тетразол-5-ил]C1-C4-алкоксила [где фенил необязательно замещен одним, двумя или тремя C1-C4-алкилом, C1-C4-алкоксилом, галогеном, OH, трифторметилом или -CO2(C1-C4-алкилом)], -[1-(пиридинил)-1H-тетразол-4-ил] C1-C4-алкоксила, -[1-(1-фенилэтил)-1H-тетразол-5-ил]C1-C4-алкоксила, или -C1-C4-алкоксила;
более предпочтительно,
(I) R5, R6, R7 и R8 каждый обозначает атом водорода, или
(II) R5, R6 и R8 каждый обозначает атом водорода и R7 выбирают из -O-(CH2)n-фенила (где фенил необязательно замещен одним, двумя или тремя C1-C5-алкилом, C1-C4-алкоксилом, галогеном или трифторметилом), -C ≡ C-фенила (где фенил необязательно замещен одним, двумя или тремя C1-C4-алкилом, C1-C4-алкоксилом, галогеном или трифторметилом), или -(CH2)n-фенила (где фенил необязательно замещен одним, двумя или тремя C1-C4-алкилом, C1-C4-алкоксилом, галогеном или трифторметилом), или
(III) R5 и R6 обозначают водород, R8 обозначает атом водорода или галогена, или C1-C5-алкил, а R7 выбирают из -O-(CH2)n-фенила (где фенил необязательно замещен одним, двумя или тремя C1-C4-алкилом, C1-C4-алкоксилом, галогеном или трифторметилом), -O-(CH2)n-пиридинила (где пиридинил необязательно замещен одним, двумя или тремя C1-C4-алкилом, C1-C4-алкоксилом, галогеном или трифторметилом), -O-(CH2)n-нафтила, -CH2-фенила (где фенил необязательно замещен одним, двумя или тремя C1-C4-алкилом, C1-C4-алкоксилом, галогеном или трифторметилом), -(CH2)p-пиридинила (где пиридинил необязательно замещен одним, двумя или тремя C1-C4-алкилом, C1-C4-алкоксилом, галогеном или трифторметилом), -(CH2)p(1-пиперидинила), -(CH2)p(1-пирролидинила) или -[1-циклогексил-1H-тетразол-5-ил]C1 - C4-алкоксила; или
(IV) R5, R7 и R8 каждый обозначает атом водорода и R6 обозначает -NH-C(O)-O-CH2-фенил.
X наиболее предпочтительно обозначает CH.
Y наиболее предпочтительно обозначает 4-морфолинил.
R8 предпочтительно обозначает атом водорода или C1-C5-алкил, более предпочтительно атом водорода или метил.
Соответственно настоящее изобретение включает новые 2-амино(4H)-1-бензопиран-4-оны и 2-аминоалкил(4H)-1-бензопиран-4-оны формулы I, когда X обозначает CZ, и антиатеросклеротическую пригодность указанных соединений, а также примеры получения и испытания на антиатерокслеротическую активность известных соединений формулы I, где X=N, включая 2-амино-1,3-бензоксазин-4-оны формулы IB.
Содержание углерода различных углеводородсодержащих составляющих указано префиксом, обозначающим минимальное и максимальное число атомов углерода в составляющей, то есть префикс Ci-Cj показывает содержание атомов углерода целого числа i к содержанию атомов углерода целого числа j включительно. Так, C1-C3-алкил относится к алкилу, имеющему от 1 до 3 атомов углерода включительно, или метилу, этилу, пропилу и изопропилу.
В отношении вышесказанного, C1-C4-алкил представляет собой метил, этил, пропил или бутил, включая их изомерные формы. Аналогично C1-C6-алкил представляет собой метил, этил, пропил, бутил, пентил, гексил и их изомерные формы.
Термин "галоген" включает фторо, хлоро, бромо и иодо.
Примерами C1-C8-алкилтиометила являются метилтиометил, этилтиометил, пропилтиометил, бутилтиометил, пентилтиометил, гексилтиометил, гептилтиометил, а также их изомерные формы.
Примерами C1-C8-алкоксиметила являются метоксиметил, этоксиметил, пропоксиметил, бутоксиметил, пентоксиметил, бутоксиметил, пентоксиметил, гексоксиметил и гептоксиметил, а также из изомерные формы.
Примерами гетероциклических аминов, соответствующих гетероциклическим аминовым кольцам в соответствии с -NR9R10, являются 4-морфолин, 4-фенил-1-пиперазин, 4-(2-пиридинил)-1-пиперазин, 2,6-диметил-4-морфолин, 1-пирролидин, 4-метил-1-пиперазин, 1-пиперидин, 4-фенил-1-пиперидин, тиазолидин, 3-пиперидин-метанол, 2-пиперидин-метанол, пипеколиновая кислота, 3-пиперидин-этанол, 2-пиперидин-этанол, 1-пиперидин-пропанол, п-пиперазиноацетофенон, 4-фенил-1,2,3,6-тетрагидропиридин, 4-фенилпиперидин, пролин, 1-(3-гидрокси)пирролидин, тетрагидрофуриламин, пирролидин-метанол, 3-пирролин, тиазолидин-4-карбоновая кислота, тиоморфолин, нипекотамид, 2-метилпиперидин, 3-метилпиперидин, 4-метилпиперидин, N-метилпиперазин, 1-метилгомопиперазин, 1-ацетилпиперазин, N-карбоэтоксипиперазин, 3-метилпиперазин-2-карбоновая кислота, 2-метилпиперазин, 2,3,5,6-тетраметилпиперазин, 1,4-диметилпиперазин, 2,6-диметилпиперазин, 2-метил-1-фенилпиперазин, 1-(1-фенилэтил)пиперазин, 1-(2-пиразинил)пиперазин, 1-циклопропилпиперазин, 1-циклобутилпиперазин, 1,2,3,4-тетрагидроизохинолин, имидазол, гомопиперидин, а также их фармацевтически приемлемые соли и гидраты.
Примерами -O(CH2)p(N-метилпиперидин-3-ила) являются [2-(N-метилпиперидин-3-ил)этил] окси, [3-(N-метилпиперидин-3-ил)пропил]окси, [4-(N-метилпиперидин-3-ил)бутил]окси.
Примеры -O-(CH2)pNR9R10 включают [2-(1-пиперидинил)этил]окси, [2-(4-морфолинил)этил] окси, [2-(1-пирролидинил)этил] окси, [3-(N-метилпиперазинил)пропил]окси, [4-(N-этил-N-фениламино)бутил]окси, [5-(диэтиламино)пентил] окси, [2-(4-бензилпиперазинил)этил]окси и [3-N,N-диизопропил)пропил]окси.
Примеры -O-(CH2)pOR15 включают (2-метоксиэтил)окси, (3-бутоксипропил)окси, (4-феноксибутил)окси, (2-бензилоксиэтил)окси, [2-[2-(1-пиперидинил)этокси]окси и [3-(3-пиколилметокси)пропил]окси.
Примерами -(CH2)n пиридинила являются 2-пиридил, 3-пиридилметил и 4-пиридилэтил.
Примерами -(СР2)n пиперидинила являются 1-пиперидинил, 1-пиперидинилметил, 2-(1-пиперидинил)этил и 3-(1-пиперидинил)пропил.
Примеры -(CH2)qNR9R10 включают (1-пиперидинил)метил, 2-(4-морфолинил)этил, 3-(1-пирролидинил)пропил и 4-(1-пиперазинил)бутил.
Примерами -(CH2)nC(O)-(CH2)nR9 является ацетилметил, метилацетилметил, метилацетилэтил, фенилацетил, фенилацетилметил, 2-(фенилацетил)этил, 2-пиридилацетил, 3-пиридилацетилметил, 3-(трет.-бутилацетил)пропил и 4-(этилацетил)бутил.
Примеры -(CH2)nC(O)O-(CH2)pR9 включают карбометокси, карбомептоксиметил, 2-(карбометокси)этил, карбофенилметокси, карбофенилметоксиметил, 2-[карбо(3-пиридил)метокси] этил, карбоэтоксиметил и 3-(карбопропокси) пропокси.
Примерами -(CH2)nC(O)O-(CH2)pNR9R10 являются -(C(O)O-(CH2)2-N(этил)2,
-(CH2)C(O)O-(CH2)2(CH3)фенил, -(CH2)3-C(O)O-(CH2)3(1-пирролидин),
-(CH2)3C(O)O-(CH2)2(1-пиперидинил), -(CH2C(O)O-(CH2)2(4-морфолинил). Примерами -(CH2)nC(O)(CH2)nNR9R10 являются -(CH2)C(O)(CH2)-N(этил)2,
-(CH2)2C(O)(CH2)2N(метил)фенил, -C(O)-(1-пирролидин), -(CH2)2C(O)(CH2)3(1-пиперидин) и -(CH2)3C(O)(CH2)(4-морфолин).
Примерами -O-(CH2)nC(O)-(CH2)pR9 являются -O-(CH2)C(O)-(CH2)(CH3),
-O-C(O)-(CH2)2(CH)3, -O-(CH2)3C(O)-(CH2)фенил, -O-(CH2)2C(O)-(CH2)3(2-пиридил), -O-(CH2)C(O)-(CH2)2(3-пиридил) и -O-(CH2)4C(O)-(CH2)4(трет. -бутил).
Примеры -O-(CH2)nC(O)O-(CH2)pR9 включают -O-(CH2)C(O)O-(CH2)(CH3),
-O-C(O)O-(CH2)2(CH3), -O-(CH2)2C(O)O-(CH2)3(фенил) и -O-(CH2)3C(O)O-(CH2)2(3-пиридил).
Примеры -O-(CH2)nC(O)-(CH2)nNR9R10 включают -O-(CH2)C(O)-(CH2)N(CH3)2,
-O-C(O)-(CH2)(1-пирролидин), -O-(CH2)C(O)-(1-пиперидин), -O-(CH2)2C(O)-(CH2)-(1-N-метилпиперазин), -O-(CH2)2C(O)-(CH2)2(4-морфолин), -O-(CH2)C(O)-(CH2)3(циклогексиламин), -O-(CH2)2C(O)-(CH2)3(трет. -бутиламин), -O-(CH2)C(O)-(CH2)2)(1-фенилэтиламин), -O-(CH2)C(O)-(CH2)2(анилин), -O-(CH2)C(O)-(CH2)(1-фенилаланин, сложный метиловый эфир), -O-(CH2)2C)O)-(CH2)3(3-пиридиламин).
Примерами -N(R9)(CH2)nG(O)- (CH2)nR10 являются -N(CH3)C(O)-(CH3), -N(H)(CH2)2C(O)-(CH2)(фенил), -N(H)(CH2)C(O)-(CH2)2(3-пиридил) и -N(CH3(CH2)3C(O)-(CH2)(CH3).
Примерами -N(R9)(CH2)nC(O)O- (CH2)nR10 являются -N(H)(CH2)C(O)O-(CH3),
-N(H)-(CH2)2C(O)O-(CH2)(бензил), -N(H)-(CH2)2C(O)O-(CH2)(3-пиридил) и -N(CH3)-(CH2)C(O)O-(CH2)2(трет.-бутил).
Примеры -N(R9)(CH2)nC(O)- (CH2)nR9R10 включают -N(H)(CH2)C(O)(CH2)N(CH3)2, -N(H)C(O)-(CH2)(1-пирролидин), -N(H)(CH2)2C(O)-(CH2)2(1-пиперидин) и -N(CH3)(CH2C(O)-(CH2)2(4-морфолин).
Примеры -O-(CH2)n-фенила включают 2-(4-трифторметилфенил)этокси, 4-хлорфенокси, 4-фторфенилметокси, 3-(4-метоксифенил)пропокси, 4-(2-метил-4-фторфенил)бутокси, 2-(2-метоксифенил)этокси, 3-метоксифенилметокси, 4-карбометоксифенилметокси, 2-(3,4-дихлорфенил)этокси, 4-этоксифенилметокси, 3-(4-нитрофенил)пропокси, 4-трет.-бутилфенилметокси, 4-бензилоксифенилметокси и 2-(3-трифторметилфенил)этокси.
Примерами -O-(CH2)n-пиридина являются 2-пиридилокси, 3-пиридилметокси и 2-(4-пиридил)этокси.
Примерами -O(CH2)nC(O)-(CH2)n-пиридина являются -O(CH2)C(O)-(CH2(2-пиридин), -O(CH2)3C(O)-(CH2)(3-пиридин) и -0-(CH2)2C(O)-(CH2)3)(4-пиридин). Примерами -O-(CH2)nC(O)O-(CH2)n- пиридина являются -O-(CH2)C(O)O-(CH2)(2-пиридин), -O(CH2)3C(O)O-(CH2)(3-пиридин) и -O(CH2)2C(O)O-(CH2)3(4-пиридин). Примерами -O-(CH2)nC(O)-N(R9) (CH2)n-пиридина являются -O(CH2)C-(O)-N(CH3)(CH2)(2-пиридин), -O(CH2)2C(O)-N(CH3)(CH2)(3-пиридин) и -O(CH2)C(O)-N(бензил)(CH2)2(4-пиридин).
Примеры -O-(CH2)n-хиноксалинила включают 2-хиноксалинилокси, 2-хиноксалинилметокси и 2-(2-хиноксалинил)этокси.
Примеры -O-(CH2)n-хинолинина включают 2-хинолинилокси, 2-хинолинилметокси и 2-(2-хинолинил)этокси.
Примеры -O-(CH2)n-пиразинила включают 2-пиразинилокси, 2-пиразинилметокси и 2-(2-пиразинил)этокси.
Примеры -O-(CH2)n-нафтила являются 1-нафтилокси, 2-нафтилметокси и 2-(1-нафтил)этокси.
Примеры -O-(CH2)nC(O)-(CH2)n- нафтила включают -O-(CH2)C(O)-(CH2(1-нафтил), -O-(CH2)2C(O)-(CH2)(2-нафтил), -O-C(O)-(CH2)(1-нафтил) и -O-(CH2)2C(O)-(CH2)2(2-нафтил).
Примерами -O-(CH2)nC(O)O-(CH2)n- нафтила являются -O-(CH2)C(O)O-(CH2)(1-нафтил), -O-(CH2)2C(O)O-(CH2)(2-нафтил), -O-C(O)O-(CH2)(1-нафтил) и -O-(CH2)2C(O)O-(CH2)2(2-нафтил).
Примеры -O-(CH2)nC(O)NR9- (CH2 n)-нафтила включают -O-(CH2)C(O)N(H)(CH2(1-нафтил), -O-(CH2)2C(O)N(CH3(CH2)2(2-нафтил) и -O-(CH2)C(O)N(бензил)(CH2)3(1-нафтил).
Примерами -(CH2)q-OH являются гидроксиметил, гидроксиэтил и гидроксибутил.
Примеры (CH2)qOC(O)R9 включают (CH2)OC(O)метил, (CH2)2-(CH2)2OC(O)этил,
(CH2)3OC(O)фенил, (CH2)4OC(O)(3-пиридил) и (CH2)-OC(O)тиофен.
Примерами -(CH2)qOC(O)-NR9R10 являются -(CH2)OC(O)-N(CH2)2, -(CH2)2OC(O)-N(этил)2, -(CH2)3OC(O)-(1-пирролидин), -(CH2)4OC(O)-(1-пиперидин) и (CH2)OC(O)-N-бензиламин.
Примеры -(1-циклогексил-1H-тетразол-5-ил)C1-C4- алкокси, -[1-(C1-C5-алкил)-1H-тетразол-5-ил] C1-C4-алкокси включают -(1-циклогексил-1H-тетразол-5-ил)метокси, -(1-циклогексил-1H-тетразол-5-ил)этокси, -[1-(метил)-1H-тетразол-5-ил)метокси, -[1-(циклопропил)-1H-тетразол-5-ил]этокси, -[1-(1-трет. -бутил)-1H-тетразол-5-ил] пропокси и -[1-(циклопентил)-1H-тетразол-5-ил]метокси.
Примерами -[1-(фенил)-1H-тетразол-5-ил]C1-C4 -алкокси (где фенил необязательно замещен одним, двумя или тремя C1-C4-алкилом, C1-C4-алкоксилом, галогеном или трифторметилом) являются -[1-(фенил)-1H-тетразол-5-ил]метокси, -[1-(фенил)-1H-тетразол-5-ил] этокси, -[1-(4-метоксифенил)-1H-тетразол-5-ил] метокси, -[1-(4-фторфенил)-1H-тетразол-5-ил]пропокси.
Примерами -[1-(пиридинил)-1H-тетразол-5-ил] C1-C4- алкокси или -[1-(1-фенилэтил)-1H-тетразол-5-ил] C1-C4-алкокси являются -[1-(2-пиридинил)-1H-тетразол-5-ил]метокси, -[1-(3-пиридинил)-1H-тетразол-5-ил]этокси, -[1-(4-пиридинил)-1H-тетразол-5-ил] пропокси, -[1-(1-фениэтил)-1H-тетразол-5-ил]метокси, -[1-(1-фениэтил)-1H-тетразол-5-ил]этокси.
Третичные амины и ароматические гетероциклические амины в соответствии с настоящим изобретением включают их N-оксиды.
Фармацевтически приемлемые соли означают соли, пригодные для введения соединений настоящего изобретения, и включают хлоргидрат, бромгидрат, сульфат, фосфат, ацетат, пропионат, лактат, малеат, малат, сукцинат, тартрат и тому подобные. Эти соли могут быть в гидратированной форме.
Соединения формулы I отличаются выраженной антиатерогенной активностью, которая придает этим соединениям полезность в лечении и профилактике атеросклероза.
Ввиду того, что известные аналогичные соединения, описанные в Mazzei, Farmaco, Ed. Sci, 41: 611 (1986) обладают противоаллергической активностью, было поразительно, что соединения формулы I имеют антиатеросклеротический эффект или представляют собой ингибиторы агрегации тромбоцитов или пролиферации клеток.
О сильном действии 2-морфолинилхлормонов формулы I настоящей заявки против АДФ-индуцированной агрегации тромбоцитов (при концентрации 8,0 мкМ) ясно свидетельствуют приведенные в таблицах I - III данные. Просим учесть, что ряд соединений имеют IC50 меньше [все значения являются средними ± SD (n = 3)].
2-Морфолинилхромон имеет IC50, равную 154 мкМ, действенную против АДФ-индуцированной агрегации тромбоцитов (АДФ = 8,0 мкМ). Просим учесть, что не все 2-морфолинилхромоны имеют IC50 < 154 мкМ против АДФ-индуцированной агрегации тромбоцитов (АДФ = 8,0 мкМ). Однако утверждается, что все соединения демонстрируют антиатерогеническую активность. Многие соединения формулы I являются ингибиторами пролиферации клеток (это еще не было известно для 2-аминохромонов). Соотношение 1:1 не существует между ингибированием АДФ-индуцированной тромбоцитов и ингибированием пролиферации клеток.
Публикация Mazzei et al. [Document D6; Eur. J. Med. Chem. 23, 237-242 (May-June 1988)] не раскрывает и не предлагает никаких 12-морфолинилхромонов. Более того, Mazzei сообщает в таблице II (стр. 240) IC50 = 200-750 мкМ для самых лучших соединений при концентрации АДФ (5,0 мкМ). Mazzei указывает на то, что самая высокая активность была обнаружена при испытании хромонов, содержащих в качестве 2-амино заместителя диэтиламино-группу. Действительно, 2-(диэтиламино)-7-гидроксихромон (Соединение 5q) имел IC50 равную 250±160 при концентрации АДФ (5,0 мкМ). Согласно Mazzei et al ацетилсалициловая кислота имеет IC50 = 1000 мкМ при концентрации АДФ (5,0 мкМ).
Что касается токсичности, то было полностью испытано одно соединения (Y = морфолинил, X = CH, R5 и R6 = H, R7 = -O(CH)2-4-метил-пиперазин, R8 = метил). 8-Метил-7-(2-(4-метил-1-пиперазинил)этокси)-2-(4-морфолинил)-4H-1- бензопиран-4-он при введении in vitro у крыс во время 14 суток не показано никакой токсичности. На основе этого можно сделать вывод, что соединения формулы I относятся к низкотоксичной категории.
Различные соединения, включая 2-(4-морфолинил)-4H-бензопиран-4-он (N 2), 2-(4-морфолинил)-4H-1,3-бензоксазин-4-он (N 98), 8-метил-2-(4-морфолинил)-4H-1,3-бензоксазин-4-он (N 84), 2-(1-(4-тиоморфолинил)-4H-1,3-бензоксазин-4-он (N 95) и 2-(4-метил-1-пиперазинил)-4H-1,3-бензоксазин-4-он (N 96), снижают артериальное накопление холестерина в модели SEA японской куропатки. Снижение артериального холестерина сопровождается пониженным уровнем содержания сывороточного холестерина при использовании соединений N 84 и 95, однако не с соединениями N 2, 98 и 96. У нормальной холестеринемической японской куропатки SEA наблюдается снижение сывороточного холестерина при использовании соединения N 84. Касательно описания модели японской куропатки см. Day C.E. et al., "Utility of a Selected Line (SEA) of the Japanese Quail (Coturnic Coturnix japonica) for the Discovery of New Anti-Atherosclerotic Drugs", Laboratory Animal Science 27: 817-821 (1977).
Предпочтительные антиатеросклеротические соединения включают соединения N 2, 3, 19, 51, 72, 76, 84, 95, 96, 98, 112, 139, 163, 164, 171 и 204.
Кроме того, различные соединения формулы I также являются сильными ингибиторами пролиферации клеток и пригодны в лечении пролиферативных заболеваний, таких как рак, ревматоидный артрит, псориаз, фиброз легких, склеродермия, цирроз печени, и для усовершенствованного использования искусственных протезных приспособлений, таких как артериальные трансплантаты. Эти средства также могут быть пригодными в предотвращении или лечении непроходимости или рестеноза артерий путем последующего введения лекарственного средства в таких случаях, как шунтирующая хирургия, коронарная шунтирующая хирургия, пластическая операция на сосудах (и другие методики, направленные на повторное восстановление потенциала в окклюдированных или частично окклюдированных сосудах, то есть атеректомия, лазерные или ультразвуковые методики), трансплантаты и посттромботический рестеноз.
Соединения формулы I, которые являются ингибиторами пролиферации клеток, это те, которые активны в методике испытания, описанной Pledger W.J., Stiles C. D. , Antniades H.N. and Scher C.D. Proc. Natl. Acad. Sci. (USA) (1977). Примерами ингибиторов пролиферации клеток являются соединения N 1-14, 16-17, 19-23, 25 и 26, 30-34, 36-39, 42, 46-48, 51, 52, 54-46, 58-76, 81, 100-103, 105-112, 120-122, 125-133, 135-145, 149, 155 и 156, 158-160, 163, 166, 171, 173-180, 183-190, 193, 204 и 207.
Кроме того, различные соединения формулы I также являются ингибиторами агрегации тромбоцитов, индуцированной аденозин-5'-дифосфатом (АДФ), и являются пригодными в предотвращении или лечении тромботических заболеваний и связанных с ними осложнений путем, например, ингибирования или обращения агрегации тромбоцитов, или адгезии тромбоцитов, или свертывания крови.
Соединения формулы I, являющиеся ингибиторами агрегации тромбоцитов, то те, которые активны в методике испытания, описанной Born G.R., Cross M.J. J. Physiology 168: 178 (1963). Примерами ингибиторов АДФ-индуцированной агрегации тромбоцитов являются соединения N 2-3, 5-6, 9-11, 13, 20-22, 25-26, 28, 31-32, 34, 36-38, 51-53, 56, 58-59, 63, 65, 72-76, 80, 100, 102, 104, 106-107, 109-113, 115, 116, 118, 120-123, 125-131, 133, 136-140, 147, 149, 154-160, 162-167, 169, 171, 172, 178, 181-188, 192-198 и 207.
Соответственно при использовании соединений формулы I для предотвращения или лечения атеросклеротических заболеваний или тромботических заболеваний пероральный путь введения, либо традиционные пероральные лекарственные формы или смеси с пищей представляют собой предпочтительный метод их системного введения. Альтернативно, эти соединения могут вводиться другими удобными путями, которые ведут к достижению системной активности. Эти пути введения включают ректальный, вагинальный, подкожный, внутримышечный, внутривенный и другие.
При использовании соединений формулы I для пластической операции на сосудах пероральный путь введения является предпочтительным методом системного введения. Альтернативно эти соединения могут вводиться другими традиционными путями, которые приводят к получению системной активности.
Люди и животные должны получать периодические дозы лекарственного средства в количествах, эффективных для снижения сывороточного и/или артериального холестерина, а также для снижения размера артериального атеросклеротического поражения (при обнаружении ангиографией, ультразвуком, ЯМР и так далее), или для ингибирования или обращения агрегации тромбоцитов, адгезии тромбоцитов или свертывания крови, или для предотвращения закупорки сосудов или васкулярной травме, связанного с методиками, например, шунтирующих трансплантатов, коронарных шунтирующих трансплантатов, ангиопластики, посттромботического рестеноза и трансплантатов.
Такие эффективные дозы легко определяются известными методами. Например, небольшие суточные дозы лекарственного средства (например, 0,01 - 200 мг/кг) можно вводить первоначально с более высокими последующими дозами. Так, соединение формулы I первоначально вводят при дозировке около 0,01 мг/кг веса пациента в день, с последующим повышением дозы до 200 мг/кг веса пациента в день. В том случае, если реакция организма пациента, получающего 200 мг/кг в день лекарства, недостаточная, используют более высокие дозы в зависимости от выносливости пациента.
Несмотря на то, что схема приема лекарственного средства основана на введении одноразовых доз, для получения более равномерных сывороточных уровней лекарства предпочтительны многократные дозировки в день (например, до 4-6 раз ежесуточно). Соответственно, при введении четырех суточных доз лекарственного средства каждая доза должна содержать около 50 мг/кг веса пациента или выше, в зависимости от выносливости пациента.
Аналогичные дозировки используются для млекопитающих животных, например, 0,01 - 200 мг/кг/день.
Схемы A-I раскрывают различные способы получения соединения формулы I На этих графиках X, Y, R5, R6, R7, R8,R9 и R10 имеют вышеприведенные значения.
Схема A: соединения формулы I получают путем смешивания сложного эфира салициловой кислоты с чистым морфолин-инамином или в органическом растворителе при перемешивании. Через несколько минут добавляют основание третичного амина, например, ТЭА (триэтиламин), и реакционную смесь перемешивают определенное время. Продукт можно выделить перекристаллизацией или колоночной хроматографией.
Схема B: соединения формулы I получают путем взаимодействия ортогидроксиацетофенона с амидацеталью, например, N,N-диметилформамиддиметилацеталью, с получением винилогичного амида. Обработка данного амида галогеном (Br, Cl, I или F) в органическом растворителе, таком как CHCl3 или CHCN, затем позволяет получить 3-галохромон. Обработка данного галохромона аминами, либо чистыми, либо в присутствии органических растворителей, позволяет получить требуемые 2-аминохромоны.
Схема C: соединения формулы I получают путем обработки ортогидроксиацетофенона сероуглеродом в присутствии основания, с последующей обработкой кислотой, которая приводит к получению 2-меркаптохромона. Обработка полученного меркаптана соответствующим амином позволяет получить 2-аминохромон.
Схема D: соединения формулы I получают гидрогенизацией соответствующих аналогов бензилметокси, которые получают способами, описанными в графиках A, B и C, с последующим алкилированием полученного фенола.
Схема E: эти соединения можно получить обработкой о-гидроксиацетофенона иминиевой солью, такой как морфолин 4-фосген-иминий хлорид, в присутствии эфирата трехфтористого бора. Последующий гидролиз и алкилирование позволяет получить требуемые соединения.
Схема F: указанные соединения формулы I могут быть получены обработкой о-гидроксиацетофенона, содержащего сульфонатную группу трифторметила, иминиевой солью, такой как 4-морфолин-дихлорметилениминий хлорид, в присутствии эфирата трехфтористого бора. Последующие гидролиз и алкилирование позволяют получить 2-аминохромон. Обработка 2-аминохромона ацетиленом в присутствии палладиевого катализатора, такого как дихлорид (бис)трифенилфосфин палладия, и иодидом меди позволяет получить 2-аминохромон с замещенным ацетиленом. Гидрогенизация ацетилена приводит к получению желательного производного.
Схемы G: обработка о-гидрокси-ацетофенона, содержащего группу галогена, иминиевой солью, такой как хлорид 4-морфолин-дихлорметилениминия, в присутствии эфирата трехфтористого бора, с последующим гидролизом и алкилированием промежуточного соединения позволяет получить 2-аминохромон. Обработка 2-аминохромона реагентом тетраалкилолова в присутствии палладиевого катализатора, такого как дихлорид (бис)трифенилфосфинпалладия, и солью, такой как хлорид лития, приводит к получению 2-аминохромона, замещенного алкильным заместителем.
Схема H: соединения формулы I могут быть получены путем обработки 4-бензилокси-2-гидрокси-3-метилацетофенона гидридом натрия, затем этил α -метилтиоацетатом и, наконец, кислотой с получением 7-бензилокси-8-метил-2-метилтиометил-4H-[1] -бензопиран-4-она. Обработка данного соединения метилиодидом приводит к получению соответствующего 7-бензилокси-8-метил-2-иодометил-4H-[1] -бензопиран-4-она. Обработка данного соединения соответствующим амином позволяет получить соединения формулы I. Соединения формулы I также получают путем обработки соединения формулы I, такого как 7-бензилокси-8-метил-2-(4-морфолинилметил)-4H-[1] -бензопиран-4-он, катализатором на основе металла переходного ряда в атмосфере водорода, что позволяет получить 7-гидрокси-8-метил-2-(4-морфолинилметил)-4H-[1] -бензопиран-4-он. Алкилирование данного фенола соответствующей группой также позволяет получить соединение формулы I.
Альтернативно, соединения формулы I могут быть также получены гидрогенизацией R5-8 бензилокси 2-амино-4H-1-бензопиран-4-она с последующим алкилированием полученного фенола, как показано на графике 1.
Получение соединений настоящего изобретения подробно иллюстрируется следующими примерами:
Процедура 1: Получение 1-этинилморфолина
Часть A: Получение трихлорацетилморфолина
Морфолин (4,0 мл, 45 мМ) растворяли в EtOAc (50 мл) и добавляли насыщенный K2CO3(40 мл). Смесь осаждали в ледяной бане, после чего по капле добавляли трихлорацетилхлорид (5,0 мл, 45 мМ). Реакционную смесь размешивали в течение 20 мин, а затем разбавляли EtOAc (200 мл) и промывали водным K2CO3 (20 мл), водой (2х50 мл) и солевым раствором (30 мл). Органический слой осушали сульфатом магния. После выпаривания с помощью роторного испарителя получали трихлорацетилморфолин. Т.пл.80-81oC.
1H-ЯРМ (300 МГц, C DCl3) 3,81-3,76 м
УФ EtOH 224 (4,520)
ИК (mull) 2955, 2926, 2859, 1657, 1431, 1270, 1239, 1116, 962, 852, 848, 842, 810, 777.
МС(m/e) (относительная интенсивность) 233 (12), 231 (12), 115 (8). 114(100), 86(10), 70(67), 56(26), 42(20), 28(18), 27(8).
ВРМС (высокоразрешающая масс-спектроскопия) для C6H8NO2C13:
Вычислено: 230,9621; найдено: 230,9629.
Элементарный анализ для C6H8NO2C13
Вычислено; C 31,00; H 3,47; N 6,02; Cl 45,75.
Найдено: C 31,15; H 3,43; N 6,07; Cl 45,88.
Часть B: Получение трихлорвинилморфолина
Трихлорацетилморфолин (8,3 г, 36 мМ) растворяли в толуоле, а затем добавляли трифенилфосфин (9,44 г, 36 мМ). Смесь нагревали с обратным холодильником в течение 1,5 ч, а затем охлаждали, а растворитель удаляли в вакууме. Остаток подвергали фракционной перегонке при пониженном давлении и получали в результате трихлорвинилморфолин. Т.кип. 85-87oC, 20 мм рт.ст.
Часть C. Получение морфолининамина
Трихлорвинилморфолин (5,50 г, 24,5 мМ) растворяли в безводном простом эфире (30 мл) в атмосфере азота. Смесь охлаждали до -30oC и медленно добавляли бутиллитий (50 мл, 1,5 М, 75 мМ), после чего смесь нагревали до температуры 23oC в течение 2 ч. Затем смесь охлаждали до -30oC и выливали в холодный 20% гидроксид аммония (20 мл), добавляли простой эфир (50 мл), и растворы быстро разделяли. Органический слой отфильтровывали через безводный K2CO3 (5 см) и концентрировали в вакууме, в результате чего получали маслянистое вещество желто-оранжевого цвета, которое подвергали фракционной перегонке (0,9 мм рт.ст., Т.кип. 53oC) и получали инамин, 1-этинилморфолин в виде бесцветного продукта (1,1 г, 40%).
ИК (пленка) 2970, 2940, 2870, 2137, 1647, 1458, 1382, 1272, 1123 см-1
1H-ЯМР (CDCl3) δ : 3,81, 3,12, 2,36.
Относительно Схемы A. Пример 1. Получение 6-хлоро-2-(4-морфолинил)-4H-1-бензопиран-4-она
Соединение 1.
Метиловый эфир 5-хлорсалициловой кислоты (2,00 г, 10,7 мМ) по капле смешивали с этинилморфолином (чистым, 1,00 г, 9,00 мМ). Указанная реакция является экзотермической. После охлаждения смеси добавляли триэтиламин (TEA, 1 капля) и жидкая смесь сразу кристаллизовалась. Полученную смесь хроматографировали (тонкий слой, SiO2, CH2Cl2/EtOH, 95:5) и получали 6-хлоро-2-(4-морфолинил)-4H-1-бензопиран-4-он(1,07 г, 45%). Т.пл. 194-195oC.
ИК (mull) 2949, 2946, 2855, 1640, 1615, 1566, 1464, 1450, 1437, 1345, 1246, 1118, 822, 787 см-1;
1H-ЯМР (CDCl3, 200 МГц) 8,11-(d,J=2,5 Гц, 1H); 7,49 (dd, J=8,7, 2,5 Гц, 1H); 7,23 (d,J=8,7 Гц, 1H); 5,49 (s, 1H); 3,85-3,82 (m, 4H); 3,53-3,50 (m, 4H);
УФ (EtOH) λмакс.(ε) 217 (31,360), 230 (24,900), 245 сд (12,100), 290 сд (11,170), 301 (15,810), 315 (16,070);
МС; ионы при m/e (относительная интенсивность) 267 (35), 265 (100), 210 (24), 209 (22), 208 (74), 207 (31), 180 (47), 154 (27), 126 (19), 52 (21);
ВРМС для C13H12NO3Cl: вычислено 265,0506; найдено 265,0512
Элементарный анализ для C13H14NO3Cl
Вычислено: C 58,77; H 4,55; N 5,27; Cl 13,34,
Найдено: C 58,52; H 4,66; N 5,11; Cl 13,58.
Повторяли процедуру примера 1, но вместо метилового эфира 5-хлорсалициловой кислоты использовали соответствующий о-гидроксисалициловый метиловый сложный эфир, который в зависимости от его реактивности, использовали либо в чистом виде, либо в метиленхлориде, толуоле или триэтиламине, в результате чего получали следующие соединения:
Соед. 2: 2-(4-морфолинил)-4H-1-бензопиран-4-он,
Т.пл. 160-161oC;
Соед.4: 7-хлор-2-(4-морфолинил(4-H-1-бензопиран-4-он,
Т.пл. 160-161oC (из CH2Cl/EtOH);
Соед.5: 8-хлор-2-(4-морфолинил)-4H-1-бензопиран-4-он,
Т.пл.190-191oC (из CH2Cl2/Et 2O);
Соед.6; 6-бромо-2-(4-морфолинил)-4H-1-бензопиран-4-он,
Т.пл.164-165oC (из CH2Cl2/Et2O);
Соед.7: 6-фторо-2-(4-морфолинил)-4-H-бензопиран-4-он,
Т.пл.198-199oC (из CH2Cl/Et2O);
Соед.8: 6-метил-2-(4-морфолинил)-4H-1-бензопиран-4-он,
Т.пл.166-167oC (из CH2Cl2/Et2O);
Соед.9: 7-метил-2-(4-морфолинил)-4H-1-бензопиран-4-он,
Т.пл.163-164oC(из CH2Cl2/Et2O);
Соед.10: 8-метил-2-(4-морфолинил)-4H-1-бензопиран-4-он,
Т.пл.169-170oC (из EtOAc/гексан);
Соед. 11: 6-метокси-2-(4-морфолинил)-4H-1-бензопиран-4-он, Т.пл. 148-149oC (из EtOH/CH2Cl2);
Соед. 12: 7-метокси-2-(4-морфолинил)-4H-1-бензопиран-4-он, Т.пл. 173-174oC (из EtOH/гексана);
Соед. 13: 6-(фенилметокси)-2-(4-морфолинил)-4H-1-бензопиран-4-он, Т.пл. 210-212oC;
Соед. 14: 8-(фенилметокси)-2-(4-морфолинил)-4H-1-бензопиран-4-он, Т.пл. 192-194oC;
Соед. 15: [2-(4-морфолинил)-4-оксо-4H-1-бензопиран-6-ил]-1,1- диметилэтилкарбаминовой кислоты сложный эфир;
Соед. 16: 6-(3-пиридинкарбоксамид)-2-(4-морфолинил)-4H-1- бензопиран-4-он.
Пример 17. Получение 2-(морфолинил)-6-нитро-4H-1-1-бензопиран-4- она. Соединение 17:
Этиловый эфир 5-нитросалициловой кислоты (634 мг, 3,0 мМ) растворяли в ТЕА (2,0 мл) и добавляли морфолининамин. Смесь размешивали в течение 48 часов. Затем реакционную смесь разбавляли EtOAc (200 мл) и промывали водой (5 х 25 мл), солевым раствором (30 мл) и осушали сульфатом магния. После выпаривания растворителя продукт хроматографировали на силикагеле (50 г, 4% EtOH/CH2Cl2), в результате чего получали 182 мг (22%) целевого продукта. Т. пл. 258-259oC.
1H-ЯМР (CDCl3, 300 МГц) 9,05 (d,J=2,9 Гц, 1H) 8,44 (dd,J=8,7, 2,9 Гц, 1H); 7,46 (d, J=9,3 Гц 1H); 5,69 (s, 1H); 3,91-3,86 (m, 4H); 3,61-3,56 (m, 4H); УФ (EtOH) 226 (23,700), 234 сд. (19,000), 282 (17,600), 316 (15,000);
ВРМС (m/e) (относит. интенс.) 277 (28), 276 (100), 261 (38), 219 (80), 218 (53), 191 (38), 172 (19), 55 (30), 53 (35), 41 (31);
ИК (mull) 2954, 2924, 2856, 1637, 1627, 1604, 1565, 1447, 1422, 1347, 1253, 1126, 740, 638;
ВРМС для C13H12N2O5 вычислено 276,0746; найдено 276,0742.
Элементный анализ для C13H12N2O5
Вычислено: C 56,52; H 4,38; N 10,14,
Найдено: C 56,32; H 4,52; N 10,16.
Пример 18. Получение 2-(4-морфолинил)-4H-пирано[2,3b]пиридин -4-она. Соединение 18:
Сложный метиловый эфир 2-гидрокси-3-карбоксипиридина (300 мг, 1,9 мМ) растворяли в толуоле (2,0 мл), и добавляли по капле раствор морфолининамина (250 мг, 2,2 мМ) в толуоле (2,0 мл) при 23oC. Затем реакцию нагревали до 10oC в течение 24 ч. Смесь охлаждали и очищали с помощью флеш-хроматографии (CH2Cl/EtOH, 95: 5) и получали хромон в виде бледно-желтых кристаллов (270 мг, 63%). Т.пл. 190-191oC;
ИК (mull) 2924, 2868, 2855, 1652, 1639, 1611, 1590, 1557, 1453, 1405, 1250, 1120, 788, 602 см-1;
1H-ЯМР (CDCl3, 200 МГц) δ: 8,60 (s, 1H); 8,57 (dd,J=3,2, 2,4 Гц, 1H); 7,45 (m, 1H); 5,56 (s, 1H); 3,92-3,87 (m 4H); 3,68-2,63 (m 4H);
УФ (EtOH) λмакс.(ε) 215 (16,740), 243 (10,250), 281 сд. (8,330), 289 (10,500), 320 (15,320);
МС: ионы при m/e (относит.интенс.) 233 (14), 232 (100), 217 (17), 175 (37), 174 (39), 146 (15), 122 (17), 79 (34), 53 (15), 42 (14);
Элементный анализ для C12H12N2O3
Вычислено: C 62,06; H 5,21; N 12,06,
Найдено: C 68,85; H 5,18; N 11,88.
Пример 19. Получение 6-[[(фенилметокси)карбонил]амино]-2- (4-морфолинил)-4H-1-бензопиран-4-она.
Соединение 19:
Сложный метиловый эфир 2-гидрокси-5-[[фенилметокси)карбонил] амино]бензойной кислоты (1,0 г, 3,3 мМ) добавляли к CH2Cl2 (1 мл) и охлаждали до 0oC. К указанному раствору добавляли инамин (366 мг, чистый), а затем по капле добавляли несколько капель ТЕА. Реакционный раствор становился желтым, и после его перемешивания при комнатной температуре в течение 18 часов раствор нагревали в масляной бане в течение 6 часов при 80oC. Твердый продукт образовался в колбе. Реакцию разбавляли CH2Cl2, твердый продукт собирали фильтрацией и получали в результате 350 мг (19,4%) целевого продукта. Аналитический образец получали путем перекристаллизации из CH3CN. Т.пл. 245-250oC.
ИК (mull) 3263, 2947, 2925, 2921, 2867, 2854, 1716, 1638, 1623, 1577, 1564, 1558, 1464, 1456, 1453, 1404, 1246, 1231, 1121, 731 см-1;
1H-ЯМР (CDCl3) δ: 8,15 (d, 1H, J=2 Гц); 7,95 (s, 1H); 7,87 (s, 1H); 7,3 (m, 7H); 5,42 (s, 1H, винил); 5,2 (s, 2H); 3,7 m, 4H);
УФ (EtOH) λмакс.(ε) 231 (27,520), 246 (34,960), 300 сд. (16,300), 307 (17,830), 320 сд. (12,800);
МС: ионы при m/e (относ. интенс.) 380 (17), 335 (12), 272 (100), 215 (69), 187 (44), 161 (32), 108 (79), 91 (87), 79 (99), 53 (32), 44 (50);
Элементный анализ для C21H20N2O5
Вычислено: C 66,31; H 5,26; N 7,36,
Найдено: C 66,40; H 5,28; N 7,30.
Пример 20. Получение 8-метокси-2-(4-морфолинил)-4H-1- бензопиран-4-она. Соединение 20:
Метод A: Метоксисалицилхлорид (750 мг, 4 мМ) растворяли в THF (4 мл) и охлаждали до 0oC. Морфолининамин (445 мг, 4,0 мМ) растворяли в THF (4 мл), а затем по капле добавляли в охлажденный раствор хлорангидрида. Сразу после добавления образовывался белый осадок, и после перемешивания в течение 20 мин добавляли TEA (0,60 мл, 4,5 мМ), а затем реакционную температуру повышали до 23oC. После нагревания в колбе с обратным холодильником в течение 20 мин реакционную смесь охлаждали до комнатной температуры, а ТГФ удаляли в вакууме. Сырую реакционную смесь фильтровали, а фильтрат хроматографировали на силикагеле (5%, EtOH/CH2Cl2), в результате чего после перекристаллизации получали 115 мг (12%) целевого продукта. Т.пл. 184-186oC.
ИК 2952, 2925, 2870, 2855, 1642, 1625, 1618, 1581, 1575, 1463, 1455, 1410, 1350, 1250, 1244, 1116, 773 см-1;
УФ (EtOH) λмакс.(ε) 212 сд. (20,710), 236 (25,000), 250 сд. (12,000), 301 (17,800);
1H-ЯМР (CDCl3) 7,74 (dd, 1H, J=2 и 8 Гц); 7,27 (t, 1H, J=8 Гц); 7,10 (dd, 1H, J= 2 и 8 Гц); 5,52 (s, 1H); 3,96 (s, 3H); 3,88 (m, 4H); 3,55 (m,, 4H);
MC: (ионы при m/e) (относ. интенс.) 261 (100), 204 (63), 203 (19), 176 (27), 122 (33), 77 (26), 55 (26), 57 (32), 43 (37);
Элементный анализ для C14H15NO4:
Вычислено: C 64,35; H 5,76; N 5,36,
Найдено: C 64,39; H 5,83; N 5,74.
Метод B: 3-метоксиметилсалицилат (547 мг, 3,0 мМ) растворяли в ТЭА (4,0 мл) и добавляли морфолининамин (400 мг, 3,7 мМ). Смесь размешивали в течение 48 ч, затем разбавляли EtOAc (200 мл) и промывали водой (5 • 20 мл), солевым раствором (30 мл) и осушали MgSO4. После выпаривания в вакууме получали 690 мг сырого продукта. Полученный продукт хроматографировали на силикагеле (50 г, 4% EtOH/CH2Cl2) и получали целевой продукт (160 мл, 20%).
Пример 21. Получение 3-амино-2-(4-морфолинил)-4H-1-бензопиран-4-она
Соединение 21:
Часть A. 2-(4-Морфолинил)-4H-бензопиран-4-он (2,00 г, 8,00 мМ) растворяли в CH2Cl2 и, размешивая при 23oC, по капле добавляли азотную кислоту. Через 2 ч смесь нагревали до 60oC и добавляли три капли серной кислоты. Реакционная смесь постепенно становилась красной и выделялся коричневый газ. Через 4 ч весь исходный материал был израсходован, о чем свидетельствовала TCX (EtOAc/CH3OH, 9/1). Затем реакционную смесь выливали на лед (30 мл), в результате чего почти сразу стали осаждаться кристаллы. Эти кристаллы отфильтровывали и промывали холодной водой. Неочищенный продукт растворяли в этилацетате (200 мл) и оставшийся преципитат удаляли фильтрацией. Слой EtOAc промывали насыщенным NaHCO3 (2 • 30 мл) и солевым раствором (50 мл), а затем осушали сульфатом магния. После роторного выпаривания получали 1,44 г (60%) 2-(4-морфолинил)-3-нитро-4H-1-бензопиран-4-она. Затем это соединение очищали с помощью колоночной хроматографии на силикагеле (EtOAc) для получения аналитического материала. Т.пл. 206-208oC.
ИК (mull) 2954, 2925, 2869, 2856, 1646, 1620, 1599, 1575, 1487, 1467, 1445, 1435, 1422, 1379, 1341, 1325, 1116 см-1;
1H-ЯМР (CDCl3) δ: 8,23 (dd, J=1,9, 8,9 Гц, 1H); 7,65 (ddd, J=2,1, 7,3, 10,2 Гц 1H); 7,39 (m, 2H); 3,90 (m, 4H); 3,62 (m, 4H);
MC (m/e) (относ. интенс.) 276 (78), 201 (36), 187 (38), 121 (100), 120 (56), 92 (30), 79 (23), 77 (21), 73 (22), 42 (25);
УФ (EtOH) λмакс.(ε) 230 (15,730), 286 (17,000), 295 сд. (14,760), 360 сд. (1,840);
Элементный анализ для C13H12N2O5:
Вычислено: C 56,52; H 4,38; N 10,14,
Найдено: C 56,53; H 4,56; N 9,79.
Часть B. 2-(4-Морфолинил)-3-нитро-4H-1-бензопиран-4-он (500 мг) растворяли в EtOAc (30 мл). В атмосфере азота добавляли палладированный угол (10%, 100 мг). Смесь помещали в гидрогенизатор Парра при давлении 30 фунтов/дюйм2 (206,8 кПа) на 4 ч, после чего фильтровали (целит, 1 см), а раствор удаляли в вакууме. Продукт очищали с помощью флеш-хроматографии (EtOAc) и получали в результате 3-амино-2-(морфолинил)-4H-1-бензопиран-4-он (419 мг, 94%). Т.пл. 140-141oC.
ИК (mull) 2954, 2925, 2856, 1621, 1607, 1551, 1466, 1423, 1382, 1277, 1271, 1240, 1115, 952, 762 см-1;
1H-ЯМР (CDCl3) δ: 8,24 (dd, J=7,8, 2,0 Гц, 1H); 7,60 (ddd, J=6,8, 6,7, 1,8 Гц 1H); 7,38 (br.d., J=7,8 Гц, 2H); 3,91-3,76 (m, 4H); 3,52-3,47 (m, 4H); 3,43 (br.s., 2H);
УФ (EtOH) λмакс.(ε) 212 (19,150), 233 (15,180), 255 сд. (9,900), 300 (3,000); 356 (12,000);
MC: ионы при m/e (относ. интенс.) 262 (21), 246 (100), 201 (21), 188 (18), 187 (40), 148 (88), 121 (52), 114 (21), 70 (36), 42 (17);
Элементный анализ для C13H14N2O3:
Вычислено: C 63,40; H 5,73; N 11,38;
Найдено: C 63,48; H 5,84; N 11,46.
Пример 22. Получение 3-хлоро-2-(4-морфолинил)-4H-1-бензопиран-4-она.
Соединение 22:
2-(4-Морфолинил)-4H-бензопиран-4-он (2,0 г, 8,0 мМ) растворяли в CH1Cl2 (20 мл). Затем по капле добавляли трет.-бутилгипохлорит (1,0 мл, 8,5 мМ) при 23oC. Реакционную смесь медленно нагревали и почти мгновенно прекращали. Растворитель удаляли в вакууме, а остаток растворяли в EtOAc (200 мл). Органический слой промывали водой (2 • 50 мл) и солевым раствором (80 мл), а затем осушали сульфатом магния. Раствор концентрировали в вакууме, получая в результате бесцветные кристаллы, которые перекристаллизовывали и получали целевой продукт (1,86 г, 91%). Т.пл. 127-128oC.
ИК (mull) 2962, 2923, 2856, 1635, 1612, 1597, 1562, 1555, 1466, 1457, 1325, 1233, 1119, 872, 762 см-1;
1H-ЯМР (200 МГц, CDCl3) δ: 8,20 (br.d., J=7,5 Гц); 7,60 (ddd, J=9,1, 6,7, 1,7 Гц, 1H); 7,36 (m, 2H); 3,88 (m, 4H); 3,74 (m, 4H);
MC (m/e) (относ. интен.) 267 (33), 266 (15), 265 (100), 231 (15), 230 (98), 209 (16), 207 (45), 120 (27), 110 (19), 41 (16);
УФ (EtOH) λмакс.(ε) 214 (18,900), 238 (18,160), 300 сд. (11,530);
Элементный анализ для C13H12N3Cl:
Вычислено: C 58,76; H 4,55; N 5,27;
Найдено: C 58,82; H 4,58; N 5,37.
Пример 23. Получение 3-бромо-2-(4-морфолинил)-4H-1-бензопиран-4-она.
Соединение 23:
2-(4-Морфолинил)-4H-1-бензопиран-4-он (2,0 г, 8,0 мМ) растворяли с CH2Cl2 (20 мл). Затем добавляли N-бромсукцинимид (1,6 г, 8,2 мМ) и реакционную смесь медленно нагревали, и исходный материал быстро исчезал, как было показано с помощью TCX. Растворитель удаляли в вакууме, а бесцветный остаток растворяли в EtOAc (200 мл) и промывали водой (4 • 30 мл), солевым раствором (50 мл) и осушали сульфатом магния. После выпаривания в роторном испарителе получали целевой продукт (2,27 г, 92%) в виде бесцветных кристаллов. Т.пл. 145-146oC.
ИК (mull) 3337, 3016, 2922, 2871, 2855, 1698, 1609, 1585, 1502, 1462, 1378, 1367, 1341, 1303, 1295, 1260, 1234, 996, 812 см-1;
1H-ЯМР (CDCl3) δ: 8,22 (dd, J = 7,9, 1,8 Гц, 1H); 7,63 (ddd, J = 8,2 7,4, 1,4 Гц, 1H); 7,44-7,28 (m, 2H); 3,90-3,84 (m, 4H);
MC (m/e) (относ. интенс.) 311 (55), 309 (55), 253 (14), 231 (17), 230 (100), 172 (21), 121 (20), 120 (15), 110 (61), 41 (16);
УФ (EtOH) λмакс.(ε) 216 (18,400), 238 (18,600), 317 (17,040);
BPMC: вычислено C13H12NO3Br 309,0001; найдено 308,9990.
Элементный анализ для C13H12NO3Br:
Вычислено: C 50,34; H 3,90; N 4,52;
Ннайдено: C 50,40; H 4,05; N, 4,46.
Относительно схемы B:
Пример 24. Получение 8-метил-2-(4-морфолинил)-7-фенилметокси-4H-1-бензопиран-4-она.
Соединение 24:
Часть A. 3-(Диметиламино)-1-(2-гидрокси-3-метил-4-бензилоксифенил)-пропен-1-он.
2-Гидрокси-3-метил-4-(фенилметокси)-ацетофенон (25 г, 98 мМ) и ДМФ-ДМА (17,9 г, 150 мМ) нагревали при 95-100oC в течение 2,75 ч. Реакцию охлаждали до комнатной температуры и избыточное количество реагента и CH3OH удаляли в вакууме, в результате чего получали темное твердое вещество. Это вещество перетирали с простым эфиром при 0oC и после фильтрации получали 19,64 г (64,4%) твердого желтого продукта. Маточный раствор также содержал продукт, но этот продукт не выделяли. Аналитический образец получали путем перекристаллизации из EtOAc/Skelly-B.
Часть B. 3-Бромо-8-метил-7-(фенилметокси)-[4H]-1-бензопиран-4-он
Виниловый амид части A (19,0 г, 61 мМ) растворяли в CHCl3 и охлаждали до 0oC. Затем в течение 5 мин по капле добавляли Br2 (9,75 г, 61 мМ) в CHCl3 (50 мл). После завершения добавления реакцию разбавляли водой (200 мл) и энергично размешивали 5 мин. Слой CHCl3 отделяли, осушали сульфатом магния, растворитель выпаривали в вакууме и получали в результате 23,1 г сырого продукта. После перекристаллизации из EtOAc получали 15,2 г (66%) аналитически чистый продукт.
Часть C: 8-Метил-2-(4-морфолинил)-7-(фенилметокси)-4H-1-бензопиран-4-он.
3-Бромохромон части B (1,0 г, 2,9 мМ) растворяли в ацетонитриле (35 мл). Затем добавляли безводный карбонат калия (371 мг, 2,9 мМ) с последующим добавлением по капле морфолина (0,252 мг, 2,9 мМ). Затем смесь перемешивали и нагревали в сосуде с обратным холодильником в течение 36 часов. Ацетонитрил удаляли в вакууме, а органический материал растворяли в этилацетате. Органическую фазу промывали водой и солевым раствором, а затем осушила сульфатом магния. Растворитель удаляли в вакууме, а остаток хроматографировали на силикагеле (CH2Cl2/Et2O; 2/1), в результате чего получали две основных фракции. Первая фракция содержала 3-амино-замещенный продукт.
Вторая фракция содержала продукт с уменьшенным циклом и целевой 2-морфолинилхромон. Указанную смесь еще раз хроматографировали (EtOAc/-CH3OH; 95/5) и получали две фракции, более быстро движущиеся и содержащие продукт с сокращенным кольцом (211 мг, 21%). Т.пл. 171-172oC.
ИК (mull) 2954, 2924, 2855, 1693, 1632, 1613, 1597, 1260, 1166, 1140, 1108, 1099, 749 см-1;
1H-ЯМР (200 МГц, CDCl3) δ: 7,64 (dd, J = 8,57, 1,27 Гц, 1H); 7,49-7,41 (m, 5H); 6,89 (s, винил, 1H), 8,84 (d, J = 8,57 Гц, 1H); 5,22 (s, 2H); 3,89-3,84 (m, 4H); 3,79-3,76 (m, 4H); 2,30 (s, 3H);
УФ (EtOH) λмакс.(ε) 204 (25,300), 205 сд. (24,500), 252 (8,550), 258 (6,670), 321 (18,900), 377 (33,100), 391 (29,300);
BPMC: для C21H21NO4 вычислено 351,1470; найдено 351,1470.
Элементный анализ для C21H21NO4:
Вычислено: C 71,78; H 6,02; N 3,99;
Ннайдено: C 71,60; H 6,15; N 3,96.
Затем, продолжая элюцию, получали целевой 2-морфолинилхромон (Соединение 24) (127 мг, 12%). Т.пл. 181,5-182,5oC.
ИК (mull) 2953, 2925, 2864, 2857, 1637, 1612, 1592, 1675, 1413, 1274, 1272, 1251, 1240, 1119, 782 см-1;
1H-ЯМР (200 МГц, CDCl3) δ: 8,00 (d, J = 9,1 Гц, 1H); 7,47-7,38 (m, 5H); 6,98 (d, J = 9,1 Гц, 1H); 7,47-7,38 (m, 5H); 6,98 (d, J = 9,1 Гц, 1H); 5,44 (s, 1H); 5,19 (s, 2H); 3,89-3,84 (m, 4H); 3,54-3,49 (m, 4H); 2,33 (s, 3H);
УФ (EtOH) λмакс.(ε) 217 (33,610), 239 (23,600), 291 сд. (13,980), 312 (26,160), 376 (509);
BPMC: для C21H21NO4 вычислено 351,1470; найдено 351,1464.
Элементный анализ для C21H21NO4:
Вычислено: C 71,78; H 6,02; N 3,99;
Найдено: C 71,79; H 5,99; N 3,98.
Пример 25. Получение 2-(4-морфолинил)-5-(фенилметокси)-4H-1-бензопиран-4-она.
Соединение 25:
Часть A: 6-Бензилокси-2-гидроксиацетофенон
2,6-Дигидроксиацетофенон (84,48 г, 0,55 М), бензилбромид (95 г, 0,55 М) и K2CO3 (120 г) добавляли к ацетону (750 мл). Полученную смесь нагревали в сосуде с обратным холодильником в атмосфере азота, энергично перемешивая в вертикальном смесителе в течение 18 ч. Затем реакционную смесь охлаждали до комнатной температуры и фильтровали. Фильтрат упаривали в вакууме и получали маслянистый полутвердый продукт. Этот продукт растворяли в CH2Cl2 и промывали 1н. HCl. CH2Cl2-раствор осушали сульфатом магния, растворитель удаляли и получали маслянистое светлое вещество. Этот материал хроматографировали на силикагеле (400 г), элюируя CH2Cl2, в результате чего получали 72,8 г (54,5%) продукта. Аналитический образец получали путем перекристаллизации из EtOAc/Stelly-B.
Часть B: 3-(Диметиламино)-1-(2-гидрокси-6-бензилоксифенил)-пропен-1-он.
Смесь 6-бензилокси-2-гидроксиацетофенона (15,0 г, 62 мМ) и N,N-диметилформамиддиметилацеталя (ДМФ-ДМА; 10,71 г, 90 мМ) нагревали в атмосфере азота в течение 2 ч при 100-110oC. В течение нескольких минут нахождения реакционной смеси в масляной бане уже при 100oC исходная гетерогенная смесь становилась гомогенной и темной по цвету. Еще через несколько минут твердое вещество начинало отделяться, и в конце реакционного времени колба заполнялась твердым желтым веществом. Реакцию охлаждали до комнатной температуры, а избыток ДМФ-ДМА и метанол удаляли в вакууме. Полученный в результате твердый продукт фильтровали с использованием эфира и осушали воздухом, в результате чего получали 15,41 г (83,7%) чистого продукта. Аналитический образец приготавливали путем перекристаллизации из EtOAc.
Часть C: 5-Бензилокси-3-бромо-[4H]-1-бензопиран-4-он
Виниловый амид части B (10,0 г, 33,6 мМ) растворяли в CHCl3 (150 мл) и охлаждали до 0oC. К полученному раствору в течение 10 минут по капле добавляли Br2 (5,38 г, 33,6 мМ) в CHCl3 (50 мл). После завершения добавления реакцию разбавляли водой и энергично размешивали 5 мин. Органический слой отделяли, промывали солевым раствором, осушали сульфатом магния, упаривали и получали темно-красное вещество. Это вещество хроматографировали на силикагеле (400 г), элюируя 1% CH3OH/CH2Cl2 и после перекристаллизации из EtOAc/Skelly-B получали 4,75 г (42,8%) продукта.
5-Бензилоксибромохромон части B (3,31 г, 10,0 мМ) растворяли в ацетонитриле (50 мл). Добавляли безводный карбонат калия (1,38 г, 10,0 мМ), а затем добавляли морфолин (1,02 мл, 110 мМ). Смесь нагревали с обратным холодильником 72 ч. Растворитель удаляли в вакууме, а остаток растворяли в EtOAc (400 мл) и промывали водой (3 • 50 мл) и солевым раствором (100 мл), после чего осушали сульфатом магния. Растворитель удаляли в вакууме, а остаток очищали с помощью флеш-хроматографии (CHCl3/CH3OH, 99/1), в результате чего получали три фракции. Первая фракция содержала 3-морфолинилхромон (0,92 г, 51%). Т.пл. 122,5-124oC.
ИК (mull) 2956, 2924, 2856, 1641, 1604, 1464, 1459, 1269, 1235, 1180, 1115, 1070, 1064, 772, 699 см-1;
1H-ЯМР (200 МГц, CDCl3) δ: 7,61 (dd, J = 6,7, 1,5 Гц, 1H); 7,59-7,29 (m, 5H); 6,98 (dd, J = 8,2, 1,5 Гц, 1H); 6,77 (dd, J = 8,2, 1,5 Гц, 1H); 5,31 (s, 2H); 3,94-3,90 (m, 4H); 3,08-3,04 (m, 4H);
УФ (EtOH) λмакс.(ε) 244 (22,700), 249 (21,500), 336 (6,270);
Элементный анализ для C20H19NO4:
Вычислено: C 71,20; H 5,68; N 4,15
Найдено: C 70,84; H 5,75; N 4,05.
Вторая фракция содержала продукт с сокращенным кольцом (0,60 г, 33%). Т. пл. 179-181oC.
Третья фракция содержала целевой 2-морфолинилхромон (Соединение 25) (0,29 г, 16%). Т.пл. 139-140oC.
ИК (mull) 2954, 2926, 2870, 2855, 1640, 1623, 1615, 1600, 1470, 1449, 1407, 1239, 1122, 745, 740 см-1;
1H-ЯМР (CDCl3, 200 МГц) δ: 7,65 (br.d.., J = 7,2 Гц, 2H); 7,47-7,30 (m, 4H); 6,92 (dd, J = 8,1, 0,9 Гц, 1H); 6,85 (br.d., J = 8,1 Гц, 1H); 5,45 (s, 1H); 5,32 (s, 2H); 3,89-3,85 (m, 4H); 3,52-3,47 (m, 4H);
УФ (EtOH) λмакс.(ε) 210 (32,900), 238 (23,500), 252 сд. (8,040), 260 сд. (5,650), 313 (18,460);
MC: ионы при m/e (отн. интенс.) 91 (100), 337 (66), 231 (36), 174 (33), 173 (16), 338 (16), 336 (15), 218 (15), 65 (14), 146 (12);
BPMC: для C20H19NO4 вычислено 337,1314; найдено 337,1312.
Элементный анализ для C20H19NO4:
Вычислено: C 71,20; H 5,58; N 4,16;
Найдено: C 71,05; H 5,56; N 4,17.
Пример 26. Получение 7,8-диметокси-2-(4-морфолинил)-4H-1-бензопиран-4-она.
Соединение 26:
Часть A: 7,8-Диметокси-3-бромохромон [R.B.Gammill, Synthesis (1979) стр. 901], (3,42 г, 12,0 мМ) растворяли в ацетонитриле (100 мл) и добавляли безводный карбонат калия (1,66 г, 12,0 мМ). Затем по капле добавляли морфолин (1,10 мл, 12,5 мМ) и реакционную смесь нагревали с обратным холодильником в течение 24 ч (температура бани 82oC). Ацетонитрил удаляли в вакууме, а смесь растворяли в этилацетате (400 мл). Раствор промывали водой (2 • 50 мл) и солевым раствором (100 мл), осушали сульфатом магния, концентрировали в вакууме и получали в результате твердый продукт желтого цвета. Этот продукт хроматографировали с помощью флешхроматографии на силикагеле (EtOAc/MeOH, 95/5) и получали 3-морфолиниладдукт (2,77 г, 79%), продукт сокращения цикла (0,24 г, 6,9%) и 0,23 г смеси продукта сокращения цикла и 2-замещенного продукта (79%). Т.пл. 168-169oC.
ИК (mull) 2952, 2924, 2866, 2854, 1639, 1619, 1509, 1456, 1441, 1433, 1322, 1291, 1200, 1171 см-1;
1H-ЯМР (200 МГц, CDCl3) δ: 8,0 (d, 1H); 7,56 (c, 1H, =C(H)OAr), 7,02 (d, 1H, J=8,9 Гц), 4,0 (s, 3H, OCH3), 3,98 (s, 3H, OCH3), 3,91 (m, 4H), 3,08 (m, 4H);
УФ (EtOH) λмакс.(ε) 247 (30,060), 303 (7,490), 326 (3,990);
BPMC: для C15H17NO5: вычислено 291,1107; найдено 291,1110.
Элементный анализ для C15H17NO5:
Вычислено: C 61,85; H 5,88; N 4,81;
Найдено: C 61,79; H 5,86; N 4,74.
Часть B: Смесь продукта с сокращенным кольцом и 2-морфолинилхромона еще раз хроматографировали (SiO2, CH2Cl2/CH3OH, 98/2). Продукт с сокращенным кольцом перекристаллизовывали из EtOH и получали бледно-желтые кристаллы. Т. пл. 180-181oC.
2-Морфолинилхромон перекристаллизовывали из EtOH и получали целевой продукт (Соединение 26) в виде бесцветных кристаллов. Т.пл. 194,5-195,55oC.
1H-ЯМР (CDCl3) δ: 7,88 (d, J = 8,8 Гц, 1H); 6,97 (d, J = 8,8 Гц, 1H); 5,43 (s, 1H); 3,98 (s, 3H); 3,94 (s, 3H); 3,86 (m, 4H); 3,55 (m, 4H);
УФ (EtOH) λмакс.(ε) 217 (27,140), 239 (23,530), 270 (6,700), 311 (23,530);
BPMC для C15H17NO5: вычислено 291,1107; найдено 291,1093.
Элементный анализ для C15H17NO5:
Вычислено: C 61,85; H 5,88; N 4,81;
Найдено: C 61,85; H 5,83; N 4,78.
Пример 27. Получение 2-(4-метил-1-пиперазинил)-4H-1-бензопиран-4-она.
Соединение 27:
Процедура этого примера в общих чертах проиллюстрирована на схеме B, и в результате осуществления этой процедуры получали целевое соединение.
Относительно схемы C:
Пример 28. Получение 8-метил-7-(фенилметокси)-2-[4-(2- пиридинил)-1-пиперазинил]-4H-бензопиран-4-она.
Соединение 28:
Часть A: Получение 8-метил-7-(фенилметокси)-2-меркаптто-4H-1-бензопиран-4-она
Трет.-бутоксид калия (65,5 г) покрывали 500 мл бензола в атмосфере азота и раствор помещали в водяную баню. 4'-Бензилокси-2'-гидрокси-3'-метилацетофенон (50,0 г) и сероуглерод (14,82 г) растворяли в 500 мл бензола и по капле в течение часа добавляли к раствору трет.-бутоксида калия. После завершения добавления темно-красную пасту размешивали в течение ночи при комнатной температуре, а затем разбавляли 1 л воды. Эту смесь выливали в делительную воронку, а органический слой отбрасывали. Водный раствор разбавляли 300 мл 20%-ной H2SO4, а твердое вещество собирали фильтрацией, осушали воздухом и получали 31,0 г желтого порошка. Т.пл. 245oC.
[D] 2954, 2869, 2855, 1619, 1602, 1542, 1499, 1462, 1455, 1377, 1305, 1280, 1113, 1076, 822 см-1;
УФ (EtOH) λмакс.(ε) 208 (34260), 231 (24940), 252 (15070), 263 сд. (9470), 285 (5030), 299 (4930), 353 (18200), 392 (6840);
1H-ЯМР (DMSO-d6) δ:/ 7,73 (d, 1H, J = 8,9 Гц); 7,45 (m, 5H, аром.); 7,24 (d, 1H, J = 8,9 Гц); 6,58 (s, 1H, винил при C-3); 5,29 (s, 2H); 2,29 (s, 3H, -CH3);
MC (ионы при m/e) (отн. инт.) 298 (12), 207 (1), 179 (1), 149 (1), 121 (1), 91 (100), 65 (6), 43 (1). [см. Bantick J.R. и Suschitzky J.L., J. Heterocyclie Chem., 18, 679 (1981)].
Часть B: 8-Метил-7-(фенилметокси)-2-меркапто-4H-1-бензопиран-4-он (2,0 г, 6,7 мМ), 1-(2-пиридил)пиперазин (1,19 г, 7,3 мМ) и TsOH (25 мг) добавляли к толуолу и нагревали с обратным холодильником в течение 20 ч.
Реакционную температуру понижали до комнатной, а толуол удаляли в вакууме. Полученный темный маслянистый продукт разводили EtOAc и выпавшие кристаллы собирали на фильтре, в результате чего получали 2,42 г продукта. Т. пл. 148 - 149oC.
Следуя основной процедуре, описанной в примере 28, но используя соответствующий амин вместо 1-(2-пиридил)пиперазина, получали следующие соединения:
Соед. 29: 8-метил-7-(фенилметокси)-2-(1-пиперазинил)-4H- бензопиран-4-он, Т. пл. 165 - 170oC;
Соед. 30: 8-метил-7-(фенилметокси)-2-(1-пирролидинил)-4H- бензопиран-4-он, Т. пл. 190 - 193oC;
Соед. 31: 8-метил-7-(фенилметокси)-2-(1-пиперидинил)-4H-бензопиран-4-он, Т. пл. 172 - 174oC;
Соед. 32: 8-метил-2-(4-метил-1-пиперазинил)-7-(фенилметокси)-4H- бензопиран-4-он, Т. пл. 180 - 181oC;
Соед. 33: 8-метил-7-(фенилметокси)-2-(2,6-диметил-4-морфолинил)- 4H-бензопиран-4-он, Т. пл. 166 - 168oC;
Соед. 34: 2-[4-(гидроксиэтил)-1-пиперазинил]-8-метил-7- (фенилметокси)-4H-бензопиран-4-он, моногидрохлорид, Т. пл. 235 - 255oC;
Соед. 35: 2-[4-(дифенилметил)-1-пиперазинил]-8-метил-7- (фенилметокси)-4H-бензопиран-4-он, Т. пл. 90 - 95oC;
Соед. 36: 8-метил-7-(фенилметокси)-2-(4-фенил-1-пиперидинил)- 4H-бензопиран-4-он, Т. пл. 193 - 194oC;
Соед. 37: 8-метил-7-(фенилметокси)-2-(4-фенил-1-пиперазинил)- 4H-бензопиран-4-он, Т. пл. 153 - 154oC;
Соед. 38: 2-(4-гидрокси-1-пиперидинил)-8-метил-7-(фенилметокси)- 4H-бензопиран-4-он.
Относительно схемы D и E:
Пример 39. Получение 7-гидрокси-2-(4-морфолинил)-8-метил-4H-1- бензопиран-4-она.
Соединение 39: (в соответствии со схемой 1) Часть A: 8-Метил-2-(4-морфолинил)-7-(фенилметокси)-4H-1-бензопиран-4- он (8,59 г, 24,4 мМ) суспендировали в 250 мл этилацетата. Затем добавляли 9,9 мл циклогексана с последующим добавлением 0,85 г 10% палладированного угля. Смесь нагревали в колбе с обратным холодильником в течение 18 ч. После этого реакцию охлаждали и фильтровали, твердый остаток растворяли в метаноле, сливали и фильтровали. Метанол выпаривали и получали 4,71 г (74%) фенола; т. пл. > 250oC.
Альтернативная часть A: 2',4'-дигидрокси-3'-метил-ацетофенон (с чистотой 90%, 1,108 г, 6 мМ) суспендировали в 25 мл 1,2-дихлорэтана и полученную смесь обрабатывали трифторидэфиратом бора (1,48 мл, 12 мМ), размешивая при этом в 50 мл одногорловой круглодонной колбе в атмосфере азота. Смесь размешивали 30 мин при комнатной температуре и после этого обрабатывали морфолин-4-фосгениминия хлоридом (2,70 г, 13,2 мМ). Затем реакционную смесь нагревали до 70oC в течение 3 ч. После этого реакцию охлаждали до комнатной температуры, и нерастворившийся твердый продукт оранжевого цвета собирали фильтрацией; осадок на фильтре тщательно промывали диэтилэфиром. Твердый продукт растворяли в 25 мл ацетонитрила в 50-мл одногорловой круглодонной колбе в присутствии азота, и полученный раствор охлаждали до 0oC. Смесь обрабатывали 2,5 мл воды и реакционную смесь размешивали 48 ч, пока не закончится охлаждение ванны. Ацетонитрил удаляли в вакууме, и остаток осторожно разбавляли 75 мл смеси насыщенного бикарбоната натрия и хлорида натрия (2:1). Смесь экстрагировали дихлорметаном (4 • 35 мл). Органические слои объединяли, сушили сульфатом магния, концентрировали в вакууме и получали твердый продукт янтарного цвета. Этот продукт последовательно промывали этилацетатом и диэтилэфиром и получали в результате 980 мг [8-метил-2-(4-морфолин)-4-оксо-4H-бензопиран-7-ил]- 4-морфолинил-карбоновой кислоты сложного эфира (Соединение 100), Т. пл. 232 - 234oC. Карбамат (945 мг , 2,51 мМ) суспендировали в 9 мл смеси метанола и воды (2:1) в 25-мл одногорловой круглодонной колбе в присутствии азота. Суспензию обрабатывали гидроокисью лития (236 мг, 5,62 мМ) и реакционную смесь размешивали 48 ч при комнатной температуре. Метанол удаляли в вакууме, а pH водного остатка доводили до pH 4,9 путем добавления 5% HCl. Осажденный материал собирали фильтрацией и сушили в вакууме при 25oC, в результате чего получали 569 мг (87%, фенола 39), (Т. пл. > 250oC) в виде сероватого мелообразного вещества.
Вторая альтернативная часть A: 2',4'-Дигидрокси-3'-метил-ацетофенон (90% чистоты, 18,46 г, 100 мМ) суспендировали в 50 мл диэтилового эфира в 100-мл одногорловой круглодонной колбе в атмосфере азота. Смесь обрабатывали трифторидэфиратом бора (18,45 мл, 150 мМ) и полученную реакционную смесь размешивали в течение ночи при комнатной температуре. Осадок собирали фильтрацией и промывали свежим диэтилэфиром. Фильтрат осушали воздухом и получали 10,45 г (47%) дифторбороната соли в виде желтого твердого продукта.
Этот дифторборонат (10,45 г, 47 мМ) объединяли с хлоридом морфолин-4-фосфгениминия (21,2 г, 104 мМ) в 125 мл 1,2-дихлорэтана в 250-мл одногорловой круглодонной колбе в присутствии аргона. Реакционную смесь нагревали до 70oC в течение 3 ч и охлаждали до комнатной температуры. Оранжево-желтый осадок собирали фильтрацией и промывали 1,2-дихлорэтаном, а затем диэтилэфиром, в результате чего получали 25,3 твердого вещества оранжевого цвета. Это вещество суспендировали в 200 мл ацетонитрила в 500-мл одногорловой круглодонной колбе и смесь охлаждали до 0oC. Охлажденную смесь обрабатывали 20 мл воды, а затем размешивали 20 мин при 0oC и в течение ночи при комнатной температуре. После этого смесь охлаждали до -33oC в течение 2 ч, и охлажденную гидрохлоридную соль собирали фильтрацией и промывали 125 мл охлажденного льдом ацетонитрила. Осадок на фильтре сушили и получали 13,25 г (69%) гидрохлорида карбамат-хромона в виде белого твердого продукта. Фильтрат концентрировали в вакууме до получения сиропа янтарного цвета. Этот сироп разбавляли 100 мл насыщенного бикарбоната натрия, и смесь экстрагировали дихлорметаном (4 • 50 мл). Объединенные органические слои осушали сульфатом магния и концентрировали в вакууме до получения маслянистого красноватого вещества, после кристаллизации которого из этилацетата получали 875 мг 5% желтого твердого карбамат-хромона. После его гидролиза способом, описанным в методике B, получали целевой фенол. Часть B: 7-Гидрокси-8-метил-2-(4-морфолинил)-1H-1-бензопиран-4-он (0,50 г, 1,91 мМ) суспендировали в 15 мл ацетонитрила. Затем добавляли 1,3 г карбоната калия, а после этого 0,39 г (2,1 мМ) альфабромо-п-ксилола. Смесь нагревали с обратным холодильником 5 ч. Затем добавляли 0,04 г дополнительного агента алкилирования и смесь нагревали с обратным холодильником еще 2 с. Охлажденную смесь разбавляли 5 мл воды и фильтровали. Белый осадок промывали водой и сушили. После перекристаллизации из этилацетата получали 0,59 г (84%) (соединение 48); т. пл. 167,5 - 168oC.
Следуя основной процедуре примера 39, но используя соответствующий фенилметоксиаминохромон вместо (7-фенилметокси)-8- метил-2-(4-морфолинил)-4H-бензопиран-4-она, получали следующие соединения:
Соед. 40: 6-гидрокси-2-(4-морфолинил)-4H-1-бензопиран-4-он, Т. пл. 290 - 292oC;
Соед. 41: 7-гидрокси-2-(4-морфолинил)-4H-1-бензопиран-4-он;
Соед. 42: 5-гидрокси-2-(4-морфолинил)-4H-1-бензопиран-4-он, Т. пл. 295 - 297oC;
Соед. 43: 8-гидрокси-2-(4-морфолинил)-4H-1-бензопиран-4-он, Т. пл. 300oC;
Соед. 44: 7-метокси-8-метил-2-(4-морфолинил)-4H-1-бензопиран- 4-он, Т. пл. 224,5 - 225,5oC;
Соед. 45: [[8-метил-2-(4-морфолинил)-4H-1-бензопиран-7- ил]окси]уксусной кислоты литиевая соль;
Соед. 46: [[8-метил-2-(4-морфолинил)-4-окси-4H-1-бензопиран- 7-ил]окси] уксусной кислоты сложный метиловый эфир, Т. пл. 181 - 182oC;
Соед. 47: 7-[(4-метоксифенил)метокси]-8-метил-2-(4-морфолинил)- 4H-1-бензопиран-4-он, Т. пл. 171 - 172oC;
Соед. 48: 8-метил-7-[(4-метилфенил)метокси] -2-(4-морфолинил)- 4H-1-бензопиран-4-он, Т. пл. 167,5 - 167,8oC;
Соед. 49: 7-[)4-хлорфенил)метокси]-8-метил-2-(4-морфолинил)- 4H-1-бензопиран-4-он, Т. пл. 226 - 227oC;
Соед. 50: 7-[(4,5-дихлорфенил)метокси]-8-метил-2-(4- морфолинил)-2H-1-бензопиран-4-он, Т. пл. 243 - 244oC;
Соед. 51: 8-метил-2-(4-морфолинил)-7-(2-пиридинилметокси)- 4H-1-бензопиран-4-он, Т. пл. 174 - 175,5oC;
Соед. 52: 8-метил-7-[[(фенил)карбонил] окси] -2-(4- морфолинил)-4H-1-бензопиран-4-он, Т. пл. 223,5 - 223,25oC;
Соед. 53: 8-метил-7-[2-[4-метил1(1-пиперизинил)]этил]окси-2- (4-морфолинил)-4H-1-бензопиран-4-он, Т. пл. 159,0 - 159,5oC;
Соед. 54: 7-[[4-±1,1-диметилэтил)фенил]метокси]-8- метил-2-(4-морфолинил)-4H-1-бензопиран-4-он, Т. пл. 218,5 - 220oC;
Соед. 55: 8-метил-2-(4-морфолинил)-7-[[(4-фенилметокси)фенил]метокси]- 4H-1-бензопиран-4-он, Т. пл. 110 - 111oC;
Соед. 56: 7-[(3-метоксифенил)метокси]-8-метил-2-(4- морфолинил)-4H-1-бензопиран-4-он, Т. пл. 153,5 - 155,5oC;
Соед. 57: 7-[(4-нитрофенил)метокси] -8-метил-2-(4- морфолинил)-4H-1-бензопиран-4-он, Т. пл. 285oC с разл.;
Соед. 58: 7-[(2-фенилэтил)метокси]-8-метил-2-(4- морфолинил)-4H-1-бензопиран-4-он, Т. пл. 200,5 - 201,5oC с разл.;
Соед. 59: 7-[(2-метоксифенил)метокси]-8-метил-2-(4- морфолинил)-4H-1-бензопиран-4-он, Т. пл. 202 - 203oC;
Соед. 60: 7-[(4-этоксифенил)метокси] -8-метил-2-(4- морфолинил)-4H-1-бензопиран-4-он, Т. пл. 186 - 188oC;
Соед. 61: 8-(4-этоксибензилокси)-2-(4-морфолинил)-4H-1- бензопиран-4-он, Т. пл. 149,5 - 151,5oC;
Соед. 62: 2-(4-морфолинил(-8-(4-нитробензилокси)-4H-1- бензопирпн-4-он, Т. пл. 240 - 241oC;
Соед. 63: 8-(2-метоксибензилокси)-2-(4-морфолинил)-4H-1- бензопиран-4-он, Т. пл. 149 - 150oC;
Соед. 64: 2-(4-морфолинил)-8-(2-фенилэтокси)-4H-1- бензопиран-4-он, Т. пл. 131 - 132oC;
Соед. 65: 2-(4-морфолинил)-(2-оксо-2-фенилэтокси)-4H-1- бензопиран-4-он, Т. пл. 200 - 201,5oC;
Соед. 66: 8-(4-бензилоксибензилокси)-2-(4-морфолинил)-4H- бензопиран-4-он, Т. пл. 143,5 - 145oC;
Соед. 67: 8-(4-хлоробензилокси)-2-(4-морфолинил)-4H-1- бензопиран-4-он, Т. пл. 208 - 209oC;
Соед. 68: 8-(4-трет. -бутилбензилокси)-2-(4-морфолинил)-4H-1- бензопиран-4-он, Т. пл. 165,5 - 166,5oC;
Соед. 69: 8-(3-метоксибензилокси)-2-(4-морфолинил)-4H-1- бензопиран-4-он, Т. пл. 177 - 178oC;
Соед. 70: 8-(3,4-дихлоробензилокси)-2-(4-морфолинил)-4H-1- -бензопиран-4-он, Т. пл. 207 - 208oC;
Соед. 71: 8-(4-метоксибензилокси)-2-(4-морфолинил)-4H-1- бензопиран-4-он, Т. пл. 177 - 178oC;
Соед. 72: 8-(4-метоксибензилокси)-2-(4-морфолинил)-4H-1- бензопиран-4-он, Т. пл. 173,5 - 174,5oC;
Соед. 73: 2-(4-морфолинил)-8-(нафтил-2-метилокси)-4H-1- бензопиран-4-он, Т. пл. 200,5 - 201,5oC;
Соед. 74: 2-(4-морфолинил)-8-(нафтил-1-метилокси)-4H-1- бензопиран-4-он, Т. пл. 192,5 - 193,5oC;
Соед. 75: 8-метил-2-(4-морфолинил)-7-(нафтил-2-метилокси)- 4H-1-бензопиран-4-он, Т. пл. 158,5 - 159,5oC;
Соед. 76: 8-метил-2-(4-морфолинил)-7-(нафтил-1-метилокси)- 4H-1-бензопиран-4-он, Т. пл. 205,5 - 207oC;
Соед. 77: 2-(диметиламино)-8-метил-4-оксо-4H-1-бензопиран-7- из карбаминовой кислоты сложный диметиловый эфир;
Соед. 78: 2-(диметиламино)-4-оксо-4H-1-бензопиран-6-ил карбаминовой кислоты сложный диметиловый эфир, Т. пл. 179,5 - 180oC;
Соед. 79; 2-(диметиламино)-4-оксо-4H-1-бензопиран-7-ил карбаминовой кислоты сложный диметиловый эфир, Т. пл. 158 - 159oC;
Соед. 80: 2-(диметиламино)-4H-1-бензопиран-4-он, Т. пл. 122 - 123,5oC;
Соед. 81: 2-(диметиламино)-8-метил-7-(фенилметокси)-4H-1- бензопиран-4-он, Т. пл. 165 - 166oC;
Соед. 102: 8-метил-2-(4-морфолинил)-7-(2-оксо-2-фенилэтокси)- 4H-1-бензопиран-4-он, Т. пл. 226,5 - 227,5oC;
Соед. 103: 6-хлоро-8-метил-2-(4-морфолинил)-7- фенилметокси)-4H-1-бензопиран-4-он, Т. пл. 207 - 209oC;
Соед. 104: [[2-(4-морфолинил)-4-оксо-4H-1-бензопиран-8-ил]- окси]уксусной кислоты сложный метиловый эфир, Т. пл. 192,5 - 193oC;
Соед. 105: 4-[[[8-метил-2-(4-морфолинил)-4-оксо-4H-1- бензопиран-7-ил] окси]метил]бензойной кислоты сложный метиловый эфир, Т. пл. 226 - 228oC;
Соед. 106: 4-[[[2-(4-морфолинил)-4-оксо-4H-1-бензопиран-8- ил]окси]метил]бензойной кислоты сложный метиловый эфир, Т. пл. 207 - 209oC;
Соед. 107: 8-метил-2-(4-морфолинил)-7-[[3- трифторметил)фенил]метокси] -4H-1-бензопиран-4-он, Т. пл. 194,5 - 195,5oC;
Соед. 108: 2-(4-морфолинил)-8-[[3-(трифторметил)фенил]метокси]- 4H-1-бензопиран-4-он, Т. пл. 204 - 204,5oC;
Соед. 109: 7-(циклогексилметокси)-8-метил-2-(4-морфолинил)- 4H-1-бензопиран-4-он, Т. пл. 184,5 - 185,5oC;
Соед. 110: 8-метил-2-(4-морфолинил)-7-(2-пропенилокси)-4H-1- бензопиран-4-он, Т. пл. 191 - 192oC;
Соед. 111: 2-(4-морфолинил)-7-(1-нафталенилметокси)-4H-1- бензопиран-4-он, Т. пл. 195,2 - 195,8oC;
Соед. 112: 8-метил-2-(4-морфолинил)-7-(3-пиридинилметокси)-4H- 1-бензопиран-4-он, Т. пл. 182,5 - 184oC;
Соед. 113: 8-метил-2-(4-морфолинил)-7-(4-пиридинилметокси)-4H- 1-бензопиран-4-он, Т. пл. 253,5 - 255,5oC;
Соед. 115: 8-метил-2-(4-морфолинил)-7-(2-хиноксалинилметокси)- 4H-1-бензопиран-4-он, Т. пл. 250,5 - 252,5oC;
Соед. 116: 8-метил-2-(4-морфолинил)-7-(пиразинилметокси)-4H-1- бензопиран-4-он, Т. пл. 236 - 237oC;
Соед. 117: 8-метил-2-(4-морфолинил)-7-(2-пиридинилметокси)-4H- 1-бензопиран-4-он, N-оксид, Т. пл. 248 - 249,5oC;
Соед. 118: 8-метил-2-(4-морфолинил)-7-(3-пиридинилметокси)-4H- 1-бензопиран-4-он, N-оксид, Т. пл. 233,5 - 234oC;
Соед. 119: 8-иодо-2-(4-морфолинил)-7-(3-пиридинилметокси)-4H- 1-бензопиран-4-, Т. пл. 214 - 215oC;
Соед. 120: 3,3-диметил-1-[[8-метил-2-(4-морфолинил)-4-оксо- 4H-1-бензопиран-7-ил]окси]бутан-2-он, Т. пл. 197 - 198oC;
Соед. 121: 1-[[8-метил-2-(4-морфолинил)-4-оксо-4H-1- бензопиран-7-ил] окси]пропан-2-он, Т. пл. 206,5oC;
Соед. 122: 1-[[8-метил-2-(4-морфолинил)-4-оксо-4H-1- бензопиран-7-ил] окси]бутан-2-он, Т. пл. 183 - 184oC;
Соед. 123: 8-метил-2-(4-морфолинил)-7-(2-оксо-2-(2-нафтил)- этокси)-4H-1-бензопиран-4-он, Т. пл. 214,5 - 215,5oC;
Соед. 125: 2-(4-морфолинил)-7-(2-пиридинилметокси)-4H-1- бензопиран-4-он, Т. пл. 274 - 276oC;
Соед. 126: 2-(4-морфолинил)-7-(3-пиридинилметокси)-4H-1- бензопиран-4-он, Т. пл. 193 - 194oC;
Соед. 127: 2-(4-морфолинил)-8-(2-пиридинилметокси)-4H-1- бензопиран-4-он, Т. пл. 199 - 200oC;
Соед. 128: 2-(4-морфолинил)-8-(3-пиридинилметокси)-4H-1- бензопиран-4-он, Т. пл. 160 - 161oC;
Соед. 129: 8-метил-2-(4-морфолинил)-7-(2-хинолинилметокси)-4H- 1-бензопиран-4-он, Т. пл. 223,5 - 224,5oC;
Соед. 130: 7,8-(бис)-фенилметокси-2-(4-морфолинил)-4H-1- бензопиран-4-он, Т. пл. 165,5 - 167oC;
Соед. 131: 7,8-(бис)-ацетилокси-2-(4-морфолинил)-44H-1- бензопиран-4-он, Т. пл. 231,5 - 233oC;
Соед. 132: 7,8-(бис)-гидрокси-2-(4-морфолинил)-4H-1- бензопиран-4-он, Т. пл. > 300oC;
Соед. 133: 7-гидрокси-2-(4-морофлинил)-8-фенилметокси-4H-1- бензопиран-4-он, Т. пл. 198 - 199oC;
Соед. 134: 7,8-(бис)-(3-трифторметил)фенилметокси-2-(4- морфолинил)-4H-1-бензопиран-4-он, Т. пл. 178,5 - 179,5oC;
Соед. 135: 8-гидрокси-2-(4-морфолинил)-7-(3- трифторметил)фенилметокси-4H-1-бензопирин-4-он, Т. пл. 262 - 262,5oC;
Соед. 136: 7-гидрокси-2-(4-морфолинил)-8-(3- трифторметил)фенилметокси-4H-1-бензопиран-1-он, Т. пл. 236 - 237oC;
Соед. 137: 7-[3-(1-циклогексил-1H-тетразол-5-ил)-пропокси- 8-метил-2-(4-морфолинил)-4H-1-бензопиран-4-он, Т. пл. 228 - 230oC;
Соед. 138: 8-[3-(1-циклогексил-1H-тетразол-5-ил)пропокси]- 2-(4-морфолинил)-4H-1-бенозопиран-4-он, Т. пл. 185 - 186oC;
Соед. 139: 7-[(1-циклогексил-1H-тетразол-5-ил)метокси]-8- метил-2-(4-морфолинил)-4H-1-бензопиран-4-он, Т. пл. 228oC;
Соед. 140: 8-[(1-циклогеквил-1H-тетразол-5-ил)метокси]-5- ил-2-(4-морфолинил)-4H-1-бензопиран-4-он, Т. пл. 218oC;
Соед. 141: 2-(4-морфолинил)-8-[(1-фенил-1H-тетразол-5- ил)окси]-4H-1-бензопиран-4-он, Т. пл. 214 - 215oC;
Соед. 142: N-циклогексил-2-[[2-(4-морфолинил)-4-оксо-4H-1- бензопиран-8-ил]окси]ацетамид, Т. пл. 238 - 241oC;
Соед. 143: N-(1,1-диметилэтил)-2-[[2-(4-морфолинил)-4- оксо-4H-1-бензопиран-8-ил]окси]ацетамид, Т.. пл. 219 - 220oC;
Соед. 144: 2-[[2-(4-морфолинил)-4-оксо-4H-1-бензопиран-8- ил]-N-фенилацетамид, Т. пл. 225 - 228oC;
Соед. 145: 2-[[2-(4-морфолинил)-4-оксо-4H-1-бензопиран-8-ил]- окси]-N-(1-фенилэтил)-ацетамид, Т. пл. 178 - 180oC;
Соед. 146: N-циклогексил-2-[[8-метил-2-(4-морфолинил)-4- оксо-4H-1-бензопиран-7-ил]окси]ацетамид, Т. пл. 255 - 256oC;
Соед. 147: N-[[[8-метил-2-(4-морфолинил)-4-оксо-4H-1- бензопиран-7-ил] окси]ацетил]-фенилаланин, сложный этиловый эфир, Т. пл. 173 - 175oC;
Соед. 148: 2-[[8-метил-2-(4-морфолинил)-4-оксо-4H-1- бензопиран-7-ил]окси]-N-фенилацетамид, Т. пл. 242 - 244oC;
Соед. 149: 8-метил-2-(4-морфолинил)-7-[(1-фенил-1H-татразол-5- ил)окси] -4H-1-бензопиран-4-он, Т. пл. 209 - 211oC;
Соед. 150: 6-[(1-циклогексил-1H-тетразол-5-ил)метокси]-2- (4-морфолинил)-4H-1бензопиран-4-он, Т. пл. 215 - 217oC;
Соед. 151: 2-[[8-метил-2-(4-морфолинил)-4-оксо-4H-1-бензопиран-7-ил] окси]- N-(1-фенилэтил)-ацетамид, Т. пл. 203 - 205oC;
Соед. 152: 2-[[8-метил-2-(4-морфолинил)-4-оксо-4H-1- бензопиран-7-ил] окси]-N-3-пиридинилацетамид, Т. пл. 243 - 245oC;
Соед. 153: N-[[[8-метил-2-(4-морфолинил)-4-оксо-4H-1- бензопиран-7-ил] окси]ацетил]-фенилаланин, Т. пл. 259 - 262oC;
Соед. 154: 7-(2,2-диметилоксиэтокси)-8-метил-2-(4-морфолинил)- 4H-1-бензопиран-4-он, Т. пл. 168 - 169oC;
Соед. 155: 2-(4-морфолинил)-8-(2-пропенил)-4H-1-бензопиран-4- он, Т. пл. 145,5 - 146,5oC;
Соед. 156: 2-(4-морфолинил)-8-(1-пропенил)-4H-1-бензопиран-4- он, Т. пл. 163 - 164oC;
Соед. 157: 8-формил-2-(4-морфолинил)-4H-1-бензопиран-4-он, Т. пл. 209 - 209,5oC;
Соед. 158: 2-(4-морфолинил)-8-(фениламино)метил)-4H-1- бензопиран-4-он, Т. пл. 226 - 227oC;
Соед. 159: 2-(4-морфолинил)-8-(2E-фенил)этил-4H-1-бензопиран- 4 он, Т. пл. 209 - 209,5oC;
Соед. 160: 8-гидроксиметил-2-(4-морфолинил)-4H-1-бензопиран-4- он, Т. пл. 243 - 243,5oC;
Соед. 162: 8-метил-7-[(1-метил-3-пиперидинил)метокси] -2- (4-морфолинил)-4H-1-бензопиран-4-он, Т. пл. 159 - 161oC;
Соед. 163: 8-метил-2-(4-морфолинил)-7-[2-(1- пиперидинил)этил]окси-4H-1-бензопиран-4-он, Т. пл. 154 - 156oC;
Соед. 164: 8-метил-2-(4-морфолинил)-7-[2-(1- пирролидинил)этил]окси-4H-1-бензопиран-4-он, Т. пл. 136 - 138oC;
Соед. 165: 8-метил-2-(4-морфолинил)-7-[2-(4- морфолинил)этил]окси-4H-1-бензопиран-4-он, Т. пл. 170,5 - 172,5oC;
Соед. 166: 8-метил-2-(4-морфолинил)-7-[3-(1- пиперидино)пропил[окси-4H-1-бензопиран-4-он, Т. пл. 144 - 145oC;
Соед. 167: 7-(2-диэтиламиноэтил)окси-8-метил-2-(4-морфолинил)- 4H-1-бензопиран-4-он, Т. пл. 162 - 162,5oC;
Соед. 168: 7-[2-(этилфениламино)этокси]-8-метил-2-)4- морфолинил)-4H-1-бензопиран-4-он, Т. пл. 146 - 147oC;
Соед. 169: 7-[2-диизопропиламиноэтил)окси-8-метил-2- (4-морфолинил)-4H-1-бензопиран-4-он, Т. пл. 136,5 - 138,5oC;
Соед. 170: 7-гидрокси-8-метил-2-(1-пиперидин)-4H-1-бензопиран- 4-он, Т. пл. 278 - 284oC;
Соед. 171: 8-метил-2-(1-пиперидинил)-7-(3-пиридинилметокси)-4H- 1-бензопиран-4-он, Т. пл. 144 - 158oC;
Соед. 172: 7-[2-[4-бензил-(1-пиперизинил)этил]окси]-8-метил-2- (4-морфолинил)-4H-1-бензопиран-4-он, Т. пл. 138 - 139oC.
Пример 82. Получение 2-(4-морфолинил)-4H-1-бензопиран-4-она.
Соединение 2:
Часть A: Трет.-бутоксид калия (134 г, 1,2 М) заливали бензолом (1 л) в круглодонной колбе, осушенной пламенем и снабженной смесителем, дополнительной воронкой, термометром и впускным отверстием для азота. Суспензию поддерживали при 15oC. Затем медленно в течение 1,3 часа добавляли раствор о-гидроксиацетофенона (54,4 г, 48,1 мл, 0,4 М) и сероводород (30,4, 24 мл, 0,4 М) в бензоле (700 мл), пополняя периодически ледяную ванну для поддержания температуры 18oC. Полученную суспензию размешивали при температуре окружающей среды в течение 1 дня. После этого реакционную смесь переносили в разделительную воронку, содержащую воду (4 л), и экстрагировали эфиром (4 • 250 мл) и EtOAc (3 • 250 мл). Водный слой подкисляли с помощью 10% Н2SO4 (1 л) и размешивали в течение ночи при комнатной температуре. Полученное в результате твердое вещество отфильтровывали и осушали при 50oC в течение ночи, получая 22,07 г 2-меркапто-4H-1бензопиран-4-она. Т. пл. 207 - 208oC.
Часть B: Тозиевую кислоту (0,4 г, 2 мМ) добавляли в раствор 2-меркапто-4H-1-бензопиран-4-она (3,56 г, 20 мМ) и морфолина (2,44 г, 2,44 мл, 28 мМ) в бензоле (400 мл). После 4-часового нагревания в колбе с обратным холодильником реакционную смесь переносили в разделительную воронку, содержащую EtOAc и воду. Затем смесь экстрагировали EtOAc (2x), промывали вместе с объединенными органическими слоями водой и солевым раствором, фильтровали через сульфат натрия и получали 4,56 г сырого продукта после выпаривания растворителя. В результате флеш-хроматографии на силикагеле (300 г, 2,5% MeOH/CHCl3, 50-мл фракции) получали 2,07 г 2-(4-морфолинил)-4H-1-бензопиран-4-она (44,8%, фракции 22 - 32). Т. пл. 160 - 161oC.
Пример 83. Получение 6-метил-2-(4-морфолинил)-4H-1,3- бензоксазин-4-она.
Соединение 83:
Метиловый эфир 5-метилсалициловой кислоты (2,73 г, 16,4 мМ) растворяли в ацетоне (50 мл), затем добавляли бромистый цианид и раствор охлаждали до 0oC. Триэтиламин (1,73 г, 18,2 мМ) растворяли в ацетоне (5 мл) и по капле добавляли в раствор. Быстро выпавший осадок и твердые вещества удаляли фильтрацией. Фильтрат концентрировали в вакууме и получали 3,41 г промежуточного соединения цианоэфира. Этот цианоэфир растворяли в ацетонитриле (50,1), добавляли морфолин (1,43 г, 16,4 мМ) в ацетонитриле (5 мл) и реакционную смесь 2 ч размешивали при комнатной температуре. Образовавшиеся кристаллы и реакционную смесь охлаждали до 0oC, промывали холодным ацетонитрилом и получали 1,65 г (40,8%) продукта. Маточные растворы перекристаллизовывали из ацетонитрила и получали 0,54 г (13,4%) продукта. Т.пл. 197-197,9oC.
ИК (mull) 2955, 2923, 2858, 1674, 1619, 1576, 1466, 1453, 1433, 1424, 1333, 1325, 1315, 1112, 817 см-1;
1H-ЯМР (CDCl3) δ: 7,91 (d, J = 1,4 Гц, 1H, аром.); 7,40 (dd, J = 8,3, 1,9 Гц, 1H, аром.); 7,09 (d, J = 8,4 Гц, 1H, аром.); 3,81 (br.s., 8H, морфолинметилен); 2,40 (s, 3H, метил);
УФ λмакс.(ε) 217 сд. (26,550), 223 сд. (26,350), 259 (15,100), 296 (4,250), 304 сд. (3,550);
MC: ионы при m/e (относ. интенс.) 246 (макс., 29), 218 (10), 189 (20), 134 (осн., 100), 106 (18), 105 (10), 78 (12), 77 (8), 28 (19).
Элементный анализ для C13H14N2O3:
Вычислено: C 63,40; H 5,73; N 11,38;
Найдено: C 63,29; H 5,92; N 11,31.
Следуя основной процедуре примера 83, но используя соответствующий сложный метиловый эфир о-гидроксисалициловой кислоты вместо метилового эфира 5-метилсалициловой кислоты, были получены следующие соединения:
Соед. 84: 8-метил-2-(4-морфолинил)-4H-1,3-бензоксазин-4-он, Т.пл. 229-231oC;
Соед. 85: 6-бромо-2-(4-морфолинил)-4H-1,3-бензоксазин-4-он, Т.пл. 207-214oC;
Соед. 86: 7-хлоро-2-(4-морфолинил)-4H-1,3-бензоксазин-4-он, Т.пл. 207-214oC;
Соед. 87: 6,8-бис(1-метилэтил)-2-(4-морфолинил)-4H-1,3-бензоксазин-4-он, Т.пл. 120-120,5oC;
Соед. 88: 6-фторо-2-(4-морфолинил)-4H-1,3-бензоксазин-4-он, Т.пл. 220-231oC;
Соед. 89: 6-диметоксиметил-2-(4-морфолинил)-4H-1,3-бензоксазин-4-он, Т. пл. 101-108oC;
Соед. 90: 7-метокси-2-(4-морфолинил)-4H-1,3-бензоксазин-4-он, Т. пл. 197-200oC;
Соед. 91: 6-(морфолинил-1-ил)-пиридо[2,3-e] -1,3-оксазин-4-он, Т. пл. 181-184oC;
Следуя основной процедуре примера 83, но используя соответствующий сложный метиловый эфир о-гидроксисалициловой кислоты вместо сложного метилового эфира 5-метилсалициловой кислоты и соответствующего гетероциклического соединения вместо морфолина, были получены следующие соединения:
Соед. 92: 8-метил-2-(1-пиперидинил)-4H-1,3-бензоксазин-4-он, Т. пл. 214,5-217,5oC;
Соед. 93: 8-метил-2-(1-пирролидинил)-4H-1,3-бензоксазин-4-он, Т. пл. 199,5-200,5oC;
Соед. 94: 2-(1-пирролидинил)-4H-1,3-бензоксазин-4-он, Т.пл. 163-164oC;
Соед. 95: 2-[1-(4-тиоморфолинил)]-4H-1,3-бензоксазин-4-он, Т.пл. 179-180oC;
Соед. 96: 2-(4-метил-1-пиперазинил)-4H-1,3-бензоксазин-4-он.
Пример 98. Получение 2-(4-морфолинил)-4H-1,3-бензоксазин-4-она.
Соединение 98 (Метод A):
Метилсалицилат (25 г, 0,164 М) и BrCN (18,08 г, 0,172 М) добавляли к сухому ацетону (500 мл) и охлаждали до 0oC. Затем эту смесь обрабатывали TEA (17,37 г, 0,172 М) в ацетоне (50 мл) в течение 20 мин по капле. Из раствора выделялся белый осадок. После размешивания в течение 1 ч ацетон сливали, а осадок промывали ацетоном. Фильтрат концентрировали в вакууме и использовали без дальнейшей очистки. Полученный выше цианоэфир (29,0 г, 0,164 М) добавляли к ацетонитрилу (300 мл) в атмосфере азота. Затем за 30 мин по капле добавляли (14,26 г, 0,164 М) ацетонитрильный раствор морфолина. Во время добавления реакционная смесь нагревалась. После перемешивания в течение 3 часов растворитель удаляли в вакууме и получали рыжевато-коричневый твердый продукт, после промывания которого эфиром получали 22 г (58%) чистого продукта. Аналитический образец получали путем перекристаллизации из EtOAc. Т.пл. 184,5-186,0oC (теор. Т.пл. 187-189oC).
ИК (CHCl3) 2950, 2825, 2750, 1670, 1620, 1600, 1560, 1460, 1440, 1420, 1340, 1260, 1110, 980, 850 см-1;
1H-ЯМР (CDCl3) 8,25 (dd, 1H, J = 1,5 м 6,0 Гц); 7,8-7,2 (m, 3H, аромат. ); 3,80 (s, 8H);
MC: ионы при m/e (отн. инт.) 232 (47), 215 (13), 204 (20), 189 (11), 176 (14), 175 (56), 121 (35), 120 (100), 92 (46), 64 (14);
УФ (EtOH) λмакс.(ε) 210 (24,000), 218 (24,200), 240 сд. (11,200), 258 (14,750), 286 (4,850), 295 (3,900);
Элементный анализ для C12H12N2O3:
Вычислено: C 62,06; H 5,17; N 12,06
Найдено: C 61,70; H 5,22; N 11,99.
Пример 99. Получение 2-(4-морфолинил)-4H-1,3-бензоксазин-4-она.
Соединение 98 (Метод B):
Тозиевую кислоту (0,4 г, 2 мМ) добавляли к раствору 2-меркапто-4H-1-бензопиран-4-она (3,56 г, 20 мМ) и пиперидина (2,38 г, 2,77 мл, 28 мМ) в бензоле (400 мл). Затем раствор нагревали в колбе с обратным холодильником в течение 5 ч и выпаривали в вакууме. Остаток переносили в разделительную колонку с метиленхлоридом и водой. После экстрагирования метиленхлоридом органический слой дважды промывали водой, фильтровали через сульфат натрия и получали 2,80 г сырого продукта (после выпаривания растворителя). В результате флеш-хроматографии на силикагеле (300 г, 7% MeOH/CH2Cl2) получали 0,39 г 2-(4-морфолинил)-4H-1,3-бензоксазин-4-она.
Пример 101. 2-(4-Морфолинил)-7-(фенилметокси)-4H-1-бензопиран-4-он.
Соединение 101:
Соединение получали способом, проиллюстрированном в схеме C.
Пример 173. Получение 4'-ацетокси-3'-метил-2'-гидрокси-пропиофенона.
(Относительно схемы E).
Часть A: 2',4'-Дигидрокси-3'-метил-пропиофенон (7,21 г, 40 мМ) суспендировали в 200 мл дихлорметана в 500 мл одногорлой круглодонной колбе в присутствии азота. Суспензию обрабатывали диизопропилэтиламином (6,97 мл, 40 мМ) и раствор охлаждали до 0oC. Затем к реакционной смеси при 0oC медленно по капле (в течение 1 ч) добавляли ацетилхлорид (3,26 мл, 46 мМ) в 80 мл дихлорметана. После этого смесь нагревали до комнатной температуры и размешивали в течение 20 мин. Реакционную смесь промывали 5% соляной кислотой (1 • 150 мл), а органические слои осушали сульфатом магния. Смесь концентрировали в вакууме и получали желтое маслянистое вещество, которое затем кристаллизовали и перекристаллизовывали из этанола, в результате чего получали 7,2 г (81%) ацетата в виде твердого белого продукта. Т.пл. 59-61oC.
Часть B: Получение 7-ацетокси-3,8-диметил-2-(4-морфолинил)-4H-1-бензопиран-4-она (Соединение 173).
4'-Ацетокси-2'-гидрокси-3'-метил-пропиофенон (6,2 г, 27,9 мМ) растворяли в 60 мл диэтилового эфира в 100-мл одногорлой круглодонной колбе в присутствии азота. Раствор обрабатывали трифторидэфиратом бора и реакционную смесь размешивали в течение ночи при комнатной температуре. Осадок собирали путем фильтрации и промывали 150 мл диэтилового эфира, в результате чего получали 6,8 г (90%) комплекса дифторида бора в виде желтого твердого вещества. Этот комплекс дифторида бора (1,05 г, 5,13 мМ) и хлорид-4-морфолинфосгениминия (1,25 г, 4,63 мМ) объединяли в 12 мл 1,2-дихлорэтана в 25-мл одногорлой колбе в присутствии азота. Реакционную смесь нагревали до 60oC в течение 3 ч. Затем смесь охлаждали до комнатной температуре, а дихлорэтан удаляли в вакууме. Маслянистый остаток растворяли в 12 мл ацетонитрила в 25-мл одногорлой круглодонной колбе, смесь нагревали до 60oC, разбавляли 10 мл воды размешивали 5 мин. Реакционную смесь сразу нейтрализовали 25 мл насыщенного бикарбоната натрия, а ацетонитрил удаляли в вакууме. Водный остаток экстрагировали дихлорметаном (4 х 25 мл). Объединенные органические слои осушали сульфатом магния и концентрировали в вакууме, в результате чего получали 750 мг (51%) соединения 173 в виде твердого продукта оранжевого цвета. Т. пл. 142,5 - 144,5oC.
Часть C. Получение 3,8-диметил-7-гидрокси-2-(4-морфолинил)-4H-1- бензопиран-4-она (соединение 174).
Комплекс дифторида бора (полученный в части A, 3,0 г, 11,1 мМ) объединяли с хлоридом 4-морфолинфосгениминия (2,5 г, 12,2 мМ) в 29 мл 1,2-дихлорэтана в 50-мл одногорлой круглодонной колбе в присутствии азота. Реакционную смесь нагревали до 60oC в течение 3, 5 ч, а затем охлаждали до комнатной температуры. Дихлорэтан удаляли в вакууме и маслянистый остаток растворяли в 30 мл ацетонитргила в 100-мл одногорлой круглодонной колбе в присутствии азота. Раствор нагревали до 60oC, разбавляли 25 мл воды и размешивали 5 мин. Реакционную смесь резко охлаждали 30 мл насыщенного бикарбоната натрия, а ацетонитрил удаляли в вакууме. Водный остаток экстрагировали дихлорметаном (4 х 25 мл) и объединенные органические слои осушали сульфатом магния. Осушенные органические слои концентрировали в вакууме, получая в результате желтое твердое вещество (2,82 г), которое растворяли в 30 мл метанола в 100-мл одногорлой круглодонной колбе в присутствии азота. Раствор разбавляли 15 мл воды и смесь обрабатывали гидроксидом лития (8) (мг, 19,1 мМ). Реакционную смесь размешивали в течение 1 ч при комнатной температуре. Метанол удаляли в вакууме, а pH водного остатка доводили до 5 с помощью 5%-ной соляной кислоты (pH-метр). Осажденный фенол собирали фильтрацией, осушали и получали 1,2 г (40%) соединения 174. Т. пл. > 300oC.
Часть D. Получение 7-бензилокси-3,8-диметил-2-(4-морфолинил)-4H- 1-бензопиран-4-она, соединение 175.
3,8-Диметил-7-гидрокси-2-(4-морфолинил)-4H-1-бензопиран-4-он (355 мг, 1,29 мМ) суспендировали в 9 мл сухого ацетонитрила в 25-мл одногорлой круглодонной колбе в присутствии азота. Суспензию обрабатывали последовательно карбонатом калия (1,1 г, 8,0 мМ) и бензилбромидом (213 мг, 1,79 мМ). Реакционную смесь нагревали до 60oC в течение 16 ч, а затем охлаждали до комнатной температуры. Летучие вещества удаляли в вакууме, а остаток промывали 25 мл дихлорметана. Нерастворившийся материал удаляли фильтрацией и фильтрат концентрировали до получения светлого маслянистого вещества. После кристаллизации этого вещества из диэтилового эфира получали 323 мг (69%) соединения 175 в виде белого твердого продукта. Т. пл. 136 - 137,5oC.
Следуя основной процедуре примера 173, но используя в качестве исходного соединения 2'-гидроксипропиофенон, получали следующие соединения:
Соед. 176: 3,8-диметил-2-(4-морфолинил)-7-(нафтил-1-метилокси)- 4H-1-бензопиран-4-он, Т. пл. 204 - 206oC;
Соед. 177: 3,8-диметил-7-(4-метокси-бензилокси)-2-(4-морфолинил) -4H-1-бензопиран-4-он, Т. пл. 141 - 142oC;
Соед. 178: 3,8-диметил-2-(4-морфолинил)-7-(2-фенилэтилокси)-4H- 1-бензопиран-4-он, Т. пл. 160 - 161,5oC;
Соед. 179: 3,8-диметил-7-(4-хлорбензилокси)-2-(4-морфолинил)-4H- 1-бензопиран-4-он, Т. пл. 166 - 167,5oC;
Соед. 180: 3,8-диметил-2-(4-морфолинил)-7-(3- трифторметилбензилокси)-4H-1-бензопиран-4-он, Т. пл. 158,5 - 160oC;
Соед. 181: 7-(карбометоксиметоксил)-3,8-диметил-2-(4-морфолинил) -4H-1-бензопиран-4-он, Т. пл. 174 - 175oC;
Соед. 182: 8-гидрокси-3-метил-2-(4-морфолинил)-4H-1-бензопиран- 4-он, Т. пл. 239 - 240oC;
Соед. 183: 8-бензилокси-3-метил-2-(4-морфолинил)-4H-1-бензопиран -4-он, Т. пл. 134 - 135oC;
Соед. 184: 3-метил-2-(4-морфолинил)-8-(м-трифторметилбензилокси) -4H-1-бензопиран-4-он, Т. пл. 160,5 - 161oC.
Пример 185. Получение C-7-алкиловых, алкениловых и алкилариловых заместителей. (Схема F)
Часть A. Получение 2'-гидрокси-3'-метил-4'- трифторметансульфонилокси-ацетофенона.
2', 4'-Дигидрокси-3'-метил-ацетофенон (11 г, 60,2 мМ) суспендировали в 300 мл дихлорметана в 1000-мл одногорлой круглодонной колбе в присутствии азота. Полученную суспензию последовательно обрабатывали пиридином (4,4 мл, 54 мМ) и N, N-диметиламинопиридином (730 мг, 6 мМ) и охлаждали раствор до 0oC. В реакционную смесь медленно (30 мин) по капле добавляли ангидргид трифторуксусной кислоты (11 мл, 66,2 мМ) в дихлорметане (1 х 100 мл). Реакционную смесь размешивали 1 ч при комнатной температуре, а затем промывали 5% HCl (2 х 200 мл). Органические слои осушали сульфатом магния и концентрировали в вакууме, в результате чего получали желтый маслянистый остаток. Этот остаток перегоняли с помощью цилиндрического аппарата при высоком вакууме (165oC) получали 16,4 г (91%) трифлата в виде белого твердого продукта. Т. пл. 60 - 64oC.
Часть B. Получение 8-метил-2-(4-морфолинил)-7- трифторметансульфонилокси-4H-1-бензопиран-4-она.
2'-Гидрокси-3'-метил-4'-трифторметансульфонилоксиацетофенон (1,5 г, 5,03 мМ) растворяли в 10 мл диэтилового эфира в 26-мл одногорлой круглодонной колбе в присутствии азота. Раствор обрабатывали трифторидэфиратом бора (0,9 мл, 7,5 мМ) и реакционную смесь размешивали в течение 6 часов при комнатной температуре. Приблизительно 1/2 эфира удаляли в вакууме, а осадок собирали фильтрацией. Светло-желтое твердое вещество промывали холодным диэтиловым эфиром и получали 1,1 г (63%) дифторбороната. Комплекс дифторида бора (1,1 г, 3,2 мМ) объединяли с хлоридом 4-морфолинофосгениминия (0,72 г, 3,5 мМ) в 12 мл 1,2-дихлорэтана в 50-мл одногорлой круглодонной колбе в присутствии азота. Реакционную смесь нагревали до 65oC в течение 3 ч, а затем охлаждали до комнатной температуры. Осадок удаляли фильтрацией и промывали диэтиловым эфиром, в результате чего получали 1,35 г продукта. Твердый продукт суспендировали в 12 мл ацетонитрила в 25-мл одногорлой круглодонной колбе в присутствии азота. Суспензию размешивали 48 часов с 1,2 мл воды. Бесцветный раствор разводили 10 мл насыщенного бикарбоната натрия, а ацетонитрил удаляли в вакууме.
Водный остаток экстрагировали дихлорметаном (4 х 25 мл). Объединенные органические слои осушали сульфатом натрия и концентрировали в вакууме, в результате чего получали красный твердый продукт. После перекристаллизации этого продукта из этилацетата получали 566 мг (45%) хромонтрифлата в виде беловатого твердого продукта. Т. пл. 151 - 155oC.
Часть C. Получение 8-метил-7-(2-фенил)этинил-2-(4-морфолинил)- 4H-1-бензопиран-4-она (соединение 185).
8-Метил-7-(трифторметансульфонилокси)-2-(4-морфолинил)-4H-1- бензопиран-4-он (190 мг, 0,48 мМ) суспендировали в 6 мл смеси бензола и триэтиламина (1:1) в 15-мл трубе высокого давления со шнековой головкой. Суспензию обрабатывали последовательно фенилацетатом (100 мкл, 0,91 мМ), дихлоридом бис(трифенилфосфин)палладия (14 мг, 0,02 мМ) и иодидом меди (2 мг, 0,01 мМ). Реакционную смесь нагревали в течение ночи до 100 - 110oC. Затем смесь охлаждали до комнатной температуры и снова обрабатывали последовательно фенилацетиленом (100 мкл, 0,91 мМ), бис(трифенилфосфин)палладия дихлоридом (14 мг, 0,02 М) и иодидом меди (2 мг, 0,01 мМ). Реакционную смесь нагревали до 110oC в течение 4 ч и охлаждали до комнатной температуры. Летучие вещества удаляли в вакууме до получения черного остатка. Этот остаток хроматографировали на силикагеле (12 г, 230 - 400 меш), элюируя 1% метанол/дихлорметаном, и собирали 3 мл для 48 фракций. После элюирования 2% метанол/дихлорметаном собирали 5 мл фракции. Фракции 55 - 72 объединяли, концентрировали и получали 153 мг темно-коричневого твердого продукта. После перекристаллизации этого продукта из этилацетата получали 94 мг (56%) соединения 185 в виде светло-серого твердого продукта. Т. пл. 228,5 - 229,5oC.
Пример 186. Получение 8-метил-2-(4-морфолинил)-7-(2-фенил)-этил- 4H-1-бензопиран-4-она.
Соединение 186:
8-Метил-2-(4-морфолинил)-7-(2-фенилэтинил)-4H-1-бензопиран-4-он (90 мг, 0,261 мМ) растворяли в 90 мл смеси метанола и ацетона (8:1) в смесителе Парра. Раствор обрабатывали 18 мг 10% палладированного угля и реакционную смесь гидрогенизировали в течение 2 часов при давлении 40 фунтов/дюйм2 (275,76 кПа). Катализатор удаляли фильтрацией через 1'' (25,4 мм) слой цеолита, а остаток промывали метанолом. Фильтрат концентрировали в вакууме, полученный желтый маслянистый продукт кристаллизовали из гексана и получали 70 мг (77%) соединения 186 в виде желто-коричневого твердого продукта. Т. пл. 162 - 163oC.
Следуя основной процедуре примера 185, но используя в качестве исходного соединения соответствующий 2'-гидроксиацетофенон, получали следующие соединения:
Соед. 187: 2-(4-морфолинил)-8-(2-фенил)этинил-4H-1-бензопиран-4- он, Т. пл. 196 - 197oC;
Соед. 188: 2-(4-морфолинил)-8-(2-фенил)этил-4H-1-бензопиран-4- он, Т пл. 110 - 112oC;
Соед. 189: 2-(4-морфолинил)-8-[2-(3-трифторметил)фенил] этинил- 4H-1-бензопиран-4-он, Т. пл. 157,5 - 158,5oC;
Соед. 190: 2-(4-морфолинил)-8-[2-(3-трифторметил)фенил]этил-4H- 1-бензопиран-4-он, Т. пл. 130 - 131oC;
Соед. 192: 8-метил-2-(4-морфолинил)-7-[2-(1-нафтил)] этил-4H-1- бензопиран-4-он, Т. пл. 188,5 - 189,5C;
Соед. 193: 8-метил-2-(4-морфолинил)-7-фенил-4H-1-бензопиран-4- он, Т. пл. 194,5 - 195oC.
Пример 194 (Схема G).
Часть A. Получение 4'-ацетокси-3'-иодо-2'-гидрокси-пропиофенона.
2', 4'-Дигидрокси-3'-иодоацетофенон (55,6 г, 0,2 M) суспендировали в 600 мл метиленхлорида. Затем добавляли триэтиламин (27,8 мл, 0,2 М) и охлажденную смесь (0oC) по капле обрабатывали ацетилхлоридом (16,35 мл, 0,23 М). Смесь размешивали 1 час при 0oC и 2 ч при комнатной температуре. Затем смесь промывали 5% HCl, осушали сульфатом магния и выпаривали. Твердый остаток перекристаллизовывали из этанола и получали 48,39 г продукта.
Часть B. Получение 7-ацетилокси-8-иодо-2-(4-морфолинил)-4H-1- бензопиран-4-она (соединение 194). 4'-Ацетокси-3'-иодо-2'-гидрокси-пропиофенон (48,4 г, 0,15 М) суспендировали в 750 мл простого эфира и обрабатывали трифторидэфиратом бора (27,9 мл, 0,22 М). Смесь размешивали в течение ночи при комнатной температуре, фильтровали, а твердый остаток промывали эфиром, в результате чего получали 47,0 г комплекса дифторида бора. Этот комплекс объединяли с хлоридом 4-морфолиндихлорметилиминия в 400 мл этилендихлорида и нагревали 5 ч при 70oC и 16 ч при 50oC. Затем реакционную смесь охлаждали до 0oC, а твердый остаток фильтровали и тщательно промывали эфиром (45 г). Твердый остаток суспендировали в 400 мл ацетонитрила, затем добавляли 40 мл воды и полученную смесь размешивали в течение ночи при комнатной температуре, нагревали при 50oC в течение 2 ч, и наконец нагревали в течение 30 мин при 60oC. Растворитель выпаривали, а остаток растворяли в смеси метиленхлорида и насыщенного бикарбоната натрия. Водный слой экстрагировали дважды метиленхлоридом, а органические слои осушали сульфидом магния. После выпаривания растворителя и перекристаллизации из метанола получали 20,8 г (39%) хромона. Маточные растворы содержали 5,8 г неочищенного продукта, после второй перекристаллизации которого получали 0,7 г продукта. Т. пл. 201,5 - 202,5oC.
Часть C. Получение 8-этил-7-гидрокси-2-(4-морфолинил)-4H-1- бензопиран-4-она.
7-Ацетилокси-8-иодо-2-(4-морфолинил)-4H-1-бензопиран-4-он (2,07 г, 5,0 мМ) объединяли с хлоридом лития (0,64 г, 15 мМ), тетраэтилоловом (1,04 мл, 5,25 мМ) и дихлоридом(бис)трифенилфосфинпалладия (70 мг, 0,10 мМ) в 20 мл диметилформамида. Полученную смесь нагревали 40 мин при 100oC, выливали в полунасыщенный раствор хлорида натрия и дважды экстрагировали метиленхлоридом. Органические слои промывали два раза полунасыщенным раствором хлорида натрия, сушили сульфатом магния и выпаривали. Остаток растворяли в 20 мл метанола и 10 мл воды и обрабатывали 0,63 г (15 мМ) гидроксидом лития. Смесь размешивали 30 мин при комнатной температуре. Растворитель выпаривали, смесь разбавляли водой и экстрагировали этилацетатом. Водный слой подкисляли до pH 6,1 с помощью 5%-ной соляной кислоты, твердый продукт отфильтровывали, промывали эфиром, осушали и получали 0,98 г (71%) продукта.
Часть D. Получение 8-этил-2-(4-морфолинил)-7-(3- пиридинилметокси)-4H-1-бензопиран-4-она (соединение 195).
8-Этил-7-гидрокси-2-(4-морфолинил)-4H-1-бензопиран-4-он (0,176 г, 0,64 мМ) и гидрид натрия (0,105 г, 60%, 2,6 мМ) объединяли в 4 мл диметилформамида и нагревали до 60oC в течение 20 минут. Затем добавляли гидрохлорид 3-пикоилхлорида (0,321 г, 1,76 мМ) и смесь нагревали при 60oC в течение 1 ч. Охлажденную смесь выливали в 2н. гидроксид натрия и лед. Твердый остаток фильтровали, тщательно промывали водой и эфиром и после перекристаллизации из этилацетата получали 0,156 г продукта. Т. пл. 178 - 179oC.
Следуя основной процедуре примера 194, но используя в качестве исходного соединения 2'-гидроксиацетофенон, получали следующие соединения:
Соед. 196: 8-этил-2-(4-морфолинил)-7-фенилметокси-4H-1- бензопиран-4-он, Т. пл. 153 - 154,5oC;
Соед. 197: 8-иодо-2-(4-морфолинил)-7-фенилметокси-4H-1- бензопиран-4-он, Т. пл. 155 - 157oC;
Соед. 198: 8-этил-2-(4-морфолинил)-7-[2-(1-пиперидинил-4- он, Т. пл. 151 - 152oC;
Соед. 199: 8-иодо-2-(4-морфолинил)-7-(3-пиридинилметокси)-4H- 1-бензопиран-4-он, Т. пл. 214 - 215oC;
Соед. 200: 8-иодо-7-гидрокси-2-(4-морфолинил)-4H-1- бензопиран-4-он, Т. пл. 224 - 225oC.
Пример 201 (Схема H).
Часть A. Получение 7-гидрокси-8-метил-2-(1-пиперидинил)- 4H-1-бензопиран-4-она (соединение 201).
К раствору бензилового эфира соед. 31 (1,00 г, 2,86 мМ) а EtOAc (80 мл) добавляли палладированный уголь (225 мг). После взбалтывания в гидрогенизаторе Парра при давлении водорода 50 фунтов/дюйм2 (344,7 кПа) в течение 2 дней, катализатор отфильтровывали через стеклянную воронку, промытую EtOAc и MeOH. После выпаривания растворителя получали 0,99 г сырого материала. Этот материал подвергали флеш-хроматографии (60 г силикагеля, 10% MeOH/CH2Cl2) и получали 0,83 г фенола. В результате перекристаллизации из MtOH/EtOAc при 4oC получали 0,65 г (88%) целевого продукта в виде белых кристаллов. Т. пл. 278 - 284oC.
Часть B: Получение 7-(3-пиридинилметокси)-2-(1-пиперидинил)-8- метил-4H-1-бензопиран-4-она, соединение 202.
Суспензию фенольного соединения 170 (130 мг, 0,5 мМ), 3-пиколинилхлорид-HCl (161 мг, 1,0 мМ), карбоната калия (277 мг, 2,0 мМ) в диметилформамиде (5 мл) размешивали при 90oC. Через 7 дней реакционную смесь выпаривали и добавляли CHCl3. Твердый продукт отфильтровывали, а фильтрат выпаривали. После флеш-хроматографии остатка (15 г силикагеля, 2% MeOH-CH2Cl2, 6 мл фракции) получали 18 мг (10%), фракции 37 - 52 соединения 202. Т. пл. 144 - 158oC.
Пример 203. Получение 7-фенилметокси-2-метилтиометил-8-метил- 4H-1-бензопиран-4-она (соединение 203) (Схема 1).
Часть A. Гидрид натрия (50% масляная суспензия, трижды промытая гексаном, 23,2 г, 0,48 М) размешивали в ТГФ (185 мл) в присутствии азота в 2-л трехгорлой круглодонной колбе, осушенной пламенем и снабженной дополнительной воронкой и обратным холодильником. Раствор 2-гидроксиацетофенона (25 г, 97,6 мМ) и этил- -α- тиометилацетата (130,4 г, 123 мл, 0,9 М) в ТГФ (164 мл) медленно, по капле, добавляли к суспензии гидрида натрия. После того, как было добавлено около половины раствора, реакционную массу нагревали с помощью аппарата для нагревания струей горячего воздуха до начала дефлегмации. После этого при перемешивании медленно добавляли оставшуюся половину раствора. Затем 10 мин раствор выдерживали при комнатной температуре и 1 ч 40 мин при температуре дефлегмации, после чего раствор выпаривали в вакууму. Затем раствор переносили в разделительную воронку со смесью метиленхлорида и 2н HCl и встряхивали около 10 мин. После экстракции метиленхлоридом (2х) и сушкой сульфатом магния, получали сырой β- дикетон, не подвергавшийся дальнейшей очистке.
Двухфазный раствор β- дикетона в 6н. HCl (250 мл) размешивали в течение ночи при комнатной температуре. После экстракции метиленхлоридом и сушки сульфатом магния получали 127,13 г сырого материала (после выпаривания растворителя). Этот материал подвергали флеш-хроматографии (700 г силикагеля, 30 - 50% EtOAc/гексан) и получали 122 г смеси исходного ацетофенона, тиометилацетата, некоторого количества β- дикетона и 4,94 г соединения 203 (15%). Аналитический образец перекристаллизовывали из эфир/гексана и получали целевой продукт в виде белых кристаллов. Т. пл. 110 - 114oC.
Часть B. Получение 7-фениламетокси-2-иодометил-8-метил-4H-1- бензопиран-4-она.
Раствор соединения 203 (4,0 г, 12,3 мМ) в метилиодиде (12,5 мл) и CH2Cl2 (8 мл) размешивали при орошении. Через 3 дня раствор охлаждали до 0oC, желтый осадок отфильтровывали. Фильтрат выпаривали, а остаток подвергали флеш-хроматографии на силикагеле (100 г, 40% EtOAc/гексан), в результате чего получали 1,48 г 7-фенилметокси-2-иодометил-8-метил-4H-1-бензопиран-4-она (30%). Аналитический образец получали путем перекристаллизации из CH2Cl2/EtOAc/гексан в виде кристаллического целевого продукта белого цвета. Т. пл. 144 - 147oC.
Часть C. Получение 8-метил-2-(4-морфолинилметил)-7-(фенилметокси)-4H-1-бензопиран-4- она, соединение 204.
Морфолин (0,21 г, 2,5 мМ) добавляли к размешанному раствору 7-фенилметокси-2-иодометил-8-метил-4H-4-она (1,0 г, 2,5 мМ) и триэтиламина (0,25 мл, 2,5 мМ) в CHCl3 (12 мл). После перемешивания при комнатной температуре в течение 2,4 ч растворитель выпаривали в вакууме. Остаток подвергали флеш-хроматографмм (100 г силикагеля, 50 - 100% EtOAc/CH2Cl2, 45-мл фракции) и получали 0,72 г (79%) продукта. После перекристаллизации из эфира получали белый твердый целевой продукт. Т. пл. 130 - 133oC.
Часть D. Получение 7-гидрокси-2-(4-морфолинилметил)-8- метил-4H-1-бензопиран-4-она, соединение 205.
Палладированный уголь (140 мг) добавляли к раствору бензилового эфира соединения 204 (0,65 г, 1,78 мМ) в EtOAc (50 мл). Смесь взбалтывали в гидрогенизаторе Парра в течение 23 ч под давлением водорода 50 фунтов/дюйм2 (344,7 кПа), после чего катализатор отфильтровывали через воронку из пористого стекла, промытую EtOAc и MeOH. После выпаривания растворителя получали 0,49 г сырого продукта. Этот продукт подвергали флеш-хроматографии на силикагеле [(100 г), 4% MeOH/CH2Cl2, 50-мл фракции] и получали 35 мг (5%, фракции 6 - 7) исходного материала и 0,33 г (68%) фракции 11 - 16) фенола. Аналитический образец приготавливали путем перекристаллизации из EtOAc/эфир/гексана при 4oC, который получали в виде белого кристаллического целевого продукта. Т. пл. 144 - 146oC.
Часть E. Получение 7-[(циклогексил-1H-тетразол-5-ил)метокси- 8-метил-2-(4-морфолинилметил)-4H-1-бензопиран-4-она, соединение 206.
Суспензию соединения 205 (100 мг, 0,36 мМ), 5-(4-хлорометил)-1- циклогексилтетразола [см., например, Chem. Phatm. Bull. 31, 1151 (1983)] (146 мг, 0,73 мМ) и карбоната калия (201 мг, 1,45 мМ) в ацетонитриле (3 мл) размешивали при 60oC. Через 17 ч реакционную смесь выпаривали и добавляли CHCl3. Твердый остаток отфильтровывали и фильтрат выпаривали. После флеш-хроматографии остатка (25 г силикагеля, 3% MeOH/CH2Cl2, 15 мл фракции) получали 134 мг (85%, фракции 5 - 6) белого кристаллического целевого продукта. Т. пл. 193 - 195oC.
Часть F. Получение 8-метил-2-(4-морфолинилметил)-7- (3-пиридинилметокси)-4H-1-бензопиран-4-она, соединение 207.
Суспензию соединения 205 (50 мг, 0,18 мМ), 3-пиколинилхлорид-HCl (58 мг, 0,36 мМ) и карбоната калия (100 мг, 0,72 мМ) в ацетонитриле (2 мл) размешивали при 60oC. Через 2 дня реакционную смесь выпаривали и добавляли CHCK3. Твердый остаток отфильтровывали и фильтрат выпаривали. После флеш-хроматографии остатка (20 г силикагеля, 3% MeOH/CH2Cl2, 10 мл фракции) получали 45 мг (68%, фракции 17 - 25) белого кристаллического целевого продукта, который перекристаллизовывали из эфира. Т. пл. 105 - 108oC.
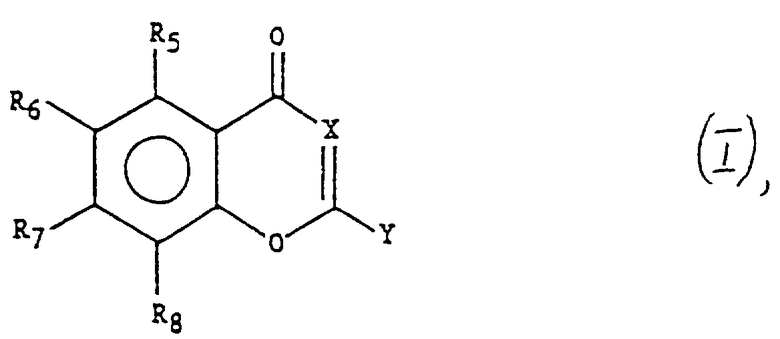



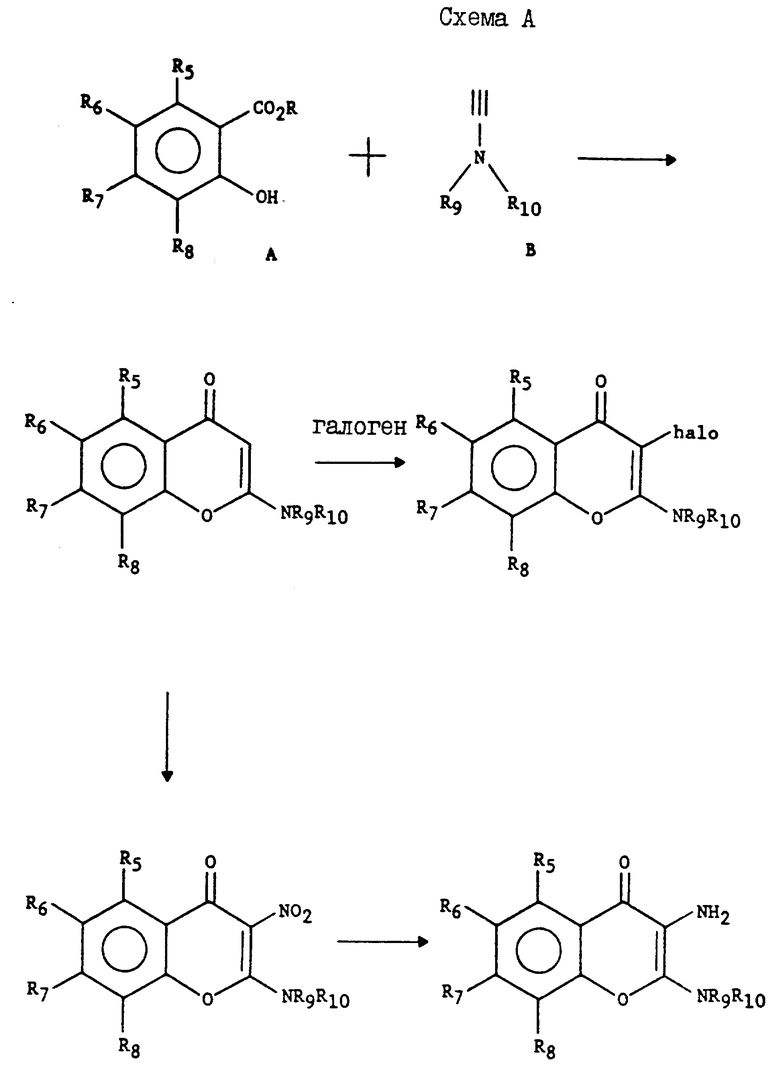



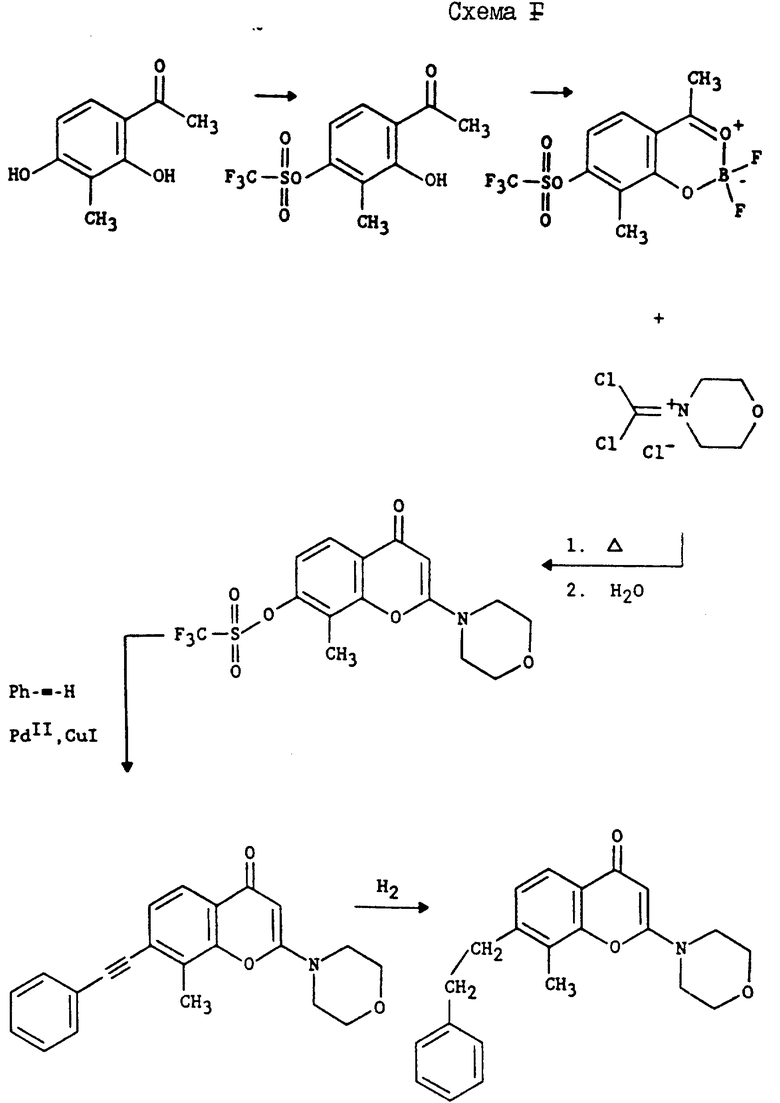
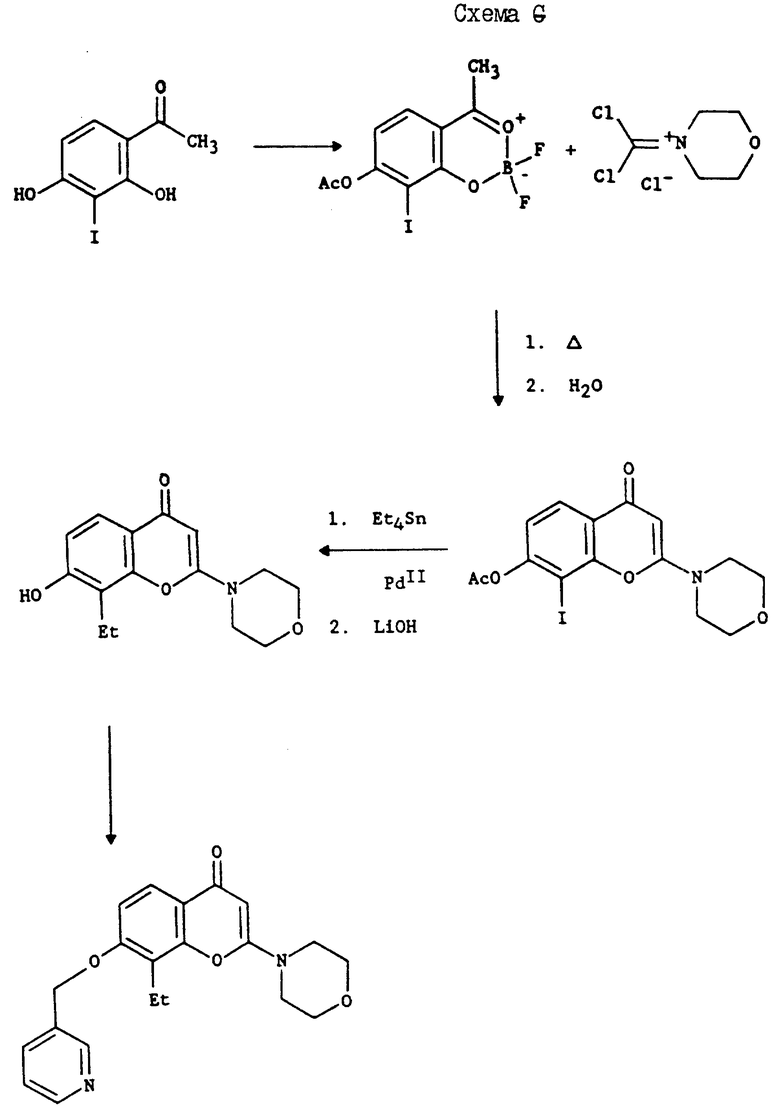
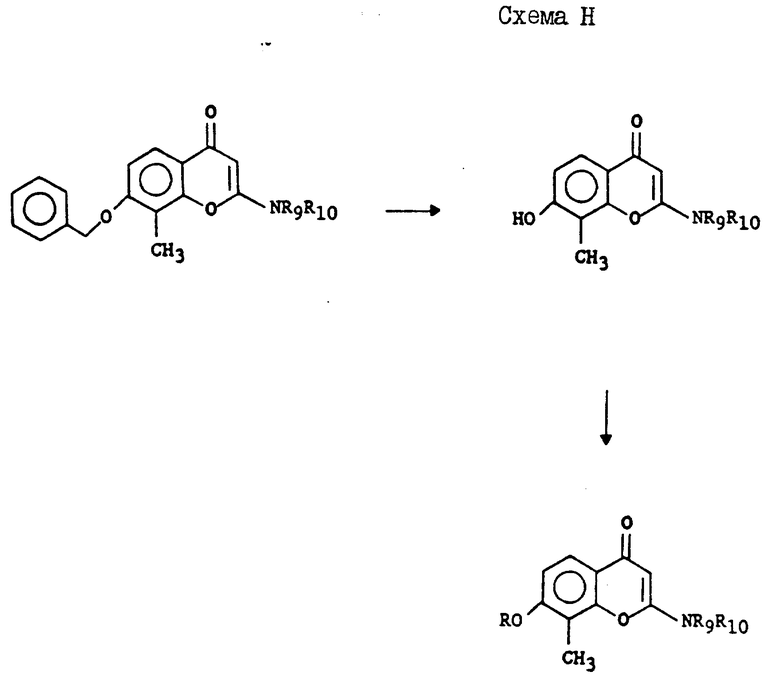
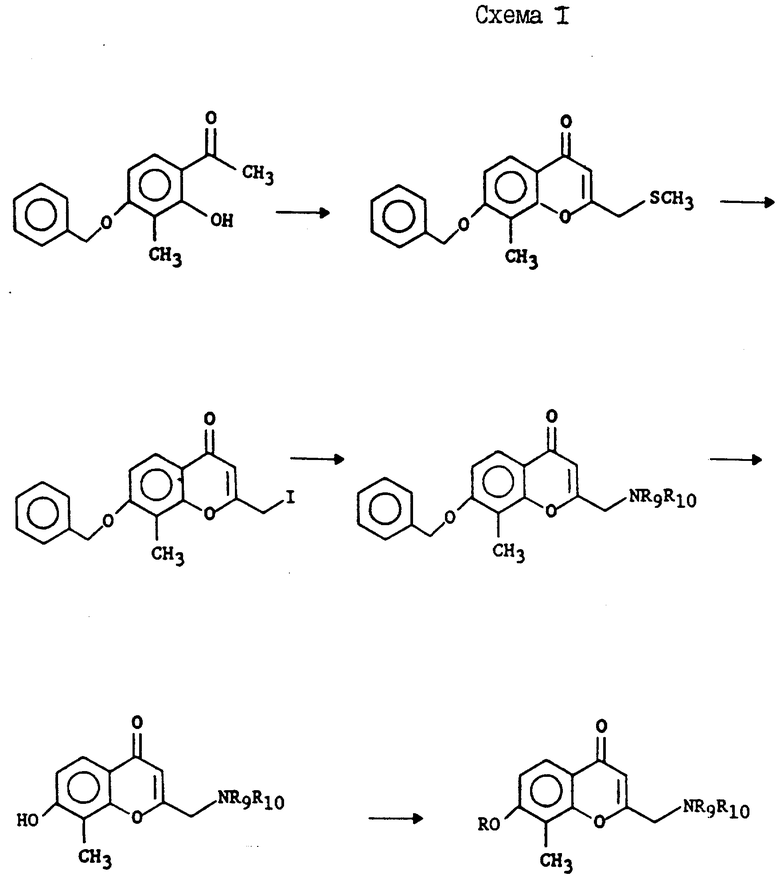
Настоящее изобретение относится к соединениям формулы I
которые пригодны в сочетании с фармацевтическим носителем в качестве антиатеросклеротических веществ. Кроме того, различные соединения формулы I являются полезными ингибиторами пролиферации клеток. 1 9 з.п.-ф-лы, 3 табл..
\\\1 1. Замещенные бензопираноны формулы I \\\6 $$$ \\\1 где X - CZ, где Z - H, C<Mv>1<D> - C<Mv>5<D>-алкил, аминогруппа или атом галогена; \\\4 Y выбран из группы, состоящей из -(CH<Mv>2<D>)<Mv>n<D> NR<Mv>9<D>R <Mv>10<D>, где R<Mv>9<D> и R<Mv>10<D> - одинаковые или различные, выбираются из групп, состоящих из \\\2 (а) водород, при условии, что R<Mv>9<D> и R<Mv>10<D> оба вместе не являются водородами; \\\2 (b) C<Mv>1<D> - C<Mv>12<D>-алкил; \\\2 (c) фенил, необязательно замещенный одним, двумя или тремя остатками C<Mv>1<D> - C<Mv>4<D>-алкила, C<Mv>1<D> - C<Mv>4<D>-алкоксила, галогена, группой OH, трифторметильной или -CO<Mv>2<D>(C<Mv>1<D> - C<Mv>4<D>-алкил); \ \\2 (d) (CH<Mv>2<D>)<Mv>n<D> фенил, (где фенил, необязательно замещен одним, двумя или тремя остатками C<Mv>1<D> - C<Mv>4<D>-алкила, C<Mv>1<D> - C<Mv>4<D>-алкоксила, галогена, группой OH, трифторметильной или -CO<Mv>2<D>(C<Mv>1<D> - C<Mv>4<D>-алкильной); \\\2 (e) -(CH<Mv>2<D>)<Mv>n<D> пиридинил или \ \\2 (f) где R<Mv>9<D> и R<Mv>10<D>, взятые вместе с N, образуют насыщенное или ненасыщенное гетероциклическое аминовое кольцо, выбранное из группы, состоящей из \\\2 (aa) 4-морфолина, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C<Mv>1<D> - C<Mv>4<D>-алкила, C<Mv>1<D> - C<Mv>4<D>-алкоксила, галогена или трифторметила; \\\2 (bb) 4-тиоморфолина, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C<Mv>1<D> - C<Mv>4<D>-алкила, C<Mv>1<D> - C<Mv>4<D>-алкоксила; галогена или трифторметила; \ \ \2 (cc) 3-амино-1-пирролидин; \\\2 (dd) 1-пирролидин, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из C<Mv>1<D> - C<Mv>4<D>-алкила, C<Mv>1<D> - C<Mv>4<D>-алкоксила, галогена, OH, -CH<Mv>2<D>OH или трифторметила; \\\2 (ee) 1-пиперидин, необязательно замещенный одним или двумя заместителями, выбранными из группы, содержащей C<Mv>1<D> - C<Mv>4<D>-алкил, C<Mv>1<D> - C<Mv>4<D>-алкоксил, галоген, трифторметил, -(CH<Mv>2<D>)<Mv>q<D> OH, -COOH, -CO<Mv>2<D>CH<Mv>3<D>, -CO<Mv>2<D>CH<Mv>2<D>CH<Mv>3<D> или фенил(где фенил необязательно замещен одним, 2 или 3 C<Mv>1<D> - C<Mv>4<D>-алкилом, C<Mv>1<D> - C<Mv>4<D>-алкоксилом, галогеном или трифторметилом; \\\2 (ff) 1-пиперазин, 4-метил-1-пиперазин, 4-фенил-1-пиперазин (где фенил может быть необязательно замещен одним, 2 или 3 C<Mv>1<D> - C<Mv>4<D>-алкилом, C<Mv>1<D> - C<Mv>4<D>-алкоксилом, галогеном или трифторметилом) или 4-пиридинил-1-пиперазин, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из C<Mv>1<D> - C<Mv>4<D>-алкила, C<Mv>1<D> - C<Mv>4<D>-алкоксила, галогена, трифторметила, -COOH, -CH<Mv>2<D>OH, -CO<Mv>2<D>CH<Mv>3<D> или -CO<Mv>2<D>CH<Mv>2<D>CH<Mv>3<D>, и \ \\2 (gg) тиазолидин, тиазолидин-4-карбоновая кислота, пипеколиновая кислота, п-пиперазинацетофенон, 1-гомопиперазин, 1-метилгомопиперазин, 4-фенил-1, 2, 3, 6-тетрагидропиридин, пролин, тетрагидрофуриламин, 1-(3-гидрокси)пирролидин, нипекотамид, 1, 2, 3, 4-тетрагидроизохинолин или имидазол, \ \\1 a R<Mv>5<D>, R<Mv>6<D>, R<Mv>7<D> и R<Mv>8<D>, одинаковые или различные, выбраны из группы, состоящей из водорода, C<Mv>1<D> - C<Mv>8<D>-алкила, -(CH<Mv>2<D>)<Mv>n<D> фенила (где фенил может быть необязательно замещен одним, 2 или 3 C<Mv>1<D> - C<Mv>4<D>-алкилом, C<Mv>1<D> - C<Mv>4<D>-алкоксилом, галогеном, OH, трифторметилом или -CO<Mv>2<D> (C<Mv>1<D> - C<Mv>4<D>-алкилом)], -(CH<Mv>2<D>)<Mv>n<D> нафтил, -(CH<Mv>2<D>)<Mv>n<D> пиридил, -(CH<Mv>2<D><Mv>q<D> NR<Mv>9<D>R<Mv>10<D>, -CH= CH-фенил (где фенил необязательно замещен одним, 2 или 3 C<Mv>1<D> - C<Mv>4<D>-алкилом, C<Mv>1<D> - C<Mv>4<D>-алкоксилом, галогеном, OH, трифторметилом или -CO<Mv>2<D>(C<Mv>1<D> - C<Mv>4<D>-алкилом)], -CH<Mv>2<D>-CH= CH<Mv>2<D>, -CH= CH-CH<Mv>3<D>, -O-CH<Mv>2<D>-CH= CH<Mv>2<D>, -C$$$C-фенил [где фенил может быть необязательно замещен одним, 2 или 3 C<Mv>1<D> - C<Mv>4<D>-алкилом, C<Mv>1<D> - C<Mv>4<D>-алкоксилом, галогеном, OH, трифторметилом или -CO<Mv>2<D>(C<Mv>1<D> - C<Mv>4<D>-алкилом)], -O-(CH<Mv>2<D>)<Mv>p<D> (N-метилпиперидин-3-ил), -O-(CH<Mv>2<D>)<Mv>p<D> NR<Mv>9<D>R<Mv>10<D>, -O-CH<Mv>2<D>CH(OCH<Mv>3<D>)<Mv>2<D>, -O-(CH<Mv>2<D>)<Mv>p<D> OR<Mv>15<D>, -(CH<Mv>2<D>)<Mv>n<D> C(O)-(CH<Mv>2<D>)<Mv>n<D> R<Mv>9<D>, -(CH<Mv>2<D>)<Mv>n<D> C(O)0-(CH<Mv>2<D>)<Mv>p<D>R<Mv>9<D>, -(CH<Mv>2<D>)<Mv>n<D> C(O)O-(CH<Mv>2<D>)<Mv>p<D> NR<Mv>9<D>R<Mv>10<D>, -(CH<Mv>2<D>)<Mv>n<D> C(O)(CH<Mv>2<D>)<Mv>n<D> NR<Mv>9<D>R<Mv>10<D>, NO<Mv>2<D>, -O-(CH<Mv>2<D>)<Mv>n<D> C(O)-(CH<Mv>2<D>)<Mv>p<D>R<Mv>9<D>, -O-(CH<Mv>2<D>)<Mv>n<D> C (O)O-(CH<Mv>2<D>)<Mv>p<D>R<Mv>9<D>, -O-(CH<Mv>2<D>)<Mv>n<D> C(O)-(CH<Mv>2<D>)<Mv>n<D>NR<Mv>9<D>R<Mv>10<D>, - NR<Mv>9<D>R<Mv>10<D>,-N(R<Mv>9<D>)(CH<Mv>2<D>)<Mv>n<D> C(O)-(CH<Mv>2<D>)<Mv>n<D>R<Mv>10<D>, -N(R<Mv>9<D>)-(CH<Mv>2<D>)<Mv>n<D> C(O)O-(CH<Mv>2<D>)<Mv>n<D>R<Mv>10<D>, -N(R<Mv>9<D>)(CH<Mv>2<D>)<Mv>n<D> C(O)-(CH<Mv>2<D>)<Mv>n<D>NR<Mv>9<D> R<Mv>10<D>, -O-(CH<Mv>2<D>)<Mv>n<D> фенил, [где фенил необязательно замещен одним, 2 или 3 C<Mv>1<D> - C<Mv>4<D>-алкилом, C<Mv>1<D> - C<Mv>4<D>-алкоксилом, галогеном, OH, трифторметилом или CO<Mv>2<D>(C<Mv>1<D> - C<Mv>4<D>-алкилом)], -O-(CH<Mv>2<D>)<Mv>n<D> пиридин, -O(CH<Mv>2<D>)<Mv>n<D> C(O)-(CH<Mv>2<D>)<Mv>n<D> пиридин, -O-(CH<Mv>2<D>)<Mv>n<D> C (O)0-(CH<Mv>2<D>)<Mv>n<D> пиридин, -O(CH<Mv>2<D>)<Mv>n<D> -C(O) -N(R<Mv>9<D>) (CH<Mv>2<D>)<Mv>n<D> пиридин, -O(CH<Mv>2<D>)<Mv>n<D> хиноксалинил, -O-(CH<Mv>2<D>)<Mv>n<D> хинолинил, -O-(CH<Mv>2<D>)<Mv>n<D> пиразинил, -O-(CH<Mv>2<D>)<Mv>n<D> нафтил, -O-(CH<Mv>2<D>)<Mv>n<D> -C(O)-(CH<Mv>2<D>)<Mv>n<D> нафтил, -O-(CH<Mv>2<D>)<Mv>n<D> -C(O)O-(CH<Mv>2<D>)<Mv>n<D> нафтил, -O-(CH<Mv>2<D>)<Mv>n<D> C(O)NR<Mv>9<D>- (CH<Mv>2<D>)<Mv>n<D> нафтил, галоген (фтор, хлор, бром, иод), OH, -(CH<Mv>2<D>)<Mv>q<D> -OH,-(CH<Mv>2<D>)<Mv>q<D>OC(O)R<Mv>9<D>, -(CH<Mv>2<D>)<Mv>q<D> OC(O) - NR<Mv>9<D>R<Mv>10<D> , -(1-циклогексил-1H-тетразол-5-ил)-C<Mv>1<D> - C<Mv>4<D>-алкокси, - [1-(C<Mv>1<D> - C<Mv>5<D>-алкил)-1H-тетразол-5-ил)- C<Mv>1<D> - C<Mv>4<D>-алкоксил, -(1-(фенил)-1H-тетразол-5-ил)-C<Mv>1<D> - C<Mv>4<D>-алкоксил [где фенил необязательно замещен одним, 2 или 3 C<Mv>1<D> - C<Mv>4<D>-алкилом, C<Mv>1<D> - C<Mv>4<D>-алкоксилом, галогеном, OH, трифторметилом или -CO<Mv>2<D>(C<Mv>1<D> - C<Mv>4<D>-алкилом)] , -[1-(пиридинил)-1H-тетразол-5-ил] C<Mv>1<D> - C<Mv>4<D>-алкоксил, -[1-(1-фенилэтил)-1H-тетразол-5-ил] C<Mv>1<D> - C<Mv>4<D>-алкокси, C<Mv>1<D> - C<Mv>4<D>-алкоксил, группа формулы II \\\6 $$$ \\\1 где R<M^>I<D> - метил или карбоксил; \\\4 R<M^>II<D> - водород и \\\4 R<M^>III<D> выбран из бензила [необязательно замещенного одной, двумя или тремя группами, выбранными из гидрокси, галоген или фенокси (необязательно замещенной одной, двумя или тремя группами, выбранными из гидроксильной ли галогена)]; C<Mv>1<D> - C<Mv>5<D>-алкил, ((CH<Mv>2<D>)<Mv>n<D>COOH, -CH<Mv>2<D>SH, -CH<Mv>2<D>SCH<Mv>3<D>, имидазолинилметилен, идолинилметилен, -CH<Mv>3<D>CH(OH), -CH<Mv>2<D>OH, H<Mv>2<D>N(CH<Mv>2<D>)<Mv>4<D>-(необязательно в защищенном виде), или H<Mv>2<D>NC(NH) NH(CH<Mv>2<D>)<Mv>3<D> (необязательно в защищенном виде), при условии, что, когда R<Mv>5<D>, R<Mv>6<D> и R<Mv>8<D> выбраны из: H, C<Mv>1<D> - C<Mv>8<D>-алкил, или галоген, а Z - H или C<Mv>1<D> - C<Mv>5<D>-алкил, тогда R<Mv>7<D> отличен от -O-(CH<Mv>2<D>)<Mv>n<D> C(O)O-(CH<Mv>2<D>)<Mv>p<D>R<Mv>9<D> или -O-(CH<Mv>2<D>)<Mv>n<D> C(O) - NR<Mv>9<D>R<Mv>10<D>, где n имеет значение, отличное от 0, а R<Mv>9<D> и R<Mv>10<D> выбраны из H или C<Mv>1<D> - C<Mv>12<D>-алкил; при общем условии, что, когда Y отличен от -(CH<Mv>2<D>)<Mv>n<D> морфолинила, по меньшей мере один из заместителей R<Mv>5<D>, R<Mv>6<D>, R<Mv>7<D> или R<Mv>8<D> отличен от водорода C<Mv>1<D> - C<Mv>8<D>-алкила, NO<Mv>2<D>, OH, C<Mv>1<D> - C<Mv>4<D>-алкокси, атома галогена, фенила, бензила, 4-морфолинилметила, NH<Mv>2<D> или диметиламиногруппы, и еще при условии, что когда Y равен 4-морфолинилу, в соединения формулы I не входят: \\\2 6,7-диметокси-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 7,8-(бис)-(3-трифторметил)фенилметокси-2-(4-морфолинил)-4H-1 -бензопиран-4-он; \\\2 N- циклогексил-2-[[8-метил-2-(4-морфолинил) -4-оксо-4H-1-бензопиран-7-ил] окси] -ацетамид; \\\2 2-[[8-метил-2-(4-морфолинил)-4-оксо-4H-1-бензопиран-7-ил] окси] -N-фенилацетамид; \\\2 6- [(1-циклогексил-1H-тетразол-5-ил)метокси] -2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 2- [[8-метил-2-(4)морфолинил)-4-оксо-4H-1-бензопиран-7-ил]] окси] -N -(1-фенилэтил)-ацетамид; \\\1 при дополнительном условии, что, когда Y означает диметиламино, в соединения не входят: \ \ \2 диметиловый эфир 2-(диметиламино)-8-метил-4-оксо-4H -1-бензопиран-7-ил-карбаминовой кислоты; \\\2 диметиловый эфир (диметиламино)-4-оксо-4H-1-бензопиран -6-ил-карбаминовой кислоты; \\\2 диметиловый эфир 2-(диметиламино)-4-оксо-4H-1-бензопиран-7-ил- карбаминовой кислоты; \\\2 метиловый эфир [[8-метил-2-(4-морфолинил)-4-окси-4-H]-бензопиран -7-ил-карбаминовой кислоты; \\\2 диметиловый эфир 2-(диметиламино)-4-оксо-4H-1-бензопиран-6-ил- карбаминовой кислоты; \\\2 диметиловый эфир 2-(диметиламино)-4-оксо-4H-1-бензопиран-7-ил карбаминовой кислоты; \\\2 метиловый эфир [[8-метил-2-(4-морфолинил)-4-оксо-4H)-бензопиран-7-ил] окси] уксусной кислоты; \ \ \ 2 литиевая соль [(8-метил-2-(4-морфолинил)-4-окси-4H-1- бензопиран-7-ил) оксиуксусной кислоты; \\\4 R<Mv>15<D> выбран из групп: C<Mv>1<D> - C<Mv>5<D>-алкил, -(CH<Mv>2<D>)<Mv>n<D> фенил, [где фенил необязательно замещен одним, 2 или 3 C<Mv>1<D> - C<Mv>4<D>-алкилом, C<Mv>1<D> - C<Mv>4<D>-алкоксилом, галоидом, OH, трифторметилом или -CO<Mv>2<D>(C<Mv>1<D> - C<Mv>4<D>-алкилом)] -(CH<Mv>2<D>)<Mv>n<D> пиридин-1-ил или -(CH<Mv>2<D>)<Mv>p<D> пиперидин-1-ил; \\\4 n = 0 - 5; \\\4 p = 2 - 5; \\\4 q = 1 - 5, \\\1 и их фармацевтически приемлемые соли и гидраты. \\\2 2. Замещенные бензопираноны формулы I по п. 1, в которых Y выбран из группы, состоящей из -(CH<Mv>2<D>)<Mv>n<D>R<Mv>9<D>R<Mv>10<D>, где R<Mv>9<D> и R<Mv>10<D> взятые вместе с атомом N, образуют насыщенное или ненасыщенное гетероциклическое аминовое кольцо, выбранное из группы, состоящей из: \\\2 (aa) 4-морфолина, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C<Mv>1<D> - C<Mv>4<D>-алкила, C<Mv>1<D> - C<Mv>4<D>-алкоксила, галогена или трифторметила, \\\2 (bb) 4-тиоморфолина, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C<Mv>1<D> - C<Mv>4<D>-алкила, C<Mv>1<D> - C<Mv>4<D>-алкоксила, галогена или трифторметила; \\\2 (cc) 3-амино-1-пирролидина; \\\2 (dd) 1-пирролидина, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C<Mv>1<D> - C<Mv>4<D>-алкила, C<Mv>1<D> - C<Mv>4<D>-алкоксила, галогена, OH,-CH<Mv>2<D>OH или трифторметила; \\\2 (ee) 1-пиперидина, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C<Mv>1<D> - C<Mv>4<D>-алкила, C<Mv>1<D> - C<Mv>4<D>-алкоксила, галогена, трифторметила, -(CH<Mv>2<D>)<Mv>q<D> OH, -COOH, -CO<Mv>2<D>CH<Mv>3<D>, -CO<Mv>2<D>CH<Mv>2<D>CH<Mv>3<D> или фенила (где фенил необязательно замещен одним, двумя или тремя C<Mv>1<D> - C<Mv>4<D>-алкилом, C<Mv>1<D> - C<Mv>4<D>-алкоксилом, галогеном или триформетилом; \\\2 (ff) 1-пиперазина, 4-метил-1-пиперазина, 4-фенил-1-пиперазина (где фенил может быть необязательно замещен одним, двумя или тремя C<Mv>1<D> - C<Mv>4<D>-алкилами, C<Mv>1<D> - C<Mv>4<D>-алкоксилами, галогеном или трифторметилами) или 4-пиридинил-1-пиперазина, необязательно замещенного одним или двумя заместителями, выбранными из группы, состоящей из C<Mv>1<D> - C<Mv>4<D>-алкила, C<Mv>1<D> - C<Mv>4<D>-алкоксила, галогена, трифторметила, -COOH, -CH<Mv>2<D>OH, -CO<Mv>2<D>CH<Mv>3<D> или -CO<Mv>2<D>CH<Mv>2<D>CH<Mv>3<D>. \ \\2 3. Замещенные бензопираноны формулы 1 по п.1, отличающиеся тем, что Z - H или C<Mv>1<D> - C<Mv>5<D>-алкил. \\\2 4. Замещенные бензопираноны формулы 1 по п.3, в которых Y выбирают из группы, состоящей из -(CH<Mv>2<D>)<Mv>n<D> NR<Mv>9<D>R<Mv>10<D>, где R<Mv>9<D> и R<Mv>10<D> вместе с N образуют 4-морфолин, а n = 0. \\\2 5. Замещенный бензопиранон формулы I по п.4, в котором Z - H. \\\2 6. Замещенный бензопиранон формулы I по п.5, в котором n = 0. \\\2 7. Замещенные бензопираноны формулы I по п.2, в которых по меньшей мере один заместитель из R<Mv>5<D>, R<Mv>6<D>, R<Mv>7<D> или R<Mv>8<D> выбирают из группы, состоящей из - (CH<Mv>2<D>)<Mv>n<D> фенила [ где фенил может быть необязательно замещен одним, двумя или тремя заместителями из C<Mv>1<D> - C<Mv>4<D>-алкила, C<Mv>1<D> - C<Mv>4<D>-алкоксила, галогена, OH, трифторметила или -CO<Mv>2<D>(С<Mv>1<D>-C<Mv>4<D>-алкила)] , -(CH<Mv>2<D>)<Mv>n<D>нафтила, -(CH<Mv>2<D>)<Mv>n<D> пиридинила, -(СH<Mv>2<D>)<Mv>q<D>NR<Mv>9<D>R<Mv>10<D> -CH= CH-фенила [где фенил необязательно замещен одним, двумя или тремя заместителями из группы C<Mv>1<D> - C<Mv>4<D>-алкила, C<Mv>1<D> - C<Mv>4<D>-алкоксила, галогена, OH, трифторметила или -CO<Mv>2<D>(C<Mv>1<D> - C<Mv>4<D>-алкила)] , -CH<Mv>2<D>-CH= CH<Mv>2<D>, -CH= CH-CH<Mv>3<D>, -O-CH<Mv>2<D>-CH= CH<Mv>2<D>. \\\2 8. Замещенные бензопираноны формулы I по пп. 2, 3, 4 или 6, где R<Mv>5<D>, R<Mv>6<D>, R<Mv>7<D> и R<Mv>8<D> выбирают из групп: R<Mv>5<D>, R<Mv>6<D>, R<Mv>7<D> и R<Mv>8<D> каждый - водород, R<Mv>5<D>, R<Mv>6<D> и R<Mv>8<D> каждый - водород, а R<Mv>7<D> выбирают из -O(CH<Mv>2<D>)<Mv>n<D> фенила, (где фенил может быть необязательно замещен одним, двумя или тремя заместителями из C<Mv>1<D> - C<Mv>4<D>-алкила, C<Mv>1<D> - C<Mv>4<D>-алкоксила, галогена или трифторметила) или -(CH<Mv>2<D>)<Mv>n<D> фенила (где фенил может быть необязательно замещен одним, двумя или тремя заместителями из C<Mv>1<D> - C<Mv>4<D>-алкила, C<Mv>1<D> - C<Mv>4<D>-алкоксила, галогена или трифторметила; \\\2 R<Mv>5<D> и R<Mv>6<D> означают водород; \ \ \ 4 R<Mv>8<D> - водород, галоген или C<Mv>1<D> - C<Mv>5<D>-алкил и R<Mv>7<D> выбирают из -O(CH<Mv>2<D>)<Mv>n<D> фенила (где фенил может быть замещен одним, двумя или тремя заместителями из C<Mv>1<D> - C<Mv>4<D>-алкила, C<Mv>1<D> - C<Mv>4<D>-алкоксила, галогена или трифторметила), -O-(CH<Mv>2<D>)<Mv>n<D> пиридинила (где пиридинил может быть замещен одним, двумя или тремя заместителями из C<Mv>1<D> - C<Mv>4<D>-алкила, C<Mv>1<D> - C<Mv>4<D>-алкоксила, галогена или трифторметила), -O-(CH<Mv>2<D>)<Mv>n<D> нафтила, -(CH<Mv>2<D>)<Mv>n<D> фенила (где фенил может быть замещен одним, двумя или тремя заместителями из C<Mv>1<D> - C<Mv>4<D>-алкила, C<Mv>1<D> - C<Mv>4<D>-алкоксила, галогена или трифторметила), -(CH<Mv>2<D>)<Mv>n<D> пиридинила (где пиридинил может быть замещен одним, двумя или тремя заместителями из C<Mv>1<D> - C<Mv>4<D>-алкила, C<Mv>1<D> - C<Mv>4<D>-алкоксила, галогена или трифторметила). \\\2 9. Замещенный бензопиранон формулы I по п.1, выбранный из группы: \\\2 1. 6-Хлоро-2-(4-морфолинил)-4H-1-бензопиран-4-он; \ \\2 2. 2-(4-Морфолинил)-4H-1-бензопиран-4-он; \ \ \2 3. 8-Метил-2-(4-морфолинил)-(7-фенилметокси)-4H-1-бензопиран-4-он; \\\2 4. 7-Хлоро-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 5. 8-Хлоро-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 6. 6-Бромо-2-(4-морфолинил)-4H-1-бензопиран-4-он; \ \\2 7. 6-Фторо-2-(4-морфолинил)-4H-1-бензопиран-4-он; \ \\2 8. 6-метил-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 9. 7-Метил-2-(4-морфолинил)-4H-1-бензопиран-4-он; \ \\2 10. 8-Метил-2-(4-морфолинил)-4H-1-бензопиран-4-он; \ \\2 11. 6-Метокси-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 12. 7-Метокси-2-(4-морфолинил)-4H-1-бензопиран-4-он; \ \ \ 2 13. 6-(Фенилметокси)-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 14. 8-(Фенилметокси)-2-(4-морфолинил)-4H-1-бензопиран-4-он; \ \ \ 2 15. [2-(4-Морфолинил)-4-оксо-4H-1-бензопиран-6-ил] -1,1-диметилэтиловый сложный эфир карбаминовой кислоты; \\\2 16. 6-(3-Пиридинкарбоксамид) -2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 17. 2-(4-Морфолинил)-6-нитро-4H-1-бензопиран-4-он; \ \\2 18. 6-([[Фенилметокси]карбонил]амино) -2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 19. 8-Метокси-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 20. 3-Амино-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 21. 3-Хлоро-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 22. 3-Бромо-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 23. 8-Метил-2-(4-морфолинил)-7-(фенилметокси)-4H-1-бензопиран-4-он; \ \\2 24. 2-(4-Морфолинил)-5-(фенилметокси)-4H-1-бензопиран-4-он; \\\2 25. 7,8-Диметокси-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 26. 8-Метил-7-(фенилметокси)-2-[4-(2-пиридинил)-1-пиперазинил] -4H-бензопиран-4-он; \ \ \2 27. 8-метил-7-(фенилметокси)-2-(1-пиперазинил)-4H-бензопиран-4-он; \ \\2 28. 8-Метил-7-(фенилметокси)-2-(1-пирролидинил)-4H-бензопиран-4-он; \ \ \2 29. 8-Метил-7-(фенилметокси)-2-(1-пиперидинил)-4H-бензопиран-4-он; \ \\2 30. 8-Метил-2-(4-метил-1-пиперазинил)-7-(фенилметокси)-4H-бензопиран-4-он; \\\2 31. 8-Метил-7-(фенилметокси)-2-(2,6-диметил-4-морфолинил) -4H-бензопиран-4-он; \\\2 32. 8-Метил-7-(фенилметокси)-2-(4-фенил-1- пиперидинил)-4H-бензопиран-4-он; \\\2 33. 8-Метил-7-(фенилметокси)-2- (4-фенил-1-пиперазинил)-4H-бензопиран-4-он; \ \\2 34. 7-Гидрокси-8-метил-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 35. 6-Гидрокси-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 36. 7-Гидрокси-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 37. 5-Гидрокси-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 38. 8-Гидрокси-2-(4-морфолинил)-4H-1-бензопиран-4-он; \ \ \2 39. 7-Метокси-8-метил-2-(4-морфолинил)-4H-1-бензопиран-4-он; \ \ \ 2 40. 7-[(4-Метоксифенил)метокси] -8-метил-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 41. 8-Метил-7-[(4-метилфенил)метокси] -2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 42. 7-[(4-Хлорфенил)метокси]-8-метил-2-(4-морфолинил)-4H-1-бензопиран-4-он; \ \ \ 2 43. 7-[(4,5-Дихлорфенил)метокси]-8-метил -2-(4-морфолинил)-4H-1-бензопиран-4-он; \ \ \2 44. 8-Метил-2-(4-морфолинил) -7-(2-пиридинилметокси)-4H-1-бензопиран-4-он; \\\2 45. 8-Метил-7-[[(фенил)карбонил]окси] -2-(4-морфолинил)-4H-1-бензопиран-4-он; \ \ \ 2 46. 7-Метокси-8-метил -2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 47. 7-[[4-1,1-Диметилэтил)фенил]метокси-8-метил -2-(4-морфолинил)-4H-1-бензопиран-4-он; \ \ \2 48. 7-[(3-Метоксифенил)метокси] -8-метил -2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 49. 7 -[(2-Фенилэтил)метокси] -8-метил-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 50.7-[(2-Метоксифенил)метокси] -8-метил -2-(4-морфолинил)-4H-1-бензопиран-4-он; \ \\2 51. 7-[(4-Этоксифенил)метокси]-8-метил -2-(4-морфолинил)-4H-1-бензопиран-4-он; \ \\2 52. 8-(4-Этоксибензилокси) -2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 53. 8-(2-Метоксибензилокси) -2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 54. 2-(4-Морфолинил)-8-(2-фенилэтокси)-4H-1-бензопиран-4-он; \ \ \ 2 55. 2-(4-Морфолинил)-(2-оксо-2-фенилэтокси)-4H-1-бензопиран-4-он; \\\2 56. 8-(4-Хлоробензилокси)-2-(4-морфолинил)-4H-1-бензопиран-4-он; \ \\2 57. 8-(4-т.-Бутилбензилокси)-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 58. 8-(3-Метоксибензилокси)-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 59. 8-(3,4-Дихлоробензилокси)-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 60. 8-(4-Метилбензилокси)-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\ \ 2 61. 8-(4-Метоксибензилокси)-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 62. 2-(4-Морфолинил)-8-(нафтил-2-метилокси)-4H-1-бензопиран-4-он; \\\2 63. 2-(4-Морфолинил)-8-(нафтил-1-метилокси)-4H-1-бензопиран-4-он; \\\2 64. 8-Метил-2-(4-морфолинил)-7-(нафтил-2-метилокси)-4H-1-бензопиран-4-он; \\\2 65. 8-Метил-2-(4-морфолинил)-7-(нафтил-1-метилокси)-4H-1-бензопиран-4-он; \\\2 66. 2-(Диметиламино)-8-метил-7-(фенилметокси)-4H-1-бензопиран-4-он; \\\2 67. Сложный эфир [8-метил-2-(4-морфолинил)-4-оксо-4H-1-бензопиран-7-ил]-4-морфолинилкарбоновой кислоты; \\\2 68. 2-(4-Морфолинил)-7-(фенилметокси)-4H-1-бензопиран-4-он; \ \\2 69. 8-Метил-2-(4-морфолинил)-7-(2-оксо-2-фенилэтокси)-4H-1-бензопиран-4-он; \ \ \ 2 70. 6-Хлоро-8-метил-2-(4-морфолинил)-7-(фенилметокси)-4H-1-бензопиран-4-он; \\\2 71. Сложный метиловый эфир [[2-(4-морфолинил)-4-оксо-4H-1-бензопиран-8-ил] окси] уксусной кислоты; \\\2 72. Сложный метиловый эфир 4-[[[8-метил-2-(4-морфолинил)-4-оксо-4H-1-бензопиран-7-ил] окси] метил]бензойной кислоты; \\\2 73. Сложный метиловый эфир 4-[[[2-(4-морфолинил)-4-оксо-4H-1-бензопиран-8-ил] окси] метил] бензойной кислоты; \ \\2 74. 8-Метил-2-(4-морфолинил)-7-[[3-(трифторметил)фенил]метокси] -4H-1-бензопиран-4-он; \\\2 75. 2-(4-Морфолинил)-8-[[3-(трифторметил)фенил] метокси] -4H-1-бензопиран-4-он; \\\2 76. 7-(Циклогексилметокси)-8-метил-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 77. 8-Метил-2-(4-морфолинил)-7-(2-пропенилокси)-4H-1-бензопиран-4-он; \\\2 78. 2-(4-Морфолинил)-7-(1-нафталенилметокси)-4H-1-бензопиран-4-он; \\\2 79. 8-Метил-2-(4-морфолинил)-7-(3-пиридинилметокси)-4H-1-бензопиран-4-он; \ \\2 80. 8-Метил-2-(4-морфолинил)-7-(4-пиридинилметокси)-4H-1-бензопиран-4-он; \\\2 81. 8-Метил-2-(4-морфолинил)-7-(2-хиноксалинилметокси)-4H-1-бензопиран-4-он; \\\2 82. 8-Метил-2-(4-морфолинил)-7-(пиразинилметокси)-4H-1-бензопиран-4-она; \\\2 83. N-Оксид-8-метил-2-(4-морфолинил)-7-(2-пиридинилметокси)-4H-1-бензопиран-4-он; \\ \ 2 84. N-Оксид-8-метил-2-(4-морфолинил)-7-(3-пиридинилметокси)-4H-1-бензопиран-4-она; \\\2 85. 8-Иодо-2-(4-морфолинил)-7-(3-пиридинилметокси)-4H-1-бензопиран-4-он; \\\2 86. 3,3-Диметил-1-[[8-метил-2-(4-морфолинил)-4-оксо-4H-1-бензопиран-7-ил] - окси]бутан-2-он; \\\2 87. 1-[[8-Метил-2-(4-морфолинил)-4-оксо-4H-1-бензопиран-7-ил] окси]пропан-2-он; \\\2 88. 1-[[8-Метил-2-(4-морфолинил)-4-оксо-4H-1-бензопиран-7-ил]окси]бутан-2-он; \\\2 89. 8-Метил-2-(4-морфолинил)-7-(2-оксо-2-(2-нафтил)этокси)-4H-1-бензопиран-4-он; \\\2 90. 2-(4-Морфолинил)-7-(2-пиридинилметокси)-4H-1-бензопиран-4-он; \\\2 91. 2-(4-Морфолинил)-7-(3-пиридинилметокси)-4H-1-бензопиран-4-он; \\\2 92. 2-(4-Морфолинил)-8-(2-пиридинилметокси)-4H-1-бензопиран-4-он; \\\2 93. 2-(4-Морфолинил)-8-(3-пиридинилметокси)-4H-1-бензопиран-4-он; \\\2 94. 8-Метил-2-(4-Морфолинил)-7-(2-хинолинилметокси)-4H-1-бензопиран-4-он; \ \ \ 2 95. 7,8-(Бис)-фенилметокси-2-(4-морфолинил)-4H-1-бензопиран-4-он; \ \ \ 2 96. 7,8-(Бис)-ацетилокси-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 97. 7,8-(Бис)-гидрокси-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 98. 7-Гидрокси-2-(4-морфолинил)-8-фенилметокси-4H-1-бензопиран-4-он; \\\2 99. 8-Гидрокси-2-(4-морфолинил)-7-(3-трифторметил)фенилметокси-4H-1- бензопиран-4-он; \\\2 100. 7-Гидрокси-2-(4-морфолинил)-8-(3-трифторметил)фенилметоски-4H-1-бензопиран-4-он; \\\2 101. 7-[3-(1-Циклогексил-1H-тетразол-5-ил)пропокси]-8-метил-2-(4-морфолинил) -4H-1-бензопиран-4-он; \\\2 102. 8-[3-(1-Циклогексил-1H-тетразол-5-ил)пропокси]-2-(4-морфолинил) -4H-1-бензопиран-4-он; \\\2 103. 7-[(1-Циклогексил-1H-тетразол-5-ил)метокси] -8-метил-2-(4-морфолинил) -4H-1-бензопиран-4-он; \\\2 104. 8-[(1-Циклогексил-1H-тетразол-5-ил)метокси]-2-(4-морфолинил) -4H-1-бензопиран-4-он; \\\2 105. 2-(4-Морфолинил)-8-[(1-фенил-1H-тетразол-5-ил)окси] -4H-1-бензопиран-4-он; \ \\2 106. N-циклогегсил-2-[[2-(4-морфолинил)-4-оксо- -4H-1-бензопиран-8-ил] окси]ацетамид; \\\2 107. N-(1,1-Диметилэтил)-2-[[2-(4-морфолинил)-4-оксо-4H-1-бензопиран-8-ил] окси] ацетамид; \\\2 108. 2-[[2-(4-Морфолинил)-4-оксо-4H-1-бензопиран-8-ил] -N] -фенилацетамид; \\\2 109. 2-[[2-(4-Морфолинил)-4-оксо-4H-1-бензопиран-8-ил] окси] N-(1- фенилэтил)ацетамид; \\\2 110. 8-Метил-2-(4-морфолинил)-7-[(1-фенил-1H-тетразол-5-ил)окси] -4H-1-бензопиран 4-он; \\\2 111. 2-[[8-Метил-2-(4-морфолинил)-4-оксо-4H-1-бензопиран-7-ил] окси] -N-3-пиридинилацетамид; \\\2 112. N-[[[8-Метил-2-(4-морфолинил)-4-оксо-4Н-1-бензопиран-7-ил] окси]-N-3-пиридинилацетамид; \\\2 113. 7-(2,2-Диметоксиэтокси)-8-метил-2-(4-морфолинил)-4H-1-бензопиран-4-он; \ \ \2 114. 2-(4-Морфолинил)-8-(2-пропенил)-4H-1-бензопиран-4-он; \\\2 115. 2-(4-Морфолинил)-8-(1-пропенил)-4H-1-бензопиран-4-он; \\\2 116. 8-Формил-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 117. 2-(4-Морфолинил)-8-(фениламино)метил-4H-1-бензопиран-4-он; \ \\2 118. 2-(4-Морфолинил)-8-(2E-фенил)этинил-4H-1-бензопиран-4-он; \\\2 119. 8-Гидроксиметил-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 120. 8-Метил-7-[(1-метил-3-пиперидинил)метокси]-2-(4-морфолинил) -4H-1-бензопиран-4-он; \ \ \ 2 121. 8-Метил-2-(4-морфолинил)-7-(2-(1-пиперидинил)этил)окси -4H-1-бензопиран-4-он; \ \ \ 2 122. 8-Метил-2-(4-морфолинил)-7-(2-(1-пирролидинил)этил)окси-4Н-1-бензопиран-4-он; \\\2 123. 8-Метил-2-(4-морфолинил)-7-(2-(4-морфолинил)этил)окси -4H-1-бензопиран-4-он; \\\2 124. 8-Метил-2-(4-морфолинил)-7-(3-(1-пиперидино)пропил)окси -4H-1-бензопиран-4-он; \\\2 125. 7-(2-Диэтиламиноэтил)окси-8-метил-2-(4-морфолинил) -4H-1-бензопиран-4-он; \\ \2 126. 7-[2-(Этилфениламино)этокси]-8-метил-2-(4-морфолинил) -4H-1-бензопиран-4-он; \\\2 127. 7-(2-Диизопропиламиноэтил)окси-8-метил-2-(4-морфолинил) -4H-1-бензопиран-4-он; \\\2 128. 7-Гидрокси-8-метил-2-(1-пиперидинил) -4H-1-бензопиран-4-он; \ \ \2 129. 8-Метил-2-(1-пиперидинил)-7-(3-пиридинилметокси) -4H-1-бензопиран-4-он; \\\2 130. 7-Ацетокси-3,8-диметил-2-(4-морфолинил) -4H-1-бензопиран-4-он; \\\2 131. 3,8-Диметил-7-гидрокси-2-(4-морфолинил) -4H-1-бензопиран-4-он; \\\2 132. 7-Бензилокси-3,8-диметил-2-(4-морфолинил) -4H-1-бензопиран-4-он; \\\2 133. 3,8-Диметил-2-(4-морфолинил)-7-(нафтил-1-метилокси) -4H-1-бензопиран-4-он; \\\2 134. 3,8-Диметил-7-(4-метоксибензилокси)-2-(4-морфолинил) -4H-1-бензопиран-4-он; \\\2 135. 3,8-Диметил-2-(4-морфолинил)-7-(2-фенилэтокси) -4H-1-бензопиран-4-он; \ \ \ 2 136. 3,8-Диметил-7-(хлорбензилокси)-2-(4-морфолинил) -4H-1-бензопиран-4-он; \\\2 137. 3,8-Диметил-2-(4-морфолинил)-7-(3-трифторметилбензилокси) -4H-1-бензопиран-4-он; \\\2 138. 7-(Карбометоксиметокси)-3,8-диметил-2-(4-морфолинил) -4H-1-бензопиран-4-он; \\\2 139. 8-Гидрокси-3-метил-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 140. 8-Бензилокси-3-метил-2-(4-морфолинил)-4H-1-бензопиран-4-он; \ \ \2 141. 3-Метил-2-(4-морфолинил)-8-(м-трифторметилбензилокси) -4H-1-бензопиран-4-он; \ \\2 142. 8-Метил-7-(2-фенилэтинил)-2-(4-морфолинил) -4H-1-бензопиран-4-он; \\\2 143. 8-Метил-2-(4-морфолинил)-7-(2-фенил)этил -4H-1-бензопиран-4-он; \ \\2 144. 2-(4-Морфолинил)-8-(2-фенил)этинил-4H-1-бензопиран-4-он; \ \ \ 2 145. 2-(4-Морфолинил)-8-(2-фенил)этил-4H-1-бензопиран-4-он; \\\2 146. 2-(4-Морфолинил)-8-(2-(3-трифторметил)фенил)этинил -4H-1-бензопиран-4-он; \\\2 147. 2-(4-Морфолинил)-8-(2-(3-трифторметил)фенил)этил -4H-1-бензопиран-4-он; \\\2 148. 8-Метил-2-(4-морфолинил)-7-(2-(1-нафтил)этил -4H-1-бензопиран-4-он; \\\2 149. 8-Метил-2-(4-морфолинил)-7-фенил-4H-1-бензопиран-4-он; \ \\2 150. 7-Ацетилокси-8-иодо-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 151. 8-Этил-2-(4-морфолинил)-7-(3-пиридинилметокси) -4H-1-бензопиран-4-он; \\\2 152. 8-Этил-2-(4-морфолинил)-7-фенилметокси-4H-1-бензопиран-4-он; \\\2 153. 8-Иодо-2-(4-морфолинил)-7-фенилметокси-4H-1-бензопиран-4-он; \\\2 154. 8-Этил-2-(4-морфолинил)-7-[2-(1-пиперидинил)этил)-11-окси -4H-1-бензопиран-4-он; \\\2 155. 8-Иодо-2-(4-морфолинил)-7-(3-пиридинилметокси) -4H-1-бензопиран-4-он; \\\2 156. 8-Иодо-7-гидрокси-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 157. 7-(3-Пиридинилметокси)-2-(1-пиперидинил)-8-метил -4H-1-бензопиран-4-он; \\\2 158. 8-Метил-2-(4-морфолинилметил)-7-(фенилметокси) -4H-1-бензопиран-4-он; \ \\2 159. 7-Гидрокси-2-(4-морфолинилметил)-8-метил -4H-1-бензопиран-4-он; \\\ 2 160. 7-[(1-Циклогексил-1H-тетразол-5-ил)метилокси] -8-метил-2- (4-морфолинилметил)-4H-1-бензопиран-4-он; \\\2 161. 8-Метил-2-(4-морфолинилметил)-7-(3-пиридинилметокси) -4H-1-бензопиран-4-он, \\\1 или его фармацевтически приемлемая соль, или гидрат, \\\2 10. замещенный бензопираном формулы 1, по п.1, выбранный из группы: \\\2 1. 2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\ 2 2. 8-метил-2-(4-морфолинил)-(7-фенилметокси)-4H-1-бензопиран-4-он; \\\2 3. 6-[[фенилметокси]карбонил]амино)-2-(4-морфолинил) -4H-1-бензопиран-4-он; \\\ 2 4. 8-метил-2-(4-морфолинил)-7-(2-пиридинилметокси) -4H-1-бензопиран-4-он; \ \\2 5. 8-(4-метоксибензилокси)-2-(4-морфолинил)-4H-1-бензопиран-4-он; \\\2 6. 8-метил-2-(4-морфолинил)-7-(нафтил-1-метилокси) -4H-1-бензопиран-4-он; \\ \2 7. 8-метил-2-(4-морфолинил)-7-(3-пиридинилметокси) -4H-1-бензопиран-4-он; \\\2 8. 7-[(1-циклогексил-1H-тетразол-5-ил)метокси]-8-метил-2-(4-морфолинил) -4H-1-бензопиран-4-он; \ \\2 9. 8-метил-2-(4-морфолинил)-7-(2-(1-пиперидинил)этил)окси -4H-1-бензопиран-4-он; \\\2 10. 8-метил-2-(4-морфолинил)-7-(2-(1-пирролидинил)этил)окси -4H-1-бензопиран-4-он; \\\2 11. 8-метил-2-(1-пиперидинил)-7-(3-пиридинилметокси) -4H-1-бензопиран-4-он.
| US, 4092416, A 61 K 31/495, 1978 | |||
| DE, 2555290, C 07 D 405/06, 1975. |
Авторы
Даты
1998-08-27—Публикация
1989-12-15—Подача