Изобретение относится к медицинe и может использоваться для специфической индикации и диагностики инфекционных болезней (в данном случае холеры, вызванной возбудителями трех сероваров: Инаба, Огава, 0139).
Известно, что действующим началом препаратов, используемых для серодиагностики и идентификации холеры, как и для ряда других представителей микробов кишечной группы, является О-антиген - основной компонент клеточной стенки грамотрицательных микроорганизмов, имеющий липополисахаридную природу и обладающий серологической специфичностью. В тоже время известно, что для производства диагностических препаратов (сывороток, диагностикумов), в том числе и холерных, наиболее часто используют целые убитые микробные клетки, обладающие комплексом различных антигенов, что затрудняет технологию (необходимостью удаления адсорбцией неспецифических балластных антител) и уменьшает активность и специфичность препаратов. О-антигены бактерий и их дериваты применяют с целью создания некоторых МИБП (диагностикумов эритроцитарных, латексных и др.), причем для их приготовления, как правило, используют жесткие методы получения О-антигена путем воздействия на клетки фенолом, смесью фенол-хлороформ-петролейный эфир, трихлоруксусной кислотой, бутанолом и т.п. Все эти методы, предложенные рядом авторов: Буавеном, Месробяну, Вестфалем, Людеритцем и некоторыми другими, в 40-50-х годах стали классическими и в настоящее время остались общепринятыми при получении комплексных антигенов липополисахаридной природы - О-антигенов компонентов оболочек грамнегативных микробов. Так, например, в 1997 году в каталоге фирмы Sigma описано более 60 коммерческих препаратов липополисахаридов бактерий кишечной группы, выделенных при помощи вышеназванных реагентов и методов, в том числе и фенольной экстракцией из штамма 569B холерного вибриона (см. Sigma. Diochemikalien und reagenzien fur die Naturnissenschaftiche Torschung. Deutschland. - 1997. - С. 694-697).
Известны способы получения препаратов O-антигена, основанные на применении вышеперечисленных методов из клеток холерного вибриона, в основном при создании химических вакцин (Александров и Гефен, 1948 г.; Ватанабе и Вервей, 1963 г. ; Лавровская, 1966 г.; B кн. Захарова И.Л., Варбанец Л.Д. Углеводсодержащие биополимеры мембран бактерий. - Киев: Наукова думка, 1983). В последние годы для тех же целей для получения O-антигена С.Кабир (Infection and Immunity, 1987) и некоторые другие авторы применяли водно-фенольную экстракцию из убитых целых клеток с последующим деацилированием щелочью при 56oC.
В работах Джапаридзе М.Н., Караевой Л.Т, Дертевой И.И, Бургасова П.Н., Сумарокова А. А., и др. (Журнал микробиологии, эпидемиологии и иммунологии, 1981, N 11; 1990, N 12; 1991, N 4) для получения O-антигенов холерного вибриона было использовано его свойство при глубинном культивировании выделять спонтанно в среду выращивания растворимый O-антиген, что исключало применение химических агентов для его выделения. В результате выполнения этих работ разработан способ получения оральной холерной бивалентной вакцины, состоящей из двух компонентов - анатоксина-холерогена и O-антигенов серовара Инаба и Огава (патенты N 2076734 и N 2080121, кл. A 61 K 39/00). Эта вакцина применяется в России.
Известен способ получения O-антигена Огава (Способ производства вакцины для профилактики холеры, патент N 2080121), при котором проводят глубинное культивирование вибрионов в реакторе, обезвреживание, сепарирование микробных тел, выделение и очистку O-антигена из культуральной жидкости путем осаждения сульфатом аммония при 0,5 насыщения при pH 7,0±0,3 и фракционирование между 0,3-0,4 насыщения при pH 6,8±0,1, диализ, лиофилизацию.
Недостатком данного способа является то, что получение O-антигена осуществляется двукратным переводом его сульфатом аммония из растворенного состояния в осадок, отрицательно влияющий на нативность и растворимость препарата.
Известен также способ получения O-антигена штамма возбудителя холеры 0139 серовара (Журнал микробиологии, эпидемиологии и иммунологии, 1996, N 2), в котором также выделение антигена из культуральной жидкости проводится фракционированием сульфатом аммония в интервале 0,2-0,8 насыщения при pH 7,0±0,3, с последующим диализом и лиофилизацией.
Однако и он связан с переводом антигена из растворенного состояния в осадок, полученная фракция кроме липополисахаридного компонента содержит белки, экзоферменты.
Наиболее близким к заявляемому способу является способ получения холерных O-антигенов Инаба и Огава (патент N 2076734), который заключается в их осаждении из культуральной жидкости сульфатом аммония при 0,5 насыщения с последующим диализом осадка и затем рефракционированием между 0,25 - 0,5 насыщения при pH 6,8±0,1 повторным диализом и лиофилизацией.
Содержание O-антигена в 1 мг конечного продукта выражается условными единицами - обратным титром реакции непрямой гемагглютинации с холерной O-сывороткой (для O-антигена Инаба она составляет в РПГА не ниже 50 усл. ед., а для O-антигена Огава - 100 усл. ед.).
Этот способ принят в качестве ближайшего аналога заявленного способа получения O-антигена, поскольку исходные и конечные продукты обладают сходными биологически-активными свойствами, являются O-антигенами холерного вибриона, находящимися в культуральной жидкости липополисахаридобелковыми комплексами клеточной стенки. Конечные продукты обоих методов лиофильно высушены, и их качество описывается специфической антигенной активностью O-антигена.
Имеется также сходство в операциях получения бульонной культуры штаммов-продуцентов при глубинном культивировании в реакторе с подкормкой глюкозой и аммиаком. Основным материалом для выделения O-антигена обоими способами является культуральная жидкость с растворенным O-антигеном, так что применение химических агентов, жестких методов исключается.
Однако и при данном способе получения в O-антигене присутствуют ряд иммуногенов холерного вибриона, экзоферменты, что объясняется его назначением как компонента холерной оральной вакцины.
Задачей изобретения является разработка способа, позволяющего получить препарат высокоочищенного, нативного, хорошо растворимого O-антигена холерного вибриона 01 серовара (Инаба, Огава), а также эпидемически значимого НАГ вибриона 0139 серовара.
Сущность способа получения O-антигена заключается в использовании совокупности последовательных операций, начиная от выбора в качестве исходного материала растворимого в культуральной жидкости O-антигена, спонтанно выделенного штаммом-продуцентом.
Все последующие операции по его очистке и концентрации предполагали сохранение целевого продукта в однофазном растворенном состоянии.
Известно решающее значение при получении биологических объектов сохранения постоянным их фазового состояния. Воздействие на высокомолекулярные биологические соединения, не изменяющие их фазового состояния, позволяют сохранить структуру и биологическую активность даже лабильных соединений (Гейли Дж., Олис Д. Основы биохимической инженерии. - М.: Мир, 1989).
В предлагаемом способе получения очищенного O-антигена для решения вышеназванной задачи применяют следующие последовательно сменяющиеся операции. Проводят глубинное культивирование штаммов в реакторе с подкормкой глюкозой и аммиаком и в качестве исходного материала используют культуральную жидкость, в которой растворен спонтанно образованный O-антиген. Очистку O-антигена от балластных белков культуральной жидкости осуществляют осаждением их при pH 4,4±0,2 с последующим отделением центрифугированием. O-антиген, оставшийся растворенным в центрифугате, концентрируют в 10-20 раз и освобождают от неспецифических компонентов с мол. массой менее 100 кДа. Жидкий концентрат O-антигена вновь очищают методом колоночной разделительной хроматографии на геле TSK и выделяют цельный продукт с мол. массой 1000-2000 кДа. Препарат замораживают при -40oC и лиофильно высушивают.
В отличие от наиболее близкого аналога, где очистка и концентрация осуществляются переводом O-антигена сульфатом аммония в осадок с последующим растворением и диализом, предлагаемый способ обеспечивает сохранение O-антигена в однофазном растворенном состоянии на всех этапах очистки, что осуществляется тщательным подбором, последовательным использованием высокоэффективных методов отделения балластных неспецифических примесей (гель-хроматография, мембранная ультрафильтрация), не изменяющих фазового состояния целевого продукта.
Отличия заявляемого способа от наиболее близкого аналога в следующем.
1. В предлагаемом способе на всех этапах получения сохраняется однофазное состояние O-антигена, так как он остается в растворенном состоянии, что сохраняет его нативность, неизменность медико-биологических свойств. В практике известного способа ближайшего аналога получение O-антигена осуществляется двукратным переводом его сульфатом аммония из растворенного состояния в осадок.
2. Очистка - отделение примесей от O-антигена заявляемьм способом проводится совокупностью последовательных не изменяющих фазного состояния операций, заключающихся в переводе в нерастворимое состояние примесей (белков), а не O-антигена, ультрафильтрации, отделяющей его от веществ с молекулярной массой менее 100 кДа, и гель-хроматографии, удаляющей соединения, не обладающие специфической серологической активностью O-антигена с мол. массой менее 300 кДа, чем достигается высокая степень очистки и гомогенности O-антигена.
В наиболее близком аналоге очистка O-антигена проводится путем фракционирования сульфатом аммония при насыщении 0,25 - 0,50. Уровень чистоты O-антигена в этом случае значительно ниже, присутствуют ряд иммуногенов холерного вибриона, экзоферментов, некоторые факторы патогенности, что объясняется его назначением как компонента холерной оральной вакцины.
В результате медико-биологические свойства полученного препарата значимо отличаются от таковых аналога.
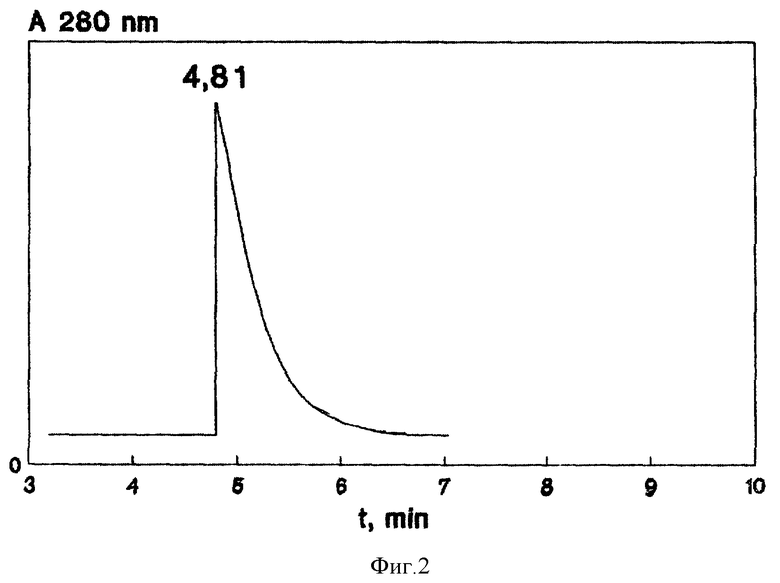
Подробное изложение способа представлено с помощью фиг. 1 и 2, где на фиг. 1 показан график гель-фильтрации холерного O-антигена на TSK-геле HW-60 (A) и HW-75 (B), где по оси ординат: A280 - кривая элюции белка; T - величина титра; O-ag - содержание O-антигена; Pr, Ph - протеазная и фосфолипазная активности (Т/в пробе); по оси абсцисс - номер проб. На фиг. 2 показан спектр ВЭЖХ очищенного гель-фильтрацией O-антигена, где по оси ординат A280 - кривая элюции белка, по оси абсцисс - время выхода проб.
Подробное описание осуществления способа представлено на примере технологии, разработанной РосНИПЧИ "Микроб".
В качестве продуцентов холерного O-антигена использовали штаммы 01 серовара M41 Огава и 569B Инаба, а также 0139.
Холерный вибрион выращивают при температуре 34-37oC в реакторе на среде из ферментативного гидролизата казеина (pH 8,0, 200 мг% аминного азота, Na2HPO4 - 0,05%, NaCl - 0,5%) в условиях глубинного культивирования с подкормкой глюкозой и аммиаком. В стационарной фазе роста (10-11 ч выращивания), когда концентрация микробных тел, достигнув 70-80 млрд в 1 мл, оставалась постоянной в течениe 3 ч, выращивание прекращали добавлением 0,6 - 0,2% формалина. Содержание растворенного в культуральной жидкости O-антигена в это время по реакции диффузионной преципитации с O-сывороткой составляло 4-8 усл. ед. (обратный титр реакции диффузионной преципитации в геле). Убитые микробные тела через 12 ч отделяли центрифугированием при 15000 об/мин, а надосадочную жидкость выдерживали 30 дней при температуре 10-12oC для снижения токсичности O-антигена (и одновременно образования анатоксина у токсигенного штамма 569B). После этого приступали к выделению, очистке и концентрации O-антигена из культуральной жидкости, сохраняя его на всех этапах в растворенном нативном состоянии. Оставшиеся микробные тела и балластные белки осаждают снижением pH до 4,4 ± 0,2 (возможно в присутствии гексаметафосфата натрия) и удаляют центрифугированием при 15000 об/мин, при этом O-антиген остается растворенным в центрифугате. Стерильность достигалась добавлением азида натрия в конечной концентрации 0,02%. На следующем этапе очистка центрифугата производится мембранной ультрафильтрацией центрифугата на автоматизированной установке АУФ-01 через полые волокна, пропускающие частицы с мол. массой менее 100 кДа, очищающие O-антиген от неспецифических примесей и одновременно концентрирующие в 20 раз. Концентрированный раствор O-антигена отделяют от оставшихся высокомолекулярных неспецифических примесей путем разделительной хроматографии (например, на TSK-геле HW-60), который обладает высокой механической стабильностью, и обеспечивая высокоскоростное выделение антигена при минимальном разведении образца, что позволяет использовать его в производстве. Преимущество разделительной способности TSK-геля HW-60 показано на фиг. 1.
Полученный целевой продукт диализуют против 0,9% хлорида натрия, разливают по 1 мл в ампулы и лиофильно высушивают.
Одна ампула содержит (5±0,5) мг сухого препарата, 250-500 условных доз O-антигена, равных обратному титру в РПГА с O-сывороткой (холерной или против 0139 штамма). Содержание белка составляет 7-8% белка (по Лоури), токсичность при введении белым мышам в расчете по LD50, установленная в среднем, равна (2±0,5) мг. Препарат гомогенен при высокоэффективной жидкостной хроматографии на TSK геле 3000 SW, элюция происходит одним острым пиком со временем удерживания 4,8 мин (фиг. 2).
| название | год | авторы | номер документа |
|---|---|---|---|
| ОРАЛЬНАЯ ХИМИЧЕСКАЯ ВАКЦИНА ПРОТИВ ХОЛЕРЫ | 2000 |
|
RU2159128C1 |
| СПОСОБ ПРОИЗВОДСТВА ВАКЦИНЫ ДЛЯ ПРОФИЛАКТИКИ ХОЛЕРЫ | 1988 |
|
RU2080121C1 |
| ШТАММ БАКТЕРИЙ VIBRIO CHOLERAE 2414 КЛАССИЧЕСКОГО БИОВАРА СЕРОВАРА ОГАВА - ПРОДУЦЕНТ ХОЛЕРНОГО ТОКСИНА И ТОКСИНКОРЕГУЛИРУЕМЫХ ПИЛЕЙ АДГЕЗИИ | 2000 |
|
RU2169187C1 |
| АВИРУЛЕНТНЫЙ ТЕСТ-ШТАММ БАКТЕРИЙ Vibrio cholerae БИОВАРА eltor СЕРОВАРА Ogawa (ctxA-, tcpA-, toxR-, zot-), ИСПОЛЬЗУЕМЫЙ В ИММУНОЛОГИЧЕСКИХ, ГЕНЕТИЧЕСКИХ ИССЛЕДОВАНИЯХ И УЧЕБНОМ ПРОЦЕССЕ | 2004 |
|
RU2254371C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРОРАЛЬНОЙ ХИМИЧЕСКОЙ ВАКЦИНЫ | 1993 |
|
RU2076734C1 |
| СПОСОБ КОНЦЕНТРИРОВАНИЯ НАТИВНОГО О-АНТИГЕНА Vidrio cholerae | 2011 |
|
RU2445116C1 |
| АВИРУЛЕНТНЫЙ ШТАММ БАКТЕРИЙ Vibrio cholerae KM 263 БИОВАРА ЭЛЬТОР СЕРОВАРА ИНАБА - ПРОДУЦЕНТ ПРОТЕКТИВНОГО О1 АНТИГЕНА | 2010 |
|
RU2425867C1 |
| ШТАММ БАКТЕРИЙ VIBRIO CHOLERAE КМ207 КЛАССИЧЕСКОГО БИОВАРА СЕРОВАРА ИНАБА - ПРОДУЦЕНТ ПРОТЕКТИВНЫХ АНТИГЕНОВ | 2002 |
|
RU2222595C1 |
| СПОСОБ ПОЛУЧЕНИЯ ХОЛЕРОГЕНА-АНАТОКСИНА | 2013 |
|
RU2535122C1 |
| ШТАММ БАКТЕРИЙ VIBRIO CHOLERAE KM 200 - ПРОДУЦЕНТ ХОЛЕРНОГО ТОКСИНА И ТОКСИН - КОРЕГУЛИРУЕМЫХ ПИЛЕЙ АДГЕЗИИ | 2001 |
|
RU2193598C1 |
Изобретение предназначено для специфической индикации и диагностики холеры, вызванной возбудителями трех сероваров: Инаба, Огава, 0139. Штаммы трех сероваров (Инаба, Огава, 0139) выращивают при глубинном культивировании с подкормкой глюкозой и аммиаком. Получают нативный препарат О-антигена, спонтанно выделяющийся в культуральную среду. Удаляют балластные белки осаждением их при рН 4,4 ± 0,2. Концентрируют и отделяют неспецифические примеси с мол. массой менее 100 кДа ультрафильтрацией. Неспецифические примеси с молекулярной массой менее 300 кДа отделяют колоночной хроматографией. При этом сохраняют на всех стадиях очистки однофазное растворенное состояние О-антигена. Концентрированный раствор O-антигена лиофильно высушивают в ампулах. Одна ампула содержит (5 ± 0,5) мг сухого препарата, 250-500 условных доз антигена, равных обратному титру в РПГА с О-сывороткой (холерной или против 0139 штамма) в зависимости от серовара. Содержание белка составляет 7-8% (по Лоури). Токсичность для белых мышей по LD50 равна (2 ± 0,5) мг. Препарат гомогенен при контроле с помощью высокоэффективной жидкостной хроматографии. Изобретение позволяет получить высокоочищенный, хорошо растворимый О-антиген холерного вибриона 01 серовара (Инаба, Огава), а также эпидемически значимого НАГ вибриона 0139 серовара. 3 ил.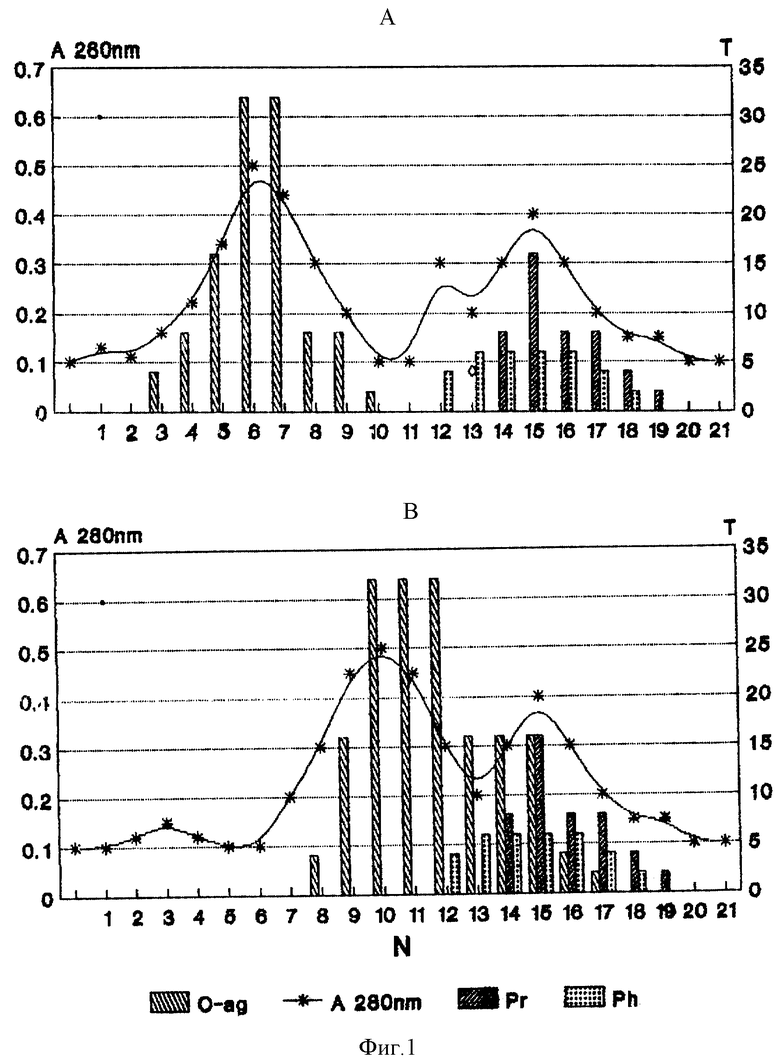
Способ получения холерного O-антигена очищенного из культуральной жидкости штаммов трех сероваров (Инаба, Огава, 0139), выращенных при глубинном культивировании в реакторе с подкормкой глюкозой и аммиаком, отличающийся тем, что для получения нативного препарата, спонтанно выделяющегося в культуральную среду, удаляют балластные белки осаждением их при рH 4,4 ± 0,2, концентрируют и отделяют неспецифические примеси с мол. массой менее 100 кДа ультрафильтрацией, неспецифические примеси с молекулярной массой менее 300 кДа отделяют колоночной хроматографией, сохраняя на всех стадиях очистки однофазное растворенное состояние O-антигена.
| СПОСОБ ПОЛУЧЕНИЯ ПЕРОРАЛЬНОЙ ХИМИЧЕСКОЙ ВАКЦИНЫ | 1993 |
|
RU2076734C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВАКЦИНЫ ПРОТИВ ХОЛЕРЫ | 1991 |
|
RU2021817C1 |
| СПОСОБ ПРОИЗВОДСТВА ВАКЦИНЫ ДЛЯ ПРОФИЛАКТИКИ ХОЛЕРЫ | 1988 |
|
RU2080121C1 |
| US 5653986 A, 05.08.97 WO 87/06839 A, 19.11.87 | |||
| СПОСОБ И КОМПОНОВКА ДЛЯ РЕГУЛИРУЕМОЙ ЗАКАЧКИ ЖИДКОСТИ ПО ПЛАСТАМ | 2017 |
|
RU2636842C1 |
Авторы
Даты
1999-12-27—Публикация
1999-05-26—Подача