Изобретение относится к области ветеринарной вирусологии, микробиологии и биотехнологии, в частности, к производству вакцины для специфической профилактики смешанных инфекционных диарей новорожденных телят, основными этиологическими агентами которых признаны рота-, корона-, герпесвирусы и энтеропатогенные штаммы E. coli., синтезирующие адгезивные антигены К99 и А20.
Имеющаяся в литературе информация последних лет и накопленные нами знания свидетельствуют о том, что массовые энтериты и энтероколиты новорожденных телят с клиническими признаками диареи обусловливаются рота-, корона-, герпесвирусами и E. coli, синтезирующими адгезивные антигены К99 и А20, которые способны самостоятельно вызывать симптомы диареи, сопровождаемые общей интоксикацией и обезвоживанием организма.
Кроме того, выяснилось определенное этиологическое значение при этой форме патологии у телят парвовируса, вируса диареи крупного рогатого скота, хламидий, некоторых бактерий, криптоспоридий и кокцидий (Mebus C. et. al., Amer. Vet. Med. Assoc., 1973, 163, N 7, 2, 880-883; Moussa A. et. al. - Rec. Med. Veter., 1983, 159, 3, 185-190; Коромыслов Г.Ф., Сидоров М,А., Крюков Н. Н. "Инфекционные болезни при промышленном скотоводстве", Москва, 1980, стр. 1-169; Hall G. A. et. al. - Res. in Veter. Se., 1988, 45, 2, 240-250; Pospisil Z. et. al., Zbl. Veter. Med. Reihe, 1979, 26, 4, 325-335; Соколова Н.Л., Мникова Л. А. , Сатторов И.Т. - Актуальные проблемы вирусологии и бактериологии. Труды ВИЭВ, т. 64, М., 1988, стр. 16-17).
Инфекционный процесс усугубляется тем, что эти возбудители действуют на беззащитный организм в комбинации друг с другом, вызывая смешанную инфекцию (Wellemans G. , Van Opdenbosсh E., - Elevages belges, 1981, 35, 10, 10-11; Сизов И. с соавт., - Ветер. - мед. науке, 1984, 21, 10, 89-94; Бондарь В.М. с соавт. , - Молдавский НИИ животноводства и ветеринарии, N 681-М, Кишинев, 1986; Morris J. A. et. al., - Veter. Rec., 1987, 121, 9, 189-191; Белянко Л. В. , Вирусные болезни с/х животных (Тезисы докладов Всероссийской научно-практической конференции), Владимир, 1995, стр. 218).
Изучение особенностей эпизоотического процесса при смешанной форме диареи показало, что заражаются, как правило, 90-100% новорожденных телят, смертность больных телят достигается 27-55%. Возникновение и распространение инфекционных диарей обусловлено высокой концентрацией поголовья скота, латентным персистированием возбудителей в организме коров, но вызывающих острые инфекции у новорожденных телят, несвоевременным вскармливанием полноценного молозива, несоблюдением ветеринарно-санитарного режима в животноводческих помещениях.
С учетом изложенного важное значение придается потреблению телятам молозива с высоким содержанием специфических антител на протяжении не менее двух недель, так как только антитела, введенные телятам перорально, предохраняют их от заболевания. Это положение определяет стратегию разработки средств специфической профилактики. Следовательно, специфическая защита новорожденных телят в первые дни жизни осуществляется путем активной иммунизации матерей с тем, чтобы стимулировать у них образование антител и обеспечить передачу их молозивом. С этой целью проводят вакцинацию коров во второй половине стельности.
В 1982 году МСХ США сообщило о получении и применении новой комбинированной трехвалентной вакцины против рота-, коронавирусов и бактерий E. coli, предназначенной для вакцинации стельных коров и нетелей. Широкое испытание этой вакцины (Scour - Gnord -3) стимулировало формирование антител у матерей и способствовало передаче их с молозивом новорожденным телятам, тем самым обеспечивая 100%-й эффект невосприимчивости у телят к энтеритам смешанной этиологии (Anon, Scour, vaccine now availadle "Colorado Rancher Farmer" 1982, 10, 37, 28).
В Моредунском исследовательском институте (Эдинбург, Великобритания) создана комбинированная вакцина из инактивированного формальдегидом ротавируса телят и антигена К99 E. coli с масляным адьювантом и применена внутримышечно для иммунизации стельных коров. Вакцина стимулировала секрецию специфических антител в молозиво и молоко. Телята, родившиеся от вакцинированных коров, оказались полностью защищенными от колибактериоза при экспериментальном заражении. Эффективность ротавирусного компонента комбинированной вакцины изучали в полевых опытах. В группах телят от вакцинированных коров примерно в два раза снижается количество телят, больных диареей, сокращается ее длительность, повышаются привесы (Snodgrass D. R., - Ann. Rec. Veter., 1983, 14,4, 519-521; Snodgrass D.R., - Veter. Rec. 1986, 119, 2, 39-42).
Подобные биопрепараты были разработаны и признаны эффективными в ФРГ, Австрии, Франции, Чехословакии и др. европейских странах).
В нашей стране Преображенский Д.С., Соколова Н.Л., Гоголев М.М., Мникова Л. А. изучали возможность иммунизации глубокостельных коров ассоциированными препаратами рота-, коронавирусов с целью повышения титров антител в молозиве коров к обоим вирусам одновременно. На основании результатов исследований авторы пришли к выводу, что обеспечивается прирост титров антител в колозиве коров, и целесообразно сочетать в дальнейшем этот вакцинный препарат с другими микробными вакцинами из E. coli и Cl. perfringens (Бюллетень ВИЭВ, выпуск 66, М., 1988, стр. 21-26).
Известна и выпускается биологической промышленностью "Формолтиомерсаловая вакцина против колибактериоза и паратифа пушных зверей, птиц, телят и поросят" (Шустер Б.Ю., Малахов Ю.А., Соловьев В.С., Тугаринов О. А. , - Ветеринарные препараты, Справочник, Москва "Колос", 1981, стр. 223-224). Однако результаты применения этой вакцины признаны неудовлетворительными (Дворнин Г.Л., Ленкова В.А. в книге "Проблемы ветеринарной иммунологии", Научные труды, Москва, Агропромиздат, 1985, стр. 108).
Известна также поливалентная гидроокисьалюминиевая формолтиомерсаловая вакцина ВГНКИ против эшерихиоза телят, которая способна вызывать значительные иммунологические перестройки в организме вакцинированных коров.
Антимикробная иммуногенность указанных вакцин невысокая, недостаточно в ней и количества протективных К-антигенов. Вакцина рекомендована для применения не только стельным коровам, но и телятам с 3-10 до 17-20-дневного возраста. Эффективность подобных прививок представляется сомнительной из-за возможной нейтрализации колостральных антител специфическими антигенами вакцины.
Наиболее близким аналогом является "Ассоциированная вакцина против диареи телят", представляющая собой композицию из 10 штаммов энтеробактерий, инактивированных этанолом и депонированных на гидроокиси алюминия. Штаммы в составе вакцины подобраны из представителей энтеробактерий: 3-х штаммов эшерихий, двух клебсиел, двух протеев (Лавровская В.М., Воронин Е.С., Деврищев Д.А., Бруснигина Н.Ф., Патент РФ N 2035916, 1993).
Недостатком известной ассоциированной вакцины является недостаточно высокая эффективность вследствие неполноценности (неполноты) антигенного состава, входящих в нее компонентов. В составе вакцины отсутствуют антигены рота-, корона-, герпесвирусов крупного рогатого скота, т.к. в этиологии вспышек диарейных заболеваний телят в хозяйствах страны преобладают упомянутые вирусы.
Поэтому проблема создания единой ассоциированной вакцины против основных возбудителей инфекционных диарей новорожденных телят продолжает оставаться актуальной.
Задачей изобретения является разработка безвредной вакцины на основе синергетической ассоциации рота-, корона-, герпесвирусов и E. coli, синтезирующих адгезивные антигены К99 и А20 с целью специфической профилактики диареи новорожденных телят, вызываемой смешанной инфекцией.
Технические результат изобретения заключается в получении ассоциированной вакцины, обладающей высокой иммуногенной активностью и повышенным затратным эффектом.
Сущность изобретения заключается в следующем: ассоциированная вакцина против рота-, корона-, герпесвирусной диареи новорожденных телят содержит антигены рота-, корона-, герпесвирусов крупного рогатого скота, E. coli, синтезирующие адгезивные антигены К99 и А20, депонированные на гидроокиси алюминия при следующем соотношении компонентов, об.%:
Инактивированные культуральные суспензии:
штамма Bovine rotavirus "III-I" с титром 107,0 - 107,8 ТЦД50/мл - 27,0 - 30,0
штамма Bovine coronavirus "СМ-1" с титром 105,0 - 105,8 ТЦД50/мл - 27,0 - 30,0
штамма Bovine Herpesvirus "ТКА-ВИЭВ-В2" с титром 107,6 - 108,0 ТЦД50/кл - 27,0 - 30,0
Инактивированная суспензия клеток штамма Escherichia coli , содержащая адгезивный антиген К99 с концентрацией 100-120 млрд. м.к. в 1 мл физ. раствора - 3,0 - 4,0
Инактивированная суспензия клеток штамма Escherichia coli, содержащая адгезивный антиген А20 с концентрацией 100-120 млрд, м.к. в 1 мл физ. раствора - 3,0 - 4,0
Гель гидроокись алюминия, 6%-ный раствор - Остальное.
Входящие в ассоциированную вакцину штаммы вирусов изысканы и являются производственными при изготовлении моновалентных вакцин. Из антигенов эшерихий вакцина содержит любые из производственных или местных штаммов E. coli, активно продуцирующих адгезины К99 и А20.
Пример 1. Приготовление нативных суспензий ротавируса, коронавируса и герпесвируса крупного рогатого скота.
Ротавирус крупного рогатого скота (штамм "III-I") размножают в роллерных трехлитровых бутылях с выросшей однослойной перевиваемой культурой клеток почки эмбриона свиньи (линия СПЭВ) на комбинированной ростовой среде, состоящей из гидролизата лактоальбумина (ГЛА) - 45%, из среды 199 - 45%, сыворотки крупного рогатого скота - 10% и антибиотиков. Культуру выращивают в течение 3-4-х суток при посевной концентрации 100-120 тыс. клеток на 1 мл среды. Перед внесением в культуры вирус активируют трипсином (0,6 мл 0,25%-ного трипсина на 100 мл среды в течение 30-35 минут при 37-38oC) в соотношении 1: 10 - 1:12 и добавляют его в поддерживающую среду без сыворотки из расчета 5 мл на 500 мл среды, а также 3%-ный раствор глутамина (5 мл на 500 мл среды) и антибиотики.
Ростовую среду сливают, вносят в бутыли с культурой поддерживающую среду в количестве 350-370 мл и инкубируют при 37-38oC в течение 24-48 часов. После выраженного разрушения культуры клеток титр вируса должен составлять 107,0 - 107,8 ТЦД50/мл. Для освобождения вируса культуру трехкратно замораживают при минус 18-20oC и в дальнейшем быстро оттаивают при 36-37oC. Полученную культуральную вирусную суспензию осветляют центрифугированием в течение 20 минут при 2000 об/мин.
Коронавирус крупного рогатого скота (штамм "СМ-1") размножают в перевиваемой культуре клеток почки эмбриона коров (линия МДВК), выращенных в роллерных трехлитровых бутылях на комбинированной среде, состоящей из среды 199 - 60%, ГЛА - 30% и эмбриональной сыворотки крупного рогатого скота - 10%. Монослой формируется на 3-4-е сутки при посевной концентрации 120-150 тыс. клеток на 1 мл среды.
Для расплодки коронавируса крупного рогатого скота ростовую среду сливают, вносят поддерживающую среду (среда 199 - 50% и ГЛА - 50%) в количестве 350-370 мл, в которую предварительно вносят вирус из расчета 15-20 мл на 500 мл среды, 0,25%-ый трипсин 3 мл, 3%-ный раствор глутамина - 5 мл и антибиотики. Бутыли инкубируют в роллерной установке при 37-38oC в течение 3-4-х дней. Через 72-96 часового выращивания при 37oC проявляется ЦПД 50%. Цитопатогенное действие характеризуется гранулированием цитоплазмы, распадом изолированных клеток, образованием симпластов с последующей дегенерацией. Сбор культуральной жидкости производят в период выраженного цитопатического эффекта. Титр вируса должен составлять не ниже 105,0 - 105,8 ТЦД50/мл.
Освобождение вируса из клеток осуществляется путем замораживания и оттаивания, полученную вирусную суспензию осветляют путем центрифугирования.
Герпесвирус крупного рогатого скота (штамм "ТКА-ВИЭВ-В2") размножают в перевиваемой культуре клеток трахеи эмбриона коровы (ТР), выращенных в роллерных трехлитровых бутылях на комбинированной среде, состоящей из среды 199 - 10%, ГЛА - 40%, среды Игла МЕМ - 40% и сыворотки крупного рогатого скота - 10%. Культуру выращивают в течение 3-4-х суток при посевной концентрации 140-150 тыс. клеток.
Ростовую среду сливают, вносят поддерживающую среду (среда 199 - 20%, ГЛА - 40% и Игла МЕМ - 40%) в количестве 350-370 мл, в которую предварительно вносят вирус из расчета 10 мл на 500 мл среды, 3%-ный раствор глутамина - 5 мл и антибиотики. Бутыли инкубируют в роллерной установке при 37-38oC в течение 3-4-х дней.
Пример 2. Объединение вирусных суспензий в серию и ее инактивация.
Полученные вирусные суспензии объединяют и с целью инактивации вирусов добавляют формалин с содержанием активного формальдегида 37-38% (из расчета 0,5 мл на 100 мл вирусной суспензии), перемешивают и оставляют на сутки при комнатной температуре, после этого проверяют на бактериальную и грибковую контаминацию. Для приготовления вакцины берут вирусные сборы без посторонней контаминации. Контроль полноты инактивации осуществляют путем дачи реr оs 5 мл вакцинного препарата двум новорожденным телятам, не получавшим молозива, двух других телят оставляют в качестве контроля. Вакцинный препарат считают инактивированным, если в течение 7 суток после введения телята остаются клинически здоровыми.
Пример 3. Получение матровой расплодки каждого штамма E. coli.
В качестве производственных штаммов при изготовлении ассоциированной вакцины против рота-, корона-, герпесвирусной и эшерихиозной диареи новорожденных телят используют:
"КВ-1" - синтезирующий адгезивный антиген К99;
"ПЗ-3" - синтезирующий адгезивный антиген А20;
которые вызывают гибель белых мышей массой 14-16 г в течение двух суток после внутрибрюшинного заражения в дозе 0,5 см3 суспензией суточной культуры, содержащей 1 млрд. м.к. в см3 по бактерийному или оптическому стандарту мутности.
Для получения культур E. coli используют питательные среды - мясопептонный агар (для штамма, синтезирующего адгезивный антиген А20) и среду Минка (для штамма, синтезирующего адгезивный антиген К99). Штамм указанных культур E. coli выращивают в отдельности на соответствующих питательных средах при температуре 37oC. Через 24 часа выросшие колонии E. coli исследуют в РА на стекле с моновалентными агглютинирующими антиадгезивными коли-сыворотками соответственно с А20 и К99 для уточнения чистоты культур.
Матровые расплодки штаммов E. coli хранят в лиофилизированном виде или на полужидком МПА под вазелиновым маслом при температуре 4-6oC. Для поддержания в активном состоянии штаммы ежегодно пассируют через белых мышей.
Пример 4. Выращивание бактериальной массы в отдельности к каждому штамму и ее инактивация.
Для получения биомассы культур E. coli используют МПА (для штамма, синтезирующего адгезивный антиген А20) и среду Минка (для штамма, синтезирующего адгезивный антиген К99). С этой целью указанные среды разливают в матры по 200 см3 и стерилизуют при 0,5 атмосферных (110oC) в течение 15 минут. После застывания сред делают посев указанных культур по 1,0 см3 1 млрд. м.к. Посевы выдерживают в термостате при 37oC. Через 24 часа выросшие колонии культур E. coli смывают 0,85%-ным раствором хлорида натрия, готовят суспензию в концентрации 100 млрд. м.к. в 1 см3 по бактерийному или оптическому стандарту мутности ГИСК им. Тарасевича. Культуры проверяют на чистоту, морфологическую и серологическую типичность.
Инактивация бактериальной взвеси, имеющей 100 млрд. м.к. в 1 см3, осуществляется формалином. Для этого в микробную взвесь добавляют формалин с содержанием 37-38% активного формальдегида (0,5 см3 на 100 см3 суспензии). Перемешивают и ставят в термостат на 3 суток. Затем берут пробу для контроля на полноту инактивации, которую проводят путем посева инактивированных микробных взвесей на соответствующие питательные среды.
Пример 5. Приготовление ассоциированной вакцины.
Вакцину готовят из антигенов рота-, корона-, герпесвирусов телят, содержащих специфического белка не менее 30-35 мг/мм и штаммов E. coli, "П3-3" и "КВ-1", продуцирующих адгезивные антигены соответственно А20 и К99.
Рота-, корона-, герпесвирусные суспензии берут в равных соотношениях и к ним добавляют 100 млрд-ную суспензию E. coli, исходя из расчета 3 см3 каждого штамма на 100 см3 вакцинного препарата, а также 6%-ную гель гидроокиси алюминия из расчета 10 см3 на 100 см3 вакцины. Доводят pH вакцины до 7,2-7,4 и расфасовывают при периодическом тщательном перемешивании во флаконы, которые затем закрывают резиновыми пробками, обкатывают металлическими колпачками и этикетируют.
В таблице N 1 приведен состав вакцины.
Пример 6. Контроль вакцины на стерильность, безвредность и на антигенную активность.
Для проверки на стерильность из 6 флаконов вакцины каждой серии делают посевы на 0,5 мл на МПБ, МПА, МППБ под вазелиновым маслом и агар Сабуро по 2 пробирки на каждый флакон. Посевы со всеми средами выдерживают в термостате при 37oC, а с агаром Сабуро - при температуре 20-22oC в течение 15 суток. Питательные среды с посевами должны оставаться стерильными.
Для проверки на безвредность отбирают 10 белых мышей живой массой 17-18 г и вводят вакцину в дозе 0,5 см3 подкожно. Вакцину считают безвредной, если мыши в течение 10 суток после введения вакцины остаются живыми и клинически здоровыми.
Антигенную активность вакцины контролируют на 3-х кроликах живой массой 2,0-2,5 кг, которым вводят препарат подкожно в дозе 2 см3 двукратно с интервалом 14-15 дней. Через 14 дней после последней вакцинации у кроликов из ушной вены берут кровь и исследуют сыворотку с целью установления уровня специфических антител к рота-, корона-, герпесвирусу, а также эшерихиозным антигенам. Титры антител к рота-, герпесвирусам должны быть в пределах 1:800 - 1:1600 - в ИФА, к коронавирусу 1:128 - 1:256 в РТГА и эшерихиям коли 1:320 - 1:640 в РА.
Результаты контроля экспериментальных серий ассоциированной вакцины показали, что все серии биопрепарата были стерильными, безвредными и антигенно-активными.
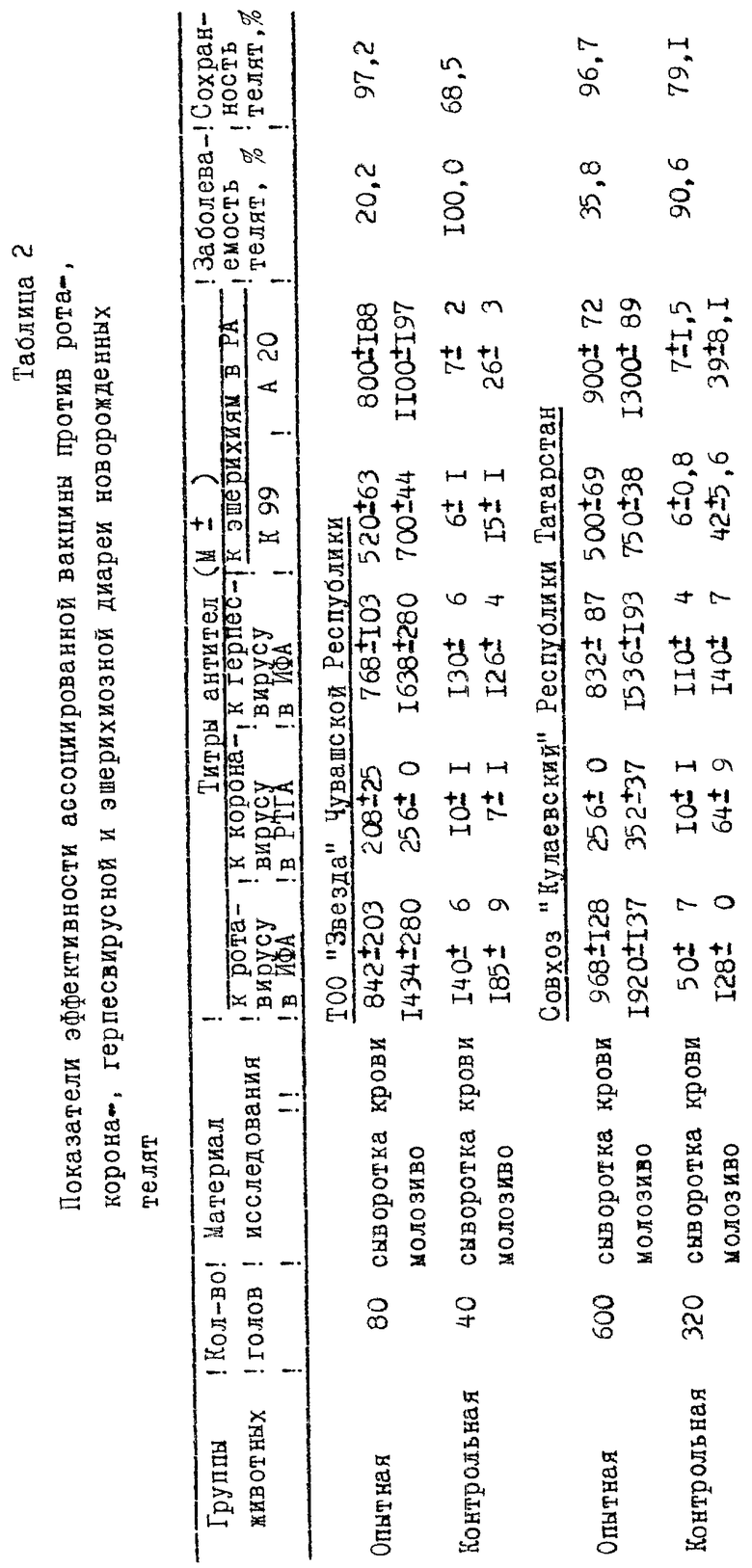
Производственное испытание экспериментальных серий ассоциированной вакцины было проведено на глубокостельных коровах двух хозяйств Республики Татарстан, неблагополучных по смешанным формам инфекционной диареи новорожденных телят. При этом животные были разделены на 2 группы: опытные и контрольные. Животным опытной группы вакцина вводилась подкожно двукратно за 30-35 и 15-20 дней до отела в дозе 10 см3. Животным контрольной группы вакцина не вводилась. Результаты испытаний представлены в таблице N 2, из которой следует что ассоциированная вакцина обладает выраженной иммуногенной активностью: в группах телят, полученных от вакцинированных коров, заболеваемость телят составила от 20,2 до 35,8%, сохранность - 96,7 - 97,2%, тогда как у телят контрольной группы эти показатели были 90,6 - 100% и 68,5 - 79,1% соответственно.
Пример 7. Назначение, общие сведения и порядок применения ассоциированной вакцины против рота-, корона-, герпесвирусной и зшерихиозной диарей телят.
Вакцина предназначена для профилактики диареи новорожденных телят, вызываемой смешанной инфекцией, обусловленной рота-, корона-, герпесвирусом и энтеротоксигенными штаммами эшерихий, продуцирующими факторы адгезии К99 и А20.
Вакцина представляет собой равную смесь суспензии антигенов рота-, корона-, герпесвирусов, а также культур Э. коли, содержащих антигены К99 и А20 в оптимальных соотношениях.
По внешнему виду вакцина, депонированная гидроокисьалюминием, непрозрачная жидкость с белым осадком, который при встряхивании флакона легко разбивается, образуя гомогенную взвесь бледно-розового цвета.
Вакцину выпускают в стеклянных флаконах по 50, 100 и 200 см3 с плотно закрытыми резиновыми пробками, обкатанными металлическими колпачками, и этикетируют в соответствии с ТУ.
Вакцина пригодна для применения в течение 12 месяцев со дня ее изготовления при условии хранения и транспортировки при температуре 2-10oC.
Вакцину применяют с профилактической целью в хозяйствах, стационарно неблагополучных по инфекционным диареям новорожденных телят. Препарат вводят в среднюю треть шеи подкожно глубокостельным коровам и нетелям двукратно до 30-35 и 15-20 суток до отела в дозе 10 см3.
Вакцина обеспечивает создание у новорожденных телят колострального иммунитета к рота-, корона-, герпесвирусам и возбудителям колибактериоза, продуцирующим соответствующие факторы адгезии - антигены К99 и А20.
За период 1994 - 1998 г.г. изготовлено 79200 доз ассоциированной вакцины и использовано в хозяйствах 12 районов Республики Татарстан. 3-х - Чувашской Республики, 4-х - Республики Башкортостан, 3-х - Республики Мари-Эл, неблагополучных по инфекционным диареям новорожденных телят.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИСПЕЦИФИЧЕСКАЯ ГИПЕРИММУННАЯ СЫВОРОТКА ПРОТИВ РОТА-, КОРОНА-, ГЕРПЕСВИРУСОВ И E.coli (K 99, A 20) ДЛЯ ЛОКАЛЬНОЙ ЗАЩИТЫ И ИММУНОТЕРАПИИ СМЕШАННЫХ ФОРМ ДИАРЕИ НОВОРОЖДЕННЫХ ТЕЛЯТ | 1999 |
|
RU2145504C1 |
| АССОЦИИРОВАННАЯ ВАКЦИНА ПРОТИВ РОТА-, КОРОНАВИРУСНОЙ И ЭШЕРИХИОЗНОЙ ДИАРЕИ НОВОРОЖДЕННЫХ ПОРОСЯТ | 1998 |
|
RU2137499C1 |
| Вакцина против рота-, коронавирусной инфекции и эшерихиоза крупного рогатого скота | 2018 |
|
RU2708891C1 |
| ВАКЦИНА ИНАКТИВИРОВАННАЯ КОМБИНИРОВАННАЯ ПРОТИВ ВИРУСНОЙ ДИАРЕИ, РОТА-, КОРОНАВИРУСНОЙ БОЛЕЗНЕЙ И ЭШЕРИХИОЗА КРУПНОГО РОГАТОГО СКОТА | 2009 |
|
RU2403063C1 |
| АССОЦИИРОВАННАЯ ВАКЦИНА ДЛЯ СПЕЦИФИЧЕСКОЙ ПРОФИЛАКТИКИ ИНФЕКЦИОННОГО КЕРАТОКОНЪЮНКТИВИТА КРУПНОГО РОГАТОГО СКОТА НА ОСНОВЕ АНТИГЕНОВ БАКТЕРИЙ MORAXELLA BOVIS И ГЕРПЕСВИРУСА ТИПА I | 2004 |
|
RU2264227C1 |
| ИНАКТИВИРОВАННАЯ ВАКЦИНА ПРОТИВ ВИРУСНЫХ ПНЕВМОГАСТРОЭНТЕРИТОВ КРУПНОГО РОГАТОГО СКОТА И ТЕЛЯТ И СПОСОБ ПРОФИЛАКТИКИ ВИРУСНЫХ ПНЕВМОГАСТРОЭНТЕРИТОВ | 2004 |
|
RU2261111C1 |
| ВАКЦИНА АССОЦИИРОВАННАЯ ПРОТИВ ПАРВОВИРУСНОЙ, РЕОВИРУСНОЙ, ГЕРПЕСВИРУСНОЙ ТИПА I ИНФЕКЦИЙ И ВИРУСНОЙ ДИАРЕИ - БОЛЕЗНИ СЛИЗИСТЫХ ОБОЛОЧЕК КРУПНОГО РОГАТОГО СКОТА ИНАКТИВИРОВАННАЯ ЭМУЛЬСИОННАЯ | 2010 |
|
RU2452512C2 |
| ВАКЦИНА АССОЦИИРОВАННАЯ ПРОТИВ АДЕНОВИРУСНОЙ, ГЕРПЕСВИРУСНОЙ ИНФЕКЦИЕЙ, ПАРАГРИППА-3 И ВИРУСНОЙ ДИАРЕИ-БОЛЕЗНИ СЛИЗИСТЫХ ОБОЛОЧЕК КРУПНОГО РОГАТОГО СКОТА ИНАКТИВИРОВАННАЯ ЭМУЛЬСИОННАЯ | 2012 |
|
RU2517733C1 |
| АССОЦИИРОВАННАЯ ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОГО РИНОТРАХЕИТА И КОРОНАВИРУСНОЙ ИНФЕКЦИИ КРУПНОГО РОГАТОГО СКОТА ЭМУЛЬСИОННАЯ ИНАКТИВИРОВАННАЯ | 2007 |
|
RU2378017C2 |
| Способ профилактики рота-, коронавирусной инфекции и эшерихиоза крупного рогатого скота | 2019 |
|
RU2723709C1 |



Изобретение предназначено для изготовления вакцины для специфической профилактики смешанных инфекционных диарей новорожденных телят. В качестве источника специфических антигенов используют производственные штаммы рота-, корона-, герпесвирусов крупного рогатого скота и Е. coli, синтезирующие адгезивные антигены К99, А20. Штаммы выращивают раздельно. Ротавирусы - в перевиваемой культуре клеток почки свиньи (линия СПЭВ). Коронавирусы - в перевиваемой культуре клеток почки эмбриона коров (линия МДВК). Герпесвирусы - в перевиваемой культуре клеток трахеи эмбриона коров (ТР) в роллерных установках промышленного типа. Е. coli, синтезирующие адгезивный антиген К99, А20 - на среде Минка и мясопептонном агаре. Сбор рота-, герпесвирусов осуществляют через 24-48 ч, коронавирусов - через 72 - 96 ч, Е. coli - через 24 - 36 ч. Инактивацию вирусов проводят 0,5%-ным формалином при 25-27oС в течение 24-36 ч. Культуру Е. coli инактивируют 0,5%-ным формалином в течение 72 ч при 36-37oC. Смешивают инактивированные культуры. К полученной смеси добавляют 6%-ный раствор геля гидроокиси алюминия в количестве 10%. С профилактической целью вакцину вводят внутримышечно глубокостельным коровам и нетелям (за 30-35 дней до отела) двукратно с 14-15-дневным интервалом в дозе 10 см3. Вакцина способна повысить уровень накопления специфических защитных антител в сыворотке крови и молозиве у вакцинированных коров и сохранить новорожденных телят за счет колострального иммунитета. 3 табл.
Ассоциированная вакцина против рота-, корона-, герпесвирусной и эшерихиозной диареи новорожденных телят, отличающаяся тем, что в качестве антигенов рота-, корона и герпесвирусов она содержит инактивированные культуральные суспензии штаммов Bovine rotavirus "III-1", Bovine coronavirus "CM-1", Bovine Herpesvirus "ТКА-ВИЭВ-В2" с титрами соответственно 107,0 - 107,8 ТЦД50/мл, 105,0 - 105,8 ТЦД50/мл, 107,6 - 108,0, из антигенов эшерихий - инактивированные суспензии клеток штаммов Ecsherichia coli, содержащие адгезины К99 и А20 с концентрацией 100 - 120 млрд.м.к. в 1 мл физиологического раствора, и гель гидроокиси алюминия при следующем соотношении компонентов, об.%:
Инактивированные культуральные суспензии: штамма Bovine rotavirus "III-1", с титром 107,0 - 107,8 ТЦД50/мл - 27,0 - 30,0
Штамма Bovine coronavirus "CM-1", с титром 105,0 - 105,8 ТЦД50/мл - 27,0 - 30,0
Штамма Bovine Herpesvirus "ТКА-ВИЭВ-В2" с титром 107,6 - 108,0 ТЦД50/мл - 27,0 - 30,0
Инактивированная суспензия клеток штамма Ecsherichia coli, содержащая адгезивный антиген К99 с концентрацией 100 - 120 млрд. м.к. в 1 мл физиологического раствора - 3,0 - 4,0
Инактивированная суспензия клеток штамма Ecsherichia coli, содержащая адгезивный антиген А20 с концентрацией 100 - 120 млрд. м.к. в 1 мл физиологического раствора - 3,0 - 4,0
Гель гидроокиси алюминия, 6%-ный раствор - Остальное
| ВАКЦИНА "ТРИВАК (ВИЭВ)" ДЛЯ ПРОФИЛАКТИКИ ИНФЕКЦИОННОГО РИНОТРАХЕИТА, ПАРАГРИППА-3 И ВИРУСНОЙ ДИАРЕИ - БОЛЕЗНИ СЛИЗИСТЫХ КРУПНОГО РОГАТОГО СКОТА | 1996 |
|
RU2111011C1 |
| RU 96106059 A, 27.12.98 | |||
| US 4618493 A, 21.10.86 | |||
| Станок для резки труб | 1977 |
|
SU650734A2 |
| WO 9001337 A, 22.02.90 | |||
| Гаффаров Х.З | |||
| и др | |||
| Ассоциированная вакцина для специфической профилактики рота-, корона- вирусной и эшерихиозной диареи новорожденных телят | |||
| / В: "Научные основы технологии промышленного производства ветеринарных биологических препаратов", тез | |||
| докл | |||
| Всероссийской конф., 14 - 17 мая 1996, Щелково, 1996, с | |||
| Счетная таблица | 1919 |
|
SU104A1 |
Авторы
Даты
2000-02-10—Публикация
1999-04-30—Подача