Настоящее изобретение относится к системе для уничтожения растительных клеток и прежде всего к трансгенным растениям, которые несут в своем геноме химерный ген, при экспрессии которого образуется цитотоксический протеин.
Одним из известных селекционерам растений путей получения новых сортов является создание гибридов существующих сортов, несущих требуемые признаки. Гибриды, как правило, отличаются от любого из родителей улучшенными различными характеристиками, это явление называют гибридной силой (гетерозис). Такие гибридные скрещивания можно осуществлять с помощью перекрестного опыления вручную, что представляет собой утомительную и требующую много времени процедуру.
В процессе осуществления таких гибридных скрещиваний решающее значение имеет предупреждение самоопыления. Для предупреждения самоопыления материнское растение можно эмаскулировать вручную, например, путем удаления метелки при получении гибридной кукурузы. Однако крупномасштабная эмаскуляция видов с гермафродитными цветками невозможна с экономической точки зрения. Можно также получать материнские линии (с мужской стерильностью) с помощью генетической мужской стерильности, этот хорошо известный у многих растений признак, как правило, является рецессивным и моногенным. Связанная с использованием этого подхода проблема состоит в трудности получения для каждого скрещивания чистых родительских линий с мужской стерильностью. Наиболее широко применяемая для создания гибридов система получения мужской стерильности представляет собой систему цитоплазматической мужской стерильности (cms). В этом случае недоразвитие пыльцы обусловлено цитоплазматическими факторами. У тех культурных растений, у которых в зародышевой плазме выявлена cms, например у кукурузы и подсолнечника, этот признак широко используется для создания гибридов. Известно несколько недостатков указанной системы: цитоплазма с мужской стерильностью может нести другие нежелательные характеристики, например Т-цитоплазму у кукурузы и чувствительность к Helminthosporium maydis; при ее применении необходимо поддерживать линии с изогенной мужской фертильностъю; и применение этой системы ограничено видами, у которых доступен цитоплазматический источник стерильности.
Другим преимуществом системы, основанной на использовании мужской стерильности, является то, что с ее помощью можно получать беспыльцевые растения. Это требуется для многих сортов декоративных цветковых растений и также может найти применение для борьбы с нежелательными генетическими признаками путем предупреждения ауткроссинга.
Еще одним ценным признаком основанной на использовании стерильности системы является возможность получать растения с женской стерильностью, у которых при развитии плодов не происходит образования семян. Бессемянные сорта плодов имеют преимущества при обработке, например, томатов, и также являются предпочтительными для потребителя, например, дыни. В настоящее время бессемянные сорта известны и существуют соответствующие программы селекции, но создание бессемянных плодов ограничено отсутствием у многих видов растений пригодной зародышевой плазмы.
В тех случаях, когда генетический источник стерильности отсутствует или недоступен по другим причинам, можно применять метод генетической модификации, который обеспечивает стерильность с помощью системы для уничтожения клеток, при этом некроз происходит в специфических клетках репродуктивных тканей.
В WO 89/10396 описана система для уничтожения растительных клеток, при использовании которой в растение интродуцируют химерный ген, содержащий специфичный для пыльника промотор, связанный с протеином или полипептидом РНКазы, при экспрессии которого происходит нарушение клеточного метаболизма. Таким образом, экспрессия химерного гена приводит к некрозу клеток пыльника и, как следствие, к мужской стерильности растений.
Для создания женской стерильности у растений можно использовать аналогичную систему для уничтожения клеток, мишенью которой является семяпочка растения.
В WO 93/18170 и WO 92/04453 описаны системы для уничтожения растительных клеток, специфические для борьбы с заражением нематодами. Согласно описанным в WO 93/18170 и WO 92/04453 системам в определенные виды растений-хозяев интродуцируют ген, содержащий кодирующую последовательность, причем кодирующая последовательность кодирует продукт, снижающий вредоносное действие нематод. Ген содержит также промоторную область, которая контролирует экспрессию кодирующей последовательности таким образом, что экспрессия происходит при нападении нематод и осуществляется практически специфично в клетках областей, которыми питаются нематоды, или в соседних клетках. Для снижения вредоносного действия нематод продукт либо может оказывать неблагоприятное воздействие на растительные клетки, которые в результате дифференцировки превращаются в клетки областей, которыми питаются нематоды, либо на соседние с ними клетки, либо может оказывать неблагоприятное воздействие непосредственно на нематод.
Имеющие экономическое значение паразитирующие на растениях нематоды включают цистообразующие нематоды, такие как картофельные нематоды (Globodera rostochiensis и G.pallida), соевая нематода (Heterodera glycines), свекловичная нематода (Heterodera schachtii) и зерновая нематода (Heterodera avenae), и галловые нематоды, такие как Meloidogyne spp. Такие паразитирующие на растениях нематоды являются основными патогенами многих культурных растений во всем мире, например овощных, кормовых бобовых культур, томатов, арбузов, винограда, арахиса, табака и хлопчатника.
Наиболее широко распространенные современные средства борьбы с нематодами основаны на применении химических средств защиты растений, агротехнических приемов и устойчивых сортов растений, и их часто используют в интегрированной системе борьбы с паразитирующими на растениях нематодами. Имеется необходимость в совершенствовании системы борьбы с нематодами, поскольку указанные существующие в настоящее время подходы не обеспечивают надежную защиту посевов. Безопасность нематицидов для окружающей среды является проблематичной, и они не всегда обладают достаточно высокой эффективностью. Однако применение системы защиты культурных растений может быть убыточным для фермеров вследствие различных причин. Широкий круг хозяев галловых нематод ограничивает возможность применения экономически значимых культур, которые не являются мишенью для нематод. Эффективные устойчивые сорта часто не являются доступными, а те, которые фермер может применять, иногда при невысокой численности нематод оказываются хуже чувствительных сортов. Кроме того, устойчивость может снижаться при высоких температурах почвы, что характерно для тропической и субтропической зон.
Можно рассматривать и другие пути применения систем для уничтожения растительных клеток. Например, мишенью могут быть определенные части цветка, что обусловливает изменение морфологии цветка. В другом варианте мишенью могут быть боковые корни, шипы или жгучие волоски. Можно достигать отделения (абсцизии) листьев или плодов, когда мишенью является отделительный слой листа или плода. Можно достигать также облегчения сбрасывания семян в случае, когда мишенью является семяножка. При использовании в качестве мишеней других органов, таких как трихомы, которые, как правило, являются железистыми (гландулярными), производство химических субстанций в этих органах можно прекращать или предупреждать. Другим вариантом применения может быть индуциуемое отделение корней, листьев, цветков или плодов в конце вегетационного периода.
Инактивирующие рибосому протеины (RIP) представляют собой группу токсичных растительных протеинов, которые каталитически инактивируют рибосомы эукариотических организмов (Stirpe и Barbieri, 1986). RIP функционируют в качестве N-гликозидаз, осуществляя удаление определенного аденина в консервативной петле большой молекулы рРНК и тем самым предупреждают связывание фактора удлинения 2, блокируя в результате этого синтез клеточного протеина.
Описаны три формы RIP. RIP типа 1, такие как антивирусный протеин фитолакки американской и ингибитор трансляции ячменя, каждый из которых имеет одну полипептидную цепь, величина относительной молекулярной массы (Мr) которой составляет примерно 30000. Все RIP типа 2, такие как рицин, абрин и модекцин, имеют по две полипептидные цепи. Один обладающий RIP-активностью полипептид (А-цепь) связывают с помощью дисульфидного мостика со связывающим галактозу лектином (Б-цепь; Stirpe и др., 1978). Величина Mr каждого RIP типа 2 составляет примерно 60000.
RIP кукурузы, обнаруженные в эндосперме семян кукурузы (Zea mays), относится к RIP типа 3. Этот RIP синтезируется в виде одной полипептидной цепи, которая затем подвергается протеолитическому расщеплению с высвобождением двух активных пептидных доменов. RIP кукурузы содержит два домена, т.е. α-домен и β-домен, в неактивной форме RIP кукурузы (т.е. pro-RIP кукурузы) эти домены разделены центральным пептидным спейсером и фланкированы N- и С-концевыми пептидами. α-Домен локализован вблизи N-конца pro-RIP, а β-домен вблизи С-конца. В процессе прорастания семян pro-RIP кукурузы активируется в результате протеолитического отщепления N- и С-концевых пептидов вместе с центральным пептидным спейсером, и два домена образуют зрелый (активный) RIP кукурузы (патент США 5248606). Расщепление осуществляется эндогенными протеазами.
Настоящее изобретение относится к растению, трансформированному химерным геном, содержащим промотор, где промотор индуцируется в области-мишени и/или в соседней области, и функционально связан с кодирующей последовательностью, которая кодирует инактивирующий рибосому протеин кукурузы или его фрагмент.
В заявке, кроме того, описаны растительная клетка, трансформированная химерным геном, содержащим промотор, этот промотор индуцируется в области-мишени и/или в соседней области и функционально связан с кодирующей последовательностью, которая кодирует инактивирующий рибосому протеин кукурузы или его фрагмент; ДНК, выделенная из химерного гена, содержащего промотор, где промотор индуцируется в области-мишени и/или в соседней области, и функционально связан с кодирующей последовательностью, которая кодирует инактивирующий рибосому протеин кукурузы или его фрагмент, а также функциональный экспрессионный вектор, несущий химерный ген, который содержит промотор, этот промотор индуцируется в области-мишени и/или в соседней области, и функционально связан с кодирующей последовательностью, которая кодирует инактивирующий рибосому протеин кукурузы или его фрагмент.
Кодирующая последовательность инактивирующего рибосому протеина кукурузы по изобретению может включать описанную выше полную последовательность pro-RIP кукурузы, которая содержит N-концевой пептид, α-домен, центральный пептидный спейсер, β-домен и С-концевой пептид.
В другом варианте кодирующая последовательность инактивирующего рибосому протеина кукурузы может включать рекомбинантный "зрелый" RIP, обозначенный в настоящем описании как "RIP-P", который содержит расположенные последовательно α-домен и β-домен, т.е. в котором удалены N- и С-концевые удлинения и центральный пептидный спейсер. В настоящем изобретении продемонстрировано, что образование функционально активной молекулы RIP не зависит от каких-либо конформационных ограничений, связанных с интактной молекулой pro-RIP кукурузы или реакцией расщепления. В патентах США 5248606 и 5646026 продемонстрирована функциональная активность рекомбинантных молекул RIP, лишенных центрального спейсера и концевых пептидов, в бесклеточных трансляционных системах.
В другом варианте кодирующая последовательность инактивирующего рибосому протеина кукурузы предпочтительно может содержать рекомбинантный RIP, включающий только α-домен, или рекомбинантный RIP, включающий только β-домен, при этом и α-домен, и β-домен по отдельности являются фрагментом инактивирующего рибосому протеина кукурузы, который обладает требуемой функциональной активностью. α-Домен инактивирующего рибосому протеина кукурузы представляет собой домен, расположенный вблизи N-конца инактивирующего рибосому протеина кукурузы, а β-домен расположен вблизи С-конца инактивирующего рибосому протеина кукурузы. Если в α- или β-домен включают дополнительные нуклеиновые кислоты, то активный фрагмент, как правило, должен по-прежнему представлять собой только α- или β-домен.
Не вдаваясь в теорию, можно предположить, что α-домен содержит области распознавания рибосомы и области связывания, а β-домен содержит каталитический сайт, необходимый для депуринизации/расщепления рибосомы. Ранее, до создания настоящего изобретения считалось, что в проявлении активности инактивирующего рибосому протеина кукурузы основная роль принадлежит β-домену. При создании настоящего изобретения неожиданно было установлено, что включение только α-домена (т.е. без β-домена) можно применять для нарушения функции рибосом растений и, как следствие, для некроза растительных клеток.
Нуклеотидная последовательность кодирующей последовательности pro-RIP приведена в SEQ. ID. No: 1 или представляет собой гомологичную ей кодирующую последовательность; нуклеотидная последовательность кодирующей последовательности RIP-P приведена в SEQ. ID. No: 2 или представляет собой гомологичную ей кодирующую последовательность; нуклеотидная последовательность кодирующей последовательности α-домена приведена в SEQ. ID. No: 3 или представляет собой гомологичную ей кодирующую последовательность; нуклеотидная последовательность кодирующей последовательности β-домена приведена в SEQ. ID. No: 4 или представляет собой гомологичную ей кодирующую последовательность.
В зависимости от требуемой гомологии нуклеотидных последовательностей можно применять различные условия строгости гибридизации для скрининга аналогичных последовательностей. В качестве примера (но, не ограничиваясь ими) для процесса гибридизации используют следующие строгие условия: гибридизация со связанной с фильтром ДНК в 0,5 М NaHPO4, 7%-ном додецилсульфате натрия (ДСН), 1 мМ ЭДТК при 65°С и отмывка в 0,1xSSC/0,1% ДСН при 68°С (Ausubel F.M. и др. (ред.), 1989, Current Protocols in Molecular Biology, т.I, изд-во Green Publishing Associates, Inc. и John Wiley и Sons, Inc., New York, c. 2.10.3). Другие строгие условия, которые можно использовать, хорошо известны в данной области. Можно применять процессы гибридизации в следующих условиях умеренной строгости: гибридизация со связанной с фильтром ДНК в 0,5 М NaHPO4, 7%-ном додецилсульфате натрия (ДСН), 1 мМ ЭДТК при 65°С и отмывка в 0,2xSSC/0,1% ДСН при 42°С (Ausubel и др., 1989, выше). Другие условия умеренной строгости, которые можно использовать, хорошо известны в данной области. Для процессов гибридизации можно применять другие растворы, такие как стандартный раствор хлорида и цитрата натрия (SSC) или хлорида натрия и фосфата ЭДТК (SSPE).
Приемлемые гомологичные последовательности представляют собой последовательности, которые по меньшей мере на 70%, предпочтительно на 80%, более предпочтительно на 85% и еще более предпочтительно на 90 или 95% гомологичны каждой из приведенных в настоящем описании последовательностей, причем такие гомологичные последовательности сохраняют требуемую ферментативную активность.
Приемлемые последовательности могут также представлять их варианты. Согласно настоящему изобретению вариант может представлять собой любую замену, вариацию, модификацию, замещение, или делецию, или добавление одной или нескольких нуклеиновых кислот/аминокислот, позволяющую получать последовательность, которая экспрессирует или проявляет требуемую ферментативную активность. Согласно изобретению можно также использовать производное или мутацию. Производное имеет определенные модификации, как правило, химические, по сравнению со встречающимся в естественных условиях полипептидом, экспрессируемым нуклеиновой кислотой.
Химерный ген может дополнительно содержать 3'-нетранслируемую последовательность терминатора. Последовательность терминатора можно получать из генов растений, бактерий или вирусов. Пригодные последовательности терминаторов представляют собой, например, последовательность терминатора rbcS гена Е9 гороха, последовательность терминатора Nos, выведенную из гена нопалинсинтазы Agrobacterium tumefaciens, и последовательность терминатора 35S вируса мозаики цветной капусты. Специалисту в данной области известны другие последовательности терминаторов. Химерный ген может также необязательно содержать последовательности энхансеров транскрипции или трансляции, например, описанные в международной заявке на патент, опубликованной под No. WO 97/20056, например последовательности, обеспечивающие направленный перенос внутри клетки, и интроны, а также нуклеотидные последовательности, функцией которых является облегчение процесса трансформации и стабильной экспрессии химерного гена, такие как пограничные области Т-ДНК, области, обеспечивающие присоединение к матриксу, и последовательности эксцизии/рекомбинации.
Описанная в заявке двухкомпонентная система предназначена для уничтожения клеток. Такие двухкомпонентные системы описаны в международных заявках на патент WO 98/32325 и WO 93/18170, в которых применяют два или большее количество трансгенов, при этом совместные действия продуктов их экспрессии приводят к уничтожению клеток. Индивидуальные компоненты по отдельности являются неактивными или безвредными, но обладают цитотоксическим действием при их объединении. Каждый трансген находится под контролем конкретного промотора, промоторы выбирают так, чтобы профили их экспрессии перекрывались в требуемой области-мишени, в которой должна происходить гибель клеток, но не в других тканях. В настоящем изобретении описана двухкомпонентная система, содержащая по отдельности α-домен и β-домен инактивирующего рибосому протеина кукурузы, каждый в виде индивидуальной трансгенной конструкции под контролем конкретного промотора. Примеры приемлемых промоторов приведены ниже, а другие промоторы хорошо известны специалистам в данной области. Такую двухкомпонентную систему можно получать путем скрещивания двух растений, каждое из которых содержит один из компонентов, путем последовательной или одновременной трансформации трансгенов с использованием двух трансгенных конструкций или путем трансформации конструкцией, содержащей оба компонента в одной кассете. Два домена могут происходить из различных инактивирующих рибосому протеинов кукурузы.
Предпочтительно промотор индуцируется специфично или практически специфично в области-мишени и/или в соседней с ней области. Если промотор индуцируется в сайтах, отличных от области-мишени и/или соседней с ней области, то промотор предпочтительно обеспечивает экспрессию главным образом в области-мишени и/или в соседней с ней области.
Согласно первому варианту осуществления настоящего изобретения область-мишень может представлять собой область, которой питаются нематоды. В случае, когда область-мишень представляет собой область, которой питаются нематоды, в качестве промотора выбирают промотор, который индуцируется в области, которой питаются нематоды, и/или в соседней области. Индукция такого промотора предпочтительно происходит при поражении растения нематодами. Примером приемлемого промотора является промотор KNT1. Метод выделения промотора KNT1 описан в новозеландском патенте 260511, а также дополнительно описан ниже. Другие приемлемые промоторы включают промотор TobRB7 и промоторы Lemmi. Метод выделения промотора TobRB7 описан в международной заявке на патент WO 94/17194, а метод выделения промоторов Lemmi описан в международной заявке на патент WO 92/21757.
Область, которой питаются нематоды, может включать, например, растительные клетки, находящиеся в локальной области поражения, которые впоследствии подвергаются редифференцировке, образуя синцитий (в случае цистообразующих нематод), или гигантские клетки, и/или сопутствующие гипертрофические клетки (в случае галловых нематод), и/или одну или несколько клеток синцития, гигантских клеток и сопутствующих гипертрофических клеток.
При использовании в качестве мишени области, которой питаются нематоды, можно получать устойчивые к нематодам растения. Понятие "устойчивое к нематодам растение" относится к растению, которое при заражении паразитирующими на растении нематодами обладает способностью предупреждать, замедлять или иным образом оказывать отрицательное воздействие на рост и развитие нематод, поражающих растение, предупреждая тем самым достижения экономически значимой численности паразитирующих на растениях нематод в период вегетации культуры. При этом подразумевается, что нематоды могут, например, погибать или жизненный цикл нематод может замедляться, что приводит к удлинению времени, необходимого для достижения половой зрелости и откладки яиц, или женские особи нематод могут иметь уменьшенный размер и вследствие этого пониженную способность к откладке яиц, которая происходит только после достижения женскими особями нематод минимального критического размера.
Настоящее изобретение применимо к следующим видам нематод (но, не ограничиваясь ими): Globodera spp., Heterodera spp. и Meloidogyne spp.
Согласно второму варианту осуществления настоящего изобретения областью-мишенью может быть один или несколько из таких органов растения, как пыльца, пыльник или тапетум. Если областью-мишенью является, например, тапетум, то выбранный промотор представляет собой промотор, который индуцируется в тапетуме и/или в соседних с тапетумом областях. Примером приемлемого для тапетума промотора является промотор ТА29 табака, описанный у Mariani и др. (1990). Специфичные для пыльника промоторы описаны у Twell и др. (1991).
Согласно третьему варианту осуществления настоящего изобретения область-мишень может представлять собой семяпочку растения. Это предусматривает, что выбранный промотор представляет собой промотор, который индуцируется в семяпочке и/или соседней области. Примером приемлемого промотора является промотор AGL15, описанный у Perry и др. (1996).
Согласно четвертому варианту осуществления настоящего изобретения области-мишени могут представлять собой определенные части цветка, при этом целью является, чтобы эти определенные части цветка не развивались и морфологическое строение цветка изменялось. В этом случае выбранный промотор представляет собой промотор, который индуцируется в чашелистике, плодолистике, лепестке и/или тычинке, или в соседних областях. Примерами приемлемых промоторов являются промоторы генов, обусловливающих бесполость (agamous), отсутствие лепестков (apetala3), шарообразность (globosa), пестичность (pistillata) и другие различные дефициты (Sieburth и Meyerowitz, 1997; Samach и др., 1997 и приведенных в этих публикациях ссылках).
Согласно пятому варианту осуществления настоящего изобретения область-мишень может представлять собой отделительный слой листа и/или плода. Выбранный в этом случае промотор представляет собой промотор, который индуцируется в отделительном слое и/или в соседней области.
Согласно шестому варианту осуществления настоящего изобретения мишенью являются трихомы, при этом трихомы, как правило, являются гландулярными. Выбранный промотор представляет собой промотор, который индуцируется в трихомах и/или соседних областях. Вызывая некроз трихомов растения, можно прекращать или предупреждать производство трихомом химических субстанций.
Согласно седьмому варианту осуществления настоящего изобретения мишенью являются боковые корни, шипы или жгучие волоски.
Согласно восьмому варианту осуществления настоящего изобретения при вирусных инфекциях в пораженных вирусом клетках специфично или практически специфично индуцируются многочисленные гены. Выбранный промотор представляет собой промотор, который индуцируется в пораженных вирусом клетках и/или в соседней области.
Согласно девятому варианту осуществления настоящего изобретения мишенью являются семена. Известно большое количество генов, которые в процессе развития семян специфично или практически специфично индуцируются в определенных клетках/частях семени.
Согласно десятому варианту осуществления настоящего изобретения выбирают промотор, который индуцируется внешним стимулом и который индуцируется, например, в корнях растения. Такой промотор можно использовать для отделения корня в конце вегетационного периода. Для отделения листьев, цветков или плодов в конце вегетационного периода можно применять промоторы, которые индуцируются, например, в черешках листьев, цветоножках или плодоножках.
Методы трансформации растений хорошо известны в данной области и включают, например, опосредуемую Agrobacterium трансформацию. Как правило, при опосредуемой Agrobacterium трансформации бинарный вектор, несущий представляющую интерес чужеродную ДНК, т.е. химерный ген, переносят из соответствующего штамма Agrobacterium в растение-мишень посредством совместного культивирования Agrobacterium с эксплантатами растения-мишени. Трансформированную ткань растения затем регенерируют на средах для селекции, причем среды для селекции содержат селектируемый маркер и гормоны роста растений.
Пригодные методы трансформации включают, например, непосредственный перенос генов в протопласты с помощью полиэтиленгликоля или электропорации, бомбардировку частицами, микроинъекцию и применение волокон из карбида кремния.
Приемлемые виды растений, которые можно трансформировать согласно настоящему изобретению, включают (но, не ограничиваясь ими) рис, пшеницу, кукурузу, картофель, табак, сахарную свеклу, сою, канолу, томаты, арахис, хлопчатник, виноград, арбуз, папайю, овощные культуры и кормовые бобовые растения.
Для облегчения понимания и осуществления на практике изобретение более подробно рассмотрено ниже со ссылкой на прилагаемые чертежи, на которых показано:
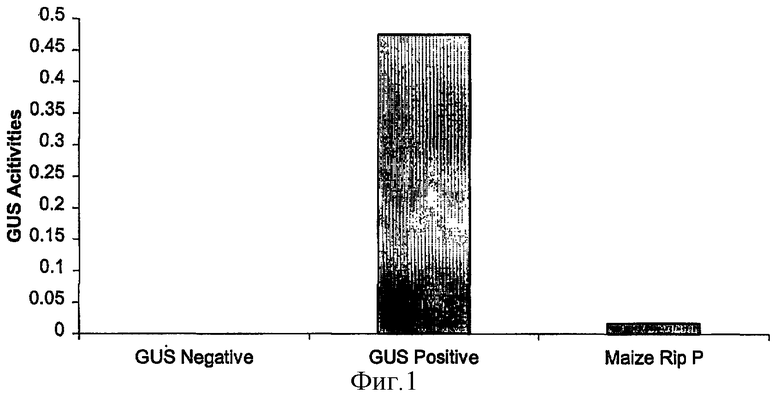
на фиг.1 - воздействие зрелого инактивирующего рибосому протеина кукурузы (RIP-P) на рибосомы табака, оцененное по синтезу протеина GUS;
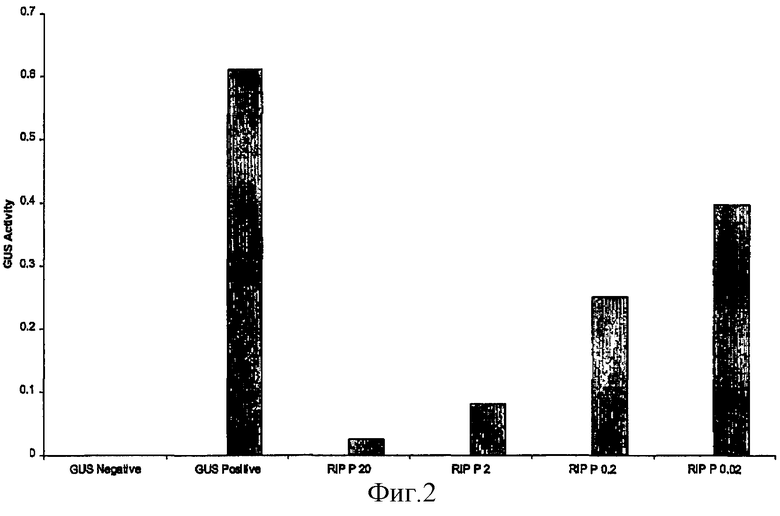
на фиг.2 - воздействие различных количеств ДНК RIP-P кукурузы (от 0,02 до 20 мкг) на рибосомы табака, оцененное по синтезу протеина GUS;
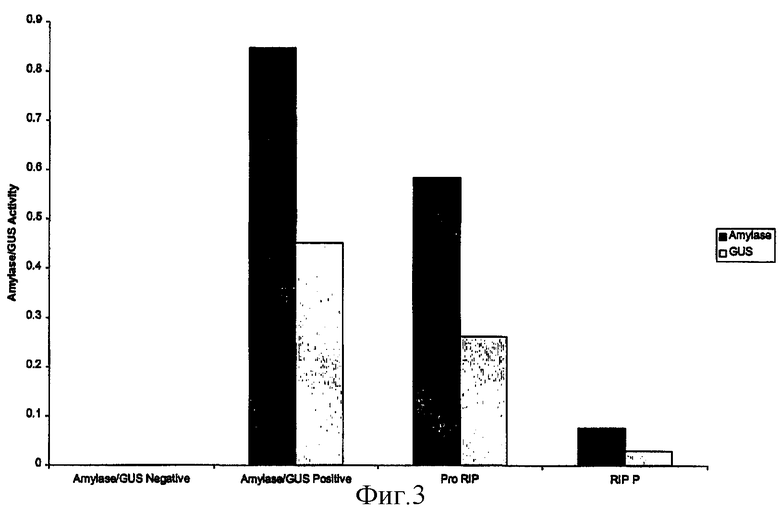
на фиг.3 - воздействие протеинов RIP-P кукурузы на рибосомы табака, оцененное по синтезу α-амилазы и протеина GUS;
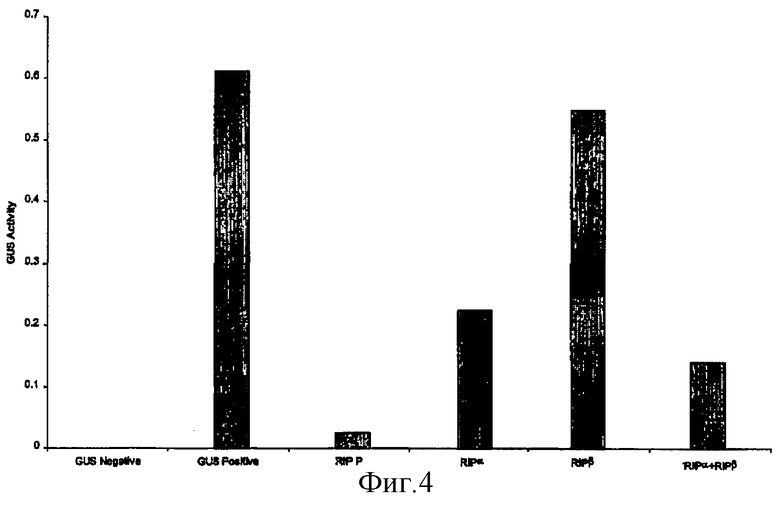
на фиг.4 - воздействие на рибосомы табака α- и β-доменов RIP-P кукурузы по отдельности и совместное воздействие α- и β-доменов, оцененное по синтезу протеина GUS;
на фиг.5 - схематическое изображение несущих промотор KNT1 конструкций pDVM35S и рАТС и конструкций рАТС KNT2/RIP α: KNT/RIP β, применяемых для трансформации растений;
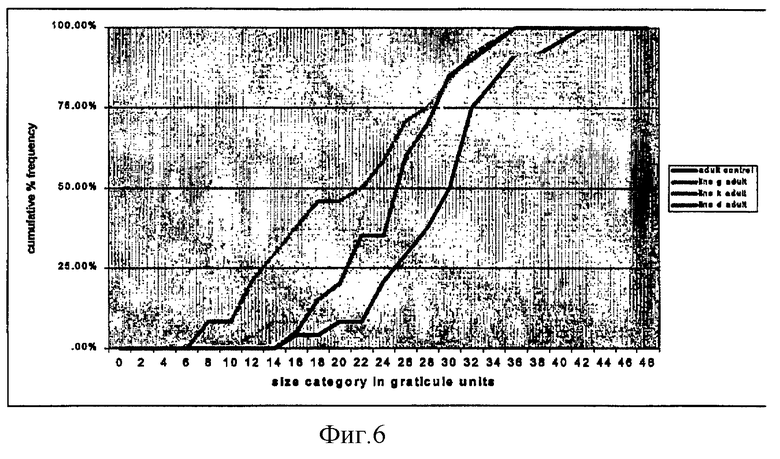
на фиг.6 - взаимосвязь между размерами взрослых нематод на контрольных и трансгенных несущих RIP линиях кукурузы и их кумулятивной частотой;
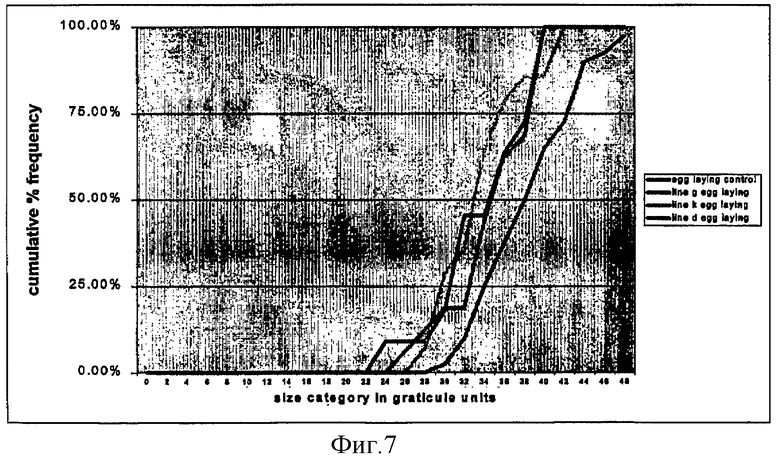
на фиг.7 - взаимосвязь между размерами яйцекладущих женских особей нематод на тех же контрольных и трансгенных несущих RIP линиях кукурузы, что и на фиг.6, и их кумулятивной частотой;
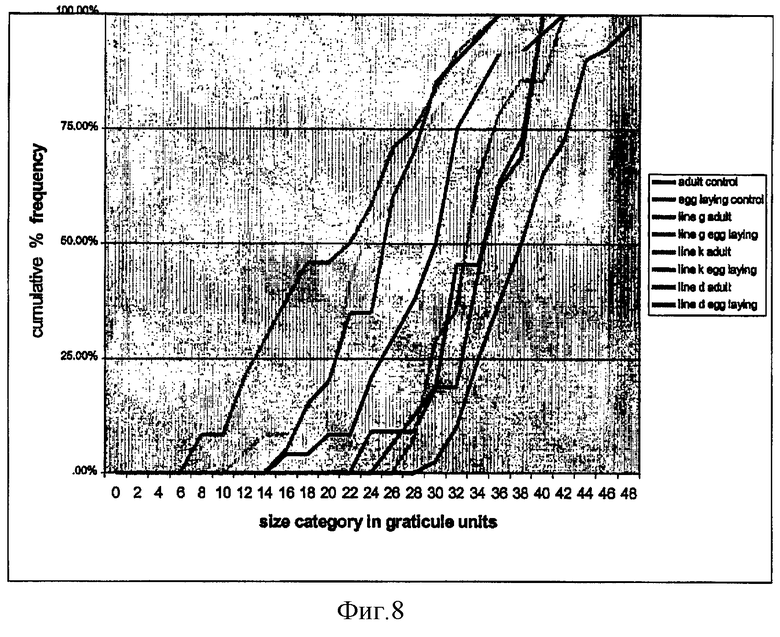
на фиг.8 - сравнение взаимосвязи между размерами взрослых особей и яйцекладущих женских особей галловых нематод на контрольных и трансгенных линиях кукурузы и их кумулятивной частотой;
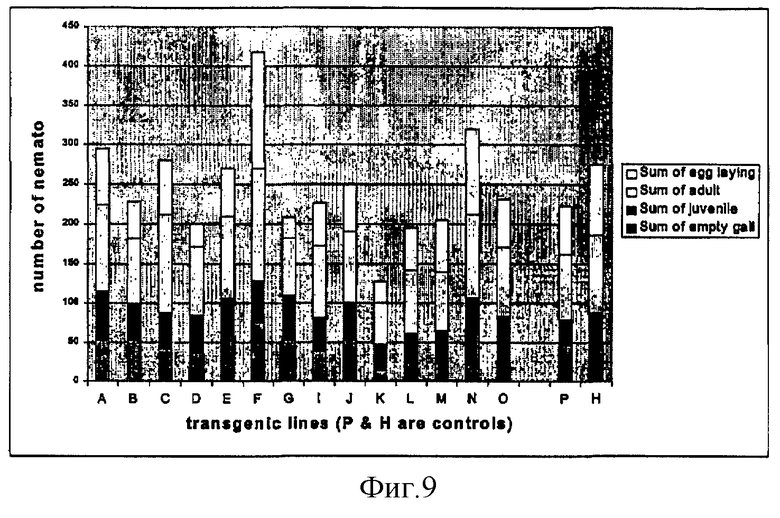
на фиг.9 - количество галлов и три категории нематод для каждой трансгенной в отношении устойчивости к нематодам линий. Линии A-G представляют собой потомство трансформантов кукурузы, несущих RIP-P, линии I-Q представляют собой потомство трансформантов кукурузы, несущих двухкомпонентную систему RIPα/RIPβ, а линии Р и Н обозначают нетрансформированные контрольные линии;
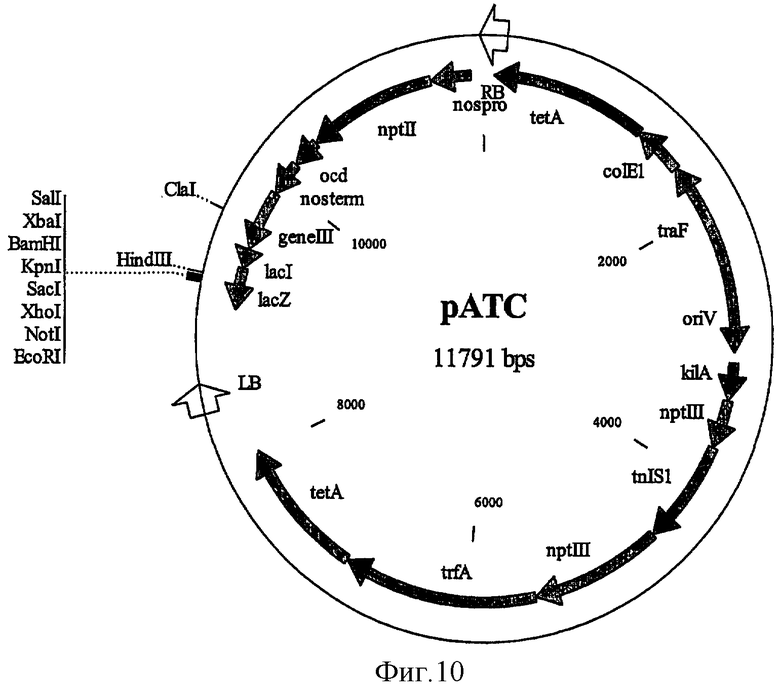
на фиг.10 - трансформирующий вектор рАТС, в который встраивают приведенные на фиг.5 конструкции RIP для трансформации растений;
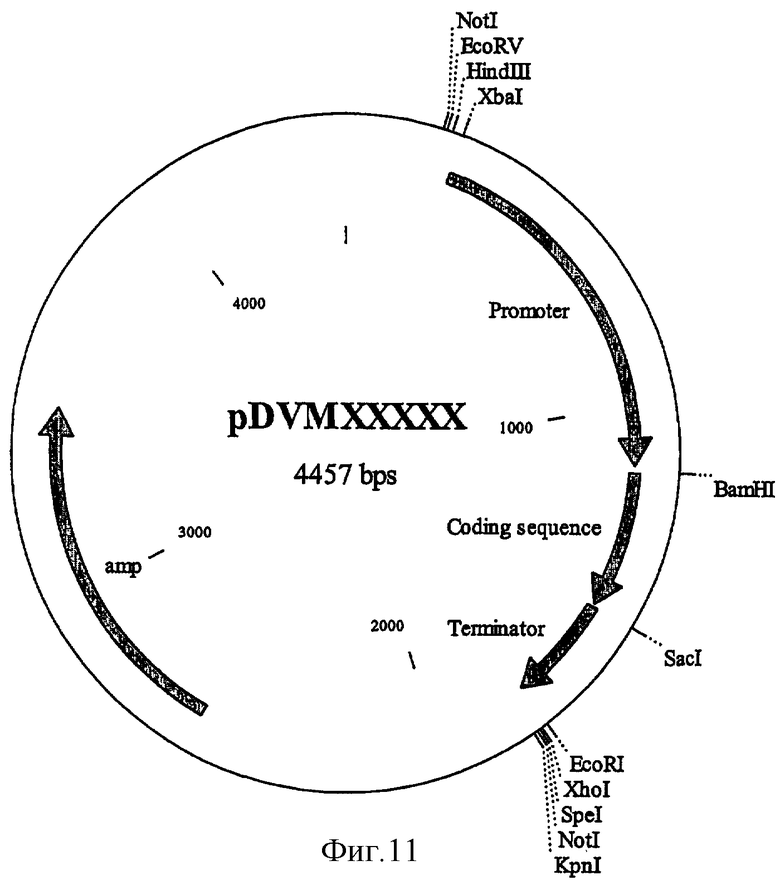
на фиг.11 - клонирующий вектор pDE4;
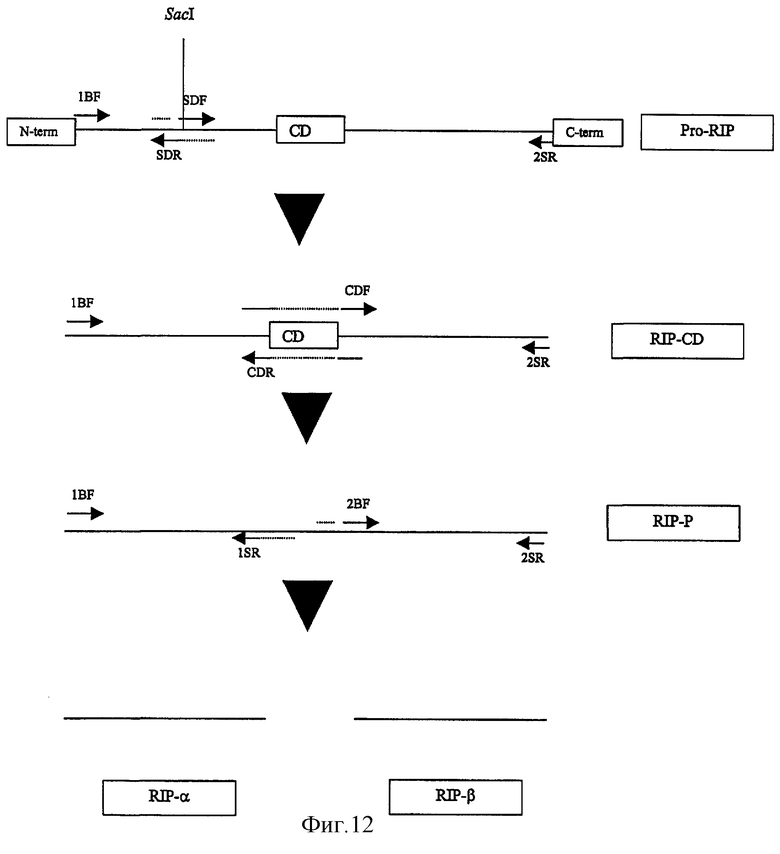
на фиг.12 - схематическая диаграмма получения с помощью ПЦР вариантов инактивирующего рибосому протеина кукурузы;
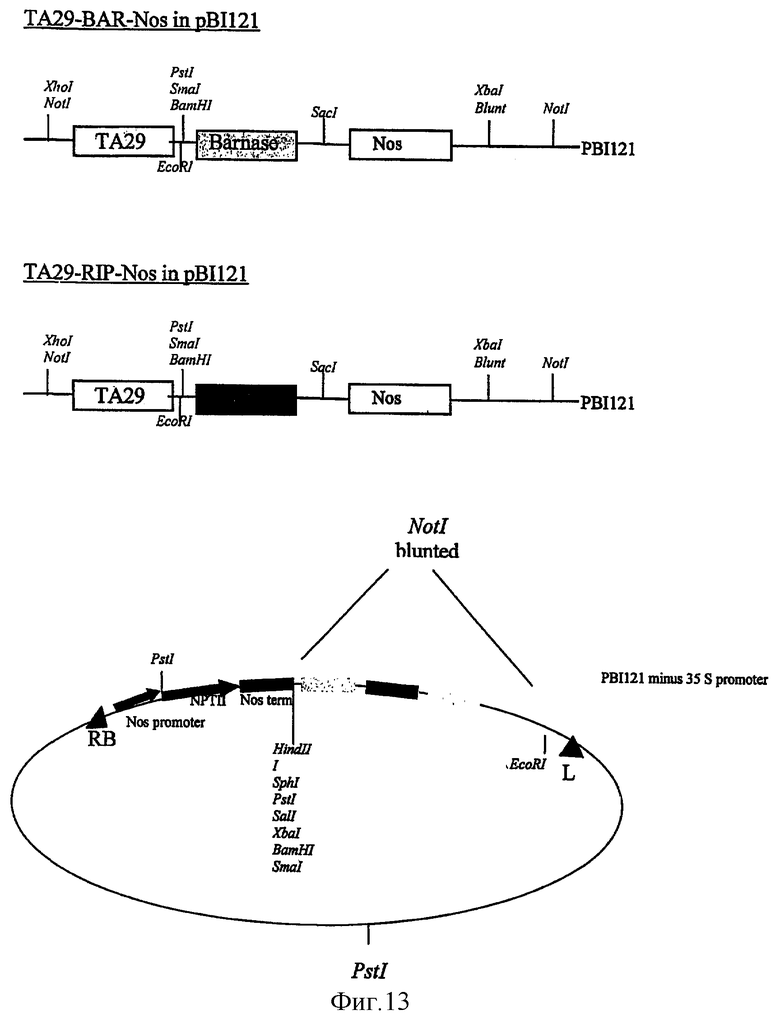
на фиг.13 - конструкция, применяемая для получения мужской стерильности;
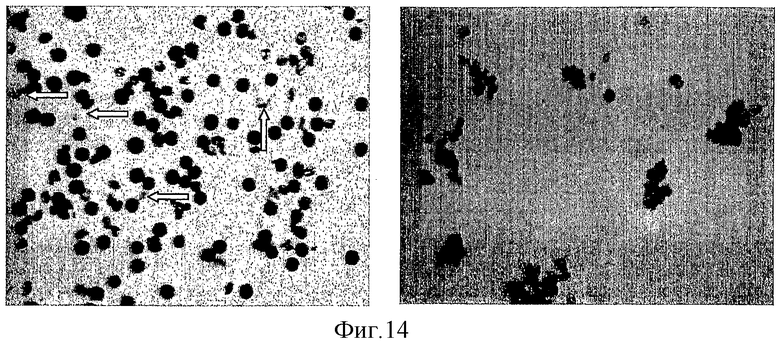
на фиг.14 - формирование пыльцевой трубки пыльцы у растения дикого типа (слева) с обозначенными стрелками ростовыми трубочками и у трансгенного, трансформированного RIP-P растения (справа) с деформированным пыльцевым зерном, лишенным ростовых трубочек;
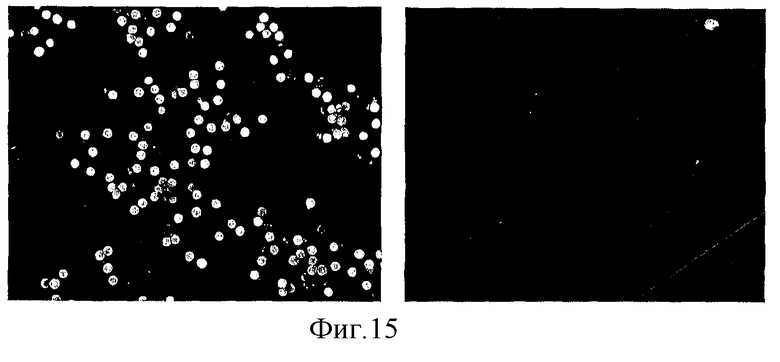
на фиг.15 - пыльца растения дикого типа сорта Desiree (слева), для которой установлено поглощение ФДА (флуоресцеиндиацетат) жизнеспособными пыльцевыми зернами, и аналогичное количество пыльцевых зерен трансгенной, трансформированной RIP-P линии растения (справа), только для одной из которых установлено поглощение ФДА. Пыльцевые зерна имеют диаметр 50 мкм.
Примеры
Клонирование и секвенирование инактивирующего рибосому протеина кукурузы
Геномную ДНК экстрагировали из 14-дневных проростков кукурузы сорта Earli King.
Праймеры конструировали на основе нуклеотидной последовательности геномной ДНК RIP кукурузы для получения вариантов последовательностей RIP путем удаления N- и С-концевых областей и центрального спейсера. Также конструировали праймеры для удаления сайта рестрикции SacI в последовательности RIP, облегчая тем самым клонирование. Последовательности RIP амплифицировали с помощью полимеразы Pfu.
С помощью ПЦР геномной ДНК получали последовательность PRORIP (SEQ. ID. No: 1) с помощью следующего метода:
Для удаления сайта рестрикции SacI гена осуществляли две ПЦР с использованием праймеров PRORIPBF (SEQ. ID. No: 5) плюс RIPSDR (SEQ. ID. No: 14) и RIPSDF (SEQ. ID. No: 13) плюс PRORIPSR (SEQ. ID. No: 6) соответственно. ПЦР-продукты очищали на геле и объединяли. После перекрывающегося удлинения с последующей ПЦР-амплификацией с использованием праймеров PRORIPBF (SEQ. ID. No: 5) плюс PRORIPSR (SEQ. ID. No: 6) получали полноразмерную последовательность ProRIP (SEQ. ID. No: 1).
ПЦР ProRIP с использованием праймеров RIP1BF (SEQ. ID. No: 7) RIP2SR(SEQ. ID. No: 8) позволяла получать ПЦР-продукт длиной примерно 800 пар оснований, соответствующий домену RIPα, центральному спейсеру и домену RIPβ. Этот продукт ("RIP-CD") расщепляли с помощью рестриктаз Xbal и SalI, очищали на геле, встраивали путем лигирования в вектор pBluescript, трансформировали клетки Е.coli XL 1-Blue и секвенировали. Последовательность оказалась идентична последовательности эквивалентной области ДНК кукурузы.
Центральную спейсерную область удаляли следующим образом: ДНК RIP-CD амплифицировали с помощью двух ПЦР с использованием праймеров RIP1BF (SEQ. ID. No: 7) плюс RIPCDR (SEQ. ID. No: 12) и RIPCDF (SEQ. ID. No: 11) плюс RIP2SR (SEQ. ID. No: 8). ПЦР-продукты очищали на геле и объединяли. После перекрывающегося удлинения с последующей ПЦР с использованием праймеров RIP1BF (SEQ. ID. No: 7) и RIP2SR (SEQ. ID. No: 8) получали полностью процессированний RIP (RIP-P). RIP-P расщепляли с помощью рестриктаз Xbal и SalI, очищали на геле, встраивали путем лигирования в вектор pBluescript, трансформировали клетки Е.coli XL1-Blue и секвенировали. Последовательность RIP-P представлена в настоящем описании в виде SEQ. ID. No: 2.
Дополнительные ПЦР осуществляли с использованием RIP-P с помощью либо праймеров RIP1BF (SEQ. ID. No: 7) плюс RIP1SR (SEQ. ID. No: 9), либо RIP2BF (SEQ. ID. No: 10) плюс RIP2SR (SEQ. ID. No: 8) для амплификации доменов RIPα или RIPβ соответственно. RIPα и RIPβ расщепляли с помощью рестриктаз XbaI и SalI, очищали на геле, встраивали путем лигирования в вектор pBluescript, трансформировали клетки Е.coli XL1-Blue и секвенировали. Последовательности RIPα и RIPβ представлены в виде SEQ. ID. No: 3 и SEQ. ID. No: 4 соответственно.
Получение конструкций, содержащих инактивирующий рибосому протеин кукурузы, для анализов кратковременной экспрессии в протопласте
Конструкции, содержащие конститутивный промотор вируса 35S мозаики цветной капусты, связанный с кодирующей последовательностью, выведенной из инактивирующего рибосому протеина кукурузы, и последовательностью терминатора Nos, получали в векторе, являющемся производньм pDE4 (Denecke и др., 1990) (см. фиг.11), пригодном для применения в системе кратковременной экспрессии в протопласте. Были созданы следующие конструкции, которые схематично представлены на фиг.5:
1. pDE4 35S/Pro RIP
2. pDE4 35S/RIP P ("зрелый" RIP)
3. pDE4 35S/RIP α
4. pDE4 35S/RIP β
Экспресс-анализ конструкций RIP в протопластах табака
В этом анализе опосредуемую инактивирующим рибосому протеином кукурузы инактивацию рибосом определяли, оценивая синтез протеина GUS. Протопласты получали из листьев выращенных in vitro растений табака и подвергали электропорации с использованием конструкций RIP. Эффективность рибосом в отношении трансляции протеина в протопластах табака оценивали с помощью репортерного гена GUS в конструкции pDE4 под контролем промотора 35S CaMV. Несущую ген GUS конструкцию pDE4 подвергали совместной электропорации с каждой конструкцией RIP. Для получения данных об оптимальных уровнях синтеза протеина GUS в протопластах в условиях конкуренции со вторым протеином использовали GUS-позитивный контроль, для создания которого осуществляли совместную электропорацию протопластов табака с использованием несущей нетоксичный протеин BiP конструкции pDE800 (Leborgna-Castel и др., 1999) и несущей GUS конструкции pDE4. Также применяли GUS-отрицательный контроль, для создания которого осуществляли совместную электропорацию протопластов табака с использованием незагруженного вектора pDE4 и несущей нетоксичный хаперонный протеин BiP конструкции.
(I) Зрелый RIP-P кукурузы.
Протопласты табака трансформировали путем совместной электропорации конструкциями RIP-P кукурузы и конструкцией, несущей GUS. Воздействие активности RIP кукурузы на рибосомы оценивали по уровням активности GUS после экспрессии в течение 24 ч (фиг.1). Результаты свидетельствовали о том, что протеин RIP-P эффективно инактивирует рибосомы табака. Воздействие разных доз конструкций оценивали путем электропорации различных количеств (от 0,02 до 20 мкг) конструкции, несущей RIP-P кукурузы (фиг.2).
Результаты свидетельствовали о том, что зрелый протеин RIP-P кукурузы эффективно инактивировал рибосомы табака. Поэтому при сравнении с GUS-положительным контролем были обнаружены лишь фоновые уровни GUS.
Эффективность инактивации рибосом зависела от количества ДНК, применяемой для электропорации протопласта. Более высокие количества ДНК RIP (20 мкг) быстро индуцировали инактивацию рибосом и при этом были обнаружены лишь фоновые уровни GUS. Более низкие количества применяемой ДНК (0,02 мкг) приводили к более высокой остаточной активности GUS, вероятно из-за более длительного времени, необходимого для достижения критических концентраций протеина RIP и полной инактивации рибосом.
(II) Активность RIP-P кукурузы на различные рибосомы клетки:
Был проведен эксперимент для оценки того, обладает ли RIP-P кукурузы способностью осуществлять депуринизацию как рибосом эндоплазматического ретикулума (ЭР), так и рибосом цитозоля. В качестве примера протеина, синтез которого происходит в ЭР, использовали α-амилазу, т.е. протеин, который несет N-концевую сигнальную последовательность и секретируется в ЭР. Протопласты подвергали совместной электропорации конструкцией, несущей α-амилазу, и конструкцией, несущей RIP-P, для сравнения использовали несущую GUS конструкцию. После экспрессии в течение 24 ч осуществляли анализ амилазы (фиг.3).
Результаты свидетельствовали об отсутствии заметного различия между воздействием RIP-P на активность α-амилазы и GUS. Зрелый RIP-P кукурузы инактивировал все рибосомы, независимо от их клеточной локализации. Результаты этих анализов, проведенные с использованием RIP-P кукурузы, свидетельствовали о том, что фермент обладает высокой эффективностью в отношении индукции полной инактивации рибосом и последующего истощения клеток или гибели клеток.
(III) Функции различных доменов RIP-P кукурузы
Кроме того, в протопластах табака индивидуально или в сочетании экспрессировали полипептидные области RIPα и RIPβ кукурузы (фиг.4). Неожиданно было установлено, что экспрессия только протеина RIPα приводила к заметному снижению активности GUS. В противоположность этому экспрессия только протеина RIPβ не влияла на активность. С учетом предположений, основанных на структурных особенностях, RIPα содержит мотив распознавания РНК и области домена связывания рибосомы, но не содержит имеющий решающее значение остаток каталитического сайта. Протеин RIPα может предупреждать трансляцию протеинов путем связывания с рибосомами и прекращения трансляции протеинов. Результаты позволяют предположить, что RIPα адаптирован к правильной складчатой конформации и обладает способностью к специфическому распознаванию молекул. RIPβ содержит остаток активного сайта, необходимый для депуринизации рибосом, но маловероятно, что он обладает способностью взаимодействовать с рибосомой.
Одновременная экспрессия и RIPα, и RIPβ в протопластах приводила к дополнительному снижению активности GUS по сравнению с экспрессией только протеина RIPα и протеина RIPβ. Этот результат свидетельствует о том, что оба пептида могут взаимодействовать и облегчать депуринизацию рибосом.
Выделение промотора, который индуцируется в области-мишени и/или соседних областях
Приведенный в настоящем описании метод выделения промотора дан только в качестве примера. Альтернативные методы выделения приемлемого промотора, предназначенного для применения согласно настоящему изобретению, хорошо известны специалисту в данной области, на некоторые из этих методов сделаны ссылки выше.
Метод выделения промотора KNT1 состоит в следующем.
Выращивание и заражение растений табака
Семена табака сорта С319 проращивали в компосте Fisons F1 в следующих условиях: интенсивность света 4500-5000 лк; 16 ч света/8 ч темноты; температура 20-25°С. Примерно через 3 недели проростки осторожно промывали водопроводной водой для удаления почвы и переносили в пакеты (фирма Northrup-King), по 2 растения на пакет, и выращивали в течение еще 1 недели в камере Conviron при 25°С и при указанном выше световом режиме. Корни с задней стороны пакета высвобождали и их кончики поддерживали с помощью бумаги из стекловолокна типа Whatman GF/A. Затем кончики корней заражали трехдневными нематодами (М.javanica), внося аликвотные количества по 10 мкл (50 нематод), и наверх помещали второй кусок бумаги типа GF/A для того, чтобы полностью со всех сторон закрыть кончик корня. Через 24 ч после заражения бумагу GF/A удаляли для того, чтобы обеспечить синхронность заражения. Через 3 дня после заражения корневые узлы отсекали (оставляя здоровую часть корня и ткань кончика корня сзади) и немедленно замораживали в жидком азоте. С 80 инокулированных растений получали примерно 0,5-1,0 г зараженной ткани корня.
Окрашивание для визуализации нематод в зараженных корнях
Уровень заражения оценивали по количеству нематод, заразивших один кончик корня. Корни отделяли через 3 дня после заражения растений и погружали на 90 с при 95°С в лактофенол, содержащий 0,1% красителя Cotton Blue. После отмывки в течение 5 с в воде корни выдерживали в лактофеноле при комнатной температуре (КТ) в течение 3-4 дней до обесцвечивания. Окрашенные нематоды визуализировали с помощью светового микроскопа.
Выделение РНК из здоровой и зараженной корневой ткани
Корневую ткань измельчали с помощью ступки и пестика при охлаждении в жидком азоте с получением тонко измельченного порошка. Затем аликвотные количества примерно по 100 мг переносили в аналогичным образом охлажденные микроцентрифужные пробирки и добавляли 300 мкл горячего фенольного буфера для экстракции (50% фенола, 50% буфера для экстракции: 0,1М хлорид лития, 0,1М Трис-HCl рН 8,0 (КТ), 10 мМ ЭДТК, 1% ДСН) и инкубировали при 80°С в течение 5 мин. Затем добавляли равный объем хлороформа и гомогенат центрифугировали с помощью микроцентрифуги в течение 15 мин при 4°С. После этого водную фазу экстрагировали с помощью 600 мкл фенола/хлороформа и вновь центрифугировали с помощью микроцентрифуги, как описано выше. Водную фазу вновь отделяли и РНК осаждали с помощью равного объема хлорида лития при 4°С в течение ночи. Осадок пеллетировали с помощью микроцентрифуги в течение 15 мин при КТ и промывали в 70%-ном этаноле. Дебрис лиофилизировали, ресуспендировали в обработанной DEPC-водой и анализировали спектрофотометрически. Уровень РНК оценивали с помощью денатурирующего гель-электрофореза (адаптированный для целей исследования метод, описанный у Shirzadegan и др., 1991).
Субтрактивное клонирование инфекционных специфических кДНК
Поли(А)+ - РНК (мРНК) выделяли из 200 мг образцов общей РНК, полученных из здоровой и зараженной корневой ткани табака сорта С319 с помощью магнитных загруженных олиго-дТ гранул типа Dynabead согласно инструкциям производителя. Синтез первой цепи кДНК осуществляли in situ с использованием связанной с гранулами Dynabead поли(A)+ фракции, выделенной из здоровой ткани, получая драйвер-ДНК. Синтез первой и второй цепи осуществляли in situ с использованием связанной с гранулами Dynabead поли(А) фракции, выделенной из зараженной ткани, получая ДНК-мишень. Все реакции с использованием кДНК проводили с помощью набора для синтеза кДНК согласно инструкциям производителя (фирма Pharmacia). Три примененных олигонуклеотида, т.е. SUB 21 (5' CTCTTGCTTGAATTCGGACTA 3') (SEQ. ID. No. 15), SUB 25 (5' TAGTCCGAATTCAAGCAAGAGCACA 3') (SEQ. ID. No. 16) (последовательности, описанные у Duguid и Dinauer, 1990) и LDT15 (5' GACAGAAGCGGATCCd(T)15 3') (SEQ. ID. No. 17) (O'Reilly, 1991), обрабатывали полинуклеотидкиназой фага Т4 согласно методу, описанному у Maniatis и др., (1982). Затем SUB21 и SUB25 "отжигали", получая линкер, который далее лигировали с ДНК-мишенью с помощью ДНК-лигазы фага Т4 согласно методу, описанному у King и Blakesley (1986). Затем гранулы, несущие ДНК-мишень, интенсивно промывали с помощью ТЕ и вторую цепь кДНК элюировали при 95°С в пятикратном (5х) SSC.
РНК, связанную с гранулами Dynabead, которые связаны с драйвер-ДНК, удаляли нагреванием и элюированную ДНК-мишень гибридизовали с драйвер-ДНК при 55°С в 5xSSC в течение 5 ч. Не вступившую в реакцию гибридизации ДНК-мишень отделяли от связанной с гранулами драйвер-ДНК при комнатной температуре (КТ) согласно инструкциям производителя, после чего вступившую в реакцию гибридизации ДНК-мишень также отделяли от связанной с гранулами драйвер-ДНК при 95°С. ДНК-мишень, полученную элюированием при комнатной температуре, вновь добавляли к драйвер-ДНК и гибридизацию повторяли. Этот процесс повторяли до тех пор, пока количество ДНК-мишени, вступившее в реакцию гибридизации с драйвер-ДНК, больше не превышало количество, не вступившее в реакцию гибридизации. Концентрации ДНК оценивали с помощью набора типа DNA Dipstick (фирма Invitrogen) согласно инструкциям производителя.
Аликвотные количества конечной фракции, полученной элюированием при комнатной температуре, использовали для ПЦР-амплификации (Eckert и Kunkel, 1990), получая двухцепочечную кДНК для клонирования в плазмидном векторе. Амплификацию ДНК-мишени осуществляли с помощью праймеров SUB21 и LDT15 в условиях, описанных у Frohman и др., 1988. Затем ПЦР-продукты встраивали путем лигирования в расщепленный с помощью Smal вектор pBluescript согласно методу, описанному у King и Blakesley (1986).
Скрининг субтрактивной библиотеки с помощью обратного Нозерн-блоттинга
Рекомбинанты идентифицировали с помощью колониальной ПЦР (Gussow и Clackson, 1989). Амплифицированные вставки анализировали с помощью Саузерн-блоттинга в трех повторностях на мембранах типа Pall Biodyne согласно рекомендациям производителя. Как предварительную гибридизацию, так и основную гибридизацию осуществляли при 42°С в 5xSSPE, 0,05% BLOTTO, 50% формамида. Мембраны гибридизовали по отдельности с кДНК-зондами (см. ниже), полученными из здоровой и зараженной ткани, и с зондом, содержащим амплицированную ДНК-мишень из полученной отделением (вычитанием) фракции. Клоны, проявившие сигнал гибридизации только с кДНК-зондом из зараженной ткани или проявившие сигнал гибридизации только с зондом из полученной отделением (вычитанием) фракции, отбирали для дальнейшего анализа.
Получение кДНК-зонда
Образцы, содержащие по 10 мкг общей РНК из здоровой и зараженной ткани, обрабатывали 2,5 ед. ДНКазы1 при 37°С в течение 15 мин. Затем ДНКазу1 денатурировали при 95°С в течение 10 мин перед синтезом кДНК, который осуществляли с использованием протокола производителя (фирма Pharmacia). Затем РНК удаляли в присутствии 0,4М гидроксида натрия в течение 10 мин при КТ и кДНК очищали с помощью вращающейся колонки Sephacry1 400HR. Выход и концентрацию определяли с помощью набора типа DNA Dipsticks (фирма Invitrogen). кДНК метили с помощью олигонуклеотидов из расчета примерно 35 нг/зонд с использованием стандартного протокола олигонуклеотидного мечения фирмы Pharmacia.
Нозерн-блоттинг
Для оценки профиля экспрессии клонов, выбранных с использованием анализа на основе обратного Нозерн-блоттинга, их применяли в качестве зондов для анализа с помощью Нозерн-блоттинга либо общей РНК, либо поли(А)+-РНК, полученной из здоровых и зараженных корней, стеблей, листьев и цветков. Блоты общей РНК содержали по 25 мкг РНК на полосу, в то время как блоты поли(А)+-РНК содержали по 0,5-1,0 мкг РНК на полосу. РНК подвергали электрофорезу на формальдегидных гелях и блоттировали на мембране типа Pall Biodyne В согласно методу, описанному у Fourney и др. (1988). Зонды метили и гибридизовали согласно описанным выше методикам.
Саузерн-блоттинг
Для определения того, имеют ли отобранные кДНК происхождение из растения или нематоды, ДНК табака сорта С319 и нематоды M.javanica получали согласно методу, описанному у Gawel и Jarret (1991). Готовили блоты для анализа методом Саузерн-блоттинга, которые содержали по 10 мкг расщепленной с помощью EcoRI и HindIII ДНК на полосу. Блоты гибридизовали с меченными с помощью олигонуклеотидов зондами согласно описанному выше методу.
Гибридизация in situ
Для определения локализации экспрессии представляющих интерес кДНК в области, которой питаются нематоды, осуществляли гибридизацию in situ. Ткань зараженных и здоровых корней погружали в воск, делали срезы и гибридизовали с зондами согласно методу, описанному у Jackson (1991).
Выделение 5'-концов мРНК
Строение 5'-концов представляющих интерес РНК определяли с помощью 5'-RACE согласно методу, описанному у Frohman и др. (1988).
Выделение промоторных областей
Промоторные области представляющих интерес генов выделяли с помощью ПЦР с использованием лигированного вектора. 100 нг образцов расщепленной с помощью рестриктаз геномной ДНК табака сорта С319 лигировали в течение 4 ч при КТ (King и Blakesley, 1986) с 100 нг образцов вектора pBluescript (расщепленного с помощью рестриктаз с получением совместимых концов). Как правило, использовали такие ферменты, как EcoRI, BamHI, HindIII, BglII, XhoI, ClaI, SalI, KpnI, PstI и SstI. Затем осуществляли ПЦР с использованием в качестве матрицы продуктов лигирования с применением векторного праймера, такого как секвенирующий праймер-40 и праймер, комплементарный 5'-концу мРНК. Затем ПЦР-продукты клонировали и секвенировали. При необходимости процесс повторяли с использованием нового праймера, комплементарного 5'-концу промоторного фрагмента, для гарантии того, что выделены контролирующие последовательности промоторов.
С использованием описанных выше процедур был идентифицирован и выделен из растений табака ген KNT1. Промоторный фрагмент KNT1 длиной примерно 0,8 т.п.н., простирающийся от сайта инициации транскрипции, выделяли и встраивали в репортерный несущий ген GUS вектор pBI101 (Jefferson и др., 1987). Полученную в результате конструкцию pBIN05101 применяли для трансформации растений табака. При заражении М.javanica был обнаружен высокий уровень экспрессии гена GUS в областях, которыми питаются нематоды.
Установлено, что ген KNT1 гомологичен гену, присутствующему в других видах растений, отличных от табака. Эти растения включают (но не ограничиваясь ими) Solanum tuberosum (картофель), Lycopersicon esculentum (томаты) и Beta vulgaris (свекла). Ген KNT1 индуцировался как галловыми, так и цистообразующими видами нематод.
В соответствии с Будапештским договором о международном признании депонирования микроорганизмов для целей патентной процедуры конструкция pBIN05101 была депонирована фирмой Advanced Technologies (Кэмбридж) Limited, 210 Cambridge Science Park, Cambridge CB4 0WA, Великобритания в Национальных коллекциях промышленных, пищевых и морских бактерий (National Collections of Industrial, Food и Marine Bacteria, NCIMB), 23 St.Machar Street, Абердин, Шотландия, 20 марта 1997 г. под регистрационным номером NCIMB 40870. Вектор содержит левую и правую пограничные последовательности Т-ДНК штамма Agrobacterium tumefaciens C58. Между пограничными последовательностями находится множественный сайт клонирования и ген, обусловливающий устойчивость к канамицину, под контролем растительного промотора (Nos). Снаружи от пограничных последовательностей в векторе расположен бактериальный ген, обусловливающий устойчивость к канамицину. Вставка в вектор включает промотор KNT1 - кодирующую последовательность глюкуронидазы - терминатор Nos.
Получение конструкций для опытов по трансформации растений, где конструкции содержат инактивирующий рибосому протеин кукурузы и промоторы, индуцируемые в областях, которыми питаются нематоды, и/или в соседних областях
В опытах по трансформации растений использовали конструкции, содержащие чувствительный к воздействию нематод промотор KNT1, связанный с кодирующей последовательностью инактивирующего рибосому протеина кукурузы и терминатором Nos в полученном из рАТС растительном трансформирующем векторе (фиг.10). Эти конструкции создавали для оценки эффективности содержащих RIP конструкций вызывать гибель клеток в областях, которые создают нематоды для своего питания. Конструкции встраивали в вектор pDMV и затем трансгенные кассеты вырезали с помощью рестриктазы NotI и клонировали в бинарном векторе рАТС. Конструкции интродуцировали в штамм Agrobacterium tumefaciens LBA4404 путем электропорации. Были получены следующие конструкции:
1. pATCKNT1/Pro RIP
2. pATCKNT1/RIP-P
3. pATCKNT1/RIPα
4. pATCKNT1/RIPβ
Получали конечную конструкцию, которая содержала кодирующие области как RIPα, так и RIPβ, под контролем двух различных чувствительных к воздействию нематод промоторов (фиг.5). Второй применяемый промотор представлял собой сконструированный промотор KNT2 (см. SEQ. ID. No: 18). Эту конструкцию обозначили:
рАТСKNT2/RIPα KNT/RIPβ
Промотор KNT1 обеспечивает экспрессию в клетках областей, которыми питаются нематоды, кончиках корней и в меньшей степени в других видах меристемы. Промотор KNT2 обеспечивает экспрессию в массе корня и в клетках областей, которыми питаются нематоды (но не в кончиках корней). Таким образом, зоной перекрывающейся экспрессии в клетках областей, которыми питаются нематоды, обусловливающей повышенную специфичную для растения цитотоксичность, является зона, в которой происходит совместная экспрессия α- и β-доменов.
Применяемые в других вариантах осуществления изобретения конструкции получают аналогичным методом с использованием приемлемых для альтернативного варианта промоторов, обеспечивающих экспрессию в определенной мишени.
Получение трансгенных растений, содержащих конструкции, которые несут RIP кукурузы под контролем индуцируемых нематодами промоторов
Все описанные выше конструкции (см. фиг.5) интродуцировали в картофель сорта Hermes и табак сорта К326 методом совместного культивирования листовых дисков с использованием штамма Agrobacterium tumefaciens LBA4404 (Horsch и др., 1985).
Получали трансгенные растения картофеля и табака и в опытах в теплицах оценивали их устойчивость к нематодам.
Скрининг в отношении устойчивости растений табака, зараженных Meloidogyne javanica
Трансгенные и контрольные проростки табака высаживали случайным образом вслепую в устройства, позволяющие увлажнять корни [(рутрайнеры (rootrainer)], заполненные не содержащим удобрений перегнойным компостом высокого качества, и наиболее крупные листья подрезали наполовину. Растения накрывали полиэтиленом для поддержания высокой влажности до тех пор, пока не произойдет приживление. Перед завершением приживления в полиэтилене постепенно делали отверстия для снижения влажности. Через неделю после приживления небольшие растения заражали 200 вылупившимися нематодами второго возраста (J2) Meloidogyne javanica. Полив жидкой подкормкой осуществляли только после того, как почва становилась достаточно сухой для начала увядания листьев. Рутрайнеры помещали в ящики на нагреваемое утепляющее покрытие для поддержания температуры почвы на уровне 25-30°С. Листья повторно обрезали один раз в неделю для прекращения их роста и предотвращения покрытия точек роста более крупными листьями из-за плотности посадки.
Растения собирали для их анализа примерно через 8 недель после заражения. Как правило, корни промывали и оценивали рост корней, количество образовавшихся галлов и размер галлов.
Скрининг в отношении устойчивости растений табака, зараженных Globodera pallida, патогенный вариант 2/3
Первичную оценку устойчивости трансгенных растений осуществляли с помощью случайных опытов вслепую с использованием групп, включающих 20-25 трансгенных линий, и с использованием по меньшей мере 10 повторностей двух или большего количества контрольных линий. Рутрайнеры или контейнеры заполняли смесью 50:50 суглинка и песка. 12 л смеси суглинка и песка увлажняли 1250 мл воды, получая смесь с концентрацией воды 40%. По 3 цисты помещали на корни каждого проростка, который затем вносили в отверстие в компосте и компостом осторожно закрывали корни. Растения приживлялись и после этого их поливали только 1 раз в неделю жидкой подкормкой или только тогда, когда почва становилась достаточно сухой. После достижения растениями высоты примерно 10 см их верхушки отрезали, препятствуя дальнейшему росту.
Растения выращивали в течение примерно 3 месяцев, позволяя цистам созреть. Затем растениям давали засохнуть в течение 1 месяца. Цисты выделяли из растений, интенсивно промывая почву и корни в химическом стакане с 250 мл воды. Почве давали осадиться в течение нескольких минут и супернатант сливали в большую фильтровальную воронку с помещенным в нее диском из фильтровальной бумаги типа Whatman No. 1 диаметром 32 см. Супернатанту давали выстояться в воронке в течение 1 мин и затем в центральную область поверхности раствора вносили каплю детергента Hederol для смещения материала поверхности мениска раствора к боковой стороне фильтра. Затем основание фильтра прокалывали для удаления остатка раствора. Диск из фильтровальной бумаги удаляли и подсчитывали количество прикрепившихся цист.
Растения рассматривались как обладающие признаками устойчивости, если они были заражены меньшим количеством цист, чем чувствительные контрольные линии.
Оценка с помощью окрашивания уровня заражения растений табака и картофеля нематодами
Растения табака, полученные их культуры ткани или проростков, высаживали и выращивали согласно описанному выше методу со следующей модификацией. Растения заражали 1000 вылупившихся неметод Meloidogyne javanica J2. Растения картофеля заражали Globodera pallida согласно описанному выше методу.
Через 1 месяц после заражения у растений отрезали отводки. Корни отмывали от почвы и отбеливали в течение 4 мин в 1%-ном растворе гипохлорита натрия. Отбеливатель удаляли промывкой водой и затем корни замачивали в большом объеме воды в течение 15 мин при периодическом перемешивании. Затем корни помещали в 10-15 мл разбавленного в соотношении 1:500 маточного раствора кислого фуксина в 5% уксусной кислоте (маточный раствор кислого фуксина получали согласно методу, описанному в "Introduction to Plant Nematology" y V.H.Dropkin, ISBN 0-471-85268-6. Для его приготовления 0,35 г кислого фуксина растворяли в 100 мл смеси 1:3 ледяной уксусной кислоты и дистиллированной воды). Для окраски образцы помещали в кипящую водяную баню на 4 мин и затем переносили в баню с температурой 37°С на 4 ч. Краситель декантировали и образцы осветляли, добавляя подкисленный глицерин, и инкубировали при 37°С в течение ночи.
Затем осветленные корни с окрашенными нематодами помещали в чашки Петри (образец помещали на внутреннюю сторону крышки чашки Петри и основание чашки Петри использовали для распределения и придавливания образца с целью облегчения его анализа с помощью микроскопа).
Образцы обследовали при увеличении в 20-100 раз и популяцию нематод анализировали несколькими путями. Галловые нематоды разделяли по категориям на 3 группы: а) паразитиформные нематоды, б) инкапсулированные нематоды, у которых не образуются яйца, и в) инкапсулированные нематоды, у которых образуются яйца. Диаметры практически полностью инкапсулированных нематод оценивали визуально с помощью окулярной шкалы.
Цистообразующие нематоды также разделяли по категориям на 3 группы: а) паразитиформные нематоды, б) напитавшиеся паразитиформные нематоды, у которых не образуются яйца, и в) шарообразные нематоды, у которых образуются яйца. Диаметры практически шарообразных нематод оценивали визуально с помощью окулярной шкалы.
Уровни устойчивости растений оценивали в виде абсолютного количества нематод на корневых системах, в виде соотношения нематод, которые достигли половой зрелости, и нематод, у которых образовались яйца, и в виде размера нематод.
Определяли количество устойчивых линий табака и картофеля, у которых экспрессия RIP кукурузы происходила в качестве единственного эффекторного компонента, а также у которых происходила экспрессия двухкомпонентной системы.
Опыты в вегетационных сосудах по оценке устойчивости линий картофеля, трансформированных RIP кукурузы
Проросшие клубни отобранных линий картофеля сорта Hermes разделяли на части и применяли для стандартного опыта по оценке устойчивости к цистообразующим нематодам G.pallida, патогенный вариант 2/3 (картофельная (цистообразующая) нематода, КЦН), к которым обнаружена лишь частичная устойчивость. Тестируемые линии картофеля включали 4 линии, трансформированные процессированным RIP-P кукурузы, и 4 линии, трансформированные двухкомпонентной конструкцией RIPα/RIPβ. В опыте использовали также нетрансформированные линии Hermes и Prairie, клубни которых использовали в качестве исходных (контроль), и материал, полученный с помощью процедуры, аналогичной той, которую применяли для получения трансгенных растений (контроль ncc). Кроме того, в опыте использовали нетрансформированные контрольные сорта Desiree и Maris Piper (оба сорта чувствительны к КЦН) и Sante (сорт, обладающий частичной устойчивостью к КЦН, патогенный вариант 2/3, который представляет собой лучшую из доступных поступающих в продажу линий).
В таблице 1 обобщены результаты, выраженные в виде процента чувствительности трансгенных линий по сравнению с не обладающими устойчивостью контрольными линиями.
Обнаружена большая вариабельность в количестве цист КЦН как между контрольными линиями, так и между отдельными повторностями, что может быть связано с внешними факторами. Однако для одной линии, трансформированной процессированным RIP кукурузы (RIP-P), и одной линии, трансформированной двухкомпонентной системой RIP кукурузы, выявлено значительное снижение чувствительности по сравнению с контрольными линиями. Эти линии обозначены в таблице 1 двумя звездочками (**). Для растений, трансформированных двухкомпонентной системой, неожиданно было установлено, что некоторые растения сохранили жизнеспособность, несмотря на экспрессию RIPα или RIPβ в не перекрывающихся областях.
Анализ нематод на трансгенных линиях табака, экспрессирующих RIP кукурузы
Потомство трансгенных линий табака, трансформированных процессированным RIP-P кукурузы или двухкомпонентной конструкцие RIP кукурузы, заражали галловыми нематодами. Через 1 месяц после заражения корни зараженных растений обрабатывали кислым фуксином для окрашивания нематод in situ. Подсчитывали количество галлов и окрашенных нематод и разделяли их на 4 категории: пустые галлы, паразитиформные ювенильные особи, сферические взрослые особи, яйцекладующие взрослые особи (фиг.9).
Хотя между трансгенными и контрольными линиями не было обнаружено существенного различия в общем количестве нематод и галлов на каждой линии, на трех трансгенных линиях D, G и К выявлено меньшее количество яйцекладущих взрослых особей.
Для определения того, происходит ли на линиях, трансформированных RIP кукурузы, снижение роста нематод, размер взрослых нематод оценивали с помощью описанного выше метода.
Неяйцекладующие взрослые особи нематод имели существенно меньший размер на линиях D, G и К по сравнению с размером нематод на контрольных растениях (фиг.6). Однако различие в размерах яйцекладующих нематод оказалось существенно меньшим (фиг.7), что, вероятно, свидетельствует о том, что процесс яйцекладки начинается только после достижения нематодами определенного минимального размера (32-36 единиц окулярной шкалы). Экспрессия RIP, вероятно, замедляет рост нематод, приводя к замедлению достижения ими необходимого для яйцекладки размера (фиг.8).
В противоположность этому на линиях, на которых не выявлено какое-либо снижение количества инфицирующих нематод или количества яйцекладующих женских особей, не обнаружено снижение размера взрослых женских особей, характерное для линий D, G и К.
Таким образом, эти результаты свидетельствуют о том, что RIP кукурузы и двухкомпонентные конструкции на основе RIP кукурузы оказывают воздействие на развитие галловых нематод.
Для применения в других объектах изобретения используют соответствующий промотор, функционально связанный с инактивирующим рибосому протеином кукурузы или его фрагментом, согласно методам, описанным выше в качестве примера.
Мужская стерильность, индуцируемая в пыльце в результате экспрессии инактивирующего рибосому протеина (RIP)
Конструкции
Последовательность барназы Bacillus amyloliquefaciens (Hartley R.W. и др., 1998) и инактивирующего рибосому протеина (RIP-P; SEQ.ID. No: 2) из зерен кукурузы (Bass и др., 1995) встраивали в различные конструкции под контролем специфического для тапетума промотора (ТА29, Mariani С., 1989) Nicotiana tabacum. Создавали конструкции (фиг.13) и осуществляли трансформацию с помощью растительного вектора рВI121 (без промотора 35S CaMV). Конструкциями трансформировали Solanum tuberosum spp. tuberosum, сорт Desiree, что позволяло осуществлять непосредственное сравнение с сортом Desiree, имеющим нормальный фенотип.
Трансформация и регенерация трансгенных растений
Указанную выше кассету клонировали в бинарном векторе рВI121 в виде NotI-фрагмента. Конечную конструкцию интродуцировали путем электропорации в компетентный штамм Agrobacterium tumefaciens LBA4404 согласно методу, описанному у Shen и др., 1989.
Затем трансформировали листовые диски Solanum tuberosum spp. tuberosum, сорт Desiree с использованием стандартного протокола (Dietze J. и др., 1995). Трансгенные растения для образования корней помещали в жидкую среду MS (Murashige Т. и Skroog F., 1962), дополненную 0,1 мг/л НУК (нафтилуксусная кислота), перед переносом в почву.
Регенерированные растения переносили в вегетационные сосуды, заполненные смесью 50:50 песка:суглинка. Растения каждого сорта выращивали в отдельной теплице при 18±2°С при длине светового дня 14 ч, осуществляя полив при необходимости. Нетрансгенные линии создавали в культуре ткани из стеблей растений, выращенных в теплице. Растения, полученные из указанного источника, переносили в теплицы одновременно с трансгенными линиями.
Трансгенные и контрольные линии оценивали в отношении жизнеспособности пыльцы, используя для этого как биологический анализ прорастания пыльцевых трубок, так и анализ их способности поглощать флуоресцеиндиацетат. Отобранные линии, для которых выявлена потеря жизнеспособности пыльцы, а также контрольные растения затем применяли для экспериментов по скрещиванию, которое осуществляли вручную, с целью подтверждения способности (или отсутствия способности) их пыльцы осуществлять перекрестное опыление рыльца другого растения картофеля.
Образование пыльцевой трубки
Прорастание пыльцы изучали с помощью протокола, описанного у Krishnakumar и Oppenheimer (1999).
На стеклянные предметные стекла наносили расплавленную среду для прорастания пыльцы. Эта среда представляла собой раствор, рН 6, содержащий 1 мМ CaCl2, 1 мМ Са(NO3)2, 1 мМ MgSO4, 0,01% борной кислоты, 18% сахарозы и 0,5% агарозы. У тестируемого растения удаляли пыльник и стряхивали пыльцу на предметное стекло. Это стекло с пыльцой выдерживали в течение 18 ч в камере при относительной влажности примерно 100% в термостате при 22-25°С в темноте. На предметное стекло помещали покровное стекло и подсчитывали относительное количество пыльцевых зерен с ростовыми трубочками, оценивая пыльцевые зерна при освещении методом яркого поля. На фиг.14 представлено доказательство образования пыльцевой трубки у пыльцы дикого типа, но его отсутствие у аномальной пыльцы у одной из трансформированных RIP-P линий, которая была отобрана по признаку наличия мужской стерильности.
Окрашивание флуоресцеиндиацетатом (ФДА) жизнеспособной пыльцы
Для этой методики использовали маточный раствор флуоресцеиндиацетата в ацетоне (концентрация 2 мг/мл). Перед применением его разбавляли в 1000 раз, используя для разбавления 20%-ный раствор сахарозы в дистилированной воде, который предварительно стерилизовали фильтрацией. Пыльники удаляли у каждого цветка растения картофеля с помощью пинцета и слегка прикасались ими к стеклянному предметному стеклу, стряхивая пыльцевые зерна. Добавляли разбавленный раствор ФДА и на предметные стекла помещали покровные стекла. Препараты сразу же оценивали под микроскопом (фирма Leica DMR) с верхним освещением и с соответствующими фильтрами для оценки флуоресценции, испускаемой флуоресцеином. Изображения регистрировали с помощью присоединенной фотокамеры (тип Olympus OM4) и обращаемой пленки (тип Kodak Elite 100 ASA). На фиг.15 представлен пример изображения пыльцы дикого типа, полученного при освещении методом яркого поля. В отличие от этого трансгенные линии, экспрессирующие SEQ. ID. NO: 2 или барназу, давали сморщенную пыльцу, у которой не образовывались пыльцевые трубки. Это свидетельствует об отсутствии жизнеспособности у пыльцы трансгенных линий.
По результатам анализа прорастания пыльцевых трубок и анализа их способности поглощать ФДА, было отобрано всего 8 из 37 трансформированных RIP-P линий с очень низкой жизнеспособностью пыльцы. Отсутствие жизнеспособной пыльцы выявлено также всего у 2 из 21 трансформированных барназой линий. Данные для каждой из этих линий в сочетании с примером конструкций, которыми трансформировали линию, отбракованную как не обладающую соответствующей мужской стерильностью, приведены в таблице 2. В таблицу включены также данные, полученные для некоторых контрольных линий.
На основе данных биологических анализов прорастания пыльцевых трубок и данных о низком уровне поглощении ФДА пыльцевыми зернами были отобраны в качестве обладающих мужской стерильностью 8 экспрессирующих RIP и 2 экспрессирующие барназу трансгенные линии. Для сравнения приведены данные, полученные для двух трансгенных линий, у которых не выявлен высокий уровень нежизнеспособной пыльцы, и данные, полученные для нетрансформированных контрольных сортов картофеля дикого типа (н.а. обозначает отсутствие данных).
Различие между частотой прорастания пыльцевых трубок или поглощением ФДА у линий, позитивных в отношении RIP и барназы, и контрольных линий оказались статистически достоверными (тест с использованием χ2-критерия, р<0,001 в обоих случаях).
Опыление растений картофеля вручную
Данную процедуру применяли для доказательства того, что линии, трансформированные как конкретным RIP (SEQ. ID. No:2), так и барназой, которые на основе анализов прорастания пыльцевых трубок и поглощения ФДА отнесены к линиям, обладающим мужской стерильностью, не могут оплодотворять рыльце цветков картофеля, обработанных пыльцой указанных линий. В этом опыте применяли также несколько контрольных сортов. Сорта Revolution и Waycha получали из Solanum tuberosum spp. andigena. Их выбирали с учетом того, что сорт Waycha характеризуется большим количеством плодов, а для сорта Revolution характерна мужская стерильность и поэтому у него не образуется плодов, если пыльца попадает на цветки. С помощью контрольных экспериментов установлено, что опыление вручную часто бывает успешным при использовании источника жизнеспособной пыльцы.
В этих опытах также использовали Solanum tuberosum spp. tuberosum, сорт Desiree. Этот сорт дает большое количество плодов и для этого сорта характерно формирование настоящих семян картофеля. С учетом его нормальной способности образовывать плоды он представляет собой сорт, пригодный для оценки потери этой способности при использовании одного из генов RIP, которые являются объектом изобретения. Эффективность этого трансгена в отношении предупреждения оплодотворения сравнивали с эффективностью несущего барназу трансгена.
После формирования цветков их использовали для скрещивания вручную. Если цветок являлся реципиентом пыльцы, то у него удаляли лепестки, а затем пыльники, выставляя рыльце.
Если цветок являлся донором пыльцы, то у него удаляли лепестки и рыльце. В этом случае один пыльник удаляли пинцетом и стряхивали на поверхность черного кафеля так, чтобы можно было визуально оценивать отложение пыльцы. Источником пыльцы натирали рыльце цветков, которые являлись реципиентами или донорами пыльцы. Все необработанные цветки растения отрезали. Когда рыльце было успешно оплодотворено, цветок не опадал, а начинал разрастаться, образуя плод. Наличие плодов представляло собой надежный предварительный индикатор того, что оплодотворение произошло. Предварительные эксперименты позволили установить, что плоды содержали семена, но их количество на плод обычно не подсчитывали.
Приведенные в таблице 3 результаты подтверждали, что пыльца растений линии 33, трансформированной RIP, и линии 12, трансформированной барназой, которые отобраны в качестве линий с мужской стерильностью на основе биологических анализов, позволивших установить прекращение образования пыльцевой трубки, и по отсутствию поглощения ФДА пыльцевыми зернами, не могла оплодотворять рыльце цветков картофеля.
В таблице 3 обобщены данные по оплодотворению вручную индивидуальных рыльцев различных сортов в качестве реципиентов или доноров пыльцы и количество полученных в результате плодов. Скрещивания с трансгенным сортом Desiree подтвердили заключение о высоком уровне мужской стерильности двух линий, у которых мужская стерильность была установлена на основе биологических анализов образования пыльцевой трубки и по отсутствию поглощения ФДА пыльцевыми зернами.









Изобретение относится к биотехнологии, в частности к трансгенным растениям и растительным клеткам, которые несут в геноме химерный ген, при экспрессии которого образуется обладающий цитотоксическим действием протеин. Растение, трансформированное химерным геном, где химерный ген включает промотор, который индуцируется в области-мишени и/или в соседней области, функционально связанный с кодирующей последовательностью, которая кодирует инактивирующий рибосому протеин кукурузы или его фрагмент, эта кодирующая последовательность включает рекомбинантный зрелый RIP, включающий расположенные последовательно α- домен и β-домен; рекомбинантный RIP, включающий в качестве активного фрагмента только α-домен инактивирующего рибосому протеина кукурузы; или рекомбинантный RIP, включающий в качестве активного фрагмента только β-домен инактивирующего рибосому протеина кукурузы; или кодирующую последовательность, приведенную в SEQ. ID. No: 1, или кодирующую последовательность, гомологичную ей по меньшей мере на 85%. Растительная клетка, трансформированная химерным геном, где химерный ген включает промотор, который индуцируется в области-мишени и/или в соседней области, функционально связанный с кодирующей последовательностью, которая кодирует инактивирующий рибосому протеин кукурузы или его фрагмент, эта кодирующая последовательность включает рекомбинантный зрелый RIP, включающий расположенные последовательно α-домен и β-домен; рекомбинантный RIP, включающий в качестве активного фрагмента только α-домен инактивирующего рибосому протеина кукурузы; или рекомбинантный RIP, включающий в качестве активного фрагмента только β-домен инактивирующего рибосому протеина кукурузы; или кодирующую последовательность, приведенную в SEQ. ID. No: 1, или кодирующую последовательность, гомологичную ей по меньшей мере на 85%. Изобретение раскрывает растения, имеющие хозяйственно ценные признаки, такие как мужская стерильность, бессемянность плодов, махровость цветов, а также устойчивость к нематодам. 4 н.п. ф-лы, 15 ил., 3 табл.
| WO 9318170 16.09.1993 | |||
| US 5332808 26.07.1994 | |||
| СПОСОБ БОРЬБЫ С НЕМАТОДАМИ | 1991 |
|
RU2129373C1 |
Авторы
Даты
2006-04-27—Публикация
2001-10-15—Подача