Настоящее изобретение касается способа производства ненасыщенных жирных кислот, а также способа изготовления триглицеридов с повышенным содержанием ненасыщенных жирных кислот. В существенной мере изобретение касается последовательностей ДНК, кодирующих Δ6-ацетиленазы/Δ6-десатуразы или Δ6-десатуразы для производства трансгенного организма, предпочтительно трансгенного растения или трансгенного микроорганизма с повышенным содержанием жирных кислот, масел или липидов с тройными и/или двойными Δ6-связями.
Кроме того, изобретение касается изолированной последовательности нуклеиновых кислот; экспрессионной кассеты, содержащей последовательность нуклеиновых кислот, вектора и организмов, содержащих, как минимум, одну последовательность нуклеиновых кислот, соответственно, одну экспрессионную кассету. Кроме того, изобретение касается ненасыщенных жирных кислот, а также триглицеридов с повышенным содержанием ненасыщенных жирных кислот и их применения.
Жирные кислоты и триглицериды находят многочисленное применение в пищевой индустрии, в питании животных, косметике и в фармацевтике. В зависимости от того, идет ли речь о свободных насыщенных кислотах или ненасыщенных жирных кислотах, или о триглицеридах с повышенным содержанием насыщенных или ненасыщенных кислот, они пригодны для различных применений, так, например, многократно ненасыщенные жирные кислоты входят в состав детского питания для повышения питательной ценности. Различные жирные кислоты и триглицериды добываются, главным образом, из микроорганизмов, таких как Mortierella или из масличных растений, как соя, рапс, подсолнечник и др., причем они, как правило, находятся в форме их триацилглицеридов. Однако их можно также получить из животных, например, рыб. Свободные жирные кислоты производятся преимущественно путем омыления.
В зависимости от цели применения предпочтительны масла с насыщенными или ненасыщенными жирными кислотами, так, например, в питании человека липидам с ненасыщенными жирными кислотами предпочтительны липиды со специально многократно ненасыщенными жирными кислотами, так как они уменьшают уровень холестерина в крови и снижают вероятность сердечных заболеваний. Они находят применение в различных диетических продуктах питания или медикаментах.
Ввиду их позитивных качеств, ранее предпринимались попытки использовать гены, которые участвовали в синтезе жирных кислот, соответственно, триглицеридов для производства масел в различных организмах с измененным содержанием ненасыщенных жирных кислот. Так в патенте WO 91/13972 и его эквиваленте в США описывается Δ9-десатураза. В патенте WO 93/11245 заявляется Δ15-десатураза, в WO 94/11516 заявляется Δ12-десатураза. Δ6-десатуразы описываются в WO 93/06712, US 5,614,393, WO 96/21022 и WO 99/27111. Другие десатуразы описаны, например, в патентах ЕР-А-0 550 162, WO 94/18337, WO 97/30582, WO 97/21340, WO 95/18222, ЕР-А-0 794 250, а также Стаки и др, Ж. Биол. Кем., 265, 1990: 20144-20149 (Stukey et al, J. Biol. Chem., 265, 1990: 20144-20149), Вада и др., Нэйча 347, 1990: 200-203 (Wada et al., Nature 347, 1990: 200-203) или Хуан и др., Липидз 34, 1999: 649-659 (Huang et al., Lipids 34, 1999: 649-659). В WO 96/13591 описывается и заявляется Δ6-пальмитойл-АСР-десатураза. Биохимическая характеристика различных десатураз до сих пор была недостаточной, т.к. ферменты в качестве мембранносвязанных протеинов, очень тяжело изолировать и характеризовать. (Мак Кеон и др., - Методз ин энзимол. 71, 1981: 12141-12147 (McKeon et al., Methods in Enzymol. 71, 1981: 12141-12147), Ванг и др.. Плант Физиол. Биокем., 26, 1988: 777-792 (Wang et al., Plant Physiol. Biochem., 26, 1988: 777-792)).
В патенте WO 97/37033 описывается Δ12-ацетиленаза. С помощью этого фермента можно изготовить ненасыщенные жирные цис-кислоты с тройной связью. Такие жирные кислоты кроме применения в продуктах питания ввиду их реактивности могут применяться также при производстве полимеров. Шперлинг и др. сообщали на съезде Саус Лэйк Тахо, Канада, Июнь 9-13, 1999 (Sperling et al., South Lake Tahoe, Canada, June 9-13, 1999) о клонировании фермента, который также производит тройные связи в жирных кислотах. При этом субстраты этого фермента отличаются от субстратов Δ12-ацетиленазы, а тройные связи вводятся ферментом в жирных кислотах на других позициях.
В дрожжах прослеживается, как смещение спектра жирных кислот к ненасыщенным жирным кислотам, так и повышение производительности (см. Хуан и др., Липидз 34, 1999: 649-659 (Huang et al., Lipids 34, 1999: 649-659), Напьер и др., Биокем. Ж., Том 330, 1998: 611-614 (Napier et al, Biochem. J. Vol. 330, 1998: 611-614)). Однако экспрессия различных десатураз в трансгенных растениях не привела к желаемому успеху. Хотя показана возможность смещения спектра жирных кислот к ненасыщенным жирным кислотам, одновременно оказывается, что производительность синтеза трансгенных растений сильно уменьшается, что означает уменьшение получения масла из исходных растений.
Поэтому, как и прежде, существует большая потребность в новых генах, которые кодируют ферменты, участвующие в биосинтезе ненасыщенных жирных кислот, и дают возможность производить их в техническом масштабе.
Поэтому возникла задача по разработке новых ферментов для синтеза ненасыщенных сопряженных жирных кислот. Эта задача решалось с помощью изолированной последовательности нуклеиновых кислот, которая кодирует полипептид с активностью Δ6-ацетиленазы и/или Δ6-десатуразы, выбранной из группы:
a) последовательности нуклеиновых кислот из SEQ ID NO:1, SEQ ID NO:3 или SEQ ID NO:11,
b) последовательностей нуклеиновых кислот, которые получаются как результат дегенерированного генетического кода из приведенных в SEQ ID NO:1, SEQ ID NO:3 или SEQ ID NO:11 последовательностей нуклеиновых кислот,
c) производных последовательностей нуклеиновых кислот, приведенных в SEQ ID NO:1, SEQ ID NO:3 или SEQ ID NO:11, которые кодируют полипептиды с последовательностью нуклеиновых кислот, представленной в SEQ ID NO:2, и обнаруживают, по меньшей мере, 75% гомологии на аминокислотном уровне, без существенного уменьшения действия полипептидов.
Под производной (производными) следует понимать, например, функциональные гомологи кодированных последовательностями SEQ ID NO:1, SEQ ID NO:3 или SEQ ID NO:11 ферментов или их ферментационную активность, это значит ферменты, которые катализируют те же ферментативные реакции, что и ферменты, кодированные последовательностями SEQ ID NO:1, SEQ ID NO:3 или SEQ ID NO:11.
Эти гены содействуют также выгодному получению ненасыщенных жирных кислот с тройными и/или двойными связями в Δ6-позиции. Под ненасыщенными жирными кислотами в дальнейшем следует понимать моно или полиненасыщенные жирные кислоты, обнаруживающие тройные и/или двойные связи. Тройные и/или двойные связи могут быть сопряженньми или не сопряженными. Приведенные в SEQ ID NO:1, SEQ ID NO:3 или SEQ ID NO:11 последовательности кодируют новые ферменты, которые обнаруживают активность ацетиленазы и/или Δ6-десатуразы.
Заявляемый фермент Δ6-ацетиленаза/Δ6-десатураза выгодно вводит в остатки жирных кислот глицеролипидов цис-двойную связь в позиции С6-С7 и/или конвертирует уже имеющуюся цис-двойную связь в позиции С6-С7 в тройную связь (см. SEQ ID NO:1 или SEQ ID NO:3). Фермент имеет, кроме того, активность Δ6-десатуразы, которая выгодно вводит в остатки жирных кислот глицеролипидов исключительно цис-двойную связь в позиции С6-С7. Эту активность имеет также фермент с последовательностью, упомянутой в SEQ ID NO:11. При этом речь идет о монофункциональной Δ6-десатуразе.
Заявляемая(ые) последовательность(ти) нуклеиновых кислот (для заявки единственное число должно охватывать множественное число и наоборот) или их фрагменты могут выгодно использоваться для выделения дальнейших геномных последовательностей путем гомологического скрининга.
Упомянутые производные можно выделять, к примеру, из других организмов с помощью эукариотических организмов, таких как растения, специальные мхи, Dinoflagellaten или грибы.
В дальнейшем под производными и, соответственно, функциональными производными последовательностей, приведенных в SEQ ID NO:1, SEQ ID NO:3 или SEQ ID NO:11, следует понимать, к примеру, варианты аллелей, которые обнаруживают, как минимум, 70% гомологию на отведенном аминокислотном уровне, преимущественно, по меньшей мере, 75% гомологию, предпочтительно, по меньшей мере, 80% гомологию, особенно предпочтительно, по меньшей мере, 85% гомологию, исключительно предпочтительно 90% гомологию. Гомология рассчитывается по всей области аминокислот. Применяется программа ПайлАп, БЭСТФИТ. ГЭП, ТРАНСЛЭЙТ (PileUp, BESTFIT. GAP, TRANSLATE) и, соответственно, БЭКТРАНСЛЭЙТ (BACKTRANSLATE) (составная часть программного пакета UWGCG. Висконсин Пэкедж, Версия 10.0-Юникс, Январь 1999, Дженэтикс Компьютер Груп Инк. (UWGCG. Wisconsin Package, Version 10.0-UNIX, January 1999, Genetics Computer Group, Inc.), Дэверакс и др., Ньюклеис. Эйсид. Рез., 12. 1984: 387-395 (Deverux et al., Nucleic. Acid Res., 12, 1984: 387-395)) используют (Ж. Мол. Эволюшн., 25. 351-360. 1987, Хиггинс и др., КАБИОС, 5 1989: 151-153 (J. Mol. Evolution., 25. 351-360. 1987, Higgins et al., CABIOS, 5 1989: 151-153)), Производные от упомянутых нуклеиновых кислот последовательности аминокислот следует брать из последовательностей SEQ ID NO:2, SEQ ID NO:4 и SEQ ID NO:12. Под гомологией нужно понимать идентичность, что означает: последовательности аминокислот идентичны, по меньшей мере, на 70%. Заявляемые последовательности являются на плоскости аминокислот, по меньшей мере, на 65% гомологичными, предпочтительно на 70%, особенно предпочтительно на 75%, исключительно предпочтительно, как минимум, на 80%.
Варианты аллелей охватывают, в частности, функциональные варианты, которые получены путем удаления, вставки или замещения нуклеотидов из последовательностей, представленных в SEQ ID NO:1, SEQ ID NO:3 или SEQ ID NO:11, причем ферментативная активность производных синтезированных протеинов сохраняется.
Такие последовательности ДНК можно выделять, исходя из описанных в SEQ ID NO:1, SEQ ID NO:3 или SEQ ID NO:11 последовательностей ДНК или части этих последовательностей, к примеру с помощью обыкновенного способа гибридизации или ПЦР-техники (техники полимеразной цепной реакции) из других эукариотов, как, например, упомянуто выше. Эти ДНК-последовательности гибридизируют при стандартных условиях упомянутые последовательности. Для гибридизации применяются преимущественно короткие олигонуклеотиды, к примеру, законсервированных областей, которые могут определяться путем сравнения с другими генами ацетиленазы и/или десатуразы известным специалисту способом. Преимущественно используются последовательности из гистидинового бокса. Для гибридизации могут использоваться также более длинные фрагменты заявляемых нуклеиновых кислот или полные последовательности. Эти стандартные условия варьируют в зависимости от использованной нуклеиновой кислоты: олигонуклеотид, более длинный фрагмент или полная последовательность или, в зависимости от того, какой вид нуклеиновой кислоты - ДНК или РНК используется для гибридизации. Таким образом, к примеру, температуры плавления для ДНК: ДНК-гибридов лежат примерно на 10°С ниже, чем для ДНК: РНК-гибридов равной длины.
Под стандартными условиями нужно понимать в зависимости от нуклеиновой кислоты температуры между 42 и 58°С в водном растворе буфера с концентрацией 0,1-5 х SSC (1 X SSC = 0,15 M NaCl, 15 мМ цитрата натрия, рН 7,2) или дополнительно в присутствии 50% формамида, как, к примеру, 42°С в 5 х SSC, 50% формамиде. Преимущественно условия гибридизации для ДНК: ДНК-гибридов лежат при 0,1 х SSC и температурах между 20 и 40°С, предпочтительно между 30 и 40°С. Для ДНК: РНК-гибридов условия гибридизации преимущественно лежат при 0,1 х SSC и температурах между 30 и 50°С, предпочтительно между 40 и 50°С. Эти указанные температуры для гибридизации примерно равны рассчитанным значениям температуры плавления для нуклеиновой кислоты с длиной примерно от 100 нуклеотидов и содержанием G+C, равным 50% в отсутствие формамида. Экспериментальные условия ДНК-гибридизации приводятся в специальных учебниках генетики, как, например, в Сэмбрук и др., "Молекьюла Клонин", Колд Спринг Харбор Лэборатори, 1989 (Sambrook et al., "Molecular Cloning", Cold Spring Harbor Laboratory, 1989) и могут рассчитываться специалистом по известным формулам, например, в зависимости от длины нуклеиновых кислот, вида гибридов или содержания G+C. Специалист может получить дальнейшие сведения о гибридизации из следующих учебников: Аусабель и др. (изд), 1985, Карэнт Протокас ин Молекула Байолоджи, Джон Вайли энд Санз, Нью Йорк (Ausubel et al. (eds), 1985, Current Protocols in Molecular Biology, John Wiley & Sons, New York); Харнс энд Хиггинс (изд), 1985, Ньюклеис. Эйсид Гибридизэйшн: Э Прэктикал Эпроуч, АйЭрЭл Пресс от Оксфорд Юниверсити Пресс, Оксфорд (Harnes and Higgins (eds), 1985, Nucleic Acids Hybridization: A Practical Approach, IRL Press at Oxford University Press, Oxford); Браун (изд), 1991, Эссеншал Молекула Байолоджи: Э Прэктикал Эпроуч, АйЭрЭл Пресс от Оксфорд Юниверсити Пресс, Оксфорд Brown (ed), 1991, Essential Molecular Biology: A Practical Approach, IRL Press at Oxford University Press, Oxford).
В дальнейшем под производными следует понимать гомологи последовательности SEQ ID NO:1, SEQ ID NO:3 или SEQ ID NO:11, к примеру, эукариотические гомологи, сокращенные последовательности, одноцепочечную-ДНК кодирующей и некодирующей последовательности ДНК или РНК кодирующей и некодирующей последовательности ДНК.
Кроме того, под гомологами последовательностей SEQ ID NO:1, SEQ ID NO:3 или SEQ ID NO:11 следует понимать производные, например, варианты промоторов. Эти варианты могут быть изменены одним или несколькими обменами нуклеотидов, вставкой(ами) и/или удалением(ями), но без уменьшения функциональности и, соответственно, эффективности промоторов. В дальнейшем промоторы могут повышать эффективность вследствие изменения последовательности или полностью заменяться более действенными промоторами, в том числе, организмов другого вида.
Под производными следует также понимать преимущественные варианты, последовательность нуклеотидов которых в области от -1 до -2000 перед стартовым кодоном изменялись так, что экспрессия гена и/или протеина изменяется, предпочтительно повышается.
Дальше под производными нужно понимать также варианты, которые были изменены на конце 3'.
Под производными нужно понимать также антисмысловые-ДНК, которые могут использоваться для торможения биосинтеза заявляемых протеинов. Эти антисмысловые-ДНК принадлежат к заявляемым нефункциональным производным, как производные, которые не обнаруживают никакой ферментативной активности. Дальнейшие известные специалисту методы изготовления нефункциональных производных - так называемая, косупрессия, применение рибозимов и интронов. Рибозимы являются каталитическими РНК-молекулами с рибонуклеазной активностью, которые могут разрезать одноцепочечные нуклеиновые кислоты, как мРНК, к которой они обнаруживают дополнительность. Вследствие этого с помощью этих рибозимов (Хазельхофф энд Герлах, Нэйча, 334, 1988: 585-591 (Haselhoff and Gerlach, Nature, 334, 1988: 585-591)) могут каталитически расщепляться транскрипты мРНК и таким образом тормозить трансляцию этих мРНК. Подобные рибозимы могут специально перекраиваться для их задач (US 4,987,071; US 5.116.742 и Бэртель и др., Сайенс 261, 1993: 1411-1418 (Bartel et al., Science 261, 1993: 1411-1418)). С помощью антисмысловых ДНК вследствие этого могут производиться жирные кислоты, липиды или масла с повышенной долей насыщенных жирных кислот.
Заявляемые последовательности нуклеиновых кислот, которые кодируют Δ6-ацетиленазу/Δ6-десатуразу и/или Δ6-десатуразу, могут быть произведены синтетически или добыты природным путем или содержать смесь из синтетических и естественных составных частей, а также состоять из различных гетерологических участков гена Δ6-ацетиленазы/Δ6-десатуразы и/или Δ6-десатуразы различных организмов. В общем, производятся синтетические последовательности нуклеотидов с кодонами, которые предпочитаются от соответствующего организма хозяина, к примеру, растения. Это приводит, как правило, к оптимальной экспрессии гетерологических генов. Эти предпочитаемые от растений кодоны могут определяться из кодонов с высшей частотой протеина, которые экспримируются в большинство интересных видов растений. Пример для Corynebacterium glutamicum дан в: Уада и др., (1992) Нуклеис. Рес., 20:2111-2118 (Wada et al. (1992) Nudele Acids Res. 20:2111-2118).
Такие эксперименты выполняются с помощью стандартных методов и известны специалисту в данной области. Функционально эквивалентные последовательности, которые кодируют ген Δ6-ацетиленазы/Δ6-десатуразы и/или Δ6-десатуразы, являются такими производными заявляемых последовательностей, которые, несмотря на отклоняющуюся последовательность нуклеотидов, еще обладают желаемыми функциями, т.е. владеют ферментативной активностью протеинов. Функциональные эквиваленты охватывают, таким образом, варианты природного происхождения описанных здесь последовательностей, а также искусственные, например, полученные путем химического синтеза, приспособленные к употреблению кодона растением искусственные последовательности нуклеотидов.
Кроме того, искусственные последовательности ДНК пригодны до тех пор, пока они, как описано выше, передают желаемое качество культурным растениям, к примеру, повышение содержания тройных или двойных Δ6-связей в жирных кислотах, маслах или липидах в растениях путем сверхэкспрессии генов Δ6-ацетиленазы/Δ6-десатуразы и/или Δ6-десатуразы. Такие искусственные последовательности ДНК могут определяться, например, путем обратного перевода посредством молекулярного моделирования сконструированных протеинов, которые проявляют активность Δ6-ацетиленазы/Δ6-десатуразы и/или Δ6-десатуразы, или путем селекции in vitro. Существующие технические возможности эволюции ДНК in vitro по изменению и, соответственно, улучшению последовательностей ДНК описаны Паттен Пи. Эй. и др.. Каррент Опиньон ин Байотехнолоджи 8, 724-733 (1997) (Patten, P.A. et al.. Current Opinion in Biotechnology 8, 724-733 (1997)) или в Мур Дж. Си и др., Джорнал оф Молекула Байолоджи 272, 35 336-347 (1997) (Moore, J.C. et al.. Journal of Molecular Biology 272, 35 336-347 (1997)). Особенно предпочтительны кодирующие последовательности ДНК, которые получаются обратным переводом последовательности полипептидов согласно специфическому для растения хозяина использованию кодона. Специфическое использование кодона с помощью растительно-генетических методов может легко установить опытный специалист, пользуясь компьютерными оценками других известных генов трансформируемого растения.
В качестве дальнейших подходящих эквивалентов последовательностей нуклеиновых кислот следует называть последовательности, которые кодируют протеины слияния, причем составной частью протеина слияния является полипептид Δ6-ацетиленазы/Δ6-десатуразы и/или Δ6-десатуразы или функционально эквивалентная часть этого. Вторая часть протеина слияния может быть, например, другим полипептидом с ферментативной активностью, или антигенной полипептидной последовательностью, с помощью которой возможно подтверждение экспрессии Δ6-ацетиленазы/Δ6-десатуразы и/или Δ6-десатуразы (например, myc-tag или his-tag). Предпочтительно речь идет при этом, тем не менее, о регулирующих последовательностях протеина, как, например, сигнальной последовательности для ER, которая руководит протеином Δ6-ацетиленазы/Δ6-десатуразы и/или Δ6-десатуразы в желаемом месте действия.
В заявляемом процессе гены Δ6-ацетиленазы/Δ6-десатуразы и, соответственно, Δ6-десатуразы с преимуществом могут комбинироваться с другими генами биосинтеза жирных кислот. Примерами подобных генов являются ацетилтрансферазы, другие десатуразы или элонгазы. Для синтеза in vivo и специально in vitro преимущественной является комбинация с, например, НАДФ-цитохром В 5 редуктазами, которые могут принимать или отдавать эквиваленты сокращения.
Под заявляемой последовательностью аминокислот нужно понимать протеины, которые содержат последовательности аминокислот, представленные в последовательностях SEQ ID NO:2, SEQ ID NO:4 или SEQ ID NO:12, или последовательность, полученную из них путем замещения, инверсии, вставки или удаления одного или нескольких остатков аминокислот, причем ферментативная активность представленных в SEQ ID NO:2, SEQ ID NO:4 или SEQ ID NO:12 протеинов сохраняется, соответственно, сокращается несущественно. Под несущественностью сокращения понимаются все ферменты, которые еще обнаруживают, по меньшей мере, 10%, предпочтительно 20%, особенно предпочтительно 30% ферментативной активности исходного фермента. При этом определенные аминокислоты могут заменяться похожими по физико-химическим свойствам (пространственная структура, основность, гидрофобность и т.д.). К примеру, аргининовые остатки обмениваются на лизиновые остатки, валиновые остатки - на изолеуциновые остатки или остатки аспрагиновой кислоты - на остатки глютаминовой. Одна или несколько аминокислот могут в порядке их следования меняться, дополняться или удаляться, или несколько из этих операций могут комбинироваться друг с другом.
Под производными нужно понимать также функциональные эквиваленты, которые, в частности, охватывают естественные или искусственные мутации первоначально изолированной кодирующей Δ6-ацетиленазу/Δ6-десатуразу и/или Δ6-десатуразу последовательности, которая в дальнейшем обнаруживает желаемую функцию, что означает незначительное сокращение ферментативной активности. Мутации охватывают замещения, сложения, удаления, обмены или вставки одного или нескольких остатков нуклеотидов. Таким образом, данным изобретением охватываются, к примеру, также такие последовательности нуклеотидов, которые получены вследствие модификации последовательности нуклеотидов Δ6-ацетиленазы/Δ6-десатуразы и/или Δ6-десатуразы. Целью такой модификации может быть, например, дальнейшее ограничение содержащейся в ней кодирующей последовательности или, например, также вставка дальнейших стыков рестрикционных центров.
Функциональные эквиваленты - это также такие варианты, функция которых, по сравнению с исходным геном и соответственно фрагментом гена, ослаблена (= не значительно сокращена) или усилена (= активность фермента более сильна, чем активность исходного фермента, это значит активность выше, чем 100%, предпочтительно выше, чем 110%, особенно предпочтительно выше, чем 130%).
Последовательность нуклеиновых кислот может при этом быть, например, преимущественно последовательностью ДНК- или кДНК. Подходящие кодирующие последовательности для вставки в заявляемую экспрессионную кассету - это такие, которые кодируют вышеописанными последовательностями Δ6-ацетиленазу/Δ6-десатуразу и/или Δ6-десатуразу и дают хозяину способность производить жирные кислоты, масла или липиды с тройными и/или двойными связями в позиции Δ6. Эти последовательности могут быть гомологического или гетерологического происхождения.
Под заявляемой экспрессионной кассетой (= конструкт или фрагмент нуклеиновой кислоты) следует понимать последовательности, упомянутые в SEQ ID NO:1, SEQ ID NO:3 или SEQ ID NO:11, которые получены как результат генетического кода и/или его функциональных или нефункциональных производных, которые функционально были связаны с одним или несколькими сигналами регулирования, преимущественно, для повышения экспрессии гена и которые управляют экспрессией кодирующей последовательности в клетке хозяина. Эти регулирующие последовательности должны содействовать целенаправленной экспрессии генов и протеина. Это может значить, к примеру, в зависимости от организма хозяина, что ген экспримируется и/или переэкспримируется только после индукции, или что он сразу экспримируется и/или переэкспримируется. К примеру, в случае этих регулирующих последовательностей речь идет о последовательностях, которые связывают индукторы и репрессоры и таким образом регулируют экспрессию нуклеиновой кислоты. Дополнительно к этим новым регулирующим последовательностям или вместо этих последовательностей может дополнительно присутствовать естественное регулирование этих последовательностей собственными генами структуры и при необходимости быть изменено генетически, так что естественное регулирование исключается и повышается экспрессия генов. Генный конструкт может быть построен также проще, это значит, что не давались никакие дополнительные сигналы регулирования для последовательности нуклеиновых кислот или их производных, а природный промотор с его регулированием не удалялся. Вместо этого природная регулирующая последовательность мутирует так, что никакое регулирование больше не происходит и/или экспрессия гена повышается. Эти измененные промоторы могут вводиться в форме частичных последовательностей (= промотор с частями заявляемой последовательности нуклеиновых кислот), а также только перед природным геном для повышения активности. Генный конструкт может, кроме того, также содержать преимущественно также одну или несколько так называемые "усилительные последовательности", функционально связанные с промотором, которые повышают экспрессию последовательности нуклеиновых кислот. Также на 3'-конце последовательности ДНК могут даваться вставки дополнительных дающих преимущества последовательностей, таких как дальнейшие регулирующие элементы или терминаторы. Гены Δ6-ацетиленазы/Δ6-десатуразы и/или Δ6-десатуразы могут содержаться в экспрессионной кассете (= генном конструкте) в одной или нескольких копиях.
Регулирующие последовательности и, соответственно, факторы могут при этом, как описано выше, положительно влиять на экспрессию введенных генов и вследствие этого повышать ее. Таким образом, усиление регулирующих элементов с преимуществами происходят на плоскости транскрипции, причем используются сильные сигналы транскрипции, как промоторы и/или "усилитель". Наряду с этим возможно также усиление трансляции, причем, к примеру, стабильность мРНК улучшается.
В качестве промоторов в экспрессионной кассете принципиально годны все промоторы, которые могут управлять экспрессией чужих генов в организмах, преимущественно в растениях или грибах. Предпочтительно используют, в частности, растительные промоторы или промоторы, которые происходят из вируса растений. Дающие преимущество последовательности регулирования для заявляемого способа содержатся, к примеру, в таких промоторах, как cos-, tac-, trp-, tet-, trp-tet-, lpp-, lac-, lpplac-, lacIq-' T7-, T5-, T3-, gal-, trc-, ara-, SP6-, λ-PR- или λ-PL-промотор, которые находят применение преимущественно в грам-отрицательных бактериях. Следующие дающие преимущество последовательности регулирования содержатся, например, в грам-положительных промоторах amy и SP02, в дрожжевых или грибных промоторах ADC1, MFα, AC, Р-60, CYC1, GAPDH, TEF, rp28, ADH или в растительных промоторах, как CaMV/35S (Фрэнк и др., Селл 21 (1980) 285-294 (Franck et al. Cell 21(1980) 285-294)), SSU, OCS, lib4, STLS1, B33, nos (= промотор нопалин синтазы) или в убиквитиновом промоторе. Экспрессионная кассета может содержать также химически индуцируемый промотор, которым может управляться экспрессия экзогенного гена Δ6-ацетиленазы/Δ6-десатуразы и/или Δ6-десатуразы в организмах, преимущественно в растениях, в определенный момент времени. Подобными дающими преимущество растительными промоторами являются к примеру deer PRPL промотор (Вард и др., Плант. Мол. Биол. 22 (1993), 361-3663 (Ward et al., Plant.Mol. Biol.22(1993). 361-3663)), индуцируемый бензенсульфонамидный (ЕР 388186), индуцируемый тетрациклиновый (Гатц и др., (1992) Плант Ж. 2397-404 (Gatz et al., (1992) Plant J. 2,397-404)), индуцируемый промотор салициловой кислоты (WO 95/19443), индуцируемый промотор абсцизиновой кислоты (ЕР335528) и, соответственно, этанол- или цикло-гексаноновый индуцируемый (WO93/21334) промотор. Следующими растительньми промоторами являются, к примеру, промотор цитозолической FBPase из картофеля, ST-LSI промотор из картофеля (Стокхауз и др., ЭМБО Ж.. 8 (1989) 2445-245 (Stockhaus et al., EMBO J. 8 (1989) 2445-245)), промотор фосфорибосилпирофосфат амидотрансферазы из глицина макс. (см. также банк гена Акцессион номер U87999) или нодиенспецифический промотор, как в ЕР 249676, которые могут с преимуществом считаться родственньми. Преимущественными являются, в частности, такие растительные промоторы, которые обеспечивают экспрессию в тканях или в растительных частях/органах, в которых происходит биосинтез жирных кислот и, соответственно, его первые ступени, например, в эндосперме, или в развивающемся эмбрионе. В частности, следует назвать дающие преимущество промоторы, которые гарантируют специфическую семенную экспрессию, как, к примеру, USP-промотор или его производные, LЕВ4-промотор, фазеолиновый промотор или напиновый промотор. Особенно преимущественный USP-промотор или его производные способствуют в развитии семени очень ранней экспрессии гена (Баеумлайн и др., Мол. Ген. Генет., 1991, 225 (3): 459-67 (Baeumlein et al., Mol Gen Genet, 1991, 225 (3): 459-67)). Следующими имеющими преимущество семенноспецифическими промоторами, которые могут использоваться для однодольных и двудольных растений, являются предназначенные для двудольных промоторы, такие как напинген-промотор из рапса (US 5, 608,152), олеосин-промотор из Arabidopsis (WO98/45461), фазеолин-промотор из Phaseolus vulgaris (US 5,504,200), Все4-промотор из Brassica (WO91/13980) или легуминоза В4-промотор (LeB4, Баеумлайн и др., Плант Ж.. 2,2, 1992: 233-239 (LeB4, Baeumlein et al.. Plant J.. 2, 2, 1992: 233 - 239)), или предназначенные для однодольных промоторы, как lpt2- или ipt1-генов из ячменя (WO95/15389 и WO95/23230) или промоторы ячменного хордеин-гена, рисового глютелин-гена, рисового оризин-гена, рисового проламин-гена, пшеничного глиадин-гена, пшеничного глютелин-гена, кукурузного зеин-гена, овсяного глютелин-гена, казирин-гена из сорго или ржаного секалин-гена, которые описываются в WO99/16890.
Далее предпочтительны, в частности, такие промоторы, которые обеспечивают экспрессию в тканях или частях растений, в которых, например, происходит биосинтез жирных кислот, масел и липидов и, соответственно, его первые ступени. В частности, следует назвать промоторы, которые гарантируют семенноспецифическую экспрессию. Следует назвать промотор напин-гена из рапса (US 5,608,152), USP-промотор из Vicia faba (USP=неизвестный семенной протеин), (Баеумлайн и др.. Мол. Ген. Генет., 1991, 225 (З): 45 459-67 (Baeumlein et al., Mol Gen Genet, 1991, 225 (3): 459-67)), олеосин-ген из Arabidopsis (WO98/45461), фазеолиновые-промоторы (US 5,504,200) или промотор легумин В4-гена (LeB4, Баеумлайн и др., 1992, Плант Джорнел, 2 (2): 233-9 (LeB4; Baeumlein et al., 1992, Plant Journal, 2 (2): 233-9)). Дальше нужно назвать промоторы, как lpt2 или ipt1-ген из ячменя (WO95/15389 и WO95/23230), которые способствуют семенноспецифической экспрессии в однодольных растениях.
В экспрессионной кассете (= генный конструкт, конструкт нуклеиновой кислоты) могут, как описано выше, содержаться дальнейшие гены, которые должны вноситься в организмы. Эти гены могут располагаться при раздельном регулировании или под тем же регионом регулирования как гены Δ6-ацетиленазы/Δ6-десатуразы и/или Δ6-десатуразы. При этих генах речь идет, к примеру, о дальнейших генах биосинтеза, преимущественно биосинтеза жирных кислот, которые содействуют повышенному синтезу. К примеру, следовало бы назвать гены Δ15-, Δ12-, Δ9-, Δ6, Δ5-десатуразы, различных гидроксилаз Δ12-ацетиленазы, ацил-АСР-тиоэстеразы, β-кетоацил-АСР-синтазы или β-кетоацил-АСР-редуктазы. С преимуществом используются гены десатуразы в конструкте нуклеиновой кислоты.
Принципиально могут использоваться все естественные промоторы с их последовательностями регулирования, как те, что упомянуты выше, для заявляемой экспрессионной кассеты и заявляемого способа, как описано ниже. Исходя из этого, с преимуществом могут использоваться также синтетические промоторы.
При подготовке экспрессионной кассеты могут комбинироваться различные фрагменты ДНК, чтобы получить последовательность нуклеотидов, которая читает более целесообразно в правильном направлении и которая оснащена правильным растром чтения. Для связи фрагментов ДНК (= заявляемые нуклеиновые кислоты) друг с другом во фрагменты могут встраиваться адаптеры или линкеры.
Для целесообразности промотор- и терминатор-регионы могут снабжаться в направлении транскрипции линкером или полилинкером, который содержит одно или несколько мест рестрикции для вставки этой последовательности. Как правило, линкер имеет от 1 до 10, большей частью от 1 до 8, преимущественно от 2 до 6 мест рестрикции. В общем, линкер имеет в пределах регулирующих областей величину меньше, чем 100 bp, часто меньше, чем 60 bp, по меньшей мере, 5 bp. Промотор может быть как нативным, соответственно гомологичным, так и чужеродным и, соответственно, гетерологичным к организму хозяина, например, к растению хозяину. Экспрессионная кассета содержит в 5'-3'-направлении транскрипции промотор, последовательность ДНК, которая кодирует ген Δ6-ацетиленазы/Δ6-десатуразы и/или Δ6-десатуразы, и регион для транскрипциональной терминации. Различные области терминации взаимозаменяемы по отношению друг к другу как угодно.
В дальнейшем могут применяться манипуляции, которые готовят подходящие рестрикционные стыки или удаляют излишние ДНК или рестрикционные стыки. Где принимаются в расчет вставки, удаления или замещения как, например, переходы и трансверсии, могут использоваться in vitro: мутагенезы, репарация праймера, рестрикция или лигирование. При подходящей манипуляции, как, например, рестрикции, -чевинг-бэк- (-chewing-back- - операция, согласно которой рестрикционный фермент сам распознает ошибку при расщеплении нити, исправляет ошибку, после чего начинает работать в правильном месте) или наполнения выступов - тупыми концами-, для лигирования в распоряжение могут представляться концы дополнительных фрагментов.
Для имеющей преимущества высокой экспрессии среди прочего может иметь значение приложения специфического сигнала ER- ретенции SEKDEL (Шоутен А. и др., Плант Мол. Биол. 30 (1996), 781-792 (Schonten, A. et al., Plant Mol. Biol. 30 (1996), 781-792)), средний уровень экспрессии будет вместе с тем утроен - учетверен. Для сооружения кассеты могут применяться также другие сигналы удержания (ретенции), которые природным образом происходят при локализации в ER растительных и животных протеинах.
Предпочтительные сигналы полиаденилирования - растительные, преимущественно такие, которые соответствуют в существенной мере сигналам полиаденирования Т-ДНК из Agrobacterium tumefaciens, в частности, гена 3 Т-ДНК (Octopin Synthase) Ti-плазмида pTiACHS (Гайлен и др., ЭМБО Ж..3 (1984), 835 и на следующих страницах (Gielen et al., EMBO J.3 (1984), 835 ff)), или соответствующие функциональные эквиваленты.
Изготовление экспрессионной кассеты происходит слиянием подходящего промотора с подходящей последовательностью ДНК Δ6-ацетиленазы/Δ6-десатуразы и/или Δ6-десатуразы, а также с сигналом полиаденилирования согласно употребительной технике рекомбинации и клонирования, как, например, описывается в Т. Маньятис, Е.Ф. Фритш и Дж. Самбрук, Молекула Клонинг: Э Лаборатори Мэньюал, Колд Спринг Харбор Лаборатори, Колд Спринг Харбор, Нью Йорк (1989) (Т. Maniatis, Е.F. Fritsch und J. Sambrook, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY (1989)), также в Т.Ж. Сильхэви, М.Л. Берман и Л.В. Энкуист. Икспириментс уиз Джини Фьюжнс, Колд Спринг Харбор Лаборатори, Колд Спринг Харбор, Нью Йорк (1984) (T.J. Silhavy, M.L. Berman und L.W. Enquist. Experiments with Gene Fusions, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY (1984)) и в Аусабель Ф.М. и др., Карент протоколз ин Молекула Байолоджи, Грини Паблишинг Ассос. Энд Уайли-Интерсайнс (1987) (Ausubel, F.M. et al., Current Protocols in Molecular Biology, Greene Publishing Assoc. and Wiley-Interscience (1987)).
При подготовке экспрессионной кассеты могут комбинироваться различные фрагменты ДНК, чтобы получить последовательность нуклеотидов, которая читает целесообразным способом в правильном направлении и которая оснащена правильным растром считывания. Для связывания фрагментов ДНК друг с другом на них могут устанавливаться адаптеры или линкеры.
Целесообразным способом регионы промотора и терминатора могут снабжаться в направлении транскрипции линкером или полилинкером, который содержит одно или несколько мест рестрикции для вставки этой последовательности. Как правило, линкер имеет от 1 до 10, большей частью от 1 до 8, преимущественно от 2 до 6 мест рестрикции. В общем, в пределах регулирующих областей линкер имеет величину, меньше чем 100 bp, часто меньше чем 60 bp, по меньшей мере, тем не менее 5 bp. Промотор может быть как нативным, соответственно, гомологичным, так и чужим, соответственно, гетерологичным к растению хозяину. Экспрессионная кассета содержит в 5'-3'-направлении транкскрипции промотор, последовательность ДНК, которая кодирует ген D6-ацетиленазы/десатуразы и региона для транскрипциональной терминации. Различные области терминации как угодно взаимозаменяемы.
При подготовке экспрессионной кассеты различные фрагменты ДНК могут комбинироваться, чтобы получать последовательность нуклеотидов, которая читает целесообразньм способом в правильном направлении и которая оснащена правильным растром чтения. Для связи фрагментов ДНК друг с другом в них могут устанавливаться адаптеры или линкеры.
Целесообразным способом регионы промотора и терминатора могут снабжаться в направлении транскрипции линкером или полилинкером, который содержит одно или несколько мест рестрикции для вставки этой последовательности. Как правило, линкер имеет от 1 до 10, большей частью от 1 до 8, преимущественно от 2 до 6 мест рестрикции. В общем, в пределах регулирующих областей линкер имеет величину, меньше чем 100 bp, часто меньше чем 60 bp, по меньшей мере, тем не менее 5 bp. Промотор может быть как нативньм, соответственно, гомологичным, так и чужим, соответственно, гетерологичным к растению хозяину. Экспрессионная кассета содержит в 5'-3'-направлении транкскрипции промотор, последовательность ДНК, которая кодирует ген Δ6-ацетиленазы/Δ6-десатуразы или Δ6-десатуразы и региона для транскрипциональной терминации. Различные области терминации как угодно взаимозаменяемы.
Последовательность ДНК, кодирующая Δ6-ацетиленазу/Δ6-десатуразу и/или Δ6-десатуразы из Ceratodn purpureus содержит все признаки последовательности, которые необходимы, чтобы правильно локализовать место биосинтеза жиров кислот, липидов или масла. Поэтому нет непосредственной необходимости в целевых последовательностях. Разумеется, такая локализация может быть желательной и выгодной и поэтому может искусственно изменяться или усиливаться, так что такой конструкт слияния также является предпочтительной дающей преимущество формой выполнения изобретения.
В частности, предпочитаемы последовательности, которые гарантируют включение плазмиды. При определенных обстоятельствах может быть желательным также включение в другие компартименты (реферировано: Кермоде, Крит. Рев. Плант Сайенс 15, 4 (в 1996), 285-423 (Kermode, Crit. Rev. Plant Sei. 15, 4 (1996), 285-423)), например, в вакуоль, в митохондрию, в эндоплазматический ретикулюм (ER), пероксизомы, липидные тела или при отсутствии соответствующих оперативных последовательностей оставление в компартименте возникновения - цитозоле.
С преимуществом заявляемые последовательности нуклеиновой кислоты клонируются, по меньшей мере, одним репортерным геном в экспрессионную кассету, которая вносится в организм с помощью вектора или непосредственно в геном. Этот репортерный ген должен был обеспечивать легкую детектируемость по измерениям роста, флуоресценции, хемо- и биолюминесценции или резистентности, или по фотометрическому измерению. Например, в качестве репортерных генов следовало бы назвать резистентные гены антибиотиков или гербицидов, гены гидролазы, флуоресцентные гены протеина, гены биолюминесценции, сахарные или нуклеотидные гены обмена веществ или гены биосинтеза, как Ura3-ген, Ilv2-ген, ген люциферазы, ген β-галактосидазы, gfp-ген, ген 2-дезоксиглюкозы-6-фосфат-фосфатазы, ген β-глюкоронидазы, ген β-лактамазы, ген неомицинфосфотрансферазы, ген гидромицинфосфотрансферазы или ген BASTA (= глюфозинатная резистенция). Эти гены содействуют в легкой измеряемости и квантифицируемости транскрипционной активности и, вместе с тем, экспрессии генов. Вместе с тем, можно идентифицировать места генома, которые обнаруживают различную продуктивность.
Согласно предпочтительной форме выполнения экспрессионная кассета охватывает по восходящему потоку, т.е. на конце 5', кодирующую последовательность, промотор и по нисходящену потоку, т.е. на конце 3', сигнал полиаденилирования и, при необходимости, дальнейшие регулирующие элементы, которые оперативно связаны с последовательностью, лежащей между ними, кодирующей последовательность ДНК Δ6-ацетиленазы/Δ6-десатуразы и/или Δ6-десатуразы. Под оперативной связью понимают последовательное расположение промотора, кодирующей последовательности, терминатора и, при необходимости, дальнейших регулирующих элементов так, что каждый из регулирующих элементов может исполнять свою функцию при экспрессии кодирующей последовательности. Предпочитаемые для оперативной связи последовательности являются целенаправленно внесенными последовательностями для гарантии субклеточной локализации в пластидах. Но целенаправленно внесенные последовательности также могут при необходимости применяться для гарантии субклеточной локализации в митохондрии, в эндоплазматическом ретикулюме (= ER), в ядрах клеток, в масляных тельцах или в других компартиментах, как и усилитель трансляции, как ведущая последовательность 5' из вируса табачной мозаики (Гэллай и др., Нукл. Эйсидс Рез. 15 (1987), 8693-8711 (Gallie et al., Nucl. Acids Res. 15 (1987), 8693-8711)).
Экспрессионная кассета может, например, содержать конститутивный промотор (предпочтительно USP- или напин-промотор), ген, который следует экспримировать и сигнал ER-ретенции. Как сигнал ER-ретенции предпочтительно используется последовательность аминокислот KDEL (лизин, аспарагиновая кислота, глютаминовая кислота, леуцин).
Экспрессионная кассета внедряется для экспрессии в прокариотическом или эукариотическом организме хозяина, например, в микроорганизме, в грибе или растении, преимущественно в векторе, таком как, к примеру, плазмид, фаг или прочие ДНК, который содействует оптимальной экспрессии генов в организме хозяина. Подходящие плазмиды содержатся, к примеру, в E.coli pLG338, pACYC184, pbr-серии как, например, PBR322, puc-серии, как pUC18 или pUC19, М113mр-серии, рКС30, pRep4, pHS1, PHS2, pPLc236, pMBL24, PLG200, pbR290, pIN-III113-B1, λgtll или pBdCI, в Streptomyces pIJlOl, PIJ364, pIJ702 или pIJ361, в Bacillus рВllО, рС194 или pBD214, в Corynebacterium pSA77 или pAJ667, в грибах pALS1, pIL2 или рВВ116, дальнейшие имеющие преимущество векторы гриба описаны в Романо М.А. и др., ((1992) "Форин джини икспрешн ин йист: э ревью", Йист 8: 423-488 (Romanes. M.A. et al., ((1992) "Foreign gene expression in yeast: a review". Yeast 8: 423-488)) и Ван ден Хондел, С.А.М.Дж.Дж. и др. ((1991) "Хетерологос джини икспрешн ин филаментоус фанджи (von van den Hondel, C.A.M.J.J. et al. [(1991) "Heterologous gene expression in filamentous fungi) также в Мо Джини Манипьюлэйшнз ин Фьюнджи (Дж.В. Бэннет энд Л. Л. Лэжэ, эдз.. стр.396-428: Академик пресс: Сан Диего (More Gene Manipulations in Fungi (J.W. Bennet & L. L. Lasure, eds., p.396-428: Academic Press: San Diego) и в "Джини трансфер Системз энд вектор дэвелопмент фор филаментоуз фанджи" (Ван ден Хондел, С.А.М.Дж.Дж. энд Пант, Пи.Дж. (1991) в: Эплайд Молекула Джэнетикс оф Фанджи, Пеберди, Дж.Ф. и др., эдз., стр.1-28, Кэмбридж юниверсити Пресс: Кэмбридж ("Gene transfer Systems and vector development for filamentous fungi" (van den Hondel, C.A.M.J.J. & Punt, P.J. (1991) in: Applied Molecular Genetics of Fungi, Peberdy, J.F. et al., eds., p.1-28, Cambridge university Press: Cambridge)). Дающими преимущество дрожжевыми промоторами являются, к примеру, 2μМ, PAG-1, YEP6, YEPL3 или pEMBLYe23. Примерами для промоторов из водорослей или растений являются PLGV23, pGHIac+, pBIN19, pAK2004, pVKH или pDH51 (см. Шмидт Р. и Вильнатцер Л., 1988 (Schmidt, R. and Willnutzer, L., 1988)). Вышеупомянутые векторы или производные выше упомянутых векторов представляют малый выбор возможных плазмидов. Дальнейшие плазмиды достаточно известны специалисту и могут быть взяты, к примеру, из книги «Векторы клонирования» (Ред. Поувелс П.Х. и др. Эльсевье, Амстердам-Нью-Йорк-Оксфорд 1985, ISBN 0 444 904018 (Eds. Pouwels P.H. et al. Eisevier, Amsterdam-New York-Oxford, 1985, ISBM 0 444 904018)). Пригодные растительные векторы описываются среди прочего в «Методы в молекулярной биологии и биотехнологии растений» (СиРСи Пресс), гл. 6-7, с.71-119 ("Methods in Plant Molecular Biology and Biotechnology" (CRC Press), Кар. 6/7, S.71-119). Выгодными векторами являются т.н. шаттл-векторы или бинарные векторы, которые реплицируют в E.coli и Agro-bacterium.
Под векторами кроме плазмидов нужно понимать также все другие известные специалисту векторы как, к примеру, фаги, вирусы, как SV40, CMV, бакуловирус, аденовирус, транспонсы, IS-элементы, фазмиды фагемиды, космиды, линейная или циркулярная ДНК. Эти векторы могут реплицироваться автономно в организме хозяина, или реплицироваться хромосомно, предпочтительна хромосомная репликация.
В дальнейшей форме исполнения заявляемая экспрессионная кассета может с преимуществом вводиться в организмы в форме линейной ДНК и интегрироваться в геном организма хозяина путем гетерологической или гомологической рекомбинации. Эта линейная ДНК может состоять из линеаризированного плазмида или только из экспрессионной кассеты как вектора, или заявляемых последовательностей нуклеиновых кислот.
В дальнейшей обладающей преимуществом форме исполнения в организм может вводиться только заявляемая последовательность нуклеиновых кислот.
Если, наряду с заявляемой последовательностью нуклеиновых кислот в организм должны вводиться дальнейшие гены, то все вместе могут вноситься в организм вместе с репортерным геном в единственном векторе или каждый отдельный ген с репортерным геном в отдельном векторе, причем различные векторы могут вводиться одновременно или постепенно.
Вектор преимущественно содержит, по меньшей мере, одну копию заявляемой последовательности нуклеиновых кислот и/или заявляемую экспрессионную кассету.
Например, растительная экспрессионная кассета может быть встроена в трансформационный вектор табака pBinAR.
На чертеже показан трансформационный вектор табака pBinAR с промотором 35S (С) и соответственно pBin-USP с USP-промотором (D). Исходные векторы представлены на Фиг.1А) и В).
Альтернативно рекомбинантный вектор (=экспрессионный вектор) может быть траскрибирован и траслирован in vitro, например, с использованием Т7-промотора и Т7-РНК полимеразы.
Использованные в прокариотах экспрессионные векторы часто используют индуцируемые системы с протеинами слияния и без них и, соответственно, фузионные олигопептиды, причем эти слияния могут происходить как N-терминал, так и С-терминал или другие полезные домены протеина. Такие векторы слияния служат, как правило, для того, чтобы: i) повышать экспрессионную долю РНК, ii) повышать достижимую норму синтеза протеина, iii) повышать растворимость протеина, iv) или упрощать очистку с помощью используемой для аффинной хроматографии связывающей последовательности. Часто через протеины слияния также вводятся протеолитические места расщепления, что делает возможным отщепление части протеина слияния, а также содействует чистке. Такие последовательности узнавания для протеаз известны, например, фактор Ха, тромбин и энтерокиназа.
Типичные дающие преимущество векторы слияния и экспрессионные векторы - pGEX (Фармасия Байотек Инк; Смит, Д.Б. и Джонсон. К.С. (1988) Джини 67: 31-40 (Pharmacia Biotech Ine; Smith, D.B. and Johnson. K.S. (1988) Gene 67: 31-40)), pMAL (Нью Ингланд Байолэбз, Беверли, Массачусетс (New England Biolabs, Beverly, MA)) и pRITS (Фармасия, Пискэтэуэй, Нью Джерси (Pharmacia, Piscataway, NJ)), которые содержат глютационную S-трансферазу (GST), связывающий протеин мальтозы, или протеин А.
Дальнейшими примерами для экспрессионных векторов Е.coli являются pTrc (Эмэнн и др., (1988) Джини 69:301-315 (Amann et al., (1988) Gene 69:301-315)) и рЕТ-векторы (Стадиэ и др., Джини Икспрешн Тэкнолоджи: Месодз ин Энзимолоджи 185, 25 Академик пресс. Сан Диего, Калифорния (1990) 60-89; Стратаджини, Амстердам, Нидерланды (Studier et al., Gene Expression Technology: Methods in Enzymology 185, 25 Academic Press, San Diego, California (1990) 60-89; Stratagene, Amsterdam, Niederlande)).
Дальнейшие имеющие преимущество выгодные векторы для применения в дрожжах - это pYepSecl (Балдари и др.., (1987) ЭМБО Ж.,. 6:229-234 (Baldari, et al., (1987) Embo J". 6:229-234)), рМРа (Карджан энд Херсковиц, (1982) Се22 30:933-943 (Kurjan and Herskowitz, (1982) Се22 30:933-943)), PJRY88 (Скбиц и др., (1987) Джини 54:113-123 (Scbuitz et al., (1987) Gene 54:113-123)), и производные pYES (Инвитроген Корпорэйшн, Сан Диего, Калифорния Derivate (Invitrogen Corporation, San Diego, CA)).
Векторы для использования в филаментозных грибах описаны в: Ван ден Хондел, С.А.М.Дж.Дж. и Пант, Пи.Дж. (1991) "Джини трансфер Системз энд вектор девелопмент фор филаментоус фанджи, ин: Эплайд Молекула Дженетикс оф Фанджи, Дж.Ф. Петерби и др., эдз., стр.1-28, Кэмбридж Юнивесити пресс: Кэмбридж (van den Hondel, C.A.M.J.J. & Punt, P.J. (1991) "Gene transfer Systems and vector development for filamentous fungi, in: Applied Molecular Genetics of Fungi, J.F. Peberdy, et al., eds., p.1-28, Cambridge University Press: Cambridge).
Альтернативно могут с преимуществом использоваться также экспрессионные векторы из клеток насекомых, например, для экспрессии в клетках Sf 9. Это, например, векторы серии рАс (Смит и др.. (1983) Мол. Целл. Биол.. 3:2156-2165 (Smith et al. (1983) Mol. Cell Biol. 3:2156-2165)) и pVL серии (Луклов энд Саммерс (1989) Виролоджи 170:31-39 (Lucklow and Summers (1989) Virology 170:31-39)).
Далее для экспрессии гена с преимуществом могут использоваться клетки растений или водорослей. Примеры экспрессионных векторов растений приводятся в Беккер Д., и др. (1992) "Нью плант байнари векторз уиз селектабл макерз локэйтид проксимал ту зэ лефт боде". Плант Мол. Байол. 20: 1195-1197 (Becker, D., et al. (1992) "New plant binary vectors with selectable markers located proximal to the left border". Plant Mol. Biol. 20: 1195-1197) или в Бивэн, М.В. (1984) "Байнэри Агробактэриэ векторз фор плант трансформэйшн", Ньюкл. Эйсид. Рез. 12: 8711-8721 (Bevan, M.W. (1984) "Binary Agrobacteriuxa vectors for plant transformation", Nucl. Acid. Res. 12:8711-8721).
Далее, заявляемые последовательности нуклеиновых кислот могут быть экспримированы в клетках млекопитающих. Пример для соответствующих экспрессионных векторов pCDM8 и рМТ2РС упомянуты в: Сид Б.. (1987) Нэйчур, 329:840 (Seed, В. (1987) Nature 329:840) или Кауфман и др. (1987) ЭМБО Ж.. 6: 10 187-195 (Kaufman et al. (1987) EMBO J. 6: 187-195). При этом используемые промоторы имеют преимущественно вирусное происхождение как, например, промоторы полиома, аденовирус 2, цито-мегаловирус или симиан вирус 40. Дальнейшие прокариотические и эукариотические экспрессионные системы упомянуты в главе 16 и 17 в Сэмбрук и др., Молекьюла Клонинг: Э Лаборатори Мэньюал. 2е изд., Колд Спринг Харбор Лаборатори, Колд Спринг Харбор Лаборатори Пресс, Колд Спринг Харбор, Нью Йорк, 1989 (Sambrook et al., Molecular Cloning: A Laboratory Manual. 2nd, ed., Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989).
Ввод заявляемых нуклеиновых кислот, экспрессионных кассет или вектора в организмы, например, в растения может осуществляться всеми известными специалисту методами.
Для микроорганизмов специалист может извлечь соответствующие методы из учебников Сэмбрук Дж. и др. (1989) Молекьюла Клонинг: Э Лаборатори Мэньюал, Колд Спринг Харбор Лаборатори Пресс (Sambrook, J. et al. (1989) Molecular cloning: A laboratory manual, Cold Spring Harbor Laboratory Press), Ф.М. Аусабель и др. (1994) Карэнт протоколз ин молекьюла байолоджи (von F.M. Ausubel et al. (1994) Current protocols in molecular biology), Джон Уайли энд Санз, Д.М. Гловер и др., ДиЭнЭй Клонинг Том 1, (1995), АйЭрЭл Пресс (ISBM 019-963476-9) (John Wiley and Sons, von D.M. Glover et al., DNA Cloning Vol.1, (1995), IRL Press (ISBM 019-963476-9)), Кайзер и др. (1994) Месодз ин Йист Дженетикс, Колд Спринг Харбор Лаборатори Пресс (von Kaiser et al. (1994) Methods in Yeast Genetics, Cold Spring Habor Laboratory Press) или Гасри и др. Гайд ту Йист Дженетикс энд Молекьюла Байолоджи, Месодз ин Энзимолоджи, 1994, Академик Пресс (Guthrie et al. Guide to Yeast Genetics and Molecular Biology, Methods in Enzymology, 1994, Academic Press).
Передача чужих генов в геном растения обозначается как трансформация. При этом описанные методы по трансформации и регенерации растений из растительных тканей или клеток используются для переходной или стабильной трансформации. Пригодными методами являются трансформация протопластов путем включения индуцируемой полиэтиленгликолем ДНК, биолистический способ с генной пушкой - так называемые методы бомбардирующих частиц, электропорация, инкубация сухих эмбрионов в растворе, содержащем ДНК, микроинъекция и стимулированный Agrobacterium трансфер гена. Упомянутые процессы описаны, к примеру, в Б. Дженес и др., Тэкникс фор Джини Трансфер, ин: Трансдженик Плантс, Том 1, Энджиниринг энд Ютилизэйшн. Изд. С.Д. Канг и Р. By, Академик пресс (1993) 128-143 (В. Jenes et al., Techniques for Gene Transfer, in:
Transgenic Plants, Vol. 1, Engineering and Utilization, herausgegeben von S.D. Kung und R. Wu, Academic Press (1993) 128-143), а также в Потрикус Анну. Рев. Плант Физиол. Плант Молек. Биол. 42 (1991) 205-225 (Potrykus Annu. Rev. Plant Physiol. Plant Molec. Biol. 42 (1991) 205-225).
Преимущественно конструкт, который следует экспримировать, клонируется в вектор, который способен трасформировать Agrobacterium tumefaciens, к примеру, pBinl9 (Бивэн и др., Нукл. Эйсидс. Рез. 12 (1984) 8711(Bevan et al., Nucl. Acids Res. 12(1984)8711).
Трансформированные таким способом агробактерии могут применяться в известном способе трансформации растений, в частности, культурных растений, как табак, причем надрезанные листья или их кусочки опускались в раствор агробактерий, а затем культивировались в пригодной для этого среде.
Трансформация растений с помощью Agrobacterium tumefaciens описана, к примеру, Хофген и Вильмитцер в Ньюкл. Эйсид Pec. (1988) 16, 9877 (Hofgen und Willmitzer in Nucl. Acid Res. (1988) 16, 9877), или известна среди прочего из Ф.Ф. Майт, Векторз фо Джини трансфер ин хайе Плантс; ин трансдженик плантс. Том 1, Энджиниринг энд Ютилизэйшн, изд. С.Д. Кунг и Р. By, Академик пресс, 1993, S. 15-38 (F.F. Mhite, Vectors for Gene Transfer in Higher Plants; in Transgenic Plants, Vol. 1, Engineering and Utilization, herausgegeben von S.D. Kung und R. Wu, Academic Press, 1993, S.15-38).
Трансформированные заявляемым вектором агробактерии могут применяться также в известном способе к трансформации растений, как тестовые растения, как Arabidopsis, или культурных растений, как зерновые, кукуруза, овес, рожь, ячмень, пшеница, соя, рис, хлопок, сахарная свекла, летний рапс, подсолнух, лен, конопля, картофель, табак, помидор, морковь, красный перец, рапс, тапиока, маниок, арроурут вестиндский, тагетес, люцерна посевная, салат и различные виды дерева, ореха и винограда, в особенности, масличные культурные растения, как соя, арахис, клещевина, подсолнух, кукуруза, хлопок, лен, рапс, кокосовый орех, масличная пальма, сафлор красильный (Carthamus tinctorius) или какао, причем надрезанные листья или их кусочки опускались в раствор агробактерий, а затем культивировались в пригодной для этого среде.
Генетически измененные ячейки растений могут регенерироваться всеми известными специалисту методами. Соответствующие методы могут быть найдены в вышеупомянутых источниках. С.Д. Канг и Р. By, Потрикус, или Хофген и Вильмитцер (S.D. Kung und R. Wu, Potrykus oder Hof gen und Willmitze).
Как организмы и, соответственно, организмы хозяина для заявляемый нуклеиновой кислоты, экспрессионной кассеты или вектора с преимуществом принципиально подходят все организмы, которые могут синтезировать жирные кислоты, специально ненасыщенные жирные кислоты и, соответственно, пригодны для экспрессии рекомбинантных генов. Примерами являются такие растения, как Arabidopsis, Asteraceae, как календула, или культурные растения как соя, арахис, клещевина, подсолнух, кукуруза, хлопок, лен, рапс, кокосовый орех, масличная пальма, сафлор красильный (Carthamus tinctorius) или какао, микроорганизмы, как грибы, к примеру, рода Mortierella, Saprolegnia или Pythium, бактерии, как рода Escherichia, дрожжи, как рода Saccharomyces, Cyanobakterien, Ciliaten, водоросли или протозои, как Dinoflagellaten, как Crypthecodinium. Предпочитаются организмы, которые могут синтезировать от природы масла в повышенных количествах, как грибы, как Mortierella alpina, Pythium insidiosum, или растения, как соя, рапс, кокосовый орех, масличная пальма, сафлор красильный (Carthamus tinctorius), клещевина, календула, арахис, бобы какао или подсолнух, или дрожжи, как Saccharomyces cerevisiae, особенно предпочтительны соя, рапс, подсолнух, календула или Saccharomyces cerevisiae. Принципиально в качестве хозяина могут быть использованы также трансгенные животные, к примеру, С. elegans.
Полезные клетки хозяина в существенной мере упомянуты в: Годдел, Джини Экспрешн текнолоджи: Месодз ин Энзимолоджи 185, Академик пресс Сан Диего, Калифорния (1990) (Goeddel, Gene Expression rechnology: Methods in Enzymology 185, Academic Press, San Diego, CA (1990)).
Применяемые экспрессионные штаммы, например, такие, которые имеют незначительную активность протеазы, описаны в: Готтесмэн, С., Джини Экспрешн текнолоджи: Месодз ин Энзимолоджи 185, Академик пресс Сан Диего, Калифорния (1990) 119-128 (Gottesman, S., Gene Expression Tecbnology: Methode in Enzymology 185, Academic Press, San Diego, California (1990) 119-128).
Дальнейший предмет изобретения касается применения экспрессионной кассеты, содержащей последовательности ДНК, кодирующие гены Δ6-ацетиленазы/Δ6-десатуразы и/или Δ6-десатуразы, или с ними гибридизирующие последовательности ДНК для трансформации клеток растений, тканей растений или частей растений. Цель применения - повышение содержания жирных кислот, масел или липидов с повышенным содержанием тройных и двойных связей в позиции Δ6.
При этом в зависимости от выбора промотора экспрессия гена Δ6-ацетиленазы/Δ6-десатуразы и/или Δ6-десатуразы происходит специфически в листьях, в семени, клубнях или других частях растения. Такие жирные кислоты, масла или липиды с тройными и двойньми Δ6-связями, сверхпроизводящие трансгенные растения, их материал размножения, а также клетки растений, ткани или части растений, являются дальнейшим предметом данного изобретения. Предпочтительный заявляемый предмет - трансгенные растения, содержащие заявляемую функциональную или не функциональную (= антисмысловую ДНК или ферментативно неактивный фермент) последовательность нуклеиновых кислот или функциональную или не функциональную экспрессионную кассету.
Экспрессионная кассета или заявляемые последовательности нуклеиновых кислот, содержащие последовательность генов Δ6-ацетиленазы/Δ6-десатуразы и/или Δ6-десатуразы, исходя из этого, может применяться также для трансформации примерно упомянутых выше организмов, как бактерии, цианобактерии, дрожжи, филаментозные грибы, цилиаты и водоросли с целью повышения содержания жирных кислот, масел или липидов с тройными или двойньми Δ6-связями.
Повышение содержания жирных кислот, масел или липидов с тройными или двойными Δ6-связями означает в рамках настоящего изобретения, например, искусственно приобретенную способность повышенной производительности биосинтеза путем функциональной сверхэкспрессии генов Δ6-ацетиленазы/Δ6-десатуразы и/или Δ6-десатуразы в заявляемых организмах, с преимуществом в заявляемых трансгенных растениях, по отношению к не модифицированным с помощью генной инженерии исходным растениям, по меньшей мере, на срок одного поколения растений.
Местом биосинтеза жирных кислот, масел или липидов, к примеру, является, в общем, семя или клеточные слои семени, так что рациональна семенноспецифическая экспрессия гена Δ6-ацетиленазы/Δ6-десатуразы и/или Δ6-десатуразы. Тем не менее, понятно, что биосинтез жирных кислот, масел или липидов не должен быть ограничен тканью семени, а может происходить специфически для ткани и во всех остальных частях растения, к примеру, в клетках эпидермиса или в клубнях.
Исходя из этого, конститутивная экспрессия экзогенного гена Δ6-ацетиленазы/Δ6-десатуразы и/или Δ6-десатуразы является преимущественной. Однако с другой стороны желательна индуцируемая экспрессия. Эффективность экспрессии трансгенного гена Δ6-ацетиленазы/Δ6-десатуразы и/или Δ6-десатуразы может определяться, к примеру, in vitro размножением зародышей меристемы. При этом вид и уровень измененной экспрессии гена Δ6-ацетиленазы/Δ6-десатуразы и/или Δ6-десатуразы и ее воздействие на продуктивность биосинтеза жирных кислот, масел и липидов может определяться в тепличных опытах на тестовых растениях.
Предметом изобретения, кроме того, являются трансгенные растения, трансформированные с помощью экспрессионной кассеты, содержащей последовательность генов Δ6-ацетиленазы/Δ6-десатуразы и/или Δ6-десатуразы или с нею гибридизирующей последовательности ДНК, а также трансгенные клетки, ткань, части и материал для размножения таких растений. Особенно предпочитаемые при этом трансгенные культурные растения, как, например, ячмень, пшеница, рожь, овес, кукуруза, соя, рис, хлопок, сахарная свекла, рапс и летний рапс, подсолнух, лен, конопля, картофель, табак, помидоры, рапс, тапиока, маниок, арроурут вестиндский, люцерна посевная, салат и различные виды деревьев, орехов и винограда. Растениями согласно изобретению являются одно- и двудольные растения или водоросли.
Дальнейшим предметом изобретения являются вышеописанные трансгенные растения, которые содержат функциональную или не функциональную заявляемую последовательность нуклеиновых кислот или функциональную или не функциональную заявляемую экспрессионную кассету. Под нефункциональностью следует понимать, что не будет больше синтезироваться никакой ферментативно активный протеин. Кроме того, нужно понимать под нефункциональностью нуклеиновых кислот или коструктов нуклеиновой кислоты также так называемую антисмысловую ДНК, которая ведет к трансгенным растениям, обнаруживающим сокращение или отсутствие ферментативной активности. С помощью антисмысловой техники, если заявляемая последовательность нуклеиновых кислот специально комбинируется с другими генами синтеза жирных кислот в антисмысловой ДНК, можно синтезировать триглицериды с повышенным содержанием насыщенных жирных кислот и, соответственно, насыщенные жирные кислоты. Под трансгенными растениями следует понимать отдельные растительные клетки их культуры на твердых средах или в жидкой культуре, в частях растений и во всем растении.
Дальнейшими предметами изобретения являются:
- способ трансформации растения, отличающийся тем, что экспрессионные кассеты, содержащие последовательность генов Δ6-ацетиленазы/Δ6-десатуразы и/или Δ6-десатуразы, или с нею гибридизирующие последовательности ДНК, вносят в клетки растений, в ткани каллюса, все растение или протопласты растений;
- применение последовательности ДНК-генов Δ6-ацетиленазы/Δ6-десатуразы и/или Δ6-десатуразы, или с нею гибридизирующих последовательностей ДНК для производства растений с повышенным содержанием жирных кислот, масел или липидов с тройными или двойными Δ6-связями путем экспрессии этих ДНК-последовательностей D6-ацетилиназы/десатуразы в растениях;
- протеин, содержащий последовательность аминокислот, представленную в SEQ ID NO:8;
- протеин, содержащий последовательность аминокислот, представленную в SEQ ID NO:10;
- применение протеинов с последовательностями SEQ ID NO:8 и SEQ ID NO:10 для производства ненасыщенных жирных кислот.
Дальнейшим предметом изобретения является способ производства ненасыщенных жирных кислот, отличающийся тем, что в предпочтительный производящий масло организм вносят, как минимум, одну вышеописанную заявляемую последовательность нуклеиновых кислот или один заявляемый конструкт нуклеиновой кислоты, этот организм культивируют, выделяют содержащееся в организме масло и освобождают содержащиеся в масле жирные кислоты. Эти ненасыщенные жирные кислоты содержат с преимуществом тройные и/или двойные Δ6-связи. Жирные кислоты могут освобождаться из масел, соответственно, липидов, например, путем основного гидролиза, например, с NaOH или КОН.
Предметом изобретения является также способ производства триглицеридов с повышенным содержанием ненасыщенных жирных кислот, отличающийся тем, что в производящий масло организм вносят, как минимум, одну вышеописанную заявляемую последовательность нуклеиновых кислот или, как минимум, одну заявляемую экспрессионную кассету, этот организм культивируют и выделяют содержащееся в организме масло.
Дальнейшим предметом изобретения является способ производства триглицеридов с повышенным содержанием ненасыщенных жирных кислот, причем инкубируют триглицериды с насыщенными или ненасыщенными, или с насыщенными и ненасыщенными жирными кислотами, содержащими, как минимум, один протеин, который кодируется одной из последовательностей SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:8, SEQ ID NO:10 или SEQ ID NO:11. С преимуществом способ реализуется в присутствии соединений, которые могут принимать и отдавать эквиваленты редукции. Далее, из триглицеридов могут освобождаться жирные кислоты.
Способ по п.п.16 или 17, отличающийся тем, что жирные кислоты освобождаются из триглицеридов.
Вышеупомянутые способы с преимуществом содействуют синтезу жирных кислот или триглицеридов с повышенным содержанием жирных кислот с тройными и/или двойными Δ6-связями.
Способом с так называемой антисмысловой технологией также могут производиться жирные кислоты или триглицериды с повышенным содержанием насыщенных жирных кислот.
Как организмы для упомянутых способов следовало бы назвать растения, как Arabidopsis, ячмень, пшеница, рожь, овес, кукуруза, соя, рис, хлопок, сахарная свекла, рапс и летний рапс, подсолнух, лен, конопля, картофель, табак, помидор, рапс, тапиока, маниок, арроурут вестиндский, люцерна посевная, земляной орех, клещевина, кокосовый орех, масличная пальма, сафлор красильный (Carthamus tinctorius) или какао-бобы, микроорганизмы, как грибы Mortierella, Saprolegnia или Pythium, бактерии, как Gattung Escherichia, Cyanobakterien, дрожжи, как Gattung Saccharomyces, водоросли или протозои, как Dinoflagellaten, как Crypthecodinium. Предпочитаются организмы, которые могут синтезировать естественным образом масла в большем объеме как микроорганизмы, как грибы Mortierella alpina, Pythium insidiosum или растения, как соя, рапс, кокосовый орех, масличная пальма, сафлор красильный, клещевина, календула, земляной орех, какао-бобы, или подсолнечник, или дрожжи, как Saccharomyces cerevisiae, особенно предпочитаются соя, рапс, подсолнух, Carthamus или Saccharomyces cerevisiae.
Использованные в способах организмы культивируются, например, выращиваются в зависимости от организма хозяина известным специалисту способом. Микроорганизмы культивируются, как правило, в жидкой среде, которая содержит источник углерода большей частью в форме сахаров, источник азота больше всего в форме органических источников азота, как экстракт дрожжей или соли сульфата аммония, следовые элементы как соли железа, марганца, магния и, при необходимости, витамины, при температурах между 0 и 100°С, предпочтительно от 10 до 60°С при насыщении кислородом. При этом рН питательной среды может поддерживаться на одном уровне, что означает, во время выращивания регулируется, или не регулируется. Выращивание может происходить способом однократной засыпки, порционно, или непрерывно. Питательные вещества могут вкладываться к началу ферментации, или вводиться порциями или непрерывно после начала ферментации.
Растения после трансформации регенерируются, как описано выше, а затем, как обычно, выращиваются, или прививаются.
Из организмов после выращивания обычным способом добываются липиды. К тому же, после уборки организмы могут сначала быть вскрыты или используются непосредственно. Липиды экстрагируются преимущественно предназначенными для этого средствами, как неполярные растворители, как гексан или этанол, изопропанол, или смесями, как гексан/изопропанол, фенол/хлороформ/изоамиловый спирт при температурах от 0 до 80°С, предпочтительно от 20 до 50°C. Биомасса экстрагируется, как правило, с избытком растворителя, к примеру, избытком растворителя по отношению к биомассе, как 1:4. Растворитель удаляется затем, к примеру, путем дистилляции. Экстракция может происходить также со сверхкритическим CO2. После экстракции остаточная биомасса может удаляться, к примеру, путем фильтрации.
Добытое таким образом масло-сырец может быть затем далее очищено, к примеру, помутнение может удаляться путем подмешивания полярных растворителей, как ацетон или хлороформ и последующей фильтрацией или центрифугированием. Возможна также дальнейшая очистка в колонках.
Для получения свободных жирных кислот из триглицеридов последние, как правило, омыляются.
Дальнейшим предметом изобретения являются ненасыщенные жирные кислоты, а также триглицериды с повышенным содержанием ненасыщенных жирных кислот, которые производились вышеупомянутыми способами, а также их применение для изготовления пищевых продуктов, корма для животных, в косметических средствах или формацевтических препаратах. Кроме того, они добавляются в обычных количествах в пищевые продукты, корм для животных, косметику или фармацевтику.
Более подробно изобретение поясняется следующими примерами:
Примеры
Пример 1:
Общие способы клонирования:
Способы клонирования: как, например, расщепления рестрикции, агарозный электрофорез, чистка фрагментов ДНК, трансфер нуклеиновых кислот на нитроцеллюлозную и нейлоновую мембраны, связи ДНК-фрагментов, трансформации клетки Escherichia coli, выращивание бактерий и анализ последовательности рекомбинантных ДНК были проведены так, как описано в Сэмбрук и др. (1989) (Колд Спринг Харбор Лаборатори Пресс: ISBN 0-87969-309-6 (Sambrook et al. (1989) (Cold Spring Harbor Laboratory Press: ISBN 0-87969-309-6)).
Пример 2:
Анализ последовательности рекомбинантных ДНК:
Секвенцирование рекомбинантных ДНК-молекул производилось с помощью лазерно-флуоресцентного секвенцера ДНК фирмы АБИ (ABI) по методу Зэнгера (Зэнгер и др. (1977) Проц. Натл. Акад. Сай. США А74. 45 5463-5467 (Sanger et al. (1977) Proc. Natl. Acad. Sei. USA74. 45 5463-5467)). Фрагменты, следующие из цепной реакции полимеразы для устранения дефектов полимеразы в конструктах, предназначенных для экспримации, секвенцировались и перепроверялись.
Пример 3:
Производство трансгенного рапса (изменен по Молони и др., 1992,
Плант.Целл. Рипорт. 8:238-242 (Moloney et al., 1992, Plant Cell Reports. 8:238-242))
Для производства трансгенного рапса использовались бинарные векторы в Agrobacterium tumefaciens C58Cl:pGV2260 или Escherichia coli (Деблайере и др., 1984, Ньюкл. Эйсидз. Рез. 13, 4777-4788 (Deblaere et al, 1984, Nucl. Acids. Res. 13, 4777-4788)).
Для трансформации растений рапса (Вар. Драккар, НПЗ Нордойчен пфланценцухт, Хоэнлит, Германия (Var. Drakkar, NPZ Nordeutsche Pflanzenzucht, Hohenlieth, Deutschland)) была использована переночевавшая культура положительно трансформированной колонии агробактерии, разбавленная 1:50 в среде Мурашиги-Скуга (Мурашиги и Скуг 1962 Физиол. Плант. 15, 473 (Murashige und Skoog 1962 Physiol. Plant. 15, 473)) с 3% сахарозой (ЗМS-среда). Петиоли или гипокотиледоны свежепророщенных стерильных растений рапса (на каждое примерно 1 см2) были инкубированы в чашке Петри с разбавлением агробактериями 1:50 на 5-10 минут. Осуществлялась трехдневная конкубация в темноте при 25°С на среде 3MS с 0,8% бакто-агара. После 3 дней культивация была продолжена в недельном ритме: 16 часов на свету/8 часов в темноте на среде MS с 500 мг/л клафорана (цефатоксим-натрий), 50 мг канамицина, 20 мкМ бензиламинопурина (БАП) и 1,6 г/л глюкозы. Растущие побеги были переведены на MS-среду с 2% сахарозы, 250 мг/л клафорана и 0,8% бакто-агара. Если после трех недель корней не было, то для окорневания в среду добавлялась в качестве гормона роста 2-индолмасляная кислота.
Пример 4:
Получение трансгенных растений Arabidopsis thaliana
Трансформация Arabidopsis thaliana Var. Columbia Col 0 (Лейла Сидс, Раунд Рок, Техас, США (Lehle Seeds, Round Rock, Texas, USA)) происходила посредством метода инфильтрации цветков, как описано в: Бехтольд Н., Эллис Дж. и Пельтье Г. ин Планта, Агробактериум медиэтид лжини трансфер бай инфильтрэйшн оф эдальт эрабидопсис талиана плантс Си. Р. C.R. Акад. Сай. Париж, лайф Сайенс 316 (1993), 1194-119 (Bechtold, N., Ellis, J. 35 and Pelletier, G. in Planta, Agrobacterium mediated gene transfer by Infiltration of adult Arabidopsis thaliana plants, C.R. Acad. Sei. Paris, Life Sciences 316 (1993), 1194-119), или посредством метода трансформации корня.
Пример 5:
Трансформация растений кукурузы происходила, как описано у Парэдди Д., Петолино Дж., Скокат Т., Хопкинс Н., Миллер, М., Уэлтер, М., Смит, К., Клэйтон, Д., Пескителли, С., Гоулд, А., Маиз Трансформэйшн виа Хелиум Бластинг. Мэйдика. 42(2): 143-154, 1997 (Pareddy, D., Petolino, J., Skokut, Т., Hopkins, N., Miller, M., Welter, M., Smith, K., Clayton, D., Pescitelli, S., Gould, A., Maize Trans-45 formation via Helium Blasting. Maydica. 42(2): 143-154, 1997).
Пример 6:
Выделение и клонирование Δ6-ацетиленазы/Δ6-десатуразы и Δ6-десатуразы из Ceratodon purpureus
Чтобы выделять последовательности ДНК из Ceratodon purpureus, которые кодируют Δ6-ацетиленазу/Δ6-десатуразу и Δ6-десатуразу, из последовательностей ДНК были выведены различные дегенерированные праймеры олигонуклеотидов, которые кодируют Δ5- (ЕМБЛ эссешн-номер Z81122) и Δ6-десатуразы жирных кислот (U79010, AJ222980, АР031477):
Праймер А: 5'-TGG TGG AA (A/G) TGG А (А/С) I СА (С/Т) АА-3'
прямой праймер, производный от последовательности аминокислот WWKW (N/T/K) H (N/K)
Праймер В: 5' - (T/G) GI TGG AA (A/G) (T/G) (G/A) I (А/С) AI СА (С/Т) АА-3' прямой праймер, производный от последовательности аминокислот (G/W) WK (E/D/W) (N/Q/K) Н (N/K)
Праймер С: 5'-AT (A/T/G/C) Т (T/G) (A/T/G/C)GG (A/G) AA (A/T/G/C) A (A/G) (A/G) TG (A/G) TG-3'.
обратный праймер, производный от последовательности аминокислот (I/M) (H/Q/N) PF (L/F) НН
Посредством цепной реакции полимеразы (ПЦР) с одноцепочечной кДНК из С.purpureus с праймером А и праймером С были амплифицированы два ДНК-фрагмента длиной 557 bp (Сеr3) и 575 bp (Cer16) и с праймером В и праймером С ДНК-фрагмент длиной 560 bp (Cer1). Для амплификации была использована следующая программа: 10 минут при 94°С, пауза для "хот старт" при 72°С, последовавшие 32 цикла по 20 с при 94°С, 1 минута при 40°С (температура соединения, Тm) и 1 минута при 72°С, 1 цикл за 10 минут при 72°С и стоп при 4°С. Для амплификации использовалась Таг-ДНК-полимераза (Гибко БР).
Вышеупомянутые двухцепочечные фрагменты ДНК из двух амплификаций лигировались в pGEM-T вектор (промега), трансформировались в E.coli XL1BLUE MRF' Kan (стратаген) и секвенцировались АБИ ПРИЗМ Биг даи терминатор саикл секвеншинг рэди риэкшен кит (Перкин-Эльмер, Вайтерштадт) (dem ABI PRISM Big Dye Terminator Cycle Sequencing Ready Reaction Kit (Perkin-Elmer, Weiterstadt)). Частичные последовательности ДНК Cer1 и Сеr3 показали 70% идентичность. Вышеупомянутые частичные последовательности ДНК кодировали без праймера для открытых рамок чтения при Cer1 от 173 аминокислоты (SEQ ID NO:5 = частичная последовательность нуклеотидов без праймера от Cer1 и SEQ ID NO: 6 = частично дедуцированная последовательность аминокислот от Cer1), при Сеr3 от 172 аминокислоты (SEQ ID NO:7 = частичная последовательность нуклеотидов без праймера от Сеr3 и SEQ ID NO:8 = частичная выведенная последовательность аминокислот от Сеr3) и при Сеr16 от 178 аминокислоты (SEQ ID NO:9 = частичная последовательность нуклеотидов без праймера от Cer16 и SEQ ID NO: 10 = частичная выведенная последовательность аминокислот Сеr16). Производная последовательность протеина Cer1 обнаруживала 64% к Сеr3 и 28% идентичных аминокислот к Сеr16; Сеr3 и Сеr16 обнаруживали с другой стороны 27% идентичных аминокислот.
Высшее сходство Cer1- и Cer3-протеинов имеется по отношению к Δ6-ациллипид-десатуразе из Physcomitrella patens (Гирке и др., Плант Ж., 15, 1998: 39-48 (Girke et al.. Plant J., 15, 1998: 39-48)), в то время как Cer16 обнаруживает высшее сходство к Δ6-ациллипид-десатуразе и Δ8-сфинголипид-десатуразе из более высоких растений.
Направленный λZAP банк кДНК Ceratodon purpureus был представлен в распоряжение Фрицем Туммлером, Ботанический институт университета Мюнхен, (Пэйсентсис и др. Плант Ж., 13, 1, 1998: 51-61 (Pasentsis et al.. Plant J., 13, 1, 1998: 51-61)). Проводился ПЦР-тест этого цератодонового банка, при котором были выведены специфические праймеры вышеупомянутых частичных последовательностей Cer1, Cer3 и Cer16:
Специфический прямой и обратный праймер:
Cerl: 5'-CGAATGAGTGCGACGAAC-3' + 5'-AATAACCTGGGCTCTCAC-3'
Cer3: 5'-ATGAGGATATTGATACTCTC-3' + 5'-GCAATCTGGGCATTCACG-3' 25
Cer16: 5'-GACATCAAAGCTCTTCTC-3' + 5'-GGCGATGAGAAGTGGTTC-3'
Рестрикционный анализ (Hind III и, соответственно, EcoR V) из банка кДНК посредством ПЦР амплифицированных продуктов во всех трех случаях показал одинаковый образец рестрикции, как ПЦР-амплификаты из ss-кДНК, т.е. цератодоновый банк кДНК содержит три клона Cer1, Cer3 и Cer16.
Пример 7:
Банк кДНК скрининга и секвентирования клонов "полной длины"
Мини-подготовки ДНК трех из ss-кДНК амплифицированных ПЦР-фрагментов Cer1, Cer3, Cer16 570 bp в длину в pGEM-T (см. Пример 6) были отданы для дальнейшего скрининга полного клона из λZAP банка кДНК Ceratodon purpureus М.Ли и С.Стаймни (М. Lee und S. Stymne). Этот скрининг банка кДНК вел до сих пор к двум полным клонам Cer1 и Cer3 со вставками около 2,2 kb, которые были субклонированы как фрагменты EcoR I / Kpn из λZAP-вектора в EcoR I / Kpn-места стыковки вектора рис19 (Нью ингленд биолэбс (New England Biolabs)) и трансформировались в E.coli JM105. Дальнейший скрининг кДНК-банка Cer1 и Cer3 как проб гибридизации при низкой строгости показал, что существует, по меньшей мере, один дальнейший гомологичный Cer1 клон, который, возможно, мог бы кодировать Δ5-десатуразу.
Два E.coli-клона, Cer1-50 и Cer3-50, были полностью секвентированы. Cer1-50 имеет длину в 2003 bp (SEQ ID NO: 1 = последовательность нуклеотидов Δ6 ацетиленаза/Δ6-десатураза из Ceratodon purpureus с 5'- и 3'-нетранслируемыми регионами и поли А) и кодирует для открытого растра считывания 483 аминокислоты < SEQ ID NO:2 = выведенная последовательность аминокислот Δ6-ацетиленазы/Δ6-десатуразы из Ceratodon purpureus). Cer3-50 имеет длину в 2142 bp (SEQ ID NO:11 = последовательность нуклеотидов [2142 bp] Δ6-десатуразы из Ceratodon purpureus с 5'- и 3'-нетранслируемыми регионами) с открытыми рамами считывания 520 аминокислот (SEQ ID NO:12 = выведенная последовательность аминокислот Δ6-десатуразы из Ceratodon purpureus). Обе последовательности протеина обнаруживают на N-терминале высококонсервированный HPGG-мотив цитохрома b5 (Ледерер Ф., Биохими 76, 1994: 674-692 (Lederer F., Biochimie 76, 1994:674-692)) и на С-терминале три характерных для десатуразы гистидиновых бокса (Щэнклин и др. Биокемистри, 33, 1994:12787-12794 (Shanklin et al., Biochemistry, 33, 1994: 12787-12794)). Они представляют, таким образом, следующие члены растущей семьи протеинов слияния Cytochrom b5 (Напье и др., Трендс ин Плант Сайенс, 4,1, 1999; 2-4 (Napier et al., Trends in Plant Science, 4, 1, 1999; 2-4)). Первый гистидин третьего бокса обменен на глютамин, дальнейшую характеристику Δ5- и Δ6-ациллипид-десатураз, а также Δ8-сфинголипид-десатураз.
Пример 8:
Клонирование общей функционально активной последовательности Δ6-ацетиленазы/Δ6-десатуразы и Δ6-десатуразы посредством ПЦР и предоставления этой последовательности для клонирования в векторах, а также функциональной экспрессии в дрожжах
Была изготовлена кДНК, которая кодирует ферменты с активностью Δ6-ацетиленазы/Δ6-десатуразы из Ceratodon purpureus. Аналогично к здесь описанному примеру была клонирована Δ6-десатураза (см. SEQ ID NO:2, SEQ ID NO:4 и соответственно SEQ ID NO:12).
Кроме того, произведены, прежде всего, посредством Cer1-кДНК для D6-ацетиленазы/десатуразы из Ceratodon purpureus олигонуклеотиды для цепной реакции полимеразы (ПЦР).
Cer1: 5'-СС GGTACC ATG GCC CTC GTT ACC GAC-3' +
5'-СС GAATTC ТТА GTG AGC GTG AAG CCG-3'
Cer3: 5'-СС GGTACC ATG GTG TCC CAG GGC GGC-3' +
5'-СС GAATTC TCA ACT CGC AGC AAG CTG-3'
Следующие праймеры были выведены из Cer1 для экспрессии в дрожжах:
5'-праймер: 5'-AAAAGGATCCAAAATGGCCCTCGTTACCGAC-3'
3'-праймер: 5'-AAAAGTCGACTTAGTGAGCGTGAAGCC-3'
В ПЦР реакции как матрица используется кДНК D6-ацетиленазы/десатуразы из Ceratodon purpureus. С помощью праймера вводится BamHI-место стыка для рестрикции перед стартовьм кодоном D6-ацетиленазы/десатуразы кДНК. Для направленного клонирования за стоп-кодоном вводится Sall-место стыка для рестрикции. Смеси реакции содержали около 1 нг/мкл матриц ДНК, 0,5 мкМ олигонуклеотидов и 200 мкМ дезокси-нуклеотида (Фармация (Pharmacia)), 50 мМ KCl, 10 мМ ТРИС-HCl (рН 8,3 при 20°С, 1,5 мМ MgCl2) и 0,02 ед/мкл ПВО полимеразы (Берингер Маннгейм (Boehringer Mannheim)) и инкубируются в ПЦР-машине фирмы Перкин-Эльмер (Perkin Eimer) со следующей программой температуры:
Температура хранения: 5°С, 52 с
температура денатурации: 90°С, 52 с
температура элонгации: 72°С, 90 с
количество циклов: 30.
Полученный фрагмент 1467 базовых пар лигируется в расщепленном EcoRV векторе pBluescript SK-(стратагены). Контрольным расщеплением идентифицируется клон pBS-CerI, вставка которого в полной длине достигается с помощью BamHI/SalI (1452 базовых пар плюс 15 нуклеотидов мест стыка для рестрикции) и обнаруживает следующую последовательность (старт и стоп-кодон подчеркнут, места стыка представлены курсивом). Аналогично может использоваться также кДНК последовательность клона Cer50. При этом речь идет о монофункциональной Δ6-десатуразе (см. SEQ ID NO:3). Производную последовательность аминокислот следует взять из SEQ ID NO:4.
Для перепроверки функциональности кодированного фермента в микроорганизме, фрагмент 1467 bp BamHI/Sal из PBS-45 Cer1 лигируется в экспрессионном векторе pYES2, разрезанном BamHI/XhoI (Инвитоген, Гронинген, Нидерланды), и используется для трансформации дрожжей по стандартным протоколам с помощью вновь созданного плазмида pYES2-Cer1 (см. протокол трансформации Инвитоген, Гронинген, Нидерланды (Transformationsprotokoll Invitrogen, Groningen, Niederlande)). Полученные колонии культивируются на содержащей раффинозу среде и посредством галактозы индуцируется экспрессия гена D6-ацетиленазы/десатуразы (см. ниже).
Пример 9:
Липидный анализ трансформированных дрожжей
Дрожжи могут инкорпорировать в свои мембранные липиды наряду с собственными жирными кислотами (16:0, 16:1, 18:0 и 18:1) также экзогенные жирные кислоты. Чтобы проверить специфичность субстрата соответственно экспримированной десатуразы, на СМ - 2% раффинозную среду для солюбилизации экзогенных жирных кислот перед инокуляций наносили 1% тергитола НП-40 (вес/объем. Сигма) и 0,003% соответствующей жирной кислоты (исходный раствор: 0,3% и, соответственно, 3% жирной кислоты в 5% тергидроле НП-40, вес/объем). Предкультивирование происходило путем инокуляции 3 мл СМ - 2% раффинозной среды/1% тергитола НП-40 трансгенной колонией дрожжей и заключительной инкубацией на 2 дня при 30°С в барабане до оптической плотности при 600 нм (OD600) от 4,0 до 4,3. Основная культура прививалась 10 мл среды СМ 2% рафинозы/1% тергитола НП-40±0,003% жирной кислоты с аликвотной предкультурой (200-кратное разбавление) по OD600 0,02 и инкубировалась 24 часа при 30°С, 250 об/мин в шаттлере. Индукция тестовых культур происходила в логарифмической фазе роста (OD600 от 0,5 до 0,6) путем добавки галактозы по 1,8%. Созревание индуцированных клеток происходило после дальнейшего 24-часового аэробного роста при 30°С при OD600 от 4,0 до 4,3.
Индуцированные клетки дрожжей были выделены путем 10-минутного центрифугирования при 2000 g, ресуспендированы в 3 мл дистиллированной воды, прокипячены 10 минут при 100°С и после охлаждения на льду снова седиментированы. Клеточный седимент гидролизировали с 1 н метанольной серной кислотой и 2% диметоксипропана 1 час при 90°С, а липиды трансметилировали. Результирующий сложный эфир жирных кислот (FAME) экстрагировали в петролейный эфир. Экстрагированный FAME анализировали с помощью жидкостно-газовой хроматографии с капиллярной колонкой (Chrompack, WCOT Fused Silica, CP-WAX-52 CB, 25 м, 0,32 мм) и температурным градиентом от 170 до 240°С за 20 минут и 5 минут при 240°С. Идентичность сложных метиловых эфира моно-, ди-, три- и тетраэновой кислот подтверждается сравнением с соответствующим РАМЕ-стандартом (Сигма). Для три- и тетраиновой кислоты нет сравнительных субстанций. Их идентичность и позиция тройной связи определялась подходящей для этого химический дериватизацией FAME-смесей, например, производными 4,4-диметоксиоксазолина (Кристи, 1998 (Christie, 1998)) посредством газовой хроматографии с масс-спектрометрией (ГХ-МС). Результаты анализа с помощью газовой хроматографии сложных метилэфиров жирных кислот из трансгенных дрожжей, которые трансформируются пустым вектором pYES2, с pYES2-Cerl (Δ6-ацетиленаза), представлены в табл. 1.
Трансгенные клетки дрожжей анализируются без экзогенных жирных кислот или после добавки линоловой кислоты (18:2), γ-линоленовой кислоты (γ-18:3), α-линоленовой кислоты (α-18:3) или ω3-октадекатетраэновой кислоты (18:4).
В таблице 1 представлены результаты ГХ-анализа сложного метилового эфира жирных кислот из трансгенных дрожжей, которые трансформировались пустым вектором pYES2, Δ-6-ацетиленазой (Cer1/pYES2) и Δ6-десатуразой (Cer3/pYES2). Трансгенные клетки дрожжей анализировались без экзогенных жирных кислот (-) или после добавки линоловой кислоты (18:2), γ-линоленовой кислоты (γ-18:3), α-линоленовой кислоты (α-18:3) или ω3-октадекатетраэновой кислоты (18:4). В таблице приводится состав жирной кислоты в [моль %] всех жирных кислот, причем указывается включение насыщенных жирных кислот (черный жирный шрифт), ненасыщенные продукты (красным цветом) и сумма ненасыщенных продуктов (последняя строка) в отдельных опытах по насыщению.
Пример 10:
Производство трансгенных растений, которые переэкспримируют фермент с активностью D6-ацетиленазы/десатуразы
Для трансформации растений производится трансформационный вектор, который лигирует BamHI/Sali-фрагмент из pBS-Cer1 в вектор pBin-USP, расщепленный BamHI/SalI, или в pBinAR. PBinUSP и pBinAR являются производными плазмида pBinl9. PBinAR произошел из pBinl9, причем в pBinl9 (Бивэн и др. (1980) Нукл. Эйсидс Рис. 12, 8711 (Bevan et al. (1980) Nucl. Acids Res. 12, 8711)) вставляется 35S CaMV промотор как фрагмент EcoRI-KpnI (соответственно нуклеотидам 6909-7437 вируса мозаики цветной капусты (Фрэнк и др. (1980) т. 21, 285 (Franck et al. (1980) Cell 21, 285)). Сигнал полиаденилирования гена 3 Т-ДНК Ti-плазмида pTiACHS (Гилен и др. (1984) ЭМБО Ж. 3, 835 (Gielen et al., (1984) EMBO J. 3, 835)), нуклеотид 11749-11939 изолируется как PvulI-HindIII-фрагмент и клонируется после сложения, от Sphl-линкера в Pvull-месте стыка между местом стыка SpHI-HindIII вектора. Возникает плазмид pBinAR (Хефген и Вилльмитцер (1990) Плэнт Сайенс 66, 221-230 (Hofgen und Willmitzer (1990) Plant Science 66, 221-230)), причем путем переклонирования из pBluescript в распоряжении имеются многие стыковочные места рестрикции между промотором и терминатором. USP-промотор (банк генов Accession X56240) соответствует нуклеотидам 1-684, причем часть не кодирующего региона USP-гена не занесена в промотор. Фрагмент промотора, величиной 684 базовых пары, был амплифицирован посредством коммерческого стандартного праймера Т7 (стратагены) и с помощью синтезированного праймера через ПЦР-реакцию с помощью стандартных методов.
(Последовательность праймера: 5'-GTCGACCCGCGGACTAGTGGGCCCTCTAGAC CCGGGGGATCCGGATCTGCTGGCTATGAA-3'). PCR-фрагмент был отрезан EcoRI/SalI и вставлен в вектор pBinAR. Возникает плазмид с обозначением pBinUSP.
Конструкт применяется для трансформации Arabidopsis thaliana и растений рапса.
Регенерировавшие ростки получаются на среде 2MS с канамицином и клафораном, после окорневания вносятся в землю и после культивации растут в течение двух недель в климатической камере или в теплице, доводятся до цветения, собираются спелые семена и исследуются на экспрессию D6-ацетиленазы/десатуразы посредством анализов липидов. Идентифицируются линии с повышенным содержанием ацетиленовых жирных кислот или двойными связями на позиции Δ6. Оказывается, что в стабильно трансформированных трансгенных линиях, которые функционально экспримируют трансген, фиксируется повышенное содержание ацетиленовых жирных кислот и двойных связей на позиции Δ6 по сравнению с нетрансформированными контрольньми растениями.
Пример 11:
Экстракция липидов из семян
Анализ липидов из семян растений протекает аналогично анализу липидов дрожжей. Тем не менее, растительный материал сначала механически гомогенизируется в ступе, чтобы сделать его доступным для экстракции.
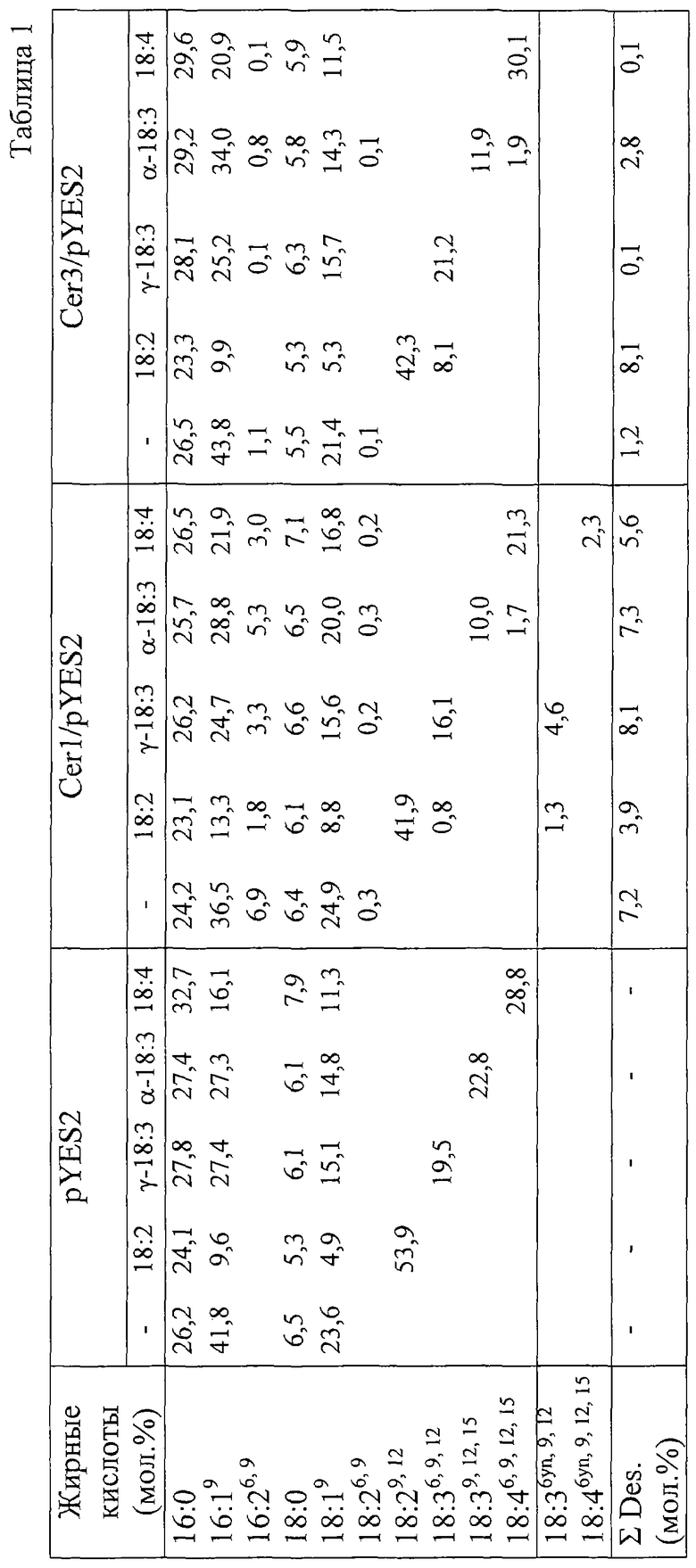













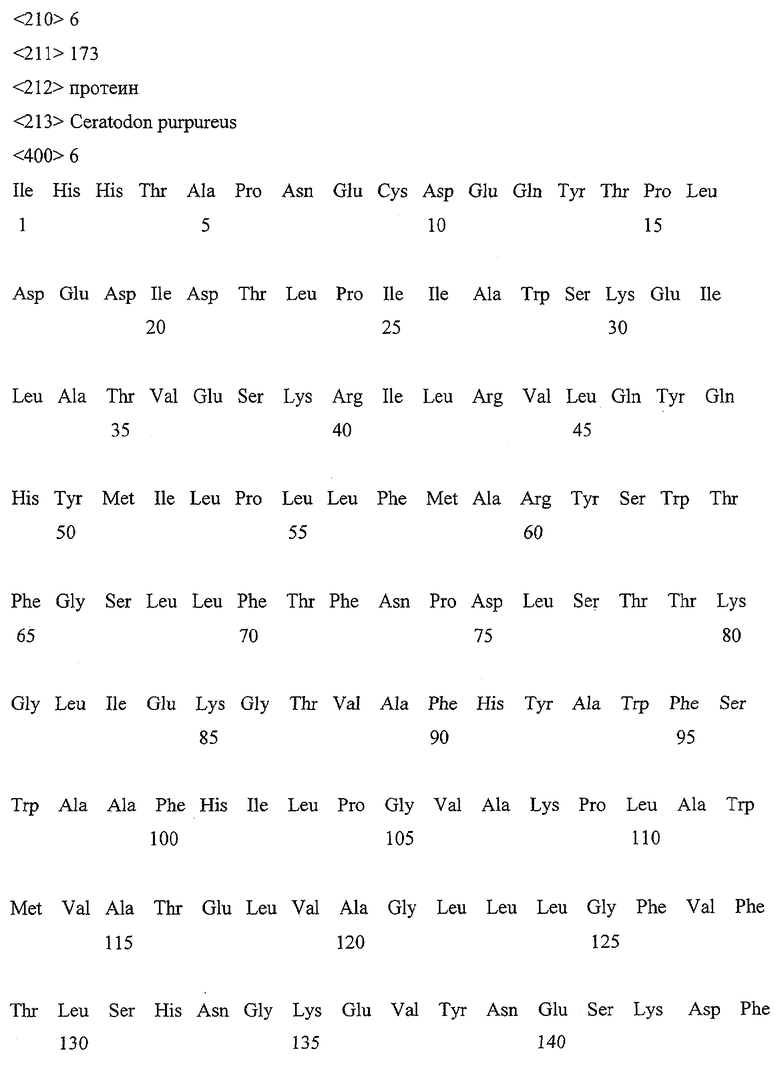










Изобретение относится к биотехнологии. Предложена последовательность нуклеиновой кислоты, которая кодирует полипептид с активностью Δ6-ацетиленазы/Δ6-десатуразы или Δ6-десатуразы, а также сам полипептид. Указанную последовательность нуклеиновой кислоты приводят в контакт с производящим масло организмом с последующей культивацией для выделения триглицеридов, содержащихся в организме. Данное изобретение позволяет получать триглицериды с повышенным содержанием ненасыщенных жирных кислот. 3 н. и 3 з.п. ф-лы, 1 ил., 1 табл.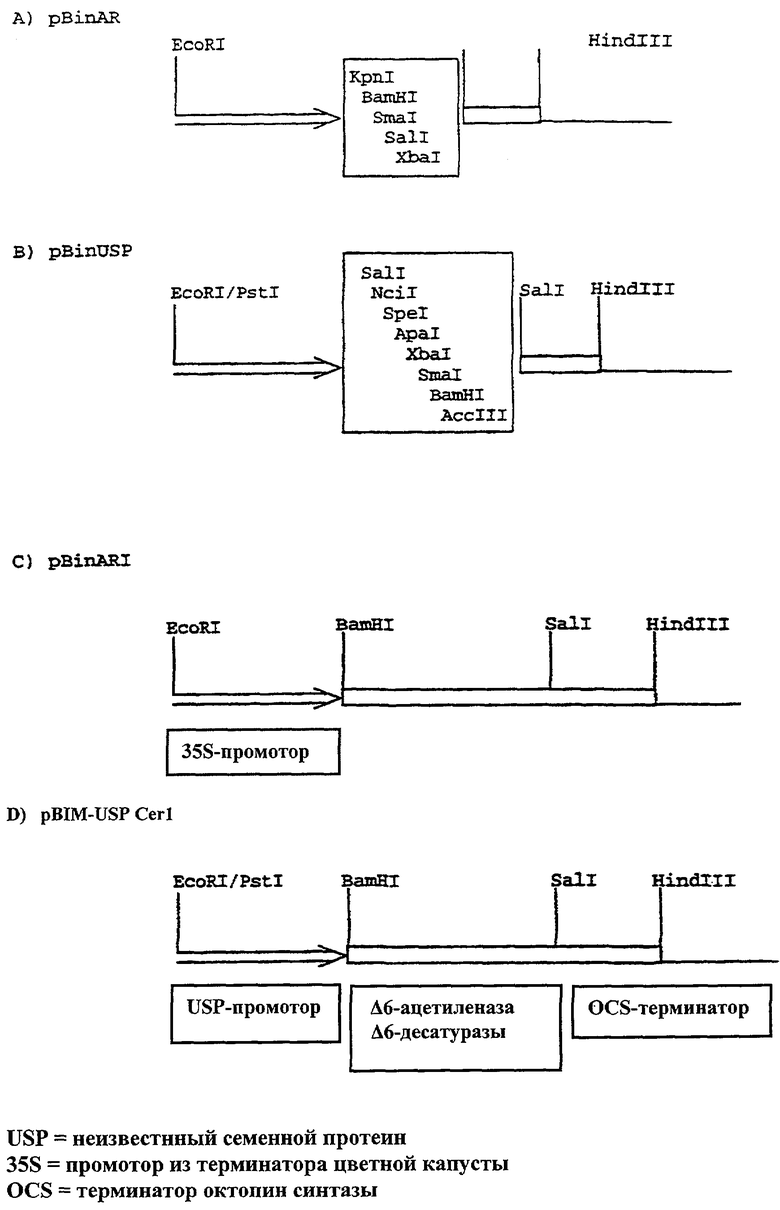
a) последовательности нуклеиновых кислот с представленной в SEQ ID NO:1, SEQ ID NO:3 или SEQ ID NO:11 последовательностью,
b) последовательностей нуклеиновых кислот, которые производятся от последовательности, представленной в SEQ ID NO:1, SEQ ID NO:3 или SEQ ID NO:11, как результат дегенерированного генетического кода,
c) производных последовательности, представленной в SEQ ID NO:1, SEQ ID NO:3 или SEQ ID NO:11, которые кодируют полипептиды с последовательностями аминокислот, представленными в SEQ ID NO:2, SEQ ID NO:4 или SEQ ID NO:12, и имеют, по меньшей мере, 75% гомологии на уровне аминокислот без того, чтобы существенно сокращалось ферментативное действие полипептида.
| G | |||
| KOHN et al, Biosynthesis, of acetylenic fatty acid in the moss Ceratodon purpureus, J | |||
| Plant physiol., vol 144, p.265-271, 1994 | |||
| WO 9621022, 11.07.1996 | |||
| WO 9846763, 22.10.1998 | |||
| WO 9737033, 09.10.1997 | |||
| RU 94030816, 27.03.1996. |
Авторы
Даты
2006-01-27—Публикация
2000-06-07—Подача