Изобретение относится к 3-замещенным производным 3H-2,3-бензодиазепина, способу их получения и к фармацевтической композиции на их основе.
Уже известно, что производные 2,3-бензодиазепинов обладают медикаментозным действием на центральную нервную систему (EP 492485 A1, кл. C 07 D 491/056) и благодаря этому пригодны в качестве лекарственного средства для лечения болезней центральной нервной системы.
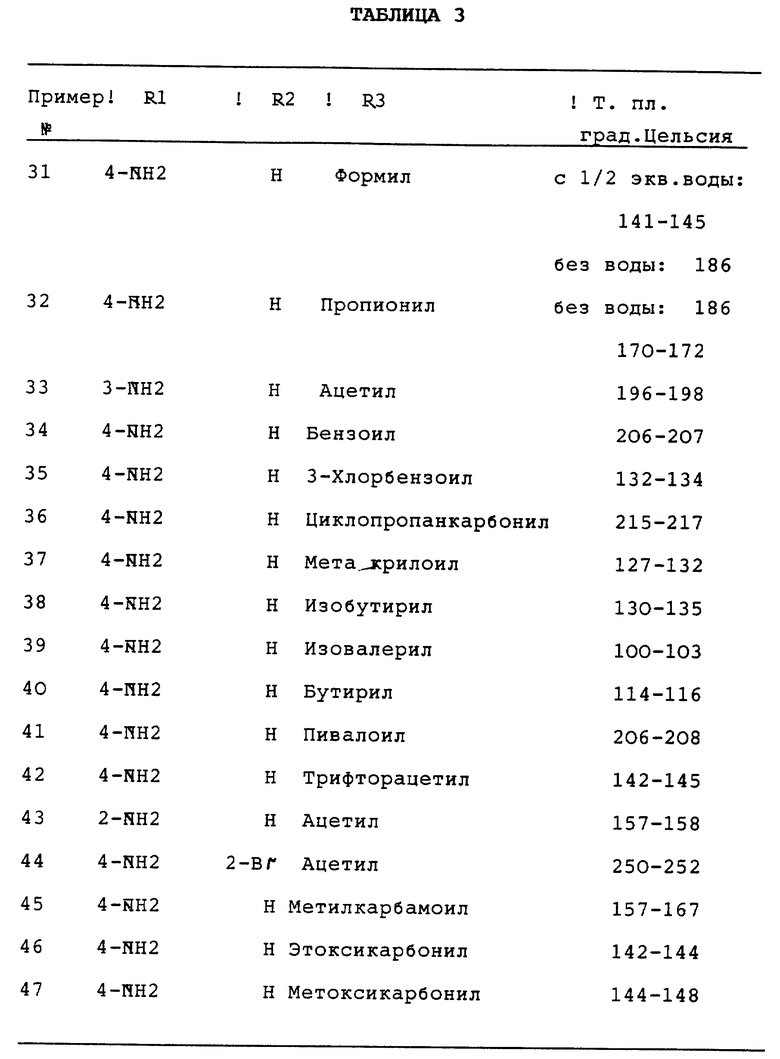
Было найдено, что 3-замещенные производные 3H-2,3-бензодиазепина общей формулы I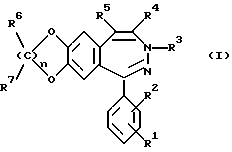
в которой R1 и R2 одинаковы или различны и обозначают водород, (C1-C6)-алкил, нитро, галоген, группу -NR8R9, -O-(C1-C4)-алкил или -CF3,
R3 обозначает группу 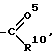
R4 обозначает (C1-C6)-алкил,
R5 обозначает водород
R6 и R7 являются одинаковыми или различными и обозначают водород,
R8 и R9 являются одинаковыми или различными и обозначают водород,
R10 обозначает водород, (C1-C6)-алкил, в случае необходимости однократно или многократно замещенный фтором, фенил, в случае необходимости замещенный галогеном группы NR11R12, -O-(C1-C6)-алкил, (C3-C7)-циклоалкил, (C2-C6)-алкенил или -O-(C3-C7)-циклоалкил,
R11 и R12 являются одинаковыми или различными и обозначают водород, (C1-C6)-алкил,
n обозначает 1, 2 или 3,
а также их физиологически переносимые соли пригодные для лечения болезней центральной нервной системы, причем соединения отличаются в сравнении с названным уровнем техники лучшими свойствами. Так как ни в положении 4, ни в положении 5 нет оптически активного центра, то соединения формулы I легко доступны и без разделения энантиомеров.
Под алкилом следует понимать линейный или разветвленный алкильный остаток, как, например, метил, этил, пропил, изопропил, бутил, изобутил, втор. -бутил, пентил, изопентил или гексил, который - как арильный остаток - может быть при необходимости замещен (C1-C6)-алкокси, галогеном или (C1-C6)-алканоилом.
Если имеется галогенированный алкильный остаток, то он может быть многократно галогенирован или пергалогенирован.
Под галогеном следует понимать фтор, хлор, бром или иод.
Арильный остаток может содержать 6 - 10 атомов углерода, причем предпочтителен фенил.
Под циклоалкилом понимается соответственно циклопропил, циклобутил, циклопентил, циклогексил и циклогептил, в частности (C3-C5)-циклоалкил.
Алкениловые остатки могут быть линейными или разветвленными. Можно назвать, например, 2-пропенил, 3-метил-2-пропенил, 2-бутенил, металлил, винил.
Алканоильные остатки являются производными алифатических карбоновых кислот, как, например, муравьиной, уксусной, пропионовой, масляной, капроновой, валериановой, триметилуксусной и других кислот.
Физиологически переносимые соли являются производными неорганических и органических кислот. Подходящими являются неорганические кислоты, как, например, галогеноводородные кислоты, как-то хлористоводородная, бромистоводородная кислоты, фосфорная, серная кислоты, или органические кислоты, как, например, алифатические или ароматические моно- и дикарбоновые кислоты, как-то муравьиная, уксусная, малеиновая, фумаровая, янтарная, молочная, винная, лимонная, щавелевая, глиоксиловая кислоты или сульфоновые кислоты, например (C1-C4)-алкансульфокислоты, как-то метансульфокислота или, возможно, замещенные галогеном или (C1-C4)-алкилом бензолсульфокислоты, как-то п-толуолсульфокислота.
Соединения формулы (I) включают также E- или Z-изомеры или, если имеется хиральный центр, их рацематы или энантиомеры.
Предпочтительными соединениями общей формулы (I) являются те, в которых R1 обозначает амино или нитро.
Особенно предпочтительны соединения общей формулы (I), в которых обозначают
R1 нитро или амино,
R2 водород,
R3 группу 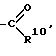
R4 метил или этил,
R5, R6 и R7 водород,
R10 водород, (C1-C6)-алкил, фенил, в случае необходимости замещенный галогеном, группу -NR11R12, (C3-C7)-циклоалкил, (C2-C6)-алкенил, -O-(C1-C6)-алкил или (C1-C6)-алкил, однократно или многократно замещенный фтором,
R11 и R12 одинаковы или различны и обозначают водород, (C1-C4)-алкил или фенил и
n - 1, 2 или 3.
Соединения общей формулы (I), а также их физиологически переносимые соли благодаря их неконкурентному торможению AMPA-рецепторов могут применяться в качестве лекарственных средств. На основе их профиля активности соединения согласно изобретению пригодны для лечения болезней, вызываемых гиперактивностью "возбудительных" (эксцитаторных) аминокислот, например глутамата или аспартата. Так как новые соединения действуют как неконкурентные антагонисты возбудительных аминокислот, то они особенно пригодны для лечения таких болезней, которые вызываются через рецепторы "возбудительных" аминокислот, в частности AMPA-рецептор.
Фармакологическая активность соединений формулы (I) определялась с помощью нижеописанных тестов.
Самцов мышей HMRI весом 18-22 г содержали в контролируемых условиях [12-часовой ритм смены светлого и темного периода (от 6 час до 18 час) при свободном доступе к пище и воде], и принадлежность их к группам выбирали случайно. Группы состояли из 5-16 животных. Наблюдение за животными производилось между 8 и 13 часами.
AMPA впрыскивали в левый желудочек свободно двигающихся мышей. Аппликатор состоял из канюли с устройством из нержавеющей стали, которое ограничивало глубину инъекции 3,2 миллиметрами. Аппликатор был присоединен к инъекционному насосу. Инъекционную иглу вводили перпендикулярно к поверхности черепа по координатам Монтемурро и Дукелов (Montemurro und Dukelow). Животные наблюдались до появления клонических или соответственно тонических судорог до 180 сек. Клонические движения, продолжавшиеся более 5 сек, считались судорогами. Начало клонических судорог использовалось как конечный момент для определения судорожного порога. Доза, которая была необходима, чтобы повысить или соответственно понизить на 50% судорожный порог (THRD50), определялась в 4 - 5 экспериментах. Величину THRD50 и доверительную границу определяли с помощью регрессионного анализа.
Результаты этих опытов показывают, что соединение формулы I и его соли присоединения кислот влияют на функциональные расстройства AMPA-рецептора. Поэтому они пригодны для получения лекарственных средств для симптоматического и превентивного лечения заболеваний, вызываемых изменением функции комплекса AMPA-рецептор. Лечение с помощью соединения согласно изобретению препятствует или замедляет появляющиеся в результате заболевания повреждения клеток и функциональные расстройства и уменьшает возникающие вследствие этого симптомы.
Согласно изобретению соединения могут применяться для лечения нейрологических и психиатрических расстройств, вызываемых чрезмерной стимуляцией AMPA-рецептора. К нейрологическим заболеваниям, которые могут лечиться функционально или профилактически, относятся, например, нейродегенеративные расстройства, такие как болезнь Паркинсона, болезнь Альцгеймера, хорея Хантингтона, боковой амиотрофический склероз и оливомостомозжечковая дегенерация (Olivopontocerebellare Degeneration). Согласно изобретению соединения могут применяться для профилактики постишемической гибели клеток, гибели клеток после мозговой травмы, при инсульте, гипоксии, аноксии и гипогликемии и для лечения старческого слабоумия, Aids Demenz, нейрологических симптомов, связанных с ВИЧ-инфекцией, мультиинфарктного слабоумия, а также эпилепсии и мышечной спастики. К психиатрическим заболеваниям относятся состояния страха, шизофрения, мигрень, состояния боли, а также лечение расстройств сна и симптоматика запрещения после злоупотребления наркотиками, как, например, при запрещении алкоголя, кокаина, бензодиазепина или опиата. Соединения, кроме того, могут найти применение в профилактике развития толерантности во время длительного лечения седативными лекарствами, как, например, бензодиазепинами, барбитуратами и морфином. Кроме того, соединения могут использоваться в качестве анестетиков (наркоз), антианальгетиков или антиэметиков.
Для применения соединений согласно изобретению в качестве лекарственных средств их переводят в форму фармацевтического препарата, который наряду с активным веществом содержит пригодные для энтеральной или парентеральной аппликации фармацевтические, органические или неорганические инертные вещества-носители, как, например, воду, желатину, гуммиарабик, молочный сахар, крахмал, стеарат магния, тальк, растительные масла, полиалкиленгликоли и т. д. Фармацевтические препараты могут быть в твердой форме, например в виде таблеток, драже, суппозиториев, капсул, или в жидкой форме, например в виде растворов, суспензий или эмульсий. Сверх того, они могут содержать вспомогательные вещества, как-то консервирующие, стабилизирующие, смачивающие средства или эмульгаторы, соли для изменения осмотического давления или буфера.
Для парентерального применения пригодны, в частности, инъекционные растворы или суспензии, в частности водные растворы активных соединений в полигидроксиэтоксилированном касторовом масле.
В качестве систем-носителей могут применяться также поверхностно-активные вспомогательные вещества, такие как соли желчных кислот или животные или растительные фосфолипиды и их смеси, а также липосомы или их компоненты.
Для орального применения пригодны, в частности, таблетки, драже или капсулы с тальком и/или углеводородным носителем или связующим, как, например, лактозой, кукурузным или картофельным крахмалом. Применение возможно также и в жидком виде, например в виде сока, в который при необходимости добавлено сладкое вещество. Дозировка активных веществ может варьировать в зависимости от пути введения, возраста и веса пациента, вида и тяжести лечимого заболевания и подобных факторов. Ежедневная доза составляет 0,5-1000 мг, предпочтительно 50-200 мг, причем доза может даваться как однократно вводимая разовая доза, так и в виде двух или нескольких дробных дневных доз.
Соединения согласно изобретению получают известными методами. Например, соединение формулы I получают тем, что соединение общей формулы II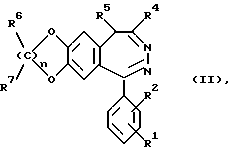
в которой R1, R2, R4, R5, R6, R7 и n имеют указанные в общей формуле I значения, ацилируют и при необходимости каталитически восстанавливают нитрогруппу при R1 и/или R2 и затем при необходимости ацилируют, алкилируют, галогенируют, вводят с органическими аминами карбамоильную группу или со спиртами сложноэфирную группу, отделяют изомеры или образуют соли.
Ацилирование можно проводить с растворителем или без него при комнатной или повышенной температуре обычными ацилирующими средствами. В качестве ацилирующих средств пригодны ангидриды или галогенангидриды кислот. В качестве ангидридов могут применяться смешанные или также симметричные ангидриды. Если ацилирование производится эфирами хлормуравьиной кислоты, например фениловым эфиром хлормуравьиной кислоты, то путем последующей реакции с первичными и вторичными органическими аминами, такими как метиламином, получают соответствующие карбамоильные соединения, или же путем реакции со спиртами, такими как, например, метанолом, этанолом, в случае необходимости в присутствии каталитических количеств NaCN вводят соответствующую сложноэфирную группу.
Восстановление в нитрогруппе проводят в полярных растворителях при комнатной или повышенной температуре. В качестве катализаторов окисления пригодны металлы, такие как никель Ренея, или катализаторы из благородных металлов, например палладий или платина, в случае необходимости на носителях. Вместо водорода могут быть использованы известным образом также, например, формиат аммония или гидразин. Также могут применяться восстановители, такие как хлорид олова (II) или хлорид титана (III), а также комплексные гидриды металлов, возможно в присутствии солей тяжелых металлов. В качестве восстановителя пригодно также железо. Тогда реакция проводится в присутствии кислоты, например уксусной кислоты, или хлорида аммония, в случае необходимости с добавкой растворителя, например воды или метанола.
Если желательно провести алкилирование аминогруппы, то алкилировать можно известными методами - например с алкилгалогенидами - или по варианту Мицонубо (Mitsonubo) взаимодействием со спиртом в присутствии трифенилфосфина и эфира азодикарбоновой кислоты, или же подвергая амин восстановительному аминированию с альдегидами или кетонами, в случае необходимости последовательно с двумя различными карбонильными соединениями, получая при этом смешанные производные [Литература, например, Veraldo et al, Synthesis (1993), 121; Synthesis (1991), 447; Kawaguchi, Synthesis (1985), 701; Micovic et al, Synthesis (1991), 1043].
Ацилирование аминогруппы проводят обычным образом, например с галогенангидридом или ангидридом кислоты, в случае необходимости в присутствии основания, такого как диметиламинопиридин, в растворителях, таких как метиленхлорид, тетрагидрофуран или пиридин, по варианту Шоттен-Бауманна (Schotten-Baumann) в водном растворе при слабощелочном pH, или путем взаимодействия с ангидридом в ледяной уксусной кислоте.
Введение галогенов - хлора, брома или иода - через аминогруппу можно осуществлять, например, также по Сандмайеру (Sandmeyer), подвергая образующиеся в виде промежуточных продуктов с нитритами соли диазония взаимодействию с хлоридом меди (1) или бромидом меди (1) в присутствии соответствующей кислоты, например соляной или бромистоводородной кислоты, или с иодидом калия. Если используется органический эфир азотистой кислоты, то галогениды можно вводить, например, добавляя метилениодид или тетрабромметан в растворителе, например диметилформамиде.
Введение фтора удается, например, по реакции Бальц-Шимана (Balz - Schiemann) с диазонийтетрафторборатом.
Смеси изомеров могут быть разделены на энантиомеры и/или E/Z-изомеры обычными методами, например кристаллизацией, хроматографией или солеобразованием.
Соли получают обычным способом, смешивая раствор соединения формулы (I) с эквивалентным количеством или избытком кислоты, которая также может быть и в растворе, и отделяя осадок или обычным образом перерабатывая раствор.
Поскольку получение исходных соединений не описывается, они известны или же получаются аналогично известным соединениям (см., например, DE 3527117, Brevet d'invention 879404, EP 0492485, HU 191702, FR 2566774, HU 194550, HU 194529, BP 2034706).
Нижеследующие примеры поясняют получение соединений согласно изобретению, не ограничивая его.
Пример 1.
7-Ацетил-5-(4-нитрофенил)-8-метил-7H-1,3-диоксоло[4,5-h][2,3]- бензодиазепин
Суспензию 1,0 г (3,1 ммоля) 5-(4-нитрофенил)-8-метил-9H-7H-1,3-диоксоло[4,5-h] [2,3] -бензодиазепина в 10 мл ацетангидрида нагревают 7 часов до 130-140 град. Цельсия. Раствор выливают на лед, осадок отсасывают. Получают 0,99 г (87% от теории) желтого порошка. После мгновенной хроматографии (flash chromatography) этого сырого продукта на кизельгеле 60 с бензол/уксусным эфиром (4:1) в качестве растворителя получают после объединения соответствующих фракций и концентрирования 0,78 г (70% от теории) 7-ацетил-5-(4-нитрофенил)-8-метил-7H-1,3-диоксоло-[4,5-h] [2,3] -бензодиазепина в виде твердого вещества с точкой плавления 200-202 град. Цельсия. Пробу перекристаллизовывают из этанола и тогда она имеет температуру плавления 205-207 град. Цельсия (легкое разложение).
Аналогично получают:
7-ацетил-5-(4-N-ацетиламинофенил)-8-метил-7H-1,3-диоксоло [4,5-h]-[2,3] -бензодиазепин
Пример 2.
7-Ацетил-5-(4-аминофенил)-8-метил-7H-1,3-диоксоло[4,5-h] [2,3] - бензодиазепин
К суспензии 0,6 г (1,64 ммоля) 7-ацетил-5-(4-нитрофенил)-8-метил-7H-1,3-диоксоло[4,5-h] [2,3] - бензодиазепина в 40 мл метанола добавляют 0,1 г никеля Ренея и 0,25 мл (4,93 ммоля) 98%-ного гидразингидрата. Смесь перемешивают 0,5 часа. Исходный материал растворяется в течение нескольких минут. После того как реакция закончится катализатор отфильтровывают. Фильтрат концентрируют в вакууме. Остаток перемешивают в воде, отсасывают и промывают водой. Получают 0,49 г 7-ацетил-5-(4-аминофенил)-8-метил-7H-1,3-диоксоло[4,5-h][2,3]-бензодиазепина с точкой плавления 175-180 град. Цельсия. Перекристаллизация этого сырого продукта из 50%-ного водного этанола дает 0,46 г (79%) 7-ацетил-5-(4-аминофенил)-8-метил-7H-1,3-диоксоло[4,5-h][2,3]- бензодиазепина с точкой плавления 208-210 град. Цельсия. 1H-NMR (CDCl3) d: 2,23 (s, 3H), 2,26 (br s, 3H), 4,02 (br s, 2H), 5,97 (br s, 1H), 6,05 (br s, 1H), 6,32 (br s, 1H), 6,64 (d, 2H), 6,74 (s, 2H), 7,33 (d, 2H).
Элементарный анализ. Рассчитано для C19H17N3O3•H2O (353,36):
C 64,68%, H 5,42%; N 11,89%. Найдено: C 64,74%, H 4,89%; N 11,92%.
Примеры 3 - 18.
Аналогично примеру 1 получают описанные в таблице 1 соединения формулы I, в которой R5, R6 и R7 обозначают водород, n=1 и R4 обозначает метил.
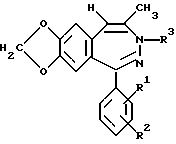
Пример 19.
1-Циклопропанкарбонил-8-метил-5-фенил-7H-1,3-диоксоло[4,5-h] [2,3] - бензодиазепин
Суспензию 0,56 г (2,0 ммоля) 8-метил-5-фенил-9-H-1,3-диоксоло[4,5-h] [2,3] -бензодиазепина и 0,41 г (3,0 ммоля) карбоната калия в 15 мл бензола нагревают до кипения и добавляют 0,31 г (3,0 ммоля) циклопропанкарбонилхлорида. При этой температуре дополнительно перемешивают 1,5 часа и затем фильтруют. После удаления растворителя остаток хроматографируют на кизельгеле 60 с гексан/этилацетатом 2:1 в качестве элюента. После кристаллизации главной фракции из этанола получают 0,35 г (50%) указанного в заголовке соединения с точкой плавления 165-166 град. Цельсия.
Примеры 20 - 26.
Аналогично примеру 19 получают описанные в таблице 1 соединения формулы I, в которой R5, R6 и R7 обозначают водород, n = 1 и R4 обозначает метил.
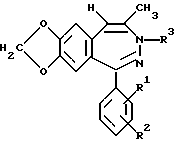
Пример 27.
7-Формил-5-(4-нитрофенил)-8-метил-7H-1,3-диоксоло[4,5-h] [2,3] - бензодиазепин
Аналогично примеру 1 получают указанное в заголовке соединение со смесью из ацетангидрида и 98%-ной муравьиной кислоты 3:1. После хроматографии на кизельгеле с бензол/этилацетатом 4:1 в качестве элюента получают коричневые кристаллы, точка плавления 123-127 град. Цельсия (36%).
Пример 28.
7-Этоксикарбонил-5-(4-нитрофенил)-8-метил-7H-1,3-диоксоло[4,5] [2,3] - бензодиазепин
Нагревают при перемешивании обратным потоком 5-(4-нитрофенил)-8-метил-9H-1,3-диоксоло[4,5-h] -2,3] -бензодиазепин (0,323 г, 1,0 ммоль), безводный карбонат калия (0,28 г, 2,0 ммоля), этиловый эфир хлормуравьиной кислоты (0,12 мл, 1,2 ммоля) и безводный бензол. Соответственно через 1 час и через 12 часов добавляют этиловый эфир хлормуравьиной кислоты (0,12 мл) и карбонат калия (0,28 г). Через 18 часов отфильтровывают, концентрируют и остаток хроматографируют над кизельгелем с элюатом бензол/этилацетат. Получают 92 мг желтых аморфных кристаллов (23%), которые без очистки перерабатывают дальше.
Пример 29.
8-Метил-7-метилкарбамоил-5-(4-нитрофенил)-7H-1,3-диоксоло[4,5-h] [2,3] - бензодиазепин
A: Смесь 5-(4-нитрофенил)-8-метил-9H-1,3-диоксоло-[4,5-h] [2,3]-бензодиазепина (1,61 г, 5,0 ммоля), фенилового эфира хлормуравьиной кислоты (1,5 мл, 12,0 ммоля), карбоната калия (1,4 г, 10 ммоля) и бензола (50 мл) нагревают 1,5 часа при перемешивании с обратным потоком. Реакционную смесь подвергают горячей фильтрации, концентрируют и остаток перемешивают с 15 мл уксусного эфира.
B: Полученный на стадии A остаток смешивают с 10 мл диметилформамида и 3 мл 40%-ного раствора метиламина в воде, нагревают до 100 град. Цельсия и через 16 часов выливают в воду. После экстракции хлороформом перерабатывают обычным образом и получают 0,307 г указанного в заголовке соединения (16%).
Пример 30.
8-Метил-7-метоксикарбонил-5-(4-нитрофенил)-7H-1,3-диоксоло [4,5-h][2,3] -бензодиазепин
1,85 г (3,9 ммоля) полученного по примеру 29, стадия A, продукта смешивают с 90 мл безводного метанола и 15 мл 50%-ного раствора метиламина в метаноле. Добавляют каталитическое количество NaCN и 18 ч нагревают при 90 град. Цельсия. Перерабатывают обычным образом. После хроматографии с бензол/этилацетатом 2:1 получают 0,44 г (30%) целевого соединения.
Примеры 31 - 37.
Аналогично примеру 2 получают описанные в таблице 3 соединения формулы I, в которой R4 обозначает метил, n=1, R5, R6 и R7 обозначают водород.
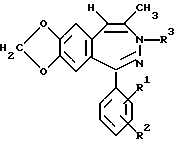
Пример 48.
7-Ацетил-5-(4-нитрофенил)-8-этил-7H-1,3-диоксоло[4,5-h] [2,3]-бензодиазепин
A: 7-Этил-5-(4-нитрофенил)-1,3-диоксоло[4,5g]изохроман
Восстанавливают 1-(3-бенздиоксол-5-ил)-бутан-2-он (Nichols et al. J. Med. Chem: 1986, 29, 2009) до соответствующего изобутанола и подвергают этот последний взаимодействию с 4-нитробензальдегидом по венгерскому патенту HU 194550 (C.A.105, 1986, 226357 V), получая целевое соединение. Выход 85%, точка плавления 116-118 град. Цельсия (метанол).
B: Перхлорат 7-этил-5-(4-нитрофенил)-1,3-диоксоло[4,5-g][2]-бензопирилия
Полученное на стадии A изохромановое соединение окисляют по венгерскому патенту HU 194529 (C.A. 105, 1986, 152712h) до соответствующего дикетона, который 70%-ной HClO4 переводят в соль бензопирилия. Выход 50%, точка плавления 243-245 град. Цельсия (разложение).
C: 8-Этил-5-(4-нитрофенил)-9H-1,3-диоксоло[4,5-h][2,3]-бензодиазепин
Полученную на стадии B соль пирилия подвергают реакции с гидразингидратом по британскому патенту BR 2034706 (C.A. 94, 1981, 103443S), получая 9-H-2,3-бензодиазепин. Выход 88%, точка плавления 218-220 град. Цельсия (диметилформамид).
D: Полученный на стадии C продукт ацетилируют аналогично примеру 1. Получают целевое соединение с точкой плавления 132-134 град. Цельсия (этанол), выход 33%.
Пример 49.
7-Ацетил-5-(4-аминофенил)-8-этил-7H-1,3-диоксоло[4,5-h] [2,3]-бензодиазепин
Полученное по примеру 48 соединение восстанавливают аналогично примеру 2. Выход 45%, точка плавления 136-138 град.Цельсия (этанол/вода 1:1).
Пример 50.
8-Ацетил-9-метил-6-(4-нитрофенил)-8H-2,3-дигидро-1,4- диоксано[2,3-h] [2,3]-бензодиазепин
A: Перхлорат 6,7-дигидрокси-3-метил-1-(4-нитрофенил)-2-бензопирилия
44,0 г перхлората 3-метил-6,7-диметокси-1-(4-нитрофенил)-2-бензопирилия (C. A. 105, 1986, 152712h) прибавляют к раствору 46,3 г AlCl3 в 170 мл нитрометана и нагревают 4 часа до кипения. Растворитель удаляют, остаток обрабатывают 500 мл охлажденного 50%-ного раствора HCl и полученный продукт промывают холодной водой. Получают 43,5 г продукта-сырца, который смешивают со 130 мл уксусной кислоты, нагревают до кипения и смешивают с 13,3 мл 70/%-ной HClO4. После охлаждения получают 30,0 г указанного в заголовке соединения (73%) с точкой плавления 253-255 град.Цельсия (разл.уксусный эфир).
B: 7,8-Дигидрокси-4-метил-1-(4-нитрофенил)-5H-2,3-бензодиазепин
Соединение со стадии A реакции приводят во взаимодействие с гидразингидратом аналогично C.A. 94, 1981, 1034435, получая соединение, указанное в заголовке, точка плавления 254-256 град.Цельсия (разложение).
C: 9-Метил-6-(4-нитрофенил)-10H-2,3-дигидро-1,4-диоксано[2,3-h] [2,3] - бензодиазепин
К суспензии 3,0 г полученного на стадии B реакции соединения в 37 мл сухого диметилформамида (DMF) добавляют 4,8 г KF и 1,12 мл 1,2-дибромметана и перемешивают смесь один час при 110-112 град.Цельсия. После охлаждения реакционную смесь выливают в 250 мл воды, продукт отфильтровывают, промывают водой и обрабатывают обычным образом. Получают 1,42 (44%) указанного в заголовке соединения с точкой плавления 228-230 град.Цельсия (разложение).
D: Полученное на стадии C реакции соединение ацетилируют аналогично примеру 1, выход составляет 82%, точка плавления 226-228 град.Цельсия.
Пример 51.
8-Ацетил-9-метил-6-(4-аминофенил)-8H-2,3-дигидро-1,4-диоксано [2,3-h] [2,3]-бензодиазепин
Полученное по примеру 50 соединение восстанавливают аналогично примеру 2. Выход 72%, точка плавления 231-233 град.Цельсия (разложение).
Пример 52.
9-Ацетил-10-метил-7-(4-нитрофенил)-2,3,4,9-тетрагидро-1,5- диоксепино-[2,3-h][2,3]-бензодиазепин
A: 10-Метил-7-(4-нитрофенил)-2,3,4,11-тетрагидро-1,5-диоксепино[2,3-h] [2,3]-бензодиазепин
Способ, описанный на стадии C реакции примера 50, проводят с 1,3-дибромпропаном и получают указанное в заголовке соединение с 62%-ным выходом с точкой плавления 204-206 град.Цельсия (диметилформамид/вода 10:1).
B: Ацетилируют аналогично примеру 1 и получают соединение, указанное в заголовке, с 65%-ным выходом с точкой плавления 202-204 град.Цельсия.
Пример 53.
9-Ацетил-10-метил-7-(4-аминофенил)-2,3,4,9-тетрагидро-1,5- диоксепино[2,3-h][2,3]-бензодиазепин
Полученное по примеру 52 соединение восстанавливают аналогично примеру 2 и получают целевое соединение с 66%-ным выходом с точкой плавления 183-184 град.Цельсия.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 2,3-БЕНЗОДИАЗЕПИНА, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ИХ ПОЛУЧЕНИЯ И СРЕДСТВО, ОБЛАДАЮЩЕЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ АМРА-РЕЦЕПТОРОВ | 1997 |
|
RU2179557C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ 2,3-БЕНЗОДИАЗЕПИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ | 2000 |
|
RU2243228C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ДИГИДРО-2,3-БЕНЗОДИАЗЕПИНА И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1995 |
|
RU2151149C1 |
| ПРОИЗВОДНЫЕ 8-ЗАМЕЩЕННОГО-9H-1,3-ДИОКСОЛ/4,5-h//2,3/БЕНЗОДИАЗЕПИНА, ЯВЛЯЮЩИЕСЯ ИНГИБИТОРАМИ AMPA/КАИНАТНОГО РЕЦЕПТОРА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ | 1998 |
|
RU2208013C2 |
| АНЕЛЛИРОВАННЫЕ β--КАРБОЛИНЫ | 1996 |
|
RU2169148C2 |
| ДИГИДРОБЕНЗОДИАЗЕПИНЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2000 |
|
RU2247115C2 |
| ПРОИЗВОДНЫЕ 1,3-ДИОКСОЛ/4,5-h//2,3/БЕНЗОДИАЗЕПИНА, ЯВЛЯЮЩИЕСЯ ИНГИБИТОРАМИ AMPA/КАИНАТНОГО РЕЦЕПТОРА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, СПОСОБ ЛЕЧЕНИЯ | 1998 |
|
RU2208014C2 |
| ПРОИЗВОДНЫЕ ХИНОКСАЛИНДИОНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 1994 |
|
RU2140420C1 |
| 17-ДИФТОРМЕТИЛЕН-ЭСТРАТРИЕНЫ, СОЕДИНЕНИЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1996 |
|
RU2155770C2 |
| ПРОИЗВОДНЫЕ ПИРИДО(1,2,3-DE)ХИНОКСАЛИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1994 |
|
RU2140924C1 |


Описываются новые 3-замещенные производные 3Н-2,3-бензодиазепина общей формулы I, где значения R1-R7, n указаны в п.1 формулы изобретения, а также их физиологически переносимые соли, обладающие АМРА-антагонистической активностью. Они могут найти применение в составе лекарственного средства для лечения нейрологических и психиатрических расстройств, таких как болезнь Паркинсона, болезнь Альцгеймера, боковой амиотрофический склероз и др. Описываются также способ их получения и фармацевтическая композиция на их основе. 3 с. и 3 з.п. ф-лы, 3 табл.
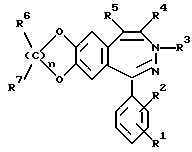
в которой R1 и R2 одинаковые или различные и обозначают водород, (С1-С6)алкил, нитро, галоген, группу -N R8R9, или -О-(С1-С4)алкил или -CF3,
R3 обозначает группу 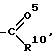
R4 обозначает (С1-С6)алкил;
R5 обозначает водород;
R6 и R7 обозначают водород;
R8 и R9 обозначают водород;
R10 обозначает водород, (С1-С6)алкил, в случае необходимости однократно или многократно замещенный фтором, фенил, в случае необходимости замещенный галогеном, группы -NR11R12, -О-(С1-С6)алкил, (С3-С7)циклоалкил, (С2-С6)алкенил или -О-(С3-С7)циклоалкил;
R11 и R12 одинаковые или различные и обоначают водород, или (C1-C6)алкил;
n обозначает 1, 2 или 3,
а также их физиологически переносимые соли.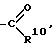
R4 обозначает (С1-С6)алкил, R5 обозначает водород, R6 и R7 обозначают водород, R8 и R9 обозначают водород, R10 обозначает водород, в случае необходимости замещенный однократно или многократно фтором (С1-С6)алкил, фенил, в случае необходимости замещенный галогеном, группу -NR11R12, -О-(С1-С6)алкил, (С3-С7)циклоалкил, (С2-С6)алкенил или -О-(С3-С7)циклоалкил, R11 и R12 одинаковые и различные и обозначают водород или (С1-С6)-алкил, n = 1, 2 или 3, а также их физиологически переносимые соли.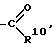
R4 метил или этил, R5, R6 и R7 - водород, R10 - водород, (С1-С6)алкил, фенил, в случае необходимости замещенный галогеном, группу -NR11R12, (С3-С7)циклоалкил, (С2-С6)алкенил, -О-(С1-С6)алкил или (С1-С6)алкил, однократно или многократно замещенный фтором, R11 и R12 одинаковые или различные и обозначают водород или (С1-С6)-алкил, n = 1, 2 или 3, а также их физиологически переносимые соли.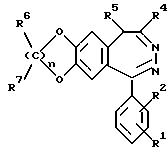
в которой R1, R2, R4, R5, R6, R7 и n имеют указанные в общей формуле I значения,
ацилируют и в случае необходимости каталитически восстанавливают нитрогруппу при R1 и/или R2 и затем в случае необходимости ацилируют, алкилируют, галогенируют, вводят с органическими аминами карбамоильную группу или со спиртами сложноэфирную группу или образуют соли.
| Телефонное реле | 1916 |
|
SU2118A1 |
| Катодный усилитель | 1923 |
|
SU492A1 |
| Способ получения морфия из опия | 1922 |
|
SU127A1 |
Авторы
Даты
2000-03-20—Публикация
1995-07-28—Подача