Изобретение относится к анеллированным β-карболинам, их получению и применению в лекарственных средствах.
Из многочисленных публикаций известно, что β-карболины обладают сродством к бензодиазепиновым рецепторам, хотя структурно они отличаются от бензодиазепинов, и на основании сродства к бензодиазепиновым рецепторам используются в качестве психофармацевтических средств. β-карболины могут воздействовать на известные свойства бензодиазепиновых рецепторов антагонистически, агонистически или инверсноагонистически.
В настоящее время найдено, что предлагаемые согласно изобретению соединения обладают очень хорошим сродством к бензодиазепиновым рецепторам и воздействуют специфически инверсноагонистически на известные свойства бензодиазепинов. Соединения обладают анксиолитической, антиамнестической и ноотропной активностями и улучшают способность к обучению и внимательность. На основании своего профиля действия предлагаемые согласно изобретению соединения пригодны для получения лекарственных средств для лечения гериатрических недугов, а также для уменьшения когнитивных дефицитов и для улучшения состояния в отношении бессонницы, без появления отягчающих побочных действий.
Изобретение относится к соединениям формулы (I):
их изомерам, таутомерам и солям, причем в формуле (I) R3 означает водород, (C1-C6)-алкил, -CO-R1, -C≡N, фенил, который в случае необходимости от одно- до трехкратно замещен (C1-C4)-алкилом, (C1-C4)-алкоксилом, галогеном или -CF3,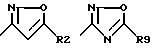
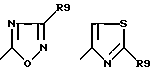
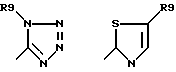
R4 означает водород, (C1-C6)-алкил, (C1-C4)-алкокси-(C1-C2)-алкил;
A означает 5-6-членный ненасыщенный цикл, в котором 1-2 атома углерода могут быть заменены на азот, кислород и/или серу и который может быть замещен с помощью R5 и R6, причем R5 и R6 являются одинаковыми или разными и означают водород, (C1-C6)-алкил, (C1-C6)-алкоксил, гидроксил, который может быть функционально изменен, NR7R8, COR, (C1-C6)-алкил, который, в случае необходимости, замещен функционально измененным гидроксилом, (C1-C4)-алкоксилом или галогеном; (C6-C12)-арил или 5-6-членный гетероарильный остаток, который содержит от одного до трех атомов азота, кислорода и/или серы, и арильный и гетероарильный остаток может быть замещен (C1-C4)-алкилом, (C1-C4)-алкоксилом, галогеном или CF3; или
R5 и R6 совместно означают (CH2)nгруппу; и
R1 и R означают гидроксил, (C1-C6)-алкоксил или NR10R11;
R2 означает водород, (C1-C4)-алкил или (C1-C4)-алкокси-(C1-C2)-алкил;
R9 означает водород или (C1-C6)-алкил;
n означает 3 или 4;
R7 и R8, каждый, означают водород, (C1-C6)-алкил, ацил или фенил, который может быть замещен (C1-C4)-алкилом, (C1-C4)-алкоксилом, галогеном или трифторметилом;
R10 и R11, каждый, означают водород, (C1-C6)-алкил, (C3-C7)-циклоалкил или (C6-C12)-арил или 5-6-членный гетероарильный остаток, который содержит от одного до трех атомов азота, кислорода и/или серы, и причем арильный и гетероарильный остаток может быть замещен (C1-C4)-алкилом, (C1-C4)-алкоксилом, галогеном или CF3.
Алкил, смотря по обстоятельствам, включает как линейные, так и разветвленные остатки, как, например, метил, этил, пропил, изопропил, бутил, изобутил, втор.-бутил, трет.-бутил, пентил, изопентил и гексил.
В качестве арильного остатка R5, R6, R10 или R11 следует, например, назвать фенил, бифенил и α- или β-нафтил, которые, возможно, 1-3-кратно замещены.
Если R5, R6, R10 или R11 означают гетероарильный остаток, то имеют в виду шестичленные гетероароматические соединения, содержащие вплоть до трех атомов азота, и пятичленные гетероароматические соединения, содержащие от одного до двух атомов О, S и/или N, как, например, триазин, пиридин, пиримидин, пиразин, пиридазин, фуран, тиофен, пиррол, имидазол, тиазол, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил, которые могут быть 1-3-кратно замещены.
Под галогеном, смотря по обстоятельствам, нужно понимать фтор, хлор, бром и йод.
Циклоалкил, смотря по обстоятельствам, означает циклопропил, циклобутил, циклопентил, циклогексил, циклогептил.
Алкильный остаток R5, R6 может быть 1-3-кратно замещен или также может быть пергалогенирован.
Гидроксильные группы могут быть функционально изменены, например, путем этерификации с образованием простого или сложного эфира. В качестве простых эфирных и ацильных остатков используют известные специалисту остатки. Предпочтительными являются легко отщепляющиеся простые эфирные остатки, как, например, тетрагидропиранильный, тетрагидрофуранильный, трет-бутилдиметилсилильный, трет-бутилдифенилсилильный, трибензилсилильный остаток. В качестве ацильных остатков используют, например, (C1-C6) -алканоил, как ацетил, пропионил, бутирил и бензоил.
Если присутствуют насколько гидроксильных групп, то могут иметься в виду циклические ацетали или кетали, как 1,3-диоксановые или 1,3-диоксолановые остатки, как 2-фенил-1,3-диоксан, 2,2-диметил-1,3-диоксолан, которые получаются, например, путем введения во взаимодействие с ацетоном, простым енольным эфиром, 1,1-дигалогеналканом или ацетондиметилкеталем.
Ацильная группа R7 или R8 включает ароматические и алифатические ацильные группы, как бензоил и от однократно до трехкратно замещенные бензоилы, а также линейные или разветвленные алканоилы с количеством атомов углерода вплоть до 6.
Если A означает гетероароматический пятичленный цикл, то он может включать следующие группировки: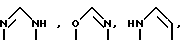

В качестве гетероароматического шестичленного цикла следует указать, например, следующие группировки: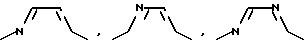
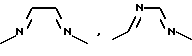
Заместители R5 и R6, смотря по обстоятельствам, могут находиться в любом положении остатка А или его таутомерных или изомерных форм. В качестве предпочтительных форм остатка R3 нужно рассматривать COR1, а остатков R1 и R-гидроксил и (C1-C6)-алкоксил. Если присутствует основная функциональная группа, то образуются физиологически приемлемые соли неорганических и органических кислот. Пригодны неорганические кислоты, такие, как, например, соляная кислота, бромоводородная кислота, серная кислота, или органические кислоты, такие, как, например, алифатические или ароматические моно- или дикарбоновые кислоты, как муравьиная кислота, уксусная кислота, малеиновая кислота, фумаровая кислота, янтарная кислота, молочная кислота, винная кислота, лимонная кислота, щавелевая кислота, глиоксиловая кислота, или сульфокислоты, например, (C1-C4)-алкансульфокислоты, такие, как метансульфокислота, или возможно замещенные галогеном или (C1-C4)-алкилом бензолсульфокислоты, как п-толуолсульфокислота.
Если присутствует кислотная функция, то в качестве солей пригодны физиологически приемлемые соли органических оснований, как, например, хорошо растворимые соли щелочных и щелочноземельных металлов, а также соли N-метилглюкамина, диметилглюкамина, этилглюкамина, лизина, 1,6-гексадиамина, этаноламина, глюкозамина, саркозина, серинола, трис-гидроксиметиламинометана, аминопропандиола, основания Совака, 1-амино-2,3,4-бутантриола.
Соединения формулы (I), а также их соли на основании их сродства к бензодиазепиновым рецепторам используют в качестве лекарственного средства. Они обладают различной, присущей им активностью (то есть агонистической, антагонистической и/или инверсноагонистической активностью) по отношению к различным изоформам бензодиазепинового рецептора гамма-аминомасляной кислоты.
Для применения предлагаемых согласно изобретению соединений в качестве лекарственных средств из них получают лекарственную форму, которая наряду с активным веществом содержит пригодные для энтерального или парентерального введения фармацевтические, органические или неорганические, инертные носители, как, например, вода, желатин, гуммиарабик, молочный сахар, крахмал, стеарат магния, тальк, растительные масла, полиалкиленгликоли и т.д. Лекарственные формы могут находиться в твердом состоянии, например, в виде таблеток, драже, суппозиториев, капсул, или в жидком состоянии, например, в виде растворов, суспензий или эмульсий. В случае необходимости они содержат, сверх того, вспомогательные вещества, как консерванты, стабилизаторы, смачиватели или эмульгаторы, соли для изменения осмотического давления или буферы.
Для парентерального применения в особенности пригодны растворы для инъекции или суспензии, в особенности водные растворы активных соединений в полигидроксиэтоксилированном касторовом масле.
В качестве систем носителей можно использовать также поверхностно-активные вспомогательные вещества, как соли желчных кислот, или животные или растительные фосфолипиды, однако также их смеси, а также липосомы или их составные части.
Для перорального применения в особенности пригодны таблетки, драже или капсулы с тальком и/или углеводородным носителем или связующим, как, например, лактоза, кукурузный или картофельный крахмал. Перорально также можно применять жидкую лекарственную форму, как, например, сок, к которому в случае необходимости добавляют подслащивающее вещество. Предлагаемые согласно изобретению соединения используют в разовой дозе с содержанием 0,05-100,0 мг активного вещества в физиологически приемлемом носителе.
Дозу активных веществ можно изменять в зависимости от способа введения, возраста и массы пациента, рода и тяжести излечиваемого заболевания и подобных факторов. Суточная доза составляет 0,1-300,0 мг, предпочтительно 0,1-30 мг, причем дозу можно вводить в виде однократно принимаемой разовой дозы или разделенной на 2 или более суточных доз.
Предлагаемые согласно изобретению соединения получают само по себе известными способами. Например, соединения формулы (I) можно получать тем, что
а) соединение формулы (II):
вводят во взаимодействие с 2-азадиеном формулы (III):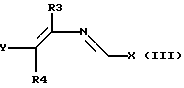
где R3, R4 и A имеют вышеуказанное значение, а X и Y представляют собой удаляемые группы, в присутствии кислот; или
б) соединение формулы (IV):

где R3, R4 и A имеют вышеуказанное значение, ароматизируют; или
в) соединение формулы (V):
где R3 и R4 имеют вышеуказанное значение, вводят во взаимодействие с α,β-ненасыщенным альдегидом с получением приконденсированного пиридина или с первичным амином; H2N-CH2-R5 с получением приконденсированного имидазола, или получаемые с помощью нитритов соли диазония вводят во взаимодействие с производными ацетоуксусной кислоты с образованием производного этилиденгидразина, который циклизуют до пиррола, или вводят во взаимодействие с тиоцианатными или изотиоцианатными производными с получением приконденсированного тиазола; или
г) соединение формулы (VI):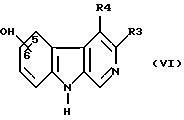
где R3 и R4 имеют вышеуказанное значение, вводят во взаимодействие с первичным амином; H2N-CH2R5 с получением приконденсированного оксазола или вводят во взаимодействие с вицинальным первичным диамином: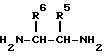
с получением приконденсированного пиразина; или
д) нитрилоксид формулы (VII):
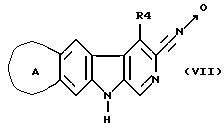
циклизуют с помощью ацетиленового производного ≡- R2 с получением производного изоксазола;
е) α-галогенкетон формулы (VIII):

где R4 и A имеют вышеуказанное значение, a Z означает галоген, вводят во взаимодействие с тиоамидом; H2N-CS-R9 с получением соединения, где R3 означает тиазолил; или
ж) нитрил формулы (IX):

где R4 и A имеют вышеуказанное значение, циклизуют с помощью азида с получением соединения, где R3 означает тетразолил; и в желательном случае затем омыляют или переэтерифицируют сложноэфирную группу, этерифицируют карбоксильную группу, алкилируют или ацилируют аминогруппу, высвобождают функционально измененную гидроксильную группу, разделяют изомеры или получают физиологически приемлемые соли.
Взаимодействие соединений формулы (II) с 2-азадиенами формулы (III), согласно изобретению, с получением соединений формулы (I) осуществляют по способу а) согласно ЕР-А-110813 в присутствии кислот при температурах от 0 до 150oC. Удаляемые группы X и Y могут быть одинаковыми или разными; в особенности пригодны (C1-C3)-диалкиламины, как диметил-, диэтил- и диизопропиламин, и циклические амины, как пирролидин.
Взаимодействие, например, осуществляют так, что производное индола и азадиен сначала перемешивают при комнатной температуре в органической кислоте, такой, как, например, муравьиная кислота, уксусная кислота, пропионовая кислота или трифторуксусная кислота, и затем реакционную смесь нагревают вплоть до температуры кипения.
Кислота может одновременно служить в качестве компонента реакции и также в качестве растворителя. Однако также можно добавлять растворитель, такой, как, например, спирты, простые эфиры, кетоны, сложные эфиры, как этилацетат, углеводороды, как толуол, или галогенированные углеводороды, как тетрахлоруглерод.
Количество кислоты можно изменять в широких пределах, однако, ее используют в избытке. Предпочтительно выбирают 3-10-кратный избыток кислоты в расчете на азадиен.
Молярные соотношения индола к азадиену для успешного протекания взаимодействия не критические. В общем, используют примерно равные молярные количества компонентов реакции, причем предпочтительны количественные соотношения 1 моль анилина и 1-3 моль азадиена. Осуществляемое согласно изобретению взаимодействие можно в принципе также проводить в вышеуказанных растворителях в присутствии каталитических количеств неорганических кислот, таких, как серная, соляная, хлорная кислоты, или органических кислот, таких, как п-толуолсульфокислота и трифторуксусная кислота.
Для ароматизации соединений формулы (IV) пригодны известные для β-карболинов способы, как, например, дегидрирование с помощью трет-бутилгипохлорида (ЕР-А-190987) или с помощью трихлоризоциануровой кислоты (международная заявка WO 94/12498).
Неконденсирование ненасыщенного цикла А по вариантам способа в) и г) осуществляют в зависимости от нахождения аминогруппы или гидроксильной группы в положении 5, 6 или 6, 7 β-карболина, предпочтительно в положении 5,6. Возможно образующуюся смесь изомеров разделяют обычным образом путем фракционной кристаллизации или хроматографии.
Если синтезируют пиридиновое кольцо, то это можно осуществлять согласно синтезу Скраупа [G.Alunni-Bistocchi и др., J.Chem.Soc.Perkin Trans. 1, 2935 (1992)] , тем, что, например, α,β-ненасыщенный альдегид, который можно получать промежуточно, присоединяют к амину и затем циклизуют под действием кислот и ароматизируют с помощью окислителя, как, например, пентоксид мышьяка, оксид трехвалентного железа или пикриновая кислота. Реакцию проводят при температурах от комнатной до 150oC в инертных растворителях, как толуол, ксилол. Для получения имидазола, например, соответствующее производное амино-β-карболина конденсируют с первичным амином; R5-CH2-NH2 в присутствии окислителя, как MnO2, при комнатной температуре или при повышенной температуре и в инертных растворителях, как дихлорметан, дихлорэтан или простой эфир этиленгликоля.
Пирролкарболин можно получать, например, из производного этиленгидразино-β-карболина тем, что это соединение в инертном растворителе, таком, как углеводороды, например, толуол, ксилол, бензол, нагревают в присутствии органических или неорганических кислот или эфиров полифосфорной кислоты.
Исходные этиленгидразиновые соединения можно получать с помощью реакции Зандмейера, в которой, например, соли диазония, промежуточно получаемые из аминосоединений с нитрилами, вводят во взаимодействие с солями щелочных металлов сложного эфира ацетоуксусной кислоты в протонных растворителях, как вода или спирты, при температурах от 0oC до комнатной температуры.
Тиазолкарболины можно получать, например, путем взаимодействия соединений формулы (V) с тиоцианатами или изотиоцианатами. Взаимодействие целесообразнее проводить в инертном растворителе в присутствии органической или неорганической кислоты, причем, если используют органическую кислоту, то она может служить в качестве растворителя. Для циклизации в общем добавляют окислитель, как, например, бром. Исходя из гидрокси-β-карболинов, по аналогии с вышеописанным синтезом Скраупа, путем взаимодействия с первичным амином в присутствии окислителя, как MnO2, при комнатной температуре или при повышенной температуре и в инертном растворителе получают оксазолкарболины. Если при взаимодействии вместо первичного амина используют вицинальное первичное диаминосоединение, то получают соответствующие пиразиновые производные, смесь изомеров которых можно разделять обычным образом с помощью хроматографии или путем фракционной кристаллизации.
Взаимодействие нитрилоксидов формулы (VII) с производными ацетилена можно осуществлять, например, согласно описанным K.G.B. Torsell способам (K. G. B. Torsell, Nitrile Oxides, Nitrones and Nitronates in Organic Synthesis, 1988 VCH, Verlagsgesellschaft mbH). При этом, как правило, сначала получают нитрилоксид, который затем без выделения вводят во взаимодействие с производным ацетилена.
Молярные соотношения нитрилоксида и ацетилена могут изменяться в широких пределах. В общем, используют примерно равные молярные количества компонентов реакции, однако часто также может оказаться благоприятным использование большего количества производного ацетилена. Взаимодействие протекает при температурах от -78oC до 150oC, предпочтительно от -20oC до 50oC, в апротонном растворителе.
В качестве растворителя пригодны, например, алифатические и циклические простые эфиры, как диэтиловый эфир, тетрагидрофуран, диоксан, галогенированные углеводороды, как дихлорэтан, дихлорметан, хлороформ, углеводороды, как гексан, пентан и диметилформамид, диметилсульфоксид.
Если исходные соединения являются газообразными, как, например, ацетилен, то в реакции предпочтительно использовать соответствующие жидкие соединения, которые содержат затем легко удаляемую группу. В качестве легко удаляемой группы пригодна, например, триалкилсилильная группа. Отщепление осуществляют перед обработкой реакционной смеси по известным способам, как, например, путем добавки оснований при комнатной температуре. Пригодными основаниями являются, например, гидроксиды и алкоголяты щелочных металлов, как гидроксид, метилат или этилат натрия или калия, или фториды, как фторид цезия или тетра-н-бутиламмонийфторид.
В случае необходимости, в реакции можно использовать защищенные в положении 9 производные β-карболина. Защитную группу отщепляют обычным образом при обработке реакционной смеси или потом путем обработки с помощью оснований или кислот в зависимости от рода защитной группы.
Нитрилоксиды получают, например, путем превращения β-карболин-3-карбальдегидов в соответствующие оксимы, которые, например, с помощью N-галогенсукцинимида, трет-бутоксихлорита или галогенсукцинимида натрия, трет-бутоксихлорита или гипохлорита натрия в апротонных растворителях можно переводить в галогениды гидроксамовой кислоты. С помощью оснований, как алкоголяты натрия или калия, триалкиламины, основания Хенига, DBU или диазабициклооктан, от галогенидов гидроксамовой кислоты отщепляют галогенводород и получают нитрилоксиды, которые без выделения подвергают реакции циклоприсоединения (R. Annunziata и др., J.Chem.Soc., 529 (1987)).
β-Карболин-3-карбальдегид можно получать, например, по описанному в ЕР-305322 способу из алкиловых сложных эфиров β-карболин-3-карбоновой кислоты. Взаимодействие с α-галогенкетонами по способу е) осуществляют способами, описанными в "Химия гетероциклических соединений", том 34, часть 1, с. 180 и последующие (1979). Например, в растворе или в суспензии при температурах вплоть до температуры кипения реакционной смеси тиоамид вводят во взаимодействие α-галогенкетоном, в особенности хлор- или бромкетоном. В качестве инертных растворителей пригодны спирты, циклические и нециклические простые эфиры, сложные эфиры, углеводороды и галогенированные углеводороды.
3-Тетразолил-β-карболины можно получать, например, по описанному в ЕР-А-54507 способу с помощью аммиака или по способам, описанным E.W.Thomas, Synthesis, 767 (1993) и P. Ornstein и др., J.Med.Chem., 36, 2046 (1993).
Гидролиз сложноэфирной группы, как кислотный так и щелочной, можно проводить обычным образом, например, с помощью водных растворов щелочных или щелочноземельных металлов, при необходимости при добавке органических растворителей, как спирты, при температурах от комнатной до 150oC или описанным в ЕР-А-161574 способом.
Если желательна переэтерификация, то можно использовать описанный в ЕР-А-237467 способ, согласно которому переэтерикацию проводят с помощью алкоголятов щелочных металлов или соответствующих спиртов при необходимости при добавлении тетраизопропилата титана в качестве катализатора, при повышенной температуре. Введение трет-бутильной сложноэфирной группы осуществляют, например, путем взаимодействия карбоновой кислоты с трет-бутокси-бис-диметиламинометаном.
Этерификацию карбоновой кислоты осуществляют само по себе известным образом, например, с помощью соответствующего спирта в кислоте или в присутствии активированного производного кислоты. В качестве активированных производных кислоты используют, например, хлорангидрид, имидазолид или ангидрид кислоты.
Если желательно алкилирование аминогруппы, то можно алкилировать обычными способами, например, с помощью алкилгалогенидов. Ацилирование аминогруппы осуществляют известными способами, например, в водной среде в присутствии основания с помощью соответствующих ангидридов или галогенидов кислот.
Высвобождение функционально измененных гидроксильных групп осуществляют известными специалисту способами. Например, защитные простые эфирные группы отщепляют в водном растворе органической кислоты, как, например, муравьиная, уксусная, пропионовая, трифторуксусная, лимонная кислоты и т.д., или в водном растворе неорганической кислоты, такой, как, например, соляная кислота, или при применении кислот Льюиса, как эфират трифторида бора.
Силильные защитные группы можно удалять, например, с помощью фторидов, как тетрабутиламмонийфторид или фторид цезия.
Омыление ацильных групп проводят известными специалисту способами, как, например, с помощью основных катализаторов, как, например, карбонатов или гидроксидов щелочных или щелочноземельных металлов, в спирте или в водном растворе спирта.
Соединения формулы (I) известным образом можно выделять из реакционной смеси и очищать. Соли присоединения кислоты обычным образом можно переводить в свободные основания и в желательном случае их можно превращать известным образом в физиологически приемлемые соли, например, смешиванием раствора соединения с концентрированным раствором желательной кислоты.
Если соединения формулы (I) содержат центр хиральности, то оптически активные соединения можно получать исходя из оптически активных исходных соединений или известным образом из рацематов. Энантиомеры можно разделять обычным образом, например, путем хроматографии на оптически активных носителях, путем введения во взаимодействие с оптически активными кислотами и последующей фракционной кристаллизации.
Для получения физиологически приемлемых солей присоединения кислоты соединение формулы (I), например, растворяют в небольшом количестве спирта и смешивают с концентрированным раствором желаемой кислоты.
Если получение исходных соединений не описывается, они известны или их получают по аналогии с известными соединениями или описанными выше способами.
Например, получение сложных эфиров 3-карбоновой кислоты формулы (VI) описывается в ЕР-А-130140, а получение соединений формулы (V) описывается в ЕР-А-54507.
Сродство к бензодиазепиновым рецепторам определяют путем исследования способности испытуемых веществ вытеснять радиоактивно маркированные бензодиазепины из бензодиазепинового рецептара. Для исследования анксиолитического действия соединения испытывают в тесте с 4-мя- пластинками по методу Буасье и др. (Boissier и др., Eur. J. Pharmacol., 4, 145-150 (1968)).
Антиамнестическую активность определяют по методу B. J. Cole и др., Psychopharmacology, 111, 465-471, (1993) (DMTP-тест), а тест на внимательность можно осуществлять по методу J.L.Muir и др., Exp. Brain. Res., 89, 611-622 (1982) (9-Hole Box).
Так, например, изопропил-11-метоксиметил-3-метилпиразино [2,3-g] -β-карболин-10-карбоксилат в "тестах на поведение в отношении способности учиться и памяти" (например, по Cole и др., Psychopharmacology, 116, 135-142 (1994)) на крысах в дозах 10 мг/кг интраперитонеально вызывает улучшение когнитивного показателя.
Нижеследующие примеры поясняют предлагаемый согласно изобретению способ.
ПРИМЕР 1
Изопропил-11-этил-3-метил-пиразино[2,3-g] -β-кapбoлин-10-карбоксилат и изопропил-11-этил-2-метил-пиразино[2,3-g]-β-карболин-10-карбоксилат
При пропускании азота и при комнатной температуре, 20 г изопропил- 4 -этил-β-гидрокси-β-карболин-3-карбоксилата растворяют в 800 мл диметилового эфира этиленгликоля (ДМЭ) и 7,2 мл 1,2-диаминопропана. К полученному раствору в течение 30 мин и при перемешивании порциями добавляют 175 г оксида марганца (IV), так, чтобы температура реакции не превышала 28oC. По окончании добавления оксида марганца (IV) добавляют следующие 2,9 мл 1,2-диаминопропана. Реакционную смесь перемешивают в атмосфере азота в течение ночи.
Реакционную смесь фильтруют через кизельгур и остаток на фильтре дополнительно промывают пятикратно диметиловым эфиром этиленгликоля, используя каждый раз по 100 мл эфира. Объединенные фильтраты концентрируют почти досуха и выделяют выпавшие кристаллы. Полученный сырой кристаллизат трижды перекристаллизовывают из метанола. Получают 9,5 г изопропил-11-этил-3-метил-пиразино[2,3-g] -β-карболин-10-карбоксилата с температурой плавления 236,5-237,5oC.
Объединенные маточные растворы концентрируют досуха и затем кипятят с изопропилацетатом. Нерастворимый остаток отфильтровывают и четырехкратно перекристаллизовывают из метанола.
Получают 265 мг изопропил-11-этил-2-метил-пиразино[2,3-g]-β-карболин-10-карбоксилата с т.пл. 215-216oC.
Аналогичным образом получают:
Изопропил-11-метоксиметил-3-этил-пиразино[2,3-g] -β-карболин-10-карбоксилат, т.пл. 202-203oC;
Изопропил-11-метил-3-этил-пиразино[2,3-g] -β-карболин-10-карбоксилат, т. пл. 204-206oC;
Изопропил-3,11-диэтил-пиразино [2, 3-g]-β-карболин-10-карбоксилат, т.пл. 188-190oC;
Изопропил-11-метоксиметил-пиразино[2,3-g] -β-карболин-10-карбоксилат, т. пл. 238oC (разложение);
Изопропил-11-метоксиметил-2,3,4,5-тетрагидрогуиноксалино [2,3-g] -β-карболин-12-карбоксилат, т.пл. 224-225oC (разложение);
Изопропил-11-метоксиметил-3-фенил-пиразино[2,3-g] β-карболин-10-карбоксилат, т.пл. 262-263oC;
Изопропил-11-этил-3-фенил-пиразино [2,3-g]-β-карболин-10-карбоксилат, т. пл. 235-236oC;
Изопропил-11-метоксиметил-3-метил-пиразино [2,3-g] -β-карболин-10-карбоксилат, т.пл. 195-197oC;
Изопропил-3,11-диметил-пиразино [2,3-g]-β-карболин-10-карбоксилат, т.пл. 155-160oC;
Изопропил-11-метоксиметил-2,3-диметил-пиразино [2,3-g] -β-карболин-10-карбоксилат, т.пл. 244-245oC;
Изопропил-11-этил-2,3-диметил-пиразино [2,3-g] -β-карболин-10-карбоксилат, т.пл. 233-236oC;
Изопропил-11-метил-2,3-диметил-пиразино [2,3-g] -β-карболин-10-карбоксилат, т.пл. 305oC (разложение);
Изопропил-11-метоксиметил-3-пропил-пиразино[2,3-g] -β-карболин-10-карбоксилат, т.пл. 172-173oC;
Изопропил-11-этил-3-пропил-пиразино[2,3-g]-β-карболин-10-карбоксилат, т. пл. 184-186oC;
Изопропил-11-этил-3-метоксиметил-пиразино[2,3-g] -β-карболин-10-карбоксилат, т.пл. 198-199oC;
Изопропил-3,11-бис-метоксиметил-пиразино [2,3-g] -β-карболин-10-карбоксилат, т.пл. 193-194oC.
ПРИМЕР 2
Этиловый эфир 7H-бензо[е]пиридо[3,4]-индол-10-карбоновой кислоты
Аналогично способу, описанному в примере 1 ЕР-110813, из 3H-бензо[е] индола и этилового эфира 3-диметиламино-2-(диметиламинометиленамино)акриловой кислоты (азадиен 1) получают целевое соединение с т.пл. 278-280oC.
ПРИМЕР 3
Изопропиловый эфир 7H-бензо[е] пиридо[3,4-b]индол-11-метоксиметил-10-карбоновой кислоты
а) Аналогично способу, описанному в примере 19 ЕР-А-54507 из 3H-бензо[е] индола получают этиловый эфир 7H-бензо[е]пиридо [3,4-b]-индол-11-метоксиметил-10-карбоновой кислоты с т.пл. 195-197oC.
б) Путем переэтерификации с помощью изопропилата титана (IV) из сложного этилового эфира получают целевое соединение с т.пл. 163-164oC.
ПРИМЕР 4
Изопропиловый эфир 7H-бензо[е]пиридо [3,4-b]индол-11-метил-10-карбоновой кислоты
а) Аналогично способу, описанному в примере 60 ЕР-А-54507 из 3H-бензо[е] индола получают этиловый эфир 7H-бензо[е]пиридо [3,4-b]-индол-H-метил-10-карбоновой кислоты с т.пл. 244-246oC.
б) Путем переэтерификации с помощью изопропилата титана (IV) из сложного этилового эфира получают целевое соединение с т.пл. 171-173oC.
ПРИМЕР 5
Изопропиловый эфир 7H-бензо[е]пиридо[3,4-b]индол-11-этил-10-карбоновой кислоты
а) Аналогично способу, описанному в примере 60 ЕР-А-54507 из 3H-бензо[е] индола получают этиловый эфир 7H-бензо[е]пиридо [3,4-b]индол-11-этил-10-карбоновой кислоты с т.пл. 201-205oC.
б) Путем переэтерификации с помощью изопропилата титана (IV) из сложного этилового эфира получают целевое соединение с т.пл. 193-196oC.
ПРИМЕР 6
Изопропиловый эфир 10-метил-2-пропил- оксазоло[4,5-g]-β-карболин-9-карбоновой кислоты
Раствор 570 мг изопропилового эфира 6-гидрокси-4-метил-β-карболин-3-карбоновой кислоты в 15 мл диметилового эфира этиленгликоля смешивают с 1 мл н-бутиламина и 5,2 г диоксида марганца и перемешивают в течение ночи при комнатной температуре. Реакционную смесь фильтруют через целит. Полученный после концентрирования органической фазы остаток хроматографируют на силикагеле с помощью этилацетата. Желательные фракции концентрируют и перемешивают с диэтиловым эфиром. Получают 325 мг изопропилового эфира 10-метил-2-пропил-оксазоло-[4,5-g]-β-карболин-9-карбоновой кислоты с т.пл. 223-224oC.
Аналогичным образом получают:
Изопропиловый эфир 10-этил-2-изопропил-оксазоло [4,5-g] -β-карболин-9-карбоновой кислоты, т.пл. 205-207oC;
Изопропиловый эфир 10-этил-2-пропил-оксазоло[4,5-g] -β-карболин-9-карбоновой кислоты, т.пл. 163-165oC;
Изопропиловый эфир 10-метил-2-изопропил-оксазоло[4,5-g] -β-карболин-9-карбоновой кислоты, т.пл. 248-249oC;
Изопропиловый эфир 10-метоксиметил-2-этил-оксазоло [4,5-g]-β-карболин-9-карбоновой кислоты, т.пл. 188-189oC;
Изопропиловый эфир 10-метоксиметил-2-метил-оксазоло[4,5-g]-β-карболин-9-карбоновой кислоты, т.пл. 191-193oC;
Изопропиловый эфир 10-метоксиметил-2-пентил-оксазоло [4,5-g]-β-карболин-9-карбоновой кислоты, т.пл. 188-190oC;
Изопропиловый эфир 10-метоксиметил-2-изопропил-оксазоло[4,5-g] -β-карболин-9-карбоновой кислоты, т.пл. 174-176oC;
Изопропиловый эфир 10-метоксиметил-2-фенил-оксазоло [4,5-g]-β-карболин-9-карбоновой кислоты,
т.пл. 274-276oC;
Изопропиловый эфир 10-метоксиметил-2-пропил-оксазоло[4,5-g]-β-карболин-9-карбоновой кислоты, т.пл. 188-189oC;
Изопропиловый эфир 10-метоксиметил-2-(2,2-диметил- 1,3-диоксолан-4-ил)-оксазоло [4,5-g]-β-карболин-9-карбоновой кислоты, т.пл. 202-203oC.
Изопропиловый эфир 2-(2,2-диметил-1,3-диоксолан-4-ил)-10-метил-оксазоло[4,5-g]-β-карболин-9-карбоновой кислоты, т.пл. 278-280oC;
Изопропиловый эфир 2-(2,2-диметил-1,3-диоксолан-4-ил)-10-этил-оксазоло [4,5-g]-β-карболин-9-карбоновой кислоты, т.пл. 228-230oC.
ПРИМЕР 7
Изопропиловый эфир 2-(1,2-дигидроксиэтил)-10-метоксиметил-оксазоло[4,5-g]-β-карболин-9-карбоновой кислоты
Раствор 200 мг изопропилового эфира 2-(2,2-диметил-1,3-диоксолан-4-ил)-10-метоксиметил-оксазоло[4,5-g] -β-карболин-3-карбоновой кислоты в 20 мл метиленхлорида при комнатной температуре по каплям смешивают с 1 мл трифторуксусной кислоты и перемешивают следующие 4 часа в атмосфере защитного газа при комнатной температуре. Реакционный раствор нейтрализуют эквимолярным количеством раствора гидрокарбоната натрия. Выпавший в осадок твердый продукт отфильтровывают под вакуумом и промывают метиленхлоридом. После высушивания в вакууме при 50oC получают 112 мг изопропилового эфира 2-(1,2-дигидроксиэтил)-10-метоксиметил- оксазоло[4,5-g]-β-карболин-9-карбоновой кислоты с т. пл. 168oC (разложение).
Аналогичным образом получают:
Изопропиловый эфир 2-(1,2-дигидроксиэтил)-10-метил-оксазоло [4,5-g] -β-карболин-9-карбоновой кислоты, т.пл. 195-196oC (разложение);
Изопропиловый эфир 2-(1,2-дигидроксиэтил)-10-этил-оксазоло [4,5-g] -β-карболин-9-карбоновой кислоты, т.пл. 184-186oC (разложение).
ПРИМЕР 8
10-Метоксиметил-2-изопропил-оксазоло[4,5-g] -9-(5-метоксиметил-3-изоксазолил)-β-карболин
К раствору гидрохлорида 10-метоксиметил-2-изопропил-оксазоло [4,5-g]-6-тозил-β-карболин-3-карбальдегиоксима в 6 мл абсолютного тетрагидрофурана при комнатной температуре и в атмосфере защитного газа прикапывают 1,4 мл раствора гипохлорита натрия. Перемешивают в течение 1 часа при комнатной температуре вплоть до исчезновения оксима (контроль с помощью тонкослойной хроматографии), затем прикапывают 210 мг метилпропаргилового простого эфира и перемешивают в течение ночи. После отгонки растворителя остаток распределяют между этилацетатом и водой и органическую фазу сушат, отфильтровывают и концентрируют. Остаток растворяют в 8 мл метанола, смешивают с 60 мг метилата натрия и в течение 1 часа кипятят с обратным холодильником. После концентрирования органической фазы получают остаток, который хроматографируют при использовании силикагеля с помощью смеси толуола с этилацетатом в соотношении 1: 1. Желательные фракции концентрируют и остаток кристаллизуют из этилацетата. Получают 81 мг 10-метоксиметил-2-изопропил-оксазоло [4,5-g]-9-(5-метоксиметил-3-изоксазолил)-β-карболина с т.пл. 121-122oC.
Необходимый в качестве исходного продукта гидрохлорид карбальдегидоксима получают согласно ЕР-305322 способу.
Аналогичным образом получают:
10-метоксиметил-2-изопропил-оксазоло[4,5-g] -9-(5-метил-3-изоксазолил)-β-карболин, т.пл. 252-255oC.
ПРИМЕР 9
Изопропиловый эфир 2-амино-10-этил-тиазоло[4,5-g]-β-карболин-9-карбоновой кислоты
297 мг Изопропилового эфира 6-амино-4-этил-β-карболин-3-карбоновой кислоты растворяют в 5 мл уксусной кислоты, смешивают со 152 мг тиоцианата аммония и перемешивают в течение 1 часа при комнатной температуре. Затем реакционный раствор охлаждают до 10oC и по каплям смешивают с 0,05 мл уксуснокислого раствора брома (0,5 мл Br2 в 9,5 мл уксусной кислоты). Дополнительно перемешивают в течение 1 часа при 10oC и затем оставляют нагреваться до комнатной температуры. Реакционную смесь обрабатывают этилацетатом и водой и нейтрализуют с помощью 10%-ного раствора карбоната калия. Органическую фазу отделяют, сушат и выпаривают досуха. Остаток растирают с эфиром. Получают 214 мг целевого соединения с т.пл. 160oC (разложение).
ПРИМЕР 10
Изопропиловый эфир 2-амино-10-метоксиметил-тиазоло[4,5-g]-β-карболин-9-карбоновой кислоты
Из изопропилового эфира 6-амино-4-метоксиметил-β-карболин-3-карбоновой кислоты описанным в примере 9 способом получают целевое соединение с т.пл. 188-192oC (разложение).
ПРИМЕР 11
Изопропиловый эфир 2-ацетамидо-10-этил-тиазоло[4,5-g]-β-карболин-9-карбоновой кислоты
100 мг Изопропилового эфира 2-амино-10-этил-тиазоло[4,5-g]-β-карболин-9-карбоновой кислоты суспендируют в 10 мл уксусного ангидрида и нагревают в течение 15 минут при 80oC. Выпавший после охлаждения осадок отфильтровывают и перекристаллизуют из этилацетата. Получают 51 мг изопропилового эфира 2-ацетамидо-10-этилтиазоло[4,5-g] -β-карболин-9-карбоновой кислоты с т. пл. 208-210oC.
ПРИМЕР 12
Изопропиловый эфир 2-этиламинo-10-этил-тиазоло[4,5-g]-β-карболин-9-карбоновой кислоты
а) 297 мг Изопропилового эфира 6-амино-4-этил-β-карболин-3-карбоновой кислоты и 88 мг метилизотиоцианата в 20 мл изопропанола кипятят с обратным холодильником в течение двух часов. Растворитель отгоняют в вакууме и остаток перекристаллизовывают из смеси этилацетата с диэтиловым эфиром. Получают 257 мг изопропилового эфира 4-этил-6-(3-этил- тиоуреидо)-β-карболин-3-карбоновой кислоты с т.пл. 234-236oC.
б) При комнатной температуре 0,035 мл брома прикапывают к суспензии 180 мг изопропилового эфира 4-этил-6-(3-этил-тиоуреидо)-β-карболин-3-карбоновой кислоты в 20 мл хлороформа и затем в течение трех часов кипятят с обратным холодильником. Реакционный раствор концентрируют и остаток обрабатывают этилацетатом и 20%-ным раствором карбоната калия. Органическую фазу отделяют, сушат и концентрируют. Остаток перекристаллизовывают из этилацетата. Получают 141 мг целевого соединения с т.пл. 275-276oC.
ПРИМЕР 13
Аналогично описанному в примере 11 способу получают:
Изопропиловый эфир 2-метиламино-10-этил-тиазоло[4,5-g]-β-карболин-9-карбоновой кислоты, т.пл. 200oC (разложение);
Изопропиловый эфир 2-метиламино-10-метил-тиазоло[4,5-g]-β-карболин-9-карбоновой кислоты;
Изопропиловый эфир 2-метиламино-10-метоксиметил-тиазоло [4,5-g] -β-карболин-9-карбоновой кислоты.
ПРИМЕР 14
Диэтиловый эфир пирроло[4,5-g]-β-карболин-2,5-дикарбоновой кислоты
а) 710 мг Этилового эфира 6-амино-β-карболин-3-карбоновой кислоты в 18 мл воды при температуре 4oC смешивают с 1,2 мл концентрированной соляной кислоты. К выпавшей в осадок соли прикапывают раствор 210 мг нитрита натрия в 20 мл воды и перемешивают следующие 15 минут при температуре 4oC. Этот раствор прикапывают при температуре 4oC к 410 мг этил-2-метилацетацетата и 1 мл 50%-ного раствора КОН в 3 мл этанола и 6 мл воды и перемешивают следующие 3 часа. Реакционную смесь смешивают с 50 мл воды и экстрагируют этилацетатом. Органические фазы промывают водой, сушат и концентрируют. Получают 250 мг этилового эфира 6-(1-этокси-карбонил-этилиденгидразино)-β-карболин-3-карбоновой кислоты, который используют далее без дальнейшей очистки.
б) 750 мг Этилового эфира 6-(1-этоксикарбонилэтилиденгидразино)-β-карболин-3-карбоновой кислоты вместе с 1,83 г этилового эфира полифосфорной кислоты в 35 мл абсолютного ксилола кипятят с обратным холодильником в атмосфере защитного газа в течение двух часов. После охлаждения ксилол удаляют декантацией и остаток обрабатывают этилацетатом, фильтруют через целит и концентрируют. Полученный остаток хроматографируют при использовании силикагеля и этанола. Получают 45 мг целевого соединения с т.пл. 198-201oC.
ПРИМЕР 15
Изопропиловый эфир 2-изопропил-10-метоксиметил-1H- имидазо[4,5-g] -β-карболин-9-карбоновой кислоты
627 мг Изопропилового эфира 6-амино-4- метоксиметил-β-карболин-3-карбоновой кислоты в 10 мл диметилового эфира этиленгликоля вместе с 1,6 г диоксида марганца и 0,98 г изобутиламина перемешивают в течение 16 часов при комнатной температуре. Реакционную смесь фильтруют через целит, фильтрат концентрируют и хроматографируют при использовании силикагеля и смеси метиленхлорида с этанолом в соотношении 10:1. Из желательных фракций получают 499 мг изопропилового эфира 2-изопропил-10-метоксиметил-1Н-имидазо[4,5-g] -β-карболин-9-карбоновой кислоты (масло).
Аналогичным образом получают:
Изопропиловый эфир 2-изопропил-10-метил-1H-имидазо[4,5-g]-β-карболин-9-карбоновой кислоты;
Изопропиловый эфир 2-изопропил-10-этил-1H-имидазо[4,5-g]-β-карболин-9-карбоновой кислоты;
Изопропиловый эфир 2-фенил-10-метоксиметил-1Н-имидазо[4,5-g] -β-карболин-9-карбоновой кислоты;
Изопропиловый эфир 2-бутил-10-метоксиметил-1Н-имидазо[4,5-g] -β-карболин-9-карбоновой кислоты;
Изопропиловый эфир 2-(2,2-диметил-1,3-диоксолан-4-ил)-10-этил-1H-имидазо [4,5-g]-β-карболин-9-карбоновой кислоты;
Изопропиловый эфир 2-(2,2-диметил-1,3-диоксолан-4-ил)-10- метоксиметил-1H-имидазо[4,5-g]-β-карболин-9-карбоновой кислоты;
Изопропиловый эфир 2-этил-10-метоксиметил-1H-имидазо[4,5-g]-β-карболин-9-карбоновой кислоты;
Изопропиловый эфир 10-метоксиметил-2-трифторметил-1H-имидазо[4,5-g] -β-карболин-9-карбоновой кислоты;
Изопропиловый эфир 10-метоксиметил-2-(2-тиенил)-1H-имидазо[4,5-g] -β-карболин-9-карбоновой кислоты;
Изопропиловый эфир 2-(2-фурил)-10-метоксиметил-1H-имидазо [4,5-g] -β-карболин-9-карбоновой кислоты;
Изопропиловый эфир 2-(4-хлорфенил)-10-метоксиметил-1H-имидазо [4,5-g] -β-карболин-9-карбоновой кислоты, т.пл. 270oC (разложение);
Изопропиловый эфир 2-(2-хлорфенил)-10-метоксиметил-1H-имидазо [4,5-g] -β-карболин-9-карбоновой кислоты, т.пл. 205-207oC;
Изопропиловый эфир 2-(4-метилфенил)-10-метоксиметил-1H-имидазо [4,5-g] -β-карболин-9-карбоновой кислоты, т.пл. 168oC (разложение);
Изопропиловый эфир 2-(4-метоксифенил)-10-метоксиметил-1H-имидазо [4,5-g] -β-карболин-9-карбоновой кислоты, т.пл. 258-260oC;
Изопропиловый эфир 2-(2-метоксифенил)-10-метоксиметил-1H-имидазо-[4,5-g] -β-карболин-9-карбоновой кислоты, т.пл. 225-228oC.
ПРИМЕР 16
Аналогично описанному в примере 7 способу получают:
Изопропиловый эфир 2-(1,2-дигидроксиэтил)-10-метоксиметил-1H-имидазо[4,5-g]-β-карболин-9-карбоновой кислоты, т.пл. 198oC;
Изопропиловый эфир 2-(1,2-дигидроксиэтил)-10-этил-1H-имидазо [4,5-g] -β--карболин-9-карбоновой кислоты, т.пл. 168oC.
ПРИМЕР 17
Изопропиловый эфир 10-этил-2-метил-тиазоло[5,4-g]-β-карболин-9-карбоновой кислоты
а) 2500 мг Изопропилового эфира 6-амино-4-этил-β-карболин-3-карбоновой кислоты растворяют в 40 мл пиридина, смешивают с 0,79 мл ацетангидрида и нагревают в течение двух часов при температуре 50oC. После добавления 20 мл воды концентрируют в вакууме. Остаток растворяют в этилацетате и промывают водой. Органическую фазу отделяют, сушат и концентрируют досуха. Остаток в количестве 3110 мг изопропилового эфира 6-ацетиламино-4-этил-β-карболин-3-карбоновой кислоты используют далее без дальнейшей очистки.
б) 2741 мг Изопропилового эфира 6-ацетиламино-4-этил-β-карболин-3-карбоновой кислоты в 110 мл диоксана вместе с 3915 мг реактива Лавессона нагревают при перемешивании до 70oC. После охлаждения смешивают со 100 мл этилацетата и промывают насыщенным раствором хлорида натрия. Органические фазы сушат и концентрируют в вакууме. Остаток хроматографируют при использовании силикагеля и смеси толуола с метанолом в соотношении 8:2. Из желательных фракций получают 1541 мг изопропилового эфира 4-этил-6-тиоацетиламино-β-карболин-3-карбоновой кислоты с т.пл. 158-160oC.
в) 450 мг K3Fe(CN)6 растворяют в 1,8 мл воды, смешивают с 1,4 мл 1 н. раствора NaOH и охлаждают до 4oC. К этому раствору прикапывают раствор 200 мг изопропилового эфира 4-этил-6-тиоацетиламино-β-карболин-3-карбоновой кислоты в 4 мл пиридина и перемешивают следующие два часа при этой температуре. Реакционную смесь обрабатывают этилацетатом, промывают водой, сушат и концентрируют. Остаток хроматографируют на силикагеле с помощью смеси толуола с этанолом в соотношении 95:5. Желательные фракции концентрируют и растирают с диэтиловым эфиром. Получают 30 мг целевого соединения с т.пл. 239-240oC.
Изучено сродство к бензодиазепин-рецепторам соединений формулы (I), определяли способность тестируемых соединений вытеснять радиомеченые бензодиазепины в бензодиазепин-рецепторах. Связывание бензодиазепина изучали in vitro, в результате для соединений нижеприведенных структурных формул определены значения IC50 нмоль:
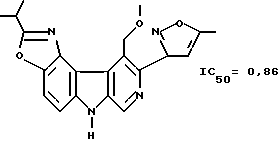
Антиамнестическое действие протестировано (DMTP-тестом) в соответствии с методом, описанным J.Cole et al., Psychopharmacology (1993) 111, 465-471, и действие, способствующее повышению внимательности, тестируется в соответствии с методом, описанным J.L.Muir et al., Exp. Brain Res (1982) 89, 611-622.
Для примера изопропил-11-метоксиметил-3-метил-пиразино-[2,3-g] -β-карболин-10-карбоксилат в "поведенческих тестах по обучению и памяти" (в соответствии с Cole et al., Psychopharmacol. (1993), 116, 135-142), проведенных на крысах при дозах от 10 мг/кг i.p., способствовал улучшению когнитивных действий.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕТАРИЛОКСИ- β КАРБОЛИНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 1993 |
|
RU2105766C1 |
| ПРОИЗВОДНЫЕ 2,3-БЕНЗОДИАЗЕПИНА, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ИХ ПОЛУЧЕНИЯ И СРЕДСТВО, ОБЛАДАЮЩЕЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ АМРА-РЕЦЕПТОРОВ | 1997 |
|
RU2179557C2 |
| Способ получения производных @ -карболин-3-карбоновой кислоты | 1980 |
|
SU1114335A3 |
| 5- ИЛИ 6-ЗАМЕЩЕННЫЕ СЛОЖНЫЕ ЭФИРЫ β -КАРБОЛИН-3-КАРБОНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩИЕ ПСИХОТРОПНОЙ АКТИВНОСТЬЮ, И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ ПСИХОТРОПНЫХ ЗАБОЛЕВАНИЙ | 1991 |
|
RU2034845C1 |
| Способ получения производных @ -карболина | 1984 |
|
SU1376946A3 |
| Способ получения @ -карболинов | 1981 |
|
SU1318166A3 |
| БИЦИКЛИЧЕСКИЕ 6-АЛКИЛИДЕНПЕНЕМЫ В КАЧЕСТВЕ ИНГИБИТОРОВ β-ЛАКТАМАЗ | 2003 |
|
RU2339640C2 |
| АЗАБЕНЗИМИДАЗОЛЬНЫЕ СОЕДИНЕНИЯ И ФАРМКОМПОЗИЦИЯ | 2019 |
|
RU2804485C2 |
| ПРОИЗВОДНЫЕ ДОЛАСТАТИНА 15 | 1998 |
|
RU2195462C2 |
| Способ получения производных @ -карболина | 1984 |
|
SU1376940A3 |
Изобретение относится к анеллированным β-карболинам, формулы I, где R3 обозначает -CO-R1 или группа (a); R1 - C1-C6алкокси; R2 - Н2, C1-C4 алкил, C1-C4алкокси - C1-C2алкил; А - 5-6-членный ненасыщенный цикл, в котором 1-2 атома углерода могут быть заменены на N, О и/или S, который может быть замещен с помощью одного R5 или R6; R5 и R6, одинаковые или различные, означают Н, C1-C6алкил, NR7R8, C1-C6 алкил, который может быть замещен гидроксилом или C1-C4алкоксилом, фенил, 5-6-членный гетероарильный остаток, который содержит один или два атома N, О или S, и фенильный и гетероарильный остаток может быть замещен C1-C4алкилом, C1-C4алкоксилом, галогеном или R5 и R6 вместе - -СН2)n, где n = 4; R7 и R8 - Н, C1-C4алкил, ацил, а также их изомеры, таутомеры и соли. Соединения I пригодны для улучшения когнетивных функций. 2 с. и 2 з.п. ф-лы.

 (а)
(а)
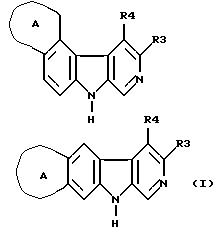
где R3 - -CO-R1 или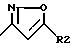
R1 - C1-6-алкокси;
R4 - H, C1-6-алкил, C1-4-алкокси-C1-2-алкил;
А - 5-6-членный ненасыщенный цикл, в котором 1-2 атома углерода могут быть заменены на N, O и/или S и который может быть замещен с помощью одного R5 или R6;
R5 и R6, одинаковые или различные, - водород, C1-6-алкил, NR7R8, C1-6-алкил, который может быть замещен гидроксилом или C1-4-алкоксилом, фенил, 5-6-членный гетероарильный остаток, который содержит один или два атома N, O или S, и фенильный и гетероарильный остаток может быть замещен C1-4-алкилом, C1-4-алкоксилом, галогеном или R5 и R6 вместе - -(CH2)n-группа, где n=4;
R2 - H, C1-4-алкил, C1-4-алкокси-C1-2-алкил;
R7 и R8 каждый - H, C1-6-алкил, ацил,
а также их изомеры, таутомеры и соли.
| DE 4130933 A1, 18.03.1993 | |||
| US 4894377 A1, 16.01.1990 | |||
| Способ получения производных @ -карболина | 1984 |
|
SU1376940A3 |
Авторы
Даты
2001-06-20—Публикация
1996-04-03—Подача