Предпосылки изобретения
Настоящее изобретение относится к способам получения 3-(1-пиперазинил)-1,2-бензизотиазола или его фармацевтически приемлемых солей и к новым промежуточным соединениям, используемым при осуществлении указанных способов. 3-(1-Пиперазинил)-1,2-бензизотиазол является основным промежуточным соединением, используемым при получении 5-(2-(4-(1,2-бензизотиазол-3-ил)-1-пиперазинил)этил)-6-хлор- 1,3-дигидро-2H-индол-2-она (ципразидона). Это соединение проявляет нейролептическую активность.
В патенте США N 4831031, выданном 16 мая 1989 г., который полностью включен в эту заявку на патент в качестве ссылки, описывается гидрохлорид 5-(2-(4-(1,2-бензизотиазол-3-ил)-1-пиперазинил)этил)-6- хлор-1,3-дигидро-2H-индол-2-она формулы:
где Ar обозначает бензизотиазол-3-ил, который получен в виде полугидрата (далее именуется "полугидрат").
Патент США N 5312925, выданный 17 мая 1994 г., который полностью включен в эту заявку на патент в качестве ссылки, относится к моногидрату хлористоводородной соли ципразидона, к способам его получения, фармацевтическим композициям и методам лечения психотических расстройств.
Патент США N 5359068, выданный 25 октября 1994 г., который полностью включен в эту заявку на патент в качестве ссылки, относится к способам получения ципразидона и промежуточным соединениям его получения.
Патент США N 5206366, выданный 27 апреля 1993 г., который полностью включен в эту заявку на патент в качестве ссылки, относится к способам получения ципразидона на водной основе.
Патент США N 4590196, выданный 20 мая 1986 г., относится к 1-(1,2-бензизотиазол-3-ил)пиперазину, который является предпоследним промежуточным соединением, полученным в соответствии со способами по настоящему изобретению.
Патент Японии N 6220030, опубликованный 9 августа 1994 г., относится к получению производных 3-амино-1,2-бензизотиазола в результате взаимодействия производных бис-(2-цианфенил)дисульфида с амидами металлов и последующей обработкой оксидантом.
Краткое изложение сущности изобретения
Настоящее изобретение относится к соединению формулы: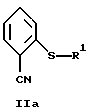
где R1 обозначает
или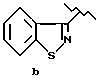
Настоящее изобретение относится также к способу получения соединения формулы: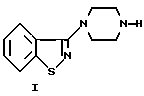
который заключается в том, что соединение формулы: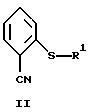
где R1 обозначает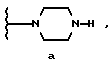
или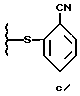
подвергают взаимодействию с пиперазином при температуре от около 80oC до около 170oC, R1 предпочтительно является группой формулы "c". Количество пиперазина предпочтительно составляет от около 2 молярных эквивалентов до около 15 молярных эквивалентов в расчете на количество соединения формулы II. Количество пиперазина наиболее предпочтительно составляет около 10 молярных эквивалентов в расчете на количество соединения формулы II.
Предпочтительный вариант осуществления настоящего изобретения относится к способу превращения соединения формулы II в соединение формулы I в присутствии осветлителя пиперазина. Приемлемыми осветлителями пиперазина являются изопропанол, пиридин или трет-бутанол, предпочтительно изопропанол. Осветлитель предпочтительно используют в количестве, составляющем около 1,2 объема (в расчете (мл/г) на массу соединения формулы II) пиперазина.
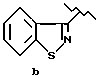
Предпочтительный вариант осуществления настоящего изобретения относится к способу превращения соединения формулы II, в котором R1 обозначает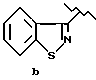
или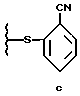
в соединение формулы I, который далее заключается в том, что осуществляют взаимодействие указанного соединения формулы II с пиперазином в присутствии тиолового оксиданта. Приемлемыми тиоловыми оксидантами являются диметилсульфоксид, воздух, соли меди (II), бисульфит, метабисульфит или перекись водорода, предпочтительно диметилсульфоксид. Количество указанного тиолового оксиданта, в частности диметилсульфоксида, предпочтительно составляет 2-4 молярных эквивалента в расчете на количество соединения формулы (II).
Наиболее предпочтительный вариант осуществления настоящего изобретения относится к способу превращения соединения формулы II, в котором R1 обозначает группу "c", в соединение формулы I, который заключается в том, что указанное соединение формулы II подвергают взаимодействию с пиперазином, осветлителем пиперазина (наиболее предпочтительно, изопропанолом) и тиоловым оксидантом (наиболее предпочтительно, диметилсульфоксидом).
Термин "осветлитель пиперазина" в используемом здесь значении относится к растворителю, который при нагревании с обратным холодильником способен растворять пиперазин, затвердевший в головном и паровом пространстве реактора. Специалистам в этой области известно, что пиперазин затвердевает при температуре около 108oC, поэтому он будет затвердевать в любой зоне реактора с такой или более низкой температурой. Специалистам в этой области также известно, что отверждение пиперазина будет происходить во всех зонах реактора, расположенных выше уровня раствора в реакторе.
Зона, расположенная выше уровня раствора внутри реактора, входит в реакционную область и именуется головным пространством реактора. Паровым пространством является пространство внутри и вокруг различных питающих трубопроводов, идущих к реактору и от него.
Термин "соли меди (II)" в используемом здесь значении относится к хлориду меди (CuCl2), бромиду меди (CuBr2) или сульфату меди (CuSO4).
Термин "бисульфит" в используемом здесь значении относится к бисульфиту натрия (NaHSO3) или бисульфиту калия (KHSO3).
Термин "метабисульфит" в используемом здесь значении относится к метабисульфиту натрия (Na2S2O5) или метабисульфиту калия (K2S2O5).
Подробное описание изобретения
Соединения формулы I и ципразидон можно получить так, как это показано на приведенных ниже схемах реакций и изложено в описании изобретения. За исключением особо оговоренных случаев соединения формулы I, II и IIa и группа R1, указанная на схемах реакций и в описании изобретения, имеют указанные выше значения.
Схема 1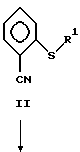
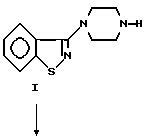

Схема 2
На схеме 1 показано получение промежуточных соединений формулы I или Ia, которые можно превратить в конечный продукт, ципразидон, в соответствии со способами, показанными на схеме 2.
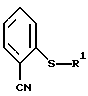
Показанное на схеме 1 соединение формулы II, в которой R1 обозначает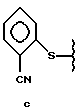
можно приобрести коммерческим путем или получить в соответствии со способом, описанным в патенте Японии N 6220030, опубликованном 9 августа 1994 г.
Соединение формулы II, в которой R1 обозначает
можно получить в результате взаимодействия соединения формулы:
примерно с 1-10 эквивалентами пиперазина, предпочтительно с 2-5 эквивалентами пиперазина. Температура вышеуказанной реакции находиться в интервале от около 25oC до около 105oC, предпочтительно она равна примерно 65oC. Время реакции составляет от около 1 часа до около 20 часов, предпочтительно от около 2 до около 6 часов.
Соединение формулы V получают из амида формулы:
в результате взаимодействия примерно с 1 - 3 эквивалентами хлорирующего агента, такого как оксихлорид фосфора (POCl3) трихлорид фосфора (PCl3) или пентахлорид фосфора (PCl5) в инертном растворителе. В качестве хлорирующего агента предпочтительно используют 1,2 эквивалента оксихлорида фосфора. Приемлемыми растворителями являются диметилформамид, диметилацетамид или пиридин, предпочтительно диметилформамид. Время реакции составляет от около 1 до около 5 часов, предпочтительно около 3,5 часов. Реакцию осуществляют при температуре от около 30oC до около 100oC, предпочтительно около 70oC.
Соединение формулы VI является коммерчески доступным.
Соединения формулы II, в которой R1 обозначает
можно получить в результате взаимодействия бис(2-цианфенил)дисульфида с соединением формулы:
в инертном растворителе. Приемлемыми инертными растворителями являются изопропанол, этанол или тетрагидрофуран, предпочтительно изопропанол. Вышеуказанную реакцию осуществляют при температуре от около 50oC до около 120oC. Время реакции составляет от около 1 часа до около 3 часов, предпочтительно около 2 часов.
Соединение формулы II, в которой R1 обозначает
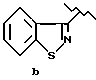
или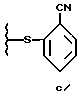
можно превратить в соединение формулы I в результате взаимодействия примерно с 2 - 20 эквивалентами пиперазина (предпочтительно безводного). Пиперазин предпочтительно используют в таком количестве, которое сводит до минимума бис-замещение свободного амина в пиперазиновой группе соединения формулы I. R1 предпочтительно обозначает
Когда R1 обозначает указанную выше группу формулы "c", предпочтительное количество пиперазина составляет около 5 - 10 эквивалентов, наиболее предпочтительно около 10 эквивалентов. Температура вышеуказанной реакции находится в интервале от около 76oC до 200oC, предпочтительно она равна примерно 120oC. Время реакции изменяется в зависимости от температуры, при которой протекает реакция. При увеличении температуры реакции время реакции сокращается. Если реакция осуществляется при температуре около 80oC, через 2 дня можно получить лишь небольшое количество продукта. Если реакция осуществляется при температуре около 200oC, в реакторе необходимо создать повышенное давление, чтобы предотвратить потерю пиперазина и осветлителя, при этом время реакции будет составлять около 1 часа. Когда реакция осуществляется при высоких температурах, давление внутри реактора должно составлять около 3,5 - 4,2 атм., и таким образом оно соответствует стандартным характеристикам давления промышленных реакторов. Когда реакция осуществляется при идеальной температуре около 120oC, время реакции составляет примерно 24 часа.
В результате взаимодействия соединения формулы II, в которой R1 обозначает
или
с пиперазином образуется тиол, являющийся побочным продуктом формулы:
Предпочтительный вариант осуществления этой реакции заключается в том, что производят окисление in situ соединения формулы VII с получением соединения формулы II, в которой R1 обозначает
Процесс окисления in situ можно облегчить путем добавления в реактор от около 1 до около 10 эквивалентов, предпочтительно 4 эквивалента, оксиданта. Приемлемыми оксидантами являются диметилсульфоксид, воздух, соли меди (II), бисульфит, метабисульфит или перекись водорода, предпочтительно диметилсульфоксид. Диметилсульфоксид в качестве оксиданта предпочтительно используют в количестве от около 2 до 5 эквивалентов.
В соответствии с другим предпочтительным вариантом осуществления этой реакции в реактор добавляют осветлитель пиперазина в количестве от около 0,5 до около 5 объемов, чтобы не допустить отверждения пиперазина в головном пространстве и паропроводах реактора. Приемлемые осветлители пиперазина имеют температуру кипения в интервале от около 70oC до около 130oC и представляют собой изопропанол или трет-бутанол, пиридин, толуол или диглим, предпочтительно изопропанол. Осветлитель пиперазина предпочтительно используют в количестве около 1,2 объема (в расчете (мл/г) на массу соединения формулы II).
Соединение формулы I можно превратить в более стабильные фармацевтически приемлемые соли соединения формулы Ia, в которой R обозначает фармацевтически приемлемый анион, сопряженный с фармацевтически приемлемой кислотой, в результате обработки свободного основания формулы I фармацевтически приемлемой кислотой формулы RH в полярном растворителе. Приемлемыми кислотами формулы RH являются кислоты, которые образуют нетоксичные соли присоединения кислоты, например соли, содержащие фармацевтически приемлемые анионы, такие как хлорид, бромид, йодид, нитрат, сульфат или бисульфат, фосфат или кислый фосфат, ацетат, лактат, цитрат или кислый цитрат, тартрат или битартрат, сукцинат, малеат, фумарат, глюконат, сахарат, бензоат, метансульфонат и памоат [то есть, 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)]. Кислотой предпочтительно является хлористоводородная кислота. Приемлемыми растворителями являются низшие спирты, такие как метанол, этанол, изопропанол или трет-бутанол, толуол, простые эфиры, такие как диэтиловый эфир или тетрагидрофуран, или смеси вышеуказанных растворителей. Растворителем предпочтительно является смесь изопропанола и толуола.
Соединение формулы I или Ia превращают в ципразидон в соответствии со способами, описанными в патентах США N 4831031, 5206366 или 5359068, выданных соответственно 16 мая 1989 г., 27 апреля 1993 г. и 25 октября 1994 г.
На схеме 2 показано получение ципразидона из соединений формулы I или Ia в соответствии со способами, описанными в патенте США N 4831031, выданном 16 мая 1989 г. Соединение формулы I или Ia, в частности, подвергают взаимодействию с соединением формулы III, в которой Hal обозначает фтор, хлор, бром или йод. Эту реакцию сочетания обычно осуществляют в полярном растворителе, таком как низший спирт, например этанол, диметилформамид или метилизобутилкетон, и в присутствии слабого основания, такого как основание третичного амина, например триэтиламин или диизопропилэтиламин. Эту реакцию предпочтительно осуществляют в присутствии каталитического количества йодида натрия и нейтрализующего агента для гидрохлорида, такого как карбонат натрия. Эту реакцию предпочтительно осуществляют при температуре кипения с обратным холодильником используемого растворителя.
Альтернативно, схема 2 относится также к превращению соединений формулы I или Ia в ципразидон в соответствии со способами, описанными в патенте США N 5206366, выданном 27 апреля 1993 г. Соединение формулы I или Ia, в частности, подвергают взаимодействию с соединением формулы III, в которой Hal обозначает фтор, хлор, бром или йод. Реакцию сочетания осуществляют в воде при температуре кипения с обратным холодильником с использованием такого нейтрализатора, как галоидводородная кислота.
Соединения формулы I можно альтернативно превратить в ципразидон в соответствии со способами, описанными в патенте США N 5359068, выданном 25 октября 1994 г.
Соединения формулы I, в частности, могут быть подвергнуты взаимодействию с соединением формулы:
в присутствии (C1-C6)алкановой кислоты с получением соединения формулы:
Соединение формулы IX можно затем обработать восстановителем с получением соединения формулы:
Соединение формулы X можно затем обработать соединением формулы R2-CH2-CO2R3, где R2 обозначает CO2R3 или CN, и R3 обозначает (C1-C6)алкил,
с получением соединения формулы: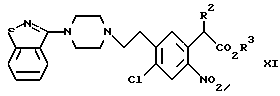
где R2 обозначает CN или CO2R3, и R3 обозначает (C1-C6)алкил.
Соединение формулы XI можно затем обработать кислотой при повышенной температуре с получением соединения формулы XI, в которой R2 и R3 оба обозначают водород.
Соединение формулы XI можно затем обработать (C1-C6)алканолом в присутствии катализатора кислотной этерификации с получением соединения формулы XI, в которой R2 обозначает водород, и R3 обозначает (C1-C6)алкил.
Соединение формулы XI, в которой R2 обозначает водород, CN или CO2R3, и R3 обозначает водород или (C1-C6)алкил, можно затем обработать восстановлением при условии, что когда R2 обозначает CN или CO2R3, и R3 обозначает (C1-C6)алкил, продукт реакции восстановления нагревают с кислотой с получением ципразидона.
Конкретное описание стадий превращения соединений формулы I в ципразидон приведено в патенте США N 5359068, выданном 25 октября 1994 г.
Ципразидон (полугидрат или моногидрат) можно использовать в качестве нейролептического средства в соответствии с описанием, приведенным в вышеуказанных патентах США N 4831031 или 5312925 (относящихся соответственно к полугидрату и моногидрату). Это вещество можно вводить нуждающемуся субъекту отдельно или, предпочтительно, в сочетании с фармацевтически приемлемыми носителями или разбавителями в виде фармацевтических композиций, получаемых в соответствии с обычной фармацевтической практикой. Ципразидон (полугидрат или моногидрат) можно вводить перорально или парентерально, в том числе внутривенно или внутримышечно. Приемлемыми фармацевтическими носителями являются твердые разбавители или наполнители, стерильные водные растворы и различные органические растворители. Фармацевтические композиции используют в виде разных лекарственных форм, таких как таблетки, порошки, лепешки, сиропы и растворы для инъекций. Эти фармацевтические композиции, при желании, могут содержать дополнительные ингредиенты, такие как ароматизаторы, связывающие вещества и наполнители. Таким образом, для перорального введения можно использовать таблетки, содержащие разные наполнители, такие как цитрат натрия, карбонат кальция и фосфат кальция, вместе с разными дезинтеграторами, такими как крахмал, альгиновая кислота и определенные комплексные силикаты, а также со связывающими веществами, такими как поливинилпирролидон, сахароза, желатин и аравийская камедь. Помимо этого, для изготовления таблеток часто используют смазывающие вещества, такие как стеарат магния, лаурилсульфат натрия и тальк. Твердыми композициями аналогичного типа можно наполнить мягкие и жесткие желатиновые капсулы. Для их изготовления предпочтительно используют такие материалы, как лактоза или молочный сахар и высокомолекулярные полиэтиленгликоли. При изготовлении водных суспензий или эликсиров для перорального введения активный ингредиент можно смешивать с разными подслащивающими или ароматизирующими веществами, красителями или пигментами и, при желании, с эмульгирующими или суспендирующими веществами, с такими разбавителями, как вода, этанол, пропиленгликоль, глицерин и их смеси.
Для парентерального введения можно использовать раствор или суспензию ципразидона (полугидрат или моногидрат) в кунжутном или арахисовом масле, водном растворе пропиленгликоля или в стерильном водном растворе. Такие водные растворы, при необходимости, должны быть дополнены соответствующим буфером и жидким разбавителем, который сначала делают изотоническим, добавляя достаточное количество солевого раствора или глюкозы. Эти водные растворы особенно пригодны для внутривенного, внутримышечного, подкожного и внутрибрюшинного введения. Стерильные водные среды можно легко получить в соответствии со стандартными методами, известными специалистам в этой области.
Эффективная доза ципразидона (полугидрат или моногидрат), как известно, зависит от способа введения и других факторов, таких как возраст и масса нуждающегося субъекта.
Приводимые ниже примеры иллюстрируют промежуточные соединения и способы их получения по настоящему изобретению. Коммерческие реагенты использованы без дальнейшей очистки. Температуры плавления не скорректированы. Данные спектроскопии ЯМР указаны в миллионных долях (δ) и соотнесены с синхросигналом дейтерия в растворителе образца. За исключением особо оговоренных случаев все масс-спектры получены в условиях электронного удара (EI, 70 эВ). За исключением особо оговоренных случаев анализы выполнены посредством хроматографии на колонках из силикагеля с размером частиц 32 - 63 мкм под давлением в атмосфере азота (флэш-хроматография). Для жидкостной хроматографии высокого давления использовано оборудование LDC Analytical constaMetric® 3200 HPLC (Thermo Separation Products Co). Анализы посредством жидкостной хроматографии высокого давления (подвижная фаза: 40% ацетонитрила, 45% 0,05 М раствора кислого фосфата калия (KH2PO4) с pH 6,0, регулируемым гидроксидом калия (KOH), 15% метанола; объемная скорость равна 1,0 мл/минуту; детектор: ультрафиолетовый 229 нм; дозатор: 10 мкл; образцы получены в подвижной фазе (0,05 мг/мл)) выполнены на колонке Zorbax®C8 ,  3,9 х 150 мм (Mac-Mod Analytical, Inc. , Chadds Ford, PA 19317). Комнатная температура равна 20 - 25oC.
3,9 х 150 мм (Mac-Mod Analytical, Inc. , Chadds Ford, PA 19317). Комнатная температура равна 20 - 25oC.
Условные обозначения
NMR - спектр ЯМР; (s) - синглет, (d) - дублет, (t) - триплет, (q) - квартет, (m) - мультиплет; HRMS - масс-спектрометрия высокого разрушения; FAB-MS - масс-спектрометрия с бомбардировкой ускоренными атомами; т.к. - температура кипения.
Пример 1
Гидрохлорид 3-(1-пиперазинил)-1,2-бензизотиазола
Способ A
В 500 мл круглодонную колбу, оснащенную механической мешалкой, термометром, обратным холодильником, в верхней части которого имеется впускное отверстие для азота и соединительной трубкой, ведущей в отбеливающий скруббер, загружают бис(2-цианфенил)дисульфид (20,0 г, 74,5 ммоль), безводный пиперазин (64,2 г, 745 ммоль), диметилсульфоксид (12,8 г, 164 ммоль) и изопропанол (24 мл). Колбу продувают азотом, реагенты расплавляют (при температуре примерно 80oC) и нагревают до температуры кипения с обратным холодильником (110 - 126oC). После нагревания с обратным холодильником в течение 24 часов из красноватого раствора берут образец для тонкослойной хроматографии (производя элюирование смесью метиленхлорид : изопропанол : триэтиламин с соотношением 15 : 5 : 1), результаты которой указывают на завершение реакции. Раствор охлаждают до 85 - 90oC и при этой температуре добавляют воду (130 мл). Полученную суспензию охлаждают до 30 - 35oC. Реакционную смесь концентрируют при пониженном давлении (т.к. = 50 - 60oC при давлении 110 мм), что дает примерно 30 мл дистиллята. Дистиллят обрабатывают отбеливающим средством, чтобы разрушить диметилсульфид (ДМС). С помощью трубок Драгера Drägerweck Ag Lübeck , Германия) предназначенных для определения содержания диметилсульфида в частях на миллион, устанавливают, что пары в головном пространстве реакционной колбы содержат менее 1 части на миллион остаточного ДМС. Образец сырой реакционной смеси анализируют посредством тонкослойной хроматографии высокого давления. Сырая реакционная смесь содержит 3-(1-пиперазинил)-1,2-бензизотиазол (80%), 3,3'-(1,4-пиперазинил)-бис-1,2-бензизотиазол (4,6%) и 2-(1-пиперазинил)-пиперазин (4%). Затем добавляют изопропанол (28 мл) и воду (71 мл), суспензию охлаждают до 30oC, гранулируют в течение 0,5 часа и фильтруют через диатомовую землю, например целит (Celite®), с получением 3,3'-(1,4-пиперазинил)-бис-1,2-бензизотиазола. Фильтровальный осадок промывают 56 мл смеси изопропанола : вода (1:1). К теплому (32oC) фильтрату добавляют толуол (170 мл) и отделенный водный слой промывают свежим толуолом (100 мл). Объединенные слои толуола промывают водой (100 мл), а затем обрабатывают обесцвечивающим углем, например DARKO KB-B® (2 г). Слой целита промывают толуолом (60 мл), промывочную воду объединяют с фильтратом и концентрируют при пониженном давлении до 90 мл. К концентрату добавляют изопропанол (220 мл) и желтоватый раствор охлаждают до 20oC. Показатель pH раствора медленно доводят до 3,5 - 4,0, добавляя 9,8 мл концентрированной хлористоводородной кислоты. Полученную суспензию охлаждают до 0 - 5oC, гранулируют в течение 1 часа, а затем фильтруют. Осадок продукта промывают холодным изопропанолом (80 мл) и сушат в вакууме при температуре 40oC в течение 24 часов. Указанное в заголовке соединение (43,2 г) выделяют в виде светло-желтого твердого вещества с выходом 77,6% (степень чистоты 98,5%, определяемая жидкостной хроматографией высокого давления). Спектроскопические и физические свойства твердого вещества идентичны подлинному образцу (внимание: соединение является сильным раздражителем). 1H NMR (D2O): δ 7,80 (m, 2H), 7,49 (m, 1H), 7,35 (m, 1H), 3,58 (m, 4H) и 3,42 (m, 4H).
13C NMR (диметилсульфоксид): δ 162,72, 152,10, 128,15, 127,09, 124,63, 124,12, 121,21, 48,48 и 42,49.
Пример 2
Гидрохлорид 3-(1-пиперазинил)-1,2-бензизотиазола
Бис(2-цианфенил)дисульфид (5,00 г, 18,6 ммоль), безводный пиперазин (8,02 г 93,2 моль) и изопропанол ( 5 мл) смешивают в атмосфере азота и нагревают до температуры кипения с обратным холодильником (115oC). Желтый раствор нагревают с обратным холодильником (110-115oC) в течение 23 часов, а затем охлаждают до 95oC. Затем добавляют воду (30 мл), полученную суспензию охлаждают до 25oC и фильтруют. Фильтровальный осадок промывают 12 мл смеси вода : изопропанол (261). Промывочную воду смешивают с фильтратом и добавляют толуол (50 мл). Слой толуола отделяют и водный слой экстрагируют дополнительным количеством толуола (25 мл). Объединенные слои толуола промывают водой (20 мл), обрабатывают активированным углем (DARKO KB-B® (0,5 г), фильтруют и концентрируют при пониженном давлении (42oC при давлении 700 мм рт. ст. ) до 12 мл. К концентрату добавляют изопропанол (30 мл), после чего показатель pH доводят до 4,4, добавляя концентрированную хлористоводородную кислоту. Полученную суспензию охлаждают до 0-5oC, гранулируют в течение 1 часа и фильтруют. Осадок продукта промывают холодным изопропанолом (10 мл) сушат в вакууме при температуре 42oC с получением 3,22 г (общий выход 34%) 3-(1-пиперазинил)-1,2-бензизотиазола. Анализ, выполняемый посредством тонкослойной хроматографии, показывает наличие продукта в виде одного пятна.
Показатель pH водного слоя доводят до 4,0, добавляя концентрированную хлористоводородную кислоту, и экстрагируют метиленхлоридом (40 мл). Раствор в метиленхлориде концентрируют при пониженном давлении с получением масла, которое растворяют в метаноле (19 мл). Раствор охлаждают на ледяной бане и, перемешивая, добавляют 10% раствор перекиси водорода (7 мл). Раствор перемешивают в течение 10 минут и анализируют посредством тонкослойной хроматографии, результаты которой указывают на завершение реакции. Затем добавляют воду (12 мл) и гранулируют суспензию в течение 1,5 часов. Продукт фильтруют и сушат в вакууме при температуре 40oC с получением 1,64 г (выход 33%) бис(2-цианфенил)дисульфида, предназначенного для рециркуляции.
Пример 3
Гидрохлорид 3-(1-пиперазинил)-1,2-бензизотиазола
В сухую 300 мл круглодонную колбу, оснащенную механической мешалкой, термометром, обратным холодильником, в верхней части которого имеется впускное отверстие для азота, и капельной воронкой для выравнивания давления, загружают безводный пиперазин (49,4 г, 0,57 моль) и трет-бутанол (10 мл). Колбу продувают азотом и нагревают до 100oC на масляной бане. В капельную воронку вводят раствор 3-хлор-1,2-бензизотиазола (19,45 г, 0,11 моль) в трет-бутаноле (10 мл) и в течение 20 минут медленно добавляют его в реакционную колбу, в результате чего происходит экзотермическая реакция (112 - 118oC). Закончив добавление, желтый раствор нагревают до температуры кипения с обратным холодильником (121oC) и продолжают нагревать с обратным холодильником в течение 24 часов. Результаты тонкослойной хроматографии показывают, что реакция завершена. Реакционную смесь охлаждают до 85oC и добавляют 120 мл воды. Мутный раствор фильтруют и фильтровальный осадок промывают 60 мл смеси трет-бутанол : вода (1:1). Показатель pH смеси фильтрата и промывочной воды доводят до 12,2, добавляя 50% водный раствор каустической соды. Водный раствор экстрагируют толуолом (200 мл), слои разделяют и водный слой экстрагируют свежим толуолом (100 мл). Объединенные слои толуола промывают водой (75 мл), после чего раствор толуола концентрируют до 90 мл в вакууме при температуре 48oC. К концентрату добавляют изопропанол (210 мл) и pH медленно доводят до 3,8, добавляя 7,6 мл концентрированной хлористоводородной кислоты. Полученную суспензию охлаждают до 0oC, гранулируют в течение 45 минут и фильтруют. Фильтровальный осадок промывают холодным изопропанолом (50 мл) и сушат в вакууме при температуре 40oC с получением 23,59 г (выход 80%) гидрохлорида 3-(1-пиперазинил)-1,2-бензизотиазола в виде твердого вещества белого цвета с сероватым оттенком.
Пример 4
3-(1-Пиперазинил)-1,2-бензизотиазол
В 6 мл круглодонную колбу, оснащенную магнитной мешалкой, обратным холодильником, в верхней части которого имеется впускное отверстие для азота и термометром, загружают 3-(2-цианфенилтио)-1,2-бензизотиазола (0,25 г, 0,93 ммоль), безводный пиперазин (0,80 г, 9,32 ммоль) и изопропанол (0,25 мл). Колбу продувают азотом и погружают в масляную баню с температурой 120oC, что дает желтый раствор, который нагревают с обратным холодильником. Красноватый раствор нагревают в течение 25 часов при температуре 116 - 120oC, охлаждают до 25oC и добавляют 5 мл метанола. Результаты тонкослойной хроматографии (смесь метиленхлорида : изопропанол : триэтиламин с соотношением 15:5:1) показывают, что реакция в основном завершена. Сырой реакционный раствор анализируют посредством жидкостной хроматографии высокого давления с получением 3-(1-пиперазинил)-1,2-бензизотиазола с выходом 70%.
Пример 5
3-(1-Пиперазинил)-1,2-бензизотиазол
В круглодонную колбу, оснащенную механической мешалкой, термометром, обратным холодильником, в верхней части которого имеется впускное отверстие для азота, и капельной воронкой, загружают безводный пиперазин (17,2 г, 0,20 моль) и изопропанол (3,0 мл). Колбу продувают азотом и выдерживают в его атмосфере, после чего смесь нагревают до температуры 90oC с получением раствора. Раствор 1-(2-цианфенилтио)пиперазина (4,38 г, 20,0 ммоль) в изопропаноле (2,0 мл) в течение 1 часа медленно добавляют к теплому раствору пиперазина. Закончив добавление, раствор нагревают до температуры кипения с обратным холодильником (118oC) в течение 24 часов. Красноватый раствор охлаждают до комнатной температуры и анализируют посредством жидкостной хроматографии высокого давления. Результаты анализа показывают, что получен 3-(1-пиперазинил)-1,2-бензизотиазол с выходом 55%.
Пример 6
3-(2-Цианфенилтио)-1,2-бензизотиазол
Способ A
В 50 мл круглодонную колбу, оснащенную магнитной мешалкой, термометром и обратным холодильником, в верхней части которого имеется впускное отверстие для азота, загружают бис(2-цианфенил)дисульфид (1,25 г, 4,66 ммоль), безводный пиперазин (4,01 г, 46,6 ммоль) и диметилсульфоксид (0,80 г, 10,3 ммоль) в 15 мл тетрагидрофурана. Колбу продувают азотом и нагревают смесь с обратным холодильником (75oC) в течение 25 часов. Реакционную смесь охлаждают до 25oC и удаляют тетрагидрофуран при пониженном давлении. Полученное твердое вещество растворяют в 40 мл смеси метиленхлорида : вода (1:1), слои разделяют и органический слой промывают водой (20 мл). Раствор в метиленхлориде упаривают с получением сырого твердого вещества (0,85 г), которое кристаллизуют из изопропанола (17 мл) с получением светло-желтых кристаллов. Продукт фильтруют и сушат в вакууме при температуре 40oC с получением 0,39 г (выход 31%) 3-(2-цианфенилтио)-1,2-бензизотиазола. Температура плавления 115,5 - 117oC. 1H NMR (CDCl3): δ 8,03 (m, 1H), 7,92 (m, 1H), 7,77 (m, 1H), 7,70 (m, 1H), 7,57 (m, 2H) и 7,48 (m, 2H). 13C NMR (CDCl3): δ 154,99, 152,30, 134,83, 134,56, 134,06, 133,24, 129,07, 128,51, 125,33, 123,29, 120,13, 117,13 и 116,95. Вычислено для C14H8N2S2: C, 62,66; H, 3,00; N, 10,44; S, 23,90. Найдено: C, 62,43; H, 3,01; N 10,68; S, 24,05.
Кроме того, для подтверждения структуры продукта получена рентгеновская кристаллическая структура.
Пример 7
3-(2-Цианфенилтио)-1,2-бензизотиазол
Способ B
Бис(2-цианфенил)дисульфид (0,40 г, 1,48 ммоль) и 2-меркаптобензонитрил (0,20 г, 1,48 ммоль) смешивают в 2 мл изопропанола и нагревают с обратным холодильником (90oC) в течение 25 часов в атмосфере азота (N2). Результаты анализа, выполненного посредством тонкослойной хроматографии высокого давления, показывают, что получен 3-(2-цианфенилтио)-1,2-бензизотиазол с выходом 69%.
Пример 8
1-(2-Цианфенилтио)пиперазин
Безводный пиперазин (22,5 г, 261 ммоль) и тетрагидрофуран (100 мл) смешивают в атмосфере азота и нагревают до температуры 60 - 65oC. 3-Хлор-1,2-бензизотиазол (10,0 г, 59,0 ммоль) в течение одного часа медленно добавляют к теплому раствору пиперазина и полученный красноватый раствор нагревают при температуре 65oC в течение 17 часов. Результаты тонкослойной хроматографии (смесь этилацетат : гексаны : триэтиламин с соотношением 10:10:1) показывают, что реакция завершена. Смесь охлаждают до комнатной температуры и фильтруют. К раствору добавляют толуол (100 мл). После чего его концентрируют при пониженном давлении (40oC) до половины объема. Раствор в толуоле промывают водой (100 мл) и экстрагируют водный слой свежим толуолом (25 мл). Объединенные слои толуола концентрируют при пониженном давлении примерно до 30 мл. Охладив раствор до 0 - 5oC, к нему медленно добавляют гексаны (50 мл). Полученные кристаллы гранулируют в течение 1 часа при температуре 0 - 5oC, фильтруют и промывают фильтровальный осадок свежими гексанами (15 мл); твердые вещества сушат в течение 18 часов при температуре 23oC с получением 11,51 г (выход 89%) кристаллического твердого вещества желтого цвета (т.пл. = 67 - 71oC). Результаты спектроскопии ЯМР показывают, что получен сырой сульфенамид, содержащий примерно 5% 1,4-бис(2-цианфенилтио)пиперазина. Сульфенамид хранят при температуре от 0 до -10oC, чтобы не допустить его медленного превращения в 1,4-бис(2-цианфенилтио)пиперазин, происходящего при нагревании при хранении при комнатной температуре. 1H NMR (CDCl3): δ 7,63 (m, 1H), 7,56 (m, 3H), 7,21 (m, 1H), 2,96 (m, 4H) и 2,87 (m, 4H). 13C NMR (CDCl3): δ 142,69, 133,55, 132,67, 128,14, 126,69, 116,80, 110,24, 57,34 и 47,06. HRMS найдено: 220,0878; C11H13N3S. Вычислено (FABP+1): 220,0908.
Описываются новые 2-цианфенилтиопроизводные общей формулы IIа, где R1 обозначает (в) или (а), проявляющие нейролептическую активность. Описывается также способ получения промежуточного продукта. 2 c. и 16 з.п. ф-лы.



где R1 обозначает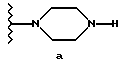
или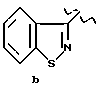
2. Способ получения 3-(1-пиперазинил)-1,2-бензизотиазола формулы I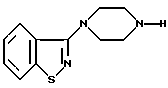
отличающийся тем, что соединение формулы II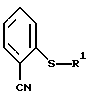
где R1 обозначает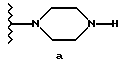
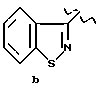
или
подвергают взаимодействию с пиперазином при температуре от около 80oС до около 170oС.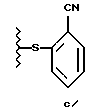
4. Способ по п.3, отличающийся тем, что пиперазин присутствует в количестве от около 2 молярных эквивалентов до около 15 молярных эквивалентов в расчете на количество соединения формулы II.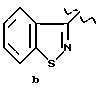
или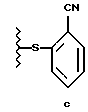
подвергают взаимодействию с пиперазином в присутствии тиолового оксиданта.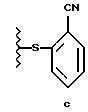
13. Способ по п.12, отличающийся тем, что в качестве тиолового оксиданта используют диметилсульфоксид, воздух, соли меди (II), бисульфит, метабисульфит или перекись водорода.
| SU, 1687030 A3, 1991 | |||
| US, 4590196 A, 1986 | |||
| EP, 0741129 A2, 06.11.96. |
Авторы
Даты
2000-04-10—Публикация
1996-10-11—Подача