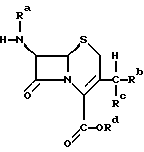
Объектом данного изобретения являются новые промежуточные соединения при получении цефалоспорина. В частности, объектом изобретения является производное цефалоспорина формулы
в которой либо
α) Ra обозначает водород или силильную группу; Rb обозначает группу формулы -ORe, в которой Re обозначает водород или низший алкил; a Rc и Rd совместно обозначают связь; или
β) Ra и Rd обозначают водород или силильную группу; Rb и Rc совместно обозначают иминогруппу формулы = N-Y, где Y обозначает арил, в частности фенил; или
γ) Rd обозначает водород или силильную группу; Ra обозначает водород, если Rd обозначает водород; либо Ra обозначает водород или силильную группу, если Rd обозначает силильную группу; a Rb и Rc совместно обозначают оксогруппу; а силильная группа обозначает три(низш.)алкилсилильную группу;
в свободной форме или в форме соли.
Кроме того, Y может обозначать алкил или гетероциклил.
В одном частном аспекте объектом изобретения является соединение формулы
в которой X- обозначает анион неорганической или органической кислоты, a R1 обозначает водород или (низш.)алкильную группу, предпочтительно водород.
Предпочтительным соединением формулы I является соединение, выбранное из группы, состоящей из
гидрохлорида 6-амино-5a, 6-дигидро-3-гидрокси-3Н, 7H-ацето [2,1- b]фуро[3,4-d] [1,3]тиазин-1,7(4H)-диона,
толуолсульфоната 6- амино-5a,6-дигидро-3-гидрокси-3Н,7H-ацето [2,1-b]фуро[3,4-d][1,3]тиазин-1,7(4H)-диона,
гидрохлорида 6-амино-5a, 6-дигидро-3-метокси-3Н, 7H-ацето [2,1-b] фуро[3,4-d] [1,3]тиазин-1,7(4H)-диона и
толуолсульфоната 6-амино-5а, 6-дигидро-3-метокси-3Н,7H- ацето[2,1-b]фуpo[3,4-d] [1,3]тиазин-1,7(4H)-диона.
В другом частном аспекте объектом изобретения является соединение формулы
в которой Ra и Rd обозначают водород или силильную группу.
В следующем частном аспекте объектом изобретения является соединение формулы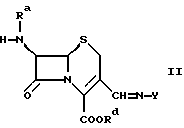
в которой Y, Ra и Rd имеют значения, определенные для формулы Ia,
в свободной форме или в форме соли.
Предпочтительное соединение формулы II представляет собой 7-амино-3-(N-фенилимино)метил-3-цефем-4-карбоновую кислоту.
Алкил, арил или гетероциклил в значении Y включают незамещенный алкил, арил или гетероциклил; либо замещенные амино-, диалкиламино-, гидрокси-, алкоксигруппой, алкилом, арилом, нитрогруппой, галогеном, карбалкокси- или уреидогруппой алкил, арил или гетероциклил. Y обозначает предпочтительно трет.-бутил, фенил, нафтил или пиримидинил.
Если не указано иное, то алкил включает алкильную группу, имеющую от 1 до 22, например от 1 до 12, в частности от 1 до 8 атомов углерода, предпочтительно низший алкил, такой как (C1-4)алкил. Алкильная группа может быть незамещенной или может быть замещена группами, инертными при соответствующих реакционных условиях. Силильная группа предпочтительно является силильной защитной группой и включает обычную силильную защитную группу, такую как триалкилсилильная группа, например триметилсилильную группу. Арильная группа включает арил, имеющий от 6 до 18 атомов углерода, предпочтительно фенил, нафтил. Арильная группа может быть незамещенной или может быть замещена группами, инертными при соответствующих реакционных условиях. Гетероциклил включает гетероциклические группы, указанные ниже для значений R5 и R6. Гетероциклическая группа может быть незамещенной или может быть замещена группами, инертными при соответствующих реакционных условиях.
Соединение формулы Ia, в которой Ra и Rd обозначают водород, является таутомерной альдегидной формой соединения формулы I в свободной основной форме, где R1 обозначает водород; соединение формулы II может быть использовано в качестве промежуточного соединения при получении соединения формулы I.
Соединение формулы IA, в частности соединение формулы I, la или II, является удобным промежуточным соединением при получении высокоактивных антибиотиков. Оно может быть использовано для получения целого ряда цефалоспоринов, замещенных по атому азота в положении 7 и в положении 3 структуры цефалоспорина различными группами, которые являются группами, влияющими на активность соответствующего цефалоспорина. Соединение формулы I является само по себе или в равновесии со своей таутомерной альдегидной формой формулы Ia, в которой Ra и Rd обозначают силильную группу, приемлемым в качестве исходного материала, например для реакции Виттига, для реакций декарбоксилирования, для получения большинства различных альдегидных производных. В то же время можно получать его необходимые производные по положению 7, например посредством ацилирования.
Примерами высокоактивных антибиотиков, которые могут быть получены из соединений по изобретению традиционным способом, являются цефтибутен как пример декарбонилированного продукта; цефиксим, цефдинир, Е-1077 или соединения, описанные в ЕР 620225, например соединения от А до P ЕР 620225, в качестве примеров продуктов реакции Виттига; соединения, имеющие структуру формулы А, описанные в ЕР 392796, в виде тиоацеталя (тиоацетальная структура формулы А может быть получена, например, способом согласно J.Antibiotics 44(4), 415-21, 1991).
Из литературы известны способы получения 3-формил- цефалоспорина или соединения формулы I, которые ацилированы по атому азота в положении 7. В качестве исходных веществ в них берут исключительно 7-ациламино-3-гидроксиметил-3-цефем-4-карбоновые кислоты (эфиры), 7-бензилиден-3-гидроксиметил-3-цефем-4-карбоновые кислоты (эфиры), эфиры 7-ациламино-3-галогенметил-3-цефем-4-карбоновых кислот либо лактоны 7-ациламино-3-цефалоспорина.
Например, 3-формилцефалоспорин, который ацетилирован по атому азота в положении 7, получают путем окисления соответствующего бензгидрилового эфира 7-фенил-ацетамидо-3-гидроксиметил-3-цефем-4-карбоновой кислоты, а затем путем расщепления трифторуксусной кислотой в присутствии метилового эфира орто-муравьиной кислоты получают аналоги формулы I (R1=H или метил), которые ацетилированы по атому азота в положении 7 посредством фенилацетильной группы (H.Peter and H.Bickel, Helvetica Chimica Acta, vol. 57, N 219, p.p. 2044 f.f, 1974). Помимо применения сложной технологии защитных групп, способ имеет также еще частный недостаток, заключающийся в том, что окисление спирта до альдегида сопровождается нежелательной Δ-2 изомеризацией и лактонизацией. Кроме того, применяемые окисляющие агенты, такие как оксид хрома (VI), и расщепляющие реагенты, такие как трифторуксусная кислота, не могут применяться в промышленных масштабах по экологическим соображениям.
Известен способ получения п-метоксибензилового эфира 7-фенила-цетиламино-3-формил-3-цефем-4- карбоновой кислоты, в котором в качестве исходного вещества используют соответствующее 3-йодметиловое соединение (H.Tanaka et al. , Synlett, p. 660, 1990). Применяемым в нем окисляющим агентом является O2 с хлоридом родия и алюминия в качестве катализатора. Продукт окисления должен быть очищен посредством хроматографии, максимальный выход достигает 66%.
Известно окисление 7-ациламино-3-гидроксиметил-3-цефем-4-карбоксилата с помощью смеси хромовая кислота/серная кислота с получением в результате соответствующего лактона (DE 2360620). Особо рассмотрены проблемы стабильности соответствующего таутомерного альдегида по сравнению с лактонной формой формулы I. Применение соединений хрома исключается в промышленных масштабах по экологическим соображениям.
Известен способ получения гидроксилактонов 7-ациламино-3-формил-3-цефем-4- карбоновой кислоты, исходя из соответствующих лактонов, посредством бромирования с последующей заменой галогена на гидроксил. Следует тщательно подбирать условия, исключающие бромирование тиазинового ядра (Chem. Pharm. Bull, vol. 28, p. 1339 f.f, 1980).
Согласно настоящему изобретению соединение формулы IА, в частности формулы I, la, Iб и II, может быть, как ни странно, получено без применения сложной технологии защитных групп и избегая описанных выше недостатков очень простым способом с получением высоких выходов.
В соответствии с этим в другом аспекте изобретения предложен способ получения соединения формулы IA, определенной выше, согласно которому
а) для получения соединения формулы IA, группа α), расщепляют двойную связь в положении 3 кольцевой структуры соединения формулы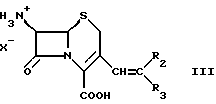
в которой R2 и R3 одинаковы или различны и независимо друг от друга обозначают водород или органическую группу, а X- имеет значение, определенное выше, в присутствии озона и, если это желательно, превращают полученное таким образом соединение формулы IA, группа α), где Re обозначает алкил, в соответствующее свободное основание формулы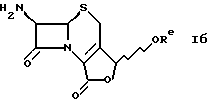
в которой Re обозначает алкил, и, если это желательно, превращают свободное основание формулы Iб в соль формулы IA, которая имеет солевой анион, отличный от аниона, применяемого в исходном соединении формулы III, либо
б) для получения соединения формулы IA, группа β), обрабатывают соединение формулы
в которой R обозначает силильную группу, Z обозначает P+ (R4)3I или H(O)-(OR4)2, a R4 обозначает низший алкил или арил, по меньшей мере одним сильным органическим основанием в сочетании с силилирующим агентом и подвергают взаимодействию с нитрозосоединением формулы
Y -N = O, (I)
в которой Y определен в формуле IA, и, если желательно, превращают полученную таким образом свободную форму соединения формулы IA в солевую форму, либо
в) для получения соединения формулы IA, группа α), которое является соединением формулы
в которой X- определен выше, обрабатывают соединение формулы
в которой Ra и Rd обозначают силильную группу или ее деацетилированную форму формулы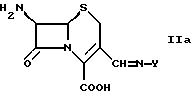
в которой Y определен выше, по меньшей мере одной сильной водной неорганической кислотой или по меньшей мере одной сильной органической кислотой, либо
г) для получения соединения формулы IA, группа γ),
γα) обрабатывают соединение формулы
основанием, получая в результате соединение формулы
в которой Ra и Rd обозначают водород, и, если желательно, подвергают соединение формулы Ia, в которой Ra и Rd обозначает водород, взаимодействию с силилирующим агентом, получая в результате соединение формулы Ia, в которой Ra и Rd обозначают силильную группу, либо
γβ) подвергают соединение формулы Iв взаимодействию с силилирующим агентом, получая в результате соединение формулы Ia, в которой Ra и Rd обозначают силильную группу, и, если желательно, превращают соединение, полученное согласно а) - г) в свободной форме, в его солевую форму или наоборот.
Способ а) реализуется по следующей схеме:
Соединение формулы III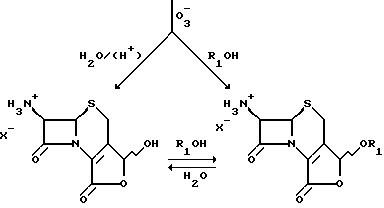
Способ а) является реакцией озонолиза. Он может быть реализован в растворителе или смеси растворителей, которая содержит спирт, либо не содержит его, в присутствии или отсутствие воды. Растворители, которые могут быть использованы, включают спирты, такие как (C1-4) спирты с прямой или разветвленной цепью; либо органические растворители, инертные при реакционных условиях, такие как галогенизированные углеводороды, например дихлорметан; либо эфиры, например эфиры уксусной кислоты; в сочетании с (C1-4) спиртом; в присутствии или отсутствие воды. Например, соединение формулы III (которое может быть получено, например, согласно ЕР 503453), в которой предпочтительно R2 или R3 обозначает водород, а соответствующий R3 или R2 обозначает предпочтительно водород, алкил, циклоалкил, арил или группу формулы
-CH2-А,
в которой А обозначает предпочтительно водород, гидрокси, алкокси, ацилокси, галоген, а X- определено выше, либо свободное основание соединения формулы III, обработанное в спирте или в смеси спиртосодержащих растворителей неорганической или органической кислотой, суспендируют или растворяют в спирте или в смеси растворителей, содержащей спирт и растворитель, который стабилен в присутствии озона, и проводят озонолиз общепринятым способом. Если это желательно, в ходе озонолиза или после него к реакционной смеси может быть добавлен восстановитель, такой как сульфид или фосфин. Соединение формулы IA, группа α), в которой Ra=H (= соединение формулы I, в которой R1 определено выше), может быть выделено, например, посредством осаждения с антирастворителем, если желательно, после (частичного) удаления растворителя (смеси). Если озонолиз проводят в среде, не содержащей спирт, то может быть получено соединение формулы I, в которой R1 обозначает водород. Если озонолиз проводят в среде, содержащей спирт, то может быть получено соединение формулы I, в которой R1 обозначает водород, либо соединение формулы I, в которой R1 обозначает алкил. Озонолиз в спирте в качестве растворителя и обработка при низких температурах могут привести к получению соединения формулы I, в которой R1 обозначает водород. Если реакционную смесь оставляют при повышенных температурах, например при комнатной температуре, в частности, в присутствии избытка кислоты HX, где X обозначает анион неорганической или органической кислоты, то может быть получено соединение формулы I, в которой R1 обозначает алкил. Если в содержащем спирт растворителе дополнительно присутствует вода или воду добавляют без избытка кислоты HX, то может быть выделено соединение формулы I, в которой R1 обозначает водород. Соединение формулы I, в которой R1 обозначает водород, может быть превращено в соединение формулы I, в которой R1 обозначает алкил, посредством добавления небольшого количества воды либо пролонгированного выдерживания в спиртосодержащей среде. Превращение соединения формулы I, в которой R1 обозначает алкил, в соединение формулы I, в которой R1 обозначает водород, и наоборот может быть осуществлено в несколько стадий, как описано ниже.
Выделенное соединение формулы I, в которой R1 обозначает алкил, легко может быть превращено в соединение формулы I, в которой R1 обозначает водород, следующим образом: соединение формулы I, в которой R1 обозначает алкил, растворяют или суспендируют в воде или органическом растворителе с добавлением небольшого количества воды. Дополнительно может быть добавлена кислота, при этом образуются соединение формулы I, в которой R1 обозначает водород, и соответствующий спирт. Продукт может быть осажден либо выделение может быть проведено общепринятым способом, например путем добавления антирастворителя, возможно после удаления растворителя и воды. К числу приемлемых растворителей относятся вода в сочетании с по меньшей мере одним спиртом, нитрилами, например ацетонитрилом, или кетонами, например ацетоном. Антирастворители включают в себя растворители для достижения полноты осаждения или увеличения выходов, такие как органические растворители, которые не содержат воду, например углеводороды, кетоны, нитрилы, сложные или простые эфиры.
С другой стороны, соединение формулы I, в которой R1 обозначает водород, может быть растворено или суспендировано в спирте или смеси растворителей, содержащей спирт, возможно с добавлением дополнительного количества кислоты, а продукт формулы I, в которой R1 обозначает алкил, может быть выделен либо посредством простой фильтрации, либо может быть осажден посредством добавления антирастворителя, возможно после концентрирования. Приемлемые растворители включают, например, соответствующие спирты; нитрилы, такие как ацетонитрил; эфиры, такие как этилацетат; кетоны, такие как ацетон в присутствии соответствующего спирта; в частности, спирты. Антирастворителями являются, например, эфиры или углеводороды. Для полноты осаждения реакционная смесь может быть разбавлена углеводородами, кетонами, нитрилами, сложными или простыми эфирами. К числу приемлемых кислот относятся, например, (сильные) неорганические кислоты, такие как галоидводородные кислоты, азотная кислота или перхлорная кислота, и (сильные) органические кислоты, включая, например, органические сульфокислоты, такие как бензолсульфокислота или толуолсульфокислота.
Как это ни удивительно, но в ходе реакции озонолиза не образуются изомерные сульфоксиды, и аналогичным образом выделенные соединения формулы I свободны от нежелательных Δ-2- соединений. Кроме того, не происходит полимеризация соединения формулы I, которое может рассматриваться как аминоальдегидное производное.
В результате получения согласно изобретению соединения формулы IA в его лактольном кольце образуется новый асимметричный центр. В зависимости от реакционных условий могут быть получены смеси обоих диастереоизомеров, либо один или другой из диастереоизомеров. Отдельная диастереоизомерная форма может быть обнаружена, например, посредством 1H-ЯМР. Предметом изобретения являются оба диастереоизомера, также как и их смеси, включая рацемические смеси. Если это желательно, то может быть проведено разделение диастереоизомеров общепринятыми способами, например, посредством хроматографии.
Соединение формулы I, в которой R1 обозначает алкил, посредством применения основания может быть превращено в соединение формулы Iб, в которой Re обозначает алкил, а затем снова превращено в соединение формулы I, в которой X- отличен от исходного X- соединения формулы III, путем применения кислоты HX, в которой X обозначает желаемый анион неорганической или органической кислоты. Приемлемые основания включают органические амины, такие как ариламины, например, пиридин, или алифатические амины, например, триэтиламин. Растворители, пригодные для получения соединения формулы Iб, включают соответствующие спирты, возможно в сочетании со сложным эфиром, кетоном, простым эфиром или нитрилом.
Способ б) описывает реакцию соединения формулы IV, в которой R обозначает силильную группу (соединение может быть получено известным способом, описанным в ЕР 503 453), с нитрозосоединением формулы V с образованием соединения формулы IA, группа β) (= соединение формулы II) в форме свободного основания. Реакция может быть проведена в присутствии по меньшей мере одного сильного органического основания в сочетании с силилирующим агентом и растворителем. Сильное органическое основание включает, например, гуанидин или амидин, такой как 1,8-диазабицикло[5.4.0]-ундецен-7-ен (=ДБУ) или 1,5-диазабицикло[4.3.0] -нон-5-ен (= ДБН); щелочную соль азотсодержащего соединения, такую как литиевая или натриевая соль гексаметилдисилазана или иминофосфорана; литиевую соль карбоновой кислоты, такую как ацетат лития; либо эпоксид, такой как пропиленоксид или бутиленоксид; предпочтительно пропиленоксид или бутиленоксид. Примеры силилирующего агента включают бистриметилсилилацетамид, бистриметилсилилмочевину. Реакцию предпочтительно проводят в растворителе, инертном в данных реакционных условиях. Пригодные растворители включают галоидуглеводороды, такие как метиленхлорид; амиды, такие как диметилформамид, диметилацетамид; эфиры, такие как тетрагидрофуран. В том случае, если применяют эпоксид, он может реагировать как основание.
На моль исходного соединения формулы IV можно использовать приблизительно от 1 до 1,5 молей, предпочтительно около 1,2 моль органического основания и приблизительно от 0,5 до 2 моль, предпочтительно около 1,5 моль силилирующего агента.
Химическая природа нитрозосоединения не играет решающей роли.
Пригодное нитрозосоединение может включать алифатическое, ароматическое или гетероциклическое нитрозосоединение, предпочтительно ароматическое нитрозосоединение, более предпочтительно - нитрозобензольное соединение, такое как п-нитрозобензол. Нитрозосоединение может быть незамещенным либо замещенным по какому-либо положению, например, галогеном, нитрогруппой, алкилом, алкоксигруппой, содержащим азот заместителем или функциональной группой, такой как карбалкокси или карбоксамидогруппа. Могут быть использованы эквивалентные количества исходного соединения формулы IV и нитрозосоединения формулы V. Может быть полезным избыток одного или другого компонента. Процесс может быть проведен в пределах широкого температурного интервала, например, при температуре между +5 и -20oC.
Силильные группы Ra и Rd в полученном таким образом соединении формулы IA, группа β), могут быть удалены посредством простого гидролиза или алкоголиза, например, путем добавления спирта, в частности, (C1-4)спирта, к реакционной смеси после окончания реакции между соединением формулы IV и формулы V. В результате в осадок может выпадать десилилированное имино соединение формулы IIа.
Соединение формулы IА, полученное в свободной форме, может быть превращено в соединение формулы IА в солевой форме и наоборот общепринятым способом.
Способ в) представляет собой реакцию гидролиза и приводит к образованию соединения формулы IА, группа α), в которой Ra обозначает водород, в форме соли, например, соединения формулы Iв. Гидролиз проводят путем обработки соединения формулы II или формулы II по меньшей мере одной сильной неорганической кислотой, такой как соляная кислота, бромистоводородная кислота, серная кислота, либо по меньшей мере одной сильной органической кислотой, такой как сульфоновая кислота, например, п-толуолсульфоновая кислота или метансульфоновая кислота, в водном растворителе или смеси растворителей. Растворители для проведения реакций гидролиза известны. Способ можно проводить либо после выделения соединения формулы II, соответственно IIа, либо непосредственно в реакционной смеси, в которой получали соединение формулы II. Соединение формулы Iв может быть отделено от амина, который образуется в процессе реакции, например, путем экстракции водной реакционной смеси не смешивающимся с водой растворителем либо путем осаждения соединения формулы Iв, например, посредством использования антирастворителя, который смешивается с водой, такого как ацетон, ацетонитрил или изопропанол, если желательно, после концентрирования путем удаления по меньшей мере части растворителя. Выделение соединения формулы Iв может осуществляться, например, посредством лиофилизации.
Превращение соединения формулы IV в соединение формулы Iв через промежуточное соединение формулы II является новым и неожиданным. Возможно получать соединение формулы I способом согласно изобретению несмотря на общую тенденцию открытия кольца β-лактамной системы в водородосодержащих условиях (Y. Fujisawa, T.Kanzaki, J.Antibiotics 28, 376-377; J.E.Baldwin, R.M.Adlington, N. P. Crouch and I.A.C.Pereira, Tetrahedron, vol. 49, N.22, p. 4915, 1993; J. E.Baldwin, K.C.Goh and C.J.Schofield, J.Antibiotics, vol. 45, N.8, pp. 1378-1380, 1992) и при очень сильной тенденции аминоальдегидов к полимеризации вследствие реакций конденсации (Houben-Weyl, Methoden der Organischen Chemie, 7/1, p. 156, 403; Beilstein H14, pp. 23, 28, 30; E II p.22; US 3997528).
Способ г) направлен на получение альдегида формулы IА, группа γ), и включает процесс, который влияет на таутомерное равновесие между соединением формулы IА, группа α) (формула Iв) и соединения формулы IА, группа γ) (формула Iа). Соединение формулы Iв, например, полученное согласно способу а) или способу в), может быть использовано для получения соединения формулы Iа. Может быть использовано выделенное соединение формулы Iв либо соединение формулы Iв, образованное in situ в процессе его получения. Реакция может быть осуществлена путем добавления основания к реакционной смеси, предпочтительно в присутствии растворителя или смеси растворителей, которая инертна в данных реакционных условиях. Приемлемые инертные растворители включают, например, спирты, такие как метанол, нитрилы, такие как ацетонитрил, кетоны, такие как ацетон, эфиры или галоидные растворители, воду или смесь растворителей, упоминавшихся выше. Пригодные основания включают алифатические или ароматические амины, кислоты присоединения которых растворимы в применяемом растворителе, например, триэтиламин или пиридин. Если в качестве растворителя используют воду либо вода присутствует в реакционной смеси, то можно использовать неорганическое основание, такое как карбонат или гидрокарбонат, или соль слабой органической кислоты, такую как ацетат натрия. Основание может быть использовано в примерно эквивалентном количестве или в избытке, предпочтительно в примерно эквивалентном количестве по отношению к соединению формулы Iв, используемому в качестве исходного материала. В ходе реакции может быть выделен аминоальдегид карбоновой кислоты формулы Iа, в которой Ra и Rd обозначают водород, например, посредством фильтрации, если он нерастворим в реакционной среде.
Соединение формулы Iа, в которой Ra и Rd обозначают силильную группу, может быть получено из соединения формулы Iа, в которой Ra и Rd обозначают водород, или из соединения формулы Iв путем обработки силилирующим агентом.
К числу силилирующих агентов относятся, например, N,O-бистриалкилсилилацетамиды, такие как N,O- бистриметилсилилацетамид, N,O-бистриметилсилилформамид, N,О-бистриметилсилилтрифторацетамид и силилированные мочевины, такие как бистриметилсилилмочевина. Пригодные растворители включают растворители, инертные по отношению к силилирующим агентам, например, галоидуглеводороды; нитрилы, такие как ацетонитрил; сложные эфиры, например, этиловый эфир уксусной кислоты; простые эфиры, например, трет.-бутилметиловый эфир, тетрагидрофуран; эпоксиды, такие как пропиленоксид, бутиленоксид. Количество силилирующего агента может быть предпочтительно достаточным для приблизительно количественного силилирования карбоновой кислоты в положении 4, также как и аминогруппы в положении 7. Было установлено, что таким образом можно избежать самоконденсации свободной аминогруппы с альдегидной функцией. В частности, например, на моль исходного материала, подлежащего силилированию, может быть израсходовано от двух до трех молей силилирующего агента.
Соединение формулы Iа, в которой Ra и Rd обозначают водород, как ни странно, достаточно стабильно при выделении из водного раствора; если это желательно, оно может быть превращено в бис(силил)соединение формулы Iа, в которой Ra и Rd обозначают силильную группу, путем добавления силилирующего агента. Соединение формулы I, в которой R1 обозначает силильную группу, является стабильным и может быть далее подвергнуто реакции в растворе, если это желательно. Соединения формулы I и формулы Iа таким образом показаны для применения при получении антибиотиков, например, путем ацилирования по аминогруппе в положении 7 или путем реакции альдегидной группы в положении 3 с реагентом, взаимодействующим с альдегидом (далее альдегидный реагент). Эти реакции могут проводиться общепринятым способом.
Приемлемые ацилирующие агенты включают, например, активированные карбоновые кислоты, такие как хлорангидриды кислот, смешанные ангидриды или активированные эфиры. Ацилирование можно проводить общепринятым способом. Выделение N-ацилированного соединения может быть осуществлено традиционным способом, например, путем десилилирования с помощью протонного растворителя, например, спирта или воды. Ацилированное соединение может выпадать в осадок непосредственно, либо может быть осаждено с помощью антирастворителя или в форме соли карбоновой кислоты. Оно также может быть выделено в форме соответствующего эфира карбоновой кислоты, например, в виде дифенилметилового эфира, путем взаимодействия десилилированного продукта с дифенилдиазометаном.
Альдегидная группа соединения формулы Iа, в которой Ra и Rd определены выше, а также латентная альдегидная группа его таутомерной формы формулы I, в которой R1 обозначает водород, может быть подвергнута взаимодействию с альдегидными реагентами. Выбор между различными выделенными продуктами, в частности, например, соединением формулы Iа, в которой Ra и Rd обозначают водород; или соединением, которое находится в таутомерном равновесии с соединением формулы Iа, в частности, соединением формулы I, в которой R1 обозначает водород; или соединением формулы Iа, в которой Ra и Rd обозначают силильную группу; зависит от типа реакции и реакционных условий, используемых в каждом конкретном случае.
Если применяют обычный азотсодержащий альдегидный реагент, такой как амин, гидроксиламин, гидразин, гуанидин или семикарбазид, то могут быть применены все выделенные продукты формулы Iа, в которой Ra и Rd определены выше; или формулы I, в которой R1 обозначает водород.
Если применяют соединение формулы Iа, в которой Ra и Rd обозначают силильную группу, то обе группы, например, аминогруппа в положении 7, а также карбоксильная группа в положении 4 кольцевой системы должны быть силилированы почти количественно, поскольку было обнаружено, что моносилилирование по карбоксильной кислотной группе может привести к полимеризации и распаду.
Если альдегидный реагент содержит группы, которые могут быть силилированы, то альдегидный реагент удобно использовать в виде его силилированного аналога. Реакцию с соответствующим альдегидным реагентом проводят, например, в растворителях, приводимых выше для силилирования. Если это желательно, то растворимость альдегидного реагента может быть увеличена путем добавления биполярного апротонного растворителя, такого как ДМФ или сульфолан. Температура реакции не является существенной. Реакцию можно проводить, например, при комнатной температуре или при охлаждении. Выделение продукта реакции может быть проведено традиционным способом, например, либо посредством десилилирования протонным растворителем, таким как спирт или вода, либо путем экстракции и последующего выделения из воды или органического растворителя (смеси). Продукт может выпадать в осадок.
Если желательно воздействовать на альдегидную группу соединения формулы I, в которой R1 обозначает водород, то на нее можно воздействовать в пригодном растворителе непосредственно желаемым альдегидным реагентом.
Если, например, применяют азотсодержащий альдегидный реагент, как определено выше, то он может быть применен в виде свободного соединения или в виде его соли. Приемлемые растворители включают, например, воду, полярные органические растворители, такие как органические амиды, кетоны, сложные эфиры, галоидуглеводороды, спирты, органические кислоты, такие как уксусная кислота. Спирты, в частности, могут быть использованы в смеси с водой. Продукты реакции могут выпадать в осадок или могут быть выделены традиционным способом, например, путем добавления антирастворителя или путем экстракции из органического растворителя или смеси растворителей.
Если желательно воздействовать на альдегидную группу соединения формулы Iа, в которой Ra и Rd обозначают водород, то к реакционной смеси для увеличения растворимости соединения формулы Iа и усиления его реакционной способности может быть добавлена кислота. Реакция может быть проведена в таутомерном равновесии с соединением формулы I, в которой R1 обозначает водород, как описано выше.
Учитывая известную нестабильность цефалоспоринов, имеющих альдегидную группу в положении 3, способность соединений формулы Iа к существованию является неожиданной и совершенно удивительной.
Известны некоторые 7-ацильные производные формулы Iа, существующие в форме их изомерных гидроксилактонов формулы.

в которой Ac обозначает ацильную группу.
Попытки превратить эти гидроксилактоны в соль изомера 7-ациламино-3-формил-4-карбоновой кислоты формулы
в которой Ac определено выше, a W обозначает катион,
могут привести к распаду в результате кольцевого раскрытия лабильного β- лактамного кольца, особенно в присутствии воды.
Удивительным является существование соединения формулы Iа в силу очень сильной тенденции аминоальдегидов к полимеризации путем самоконденсации (см. Houben-Weyl, Methoden der Organischen Chemie 7/1, p.p. 156, 403; Beilstein H 14, p.p. 23, 28, 30; E II, p.22).
Соединение
как представитель обширного класса, определяемого его формулой II, упомянуто в US 3997528. Однако не описано его выделение или характеристика. В этом отношении дискуссионным является существование этого соединения в условиях, описанных для его получения. Кроме того, все предшествующие попытки выделить соединение формулы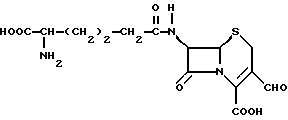
имеющего свободный альдегид в положении 3 кольцевой системы, которое соответствует цефалоспорину С и которое является предусмотренным продуктом биотрансформации ЦефС, потерпели неудачу (см., например, Y.Fujisawa and T. Kanzaki, J. Antibiotics 28, p.p. 376-377; J.E.Baldwin, R.M.Adlington, N.P. Crouch and I.A.C.Pereira, Tetrahedron, vol. 49, No.22, p. 4915; J.E.Baldwin, K. C.Goh and C.J.Schofield, J.Antibiotics, vol. 45, p.p. 1378-1380). Во всех случаях вместо ожидавшейся структуры выделяли открытую кольцевую структуру формулы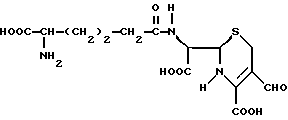
Как уже упоминалось, соединение формулы I или формулы Iа может быть использовано в качестве исходного материала или промежуточного соединения при получении цефалоспорина. Следующий частный аспект изобретения связан с использованием соединения формулы IА для получения цефалоспорина.
В другом более частном аспекте изобретения описывают применение соединения формулы I, где R1 обозначает водород; либо его свободной формы вышеприведенной формулы Iб, где Re обозначает водород; либо соединения формулы Iа в реакции взаимодействия свободной или латентной альдегидной группы в положении 3 кольцевой системы с азотсодержащим альдегидным реагентом для получения соответствующего продукта.
В следующем частном аспекте изобретения соединение формулы I или формулы Iа является пригодным для получения соединения формулы
в которой R5 и R6 одинаковы или различны и обозначают водород или органическую группу, либо R5 и R6 обозначают совместно замещенное или незамещенное кольцо.
Органическая группа, обозначаемая как R5 и R6, включает, например, незамещенный или замещенный алкил, арил или гетероциклил. В любом положении может иметь место замещение, например, галогеном, алкокси, арилокси, содержащим азот или серу заместителем или функциональной группой, такой как карбалкоксигруппа или карбоксамидная группа. R5 и R6 могут являться частью незамещенной или замещенной кольцевой системы, которая может содержать гетероатомы, такие как азот, кислород, сера.
Например, один из заместителей R5 или R6 может обозначать водород, а другой:
а) водород, низший алкил, низший алкенил или низший алкинил;
б) циклоалкил, циклоалкилалкил, арил, арилалкил, гетероциклил или гетероциклилалкил; эти группы могут быть незамещенными или замещенными низшим алкокси, низшей алкилтиогруппой, галогеном, низшим алкилом, нитрогруппой, гидрокси, ацилокси, карбокси, карбалкокси, низшим алкилкарбонилом, низшим алкилсульфонилом, низшим алкоксисульфонилом, низшей аминоалкиламингруппой, ациламидогруппой один или несколько раз, например, один или три раза;
в) группу формулы -CH2R7, в которой R7 обозначает
α) гидрокси, низший алкокси, формилокси, ацетоксигруппу, низший алкилсульфонилокси, галоген, N-моно(низший)алкилкарбамоилокси или N,N-ди(низший)алкилкарбамоилокси,
β) гетероциклическую группу,
γ) группу формулы -S(O)mR8, в которой R8 обозначает алифатическую, аралифатическую, алициклическую, ароматическую или гетероциклическую группу, a m обозначает 0, 1 или 2, либо
δ) ациклическую или циклическую аммониевую группу.
"Низший" в этом контексте обозначает C1-6, предпочтительно C1-4.
Пригодные гетероциклические группы включают, например, неконденсированные или конденсированные кольца, имеющие, например, от 4 до 7, в частности, 5 или 6, кольцевых членов в каждом кольце. Каждое кольцо может содержать, например, до 4 гетероатомов, таких как кислород, азот или сера. Гетероциклическая группа может быть замещенной, например, до 3 раз. Приемлемые заместители включают, например, (C1-4)алкил, (C1-4)алкокси, галоген, тригало-(C1-4)алкил, гидрокси, оксо, меркапто, аминогруппу, карбокси, карбамоил, ди- (C1-4)алкиламино, карбоксиметил, карбамоилметил, сульфометил и метоксикарбониламиногруппу.
Примеры гетероциклических групп включают незамещенные и замещенные имидазолил, диазолил, триазолил, тетразолил, тиазолил, тиадиазолил, тиатриазолил, оксазолил, оксадиазолил, бензимидазолил, бензоксазолил, бензотиазолил, триазолилпиридил, пуринил, пиридил, пиримидинил, пиридазинил, пиразолил и триазинил; такие как незамещенные или замещенные 4-гидрокси-4-пиридон-2-ил, 1,2,3-триазолил, 1,2,4-триазолил, тетразолил, оксазолил, тиазолил, 1,3,4-оксидиазолил, 1,3,4-тиадиазолил, 1,2,3-тиадиазолил, в частности, 1,5-дигидрокси-4-пиридон-2-ил, 5- гидрокси-1-метил-4-пиридон-2-ил, 5-гидрокси-4-пиридон-1-ил, 1- метил-1H-тетразол-5-ил, 2-метил-1,3,4-тиадиазол-5-ил, 1- карбоксиметил-1H-тетразол-4-ил, 6-гидрокси-2-метил-5-оксо-2H- 1,2,4-триазин-3-ил, 1,2,3-триазол-5-ил, 4-метилтиазол-5-ил.
Примеры ациклических аммониевых групп включают (1-карбамоил-2- гидроксиэтил)диметиламмоний, (карбамоилметил) (этил)-метиламмоний, триметиламмоний.
Примеры циклических аммониевых групп включают пирролидиний, который может быть одно- или двузамещенным по атому азота алкилом, карбамоилалкилом, аминоалкилом, карбоксиалкилом; пиридиний или циклопентенопиридиний, который может быть замещен по атому азота алкилом, галогеном, гидрокси, карбоксамидогруппой, алкоксикарбонилом, аминогруппой, моноалкиламиногруппой, диалкиламиногруппой.
Примеры R5 и R6 как части незамещенной или замещенной кольцевой системы, которая может содержать гетероатомы, такие как азот, кислород, сера в каждом из колец, включают, например, неконденсированные или конденсированные кольца, имеющие от 3 до 7 кольцевых членов, например, 5 или 6 кольцевых членов. Кольца могут быть незамещенными или замещенными, например, (C1-4)алкилом, (C1-4)алкокси, галогеном, тригало(C1-4)алкилом, гидрокси, оксогруппой, меркаптогруппой, аминогруппой, карбокси, карбамоилом, ди(C1-4)алкиламиногруппой, карбоксиметилом, карбамоилметилом, сульфометилом, метоксикарбониламиногруппой.
Известен способ получения соединений формулы VI. Однако соединения формулы VI исходя из существующего уровня техники могут быть получены только с помощью сложной технологии защитных групп в несколько реакционных стадий. Например, для получения 3-винилцефалоспоринов существуют, в частности, два способа, основанных на реакции Виттига или Хорнера:
Первым вариантом является реакция соединения формулы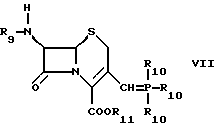
или соединения формулы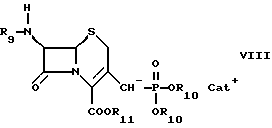
в которой R9 обозначает ацильную группу или защитную группу, R10 обозначает арил, особенно фенил или низший алкил, R11 обозначает отщепляемую эфирную защитную группу, a Cat+ обозначает катион щелочного металла или протонированную форму сильного органического основания, с альдегидом или кетоном формулы
в которой R5 и R6 определены выше, с образованием соответствующего 3-винилцефалоспорина.
После отщепления R9 и R11 может быть получено соединение формулы VI.
Второй вариант представляет собой реакцию взаимодействия соединения формулы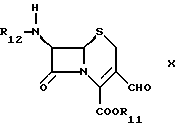
в которой R12 обозначает ацильную группу или карбалкоксигруппу, a R11 определено выше, с реагентом Виттига формулы
или реагентом Хорнера формулы
в которой R5, R6, R10 и Cat+ определены выше. После отщепления защитных групп может быть получено соединение формулы VI.
Второй вариант реакции 3-формилцефемного соединения выглядит экономически более целесообразным по сравнению с первым вариантом в отношении выходов, в отношении доступности соответствующего альдегида или кетона формулы IX (из первого варианта), в отношении чистоты продуктов или в отношении соответствующего Z/E содержания продукта, например, 3-виниловых соединений, получаемых посредством обоих вариантов.
Однако, исходя из уровня техники, второй вариант обладает следующими недостатками:
Известна реакция трет. -бутилового эфира сульфоксида 7-фенилоксиацетамидо-3-формил-3-цефем-4-карбоновой кислоты с фосфоранами. Получаемый таким образом сульфоксид должен быть восстановлен и очищен хроматографически. После отщепления эфирной защитной группы и отщепления феноксиуксусной кислоты следует превратить сульфоксид в соответствующую 7- амино-3-винил-3-цефем-4-карбоновую кислоту. Затем необходимы дополнительные стадии очистки посредством хроматографии (J. A. Webber, J.L.Ott and R.T.Vasileff, Journal of Medical Chemistry, vol. 18, N10, p. 986 f.f.).
Известна реакция взаимодействия дифенилметилового эфира 7-(2-тиенил)ацетамидо-3-формил-3-цефем-4-карбоновой кислоты с этоксикарбонилтриметилентрифенилфосфораном с образованием соответствующего 3- винилцефалоспорина. После очистки посредством хроматографии получают неочищенный E-изомер с выходом, не превышающим 21% (DE 2103014А, экспериментальная часть В, пример 1 (b)).
Известно превращение в ходе первой стадии дифенилметилового эфира 7- [2- (2-формамидотиазол-4-ил)-2-метоксиминоацетамидо] -3-формил-3-цефем-4-карбоновой кислоты в соответствующее Δ-2-соединение, которое в ходе второй стадии вступает в реакцию Виттига с образованием соответствующего 3-винилового соединения. 3-Виниловое соединение должно быть очищено хроматографически, подвергнуто окислению с образованием соответствующего Δ-3- cульфоксида и восстановлено с образованием искомого Δ-3- соединения (ЕР 103264).
Способ согласно изобретению позволяет избегать трудностей, свойственных процессам, известным из уровня техники, и делает второй вариант экономически привлекательным.
Следующим объектом изобретения является способ получения цефалоспорина формулы VI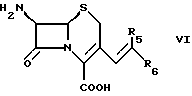
в которой R5 и R6 одинаковы или различны и обозначают водород или органическую группу, либо R5 и R6 совместно обозначают замещенное или незамещенное кольцо, согласно которому в качестве формилцефалоспоринового соединения используют соединение формулы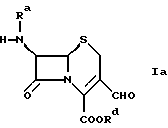
в которой Ra и Rd обозначают силильную группу. Соединение формулы Iа взаимодействует с соединением формулы
либо с соединением формулы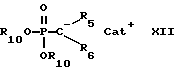
в которой R5 и R6 определены выше, R10 обозначает арил или низший алкил, а Cat+ обозначает катион щелочного металла или протонированную форму сильного органического основания, с образованием соединения формулы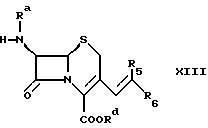
в которой Ra, Rd, R5 и R6 определены выше, с последующим его десилилированием с образованием соединения формулы VI.
Реакция Виттига или Хорнера может быть проведена очень простым образом. Например, N,O-бисилилированная 7-амино-3-формил-3-цефем- 4- карбоновая кислота в качестве исходного материала взаимодействует с соответствующим фосфоранилиденом, который добавляют к исходному материалу, либо реакцию осуществляют in situ путем добавления к исходному материалу основания формулы
в которой R5, R6 и R10 определены выше, a Hal- обозначает анион галогена, такой как хлор, бром, иод, с образованием соответствующего илида; или к исходному материалу добавляют анион соответствующего диалкокси(диарилокси)фосфинильного соединения. После завершения реакции соединение формулы VI может быть выделено, например, традиционным способом, в частности, путем гидролиза силильных групп протонным растворителем, таким как вода или спирт, либо соединение выделяют, например, путем экстракции и осаждают в интервале pH, близком к изоэлектрической точке.
Приемлемые растворители для реакции Виттига или Хорнера включают такие растворители, которые инертны по отношению к силилирующим агентам, например, галоидуглеводороды, в частности, метиленхлорид; N,N-диалкиламиды, например, ДМФ; нитрилы, например, ацетонитрил; сложные эфиры, например, алкилацетат, такой как этилацетат; эфиры, например, тетрагидрофуран или метилтрет.- бутиловый эфир; эпоксиды (которые могут в то же самое время действовать как основание), такие как пропиленоксид или бутиленоксид; либо их смеси. Реакционные температуры для реакций Виттига и Хорнера не существенны. Реакцию можно проводить, например, при охлаждении ниже или около 0oC. В зависимости от применяемого илида могут быть использованы более высокие или более низкие температуры.
Пригодные основания для образования илида in situ из соответствующей соли фосфония включают, например, эпоксиды (которые могут в то же самое время являться растворителем), такие как пропиленоксид; или соль карбоновой кислоты в сочетании с силилирующим агентом. Силилирующий агент может быть использован для нейтрализации карбоновой кислоты, образующейся в ходе реакции как силильное соединение. Приемлемые силилирующие агенты включают, например, N,O-бистриметилсилилацетамид (=БСА), N,O- бистриметилсилилтрифторацетамид.
Если используемые соль фосфония, фосфоранилиденовое соединение или фосфинильное соединение (= фосфорное соединение) содержат группы, которые могут быть силилированы, то фосфорное соединение может быть силилировано перед реакцией Виттига или Хорнера.
Стехиометрия альдегидного соединения и фосфорного соединения, которые могут быть введены, зависит от основных свойств применяемого фосфорного соединения. Альдегидное или фосфорное соединение могут быть использованы в избытке, либо их используют приблизительно в эквимолярных количествах. Если применяют илиды или фосфинильные анионы, обладающие сильными основными свойствами, то в избытке должно быть использовано в первую очередь соединение формулы Iа, а не илид или фосфинильный анион.
Соединения формулы Iа или формулы XIII в данных реакционных условиях имеют удивительно слабую тенденцию к образованию Δ-2-соединений. Если применяют стабилизированные илиды, то Δ-2-соединения не образуются или почти не образуются. Кроме того, Δ-2-соединения, которые могут быть образованы в ходе реакции, исчерпываются в ходе обработки.
Способ согласно изобретению показывает высокую трансселективность по отношению к двойной связи, образующейся в ходе реакции. Если, например, соединение формулы Iа взаимодействует с этоксикарбонилметилентрифенилфосфораном, то к удивлению на практике выделяется только транссоединение. Это контрастирует с известными результатами, говорящими о том, что в результате реакции взаимодействия дифенилметилового эфира 7-фенилацетамидо-3-формил -3-цефем-4-карбоновой кислоты с метоксикарбонилметилентрифенилфосфораном получается продукт, содержащий приблизительно от 8 до 9% цис-изомера (S.C.M Fell et al., J. Chem. Soc. Perkin I, 1361 f.f., 1991).
Преимущества способа согласно изобретению по сравнению с известными из уровня техники заключаются в простоте осуществления реакции; простоте обработки; высокой нечувствительности системы в отношении Δ-2-изомеризации; и транс-селективности реакций Виттига и Хорнера.
Следующие примеры определяют изобретение более подробно, не ограничивая его рамки. Все температуры приведены в градусах Цельсия и не
откорректированы. Смеси изомеров, полученные согласно примерам, могут быть разделены, например, хроматографически.
Пример 1: Гидрохлорид 6-амино-1,4,5а,6-тетрагидро-3-гидрокси-1,7-диоксо-3Н, 7H-ацето[2,1-b] фуро[3,4-d] [1,3]тиазин (гидроксилактон гидрохлорида 7-амино-3-формил-3-цефем-4-карбоновой кислоты) (способ а)
13,8 г гидрохлорида 7-aминo-3-[Z(/E)-пpoп-1-eн-1-ил]- 3-цeфeм-4-карбоновой кислоты (7-ПАКК) растворяют в 200 мл метанола и охлаждают слабо желтоватый раствор до -50oC. При этой температуре в данный раствор при перемешивании вводят O2, содержащий приблизительно 2 об.% озона, со скоростью 8 л/минуту. Озонолиз завершается спустя примерно 20 минут. ЖХВР показывает практически количественное и однородное превращение исходного соединения в соединение, указанное в заголовке. Через реакционную смесь в течение приблизительно 2 минут пропускают 8 л N2, слабо мутный раствор при перемешивании приливают к 1400 мл метилтрет.- бутилового эфира и ацетонитрила. Осажденный продукт фильтруют под N2, промывают небольшим количеством метилтрет.-бутилового эфира и ацетонитрила, сушат в вакуумной сушильной камере над осушающим агентом. Получают гидрохлорид 6-амино-1,4,5а,6-тетрагидро-3- гидрокси-1,7-диоксо-3Н, 7H-ацето[2,1-b] фуро[3,4-d] [1,3] тиазин в виде белого порошка с чистотой (ЖХВР) свыше 95%.
1H-ЯМР (D2O+DCl): 3,62 (ABq, J=16 Гц, 2H, S-CH2); 5,10 (2d, J=5 Гц, 2H, β- лактам Н); 6,20 (s, широкий, 1H, O-CH-O).
Пример 2: Тозилат (толуолсульфонат) 6-амино-1,4,5а,6-тетрагидро-3- гидрокси-1,7-диоксо-3Н, 7H-ацето[2,1-b] фуро[3,4-d][1,3]тиазина (гидроксилактон тозилата 7-амино-3-формил-3-цефем-4- карбоновой кислоты) (способ а)
12 г 7-ПАКК суспендируют в 200 мл метанола и превращают в раствор путем добавления 9,5 г гидрата п- толуолсульфоновой кислоты. Этот раствор озонируют и обрабатывают, как описано в примере 1. Получают тозилат 6-амино-1,4,5а, 6- тетрагидро-3-гидрокси-1,7-диоксо-3Н, 7H-ацето [2,1-b]фуpo[3,4-d] [1,3]тиазин в виде слабо желтоватого порошка. 1H-ЯМР (ДМСО-d6): 2,35 (s, 3H, CH3); 3,7-3,9 (2H, S-CH2); 5,1-5,4 (,2H, β- лактам Н); 6,3 (d, широкий, 1H, O-CH-O); 7,1 и 7,5 (A2B2, J=7 Гц, 4H, Ar-H).
Пример 3: Гидрохлорид 6-амино-1,4,5а,6- тетрагидро-3-метокси-1,7- диоксо-3H, 7H-ацето[2,1-b]фуро[3,4-d] [1,3]тиазина (метоксилактон гидрохлорида 7-амино-3-формил-3-цефем- 4-карбоновой кислоты) (способ а)
13,8 г 7-ПАКК гидрохлорида растворяют в 250 мл метанола, озонируют, как описано в примере 1, и осаждают метилтрет.-бутиловым эфиром. Продукт отфильтровывают, суспендируют в 200 мл ацетонитрила, пока он находится во влажном, содержащем метанол состоянии, суспензию перемешивают в течение приблизительно 30 минут. Остаток, который является 6-амино- 1,4,5а,6- тетрагидро-3-метокси-1,7-диоксо-3Н, 7H-ацето [2,1-b] фуро [3,4-d] [1,3]тиазином, выделяют и сушат в вакуумной сушильной камере над пентоксидом фосфора (желтоватый порошок).
1H-ЯМР (ДМСО-d6): 3,55 (s, 3H, O-CH3); 3,8 (ABq, J=4 Гц, 2H, S-CH2); 5,3 (2d, J=5 Гц, 2H, β- лактам Н); 6,2 (s, 1H, O-CH-O).
Пример 4: Гидрохлорид 6-амино-1,4,5а,6-тетрагидро-3-метокси-1,7- диоксо-3Н, 7H-ацето [2,1-b] фуро [3,4-d] [1,3]тиазина (метоксилактон гидрохлорида 7-амино-3-формил-3-цефем-4-карбоновой кислоты) (способ а)
13,3 г 7-aминo-3-[(Z/E)-3-aцeтoкcи-1-пpoп-1-eн-1- ил]-3-цeфeм-4-карбоновой кислоты суспендируют в приблизительно 230 мл метанола. Добавляют 13,1 г трифенилфосфина, после добавления 10 мл диизопропилового эфира, содержащего приблизительно 1 г сухой HCl, с последующим добавлением еще 100 мл метанола получают раствор. Раствор озонируют, как в примере 1, в течение приблизительно 30 минут вводят в общей сложности приблизительно 2,4 молярных эквивалента озона. После удаления возможного остатка озона с помощью N2 реакционную смесь приливают к 1800 мл метилтрет.-бутилового эфира. Гидрохлорид 6-амино-1,4,5а,6- тетрагидро-3-метокси-1,7-диоксо-3Н,7H-ацето [2,1-b] фуро [3,4-d] [1,3]тиазина выпадает в осадок.
1H-ЯМР спектр идентичен спектру, приведенному в примере 3.
Пример 5: Гидрохлорид 6-амино-1,4,5a,6-тетрагидро-3- метокси-1,7-диоксо-3Н, 7H-ацето[2,1-b] фуро[3,4-d] [1,3]тиазина (метоксилактон гидрохлорида 7-амино-3-формил-3-цефем-4-карбоновой кислоты)
1 г гидрохлорида 6-амино-1,4,5а,6-тетрагидро-3-гидрокси- 1,7-диоксо-3H, 7H-aцeтo[2, l-b] фуpo[3,4-d] [1,3]тиазина растворяют в 5 мл метанола. Добавляют приблизительно 0,5 мл диизопропилового эфира, который смешивают с газообразной HCl, смесь перемешивают в течение приблизительно 10 минут. Гидрохлорид 6-амино-1,4,5а,6- тетрагидро-3-метокси-1,7-диоксо-3Н,7H-ацето[2,1-b] фуро[3,4-d] [1,3] тиазина осаждают посредством добавления приблизительно 50 мл ацетонитрила. Получают только один из диастереоизомеров относительно положения 3.
1H-ЯМР (300 МГц, ДМСО-d6): 3,48 (s, 3H, O-CH3); 3,73 и 3,89 (ABq, J=18 Гц, 2H, S-CH2; 5,22 и 5,32 (ABq, J=5 Гц, 2H, β- лактам Н); 6,17 (s, 1H, O-CH-O).
Пример 6: Гидрохлорид 6-амино-1,4,5а,6-тетрагидро-3-этокси-1,7-диoкco-3H,7H-aцeтo[2,l-b]фуpo[3,4-d] [1,3]тиазина (этоксилактон гидрохлорида 7- амино-3-формил-3-цефем-4-карбоновой кислоты)
5 г гидрохлорида 6- амино-1,4,5а,6-тетрагидро-3-гидрокси-1,7-диоксо-3H, 7H-aцeтo[2, l- b]фуpo[3,4-d] [1,3]тиазина растворяют в 30 мл этанола. Добавляют приблизительно 2 мл диизопропилового эфира, смешанного с газообразной HCl, смесь перемешивают в течение приблизительно 10 минут. Растворитель удаляют под вакуумом, остаток обрабатывают метил-трет.-бутиловым эфиром и отфильтровывают. Остаток представляет собой смесь диастереоизомеров гидрохлорида 6-амино- 1,4,5а,6-тетрагидро-3-этокси-1,7-диоксо-3Н,7H-ацето[2,1-b] фуро[3,4-d] [1,3] тиазина в отношении положения 3 в соотношении приблизительно 9:11.
1H-ЯМР (300 МГц, ДМСО-d6): 1,18 (2t, J=7 Гц, 3H, CH3); 3,37 (2q, 2H, CH2-CH3); 3,9 (m, 2хABq, 2H, S-CH2); 5,20 (d), относит. 5,22 (d) и 5,31 (2 изохрон d) (2xABq, J=5 Гц, 2H, β-лактам Н); 6,21 и 6,31 (s, 1H, O-CH-O).
Пример 7: Гидрохлорид 6-амино-1,4,5a,6-тетрагидро-3- пропокси-1,7-диоксо-3Н, 7H-ацето[2,1-b]фуро[3,4-d][1,3]тиазина (пропоксилактон гидрохлорида 7-амино-3-формил-3-цефем-4-карбоновой кислоты)
5 г гидрохлорида 6-амино-1,4,5а,6-тетрагидро-3-гидрокси- 1,7-диоксо-3H, 7H-aцeтo[2,l-b]фуpo[3,4-d] [1,3]тиазина растворяют в 50 мл п-пропанола. Добавляют приблизительно 2 мл диизопропилового эфира, смешанного с газообразной HCl, смесь перемешивают в течение приблизительно 10 минут. Растворитель удаляют под вакуумом, остаток обрабатывают метил-трет.-бутиловым эфиром и отфильтровывают. Остаток представляет собой смесь диастереоизомеров гидрохлорида 6-амино-1,4,5а, 6-тетрагидро-3-пропокси-1,7-диоксо-3Н, 7H-ацето[2,1-b] фуро[3,4-d] [1,3]тиазина в отношении положения 3 в соотношении приблизительно 1:1.
1H-ЯМР (300 МГц, ДМСО-d6): 0,85 (2t, J=7 Гц, 3H, CH3); 1,6 (m, 2H, CH2-CH3); 3,7 (m, 2H, O-CH2); 4,9 (m, 2xABq, 2H, S-CH2; 5,20 (d), относит. 5,21 (d) и 5,31 (2 изохрон d) (ABq, J=5 Гц, 2H, β- лактам Н); 6,21 и 6,3 (s, 1H, O-CH-O).
Пример 8: Тозилат 6-амино-1,4,5а,6- тетрагидро-3-метокси-1,7-диоксо-3H, 7H-aцeтo[2,1-b] фуpo[3,4-d] [1,3]тиазина (метоксилактон тозилата 7-амино-3-формил-3-цефем-4- карбоновой кислоты)
15 г гидрохлорида 6-амино-1,4,5а,6-тетрагидро-3-метокси-1,7- диоксо-3Н, 7H-ацето[2,1-b]фуро[3,4-d] [1,3]тиазина растворяют в 30 мл метанола. При 0oC добавляют 20 мл трибутиламина и перемешивают смесь в течение приблизительно 15 минут. Осадок отфильтровывают и промывают небольшим количеством метанола (0oC). Полученное таким образом свободное основание 6-амино-1,4,5а,6-тетрагидро-3-метокси- 1,7-диоксо-3Н, 7H-ацето[2,1-b] фуро[3,4-d] [1,3]тиазина представляет собой коричневый порошок, содержащий только один из диастереоизомеров в отношении положения 3.
1H-ЯМР (300 МГц, CD2Cl2): 3,51 и 3,61 (ABq, J=18 Гц, 2H, S-CH2); 3,56 (s, 3H, CH3); 4,91 (s, широкий); и 4,97 (ABq, J=5 Гц, 2H, β-лактам Н); 5,82 (s, 1H, O-CH-O).
1 г свободного основания, полученного как описано выше, растворяют в 10 мл метиленхлорида и обрабатывают раствором 780 мг моногидрата п- толуолсульфоновой кислоты в 1 мл метанола. Спустя 5 минут растворитель удаляют под вакуумом, а остаток обрабатывают диэтиловым эфиром и фильтруют. В результате получают слабо окрашенные кристаллы одного из диастереоизомеров тозилата 6- амино-1,4,5а, 6-тетрагидро-3-метокси-1,7-диоксо-3H, 7H-ацето[2,1- b] фуро[3,4-d] [1,3]тиазина.
1H-ЯМР (300 МГц, ДМСО-d6): 3,48 (s, 3H, CH3); 3,75 и 3,88 (ABq, J=18 Гц, 2H, S-CH2); 5,23 и 5,32 (ABq, J=5 Гц, 2H, β- лактам H); 6,2 (s, 1H,) O-CH-О); 7,1 и 7,48 (А2B2, J=8 Гц, 4H, ArH).
Пример 9: 7-Амино-3-(N-фенилимино)метил-3- цефем-4-карбоновая кислота (способ б)
106,5 мл бистриметилсилилацетамида (БСА) и 412 мл пропиленоксида добавляют при 0oC к 212,8 г иодида триметилсилилового эфира 7- триметилсилиламино - 3 - трифенилфосфонийметил -3-цефем-4-карбоновой кислоты в 460 мл сухого диметилформамида. Раствор затем перемешивают при этой температуре в течение 3 часов. Добавляют 119,6 г п-нитрозобензола. После перемешивания в течение 16 часов при -13oC темноокрашенный реакционный раствор вливают при перемешивании в 2400 мл этанола при этой температуре. Продукт осаждают. После перемешивания в течение 30 минут на охлаждающей бане осадок отфильтровывают, промывают холодным этанолом и сушат.
1H-ЯМР (CDCl3 + БСА): 0,09 (s, 9H, N-Si(CH3)3); 0,25 (s, 9H, O- Si(CH3)3); 1,87 (d, J=9,4 Гц, 1H, NH-Si(CH3)3); 4,04 (ABq, J=18,5 Гц, 2H, S-CH2); 4,87 (2d, J=9,4 Гц, J=5,3 Гц, 11H, β- лактам-H); 5,06 (d, J=5,3 Гц, 1H, β- лактам-H); 7,14-7,41 (m, 5H, ароматический-H); 8,72 (s, 1H, CH=N).
Пример 10: Гидрохлорид 6-амино-1,4,5а,6-тетрагидро-3- гидрокси-1,7-диоксо-3H, 7H-ацето[2,1-b]фуро[3,4-d] [1,3]тиазин (гидроксилактон гидрохлорида 7-амино-3-формил-3-цефем-4-карбоновой кислоты) (способ в)
5 г 7-амино-3-(N-фенилимино)метил-3-цефем-4- карбоновой кислоты вводят в 150 мл 2N соляной кислоты при 0oC. После перемешивания в течение 10 минут при этой температуре путем фильтрации отделяют небольшое количество нерастворившегося исходного материала. Прозрачный фильтрат промывают несколько раз изобутанолом для удаления анилина и лиофилизируют. Таким образом получают гидрохлорид 6-амино-1,4,5а, 6- тетрагидро-3-гидpoкcи-1,7-диoкco-3H,7H-aцeтo[2,l-b]фуpo[3,4-d] [1,3]тиазина в виде светлого ярко-желтого порошка.
1H-ЯМР (D2O + DCl): 3,77 (ABq, J=18 Гц, 2H, S-CH2; 5,22 (d, J=5,2 Гц, 1H, β- лактам H); 5,27 (d, J=5,2 Гц, 1H, β- лактам H); 6,35 (s, широкий, 1H, O-CH-O).
Пример 11: Гидрохлорид 6-амино-1,4,5а,6- тетрагидро-3-гидрокси-1,7-диoкco-3H,7H-aцeтo[2,1-b]фуpo[3,4-d] [1,3]тиазина (гидроксилактон гидрохлорида 7-амино-3-формил-3- цефем-4-карбоновой кислоты) (способы б+в)
13,4 мл бистриметилсилилацетамида (БСА) и 51,5 мл пропиленоксида добавляют при 0oC к 26,6 г иодида триметилсилилового эфира 7- триметилсилиламино - 3 -трифенилфосфонийметил - 3 - цефем-4 - карбоновой кислоты в 50 мл дихлорметана, содержащего гексаметилдисилазан. Раствор перемешивают при этой температуре в течение 1 часа. Добавляют 7,9 г п-нитрозобензола. После перемешивания в течение 18 часов при 0oC пропиленоксид отгоняют в вакууме. Реакционную смесь вливают при перемешивании в 100 мл холодной 1N соляной кислоты. После разделения фаз водную фазу промывают несколько раз изобутанолом для отделения анилина и лиофилизируют. В результате получают гидрохлорид 6-амино- 1,4,5а,6-, тетрагидро-3-гидрокси-1,7-диоксо-3Н,7H-ацето[2,1-b]фуро[3,4- d] [1,3]тиазина в виде порошка светло-желтого цвета.
Обработка реакционной смеси может быть произведена также следующим образом: Остаток после упаривания вливают при перемешивании в 100 мл холодной 1N соляной кислоты и перемешивают в течение 10 минут при 0oC. Двухфазную смесь подвергают грубой фильтрации. После разделения фаз содержащую продукт водную фазу промывают несколько раз изобутанолом. Водную фазу концентрируют под вакуумом и очищают при помощи адсорбционной смолы HP20. Фракции, содержащие продукт, объединяют и лиофилизируют. В результате получают гидрохлорид 6-амино-1,4,5а, b-тетрагидро-3-гидрокси-1,7-диоксо-3Н, 7H-ацето[2,1- b] фуро[3,4-d] [1,3]тиазина в виде белого порошка.
1H-ЯМР спектр идентичен спектру из примера 1.
Пример 12: (6R-транс)-7-амино-3-формил-8-оксо-5-тиа-1-азабицикло[4.2.0] окт- 2-ен-2-карбоновая кислота (= 7-амино-3-формил-3-цефем-4-карбоновая кислота) (способ г)
2,64 г гидрохлорида 6-амино-1,4,5а,6- тетрагидро-3-гидрокси-1,7-диоксо-3Н, 7H-ацето[2,1-b] фуро[3,4-d] [1,3]тиазина (гидроксилактон гидрохлорида 7-амино-3-формил-3-цефем-4-карбоновой кислоты) растворяют в 50 мл метанола. К этому раствору при перемешивании и охлаждении с помощью льда по каплям добавляют раствор 0,78 г пиридина в 10 мл метанола. Осажденный продукт отфильтровывают в атмосфере азота, исключающей увлажнение, промывают небольшим количеством метанола и сушат над высушивающим агентом под вакуумом при комнатной температуре. В результате получают (6R-транс)-7-амино-3-формил-8-оксо-5-тиа-1-азабицикло [4.2.0] окт-2-ен-2-карбоновую кислоту в виде светло-коричневого порошка.
ИК (KBr): 1799 см-1 (β-лактам), 1672 см-1 (CHO), 1606 и 1542 см-1 (карбоксилат).
УФ спектр: λmax в H2О = 302 нм.
Пример 13: Триметилсилиловый эфир 7-триметилсилиламино-3-формил-3-цефем-4-карбоновой кислоты (способ г)
Суспензию 100 мг 6-амино-1,4,5а,6-тетрагидро-3-гидрокси-1,7- диоксо-3Н, 7H-ацето[2,1-b] фуро[3,4-d] [1,3]тиазина (гидроксилактон гидрохлорида 7-амино-3-формил-3-цефем-4-карбоновой кислоты) в 1 мл дейтерированного хлороформа смешивают при комнатной температуре с 0,28 мл БСА. Реакционную смесь перемешивают в течение 10 минут при комнатной температуре. Получают прозрачный раствор. Реакционный раствор имеет следующий 1H-ЯМР спектр: 1,40 (d, J=12 Гц, 1H, NH-[TMC]2); 3,57 (ABq, J=18,3 Гц, 2H, S-CH2); 4,80 (2d, J=12 Гц, J= 5,3 Гц, 1H, β-лактам-Н); 4,90 (d, J=5,3 Гц, 1H, β-лактам-H); 9,81 (s, 1H, CH=O).
Триметилсилиловый эфир 7-триметилсилиламино-3-формил -3- цефем-4-карбоновой кислоты может быть получен из этого раствора путем выпаривания.
Пример 14: Триметилсилиловый эфир 7-триметилсилиламино-3-формил-3-цефем-4- карбоновой кислоты
2,28 г 7-амино-3-формил-3-цефем-4-карбоновой кислоты перемешивают в течение 15 минут при 0oC в смеси 50 мл дихлорметана и 20 мл ацетонитрила с 5,4 мл N,O-бис-(триметилсилил)ацетамида. Получают светло-желтый раствор. Триметилсилиловый эфир 7 - триметилсилиламино-3-формил-3-цефем-4-карбоновой кислоты может быть получен из этого раствора посредством выпаривания.
Пример 15: (6R-транс)-7-амино-3-формил-8-оксо-5-тиа-1-азабицикло [4.2.0] окт-2-ен-2-карбоновая кислота (7-амино-3-формил-3-цефем-4- карбоновая кислота) (способ а+г)
Раствор 956 г гидрохлорида 7- амино-3-[(E/Z)-проп-1-ен-1-ил]-3-цефем-4-карбоновой кислоты в 7 л метанола озонируют как описано в примере 1 (температура: -50oC; вводят 10 л/мин кислорода, содержащего приблизительно 4 об.% озона). Озонолиз заканчивают приблизительно через 4 часа. Через реакционную смесь в течение приблизительно 5 минут пропускают 40 л N2. Температуру реакции доводят до -35oC и при перемешивании без дальнейшего охлаждения добавляют 5,6 л водного 5%-ного раствора ацетата натрия. Осадок незамедлительно фильтруют в атмосфере азота, исключающей увлажнение, промывают дважды 2,5 л ацетонитрила и сушат в сушильной камере при 30oC в течение 5 часов. В результате получают (6R-транс)-7-амино-3-формил-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2- карбоновую кислоту в виде светло-желтоватого порошка.
ИК (KBr): 1799 см-1 (β-лактам), 1672 см-1 (CHO), 1606 и 1542 см-1 (карбоксилат).
УФ спектр: λmax в H2О = 302 нм.
Соединения формулы I, la и II могут быть использованы для получения цефалоспорина, например, для получения
16) Амида N-(1,4,5а, 6-тетрагидро-3- метокси-1,7-диоксо-3Н, 7H-ацето[2,1-b]фуро[3,4-d] [1,3]тиазин-6- ил)-фенилуксусной кислоты
2 г тозилата 6-амино-1,4,5а,6- тетрагидро-3-метокси-1,7-диоксо-3Н,7H-ацето[2,1-b]фуро[3,4-d] [1,3]тиазина растворяют в 50 мл метиленхлорида, охлаждают до 0oC и обрабатывают 1,85 г N,O-бис(триметилсилил)ацетамида. Спустя 30 минут добавляют 1,4 г хлорида фенилуксусной кислоты и перемешивают реакционную смесь в течение 30 минут при комнатной температуре. Добавляют 2 мл метанола, продолжают перемешивание еще в течение 5 минут при комнатной температуре и фильтруют. После удаления растворителя остаток обрабатывают 50 мл метил-трет. -бутиловым эфиром и 20 мл метанола и фильтруют. В результате получают один из диастереоизомеров амида N-(1,4,5а,6- тетрагидро-3-метокси-1,7-диоксо-3H, 7H-ацето[2,1-b]фуро[3,4-d] [1,3]тиазин-6-ил)-фенилуксусной кислоты в виде бесцветного порошка.
1H-ЯМР (300 МГц, CD2Cl2): 3,50 и 3,60 (ABq, J=18 Гц, 2H, S-CH2); 3,57 (s, 3H, CH3); 3,63 (AB, 2H, CH2); 5,00 (d, J=5 Гц, 1H, β- лактам H); 5,80 (s, 1H, O-CH-O); 5,94 (dd, J=9 Гц и 5 Гц, 1H, β- лактам H); 6,4 (d широкий, J=9 Гц, NH); 7,23-7,4 (m, 5H, Ar-H).
1H-ЯМР (300 МГц, ДМСО-d6): 3,40 (s, 3H, CH3); 3,49 и 3,55 (ABq, J=13 Гц, 2H, CH2);3,61 и 3,76 (ABq, 18 Гц, 2H, S- CH2); 5,11 (d, J=5 Гц, 1H, β- лактам H); 5,87 (dd, J=8 Гц и 5 Гц, 1H, β- лактам H); 6,12 (s, 1H, O-CH-O); 7,2-7,3 (m, 5H, Ar-H); 9,20 (d, J=8 Гц, 1H, NH).
17) 7-амино-3-(N-фенилимино)метил-3- цефем-4-карбоновая кислота
Суспензию 0,50 г гидрохлорида 6-амино- 1,4,5а,6-тетрагидро-3-гидрокси-1,7-диоксо-3H, 7H-ацето[2,1- b] фуро[3,4-d] [1,3]тиазина в 5 мл хлороформа смешивают при 0oC с 2,3 мл БСА и перемешивают в течение 15 минут. Получают прозрачный раствор. Добавляют 0,35 мл анилина. После перемешивания в течение 3 часов при 0oC реакционную смесь вливают при перемешивании в 30 мл холодного этанола. Иминосоединение выпадает в осадок. После перемешивания в течение 30 минут на охлаждающей бане образовавшийся осадок отфильтровывают, промывают этанолом и сушат.
1H-ЯМР (CDCl3+БСА): 1,87 (d, J=9,4 Гц, 1H, NH- (TMC)2); 4,04 (ABq, J= 18,5 Гц, 2H, S-CH2); 4,87 (2d, J=9,4 Гц, J=5,3 Гц, 1H, β- лактам-H); 5,06 (d, J=5,3 Гц, 1H, β- лактам-H); 7,14-7,41 (m, 5H, ароматический H); 8,72 (s, 1H, CH=N).
ИК (KBr): 1789 см-1 (C=О, β- лактам).
18) [5aR(5a α, 6 β)] -1,4,5а,6-тетрагидро-3-гидрокси-6- фенилацетамидо-3Н, 7H-ацето[2,1-b]фуро[3,4-d] [1,3]тиазин-1,7(4H)-дион (= гидроксилактон 7-фенилацетамидо-3- формил-3-цефем-4-карбоновой кислоты)
2,85 мл N,O-бис-(триметилсилил)-ацетамида добавляют при 0oC к суспензии 1,39 г 6-амино-1,4,5а,6-тетрагидро-3- гидрокси-1,7-диоксо-3Н,7H-ацето[2,1-b] фуро[3,4-d] [1,3] тиазина в смеси 50 мл дихлорметана и 10 мл ацетонитрила. После перемешивания в течение 10 минут получают прозрачный раствор, в который по каплям добавляют 0,6 мл хлорангидрида фенилуксусной кислоты. Реакционную смесь перемешивают в течение 30 минут при 0oC и добавляют 0,2 мл воды. После отделения выпавшего в осадок ацетамида-HCl проводят выпаривание под вакуумом. Остаток обрабатывают метил-трет.-бутиловым эфиром и сушат. В результате получают [5aR(5a α, 6 β )]-1,4,5а,6-тетрагидро-3-гидрокси-6- фенилацетамидо-3H, 7H-ацето[2,1-b] фуро[3,4-d] [1,3] тиазин-1,7(4H)- дион в виде светло-желтого порошка.
1H-ЯМР (60 МГц, d6-ДМСО): 3,5 (s, 2H, -CH2-СО-); 3,75 (s, широкий, 2H, SCH2); 5,1 (d, J=5 Гц, 1H); 5,9 (dd, J=5 и 8 Гц, 1H); 6,25 (d, J=6 Гц, 1H, O-CH-O); 7,25- 7,3 (s, широкий, 5H, Ar-H); 9,2 (d, J=7 Гц, 1H, NH).
19) Натриевая соль 7-фенилацетамидо-3-формил-3-цефем-4-карбоновой кислоты
2,28 г 7-амино-3-формил-3-цефем-4-карбоновой кислоты перемешивают в течение 15 минут при 0oC в смеси 50 мл дихлорметана и 20 мл ацетонитрила с 5,4 мл N,O-бис-(триметилсилил)-ацетамида. К полученному светло-желтому раствору по каплям добавляют 1,32 мл хлорангидрида фенилуксусной кислоты. Реакционную смесь перемешивают в течение 30 минут при 0oC, а затем гидролизуют посредством добавления 0,4 мл воды. Мутный коричневый раствор фильтруют до тех пор, пока он не станет прозрачным, и под вакуумом удаляют дихлорметан. Остаток разбавляют 20 мл ацетонитрила, а затем смешивают при перемешивании с 1,7 г натрий-2-этилгексаноата. Перемешивание продолжают в течение 10 минут при комнатной температуре, затем фильтруют продукт, выпавший в осадок. После сушки под вакуумом получают натриевую соль 7-фенилацетамидо-3-формил-3-цефем-4-карбоновой кислоты.
1H-ЯМР (60 МГц, (d6-ДМСО): 3,45 (ABq, J=15 Гц, 2H, SCH2); 3,60 (s, 2H, -CH2-CO); 5,1 (d, J=5 Гц, 1H); 5,65 (dd, J=5 и 8 Гц, 1H); 7,2-7,5 (s, широкий, 5H, Ar-H); 9,2 (d, J=7 Гц, 1H, NH); 9,7 (s, 1H, CH=O).
20) Дифенилметиловый эфир 7-фенилацетамидо-3- формил-3-цефем-4-карбоновой кислоты
2,28 г 7-амино-3-формил-3- цефем-4-карбоновой кислоты подвергают бисилилированию, как описано в примере 19, с помощью 5,4 мл N,O-бис-(триметилсилил) -ацетамида и обработке хлорангидридом фенилуксусной кислоты, а затем гидролизуют с помощью 0,4 мл воды. Гидролизованную реакционную смесь обрабатывают 1 г активированного угля, а затем фильтруют. Желтый фильтрат смешивают с 20 мл 10%-ного раствора дифенилдиазометана в дихлорметане, а затем концентрируют до 10 мл под вакуумом. Продукт осаждают из остатка, полученного после упаривания, путем добавления 100 мл н-гексана. В результате получают дифенилметиловый эфир 7-фенилацетамидо-3-формил-3-цефем- 4-карбоновой кислоты в виде светло-желтого продукта.
1H-ЯМР (60 МГц, d6-ДМСО): 3,15 и 3,90 (ABq, J=18 Гц, 2H, SCH2); 3,55 (s, 2H, -CH2-CO); 4,9 (d, J=5 Гц, 1H, Н-6); 5,90 (dd, J=5 и 8 Гц, 1H, H-7); 6,6 (d, J= 8 Гц, 1H, NH); 7,0 (s, 1H, CHPh2); 7,25 и 7,30 (2s, 15H, Ar-H); 9,62 (s, 1H, CH=O).
21) 7-Амино-3-[[(аминокарбонил)гидразоно] метил]-3-цефем-4- карбоновая кислота
1,3 г гидрохлорида семикарбазида растворяют в 30 мл воды и охлаждают раствор до 0oC. К этому раствору небольшими порциями добавляют 3,0 г гидрохлорида 6-амино- 1,4,5а,6-тетрагидро-3-гидрокси-1,7-диоксо-3Н,7H-ацето[2,1- b]фуро[3,4-d] [1,3]тиазина. Реакционную смесь перемешивают в течение 4 часов при 3-5oC. Осадок, который является 7-амино-3- [(аминокарбонил)гидразоно] метил]-3-цефем-4-карбоновой кислотой, отфильтровывают и промывают 10 мл ацетона.
1H-ЯМР (300 МГц, CD3OD): 8,35 (s, 1H, CH=N); 5,31 (d, J=5,1 Гц, 1H, CH); 5,14 (d, J=5,l Гц, 1H, CH); 4,28 и 4,84 (ABq, J=17,9 Гц, S-CH3).
22) 7-Амино-3-(метоксиимино)метил-3-цефем-4-карбоновая кислота
Раствор 0,25 г гидрохлорида О-метилгидроксиламина в 7 мл воды смешивают при 0o с 0,79 г гидрохлорида 6-амино-1,4,5а,6- тетрагидро-3-гидрокси-1,7-диоксо-3Н, 7H-ацето[2,1-b] фуро[3,4-d] [1,3] тиазина. После перемешивания в течение 15 минут при 0oC суспензию фильтруют.
Кристаллический слой промывают холодной водой и ацетоном. После сушки под вакуумом получают 7-амино-3- (метоксиимино)метил-3-цефем-4-карбоновую кислоту в виде практически белого кристаллического порошка.
1H-ЯМР (CD3COOD) + CF3COOD): 3,99 (2H, S-CH2); 4,01 (s, 3H, CH3О); 5,39 (2H, β-лактам-H); 8,67 (s, 1H, CH=N);
ИК (KBr): 1799 см-1 (С=O, β- лактам).
23) 7-Амино-3[(Е)-2-трет. - бутоксикарбонил] этенил-3-цефем-карбоновая кислота
Суспензию 1 г 6- амино-1,4,5а,6-тетрагидро-3-гидрокси-1,7-диоксо-3H, 7H-aцeтo[2,l- b]фуpo[3,4-d] [1,3]тиазина в 10 мл метиленхлорида обрабатывают при комнатной температуре 3,6 мл БСА. Реакционную смесь перемешивают в течение 10 минут при комнатной температуре. Получают прозрачный раствор, содержащий N,O-бистриметилсилил-7-амино-3-формил-3-цефем-4-карбоновую кислоту. Раствор охлаждают до 0oC и обрабатывают 0,37 г ацетата лития и 1,5 мл ДМФ. После 15 минут непрерывного перемешивания при охлаждении на водяной бане добавляют 1,42 г трет.-бутоксикарбонилметилентрифенилфосфорана. После перемешивания в течение 24 часов при 0oC реакционную смесь вливают при перемешивании в 30 мл метанола. Продукт кристаллизуют. После перемешивания в течение 30 минут при комнатной температуре суспензию кристаллов фильтруют, а отфильтрованный слой промывают метанолом. После сушки получают 0,76 г (65,4%) 7-амино-3[(Е)-2- трет.-бутоксикарбонил] этенил-3-цефем-4-карбоновую кислоту в виде светлоокрашенного кристаллического порошка.
ИК-спектр (KBr): 1803 см-1 (С=O, β- лактам), 1705 см-1 (С=O эфирная)
1H-ЯМР-спектр (90 МГц, D2O + К2СО3): 1,50 (s, 9H, С(CH3)3); 3,61 (2H, S-CH2); 4,82 (d,J=4,5 Гц, 1H, β- лактам-H); 5,31 (d, J=4,5 Гц, 1H, β- лактам-H); 5,97 (d, J=15,0 Гц, 1H, C=CH-CO); 7,65 (d, J=15,0 Гц, 1H, CH=C-CO).
24) 7-Амино-3-[(Е)-2-этоксикарбонил]этенил-цефем-4- карбоновая кислота
Суспензию 1 г 7-амино-3-формил-3-цефем-4- карбоновой кислоты в 10 мл пропиленоксида обрабатывают при комнатной температуре 4,7 мл БСА. Реакционную смесь перемешивают при комнатной температуре в течение 10 минут. Получают прозрачный раствор, содержащий N,O-бистриметилсилил-7-амино-3-формил-3-цефем- 4-карбоновую кислоту. Раствор охлаждают до 0oC и обрабатывают 1,45 г этоксикарбонилметилтрифенилфосфонийхлорида. После 44-часового перемешивания при 0oC реакционную смесь обрабатывают, как описано в примере 23. После сушки получают 0,90 г (71,7%) 7-амино-3-[(Е)-2- этоксикарбонил]этенил-3-цефем-4-карбоновой кислоты в виде светлого кристаллического порошка.
ИК-спектр (КВг): 1801 см-1 (С=O β- лактам), 1709 см-1 (С=O эфирная)
УФ-спектр (H2О): λmax = 316,1 нм.
1H-ЯМР-спектр (90 МГц, ДМСО-d2 + CF3COOD): 2,24 (t, J=7,0 Гц, 3H, CH3); 3,90 (ABq, J=18,0 Гц, 2H, S-CH2); 4,18 (q, J=7,0 Гц, 2H, O-CH2-); 5,30 (d, J=5,0 Гц, 1H, β- лактам-H); 5,36 (d, J=5,0 Гц, 1H, β- лактам-H); 6,30 (d, J= 16,0 Гц, 1H, C=CH-CO); 7,80 ((d, J=16,0 Гц, 1H, CH=C-CO).
25) 7-Амино-3[(Е)-2- этоксикарбонил]этенил-3-цефем-4-карбоновая кислота
Суспензию 1 г 7-амино-3-формил-3-цефем-4-карбоновой кислоты в 10 мл пропиленоксида обрабатывают при комнатной температуре 4,7 мл БСА. Реакционную смесь перемешивают при комнатной температуре в течение 10 минут. Получают прозрачный раствор, содержащий N,O-бистриметилсилил-7-амино-3-формил-3-цефем-4-карбоновую кислоту. Раствор охлаждают до 0oC и обрабатывают 1,32 г этоксикарбонилметилтрифенилфосфорана. После 24-часового перемешивания при 0oC реакционную смесь обрабатывают, как описано в примере 23.
ИК-спектр (KBr): 1803 см-1 (C=O β-лактам), 1736 см-1 (C=O эфирная)
УФ-спектр (H2O): λmax = 316,1 нм.
1H-ЯМР, УФ и ИК спектры идентичны спектрам из примера 23.
26) 7-Амино-3[(Е)-2-этоксикарбонил]этенил-3-цефем-4- карбоновая кислота
Суспензию 200 мг 7-амино-3-формил-3-цефем-4- карбоновой кислоты в 2 мл ТГФ обрабатывают при комнатной температуре 1,08 мл БСА. Реакционную смесь перемешивают при комнатной температуре в течение 10 минут. Получают прозрачный раствор, содержащий N,O-бистриметилсилил-7-амино-3-формил-3-цефем- 4-карбоновую кислоту. Раствор охлаждают до 0oC и по каплям обрабатывают смесью 197 мг диэтилэтоксикарбонилметилфосфоната и 98 мг трет.-бутилата калия в 2 мл ТГФ. После 18-часового перемешивания при 0oC реакционную смесь обрабатывают, как описано в примере 23. В результате получают 39 мг (15,5%) 7-амино-3[(Е)-2- этоксикарбонил] этенил-3-цефем-4-карбоновой кислоты в виде окрашенного в коричневый цвет порошка.
1H-ЯМР, УФ и ИК спектры идентичны спектрам из примера 23.
27) 7-Амино-3[(Е)-2-N- диэтилкарбамоил]этенил-3-цефем-4-карбоновая кислота
Суспензию 300 мг 7-амино-3-формил-3-цефем-4-карбоновой кислоты в 3 мл пропиленоксида обрабатывают при комнатной температуре 1,4 мл БСА. Реакционную смесь перемешивают при комнатной температуре в течение 10 минут. Получают прозрачный раствор, содержащий N,O- бистриметилсилил-7-амино-3-формил-3-цефем-4-карбоновую кислоту. Раствор охлаждают до 0oC и обрабатывают 377 мг диэтилкарбамоилметиленфосфорана. После 24-часового перемешивания при 0oC реакционную смесь обрабатывают, как описано в примере 23. В результате получают 205 мг (49,8%) 7-амино-3[(Е)-2- N-диэтилкарбамоил]этенил-3-цефем-4-карбоновой кислоты в виде светло-желтоватого порошка.
ИК-спектр (KBг): 1798 см-1 (С=O β- лактам), 1635 см-1 (С=O амидная)
УФ-спектр (H2О): λmax = 315,7 нм.
1H-ЯМР-спектр (90 МГц, ДМСО-d6 + CF3COOD): 1,03-1,33 (m, 6H, 2хCH3); 3,60-3,66 (m, 4H, 2хN-CH2-); 3,87 (ABq, 2H, S-CH2); 5,10 (d, J=4,8 Гц, 1H, β- лактам-H); 5,31 (d, J=4,8 Гц, 1H, β- лактам-H); 6,67 (d, J=15,0 Гц, 1H, C=CH-CO); 7,88 ((d, J=15,0 Гц, 1H, CH=C-CO).
28) 7-Амино-3-(2-фенил)этенил-3-цефем-4-карбоновая кислота
Суспензию 0,3 г 7-амино-3-формил-3-цефем-4-карбоновой кислоты в 3 мл ТГФ обрабатывают при комнатной температуре 1,4 мл БСА. Реакционную смесь перемешивают при комнатной температуре в течение 10 минут. Получают прозрачный раствор, содержащий N, O- бистриметилсилил-7-амино-3-формил-3-цефем-4-карбоновую кислоту. Раствор охлаждают до 0oC и обрабатывают раствором 0,53 г фенилметилентрифенилфосфорана в 4 мл ТГФ. После 24-часового перемешивания при 0oC реакционную смесь обрабатывают, как описано в примере 23. Получают смесь изомеров (6 частей Z-изомера и 11 частей Е-изомера).
29) {6R-[3(Е) α, 7 β(Z)]}-7-{[(2-амино-4-тиазолил) (метоксиимино)ацетил] амино} -3-(3-этокси-3-оксо-1-пропенил)-8- оксо-5-тиа-1-азабицикло[3.2.0] окт-2-ен-4-карбоновая кислота (= 7- [(2-амино-4-тиазолил) (метоксиимино) ацетил] амино-3-(3-этокси-3-оксо-1-пропенил)-3-цефем-4-карбоновая кислота)
0,34 г триметиламина по каплям добавляют при 0oC к суспензии 0,5 г 7- амино-3-[(Е)-3-этокси-3-оксо-1-пропенил]-3-цефем-4-карбоновой кислоты и 0,67 г меркаптобензтиазолилового эфира (2-амино-4- тиазолил) (метоксиимино) уксусной кислоты в 5 мл этанола. Реакционную смесь перемешивают в течение 5 часов при этой температуре. Получают прозрачный раствор. Посредством капельного добавления разбавленной соляной кислоты pH доводят приблизительно до 2,5. Образуется осадок. После перемешивания в течение 1 часа при 0oC суспензию кристаллов фильтруют, а отфильтрованный слой промывают этанолом. После сушки получают 0,27 г (33,6%) 7-[(2- амино-4-тиазолил) (метоксиимино) ацетил] амино-3-(3-этокси-3-оксо- 1-пропенил)-3-цефем-4-карбоновой кислоты в виде светлоокрашенного кристаллического порошка.
1H-ЯМР спектр (90 МГц, ДМСО-d5: 1,22 (t, J=7,0 Гц, 3H, -CH3); 3,80 (ABq J= 18 Гц, 2H, S-CH2); 3,87 (s, 3H, O-CH3); 4,18 (q, J=7,0 Гц, 2H, O-CH2); 5,25 (d, J= 4,8 Гц, 1H, β- лактам-Н); 5,86 (dd, J=8,5 Гц, J=4,8 Гц, 1H, β- лактам-Н); 6,24 (d, J=16,0 Гц, 1H, C=CH-CO); 7,73 (d, J=16,0 Гц, 1H, CH=C- CO); 9,70 (d, J=8,5 Гц, 1H).
30) 7-Амино-3[(Е)-N-(2,2,2-трифторэтил)пирролидин-2-он-3- илиденметил] -3-цефем-4-карбоновая кислота
Суспензию 126 мг 7- амино-3-формил-3-цефем-4-карбоновой кислоты в 2 мл пропиленоксида обрабатывают при комнатной температуре 572 мг БСА. Реакционную смесь перемешивают при комнатной температуре в течение 10 минут. Получают прозрачный раствор, содержащий N,O-бистриметилсилил-7- амино-3-формил-3-цефем-4-карбоновую кислоту. Раствор охлаждают до 0oC и обрабатывают 152 мг N-(2,2,2-трифторэтил)-пирролидин-2-он-3-ил-трифенилфосфонийбромидом. После 24-часового перемешивания при 0oC реакционную смесь обрабатывают, как описано в примере 23. После сушки в результате получают 119 мг (57%) 7-амино-3[(Е)-N-(2,2,2- трифторметил)пирролидин-2-он-3-илиденметил] -3-цефем-4-карбоновой кислоты в виде светлоокрашенного кристаллического порошка.
ИК-спектр (КВг): 1791 см-1 (С = О β- лактам), 1692 см-1 (С=O амид)
УФ-спектр (H2О): λmax = 324,3 нм.
1H-ЯМР-спектр (90 МГц, ДМСО-d2 + CF3COOD): 2,91-3,23 (m, 2H, C-CH2-C-пирролидинон); 3,47-3,58 (m, 1H, N-СН2-пирролидинон); 3,99 (q, J=15 Гц, 2H, S-CH2-); 4,17 (ABq, J=15 Гц, N-СН2-CF3); 5,25 (d, J=3,0 Гц, 1H, β- лактам-H); 5,32 (d, J=3,0 Гц, 1H, β- лактам-H); 7,47 (t, J=3 Гц, 1H, CH=C).
31) 7-Амино-3 [(E)-N-метилпирролидин-2-он-3-илиденметил] -3-цефем-4-карбоновая кислота
Суспензию 300 мг 7- амино-3-формил-3-цефем-4-карбоновой кислоты в 3 мл пропиленоксида обрабатывают при комнатной температуре 1,6 мл БСА. Реакционную смесь перемешивают при комнатной температуре в течение 10 минут. Получают прозрачный раствор, содержащий N,O-бистриметилсилил-7- амино-3-формил-3-цефем-4-карбоновую кислоту. Раствор охлаждают до 0oC и обрабатывают 445 мг N-метилпирролидин-2-он-3-ил-метилентрифенилфосфорана. После 15-часового перемешивания при 0oC реакционную смесь обрабатывают, как описано в примере 23. После сушки в результате получают 328 мг (83,9%) 7-амино-3[(Е)-N- метилпирролидин-2-он-3-илиденметил]-3-цефем-4-карбоновой кислоты в виде светлоокрашенного порошка.
ИК-спектр (KBr): 1783 см-1 (C=O β-лактам)
1H-ЯМР-спектр (90 МГц, ДМСО-d6 + CF3COOD): 2,88 (s, 3H, N-СН3); 2,80-3,56 (m, 4H, H- пирролидинон); 3,95 (ABq, J=19,3 Гц, 2H, S-CH2); 5,21 (d, J= 5,7 Гц, 1H, β-лактам-H); 5,29 (d, J=5,7 Гц, 1H, β- лактам-H); 7,32 (t, J= 3Гц, 1H, CH=C).
Изобретение относится к промежуточному соединению цефалоспоринов формулы IA, приведенной в описании, в которой либо α) Ra обозначает водород или силильную группу; Rb обозначает группу формулы -ORe, в которой Re обозначает водород или низший алкил, a Rc и Rd совместно обозначают связь; либо β) Rd и Ra обозначают водород или силильную группу, а Rd и Rc совместно обозначают иминогруппу формулы =N-Y, в которой Y обозначает фенил, либо Y) Rd обозначает водород или силильную группу; Ra обозначает водород, если Rd обозначает водород, либо Ra обозначает водород или силильную группу, если Rd обозначает силильную группу, а Rb и Rc совместно обозначают оксогруппу, а силильная группа обозначает три(низш)алкилсилильную группу в свободной форме или в форме соли. Способ получения цефалоспорина формулы VI, приведенной в описании, осуществляют путем взаимодействия соединения IA с соединением XI или XII и получают соединение XIII, которое десилилируют. Технический результат - получение нового соединения формулы IA. 2 с. и 6 з.п. ф-лы.



в которой α) Ra обозначает водород или силильную группу;
Rb обозначает группу формулы -ORe, в которой Re обозначает водород или низший алкил;
Rc и Rd вместе обозначают связь;
или β) Ra и Rd обозначают водород или силильную группу;
Rb и Rc совместно обозначают иминогруппу формулы =N-Y, в которой Y обозначает фенил;
или γ) Rd обозначает водород или силильную группу;
Ra обозначает водород, если Rd обозначает водород;
либо Ra обозначает водород или силильную группу, если Rd обозначает силильную группу;
Rb и Rc совместно обозначают оксогруппу,
силильная группа обозначает три(низш.)алкилсилильную группу,
в свободной форме или в форме соли.
в которой X- обозначает анион неорганической или органической кислоты;
R1 обозначает водород или (низш.)алкильную группу.
гидрохлорида 6-амино-5а, 6-дигидро-3-гидрокси-3Н, 7Н-ацето[2,1-b] фуро[3,4-d][1,3]тиазин-1,7(4Н)-диона,
толуолсульфоната 6-амино-5а, 6-дигидро-3-гидрокси-3Н,7Н-ацето[2,1-b]фуро[3,4-d][1,3]тиазин-1,7(4Н)-диона,
гидрохлорида 6-амино-5а, 6-дигидро-3-метокси-3Н, 7Н-ацето[2,1-b] фуро[3,4-d][1,3]тиазин-1,7(4Н)-диона и
толуолсульфоната 6-амино-5а, 6-дигидро-3-метокси-3Н, 7Н-ацето[2,1-b]фуро[3,4-d][1,3]тиазин-1,7(4Н)-диона.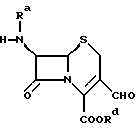
в которой Ra и Rd обозначают водород или силильную группу.
в которой Y имеет значение, определенное в п.1;
Ra и Rd имеют значения, определенные в п.5,
в свободной форме или в форме соли.
в которой R5 и R6 одинаковы или различны и обозначают водород или органическую группу либо R5 и R6 вместе обозначают замещенное или незамещенное кольцо,
путем воздействия формилцефалоспоринового соединения с соединением формулы XI или XII
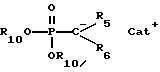
в которой R5 и R6 определены выше;
R10 обозначает арил или низший алкил;
Cat+ обозначает катион щелочного металла или протонированную форму сильного органического основания,
отличающийся тем, что в качестве формилцефалоспоринового соединения используют соединение формулы Ia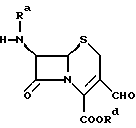
где Ra и Rd обозначают силильную группу,
из которого получают соединение формулы XIII
где Ra, Rd, R5 и R6 определены выше,
с последующим его десилилированием с образованием соединения формулы VI.
Приоритет по пунктам:
25.04.94 - по пп.1 - 4 и 6 - 8;
25.05.94 - по пп.1, 5 и 8.
| Преобразователь кода Грея в двоичный код | 1960 |
|
SU142820A1 |
| EP 0503453 A, 16.02.1992 | |||
| US 3997528 A, 14.12.1976. | |||
Авторы
Даты
2000-06-10—Публикация
1995-04-24—Подача