Предлагаемое изобретение относится к биотехнологии, а именно к гибридным клеткам и, в частности, к гибридомам. Более специфически предлагаемое изобретение относится к гибридомам, способным продуцировать моноклональные антитела к эритропоэтину человека. Указанные антитела могут быть использованы для иммуноаффинной очистки эритропоэтина человека, для выделения его из белковых смесей или для его качественного и количественного анализа.
Известен штамм гибридомы мышей ATCC NHB8209, являющийся продуцентом моноклональных антител к эритропоэтину человека [EP N 0116446, МПК5 C 12 N 5/00, опубл. 22.08.90]. Указанный штамм получен гипериммунизацией мыши линии Balb/C сшитым 20-членным синтетическим олигопептидом, синтезированным авторами. Штамм HB 8209 продуцирует при своем росте в питательную среду моноклональные антитела к антигенной детерминанте, находящейся в структуре синтетического 20-членного олигопептида.
Существенным недостатком известного штамма является неполная адекватность структуры синтетического олигопептида структуре гликозилированного белка эритропоэтина человека и вследствие этого невозможность получения антител к эритропоэтину с независимо распознаваемыми антигенными детерминантами, что делает невозможным использование полученных антител для количественного определения эритропоэтина. Кроме того, описанный авторами факт вытеснения из иммунного комплекса эритропоэтина синтетическим олигопептидом указывает на низкую аффинность полученных антител по отношению к эритропоэтину.
Целью предлагаемого изобретения является приближение характеристик продуцируемых антител к структуре природного эритропоэтина человека и получение панели гибридом, продуцирующих антитела к независимым антигенным детерминантам его молекулы.
Поставленная цель достигается культивированием новых штаммов гибридом мышей, получивших при регистрации N ВСК/П/634D, N ВСК/П/635D и N ВСК/П/636D, продуцирующих моноклональные антитела к независимым антигенным детерминантам человеческого эритропоэтина. Штаммы получены по следующей технологии.
Эритропоэтин человека иммобилизовывали на нитроцеллюлозной мембране тип HAHY (Millipore, США), гомогенизировали мембрану в диметилсульфоксиде, высаливали нитроцеллюлозу с эритропоэтином водой и полученную суспензию вводили мышам линии Balb/c в подушечки задних лап. Спустя 30 дней мышей бустировали внутрибрюшинно раствором эритропоэтина в количестве 10 мкг на 1 мышь. Через 4 дня мышей забивали и лимфоциты из селезенки и лимфоузлов использовали для последующей гибридизации. Слияние лимфоцитов от иммунных мышей проводили по общепринятой процедуре с помощью полиэтиленгликоля. В качестве миеломного партнера при слиянии использовали миелому Px63.Ag8.6.5.3.
После слияния клетки переносили в 96-ячеечные микропланшеты при концентрации 105-106 клеток на 1 лунку в селективной питательной среде, содержащей HAT. Спустя 10 дней микропланшеты контролировали микроскопически на присутствие в ячейках растущих колоний клеток. Из ячеек с растущими колониями отбирали образцы культуральной жидкости с целью выявления колоний, продуцирующих антитела, реагирующие с человеческим эритропоэтином.
Скрининг колоний, продуцирующих антитела к человеческому эритропоэтину, осуществляли посредством твердофазного иммуноферментного анализа на эритропоэтине, иммобилизованном на поверхности ячеек микропланшетов для иммуноферментного анализа (Costar, Holland, high-bond), по общепринятой процедуре (Engvall, Е. , and Pertmann, P., J. Immunology, 109, 129, 1972). Клетки из позитивных ячеек с растущими колониями подвергали клонированию посредством переноса в новые микропланшеты в концентрации 1 - 5 клеток на ячейку. Спустя 10-12 дней наличие растущих клонов в микропланшетах контролировали микроскопически, и из ячеек с растущими колониями отбирали образцы культуральной жидкости с целью выявления клонов, продуцирующих антитела к человеческому эритропоэтину. Позитивные клоны использовали для дальнейшего клонирования и размножали для депонирования культур.
Из первично позитивных колоний в результате скрининга и клонирования были отобраны клоны PCE/D7, PCE/D10 и PCE/F6. Эти клоны характеризовались высокой скоростью роста, высокой стабильностью продукции антител, специфически реагирующих с человеческим эритропоэтином. Продукция антител достигает 50 мкг/мл при культивировании в стационарных условиях.
Полученные штаммы PCE/D7, PCE/D10 и PCE/F6 культивируемых гибридом мышей были депонированы в Специализированной коллекции перевиваемых соматических клеток позвоночных Всероссийской коллекции клеточных культур под номерами ВСКК/П/634D, ВСКК/П/635D и ВСКК/П/636D соответственно.
Штаммы характеризуются следующими признаками:
1. Морфологические признаки
Клетки правильной округлой формы, одиночные или сгруппированные в кластеры.
2. Культуральные признаки
Тип роста - суспензионный
3. Принцип гибридизации
Гибридома получена слиянием миеломы мышей Px.63.Ag8.653 с лимфоцитами мышей линии Balb/C с помощью полиэтиленгликоля.
4. Устойчивость к селективным факторам
Растет на селективной среде HAT.
5. Криоконсервация
Среда для криоконсервации - 90% фетальной сыворотки и 10% диметилсульфоксида. Хранение при -196oC в жидком азоте.
6. Контроль видовой идентичности
Гибридома способна к культивированию в перитонеальной полости сингенных мышей без использования иммуносупрессии и продуцирует иммуноглобулины мыши типа Hγ1 Lк.
7. Контаминация
Клетки гибридомы свободны от микоплазмы.
Было проведено накопительное культивирование полученных гибридом в бессывороточной синтетической питательной среде. Культуральные жидкости в количестве по 1 литру для каждого клона были сконцентрированы ультрафильтрацией на половолоконном модуле с проницаемостью волокон 30 kD до 100 мл и подвергнуты диафильтрации против 20 объемов 0,02 М Трис-буфера pH 7,5. Полученные концентраты были фронтально нанесены на колонку K26/30, содержащую 100 мл анионита Q-Sepharose FF (Фармация, Швеция), уравновешенного тем же буфером. Элюция антител была осуществлена линейным градиентом хлорида натрия в том же буфере от 0 до 0,5 М. Собранные мажорные пики, содержащие моноклональные антитела, были нанесены на колонку K26/100, заполненную гелем Sephacryl S-200 (Фармация, Швеция) и элюированы 0,02 М фосфатным буфером pH 7,2, содержащим 0,15 М натрия хлористого. В результате очистки было получено по 12 мг моноклональных антител в практически гомогенном состоянии. Моноклональные антитела были охарактеризованы по следующим параметрам:
При помощи иммуноферментного набора фирмы Calbiochem установлены изотипы (γ1) тяжелых и легких (к) цепей иммуноглобулинов.
С помощью иммуноферментного анализа показана способность связывать эритропоэтин человека из раствора.
С помощью иммуноферментного и иммунофлуоресцентного анализа установлено, что моноклональные антитела, продуцируемые заявляемыми штаммами, не связывают компонентов человеческой и бычьей сыворотки и белков клеток селезенки человека. Установлено также, что антитела не связывают белков клеток реципиентного штамма CHO, использовавшегося для получения клеточной линии - продуцента эритропоэтина.
С помощью электрофореза полученные антитела были охарактеризованы по молекулярным массам (160 kD) и степени чистоты. Полученные результаты представлены в таблице и на фиг.1
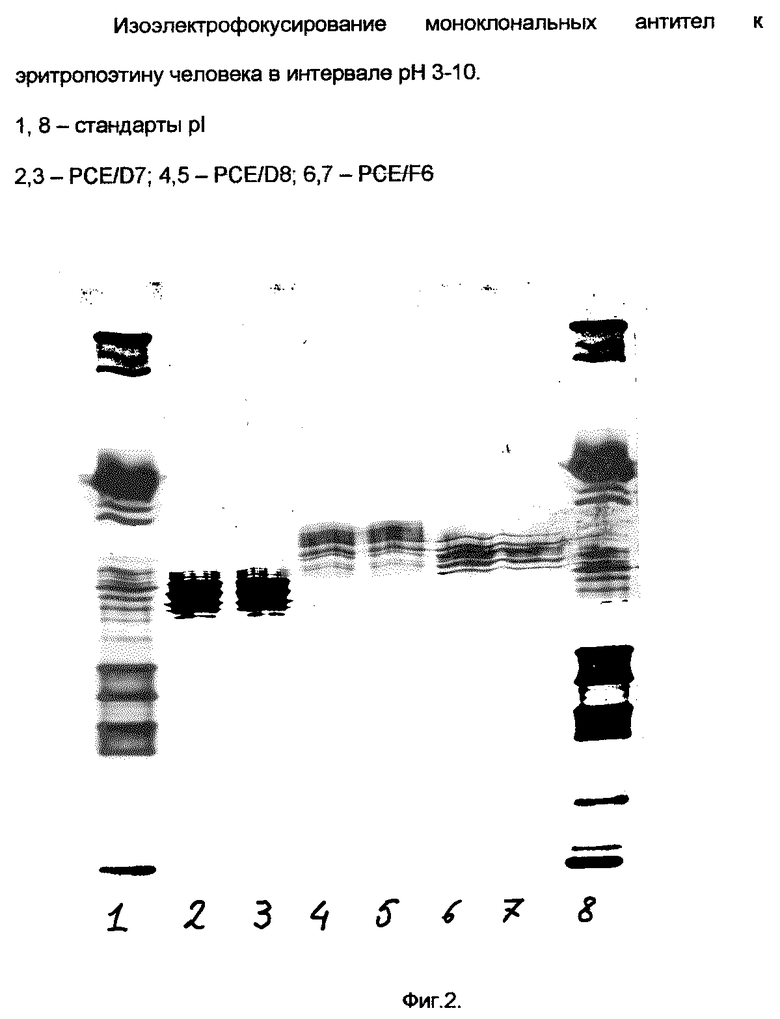
На фиг. 2 представлен спектр изоэлектрофокусирования моноклональных антител, продуцируемых заявляемыми штаммами. Как следует из рисунка, антитела характеризуются изоформами, располагающимися в диапазоне pH от 5,3 до 6,0.

Изобретение относится к биотехнологии, в частности к производству гибридом. Гибридомы получают путем слияния лимфоцитов, полученных от иммунизированных эритропоэтином человека мышей, с миеломой. Гибридомы депонированы под номерами ВСКК/П/634Д, ВСКК/П/635Д, ВСКК/П/636Д. Гибридомы продуцируют многоклональные антитела к эритропоэтину человека. Моноклональные антитела имеют молекулярную массу 160 кД и относятся к IgG1 с легкими цепями типа к. Изобретение позволяет получить панели гибридом, продуцирующие антитела к независимым антигенным детерминантам природного эритропоэтина человека. 6 с.п. ф-лы, 2 ил., 1 табл.
| Передвижной исчезающий упор | 1958 |
|
SU116446A1 |
| EP 066835 A1, 25.08.95 | |||
| US 4558005, 12.10.85. | |||
Авторы
Даты
2000-06-20—Публикация
1998-12-09—Подача