Настоящее изобретение относится к новым пептидным соединениям с биологической активностью, более конкретно к производным дипептидных п-амидинобензиламидов с N-концевыми сульфонильными остатками и их солям с физиологически приемлемыми кислотами.
Известны пептидные соединения, обладающие биологической активностью, в частности ингибирующей тромбин активностью (см. заявку WO 93/11152, C 07 K 5/06, A 61 K 37/64, 10 06.1993 г.).
Задачей изобретения является расширение ассортимента пептидных соединений с биологической активностью, в частности с ингибирующей тромбин активностью.
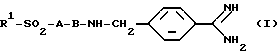
Поставленная задача решается предлагаемыми производными дипептидных п-амидинобензиламидов с N-концевыми сульфонильными остатками общей формулы (I)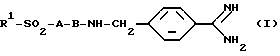
в которой R1 алкил с 1-20 атомами углерода, фторалкил с 1-3 атомами углерода, арилалкил с 1-10 атомами углерода в алкильной части, арил, гетероарил, представляющий собой пяти или шестичленный ароматический цикл, содержащий один гетероатом из числа азота и серы, гидроксил или R2R3N, где R2 и R3 являются одинаковыми или разными и означают водород, алкил с 1-10 атомами углерода,
A означает остаток α-аминокислоты формулы (II):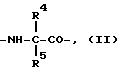
где R4 означает водород, циклоалкил с 3-7 атомами углерода или арил,
R5 означает водород, циклоалкилалкил с 3-7 атомами углерода в циклоалкильной части и 1-3 атомами углерода в алкильной части, арилалкил с 1-3 атомами углерода в алкильной части,
B означает остаток циклической α -аминокислоты формулы (III):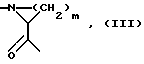
где m означает число 2, 3 или 4, при этом если m означает 3 или 4, то два соседних атома водорода могут быть заменены двойной связью,
или их солями с физиологически приемлемыми кислотами.
Под термином "физиологически приемлемые кислоты" понимаются такие кислоты, как соляная кислота, лимонная кислота, винная кислота, молочная кислота, фосфорная кислота, метансульфокислота, уксусная кислота, муравьиная кислота, малеиновая кислота, фумаровая кислота, янтарная кислота, гидроксиянтарная кислота, серная кислота, глутаровая кислота, аспарагиновая кислота, пировиноградная кислота, бензойная кислота, глюкуроновая кислота, щавелевая кислота, аскорбиновая кислота и ацетилглицин.
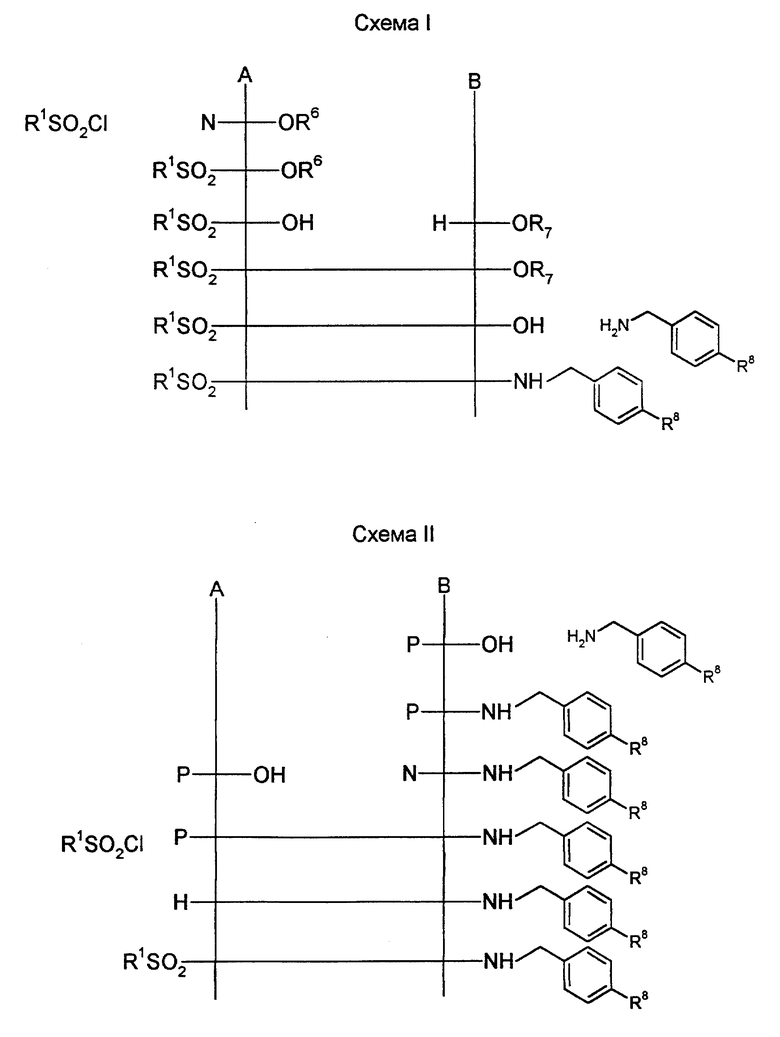
Предлагаемые соединения общей формулы (I) относятся к категории малотоксичных веществ, их можно получать известными способами. Так, например, их можно получать, исходя из α -аминокислоты формулы H-A-OH, соответственно, из защищенной по азоту циклической аминокислоты формулы B-OH, реакционной схеме I, соответственно, II (см. в конце описания).
В приведенных реакционных схемах R6 означает водород или алкил с 1-4 атомами углерода;
R7 означает алкил с 1-4 атомами углерода, предпочтительно метил или трет-бутил;
R8 означает цианогруппу или группу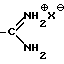
(X означает хлор, бромйод, ацетил),
P означает защитную группу, предпочтительно трет-бутоксикарбонил (Boc) или бензилоксикарбонил (Cbz).
Альтернативно, защищенные аминокислоты P-A-OH и H-B-OR7 можно вводить в реакцию сочетания с образованием дипептида P-A-B-OR7 и затем, после отщепления группы P с помощью R1SO2Cl, соответственно, радикала R7 с помощью п-циано- или п-амидинобензиламина, вводить во взаимодействие, причем последовательность реакций может быть любой.
R1-SO2-A-OH можно также непосредственно вводить в реакцию сочетания с пара-H-B-NHCH2C6H4R9 с целью получения целевого продукта формулы (I), соответственно, промежуточного продукта формулы (IV)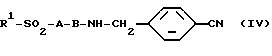
где R1, A и B имеют указанное значение.
Необходимые реакции сочетания осуществляют в стандартных условиях химии пептидов.
Трет-бутоксикарбонильные защитные группы отщепляют с помощью хлороводорода в диоксане или трифторуксусной кислоты в метиленхлориде; бензилоксикарбонильные защитные группы отщепляют путем гидрогенолиза или с помощью фтороводорода. Омыление сложноэфирных функций осуществляют с помощью раствора гидроксида натрия или гидроксида лития в спирте, таком, как метанол или этанол. Трет-бутиловые сложные эфиры омыляют с помощью кислот, таких, как, например, трифторуксусная кислота.
Взаимодействие с сульфонилхлоридами R1-SO2Cl в присутствии органического основания, такого как триэтиламин, пиридин или N,N-диизопропилэтиламин, осуществляют в органических растворителях, таких как, например, метиленхлорид, тетрагидрофуран или диметилформамид. В случае свободных карбонильных групп взаимодействие осуществляют в присутствии водных растворов гидроксида или карбоната щелочного металла.
Амидины получают из нитрилов в качестве предшественников путем классического синтеза Пиннера или предпочтительно путем модифицированного синтеза Пиннера, который протекает через образование солей сложных иминотиоэфиров в качестве промежуточной стадии. Каталитическое гидрирование N-гидроксиамидинов, которые получают путем присоединения гидроксиламина к цианогруппе, в присутствии никеля Ренея, соответственно, палладия-на-угле, в спиртах в качестве растворителей также приводит к амидинам.
Как уже указывалось выше, предлагаемые соединения общей формулы (I) обладают ингибирующей тромбин активностью, и поэтому их можно применять для лечения и профилактики всех заболеваний, при которых играет роль тромбин. Это особенно тромбоэмболические заболевания, такие как инфаркт миокарда, периферический облитерирующий эндартериит, глубокий венозный тромбоз, амболия легочной артерии и инсульт. Кроме того, их можно применять для предотвращения повторной окклюзии после вскрытия артериальных сосудов механическими методами или за счет лизиса.
Предлагаемые соединения общей формулы (I) можно вводить обычным образом перорально или парентерально (подкожно, внутривенно, внутримышечно, интраперитонеально, ректально). Их можно также вводить с помощью паров или аэрозолей через носоглотку.
Дозировка зависит от возраста, состояния здоровья и массы пациента, а также от формы применения. Как правило, суточная доза активного вещества на человека составляет примерно от 10 до 2000 мг при пероральном введении и примерно от 1 до 200 мг при парентеральном введении. Эту дозу можно вводить в виде от двух до четырех разовых доз или один раз в день в форме пролонгированного действия.
Новые соединения можно применять в обычных, твердых или жидких, готовых лекарственных формах, таких как, например, таблетки, капсулы, порошки, грануляты, драже, суппозитории, растворы, мази, кремы и аэрозоли. Их получают обычным образом. Активные вещества при этом можно переводить в лекарственные формы с помощью обычных галеновых вспомогательных средств, таких как связующие для таблеток, наполнители, консерванты, разрыхлители для таблеток, регуляторы текучести, мягчители, смачиватели, диспергаторы, эмульгаторы, растворители, способствующие замедлению выделения активного вещества средства, антиоксиданты и/или рабочие газы. Таким образом, полученные готовые лекарственные формы содержат активное вещество обычно в количестве от 0,1 до 99 мас.%.
Получение предлагаемых соединений обшей формулы (I) поясняется следующими примерами, в которых используют следующие условные сокращения: Boc = трет-бутоксикарбонил, Phe = фенилаланил, Pro = пролин, MC = масс-спектр.
Пример 1
Ацетат N-изопропилсульфонил-D-фенилаланилпролин-(п-амидинобензил)амида
а) Вос-0-фенилаланилпролин-(п-цианобензил)амид.
К раствору 5,1 г (14,2 ммоль) Boc-D-Phe-Pro-OH и 1,53 г (15,2 ммоль) N-метил-морфолина в 15 мл диметилформамида при температуре -15oC и в течение двух минут добавляют 2,0 г (14,6 ммоль) изобутилового эфира хлормуравьиной кислоты, дополнительно перемешивают в течение десяти минут и затем добавляют раствор 1,9 г (14,2 ммоль) п-цианобензиламина (и 1,53 г N-метилморфолина в 3 мл диметилформамида. После перемешивания дополнительно в течение трех часов при температуре -15oC согласно контролю с помощью тонкослойной хроматографии (смесь метилен-хлорида с метанолом в соотношении 9:1) более не обнаруживают никаких исходных соединений.
Для выделения целевого продукта реакционную смесь выливают в 200 мл воды, причем выделяется масло, которое спустя непродолжительное время затвердевает, и после размельчения продукт отфильтровывают под вакумом. Еще влажный остаток растворяют в смеси из 250 мл этилацетата и 50 мл диэтилового эфира и полученный раствор промывают последовательно с помощью пятипроцентного водного раствора лимонной кислоты, раствора гидрокарбоната натрия и насыщенного раствора хлорида натрия. После высушивания над сульфатом натрия растворитель отгоняют в вакууме, остаток смешивают с н-гексаном и затем отфильтровывают под вакуумом. После перекристаллизации из 50 мл этилацетата получают 5,6 г чистого, согласно тонкослойной хроматографии, продукта.
Температура плавления от 156 до 157oC.
б) D-фенилаланилпролин-(п-цианобензил)амидгидрохлорид.
Вышеполученное соединение растворяют в 100 мл 5 н. соляной кислоты и перемешивают в течение трех часов при комнатной температуре, причем осаждается гидрохлорид. Его отфильтровывают под вакуумом, промывают не содержащим хлороводорода диэтиловым эфиром и сушат в вакууме над гидроксидом калия. Получают 4,6 г (95% от теоретически рассчитанного количества) кристаллов белого цвета.
Температура плавления от 220 до 222oC.
в) N-изопропилсульфонил-D-фенилаланилпролин-(п-цианобензил)амид.
2,05 г (6,05 ммоль) вышеполученного гидрохлорида суспендируют в 50 мл метиленхлорида. После добавления 1,35 г (13,5 ммоль) триэтиламина образуется раствор, в который при температуре от 0 до 5oC прикапывают раствор 0,9 г (6,1 ммоль) хлорангидрида пропан-2-сульфокислоты в 10 мл метиленхлорида. Реакционную смесь дополнительно перемешивают в течение пяти часов при комнатной температуре и затем встряхивают с водой, пятипроцентным раствором лимонной кислоты и пятипроцентным раствором гидрокарбоната натрия. Полученный после высушивания над сульфатом натрия и отгонки растворителя вязкий маслянистый остаток выкристаллизовывают из смеси этилацетата с диэтиловым эфиром в соотношении 1:1.
г) N-изопропилсульфонил-D-фенилаланилпролин-(п-тиоамидинобензил)амид.
4,1 г вышеполученного соединения и 4 мл триэтиламина растворяют в 40 мл пиридина, при температуре 0oC насыщают полученный раствор сероводородом и выдерживают в течение ночи при комнатной температуре. Согласно контролю с помощью тонкослойной хроматографии (смесь метиленхлорида с метанолом в соотношении 9:1) превращение в тиоамид происходит полностью. С целью выделения целевого продукта пиридин отгоняют в вакууме, остаток обрабатывают 250 мл зтилацетата и полученный раствор промывают раствором хлорида натрия, пятипроцентным раствором лимонной кислоты и раствором гидрокарбоната натрия. После высушивания и отгонки растворителя получают 4,1 г чистого кристаллического тиоамида.
д) Ацетат N-изопропилсульфонил-D-фенилаланилпролин-(п-амидинобензил)амида.
Тиоамид растворяют в 150 мл ацетона и после добавления 7 мл метилиодида выдерживают в течение ночи при комнатной температуре. Полученный после удаления растворителя аморфный остаток перемешивают с безводным диэтиловым эфиром и затем высушивают. Гидроиодид метилового эфира S-метил-тиоимидо-кислоты растворяют в 50 мл этанола, смешивают с 15 мл десятипроцентного раствора ацетат аммония и в течение трех часов нагревают при 60oC. Для выделения целевого продукта растворитель удаляют, остаток растворяют в 100 мл метиленхлорида, нерастворимые составные части отфильтровывают и затем отгоняют метиленхлорид. Путем настаивания со смесью этилацетата с диэтиловым эфиром отделяют растворимые в этой смеси примеси. Полученную иодид-ацетатную смешанную соль растворяют в смеси ацетона с водой в соотношении 3:2 и с помощью ионообменной смолы марки IRA в ацетатной форме переводят в чистый ацетат, который после нагревания в ацетонитриле представляет собой кристаллический порошок белого цвета.
Температура плавления от 148 до 152oC (при разложении); МС (бомбардировка быстрыми атомами): (М+ H+) = 500.
Пример 2
Ацетат N-(тиенилсульфонил)-D-фенилаланилпролин-(п-амидинобензил)амида
а) Вос-D-фенилаланилпролин-(п-амидинобензил)амид.
Вос-D-фенилаланилпролин-(п-цианобензил)амид (получение см. пример 1 a)) согласно методике примера 1 в) с помощью сероводорода переводят в тиоамид и затем согласно методике примера 1 г) превращают в амидин. Амидин получают в форме кристаллов белого цвета.
Температура плавления от 237 до 239oC;
МС (бомбардировка быстрыми атомами): (M-H+) = 347.
б) D-фенилаланилпролин-(п-амидинобензил)амиддигидрохлорид.
Согласно методике примера 1 б), от вышеполученного соединения с помощью 5 н. раствора хлороводорода в диоксане отщепляют Вос-защитную группу. Дигидрохлорид получают в виде очень гигроскопичного порошка.
Температура плавления от 130 до 140oC;
МС (бомбардировка быстрыми атомами): (M-H+) = 247.
в) Ацетат N-(тиенилсульфонил)-D-фенилаланилпролин-(п-амидинобензил)амида.
Раствор 3,9 г (12,6 ммоль) N-фенилсульфонил-D-фенилаланина в 40 мл тетрагидрофурана, после добавления 1,9 г (12,6 ммоль) 1-гидроксибензотриазола и 3,3 г (25 ммоль) дициклогексилкарбодиимида, перемешивают в течение четырех часов при комнатной температуре. Выпавшую в осадок мочевину отфильтровывают под вакуумом и дополнительно промывают небольшим количеством тетрагидрофурана.
При температуре 5oC к этому фильтрату добавляют раствор 4,1 г (12,6 ммоль) N-(п-амидинобензил)пролинамидгидрохлорида и 1,6 г гидрокарбоната натрия в 6 мл воды. После перемешивания в течение сорока восьми часов при комнатной температуре растворитель отгоняют, остаток обрабатывают этанолом, отфильтровывают от нерастворимых составных частей и снова концентрируют.
Остаток очищают на колонке с силикагелем с помощью смеси метиленхлорида с метанолом и пятидесятипроцентной уксусной кислотой в соотношении 45:5:1,5. Из элюата однородных фракций отгоняют растворители, к концу с толуолом в качестве добавки, и остаток перекристаллизуют из 50 мл ацетона при добавке небольшого количества воды. Выделяют 3,3 г (48% от теоретически рассчитанного количества) амидинацетата в виде кристаллов белого цвета.
Температура плавления от 95 до 98oC;
МС (бомбардировка быстрыми атомами): (M-H+) = 540,5.
Пример 3
Ацетат N-(2-нафтилсульфонил)-D-фенилаланилпролин-(п-амидинобензил)амида
а) Boc-пролин-(п-цианобензил)амид.
276 г (0,88 ммоль) Boc-Pro-оксисукцинимида при 0oC растворяют в двух литрах метиленхлорида. К этому раствору затем добавляют 163,9 г (0,97 моль) 4-циано-бензиламингидрохлорида и 230 мл (1,34 моль) диизопропилэтиламина. Суспензию перемешивают в течение сорока восьми часов на бане с тающим льдом и затем отфильтровывают. Фильтрат экстрагируют четырехкратно с помощью двадцатипроцентного раствора гидросульфата натрия, трехкратно с помощью насыщенного раствора гидрокарбоната натрия и двукратно с помощью насыщенного раствора хлорида натрия, сушат и растворитель удаляют в ротационном испарителе. После перекристаллизации остатка из метил-трет-бутилового эфира получают 261 г (90% от теоретически рассчитанного количества) кристаллов белого цвета.
Температура плавления от 124 до 125oC.
б) N-(4-цианобензил)пролинамидгидрохлорид.
260 г (0,79 моль) вышеполученного соединения с Boc-защитной группой растворяют в одном литре диэтилового эфира и после добавления избытка эфирного раствора хлороводорода перемешивают в течение ночи. Выпавший в осадок гидрохлорид отфильтровывают, промывают не содержащим хлороводорода диэтиловым эфиром и затем перекристаллизуют из этанола. Получают 200 г (95% от теоретически рассчитанного количества) кристаллов белого цвета.
Температура плавления от 209 до 211oC.
в) N-(2-нафтилсульфонил)-D-фенилаланилпролин-(п-цианобензил)амид.
5,9 г (21,3 ммоль) вышеполученного пролинамидгидрохлорида растворяют в 100 мл диметилформамида и последовательно смешивают с 7,8 г (21,3 ммоль) N-(2-нафтилсульфонил)-D-фенилаланина, 2,15 г (21,3 ммоль) триэтиламина и 3,25 г (21,3 ммоль) 1-гидроксибензотриазола. При температуре от 0 до 5oC и при перемешивании добавляют раствор 4,4 г (21,3 ммоль) дициклогексилкарбодиимида в 30 мл этилацетата и затем перемешивают в течение сорока восьми часов при комнатной температуре. После отфильтровывания под вакуумом выпавшей в осадок мочевины растворитель отгоняют в вакууме, остаток растворяют в 200 мл этилацетата и последовательно промывают полученный раствор с помощью пятипроцентного раствора гидрокарбоната натрия, четырехпроцентного раствора лимонной кислоты и водой. Полученный после высушивания и отгонки этилацетата маслянистый остаток растворяют в 30 мл метиленхлорида и выкристаллизовывают путем добавления 50 мл диэтилового эфира. Получают 9,1 г (76% от теоретически рассчитанного количества) целевого соединения.
г) Ацетат N-(2-нафтилсульфонил)-D-фенилаланилпролин-(п-амидинобензил)амида.
В отсутствие влаги и при температуре 0oC 80 мл метанола насыщают газообразным хлороводородом, затем в нем растворяют 5,6 г (10 ммоль) вышеполученного соединения и выдерживают при температуре 0oC в течение сорока восьми часов. После этого растворитель удаляют при температуре 20oC, остаток растворяют в 20 мл метанола и при температуре от 0 до 5oC полученный раствор добавляют к 80 мл насыщенного метанольного раствора аммиака. После кипячения с обратным холодильником в течение трех часов охлажденный раствор фильтруют, растворитель отгоняют и остаток с помощью ионообменной смолы в ацетатной форме переводят в амидинацетат. После перекристаллизации из ацетона при добавке небольшого количества воды получают 5,1 г (80%) целевого соединения в виде кристаллов белого цвета.
Температура плавления от 221 до 225oC;
МС (бомбардировка быстрыми атомами): (M+H+) = 584,5.
Пример 4
Ацетат N-(пиридилсульфонил)-D-фенилаланилпролин-п-амидинобензил)амида
а) N-(3-пиридилсульфонил)-D-фенилаланилпролин-(п-цианобензил)амид.
Согласно методике примера 1 в), D-фенилаланилпролин-(п-цианобензил)амидгидрохлорид (получение согласно методике примера 1 а) и 1 б)) вводят во взаимодействие с хлорангидридом пиридин-3-сульфокислоты. Rf составляет 0,57 (смесь метиленхлорида с метанолом в соотношении 9:1).
б) Ацетат N-(3-пиридилсульфонил)-D-фенилаланилпролин-(п-гидроксиамидинобензил)амида.
2 г вышеполученного соединения, 0,74 г гидроксиламингидрохлорида и 2,2 г триэтиламина растворяют в 30 мл этанола и перемешивают в атмосфере азота в течение двух часов при температуре от 60 до 70oC. После этого, согласно контролю с помощью тонкослойной хроматографии, более не обнаруживают никаких исходных веществ. Реакционную смесь смешивают с водой и с помощью ледяной уксусной кислоты устанавливают значение pH, равное 3-4. Водную фазу многократно экстрагируют метиленхлоридом, объединенные метиленхлоридные экстракты сушат и метиленхлорид отгоняют. Остаток, который еще содержит уксусную кислоту, прямо используют в последующей реакции.
Rf составляет 0,1 (смесь метиленхлорида с метанолом в соотношении 9:1).
в) Ацетат N-(3-пиридилсульфонил)-D-фенилаланилпролин-(п-амидинобензил)амида
Раствор 2,4 г (5 ммоль) вышеполученного соединения в 40 мл метанола гидрируют в присутствии 0,4 г 10%-ного палладия-на-угле в течение семи часов при температуре 50oC. Затем катализатор отфильтровывают под вакуумом, растворитель отгоняют и остаток смешивают с этилацетатом и нагревают. Вследствие добавления ацетона и небольшого количества воды образуется прозрачный раствор, из которого при охлаждении выкристаллизовывается амидацетат. Получают 1,3 г (49,5% от теоретически рассчитанного количества) порошка белого цвета.
Температура плавления от 201 до 202oC;
Rf составляет 0,28 (смесь метиленхлорида с метанолом и пятидесятипроцентной уксусной кислотой в соотношении 8:2:0,5).
Пример 5
Ацетат N-(2-нафтилсульфонил)глицилпролин-(п-амидинобензил)амида
а) Boc-глицилпролин-(п-цианобензил)амид
К раствору 7,0 г (40 ммоль) Boc-глицина в 240 мл метиленхлорида при температуре 0oC последовательно добавляют 30 мл диизопропилэтиламина, 10,6 г (40 ммоль) N-(п-цианобензил)пролиламидгидрохлорида и 32 мл (44 ммоль) ангидрида пропанфосфоновой кислоты (50%-ный раствор в этилацетате). После перемешивания дополнительно в течение двух часов при температуре 0oC органическую фазу промывают с помощью 1 н. раствора гидроксида натрия, водой и насыщенным раствором хлорида натрия, сушат и растворитель отгоняют. Получают 14,8 г (96% от теоретически рассчитанного количества) порошка белого цвета.
Rf составляет 0,57 (смесь метиленхлорида с метанолом в соотношении 9:1).
1H-ЯМР (дейтерированный диметилсульфоксид), d в м. д. : 1,4 (с, 9Н, (CH3)3); 1,7 - 2,2 (м, 4Н, CH2 - CH2); 3,3 - 3,6 (м, 2Н, N-CH2 пролина); 3,8 (м, 2Н, N-CH2 глицина); 4,3 - 4,5 (м, 3Н, CH и N-CH2-Ar); 6,8 (м, 1Н, Boc-); 7,4 - 7,5 (м (кажущийся триплет из-за второго геометрического изомера), 2Н, Ar - H); 7,8 (д, 2Н, Ar - H); 8,5 и 8,8 (в каждом случае мультиплет, образуют вместе 1H (два геометрических изомера), NH).
б) Гидрохлорид N-глицилпролин-(п-цианобензил)амида.
Согласно методике примера 1 б), от вышеполученного соединения отщепляют Boc-группу. Получают 8 г (64% от теоретически рассчитанного количества) порошка белого цвета.
1H-ЯМР (дейтерированный диметилсульфоксид), d в м.д.: 1,7 - 2,2 (м, 4Н, CH2 - CH2); 3,4 - 4,0 м, 4Н, N-CH2 пролина и глицина); 4,2 - 4,5 (м, 3Н, CH и N-CH2-Ar); 7,5 (д, 2Н, Ar); 7,8 (д, 2Н, Ar); 8,3 (уш. с, 3Н, NH3 +); 8,9 - 9,2 (в каждом случае м, образуют вместе 1H (два геометрических изомера), NH).
в) N-(2-нафтилсульфонил)глицилпролин-(п-цианобензил)амид.
Согласно методике примера 1 в), из вышеполученного соединения за счет его взаимодействия с 2-нафтилсульфонилхлоридом получают 3,3 г порошка белого цвета.
Rf составляет 0,59 (смесь метиленхлорида с метанолом в соотношении 9:1).
1H-ЯМР (дейтерированный диметилсульфоксид), d в м.д.: 1,6-2,0 (м, 4Н, CH2 - CH2); 3,3 - 3,5 м, 2Н, N-CH2 пролина); 3,7 м, 2Н, N-CH2 глицина); 4,1 - 4,4 (м, 3Н, CH и N-CH2-Ar); 7,4 - 8,5 (13Н, ароматические протоны и 2NH).
г) N-(2-нафтилсульфонил)глицилпролин-(п-тиоамидобензил)амид.
Вышеполученное соединение согласно методике примера 1 г) переводят в тиоамид. Получают 3,0 г (85% от теоретически рассчитанного количества) желтоватого порошка.
1H-ЯМР (дейтерированный диметилсульфоксид), d в м.д.: 1,5-2,0 (м, 4Н, CH2 - CH2); 3,3 - 3,5 (м, 2Н, N-CH2 пролина); 3,7 (м, 2Н, N-CH2 глицина); 4,1- 4,4 (м, 3Н, CH и N-CH2-Ar); 9,5 (с, 1Н, тиоамид); 9,8 (с, 1Н, тиоамид).
д) Ацетат N-(2-нафтилсульфонил)глицилпролин-(п-амидинобензил)амида.
Целевое соединение получают согласно методике примера 1 д). Выделяют 2,5 г (68% от теоретически рассчитанного количества) гидроиодида [Rf составляет 0,09 смесь метиленхлорида с метанолом в соотношении 9:1)] и затем с помощью ионообменной смолы в ацетатной форме (амберлит) переводят в ацетат. Чистота, согласно высокоэффективной жидкостной хроматографии, составляет 99%.
МС (бомбардировка быстрыми атомами): (M-H+) = 493,5.
1H-ЯМР (дейтерированный диметилсульфоксид), d в м.д.: 1,6 - 2,0 (м, 4Н, CH2 - CH2); примерно 3,5 (м, 2Н, N-CH2 пролина, частично перекрытый сигналом H2O); 3,7 (м, 2Н, N-CH2 глицина); 4,1 - 4,4 (м, 3Н, CH и N-CH2-Ar); 7,3 - 8,5 (13Н, ароматические протоны и NH); примерно 8,4 - 9,2 (4Н, амидин).
Пример 6
N-(1-нафтилсульфонил)глицилпролин-(п-амидинобензил)амид
Целевое соединение получают согласно методике примера 5 при использовании 1-нафтилсульфонилхлорида.
МС (бомбардировка быстрыми атомами): (M-H+) = 493.
Пример 7
Ацетат N-(н-гексадецилсульфонил)-D-фенилаланилпролин-п-амидинобензил)амида
Целевое соединение получают согласно методике примера 1 в виде порошка белого цвета.
Температура плавления от 194 до 201oC;
МС (бомбардировка быстрыми атомами): (M-H+) = 695.
Пример 8
Ацетат N-(н-бутилсульфонил)-D-фенилаланилпролин-(п-амидинобензил)амида
Целевое соединение получают согласно методике примера 1 в виде порошка белого цвета.
Температура плавления от 203 до 211oC;
МС (бомбардировка быстрыми атомами): (M-H+) = 526,5.
Пример 9
Ацетат N-(изопропиламиносульфони)-D-фенилаланилпролин-(п-амидинобензил)амида
а) N-(изопропиламиносульфонил)-D-фенилаланилпролин-(п-цианобензил)амид.
Согласно методике примера 1 в), D-фенилаланилпролин-(п-цианобензил)амид-гидрохлорид вводят во взаимодействие с хлорангидридом изопропиламиносульфокислоты.
б) N-(изопропиламиносульфонил)-D-фенилаланилпролин-(п-гидроксиамидинобензил)амид.
Целевое соединение получают согласно методике примера 4 б) путем взаимодействия соединения примера 9 а) с гидроксиламингидрохлоридом.
в) Ацетат N-(изопропиламиносульфонил)-D-фенилапанилпролин-(п-амидинобензил)амида.
Гидрирование соединения примера 9 б) осуществляют в смеси метанола с ледяной уксусной кислотой и тетрагидрофураном в качестве растворителя в присутствии палладия-на-угле при температуре 40oC в течение тринадцати часов. Затем катализатор отфильтровывают под вакуумом, раствор концентрируют в вакууме, многократно перегоняют вместе с этанолом, остаток обрабатывают водой, водную фазу экстрагируют трижды с помощью этилацетата и затем водную фазу, которая содержит целевой продукт, лиофилизируют. Получают твердое вещество белого цвета.
Температура плавления от 199 до 205oC;
МС (бомбардировка быстрыми атомами): (М+H+)= 515.
Пример 10
Ацетат N-(диметиламиносульфонил)-D-фенилаланилпролин-(п-амидинобензил)амида
Целевое соединение получают согласно методике примера 9 в виде твердого вещества белого цвета, которое разлагается начиная с температуры 90oC.
МС (бомбардировка быстрыми атомами): (М+H+) = 501.
Пример 11
N-гидроксисульфонил-D-фенилаланилпролин-(п-амидинобензил)амид
К раствору 1,8 г (4,36 ммоль) гидрохлорида D-фенилаланилпролин-(п-цианобензил)амида и 1,68 г (13,0 ммоль) диизопропилэтиламина в 20 мл метиленхлорида медленно, при температуре 20oC и при охлаждении, прикапывают раствор 0,58 г (0,33 мл, 5 ммоль) хлорсульфоновой кислоты в 10 мл метиленхлорида. После перемешивания в течение тридцати минут при комнатной температуре разбавляют до объема 100 мл с помощью метиленхлорида, после чего экстрагируют сначала с помощью 2 н. соляной кислоты, затем дважды по 10 мл водой, органическую фазу сушат над сульфатом магния и концентрируют в вакууме в ротационном испарителе. Получают 2,0 г N-гидроксисульфонил-D-фенилаланилпролин-(п-цианобензил)амида в виде сырого продукта, который без дальнейшей очистки вводят в последующую реакцию.
2,0 г указанного сырого продукта вместе с 0,9 г (13 ммоль) гидроксиламингидрохлорида и 2,5 мл диизопропиламина в 50 мл этанола перемешивают в течение ночи при комнатной температуре, затем концентрируют и летучие составные части удаляют в высоком вакууме в течение одного часа при температуре 50oC. На основании высокой водорастворимости продукта экстрактивная обработка невозможна. Сырой продукт (1,8 г) прямо используют в последующем гидрировании.
Гидрирование сырого продукта осуществляют при слегка повышенном давлении водорода в смеси из 40 мл метанола и 5 мл ледяной уксусной кислоты в присутствии добавленного на кончике шпателя 10%-ного палладия-на-угле при температуре 50oC. Спустя пять с половиной часов катализатор отфильтровывают, раствор концентрируют в вакууме в ротационном испарителе и многократно перегоняют вместе с метанолом и толуолом. После многократного перемешивания полученного продукта с метиленхлоридом получают 1,5 г (73% от теоретически рассчитанного количества через три стадии) чистого N-гидроксисульфонил-D-фенилаланилпролин-(п-амидинобензил)амида, который согласно ЯМР находится в виде бетаина. Порошок белого цвета.
Температура плавления от 220 до 224oC;
МС (бомбардировка быстрыми атомами): (M-H+) = 474.
Аналогично примерам 1-11 получают еще следующие соединения.
Пример 12
Ацетат N-трифторметилсульфонил-D-фенилаланилпролин-(п-амидинобензил)амида
Кристаллы белого цвета.
Температура плавления от 240 до 242oC (при разложении);
МС (бомбардировка быстрыми атомами): (М - H+) = 526.
Пример 13
Ацетат N-(β,β,β -трифторэтилсульфонил)-D-фенилаланилпролин-(п-амидинобензил)амида
Кристаллы белого цвета.
Температура плавления от 87 до 89oC;
MС (бомбардировка быстрыми атомами): (M-H+) = 540.
Пример 14
Ацетат N-(н-октилсульфонил)-D-фенилаланилпролин-(п-амидинобензил)амида
Кристаллы белого цвета.
МС (бомбардировка быстрыми атомами): (M-H+) = 570.
Пример 15
Ацетат N-метилсульфонил-(D,L)-дифенилаланилпролин-(п-амидинобензил)амида
Кристаллы белого цвета.
МС (бомбардировка быстрыми атомами): (M-H+) = 548.
Пример 16
Ацетат N-метилсульфонил-ди(4-хлорфенил)аланилпролин-(п-амидинобензил)амида
Кристаллы белого цвета.
МС (бомбардировка быстрыми атомами): (M-H+) = 617.
Пример 17
Ацетат N-метилсульфонил-(D)-циклогексоланил-дегидролин-(п-амидинобензил)амид
МС (бомбардировка быстрыми атомами): 476 (M-H). Белые аморфные кристаллы;
Пример 18
Ацетат N-метилсульфонил-(D)-циклогексоланил-пролин-(п-амидинобензил)амид.
МС (бомбардировка быстрыми атомами): 478 (M-H). Белые аморфные кристаллы.
Пример 19
Ацетат N-метилсульфонил-(D)-циклогексолглицил-пролин-(п-амидинобензил)амид.
МС (бомбардировка быстрыми атомами): 464 (M-H). Белые аморфные кристаллы.
Пример 20
Ацетат N-бензилсульфонил-(L)-фенилаланил-пролин-(п-амидинобензил)амид
МС (бомбардировка быстрыми атомами): 548 (M-H). Белые аморфные кристаллы.
Пример 21
Ацетат (п-амидинобензил)амида N-метилсульфонил-(D)-циклогексолаланил-пипеколиновой кислоты.
МС (бомбардировка быстрыми атомами): 492 (M-H). Белые аморфные кристаллы.
Пример 22
Ацетат (п-амидинобензил)амида N-метилсульфонил-(D)-циклогексолаланил-ацетидин-2-карбоновой кислоты.
МС (бомбардировка быстрыми атомами): 462 (M-H). Белые аморфные кристаллы.
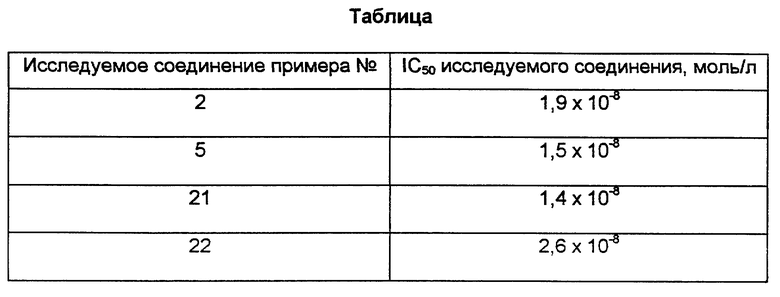
Биологическая активность предлагаемых соединений формулы (I) подтверждается следующим опытом.
Опыт
Ингибирующая тромбин активность
10 мкл раствора исследуемого соединения в диметилсульфоксиде или же 10 мкл диметилсульфоксида добавляли к 250 мкл буферного раствора (50 ммоль/л трис, 154 ммоль/л хлористого натрия, pH 8,0), содержащего тромбин, выделенный из плазмы человека, до конечной концентрации 0,1 ед. ингибитора/мл и инкубировали при температуре 20-28oC в течение 5 минут. Опыт, который проводился в микротировых пластинках с 96 углублениями, инициировали добавлением 50 мкл раствора исследуемого соединения в буфере (конечная концентрация: 100 мкмоль/л) и прекращали после 5-минутной инкубации при 20-28oC добавлением 50 мкл 35%-ной лимонной кислоты. Абсорбцию при 405/630 нм в каждом углублении определяли по сравнению с контрольным опытом. По полученным при этом результатам определяли концентрацию исследуемого соединения в моль/л, требуемую для 50%-ного ингибирования амидолитической активности тромбина (концентрация IC50).
Результаты опыта сведены в таблицу.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОРЫ ТРОМБИНА И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ИХ ПОЛУЧЕНИЯ | 1995 |
|
RU2172741C2 |
| ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ АМИДИНЫ, ОБЛАДАЮЩИЕ СВОЙСТВАМИ ИНГИБИТОРОВ ТРОМБИНА, СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ ПЯТИЧЛЕННОГО ГЕТЕРОЦИКЛИЧЕСКОГО АМИДИНА, В КАЧЕСТВЕ СОСТАВНОЙ ЧАСТИ ИНГИБИТОРОВ СЕРИНПРОТЕАЗЫ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1997 |
|
RU2175328C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 3-ПИРРОЛИН-2-КАРБОНОВОЙ КИСЛОТЫ | 1997 |
|
RU2199529C2 |
| ПРОИЗВОДНЫЕ N-ЗАМЕЩЕННОГО 3-АЗАБИЦИКЛО[3.2.0]ГЕПТАНА | 1994 |
|
RU2136678C1 |
| ПРОИЗВОДНЫЕ БИСНАФТАЛИМИДА И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ КИСЛОТНО-АДДИТИВНЫЕ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ, ИХ СОДЕРЖАЩАЯ | 1994 |
|
RU2138484C1 |
| ГЕКСАГИДРОПИРИДОИЗОХИНОЛИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ДИПЕПТИДИЛПЕПТИДАЗЫ IV (DPP-IV) | 2004 |
|
RU2339636C2 |
| НОВЫЕ КЕТОБЕНЗАМИДЫ | 1997 |
|
RU2190599C2 |
| ПРОТИВООПУХОЛЕВЫЕ ПЕПТИДЫ | 1996 |
|
RU2182911C2 |
| ПРОИЗВОДНЫЕ КАРБОНОВОЙ КИСЛОТЫ | 1996 |
|
RU2175315C2 |
| ПРОИЗВОДНЫЕ N-ЗАМЕЩЕННЫХ 3-АЗАБИЦИКЛО(3.2.0) ГЕПТАНОВ | 1995 |
|
RU2160254C2 |
Описываются новые производные дипептидных п-амидинобензиламидов с N-концевыми остатками общей формулы I, в которой R-алкил с 1-20 атомами углерода, фторалкил с 1-3 атомами углерода, арилалкил с 1-10 атомами углерода в алкильной части, арил, гетероарил, представляющий собой пяти- или шестичленный ароматический цикл, содержащий один гетероатом из числа азота и серы, гидроксил или R2R3N, где R2 и R3 являются одинаковыми или разными и означают водород, алкил с 1-10 атомами углерода, А означает остаток α-аминокислоты формулы II, где R4 означает водород, циклоалкил с 3-7 атомами углерода или арил, R5 означает водород, циклоалкилалкил с 3-7 атомами углерода в циклоалкильной части и 1-3 атомами углерода в алкильной части, арилалкил с 1-3 атомами углерода в алкильной части, В означает остаток циклической α-аминокислоты формулы III, где m означает число 2, 3 или 4, при этом если m означает 3 или 4, то два соседних атома водорода могут быть заменены двойной связью, или их соли с физиологически приемлемыми кислотами. Соединения формулы I обладают биологической активностью, в частности ингибирующей тромбин активностью. 1 з.п. ф-лы, 1 табл.
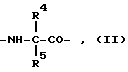
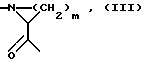

в которой R1-алкил с 1 - 20 атомами углерода, фторалкил с 1 - 3 атомами углерода, арилалкил с 1 - 10 атомами углерода в алкильной части, арил, гетероарил, представляющий собой пяти- или шестичленный ароматический цикл, содержащий один гетероатом из числа азота и серы, гидроксил или R2R3N, где R2 и R3 являются одинаковыми или разными и означают водород, алкил с 1 - 10 атомами углерода;
A означает остаток α-аминокислоты формулы II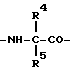
где R4 означает водород, циклоалкил с 3 - 7 атомами углерода или арил;
R5 означает водород, циклоалкилалкил с 3 - 7 атомами углерода в циклоалкильной части и 1 - 3 атомами углерода в алкильной части, арилалкил с 1 - 3 атомами углерода в алкильной части;
B означает остаток циклической α-аминокислоты формулы III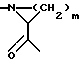
где m означает число 2, 3 или 4, при этом, если m означает 3 или 4, то два соседних атома водорода могут быть заменены двойной связью,
или их соли с физиологически приемлемыми кислотами.
| Способ получения @ -арилсульфонил- @ -аргининамида или его солей | 1978 |
|
SU1181539A3 |
| Устройство для испытания угольных столбов сопротивления | 1977 |
|
SU672658A1 |
| Устройство для непрерывной контактной печати фотографических фонограмм 16 и 8 мм фильмокопий | 1977 |
|
SU669317A1 |
| Нагнетатель | 1976 |
|
SU601459A1 |
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| Экономайзер | 0 |
|
SU94A1 |
Авторы
Даты
2000-07-20—Публикация
1995-11-25—Подача