Изобретение относится к новым производным хинолина, к способам их получения и их использованию в медицине.
Пептид млекопитающих Нейрокинин B (NKB) принадлежит к семейству пептида Тахикинина (ТК), которое включает также Вещество P (SP) и Нейрокинин A (NKA). Фармакологические и молекулярно-биологические свидетельства показали существование трех подтипов ТК рецептора (NK1, NK2 и NK3), и NKB связывается предпочтительно с NK3 рецептором, хотя он также распознает и другие два рецептора с более низким сродством (Maggi et al, 1993, J. Auton. Pharmacol., 13, 23 - 93).
Известны селективные пептидные антагонисты NK3 рецептора (Drapeau, 1990 Regul. Pept., 31, 125 - 135) и находки или открытия, связанные с пептидными антагонистами NK3 рецептора, предполагают, что NKB путем активирования NK3 рецептора играет ключевую роль в модуляции неврального входа в верхние дыхательные пути, кожу, спинной мозг и нигро-стриатальные пути (Myers and Undem, 1993, J. Phisiol., 470, 665 - 679; Counture et al., 1993, Regul. Peptides, 46, 426 - 429; Mccarson and Krause, 1994, J. Neurosci., 14(2), 712 - 720; Arenas et al., 1991, J. Neurosci., 11, 2332-8).
Однако, пептидно-подобный характер известных антагонистов заставляет их, вероятно, быть слишком лабильными с метаболической точки зрения, чтобы служить в качестве практических терапевтических агентов.
В настоящее время изобретатели обнаружили новый класс селективных непептидных NK3 антагонистов, которые являются гораздо более стабильными с метаболической точки зрения, чем известные пептидные антагонисты NK3 рецептора, и представляют потенциальную терапевтическую полезность или применимость при лечении легочных расстройств (астмы, хронических обструктивных легочных заболеваний -COPD-, гиперреактивности дыхательных путей, кашля), кожных нарушений и зуда или чесотки (например, атопического дерматита и кожных волдырей и красного дермографизма), нейрогенного воспаления и расстройств ЦНС (болезни Паркинсона, нарушений двигательной способности, беспокойства или страха и психоза). Данные расстройства или нарушения далее здесь называют первичными нарушениями или расстройствами.
Новые антагонисты NK3 настоящего изобретения представляют также потенциальную терапевтическую полезность при лечении конвульсивных расстройств (например, эпилепсии), почечных расстройств, недержания мочи, глазных воспалений, воспалительных болей, расстройств приема пищи (торможения приема пищи), аллергического ринита, нейродегенеративных расстройств (например, болезни Альцгеймера), псориаза, болезни Хантингтона и депрессии (далее называемых здесь вторичными нарушениями).
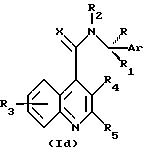
Согласно настоящему изобретению предоставляются соединения, или их сольваты, или соли формулы (I):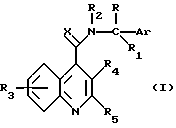
в которой Ar представляет необязательно замещенную фенильную, нафтильную или C5-7циклоалкдиенильную группу или необязательно замещенную одинарную или сконденсированную кольцевую гетероциклическую группу, имеющую ароматический характер, содержащую от 5 до 12 кольцевых атомов и включающую до четырех гетеро-атомов в кольце или в каждом кольце, выбранных из S, О, N;
R представляет линейный или разветвленный C1-8алкил, C3-7циклоалкил, C4-7циклоалкилалкил, необязательно замещенный фенил или фенил C1-6алкил, необязательно замещенное пятичленное гетероароматическое кольцо, включающее до четырех гетероатомов, выбранных из О и N, гидрокси C1-6алкил, амино C1-6алкил, C1-6алкиламиноалкил, ди-C1-6алкиламиноалкил, C1-6ациламиноалкил, C1-6алкоксиалкил, C1-6алкилкарбонил, карбокси, C1-6алкоксикарбонил, C1-6алкоксикарбонил-C1-6алкил, аминокарбонил, C1-6алкиламинокарбонил, ди-C1-6алкиламинокарбонил, галоид C1-6алкил; или представляет группу -(CH2)p-, когда он циклизован с Ar, где p представляет 2 или 3.
R1 и R2, которые могут быть одинаковыми или различными, представляют независимо водород или C1-6 линейный или разветвленный алкил, или вместе образуют группу -(CH2)n-, в которой n представляет 3, 4 или 5; или R1 вместе с R образует группу -(CH2)q-, в которой q представляет 2, 3, 4 или 5.
R3 и R4, которые могут быть одинаковыми или различными, представляют независимо водород, C1-6 линейный или разветвленный алкил, C1-6алкенил, арил, C1-6алкокси, гидрокси, галоген, нитро, циано, карбокси, карбоксамидо, сульфонамидо, C1-6алкоксикарбонил, трифторметил, ацилокси, фталимидо, амино, моно- или ди-C1-6алкиламино, -O(CH2)r-NT2, в которой r представляет 2, 3 или 4, и T представляет водород или C1-6алкил, или он образует с соседним азотом группу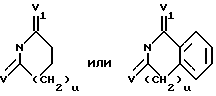
в которой V и V1 представляют независимо водород или кислород, и u представляет 0, 1 или 2; -O(CH2)s-OW2, в которой s представляет 2, 3 или 4, и W представляет водород или C1-6алкил; гидроксиалкил, аминоалкил, моно- или диалкиламиноалкил, ациламино, алкилсульфониламино, аминоациламино, моно- или диалкиламиноациламино; причем в хинолиновом ядре присутствует до четырех R3 заместителей; или R4 представляет группу -(CH2)t, когда он циклизован с R5 в виде арила, в которой t представляет 1, 2 или 3;
R5 представляет линейный или разветвленный C1-6алкил, C3-7циклоалкил, C4-7циклоалкилалкил, необязательно замещенный арил или необязательно замещенную одинарную или сконденсированную кольцевую гетероциклическую группу, имеющую ароматический характер, содержащую от 5 до 12 кольцевых атомов и включающую до четырех гетеро-атомов в кольце или в каждом кольце, выбранных из S, О, N;
X представляет О, S или N-C≡N.
Примерами Ar являются фенил, необязательно замещенный гидрокси, галогеном, C1-6алкокси или C1-6алкилом. Примерами галогена являются хлор и фтор, примером C1-6алкокси является метокси, и примером C1-6алкила - метил.
Примерами Ar как гетероциклической группы являются тиенил и пиридил.
Примерами Ar как C5-7циклоалкдиенильной группы является циклогексадиенил.
Примерами R являются следующие:
C1-8алкил: метил, этил, n-пропил, изо-пропил, n-бутил, гептил;
фенил C1-6алкил: бензил;
гидрокси C1-6алкил: -CH2OH, -CH2CH2OH, CH(Me)OH;
амино C1-6алкил: - CH2NH2;
ди-C1-6алкиламиноалкил: -CH2NMe2;
C1-6алкоксиалкил: - CH2OMe;
C1-6алкилкарбонил: COMe;
C1-6алкоксикарбонил: COOMe;
C1-6алкоксикарбонил C1-6алкил: CH2COOMe;
C1-6алкиламинокарбонил: CONHMe;
ди-C1-6алкиламинокарбонил: CONMe2, CO(1-пирролидинил); галоген C1-6алкил: трифторметил;
-(CH2)p-, когда циклизован с Ar:
Примером R1 и R2 в виде C1-6 алкила является метил; примером R1 вместе с R, образующими группу -(CH2)q-, является спироциклопентан.
Примерами R3 и R4 являются метил, этил, n-пропил, n-бутил, метокси, гидрокси, амино, хлор, фтор, бром, ацетилокси, 2-(диметиламино)этокси, 2-(1-фталоил)этокси, аминоэтокси, 2-(1-пирролидинил)этокси, фталоил, диметиламинопропокси, диметиламиноацетиламино, ацетиламино, диметиламинометил и фенил.
Примерами R5 являются циклогексил, фенил, необязательно замещенный, как это определено выше для Ar; примерами R5 в виде гетероциклической группы являются фурил, тиенил, пиррил, тиазолил, бензофурил и пиридил.
Предпочтительной группой соединений формулы (I) являются соединения, в которых:
Ar представляет фенил, необязательно замещенный C1-6алкилом или галогеном; тиенил или C5-7циклоалкдиенильную группу;
R представляет C1-6алкил, C1-6алкоксикарбонил, C1-6алкилкарбонил, гидрокси C1-6алкил;
R1 и R2 представляют каждый водород или C1-6алкил;
R3 проставляет водород, гидрокси, галоген, C1-6алкокси, C1-6алкил;
R4 представляет водород, C1-6алкил, C1-6алкокси, гидрокси, амино, галоген, аминоалкокси, моно- или диалкиламиноалкокси, моно- или диалкиламиноалкил, фталоилалкокси, моно- или диалкиламиноациламино и ациламино;
R5 представляет фенил, тиенил, фурил, пиррил и тиазолил.
Дополнительную предпочтительную группу соединений формулы (I) составляют соединения, в которых:
Ar представляет фенил, 2-хлорфенил, 2-тиенил или циклогексадиенил;
R представляет метил, этил, n-пропил, -COOMe, -COMe;
R1 и R2 каждый представляет водород или метил;
R3 представляет водород, метокси или гидрокси;
R4 представляет водород, метил, этил, метокси, гидрокси, амино, хлор, бром, диметиламиноэтокси, 2-(1-фталоил)этокси, аминоэтокси, 2-(1-пирролидинил)этокси, диметиламинопропокси, диметиламиноацетиламино, ацетиламино и диметиламинометил;
R5 представляет фенил, 2-тиенил, 2-фурил, 2-пиррил, 2-тиазолил и 3-тиенил; и
X представляет кислород.
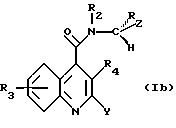
Предпочтительную подгруппу соединений в объеме формулы (I), представленной выше, составляют соединения формулы (Iа):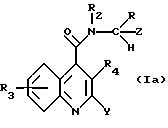
в которой R, R2, R3 и R4 имеют значения, определенные для формулы (I), и Y и Z, которые могут быть одинаковыми или различными, каждый представляет Ar, как он определен для формулы (I).
Особенно предпочтительной группой соединений формулы (Ia) являются соединения формулы (Ib), в которой группа R ориентирована в направлении вниз, и H - вверх.
Соединения формулы (I) или их соли или сольваты представлены предпочтительно в фармацевтически приемлемой или по существу чистой форме. Под фармацевтически приемлемой формой соединений имеются в виду, наряду с другими, соединения фармацевтически приемлемого уровня чистоты, исключая обычные фармацевтические добавки, такие как разбавители и носители, и не включающие вещества, считающиеся токсичными при обычных дозировочных уровнях. По существу чистая форма обычно содержит, по крайней мере, 50% (исключая обычные фармацевтические добавки), предпочтительно 75%, более предпочтительно 90% и еще более предпочтительно 95% соединения формулы (I) или его соли или сольвата. Одну из предпочтительных фармацевтически приемлемых форм составляет кристаллическая форма, включая такую форму в фармацевтической композиции. В случае солей и сольватов дополнительные части - ионная и растворителя также должны быть нетоксичными.
Примеры фармацевтически приемлемых солей соединения формулы (I) включают кислотно-аддитивные соли с обычными фармацевтическими кислотами, например, малеиновой, соляной, бромистоводородной, фосфорной, уксусной, фумаровой, салициловой, лимонной, молочной, миндальной, винной, янтарной, бензойной, аскорбиновой кислотами и метансульфоновой кислотой.
Примеры фармацевтически приемлемых сольватов соединения формулы (I) включают гидраты.
Соединения формулы (I) могут иметь, по крайней мере, один асимметрический центр и поэтому могут существовать в более чем одной стереоизомерной форме. Данное изобретение охватывает все такие формы и их смеси, включая рацематы.
Данное изобретение предоставляет также способ получения соединений формулы (I), который включает реакцию соединения формулы (III)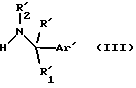
в которой R', R'1, R'2 и Ar' представляют R, R1, R2 и Ar, как они определены для формулы (I), или группу или атом, способные превращаться в R, R1, R2, и Ar, с соединением формулы (II)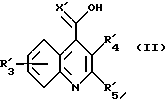
или его активным производным, в которой R'3, R'4, R'5 и X' представляют R3, R4, R5 и X, как они определены для формулы (I), или группу, способную превращаться в R3, R4, R5 и X, с получением соединения формулы (Ic)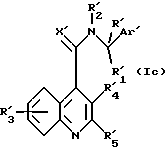
и необязательное выполнение после этого одной или более из следующих стадий:
(а) когда R', R'1 - R'5, Ar' и X' являются иными, чем R, R1-R5, Ar и X, превращение любого одного из R', R'1 - R'5, Ar' и X' в R, R1 - R5, Ar и X с получением соединения формулы (I),
(b) когда R', R'1 - R'5, Ar' и X' представляют R, R1 - R5, Ar и X, превращение любого одного из R, R1 - R5, Ar и X в иной R, R1 - R5, Ar и X с получением соединения формулы (I),
(с) образование соли и/или сольвата полученного соединения формулы (Ic).
Подходящими активными производными соединений формулы (II) являются галоидангидриды кислот (предпочтительно хлорангидриды), азиды кислот или ангидриды кислот. Еще одним подходящим производным является смешанный ангидрид, образованный между кислотой и алкилхлорформиатом; еще одним подходящим производным является активированный сложный эфир, такой как цианометиловый, тиофениловый, n-нитрофениловый, n-нитротиофениловый эфиры, 2,4,6-трихлорфениловый эфир, пентахлорфениловый, пентафторфениловый эфиры, N-гидрокси-фталимидо эфир, N-гидроксипиперидиновый эфир, N-гидроксисукцинимидный эфир, N-гидрокси-бензотриазоловый эфир; или карбокси группа может активироваться с использованием карбодиимида или N,N'-карбонилдиимидазола.
Например, согласно стандартным методам, хорошо известным специалистам в данной области, соединения формулы (III) могут сочетаться:
(а) с хлорангидридом кислоты в присутствии неорганического или органического основания в подходящем апротонном растворителе, таком как диметилформамид (DMF или ДМФ), при температуре в интервале от -70 до 50oC (предпочтительно в интервале от -10 до 20oC),
(b) с кислотой в присутствии подходящего конденсирующего агента, такого как, например, N,N'-карбонилдиимидазол (GDI) или карбодиимид, такой как дициклогексилкарбодиимид (DCC) или N-диметиламинопропил-N'-этилкарбодиимид и N-гидроксибензотриазол (НОВТ), для достижения максимальных выходов и для того, чтобы избежать процессов рацемизации (Synthesis, 453, 1972) в апротонном растворителе, таком как смесь ацетонитрила (MeCN) и тетрагидрофурана (TGF или ТГФ) в соотношении от 1:9 до 7:3 соответственно, при температуре в интервале от -70 до 50oC (предпочтительно в интервале от -10 до 25oC) (см. схему 1),
(с) со смешанным ангидридом, получаемым на месте (ин ситу) из кислоты и алкил (например, изопропил)хлорформиата в подходящем апротонном растворителе, таком как дихлорметан, при температуре в интервале от -70 до 50oC (предпочтительно в интервале от -20 до 20oC). Очевидно, понятно, что соединение формулы (Ic) может превращаться в соединение формулы (I), или одно соединение формулы (I) может превращаться в другое соединение формулы (I) с помощью взаимопревращений подходящих заместителей. Таким образом, некоторые соединения формулы (I) и (Ic) являются полезными промежуточными соединениями при образовании других соединений настоящего изобретения.
Например, R'2 может представлять водород и превращаться в R2 алкильную группу, например, метильную, с помощью общепринятых процедур амидного алкилирования (Zabicky, The chemistry of amides; Interscience, London, 1970, стр. 749). Когда X' представляет кислород, он может превращаться в X серу с помощью стандартных реагентов образования тиоамидов, таких как P2S5 (Chem. Rev. , 61, 45, 1961 или Angew.Chem., 78, 517, 1966) или реагент Lawesson (Tetrahedron, 41, 5061, 1985). Когда Ar' или R'5 представляет метокси-замещенный фенил, он может превращаться в иной Ar' или R'5 гидрокси-замещенный фенил с помощью стандартных приемов деметилирования с использованием кислот Льюиса, таких как трехбромистый бор (Synthesis, 249, 1983), или минеральных кислот, таких как бромистоводородная или иодистоводородная кислота. Когда R представляет алкоксикарбонильную группу, например метоксикарбонильную, он может превращаться в иной R, такой как этоксикарбонил с помощью сложной трансэтерификации соответствующим спиртом при температуре в интервале от 0 до 120oC, карбокси с помощью гидролиза в кислой или основной среде, аминокарбонил, алкиламинокарбонил или диалкиламинокарбонил с помощью трансамидирования аммиаком, первичным амином или вторичным амином в метаноле в качестве растворителя при температуре в интервале от 10 до 120oC, необязательно в присутствии каталитического количества NaCN (J. Org. Chem., 52, 2033, 1987) или с помощью использования триметилалюминия (Me3Al) (Tetrahedron Letters, 48, 4171, 1977), гидроксиметил с помощью селективного восстановления гидридом металла, такого как восстановление боргидридом лития (Tetrahedron, 35, 567, 1979) или восстановление боргидридом натрия в смеси ТГФ + MeOH (Bull Chem. Soc. Japan, 57, 1948, 1984 или Syntn. Commun., 12, 463, 1982), алкилкарбонил - с помощью образования ацилхлорида и последующей реакции с алкилмагнийгалогенидами в ТГФ в качестве растворителя при температуре в интервале от -78 до 30oC (Tetrahedron Letters, 4303, 1979) или с алкилкадмийгалогенидами или диалкилкадмием в присутствии MgCl2 или хлорида лития (J.Org. Chem., 47: 2590, 1982). Еще одна группа R' как метоксикарбонил может превращаться в замещенное гетероциклическое кольцо, такое как оксадиазол (J.Med. Chem., 34: 2726, 1991), гетероароматическое кольцо, такое как оксадиазол (J. Med. Chem. , 34, 2726, 1991).
Схема 2 суммирует некоторые из описанных выше приемов превращения соединения формулы (Ic) или (I), в которой X' представляет кислород, R' представляет COOMe, Ar' и R'1-R'5 имеют значения, описанные для формулы (I), в другое соединение формулы (I) (схему 2 см. в конце описания).
Соединения формулы (I) могут превращаться в их фармацевтически приемлемые кислотно-аддитивные соли с помощью реакции с подходящими или соответствующими органическими или минеральными кислотами.
Сольваты соединений формулы (I) могут образовываться с помощью кристаллизации или перекристаллизации из соответствующего растворителя. Например, гидраты могут получаться с помощью кристаллизации или перекристаллизации из водных растворов, или растворов в органических растворителях, содержащих воду.
Соли или сольваты соединений формулы (I), которые не являются фармацевтически приемлемыми, также могут быть полезными в качестве промежуточных соединений при получении фармацевтически приемлемых солей и сольватов. Соответственно такие соли и сольваты также составляют часть данного изобретения.
Как упоминалось выше, соединения формулы (I) могут существовать в более, чем одной, стереоизомерной форме, и процесс данного изобретения может давать рацематы также, как и энантиомерно чистые формы. Для получения чистых энантиомеров соответствующие энантиомерно чистые первичные или вторичные амины формулы (IIId) или (IIIe)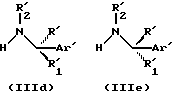
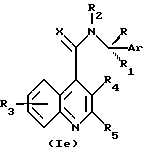
подвергаются реакции с соединениями формулы (II) с получением соединений формулы (I'd) или (I'e).
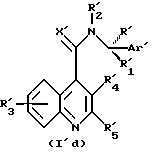
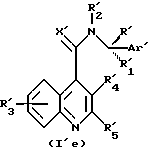
Соединения формулы (I'd) или (I'e) могут впоследствии превращаться в соединения формулы (Id) или (Ie) с помощью методов превращения, упомянутых выше.
Соединения формулы (II) являются известными или могут получаться из известных соединений с помощью известных способов.
Например, соединение формулы (II), в которой X' представляет кислород, R'3, R'4 и R'5 представляют водород, описано в работе Pfitzinger, J. Prakt. Chem. , 38, 582, 1882 и в работе Pfitzinger, J. Prakt. Chem., 56, 293, 1897; соединение формулы (II), в которой X' представляет кислород, R'3 и R'4 представляют водород и R'5 представляет 2-пиридил, описано в работе Risaliti, Ric. Scient. , 28, 561, 1958; соединения формулы (II), в которой X' представляет кислород, R'3 и R'4 представляют водород, и R'5 представляет о-, м- и п-хлорфенил, о-фторфенил и 3,4-дихлорфенил, описаны в работе Brown et al. J. Am. Chem. Soc., 68, 2705, 1946; соединение формулы (II), в которой X' представляет кислород, R'3 и R'4 представляют водород, и R'5 представляет п-метоксифенил, описано в работе Ciusa и Luzzatto, Gazz. Chim. Ital., 44, 64, 1914; соединение формулы (II), в которой X' представляет кислород, R'3 и R'4 представляют водород, и R'5 представляет м-трифторметилфенил, описано в работе Shargier и Lalezari, J. Chem. Eng. Data, 8, 276, 1963; соединение формулы (II), в которой X' представляет кислород, R'3 и R'4 представляют водород, и R'5 представляет п-фторфенил, описано в работе Bu Hoi et al., Rec Trav. Chim. , 68, 781, 1949; соединение формулы (II), в которой X' представляет кислород, R'3 и R'4 представляют водород, и R'5 представляет п-метилфенил, описано в работе Prevost et al., Compt. Rend. Acad. Sci., 258, 954, 1964; соединение формулы (II), в которой X' представляет кислород, R'3 и R'4 представляют водород, и R'5 представляет п-бромфенил, описано в работе Nicolai et al. , Eur. J. Med. Chem., 27, 977, 1992; соединение формулы (II), в которой X' представляет кислород, R'4 и R'5 представляют водород, и R'3 представляет 6-метил, описано в работе Buchmann and Howton, J. Am. Chem. Soc. , 68, 2718, 1946; соединение формулы (II), в которой X' представляет кислород, R'4 и R'5 представляют водород, и R'3 представляет 8-нитро, описано в работе Buchmann et al, J. Am. Chem. Soc., 69, 380, 1947; соединение формулы (II), в которой X' представляет кислород, R'4 представляет водород, R'3 представляет 6-хлор, R'5 представляет п-хлорфенил, описано в работе Lutz et al., J. Am. Chem. Soc., 68, 1813, 1946; соединение формулы (II), в которой X' представляет кислород, R'3 и R'4 представляют водород, и R'5 представляет 2-тиазолил, описано в европейской патентной заявке ЕР 112776; соединения формулы (II), в которой X' представляет кислород, R'3 представляет 8-трифторметил, R'4 представляет водород и R'5 представляет фенил, o- и п-фторфенил, 3,4-дихлорфенил, п-метоксифенил, описываются в работе Nicolai et al. , Eur. J. Med. Chem., 27, 977, 1992; соединения формулы (II), в которой X'представляет кислород, R'3 представляет 6-бром, R'4 представляет водород и R'5 представляет фенил или п-фторфенил, описываются в работе Nicolai et al., Eur. J. Med. Chem., 27, 977, 1992; другие соединения формулы (II) описываются в немецкой выложенной заявке DE 3721222 и в европейской патентной заявке ЕР 384313.
Соединения формул (III), (IIId) и (IIIe) являются промышленно доступными соединениями или могут быть получены из известных соединений с помощью известных способов (например, соединения формулы (III), в которой R' представляет алкокси-карбонил, R'1 и R'2 представляют водород и Ar' имеет значения, определенные для соединений формулы (I), описываются в Liebigs Ann. der Chemie, 523, 199, 1936).
Активность соединений формулы (I) в качестве антагонистов NK3 рецептора в стандартных испытаниях указывает на то, что они имеют потенциальную терапевтическую полезность при лечении как первичных, так и вторичных расстройств, на которые здесь ранее давалась ссылка. Обнаружение того, что антагонисты NK3 рецептора представляют потенциальную терапевтическую полезность при лечении вторичных расстройств, является новым, и в соответствии со следующим аспектом настоящего изобретения предоставляется использование антагонистов NK3 рецептора при лечении вторичных расстройств. Предоставляется также использование антагонистов NK3 рецептора при производстве медикаментов для лечения любого из вторичных расстройств.
Настоящее изобретение также предоставляет соединения формулы (I) или их фармацевтически приемлемые соли или сольваты для использования в качестве активных терапевтических веществ.
Настоящее изобретение далее предоставляет фармацевтические композиции, включающие соединение формулы (I) или его фармацевтически приемлемую соль или сольват и фармацевтически приемлемый носитель.
Настоящее изобретение предоставляет также использование соединений формулы (I) или их фармацевтически приемлемых солей или сольватов в производстве медикаментов для лечения первичных и вторичных расстройств.
Такие медикаменты и композиции данного изобретения могут быть получены с помощью смешения соединения изобретения с соответствующим носителем. Они могут содержать общепринятые разбавители, связующие, наполнители, дезинтегрирующие агенты, вкусовые или ароматизирующие агенты, красящие агенты, смазочные или консервирующие агенты.
Данные общепринятые эксципиенты являются такими, как те, что могут применяться, например, при получении композиций с известными агентами для лечения указанных состояний.
Предпочтительно фармацевтическая композиция изобретения находится в форме единичной дозы и в форме, приемлемой для использования в медицинской или ветеринарной областях. Например, такие препараты могут быть в упакованной форме, сопровождаемой написанными или отпечатанными инструкциями по использованию в качестве агента при лечении указанных состояний.
Интервал подходящих доз для соединений изобретения зависит от применяемого соединения и от состояния пациента. Он зависит также от связи активности или силы действия и способности к поглощению и частоты и способа назначения к приему препарата.
Соединение или композиция изобретения могут быть изготовлены в виде препаративной формы для назначения любым способом, и предпочтительно в форме единичной дозы или в форме, которую человек может сам принять в виде дозы на один прием. Композиция с успехом может быть в форме, подходящей для орального, ректального, топического или местного, парентерального, внутривенного или внутримышечного приема. Препараты могут производиться таким образом, чтобы обеспечивать медленное высвобождение активного ингредиента.
Композиции могут быть, например, в форме таблеток, капсул, саше, флаконов или пробирок, порошков, гранул, лепешек, реконституируемых или пересоставляемых порошков или жидких препаратов, например растворов или суспензий, или в форме медицинских свечей или суппозиторий.
Композиции, например, те, что являются подходящими для орального назначения, могут содержать общепринятые эксципиенты, такие как связующие агенты, например сироп, камедь акации, желатин, сорбит, трагакант или поливинилпирролидон; наполнители, например лактозу, сахар, кукурузный крахмал, фосфат кальция, сорбит или глицин; таблеточные смазочные агенты, например стеарат магния; дезинтегрирующие агенты, например крахмал, поливинил-пирролидон, натрийкрахмалгликолят или микрокристаллическую целлюлозу; или фармацевтически приемлемые агенты для застывания, такие как лаурилсульфат натрия.
Твердые композиции могут получаться с помощью общепринятых методов смешения, заполнения, таблетирования или аналогичных. Повторные операции смешения могут использоваться для распределения или распространения активного агента в тех композициях, в которых применяются огромные количества наполнителей. Когда композиция находится в форме таблетки, порошка или лепешки, может использоваться любой носитель, подходящий для образования твердых фармацевтических композиций, причем примерами являются стеарат магния, крахмал, глюкоза, лактоза, сахароза, рисовая мука и мел. Таблетки могут покрываться в соответствии со способами, хорошо известными в обычной фармацевтической практике, в частности энтерическим покрытием. Композиция может быть также в форме проглатываемой капсулы, например, из желатин-содержащего соединения, при желании с носителем или другими эксципиентами.
Композиции для орального назначения в виде жидкостей могут быть в форме, например эмульсий, сиропов или элексиров, или они могут быть представлены в виде сухого продукта, предназначенного для реконституирования с водой или другим подходящим носителем перед использованием. Такие жидкие композиции могут содержать обычные добавки, такие как суспендирующие агенты, например сорбит, сироп, метилцеллюлозу, желатин, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу, алюминийстеаратный гель, гидрированные съедобные жиры; эмульгирующие агенты, например лецитин, сорбитанмоноолеат или камеди акации; водные или неводные носители, которые включают съедобные масла, например миндальное масло, фракционированное масло кокосовых орехов, масляные сложные эфиры, например сложные эфиры глицерина или пропиленгликоля или этиловый спирт, глицерин, воду или обычный физиологический или солевой раствор; консервирующие агенты, например метил- или пропил-п-гидроксибензоат или аскорбиновую кислоту; и, при желании, общепринятые вкусовые или красящие агенты.
Композиции данного изобретения могут также назначаться для приема неоральным способом. В соответствии с обычными фармацевтическими процедурами композиции могут формироваться для ректального назначения в виде медицинских свечей. Они могут также формироваться или составляться для представления в инъецируемой форме в водном или неводном растворе, суспензии или эмульсии в фармацевтически приемлемой жидкости, например стерильной, свободной от пирогенов воде или в парентерально приемлемом масле или смеси жидкостей. Жидкость может содержать антибактериальные агенты, антиоксиданты или другие предохраняющие агенты, буферы или растворенные вещества для придания раствору изотоничности по отношению к крови, загущающие агенты, суспендирующие агенты или другие фармацевтически приемлемые добавки. Такие формы представляются в форме единичной дозы, такой как ампулы или разовые изделия для инъекций, или в форме многих доз, таких как бутылочка или флакон, из которых может быть взята соответствующая доза, или твердая форма или концентрат, которые могут использоваться для приготовления инъецируемых готовых форм.
Соединения данного изобретения могут также назначаться с помощью ингаляции через нос или рот. Такой прием лекарства может осуществляться с помощью готовой формы в виде спрея, включающего соединение изобретения и подходящий носитель, необязательно суспендированные, например, в углеводородном реактивном топливном веществе.
Предпочтительные готовые формы в виде спрея включают мельчайшие (микронизированные) частицы соединения в сочетании с поверхностно-активным агентом, растворителем или диспергирующим агентом для предотвращения оседания суспендированных частиц. Размер частиц соединения составляет предпочтительно примерно от 2 до 10 микрон.
Дополнительный способ назначения соединений изобретения включает трансдермальную доставку с использованием готовой формы препарата в виде накожного пластыря. Предпочтительная готовая препаративная форма включает соединение изобретения, диспергированное в чувствительном к давлению адгезиве, который прилипает к коже, позволяя тем самым соединению диффузировать из адгезива через кожу для доставки пациенту. Для постоянной степени или скорости абсорбции через кожу могут использоваться чувствительные к давлению адгезивы, известные в данной области техники, такие как природный каучук или силикон.
Как упоминалось выше, эффективная доза соединения зависит от конкретно применяемого соединения, от состояния пациента и от частоты и способа назначения. Единичная доза обычно содержит от 20 до 1000 мг, и предпочтительно от 30 до 500 мг, в частности 50, 100, 150, 200, 250, 300, 350, 400, 450 или 500 мг. Композиция может назначаться для приема один или более раз в сутки, например, 2, 3 или 4 раза в день, и общая дневная доза для взрослого человека весом 70 кг обычно составляет в интервале от 100 до 3000 мг. Альтернативно единичная доза содержит от 2 до 20 мг активного ингредиента и принимается многократно, если необходимо, чтобы дать указанную дневную дозу.
В случае соединений изобретения, когда они принимаются в соответствии с изобретением, не ожидается никаких неприемлемых токсикологических эффектов.
Настоящее изобретение также предоставляет способ лечения и/или профилактики первичных и вторичных расстройств у млекопитающих, в частности людей, который включает назначение млекопитающему, нуждающемуся в таком лечении и/или профилактике, эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли или сольвата.
Изобретение далее предоставляет способ лечения и/или профилактики вторичных расстройств у млекопитающих, особенно людей, который включает назначение млекопитающему, нуждающемуся в таком лечении и/или профилактике, эффективного количества антагониста NK3 рецептора.
Активность соединений настоящего изобретения в качестве лигандов NK3 определяется по их способности ингибировать связывание радиоактивно меченых лигандов NK3, [125I]-[Ме-Phe7]-NKB или [3H]-Сенктида, с NK3 рецепторами морских свинок и человека (Renzetti et al., 1991. Neuropeptide, 18, 104 - 114; Buell et al, 1992. FEBS, 299 (1), 90 - 95; Chung et al, 1994, Biochem. Biophys. Res. Commun., 198(3), 967 -972). Используемые анализы связывания позволяют определить концентрацию отдельного соединения, требуемую для снижения на 50% специфического связывания [125I]-[Me-Phe7]-NKB и [3H]-Сенктида с NK3 рецептором в условиях равновесия (IC50). Анализы связывания дают для каждого испытанного соединения среднюю величину IC50 от 2-5 отдельных экспериментов, выполненных с двукратным или трехкратным повторением. Наиболее активные соединения настоящего изобретения показывают величины IC50 в интервале 1 - 1000 нМ; в частности, в опыте с корой головного мозга морских свинок с замещением (вытеснением) [3H] -Сенктида соединения примеров 22, 47, 48 и 85 показывают KiS (нМ) соответственно 5.6, 8.8, 12.0 и 4.8 (n=3). NK3-антагонистическая активность соединений настоящего изобретения определяется по их способности ингибировать вызванное сенктидом сокращение подвздошной кишки морской свинки (Maggi et al, 1990, Br. J, Pharmacol., 101, 996 - 1000) и изолированной сфинктерной мышцы радужной оболочки кролика (Hall et al., 1991, Eur. J. Pharmacol. , 199, 9-14) и опосредуемую NK3-рецепторами Ca++ мобилизацию (Mochizuki et al. , 1994, J. Biol. Chem., 269. 9651 - 9658). Функциональные анализы ин витро на морских свинках и на кроликах дают для каждого испытываемого соединения среднюю величину KB от 3-8 отдельных экспериментов, где KB представляет концентрацию индивидуального соединения, необходимую для получения 2-кратного сдвига вправо на кривой сенктида концентрация - ответная реакция. Функциональный анализ с рецепторами человека позволяет определить концентрацию индивидуального соединения, необходимую для уменьшения на 50% (величины IC50) Ca++ мобилизации, индуцируемой антагонистом NKB. В данном анализе соединения настоящего изобретения ведут себя как антагонисты.
Терапевтический потенциал соединений настоящего изобретения при лечении указанных состояний может быть оценен с использованием моделей заболевания на грызунах.
Следующие ниже описания иллюстрируют получение промежуточных соединений, тогда как примеры иллюстрируют получение соединений настоящего изобретения. Соединения приведенных примеров представлены в таблицах 1 - 6.
ОПИСАНИЕ 1
Хлорангидрид 2-фенилхинолин-4-карбоновой кислоты
11,7 мл (136,3 ммоля) оксалилхлорида растворялось в 150 мл метиленхлорида. Раствор охлаждался при -10oC, и порциями добавлялось 20 г (80,2 ммоля) промышленно доступной 2-фенилхинолин-4-карбоновой кислоты. Реакционная смесь оставлялась на ночь при комнатной температуре, а затем выпаривалась досуха, давая 22 г указанного в заголовке соединения, используемого без дальнейшей очистки.
C16H10ClNO
М.В. = 267,76
ОПИСАНИЕ 2
7-метокси-2-фенилхинолин-4-карбоновая кислота
5 г (28,2 ммоля) 6-метоксиизатина, 4 мл (33,8 ммоля) ацетофенона и 5,2 г (92,6 ммоля) гидроокиси калия растворялось в 22,9 мл абсолютного этанола, и суспензия нагревалась при 80oC в течение 42 часов. После охлаждения реакционной смеси добавлялось 50 мл воды, и раствор экстрагировался 50 мл диэтилового эфира. Охлажденная льдом водная фаза подкислялась до pH 1 с помощью 37% HCl, и осадок собирался фильтрованием и промывался водой. Полученное твердое вещество сушилось в вакууме при 40oC, давая 7,0 г указанного в заголовке соединения.
C17H13NO3
Т. пл. = 226- 228oC
М.В.= 279,30
Элементный анализ: Вычислено C 73,11; H 4,69; N 5,01
Найдено C 72,07; H 4,59; N 4,90.
ИК (KBr): 3420, 1630 см-1
ОПИСАНИЕ 3
Хлорангидрид 7-метокси-2-фенилхинолин-4-карбоновой кислоты
2,8 мл (32,3 ммоля) оксалилхлорида растворялось в 60 мл метиленхлорида. Раствор охлаждался при -10oC, и порциями добавлялось 6 г (19,0 ммолей) 7-метокси-2-фенилхинолин-4-карбоновой кислоты. Реакционная смесь оставлялась на ночь при комнатной температуре, а затем выпаривалась досуха, давая 7 г указанного в заголовке соединения, используемого без дальнейшей очистки.
C17H12ClNO2
М.В. = 297,74
ОПИСАНИЕ 4
Гидроиодид 7-гидрокси-2-фенилхинолин-4-карбоновой кислоты
1,5 г (5,4 ммоля) 7-метокси-2-фенилхинолин-4-карбоновой кислоты добавлялось порциями к 50 мл 57% водного HI. Реакционная смесь нагревалась с обратным холодильником и энергично перемешивалась в течение 5 часов; затем она выпаривалась в вакууме досуха, давая 2,1 г указанного в заголовке соединения.
C16H11NO3 • HI
М.В. = 393,17
ИК (KBr): 3120; 1650; 1620 см-1.
ОПИСАНИЕ 5
2-(2-тиенил)хинолин-4-карбоновая кислота
5 г (34,0 ммоля) изатина, 4,4 мл (40,8 ммоля) 2-ацетилтиофена и 6,3 г (112,2 ммоля) гидроокиси калия растворялось
в 40 мл абсолютного этанола, и суспензия нагревалась при 80oC в течение 16 часов. После охлаждения реакционной смеси добавлялось 50 мл воды, и раствор экстрагировался 50 мл диэтилового эфира. Охлажденная льдом водная фаза подкислялась до pH 1 с помощью 37% HCl, и осадок собирался фильтрованием и промывался водой. Полученный сырой продукт сушился в вакууме при 40oC и растирался с этилацетатом, давая 4,8 г указанного в заголовке соединения.
C14H9NO2S
Т.пл. = 181 - 183oC
М.В. = 255,29
ИК (KBr): 1620 см-1
300 МГц 1H-ЯМР (ДМСО-d6): δ 8,60 (д., 1Н); 8,45 (с., 1Н); 8,10 (м., 2Н); 7,78 (м., 2Н); 7,68 (т., 1Н); 7,22 (м., 1Н).
ОПИСАНИЕ 6
2-(2-фурил)хинолин-4-карбоновая кислота
5 г (34,0 ммоля) изатина, 4 мл (40,8 ммоля) 2-ацетилфурана и 6,3 г (112,2 ммоля) гидроокиси калия растворялись в 40,9 мл абсолютного этанола, и суспензия нагревалась при 80oC в течение 12 часов. После охлаждения реакционной смеси добавлялось 50 мл воды, и раствор экстрагировался 50 мл диэтилового эфира. Охлажденная льдом водная фаза подкислялась до pH 1 с помощью 37% HCl, и осадок собирался фильтрованием и промывался водой. Полученный сырой продукт сушился в вакууме при 40oC, давая 8,5 г указанного в заголовке соединения.
C14H9NO3
M.B. = 239,23
ОПИСАНИЕ 7
Хлорангидрид 2-(2-фурил)хинолин-4-карбоновой кислоты 5,2 мл (60,4 ммоля) оксалилхлорида растворялось в 70 мл метиленхлорида. Раствор охлаждался при -10oC, и порциями добавлялось 8,5 г (35,5 ммолей) 2-(2-фурил)хинолин-4-карбоновой кислоты. Реакционная смесь оставлялась на ночь при комнатной температуре, а затем выпаривалась досуха, давая 9,2 г указанного в заголовке соединения, используемого без дальнейшей очистки.
C14H8ClNO2
М.В. = 257,78
ОПИСАНИЕ 8
Хлорангидрид 2-(4-пиридил)хинолин-4-карбоновой кислоты
5 г (34,0 ммоля) изатина, 4,5 мл (40,8 ммоля) 4-ацетилпиридина и 6,3 г (112,2 ммоля) гидроокиси калия растворялось в 40 мл абсолютного этанола, и суспензия нагревалась при 80oC в течение 12 часов. После охлаждения реакционной смеси добавлялось 50 мл воды, и раствор экстрагировался 50 мл диэтилового эфира. Охлажденная льдом водная фаза подкислялась до pH 1 с помощью 37% HCl, и осадок собирался фильтрованием и промывался водой.
Водный раствор выпаривался в вакууме досуха, остаток растирался с этанолом и отфильтровывался. Выпаривание растворителя давало 6,0 г сырого указанного в заголовке соединения. Данный продукт объединялся с полученным ранее осадком и перекристаллизовывался из толуола, содержащего следы метанола, давая 4,5 г указанного в заголовке соединения.
C15H10N2O2 • HCl
Т.пл. = 297 - 301oC
М.В. = 286,72
ИК (KBr): 1705, 1635, 1610 см-1.
300 МГц 1H-ЯМР (ДМСО-d6): δ 8,90 (д., 2Н), 8,70 (м., 2Н), 8,50 (с., 2Н), 8,28 (д., 1Н), 7,89 (дт., 2Н).
ОПИСАНИЕ 9
Хлоргидрат хлорангидрида 2-(4-пиридил)хинолин-4-карбоновой кислоты
1,3 мл (10,4 ммоля) оксалилхлорида растворялось в 60 мл метиленхлорида. Раствор охлаждался при - 10oC и порциями добавлялось 3,0 г (14,4 ммоля) хлоргидрата 2-(4-пиридил)хинолин-4-карбоновой кислоты. Реакционная смесь оставлялась на 72 часа при комнатной температуре, а затем выпаривалась досуха, давая 4,0 г указанного в заголовке соединения, используемого без дальнейшей очистки.
C15H9ClN2O • HCl
М.В. = 305,22
Пример 1
(R, S)-N-(α-метилбензил)-2-фенилхинолин-4-карбоксамид 1,2 мл (9,4 ммоля) (R, S)(α-метилбензиламина и 1,6 мл (11,7 ммоля) триэтиламина (TEA) растворялось в атмосфере азота в 50 мл 1:1 смеси сухого метиленхлорида и CH3CN. К охлажденному льдом раствору аминов добавлялось по каплям 2,0 г (7,8 ммоля) 2-фенилхинолин-4-карбонилхлорида, растворенного в 50 мл 1:4 смеси сухого метиленхлорида и ДМФ, и реакционная смесь хранилась при 0 - 5oC в течение 1 часа и оставлялась на ночь при комнатной температуре. Реакционная смесь выпаривалась в вакууме досуха, остаток растворялся в этилацетате и промывался дважды насыщенным раствором бикарбоната натрия. Органический слой отделялся, сушился над сульфатом натрия, фильтровался и выпаривался в вакууме досуха. Остаточное масло кристаллизовалось из этилацетата, давая 1,1 г целевого соединения в виде белого твердого вещества.
C24H20N2O
Т.пл. = 156 - 157oC
М.В. = 352,43
Элементный анализ: Вычислено C 81,79; H 5,72; N 7,95
Найдено C 81,99; H 5,69; N 7,89
ИК (KBr): 3240, 1645 см-1.
300 МГц 1H-ЯМР (ДМСО-d6): δ 9,29 (д., 1Н), 8,32 (д., 2Н), 8,13 (д., 1Н), 8,13 (с., 1Н), 8,06 (д., 1Н), 7,81 (ддд., 1Н), 7,68-7,52 (м., 4Н), 7,47 (д., 2Н), 7,39 (дд., 2Н), 7,27 (дд., 1Н), 5,30 (дкв., 1Н), 1,52 (д., 3Н).
MC (EI; источник 200oC, 70 В, 200 мА): 352 (М+.), 337, 232, 204, 77.
Пример 2
S-(+)-N-( α- метилбензил)-2-фенилхинолин-4- карбоксамид
Получался, как в примере 1, из 1,2 мл (9,4 ммоля) S-(-)- α- метилбензиламина, 1,6 мл (11,7 ммоля) TEA, 2,0 г (7,8 ммоля) 2-фенилхинолин-4-карбонилхлорида в 100 мл смеси метиленхлорида, CH3CN и ДМФ. Обработка реакционной смеси осуществлялась таким же образом, как описано в примере 1. Остаточное масло кристаллизовалось из этилацетата, давая 1,1 г целевого соединения.
C24H20N2O
Т.пл. = 161- 162oC
М.В. = 352,43
[α]
300 МГц 1H-ЯМР (ДМСО-d6): δ 9,29 (д., 1Н), 8,32 (д., 2Н), 8,13 (д., 1Н), 8,13 (с., 1Н), 8,06 (д., 1Н), 7,81 (ддд., 1Н), 7,68-7,52 (м., 4Н), 7,47 (д., 2Н), 7,39 (дд., 1Н), 7,27 (дд., 1Н), 5,30 (дкв., 1Н), 1,52 (д., 3Н).
МС спектр был идентичен спектру примера 1.
Пример 3
R-(-)-N-( α- метилбензил)-2-фенилхинолин-4- карбоксамид
Получался, как в примере 1, из 1, 2 мл (9,4 ммоля) R-(+)- α- метилбензиламина, 1,6 мл (11,7 ммоля) TEA, 2,0 г (7,8 ммоля) 2-фенилхинолин-4-карбонилхлорида в 100 мл смеси метиленхлорида, CH3CN и ДМФ. Обработка реакционной смеси осуществлялась таким же образом, как описано в примере 1. Остаточное масло кристаллизовалось из этилацетата, давая 1,1 г целевого соединения.
C24H20N2O
Т.пл. = 158 - 160oC
M.B. = 352,43
[α]
1H-ЯМР и МС спектры были идентичными спектрам примеров 1 и 2.
Пример 4
(R,S)-N-[ α- (метоксикарбонил)бензил]-2-фенилхинолин- 4-карбоксамид
2,0 г (8,0 ммолей) 2-фенилхинолин-4-карбоновой кислоты растворялось в атмосфере азота в 130 мл сухого ТГФ и 100 мл CH3CN. Добавлялось 2,0 г (9,9 ммоля) хлоргидрата (D, L) метилфенилглицианата и 1,5 мл (10,7 ммоля) TEA, и реакционная смесь охлаждалась при 5oC. По каплям добавлялось 2,5 г (12,1 ммоля) дициклогексилкарбодиимида (DCC), растворенного в 10 мл сухого метиленхлорида, и раствору давалась возможность достичь комнатной температуры, раствор перемешивался в течение 5 часов и оставлялся на ночь. Выпавшая в осадок дициклогексилмочевина отфильтровывалась, и раствор выпаривался в вакууме досуха. Остаток растворялся в метиленхлориде, а затем промывался водой. Органический слой отделялся, сушился над сульфатом натрия и выпаривался в вакууме досуха, давая 6,0 г сырого продукта, который растворялся в 20 мл метиленхлорида и оставлялся на ночь. Еще некоторое количество дициклогексилмочевины выпадало в осадок и отфильтровывалось.
Раствор выпаривался в вакууме досуха, и остаток подвергался флешхроматографии на 230 - 400 меш силикагеле, с элюированием смесью гексан/этилацетат 3/2, содержащей 0,5% гидроокиси аммония. Полученное сырое или неочищенное твердое вещество растиралось с теплым диизопропиловым эфиром, отфильтровывалось, промывалось и сушилось, давая 1,1 г целевого соединения.
C25H20N2O3
Т.пл. = 170 - 172oC
М.В. = 396,45
Элементный анализ: Вычислено C 75,74; H 5,09; N 7,07
Найдено C 75,88; H 5,12; N 7,06
ИК (нуйол): 3240, 1750, 1670 см-1.
300 МГц 1H-ЯМР (ДМСО-d6): δ 9,72 (д., 1Н), 8,28 (дд., 2Н), 8,20 (дд., 1Н), 8,13 (дд. , 1Н), 8,11 (с. , 1Н), 7,83 (ддд., 1Н), 7,66 (ддд., 1Н), 7,60-7,50 (м., 5Н), 7,47-7,37 (м., 3Н), 5,78 (д., 1Н), 3,72 (с., 3Н).
МС (EI; источник 200oC, 70 В, 200 мА): 396 (M+.), 337, 232, 204.
Пример. 5
(+)-(S)-N-[α-(метоксикарбонил)бензил]-2- фенилхинолин-4-карбоксамид
2,0 г (8,0 ммолей) 2-фенилхинолин-4-карбоновой кислоты растворялось в атмосфере азота в 70 мл сухого ТГФ и 30 мл CH3CN. Добавлялось 1,7 г (8,4 ммоля) хлоргидрата (L) метилфенилглицината, 1,1 мл (9,9 ммоля) N-метилморфолина и 2,1 мл (15,5 ммолей) N-гидроксибензотриазола (НОВТ), и реакционная смесь охлаждалась при 0oC. По каплям добавлялось 1,85 г (9,0 ммолей) DCC, растворенного в 10 мл метиленхлорида, и раствор хранился при 0 - 5oC в течение 1 часа, а затем при комнатной температуре в течение 2 часов. Выпавшая в осадок дициклогексилмочевина отфильтровывалась, и раствор выпаривался в вакууме досуха. Остаток растворялся в метиленхлориде и промывался водой, насыщенным раствором бикарбоната натрия, 5% лимонной кислотой, насыщенным раствором бикарбоната натрия и насыщенным раствором хлорида натрия. Органический слой отделялся, сушился над сульфатом натрия и выпаривался в вакууме досуха, остаток растворялся в 20 мл метиленхлорида и оставлялся на ночь. Еще некоторое количество дициклогексилмочевины выпадало в осадок и отфильтровывалось. Раствор выпаривался в вакууме досуха, и получалось 2,6 г сырого продукта, который растирался с петролейным эфиром, растворялся, промывался диизопропиловым эфиром, а затем перекристаллизовывался из 70 мл изопропанола, давая 1,7 г целевого соединения.
C25H20N2O3
Т.пл. = 180 - 181oC
М.В. = 396,45
ИК (нуйол): 3300, 1750, 1640 см-1
[α]
1H-ЯМР и МС спектры были идентичными спектрам примера 4.
Пример 6
(-)-(R)-N-[ α- (метоксикарбонил)бензил]-2-фенилхинолин-4- карбоксамид
Получался, как в примере 5, из 2,0 г (8,0 ммолей) 2-фенилхинолин-4-карбоновой кислоты, 1,7 г (8,4 ммоля) хлоргидрата (D) метилфенилглицината, 1,1 мл (9,9 ммоля) N-метилморфолина, 2,1 г (15,5 ммолей) НОВТ и 1,85 г (9,0 ммолей) DCC в 70 мл сухого ТГФ и 30 мл CH3CN. Обработка реакционной смеси осуществлялась таким же образом, как описано в примере 5. Полученный сырой продукт (3,5 г) растирался дважды с теплым диизопропиловым эфиром, фильтровался, промывался, а затем перекристаллизовывался из 80 мл изопропанола, давая 2,3 г целевого соединения.
C25H20N2O3
Т.пл. = 180 - 181oC
М.В. = 396,45
ИК (нуйол): 3300, 1750, 1640 см-1.
[α]
1H-ЯМР и МС спектры были идентичными спектрам примеров 4 и 5.
Пример 7
(R, S)-N-[α-(метоксикарбонил)бензил] -7-метокси-2- фенилхинолин-4-карбоксамид
1,0 г (5,0 ммолей) хлоргидрата (D,L) метилфенилглицината растворялся в атмосфере азота в 30 мл сухого ДМФ. Добавлялось 2,5 г (18,1 ммоля) безводного карбоната калия, и раствор охлаждался до 0oC. По каплям добавлялось 0,7 г (2,3 ммоля) соединения описания 3, растворенного в 25 мл сухого ДМФ, и раствор хранился при 0 - 5oC в течение 1 часа и при комнатной температуре на протяжении ночи. Реакционная смесь выпаривалась в вакууме досуха, и остаток растворялся в этилацетате и промывался дважды водой. Органический слой отделялся, сушился над сульфатом натрия, фильтровался и выпаривался в вакууме досуха. Остаточное масло подвергалось флешхроматографии на 230-400 меш силикагеле при элюировании смесью гексана и этилацетата 3:2, содержащей 0,5% гидроокиси аммония, давая 0,1 г сырого продукта, который растирался с диизопропиловым эфиром, давая 0,08 г целевого соединения.
C26H22N2O4
Т.пл. = 187 - 190oC
М.В. = 426,48
ИК (KBr): 3220, 1750, 1660, 1620 см-1.
300 МГц 1H-ЯМР (CDCl3): δ 8,13-8,08 (м., 3H), 7,80 (с., 1H), 7,55 -7,38 (м. , 9Н), 7,21 (дд., 1H), 7,02 (д. широкий, Н), 5,88 (д., 1H), 3,97 (с., 3Н), 3,80 (с., 3Н).
МС (EI; источник 200oC, 70 В, 200 мА): 426 (М+.), 367, 262, 234, 191, 77.
Пример 8
(R, S)-N-[α-(метоксикарбонил)бензил] -7-гидрокси-2-фенилхинолин- 4-карбоксамид
Получался, как в примере 5, из 2,1 г (5,3 ммоля) соединения описания 4, 1,08 г (5,3 ммоля) хлоргидрата (D, L) метилфенилглицината, 1,5 мл (10,7 ммоля) TEA, 1,7 г (12,5 ммолей) НОВТ и 1,2 г (5,8 ммоля) DCC в 70 мл сухого ТГФ и 30 мл CH3CN. Обработка реакционной смеси осуществлялась таким же образом, как описано в примере 5. Полученный сырой продукт растирался с диизопропиловым эфиром, а затем перекристаллизовывался дважды из изопропанола, давая 0,06 г целевого соединения.
C25H20N2O4
Т.пл. = 256 - 257oC
М.В. = 412,45
ИК (KBr): 3270, 1750, 1650, 1620 см-1
300 МГц 1H-ЯМР (ДМСО-d6): δ 10,30 (с. широкий, 1Н), 9,64 (д., 1Н), 8,22 (д. , 2Н), 8,04 (д., 1Н), 7,85 (с., 1Н), 7,60-7,34 (м., 9Н), 7,21 (дд., 1Н), 5,74 (д., 1Н), 3,71 (с., 3Н).
МС (EI; источник 200oC, 70 В, 200 мА): 412 (М+.), 353, 248, 220, 77.
Пример 9
Хлоргидрат (R, S)-N-[α-(карбокси)бензил] -7- метокси-2-фенилхинолин-4-карбоксамид
0,18 г (0,4 ммоля) продукта примера 7 растворялось в 10 мл 10% HCl и 5 мл диоксана. Реакционная смесь нагревалась с обратным холодильником и перемешивалась в течение 3 часов, а затем выпаривалась в вакууме досуха. Сырой продукт растирался с теплым этилацетатом (содержащим несколько капель этанола), давая 0,16 г целевого соединения.
C25H20N2O4 • HCl
Т.пл. = 228-230oC
М.В. = 448,91
ИК (KBr): 3180, 1735, 1655, 1630 см-1.
300 МГц 1H-ЯМР (ДМСO-d6): δ 9,6 (д., 1H), 8,26 (дд., 2H), 8,14 (д., 1H), 7,98 (с., 1H), 7,63-7,52 (м., 6Н), 7,46-7,36 (м., 3Н), 7,33 (дд., 1Н), 5,66 (д., 1Н), 3,98 (с., 3Н).
МС (EI; источник 200oC, 70 В, 200 мА): 412 (М+.), 368, 262, 234, 191, 77.
Пример 10
(R,S)-N-[α-(метиламинокарбонил)бензил]-2- фенилхинолин-4-карбоксамид
0,45 г (1,1 ммоля) продукта примера 4 растворялось в 40 мл смеси 33% MeNH2/EtOH, добавлялось каталитическое количество NaCN, и реакционная смесь нагревалась при 70oC в течение 1 часа в аппарате Парра. Внутреннее давление поднималось до 40 фунт/дюйм2 (2,812 кг/см2). Раствор выпаривался в вакууме досуха, и остаток растирался с водой, фильтровался и перекристаллизовывался из смеси изопропанола (50 мл) и этанола (30 мл), давая 0,2 г целевого соединения.
C25H21N3O2
Т.пл. = 261 - 263oC
М.В. = 395,47
Элементный анализ: Вычислено C 75,93; H 5,35; N 10,63
Найдено C 75,65; H 5,34; N 10,55
ИК (KBr): 3300, 3270, 1660, 1635 см-1
300 МГц 1H-ЯМР (ДМСО-d6): δ 9,48 (д., 1H), 8,33-8,25 (М., 3Н), 8,18-8,10 (м., 3Н), 7,80 (ддд., 1Н), 7,68-7,50 (м., 6Н), 7,40-7,28 (м., 3Н), 5,75 (д., 1Н), 2,63 (д., 3Н).
МС (EI; источник 200oC, 70 В, 200 мА): 395 (М+.), 337, 232, 204, 77.
Пример 11
(R,S)-N-[α-(метоксикарбонил)бензил]-2-(2- тиенил)хинолин-4-карбоксамид
Получался, как в примере 5, из 2,0 г (7,3 ммоля) 2-(2-тиенил)хинолин-4-карбоновой кислоты, 1,7 г (8,4 ммоля) хлоргидрата (D,L) метилфенилглицината, 1,1 мл (10 ммолей) N-метилморфолина, 2,1 г (15,5 ммолей) НОВТ и 1,85 г (9,0 ммолей) DCC в 70 мл сухого ТГФ, 30 мл метилцианида и 10 мл метиленхлорида. Обработка реакционной смеси осуществлялась таким же образом, как описано в примере 5. Полученный сырой продукт кристаллизовался из этилацетата, а затем перекристаллизовывался из абсолютного этанола, давая 0,9 г целевого соединения.
C23H18N2O3S
Т.пл. = 178 - 180oC
М.В. = 402,47
Элементный анализ: Вычислено C 68,64; H 4,51; N 6,96
Найдено C 67,50; H 4,99; N 7,43
ИК (KBr): 3300, 1745, 1645 см-1.
300 МГц 1H-ЯМР (ДМСО-d6): δ 9,70 (д., 1Н), 8,12 (д., 1Н), 8,08 (с., 1Н), 8,04 (д. , 1Н), 8,02 (д., 1H), 7,19 (т., 1Н), 7,76 (д., 1Н), 7,62 (т., 1Н), 7,53 (д. , 2Н), 7,46-7,37 (м., 3Н), 7,3 (дд., 1H), 5,68 (д., 1Н), 3,68 (с., 3Н).
MC (EI; источник 200oC, 70 В, 200 мА): 402 (М+.), 343, 238, 210, 77.
Пример 12
(R,S)-N-[α-(метоксикарбонил)бензил]-2-(2-фурил)хинолин- 4-карбоксамид
Получался, как в примере 1, из 7,2 г (35,5 ммолей) хлоргидрата (D,L) метилфенилглицината, 12,4 мл (88,8 ммолей) TEA и 9,1 г (35,5 ммолей) сырого 2-(2-фурил)хинолин-4-карбонилхлорида в 350 мл смеси метиленхлорида, метилцианида и ДМФ. Обработка реакционной смеси осуществлялась таким же образом, как описано в примере 1. Полученный сырой продукт растирался с метанолом, давая 3,3 г целевого соединения.
C23H18N2O4
Т.пл. = 178- 180oC
М.В. = 386,405
Элементный анализ: Вычислено C 71,49; H 4,70; N 7,25
Найдено C 71,67; H 4,74; N 7,17.
ИК (KBr): 3300, 1750, 1650 см-1.
300 МГц 1H-ЯМР (ДМСО-d6): δ 9,72 (д., 1H), 8,12 (д., 1Н), 8,06 (д., 1H), 7,96 (дд., 1H), 7,92 (с., 1H), 7,80 (ддд., 1H), 7,62 (ддд., 1H), 7,52 (дд., 2Н), 7,45-7,35 (м., 4Н), 6,73 (дд., 1H), 5,77 (д., 1H), 3,74 (с., 3Н).
МС (ЕI; источник 200oC, 70 В, 200 мА): 386 (М+.), 327, 222, 194, 77.
Пример 13
(R,S)-N-[α-(метоксикарбонил)бензил]-2-(4-пиридил)хинолин-4- карбоксамид
Получался, как в примере 1, из 3,4 г (16,7 ммолей) хлоргидрата (D,L) метилфенилглицината, 3,9 мл (27,8 ммоля) TEA и 3,0 г (11,1 ммоля) 2-(4-пиридил)хинолин-4-карбонилхлорида в 100 мл смеси метиленхлорида, метилцианида и ДМФ. Обработка реакционной смеси осуществлялась таким же образом, как описано в примере 1. Полученный сырой продукт перекристаллизовывался три раза из этилацетата, давая 1,9 г целевого соединения.
C24H19N3O3
Т.пл. = 172 - 174oC,
М.В. = 397,43
Элементный анализ: Вычислено C 72,53; H 4,82; N 10,57
Найдено C 71,87; H 4,87; N 10,44
ИК (KBr): 3240, 1750, 1670 см-1.
300 МГц 1H-ЯМР (ДМСО-d6): δ 9,74 (д., 1Н), 8,79 (дд., 2Н), 8,27-8,17 (м. , 5Н), 7,89 (ддд., 1Н), 7,74 (ддд., 1Н), 7,54 (дд., 2Н), 7,47-7,38 (м., 3Н), 5,8 (д., 1Н), 3,75 (с., 3Н).
МС (EI; источник 200oC, 70 В, 200 мА): 397 (М+.), 338, 233, 205, 77.
Пример 14
(R, S)-N-[α-(метоксикарбонил)-2-тиенилметил] -2- фенилхинолин-4-карбоксамид
Получался, как в примере 1, из 1,94 г (9,4 ммолей) хлоргидрата (D,L) метилфенилглицината, 2,7 мл (19,5 ммолей) TEA и 2,0 г (7,8 ммоля) 2-фенилхинолин-4-карбонилхлорида в 100 мл смеси метиленхлорида, метилцианида и ДМФ. Обработка реакционной смеси осуществлялась таким же образом, как описано в примере 1. Полученный сырой продукт перекристаллизовывался три раза из этилацетата, давая 0,66 г целевого соединения.
C23H18N2O3S
Т.пл. = 144 - 145oC
М.В. = 402,47
Элементный анализ: Вычислено C 68,64; H 4,51; N 6,96
Найдено C 68,81; H 4,46; N 6,96.
ИК (KBr): 3295, 1745, 1640 см-1.
300 МГц 1H-ЯМР (ДМCО-d6): δ 8,25 (дд., 1Н), 8,22 (дд., 1Н), 8,17 (дд., 2Н), 7,95 (с. , 1Н), 7,78 (ддд., 1Н), 7,60 (ддд., 1Н), 7,56-7,45 (м, 3Н), 7,35 (дд. , 1Н), 7,20 (д, 1Н), 7,05 (дд., 1Н), 7,05 (с. широкий, 1Н), 6,22 (д., 1Н), 3,9 (с., 3Н).
МС (EI; источник 200oC, 70 В, 200 мА): 402 (М+.), 343, 232, 204.
Пример 15
(R,S)-N-[α-(метоксикарбонилметил)бензил]-2- фенилхинолин-4-карбоксамид
Получался, как в примере 5, из 1,39 г (5,60 ммоля) 2-фенилхинолин-4-карбоновой кислоты, 1,2 г (5,60 ммоля) хлоргидрата (R,S) метил-3-амино-3-фенилпропионата, 0,78 мл (5,60 ммоля) TEA, 1,51 г (11,2 ммоля) НОВТ и 2,31 г (11,2 ммоля) DCC в 10 мл ТГФ, 4 мл CH3CN и 7 мл метиленхлорида. Обработка реакционной смеси осуществлялась таким же образом, как описано в примере 5. Полученный сырой продукт растворялся в метиленхлориде и оставлялся на ночь при 0oC. Выпадало в осадок еще некоторое количество дициклогексилмочевины и отфильтровывалось. Раствор выпаривался в вакууме досуха, и получалось 1,4 г сырого продукта, который растирался со смесью диизопропилового эфира и ацетона 99: 1, давая 1,2 г целевого соединения в виде белого твердого вещества.
C26H22N2O3
Т.пл. = 156 - 158oC
М.В. = 410,47
Элементный анализ: Вычислено C 76,07; H 5,40; N 6,82
Найдено C 75,77; H 5,38; N 6,94.
ИК (KBr): 3295, 1755, 1645, 1590, 1530 см-1.
300 МГц 1H-ЯМР (ДМСО-d6): δ 9,40 (д., 1Н), 8,29 (дд., 2H), 8,14 (д., 1H), 8,07 (д., 1Н), 8,04 (с., 1H), 7,83 (ддд, 1H), 7,66- 7,52 (м., 4Н), 7,50 (д. , 2H), 7,40 (дд, 2H), 7,31 (ддд., 1Н), 5,60 (дт., 1H), 3,65 (с., 3H), 3,40-2,89 (м., 2Н).
МС (EI; источник 200oC, 70 В, 200 мА): 410 (М+.), 337, 233, 205.
Соединения примеров 16-49 общей формулы (I) (см. таблицу 2) синтезировались, исходя из соответствующих ацилхлоридов соединений (II) и аминов (III), показанных в таблице, и следуя процедуре синтеза, описанной в примере 1. Ацилхлориды синтезировались, исходя из соответствующей кислоты формулы (II) и следуя описанию 1. Выходы в результате реакции вычислены на очищенном, но неперекристаллизованном материале. Аналитические и спектроскопические данные соединений примеров 16-49 приведены в таблице 5.
Соединения примеров 50-88 общей формулы (I) (см. таблицу 3) синтезировались, исходя из соответствующих реагентов (II) и (III), показанных в таблице, и следуя процедуре синтеза, описанной в примере 5. Реакционные выходы вычислены для очищенного, но неперекристаллизованного вещества. Аналитические и спектроскопические данные соединений примеров 50-88 приведены в таблице 5.
Соединения примеров 89-92 общей формулы (I) (см. таблицу 4) синтезировались, исходя из других соединений формулы (I) (т.е. соединений формулы Ic) и следуя процедуре синтеза, описанной в примере 10 (для соединений примеров 89, 90 и 91) и в примере 9 (для соединения примера 92). Реакционные выходы вычислены на очищенном, но неперекристаллизованном материале. Аналитические и спектроскопические данные соединений примеров 89-92 приведены в таблице 5.
Имеющиеся в Таблице 5 условные обозначения имеют следующие значения:
IR = ИК (инфракрасный)
cm = см
MHz = МГц
1H NMR = ЯМР
DMSO = ДМСО
Calcd. = вычислено
Found = найдено
d = д. (дублет или двойной)
dd = дд (двойной дублет)
s = с. (синглет)
br = широкий
m = м. (мультиплет)
q = кв. (квартет)
t = т. (триплет)
Пример 93
(R, S)-N-[α-(метоксикарбонил)бензил] -2-(п-хлорфенил) хинолин-4-карбоксамид
2 г (7,0 ммолей) 2-(п-хлорфенил)хинолин-4-карбоновой кислоты и 1,7 мл (15,4 ммоля) N-метилморфолина растворялись в атмосфере азота в 50 мл сухого ТГФ. Раствор охлаждался до -20oC, и добавлялось 0,91 мл (7,0 ммолей) изобутилхлорформиата. Через 20 минут добавлялось 2,12 г (10,5 ммоля) хлоргидрата метил (R,S)фенилглицината и 1,3 мл (11,9 ммоля) N-метилморфолина, растворенных в 30 мл сухого ТГФ, и реакционная смесь перемешивалась при комнатной температуре в течение ночи. 3атем добавлялось 5 мл H2O, и реакционная смесь выпаривалась в вакууме досуха. Остаток растворялся в Et2O, промывался насыщенным раствором NaHCO3, отделялся, сушился над сульфатом натрия и выпаривался в вакууме досуха. Остаточное масло подвергалось мгновенной флеш-хроматографии на силикагельной колонке 230-400 меш при элюировании смесью гексан/изопропиловый эфир 7: 3, давая 0,9 г неочищенного продукта, который перекристаллизовывался три раза смесью изо-PrO2/толуол, давая 0,5 г целевого соединения.
C25H19ClN2O3
Т.пл. = 170-172oC
М.В. = 430,90
Элементный анализ: Вычислено С 69,72; H 4,45; N 6.50
Найдено C 69,82; H 4,47; N 6,48
И.К. (KBr): 3280; 1740; 1670; 1635; 1590; 1530 см-1.
300 МГц 1H-ЯМР (ДМСО-d6): δ 9,71 (д, 1Н); 8,32 (д, 2Н); 8,21 (д, 1Н); 8,13 (д, 1Н); 8,13 (с, 1Н); 7,85 (дд, 1Н); 7,67 (дд, 1Н); 7,63 (д, 2Н); 7,53 (дд, 2Н); 7,46-7,38 (м, 3Н); 5,79 (д, 1Н); 3,74 (с, 3Н).
МС (EI; источник 200oC; 70 эВ; 200 мкА): 430(М+.); 371; 266; 238; 203.
Пример 94
(R)-N-[α-(метоксикарбонил)-4-метоксибензил]-2-фенилхинолин-4-карбоксамид
0,62 г (1,5 ммоля) (R)-N[α-(метоксикарбонил)-4- гидроксибензил]-2-фенилхинолин-4-карбоксамида (соединение примера 83) растворялось в 30 мл сухого ацетона и 2 мл сухого ДМФ, затем добавлялось 0,14 г (0,75 ммоля) K2CO3, и реакционная смесь перемешивалась в течение 30 минут. При комнатной температуре добавлялось 0,093 мл (1,5 ммоля) метилйодида и реакционная смесь нагревалась при 40oC в течение 4 часов. 3атем снова добавлялось 0,104 г (0,75 ммоля) K2CO3 и 0,093 мл (1,5 ммоля) метилйодида, и смесь нагревалась с обратным холодильником в течение дополнительных 6 часов. Смесь выпаривалась в вакууме досуха, растворялась в EtOAc и промывалась водой. Органический слой сушился над сульфатом натрия и выпаривался в вакууме досуха. Остаток перекристаллизовывался из Et2O, давая 0,45 г целевого соединения.
C26H22N2O4
Т.пл. = 160-162oC
М.В. = 426,48
Элементный анализ: Вычислено C 73,22; H 5,20; N 6,57
Найдено C 73,01; H 5,20; N 6,48
И.К. (KBr): 3210; 1750; 1635; 1625; 1590; 1530; 1515 см-1
300 МГц 1H-ЯМР (ДМСО-d6): δ 9,65 (д, 1Н); 8,28 (д, 2Н); 8,21 (д, 1Н); 8,14 (д, 1Н); 8,10 (с, 1Н); 7,84 (дд, 1Н); 7,67 (дд, 1H); 7,61-7,49 (м, 3Н); 7,44 (д, 2Н); 6,98 (д, 2Н); 4,70 (д, 1Н); 3,79 (с, 3Н); 3,76 (с, 3Н).
МС (EI; источник 200oC; 70 эВ; 200 мкА): 426 (М+.); 367; 232; 204.
Пример 95
Хлоргидрат (R,S)-N-[α-(метоксикарбонил)- α- (метил) бензил]-N-метил-2-фенилхинолин-4-карбоксамида
0,50 г (1,3 ммоля) (R,S)-N-[ α- (метоксикарбонил)бензил]-2-фенилхинолин-4- карбоксамида (соединение примера 4) растворялось в 10 мл сухого ДМФ в атмосфере азота. Раствор охлаждался до 0oC и добавлялось 0,052 г (1,3 ммоля) NaH (60%); спустя 20 минут при 0oC температура поднималась до комнатной, и добавлялось 0,09 мл (1,4 ммоля) MeI. Реакционная смесь перемешивалась при комнатной температуре в течение ночи, затем процедура повторялась при добавлении дополнительных 0,052 г (1,3 ммоля) NaH (60%) и 0,1 мл (1,6 ммоля) MeI. Через 6 часов при комнатной температуре добавлялось 10 мл насыщенного раствора NH4Cl, и реакционная смесь выпаривалась в вакууме досуха. Остаток растворялся в CH2Cl2 и промывался водой; органический слой отделялся, сушился над сульфатом натрия и выпаривался в вакууме досуха. Остаточное масло подвергалось мгновенной хроматографии на силикагельной колонке 230-400 меш, элюировалось смесью гексан/этилацетат 3:2, содержащей 0.5% конц. NH4OH, давая 0,18 г неочищенного продукта, который растворялся в Et2O и обрабатывался смесью HCl/Et2O, давая 0,15 г целевого соединения.
C27H24N2O3 • HCl
М.В. = 460,96
И.К. (KBr): 1745; 1640; 1610 см-1.
МС (EI; источник 200oC; 70 эВ; 200 мкА): 424 (М+.); 365; 232; 204.
Пример 96
(R,S)-N-[α-(метилкарбонил)бензил]-2-фенилхинолин-4-карбоксамид
0,27 мл (3,1 ммоля) оксалилхлорида растворялось в 2,3 мл сухого CH2Cl2 в атмосфере азота. Раствор охлаждался до -55oC, и по каплям добавлялось 0,22 мл (3,1 ммоля). ДМСО, растворенного в 0,7 мл сухого CH2Cl2, с поддержанием температуры ниже -50oC. Реакционная смесь перемешивалась при -55oC в течение 7 минут, затем добавлялось 0,97 г (2,5 ммоля) (R,S)-N-[α-(1-гидроксиэтил)бензил] -2-фенилхинолин-4-карбоксамида (соединение примера 17), растворенного в 25 мл сухого CH2Cl2 с поддержанием температуры между -50 и -55oC. Через 30 минут при -55oC добавлялось 1,9 мл (13,6 ммоля) TEA без превышения -40oC, затем реакционной смеси давалось достичь комнатной температуры и она перемешивалась дополнительные 15 минут. Реакционная смесь гасилась 5 мл воды и экстрагировалась CH2Cl2; органический слой промывался водой, 20% лимонной кислотой, насыщенным раствором NaHCO3 и солевым раствором; органический слой отделялся, сушился над сульфатом натрия и выпаривался в вакууме досуха. Остаточное масло подвергалось мгновенной хроматографии на силикагельной колонке 230-400 меш, элюировалось смесью гексан/этилацетат 70:30, содержащей 0,5% конц. NH4OH, давая 0,64 г неочищенного продукта, который растирался с теплой смесью изо-Pr2O/изо-PrOH 2: 1, фильтровался и сушился, давая 0,5 г целевого соединения.
C25H20N2O2
Т.пл. = 160-161oC
М.В. = 380,45
Элементный анализ: Вычислено C 78,93; H 5,30; N 7,36
Найдено C 79,01; H 5,31; N 7.27
И.К. (KBr): 3400; 3265; 1725; 1660; 1640; 1592 см-1.
300 МГц 1H-ЯМР (ДМСО-d6): δ 9,60 (д, 1Н); 8,29 (д, 2Н); 8,17 (д, 1Н); 8,14 (д, 1H); 8,12 (с, 1Н); 7,82 (дд, 1Н); 7,65 (дд, 1H); 7,61-7,51 (м, 5Н); 7,48-7,36 (м, 3Н); 2,19 (с, 3Н).
МC (EI; источник 200oC; 70 эВ; 200 мкА): 380 (М+.); 337; 232; 204.
Пример 97
(R,S)-N-[α-(2-гидроксиэтил)бензил]-2-фенилхинолин-4-карбоксамид
0,7 г (1,7 ммоля) (R,S)-N-[α-(метоксикарбонилметил)бензил]-2-фенилхинолин-4-карбоксамида (соединение примера 15) растворялось в 50 мл трет-BuOH и 2 мл MeOH в атмосфере азота. К кипящему раствору в течение 15 минут добавлялось 60 мг (1,6 ммоля) NaBH4. Реакционная смесь нагревалась с обратным холодильником в течение 6 часов, гасилась 5 мл насыщенного раствора NH4Cl и затем выпаривалась в вакууме досуха. Остаток растворялся в CH2Cl2 и промывался солевым раствором; органический слой отделялся, сушился над сульфатом натрия и выпаривался в вакууме досуха. Неочищенный продукт подвергался мгновенной хроматографии на силикагельной колонке 230-400 меш, элюировался Et2O, содержащим 0,5% конц. NH4OH, и затем кристаллизовался из изо-PrOH, давая 0,19 г целевого соединения.
C25H22N2O2
Т.пл. = 167-169oC
М.В. = 382,47
Элементный анализ: Вычислено C 78,52; H 5,80; N 7,32
Найдено C 78,49; H 5,79; N 7,29
И.К. (KBr): 3360; 1650; 1592 см-1.
300 МГц 1H-ЯМР (ДМСО-d6): δ 9,30 (д, 1Н); 8,31 (д, 2Н); 8,13 (д, 1Н); 8,10 (с, 1Н); 8,03 (д, 1Н); 7,81 (дд, 1Н); 7,64-7,51 (м, 4Н); 7,46 (д, 2Н); 7,39 (дд, 2Н); 7,29 (дд, 1Н); 5,30 (дт, 1Н); 4,61 (т, 1Н); 3,61-3,41 (м, 2Н); 2,11-1,86 (м, 2Н).
МС (EI; источник 200oC; 70 эВ; 200 мкА): 382 (М+.); 337; 232; 204.
Пример 98
Хлоргидрат (S)-N-( этилбензил)-3-(2- диметиламиноэтокси)-2-фенилхинолин-4-карбоксамида
этилбензил)-3-(2- диметиламиноэтокси)-2-фенилхинолин-4-карбоксамида
0,62г (1,6 ммоля) (S)-N-(α-этилбензил)-3-гидpoкси-2-фенилхинолин-4-карбоксамида (соединение примера 85) растворялось в 30 мл сухого ДМФ. 3атем добавлялось 0,58 г (4,0 ммоля) хлоргидрата диметиламиноэтилхлорида и 0,56 г (4,0 ммоля) K2CO3, и реакционная смесь нагревалась с обратным холодильником в течение 20 часов. K2CO3 отфильтровывался, и смесь выпаривалась в вакууме досуха, растворялась в AcOEt и промывалась водой и 20% лимонной кислотой. Водный слой подщелачивался 2 норм. NaOH и экстрагировался EtOAc; органический слой промывался солевым раствором, отделялся, сушился над сульфатом натрия и выпаривался в вакууме досуха. Остаток подвергался мгновенной хроматографии на силикагельной колонке с 230-400 отверстиями, элюировался смесью CH2Cl2/MeOH 98: 2, содержащей 0,4% конц. NH4OH, и затем смесью CH2Cl2/MeOH 86: 10, содержащей 0,6% конц. NH4ОH, давая 85 мг неочищенного продукта, который растворялся в EtOAc и обрабатывался смесью HCl/Et2O для получения 75 мг целевого соединения.
C29H31N3O2 • HCl
Т.пл. = 70oC разлож.
М.В. = 490,05
И.К. (нуйол): 3600; 3100; 1650: 1550 см-1.
300 МГц 1H-ЯМР (ДМСО-d6): δ 10,28 (шир.с, 1Н); 9,50 (д, 1Н); 8,10 (д, 1Н); 7,96 (дд, 2Н); 7,78 (м, 1Н); 7,67-7,61 (м, 2H); 7,61-7,51 (м, 3Н); 7,49-7,39 (м, 4Н); 7,33 (дд, 1Н); 5,08 (дт, 1Н); 3,90 (т, 2Н); 2,96 (дт, 2Н); 2,49 (с, 6Н); 1,85 (м, 2Н); 0,97 (т, 3Н).
МС (FAB POS. , тиоглицериновая матрица, Xe газ, 8 КэВ, источник 50oC): 454 (МН+).
Пример 99
(S)-N-(α-этилбензил)-3-ацетиламино-2-фенилхинолин-4-карбоксамид
0.40 г (1.05 ммоля) (S)-N-( α- этилбензил)-3-амино-2-фенилхинолин-4- карбоксамида (соединение примера 69) нагревалось в 25 мл уксусного ангидрида при 70oC в течение 1 часа и затем при 100oC в течение дополнительных 3 часов. Реакционная смесь затем выпаривалась в вакууме досуха, и остаток растворялся в EtOAc; раствор промывался водой, насыщенным раствором NaHCO3, солевым раствором, сушился над сульфатом натрия и выпаривался в вакууме досуха. Неочищенный продукт (0,39 г) очищался с помощью мгновенной хроматографии на силикагельной колонке, элюировался смесью гексан/EtOAc/конц. NH4OH 70: 30: 0.5 соответственно, давая 0,2 г чистого соединения, которое перекристаллизовывалось из ацетона, давая 0,14 г целевого соединения.
C27H25N3O2
Т.пл. = 268-269oC
М.В. = 423,52
Элементный анализ: Вычислено C 76,57; H 5,95; N 9,92
Найдено C 76,38; H 5,98; N 9,90.
И.К. (KBr): 3230, 1670, 1640, 1555, 1525 см-1
300 МГц 1H-ЯМР (ДМСО-d6): δ 9,65 (с., 1Н), 9,05 (д., 1H), 8,10 (д., 1H), 7,80 (т., 1Н), 7,70-7,50 (м., 4Н), 7,45-7,20 (м., 8Н), 5,08 (дт., 1H), 1,85 (м., 2Н), 1,60 (с., 3Н), 0,97 (т., 3Н).
МС (EI; источник 200oC, 70 эВ, 200 мкА): 423 (М+.), 381, 334, 289, 261, 247, 218.
Пример 100
Хлоргидрат (-)-(S)-N-(α-этилбензил)-3-(3- диметиламинопропокси)-2-фенилхинолин-4-карбоксамида
1,2 г (3,1 ммоля) (-)-(S)-N-(α-этилбензил)-3-гидрокси-2-фенилхинолин-4-карбоксамида (соединение примера 85) растворялось в 15 мл сухого ТГФ. Добавлялся 1,0 г (8,2 ммоля) 3-диметиламинопропилхлорида, растворенного в 10 мл Et2O, 1,3 г (9,4 ммоля) К2CO3 и 0,16 г KI, и реакционная смесь перемешивалась при комнатной температуре в течение 30 минут и затем нагревалась с обратным холодильником в течение 2 часов. Далее каждые 12 часов добавлялось 0,77 г (6,3 ммоля), 1,0 г (8,2 ммоля), 0,6 г (4,9 ммоля) и дополнительно 0,6 г (4,9 ммоля) 3-диметиламинопропилхлорида, каждый раз растворенного в 10 мл Et2O, и немного KI, и реакционная смесь нагревалась с обратным холодильником. K2CO3 отфильтровывался, и смесь выпаривалась в вакууме досуха, растворялась в EtOAc и промывалась водой и 20% лимонной кислотой. Водный слой подщелачивался 2 норм. NaOH и экстрагировался EtOAc; органический слой промывался солевым раствором, отделялся, сушился над сульфатом натрия и выпаривался в вакууме досуха. Остаток подвергался мгновенной хроматографии на силикагельной колонке 230 - 400 меш, элюировался смесью CH2Cl2/MeOH 95:5, содержащей 0,5% конц. NH4OH, давая 0,9 г неочищенного продукта, который растворялся в EtOAc и обрабатывался смесью HCl/Et2O, давая 0,62 г целевого соединения.
C30H33N3O2 • HCl,
Т.пл. = 108oC разл.
М.В. = 504,08
[α]
И.К. (KBr): 3400, 3080, 1655, 1545 см-1.
300 МГц 1H-ЯМР (ДМСО-d6): δ 10,55 (шир.с., 1H), 9,35 (д., 1H), 8,09 (д., 1H), 7,92 (дд. , 2Н), 7,76 (ддд., 1H), 7,65-7,51 (м., 5Н), 7,48-7,40 (м., 4Н), 7,31 (дд., 1Н), 5,10 (дт., 1H), 3,72-3,62 (м., 2Н), 2,75-2,60 (м., 2Н), 2,58 (д., 3Н), 2,56 (д., 3Н), 1,90-1,67 (м., 4Н), 1,00 (т., 3Н).
МС (EI; источник 180oC, 70 В, 200 мА): 467 (М+.), 466, 395, 58.
Пример 101
Хлоргидрат (-)-(S)-N-(α-этилбензил)-3-[2-(1- фталоил)-этокси]-2-фенилхинолин-4-карбоксамида
1,9 г (5,0 ммолей) (-)-(S)-N-( α- этилбензил)-3-гидрокси-2-фенилхинолин-4-карбоксамида (соединение примера 85) растворялось в 20 мл сухого ТГФ. 3атем добавлялось 3,8 г (14,9 ммоля) 2-фталимидоэтилбромида, растворенного в 15 мл ТГФ, 2,0 г (14,5 ммоля) K2CO3 и 0,25 г KI, и реакционная
смесь перемешивалась при комнатной температуре в течение 2,5 часов и затем нагревалась с обратным холодильником в течение 2 часов. 3атем добавлялось 1,9 г (7,4 ммоля) 2-фталимидоэтилбромида и немного KI, и реакционная смесь нагревалась с обратным холодильником дополнительно 3,5 часа. Снова добавлялось 0,5 г (2,0 ммоля) 2-фталимидоэтилбромида и немного KI, и смесь нагревалась с обратным холодильником в течение 5 часов. K2CO3 отфильтровывался, и смесь выпаривалась в вакууме досуха, растворялась в CH2Cl2 и промывалась водой. Органический слой сушился над сульфатом натрия и выпаривался в вакууме досуха. Остаток подвергался мгновенной хроматографии на силикагельной колонке 230 - 400 меш, элюировался смесью гексан/EtOAc 80:20, содержащей 0,5% конц. NH4OH и затем смесью гексан/EtOAc 60:40, содержащей 0,5% конц. NH4OH, давая 2,6 г очищенного продукта, который растирался с изо-Pr2O, давая 2,5 г целевого соединения.
C35H29N3O4
Т.пл. = 172 - 175oC
М.В. = 555,64
[α]
И.К. (KBr): 3280, 3060, 2960, 1780, 1715, 1660, 1530 см-1.
300 МГц 1H-ЯМР (ДСМО-d6): δ 9,27 (д., 1H), 8,03 (д., 1Н), 7,92-7,84 (м., 4Н), 7,78-7,69 (м., 3Н), 7,60-7,53 (м., 2Н), 7,46- 7,38 (м., 4Н), 7,27 (дд., 1Н), 7,13-7,04 (м., 3Н), 4,96 (дт., 1Н), 3,92-3,78 (м., 2Н), 3,72-3,55 (м., 2Н), 1,78 (д. кв., 2Н), 0,93 (т., 3Н).
MС (EI; источник 180oC, 70 В, 200 мА): 555 (М+.), 526, 421, 174.
Пример 102
Хлоргидрат (-)-(S)-N-(α-этилбензил)-3-(2-аминоэтокси)-2- фенилхинолин-4-карбоксамида
2,2 г (3,9 ммоля) хлоргидрата (-)-(S)-N-[ α- этилбензил)-3- [2-(1-фталоил)этокси]-2-фенилхинолин-4-карбоксамида (соединение примера 101) растворялось в 150 мл 96% EtOH, и к кипящему раствору добавлялось 0,38 мл (7,8 ммоля) гидразингидрата, и раствор нагревался с обратным холодильником в течение 4 часов. Далее через каждые 12 часов добавлялось 0,4 мл (8,2 ммоля), 0,2 мл (4,1 ммоля), 0,2 мл (4,1 ммоля), 0,4 мл (8,2 ммоля) и 0,4 мл (8,2 ммоля) гидразингидрата и реакционная смесь поддерживалась при нагревании с обратным холодильником. Реакционная смесь затем выпаривалась в вакууме досуха, растворялась в 20 мл воды, охлаждалась и подкислялась 10 мл конц. НС1. Смесь кипятилась в течение 1 часа и охлаждалась, фталгидразид отфильтровывался. Водный слой промывался EtOAc и затем подщелачивался 2 норм. NaOH и экстрагировался EtOAc, органический слой промывался солевым раствором, отделялся, сушился над сульфатом натрия и выпаривался в вакууме досуха. Остаток подвергался хроматографии на силикагельной колонке 230 - 400 меш, элюировался смесью EtOAc/MeOH 96:4, содержащей 1,2% конц. NH4OH, давая очищенный продукт, который растворялся в EtOAc и обрабатывался смесью HCl/Et2O, давая 1,2 г целевого соединения.
C27H27N3O2 • HCl
Т.пл. = 119oC разл.
М.В. = 462,00
[α]
И.К. (KBr): 3400, 3080, 1640, 1545 см-1
300 МГц 1H-ЯМР (ДМСО-d6): δ 9,45 (д., 1Н), 8,09 (д., 1Н), 8,00 (дд., 1Н), 7,94 (шир.с., 3Н), 7,76 (ддд., 1Н), 7,65-7,51 (м., 4Н), 7,48-7,40 (м., 3Н), 7,31 (дд., 1Н), 5,09 (дт., 1Н), 3,83 (т., 2Н), 2,72 (м., 2Н), 1,93-1,80 (м., 2Н), 0,99 (т., 3Н).
МС (FAB POS, тиоглицериновая матрица, Xe газ, 8 кэВ, источник 50oC): 426 (МН+).
Пример 103
Хлоргидрат (+)-(S)-N-( α- этилбензил)-3-[2- (1-пирролидинил)этокси]-2-фенилхинолин-4-карбоксамида
2,0 г (5,2 ммоля) (-)-(S)-N-( α- этилбензил)-3-гидрокси-2- фенилхинолин-4-карбоксамида (соединение примера 85) растворялось в 25 мл сухого ТГФ. Добавлялись 1,0 г (7,5 ммоля) 2-пирролидиноэтилхлорида и 2,2 г (15,9 ммоля) K2CO3, и реакционная смесь перемешивалась при комнатной температуре в течение 30 минут и затем нагревалась с обратным холодильником, к кипящему раствору добавлялось 1,1 г (8,2 ммоля) 2-пирролидиноэтилхлорида, и раствор нагревался с обратным холодильником в течение ночи. K2CO3 отфильтровывался, и смесь выпаривалась в вакууме досуха, растворялась в EtOAc и промывалась водой и 20% лимонной кислотой. Водный слой подщелачивался 2 норм. NaOH и экстрагировался EtOAc, органический слой промывался солевым раствором, отделялся, сушился над сульфатом натрия и выпаривался в вакууме досуха. Остаток подвергался мгновенной хроматографии на силикагеле 230 - 400 меш, элюировался смесью CH2Cl2/MeOH 97:3, содержащей 0,5% конц. NH4OH, давая 1,8 г очищенного продукта, который растворялся в EtOAc и обрабатывался смесью HCl/Et2O, давая 2,0 г целевого соединения.
C31H33N3O2 • HCl
Т.пл.= 110 - 115oC (разл.)
М.В. = 516,08
[α]
И.К. (KBr): 3400, 3080, 1655, 1545 см-1.
300 МГц 1H-ЯМР (ДМСО-d6): δ 10,50 (шир.с., 1H), 9,50 (д., 1H), 8,10 (д., 1H), 7,96 (дд., 2Н), 7,78 (ддд., 1H), 7,68-7,30 (м., 10Н), 5,10 (дт., 1H), 3,90 (м. , 2Н), 3,20 (м., 2Н), 3,00 (м., 2Н), 2,65 (м., 2Н), 1,95-1,65 (м., 6Н), 1,94 (т., 3Н).
МС (EI; источник 180oC, 70 В, 200 мА): 479 (М+.), 478, 383, 97,84.
Пример 104
(-)-(S)-N-(α-этилбензил)-3-(диметиламиноацетиламино)-2- фенилхинолин-4-карбоксамид
1,1 г (2,8 ммоля) (-)-(S)-N-( α- этилбензил)-3-амино-2-фенилхинолин-4-карбоксамида (соединение примера 69) растворялось в 10 мл теплого толуола в атмосфере азота. К раствору по каплям добавлялось 0,96 г (5,6 ммоля) хлоруксусного ангидрида, растворенного в 5 мл толуола, и раствор нагревался с обратным холодильником в течение 1 часа. Реакционная смесь выпаривалась в вакууме досуха, суспендировалась в 10 мл CH2Cl2 и по каплям вливалась в 5 мл охлажденной льдом смеси 28% Me2NH/EtOH. Раствор перемешивался при комнатной температуре в течение ночи, затем добавлялось 15 мл смеси 28% Me2NH/EtOH, и реакционная смесь нагревалась при 60oC в аппарате Парра. Смесь выпаривалась в вакууме досуха, растворялась в 20% лимонной кислоте и промывалась EtOAc. Водный слой подщелачивался 2 норм. NaOH и экстрагировался EtOAc, органический слой промывался солевым раствором, отделялся, сушился над сульфатом натрия и выпаривался в вакууме досуха, давая 1,4 г неочищенного продукта. Данный продукт растирался с теплым изо-Pr2O, давая 0,86 г целевого соединения.
C29H30N4O2
Т.пл. = 189 - 191oC
М.В. = 466,59
[α]
И.К. (KBr): 3230, 3180, 1670, 1630, 1540 см-1.
300 МГц 1H-ЯМР (ДМСО-d6): δ 9,41 (с., 1Н), 8,97 (д., 1Н), 8,08 (д., 1Н), 7,81 (дд., 1Н), 7,70-7,59 (м., 4Н), 7,49-7,26 (м., 8Н), 5,00 (дт., 1Н), 2,55 (с., 2Н), 1,97 (с., 3Н), 1,90-1,65 (м., 2Н), 0,93 (т., 3Н).
МС (EI; источник 180oC, 70В, 200 мА): 466 (М+.), 331, 58.
Пример 105
N-( α,α- диметилбензил)-3-гидрокси-2-фенилхинолин-4-карбоксамид
2,0 г (7,5 ммолей) 3-гидрокси-2-фенилхинолин-4-карбоновой кислоты в атмосфере азота растворялось в 70 мл сухого ТГФ и 30 мл CH3CN. 3атем добавлялось 1,02 г (7,5 ммоля) кумиламина и 1,12 г (8,3 ммоля) N-гидроксибензотриазола (НОВТ), и реакционная смесь охлаждалась при -10oC. По каплям добавлялось 1,71 г (8,3 ммоля) DCC, растворенного в 20 мл CH2Cl2 и раствор выдерживался при -5oC в течение 2 часов, а затем при комнатной температуре в течение ночи. Осажденная дициклогексилмочевина отфильтровывалась, и раствор выпаривался в вакууме досуха. Остаток растворялся в CH2Cl2 и промывался водой, насыщенным раствором NaHCO3, 5% лимонной кислотой, насыщенным раствором NaHCO3 и солевым раствором. Органический слой отделялся, сушился над сульфатом натрия и выпаривался в вакууме досуха, остаток растворялся в 20 мл CH2Cl2 и оставлялся на ночь. Осаждалось еще некоторое количество дициклогексилмочевины и отфильтровывалось. Раствор выпаривался в вакууме досуха, давая 1,4 г неочищенного продукта, который подвергался мгновенной хроматографии на силикагеле 230 - 400 меш, элюировался сначала смесью гексан/EtOAc 9:1, а затем смесью гексан/EtOAc 8:2, давая 0,4 г очищенного продукта, который перекристаллизовывался дважды из изо-PrOH, давая 0,15 г целевого соединения.
C25H22N2O2
Т.пл. = 166 - 169oC (разл.)
М.В. = 382,47
И.К. (нуйол): 3200, 1650, 1580, 1535 см-1.
300 МГц 1H-ЯМР (ДМСО-d6): δ 9,56 (с., 1Н), 8,92 (шир.с., 1Н), 8,00-7,94 (м. , 3Н), 7,76 (шир.д., 1Н), 7,63-7,45 (м., 7Н), 7,36 (дд., 2Н), 7,24 (дд., 1Н), 1,72 (с., 6Н).
МС (EI; источник 180oC, 70 В, 200 мА): 382 (М+.), 264, 247, 219, 119.
Пример 106
N-( α,α- диметилбензил)-3-амино-2-фенилхинолин-4-карбоксамид
2,0 г (7,6 ммоля) 3-амино-2-фенилхинолин-4-карбоновой кислоты в атмосфере азота растворялось в 70 мл сухого ТГФ и 30 мл CH3CN. 3атем добавлялось 1,02 г (7,6 ммоля) кумиламина и 1,12 г (8,3 ммоля) N-гидроксибензотриазола (НОВТ), и реакционная смесь охлаждалась при -10oC. По каплям добавлялось 1,72 г (8,3 ммоля) DCC, растворенного в 20 мл CH2Cl2, и раствор выдерживался при - 5oC в течение 2 часов и затем при комнатной температуре в течение ночи. Осажденная дициклогексилмочевина отфильтровывалась, и раствор выпаривался в вакууме досуха. Остаток растворялся в CH2Cl2 и промывался водой, насыщенным раствором NaHCO3, 5% лимонной кислотой, насыщенным раствором NaHCO3 и солевым раствором. Органический слой отделялся, сушился над сульфатом натрия и выпаривался в вакууме досуха, остаток растворялся в 20 мл CH2Cl2 и оставлялся на ночь. Осаждалось еще некоторое количество дициклогексилмочевины и отфильтровывалось. Раствор выпаривался в вакууме досуха с получением 2,0 г неочищенного продукта, который подвергался мгновенной хроматографии на силикагеле 230 - 400 меш, элюировался смесью гексан/EtOAc 6:4, содержащей 1% конц. NH4OH, давая 0,9 г очищенного продукта, который перекристаллизовывался из смеси гексан/ЕtOAc 1:1 и затем из изо-PrOH, давая 0,45 г целевого соединения.
C25H23N3O
Т.пл. = 166- 168oC
М.В. = 381,48
И.К. (нуйол): 3460, 3360, 3220, 1667, 1605, 1527 см-1.
300 МГц 1H-ЯМР (ДМСО-d6): δ 9,05 (с., 1H), 7,87 (дд., 1H), 7,74-7,68 (м. , 3Н), 7,60-7,42 (м., 7Н), 7,37 (дд., 2Н), 7,24 (дд., 1Н), 4,74 (с., 2Н), 1,71 (с., 6Н).
МС (EI; источник 180oC, 70 В, 200 мА): 381 (М+.), 263, 218, 119.
Пример 107
(-)-(S)-N-( α- этилбензил)-5-метил-2-фенилхинолин-4-карбоксамид
0,8 г (3,04 ммоля) 5-метил-2-фенилхинолин-4-карбоновой кислоты в атмосфере азота растворялось в 30 мл сухого ТГФ и 12 мл CH3CN. Добавлялось 0,43 г (3,20 ммоля) (S)-(-)- α- этилбензиламина и 0,78 г (5,78 ммоля) N-гидроксибензотриазола (НОВТ), и реакционная смесь охлаждалась при -10oC. По каплям добавлялось 0,69 г (3,34 ммоля) DCC, растворенного в 5 мл CH2Cl2, и раствор выдерживался при -5oC 2 часа и затем при комнатной температуре в течение ночи. Осажденная дициклогексилмочевина отфильтровывалась, и раствор выпаривался в вакууме досуха. Остаток растворялся в CH2Cl2 и промывался водой, насыщенным раствором NaHCO3, 5% лимонной кислотой, насыщенным раствором NaHCO3 и солевым раствором. Органический слой отделялся, сушился над сульфатом натрия и выпаривался в вакууме досуха, остаток растворялся в 10 мл CH2Cl2 и оставлялся на ночь. Осаждалось еще некоторое количество дициклогексилмочевины и отфильтровывалось. Раствор выпаривался в вакууме досуха с получением 1,15 г неочищенного продукта, который подвергался мгновенной хроматографии на силикагеле 230-400 меш, элюировался смесью гексан/EtOAc 6:2, содержащей 0,5% конц. NH4OH, давая 0,47 г очищенного продукта, который перекристаллизовывался из изо-Pr2O, содержащего несколько капель EtOAc, давая 0,36 г целевого соединения в виде белого порошка.
C26H24N2O
Т.пл. = 189 - 192oC
М.В. = 380,49
[α]
И.К. (KBr): 3280, 3070, 3020, 1635, 1545 см-1.
300 МГц 1H-ЯМР (ДМСО-d6): δ 9,20 (д., 1Н), 8,23 (д., 2Н), 7,93 (д., 1Н), 7,78 (с. , 1Н), 7,20-7,70 (м. , 10Н), 5,00 (дт., 1Н), 2,38 (шир.с., 3H), 1,70-1,90 (м., 2Н), 0,95 (т., 3Н).
МС (EI; источник 180oC, 70 В, 200 мА): 380 (М+.), 246, 218.
Пример 108
(R, S)-N-[ α- (1-гидроксиэтил)бензил]- 3-метил-2-фенилхинолин-4-карбоксамид
Получено, как описано в примере 1, исходя из 11,08 г (39,33 ммоля) неочищенного 3-метил-2-фенилхинолин-4-карбонилхлорида, 4,87 г (32,20 ммоля) 1-фенил-2-гидроксипропиламина и 10,33 мл (74,14 ммоля) TEA в 150 мл смеси 1: 1 сухого CH2Cl2 и CH3CN. Осажденный хлоргидрат TEA отфильтровывался, и фильтрат концентрировался в вакууме досуха, остаток растворялся в CH2Cl2 (100 мл) и промывался насыщенным раствором NaHCO3, 20% лимонной кислотой и солевым раствором. Органический слой сушился над сульфатом натрия и выпаривался в вакууме досуха, давая 13,23 г масла, которое кристаллизовалось из изо-PrО2 (100 мл), содержащего 6 мл изо-PrOH, давая 9,14 г целевого соединения в виде не совсем белого твердого вещества.
C26H24N2O2
Т.пл. = 163-165oC
М.В. = 396,49
И.К. (нуйол): 3400, 3260, 1635, 1580 см-1
Пример 109
(R, S)-N-[ α- (1-метилкарбонил)бензил] -3-метил-2-фенилхинолин- 4-карбоксамид
Получался, как описано в примере 96, исходя из 3,25 г (25,60 ммоля) оксалилхлорида, 3,88 г (49,66 ммоля) ДМСО, 8,2 г (20,68 ммоля) (R,S)-N-[ α- (1-гидроксиэтил)бензил] - 3-метил-2-фенилхинолин-4-карбоксамида (соединение примера 108) и 15,72 мл (112,76 ммоля) TEA в 230 мл сухого CH2Cl2. Реакционная смесь гасилась 40 мл воды, и органический слой отделялся и промывался 20% лимонной кислотой, насыщенным раствором NaHCO3 и солевым раствором. Органический слой сушился над сульфатом натрия и выпаривался в вакууме досуха, давая 9,4 г неочищенного целевого соединения в виде масла. Данное остаточное масло подвергалось мгновенной хроматографии на силикагеле 230 - 400 меш, элюировалось смесью гексан/этилацетат 70:30, содержащей 1% конц. NH4OH, давая 7,7 г очищенного продукта, который кристаллизовался из смеси EtOAc/гексан 1:3 соответственно, давая 6,0 г чистого целевого соединения.
C26H22N2O2
Т.пл. = 156-158oC
М.В. = 394,48
И.К. (нуйол): 3270, 3180, 1735, 1725, 1660, 1630, 1527, 1460 см-1.
300 МГц 1H-ЯМР (ДМСО-d6): δ 9,53 (д., 1H), 8,01 (д., 1H), 7,73 (дд., 1H), 7,62-7,35 (м., 12H), 5,97 (д., 1H), 2,30 (шир.с., 3Н), 2,18 (с., 3Н).
МС (EI; источник 180oC, 70 В, 200 мА): 394 (М+.), 352, 351, 246, 218, 217.
Пример 110
(R,S)-N-[ α- (этил)-4-пиридилметил]-2-фенилхинолин-4-карбоксамид
4,12 г (16,52 ммоля) 2-фенилхинолин-4-карбоновой кислоты растворялось в атмосфере азота в 40 мл сухого CH2Cl2 и 30 мл ТГФ. Добавлялось 1,50 г (11,01 ммоля) 1-(4-пиридил)-n-пропиламина и 2,23 г (16,52 ммоля) N-гидроксибензотриазола (НОВТ), и реакционная смесь охлаждалась при 0oC. По каплям добавлялось 3,41 г (16,52 ммоля) DCC, растворенного в 26 мл сухого CH2Cl2, и раствор выдерживался при 0oC в течение 2 часов и затем перемешивался при комнатной температуре в течение 36 часов. Осажденная дициклогексилмочевина отфильтровывалась, и раствор выпаривался в вакууме досуха. Остаток растворялся в 100 мл CH2Cl2 и промывался водой, 10% K2CO3, 5% лимонной кислотой и солевым раствором. Органический слой отделялся, сушился над сульфатом натрия и выпаривался в вакууме досуха, остаток растворялся в 30 мл CH2Cl2 и оставлялся на ночь. Осаждалось еще некоторое количество дициклогексилмочевины и отфильтровывалось. Раствор выпаривался в вакууме досуха, давая 3,5 г неочищенного продукта, который перекристаллизовывался три раза из изо-PrOH, давая 0,91 г целевого соединения.
C24H21N3O
Т.пл. = 218 - 219oC
М.В. = 367,45
И.К. (KBr): 3260, 3060, 1648, 1595, 1545, 1350 см-1.
300 МГц 1H-ЯМР (ДМСО-d6): δ 9,33 (д., 1H), 8,53 (д., 2H), 8,33 (дд., 2Н), 8,15 (д., 1H), 8,14 (с., 1H), 8,03 (д., 1H), 7,82 (дд., 1H), 7,66- 7,52 (м., 4Н), 7,47 (д., 2Н), 5,05 (дт., 1H), 1,85 (дкв., 2Н), 1,00 (т, 3Н).
MС (EI; источник 180oC, 70 В, 200 мА): 367 (M+.), 338, 232, 204.
Пример 111
(R,S)-N-[ α- этил)-2-тиенилметил]-2-фенилхинолин-4-карбоксамид
1,40 г (8,00 ммолей) хлоргидрата 1-(2-тиенил)-n-пропиламина и 2,45 мл (17,60 ммоля) TEA в атмосфере азота растворялось в 50 мл сухого CH2Cl2 и 30 мл CH3CN. Добавлялось 2,0 г (8,00 ммолей) 2-фенилхинолин-4-карбоновой кислоты и 1,30 г (9,60 ммоля) N-гидроксибензотриазола (НОВТ). По каплям добавлялось 2,48 г (12,0 ммолей) DCC, растворенного в 30 мл сухого CH2Cl2, и раствор перемешивался при комнатной температуре в течение 36 часов. 3атем добавлялось 50 мл 10% HCl, и раствор дополнительно перемешивался 2 часа. Осажденная дициклогексилмочевина отфильтровывалась, и органический слой промывался 10% лимонной кислотой и 10% K2CO3. Органический слой отделялся, сушился над сульфатом натрия и выпаривался в вакууме досуха. Неочищенный продукт подвергался мгновенной хроматографии на силикагеле 230 - 400 меш, элюировался смесью гексан/EtOAc/CH2Cl2 80:15:0,5, давая 2,0 г желтого масла, которое кристаллизовалось из смеси толуол/гексан, давая 0,9 г чистого целевого соединения в виде белых кристаллов.
C23H20N2OS
Т.пл. = 134 - 137oC
М.В. = 372,49
И.К. (KBr): 3230, 3060, 1630, 1590, 1545 см-1.
300 МГц 1H-ЯМР (ДМСО-d6): δ 9,33 (д., 1H), 8,30 (дд., 2Н), 8,15 (д., 1Н), 8,13 (д., 1H), 8,08 (с., 1H), 7,84 (ддд., 1H), 7,68-7,51 (м., 4Н), 7,44 (дд. , 1H), 7,11 (д., 1H), 7,02 (дд., 1H), 5,33 (дт., 1H), 2,10-1,88 (м., 2Н), 1,05 (т., 3Н).
МС (EI; источник 180oC, 70 В, 200 мА): 372 (М+.), 343, 232, 204.
Пример 112 Хлоргидрат (+)-(S)-N-( α- этилбензил)-3- диметиламинометил-2-фенилхинолин-4-карбоксамида
5,60 г (21,27 ммоля) 3-метил-2-фенилхинолин-4-карбоновой кислоты растворялось в 100 мл дихлорэтана. Добавлялось 7,60 г (42,50 ммоля) N-бромсукцинимида и 0,52 г (2,00 ммоля) перекиси дибензоила, и раствор нагревался с обратным холодильником 24 часа. Реакционная смесь выпаривалась в вакууме досуха, суспендировалась в 100 мл смеси 33% Me2NH/EtOH и перемешивалась в течение ночи при комнатной температуре. Раствор выпаривался в вакууме досуха, растворялся в 50 мл 20% K2CO3 и снова выпаривался в вакууме досуха. К остатку добавлялось 50 мл воды, и раствор, подкисленный 37% HCl, выпаривался в вакууме досуха. Неочищенный остаток и 10,8 мл (77,20 ммоля) TEA растворялись в 50 мл CH2Cl2, 50 мл ТГФ и 100 мл CH3CN. Добавлялось 3,00 г (22,20 ммоля) (S)-(-)-α- этилбензиламина, 0,78 г (5,78 ммоля) N-гидроксибензотриазола (НОВТ) и 11,9 г (57,90 ммоля) DCC, и раствор перемешивался при комнатной температуре в течение ночи. Осажденная дициклогексилмочевина отфильтровывалась, и органический слой выпаривался в вакууме досуха. Коричневый маслянистый остаток растворялся в 100 мл CH2Cl2, и осадок отфильтровывался. Фильтрат экстрагировался три раза 40% лимонной кислотой. Водный слой, подщелоченный твердым K2CO3, экстрагировался CH2Cl2, органический слой сушился над сульфатом натрия и выпаривался в вакууме досуха, давая 10 г коричневого масла. Неочищенный продукт подвергался мгновенной хроматографии на силикагеле 230 - 400 меш, элюировался смесью изо-Pr2O/CH2Cl2 9:1, давая 2,5 г белого твердого вещества, которое растворялось в толуоле и оставлялось на ночь. Осажденная DCU отфильтровывалась, и раствор, обработанный этанольной HCl, выпаривался в вакууме досуха. Неочищенный продукт перекристаллизовывался из смеси толуол/EtOH, давая 0,7 г чистого целевого соединения в виде бесцветных кристаллов.
C28H29N3O • HCl
Т.пл. = 164 - 167oC
М.В. = 460,02
[α]
И.К. (KBr): 3440, 3150, 3020, 2560, 2460, 1650, 1540 см-1.
300 МГц 1H-ЯМР (ДМСО-d6, 353 K): δ 9,70 (шир.с., 1H), 8,10 (д., 1H), 7,85 (дд. , 1H), 7,80 (шир.с., 1H), 7,70-7,10 (м., 12Н), 5,15 (дт., 1H), 4,38-4,20 (м. , 2Н), 2,30 (с., 3Н), 2,22 (с., 6Н), 2,10-1,82 (м., 2Н), 1,00 (т., 3Н).
МС (EI; источник 180oC, 70 В, 200 мА): 423 (М+.), 380, 288.
Пример 113
(S)-N-( α- этилбензил)-3-метил-7-метокси-2-фенилхинолин-4- карбоксамид
Получался, как описано в примере 1, исходя из 1,27 г (4,09 ммоля) неочищенного 3-метил-7-метокси-2-фенилхинолин-4- карбонилхлорида, 0,55 г (4,09 ммоля) (S)-(-)- α- этилбензиламина и 1,71 мл (12,27 ммоля) TEA в 24 мл сухого CH2Cl2 и 1 мл ДМФ для способствования растворимости. Реакционная смесь перемешивалась при комнатной температуре в течение 12 часов. После концентрирования в вакууме досуха остаток растворялся в CH2Cl2 (30 мл) и промывался 10% NaHCO3, 5% лимонной кислотой и солевым раствором. Органический слой сушился над сульфатом натрия и выпаривался в вакууме досуха, давая 1,87 г неочищенного продукта, который подвергался мгновенной хроматографии на силикагеле 230 - 400 меш, элюировался смесью гексан/EtOAc 70:30, давая 0,35 г желтого масла.
C27H26N2O2
М.В. = 410,51
И.К. (KBr): 3240, 2965. 2930. 1635. 1535, 1220 см-1
Пример 114
(S)-N-(α-этилбензил)-3-амино-5-метил-2-фенилхинолин-4-карбоксамид
0,75 г (2,64 ммоля) 3-амино-5-метил-2-фенилхинолин-4-карбоновой кислоты в атмосфере азота растворялось в 30 мл сухого ТГФ и 10 мл CH3CN. Добавлялось 0,38 г (2,83 ммоля) (S)-(-)- α- этилбензиламина и 0,69 г (5,18 ммоля) N-гидроксибензотриазола (НОВТ), и реакционная смесь охлаждалась при -10oC. По каплям добавлялось 0.61 г (2.97 ммоля) DCC, растворенного в 5 мл CH2Cl2, и раствор выдерживался при -5 - 0oC 2 часа, нагревался при 50oC 4 часа и затем выдерживался при комнатной температуре в течение ночи. Осажденная дициклогексилмочевина отфильтровывалась, и раствор выпаривался в вакууме досуха. Остаток растворялся в CH2Cl2 и промывался водой, насыщенным раствором NaHCO3, 5% лимонной кислотой, насыщенным раствором NaHCO3 и солевым раствором. Органический слой отделялся, сушился над сульфатом натрия и выпаривался в вакууме досуха; остаток растворялся в 10 мл CH2Cl2 и оставлялся на ночь. Осаждалось еще некоторое количество дициклогексилмочевины и отфильтровывалось. Раствор выпаривался в вакууме досуха с получением 0,86 г неочищенного продукта, который подвергался мгновенной хроматографии на силикагеле 230 - 400 меш, элюировался смесью CH2Cl2/MeOH/конц. NH4OH 90:10:0.5 соответственно, давая 0,41 г целевого соединения в виде масла.
C26H25N3O
М.В. = 395,50
И.К. (KBr): 3480; 3390; 3230; 3020; 1635; 1615; 1545 см-1.
Пример 115
(S)-N-( α- этилбензил) -3-метокси-5-метил-2-фенилхинолин-4-карбоксамид
1,29 г (4,40 ммоля) 3-метокси-5-метил-2-фенилхинолин-4-карбоновой кислоты в атмосфере азота растворялось в 40 мл сухого ТГФ и 20 мл CH3CN. Добавлялось 0,63 г (4,62 ммоля) (S)-(-)-( α- этилбензиламина и 1,13 г (8,36 ммоля) N-гидроксибензотриазола (НОВТ), и реакционная смесь охлаждалась при -10oC. По каплям добавлялся 1,0 г (4,84 ммоля) DCC, растворенного в 5 мл CH2Cl2 и раствор выдерживался при -5oC - 0oC в течение 2 часов, нагревался при 50oC 4 часа и затем оставлялся на ночь при комнатной температуре. Осажденная дициклогексилмочевина отфильтровывалась, и раствор выпаривался в вакууме досуха. Остаток растворялся в CH2Cl2 и промывался водой, насыщенным раствором NaHCO3, 5% лимонной кислотой, насыщенным раствором NaHCO3 и солевым раствором. Органический слой отделялся, сушился над сульфатом натрия и выпаривался в вакууме досуха, остаток растворялся в 20 мл CH2Cl2 и оставлялся на ночь. Осаждалось еще некоторое количество дициклогексилмочевины и отфильтровывалось. Раствор выпаривался в вакууме досуха, давая 2,45 г неочищенного продукта, который подвергался мгновенной хроматографии на силикагеле 230 - 400 меш, элюировался смесью гексан/EtOAc 7:2, содержащей 0,5% конц. NH4OH, давая 0,28 г целевого соединения в виде масла.
C27H26N2O2
М.В. = 410,52
И.К. (KBr): 3270; 3020; 1635; 1535 см-1.
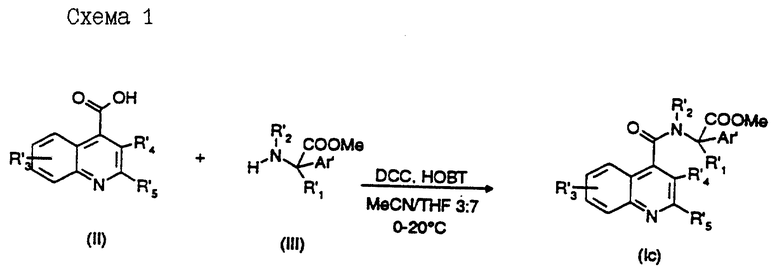
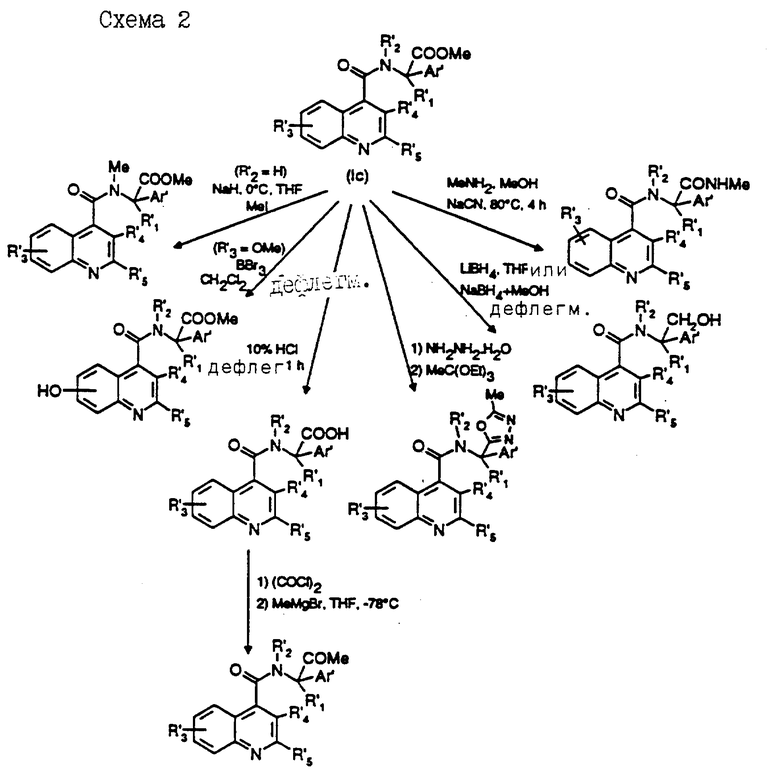
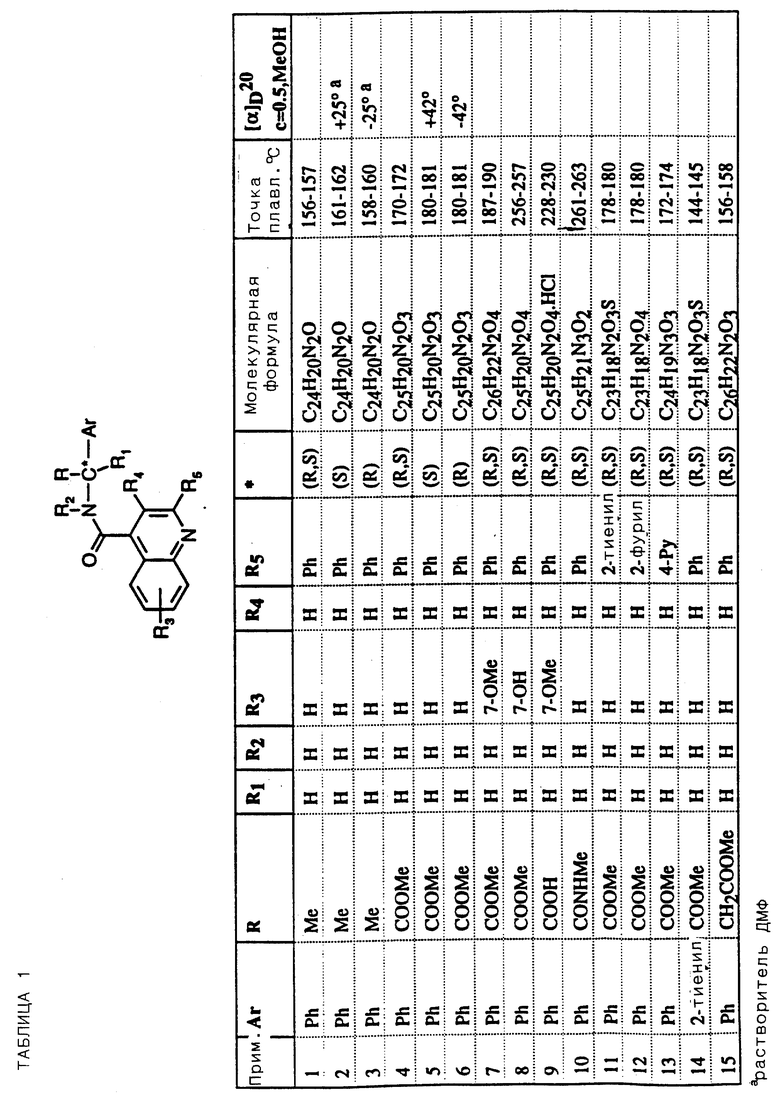
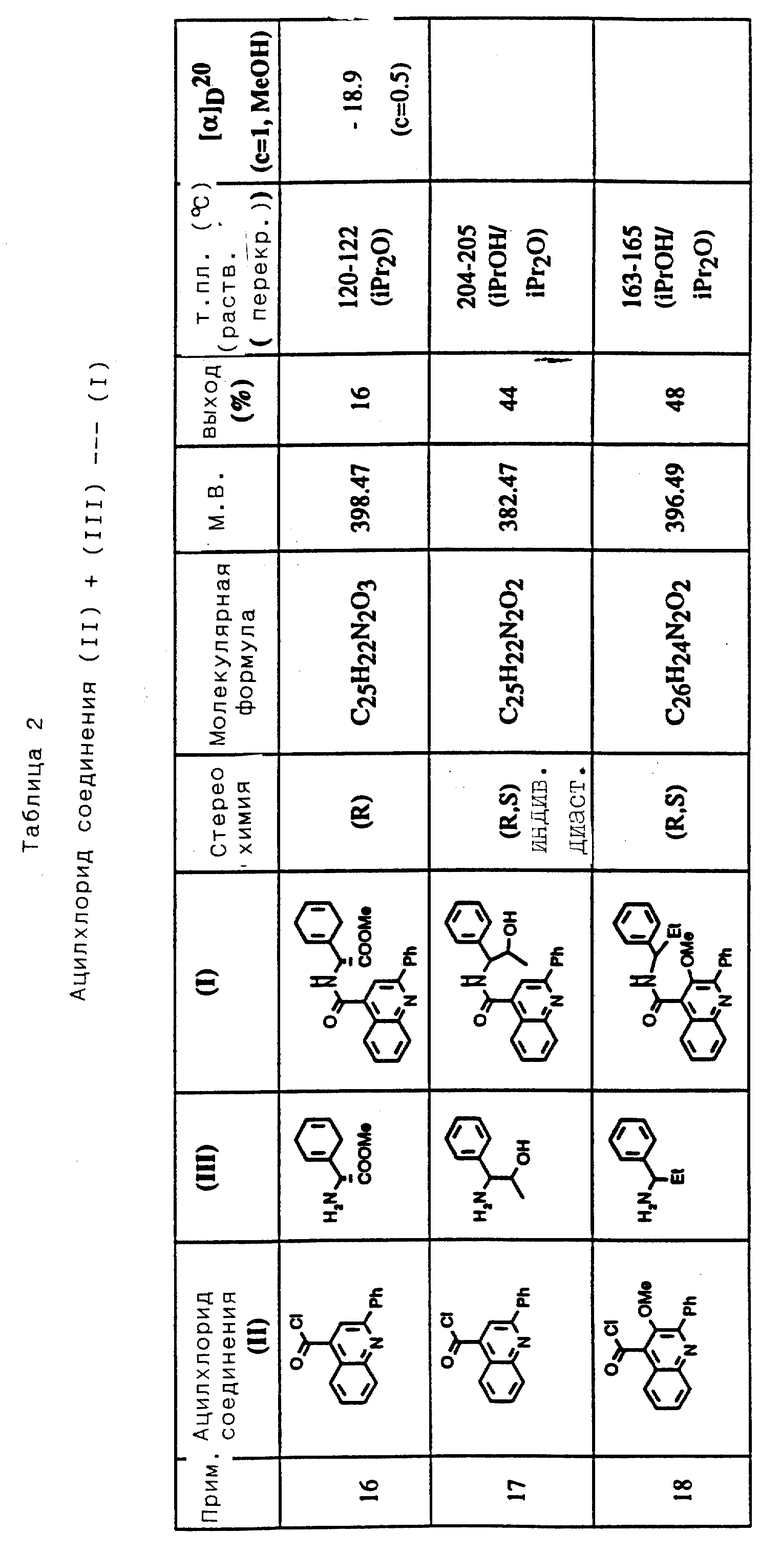
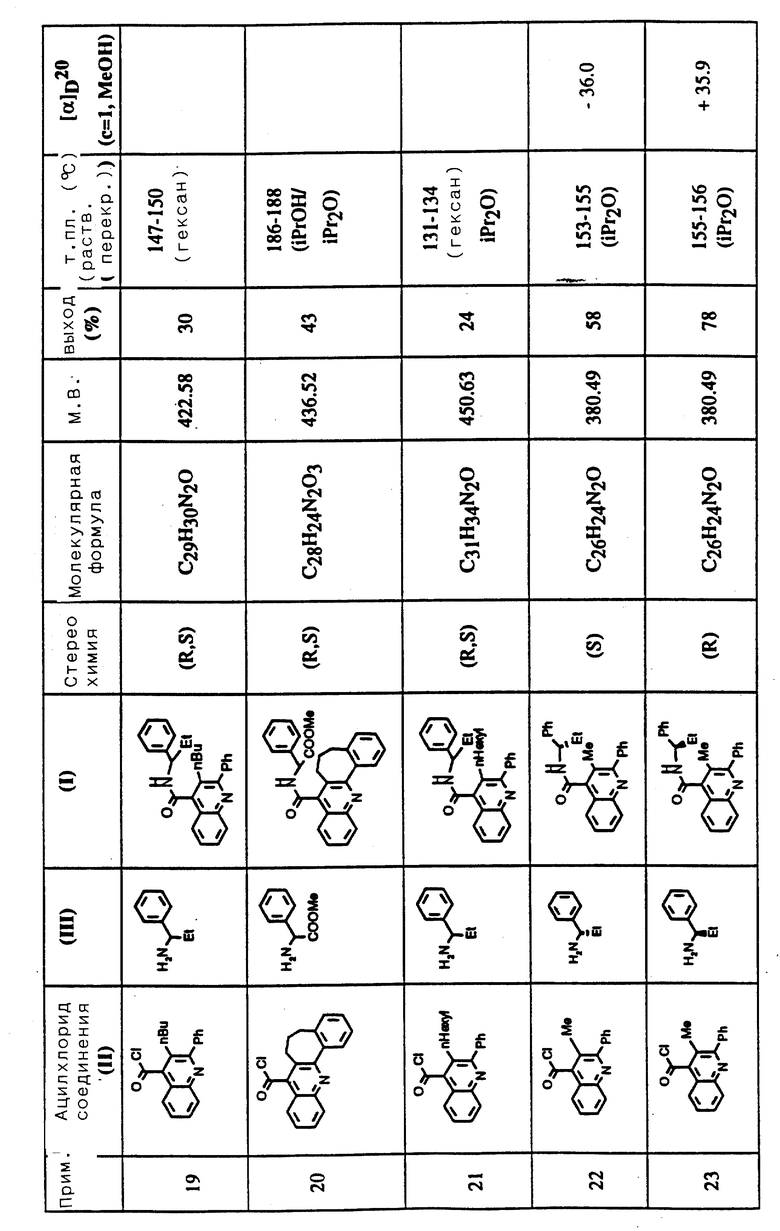
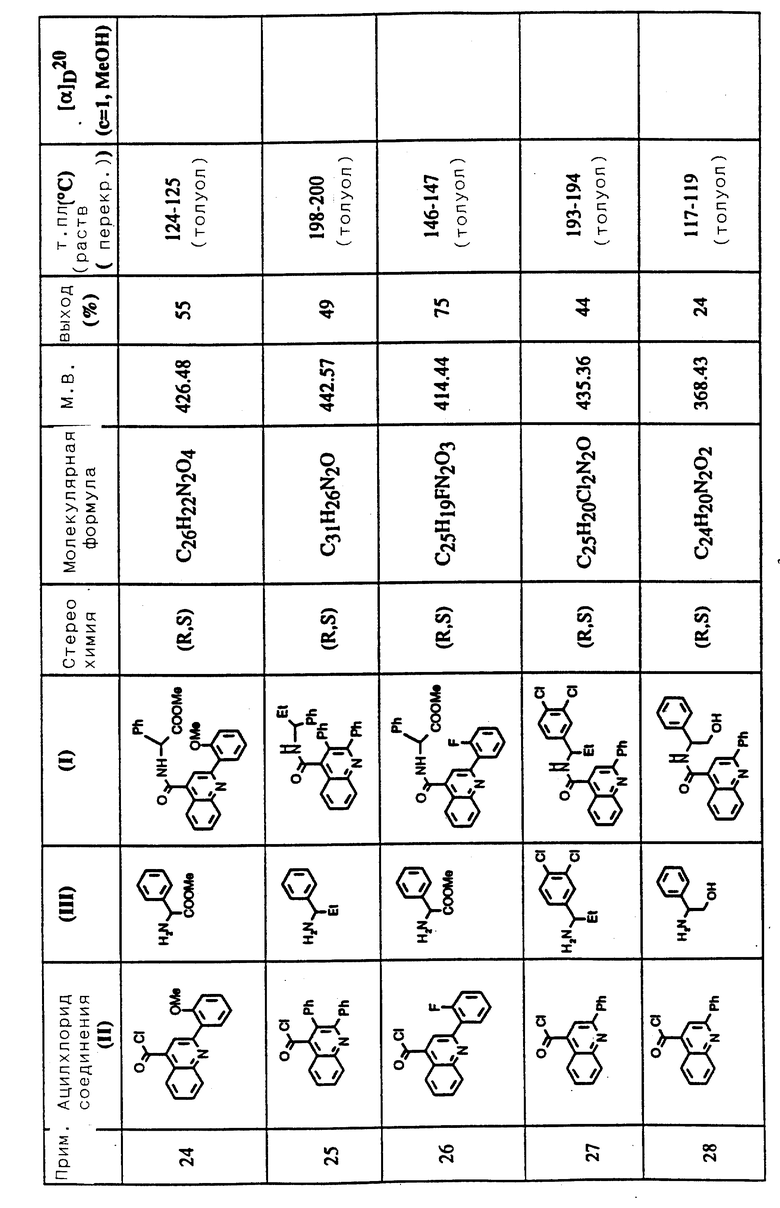
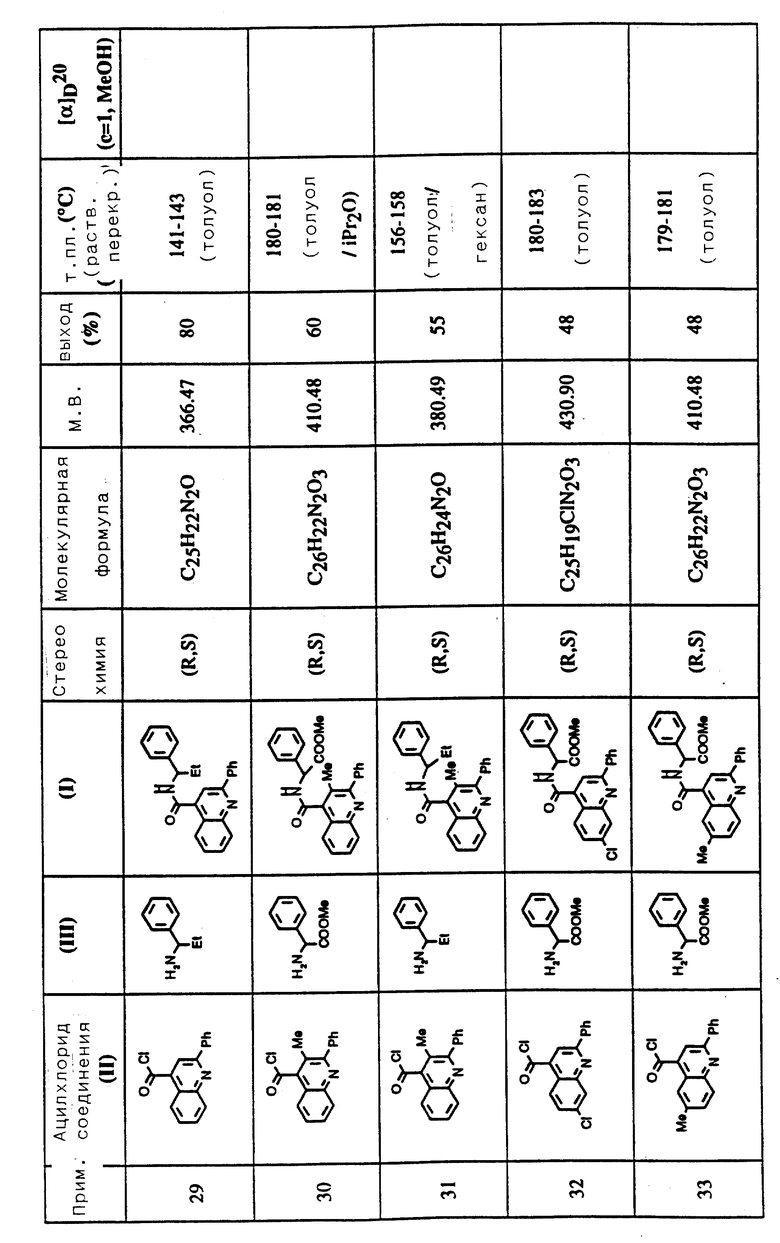
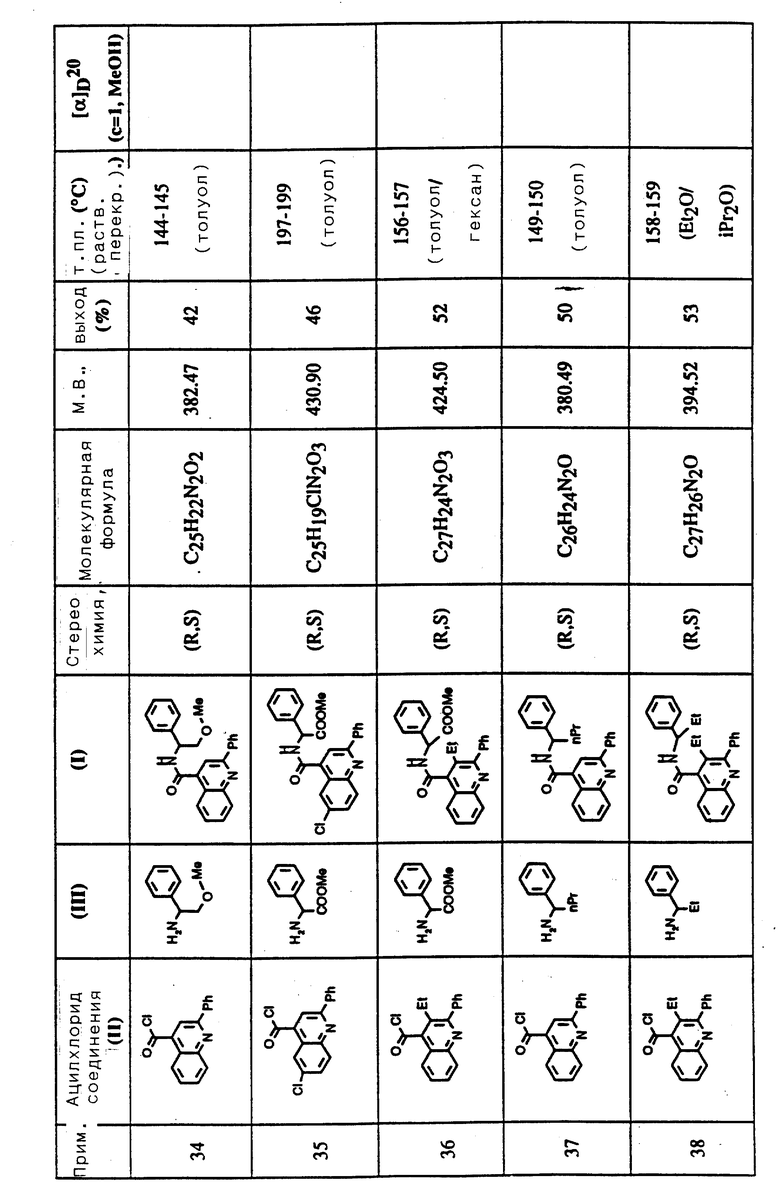
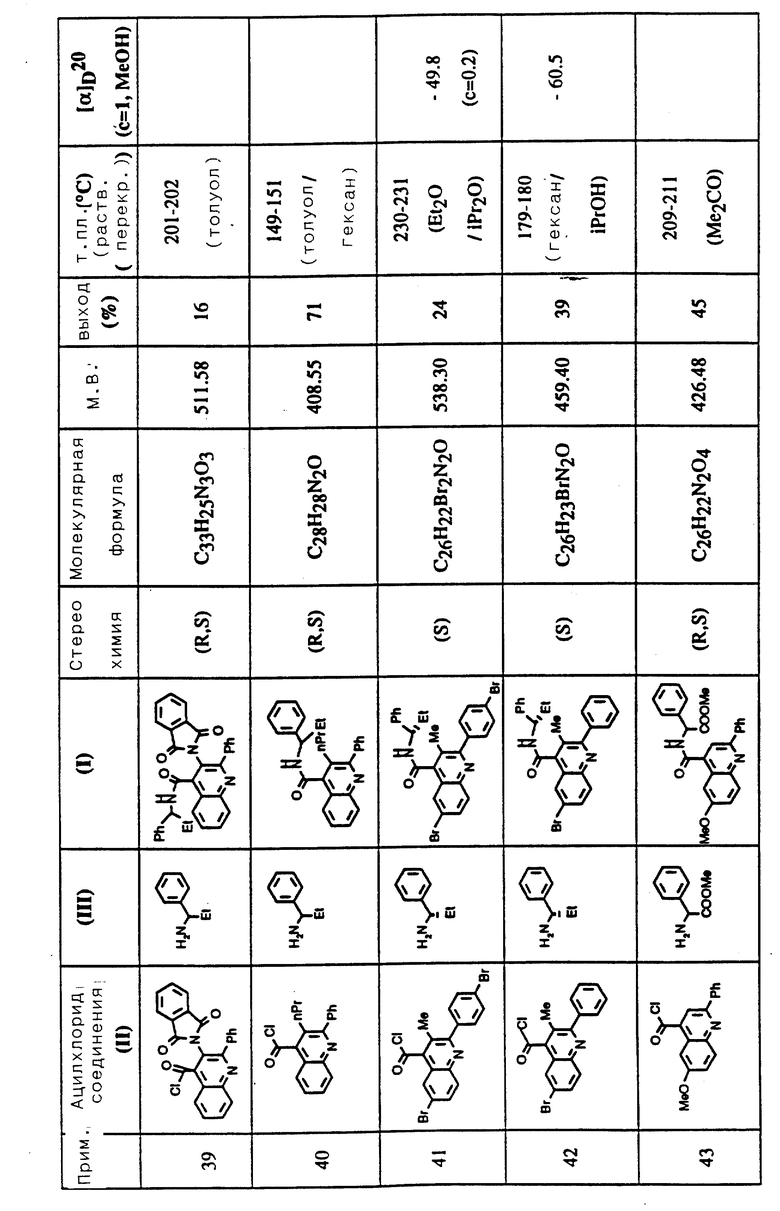
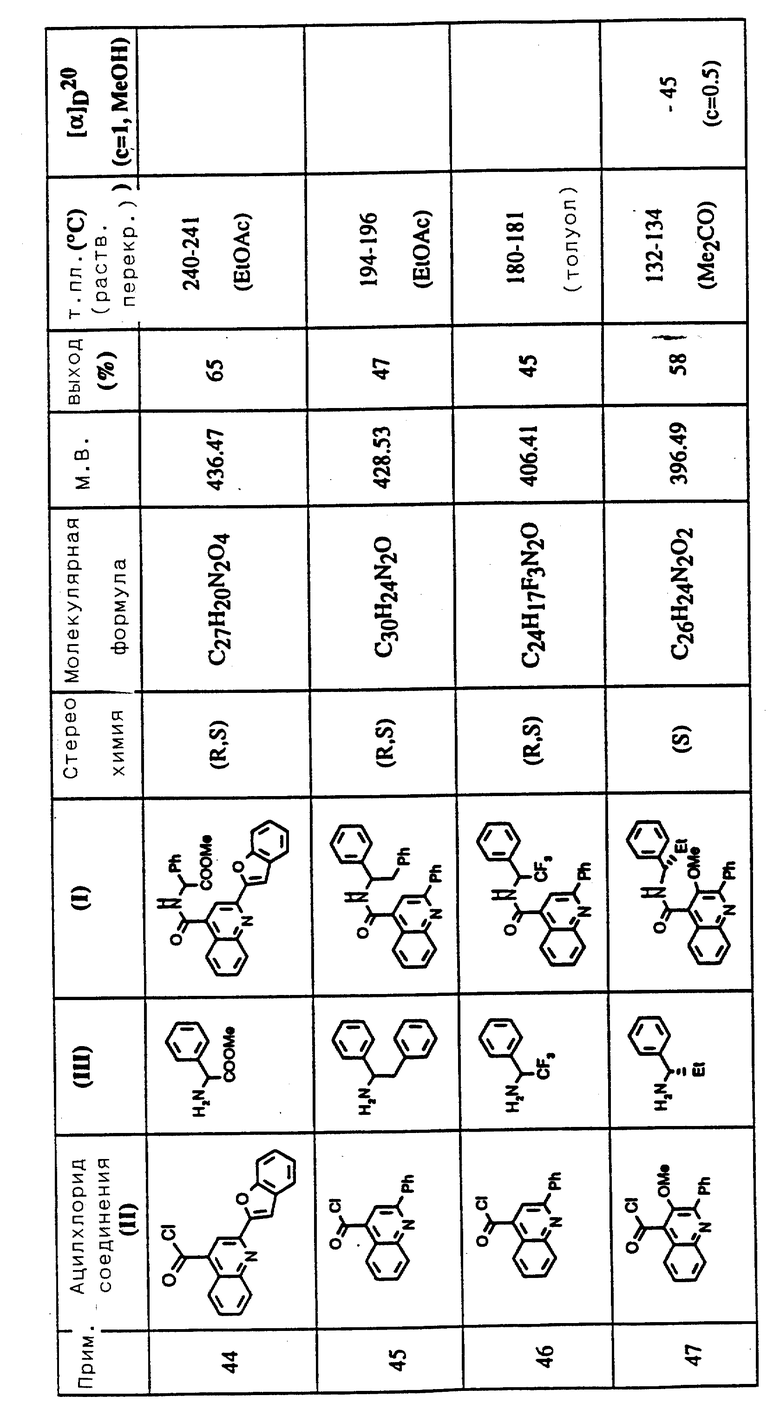
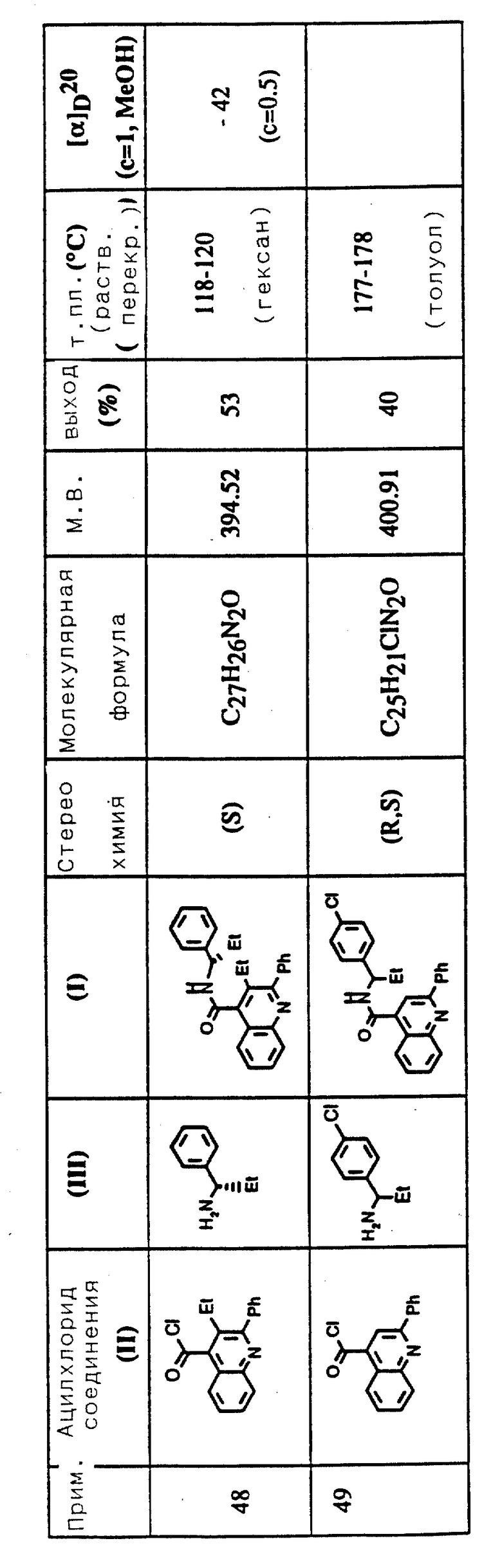
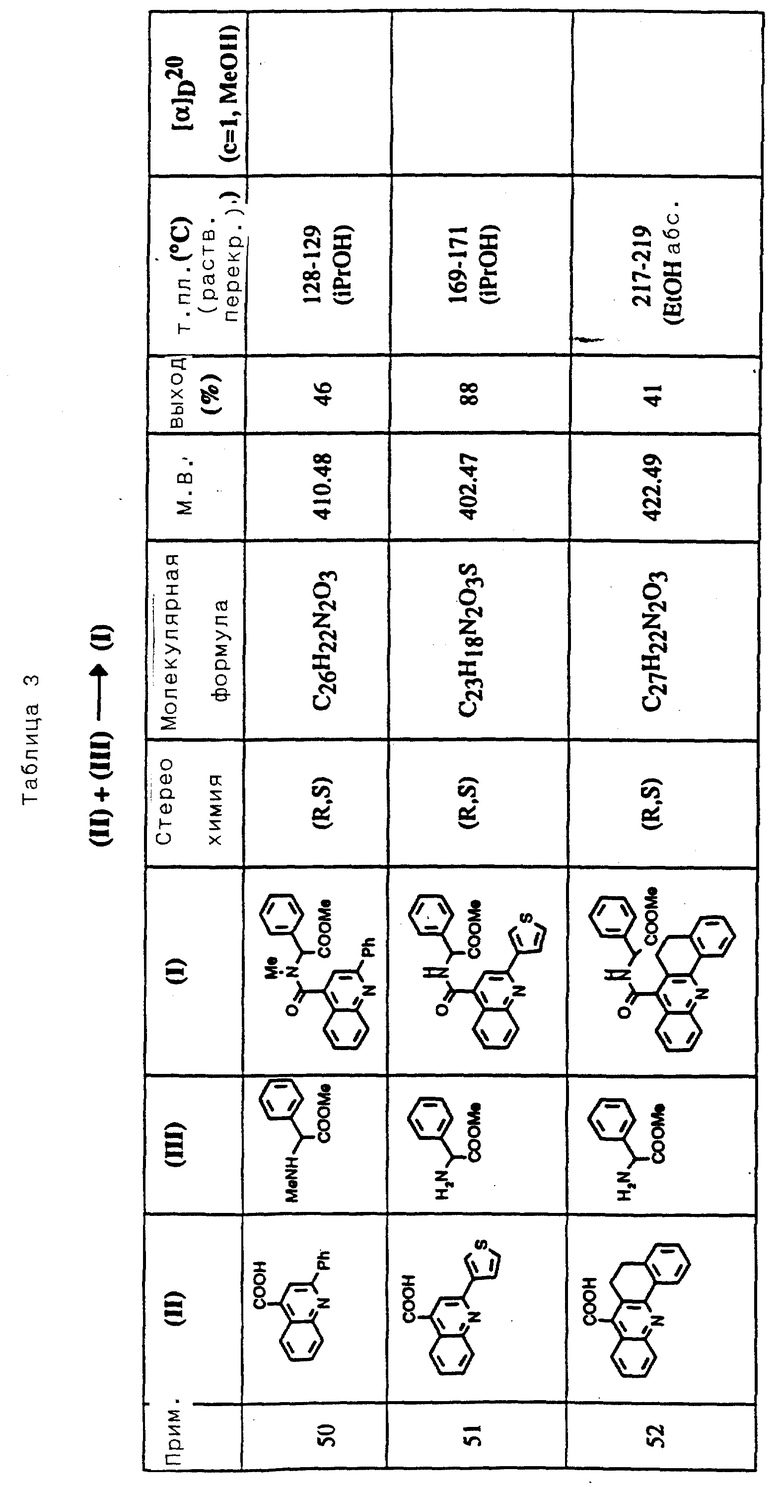
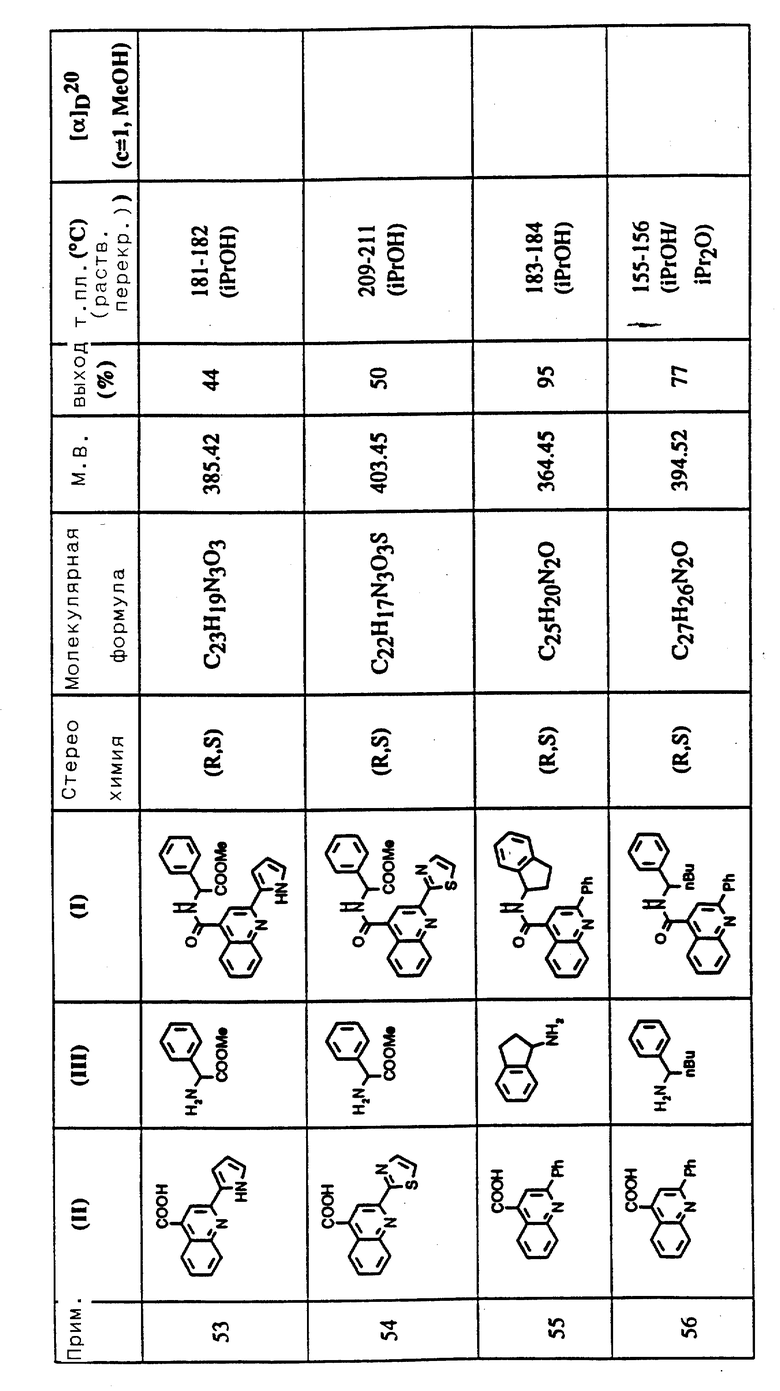
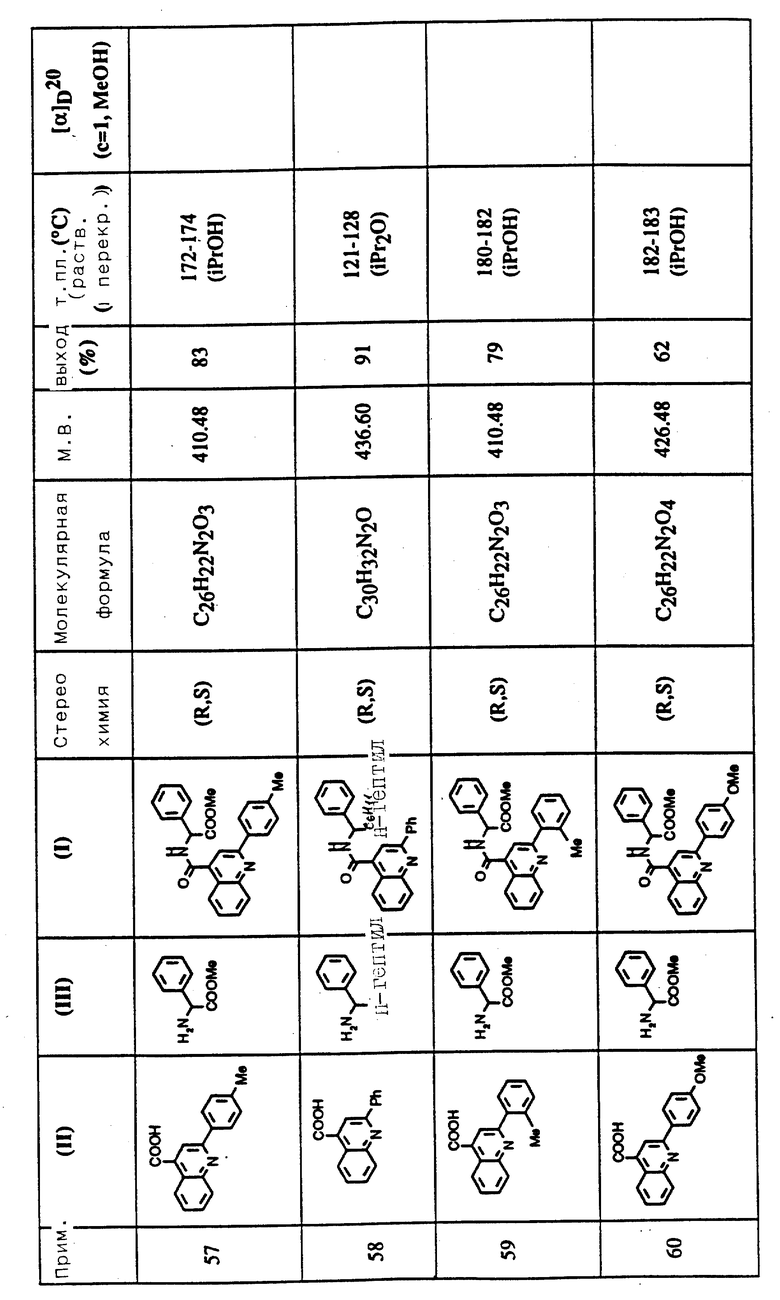
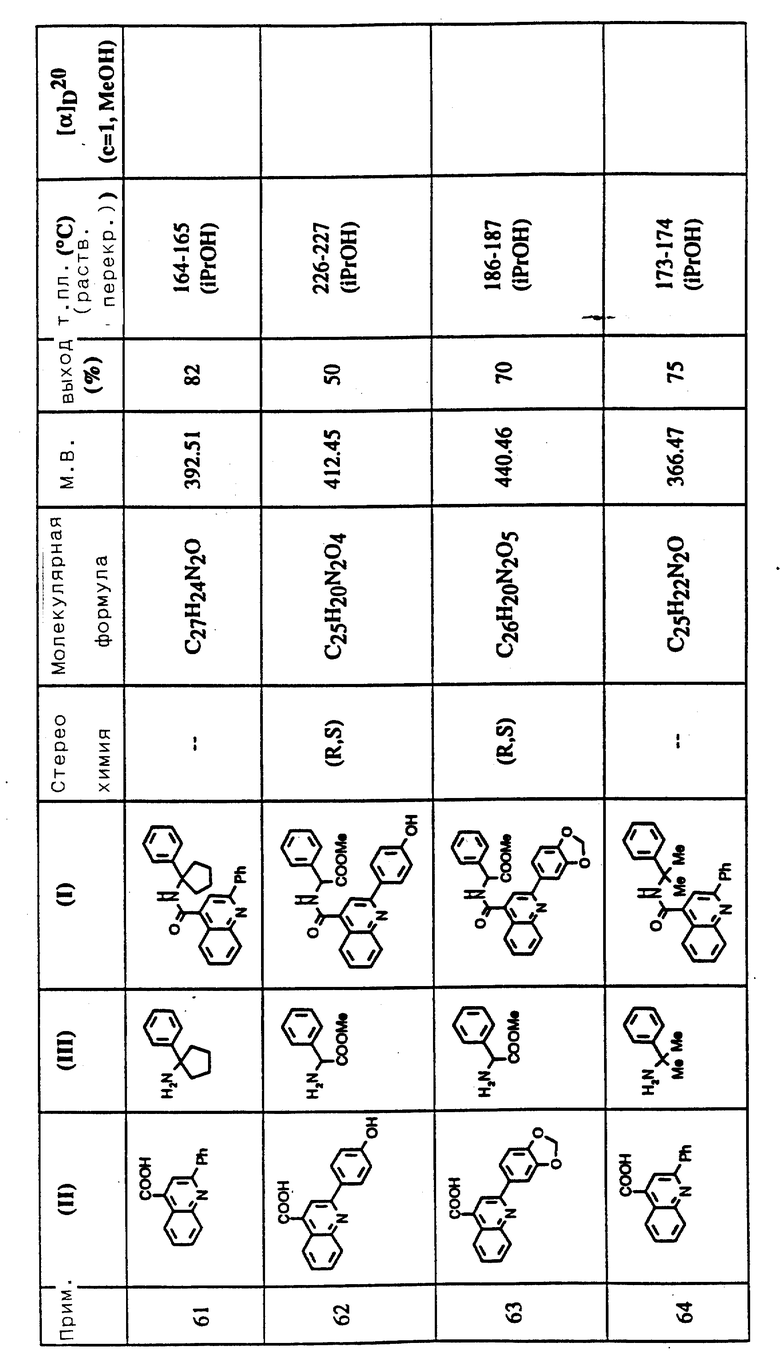
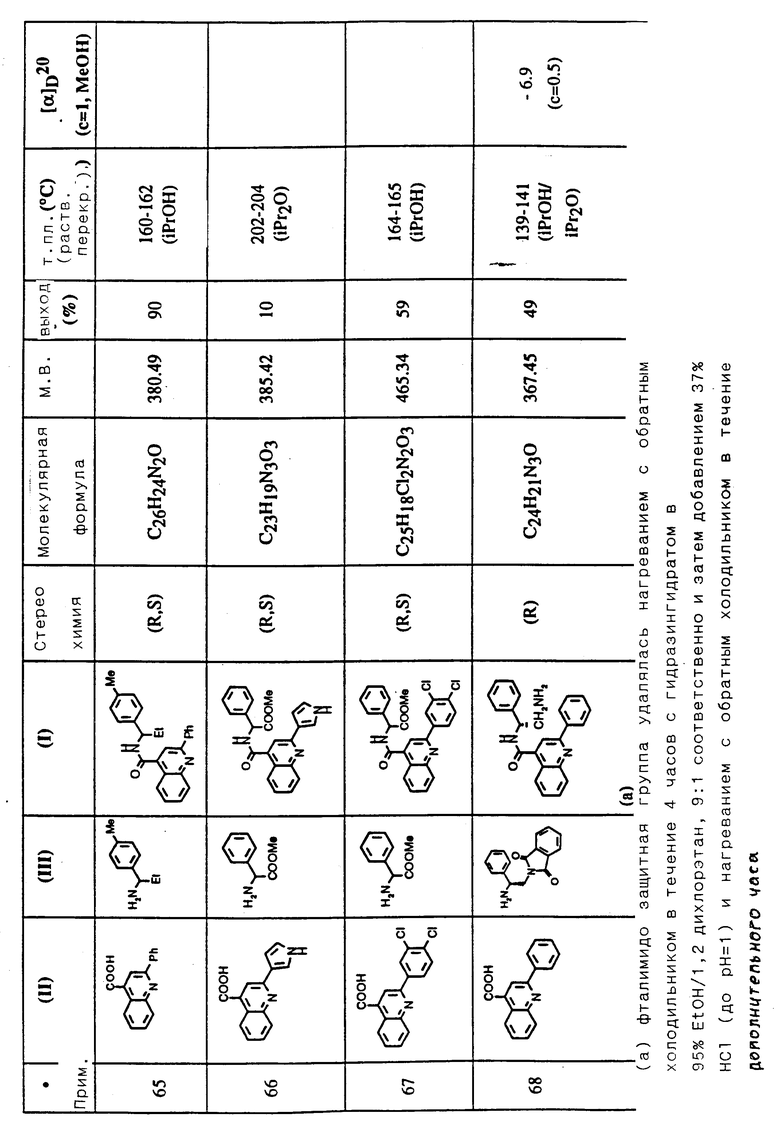
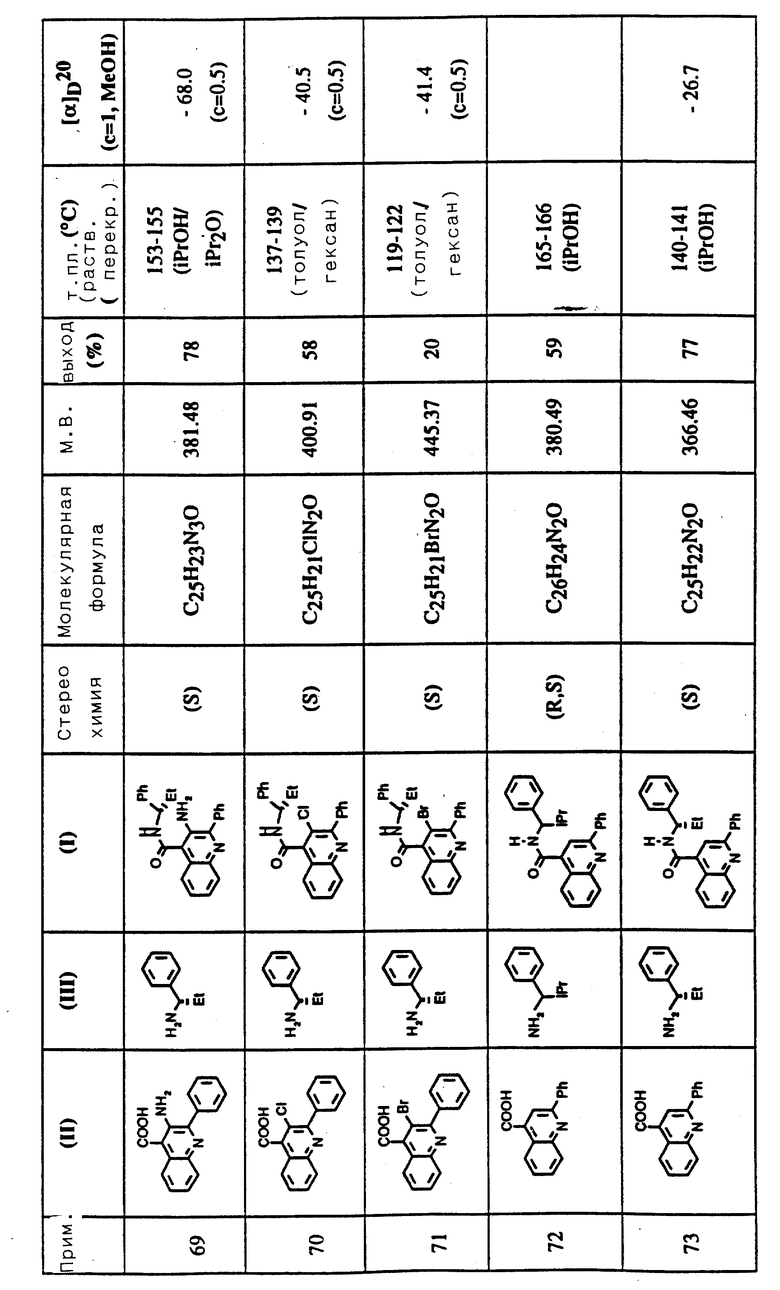
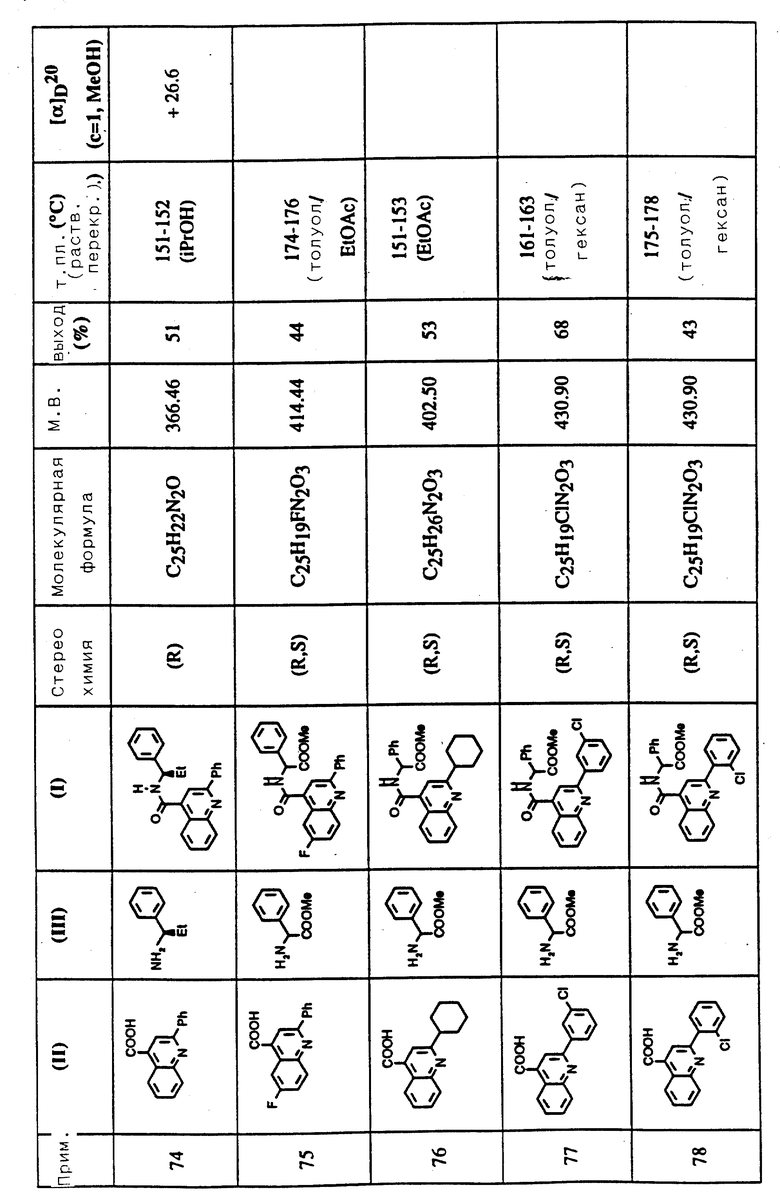
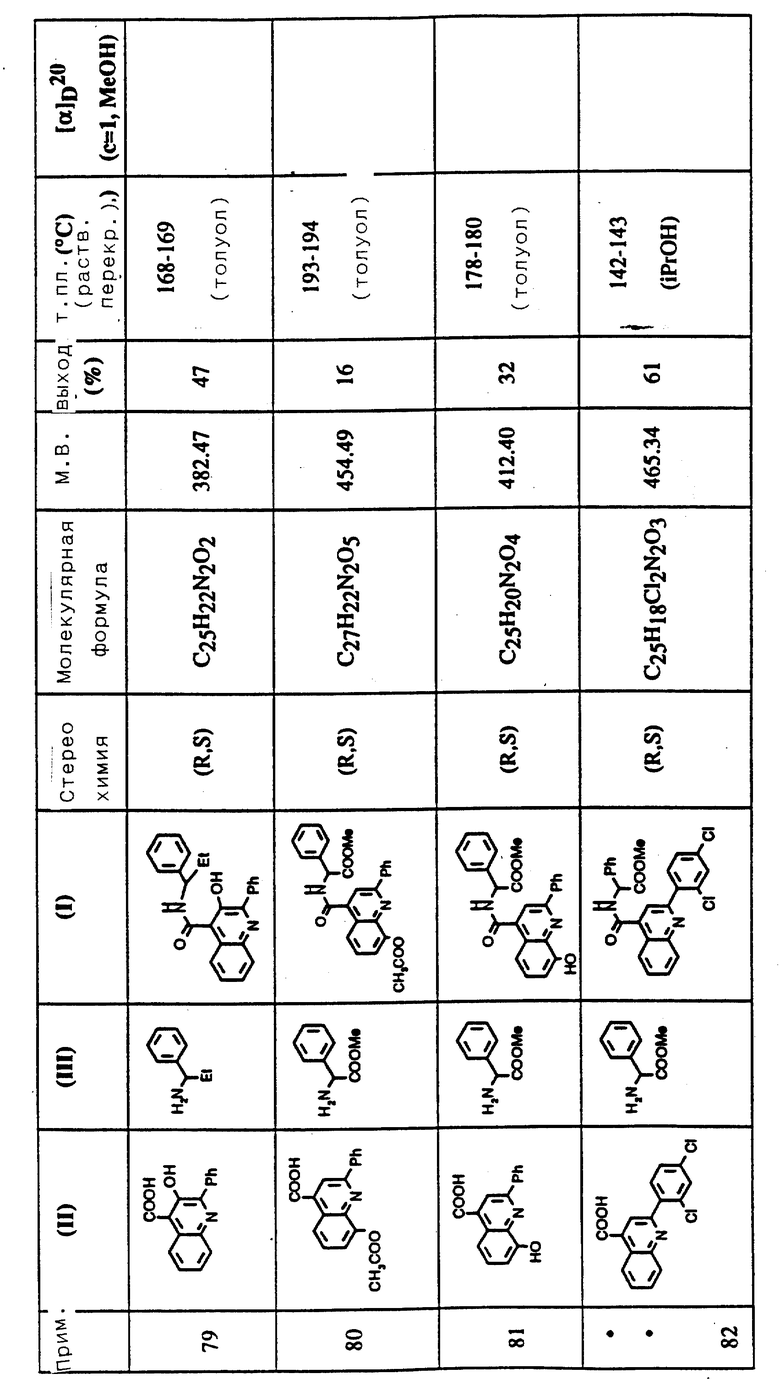
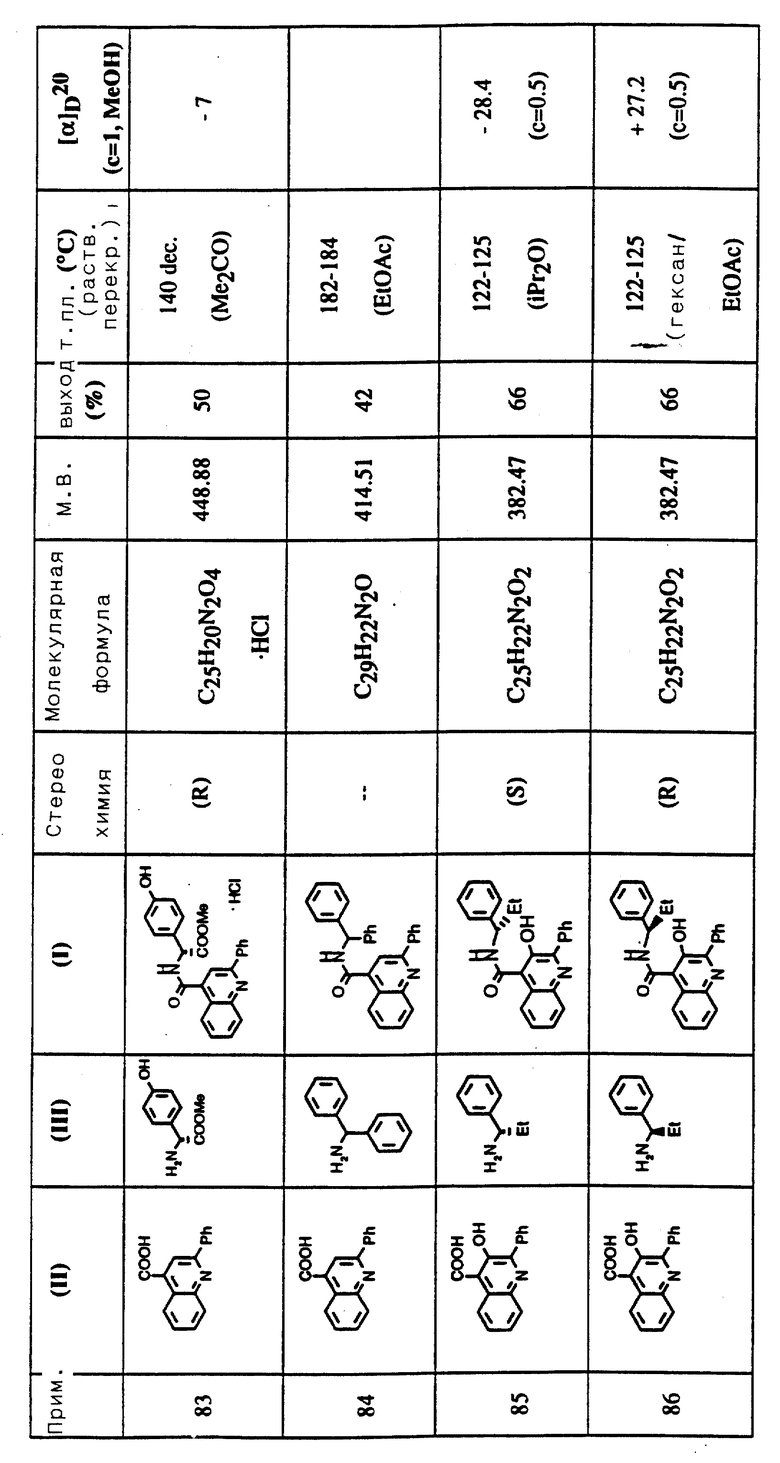
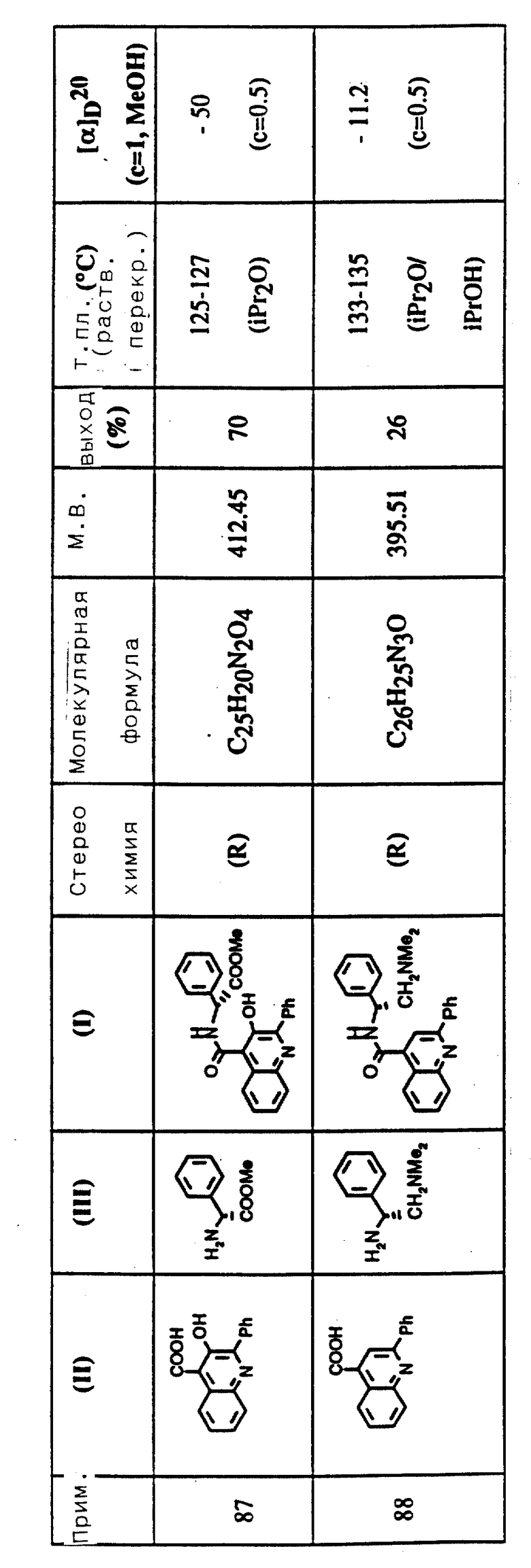
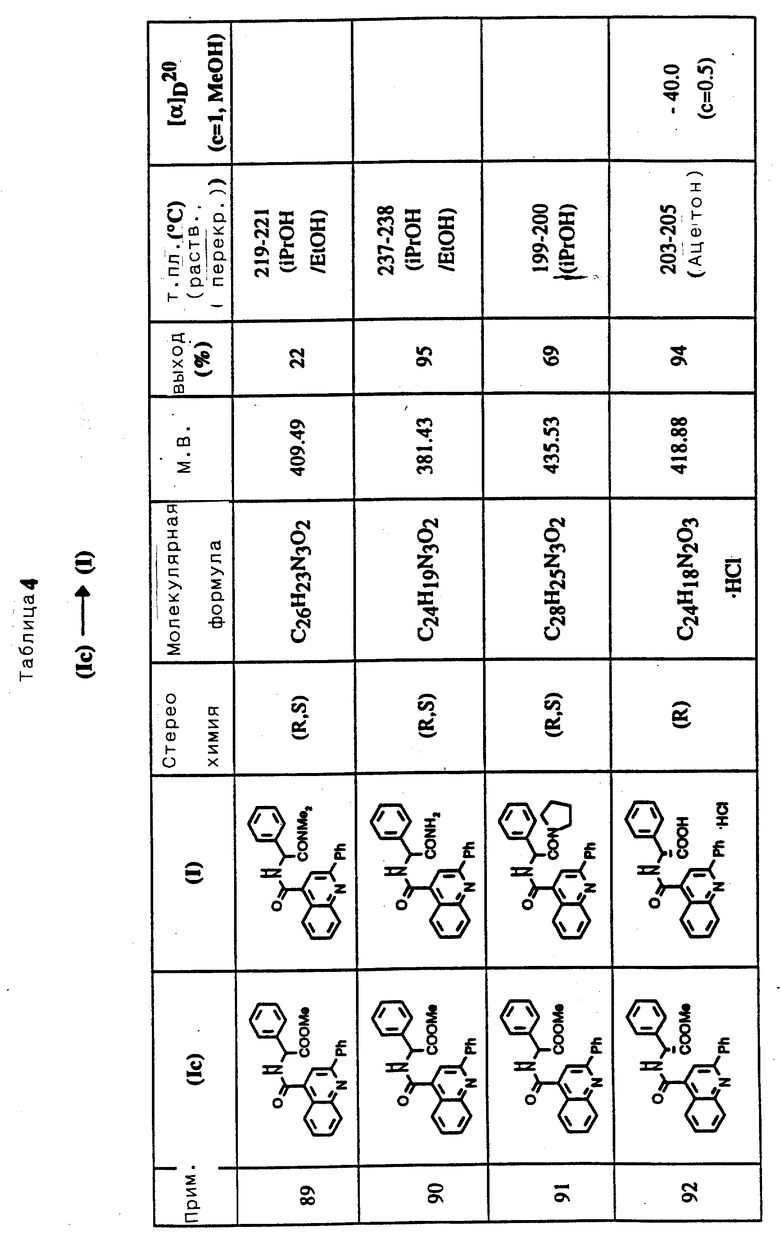
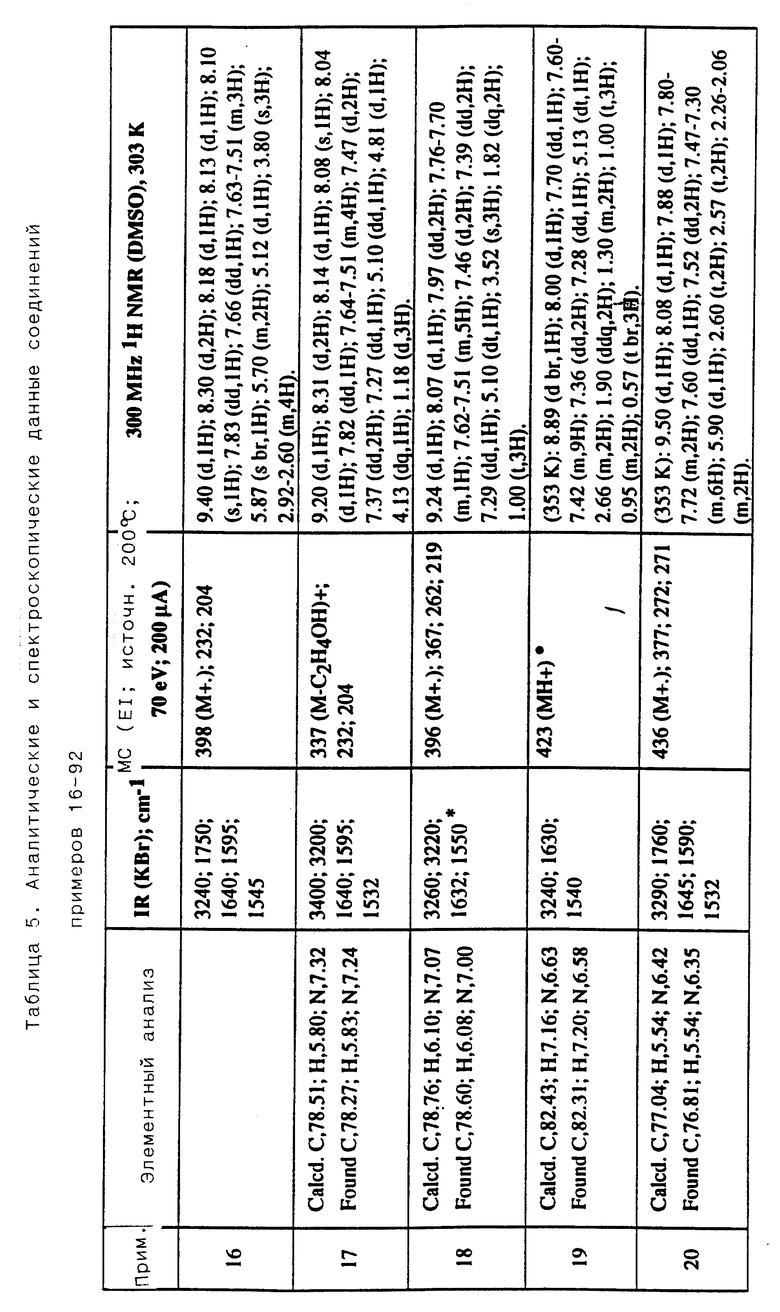
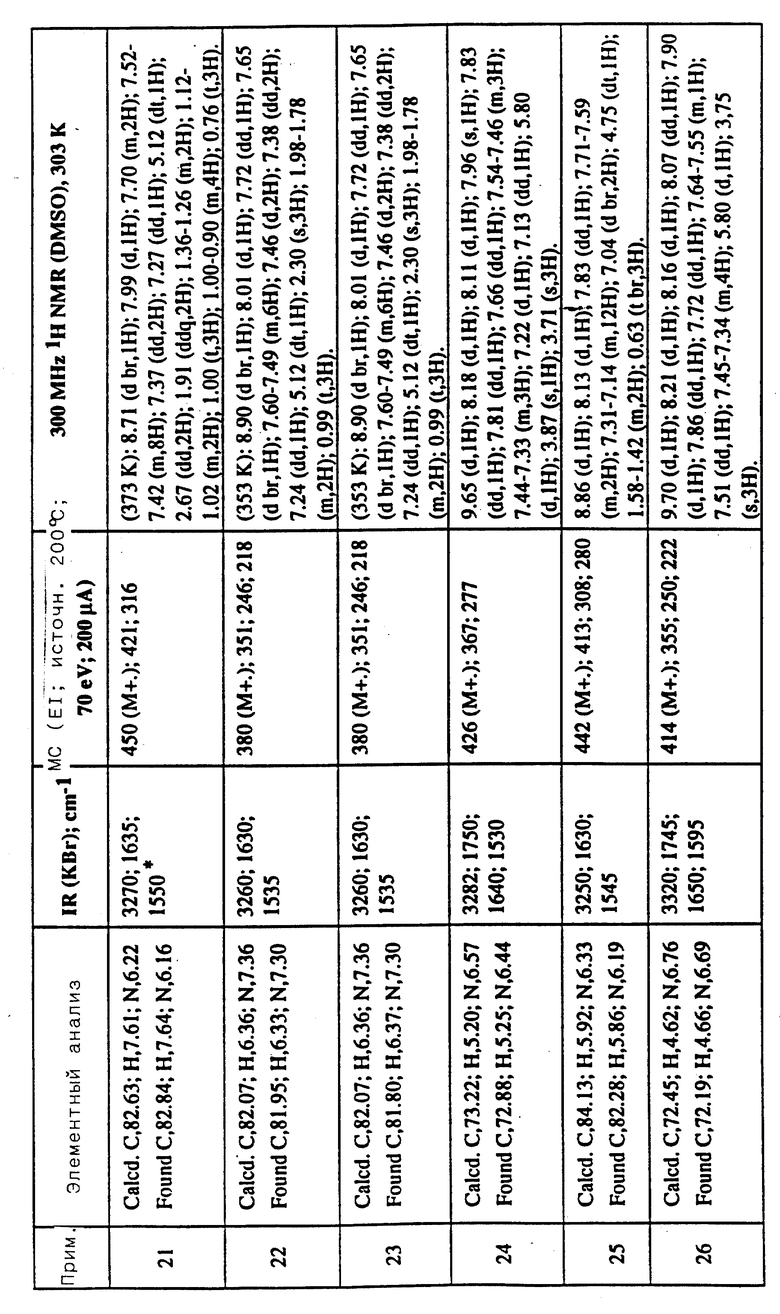
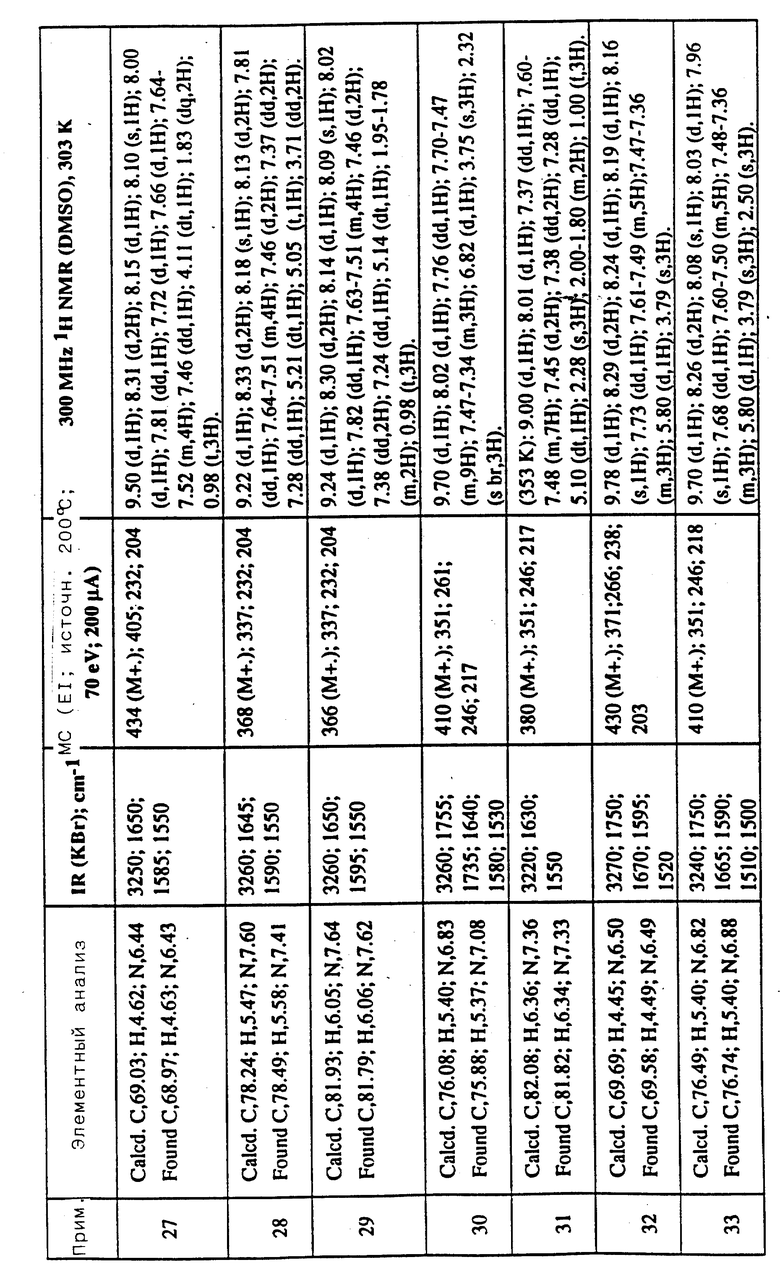
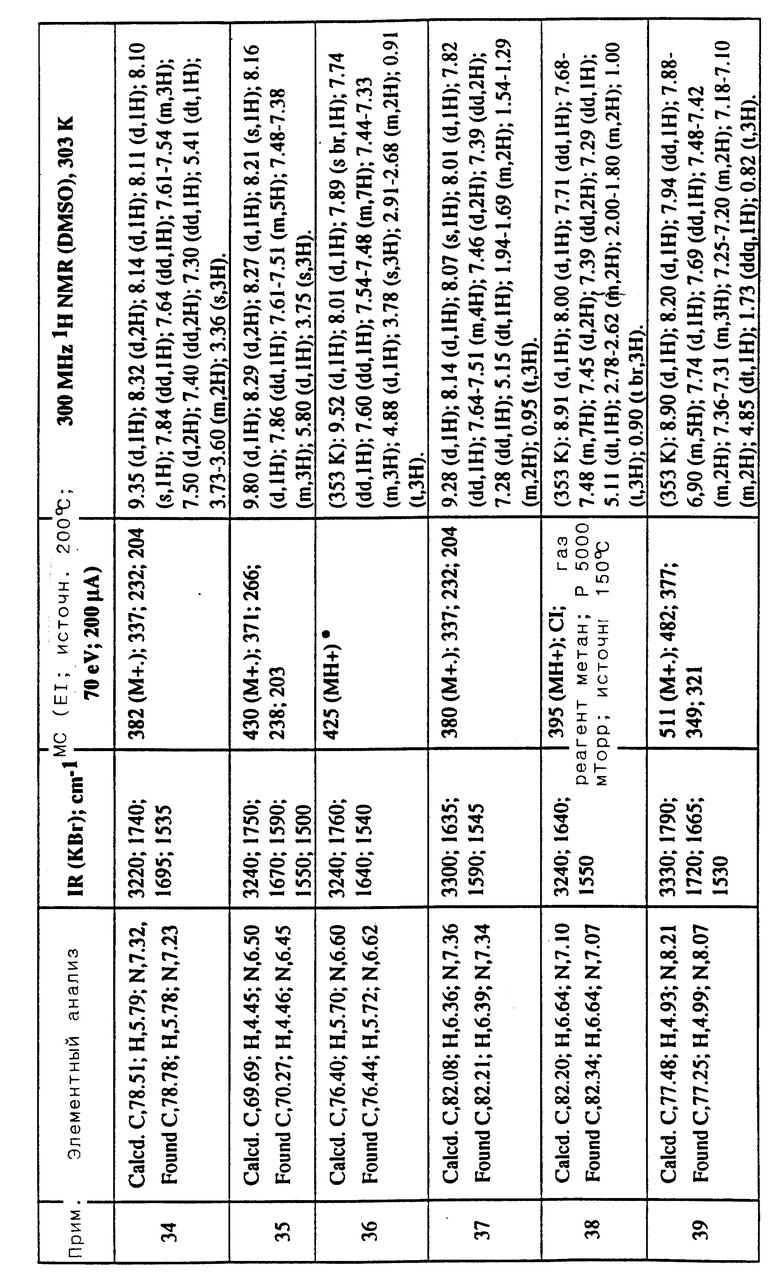
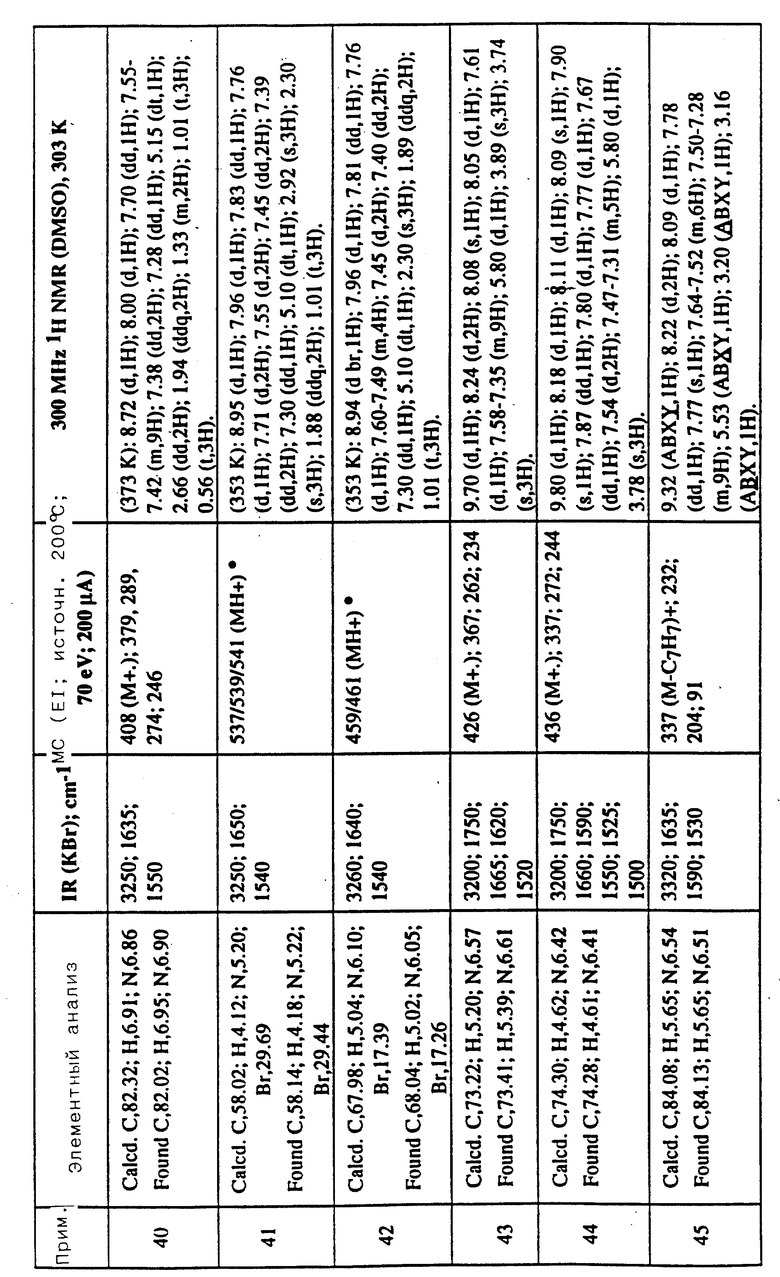
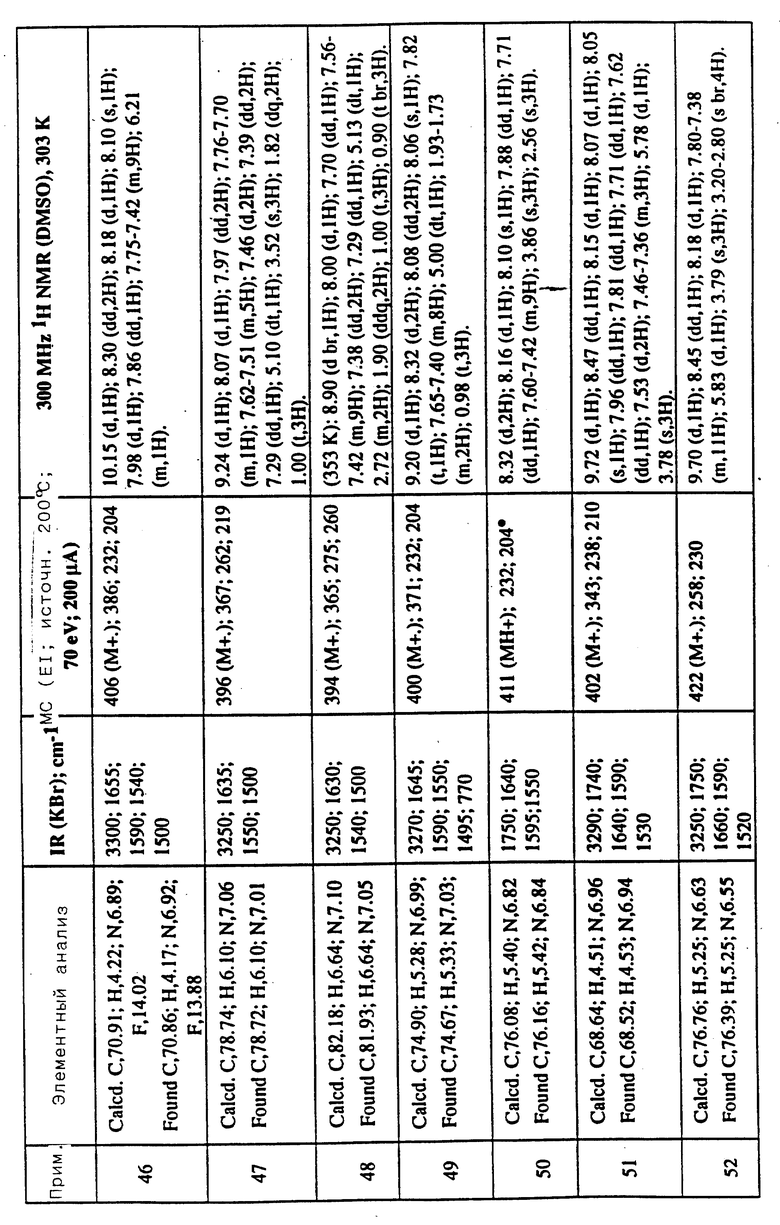

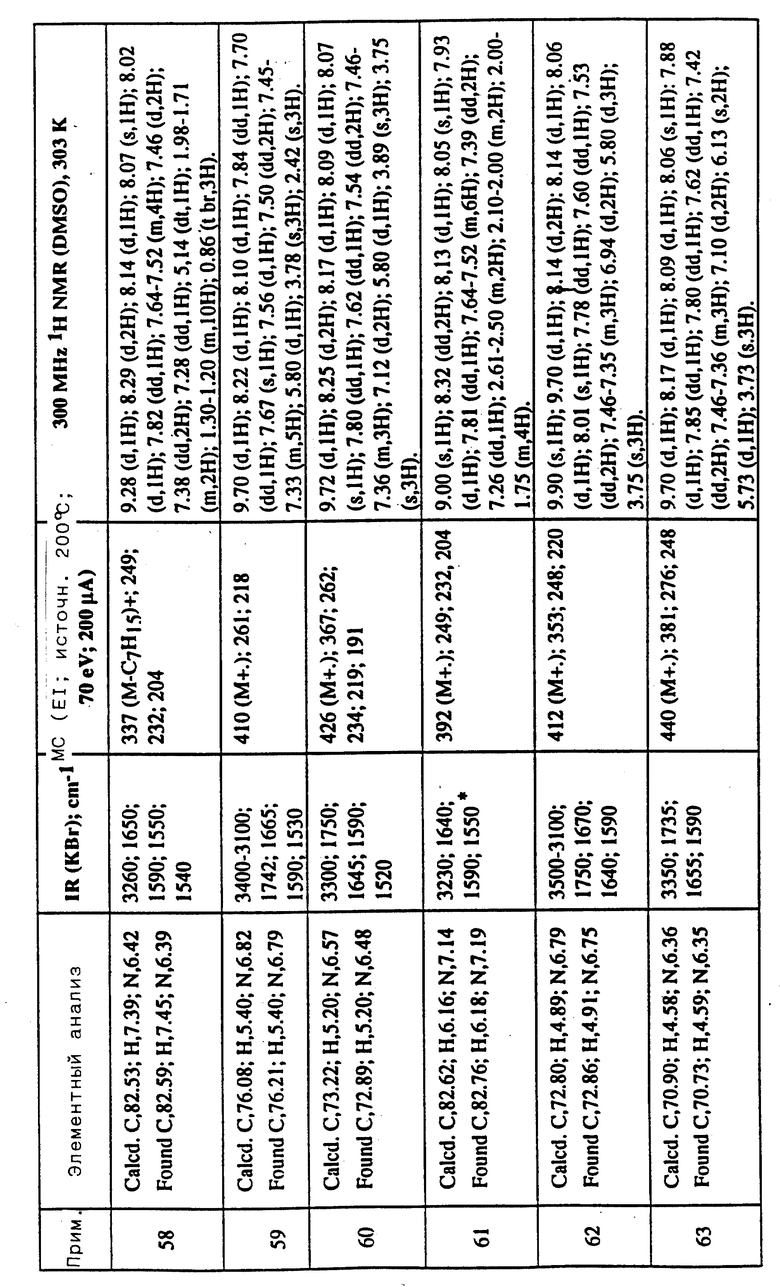

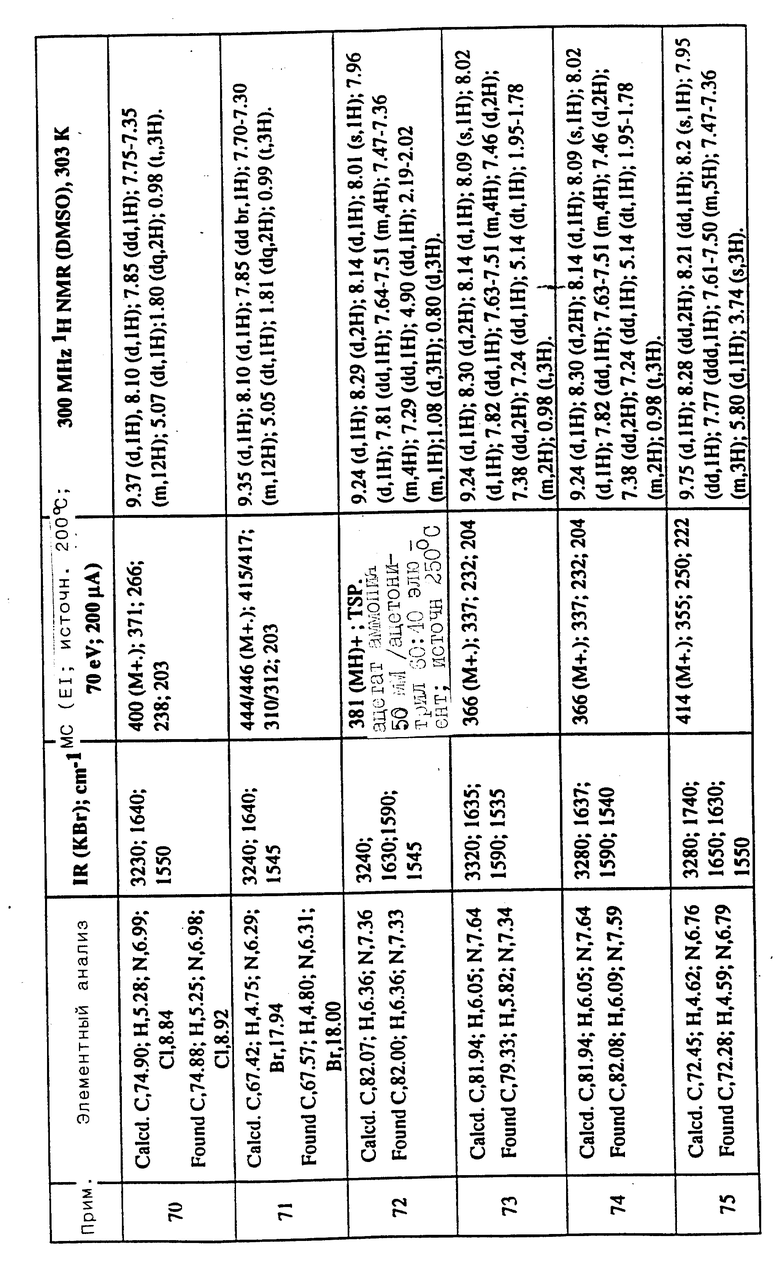
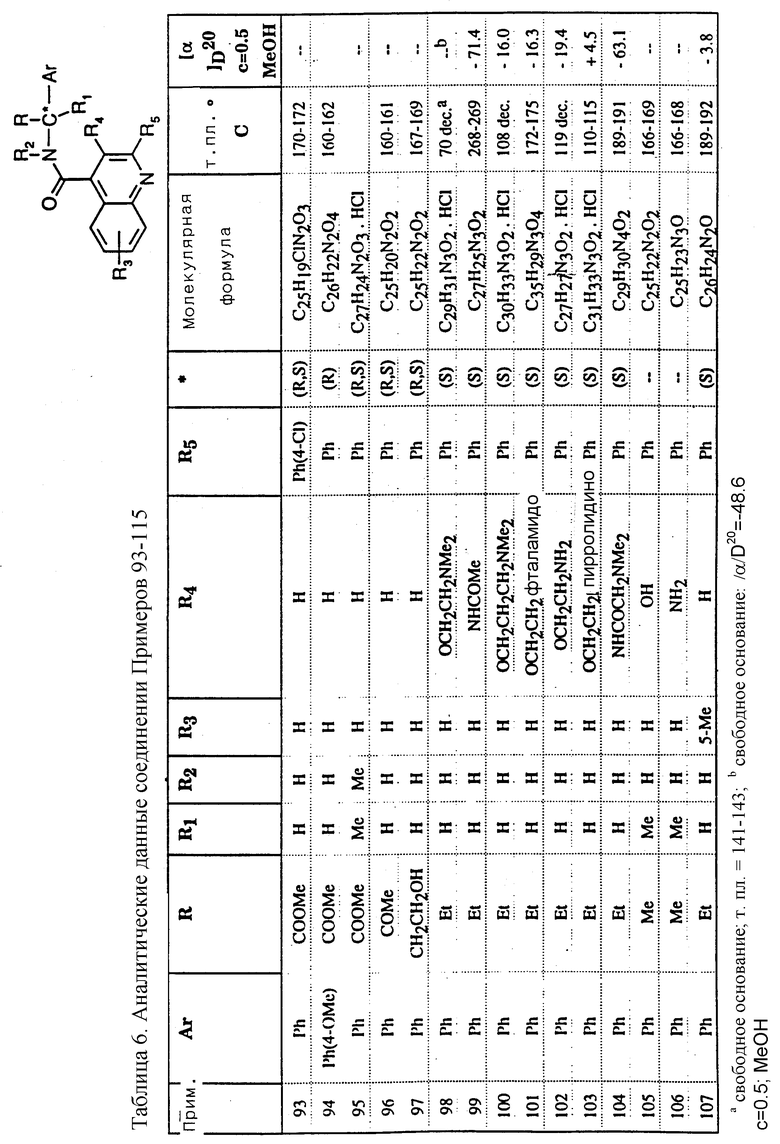
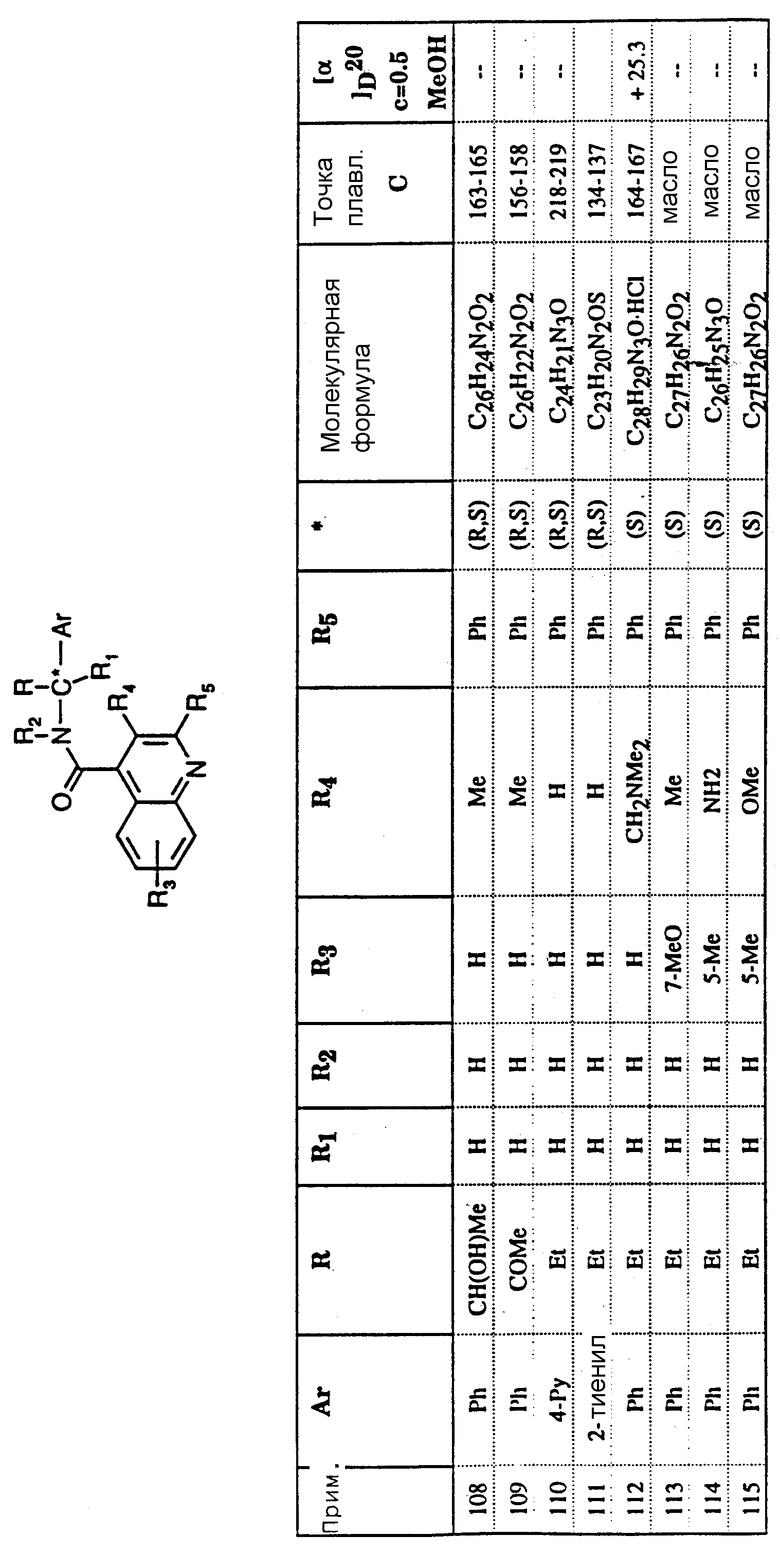
Производное хинолина формулы I, или его сольват или соль, где Ar - фенил, необязательно замещенный галогеном, OH или C1-6алкилом, бензил, тиенил, пиридил, C5-7циклоалкадиенильная группа; R - C1-8алкил, C3-7циклоалкил, гидроксиалкил, аминоалкил,алкиламиноалкил, ди-C1-6алкиламиноалкил, C1-6алкоксиалкил, C1-6алкилкарбонил, карбокси, C1-6-алкоксикарбонил, C1-6алкоксикарбонилалкил, алкиламинокарбонил, галоген-C1-6алкил; R1 и R2 одинаковые или различные, представляют водород или C1-6алкил; (другие обозначения радикалов см. в п.1 формулы изобретения), является непептидным антагонистом NK3 и представляет потенциальную терапевтическую аполезность при лечении конвульсивных расстройств, почечных расстройств, воспалительных болей, недержания мочи. 5 с. и 8 з.п.ф-лы, 6 табл.
где Ar представляет фенил, необязательно замещенный галогеном, OH или C1-6алкилом; бензил, тиенил, пиридил, C5-7циклоалкадиенильную группу;
R представляет C1-8алкил, C3-7циклоалкил, гидрокси-C1-6алкил, аминоалкил, алкиламиноалкил, ди-C1-6алкиламиноалкил, C1-6алкоксиалкил, C1-6алкилкарбонил, карбокси, C1-6алкоксикарбонил, C1-6алкоксикарбонил-C1-6алкил, C1-6алкиламинокарбонил, галоген-C1-6алкил;
R1 и R2, которые могут быть одинаковыми или различными, представляют независимо водород или C1-6 линейный или разветвленный алкил;
R3 и R4, которые могут быть одинаковыми или различными, представляют независимо водород или C1-6 линейный или разветвленный алкил, фенил, C1-6алкокси, гидрокси, галоген, карбоксимидо, ацилокси, фталимидо, амино, моно- или ди-C1-6алкиламино, -O(CH2)r-NT2, в котором r = 2, 3 или 4, и T представляет C1-6алкил;
R5 представляет C5-7циклоалкил, фенил, необязательно замещенный 1 - 2 атомами галогена, или одинарную или бензо-сконденсированную гетероциклическую группу, имеющую ароматический характер, содержащую 5 - 9 кольцевых атомов и включающую 1 - 2 гетеро-атома в кольце, выбранных из N, O и S;
X представляет 0.
где R, R2, R3 и R4 имеют значения, определенные для формулы I в любом из пп.1 - 6;
Y представляет фенил, необязательно замещенный 1 - 2 атомами галогена;
Z представляет Ar, определенный в п.1.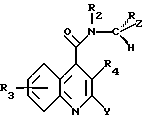
где R, R2, R3 и R4, Y и Z имеют значения, определенные в п.8.
(R,S)-N-(альфа-метилбензил)-2-фенилхинолин-4-карбоксамида,
(+)-(S)-N-(альфа-метилбензил)-2-фенилхинолин-4-карбоксамида,
(-)-(R)-N-(альфа-метилбензил)-2-фенилхинолин-4-карбоксамида,
(R,S)-N-[альфа-(метоксикарбонил)бензил]-2-фенилхинолин-4-карбоксамида,
(+)-(S)-N-[альфа-(метоксикарбонил)бензил]-2-фенилхинолин-4-карбоксамида,
(-)-(R)-N-[альфа-метоксикарбонил)бензил]-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -7-метокси-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -7-гидрокси-2-фенилхинолин-4-карбоксамида,
гидрохлорида(R, S)-N-[альфа-(карбокси)бензил]-7-метокси-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метиламинокарбонил)бензил]-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -2-(2-тиенил)хинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -2-(2-фурил)хинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -2-(2-пиридил)хинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)-2-тиенилметил] -2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонилметил)бензил] -2-фенилхинолин-4-карбоксамида,
(-)-(R)-N-[альфа-(метоксикарбонил)-1,4-циклогептадиенилметил]-2-фенилхинолин-4-карбоксамида,
единств. диаст. (R,S)-N-[альфа-(1-гидроксиэтил)бензил]-2-фенилхинолин-4-карбоксамида,
(R,S)-N-(альфа-этилбензил)-3-метокси-2-фенилхинолин-4-карбоксамида,
(R,S)-N-(альфа-этилбензил)-3-н-бутил-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил]бензо-1,3-циклопентадиено[1,2-b] -хинолин-8-карбоксамида,
(R,S)-N-(альфа-этилбензил)-3-гексил-2-фенилхинолин-4-карбоксамида,
(-)-(S)-N-(альфа-этилбензил)-3-метил-2-фенилхинолин-4-карбоксамида,
(+)-(R)-N-(альфа-этилбензил)-3-метил-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -2-(2-метоксифенил)хинолин-4-карбоксамида,
(R,S)-N-(альфа-этилбензил)-3-фенил-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -2-(2-фторфенил)хинолин-4-карбоксамида,
(R,S)-N-[альфа-(этил)-3,4-дихлорбензил]-2-фенилхинолин-4-карбоксамида,
(R,S)-N-[альфа-(гидроксиметил)бензил]-2-фенилхинолин-4-карбоксамида,
(R,S)-N-(альфа-этилбензил)-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -3-метил-2-фенилхинолин-4-карбоксамида,
(R,S)-N-(альфа-этилбензил)-3-метил-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -7-хлор-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -6-метил-2-фенилхинолин-4-карбоксамида,
(R,S)-N-[альфа-(метоксиметил)бензил]-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -6-хлор-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -3-этил-2-фенилхинолин-4-карбоксамида,
(R,S)-N-(альфа-н-пропилбензил)-2-фенилхинолин-4-карбоксамида,
(R,S)-N-(альфа-этилбензил)-3-этил-2-фенилхинолин-4-карбоксамида,
(R,S)-N-(альфа-этилбензил)-3-фталимидо-2-фенилхинолин-4-карбоксамида,
(R,S)-N-(альфа-этилбензил)-3-н-пропил-2-фенилхинолин-4-карбоксамида,
(-)-(S)-N-(альфа-этилбензил)-6-бром-3-метил-2-(4-бромфенил)хинолин-4-карбоксамида,
(-)-(S)-N-(альфа-этилбензил)-6-бром-3-метил-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -6-метокси-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -2-(2-бензофурил)хинолин-4-карбоксамида,
(R,S)-N-[(1,2-дифенил)этил]-2-фенилхинолин-4-карбоксамида,
(R,S)-N-(альфа-трифторметилбензил)-2-фенилхинолин-4-карбоксамида,
(-)-(S)-N-(альфа-этилбензил)-3-метокси-2-фенилхинолин-4-карбоксамида,
(-)-(S)-N-(альфа-этилбензил)-3-этил-2-фенилхинолин-4-карбоксамида,
(R,S)-N-[альфа-(этил)-4-хлорбензил]-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -N-метил-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -2-(3-тиенил)хинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил]-5,6-дигидробензо[a]-акридин-7-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -2-(2-пиррил)хинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -2-(2-тиазолил)хинолин-4-карбоксамида,
(R,S)-N-[1-инданил]-2-фенилхинолин-4-карбоксамида,
(R,S)-N-(альфа-н-бутилбензил)-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -2-(4-метилфенил)хинолин-4-карбоксамида,
(R,S)-N-(альфа-гептилбензил)-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -2-(2-метилфенил)хинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -2-(4-метоксифенил)хинолин-4-карбоксамида,
N-(1-фенилциклопентил)-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -2-(4-гидроксифенил)хинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -2-(3,4-метилендиоксифенил)хинолин-4-карбоксамида,
N-(альфа,альфа-диметилбензил)-2-фенилхинолин-4-карбоксамида,
(R,S)-N-[альфа-(этил)-4-метилбензил]-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -2-(3-пиррил)хинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -2-(3,4-дихлорфенил)хинолин-4-карбоксамида,
(-)-(R)-N-[альфа-(аминометил)бензил]-2-фенилхинолин-4-карбоксамида,
(-)-(S)-N-[альфа-этилбензил)-3-амино-2-фенилхинолин-4-карбоксамида,
(-)-(S)-N-[альфа-этилбензил)-3-хлор-2-фенилхинолин-4-карбоксамида,
(-)-(S)-N-[альфа-этилбензил)-3-бром-2-фенилхинолин-4-карбоксамида,
(R,S)-N-(альфа-изо-пропилбензил)-2-фенилхинолин-4-карбоксамида,
(-)-(S)-N-(альфа-этилбензил)-2-фенилхинолин-4-карбоксамида,
(+)-(R)-N-(альфа-этилбензил)-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -6-фтор-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -2-циклогексилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -2-(3-хлорфенил)хинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -2-(2-хлорфенил)хинолин-4-карбоксамида,
(R,S)-N-(альфа-этилбензил)-3-гидрокси-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил]-8-ацетилокси-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -8-гидрокси-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -2-(2,4-дихлорфенил)хинолин-4-карбоксамида,
гидрохлорида (-)-(R)-N-[альфа-(метоксикарбонил)-4-гидроксибензил] -2-фенилхинолин-4-карбоксамида,
N-дифенилметил-2-фенилхинолин-4-карбоксамида,
(-)-(S)-N-(альфа-этилбензил)-3-гидрокси-2-фенилхинолин-4-карбоксамида,
(+)-(R)-N-(альфа-этилбензил)-3-гидрокси-2-фенилхинолин-4-карбоксамида,
(-)-(R)-N-[альфа-(метоксикарбонил)бензил] -3-гидрокси-2-фенилхинолин-4-карбоксамида,
(-)-(R)-N-[альфа-(диметиламинометил)бензил] -2-фенилхинолин-4-карбоксамида,
(R,S)-N-[альфа-(диметиламинометил)бензил]-2-фенилхинолин-4-карбоксамида,
(R,S)-N-[альфа-(аминокарбонил)бензил]-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(1-пирролидинилкарбонил)бензил] -2-фенилхинолин-4-карбоксамида,
гидрохлорида (-)-(R)-N-[альфа-(карбокси)бензил] -2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)бензил] -2-(4-хлорфенил)хинолин-4-карбоксамида,
(R, S)-N-[альфа-(метоксикарбонил)-4-метоксибензил] -2-фенилхинолин-4-карбоксамида,
гидрохлорида (R,S)-N-[альфа-(метоксикарбонил)-альфа-(метил)бензил]-N-метил-2-фенилхинолин-4-карбоксамида,
(R,S)-N-[альфа-(метилкарбонил)бензил]-2-фенилхинолин-4-карбоксамида,
(R,S)-N-[альфа-(2-гидроксиэтил)бензил]-2-фенилхинолин-4-карбоксамида,
гидрохлорида (-)-(S)-N-(альфа-этилбензил)-3-(2-диметиламиноэтокси)-2-фенилхинолин-4-карбоксамида,
(-)-(S)-N-(альфа-этилбензил)-3-ацетиламино-2-фенилхинолин-4-карбоксамида,
гидрохлорида (-)-(S)-N-(альфа-этилбензил)-3-(3-диметиламинопропокси)-2-фенилхинолин-4-карбоксамида,
гидрохлорида (-)-(S)-N-(альфа-этилбензил)-3-[2-(1-фталоил)этокси] -2-фенилхинолин-4-карбоксамида,
гидрохлорида (-)-(S)-N-(альфа-этилбензил)-3-(2-аминоэтокси)-2-фенилхинолин-4-карбоксамида,
гидрохлорида (+)-(S)-N-(альфа-этилбензил)-3-[2-(1-пирролидинил)этокси] -2-фенилхинолин-4-карбоксамида,
(-)-(S)-N-(альфа-этилбензил)-3-(диметиламиноацетиламино)-2-фенилхинолин-4-карбоксамида,
N-(альфа,альфа-диметилбензил)-3-гидрокси-2-фенилхинолин-4-карбоксамида,
N-(альфа,альфа-диметилбензил)-3-амино-2-фенилхинолин-4-карбоксамида,
(-)-(S)-N-(альфа-этилбензил)-5-метил-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(1-гидроксиэтил)бензил] -3-метил-2-фенилхинолин-4-карбоксамида,
(R, S)-N-[альфа-(метилкарбонил)бензил] -3-метил-2-фенилхинолин-4-карбоксамида,
(R,S)-N-[альфа-(этил)-4-пиридилметил]-2-фенилхинолин-4-карбоксамида,
(R,S)-N-[альфа-(этил)-2-тиенилметил]-2-фенилхинолин-4-карбоксамида,
гидрохлорида (+)-(S)-N-(альфа-этилбензил)-3-диметиламинометил-2-фенилхинолин-4-карбоксамида,
(S)-N-(альфа-этилбензил)-3-метил-7-метокси-2-фенилхинолин-4-карбоксамида,
(S)-N-(альфа-этилбензил)-3-амино-5-метил-2-фенилхинолин-4-карбоксамида,
(S)-N-(альфа-этилбензил)-3-метокси-5-метил-2-фенилхинолин-4-карбоксамида.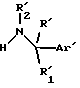
где R', R'1, R'2 и Ar' имеют значения R, R1, R2 и Ar, определенные для формулы I, или группу или атом, способные превращаться в R, R1, R2 и Ar, с соединением формулы II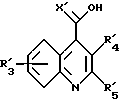
где R'3, R'4, R'5 и X' имеют значения R3, R4, R5 и X, определенные для формулы I, или группу или атом, способные превращаться в R3, R4, R5 и X, или его активным производным, с образованием соединения формулы Ic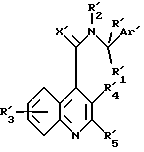
и после этого необязательное проведение одной или более из следующих стадий:
(а) когда R', R'1 - R'5, Ar' и X' имеют значения отличные от R, R1 - R5, Ar и X, превращение любой одной из групп R', R'1 - R'5, Ar' и X' в группу R, R1 - R5, Ar и X с получением соединения формулы I,
(b) когда R', R'1 - R'5, Ar' и X' имеют значения R, R1 - R5, Ar и X, превращение любой одной из групп R, R1 - R5, Ar и X в другую группу R, R1 - R5, Ar и X с получением соединения формулы I,
(c) образование соли и/или сольвата полученного соединения формулы I.
| Способ получения рацемических или стереоизомерных производных нафталин- или азанафталинкарбоксамидов | 1983 |
|
SU1255050A3 |
| Способ получения производных хинальдинамида или их кислотно-аддитивных солей | 1986 |
|
SU1450741A3 |
| Многопозиционный переключатель | 1973 |
|
SU490200A1 |
Авторы
Даты
2000-09-10—Публикация
1995-05-23—Подача