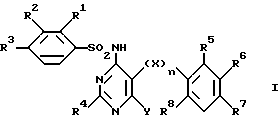
Изобретение относится к новым сульфонамидам и их применению в качестве лечебных препаратов. Прежде всего изобретение относится к новым соединениям формулы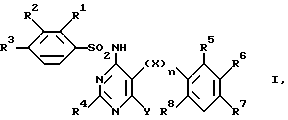
где R1 обозначает водород, низший алкил, низший алкокси, низший алкилтио, галоген или трифторметил;
R2 обозначает водород, низший алкил, галоген, низший алкокси, трифторметил или -OCH2COOR9;
R3 обозначает водород, низший алкил, галоген, низший алкилтио, трифторметил, низший алкокси или трифторметокси;
R2 и R3 обозначают вместе бутадиенил, метилендиокси, этилендиокси или изопропилидендиокси;
R4 обозначает водород, низший алкил, трифторметил, низший алкокси, низший алкилтио, окси-низший алкил, окси-низший алкокси, окси-низший алкокси-низший алкил, окси-низший алкокси-низший алкокси, алкокси-низший алкил, алкокси-низший алкилокси, низший алкилсульфинил, низший алкилсульфонил, 2-метокси-3-оксипропокси, 2-окси-3-фенилпропил, амино-низший алкил, низший алкиламино-низший алкил, ди-низший алкиламино-низший алкил, амино, низший алкиламино, ди-низший алкиламино, ариламино, арил, арилтио, арилокси, арил-низший алкил, гетероциклил, гетероциклил-низший алкил, гетероциклиламино, гетероциклилтио, гетероциклилокси, -CHO, -CH2OH или -CH2Cl;
R5-R8 обозначают водород, галоген, трифторметил, низший алкокси, низший алкилтио, циано;
R6 вместе с R5 либо R7 обозначает бутадиенил, метилендиокси, этилендиокси или изопропилидендиокси;
X обозначает -O- или -S-;
Y обозначает -CHO, C1-4-алкил, -(CH2)1-4-Z-R9,
-(CH2)1-4-OC(O) (CH2)1-4CH3,
-(CH2)1-4OC(O)гет, -(CH2)1-4NHC(O)R10 ,
-(CH2)1-4OCH2CH(OH)CH2OH и его циклические кетали,
-(CH2)1-4NR9CH2CH(ОН)CH2ОН, -(CH2)1-4OCH2CH2SCH3,
-(CH2)1-4OCH2CH2S(O)CH3, -(CH2)1-4O(CH2)1-4-ZH,
-(CH2)1-4O(CH2)1-4OC(O)R10, -(CH2)1-4NR9(CH2)1-4ZH,
-(CH2)1-4O(CH2)1-4OC(O)гет, -(CH2)0-3CH(OH)R10 , -(CH2)0-3CH(OH)(CH2)1-4ZH,
-(CH2)0-3CH(OH)CH2SCH3, -(CH2)0-3CH(OH)CH2S(О)CH3
-(CH2)0-3CH(OH)OCH2CH2OH, -(CH2)0-3C(O)(CH2)1-4CH3,
-(CH2)0-3C(O)(CH2)1-4ZR11, -(CH2)0-3C(O)CH2гал, -(CH2)1-4гал, -(CH2)1-4CN,
-(CH2)0-3C(O)OR9, -OR12 или -SR12,
R9 представляет собой водород или C1-4-алкил,
R10 представляет собой C1-4-алкил,
R11 представляет собой водород, C1-4-алканоил или гетероциклилкарбонил,
R12 представляет собой C1-4-алкил или -(CH2)0-4-арил,
Z обозначает -O-, -S- или -NR9-,
гет - гетероциклический остаток,
гал - галоген и
n обозначает 0 или 1;
и соли этих соединений.
Применяемый здесь термин "низший" обозначает группы с числом атомов углерода 1-7, предпочтительно 1-4. Алкил-, алкокси- и алкилтио-группы, а также алкильные группы как компоненты алканоильных групп могут быть неразветвленными либо разветвленными. Примерами таких алкильных групп являются метил, этил, пропил, изопропил, бутил, втор- и третбутил. Галоген обозначает фтор, хлор, бром и йод, причем хлор предпочтителен. В качестве заместителей арильных остатков следует назвать фенил и замещенные фенильные остатки, причем заместителями могут быть прежде всего галоген, низший алкил, низший алкокси, карбоксил и трифторметил. Примерами гетероциклических остатков являются замещенные, в частности одно- либо двузамещенные, например, низшим алкилом, низшим алкокси, галогеном, арилом, арил- низшим алкилом, или незамещенные моно- либо бициклические 5- и 6-звенные гетероциклические остатки с кислородом, азотом или серой в качестве гетероатома, как 2- и 3-фурил, 2-, 4- и 5-пиримидинил, 2-, 3- и 4-пиридил и пиридил-N-оксид, 1,2- и 1,4-диазинил, морфолино, 2- и 3-тиенил, изоксазолил, оксазолил, тиазолил, имидазолил, пирролил, бензофуранил, бензотиенил, индолил, пуринил, хинолил, изохинолил и хиназолил. В качестве примеров солей можно назвать соли щелочных металлов, как соли натрия и калия, и соли щелочноземельных металлов, как соли кальция и магния.
Соединения приведенной выше формулы I представляют собой ингибиторы эндотелий-рецепторов. Поэтому они могут применяться для лечения заболеваний, связанных с повышенной активностью эндотелия, в первую очередь, сердечно-сосудистых, таких, как гипертония, ишемия, спазмы сосудов и стенокардия.
В предпочтительную группу соединений в формуле I входят такие соединения, где n = 1, а X представляет собой -O-; далее, к названной группе относятся такие соединения, в которых R5 обозначает низший алкокси, прежде всего метокси; R5 и R7 обозначают водород и R8 - галоген, предпочтительно хлор.
Предпочтительным заместителем R1 и R2 является водород, предпочтительным заместителем R3 - низший алкил, в первую очередь третбутил. Предпочтительными заместителями R4 являются водород, 2-пиримидинил, 2- и 3-фурил, 2- и 3-тиенил, p-метоксифенил и прежде всего морфолино.
Предпочтительными заместителями Y являются -CHO, C1-4-алкил, -(CH2)1-4-Z1-R9, -(CH2)1-4NHC(O)R10, -СH2OCH2CH(OH)CH2OH и его циклические кетали, -CH2NR9CH2CH(OH)CH2OH, -CH2OCH2CH2S(O)CH3, -CH2O(CH2)1-4-ZH, -CH2O(CH2)1-4OC(O)R10, -CH2O(CH2)1-4OC(O)гет, -CH2гал, прежде всего оксиметил, 2-окси-этоксиметил и 2,3-диоксипропоксиметил.
Соединения формулы I могут быть получены благодаря тому, что
а) соединение формулы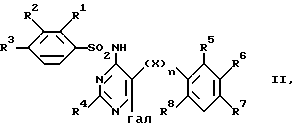
где X, n и R имеют указанное выше значение и гал является галогеном, преобразуют соединением формулы
R12AM, III
где A представляет собой кислород или серу, а М является щелочным металлом, в соединение формулы I, в которой Y представляет собой остаток -OR12 либо -SR12; или
б) соединение формулы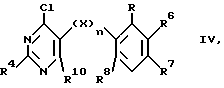
где R4-R8, R10 , X и n имеют указанные выше значения,
преобразуют соединением формулы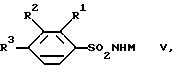
где М представляет собой катион,
в соединение формулы I, где Y является остатком R10, a R1-8, X и n имеют указанное выше значение, при определенных условиях полученное соединение формулы I, в которой Y и/или R4 являются остатком CH3, путем окисления преобразуют в соединение формулы I, в которой Y и/или R4 являются остатком CHO, и при определенных условиях остаток CHO преобразуют в другой, названный выше остаток Y и/или R4, или
в) осуществляют реакцию между соединением формулы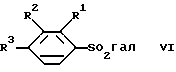
и соединением формулы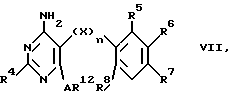
причем R1-R9, R12, n, A и X имеют указанное выше значение, и при определенных условиях полученное соединение формулы I преобразуют в соль.
Реакцию между соединением формулы II и соединением формулы III осуществляют предпочтительно с применением составляющего основу соединения III (тио)спирта, т. е. , например, в этаноле, если A является водородом, a R12 этилом. Щелочной металл М представляет собой предпочтительно натрий. Реакцию целесообразно проводить при нагревании, например, до температуры 40-120oC.
Реакция между соединениями IV и VII и соединениями V, соответственно VI, может осуществляться с помощью известных методов, используемых при получении сульфонамидов, например, в инертном органическом растворителе, как диметилсульфоксид, предпочтительно при нагревании и в среде защитного газа, например аргона. В соединениях формулы V катион представляет собой предпочтительно катион щелочного металла, как Na+ или К+.
При реакции между соединением формулы VI и соединением формулы VII в этом последнем при определенных условиях имеющиеся в качестве заместителей R4-R9 окси- и аминогруппы предпочтительно защищаются. Оксигруппы могут защищаться, например, силиловыми группами, такими, как диметил-третбутилсилиловые группы, либо ацильными группами, как ацетил; аминогруппы могут защищаться третбутоксикарбонилом либо бензилоксикарбонилом. Эти защитные группы могут вводиться известным образом и после реакции между соединениями VI и VII снова удаляться.
Полученные описанным выше путем соединения формулы I, в которых Y и/или R4 представляют собой остаток CH3 например метил, благодаря модификации заместителей могут преобразовываться в другие соединения формулы I. Так, представляющая заместитель Y и/или R4 группа CH3 посредством окисления может преобразовываться в группу CHO. Окисление может проводиться известным образом, например двуокисью селена. В полученном таким путем соединении формильная группа может быть восстановлена в оксиметиловую группу. Такое восстановление может проводиться известным образом, например с помощью восстановителей, как NaBH4. Оксиметиловая (соответственно - алкильная) группа путем обработки галогенирующим средством, как POCl3/PCl5, может преобразовываться в галогенметиловую (соответственно - алкильную) группу, из которых с помощью реакции со спиртами или аминоспиртами получают соединения формулы I, в которых Y представляет собой остаток -(CH2)1-4ZR9, -CH2OCH2CH(OH)CH2OH и его циклические кетали, -CH2NR9CH2CH(OH)CH2OH или -CH2O(CH2)1-4ZH. В полученных таким путем соединениях формулы I содержащиеся в Y окси- или аминогруппы могут этерифицироваться, в результате чего получают соединения формулы I, в которых Y представляет собой один из указанных выше остатков, в которых остаток R11 содержится при значении C1-4-алканоил или гетероциклилкарбонил.
С другой стороны, формильная группа с помощью реакции Гриньяра алкилмагниевыми галогенидами может быть преобразована в соединение формулы I, в которой Y является остатком -CH(OH)R11. Формильная группа может, далее, вступать в реакцию с соединениями Гриньяра формулы Br-Mg-(CH2)1-4-Z-H, в которых ОН- и SH-группы представлены в защищенной форме (например, в качестве бензилового эфира), с целью получения (после отщепления ОН- и SH-защитных групп) соединений формулы I с Y=-CH(OH)(CH2)1-4-Z-H. С помощью реакции между соединением формулы I и диметилсульфидом/Li могут быть получены соединения формулы I с Y= -CH(OH)CH2SCH3, которые посредством окисления NaJO4 могут преобразовываться в соединения формулы I с Y=-CH(OH)CH2S(O)CH3.
Соединения формулы I с Y=-C(O)R10 или -C(O)(CH2)1-4-Z-R11 могут быть получены посредством окисления соответствующих соединений, в которых Y представляет собой остаток -CH(OH)R10 или - CH(OH)(CH2)1-4ZR11, причем OH- или SH-группы ZR11 в ходе реакции предпочтительно защищаются, например, в качестве бензилового эфира. В качестве средства окисления в названной реакции может использоваться, например, CrO3/пиридин.
Все перечисленные реакции могут осуществляться по известной методике. И, наконец, соединения формулы I могут известным образом преобразовываться в соли, например соли щелочных металлов, как соли натрия и калия.
Используемые в качестве исходного материала соединения, если они известны или если их получение описывается ниже, могут быть получены аналогично известным, соответственно описанным ниже методам.
Соединения формулы II, в которых n=1, могут быть получены согласно нижеследующей схеме: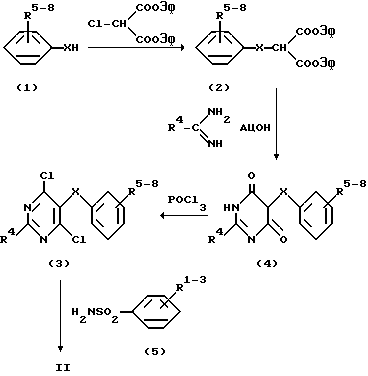
Путем алкилирования фенола (1) сложным диэтиловым эфиром хлормалоновой кислоты получают соединение (2), из которого путем конденсации формамидинацетатом или каким-либо гомологенным соединением, как ацетамидинацетат, получают пиримидиндионпроизводное (3). Из этого последнего с помощью фосфороксихлорида получают дихлорсоединение (4), из которого с помощью реакции обмена со стехиометрическим количеством соединения (5) получают соединение II с n=1. Соединения формулы II, в которых n=0, могут быть получены согласно следующей схеме: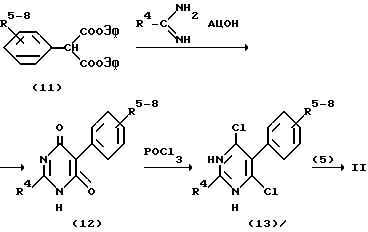
Все эти реакции являются стандартными и могут осуществляться при обычных для таких реакций условиях, известных каждому специалисту.
Соединения формулы IV с n = 1 могут быть получены следующим образом: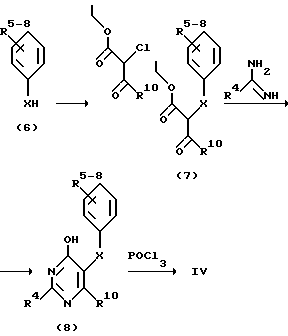
Фенол либо тиофенол формулы (6) в присутствии натрия в соответствующем растворителе, например толуоле, может преобразовываться сложным этиловым эфиром 2-хлорацетуксусной кислоты в соединение формулы (7), из которого посредством конденсации амидином R4C(NH)NH2 может быть получено окси-пиримидинпроизводное (8), соответственно его таутомер -NH-CO-. В результате обмена оксигруппы на хлор с помощью POCl3 получают соединение IV.
Соединения формулы IV, в которых n = 0, могут быть получены исходя из соединений формулы (9)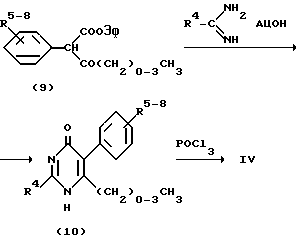
Тормозящее действие соединений формулы I на эндотелиальные рецепторы может быть проиллюстрировано описанными ниже экспериментами, проводившимися по следующей схеме.
1. Торможение эндотолиального связывания на плацентамембранах человека
(ср. Life Sci 44:1429 (1989))
Мембрану человека гомогенируют в 5 мМ трис-буферного раствора, pH 7,4, содержащего 1 мМ MgCl2 и 200 мМ сукрозы. Гомогенизат обрабатывают на центрифуге с центробежным ускорением 3000g в течение 15 минут при 4oC, остаток, содержащий фракцию мембранной плазмы, центрифугируют с центробежным ускорением 72000g в течение 30 мин и осадок вымывают 75 мМ трис-буферного раствора pH 7,4, содержащего 25 мМ MgCl2. Затем получаемый из каждых 10 г оригинальной ткани осадок суспендируют в 1 мл 75 мМ трис-буферного раствора, pH 7,4, содержащего 25 мМ MgCl2 и 250 мМ сукрозы, и замораживают в 1 мл аликвоты при температуре -20oC.
Для теста на связывание замороженные мембранные препараты оттаивают и после центрифугирования с центробежным ускорением 25000g в течение 10 мин при 20oC в тестовом буферном растворе (50 мМ трис-буферного раствора, pH 7,4, содержащего 25 мМ MnCl2, 1 мМ ЭДТУ и 0,5% сыворотки крови крупного рогатого скота) снова суспендируют. 100 мкл этой суспензии, содержащей 70 мг протеина, инкубируют 50 мкл 125I-эндотелия (удельная активность 2200 Ки/ммоль) в тестовом буферном растворе (25000 импульс/мин, конечная концентрация 20 пМ) и 100 мкл тестового буферного раствора, содержащего испытуемое соединение в различных концентрациях. Инкубирование осуществляют в течение 2 ч при 20oC или в течение 24 ч при 4oC. Разделение свободных и мембраносвязанных радиолигандов производят посредством фильтрации через фильтры из стекловолокна.
II. Торможение индуцированных эндотелием сокращений на изолированных аортальных кольцах крысы
Из аорты грудной клетки взрослых крыс Вистар-Киото вырезались кольца длиной 5 мм. Эндотелий удаляли легким растиранием внутренней поверхности. Каждое кольцо погружали при 37oC в изолированную ванну с 10 мл раствора Кребса-Гензелейта при одновременной обработке газом, содержащим 95% O2 и 5% CO2. Изометрическое напряжение колец измерялось. Растяжением с нагрузкой в 3 г кольцам придавалось предварительное напряжение. После инкубирования в течение 10 мин с помощью испытуемого соединения или связующего добавляли кумулятивные дозы эндотелия-1. Активность испытуемого соединения определялась по соотношению доз, т.е. по обусловленному 100 мкМ испытуемого соединения смещению вправо (смещение в сторону больших показателей) EC50 эндотелия, причем EC50 обозначает концентрацию эндотелия, необходимую для половины максимального сокращения. Чем выше это соотношение доз, тем эффективнее испытуемое соединение тормозит биологическое действие эндотелия-1. EC50 эндотелия при отсутствии испытуемого соединения составляет 0,3 нМ.
III. Тормозящее действие на сужение сосудов у крысы
Крыс анестезировали тиобутарбиталем натрия (100 мг/кг перорально). Через феморальную (бедренную) артерию вводили катетер для измерения системного артериального давления крови, а через феморальную вену вводили еще один катетер в нижнюю полую вену для инъекции испытуемого соединения. На артерию левой почки накладывали зонд, который соединяли с измерительным прибором Допплера. Зажимом в течение 45 мин артерии левой почки на выходе вызывали ренальную ишемию. За 10 минут до появления ишемии внутриартериально (в.а.) дозами 5 мг/кг или внутривенно (в.в.) дозами 10 мг/кг вводили испытуемые соединения. В контрольных опытах ренальное кровоснабжение уменьшалось по сравнению с предишемическим показателем на 43±4%.
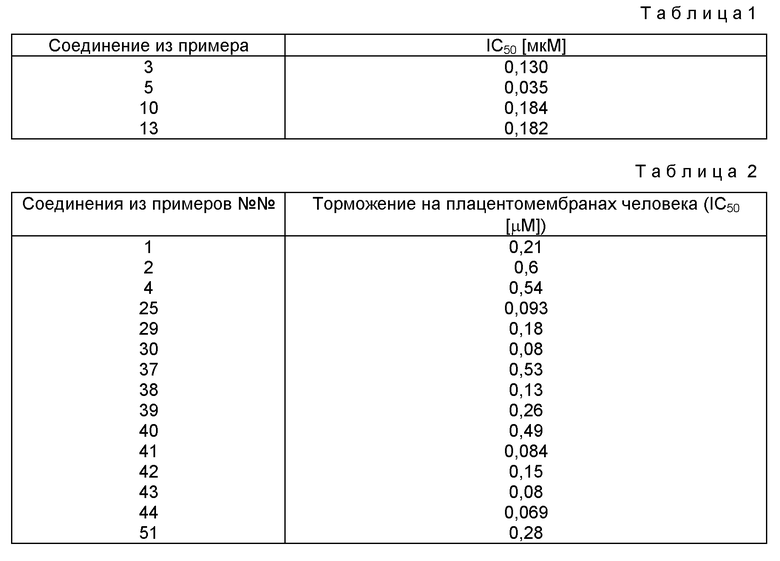
В таблице 1 приведено выявленное в эксперименте I тормозящее действие соединений формулы 1 под сокращением IC50, что означает концентрацию [мкМ], необходимую для 50%-ного удельного связывания 125I-эндотелия.
В таблице 2 приведено торможение на плацентмембранах человека.
Соединения формулы I благодаря их способности подавлять связывание эндотелия могут применяться в качестве препаратов для лечения заболеваний, вызываемых процессами, связанными с повышенным сужением сосудов. Примерами таких заболеваний являются высокое кровяное давление, коронарные болезни, сердечная недостаточность, ренальная и миокардиальная ишемия, почечная недостаточность, диализ, церебральная ишемия, инфаркт головного мозга, мигрени, субарахноидальное кровоизлияние, болезнь Рейно, пульмональное высокое давление. Названные соединения могут применяться также при атеросклерозе, для предотвращения рестеноза после искусственной дилятации сосудов, при воспалениях, язвах желудка и двенадцатиперстной кишки, варикозных язвах, Грам-отрицательном сепсисе, шоках, воспалении почек, почечных коликах, глаукоме, астме, при лечении и профилактике диабетических осложнений и осложнений при приеме циклоспорина, равно как и при заболеваниях, вызываемых повышением эндотелиальной активности.
Соединения формулы I могут применяться для орального, ректального, парентерального введения, например, для внутривенных, внутримышечных, подкожных, трансдермальных инъекций или инъекций внутри ликворного пространства; или для подъязычного введения или в качестве офтальмологических препаратов, или же в виде аэрозолей. Препараты могут применяться, например, в виде капсул, таблеток, вводимых орально суспензий или растворов, суппозиториев, инъекционных растворов, глазных капель, мазей или аэрозольных растворов.
Предпочтительной формой применения являются внутривенные, внутримышечные инъекции и введение оральным путем. Дозировка эффективных количеств соединений формулы I зависит от специфики биологически активного вещества, возраста и потребностей пациента, равно как и от способа применения. Как правило, ежедневная дозировка определяется из расчета 0,1-100 мг/кг веса тела. Препараты, содержащие соединения формулы I, могут содержать также инертные или обладающие фармакодинамической активностью добавки. Таблетки или грануляты, например, могут содержать ряд связывающих веществ, наполнителей, носителей или разбавителей. Жидкие препараты могут изготавливаться, например, в виде стерильного, смешиваемого с водой раствора. Капсулы могут наряду с биологически активным веществом содержать в качестве добавок наполнитель либо загуститель. Кроме того, могут использоваться улучшающие вкус добавки, а также вещества, применяемые обычно в качестве консервантов, стабилизаторов, эмульгаторов и влагосохраняющих средств, далее, также соли для изменения осмотического давления, буферы и другие добавки.
Для получения упомянутых выше носителей и разбавителей могут применяться органические и неорганические вещества, например желатин, молочный сахар, крахмал, стеарат магния, тальк, гуммиарабик, полиалкиленгликоли и т.п. Необходимым условием является то, чтобы все используемые при изготовлении препаратов вспомогательные вещества не были токсичными.
Нижеследующие примеры поясняют изобретение подробно. Применяемые в них сокращения означают следующее:
т.к. - точка кипения,
т.пл. - точка плавления,
МС - масс-спектр и
М - масса моля
Пример 1
10,7 г 4-[4-хлоро-5-(2-хлоро-5-метокси-фенокси)-6-метил-пиримидин-2-ил]- морфолина и 21,6 г p-t-бутил-бензолсульфонамид-калия в 150 мл сухого диметилсульфоксида нагревали в среде аргона в течение 16 ч до 120oC. Затем диметилсульфоксид отгоняли, остаток распределяли между этилацетатом и 1н. соляной кислоты и органическую фазу вымывали нейтрализующим веществом. Органическую фазу сушили, раствор выпаривали и остаток перекристаллизовывали из дихлорметана/этанола. В результате получили 14,7 г 4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-метил-2- (морфолин-4-ил)-пиримидин-4-ил]-бензолсульфонамида, т.пл. 154oC, МС:М=546.
Исходный материал получали следующим образом:
а) В раствор, содержащий 17,1 г 2-хлор-5-метоксифенола в толуоле, добавляли 2,8 г натрия. Реакционную смесь перемешивали при температуре 110oC в среде аргона в течение 3 часов, после чего обрабатывали раствором из 19,57 г сложного этилового эфира 2-хлор-ацетуксусной кислоты в толуоле. Реакционную смесь продолжали перемешивать еще в течение 3 часов при 110oC и распределяли между уксусной кислотой/водой 20% и толуолом. Органическую фазу сушили и раствор отгоняли. Остаток очищали над силикагелем дихлорметаном. В результате получили 18,2 г сложного этилового эфира (RS)-(2-хлоро-5-метокси-фенокси)-ацетуксусной кислоты в виде масла желтоватого цвета. МС:М=286.
б) В раствор натрийметилата, содержащего 10 мл метанола и 0,19 г натрия, добавили 0,8 г морфолиноформамидингидробромида и 1 г сложного эфира (RS)-(2-хлоро-5-метокси-фенокси)ацетуксусной кислоты. Реакционную смесь перемешивали в течение 16 часов при температуре 80oC, установили на pH 6 и концентрировали. Остаток распределяли между хлороформом и водой. После сушки и выпаривания растворителя остаток кристаллизовали из этанола/дихлорметана. В результате были получены 0,45 г 5-(2-хлоро-5-метокси-фенокси)-6- метил-2-(морфолин-4-ил)-пиримидин-4-ола, т.пл. 252oC, МС:М=351.
в) 1,72 г 5-(2-хлоро-5-метокси-фенокси)-6-метил-2-(морфолин-4-ил)- пиримидин-4-ола обрабатывали 3,3 мл POCl3. Реакционную смесь перемешивали при температуре 120oC в течение 2 часов, после чего избыточный реагент отгоняли. Остаток обрабатывали хлороформом и вымывали водой, 1н. NaOH. Органическую фазу сушили, концентрировали и остаток перекристаллизовывали из простого эфира. В результате были получены 1,48 г 4-[4-хлоро-5- (2-хлоро-5-метокси-фенокси)-6-метил-пиримидин-2-ил]-морфолина, т.пл. 134oC, МС:М=369.
Пример 2
14,6 г 4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-метил-2- (морфолин-4-ил)-пиримидин-4-ил]-бензолсульфонамида и 15,9 г двуокиси селения в 500 мл диоксана перемешивали в автоклаве при температуре 170oC в течение 6 часов. Реакционную смесь фильтровали и фильтрат концентрировали. Остаток распределяли между хлороформом и водой. Органическую фазу сушили, растворитель выпаривали и остаток перекристаллизовывали из дихлорметана/этанола. В результате были получены 10,3 г 4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси) -6-формил-2-(морфолин-4-ил)-пиримидин-4-ил] -бензолсульфонамида, т.пл. 235-236oC, МС:М=561.
Пример 3
7 г 4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-формил-2- (морфолин-4-ил)-пиримидин-4-ил] -бензолсульфонамида в 300 мл этанола обрабатывали 0,9 г натрийборгидрида. Реакционную смесь перемешивали при температуре 80oC в течение часа. Затем этанол отгоняли, а остаток распределяли между хлороформом и 1н. NaCl. Органическую фазу вымывали водой и сушили, растворитель выпаривали и остаток хроматографировали дихлорметаном над силикагелем. После перекристаллизации из дихлорметана/этанола получили 4,6 г 4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6- оксиметил-2-(морфолин-4-ил)-пиримидин-4-ил]-бензолсульфонамида, т.пл. 103oC, МС:М=536.
Пример 4
4,57 г 4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-оксиметил- 2-(морфолин-4-ил)-пиримидин-4-ил] -бензолсульфонамида в 50 мл POCl3, перемешивали с 2,03 г PCl5 в течение двух часов при температуре 20oC. Затем POCl3 отгоняли, а остаток распределяли между уксусным эфиром и водой 1н. NaOH. Органическую фазу вымывали водой, сушили и растворитель выпаривали. Остаток хроматографировали над силикагелем дихлорметаном и хлороформом, после чего перекристаллизовывали из дихлорметана/этанола. В результате получили 3,01 г 4-третбутил-N- [5-(2-хлоро-5-метокси-фенокси)-6-хлорометил-2-(морфолин-4-ил) - пиримидин-4-ил]-бензолсульфонамида, т.пл. 170oC, МС:М=581.
Пример 5
В раствор натрийгликоля, содержащий 2,5 г этиленгликоля и 0,12 г натрия, добавляли 1 г 4-третбутил-N-[5-(2- хлоро-5-метокси-фенокси)-6-хлорометил-2-(морфолин-4-ил) - пиримидин-4-ил] -бензолсульфонамида. Реакционную смесь перемешивали в среде аргона в течение 72 часов при температуре 80oC. Затем отгоняли этиленгликоль, а остаток распределяли между этилацетатом и 1н. соляной кислоты. Органическую фазу вымывали водой, сушили над сульфатом натрия, а растворитель отгоняли. Остаток хроматографировали над силикагелем простым эфиром. В результате получили 0,85 г 4-третбутил-N-[5-(2-хлоро-5-метокси- фенокси)-6-(2-окси-этоксиметил)-2-(морфолин-4-ил)-пиримидин-4-ил]- бензолсульфонамида, т.пл. 162-164oC, МС:М=606.
Пример 6
Аналогично тому, как это описано в примере 1, из 4-хлоро-5-(2-хлоро- 5-метокси-фенокси)-6-метил-пиримидина получили 4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-метил-пиримидин-4- ил]-бензолсульфонамид. Т.пл. 191oC, МС:(M-Cl*)=426.
Исходный материал получали следующим образом:
Аналогично примеру 1, абзац а) из сложного этилового эфира (RS)-(2-хлоро-5-метокси-фенокси)-ацетуксусной кислоты и формамидинацетата получили 5-[2-хлоро-5-метокси-фенокси]-6-метил-пиримидин-4-ол в виде воска, МС:М=266, который обрабатывали аналогично примеру 1, абзац б) POCl3.
Пример 7
Аналогично тому, как это описано в примере 2, полученное в примере 6 соединение преобразовывали в 4-третбутил-N- [-5-(2-хлоро-5-метокси-фенокси)-6-формил-пиримидин-4-ил] - бензолсульфонамид. Т.пл. 99-101oC, МС:М=475.
Пример 8
Аналогично тому, как это описано в примере 3, из полученного в примере 7 соединения получили 4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)- 6-окси-метил-пиримидин-4-ил]-бензолсульфонамид, т.пл. 188oC, МС:М=477.
Пример 9
Аналогично тому, как это описано в примере 4, из полученного в примере 8 соединения получили 4-третбутил-N-[6-хлорометил-5-(2-хлоро- 5-метокси-фенокси)-пиримидин-4-ил]-бензолсульфонамид. Т.пл. 170oC, МС:(M-Cl*=460.
Пример 10
Аналогично тому, как это описано в примере 5 из 4-третбутил-N- [6-хлорометил-5-(2-хлоро-5-метокси-фенокси)-пиримидин-4-ил] -бензолсульфонамида получили 4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)- 6-(2-окси-этокси-метил)-пиримидин-4-ил]-бензолсульфонамид. Т.пл. 80oC, МС:(М+Н)+ = 522.
Пример 11
100 мг 4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-(2-окси-этокси- метил)-2-(морфолин-4-ил)-пиримидин-4-ил] -бензолсульфонамида этерифицировали 3-тиофенкарбоновой кислотой при следующих условиях: сначала растворили 100 мг сульфонамида, 175 мг N-этил-N'-(3-диметиламинопропил)-карбодиимид-гидрохлорида, 150 мг триэтиламина и 5 мг диметиламинопиридина в 10 мл дихлорметана и раствор выдерживали в течение 2 часов при комнатной температуре. Затем выпаривали до сухого состояния. Остаток обрабатывали толуолом и распределяли между уксусным эфиром и 1н. HCl, после чего вымывали водой и выделяли по обычной методике. Соединение очищали над силикагелем хлороформом в качестве подвижной фазы. В результате получили 90 мг 2-[6-(4- третбутил-фенилсульфонамино)-5-(2-хлоро-5-метокси-фенокси)-2- морфолин-4-ил)-пиримидин-4-ил-метокси] -сложного этилового эфира тиофен-3-карбоновой кислоты в виде аморфного порошка, МС:М=716.
Пример 12
Аналогично тому, как это описано в примере 5, из 200 мг 4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-хлорметил-2- (морфолин-4-ил)-пиримидин-4-ил] -бензолсульфонамида и (RS)- 2,2-диметил-1,3-диоксолан-4-метанол-Na получили (RS)-4-третбутил- N-[5-(2-хлоро-5-метокси-фенокси)-6-(2,2-диметил-1,3-диоксолан-4- илметоксиметил)-2-морфолин-4-ил)-пиримидин-4-ил] - бензолсульфонамида. Т.пл. 155-156oC, МС:М=676.
Пример 13
В раствор, содержащий 100 мг полученного в примере 12 соединения в 2 мл диоксана, добавляли 1,5 мл 1н. HCl и в течение 15 минут смесь нагревали до 80oC. После выпаривания остаток хроматографировали над силикагелем с помощью простого эфира в качестве подвижной фазы и получили 85 мг (RS)-4-третбутил-N-[5- (2-хлоро-5-метокси-фенокси)-6- (2,3-диокси-пропоксиметил)-2-(морфолин-4-ил)-пиримидин-4-ил] - бензолсульфонамида в виде пены МС:(М+Н)+= 637.
Пример 14
Путем реакции обмена между 4-третбутил-N-[6-хлорометил-5-(2-хлоро-5- метокси-фенокси)-пиримидин-4-ил]-бензолсульфонамидом и этаноламином получили 4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6- (2-окси-этиламинометил)-пиримидин-4-ил]-бензолсульфонамид.
Пример 15
Путем реакции обмена между 4-третбутил-N-[6-хлорометил-5-(2-хлоро-5- метокси-фенокси)-пиримидин-4-ил] -бензолсульфонамидом и пропандиолом-Na получили 4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6- (3-окси-пропоксиметил)-пиримидин-4-ил]-бензолсульфонамид. МС:М-(Cl*+HC(O)CH2CH2OH)=436.
Пример 16
Путем реакции обмена между 4-третбутил-N-[6-(хлорометил-5-(2-хлоро-5- метокси-фенокси)-пиримидин-4-ил] -бензолсульфонамидом и 1-аминопропандиолом получили (RS)-4-третбутил-N-[5-(2-хлоро-5-метокси- фенокси)-6-(2,3-диоксипропиламинометил)-пиримидин-4-ил]-бензолсульфонамид. МС:(М+Н)+=551.
Пример 17
Аналогично тому, как это описано в примере 12, из 4-третбутил-N-[6-хлорометил-5-(2-хлоро-5-метокси-фенокси)-пиримидин-4-ил]- бензолсульфонамида получили (RS)-4-третбутил-N-[5-(2-хлоро-5-метокси- фенокси)-6-(2,2-диметил-1,3-диоксолан-4-илметоксиметил) -пиримидин-4-ил]-бензолсульфонамид. МС: (М+Н)+ = 592.
Пример 18
Аналогично тому, как это описано в примере 13, из (RS)-4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-(2,2-диметил- 1,3-диоксолан-4-ил-метоксиметил)-пиримидин-4-ил] - бензолсульфонамида получили (RS)-4-третбутил-N-[5-(2-хлоро-5- метокси-фенокси)-6-(2,3-диокси-пропоксиметил)-пиримидин-4-ил] - бензолсульфонамид. МС:М = 551.
Пример 19
Путем реакции обмена между 4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)- 6-(2-окси-этокси-метил)-пиримидин-4-ил] -бензолсульфонамидом и никотиновой кислотой получили сложный 2-[6-(4-третбутил-фенилсульфониламино)- 5-(2-хлоро-5-метокси-фенокси) -пиримидин-4-илметокси] -этиловый эфир пиридин-3-ил-уксусной кислоты. МС:М=626.
Пример 20
Путем реакции обмена между 4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)- 6-(2-окси-этокси-метил)-пиримидин-4-ил]-бензолсульфонамидом и изоникотиновой кислотой получили сложный 2-[6-(4-третбутил-фениосульфониламино)-5-(2-хлоро-5-метокси-фенокси)- примидин-4-илметокси] -этиловый эфир пиридин-4-ил-уксусной кислоты.
Пример 21
Путем реакции обмена между 4-третбутил-N-[5-(2-хлоро-5-метокси- фенокси)-6-(2-окси-этокси-метил)-пиримидин-4-ил] -бензолсульфонамидом и 3-фуранкарбоновой кислотой получили сложный 2-[6-(4-третбутил-фенилсульфониламино)-5-(2-хлоро-5-метокси-фенокси)- пиримидин-4-илметокси]-эфир фуран-3-карбоновой кислоты. МС:(М+Н)+=618.
Пример 22
Путем реакции обмена между 4-третбутил-N-[5-(2-хлоро-5-метокси- фенокси)-6-(2-оксиэтокси-метил)-пиримидин-4-ил] -бензолсульфонамидом и 3-тиофенкарбоновой кислотой получили сложный 2-[6-(4-третбутил-фенилсульфониламино)-5-(2-хлоро-5-метокси-фенокси)- пиримидин-4-илметокси] -этиловый эфир тиофен-3-карбоновой кислоты. МС:М=631.
Пример 23
а) Аналогично тому, как это описано в примере 1, путем реакции обмена между сложным этиловым эфиром 2,6-дихлоро-5-фенокси-пиримидин- 4-карбоновой кислоты и р-третбутил-бензолсульфонамид-калийной солью получают сложный этиловый эфир 6-(4-третбутил-фенилсульфониламино)-2- хлоро-5-фенокси-пиримидин-3-карбоновой кислоты. МС:(М+Н)+=490.
б) Требуемое в качестве исходного соединения дихлорид получают следующим образом:
130 мг сложного этилового эфира 2,6-диоксо-5-фенокси-1,2,3,6- тетрагидро-пиримидин-4-карбоновой кислоты растворяют в 7,6 мл POCl3, обрабатывают 7,6 мг PCl5, и желтый раствор в течение 17 часов нагревают с обратным холодильником. POCl3 удаляют в водоструйном вакууме, остаток распределяют между водой и уксусным эфиром. После обычной обработки органической фазы остаток хроматографируют на силикагеле (растворители: CH2Cl2/простой эфир: 6/1). В результате получают 44 мг сложного этилового эфира 2,6-дихлоро-5-фенокси-пиримидин-4-карбоновой кислоты в виде масла. МС:М=312.
в) Требуемое в качестве исходного соединение получают следующим образом: 1,8 г 2,6-диоксо-5-фенокси-1,2,3,6-тетрагидро-пиримидин-4- карбоновой кислоты (получение описывается в "Химические гетероцикл. соед-я", 1974 г., стр. 1527) эмульгируют в 65 мл этанола, затем добавляют 0,92 мл концентрированной H2SO4, и 0,92 мл SOCl2; и смесь в течение 12 часов нагревают с обратным холодильником. Затем концентрируют с помощью ротационного испарителя и отфильтровывают на нутче выпавший твердый осадок, который хроматографируют на силикагеле (растворители: CH2Cl2простой эфир: 3/1). В результате получают 520 мг сложного этилового эфира 2,6-диоксо-5-фенокси-1,2,3,6-тетрагидро-пиримидин- 4-карбоновой кислоты в виде твердого вещества. МС:М = 276.
Пример 24
В раствор, содержащий 69 мг Na в 5,0 мл абс. этанола, добавляли 526 мг 4-третбутил-N-[6-хлоро-5-(2-метокси-фенокси)-2-(пиримидин-2-ил)- пиримидин-4-ил]-бензолсульфонамида. Раствор кипятили при перемешивании в течение 4 часов с использованием нагрева с обратным холодильником. После выпаривания растворителя при пониженном давлении остаток распределяли между уксусным эфиром и 1 М-водной винной кислоты, органическую фазу сушили и выпаривали, после чего остаток перекристаллизовывали из спирта. В результате получили 4-третбутил-N- [6-этокси-5-(2-метокси-фенокси)-2,2'-бипиримидин- 4-ил] -бензолсульфонамид в виде белых кристаллов. Т.пл. 140-141oC.
4-третбутил-N-[6-хлоро-5-(2-метокси-фенокси)-2-пиримидин-2-ил)- пиримидин-4-ил] -бензолсульфонамид получали исходя из пиримидин-2-карбоксамидин-гидрохлорида через рац-5-(2-метокси- фенокси)-2-пиримидин-2-ил-тетрагидро-пиримидин-4,6-дион и 4,6- дихлор-5-(2-метокси-фенокси)-2,2'-бипиримидин.
Пример 25
Аналогично тому, как это описано в примере 24 из 4-третбутил-N-[6-хлоро-5-(2-метокси-фенокси)-2-(пиримидин-2- ил)-пиримидин-4-ил] -бензолсульфонамида и метилата натрия в метаноле получили 4-третбутил-N-[6-метокси-5-(2-метокси-фенокси) -2-бипиримидин-4-ил] -бензолсульфонамид в виде твердого вещества.
Пример 26
Аналогично тому, как это описано в примере 1, из 4-хлоро-5-(2-хлоро-5-метокси-фенокси)-6-метил-2,2'-бипиримидинила получили 4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-метил- 2,2'-бипиримидинил-4-ил] -бензолсульфонамид, т.пл. 122oC, МС:(M- Cl)=504.
Исходный материал получили следующим образом:
а) Аналогично тому, как это описано в примере 1б), из 2- пиримидиноамидин-гидрохлорида получили 5-(2-хлоро-5-метокси- фенокси)-6-метил-2,2'-бипиримидинил-4-ол. МС:М=344.
б) Аналогично тому, как это описано в примере 1в), из описанной выше субстанции получили 4-хлоро-5- (2-хлоро-5-метокси-фенокси)-6-метил-2,2'-бипиримидинил, т.пл. 110oC, МС:М=363.
Пример 27
Аналогично тому, как это описано в примере 12, получили (S)-4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-(2,2- диметил-1,3-диоксолан-4-илметоксиметил)-2-морфолин-4-ил) - пиримидин-4-ил]-бензолсульфонамид. МС:М=677.
Пример 28
Аналогично тому, как это описано в примере 12, получили (R)-4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-(2,2- диметил-1,3-диоксолан-4-ил-метоксиметил)-2-(морфолин-4-ил) - пиримидин-4-ил]-бензолсульфонамид. МС:М= 677.
Пример 29
Аналогично тому, как это описано в примере 13, из полученного в примере 28 соединения получили (S)-4-третбутил-N-[5-(2-хлоро-4-метокси- фенокси)-6-(2,3-диоксипропоксиметил)-2-(морфолин-4-ил)-пиримидин-4-ил]- бензолсульфонамид. МС:М=637.
Пример 30
Аналогично тому, как это описано в примере 13, из полученного в примере 28 соединения получили (R)-4-третбутил-N-[5- (2-хлоро-5-метокси-фенокси)-6-(2,3-диокси-пропоксиметил)-2- (морфолин-4-ил)-пиримидин-4-ил]-бензолсульфонамид. МС:М=637.
Пример 31
Аналогично тому, как это описано в примере 17, из 4-третбутил-N-[6-хлорметил-5-(2-хлоро-5-метокси-фенокси) - пиримидин-4-ил]-бензолсульфонамида и 2,3-O-изопропилиден-L- треита получили (4S,5S)-4-третбутил-N-[5-(2-хлоро-5-метокси- фенокси)-6-(5-оксиметил-2,2-диметил-1,3-диоксолан-4- илметоксиметил)-пиримидин-4-ил]-бензолсульфонамид. МС:М=622.
Пример 32
Аналогично тому, как это описано в примере 18, из полученного в примере 31 соединения получили (2S,3S)-4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6- (2,3,4-триоксибутоксиметил)-пиримидин-4-ил]-бензолсульфонамид. Т.пл. 192oC, МС:М=582.
Пример 33
Аналогично тому, как это описано в примере 2, из полученного в примере 26 соединения получили 6-(4-третбутил- фенилсульфонамино)-5-(2-хлоро-5-метокси-фенокси)-2,2'- бипиримидинил-4-карбоксальдегид, т.пл. 211oC.
Пример 34
Аналогично тому, как это описано в примере 3, из полученного в примере 33 альдегида получили 4-третбутил-N-[5-(2-хлоро-5-метокси- фенокси)-6-оксиметил-2,2'-бипиримидин-4-ил]-бензолсульфонамид, МС:М=556.
Пример 35
Аналогично тому, как это описано в примере 4, из полученного в примере 34 спирта получили 4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)- 6-хлоро-метил-2,2'-бипиримидин-4-ил]-бензолсульфонамид, МС:М=574.
Пример 36
Аналогично тому, как это описано в примере 5, из полученного в примере 35 вещества получили 4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)- 6-(2-оксиэтоксиметил)-2,2'-бипиримидин-4-ил]-бензолсульфонамид, МС:(МН)-=598.
Пример 37
Аналогично тому, как это описано в примере 25, из 4-третбутил-N-[6-хлоро-5-(2-хлоро-5-метокси-фенокси-2-метил- пиримидин-4-ил] -бензенесульфонамида и метилата натрия в метаноле получили 4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-метокси- 2-метил-пиримидин-4-ил]-бензолсульфонамид, т.пл. 174oC, MC:M- (SO2+Cl)=392.
Пример 38
Аналогично тому, как это описано в примере 2, из полученного в примере 37 соединения получили 4-третбутил-N-[5-(2-хлоро-5-метокси- фенокси)-2-формил-6-метоксипиримидин-4-ил] -бензолсульфонамид, т.пл. 163oC, МС:(М-Н)-= 503.
Пример 39
Аналогично тому, как это описано в примере 3, из полученного в примере 38 соединения получили 4-третбутил-N-[5-(2-хлоро-5-метокси- фенокси)-2-оксиметил-6-метокси-пиримидин-4-ил] -бензолсульфонамид, т.пл. 167oC, МС:М+Н+= 508.
Пример 40
Аналогично тому, как это описано в примере 4, из полученного в примере 39 соединения получили 4-третбутил-N-[5-(2-хлоро-5-метокси- фенокси)-2-хлорометил-6-метокси-пиримидин-4-ил] -бензолсульфонамид, т.пл. 165oC, МС:М= 526.
Пример 41
Аналогично тому, как это описано в примере 5, из полученного в примере 40 соединения получили 4-третбутил-N-[5-(2- хлоро-5-метокси-фенокси)-2-(2-окси-этоксиметил-6-метокси-пиримидин-4-ил]- бензолсульфонамид, т. пл. 150oC, МС:М=552.
Пример 42
Аналогично тому, как это описано в примере 27, из полученного в примере 40 соединения получили (RS)-4-третбутил-N-[5-(2-хлоро-5-метокси- фенокси)-2-(2,2-диметил-1,3-диоксолан-4-илметокси-метил)-6-метокси- пиримидин-4-ил] -бензолсульфонинамид, т.пл. 162oC, МС:М=622.
Пример 43
Аналогично тому, как это описано в примере 29, из полученного в примере 42 соединения получили (RS)-4-третбутил-N-(5-(2-хлоро-5- метокси-фенокси)-2-(2,3-окси-пропокси-метил)-6-метокси-пиримидин-4-ил]- бензолсульфонамид, т. пл. 81oC, МС:М=582.
Пример 44
Раствор, содержащий 100 мг полученного в примере 40 соединения в 20 мл NH3-диоксана, нагревали в толстостенной колбе для работ под давлением в течение 16 часов до 80oC. После выпаривания остаток хроматографировали над силикагелем хлороформом/метанолом, в результате получили 30 мг 4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)- 2-аминометил-6-метокси-пиримидин- 4-ил]-бензолсульфонамида, МС:М=507.
Пример 45
Аналогично тому, как это описано в примере 24, из N-[5-(2-хлоро-5-метокси-фенокси)-2-метил-6-хлоро-пиримидин-4-ил] - 1,3-бензодиоксол-5-сульфонамида и 2-метоксиэтанолата натрия получили N-[5-(2-хлоро-5-метокси-фенокси)-6-(2-метокси-этокси) - 2-метил-пиримидин-4-ил] -1,3-бензодиоксол-5-сульфонамид, т.пл. 128oC, MC:M-(SO2+Cl)=424.
Пример 46
Аналогично тому, как это описано в примере 2, из полученного в примере 45 соединения получили N-[5-(2-хлоро-5- метокси-фенокси)-2-формил-6-(2-метокси-этокси)-пиримидин-4-ил] - 1,3-бензодиоксол-5-сульфонамид, МС:М-(SO2 + Cl) = 438.
Пример 47
Аналогично тому, как это описано в примере 3, из полученного в примере 46 соединения получили N-[5-(2-хлоро-5- метокси-фенокси)-2-оксиметил-6-(2-метокси-этокси)-пиримидин-4-ил]- 1,3-бензодиоксол-5-сульфонамид, МС:М-(SO2 + Cl) = 440.
Пример 48
Аналогично тому, как это описано в примере 4, из полученного в примере 47 соединения получили N-[5-(2-хлоро-5-метокси-фенокси)-2- хлорометил-6-(2-метокси-этокси)-пиримидин-4-ил] -1,3-бензодиоксол-5- сульфонамид, МС:М-(SO2 + Cl) = 458.
Пример 49
Аналогично тому, как это описано в примере 41, из полученного в примере 48 соединения получили N-[5-(2-хлоро-5-метокси-фенокси)-2- (2-окси-этоксиметил)-6-(2-метокси-этокси)-пиримидин-4-ил]-1,3-бензодиоксол- 5-сульфонамид, МС:М = 584.
Пример 50
Аналогично тому, как это описано в примере 25, из 4-третбутил-N-[6-(2-хлоро-5-метокси-фенилсульфонил)-2-метил- пиримидин-4-ил]-бензолсульфонамида получили 4-третбутил-N-[6- метокси-5-(2-метокси-фенилсульфонил)-2-метил-пиримидин-4-ил] - бензолсульфонамид, МС:М=474.
Исходный материал получали следующим образом:
а) В раствор, содержащий 2,2 мл 2-метокситиофенола в 30 мл этанола добавляли 1 г KOH. Реакционную смесь подвергали при комнатной температуре взаимодействию с раствором сложного диметилового эфира хлормалоновой кислоты в 5 мл этанола, продолжая перемешивать еще в течение часа, после чего выпаривали. Остаток распределяли между простым эфиром и водой. Органическую фазу сушили, концентрировали и остаток очищали над силикагелем хлористым метиленом. В результате получили 3,6 г сложного диметилового эфира (2-метокси-фенилсульфонил) -малоновой кислоты, МС:М = 270.
б) Аналогично тому, как это описано в примере 1б, из полученного в примере 50а вещества и ацетамидин-гидрохлорида получили 6-окси-5-(2-метокси-фенилсульфанил)-2-метил-3,4-дигидро- пиримидин-4-он, т. пл. 290oC, МС:М = 264.
в) Аналогично тому, как это описано в примере 1в, из полученного в примере 50б вещества получили 4,6-дихлоро-5-(2- метокси-фенилсульфанил)-2-метил-пиримидин, т.пл. 140oC, МС:М=301.
г) Аналогично тому, как это описано в примере 1, из полученного в примере 50в вещества получили 4-третбутил-N-[6-хлоро-5-(2- метокси-фенилсульфанил)-2-метил-пиримидин-4-ил] - бензолсульфонамид, т.пл. 155oC.
Пример 51
Аналогично тому, как это описано в примере 2, из полученного в примере 50 вещества получили 4-третбутил-N-[2-формил-6-метокси-5- (2-метокси-фенилсульфанил)-пиримидин-4-ил]-бензолсульфонамид, МС:М=487.
Пример 52
Аналогично тому, как это описано в примере 3, из полученного в примере 51 вещества получили 4-третбутил-N-[2-оксиметил-6-метокси-5- (2-метокси-фенилсульфанил)-пиримидин-4-ил]-бензолсульфонамид, т.пл. 152oC, МС:М=490.
Пример 53
В раствор фенолята натрия, содержащего 0,024 г фенола и 0,06 г NaOH в 2 мл ацетона и 1 мл воды, добавляли 0,145 г 4-третбутил-N- [5-(2-хлоро-5-метокси-фенокси)-6-хлоро-метил-2-(морфолин-4-ил) -пиримидин-4-ил] -бензолсульфонамида (пример 4) в 3 мл ацетона. Реакционную смесь перемешивали в среде аргона в течение 48 часов при температуре 80oC. После этого ацетон отгоняли, а остаток распределяли между хлороформом и водой. Хлороформ-фазу вымывали водой, сушили над сульфатом натрия и растворитель отгоняли. Остаток хроматографировали над силикагелем с помощью хлороформа. В результате получили 0,07 г 4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-2-морфолин- 4-ил-6-феноксиметил-пиримидин-4-ил]-бензолсульфонамида, МС:М = 639.
Пример 54
Аналогично тому, как это описано в примере 53, из 4-бифенолята натрия получили N-[6-бифенил-4-илоксиметил-5-(2-хлоро-5- метокси-фенокси)-2-морфолин-4-ил-пиримидин-4-ил]-4-третбутил- бензолсульфонамид, МС:М=715.
Пример 55
Аналогично тому, как это описано в примере 26, получили 305 мг N-[5-(2-хлор-5-метокси-фенокси)-6-метокси-2-метилсульфанил-пиримидин-4-ил] - 1,3-бензодиоксол-5-сульфонамида из 520 мг N-[6-хлор-5-метокси-фенокси)-2-метилсульфанил-пиримидин-4-ил] -1,3- бензодиоксол-5-сульфонамида и 270 мг метилата натрия в абс. MeOH. Т.пл. 176oC (из этанола).
Пример 56
Другими примерами соединений, полученных согласно изобретению, являются следующие:
4-метокси-N-[6-метокси-5-(2-метокси-фенокси)-2,2'-бипиримидин - 4-ил]-3-(3-морфолин-4-ил-3-оксопропил)-бензолсульфонамид;
сложный 2-[4-[6-метокси-5-(2-метокси-фенокси)-2,2'-бипиримидин-4-ил-сульфамоил] фенокси]-этиловый эфир уксусной кислоты;
4-(2-окси-этокси)-N-[6-метокси-5-(2-метокси-фенокси)-2,2'-бипиримидин-4-ил]- бензолсульфонамид;
N-[6-метокси-5-(2-метокси-фенокси)-2,2'-бипиримидин-4-ил]-4-(2-морфолин-4- ил-2-оксо-этокси)-бензолсульфонамид;
N-[6-метокси-5-(2-метокси-фенокси)-2,2'-бипиримидин-4-ил]-4-(3-морфолин- 4-ил-3-оксо-пропил)-бензолсульфонамид;
4-метокси-N-[6-метокси-5-(2-метокси-фенокси)-2,2'-бипиримидин-4-ил] -3-(2-оксоэтил)-бензолсульфонамид;
сложный этиловый эфир [2-метокси-5-[6-метокси-5-(2-метокси- фенокси)-2,2'-бипиримидин-4-ил-сульфамоил]фенокси]-уксусной кислоты;
4-третбутил-N-[6-метокси-5-(2-метокси-фенокси)-2-метил- пиримидин-4-ил] -бензолсульфонамид;
4-третбутил-(6-метокси-5-нафталин-2-илокси-2,2'-бипиримидин-4-ил)- бензолсульфонамид.
Пример А
Таблетки, содержащие следующие ингредиенты, могут изготавливаться обычным путем:
Ингредиенты - На одну таблетку
Соединения формулы I - 10,0 - 100,0 мг
Лактоза - 125,0 мг
Кукурузный крахмал - 75,0 мг
Тальк - 4,0 мг
Стеарат магния - 1,0 мг
Пример Б
Капсулы, содержащие следующие ингредиенты, могут изготавливаться обычным путем:
Ингредиенты - На одну капсулу
Соединения формулы I - 25,0 мг
Лактоза - 150,0 мг
Кукурузный крахмал - 20,0 мг
Тальк - 5,0 мг
Пример В
Инъекционные растворы могут иметь следующий состав:
Соединение формулы I - 3,0 мг
Желатин - 150,0 мг
Фенол - 4,7 мг
Вода для инъекционных растворов - ad 1,0 мл
Пример Г
В 3,5 мл миглиоля 812 и 0,08 г бензилового спирта суспендируют 500 мг соединения формулы 1. Полученную суспензию помещают в баллончик с дозирующим клапаном. Через этот клапан в баллончик подают под давлением 5,0 г фреона 12. В результате встряхивания фреон растворяется в смеси миглиоля и бензилового спирта. Этот аэрозольный баллончик содержит приблизительно 100 одинарных доз, которые могут использоваться по отдельности.
Описываются новые сульфонамиды общей формулы I, где R1 обозначает водород, низший алкил; R2 обозначает водород, низший алкил; R3 обозначает водород, низший алкил; R2 и R3 обозначают вместе метилендиокси, этилендиокси или изопропилидендиокси; R4 обозначает водород, низший алкил, низший алкоксил, низший алкилтио, окси-низший алкил, окси-низший алкокси, окси-низший алкокси-низший алкил, окси-низший алкокси-низший алкокси, алкокси-низший алкил, алкокси-низший алкилокси, амино-низший алкил, низший алкиламино-низший алкил, морфолино, 2-пиримидинил, -СНО, -СН2ОН или -CН2Cl; R5-R8 обозначают водород, галоген, низший алкокси, низший алкилтио; Х обозначает -О- или -S-; Y обозначает -СНО, С1-4-алкил, -(CH2)1-4-Z-R9, -(СН2)0-3С(O)ОR9, -(CH2)1-4-OC(O) (СН2)1-4СН3, -(СН2)1-4OС(O)гет, -(СН2)1-4OСН2СН(ОН)СН2OН и его циклические кетали, -(CH2)1-4NR9CH2CH(OH)CH2OH, -(CH2)1-4O(CH2)1-4-ZH, -(CH2)1-4NR9(CH2)1-4ZH, -(СН2)1-4O(СН2)1-4OС(O)гет, -(СН2)1-4гал, -OR12, R9 представляет собой водород или С1-4-алкил; R12 представляет собой C1-4-алкил или -(СН2)0-4-арил; Z обозначает -О-, гет-гетероциклический остаток, такой, как тиенил, фурил, пиридинил, гал-галоген, и n обозначает 0 или 1. Соединения представляют собой ингибиторы эндотолиальных рецепторов и могут применяться для лечения заболеваний, связанных с процессами, способствующими сужению сосудов. 12 з.п. ф-лы, 2 табл.
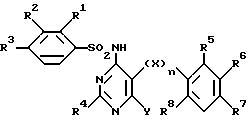
где R1 обозначает водород, низший алкил;
R2 обозначает водород, низший алкил;
R3 обозначает водород, низший алкил;
R2 и R3 обозначают вместе метилендиокси, этилендиокси или изопропил идендиокси;
R4 обозначает водород, низший алкил, низший алкоксил, низший алкилтио, окси-низший алкил, окси-низший алкокси, окси-низший алкокси-низший алкил, окси-низший алкокси-низший алкокси, алкокси-низший алкил, алкокси-низший алкилокси, амино-низший алкил, низший алкил-амино-низший алкил, морфолино, 2-пиримидинил, -CHO, -CH2OH или -CH2Cl;
R5-R8 обозначают водород, галоген, низший алкокси, низший алкилтио;
X обозначает -O- или -S-;
Y обозначает -CHO, C1-4-алкил, -(CH2)1-4-Z-R9, -(CH2)0-3C(O)OR9, -(CH2)1-4-OC(O)(CH2)1-4CH3, -(CH2)1-4-OC(O)гет, -(CH2)1-4OCH2CH(OH)CH2OH и его циклические кетали, -(CH2)1-4NR9CH2CH(OH)CH2OH, -(CH2)1-4O(CH2)1-4-ZH,
-(CH2)1-4NR9(CH2)1-4-ZH, -(CH2)1-4O(CH2)1-4-OC(O)гет, -(CH2)1-4гал, -OR12; R9 представляет собой водород или C1-4-алкил,
R12 представляет собой C1-4-алкил или -(CH2)0-4-арил;
Z обозначает -O-;
гет - гетероциклический остаток, такой, как тиенил, фурил, пиридинил;
гал - галоген;
n обозначает 0 или 1.
-CH2OCH2CH(OH)CH2OH и его циклические кетали, -CH2NR9CH2CH(OH)CH2OH, -CH2O(CH2)1-4-ZH, -CH2NR9(CH2)1-4-ZH, -CH2O(CH2)1-4-OC(O)гет, -CH2гал;
R1-R9, R11, гет, гал, X, Z, n имеют значения, указанные в п.1.
4-третбутил-N-[6-этокси-5-(2-метоксифенокси)-2,2'-бипиримидин-4-ил] -бензолсульфонамид и
4-третбутил-N-[6-метокси-5-(2-метоксифенокси)-2,2'-бипиримидин-4-ил] -бензолсульфонамид.
4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-метил-2-(морфолин-4-ил)-пиримидин-4-ил]-бензолсульфонамид,
4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-формил-2-(морфолин-4-ил)-пиримидин-4-ил]-бензолсульфонамид,
4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-оксиметил-2-(морфолин-4-ил)-пиримидин-4-ил]-бензолсульфонамид,
4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-хлорметил-2-(морфолин-4-ил)-пиримидин-4-ил]-бензолсульфонамид,
4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-(2-оксиэтоксиметил)-2-(морфолин-4-ил)-пиримидин-4-ил]-бензолсульфонамид,
4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-метил-пиримидин-4-ил]-бензолсульфонамид,
4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-формил-пиримидин-4-ил] -бензолсульфонамид,
4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-окси-метил-пиримидин-4-ил]-бензолсульфонамид,
4-третбутил-N-[5-(2-хлорометил-5-(2-хлоро-5-метокси-фенокси)-пиримидин-4-ил]-бензолсульфонамид,
4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-(2-окси-этоксиметил)-пиримидин-4-ил]-бензолсульфонамид,
сложный 2-[6-(4-третбутил-фенилсульфонамино)-5-(2-хлоро-5-метокси-фенокси)-2-(морфолин-4-ил)-пиримидин-4-ил-метокси]-этиловый эфир тиофен-3-карбоновой кислоты,
(RS)-4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-(2,2-диметил-1,3-диоксолан-4-илметоксиметил)-2-морфолин-4-ил)-пиримидин-4-ил] -бензолсульфонамид,
(RS)-4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-(2,3-диоксипропоксиметил)-2-(морфолин-4-ил)-пиримидин-4-ил]-бензолсульфонамид,
4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-(2-окси-этиламинометил)-пиримидин-4-ил]-бензолсульфонамид,
4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-(3-окси-пропоксиметил)-пиримидин-4-ил]-бензолсульфонамид,
(RS)-4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-(2,3-диокси-пропиламинометил)-пиримидин-4-ил]-бензолсульфонамид,
(RS)-4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-(2,2-диметил-1,3-диоксолан-4-илметоксиметил)-пиримидин-4-ил]-бензолсульфонамид,
(RS)-4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-(2,3-диокси-пропоксиметил)-пиримидин-4-ил]-бензолсульфонамид,
сложный 2-[6-(4-третбутил-фенилсульфониламино)-5-(2-хлоро-5-метокси-фенокси)-пиримидин-4-илметокси]-этиловый эфир пиридин-3-ил-уксусной кислоты,
сложный 2-[6-(4-третбутил-фенилсульфониламино)-5-(2-хлоро-5-метокси-фенокси)-пиримидин-4-илметокси]-этиловый эфир пиридин-3-ил-уксусной кислоты,
сложный 2-[6-третбутил-фенилсульфониламино)-5-(2-хлоро-5-метокси-фенокси)-пиримидин-4-илметокси]-этиловый эфир фуран-3-карбоновой кислоты,
сложный 2-[6-третбутил-фенилсульфониламино)-5-(2-хлоро-5-метокси-фенокси)-пиримидин-4-илметокси]-этиловый эфир тиофен-3-карбоновой кислоты и
сложный этиловый эфир 6-(4-третбутил-фенилсульфонил-амино)-2-хлоро-5-фенокси-пиримидин-3-карбоновой кислоты.
4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-метил-2,2'-бипиримидинил-4-ил]-бензолсульфонамид,
(S)-4-третбутил-N-[5-(2-хлоро-5-метокси-фениокси)-6-(2,2-диметил-1,3-диоксолан-4-илметоксиметил)-2-морфолин-4-ил)-пиримидин-4-ил] -бензолсульфонамид,
(R)-4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-(2,2-диметил-1,3-диоксолан-4-илметоксиметил)-2-(морфолин-4-ил)-пиримидин-4-ил] -бензолсульфонамид,
(S)-4-третбутил-N-[5-(2-хлоро-4-метокси-фенокси)-6-(2,3-диокси-пропоксиметил)-2-(морфолин-4-ил)-пиримидин-4-ил]-бензолсульфонамид,
(R)-4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-(2,3-диокси-пропоксиметил)-2-(морфолин-4-ил)-пиримидин-4-ил]-бензолсульфонамид,
(4S, 5S)-4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-(5-оксиметил-2,2-диметил-1,3-диоксолан-4-илметоксиметил)-пиримидин-4-ил] -бензолсульфонамид,
(2S, 3S)-4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-(2,3,4-триоксибутоксиметил)-пиримидин-4-ил]-бензолсульфонамид,
6-(4-третбутил-фенилсульфонамино)-5-(2-хлоро-5-метокси-фенокси)-2,2'-бипиримидинил-4-карбоксальдегид,
4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-оксиметил-2,2'-бипиримидин-4-ил]-бензолсульфонамид,
4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-хлорометил-2,2'-бипиримидин-4-ил]-бензолсульфонамид,
4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-(2-оксиэтоксиметил)-2,2'-бипиримидин-4-ил]-бензолсульфонамид,
4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-6-метокси-2-метил-пиримидин-4-ил]-бензолсульфонамид,
4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-2-формил-6-метоксипиримидин-4-ил]-бензолсульфонамид,
4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-2-оксиметил-6-метокси-пиримидин-4-ил]-бензолсульфонамид,
4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-2-хлорометил-6-метокси-пиримидин-4-ил]-бензолсульфонамид,
4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-2-(2-оксиэтоксиметил-6-метокси-пиримидин-4-ил]-бензолсульфонамид,
(RS)-4-третбутил-N-[5-(хлоро-5-метокси-фенокси)-2-(2,2-диметил-1,3-диоксолан-4-илметокси-метил)-6-метокси-пиримидин-4-ил]-бензолсульфонамид,
(RS)-4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-2-(2,3-диоксипропоксиметил)-6-метокси-пиримидин-4-ил]-бензолсульфонамид,
4-третбутил-N-[5-(2-хлоро-5-метокси-фенокси)-2-аминометил-6-метокси-пиримидин-4-ил]-бензолсульфонамид,
N-[5-(2-хлоро-5-метокси-фенокси)-6-(2-метокси-этокси)-2-метил-пиримидин-4-ил]-1,3-бензодиоксол-5-сульфонамид,
N-[5-(2-хлоро-5-метокси-фенокси)-2-формил-6-(2-метокси-этокси)-пиримидин-4-ил]-1,3-бензодиоксол-5-сульфонамид,
N-[5-(2-хлоро-5-метокси-фенокси)-2-оксиметил-6-(2-метокси-этокси)-пиримидин-4-ил]-1,3-бензодиоксол-5-сульфонамид,
N-[5-(2-хлоро-5-метокси-фенокси)-2-хлорометил-6-(2-метокси-этокси)-пиримидин-4-ил]-1,3-бензодиоксол-5-сульфонамид,
N-[5-(2-хлоро-5-метокси-фенокси)-2-(2-окси-этоксиметил)-6-(2-метокси-этокси)-пиримидин-4-ил]-1,3-бензодиоксол-5-сульфонамид,
4-третбутил-N-[6-метокси-5-(2-метокси-фенилсульфанил)-2-метил-пиримидин-4-ил]-бензолсульфонамид,
4-третбутил-N-[2-формил-6-метокси-5-(2-метокси-фенилсульфанил)-пиримидин-4-ил]-бензолсульфонамид и
4-третбутил-N-[2-оксиметил-6-метокси-5-(2-метокси-фенилсульфанил)-пиримидин-4-ил]-бензолсульфонамид.
Приоритет по пунктам:
10.12.92 - по пп.1, 3 - 7, 9 - 12;
14.10.93 - по пп.2 и 8. На основании первоначально поданных.
| БИ•:.:.К1ШИбЛИОТША I(Федеративная Республика Гермаиии) | 0 |
|
SU389661A1 |
| US 4294965, 13.10.1981 | |||
| WO 9207836 A1, 14.05.1992 | |||
| Способ и прибор для определения глубины залегания камней, пузырей и т.п. в кусках стекла | 1927 |
|
SU7687A1 |
Авторы
Даты
2000-09-20—Публикация
1993-12-07—Подача