Изобретение относится к системам для трансдермальной дачи нескольких активных начал одновременно, причем указанные системы смоделированы таким образом, чтобы облегчить подбор доставляемых доз одного или нескольких действующих начал и уменьшить площадь поверхности таких систем, чтобы повысить безопасность и удобство при приеме их пациентом.
В настоящее время существуют многочисленные средства для трансдермальной дачи активного начала лекарственного средства.
Состав таких средств определяется целью (1) обеспечения хорошей физико-химической стабильности активного начала во времени и (2) получения оптимального трансдермального абсорбционного выделения через единицу площади поверхности. Таким образом, доза активного начала, употребляемого во время лечения, в основном определяется площадью поверхности трансдермального средства, нанесенного на кожу.
Эта площадь поверхности не должна быть такой большой, чтобы вызывать чувство физического дискомфорта при использовании трансдермального средства, и это средство должно иметь такой размер и эстетический вид, которые вовсе не исключают его применение. Трансдермальное средство должно также иметь хорошую адгезию и когезию, чтобы при его применении его можно было наносить легко, приятно и незаметно.
Таким образом, в настоящее время производят такие трансдермальные средства, которые содержат одно активное начало и удовлетворяют вышеуказанным требованиям, то есть они эффективны, невелики по размеру и удобны и ни сползают, ни отделяются во время использования.
С другой стороны, производство таких эффективных систем для введения двух активных начал все еще связано с многочисленными проблемами, которые становится все более трудно решить с увеличением числа активных начал, которые нужно дать пациенту.
Первое известное из уровня техники техническое решение касается трансдермальных систем, которые представляют собой одно средство, содержащее все активные начала в смеси друг с другом. Такие системы описаны, например, в патентных документах EP-A-О 285 563, WO-A-92/07589, WO-A-92/07590 и WO-A-94/06383. Хотя все эти системы имеют преимущество в отношении маленького размера, они обычно оказываются очень сложными, если не невозможными, в производстве.
В действительности, благодаря своей природе и физико-химическим свойствам, активные начала ведут себя различно по отношению к корнеальному слою и часто оказывают большое влияние на состав средства.
Поскольку кожа обладает различной проницаемостью по отношению к активным началам, каждое активное начало имеет различную скорость выделения. Следовательно, оказывается практически невозможным получить требуемую терапевтическую дозу каждого активного начала, которое нужно ввести в организм, путем одновременного использования одной и той же площади абсорбции и одного и того же состава.
Далее, если невозможно менять вводимую дозу, по меньшей мере, одного активного начала во время клинического применения, невозможно модифицировать вводимую дозу этого активного начала независимо от других активных начал без необходимости изменения состава других компонентов.
Точно так же общепринятым для одной и той же системы трансдермального введения ряда активных начал является ее использование для введения нескольких доз этих активных начал в зависимости от пациентов и подвергающихся лечению патологических состояний.
Это делается путем подбора различных площадей поверхности указанной системы на основе принципа, заключающегося в том, что вводимая доза активного начала будет пропорциональна площади поверхности средства, нанесенного на кожу.
В случае использования такой системы для введения нескольких активных начал, когда требуется различная заправка, если, по меньшей мере, два активных начала не остаются в одном и том же соотношении для всех выбранных доз или если одно активное начало вводится в фиксированной дозе, будет невозможно получить различные требуемые дозировки путем изменения площади поверхности средства, так как в этом случае дозы каждого активного начала изменяются одновременно как функция площади поверхности и в постоянных соотношениях.
Следовательно, в обоих вышеуказанных случаях преимущество системы, уже заложенное в ней, теряется и удобные системы с хорошим выделением активных начал и хорошими физическими свойствами остаются без употребления.
К тому же выбор компонентов, образующих часть состава системы, становится сильно ограниченным по мере увеличения числа активных начал, причем последние часто накладывают противоречивые требования.
Действительно, активные начала могут быть частично или полностью несовместимы с некоторыми компонентами состава (смолами, растворителями, пластификаторами, полимерами, промоторами абсорбции кожей и т.д.). Они могут иметь различную растворимость и термостабильность и некоторые из них перекристаллизуются со временем, разлагаются при нанесении или могут быть использованы в составе только в таких концентрациях, которые слишком низки для получения требуемой терапевтической дозировки. Точно так же не существует универсального промотора абсорбции кожей всех активных начал для увеличения их трансдермального выделения. Следовательно, для того чтобы ввести в организм несколько активных начал, часто необходимо использовать несколько промоторов или растворителей. К тому же введение любого нового вещества может вызвать проблемы с раздражением кожи и когезией или адгезией системы.
Точно так же эти ограничения (совместимость, растворимость и т.д.) также влияют на различные составляющие состава помимо активных начал, тем самым усиливая трудности с оптимизацией их роли в составе и снижая конкретные преимущества, которые может дать их применение.
На практике вышеуказанное это первое известное техническое решение не работает и приводит к безвыходному положению или, в лучшем случае, к средствам, имеющим очевидные недостатки при использовании этого типа фармацевтических форм.
Второе известное решение проблемы одновременного введения нескольких активных начал заключается в создании системы, образованной несколькими трансдермальными средствами, наносимыми на кожу, при этом каждое средство содержит одно активное начало. Такие системы описаны, например, в патентных документах WO-A-94/06383, WO-A-90/06736 и WO-A-94/13354.
Эта система решает вышеуказанные проблемы совместимости, стабильности и подбора желательной дозировки. Получение нужной дозы каждого активного начала теперь определяется площадью поверхности каждого трансдермального средства.
Именно это является основным недостатком этого решения, так как такая система обычно имеет большую общую площадь поверхности, причем ее размер возрастает с увеличением числа активных начал.
При этом, в общем, чем больше поверхность трансдермальной системы, тем труднее ее использовать. Это происходит потому, что становится труднее оптимизировать ее адгезионные и когезионные свойства на всей площади поверхности, которая должна войти в контакт с кожей.
Таким образом, чем больше размер системы, тем больше будет риск увеличения возможности сползания адгезивной массы и, следовательно, загрязнения одежды, ощущений стягивания, дискомфорта или даже раздражения кожи или когезионного разрыва при удалении системы, что делает последнюю менее удобной и приемлемой.
Далее, поскольку доза, доставляемая во времени, определяется площадью поверхности трансдермального средства, нанесенного на кожу, любое увеличение площади поверхности увеличивает риск частичного или полного отделения системы или вздутия, что может привести к потере активности вследствие неравномерного контакта с кожей, особенно на изогнутых частях тела или частях, которые часто двигаются.
Кроме того, при использовании системы с резервуаром неравномерное распределение на всей площади поверхности, которая должна соприкасаться с кожей, неизбежно изменяет выделяемую дозу и не позволяет достичь желаемой терапевтической активности. Таким образом, в случае очень большого резервуара, в котором жидкость или полужидкость (раствор или гель), содержащие активное начало, имеют тенденцию задерживаться в нижней части резервуара под действием силы тяжести, используемая площадь поверхности будет снижаться и в результате система будет менее эффективной.
Другой недостаток системы большого размера, независимо от ее природы, заключается в наличии риска, что она будет плохо переноситься пациентом из-за того, что она слишком заметна и, следовательно, ее трудно скрыть.
Эстетический внешний вид и незаметность трансдермальной системы, возможно, без ощущения физического дискомфорта являются действительно важными параметрами для переносимости вещества и восприимчивости пациента к терапевтическому лечению.
Все эти проблемы отвлекают от удобства системы, когда она используется или, даже хуже, от ее терапевтической эффективности при ее применении пациентом.
Поэтому решения согласно предшествующему уровню техники являются неудовлетворительными, так как в случае их применения не удается сочетать возможность подбора вводимых доз каждого из активных начал с получением системы с небольшой общей поверхностной площадью, обеспечивающей более безопасное и удобное применение при нанесении на кожу.
Цель изобретения
Следовательно, в области одновременного трансдермального введения в организм ряда активных начал желательно создание нового технического решения, которое обеспечивает достижение желательного компромисса без вышеуказанных неудобств.
Согласно данному изобретению предлагается для достижения этой цели создание системы для одновременного трансдермального введения в организм, по меньшей мере, двух активных начал, которая позволяет простым способом подобрать вводимую дозу каждого активного начала и в то же время имеет уменьшенную общую площадь поверхности.
Существо изобретения
Вышеуказанная цель достигается путем создания в качестве нового промышленно изготавливаемого продукта новой системы для трансдермальной дачи, по меньшей мере, двух активных начал, которая состоит из, по меньшей мере, двух совмещенных (или связанных) средств, причем указанная система характеризуется тем, что включает
(1) первое средство, содержащее смесь всех активных начал, в котором, по меньшей мере, одно первое активное начало (A) содержится в количестве, обеспечивающем эффективную терапевтическую дозу, которую нужно ввести и, по меньшей мере, одно второе активное начало (B) содержится в количестве, которое меньше требуемого для доставки эффективной терапевтической дозы, и
(2) одно или несколько дополнительных средств, каждое из которых содержит одно активное начало (B), выбранное из тех, которые содержатся в первом средстве и находящееся в количестве, которое меньше того количества, которое требуется для доставки эффективной терапевтической дозы, причем указанное дополнительное средство или средства поставляют каждое из активных начал (B), содержащихся в системе в количестве, необходимом для получения эффективной терапевтической дозы.
Подробное описание изобретения
В данном описании выражение "трансдермальная система" означает сочетание, по меньшей мере, двух средств для одновременной доставки всех активных начал путем нанесения на кожу.
"Средство" в данном описании следует понимать как термин, обозначающий любую систему, используемую для введения, по меньшей мере, одного активного начала трансдермально. Такие средства обычно подразделяются на две основные категории:
- средства в резервуарах, в которых активное начало или начала содержатся в виде раствора в растворителе, действующем как вектор для транспортировки активного начала через адгезионную или неадгезионную микропористую мембрану; и
- матричные средства, в которых активное начало или начала растворены или диспергированы в полимерной сетке, образующей матрицу, которая может быть самоклеющейся или неадгезивной.
Эти средства могут быть однослойными или многослойными (называемыми также ламеллярными), то есть образованными путем наложения друг на друга нескольких матриц или резервуаров, которые могут содержать или не содержать одно или несколько активных начал, причем указанные матрицы или резервуары могут быть разделены микропористыми мембранами.
Ассоциация, по меньшей мере, двух средств согласно изобретению может быть осуществлена методами, известными специалистам, например, путем наложения на подложку, покрытую адгезивом, совмещенного двойного покрытия или термосварки с одной подложкой. Средства в вышеуказанных случаях будут иметь одну подложку, но можно также получать систему, в которой каждое средство имеет идентичные или разные самостоятельные подложки, при этом сочетание осуществляется путем совмещения средств, например, термосваркой, или совмещением средств на дополнительной подложке, всегда путем одних и тех же методов.
Используемая подложка может быть любой, обычно применяемой в герметической или негерметической трансдермальной системе, с различной толщиной, непроницаемой для составляющих средства.
Предпочтительные подложки являются, например, полиэтиленовыми, полипропиленовыми или полиэфирными пленками, композиционным материалом, выполненным из полиэтилена и сополимера этилена с винилацетатом, или алюминизированной пленкой, или вспененным материалом.
На практике вся система или каждое из средств могут быть покрыты защитным слоем или пленкой, которые можно снять перед применением системы, при этом можно упаковать такую систему в герметичную упаковку, например, из композита, выполненного из полиэтилена и алюминия.
Средство согласно изобретению может быть выполнено из материалов, известных специалисту, например, из природных или синтетических полимеров (таких, как акрилаты и их производные, силиконы, блок-сополимеры, сополимеры этилена с винилацетатом, каучуки и их производные и т.д.) в зависимости от свойств активных начал, которые нужно ввести. С указанными активными началами могут сочетаться другие подходящие известные вещества, обычно используемые специалистами, примерами этих продуктов являются солюбилизирующие агенты, пластификаторы, разрыхляющие агенты или промоторы проникновения через кожу.
Точно также мембраны, которые можно применять, обычно являются такими, которые используют в области трансдермальных систем, примером является пленка из сополимера этилена с винилацетатом.
В случае, когда в системе по изобретению используются одно или несколько матричных средств, эти матричные средства изготавливают методами, общеизвестными в технологии получения покрытий, или из раствора, или так называемым методом из горячего расплава (то есть в отсутствие растворителя).
Точно также в случае применения средств резервуарного типа эти средства изготавливают известными методами, например, путем получения резервуара при сварке подложки с мембраной и одновременном или неодновременном наполнении резервуара.
В обоих случаях при промышленном производстве определяют соответствующие размеры трансдермального средства в зависимости от количества активного(ых) начал(а), приходящегося на единицу площади поверхности, с получением выбранных доз активных начал, которые должны быть введены из системы в организм в течение определенного промежутка времени.
Трансдермальная система в соответствии с данным изобретением может иметь любую геометрическую форму: квадратную, прямоугольную, круглую или овальную. Разные средства могут быть расположены или бок о бок, или концентрически, тогда каждое средство будет полностью охватывать предыдущее; может быть также использована любая другая геометрическая конструкция. Средства могут быть разделены одним или несколькими дополнительными слоями, которые могут быть адгезионными для того, чтобы скреплять всю систему, если это необходимо.
В рамках данного изобретения можно использовать любую комбинацию активных начал, способных к трансдермальному применению и проявляющих или местное, или системное действие.
Среди этих комбинаций можно упомянуть следующие возможные сочетания:
(а) одного или нескольких экстрогенов с одним или несколькими прогестинами, природными или синтетическими, для контрацептивных целей или при лечении симптомов менопаузы, например, эстрадиола, этинилэстрадиола, эстриола и их производных с норэтистеронацетатом, норгестрелом, левоноргестрелом, дезогестрелом, норгестиматом, линестренолом, гестоденом, номегестролацетатом или диеногестом;
(б) β-блокера и диуретических соединений, особенно полезных в случае сердечно-сосудистых заболеваний, например, тимолола, пиндолола, буфрадола, инденолола или нипрадинола, и амилонида или гидрохлортиазида;
(в) кортикоида и антигистаминных соединений, особенно полезных при лечении аллергий, например, метилпреднизолона, преднизолона, гидрокортизона, беклометазона или триамсинолона, с астемизолом, дексхлорфенирамином, цетиризином, дифенилгидроминхлоридом или хлорфенирамином;
(г) анальгетических и противовоспалительных соединений, особенно полезных при лечении болевых симптомов, например, ацетилсалициловой кислоты, парацетомола или норамидопирина с мефенамовой кислотой, флуфенановой кислотой, диклофенаком, оксифенбутазоном, ибупрофеном, наксопреном или фенбуфеном, и
(д) бактерицидов и антибиотиков, особенно полезных при лечении инфекционных заболеваний, например, амоксициллина с клавулановой кислотой, сульфаметоксазола с триметопримом, эритромицина с ацетилсульфафуразолом или эритромицина с тетрациклином.
Преимущественно рекомендуется система, в которой активные начала, которые нужно ввести одновременно, выбираются, с одной стороны, из эксрогенов и, с другой стороны, из прогестинов.
Предпочтительный вариант изобретения
Предпочтительный вариант осуществления изобретения состоит в использовании системы для трансдермального введения двух активных начал (A и B), он характеризуется тем, что включает:
(1) первое матричное средство, которое является матрицей, содержащей в массе активное начало A в количестве, которое обеспечивает эффективную терапевтическую дозу, которую нужно ввести, и активное начало B в количестве, меньшем, чем необходимое для введения эффективной терапевтической дозы, и
(2) второе матричное средство, которое является матрицей, содержащей в массе активное начало B в количестве, регулирующем количество, содержащееся в первом матричном средстве, до достижения эффективной терапевтической дозы.
Другими словами, рекомендуется система, которая состоит из расположенных рядом (или ассоциированных) матриц, причем это такая система, что первая матрица, которая содержит смесь двух активных начал, одно из которых вводится в дозе, меньшей, чем эффективная терапевтическая доза, соединена со второй матрицей, которая содержит это же активное начало и которая обеспечивает введение в организм его эффективной терапевтической дозы.
Эта система очень полезна для одновременного введения экстрогена и прогестина, в частности, для одновременного введения различных доз 17- β- эстрадиола, от 25 до 100 мкг за 24 час, и различных доз норэтистеронацетата, от 100 до 800 мкг за 24 час, при соотношении доз 17- β- эстрадиола и норэтистеронацетата от 1/4 до 1/8 соответственно, причем эти дозы являются терапевтически эффективными при лечении симптомов менопаузы и сердечно-сосудистых нарушений, возникающих в результате.
Преимущества и характерные особенности изобретения будут более понятны из нижеследующих примеров систем по изобретению и испытаний, в которых они сравниваются с описанными в источниках информации. Конечно, эти подробности никоим образом не ограничивают изобретение, а служат лишь для его иллюстрации. Трансдермальные системы по изобретению и сравнительные системы получают различной комбинацией матричных средств, описанных ниже.
Пример 1 (средство 1)
В сосуд помещают 47,8 г LEVAPREN® 450Р (сополимер этилена с винилацетатом (обозначаемый ниже ЭВА), продуцент - фирма Байер АГ, ФРГ), 48 г кротамитона [N-этил-N-(2-метилфенил)-2- бутенамид] (поставляемого на продажу фирмой Берингер Ингельхайм, ФРГ), 0,2 г Ирганокса (IRGANOX®B215) (антиоксидант, производимый фирмой Циба-Гейги, Швейцария) и 115,53 г этилацетата. Смесь нагревают в течение 5 час до тех пор, пока ЭВА полностью не растворится. Смесь перемешивают при комнатной температуре в течение 1 час и затем добавляют 4 г норэтистеронацетата (ниже обозначаемого как НЭТА), предварительно растворенного в 20 г тетрагидрофурана. Полученную смесь перемешивают примерно 30 мин до тех пор, пока она не станет гомогенной; затем ее оставляют стоять до полного исчезновения пузырьков. Полученную массу наносят на полиэфирную пленку, покрытую силиконом, при комнатной температуре (15-25oC) с получением осажденного материала в количестве (100±10) г/м2. Полученный элемент нагревают при 70oC в течение 30 мин и затем переносят на полиэтиленовую подложку. Полученный продукт затем обрезают до нужного размера. Если необходимо, нарезанные изделия упаковывают в пакеты, конверты или непроницаемые упаковки.
Пример 2 (средство 2)
Процедура аналогична описанной в Примере 1, используют 49,8 г LEVAPREN® , 450P, 44 г кротамитона, 0,2 г IRGANOX® 215, 116,2 г этилацетата, 2 г 17- β- эстрадиола и 4 г норэтистеронацетата (добавленного в тот же момент, что и 17-β- эстрадиол), причем оба эти гормона растворяют вместе в 30 г тетрагидрофурана.
Пример 3 (средство 3)
20,7 г ELVAX® 46 L и 6,9 г ELVAX® 46 (сополимеры этилена с винилацетатом, производимые фирмой Дюпон, США) и 6 г ETHOCEL® (этилцеллюлоза, производимая фирмой Доу Кемикел, США) помещают в сосуд при перемешивании и нагревают до примерно 130oC. Затем при непрерывном перемешивании при 130oC постепенно вводят 1,2 г 17- EUTANOL® эстрадиола и 18,9 г β- G (2-октилдодеканол, производимый фирмой Хенкель КГаА, ФРГ), и смесь перемешивают, пока она не станет гомогенной. Затем при температуре от 100 до 110oC добавляют 6,3 г SURFADONE® LP300 (N-додецил-2-пирролидона, производимого фирмой GAF CORPORATION) и продолжают перемешивание, пока не получится абсолютно гомогенная смесь. Полученную смесь наносят при температуре от 100 до 140oC на антиадгезионную временную промежуточную подложку, предпочтительно, силиконизированную полиэфирную пленку со скоростью (100±10) г/м2. Полученную матрицу переносят на полиэтиленовую подложку.
Пример 4 (средство 4)
Процедура идентична описанной в Примере 3 за исключением того, что используют 11 г ELVAX® 46L, 11 г ELVAX® 46,5 г ETHOCEL® 15 г EUTANOL® G, 5 г SURFADONE® LP300, 1 г 17- β- -эстрадиола и 2 г норэтистеронацетата.
Пример 5 (средство 5)
Процедура идентична описанной в Примере 3 за исключением того, что в этом случае используют 33,75 г ELVAX® 46L, 11,25 г ELVAX® 46, 10 г ETHOCEL®, 30,5 г EUTANOL® G, 4 г норэтистеронацетата и 10,5 г SURFADONE® LP300.
Пример 6 (средство 6)
В колбу объемом 250 мл помещают 13,35 г KRATON G® 1657 (трехблочный сополимер стирол/этилен/бутилен/стирол, поставляемый фирмой Шелл), 0,1 г IRGANOX® 565 (антиоксидант, поставляемый фирмой Циба-Гейги, Швейцария), 12,5 г ZONATAC® 105L (смола, повышающая клейкость, поставляемая фирмой ARIZONA CHEMICAL), 10,25 г PARAPOL® 950 (cополимер Н-бутена с изобутиленом, поставляемый фирмой EXXON CHEMICAL), 10,25 г EUTANOL® G (2-октилдодеканол, поставляемый фирмой Хенкель КГаА, ФРГ), 3 г SURFADONE® LP300 (N-додецил-2-пирролидон, поставляемый фирмой GAF CORPORATION) и 25 г циклогексана. Смесь перемешивают в течение 6 час при нагревании при 60oC до полного растворения ингредиентов. Затем добавляют 0,55 г норэтистеронацетата, предварительно растворенного в 2,75 г тетрагидрофурана. Полученную смесь перемешивают в течение 30 мин до получения абсолютной гомогенности и затем оставляют стоять до полного исчезновения пузырьков. Полученную смесь наносят на силиконизированную полиэфирную пленку со скоростью (100±10) г/м2 при комнатной температуре (15-25oC). После нагревания при 70oC в течение 0,5 час полученную матрицу переносят на полиэтиленовую подложку. Затем изделие нарезают на части нужного размера и, если необходимо, упаковывают в пакеты.
Пример 7 (средство 7)
В колбу объемом 250 мл помещают 13,8 г VECTOR® 4211D (трехблочный сополимер стирол/изопрен/стирол, поставляемый фирмой EXXON CHEMICAL), 23,85 г ECR® 385 105L (смола, повышающая клейкость, поставляемая фирмой EXXON CHEMICAL), 0,1 г IRGANOX® 565 (антиоксидант, поставляемый фирмой Циба-Гейги, Швейцария), 3,5 г SURFADONE® LP-300 (N-додецил-2-пирролидон, поставляемый фирмой Берингер Ингельхайм, ФРГ), 7,5 г LAUROGLYCOL® (смесь моноэфира и диэфира пропиленгликоля и лауриновой кислоты, поставляемый фирмой GATTEFOSSE) и 19,8 г этилацетата. Смесь перемешивают при нагревании при 60oC до полного растворения ингредиентов. Затем добавляют раствор 1,25 г норэтистеронацетата, который был предварительно растворен в 6,25 г тетрагидрофурана. Полученную смесь перемешивают в течение примерно 30 мин до достижения полной гомогенности. Ее оставляют охлаждаться до полного исчезновения пузырьков. Полученную массу наносят на силиконизированную полиэфирную пленку со скоростью (100±10) г/м2 при комнатной температуре (15-25oC). Полученное покрытие нагревают при 50oC в течение, по меньшей мере, 30 мин и затем переносят на полиэтиленовую подложку. Полученное изделие разрезают на части нужного размера.
Преимущества данного изобретения иллюстрируются испытаниями по определению ex vivo проницаемости на коже брюшной полости мужской особи мыши в соответствии с нижеследующей методикой.
Количества гормонов (то есть стероидов), выделенных трансдермальным средством с площадью поверхности 2,54 см2 вырезанным заранее при помощи полного штамма и наложенным на диск из кожи брюшной полости, не содержащей волосяного покрова, мужской особи мыши, площадью 3,14 см2, определяют в статической стеклянной ячейке, термостатируемой при 37oC, которая содержит отделение для помещения образца объемом 11,5 мл, содержащее фазу, представляющую собой изотонический раствор в смеси с ПЭГ400 (75/25; об/об).
Образцы раствора, в который помещен образец, отбирают через 2, 4, 6, 8, 12, 16, 20 и 24 час и анализируют методом жидкостной хроматографии. Для учета возможных отклонений, связанных с собственной проницаемостью образцов кожи, каждый опыт по определению проницаемости образца трансдермального средства осуществляют минимум с 3-5 образцами. Приведенные данные представляют среднее значение полученных результатов.
Таким образом, для средств 1-7 получают следующие средние значения величин абсорбции 17- β- эстрадиола (FES) и/или норэтистеронацетата (FNETA):
Средство 1: FNETA = 0,35 ± 0,16 мкг/см2/час
Средство 2: FES = 0,2 ± 0,07 мкг/см2/час
FNETA = 0,39 ± 0,1 мкг/см2/час
Средство 3: FES = 0,61 ± 0,08 мкг/см2/час
Средство 4: FES = 0,57 ± 0,13 мкг/см2/час
FNETA = 0,57 ± 0,17 мкг/см2/час
Средство 5: FNETA = 0,5 ± 0,3 мкг/см2/час
Средство 6: FNETA = 0,47 ± 0,05 мкг/см2/час
Средство 7: FNETA = 0,89 ± 0,12 мкг/см2/час
Таблицы I-V иллюстрируют снижение площади поверхности для систем по изобретению в сравнении с системами, образованными совмещенными средствами, каждое из которых содержит одно активное начало, для случая одновременного трансдермального введения в организм 17-β- эстрадиола и норэтистеронацетата.
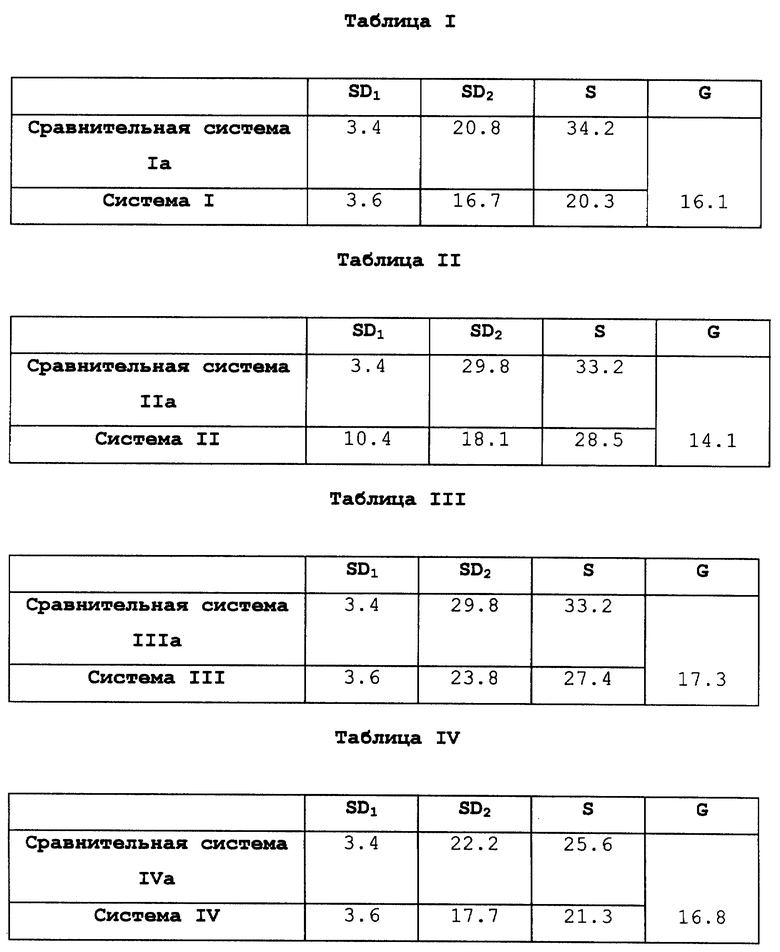
В Таблице I приведено сравнение системы I по изобретению, включающей средства 4 и 5, со сравнительной системой Iа, включающей средства 3 и 5.
В Таблице II приведено сравнение системы II по изобретению, включающей средства 2 и 1, со сравнительной системой IIа, включающей средства 3 и 1.
В Таблице III приведено сравнение системы III по изобретению, включающей средства 4 и 1, со сравнительной системой IIIa, включающей средства 3 и 1.
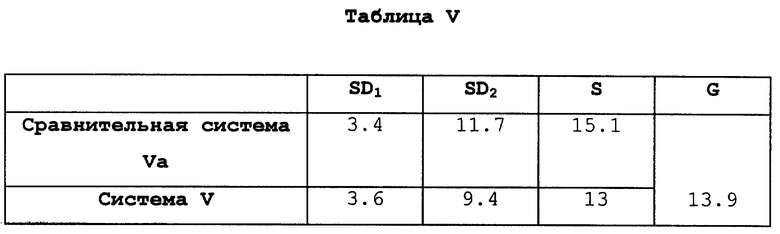
В Таблице IV система IV по изобретению, включающей средства 4 и 6, сравнивается со сравнительной системой IVa, включающей средства 3 и 6.
В Таблице V приведено сравнение системы V по изобретению, включающей средства 4 и 7, со сравнительной системой Va, включающей средства 3 и 7.
Сокращения, используемые в этих Таблицах, обозначают следующее:
SD1 означает площадь поверхности первого средства, см2;
SD2 означает площадь поверхности второго средства, см2;
S - общая площадь поверхности системы, полученной совмещением обоих средств, см2;
G означает уменьшение площади поверхности, выраженное в %, для систем по изобретению (вторая строка Таблиц) в сравнении с системами, полученными совмещением двух средств, каждое из которых содержит одно активное начало (первая строка Таблиц).
Первое средство содержит смесь 17- β--эстрадиола и норэтистеронацетата в случае систем по изобретению или 17- β- эстрадиол только в случае сравнительных систем.
Второе средство всегда содержит только норэтистеронацетат.
В данном случае желательно ввести следующие терапевтически эффективные дозы:
- 50 мкг 17- β-эстрадиола за 24 часа и
- 250 мкг норэтистеронацетата за 24 часа.
Если желательно ввести эти два гормона, содержащиеся в одном средстве, разница в проницаемости через кожу, то есть абсорбционное выделение через кожу, норэтистеронацетата и 17- β-эстрадиола должна быть 5. На практике такую разницу, которую теоретически можно получить, хотя и с трудом, оказывается невозможно получить, если принимаются во внимание такие ограничения, как стабильность, удобство и адгезионные, и когезионные свойства, требующиеся при продаже такого средства.
Так, средства 2 и 4, которые обладают такими хорошими физико-химическими свойствами и вполне удобны, не позволяют осуществить подбор нужных доз.
Невозможно достичь желаемой эффективной дозы норэтистеронацетата без 2,5-кратного и 5-кратного увеличения, соответственно, доз 17-β- эстрадиола. Альтернативное решение, которое использует систему, образованную двумя совмещенными матричными средствами, причем одно содержит 17- β- эстрадиол и другое содержит норэтистеронацетат, является менее эффективным, чем решение по изобретению, хотя позволяет уменьшить площадь поверхности в сравнении с первой системой при помощи соединения первого матричного средства, содержащего смесь двух гормонов, в которой концентрация норэтистеронацетата не обеспечивает нужную дозу, равную 250 мкг за 24 часа, со вторым средством, содержащим только норэтистеронацетат, которое обеспечивает дополнительную дозу, необходимую для достижения дозы, равной 250 мкг за 24 часа.
Так, для сравнительной системы Iа в Таблице I, использующей средство 3 со скоростью абсорбционного выделения 0,61 мкг/см2/час, необходимо применять средство с площадью поверхности 3,4 см2 для того, чтобы ввести 50 мкг 17- β- эстрадиола за 24 часа.
Точно также для того, чтобы ввести 250 мкг норэтистеронацетата за 24 часа из средства 5 со скоростью абсорбционного выделения 0,5 мкг/см2/час, необходимо применять средство с площадью поверхности 20,8 см2. Это обеспечивает общую площадь поверхности 24,2 см2 для сравнительной системы Iа.
По контрасту найдено, что для системы I по изобретению, использующей средство 4 со скоростью абсорбционного выделения 0,57 мкг/см2час для норэтистеронацетата и 17- β- эстрадиола, необходимо применять средство с площадью поверхности 3,6 см2, чтобы ввести 50 мкг 17- β- эстрадиола за 24 часа. Это средство площадью 3,6 см2 позволит одновременно ввести 49,2 мкг норэтистеронацетата за 24 часа. Следовательно, для достижения желаемой дозы 250 мкг остается ввести 200,8 мкг норэтистеронацетата. Это количество будет получено со средством 5, площадь поверхности которого будет 16,7 см2 для скорости выделения через кожу 0,5 мкг/час/см2.
Полная система I будет, следовательно, иметь площадь поверхности 20,3 см2, что составляет 16,1% уменьшения в сравнении со сравнительной системой Iа, описанной выше и содержащей средства 3 и 5.
Анализ Таблицы II также показывает, что уменьшение площади поверхности на 14,1% достигается для системы II по изобретению. Этот результат интересен, потому что в этом случае скорость выделения 17- β-эстрадиола (0,2 ± 0,07 мкг/час/см2) средством 2 в системе II по изобретению, содержащей оба гормона, гораздо ниже, чем у средства 3 сравнительной системы IIа, содержащей только 17- β- эстрадиол (FES = 0,61 мкг/час/см2), что означает, что средство 2 должно иметь очень большую площадь поверхности (10,4 см2) в системе по изобретению. Несмотря на это, для системы II по изобретению получается заметное уменьшение площади поверхности по сравнению с системой IIa. Этот результат еще более замечателен, так как средство 2 также имеет низкую скорость выделения норэтистеронацетата, равную 0,39 мкг/час/см2, что означает, что количество норэтистеронацетата, которое нужно ввести при помощи дополнительного средства, все еще велико.
Можно также указать, что в этом случае скорость выделения норэтистеронацетата средством 1, общим для обеих систем, низка: FNETA = 0,35 мкг/час/см2.
Тем не менее установлено, что при наличии средства 1 система II по изобретению позволяет достичь значительное уменьшение площади поверхности по сравнению со сравнительной системой IIa, а именно 18,1 см2 против 29,8 см2, то есть 40% уменьшение.
Одним из следствий этого является увеличение числа возможных составов, которые можно использовать, так как даже если они характеризуются низкими скоростями проницаемости через кожу, это не означает с неизбежностью, что следует применять слишком большие площади поверхности.
В Таблице V, где по контрасту с предыдущим случаем скорость выделения норэтистеронацетата средством 7, общим для обеих систем, высока (0,89 мкг/час/см2), приводя к небольшой общей площади поверхности, равной 15,1 см2, для сравнительной системы Va (где каждое средство содержит один гормон), для системы V по изобретению уменьшение площади поверхности составляет величину порядка 14%.
Результаты того же порядка показаны в Таблицах III и IV, где уменьшение площади поверхности составляет 17,3 и 16,8%, соответственно. Эти две Таблицы и Таблица V показывают еще одно преимущество данного изобретения, а именно применение различных видов средств для получения системы.
Так, средство 4 на основе сополимера этилена с винилацетатом сочеталось или со средством 1 на основе сополимера того же типа, но другого состава (Таблица III), или со средством 6 на основе блок-сополимера стирол/этилен/бутилен (Таблица IV), или со средством 7 на основе блок-сополимера стирол/изопрен/стирол (Таблица V).
Расширенный ассортимент соединений, которые могут быть использованы в композициях средств, и вышеупомянутая способность применять средства с низкими скоростями выделения облегчают подбор желаемых доз каждого активного начала и, следовательно, значительно расширяют возможный объем разработок и адаптации нескольких дозировок удобных систем приемлемого размера для одновременного введения, по меньшей мере, двух активных начал.
Уменьшение площади поверхности порядка 15-20%, приведенное как пример для систем эстроген/прогестин, очевидно, может быть еще больше в зависимости от проницаемости используемых активных начал.
Изобретение относится к области медицины, а именно новой системы для чрескожного введения, по меньшей мере, двух активных начал, состоящая, по меньшей мере, из двух совмещенных средств. Система включает первое средство, содержащее смесь всех активных начал, в котором, по меньшей мере, одно первое активное начало (A) содержится в количестве, обеспечивающем эффективную терапевтическую дозу, которую нужно ввести, и, по меньшей мере, одно второе активное начало (B) содержится в количестве, которое меньше требуемого для доставки эффективной терапевтической дозы, и одно или несколько дополнительных средств, каждое из которых содержит одно активное начало (B), выбранное из тех, которые содержатся в первом средстве, и находящееся в количестве, которое меньше того количества, которое требуется для введения эффективной терапевтической дозы, причем указанное дополнительное средство или средства поставляют каждое из активных начал (B), содержащихся в системе в количестве, необходимом для получения эффективной терапевтической дозы. Система позволяет уменьшить на 15 - 20% площадь поверхности средства, расширяет возможность адаптации нескольких удобных дозировок приемлемого размера. 7 з. п. ф-лы, 5 табл.
| Экономайзер | 0 |
|
SU94A1 |
| DE 4223360 C, 08.04.1993 | |||
| ПАТЕНТВС-ТЕХШ-ЧЕОКАЯ. .RHbisHnTFHA | 0 |
|
SU285563A1 |
| US 4666441 A, 19.05.1987. | |||
Авторы
Даты
2000-10-10—Публикация
1995-12-19—Подача