Изобретение относится к способам лечения повреждений центральной нервной системы и в частности к использованию трофических факторов для регенерации спинного мозга.
После раннего детства повреждение центральной нервной системы (ЦНС) приводит к функциональным недостаточностям, которые в значительной степени не обратимы. Внутри мозга или спинного мозга повреждение, являющееся результатом удара, травмы, или других причин, может привести к пожизненным потерям познавательной, сенсорной или моторной функций, и даже к потере поддержания жизненных функций. Нервные клетки, которые теряются, не восполняются, и те нервные клетки, которые удалось сберечь, обычно не способны восстановить разъединенные связи, хотя ограниченное количество локальной синаптической реорганизации может происходить вблизи места повреждения. Функции, которые утеряны, в настоящее время не поддаются лечению.
Регенеративное повреждение в ЦНС приписывают ряду факторов, которые включают присутствие ингибиторных молекул на поверхности глиальных клеток, которые подавляют аксонный рост; отсутствие подходящих молекул субстрата, таких как ламинин, который способствует росту; и отсутствие подходящих трофических факторов, необходимых для активации программ экспрессии генов, требуемой для выживания клетки, и дифференциации.
В противоположность этому, внутри периферической нервной системы (ПНС) поврежденные нервные волокна могут возобновить рост на большие расстояния с возможным прекрасным восстановлением функции. За последние 15 лет специалисты в области нейрологии пришли к выводу, что это не есть следствие внутренних (присущих) различий между нервными клетками периферической и центральной нервной системы; примечательно, что нейроны ЦНС обычно распространяют свои аксоны на большие расстояния, если им предоставляется возможность расти через трансплантированный сегмент ПНС (например, седалищный нерв). Поэтому нейроны ЦНС сохраняют способность расти, если им подаются правильные сигналы из внеклеточного окружения. Факторы, которые вносят вклад в потенциалы в различный рост ЦНС и ПНС, включают частично охарактеризованные, ингибирующие рост молекулы на поверхности олигодендроцитов, которые окружают нервные волокна в ЦНС, но которые менее распространены в подлежащей сравнению клеточной популяции ПНС (Шванновские клетки, Schwann cells); молекулы базальной пластинки (оболочки Бруха) или других поверхностей, которые способствуют росту в ПНС, но которые отсутствуют в ЦНС (например, ламинин); и трофические факторы, растворимые полипептиды, которые активируют программу экспрессии генов, которая лежит в основе выживания клеток и дифференциации. Хотя такие трофическое факторы рассматриваются как необходимые для поддержания жизнеспособности и дифференциации нервных клеток, конкретные трофические факторы, которые ответственны за индуцирование аксонной регенерации в ЦНС, остаются невыясненными.
В противоположность человеку и другим высшим позвоночным, низшие позвоночные способны к регенерации поврежденных ЦНС проводящих путей в течение жизни (Sperry, R.W. (1994), J. Neurophysiol., 7:57-69; Sperry, R.W. (1963), Proc. Nat. Acad. Sci. USA, 50:703-710). У серебряного карася 95% клеток ганглия сетчатки выживают при повреждении зрительного нерва (Meyer, et al., (1985), J. Comp. Neurol., 239:27-43) и продолжают повторно восстанавливать топографически организованные, функциональные связи с клетками зрительной перемычки и другими мишенями-областями на протяжении от одного до двух месяцев (обзор Grafstein, (1986), The retina as a regenerating organ, In R.Adler and B.D.Farber (Eds.), The Retina: A Model for Cell Biology Studies Part 11, Academic Press, New York, 275-335; Jacobson, (1991), Development Neurobiology, third edition (Plenum Publishing Co., New York)). Клеточные и молекулярные изменения, которые сопровождают этот процесс, изучены достаточно глубоко. Клетки ганглия сетчатки претерпевают экстенсивные метаболические и морфологические изменения, которые включают драматическое увеличение ядрышек, пролиферацию свободных рибосом и увеличение диаметра клетки (Murray & Grafstein, (1969), Exp. Neurol., 23:544-560; Murray & Forman, (1971), Brain Res. , 32:287-298). Массивные разрастания видны в экспрессии генов, кодирующих некоторые компоненты цитоскелета (Burrell, et al., (1978), J. Neurochem. , 31: 289-298; Heacock & Agranoff, (1982), Neurochem. Res., 7:771-788; Giulian, et al., (1980), J. Biol. Chem., 255:6494-6501; Quitschke & Schechter, (1983), Brain Res. , 258:69-78; Glasgow, et al., (1994) EMBO J., 13: 297-305; Glasgow, et al. (1992) Neuron, 9:373-381), молекулы адгезии клеточной поверхности (Vielmetter, et al., (1991) J. Neurosci, 11:3581-3593; Bastmeyer, et al., (1990) Development., 108:299-311; Paschke, et al., (1992) J. Cell Biol. , 117:863-875; Blaugrund, et al., 1990; Battisti, et al., (1992) J. Neurocytol. , 21:557-73), и некоторые белки, которые встраиваются в терминальную мембрану растущего нерва, особенно GAP-43 (Benowitz, et al., (1981) J. Neurosci., 1:300-307; Heacock & Agranoff, (1982); Perrone-Bizzozero, et al., (1987), J. Neurochem., 48:644-652; Perry, et al., (1987), J. Neurosci. , 7:792-806; LaBate & Skene, (1989), Neuron, 3:299-310; Wilmot, et al. , (1993), J. Neurosci., 13:387-401). Некоторые из этих изменений связаны с развитием и регенерацией зрительного нерва в других видах (Skene & Willard, J. Cell Biol. 89:86-95; J. Cell. Biol., 89:96-103; Moya, et al., (1988), J.Neurosci., 8:4445-4454; Doster, et al., (1991), Neuron, 6:635-647).
В общем, на способность нейронов регенерировать свои аксоны после повреждения оказывают сильное влияние окружающие не-нейронные элементы (Aguayo, et al. , (1991) Phil. Trans. Royal Soc. London, Series B, 331:337-343). В случае ретинофугального (retinofugal) проводящего пути серебряного карася, глиальные клетки Шванна зрительного нерва, по-видимому, обеспечивают окружение, которое имеет высокую проводимость к аксонному отростку (Bastmeyer, et al. , (1993) Glia, 8:1-11; Bastmeyer, et al., (1991) J. Neurosci, 11: 626-640). Частично, это может быть приписано экспрессии конкретных белков клеточной поверхности и внеклеточной матрицы, включая молекулу адгезии L1-подобной клетки (Blaugrund, et al., (1990) Brain Res., 530:239-244; Bastmeyer, et al., (1993); Bastmeyer, et al. (1991); Vielmetter, et al., 1991; Battisti, et al., 1992), ламинин (Hopkins, et al., (1985) J. Neurosci., 5: 3030-3038), и хондроитин сульфат протеогликаны (Battisti, et al., 1992). В то же самое время, глии зрительного нерва серебряного карася, по-видимому, экспрессируют более низкие уровни ингибирующих рост белков на своих поверхностях, чем олигодендроциты ЦНС человека (Caroni & Schwab, (1988) J. Cell Biol., 106:1281-1288; Schwab & Caroni, (1988) J. Neurosci., 8:2381-2393; Bastmeyer, et al. , 1991; Sivron, et al., (1994), Presence of growth inhibitors in fish optic nerve myelin: postinjury changes. J. Comp. Neurol., 343:237-246).
Помимо компонентов клеточной поверхности, клетки зрительного нерва серебряного карася секретируют растворимые факторы, которые стимулируют аксонный отросток из эксплантатов сетчатки серебряного карася (Mizrachi, et al., (1986) J, Neurochem. , 46: 1675-1682), нейронов эмбрионов млекопитающих (Finkelstein, et al., (1987) Brain Res,. 413:267-274; Caday, et al., 1989), и сетчатки зрелого кролика (Schwartz, et al., (1985) Science, 228:600-603). Среди белков, которые секретируются глиями и микрофагами зрительного нерва, присутствуют аполипопротеин A (Harel, et al. , (1989) J. eurochem., 52: 1218-1228), плазминогенный активатор (Salles, et al., (1990) EMBO J., 9: 2471-2477), интерлейкин-2 (Eitan, et al., 1992), трансглутаминаза (Eitan and Schwartz, (1993) Science, 261:106-108), и фактор роста, получаемый в виде пластинок (Eitan, et al., (1992) Proc. Natl. Acad. Sci. USA, 89:5442-5446).
Несмотря на эти результаты, факторы, ответственные за инициирование аксонного отростка из клеток ганглия сетчатки, остаются неизвестными. Исследования, направленные на выяснение этого вопроса, обычно проводили либо in vivo, либо используя эксплантат сетчатки, полученный из животных, у которых регенерация уже запущена in vivo путем кондиционированного повреждения (Landreth and Agranoff (1976) Brain Res., 118:299-303; Landreth and Agranoff (1979) Brain Res., 161:39-53; Turner, et al., (1981) Brain Res., 204:283-294; Turner, et al. (1982) Dev. Brain Res., 4:59-66; Schwartz, et al., 1985; Yip & Graf stein, (1982) Brain Res., 238:329-339; Hopkins, et al., 1985; Lima, et al. , (1989) Int. J. Devi. Neuroscience, 7:375-382). Факт, что различные испытанные агенты не в состоянии увеличить отросток, несмотря на то, что регенеративные процессы уже начаты in vivo, подтверждает, что факторы, требуемые для инициирования регенерации, можно получить из источника, который отсутствует в культурах эксплантата, например, глиа зрительного нерва, система кровообращения, или другие ткани мозга (Johnson and Turner, (1982) J. Neurosci. Res., 8:315-329). Обзоры по трофическим факторам обычно публикуются в Developmental Neurobiology, M. Jacobson (Third Edition, Plenum Publ. Co. , NY 1991, Chapters 8 and 11); Molecular Neurobiology, Z. Hall, editor (Sinauer Publ. Co., Sunderland, MA 1992, Chapters 11 and 12).
Поэтому цель данного изобретения заключается в обеспечении способа получения молекулярных сигналов, которые инициируют регенерацию нервных связей у млекопитающих.
Другая цель данного изобретения заключается в обеспечении факторов, которые инициируют регенерацию нервной ткани у млекопитающих.
Еще одна цель данного изобретения заключается в обеспечении способов лечения повреждений спинного мозга и другой ткани центральной нервной системы.
Разработаны условия для культуры клеток, которые поддерживают нервные клетки сетчатки во вполне определенных, свободных от сыворотки условиях. Молекулярные факторы, которые стимулируют аксонную регенерацию, выделяют из глиальных клеток, которые окружают нервные волокна. Эти факторы, выделенные из нейронов серебряного карася, и глиальные клетки из центральной нервной системы (ЦНС) млекопитающего, охарактеризовывают. Глиальные клетки оболочки, которые окружают аксоны зрительного нерва серебряного карася, освобождают две молекулы, которые инициируют и поддерживают регенерацию нерва. Одну из молекул называют фактором 1 аксогенеза (AF-1), и она представляет низкомолекулярный полипептид с размером приблизительно 1000 дальтон, по данным масс-спектроскопии она имеет массу 707 дальтон. Вторая молекула, AF-2, представляет белок большего размера, приблизительно 12000 дальтон. Концентрация AF-1 значительно выше в КС (кондиционированная среда), чем в гомогенатах зрительного нерва, подтверждая, что он активно секретируется; AF-2 имеет сходную концентрацию внутри- и внеклеточно.
Исследования указывают на то, что эти факторы строго вовлечены в ЦНС регенерацию, и поэтому их можно было бы использовать при лечении зрительного нерва, мозга, спинного мозга и других повреждений нервной ткани. Например, в диссоциированной клеточной культуре клетки ганглия сетчатки серебряного карася регенерируют свои аксоны в ответ на два фактора, получаемые от шванновских клеток зрительного нерва. В отсутствии этих факторов диссоциированные клетки сетчатки остаются жизнеспособными в определенных, свободных от сыворотки, средах в течение, по крайней мере, недели, но демонстрируют незначительный отросток, визуализированный при помощи витального красителя диацетата 5,6-карбоксифлуоресцеина (5,6-ДАКФ, 5,6-CFDA). Добавление AF-1 вызывало у вплоть до 25% клеток в культуре за 6 дней прорастание отростков более чем 75 мкм в длину; AF-2 оказывало меньшее, но весьма значительное действие. Чтобы подтвердить, что невритный отросток происходит из клеток ганглия сетчатки per se, липофильный краситель 4-Di-10-ASP наносят на зрительную перемычку и дают возможность ему распространиться по зрительному нерву в течение нескольких дней до культивирования сетчатки. Гораздо большее процентное содержание клеток, содержащих краситель, показало аксонный отросток, чем наблюдалось из общей популяции клеток, указывая на то, что клетки ганглия являются селективными мишенями факторов. Воздействия AF-1 или AF-2 не являются вторичными для повышенной жизнеспособности, поскольку присутствие этих факторов не оказывает действия ни на суммарное выживание клеток, ни на число клеток ганглия сетчатки, остающихся в культуре после 6 дней. Активность AF-1 и AF-2 не имитируется несколькими испытанными в широком диапазоне концентраций определенными факторами, включая фактор роста нерва, BDNF, NT-3, CNTF, таурин, ретиноевая кислота, кислотные и основные факторы роста фибробластов. AF-1 из клеток серебряного карася были активны при испытании на культурах клеток ганглия сетчатки крысы и нейронов спинного мозга млекопитающего. Аналогичную активность наблюдали для AF-1, изолированного из мозга неонатальной (новорожденной) крысы, как и для AF-1, изолированного из клеток серебряного карася, используя тот же самый анализ.
Фиг. 1a-1d представляет гистограмму количества невритных отростков: распределение аксонов по длине определяют спустя 5 дней после культивирования нервных клеток с КС при указанных концентрациях 0%, 5%, 10% и 15%. Число клеток, простирающих отростки на 1-5 диаметров в длину (светлый фон); число клеток, простирающих отростки более чем на 5 диаметров клеток в длину (заштриховано). Значения представляют средние из 4 лунок для каждой КС концентрации; отрезки показывают ошибку ± стандартное отклонение от среднего (СОС, SEM).
Фиг. 1e представляет кривые доза-ответ 2 отдельных экспериментов, показывающих невритный отросток (% клеток с аксонами большими чем 5 диаметров клетки) в ответе на повышение концентрации КС (0%, 5%, 10% и 15%). Данные представляют процентное отношение клеток с отростками большими, чем 5 диаметров клетки в длину, точка отсечки выбрана, основываясь на данных гистограммы фиг. 1a-1d. В обоих экспериментах максимальный отросток наблюдается в ответе к КС при 10% концентрации (то есть суммарная концентрация белка около 10 мкг/мл). Ошибка не показана, если она меньше, чем 1%.
Фиг. 1f представляет график выживания клеток как функцию КС концентрации в двух независимых экспериментах (5,6-ДАКФ меченных клетках, подсчитанных в 14 последовательных полях в микроскопе, усредненных для 4 лунок, нормированных к L-15 контрольным значениям).
Фиг. 2a и 2b представляют графики неврит-стимулирующей активности в зависимости от размера фракций КС. Фиг. 2a представляет КС, полученную из ранее неповрежденных зрительных нервов (день 0) или от зрительных нервов, которые были повреждены 3 или 7 днями ранее, разделены на высокомолекулярную и низкомолекулярную фракции с помощью ультрафильтрации (предел пропускания 3000 Да). Во всех случаях и низкомолекулярная (светлый фон) и высокомолекулярная (заштриховано) фракции дают высокие уровни неврит-стимулирующих активности. Фиг. 2b представляет сравнение контроля с КС1 и КС, с молекулярной массой меньше 1000 Да. Фиг. 2c представляет хроматограмму высокомолекулярной фракции КС, выделенной с помощью эксклюзивной по размерам жидкостной хроматографии высокого разрешения (оптическая плотность, О.П., запись при 280 нм). Высокомолекулярную фракцию концентрируют 70-кратно и затем разделяют на 1 мл фракции (обозначенные отрезками линий). Стрелки указывают времена удерживания калиброванных по молекулярным массам стандартов (BSA, бычий сывороточный альбумин; Ova, овальбумин; Cyto C, цитохром C). Фиг. 2d представляет зависимость невритного отростка от фракций колонки, анализированных при концентрациях 25% (в расчете на исходное вещество). Фракции сначала подвергают биоанализу по парам; если обнаруживают какую-либо активность, то их повторно анализируют индивидуально, в противном случае их повторно анализируют по парам. Только фракции 12 и 13 содержат значительную неврит-стимулирующую активность.
Фиг. 3 представляет график невритного отростка, показывающий, что низкомолекулярный фактор, AF-1, может быть изолирован при использовании системы экстракции с двухфазным растворителем. Отрицательный контроль представляет только культуральную среду; положительный контроль, столбец 2, представляет низкомолекулярные фракции молекул, секретированные глиальными клетками Шванна в культуральной среде, КС менее чем 3000 Да, которая индуцирует высокие уровни аксонного роста. При смешении этого материала с органическим растворителем при pH 7,5, изобутанол, небольшая активность остается в водной фазе (pH 7,5 Aq). При смешении органической фазы затем с буфером с низким pH (pH 2 Aq) биологически активные молекулы переходят в водную фазу и ничего не остается в органической фазе (pH 2 орг).
Фиг. 4 представляет график невритного отростка, показывающий, что, когда частично очищенный экстракт, содержащий низкомолекулярный трофический фактор, AF-1, отделяют с помощью ЖХВР (HPLC) с обращенной фазой, активный компонент появляется в определенных фракциях колонки (Фр. C, Фр. D, Фр. E). Как видно на фиг. 3, отрицательный контроль (L-15) представляет только тканевую культуральную среду; положительный контроль представляет нефракционированный низкомолекулярный компонент молекул, секретированных глией зрительного нерва (1КС меньше, чем 3000 Да, 10% концентрация); Фр. A - Фр. I обозначают фракции колонки из разделения с помощью жидкостной хроматографии высокого разрешения.
Фиг. 5a и 5c изображают фракции клеток с аксонами, большими, чем 10 диаметров клетки, для контроля и AF-1, обработанного диссоциированными нейронами из спинного мозга 15-дневного эмбриона крысы, культивированными в либо нейробазальных средах (фиг. 5b), либо в сывороточных минимальных поддерживающих средах Дульбекко (фиг. 5c). Фиг. 5b и 5d представляют графики жизнеспособных клеток в колонке, ширина 1 поля зрения микроскопа x, радиус одной лунки, для контроля и AF-1, обработанного диссоциированными нейронами из спинного мозга 15-дневного эмбриона крысы, культивированными в либо нейробазальной среде (фиг. 5b), либо в дополненных сывороткой минимальных поддерживающих средах Дульбекко (фиг. 5d). Эксперименты проводили на слепых, четырежды воспроизведенных образцах; отрезки обозначают средние значения ± стандартные отклонения от среднего (СОС, SEM).
Фиг. 6a представляет график, показывающий невритный отросток, как фракции клеток с аксонами указанных длин (в диаметрах клетки) для клеток ганглия сетчатки крысы, инкубированных с AF-1 в MEM (минимальная поддерживающая среда) или GCM-D (среда глиольных клеток) при 2%. Фиг. 6b, представляет график, показывающий жизнеспособность клеток, как жизнеспособные клетки в 14 микроскопических полях, для клеток ганглия сетчатки крысы, инкубированных с AF-1 в MEM или GCM-D при 2%. Эксперименты проводили на слепых, четырежды воспроизведенных образцах; отрезки обозначают средние значения ± стандартные отклонения от среднего (СОС).
Фиг. 7 представляет график, показывающий, что глиальные клетки млекопитающего секретируют фактор, аналогичный AF-1, изображающий невритный отросток, процентное содержание клеток с аксонами выше, чем пять диаметров клетки в длину, для контрольных глиальных культур, полученных из клеточных культур ганглия сетчатки серебряного карася, и культур, инкубированных с частично фракционированными глиякондиционированными средами из почти слитых культур клеток мозга новорожденной крысы, выращенных в содержащих сыворотку средах (MGCM). MGCM разделяют на высокомолекулярные и низкомолекулярные компоненты путем ультрафильтрации и фракцию, имеющую молекулярную массу, менее чем 1000 Да (MGCM < 1 кДа 20%) анализируют. Субфракции этого компонента, который не связывается с гидрофобной, C-18 колонкой с обращенной фазой (фракции 4,5 и 6,7), также анализируют. Положительный контроль представлял собой высокоактивный образец, содержащий AF-1 из серебряного карася.
Детальное описание изобретения
I. Обнаружение молекулярных сигналов, которые инициируют регенерацию нерва.
Способность низших позвоночных отращивать поврежденный зрительный нерв представляет предмет многочисленных исследований, направленных на понимание развития и пластичности ЦНС. Чтобы охарактеризовать эндогенные факторы, которые побуждают клетки ганглия сетчатки регенерировать свои аксоны, была разработана диссоциированная модель сетчатки серебряного карася, культивированная в бессывороточных средах определенного состава. В этих условиях клетки ганглия сетчатки распространяют длинные, аксоно-подобные отростки в ответ на два растворимых фактора, которые получают из клеток зрительного нерва серебряного карася. Один из них, названный фактором 1 аксогенеза (AF-1), представляет низкомолекулярную, термоустойчивую, протеаза-чувствительную молекулу, которая проходит через фильтр, отсекающий молекулы с 1 кДа, и имеющий массу 707 Да, определенную с помощью масс-спектроскопии; второй, AF-2, представляет лабильный при нагревании белок с определенным размером 12 кДа.
Эти исследования проводят следующим образом. Спустя три дня после разрушения зрительного нерва, расположенного за глазницей, зрительные нервы и тракты удаляют, нарезают на кусочки 0,5-1 мм, и инкубируют в HEPES-забуференной L15 среде в течение 3-4 часов. Эту кондиционированную среду отфильтровывают и подвергают ионообменной, HPLC (ЖХВР) с обращенной фазой и эксклюзивной по размеру хроматографии, для того чтобы очистить фактор(ы), которые индуцируют невритный отросток из диссоциированных нейронов сетчатки в культуре. Культуры получают путем нарезания сетчатки из нормальных серебряных карасей, обработкой папаином в течение 45 минут, тщательного растирания и седиментации больших кусочков ткани. Отросток подсчитывают вслепую в 3-6 лунках на кондицию в расчете на фракцию больших, жизнеспособных клеток, распространяющих невриты с размером более чем или равным 5 клеточным диаметрам после 5 дней в культуре, с жизнеспособностью, оцениваемой с использованием диацетата 5(6)-карбоксифлуоресцеина.
Увеличение невритного отростка в несколько раз было индуцировано трипсин-чувствительным, устойчивым к нагреванию, основным белком, Mr = 10-15 кДа. Второй, отличный пик неврит-стимулирующей активности имеет Mr менее чем 1000 кДа. Эти исследования показали, что зрительный нерв серебряного карася секретирует множество трофических факторов, которые могут вносить различные вклады в аксонный рост.
Как описано здесь, в базовых условиях, клетки остаются жизнеспособными в течение, по крайней мере, недели, но демонстрируют маленький отросток, оцененный с использованием витального красителя диацетата 5,6-карбоксифлуоресцеина (5,6-ДАКФ). Добавление кондиционированной среды (КС), содержащей молекулы, секретированные поддерживающими клетками зрительного нерва (AF-1 и/или AF-2), индуцировало вплоть до 25% нейронов, которые простирают отростки более чем или равные 5 клеточным диаметрам в длину, после пяти-шести дней. В некоторых случаях этот рост превышает 300 мкм. Для подтверждения того, что этот отросток происходит из клеток ганглия сетчатки (ГКС, RGCs) per se, на зрительную перемычку наносят липофильный краситель 4-Di-10 ASP за 5-7 дней до рассечения сетчаток. После шести дней в культуре клетки, которые были ретроградно мечены 4-Di-10 ASP, демонстрировали в два раза больший невритный отросток, чем вся популяция, указывая на то, что КС действует на ГКС селективно. Действие КС, как показано, не является вторичным для повышенной жизнеспособности, поскольку присутствие КС не действует ни на процентное содержание 4-Di-10 ASP-меченых клеток во всей популяции, ни на суммарное выживание клеток.
По-видимому, AF-1 и AF-2 не соответствуют любой из молекул, идентифицированных ранее в КС из зрительного нерва серебряного карася. Nizrachi, et al. (1986) сообщил о 10 кДа белке в КС зрительного нерва, который связывается с DEAE при нейтральном pH и который адсорбируется на полилизиновом субстрате. Этот белок увеличивает невритный отросток в эксплантатах сетчатки, которые начинают регенерировать свои аксоны in vivo, но не индуцируют отросток из непримированных сетчаток. AF-2, помимо индуцирования отростка из непримированных клеток ганглия сетчатки, не связывается с DEAE даже при pH 8,4 и не адсорбируется на субстрате. Другие компоненты КС, которые также отличаются от компонентов, описанных здесь, включают аполипопротеин A, 28 кДа белок, который связывается с гепарин сульфат протеогликанами и который может способствовать липидному переносу (Harel, et al,., 1989); 60-65 кДа активатор плазминогена, который может включаться в протеолиз внеклеточной матрицы, тем самым давая возможность растущим аксонам продвигаться (Salles, et al., 1990); 28 кДа белок, похожий на интерлейкин-2 (IL-2; Eitan, et al., 1992); трансглутаминазу, которая может вносить вклад в димеризацию IL-2, делая его токсичным для олигодендроцитов (Eitan & Schwartz, 1993); тромбоцитарный фактор роста (Eitan, et al., 1992); кислотный 26 кДа белок, который связывается с полилизиновым субстратом и вынуждает эмбриональные нейроны млекопитающего распространять длинные, неразветвленные аксоны (Caday, et al. (1989) Mol. Brain Res., 5:45-50); и ламинин, 106 кДа гликопротеин, который является основной составляющей внеклеточной матрицы (Hopkins, et al., 1985; Battisti, et al., 1992; Reichardt and Tomaselli, (1991) Ann. Rev. Neurosci., 14:531-70); Giulian, et al. (1986a) J. Cell Biol., 102:803-811; Giulian and Young (1986b) J. Cell Biol., 102:812-820; имеют описанные полипептиды 3, 6, 9 и 125 кДа, которые секретируются перемычкой после повреждения зрительного нерва и которые вносят вклад в пролиферацию конкретных макроглиальных популяций нерва. Наконец, как показано, группа гликопротеинов с молекулярными массами, большими или равными 37 кДа (эпендимины или X-GPs), которые секретируются клетками хороидного сплетения (Thormodsson, et al., (1992) Exp. Neurol., 118:275-283), и субэпендимный слой (Shashoua, (1985) Cell. Mol. Neurobiol. , 5:183-207) активируют аксонный отросток в примированных эксплантатах (Schmidt, et al. , 1991). Факт, что молекулы, сочетающие эти свойства, как установлено, не являются активными в описанной здесь системе, подтверждает, что либо (a) их действия на ГКС слишком неуловимы для определения в анализе, (b) они могут работать лишь на ГКС, которые примированы сначала in vivo, либо (c) их первичные действия направлено на другой тип клеток, который действует на ГКС вторично.
II. Характеристика трофических факторов
Исследования разделения по размеру обнаружило, что КС содержит два активных компонента. Первая молекула, названная фактором 1 аксогенеза (AF-1), проходит через фильтр, отсекающий молекулы с 1 кДа. Она является устойчивой к нагреванию, но чувствительной к расщеплению протеиназой K. Вторая молекула, AF-2, имеет размер 12 кДа, чувствительна к нагреванию и является трипсин-чувствительной. AF-1 значительно более концентрирована в КС, чем в гомогенатах зрительного нерва, подтверждая, что он активно секретируется; AF-2 имеет сходные концентрации внутри- и внеклеточно.
Два фактора вызывают энергичный рост невритов из ГКС независимо от того, инициирован ли регенеративный ответ in vivo примирующим (служащим затравкой) повреждением. Кроме того, клетки ганглия, примированные, чтобы расти, путем кондиционирующего повреждения, не демонстрируют существенного отростка в отсутствии какого-либо фактора. Так, в используемых здесь экспериментальных условиях, AF-1 и/или AF-2 требуются для того, чтобы вызвать и поддержать аксонную регенерацию.
Зрительный нерв серебряного карася состоит из нескольких типов клеток, включая олигодендроглию, астроциты, макрофаги, микроглию и эпителиальные клетки (Battisti, et al., 1992). Трофические факторы обычно секретируются любым из этих типов, или, альтернативно, они могут выделяться из цитоплазмы клеток, поврежденных путем раздавливания нерва или путем рассечения в культуре. Имея это в виду, сравнивают концентрацию двух факторов в кондиционированных средах (КС) и в цитозольных фракциях, полученных из гомогенатов зрительного нерва. Как установлено, AF-1 присутствует в значительно больших концентрациях в КС, чем в цитозоле зрительного нерва, подтверждая, что он активно секретируется. AF-2, с другой стороны, присутствует в сходных концентрациях внутри- и внеклеточно. Если большинство белков в КС являются следствием лизиса клеток, тогда белок, который присутствует в равных концентрациях внутри- и внеклеточно, может нормально находиться только в клетках, хотя физиологически он может еще появиться внеклеточно после повреждения нерва. Однако, если большинство белков, которые присутствуют внеклеточно, получаются активными секреторными механизмами, тогда AF-2 мог бы нормально секретироваться физиологически. Исследования, проведенные в сотрудничестве с доктором C. Stormier (University of Constants, Germany), показали, что среды, содержащие факторы, секретированные из диссоциированной глии зрительного нерва серебряного карася, содержат значительные уровни трофического фактора меньшего чем 3000 Да, и более низкие уровни трофического фактора большего чем 3000 Да. Эти полученные данные указывают на то, что именно глиальные клетки зрительного нерва являются источником AF-1 и AF-2, и не наносят ущерба аксонам или крови. Последний источник оказывается маловероятным из-за отсутствия неврит-стимулирующей активности в средах, кондиционированных рядом других тканей.
Характеристика AF-1 и AF-2
AF-1 и AF-2 вначале характеризовали путем определения присутствия трофической активности после прохождения материала через фильтры молекулярных масс или сита для конкретных молекулярной масс. Использовано несколько методов для определения размера активных факторов. КС сначала разделяют методом ультрафильтрации центрифугированием, используя фильтры с отсечкой с молекулярной массой до 10, 100 и 1000 кДа. Фильтраты и ретентаты (не прошедшая через фильтр часть) подвергают биоанализу. Затем КС пропускают через 6000 Да колонку для обессолевания и фракции анализируют по поглощению при 280 нм (для белка) и путем измерения проводимости (для низкомолекулярных фракций, содержащих соли). Фракции, содержащие высокомолекулярные и низкомолекулярные составляющие, оценивают с помощью биоанализа и, как было установлено, обе являются активными. Фракции, большие чем 6000 Да, объединяют, концентрируют в 10-100 раз, используя фильтр, отсекающий 3000 Да, затем разделяют с помощью жидкостной хроматографии высокого разрешения (ЖХВР). Низкомолекулярное вещество, менее чем 6000 Да, в дальнейшем характеризуют, пропуская через фильтр, отсекающий молекулярные массы 1000 Да.
Затем проводят анионобменную хроматографию трофических факторов, например на диэтиламиноэтилцеллюлозных колонках. Колонку вначале промывают 25 мМ HEPES, затем ступенчато элюируют 0,1, 0,2, 0,5 и 1,0 М NaCl в 25 мМ HEPES.
Очистка AF-1 и AF-2, основанная на анионообменной хроматографии с разделением по молекулярной массе, как описано здесь, достаточна для получения аминокислотной последовательности, которую используют для генерации олигонуклеотидных проб для скрининга библиотек генов для клонов, кодирующих трофические факторы.
Например, образцы очищенного AF-1 были представлены на рассмотрение Harvard University Microchemistry Facility для определения аминокислотного состава и точной молекулярной массы при помощи масс-спектроскопии, за минимальное вознаграждение. Этот факультет может микросеквенировать полипептиды за минимальное вознаграждение. Поскольку очищенные фракции содержат свободную аминокислоту, ее предпочтительно удаляют до анализа. Children's Hospital имеет факультет, который может создавать сложные олигонуклеотиды, которые кодируют пептидную последовательность, допуская вырождение в генетическом коде. Эти олигонуклеотиды можно пометить радиоактивной меткой и использовать для просмотра кДНК библиотеки, чтобы изолировать гены, которые кодируют полипептид, из которого получают AF-1. Затем его секвенируют, чтобы определить, кодирует ли он правильную аминокислотную последовательность для AF-1.
Секвенированные белки можно получить экспрессией рекомбинатных последовательностей в клеточной культуре, изоляцией встречающихся в природе трофических факторов, или, предпочтительно в случае AF-1, синтетическим способом. Эти способы известны для специалистов в данной области. Примером является твердофазный синтез, описанный J. Merrifield, J. Am. Chem. Soc. 85, 2149 (1964), используемый в Пат. США N 4792525, и описанный в Пат. США N 4244946, в котором защищенную альфа-аминокислоту связывают с подходящей смолой, чтобы инициировать синтез пептида, начинающийся с C-конца пептида. Другие способы синтеза описаны в Пат. США 4305872 и 4316891. Эти способы могут быть использованы для синтеза пептидов, имеющих последовательность, идентичную трофическим факторам, описанным здесь, или замещений или присоединений аминокислот, которые можно скринировать на активность, как описано выше и в нижеследующих примерах.
III. Использование в диагностике, скрининге, и изоляция трофических факторов.
Эволюционная консервация и изоляция других трофических факторов.
Исследование на протяжении последних десяти лет или около этого ясно показало, что молекулярные элементы, которые лежат в основе развития и функционирования нервной системы, филогенетически древни и весьма консервативны на всем протяжении эволюции позвоночных. Молекулы, такие как факторы транскрипции, контролирующие программы экспрессии генов, известные трофические факторы, молекулы узнавания клеток, трансмиттеры и их рецепторы, заметно не изменились на протяжении последних нескольких сотен миллионов лет, и поэтому можно предсказать, что гомологичные эквиваленты AF-1 и AF-2 существуют в нервной системе высших позвоночных, включая людей, и их можно идентифицировать на основе аналогичных структур и последовательностей трофических факторов рыбы и крысы, описанных здесь вначале. Кроме того, хотя эти молекулы изучены в зрительной системе, сетчатка и зрительный нерв развиваются онтогенетически как расширения среднего мозга и являются, в основном, идентичными другим частям центральной нервной системы. Поэтому предполагают, что AF-1 и AF-2 будут действовать, помимо клеток ганглия сетчатки, на другие популяции нейронов, особенно на спинной мозг и кору головного мозга млекопитающих. Это демонстрируется следующим примером. Повреждение в нейронах в коре головного мозга является принципиальным фактором при ударе, в то время как повреждение нейронов спинного мозга, которые регенерируют поврежденные аксоны, является основным фактором во многих типах паралича, который является следствием несчастных случаев.
Подтверждение широкой специфичности факторов было установлено, используя систему первичной культуры диссоциированных нейронов из спинного мозга крысы, например, описанной Backer and K.Goslin, eds. Culturing Nerve Cells (MIT Press, 1991). Эта система может быть также использована для того, чтобы исследовать, влияет ли AF-1 или AF-2 на рост аксонов из всех типов клеток в культуре, в основном, соответствуя подходу, используемому в нижеследующих примерах, использующих клетки ганглия сетчатки.
Подтверждение этих результатов можно получить, используя in vivo модель для исследования действия AF-1 и AF-2, например, модель повреждения спинного мозга млекопитающего. Спинной мозг перерезают по дорсальным колонкам, после чего AF-1 и AF-2 выделяют либо посредством использования мининасоса, либо путем помещения их в капсулы медленного освобождения, описанные более детально ниже.
Используемые здесь, если не оговорено особо, термины "AF-1" и "AF-2" относятся к соответствующим описанным здесь белкам и их вырожденным вариантам и эквивалентам другого вида происхождения, в частности человека или других млекопитающих, а также функционально эквивалентным вариантам, имеющим присоединения, делеции, и замещения аминокислот, которые существенно не изменяют функциональную активность нейротрофических факторов, охарактеризованных выше.
Применение в диагностике и скрининге
Понимание структуры и функций описанных здесь трофических факторов, а также кДНК, кодирующих эти белки и антитела, иммунореактивные к ним, имеют ряд применений. В частности, белки и их ДНК можно использовать не только для лечения пациентов, как описано ниже, но и в скрининге лекарственных средств, которые модулируют активность и/или экспрессию трофических факторов, и в скрининге проб от пациента на присутствие функционального трофического фактора; применение ДНК для конструирования проб для скрининга библиотек для других трофических факторов, включая эквиваленты человека, и регуляторных последовательностей, контролирующих экспрессию этих и других трофических факторов.
Например, нуклеотидные последовательности, идентифицированные здесь как кодирующие 707 Да (AF-1) и 12000 Да (AF-2) трофические факторы, используют в качестве проб для скрининга библиотек на присутствие родственных трофических факторов. Библиотеки конструируют из клеток или тканей требуемого вида, такого как мозг человека, которые затем скринируют по всей либо AF-2. Особый интерес представляют области, которые являются теми частями нуклеотидной последовательности, которые кодируют области белка, консервативные между различными трофическими факторами; между теми же самыми трофическими факторами от различных видов; и внутри дискретных областей трофических факторов. Эти области идентифицируют с помощью структурного анализа, используя методы, обычно доступные специалистам в данной области. Эти методы включают электрофоретический анализ и электронную микроскопию и анализ структуры с помощью компьютерного моделирования на основе предсказанной аминокислотной последовательности.
Аминокислотные последовательности и нуклеотидные последовательности, кодирующие аминокислотные последовательности, могут быть также использованы для изоляции и характеристики регуляторных последовательностей, присутствующих в геноме, которые контролируют пространство, в котором экспрессируются в клетке нейротрофические факторы, и для скрининга лекарственных средств, изменяющих экспрессию трофических факторов.
Скрининг проб пациента на экспрессию трофических факторов
Последовательности, кодирующие раскрытые здесь белки, используют для скрининга проб пациентов на присутствие трофических факторов, используя анализ проб пациента на гибридизацию, включая кровь и ткани. Скрининг можно осуществить, используя антитела, обычно меченые флуоресцентной меткой, радиоактивной меткой или ферментной меткой, или путем изоляции клеток-мишеней и скрининга на связывающую активность, используя способы, известные специалистам в данной области. Обычно желателен скрининг на экспрессию, либо качественно, либо количественно, или скрининг на экспрессию функционального трофического фактора.
Зонды гибридизации
Условия реакции гибридизации олигонуклеотидного зонда или праймера с последовательностью нуклеиновой кислоты варьируются от олигонуклеотида к олигонуклеотиду, в зависимости от факторов, таких как длина олигонуклеотида, число G и C нуклеотидов, и состава буфера, используемого для реакции гибридизации. Под умеренно строгими условиями гибридизации специалисты в данной области обычно понимают условия приблизительно на 25oC ниже температуры плавления идеально спаренной по основаниям двутяжевой ДНК. Более высокой специфичности достигают обычно путем использования условий инкубации, имеющих более высокие температуры, другими словами, используя более жесткие условия. В общем, чем длиннее последовательность или выше G и С содержание, тем требуется более высокая температура и/или концентрация соли. В главе 11 хорошо известного лабораторного руководства Sambrook et al., Molecular Cloning: A Laboratory Manual, second edition. Gold Spring Harbor Laboratory Press, New York (1990) (на которую здесь ссылаются) более детально описываются условия гибридизации для олигонуклеотидных зондов и праймеров, включая описание затрагиваемых факторов и уровня жесткости, необходимые для того, чтобы гарантировать специфичность гибридизации.
Предпочтительный размер зонда гибридизации составляет от 10 нуклеотидов до 10000 нуклеотидов в длину. Ниже 10 нуклеотидов гибридизованные системы не стабильны и могут денатуриваться выше 20oC. Установлено, что в случае выше 10000 нуклеотидов, гибридизация (ренатурация) протекает значительно медленнее и представляет незавершенный процесс, как описано более детально в Molecular Genetics, Stent, G. S. and R.Calender, pp. 213-219 (1971). Идеально, зонд должен состоять из от 20 до 10000 нуклеотидов. Меньшие последовательности нуклеотидов (20-100) можно получить (пригодны для получения) путем автоматизированных техник органического синтеза. Последовательности из 100-10000 нуклеотидов можно получить путем обработок соответствующими эндонуклеазами рестрикции. Мечение меньших зондов относительно объемными хемилюминесцентными частями может в некоторых случаях мешать процессу гибридизации.
Получение антител к AF-1 и AF-2.
Животных, таких как мыши, можно иммунизировать путем введения иммуногена в количестве, эффективном
для получения иммунного ответа. Поскольку белки обычно демонстрируют высокую эволюционную консервативность, целесообразно генерировать антитела к белку отличающегося вида происхождения, чем вид, в котором антитела должны испытываться или применяться, выбирая те антитела, которые иммуннореактивны в отношении большинства эволюционно консервативных областей.
Затрагиваемые способы известны специалистам в данной области. Например, мышь подкожно инъецируют в спинку 100 микрограммами антигена, с последующей три недели спустя внутрибрюшинной инъекцией 100 микрограмм кокаинового иммуногена с адъювантом, наиболее предпочтительно Freund's полным адъювантом. Дополнительные внутрибрюшинные инъекции каждые две неделя адъювантом, предпочтительно Freund's неполным адъювантом, обычно необходимы до тех пор, пока не будет достигнут соответствующий титр в крови мыши. В случае использования мыши для слияния и получения гибридомы, титр, по крайней мере, 1:5000 является предпочтительным, и титр 1:100000 или более, наиболее предпочтителен.
В случае, когда белки не являются хорошими иммуногенами, чтобы вызвать иммунный ответ, их можно конъюгировать способами, известными специалистам в данной области, с подходящими носителями для инъекции млекопитающему. К предпочтительным носителям относятся альбумин, токсоид дифтерии и токсоид столбняка, хотя другие подходящие носители могут быть легко определены специалистами в данной области.
Технику in vitro иммунизации лимфоцитов человека часто применяют для того, чтобы генерировать большой ряд моноклональных антител человека. Смотри, например, T. Inai, et al., (May 1993) Histochemistry (Germany), 99(5):335-362; A. Mulder, et al. (Mar. 1993) Hum. Immunol., 36(3):186-192; H. Harada, (April 1993) et al. , J. Oral Pathol. Med. (Denmark), 22(4):145-152; N. Stauber, et al., (May 26, 1993) J. Immunol. Methods {Netherlands), 161(2): 157-168; and S. Venkateswaran, et al., (Dec. 1992) Hybridoma, 11(6):729-739, на которые здесь ссылаются в качестве уровня техники.
Технология моноклональных антител может быть использована для получения MAbs, иммунореактивных либо с AF-1, либо с AF-2; их можно применить при очистке трофических факторов. Способы получения моноклональных антител сегодня являются трудоемкими для специалистов в данной области техники. Смотри, например, публикацию Galfre, G. и Milstein, C., (1981) Methods Enzymol. , 73:3-46, на которую здесь ссылаются. Кратко, гибридомы получают, используя клетки селезенки от мышей, иммунизированных конкретным трофическим фактором. Клетки селезенки каждой иммунизированной мыши подвергают слиянию с клетками миеломы Sp 2/0 мыши, например, используя полиэтиленгликолевый способ слияния Galfre, G. и Milstein, C., (1981) Methods Enzymol., 73:3-46. Рост гибридом, селекцию в HAT среде, клонирование и скрининг клонов против антигенов проводят, используя стандартную методологию (Galfre, G. and Milstein, C., (1981) Methods Enzymol., 73:3-46).
HAT-селектированные клоны инъецируют мышам для получения больших количеств MAbs в асцитах, как описано Galfre, G. and Milstein, C., (1981) Methods Enzymol. , 73:3-46, которые можно очистить, используя колоночную хроматографию с белком A (BioRad, Hercules, CA). Mabs отбирают с учетом их (a) специфичности для конкретного белка, (b) высокого сродства к связыванию, (c) изотипа, (d) стабильности. Mabs можно скринировать или испытать на специфичность, используя одну из ряда стандартных техник, включая Вестерн-блоттинг (Koren, E. et al., (1986) Biochim. Biophys. Acta 876:91-100) и твердофазный иммуноферментный анализ (ELISA) (Koren, E. et al., (1986) Biochim. Biophys. Acta 876:91-100).
Экспрессия рекомбинантных трофических факторов
Трофические факторы можно получить путем изоляции встречающегося в природе белка, как описано выше. Однако предпочтительно экспрессировать белки, в частности больший белок AF-2, путем экспрессии в подходящей рекомбинантной системе-хозяине, такой как клетки млекопитающего, дрожжей, бактерий или насекомого. Изоляцию можно облегчить путем получения антител к рекомбинантному белку, которые затем иммобилизуют на субстратах для использования в очистке дополнительных трофических факторов, как описано выше. Соответствующие векторы и системы экспрессии коммерчески доступны, например, из инвитрогена (Invitrigen) и стратагена (Stratagene).
В некоторых случаях целесообразно вставить энхансеры, или множественные копии регуляторных последовательностей, или белок кодирующих последовательностей в систему экспрессии, чтобы облегчить скрининг способов и реагентов для манипулирования экспрессией и экспрессию белка.
Скрининг на лекарственные средства, модифицирующие или изменяющие (длину, величину) протяженность функции трофического фактора или экспрессию
Трофические факторы используют в качестве мишени для соединений, которые включают, или отключают, или иным способом регулируют экспрессию этих факторов. Анализы, описанные выше, ясно предусматривают рутинную методологию, с помощью которой соединение может быть тестировано на нейротрофическую активность. In vitro исследования соединений, которые, по-видимому, имеют нейротрофическую активность, подтверждаются испытанием на животных. Поскольку молекулы, как предполагают, эволюционно консервативны, то можно проводить исследования на лабораторных животных, таких как крысы, чтобы предсказать действия на людях. Первоначальные данные подтверждают, что AF-1 стимулирует отросток аксонов из нейронов крысы (клетки ганглия сетчатки).
Альтернативно, анализы могут основываться на взаимодействии с последовательностью гена, кодирующей трофический фактор, предпочтительно регуляторными последовательностями, направляющими экспрессию трофического фактора. Например, антисмысловые олигонуклеотиды, которые связываются с регуляторными последовательностями, которые предотвращают экспрессию трофических факторов в полностью дифференциированных, зрелых клетках, могут быть синтезированы, используя стандартную синтетическую химию олигонуклеотидов. Антисмысловые (нуклеотиды) можно стабилизировать для фармацевтического использования, используя стандартную методологию (инкапсулирование в липосоме или микросфере; введение модифицированных нуклеотидов, которые устойчивы к деградации, или групп, которые увеличивают устойчивость к эндонуклеазам, таких как фосфоротиодаты и метилфосфориаты), затем скринировать первоначально на изменение активности трофического фактора в трансфецированных или встречающихся в природе клетках, которые экспрессируют трофический фактор, затем in vivo на лабораторных животных. Типично, антисмысловой (нуклеотид) включает экспрессию путем блокирования тех последовательностей, которые "останавливают" синтез.
Молекулы нуклеиновых кислот, содержащие 5' регуляторные последовательности генов трофического фактора, могут быть использованы для регулирования экспрессии гена in vivo. Векторы, включая как плазмидный, так и эукариотический вирусный векторы, могут быть использованы для экспрессии конкретной конструкции рекомбинатного гена с 5' фланкирующей областью в клетках, выбираемых практикующим специалистом, например, смотри Sambrook et al., Chapter 16). Кроме того, разработан ряд вирусных и невирусных векторов, которые способны ввести последовательности нуклеиновых кислот in vivo, как описано Mulligan, (1993) Science, 260, 926-932; Пат. США N 4980286; Пат. США N 4868116, на которые здесь ссылаются. Разработана система доставки, в которой нуклеиновую кислоту инкапсулируют в катионные липосомы, которые можно инъецировать внутривенно или в ЦНС жидкость млекопитающего. Эту систему используют для введения ДНК в клетки большинства тканей взрослых мышей, включая эндотелий (endothelium) и костный мозг, как описано Zhu et al., (1993) Science 261, 209-211, на которую здесь ссылаются. Олигонуклеотиды можно синтезировать на автоматизированном синтезаторе (например. Model 8700 автоматизированный синтезатор Milligen-Biosearch, Burlington, MA or ABI Model 380B). Кроме того, показано, что антисмысловые дезоксиолигонуклеотиды эффективны в ингибировании транскрипции генов и репликации вирусов Zamecnik et al., (1978) Proc. Natl. Acad. Sci. USA 75, 280-284; Zamecnik et al., (1986) Proc. Natl, Acad. Sci., 83, 4143-4146; Wickstrom et al., (1988) Proc. Natl. Acad. Sci. USA 85, 1028-1032; Crooke, (1993) FASEB J. 7, 533-539. В недавно опубликованной работе показано, что улучшенные результаты можно получить, если антисмысловые олигонуклеотиды содержат модифицированные нуклеотиды, как сообщено Offensperger et. al., (1993) EMBO J. 12, 1257-1262 (in vivo ингибирование репликации вируса гепатита B уток и экспрессии гена с помощью антисмысловых фосфоротиодатных олигодезоксинуклиотидов; Rosenberg et al., PCT WO 93/01286 (синтез сульфуртиоатных олигонуклеотидов); Agrawal et al., (1988) Proc. Natl. Acad. Sci. USA 85, 7079-7083 (синтез антисмысловых олигонуклеозидных фосфорамидатов и фосфоротиоатов для ингибирования репликации вируса-1 иммунодефицита человека); Sarin et al., (1989) Proc. Natl. Acad. Sci. USA 85, 7448-7794 (синтез антисмысловых метилфосфонатных олигонуклеотидов); Shaw et al. , (1991) Nucleic Acids Res 19, 747-750 (синтез 3' экзонуклеаза-резистентных олигонуклеотидов, содержащих 3' концевые фосфороамидатные модификации), на которые здесь ссылаются. Олигонуклеотиды обычно должны быть по длине больше чем 14 нуклеотидов, чтобы гарантировать специфичность последовательности мишени (Maher et al., (1989); Grigoriev et al., (1992)). Многие клетки жадно захватывают олигонуклеотиды, которые меньше чем 50 нуклеотидов по длине (Orson et al. , (1991); Holt et al., (1988) Mol. Cell. Biol. 8, 963-973; Wickstrom et al., (1988) Proc. Natl. Acad. Sci. USA 85, 1028-1032). Чтобы понизить чувствительность к внутриклеточной деградации, например, с помощью 3' экзонуклеаз, можно ввести свободный амин в 3' концевую гидроксильную группу олигонуклеотидов без потери специфичности связывания последовательности (Orson et al., 1991). Кроме того, образуются более стабильные триплексы, если метилировать любые цитозины, которые могут присутствовать в олигонуклеотиде, и также если интеркалирующий агент, такой как производное акридина, ковалентно присоединен к 5' концевому фосфату (через пентаметиленовый мостик); снова без потери специфичности последовательности (Maher et al., (1989); Grigoriev et al., (1992)).
Способы получения или синтеза олигонуклеотидов хорошо известны в данной области техники. Такие способы могут варьироваться от стандартного ферментативного переваривания с последующей изоляцией фрагмента нуклеотида, например, как описано Sambrook et al., Chapters 5, 6, до чисто синтетических способов, например, цианоэтил фосфороамидитным способом, используя Milligen или Beckman System IPlus ДНК синтезатор (смотри также Ikuta et al., in (1984) Ann. Rev. Biochem. 53, 323-356 (фосфотриэфирный и фосфит-триэфирный способы); Narang et al., in (1980) Methods Enzymol., 65, 610-620 (фосфотриэфирный способ).
IV. Лечение повреждений и нарушений нервной системы
Трофические факторы могут быть использованы для стимуляции отрастания и/или регенерации нервной ткани. В недавней работе отмечается, что комбинация трофических факторов плюс антитела, которые блокируют рост-ингибирующие белки на поверхности ЦНС олигодендроцитов, стимулирует увеличенный невритный отросток у взрослых млекопитающих (Schnell, et al., (1994) Nature, 367: 170-173). Таким образом, AF-1 и AF-2 или их человеческие гомологи, используемые в сочетании с агентами, которые предотвращают образование свободных радикалов, такими как лазароид (LaZaroid), 21-аминостероид, или утилизаторами свободных радикалов, такими как фенилбутилнитрон и производные, и противодействуют рост-ингибирующим молекулам, должны иметь клиническое значение.
Повреждения и нарушения нервной системы
Нервные клетки, или нейроны, обычно состоят из тела клетки, которое содержит ядро и большинство органелл; множество дендритов, отростки, которые получают стимулы; и аксон, отросток, который генерирует или проводит нервные импульсы к другим клеткам, таким как мышца, железа, и другим нейронам. Нервные волокна представляют аксоны, завернутые в специальные клеточные оболочки. Группы нервных волокон составляют тракты головного мозга, спинного мозга и периферические нервы. Оболочечная клетка большинства аксонов в ткани взрослого нерва представляет клетку Шванна в периферических нервах и олигодендроцит в волокнах центрального нерва. Аксоны маленького диаметра обычно не имеют оболочки, и их называют немиелинизированными нервными волокнами. Более толстые аксоны, завернутые в клеточные оболочки, называют миелинизированными нервными волокнами. В периферической нервной системе нервные волокна сгруппированы в пучки и образуют нервы. Большинство периферических нервов содержат миелинизированные волокна.
Нервные отростки в центральной нервной системе (головной мозг и спинной мозг) могут регенерироваться в узких пределах при помощи активности тела клетки, пока оно остается живым. Однако важная проблема заключается в том, что отростки обычно не могут генерировать так быстро, чтобы избежать блокады астроглиальной рубцовой тканью. Поэтому регенерация может быть блокирована физическим барьером прежде, чем регенерация может произойти. Отростки в периферической нервной системе также могут регенерироваться, пока живет тело клетки. Дегенеративные и регенеративные стадии описаны, но совершенно не поняты. Когда периферический нерв разрезан, сегменты аксона, проксимальные к разрезу, растут в направлении миелиновых оболочек, которые ранее вмещали сегменты аксона дистально к срезу. Только аксоны, которые успешно состязаются с оболочками, будут регенерировать и достигнут эффекторных клеток. Таким образом, рост отростков, который происходит до образования рубцовой ткани, приводит к более успешной регенерации.
Дегенерация аксонов или потеря аксонов является наиболее обычным явлением при токсических, наследственных, травматических, и ишемических заболеваниях. Она может происходить совместно с демиелинизирующими заболеваниями, которые, в свою очередь, могут быть наследственными или аутоиммунными воспалительными нарушениями. Смешанная картина дегенерации и демиелинизации, приводящая к потере аксонов, имеет место, например, при сахарном диабете.
Повреждение отростков нерва, особенно аксонов, в результате травмы, может происходить в центральной и периферической нервных системах, включая головной мозг, черепно-мозговые нервы, спинной мозг и периферические нервы. Типы повреждения, вызванные травмой, включают повреждения, вызванные прямыми порезами, набухание и сжатие, ушиб, и т.п., каждое из которых может приводить к потере всех или части поврежденных аксонов. Травма может также создать пути для входа микроорганизмов и воздуха или отсечь снабжение нервов кровью. Эффекторные клетки, функция которых состоит в разрушении путем деструкции нервных аксонов, включают скелетную мышцу; гладкую мышцу кровеносных и лимфатических сосудов; гладкую мышцу систем основных органов, включая дыхательную, мочеполовую и пищеварительную системы; клетки эндокринной и экзокринной желез; и другие нервные клетки. Таким образом, физиологическая функция фактически любой системы в организме может быть изменена путем повреждения иннервации, которое включает потерю аксонов.
Примером травматического повреждения является разрыв двигательного нерва в скелетной мышце. Аксоны, дистальные к разрезу, дегенерируют на протяжении ряда дней. Мышечные волокна, которые изолированы от нервной системы, претерпевают фасцикуляции и позже глубокую атрофию, вызванную денервацией, зависящую от того, существует ли другая иннервация. Такая мышца становится нефункциональной до тех пор, пока не произойдет регенерация ее иннервации.
Демиелинизирующие заболевания также связаны с потерей аксонов. Эти заболевания могут быть вызваны аутоиммунитетом и/или вирусной инфекцией и генетически заданными дефектами и включают множественный склероз, острый рассеянный энцефаломиелит, и острый вызывающий омертвление геморрагический энцефаломиелит. Демиелинизация и потеря аксонов может быть также обусловлена токсинами, таким как монооксид углерода.
Аксоны могут быть также потеряны из-за дегенеративных заболеваний нервной системы, например, при амиотрофическом латеральном склерозе и прогрессирующей спинальной мышечной атрофии; при некоторых двигательных нейропатиях; при острой, хронической демиелинизации и других типах полинейропатий, вызванных, например, обширной интоксикацией или отравлением мышьяком, вирусными инфекциями (Guillian-Barre синдром, герпес, цитомегало-вирус, Epstein-Barr), хирургической травмой, лимфомой, волчанкой, диабетом, диспротеинемией, обморожением.
Регенерация после аксонной дегенерации может продолжаться от двух месяцев до более чем года, в зависимости от тяжести и расстояния, которое следует покрыть.
Фармацевтические композиции
Белки можно применять в виде фармацевтически приемлемой соли присоединения кислоты или основания, получаемой взаимодействием с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, перхлорная кислота, азотная кислота, тиоциановая кислота, серная кислота и фосфорная кислота, и органическими кислотами, такими как муравьиная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, малоновая кислота, янтарная кислота, малеиновая кислота и фумаровая кислота, или взаимодействием с неорганическим основанием, таким как гидроксид натрия, гидроксид аммония, гидроксид калия, и органическими основаниями, такими как моно-, ди-, триалкил- и ариламины и замещенные этаноламины.
Трофические факторы можно модифицировать, чтобы увеличить in vivo период полураспада, путем химической модификации аминокислот или путем присоединения к молекуле носителя или инертному субстрату. Например, пептиды можно конъюгировать с белком-носителем, таким как keyhole limpet гемоцианин, по его N-концевому цистеину с помощью стандартных способов, таких как коммерческий Imject набор от Pierce Chemicals, или определенным как слитый белок, который может иметь повышенную эффективность и период полураспада in vivo.
Могут быть также использованы пептиды, содержащие циклопропильные аминокислоты, или аминокислоты, модифицированные аналогичным образом. Эти пептиды сохраняют свою первоначальную активность, но имеют увеличенный период полураспада in vivo. Способы модификации аминокислот и их использование известны специалистам в данной области, например, описанные Stammer в Пат. США N 4629784.
Введение пациенту
Исходя из in vitro исследований, IC50, доза трофического фактора, требуемая для воздействия или повышения нейронного роста, обычно соответствует пикомолярной. Эта доза обычно зависит, в частности, от того, вводят ли один или более белков.
Трофические факторы предпочтительно применяют в фармацевтически приемлемом наполнителе. Подходящие фармацевтические наполнители известны специалистам в данной области. Например, соединение обычно растворяют или суспендируют в стерильной воде или соляном растворе. Соединения можно также применять локально путем местного нанесения раствора.
Альтернативно, соединение можно применять в виде липосом или микросфер (или микрочастиц). Способы получения липосом и микросфер для введения пациенту известны специалистам в данной области.
В Пат. США N 4789734 описываются способы инкапсулирования биологических веществ в липосомах. По существу, вещество растворяют в водном растворе, добавляют соответствующие фосфолипиды и липиды наряду с поверхностно-активными веществами, если требуется, и вещество диализуют или гомогенизируют при помощи воздействия ультразвука, при необходимости. Обзор известных способов представлен G. Gregoriadis, в Chapter 14. "Liposomes", Grug Carries in Biology and Medicine pp. 287-341 (Academic Press, 1979).
Микросферы, получаемые из полимеров и белков, хорошо известны специалистам в данной области. Микросферы или композит микросфер имплантируют для медленного высвобождения на протяжении времени, находящегося в пределах от нескольких дней до месяцев. Смотри, например. Пат. США N 4906474, 4925673 и 3625214.
Полимерные покрытия предпочтительно получают, используя способ, в котором лекарственное средство равномерно диспергируется по всему объему, такой как отливка (пленок) из раствора или расплав, распылительная сушка или прямое прессование, и могут быть выполнены в форме пластинок, гранул, пилюль, микрочастиц, включая микросферы и микрокапсулы, или сформованы в пасте. Микрочастицы, микросферы и микрокапсулы, все вместе, называют здесь "микрочастицами", которые могут быть покрыты другим полимером или другим веществом, чтобы изменить характеристики высвобождения и повысить биосовместимость. Микрочастицы могут вводиться в виде суспензии или могут быть помещены в желатиновую капсулу, или можно использовать, получая пасту, например.
В предпочтительных вариантах воплощения, форму микрочастиц. Требуемого профиля освобождения можно достичь путем использования смеси микрочастиц, полученных из полимеров, имеющих различные скорости выделения, например полимеров, выделяющих в течение одного дня, трех дней и одной недели, так, что линейного высвобождения достигают даже когда каждый полимер per se не освобождает линейно (анестетик) на протяжении того же периода времени.
В предпочтительном способе введение липосом, микрочастиц или пластинок осуществляют путем инъекции в место, где должен быть достигнут эффект. Альтернативно, хирургически имплантируют в данное место. Имплантацию можно осуществлять в клинической практике, либо путем хирургического вмешательства, либо с помощью игл.
Контролируемое освобождение может быть достигнуто непрерывной инфузией при помощи мининасоса, например типа используемого для доставки лекарственного средства (для обезболивания) эпидурально.
Данное изобретение в дальнейшем станет понятным при рассмотрении нижеследующих не ограничивающих его примеров.
Пример 1: Разработка модели для идентификации эндогенных нейротрофических факторов
Разработана экспериментальная модель, с помощью которой можно идентифицировать эндогенные факторы, которые вызывают регенерацию зрительного нерва. Цель состоит в том, чтобы создать систему культивирования клеток, обогащенную клетками ганглия сетчатки, поддерживаемую при низких плотностях клеток, которая предусматривает количественную оценку невритного отростка и которая сводит к минимуму непрямые воздействия, опосредованные через другие типы клеток; кроме того, важно использовать сетчатки от "не подвергнутых какому-либо воздействию" животных, культивированные в отсутствии сыворотки, чтобы идентифицировать факторы, которые инициируют отросток.
Результаты демонстрируют, что диссоциированные клетки ганглия сетчатки хорошо выживают в определенных, бессывороточных условиях, установленных здесь, но показывают незначительный аксонный отросток, если не подвергнуты воздействию одного из двух факторов, которые секретируются клетками ганглия зрительного нерва серебряного карася. Этими факторами являются (a) протеаза-чувствительная, устойчивая к нагреванию молекула, которая, по-видимому, имеет размер менее чем один килодальтон, и (b) чувствительная к нагреванию и протеазе молекула размером 8-15 кДа. Эксперименты по ретроградному мечению демонстрируют, что клетки ганглия сетчатки являются принципиальными мишенями этих факторов, усиливая вероятность того, что эти молекулы играют главную роль в инициировании регенерации зрительного нерва in vivo.
Способы
Кондиционированные Среды.
Нерв (Comet) серебряного карася (от 3 до 4 дюймов в длину, Mt. Parnell Fisheries, Pt. Loudon, PA) используют для приготовления как кондиционированной среды (КС), так и диссоциированных культур сетчатки. Животных анестизируют путем охлаждения до 4oC и затем умерщвляют путем цервикальной перерезки. Зрительные нервы (ЗН) и тракты разделяют, освобождая от кости и соединительной ткани в две стадии: грубое рассечение под 2x увеличением, получая зрительные нервы и тракты, освобожденные из глаз и зрительных перемычек, но с все еще прикрепленным некоторым количеством соединительной ткани и кости, затем проводят вторую стадию при 12x увеличении, используя настольный микроскоп для препарирования (Wild). Следуя методикам, описанным Schartz, et al. (1985) и модифицированным Finkelstein, et al. (1987), 6 ЗН помещают в 3 мл HEPES-забуференную Liebovitz L-15 среду (Gibco/BRL, Gaithersburg, MD) и нарезают на сегменты длиной 1-2 мм. Их инкубируют в течение 3-4 ч при 37oC в атмосфере, содержащей 5% CO2, затем стерилизуют фильтрацией с помощью фильтра с порами 0,2 мкм с низкой белок-связывающей способностью, одеваемого на шприц (Acrodisc, Gelman Sciences, Ann Arbor, MI). КС обычно делят на части и хранят при -80oC сразу после приготовления, хотя в некоторых случаях ее хранят при 4oC в течение от одного до пяти дней, прежде чем фракционировать или использовать в биоанализах. Определения белка (Bradford набор, BSA стандарт; BioRad, Richmond, CA), проведенные на нескольких пробах КС, показали концентрацию белка около 100 мкг/мл.
В случаях, когда операцию на зрительном нерве проводят до рассечения, животных анестезируют в 0,5 мг/мл этилового эфира 3-аминобензойной кислоты (Sigma Chemical Co., St. Louis, MO) и помещают в PlexiglassTM держатель, который фиксирует положение головы, и подают постоянный поток воды из аэрационного танка к жабрам. Делают надрезы, отступя 3 мм от верхнего края глазницы, костный трансплантат оттягивают, и мягкую глазную ткань и адвентицию отсекают прочь, обнажая зрительные нервы. Нервы раздавливают билатерально, 1-2 мм позади глаз, используя загнутые 4 дюймовые ювелирные пинцеты. В случае глазного кровотечения или перерезания нервов животных из исследования устраняют.
Диссоциированные культуры сетчатки
Культуры получают, используя модификацию методик, описанных Landreth & Agranoff (1976, 1979) and Dowling, et al. (1985) Brain Res., 360:331-338. Серебряного карася адаптируют к темноте в закрытых сосудах в течение, по крайней мере, 30 мин до умерщвления. Глаза быстро удаляют и промывают в стерильном L-15, 70% этаноле, и L-15, быстро меняя среды. Хрусталик, роговицу, радужную оболочку удаляют, используя ножницы для разрезания радужной оболочки. Сетчатку препарируют при помощи иглы из склеры и пигментного эпителия, используя ножницы для микрорассечения и ювелирный пинцет, при 25x увеличении. Четыре сетчатки помещают в 5 мл стерильного раствора для переваривания в бокс для асептических манипуляций с ламинарным потоком, где проводят оставшуюся часть препарирования культуры. Чтобы приготовить раствор для переваривания, 100 единиц папаина (Worthington) плюс 2 мг L-цистеина (Sigma) добавляют к 5 мл HEPES забуференного L-15, доведенного до pH 7,4 NaOH, затем стерилизуют фильтрацией. Через 45 мин раствор для переваривания заменяют на 5 мл стерильной L-15 и ткань осторожно растирают 5 раз для того, чтобы разрушить сетчатку на маленькие кусочки. Раствор снова заменяют 5 мл стерильной L-15 и ткань энергично растирают 5 раз, разделяя сетчатки на тонкие фрагменты и удаляя фоторецепторные клетки. Эту стадию повторяют в свежей L-15, получая суспензию с одним типом клеток. Последовательные стадии растирания приводят к обогащению концентрации клетками ганглия путем удаления большинства фоторецепторных клеток и мезенхимы.
Клетки помещают в 24-луночные чашки для тканевых культур (Costar, Cambridge, MA), покрытые поли-L-лизином (MM выше 300000, Sigma). В каждую лунку сначала помещают 200 мкл 2x Среды E, которая разработана на основе публикаций Bottenstein (1983) In: Current Methods in Cellular Neurobiology, Vol. IV: Model Systems. J. L. Barker and J. F. McKeIvy, eds., 107-130 (John Wiley & Sons, New York); Dichter Brain. Res., 149:279-293 (1978); Walicke, et al. J. Neurosci. , 6: 114-121 (1986); and Aizenman & deVellis Brain Res., 406: 32-42 (1987)). При конечной концентрации Среда E содержит 20 нМ гидрокортизона, 1 мМ каинурината (kainurinate), 100 мкл путресцина (putrescine), 20 нМ прогестерона, 30 нМ селена, 0:3 мМ 3,3',5-трииодо-L-тиронина, 50 мкг/мл трансферрина, 150 Е/мл каталазы, 60 Е/мл супероксида дисмутазы, 1% бычьего сывороточного альбумина (Тип V), 10 мкг/мл гентамицина, 5 мкг/мл инсулина, и 15 мМ HEPES (все реагенты от Sigma). Среду E титруют до pH 7 и стерилизуют фильтрацией до добавления в культуральные планшеты. Чтобы облегчить приготовление и достичь воспроизводимости, первые шесть составляющих получают вместе и хранят при 25x концентрации в 0,5 мл аликвотах при -20oC. После добавления Среды E в каждую лунку добавляют 50 мкл суспензии клеток, затем экспериментальный или контрольный образец доводят до 150 мкл с помощью L-15. Если не оговорено особо, экспериментальные образцы располагают вслепую, статистическим образом, с помощью другого сотрудника лаборатории, так чтобы исследователь не знал условий, имеющихся в любой лунке. В пределах данного эксперимента каждое экспериментальное условие представлено в от 4 до 8 лунках; каждый эксперимент включает, по крайней мере, 4 лунки положительного контроля (ранее подтвержденной КС при 5-15% концентрации) и, по крайней мере, 4 лунки L-15 и Среды E только, в качестве отрицательного контроля. Планшеты инкубируют в течение 5-6 дней в темном увлажненном сосуде при комнатной температуре до проведения оценки. Большинство экспериментов повторяют с веществом от 2-5 раздельных приготовлений. Результаты представляют как среднее значение ± стандартная ошибка для 4-8 повторений. Где указано, некоторые результаты нормируют путем вычитания роста в отрицательных контролях и затем деления на чистый (без вычетов) рост в положительных контролях.
Анализ невритного отростка
Невритный отросток количественно анализируют после 5 или 6 дней. Культуральную среду заменяют 0,1 мг/мл диацетата 5,6-карбоксифлюоресцеина (ДАКФ, CFDA: Sigma) в забуференном фосфатом физиологическом растворе (ЗФР, PBS) и инкубируют при комнатной температуре в течение 10 мин. ДАКФ (CFDA), витальный краситель, поглощается и метаболизируется живыми клетками с образованием флюоресцентного продукта, который распределяется по всей клетке, позволяя нам оценить как жизнеспособность клеток, так и невритный отросток. Культуры исследуют при 100x увеличениях при флюоресцентном освещении (Nikon AF-BS обращенный микроскоп), используя зеленый барьерный фильтр. Общее число жизнеспособных клеток в четырнадцати последовательных микроскопических рамках (т. е. радиус одной лунки), записывают, начиная с верха лунки. Клетки, соответствующие морфологическому критерию для клеток ганглия сетчатки (ГКС), установленному в экспериментах с ретроградным мечением (т.е. размер и число отростков) оценивают по длине их невритов, т.е., клетки с невритами, простирающимися от одного до пяти диаметров клетки в длину, от пяти до десяти диаметров клетки, от 10 до 20 диаметров клетки и выше чем 20 диаметров клетки. В большинстве случаев, однако, последние три клетки коллапсируют с образованием единственной меры (значения) невритного отростка, т.е. ([число клеток с невритами больших, чем пять диаметров клетки] + [общее число жизнеспособных клеток] • 100).
Идентификация клеток ганглия сетчатки
Рыб анестезируют и делают ряд надрезов скальпелем в области черепа, определяемой костным швом выше зрительной перемычки. Костный трансплантат оттягивают и кристаллы липофильного красителя, иодид 4-(4-дидециламиностирил)-N-метилпиридиния (4-di 10 ASP: Молекулярные пробы, Inc., Portland, OR) помещают непосредственно на зрительную перемычку. Костный трансплантат заменяют и герметизируют Aron Alpha (Ted Pella, Inc.). По истечении от пяти до девяти дней, в течение которых краситель транспортируется назад в клетки ганглия, сетчатки рассекают и культивируют в присутствии либо 10% КС, либо только контрольных сред, как описано выше. После шести дней нахождения в культуре невритный отросток количественно анализируют под флюоресцентным микроскопом на клетки, которые ретроградно мечены 4-di-10 ASP. Помимо получения информации о невритном отростке в клетках ганглия per se, эти исследования помогают установить критерии, которые используют для идентификации ГКС в стандартных гетерогенизированных культурах.
Пример 2: Определение источника трофических факторов
Источник трофических факторов
Чтобы исследовать, секретируются ли активно трофические факторы или только выделяются из клеток зрительного нерва, которые повреждаются во время рассечения, сравнивают активность высоко- и низкомолекулярных фракций КС и цитозоля зрительного нерва. Цитозольные фракции получают гомогенизацией 10 зрительных нервов в 25 мМ HEPES, pH 7,4 или L-15. Высокоскоростной супернатант этого экстракта подбирают для концентрации белка во всей КС, используя BioRadTM анализ белка. Цитозоль зрительного нерва и КС затем разделяют на высоко- и низкомолекулярные фракции с помощью CetriprepTM фильтра. Проводят скрининг фракций в биопробах. Факторы, кроме того, исследуют, чтобы определить, секретируются ли они селективно зрительным нервом, сравнивая стандартную КС со средами, кондиционированными факторами, секретируемыми другими тканями серебряного карася. Зрительные нервы, требуемые для получения 3 мл КС, взвешивают до измельчения. Равные массы ткани из скелетной мышцы серебряного карася, печени, и жабер используют для препарирования кондиционированных сред, как описано выше.
Для того, чтобы оценить воздействия молекул, которые, как ранее установлено, действуют на рост в культурах эксплантата сетчатки, таурин, при концентрациях 10-9-10-3 М (Sigma), ретиноевую кислоту (10-9-10-4 М: Sigma) и NGF (ростовый фактор нервов) ( β-субъединица, 100 нМ: Collaborative Research, Bedford, MA) испытывают в биоанализе. Проводят дополнительные эксперименты, чтобы исследовать, зависит ли ответ ГКС в КС от плотности посева в культуре. Кроме стандартной плотности клеток, используемой на всем протяжении исследований, клетки также высевают при 1/3, 1/9 и 1/27 этой плотности. Наконец, эксперименты проводят, чтобы сравнить аксонный отросток "примированных" клеток ганглия сетчатки, который начинает регенерировать свои аксоны in vivo, с аксонным отростком не подвергнутых какому-либо воздействию сетчаток, отделенных из ранее не поврежденных рыб. Сетчатки примируют, позволяя регенеративному процессу протекать in vivo в течение 10 дней до диссоциации и посева, период, как ранее показано, максимального увеличения аксонного отростка в эксплантатах сетчатки (Landreth & Agranoff, 1976), и в нервах, раздавленных второй раз и допущенных к регенерации in vivo (McQuarrie and Grafstein, (1981) Brain Research, 216:253-264). Сравнения, сделанные между двумя условиями, основываются на 2-хвостовых (2-tailed) t-тестах, повсюду.
Результаты.
Диссоциированные клетки сетчатки отвечают на факторы, полученные из зрительного нерва.
Ответ диссоциированных клеток сетчатки на факторы, секретируемые зрительным нервом, определяют, используя краситель 5,6-ДАКФ (CFDA). В базовых условиях, клетки остаются жизнеспособными, но демонстрируют маленький отросток. При добавлении КС, содержащей факторы, секретированные зрительным нервом, клетки 10-17 мкм (в поперечнике) распространяют один или два длинных отростка равномерно тонкого калибра, которые иногда обрываются в выступающем конусе роста. Более крупные, полигональные клетки не подсчитываются при количественной оценке невритного отростка.
Спустя шесть дней после посева с L-15 и среде E только, клетки сетчатки остаются жизнеспособными, но демонстрируют маленький отросток. Прокрашивание 5,6-ДАКФ обнаруживает плотность около 70 клеток/мм2. Подсчет на 14 микроскопических полях (т. е. , 1 радиус лунки) допускает выборку 200-300 клеток/лунка. Добавление сред, кондиционированных факторами, секретируемыми зрительным нервом, побуждает клетки распространять длинные невриты, которые похожи на аксоны.
Характеристики доза-ответ
Ответ клеток сетчатки на возрастающие концентрации КС представлен на фиг. 1. Фиг. 1a представляет гистограмму распределения длины аксонов после 5 дней культивирования с КС при указанных концентрациях. Хотя число клеток, распространяющих отростки длиной 1-5 диаметров клетки, изменяется незначительно с увеличением концентрации КС, число распространяющихся отростков, больших чем 5 диаметров клетки в длину, сильно увеличивается. На фиг. 1e изображены кривые доза-ответ двух отдельных экспериментов, представляющих невритный отросток как ответ на увеличение концентраций КС. Данные представляют процентное содержание клеток с отростками длиной, большей чем 5 диаметров клетки, точка отсечки выбрана на основе данных гистограммы на фиг. 1a. В обоих экспериментах максимальный отросток связан с ответом на КС при 10% концентрации (т.е. общая концентрация белка составляет около 10 мкг/мл). На фиг. 1f представлена зависимость выживания клеток от КС концентрации в двух независимых экспериментах.
Как указано на гистограммах фиг. 1a-d, в отсутствии КС 4% клеток имеют невриты в диапазоне 1-5 диаметров клетки, и менее чем 1% имеет отростки более длинные, чем эти. При добавлении КС при 5% концентрации распределение отростков по длине заметно сдвигается: теперь 7% клеток имеет невриты длиной 5-10 диаметров клетки и 2% имеют даже более длинные отростки. При более высоких концентрациях КС (15%), почти не имеется клеток с аксонами длиной 1-5 диаметров клетки. Как и во всех последующих экспериментах, показанные результаты представляют средние значения из 4 или более лунок для каждой пробы ± С.О.С. (S.E.M.). С учетом установленных здесь картин распределения большинство последующих результатов представлено как процентное содержание клеток с аксонами, большими чем 5 диаметров клетки, точка отсечки, которая разделяет откликающиеся и неоткликающиеся группы.
На фиг. 1e изображены кривые доза-ответ двух последовательных экспериментов, использующих различные препараты КС и сетчаток. Для КС концентраций вплоть до 10% число клеток с аксонами, большими чем 5 диаметров клетки в длину, увеличивается, затем уровни падают (отросток в ответ на 5% КС в сравнении с L-15 + Среда E только, p < 0,001 для обоих экспериментов; рост с 10% КС в сравнении с 5% КС, p < 0,02 для обоих; интервалы ошибки не показаны, если они менее чем 1%; один из двух экспериментов был проведен ранее и он не был слепым). Максимальное число отвечающих клеток до некоторой степени отличается между двумя экспериментами, возможно отражая разницу в процентном содержании ГКС в двух препаратах. Эта вставка демонстрирует, что КС слабо влияет на жизнеспособность клеток. Эти данные, взятые из двух исследований, показывают число жизнеспособных клеток, подсчитанных в 14 последовательных микроскопических полях (т.е. 1 диаметр лунки), усредненных по 4 лункам для каждого условия, при возрастающих концентрациях КС. Данные нормируют к числу жизнеспособных клеток в отрицательном контроле (чтобы подсчитать разницу в плотностях посева в двух экспериментах). Хотя, по-видимому, жизнеспособность повышается в ответ на 15% КС в одном эксперименте, она падает, достигая статистического значения (15% КС в сравнении с L-15, p = 0,21) и не видна в другом эксперименте.
Идентификация клеток ганглия сетчатки
Для исследования отростка в клетках ганглия сетчатки per se, используют ретроградное мечение. Нанесение 4-di-10 ASP к малой области зрительной перемычки приводит к ретроградному мечению 4-5% жизнеспособных клеток в культуре. Эти клетки представляют эллипсоид с размерами 8-10 х 16-18 мкм, сходный с размерами ГКС (RGSs), сообщенными Schwarz & Agranoff (1981) Brain Res. , 206: 331-343. Клетки, меченные 4-di-10 ASP, демонстрируют незначительный спонтанный отросток в присутствии L-15 и Среды E только; в ответ на 10% КС, однако, эти клетки показывают двойной уровень невритного отростка, наблюдаемого в общей популяции клеток. КС не оказывает действия на выживание ГКС. Для обеих партий сетчаток число ретроградно меченных клеток в культуре, деленное на общее число жизнеспособных клеток, составляло от 4 до 5%, независимо от присутствия или отсутствия КС. Для отростка в ГКС в сравнении со всеми клетками p < 0,005 для обеих партий сетчаток.
Клетки ганглия сетчатки метят путем нанесения липофильного красителя 4-di-10 ASP на зрительную перемычку за 7 дней до культивирования. Спустя 6 дней нахождения в культуре меченые клетки распространяют один или два отростка в ответ на КС. Эти клетки обычно образуют один или два длинных, тонких отростка. Для обеих партий сетчаток жизнеспособность ретроградно меченных клеток по сравнению с полной популяцией клеток не претерпевает изменения при добавлении КС. Таким образом, КС стимулирует невритный отросток из ГКС селективно, и это действие не является следствием повышения выживания клеток этого типа. Это исследование также дает критерий (диаметр, число отростков) для распознавания клеток ганглия в смешанных, 5,6-ДАКФ-прокрашенных культурах. В смешанных культурах невритный отросток подсчитывают только из клеток, которые соответствуют критерию для ГКС, и находят, что 15-25% полной популяции распространяет невриты, большие чем 5 диаметров клетки. Поскольку из исследования ретроградным мечением можно определить, что приблизительно одна треть нейронов, идентифицированный как ГКС, интенсивно растет в этих условиях, то из этого следует, что ГКС составляют 45-75% клеток в смешанных культурах.
Тканевая специфичность кондиционированных сред
В отличие от сред, кондиционированных зрительным нервом серебряного карася, среды, кондиционированные равной массой скелетной мышцы серебряного карася, жабер или печени, демонстрируют незначительную неврит-стимулирующую активность (все образцы
отличаются от КС зрительного нерва при p < 0,01; эксперимент не слепой).
Пример 3: Изоляция и характеристика нейротрофических факторов
КС зрительного нерва содержит два трофических фактора
Предварительные разделения, проведенные с помощью ультрафильтрации, показали, что вся трофическая активность (все факторы) проходит через ультрафильтрационные устройства с отсечками по молекулярной массе 100 и 1000 кДа; кроме того, много активности проходит через фильтры с отсечкой 10000 и 3000 Да. На колонке с эксклюзией по размеру, с отсечкой молекулярной массы 6 кДа, (т. е. , обессолевающая колонка: Bio-Rad), неврит-стимулирующая активность, как установлено, присутствует как во фракциях, содержащих белок (оцененных при помощи спектроскопии при О.П.280), так и в низкомолекулярных фракциях (содержащие соли, оцененные по измерению проводимости). Исходя из этих наблюдений, кондиционированные среды получают из зрительных нервов нормального серебряного карася либо от животных спустя 3 или 7 дней после билатерального раздавливания зрительного нерва, затем используют ультрафильтрацию для разделения КС образцов на фракции по размеру менее чем 3000 Да и выше чем 3 000 Да. КС, полученная либо из неповрежденных либо из поврежденных зрительных нервов, дает как высокомолекулярные, так и низкомолекулярные неврит-стимулирующие факторы (все образцы показывают более высокий рост, чем L-15 контроль при уровне p < 0,002). Чтобы упростить чертеж, данные представлены сначала вычитанием уровня роста в отрицательных контролях, выращенных со Средой E и L-15 только (3 ± 0,2% [среднее ± С.О.С.], в этом конкретном эксперименте), затем нормированием к чистому росту (без вычетов) в положительных контролях, обработанных нефракционированной КС (21,3 ± 2,3% в этом случае). Данные на фиг. 2a подтверждают, что большинство активности в нефракционированной КС может быть приписано меньшему фактору, хотя это менее очевидно для вещества, собранного за три дня после повреждения. Качественно, присутствие высоко- и низкомолекулярных трофических факторов наблюдалось повторно в КС, полученной из либо неповрежденных либо поврежденных зрительных нервов.
Фракционирование по размеру
Несколько способов используют для определения размера активных факторов. КС сначала отделяют при помощи ультрафильтрационного центрифугирования, используя фильтры с отсечкой молекулярных масс 10, 100 и 1000 кДа (Amicon, Beverly, MA). Фильтраты и ретентаты (фракции, задержанные фильтром) испытывают в биоанализе. Затем КС пропускают через 6 кДа обессоливающую колонку (BioRad) и фракции контролируют по поглощению при 280 нм (для белка) и путем измерения проводимости (для низкомолекулярных фракций, содержащих соли). Фракции, содержащие высоко- и низкомолекулярные составляющие, оценивают при помощи биоанализа, и, как было установлено, они являются активными, как показано на фиг. 2a. Фракции выше чем 6 кДа, объединяют и концентрируют в 10-100 раз, используя Centriprep-3TM фильтр (Amicon) с 3 кДа отсечкой. Затем это вещество разделяют с помощью жидкостной хроматографии высокого разрешения (ЖХВР, Beckman Instruments), используя Biosep SecTM-S3000 N-покрытую связанным кремнеземом колонку (Phenomenex, Torrance, CA). Фракции колонки скринируют в биоанализе, как показано на фиг. 2c. Низкомолекулярное вещество (меньше чем 6 кДа) характеризуют далее путем пропускания через Centriprep-3TM фильтр (Amicon) или Microsep-3TM (Filtron, Northborough, MA) центрифужный фильтр с 1 кДа отсечкой. Вслед за 15х концентрированием лиофилизацией низкомолекулярную фракцию затем анализируют с помощью эксклюзивной - по размерам ЖХВР (BiosepTM Sec S-2000, Phenomenex). С учетом времени элюирования нескольких небольших пептидов (leu-энкефалин [leu, MM = 556], met-энкефалин [met, MM = 877], ангиотензин 1 [angio, MM = 1297]; все от Sigma), активный фактор, по-видимому, имеет размер 600-900 Да.
Обработка нагреванием и протеазой
Чтобы определить, являются ли неврит-стимулирующие факторы в КС полипептидами, высоко- и низкомолекулярные фракции нагревают до 95oC в течение 15 мин или подвергают воздействию 0,1% трипсина. Соевый ингибитор трипсина при 0,125% добавляют либо вместе с трипсином, либо после 1 или 2 ч инкубации с трипсином. Затем образцы скринируют в биопробе. Кроме того, фракцию с менее чем 3 кДа подвергают действию проназы (Sigma) при 10 Е/мл в течение 8 часов (49oC), или протеиназы K (PK, Boehringer Mannheim, Indianapolis, IN: 50 мкг/мл, 56oC, 1 ч). После инкубации ферменты отделяют от низкомолекулярных компонентов, используя Centriprep-3TM фильтр и фильтраты подвергают биоанализу. Контроли включали нагревание активных фракций без ферментов, чтобы подтвердить, что нагрев per se не вызывает инактивации; и инкубирование ферментов самих по себе при 56oC в течение 1 ч, фильтрование, затем добавление фильтрата к фракции с менее чем 3 кДА, чтобы подтвердить, что протеазы не генерируют аутолитические фрагменты, которые могли бы воздействовать на рост клеток.
Чувствительность двух факторов к нагреванию и протеазам указывает на то, что оба фактора являются полипептидами. После нагревания при 95oC в течение 15 мин, нефракционированная КС (5%) теряет половину своей активности; высокомолекулярная фракция сама по себе (при 20% концентрации) теряет почти всю свою активность. Низкомолекулярный фактор сам по себе, обработанный в течение 1 ч при 56oC или в течение 15 мин при 95oC, теряет только 30% своей активности.
Экспозиция с трипсином в течение 1 или 2 ч уменьшает активность нефракционированной КС на около 60%, хотя низкомолекулярная фракция сама по себе показала незначительную потерю в активности после переваривания трипсином. В контроле соевый ингибитор трипсина, добавленный в то же самое время как трипсин, предотвращает потерю активности. Чувствительность низкомолекулярного фактора к протеазам, кроме того, исследуют путем обработки его проназой (8 ч, 40oC) или протеиназой K (1 ч, 56oC). После инкубаций, низкомолекулярные компоненты отделяют от ферментов путем ультрафильтрации и затем тестируют в биопробе. Контроли инкубируют без присутствия ферментов.
Проназа, подобно трипсину, имеет незначительное действие на активность низкомолекулярного фактора(ов). Протеиназа K, однако, уменьшает свою активность на 80% (обработка при 56oC с или без протеиназы K показательна при p = 0,004). Таким образом, как большой, так и малый факторы, по-видимому, являются полипептидами.
Анионообменная хроматография
Анионообменную хроматографию проводят на колонках с диэтиламиноэтил целлюлозой (DE-52, Whatman, Hillsboro, OR). DE-52 гранулы уравновешивают 25 мМ HEPES при pH 8,4, затем добавляют, при отношении, 0,5 мл гидратированных гранул: 10 мл КС (которую обессоливают, используя колонку для эксклюзии по размеру с 6 кДа отсечкой). После инкубирования в течение ночи (4oC) смесь прикапывают в 5 мм в.д. (I.D.), стеклянную Econo-колонку (BioRad). Несвязанную фракцию и первую промывку колонки 25 мМ HEPES объединяют. Связанные белки затем элюируют порциями по 3 мл последовательно 0,1, 0,2, 0,5 и 1,0 М NaCl в 25 мл HEPES. Фракции разделяют на порции и хранят при -80oC для биоанализа. Ионообменную хроматографию также проводят на высокомолекулярной фракции КС при pH 10.
Меньший трофический фактор проходит через 1000 Да фильтр.
Дополнительное фракционирование КС с использованием Microsep-3TM фильтра с 1000 Да отсечкой дает высокие уровни активности в фильтрате, как показано на фиг. 2b; фракция с менее, чем 1000 Да в сравнении с L-15 контролем, p = 0,01; фракция с менее чем 1000 Да в сравнении с полной КС, p = 0,06. Поскольку способность молекулы проходить через этот размер пор зависит от ее формы, а также и от ее размера, то способность абсолютно не определяется размером. Дополнительные исследования с помощью ЖХВР (HPLC) указывают на то, что фактор имеет размер порядка 600-900 дальтон.
С помощью масс-спектроскопии, проведенной Harvard Microchemistry Facility, было определено, что пептид имеет примеси свободных аминокислот и имеет массу около 707 Дальтон. Аминокислотный анализ показывает отсутствие гидрофобных остатков, что согласуется с наблюдаемым гидрофильным поведением при ЖХВР.
Установление размера большего трофического фактора.
На фиг. 2c изображен профиль элюирования высокомолекулярной фракции КС, при разделении с помощью эксклюзии по размеру ЖХВР. Как показано с помощью электрофореза в SDS-полиакриламидном геле (Caday, et al., 1989) и представленной хроматограммы, КС содержит сложную смесь белков. Фракции первоначально подвергают биоанализу группами по две; если объединенные фракции показывают какую-либо активность, то их повторно скринируют индивидуально или парами снова, если активности нет. Высокие уровни активности наблюдали во фракциях 12 и 13 как при первоначальном, так и при вторичном обследованиях (фиг. 2d; фракция 12 в сравнении с L-15, p = 0,01; фракция 13 в сравнении с L-15, p = 0,053; все другие н.с. (N.S.)). Активный фактор имеет сходное с цитохромом C время удерживания (12 кДа; фиг. 2d), таким образом, этот размер, как определено, находится в диапазоне между 8000 и 15000 Да.
В нескольких экспериментах дополнительный пик активности наблюдали при 70000-100000 Да, но он не был воспроизведен. Эта более крупная по размеру молекула может быть нестабильна и деградировать с образованием 12000 Да фактора или может быть многомерным комплексом, который диссоциирует при определенных экспериментальных условиях.
Заряд и связывание с субстратом.
Далее, для очистки большего фактора используют ионообменную хроматографию. С помощью DEAE-анионообменной хроматографии осуществляют отделение высокомолекулярного компонента КС. При pH 8,4, неврит-стимулирующая активность обнаруживается в несвязанной фракции, в то время как при pH 10 активный фактор связывается с колонкой и элюируется 0,2 М NaCl. Ни один из компонентов КС не действует как субстрат-связанный трофический фактор. КС разделяют на высоко- и низкомолекулярные фракции с помощью ультрафильтрации (3000 Да отсечка). Продолжительная экспозиция большего белка при повышенном pH, по-видимому, существенно понижает его активность.
Покрытые полилизином планшеты инкубируют в течение ночи либо с высоко-, либо с низкомолекулярными фракциями КС, либо неразбавленными, либо при 1:10 разбавлении. После промывания лунок для удаления несвязанного вещества никакой неврит-стимулирующей активности не остается после промывания планшетов L-15. Таким образом, ни большой, ни маленький фактор не действует как субстрат-связанный фактор роста.
Фиг. 4 представляет график невритного отростка, показывающий, что, когда частично очищенный экстракт, содержащий низкомолекулярный трофический фактор AF-1, разделяют с помощью ЖХВР с обращенной фазой, то активный компонент появляется во фракциях колонки, обозначенных Фр. C, Фр. D и Фр. E. Как описано выше, отрицательный контроль (L-15) представляет только тканевую культуральную среду; положительный контроль представляет нефракционированный низкомолекулярный компонент молекул, секретированных глией зрительного нерва (1 КС менее чем 3000 Да, 10% концентрация); Фр.A - Фр. I обозначают колоночные фракции из разделения с помощью жидкостной хроматографии высокого разрешения.
Внутри- и внеклеточная концентрация двух факторов.
Секретируются ли активно два неврит-стимулирующие фактора, определяют путем сравнения их активности в КС и в высоко- скоростной супернатантной фракции гомогенатов зрительного нерва. В биоанализе используют образцы при концентрациях 10% и 20%, доводя концентрацию белка цитозоля зрительного нерва до соответствия концентрации белка КС (т.е. 10% концентрация эквивалентна концентрации белка до ультрафильтрации около 10 мкг/мл белка для каждой. Это основывается на гипотезе, что большинство белков, обнаруженных в КС, возникают из лизиса клеток, а не в результате активной секреции.
Низкомолекулярный фактор значительно более концентрирован в КС, чем в ON Cyto (p = 0,002). Эти данные, которые повторяются в еще двух экспериментах, подтверждают, что меньшие молекулы активно секретируются. Больший фактор присутствует при равных концентрациях внутри- и внеклеточно.
Действие повреждения на зрительный нерв
Чтобы исследовать, изменяется ли экспрессия трофических факторов после повреждения зрительного нерва, серебряного карася анестизируют в 0,5 мг/мл этилового эфира 3-аминобензойной кислоты (Sigma Chemical Co., St. Louis, MO) и помещают в плексигласовый держатель, который фиксирует положение головы и позволяет течь постоянному потоку воды из аэрационного сосуда через рот и жабры. Чтобы обнажить зрительные нервы, делают два надреза 3 мм отступя от верхнего края глазницы, костный трансплантат оттягивают, глазничную мягкую ткань и адвентицию отсекают прочь и зрительные нервы раздавливают билатерально 1-2 мм позади глаз, используя загнутый 4-дюймовый ювелирный пинцет. Животных удаляют, если перерезают нерв или если наблюдают значительное кровотечение.
КС получают из зрительных нервов, выделенных либо из нормальной серебряного карася, либо из животных после 3 или 7 дней билатерального раздавления зрительного нерва и затем используют колонку для разделения по размеру, чтобы разделить образцы на фракции менее чем 6 кДа, и больше чем 6 кДа. КС, полученную либо из неповрежденного или поврежденного зрительных нервов, дают как высоко-, так и низкомолекулярные неврит-стимулирующие факторы (все образцы показывают более высокий рост, чем L-15 контроль при уровне p < 0,002). Данные показывают, что большая часть активности в нефракционированной КС может быть приписана меньшему фактору. После фракционирования КС из зрительной перемычки, как установлено, содержит как высоко-, так и низкомолекулярный трофические факторы, каждый при около одной третьей уровня, найденного в кондиционированных средах зрительного нерва.
Влияние плотности клеток.
Чтобы определить, влияет ли плотность клеток на ответ клеток ганглия сетчатки в КС, сетчатки помещают в планшеты при либо стандартной плотности, используемой на протяжении этих исследований (около 70 клеток/мм2), либо при более низких плотностях. Если ГКС соответствует вторичному фактору, выделенному другим типом клетки, которая является непосредственной мишенью КС, то в том случае, когда число этих других клеток уменьшается и концентрация вторичного фактора уменьшается, следует ожидать уменьшенный ответ ГКС при более низких плотностях клеток. При одной трети стандартной плотности клеток (около 25 клеток/мм2), нейроны сетчатки, по-видимому, имеют немного более высокий ответ к КС, чем при стандартной плотности (н.с.), а при другом 3-кратном разбавлении, отросток был только на 30% меньше, чем при нормальной плотности посева [p = 0,18, несущественно]. При 1/27 стандартной плотности отросток все же показывал существенное уменьшение (p = 0,05).
Отсутствие эффекта примирования.
Сетчатки, отсеченные от либо ранее не поврежденной рыбы, либо от рыбы, которая претерпела хирургическое вмешательство в зрительный нерв за 14 дней до инициирования регенеративного ответа, диссоциируют и культивируют в присутствии либо только контрольной (L-15) среды, нефракционированной КС при 10% концентрации, либо в присутствии низкомолекулярной фракции КС при 10% концентрации. Во всех случаях на ответ ГКС не оказывает действие "примирующее" повреждение".
Это делалось для того, чтобы определить, могут ли неврит-стимулирующие факторы в КС позволить "не подвергнутым какому-либо воздействию" клеткам ганглия сетчатки вырасти до той же самой степени, как "примированные" клетки, в которых регенеративный процесс инициирован in vivo. Четыре сетчатки из ранее не поврежденных рыб объединяют, так же как четыре сетчатки от рыбы, которая претерпела билатеральное хирургическое вмешательство в зрительный нерв 10-ю днями раньше. Подобно "не подвергнутым какому-либо воздействию" клеткам ганглия сетчатки, "примированные" ГКС показывают незначительный спонтанный отросток в контрольных средах. В присутствии либо полной (нефракционированной) КС либо только низкомолекулярной фракции (меньше 3 кДа), нейроны из "не подвергнутых какому-либо воздействию" и "примированных" сетчаток показывают идентичные уровни невритных отростков.
Пример 4: Активность других молекул на культурах диссоциированной сетчатки.
Затем определяли, будут ли другие молекулы, которые, как уже сообщалось, изменяют характеристики роста культур эксплантата сетчатки, активны в этой системе. Чтобы исследовать, мимикрируют ли другие факторы активность, найденную в КС, испытывают две небольшие молекулы, которые, как было сообщено, модулируют отросток в "примированных" культурах сетчатки наряду с несколькими макромолекулярными факторами роста.
Таурин, ретиноевая кислота и NGF, все, как уже было сообщено, влияют на невритный отросток из эксплантатов сетчатки. Lima, et al. (1989) сообщает, что таурин в присутствии ламинина увеличивает невритный отросток из эксплантатов сетчатки, примированных для регенирирования in vivo, но имеет незначительное действие на ранее не поврежденную сетчатку. Кроме того, таурин способствует дифференциации палочек сетчатки (Altschuler, et ai. (1993) Development, 119:1317-1328).
Ретиноевая кислота (РК), известный фактор в клеточной дифференциации, как было найдено, усиливает экспрессию белков промежуточного филамента ON1 (гефилтин) и ON2 в эксплантатах сетчатки серебряного карася, не воздействуя на отросток per se (Hall, et al., 1990).
NGF активность была продемонстрирована на мозге серебряного карася (Benowitz & Greene, (1979) Brain Res., 162:164-168), и присутствие NGF-подобной молекулы в зрительном нерве КС подтверждается с помощью предварительного вестерн блот изучения, показывающего, что антитела к мышиному NGF перекрестно реагируют с белком 12-13 кДа, ожидаемый размер β-NGF мономера. При низких концентрациях (т.е., 5 нг/мл), β-субъединица NGF млекопитающего увеличивает невритный отросток из эксплантатов сетчатки серебряного карася, которые были примированы, чтобы расти in vivo, в то время как антитела к NGF подавляют отросток из примированных эксплантантов сетчатки, сохраняемых в присутствии сыворотки (Turner, et al., 1982). Однако NGF имеет незначительное действие на эксплантаты непримированной сетчатки (Turner, et al., 1982), а также на скорость роста аксонного отростка in vivo (Yip & Grafstein, 1982). Поэтому, хотя NGF, вероятно, играет модуляторную роль в этой системе, он, по-видимому, непосредственно не индуцирует аксонный отросток. NGF может стимулировать глиальные клетки выделять факторы, которые, в свою очередь, действуют на нейроны.
Полученный из мозга нейротрофический фактор (BDNF), нейротрофический фактор 3 (NT-3), NT-4-5, ресничный нейротрофический фактор (CNTF; все от Regeneran, Tarrytown, NY, испытаны при 1-100 нг/мл) и фактор роста кислотного фибробласта (aFGF, R&D Systems, Minneapolis, MN, 1-100 нг/мл) и фактор роста основного фибробласта (дар Dr. Patricia D'Amore, 1-100 нг/мл) были также тестированы в биопробе.
В этой клеточной системе таурин при концентрациях между 1 мкм и 10 мМ, не имеет эффекта совсем, а ретиноевая кислота не имеет эффекта между 10-9 и 10-4. Предварительные эксперименты не показали действия NGF на диссоциированные нейроны сетчатки при 50 нм и показали слабую стимуляцию при 500 нм; результаты показывают отсутствие NGF активности при 100 нм, 20-кратная доза, которая увеличивают аксонный отросток в примированных культурах эксплантата (Turner, et al., 1982).
Хотя фактор роста нерва (NGF) не вызывал рост невритного отростка в этих культурах, тем не менее он может вносить вклад в регенерацию зрительного нерва в непрямой форме.
Другие нейротрофины также не индуцируют отросток в широком интервале концентраций: BDNF, NT-3 и NT-4/5 испытаны между 10 рг/мл и 100 рг/мл и все не вызывали роста аксонного отростка. Ненейротрофинные факторы роста, которые были испытаны между 1 и 100 нг/мл, включают факторы роста кислотного и основного фибробластов и ресничного нейротрофического фактора. Эти факторы роста, также, не имели успеха.
Пример 5: Тканевая специфичность кондиционированных сред.
Специфичны ли активные факторы по отношению к зрительному нерву, исследовали путем сравнения стандартной КС со средами, содержащими факторы, секретированные другими тканями серебряного карася. Зрительные нервы, требуемые для получения 3 мл КС, взвешивают до измельчения. Для получения других кондиционированных сред используют равные массы печени, жабер и скелетных мышц. Чтобы оценить другую ткань головного мозга, кондиционированные среды получают из зрительных перемычек шести серебряных карасей; биоанализы проводят, подгоняя концентрацию белка сред, кондиционированных зрительной перемычкой, к концентрации стандартного сред, кондиционированных зрительным нервом.
В отличие от сред, кондиционированных зрительным нервом серебряного карася, среды, кондиционированные равной массой скелетных мышц, жабер или печенью, демонстрируют незначительную неврит-стимулирующую активность. Все образцы отличаются от КС зрительного нерва при p < 0,01. Среды, кондиционированные зрительными перемычками, когда в них концентрацию белка подогнана к концентрации, КС зрительного нерва (т.е. к 10 мкг/мл), демонстрируют около одной трети активности сред, кондиционированных зрительными нервами.
Отношение двух факторов, одного к другому, в настоящее время не совсем понятно. AF-1 и AF-2, каждый, может индуцировать невритный отросток независимо в этих анализах, и их действия, по-видимому, не синергичны. Тем не менее, возможно, что in vivo они функционируют комлементарным образом. Кроме того, возможно, что AF-1 получается при деградации AF-2. Поскольку культуры содержат ряд типов клеток, возможно, что AF-1 и AF-2 могут не действовать непосредственно на клетки ганглия сетчатки, а скорее действуют на другой тип клеток как посредник. Как наблюдали Schwartz & Agranoff (1981), ГКС являются доминантным типом клеток в диссоциированных культурах сетчатки серебряного карася, полученных как описано выше, и поддерживающие клетки встречаются не часто. Таким образом, вместо того, чтобы подавлять пролиферацию поддерживающих клеток, систематически снижают плотность клеток, чтобы понизить концентрацию любых вторичных факторов, которые могли бы выделяться другим типом клеток, поддерживая концентрацию КС постоянной. Поскольку рост невритного отростка существенно не снижается при 9-кратном снижении плотности клеток, ГКС, по-видимому, должны реагировать на КС непосредственно. При плотности клеток около 3 клетки/мм2, однако, отросток все же показывает существенное снижение. Это может быть результатом пониженной концентрации трофического фактора, выделяемого другим типом клеток в культуре или самими ГКС, это требуется для того, чтобы поддерживать клетки в состоянии, в котором они могут реагировать на КС.
Эти данные подтверждают специфичность AF-1 и AF-2 в индуцировании аксонного отростка из ГКС.
Пример 6: AF-1, полученный из рыбы, стимулирует аксонную регенерацию клеток ганглия сетчатки млекопитающего.
Исследования проводят для того, чтобы определить, стимулируют ли низкомолекулярные пептиды, которые стимулируют аксонный отросток из нейронов серебряного карася, также аксонную регенерацию из клеток ганглия сетчатки млекопитающего (т.е. основные проецированные нейроны сетчатки).
Диссоциированные нейроны из спинного мозга 15-дневного эмбриона культивируют либо в нейробазальной среде либо в сывороточных минимальных поддерживающих средах Дульбекко (DMEM).
Как показано на фиг. 5a-d, в ряде слепых экспериментов неоднократно было установлено, что фактор 1 аксоногенеза (AF-1) индуцирует значительные уровни аксонного отростка в диссоциированных культурах сетчатки, полученных из постнатальных 10-дневных крыс. В нейробазальных средах добавление AF-1 увеличивает суммарный невритный отросток приблизительно в 2,5 раза (фиг. 5a) и повышает выживание клеток на 75% (фиг. 5b). При условиях, которые повышают суммарное выживание клеток, AF-1 больше не имеет влияния на жизнеспособность клеток, но все же вызывает приблизительно 2,5-кратное увеличение невритного отростка (фиг. 5c и 5d).
Результаты демонстрируют, что влияние AF-1 на невритный отросток не является простым следствием обеспечения выживания конкретной субпопуляции клеток или повышения суммарной жизнеспособности клеток.
Пример 7: Влияние AF-1, полученного из серебряного карася, на клетки ганглия сетчатки крысы.
Исследования проводили для того, чтобы понять, стимулирует ли AF-1, полученный из серебряного карася, нервные клетки спинного мозга млекопитающего увеличивать аксоны в культуре. В этих исследованиях нейроны получали из спинного мозга эмбриональных крыс. Подтверждение высокой специфичности факторов было установлено, используя первичную культуру (основную систему культивирования) диссоциированных нейронов из спинного мозга крысы, описанную G. Banker and K. Goslin, eds. Culturing Nerve Cells (MIT Press, 1991). Эту систему можно также использовать для изучения того, влияют ли AF-1 или AF-2 на отросток аксонов из всех типов клеток в культуре.
Сетчатки постнатальных 7-10-дневных крыс диссоциируют и культивируют в DMEM. Клетки ганглия идентифицируют путем предварительного мечения аксонов зрительного нерва гранулярным голубым и позволяя красителю ретроградно транспортироваться в сетчатку в течение трех дней.
В отсутствии AF-1 приблизительно 5% клеток ганглия сетчатки распространяет аксоны длиной 5-10 диаметров клетки, и только 1% распространяет аксоны большие, чем эти. При добавлении AF-1, в низком наномолярном диапазоне, число клеток с аксонами 5-10 диаметров клетки удваивается, и число с аксонами, большими чем 10 диаметров клетки, увеличивается примерно в 10 раз. Никакого влияния на выживание клеток не наблюдали.
Результаты показаны на фиг. 6a-6d. В исследованиях, показанных на фиг. 6a и 6b, среды используют, чтобы продемонстрировать действие AF-1 как на выживание клеток, так и на аксонный отросток. В исследованиях, показанных на фиг. 6c и 6d, условия сред были изменены. Показано, что AF-1 все же вызывает большое увеличение аксонного отростка, хотя очевидно нет влияния на выживаемость.
Пример 8: Идентификация фактора, сравнимого с AF-1 из серебряного карася, присутствующего в культивированных средах глиальных клеток, полученных из ЦНС млекопитающего.
Исследования предприняты для того, чтобы продемонстрировать, что глиальные клетки, полученные из ЦНС млекопитающего, секретируют фактор, который похож на AF-1, полученный из серебряного карася, в терминах его размера и биологической активности.
Глиальные культуры головного мозга неонатальной крысы выращивают вблизи слияния в содержащей сыворотку среде. Среду меняют на бессывороточную среду определенного состава, чтобы собрать факторы, секретируемые глией в течение 24 часов. Среду, кондиционированную глией, ("MGCM"), разделяют на высокомолекулярные и низкомолекулярные компоненты с помощью ультрафильтрации, и фракции, имеюшие молекулярную массу менее чем 1000 Да, анализируют на активность в стандартных пробах серебряного карася. Субфракции этого компонента получают с помощью жидкостной хроматографии высокого давления с обращенной фазой (ЖХВД). Субфракции, которые не связываются с гидрофобной, с обращенной фазой, C-18 колонкой (фракции 4, 5 и 6, 7), также анализируют.
На фиг. 7 представлен график, показывающий, что глиальные клетки млекопитающего секретируют фактор, похожий на AF-1, который показывает невритный отросток, процент клеток с аксонами, большими чем пять диаметров клетки в длину, для различных фракций. Фракция, имеющая молекулярную массу ниже 1000 Да, и обе фракции из HPLC элюатов, особенно последние, имеют почти одинаковую активность с соединением, полученным из серебряного карася.
Вместе эти исследования демонстрируют, что (a) AF-1 работает так же хорошо на нейронах млекопитающего, как на нейронах из низших позвоночных, (b) AF-1 торпедирует другие клетки нервной системы, помимо клеток ганглия сетчатки, (c) сравнимая молекула продуцируется глиальными клетками млекопитающего.
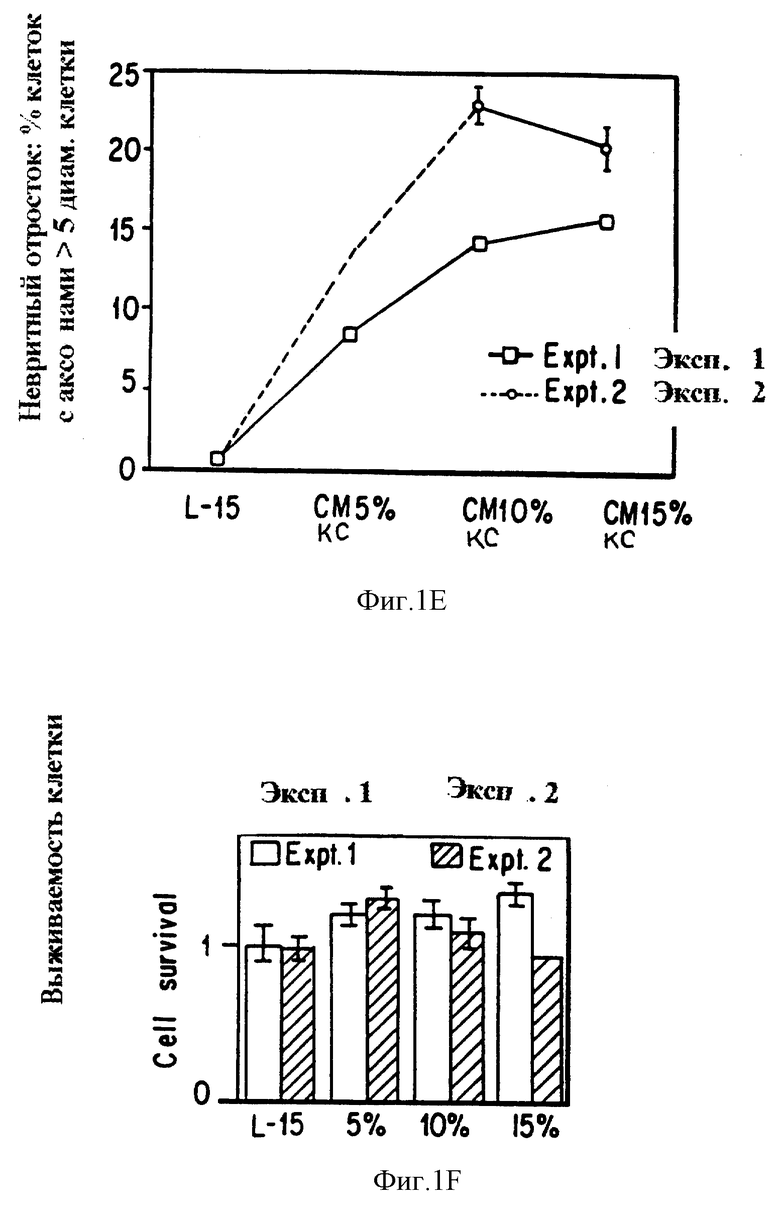
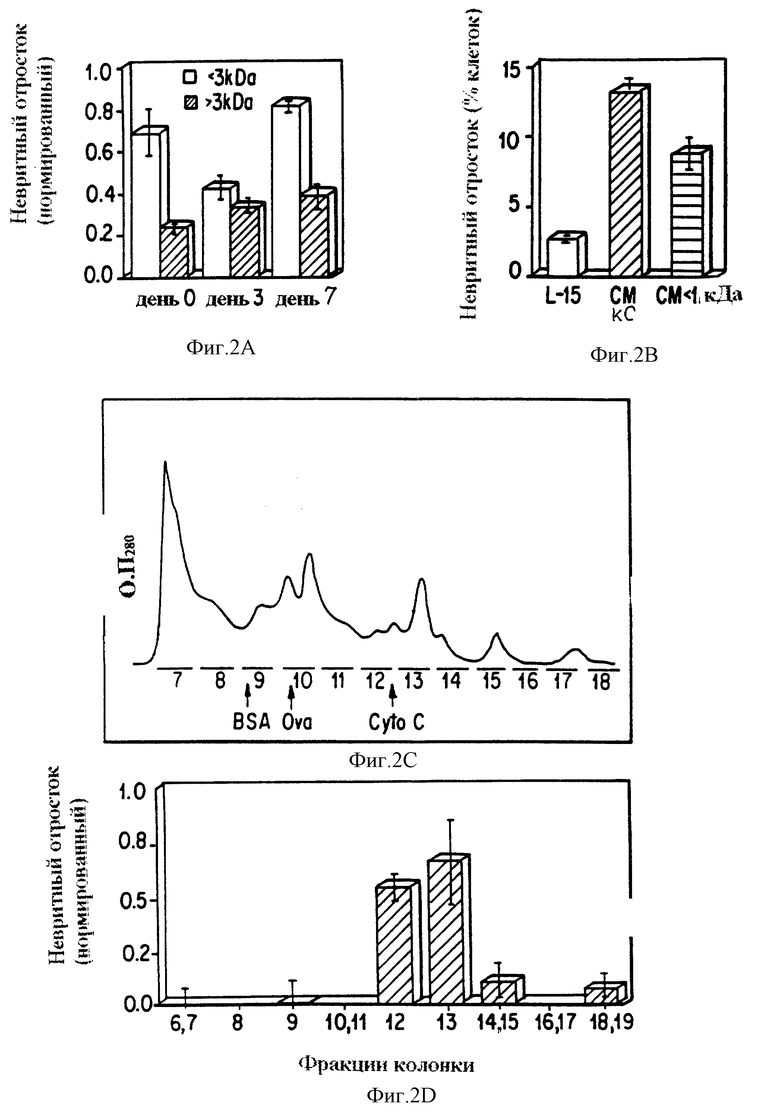
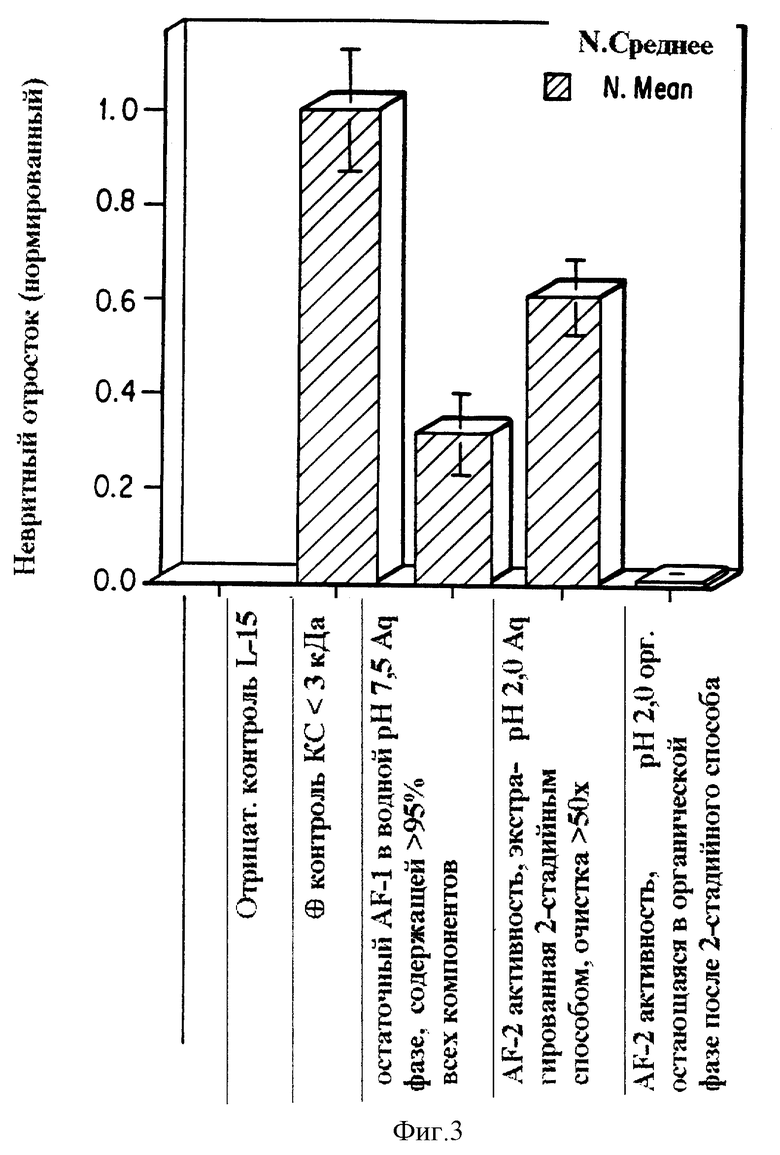
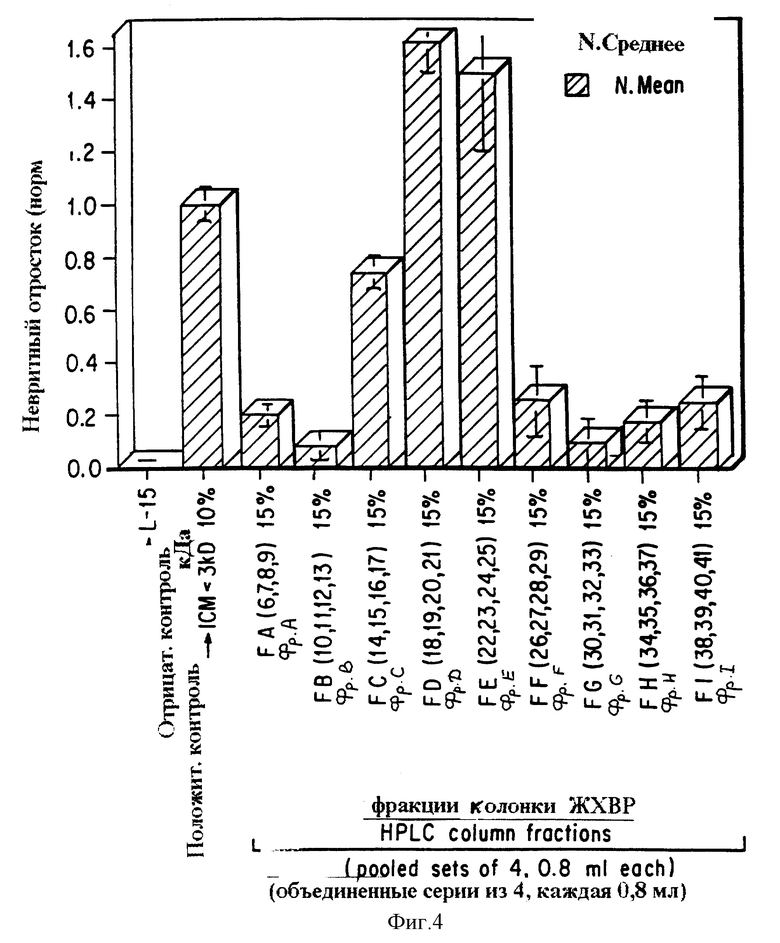
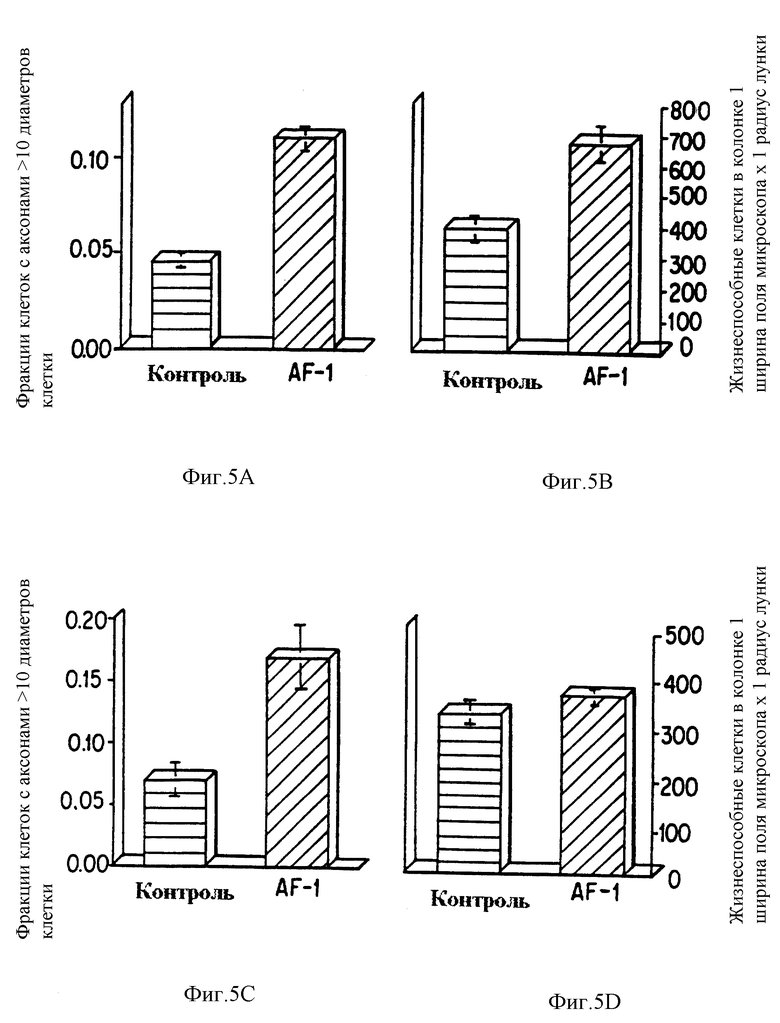
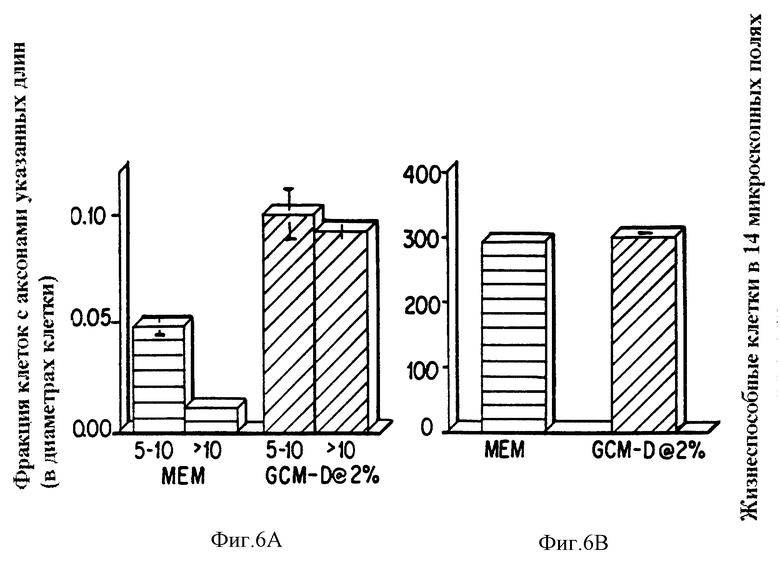
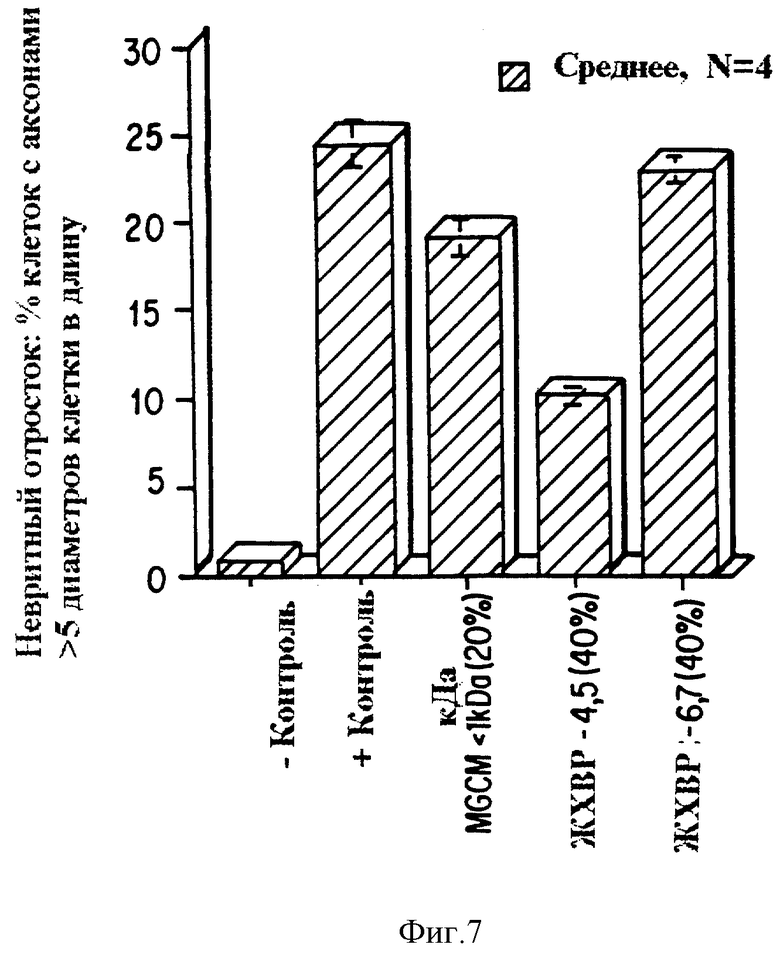
Изобретение относится к медицине, а именно к средствам лечения поврежденной центральной нервной системы. Для этого разработаны условия культивирования клеток, которые поддерживают нервные клетки сетчатки в вполне определенных, бессывороточных условиях. Охарактеризованы молекулярные факторы, которые стимулируют аксонную регенерацию из этих нейронов. Клетки глиальной оболочки, которые окружают аксоны зрительного нерва, выделяют две молекулы, которые инициируют и поддерживают регенерацию нерва. Одна из молекул называется фактором 1 аксогенеза (AF-1), и представляет низкомолекулярный полипептид с размером в диапазоне 1000 дальтон, который по данным масс-спектроскопии составляет около 707 дальтон. Вторая молекула, AF-2, представляет большой белок с размером приблизительно 12000 дальтон. Эти факторы строго включены в регенерацию ЦНС, и поэтому их используют для лечения спинного мозга и других повреждений нервной ткани. 2 с. и 2 з.п.ф-лы, 7 ил.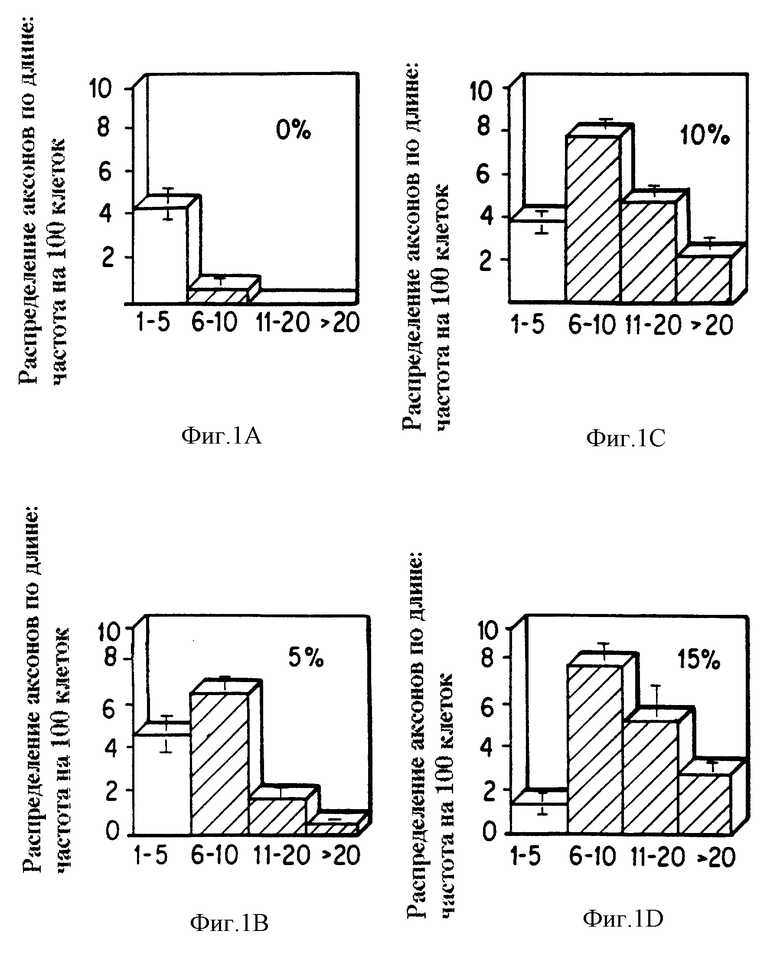
| MIZRACHI, et al, J Neurochem, 1986, 46: 1675-1682 | |||
| 0 |
|
SU82612A1 | |
| Способ выделения фактора роста нервной ткани из змеиного яда | 1982 |
|
SU1055732A1 |
Авторы
Даты
2000-10-10—Публикация
1995-08-24—Подача