Область техники, к которой отностится изобретение
Настоящее изобретение относится к новым моноклональным антителам, которые обладают способностью ингибировать хоминг гемопоэтических стволовых клеток и распознавать стромальные клетки селезенки, которые, в свою очередь, могут поддерживать хоминг гемопоэтических стволовых клеток, кроме того, изобретение относится также к гибридоме, продуцирующей моноклональные антитела.
Поскольку моноклональные антитела настоящего изобретения могут распознавать вещество, важное для осуществления хоминга клеток костного мозга на гемопоэтической ткани как на антигене, и характеризуются способностью ингибировать хоминг гемопоэтических стволовых клеток, они могут рассматриваться на основе свойственной им функции повышения эффективности действия антиракового средства как перспективный лекарственный препарат, в частности, за счет усиления действия антиракового средства для лечения лейкоза посредством высвобождения миелоидных лейкозных клеток из костного мозга.
Предпосылки создания изобретения
Гранулоцитарные колониестимулирующие факторы, такие, например, как рекомбинантные гранулоцитарные колониестимулирующие факторы /рГ-КСФ (rG-CSF)/, были известны вначале как гуморальные факторы, стимулирующие дифференциацию и пролиферацию гранулоцитарных клеток, при этом в экспериментах на мышах in vivo было показано, что введение рГ-КСФ стимулирует гемопоэз в костном мозге и, кроме того, вызывает выраженный экстрамедуллярный гемопоэз, осуществляемый в селезенке при пролиферации гемопоэтических стволовых клеток и всех клеток-предшественников, имеющихся в процессе кроветворения в селезенке. Считается при этом, что механизм гемопоэза в селезенке, будучи экстрамедуллярным по своей природе, осуществляется благодаря модификациям в микросреде в процессе кроветворения в селезенке, которые возникают в связи со стимулирующим действием рГ-КСФ, повышающим гемопоэтический потенциал.
Исходя из этого, авторы настоящего изобретения пометили стромальные клетки селезенки, в которые был введен рГ-КСФ, с целью выяснения уровня гемопоэтического потенциала в селезенке, далее установили гемопоэтическую клеточную линию стромы (CF-1 клетки) из селезенки мышей, которым был введен рГ-КСФ, для исследования существования факта повышения гемопоэтического потенциала под действием стромальных клеток, содержащих введенный рГ-КСФ, продемонстрировали, с применением гемопоэтических стромальных клеток, потенциальный эффект на гемопоэз и, наконец, определили колониестимулирующую активность in vitro, а также способность поддерживать гемопоэтические стволовые клетки in vivo (Blood, 80, 1914, 1992).
Поскольку поддерживающая способность гемопоэтических стволовых клеток in vivo реализуется в том случае, когда CF-1 клетки трансплантируют вместе с клетками костного мозга на трансплантате костного мозга, считалось, что вышеупомянутая гемопоэтическая стромальная клеточная линия (CF-1 клетки) экспрессирует указанную функцию в виде фактора клеточной адгезии, позволяющего гемопоэтическим стволовым клеткам осуществлять хоминг на гемопоэтической ткани.
Однако, несмотря на то, что на основе ряда стромальных клеток селезенки, обладающих способностью поддерживать хоминг гемопоэтических стволовых клеток, удалось получить стабильные клеточные линии (CF-1 клетки) и определить их цитологические характеристики, до сих пор еще не были получены специфические антитела, распознающие клеточную поверхность их антигенов, как неизвестны до настоящего времени и характеристики таких антител.
В этой связи авторы настоящего изобретения предприняли кропотливое исследование с целью получения, на основе использования приведенной выше информации, касающейся стромальных клеток селезенки, а также результатов проведенных исследований, специфических антител, способных распознавать стромальные клетки селезенки, обладающие способностью поддерживать хоминг гемопоэтических клеток, создания клеточной линии на основе стромальных клеток селезенки, обладающих способностью поддерживать хоминг гемопоэтических клеток, а также приготовления моноклональных антител с использованием стромальных клеточных линий из селезенки в качестве антигенов для иммунизации, в результате чего были получены новые, неизвестные ранее моноклональные антитела.
В ходе изучения свойств полученных моноклональных антител авторы настоящего изобретения показали, что упомянутое антитело характеризуется способностью распознавать поверхностный антиген стромальной клетки селезенки, поддерживающей хоминг гемопоэтических стволовых клеток, а также ингибировать хоминг гемопоэтических стволовых клеток, и этот факт поставил точку в исследованиях, составивших предмет настоящего изобретения.
Раскрытие изобретения
Целью и объектом настоящего изобретения является приготовление новых моноклональных антител, распознающих поверхностные антигены стромальных клеток селезенки, которым свойственна функция поддержания хоминга гемопоэтических стволовых клеток, а также характеризующихся способностью ингибировать хоминг гемопоэтических стволовых клеток. Кроме того, другой целью настоящего изобретения является получение гибридомы, способной к продуцированию моноклонального антитела.
Моноклональное антитело настоящего изобретения относится к новому моноклональному антителу к поверхностному антигену стромальных клеток селезенки, обладающих способностью поддерживать хоминг гемопоэтических стволовых клеток, кроме того, упомянутое антитело характеризуется свойством распознавать стромальную клетку селезенки, что связано с повышением гемопоэтического потенциала селезенки, при этом упомянутое антитело представляется чрезвычайно полезным с точки зрения его применения в качестве вещества, функционирующего в качестве ингибитора хоминга гемопоэтических стволовых клеток. В контексте настоящего описания хоминг гемопоэтических стволовых клеток означает процесс, в ходе которого под влиянием стромальных клеток гемопоэтической ткани происходит адгезия гемопоэтических стволовых клеток, при этом клетки дифференцируются и пролиферируют в виде KOE-C (колониеобразующих единиц в селезенке, CFU-S) колоний.
В общих чертах, моноклональное антитело настоящего изобретения может быть получено по приведенной ниже процедуре.
А именно: моноклональное антитело настоящего изобретения может быть получено, например, с использованием в качестве антигена стромальных клеток селезенки, взятых от животных, которым вводили рГ-КСФ, в частности, CF-1 клеток (стромальных клеток селезенки), установленных авторами настоящего изобретения в виде клеточной линии, далее с их применением осуществляют по традиционно принятой методике иммунизацию, затем проводят слияние иммунизиронных клеток с помощью стандартной процедуры слияния и после этого клонируют слитые клетки с использованием стандартной техники клонирования.
В качестве предпочтительного способа получения моноклональных антител настоящего изобретения может быть приведен метод, включающий использование в качестве антигена CF-1 клеток, представляющих собой стромальные клетки селезенки животного, которому вводят рГ-КСФ, и которые установлены авторами настоящего изобретения в качестве культуральной клеточной линии (Blood, 80, 1914, 1992), слияние плазматических клеток (иммуноцитов) из млекопитающего, иммунизированного антигеном, с миеломными клетками млекопитающего, в частности, мыши, клонирование полученных слитых клеток (гибридом), селекцию клонов, продуцирующих антитело настоящего изобретения, которое способно распознавать указанную клеточную линию среди других, и культивирование их с выходом целевого антитела.
Однако указанный метод приведен лишь в качестве одного из возможных примеров, так что в данном случае для получения, на основе того же способа, что и в случае CF-1 клеток, целевых антител, могут использоваться не только вышеупомянутые CF-1 клетки, но также другие стромальные клетки гемопоэтической ткани, полученные по методу, аналогичному примененному в случае CF-1 клеток, или стромальные клетки гемопоэтической ткани, полученные из клеток селезенки человека.
В соответствии со способом получения таких моноклональных антител использование тех или иных млекопитающих, которые могут быть иммунизированы вышеупомянутым антигеном, не сковано особыми ограничениями, однако предпочтительно проводить отбор с точки зрения удобств использования миеломных клеток в процедуре слияния клеток, при этом по данному способу оказывается предпочтительно работать с мышами, крысами и хомячками.
Иммунизацию осуществляют в соответствии с общепринятой методикой, в частности, посредством введения с помощью инъекции стромальных клеток селезенки, таких как вышеупомянутые CF-1 клетки, в брюшную полость млекопитающего. Более специфично, предпочтительно вводить их животному при разбавлении или суспендировании в соответствующем количестве фосфатно-буферного раствора (ФБР) или изотонического раствора хлорида натрия по несколько раз ежемесячно. Предпочтительно, кроме того, использовать в качестве иммуноцитов клетки селезенки, отобранные по завершению последнего введения вышеупомянутых клеток.
В качестве второго компонента, необходимого для проведения слияния клеток, который представляет собой миеломные клетки, предпочтительно использование ряда известных клеточных линий, которые включают P3(Р3Х63Ag8.653) (J. Immunol. , 123, 1548, 1978), P3-U1 (Current Topics in Microbiology and Immunology, 81, 1-7, 1978), NS-1 (Eur. J. Immunol., 6, 511-519, 1976), MPC-11 (Cell, 8, 405-415; 1976), Sp2/0-Agl4 (Nature, 276, 269-270, 1978), F О (J. Immunol. Meth. , 35, 1-21, 1980), S194 (J. Exp. Med., 148, 313-323, 1978) и R210 (Nature, 277, 131-133, 1979).
Слияние клеток при использовании вышеупомянутого иммуноцита и миеломной клетки может быть проведено в основных чертах с помощью одного из традиционных способов, например, по методу Мильштейна с соавт. (Methods Enzymol., 73, 3-46, 1981).
Более специфично, вышеупомянутое слияние клеток может быть проведено, например, в простой питательной среде в присутствии вещества, ускоряющего слияние. В качестве такого ускоряющего слияние клеток агента может использоваться полиэтиленгликоль (ПЭГ) и Сендаи Вирус (HVJ), а кроме того, при необходимости усилить эффективность слияния, практикуется добавление адъювантов, таких как диметилсульфоксид. Что касается коэффициентов отношения иммуноцитов и миеломных клеток, то предпочтительно использование первого из них в 1-10-кратном количестве относительно второго компонента смеси для слияния клеток. В качестве примеров среды, применимой для проведения вышеупомянутой процедуры слияния, можно привести среду RPMI-1640 и MEM среду (минимальную незаменимую среду), которые хорошо подходят для осуществления пролиферации упомянутых миеломных клеток, а также ряд других сред, традиционно используемых для культивирования такого рода клеток, которые, кроме того, могут содержать дополнительно сыворотку, в частности, фетальную телячью сыворотку (ФТС).
Клеточное слияние проводят при смешивании описанных ранее количеств вышеупомянутых иммуноцитов и миеломных клеток в вышеупомянутой среде, при добавлении в среду, обычно в концентрации 30-60% (вес/объем), раствора ПЭГ, предварительно нагретого до температуры около 37oC, например, такого ПЭГ, который имеет средний молекулярный вес в диапазоне от 1000 до 6000, с последующим перемешиванием. Затем последовательно, при повторении процедур добавления соответствующих сред друг за другом, центрифугировании реакционной смеси и удалении супернатантов могут быть получены целевые гибридомы.
Упомянутые гибридомы подвергают селекции при культивировании на обычной селективной среде, в частности, на ГАТ среде (среде, содержащей гипоксантин, аминоптерин и тимидин). Культуру растят на ГАТ среде в течение периода времени, достаточного для того, чтобы клетки, отличные от гибридом (неслитые клетки), погибли, обычно этот процесс занимает от нескольких дней до нескольких недель. Затем с применением обычного метода ограниченных разведений проводят скрининг и клонирование гибридом.
Полученные гибридомы, способные к продуцированию моноклональных антител настоящего изобретения, могут быть далее подвергнуты субкультивированию, после чего они могут храниться в жидком азоте в течение длительного времени.
Для целей получения моноклональных антител настоящего изобретения от гибридом может быть применен метод, включающий культивирование гибридом по обычной методике с получением их из супернатантов, или метод, включающий введение гибридомы с целью ее пролиферации в организм подходящего млекопитающего с получением их из асцита. Первый способ применяется для случаев получения антител высокой чистоты, тогда как второй - для целей массовой продукции антител.
Кроме того, антитела, получаемые при использовании вышеуказанных методов, могут быть очищены до высокой степени чистоты с помощью традиционных способов очистки, таких как техника высаливания, гель-фильтрация и аффинная хроматография.
Поскольку моноклональное антитело настоящего изобретения обладает способностью ингибировать хоминг гемопоэтических стволовых клеток, они могут найти применение в качестве лекарственного препарата, усиливающего действие антиракового средства в ходе лечения лейкоза; в частности, в связи с упомянутой функцией, из костного мозга происходит высвобождение миелоидных лейкозных клеток, что сказывается на повышении эффективности действия антиракового препарата при лечении лейкоза.
Нет необходимости говорить о том, что создание на основе моноклональных антител настоящего изобретения специфичной системы для использования в медицине на основе ее свойства усиливать действие лекарственного средства при лечении лейкоза, а также все виды модификации и применения такой системы включены в рамки настоящего изобретения, в той мере, в какой все они применимы на практике с использованием метода, очевидного для каждого специалиста, обладающего средним уровнем знаний в данной области.
Краткое описание фигур
На фиг. 1 приведены результаты иммунофлюоресцентного анализа (контроль в отсутствие антитела, CF-1 клетка).
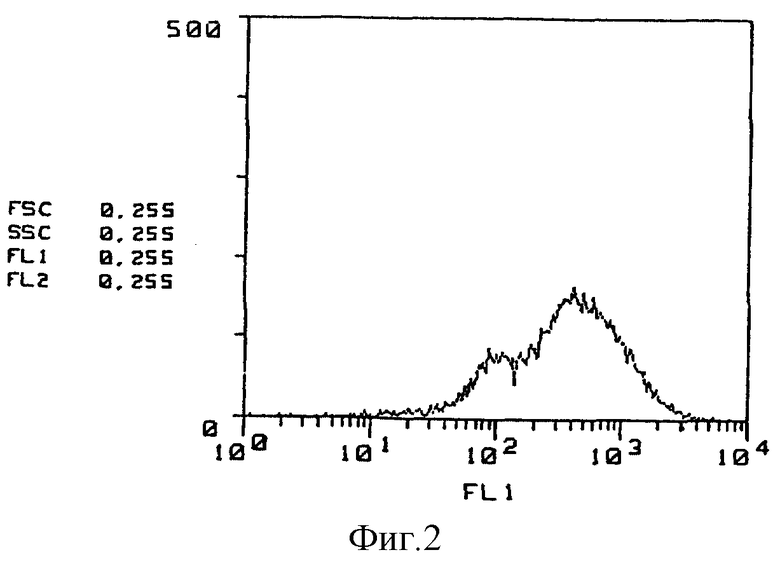
На фиг. 2 приведены результаты исследования способности к связыванию GSPST-1 антитела с CF-1 клетками на основе иммунофлюоресцентного анализа.
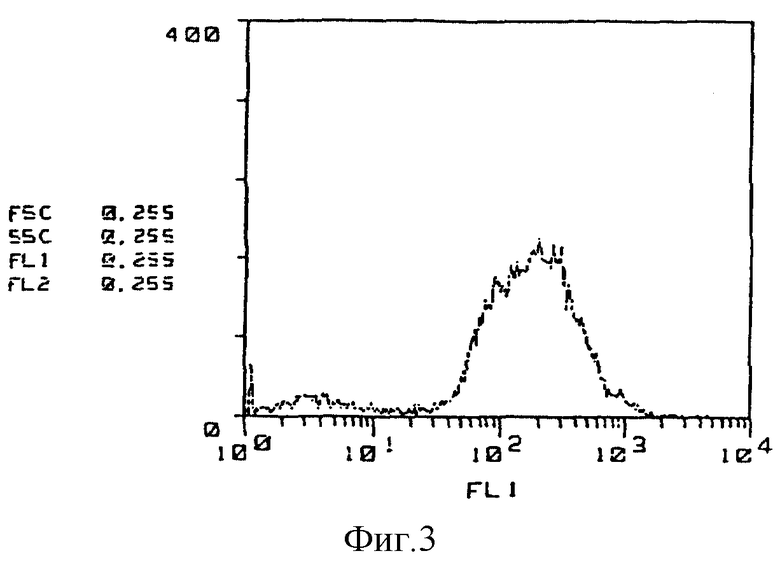
На фиг. 3 приведены результаты исследования способности к связыванию HMS-1 антитела с CF-1 клетками на основе иммунофлюоресцентного анализа.
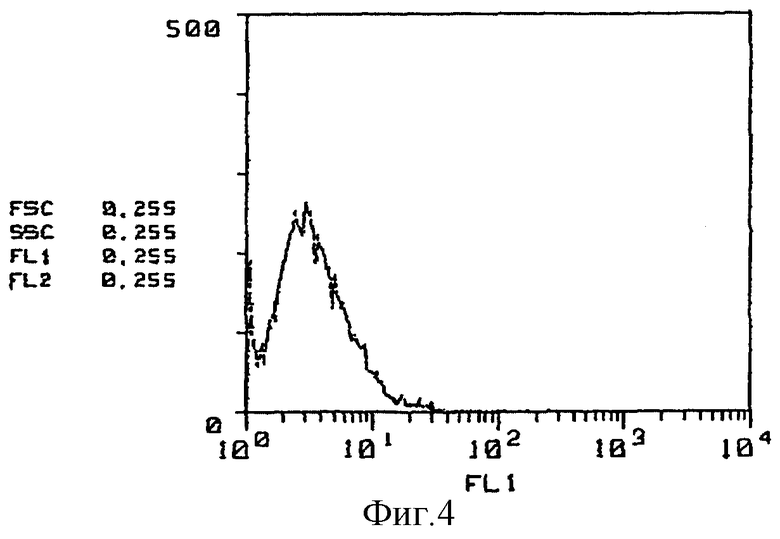
На фиг. 4 приведены результаты иммунофлюоресцентного анализа (контроль в отсутствие антитела, клетка костного мозга).
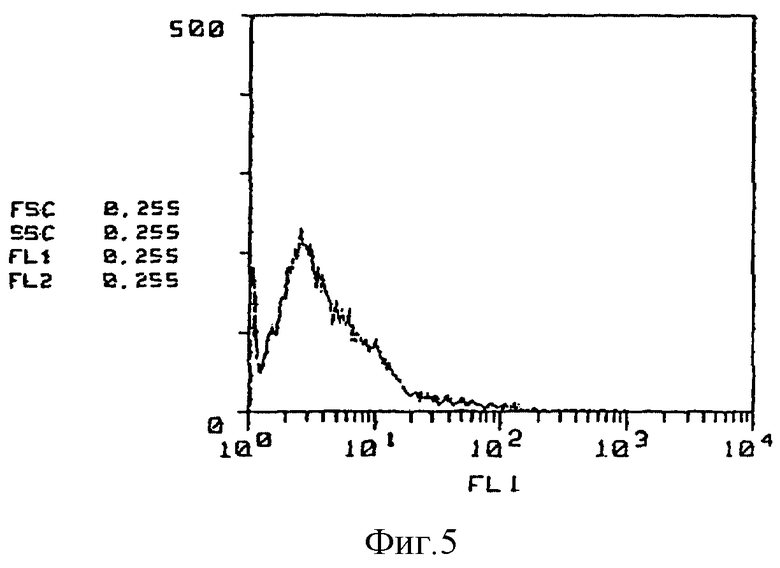
На фиг. 5 приведены результаты исследования способности к связыванию GSPST-1 антитела с клетками костного мозга на основе иммунофлюоресцентного анализа.
На фиг. 6 приведены результаты исследования способности к связыванию HMS-1 антитела с клетками костного мозга на основе иммунофлюоресцентного анализа.
На фиг. 7 проиллюстрирован метод количественного определения моноклональных антител (GSPST-1), ингибирующих трансплантацию костного мозга.
На фиг. 8 проиллюстрирован метод количественного определения моноклональных антител (HMS-1), ингибирующих трансплантацию костного мозга.
Далее следует подробное описание настоящего изобретения в соответствии со ссылочной процедурой и Примером, неограничивающим объем настоящего изобретения.
Ссылочная Процедура
Создание линии стромальных клеток селезенки и ее характеристика
1) Создание линии стромальных клеток селезенки
Линию стромальных клеток селезенки, обладающих способностью поддерживать гемопоэтические стволовые клетки, создают на основе первичной культуры клеток селезенки мыши C57BL/6J, которой вводили рГ-КСФ в дозе 100 мкг/кг в течение 5 дней.
Процедура заключалась в следующем: после завершения введения рГ-КСФ в асептических условиях из животного удаляют селезенку, культивируют ее в инкубаторе при температуре 37oC в условиях 5% содержания CO2 в течение 6 недель в пластиковой колбе с площадью основания 25 см2 /Корнинг, Ко. (Corning Co. )/, используя среду Дульбекко в модификации Искова (IMDM) /Берингер-Маннгейм, Ко. (Boehringer-Mannheim Co.)/, в которую внесены инактивированная нагреванием 10% фетальная телячья сыворотка /ФТС (F BS)/ /Санко Юниако, Токио (Sanko Junyaku, Tokyo)/, 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина, при этом указанную среду заменяют свежей ростовой средой два раза в неделю.
В конфлюентной культуре популяции слипшихся клеток (стромальных клеток) отбирают из колбы с применением ФБР, не содержащего Ca и Mg, в который внесены 0,05% трипсина и 0,02% ЭДТА (Сигма Кемикал, Ко.), и переносят в новые колбы. Такую процедуру повторяют один или два раза в неделю. Сначала (первые десять раз) коэффициент расщепления клеток составляет от 1/4 до 1/8, впоследствии он снижается до величин в диапазоне от 1/16 до 1/32. Приблизительно после 10-го переноса стромальные клетки становятся гомогенными и фибробластоидными.
К 20-му разу проведения вышеуказанной процедуры стромальные клетки отбирают указанным выше способом и направляют на клеточное клонирование с использованием техники ограниченных разведений; клеточное клонирование повторяют дважды с установлением линии стромальных клеток (клеточная линия CF-1).
Далее эти клетки поддерживают в колбе с площадью основания 25 см2 (Корнинг Ко. ) в 5 мл среды IMDM с добавлением 10% инактивированной нагреванием ФТС и проводят субкультивирование каждые пять дней при коэффициенте расщепления 1/32. Линии стромальных клеток селезенки могут быть созданы не только на основе мыши, но и из других животных; так, например, с использованием вышеописанного способа могут быть получены стромальные клеточные линии человека посредством трансформации клеток аденовирусным вектором SV-40 (J.Cell. Physiol., 148, 245, 1991).
2) Характеристика CF-1 клеток
CF-1 клетки, установленные описанным выше способом в виде стабильной клеточной линии, исследовали с применением стандартной цитохимической технологии на содержание щелочной фосфатазы, кислой фосфатазы, β-глюкуронидазы, α-нафтил-ацетат-эстеразы и ойл ред О. При изучении CF-1 клеток методами иммуноферментной гистохимии использовали следующие моноклональные и поликлональные антитела: mac1 /Серо Тек. (Sero Tec.)/; антиген, связанный с фактором VIII /Дакопаттс (Dacopatts)/; коллаген типа I, коллаген типа III и фибронектин /Кемикон Интернэшнл Инк. (Chemicon International Inc.)/. Фагоцитоз исследовали по поглощению латексных гранул (размер частиц 1,09 мкм; Сигма), а способность CF-1 клеток превращаться в адипоциты определяли при воздействии гидрокортизона фосфата (Сигма) в дозе 10-6 моль/л в течение 4 недель на конфлюентную культуру, находящуюся в колбе с площадью основания 25 см2.
В результате проведенных исследований было показано, что CF-1 клетки не содержат щелочной фосфотазы, антигена, связанного с фактором VIII, mac 1, кроме того, при исследовании фагоцитоза были получены отрицательные результаты, тогда как положительные данные были показаны при тестировании их на наличие коллагена типа I, коллагена типа III и фибронектина. CF-1 клетки не демонстрировали трансформации в адипоциты в течение 4 недель в конфлюентной культуре при наличии гидрокортизона в дозе 10-6 моль/л, хотя CF-1 клетки содержат, как было показано, следы липида. На основании этих результатов был сделан вывод о том, что CF-1 клетки не обладают свойствами преадипоцитов, макрофагов и эндотелиальных клеток, и в этой связи очевидно их происхождение из других клеток, а именно из стромальных клеток.
3) Поддержание гемопоэтических стволовых клеток клетками CF-1
Для того чтобы определить, способны ли CF-1 клетки поддерживать рост гемопоэтических стволовых клеток, с помощью техники Тилля и Макаллоха (Till and McCulloch) было проведено тестирование на образование KOE-C (тест на колониеобразующую способность селезеночных клеток). В ходе тестирования группу из 10 мышей облучали дозой в 900 cGy (MBR-1520R; Хитачи, Токио), после чего животным инъецировали внутривенно моноядерные клетки костного мозга (ВМ клетки) (1,0 • 105/организм, 5,0 • 104/организм или 2,5 • 104/организм) и CF-1 клетки (1,0 • 105/организм), а на 12-й день в селезенке подсчитывали количество образовавшихся колоний в виде KOE-C клонов (селезеночные колонии).
Было показано, что при трансплантации в организм облученных мышей моноядерных клеток костного мозга (ВМ клеток) и CF-1 клеток количество колоний каждой группы ВМ клеток значительно возрастает (от 1,4 до 1,8 раз) в сравнении с мышами, которым не вводили CF-1 клетки, при этом происходит также снижение уровня смертности, поскольку на 12-й день после трансплантации коэффициент выживания мышей с трансплантированными ВМ клетками и CF-1 клетками был выше, чем в случае мышей, несущих в качестве трансплантированных только ВМ клетки; эти результаты демонстрируют очевидную способность CF-1 клеток поддерживать рост гемопоэтических стволовых клеток.
Оптимальный способ реализации изобретения
Ниже приводится подробное описание такого варианта настоящего изобретения.
Пример
Получение моноклональных антител
1) Антигены и иммунизация
Иммунизацию проводят с применением в качестве антигенов CF-1 клеток, полученных по вышеприведенной стандартной процедуре. Клетки культивируют в инкубаторе при температуре 37oC и содержании 5% CO2 в среде Дульбекко в модификации Искова (IMDM среде) (Берингер-Маннгейм Ко.), содержащей 10% фетальную телячью сыворотку (ФТС; Санко Юниаку).
Клетки обрабатывают 1 мМ ЭДТА/ФБР и с помощью пипетки отбирают из культуральной колбы. Затем клетки суспендируют в 1 мМ ЭДТА/ФБР до концентрации клеток примерно 1 • 107/мл, после чего полученную суспензию вводят крысам Вистар Имамих (Wistar Imamich) /крысы 7-недельного возраста, самки, полученные из исследовательской лаборатории по разведению животных (Animal Breeding Research Laboratory)/. Один мл клеточной суспензии, содержащей около 1•107 клеток/мл, инъецируют в брюшную полость крысы в ходе первичной иммунизации, а через месяц вводят еще 1 мл клеточной суспензии, содержащей примерно 1 • 107 клеток/мл. Далее с интервалом в один месяц вводят еще несколько раз 1 мл клеточной суспензии, содержащей приблизительно 1 • 107 клеток/мл, а затем, после наблюдения реакции между антителом иммунизированной крысы и CF-1 клетками, вводят завершающую дозу иммунизации в 1 мл клеточной суспензии, содержащей около 1 • 108 клеток/мл. Спустя три дня после введения завершающей дозы крыс забивают и удаляют из них селезенки.
2) Слияние клеток
Селезенку после удаления из организма крысы измельчают, выделенные селезеночные клетки центрифугируют, суспендируют в IMDM среде (Берингер-Маннгейм Ко. ) и тщательно промывают. С другой стороны, клетки, полученные при культивировании миеломной клеточной линии мышей Sp2/O-Aql4 (Nature, 276, 269-270, 1978) и находящиеся в среде IMDM (Берингер-Маннгейм Ко.) с добавлением 10% фетальной телячьей сыворотки (ФТС; Санко Юниаку), также промывают в вышеприведенной IMDM среде, после чего из них отбирают 1 • 108 клеток, а из описанных ранее селезеночных клеток отбирают соответственно 2 • 108 клеток и помещают обе аликвоты в центрифужную пробирку для осуществления по традиционной методике процесса слияния клеток под влиянием полиэтиленгликоля 4000 /Нагараи Кадаку (Nagarai Kadaku)/ (Clin. Exp. Immunol., 42, 458-462, 1980).
Далее полученные слитые клетки распределяют по 96-гнездному планшету в IMDM среде, содержащей 20% ФТС, и культивируют при температуре 37oC и содержании 5% CO2. На следующий день их осторожно переносят на селективную ГАТ среду, продолжая на ней культивирование.
С момента начала культивирования два раза в неделю заменяют супернатанты на свежую ГАТ среду с целью продолжения роста культуры и поддержания пролиферации клеток.
После этого полученные после слияния гибридные клетки клонируют по традиционной методике с использованием способа ограниченных разведений. А именно: в соответствии с указанной традиционной методикой с применением способа ограниченных разведений клонируются только те клоны, которые обладают выраженными способностями к связыванию, при этом отслеживают их связывающую способность с антигенами, которые соединяются с антителами, находящимися в супернатантах таких гибридных клеток.
3) Скрининг
Скрининг слитых клеток (гибридом) проводят на основе опосредованной флюоресценции антител с использования проточной цитометрии.
Скрининг клонов, продуцирующих целевые антитела, осуществляют с помощью CF-1 клеток в качестве клеток-мишеней. При этом клетки, суспендированные в реакционном буфере (ФБР с добавлением 2% ФТС и 0,02% NaN3), центрифугируют, а осадок вновь суспендируют в 100 мкл культурального супернатанта от выращивания гибридом (примерно 1 • 106 клеток/100 мкл) и проводят реакцию при температуре 4oC в течение 1 часа. После этого клетки промывают еще раз вышеописанным буфером, добавляют меченное флуоресцином козлиное антитело к IqG крысы (FC) (Кемикон) и проводят инкубацию в течение 1 часа.
По окончании еще одной стадии промывания клетки анализируют методом проточной цитометрии (ФАКСкан, Бектон Диккенсон (FACScan Becton Dickinson)/.
4) Очистка антител
После скрининга по приведенному в 3) методу слитые клетки культивируют с использованием обычной методики, при этом образуемые антитела выделяют из супернатантов с помощью традиционной процедуры и далее очищают.
В соответствии с этой процедурой гибридомы с высокими титрами антител к антигенам отбирают из ячеек, распределяют в культуре ткани на пластиковой чашке Петри (Корнинг Ко.), культивируют с целью пролиферации при температуре 37oC и содержании 5% CO2 и затем очищают по обычной методике для получения моноклональных антител GSPST-1 и HMS-1.
Для выделения GSPST-1 и HMS-1 антител полученные клетки инъецируют в брюшную полость лишенных волосяного покрова ньюд мышей (nude) BALB/cAJc1-nu /мыши самцы, 8-недельного возраста, Ниппон Курса (Nippon Kurea)/, а возникший асцит вскрывают через 10-14 дней, высаливают с применением 33% сульфата аммония и диализуют против ФБР.
Далее, как было описано в Примере, CF-1 клетки используют в качестве антигенов для проведения иммунизации, однако возможно с применением того же способа получение моноклональных антител в случае использования других стромальных клеток селезенки, которые включают стромальные клеточные линии гемопоэтической ткани, полученной из стромальных клеток селезенки человека, так что настоящее изобретение не ограничивается вышеприведенными моноклональными антителами, но включает также все приготовленные таким же способом моноклональные антитела, имеющие такие же характеристики, а также все гибридомы, продуцирующие моноклональные антитела.
Гибридома, продуцирующая моноклональное антитело HMS-1 настоящего изобретения, представляет собой новую гибридную клетку, полученную путем слияния селезеночной клетки из крысы Вистар Имамих и миеломной клетки из клеточной линии мышей Sp2/0-Agl4, которая была депонирована 9 августа 1993 г. под названием HMS-1 (гибридома из материала крысы и мыши) под депозитным номером FPRM ВР-4383 в Национальном Институте Биологических Наук и Технологии Исследования Человека Агентства Промышленной Науки и Технологии в Японии (адрес: 1-3, Хигаши 1-хом, Тсукубаши, Ибараки 305, Япония) /National Institute of Bioscience and Human Technology, Agency of Industrial Science and Technology in Japan (1-3, Higashi 1-chome, Tsukuba-shi, Ibaraki 305, Japan) международного депозитарного управления, действующего на основе Будапештского Договора по международной классификации депозитов микроорганизмов с целью их патентования.
5) Свойства антител
(i) Реакционная способность антител
(Реактивность относительно CF-1 клетки) Результаты исследования с применением иммунофлюоресцентного анализа реакционной способности моноклональных антител GSPST-1 и HMS-1 относительно CF-1 клеток показаны на фиг. 1 - 3. Так, на фиг. 1 приведены данные по изучению контроля в отсутствие антитела, на фиг. 2 представлены результаты исследования способности GSPST-1 к связыванию с CF-1 клетками, а на фиг. 3 - результаты анализа связывающей способности HMS-1 также с CF-1 клетками. На фиг. 1-3 вертикальные оси показывают относительное количество клеток, тогда как на горизонтальных осях приведены данные по интенсивности флюоресценции.
Как следует из фиг. 1 - 3, моноклональные антитела GSPST-1 и HMS-1 характеризуются способностью как к связыванию с CF-1 клетками, так и к распознаванию поверхностных антигенов CF-1 клеток.
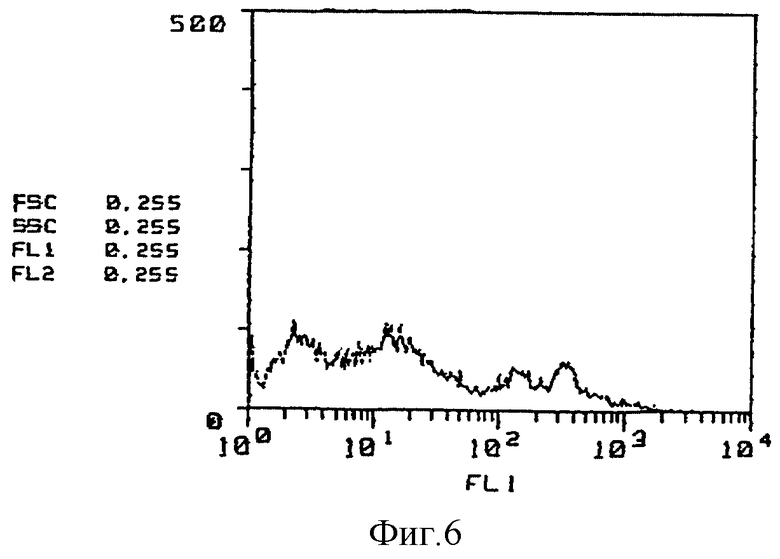
(Реактивность относительно клеток костного мозга) Далее на фиг. 4 - 6 представлены результаты исследования с применением метода проточной цитометрии /ФАКСкан, Бектон, Диккинсон (FACScan, Becton Dickinson)/ реакционной способности GSPST-1 и HMS-1 относительно клеток костного мозга. Так, на фиг. 4 приведены данные по изучению контроля в отсутствие антитела, на фиг. 5 представлены результаты исследования способности GSPST-1 к связыванию с клетками костного мозга, а на фиг. 6 - результаты анализа связывающей способности HMS-1 также с клетками костного мозга. На фиг. 4-6 вертикальные оси показывают относительное количество клеток, тогда как на горизонтальных осях приведены данные по интенсивности флюоресценции.
Как следует из фиг. 4-6, у GSPST-1 полностью отсутствует способность к связыванию с клетками костного мозга, тогда как для HMS-1 характерна способность к связыванию с некоторыми клетками костного мозга.
(ii) Типирование антител
Далее в результате типирования подкласса IgG полученных моноклональных антител /с использованием набора Моно АБИД-Сп (Зимед) (Mono AbID-Sp, Zymed) и меченного биотином мышиного антитела к lgGl крысы (Зимед)/ было показано, что GSPST-1 представляет собой IgG2a, a HMS-1 является IgG2b.
(iii) Способность ингибировать трансплантацию костного мозга
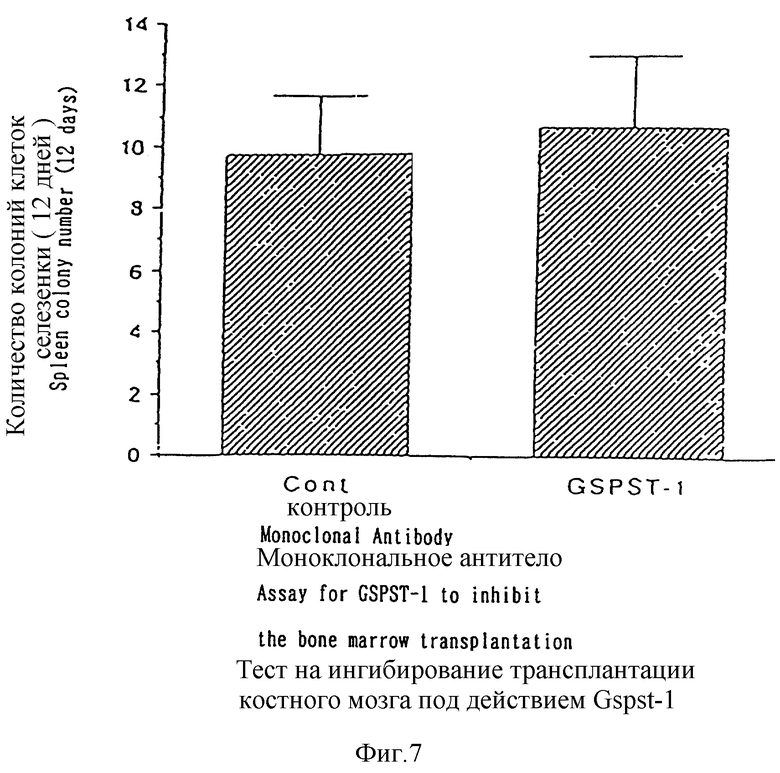
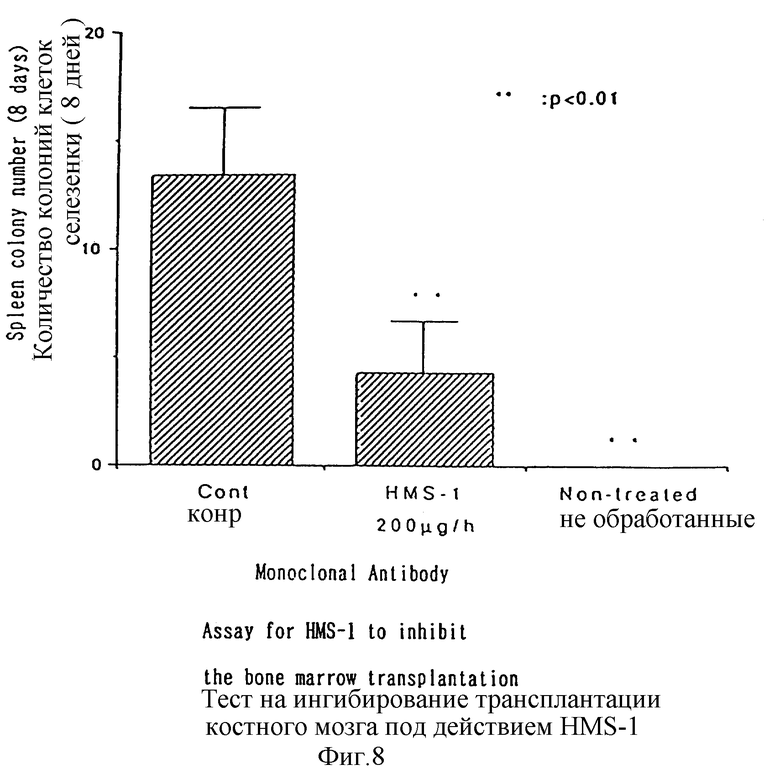
С целью дальнейшего изучения антитела настоящего изобретения были использованы в экспериментах по ингибированию трансплантации костного мозга. На фиг. 7 и 8 представлены результаты, полученные при этом. Как следует из данных, приведенных на фиг. 7 и 8, HMS-1 демонстрирует ингибирующий трансплантацию костного мозга эффект, тогда как GSPST-1 такое действие несвойственно. Указанные результаты получены при введении через хвостовые вены облученным летальной дозой радиации (900 cGy) мышам C57BL/6J клеток костного мозга в количестве 1,0 • 105 в расчете на одно животное и моноклональных антител с последующим подсчетом числа клеточных колоний в селезенке. Вариант "Не обработанные" на фиг. 8 относится к случаю, при котором клетки костного мозга не вводятся в исследуемое животное. В соответствии с этим, поскольку моноклональное антитело HMS-1 настоящего изобретения ингибирует трансплантацию костного мозга, очевидно, что упомянутое антитело ингибирует также хоминг гемопоэтических стволовых клеток и образование KOE-C колоний.
В данном случае каждому специалисту, обладающему средним уровнем знаний в данной области, должно быть очевидно, что ингибирующее действие моноклонального антитела в отношении трансплантации костного мозга соответствует тем активностям, которые направлены на ингибирование хоминга гемопоэтических стволовых клеток и образования KOE-C колоний. Так, например, имеется сообщение о том, что моноклональное антитело (АСК-2 антитело, входящее в состав C-набора антител), полученное с использованием в качестве антигена известных в технике тучных клеток, способно, аналогично моноклональным антителам настоящего изобретения, ингибировать трансплантацию костного мозга у мышей (Blood, 78, 1706, 1991). В указанном сообщении, на основании результатов эксперимента по ингибированию трансплантации костного мозга, был сделан вывод о том, что упомянутое антитело ингибирует хоминг гемопоэтических стволовых клеток и образование KOE-C колоний.
Вышеупомянутое известное в технике антитело АСК-2 получают с использованием в качестве антигена тучной клетки, при этом тучная клетка представляет собой дифференцированную пролиферирующую гемопоэтическую клетку, которая развилась из стволовой гемопоэтической клетки. С другой стороны, использованные в настоящем изобретении стромальные клетки гемопоэтической ткани являются не гемопоэтическими клетками, а клетками, поддерживающими дифференциацию и пролиферацию гемопоэтических клеток, и в этой связи оба вида клеток существенно отличаются друг от друга.
Далее при введении гибридомы, продуцирующей HMS-1, в брюшную полость ньюд мыши было показано, что упомянутая мышь не погибает от образовавшегося асцита. В этой связи есть основания полагать, что действие HMS-1 по ингибированию трансплантации костного мозга проистекает не благодаря так называемому апоптозу /это явление называют также саморазрушением клеток, при котором ДНК ядерного хроматина расщепляется в нуклеосоме (происходит образование так называемой "лэддер-последовательности"), приводя в итоге к гибели клеток/, но имеет отношение к феномену связывания моноклонального антитела с молекулой, необходимой для хоминга гемопоэтической стволовой клетки на гемопоэтической ткани. Исходя из этого, очевидно, что антиген, распознаваемый HMS-1, представляет собой вещество, важное для осуществления хоминга гемопоэтических стволовых клеток на гемопоэтической ткани.
Как было обнаружено в описанном выше эксперименте, моноклональное тело HMS-1 настоящего изобретения распознает поверхностный антиген стромальной клетки селезенки, которая обладает способностью поддерживать хоминг гемопоэтических стволовых клеток, а также характерным для нее свойством ингибировать хоминг гемопоэтических стволовых клеток.
Так, HMS-1 обладает способностью ингибировать хоминг клеток костного мозга на гемопоэтической ткани; имеется сообщение о том, что лейкозные клетки высвобождаются из костного мозга в связи со снижением уровня экспрессии адгезивных молекул VLA4 и VLA5 гемопоэтических клеток /экспрессия VLA молекулы может быть связана с процессом высвобождения из костного мозга миелоидных лейкозных клеток (Leuk Res., 16, 5, 469-474, 1992)/, при этом следует полагать, что VLA4 и VLA5 усиливают действие лекарственных средств, используемых для лечения лейкоза, за счет высвобождения лейкозных клеток из костного мозга. Аналогично, можно сделать вывод о том, что вышеупомянутое антитело HMS-1 также может использоваться для лечения лейкоза с достижением сходного эффекта.
Моноклональные антитела настоящего изобретения были подробно описаны выше, в разделе Примера; при этом, несмотря на то, что моноклональные антитела могут быть проиллюстрированы указанными выше примерами, настоящее изобретение ими не ограничивается, а включает все приготовленные таким же способом моноклональные антитела, обладающие теми же характеристиками и функциями, независимо от вида антигенов.
Промышленное применение
Поскольку моноклональные антитела настоящего изобретения способны распознавать как антиген вещество, необходимое для хоминга клеток костного мозга на гемопоэтической ткани, а также обладают характерным для них свойством ингибировать хоминг гемопоэтических стволовых клеток, они могут, на основе свойственной им функции усиливать действие антиракового средства, в частности, улучшать действие используемого для лечения лейкоза антиракового средства за счет высвобождения из костного мозга миелоидных лейкозных клеток, найти применение в медицине в качестве эффективного лекарственного препарата.
Изобретение относится к моноклональному антителу, обладающему способностью ингибировать хоминг гемопоэтических стволовых клеток и распознавать поверхностный антиген стромальной клетки, имеющей свойство поддерживать хоминг гемопоэтических стволовых клеток, а также к гибридоме, продуцирующей моноклональное антитело. Моноклональные антитела изобретения характеризуются способностью ингибировать хоминг гемопоэтических стволовых клеток и могут использоваться в качестве лекарственного средства, усиливающего действие антиракового средства, применяемого для лечения лейкоза. 3 с. и 1 з.п. ф-лы, 8 ил.
| US 4626507 A, 02.12.1986 | |||
| US 4361549, 30.11.1982 | |||
| US 4892828, 09.01.1990. |
Авторы
Даты
2000-12-10—Публикация
1994-09-02—Подача