Изобретение относится к новым моноклональным антителам, обладающим свойством индуцировать апоптоз ядросодержащих клеток крови с интегринассоциированным белком (IAP), а также к их фрагментам, пептидам и низкомолекулярным соединениям, и к гибридам, продуцирующим эти моноклональные антитела. Новые антитела применимы в качестве лекарственных средств при миелоидном лейкозе и лимфоидном лейкозе.
Предпосылки изобретения
Гранулоцитарные колониестимулирующие факторы, такие как рекомбинантный гранулоцитарный колониестимулирующий фактор (rG-CSF) известны на сегодняшнем уровне техники как гуморальные факторы, которые стимулируют дифференциацию и пролиферацию гранулоцитов. Сообщения, основанные на экспериментах in vivo на мышах, показывают, что введение rG-CSF приводит не только к ускоренному миелопоэзу в костном мозге, но также к заметному экстрамедуллярному гемопоэзу в селезенке и пролиферации в селезенке всех гемопоэтических клеток-предшественников, включая стволовые кроветворные клетки. Механизм такого эктрамедуллярного гемопоэза в селезенке, как полагают, заключается в том, что стимуляция посредством rG-CSF изменяет гемопоэтическое микроокружение селезенки и стимулирует гемопоэз, поддерживая его возможность, причем таким образом индуцируется гемопоэз.
Для того чтобы выяснить гемопоэтическую функцию в селезенке, авторы изобретения ранее сосредоточили внимание на стромальных клетках селезенки после повторного введения rG-CSF. Авторы изобретения приложили много усилий для проверки того, каким образом гемопоэтическая функция стимулируется rG-CSF через стромальные клетки, и создали линию гемопоэтических стромальных клеток (клетки CF-1) из селезенки мыши посредством повторного введения rG-CSF. Авторы изобретения исследовали способность гемопоэтических стромальных клеток поддерживать гемопоэз и подтвердили колониестимулирующую активность in vitro и поддерживающую способность гемопоэтических стромальных клеток in vivo [Blood, 80, 1914 (1992)].
Однако, тогда как создана одна клеточная линия стромальных клеток селезенки (клетки CF-1) и исследованы ее цитологические свойства, специфические антитела, распознающие поверхностные антигены этих клеток, никогда не получали, и их характеристики пока совсем не выяснены.
Описание изобретения
Учитывая изложенные выше обстоятельства, касающиеся стромальных клеток селезенки, и результаты предшествующих исследований, авторы настоящего изобретения провели дополнительные интенсивные исследования, направленные на разработку специфических антител, которые могут узнавать стромальные клетки селезенки, приложили усилия для получения моноклональных антител с использованием вышеуказанной линии стромальных клеток селезенки в качестве сенсибилизирующего антигена и, наконец, добились успеха, получив новые моноклональные антитела.
Затем авторы изобретения исследовали свойства моноклональных антител, полученных, как указано выше, и обнаружили, что моноклональные антитела обладают свойством индуцировать апоптоз миелоидных клеток. Эти моноклональные антитела названы "антитело ВМАР-1", и это название будет применяться далее.
Авторы изобретения также проверили антиген, распознаваемый антителом ВМАР-1, и с помощью прямой экспрессии обнаружили, что он представляет собой мышиный интегринассоциированный белок (мышиный IAP) (GenBank, инвентарный номер Z25524).
Действие антител ВМАР-1 исследовали с использованием рекомбинантных клеток, в которые введен ген мышиного IAP. A именно, ген мышиного IAP обычным способом вводили в мышиные клетки Jurkat, которые не экспрессировали мышиный IAP, чтобы создать клеточную линию, экспрессирующую мышиный IAP (peкомбинантные клетки Jurkat), и действие антитела ВМАР-1 на экспрессирующие мышиный IAP клетки исследовали с помощью МТS-анализа и фрагментации ДНК посредством применения проточной цитометрии (заявка на патент Японии HEI 9-67499).
Ожидалось, на основании этих поисков, что моноклональные антитела к антигену интегринассоциированного белка человека (называемого здесь далее IAP человека; аминокислотная последовательность и последовательность оснований описаны в J. Cell Biol., 123, 485-496, 1993; см. также Journal of Cell Science, 108, 3419-3425, 1995) должны иметь эффект индуцирования апоптоза ядросодержащих клеток крови, которые экспрессируют этот антиген (миелоидные клетки и лимфоциты), и авторы настоящего изобретения приложили усилия для получения моноклональных антител к антигену интегринассоциированного белка человека и добились успеха, получив моноклональные антитела, индуцирующие апоптоз ядросодержащих клеток крови человека, экспрессирующих этот антиген.
Иными словами, объектом данного изобретения являются новые моноклональные антитела, обладающие свойством индуцировать апоптоз ядросодержащих клеток крови (миелоидных клеток и лимфоцитов) с интегринассоциированным белком человека (IАP человека), и их фрагменты, а также гибридомы, продуцирующие указанные моноклональные антитела.
Эти новые моноклональные антитела применимы в качестве лекарственных средств при миелоидном лейкозе и лимфоидном лейкозе.
Описанные функции интегринассоциированного белка состоят в связывании с β-цепью интегрина αVβ3 для поддержания связывания между αVβ3 и его лигандом витронектином (J. Cell. Biol., 123, 485-496 (1993)), что индуцирует приток Са2+ в эндотелий сосудов после прилипания нейтрофилов к эндотелию сосудов (J. Biol. Chem., 268, 19931-19934 (1993)), и что поддерживает миграцию нейтрофилов через сосудистый эндотелий (Proc. Natl. Acad. Sci. USA, 92, 3978-3982 (1995)), но нет сообщений о его функции, относящейся к апоптозу ядросодержащих клеток крови.
Моноклональные антитела изобретения являются антителами, которые специфически распознают интегринассоциированный белок человека. Поэтому они демонстрируют функцию различения и идентификации интегринассоциированного белка человека.
Кроме того, моноклональные антитела изобретения являются антителами, которые демонстрируют свойство индуцирования апоптоза ядросодержащих клеток крови (миелоидных клеток и лимфоцитов) с интегринассоциированным белком человека. Апоптоз представляет собой явление, при котором ДНК ядерного хроматина расщепляется на нуклеосомные единицы (что известно как "образование лэддера"), результатом чего является гибель клетки, и которое также называют "самоубийством" клетки.
Известные до сих пор моноклональные антитела, обладающие свойством индуцировать апоптоз ядросодержащих клеток крови (миелоидных клеток и лимфоцитов), включают антитело против Fas (Cell, 66; 233-243, 1991), антитело против CD43 (Blood, 86, 502-511, 1995) и антитело против домена HLA класса Iα1 (Blood, 90, 726-735, 1997), но свойство индуцировать апоптоз ядросодержащих клеток с помощью антител данного изобретения, распознающих интегринассоциированный белок, никогда не было известно. Моноклональные антитела изобретения, таким образом, определяются как включающие любое моноклональное антитело, способное специфически узнавать интегринассоциированный белок и обладающее свойством индуцировать апоптоз ядросодержащих клеток крови (миелоидных клеток и лимфоцитов) с интегринассоциированным белком.
Антитела изобретения не ограничиваются только антителами, индуцирующими апоптоз всех ядро со держащих клеток крови. К ним также относятся антитела, индуцирующие апоптоз по меньшей мере одного типа ядросодержащих клеток крови. А именно, достаточно, в случае миелоидного лейкоза, чтобы происходила индукция апоптоза по меньшей мере миелоидных клеток.
Конкретнее, данное изобретение относится к моноклональным антителам, индуцирующим апоптоз ядросодержащих клеток крови, содержащих интегринассоциированный белок (IАP).
Изобретение также относится к фрагментам, пептидам и низкомолекулярным соединениям моноклональных антител, индуцирующим апоптоз ядросодержащих клеток крови, содержащих интегринассоциированный белок (IАР).
Изобретение также относится еще и к гибридомам, продуцирующим эти моноклональные антитела.
Изобретение также относится еще к противолейкозному средству, содержащему вещество, которое связывается с IАP и промотирует действие IАP для индуцирования апоптоза ядросодержащих клеток крови.
Изобретение также еще относится к противолейкозному средству, отличающемуся тем, что указанное вещество представляет собой моноклональное антитело.
Изобретение также относится еще к противолейкозному средству, отличающемуся тем, что указанное вещество представляет собой фрагмент, пептид или низкомолекулярное соединение моноклональных антител.
Краткое описание чертежей
Фиг. 1 представляет собой картину электрофореза, показывающую полосу для IАР человека, амплифицированного посредством PCR с использованием кДНК, полученной из мРНК клеточной линии HL-60. Слева показан маркер молекулярной массы (М), затем IAP человека (1) и β-актин (2).
Фиг.2 представляет собой график, показывающий уровень экспрессии IAP человека клетками L1210, которые экспрессировали IAP человека, с использованием антитела против CD47. Пик представляет клетки L1210, трансфицированных только геном pCOS1 как контроль.
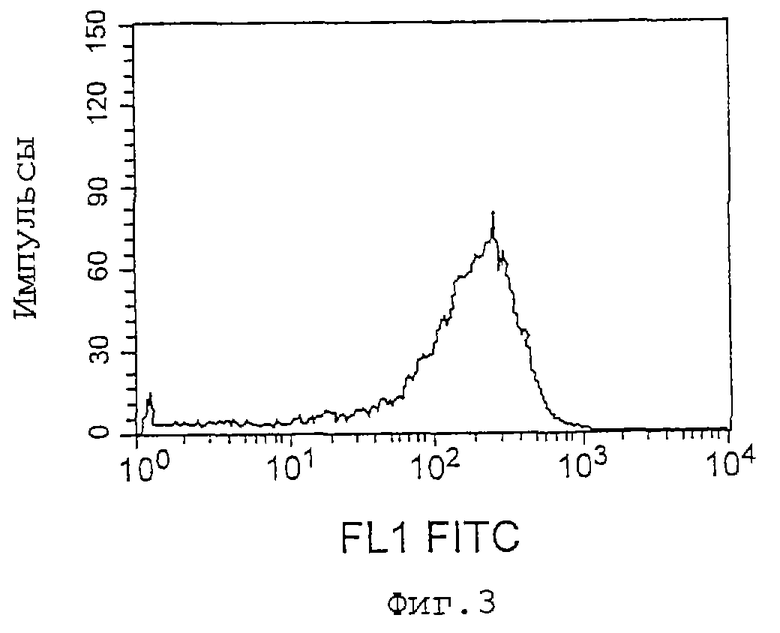
Фиг. 3 представляет собой другой график, показывающий уровень экспрессии IАР человека клетками L1210, которые экспрессировали IAP человека, с использованием антитела против CD47. Пик показывает, что экспрессия IАР человека определенно возрастает в клетках L1210, трансфицированных геном IAP человека.
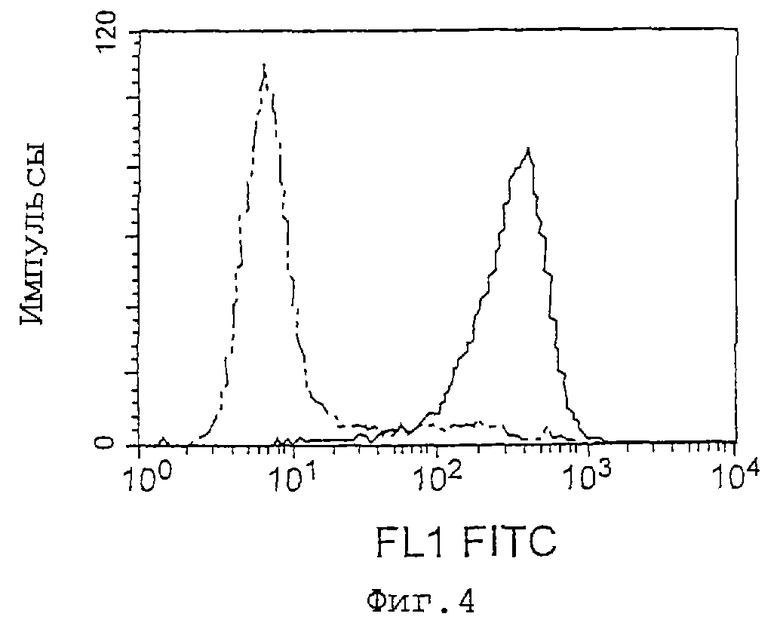
Фиг. 4 представляет собой график, показывающий титры антител у иммунизированных мышей. Левый пик представляет интактные клетки L1210. Правый пик представляет клетки L1210, трансфицированные геном IAP человека, что показывает, что сыворотка мыши, подвергнутая слиянию клеток, четко узнает IAP человека.
Фиг.5 представляет собой диаграмму, показывающую результаты эксперимента по ингибированию роста клеток (клетки Jurkat) с использованием супернатанта гибридомной культуры.
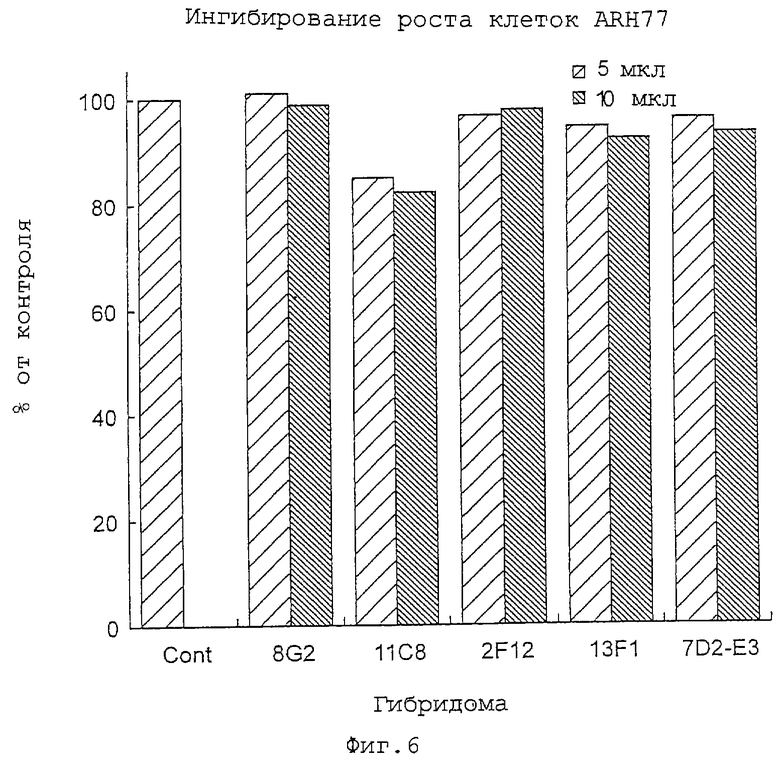
Фиг.6 представляет собой диаграмму, показывающую результаты эксперимента по ингибированию роста клеток (клетки ARH77) с использованием супернатанта гибридомной культуры.
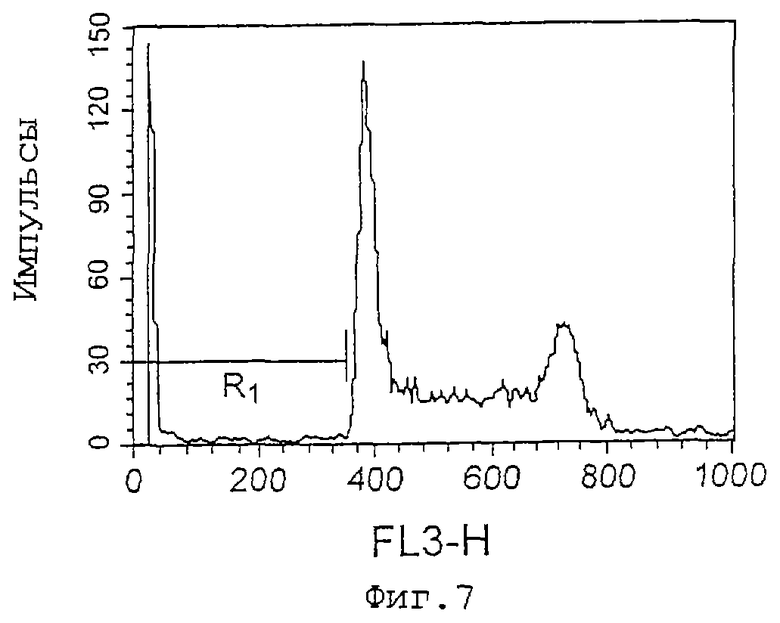
Фиг.7 представляет собой график, показывающий эффект индуцирования апоптоза клеток Jurkat культуральным супернатантом (при анализе методом окрашивания PI), который является результатом в случае использования в качестве контроля культурального супернатанта 8G2. R1 показывает процент (%) апоптоза, который равен 7,43%.
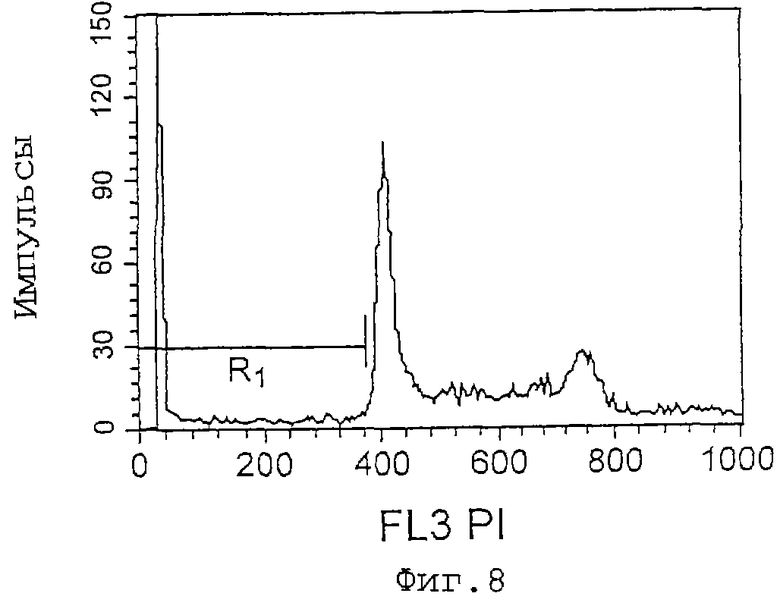
Фиг.8 представляет собой график, показывающий эффект индуцирования апоптоза клеток Jurkat культуральным супернатантом (при анализе методом окрашивания PI), который является результатом в случае 7D2-E3. R1 показывает процент (%) апоптоза, который равен 9,84%.
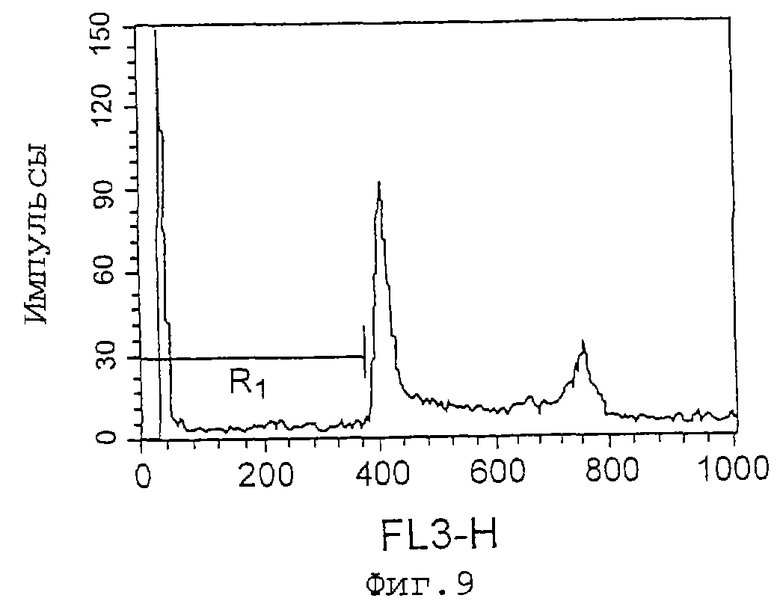
Фиг.9 представляет собой график, показывающий эффект индуцирования апоптоза клеток Jurkat культуральным супернатантом (при анализе методом окрашивания PI), который является результатом в случае 11С8. R1 показывает процент (%) апоптоза, который равен 15,32%.
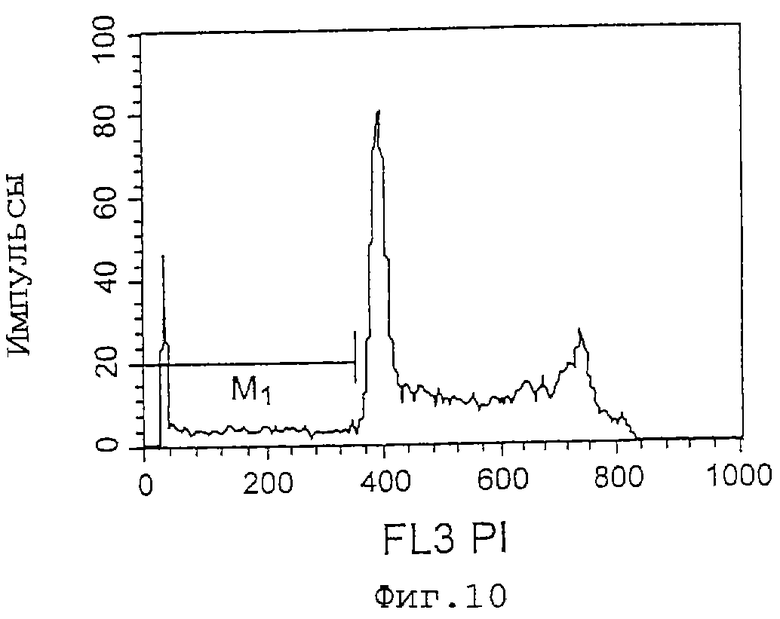
Фиг. 10 представляет собой график, показывающий эффект индуцирования апоптоза клеток HL-60 культуральным супернатантом (при анализе методом окрашивания PI), который является результатом в случае супернатанта культуры 8G2, используемой в качестве контроля. Ml показывает процент (%) апоптоза, который равен 6,94%.
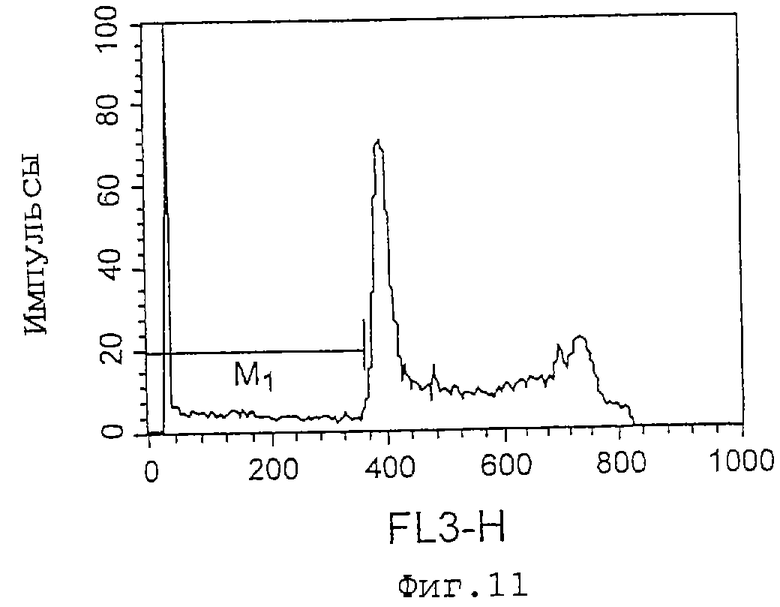
Фиг. 11 представляет собой график, показывающий эффект индуцирования апоптоза клеток HL-60 культуральным супернатантом (при анализе методом окрашивания PI), который является результатом в случае 11С8. Ml показывает процент (%) апоптоза, который равен 12,16%.
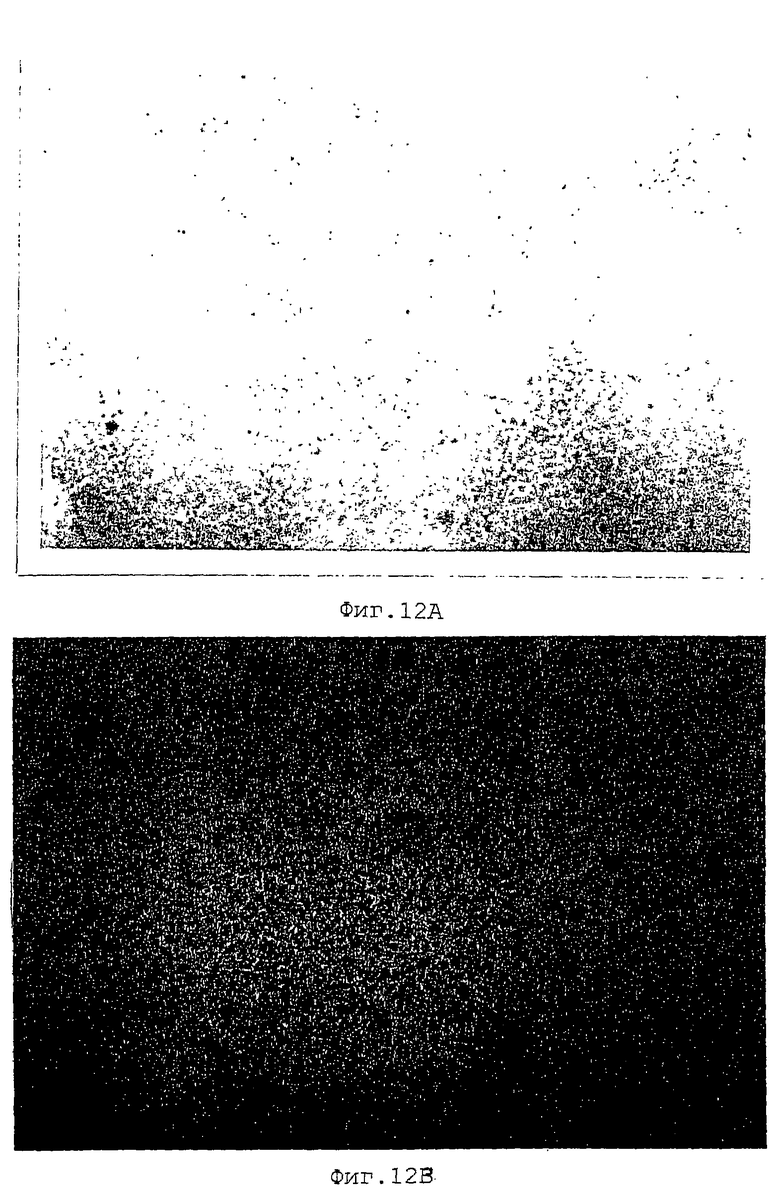
Фиг. 12А представляет собой однокрасочную микрофотографию, показывающую результат анализа на апоптоз (метод TUNEL) в системе сокультивирования клеток КМ-102 и HL-60 с использованием в качестве контроля супернатанта культуры 9С5. Апоптозные клетки окрашиваются в черный или коричневый цвет. Окрашивание ядер осуществляют метиловым зеленым, и увеличение составляет 100x.
Фиг.12В представляет собой цветную микрофотографию, показывающую результат анализа на апоптоз (метод TUNEL) в системе сокультивирования клеток КМ-102 и HL-60 с использованием в качестве контроля супернатанта культуры 9С5. Апоптозные клетки окрашиваются в черный или коричневый цвет. Окрашивание ядер осуществляют метиловым зеленым, и увеличение составляет 100x.
Фиг. 13А представляет собой однокрасочную микрофотографию, показывающую результат анализа на апоптоз (метод TUNEL) в системе сокультивирования клеток КМ-102 и HL-60 с использованием в качестве контроля супернатанта культуры 11С8. Видно больше TUNEL-положительных клеток, чем на фиг.12. Апоптозные клетки окрашиваются в черный или коричневый цвет. Окрашивание ядер осуществляют метиловым зеленым, и увеличение составляет 100x.
Фиг. 13В представляет собой цветную микрофотографию, показывающую результат анализа на апоптоз (метод TUNEL) в системе сокультивирования клеток КМ-102 и HL-60 с использованием в качестве контроля супернатанта культуры 11С8. Видно больше TUNEL-положительных клеток, чем на фиг.12. Апоптозные клетки окрашиваются в черный или коричневый цвет. Окрашивание ядер осуществляют метиловым зеленым, и увеличение составляет 100x.
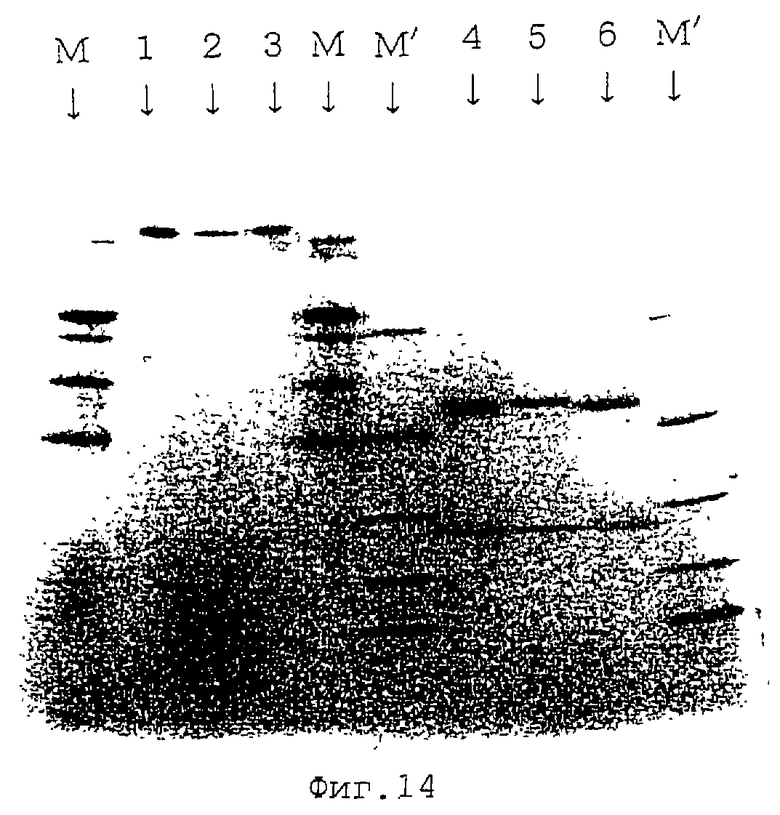
Фиг.14 представляет собой картину электрофореза, показывающую результаты анализа методом SDS-PAGE IgG, выделенного из гибридомных линий 7D-E3 и 11С8. Показаны маркеры молекулярной массы (М,М'), мышиный IgG (аутентичиный образец) в условиях отсутствия редукции (1), 7D2-E3 (2), 11С8 (3), мышиный IgG (аутентичиный образец) в условиях редукции (4), 7D2-E3 (5) и 11С8 (6).
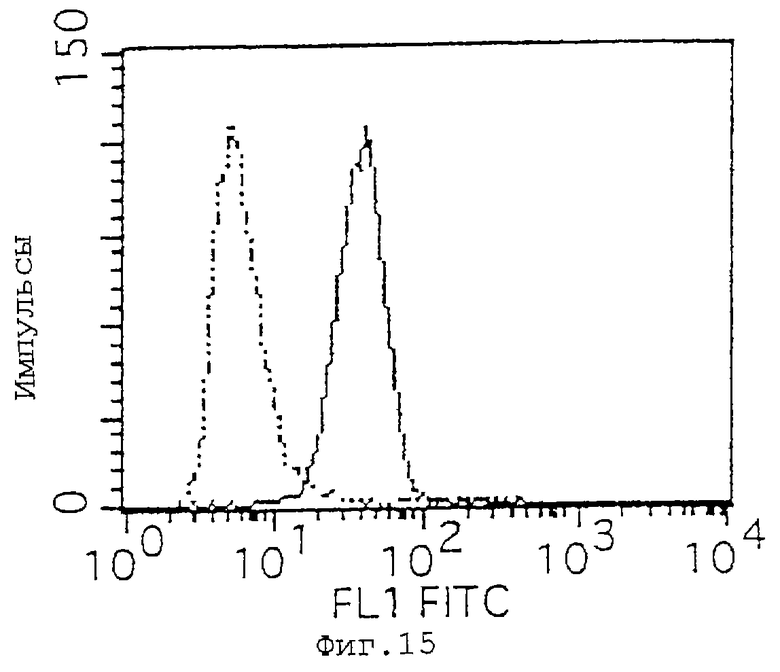
Фиг. 15 показывает результаты анализа экспрессии CD47 методом проточной цитометрии с использованием клеток HL-60.
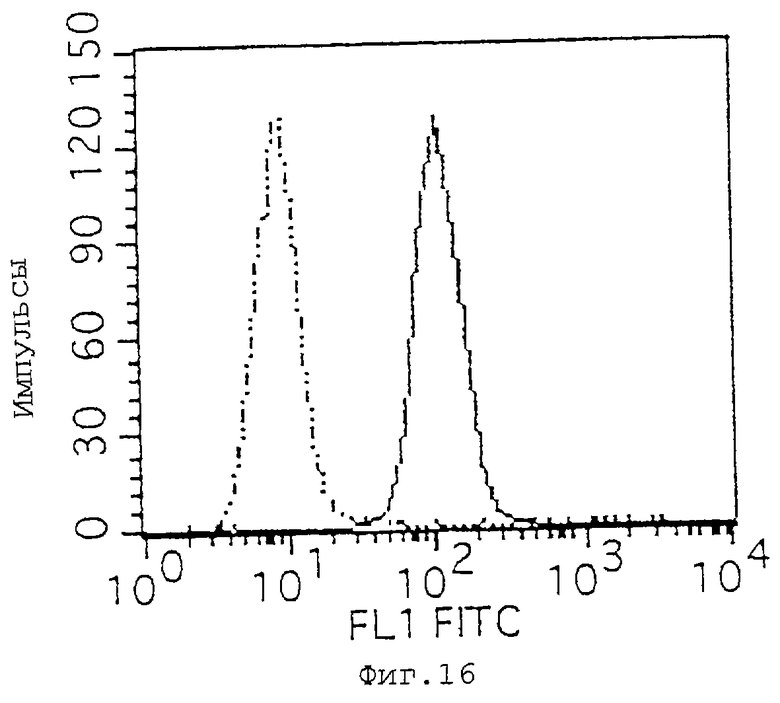
Фиг. 16 показывает результаты анализа экспрессии CD47 методом проточной цитометрии с использованием клеток Jurkat.
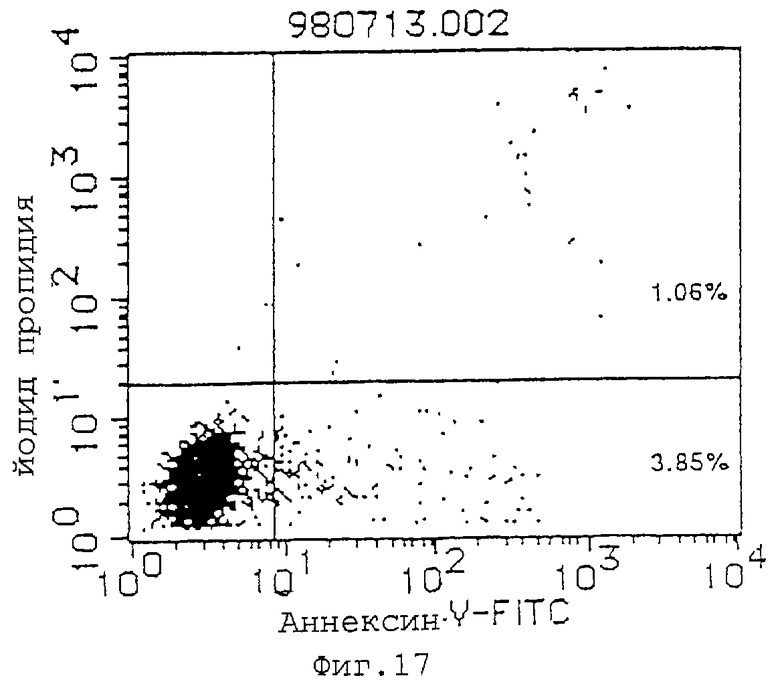
Фиг. 17 показывает результаты в случае mIgG (10 мкг/мл) в качестве контроля для демонстрации его действия индуцирования апоптоза клеток L1210, трансфицированных геном IАP человека (L1210-hIAP) (инкубация в течение 72 часов).
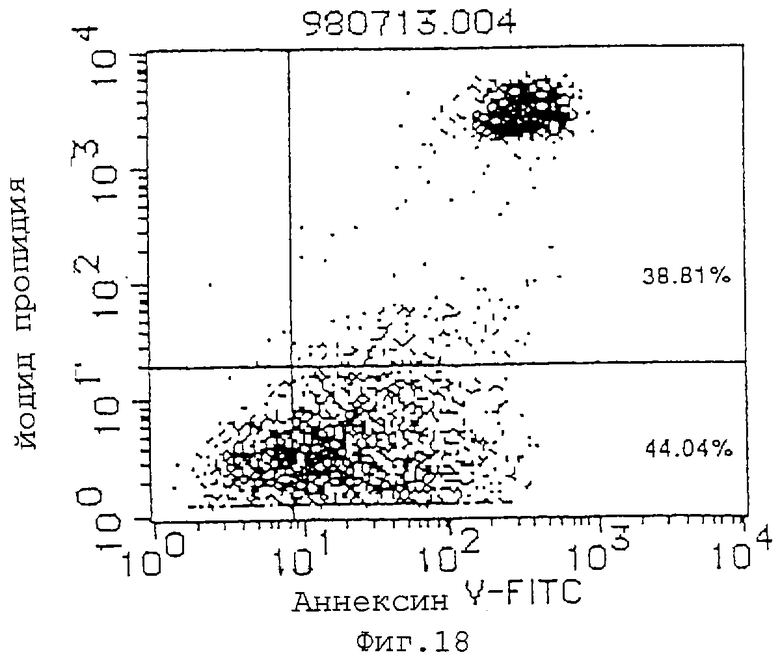
Фиг. 18 показывает индуцирующее апоптоз действие MABL-1 (10 мкг/мл) на клетки L1210, трансфицированные геном IAP человека (инкубация в течение 72 часов).
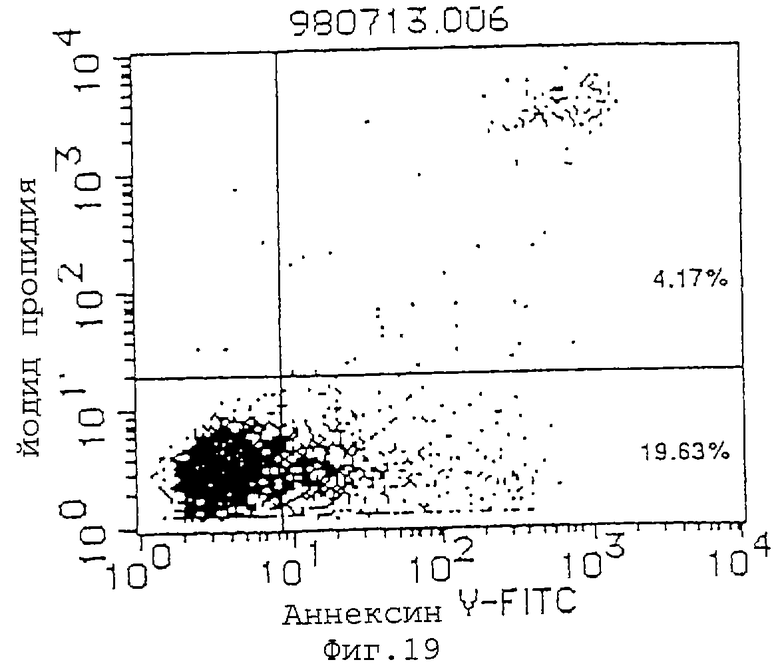
Фиг. 19 показывает индуцирующее апоптоз действие MABL-2 (10 мкг/мл) на клетки L1210, трансфицированные геном IАР человека (инкубация в течение 72 часов).
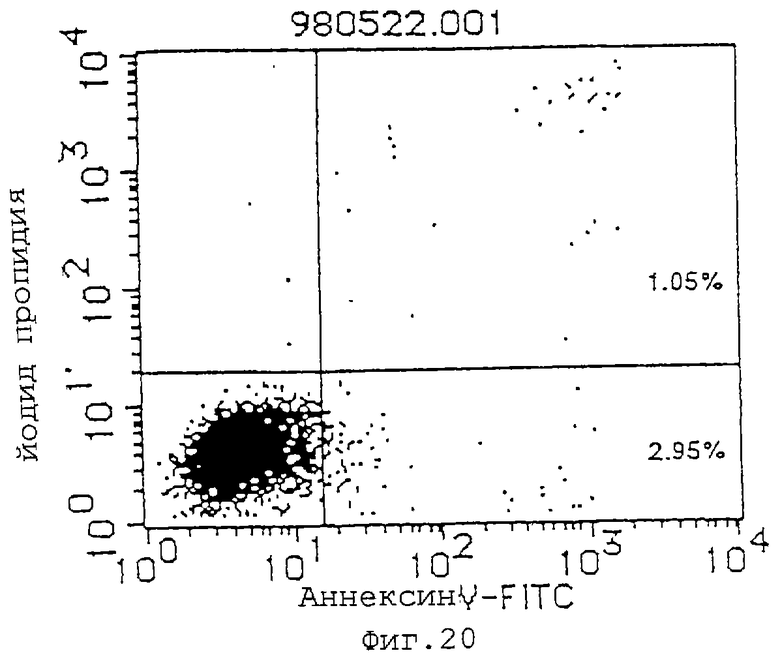
Фиг. 20 показывает результаты в случае mIgG (10 мкг/мл) в качестве контроля для демонстрации его действия индуцирования апоптоза клеток Jurkat (инкубация в течение 48 часов).
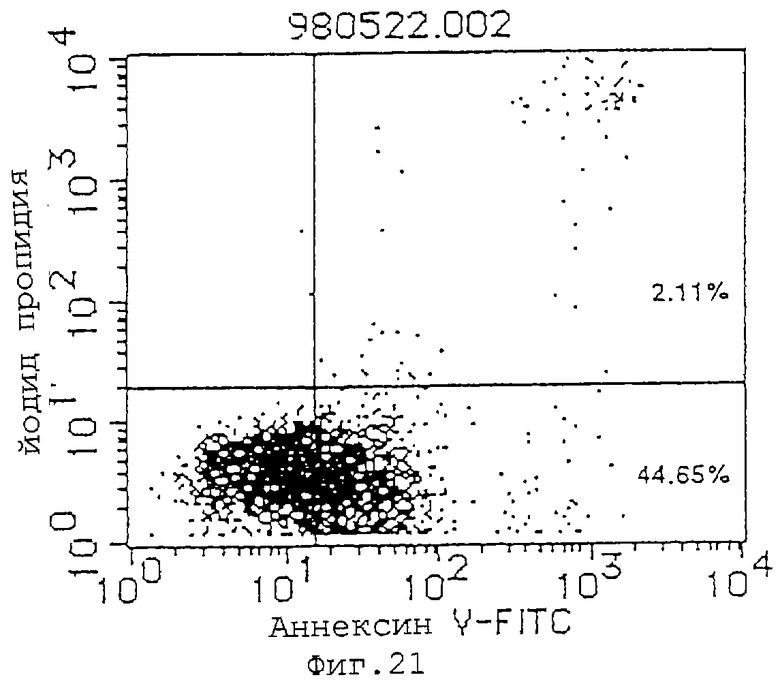
Фиг. 21 показывает индуцирующее апоптоз действие MABL-1 (10 мкг/мл) на клетки Jurkat (инкубация в течение 48 часов).
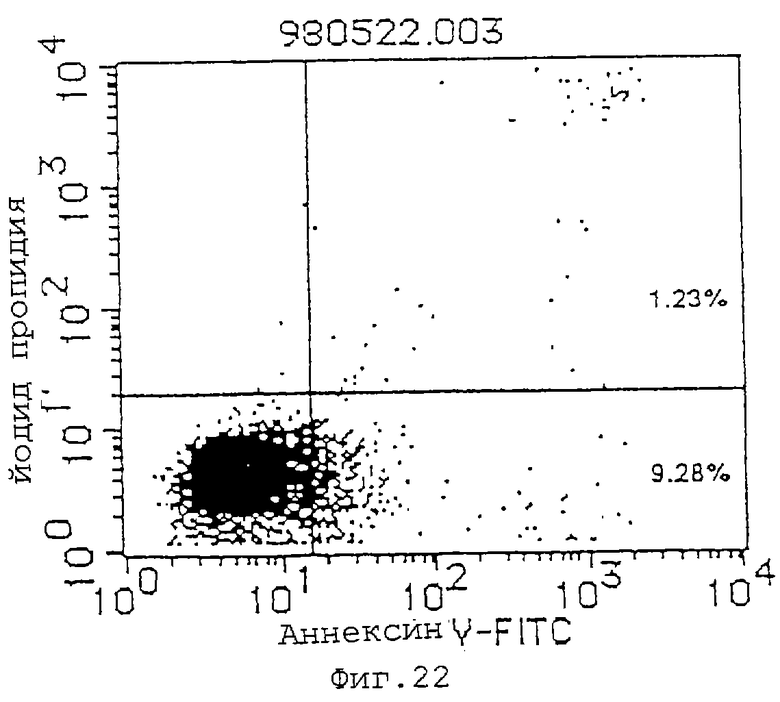
Фиг. 22 показывает индуцирующее апоптоз действие MABL-2 (10 мкг/мл) на клетки Jurkat (инкубация в течение 48 часов).
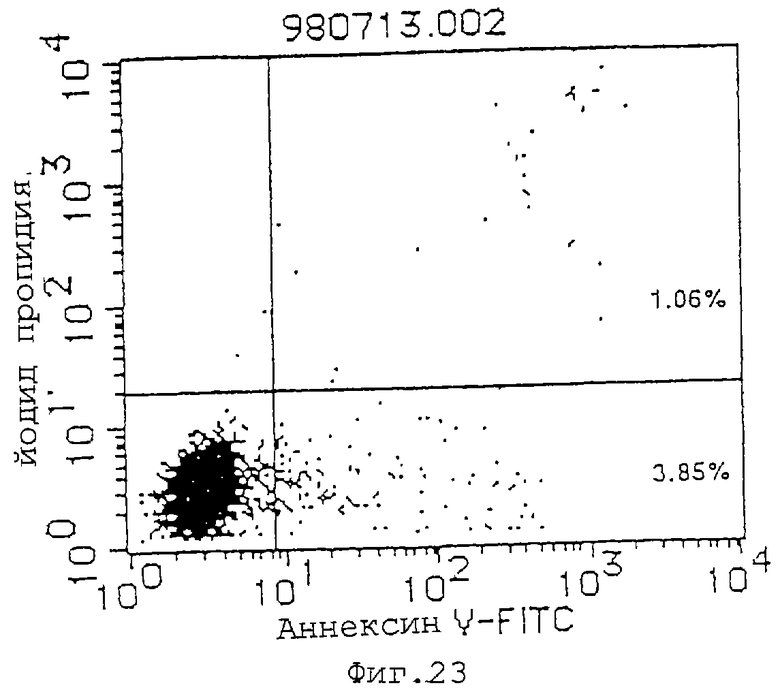
Фиг. 23 показывает результаты в случае mIgG (10 мкг/мл) в качестве контроля для демонстрации его действия индуцирования апоптоза клеток L1210, трансфицированных введенным в них геном IAP человека (L1210-hIAP) (инкубация в течение 72 часов).
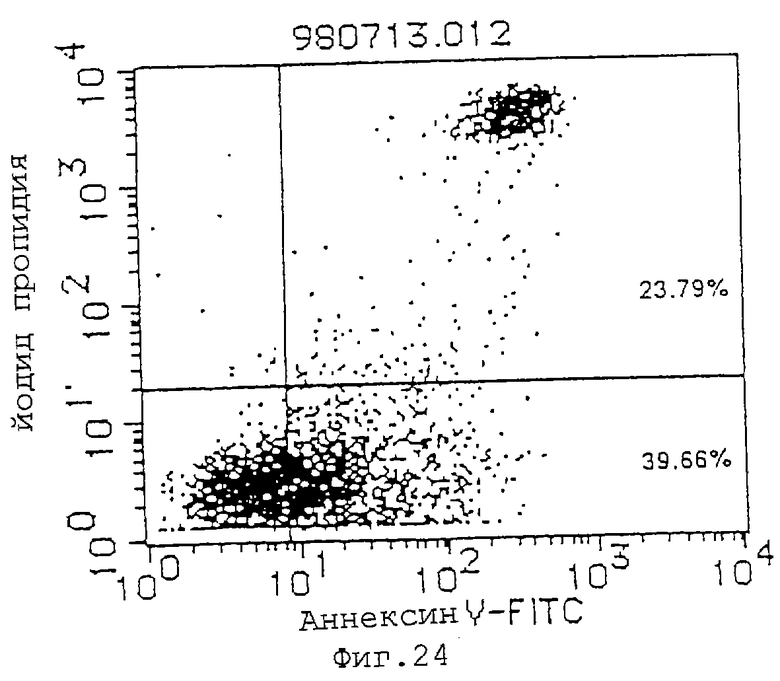
Фиг. 24 показывает индуцирующее апоптоз действие Fab-фрагментов MABL-2 (10 мкг/мл) на клетки L1210, трансфицированные геном IAP человека.
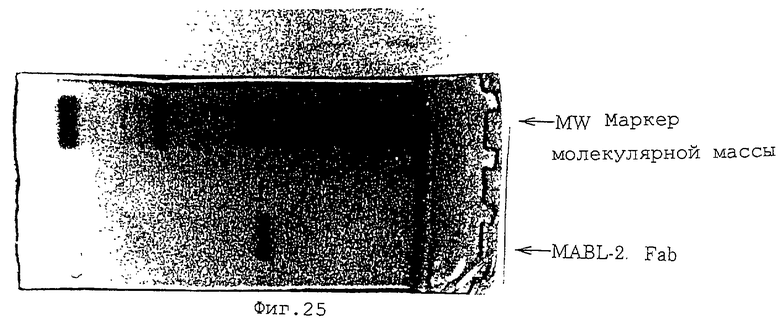
Фиг. 25 показывает картину электрофореза с SDS для Fab-фрагментов антитела MABL-2.
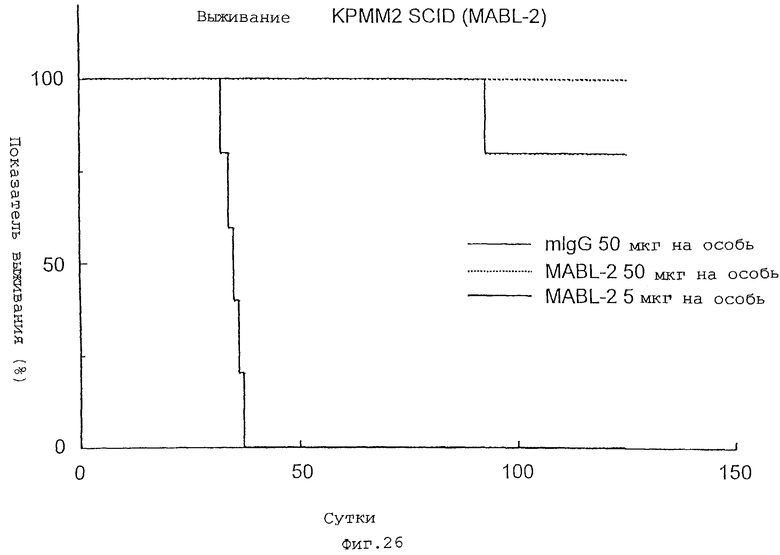
Фиг. 26 показывает заметно удлиненный период выживания после обработки MABL-2.
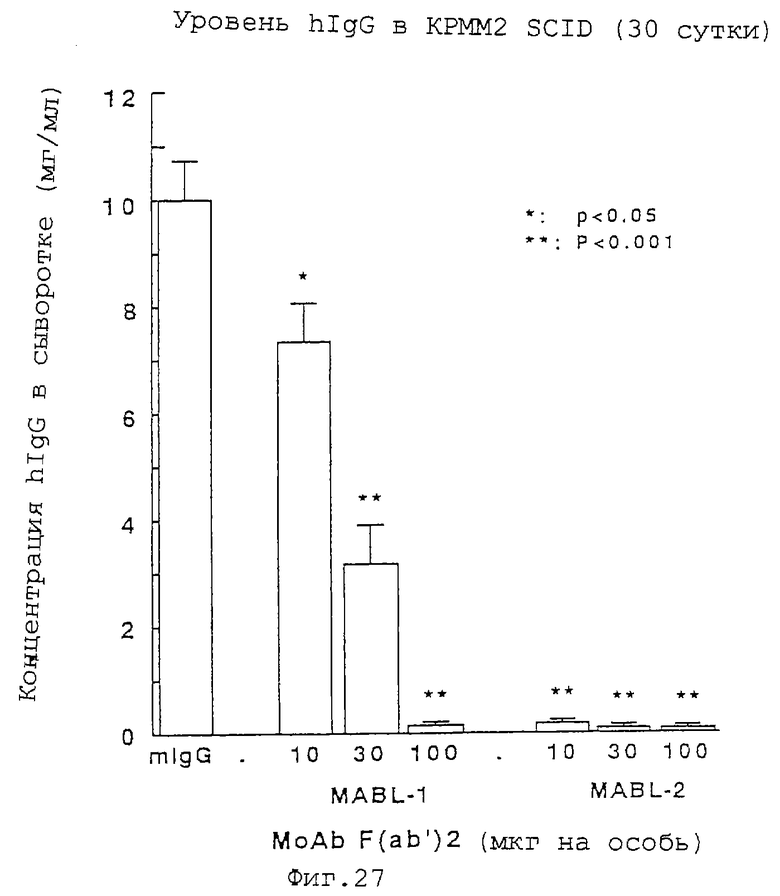
Фиг.27 показывает результаты ELISA в случае примера 5(2).
Фиг. 28 показывает заметно удлиненный период выживания после обработки F(ab')2-фрагментами MABL-2.
Фиг. 29 показывает картину электрофореза с SDS для антитела MABL-1 и F(ab')2-фрагментов антитела MABL-2.
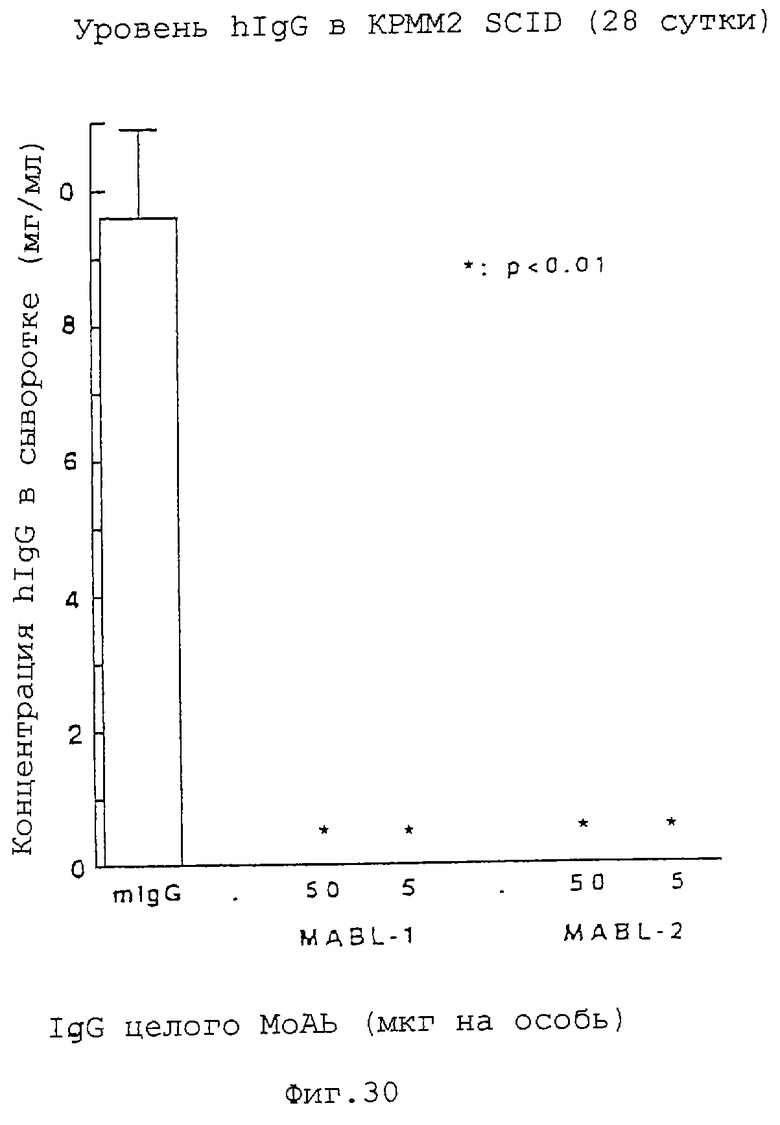
Фиг. 30 показывает, что содержание человеческого IgG в мышиной сыворотке существенно снижается в группах, обработанных MABL-1 и MABL-2, что указывает на противоопухолевое действие этих антител.
Наилучший способ осуществления изобретения
Получение моноклонального антитела
Моноклональные антитела данного изобретения можно, как правило, получить следующим образом. А именно, моноклональные антитела данного изобретения можно получить, например, используя интегринассоциированный белок человека в качестве сенсибилизирующего антигена, причем животных иммунизируют антигеном посредством способа, известного из уровня техники, слияние клеток осуществляют с помощью метода слияния клеток, известного из уровня техники, и клонируют методом клонирования, известным из уровня техники.
Конкретнее, предпочтительным способом получения моноклональных антител изобретения является, например, способ, при котором рекомбинантные клетки клеточной линии лейкоза мышей L1210, экспрессирующие интегринассоциированный белок человека, используют в качестве сенсибилизирующего антигена, клетки плазмы (иммуноциты) млекопитающего, иммунизированного сенсибилизирующим антигеном, сливают с миеломными клетками млекопитающих, таких как мыши, клонируют полученные слитые клетки (гибридомы), из полученных клонов отбирают клоны, продуцирующие антитела изобретения, распознающие вышеуказанную клеточную линию, и получают целевые антитела.
Вышеописанный способ является лишь одним возможным примером изобретения, и, например, сенсибилизирующий антиген не ограничивается вышеуказанными рекомбинантными клетками L1210, но может также являться сам интегринассоциированным белком (IАР) человека или IAP человека в растворимой форме; целевые моноклональные антитела, индуцирующие апоптоз ядросодержащих клеток крови (миелоидных клеток и лимфоцитов) можно получить таким же способом, как в случае указанных выше рекомбинантных клеток L1210.
Можно также использовать метод фагового отображения, чтобы получить целевое моноклональное антитело из библиотеки кДНК антитела.
Млекопитающие, которых иммунизируют сенсибилизирующим антигеном при способе получения моноклональных антител, не имеют особых ограничений, но предпочтительно выбирать их с учетом их совместимости с миеломными клетками, используемыми для слияния клеток, и, как правило, подходящими являются мыши, крысы, хомяки и подобные животные.
Иммунизацию осуществляют, предпочтительно, стандартным способом. Например, животному вводят посредством интраперитонеальной инъекции, или подобным образом, рекомбинантные клетки L1210, экспрессирующие интегринассоциированный белок человека. Конкретнее, соответствующий раствор или суспензию в PBS или физиологическом растворе животному вводят, предпочтительно, несколько раз с интервалами в 10 дней. Используемыми иммуноцитами являются, предпочтительно, клетки селезенки, экстрагированные после последнего введения клеток.
Клетки миеломы млекопитающего, используемые в качестве родительских клеток для слияния с иммуноцитами, могут представлять собой любую из различных клеточных линий, известных в технике, например, Р3 (Р3Х63Аg8.653) [J. Immunol., 123, 1548 (1978)], P3-U1 [Current Topics in Microbiology and Immunology, 81, 1-7 (1978)], NS-1 [Eur. J.Immunol., 6, 511-519 (1976)], MPC-11 [Cell, 8, 405-415 (1976)], Sp2/0-Agl4 [Nature, 276, 269-270 (1978)], FO [J. Immunol. Meth., 35, 1-21 (1980)], S194 [J. Exp. Med., 148. 313-323 (1978)] и R210 [Nature, 277, 131-133 (1979)].
Слияние иммуноцитов и миеломных клеток можно осуществить, в основном, в соответствии с обычным способом, таким как способ Milstein et al. [Methods Enzymol., 73, 3-46 (1981)].
Конкретнее, слияние клеток осуществляют, например, в обычной питательной среде в присутствии промотора слияния. Например, используемым промотором слияния могут являться полиэтиленгликоль (ПЭГ), вирус Сендай (HVJ) или подобный промотор, и, при необходимости, можно также добавить, соответственно, адъювант, такой как диметилсульфоксид, для того, чтобы повысить эффективность слияния. Иммуноциты используют, предпочтительно, в количестве в 1-10 раз превышающем количество миеломных клеток. Средой, используемой для слияния клеток, может быть, например, среда RPMI-1640, среда MEM и подобные среды, подходящие для роста линий миеломных клеток, или другие среды, обычно применяемые для выращивания таких клеток, и ее можно также использовать в сочетании с добавлением сыворотки, такой как околоплодная сыворотка теленка (FBS).
Слияние клеток осуществляют посредством тщательного смешивания указанных ранее количеств иммуноцитов и миеломных клеток в среде, добавляя к среде раствор ПЭГ, предварительно нагретый примерно до 37oС, причем ПЭГ имеет среднюю молекулярную массу приблизительно 1000-6000, например, как правило, при концентрации примерно 30-60% (м/о), и перемешивая. Затем последовательно добавляют подходящую среду, и полученный супернатант удаляют посредством центрифугирования. Эту процедуру повторяют, и получают целевые гибридомы.
Гибридомы отбирают посредством культивирования в обычной среде для селекции, такой как среда HAT (среда, содержащая гипоксантин, аминоптерин и тимидин). Культивирование в среде HAT продолжают в течение времени, достаточного для гибели всех клеток, иных чем целевые гибридомы (все неслившиеся клетки), что обычно составляет от нескольких суток до нескольких недель. Затем используют обычный метод серийных разведений для скрининга и моноклонирования гибридом, продуцирующих целевые антитела.
Полученные таким способом гибридомы, продуцирующие моноклональные антитела изобретения, можно субкультивировать обычным способом и можно оставить на длительное хранение в жидком азоте.
Для того чтобы получить моноклональные антитела изобретения из гибридом, можно использовать любой подходящий способ, такой как способ, при котором гибридомы можно культивировать в соответствии со стандартными методами, и можно получить антитела из культуральных супернатантов; или, с другой стороны, использовать способ, при котором гибридомы можно ввести в совместимое млекопитающее для пролиферации, а затем антитела можно получить из его асцитической жидкости. Первый способ подходит для получения высокочистых антител, в то время как второй способ является более подходящим для массового получения антител.
Антитела, полученные вышеуказанными способами, можно хорошо очистить, применяя стандартные способы очистки, такие как высаливание, гель-фильтрация, аффинная хроматография, или подобными способами.
Фрагменты моноклональных антител
Моноклональные антитела данного изобретения могут представлять собой полные антитела, описанные выше, или их фрагменты. А именно, это могут быть любые фрагменты моноклонального антитела изобретения, которые специфически распознают интегринассоциированный белок человека и индуцируют апоптоз ядросодержащих клеток крови (миелоидных клеток и лимфоцитов), содержащих интегринассоциированный белок человека. К таким фрагментам относятся Fab, F(ab')2, Fab', и т.п. Эти фрагменты можно получить посредством расщепления с помощью фермента, такого как папаин, пепсин, фицин, или подобного. Свойства полученных фрагментов можно подтвердить тем же способом, какой описан выше. Пептиды и низкомолекулярные соединения, обладающие такой же функцией, как моноклональные антитела
Описанные выше моноклональные антитела, которые распознают интегринассоциированный белок человека и индуцируют апоптоз ядросодержащих клеток крови, также включают пептиды и низкомолекулярные соединения, которые также распознают IАР и индуцируют апоптоз ядросодержащих клеток крови.
Свойства моноклональных антител изобретения
Как описано более конкретно в приведенных далее примерах, моноклональные антитела изобретения специфически распознают интегринассоциированный белок человека.
Моноклональные антитела изобретения также индуцируют апоптоз ядросодержащих клеток крови (миелоидных клеток и лимфоцитов) с интегринассоциированным белком человека.
Эти свойства можно использовать для получения полезных лечебных средств, для применения при лечении миелоидного лейкоза и лимфоидного лейкоза.
Таким образом, следует иметь в виду, что создание специфических систем, включающих применение моноклональных антител изобретения как антител для специфического распознавания антигена, вызывающего апоптоз ядросодержащих клеток крови, для различения и идентификации антигенов, или применение уникальных свойств моноклональных антител как лечебных средств при миелоидном лейкозе и лимфоидном лейкозе, так же как и любые модификации и применения системы, также входят в объем данного изобретения, постольку поскольку их можно осуществить путем применения стандартных способов, очевидных для специалистов в этой области техники.
Противолейкозные средства
Противолейкозное средство по данному изобретению имеет основанием тот факт, что действие IАР промотируется посредством связывания антитела или его подобия по изобретению. Хотя не существует определенных ограничений в отношении дозы антитела изобретения, предпочтительно, такая доза находится в интервале от 5 мкг до 500 мг/кг.
Примеры
Теперь данное изобретение будет поясняться подробнее с помощью приведенных далее примеров; однако, изобретение не ограничивается этими примерами.
Пример 1 (Получение моноклональных антител)
(1) Сенсибилизирующий антиген и способ иммунизации
Сенсибилизацию антигена осуществляют с использованием в качестве сенсибилизирующего антигена рекомбинантной клеточной линии, представляющей собой клетки L1210, трансфицированные геном IАP человека, и экспрессирующие продукт в большом количестве. L1210 получают из линии лейкозных клеток, полученных от мыши DBA (АТСС, CCL-219, J. Natl. Cancer Inst., 10:179-192, 1949).
Ген IAP человека амплифицируют посредством PCR с использованием праймера с характерной для IАP человека последовательностью (смысловой праймер: GCAAGCTTATGTGGCCC CTGGTAGCG, антисмысловой праймер: GCGGCCGCTCAGTTATTCCTAG GAGG) и кДНК, полученной из мРНК клеточной линии HL-60 (Clontech laboratories. Inc.), в качестве матрицы (фиг.1).
Продукт PCR субклонируют в клонирующий вектор pGEM-T (Promega Corporation) и используют для трансформации JM109 Е. coli (Takara Shuzo Co., Ltd.), и после подтверждения нуклеотидной последовательности ДНК-вставки с помощью секвенатора ДНК (секвенатор ДНК 373А, поставляется ABI), его субклонируют с помощью экспрессионного вектора pCOSl.
Экспрессионный вектор pCOSl является производным pEF-BOS (Nucleic Acids Research, 18, 5322, 1990), и он представляет собой вектор, полученный посредством субклонирования гена устойчивости к неомицину с использованием в качестве промотора/энхансера фактора 1α элонгации человека. Этот субклонированный вектор экспрессии IAP человека используют для введения гена в клеточную линию L1210 с DMRIE-C (GIBCO/BRL), осуществляют отбор с помощью генетицина (конечная концентрация 1 мг/мл, доступен от GIBCO/BRL), и клетки L1210 с введенным в них геном клонируют методом серийного разведения.
Экспрессию антигена полученных клонов проверяют с использованием распознающего IAP человека антитела против CD47 (PharMingen), и клоны с высоким уровнем экспрессии отбирают как антигенсенсибилизированные клетки (фиг.2, 3). Для культивирования рекомбинантных клеток L1210 в качестве среды используют 10% околоплодную сыворотку теленка (FBS, доступна от Moregate Inc.) и среду Дульбекко, модифицированную по способу Исков (IMDM) (GIBCO/BRL), и клетки субкультивируют в инкубаторе с 5% СO2 при температуре 37oС.
Используемыми иммунизированными животными являются мыши DBA/2 (разводятся Charles River, Япония) той же линии, что и клетки L1210. Клетки L1210, трансфицированные геном интегринассоциированного белка (IAP) человека, используемые для сенсибилизации антигена, инкубируют в течение примерно 30 мин с митомицином С (Kyowa Hakko Kogyo Co., Ltd.) при концентрации 200 мкг/мл, и после суспензионного выращивания клеток, перед суспендированием в PBS, тщательно отмывают от митомицина С.
Клетки вводят мышам посредством интраперитонеальной инъекции три раза с интервалами примерно в 10 дней, каждый раз в количестве приблизительно 5•106 клеток. После третьей иммунизации берут кровь из глазницы, сыворотку разводят в 50 раз PBS, содержащим 1% BSA, и подтверждают связывание разведенной сыворотки с рекомбинантными клетками L1210, используемыми для сенсибилизации антигена, с помощью FACScan (Becton Dickinson and Company) (фиг.4);
мышь с наилучшей активностью антисыворотки подвергают повторной иммунизации посредством интраперитонеальной инъекции 1•107 клеток через 5 дней после четвертой иммунизации. Через четыре дня после последней иммунизации мышь умервщляют и извлекают селезенку.
(2) Слияние клеток
После получения тонких срезов селезенки, извлеченной из мыши, диссоциированные клетки селезенки центрифугируют и затем суспендируют в среде IMDM, дают всплыть и тщательно промывают. Отдельно в среде IMDM, содержащей 10% околоплодной сыворотки теленка (FBS, доступна от Moregate Inc.), культивируют линию клеток миеломы мышей P3-U1 [Current Topics in Microbiology and Immunology, 81, 1-7 (1978)], и, также после промывания средой IMDM, 1•107 клеток помещают в центрифужную пробирку в смеси с 5•107 клетками селезенки и подвергают клетки слиянию в соответствии со стандартным способом [Clin. Exp. Immunol. , 42, 458-462 (1980)] с использованием полиэтиленгликоля 4000 (Nakarai Chemical Co., Ltd.).
Затем полученные слитые клетки суспендируют в среде IMDM, содержащей 10% FBS и агент стимуляции роста слитых клеток (BM-Condimed HI, доступен от Boehringer Mannheim Biochemicals), и распределяют в 96-луночном планшете для культивирования в инкубаторе с 5% СО2 при 37oС. На следующий день клетки помещают в среду для селекции HAT, а затем в среду IMDM с 10% FBS, содержащую агент стимуляции роста, и продолжают культивирование для поддержания роста.
Для того чтобы проверить действие культурального супернатанта этих слитых клеток на линии лейкозных клеток, среду для слитых клеток заменяют средой IMDM, содержащей 10% FBS, и продолжают культивирование для поддержания роста.
(3) Скрининг
Осуществляют описанный далее скрининг с использованием культурального супернатанта вышеуказанных слитых клеток.
[1] Первичный скрининг
Клетки линии стромальных клеток селезенки мыши (клетки CF-1), трансфицированные геном интегринассоциированного белка (IАР) человека (рекомбинантные клетки, в которые субклонирована та же плазмида, которую использовали для получения клеток L1210, экспрессирующих IАР человека, используемых для сенсибилизации антигена), высевают в 96-луночный планшет в количестве 1•104 клеток на лунку и культивируют в течение ночи, и затем фиксируют 2% PLP (периодат-лизин-параформальдегид), чтобы получить планшет для ELISA. После промывки планшет подвергают блокированию в течение 1 часа при комнатной температуре с использованием 1% раствора BSA, и после дополнительного промывания добавляют 50 мкл культурального супернатанта каждой гибридомы для инкубации при комнатной температуре в течение одного часа.
После промывания, перед инкубацией при комнатной температуре в течение 1 часа, добавляют противомышиный IgG+A+M (H+L) (Zymed Laboratories Inc.), меченный щелочной фосфатазой. После промывания добавляют субстрат SIGMA 104 (Sigma-Aldrich Corporation), чтобы получить конечную концентрацию 1 мг/мл, продолжают инкубацию при комнатной температуре и измеряют специфическую активность с помощью аппарата для прочтения микропланшетов (модель 3550, поставляется BioRad Laboratories Inc.).
В результате среди гибридом, высеянных в 2880 лунок, подтверждается появление гибридом в 2089 лунках, причем 187 лунок положительны при первичном скрининге. Перед осуществлением инкубации при комнатной температуре в течение 1 часа добавляют мышиный IgG1 в качестве отрицательного контроля и антитело против CD47 человека (BD PharMingen) в качестве положительного контроля, соответственно, по 50 мкл каждого при концентрации 3 мкг/мл.
[2] Вторичный скрининг
Клоны, признанные положительными при первичном скрининге, подвергают анализу по системе ELISA с использованием клеток CF-1, экспрессирующих интегринассоциированный белок (IАP) человека, где отрицательным контролем являются клетки CF-1, трансфицированные только экспрессионным вектором pCOS1, для того, чтобы проверить, распознают ли специфически антитела, продуцированные гибридомами, IАP человека.
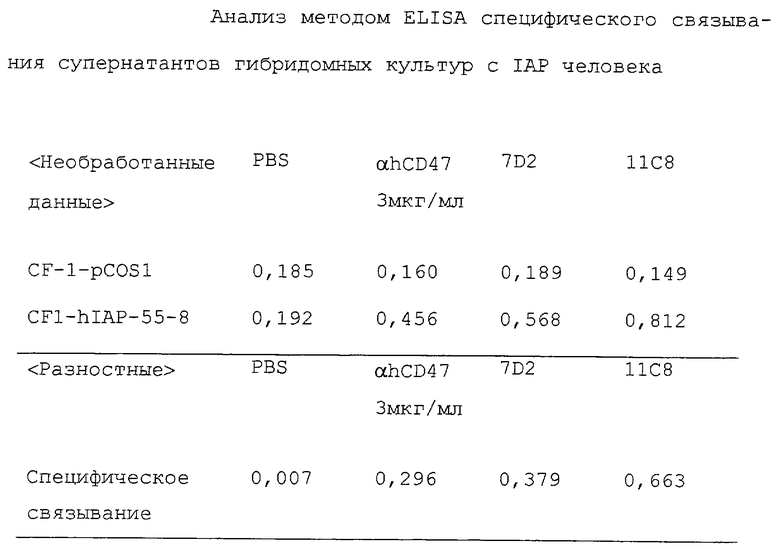
В результате обнаруживают, что положительны 21 из 187 лунок, охарактеризованных как положительные при первичном скрининге. Табл. 1 показывает специфическое связывание IАP человека с 7D2 и 11С8 как характерными примерами из их числа, в показателях поглощения при ELISA.
[3] Третичный скрининг
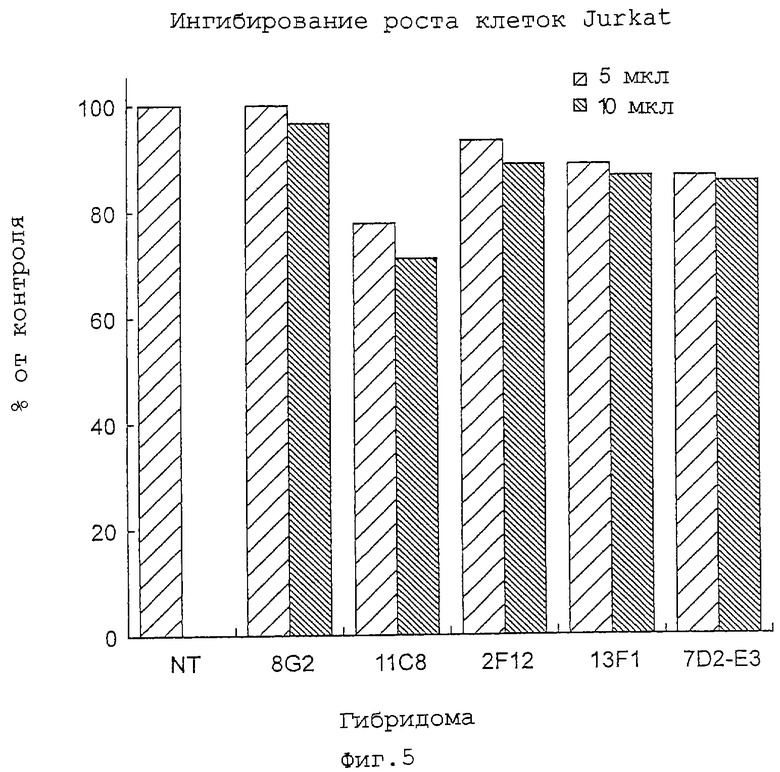
Клоны, признанные положительными при вторичном скрининге, подвергают испытанию по ингибированию роста с использованием клеток Jurkat (линия Т-клеточной лимфомы человека) и клеток ARH77 (линия клеток миеломы человека). В каждую лунку 96-луночного планшета высевают 100 мкл клеток Jurkat, 5•l03 клеток на лунку, и клеток ARH77, 1•104 клеток на лунку, и к клеточным суспензиям добавляют 5 или 10 мкл культурального супернатанта гибридомных клонов. После культивирования в течение примерно 2 суток измеряют число клеток посредством MTS-анализа. В качестве контроля добавляют 5 или 10 мкл среды IMDM, содержащей 10% FBS, и культуральных супернатантов клонов, отрицательных при первичном скрининге (8G2 и 9С5).
Фиг. 5 и 6 показывают результаты ингибирующего действия на рост клеток четырех характерных клонов - 11С8, 7D2-E3 (субклон 7D2), 13F1 и 2F12.
(4) Свойства антител
[1] Проверяют тип иммуноглобулина культуральных супернатантов 11С8, 7D2-E3, 13F1 и 2F12 с использованием системы ELISA.
А именно, клетки CF-1, экспрессирующие интегринассоциированный белок (IАP) человека, высевают в 96-луночный планшет, чтобы получить планшет для ELISA, и затем добавляют 50 мкл каждого культурального супернатанта, вводят во взаимодействие с этим антитела против мышиного IgG, меченные щелочной фосфатазой (Zymed Laboratories Inc. ) или антитела против мышиного IgM (Biosource Intl., Inc.) как вторичные антитела, и измеряют активность с помощью аппарата для прочтения микропланшетов. В результате подтверждается, что 11С8 и 7D2-E3 являются IgG, в то время как подтверждается, что 13F1 и 2F12 являются IgM.
[2] Фрагментацию ДНК двух клонов 11С8 и 7D2-E3 из числа четырех клонов, описанных выше, анализируют посредством проточной цитометрии (FAScan, поставляется Becton, Dickinson and Company) с использованием клеток Jurkat и клеток HL-60. Клетки Jurkat используют в случае 11С8 и 7D2-Е3, а клетки HL-60 используют в случае 11С8.
Клетки Jurkat и клетки HL-60 высевают в 12-луночный планшет в количестве 4•104 клеток на лунку/2 мл, соответственно, и добавляют 200 мкл культуральных супернатантов 11С8 и 7D2-E3. Клетки культивируют в течение 2 суток, и проводят измерения. В качестве контроля в эквивалентном объеме добавляют культуральный супернатант 8G2. Клетки извлекают из планшета для культивирования, и фиксируют клеточный осадок при 200 • g в течение 60 минут при 4oС в 2 мл охлажденного 70% этанола. Затем клетки центрифугируют, промывают в 1 мл PBS и ресуспендируют в 0,5 мл PBS. К 0,5 мл образцу клеток добавляют 0,5 мл РНКазы (тип I-A, Sigma-Aldrich Corporation, Сент-Луис, Миссури, США; 1 мг/мл в PBS), и смешивают все с 1 мл раствора пропидиййодида (PI, Sigma; 100 мкг/мл в PBS). Смешанные клетки инкубируют в течение 60 мин в темной камере при 37oС, и затем сохраняют в темной камере при 4oС, и проводят измерения методом проточной цитометрии.
Как показано на фиг.7-9 и 10-11, культуральные супернатанаты 7D2-E3 и 11С8 увеличивают число апоптозных клеток Jurkat, и культуральный супернатант 11С8 увеличивает количество апоптозных клеток HL-60, соответственно.
[3] Культуральные супернатанты 11С8 используют в системе сокультивирования с клетками HL-60 с использованием питающего подслоя клеток линии миелоидных стромальных клеток человека КМ102, чтобы определить, индуцируют ли эти культуральные супернатаны апоптоз клеток HL-60.
А именно, клетки КМ102 высевают на 2-луночное предметное стекло Lab-Tek Chamber (Nalge Nunc Intl. Corporation) и приводят в субконфлюентное состояние, на них высевают 1•105 клеток HL-60 и культивируют в течение примерно одних суток, и затем удаляют несвязанные клетки HL-60. Одновременно добавляют вышеуказанные культуральные супернатанты для получения конечной концентрации 10%, и клетки культивируют в течение 2 суток. После культивирования клетки фиксируют 10% формалином, и клетки HL-60, в которых индуцирован апоптоз, обнаруживают методом TUNEL (ApopTag Plus, поставляется Oncor Inc.). Как видно на фиг. 12 и 13, культуральный супернатант 11С8 в большей мере увеличивает апоптоз клеток HL-60, чем культуральный супернатант 9С5, представляющий собой культуральный супернатант гибридомного клона, не взаимодействующего с IAP человека, используемого в качестве контроля.
(5) Очистка антител
Для очистки антител, продуцированных гибридомами, клеточные линии продуцирующих IgG клонов 7D2-E3 и 11С8 из числа описанных выше гибридомных линий инъецируют интраперитонеально мышам BALB/c/AnNCrj (самцы, доступны от Charles River, Япония), которым введен пристан, в соответствии со стандартным способом. Через несколько недель отбирают продуцированную асцитическую жидкость, и антитела отделяют и очищают стандартными способами. А именно, антитела очищают от полученной асцитической жидкости с помощью пластиковой колонки с протеином A Polos (Perceptive Biosystems Inc.) и диализуют с PBS (Dulbecco Inc.), и подтверждают расположение полос с помощью анализа методом SDS-PAGE. Как видно на фиг.14, электрофорез с использованием аутентичного образца мышиного IgG (Cappel Inc.) в качестве контроля подтверждает наличие полос IgG для клонов 7D2-E3 и 11С8 в тех же положениях, что и для аутотентичного образца мышиного IgG, как в условиях отсутствия редукции, так и в условиях редукции.
В этом примере клетки L1210, экспрессирующие интегринассоциированный белок (IАР) человека, используют в качестве сенсибилизирующего антигена в целях пояснения, но также возможно получить моноклональные антитела таким же способом с использованием других экспрессирующих IAP человека клеток или самого IAP человека, и получить моноклональные антитела из библиотеки антител с использованием метода отражения фагов; данное изобретение не ограничивается вышеуказанными моноклональными антителами, но охватывает все моноклональные антитела, обладающие свойствами, подобными описанным выше, и все гибридомы, продуцирующие такие моноклональные антитела.
Более того, изобретение в части таких моноклональных антител также включает гуманизированные антитела, человеческие антитела, химерные антитела, одноцепочечные антитела, приматизированные антитела и фрагменты антител, полученные посредством расщепления антител различными ферментами (папаином, пепсином, фицином и т.п.).
Гибридомы, продуцирующие моноклональные антитела изобретения против интегринассоциированного белка (IАР) человека, являются новыми слитыми клетками, созданными из клеток селезенки мышей DBA и клеточной линии миеломы мышей P3-U1 в качестве родительских клеток; антитело против IАР (мышиная гибридома 11C8-F8 (субклон 11С8), названное "MABL-1") депонировано как FERM ВР-6100, и антитело против IAP (мышиная гибридома 7D2-E3 (субклон 7D2), названное "MABL-2") депонировано как FERM BP-6101 1 сентября 1997 Национальным институтом биологии и технологии человека, управление технических наук и технологии. Министерство международной торговли и промышленности, расположенным по адресу 1-3 Higashi 1-chome, Tsukuba-shi, Ibaraki-ken, Japan, как зарегистрированным депозитарием общедоступных микроорганизмов.
Пример 2 (Идентификация подклассов антител MABL-1 и MABL-2).
Для того чтобы идентифицировать подклассы антител MABL-1 и MABL-2, полученных выше, 500 мкл каждого из MABL-1 и MABL-2, доведенных до 100 нг/мл, исследуют в виде пятен с набором для определения изотипа (Stratagene), с помощью которого показывают, что MABL-1 представляет собой IgG1, κ, a MABL-2 представляет собой IgG2, κ.
Пример 3 (Лейкозные клетки человека, экспрессирующие IАP человека)
Экспрессию IАP в различных линиях лейкозных клеток человека определяют посредством проточной цитометрии с распознающим IАP человека антителом против CD47 (коммерчески доступный продукт). Это антитело используют для детекции, поскольку считается, что IАP человека идентичен CD47 (Biochem. J., 304, 525-530 (1994). Используемыми клеточными линиями являются клетки Jurkat и HL-60 (клетки К562, клетки ARH77, Raji-клетки и клетки СМК). Клетки используют в количестве 2•105 клеток на образец, антитела против CD47 инкубируют с клетками при конечной концентрации 5 мкг/мл, и вторичным используемым антителом является антитело против мышиного IgG, меченное FITC (Becton Dickinson and Company). Мышиное IgGI антитело (Zymed Laboratories Inc. ) используют в качестве контроля. Результаты проточной цитометрии, как показано на фиг.15 (HL-60) и фиг.16 (клетки Jurkat), подтверждают, что обе клеточные линии экспрессируют IAP.
Пример 4 (Апоптозное действие in vitro)
(1) Индуцирующее апоптоз действие антител MABL-1 и MABL-2 на клетки L1210, трансфицированные геном IAP человека, клетки Jurkat и клетки HL-60 проверяют с использованием аннексина-V (Boehringer Mannheim). Результаты анализа с аннексином-V приводятся на фиг.17-22, где пятнышки в левой нижней части фигур показывают живые клетки, пятнышки в нижней правой части показывают апоптозные клетки, и пятнышки в верхней правой части показывают некротические клетки. Используемыми антителами являются мышиный IgG (Zymed Laboratories Inc.) в качестве контроля и MABL-1 и MABL-2 в количестве 10 мкг/мл, и после инкубации 4•103 клеток L1210, трансфицированных геном IAP человека, в течение 72 час и 6•104 клеток Jurkat в течение 48 час, их анализируют с аннексином-V. Наблюдают гибель клеток, как видно на фиг.17-22. В случае клеток HL-60 используют 10 мкг/мл MABL-1, и анализ с аннексином-V при 1•105 клеток также показывает гибель клеток.
(2) Проверяют индуцирующее апоптоз действие Fab-фрагментов антитела MABL-2 на клетки L1210, трансфицированные геном IAP человека. А именно, культивируют 4•103 клеток L1210, трансфицированных геном IAP человека, и используют Fab-фрагменты антитела MABL-2 и в качестве контроля мышиный IgG при концентрации 10 мкг/мл. Клетки инкубируют в течение 72 час, и проводят измерения с аннексином-V. В результате наблюдают гибель множества клеток (фиг.23, 24). Fab-фрагменты антитела MABL-2, используемые в эксперименте, получают посредством расщепления антитела папаином (Pierce Laboratories, Inc.) и очищают. Fab-фрагменты антитела MABL-2 анализируют посредством электрофореза с SDS (фиг.25).
Пример 5 (Исследование апоптоза in vivo)
(1) Лекарственная эффективность MABL-1 и MABL-2 (полный IgG).
Клетки КРММ2 (линия миеломных клеток человека), экспрессирующие IAP человека, трансплантируют мышам SCID, и на 10-е сутки после трансплантации вводят MABL-1 и MABL-2 (полный IgG) посредством однократной внутривенной инъекции при дозе, каждого, 5 мкг на особь и 50 мкг на особь, соответственно (n= 5); на 28-е сутки после трансплантации посредством ELISA измеряют количество IgG человека, полученного из КРММ2, и подтверждается его исчезновение. Также проверяют период выживания. Результаты показывают заметную супрессию уровня IgG человека в крови в группах, обработанных MABL-1 и MABL-2, что является противоопухолевым действием (фиг. 30). Также показано, что заметно удлиняется период выживания (фиг.26).
(2) Лекарственная эффективность MABL-1 и MABL-2 (F(ab')2)
F(ab')2-Фрагменты, полученные посредством расщепления антител MABL-1 и MABL-2 пепсином и очистки с протеином А (Pierce laboratories. Inc.), используют для проверки противоопухолевого действия за исключением цитотоксического действия через Fc-области. А именно, клетки КРММ2 (линия миеломных клеток человека), экспрессирующие IАP человека, трансплантируют мышам SCID, и вводят внутривенно F(аb')2-фрагменты MABL-1 и MABL-2 одним группам при дозе 100 мкг на особь на 6-е и 10-е сутки после трансплантации и другим группам при дозе 10 и 30 мкг на особь на 6-е, 8-е и 10-е сутки после трансплантации, соответственно; на 30-е сутки после трансплантации посредством ELISA измеряют количество IgG человека, полученного из КРММ2 (фиг.27). Также на 90-е сутки после трансплантации проверяют период выживания. В результате обнаруживают заметный эффект супрессии уровня IgG человека в крови в группах, обработанных MABL-1 и MABL-2, что является противоопухолевым действием. Также заметно удлиняется период выживания (фиг.28). Фиг.29 показывает картину электрофореза с SDS в случае F(ab')2-фрагментов антитела MABL-1 и антитела MABL-2.
Промышленная применимость
Моноклональные антитела данного изобретения являются антителами, специфически распознающими интегринассоциированный белок человека, и антигенами, индуцирующими апоптоз ядросодержащих клеток, содержащих интегринассоциированный белок человека. Соответственно, они полезны в качестве антител, распознающих интегринассоциированный белок человека, для его различения и идентификации, причем в то же время они обладают действием индуцирования апоптоза ядросодержащих клеток крови; эти свойства можно использовать для получения лечебных средств для применения при лечении миелоидного лейкоза и лимфоидного лейкоза.






Изобретение относится к биотехнологии. Предложено моноклональное антитело, распознающее интегринассоциированный белок человека и индуцирующее апоптоз ядросодержащих клеток крови. Гибридомы MALB-1 и MALB-2 продуцируют моноклональное антитело, которое используют как средство, полезное при лечении миелоидного и лимфоидного лейкозов. 5 с. и 4 з.п.ф-лы, 32 ил., 1 табл.
| US 5783186 А, 21.07.1998. |
Авторы
Даты
2003-09-20—Публикация
1998-09-11—Подача