Изобретение относится к области ветеринарной микробиологии и может быть использовано при разработке и производстве средств специфической профилактики пастереллеза животных и птиц.
Пастереллез, геморрагическая септицемия, - это инфекционная болезнь животных и птиц, а также человека, характеризующая септицемическими явлениями и геморрагическими воспалительными процессами слизистых оболочек дыхательных путей и кишечника, пневмонией, плевропневмонией, а также отеками. Возбудителем заболевания является неподвижная мелкая овальная грамотрицательная бактерия 0,25-0,5 мкм шириной и 0,5-2 мкм длиной. Пастереллы, вызывающие заболевание у различных видов животных, не отличаются по своим культурально-морфологическим и ферментативным свойствам, но патогенность их наиболее высока для того вида животных, от которого они выделены. Источник возбудителя инфекции - больные и переболевшие животные. Заражение происходит чаще всего через дыхательные пути. Птица заражается чаще всего при склевывании зараженных трупов.
В нашей стране пастереллез сельскохозяйственных животных и птиц до настоящего времени широко распространен и наносит сельскому хозяйству значительный ущерб. Важное место среди мер борьбы с пастереллезом занимает вакцинопрофилактика. Для профилактики пастереллеза известно использование инактивированных сорбированных и эмульсионных вакцин, которые не лишены недостатков. Опыт промышленного производства инактивированных вакцин против пастереллеза насчитывает несколько десятилетий, однако, до сих пор проблема подбора средств для инактивации пастерелл и режимов инактивации, позволяющих максимально полно сохранять нативную структуру бактерий, продолжает оставаться актуальной.
Известен способ изготовления сорбированной противопастереллезной вакцины, включающей суспензионное выращивание производственных штаммов пастерелл, осаждение полученной культуры 10% раствором алюминиевых квасцов и инактивацию 0,16-0,18% формалином в течение 6 суток (авт. свид. СССР N 94044, 30 Н 6, 17.02.51 г.).
Недостатком вакцины, полученной данным способом, является непродолжительность иммунитета у вакцинированных сельскохозяйственных животных, при этом прививки производятся двукратно в относительно высоких дозах, особенно для телят: 50 мл - первая прививка, 10 мл - вторая прививка.
Известны также различные способы инактивации вирусов при производстве вакцин против вирусных заболеваний, включающих воздействие на живой вирус этиленимином или его производными (патент ФРГ N 2309329, НКИ 30 Н 6, 29.08.74 г. ; патент США N 3318775, НКИ 424-89, 09.05.67 г.; патент ФРГ N 1924303, НКИ 30 Н 6, 17.12.70 г.; патент СССР N 594771, A 61 K 39/12, C 12 N 7/04, 07.07.93 г.).
Основной недостаток использования этиленимина заключается в его высокой токсичности и работа с ним требует самых строгих мер предосторожности.
Недостатки производных этиленимина (ацетилэтиленимина, этилэтиленимина, димера этиленимина) состоят в том, что их концентрации, используемые для инактивации вирусов, не пригодны для инактивации пастерелл.
Наиболее близким предлагаемому изобретению по совокупности существенных признаков является способ изготовления эмульсионной противопастереллезной вакцины, включающий получение суспензии возбудителя, его инактивацию 0,3-0,5% раствором формалина и последующее соединение инактивированного антигена с масляным адъювантом (авт. свид. СССР N 1839092, A 61 K 39/102, 39/39, 30.12.93 г.).
Недостаток способа-прототипа состоит в том, что полученный препарат обладает сравнительно невысокой иммуногенной активностью. Это обусловлено жестким химическим воздействием формалина на белковые антигены, их частичной денатурацией, приводящей к снижению их антигенной и иммуногенной активности.
В задачу создания изобретения входило поиск нового химического реагента для инактивации пастерелл и разработка на его основе способа приготовления эмульсионной вакцины против пастереллеза животных и птиц с высокой иммуногенной активностью и специфической безопасностью.
Технический результат от использования изобретения заключается в повышении иммуногенной активности и специфической безопасности препарата путем сохранения исходных свойств белковых антигенов пастерелл при инактивации.
Указанный технический результат достигается созданием изобретения, охарактеризованного следующей совокупностью признаков:
1) способ изготовления эмульсионной противопастереллезной вакцины;
2) получение суспензии культуры пастерелл, по меньшей мере, одного серотипа;
3) инактивация полученной культуры;
4) в качестве инактиванта используют аминоэтилэтиленимин (АЭЭИ);
5) АЭЭИ вносят в бактерийную суспензию в эффективном количестве;
6) АЭЭИ вносят в бактерийную суспензию до концентрации 0,5-4%;
7) инактивацию ведут в течение 12-16 часов при 37-38oC;
8) осаждение бактерийного антигена центрифугированием;
9) разведение бактерийного антигена стабилизирующей средой;
10) в качестве стабилизирующей среды используют сахарозо-желатиновую среду;
11) соединение бактерийного антигена с масляным адъювантом;
12) бактерийный антиген и масляный адъювант соединяют в соотношении 4: 6-2:8;
13) бактерийный антиген и масляный адъювант соединяют в соотношении предпочтительно 3:7.
Предлагаемое изобретение включает следующую совокупность существенных признаков, обеспечивающих получение технического результата во всех случаях, на которые испрашивается правовая охрана:
1) способ приготовления эмульсионной противопастереллезной вакцины;
2) получение суспензии культуры пастерелл, по меньшей мере, одного серотипа;
3) инактивация полученной культуры;
4) в качестве инактиванта используют АЭЭИ;
5) АЭЭИ вносят в бактерийную суспензию в эффективном количестве;
6) разведение бактерийного антигена стабилизирующей средой;
7) соединение бактерийного антигена с масляным адъювантом.
Предлагаемый способ характеризуется также другими признаками, выражающими конкретные формы выполнения или особые условия его использования:
1) АЭЭИ вносят в бактерийную суспензию до концентрации в пределах 0,5-4%;
2) инактивацию ведут в течение 12-16 часов при 37-38oC;
3) осаждение бактерийного антигена центрифугированием;
4) в качестве стабилизирующей среды используют сахаро-желатиновую среду;
5) бактерийный антиген и масляный адъювант соединяют в соотношении в пределах 4:6-2:8;
6) бактерийный антиген и масляный адъювант соединяют в соотношении предпочтительно 3:7.
Признаками изобретения, характеризующими предлагаемый способ и совпадающими с признаками прототипа, в том числе родовое понятие, отражающее назначение, являются:
1) способ изготовления эмульсионной противопастереллезной вакцины;
2) получение суспензии культуры пастерелл, по меньшей мере, одного серотипа;
3) инактивация полученной культуры;
4) соединение бактерийного антигена с масляным адъювантом.
По сравнению со способом-прототипом существенными отличительными признаками изобретения являются:
1) в качестве инактиванта используют АЭЭИ;
2) АЭЭИ вносят в бактерийную суспензию в эффективном количестве;
3) после инактивации бактерийный антиген разводят в стабилизирующей среде.
Предлагаемый способ характеризуется другими отличительными признаками, выражающими конкретные формы выполнения, или особые условия его использования:
1) АЭЭИ вносят в бактерийную суспензию до концентрации в пределах 0,5-4%;
2) инактивацию ведут в течение 12-16 часов при 37-38oC;
3) бактерийный антиген осаждают центрифугированием;
4) в качестве стабилизирующей среды используют сахаро-желатиновую среду;
5) бактерийный антиген и масляный адъювант соединяют в соотношении 4: 6-2:8;
6) бактерийный антиген и масляный адъювант соединяют в соотношении предпочтительно 3:7.
Благодаря использованию предлагаемого способа получена эмульсионная противопастереллезная вакцина, обладающая по сравнению с прототипом более высокой иммуногенной активностью и специфической безопасностью.
Достижение технического результата от использования предлагаемого способа объясняется тем, что для инактивации пастерелл используют АЭЭИ, который разрушая ДНК инфекционного агента, не изменяет его белковую структуру и сохраняет его исходные антигенные свойства и иммуногенную активность.
Кроме того, для сохранения антигена от разрушения при хранении после инактивации его разводят в стабилизирующей среде, в качестве которой используют сахаро-желатиновую смесь.
Проведенный заявителем анализ уровня техники, включающий поиск по патентам и источникам научно-технической информации, и выявление источников, содержащих сведения об аналогах предлагаемого способа, позволил установить, что заявитель не обнаружил источник, характеризующейся признаками, тождественными (идентичными) всем существенным признакам предлагаемого способа. Определение из перечня выявленных аналогов прототипа, как наиболее близкого по совокупности признаков аналога, позволил установить совокупность существенных по отношению к усматриваемому заявителем техническому результату отличительных признаков в предлагаемом способе, изложенных в формуле изобретения.
Следовательно, предлагаемый способ соответствует условию патентоспособности "новизна".
Для проверки соответствия предлагаемого способа условию патентоспособности "изобретательский уровень" заявителем проведен дополнительный поиск известных решений для выявления признаков, включенных в отличительную часть формулы изобретения. В результате поиска установлено следующее.
Известно использование АЭЭИ для инактивации вируса ящура (патент РФ N 594771, A 61 K 39/12, C 12 N 7/04, 07.07.73 г.). Для инактивации пастерелл АЭЭИ использован авторами впервые. АЭЭИ инактивирует пастереллы также по реакции первого порядка. Однако проведенными исследованиями установлено, что концентрации АЭЭИ, используемые для инактивации вируса ящура, не приемлемы для инактивации пастерелл. Для инактивации пастерелл авторами предложено использовать АЭЭИ в концентрации 0,5-4%, преимущественно 1-2%, что выходит далеко за пределы значений концентраций АЭЭИ, используемых для инактивации вируса ящура. В этом состоит существенное отличие предлагаемого способа от изобретения по патенту РФ N 594771.
Другое существенное отличие предлагаемого способа заключается в том, что сразу после инактивации авторами предложено разводить полученный антиген в стабилизирующей среде, в качестве которой целесообразно использовать сахаро-желатиновую смесь. Необходимость введения этой операции обусловлена тем, что авторами по результатам исследований установлено, что при хранении антиген быстро разрушается под действием ферментов, теряя свои антигенные свойства и иммуногенную активность. Разведение пастереллезного антигена в сахарозо-желатиновой среде позволяет предотвратить его разрушение и хранить сколь угодно долго до использования в эмульсионной вакцине. Операция по разведению пастереллезного антигена в стабилизирующей среде предложена авторами впервые при изготовлении инактивированной эмульсионной вакцины против пастереллеза животных и птиц.
Результаты поиска показывают, что предлагаемый способ не вытекает для специалиста явным образом из известного уровня техники, изложенного в соответствующем разделе описания (не выявлены решения, имеющие признаки, совпадающие с отличительными признаками предлагаемого способа), а также не выявлено влияние предусматриваемых существенными признаками предлагаемого способа преобразований для достижения технического результата. Следовательно, предлагаемый способ соответствует условию патентоспособности "изобретательский уровень".
Сущность предлагаемого способа пояснена примерами его исполнения, которые не ограничивают объем изобретения.
Пример 1.
Для приготовления серии вакцины используют 3 ампулы с сухой культурой производственных штаммов Pasterella multocida серотипов A, D и B. В каждую ампулу вносят 2-3 см3 питательной среды. В качестве питательной среды используют бульон по Хоттингеру с pH 7,6-7,8 и показателем аминного азота 200-250 мг%. Полученной равномерной взвесью пастерелл каждого серотипа в объеме 0,3-0,5 см3 засевают по 2-3 флакона емкостью 100 см3, содержащих по 40-50 см3 питательной среды. Одновременно производят контрольные высевы каждой культуры в пробирки с МПА, МПБ, МППБ под вазелиновым маслом. Посевы культивируют в течение 12-16 часов при 37-38oC. В результате получают культуру первой генерации пастерелл каждого серотипа. Культуры первой генерации проверяют микроскопически. Для получения культуры второй генерации чистую культуру первой генерации каждого серотипа засевают по 5-15 см3 каждого серотипа на питательную среду в трех-, пяти- или десятилитровые бутыли с содержанием среды 1/2 объема бутыли с одновременным проведением контрольного высева в пробирки с МПА, МПБ, МППБ под вазелиновым маслом и в бактериологические чашки с МПА.
Матриксную культуру второй генерации в количестве, необходимом для засева в реактор выращивают в термостате в течение 6-8 часов при 37-38oC с 2-3 перемешиваниями культуры в течение 1-2 минут. Из выращенной культуры делают посевы в пробирки с питательными средами, чашки Петри с МПА, проводят микроскопию и определяют концентрацию микробных клеток, которая должна быть не менее, чем 109 КОЕ/см3. Для получения бактериальной массы матриксную культуру пастерелл каждого серотипа вносят в отдельный реактор с питательной средой. Матриксную культуру вносят в объеме 5-10% от рабочего объема реактора. Культивирование ведут при 37-38oC и pH 7,4-7,7 в течение 12 часов до получения суспензии с концентрацией микробных клеток 2-4·1010 КОЕ/см3. Для регулирования pH используют растворы Na2HPO4 и NaH2PO4. Выращенные культуры пастерелл каждого серотипа с помощью забуференного физиологического раствора приводят к единой наименьшей концентрации, смешивают в равных пропорциях, перекачивая в стерильный реактор. Полученную бактериальную смесь подвергают инактивации, АЭЭИ. Для этого в бактериальную смесь вносят АЭЭИ до концентрации 0,5-4%, преимущественно 1 - 2%, и инактивируют до 12 часов в условиях перемешивания при 50-80 об/мин и температуре 37-38oC. По окончании инактивации антиген оставляют при комнатной температуре в стационарных условиях на 18-24 часа. Контроль полноты инактивации осуществляют путем высева содержимого реактора на бульон и агар по Хоттингеру и инкубирования посевов при 37-38oC в течение 18-24 часов. Роста бактериальной микрофлоры на питательных средах не должно быть. Полученный антиген очищают от балластных белков и АЭЭИ, а также концентрируют осаждением на проточной центрифуге. Концентрат антигена ресуспендируют в сахарозо-желатиновой среде до концентрации 10-1210 КОЕ/см3 по оптическому стандарту ГИСК им. Тарасовича. После этого антиген соединяют с масляным адъювантом. При этом количество водной фазы, содержащей антиген, составляет по объему 30%, а масляного адъюванта - 70%. Для изготовления эмульсионной вакцины используют коллоидные мельницы. Полученная вакцина представляет собой эмульсию белого цвета с желтоватым оттенком, слегка вязкой консистенции, pH 7,2-7,6. При длительном хранении возможно незначительное отслоение минерального масла над не расслаивающейся однородной эмульсией. При тщательном встряхивании вакцина приобретает вид гомогенной массы.
Пример 2.
Бактериологический контроль стерильности полученной вакцины осуществляют следующим образом. Пробы вакцины высевают на сывороточный бульон и агар, жидкую и плотную среду Сабуро, МПА, МПБ - по 3 пробирки, на МППБ - по 2 пробирки и 2 флакона, среду Эндо - по 3 чашки. Для выявления аэробов высевают по 0,5 см3 вакцины в одну пробирку и 2 см3 в один флакон, а для выявления анаэробов - соответственно по 1 и 5 см3. Пробирки, бактериологические чашки, флаконы с посевами на всех средах, кроме Сабуро, выдерживают в термостате при (37,0±0,5)oC, на среде Сабуро при (21,0±0,5)oC в течение 7 суток. По истечении указанного срока делают пересев, за исключением посевов на МПА, среду Эндо, агар Сабуро и сывороточный агар. Пересевают пробы на те же питательные среды и в тех же объемах, что и при посеве. Вторичные посевы выдерживают 7 суток. Одновременно проводят контроль стерильности питательных сред. Результаты первичного и повторного посевов оценивают путем микроскопического исследования посевов. Рост микроорганизмов на питательных средах отсутствует.
Пример 3.
Контроль безвредности реактогенности полученной вакцины осуществляют следующим образом. Безвредность вакцин проверяли на 6 морских свинках и 12 белых мышах. Препарат вводили подкожно морским свинкам в области паха 1 и 2 см3, белым мышам в области спины в объеме 0,5 см3. Наблюдение за животными вели в течение 10 суток. Все животные остались живы.
Для проверки реактогенности препарат вводили внутримышечно 2 цыплятам по - 5 см3 в грудную мышцу и двум поросятам - по 10 см3, за ухом. Через 14 дней после введения вакцины, у поросят на месте инъекции препарата сохранились местные изменения в виде уплотнения тканей, величиной от 1 до 3 см3 Уплотнения однородны, без размягчения, безболезненны. При вскрытии поросят в толще мышечного слоя обнаружены светло-желтого цвета гранулемы плотной консистенции.
Пример 4.
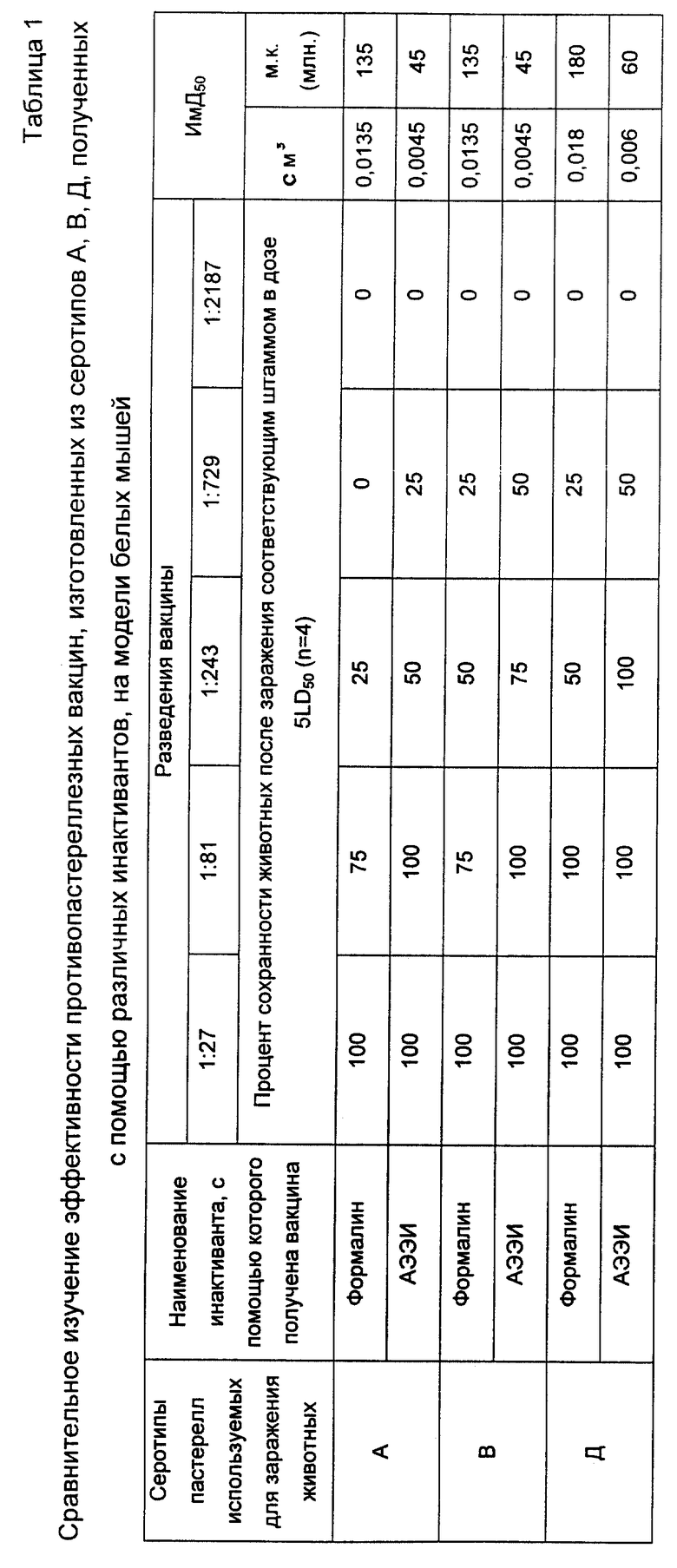
Для испытания иммуногенной активности полученной вакцины на белых мышах использовали по 10 животных на каждый серотип. Вакцину вводили 30 белым мышам подкожно в области спины в объеме 0,1 см3 (1,5 млрд. м.к.) однократно. Через 21 сутки после иммунизации по 10 вакцинированных и по 5 интактных белых мышей заражали подкожно предварительно оттитрованной смертельной дозой пастерелл соответствующего серотипа. Серотип B вводили в дозе 3-5 ж.м.к. на белую мышь (0,5 см3 20-часовой бульонной культуры в разведении 10-8 с накоплением 1 млрд. ж.м.к. в 1 см3 питательной среды). Контрольные мыши пали в течение 24 часов. Вакцинированные остались живы в течение 10 суток наблюдения после гибели контроля.
Серотип A вводили в дозе 10-20 ж.м.к. на белую мышь (0,2 см3 20-часовой бульонной культурой в разведении 10-7 с накоплением 1 млрд. ж.м.к. в 1 см3 питательной среды). Контрольные мыши пали в течение 24-36 часов. Вакцинированные остались живы в течение 10 суток наблюдения после гибели контроля.
Серотип D вводили в дозе 300 ж.м.к. на белую мышь (0,3 см3 20-часовой бульонной культуры в разведении 10-6 с накоплением 1 млрд. ж.м.к. в 1 см3 питательной среды). Контрольные мыши пали в течение 6 суток. Вакцинированные остались живы в течение 10 суток наблюдения после гибели последней контрольной белой мыши. В заключениие проведена оценка вакцины количественным методом.
Результаты сравнительного изучения эффективности противопастереллезных вакцин, изготовленных из серотипов A, B и D, полученных с помощью различных инактивантов, на белых мышах представлены на табл. 1.
Пример 5.
Для испытания иммуногенной активности полученной вакцины на кроликах использовали по 4 животных на каждый серотип. Вакцину вводили 12 кроликам внутримышечно в бедро в объеме 0,5 см3 (7,5 млрд. ж.м.к.) однократно. Через 21 день после иммунизации по 4 вакцинированных и 2 интактных кролика заражали внутримышечно в бедро предварительно оттитрованной смертельной дозой пастерелл соответствующего серотипа.
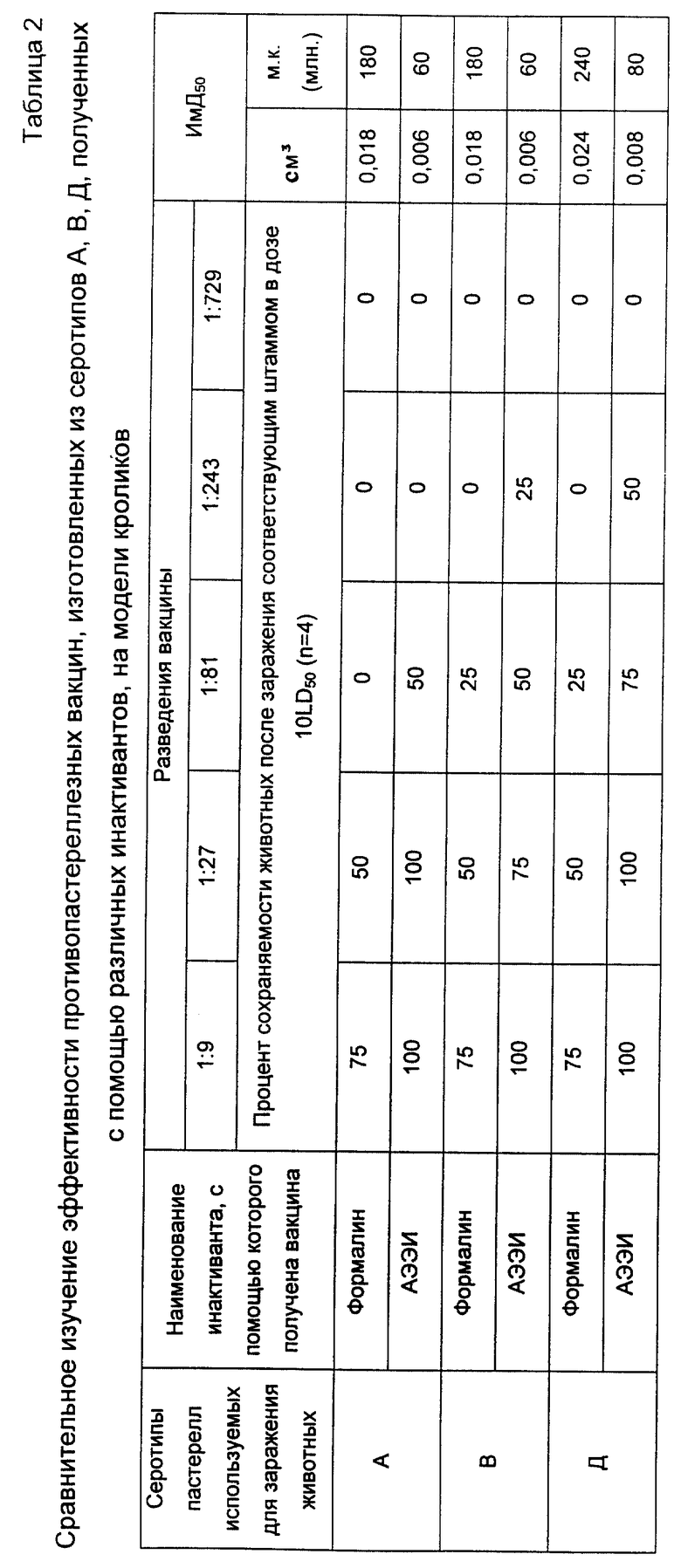
Серотип B вводили в дозе 50 ж.м.к. на одного кролика (0,5 см3 20-часовой бульонной культуры в разведении 10-8 с накоплением 1 млрд. ж.м.к. в 1 см3 питательной среды). Контрольные животные пали в течение 24 часов. Вакцинированные остались живы в течение 10 суток наблюдения после гибели контроля.
Серотип A вводили в дозе 50 ж.м.к. на одного кролика (0,5 см3 20-часовой бульонной культуры в разведении 10-8 с накоплением 1 млрд. ж.м.к. в 1 см3 питательной среды). Контрольные животные пали в течение 24-36 часов. Вакцинированные остались живы в течение 10 суток наблюдения после гибели контроля.
Серотип D вводили в дозе 500 ж.м.к. на одного кролика (0,5 см3 20-часовой бульонной культуры в разведении 10-8 с накоплением 1 млрд. ж.м.к. в 1 см3 питательной среды). Контрольные животные пали в течение 6-7 суток. Вакцинированные остались живы в течение 10 суток наблюдения после гибели контроля.
Результаты сравнительного изучения эффективности противопастереллезных вакцин, изготовленных из серотипов A, B и D, полученных с помощью различных инактивантов, количественным методом на кроликах представлены на табл. 2.
Пример 6.
Для испытания иммуногенной активности полученной вакцины на птице использовано 11 цыплят 120-дневного возраста, иммунизированных против пастереллеза однократным введением 0,5 см3 вакцины, подкожно в области нижней трети шеи и 5 цыплят 21-дневного возраста, иммунизированных против пастереллеза однократным введением 0,3 см3 вакцины (4,5 млрд. ж.м.к.) подкожно в области нижней трети шеи. Через месяц после иммунизации опытных и 4 контрольных цыплят заражали внутримышечно предварительно оттитрованной смертельной дозой пастерелл серотипа A: 11 голов в дозе 1000 мышиных LD50 (0,25 см3 20-часовой бульонной культурой в разведении 10-8 с накоплением 2 млрд. ж.м.к. в 1 см3 питательной среды, что составило 5000 ж.м.к. пастерелл) для опытных и контрольных цыплят и 2000 мышиных LD50 (0,5 см3 20-часовой бульонной культуры в разведении 10-8 с накоплением 2 млрд. ж.м.к. в 1 см3 питательной среды, что составило 10000 ж. м. к. пастерелл) еще для 5 опытных цыплят. Контрольные цыплята пали в течение 68-72 часов с бактериологическим подтверждением пастереллеза. Опытные цыплята оставались живы в течение 10 дней наблюдения после гибели последнего контроля.
Результаты сравнительного изучения эффективности противопастереллезных вакцин, изготовленных из серотипа A, полученных с помощью различных инактивантов, на модели цыплят 120-дневного возраста представлены на табл. 3.
Пример 7.
Иммуногенную активность вакцины на свиньях определяли путем прямого заражения вакцинированных подсвинков (прививная доза 2 см3, внутримышечное введение препарата, 1 животное на серотип). Через 21 сутки после вакцинации животные заражены 20-часовыми бульонными культурами пастерелл: серотип B - 0,3 см3, разведения 10-4; серотип A - 0,5 см3; серотип D - 7 см3.
Контрольные животные пали, а опытные остались живы в течение 10 суток наблюдения после гибели контроля.
Пример 8.
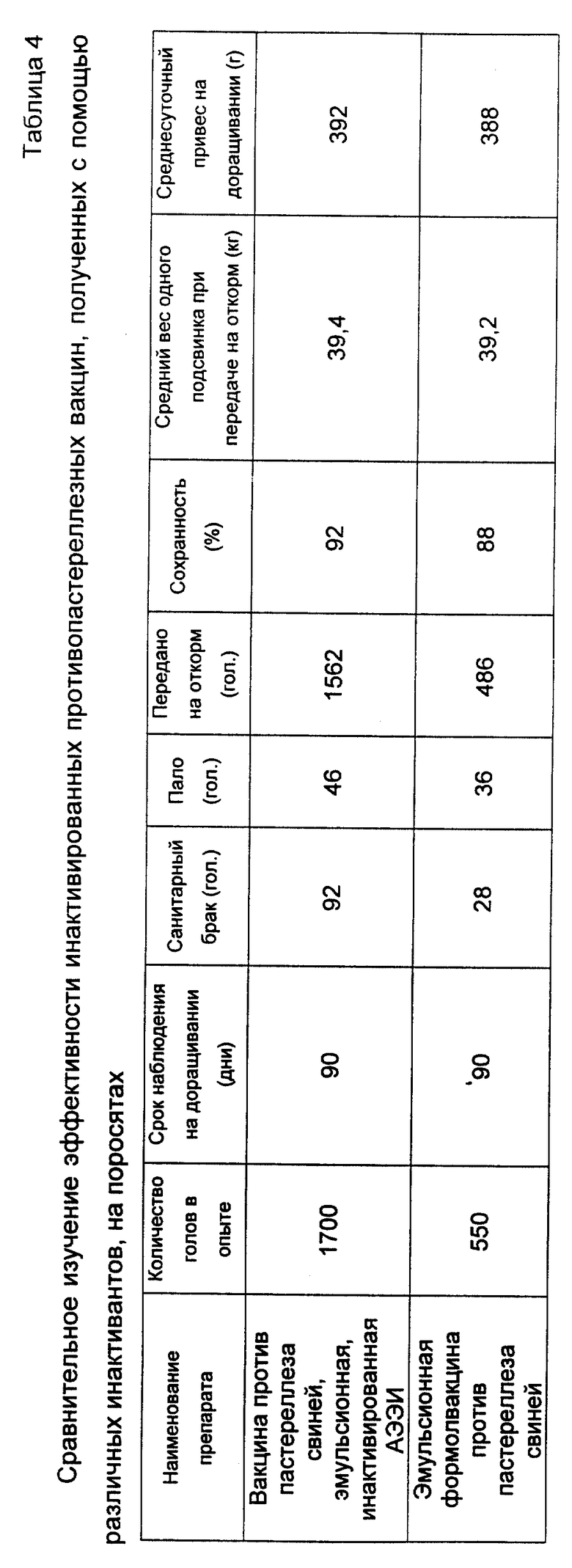
Произведены опыты по сравнительному изучению эффективности инактивированных противопастереллезных вакцин, полученных с помощью различных инактивантов, на поросятах в условиях КСП "Украина" Ивановского района Херсонской области Украины. Опыт проведен на 2-месячных поросятах в период доращивания в течение 3 месяцев. Испытания проводились на репродуктивной свиноферме хозяйства. Результаты испытаний представлены в табл. 4.
Таким образом, приведенная выше информация свидетельствует о выполнении при использовании предлагаемого изобретения следующей совокупности условий:
- способ изготовления эмульсионной противопастереллезной вакцины, воплощающей предлагаемое изобретение, предназначен для использования в сельском хозяйстве, а именно в ветеринарной микробиологии и биотехнологии;
- для предлагаемого изобретения в том виде, как оно охарактеризовано в независимом пункте формулы изобретения, подтверждена возможность его осуществления с помощью описанных в заявке или известных до даты приоритета средств и методов;
- при использовании предлагаемого способа достигается технический результат, предусмотренный задачей создания изобретения.
Следовательно, предлагаемое изобретение соответствует условию патентоспособности "промышленная собственность".
Источники информации
1. Авт. свид. СССР N 94044, 30 Н 6, 17.02.51 г.
2. Патент ФРГ N 2309329, НКИ 30 Н 6, 29.08.74 г.
3. Патент США N 3318775, 424-89, 09.05.67 г.
4. Патент ФРГ N 1924303, НКИ 30 Н 6, 17.12.70 г.
5. Патент СССР N 594771, A 61 K 39/12, C 12 N 7/04, 07.07.93 г.
6. Авт. свид.СССР N 1839092, A 61 K 39/102, 39/39, 30.12.93 г. (прототип).
7. Емельяненко П.А., Дунаев Г.В., Кудлай Д.Г. и др. Ветеринарная микробиология. М.: Колос, 1982, с. 177-180.
8. Радчук Н.А., Дунаев Г.В., Колычев Н.М. и др. Ветеринарная микробиология и иммунология. М.: Агропромиздат, 1991, с. 217-219.
9. Ярцев М.Я. Разработка технологии вакцин против пастереллеза животных и птиц. Ветеринария, 1996, N 2, с. 17-19.
10. Душук P. В., Белкин З.П., Егорова Г.П. и др. Иммуногенность вакцин против пастереллеза свиней. Ветеринария, 1997, N 10, с. 18-20.
11. Азарян С.Л. Изучение реактогенности и иммуногенности противопастереллезных вакцин с различными адъювантами на лабораторных животных. В сб. научн. трудов "Диагностика, профилактика и меры борьбы с инфекционными и инвазионными болезнями сельскохозяйственных животных и птиц на Северном Кавказе". Новочеркасск, 1990, с. 52-59.
12. Душук P. В., Азарян С.Л., Ким В.Д. и др. Изучение реактогенности и иммуногенной активности противопастереллезных вакцин на сельскохозяйственных животных. В сб. научн. трудов "Диагностика, профилактика и меры борьбы с инфекционными и инвазионными болезнями сельскохозяйственных животных и птиц на Северном Кавказе". Новочеркасск, 1990, с. 59-63.
13. Азарян С. Л. Изыскание масла для эмульгированных противопастереллезных вакцин. В сб. научн. трудов "Диагностика, профилактика и меры борьбы с инфекционными и инвазионными болезнями сельскохозяйственных животных и птиц на Северном Кавказе". Новочеркасск, 1990, с. 64-69.
14. Авт. свид. СССР N 1566533, A 61 K 39/102, 15.11.94 г.
15. Патент РФ N 2050161, A 61 K 39/102, A 61 B 10/00, 20.12.95 г.
16. Патент РФ N 2071662, A 61 K 39/295, 39/102, 39/125, 10.01.97 г.
17. Патент РФ N 2099083, A 61 K 39/116, 39/09, 39/102, C 12 N 1/20, 20.12.97 г.
18. Патент РФ N 2099084, A 61 K 39/116, 39/09, 39/102, 20.12.97 г.
19. Патент РФ N 2129015, A 61 K 39/102, C 12 N 1/20, 20.04.99 г.
20. Патент РФ N 2129440, A 61 K 39/102, C 12 N 1/20, 5/00, 27.04.99 г.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИЗГОТОВЛЕНИЯ ВАКЦИННОГО ПРЕПАРАТА ПРОТИВ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ БАКТЕРИАЛЬНОЙ ЭТИОЛОГИИ ЖИВОТНЫХ И ПТИЦ | 2000 |
|
RU2173560C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВАКЦИНЫ ПРОТИВ САЛЬМОНЕЛЛЕЗА СВИНЕЙ | 2000 |
|
RU2162340C1 |
| ИНАКТИВИРОВАННАЯ ЭМУЛЬСИОННАЯ ВАКЦИНА ПРОТИВ ПАРВОВИРУСНОЙ ИНФЕКЦИИ СВИНЕЙ | 2002 |
|
RU2214276C1 |
| ВАКЦИНА ПРОТИВ ЯЩУРА ТИПА А И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 1999 |
|
RU2143921C1 |
| ПОЛИВАЛЕНТНАЯ ИНАКТИВИРОВАННАЯ ВАКЦИНА ПРОТИВ РИЕМЕРЕЛЛЁЗА, ПАСТЕРЕЛЛЁЗА И САЛЬМОНЕЛЛЁЗА ИНДЕЕК, УТОК И ГУСЕЙ, СПОСОБ ЕЁ ПОЛУЧЕНИЯ | 2020 |
|
RU2750865C1 |
| ВАКЦИНА ЭМУЛЬСИОННАЯ ИНАКТИВИРОВАННАЯ ПРОТИВ РЕПРОДУКТИВНО-РЕСПИРАТОРНОГО СИНДРОМА СВИНЕЙ | 2002 |
|
RU2236253C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ИНАКТИВИРОВАННОЙ ЭМУЛЬСИОННОЙ ВАКЦИНЫ ПРОТИВ ПАРВОВИРУСНОЙ ИНФЕКЦИИ СВИНЕЙ | 2002 |
|
RU2214275C1 |
| ВАКЦИНА ПРОТИВ ЯЩУРА ТИПА О И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 2001 |
|
RU2212895C2 |
| ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОГО АТРОФИЧЕСКОГО РИНИТА И ПАСТЕРЕЛЛЕЗА СВИНЕЙ ИНАКТИВИРОВАННАЯ, СПОСОБ ЕЁ ПОЛУЧЕНИЯ | 2021 |
|
RU2763991C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВАКЦИНЫ ЭМУЛЬСИОННОЙ ИНАКТИВИРОВАННОЙ ПРОТИВ РЕПРОДУКТИВНО-РЕСПИРАТОРНОГО СИНДРОМА СВИНЕЙ | 2002 |
|
RU2236254C2 |

Изобретение предназначено для ветеринарной микробиологии и битехнологии. Производственные штаммы Pasteurella multocida серотипов А, Д и В культивируют в питательной среде, содержащей бульон по Хоттингеру с добавлением 10-15% сыворотки КРС, рН 7,6-7,8 и показателем аминного азота 200-250 мг%. Полученную бактериальную массу подвергают инактивации аминоэтилэтиленимином (АЭЭИ). АЭЭИ вносят в бактерийную суспензию до концентрации 0,5-4%. Смесь инкубируют в течение 12-16 ч при 37-38°С. По окончании инактивации полученный антиген вносят в сахарозо-желатиновую среду. После этого антиген соединяют с масляным адъювантом в соотношении 3:7 соответственно. Изобретение повышает иммуногенную активность и специфическую безопасность вакцины. 4 з. п. ф-лы, 4 табл.
| Способ приготовления противопастереллезной вакцины | 1990 |
|
SU1839092A1 |
| Способ изготовления формол-квасцовой вакцины против пастереллеза крупного рогатого скота, овец и свиней | 1951 |
|
SU94044A1 |
| RU 94023126 А, 10.10.1997 | |||
| СПОСОБ ИЗГОТОВЛЕНИЯ ВАКЦИНЫ ПРОТИВ ПАСТЕРЕЛЛЕЗА ПТИЦ | 1988 |
|
SU1566533A1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВАКЦИНЫ ПРОТИВ ПАСТЕРЕЛЛЕЗА СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ И ПТИЦ | 1997 |
|
RU2129015C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВАКЦИН ПРОТИВ ПАСТЕРЕЛЛЕЗА ЖИВОТНЫХ И ПТИЦ | 1998 |
|
RU2129440C1 |
| Средство для инактивации вирусов при изготовлении противовирусных препаратов | 1973 |
|
SU594771A1 |
| ВАКЦИНА ПРОТИВ ЯЩУРА ТИПА А И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 1999 |
|
RU2143921C1 |
| СПОСОБ ТОЧЕЧНОЙ СВАРКИ ЭЛЕКТРИЧЕСКОЙ ДУГОЙ | 1949 |
|
SU85469A1 |
Авторы
Даты
2001-01-27—Публикация
2000-04-17—Подача