Изобретение относится к области ветеринарной микробиологии и биотехнологии и может быть использовано при разработке и производстве средств специфической профилактики сальмонеллеза свиней.
Сальмонеллезы - группа инфекционных болезней преимущественно молодняка сельскохозяйственных и промысловых животных (телят, поросят, жеребят, ягнят, птиц, пушных зверей). Род Salmonella - паратифозные бактерии, в серологическом отношении родственны, патогенны для людей и животных или одновременно для тех и других. Данный род назван в честь американского исследователя Сальмона. Сальмонеллы могут вызывать первичные инфекции (сальмонеллезы у молодняка животных, аборты у овец и кобыл, пуллороз птиц, брюшной тиф человека и др.), а также вторичные инфекции, осложняющие бактериальные и вирусные болезни (пневмонии молодняка, аборты у овец, чума свиней и др.).
При употреблении инфицированных продуктов животного происхождения (мясо, молоко, яйца) сальмонеллы вызывают у людей токсикоинфекции. Животные являются основным резервуаром сальмонеллезной (паратифозной) инфекции во всех странах мира. Отмечается их возрастающая роль как источников сальмонеллезных болезней человека. В этой связи сальмонеллезы представляют важную ветеринарную и медико-биологическую проблему.
В настоящее время насчитывают свыше 1500 вариантов сальмонелл, различающихся по антигенной структуре и ферментативной активности, из них примерно 150 типов постоянно обнаруживают в Европе.
В нашей стране сальмонеллез сельскохозяйственных животных и птиц широко распространен и наносит сельскому хозяйству значительный ущерб. Например, в свиноводстве на сальмонеллез приходится приблизительно 20% заболеваемости и около 25-30% летальности от всех болезней, вызываемых необлигатнопатогенными микроорганизмами. Важное место среди мер борьбы с сальмонеллезами занимает вакцинопрофилактика. Для специфической профилактики сальмонеллеза у свиней в нашей стране применяют ряд живых и инактивированных вакцин. Те и другие вакцины имеют как положительные, так и отрицательные стороны. Живые вакцины создают напряженный иммунитет как по напряженности, так и по продолжительности, но это живые бактерии, вызывающие хоть и легкое, но переболевание с бактерионосительством до 6-8 месяцев, а отсутствие у вакцинных штаммов надежных генетических маркеров затрудняет реальную диагностику сальмонеллеза. Инактивированные вакцины лишены этих недостатков, но им свойственна короткая продолжительность защиты. Опыт промышленного производства инактивированных вакцин против сальмонеллеза насчитывает несколько десятилетий, однако до сих пор проблема подбора средств для инактивации сальмонелл и режимов инактивации, позволяющих максимально полно сохранять нативную структуру бактерий, продолжает оставаться актуальной (Емельяненко П.А., Дунаев Г.В. и др. Ветеринарная микробиология. М.: Колос, 1982, 154-173).
Известны различные способы инактивации вирусов при производстве вакцин против вирусных заболеваний, включающие воздействие на живой вирус этиленимином или его производными (пат. ФРГ N2309329, НКИ 30h,6: 29.08.74; пат. США N3318775, НКИ 424-89, 09.05.67; пат. ФРГ N 1924303, НКИ 30h,6: 17.12.70; пат.СССР N594771, A 61 K 39/12, C 12 N 7/04, 07.07.93).
Основной недостаток использования этиленимина заключается в его высокой токсичности и работа с ними требует самых строгих мер предосторожности.
Недостатки производных этиленимина (ацетилэтиленимина, этилэтиленимина, димера этиленимина) состоят в том, что их концентрации, используемые для инактивации вирусов, не пригодны для инактивации сальмонелл.
Наиболее близким предлагаемому изобретению по совокупности существенных признаков является способ изготовления вакцины против сальмонеллеза свиней, включающий получение культуры возбудителя болезни, его инактивацию формалином и последующее соединение бактериального антигена с адъювантом (Наставление по применению формолвакцины против паратифа поросят. Утверждено ГУВ МСХ СССР 14 июля 1956 г. с изменениями от 22 марта 1962 г. взамен Наставления по применению биологических препаратов, утвержденного МСХ СССР 11 марта 1950 г. N И-56; авт. свид. СССР N 172961;30h, 6; 07.07.65).
Недостаток способа-прототипа состоит в том, что полученный препарат обладает сравнительно невысокой иммуногенной активностью. Это обусловлено жестким химическим воздействием формалина на белковые антигены, их частичной денатурацией, приводящей к изменению их антигенных свойств и снижению иммуногенной активности.
В задачу создания изобретения входили поиск нового химического реагента для инактивации сальмонелл и разработка на его основе способа изготовления вакцины против сальмонеллеза свиней с высокой иммуногенной активностью и специфической безопасностью.
Технический результат от использования изобретения заключается в повышении иммуногенной активности и специфической безопасности препарата путем сохранения исходных свойств белковых антигенов сальмонелл при инактивации.
Указанный технический результат достигается созданием изобретения, охарактеризованного следующей совокупностью:
1) способ изготовления вакцины против сальмонеллеза свиней;
2) получение суспензии культуры сальмонелл, по меньшей мере, одного сероварианта;
3) инактивация полученной культуры;
4) в качестве инактиванта используют аминоэтилэтиленимин (АЭЭИ);
5) соединение бактериального антигена с адъювантом;
6) АЭЭИ вносят в бактериальную суспензию в эффективном количестве;
7) АЭЭИ вносят в бактериальную суспензию до концентрации 0,5-4%;
8) инактивацию возбудителя ведут в течение 12-16 часов при 37-38oC;
9) разведение бактериального антигена стабилизирующей средой;
10) в качестве стабилизирующей среды используют сахарозо-желатиновую среду;
11) соединение бактерийного антигена с адъювантом;
12) в качестве адъюванта используют масляный адъювант;
13) бактерийный антиген и масляный адъювант соединяют в соотношении 2:3 - 1:4.
Предлагаемое изобретение включает следующую совокупность существенных признаков, обеспечивающих получение технического результата во всех случаях, на которые испрашивается правовая охрана:
1) способ изготовления вакцины против сальмонеллеза свиней;
2) получение суспензии культуры сальмонелл, по меньшей мере, одного сероварианта;
3) инактивация полученной культуры;
4) в качестве инактиванта используют АЭЭИ;
5) АЭЭИ вносят в бактерийную суспензию в эффективном количестве;
6) разведение бактерийного антигена стабилизирующей средой;
7) соединение бактерийного антигена с масляным адъювантом.
Предлагаемый способ характеризуется также другими признаками, выражающими конкретные формы выполнения или особые условия его использования:
1) АЭЭИ вносят в бактерийную суспензию до концентрации 0,5-4%;
2) инактивацию ведут в течение 12-16 часов при 37-38oC;
3) в качестве стабилизирующей среды используют сахарозо-желатиновую среду;
4) бактерийный антиген и масляный адъювант соединяют в соотношении 2: 3-1:4.
Признаками изобретения, характеризующими предлагаемый способ и совпадающими с признаками прототипа, в том числе родовое понятие, отражающее назначение, являются:
1) способ изготовления вакцины против сальмонеллеза свиней;
2) получение суспензии культуры сальмонелл, по меньшей мере, одного сероварианта;
3) инактивация полученной культуры;
4) соединение бактерийного антигена с адъювантом.
По сравнению со способом-прототипом существенными отличительными признаками изобретения являются:
1) в качестве инактиванта используют АЭЭИ;
2) АЭЭИ вносят в бактерийную суспензию в эффективном количестве;
3) после инактивации бактерийный антиген разводят в стабилизирующей среде.
Предлагаемый способ характеризуется другими отличительными признаками, выражающими конкретные формы выполнения или особые условия его использования:
1) АЭЭИ вносят в бактериальную суспензию до концентрации 0,5-4%;
2) инактивацию ведут в течение 12-16 часов при 37-38oC;
3) в качестве стабилизирующей среды используют сахарозо-желатиновую среду;
4) в качестве адъюванта используют масляный адъювант;
5) бактерийный антиген и масляный адъювант соединяют в соотношении 2:3 - 1:4.
Благодаря использованию предлагаемого способа получена эмульсионная вакцина против сальмонеллеза свиней, обладающая по сравнению с прототипом более высокой иммуногенной активностью и специфической безопасностью.
Достижение технического результата от использования предлагаемого способа объясняется тем, что для инактивации сальмонелл используют АЭЭИ, который, разрушая ДНК инфекционного агента, не изменяют его белковую структуру и сохраняет его исходные антигенные свойства и иммуногенную активность. Кроме того, для сохранения антигена от разрушения при хранении после инактивации его разводят в стабилизирующей среде, в качестве которой используют сахарозо-желатиновую смесь.
Проведенный заявителем анализ уровня техники, включающий поиск по патентам и источникам научно-технической информации, и выявление источников, содержащих сведения об аналогах предлагаемого способа, позволили установить, что заявитель не обнаружил источник, характеризующийся признаками, тождественными (идентичными) всем существенным признакам предлагаемого способа. Определение из перечня выявленных аналогов прототипа, как наиболее близкого по совокупности признаков аналога, позволило установить совокупность существенных по отношению к усматриваемому заявителем техническому результату отличительных признаков в предлагаемом способе, изложенных в формуле изобретения.
Следовательно, предлагаемый способ соответствует условию патентоспособности "новизна".
Для проверки соответствия предлагаемого способа условию патентоспособности "изобретательский уровень" заявителем проведен дополнительный поиск известных решений для выявления признаков, включенных в отличительную часть формулы изобретения. В результате поиска установлено следующее.
Известно использование АЭЭИ для инактивации вируса ящура (пат. РФ N594771; A 61 K 39/12, C 12 N 7/04; 07.05.73). Для инактивации сальмонелл АЭЭИ использован авторами впервые. АЭЭИ инактивирует сальмонеллы также по реакции первого порядка. Однако проведенными исследованиями установлено, что концентрации АЭЭИ, используемые для инактивации вируса ящура, не приемлемы для инактивации сальмонелл. Для инактивации сальмонелл авторами предложено использовать АЭЭИ в концентрации 0,5-4%, преимущественно 1 - 2%, что выходит далеко за пределы значений концентраций АЭЭИ, используемых для инактивации вируса ящура. В этом состоит существенное отличие предлагаемого способа от изобретения по патенту РФ N594771.
Другое существенное отличие предлагаемого способа заключается в том, что сразу после инактивации авторами предложено разводить полученный антиген в стабилизирующей среде, в качестве которой целесообразно использовать сахарозо-желатиновую смесь. Необходимость введения этой операции обусловлена тем, что авторами по результатам исследований установлено, что при хранении в жидкой среде сальмонеллезный антиген быстро разрушается под действием ферментов, теряя свои антигенные свойства и иммуногенную активность. Разведение сальмонеллезного антигена в сахарозо-желатиновой среде позволяет предотвратить его разрушение и хранить сколь угодно долго до использования в эмульсионной вакцине. Операция по разведению сальмонеллезного антигена в стабилизирующей среде при изготовлении эмульсионной инактивированной вакцины предложена авторами впервые.
Результаты поиска показывают, что предлагаемый способ не вытекает для специалиста явным образом из известного уровня техники, изложенного в соответствующем разделе описания (не выявлены решения, имеющие признаки, совпадающие с отличительными признаками предлагаемого способа), а также не выявлено влияние предусматриваемых существенными признаками предлагаемого способа преобразований для достижения технического результата. Следовательно, предлагаемый способ соответствует условию патентоспособности "изобретательский уровень".
Сущность изобретения пояснена примерами его исполнения, которые не ограничивают объем изобретения.
Пример 1.
Для приготовления серии вакцины используют 2 ампулы с сухой культурой производственных штаммов Salmonella choleraesusis и Salmonella typhimurium. В каждую ампулу вносят 2-3 см3 питательной среды. В качестве питательной среды используют бульон по Хоттингеру с pH 7,6-7,8 и показателем аминного азота 200-250 мг%. Полученной равномерной взвесью сальмонелл каждого сероварианта в объеме 0,3-0,5 см3 засевают по 2-3 флакона емкостью 100 см3, содержащих по 40-50 см3 питательной среды. Одновременно производят контрольные высевы каждой культуры в пробирки с МПА, МПБ, МППБ под вазелиновым маслом. Посевы культивируют в течение 12-16 часов при 37-38oC. В результате получают культуру первой генерации сальмонелл каждого сероварианта. Культуры первой генерации проверяют микроскопически. Для получения культуры второй генерации чистую культуру первой генерации каждого сероварианта засевают по 5-15 см3 каждого сероварианта на питательную среду в трех-, пяти- или десятилитровые бутыли с содержанием среды 1/2 объема бутыли с одновременным проведением контрольного высева в пробирки с МПА, МПБ, МППБ под вазелиновым маслом и в бактериологические чашки с МПА. Матриксную культуру второй генерации в количестве, необходимом для засева в реактор, выращивают в термостате в течение 6-8 часов при 37-38oC с 2-3 перемешиваниями культуры в течение 1-2 минут. Из выращенной культуры делают посевы в пробирки с питательными средами, чашки Петри с МПА, проводят микроскопию и определяют концентрацию микробных клеток, которая должна быть не менее чем 109 КОЕ/см3. Для получения бактериальной массы матриксную культуру сальмонелл каждого сероварианта вносят в отдельный реактор с питательной средой. Матриксную культуру вносят в объеме 5-10% от рабочего объема реактора. Культивирование ведут при 37-38oC и pH 7,4-7,6 в течение 12 часов до получения суспензии с концентрацией микробных клеток 2-4·1010 КОЕ/см3. Для регулирования pH используют растворы Na2HPO4 и NaH2PO. Выращенные культуры сальмонелл каждого сероварианта с помощью забуференного физиологического раствора приводят к единой наименьшей концентрации, смешивают в равных пропорциях, перекачивая в стерильный реактор. Полученную бактериальную смесь подвергают инактивации АЭЭИ. Для этого в бактериальную смесь вносят АЭЭИ до концентрации в пределах 0,5-4%, преимущественно 1 - 2%, и инкубируют до 12 часов в условиях перемешивания при 50-80 об/мин и температуре 37-38oC. По окончании инактивации антиген оставляют при комнатной температуре в стационарных условиях на 18-24 часа. Контроль полноты инактивации осуществляют путем высева содержимого реактора на бульон и агар по Хоттингеру и инкубирования посевов при 37-38oC в течение 18-24 часов. Роста бактериальной микрофлоры на питательных средах не должно быть. Полученный антиген концентрируют центрифугированием. Концентрат антигена ресуспендируют в сахарозо-желатиновой среде до концентрации 10-1210 КОЕ/см3 по оптическому стандарту ГИСК им.Тарасевича. После этого антиген соединяют с масляным адъювантом.
При этом количество водной фазы, содержащей антиген, составляет по объему 30%, а масляного адъюванта - 70%. Для изготовления эмульсионной вакцины используют коллоидные мельницы. Полученная вакцина представляет собой эмульсию белого цвета, слегка вязкой консистенции, pH 7,2-7,6. При длительном хранении возможно незначительное отслоение минерального масла над нерасслаивающейся однородной эмульсией. При тщательном встряхивании вакцина приобретает вид гомогенной массы.
Пример 2.
Бактериологический контроль стерильности полученной вакцины осуществляют следующим образом. Пробы вакцины высевают на жидкую и плотную среду Сабуро, МПА, МПБ - по 3 пробирки, на МППБ - по 2 пробирки и 2 флакона, среду Эндо - по 3 чашки. Для выявления аэробов высевают 0,5 см3 вакцины в одну пробирку и 2 см3 в один флакон, а для выявления анаэробов - соответственно по 1 и 5 см3. Пробирки, бактериологические чашки, флаконы с посевом на всех средах, кроме Сабуро, выдерживают в термостате при (37±0,5)oC, на среде Сабуро при (21±0,5)oC в течение 7 суток. По истечении указанного срока делают пересев, за исключением пересевов на МПА, среду Эндо, агар Сабуро. Пробы пересевают на те же питательные среды и в тех же объемах, что и при посеве. Вторичные посевы выдерживают 7 суток. Одновременно проводят контроль стерильности питательных сред. Результаты первичного и повторного посевов оценивают путем микроскопического исследования посевов. Рост микроорганизмов на питательных средах с посевами отсутствует.
Пример 3.
Контроль безвредности и реактогенности полученной вакцины осуществляли следующим образом. Безвредность полученной вакцины проверяли на 5 морских свинках и 10 белых мышах. Препарат вводили подкожно в области спины в объеме 2 см3 морским свинкам и 0,5 см3 белым мышам. Наблюдение за животными вели в течение 10 суток. Все животные остались живы. Реактогенность вакцины проверяли на одном подсвинке. Препарат вводили внутримышечно, за ухом в объеме 5 см3. Через 48 часов после введения вакцины на месте инъекции препарата отмечено образование разлитого уплотнения, которое сохранялось на протяжении двухнедельного срока наблюдения. Общее состояние животного было в пределах физиологической нормы.
Пример 4
Иммуногенную активность вакцины определяли количественным методом в опыте на морских свинках. Для проверки использовали смесь препарата из 3 флаконов (по каждой серии), из которых готовят объединенную пробу.
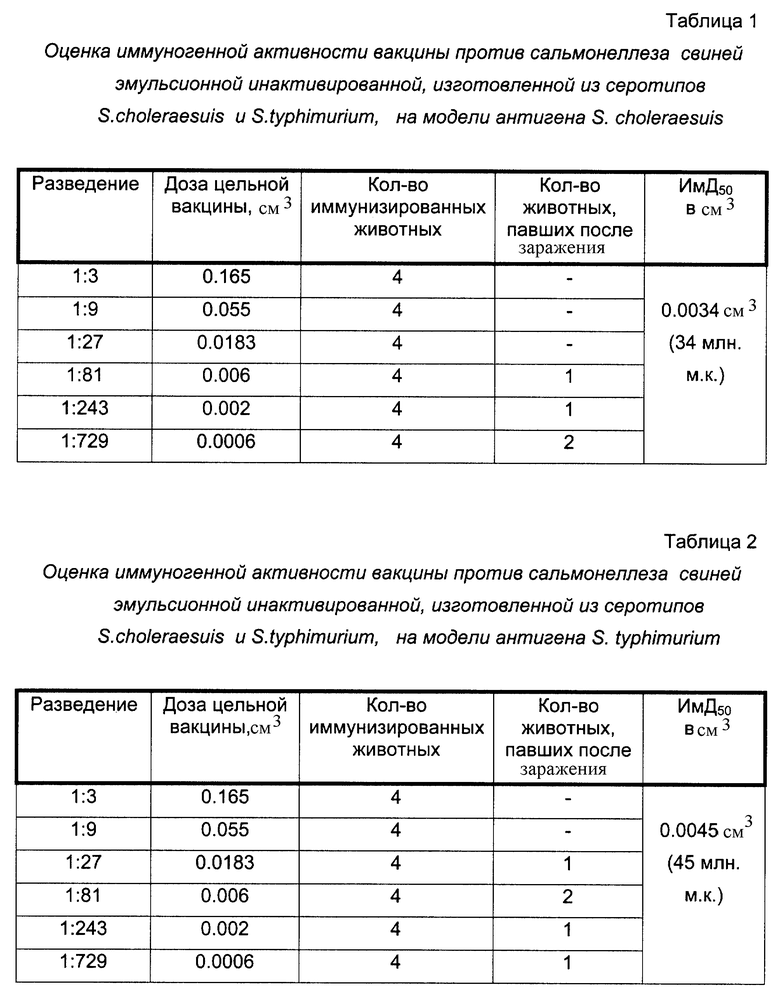
При испытании иммуногенности на морских свинках использовали 70 голов животных. Вакцину разводили в плацебо с трехкратным шагом и вводили животным внутримышечно в бедро в объеме 0,5 см3, используя по 4 морских свинки на разведение по каждому антигену. Через 21 сутки после иммунизации всех вакцинированных и 10 контрольных животных заразили вирулентным штаммом сальмонелл соответствующего серотипа подкожно в области живота. Объем вводимой суспензии - 1 см3. Результаты опыта приведены в таблицах 1, 2. Результаты проведенных исследований показали, что ИмД50 вакцины против сальмонеллеза свиней эмульсионной инактивированной составляет 0,0034 см3 для S.choleraesuis и 0,0045 см3 для S.typhimurium.
Пример 5
Иммуногенную активность вакцины определяли в опыте на поросятах. Для проверки использовали смесь препарата из 3 флаконов (по каждой серии), из которых готовят объединенную пробу. При испытании иммуногенной активности вакцины на поросятах использовали 4 головы. Вакцину вводили животным внутримышечно за ухом в объеме 0,5 см3 . По истечении 21 суток после вакцинации иммунизированных и 2 контрольных подсвинков заразили внутрибрюшинно культурой штамма Salmonella choleraesuis N 370 и Salmonella typhimurium N 371 в объеме 1 см3 с концентрацией 60 млрд.мк/см3. В течение 16 суток наблюдения животные опытной группы остались живы. У контрольных животных на 4 сутки появились признаки заболевания: слабость, угнетение, исхудание, появление слизи в каловых массах и на 7 сутки животные погибли.
Результаты испытания иммуногенной активности вакцины количественным методом показали, что ИмД50 вакцины против сальмонеллеза свиней эмульсионной инактивированной составляет 0,005 см3 для S.typhimurium и для S. choleraesuis.
Пример 6
Проведены исследования по сравнительному изучению эффективности инактивированных противосальмонеллезных вакцин, полученных с помощью различных инактивантов, на поросятах в АОЗТ "Владимирское" Владимирской области. Испытания проведены на поросятах 20-25-дневного возраста. Результаты исследований представлены в таблице 3.
Таким образом, изложенные сведения свидетельствуют о выполнении при использовании предлагаемого способа следующей совокупности условий:
- способ, воплощающий предлагаемое изобретение, предназначен для использования в области микробиологии и биотехнологии;
- для предлагаемого способа в том виде, как он охарактеризован в независимом пункте формулы изобретения, подтверждена возможность его осуществления с помощью описанных в заявке или известных до даты приоритета средств и методов;
- способ, воплощающий предлагаемое изобретение, при его осуществлении обеспечивает достижение усматриваемого заявителем технического результата: повышение иммуногенной активности и специфической безопасности препарата.
Следовательно, предлагаемое изобретение соответствует условию патентоспособности "промышленная применимость".
Источники информации
1. Емельяненко П.А., Дунаев Г.В. и др. Ветеринарная микробиология. М.: Колос, 1982, 154-173.
2. Пат. ФРГ N 2309329; НКИ 30h,6; 29.08.74.
3. Пат. США N3318775, НКИ 424-89б, 09.05.67.
4. Пат. ФРГ N 1924303; НКИ 30h,6; 17.12.70.
5. Пат. СССР N 59477; A 61 K 39/12, C 12 N 7/04, 07.07.93.
6. Наставление по применению формолвакцины против паратифа поросят. Утверждено ГУВ МСХ СССР 14 июля 1956 г. с изменениями от 22 марта 1962 г. взамен Наставления по применению биологических препаратов, утвержденного МСХ СССР 11 марта 1950 г. N И-56 (прототип).
7. Авт свид. СССР N 172961; 30h,6; 07.07.65.
8. Авт.свид. СССР N 1197186; МПК5 A 61 K 39/112, C 12 N 1/00; 30.11.94.
9. Авт.свид. СССР N 1197187; МПК5 A 61 K 39/112, 30.11.94.
10. Авт. свид. СССР N 1378389; МПК6 C 12 N 1/20; A 61 K 39/112 (C 12 N 15/00, C 12 R:42); 10.11.95.
11. Пат. РФ N 1577116; МПК6 A 61 K 39/112, C 12 N 1/20; 20.11.95.
12. Пат. РФ N 2026082; МПК6 A 61 K 39/112, C 12 N 7/00, 1/20 (C 12 N 1/20, C 12 R1:42); 09.01.95.
13. Пат. РФ N 2030916; МПК6 A 61 K 39/112, C 12 N 1/20, (C 12 N 1/20, C 12 R1:42); 20.03.95.
14. Пат. РФ N 2080875; МПК6 A 61 K 39/112, 39/116; 10.06.97.
15. Пат. РФ N 2086259; МПК6 A 61 K 39/116, 39/106; 39/112, 39/118; 10.08.97.
16. Пат. РФ N 2092187; МПК6 A 61 K 39/112, 39/39, C 12 N 1/20 (C 12 N 1/20, C 12 R1:42); 10.10.97.
17. Пат. РФ N 2099083; МПК6 A 61 K 39/116, 39/09, 39/102, C 12 N 1/20 (C 12 N 1/20, C 12 R1:42); 20.12.97.
18. Пат. РФ N 2129016; МПК6 A 61 K 39/112, 39/02, C 12 N 1/00, 1/20 (C 12 N 1/00, C 12 R1:42); 20.04.99.
19. Пат. Великобритании N 1248097, A 5 B, 29.02.71.
20. Пат.ФРГ N 1792256, A 61 K 39/02, 09.11.78.
21. Пат. Болгарии N 24875, C 12 K 5/00.
22. Пат. МНР N 373, A 61 K 39/02, 15.12.86.
23. Пат. ЧСФР N 267949, A 61 K 39/112, 31.07.90.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИЗГОТОВЛЕНИЯ ВАКЦИННОГО ПРЕПАРАТА ПРОТИВ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ БАКТЕРИАЛЬНОЙ ЭТИОЛОГИИ ЖИВОТНЫХ И ПТИЦ | 2000 |
|
RU2173560C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ЭМУЛЬСИОННОЙ ПРОТИВОПАСТЕРЕЛЛЕЗНОЙ ВАКЦИНЫ | 2000 |
|
RU2162339C1 |
| ВАКЦИНА ПРОТИВ ЯЩУРА ТИПА А И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 1999 |
|
RU2143921C1 |
| ВАКЦИНА ПРОТИВ ЯЩУРА ТИПА О И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 2001 |
|
RU2212895C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВАКЦИНЫ ЭМУЛЬСИОННОЙ ИНАКТИВИРОВАННОЙ ПРОТИВ РЕПРОДУКТИВНО-РЕСПИРАТОРНОГО СИНДРОМА СВИНЕЙ | 2002 |
|
RU2236254C2 |
| ВАКЦИНА ЭМУЛЬСИОННАЯ ИНАКТИВИРОВАННАЯ ПРОТИВ РЕПРОДУКТИВНО-РЕСПИРАТОРНОГО СИНДРОМА СВИНЕЙ | 2002 |
|
RU2236253C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ИНАКТИВИРОВАННОЙ ЭМУЛЬСИОННОЙ ВАКЦИНЫ ПРОТИВ ПАРВОВИРУСНОЙ ИНФЕКЦИИ СВИНЕЙ | 2002 |
|
RU2214275C1 |
| ШТАММ "ВЛ-94" ПАРВОВИРУСА СВИНЕЙ ДЛЯ ИЗГОТОВЛЕНИЯ ВАКЦИННЫХ ПРЕПАРАТОВ | 2002 |
|
RU2212898C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ИНАКТИВИРОВАННОЙ ВАКЦИНЫ ПРОТИВ БЕШЕНСТВА ЖИВОТНЫХ | 1997 |
|
RU2134590C1 |
| ВАКЦИНА ПРОТИВ ЯЩУРА ТИПА АЗИЯ-1 И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 2002 |
|
RU2220744C1 |

Изобретение предназначено для ветеринарной микробиологии и биотехнологии. Производственные штаммы Salmonella choleraesuis и Salmonella typhimurium культивируют в питательной среде, содержащей бульон по Хоттингеру с рН 7,6-7,8 и показателем аминного азота 200-250 мг%. Полученную бактерийную смесь подвергают инактивации аминоэтилэтиленимином (АЭЭИ). АЭЭИ вносят в бактерийную суспензию до концентрации 0,5-4%. Смесь инкубируют в течение 12-16 ч при 37-38°С. По окончании инактивации полученный антиген вносят в сахарозожелатиновую среду. После этого антиген соединяют с масляным адъювантом в соотношении 2:3 - 1:4 соответственно. Изобретение повышает иммуногенную активность и специфическую безопасность вакцины. 4 з.п. ф-лы, 3 табл.
| СПОСОБ ИЗГОТОВЛЕНИЯ СУХОЙ ЖИВОЙ ВАКЦИНЫ ПРОТИВ ПАРАТИФА СВИНЕЙ | 0 |
|
SU172961A1 |
| ВАКЦИНА ПРОТИВ САЛЬМОНЕЛЛЕЗА МОЛОДНЯКА | 1984 |
|
SU1197187A1 |
| Средство для инактивации вирусов при изготовлении противовирусных препаратов | 1973 |
|
SU594771A1 |
| ВАКЦИНА ПРОТИВ САЛЬМОНЕЛЛЕЗА СВИНЕЙ, СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ И СПОСОБ ПРОФИЛАКТИКИ САЛЬМОНЕЛЛЕЗА СВИНЕЙ | 1988 |
|
RU1577116C |
| ИНАКТИВИРОВАННАЯ ВАКЦИНА ПРОТИВ САЛЬМОНЕЛЛЕЗА ОВЕЦ | 1994 |
|
RU2092187C1 |
| СПОСОБ ИНАКТИВАЦИИ ИНФЕКЦИОННОЙ АКТИВНОСТИ ВОЗБУДИТЕЛЕЙ КИШЕЧНЫХ ИНФЕКЦИЙ И ВАКЦИНА ДЛЯ ИММУНИЗАЦИИ ЖИВОТНЫХ | 1995 |
|
RU2098134C1 |
| ВАКЦИНА ПРОТИВ ЯЩУРА ТИПА А И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 1999 |
|
RU2143921C1 |
| 0 |
|
SU158282A1 | |
| k | |||
Авторы
Даты
2001-01-27—Публикация
2000-04-17—Подача